治療用培養細胞の製造方法
【課題】種々の危険因子や栄養支持細胞を用いることなく培養が可能で、安全性の高い治療用培養細胞の製造方法の提供。
【解決手段】哺乳動物由来から組織を採取し、タンパク質分解酵素処理した後にタンパク質分解酵素阻害剤処理を行い、その際、使用したタンパク質分解酵素の活性を失活させるのに必要な理論量よりも過剰量のタンパク質分解酵素阻害剤で処理すると共に、低カルシウムイオン濃度の培地を用い、さらに培地交換の際には新しい培地を添加してからその一部を除去して行う馴化培養をする。
【解決手段】哺乳動物由来から組織を採取し、タンパク質分解酵素処理した後にタンパク質分解酵素阻害剤処理を行い、その際、使用したタンパク質分解酵素の活性を失活させるのに必要な理論量よりも過剰量のタンパク質分解酵素阻害剤で処理すると共に、低カルシウムイオン濃度の培地を用い、さらに培地交換の際には新しい培地を添加してからその一部を除去して行う馴化培養をする。
【発明の詳細な説明】
【技術分野】
【0001】
この発明は、ヒトを含む哺乳動物の治療用培養細胞の製造方法に関する。より具体的には、哺乳動物由来の組織から取得した細胞を培養する、種々の治療目的に使用可能な治療用培養細胞の製造方法に関し、特に、細胞培養培地として危険因子とされる動物由来血清、脳由来物質(脳下垂体、脳抽出物、脳由来脂質等)、牛由来タンパク質、及び動植物由来アレルゲン物質を実質的に含まない培地を用い、また、培養時に栄養支持細胞を用いることのない、安全性の高い治療用培養細胞の製造方法に関する。
【背景技術】
【0002】
1975年RheinwaldとGreenは世界で始めて表皮細胞の連続培養に成功した(非特許文献1)。RheinwaldとGreenの方法(以下Greenらの方法と呼ぶ)では、組織切片を酵素で処理し、剥離した細胞を、牛胎児血清を含む培地に懸濁してγ線照射3T3細胞と共に培養する。栄養支持細胞として3T3細胞を用いることで、繊維芽細胞の増殖を抑制し、表皮細胞をコロニーとして取得することが可能となった。
【0003】
一方、1980年、培養液中のカルシウム濃度を低くすると表皮細胞が未分化の状態で増殖が亢進することが示され(非特許文献2)、その後Hamらにより低カルシウム濃度の培地MCDB153基礎培地が開発され、そこに牛脳下垂体抽出物等を添加した培地がヒト表皮細胞の増殖に有効であることが示された(非特許文献3から5)。
【0004】
一方培養された表皮の移植は1981年にO'Connor‘により初めて報告され(非特許文献6)、1984年には、全身の95%に熱傷を受けた患児が救命される例が報告された(非特許文献7)。これらの例では共にGreenらの方法による培養表皮が用いられた。また、我国でも1985年に初めて聖マリアンナ医科大学形成外科より、培養表皮の移植が報告された。その後、多くの企業(Epicell社、Genzyme社など)や病院(聖マリアンナ医科大学形成外科において583症例)が上述の培養方法を用いた皮膚移植を熱傷治療等に適用している。
【0005】
一方、他家移植を目的としたプレメイドの培養表皮も作製されている。表皮の培養は表皮形成までに3〜4週間を要するため、自家の皮膚から細胞を採取して培養していると間に合わないことがあり、プレメイドのものは有利である。さらには、皮膚そのものの移植は免疫学的拒絶反応を起こし易いが、培養表皮に対しては拒絶反応が起こりづらい。なぜなら、皮膚移植で生じる免疫学的拒絶反応の1つは、提供される細胞に対して早期に起こるGVHD(graft-versus-host disease:移植片対宿主病)と呼ばれる反応で、皮膚の場合GVHDは表皮に存在するランゲルハンス細胞に対して起こるが、培養表皮には、ランゲルハンス細胞が含まれない(非特許文献8)。また、皮膚移植の際のもう1つの拒絶反応は、真皮にある血管内皮細胞に対する抗体が出来て起こるものであるが、培養表皮は、この細胞も含まない。培養表皮を用いた他家移植については、すでに複数の報告がされている(非特許文献9、10)。
【0006】
また、他家移植を目的としたプレメイドの培養表皮は商業的利用価値が大きい。近年では、培養表皮と培養真皮線維芽細胞を組み合わせたものが凍結品として販売されている。さらに、貯蔵や輸送において有利な、凍結乾燥した培養表皮も作製された(非特許文献11)。凍結乾燥培養表皮は、静脈性下腿潰瘍における他家移植に適応され、その治癒効果が凍結品に匹敵することが示された。
【0007】
以上のように、培養表皮は火傷などの治療に大きく貢献しており、さらには、商業的利用価値も高いものである。
【0008】
しかしながら、現在報告されている培養表皮は、その培養方法を理由に、安全性が保証されないという問題がある。近年、ウシ海面状脳症(BSE;Bovine Spongiform Encephalopathy)が社会的に大きな問題として取り上げられている。BSEとヒトのクロイツフェルト・ヤコブ病には関連があると考えられ、BSEに感染した牛からの肉などが食事に含まれないよう、世界的に配慮がなされている。Greenらの方法による表皮細胞の培養には、ウシ胎児血清を用いるため、この培養方法による治療用細胞は安全性が懸念される。さらにはGreenらの方法では、栄養支持細胞として用いられる、3T3細胞を介した未知の病原体の感染も懸念される。このような理由からGreenらの方法については、米国FDAがその危険性について警告を行っている(非特許文献12)。一方、Hamらの方法では、牛胎児血清や3T3細胞は用いないが、ウシ脳下垂体抽出物を用いる。ウシの脳に由来するウシ脳下垂体抽出物を用いることは、血清よりもさらに危険性が高く、治療に用いる培養細胞の製造にこの方法を用いるのは非常に危険と考えられる。一方、最近ウシ脳下垂体抽出物を用いない無血清培地が開発され(特許文献1)、これを用いた表皮細胞の培養が期待される。しかしながら、この培地には、アレルゲンとして知られるピーナッツ抽出物が含まれ、この培地で培養した細胞を治療に用いれば、重篤なアレルギーを発生する可能性が懸念される。
【0009】
なお、培養表皮とその製造方法については、上記以外にも多くの提案がなされている(特許文献2から5等)。しかし、いずれも、細胞培養培地中に危険因子である、動物由来血清、脳由来物質(脳下垂体、脳抽出物、脳由来脂質等)、牛由来タンパク質、及び動植物由来アレルゲン物質を含み、あるいは、培養時に栄養支持細胞を必要とし、未知の病原体の感染の可能性が懸念され、いずれも安全性の高い治療用培養細胞の製造方法であるとはいえない。
【先行技術文献】
【非特許文献】
【0010】
【非特許文献1】Cell, (1975) Vol. 6, p.317
【非特許文献2】Cell, (1980) Vol. 19, p.245
【非特許文献3】The Journal of Investigative Dermatology, (1983) Vol. 81, p.33s
【非特許文献4】In Vitro, (1980) Vol. 16, p.516
【非特許文献5】Journal of Tissue Culture Methods, (1985) Vol. 9, p.83
【非特許文献6】Lancet, (1981) Vol. 1, p.75
【非特許文献7】New England Journal of Medicine, (1984) 311, p.448
【非特許文献8】Archives of Dermatology, (1990) Vol. 126, p.175.
【非特許文献9】Archives of Dermatology, (1998) Vol. 134, p.293.
【非特許文献10】British Journal of Plastic Surgery, (2005) Vol. 58, p.988.
【非特許文献11】J Eur Acad Dermatol Venereol. (2004) Vol. 18, p.173.
【非特許文献12】Journal of the American Medical Association, (2002) Vol. 288, p.688
【非特許文献13】J Cell Science vol. 111, p.3179,(1998).
【特許文献】
【0011】
【特許文献1】WO/2004/083400
【特許文献2】特表2007-500001号公報
【特許文献3】特表2006-519024号公報
【特許文献4】特開2004-344007号公報
【特許文献5】特許第3728750号公報
【発明の概要】
【発明が解決しようとする課題】
【0012】
本発明者らは、種々の危険因子や栄養支持細胞を用いることなく培養が可能で、安全性の高い治療用培養細胞の製造方法について鋭意検討した。
その結果、哺乳動物由来から組織を採取し、タンパク質分解酵素処理した後にタンパク質分解酵素阻害剤処理を行い、その際、使用したタンパク質分解酵素の活性を失活させるのに必要な理論量よりも過剰量のタンパク質分解酵素阻害剤で処理することにより、処理後の組織中のタンパク質分解酵素がなるべく残留しないようにすると共に、得られた細胞を培養する際に、低カルシウムイオン濃度の新規培地を用い、さらに培地交換の際には新しい培地を添加してからその一部を除去して行う馴化培養をすることにより、目的を達成できることを見出し本発明を完成した。
【課題を解決するための手段】
【0013】
すなわち、本発明の第一は、治療用培養細胞の製造方法であって;
哺乳動物から細胞を含む組織を採取する組織採取工程:
前記工程で得られた組織を、タンパク質分解酵素を含む酵素溶液中に浸漬する酵素溶液浸漬工程:
前記酵素溶液浸漬工程で得られた組織を、タンパク質分解酵素阻害剤を含む阻害剤溶液に浸漬する阻害剤溶液浸漬工程及び:
以上の工程で得られた細胞を培養して治療用培養細胞を得る培養工程:
を含み、さらに、
前記阻害剤溶液浸漬工程では、酵素溶液浸漬工程における酵素溶液中のタンパク質分解酵素を阻害するのに必要とされるよりも過剰のタンパク質分解酵素阻害剤を含む阻害剤溶液を用い、
前記培養工程では、動物由来血清、脳由来物質、牛由来タンパク質、及び動植物由来アレルゲン物質を実質的に含まず、かつ、カルシウムイオン濃度0.03〜0.1mEq/Lの培地を用い、また、栄養支持細胞を用いることなく、更に培養中に培地交換を行い、その培地交換は、培養に用いられている培地に新しい培地を添加してからその一部を除去して行うことを特徴とする治療用培養細胞の製造方法である。
また、本発明の第二は阻害剤溶液浸漬工程後、さらに、未消化の残渣組織のみを回収し、前記酵素溶液浸漬工程で用いたタンパク質分解酵素と異なるタンパク質分解酵素を含む酵素溶液中に浸漬する第二酵素溶液浸漬工程を含む治療用培養細胞の製造方法である。
【0014】
以下、本発明について、その詳細を説明する。
(治療用培養細胞)
本発明で、治療用培養細胞とは、移植などの治療に用いられる細胞のうち、培養によって得られるものを指す。治療用培養細胞は、治療の用いられる培養細胞であれば、なんら限定されないが、本発明においては、治療用培養細胞は、特に好ましくは、治療用の幹細胞を含む表皮細胞である。
(組織採取工程)
採取される組織は哺乳動物由来で体性幹細胞が含まれることが望ましい。幹細胞とは細胞分裂を経ても同じ分化能を維持する細胞を指し、体性幹細胞とは、幹細胞のうち出生後の生殖組織以外の生体内の各組織に分化する細胞を指す。本発明では、培養において増殖している細胞は一部が体性幹細胞であると考えられる。
本発明における哺乳動物由来の採取組織としては、例えば、ヒトの皮膚組織全層(副耳・余剰指・包皮・頭皮・体幹皮膚・屈曲部皮膚)、臍帯、口腔粘膜、角膜、骨髄、臭粘膜(Olfactory Mucosa)等を挙げることができる。
【0015】
(酵素溶液浸漬工程)
本発明の、酵素溶液浸漬工程で用いるタンパク質分解酵素としては、例えば、トリプシン(Trypsin)、recombinant Trypsin、TrypLE ,Dispase, コラゲナーゼ(Collagenase)等が挙げられ、より具体的には、例えば、0.125%Trypsin/0.01%EDTA溶液(Sigma社製)、TrypZean(Sigma社製)、TrypLE Select Stable Trypsin Replacement Enzyme(GIBCO,Invitrogen), TrypLE Express Stable Trypsin Replacement Enzyme(GIBCO,Invitrogen),Dispase(三光純薬)、Collagenase type-I,II, III,IV,V,X(和光純薬)等を挙げることができる。酵素溶液中のタンパク質分解酵素濃度は、使用するタンパク質分解酵素の種類によって異なるが、通常0.001%以上0.5%以下であり、例えば、タンパク質分解酵素がトリプシンである場合には、0.001%以上0.25%以下、好ましくは0.001%以上0.13%以下である。
酵素溶液浸漬工程における浸漬温度は、好ましくは0℃以上37℃以下、でありより好ましくは4℃以上10℃以下である。また浸漬時間は好ましくは12時間 以上36時間以下であり、より好ましくは16時間以上24時間以下である。また、酵素溶液浸漬の後、遠心分離等の手段で酵素溶液を分離除去する。
【0016】
(阻害剤溶液浸漬工程)
阻害剤溶液浸漬工程で用いるタンパク質分解酵素阻害剤としては、酵素溶液浸漬工程に用いられたタンパク質分解酵素の阻害剤が用いられ、例えば、酵素溶液浸漬工程で用いるタンパク質分解酵素がトリプシンであれば,トリプシン阻害剤(soy bean由来)、トリプシン阻害剤(lima bean由来)、組み換え体Aprotinin等であるのがよく、より具体的には、タンパク質分解酵素阻害剤含有の阻害剤として、例えば、Trypsin Inhibitor (Soy bean)(Wako社製)、Trypsin Inhibitor (lima bean)(Sigma社製),recombinant Aprotinin (Tabaco)(Sigma社製)等を挙げることができ、また、タンパク質分解酵素がコラーゲナーゼでもトリプシンと同様な阻害剤を使用できる。
阻害剤溶液浸漬工程で用いるタンパク質分解酵素阻害剤は、少なくとも酵素溶液浸漬工程で用いた酵素溶液中のタンパク質分解酵素に対して、過剰量のタンパク質分解酵素阻害剤を含む阻害剤溶液を用いる必要があり、この阻害剤溶液浸漬工程では酵素溶液浸漬工程で用いたタンパク質分解酵素を可及的に、好ましくは完全に失活させることが必要である。
【0017】
本発明において、阻害剤溶液浸漬工程でのタンパク質分解酵素阻害剤の使用量は、酵素溶液浸漬工程で用いたタンパク質分解酵素を失活させるのに必要な理論量の通常2倍以上10倍以下、好ましくは2倍以上5倍以下、より好ましくは2倍以上3倍以下であるのがよい。このタンパク質分解酵素阻害剤の使用量が理論量の2倍より少ないと、酵素溶液浸漬工程で用いたタンパク質分解酵素を必要十分な程度にまで失活させることが難しい場合があり、反対に、理論量の10倍量を超えて使用しても、細胞増殖阻害が起こり望ましくない。
【0018】
また、阻害剤溶液浸漬工程において、阻害剤処理は、好ましくは上記酵素処理後の組織を阻害剤溶液中に、浸漬温度0℃以上37℃以下、好ましくは4℃以上25℃以下、及び浸漬時間30分以上6時間以下、好ましくは30分以上2時間以下の条件でスタラー等にて撹拌して浸漬することにより実施され、これに伴って組織から細胞が遊離する。第二酵素浸漬工程を行わない場合はこれらの遊離細胞を回収して培養に用いることができる。遊離細胞は阻害剤溶液浸漬後の混合物を、遊離した細胞(遊離細胞)が通過し、かつ、未消化残渣組織が通過しないポアサイズ、例えば40〜100μm程度のメッシュを用いて濾過し、次いで、得られた濾液溶液から遠心分離等の手段で阻害剤溶液を分離除去することによって回収できる。
【0019】
(培養工程)
培養工程においては、体性幹細胞を含む細胞が増殖培養される。本発明の培養工程では、危険因子である動物由来血清、脳由来物質、牛由来タンパク質、及び動植物由来アレルゲン物質を実質的に含まず、かつ、低カルシウムイオン濃度の培地を用い、また、栄養支持細胞は用いない。
【0020】
ここで危険因子について説明する。動物由来血清とはヒト血清、サル血清、ウシ胎児血清、ウシ血清、ブタ血清、ウマ血清、ロバ血清、ニワトリ血清、ウズラ血清、羊血清、ヤギ血清、イヌ血清、ネコ血清、ウサギ血清、ラット血清、モルモット血清及びマウス血清であり、脳由来物質とは脳下垂体抽出物、脳抽出物、及び脳由来抽出脂質であり、牛由来タンパク質とはウシの体を構成する全てのタンパク質、特にアルブミン、ゼラチンであり、また、動植物由来アレルゲン物質とはピーナッツ、そば、甲殻類、小麦、牛乳及び鶏卵等に由来する物質で、アナフィラキシー等のアレルギーを惹起するおそれのあるものである。
【0021】
また、培地のカルシウムイオン濃度は、0.03mEq/L以上0.1mEq/L以下、好ましくは0.03mEq/L以上0.07mEq/L以下である必要があり、0.03mEq/Lより低くなると細胞増殖阻害・細胞接着阻害という問題が生じ、反対に、0.1mEq/Lより高くなるとFibroblastの過増殖とKeratinocytesの分化促進という問題が生じる。
また細胞培養においては多くの場合3T3細胞、skin fibroblast、CHO細胞、COS-7細胞、Vero細胞、MDBK細胞,STO細胞、BRL細胞、SL-10細胞等が栄養支持細胞として用いられるが、本発明においては、このような栄養支持細胞を用いない。
【0022】
また、培地は、基本的には危険因子を実質的に含まない低カルシウムイオン濃度の細胞培養用の培地であれば何でもよいが、好ましくは、MCDB151培地、MCDB 153培地, MCDB 156培地(Sigma社製商品名:StemlineTM Keratinocyte Basal Medium、Invitrogen社製商品名:Dedined Keratinocyte-SFM)、Ca-free RPMI 1640培地、Ca-free DMEM培地、Ca-free αMEM培地、Ca-free IMDM培地、Ca-free DMEM/F-12, Ca-free DMEM/MCDB201(Invitrogen社製)等の基本培地にCaイオンを0.03〜0.1mEq/Lとなるように添加し、さらにタンパク質分解酵素阻害剤、細胞増殖促進剤、KGF(Keratinocyte Growth Factor)、細胞毒となる活性酸素より発生するラジカルを除くラジカルスカベンジャー等の細胞培養上好適な培地添加剤を通常用いられる範囲の濃度で添加するのがよい。
【0023】
ここで、培地添加剤として添加されるタンパク質分解酵素阻害剤については、上記の阻害剤溶液浸漬工程で用いられるSoy bean由来タンパク質分解酵素阻害剤を始めとして、lima bean由来タンパク質分解酵素阻害剤、遺伝子組換えAprotinin等を例示することができ、その使用量は、通常0.0125重量%以上0.25重量%以下、好ましくは0.025重量%以上0.05重量%以下の範囲であるのがよい。0.0125重量%より少ないと培地添加剤として添加する添加効果に乏しく、反対に、0.25重量%を超えて添加してもあまり添加効果の向上が見られない。
【0024】
また、培地添加剤として添加される細胞増殖促進剤としては、例えば、KGF(Keratinocyte Growth Factor:FGF-7),インシュリン(Insulin)、トランスフェリン(Transferrin)、セレニウム(Selenium)、エタノールアミン(Ethanolamine)、脂質、ビタミンC及びビタミンC誘導体等を挙げることができ、これらはその1種のみを添加してもよく、また、2種以上を添加してもよい。なお、上記の脂質としては、例えば、(Arachidonic acid)、コレステロール(Cholesterol)、(DL-a-Tocopherol-acetate)、(Linoleic acid)、(Linolenic acid)、(Myristic acid)、(Oleic acid)、(Palmitoleic acid)、(Palmitic acid)、(Stearic acid)、Tween:80)、Pluronic F68(Sigma社又はInvitrogen社)等から選ばれた1種又は2種以上の混合物を例示することができる。
【0025】
更に、倍地添加剤として添加されるラジカルスカベンジャーとしては、例えば、還元グルタチオン(Reduced glutathione)、ビタミンE、ビタミンE誘導体、カタラーゼ(Catalase)、SOD(Superoxide Dismutase)等を挙げることができ、これらはその1種のみを添加してもよく、また、2種以上を添加してもよい。
【0026】
本発明において、基本培地に添加される培地添加剤としては、上記のもの以外に、TGF-α(Trans Growth Factor-alpha)、EGF(Epidermal Growth Factor)、FGF-2(Fibroblast Growth Factor-2)、活性型ビタミンD、塩化リチウム(LiCl)、アクチビン(Activin)、CCL-27{Chemokine(C-C motif) ligand 27}、2-メルカプトエタノール(2-mercaptoethanol)等を挙げることができ、これらはその1種のみを添加してもよく、また、2種以上を添加してもよい。これらは通常の範囲の添加量が用いられる。
【0027】
細胞は培養開始時においては1×104〜6/cm2となるように細胞培養容器に播種し、37℃にてCO2インキュベータ内で培養する。さらには、本発明の培養工程では、馴化培養を行う。一般的に、細胞培養の際は数日ごとに培地の交換を行うが、馴化培養とは培地交換を穏やかに行う培養をいう。具体的には、馴化培養においては、培養に用いられている培地をすべて除いて新しい培地に取り替えるのではなく、あらかじめ新しい培地を添加してから、培地全体の一部を除去して行うことにより培地を交換する。この際、新しい培地を添加した後に、しばらく培養を行ってから、一部除去を行ってもよいし、新しい培地の添加や培地の除去は複数回に分けて行ってもよい。また、このような培地交換は、培養開始後の始めての培養交換の際に行ってもよいし、また、2回目以後の培地交換の際に行ってもよいし、その両方で行ってもよい。
【0028】
細胞培養の際の細胞培養容器としては、ディッシュ、フラスコ、マイクロプレート、細胞培養シートなどが挙げられる。これらの容器は細胞との接着性を向上させるために、コラーゲン、ゼラチン、ポリ−L−リジン、ポリ−D−リジン、ラミニン、フィブロネクチンなどの細胞支持用基質でコーティングされてもよい。なお、細胞培養シートとは、細胞をシート状に培養することを目的する支持体を指し、例えばOptiCell(Nunc社製)が市販されている。細胞培養シートを用いれば、細胞をシート状に培養し、細胞シートを得ることができる。細胞シートはさらに空気透過性接着剤付シートに培養細胞が接着している面を外側にして、培養細胞が接着していない面をシート接着剤塗布面側に貼り付けて治療用の幹細胞を含む表皮細胞とすることができる。
【0029】
(第二酵素溶液浸漬工程)
本発明の第二における第二酵素溶液浸漬工程においては、未消化の残渣組織のみを回収し、前記酵素溶液浸漬工程で用いたタンパク質分解酵素以外のタンパク質分解酵素を含む酵素溶液中に浸漬する。このとき、酵素溶液には、前記酵素溶液浸漬工程で用いたタンパク質分解酵素以外のタンパク質分解酵素が用いられ、好ましくはコラーゲナーゼが用いられる。この工程では酵素溶液に浸漬した組織から体性幹細胞を含む被培養細胞を分離して回収する。これによって、本発明の第一では回収されずに未消化残渣組織中に残留した体性幹細胞が分離回収される。
第二酵素溶液浸漬工程は、未消化残渣組織を酵素溶液中に0℃以上37℃以下、好ましくは4℃以上25℃以下で、12時間以上36時間以下、好ましくは16時間以上24時間以下の条件で浸漬することにより実施され、その後、例えばスタラー等で攪拌後、メッシュ濾過し、その濾液を遠心分離等の手段で酵素溶液を除去して細胞を回収する。
【0030】
(酵素処理なく浮遊する細胞の採取)
本発明の対応の一においては、培養工程において、酵素処理なく浮遊する細胞を採取する工程を含んでもよい。ここで、酵素処理なく浮遊する、とは、酵素を用いずとも、浮遊することを指し、何ら処理をせずとも自然に浮遊する場合、あるいは、ピペッティングのように物理的な処理のみで剥離して、浮遊する場合を含む。このように浮遊してきた細胞を採取することにより、球状の表皮幹細胞であるSpheroid細胞を採取することができる。浮遊してくる細胞には、Spheroid細胞以外にも浮遊細胞や、死細胞が含まれる場合もあるが、これらは除去してもよいし、あるいは、Spheroid細胞と共に培養されても、それらの細胞は増殖能しないため、問題はない。
【発明の効果】
【0031】
本発明によれば血清・脳下垂体抽出物・栄養細胞やアレルゲンを用いないで、体性幹細胞を含有する皮膚細胞群を培養取得でき、その結果この細胞を用いて熱傷・褥創・糖尿病性下腿潰瘍等の皮膚疾患を従来より安全且つより有効性高く治療することができる。
また、この細胞群を用いて種々の体細胞に分化させれば、肝硬変・腎疾患・脊椎損傷・脳梗塞・パーキンソン病・アルツハイマー病・糖尿病等の全身疾患に適応可能となる。
【図面の簡単な説明】
【0032】
【図1】実験全体の概要図
【図2】培養初期(培養4日目):組織よりの細胞の培養面への接着開始
【図3】培養初期(培養7日目):コロニーの分散・拡大
【図4】培養中期(培養10日目):コロニー間の接着・融合
【図5】培養後期(培養14日目):Spheroid様表皮幹細胞の出現
【図6】OptiCell(細胞培養シート)上に実験例2の方法で培養された細胞群(ギムザ染色)
【図7】OptiCell(細胞培養シート)上に実験例3の方法で培養された細胞群(ギムザ染色)
【図8】OptiCell(細胞培養シート)上に実験例4の方法で培養された細胞群(ギムザ染色)
【図9】OptiCell(細胞培養シート)上に実験例5の方法で培養された細胞群(ギムザ染色)
【図10A】実験例6においてROCK(Rho-associated kinase)阻害剤Y-27632で処理してからTrypZean で処理して調製されて培養された細胞群。
【図10B】実験例6においてTrypZean で処理してからROCK(Rho-associated kinase)阻害剤Y-27632で処理して調製されて培養された細胞群。
【図10C】実験例6においてROCK(Rho-associated kinase)阻害剤、TrypZeanによる処理は行わずに調製されて培養された細胞群。
【図11】実施例11においてAnti-Cytokeratin15抗体で染色した結果を示す。
【発明を実施するための形態】
【0033】
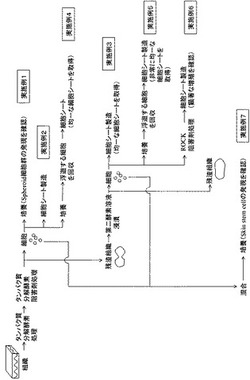
以下に本発明の例を挙げて説明するが、本発明の範囲は以下の例のみに限定されるものではない。なお、図1に本実施例の概要を示す。
【0034】
[実施例1]
(組織の採取)
美容整形手術時に顔部から切除されたヒト皮膚組織の全層部分を採取し、毛根が存在する箇所を残して皮下及び真皮結合組織を可及的に滅菌した鋏とピンセットで除去し、更に鋏で1×10mm2程度に細切して細切組織を得た。得られた細切組織をペニシリン1000u/ml及びストレプトマイシン1mg/mlを含むCaイオン及びMgイオン不含等張燐酸緩衝液(PBS(-))に3回浸漬して除菌した。
【0035】
(酵素処理)
次いで予め4℃に冷却したトリプシン溶液〔0.125%Trypsin/0.01%EDTA/PBS(-)〕10ml中に浸漬し、4℃に維持して一昼夜静置し、採取組織の酵素処理を行った。
【0036】
(阻害剤処理)
酵素処理後の組織を遠心分離してトリプシン溶液を除いた後、直ちにトリプシン阻害剤溶液〔0.25%Trypsin Inhibitor (Soy bean)/MCDB153; Trypsinの2.4倍モル濃度〕20ml中に入れ、磁石回転子を用いて室温下に30分間撹拌し、トリプシンの酵素活性を失活させると共に、組織から培養に用いる細胞を遊離させた。
【0037】
(細胞の調製)
阻害剤処理後の処理溶液をポアサイズ100μmのメッシュで濾過して未消化組織を除き、得られた濾過溶液を遠心分離してトリプシン阻害剤溶液を除き、ペレット状態で細胞を得た。
【0038】
(培養)
培養皿としてType I-collagenを塗布した細胞培養用皿(100mm)(BD Falcon社製)を用い、また、培地として下記の組成の細胞培養培地10mlを用い、得られた細胞を1〜2×104〜5/cm2の密度で播種して37℃で培養を開始した。
細胞培養培地は以下のとおり調製された。すなわち、基本培地のMCDB 153培地(Sigma社製商品名:StemlineTM Keratinocyte Basal Medium)中に、インシュリン(10mg/L)、トランスフェリン(5.5mg/L)、セレニウム(6.7μg/L)、Ethanolamine(2mg/L)、ビタミンC(L-Ascorbic acid 2-phosphate semimagnesium salt)(50μg/L)、KGF(Keratinocyte Growth Factor:10ng/L)、脂質(脂肪酸混合物、Arachidonic acid:20μg/L; Cholesterol:2.2mg/L; DL-a-Tocopherol-acetate:700μg/L; Linoleic acid:100μg/L; Linolenic acid:100μg/L; Myristic acid:100μg/L; Oleic acid:100μg/L; Palmitoleic acid:100μg/L; Palmitic acid:100μg/L; Stearic acid:100μg/L; Tween:80 22mg/L; Pluronic F-68:1000 mg/L)を添加して調製した。
培養開始に際しては、7日目までは培地交換をすることなく3ml/3dayの割合で培地を添加しつつ馴化培養を行い、その後に3日毎に培地を半交換しながら培養を行った。70%コンフルエンスに達するまで14日間を要した。
なお、MCDB 153培地の組成は以下の通りである。なお、3.33mg/Lの無水塩化カルシウムは0.03mEqに相当する。
【0039】
【表1】

【0040】
(培養された細胞の調製)
培養された細胞をPBS(-)にて2回洗浄し、TrypZean2mlを加えて、室温3分間酵素処理を行い、その後直ちに2倍量のトリプシン阻害剤溶液〔0.25%Trypsin Inhibitor (Soy bean)/MCDB153; Trypsinの2.4倍モル濃度〕4mlを加えて酵素阻害をしてから、培養された細胞を細胞培養用皿からセルスクレーパーを用いて剥がした。
【0041】
(培養された細胞の凍結など)
調製された細胞を遠心管に集めて遠心し、ペレットを治療用細胞とした。ペレットはそのまま又は凍結又は凍結乾燥して治療用細胞として用いることができる。
本実施例における培養の様子を図2から図5に示す。図2に培養初期(培養4日目)の状態を示す。組織よりの細胞の培養面への接着が開始していることが観察された。
図3に培養初期(培養7日目)の状態を示す。コロニーが分散・拡大している様子が観察された。
図4に培養中期(培養10日目)の状態を示す。コロニー間に接着・融合が起きている様子が観察された。一面に一層の表皮細胞によって培養底面が満たされた。
図5に培養後期(培養14日目)の状態を示す。球状(Spheroid様)の表皮幹細胞(Spheroid塊)の出現が観察された。一層の表皮細胞によって満たされた培養面上にSpheroid様の表皮幹細胞が出現した。このSpheroid細胞群は酵素を用いないでも物理的にピッペティングで剥離され、その剥離細胞は他の培養皿や細胞培養シートに移すと再度図2から図5のように変化し細胞が増えていった。
【0042】
本実施例では、本発明の第一である。
哺乳動物から細胞を含む組織(本実施例ではヒト皮膚組織)を採取する組織採取工程:
前記工程で得られた組織を、タンパク質分解酵素(本実施例ではトリプシン)を含む酵素溶液中に浸漬する酵素溶液浸漬工程:
前記酵素溶液浸漬工程で得られた組織を、タンパク質分解酵素阻害剤を含む阻害剤溶液(本実施例ではトリプシンインヒビター)に浸漬する阻害剤溶液浸漬工程及び:
以上の工程で得られた細胞を培養して治療用培養細胞を得る培養工程:
を含み、さらに、
前記阻害剤溶液浸漬工程では、酵素溶液浸漬工程における酵素溶液中のタンパク質分解酵素を阻害するのに必要とされるよりも過剰のタンパク質分解酵素阻害剤(本実施例では2.4倍)を含む阻害剤溶液を用い、
前記培養工程では、動物由来血清、脳由来物質、牛由来タンパク質、及び動植物由来アレルゲン物質を実質的に含まず、かつ、カルシウムイオン濃度0.03〜0.1mEq/L(本実施例では0.03mEq mEq)の培地を用い(MCDB)、また、栄養支持細胞を用いることなく、更に培養中に培地交換を行い、その培地交換は、培養に用いられている培地に新しい培地を添加してからその一部を除去して行うこと(本実施例では7日目以降3日毎に半交換)を特徴とする治療用培養細胞の製造方法
により、十分な増殖能を有する治療用培養細胞を得られさらに、培養後期においては、Spheroid細胞群を確認することができた。
【0043】
[実施例2]
(組織採取)
実施例1と同様に行った。
(酵素処理)
実施例1と同様に行った。
(阻害剤処理)
実施例1と同様に行った。
(細胞の調製)
実施例1と同様に行った。
(培養)
実施例1と同様に行った。ただし、本実施例では70%コンフルエンスに達するまで10日間増殖培養を要した点において実施例1と異なる。
(培養された細胞の調製)
実施例1と同様に行った。
【0044】
(細胞シートの調製)
上記の調製によって得られた細胞を遠心して、ペレットとして回収し、剥離液から分離した。基本培地に前に培養に用いた培地を濾過滅菌したものを等量加え、更に全量の1/10量の0.25% Trypsin Inhibitor溶液と1/100量のB-27(Invitrogen GIBCO社製:Anti-Oxidants Mixture)を加えた培養液を調製した。これを用いてペレットの細胞を分散し、注射等にてOptiCellに入れて培養した。その結果、膜状に一定数の細胞コロニーに達した(図6)。培養された細胞は、細胞付膜を細胞の接着していないシート側をシートより表面積の大きい空気透過性の医療用接着剤シート面に貼った。これをそのまま又は凍結又は凍結乾燥して移植治療用の細胞シートとして用いることができる。
本実施例では、本発明の第一における培養工程において、細胞培養シートを用いて培養を行い、細胞シート、さらに空気透過性接着剤付シートに貼り付けた細胞シートを得ることができた。
【0045】
[実施例3]
(組織採取)
実施例1と同様に行った。
(酵素処理)
実施例1と同様に行った。
(阻害剤処理)
実施例1と同様に行った。
【0046】
(未消化組織からの細胞の調製)
阻害剤処理後の処理溶液をポアサイズ100μmのメッシュで濾過し、未消化組織をメッシュ上に得た。この未消化組織を0.05% collagenase type Iと2.5mM CaCl2を終濃度で加えた基本培地に浸して1昼夜、4℃に静置した。翌日0.5% collagenase type Iと2.5mM CaCl2を終濃度で加えた基本培地に組織を移し、室温で磁石回転子を用いて30分間撹拌した。この消化物をピペットでサスペンドして組織を可及的にほぐし、再度メッシュ(100 μm pore size)で濾過して余分な組織を除いたろ液を得た。ろ過溶液を遠心分離により除き、ペレット状態で細胞を得た。
【0047】
(培養)
上記で得た細胞を下記の実施例1と同様の培地にサスペンドして、type-I collagen塗布培養dishに1.3×105 cells/cm2の密度で播種して培養を開始した。
培養1週間は、培地を除去せず添加のみ行った。2週目より遠心して細胞を集めて全培地交換を行ったが、この培地交換で遊離してきた細胞は再度培養皿に戻した。12日目に細胞が70%コンフルエンスに達した。
【0048】
(培養された細胞の調製)
実施例1と同様に行った。
【0049】
(細胞シートの調製)
実施例2と同様に行った。OptiCellで培養中の細胞をギムザ染色したものを図7に示す。コロニーが均一に存在する。阻害剤処理後の未消化の組織から調製された細胞を培養に用いることにより、より均一な細胞シートを得ることができたと推測される。
本実施例では、本発明の第一において、阻害剤(トリプシン)溶液浸漬工程後、さらに、未消化の残渣組織のみを回収し、前記酵素溶液浸漬工程で用いたタンパク質分解酵素と異なるタンパク質分解酵素(コラゲナーゼ)を含む酵素溶液中に浸漬する第二酵素溶液浸漬工程を含むことにより、細胞を得、その培養に成功し、さらに、より均一な細胞シートの作製に成功した。
【0050】
[実施例4]
(組織の採取)
実施例1と同様に行った。
(酵素処理)
実施例1と同様に行った。
(阻害剤処理)
実施例1と同様に行った。
(細胞の調製)
実施例1と同様に行った。
(培養)
実施例1と同様に行った。ただし、本実施例においては、100%コンフルエンスに達するのに10日間要し、その後、さらにコンフルエンス後の培養を行った。
(コンフルエンス後の培養及び細胞の調製)
細胞が100%コンフルエンスに達してから、更に培養を続けると4日後から表皮細胞シート上にSpheroid塊が出現した。Spheroid塊のみをピペッティング操作のみで下の表皮細胞シートから剥がし、以下の細胞シートの調製に用いた。
(細胞シートの調製)
実施例2と同様に行った。OptiCellで培養中の細胞をギムザ染色したものを図8に示す。コロニーがより均一に存在する。コンフルエンス後の培養におけるSpheroid塊から、酵素を用いないでピペッティングで剥離された細胞を培養に用いることにより、より均一なコロニーを得ることができたと推測される。
【0051】
本実施例では、本発明の第一の培養工程において、培養工程において、酵素処理することなく浮遊する細胞を採取することにより、Spheroid塊を得、さらに、これを用いて細胞シートの作製を行い、より均一なコロニーを得られた。
【0052】
[実施例5]
(組織採取)
実施例1と同様に行った。
(酵素処理)
実施例1と同様に行った。
(阻害剤処理)
実施例1と同様に行った。
(未消化組織からの細胞の調製)
実施例3と同様に行った。
(培養)
実施例3と同様に行った。ただし、本実施例では100%コンフルエンスに達するのに10日間を要し、その後さらにコンフルエンス後の培養を行った。
(コンフルエンス後の培養及び細胞の調製)
100%コンフルエンスに達してから、更に培養を続けると、本実施例では5日後から表皮細胞シート上に細胞のSpheroid塊が出現した。このSpheroid塊のみをピペッティング操作だけで下の表皮細胞シートから剥がし、以下の細胞シートの調製に用いた。
(細胞シートの調製)
実施例2と同様に行った。OptiCellで培養中の細胞をギムザ染色したものを図9に示す。コロニーが非常に均一に存在する。阻害剤処理後の未消化の組織から細胞培養に用い、さらにコンフルエンス後の培養におけるSpheroid塊から、酵素を用いないでピペッティングで剥離された細胞を培養に用いることにより、非常に均一なコロニーを得ることができたと推測される。
【0053】
本実施例では、本発明の第一において、阻害剤(トリプシン)溶液浸漬工程後、さらに、未消化の残渣組織のみを回収し、前記酵素溶液浸漬工程で用いたタンパク質分解酵素と異なるタンパク質分解酵素(コラゲナーゼ)を含む酵素溶液中に浸漬する第二酵素溶液浸漬工程を含むことにより細胞を得、さらに、培養工程において、酵素処理することなく浮遊する細胞を採取することにより、Spheroid塊を得、これを用いて細胞シートの作製を行い、非常に均一なコロニーを得られた。
【0054】
[実施例6]
(組織採取)
実施例1と同様に行った。ただし、本実施例では、すべての実施例中で最高齢である80歳代のヒト由来の組織を用いた。
(酵素処理)
実施例1と同様に行った。
(阻害剤処理)
実施例1と同様に行った。
(未消化組織からの細胞の調製)
実施例3と同様に行った。
(培養)
実施例3と同様に行った。ただし、本実施例では組織量が少なく、採取細胞数が少なかったため、6wellプレートに細胞を播種した。70%コンフルエンスに達するのに14日間を要した。
(70%コンフルエンス後の継代培養及び細胞の調製)
70%コンフルエンスに達してから、細胞を100mm Dish(type-I collagen coated)3枚に継代し培養した。培養14日で70%コンフルエンスに達したので、Opti-Cellへ継代培養した。
【0055】
(細胞シートの調製)
以下の条件を除き、実施例3と同様に行った。本実施例では3枚の細胞シートをした。すなわち、1枚目のシートの調製では細胞をTrypZean処理前に10μM ROCK(Rho-associated kinase)阻害剤Y-27632で処理した。その後Opi-Cell枚に継代し、さらに10μM Y-27632を含む培地を用いて培養を行った。2枚目の細胞シートの調製では、細胞をTrypZean処理後にY-27632で処理を行い、Opi-Cell枚に継代し、さらに10μM Y-27632を含む培地を用いて培養を行った。3枚目のシートの調製では阻害剤を用いないで細胞シートを調製した。3枚の細胞シートについて、調製から1週間後の細胞の増殖を図10AからCに示す。図10Aは培養中ROCK(Rho-associated kinase)阻害剤Y-27632で処理してからTrypZean で処理して調製された細胞、図10Bは培養中TrypZean で処理してからROCK(Rho-associated kinase)阻害剤Y-27632で処理して調製された細胞、図10Cは ROCK(Rho-associated kinase)阻害剤、TrypZeanによる処理は行わずに調製された細胞を示す。図10Aにおいて顕著に細胞の増殖が認められ、ROCK 阻害剤による前処理は効果的であることが示唆される。
【0056】
本実施例では、本発明の第一において、阻害剤(トリプシン)溶液浸漬工程後、さらに、未消化の残渣組織のみを回収し、前記酵素溶液浸漬工程で用いたタンパク質分解酵素と異なるタンパク質分解酵素(コラゲナーゼ)を含む酵素溶液中に浸漬する第二酵素溶液浸漬工程を含むことにより細胞を得、これを用いて細胞シートの作製を行った。10μM ROCK(Rho-associated kinase)阻害剤Y-27632を含む培地を用いることで、より顕著な細胞の増殖に成功した。また、80歳代のヒトの組織からも細胞シートの作製が可能であることが示された。
【0057】
[実施例7]
(組織採取)
実施例1と同様に行った。ただし、本実施例では、60歳代のヒト由来の顔部皮膚組織を用いた。
(酵素処理)
実施例1と同様に行った。
(阻害剤処理)
実施例1と同様に行った。
【0058】
(未消化組織からの細胞の調製)
阻害剤処理後の処理溶液をポアサイズ100μmのメッシュで濾過し、未消化組織をメッシュ上に得た。この未消化組織を直ぐに0.5% collagenase type Iと2.5mM CaCl2を終濃度で加えた基本培地に組織を移し、室温で磁石回転子を用いて1時間撹拌した。この消化物をピペットでサスペンドして組織を可及的にほぐし、再度メッシュ(100 μm pore size)で濾過して余分な組織を除いたろ液を得た。ろ過溶液を遠心分離により除き、ペレット状態で細胞を得た。
【0059】
(培養)
上記のトリプシンとコラーゲナーゼの両方から得た細胞を1:1の割合で混合し、15〜1×104 cells/cm2の細胞密度で100mmの培養皿に播種して培養を開始した。
(サイトケラチン15発現細胞の調製)
培養細胞が100%コンフルエンスに達して、spheroid細胞集団が多数発現し始めた段階で、4%パラホルムアルデヒド/PBS(-)液に20分以上細胞を室温で浸漬して細胞固定を行った。この時、2枚のdishを用意した。
【0060】
(サイトケラチン15発現細胞の同定=skin stem cellの同定)
近年表皮に幹細胞(表皮幹細胞)が存在することが報告され、表皮幹細胞は毛嚢のバルジ領域に存在し、サイトケラチン15を発現していることが明らかにされている(非特許文献13)。この幹細胞は表皮の角化細胞、毛嚢の脂腺細胞、そして毛の細胞に分化する能力を有している。もし、この幹細胞を同時に培養できれば、この移植体は従来の表皮のみならず毛や脂腺の形成が起こすことが可能となる。そこで本実施例では、上記実施例で得られた細胞中の、表皮幹細胞の有無を同定するために、サイトケラチン15の発現を、抗体染色によって観察した。
詳細には、次のとおり行った。すなわち、2枚のdishの上記固定細胞の固定液を除去後、0.3%過酸化水素水/40%メタノール液に一晩浸漬して内因性のペルオキシダーゼをブロッキングした。次に1% BSA/PBS(-)液で10分間3回、細胞を洗浄した。洗浄後、0.3% Triton X-100/1%BSA/10%FCS/PBS(-)液に室温で45分間、細胞を浸漬して細胞膜に穴を開けた。再度、1% BSA/PBS(-)液で10分間3回、細胞を洗浄した後、1枚のdishのみに1次抗体として、抗ヒトサイトケラチン15モノクロナール・マウスIgG抗体(DBS Mob 305)を1%BSA/10%FCS/PBS(-)液で希釈したもので浸漬し、一晩4℃で保存した。もう1枚のdishは抗体を入れない1%BSA/10%FCS/PBS(-)液で同様に処理した。以下工程からは両dishの処理法は同様に行った。1次抗体処理後、1% BSA/PBS(-)液で5分間3回、細胞を洗浄した。次に抗マウスIgGビオチン化抗体の希釈液(Vector Lab: Vectastain Elite ABC kit)で室温で暗所に1時間浸漬した。次に1% BSA/PBS(-)液で5分間3回、細胞を洗浄した後、avidin-biotin複合体(Vector Lab: Vectastain Elite ABC kit)に1時間浸漬した。次に水で10倍希釈したPBS(-)液に10分浸漬した。次に直前に調製したDAB溶液(Sigma: )を細胞に浸漬し、直ちに位相差顕微鏡下で反応の進行を観察した。約3分後充分反応が進んだので流水にて反応を停止させた。以上の結果、1次抗体を加えなかったdishの細胞は全て陰性を示したが、1次抗体を加えたdish上の細胞は陽性を示した。図11にAnti-Cytokeratin15抗体染色した結果を示す。Sheroid 細胞のみが染色され、これらがヒトケラチン15陽性であり、表皮幹細胞であることが分かる。
【0061】
なお、1次抗体を加えたdishにおいては、陽性を示す細胞は、シート状に培養されたケラチノサイトではなく、spheroid状になる細胞のみに観察された。以上より、この培養法で出現するspheroid細胞はskin stem cellであることが証明された。
本実施例では、阻害剤溶液浸漬工程で得られる細胞と、第二酵素溶液浸漬工程で得られる細胞とを混合して培養することに細胞を得た。さらに、抗体染色により、本培養で得られる細胞が、skin stem cellを含むことが分かった。
【技術分野】
【0001】
この発明は、ヒトを含む哺乳動物の治療用培養細胞の製造方法に関する。より具体的には、哺乳動物由来の組織から取得した細胞を培養する、種々の治療目的に使用可能な治療用培養細胞の製造方法に関し、特に、細胞培養培地として危険因子とされる動物由来血清、脳由来物質(脳下垂体、脳抽出物、脳由来脂質等)、牛由来タンパク質、及び動植物由来アレルゲン物質を実質的に含まない培地を用い、また、培養時に栄養支持細胞を用いることのない、安全性の高い治療用培養細胞の製造方法に関する。
【背景技術】
【0002】
1975年RheinwaldとGreenは世界で始めて表皮細胞の連続培養に成功した(非特許文献1)。RheinwaldとGreenの方法(以下Greenらの方法と呼ぶ)では、組織切片を酵素で処理し、剥離した細胞を、牛胎児血清を含む培地に懸濁してγ線照射3T3細胞と共に培養する。栄養支持細胞として3T3細胞を用いることで、繊維芽細胞の増殖を抑制し、表皮細胞をコロニーとして取得することが可能となった。
【0003】
一方、1980年、培養液中のカルシウム濃度を低くすると表皮細胞が未分化の状態で増殖が亢進することが示され(非特許文献2)、その後Hamらにより低カルシウム濃度の培地MCDB153基礎培地が開発され、そこに牛脳下垂体抽出物等を添加した培地がヒト表皮細胞の増殖に有効であることが示された(非特許文献3から5)。
【0004】
一方培養された表皮の移植は1981年にO'Connor‘により初めて報告され(非特許文献6)、1984年には、全身の95%に熱傷を受けた患児が救命される例が報告された(非特許文献7)。これらの例では共にGreenらの方法による培養表皮が用いられた。また、我国でも1985年に初めて聖マリアンナ医科大学形成外科より、培養表皮の移植が報告された。その後、多くの企業(Epicell社、Genzyme社など)や病院(聖マリアンナ医科大学形成外科において583症例)が上述の培養方法を用いた皮膚移植を熱傷治療等に適用している。
【0005】
一方、他家移植を目的としたプレメイドの培養表皮も作製されている。表皮の培養は表皮形成までに3〜4週間を要するため、自家の皮膚から細胞を採取して培養していると間に合わないことがあり、プレメイドのものは有利である。さらには、皮膚そのものの移植は免疫学的拒絶反応を起こし易いが、培養表皮に対しては拒絶反応が起こりづらい。なぜなら、皮膚移植で生じる免疫学的拒絶反応の1つは、提供される細胞に対して早期に起こるGVHD(graft-versus-host disease:移植片対宿主病)と呼ばれる反応で、皮膚の場合GVHDは表皮に存在するランゲルハンス細胞に対して起こるが、培養表皮には、ランゲルハンス細胞が含まれない(非特許文献8)。また、皮膚移植の際のもう1つの拒絶反応は、真皮にある血管内皮細胞に対する抗体が出来て起こるものであるが、培養表皮は、この細胞も含まない。培養表皮を用いた他家移植については、すでに複数の報告がされている(非特許文献9、10)。
【0006】
また、他家移植を目的としたプレメイドの培養表皮は商業的利用価値が大きい。近年では、培養表皮と培養真皮線維芽細胞を組み合わせたものが凍結品として販売されている。さらに、貯蔵や輸送において有利な、凍結乾燥した培養表皮も作製された(非特許文献11)。凍結乾燥培養表皮は、静脈性下腿潰瘍における他家移植に適応され、その治癒効果が凍結品に匹敵することが示された。
【0007】
以上のように、培養表皮は火傷などの治療に大きく貢献しており、さらには、商業的利用価値も高いものである。
【0008】
しかしながら、現在報告されている培養表皮は、その培養方法を理由に、安全性が保証されないという問題がある。近年、ウシ海面状脳症(BSE;Bovine Spongiform Encephalopathy)が社会的に大きな問題として取り上げられている。BSEとヒトのクロイツフェルト・ヤコブ病には関連があると考えられ、BSEに感染した牛からの肉などが食事に含まれないよう、世界的に配慮がなされている。Greenらの方法による表皮細胞の培養には、ウシ胎児血清を用いるため、この培養方法による治療用細胞は安全性が懸念される。さらにはGreenらの方法では、栄養支持細胞として用いられる、3T3細胞を介した未知の病原体の感染も懸念される。このような理由からGreenらの方法については、米国FDAがその危険性について警告を行っている(非特許文献12)。一方、Hamらの方法では、牛胎児血清や3T3細胞は用いないが、ウシ脳下垂体抽出物を用いる。ウシの脳に由来するウシ脳下垂体抽出物を用いることは、血清よりもさらに危険性が高く、治療に用いる培養細胞の製造にこの方法を用いるのは非常に危険と考えられる。一方、最近ウシ脳下垂体抽出物を用いない無血清培地が開発され(特許文献1)、これを用いた表皮細胞の培養が期待される。しかしながら、この培地には、アレルゲンとして知られるピーナッツ抽出物が含まれ、この培地で培養した細胞を治療に用いれば、重篤なアレルギーを発生する可能性が懸念される。
【0009】
なお、培養表皮とその製造方法については、上記以外にも多くの提案がなされている(特許文献2から5等)。しかし、いずれも、細胞培養培地中に危険因子である、動物由来血清、脳由来物質(脳下垂体、脳抽出物、脳由来脂質等)、牛由来タンパク質、及び動植物由来アレルゲン物質を含み、あるいは、培養時に栄養支持細胞を必要とし、未知の病原体の感染の可能性が懸念され、いずれも安全性の高い治療用培養細胞の製造方法であるとはいえない。
【先行技術文献】
【非特許文献】
【0010】
【非特許文献1】Cell, (1975) Vol. 6, p.317
【非特許文献2】Cell, (1980) Vol. 19, p.245
【非特許文献3】The Journal of Investigative Dermatology, (1983) Vol. 81, p.33s
【非特許文献4】In Vitro, (1980) Vol. 16, p.516
【非特許文献5】Journal of Tissue Culture Methods, (1985) Vol. 9, p.83
【非特許文献6】Lancet, (1981) Vol. 1, p.75
【非特許文献7】New England Journal of Medicine, (1984) 311, p.448
【非特許文献8】Archives of Dermatology, (1990) Vol. 126, p.175.
【非特許文献9】Archives of Dermatology, (1998) Vol. 134, p.293.
【非特許文献10】British Journal of Plastic Surgery, (2005) Vol. 58, p.988.
【非特許文献11】J Eur Acad Dermatol Venereol. (2004) Vol. 18, p.173.
【非特許文献12】Journal of the American Medical Association, (2002) Vol. 288, p.688
【非特許文献13】J Cell Science vol. 111, p.3179,(1998).
【特許文献】
【0011】
【特許文献1】WO/2004/083400
【特許文献2】特表2007-500001号公報
【特許文献3】特表2006-519024号公報
【特許文献4】特開2004-344007号公報
【特許文献5】特許第3728750号公報
【発明の概要】
【発明が解決しようとする課題】
【0012】
本発明者らは、種々の危険因子や栄養支持細胞を用いることなく培養が可能で、安全性の高い治療用培養細胞の製造方法について鋭意検討した。
その結果、哺乳動物由来から組織を採取し、タンパク質分解酵素処理した後にタンパク質分解酵素阻害剤処理を行い、その際、使用したタンパク質分解酵素の活性を失活させるのに必要な理論量よりも過剰量のタンパク質分解酵素阻害剤で処理することにより、処理後の組織中のタンパク質分解酵素がなるべく残留しないようにすると共に、得られた細胞を培養する際に、低カルシウムイオン濃度の新規培地を用い、さらに培地交換の際には新しい培地を添加してからその一部を除去して行う馴化培養をすることにより、目的を達成できることを見出し本発明を完成した。
【課題を解決するための手段】
【0013】
すなわち、本発明の第一は、治療用培養細胞の製造方法であって;
哺乳動物から細胞を含む組織を採取する組織採取工程:
前記工程で得られた組織を、タンパク質分解酵素を含む酵素溶液中に浸漬する酵素溶液浸漬工程:
前記酵素溶液浸漬工程で得られた組織を、タンパク質分解酵素阻害剤を含む阻害剤溶液に浸漬する阻害剤溶液浸漬工程及び:
以上の工程で得られた細胞を培養して治療用培養細胞を得る培養工程:
を含み、さらに、
前記阻害剤溶液浸漬工程では、酵素溶液浸漬工程における酵素溶液中のタンパク質分解酵素を阻害するのに必要とされるよりも過剰のタンパク質分解酵素阻害剤を含む阻害剤溶液を用い、
前記培養工程では、動物由来血清、脳由来物質、牛由来タンパク質、及び動植物由来アレルゲン物質を実質的に含まず、かつ、カルシウムイオン濃度0.03〜0.1mEq/Lの培地を用い、また、栄養支持細胞を用いることなく、更に培養中に培地交換を行い、その培地交換は、培養に用いられている培地に新しい培地を添加してからその一部を除去して行うことを特徴とする治療用培養細胞の製造方法である。
また、本発明の第二は阻害剤溶液浸漬工程後、さらに、未消化の残渣組織のみを回収し、前記酵素溶液浸漬工程で用いたタンパク質分解酵素と異なるタンパク質分解酵素を含む酵素溶液中に浸漬する第二酵素溶液浸漬工程を含む治療用培養細胞の製造方法である。
【0014】
以下、本発明について、その詳細を説明する。
(治療用培養細胞)
本発明で、治療用培養細胞とは、移植などの治療に用いられる細胞のうち、培養によって得られるものを指す。治療用培養細胞は、治療の用いられる培養細胞であれば、なんら限定されないが、本発明においては、治療用培養細胞は、特に好ましくは、治療用の幹細胞を含む表皮細胞である。
(組織採取工程)
採取される組織は哺乳動物由来で体性幹細胞が含まれることが望ましい。幹細胞とは細胞分裂を経ても同じ分化能を維持する細胞を指し、体性幹細胞とは、幹細胞のうち出生後の生殖組織以外の生体内の各組織に分化する細胞を指す。本発明では、培養において増殖している細胞は一部が体性幹細胞であると考えられる。
本発明における哺乳動物由来の採取組織としては、例えば、ヒトの皮膚組織全層(副耳・余剰指・包皮・頭皮・体幹皮膚・屈曲部皮膚)、臍帯、口腔粘膜、角膜、骨髄、臭粘膜(Olfactory Mucosa)等を挙げることができる。
【0015】
(酵素溶液浸漬工程)
本発明の、酵素溶液浸漬工程で用いるタンパク質分解酵素としては、例えば、トリプシン(Trypsin)、recombinant Trypsin、TrypLE ,Dispase, コラゲナーゼ(Collagenase)等が挙げられ、より具体的には、例えば、0.125%Trypsin/0.01%EDTA溶液(Sigma社製)、TrypZean(Sigma社製)、TrypLE Select Stable Trypsin Replacement Enzyme(GIBCO,Invitrogen), TrypLE Express Stable Trypsin Replacement Enzyme(GIBCO,Invitrogen),Dispase(三光純薬)、Collagenase type-I,II, III,IV,V,X(和光純薬)等を挙げることができる。酵素溶液中のタンパク質分解酵素濃度は、使用するタンパク質分解酵素の種類によって異なるが、通常0.001%以上0.5%以下であり、例えば、タンパク質分解酵素がトリプシンである場合には、0.001%以上0.25%以下、好ましくは0.001%以上0.13%以下である。
酵素溶液浸漬工程における浸漬温度は、好ましくは0℃以上37℃以下、でありより好ましくは4℃以上10℃以下である。また浸漬時間は好ましくは12時間 以上36時間以下であり、より好ましくは16時間以上24時間以下である。また、酵素溶液浸漬の後、遠心分離等の手段で酵素溶液を分離除去する。
【0016】
(阻害剤溶液浸漬工程)
阻害剤溶液浸漬工程で用いるタンパク質分解酵素阻害剤としては、酵素溶液浸漬工程に用いられたタンパク質分解酵素の阻害剤が用いられ、例えば、酵素溶液浸漬工程で用いるタンパク質分解酵素がトリプシンであれば,トリプシン阻害剤(soy bean由来)、トリプシン阻害剤(lima bean由来)、組み換え体Aprotinin等であるのがよく、より具体的には、タンパク質分解酵素阻害剤含有の阻害剤として、例えば、Trypsin Inhibitor (Soy bean)(Wako社製)、Trypsin Inhibitor (lima bean)(Sigma社製),recombinant Aprotinin (Tabaco)(Sigma社製)等を挙げることができ、また、タンパク質分解酵素がコラーゲナーゼでもトリプシンと同様な阻害剤を使用できる。
阻害剤溶液浸漬工程で用いるタンパク質分解酵素阻害剤は、少なくとも酵素溶液浸漬工程で用いた酵素溶液中のタンパク質分解酵素に対して、過剰量のタンパク質分解酵素阻害剤を含む阻害剤溶液を用いる必要があり、この阻害剤溶液浸漬工程では酵素溶液浸漬工程で用いたタンパク質分解酵素を可及的に、好ましくは完全に失活させることが必要である。
【0017】
本発明において、阻害剤溶液浸漬工程でのタンパク質分解酵素阻害剤の使用量は、酵素溶液浸漬工程で用いたタンパク質分解酵素を失活させるのに必要な理論量の通常2倍以上10倍以下、好ましくは2倍以上5倍以下、より好ましくは2倍以上3倍以下であるのがよい。このタンパク質分解酵素阻害剤の使用量が理論量の2倍より少ないと、酵素溶液浸漬工程で用いたタンパク質分解酵素を必要十分な程度にまで失活させることが難しい場合があり、反対に、理論量の10倍量を超えて使用しても、細胞増殖阻害が起こり望ましくない。
【0018】
また、阻害剤溶液浸漬工程において、阻害剤処理は、好ましくは上記酵素処理後の組織を阻害剤溶液中に、浸漬温度0℃以上37℃以下、好ましくは4℃以上25℃以下、及び浸漬時間30分以上6時間以下、好ましくは30分以上2時間以下の条件でスタラー等にて撹拌して浸漬することにより実施され、これに伴って組織から細胞が遊離する。第二酵素浸漬工程を行わない場合はこれらの遊離細胞を回収して培養に用いることができる。遊離細胞は阻害剤溶液浸漬後の混合物を、遊離した細胞(遊離細胞)が通過し、かつ、未消化残渣組織が通過しないポアサイズ、例えば40〜100μm程度のメッシュを用いて濾過し、次いで、得られた濾液溶液から遠心分離等の手段で阻害剤溶液を分離除去することによって回収できる。
【0019】
(培養工程)
培養工程においては、体性幹細胞を含む細胞が増殖培養される。本発明の培養工程では、危険因子である動物由来血清、脳由来物質、牛由来タンパク質、及び動植物由来アレルゲン物質を実質的に含まず、かつ、低カルシウムイオン濃度の培地を用い、また、栄養支持細胞は用いない。
【0020】
ここで危険因子について説明する。動物由来血清とはヒト血清、サル血清、ウシ胎児血清、ウシ血清、ブタ血清、ウマ血清、ロバ血清、ニワトリ血清、ウズラ血清、羊血清、ヤギ血清、イヌ血清、ネコ血清、ウサギ血清、ラット血清、モルモット血清及びマウス血清であり、脳由来物質とは脳下垂体抽出物、脳抽出物、及び脳由来抽出脂質であり、牛由来タンパク質とはウシの体を構成する全てのタンパク質、特にアルブミン、ゼラチンであり、また、動植物由来アレルゲン物質とはピーナッツ、そば、甲殻類、小麦、牛乳及び鶏卵等に由来する物質で、アナフィラキシー等のアレルギーを惹起するおそれのあるものである。
【0021】
また、培地のカルシウムイオン濃度は、0.03mEq/L以上0.1mEq/L以下、好ましくは0.03mEq/L以上0.07mEq/L以下である必要があり、0.03mEq/Lより低くなると細胞増殖阻害・細胞接着阻害という問題が生じ、反対に、0.1mEq/Lより高くなるとFibroblastの過増殖とKeratinocytesの分化促進という問題が生じる。
また細胞培養においては多くの場合3T3細胞、skin fibroblast、CHO細胞、COS-7細胞、Vero細胞、MDBK細胞,STO細胞、BRL細胞、SL-10細胞等が栄養支持細胞として用いられるが、本発明においては、このような栄養支持細胞を用いない。
【0022】
また、培地は、基本的には危険因子を実質的に含まない低カルシウムイオン濃度の細胞培養用の培地であれば何でもよいが、好ましくは、MCDB151培地、MCDB 153培地, MCDB 156培地(Sigma社製商品名:StemlineTM Keratinocyte Basal Medium、Invitrogen社製商品名:Dedined Keratinocyte-SFM)、Ca-free RPMI 1640培地、Ca-free DMEM培地、Ca-free αMEM培地、Ca-free IMDM培地、Ca-free DMEM/F-12, Ca-free DMEM/MCDB201(Invitrogen社製)等の基本培地にCaイオンを0.03〜0.1mEq/Lとなるように添加し、さらにタンパク質分解酵素阻害剤、細胞増殖促進剤、KGF(Keratinocyte Growth Factor)、細胞毒となる活性酸素より発生するラジカルを除くラジカルスカベンジャー等の細胞培養上好適な培地添加剤を通常用いられる範囲の濃度で添加するのがよい。
【0023】
ここで、培地添加剤として添加されるタンパク質分解酵素阻害剤については、上記の阻害剤溶液浸漬工程で用いられるSoy bean由来タンパク質分解酵素阻害剤を始めとして、lima bean由来タンパク質分解酵素阻害剤、遺伝子組換えAprotinin等を例示することができ、その使用量は、通常0.0125重量%以上0.25重量%以下、好ましくは0.025重量%以上0.05重量%以下の範囲であるのがよい。0.0125重量%より少ないと培地添加剤として添加する添加効果に乏しく、反対に、0.25重量%を超えて添加してもあまり添加効果の向上が見られない。
【0024】
また、培地添加剤として添加される細胞増殖促進剤としては、例えば、KGF(Keratinocyte Growth Factor:FGF-7),インシュリン(Insulin)、トランスフェリン(Transferrin)、セレニウム(Selenium)、エタノールアミン(Ethanolamine)、脂質、ビタミンC及びビタミンC誘導体等を挙げることができ、これらはその1種のみを添加してもよく、また、2種以上を添加してもよい。なお、上記の脂質としては、例えば、(Arachidonic acid)、コレステロール(Cholesterol)、(DL-a-Tocopherol-acetate)、(Linoleic acid)、(Linolenic acid)、(Myristic acid)、(Oleic acid)、(Palmitoleic acid)、(Palmitic acid)、(Stearic acid)、Tween:80)、Pluronic F68(Sigma社又はInvitrogen社)等から選ばれた1種又は2種以上の混合物を例示することができる。
【0025】
更に、倍地添加剤として添加されるラジカルスカベンジャーとしては、例えば、還元グルタチオン(Reduced glutathione)、ビタミンE、ビタミンE誘導体、カタラーゼ(Catalase)、SOD(Superoxide Dismutase)等を挙げることができ、これらはその1種のみを添加してもよく、また、2種以上を添加してもよい。
【0026】
本発明において、基本培地に添加される培地添加剤としては、上記のもの以外に、TGF-α(Trans Growth Factor-alpha)、EGF(Epidermal Growth Factor)、FGF-2(Fibroblast Growth Factor-2)、活性型ビタミンD、塩化リチウム(LiCl)、アクチビン(Activin)、CCL-27{Chemokine(C-C motif) ligand 27}、2-メルカプトエタノール(2-mercaptoethanol)等を挙げることができ、これらはその1種のみを添加してもよく、また、2種以上を添加してもよい。これらは通常の範囲の添加量が用いられる。
【0027】
細胞は培養開始時においては1×104〜6/cm2となるように細胞培養容器に播種し、37℃にてCO2インキュベータ内で培養する。さらには、本発明の培養工程では、馴化培養を行う。一般的に、細胞培養の際は数日ごとに培地の交換を行うが、馴化培養とは培地交換を穏やかに行う培養をいう。具体的には、馴化培養においては、培養に用いられている培地をすべて除いて新しい培地に取り替えるのではなく、あらかじめ新しい培地を添加してから、培地全体の一部を除去して行うことにより培地を交換する。この際、新しい培地を添加した後に、しばらく培養を行ってから、一部除去を行ってもよいし、新しい培地の添加や培地の除去は複数回に分けて行ってもよい。また、このような培地交換は、培養開始後の始めての培養交換の際に行ってもよいし、また、2回目以後の培地交換の際に行ってもよいし、その両方で行ってもよい。
【0028】
細胞培養の際の細胞培養容器としては、ディッシュ、フラスコ、マイクロプレート、細胞培養シートなどが挙げられる。これらの容器は細胞との接着性を向上させるために、コラーゲン、ゼラチン、ポリ−L−リジン、ポリ−D−リジン、ラミニン、フィブロネクチンなどの細胞支持用基質でコーティングされてもよい。なお、細胞培養シートとは、細胞をシート状に培養することを目的する支持体を指し、例えばOptiCell(Nunc社製)が市販されている。細胞培養シートを用いれば、細胞をシート状に培養し、細胞シートを得ることができる。細胞シートはさらに空気透過性接着剤付シートに培養細胞が接着している面を外側にして、培養細胞が接着していない面をシート接着剤塗布面側に貼り付けて治療用の幹細胞を含む表皮細胞とすることができる。
【0029】
(第二酵素溶液浸漬工程)
本発明の第二における第二酵素溶液浸漬工程においては、未消化の残渣組織のみを回収し、前記酵素溶液浸漬工程で用いたタンパク質分解酵素以外のタンパク質分解酵素を含む酵素溶液中に浸漬する。このとき、酵素溶液には、前記酵素溶液浸漬工程で用いたタンパク質分解酵素以外のタンパク質分解酵素が用いられ、好ましくはコラーゲナーゼが用いられる。この工程では酵素溶液に浸漬した組織から体性幹細胞を含む被培養細胞を分離して回収する。これによって、本発明の第一では回収されずに未消化残渣組織中に残留した体性幹細胞が分離回収される。
第二酵素溶液浸漬工程は、未消化残渣組織を酵素溶液中に0℃以上37℃以下、好ましくは4℃以上25℃以下で、12時間以上36時間以下、好ましくは16時間以上24時間以下の条件で浸漬することにより実施され、その後、例えばスタラー等で攪拌後、メッシュ濾過し、その濾液を遠心分離等の手段で酵素溶液を除去して細胞を回収する。
【0030】
(酵素処理なく浮遊する細胞の採取)
本発明の対応の一においては、培養工程において、酵素処理なく浮遊する細胞を採取する工程を含んでもよい。ここで、酵素処理なく浮遊する、とは、酵素を用いずとも、浮遊することを指し、何ら処理をせずとも自然に浮遊する場合、あるいは、ピペッティングのように物理的な処理のみで剥離して、浮遊する場合を含む。このように浮遊してきた細胞を採取することにより、球状の表皮幹細胞であるSpheroid細胞を採取することができる。浮遊してくる細胞には、Spheroid細胞以外にも浮遊細胞や、死細胞が含まれる場合もあるが、これらは除去してもよいし、あるいは、Spheroid細胞と共に培養されても、それらの細胞は増殖能しないため、問題はない。
【発明の効果】
【0031】
本発明によれば血清・脳下垂体抽出物・栄養細胞やアレルゲンを用いないで、体性幹細胞を含有する皮膚細胞群を培養取得でき、その結果この細胞を用いて熱傷・褥創・糖尿病性下腿潰瘍等の皮膚疾患を従来より安全且つより有効性高く治療することができる。
また、この細胞群を用いて種々の体細胞に分化させれば、肝硬変・腎疾患・脊椎損傷・脳梗塞・パーキンソン病・アルツハイマー病・糖尿病等の全身疾患に適応可能となる。
【図面の簡単な説明】
【0032】
【図1】実験全体の概要図
【図2】培養初期(培養4日目):組織よりの細胞の培養面への接着開始
【図3】培養初期(培養7日目):コロニーの分散・拡大
【図4】培養中期(培養10日目):コロニー間の接着・融合
【図5】培養後期(培養14日目):Spheroid様表皮幹細胞の出現
【図6】OptiCell(細胞培養シート)上に実験例2の方法で培養された細胞群(ギムザ染色)
【図7】OptiCell(細胞培養シート)上に実験例3の方法で培養された細胞群(ギムザ染色)
【図8】OptiCell(細胞培養シート)上に実験例4の方法で培養された細胞群(ギムザ染色)
【図9】OptiCell(細胞培養シート)上に実験例5の方法で培養された細胞群(ギムザ染色)
【図10A】実験例6においてROCK(Rho-associated kinase)阻害剤Y-27632で処理してからTrypZean で処理して調製されて培養された細胞群。
【図10B】実験例6においてTrypZean で処理してからROCK(Rho-associated kinase)阻害剤Y-27632で処理して調製されて培養された細胞群。
【図10C】実験例6においてROCK(Rho-associated kinase)阻害剤、TrypZeanによる処理は行わずに調製されて培養された細胞群。
【図11】実施例11においてAnti-Cytokeratin15抗体で染色した結果を示す。
【発明を実施するための形態】
【0033】
以下に本発明の例を挙げて説明するが、本発明の範囲は以下の例のみに限定されるものではない。なお、図1に本実施例の概要を示す。
【0034】
[実施例1]
(組織の採取)
美容整形手術時に顔部から切除されたヒト皮膚組織の全層部分を採取し、毛根が存在する箇所を残して皮下及び真皮結合組織を可及的に滅菌した鋏とピンセットで除去し、更に鋏で1×10mm2程度に細切して細切組織を得た。得られた細切組織をペニシリン1000u/ml及びストレプトマイシン1mg/mlを含むCaイオン及びMgイオン不含等張燐酸緩衝液(PBS(-))に3回浸漬して除菌した。
【0035】
(酵素処理)
次いで予め4℃に冷却したトリプシン溶液〔0.125%Trypsin/0.01%EDTA/PBS(-)〕10ml中に浸漬し、4℃に維持して一昼夜静置し、採取組織の酵素処理を行った。
【0036】
(阻害剤処理)
酵素処理後の組織を遠心分離してトリプシン溶液を除いた後、直ちにトリプシン阻害剤溶液〔0.25%Trypsin Inhibitor (Soy bean)/MCDB153; Trypsinの2.4倍モル濃度〕20ml中に入れ、磁石回転子を用いて室温下に30分間撹拌し、トリプシンの酵素活性を失活させると共に、組織から培養に用いる細胞を遊離させた。
【0037】
(細胞の調製)
阻害剤処理後の処理溶液をポアサイズ100μmのメッシュで濾過して未消化組織を除き、得られた濾過溶液を遠心分離してトリプシン阻害剤溶液を除き、ペレット状態で細胞を得た。
【0038】
(培養)
培養皿としてType I-collagenを塗布した細胞培養用皿(100mm)(BD Falcon社製)を用い、また、培地として下記の組成の細胞培養培地10mlを用い、得られた細胞を1〜2×104〜5/cm2の密度で播種して37℃で培養を開始した。
細胞培養培地は以下のとおり調製された。すなわち、基本培地のMCDB 153培地(Sigma社製商品名:StemlineTM Keratinocyte Basal Medium)中に、インシュリン(10mg/L)、トランスフェリン(5.5mg/L)、セレニウム(6.7μg/L)、Ethanolamine(2mg/L)、ビタミンC(L-Ascorbic acid 2-phosphate semimagnesium salt)(50μg/L)、KGF(Keratinocyte Growth Factor:10ng/L)、脂質(脂肪酸混合物、Arachidonic acid:20μg/L; Cholesterol:2.2mg/L; DL-a-Tocopherol-acetate:700μg/L; Linoleic acid:100μg/L; Linolenic acid:100μg/L; Myristic acid:100μg/L; Oleic acid:100μg/L; Palmitoleic acid:100μg/L; Palmitic acid:100μg/L; Stearic acid:100μg/L; Tween:80 22mg/L; Pluronic F-68:1000 mg/L)を添加して調製した。
培養開始に際しては、7日目までは培地交換をすることなく3ml/3dayの割合で培地を添加しつつ馴化培養を行い、その後に3日毎に培地を半交換しながら培養を行った。70%コンフルエンスに達するまで14日間を要した。
なお、MCDB 153培地の組成は以下の通りである。なお、3.33mg/Lの無水塩化カルシウムは0.03mEqに相当する。
【0039】
【表1】

【0040】
(培養された細胞の調製)
培養された細胞をPBS(-)にて2回洗浄し、TrypZean2mlを加えて、室温3分間酵素処理を行い、その後直ちに2倍量のトリプシン阻害剤溶液〔0.25%Trypsin Inhibitor (Soy bean)/MCDB153; Trypsinの2.4倍モル濃度〕4mlを加えて酵素阻害をしてから、培養された細胞を細胞培養用皿からセルスクレーパーを用いて剥がした。
【0041】
(培養された細胞の凍結など)
調製された細胞を遠心管に集めて遠心し、ペレットを治療用細胞とした。ペレットはそのまま又は凍結又は凍結乾燥して治療用細胞として用いることができる。
本実施例における培養の様子を図2から図5に示す。図2に培養初期(培養4日目)の状態を示す。組織よりの細胞の培養面への接着が開始していることが観察された。
図3に培養初期(培養7日目)の状態を示す。コロニーが分散・拡大している様子が観察された。
図4に培養中期(培養10日目)の状態を示す。コロニー間に接着・融合が起きている様子が観察された。一面に一層の表皮細胞によって培養底面が満たされた。
図5に培養後期(培養14日目)の状態を示す。球状(Spheroid様)の表皮幹細胞(Spheroid塊)の出現が観察された。一層の表皮細胞によって満たされた培養面上にSpheroid様の表皮幹細胞が出現した。このSpheroid細胞群は酵素を用いないでも物理的にピッペティングで剥離され、その剥離細胞は他の培養皿や細胞培養シートに移すと再度図2から図5のように変化し細胞が増えていった。
【0042】
本実施例では、本発明の第一である。
哺乳動物から細胞を含む組織(本実施例ではヒト皮膚組織)を採取する組織採取工程:
前記工程で得られた組織を、タンパク質分解酵素(本実施例ではトリプシン)を含む酵素溶液中に浸漬する酵素溶液浸漬工程:
前記酵素溶液浸漬工程で得られた組織を、タンパク質分解酵素阻害剤を含む阻害剤溶液(本実施例ではトリプシンインヒビター)に浸漬する阻害剤溶液浸漬工程及び:
以上の工程で得られた細胞を培養して治療用培養細胞を得る培養工程:
を含み、さらに、
前記阻害剤溶液浸漬工程では、酵素溶液浸漬工程における酵素溶液中のタンパク質分解酵素を阻害するのに必要とされるよりも過剰のタンパク質分解酵素阻害剤(本実施例では2.4倍)を含む阻害剤溶液を用い、
前記培養工程では、動物由来血清、脳由来物質、牛由来タンパク質、及び動植物由来アレルゲン物質を実質的に含まず、かつ、カルシウムイオン濃度0.03〜0.1mEq/L(本実施例では0.03mEq mEq)の培地を用い(MCDB)、また、栄養支持細胞を用いることなく、更に培養中に培地交換を行い、その培地交換は、培養に用いられている培地に新しい培地を添加してからその一部を除去して行うこと(本実施例では7日目以降3日毎に半交換)を特徴とする治療用培養細胞の製造方法
により、十分な増殖能を有する治療用培養細胞を得られさらに、培養後期においては、Spheroid細胞群を確認することができた。
【0043】
[実施例2]
(組織採取)
実施例1と同様に行った。
(酵素処理)
実施例1と同様に行った。
(阻害剤処理)
実施例1と同様に行った。
(細胞の調製)
実施例1と同様に行った。
(培養)
実施例1と同様に行った。ただし、本実施例では70%コンフルエンスに達するまで10日間増殖培養を要した点において実施例1と異なる。
(培養された細胞の調製)
実施例1と同様に行った。
【0044】
(細胞シートの調製)
上記の調製によって得られた細胞を遠心して、ペレットとして回収し、剥離液から分離した。基本培地に前に培養に用いた培地を濾過滅菌したものを等量加え、更に全量の1/10量の0.25% Trypsin Inhibitor溶液と1/100量のB-27(Invitrogen GIBCO社製:Anti-Oxidants Mixture)を加えた培養液を調製した。これを用いてペレットの細胞を分散し、注射等にてOptiCellに入れて培養した。その結果、膜状に一定数の細胞コロニーに達した(図6)。培養された細胞は、細胞付膜を細胞の接着していないシート側をシートより表面積の大きい空気透過性の医療用接着剤シート面に貼った。これをそのまま又は凍結又は凍結乾燥して移植治療用の細胞シートとして用いることができる。
本実施例では、本発明の第一における培養工程において、細胞培養シートを用いて培養を行い、細胞シート、さらに空気透過性接着剤付シートに貼り付けた細胞シートを得ることができた。
【0045】
[実施例3]
(組織採取)
実施例1と同様に行った。
(酵素処理)
実施例1と同様に行った。
(阻害剤処理)
実施例1と同様に行った。
【0046】
(未消化組織からの細胞の調製)
阻害剤処理後の処理溶液をポアサイズ100μmのメッシュで濾過し、未消化組織をメッシュ上に得た。この未消化組織を0.05% collagenase type Iと2.5mM CaCl2を終濃度で加えた基本培地に浸して1昼夜、4℃に静置した。翌日0.5% collagenase type Iと2.5mM CaCl2を終濃度で加えた基本培地に組織を移し、室温で磁石回転子を用いて30分間撹拌した。この消化物をピペットでサスペンドして組織を可及的にほぐし、再度メッシュ(100 μm pore size)で濾過して余分な組織を除いたろ液を得た。ろ過溶液を遠心分離により除き、ペレット状態で細胞を得た。
【0047】
(培養)
上記で得た細胞を下記の実施例1と同様の培地にサスペンドして、type-I collagen塗布培養dishに1.3×105 cells/cm2の密度で播種して培養を開始した。
培養1週間は、培地を除去せず添加のみ行った。2週目より遠心して細胞を集めて全培地交換を行ったが、この培地交換で遊離してきた細胞は再度培養皿に戻した。12日目に細胞が70%コンフルエンスに達した。
【0048】
(培養された細胞の調製)
実施例1と同様に行った。
【0049】
(細胞シートの調製)
実施例2と同様に行った。OptiCellで培養中の細胞をギムザ染色したものを図7に示す。コロニーが均一に存在する。阻害剤処理後の未消化の組織から調製された細胞を培養に用いることにより、より均一な細胞シートを得ることができたと推測される。
本実施例では、本発明の第一において、阻害剤(トリプシン)溶液浸漬工程後、さらに、未消化の残渣組織のみを回収し、前記酵素溶液浸漬工程で用いたタンパク質分解酵素と異なるタンパク質分解酵素(コラゲナーゼ)を含む酵素溶液中に浸漬する第二酵素溶液浸漬工程を含むことにより、細胞を得、その培養に成功し、さらに、より均一な細胞シートの作製に成功した。
【0050】
[実施例4]
(組織の採取)
実施例1と同様に行った。
(酵素処理)
実施例1と同様に行った。
(阻害剤処理)
実施例1と同様に行った。
(細胞の調製)
実施例1と同様に行った。
(培養)
実施例1と同様に行った。ただし、本実施例においては、100%コンフルエンスに達するのに10日間要し、その後、さらにコンフルエンス後の培養を行った。
(コンフルエンス後の培養及び細胞の調製)
細胞が100%コンフルエンスに達してから、更に培養を続けると4日後から表皮細胞シート上にSpheroid塊が出現した。Spheroid塊のみをピペッティング操作のみで下の表皮細胞シートから剥がし、以下の細胞シートの調製に用いた。
(細胞シートの調製)
実施例2と同様に行った。OptiCellで培養中の細胞をギムザ染色したものを図8に示す。コロニーがより均一に存在する。コンフルエンス後の培養におけるSpheroid塊から、酵素を用いないでピペッティングで剥離された細胞を培養に用いることにより、より均一なコロニーを得ることができたと推測される。
【0051】
本実施例では、本発明の第一の培養工程において、培養工程において、酵素処理することなく浮遊する細胞を採取することにより、Spheroid塊を得、さらに、これを用いて細胞シートの作製を行い、より均一なコロニーを得られた。
【0052】
[実施例5]
(組織採取)
実施例1と同様に行った。
(酵素処理)
実施例1と同様に行った。
(阻害剤処理)
実施例1と同様に行った。
(未消化組織からの細胞の調製)
実施例3と同様に行った。
(培養)
実施例3と同様に行った。ただし、本実施例では100%コンフルエンスに達するのに10日間を要し、その後さらにコンフルエンス後の培養を行った。
(コンフルエンス後の培養及び細胞の調製)
100%コンフルエンスに達してから、更に培養を続けると、本実施例では5日後から表皮細胞シート上に細胞のSpheroid塊が出現した。このSpheroid塊のみをピペッティング操作だけで下の表皮細胞シートから剥がし、以下の細胞シートの調製に用いた。
(細胞シートの調製)
実施例2と同様に行った。OptiCellで培養中の細胞をギムザ染色したものを図9に示す。コロニーが非常に均一に存在する。阻害剤処理後の未消化の組織から細胞培養に用い、さらにコンフルエンス後の培養におけるSpheroid塊から、酵素を用いないでピペッティングで剥離された細胞を培養に用いることにより、非常に均一なコロニーを得ることができたと推測される。
【0053】
本実施例では、本発明の第一において、阻害剤(トリプシン)溶液浸漬工程後、さらに、未消化の残渣組織のみを回収し、前記酵素溶液浸漬工程で用いたタンパク質分解酵素と異なるタンパク質分解酵素(コラゲナーゼ)を含む酵素溶液中に浸漬する第二酵素溶液浸漬工程を含むことにより細胞を得、さらに、培養工程において、酵素処理することなく浮遊する細胞を採取することにより、Spheroid塊を得、これを用いて細胞シートの作製を行い、非常に均一なコロニーを得られた。
【0054】
[実施例6]
(組織採取)
実施例1と同様に行った。ただし、本実施例では、すべての実施例中で最高齢である80歳代のヒト由来の組織を用いた。
(酵素処理)
実施例1と同様に行った。
(阻害剤処理)
実施例1と同様に行った。
(未消化組織からの細胞の調製)
実施例3と同様に行った。
(培養)
実施例3と同様に行った。ただし、本実施例では組織量が少なく、採取細胞数が少なかったため、6wellプレートに細胞を播種した。70%コンフルエンスに達するのに14日間を要した。
(70%コンフルエンス後の継代培養及び細胞の調製)
70%コンフルエンスに達してから、細胞を100mm Dish(type-I collagen coated)3枚に継代し培養した。培養14日で70%コンフルエンスに達したので、Opti-Cellへ継代培養した。
【0055】
(細胞シートの調製)
以下の条件を除き、実施例3と同様に行った。本実施例では3枚の細胞シートをした。すなわち、1枚目のシートの調製では細胞をTrypZean処理前に10μM ROCK(Rho-associated kinase)阻害剤Y-27632で処理した。その後Opi-Cell枚に継代し、さらに10μM Y-27632を含む培地を用いて培養を行った。2枚目の細胞シートの調製では、細胞をTrypZean処理後にY-27632で処理を行い、Opi-Cell枚に継代し、さらに10μM Y-27632を含む培地を用いて培養を行った。3枚目のシートの調製では阻害剤を用いないで細胞シートを調製した。3枚の細胞シートについて、調製から1週間後の細胞の増殖を図10AからCに示す。図10Aは培養中ROCK(Rho-associated kinase)阻害剤Y-27632で処理してからTrypZean で処理して調製された細胞、図10Bは培養中TrypZean で処理してからROCK(Rho-associated kinase)阻害剤Y-27632で処理して調製された細胞、図10Cは ROCK(Rho-associated kinase)阻害剤、TrypZeanによる処理は行わずに調製された細胞を示す。図10Aにおいて顕著に細胞の増殖が認められ、ROCK 阻害剤による前処理は効果的であることが示唆される。
【0056】
本実施例では、本発明の第一において、阻害剤(トリプシン)溶液浸漬工程後、さらに、未消化の残渣組織のみを回収し、前記酵素溶液浸漬工程で用いたタンパク質分解酵素と異なるタンパク質分解酵素(コラゲナーゼ)を含む酵素溶液中に浸漬する第二酵素溶液浸漬工程を含むことにより細胞を得、これを用いて細胞シートの作製を行った。10μM ROCK(Rho-associated kinase)阻害剤Y-27632を含む培地を用いることで、より顕著な細胞の増殖に成功した。また、80歳代のヒトの組織からも細胞シートの作製が可能であることが示された。
【0057】
[実施例7]
(組織採取)
実施例1と同様に行った。ただし、本実施例では、60歳代のヒト由来の顔部皮膚組織を用いた。
(酵素処理)
実施例1と同様に行った。
(阻害剤処理)
実施例1と同様に行った。
【0058】
(未消化組織からの細胞の調製)
阻害剤処理後の処理溶液をポアサイズ100μmのメッシュで濾過し、未消化組織をメッシュ上に得た。この未消化組織を直ぐに0.5% collagenase type Iと2.5mM CaCl2を終濃度で加えた基本培地に組織を移し、室温で磁石回転子を用いて1時間撹拌した。この消化物をピペットでサスペンドして組織を可及的にほぐし、再度メッシュ(100 μm pore size)で濾過して余分な組織を除いたろ液を得た。ろ過溶液を遠心分離により除き、ペレット状態で細胞を得た。
【0059】
(培養)
上記のトリプシンとコラーゲナーゼの両方から得た細胞を1:1の割合で混合し、15〜1×104 cells/cm2の細胞密度で100mmの培養皿に播種して培養を開始した。
(サイトケラチン15発現細胞の調製)
培養細胞が100%コンフルエンスに達して、spheroid細胞集団が多数発現し始めた段階で、4%パラホルムアルデヒド/PBS(-)液に20分以上細胞を室温で浸漬して細胞固定を行った。この時、2枚のdishを用意した。
【0060】
(サイトケラチン15発現細胞の同定=skin stem cellの同定)
近年表皮に幹細胞(表皮幹細胞)が存在することが報告され、表皮幹細胞は毛嚢のバルジ領域に存在し、サイトケラチン15を発現していることが明らかにされている(非特許文献13)。この幹細胞は表皮の角化細胞、毛嚢の脂腺細胞、そして毛の細胞に分化する能力を有している。もし、この幹細胞を同時に培養できれば、この移植体は従来の表皮のみならず毛や脂腺の形成が起こすことが可能となる。そこで本実施例では、上記実施例で得られた細胞中の、表皮幹細胞の有無を同定するために、サイトケラチン15の発現を、抗体染色によって観察した。
詳細には、次のとおり行った。すなわち、2枚のdishの上記固定細胞の固定液を除去後、0.3%過酸化水素水/40%メタノール液に一晩浸漬して内因性のペルオキシダーゼをブロッキングした。次に1% BSA/PBS(-)液で10分間3回、細胞を洗浄した。洗浄後、0.3% Triton X-100/1%BSA/10%FCS/PBS(-)液に室温で45分間、細胞を浸漬して細胞膜に穴を開けた。再度、1% BSA/PBS(-)液で10分間3回、細胞を洗浄した後、1枚のdishのみに1次抗体として、抗ヒトサイトケラチン15モノクロナール・マウスIgG抗体(DBS Mob 305)を1%BSA/10%FCS/PBS(-)液で希釈したもので浸漬し、一晩4℃で保存した。もう1枚のdishは抗体を入れない1%BSA/10%FCS/PBS(-)液で同様に処理した。以下工程からは両dishの処理法は同様に行った。1次抗体処理後、1% BSA/PBS(-)液で5分間3回、細胞を洗浄した。次に抗マウスIgGビオチン化抗体の希釈液(Vector Lab: Vectastain Elite ABC kit)で室温で暗所に1時間浸漬した。次に1% BSA/PBS(-)液で5分間3回、細胞を洗浄した後、avidin-biotin複合体(Vector Lab: Vectastain Elite ABC kit)に1時間浸漬した。次に水で10倍希釈したPBS(-)液に10分浸漬した。次に直前に調製したDAB溶液(Sigma: )を細胞に浸漬し、直ちに位相差顕微鏡下で反応の進行を観察した。約3分後充分反応が進んだので流水にて反応を停止させた。以上の結果、1次抗体を加えなかったdishの細胞は全て陰性を示したが、1次抗体を加えたdish上の細胞は陽性を示した。図11にAnti-Cytokeratin15抗体染色した結果を示す。Sheroid 細胞のみが染色され、これらがヒトケラチン15陽性であり、表皮幹細胞であることが分かる。
【0061】
なお、1次抗体を加えたdishにおいては、陽性を示す細胞は、シート状に培養されたケラチノサイトではなく、spheroid状になる細胞のみに観察された。以上より、この培養法で出現するspheroid細胞はskin stem cellであることが証明された。
本実施例では、阻害剤溶液浸漬工程で得られる細胞と、第二酵素溶液浸漬工程で得られる細胞とを混合して培養することに細胞を得た。さらに、抗体染色により、本培養で得られる細胞が、skin stem cellを含むことが分かった。
【特許請求の範囲】
【請求項1】
治療用培養細胞の製造方法であって;
哺乳動物から細胞を含む組織を採取する組織採取工程:
前記工程で得られた組織を、タンパク質分解酵素を含む酵素溶液中に浸漬する酵素溶液浸漬工程:
前記酵素溶液浸漬工程で得られた組織を、タンパク質分解酵素阻害剤を含む阻害剤溶液に浸漬する阻害剤溶液浸漬工程及び:
以上の工程で得られた細胞を培養して治療用培養細胞を得る培養工程:
を含み、さらに、
前記阻害剤溶液浸漬工程では、酵素溶液浸漬工程における酵素溶液中のタンパク質分解酵素を阻害するのに必要とされるよりも過剰のタンパク質分解酵素阻害剤を含む阻害剤溶液を用い、
前記培養工程では、動物由来血清、脳由来物質、牛由来タンパク質、及び動植物由来アレルゲン物質を実質的に含まず、かつ、カルシウムイオン濃度0.03〜0.1mEq/Lの培地を用い、また、栄養支持細胞を用いることなく、更に培養中に培地交換を行い、その培地交換は、培養に用いられている培地に新しい培地を添加してからその一部を除去して行うことを特徴とする治療用培養細胞の製造方法。
【請求項2】
酵素溶液浸漬工程は0〜37℃の温度範囲で実施される請求項1に記載の治療用培養細胞の製造方法。
【請求項3】
阻害剤溶液浸漬工程において阻害剤溶液中のタンパク質分解酵素阻害剤の量が、酵素溶液浸漬工程で用いたタンパク質分解酵素を阻害するのに必要な理論量の2〜10倍である請求項1又は2に記載の治療用培養細胞の製造方法。
【請求項4】
酵素溶液浸漬工程におけるタンパク質分解酵素がトリプシン又はコラーゲナーゼ又はそれらの混合物であり、阻害剤浸漬工程におけるタンパク質分解酵素阻害剤がトリプシン阻害剤である請求項1から3のいずれかに記載の治療用培養細胞の製造方法。
【請求項5】
阻害剤溶液浸漬工程後、さらに、未消化の残渣組織のみを回収し、前記酵素溶液浸漬工程で用いたタンパク質分解酵素と異なるタンパク質分解酵素を含む酵素溶液中に浸漬する第二酵素溶液浸漬工程を含む請求項1から4のいずれかに記載の治療用培養細胞の製造方法。
【請求項6】
第二酵素溶液浸漬工程が0〜37℃の温度範囲で実施される請求項5に記載の治療用培養細胞の製造方法。
【請求項7】
第二酵素溶液浸漬工程で用いられる酵素溶液中のタンパク質分解酵素が、コラーゲナーゼである請求項5又は6に記載の治療用培養細胞の製造方法。
【請求項8】
請求項5から7のいずれかに記載の治療用培養細胞の製造方法であって;
阻害剤溶液浸漬工程で得られる細胞と、第二酵素溶液浸漬工程で得られる細胞とを混合して培養して治療用培養細胞を得る培養工程をさらに含む治療用細胞の製造方法。
【請求項9】
培養工程で用いる培地には、タンパク質分解酵素阻害剤が0.25〜2.5重量%の範囲で添加されている請求項1から8のいずれかに記載の治療用培養細胞の製造方法。
【請求項10】
培養工程で用いる培地には、細胞増殖促進剤としてインシュリン(Insulin)、トランスフェリン(Transferrin)、セレニウム(Selenium)、エタノールアミン(Ethanolamine)、脂質、ビタミンC及びビタミンC誘導体から選ばれる1種又は2種以上が1〜20000nMol/Lの範囲で添加されている請求項1〜9のいずれかに記載の治療用培養細胞の製造方法。
【請求項11】
培養工程で用いる培地には、KGF(Keratinocyte Growth Factor)が0.1〜100ng/Lの範囲で添加されている請求項1から10のいずれかに記載の治療用培養細胞の製造方法。
【請求項12】
培養工程で用いる培地には、細胞毒となる活性酸素より発生するラジカルを除くラジカルスカベンジャーとして、還元グルタチオン(Reduced glutathione)、ビタミンE、ビタミンE誘導体、カタラーゼ(Catalase)、及びSOD(Superoxide Dismutase)から選ばれた1種又は2種以上が1〜1000nMol/Lの範囲で添加されている請求項1から11のいずれかに記載の治療用培養細胞の製造方法。
【請求項13】
培養工程で用いる培地には、ROCK(Rho-associated coiled-coil forming kinase)阻害剤(Y-27632,Fasudil)、TGF-α(Transforming Growth Factor-alpha)、EGF(Epidermal Growth Factor)、FGF-2(Fibroblast Growth Factor-2)、活性型ビタミンD、塩化リチウム(LiCl)、アクチビン(Activin)、CCL-27{Chemokine(C-C motif) ligand 27}、及び2-メルカプトエタノール(2-mercaptoethanol)から選ばれた1種又は2種以上が1nMol/L〜0.1mMol/Lの範囲で添加されている請求項1から12のいずれかに記載の治療用培養細胞の製造方法。
【請求項14】
前記培養工程において、培養開始からはじめの培地交換まで3〜10日後培養することを特徴とする請求項1から13のいずれかに記載の治療用培養細胞の製造方法。
【請求項15】
前記培養工程において、酵素処理なく浮遊する細胞を採取する請求項1から14のいずれかに記載の治療用培養細胞の製造方法。
【請求項16】
前記培養工程において、細胞培養シートを用いて培養を行い、シート形成前の細胞、形成された細胞シート、または形成された細胞シートを空気透過性接着剤付シートに貼り付けたものを、治療用培養細胞とする請求項1から15のいずれかに記載の治療用培養細胞の製造方法。
【請求項1】
治療用培養細胞の製造方法であって;
哺乳動物から細胞を含む組織を採取する組織採取工程:
前記工程で得られた組織を、タンパク質分解酵素を含む酵素溶液中に浸漬する酵素溶液浸漬工程:
前記酵素溶液浸漬工程で得られた組織を、タンパク質分解酵素阻害剤を含む阻害剤溶液に浸漬する阻害剤溶液浸漬工程及び:
以上の工程で得られた細胞を培養して治療用培養細胞を得る培養工程:
を含み、さらに、
前記阻害剤溶液浸漬工程では、酵素溶液浸漬工程における酵素溶液中のタンパク質分解酵素を阻害するのに必要とされるよりも過剰のタンパク質分解酵素阻害剤を含む阻害剤溶液を用い、
前記培養工程では、動物由来血清、脳由来物質、牛由来タンパク質、及び動植物由来アレルゲン物質を実質的に含まず、かつ、カルシウムイオン濃度0.03〜0.1mEq/Lの培地を用い、また、栄養支持細胞を用いることなく、更に培養中に培地交換を行い、その培地交換は、培養に用いられている培地に新しい培地を添加してからその一部を除去して行うことを特徴とする治療用培養細胞の製造方法。
【請求項2】
酵素溶液浸漬工程は0〜37℃の温度範囲で実施される請求項1に記載の治療用培養細胞の製造方法。
【請求項3】
阻害剤溶液浸漬工程において阻害剤溶液中のタンパク質分解酵素阻害剤の量が、酵素溶液浸漬工程で用いたタンパク質分解酵素を阻害するのに必要な理論量の2〜10倍である請求項1又は2に記載の治療用培養細胞の製造方法。
【請求項4】
酵素溶液浸漬工程におけるタンパク質分解酵素がトリプシン又はコラーゲナーゼ又はそれらの混合物であり、阻害剤浸漬工程におけるタンパク質分解酵素阻害剤がトリプシン阻害剤である請求項1から3のいずれかに記載の治療用培養細胞の製造方法。
【請求項5】
阻害剤溶液浸漬工程後、さらに、未消化の残渣組織のみを回収し、前記酵素溶液浸漬工程で用いたタンパク質分解酵素と異なるタンパク質分解酵素を含む酵素溶液中に浸漬する第二酵素溶液浸漬工程を含む請求項1から4のいずれかに記載の治療用培養細胞の製造方法。
【請求項6】
第二酵素溶液浸漬工程が0〜37℃の温度範囲で実施される請求項5に記載の治療用培養細胞の製造方法。
【請求項7】
第二酵素溶液浸漬工程で用いられる酵素溶液中のタンパク質分解酵素が、コラーゲナーゼである請求項5又は6に記載の治療用培養細胞の製造方法。
【請求項8】
請求項5から7のいずれかに記載の治療用培養細胞の製造方法であって;
阻害剤溶液浸漬工程で得られる細胞と、第二酵素溶液浸漬工程で得られる細胞とを混合して培養して治療用培養細胞を得る培養工程をさらに含む治療用細胞の製造方法。
【請求項9】
培養工程で用いる培地には、タンパク質分解酵素阻害剤が0.25〜2.5重量%の範囲で添加されている請求項1から8のいずれかに記載の治療用培養細胞の製造方法。
【請求項10】
培養工程で用いる培地には、細胞増殖促進剤としてインシュリン(Insulin)、トランスフェリン(Transferrin)、セレニウム(Selenium)、エタノールアミン(Ethanolamine)、脂質、ビタミンC及びビタミンC誘導体から選ばれる1種又は2種以上が1〜20000nMol/Lの範囲で添加されている請求項1〜9のいずれかに記載の治療用培養細胞の製造方法。
【請求項11】
培養工程で用いる培地には、KGF(Keratinocyte Growth Factor)が0.1〜100ng/Lの範囲で添加されている請求項1から10のいずれかに記載の治療用培養細胞の製造方法。
【請求項12】
培養工程で用いる培地には、細胞毒となる活性酸素より発生するラジカルを除くラジカルスカベンジャーとして、還元グルタチオン(Reduced glutathione)、ビタミンE、ビタミンE誘導体、カタラーゼ(Catalase)、及びSOD(Superoxide Dismutase)から選ばれた1種又は2種以上が1〜1000nMol/Lの範囲で添加されている請求項1から11のいずれかに記載の治療用培養細胞の製造方法。
【請求項13】
培養工程で用いる培地には、ROCK(Rho-associated coiled-coil forming kinase)阻害剤(Y-27632,Fasudil)、TGF-α(Transforming Growth Factor-alpha)、EGF(Epidermal Growth Factor)、FGF-2(Fibroblast Growth Factor-2)、活性型ビタミンD、塩化リチウム(LiCl)、アクチビン(Activin)、CCL-27{Chemokine(C-C motif) ligand 27}、及び2-メルカプトエタノール(2-mercaptoethanol)から選ばれた1種又は2種以上が1nMol/L〜0.1mMol/Lの範囲で添加されている請求項1から12のいずれかに記載の治療用培養細胞の製造方法。
【請求項14】
前記培養工程において、培養開始からはじめの培地交換まで3〜10日後培養することを特徴とする請求項1から13のいずれかに記載の治療用培養細胞の製造方法。
【請求項15】
前記培養工程において、酵素処理なく浮遊する細胞を採取する請求項1から14のいずれかに記載の治療用培養細胞の製造方法。
【請求項16】
前記培養工程において、細胞培養シートを用いて培養を行い、シート形成前の細胞、形成された細胞シート、または形成された細胞シートを空気透過性接着剤付シートに貼り付けたものを、治療用培養細胞とする請求項1から15のいずれかに記載の治療用培養細胞の製造方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10A】


【図10B】


【図10C】


【図11】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10A】


【図10B】


【図10C】


【図11】


【公開番号】特開2010−46058(P2010−46058A)
【公開日】平成22年3月4日(2010.3.4)
【国際特許分類】
【出願番号】特願2009−172191(P2009−172191)
【出願日】平成21年7月23日(2009.7.23)
【出願人】(503328193)株式会社ツーセル (24)
【Fターム(参考)】
【公開日】平成22年3月4日(2010.3.4)
【国際特許分類】
【出願日】平成21年7月23日(2009.7.23)
【出願人】(503328193)株式会社ツーセル (24)
【Fターム(参考)】
[ Back to top ]

