治療複合物
【課題】注射部位からの注射された薬剤の漏出を最小限にした、患者の身体に薬剤を注射するためのシステムを提供する。
【解決手段】側部放出針および、必要に応じて注射部位における細胞の保持を補助するキャリア、または組織封止剤もしくは注射部位を封鎖するためのフィルムを使用して、細胞を含む薬剤を、器官、組織または腫瘍に注射する新規方法が提供される。側部放出針、および必要に応じて、キャリア、封止剤もしくはフィルムの使用は、注射された薬剤の注射部位から逆流する漏出を防止する。本発明の方法を使用して注射され得る薬剤としては、薬物、低分子、ペプチド、タンパク質、ポリヌクレオチド、ウイルス、細胞などが挙げられる。筋芽細胞を含む任意の型の細胞が、本発明中で使用され得る。細胞は、心臓、脳、膵臓、肝臓などを含む任意の器官に注射され得る。
【解決手段】側部放出針および、必要に応じて注射部位における細胞の保持を補助するキャリア、または組織封止剤もしくは注射部位を封鎖するためのフィルムを使用して、細胞を含む薬剤を、器官、組織または腫瘍に注射する新規方法が提供される。側部放出針、および必要に応じて、キャリア、封止剤もしくはフィルムの使用は、注射された薬剤の注射部位から逆流する漏出を防止する。本発明の方法を使用して注射され得る薬剤としては、薬物、低分子、ペプチド、タンパク質、ポリヌクレオチド、ウイルス、細胞などが挙げられる。筋芽細胞を含む任意の型の細胞が、本発明中で使用され得る。細胞は、心臓、脳、膵臓、肝臓などを含む任意の器官に注射され得る。
【発明の詳細な説明】
【背景技術】
【0001】
(発明の背景)
患者の身体内の薬剤が必要な特定の部位への薬剤の局所的投与は、他の部位での薬剤の効果を避けるのに有用であり、かつ、望まない全身性副作用を避けるのに有用である。薬剤を特定の組織または器官に投与することにより、薬剤が全身に送達されないので、より低投薬量の薬剤が使用され得る。新生物性腫瘍を処置する場合、化学療法薬剤は、患者の健常な組織に作用する危険性なしに腫瘍の部位に送達され得る。局所的送達はまた、遺伝子治療に使用されるウイルスまたはポリヌクレオチドが器官または組織に見出される特定の細胞にのみトランスフェクトするように送達される場合、重要である。特定の部位への投与はまた、細胞が組織の損傷領域に送達される場合、重要である。分化し、増殖する大きな潜在能力を有する細胞(すなわち、前駆体細胞、筋芽細胞、幹細胞)を培養する技術、および遺伝子治療のために改変されたゲノムを有する細胞を作製する技術が開発されるにつれて、移植のために、細胞をレシピエントの身体に効率的に送達する必要性がますます重要になってきている。細胞の移植は、パーキンソン病から糖尿病、心臓疾患までに及ぶ疾患を処置するために使用されている。送達される細胞は、レシピエント、関連ドナーまたはレシピエント以外の別の種に由来し得る。器官または身体の領域への細胞の移植の課題の1つは、正しい位置に細胞を到達させることであり、そして細胞を増殖させ、分化させ、そして細胞が移植される器官の不可欠な部分になるように発生させることである。例えば、心臓や脳のような器官は、十分に機能的である細胞の既存のネットワークに、移植された細胞が組み込まれることを必要とする。細胞移植は、損傷を受け、それら自体で修復できない器官(例えば、心臓および脳)において特に重要であり、また器官の細胞が絶えず破壊されている疾患(例えば、I型糖尿病)においてもまた特に重要である。
【0002】
細胞移植が使用され得る疾患のただ1つの例である心臓疾患は、全ての工業国における障害および死の主な原因である。心臓疾患は、生活の質の低下を生じ得、長期間の入院を生じ得る。さらに、米国では心臓疾患は、癌(100,000個体あたり183の死で、後に続く)を越える100,000個体あたり約335の死(総死亡数の約40%)の原因となる。心臓疾患の4つのカテゴリは、全ての心臓関連死の約85〜90%の原因となる。これらのカテゴリは以下:1)虚血性心臓疾患、2)高血圧心臓疾患および肺性高血圧心臓疾患、3)弁疾患および4)先天的な心臓死疾患である。虚血性心臓疾患は、その種々の形態で、心臓疾患により引き起こされる全ての死の約60〜75%の原因となる。さらに、心臓障害の発生率は米国で増加している。虚血性心臓疾患を非常に破壊的にさせる因子の1つは、心筋細胞が分裂し得ないことおよび虚血性心臓損傷の領域を再増殖させ得ないことである。結果として、傷害または疾患の結果としての心臓細胞の喪失は、不可逆的である。
【0003】
ヒトからヒトへの心臓移植は、重篤な心臓障害に対する治療の最も有効な形態になった。多くの移植センターでは現在、心臓移植後1年の生存率は80〜90%を上回っていて、心臓移植後5年の生存率は70%を上回っている。しかし、心臓移植は、適切なドナーの器官の希少性により、ひどく限定されている。ドナーの器官を得る困難に加えて、心臓移植の費用は、広範な適用を妨げる。別の未解決の問題は、移植片拒絶である。外来性の心臓は、レシピエントにほとんど許容されず、免疫抑制剤が存在しない場合、免疫系により急速に破壊される。免疫抑制剤は、拒絶を予防するために使用され得るが、それらは、望ましい免疫反応(例えば、細菌感染およびウイルス感染に対する免疫反応)もまたブロックし、それによってレシピエントを感染の危険に曝す。感染、高血圧、ならびにサイクロスポリン、急速な進行性冠動脈硬化症および免疫抑制剤関連癌によって引き起こされた腎臓障害は、主要な合併症である。
【発明の概要】
【課題を解決するための手段】
【0004】
(発明の要旨)
本発明は、注射部位からの注射された薬剤の漏出を最小限にした、患者の身体に薬剤を注射するためのシステムを提供する。漏出を最小限にするために、本発明は、針の先端に開口部を有する針よりはむしろ側部開口部を有する針を使用し、そして/または、投与されるべき薬剤の注射後の部位を封鎖するために、封止剤を使用する。特定の好ましい実施形態において、治療薬剤、診断薬剤または予防薬剤は、本発明の方法を使用して投与される。これらの薬剤としては、薬物、タンパク質、ペプチド、低分子、ポリヌクレオチド、生物学的分子、ウイルス、細胞などが挙げられ得る。送達されるべき特定の好ましい薬剤は、細胞である。薬剤は、任意の器官、組織、腫瘍(良性または悪性)、傷害(injury)もしくは障害(damage)の部位、先天異常の部位または患者の身体の他の任意の部位に注射され得る。好ましくは、器官または組織は、送達されるべき薬剤の注射に対してある程度の耐性を提供するために、固形または実質的に固形である。特定の実施形態において、薬剤は標的器官または標的組織の傷害の部位に注射される。一旦薬剤が注射されると、注射部位からの、投与された薬剤の漏出が好ましくは全く観察されないか、または最小限量観察される。好ましくは、その部位からの薬剤の50%未満が漏出し、より好ましくは、薬剤の40%、30%、20%、10%、5%、4%、3%、2%または1%未満が注射部位から漏出する。最も好ましくは、注射部位から漏出が検出され得ないことである。本発明は、器官(例えば、心筋、脳、膵臓、肝臓、腎臓および骨格筋)に移植される細胞の注射において特に有用である。細胞は、注射部位での細胞の保持を補助するキャリア(例えば、コラーゲン、ゼラチン、フィブリン、メチルセルロース、アガロース、アルギン酸塩、ヒアルロン酸など)中に懸濁され得る。さらに、もしくは、あるいは、注射部位は、注射後、注射穴を閉鎖し、注射された薬剤の漏出を防止するために、組織封止剤(例えば、シアノアクリレート組織接着剤(cyanoacrylate tissue adhesive)、フィブリン接着剤(fibrin glue)((例えば、Tisseel(登録商標))、フィルム(例えば、セプラフィルム)または接着剤(glue)で封鎖され得る。
【0005】
本発明は、器官に対する傷害が、治療薬剤の送達により処置され得る障害を生じる種々の状態を処置するために使用され得る。特定の実施例において、器官の障害は、細胞移植により処置され得る。特に、本発明は、状態が処置されるように側部放出針を使用して骨格筋芽細胞を心筋傷害部位へ注射する工程を包含する、心臓組織に対する障害により特徴付けられる状態を処置するための方法を提供する。注射は、心臓状態を処置するために繰り返され得る。
【0006】
他の特定の実施形態において、本発明は、薬物を患者の身体の中の特定の部位に送達するために使用され得る。例えば、本発明の方法は、薬剤が腫瘍への最大限の効果を有し、周辺の組織へのより少ない効果を有するように、抗新生物薬剤を腫瘍塊内に送達するために使用され得る。薬物は、カプセル化され得るか、または、長時間にわたる活性薬剤の放出を可能にするような形態であり得る。
【0007】
別の局面では、本発明は、閉鎖された末端および側部放出孔を有する針を備えるキットを提供する。キットはまた、送達されるべき薬剤(例えば、薬物、タンパク質、ペプチド、ポリヌクレオチド、低分子、生物学的分子、ウイルス、細胞など)を含み得る。特定の実施形態において、キットは、移植される細胞、移植のための細胞の培養に使用される因子および培地、細胞の保持を補助するキャリア(例えば、コラーゲン、ゼラチン、細胞外マトリックスタンパク質、フィブリン、メチルセルロース、アガロース、アルギン酸塩、ヒアルロン酸など)、組織封止剤、組織接着剤(tissue glue)または組織接着剤(tissue adhesive)(例えば、シアノアクリレート組織接着剤、フィブリン接着剤(例えば、Tisseel(登録商標)))、封鎖フィルム(例えば、セプラフィルム)、注射部位を滅菌するための溶液、縫合材料、後に移植される細胞を抽出するための用具、および/またはシリンジを含み得る。好ましくは、送達される薬剤を操作する、および注射するのに使用される任意の溶液、培地または用具は、滅菌され、汚染を防止するようにパッケージされる。
【0008】
(定義)
「新脈管形成」:「新脈管形成」とは、本発明の筋細胞が移植された心臓組織における新しい毛細血管の形成をいう。新脈管形成は、移植される細胞の作用の結果として、移植された細胞由来の新脈管形成因子の分泌の結果として、および/または、細胞が移植された器官由来の内因性新脈管形成因子の分泌の結果として生じ得る。
【0009】
「動物」:用語動物は、本明細書で使用される場合、ヒトならびに、非ヒト動物(例えば、哺乳類、鳥類、爬虫類、両生類および魚類が挙げられる)をいう。好ましくは、動物は、哺乳類(例えば、げっ歯類、マウス、ラット、ウサギ、サル、イヌ、ネコ、またはブタ)であり、最も好ましくは、ヒトである。動物は、トランスジェニック動物で有り得る。
【0010】
「生物学的化合物」:「生物学的化合物」は、生体内で見出される任意の化学化合物である。特定の実施形態において、生物学的分子としては、DNA、RNA、ポリヌクレオチド、タンパク質、ペプチド、脂質、多糖、オリゴ糖および糖が挙げられ得る。
【0011】
「心筋細胞」:「心筋細胞」とは、心筋に由来する筋肉細胞をいう。このような細胞は代表的に、1つの核を有し、心臓に存在する場合、介在する円盤構造によって結合している。
【0012】
「細胞」:用語「細胞」とは、本発明の方法を使用して送達される任意の細胞型をいう。細胞は、細菌、真菌類、酵母、植物、動物、哺乳類またはヒトに由来し得る。細胞が多細胞生物に由来する場合、それは、任意の組織または器官(例えば、皮膚、心臓、骨格筋、平滑筋、膵臓、脳、神経、腎臓、肝臓、胃、腸など)に由来し得る。細胞は、それらが送達される患者、関連ドナー、家族メンバー、類似したMHCマーカーを有するドナー、非関連ドナーまたは別の種(例えば、ブタ)のドナーに由来し得る。細胞は、細胞培養から入手し得る。
【0013】
「単離された」:用語「単離された」とは、その天然の環境から分離されている細胞をいう。この用語は、その天然の環境からの細胞の全体の物理的な分離(例えば、ドナーからの除去)を含む。好ましくは、「単離された」とは、直接的に接触する隣接する細胞との細胞の関係の変化(例えば、解離による)を含む。
【0014】
「心筋虚血」:「心筋虚血」とは、心筋虚血障害を生じる心臓への酸素の流れの欠乏を含む。本明細書で使用する場合、心筋虚血障害は、心筋への減少した血流により引き起こされる障害をいう。心筋虚血および心筋虚血障害の原因の非限定的な例としては、大動脈拡張期血圧の低減、心室内圧の増加および心筋収縮、冠状動脈狭窄(例えば、環状動脈結紮、固定環状動脈狭窄、急性プラーク変化(例えば、破裂、出血)、環状動脈血栓症、血管収縮)、大動脈弁狭窄および大動脈弁逆流および右心房圧の増加が挙げられる。心筋虚血および心筋虚血障害の弊害の非限定的な例としては、心筋障害(例えば、心筋細胞喪失、心筋肥大、心筋細胞肥厚)、アンギナ(例えば、安定アンギナ、異型アンギナ、不安定アンギナ、突然心臓死)、心筋梗塞およびうっ血性心不全が挙げられる。
【0015】
「患者」:患者は、任意の種の患者であり得る。患者は、ヒト、家畜、イヌ、ネコ、鳥、ペット、魚、ハムスター、ラット、スナネズミなどであり得る。特定の好ましい実施形態では、患者はヒトである。患者は、本発明の方法を使用する処置の時点では、病気にかかっていてもかかっていなくてもよい。例えば、本発明の方法は、予防薬剤(例えば、ビタミンまたは産児調節薬剤)を送達するために使用され得る。他の実施形態において、患者は、疾患(例えば、心臓疾患、糖尿病、パーキンソン病、癌、遺伝的欠損など)を罹患している。
【0016】
「ペプチド」または「タンパク質」:本発明に従って、「ペプチド」または「タンパク質」は、ペプチド結合によって一緒に結合した少なくとも3個のアミノ酸の列を含む。本発明のペプチドは好ましくは、天然のアミノ酸のみを含むが、非天然のアミノ酸(すなわち、天然には存在しないが、ポリペプチド鎖には組み入れられ得る化合物)および/または当該分野で公知のアミノ酸アナログが、代わりに使用され得る。また、本発明のペプチドの1つ以上のアミノ酸が、例えば、化学単位(例えば、炭水化物基、リン酸基、ファルネシル基、イソファルネシル基、脂肪酸基、結合、機能付与もしくは他の改変などのためのリンカー)の添加によって改変され得る。
【0017】
「ポリヌクレオチド」または「オリゴヌクレオチド」:ポリヌクレオチドまたはオリゴヌクレオチドとは、ヌクレオチドのポリマーをいう。ポリマーとしては、天然のヌクレオシド(すなわち、アデノシン、チミジン、グアノシン、シチジン、ウリジン、デオキシアデノシン、デオキシチミジン、デオキシグアノシンおよびデオキシシチジン)、ヌクレオシドアナログ(例えば、2−アミノアデノシン、2−チオチミジン、イノシン、ピロロピリミジン、3−メチルアデノシン、5−メチルシチジン、C5−ブロモウリジン、C5−フルオロウリジン、C5−ヨードウリジン、C5−プロピニルウリジン、C5−プロピニルシチジン、C5−メチルシチジン、7−デアザアデノシン、7−デアザグアノシン、8−オキソアデノシン、8−オキソグアノシン、O(6)−メチルグアニンおよび2−チオシチジン)、化学的に改変された塩基、生物学的に改変された塩基(例えば、メチル化塩基)、間に入った塩基、改変された糖(例えば、2’−ヒドロキシリボース、2’−フルオロリボース、リボース、2’−デオキシリボースおよびヘキソース)、または改変されたリン酸基(例えば、ホスホロチオエート結合および5’−N−ホスホラミダイト結合)が挙げられ得る。
【0018】
「封止剤」または「封鎖」:「封鎖」とは、注射部位または薬剤の投与の部位を閉鎖するための封止剤の使用をいう。封止剤は、送達の部位からの、投与された薬剤の漏出を防止する。注射穴を閉鎖し得る任意の物質が、封止剤として使用され得る。封止剤は、接着剤(glue)、接着剤(adhesive)またはフィルムであり得る。封鎖は、薬剤の送達と同時になされ得るか、または投与の後に実施され得る。封止剤の例としては、シアノアクリレート組織接着剤(cyanoacrylate tissue adhesive)、フィブリン封止剤(例えば、Tisseel(登録商標)(Baxter International Incにより市販される)、セプラフィルム、ポリマー、タンパク質などが挙げられる。特定の実施形態において、封止剤は、薬剤が、側部開口部を有する針を使用して送達された後に使用される。
【0019】
「骨格筋芽細胞」:「骨格筋芽細胞」は、筋管および骨格筋繊維の前駆体である。用語「骨格筋芽細胞」としては、未分化細胞、骨格筋における筋繊維と密接に接触して見出される単核細胞が挙げられる。未分化細胞は、骨格筋芽細胞の基底膜に隣接して位置し、筋繊維に分化し得る。
【0020】
「低分子」:用語「低分子」とは、本明細書で使用される場合、研究室で合成されたか、または天然に見出されたかのどちらかである非ペプチド有機化合物、非オリゴマー有機化合物をいう。低分子は、本明細書で使用される場合、「天然産物様」である化合物をいい得るが、用語「低分子」は、「天然産物様」化合物に限定されない。むしろ、低分子は、代表的に、いくつかの炭素−炭素結合を含み、1500より小さい分子量を有するという点で特徴づけられるが、この特徴づけが本発明の目的を限定することを意図しない。天然に存在する低分子の例としては、タキソール、ダイナミシンおよびラパマイシンが挙げられるがこれらに限定されない。他の特定の好ましい実施形態において、天然産物様低分子が使用される。
【0021】
「固形器官」:「固形器官」とは、患者の身体内の任意の組織または器官をいう。本発明の方法は、任意の薬剤(細胞を含む)を固形器官に送達するために使用され得る。固形器官は、健常な器官(例えば、心臓、膵臓、脳、肝臓、腎臓、骨格筋など)または異常な増殖物(例えば、良性腫瘍または悪性腫瘍)であり得る。固形器官(例えば小腸および大腸または肺)は、その中に内腔または空間を有し得る。特定の実施形態において、固形器官は、添加物質(例えば、細胞または液体)の導入に対して抵抗性を提供する組織である。特定の好ましい実施形態において、固形器官は、心筋である。
【0022】
「幹細胞」:「幹細胞」は、適切な条件下でより分化した細胞を生じる任意の多能性の細胞を言う。本発明に従って使用され得る幹細胞は、造血幹細胞、中性幹細胞、間葉幹細胞、胃腸幹細胞、筋幹細胞、心筋幹細胞、腎幹細胞、皮膚幹細胞、肺幹細胞、および胎児性幹細胞が挙げられる。
【0023】
「治療的有効量」:用語「治療的有効量」は、所望される生物学的応答を引き出すのに必要とされる薬剤の量を言う。好ましい実施形態において、薬剤の治療的有効量が、多数の注射を使用することにより標的器官に損傷を与えないように最小回数の注射を用いて送達される:従って、各々の注射は、好ましくは送達されている薬剤の実質的部分の保持を生じるべきである。本発明において、薬剤は、薬物、低分子、ペプチド、タンパク質、ポリヌクレオチド、生体分子、ウイルス、および細胞(例えば、幹細胞、骨格筋芽細胞など)であり得る。例えば、感染の場合、治療有効量の抗生物質は、感染を取り除くか、または感染の原因である全ての生物を殺すのに必要な量である。遺伝子治療の場合、ポリヌクレオチド(例えば、ベクター、人工染色体)、ウイルス、または細胞の治療有効量は、レシピエントの内在する遺伝子欠損をなくすのに必要な量である。組織損傷または変性の場合、細胞の治療有効量は、異常な組織または損傷した組織の機能または構造を改良するのに必要な量である。例えば、心臓障害のための細胞の移植において、細胞の治療有効量は、心臓アウトプットを増大し、ストロークの容積を増大し、狭心症の徴候を減少させ、または移植された患者の心臓の状態を改善することにより、心臓機能を改善するのに必要な量である。
【図面の簡単な説明】
【0024】
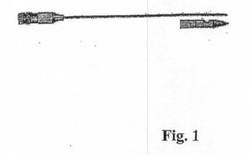
【図1】図1は、側部開口部を有する針の先端の拡大図とともに、Whitacre鉛筆先端状針(Whitacre pencil point needle)を示す。
【図2】図2は、注射した心臓のヘマトキシリンおよびエオシン染色を示す。図2Aは、標準25G傾斜針を使用して注射した心臓の領域を示し、図2Bは、25GWhitacre針を用いて注射した心臓の隣接領域を示す。注射部位に保持された細胞を矢印により印す。さらに多くの細胞が、Whitacre針を使用して注射した領域の周辺の領域に見出された。図2Aについては、4000万個の細胞を含む400μlの細胞懸濁液を、1分にわたって注射した。図2Bについては、2億個の細胞を含む400μlの細胞懸濁液を、1分にわたって注射した。
【図3】図3は、側孔針を使用して、虚血性障害を受けたヒツジの心臓に骨格筋芽細胞を注射した結果を示す。注射の6週間後に動物を屠殺し、筋肉特異的ミオシン染色を使用して心臓を染色したものを図3Bに示し、トリクロム染色を図3Bに示した。
【図4A】図4は、患者が、心臓移植手術への橋渡しとしての左心室補助デバイスを移植するための手術を受ける間に、側孔針を使用して、ヒト心臓に骨格筋芽細胞を注射した結果を示す。注射の5日後に、患者は死亡し、その心臓を、図4A(低倍率)に示すように、トリクロム染色により染色した。
【図4B】図4は、患者が、心臓移植手術への橋渡しとしての左心室補助デバイスを移植するための手術を受ける間に、側孔針を使用して、ヒト心臓に骨格筋芽細胞を注射した結果を示す。注射の5日後に、患者は死亡し、その心臓を、図4B(高倍率)に示すように、トリクロム染色により染色した。
【発明を実施するための形態】
【0025】
(特定の好ましい実施形態の詳細な説明)
1つの局面において本発明は、閉じた末端および少なくとも1つの側面の開口を有する針を使用して薬剤を送達する方法を提供する。代表的には、薬剤は、側面開口針を使用して、開口、穴、負の空間(negative space)、または管腔よりむしろ、器官または実質的に固形の組織もしくは腫瘍中に注入される。特定の実施形態において、注入部位は、器官または組織中の損傷したまたは病気の領域である。本発明の方法を使用して送達され得る薬剤としては、薬物、低分子、ポリヌクレオチド、タンパク質、生体分子、抗体、ウイルス、細胞などが挙げられる。1つの実施形態において、本発明の方法は、薬物のような薬剤を患者の体内の特定の場所(すなわち、特定の器官または組織)に送達するように用いられる。別の実施形態において、この方法は、病気の組織、損傷した組織、瘢痕組織または死んだ組織を回復し、そして/または置き換えるような治療目的のために細胞を送達するのに使用し得る。この方法はまた、遺伝子治療に使用され得、ここで送達される細胞またはウイルスのゲノムが、変えられる。
【0026】
(針)
本発明の方法を実施するのに使用される針は、末端にではなく針のシャフトの側面に開口を有する。閉じた末端は、斜角のついた先端、カーブした先端、または鉛筆先端状先端(pencil point tip)であり得る。側面上の開口は、代表的に針の先端の近くに配置される。針の側面上に1つの開口があり得、または一連の側面の開口があり得る。例えば、針の対向する側面上に2つの開口があり得、または一連の同軸開口があり得る。
【0027】
本発明の方法において特に有用な針としては、患者の脳脊髄液(CSF)に接近するために使用される脊髄注射針が挙げられる(例えば、参考として本明細書中に援用される、米国特許第5,848,996号を参照のこと)。これらの脊髄注射針は、いくらかの患者に穿刺後の頭痛を生じ得る、CSFの漏れを防ぐために、脊椎麻酔法および腰椎穿刺のために最初は設計された。これらの注射針としては、図1に示されるようなWhitacre針およびSprotte針が挙げられる(また、米国特許第5,848,996号(1998年12月15日発行)および米国特許第5,449,351号(1995年9月12日発行)を参照のこと;これらの各々は、参考として本明細書中で援用される)。
【0028】
注入された薬剤を出て行かせる大きな穿孔の作製を妨げるために、小さな半径を有する針が、大きな半径よりも好ましい。半径が小さくなるほど、ゲージは対応して大きくなる。代表的に、本発明で使用される針のゲージは、約20ゲージ〜約30ゲージの範囲にわたりそしておそらくより好ましくは約25ゲージである。針のゲージはまた、必要とされる針の強度、注入される薬剤(例えば、細胞)の大きさ、薬剤の粘度、薬剤の懸濁、または注入される薬剤の溶液、貫通される器官もしくは組織の扱いにくさ、注入手順の間に必要とされるコントロールなどにより、決定される。例えば、より大きなゲージ(例えば、30ゲージ)を有する針は、低分子、薬物またはウイルスを送達するのに使用され得るが、より小さなゲージ針が、より大きなサイズを有する薬剤(例えば細胞)を注入するのに必要とされ得る。針のゲージは、上記方法を実施する医療のプロにより上に列挙した種々の因子を考慮に入れ、そしてプロの最良の判断および類似の手段を行なう彼の経験を使用して、最も良く決定される。
【0029】
針の長さは、薬剤の注入を取り巻く種々の因子に依存する。これらの因子としては、注入される器官、細胞が送達される部位の深さ、注入を実施するのに必要な針のコントロール、移植部位に到達するために貫通しなければならない組織などが挙げられ得る。再び、針のゲージと同様に、針の長さが、手順を実施する医療のプロにより、最も良く決定される。代表的に、針の長さは、1/2インチと7インチとの間であり、好ましくは、1/2インチと4インチとの間であり、そしてより好ましくは、1/2インチと3インチとの間である。
【0030】
針はまた、特定の使用のために設計されるある他の特徴を有し得る。例えば、側面開口のサイズおよび形状は、送達される細胞および細胞が送達される部位に依存し得る。また、針は、ある移植部位への容易な接近を提供するために、カーブをつけられ得、または捩られ得る。針のシャフト上の開口のパターンおよびシャフトに垂直な開口の位置は、移植のための部位および器官に依存し得る。
【0031】
(送達される薬剤)
針を通って注入され得る任意の薬剤が、本発明の方法を使用して送達され得る。代表的な薬剤としては、薬物、低分子、薬学的薬剤、診断薬、生体分子、タンパク質、ペプチド、抗体、ポリヌクレオチド、RNA、DNA、ウイルス、細胞およびそれらの組み合わせが挙げられ得る。薬剤は、サイズにおいて、有機低分子から高分子(例えば、DNAからインタクトな細胞)の範囲にわたり得る。注入部位に送達される薬剤は、治療剤(例えば、化学療法薬物、抗生物質)、予防薬(例えば、ワクチン)、または診断剤(例えば、磁気共鳴映像法のための造影剤、標識された代謝産物)であり得る。
【0032】
薬物は、疾患の処置または予防に有用な任意の化合物を含む。多くの薬物が、ヒトにおける疾患の処置のために米国食品医薬品局により認可されている。特に好ましい実施形態において、薬物は、抗生物質、抗ウイルス剤、麻酔剤、ステロイド剤、抗炎症剤、抗腫瘍剤、抗原、ワクチン、抗体、鬱血除去薬、抗高血圧症薬、鎮静薬、産児制限剤、プロゲステロン剤、抗コリン作用薬、鎮痛剤、抗うつ薬、抗精神病剤、β−抗アドレナリン薬、利尿薬、心臓血管活性剤、血管作用剤、非ステロイド抗炎症剤、栄養剤などである。薬物の組み合わせが、本発明において使用され得る。この薬物はまた、種々の形態で送達され得、例えば、この薬物は、カプセル化され得、またはこの薬物は、徐放性形態であり得る。
【0033】
送達される薬剤はまた、生体分子(例えば、タンパク質、ペプチド、ポリヌクレオチドおよびオリゴヌクレオチド)を含み得る。タンパク質またはペプチドの例としては、インシュリン、サイトカイン、成長因子、エリトロポイエチン、抗体、抗体フラグメントなどが挙げられる。ポリヌクレオチドは、遺伝子治療およびアンチセンス療法のために送達され得る。このポリヌクレオチドは、任意の以下のエレメントを含み得る:オープンリーディングフレーム、プロモーター、エンハンサー領域、リボソーム結合部位、調節領域、スプライシングシグナル、イントロン、エキソンなど。
【0034】
薬物、低分子および生体分子に加えて、本発明は、ウイルスおよび細胞を送達するために使用され得る。特に好ましいウイルスおよび細胞は、治療用のものである。変えられたゲノムを有するウイルスは、ベクターとして遺伝子治療に使用され、外来遺伝子を患者の細胞中に導入し得る。これらのウイルスを使用して、患者自身のゲノム中の遺伝子欠損をなくすために、遺伝子を送達し得る。ある実施形態において、これらのウイルスは、その抗原性を弱めるために変えられ得る。
【0035】
本発明の方法はまた、細胞を送達するために使用され得る。任意の型の細胞または細胞の混合物が、本発明の方法を使用して移植され得る。本発明において特に有用な細胞型としては、心筋細胞、骨格筋細胞、β−島細胞、肝性細胞、造血細胞、ニューロン、線維芽細胞、幹細胞などが挙げられる。これらの細胞は、全能の胎児性幹細胞から完全に分化した細胞にわたる分化の任意の段階であり得る。細胞は、移植の部位および修復されるべき欠損または損傷の性質に依存して、選択される。例えば、虚血性心臓病に起因して損傷される心筋層の領域が、骨格筋芽細胞または骨格筋芽細胞の混合物および線維芽細胞を移植することにより修復され得る。好ましくは、これらの細胞を精製して、免疫学的応答のような有害な応答を引き起こす所望されない細胞型または細胞を除外した。これらの細胞は、FACS分類、免疫学的技術、細胞培養物中の継代などにより、精製され得る。好ましくは、これらの細胞を、注入および移植のための培地中に懸濁した。これらの細胞を、1×106細胞/ml〜1000×106細胞/ml、より好ましくは10×106細胞/ml〜500×106細胞/ml、さらにより好ましくは、50×106細胞/ml〜200×106細胞/ml、そして最も好ましくは50×106細胞/ml〜100×106細胞/mlにわたる注入のための濃度で懸濁し得る。これらの細胞は、細胞培養物から、ドナーから、組織および血液バンクから、レシピエントの親族から、またはレシピエント自身から得られ得る。これらの細胞はまた、レシピエントと同種ではない動物から得られ得る。これらの細胞は、代表的に、培地中またはいずれかの他の溶液中の細胞の均一な懸濁液として提供される。これらの細胞は、等張性溶液で、または筋芽細胞のようなある細胞型の使用において提供され得、これらの細胞は、高張性溶液中で懸濁され得る。
【0036】
これらの細胞は、別のヒト、レシピエント自身、またはレシピエントと別種の動物(例えば、ブタ)から採取される生検組織から得られ得る。組織または細胞が、トリプシンおよびコラーゲナーゼの様な消化酵素で処理され、細胞を分離し得、そしてこれらの細胞を移植および/または培養のために調製し得る。必要に応じて、これらの細胞は、移植のための細胞数を増加するために、インビトロで培養され得る。ある環境において、細胞が、ゼラチンで、またはポリ−L−リジンおよびラミニンでコーティングされる表面上で、適切な栄養物および細胞成長のための因子を含む培地中で培養される。これらの細胞はまた、変えられ、その後移植される。1つの場合において、細胞のゲノムは、遺伝子をゲノムに変え、欠失させ、または挿入することにより、変えられ得る。ゲノムの変化は、必要かも知れないし、または移植の治療効果を促進するかも知れない。別の場合において、これらの細胞は、種々の栄養物、ビタミン、ミネラル、成長因子、化学的化合物、ステロイド、ホルモン、ペプチド、タンパク質、または核酸が挙げられるある因子で処置され、細胞をある様式で発達させて分化させ得、または脱分化させ得る。これらの因子は、細胞内の形態学的変化および/または遺伝子発現における変化を引き起こし得る。改変された細胞は、代表的に、改変前の元の細胞よりも移植においてより有効である。例えば、筋芽細胞が冠状動脈疾患のために病気である心筋層中に移植される場合、虚血領域に供給する新しい毛細血管の発達を引き起こすように、移植された筋芽細胞が脈管形成因子を分泌しまたは産生するならば、有益であり得る。
【0037】
移植されるべき細胞が、免疫構成(immunological make−up)が有意に異なるドナー由来である場合には、受容者は、免疫抑制治療(例えば、移植後のステロイドおよびシクロスポリン)を必要とし得る。免疫抑制治療は、移植細胞の拒絶反応を実質的に抑制するはずである。免疫抑制治療は、移植手順および受容者の臨床状態に精通する医学の専門家によって最善に決定されるべきである。移植後の免疫抑制治療の使用を回避するために、移植されるべき細胞は、血縁関係のドナー、肉親、または受容者自身から得られ得る。器官移植の場合のように、ドナーと受容者との間のHLAがより一致しているほど、移植細胞の拒絶反応がより小さくなると思われる。移植細胞の拒絶反応を予防するために、移植細胞表面上の抗原は、改変されるか、マスクされるか、または除去されて、受容者の免疫系からの免疫応答の危険性を予防し得るかもしくは減少させ得る(米国特許第5,283,058号(1994年2月1日発行、本明細書中に参考として援用される)を参照のこと)。特定の他の実施形態において、移植細胞におけるMHCクラスI分子は、抗体、抗体フラグメント(例えば、F(ab’)2)、可溶性T細胞レセプターフラグメント、またはT細胞レセプターの抗原結合特性を模倣する合成有機分子を用いてマスクされる。特定の実施形態において、細胞は、移植時のT細胞媒介性免疫応答の危険性を予防するかまたは減少するために、遺伝的に改変され得る。特定の実施形態において、細胞は、ドナー組織の細胞上の拒絶反応を誘導する表面抗原を改変するかまたは除去するために改変されている、トランスジェニック動物から得られ得る。宿主T細胞と相互作用することが公知の表面抗原としては、MHCクラスI分子、LFA−3、およびICAM−1が挙げられる。
【0038】
一旦移植された細胞は、好ましくは、これらが移植される環境に対応し、それによって細胞自体およびそれらの子孫は、この細胞が注射された組織/器官の細胞マトリックスに組み入れられるべきである。移植細胞は、器官に対する傷害を修復するのを助けるべきである。例えば、骨格筋芽細胞を傷害した心筋に移植することは、心拍出量が増加することおよび傷害部位を修復するのを助けることが示されている(USSN60/145,849、1999年7月23日出願;USSN09/624,885、2000年7月24日出願;およびUSSN10/105,035、2002年3月21日出願を参照のこと、これらの各々が本明細書中で参考として援用される)。
【0039】
(器官)
送達されるべき薬剤は、本発明の方法を使用して、患者の体内の任意の器官、組織、または腫瘍中に注射され得る。例えば、抗腫瘍性薬剤は、腫瘍中に送達されて、周辺組織における影響を最小限に抑え得る。特定の好ましい実施形態において、この薬剤は、器官または組織内の傷害部位中に送達される。送達されるべき薬剤が細胞である特定の実施形態において、移植されるべき細胞は、傷害しているか患部であるかさらなる細胞の補充を要するか、もしくは改変したゲノムを有する細胞の補充を要する部位にて、器官中に注射される。細胞は、滅菌条件下で、側面孔の針を通じて器官または組織中に注射される。細胞の送達は、針が通過する必要のある組織および器官の数を最小限に抑え、かつ細胞の送達をより良く制御するために、外科的手順の間に行われ得る。特定の部位に対する細胞の送達は、種々の放射線技術(例えば、蛍光透視、CT、およびX線放射線)によって誘導され得る。
【0040】
細胞は、好ましくは、天然の空孔、管腔、または開口部ではなく、中実の組織または器官中に移植される。特定の好ましい実施形態において、細胞は、器官または組織内の傷害部位、疾患部位、もしくは損傷部位中に送達される。細胞が注射され得る器官としては、例えば、心臓心筋、骨格心筋、脳、脊髄、脾臓、肝臓、膵臓、甲状腺、副腎、前立腺、精巣、および卵巣が挙げられる。特定の理論によって拘束されることを希望することなく、本発明は、先端部に孔を有する通常の針によって作り出された空孔からの、新たに注射した細胞の漏出または押出を予防すると考えられる。先端部が閉じた針は、一旦針が引き抜かれるとそれ自体をより良く塞ぐ空孔を作り出し、それによって、閉じた空間に注射されたばかりの細胞が漏出するのを許容しないと考えられる。この考えは、注射部位が筋肉の収縮、器官もしくは組織の内側に蓄積する流体、炎症、細胞増殖もしくは腫瘍増殖などに起因して、増加する緊張または圧力を受ける場合に、ますます重要になる。
【0041】
状態を処置するために、1度に、または何日、何ヶ月、何週間、もしくは何年にもわたって複数の注射が必要とされ得る。例えば、移植細胞が、宿主の免疫系によって攻撃され、かつ破壊される場合、移植細胞は反復注射によって置き換えられる必要がある。処置の過程は、患者の状態の処置において経験を有する専門家によって最善に決定される。
【0042】
(適用)
本発明の方法は、器官、組織、または腫瘍中に針を通じての注射による薬剤の送達が必要とされる任意の疾患または状態の処置に対して適用され得る。本発明の方法の適用のただ1つの実施例は、患者の体内の特定の器官、組織、または腫瘍に対する細胞の送達である。最近の研究は、種々の疾患の処置における細胞移植の使用に集中している。研究者は、細胞をパーキンソン病を有する患者の脳に移植して、この破壊的な疾患に関連する運動障害を減少させようと試みてきた。研究者はまた、細胞移植を使用して、心筋梗塞後の心臓組織に対する損傷を修復しようと試みてきた。限られた再生能力かまたは全く再生能力を有していなかった器官(例えば、脳、心臓)への細胞移植は、研究者が種々の細胞型の増殖および分化を制御することを習得するにつれて、ますます重要になり得る。
【0043】
成人の心筋細胞の移植に関する主な問題は、心筋細胞が培養物中で増殖しないことである(Yoonら(1995)Tex.Heart Inst.J.22:119;本明細書中で参考として援用される)。この問題を克服するために、注意が骨格筋芽細胞の考えられる使用に集中してきた。骨格筋組織は、増殖可能な未分化細胞を含む。インビトロでのこれらの細胞の精製および拡大に基づき、これらは、損傷した筋肉を修復するのを助けるために、側面孔の針を使用して虚血性損傷の部位にて心臓に注射され得る。本発明の方法は、移植細胞が注射部位に留まることを可能にし、その結果、移植細胞が筋細胞を含む領域を再増殖し、それによって損傷した領域を修復する。好ましくは、一旦細胞が傷害部位に注射されると、この細胞は、領域を再増幅し、そして細胞と細胞外マトリックスとの既存のネットワーク中に細胞自体を組み入れる。
【0044】
本発明のこれらの局面および他の局面は、以下の実施例を考慮してさらに評価され、この実施例は、本発明のある種の特定の実施形態を例示することが意図されるが、特許請求の範囲によって規定されるように、本発明の範囲を限定することは意図されない。
【実施例】
【0045】
(実施例1−ブタの心臓へのヒト筋芽細胞のベンチトップ(bench−top)注射)
骨格筋芽細胞を注射した移植後心臓の組織学的検査に基づき、移植細胞が、時折、注射部位ではなく心外膜脂肪における心臓表面上で見出されたことが認められた。移植細胞は、針の孔を介して注射部位から増殖を開始する心臓の表面まで押し出されたと考えられた。残念なことに、注射部位に存在しない移植細胞は、損傷心臓および瘢痕心臓に対していかなる援助も提供しない;従って、細胞を中実組織または器官に移植するのに最も良い方法を決定するために、細胞を注射する種々の方法を研究した。
【0046】
凍結させたヒト筋芽細胞を含むいくつかのバイアルを、氷の上で溶かした。合計240×106個の細胞を、TX培地中で2回洗浄した。次いで、この細胞を2本のチューブに分割した。一本目のチューブは、1.6mlのTX培地中に80×106個の細胞を含み、結果として50×106細胞/mlの濃度となった。二本目のチューブは、同一容積の培地中に2倍多い細胞を含み、結果として100×106細胞/mlの濃度となった。次いで、細胞を、種々の針(針の向き、針のサイズ、細胞の濃度、注射した容積、および注射の深さ)を使用して、ブタの心臓の心筋に注射した。次いで、注射部位からの漏出量を測定して、筋芽細胞を心筋に注射しかつ細胞を注射部位にて組織中に保持するための最も良い方法を決定した。
【0047】
【表1】

上記の表に記載した14回の注射に基づき、これらの注射において2種の放出タイプ(傾斜放出 対 側面放出)、2種の細胞密度(1ml当たり100×106 対 50×106)、2種の針の長さ(5/8インチ 対 3.5インチ)、および3種の針(25G Whitacre針 3.5インチ 側面放出;25G 5/8インチ 傾斜;25G 3.5インチ 傾斜)を試験し、側面放出針が、漏出を予防することにおいて傾斜先端針より良好に実施された。傾斜針を用いて行った9回の注射のうち8回は漏出したが、側面放出針を用いた4回のうちの2回は漏出を示さず、他の2回は最小限の漏出を示した。
【0048】
多くの因子が、組織中に注射された流体の保持に影響を及ぼす。注射の速度、注射した総容積、針が組織中に挿入される深さ、および針を組織から取り除く前の時間遅延が、より重要なことの一部であると考えられる。注射後の心臓組織内の流体の相対的な保持を、2つの異なる針設計と比較するために、上記に列挙した因子のいくつかを試験した。表は、傾斜針を使用し、針を5/8インチの深さまで挿入し、そして細胞を速やかに(15秒)またはゆっくりと(1〜2分)注射した場合、常に注射部位から細胞の漏出があったことを示す(試験番号1〜7)。漏出量はばらついたが、よりゆっくりした注射(試験番号5〜7)は、速い注射(試験番号1〜4)より優れているようであった。1インチまで増大させた針の注射の深さを用いて(試験番号8)、4倍の容積が、深さ5/8インチの注射(試験番号5)での漏出と比較して、漏出における違いをほとんど有さずに首尾よく注射されたため、針の貫入の深さを増大することが、同様に役立つようであった。すべての漏出は、側面放出針を使用して1分間の間に1インチの深さまで注射することによって、停止した(試験番号10〜11)。傾斜針に戻すと、漏出を生じた(試験番号12)。側面放出針の使用をさらに試験するために、100μl流体を最少限の漏出であるかのように速やかに注射し(試験番号13〜14)、このことは、側面放出針による優れた保持を示す。
【0049】
(実施例2−虚血性うっ血心不全の処置のための自己筋芽細胞移植)
方法:虚血性うっ血心不全(CHF)を、ヒツジにおいて繰り返しの冠状微塞栓形成によって、LV駆出画分(LVEF)が35%未満に維持されるまで誘導した。骨格筋筋芽細胞を、動物の前肢から得た生検から単離し、そして細胞を、3×108個の細胞を超える収量が達成されるまで培養した。CHF誘導の約2週間後、動物に、側面孔針を使用して、直接心筋注射を介して自己骨格筋芽細胞(3×108個の細胞)を移植した。細胞を、虚血性に損傷した左心室壁内の複数の部位に注射した。動物を、筋芽細胞移植の6週間後に屠殺し、心臓をホルマリン中で固定し、そして組織学的分析を実施して、細胞生存を評価した。
【0050】
結果:側面孔針を使用する細胞の送達は、死後組織学(post−mortem histology)によって評価したように、首尾よい細胞送達の結果となった。骨格筋特異的ミオシン免疫染色(図3A)によって同定した細胞は、細胞を注射した心筋の広い領域を満たした。より高い倍率において、ある高密度な細胞堆積物のトリクロム染色は、整列した筋管の堆積を示す(図3B)。線維の整列は、ほとんどの場合、周囲の宿主心筋と平行であった。小さな環状の赤い束のように見える各々の筋管は、横断面で切断された多核線維である。
【0051】
要約:側面孔針を使用する自己筋芽細胞の心外膜注射は、細胞を虚血性に損傷した心筋に首尾よく送達した、細胞は生存能力を維持し、そして融合されて、ほとんどの場合に宿主心筋と協調する多核筋管を形成する。組織学的証拠は、移植された心筋が成熟し、収縮タンパク質(例えば、ミオシン重鎖)を発現することを示唆する。
【0052】
(実施例3−梗塞した心筋の処置のための自己筋芽細胞移植)
(プロトコルの目的) この実験の目的は、骨格筋由来の自己筋芽細胞を、心筋梗塞後の心筋の虚血性領域または瘢痕領域の中に、および周囲に移植することの実行可能性および安全性を試験することである。自己筋芽細胞の移植は、被験体が冠状動脈バイパス手術(CABG)を受けている間に実施する。この研究に登録した被験体は、心筋梗塞の経験を有し、また左心室機能不全をも有する。
【0053】
筋芽細胞を、インビトロで、被験体の骨格筋の生検から得た未分化細胞から拡大させる。この細胞を、バイパス手順の時点で左心室の壁に注射する。1つの目的は、心エコー検査法および磁気共鳴画像法(MRI)に基づいて、心機能の改善に関する予備的な情報を得て、局所的壁運動、壁の厚さ、および心室容積を評価することである。MRI画像評価は、他の画像手順、心エコー検査測定および臨床的評価と併せて実施する。
【0054】
(研究についての意義および背景) 冠状動脈疾患は、米国における主な死因であり、死者4.8人毎の1人についての原因であるか、または毎年ほぼ500,000人の死亡の原因である。この疾患は、心筋に供給する血管の壁における脂質沈着、マクロファージ、および線維組織からなるアテローム斑の蓄積によって引き起こされる。米国心臓病協会(American Heart Associaton)によると、1,800万人の米国人が、冠状動脈疾患を有する(AHA、1999)。不安定なプラークの破裂は、血小板凝集および血栓形成を促進する物質を活性化する。血栓は、血小板、血液細胞およびフィブリンからなり、1以上の冠状血管をブロックし得、結果として心筋への酸素の不十分な供給を生じる。心臓の特定の筋肉細胞である心筋は、通常は細胞分裂が起こらないため、この高度に活性な筋肉は急速に損傷し、かつこの損傷は不可逆的である。この結末が、梗塞、心筋の損傷領域であり、この領域において壊死心筋細胞が瘢痕組織および線維症によって置き換えられ、心臓の収縮性および機能が弱体化する。約1,500万人の新たな心臓発作、および再発性の心臓発作が、毎年報告される。
【0055】
心筋梗塞後の虚血性損傷を防ぐための処置は、血栓溶解薬を含み、これは、フィブリン凝塊を破壊し、そして閉塞した動脈を開放する。これらの薬物は、閉塞性の現象から著しく影響した罹患率および死亡率を有するが、有効であるために心筋梗塞後の短い時間間隔内に投与されなければならない。最近の医療マネジメントを用いてでさえ、急性心筋梗塞のうちの約5分の1が死に到る。心臓カテーテル法、血管形成、および閉塞した血管を開放するためにステント挿入することは、灌流を回復することにおける有効性が証明されているが、すでに存在する虚血性の損傷を覆し得ない。冠状動脈バイパス手術は、多くの場合、これらの手順が全く有効でない場合に行われる。500,000件を超えるバイパス手術が、毎年米国において実施される。
【0056】
心臓血管疾患に関連する経済的影響は、HCUPの全国的な入院患者の統計によって示唆されるように驚くべきものであり、この統計は、心臓血管疾患に関連する入院患者の費用が、入院患者の総医療費のうちで最も費用の多い疾患カテゴリ(主な診断に基づいて、26%または970億ドル)であることを示す。心臓血管疾患および発作について見積もられた直接費および間接費は、心筋梗塞に関連して、1年当たり1,000億ドルずつ増えて2,860億ドルにも達する。
【0057】
心筋梗塞を切り抜け、かなりのサイズの非機能性心筋の領域を有する被験体は、心不全を発症することに関して増加した危険性がある。治療における最近の進歩は、虚血性の事象によって損傷している心筋組織のためのいかなる処置も提供しない。左心室は、代償機構の一部として肥大して、弱められた筋肉において心拍出量が増加する。この代償応答は、個々の心筋細胞が肥大して結果的に減少した収縮性を生じる場合に、致命傷となる。この心筋の再構築は、ACE(アンギオテンシン変換酵素)インヒビターおよびβ遮断薬を用いる薬理学的処置によって減速されるが、末期の心不全は、5年以内に80%の被験体において死をもたらす。損傷した心筋組織を置き換え、そして心不全への進行を予防する治療は、心筋に対する虚血性損傷の処置に対する重要な貢献である。
【0058】
以前の梗塞により既に左心室機能不全が存在する患者がCABG手順を要する場合、予後はそれほど確かではなくなる。このことは、CABG手術後の向上した結果についての必要性を残し、これらの場合において、多くの場合、心室の外科的修復または自動心臓内心変換除細動器(Automatic Intracardiac Cardioverted Defibrillator(AICD))の配置と組み合わされる。このレベルでの障害を有する被験体は、バイパス手術後に正常な心臓機能を回復する可能性は低く、追加の治療から利益を得る可能性がある。
【0059】
心筋細胞(筋細胞)は、損傷した心筋層を分裂して修復する能力を有さないが、骨格筋は、損傷した筋肉を修復する必要がある場合に分裂する細胞である筋芽細胞を含む。心筋および骨格筋は、構造、機能、および顕微的外観において多くの類似性を有し、従って、骨格筋からの筋芽細胞は、損傷した心筋に移植された場合、収縮機能を提供することが可能であり得る。
【0060】
被験体の骨格筋からの自系筋芽細胞を、単離し、増殖して、損傷した心筋(heart muscle)に移植するために使用する。筋芽細胞の移植は、心筋壁の機能的能力を上昇させ得、梗塞領域において心室再造形を低下させ得る、新規の処置を提供する。心筋梗塞を罹患する被験体は、これらの筋芽細胞がその損傷した心筋層を修復し得る場合、大いに恩恵を受ける。これらの細胞は、心筋梗塞を罹患している被験体の筋肉生検から単離され、従って、被験体自身の筋芽細胞をその心臓に移植して、それにより、いかなる免疫障壁も避けることを可能にする。
【0061】
この研究における被験体は、心筋梗塞を有しており、そしてCABG外科手術を受ける前は左心室機能不全を有する。左心室機能不全は、35%未満の駆出率によって定義される。左心室機能不全を有する患者は、CABG外科手術の1ヶ月後に90%の生存率を有し、5年後には69%の生存率を有し、これに対して、正常な左心室機能を有する患者の生存率は、1ヵ月後および5年後に96%および90%である(ACC/AHA Task Force Report,Circulation 83(3):1125−1173,1991;本明細書中に参考として援用される)。梗塞部位を外科手術前に局在化させ、そしてこれらの細胞を、梗塞内に注射し、そして周囲の組織内に注射して細胞生存率および梗塞内または梗塞周辺領域(peri−infarct zone)内における細胞移植の機能的利益を評価することを企図し得る。
【0062】
CABG外科手術についての患者は、その生理学的症状、ならびに冠状動脈閉塞および心筋灌流の評価に基づいて選択される。最も一般的な生理学的知見は、重篤なアンギナであり、そしてこれが禁忌を有さない被験体において冠状動脈閉塞の証拠と組み合わさる場合、処置方法(procedure)が計画される。この研究における被験体を、心機能についてMRIを用いてモニターし、局所壁運動、壁の厚み、血管容積、および駆出率を評価した後に外科手術する。虚血性心筋層の再灌流についてのCABG外科手術の結果には、非常に定評がある。既存の左心室機能不全は、予後をより不確かにするが、細胞外マトリックスの沈着物を含む瘢痕組織は、血管再生によって影響をうけにくく、瘢痕組織を移植することは滅多に企図されない。
【0063】
ヒトにおける使用のための筋芽細胞の調製は、当該分野で記載のように実施する。これらの筋芽細胞(未分化細胞)は骨格筋に存在し、筋管(骨格筋の収縮性エレメントを有する筋線維細胞)の前駆体として作用する。未分化細胞は、筋肉が損傷した場合に細胞分裂を可能にする。骨格筋に由来する筋芽細胞は、50世代までインビトロで増殖し得、そして筋ジストロフィを処置するための2回の臨床試験に供されている(Neumeyerら,「Pilot Study of Myoblast Transfer in the Treatment of Becker Muscular Dystrophy」Neurology 51:589−592,1998;本明細書中で参考として援用される)。
【0064】
被験体の骨格筋から生検を入手し、適切な実験室に輸送して、筋芽細胞の単離および増殖を行う。次いで、細胞を回収し、そして移植のための臨床部位に戻す。
【0065】
自系筋芽細胞の使用は、免疫系によってこの細胞が異物として認識されないという利点を有する。抗原提示細胞によって提示される全ての抗原は、恐らく、宿主のT細胞に遭遇しており、従って免疫系は、これらの抗原に対して寛容化される。これは、研究を支持して実施した動物実験の場合であった。これらの研究において、心臓内に同系の筋芽細胞(Lewisラット)を注射し、免疫応答を生じなかった。この知見と一致して、これらの研究におけるシクロスポリンおよびステロイドの使用は、移植片の生存に関して、細胞に対して利点を与えなかった。
【0066】
骨格筋筋芽細胞および胎児心筋細胞の両方の移植を伴う動物研究により、骨格筋筋芽細胞は、動物の心臓の機能を損なうことなく移植片を形成し得ることが実証された(Taylorら,「Regenerating Functional Myocardium:Improved Performance after Skeletal Myoblast Transplantation」Nature Medicine 4(8):929−933,1998;Reineckeら,1999;それぞれは本明細書中で参考として援用される)。健康な組織内に注射された筋芽細胞は、心臓において、移植されて筋管を形成することを示している。心筋梗塞モデルを、3つの実験室において試験している。心筋梗塞を有するウサギにおいて、骨格筋筋芽細胞が生存し、その骨格筋表現型を維持し、そして心臓機能を増強することを見出した。(Taylorら,「Regenerating Functional Myocardium:Improved Performance after Skeletal Myoblast Transplantation」Nature Medicine 4(8):929−933,1998;本明細書中で参考として援用される)。ラット凍傷(cryoinjury)モデルにおいて、筋芽細胞は、移植されて筋管を形成し、この筋管は、心臓機能を増強し、そして心臓特異的タンパク質の発現に基づいて心筋細胞様になることが見出された(Murryら,「Skeletal Myoblast Transplantation for Repair of Myocardial Necrosis」J.Clin.Invest.98(11):2512−2523,1996;本明細書中で参考として援用される)。研究により、ラット筋芽細胞は、Langendorf手順によって測定されるように、安定な移植片を形成し、心筋機能を増強することが、示されている(Jainら,「Skeletal Muscle Implantation Attenuates Post−MI Ventricular Remodeling and Improves Cardiac Performance」2000; 本明細書中で参考として援用される)。これらの細胞は、梗塞領域の外側および内側の両方で生存する。さらに、これらの細胞は、融合して筋管を形成し、そして梗塞の境界において筋細胞と密接な結合を形成すると考えられる。コントロール動物と比較して上昇した心筋の収縮性のおよび心拍出量は、骨格筋移植片の実際の収縮、または処置による血管容量の増大の阻止からもたらされ得る。処置動物において最終拡張期容積は減少し、これは、血管再造形の進行を示した。この血管再造形の進行は、未処置動物において阻止されていることが観察された。
【0067】
左心室の約30%の梗塞を有する被験体において失われた心筋細胞を入れ替えるために、約2〜3億の新規の生存細胞が必要であると算出している。多数の筋芽細胞を注入することの安全性および効力を、30%の梗塞内に100万個の細胞を注射したラットモデルにおいて試験している。これらの実験において安全性の問題は指摘されず、そして細胞移植後のラットの生存率は優秀であった。
【0068】
要約すれば、筋芽細胞移植は、心筋梗塞を有する被験体にとって有利な治療であり得、損傷した心筋を回復させる可能性を有する。これは、瘢痕形成(scarring)および梗塞の拡大の阻止に起因し得るか、または梗塞した心筋の収縮の増大によるものであり得、これらは移植した心筋によってもたらされる。MRIによって測定される局所壁機能の改善は、機能改善を評価するために使用され得る。また、駆出率および心拍出量のような標準的心臓機能の評価のために画像化を利用し、筋芽移植が収縮を増大させ、そして梗塞拡大を阻止させるか否かを決定し得る。さらなる画像化(心電図)の評価および臨床評価もまた、心臓機能を評価するために実施される。
【0069】
(研究プロトコールの詳述)本研究の目的は、心筋梗塞後CABG外科手術を受けている被験体の左心室の壁に、骨格筋に由来する自系筋芽細胞を移植することの、実行可能性および安全性を調査することである。別の目的は、移植片生存率および心臓の機能特徴に対する移植の効果についての予備情報を得ることである。
【0070】
(研究設計)これは、心筋梗塞を経験し、左心室機能不全を有する被験体に関する研究である。被験体は、CABG外科手術の候補であり、他の外科的処置(すなわち、梗塞切除(infarctectomy)、ACID、または弁膜手術)の候補ではない。外科手術の約5週間前に、被験体の骨格筋から生検を採取する。この生検を使用して自系筋芽細胞の集団を産生し、CABG外科手術の時にこれを心臓の規定の領域に移植する。局所壁運動、壁の厚み、および血管容積に対するその効果について、移植領域をモニターした。
【0071】
(被験体選択)被験体は、本研究において筋芽細胞の移植を受ける。本研究に同意し、スクリーニングされる被験体の数は、被験体がCABG外科手術を受ける前に生検を採取し細胞を十分に増殖させて回収することができない場合、または被験体がCABG外科手術を受けないかもしくはCABG外科手術の時点で筋芽細胞移植が減少する場合、18より大きくてもよい。
【0072】
被験体の参加は、細胞移植後、基準の手順、1週間毎日の来診に次ぐ、最初の2年以内の10回までの来診からなる。被験体の病状が、同所心臓移植(OHT)を必要とする場合、心臓を処置した筋芽細胞を、検査のために回収する。任意のOHT被験体を、試験期間の残り期間にわたって追跡する。
【0073】
被験体は、以下の診断基準の全てを満たさなければ、研究参加を認められない:
1.被験体は、18歳以上でなければならず、かつインフォームドコンセントを受ることができる。
2.被験体は、基線において35%未満の左心室駆出率を有さねばならない。
3.被験体は、彼/彼女の心臓外科医の認可を有さねばならない。
4.被験体は、CABG外科手術を予定しなければならない。
5.被験体は、左心室内に同定可能な経壁瘢痕の領域を有さねばならない。
6.被験体は、MRIに適格でなければならない。
7.被験体は、血管外科回復術(ventricular surgical restoration)、AICD配置、または弁膜手術の同時候補であってはならない。
【0074】
以下の診断基準のいずれかを満たす被験体は、研究参加に不適格である:
1.被験体が、治験担当医師が手順の完了に有意であると判断した感染症を有する。
2.被験体が、治験担当医師が手順の完了に有意であると判断した他の複雑な心臓血管異常を有する。
3.被験体が、例えば、以下の臨床的に有意な心電図の異常を有する:
・高い等級の房室ブロック
・高頻度の心室頻拍、再発性の心室頻拍、または持続性の心室頻拍
4.被験体が、骨格筋疾患の証拠を有する。
5.被験体が、知見担当医師が本治験の結果に有意な影響を有するであろうと判断した他の病状の証拠を有する。
6.被験体が、活発な悪性疾患を有する。
7.被験体が、アルコール依存症または薬物依存症の最近の病歴(過去6ヶ月以内)を有する。
8.女性である場合、被験体が妊娠している、または妊娠しようとしている。
【0075】
(方法論)被験体は、CABG外科手術の最初の計画に基づいて、本研究に組み入れられる。本研究への参加に適格であることの決定後、CABG手順の予定の約5週間前に、被験体から筋肉生検を採取する。
【0076】
(基線評価)
1.インフォームドコンセント手順
2.判断基準に適格であることの決定
3.病歴審査および理学的検査
4.従来的な血液サンプル採取および以下を含む検査室検査(laboratory test):血液学(差次的なCBC)および心臓酵素レベルを含む血液化学
5.ECG
6.心エコー検査(標準的プロトコールによる)
7.尿検査
8.Diacrin免疫検査のための採血
9.筋肉生検
10.24時間のHolterモニタリング(筋芽細胞移植前に2回行う)
11.MRI(標準的プロトコールによる)
12.PETスキャン(必要に応じて)
13.NOGATMマッピング(必要に応じて)
14.血清妊娠検査(女性の場合)
15.クオリティオブライフ評価(必要に応じて)
(筋芽細胞移植片心臓供与後)
インフォームドコンセントの一部として、筋芽移植後に同所心臓移植が必要とされる場合、検査のために、被験体は彼/彼女の(自系筋芽細胞で処置した)心臓の供与を求められる。
【0077】
インフォームドコンセント手順の一部として、被験体は、被験体が筋芽細胞を与えられた後でOHTの前に亡くなった場合、剖検に同意することを考慮するよう求められる。剖検のための別の同意書を有効にする。心臓の組織学的分析の詳細については、以下を参照のこと。
【0078】
CABGについての候補が、インフォームドコンセントを得、そして包含/除外診断基準に合致した後、筋肉生検を採取する。腕または脚の筋肉から無菌条件下で採取した筋肉生検(約5.0g)を、生検輸送キットを使用して細胞処理施設に輸送する。施設は、細胞の輸送準備が出来る2〜3日前に、治験担当医師に報告する。CAGB外科手術を延期するかまたは取り消す場合、細胞を凍結保存(cyropreserve)し、将来の移植のために保存し得る。任意の未使用細胞を、基礎的な細胞移植研究目的(例えば、細胞増殖、保存、凍結などについての研究)に使用し得る。
【0079】
被験体に、骨格筋由来の自系筋芽細胞を移植する。筋芽細胞産生は、4工程のプロセスを包含する。このプロセスは、以下を包含する:被験体の筋肉組織(生検)の獲得、細胞処理施設における生検の受領および加工による未分化前駆体細胞の放出、未分化細胞に由来する筋芽細胞の増殖、ならびに移植のための最終産物の産生。産生プロセスを、FDA適正製造基準条例(21CFR第210部)および細胞/組織ベースの治療薬に関する全ての適用可能なFDAガイドラインの下で行う。
【0080】
CABGを予定する被験体が知見に組み込まれる場合、細胞を増殖させ、移植のために病院に運ぶ。筋芽細胞の単離を、本明細書中で記載のように実行する。
【0081】
被験体の看護の全ては、治験担当医および治験副担当医の管理の下である。移植は、病院内で行う。被験体を、CAGBのために準備させ、手順を実行する。本研究の意図は、細胞を、左心室壁の梗塞領域に注射することである。
【0082】
被験体1人あたりの総細胞投薬量は、投薬レジメンの増大に従う。細胞移植を受ける最初の3人の被験体は、各々最大1000万細胞を受ける。3000万細胞まで増大した細胞投薬量を、4人目、5人目および6人目の被験体に与え、そして1億細胞までを7人目、8人目および9人目の被験体に与える。10人目、11人目、および12人目の被験体に、3億細胞までの細胞投薬量を与える。13人目、14人目および15人目の被験体に、6億細胞までの細胞投薬量を与える。16人目、17人目および18人目の被験体に、9億細胞までの最大細胞投薬量を与える。
【0083】
細胞を、0.33×108細胞/ml、1.0×108細胞/ml、または1.6×108細胞/mlの濃度で臨床部位まで送達する。0.33×108細胞/mlの濃度を、最低投薬量(1000万細胞)のためのみに用い、各100μlを最大投薬量(総容積300μl)に達するまで、3回の注射を要する。3000万細胞投薬群のために、細胞を、1.0×108細胞/mlに濃縮し、各100μlの注射を3回要する(総容積300μl)。1億細胞投薬群のために、細胞を1.0×108細胞/mlに濃縮し、各100μlの注射を10回要する(総容積1ml)。3億細胞投薬群のために、細胞を1.0×108細胞/mlに濃縮し、各100μlの注射を30回要する(総容積3ml)。6億細胞投薬群のために、細胞を1.6×108細胞/mlに濃縮し、各150μlの注射を25回要する(総容積3.75ml)。9億細胞投薬群のために、細胞を1.6×108細胞/mlに濃縮し、各150μlの注射を38回要する(総容積5.7ml)。標的投薬量が増大するに従い、細胞濃度を上昇させ、注射する総容積を最小化する。
【0084】
各筋芽細胞注射を、ゆっくりと行う。各注射後、針を5〜15秒間定位置に保ち、注射の跡に沿った細胞運動を最小にする。手順の後、被験体を手術室から集中治療室(ICU)に移し、24時間観察する。手術後、従来検査のために採血する(15ml)。
【0085】
研究の被験体は、自系筋芽細胞を受けた後すぐに、移植後処置期間に入る。最初の来診は、移植の翌日である。その後の評価来診は、移植2〜6日後(または退院まで)、1週間後、2週間後、3週間後、6週間後、9週間後、12週間後、および6ヶ月後、9ヶ月後、12ヶ月後、18ヶ月後、24ヵ月後に、行う。週毎の来診(1週間後、2週間後、3週間後、6週間後、9週間後および12週間後)は、実際の時点の±3日間以内に行い得る。月毎の来診(6ヶ月後、9ヶ月後、12ヶ月後、18ヶ月後および24ヵ月後)は、実際の時点の±7日間以内に行い得る。移植後24時間の間、被験体は、生命徴候および臨床状態の継続的な標準的ICUモニタリングを受ける。筋芽細胞移植手順に関する特定の潜在的な問題点としては、以下が挙げられる:
1.不整脈
2.外科手術および細胞注射の間の細動
3.心臓の注射(移植)部位からの出血
4.感染症
理学的検査、ECG、標準化心エコー検査、Holterモニタリング、血液検査および尿検査、ならびにクオリティオブライフ評価(必要に応じて)によって、安全性モニタリングを行う。心臓機能の改善についての検査を、標準化MRIおよび標準化心エコー検査、または必要に応じてPETスキャンもしくはNOGATMマッピングによって行う。
【0086】
移植後期間に、以下の評価を完了する。
【0087】
(1日目)
・理学的検査
・ECG
・従来の血液検査
・尿検査
・有害事象
・併用薬物適用
(第2日目〜第6日目(または、病院から退院するまで))
・ECG
・通常の血液検査
・有害事象
・併用薬
(第1週)
・健康診断
・ECG
・心エコー検査
・24時間のホルターモニタリング
・通常の血液検査
・Diacrin血液検査
・尿検査
・有害事象
・併用薬
(第2週)
・健康診断
・ECG
・通常の血液検査
・有害事象
・併用薬
(第3週)
・健康診断
・ECG
・心エコー検査
・24時間のホルターモニタリング
・MRI
・PETスキャン(任意)
・通常の血液検査
・Diacrin血液検査
・尿検査
・有害事象
・併用薬
(第6週および第9週)
・健康診断
・ECG
・心エコー検査
・通常の血液検査
・尿検査
・有害事象
・併用薬
(第12週)
・健康診断
・ECG
・心エコー検査
・NOGATM マッピング(任意)
・MRI
・PETスキャン(任意)
・通常の血液検査
・Diacrin血液検査
・尿検査
・有害事象
・併用薬
(6ヶ月)
・健康診断
・ECG
・心エコー検査
・24時間のホルターモニタリング
・MRI
・PETスキャン(任意)
・NOGATM マッピング(任意)
・通常の血液検査
・Diacrin血液検査
・尿検査
・有害事象
・併用薬
・クオリティ・オブ・ライフ(任意)
(9ヶ月)
・健康診断
・ECG
・通常の血液検査
・有害事象
・併用薬
(12ヶ月)
・健康診断
・ECG
・心エコー検査
・24時間のホルターモニタリング
・MRI
・PETスキャン(任意)
・通常の血液検査
・尿検査
・有害事象
・併用薬
・クオリティ・オブ・ライフ(任意)
(18ヶ月)
・健康診断
・ECG
・心エコー検査
・MRI
・PETスキャン(任意)
・通常の血液検査
・尿検査
・有害事象
・併用薬
(24ヶ月)
・健康診断
・ECG
・心エコー検査
・24時間のホルターモニタリング
・通常の血液検査
・尿検査
・有害事象
・併用薬
・クオリティ・オブ・ライフ(任意)。
【0088】
要約すると、その状態の被験体に対する標準的な臨床的ケアを超えた、研究被験体が受ける手順は、1)筋肉生検、2)自己筋芽細胞の移植;3)ホルターモニタリング、4)頻繁な採血、ならびに5)MRI、および6)PETスキャン、および/またはNOGAマッピング(任意、そして、ベースラインにて行われる場合のみ)、7)クオリティ・オブ・ライフ(任意)である。
【0089】
(安全性評価)有害事象は、研究被験体により経験された、任意の所望でない、身体的、精神的または行動的効果である。この事象が、治験薬(investigational product)と関連するとみなされるかどうかは関係ない。さらに、有害事象は、治験薬の使用と時間的に関連する、任意の好ましくなく、かつ意図的でない徴候(すなわち、異常な実験室における所見、症状または疾患)である。患者のベースライン状態または病歴に関する症状は、有害事象としては報告されない。しかし、研究の間に悪化する、前々から存在する状態は、有害事象とみなされる。有害事象は、FDAのガイドライン文書「Conducting a Clinical Safety Review of a New Product Application and Preparing a Report on the Review,November 1996」に示唆されるように、身体系統により分類される。
【0090】
重篤な有害事象(SAE)は、以下の転帰のうちの1つとして定義される:(1)死亡;(2)生命にかかわる(治験担当医師(investigator)の観点から、事象が生じる場合に、被験体をその事象からの死亡の直接の危険性に置く、任意の有害体験、すなわち、より重篤な形態にて生じ、死亡を引き起こしかねない反応は含まない);(3)入院患者または既存の入院の延長;(4)持続性またはかなりの障害/無能;(5)被験体を危険にさらし得、かつ、他の転帰のうちの1つを予防するために、医学的または外科的な介入を必要とし得る、重要な医療事象;および(6)先天性奇形/出生時欠損。
【0091】
臨床検査における有害事象の場合について、因果関係の評価が必要とされる。治験薬の使用に関する有害事象について、その経験が、治験薬により引き起こされ得るという合理的な可能性が存在しなければならない。従って、関連する有害事象は、薬物/生物製剤/処置と有害事象との間には、原因となる関係を示唆する証拠または理由が存在することを暗示する。
【0092】
細胞移植手順から開始して、治験担当医師は、有害事象を再検討し、必要な場合、医療介入が開始される。細胞移植手順の前に、筋肉生検手順に関連するものとして治験担当医師により評価される有害事象のみが、捕捉され、報告されるべきである。
【0093】
全ての有害事象について、治験担当医師は、有害事象の研究薬物(study product)、外科的手順および、任意の必要な処置に対する関係性を評価するために質問される。21 CFR §312.32に従う場合、治験担当医師は、その有害事象を、重篤な有害事象であると決定し、以下に述べるさらなる工程を必要とする。
【0094】
(臨床的評価)移植後の臨床的評価としては以下が挙げられる:有害事象および全ての併用薬のモニタリング、健康診断、ECG、心エコー検査(標準化したプロトコールによる)、24時間のホルターモニタリング、MRI(標準化したプロトコールによる)、血液検査、尿検査、PETスキャン(任意)、NOGATMマッピング(任意)、クオリティ・オブ・ライフの評価(任意)、ならびに、移植を評価するための心臓の組織学的評価(被験体がOHTまたはダイス(dies)を受けている場合)。
【0095】
治験担当医師は、ベースライン、第1日目、第1週、第2週、第3週、第6週、第9週、第12週ならびに6ヶ月、9ヶ月、12ヶ月、18ヶ月および24ヶ月に健康診断を実施する。この健康診断としては、血圧、心拍、呼吸速度、温度(およびベースラインにおける身長および体重)の取得、および、主要な身体系統の記録による評価が挙げられる。心電図を用いて、心臓の電気的活動を評価する。ECGを、ベースラインと、全ての移植後の回診時に実施する。
【0096】
標準化した心エコー検査を用いて、心臓の性能(例えば、心室の収縮期および拡張期の機能)を評価する。心エコー検査をまた用いて、壁の厚さを評価する。この評価は、ベースライン、第1週、第3週、第6週、第9週、第12週ならびに、6ヶ月、12ヶ月、18ヶ月および24ヶ月でなされる。
【0097】
24時間のホルターモニタリングを用いて、不整脈についてモニタリングする。被験体は、ベースライン期間と、第1週および第3週、ならびに、6ヶ月、12ヶ月および24ヶ月に2回、これをなされる。
【0098】
標準化したMRIを実施して、細胞生存率および移植片の機能を評価する。MRIは、ベースライン、第3週および第12週、ならびに、6ヶ月、12ヶ月および18ヶ月において実施される。
【0099】
通常の血液サンプル(15ml)が、ベースラインの回診時の安全性評価として、移植の日、第1日目、第2〜6日目(または、排出まで)、第1週、第2週、第3週、第6週、第9週、第12週、ならびに、6ヶ月、9ヶ月、12ヶ月、18ヶ月および24ヶ月に、血液学(差次的な完全血球数が挙げられるがこれに限定されない)および血液化学(Na、K、Cl、CO2、グルコース、BUN、クレアチニンおよび心筋酵素のレベルが挙げられるがこれらに限定されない)について検査される。
【0100】
ベースライン、第1週、第3週、第12週、および6ヶ月の回診時に、検査のために、血液サンプル(5ml)が採取される。サンプルは、被験体の筋芽細胞に対する抗体について検査される。抗体検査からの結果は、被験体の臨床的ケアに影響を及ぼさないが、研究者に、自己筋芽細胞移植についてのさらなる情報を提供する。
【0101】
ベースライン、第1日、第1週、第3週、第6週、第9週、第12週、ならびに、6ヶ月、12ヶ月、18ヶ月および24ヶ月に、安全性評価として日常の尿検査が行われる。
【0102】
筋芽細胞移植を受けた被験体が、OHTまたはダイスを受けた後、筋芽細胞を移植された心臓の部分を固定し、組織学のために切片にする。移植片を含む領域を、H&Eおよびトリクロムで染色し、筋芽細胞移植片を位置決めする。移植片の同定は、ミオジェニン抗体および抗体My32を用いて、免疫組織化学により確認する。移植片のサイズ、細胞数、形態学、および免疫系の細胞による浸潤の程度が記録される。
【0103】
PETスキャンは任意の検査であり、治験担当医師の指示に従って、ベースライン、第3週および第12週、ならびに6ヶ月、12ヶ月および18ヶ月にて取得され得る。
【0104】
NOGATMマッピングは、任意の検査であり、治験担当医師の指示に従って、ベースライン、第12週および6ヶ月にて取得され得る。
【0105】
SF−36および/またはMinnesota Living with Heart Failureは、ベースライン、6ヶ月、12ヶ月および24ヶ月にて使用され得る、クオリティ・オブ・ライフ評価の例である。
(データ分析)ECG、血液検査および健康診断により安全性が評価される。耐用性は、被験体が報告した有害事象により評価される。
(危険性および利点の分析)この研究に参加している被験体に対し、直接的な利点は存在しないが、この処置が、梗塞性の心筋に関連する徴候、症状または他の合併症を減少し得ることが望まれている。この手順は、心機能を増加し得、そして、被験体の生存機会を増加し得る。自己筋芽細胞が本研究において成功する場合、他者が、この処置から恩恵を受け得る。
【0106】
本研究における危険因子としては、自己筋芽細胞に対する有害反応の可能性が挙げられる。移植された筋芽細胞の使用は、比較的新しく、従って、特定の危険性が、この時点で未知である。動物研究が、筋肉細胞の首尾よい移植が、免疫抑制なしに達成され得ることを示している。
【0107】
移植のための細胞の調製のための筋肉組織の除去に関連する、感染および他の合併症の危険性が存在する。感染が生じる場合、その感染が処置され得る。また、生検部位において、出血、挫傷または血腫の危険性が存在する。生検は、局所麻酔を用いて取得されるが、この手順からの痛みが経験され得る。瘢痕が生検部位において生じ得るわずかな危険性が存在する。
【0108】
これが自己の、細胞ベースの製品であるため、アレルギー反応の可能性はあるが、その可能性は低い。被験体は、任意のアレルギー反応についての術中期間、密にモニタリングされるべきであり、そして、反応が生じない場合、この被験体は、ケアの臨床的基準により処置されるべきである。
【0109】
左心室の注入部位において、出血および/または血餅の発生の危険性がある。被験体は、密にモニタリングされるべきであり、ケアの臨床的基準を用いて、出血および/または血餅の発生を管理するべきである。この危険性の存在は、死亡または障害をもたらし得る可能性がある。
【0110】
移植部位における自己筋芽細胞移植からの感染の危険性は、可能性が低い。被験体は、感染の任意の徴候および症状について、術中の期間、密にモニタリングされるべきであり、感染が実際に生じる場合は、被験体は、ケアの臨床的基準によって処置されるべきである。感染の存在が、死亡または障害をもたらし得る可能性がある。
【0111】
心臓の骨格筋の移植に関する不整脈の危険性が存在する。不整脈は、前臨床研究においては生じることが見出されなかった。未検出かつ未処置の不整脈は、死亡を引き起こし得る。被験体は、心臓の不整脈の発生について、密にモニタリングされる。
【0112】
左心室の壁の筋芽細胞への注射は、左心室機能の減少を生じ得る。この発生の危険性は知られていないが、左心不全および/または死亡をもたらし得る。
【0113】
心内膜マッピングの結果としての損傷の危険性は非常に低く、標準的な経皮心臓インターベンション手順に類似する。
【0114】
移植された細胞が、被験体により拒絶されるか、または、免疫拒絶以外の原因により失敗に終わるという危険性が存在する。拒絶の効果としては、発疹、熱または高血圧が挙げられ得る。存在するとしても、移植の失敗が、被験体の病状にどのような効果を与え得るかは知られていない。
【0115】
筋芽細胞が、どのくらいの期間ヒト心臓において生存するかは未知である。動物研究および、ヒトの経験は、今日までに、少なくとも3ヶ月間の心臓の生存という、移植片統合特性を示す。
【0116】
(実施例4−末期の心不全の処置のための自己筋芽細胞移植)
(プロトコールの目的)この実施例の目的は、骨格筋由来の自己筋芽細胞の、末期の心不全の被験体の心筋への移植の実現可能性および安全性を試験することである。被験体は、心臓移植手術の候補者であり、同所性移植へのつなぎとして、左心室補助デバイス(LVAD)の配置が計画されている。細胞は、被験体の骨格筋の生検から得た組織から調製され、左心室の所定の領域において、被験体の心臓へと移植される。細胞は、LVADを移植するための手術の間に心筋へと直接注射される。筋芽細胞は、インビトロで生検から得られた未分化細胞から拡大される。安全性は、予期しない任意の有害事象(例えば、筋芽細胞の移植に起因し得る、異常な心機能)に基づいて評価される。二次的な目的は、自己移植片の生存、および、自己筋芽細胞移植に関連し得る心機能の改善に対する可能性についての予備的な情報を獲得することである。
【0117】
(研究に対する有意さおよびバックグラウンド)心不全は、1年あたり100万以上の入院の原因であり、65歳以上の患者における最も一般的な診察での診断である。毎年、心不全を有するおよそ70,000の人々が、心臓置換の恩恵を受け得るが、約2,500の心臓移植のみが実施される(Hosenpubら、「The Registry of the International Society for Heart and Lung Transplantation」J.Heart Lung Transplant.16:691−712,1997;本明細書中に参考として援用される)。心不全は、心臓血管疾患からの主要な死因である。心不全の診断を有する5分の1の患者は、1年以内に死亡し、そして、50%の患者が、5年以内に死亡する。心臓血管疾患に関する経済的帰結は、HCUP(Healthcare Cost and Utilization Project)の全世界の入院患者統計により示唆されたように、驚くべきである。この統計は、心臓血管疾患が、最も費用のかかる疾患分類(主要な診断に基づく、入院患者のヘルスケア費用全体の26%、すなわち、970億ドルを占める)であることを示す。病院における心不全の管理は、一年に、約360億ドルかかる(O’Connellら、「Economic impact of heart failure in the United States:time for a different approach」J.Heart Lung Transplant 13:S107−S112,1995;本明細書中に参考として援用される)。損傷した心筋組織を置換し、心不全の進行を阻止する治療は、この疾患の処置に重要な寄与を果たす。
【0118】
心不全は、心臓に対して病理学的ストレスを生じ、次いで、代償性機構をもたらす、心臓血管疾患を背景にして開始される、心臓へのさらなる損傷を招く破壊サイクルの末期である。これらの心臓壁への変化は、これらが、心臓の収縮期または拡張期の機能に影響を及ぼすかどうかとして分類され得る。従って、心不全は、最終的には、ポンプ動作の不適切さ(収縮期心不全)、心室充填の欠損(拡張期心不全)またはこの両方の不全の組み合わせに起因し得る。
【0119】
心不全の主要な危険因子は、危険性を200%増加させる高血圧、糖尿病、冠動脈疾患、前心筋梗塞、感染および弁の欠損である。単一の危険因子は、心不全を生じ得るが、因子の組み合わせが、有意に危険性を増加させる。患者は、呼吸困難、疲労、ならびに足、足首、および脚の浮腫を伴って存在し得る。肺における過剰の流体もまた、持続性の咳または喘鳴を生じ得る。危険因子を評価するための患者の病歴、および、上記の症候を検出するための健康診断、ならびに、異常な心音および肺のうっ血は、心不全の診断を提供し得る。心不全のさらなる確認は、ECG、心エコー検査および胸部X線検査から入手可能である。
【0120】
拡張期心不全は、心室の充填の異常から生じ、これは、線維性の非膨張性の瘢痕組織での膨張性組織の置換により生じた、心室の伸展性の減少に起因し得る。この状態において、拡張期容量は、正常よりもわずかに少ないが、左心室圧は、拡張期の間中、増加している。心室圧の上昇は、上流の高い静脈圧を生じ、肺および全身のうっ血を生じる。収縮期の性能(すなわち、心拍出量および駆出分画)は、正常であるか、または正常に近い。左心室の代償性の膨張は、拡張期容量の増加をもたらし、結果として、拡張期圧を上昇させる。重要なことには、収縮性の減少は、心拍出量および駆出分画の低下を生じる。
【0121】
冠状動脈疾患は、拡張期機能不全および収縮期機能不全の両方を生じる。この非常に活性な筋肉に対する酸素の不適切な供給により、迅速な損傷および病変が生じ、これらは不可逆的と考えられる。最終的に、梗塞:壊死性心筋細胞が瘢痕組織および瘢痕線維によって置き換えられた心筋の損傷領域、を生じる。この状態において、収縮期機能不全は、心筋細胞の喪失による収縮性の慢性的な喪失に起因する。拡張期機能不全は、非膨張性瘢痕組織の侵入に起因する心室の硬さの増加によって生じる。
【0122】
心室壁にかかる圧力のタイプは、心不全の生理機能を決定する。高血圧または大動脈狭窄は、過剰に負荷される圧力に起因して、心筋を圧迫する。圧力の過剰負荷は、左心室拍出の間、収縮性壁圧力を生じる。なぜなら、心臓は、通常の力よりも大きな力と接触して、適切な容量の血液を送り出さなければならないからである。増加した後負荷は、左心室の拡張を生じ、これは次いで、心筋肥大を生じる。大動脈弁逆流(「漏出性」大動脈半月弁を通る血液の逆流)は、左心室が収縮期および拡張期の間に血液を受け取った場合、容量過剰負荷を生じる。時間が経つと、これは左心室の拡張を生じる。次いで、この拡張した心室の直径の増加は、筋細線維の筋節がその通常の最大長さを越えて伸張する場合、増加した前負荷を生じる。
【0123】
増加した負荷(圧力または容量)を補償する主な機構は、心室肥大である。心筋細胞は分裂し得ないので、心筋肥大は、細胞の数が増加することなく、個々の筋細胞のサイズの増加から生じる。圧力が容量過剰負荷に関連するか圧力過剰負荷に関連するかに依存して、肥大のパターンは異なる。従って、左心室の質量は、圧力過剰負荷または容量過剰負荷の結果と同じ程度まで増加するが、壁厚は容量過剰負荷におけるよりも圧力過剰負荷においてより大きく増加する。細胞レベルにおいて、圧力過剰負荷は心筋肥大を生じ、これは心筋線維の並行複製および個々の筋細胞の肥厚化から生じる短縮性様式で成長する。容量過剰負荷および拡張期壁圧は、連続した筋節の複製、筋細胞の伸張、および心室拡張を生じる。容量過剰負荷から生じる心室伸張の程度は、圧力過剰負荷から生じるものよりも大きい。両方の状態において、肥大性補償応答の主な結果は、収縮期壁圧を通常のレベルまで戻し、そして心拍出量を改善することである。しかし、連続した流体力学的圧力下で、さらなる細胞変化が生じ、下向きの螺旋が形成される。これらの変化としては、筋線維および管系の破壊、心臓組織の線維組織での置換、および筋細胞壊死が上げられる。心筋細胞のアポトーシスは、収縮性組織の喪失において重要な役割を果たす。これは、残りの心筋細胞に対する増加した圧力を生じ、反応性肥大および心不全を引き起こす。心筋細胞に対するこれらの変化に加えて、肥大はまた、虚血の発生を伴う毛細管密度の減少を引き起こし、これは置換性線維形成を速める。
【0124】
LVADの配置が同定された患者は、末期の心不全であり、心臓移植または心臓補助デバイスの導入以外のわずかな治療的選択肢しか有さない。この点に進行する患者は一般に、薬理学的治療によって処置されているが、発達中の心室再構築を有し、これは移植しないと生命を脅かすことになる。早期段階の心不全を有する患者の処置は、ACEインヒビター、利尿薬、強心薬およびβブロッカーで始められる。ACEインヒビターの使用は、左心室再構築の進行を遅くすることが示されているが、このプロセスは、任意の薬理学的治療によって止められない。
【0125】
LVADの使用は、正常位心臓移植を受けるべき患者の生存率を大きく増加させた。HeartMate System(ThermoCardiosystems,Inc.)を用いる臨床試験は、心臓移植候補者における死亡率の55%の減少を示した(Frazierら「The HeartMate Left Ventricular Assist System:overview and 12−year experience」Tex.Heart Inst.J.25:265−271,1998;本明細書中に参考として援用される)。BVS 500(Abiomed,Inc.)で補助し、補助を98日まで提供した場合、移植を受けた移植候補者の数は70%であった。LVADで補助された患者の平均87%が、心臓移植後に退院まで生存する(Burtonら、Ann.Thorac.Surg.55:1425−1430,1993;本明細書中に参考として援用される)。
【0126】
心筋細胞は、損傷した心筋を分裂させ、修復する能力を有していないが、骨格筋は、未分化細胞と呼ばれる細胞を含み、これは損傷した筋肉を修復するために集められる場合、筋芽細胞として分裂する。しかし、両方のタイプの横紋筋(すなわち、心筋および骨格筋)は、構造、機能および微視的外観において多くの類似点を有する;従って、骨格筋由来の筋芽細胞は、損傷した心筋に移植された場合、収縮機能を提供し得る(Murryら「Skeletal Myoblast Transplantation for Repair of Myocardial Necrosis」J.Clin.Invest.98(11):2512−2523(1996);Taylorら、「Regenerating functional myocardium:Improved performance after skeletal myoblast transplantation」Nature Medicine 4(8):929−933,1998;これらの各々は本明細書中に参考として援用される)。被験体の骨格筋由来の自系筋芽細胞は、単離され、増殖され、そして損傷した心筋に移植するために使用される。筋芽細胞の移植は、壊死性心筋壁内の死んだ筋細胞を置換することによって、その機能的能力を増大し得る新たな処置を提供する。移植された筋芽細胞は、通常の収縮期壁圧を再確立し、そして心不全の破壊的サイクルを終わらせるかまたは遅らせるのを助けることを意図する。従って、置換療法によって壁圧を解放することによって、有害な肥大性変化は、もはや起こり続けなくなり、そして肥大性の細胞は、正常な形態に戻る機会を有し得る。矛盾しているように見えるかもしれないが、筋芽細胞の添加は、実際に、心臓のサイズを減少し得、それにより心不全を予防し得る。細胞は、鬱血性心不全に罹患している被験体の筋肉生検から単離され、従って、被験体自身の筋芽細胞がその心臓へ移植され得、それにより全ての免疫学的障壁が回避される。
【0127】
被験体は、心不全と診断されている。この被験体は、LVAD移植手術の間、心筋に直接移植された自系筋芽細胞を有する。筋芽細胞移植は、心臓の心筋拡張を減少し得る収縮性心筋を有する心筋を再増殖し、それによりその機能を改善することを意図する。さらに、被験体が引き続き心臓移植を受ける場合、取り出された心臓は、組織学的分析のために使用され、筋芽細胞生存が評価される。
【0128】
ヒトにおける使用のための筋芽細胞の調製は、本明細書中に記載されている。未分化細胞に由来するこれらの筋芽細胞は、骨格筋に存在し、ここで、これらは筋管(骨格筋細胞の収縮性エレメントを有する筋線維細胞)の前駆体として働く。骨格未分化細胞は、筋肉が損傷した場合に細胞分裂し得、それによりこの損傷した筋肉を交換する。骨格細胞に由来する筋芽細胞は、インビトロで、50世代ほど長く増殖し得、そして上記の2つの臨床試験のために供給されて、筋ジストロフィーを処置する。
【0129】
この研究について、生検が被験体の骨格筋から採取され、そして筋芽細胞の単離および増殖のために、細胞処理設備に運ばれる。この筋芽細胞は、3〜5週間増殖され、収集され、そして最終的な産物が、臨床現場に運ばれる。あるいは、筋肉組織および/または増殖筋芽細胞は、将来の移植のために、低温保存され得る。次いで、これらの筋芽細胞は、LVAD手術の時に、被験体の左心室の心筋に直接移植される。
【0130】
自系筋芽細胞の使用は、この細胞が免疫系によって異物として検出されないという利点を有する。自系移植片に存在する全ての抗原は、おそらく、宿主の免疫系によって攻撃され、従ってこのレシピエントはこれらの抗原に対して耐性である。この臨床研究の支持の下で実施された同系ドナーラットを使用する動物研究は、自系筋芽細胞の使用を模倣する。この同系筋芽細胞(Lewisラット)は心臓に移植され、そして移植片に対する顕著な免疫応答はなかった。
【0131】
骨格心筋および心臓心筋の両方の移植を用いる動物研究によって、骨格心筋細胞株および骨格筋から単離された培養筋芽細胞は、動物の心臓の機能を損なうことなく、移植片を形成し得ることが実証された。健常な組織に注入された筋芽細胞は、心臓に筋管を植え付けそして形成することが示されている。心筋梗塞モデルが、3つの研究室で試験された。低温損傷を有するウサギにおいて、骨格筋芽細胞は生存し、その骨格筋表現型を維持し、そして心臓機能を増強することが見出された。ラット低温損傷モデルにおいて、筋芽細胞は、植え付き、そして筋管を形成することが見出され、この筋管は、再び、心臓機能を増強し、そして心臓特異的タンパク質の発現に基づいて心筋細胞様になった。Jainらにより行われた研究(「Cell Therapy Attenuates Deleterious Ventricular Remodeling and Improves Cardiac Performance After Myocardial Infarction」Circulation 103:1920−1927,2001;本明細書中に参考として援用される)は、ラット筋芽細胞が、安定な移植片を形成し、そしてランゲンドルフ手順およびトレッドミル容量によって測定される場合、心筋機能を増強することを示した。最終拡張期容量は、処置動物において減少し、このことは、移植された筋芽細胞が、未処置動物で観察される心室再構築の進行を妨害したことを示す。これらの細胞は、梗塞領域の外側および内側の両方で生存した。さらに、これらの細胞は融合して、筋管を形成し、そして梗塞の境界で筋細胞との密な接触を形成するようであった。コントロール動物と比較して増加した心筋収縮性および心拍出は、骨格筋移植片の実際の収縮から生じ得るか、または処置による増大した心室容量(拡張期)の防止によって生じ得る。
【0132】
自系筋芽細胞を用いて左心室を再増殖し、収縮性細胞の30%の増加を達成して、破壊された心筋細胞を交換するために、少なくとも3億個の細胞の移植が必要である。多数の筋芽細胞の移植の安全性および有効性は、百万個の細胞が左心室の30%に注入されたラットモデルにおいて試験された。安全性の問題は、これらの研究において注目され、細胞移植後のラットの生存率は非常に良好であった。
【0133】
要約すると、筋芽細胞移植は、収縮性筋細胞の喪失を有する心筋を再構築することによって、心不全を有する被験体にとって有用な治療であり得る。これは、心筋崩壊の破壊サイクルに寄与するストレスを取り除くことによって、心不全の進行を予防し得る。OHT時に得られる組織の組織病理学的分析は、移植された筋芽細胞の生存率についての試験を可能にする。これらの試験的な研究において自系筋芽細胞を使用することによって、通常、移植に関連する免疫学的問題は回避される。
【0134】
(検索プロトコールの説明)
この研究の目的は、骨格筋由来の自系筋芽細胞の、左心不全を有する被験体(ブリッジまたは正常位心臓移植としてLVAD手術を受けている)の心筋への移植の実行可能性および安全性を調査することである。別の目的は、移植片の生存、および心臓の機能的特徴に対する移植の影響についての予備情報を得ることである。
【0135】
これは、末期の心不全の被験体を含む開放研究である。この被験体は、ブリッジ心臓移植または正常位心臓移植としてのLVAD手術の候補者である。研究者は、この被験体がLVAD手術を必要としていると予測した場合、滅菌生検がこの被験体の骨格筋から採取される。この生検は、LVAD手術の際に、肥大心臓の特定の領域に直接移植される自系筋芽細胞の集団を作製するために使用される。
【0136】
この被験体の参加は、ベースライン手順、1週間の間の毎日の来診、次いで15回までの来診(これは細胞移植後の最初の2年間以内、または正常位心臓移植まで続ける)から構成される。
【0137】
被験体は、研究参加に適格であるべき以下の基準の全てを満たしていなければならない:
1.被験体は、18歳以上であり、かつインフォームドコンセントを受けることができなければならない。
2.被験体は、LVAD移植の候補者であると決定されている。
3.被験体は、正常位心臓移植の候補者である。
4.被験体は、正常位心臓移植時に、試験のためにその心臓(自系筋芽細胞で処置されている)を提供することに同意する。
【0138】
以下の基準のいずれかを満たす被験体は、この研究の参加に不適格である:
1.被験体が、細胞移植時に、敗血症、肺炎および他の活性感染を有する(尿、血液培養物または胸部X線による)。
2.被験体が、本研究者がこの手順を完了するのに重要と考える他の複雑な心血管異常を有する。
3.被験体が、骨格筋疾患の証拠を有する。
4.被験体が、本研究者がこの試験の結果に対して重大な影響を有する可能性があると決定する他の医学的状態の証拠を有する。
5.被験体が、活性悪性腫瘍を有する。
6.被験体が、最近のアルコールまたは薬物乱用の履歴(6ヶ月)を有する。
7.女性の場合、妊娠しているか、または妊娠を試みている。
【0139】
被験体は、LVAD手術の必要性の初期決定に基づいて、この研究に加えられる。この研究における参加についての適格性の決定に従って、筋肉生検がこの被験体から採取され、そして全ての他のベースライン評価が、推定LVAD手順の可能な限り近くで完了される。
【0140】
(ベースライン評価)
1.インフォームドコンセント手順。
2.適格性基準の決定。
3.履歴および身体試験。
4.慣用的な血液サンプリングおよび臨床試験(血液学(差異を用いるCBC)および心臓酵素レベルを含む血液化学を含む)。
5.ECG。
6.心臓エコー検査。
7.尿検査。
8.Diacrin免疫試験のための採血。
9.筋肉生検。
10.子供を有している可能性のある女性の血清妊娠試験。
【0141】
インフォームドコンセントの一環として、被験体は、正常位心臓移植時に、試験のためにその心臓(自系筋芽細胞で処置されている)を提供することに同意する。
【0142】
インフォームドコンセント手順の一環として、被験体は、筋芽細胞を受ける後であるが、OHTの前に、この被験体が死亡した場合、検視に同意または許容するとみなされることを要求される。心臓の組織学的分析の詳細については、以下を参照のこと。
【0143】
筋肉生検は、LVAD手術の候補者がインフォームドコンセントを受け、包含/排他基準を満たした後に、採取される。滅菌条件下で採取された筋肉生検(1.0〜5.0gまで)は、細胞処理施設に運ばれ、ここで筋芽細胞が単離され、そして、培地中で増殖される。この設備は、これらの細胞に注射の準備ができる2〜3日前に、研究者に告知する。この研究者および設備は、自系筋芽細胞の収集のスケジュールを調整し、そしてこれらの細胞は、処置のために病院に運ばれる。LVAD手術が延期され、所望の筋芽細胞用量が達成されている場合、細胞は、将来の移植のために凍結されそして貯蔵され得る。この細胞が必要になった時点で、これらは解凍され、そして臨床施設に運ばれる。
【0144】
被験体が死亡するか、LVAD移植および細胞処置の前にOHTを受けるか、細胞が移植の準備ができる前にLVADを必要とするか、またはLVAD手術を受けない場合、これらの細胞は、基本的な細胞移植研究目的のために使用され得る。
【0145】
被験体は、骨格筋由来の自系筋芽細胞を移植される。筋芽細胞生成は、4工程のプロセスを包含し、このプロセスは、被験体の筋肉組織(生検)の採取、未分化前駆体細胞を解放するための生検の受領および処理、この未分化細胞由来の筋芽細胞の増殖、および移植のための最終産物の生成を包含する。この生成プロセスは、FDA Good Manufacturing Practice規則(21CFR Part 210)の下で実施され、そして全ての適用可能なFDAガイドラインは、細胞/組織ベースの治療製品に関する。
【0146】
LVADの可能な候補者である被験体がこの研究に加えられる場合、自系筋芽細胞が増殖され、そしてLVAD手術時における輸液のために病院に運ばれる。この被験体歯、試験の包含/排他基準に基づいて同定される。筋芽細胞の単離は、上記のように実施される。
【0147】
この手順の日において、筋芽細胞移植の前に、慣用試験のために血液が採取される(15ml)。被験体の看護全ては、研究者および副研究者の管理下にある。移植は、病院で行われる。被験体は、LVADのために準備され、そしてこの手順が実施される。
【0148】
細胞は、8×107細胞/mlの濃度である。100〜500μlまでの注入が、左心室の梗塞領域および梗塞周辺領域において30個までの部位に実施される。最大300×106個の細胞が注入される。針は、注入経路に沿った細胞の移動を最小限にするために、各注射の少なくとも30秒後までその場に維持される。この手順の後、被験体は、手術室から、24時間の観察が終わるまで、集中治療室に移される。
【0149】
試験被験体は、一旦、自己由来の筋芽細胞を受けると、移植処置後段階に入る。最初の往診を、移植の1日後に行う。引き続く評価往診を、移植後2日目〜6日目、1週間目、9日目および11日目、2週間目、3週間目、および4週間目、2ヶ月目、3ヶ月目、4ヶ月目、5ヶ月目、6ヶ月目、9ヶ月目、12ヶ月目、18ヶ月目、および24ヶ月目に行う。3週間目および4週間目の往診を、実際の時点の±3日以内に行う。毎月の往診(2ヶ月目、3ヶ月目、4ヶ月目、5ヶ月目、6ヶ月目、9ヶ月目、12ヶ月目、18ヶ月目、および24ヶ月目)を、実際の時点から±7日以内に行う。同所心臓移植(OHT)の時点に、処置段階が終了し、そして評価スケジュールが終結する。同所心臓移植が、24ヵ月後に行われる場合、被験体の首位の医療医師を介して、その患者を追跡するように配置がなされ、OHTまたは死亡の時点での試験のために、筋芽細胞で処置された心臓の回復を保障する。その部位での血液の慣用的な臨床試験に加えて、血液は、定期的な試験のために収集される。移植後24時間の間、被験体は、生命徴候および臨床状態の、標準的なICUモニタリングを受ける。筋芽細胞移植手順に関連する特定の潜在的な問題としては、以下が挙げられる:
1.不整脈
2.手術および細胞の注入の間の細動
3.心臓における注入(移植)部位からの出血
4.感染。
【0150】
以下の評価が、処置段階の間に完了される:
1日目:
・身体検査
・ECG
・慣用的な血液試験
・尿検査
・有害事象
・共同投薬
2〜6日目:
・ECG
・有害事象
・共同投薬
1週間目:
・身体検査
・ECG
・24時間のホルターモニタリング
・慣用的な血液試験
・漏出分泌血液試験
・尿検査
・有害事象
・共同投薬
9〜11日目:
・ECG
・有害事象
・共同投薬
2週間目および3週間目:
・身体検査
・ECG
・有害事象
・共同投薬
4週間目:
・身体検査
・ECG
・心エコー検査法
・24時間のホルターモニタリング
・慣用的な血液試験
・漏出分泌血液試験
・尿検査
・有害事象
・共同投薬
2ヶ月目、4ヶ月目、5ヶ月目および9ヶ月目:
・身体検査
・ECG
・慣用的な血液試験
・有害事象
・共同投薬
3ヶ月目:
・身体検査
・ECG
・慣用的な血液試験
・漏出分泌血液試験
・尿検査
・有害事象
・共同投薬
6ヶ月目:
・身体検査
・ECG
・心エコー検査法
・24時間のホルターモニタリング
・慣用的な血液試験
・漏出分泌血液試験
・尿検査
・有害事象
・共同投薬
18ヶ月目:
・身体検査
・ECG
・慣用的な血液試験
・尿検査
・有害事象
・共同投薬
12ヶ月目および24ヶ月目:
・身体検査
・ECG
・心エコー検査法
・24時間のホルターモニタリング
・慣用的な血液試験
・尿検査
・有害事象
・共同投薬。
【0151】
要約すると、試験被験体が受ける、それらの状態を有する被験体に対する標準的な臨床医療を超えた手順は、以下である:1)自己由来の筋芽細胞の移植;2)ホルターモニタリング、および3)頻繁な採血。
【0152】
安全性評価。有害事象とは、その事象が調査結果に関連するとみなされるか否かにかかわらず、試験被験体によって経験される、任意の所望でない物理的効果、心理的効果、または行動効果である。さらに、有害事象は、調査結果の使用に一時的に関連する、任意の好ましくない意図されない徴候(すなわち、異常な実験室知見、症状または疾患)である。患者のベースライン状態または病歴に関連する症状は、有害事象として報告されない。しかし、試験の間に増悪する事前の状態は、有害事象とみなされる。有害事象は、身体系によって、FDA指針文書「Conducting a Clinical Safety Review of a New Product Application and Preparing a Report on the Review,1996年11月」によって提唱されるように、分類される。
【0153】
重篤な有害事象(SAE)は、以下の結果の1つを生じるものである:(1)死亡;(2)生命の切迫(調査者の観点から、被験体を、反応が起こってから即時の死の危険がある状態にする、任意の有害な経験(すなわち、より重篤な形態で起こる場合に死を引き起こし得る反応を含まない));(3)入院患者の入院または既存の入院の延長;(4)入院を必要とするかまたは入院を延長する、持続性または有意な障害/無能;(5)被験体を危険に曝し得、そして他の結果の1つを予防するために医療もしくは外科的介在を必要とし得る、重要な医学的事象;および(6)先天異常/出生時欠損。
【0154】
臨床評価。移植後の臨床評価の重要な局面は、有害事象、身体検査、ECG、心エコー検査法、24時間のホルターモニタリング、MRIおよび心臓の組織学的評価(被験体がOHTを受けた後または死亡した後)を、綿密にモニタリングして、移植を評価することである。これらの評価は、規定された、予定された往診の間に実施される。
【0155】
調査者は、ベースライン、1日目、1週間目、2週間目、3週間目、4週間目、ならびに2ヶ月目、3ヶ月目、4ヶ月目、5ヶ月目、6ヶ月目、9ヶ月目、12ヶ月目、18ヶ月目、および24ヶ月目に、身体検査を実施する。身体検査は、血圧、心拍数、呼吸数、体温、身長、体重、および主要な身体系の詳細に記録された評価を獲得することを含む。
【0156】
心電図を使用して、心臓の電気的活性を評価する。ECGを、ベースライン、1日目、2〜6日目、1週間目、9日目および11日目、4週間目、ならびに2ヶ月目、3ヶ月目、4ヶ月目、5ヶ月目、6ヶ月目、9ヶ月目、12ヶ月目、18ヶ月目、および24ヶ月目において実施する。
【0157】
心電図を使用して、心臓の性能(例えば、心室の収縮期および拡張期の機能)を評価する。心電図をまた使用して、壁厚を評価する。これは、ベースライン、4週間目、ならびに6ヶ月目、12ヶ月目および24ヶ月目になされる。
【0158】
24時間のホルターモニタリングを、不整脈をモニタリングするために実施する。被験体は、これを、1週間目、4週間目、ならびに6ヶ月目、12ヶ月目、および24ヶ月目に行われる。
【0159】
慣用的な血液サンプル(15ml)を、血液学(区別を含む完全な血球算定を含むが、これに限定されない)および血液化学(Na、K、Cl、CO2、Glu、BUN、Creatが挙げられるが、これらに限定されない)(心臓酵素のレベルを含む)について、安全性評価として、ベースライン往診、移植の日、1日目、1週間目、4週間目、ならびに2ヶ月目、3ヶ月目、4ヶ月目、5ヶ月目、6ヶ月目、9ヶ月目、12ヶ月目、18ヶ月目および24ヶ月目に試験する。
【0160】
血液サンプル(5ml)を、ベースライン、1週間目、4週間目、ならびに3ヶ月目および6ヶ月目の往診での試験のために、引き抜く。サンプルを、被験体の筋芽細胞に対する抗体について試験する。抗体試験からの結果は、被検体の臨床治療に影響を与えず、自己由来の筋芽細胞移植に関するさらなる情報を、研究者に提供する。
【0161】
慣用的な尿検査を、安全性評価として、ベースライン、1日目、1週間目、4週間目、ならびに3ヶ月目、6ヶ月目、12ヶ月目、18ヶ月目、および24ヶ月目に実施する。
【0162】
筋芽細胞移植を受けた被験体がOHTを受けるかまたは死亡した後に、筋芽細胞を移植された心臓を固定し、そして組織学のために断片化する。移植物を含む領域をH&Eおよびトリクロームで染色し、筋芽細胞移植片の位置を決定する。移植片の同一性は、筋芽細胞抗体および抗体My32を使用して、免疫組織化学によって確認される。移植片の大きさ、細胞数、形態、および免疫系の細胞による浸潤の程度が、記録される。
【0163】
データ分析。安全性を、血液試験および身体検査を用いて評価する。許容性を、有害事象が報告された被験体によって評価する。この調査の目的は、虚血性または瘢痕性の心筋層を有する被験体の心臓への、自己由来の筋芽細胞の移植の安全性を決定することである。
【0164】
危険および利益の分析。LVAD手術を受ける心不全患者のほとんどが、OHTを受けるまで進行するが、かなりの百分率が、移植まで生存しない。この試行に参加する被験体に対する直接的な利益はないかもしれないが、この処置は、心不全に関連する徴候、症状、または他の合併症を減少させ得ることが期待される。この手順は、心臓を安定化させ得、そして心室の再造形の進行を遅くし得、そして被験体が移植に対して生存する機会を増加させ得る。
【0165】
この研究における危険因子としては、自己由来の筋芽細胞に対する可能な有害反応が挙げられる。移植された筋芽細胞の使用は、比較的新しく、従って、特定の危険は、現時点で未知である。動物研究は、筋肉細胞の首尾よい移植が、免疫抑制なしで達成され得ることを示した。
【0166】
自己由来の筋芽細胞の移植に関連する、未知の危険が存在し得る。
【0167】
全ての参加調査者は、新たな危険が同定されるにつれて、新たな危険が存在するか否かを通知される。
【0168】
現時点で、ヒト心臓において筋目細胞がどれだけ長く生存するかは公知ではない。動物研究は、心臓に適切に組み込まれた移植片が、実験を実験する期間(3ヶ月)と同じくらい長期間生存することを示す。
【0169】
(実施例5:梗塞したヒト心筋層に移植された自己由来筋芽細胞の生存)
この実施例は、自己由来の骨格筋芽細胞が、ヒト被験体において単離され、処理され、そして組織培養物中で増殖され、次いで、その患者の心臓に、側部開口を有するWhitacreペンシルポイント針を使用して、送達される(一方で、この患者は、心臓移植を待つ間、左心室補助デバイス(LVAD)の移植を受けた)研究を記載する。臨床第I期研究は、Institutional Review Board for Human Studies(LGH−Bryant Heart Ctr.)によって認可され、そして認可されたINDのもとでの連邦政府の指針およびインフォームドコンセントプロセスに従って、実施した。患者は、手術の5日後に死亡し、そしてこの患者の心臓を回収し、そして分析した。
【0170】
研究の被験体およびプロトコル:患者を、心臓移植について評価および認可し、そして研究の補充および筋肉生検を行った。筋肉生検を、正方形の筋肉から、滅菌条件下で、局所麻酔薬を使用して、採取した。この筋肉標本を、すぐに輸送媒体に入れ、そしてGMP単離設備に送った。
【0171】
この患者を評価し、そして心臓移植への橋渡しとして、HeartMate(登録商標)LVAD(Thoratec,Inc.)移植を行った。LVAD移植の時点で、自己由来の骨格筋芽細胞の複数の注射を、左心室の前壁に、側部開口を有する、3.0インチ長の26ゲージのWhitacreペンシルポイント針を使用して行った。注射位置を、手術前の心エコー検査法、および開胸手術の間の直接の可視化に基づいて、選択した。15回の100μLの注射を、一定の遅い送達流量で送達した。さらなる15回の100μlの注射を、約1cm離して、1インチの長さの26ゲージの針で送達した。この針を、各注射後、少なくとも30秒間適所に維持し、注射軌道に沿った細胞の移動を最小にした。注射の全てを、手術用クリップで境界を定めた約3×3cm2の指定領域に行った。LVAD移植手順を、通常の様式で完了した。患者は、手術の5日後に死亡し、そしてこの患者の心臓を、分析のために回収した。
【0172】
自己由来の骨格筋芽細胞の調製:生検において得られた最初の10グラムの骨格筋から結合組織を除去し、切り刻んで消化媒体中でスラリーにし、次いで1×トリプシン/EDTA(0.5mg/mLトリプシン、0.53mM EDTA:GibcoBRL)および定性されたコラゲナーゼ−肝細胞(0.5mg/mL;GibcoBRL)を用いて、37℃で、数サイクルの酵素消化に供し、未分化細胞を放出した。骨格筋芽細胞培養物を、改変されたHamの方法(Ham,R.G.ら、Adv.Exp.Med.Biol.(1990),280:193−9を参照のこと、この教示の全体が、本明細書中に参考として援用される)に従って増殖させた。未分化細胞をプレート化し、そして15〜25%のウシ胎仔血清(Hyclone)、組換えヒト上皮増殖因子(rhEGF:10ng/mL)、およびデキサメタゾン(3μg/μL)を含有する筋芽細胞規定増殖培地(SkBM;Clonetics)中で増殖させた。細胞を、3億個の細胞の最終収量を達するまで、11〜13回の倍化で増殖させた。培養プロセスの間の筋管形成の任意の可能性を回避するために、細胞密度を、プロセスの間中、培養表面の75%未満が細胞によって占められるように維持した。
【0173】
移植の前に、過剰の300億個の細胞を洗浄し、そして移植培地中に、1ccあたり約1億個の細胞で懸濁させ、そして5つの1ccツベルクリン注射器に充填した。これらの細胞を、輸送の間、4℃に維持した。滅菌性試験を、最終製品に対して、ならびに消化および増殖の手順の間、実施した。
【0174】
組織学的分析および免疫組織化学的技術:切除した心筋層をホルマリン中で固定し、小さいブロックに切断し、そしてパラフィンに包埋した。6ミクロンの厚さの切片を切り取り、設置し、そしてトリクロームで染色した。
【0175】
(結果)
約300×106個の細胞を、複数の注射を使用して、患者の左心室壁に移植した。注射の5日後、患者は死亡し、そしてこの患者の心臓を回収し、固定し、そして切片にした。生存している自己由来の骨格筋細胞を、心臓の重度に瘢痕化した組織において、トリクローム染色によって同定した(図4Aおよび4B)。筋線維構造体を、移植領域において、赤色トリクローム染色(斑の線維芽細胞およびコラーゲンに関連する青色染色とは対照的に、心臓および骨格筋に特徴的)によって同定した(図4Aおよび4B)。図4Aにおける矢印は、複数の細胞が、複数の注射から沈着することを示す。図4Aから見られ得るように、細胞沈着物は、注射部位を中心に近付いたままである。より高い倍率において(図4B)、注射された細胞が初期に融合して筋管を形成することが見られ得る(矢印を参照のこと)。
【0176】
(他の実施形態)
上記は、本発明の特定の非限定的な好ましい実施形態の説明である。当業者は、この説明に対する種々の変化および改変が、添付の特許請求の範囲に規定されるような本発明の精神および範囲から逸脱することなくなされ得ることを理解する。
【背景技術】
【0001】
(発明の背景)
患者の身体内の薬剤が必要な特定の部位への薬剤の局所的投与は、他の部位での薬剤の効果を避けるのに有用であり、かつ、望まない全身性副作用を避けるのに有用である。薬剤を特定の組織または器官に投与することにより、薬剤が全身に送達されないので、より低投薬量の薬剤が使用され得る。新生物性腫瘍を処置する場合、化学療法薬剤は、患者の健常な組織に作用する危険性なしに腫瘍の部位に送達され得る。局所的送達はまた、遺伝子治療に使用されるウイルスまたはポリヌクレオチドが器官または組織に見出される特定の細胞にのみトランスフェクトするように送達される場合、重要である。特定の部位への投与はまた、細胞が組織の損傷領域に送達される場合、重要である。分化し、増殖する大きな潜在能力を有する細胞(すなわち、前駆体細胞、筋芽細胞、幹細胞)を培養する技術、および遺伝子治療のために改変されたゲノムを有する細胞を作製する技術が開発されるにつれて、移植のために、細胞をレシピエントの身体に効率的に送達する必要性がますます重要になってきている。細胞の移植は、パーキンソン病から糖尿病、心臓疾患までに及ぶ疾患を処置するために使用されている。送達される細胞は、レシピエント、関連ドナーまたはレシピエント以外の別の種に由来し得る。器官または身体の領域への細胞の移植の課題の1つは、正しい位置に細胞を到達させることであり、そして細胞を増殖させ、分化させ、そして細胞が移植される器官の不可欠な部分になるように発生させることである。例えば、心臓や脳のような器官は、十分に機能的である細胞の既存のネットワークに、移植された細胞が組み込まれることを必要とする。細胞移植は、損傷を受け、それら自体で修復できない器官(例えば、心臓および脳)において特に重要であり、また器官の細胞が絶えず破壊されている疾患(例えば、I型糖尿病)においてもまた特に重要である。
【0002】
細胞移植が使用され得る疾患のただ1つの例である心臓疾患は、全ての工業国における障害および死の主な原因である。心臓疾患は、生活の質の低下を生じ得、長期間の入院を生じ得る。さらに、米国では心臓疾患は、癌(100,000個体あたり183の死で、後に続く)を越える100,000個体あたり約335の死(総死亡数の約40%)の原因となる。心臓疾患の4つのカテゴリは、全ての心臓関連死の約85〜90%の原因となる。これらのカテゴリは以下:1)虚血性心臓疾患、2)高血圧心臓疾患および肺性高血圧心臓疾患、3)弁疾患および4)先天的な心臓死疾患である。虚血性心臓疾患は、その種々の形態で、心臓疾患により引き起こされる全ての死の約60〜75%の原因となる。さらに、心臓障害の発生率は米国で増加している。虚血性心臓疾患を非常に破壊的にさせる因子の1つは、心筋細胞が分裂し得ないことおよび虚血性心臓損傷の領域を再増殖させ得ないことである。結果として、傷害または疾患の結果としての心臓細胞の喪失は、不可逆的である。
【0003】
ヒトからヒトへの心臓移植は、重篤な心臓障害に対する治療の最も有効な形態になった。多くの移植センターでは現在、心臓移植後1年の生存率は80〜90%を上回っていて、心臓移植後5年の生存率は70%を上回っている。しかし、心臓移植は、適切なドナーの器官の希少性により、ひどく限定されている。ドナーの器官を得る困難に加えて、心臓移植の費用は、広範な適用を妨げる。別の未解決の問題は、移植片拒絶である。外来性の心臓は、レシピエントにほとんど許容されず、免疫抑制剤が存在しない場合、免疫系により急速に破壊される。免疫抑制剤は、拒絶を予防するために使用され得るが、それらは、望ましい免疫反応(例えば、細菌感染およびウイルス感染に対する免疫反応)もまたブロックし、それによってレシピエントを感染の危険に曝す。感染、高血圧、ならびにサイクロスポリン、急速な進行性冠動脈硬化症および免疫抑制剤関連癌によって引き起こされた腎臓障害は、主要な合併症である。
【発明の概要】
【課題を解決するための手段】
【0004】
(発明の要旨)
本発明は、注射部位からの注射された薬剤の漏出を最小限にした、患者の身体に薬剤を注射するためのシステムを提供する。漏出を最小限にするために、本発明は、針の先端に開口部を有する針よりはむしろ側部開口部を有する針を使用し、そして/または、投与されるべき薬剤の注射後の部位を封鎖するために、封止剤を使用する。特定の好ましい実施形態において、治療薬剤、診断薬剤または予防薬剤は、本発明の方法を使用して投与される。これらの薬剤としては、薬物、タンパク質、ペプチド、低分子、ポリヌクレオチド、生物学的分子、ウイルス、細胞などが挙げられ得る。送達されるべき特定の好ましい薬剤は、細胞である。薬剤は、任意の器官、組織、腫瘍(良性または悪性)、傷害(injury)もしくは障害(damage)の部位、先天異常の部位または患者の身体の他の任意の部位に注射され得る。好ましくは、器官または組織は、送達されるべき薬剤の注射に対してある程度の耐性を提供するために、固形または実質的に固形である。特定の実施形態において、薬剤は標的器官または標的組織の傷害の部位に注射される。一旦薬剤が注射されると、注射部位からの、投与された薬剤の漏出が好ましくは全く観察されないか、または最小限量観察される。好ましくは、その部位からの薬剤の50%未満が漏出し、より好ましくは、薬剤の40%、30%、20%、10%、5%、4%、3%、2%または1%未満が注射部位から漏出する。最も好ましくは、注射部位から漏出が検出され得ないことである。本発明は、器官(例えば、心筋、脳、膵臓、肝臓、腎臓および骨格筋)に移植される細胞の注射において特に有用である。細胞は、注射部位での細胞の保持を補助するキャリア(例えば、コラーゲン、ゼラチン、フィブリン、メチルセルロース、アガロース、アルギン酸塩、ヒアルロン酸など)中に懸濁され得る。さらに、もしくは、あるいは、注射部位は、注射後、注射穴を閉鎖し、注射された薬剤の漏出を防止するために、組織封止剤(例えば、シアノアクリレート組織接着剤(cyanoacrylate tissue adhesive)、フィブリン接着剤(fibrin glue)((例えば、Tisseel(登録商標))、フィルム(例えば、セプラフィルム)または接着剤(glue)で封鎖され得る。
【0005】
本発明は、器官に対する傷害が、治療薬剤の送達により処置され得る障害を生じる種々の状態を処置するために使用され得る。特定の実施例において、器官の障害は、細胞移植により処置され得る。特に、本発明は、状態が処置されるように側部放出針を使用して骨格筋芽細胞を心筋傷害部位へ注射する工程を包含する、心臓組織に対する障害により特徴付けられる状態を処置するための方法を提供する。注射は、心臓状態を処置するために繰り返され得る。
【0006】
他の特定の実施形態において、本発明は、薬物を患者の身体の中の特定の部位に送達するために使用され得る。例えば、本発明の方法は、薬剤が腫瘍への最大限の効果を有し、周辺の組織へのより少ない効果を有するように、抗新生物薬剤を腫瘍塊内に送達するために使用され得る。薬物は、カプセル化され得るか、または、長時間にわたる活性薬剤の放出を可能にするような形態であり得る。
【0007】
別の局面では、本発明は、閉鎖された末端および側部放出孔を有する針を備えるキットを提供する。キットはまた、送達されるべき薬剤(例えば、薬物、タンパク質、ペプチド、ポリヌクレオチド、低分子、生物学的分子、ウイルス、細胞など)を含み得る。特定の実施形態において、キットは、移植される細胞、移植のための細胞の培養に使用される因子および培地、細胞の保持を補助するキャリア(例えば、コラーゲン、ゼラチン、細胞外マトリックスタンパク質、フィブリン、メチルセルロース、アガロース、アルギン酸塩、ヒアルロン酸など)、組織封止剤、組織接着剤(tissue glue)または組織接着剤(tissue adhesive)(例えば、シアノアクリレート組織接着剤、フィブリン接着剤(例えば、Tisseel(登録商標)))、封鎖フィルム(例えば、セプラフィルム)、注射部位を滅菌するための溶液、縫合材料、後に移植される細胞を抽出するための用具、および/またはシリンジを含み得る。好ましくは、送達される薬剤を操作する、および注射するのに使用される任意の溶液、培地または用具は、滅菌され、汚染を防止するようにパッケージされる。
【0008】
(定義)
「新脈管形成」:「新脈管形成」とは、本発明の筋細胞が移植された心臓組織における新しい毛細血管の形成をいう。新脈管形成は、移植される細胞の作用の結果として、移植された細胞由来の新脈管形成因子の分泌の結果として、および/または、細胞が移植された器官由来の内因性新脈管形成因子の分泌の結果として生じ得る。
【0009】
「動物」:用語動物は、本明細書で使用される場合、ヒトならびに、非ヒト動物(例えば、哺乳類、鳥類、爬虫類、両生類および魚類が挙げられる)をいう。好ましくは、動物は、哺乳類(例えば、げっ歯類、マウス、ラット、ウサギ、サル、イヌ、ネコ、またはブタ)であり、最も好ましくは、ヒトである。動物は、トランスジェニック動物で有り得る。
【0010】
「生物学的化合物」:「生物学的化合物」は、生体内で見出される任意の化学化合物である。特定の実施形態において、生物学的分子としては、DNA、RNA、ポリヌクレオチド、タンパク質、ペプチド、脂質、多糖、オリゴ糖および糖が挙げられ得る。
【0011】
「心筋細胞」:「心筋細胞」とは、心筋に由来する筋肉細胞をいう。このような細胞は代表的に、1つの核を有し、心臓に存在する場合、介在する円盤構造によって結合している。
【0012】
「細胞」:用語「細胞」とは、本発明の方法を使用して送達される任意の細胞型をいう。細胞は、細菌、真菌類、酵母、植物、動物、哺乳類またはヒトに由来し得る。細胞が多細胞生物に由来する場合、それは、任意の組織または器官(例えば、皮膚、心臓、骨格筋、平滑筋、膵臓、脳、神経、腎臓、肝臓、胃、腸など)に由来し得る。細胞は、それらが送達される患者、関連ドナー、家族メンバー、類似したMHCマーカーを有するドナー、非関連ドナーまたは別の種(例えば、ブタ)のドナーに由来し得る。細胞は、細胞培養から入手し得る。
【0013】
「単離された」:用語「単離された」とは、その天然の環境から分離されている細胞をいう。この用語は、その天然の環境からの細胞の全体の物理的な分離(例えば、ドナーからの除去)を含む。好ましくは、「単離された」とは、直接的に接触する隣接する細胞との細胞の関係の変化(例えば、解離による)を含む。
【0014】
「心筋虚血」:「心筋虚血」とは、心筋虚血障害を生じる心臓への酸素の流れの欠乏を含む。本明細書で使用する場合、心筋虚血障害は、心筋への減少した血流により引き起こされる障害をいう。心筋虚血および心筋虚血障害の原因の非限定的な例としては、大動脈拡張期血圧の低減、心室内圧の増加および心筋収縮、冠状動脈狭窄(例えば、環状動脈結紮、固定環状動脈狭窄、急性プラーク変化(例えば、破裂、出血)、環状動脈血栓症、血管収縮)、大動脈弁狭窄および大動脈弁逆流および右心房圧の増加が挙げられる。心筋虚血および心筋虚血障害の弊害の非限定的な例としては、心筋障害(例えば、心筋細胞喪失、心筋肥大、心筋細胞肥厚)、アンギナ(例えば、安定アンギナ、異型アンギナ、不安定アンギナ、突然心臓死)、心筋梗塞およびうっ血性心不全が挙げられる。
【0015】
「患者」:患者は、任意の種の患者であり得る。患者は、ヒト、家畜、イヌ、ネコ、鳥、ペット、魚、ハムスター、ラット、スナネズミなどであり得る。特定の好ましい実施形態では、患者はヒトである。患者は、本発明の方法を使用する処置の時点では、病気にかかっていてもかかっていなくてもよい。例えば、本発明の方法は、予防薬剤(例えば、ビタミンまたは産児調節薬剤)を送達するために使用され得る。他の実施形態において、患者は、疾患(例えば、心臓疾患、糖尿病、パーキンソン病、癌、遺伝的欠損など)を罹患している。
【0016】
「ペプチド」または「タンパク質」:本発明に従って、「ペプチド」または「タンパク質」は、ペプチド結合によって一緒に結合した少なくとも3個のアミノ酸の列を含む。本発明のペプチドは好ましくは、天然のアミノ酸のみを含むが、非天然のアミノ酸(すなわち、天然には存在しないが、ポリペプチド鎖には組み入れられ得る化合物)および/または当該分野で公知のアミノ酸アナログが、代わりに使用され得る。また、本発明のペプチドの1つ以上のアミノ酸が、例えば、化学単位(例えば、炭水化物基、リン酸基、ファルネシル基、イソファルネシル基、脂肪酸基、結合、機能付与もしくは他の改変などのためのリンカー)の添加によって改変され得る。
【0017】
「ポリヌクレオチド」または「オリゴヌクレオチド」:ポリヌクレオチドまたはオリゴヌクレオチドとは、ヌクレオチドのポリマーをいう。ポリマーとしては、天然のヌクレオシド(すなわち、アデノシン、チミジン、グアノシン、シチジン、ウリジン、デオキシアデノシン、デオキシチミジン、デオキシグアノシンおよびデオキシシチジン)、ヌクレオシドアナログ(例えば、2−アミノアデノシン、2−チオチミジン、イノシン、ピロロピリミジン、3−メチルアデノシン、5−メチルシチジン、C5−ブロモウリジン、C5−フルオロウリジン、C5−ヨードウリジン、C5−プロピニルウリジン、C5−プロピニルシチジン、C5−メチルシチジン、7−デアザアデノシン、7−デアザグアノシン、8−オキソアデノシン、8−オキソグアノシン、O(6)−メチルグアニンおよび2−チオシチジン)、化学的に改変された塩基、生物学的に改変された塩基(例えば、メチル化塩基)、間に入った塩基、改変された糖(例えば、2’−ヒドロキシリボース、2’−フルオロリボース、リボース、2’−デオキシリボースおよびヘキソース)、または改変されたリン酸基(例えば、ホスホロチオエート結合および5’−N−ホスホラミダイト結合)が挙げられ得る。
【0018】
「封止剤」または「封鎖」:「封鎖」とは、注射部位または薬剤の投与の部位を閉鎖するための封止剤の使用をいう。封止剤は、送達の部位からの、投与された薬剤の漏出を防止する。注射穴を閉鎖し得る任意の物質が、封止剤として使用され得る。封止剤は、接着剤(glue)、接着剤(adhesive)またはフィルムであり得る。封鎖は、薬剤の送達と同時になされ得るか、または投与の後に実施され得る。封止剤の例としては、シアノアクリレート組織接着剤(cyanoacrylate tissue adhesive)、フィブリン封止剤(例えば、Tisseel(登録商標)(Baxter International Incにより市販される)、セプラフィルム、ポリマー、タンパク質などが挙げられる。特定の実施形態において、封止剤は、薬剤が、側部開口部を有する針を使用して送達された後に使用される。
【0019】
「骨格筋芽細胞」:「骨格筋芽細胞」は、筋管および骨格筋繊維の前駆体である。用語「骨格筋芽細胞」としては、未分化細胞、骨格筋における筋繊維と密接に接触して見出される単核細胞が挙げられる。未分化細胞は、骨格筋芽細胞の基底膜に隣接して位置し、筋繊維に分化し得る。
【0020】
「低分子」:用語「低分子」とは、本明細書で使用される場合、研究室で合成されたか、または天然に見出されたかのどちらかである非ペプチド有機化合物、非オリゴマー有機化合物をいう。低分子は、本明細書で使用される場合、「天然産物様」である化合物をいい得るが、用語「低分子」は、「天然産物様」化合物に限定されない。むしろ、低分子は、代表的に、いくつかの炭素−炭素結合を含み、1500より小さい分子量を有するという点で特徴づけられるが、この特徴づけが本発明の目的を限定することを意図しない。天然に存在する低分子の例としては、タキソール、ダイナミシンおよびラパマイシンが挙げられるがこれらに限定されない。他の特定の好ましい実施形態において、天然産物様低分子が使用される。
【0021】
「固形器官」:「固形器官」とは、患者の身体内の任意の組織または器官をいう。本発明の方法は、任意の薬剤(細胞を含む)を固形器官に送達するために使用され得る。固形器官は、健常な器官(例えば、心臓、膵臓、脳、肝臓、腎臓、骨格筋など)または異常な増殖物(例えば、良性腫瘍または悪性腫瘍)であり得る。固形器官(例えば小腸および大腸または肺)は、その中に内腔または空間を有し得る。特定の実施形態において、固形器官は、添加物質(例えば、細胞または液体)の導入に対して抵抗性を提供する組織である。特定の好ましい実施形態において、固形器官は、心筋である。
【0022】
「幹細胞」:「幹細胞」は、適切な条件下でより分化した細胞を生じる任意の多能性の細胞を言う。本発明に従って使用され得る幹細胞は、造血幹細胞、中性幹細胞、間葉幹細胞、胃腸幹細胞、筋幹細胞、心筋幹細胞、腎幹細胞、皮膚幹細胞、肺幹細胞、および胎児性幹細胞が挙げられる。
【0023】
「治療的有効量」:用語「治療的有効量」は、所望される生物学的応答を引き出すのに必要とされる薬剤の量を言う。好ましい実施形態において、薬剤の治療的有効量が、多数の注射を使用することにより標的器官に損傷を与えないように最小回数の注射を用いて送達される:従って、各々の注射は、好ましくは送達されている薬剤の実質的部分の保持を生じるべきである。本発明において、薬剤は、薬物、低分子、ペプチド、タンパク質、ポリヌクレオチド、生体分子、ウイルス、および細胞(例えば、幹細胞、骨格筋芽細胞など)であり得る。例えば、感染の場合、治療有効量の抗生物質は、感染を取り除くか、または感染の原因である全ての生物を殺すのに必要な量である。遺伝子治療の場合、ポリヌクレオチド(例えば、ベクター、人工染色体)、ウイルス、または細胞の治療有効量は、レシピエントの内在する遺伝子欠損をなくすのに必要な量である。組織損傷または変性の場合、細胞の治療有効量は、異常な組織または損傷した組織の機能または構造を改良するのに必要な量である。例えば、心臓障害のための細胞の移植において、細胞の治療有効量は、心臓アウトプットを増大し、ストロークの容積を増大し、狭心症の徴候を減少させ、または移植された患者の心臓の状態を改善することにより、心臓機能を改善するのに必要な量である。
【図面の簡単な説明】
【0024】
【図1】図1は、側部開口部を有する針の先端の拡大図とともに、Whitacre鉛筆先端状針(Whitacre pencil point needle)を示す。
【図2】図2は、注射した心臓のヘマトキシリンおよびエオシン染色を示す。図2Aは、標準25G傾斜針を使用して注射した心臓の領域を示し、図2Bは、25GWhitacre針を用いて注射した心臓の隣接領域を示す。注射部位に保持された細胞を矢印により印す。さらに多くの細胞が、Whitacre針を使用して注射した領域の周辺の領域に見出された。図2Aについては、4000万個の細胞を含む400μlの細胞懸濁液を、1分にわたって注射した。図2Bについては、2億個の細胞を含む400μlの細胞懸濁液を、1分にわたって注射した。
【図3】図3は、側孔針を使用して、虚血性障害を受けたヒツジの心臓に骨格筋芽細胞を注射した結果を示す。注射の6週間後に動物を屠殺し、筋肉特異的ミオシン染色を使用して心臓を染色したものを図3Bに示し、トリクロム染色を図3Bに示した。
【図4A】図4は、患者が、心臓移植手術への橋渡しとしての左心室補助デバイスを移植するための手術を受ける間に、側孔針を使用して、ヒト心臓に骨格筋芽細胞を注射した結果を示す。注射の5日後に、患者は死亡し、その心臓を、図4A(低倍率)に示すように、トリクロム染色により染色した。
【図4B】図4は、患者が、心臓移植手術への橋渡しとしての左心室補助デバイスを移植するための手術を受ける間に、側孔針を使用して、ヒト心臓に骨格筋芽細胞を注射した結果を示す。注射の5日後に、患者は死亡し、その心臓を、図4B(高倍率)に示すように、トリクロム染色により染色した。
【発明を実施するための形態】
【0025】
(特定の好ましい実施形態の詳細な説明)
1つの局面において本発明は、閉じた末端および少なくとも1つの側面の開口を有する針を使用して薬剤を送達する方法を提供する。代表的には、薬剤は、側面開口針を使用して、開口、穴、負の空間(negative space)、または管腔よりむしろ、器官または実質的に固形の組織もしくは腫瘍中に注入される。特定の実施形態において、注入部位は、器官または組織中の損傷したまたは病気の領域である。本発明の方法を使用して送達され得る薬剤としては、薬物、低分子、ポリヌクレオチド、タンパク質、生体分子、抗体、ウイルス、細胞などが挙げられる。1つの実施形態において、本発明の方法は、薬物のような薬剤を患者の体内の特定の場所(すなわち、特定の器官または組織)に送達するように用いられる。別の実施形態において、この方法は、病気の組織、損傷した組織、瘢痕組織または死んだ組織を回復し、そして/または置き換えるような治療目的のために細胞を送達するのに使用し得る。この方法はまた、遺伝子治療に使用され得、ここで送達される細胞またはウイルスのゲノムが、変えられる。
【0026】
(針)
本発明の方法を実施するのに使用される針は、末端にではなく針のシャフトの側面に開口を有する。閉じた末端は、斜角のついた先端、カーブした先端、または鉛筆先端状先端(pencil point tip)であり得る。側面上の開口は、代表的に針の先端の近くに配置される。針の側面上に1つの開口があり得、または一連の側面の開口があり得る。例えば、針の対向する側面上に2つの開口があり得、または一連の同軸開口があり得る。
【0027】
本発明の方法において特に有用な針としては、患者の脳脊髄液(CSF)に接近するために使用される脊髄注射針が挙げられる(例えば、参考として本明細書中に援用される、米国特許第5,848,996号を参照のこと)。これらの脊髄注射針は、いくらかの患者に穿刺後の頭痛を生じ得る、CSFの漏れを防ぐために、脊椎麻酔法および腰椎穿刺のために最初は設計された。これらの注射針としては、図1に示されるようなWhitacre針およびSprotte針が挙げられる(また、米国特許第5,848,996号(1998年12月15日発行)および米国特許第5,449,351号(1995年9月12日発行)を参照のこと;これらの各々は、参考として本明細書中で援用される)。
【0028】
注入された薬剤を出て行かせる大きな穿孔の作製を妨げるために、小さな半径を有する針が、大きな半径よりも好ましい。半径が小さくなるほど、ゲージは対応して大きくなる。代表的に、本発明で使用される針のゲージは、約20ゲージ〜約30ゲージの範囲にわたりそしておそらくより好ましくは約25ゲージである。針のゲージはまた、必要とされる針の強度、注入される薬剤(例えば、細胞)の大きさ、薬剤の粘度、薬剤の懸濁、または注入される薬剤の溶液、貫通される器官もしくは組織の扱いにくさ、注入手順の間に必要とされるコントロールなどにより、決定される。例えば、より大きなゲージ(例えば、30ゲージ)を有する針は、低分子、薬物またはウイルスを送達するのに使用され得るが、より小さなゲージ針が、より大きなサイズを有する薬剤(例えば細胞)を注入するのに必要とされ得る。針のゲージは、上記方法を実施する医療のプロにより上に列挙した種々の因子を考慮に入れ、そしてプロの最良の判断および類似の手段を行なう彼の経験を使用して、最も良く決定される。
【0029】
針の長さは、薬剤の注入を取り巻く種々の因子に依存する。これらの因子としては、注入される器官、細胞が送達される部位の深さ、注入を実施するのに必要な針のコントロール、移植部位に到達するために貫通しなければならない組織などが挙げられ得る。再び、針のゲージと同様に、針の長さが、手順を実施する医療のプロにより、最も良く決定される。代表的に、針の長さは、1/2インチと7インチとの間であり、好ましくは、1/2インチと4インチとの間であり、そしてより好ましくは、1/2インチと3インチとの間である。
【0030】
針はまた、特定の使用のために設計されるある他の特徴を有し得る。例えば、側面開口のサイズおよび形状は、送達される細胞および細胞が送達される部位に依存し得る。また、針は、ある移植部位への容易な接近を提供するために、カーブをつけられ得、または捩られ得る。針のシャフト上の開口のパターンおよびシャフトに垂直な開口の位置は、移植のための部位および器官に依存し得る。
【0031】
(送達される薬剤)
針を通って注入され得る任意の薬剤が、本発明の方法を使用して送達され得る。代表的な薬剤としては、薬物、低分子、薬学的薬剤、診断薬、生体分子、タンパク質、ペプチド、抗体、ポリヌクレオチド、RNA、DNA、ウイルス、細胞およびそれらの組み合わせが挙げられ得る。薬剤は、サイズにおいて、有機低分子から高分子(例えば、DNAからインタクトな細胞)の範囲にわたり得る。注入部位に送達される薬剤は、治療剤(例えば、化学療法薬物、抗生物質)、予防薬(例えば、ワクチン)、または診断剤(例えば、磁気共鳴映像法のための造影剤、標識された代謝産物)であり得る。
【0032】
薬物は、疾患の処置または予防に有用な任意の化合物を含む。多くの薬物が、ヒトにおける疾患の処置のために米国食品医薬品局により認可されている。特に好ましい実施形態において、薬物は、抗生物質、抗ウイルス剤、麻酔剤、ステロイド剤、抗炎症剤、抗腫瘍剤、抗原、ワクチン、抗体、鬱血除去薬、抗高血圧症薬、鎮静薬、産児制限剤、プロゲステロン剤、抗コリン作用薬、鎮痛剤、抗うつ薬、抗精神病剤、β−抗アドレナリン薬、利尿薬、心臓血管活性剤、血管作用剤、非ステロイド抗炎症剤、栄養剤などである。薬物の組み合わせが、本発明において使用され得る。この薬物はまた、種々の形態で送達され得、例えば、この薬物は、カプセル化され得、またはこの薬物は、徐放性形態であり得る。
【0033】
送達される薬剤はまた、生体分子(例えば、タンパク質、ペプチド、ポリヌクレオチドおよびオリゴヌクレオチド)を含み得る。タンパク質またはペプチドの例としては、インシュリン、サイトカイン、成長因子、エリトロポイエチン、抗体、抗体フラグメントなどが挙げられる。ポリヌクレオチドは、遺伝子治療およびアンチセンス療法のために送達され得る。このポリヌクレオチドは、任意の以下のエレメントを含み得る:オープンリーディングフレーム、プロモーター、エンハンサー領域、リボソーム結合部位、調節領域、スプライシングシグナル、イントロン、エキソンなど。
【0034】
薬物、低分子および生体分子に加えて、本発明は、ウイルスおよび細胞を送達するために使用され得る。特に好ましいウイルスおよび細胞は、治療用のものである。変えられたゲノムを有するウイルスは、ベクターとして遺伝子治療に使用され、外来遺伝子を患者の細胞中に導入し得る。これらのウイルスを使用して、患者自身のゲノム中の遺伝子欠損をなくすために、遺伝子を送達し得る。ある実施形態において、これらのウイルスは、その抗原性を弱めるために変えられ得る。
【0035】
本発明の方法はまた、細胞を送達するために使用され得る。任意の型の細胞または細胞の混合物が、本発明の方法を使用して移植され得る。本発明において特に有用な細胞型としては、心筋細胞、骨格筋細胞、β−島細胞、肝性細胞、造血細胞、ニューロン、線維芽細胞、幹細胞などが挙げられる。これらの細胞は、全能の胎児性幹細胞から完全に分化した細胞にわたる分化の任意の段階であり得る。細胞は、移植の部位および修復されるべき欠損または損傷の性質に依存して、選択される。例えば、虚血性心臓病に起因して損傷される心筋層の領域が、骨格筋芽細胞または骨格筋芽細胞の混合物および線維芽細胞を移植することにより修復され得る。好ましくは、これらの細胞を精製して、免疫学的応答のような有害な応答を引き起こす所望されない細胞型または細胞を除外した。これらの細胞は、FACS分類、免疫学的技術、細胞培養物中の継代などにより、精製され得る。好ましくは、これらの細胞を、注入および移植のための培地中に懸濁した。これらの細胞を、1×106細胞/ml〜1000×106細胞/ml、より好ましくは10×106細胞/ml〜500×106細胞/ml、さらにより好ましくは、50×106細胞/ml〜200×106細胞/ml、そして最も好ましくは50×106細胞/ml〜100×106細胞/mlにわたる注入のための濃度で懸濁し得る。これらの細胞は、細胞培養物から、ドナーから、組織および血液バンクから、レシピエントの親族から、またはレシピエント自身から得られ得る。これらの細胞はまた、レシピエントと同種ではない動物から得られ得る。これらの細胞は、代表的に、培地中またはいずれかの他の溶液中の細胞の均一な懸濁液として提供される。これらの細胞は、等張性溶液で、または筋芽細胞のようなある細胞型の使用において提供され得、これらの細胞は、高張性溶液中で懸濁され得る。
【0036】
これらの細胞は、別のヒト、レシピエント自身、またはレシピエントと別種の動物(例えば、ブタ)から採取される生検組織から得られ得る。組織または細胞が、トリプシンおよびコラーゲナーゼの様な消化酵素で処理され、細胞を分離し得、そしてこれらの細胞を移植および/または培養のために調製し得る。必要に応じて、これらの細胞は、移植のための細胞数を増加するために、インビトロで培養され得る。ある環境において、細胞が、ゼラチンで、またはポリ−L−リジンおよびラミニンでコーティングされる表面上で、適切な栄養物および細胞成長のための因子を含む培地中で培養される。これらの細胞はまた、変えられ、その後移植される。1つの場合において、細胞のゲノムは、遺伝子をゲノムに変え、欠失させ、または挿入することにより、変えられ得る。ゲノムの変化は、必要かも知れないし、または移植の治療効果を促進するかも知れない。別の場合において、これらの細胞は、種々の栄養物、ビタミン、ミネラル、成長因子、化学的化合物、ステロイド、ホルモン、ペプチド、タンパク質、または核酸が挙げられるある因子で処置され、細胞をある様式で発達させて分化させ得、または脱分化させ得る。これらの因子は、細胞内の形態学的変化および/または遺伝子発現における変化を引き起こし得る。改変された細胞は、代表的に、改変前の元の細胞よりも移植においてより有効である。例えば、筋芽細胞が冠状動脈疾患のために病気である心筋層中に移植される場合、虚血領域に供給する新しい毛細血管の発達を引き起こすように、移植された筋芽細胞が脈管形成因子を分泌しまたは産生するならば、有益であり得る。
【0037】
移植されるべき細胞が、免疫構成(immunological make−up)が有意に異なるドナー由来である場合には、受容者は、免疫抑制治療(例えば、移植後のステロイドおよびシクロスポリン)を必要とし得る。免疫抑制治療は、移植細胞の拒絶反応を実質的に抑制するはずである。免疫抑制治療は、移植手順および受容者の臨床状態に精通する医学の専門家によって最善に決定されるべきである。移植後の免疫抑制治療の使用を回避するために、移植されるべき細胞は、血縁関係のドナー、肉親、または受容者自身から得られ得る。器官移植の場合のように、ドナーと受容者との間のHLAがより一致しているほど、移植細胞の拒絶反応がより小さくなると思われる。移植細胞の拒絶反応を予防するために、移植細胞表面上の抗原は、改変されるか、マスクされるか、または除去されて、受容者の免疫系からの免疫応答の危険性を予防し得るかもしくは減少させ得る(米国特許第5,283,058号(1994年2月1日発行、本明細書中に参考として援用される)を参照のこと)。特定の他の実施形態において、移植細胞におけるMHCクラスI分子は、抗体、抗体フラグメント(例えば、F(ab’)2)、可溶性T細胞レセプターフラグメント、またはT細胞レセプターの抗原結合特性を模倣する合成有機分子を用いてマスクされる。特定の実施形態において、細胞は、移植時のT細胞媒介性免疫応答の危険性を予防するかまたは減少するために、遺伝的に改変され得る。特定の実施形態において、細胞は、ドナー組織の細胞上の拒絶反応を誘導する表面抗原を改変するかまたは除去するために改変されている、トランスジェニック動物から得られ得る。宿主T細胞と相互作用することが公知の表面抗原としては、MHCクラスI分子、LFA−3、およびICAM−1が挙げられる。
【0038】
一旦移植された細胞は、好ましくは、これらが移植される環境に対応し、それによって細胞自体およびそれらの子孫は、この細胞が注射された組織/器官の細胞マトリックスに組み入れられるべきである。移植細胞は、器官に対する傷害を修復するのを助けるべきである。例えば、骨格筋芽細胞を傷害した心筋に移植することは、心拍出量が増加することおよび傷害部位を修復するのを助けることが示されている(USSN60/145,849、1999年7月23日出願;USSN09/624,885、2000年7月24日出願;およびUSSN10/105,035、2002年3月21日出願を参照のこと、これらの各々が本明細書中で参考として援用される)。
【0039】
(器官)
送達されるべき薬剤は、本発明の方法を使用して、患者の体内の任意の器官、組織、または腫瘍中に注射され得る。例えば、抗腫瘍性薬剤は、腫瘍中に送達されて、周辺組織における影響を最小限に抑え得る。特定の好ましい実施形態において、この薬剤は、器官または組織内の傷害部位中に送達される。送達されるべき薬剤が細胞である特定の実施形態において、移植されるべき細胞は、傷害しているか患部であるかさらなる細胞の補充を要するか、もしくは改変したゲノムを有する細胞の補充を要する部位にて、器官中に注射される。細胞は、滅菌条件下で、側面孔の針を通じて器官または組織中に注射される。細胞の送達は、針が通過する必要のある組織および器官の数を最小限に抑え、かつ細胞の送達をより良く制御するために、外科的手順の間に行われ得る。特定の部位に対する細胞の送達は、種々の放射線技術(例えば、蛍光透視、CT、およびX線放射線)によって誘導され得る。
【0040】
細胞は、好ましくは、天然の空孔、管腔、または開口部ではなく、中実の組織または器官中に移植される。特定の好ましい実施形態において、細胞は、器官または組織内の傷害部位、疾患部位、もしくは損傷部位中に送達される。細胞が注射され得る器官としては、例えば、心臓心筋、骨格心筋、脳、脊髄、脾臓、肝臓、膵臓、甲状腺、副腎、前立腺、精巣、および卵巣が挙げられる。特定の理論によって拘束されることを希望することなく、本発明は、先端部に孔を有する通常の針によって作り出された空孔からの、新たに注射した細胞の漏出または押出を予防すると考えられる。先端部が閉じた針は、一旦針が引き抜かれるとそれ自体をより良く塞ぐ空孔を作り出し、それによって、閉じた空間に注射されたばかりの細胞が漏出するのを許容しないと考えられる。この考えは、注射部位が筋肉の収縮、器官もしくは組織の内側に蓄積する流体、炎症、細胞増殖もしくは腫瘍増殖などに起因して、増加する緊張または圧力を受ける場合に、ますます重要になる。
【0041】
状態を処置するために、1度に、または何日、何ヶ月、何週間、もしくは何年にもわたって複数の注射が必要とされ得る。例えば、移植細胞が、宿主の免疫系によって攻撃され、かつ破壊される場合、移植細胞は反復注射によって置き換えられる必要がある。処置の過程は、患者の状態の処置において経験を有する専門家によって最善に決定される。
【0042】
(適用)
本発明の方法は、器官、組織、または腫瘍中に針を通じての注射による薬剤の送達が必要とされる任意の疾患または状態の処置に対して適用され得る。本発明の方法の適用のただ1つの実施例は、患者の体内の特定の器官、組織、または腫瘍に対する細胞の送達である。最近の研究は、種々の疾患の処置における細胞移植の使用に集中している。研究者は、細胞をパーキンソン病を有する患者の脳に移植して、この破壊的な疾患に関連する運動障害を減少させようと試みてきた。研究者はまた、細胞移植を使用して、心筋梗塞後の心臓組織に対する損傷を修復しようと試みてきた。限られた再生能力かまたは全く再生能力を有していなかった器官(例えば、脳、心臓)への細胞移植は、研究者が種々の細胞型の増殖および分化を制御することを習得するにつれて、ますます重要になり得る。
【0043】
成人の心筋細胞の移植に関する主な問題は、心筋細胞が培養物中で増殖しないことである(Yoonら(1995)Tex.Heart Inst.J.22:119;本明細書中で参考として援用される)。この問題を克服するために、注意が骨格筋芽細胞の考えられる使用に集中してきた。骨格筋組織は、増殖可能な未分化細胞を含む。インビトロでのこれらの細胞の精製および拡大に基づき、これらは、損傷した筋肉を修復するのを助けるために、側面孔の針を使用して虚血性損傷の部位にて心臓に注射され得る。本発明の方法は、移植細胞が注射部位に留まることを可能にし、その結果、移植細胞が筋細胞を含む領域を再増殖し、それによって損傷した領域を修復する。好ましくは、一旦細胞が傷害部位に注射されると、この細胞は、領域を再増幅し、そして細胞と細胞外マトリックスとの既存のネットワーク中に細胞自体を組み入れる。
【0044】
本発明のこれらの局面および他の局面は、以下の実施例を考慮してさらに評価され、この実施例は、本発明のある種の特定の実施形態を例示することが意図されるが、特許請求の範囲によって規定されるように、本発明の範囲を限定することは意図されない。
【実施例】
【0045】
(実施例1−ブタの心臓へのヒト筋芽細胞のベンチトップ(bench−top)注射)
骨格筋芽細胞を注射した移植後心臓の組織学的検査に基づき、移植細胞が、時折、注射部位ではなく心外膜脂肪における心臓表面上で見出されたことが認められた。移植細胞は、針の孔を介して注射部位から増殖を開始する心臓の表面まで押し出されたと考えられた。残念なことに、注射部位に存在しない移植細胞は、損傷心臓および瘢痕心臓に対していかなる援助も提供しない;従って、細胞を中実組織または器官に移植するのに最も良い方法を決定するために、細胞を注射する種々の方法を研究した。
【0046】
凍結させたヒト筋芽細胞を含むいくつかのバイアルを、氷の上で溶かした。合計240×106個の細胞を、TX培地中で2回洗浄した。次いで、この細胞を2本のチューブに分割した。一本目のチューブは、1.6mlのTX培地中に80×106個の細胞を含み、結果として50×106細胞/mlの濃度となった。二本目のチューブは、同一容積の培地中に2倍多い細胞を含み、結果として100×106細胞/mlの濃度となった。次いで、細胞を、種々の針(針の向き、針のサイズ、細胞の濃度、注射した容積、および注射の深さ)を使用して、ブタの心臓の心筋に注射した。次いで、注射部位からの漏出量を測定して、筋芽細胞を心筋に注射しかつ細胞を注射部位にて組織中に保持するための最も良い方法を決定した。
【0047】
【表1】

上記の表に記載した14回の注射に基づき、これらの注射において2種の放出タイプ(傾斜放出 対 側面放出)、2種の細胞密度(1ml当たり100×106 対 50×106)、2種の針の長さ(5/8インチ 対 3.5インチ)、および3種の針(25G Whitacre針 3.5インチ 側面放出;25G 5/8インチ 傾斜;25G 3.5インチ 傾斜)を試験し、側面放出針が、漏出を予防することにおいて傾斜先端針より良好に実施された。傾斜針を用いて行った9回の注射のうち8回は漏出したが、側面放出針を用いた4回のうちの2回は漏出を示さず、他の2回は最小限の漏出を示した。
【0048】
多くの因子が、組織中に注射された流体の保持に影響を及ぼす。注射の速度、注射した総容積、針が組織中に挿入される深さ、および針を組織から取り除く前の時間遅延が、より重要なことの一部であると考えられる。注射後の心臓組織内の流体の相対的な保持を、2つの異なる針設計と比較するために、上記に列挙した因子のいくつかを試験した。表は、傾斜針を使用し、針を5/8インチの深さまで挿入し、そして細胞を速やかに(15秒)またはゆっくりと(1〜2分)注射した場合、常に注射部位から細胞の漏出があったことを示す(試験番号1〜7)。漏出量はばらついたが、よりゆっくりした注射(試験番号5〜7)は、速い注射(試験番号1〜4)より優れているようであった。1インチまで増大させた針の注射の深さを用いて(試験番号8)、4倍の容積が、深さ5/8インチの注射(試験番号5)での漏出と比較して、漏出における違いをほとんど有さずに首尾よく注射されたため、針の貫入の深さを増大することが、同様に役立つようであった。すべての漏出は、側面放出針を使用して1分間の間に1インチの深さまで注射することによって、停止した(試験番号10〜11)。傾斜針に戻すと、漏出を生じた(試験番号12)。側面放出針の使用をさらに試験するために、100μl流体を最少限の漏出であるかのように速やかに注射し(試験番号13〜14)、このことは、側面放出針による優れた保持を示す。
【0049】
(実施例2−虚血性うっ血心不全の処置のための自己筋芽細胞移植)
方法:虚血性うっ血心不全(CHF)を、ヒツジにおいて繰り返しの冠状微塞栓形成によって、LV駆出画分(LVEF)が35%未満に維持されるまで誘導した。骨格筋筋芽細胞を、動物の前肢から得た生検から単離し、そして細胞を、3×108個の細胞を超える収量が達成されるまで培養した。CHF誘導の約2週間後、動物に、側面孔針を使用して、直接心筋注射を介して自己骨格筋芽細胞(3×108個の細胞)を移植した。細胞を、虚血性に損傷した左心室壁内の複数の部位に注射した。動物を、筋芽細胞移植の6週間後に屠殺し、心臓をホルマリン中で固定し、そして組織学的分析を実施して、細胞生存を評価した。
【0050】
結果:側面孔針を使用する細胞の送達は、死後組織学(post−mortem histology)によって評価したように、首尾よい細胞送達の結果となった。骨格筋特異的ミオシン免疫染色(図3A)によって同定した細胞は、細胞を注射した心筋の広い領域を満たした。より高い倍率において、ある高密度な細胞堆積物のトリクロム染色は、整列した筋管の堆積を示す(図3B)。線維の整列は、ほとんどの場合、周囲の宿主心筋と平行であった。小さな環状の赤い束のように見える各々の筋管は、横断面で切断された多核線維である。
【0051】
要約:側面孔針を使用する自己筋芽細胞の心外膜注射は、細胞を虚血性に損傷した心筋に首尾よく送達した、細胞は生存能力を維持し、そして融合されて、ほとんどの場合に宿主心筋と協調する多核筋管を形成する。組織学的証拠は、移植された心筋が成熟し、収縮タンパク質(例えば、ミオシン重鎖)を発現することを示唆する。
【0052】
(実施例3−梗塞した心筋の処置のための自己筋芽細胞移植)
(プロトコルの目的) この実験の目的は、骨格筋由来の自己筋芽細胞を、心筋梗塞後の心筋の虚血性領域または瘢痕領域の中に、および周囲に移植することの実行可能性および安全性を試験することである。自己筋芽細胞の移植は、被験体が冠状動脈バイパス手術(CABG)を受けている間に実施する。この研究に登録した被験体は、心筋梗塞の経験を有し、また左心室機能不全をも有する。
【0053】
筋芽細胞を、インビトロで、被験体の骨格筋の生検から得た未分化細胞から拡大させる。この細胞を、バイパス手順の時点で左心室の壁に注射する。1つの目的は、心エコー検査法および磁気共鳴画像法(MRI)に基づいて、心機能の改善に関する予備的な情報を得て、局所的壁運動、壁の厚さ、および心室容積を評価することである。MRI画像評価は、他の画像手順、心エコー検査測定および臨床的評価と併せて実施する。
【0054】
(研究についての意義および背景) 冠状動脈疾患は、米国における主な死因であり、死者4.8人毎の1人についての原因であるか、または毎年ほぼ500,000人の死亡の原因である。この疾患は、心筋に供給する血管の壁における脂質沈着、マクロファージ、および線維組織からなるアテローム斑の蓄積によって引き起こされる。米国心臓病協会(American Heart Associaton)によると、1,800万人の米国人が、冠状動脈疾患を有する(AHA、1999)。不安定なプラークの破裂は、血小板凝集および血栓形成を促進する物質を活性化する。血栓は、血小板、血液細胞およびフィブリンからなり、1以上の冠状血管をブロックし得、結果として心筋への酸素の不十分な供給を生じる。心臓の特定の筋肉細胞である心筋は、通常は細胞分裂が起こらないため、この高度に活性な筋肉は急速に損傷し、かつこの損傷は不可逆的である。この結末が、梗塞、心筋の損傷領域であり、この領域において壊死心筋細胞が瘢痕組織および線維症によって置き換えられ、心臓の収縮性および機能が弱体化する。約1,500万人の新たな心臓発作、および再発性の心臓発作が、毎年報告される。
【0055】
心筋梗塞後の虚血性損傷を防ぐための処置は、血栓溶解薬を含み、これは、フィブリン凝塊を破壊し、そして閉塞した動脈を開放する。これらの薬物は、閉塞性の現象から著しく影響した罹患率および死亡率を有するが、有効であるために心筋梗塞後の短い時間間隔内に投与されなければならない。最近の医療マネジメントを用いてでさえ、急性心筋梗塞のうちの約5分の1が死に到る。心臓カテーテル法、血管形成、および閉塞した血管を開放するためにステント挿入することは、灌流を回復することにおける有効性が証明されているが、すでに存在する虚血性の損傷を覆し得ない。冠状動脈バイパス手術は、多くの場合、これらの手順が全く有効でない場合に行われる。500,000件を超えるバイパス手術が、毎年米国において実施される。
【0056】
心臓血管疾患に関連する経済的影響は、HCUPの全国的な入院患者の統計によって示唆されるように驚くべきものであり、この統計は、心臓血管疾患に関連する入院患者の費用が、入院患者の総医療費のうちで最も費用の多い疾患カテゴリ(主な診断に基づいて、26%または970億ドル)であることを示す。心臓血管疾患および発作について見積もられた直接費および間接費は、心筋梗塞に関連して、1年当たり1,000億ドルずつ増えて2,860億ドルにも達する。
【0057】
心筋梗塞を切り抜け、かなりのサイズの非機能性心筋の領域を有する被験体は、心不全を発症することに関して増加した危険性がある。治療における最近の進歩は、虚血性の事象によって損傷している心筋組織のためのいかなる処置も提供しない。左心室は、代償機構の一部として肥大して、弱められた筋肉において心拍出量が増加する。この代償応答は、個々の心筋細胞が肥大して結果的に減少した収縮性を生じる場合に、致命傷となる。この心筋の再構築は、ACE(アンギオテンシン変換酵素)インヒビターおよびβ遮断薬を用いる薬理学的処置によって減速されるが、末期の心不全は、5年以内に80%の被験体において死をもたらす。損傷した心筋組織を置き換え、そして心不全への進行を予防する治療は、心筋に対する虚血性損傷の処置に対する重要な貢献である。
【0058】
以前の梗塞により既に左心室機能不全が存在する患者がCABG手順を要する場合、予後はそれほど確かではなくなる。このことは、CABG手術後の向上した結果についての必要性を残し、これらの場合において、多くの場合、心室の外科的修復または自動心臓内心変換除細動器(Automatic Intracardiac Cardioverted Defibrillator(AICD))の配置と組み合わされる。このレベルでの障害を有する被験体は、バイパス手術後に正常な心臓機能を回復する可能性は低く、追加の治療から利益を得る可能性がある。
【0059】
心筋細胞(筋細胞)は、損傷した心筋層を分裂して修復する能力を有さないが、骨格筋は、損傷した筋肉を修復する必要がある場合に分裂する細胞である筋芽細胞を含む。心筋および骨格筋は、構造、機能、および顕微的外観において多くの類似性を有し、従って、骨格筋からの筋芽細胞は、損傷した心筋に移植された場合、収縮機能を提供することが可能であり得る。
【0060】
被験体の骨格筋からの自系筋芽細胞を、単離し、増殖して、損傷した心筋(heart muscle)に移植するために使用する。筋芽細胞の移植は、心筋壁の機能的能力を上昇させ得、梗塞領域において心室再造形を低下させ得る、新規の処置を提供する。心筋梗塞を罹患する被験体は、これらの筋芽細胞がその損傷した心筋層を修復し得る場合、大いに恩恵を受ける。これらの細胞は、心筋梗塞を罹患している被験体の筋肉生検から単離され、従って、被験体自身の筋芽細胞をその心臓に移植して、それにより、いかなる免疫障壁も避けることを可能にする。
【0061】
この研究における被験体は、心筋梗塞を有しており、そしてCABG外科手術を受ける前は左心室機能不全を有する。左心室機能不全は、35%未満の駆出率によって定義される。左心室機能不全を有する患者は、CABG外科手術の1ヶ月後に90%の生存率を有し、5年後には69%の生存率を有し、これに対して、正常な左心室機能を有する患者の生存率は、1ヵ月後および5年後に96%および90%である(ACC/AHA Task Force Report,Circulation 83(3):1125−1173,1991;本明細書中に参考として援用される)。梗塞部位を外科手術前に局在化させ、そしてこれらの細胞を、梗塞内に注射し、そして周囲の組織内に注射して細胞生存率および梗塞内または梗塞周辺領域(peri−infarct zone)内における細胞移植の機能的利益を評価することを企図し得る。
【0062】
CABG外科手術についての患者は、その生理学的症状、ならびに冠状動脈閉塞および心筋灌流の評価に基づいて選択される。最も一般的な生理学的知見は、重篤なアンギナであり、そしてこれが禁忌を有さない被験体において冠状動脈閉塞の証拠と組み合わさる場合、処置方法(procedure)が計画される。この研究における被験体を、心機能についてMRIを用いてモニターし、局所壁運動、壁の厚み、血管容積、および駆出率を評価した後に外科手術する。虚血性心筋層の再灌流についてのCABG外科手術の結果には、非常に定評がある。既存の左心室機能不全は、予後をより不確かにするが、細胞外マトリックスの沈着物を含む瘢痕組織は、血管再生によって影響をうけにくく、瘢痕組織を移植することは滅多に企図されない。
【0063】
ヒトにおける使用のための筋芽細胞の調製は、当該分野で記載のように実施する。これらの筋芽細胞(未分化細胞)は骨格筋に存在し、筋管(骨格筋の収縮性エレメントを有する筋線維細胞)の前駆体として作用する。未分化細胞は、筋肉が損傷した場合に細胞分裂を可能にする。骨格筋に由来する筋芽細胞は、50世代までインビトロで増殖し得、そして筋ジストロフィを処置するための2回の臨床試験に供されている(Neumeyerら,「Pilot Study of Myoblast Transfer in the Treatment of Becker Muscular Dystrophy」Neurology 51:589−592,1998;本明細書中で参考として援用される)。
【0064】
被験体の骨格筋から生検を入手し、適切な実験室に輸送して、筋芽細胞の単離および増殖を行う。次いで、細胞を回収し、そして移植のための臨床部位に戻す。
【0065】
自系筋芽細胞の使用は、免疫系によってこの細胞が異物として認識されないという利点を有する。抗原提示細胞によって提示される全ての抗原は、恐らく、宿主のT細胞に遭遇しており、従って免疫系は、これらの抗原に対して寛容化される。これは、研究を支持して実施した動物実験の場合であった。これらの研究において、心臓内に同系の筋芽細胞(Lewisラット)を注射し、免疫応答を生じなかった。この知見と一致して、これらの研究におけるシクロスポリンおよびステロイドの使用は、移植片の生存に関して、細胞に対して利点を与えなかった。
【0066】
骨格筋筋芽細胞および胎児心筋細胞の両方の移植を伴う動物研究により、骨格筋筋芽細胞は、動物の心臓の機能を損なうことなく移植片を形成し得ることが実証された(Taylorら,「Regenerating Functional Myocardium:Improved Performance after Skeletal Myoblast Transplantation」Nature Medicine 4(8):929−933,1998;Reineckeら,1999;それぞれは本明細書中で参考として援用される)。健康な組織内に注射された筋芽細胞は、心臓において、移植されて筋管を形成することを示している。心筋梗塞モデルを、3つの実験室において試験している。心筋梗塞を有するウサギにおいて、骨格筋筋芽細胞が生存し、その骨格筋表現型を維持し、そして心臓機能を増強することを見出した。(Taylorら,「Regenerating Functional Myocardium:Improved Performance after Skeletal Myoblast Transplantation」Nature Medicine 4(8):929−933,1998;本明細書中で参考として援用される)。ラット凍傷(cryoinjury)モデルにおいて、筋芽細胞は、移植されて筋管を形成し、この筋管は、心臓機能を増強し、そして心臓特異的タンパク質の発現に基づいて心筋細胞様になることが見出された(Murryら,「Skeletal Myoblast Transplantation for Repair of Myocardial Necrosis」J.Clin.Invest.98(11):2512−2523,1996;本明細書中で参考として援用される)。研究により、ラット筋芽細胞は、Langendorf手順によって測定されるように、安定な移植片を形成し、心筋機能を増強することが、示されている(Jainら,「Skeletal Muscle Implantation Attenuates Post−MI Ventricular Remodeling and Improves Cardiac Performance」2000; 本明細書中で参考として援用される)。これらの細胞は、梗塞領域の外側および内側の両方で生存する。さらに、これらの細胞は、融合して筋管を形成し、そして梗塞の境界において筋細胞と密接な結合を形成すると考えられる。コントロール動物と比較して上昇した心筋の収縮性のおよび心拍出量は、骨格筋移植片の実際の収縮、または処置による血管容量の増大の阻止からもたらされ得る。処置動物において最終拡張期容積は減少し、これは、血管再造形の進行を示した。この血管再造形の進行は、未処置動物において阻止されていることが観察された。
【0067】
左心室の約30%の梗塞を有する被験体において失われた心筋細胞を入れ替えるために、約2〜3億の新規の生存細胞が必要であると算出している。多数の筋芽細胞を注入することの安全性および効力を、30%の梗塞内に100万個の細胞を注射したラットモデルにおいて試験している。これらの実験において安全性の問題は指摘されず、そして細胞移植後のラットの生存率は優秀であった。
【0068】
要約すれば、筋芽細胞移植は、心筋梗塞を有する被験体にとって有利な治療であり得、損傷した心筋を回復させる可能性を有する。これは、瘢痕形成(scarring)および梗塞の拡大の阻止に起因し得るか、または梗塞した心筋の収縮の増大によるものであり得、これらは移植した心筋によってもたらされる。MRIによって測定される局所壁機能の改善は、機能改善を評価するために使用され得る。また、駆出率および心拍出量のような標準的心臓機能の評価のために画像化を利用し、筋芽移植が収縮を増大させ、そして梗塞拡大を阻止させるか否かを決定し得る。さらなる画像化(心電図)の評価および臨床評価もまた、心臓機能を評価するために実施される。
【0069】
(研究プロトコールの詳述)本研究の目的は、心筋梗塞後CABG外科手術を受けている被験体の左心室の壁に、骨格筋に由来する自系筋芽細胞を移植することの、実行可能性および安全性を調査することである。別の目的は、移植片生存率および心臓の機能特徴に対する移植の効果についての予備情報を得ることである。
【0070】
(研究設計)これは、心筋梗塞を経験し、左心室機能不全を有する被験体に関する研究である。被験体は、CABG外科手術の候補であり、他の外科的処置(すなわち、梗塞切除(infarctectomy)、ACID、または弁膜手術)の候補ではない。外科手術の約5週間前に、被験体の骨格筋から生検を採取する。この生検を使用して自系筋芽細胞の集団を産生し、CABG外科手術の時にこれを心臓の規定の領域に移植する。局所壁運動、壁の厚み、および血管容積に対するその効果について、移植領域をモニターした。
【0071】
(被験体選択)被験体は、本研究において筋芽細胞の移植を受ける。本研究に同意し、スクリーニングされる被験体の数は、被験体がCABG外科手術を受ける前に生検を採取し細胞を十分に増殖させて回収することができない場合、または被験体がCABG外科手術を受けないかもしくはCABG外科手術の時点で筋芽細胞移植が減少する場合、18より大きくてもよい。
【0072】
被験体の参加は、細胞移植後、基準の手順、1週間毎日の来診に次ぐ、最初の2年以内の10回までの来診からなる。被験体の病状が、同所心臓移植(OHT)を必要とする場合、心臓を処置した筋芽細胞を、検査のために回収する。任意のOHT被験体を、試験期間の残り期間にわたって追跡する。
【0073】
被験体は、以下の診断基準の全てを満たさなければ、研究参加を認められない:
1.被験体は、18歳以上でなければならず、かつインフォームドコンセントを受ることができる。
2.被験体は、基線において35%未満の左心室駆出率を有さねばならない。
3.被験体は、彼/彼女の心臓外科医の認可を有さねばならない。
4.被験体は、CABG外科手術を予定しなければならない。
5.被験体は、左心室内に同定可能な経壁瘢痕の領域を有さねばならない。
6.被験体は、MRIに適格でなければならない。
7.被験体は、血管外科回復術(ventricular surgical restoration)、AICD配置、または弁膜手術の同時候補であってはならない。
【0074】
以下の診断基準のいずれかを満たす被験体は、研究参加に不適格である:
1.被験体が、治験担当医師が手順の完了に有意であると判断した感染症を有する。
2.被験体が、治験担当医師が手順の完了に有意であると判断した他の複雑な心臓血管異常を有する。
3.被験体が、例えば、以下の臨床的に有意な心電図の異常を有する:
・高い等級の房室ブロック
・高頻度の心室頻拍、再発性の心室頻拍、または持続性の心室頻拍
4.被験体が、骨格筋疾患の証拠を有する。
5.被験体が、知見担当医師が本治験の結果に有意な影響を有するであろうと判断した他の病状の証拠を有する。
6.被験体が、活発な悪性疾患を有する。
7.被験体が、アルコール依存症または薬物依存症の最近の病歴(過去6ヶ月以内)を有する。
8.女性である場合、被験体が妊娠している、または妊娠しようとしている。
【0075】
(方法論)被験体は、CABG外科手術の最初の計画に基づいて、本研究に組み入れられる。本研究への参加に適格であることの決定後、CABG手順の予定の約5週間前に、被験体から筋肉生検を採取する。
【0076】
(基線評価)
1.インフォームドコンセント手順
2.判断基準に適格であることの決定
3.病歴審査および理学的検査
4.従来的な血液サンプル採取および以下を含む検査室検査(laboratory test):血液学(差次的なCBC)および心臓酵素レベルを含む血液化学
5.ECG
6.心エコー検査(標準的プロトコールによる)
7.尿検査
8.Diacrin免疫検査のための採血
9.筋肉生検
10.24時間のHolterモニタリング(筋芽細胞移植前に2回行う)
11.MRI(標準的プロトコールによる)
12.PETスキャン(必要に応じて)
13.NOGATMマッピング(必要に応じて)
14.血清妊娠検査(女性の場合)
15.クオリティオブライフ評価(必要に応じて)
(筋芽細胞移植片心臓供与後)
インフォームドコンセントの一部として、筋芽移植後に同所心臓移植が必要とされる場合、検査のために、被験体は彼/彼女の(自系筋芽細胞で処置した)心臓の供与を求められる。
【0077】
インフォームドコンセント手順の一部として、被験体は、被験体が筋芽細胞を与えられた後でOHTの前に亡くなった場合、剖検に同意することを考慮するよう求められる。剖検のための別の同意書を有効にする。心臓の組織学的分析の詳細については、以下を参照のこと。
【0078】
CABGについての候補が、インフォームドコンセントを得、そして包含/除外診断基準に合致した後、筋肉生検を採取する。腕または脚の筋肉から無菌条件下で採取した筋肉生検(約5.0g)を、生検輸送キットを使用して細胞処理施設に輸送する。施設は、細胞の輸送準備が出来る2〜3日前に、治験担当医師に報告する。CAGB外科手術を延期するかまたは取り消す場合、細胞を凍結保存(cyropreserve)し、将来の移植のために保存し得る。任意の未使用細胞を、基礎的な細胞移植研究目的(例えば、細胞増殖、保存、凍結などについての研究)に使用し得る。
【0079】
被験体に、骨格筋由来の自系筋芽細胞を移植する。筋芽細胞産生は、4工程のプロセスを包含する。このプロセスは、以下を包含する:被験体の筋肉組織(生検)の獲得、細胞処理施設における生検の受領および加工による未分化前駆体細胞の放出、未分化細胞に由来する筋芽細胞の増殖、ならびに移植のための最終産物の産生。産生プロセスを、FDA適正製造基準条例(21CFR第210部)および細胞/組織ベースの治療薬に関する全ての適用可能なFDAガイドラインの下で行う。
【0080】
CABGを予定する被験体が知見に組み込まれる場合、細胞を増殖させ、移植のために病院に運ぶ。筋芽細胞の単離を、本明細書中で記載のように実行する。
【0081】
被験体の看護の全ては、治験担当医および治験副担当医の管理の下である。移植は、病院内で行う。被験体を、CAGBのために準備させ、手順を実行する。本研究の意図は、細胞を、左心室壁の梗塞領域に注射することである。
【0082】
被験体1人あたりの総細胞投薬量は、投薬レジメンの増大に従う。細胞移植を受ける最初の3人の被験体は、各々最大1000万細胞を受ける。3000万細胞まで増大した細胞投薬量を、4人目、5人目および6人目の被験体に与え、そして1億細胞までを7人目、8人目および9人目の被験体に与える。10人目、11人目、および12人目の被験体に、3億細胞までの細胞投薬量を与える。13人目、14人目および15人目の被験体に、6億細胞までの細胞投薬量を与える。16人目、17人目および18人目の被験体に、9億細胞までの最大細胞投薬量を与える。
【0083】
細胞を、0.33×108細胞/ml、1.0×108細胞/ml、または1.6×108細胞/mlの濃度で臨床部位まで送達する。0.33×108細胞/mlの濃度を、最低投薬量(1000万細胞)のためのみに用い、各100μlを最大投薬量(総容積300μl)に達するまで、3回の注射を要する。3000万細胞投薬群のために、細胞を、1.0×108細胞/mlに濃縮し、各100μlの注射を3回要する(総容積300μl)。1億細胞投薬群のために、細胞を1.0×108細胞/mlに濃縮し、各100μlの注射を10回要する(総容積1ml)。3億細胞投薬群のために、細胞を1.0×108細胞/mlに濃縮し、各100μlの注射を30回要する(総容積3ml)。6億細胞投薬群のために、細胞を1.6×108細胞/mlに濃縮し、各150μlの注射を25回要する(総容積3.75ml)。9億細胞投薬群のために、細胞を1.6×108細胞/mlに濃縮し、各150μlの注射を38回要する(総容積5.7ml)。標的投薬量が増大するに従い、細胞濃度を上昇させ、注射する総容積を最小化する。
【0084】
各筋芽細胞注射を、ゆっくりと行う。各注射後、針を5〜15秒間定位置に保ち、注射の跡に沿った細胞運動を最小にする。手順の後、被験体を手術室から集中治療室(ICU)に移し、24時間観察する。手術後、従来検査のために採血する(15ml)。
【0085】
研究の被験体は、自系筋芽細胞を受けた後すぐに、移植後処置期間に入る。最初の来診は、移植の翌日である。その後の評価来診は、移植2〜6日後(または退院まで)、1週間後、2週間後、3週間後、6週間後、9週間後、12週間後、および6ヶ月後、9ヶ月後、12ヶ月後、18ヶ月後、24ヵ月後に、行う。週毎の来診(1週間後、2週間後、3週間後、6週間後、9週間後および12週間後)は、実際の時点の±3日間以内に行い得る。月毎の来診(6ヶ月後、9ヶ月後、12ヶ月後、18ヶ月後および24ヵ月後)は、実際の時点の±7日間以内に行い得る。移植後24時間の間、被験体は、生命徴候および臨床状態の継続的な標準的ICUモニタリングを受ける。筋芽細胞移植手順に関する特定の潜在的な問題点としては、以下が挙げられる:
1.不整脈
2.外科手術および細胞注射の間の細動
3.心臓の注射(移植)部位からの出血
4.感染症
理学的検査、ECG、標準化心エコー検査、Holterモニタリング、血液検査および尿検査、ならびにクオリティオブライフ評価(必要に応じて)によって、安全性モニタリングを行う。心臓機能の改善についての検査を、標準化MRIおよび標準化心エコー検査、または必要に応じてPETスキャンもしくはNOGATMマッピングによって行う。
【0086】
移植後期間に、以下の評価を完了する。
【0087】
(1日目)
・理学的検査
・ECG
・従来の血液検査
・尿検査
・有害事象
・併用薬物適用
(第2日目〜第6日目(または、病院から退院するまで))
・ECG
・通常の血液検査
・有害事象
・併用薬
(第1週)
・健康診断
・ECG
・心エコー検査
・24時間のホルターモニタリング
・通常の血液検査
・Diacrin血液検査
・尿検査
・有害事象
・併用薬
(第2週)
・健康診断
・ECG
・通常の血液検査
・有害事象
・併用薬
(第3週)
・健康診断
・ECG
・心エコー検査
・24時間のホルターモニタリング
・MRI
・PETスキャン(任意)
・通常の血液検査
・Diacrin血液検査
・尿検査
・有害事象
・併用薬
(第6週および第9週)
・健康診断
・ECG
・心エコー検査
・通常の血液検査
・尿検査
・有害事象
・併用薬
(第12週)
・健康診断
・ECG
・心エコー検査
・NOGATM マッピング(任意)
・MRI
・PETスキャン(任意)
・通常の血液検査
・Diacrin血液検査
・尿検査
・有害事象
・併用薬
(6ヶ月)
・健康診断
・ECG
・心エコー検査
・24時間のホルターモニタリング
・MRI
・PETスキャン(任意)
・NOGATM マッピング(任意)
・通常の血液検査
・Diacrin血液検査
・尿検査
・有害事象
・併用薬
・クオリティ・オブ・ライフ(任意)
(9ヶ月)
・健康診断
・ECG
・通常の血液検査
・有害事象
・併用薬
(12ヶ月)
・健康診断
・ECG
・心エコー検査
・24時間のホルターモニタリング
・MRI
・PETスキャン(任意)
・通常の血液検査
・尿検査
・有害事象
・併用薬
・クオリティ・オブ・ライフ(任意)
(18ヶ月)
・健康診断
・ECG
・心エコー検査
・MRI
・PETスキャン(任意)
・通常の血液検査
・尿検査
・有害事象
・併用薬
(24ヶ月)
・健康診断
・ECG
・心エコー検査
・24時間のホルターモニタリング
・通常の血液検査
・尿検査
・有害事象
・併用薬
・クオリティ・オブ・ライフ(任意)。
【0088】
要約すると、その状態の被験体に対する標準的な臨床的ケアを超えた、研究被験体が受ける手順は、1)筋肉生検、2)自己筋芽細胞の移植;3)ホルターモニタリング、4)頻繁な採血、ならびに5)MRI、および6)PETスキャン、および/またはNOGAマッピング(任意、そして、ベースラインにて行われる場合のみ)、7)クオリティ・オブ・ライフ(任意)である。
【0089】
(安全性評価)有害事象は、研究被験体により経験された、任意の所望でない、身体的、精神的または行動的効果である。この事象が、治験薬(investigational product)と関連するとみなされるかどうかは関係ない。さらに、有害事象は、治験薬の使用と時間的に関連する、任意の好ましくなく、かつ意図的でない徴候(すなわち、異常な実験室における所見、症状または疾患)である。患者のベースライン状態または病歴に関する症状は、有害事象としては報告されない。しかし、研究の間に悪化する、前々から存在する状態は、有害事象とみなされる。有害事象は、FDAのガイドライン文書「Conducting a Clinical Safety Review of a New Product Application and Preparing a Report on the Review,November 1996」に示唆されるように、身体系統により分類される。
【0090】
重篤な有害事象(SAE)は、以下の転帰のうちの1つとして定義される:(1)死亡;(2)生命にかかわる(治験担当医師(investigator)の観点から、事象が生じる場合に、被験体をその事象からの死亡の直接の危険性に置く、任意の有害体験、すなわち、より重篤な形態にて生じ、死亡を引き起こしかねない反応は含まない);(3)入院患者または既存の入院の延長;(4)持続性またはかなりの障害/無能;(5)被験体を危険にさらし得、かつ、他の転帰のうちの1つを予防するために、医学的または外科的な介入を必要とし得る、重要な医療事象;および(6)先天性奇形/出生時欠損。
【0091】
臨床検査における有害事象の場合について、因果関係の評価が必要とされる。治験薬の使用に関する有害事象について、その経験が、治験薬により引き起こされ得るという合理的な可能性が存在しなければならない。従って、関連する有害事象は、薬物/生物製剤/処置と有害事象との間には、原因となる関係を示唆する証拠または理由が存在することを暗示する。
【0092】
細胞移植手順から開始して、治験担当医師は、有害事象を再検討し、必要な場合、医療介入が開始される。細胞移植手順の前に、筋肉生検手順に関連するものとして治験担当医師により評価される有害事象のみが、捕捉され、報告されるべきである。
【0093】
全ての有害事象について、治験担当医師は、有害事象の研究薬物(study product)、外科的手順および、任意の必要な処置に対する関係性を評価するために質問される。21 CFR §312.32に従う場合、治験担当医師は、その有害事象を、重篤な有害事象であると決定し、以下に述べるさらなる工程を必要とする。
【0094】
(臨床的評価)移植後の臨床的評価としては以下が挙げられる:有害事象および全ての併用薬のモニタリング、健康診断、ECG、心エコー検査(標準化したプロトコールによる)、24時間のホルターモニタリング、MRI(標準化したプロトコールによる)、血液検査、尿検査、PETスキャン(任意)、NOGATMマッピング(任意)、クオリティ・オブ・ライフの評価(任意)、ならびに、移植を評価するための心臓の組織学的評価(被験体がOHTまたはダイス(dies)を受けている場合)。
【0095】
治験担当医師は、ベースライン、第1日目、第1週、第2週、第3週、第6週、第9週、第12週ならびに6ヶ月、9ヶ月、12ヶ月、18ヶ月および24ヶ月に健康診断を実施する。この健康診断としては、血圧、心拍、呼吸速度、温度(およびベースラインにおける身長および体重)の取得、および、主要な身体系統の記録による評価が挙げられる。心電図を用いて、心臓の電気的活動を評価する。ECGを、ベースラインと、全ての移植後の回診時に実施する。
【0096】
標準化した心エコー検査を用いて、心臓の性能(例えば、心室の収縮期および拡張期の機能)を評価する。心エコー検査をまた用いて、壁の厚さを評価する。この評価は、ベースライン、第1週、第3週、第6週、第9週、第12週ならびに、6ヶ月、12ヶ月、18ヶ月および24ヶ月でなされる。
【0097】
24時間のホルターモニタリングを用いて、不整脈についてモニタリングする。被験体は、ベースライン期間と、第1週および第3週、ならびに、6ヶ月、12ヶ月および24ヶ月に2回、これをなされる。
【0098】
標準化したMRIを実施して、細胞生存率および移植片の機能を評価する。MRIは、ベースライン、第3週および第12週、ならびに、6ヶ月、12ヶ月および18ヶ月において実施される。
【0099】
通常の血液サンプル(15ml)が、ベースラインの回診時の安全性評価として、移植の日、第1日目、第2〜6日目(または、排出まで)、第1週、第2週、第3週、第6週、第9週、第12週、ならびに、6ヶ月、9ヶ月、12ヶ月、18ヶ月および24ヶ月に、血液学(差次的な完全血球数が挙げられるがこれに限定されない)および血液化学(Na、K、Cl、CO2、グルコース、BUN、クレアチニンおよび心筋酵素のレベルが挙げられるがこれらに限定されない)について検査される。
【0100】
ベースライン、第1週、第3週、第12週、および6ヶ月の回診時に、検査のために、血液サンプル(5ml)が採取される。サンプルは、被験体の筋芽細胞に対する抗体について検査される。抗体検査からの結果は、被験体の臨床的ケアに影響を及ぼさないが、研究者に、自己筋芽細胞移植についてのさらなる情報を提供する。
【0101】
ベースライン、第1日、第1週、第3週、第6週、第9週、第12週、ならびに、6ヶ月、12ヶ月、18ヶ月および24ヶ月に、安全性評価として日常の尿検査が行われる。
【0102】
筋芽細胞移植を受けた被験体が、OHTまたはダイスを受けた後、筋芽細胞を移植された心臓の部分を固定し、組織学のために切片にする。移植片を含む領域を、H&Eおよびトリクロムで染色し、筋芽細胞移植片を位置決めする。移植片の同定は、ミオジェニン抗体および抗体My32を用いて、免疫組織化学により確認する。移植片のサイズ、細胞数、形態学、および免疫系の細胞による浸潤の程度が記録される。
【0103】
PETスキャンは任意の検査であり、治験担当医師の指示に従って、ベースライン、第3週および第12週、ならびに6ヶ月、12ヶ月および18ヶ月にて取得され得る。
【0104】
NOGATMマッピングは、任意の検査であり、治験担当医師の指示に従って、ベースライン、第12週および6ヶ月にて取得され得る。
【0105】
SF−36および/またはMinnesota Living with Heart Failureは、ベースライン、6ヶ月、12ヶ月および24ヶ月にて使用され得る、クオリティ・オブ・ライフ評価の例である。
(データ分析)ECG、血液検査および健康診断により安全性が評価される。耐用性は、被験体が報告した有害事象により評価される。
(危険性および利点の分析)この研究に参加している被験体に対し、直接的な利点は存在しないが、この処置が、梗塞性の心筋に関連する徴候、症状または他の合併症を減少し得ることが望まれている。この手順は、心機能を増加し得、そして、被験体の生存機会を増加し得る。自己筋芽細胞が本研究において成功する場合、他者が、この処置から恩恵を受け得る。
【0106】
本研究における危険因子としては、自己筋芽細胞に対する有害反応の可能性が挙げられる。移植された筋芽細胞の使用は、比較的新しく、従って、特定の危険性が、この時点で未知である。動物研究が、筋肉細胞の首尾よい移植が、免疫抑制なしに達成され得ることを示している。
【0107】
移植のための細胞の調製のための筋肉組織の除去に関連する、感染および他の合併症の危険性が存在する。感染が生じる場合、その感染が処置され得る。また、生検部位において、出血、挫傷または血腫の危険性が存在する。生検は、局所麻酔を用いて取得されるが、この手順からの痛みが経験され得る。瘢痕が生検部位において生じ得るわずかな危険性が存在する。
【0108】
これが自己の、細胞ベースの製品であるため、アレルギー反応の可能性はあるが、その可能性は低い。被験体は、任意のアレルギー反応についての術中期間、密にモニタリングされるべきであり、そして、反応が生じない場合、この被験体は、ケアの臨床的基準により処置されるべきである。
【0109】
左心室の注入部位において、出血および/または血餅の発生の危険性がある。被験体は、密にモニタリングされるべきであり、ケアの臨床的基準を用いて、出血および/または血餅の発生を管理するべきである。この危険性の存在は、死亡または障害をもたらし得る可能性がある。
【0110】
移植部位における自己筋芽細胞移植からの感染の危険性は、可能性が低い。被験体は、感染の任意の徴候および症状について、術中の期間、密にモニタリングされるべきであり、感染が実際に生じる場合は、被験体は、ケアの臨床的基準によって処置されるべきである。感染の存在が、死亡または障害をもたらし得る可能性がある。
【0111】
心臓の骨格筋の移植に関する不整脈の危険性が存在する。不整脈は、前臨床研究においては生じることが見出されなかった。未検出かつ未処置の不整脈は、死亡を引き起こし得る。被験体は、心臓の不整脈の発生について、密にモニタリングされる。
【0112】
左心室の壁の筋芽細胞への注射は、左心室機能の減少を生じ得る。この発生の危険性は知られていないが、左心不全および/または死亡をもたらし得る。
【0113】
心内膜マッピングの結果としての損傷の危険性は非常に低く、標準的な経皮心臓インターベンション手順に類似する。
【0114】
移植された細胞が、被験体により拒絶されるか、または、免疫拒絶以外の原因により失敗に終わるという危険性が存在する。拒絶の効果としては、発疹、熱または高血圧が挙げられ得る。存在するとしても、移植の失敗が、被験体の病状にどのような効果を与え得るかは知られていない。
【0115】
筋芽細胞が、どのくらいの期間ヒト心臓において生存するかは未知である。動物研究および、ヒトの経験は、今日までに、少なくとも3ヶ月間の心臓の生存という、移植片統合特性を示す。
【0116】
(実施例4−末期の心不全の処置のための自己筋芽細胞移植)
(プロトコールの目的)この実施例の目的は、骨格筋由来の自己筋芽細胞の、末期の心不全の被験体の心筋への移植の実現可能性および安全性を試験することである。被験体は、心臓移植手術の候補者であり、同所性移植へのつなぎとして、左心室補助デバイス(LVAD)の配置が計画されている。細胞は、被験体の骨格筋の生検から得た組織から調製され、左心室の所定の領域において、被験体の心臓へと移植される。細胞は、LVADを移植するための手術の間に心筋へと直接注射される。筋芽細胞は、インビトロで生検から得られた未分化細胞から拡大される。安全性は、予期しない任意の有害事象(例えば、筋芽細胞の移植に起因し得る、異常な心機能)に基づいて評価される。二次的な目的は、自己移植片の生存、および、自己筋芽細胞移植に関連し得る心機能の改善に対する可能性についての予備的な情報を獲得することである。
【0117】
(研究に対する有意さおよびバックグラウンド)心不全は、1年あたり100万以上の入院の原因であり、65歳以上の患者における最も一般的な診察での診断である。毎年、心不全を有するおよそ70,000の人々が、心臓置換の恩恵を受け得るが、約2,500の心臓移植のみが実施される(Hosenpubら、「The Registry of the International Society for Heart and Lung Transplantation」J.Heart Lung Transplant.16:691−712,1997;本明細書中に参考として援用される)。心不全は、心臓血管疾患からの主要な死因である。心不全の診断を有する5分の1の患者は、1年以内に死亡し、そして、50%の患者が、5年以内に死亡する。心臓血管疾患に関する経済的帰結は、HCUP(Healthcare Cost and Utilization Project)の全世界の入院患者統計により示唆されたように、驚くべきである。この統計は、心臓血管疾患が、最も費用のかかる疾患分類(主要な診断に基づく、入院患者のヘルスケア費用全体の26%、すなわち、970億ドルを占める)であることを示す。病院における心不全の管理は、一年に、約360億ドルかかる(O’Connellら、「Economic impact of heart failure in the United States:time for a different approach」J.Heart Lung Transplant 13:S107−S112,1995;本明細書中に参考として援用される)。損傷した心筋組織を置換し、心不全の進行を阻止する治療は、この疾患の処置に重要な寄与を果たす。
【0118】
心不全は、心臓に対して病理学的ストレスを生じ、次いで、代償性機構をもたらす、心臓血管疾患を背景にして開始される、心臓へのさらなる損傷を招く破壊サイクルの末期である。これらの心臓壁への変化は、これらが、心臓の収縮期または拡張期の機能に影響を及ぼすかどうかとして分類され得る。従って、心不全は、最終的には、ポンプ動作の不適切さ(収縮期心不全)、心室充填の欠損(拡張期心不全)またはこの両方の不全の組み合わせに起因し得る。
【0119】
心不全の主要な危険因子は、危険性を200%増加させる高血圧、糖尿病、冠動脈疾患、前心筋梗塞、感染および弁の欠損である。単一の危険因子は、心不全を生じ得るが、因子の組み合わせが、有意に危険性を増加させる。患者は、呼吸困難、疲労、ならびに足、足首、および脚の浮腫を伴って存在し得る。肺における過剰の流体もまた、持続性の咳または喘鳴を生じ得る。危険因子を評価するための患者の病歴、および、上記の症候を検出するための健康診断、ならびに、異常な心音および肺のうっ血は、心不全の診断を提供し得る。心不全のさらなる確認は、ECG、心エコー検査および胸部X線検査から入手可能である。
【0120】
拡張期心不全は、心室の充填の異常から生じ、これは、線維性の非膨張性の瘢痕組織での膨張性組織の置換により生じた、心室の伸展性の減少に起因し得る。この状態において、拡張期容量は、正常よりもわずかに少ないが、左心室圧は、拡張期の間中、増加している。心室圧の上昇は、上流の高い静脈圧を生じ、肺および全身のうっ血を生じる。収縮期の性能(すなわち、心拍出量および駆出分画)は、正常であるか、または正常に近い。左心室の代償性の膨張は、拡張期容量の増加をもたらし、結果として、拡張期圧を上昇させる。重要なことには、収縮性の減少は、心拍出量および駆出分画の低下を生じる。
【0121】
冠状動脈疾患は、拡張期機能不全および収縮期機能不全の両方を生じる。この非常に活性な筋肉に対する酸素の不適切な供給により、迅速な損傷および病変が生じ、これらは不可逆的と考えられる。最終的に、梗塞:壊死性心筋細胞が瘢痕組織および瘢痕線維によって置き換えられた心筋の損傷領域、を生じる。この状態において、収縮期機能不全は、心筋細胞の喪失による収縮性の慢性的な喪失に起因する。拡張期機能不全は、非膨張性瘢痕組織の侵入に起因する心室の硬さの増加によって生じる。
【0122】
心室壁にかかる圧力のタイプは、心不全の生理機能を決定する。高血圧または大動脈狭窄は、過剰に負荷される圧力に起因して、心筋を圧迫する。圧力の過剰負荷は、左心室拍出の間、収縮性壁圧力を生じる。なぜなら、心臓は、通常の力よりも大きな力と接触して、適切な容量の血液を送り出さなければならないからである。増加した後負荷は、左心室の拡張を生じ、これは次いで、心筋肥大を生じる。大動脈弁逆流(「漏出性」大動脈半月弁を通る血液の逆流)は、左心室が収縮期および拡張期の間に血液を受け取った場合、容量過剰負荷を生じる。時間が経つと、これは左心室の拡張を生じる。次いで、この拡張した心室の直径の増加は、筋細線維の筋節がその通常の最大長さを越えて伸張する場合、増加した前負荷を生じる。
【0123】
増加した負荷(圧力または容量)を補償する主な機構は、心室肥大である。心筋細胞は分裂し得ないので、心筋肥大は、細胞の数が増加することなく、個々の筋細胞のサイズの増加から生じる。圧力が容量過剰負荷に関連するか圧力過剰負荷に関連するかに依存して、肥大のパターンは異なる。従って、左心室の質量は、圧力過剰負荷または容量過剰負荷の結果と同じ程度まで増加するが、壁厚は容量過剰負荷におけるよりも圧力過剰負荷においてより大きく増加する。細胞レベルにおいて、圧力過剰負荷は心筋肥大を生じ、これは心筋線維の並行複製および個々の筋細胞の肥厚化から生じる短縮性様式で成長する。容量過剰負荷および拡張期壁圧は、連続した筋節の複製、筋細胞の伸張、および心室拡張を生じる。容量過剰負荷から生じる心室伸張の程度は、圧力過剰負荷から生じるものよりも大きい。両方の状態において、肥大性補償応答の主な結果は、収縮期壁圧を通常のレベルまで戻し、そして心拍出量を改善することである。しかし、連続した流体力学的圧力下で、さらなる細胞変化が生じ、下向きの螺旋が形成される。これらの変化としては、筋線維および管系の破壊、心臓組織の線維組織での置換、および筋細胞壊死が上げられる。心筋細胞のアポトーシスは、収縮性組織の喪失において重要な役割を果たす。これは、残りの心筋細胞に対する増加した圧力を生じ、反応性肥大および心不全を引き起こす。心筋細胞に対するこれらの変化に加えて、肥大はまた、虚血の発生を伴う毛細管密度の減少を引き起こし、これは置換性線維形成を速める。
【0124】
LVADの配置が同定された患者は、末期の心不全であり、心臓移植または心臓補助デバイスの導入以外のわずかな治療的選択肢しか有さない。この点に進行する患者は一般に、薬理学的治療によって処置されているが、発達中の心室再構築を有し、これは移植しないと生命を脅かすことになる。早期段階の心不全を有する患者の処置は、ACEインヒビター、利尿薬、強心薬およびβブロッカーで始められる。ACEインヒビターの使用は、左心室再構築の進行を遅くすることが示されているが、このプロセスは、任意の薬理学的治療によって止められない。
【0125】
LVADの使用は、正常位心臓移植を受けるべき患者の生存率を大きく増加させた。HeartMate System(ThermoCardiosystems,Inc.)を用いる臨床試験は、心臓移植候補者における死亡率の55%の減少を示した(Frazierら「The HeartMate Left Ventricular Assist System:overview and 12−year experience」Tex.Heart Inst.J.25:265−271,1998;本明細書中に参考として援用される)。BVS 500(Abiomed,Inc.)で補助し、補助を98日まで提供した場合、移植を受けた移植候補者の数は70%であった。LVADで補助された患者の平均87%が、心臓移植後に退院まで生存する(Burtonら、Ann.Thorac.Surg.55:1425−1430,1993;本明細書中に参考として援用される)。
【0126】
心筋細胞は、損傷した心筋を分裂させ、修復する能力を有していないが、骨格筋は、未分化細胞と呼ばれる細胞を含み、これは損傷した筋肉を修復するために集められる場合、筋芽細胞として分裂する。しかし、両方のタイプの横紋筋(すなわち、心筋および骨格筋)は、構造、機能および微視的外観において多くの類似点を有する;従って、骨格筋由来の筋芽細胞は、損傷した心筋に移植された場合、収縮機能を提供し得る(Murryら「Skeletal Myoblast Transplantation for Repair of Myocardial Necrosis」J.Clin.Invest.98(11):2512−2523(1996);Taylorら、「Regenerating functional myocardium:Improved performance after skeletal myoblast transplantation」Nature Medicine 4(8):929−933,1998;これらの各々は本明細書中に参考として援用される)。被験体の骨格筋由来の自系筋芽細胞は、単離され、増殖され、そして損傷した心筋に移植するために使用される。筋芽細胞の移植は、壊死性心筋壁内の死んだ筋細胞を置換することによって、その機能的能力を増大し得る新たな処置を提供する。移植された筋芽細胞は、通常の収縮期壁圧を再確立し、そして心不全の破壊的サイクルを終わらせるかまたは遅らせるのを助けることを意図する。従って、置換療法によって壁圧を解放することによって、有害な肥大性変化は、もはや起こり続けなくなり、そして肥大性の細胞は、正常な形態に戻る機会を有し得る。矛盾しているように見えるかもしれないが、筋芽細胞の添加は、実際に、心臓のサイズを減少し得、それにより心不全を予防し得る。細胞は、鬱血性心不全に罹患している被験体の筋肉生検から単離され、従って、被験体自身の筋芽細胞がその心臓へ移植され得、それにより全ての免疫学的障壁が回避される。
【0127】
被験体は、心不全と診断されている。この被験体は、LVAD移植手術の間、心筋に直接移植された自系筋芽細胞を有する。筋芽細胞移植は、心臓の心筋拡張を減少し得る収縮性心筋を有する心筋を再増殖し、それによりその機能を改善することを意図する。さらに、被験体が引き続き心臓移植を受ける場合、取り出された心臓は、組織学的分析のために使用され、筋芽細胞生存が評価される。
【0128】
ヒトにおける使用のための筋芽細胞の調製は、本明細書中に記載されている。未分化細胞に由来するこれらの筋芽細胞は、骨格筋に存在し、ここで、これらは筋管(骨格筋細胞の収縮性エレメントを有する筋線維細胞)の前駆体として働く。骨格未分化細胞は、筋肉が損傷した場合に細胞分裂し得、それによりこの損傷した筋肉を交換する。骨格細胞に由来する筋芽細胞は、インビトロで、50世代ほど長く増殖し得、そして上記の2つの臨床試験のために供給されて、筋ジストロフィーを処置する。
【0129】
この研究について、生検が被験体の骨格筋から採取され、そして筋芽細胞の単離および増殖のために、細胞処理設備に運ばれる。この筋芽細胞は、3〜5週間増殖され、収集され、そして最終的な産物が、臨床現場に運ばれる。あるいは、筋肉組織および/または増殖筋芽細胞は、将来の移植のために、低温保存され得る。次いで、これらの筋芽細胞は、LVAD手術の時に、被験体の左心室の心筋に直接移植される。
【0130】
自系筋芽細胞の使用は、この細胞が免疫系によって異物として検出されないという利点を有する。自系移植片に存在する全ての抗原は、おそらく、宿主の免疫系によって攻撃され、従ってこのレシピエントはこれらの抗原に対して耐性である。この臨床研究の支持の下で実施された同系ドナーラットを使用する動物研究は、自系筋芽細胞の使用を模倣する。この同系筋芽細胞(Lewisラット)は心臓に移植され、そして移植片に対する顕著な免疫応答はなかった。
【0131】
骨格心筋および心臓心筋の両方の移植を用いる動物研究によって、骨格心筋細胞株および骨格筋から単離された培養筋芽細胞は、動物の心臓の機能を損なうことなく、移植片を形成し得ることが実証された。健常な組織に注入された筋芽細胞は、心臓に筋管を植え付けそして形成することが示されている。心筋梗塞モデルが、3つの研究室で試験された。低温損傷を有するウサギにおいて、骨格筋芽細胞は生存し、その骨格筋表現型を維持し、そして心臓機能を増強することが見出された。ラット低温損傷モデルにおいて、筋芽細胞は、植え付き、そして筋管を形成することが見出され、この筋管は、再び、心臓機能を増強し、そして心臓特異的タンパク質の発現に基づいて心筋細胞様になった。Jainらにより行われた研究(「Cell Therapy Attenuates Deleterious Ventricular Remodeling and Improves Cardiac Performance After Myocardial Infarction」Circulation 103:1920−1927,2001;本明細書中に参考として援用される)は、ラット筋芽細胞が、安定な移植片を形成し、そしてランゲンドルフ手順およびトレッドミル容量によって測定される場合、心筋機能を増強することを示した。最終拡張期容量は、処置動物において減少し、このことは、移植された筋芽細胞が、未処置動物で観察される心室再構築の進行を妨害したことを示す。これらの細胞は、梗塞領域の外側および内側の両方で生存した。さらに、これらの細胞は融合して、筋管を形成し、そして梗塞の境界で筋細胞との密な接触を形成するようであった。コントロール動物と比較して増加した心筋収縮性および心拍出は、骨格筋移植片の実際の収縮から生じ得るか、または処置による増大した心室容量(拡張期)の防止によって生じ得る。
【0132】
自系筋芽細胞を用いて左心室を再増殖し、収縮性細胞の30%の増加を達成して、破壊された心筋細胞を交換するために、少なくとも3億個の細胞の移植が必要である。多数の筋芽細胞の移植の安全性および有効性は、百万個の細胞が左心室の30%に注入されたラットモデルにおいて試験された。安全性の問題は、これらの研究において注目され、細胞移植後のラットの生存率は非常に良好であった。
【0133】
要約すると、筋芽細胞移植は、収縮性筋細胞の喪失を有する心筋を再構築することによって、心不全を有する被験体にとって有用な治療であり得る。これは、心筋崩壊の破壊サイクルに寄与するストレスを取り除くことによって、心不全の進行を予防し得る。OHT時に得られる組織の組織病理学的分析は、移植された筋芽細胞の生存率についての試験を可能にする。これらの試験的な研究において自系筋芽細胞を使用することによって、通常、移植に関連する免疫学的問題は回避される。
【0134】
(検索プロトコールの説明)
この研究の目的は、骨格筋由来の自系筋芽細胞の、左心不全を有する被験体(ブリッジまたは正常位心臓移植としてLVAD手術を受けている)の心筋への移植の実行可能性および安全性を調査することである。別の目的は、移植片の生存、および心臓の機能的特徴に対する移植の影響についての予備情報を得ることである。
【0135】
これは、末期の心不全の被験体を含む開放研究である。この被験体は、ブリッジ心臓移植または正常位心臓移植としてのLVAD手術の候補者である。研究者は、この被験体がLVAD手術を必要としていると予測した場合、滅菌生検がこの被験体の骨格筋から採取される。この生検は、LVAD手術の際に、肥大心臓の特定の領域に直接移植される自系筋芽細胞の集団を作製するために使用される。
【0136】
この被験体の参加は、ベースライン手順、1週間の間の毎日の来診、次いで15回までの来診(これは細胞移植後の最初の2年間以内、または正常位心臓移植まで続ける)から構成される。
【0137】
被験体は、研究参加に適格であるべき以下の基準の全てを満たしていなければならない:
1.被験体は、18歳以上であり、かつインフォームドコンセントを受けることができなければならない。
2.被験体は、LVAD移植の候補者であると決定されている。
3.被験体は、正常位心臓移植の候補者である。
4.被験体は、正常位心臓移植時に、試験のためにその心臓(自系筋芽細胞で処置されている)を提供することに同意する。
【0138】
以下の基準のいずれかを満たす被験体は、この研究の参加に不適格である:
1.被験体が、細胞移植時に、敗血症、肺炎および他の活性感染を有する(尿、血液培養物または胸部X線による)。
2.被験体が、本研究者がこの手順を完了するのに重要と考える他の複雑な心血管異常を有する。
3.被験体が、骨格筋疾患の証拠を有する。
4.被験体が、本研究者がこの試験の結果に対して重大な影響を有する可能性があると決定する他の医学的状態の証拠を有する。
5.被験体が、活性悪性腫瘍を有する。
6.被験体が、最近のアルコールまたは薬物乱用の履歴(6ヶ月)を有する。
7.女性の場合、妊娠しているか、または妊娠を試みている。
【0139】
被験体は、LVAD手術の必要性の初期決定に基づいて、この研究に加えられる。この研究における参加についての適格性の決定に従って、筋肉生検がこの被験体から採取され、そして全ての他のベースライン評価が、推定LVAD手順の可能な限り近くで完了される。
【0140】
(ベースライン評価)
1.インフォームドコンセント手順。
2.適格性基準の決定。
3.履歴および身体試験。
4.慣用的な血液サンプリングおよび臨床試験(血液学(差異を用いるCBC)および心臓酵素レベルを含む血液化学を含む)。
5.ECG。
6.心臓エコー検査。
7.尿検査。
8.Diacrin免疫試験のための採血。
9.筋肉生検。
10.子供を有している可能性のある女性の血清妊娠試験。
【0141】
インフォームドコンセントの一環として、被験体は、正常位心臓移植時に、試験のためにその心臓(自系筋芽細胞で処置されている)を提供することに同意する。
【0142】
インフォームドコンセント手順の一環として、被験体は、筋芽細胞を受ける後であるが、OHTの前に、この被験体が死亡した場合、検視に同意または許容するとみなされることを要求される。心臓の組織学的分析の詳細については、以下を参照のこと。
【0143】
筋肉生検は、LVAD手術の候補者がインフォームドコンセントを受け、包含/排他基準を満たした後に、採取される。滅菌条件下で採取された筋肉生検(1.0〜5.0gまで)は、細胞処理施設に運ばれ、ここで筋芽細胞が単離され、そして、培地中で増殖される。この設備は、これらの細胞に注射の準備ができる2〜3日前に、研究者に告知する。この研究者および設備は、自系筋芽細胞の収集のスケジュールを調整し、そしてこれらの細胞は、処置のために病院に運ばれる。LVAD手術が延期され、所望の筋芽細胞用量が達成されている場合、細胞は、将来の移植のために凍結されそして貯蔵され得る。この細胞が必要になった時点で、これらは解凍され、そして臨床施設に運ばれる。
【0144】
被験体が死亡するか、LVAD移植および細胞処置の前にOHTを受けるか、細胞が移植の準備ができる前にLVADを必要とするか、またはLVAD手術を受けない場合、これらの細胞は、基本的な細胞移植研究目的のために使用され得る。
【0145】
被験体は、骨格筋由来の自系筋芽細胞を移植される。筋芽細胞生成は、4工程のプロセスを包含し、このプロセスは、被験体の筋肉組織(生検)の採取、未分化前駆体細胞を解放するための生検の受領および処理、この未分化細胞由来の筋芽細胞の増殖、および移植のための最終産物の生成を包含する。この生成プロセスは、FDA Good Manufacturing Practice規則(21CFR Part 210)の下で実施され、そして全ての適用可能なFDAガイドラインは、細胞/組織ベースの治療製品に関する。
【0146】
LVADの可能な候補者である被験体がこの研究に加えられる場合、自系筋芽細胞が増殖され、そしてLVAD手術時における輸液のために病院に運ばれる。この被験体歯、試験の包含/排他基準に基づいて同定される。筋芽細胞の単離は、上記のように実施される。
【0147】
この手順の日において、筋芽細胞移植の前に、慣用試験のために血液が採取される(15ml)。被験体の看護全ては、研究者および副研究者の管理下にある。移植は、病院で行われる。被験体は、LVADのために準備され、そしてこの手順が実施される。
【0148】
細胞は、8×107細胞/mlの濃度である。100〜500μlまでの注入が、左心室の梗塞領域および梗塞周辺領域において30個までの部位に実施される。最大300×106個の細胞が注入される。針は、注入経路に沿った細胞の移動を最小限にするために、各注射の少なくとも30秒後までその場に維持される。この手順の後、被験体は、手術室から、24時間の観察が終わるまで、集中治療室に移される。
【0149】
試験被験体は、一旦、自己由来の筋芽細胞を受けると、移植処置後段階に入る。最初の往診を、移植の1日後に行う。引き続く評価往診を、移植後2日目〜6日目、1週間目、9日目および11日目、2週間目、3週間目、および4週間目、2ヶ月目、3ヶ月目、4ヶ月目、5ヶ月目、6ヶ月目、9ヶ月目、12ヶ月目、18ヶ月目、および24ヶ月目に行う。3週間目および4週間目の往診を、実際の時点の±3日以内に行う。毎月の往診(2ヶ月目、3ヶ月目、4ヶ月目、5ヶ月目、6ヶ月目、9ヶ月目、12ヶ月目、18ヶ月目、および24ヶ月目)を、実際の時点から±7日以内に行う。同所心臓移植(OHT)の時点に、処置段階が終了し、そして評価スケジュールが終結する。同所心臓移植が、24ヵ月後に行われる場合、被験体の首位の医療医師を介して、その患者を追跡するように配置がなされ、OHTまたは死亡の時点での試験のために、筋芽細胞で処置された心臓の回復を保障する。その部位での血液の慣用的な臨床試験に加えて、血液は、定期的な試験のために収集される。移植後24時間の間、被験体は、生命徴候および臨床状態の、標準的なICUモニタリングを受ける。筋芽細胞移植手順に関連する特定の潜在的な問題としては、以下が挙げられる:
1.不整脈
2.手術および細胞の注入の間の細動
3.心臓における注入(移植)部位からの出血
4.感染。
【0150】
以下の評価が、処置段階の間に完了される:
1日目:
・身体検査
・ECG
・慣用的な血液試験
・尿検査
・有害事象
・共同投薬
2〜6日目:
・ECG
・有害事象
・共同投薬
1週間目:
・身体検査
・ECG
・24時間のホルターモニタリング
・慣用的な血液試験
・漏出分泌血液試験
・尿検査
・有害事象
・共同投薬
9〜11日目:
・ECG
・有害事象
・共同投薬
2週間目および3週間目:
・身体検査
・ECG
・有害事象
・共同投薬
4週間目:
・身体検査
・ECG
・心エコー検査法
・24時間のホルターモニタリング
・慣用的な血液試験
・漏出分泌血液試験
・尿検査
・有害事象
・共同投薬
2ヶ月目、4ヶ月目、5ヶ月目および9ヶ月目:
・身体検査
・ECG
・慣用的な血液試験
・有害事象
・共同投薬
3ヶ月目:
・身体検査
・ECG
・慣用的な血液試験
・漏出分泌血液試験
・尿検査
・有害事象
・共同投薬
6ヶ月目:
・身体検査
・ECG
・心エコー検査法
・24時間のホルターモニタリング
・慣用的な血液試験
・漏出分泌血液試験
・尿検査
・有害事象
・共同投薬
18ヶ月目:
・身体検査
・ECG
・慣用的な血液試験
・尿検査
・有害事象
・共同投薬
12ヶ月目および24ヶ月目:
・身体検査
・ECG
・心エコー検査法
・24時間のホルターモニタリング
・慣用的な血液試験
・尿検査
・有害事象
・共同投薬。
【0151】
要約すると、試験被験体が受ける、それらの状態を有する被験体に対する標準的な臨床医療を超えた手順は、以下である:1)自己由来の筋芽細胞の移植;2)ホルターモニタリング、および3)頻繁な採血。
【0152】
安全性評価。有害事象とは、その事象が調査結果に関連するとみなされるか否かにかかわらず、試験被験体によって経験される、任意の所望でない物理的効果、心理的効果、または行動効果である。さらに、有害事象は、調査結果の使用に一時的に関連する、任意の好ましくない意図されない徴候(すなわち、異常な実験室知見、症状または疾患)である。患者のベースライン状態または病歴に関連する症状は、有害事象として報告されない。しかし、試験の間に増悪する事前の状態は、有害事象とみなされる。有害事象は、身体系によって、FDA指針文書「Conducting a Clinical Safety Review of a New Product Application and Preparing a Report on the Review,1996年11月」によって提唱されるように、分類される。
【0153】
重篤な有害事象(SAE)は、以下の結果の1つを生じるものである:(1)死亡;(2)生命の切迫(調査者の観点から、被験体を、反応が起こってから即時の死の危険がある状態にする、任意の有害な経験(すなわち、より重篤な形態で起こる場合に死を引き起こし得る反応を含まない));(3)入院患者の入院または既存の入院の延長;(4)入院を必要とするかまたは入院を延長する、持続性または有意な障害/無能;(5)被験体を危険に曝し得、そして他の結果の1つを予防するために医療もしくは外科的介在を必要とし得る、重要な医学的事象;および(6)先天異常/出生時欠損。
【0154】
臨床評価。移植後の臨床評価の重要な局面は、有害事象、身体検査、ECG、心エコー検査法、24時間のホルターモニタリング、MRIおよび心臓の組織学的評価(被験体がOHTを受けた後または死亡した後)を、綿密にモニタリングして、移植を評価することである。これらの評価は、規定された、予定された往診の間に実施される。
【0155】
調査者は、ベースライン、1日目、1週間目、2週間目、3週間目、4週間目、ならびに2ヶ月目、3ヶ月目、4ヶ月目、5ヶ月目、6ヶ月目、9ヶ月目、12ヶ月目、18ヶ月目、および24ヶ月目に、身体検査を実施する。身体検査は、血圧、心拍数、呼吸数、体温、身長、体重、および主要な身体系の詳細に記録された評価を獲得することを含む。
【0156】
心電図を使用して、心臓の電気的活性を評価する。ECGを、ベースライン、1日目、2〜6日目、1週間目、9日目および11日目、4週間目、ならびに2ヶ月目、3ヶ月目、4ヶ月目、5ヶ月目、6ヶ月目、9ヶ月目、12ヶ月目、18ヶ月目、および24ヶ月目において実施する。
【0157】
心電図を使用して、心臓の性能(例えば、心室の収縮期および拡張期の機能)を評価する。心電図をまた使用して、壁厚を評価する。これは、ベースライン、4週間目、ならびに6ヶ月目、12ヶ月目および24ヶ月目になされる。
【0158】
24時間のホルターモニタリングを、不整脈をモニタリングするために実施する。被験体は、これを、1週間目、4週間目、ならびに6ヶ月目、12ヶ月目、および24ヶ月目に行われる。
【0159】
慣用的な血液サンプル(15ml)を、血液学(区別を含む完全な血球算定を含むが、これに限定されない)および血液化学(Na、K、Cl、CO2、Glu、BUN、Creatが挙げられるが、これらに限定されない)(心臓酵素のレベルを含む)について、安全性評価として、ベースライン往診、移植の日、1日目、1週間目、4週間目、ならびに2ヶ月目、3ヶ月目、4ヶ月目、5ヶ月目、6ヶ月目、9ヶ月目、12ヶ月目、18ヶ月目および24ヶ月目に試験する。
【0160】
血液サンプル(5ml)を、ベースライン、1週間目、4週間目、ならびに3ヶ月目および6ヶ月目の往診での試験のために、引き抜く。サンプルを、被験体の筋芽細胞に対する抗体について試験する。抗体試験からの結果は、被検体の臨床治療に影響を与えず、自己由来の筋芽細胞移植に関するさらなる情報を、研究者に提供する。
【0161】
慣用的な尿検査を、安全性評価として、ベースライン、1日目、1週間目、4週間目、ならびに3ヶ月目、6ヶ月目、12ヶ月目、18ヶ月目、および24ヶ月目に実施する。
【0162】
筋芽細胞移植を受けた被験体がOHTを受けるかまたは死亡した後に、筋芽細胞を移植された心臓を固定し、そして組織学のために断片化する。移植物を含む領域をH&Eおよびトリクロームで染色し、筋芽細胞移植片の位置を決定する。移植片の同一性は、筋芽細胞抗体および抗体My32を使用して、免疫組織化学によって確認される。移植片の大きさ、細胞数、形態、および免疫系の細胞による浸潤の程度が、記録される。
【0163】
データ分析。安全性を、血液試験および身体検査を用いて評価する。許容性を、有害事象が報告された被験体によって評価する。この調査の目的は、虚血性または瘢痕性の心筋層を有する被験体の心臓への、自己由来の筋芽細胞の移植の安全性を決定することである。
【0164】
危険および利益の分析。LVAD手術を受ける心不全患者のほとんどが、OHTを受けるまで進行するが、かなりの百分率が、移植まで生存しない。この試行に参加する被験体に対する直接的な利益はないかもしれないが、この処置は、心不全に関連する徴候、症状、または他の合併症を減少させ得ることが期待される。この手順は、心臓を安定化させ得、そして心室の再造形の進行を遅くし得、そして被験体が移植に対して生存する機会を増加させ得る。
【0165】
この研究における危険因子としては、自己由来の筋芽細胞に対する可能な有害反応が挙げられる。移植された筋芽細胞の使用は、比較的新しく、従って、特定の危険は、現時点で未知である。動物研究は、筋肉細胞の首尾よい移植が、免疫抑制なしで達成され得ることを示した。
【0166】
自己由来の筋芽細胞の移植に関連する、未知の危険が存在し得る。
【0167】
全ての参加調査者は、新たな危険が同定されるにつれて、新たな危険が存在するか否かを通知される。
【0168】
現時点で、ヒト心臓において筋目細胞がどれだけ長く生存するかは公知ではない。動物研究は、心臓に適切に組み込まれた移植片が、実験を実験する期間(3ヶ月)と同じくらい長期間生存することを示す。
【0169】
(実施例5:梗塞したヒト心筋層に移植された自己由来筋芽細胞の生存)
この実施例は、自己由来の骨格筋芽細胞が、ヒト被験体において単離され、処理され、そして組織培養物中で増殖され、次いで、その患者の心臓に、側部開口を有するWhitacreペンシルポイント針を使用して、送達される(一方で、この患者は、心臓移植を待つ間、左心室補助デバイス(LVAD)の移植を受けた)研究を記載する。臨床第I期研究は、Institutional Review Board for Human Studies(LGH−Bryant Heart Ctr.)によって認可され、そして認可されたINDのもとでの連邦政府の指針およびインフォームドコンセントプロセスに従って、実施した。患者は、手術の5日後に死亡し、そしてこの患者の心臓を回収し、そして分析した。
【0170】
研究の被験体およびプロトコル:患者を、心臓移植について評価および認可し、そして研究の補充および筋肉生検を行った。筋肉生検を、正方形の筋肉から、滅菌条件下で、局所麻酔薬を使用して、採取した。この筋肉標本を、すぐに輸送媒体に入れ、そしてGMP単離設備に送った。
【0171】
この患者を評価し、そして心臓移植への橋渡しとして、HeartMate(登録商標)LVAD(Thoratec,Inc.)移植を行った。LVAD移植の時点で、自己由来の骨格筋芽細胞の複数の注射を、左心室の前壁に、側部開口を有する、3.0インチ長の26ゲージのWhitacreペンシルポイント針を使用して行った。注射位置を、手術前の心エコー検査法、および開胸手術の間の直接の可視化に基づいて、選択した。15回の100μLの注射を、一定の遅い送達流量で送達した。さらなる15回の100μlの注射を、約1cm離して、1インチの長さの26ゲージの針で送達した。この針を、各注射後、少なくとも30秒間適所に維持し、注射軌道に沿った細胞の移動を最小にした。注射の全てを、手術用クリップで境界を定めた約3×3cm2の指定領域に行った。LVAD移植手順を、通常の様式で完了した。患者は、手術の5日後に死亡し、そしてこの患者の心臓を、分析のために回収した。
【0172】
自己由来の骨格筋芽細胞の調製:生検において得られた最初の10グラムの骨格筋から結合組織を除去し、切り刻んで消化媒体中でスラリーにし、次いで1×トリプシン/EDTA(0.5mg/mLトリプシン、0.53mM EDTA:GibcoBRL)および定性されたコラゲナーゼ−肝細胞(0.5mg/mL;GibcoBRL)を用いて、37℃で、数サイクルの酵素消化に供し、未分化細胞を放出した。骨格筋芽細胞培養物を、改変されたHamの方法(Ham,R.G.ら、Adv.Exp.Med.Biol.(1990),280:193−9を参照のこと、この教示の全体が、本明細書中に参考として援用される)に従って増殖させた。未分化細胞をプレート化し、そして15〜25%のウシ胎仔血清(Hyclone)、組換えヒト上皮増殖因子(rhEGF:10ng/mL)、およびデキサメタゾン(3μg/μL)を含有する筋芽細胞規定増殖培地(SkBM;Clonetics)中で増殖させた。細胞を、3億個の細胞の最終収量を達するまで、11〜13回の倍化で増殖させた。培養プロセスの間の筋管形成の任意の可能性を回避するために、細胞密度を、プロセスの間中、培養表面の75%未満が細胞によって占められるように維持した。
【0173】
移植の前に、過剰の300億個の細胞を洗浄し、そして移植培地中に、1ccあたり約1億個の細胞で懸濁させ、そして5つの1ccツベルクリン注射器に充填した。これらの細胞を、輸送の間、4℃に維持した。滅菌性試験を、最終製品に対して、ならびに消化および増殖の手順の間、実施した。
【0174】
組織学的分析および免疫組織化学的技術:切除した心筋層をホルマリン中で固定し、小さいブロックに切断し、そしてパラフィンに包埋した。6ミクロンの厚さの切片を切り取り、設置し、そしてトリクロームで染色した。
【0175】
(結果)
約300×106個の細胞を、複数の注射を使用して、患者の左心室壁に移植した。注射の5日後、患者は死亡し、そしてこの患者の心臓を回収し、固定し、そして切片にした。生存している自己由来の骨格筋細胞を、心臓の重度に瘢痕化した組織において、トリクローム染色によって同定した(図4Aおよび4B)。筋線維構造体を、移植領域において、赤色トリクローム染色(斑の線維芽細胞およびコラーゲンに関連する青色染色とは対照的に、心臓および骨格筋に特徴的)によって同定した(図4Aおよび4B)。図4Aにおける矢印は、複数の細胞が、複数の注射から沈着することを示す。図4Aから見られ得るように、細胞沈着物は、注射部位を中心に近付いたままである。より高い倍率において(図4B)、注射された細胞が初期に融合して筋管を形成することが見られ得る(矢印を参照のこと)。
【0176】
(他の実施形態)
上記は、本発明の特定の非限定的な好ましい実施形態の説明である。当業者は、この説明に対する種々の変化および改変が、添付の特許請求の範囲に規定されるような本発明の精神および範囲から逸脱することなくなされ得ることを理解する。
【特許請求の範囲】
【請求項1】
側孔を備える針を用いて器官に注射するための少なくとも1つの単離された細胞を包含する、治療複合物。
【請求項2】
注射部位を封鎖する薬剤をさらに包含する、請求項1に記載の治療複合物。
【請求項3】
注射部位を封鎖する前記薬剤が、シアノアクリレート組織接着剤またはフィブリン封止剤である、請求項2に記載の治療複合物。
【請求項4】
注射部位を封鎖する前記薬剤が、フィルムである、請求項2に記載の治療複合物。
【請求項5】
前記フィルムがセプラフィルムである、請求項4に記載の治療複合物。
【請求項6】
前記細胞が、注射部位での細胞の保持を補助するキャリアとともに提供される、請求項1に記載の治療複合物。
【請求項7】
前記キャリアが、細胞外マトリックスタンパク質、エラスチン、コラーゲン、ゼラチン、フィブリン、メチルセルロース、アガロース、ヒアルロン酸およびアルギン酸塩からなる群から選択される、請求項6に記載の治療複合物。
【請求項8】
前記細胞が筋細胞である、請求項1に記載の治療複合物。
【請求項9】
前記細胞が筋芽細胞である、請求項1に記載の治療複合物。
【請求項10】
前記細胞が骨格筋細胞である、請求項1に記載の治療複合物。
【請求項11】
前記細胞が骨格筋芽細胞である、請求項1に記載の治療複合物。
【請求項12】
前記細胞が心筋細胞である、請求項1に記載の治療複合物。
【請求項13】
前記細胞が幹細胞である、請求項1に記載の治療複合物。
【請求項14】
前記細胞が幹細胞に由来する、請求項1に記載の治療複合物。
【請求項15】
前記細胞が神経細胞である、請求項1に記載の治療複合物。
【請求項16】
前記細胞がランゲルハンス島細胞である、請求項1に記載の治療複合物。
【請求項17】
前記細胞が肝細胞である、請求項1に記載の治療複合物。
【請求項18】
前記細胞が腎細胞である、請求項1に記載の治療複合物。
【請求項19】
前記細胞が膵細胞である、請求項1に記載の治療複合物。
【請求項20】
前記細胞が、レシピエントにおける移植の際に、Tリンパ球媒介応答を誘導し得る細胞表面抗原を遮蔽するために改変されている、請求項1に記載の治療複合物。
【請求項21】
前記細胞表面抗原がMHC分子である、請求項20に記載の治療複合物。
【請求項22】
前記MHC分子がMHCクラスI分子である、請求項21に記載の治療複合物。
【請求項23】
前記細胞表面抗原が抗体または抗体のフラグメントで遮蔽される、請求項20に記載の治療複合物。
【請求項24】
前記細胞表面抗原が抗体のF(ab’)2フラグメントで遮蔽される、請求項20に記載の治療複合物。
【請求項25】
前記細胞表面抗原が可溶性T細胞レセプタータンパク質フラグメントで遮蔽される、請求項20に記載の治療複合物。
【請求項26】
前記器官が心臓である、請求項1に記載の治療複合物。
【請求項27】
前記細胞が心臓の心筋に注射される、請求項1に記載の治療複合物。
【請求項28】
前記器官が固形器官である、請求項1に記載の治療複合物。
【請求項29】
前記器官が、脳、肝臓、心臓、膵臓、脾臓、腎臓、甲状腺、前立腺および骨格筋からなる群から選択される、請求項1に記載の治療複合物。
【請求項30】
前記針が1より多い側部放出孔を有する、請求項1に記載の治療複合物。
【請求項31】
前記針が閉鎖された末端を有する、請求項1に記載の治療複合物。
【請求項32】
前記針がWhitacre針である、請求項1に記載の治療複合物。
【請求項33】
前記針が25ゲージWhitacre針である、請求項1に記載の治療複合物。
【請求項34】
前記針が3/4インチ、25ゲージWhitacre針である、請求項1に記載の治療複合物。
【請求項35】
前記針が25ゲージ針である、請求項1に記載の治療複合物。
【請求項36】
前記針が20と25との間のゲージである、請求項1に記載の治療複合物。
【請求項37】
前記注射が経皮的ではないように、手術の間に実施される、請求項1に記載の治療複合物。
【請求項38】
心臓組織への損傷により特徴付けられる状態を治療するための骨格筋細胞を含む、心臓組織治療複合物であって、
損傷を受けた心臓組織に前記細胞を注射することによって前記骨格筋細胞が投与される、心臓組織治療複合物。
【請求項39】
当該複合物が、線維芽細胞をさらに包含する、請求項38に記載の心臓組織治療複合物。
【請求項40】
固形組織にある病状によって特徴付けられる病状を治療するための薬物、低分子、タンパク質、ペプチド、ポリヌクレオチド及びウイルスからなる群から選択された、複合物であって、
側孔を備える針を用いて前記固形組織に薬剤が投与される、複合物。
【請求項41】
前記薬剤が薬物である、請求項40に記載の複合物。
【請求項42】
前記薬剤が低分子である、請求項40に記載の複合物。
【請求項43】
前記薬剤がタンパク質である、請求項40に記載の複合物。
【請求項44】
前記薬剤がペプチドである、請求項40に記載の複合物。
【請求項45】
前記薬剤がポリヌクレオチドである、請求項40に記載の複合物。
【請求項46】
前記薬剤がウイルスである、請求項40に記載の複合物。
【請求項47】
前記ウイルスのゲノムが改変されている、請求項46に記載の複合物。
【請求項48】
前記固形組織にあることによって特徴付けられる前記病状が、新生物の増殖物である、請求項40に記載の複合物。
【請求項49】
前記固形組織にあることによって特徴付けられる前記病状が、悪性腫瘍である、請求項40に記載の複合物。
【請求項50】
前記固形組織にあることによって特徴付けられる前記病状が、良性腫瘍である、請求項40に記載の複合物。
【請求項51】
器官内で少なくとも1インチの深さで側孔を備える針を用いて、かつ、除去の前に少なくとも30秒間注射部位に前記針を残存させることを可能とすることによって、前記器官に注射するための少なくとも1つの単離された細胞を包含する、治療複合物。
【請求項52】
当該治療複合物が、注射部位での細胞の保持を補助するキャリアをさらに包含する、請求項51に記載の治療複合物。
【請求項53】
前記キャリアが、細胞外マトリックスタンパク質、エラスチン、コラーゲン、ゼラチン、フィブリン、メチルセルロース、アガロース、アルギン酸塩およびヒアルロン酸からなる群から選択される、請求項52に記載の治療複合物。
【請求項54】
前記注射部位を封鎖するための組織接着剤または組織フィルムをさらに包含する、請求項51に記載の治療複合物。
【請求項55】
心臓組織への損傷により特徴付けられる状態を治療するための少なくとも1億個の骨格筋芽細胞を含む、心臓組織治療複合物であって、
損傷した前記心臓組織に前記細胞を送達することによって、前記骨格筋芽細胞が投与される、心臓組織治療複合物。
【請求項56】
当該組成物が、側孔を備えた針を介した注射によって前記心臓に送達される、請求項55に記載の心臓組織治療複合物。
【請求項57】
当該組成物が、複数注射によって前記心臓の複数位置に送達されることを特徴とする請求項55に記載の心臓組織治療複合物。
【請求項58】
当該組成物が、注射部位での細胞の保持を補助するキャリアを更に含んでなることを特徴とする請求項56に記載の心臓組織治療複合物。
【請求項59】
前記キャリアが、細胞外マトリックスタンパク質、エラスチン、コラーゲン、ゼラチン、フィブリン、メチルセルロース、アガロース、ヒアルロン酸、アルギン酸塩、及び、これらの組合せからなる群から選択されることを特徴とする請求項58に記載の心臓組織治療複合物。
【請求項60】
前記針が約25〜約26のゲージを備え、約5/8インチ(1.58cm)から約3.5インチ(8.89cm)の範囲の長さであることを特徴とする請求項56に記載の心臓組織治療複合物。
【請求項61】
前記針がWhitacre針であることを特徴とする請求項60に記載の心臓組織治療複合物。
【請求項62】
当該組成物が繊維芽細胞を更に含んでなることを特徴とする請求項55に記載の心臓組織治療複合物。
【請求項63】
前記損傷した心臓組織が心筋梗塞に起因していることを特徴とする請求項55に記載の心臓組織治療複合物。
【請求項64】
前記損傷した心臓組織が哺乳類にあることを特徴とする請求項55に記載の心臓組織治療複合物。
【請求項65】
うっ血性心不全によって特徴付けられる状態を治療するための少なくとも1億個の骨格筋芽細胞を含む、心臓組織治療複合物であって、
損傷した心臓組織に前記細胞を送達することによって前記骨格筋芽細胞が投与されることを特徴とする心臓組織治療複合物。
【請求項66】
当該組成物が、側孔を備えた針を介した注射によって前記心臓に送達されることを特徴とする請求項65に記載の心臓組織治療複合物。
【請求項67】
当該組成物が、複数注射によって前記心臓の複数位置に送達されることを特徴とする請求項66に記載の心臓組織治療複合物。
【請求項68】
当該組成物が、注射部位での細胞の保持を補助するキャリアを更に含んでなることを特徴とする請求項66に記載の心臓組織治療複合物。
【請求項69】
前記キャリアが、細胞外マトリックスタンパク質、エラスチン、コラーゲン、ゼラチン、フィブリン、メチルセルロース、アガロース、ヒアルロン酸、アルギン酸塩、及び、これらの組合せからなる群から選択されることを特徴とする請求項68に記載の心臓組織治療複合物。
【請求項70】
前記針が約25〜約26のゲージを備え、約5/8インチ(1.58cm)から約3.5インチ(8.89cm)の範囲の長さであることを特徴とする請求項66に記載の心臓組織治療複合物。
【請求項71】
前記針がWhitacre針であることを特徴とする請求項70に記載の心臓組織治療複合物。
【請求項72】
当該組成物が繊維芽細胞を更に含んでなることを特徴とする請求項65に記載の心臓組織治療複合物。
【請求項73】
うっ血性心不全が哺乳類にあることを特徴とする請求項65に記載の心臓組織治療複合物。
【請求項1】
側孔を備える針を用いて器官に注射するための少なくとも1つの単離された細胞を包含する、治療複合物。
【請求項2】
注射部位を封鎖する薬剤をさらに包含する、請求項1に記載の治療複合物。
【請求項3】
注射部位を封鎖する前記薬剤が、シアノアクリレート組織接着剤またはフィブリン封止剤である、請求項2に記載の治療複合物。
【請求項4】
注射部位を封鎖する前記薬剤が、フィルムである、請求項2に記載の治療複合物。
【請求項5】
前記フィルムがセプラフィルムである、請求項4に記載の治療複合物。
【請求項6】
前記細胞が、注射部位での細胞の保持を補助するキャリアとともに提供される、請求項1に記載の治療複合物。
【請求項7】
前記キャリアが、細胞外マトリックスタンパク質、エラスチン、コラーゲン、ゼラチン、フィブリン、メチルセルロース、アガロース、ヒアルロン酸およびアルギン酸塩からなる群から選択される、請求項6に記載の治療複合物。
【請求項8】
前記細胞が筋細胞である、請求項1に記載の治療複合物。
【請求項9】
前記細胞が筋芽細胞である、請求項1に記載の治療複合物。
【請求項10】
前記細胞が骨格筋細胞である、請求項1に記載の治療複合物。
【請求項11】
前記細胞が骨格筋芽細胞である、請求項1に記載の治療複合物。
【請求項12】
前記細胞が心筋細胞である、請求項1に記載の治療複合物。
【請求項13】
前記細胞が幹細胞である、請求項1に記載の治療複合物。
【請求項14】
前記細胞が幹細胞に由来する、請求項1に記載の治療複合物。
【請求項15】
前記細胞が神経細胞である、請求項1に記載の治療複合物。
【請求項16】
前記細胞がランゲルハンス島細胞である、請求項1に記載の治療複合物。
【請求項17】
前記細胞が肝細胞である、請求項1に記載の治療複合物。
【請求項18】
前記細胞が腎細胞である、請求項1に記載の治療複合物。
【請求項19】
前記細胞が膵細胞である、請求項1に記載の治療複合物。
【請求項20】
前記細胞が、レシピエントにおける移植の際に、Tリンパ球媒介応答を誘導し得る細胞表面抗原を遮蔽するために改変されている、請求項1に記載の治療複合物。
【請求項21】
前記細胞表面抗原がMHC分子である、請求項20に記載の治療複合物。
【請求項22】
前記MHC分子がMHCクラスI分子である、請求項21に記載の治療複合物。
【請求項23】
前記細胞表面抗原が抗体または抗体のフラグメントで遮蔽される、請求項20に記載の治療複合物。
【請求項24】
前記細胞表面抗原が抗体のF(ab’)2フラグメントで遮蔽される、請求項20に記載の治療複合物。
【請求項25】
前記細胞表面抗原が可溶性T細胞レセプタータンパク質フラグメントで遮蔽される、請求項20に記載の治療複合物。
【請求項26】
前記器官が心臓である、請求項1に記載の治療複合物。
【請求項27】
前記細胞が心臓の心筋に注射される、請求項1に記載の治療複合物。
【請求項28】
前記器官が固形器官である、請求項1に記載の治療複合物。
【請求項29】
前記器官が、脳、肝臓、心臓、膵臓、脾臓、腎臓、甲状腺、前立腺および骨格筋からなる群から選択される、請求項1に記載の治療複合物。
【請求項30】
前記針が1より多い側部放出孔を有する、請求項1に記載の治療複合物。
【請求項31】
前記針が閉鎖された末端を有する、請求項1に記載の治療複合物。
【請求項32】
前記針がWhitacre針である、請求項1に記載の治療複合物。
【請求項33】
前記針が25ゲージWhitacre針である、請求項1に記載の治療複合物。
【請求項34】
前記針が3/4インチ、25ゲージWhitacre針である、請求項1に記載の治療複合物。
【請求項35】
前記針が25ゲージ針である、請求項1に記載の治療複合物。
【請求項36】
前記針が20と25との間のゲージである、請求項1に記載の治療複合物。
【請求項37】
前記注射が経皮的ではないように、手術の間に実施される、請求項1に記載の治療複合物。
【請求項38】
心臓組織への損傷により特徴付けられる状態を治療するための骨格筋細胞を含む、心臓組織治療複合物であって、
損傷を受けた心臓組織に前記細胞を注射することによって前記骨格筋細胞が投与される、心臓組織治療複合物。
【請求項39】
当該複合物が、線維芽細胞をさらに包含する、請求項38に記載の心臓組織治療複合物。
【請求項40】
固形組織にある病状によって特徴付けられる病状を治療するための薬物、低分子、タンパク質、ペプチド、ポリヌクレオチド及びウイルスからなる群から選択された、複合物であって、
側孔を備える針を用いて前記固形組織に薬剤が投与される、複合物。
【請求項41】
前記薬剤が薬物である、請求項40に記載の複合物。
【請求項42】
前記薬剤が低分子である、請求項40に記載の複合物。
【請求項43】
前記薬剤がタンパク質である、請求項40に記載の複合物。
【請求項44】
前記薬剤がペプチドである、請求項40に記載の複合物。
【請求項45】
前記薬剤がポリヌクレオチドである、請求項40に記載の複合物。
【請求項46】
前記薬剤がウイルスである、請求項40に記載の複合物。
【請求項47】
前記ウイルスのゲノムが改変されている、請求項46に記載の複合物。
【請求項48】
前記固形組織にあることによって特徴付けられる前記病状が、新生物の増殖物である、請求項40に記載の複合物。
【請求項49】
前記固形組織にあることによって特徴付けられる前記病状が、悪性腫瘍である、請求項40に記載の複合物。
【請求項50】
前記固形組織にあることによって特徴付けられる前記病状が、良性腫瘍である、請求項40に記載の複合物。
【請求項51】
器官内で少なくとも1インチの深さで側孔を備える針を用いて、かつ、除去の前に少なくとも30秒間注射部位に前記針を残存させることを可能とすることによって、前記器官に注射するための少なくとも1つの単離された細胞を包含する、治療複合物。
【請求項52】
当該治療複合物が、注射部位での細胞の保持を補助するキャリアをさらに包含する、請求項51に記載の治療複合物。
【請求項53】
前記キャリアが、細胞外マトリックスタンパク質、エラスチン、コラーゲン、ゼラチン、フィブリン、メチルセルロース、アガロース、アルギン酸塩およびヒアルロン酸からなる群から選択される、請求項52に記載の治療複合物。
【請求項54】
前記注射部位を封鎖するための組織接着剤または組織フィルムをさらに包含する、請求項51に記載の治療複合物。
【請求項55】
心臓組織への損傷により特徴付けられる状態を治療するための少なくとも1億個の骨格筋芽細胞を含む、心臓組織治療複合物であって、
損傷した前記心臓組織に前記細胞を送達することによって、前記骨格筋芽細胞が投与される、心臓組織治療複合物。
【請求項56】
当該組成物が、側孔を備えた針を介した注射によって前記心臓に送達される、請求項55に記載の心臓組織治療複合物。
【請求項57】
当該組成物が、複数注射によって前記心臓の複数位置に送達されることを特徴とする請求項55に記載の心臓組織治療複合物。
【請求項58】
当該組成物が、注射部位での細胞の保持を補助するキャリアを更に含んでなることを特徴とする請求項56に記載の心臓組織治療複合物。
【請求項59】
前記キャリアが、細胞外マトリックスタンパク質、エラスチン、コラーゲン、ゼラチン、フィブリン、メチルセルロース、アガロース、ヒアルロン酸、アルギン酸塩、及び、これらの組合せからなる群から選択されることを特徴とする請求項58に記載の心臓組織治療複合物。
【請求項60】
前記針が約25〜約26のゲージを備え、約5/8インチ(1.58cm)から約3.5インチ(8.89cm)の範囲の長さであることを特徴とする請求項56に記載の心臓組織治療複合物。
【請求項61】
前記針がWhitacre針であることを特徴とする請求項60に記載の心臓組織治療複合物。
【請求項62】
当該組成物が繊維芽細胞を更に含んでなることを特徴とする請求項55に記載の心臓組織治療複合物。
【請求項63】
前記損傷した心臓組織が心筋梗塞に起因していることを特徴とする請求項55に記載の心臓組織治療複合物。
【請求項64】
前記損傷した心臓組織が哺乳類にあることを特徴とする請求項55に記載の心臓組織治療複合物。
【請求項65】
うっ血性心不全によって特徴付けられる状態を治療するための少なくとも1億個の骨格筋芽細胞を含む、心臓組織治療複合物であって、
損傷した心臓組織に前記細胞を送達することによって前記骨格筋芽細胞が投与されることを特徴とする心臓組織治療複合物。
【請求項66】
当該組成物が、側孔を備えた針を介した注射によって前記心臓に送達されることを特徴とする請求項65に記載の心臓組織治療複合物。
【請求項67】
当該組成物が、複数注射によって前記心臓の複数位置に送達されることを特徴とする請求項66に記載の心臓組織治療複合物。
【請求項68】
当該組成物が、注射部位での細胞の保持を補助するキャリアを更に含んでなることを特徴とする請求項66に記載の心臓組織治療複合物。
【請求項69】
前記キャリアが、細胞外マトリックスタンパク質、エラスチン、コラーゲン、ゼラチン、フィブリン、メチルセルロース、アガロース、ヒアルロン酸、アルギン酸塩、及び、これらの組合せからなる群から選択されることを特徴とする請求項68に記載の心臓組織治療複合物。
【請求項70】
前記針が約25〜約26のゲージを備え、約5/8インチ(1.58cm)から約3.5インチ(8.89cm)の範囲の長さであることを特徴とする請求項66に記載の心臓組織治療複合物。
【請求項71】
前記針がWhitacre針であることを特徴とする請求項70に記載の心臓組織治療複合物。
【請求項72】
当該組成物が繊維芽細胞を更に含んでなることを特徴とする請求項65に記載の心臓組織治療複合物。
【請求項73】
うっ血性心不全が哺乳類にあることを特徴とする請求項65に記載の心臓組織治療複合物。
【図1】


【図2】


【図3】


【図4A】


【図4B】




【図2】


【図3】


【図4A】


【図4B】


【公開番号】特開2010−285440(P2010−285440A)
【公開日】平成22年12月24日(2010.12.24)
【国際特許分類】
【出願番号】特願2010−165854(P2010−165854)
【出願日】平成22年7月23日(2010.7.23)
【分割の表示】特願2004−526481(P2004−526481)の分割
【原出願日】平成15年8月6日(2003.8.6)
【出願人】(506326213)マイトゲン・インコーポレーテッド (1)
【Fターム(参考)】
【公開日】平成22年12月24日(2010.12.24)
【国際特許分類】
【出願日】平成22年7月23日(2010.7.23)
【分割の表示】特願2004−526481(P2004−526481)の分割
【原出願日】平成15年8月6日(2003.8.6)
【出願人】(506326213)マイトゲン・インコーポレーテッド (1)
【Fターム(参考)】
[ Back to top ]

