法医学的DNAの定量化のための改善された方法
本明細書に記載されるものは、核酸定量化のための方法およびデバイスであり、特に、核酸定量化のためのマイクロ流体方法およびデバイスである。ある実施形態において、増幅の必要性なしで標的核酸を定量化する方法が提供される。いくつかの実施形態において、方法は、結合剤が標的核酸に対して固定されることを可能にすることを含む。あるケースでは、結合剤は、標的核酸の量を定量化するために用いることができるシグナリング部分を備える。別の態様において、定量化は、迅速に実行することができる。例えば、ある実施形態において、定量化は、5分以内に完結することができる。さらに別の態様において、低い量の標的核酸を含む試料は、定量化されることができる。例えば、あるケースでは、100ナノグラム/マイクロリットル未満を含む試料が定量化されてもよい。また、このような方法などを実行するためのデバイスおよびキットが記載される。
【発明の詳細な説明】
【技術分野】
【0001】
[政府からの助成金]
米国政府は、本発明における一括払いライセンスを有しており、米国司法省、司法プログラム局、国立司法研究所によって授与された(交付番号:NIJ 2008−DN−BX−K009)の条件により与えられるような適切な条件で他にライセンスを与えるために特許権者を必要とする限られた状況における権利を有している。
[関連出願]
【0002】
本出願は、セルデン(Selden)らによって「法医学的DNAの定量のための改善された方法(Improved Methods for Forensic DNA Quantitation)」と題されて2009年6月15日に出願された米国特許仮出願番号第61/268,770号(参考文献として本明細書に援用される)の権益を主張する。
【0003】
本明細書に記載されるものは、核酸定量化のための進歩性のある方法およびデバイスであり、特に、核酸定量化のためのマイクロ流体方法およびデバイスである。
【背景技術】
【0004】
核酸定量化は、幅広い種類の分析およびアプリケーションにおいて重要または望ましいステップである。例えば、核酸定量化は、人間(ヒト)の法鑑定における重要なステップである。例えば、DNAの短鎖縦列反復配列(STR)解析は、多くの場合、多重化PCR分析上に基づき、このような分析は、一般に、試料DNA濃度の厳密に規定された範囲内において最も確実である。分析において試料DNAが用いられなさ過ぎると、対立遺伝子のピーク高さのインバランスと対立遺伝子のドロップアウトとを含むアーティファクトが生じる場合がある。試料DNAがあまりに用いられ過ぎると、増大したスタッター(stutter)、非特異性のバンド生成、不完全な非鋳型添加、および不完全な色分解に起因するプルアップピークを含むアーティファクトが生じる場合がある。これらのアーティファクトは、STRプロファイルの解釈の問題に結びつく場合があるが、試料DNAの適正量を用いることにより緩和することができる。別の例において、法医学的ケースワーク試料は、試料におけるDNA全体の一因となる(但し、存在する場合)人類以外の哺乳類、バクテリア、または菌のDNAにより汚染されるポテンシャルを有する。したがって、犯罪現場試料の鑑定に対して、DNA諮問委員会は、全体のDNA定量化よりむしろ、ヒトの特定の定量化の利用をFBIに勧める。これは、バクテリア、菌、または他の人類以外のDNAが試料に存在するとしてもヒトのDNAの適正量が増幅されることを保証することができる。
【発明の概要】
【発明が解決しようとする課題】
【0005】
本明細書に記載されるものは、核酸定量化のための進歩性のある方法およびデバイスであり、特に、核酸定量化のためのマイクロ流体方法およびデバイスである。
【0006】
1つの態様において、標的核酸を含むまたは含むと推測される試料流体において標的核酸を定量化する方法が提供される。該方法は、マイクロ流体チャネルにおいて、試料流体とシグナリング部分を含む結合剤とを組み合わせるステップであって、結合剤は、試験液を形成するために標的核酸に対して固定化されるステップと、マイクロ流体チャネルにおける検出領域に試験液を配置するステップと、シグナリング部分を検出するステップと、試料流体と結合剤とを組み合わせてから1時間以内に試料流体における標的核酸を定量化するステップとを備える。
【0007】
別の態様において、標的核酸を含むまたは含むと推測される試料流体において標的核酸を定量化する方法が提供される。該方法は、マイクロ流体チャネルにおいて、試料流体とシグナリング部分を含む結合剤とを組み合わせるステップであって、結合剤は、試験液を形成するために標的核酸に対して固定化されるステップと、マイクロ流体チャネルにおける検出領域に試験液を配置するステップと、シグナリング部分を検出するステップと、試料流体における標的核酸を定量化するステップとを備え、標的核酸は、1ナノグラム/マイクロリットル未満の濃度を有している、または試料流体中に合計量で1ナノグラム未満含まれる。
【0008】
なお別の態様において、標的核酸を含むまたは含むと推測される法医学的試料流体において標的核酸を定量化する方法が提供される。該方法は、マイクロ流体チャネルにおいて法医学的試料流体とシグナリング部分を含む結合剤を含むプローブ流体とを組み合わせるステップであって、法医学的試料流体における標的核酸が増幅されていないステップと、マイクロ流体チャネルにおける検出領域に組み合わされた流体を配置するステップと、シグナリング部分を検出するステップと、試料流体における標的核酸を定量化するステップとを備える。
【0009】
さらに別の態様において、標的核酸を含むまたは含むと推測され、混入するヒト以外の核酸をさらに含む試料流体において標的核酸を定量化する方法が提供される。該方法は、マイクロ流体チャネルにおいて、試料流体とシグナリング部分を含む結合剤を含むプローブ流体とを組み合わせるステップであって、試料流体における標的核酸が増幅されていないステップと、マイクロ流体チャネルにおける検出領域に組み合わされた流体を配置するステップと、シグナリング部分を検出するステップと、試料流体における標的核酸を定量化するステップとを備える。
【0010】
なお別の態様において、標的核酸を含むまたは含むと推測される試料流体において標的核酸を定量化する方法が提供される。該方法は、統合化レーザーを備える検出器を備える電子装置に連結されたマイクロ流体デバイスを準備をするステップと、前記マイクロ流体デバイスのマイクロ流体チャネルにおいて前記試料流体とシグナリング部分を含む結合剤とを組み合わせるステップであって、結合剤は、標的核酸に対して固定化されるステップと、電子装置の検出器に作用する近接に配置されたマイクロ流体チャネルの検出領域に組み合わされる流体を配置するステップと、前記統合化レーザーを用いて、シグナリング部分を照射するステップと、試料流体における標的核酸を定量化するステップとを備える。
【0011】
さらに別の態様において、標的核酸を含む試料流体において標的核酸を操作する方法が提供される。該方法は、検出器を備える電子装置に連結された、試料操作のための複数のマイクロ流体チャネルおよびアクティブな領域を備えるマイクロ流体デバイスを準備をするステップと、マイクロ流体デバイスのマイクロ流体チャネルにおいて試料流体とシグナリング部分を含む結合剤とを組み合わせるステップであって、結合剤は、標的核酸に対して固定化されるステップと、電子装置の検出器に作用する近接に配置されたマイクロ流体チャネルの検出領域に組み合わされる流体を配置するステップと、試料流体における標的核酸を定量化するステップと、バイオチップのアクティブな領域に、試料流体の選択された量を方向づけるステップであって、前記選択された量は、前記定量化ステップの結果に基づいて、少なくとも部分的に究明されるステップとを備える。
【0012】
なお別の態様において、標的核酸の増幅のために標的核酸を備える試料を用意する方法が提供される。該方法は、試料操作のための少なくとも1つのマイクロ流体チャネルと、アクティブな領域とを備えるマイクロ流体デバイスを準備をするステップであって、少なくとも1つの領域は、試料から核酸を精製するように構成されたステップと、標的核酸の未知の可変量をもたらす収集方法によって試料を取得するステップと、マイクロ流体デバイスのマイクロ流体チャネルの中に試料を挿入するステップと、複製可能な量の精製された標的核酸を生成するために試料から核酸を精製するように構成されたマイクロ流体デバイスの領域で試料における標的核酸を精製するステップと、精製された標的核酸を定量化せずに、精製された標的核酸の複製可能な量を増幅するステップとを備える。
【0013】
さらに別の態様において、標的核酸を含むまたは含むと推測される法医学的試料流体において標的核酸を定量化する方法が提供される。該方法は、マイクロ流体チャネルにおいて、法医学的試料流体と、シグナリング部分を備えかつ標的核酸のための独特の混成特異性を有する分子ビーコンプローブを含むプローブ流体とを組み合わせるステップであって、法医学的試料流体における標的核酸が増幅されていないステップと、マイクロ流体チャネルにおける検出領域に組み合わされた流体を配置するステップと、シグナリング部分を検出するステップと、試料流体における標的核酸を定量化するステップとを備える。
【0014】
さらに別の態様において、バイオチップ内の複数の機能的な領域における蛍光団の励起および検出のための計器が提供される。該計器は、励起源と、励起源からバイオチップにおける複数の機能的な領域にビームを方向づける操縦エレメントであって、励起源は、複数の機能的な領域の少なくとも1つからの信号が核酸の定量化を可能にするように、検出される信号を生成する複数の機能的な領域における蛍光団を励起する操縦エレメントとを備える。
【0015】
添付の図とともに検討される場合、本発明の他の有利性および新規の特徴は、本発明の様々な非制限的実施形態である以下の詳細な説明から明らかになるだろう。特に明記されていなければ、本明細書に引用された参考文献は、すべて、参考文献として全体に援用される。参考文献として援用された本明細書および文献が、矛盾する開示および/または一貫しない開示を含む場合、本明細書を優先する。
【0016】
本発明の非制限的実施形態は、添付の図(それは概略で、縮尺比に従って拡大縮小するように描かれるようには意図されない)に関連して例として記載されるだろう。図において、図示された同一(または、ほぼ同一)のコンポーネントの各々は、典型的には、単一の符号によって表わされる。明瞭さの目的のため、図毎に各コンポーネントがラベル付けされるとは限らないし、当業者に本発明を理解させることが必要でない図に示される、本発明の各実施形態の各コンポーネントにもラベル付けされない。
【図面の簡単な説明】
【0017】
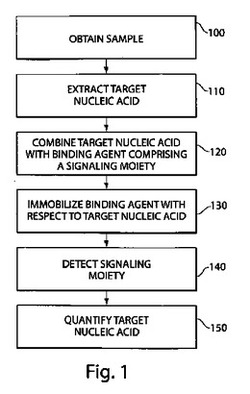
【図1】図1は、1つの実施形態による、標的核酸分析の様々なステップを表すフローチャートを示す。
【図2】図2は、1つの実施形態による、4つの個体試料の解析のための典型的な統合化バイオチップの図を示す。
【図3】図3は、1つの実施形態による、実施例10において記載されるような定量化モジュールの問い合わせチャンバ(Interrogation Chamber)を励起し問い合わせるように構成されたデバイスの光学機器列の概略図を示す。
【図4】図4は、1つの実施形態による、実施例10において記載されるような分離および検出モジュールの検出窓から励起し検出するように構成されたデバイスの光学機器列の概略図を示す。
【図5】図5は、1つの実施形態による、実施例10において記載されるような定量化モジュールの問い合わせチャンバを励起し問い合わせるように構成された別の光学機器列の概略図を示す。
【図6】図6は、1つの実施形態による、実施例10において記載されるような分離および検出モジュールの検出窓から励起し検出するように構成された別の光学機器列の概略図を示す。
【図7】図7は、1つの実施形態による、実施例10において記載されるような分離および検出モジュールの検出窓から励起し検出し、かつ定量化モジュールの問い合わせチャンバを問い合わせるように構成された別の光学機器列の概略図を示す。
【図8】図8は、1つの実施形態による、典型的な励起および検出システムの図を示す。
【図9】図9は、1つの実施形態による、別の典型的な励起および検出システムの図を示す。
【図10】図10は、1つの実施形態による、バイオチップの写真を示す。
【図11】図11は、1つの実施形態による、チップ圧縮エレメントおよび温度制御エレメント(100)、バイオチップ(101)、および温度センサ(102)を備える温度サイクラーの写真を示す。
【図12】図12は、1つの実施形態による、明瞭さのためにチップ圧縮エレメントが取り除かれた場合のTCE(1100)、バイオチップ(1101)、温度センサ(1102)、熱電冷却機(1103)、ヒートシンク(1104)、およびヒートシンク温度センサ(1105)を備える温度サイクラーの上から図の写真を示す。
【図13】図13は、1つの実施形態による、28サイクルのTH01 PCR−ピコグリーン(Picogreen)反応のための投入DNA(ナノグラム)対蛍光信号(RFU)を減じたベースラインのプロットを示す。
【図14】図14は、1つの実施形態による、(左から右へのピーク強度が0ナノグラム、0.4ナノグラム、1ナノグラム、4ナノグラム、10ナノグラム、20ナノグラム、および40ナノグラムの投入テンプレートDNAに対応する)TH01 PCRレーザー検出からの出力蛍光信号の未加工データプロットを示す。
【図15】図15は、1つの実施形態による、15サイクルのAlu PCR−ピコグリーン反応のための投入DNA(ナノグラム)対蛍光信号(RFU)を減じたベースラインのプロットを示す。
【図16】図16は、1つの実施形態による、(左から右へのピーク強度が0ナノグラム、0.4ナノグラム、1ナノグラム、4ナノグラム、10ナノグラム、20ナノグラム、および40ナノグラムの投入テンプレートDNAに対応する)Alu PCRレーザー検出からの出力蛍光信号の未加工データプロットを示す。
【図17】図17は、1つの実施形態による、(エラーバーは1つの標準偏差を表わす)測定の再現性を示す10サイクルのAlu PCR反応のための蛍光信号(RFU)を減じた投入DNA(ナノグラム)対ベースラインのプロットを示す。
【図18】図18は、1つの実施形態による、7サイクルのAlu PCR−サイバーグリーン(SYBR Green)分析のための投入DNA(ナノグラム)対蛍光信号(RFU)を減じたベースラインのプロットを示す。
【図19】図19は、1つの実施形態による、実施例5において記載されるような分子ビーコンプローブ1を用いて実際に検出された、ベースラインを差し引いた蛍光信号(RFU)対ゲノムDNA標的濃度(pg)のプロットを示す。
【図20】図20は、1つの実施形態による、実施例5において記載されるような分子ビーコンプローブ2を用いて実際に検出された、ベースラインを差し引いた蛍光信号(RFU)対ゲノムDNA標的濃度(pg)のプロットを示す。
【図21】図21は、1つの実施形態による、実施例6において記載されるような分子ビーコンプローブ2での1分間のハイブリダイゼーションを用いて実際に検出された、ベースラインを差し引いた蛍光信号(RFU)対ゲノムDNA標的濃度(pg)のプロットを示す。
【図22】図22は、1つの実施形態による、実施例9において記載されるような複数の精製フィルター層の機能としてDNA結合「カットオフ」を実証する。
【図23】図23は、1つの実施形態による、実施例9において記載されるような投入DNAの範囲にわたって直径1mmのフィルターのDNA結合性能を実証する。
【図24】図24は、1つの実施形態による、実施例10において論じられるような作動範囲にわたって光電子増倍管(PMT)ゲインが掃引される間の信号強度のプロットを示す。
【図25】図25は、1つの実施形態による、実施例10において論じられるような作動範囲にわたってPMTゲインが掃引される間の信号対ノイズ比のプロットを示す。
【図26】図26は、1つの実施形態による、実施例10において論じられるようなレーザーパワーの機能としての信号強度のプロットを示す。
【図27】図27は、1つの実施形態による、実施例10において論じられるような励起準位による光退色現象を示す。[配列の概要]
【0018】
配列ID番号:1は、配列5’−AGG GTA TCT GGG CTC TGG−3’を有するTHO1フォワードプライマー(Forward Primer)である。
配列ID番号:2は、配列5’−GCC TGA AAA GCT CCC GAT TAT−3’を有するTHO1リバースプライマー(Reverse Primer)である。
配列ID番号:3は、配列5’−GTC AGG AGA TCG AGA CCA TCC C−3’を有するAluフォワードプライマーである。
配列ID番号:4は、配列5’−TCC TGC CTC AGC CTC CCA AG−3’を有するAluリバースプライマーである。
配列ID番号:
5は、配列5’−GCC CGA TTT TGC GAC TTT GGA GGG C−3’を有するPV 92 プローブ1である。
配列ID番号:
6は、配列5’−CGC CTC AAA GTG CTG GGA TTA CAG GCG−3’を有するAluプローブ2である。
【発明を実施するための形態】
【0019】
本明細書に記載されるものは、核酸定量化のための進歩性のある方法およびデバイスであり、一部の実施形態においては、核酸定量化のためのマイクロ流体方法およびデバイスである。1つの態様において、実施形態は、一般に、事前の増幅の必要性のない天然(すなわち、非合成)の核酸などの標的核酸を定量化する方法に関する。いくつかの実施形態において、方法は、結合剤が標的核酸に対して固定化されることを可能にすることを含む。あるケースでは、結合剤は、標的核酸の量を定量化するために用いることができるシグナリング部分を含む。一部の実施形態において、定量化は迅速に実行することができる。例えば、一部の実施形態において、定量化は1時間以下で完結することができる。一部の実施形態において、低い量の標的核酸を含む試料は、一部の実施形態において流入式マイクロ流体分析を用いて、定量化することができる。例えば、あるケースでは、1ナノグラム未満を含む試料が定量化されてもよい。一部の実施形態において、標的核酸は、非標的核酸の存在下で定量化されてもよい。また、デバイス、バイオチップ、およびキットなどが、本発明の方法を実行するために提供される。
【0020】
いくつかの実施形態において、本明細書に記載された方法は、法医学的核酸分析において特に有用かもしれない。但し、当業者は、本方法が、法医学的分析に限定されず、解析するために標的核酸を含む(または、標的核酸を含むように思える)任意の適当な試料を用いることができることを理解するだろう。いくつかの実施形態において、臨床試料および環境試料が解析されてもよい。本明細書に記載された方法の一部の実施形態は、核酸の簡易化された定量化、マイクロ流体システムによる容易な統合化、低減された試薬の(すなわち、用いられる試薬の量および/または用いられる試薬の数)利用、酵素、dNTPsおよびPCRバッファなどの特殊扱いおよび/または保存を必要とする試薬の回避、定量化の速度および定量化の感度、定量化の特異性、自動化を提供するための改善された能力の1つ以上を含む(但し、限定されない)、先行技術を超える利点を備えてもよい。また、好ましくは、本明細書に記載された方法の一部の実施形態は、それが1つ以上のPCR抑制剤(それらは例えば臨床の試料、環境試料、法医学的試料などにあり得る)を含んでいるにもかかわらず試料における標的核酸を解析するために用いることができる。
【0021】
いくつかの実施形態において、本方法は、シグナリング部分を備える結合剤を、標的配列(すなわち標的核酸)を含む核酸ストランドを含むように推測される試料と組み合わせ、標的核酸が欠如している本質的に同じ状態下でその特性と比較して、シグナリング部分の測定可能な特性に変化があるか否かを判定することを含む。いくつかの実施形態において、標的を含まないコントロールを実行し、試料の応答をコントロールの応答と比較することは望ましいかもしれない。あるケースでは、信号のレベルが、定量のために測定されてもよい。一部のこのような実施形態において、測定用試料(Test Sample)により究明される信号のレベルは、標的配列を含む核酸ストランドの既知濃度を含む検量用試料(Calibration Sample)を用いて用意された検量標準物質(Calibration Standard)により比較されてもよい。いくつかの実施形態において、変化は、単に、標的核酸の存在または欠如を確認する目的で検出されてもよい。コントロールが用いられる実施形態において、試料とコントロールのと間の信号変化の差分が計算されてもよい。
【0022】
いくつかの実施形態において、複数の核酸サンプルは、本質的には同時に解析および定量化することができる。より詳細に以下で論じられるように、複数の核酸サンプルは、計測を伴うマイクロ流体バイオチップとソフトウェアとを含むマイクロ流体システムを用いて平行に解析されてもよい。いくつかの実施形態において、マイクロ流体システムを用いることは、複数サンプルが、適合する操作のセットを用いて、各試料(または試料のサブセット)のために本質的には同一の操作のセットを用いて処理されることを可能にする。その上、あるケースでは、複数の独立した試料処理および/または法医学的分析は、所定の試料上の統合方式において実行することができる。例えば、法医学的試料は、DNA(すなわち標的核酸)を連続的に分離し、分離されたDNAを定量化し、定量化結果に基づいて多くのDNA溶液を自動的に計量し、その後、分離されたDNAの短鎖縦列反復配列(STR)解析、一塩基変異多型(SNP)解析、およびミトコンドリアの配列決定の1つ以上を実行することにより解析されてもよい。同様に、臨床の試料は、標的核酸を精製し、標的核酸を定量化し、定量化結果に基づいて多くの核の溶液を自動的に計量し、標的核酸のPCR、逆転写PCRおよび/またはDNA塩基配列決定を実行することにより解析されてもよい。いくつかの実施形態において、試料は、バイオチップ上の1つ以上の病原体、細胞過程、生理学のプロセス、薬剤および毒素のために本質的に同時に問い合わせられてもよい。いくつかの実施形態において、試料分析は、システムによって自動的に行われてもよい。
【0023】
図1は、一部の実施形態による標的核酸分析の様々なステップを表すフローチャートを提供する。いくつかの実施形態において、標的核酸分析は、試料を取得することを含むステップ100から開始される。一部の実施形態において、試料は、犯罪現場または証拠の試料などの法医学的試料を含んでもよい。あるケースでは、標的核酸は、例えば、ステップ120のシグナリング部分を含む結合剤により標的核酸の混合のための試料を用意するために、ステップ110に示すように試料から抽出されてもよい。本ステップは、ステップ130に示すように標的核酸に対して結合剤を固定化し、ステップ140に示すようにシグナリング部分を検出することを含んでもよい。次に、標的核酸は、より詳細に以下で記述される技術を用いて、ステップ150に示すように定量化されてもよい。いくつかの方法が、これらのステップのすべてを含むとは限らないこと、および/または図示されない付加的なステップを含んでもよいことは理解されるべきである。例えば、あるケースでは、標的核酸は抽出される必要がなく、それによって、ステップ110を回避する。
【0024】
いくつかの実施形態において、試料はステップ100に示すように取得されてもよい。試料は、任意の適当な方法によって取得されてもよい。例えば、口腔スワブが取得されてもよい。一般に、口腔スワブは、ほおの内面から細胞の試料を収集するために収集器具(例えば小筆または綿棒)を用いる。その代わりに、小量の口内洗浄液(すなわち塩性の口内洗浄液)が、細胞を収集するために口の中で振られてもよい。いくつかの実施形態において、血液、唾液、精液、羊水、髪、皮膚または他の適合する流体および/または組織の試料を収集するために、他の方法が用いられてもよい。広範囲の試料は、また、膣のスワブ、頚部のスワブ、尿道のスワブ、直腸のスワブ、鼻のスワブ、鼻咽頭のスワブ、傷スワブ、生検標本、骨髄穿刺液および唾液穿刺液を含む。試料は、いくつかの実施形態の中で、個人的なアイテム(例えば、歯ブラシ、カミソリ)個体によって触れられたアイテム(例えば、飲用のグラスの縁、シャツカラー、キャップのリム、ドアノブ、ウインドガラスまたはテーブル)、蓄積された試料(例えば、堆積する精子または生検組織)、死体、犠牲者、犯人、容疑者、犯罪現場、患者、または親類(すなわち血族)から取得されてもよい。あるケースでは、試料核酸は、精製されなくてもよいし、部分的に精製されるまたは精製されてもよい。いくつかの実施形態において、試料核酸は、本質的には、標的核酸の混入がなくてもよい。他の実施形態において、試料は、標的核酸および非標的核酸の混合物を含んでいてもよい(例えば、法医学的分析のためのヒトのDNA試料は、また犬のDNAを含んでいてもよい)。例えば、試料は、生体外または生体内の試料であってもよい。一般に、試料は、標的核酸を含む、または標的核酸を含むように推測される。「試料」が、標的核酸、標的核酸を含む混合物(固体および/または液体)、または標的核酸を含むと推測される材料(固体および/または液体)を指してもよいことは理解されるべきである。
【0025】
試料は、ある程度の標的核酸を少なくとも含んでもよいし、または、標的核酸を含まなくてもよい。いくつかの実施形態において、試料における標的核酸の量は、試料を取得するために用いられる方法(すなわち収集方法)に依存してもよい。いくつかの実施形態において、収集方法は、本質的には0〜100マイクログラムの範囲内、1ピコグラム〜100のマイクログラムの範囲内、1ナノグラム〜100マイクログラムの範囲内、10ナノグラム〜100マイクログラムの範囲内、100ナノグラム〜100マイクログラムの範囲内、1ピコグラム〜10マイクログラムの範囲内、1ナノグラム〜10マイクログラムの範囲内、10ナノグラム〜10マイクログラムの範囲内、または100ナノグラム〜10マイクログラムの範囲内の標的核酸の量をもたらしてもよい。いくつかの実施形態において、収集方法によって収集された標的核酸の量は、少なくとも10倍、少なくとも100倍、少なくとも1000倍、または少なくとも10000倍で第1の試料から第2の試料に相違してもよい。
【0026】
試料は、標的核酸以外の1つ以上の合成物(もし存在するならば)を含んでもよい。例えば、試料収集流体は、試料を集める、薄める、懸濁する、または溶かすために用いられてもよい。一般に、試料収集流体は、水性であってよい。但し、試料収集流体は、水性溶媒の代わりに、またはその水性溶媒に加えて、有機溶媒をまた含んでもよい。様々な他の実施形態において、試料収集流体は、1つ以上のバッファ、スタビライザ、酵素阻害剤(例えば、ヌクレアーゼ抑制剤)、キレート試薬、塩類または他の合成物を含んでもよい。別の実施形態(試料収集流体による以下の試料の収集)において、試料は、乾燥させられてもよい(例えば、法医学的スワブ試料は、後で乾燥させられ処理されてもよい)。さらに別の実施形態において、試料収集流体は、利用されなくてもよい(例えば、乾燥したスワブが用いられてもよい)。
【0027】
いくつかの実施形態において、標的核酸は(存在するならば)、ステップ110に示すように試料から抽出(例えば、精製)されてもよい。あるケースでは、標的核酸は、マイクロ流体バイオチップの中で抽出されてもよい。但し、当業者は、当該技術分野の多くの既知の抽出方法(それらの多くは市販で入手可能である)のいずれかによって、標的核酸が抽出されてもよいことを認識するだろう。例えば、液液抽出技術は、フェノール−クロロホルム溶液を含むものなどのように、用いられてもよい。別の例において、液体の固形物抽出の技術は、試料が固体の基板上で収集され、標的核酸を分離するために(一般に複数の溶液とともに)洗浄される場合に用いられてもよい(例えば、キアゲン社(Qiagen Corporation)によって販売されているキットを参照)。核酸精製の他の例は、例えば「核酸精製(Nucleic Acid Purification)」と題され、2010年2月3日にセルデン(Selden)らによって出願された米国特許出願番号第12/699,564号(それは参考文献として本明細書に援用される)に見出される。
【0028】
細胞試料(すなわち、細胞、複数の細胞、細胞の混合物、組織内の1つ以上の細胞)から標的核酸が分離される実施形態において、細胞は、破砕開口されて(例えば、分裂または溶解されて)もよい。いくつかの実施形態において、細胞の膜脂質は洗浄剤を用いて分裂されてもよい。あるケースでは、タンパク質は、1つ以上のプロテアーゼで試料を処理することにより分解されてもよい。いくつかの実例において、タンパク質は、例えば酢酸ナトリウムまたは酢酸アンモニウムなどの酢酸塩により、沈殿によって取り除かれてもよい。いくつかの実施形態において、タンパク質は、フェノール−クロロホルム相分離を用いて取り除かれてもよい。いくつかの実施形態において、標的核酸は、例えばエタノールまたはイソプロピルアルコールなどのアルコールを用いて、沈殿させてもよい。あるケースでは、グアニジンチオシアン酸塩−フェノール−クロロホルムは、例えば、RNAまたはDNAの標的核酸を抽出するために用いられてもよい。部分的に精製された、または精製された標的核酸は、任意の適当な溶液(例えば、収集流体)、例えば、脱イオン水、トリスEDTA(TE)などのバッファに可溶化することができる。DNAおよび/またはRNAを精製するための他の技術は、当業者にとって既知であろう。
【0029】
以上に論じられたように、標的核酸を含む(または含むと推測される)任意の試料が、解析されてもよい。標的核酸は、任意の核酸であってもよい。例えば、いくつかの実施形態において、標的核酸は、DNA、RNA、またはそれらの混合物もしくは共重合体であってもよい。いくつかの実施形態において、標的核酸(および、本明細書に記載されたような、核酸の他の型)は、ゲノムDNA、染色体DNA、染色体外のDNA、プラスミドDNA、ミトコンドリアDNA、クロロプラストDNA、相補鎖DNA、リボソームRNA、メッセンジャーRNA、またはその破片であってもよい。標的核酸は、自然源(すなわち天然)から分離される、組み換え技術によって生成される、または人工的に合成されてもよい。例えば、標的核酸は、ヒト細胞、細菌細胞、菌の細胞、真核細胞、原核細胞、またはウィルスから分離されてもよい。あるケースでは、標的核酸は、合成(すなわち、増幅によって生成された産物[例えば、PCR、定量的PCR、リバース転写PCR]、結紮、または化学薬品合成)であってもよい。標的核酸は、タンパク質、酵素、抗体、レセプタ、リボザイム、リボソームなどの生物学的物体、またはその部分をコード化する核酸であってもよい。別の非限定の例として、標的核酸は、調節配列、または非コード化配列(例えば、小型干渉RNA、ミクロRNA低分子ヘアピンRNAなど)であってもよい。いくつかの実施形態において、標的は、特異的ゲノム配列または反復性ゲノム配列であってもよい。標的核酸および/または標的配列は、(例えば、およそ12、14、16、18、20、22、25、30、35、40、45、50、60、70、80、90、100、200、400、800、1600、3200、6400、またはそれ以上の)の長さの任意の数のヌクレオチドでありえる。核酸は、天然由来の塩基(例えば、アデノシンまたは「A」、チミジンまたは「T」、グアノシンまたは「G」、シチジンまたは「C」、またはウリジンまたは「U」)などの残基、またはメチル化された残基などの他の残基を含んでもよい。核酸は、ハイブリダイゼーションを容易にするために、いくつかのケースにおいて一本鎖であってもよい。
【0030】
いくつかの実施形態において、標的核酸は、また、PCR(ポリメラーゼ連鎖反応)などの核酸増幅法を用いて増幅することもできる。標的核酸の様々な複製は、シグナル伝達物体(例えば、蛍光染料)により標識されることができる。例えば、シグナル伝達物体は、任意の適当な位置の核酸(例えば、核酸配列の5’末端部位、3’末端部位、または核酸の内部部位)内に含まれていてもよい。
【0031】
いくつかの実施形態において、試料は、複数のソースに由来する標的核酸を含んでもよい。例えば、試料は、第1の標的核酸および第2の核酸を含んでもよい。あるケースでは、第1の標的核酸および第2の核酸の両方は、それぞれ第1のヒトおよび第2のヒトに由来してもよい。いくつかの実施形態において、第1の標的核酸は、ヒトに由来してもよいし。第2の標的核酸は、ヒト以外(例えば、バクテリア、マウス、犬、猫、爬虫類、ヘビ、昆虫、ヒト以外の霊長動物、など)に由来してもよい。あるケースでは、試料は、2、3、4、5、6、7、8、9、10、またはそれ以上の別の型の核酸(標的核酸の1つ、いくつか、または全部)を含んでもよい。
【0032】
いくつかの実施形態において、試料は、試験液を形成するために、ステップ120に示すように、結合剤により組み合わされてもよい。試験液は、結合剤を含む任意の試料流体であってもよい。より詳細に以下で論じられるにように、結合剤は、標的核酸に対して特に固定化させることができる物体である。以上に論じられたように、あるケースでは、試料は流体(すなわち、試料流体)であってもよい。いくつかの実施形態において、結合剤は、流体(以下「プローブ流体」)内に含まれていてもよい。いくつかの実施形態において、試料流体および/またはプローブ流体は、水性および/または有機であってもよい。あるケースでは、試料流体および/またはプローブ流体は、1つ以上のバッファ、スタビライザ、酵素阻害剤(例えば、ヌクレアーゼ抑制剤)、キレート試薬、塩類、または他の合成物を含んでもよい。
【0033】
いくつかの実施形態において、結合剤は、マイクロ流体デバイスに取り付けられてもよい。例えば、いくつかの実例において、結合剤は、マイクロ流体チャネルの壁に共有結合で取り付けられてもよい。あるケースでは、結合剤は、マイクロ流体チャネルの壁または機構に非共有結合で取り付けられてもよい。いくつかの実施形態において、標的核酸は、マイクロ流体デバイスに(すなわち、共有結合でまたは非共有結合で)取り付けられてもよい。いくつかの実施形態において、マイクロ流体チャネルは、結合剤および/または標的核酸を結合するために適した領域を有してもよい。例えば、結合剤および/または標的核酸は、機構には実質的に結合せずに、マイクロ流体チャネルの第1の領域を通じて流出され、マイクロ流体チャネルの第2の領域における機構に結合されてもよい。一部の実施形態において、標的核酸も結合剤も、分析の間に任意のマイクロ流体チャネルの壁に取り付けられない(または取り付けられるようにならない)が、むしろ試験液の中で懸濁され続ける。
【0034】
いくつかの実例において、試料流体とプローブ流体が、組み合わせられてもよい。例えば、試料流体およびプローブ流体は、マイクロ流体システムにおいて(例えば、マイクロ流体チャネル、またはマイクロ流体チャネルを含むシステムの混合区画において)組み合わせられてもよい。試料および結合剤は、任意の適切な技術を用いて混合されてもよい。例えば、試料流体およびプローブ流体は、混合試料を攪拌またはピペットで取ることにより、混合されてもよい。いくつかの実施形態において、試料流体およびプローブ流体は、マイクロ流体システムにおいて混合されることができる。当業者は、マイクロ流体システムにおいて流体を混合するためのデバイスおよびチャネル構成に気づくだろう。それらの非限定の例は、「統合化核酸分析(Integrated Nucleic Acid Analysis)」と題され、2008年4月4日にタン(Tan)らによって出願された国際特許出願第WO/2008/124104号パンフレットに開示され、その文献は参考文献として本明細書に援用される。
【0035】
結合剤は、標的配列を含む標的核酸に固定化することができる任意の物体であってもよい。いくつかの実施形態において、結合剤は、非共有結合を通じて標的核酸に固定化されるようになってもよい。例えば、非共有結合は、水素結合、ファン・デル・ワールス相互作用、疎水性相互作用などの1つ以上を含んでもよい。あるケースでは、結合剤は、1つ以上の共有結合を介して標的核酸に固定化されるようになってもよい。
【0036】
いくつかの実施形態において、結合剤が、標的核酸の標的配列に特に固定化されることができてもよい(すなわち、結合剤は、標的核酸のための独特の特異性を有する特異的結合剤であってもよい)。例えば、結合剤は、第2の配列(第1の配列とは異なる第2の配列)を有する第2の標的核酸に関して、第1の配列を有する第1の標的核酸に優先的に固定化され(例えば、混成され)てもよい。あるケースでは、結合剤は、標的核酸に非特異的に固定化されることができてもよい。例えば、結合剤は、標的核酸配列から独立して、標的核酸に実質的に挿入されてもよい。いくつかの実施形態において、結合剤は、挿入染料、挿入蛍光染料であってもよいし、または二本鎖核酸により選択的に挿入することができる挿入蛍光染料であってもよい。
【0037】
いくつかの実施形態において、結合剤は、核酸であってもよい(すなわち、結合剤は、核酸プローブであってもよい)。当業者は、核酸プローブが、所定のアニール条件の下で、核酸プローブの配列に対して少なくとも部分的に相補的な配列を有する標的核酸に混成することができる配列を有するように設計されてもよいことを認識するだろう。当業者は、また標的核酸と核酸プローブとの間の配列相同性が最適である必要がないことを認識するだろう。例えば、いくつかの実施形態において、標的核酸と核酸プローブとの対には、1つ以上のミスマッチがあってもよい。
【0038】
いくつかの実施形態において、結合剤(例えば、核酸プローブ)および標的核酸は、結合剤および標的核酸を含む試料を第1の温度に加熱し、その後、その試料を第2の温度に冷却することにより混成されてもよい。あるケースでは、第1の温度は、第2の温度に冷却する前に一時的に維持されてもよい。例えば、第1の温度は、1秒未満、5秒未満、10秒未満、30秒未満、1分未満、または5分未満の間維持されてもよい。もちろん、これらの範囲外の温度が同様に用いられてもよい。いくつかの実施形態において、第1の温度が、混成された結合剤および標的核酸を溶かす温度(すなわち、混成された相補鎖が分離する温度Tm)を超えてもよい。いくつかの実施形態において、第1の温度が、混成された結合剤および標的核酸のTm=5℃以内であってもよい。いくつかの実施形態において、第1の温度は、少なくとも30℃、少なくとも40℃、少なくとも50℃、少なくとも60℃、少なくとも70℃、少なくとも80℃、少なくとも90℃、または少なくとも95℃であってもよい。第2の温度は、第1の温度未満である少なくとも5℃、少なくとも10℃、少なくとも20℃、少なくとも30℃、少なくとも40℃、少なくとも50℃、少なくとも60℃、少なくとも70℃、少なくとも80℃、または少なくとも90℃であってもよい。いくつかの実施形態において、温度が第1の温度と第2の温度との間にサイクリングされるレートは、少なくとも1℃/秒、5℃/秒、10℃/秒、20℃/秒、30℃/秒、50℃/秒、100℃/秒、または200℃/秒であってもよい。一部のケースでは、本発明によれば、本発明の一部のシステムおよび方法によって提供される迅速な温度サイクリングは、少なくとも部分的に、標的核酸を典型的な従来手法よりも迅速に分析、検出および/または定量化することを可能にする。例えば、いくつかの実施形態において、迅速な温度サイクリングは、試料流体と結合剤とを組み合わせた後に、短期間で、試料流体における標的核酸の濃度が究明されることを可能にできる。
【0039】
以上に論じられるように、標的核酸は、1つ以上の結合剤によって認識され(例えば、混成され)てもよい。核酸結合剤は、標的核酸内の一部の配列を標的とするために、様々な実施形態において用いることができる。多くの場合、標的核酸の短い部分は、核酸プローブ(例えば、50残基未満、30残基未満、20残基未満、15残基未満、10残基未満、9残基未満、8残基未満、7残基未満、6残基未満、5残基未満、および4残基未満の配列)により関連づけられることができる。いくつかの実施形態において、核酸プローブは、少なくとも標的核酸の部分(すなわち、配列が、相補的、または少なくとも実質的に相補的である)を認識することができ、多くの場合、標的核酸の認識された部分と同様の長さを有する核酸残基の比較的短い配列を含んでもよい。例えば、核酸プローブは、10000ヌクレオチド未満、1000ヌクレオチド未満、500ヌクレオチド未満、250ヌクレオチド未満、100ヌクレオチド未満、75、50、40、35、30、25、24、22、20、18、16、14または12ヌクレオチド未満の長さを有する配列を有してもよい。核酸プローブ配列の構造、配列、長さおよびアニール条件の選択は、当該技術分野において周知である。核酸プローブは、任意の適切な技術(例えば、固相ホスホロアミダイトトリエステル法)を用いて合成されてもよい。他の方法は、当業者にとって既知であろう。核酸プローブは、また、例えばインテグレイティッドDNAテクノロジーズ社(Integrated DNA Technologies, Inc)から市販で入手してもよい。
【0040】
核酸プローブ内の核酸配列は、連続していてもよいし、またはその配列は非連続であってもよい。例えば、プローブ配列内に普遍的な残基またはギャップがあってもよい。さらに、ヘアピン、ループなどの二次構造は、あるケースにおいて存在してもよく、それは非連続配列を生成するために用いられてもよい。限定しない例として、核酸プローブは、標的核酸の連続配列に対して少なくとも実質的に相補的であって、かつ標的核酸の連続配列に対して相補的でない第3の領域によって分割される第1領域および第2領域を有してもよい。核酸プローブは、第3の領域がヘアピンを形成するように標的核酸に混成し、それによって、第1領域および第2領域が非連続型において連続した標的核酸配列に混成することを可能にする。
【0041】
あるケースでは、核酸プローブは、オーバーハングを生成せずに(すなわち核酸プローブの内にある少なくともいくつかの残基が標的核酸の末端を通過するように延びずに)、実質的に相補配列に混成してもよい。その代わりに、いくつかの実例において、核酸プローブは、核酸プローブの少なくとも1つの残基が標的核酸の末端を越えて延びるように、標的核酸に混成してもよい。
【0042】
核酸プローブは、標的核酸と完全に混成する必要はない。2つの核酸および/または核酸アナログの混成は、様々なファクタにより影響を与えられる場合があるし、所定の二本鎖内の特有の残基の混成の強度は、異なる場合がある。
【0043】
本明細書に用いられるように、第2の配列に対して「実質的に相補的である」第1の配列は、第1配列および第2配列の少なくとも75%が相補的な1つ(例えば、ワトソンクリック相補的対合を通じて)である。例えば、標的配列が長さ24塩基である状態において、それらに最大6つのベース対ミスマッチがあっても、プローブ配列は「実質的に相補的」であろう。いくつかの実施形態において、2つの配列は、少なくとも80%、85%、90%、または100%の相補形であってもよい。
【0044】
一部の実施形態において、核酸プローブは、残基の積層および/または骨格の前組織化を向上させることができる少なくとも1つの残基を含んでもよい。これは、いくつかのケースにおいて核酸プローブの熱的安定性(溶融温度)を著しく増大する場合がある。例えば、核酸プローブは、少なくとも1つのロックされた核酸(LNA)残基を含んでもよい。ロックされた核酸残基は、自然に生じる核酸残基(例えば相補的な残基により2つまたは3つの水素結合を形成していることができる)に対して同様の化学的形状を有しているが、自然に生じる核酸残基と同じ寸法において自由に回転することができない核酸アナログである。例えば、あるケースでは、メチレン橋が3’−エンド構造的コンフォメーション(それは、多くの場合DNAまたはRNAの一部の形式において見出される)においてリボースを「ロック」する場合に、ロックされた核酸残基は、2’−O、4’−Cメチレン橋を含んでもよい。あるケースでは、ロックされたリボース構成は、核酸プローブの熱的安定性を著しく増大してもよい。核酸配列の熱的安定性を増大することができる他の残基は、当業者にとって明らかである。例えば、ペプチド核酸は、あるケースにおいて核酸プローブとして用いられてもよい。
【0045】
一部の実施形態において、核酸プローブは、普遍的な残基(それは1つ以上の自然のヌクレオチドとの(およびあるケースでは自然のヌクレオチドのすべてとの)残基対合の関係を保つことができる)を含むことができる。核酸塩基(例えば、ヌクレオチドまたはPNA)の形式の重合体構造に組み込まれた場合、普遍的な塩基または普遍的な残基(例えば「N」)は、本明細書に用いられるように、核酸塩基を有している相補的な重合体構造の塩基をはっきりとは区別しない塩基を指す。例えば、普遍的な塩基は、A、T、CおよびGから選択された1つ以上のヌクレオチドに混成することができる。普遍的な残基は、当業者または通常の技術者にとって既知であろう。普遍的な残基の非限定的な例は、デオキシイノシン、3−ニトロピロール、4−ニトロインドール、6−ニトロインドール、5−ニトロインドール、6−メチル−7−アザインドール、ピロロピリジン、イミダゾピリジン、イソカルボスチリル、プロピニル−7−アザインドール、プロピニルイソカルボスチリル、アレニル−7−アザインドール、8−アザ−7−デアザ−2’−デオキシグアノシン、8−アザ−7−デアザ−2’−デオキシアデノシン、2’−デオキシシチジン、2’−デオキシウリジン、2’−デオキシアデノシン、2’−デオキシグアノシン、7−デアザ−2’−デオキシイノシン、2’−アザ−2’−デオキシイノシン、3’−ニトロアゾール、4’−ニトロインドール、5’−ニトロインドール、6’−ニトロインドール、4−ニトロベンズイミダゾール、ニトロインダゾール(例えば5’−ニトロインダゾール)、4−アミノベンズイミダゾール、イミダゾ−4,5−ジカルボキサミド、3’−ニトロイミダゾール、イミダゾール−4−カルボキシアミド、3−(4−ニトロアゾール−1−イル)−1、2−プロパンジオール、および8−アザ−7−デアザアデニンを含む。本明細書に記載されたシステムおよび方法のための有用な他の普遍的な残基は、当業者にとって既知であろう。
【0046】
いくつかの実施形態において、結合剤は、シグナリング部分を含んでもよい。シグナリング部分は、信号を生成することができる任意の物体であってもよい。いくつかの実施形態において、シグナリング部分は、結合剤に(すなわち、1つ以上の共有結合または非共有結合を通じて)取り付けられる。いくつかの実施形態において、シグナリング部分は、結合剤に取り付けられなくてもよい。例えば、あるケースでは、シグナリング部分は、標的核酸への結合剤の固定化の間に、またはその固定化の後に、結合剤により関連づけられてもよい。あるケースでは、シグナリング部分は、標的核酸により関連づけられてもよい。
【0047】
いくつかの実施形態において、シグナリング部分は、蛍光団、蛍光団/消光剤対、発色団、放射性同位体、酵素基質、発色基質、スピン標識、非放射性の同位体または質量分析(例えば電気泳動質量標識(EML))によって検出可能な同位体などの同位体、標識抗体、酵素のための結合パートナーとして役立つことができるリガンド、標識リガンド、抗原のための結合パートナーとして機能することができる抗体、比反応性を有するグループ、および/または電気化学的に検出可能な部分を含んでもよい。いくつかの実施形態において、シグナリング部分は、粒子(例えば、蛍光性の粒子、量子ドット、など)であってもよい。当業者は、他の適切なシグナリング部分を識別することができるだろう。あるケースでは、シグナリング部分は、例えば光(例えば、蛍光団または発色団の場合)により、刺激の信号を生成してもよい。いくつかの実例において、シグナリング部分は、放射性同位体の場合などのように、自然発生的な信号を生成してもよい。一部の実施形態において、シグナリング部分が、検出可能な信号を生成する能力は、シグナリング部分の第1のコンポーネントおよび第2のコンポーネントの近接度に依存してもよい。第1のコンポーネントおよび第2のコンポーネントが、1つ以上の結合を通じて連結されてもよい、または連結されてはならない(すなわち、分離可能である)ことは理解されるべきである。
【0048】
いくつかの実施形態において、シグナリング部分は、蛍光団を含んでもよい。蛍光団の非限定的な例は、市販で合成または入手することができる染料(例えば、オペロンバイオテクノロジー社(Operon Biotechnologies)、アラバマ州ハンツヴィル)を含む。(50を超える)染料の多くは、蛍光励起アプリケーションにおいてアプリケーションのために利用可能である。これらの染料は、フルオレセイン、ローダミンアレクサフルオル(rhodamine AlexaFluor)、バイオジピ、クマリンおよびシアニン染料ファミリーに由来するものを含む。蛍光団の具体例は、FAM、TET、HEX、Cy3、TMR、ROX、Texas red、LC red 640、Cy5、およびLC red 705を含むが限定されない。いくつかの実施形態において、410nm(例えば、Cascade Blue)から775run(例えば、Alexa Fluor750)への発光極大による染料は、有効であり、かつ用いることができる。もちろん、当業者は、これらの範囲外の発光極大を有する染料が、同様に用いられてもよいことを認識するだろう。あるケースでは、500nmから700nmの間の範囲の染料は、可視スペクトル内にあり、従来の光電子増倍管を用いて検出することができるという長所をもつ。いくつかの実施形態において、有効な染料の範囲は、検出範囲にわたって広がる発光波長を有する染料セットの選択を可能にする。多くの染料を識別することができる検出システムは、当該技術分野において知られている。
【0049】
いくつかの実施形態において、シグナリング部分は、結合剤に結合されてもよい。例えば、シグナリング部分および核酸プローブは、例えば、核酸の3’水酸基と、シグナリング部分に取り付けられたリンカとの間のエステル結合を形成することにより、結合されてもよい。リンカは、任意の適切なリンカであってもよい。例えば、リンカは、核酸プローブが標的核酸に混成することを可能にするための十分な長さであってもよい。他の技術は、当業者にとって既知であろう。
【0050】
いくつかの実施形態において、本明細書に別記されるように、消光剤は、背景蛍光を最小限にするためにオリゴ配列を標識するために、または蛍光団/消光剤対において利用するために用いることができる。消光剤は、当業者にとって既知である。消光剤の非限定的な例は、DDQ−I、Dabcyl、Eclipse、Iowa Black FQ、BHQ−1、QSY−7、BHQ−2、DDQ−II、Iowa Black RQ、QSY−21、およびBHQ−3を含む。いくつかの実施形態において、消光剤には、430nm(例えば、DDQ−I)から670nm(例えば、BHQ−3)まで範囲内の吸収極大があってもよい。
【0051】
いくつかの実施形態において、例えば、「探知できるように標識化されたデュアルコンフォメーションオリゴヌクレオチドのプローブ、分析、およびキット(Detectably Labeled Dual Conformation Oligonucleotide Probes, Assays and Kits)」題されて1999年7月20日にチャギ(Tyagi)らによって発行された米国特許第5,925,517号(その文献は参考文献として本明細書に援用される)において論じられるように、シグナリング部分を含む結合剤は、分子のビーコンであってもよい。結合剤(例えば、分子ビーコン)は、標的がない状態での分析状態の下で、ステム二本鎖を形成するために相互に作用する親和性対または腕の要素により側面に位置される標的核酸相補配列を有してもよい。その予め選ばれた標的配列に対する結合剤の混成は、腕を離れて押し進め、ステム二本鎖を除去して、結合剤における構造変化をもたらすことができる。結合剤の実施形態は、相互に作用する標識を利用する。それによって、その構造変化は、検出されることができる。いくつかの実施形態において、結合剤は、少なくとも所望の標的核酸に対して実質的に相補的な一本鎖核酸配列(「標的補数配列」として本明細書にて言及された)と、相補的な核酸配列または別の親和性対の付属の要素のいずれかによって可逆的に相互に作用する標的相補配列の側面に位置する5’および3’領域と、信号を生成するための相互に作用する標識部分を含むシグナリング部分とを含んでもよい。いくつかの実施形態において、結合剤は、標的相補配列が標的に結合されない場合に検出の状態の下で互いに混成することにより可逆的に相互に作用する、実質的に相補的な核酸配列、または「腕」を含む。いくつかの実施形態において、シグナリング部分を含む結合剤は、単分子であってもよい(すなわち、上記のコンポーネントのすべては、1つの分子内にあってもよい)。結合剤が2分子から成る実例において、標的相補配列の半分(またはおよそ半分)、親和性対の1つの部材および標識対の1つの要素は各分子にあってもよい。
【0052】
シグナリング部分の標識部分を生成する信号は、近接内の場合で十分に分割されていない場合に、少なくとも1つの標識部分が別の標識部分の少なくとも1つの物理的に測定可能な特性を変更することができるように、相互に作用するマッチした標識「対」を有してもよい。いくつかの実施形態において、標識部分は、親和性対の相互作用の状態によって互いに標識部分の近接度を調整することができるように、プローブに結合してもよい。標的がない状態において、標識部分は、親和性対のリンク相互作用によって互い近接して維持されてもよい。このコンフォメーションは「閉ざされた(closed)」状態と呼ばれてもよい。シグナリング部分の検出可能な信号が、閉ざされた状態で生成されない場合(それは、一般に大部分の実施形態でのケースである)、閉ざされた状態は、「オフ」状態にあると見なすことができる。
【0053】
標的相補配列がその標的に混成する実例において、構造変化が、親和性対および結果的に相互に作用する標識の標識部分を分割する結合剤内にて生じてもよい。このコンフォメーションは「開かれた」状態(それは、大部分の実施形態で「オン」状態にあると見なすことができる)と呼ばれてもよい理論に束縛されるものではないが、分離は、標的相補配列〜標的配列ヘリックスの形成の熱力学によって駆動されると考えられる。標的相補配列〜標的配列ヘリックスの形成は、完全であるか、または傷がついているかにかかわらず、分析状態下の親和性対の親和力を克服する。親和性対の分離が標識部分の相互作用を変更するので信号が生成され、結合剤に結合される少なくとも1つの標識部分の少なくとも1つの特性の差分が測定されてもよい。
【0054】
いくつかの実施形態において、相互に作用する標識を有する結合剤は、結合剤が開かれたか閉ざされたかに依存して相違する測定可能な特性(例えば、検出可能な信号)を有する。一般に、測定可能な特性は、標識部分の相互作用の機能、および、それらの分離の機能として変化するそれらの部分間の相互作用の度合いである。
【0055】
以上に論じられたように、結合剤は、閉ざされたコンフォメーションおよび開かれたコンフォメーションを有してもよい。閉ざされたコンフォメーションにおいて、標識部分は、互いに「隣接」していてもよい。すなわち、それらは、相互に作用しなくてもよい場合、信号が(例えば、検出量、品質、レベル、などにおいて)開かれたコンフォメーションとは異なるように、相互に作用するために十分に閉ざされてもよい。あるケースでは、差分が可能な限り大きなことは望ましいかもしれない。あるケースでは、「オフ」状態において、測定可能な特性が、限りなくゼロに近い信号であることは望ましいかもしれない。
【0056】
いくつかの実施形態において、測定可能な特性(例えば、検出可能な信号)は、蛍光共鳴エネルギー転移(FRET)対の少なくとも1つの要素の刺激に起因する特性的な光信号であってもよい。あるケースでは、信号は、例えば、検出可能な産物を形成するための基質上の酵素/抑制剤対または酵素/共同因子対の動作から結果として生じる色変化であってもよい。いくつかの実施形態において、シグナリング部分を含む結合剤は、標識部分が閉ざれた位置にある結合剤により隣接しているか、または開かれた位置にある結合剤により分割されるかに、そのレベルが依存する特性信号を有してもよい。
【0057】
いくつかの実施形態において、標識部分の選択は、信号が生成される状態において、規定することができる。あるケースでは、標識部分の選択は、各状態において個別の信号が生成されると規定することができる。いくつかの実施形態において、相互に作用する標識部分は、蛍光団/消光剤対であってもよい。いくつかの実例において、相互に作用する標識部分は、結合剤に共有結合で結合されてもよい。あるケースでは、相互に作用する標識部分は、標的核酸に対して相補的でない結合剤の部分に付けるために結合されてもよい。一部の実例において、結合剤が開かれた状態における標的核酸に結合され、かつ適合する光源により刺激される場合、シグナリング部分は、特有の波長の正の蛍光信号を生成することができる。
【0058】
以上に論じられたように、結合剤は、ステップ130に示すように、標的核酸に固定化されてもよい。固定化は、任意の適切な技術を用いて実行されてもよい。例えば、いくつかの実施形態において、結合剤および標的核酸は、固定化(例えば、混成)を容易にするために、一定期間にわたって加熱され、その後、冷却されてもよい。いくつかの実施形態において、固定化は、加熱/冷却サイクルの必要性なしで、生じてもよい。あるケースでは、標的核酸に結合剤を固定化する化学反応が生じてもよい。例えば、架橋試薬は、結合剤および標的核酸を共有結合で接合するために用いられてもよい。
【0059】
固定化は、本発明の一部の実施形態によれば、短期間で達成されてもよい。いくつかの実施形態において、標的核酸を定量化するための全体の所要時間は、迅速な固定化時間のおかげで、著しく低減することができる。例えば一部の実施形態において、迅速な温度サイクラーを含むマイクロ流体システムは、1時間未満で(一部の実施形態においては30分未満で、一部の実施形態においては20分未満で、一部の実施形態においては10分未満で、一部の実施形態においては5分未満で、一部の実施形態においては1分未満で、一部の実施形態においては30秒未満で、一部の実施形態においては10秒未満で、一部の実施形態においては5秒未満で、一部の実施形態においては1秒未満で、および一部の実施形態においては実質的に瞬間的に)反応が完了することができるように、結合剤および標的核酸が所望のターゲット温度を達成することを可能にするために用いられてもよい。温度サイクリングのためのデバイスおよび方法は、例えば、セルデン(Selden)らにより「標的核酸の迅速な多重化増幅のための方法(Methods for Rapid Multiplexed Amplification of Target Nucleic Acids)」と題されて、2008年4月4日に出願された米国特許出願第2009/0023603号公報(その文献は参考文献として本明細書に援用される)に記載されている。
【0060】
いくつかの実施形態において、シグナリング部分は、検出可能な信号(すなわち、測定可能な特性)を生成してもよい。いくつかの実施形態において、検出可能な信号は、光信号(例えば、蛍光または化学発光)であってもよい。以上に論じられたように、いくつかの実施形態において、検出可能な信号は、蛍光共鳴エネルギー転移(FRET)対の少なくとも1つの要素の刺激に起因する特性的な光信号であってもよい。いくつかの実施形態において、検出可能な信号は、特有の波長または波長領域を有する光の吸光度であってもよい。あるケースでは、信号は、例えば、検出可能な産物を形成するための基質上の酵素/抑制剤対または酵素/共同因子対の動作から結果として生じる色変化であってもよい。いくつかの実施形態において、検出可能な信号は、放射性同位体からなどの射光であってもよい。当業者は、他の適切な検出可能な信号を識別し、実施することができるだろう。
【0061】
いくつかの実施形態において、標的核酸は、ステップ150に示すように、定量化されてもよい。いくつかの実施形態において、定量化は、例えば、標準曲線を標的核酸濃度対生成された検出可能な信号に用いて、シグナリング部分を含む結合剤により組み合わせた標的核酸の範囲の既知濃度を含む一組の溶液の蛍光値を用いて、標的核酸の既知濃度に蛍光値をプロットして、達成されてもよい。いくつかの実施形態において、標的核酸の既知濃度を含む各溶液にとって、以上に記載されたような方法は、標的核酸に結合剤を固定化するために実行され、シグナリング部分が、その後、検出される。結果として生じたプロットに対して線形回帰などの方法を用いて、曲線を適合させることは、結合剤が標的核酸に固定化された後、試料の検出可能な信号値のを入力することにより、標的核酸の未知の濃度を有する試料における標的核酸の濃度を計算するための一般的な数式の導出を公式にあてはめることを可能にするかもしれない。
【0062】
別の実施形態において、シグナリング部分の物理的性質は、標的核酸の濃度を究明するために用いられてもよい。例えば、特有の波長における蛍光性のシグナリング部分のモル吸光係数および量子収量は、当業者に知られている溶液を用いる技術において標的核酸の濃度を究明するために用いられてもよい。一般に、標的核酸に固定化された結合剤を有する標的核酸の分数は、究明され定量化の要因の一つに含められる。標的核酸の未知の濃度を有する試料における標的核酸の濃度は、当業者により理解されるようにモル吸光係数および量子収量に対応する波長で試料の蛍光を測定することにより、モル吸光係数および量子収量を用いて究明することができる。
【0063】
一部の実施形態において、本明細書に記載された方法のための本発明により利用される技術およびシステムは、標的核酸の迅速な分析または定量化を可能にする。例えば、ステップ120、130、140、および150を含む方法は、10秒以内に、30秒以内に、1分以内に、2分以内に、5分以内に、10分以内に、20分以内に、30分以内に、45分以内に、または1時間以内に完結できる。あるケースでは、ステップ120、130、および140を含む方法は、10秒と1時間との間に、10秒と30分との間に、10秒と5分との間に、10秒と2分との間に、または10秒および1分との間に完結してもよい。
【0064】
いくつかの実施形態において、標的核酸の解析は、標的核酸の小量の定量化を可能にしてもよい。例えば、本方法は、100ナノグラム未満、50ナノグラム未満、20ナノグラム未満、10ナノグラム未満、5ナノグラム未満、2ナノグラム未満、1ナノグラム未満、100ピコグラム未満、10ピコグラム未満、1ピコグラム未満、100フェムトグラム未満、10フェムトグラム未満、または1フェムトグラム未満の標的核酸を定量化することができてもよい。あるケースでは、本方法は、1ナノグラム〜100ナノグラム、10ピコグラム〜20ナノグラム、または1フェムトグラム〜5ナノグラムの標的核酸の量を計ることができてもよい。いくつかの例において、本方法は、1ナノグラム/マイクロリットル〜50ナノグラム/マイクロリットル、1ピコグラム/マイクロリットル〜10ナノグラム/マイクロリットル、または1フェムトグラム/マイクロリットル〜5ナノグラム/マイクロリットルの標的核酸の量を計ることができてもよい。いくつかの実施形態において、本方法は、105未満の分子、か、105〜1015の分子、105〜1012の分子、105〜1011の分子、105〜1010の分子、または105〜109の分子を定量化することができてもよい。いくつかの実施形態において、定量化は、標的核酸を増幅するための必要性なしに、低濃度(例えば一部の法医学的試料)で天然の標的核酸を含む試料のためにでも、達成されてもよい。もちろん、これらの範囲外の量および/または濃度における標的核酸検出の解析または定量化は、当業者または通常の技術者により達成されてもよい。
【0065】
一部の実施形態において、標的核酸は、少容量の溶液で解析されてもよい。一部の実施形態において、マイクロ流体システムでの解析の実行は、解析の実行のための溶液の容量を低減することに有用かもしれない。いくつかのケースでは、検出は、1ミリリットル未満の溶液、100マイクロリットル未満の溶液、10マイクロリットル未満の溶液、1マイクロリットル未満の溶液、100ナノリットル未満の溶液、10ナノリットル未満の溶液、または1ナノリットル未満の溶液で実行されてもよい。いくつかの実施形態において、少容量の溶液を用いることによる解析は、大量の溶液を用いる場合よりも、より迅速に実行することができる。したがって、マイクロ流体システムでの解析の実行は、短期間で(すなわち、1時間以内で、または本明細書に別記されるようにさらに少ない時間で)の標的核酸の定量化に有用かもしれない。
【0066】
以上に論じられたように、いくつかの実施形態において、マイクロ流体システムにおいて方法を実行することは有用かもしれない。すべての実施形態ではなく、いくつかの実施形態において、本明細書に記載されたシステムおよび方法のすべてのコンポーネントは、マイクロ流体である。好適なマイクロ流体システムの例は、「統合化された核酸分析(Integrated Nucleic Acid Analysis)」と題され、2008年4月4日にタン(Tan)らによって出願された国際特許出願第WO/2008/124104号パンフレット、および「核酸およびタンパク質の解析のための耐久性が高められた装置(Ruggedized Apparatus for Analysis of Nucleic Acid and Proteins)」と題され、2005年5月19日にタン(Tan)らによって出願された米国特許出願第2006/0260941号公報において記載されており、それらの文献は参考文献として本明細書に援用される。「マイクロ流体」は、本明細書に用いられるように、少なくとも一つの寸法が1ミリメートル未満であるチャネルを指す。用語「マイクロ流体デバイス」または「バイオチップ」は、一般に、巨視的規模の分析化学装置が何百または何1000倍小さくかつ効率的なデバイスに置き換えられて、小容量(例えば、マイクロリットル、ナノリットル、またはピコリットル)の液体を操作することができる構造を作り出すために、例えば、半導体生産技術を用いることにより製造されたデバイスを指す。例えば、バイオチップのチャネルは、127ミクロン×127ミクロンから400ミクロン×400ミクロンまでの範囲の断面の寸法を有していてもよいし、リザーバは、400ミクロン×400ミクロンから1.9ミリメートル×1.6ミリメートルまでの範囲の断面であってもよい。いくつかの実施形態において、チャネルおよび/またはリザーバは、長さ0.5ミリメートルのような短い距離から数十ミリメートルの(例えば、20ミリメートルを超える、30ミリメートルを超える、40ミリメートルを超える、または50ミリメートルを超える)距離まで延伸してもよい。
【0067】
いくつかの実施形態において、マイクロ流体システムは、人間の介入の必要性を低減する自動システムであってもよい。自動システムは、標的核酸の定量化時間を低減するために有用かもしれない。例えば、自動マイクロ流体システムは、ユーザ介入の必要性を自動的に削減または低減する1つ以上のステップを実行してもよく、したがって、1つ以上のステップを実行するための時間を低減することができる。したがって、自動化は、いくつかの実施形態において、1時間以内に(または、本明細書に別記されるように、さらに短い時間で)標的核酸を定量化するための能力の一因となってもよい。
【0068】
いくつかの実施形態において、本明細書に記載された定量化方法は、別のプロシージャを試料に対して実行する前に標的核酸に対して実行されてもよい。例えば、定量化は、標的核酸上の反応(例えば、増幅反応)の前に標的核酸に対して実行されてもよい。プロシージャの他の例は、核酸精製、核酸増幅(例えば両方のシングルプレックスおよびマルチプレックス終了点PCR、リアルタイムPCRおよびリバース転写PCR)、後増幅核酸クリーンアップ、核酸配列決定、核酸結紮、核酸雑種形成、SNP分析、および電気泳動の分離を含む。あるケースでは、1つ以上のプロシージャが、同じマイクロ流体システムを用いて、標的核酸に対して実行されてもよい。例えば、標的核酸のPCRおよび定量化は、同じマイクロ流体システムを用いて実行されてもよい。いくつかの実施形態において、プロシージャは、マイクロ流体システムのアクティブな領域において実行されてもよい。あるケースでは、マイクロ流体システムは、1つ以上のアクティブな領域を含んでもよい。いくつかの実例において、各プロシージャは、別々のアクティブな領域において実行されてもよい。いくつかの実施形態において、アクティブな領域は、1つ以上のプロシージャに用いられてもよい。例えば、アクティブな領域は、試料および結合剤を混合するために用いられてもよく、試料の究明のための用いられてもよい(すなわち、アクティブな領域は混合領域および検出領域の両方であってもよい)。別の例において、マイクロ流体デバイスのアクティブな領域の少なくとも1つは、ポリメラーゼ連鎖反応(PCR)を介して核酸を増幅するように構成された領域を含んでもよい。いくつかの実施形態において、増幅ステップが、核酸を増幅するように構成されたアクティブな領域内で発生してもよい。
【0069】
いくつかの実施形態において、本明細書に記載された定量化方法は、試料のパラメータを調整するためのフィードバックを提供してもよい。例えば、標的核酸定量化の結果は、試料を薄めるべきか、濃縮するべきかを示してもよい。標的核酸定量化の結果は、また、試料をどの程度に希釈するか、濃縮するかを示してもよい。いくつかの実施形態において、正確な量の核酸が後続の処理のために利用されることを可能にするために、標的核酸定量化の結果は、自動システムにおいて用いられてもよい。あるケースでは、定量化は、例えば、他の処理ステップの前後に所定の試料で複数回実行されてもよい。あるケースでは、試料の個別の容量は、一つの定量化ステップに続く試料の並行処理を可能にするために(例えば、定量化に基づいて、個別の量の標的核酸は、PCR、SNP解析、またはDNA塩基配列決定などの後続の処理のために計量されることができる)、バイオチップの個別の領域への経路を選択することができる。
【0070】
いくつかの実施形態において、バイオチップは、試料操作のための複数のマイクロ流体チャネルおよびアクティブな領域を含んでもよい。いくつかの実施形態において、試料流体の選択された量がバイオチップのアクティブな領域を対象にしてもよい場合、本方法は、定量化ステップの後に1ステップを含んでもよい。いくつかの実施形態において、選択された量は、定量化ステップの結果に基づいて、少なくとも部分的に究明されてもよい。
【0071】
いくつかの実施形態において、PCR増幅などのプロシージャを受けた標的核酸の量を制御することは、望ましいかもしれない。以上に記載されるように、いくつかの実施形態において、標的核酸の量の制御は、標的核酸を定量化し、その後、プロシージャを受けるべき標的核酸の所望量をすることにより、達成することができる。但し、いくつかの実施形態において、プロシージャは、定量化の前に、または標的核酸の定量化なしで、標的核酸に対して実行されてもよい。例えば、いくつかの実施形態において、標的核酸のPCR増幅は、まず標的核酸を定量化せずに実行されてもよい。いくつかの実施形態において、複製可能な量の精製された標的核酸を生成するために、標的核酸が試料から精製されてもよい。例えば、標的核酸の量は「カットオフ」アプローチを用いることにより制御することができる。このアプローチにおいて、標的核酸を閾値まで結合することができる、その上に実質的に付加的な標的核酸が結合されない(すなわち、結合膜には規定された核酸結合能力があってもよい)結合膜が用いられてもよい。一般に、結合膜への標的核酸の結合は、標的核酸をする結合ために、少なくとも試料の一部を結合膜に接触することを含む。いくつかの実施形態において、核酸結合能力は、精製された標的核酸の複製可能な量と本質的には同一である。
【0072】
いくつかの実施形態において、実質的に、結合膜閾値よりも多い量のすべて標的核酸が、結合膜によって保持されないように、試料量は、試料内に含まれる標的核酸量の範囲が、結合膜閾値を超えるように選択することができる。したがって、結合膜閾値を超えた標的核酸の量を含むが、標的核酸の未知量を含む試料に対して、標的核酸の量を、定量化なしで制御することができる。このようなアプローチは、例えば、定量化ステップをなくすことにより、プロシージャを実行するための所要時間を低減するために有用かもしれない。
【0073】
あるケースでは、結合膜は1つ以上の層を含んでもよい。いくつかの実施形態において、結合膜による結合された核酸の量(すなわち、結合能力)は、結合膜における層数とともに実質的に直線的に比例する。いくつかの実施形態において、結合能力は、結合膜の直径に比例する。結合膜の直径は、例えば、少なくとも0.1ミリメートル、少なくとも0.5ミリメートル、少なくとも1ミリメートル、少なくとも2ミリメートル、少なくとも5ミリメートル、または少なくとも10mmであってもよい。いくつかの実施形態において、結合膜は、核酸を結合できるシリカ膜であってもよい。非限定的な例として、図12は、DNA投入の範囲にわたる直径1ミリメートルの結合膜の結合性能を示す。
【0074】
いくつかの実施形態において、結合膜の閾値(すなわち、飽和量)は、少なくとも50ナノグラム、100ナノグラム、少なくとも200ナノグラム、少なくとも300ナノグラム、少なくとも400ナノグラム、少なくとも500ナノグラム、少なくとも600ナノグラム、少なくとも700ナノグラム、少なくとも800ナノグラム、または、さらに多い量であってもよい。いくつかの実施形態において、結合膜の結合効率は、過剰な標的核酸が結合膜を飽和させるために必要とされるように、100%未満であってもよい。例えば、少なくとも10%以上、少なくとも20%以上、少なくとも50%以上、少なくとも100%以上、または、少なくとも200%以上の標的核酸は、結合膜の閾値よりも、結合膜を飽和させるために必要とされる。
【0075】
標的核酸は、任意の好適な方法を用いて、結合膜から溶出されてもよい。例えば、標的核酸は、特定の範囲内のpHまたは特定の範囲内の塩濃度を有する結合膜を通じて流体を流すことにより溶出されてもよい。他の好適な方法は、当業者にとって既知であろう。
【0076】
いくつかの実施形態において、定量化分析は、必要な工程ステップのすべてに互換性をもつように設計されたマイクロ流体バイオチップにおいて処理することができる。精製されたDNA溶液の一部が定量化モジュールの対象にされてもよく、かつ残存するDNAが例えばSTR増幅のために等分するために利用可能である場合、これは、例えばヒトの法鑑定ケースワークバイオチップにおいて有用になりえる。アプローチの主眼点は、増幅を受けさせるための容量を規定するために、定量化データが、利用されてもよいということである。用途に依存して、正確な容量または近似の容量は、マイクロ流体的に計量されるだろう。例えば、精製されたDNAの溶出容量が100マイクロリットルであり、定量化のために利用されたDNA溶液の容量が約1マイクロリットルであるならば、大多数のDNAは、STR増幅に利用可能だろう。核酸の量が少ないと知られているが正確な量が未知であるいくつかの実施形態(例えば、法医学的接触試料(forensic touch samples))において、10%(またはそれ以上)の溶出されたDNAは、定量化のために利用することができる。
【0077】
いくつかの実施形態において、定量化方法は、マイクロ流体システムを用いて実行されてもよい。マイクロ流体システムは、標的核酸、結合剤、および他の試薬を含む試料が、バイオチップを通じて流出されることを可能にしてもよい。例えば、単一のバイオチップは、PCR増幅、断片の分離および検出、核酸配列決定、限外ろ過、および核酸定量化のための領域を有してもよい。いくつかの実施形態において、この多機能のバイオチップは、1つ以上の試料を並列に処理してもよい。いくつかの実施形態において、試料は、1つ以上のプロシージャが実行されてもよいバイオチップにおいて、1つ以上の領域に流出されてもよい。1つ以上のプロシージャが実行される場合、試料は、流出または静止してもよい。例えば、試料はマイクロ流体デバイス内に含まれているが、検出が実行される場合、一部の実施形態において、それは必ずしも流出していなくてもよい。
【0078】
あるケースでは、2つ以上のプロシージャが同じ領域における試料に対して実行されてもよい。いくつかの実施形態において、以下に記載されるバイオチップは、以上に言及されるように、1つ以上の他のプロシージャにより標的核酸定量化の統合化を可能にしてもよい。したがって、ほとんど無限の数の組み合わせを、複雑な一組の操作がバイオチップ上で完結することを可能にする、バイオチップに設計することができる。当業者は、本発明のバイオチップが本質的には無限のプロセスの複雑性により多くの異なる型の解析を実行するように設計されることができることを、十分に理解するだろう。
【0079】
チャネルの「断面寸法」は、流体の流れの方向に対して垂直に測定される。本発明のコンポーネントにおける大部分の流体チャネルは、2ミリメートル未満の(いくつかのケースでは1ミリメートル未満の)最大断面寸法をもつ。一組の実施形態において、本発明の実施形態を含むすべての流体チャネルは、マイクロ流体であるか、または多くとも2ミリメートルまたは1ミリメートルの最大の断面寸法を有する。別の実施形態において、流体チャネルは、部分的に単一のコンポーネント(例えば、エッチング基板または成型されたユニット)により形成されてもよい。もちろん、より大きなチャネル、チューブ、チャンバ、リザーバなどを、大量に流体を蓄積し、かつ本発明のコンポーネントに流体を送るために用いることができる。一組の実施形態において、本発明の実施形態を含むチャネルの最大断面寸法は、500ミクロン未満、200ミクロン未満、100ミクロン未満、50ミクロン未満、または25ミクロン未満である。
【0080】
「チャネル」は、本明細書に用いられるように、少なくとも部分的に流体の流れを対象にするアーティクル(基質)上の、またはそのアーティクル内の機構を意味する。チャネルは、任意の断面形状(円形、楕円形、三角形、不整形、正方形、または矩形など)を有することができ、覆われるようにすることもできるし、覆れないようにすることもできる。チャネルが完全に覆われる実施形態において、チャネルの少なくとも1つの部分は、完全に包囲される断面を有することができるし、または、全体のチャネルは、その全長に沿って、その入口および出口を除いて、完全に包囲されてもよい。チャネルは、また、少なくとも2:1(より典型的には、少なくとも3:1、5:1もしくは10:1、またはそれ以上)の縦横比(平均断面寸法に対する長さ)を有してもよい。開放チャネルは、液体輸送に対する制御を容易にする特性、(例えば、構造特性(細長い刻み)および/または物理的または化学的特性(疎水性対親水性))または流体上の力(例えば、含有力)を及ぼすことができる他の特性を一般に含むだろう。チャネル内の流体は、部分的にまたは完全にチャネルを埋めてもよい。開放チャネルが用いられるいくつかのケースでは、流体は、例えば、表面張力(すなわち、凹または凸メニスカス)を用いてチャネル内に保持されてもよい。
【0081】
チャネルは、例えば、約5mmまたは2mm未満、約1mmまたは約500ミクロン未満、約200ミクロン未満、約100ミクロン未満、約60ミクロン未満、約50ミクロン未満、約40ミクロン未満、約30ミクロン未満、約25ミクロン未満、約10ミクロン未満、約3ミクロン未満、約1ミクロン未満、約300nm未満、約100nm未満、約30nm未満、または約10nm未満の流体の流れに対して垂直に最大寸法を有する任意のサイズであってもよい。あるケースでは、チャネルの寸法は、流体がアーティクルまたは基質を介して自由に流出することができるように選択されてもよい。チャネルの寸法は、また、例えば、チャネル内の流体の一定の容積レートまたは直線流レートを可能にするために選択されてもよい。もちろん、チャネルの数およびチャネルの形状は、当業者にとって既知の任意の方法により変更することができる。あるケースでは、1つ以上のチャネルが用いられてもよい。例えば、互いに内部に配置されて、互いに隣接して配置された、互いに交差するように配置されたなどの場合、2つ以上のチャネルが用いられてもよい。
【0082】
本発明のマイクロ流体チップ(すなわち、バイオチップ)は、主としてプラスチックから構成することができる。有用な種類のプラスチックは、不飽和(部分的に不飽和)または飽和環状オレフィン共重合体「COC」、不飽和(部分的に不飽和)または飽和環状オレフィンポリマー「COP」、ポリ塩化ビニル(メチル)メタクリル酸塩「PMMA」、環状オレフィンポリカーボネート「PC」、ポリプロピレン「PP」、ポリエチレン「PE」、ポリエーテルエーテルケトン「PEEK」、ポリ塩化ビニル(ジメチルシロキサン「PDMA」およびポリイミド「PI」を含むが、限定はされない。用語「ポリ塩化ビニル(メタクリル酸メチル)」または「PMMA」は、本明細書で用いられるように、米国特許第5,561,208号、第5,462,995号および第5,334,424号(各々は参考文献として本明細書に援用される)に記載されていたポリマーと同様、Plexiglas(商標)、Limacryl(商標)、R−Cast(商標)、Perspex(商標)、Plazcryl(商標)、Acrylex(商標)、ACrylite(商標)、ACrylplast(商標)、Altuglas(商標)、Polycast(商標)およびLucite(商標)の商品名として販売されるものを含む(但し限定されない)メタクリル酸メチルの合成高分子を意味する。いくつかの実施形態において、増幅反応に利用されるための最大温度よりも高いガラス遷移温度を有するプラスチックが選択されてもよい。これらのプロセスおよび材料のいくつでも、本明細書に記載されたバイオチップを製造するために用いることができる。いくつかの実施形態において、射出成形、熱型押しおよび/または機械加工を含むことが用いられてもよい。例えば、バイオチップは、プラスチック基板(例えば、COCまたはCOPベースポリマー(現在、Topas(商標)、Zeonex(商標)、Zeonor(商標)およびApel(商標)の商品名で販売))の射出成形により用意することができる。この製造方法において、形成されるべき特徴の原板から構成される射出金型および金型インサートは、機械加工および後続の表面研磨により製造されてもよい。金型およびインサートは、ともに、基板層が製造されることを可能にし、形成された基板がチャネル、反応チャンバ機構およびビアホールを含むことを可能にしてもよい。いくつかの実施形態において、基板およびカバー層は、熱および圧力の印加によって接合された拡散になりえる。射出成形品は、肉眼的特徴(液だめなどの)および/または微細な特徴(毛状のバルブなどの)を含んでもよい。あるケースでは、これらの寸法が異なる特徴の射出成形に対するアプローチが変化する場合があるので、一組のパーツの微細な特徴および別の組のより大きな特徴を生成することは好ましいかもしれない。大きなリザーバ(一辺が数ミリメートル(約1〜50ミリメートル)で、かつ深さ数ミリメートル(約1〜10ミリメートル)で測定し、数百マイクロリットルまで(または、それ以上に)適合することができる)のために、従来の成形には、機械加工された射出成形ツールを用いることができる。いくつかの実施形態において、そのツールは、ツールの原板であるべき機械加工されたグラファイト電極を用いて鋼または他の金属の中に焼きつけることができる。材料に関するより多くの情報および製造方法は、「標的核酸の迅速な多重化増幅のための方法(Methods for Rapid Multiplexed Amplification of Target Nucleic Acids)」と題され、セルデン(Selden)らによって2008年4月4日に出願された米国特許出願第2009/0023603号公報(それは参考文献として本明細書に援用される)に含まれている。
【0083】
いくつかの実施形態において、マイクロ流体システムは、計器およびマイクロ流体チップ(すなわちバイオチップ)を含んでもよく、マイクロ流体チップは、計器と関連づけられる。様々な実施形態において、バイオチップは、バイオチップに統合された複数の特徴を有してもよい。例えば、バイオチップは、試料挿入、異物の除去、干渉核酸の除去、重要な細胞の濃度、核酸の増幅、温度サイクリング、流体の混合、シグナリング部分の検出などを容易にするコンポーネントを含んでもよい。いくつかの実施形態において、バイオチップの前処理コンポーネントは、試料を受け入れ、細胞を含む微粒子および異種の核酸の初期除去を実行し、重要な細胞を少容量に濃縮する。いくつかの実施形態において、スワブを受け入れることができるサンプルチューブが用いられてもよい。溶解および抽出ステップを実行するために、試料チューブが、例えば、溶菌液により満たされてもよい。以上に論じられたように、スワブは、血痕、指紋、水、エアフィルター、または臨床部位(例えば、口腔スワブ、傷スワブ、鼻スワブ)を含む多くの細胞含有部位に接して配置することができる。
【0084】
いくつかの実施形態において、バイオチップは、パティキュレートフィルタ、精製フィルター、ビーズまたは他の材料を含んでもよい。
【0085】
以上でより詳細に記載されたように、様々な溶解および抽出方法を用いることができる。いくつかの実施形態において、溶解および抽出は、106個以下の細胞を含む試料に対して実行することができる。用途に依存して、105未満、104未満、103未満、102未満、10未満(および多複写配列が解析されることになっている場合では1未満)の少数の開始細胞は、本発明のバイオチップおよび方法において利用できない。
【0086】
いくつかの実施形態において、核酸精製は、入出力チャネルの間に精製媒体を挿入することにより達成することができる。あるケースでは、精製媒体は、シリカファイバ系であり得るし、生体サンプルを溶解し、標的核酸を露出し、標的核酸を精製媒体に結合するためにカオトロピック塩試薬を用いることができる。次に、溶解物は、核酸を結合するために精製媒体を通じて、入力チャネルを介して移送されてもよい。いくつかの実施形態において、結合された核酸は、汚染物質を取り除くためにエタノール系バッファによって洗浄されてもよい。あるケースでは、これは、精製膜を通じて、入力チャネルを介して洗浄試薬を流出することにより達成することができる。いくつかの実例において、結合された核酸は、次に、適合するバッファ(例えば、薄塩バッファ)を流出することにより、膜から溶出されてもよい。他の固相は、当業者にとって既知であろう。本質的には、従来の設定における機能的な任意の核酸精製方法も、バイオチップに適応する場合がある。
【0087】
いくつかの実施形態において、バイオチップは、また、機能モジュールの統合するための異なるコンポーネントを含んでもよい。これらのモジュールは、例えば、バイオチップ上のポイントツーポイントからの液体の移送、流量レートに依存するかもしれないプロセスのための流量レートの制御(例えば、洗浄ステップ、粒子分離、および溶出)、バイオチップ上の時間および空間における流体運動のゲーティング(例えば、ある形式のバルブの利用を通じて)、および流体の混合を含む。
【0088】
様々な方法は、液体輸送および制御される流体の流れに用いることができる。典型的な方法の1つは、流体または干渉ガスまたは流体のいずれかに接するプランジャが流体を駆動する場合の、動作中にプランジャにより排出される容量に基づいた正確な距離の容積移送式ポンピングである。このような方法の一例は、シリンジポンプである。別の典型的な方法は、空気的に、磁気的に、またはそうでなければ始動される、統合化エラストマ膜の利用である。いくつかの実施形態において、これらの膜は、規定されたスペース内に流体を含むために、および/また流体の早すぎた混合または送出を防ぐために、バルブとして用いることができる。あるケースでは、直列に用いられた場合、これらの膜は、蠕動ポンプと類似したポンプを形成することができる。例えば、同期され連続する膜の操作によって、先行側の膜が動流体を受け入れるために(およびデバイスのチャネル内の排気も排出するために)開かれながら、流体は、その後続側から「押し出される」ことができる。流体を駆動し、流量レートを制御する別の方法は、先行、後続、またはその両方の流体のメニスカスにて圧力を変更することにより、流体自体に直接真空または圧力をかけることである。適切な圧力(例えば、0.05〜30ポンド平方インチの範囲)が印加されてもよい。流量レートは、また、流体チャネルのサイズを適切に合わせることにより制御することもできる。理論に束縛されるものではないが、流量レートは、流体および水力直径の間の圧力差の4乗に比例し、チャネルまたは液体のプラグの長さおよび粘性に反比例する。液体輸送のための他の方法は、当業者にとって既知であろう。
【0089】
いくつかの実施形態において、流体ゲーティングは、様々な有効なバルブを用いて達成することができる。あるケースでは、有効なバルブは、チップに直接組み込むことができる圧電バルブまたは電磁バルブを、いくつかの実例において、含むことができる。いくつかの実施形態において、バルブは、チップの外側にあってもよいが、メインチップ本体上のポートにより流体連通する。いくつかの実施形態において、毛状のマイクロバルブなどの受動的なバルブが用いられてもよい。あるケースでは、マイクロバルブは、例えば、流体に印加された圧力がクリティカルなバルブより下流である場合に、流れを妨害するために、界面エネルギーおよび/またはシャープエッジなどの形体を用いることができる。
【0090】
混合は、様々な手段において達成することができる。いくつかの実施形態において、拡散は、例えば、単一のチャネルまたはチャンバの中に2つの流体を共同注入することにより、流体を混合するために用いることができる。いくつかの実施形態において、混合は、改善させることができる。例えば、薄層化などの技術(流体流が1回以上分離され再結合される)が用いられてもよい。別の実施形態において、流体チャネル内のカオス的移流は、例えば、チャネル内のミクロ組織の利用を通じて、生成することができる。有効なポンプおよびバルブを用いるシステムにおいて、混合は、デバイス上の2点間の流体を複数回サイクリングすることにより達成することができる。
【0091】
典型的な統合化バイオチップは、図2に示される。デバイスは、試薬の分配および計測、試料との試薬の混合、チップの温度サイクリング部への試料の送出し、および温度サイクリングの機能を統合する。この典型的なバイオチップは、PCR増幅(101)、サンガー配列決定(102)、および限外ろ過(103)、および定量化(104)を実行するいくつかの機能的な領域を有する。個別の試料(精製されていない、部分的に精製された、または精製されたDNAを含む)は、試料投入ポート(105)に移送されてもよい。PCR反応溶液は、バイオチップに移送され、PCR試薬リザーバおよびチャネル(106)上の空気式圧力を介して、4つの(101内の)増幅反応チャンバ内の試料とともに混合されてもよい。温度サイクリングに続いて、増幅された試料は、領域102の配列決定するチャンバに(空気式圧力によって再び)移送されてもよい。いくつかの実例において、配列決定する反応溶液(例えば、サンガー配列決定反応溶液)は、バイオチップに移送され、配列決定する試薬リザーバおよびチャネル(107)上の空気式圧力を介して、4つの増幅された試料とともに混合されてもよい。サイクル配列決定に続いて、試料は、限外ろ過のための領域103に移送されてもよい。配列決定された材料が蛍光性に標識されるとともに、定量化は、領域104内で実行することができる。この場合には、定量化は、適正量の材料が後続の分離および検出工程に装填されたことを保証するために利用することができる。
【0092】
いくつかの実施形態において、任意のDNA精製に続いて、DNA溶液は、結合剤とともに混合されるためのチャンバに移送され、状況に応じて事前の増幅なしで、定量化のためのチャネル、領域、またはチャンバに移送されてもよい。あるケースでは、定量化に続いて、精製されたDNAは、後続の処理のために測定されるだろう。いくつかの実施形態において、試料(例えば、試験液)は、分析チャンバに送られてもよい。いくつかの実施形態において、試験液は、検出領域(例えば、領域104)内に配置されてもよい。あるケースでは、試験液は、流出または静止していてもよい。例えば、方法は、マイクロ流体チャネル内の検出領域に試験液を流出することを含む配置ステップを含んでもよい。別の例において、本方法は、検出の間にマイクロ流体チャネルの検出領域を通じて試験液を流出することを含む配置ステップを含んでもよい。分析チャンバまたは検出領域は、いくつかの実例において、チップの温度サイクリング部内にあってもよい。いくつかの実施形態において、配置ステップは、領域で静止する試験液を保持し、かつ領域を検出領域に変換するために領域と1列に並ぶように検出器を移動することを含んでもよい。
【0093】
以上に論じられるように、本システムは、温度サイクリング機能を含んでもよい。温度サイクリング機能は、2つ以上の温度間のサイクリングができてもよい。例えば、温度サイクリング機能は、加熱/冷却ができてもよい。あるケースでは、温度サイクリング機能は、バイオチップの温度サイクリング部における試料の温度を迅速に変化することができる。例えば、温度サイクリング機能は、1℃/秒、5℃/秒、10℃/秒、20℃/秒、30℃/秒、50℃/秒、100℃/秒、または200℃/秒のレートで試料の温度を変化することができてもよい。温度サイクリング機能は、また、特定の温度で試料の温度を一時期保持することができてもよい。
【0094】
いくつかの実施形態において、分析チャンバは、入力チャネルと出力チャネルとの間に製造されてもよい。あるケースでは、本システムは、試料が分析チャンバを通じて流出されることを可能にしてもよい。いくつかの実施形態において、分析チャンバは、分析チャンバ内のシグナリング部分の検出可能な信号を検出するための検出システムに近接してもよい。例えば、いくつかの実施形態において、試料からの蛍光が測定されることを可能にするために、分析チャンバは光学的励起および検出システムに近接してもよい。
【0095】
いくつかの実施形態において、本システムは、試料と相互に作用するための励起および/または検出サブシステムを含む。いくつかの実施形態において、励起サブシステムは、1つ以上の励起源を含む。いくつかの実施形態において、励起サブシステムは、励起および検出窓における励起源に焦点を合わせるおよび/または調整するために、レンズ、ピンホール、ミラー、および対物レンズを含む光学エレメントを備えた励起ビームパスを含む(但し、限定されない)。いくつかの実施形態において、試料の光学的励起は、1つ以上のレーザ(例えば、デュアルレーザーシステム)によって達成することができる。あるケースでは、レーザー発振波長は、可視領域(例えば、400〜650ナノメートルの間)であってもよい。例えば、固体レーザーは、約460ナノメートル、488ナノメートル、および532ナノメートルの発光波長を提供することができる。これらのレーザーは、例えば、コーヒアレント(Coherent)社(カリフォルニア州サンタクララ)からのコンパス(Compass)、サファイア(Sapphire)、およびヴェルディ(Verdi)の製品を含む。ガスレーザーは、約488ナノメートル、514ナノメートル、543ナノメートル、595ナノメートル、および632ナノメートルでの可視光線にエミッションとともにアルゴンイオンおよびヘリウムネオンを含むことができる。可視領域の発光波長を備えた他のレーザーは、クリスタレーザ(CrystaLaser)社(ネバダ州リノ)から市販で入手可能である。1つの実施形態において、488nmの固体レーザーサファイア(Sapphire)488−200(コーヒアレント社(カリフォルニア州サンタクララ))が利用できる。別の実施形態において、可視範囲を超える波長を備えた光源は、可視範囲(例えば、赤外または紫外発光色素)を超える吸収および/または発光スペクトルをもつ色素の励起のために用いることができる。その代わりに、光学的励起は、発光ダイオードを含む色素励起およびランプに適切な発光波長を備えた非レーザー光源の利用によっても達成することができる。
【0096】
いくつかの実施形態において、検出サブシステムは、1つ以上の光検出器と、波長分散デバイス(それは波長分離を実行する)と、励起および検出窓にあるシグナル伝達物体から発光された蛍光を収集するためのレンズ、ピンホール、ミラー、および対物レンズを含む(但し限定されない)1つまたは一連の光学エレメントとを含む。発光された蛍光は、単一の色素、または色素の組み合わせからなりえる。信号を識別して発光色素からのその寄与を究明するために、蛍光の波長分離を利用することができる。これは、例えば、ダイクロイックミラーおよび帯域フィルターエレメント(クローマ(Chroma)社(バーモント州ロッキンガム))を含む多数のベンダーから市販で入手可能)の利用によって達成することができる。この構成において、波長の1つの部分がパスの下方へ移動し続けるようにミラーによって反射され、かつ別の部分が通過する場合、発光された蛍光は、一連のダイクロイックミラーを介して通過する。例えば、ダイクロイックミラーの端に各自配置された一連の離散的な光検出器は、波長の特定範囲上の検出光に対して用いることができる。いくつかの実施形態において、検出に先立って波長領域をさらに狭くするために、帯域フィルターは、ダイクロイックミラーと光検出器との間に配置されることができる。波長分離信号を検出するために利用することができる光検出器は、フォトダイオード、アバランシェフォトダイオード、光電子増倍管モジュール、および電荷結合素子(CCD)カメラを含む。これらの光検出器は、ハママツ(Hamamatsu)社(ニュージャージー州ブリッジウォーター)などのサプライヤから市販で入手可能である。
【0097】
ある実施形態において、単一の光学機器列を定量化およびレーザー励起蛍光検出の両方に対して用いることは有用かもしれない。例えば、所定の光学コンポーネントを2つ以上の機能に用いることによって、計器の容量、重量、およびコストを低減することが可能である。単一の光学機器列は、定量化モジュールの光学的問い合わせチャンバに対して励起源を連結し、かつ分離および検出モジュールの励起および検出窓に対して連結する光学エレメントを含んでもよい。いくつかの実施形態において、光学機器列は、また、波長分離エレメントを通じて、および光検出器に対して、定量化モジュールの光学的問い合わせチャンバ(すなわち、分析チャンバ)および分離および検出モジュールの励起および検出窓からの光を結合してもよい。いくつかの実施形態において、光学エレメントは、レンズ、ミラー、ダイクロイックミラー、帯域フィルター、スキャナ、並進ステージ、光源、および/または検出器を含む。
【0098】
一般に、光学機器列は、以下の対物レンズの1つ以上を達成してもよい。あるケースでは、光学機器列は、光学的問い合わせチャンバに対して効率的に励起源を連結することにより、励起効率を最大限にしてもよい。あるケースでは、光学機器列は、分離および検出モジュールの励起および検出窓に対して効率的に励起源を連結することにより、励起効率を最大限にしてもよい。あるケースでは、光学機器列は、光学的問い合わせチャンバと検出器との間の損失を最小限にすることにより、蛍光収集効率を最大限にしてもよい。あるケースでは、光学機器列は、励起および検出窓と検出器との間の損失を最小限にすることにより、蛍光収集効率を最大限にしてもよい。あるケースでは、光学機器列は、励起パスと検出パスとの間の共有エレメントの数を最大限にすることにより、光学エレメントの数を最小限にしてもよい。あるケースでは、光学機器列は、定量化モジュールと分離および検出モジュールとの間の共有エレメントの数を最大限にすることにより、光学コンポーネントの数を最小限にしてもよい。あるケースでは、光学機器列は、定量化モジュールと分離および検出モジュールとの励起に対して単一のレーザーを用いてもよい。あるケースでは、光学機器列は一般的な波長分離および検出モジュールをマイクロ流体工学の定量化およびマイクロ流体の分離および検出モジュールに対して用いてもよい。あるケースでは、光学機器列は、市販で入手可能なコンポーネントを用いて、における、移送の振動および温度の幅広い変動に耐えることができるコンポーネントを選択してもよい。
【0099】
図3および図4は、マイクロ流体工学の定量化および分離および検出の両方のための光学機器列構成の1つの実施形態の概略図を示す。励起パスは、バイオチップの定量化または分離および検出部分に対してビームパスが方向づけられることを可能にする、レーザー源(201)、ショートパスダイクロイックミラー(202)、並進ミラー(209)、および固定ミラー(208)対を含む。実例において、並進ミラー(209)が定量化位置にある場合、励起ビームは、レンズ(203)、第1の走査ミラー(205)、およびレンズおよび対物レンズのアセンブリ(204)に対して方向づけられてもよい。走査ミラー(205)は、バイオチップ内の定量チャネル(206)の各々に励起ビームを方向づけてもよい。その代わりに、分離および検出位置での並進ミラー(209)により、励起ビームは、レンズ(203b)、第2の走査ミラー(205b)、およびレンズおよび対物レンズのアセンブリ(204b)に対して方向づけられてもよい。第2の走査ミラー(205b)は、バイオチップ内の分離および検出チャネル(207)の各々に励起ビームを方向づけてもよい。この構成において、レーザー源(201)は、定量化および検出および分離ビームパスに対して共通である。レーザーに対する別の光学的励起ソースは、LEDおよびランプを含む。
【0100】
検出ビームパスは、波長分離および検出エレメント(211)、ピンホール(210)およびレンズ(203)を含んでもよい。検出ビームパスおよび励起ビームパスは、ダイクロイックミラー(202)から定量チャネル(206)、およびダイクロイックミラー(202)から分離および検出チャネル(207)まで、共通要素を共有してもよい。波長分離エレメントは、入射する蛍光の波長成分を分割するために一組のダイクロイックミラーおよび帯域フィルターを含んでもよい。これらは、個別素子でありうるし、個別素子は、単一の半組立部品において統合化できる。その代わりに、波長分離は、スペクトルグラフまたはプリズムにより達成することができる。検出エレメントは、複数のアノードを備えた離散的または統合化されたモジュールになりえるPMTを含む。この光学機器列構成において、波長分離および検出モジュール(211)は、定量化および分離および検出モジュールに共通であってもよい。
【0101】
この光学機器列において、並進ミラー(209)および固定ミラー(208)は、マイクロ流体の定量化、またはマイクロ流体の分離および検出のための励起および検出ビームパスを設定するために用いられてもよい。マイクロ流体の定量化のためのチャネル間の選択は、第1の走査ミラー(205)により達成されてもよいし、マイクロ流体の分離および検出のためのチャネル間の選択は、第2の走査ミラー(205b)により達成されてもよい。図3の概略図は、定量化チャンバを励起し問い合わせるように構成された光学機器列を示す。図4の概略図は、分離および検出モジュールの分離および検出チャネルから励起し検出するように構成された光学機器列を示す。
【0102】
図5および図6は、マイクロ流体の定量化および分離および検出の両方に用いることができる代替の光学機器列の概略図を示す。励起パスは、バイオチップの定量化または分離および検出部分に対してビームパスが方向づけられることを可能にするレーザー源(201)、ショートパスダイクロイックミラー(202)、並進ミラー(209)、および固定ミラー(208)対から構成される。実例において、並進ミラー(209)が定量化位置にある場合、励起ビームは、レンズ(203c)および第1ミラー(205c)および第2ミラー(205d)に対して方向づけられてもよい。次に、ビームは、並進ミラーアセンブリ(212)に対して方向づけられてもよい。このアセンブリは、プログラミング可能な並進ステージ上に搭載されてもよいミラーを含む。並進ミラーアセンブリ(212)は、バイオチップ内の定量チャンバ(206)の各々に励起ビームを方向づけることができる。その代わりに、分離および検出位置での並進ミラー(209)により、励起ビームは、レンズ(203b)、第2の走査ミラー(205b)、およびレンズおよび対物レンズのアセンブリ(204b)に対して方向づけられてもよい。第2の走査ミラー(205b)は、バイオチップ内の分離および検出チャンバ(207)の各々に励起ビームを方向づけてもよい。この構成において、レーザー源(201)は、定量化および分離および検出ビームパスに共通であってもよい。別の光学的励起ソースは、LEDおよびランプを含む。
【0103】
検出ビームパスは、波長分離および検出エレメント(211)、ピンホール(210)およびレンズ(203)を含む。検出ビームパスおよび励起ビームパスは、ダイクロイックミラー(202)から定量チャネル(206)まで、およびダイクロイックミラー(202)から分離および検出チャネル(207)まで、共通要素を共有してもよい。波長分離エレメントは、入射する蛍光の波長成分を分割するために一組のダイクロイックミラーおよび帯域フィルターを含む。これらは、個別素子でありうるし、個別素子は、単一の半組立部品において統合化できる。その代わりに、波長分離は、スペクトルグラフまたはプリズムにより達成することができる。検出エレメントは、複数のアノードを備えた離散的または統合化されたモジュールになりえるPMTを含む。この光学機器列構成において、波長分離および検出モジュール(211)は、定量化および分離および検出モジュールに共通であってもよい。
【0104】
この光学機器列において、並進ミラー(209)および固定ミラー(208)は、マイクロ流体の定量化またはマイクロ流体の分離および検出のための励起および検出ビームパスを設定するために用いられてもよい。マイクロ流体の定量化のためのチャネル間の選択は、並進ミラーアセンブリ(212)により達成されてもよいし、マイクロ流体の分離および検出のためのチャネル間の選択は、第2の走査ミラー(205b)により達成されてもよい。図5の概略図は、定量化チャンバを励起し問い合わせるように構成された光学機器列を示す。図6の概略図は、分離および検出モジュールの分離および検出チャネルから励起し検出するように構成された光学機器列を示す。
【0105】
第3のアプローチは、レーザー、LED、またはランプになりうる細密化された励起源、波長分離エレメント、および検出器(それらのすべては並進ステージ(213)(図7)上に搭載されてもよい)の利用である。並進ステージは、定量チャネル(206)の各々が問い合わせられることを可能にすることができる。このアプローチにおいて、定量化システムのための励起、波長分離および検出モジュールは、分離および検出システムから独立していてもよい。分離および検出のための光学機器列は、図3、図4、図5および図6に記載されるエレメントを含むことができる。
【0106】
定量化チャネルの問い合わせのための第4のアプローチは、レーザー、LED、またはランプを用いて定量化チャンバをすべて同時に励起することである。すべての定量化チャンバからの蛍光は、レンズによって集められ、蛍光の波長成分を空間的に分離するために回折素子を介して通過されてもよい。これは、次に、CCDカメラまたは2次元の検出器アレイ上で画像化されてもよい。この構成において、検出器アレイの1つの軸は、定量化チャンバのチャネルに関連することができ、検出器アレイの別の軸は、蛍光波長に関連することができる。分離および検出のための光学機器列は、図3、図4、図5および図6に記載されるエレメントを含むことができる。この構成において、励起源は、定量化モジュールと分離および検出モジュールの両方に共通になりえる。
【0107】
1つの実施形態において、波長成分は、ダイクロイックミラーおよび帯域フィルターの利用によって分離され、これらの波長成分は、光電子増倍管(PMT)検出器(H7732−10(ハママツ(Hamamatsu)社))により検出される。ダイクロイックミラーおよび帯域コンポーネントは、PMTの各々の入射光線が蛍光染料の発光波長に対応する狭い波長域から構成されるように、選択されることができる。帯域は、1〜50nmの波長領域の帯域を備えた蛍光発光ピークの中心に集められるように選択されてもよい。システムは、1、2、3、4、5、6、7またはさらに8つの色検出ができ、発光された蛍光を8つの別個の色に分割するために、1、2、3、4、5、6、7またはさらに8つのPMTおよび対応する一組のダイクロイックミラーおよび帯域フィルターにより設計されることができる。8以上の色素は、付加的なダイクロイックミラー、帯域フィルターおよびPMTを適用することにより検出することができる。図8は、1つの実施形態による、離散的な帯域フィルターおよびダイクロイックフィルタの具体化のためのビームパスを示す。この波長識別および検出構成の統合化バージョンは、H9797R(ハママツ(Hamamatsu)社(ニュージャージー州ブリッジウォーター))である。
【0108】
蛍光信号を作り上げる色素を識別する別の方法は、プリズム、回折格子、透過型回折格子(ソーラボ(ThorLabs)社(ニュージャージー州ニュートン)およびニューポート(Newport)社(カリフォルニア州アーヴィン)を含む多数のベンダーから市販で入手可能)、およびスペクトルグラフ(ホリバ・ジョバンイボン(Horiba Jobin−Yvon)社(ニュージャージー州エジソン)を含む多数のベンダーから市販で入手可能)などの波長分散方式エレメントおよびシステムの利用を含む。この実施形態において、蛍光の波長成分は、物理的空間にわたって分散してもよい。この物理的空間に沿って配置された検出エレメントは、光を検出し、波長との検出エレメントの物理的位置の相関を可能にしてもよい。この機能に適している典型的な検出器は、アレイ系を含み、マルチエレメントフォトダイオード、CCDカメラ、裏面薄化CCDカメラ、マルチアノードPMTを含む。当業者は、システムにおいて用いられる色素からの波長を識別することができるシステムをもたらすために、波長分散エレメントと光検出エレメントとの組み合わせを適用することができるだろう。
【0109】
別の実施形態において、励起した蛍光から波長成分を分離するために、スペクトルグラフが、二色性および帯域フィルターの代わりに用いられてもよい。典型的なスペクトルグラフ設計の詳細は、ジョン・ジェームズ(John James)「スペクトルグラフ設計原理(Spectrograph Design Fundamental)」ケンブリッジ、英国:ケンブリッジ大学出版局(2007年)において入手可能である。いくつかの実施形態において、505〜670runのスペクトル域を備えた凹面ホログラフィック格子を備えたスペクトルグラフP/N MF−34(P/N532.00.570)(ホリバ・ジョバンイボン(Horiba Jobin−Yvon)社(ニュージャージー州エジソン))は、本アプリケーションにおいて用いられてもよい。検出は、線形の32エレメントPMT検出器アレイ(H7260−20、ハママツ(Hamamatsu)社(ニュージャージー州ブリッジウォーター))により達成することができる。いくつかの実施形態において、収集された蛍光は、ピンホール上で画像化され、反射され、分散され、スペクトルグラフの出力ポートに取り付けられた線形のPMT検出器上に凹面ホログラフィック格子によって画像化されてもよい。あるケースでは、PMT系検出器の利用は、PMT検出器の低いダークノイズ、高感度、高ダイナミックレンジおよび早い応答特性を巧みに利用する。いくつかの実施形態において、励起する蛍光の検出のためのスペクトルグラフおよびマルチエレメントPMTの検出器の利用は、計器の検出システム(すなわち、ダイクロイックミラー、帯域通過および検出器)を物理的に再構成する必要性なしに、システムおよびレーン内に適用することができる色素の数および色素の発光波長における適応性を可能にする。いくつかの実施形態において、この構成から収集されるデータは、各レーンの各スキャンの可視波長範囲にわたる波長依存スペクトルであってもよい。あるケースでは、1スキャン当たりの最大限のスペクトルの生成は、試料内にありうる色素の発光波長および色素の数の両方に関して色素の適応性を提供する。さらに、分光計および線形のマルチエレメントPMT検出器の利用は、また、一連のPMTエレメントのすべてが並列に読出されてもよいような、非常に高速の読み出しレートを可能できる。図9は、1つの実施形態による、マルチエレメントPMTおよびスペクトルグラフの具体化のためのビームパスを示す。
【0110】
いくつかの実施形態において、計器は、複数のレーンを同時におよび/または複数の波長を同時に検出するために、観測動作モードを用いてもよい。1つの構成において、励起ビームは、同時にすべてのレーンで一斉に衝突されてもよい。いくつかの実施形態において、蛍光は、CCDカメラまたはCCDアレイなどの2次元の検出器によって集められてもよい。例えば、1次元の検出器は、物理的波長分離を表わしてもよいが、その一方で、別の次元は、空間またはレーン対レーンの分離を表わしていてもよい。
【0111】
複数サンプルの同時励起および検出のために、走査ミラーシステムは、バイオチップのレーンの各々を画像化するために、励起ビームパスおよび検出ビームパスの両方を操縦するために利用されてもよい。この動作モードにおいて、走査ミラーは、最初のレーンから最後のレーンまで、レーンからレーンへと連続して走査し、そして再び最初のレーンから最後のレーンまで再びプロセスを繰り返して、ビームパスを操縦する。レーンを探し出すアルゴリズムは、レーンの位置を識別するために用いられてもよい。
【0112】
同時のマルチレーンおよびマルチ色素の検出のための光検出システムの1つの実施形態は、図24に示される。蛍光励起および検出システム40は、記録(および究極的には解析)のために色素から1つ以上の光検出器に誘導された蛍光を集めて伝送する一方で、各々のマイクロチャネルの一部を通じてエネルギー源(例えば、レーザー光)を走査することにより、シグナリング部分(例えば、標的核酸に固定化されたシグナリング部分を含む結合剤のシグナリング部分)を励起する。1つの実施形態において、蛍光励起および検出アセンブリ40は、開口部42を通してレーザー60から発光されたレーザー光をテストモジュール55に伝送する(および光検出器64へ戻す)ためのレーザー60、スキャナ62、1つ以上の光検出器64、様々なミラー68、スペクトルグラフ、およびレンズ72を含む。スキャナ62は、テストモジュール55に関する様々なスキャニング位置に、入射するレーザー光を移動させる。具体的には、スキャナ62は、それぞれの別々のコンポーネントを検出するために、テストモジュール55内の各マイクロチャネルの適切な部分にレーザー光を移動させる。マルチエレメントPMT64(すなわち、光検出器)は、テストモジュール55からデータ(例えば、可変長のDNA断片からの蛍光信号)を収集し、ケーブルを通じてデータ収集およびストレージシステム(図示せず)にデータを電子的に提供する。1つの実施形態において、データ収集およびストレージシステムはオプションインダストリアルコンピュータ(Option Industrial Computers)社(カナダケベック州audreuil−Dorion13)から市販で入手可能な高耐久化コンピュータを含むことができる。
【0113】
いくつかの実施形態において、信号処理アルゴリズムは、データを訂正、フィルタリングおよび/または解析するために用いられてもよい。このプロセスは、呼出可能信号を捜し出し、信号のベースラインを訂正し、ノイズをフィルタリングし、色クロストークを除去および/または信号ピークの識別する、などのステップを含んでもよい。例えば、呼出可能信号を捜し出すステップは、閾値を用いることにより実行されてもよい。このプロシージャは、信号の先頭および末端から無関係のデータを取り除くために用いられてもよい。いくつかの実施形態において、例えば、信号がすべての検出色のための共通のベースラインを有するように、背景が信号から取り除かれてもよい。あるケースでは、信号から高周波騒音を取り除くためにローパスフィルタが適用されてもよい。
【0114】
1つの実施形態において、上記の構成物の1つ以上を含むキットが提供されてもよい。「キット」は、本明細書に用いられるように、例えば、先に記載されたように、典型的には、本発明の構成物の1つ以上を含むパッケージまたはアセンブリおよび/または本発明に関連づけられた他の構成物を定義する。キットの合成物の各々は、液体の形式で(例えば、溶液で)、固形(例えば、乾燥したパウダ)などで、提供されてもよい。本発明のキットは、あるケースでは、指示が本発明の構成物に関連づけられるためのものであることを当業者が認識するように、本発明の構成物に関して提供される任意の形式の指示を含んでもよい。例えば、その指示は、構成物および/またはキットに関連づけられた他の構成物の利用、変形、混合、希釈、保存、管理、アセンブリ、ストレージ、パッケージングおよび/または準備のための指示を含んでもよい。その指示は、このような指示(例えば、任意の方式において提供される、文書または出版物、口頭、聴覚(例えば、電話)、デジタル、光学、視覚(例えば、ビデオテープ、DVDなど)または電子通信(インターネットまたはウェブベースの通信を含む))を含むためにふさわしい手段として当業者によって認識可能な任意の形式において提供されてもよい。
【0115】
この記載において「標的核酸」「オリゴヌクレオチド」「結合剤」「核酸」「ストランド」および他の同種類のものなどの用語は、単数形で表す。当業者は、分子を記載するために用いられた多くの用語が、単数で用いられてもよく、かつ単数または多数のいずれかで表してもよいことを理解するだろう。例えば、標的核酸は、分析において結合剤によって検出されてもよいが、分析は、結合剤の多くの複製および標的核酸の多くの複製を必要としてもよい。このような実例において、用語は前後関係で理解されるべきである。このような用語は、単一の分子または複数の分子のいずれかの意味に限定されない。
【0116】
以下の例は、本発明のある実施形態を例証するように意図されるが、本発明の範囲を例示するわけではない。
【0117】
[実施例1]
この実施例は、以下において用いられるシステムを記載する。
【0118】
本システムは、標識されたDNA断片の分離および検出のための計器を含み、「標的核酸の迅速な多重化増幅のための方法(Methods for Rapid Multiplexed Amplification of Target Nucleic Acids)」と題され、セルデン(Selden)らによって2008年4月4日に出願された米国特許出願第2009/0023603号公報(その文献は参考文献として本明細書に援用される)に、より詳細に記載される。計器の耐久性は、現場および研究室での利用のため高められる。その計器は、低消費電力を有しており、低電圧指令73/23/EECの下で特徴づけられたCEである。DNA分離は、高電圧サブシステムを通して、適切なローディング、引き戻しおよび分離電圧を適用することにより、16試料のバイオチップおよびカスタムの篩マトリクス内で行われる。レーザー励起蛍光検出サブシステムは、バイオチップの励起および検出ゾーンを介して通過する標識されたDNA断片からの蛍光を励起し収集する。分離チャネルに沿って150V/cmおよび300V/cmの電界を印加することにより実行された分離は、それぞれ、28分および15分において完結する。このシステムは単一の塩基対解像度よりも効果的に高速の分離を提供し、かつ単一の複製標的のPCR増幅の産物を検出する
【0119】
[システム構成]
サブシステム(空気式サブシステム、温度サイクリングサブシステム、および分離および検出サブシステム)はラックマウント方式の耐久性を高められた工業用コンピュータによって制御される。このコンピュータは、標準サイズのデスクトップコンピュータの機能性を有しており、17インチのLCD表示装置、フルサイズのキーボード、およびマウスを含む。
【0120】
[流動性の操作計測]
バイオチップを通じての流体の流れは、流体チャネルの端部に配置されるポートに対する系統的な加圧によって達成される。毛状のバルブの破裂圧力未満の圧力が印加される場合、流体は、チャネルに沿って流出し、毛状のバルブで止まるだろう。バルブの破裂圧力よりも高い圧力が印加される場合、流体は、バルブを通じて流出するだろう。空気式系統は、また、膜を弁座に対して押しつけるための圧力の印加により、薄膜弁を閉じるために用いられる。薄膜弁の封止圧力は、適用される封止圧力に応じて増減する。選択されて出力に適用される5つの離散的な圧力レベルを供給するために、圧力は、小型の膜ポンプおよび圧力調整器によって生成される。本システムは、バイオチップ上のポートを通じて連結管に連結される8つの出力を提供する。空気式サブシステムは、所望の流れ制御を達成するためにコンピュータで制御される。このサブシステムは、バイオチップに対する特定の圧力レベルの系統的なアプリケーションを通じて、バイオチップ内の溶解およびPCRを実行するために流体の流れをもたらす。図10は、バイオチップの典型的な写真を示す。
【0121】
[温度サイクラーサブシステム]
温度サイクラーは、高性能のヒートシンクおよびファンアセンブリ(ヒートポンプ)上に取り付けられた高出力熱電モジュール(TEM)を含む。TEMと反応チャンバとの間の圧縮および効率的な熱の転送を供給するために、カバーによりバイオチップを締める。カバーに対する熱損失は、バイオチップとカバーアセンブリと間の絶縁材の層によって最小限にされる。TEMの表面および反応チャンバ内の温度センサは、設定値温度までの所望の迅速なランピングおよび前記設定値温度での安定度を可能にするためのフィードバックを行なう。TEM表面で測定された加熱/冷却レートは、21.6℃/秒および21.7℃/秒である。また、反応溶液の測定された加熱/冷却レートは、14.8℃/秒および15.4℃/秒である。反応溶液は、この温度サイクラー内で、急速の商用サイクラーと比較して7倍急速で加熱され冷却される。状態間の最小限の遷移時間は、バイオチップ内の反応溶液の迅速かつ制御された加熱/冷却を可能にする。図11および図12は、温度サイクラーの典型的な写真を示す。
【0122】
以上に記載された既存のTEM、ヒートシンク、およびファンアセンブリは、チップ室に直接取り付けられるように設計され、PCRチャンバをTEM上の中央におくように配置された。TEMの表面は、バイオチップとの接点を最大限にし、バイオチップ上のストレスを最小限にするように配置される。TEMの表面上に取り付けられた熱電対センサは、センサのためのポケットを取り付けることを可能にするようにバイオチップを設計することにより調節される。加熱における不統一を最小限にし、かつまた熱応答を最大限にするために、TEMと残りのチップ室との間の熱隔離は、断熱層により達成される。圧縮カバーは、精製モジュールおよびバイオチップの形式を収容するために変更され、TEMと反応チャンバとの間の効率的な熱転送のための所望の圧力を生成するために利用される。反応チャンバとカバーとの間の熱隔離は、反応チャンバの上に空気ポケットを組み立てることにより達成される。温度サイクラーの傾斜および性能は、バイオチップの16個のPCR反応チャンバ内の熱電対の配置により特徴づけられる。
【0123】
[分離端部検出サブシステム]
高電圧接続は、計器のカバーに取り付けられ、カバーが閉まっている場合、バイオチップに接触される。レーザー励起蛍光サブシステムは、光学ビームパスまたはサブシステムコンポーネントに対して変更なしで計器に統合化される。ヒーターサブシステムは。チップ室内に取り付けられる。
【0124】
[システムステータス]
温度サイクリングサブシステムは、サイクル番号、残りの工程所要時間、およびカレントブロックおよび溶液温度を含む装置ステータスをユーザに提供する。ユーザフィードバックは、キーボードを介して供給される。実行されたデータはすべて、制御コンピュータに格納され、イーサネットによってプロセスデータベースに転送される。計器上の分離および検出の間、制御コンピュータは、実行中であるステップを示す。さらに、分離チャネル電流および基板温度を含む16個のレーンおよびプロセスパラメータの各々のためのリアルタイムエレクトロフォレトグラムが表示される。機載コンピュータは、年次メンテナンスまでの残り時間、システム電源投入時自己診断テスト(POST)の結果、および故障または即時のメンテナンスを必要とする任意のサブシステムの名前について、ユーザに警告する。
【0125】
[実施例2]
この実施例は、TH01型ローカスプローブを用いて、マイクロ流体ピコグリーン分析によるDNA定量化を実証する。
【0126】
光学的に透明な反応チャンバを備えた射出成形の16個のレーンバイオチップは、以上に記載された光学システムを備えた反応生成物の問い合わせを可能にするために組み立てられた。バイオチップにおける各レーンは、約7マイクロリットルの反応混合を保持し、16個の個体試料の増幅を一斉に可能にする。先に記載されたように(ギース(Giese)ら「従来のマイクロ流体STR解析のための高速の多重化PCR(Fast Multiplexed PCR for Conventional and Microfluidic STR Analysis)」(2009年)日本法科学技術学会誌、54巻、6版、1287〜1296ページ)、PCR状態が実行された。
単一複製のヒトのチロシン水酸化酵素遺伝子、THO1(スワンゴ(Swango)ら「法医学的試料における核DNAの量および品質を評価するための多重qPCR分析の発展的な検証(Developmental validation of a multiplex qPCR assay for assessing the quantity and quality of nuclear DNA in forensic sample)」(2007年)、国際法医遺伝学会、170巻、1版、35〜45ページ)を標的とするために使用されたプライマー対は次のとおりだった。
TH01型フォワードプライマー:5’−AGG GTA TCT GGG CTC TGG−3’(配列ID番号:1)
TH01型リバースプライマー:5’−GCC TGA AAA GCT CCC GAT TAT−3’(配列ID番号:2)
9947AゲノムDNA(MCLab、サウスサンフランシスコ(カリフォルニア))のストック10ng/マイクロリットルは、反応混合に対して4マイクロリットル量におけるDNAの適正量を追加することにより、標準曲線を生成するために用いられた。この標準曲線は、未知の(ヒト/ヒト以外の)ゲノムDNA試料にフィットするデータに用いるためのゲノムDNA − 0ng、0.4ng、1ng、4ng、10ng、20ngおよび40ng − の7つの異なる濃縮物を含んだ。標準曲線試料は、4回繰り返して解析された。増幅は、[93℃で4秒、58℃で15秒、70℃で7秒]の28サイクルおよび70℃で90秒の最後の伸長反応によって追従された、93℃における20秒の活性化により始動された。完了時間は、約17分だった。
【0127】
増幅に続いて、ピコグリーン試薬(登録商標)(インビトロジェン(Invitrogen)社)は、TE−4(10ミリモルのトリス(pH8)、0.01mmEDTA)バッファに1:200で希釈され、9マイクロリットルの試薬が1マイクロリットルのPCR産物に追加された。結果として生じた溶液は、光から保護され、室温で5分間培養された。10のマイクロリットルの試料から、約6マイクロリットルが、計器レーザー検出のための分離および検出バイオチップのレーンの中に装填された。計器レーザーは、色素の光退色を回避するために、適切なレーザーパワー、ゲインおよび統合時間に設定された。レーザーは、20mWを出力するために設定され、OD2ニュートラルフィルター(ソーラボ(Thorlabs)社(ニュージャージー州ニュートン))は、出力電力を0.2mWに減ずるために用いられた。青色のPMTのゲインは、原寸大の30%に設定され、赤色、黄色および緑色のゲインは、0に設定され、リフレッシュレートは5Hzに設定された。
【0128】
試料は、4回繰り返して分析された。レーザシャッタが開かれると、信号は、最大値まで増加し、その後、低下し始めるだろう。最大信号からの蛍光信号強度1秒(5読み取り値)が記録された。投入DNAの増大につれて蛍光信号信号が増加したことが観察された。計器からの投入DNA対相対蛍光単位(RFU)のプロットは、R2=0.999を有しており、未知のDNA試料(図13)を推定するための標準曲線として用いられた。図14は、レーン変位の機能としてレーザー検出から出力されたRFUデータである。
【0129】
犬の口腔スワブ、バクテリア(セレウス菌)、イースト(サッカロミセス属セレビシアエ)、ヒトの口腔スワブ、およびヒトの全血が精製されたゲノムDNAは、分析を評価するために用いられた。バクテリアのDNAは、細菌細胞またはペレットから抽出された。犬(カニスファミリアス)のDNAは、口腔スワブから抽出された。ゲノムのイーストDNAは、ATCC(ヴァージニア州マナッサス)から入手された。抗凝血剤としてのEDTAを含む新鮮なヒトの全血試料は、Research Blood Components,L.L.C.(マサチューセッツ州ブライトン)から氷で入手された。ヒトの口腔スワブ試料は、ヒトの被検者の内部の頬面上で綿棒(Bode SecurSwab(商標))を上下に数回移動させることにより入手された。犬の口腔スワブ試料も同様に入手された。DNA精製はすべて、シリカDNA結合スピンカラムを介してグアニジン系溶解試薬および精製を用いて実行された。
【0130】
これらのDNA試料の濃度は、実験のときに生成された標準曲線からRFU値を推定することにより評価された。DNA濃度も、ナノドロップ(Nanodrop)分光測光器(サーモフィッシャーサイエンティフィック(Thermo Scientific)社(デラウェア州ウィルミントン))を用いて、UV吸光度によって測定された。表1に公表された値は、平均値±1標準偏差である。
【表1】

【0131】
ヒト以外のDNA試料は、ピコグリーン分析における背景蛍光信号のみを生成したが、UV吸光度によって検出することができる。対照的に、ヒト以外DNAにより混入されたヒトゲノムDNAの既知数は、ヒトのDNA寄与に対応する信号を生成した。ヒトのDNA源に対して260ナノメートルの吸光度から得られた値は、ピコグリーンカーブデータをあてはめたものからの値に接近していた。より高いヒトゲノムDNAテンプレートの存在下で出力蛍光信号が増加しただけでなく、データは、TH01型プライマーのヒトの特異性を実証した。
【0132】
従来の分析(例えば、BodeQuant;ボードテクノロジーグループ(The Bode Technology Group)社(バージニア州ロートン))に対するアプローチの有利性は、試料の量および増幅時間の両方において実質的な減少を含む。例えば、BodeQuantプロトコルに続く増幅は、25マイクロリットルの反応混合物および60分を超える10サイクルのプロファイルを必要とする。蛍光検出のために、BodeQuantは、プレートリーダー上での1ウェル当たり200のマイクロリットルの反応体積をもつ96ウェル分析を用いる。その上、プレートリーダー系分析は、マイクロ流体バイオチップ形式において統合するのが相当困難になりえる。対照的に、ここで記載されたマイクロ流体分析は、7マイクロリットルを用いており、28サイクル増幅は、17分で完結した。OD2減光フィルターの組み込みは、増幅サイクルの数および全体の工程所要時間のを著しく低減することができることを示す、レーザーパワーを100倍低減する。
【0133】
レーザー検出およびOD2光学フィルターにより、10マイクロリットルのピコグリーン反応溶液の約0.353ナノリットルが、30のマイクロメートルのレーザー励起ビーム径および0.5ミリメートルのチャンバ深さに基づいて、実際に励起され検出された。したがって、この構成において、システムの検出限界(LOD)は、DNAの0.005ピコグラムである。マイクロ流体量およびレーザー検出の組み合わせは、強力な分析に結びついた。OD2フィルターが利用されないならば、LODは0.05フェムトグラムである。チャンバ寸法は、所望すれば、均一のより小さなLODを可能にするために選択することができる。
【0134】
[実施例3]
この実施例は、Aluローカスプローブを用いて、マイクロ流体ピコグリーン分析によってDNA定量化を実証する。
【0135】
定量化のための反復性ローカスの利用は、反応時間のさらなる低減およびLODの改善を可能できる。ヒトのAlu配列は、ゲノムにおける何十万もの複製において存在する反復要素であり、Alu配列を標的とするプライマー対は、マイクロ流体の定量化に用いられた。
Aluフォワードプライマー:5’−GTC AGG AGA TCG AGA CCA TCC C−3’(配列ID番号:3)
Aluリバースプライマー:5’−TCC TGC CTC AGC CTC CCA AG−3’(配列ID番号:4)
高速のPCRサイクリングプロファイル反応および定量化は、93℃での20秒の活性化の改善された増幅プロトコルを備えた実施例2において記載されたように、[93℃で4秒、58℃で15秒、70℃で7秒]の15サイクルおよび70℃で90秒の最後の伸長反応によって追従された。完了時間は、約10分だった。計器からの投入DNA対相対蛍光単位(RFU)のプロットは、R2=0.999を有する(図15)。図16は、レーン変位の機能としてレーザー検出から出力されたRFUデータである。励起の間に、TH01型反応により用いられるものと比較して、振幅によってレーザーパワーの強度を弱めたフィルターは、色素の光退色を回避するために必然的に見出された。OD4減光フィルターは200mWに設定されたレーザーパワー、原寸大の30%に設定された青色のPMTのゲイン、0に設定された赤色、黄色および緑色のゲイン、および5Hzに設定されたリフレッシュレートとともに用いられた。レーザーパワーの設定およびフィルターの組み合わせにて、効果的なレーザーパワーは、実施例2の10%である。このデータは、増幅の間のサイクル数がさらに低減されたことを示唆する。
【0136】
この可能性をテストするために、15の試料が、10の増幅サイクル、2.5分ずつ縮める増幅時間を用いて、1、5、10および30ナノグラムの投入DNAにより各々定量化された。信号強度は、増加する投入DNAとともに増大する(図17)。1ngの投入に対して、ベースラインが差し引かれた信号強度は、10RFUの標準偏差および50%のCVを有する19.9RFUである。5ngの投入に対して、ベースラインが差し引かれた信号強度は、11RFUの標準偏差および17%のCVを有する68RFUである。
【0137】
ヒトゲノムDNA、ヒト以外のDNA、および混入されたヒトゲノムは、実施例2に示すように分析を評価するために用いられた。牛(ボースタウルス)および鶏(ガッルスドメスティクス)は、血液サンプルから抽出された。DNAはすべて、実施例2に示すように用意された。
【表2】

模擬の法医学的ケースワーク試料もまた鑑定に用いられた。スワブ上の湿式血液サンプルは、陶製タイル上に血液検査液の100マイクロリットルをピペットで取り、その後、綿棒により血液を収集することにより用意された。乾燥した血液サンプルが、同様に用意された(しかし夜通し乾くように放置された)。細胞試料は、ヒトの被検者の手のひらの上でスワブの頭(滅菌水により予め濡れている)の摩擦により収集された。接触試料は、1人のドナーによって数回処理された陶製タイル上で予め湿ったスワブを用いることにより用意された。DNA抽出はすべて、スワブからのゲノムDNAの分離のための製造業者のプロトコルに従うQIAmpキット(キアゲン(Qiagen)社(カリフォルニア州バレンシア))を用いて実行された。
【表3】

これらのデータに基づいて、マイクロ流体Aluピコグリーン分析が、ヒトのゲノムDNAの定量化に対して、非常に高感度で特有であることは明らかである。Alu増幅には、TH01型増幅よりも約100万倍の高い標的の有益性がある。したがって、増幅が100%効率的であるならば、28サイクルとは対照的に約8つの増幅サイクルの要件を表わす。Aluのケースでの10倍に低減されたレーザーパワーは、約3サイクルの付加的な必要とされるサイクルを表わす。理論上、これらの状態下では、Alu反応は、28サイクルのTH01型反応に匹敵する信号を生成するために、11サイクルを必要とする。2つのローカスの増幅は、恐らく同一ではないが、10サイクルにおいて観察された結果は、これらの理論考察とぴったり一致する。
【0138】
Aluプローブを用いて、マイクロ流体の容量とレーザー検出との組み合わせは、DNAの0.005ピコグラムのLODに対して結びつく。OD3と同等のレーザーフィルターの配置なしで、結果として生じるLODは、0.005フェムトグラムである。このLODは、TH01型プローブの利用、および実施例2の増幅および検出条件の10倍である。Aluプローブおよび状態は、また、サイクル数の大幅な減少を可能にする。いくつかの実施形態において、0.005未満のフェムトグラムのLODが必要とされるならば、増幅サイクル数、プローブの配列および効率、およびレーザーパワーの1つ以上を高めることができる。
【0139】
[実施例4]
この実施例は、サイバーグリーンI(SYBR Green I)分析によってDNA定量化を実証する。
【0140】
実施例3において記載されたAluプライマーを含む増幅反応コンポーネントは、トリスEDTAバッファ(pH8)におけるサイバーグリーンI(SYBR Green I)(インビトロジェン(Invitrogen)社)の1:60,000の稀釈液が、PCR混合に組み込まれたことを除いて用いられた。サイバーグリーンI(SYBR Green I)は、熱的に安定した蛍光染料であり、したがって、リアルタイムPCR分析におけるようにPCR混合に追加することができる。
【0141】
このより高速の分析の実行可能性をテストするために、標準較正曲線が生成され再生された。ゲノムの9947A DNA規格は、0ナノグラム、0.4ナノグラム、1ナノグラム、4ナノグラム、10ナノグラム、20ナノグラム、および30ナノグラムであった。増幅は、[93℃で4秒、58℃で15秒、70℃で7秒]の7サイクルおよび70℃で90秒の最後の伸長反応によって追従された、93℃における20秒の活性化により始動された。完了時間は6分だった。増幅に続いて、同じバイオチップは、実施例3に示したような光学的設定により、レーザー励起された。バイオチップにおけるPCRおよびレーン検出は、標準曲線の再現性を確認するために4回繰り返して実行され、その蛍光は、投入テンプレートDNAの増加とともに増大する。計器(図18)からの投入DNA対RFUのプロットは、R2=0.995により多項式のあてはめを示した。ピコグリーン色素の利用に対するこのアプローチの有利性は、全過程およびバイオチップ形式を簡易化する(例えば、ピコグリーン試薬を測定し、かつそれを後増幅反応とともに混合する必要性を省く)バイオチップの同一のチャンバにおいて増幅および検出を実行することができるということである。
【0142】
[実施例5]
この実施例は、分子ビーコンを用いて、混成分析によって事前の増幅をしないで、DNA定量化を実証する。
【0143】
増幅をしない直接混成は、ヒトのゲノムDNAを定量化するために利用された。2つのビーコンプローブは、それらが繰り返しヒトのAluエレメントを標的とするように、設計された。プローブ1は、PV92遺伝子に由来し、配列5’−GCC CGA TTT TGC GAC TTT GGA GGG C−3’(配列ID番号:5)を有する(配列ID番号:5)(ヒトAlu反復GenBank登録番号(Human Alu Repeat GenBank Accession Numbers):M57427.1/M33776、AF302689).プローブ2は、既知のAlu亜科の配列によって設計され、高度に保存された標的部位を選択していた。配列5’−CGC CTC AAA GTG CTG GGA TTA CAG GCG−3’(配列ID番号:6)は、より多くの高感度プローブであると予測された。両方のプローブは、5’末端にて取り付けられたフルオレセイン(fluorescein)(6−FAM(商標))および3’末端にて取り付けられた、アイオワブラック消光剤(Iowa Black Quencher)(IBRFQ)を有する(IDT(Integrated DNA Technologies)社(アイオワ州コーラルヴィル)。
【0144】
プローブ1に適した蛍光バッファは、40ミリモルのNaCl、5ミリモルのMgCl2、および10ミリモルのトリス−HCl(pH8.0)を含んだ。プローブ2に適した蛍光バッファは、1ミリモルのMgCl2、および20ミリモルのトリス−HCl(pH8.0)を含んだ。蛍光バッファは、高い信号対ノイズ比を示した人工のssDNA標的との混成に基づいて選択された。ハイブリッドおよびステム構体の溶融温度(Tm)は、IDT,SciToolsオリゴアナライザ(OligoAnalyzer)3.1、およびmfoldバージョン3.4プログラム(mfold version 3.4 programs)を用いて究明された。混成温度は、53℃(混成の温度Tmより下で、ステムの温度Tmよりも高い温度)に設定された。
【0145】
所望の蛍光バッファにおける22マイクロリットルの試料反応が、10マイクロリットルの分子ビーコンの2マイクロリットルにより用意され、ヒトゲノムDNAの濃度(0、4.5、9、18、32、50、100ナノグラム/マイクロリットル)を変化させた(ロシュ・アプライド・サイエンス(Roche Applied Science)社(インディアナ州インディアナポリス))。次に、約7マイクロリットルが、熱変性および混成のための実施例2〜実施例4のバイオチップに転送された。バイオチップのための温度プロフィールは、53℃で60秒間の混成および25℃で60秒間の冷却により追随される95℃で10秒間の変性の単一のサイクルにより始動された。次に、バイオチップは、続いて、計器から解析された。プローブ1が利用された場合、レーザーパワーは、20mWに設定された、青色のPMTのゲインは原寸大の30%に、残りのすべての色は0および10Hzのリフレッシュレートに設定された。但し、プローブ2に対して、OD2減光フィルターの利用は、必然的であり、残りの設定は、プローブ1のように実施された。これは、プローブ1に対してプローブ2の高められた感度を確認した。試料は、4回繰り返して評価され、一組の対照試料は、同様にしかしヒトゲノムDNAなしで、用意された。
【0146】
図19は、分子ビーコンプローブ1を用いて検出された、RFU対投入DNAの混成プロットである。陰性対照の平均RFU信号は、216RFUのSDを有する3427RFUであり、4.5ナノグラム/マイクロリットルの総投入に対して583RFUのSDを有する4641RFUであった。図20は、分子ビーコンプローブ2を用いる、混成プロットである。陰性対照の平均RFU信号は、33RFUのSDを有する3668RFUであり、4.5ナノグラム/マイクロリットルの総投入に対して83RFUのSDを有する4075RFUであった。ベースラインが差し引かれたRFUは、レーザーによって検出された実際の投入DNAに対してプロットされた。これは、0、4.5、9、18、32、50、100ナノグラム/マイクロリットルの全体のヒトゲノムDNAを、0、1.6、3.2、6.4、11.3、17.6、35.3ピコグラムのDNAにそれぞれ変換した。混成形成による信号の増加は、試料にある標的DNAの増大につれて高められた。データは、2つのプローブが、0ピコグラム〜1.6ピコグラムのDNAを連続して識別することを実証した。プローブ1を使用するLODは、1.6のピコグラムであった。プローブ2に対して、OD2レーザーフィルターなしで、分析は、約16フェムトグラムのDNAを検出することができる。このLODが、単一のヒト細胞(約6ピコグラム)内にあるDNAより1000倍少なく、微量法医学的証拠の効果的な定量化を可能にすることに留意されたい。
【0147】
当業者が認識するとともに、Aluビーコンに対する変更(例えば、より優れた消光効率を有する、より高度に保存された標的配列および連結される蛍光団を用いて)は、直接混成アプローチの感度およびLODをさらに向上させることができる。しかしながら、この実施例において用いられるAluプローブに関して、直接混成は、10サイクルのPCR−ピコグリーン分析とほぼ同じ感度を有している。但し、工程所要時間に関して、増幅分析をしない混成は、全体的な定量化を約5分短縮し、約2分のみを必要とした。さらに、直接混成は、大幅な全体経費の削減をもたらし、マイクロ流体バイオチップ上の実装場所(real estate)を必要とする酵素、dNTPs、およびPCRバッファが、反応に関係しないので、統合化マイクロ流体システムを簡易化する。最後に、臨床試料、環境上の試料、および法医学的試料において一般的であるPCR抑制剤は、混成反応を禁止するべきでない。
【0148】
[実施例6]
この実施例は、直接混成分子ビーコン分析の還元反応時間を実証する。
【0149】
分子ビーコンプローブ2のための反応状態は、実施例5のものと同様であるが、53℃で30秒間の混成および25℃で10秒間の冷却により追随される95℃で10秒間の変性が、単一サイクルにより実行された。同じ光学的設定も実施された。図21は、定量化された検出された実際のピコグラムDNAに変換されたRFU対投入DNAの混成プロットである。陰性対照の平均RFU信号は、105RFUのSDを有する3321RFUであり、1.6ピコグラムに対して61RFUのSDを有する3806RFUである。データは、分析に影響がなかった全体の定量化時間を130秒から50秒に低減することを示唆する。実際、さらなる最適化(改善されたプローブを有する(および有しない)は、分析時間を15秒未満(例えば、3秒間の変性、10秒間の混成、および1秒間の冷却)に低減することを可能にするだろう。
【0150】
[実施例7]
この実施例は、ヒト口腔スワブDNAを定量化するために、直接混成分子ビーコン分析を実証する。
【0151】
実施例6の標準曲線から、男女のヒトの被検者からの口腔スワブDNAの蛍光信号が推定され、UV吸光度から得られた値と比較された。
【表4】

【0152】
[実施例8]
この実施例は、直接混成分子ビーコン分析の特異性を実証する。記載されるように、ヒト以外のDNAが精製された。実施例6の標準曲線から、バクテリア、犬、および、鶏DNAからの蛍光信号が、再び推定され、UV吸光度から得られた値と比較された。さらに、既知のヒト口腔スワブのDNA試料は、これらの異なるバックグラウンドDNAにより混入された。
【表5】

ビーコン分析からのヒト以外のDNAは、わずかにバックグラウンドの上の蛍光信号を示したが、このアーティファクトは、恐らく緩衝効果によるものである。分析において用いられるバックグラウンドDNA試料は、蛍光バッファにおいてではなく、TE緩衝剤において再懸濁された。ビーコンバッファコンポーネントが検出された蛍光に寄与することができることは、先に示された。高速の直接混成は、不均一試料におけるヒト特有のDNA定量化を可能にする。
【0153】
[実施例9]
この実施例は、法医学的データベース試料による定量化の必要性をなくすことを実証する。
【0154】
大多数の試料は、500ナノグラム〜4マイクログラムのDNAを含むが、口腔のスワビングによって収集されたDNAの量は、高度に調整可能であり、約100ナノグラムから10マイクログラムを超えるまでの範囲に及ぶ。研究室において、精製されたDNAが定量化されるように、この可変性は、STRタイピングプロセスの全体に最小限の影響を及ぼし、DNAの所望量は、後続のPCR反応において利用される。
【0155】
口腔スワブDNAは、「核酸精製」と題され、2010年2月3日にセルデンらによって出願された米国特許出願番号第12/699,564号(それは参考文献によって本明細書に援用される)に記載されたものから改善されたグアニジン系シリカ結合アプローチを用いて精製された。実施例3に記載されたように、15人のヒトの被検者から口腔の細胞試料が入手された。スワブの軸体は、2ミリリットルの微小遠心管の中に適合させるスコアラインで切断された。グアニジン塩酸塩および清浄液を含む溶解バッファのマスタ混合およびプロテイナーゼK(キアゲン社(カリフォルニア州バレンシア)が用意された。0.5mgのプロテイナーゼKを含むこの500μLの溶菌液が、チューブの各々に転送された。その溶液は、5秒間の攪拌により徹底的に混合された。550μLの無水エタノールは、混合物に追加され、再び5秒間攪拌された。100μLの均質化された流入物は、手動でバイオチップの入力ポートの中に充填された。このバイオチップには、精製のための1.5ミリメートルのDNA結合性のシリカ膜がある。結合膜は、2ミリリットルのエタノール−イソプロピルアルコール−NaCl洗浄液により洗浄された。溶出に先立って、結合膜を30秒間乾かした。DNAは、600μLのTE−4(10ミリモルのトリス−HCl(pH8)および0.1ミリモルのEDTA)により溶出された。
【0156】
参照試料DNAの生成に続いて、7マイクロリットルのPCR反応混合物が含まれた3.4マイクロリットルのバイオチップに精製されたDNAおよび1X Powerplex16プライマー(Promega社(ウイスコンシン州マディソン))が用意された。定量化ステップが増幅に先立って実行されなかった(精製されたDNAの一定の容量が、増幅反応に対して常に用いられた)ことに留意されたい。制御として、TE−4におけるストックから希釈された標準規格の1ナノグラムの9947AゲノムDNAも増幅された。増幅は、93℃における20秒の活性化により始動され、[93℃で4秒、56℃で20秒、70℃で20秒]の30サイクルおよび70℃で90秒の最後の伸長反応によって追従された。完了時間は、約25分だった。
【0157】
計器からのDNA分析試料は、分離バイオチップの試料リザーバ内に、手動で試料をピペットで取ることにより用意された。特に、2.7マイクロリットルの増幅された産物、0.3マイクロリットルのHD400サイジング標準規格、および10マイクロリットルのHiDiは、ともに混合され、試料ウェルの中に充填された。試料およびバッファを充填した後に、バイオチップは、増幅されたDNAを分離し検出するために適用される電界により計器の中に配置された。計器および検出は、増幅された各口腔スワブDNA試料に対して複製して実行された。対応するローカスで、ヘテロ接合の対立遺伝子のピーク高さとの比較を可能にするために、所定のローカスにおけるホモ接合体の対立遺伝子のピーク高さは、2で除算された。1ナノグラムの投入する9947A制御DNAからのすべてのローカスの平均のピーク高さは、PCR反応の中への投入DNAの量を推測するために用いられた。この信号強度解析に基づいて、15の口腔スワブ抽出物からのDNAの量は、すべて1.26〜2.50ナノグラムの範囲内にあり、大部分の試料は1.5〜2.25ナノグラム/3.4マイクロリットルの範囲でPCRの中へ含まれた。
【表6】

スワブ精製における調整可能な修復および修復されたDNAの莫大な過剰量は、結合膜の結合能力を制御することにより対処された。図22は、この「カットオフ」アプローチを示す。DNA結合能力は、DNA結合に対して用いられた7ミリメートルのシリカ膜の層数に比例する。同様に、結合膜の結合能力は、また、結合膜の有効な直径に比例する。図23は、DNA投入の範囲にわたる、直径1ミリメートルの結合膜の結合性能を示す。DNA収率は、600ナノグラム未満の投入レベルに対してDNA投入レベルとともに直線的に増大し、その収率は、600ナノグラム(またはそれ以上)の投入に対して約300ナノグラムのDNAで飽和している。マイクロ流体DNA精製が増幅統合される設定(または、所望のとおり他の処理ステップ)において、修復されたDNAの範囲の情報は、バイオチップ設計における大幅な適応性を可能にする。法医学的参照試料の処理において、溶解物の破片は、精製されてもよい(溶解物材料の10分の1のみが精製されたように、PCRに用いられたDNAの1.26〜2.50ナノグラムが600マイクロリットルの溶出量における220〜440ナノグラムのDNAに変換することに留意)。精製されるべきDNAの量を低減することによって、精製媒体の結合能力は、付随的に低減されることができる。定量化をしない所定の定義された範囲内の精製された核酸を生成するための能力は、バイオチップ設計を簡易化することができ、さらに、コストを低減し、そしてさらに、プロセスタイミングを加速することができる。
【0158】
[実施例10]
この実施例は、特有の光学機器列に基づいた定量化のための励起および検出パラメータの開発を示す。
【0159】
DNAおよびピコグリーン挿入染料のマスタ混合物は、用意され、定量化バイオチップの中に挿入され、定量化計器により、励起および検出に用いられた。レーザー励起の下では、検知器信号の強度は、増加するPMTゲインとともに増大した。PMTゲインがそれらの作動範囲にわたって掃引された間、信号強度は、10RFUおよび10,600から1000倍に高められた(図24)。信号対ノイズ比は、PMTゲインの増加(30%までに設定されている)につれて増加し、30%以上のPMTゲインに対して約22で飽和させる。このデータセットは、PMTゲインが30%に設定されるとき、検出電子機器に関連づけられたノイズ寄与が無視できたことを示す。30%のゲイン設定値は、信号対雑音、信号強度、およびダイナミックレンジを最大限にするために利用のに最適であった(図25)。
【0160】
信号強度のレーザー励起の影響は、図26に示される。2つのデータセットは、光学的濃度4および2により、減光フィルターを用いて、試料での励起パワーをレーザー出力の10000倍および100倍低減するように生成された。該データは、両方のデータセットのための励起パワーとともに増加する信号強度を示す。試料上に入射される適度な励起パワー(0.02ミリワット)は、経時的に、比較的一定の信号強度を生成した。この信号強度は、試料における蛍光団の濃度に一致していた。試料上に入射されるハイレベルの励起(2ミリワット)は、試料における蛍光団数の独立したレベルに対する指数関数形崩壊を示す。試料上に入射されるハイレベルの励起は、光退色としても知られている蛍光団の光化学的破壊、および試料における蛍光活性の不可逆的損失に帰着した(図27)。これらの結果は、0.2ミリワットの試料励起パワーが定量化に最適であったことを示す。総合すれば、該結果は、30%のPMTゲインおよび0.2ミリワットの励起パワーが、最適な信号対雑音、感度、励起、および検出計器でのダイナミックレンジを達成するための設定値であることを示す。
【0161】
本発明のいくつかの実施形態が本明細書に記載され図示されたが、当業者は、本明細書に記載された機能を実行するためのおよび/または結果および/または1つ以上の有利性を取得するための様々な他の手段および/または構造を容易に予見するだろう。また、このような変更および/または変形の各々は、本発明の範囲内であるものと見なされる。より一般には、当業者は、本明細書に記載されたパラメータ、寸法、材料、および構成がすべて典型的な事例であることが目的であり、そして、実際のパラメータ、寸法、材料および/または構成は、本発明の教示が用いられる特有のアプリケーション(複数可)に依存することを、十分にかつ容易に理解するだろう。当業者は、単なるルーチン実験を用いて、本明細書に記載された本発明の特有の実施形態に対する多くの等価物を、認識または確認することができるだろう。したがって、前述の実施形態は、単なる例として示されており、本発明は、添付された請求項およびその等価物の範囲内で、特に記載され請求されたとおり以外に実施されてもよいことは理解されるべきである。本発明は、本明細書に記載された個別の特徴、システム、アーティクル、材料、キットおよび/または方法の各々を対象にする。さらに、このような特徴、システム、アーティクル、材料、キットおよび/または方法の2つ以上の任意の組み合わせは、このような特徴、システム、アーティクル、材料、キットおよび/または方法が相互に矛盾していないのであれば、本発明の範囲内に含まれている。
【0162】
すべての定義は、本明細書に定義され用いられたように、辞書の定義、参考文献によって組み込まれた文献における定義および/または定義された用語の通常の意味を統制することを理解すべきである。
【0163】
不定冠詞「1つの(a)」「1つの(an)」は、本明細書および特許請求の範囲において用いられたように、別途明示されない限り、「少なくとも1つの(at least one)」を意味することを理解するべきである。
【0164】
語句「および/または(and/or)」は、本明細書および特許請求の範囲において用いられたように、そのように結合されたエレメント(すなわち、結合的にいくつかのケースに含まれるエレメントおよび分離的に他のケースに含まれるエレメント)の「いずれか一方または両方(either or both)」を意味することを理解するべきである。「および/または(and/or)」によりリストされた複数のエレメントは、同一の種類(すなわち、そのように結合された「1つ以上の(one or more)」エレメント)であるものと解釈されるべきである。他のエレメントは、「および/または」句によって特に識別されたエレメント以外に(特に識別されたエレメントに関連してもしなくても)任意に存在してもよい。したがって、非限定的な例として、「Aおよび/またはB(A and/or B)」への言及は、「〜を備える(〜を含む)(comprising)」などの開放式の用語(open−ended language)に関連して用いられた場合、1つの実施形態において、Aのみ(状況に応じてB以外のエレメントを含む)を表わすことができるし、別の実施形態において、Bのみ(状況に応じてA以外のエレメントを含む)を表わすことができるし、さらに別の実施形態において、AおよびBの両方(状況に応じて他のエレメントを含む)を表わすことなどができる。
【0165】
明細書および特許請求の範囲において用いられたように、「または(or)」は、上記で定義されたように「および/または(and/or)」と同じ意味を有することを理解されるべきである。例えば、リストアップされたアイテムを区別する場合、「または(or)」または「および/または(and/or)」は、包括的である(すなわち、少なくとも1つの(但し、1つ以上も含む)複数の(またはリストの)エレメント(および状況に応じて付加的なリストアップされていないアイテム)の包括)と解釈されるべきである。「1つのみの(only one of)」または「厳密に1つのみの(exactly one of)」または、特許請求の範囲において用いられた場合の「〜により構成される(consisting of)」などの別途明示された用語だけは、複数の(またはリストアップされた)エレメントの厳密な1つのエレメントの包括を表わすだろう。一般に、本明細書に用いられたように、用語「または(or)」は、「いずれか(either)」「1つの(one of)」「1のみの(only one of)」または「厳密に1つの(exactly one of)」などの排他性の用語により先行された場合のみ、排他的な選択肢(すなわち「1つまたは別のもの(但し両方ではない)(one or the other but not both)」を示すものと解釈されるべきである。特許請求の範囲において用いられた場合、「〜により本質的に構成される(consisting essentially of)」は、特許法の分野において用いられるような通常の意味を有するものとする。
【0166】
明細書および特許請求の範囲において本明細書に用いられるように、語句「少なくとも1つの(at least one)」は、1つ以上のエレメントのリストを参照して、リストアップされたエレメントのいずれか1つ以上のエレメントから選択された少なくとも1つのエレメントを意味することは理解されるべきである。但し、エレメントのリストに特にリストアップされたうちのすべてのエレメントの少なくとも1つを必ずしも含まず、かつリストアップされたエレメントの任意の組み合わせを必ずしも除外しない。この定義は、また、語句「少なくとも1(at least one)」が指すエレメントのリストのうちで特に識別されたエレメント以外に(特に識別されたエレメントに関連してもしなくても)エレメントが任意に存在してもよいことを認める。したがって、非限定的な例として、「AおよびBの少なくとも1つ」(または、同等に、「AまたはBの少なくとも1つ」、または、同等に、「Aおよび/またはBの少なくとも1つ」)は、1つの実施形態において、少なくとも1つ(状況に応じて1つ以上を含む)のA(Bはない)(および状況に応じてB以外のエレメントを含む)を表わすことができ、別の実施形態において、少なくとも1つ(状況に応じて1つ以上を含む)のB(Aはない)(および状況に応じてA以外のエレメントを含む)を表わすことができ、さらに別の実施形態において、少なくとも1つ(状況に応じて1つ以上を含む)のAおよび少なくとも1つ(状況に応じて1つ以上を含む)のB(および状況に応じて他のエレメントを含む)などを表わすことができる。
【0167】
また、別途明示されない限り、1つ以上のステップまたは機能を含む本明細書において請求された任意の方法において、該方法のステップまたは機能の順序は、該方法のステップまたは機能が詳述される順序に必ずしも限定されていないことは理解されるべきである。
【0168】
特許請求の範囲において、上記明細書と同様に、「〜を備える(comprising)」「〜を含む(including)」「〜をもつ(carrying)」「〜を有する(having)」「〜を含む(containing)」「〜を含む(involving)」「〜を保持する(holding)」「〜により構成される(composed of)」などのようなすべての移行句は、開放式であるように(すなわち、含むこと意味する(但し、限定されない)ように)理解されるべきである。「〜により構成される(consisting of)」および「〜により本質的には構成される(consisting essentially of)」の移行句だけは、米国特許審査基準セクション2111.03に記載されるように、それぞれ閉鎖式の移行句または半閉鎖式の移行句であるものとする。
【技術分野】
【0001】
[政府からの助成金]
米国政府は、本発明における一括払いライセンスを有しており、米国司法省、司法プログラム局、国立司法研究所によって授与された(交付番号:NIJ 2008−DN−BX−K009)の条件により与えられるような適切な条件で他にライセンスを与えるために特許権者を必要とする限られた状況における権利を有している。
[関連出願]
【0002】
本出願は、セルデン(Selden)らによって「法医学的DNAの定量のための改善された方法(Improved Methods for Forensic DNA Quantitation)」と題されて2009年6月15日に出願された米国特許仮出願番号第61/268,770号(参考文献として本明細書に援用される)の権益を主張する。
【0003】
本明細書に記載されるものは、核酸定量化のための進歩性のある方法およびデバイスであり、特に、核酸定量化のためのマイクロ流体方法およびデバイスである。
【背景技術】
【0004】
核酸定量化は、幅広い種類の分析およびアプリケーションにおいて重要または望ましいステップである。例えば、核酸定量化は、人間(ヒト)の法鑑定における重要なステップである。例えば、DNAの短鎖縦列反復配列(STR)解析は、多くの場合、多重化PCR分析上に基づき、このような分析は、一般に、試料DNA濃度の厳密に規定された範囲内において最も確実である。分析において試料DNAが用いられなさ過ぎると、対立遺伝子のピーク高さのインバランスと対立遺伝子のドロップアウトとを含むアーティファクトが生じる場合がある。試料DNAがあまりに用いられ過ぎると、増大したスタッター(stutter)、非特異性のバンド生成、不完全な非鋳型添加、および不完全な色分解に起因するプルアップピークを含むアーティファクトが生じる場合がある。これらのアーティファクトは、STRプロファイルの解釈の問題に結びつく場合があるが、試料DNAの適正量を用いることにより緩和することができる。別の例において、法医学的ケースワーク試料は、試料におけるDNA全体の一因となる(但し、存在する場合)人類以外の哺乳類、バクテリア、または菌のDNAにより汚染されるポテンシャルを有する。したがって、犯罪現場試料の鑑定に対して、DNA諮問委員会は、全体のDNA定量化よりむしろ、ヒトの特定の定量化の利用をFBIに勧める。これは、バクテリア、菌、または他の人類以外のDNAが試料に存在するとしてもヒトのDNAの適正量が増幅されることを保証することができる。
【発明の概要】
【発明が解決しようとする課題】
【0005】
本明細書に記載されるものは、核酸定量化のための進歩性のある方法およびデバイスであり、特に、核酸定量化のためのマイクロ流体方法およびデバイスである。
【0006】
1つの態様において、標的核酸を含むまたは含むと推測される試料流体において標的核酸を定量化する方法が提供される。該方法は、マイクロ流体チャネルにおいて、試料流体とシグナリング部分を含む結合剤とを組み合わせるステップであって、結合剤は、試験液を形成するために標的核酸に対して固定化されるステップと、マイクロ流体チャネルにおける検出領域に試験液を配置するステップと、シグナリング部分を検出するステップと、試料流体と結合剤とを組み合わせてから1時間以内に試料流体における標的核酸を定量化するステップとを備える。
【0007】
別の態様において、標的核酸を含むまたは含むと推測される試料流体において標的核酸を定量化する方法が提供される。該方法は、マイクロ流体チャネルにおいて、試料流体とシグナリング部分を含む結合剤とを組み合わせるステップであって、結合剤は、試験液を形成するために標的核酸に対して固定化されるステップと、マイクロ流体チャネルにおける検出領域に試験液を配置するステップと、シグナリング部分を検出するステップと、試料流体における標的核酸を定量化するステップとを備え、標的核酸は、1ナノグラム/マイクロリットル未満の濃度を有している、または試料流体中に合計量で1ナノグラム未満含まれる。
【0008】
なお別の態様において、標的核酸を含むまたは含むと推測される法医学的試料流体において標的核酸を定量化する方法が提供される。該方法は、マイクロ流体チャネルにおいて法医学的試料流体とシグナリング部分を含む結合剤を含むプローブ流体とを組み合わせるステップであって、法医学的試料流体における標的核酸が増幅されていないステップと、マイクロ流体チャネルにおける検出領域に組み合わされた流体を配置するステップと、シグナリング部分を検出するステップと、試料流体における標的核酸を定量化するステップとを備える。
【0009】
さらに別の態様において、標的核酸を含むまたは含むと推測され、混入するヒト以外の核酸をさらに含む試料流体において標的核酸を定量化する方法が提供される。該方法は、マイクロ流体チャネルにおいて、試料流体とシグナリング部分を含む結合剤を含むプローブ流体とを組み合わせるステップであって、試料流体における標的核酸が増幅されていないステップと、マイクロ流体チャネルにおける検出領域に組み合わされた流体を配置するステップと、シグナリング部分を検出するステップと、試料流体における標的核酸を定量化するステップとを備える。
【0010】
なお別の態様において、標的核酸を含むまたは含むと推測される試料流体において標的核酸を定量化する方法が提供される。該方法は、統合化レーザーを備える検出器を備える電子装置に連結されたマイクロ流体デバイスを準備をするステップと、前記マイクロ流体デバイスのマイクロ流体チャネルにおいて前記試料流体とシグナリング部分を含む結合剤とを組み合わせるステップであって、結合剤は、標的核酸に対して固定化されるステップと、電子装置の検出器に作用する近接に配置されたマイクロ流体チャネルの検出領域に組み合わされる流体を配置するステップと、前記統合化レーザーを用いて、シグナリング部分を照射するステップと、試料流体における標的核酸を定量化するステップとを備える。
【0011】
さらに別の態様において、標的核酸を含む試料流体において標的核酸を操作する方法が提供される。該方法は、検出器を備える電子装置に連結された、試料操作のための複数のマイクロ流体チャネルおよびアクティブな領域を備えるマイクロ流体デバイスを準備をするステップと、マイクロ流体デバイスのマイクロ流体チャネルにおいて試料流体とシグナリング部分を含む結合剤とを組み合わせるステップであって、結合剤は、標的核酸に対して固定化されるステップと、電子装置の検出器に作用する近接に配置されたマイクロ流体チャネルの検出領域に組み合わされる流体を配置するステップと、試料流体における標的核酸を定量化するステップと、バイオチップのアクティブな領域に、試料流体の選択された量を方向づけるステップであって、前記選択された量は、前記定量化ステップの結果に基づいて、少なくとも部分的に究明されるステップとを備える。
【0012】
なお別の態様において、標的核酸の増幅のために標的核酸を備える試料を用意する方法が提供される。該方法は、試料操作のための少なくとも1つのマイクロ流体チャネルと、アクティブな領域とを備えるマイクロ流体デバイスを準備をするステップであって、少なくとも1つの領域は、試料から核酸を精製するように構成されたステップと、標的核酸の未知の可変量をもたらす収集方法によって試料を取得するステップと、マイクロ流体デバイスのマイクロ流体チャネルの中に試料を挿入するステップと、複製可能な量の精製された標的核酸を生成するために試料から核酸を精製するように構成されたマイクロ流体デバイスの領域で試料における標的核酸を精製するステップと、精製された標的核酸を定量化せずに、精製された標的核酸の複製可能な量を増幅するステップとを備える。
【0013】
さらに別の態様において、標的核酸を含むまたは含むと推測される法医学的試料流体において標的核酸を定量化する方法が提供される。該方法は、マイクロ流体チャネルにおいて、法医学的試料流体と、シグナリング部分を備えかつ標的核酸のための独特の混成特異性を有する分子ビーコンプローブを含むプローブ流体とを組み合わせるステップであって、法医学的試料流体における標的核酸が増幅されていないステップと、マイクロ流体チャネルにおける検出領域に組み合わされた流体を配置するステップと、シグナリング部分を検出するステップと、試料流体における標的核酸を定量化するステップとを備える。
【0014】
さらに別の態様において、バイオチップ内の複数の機能的な領域における蛍光団の励起および検出のための計器が提供される。該計器は、励起源と、励起源からバイオチップにおける複数の機能的な領域にビームを方向づける操縦エレメントであって、励起源は、複数の機能的な領域の少なくとも1つからの信号が核酸の定量化を可能にするように、検出される信号を生成する複数の機能的な領域における蛍光団を励起する操縦エレメントとを備える。
【0015】
添付の図とともに検討される場合、本発明の他の有利性および新規の特徴は、本発明の様々な非制限的実施形態である以下の詳細な説明から明らかになるだろう。特に明記されていなければ、本明細書に引用された参考文献は、すべて、参考文献として全体に援用される。参考文献として援用された本明細書および文献が、矛盾する開示および/または一貫しない開示を含む場合、本明細書を優先する。
【0016】
本発明の非制限的実施形態は、添付の図(それは概略で、縮尺比に従って拡大縮小するように描かれるようには意図されない)に関連して例として記載されるだろう。図において、図示された同一(または、ほぼ同一)のコンポーネントの各々は、典型的には、単一の符号によって表わされる。明瞭さの目的のため、図毎に各コンポーネントがラベル付けされるとは限らないし、当業者に本発明を理解させることが必要でない図に示される、本発明の各実施形態の各コンポーネントにもラベル付けされない。
【図面の簡単な説明】
【0017】
【図1】図1は、1つの実施形態による、標的核酸分析の様々なステップを表すフローチャートを示す。
【図2】図2は、1つの実施形態による、4つの個体試料の解析のための典型的な統合化バイオチップの図を示す。
【図3】図3は、1つの実施形態による、実施例10において記載されるような定量化モジュールの問い合わせチャンバ(Interrogation Chamber)を励起し問い合わせるように構成されたデバイスの光学機器列の概略図を示す。
【図4】図4は、1つの実施形態による、実施例10において記載されるような分離および検出モジュールの検出窓から励起し検出するように構成されたデバイスの光学機器列の概略図を示す。
【図5】図5は、1つの実施形態による、実施例10において記載されるような定量化モジュールの問い合わせチャンバを励起し問い合わせるように構成された別の光学機器列の概略図を示す。
【図6】図6は、1つの実施形態による、実施例10において記載されるような分離および検出モジュールの検出窓から励起し検出するように構成された別の光学機器列の概略図を示す。
【図7】図7は、1つの実施形態による、実施例10において記載されるような分離および検出モジュールの検出窓から励起し検出し、かつ定量化モジュールの問い合わせチャンバを問い合わせるように構成された別の光学機器列の概略図を示す。
【図8】図8は、1つの実施形態による、典型的な励起および検出システムの図を示す。
【図9】図9は、1つの実施形態による、別の典型的な励起および検出システムの図を示す。
【図10】図10は、1つの実施形態による、バイオチップの写真を示す。
【図11】図11は、1つの実施形態による、チップ圧縮エレメントおよび温度制御エレメント(100)、バイオチップ(101)、および温度センサ(102)を備える温度サイクラーの写真を示す。
【図12】図12は、1つの実施形態による、明瞭さのためにチップ圧縮エレメントが取り除かれた場合のTCE(1100)、バイオチップ(1101)、温度センサ(1102)、熱電冷却機(1103)、ヒートシンク(1104)、およびヒートシンク温度センサ(1105)を備える温度サイクラーの上から図の写真を示す。
【図13】図13は、1つの実施形態による、28サイクルのTH01 PCR−ピコグリーン(Picogreen)反応のための投入DNA(ナノグラム)対蛍光信号(RFU)を減じたベースラインのプロットを示す。
【図14】図14は、1つの実施形態による、(左から右へのピーク強度が0ナノグラム、0.4ナノグラム、1ナノグラム、4ナノグラム、10ナノグラム、20ナノグラム、および40ナノグラムの投入テンプレートDNAに対応する)TH01 PCRレーザー検出からの出力蛍光信号の未加工データプロットを示す。
【図15】図15は、1つの実施形態による、15サイクルのAlu PCR−ピコグリーン反応のための投入DNA(ナノグラム)対蛍光信号(RFU)を減じたベースラインのプロットを示す。
【図16】図16は、1つの実施形態による、(左から右へのピーク強度が0ナノグラム、0.4ナノグラム、1ナノグラム、4ナノグラム、10ナノグラム、20ナノグラム、および40ナノグラムの投入テンプレートDNAに対応する)Alu PCRレーザー検出からの出力蛍光信号の未加工データプロットを示す。
【図17】図17は、1つの実施形態による、(エラーバーは1つの標準偏差を表わす)測定の再現性を示す10サイクルのAlu PCR反応のための蛍光信号(RFU)を減じた投入DNA(ナノグラム)対ベースラインのプロットを示す。
【図18】図18は、1つの実施形態による、7サイクルのAlu PCR−サイバーグリーン(SYBR Green)分析のための投入DNA(ナノグラム)対蛍光信号(RFU)を減じたベースラインのプロットを示す。
【図19】図19は、1つの実施形態による、実施例5において記載されるような分子ビーコンプローブ1を用いて実際に検出された、ベースラインを差し引いた蛍光信号(RFU)対ゲノムDNA標的濃度(pg)のプロットを示す。
【図20】図20は、1つの実施形態による、実施例5において記載されるような分子ビーコンプローブ2を用いて実際に検出された、ベースラインを差し引いた蛍光信号(RFU)対ゲノムDNA標的濃度(pg)のプロットを示す。
【図21】図21は、1つの実施形態による、実施例6において記載されるような分子ビーコンプローブ2での1分間のハイブリダイゼーションを用いて実際に検出された、ベースラインを差し引いた蛍光信号(RFU)対ゲノムDNA標的濃度(pg)のプロットを示す。
【図22】図22は、1つの実施形態による、実施例9において記載されるような複数の精製フィルター層の機能としてDNA結合「カットオフ」を実証する。
【図23】図23は、1つの実施形態による、実施例9において記載されるような投入DNAの範囲にわたって直径1mmのフィルターのDNA結合性能を実証する。
【図24】図24は、1つの実施形態による、実施例10において論じられるような作動範囲にわたって光電子増倍管(PMT)ゲインが掃引される間の信号強度のプロットを示す。
【図25】図25は、1つの実施形態による、実施例10において論じられるような作動範囲にわたってPMTゲインが掃引される間の信号対ノイズ比のプロットを示す。
【図26】図26は、1つの実施形態による、実施例10において論じられるようなレーザーパワーの機能としての信号強度のプロットを示す。
【図27】図27は、1つの実施形態による、実施例10において論じられるような励起準位による光退色現象を示す。[配列の概要]
【0018】
配列ID番号:1は、配列5’−AGG GTA TCT GGG CTC TGG−3’を有するTHO1フォワードプライマー(Forward Primer)である。
配列ID番号:2は、配列5’−GCC TGA AAA GCT CCC GAT TAT−3’を有するTHO1リバースプライマー(Reverse Primer)である。
配列ID番号:3は、配列5’−GTC AGG AGA TCG AGA CCA TCC C−3’を有するAluフォワードプライマーである。
配列ID番号:4は、配列5’−TCC TGC CTC AGC CTC CCA AG−3’を有するAluリバースプライマーである。
配列ID番号:
5は、配列5’−GCC CGA TTT TGC GAC TTT GGA GGG C−3’を有するPV 92 プローブ1である。
配列ID番号:
6は、配列5’−CGC CTC AAA GTG CTG GGA TTA CAG GCG−3’を有するAluプローブ2である。
【発明を実施するための形態】
【0019】
本明細書に記載されるものは、核酸定量化のための進歩性のある方法およびデバイスであり、一部の実施形態においては、核酸定量化のためのマイクロ流体方法およびデバイスである。1つの態様において、実施形態は、一般に、事前の増幅の必要性のない天然(すなわち、非合成)の核酸などの標的核酸を定量化する方法に関する。いくつかの実施形態において、方法は、結合剤が標的核酸に対して固定化されることを可能にすることを含む。あるケースでは、結合剤は、標的核酸の量を定量化するために用いることができるシグナリング部分を含む。一部の実施形態において、定量化は迅速に実行することができる。例えば、一部の実施形態において、定量化は1時間以下で完結することができる。一部の実施形態において、低い量の標的核酸を含む試料は、一部の実施形態において流入式マイクロ流体分析を用いて、定量化することができる。例えば、あるケースでは、1ナノグラム未満を含む試料が定量化されてもよい。一部の実施形態において、標的核酸は、非標的核酸の存在下で定量化されてもよい。また、デバイス、バイオチップ、およびキットなどが、本発明の方法を実行するために提供される。
【0020】
いくつかの実施形態において、本明細書に記載された方法は、法医学的核酸分析において特に有用かもしれない。但し、当業者は、本方法が、法医学的分析に限定されず、解析するために標的核酸を含む(または、標的核酸を含むように思える)任意の適当な試料を用いることができることを理解するだろう。いくつかの実施形態において、臨床試料および環境試料が解析されてもよい。本明細書に記載された方法の一部の実施形態は、核酸の簡易化された定量化、マイクロ流体システムによる容易な統合化、低減された試薬の(すなわち、用いられる試薬の量および/または用いられる試薬の数)利用、酵素、dNTPsおよびPCRバッファなどの特殊扱いおよび/または保存を必要とする試薬の回避、定量化の速度および定量化の感度、定量化の特異性、自動化を提供するための改善された能力の1つ以上を含む(但し、限定されない)、先行技術を超える利点を備えてもよい。また、好ましくは、本明細書に記載された方法の一部の実施形態は、それが1つ以上のPCR抑制剤(それらは例えば臨床の試料、環境試料、法医学的試料などにあり得る)を含んでいるにもかかわらず試料における標的核酸を解析するために用いることができる。
【0021】
いくつかの実施形態において、本方法は、シグナリング部分を備える結合剤を、標的配列(すなわち標的核酸)を含む核酸ストランドを含むように推測される試料と組み合わせ、標的核酸が欠如している本質的に同じ状態下でその特性と比較して、シグナリング部分の測定可能な特性に変化があるか否かを判定することを含む。いくつかの実施形態において、標的を含まないコントロールを実行し、試料の応答をコントロールの応答と比較することは望ましいかもしれない。あるケースでは、信号のレベルが、定量のために測定されてもよい。一部のこのような実施形態において、測定用試料(Test Sample)により究明される信号のレベルは、標的配列を含む核酸ストランドの既知濃度を含む検量用試料(Calibration Sample)を用いて用意された検量標準物質(Calibration Standard)により比較されてもよい。いくつかの実施形態において、変化は、単に、標的核酸の存在または欠如を確認する目的で検出されてもよい。コントロールが用いられる実施形態において、試料とコントロールのと間の信号変化の差分が計算されてもよい。
【0022】
いくつかの実施形態において、複数の核酸サンプルは、本質的には同時に解析および定量化することができる。より詳細に以下で論じられるように、複数の核酸サンプルは、計測を伴うマイクロ流体バイオチップとソフトウェアとを含むマイクロ流体システムを用いて平行に解析されてもよい。いくつかの実施形態において、マイクロ流体システムを用いることは、複数サンプルが、適合する操作のセットを用いて、各試料(または試料のサブセット)のために本質的には同一の操作のセットを用いて処理されることを可能にする。その上、あるケースでは、複数の独立した試料処理および/または法医学的分析は、所定の試料上の統合方式において実行することができる。例えば、法医学的試料は、DNA(すなわち標的核酸)を連続的に分離し、分離されたDNAを定量化し、定量化結果に基づいて多くのDNA溶液を自動的に計量し、その後、分離されたDNAの短鎖縦列反復配列(STR)解析、一塩基変異多型(SNP)解析、およびミトコンドリアの配列決定の1つ以上を実行することにより解析されてもよい。同様に、臨床の試料は、標的核酸を精製し、標的核酸を定量化し、定量化結果に基づいて多くの核の溶液を自動的に計量し、標的核酸のPCR、逆転写PCRおよび/またはDNA塩基配列決定を実行することにより解析されてもよい。いくつかの実施形態において、試料は、バイオチップ上の1つ以上の病原体、細胞過程、生理学のプロセス、薬剤および毒素のために本質的に同時に問い合わせられてもよい。いくつかの実施形態において、試料分析は、システムによって自動的に行われてもよい。
【0023】
図1は、一部の実施形態による標的核酸分析の様々なステップを表すフローチャートを提供する。いくつかの実施形態において、標的核酸分析は、試料を取得することを含むステップ100から開始される。一部の実施形態において、試料は、犯罪現場または証拠の試料などの法医学的試料を含んでもよい。あるケースでは、標的核酸は、例えば、ステップ120のシグナリング部分を含む結合剤により標的核酸の混合のための試料を用意するために、ステップ110に示すように試料から抽出されてもよい。本ステップは、ステップ130に示すように標的核酸に対して結合剤を固定化し、ステップ140に示すようにシグナリング部分を検出することを含んでもよい。次に、標的核酸は、より詳細に以下で記述される技術を用いて、ステップ150に示すように定量化されてもよい。いくつかの方法が、これらのステップのすべてを含むとは限らないこと、および/または図示されない付加的なステップを含んでもよいことは理解されるべきである。例えば、あるケースでは、標的核酸は抽出される必要がなく、それによって、ステップ110を回避する。
【0024】
いくつかの実施形態において、試料はステップ100に示すように取得されてもよい。試料は、任意の適当な方法によって取得されてもよい。例えば、口腔スワブが取得されてもよい。一般に、口腔スワブは、ほおの内面から細胞の試料を収集するために収集器具(例えば小筆または綿棒)を用いる。その代わりに、小量の口内洗浄液(すなわち塩性の口内洗浄液)が、細胞を収集するために口の中で振られてもよい。いくつかの実施形態において、血液、唾液、精液、羊水、髪、皮膚または他の適合する流体および/または組織の試料を収集するために、他の方法が用いられてもよい。広範囲の試料は、また、膣のスワブ、頚部のスワブ、尿道のスワブ、直腸のスワブ、鼻のスワブ、鼻咽頭のスワブ、傷スワブ、生検標本、骨髄穿刺液および唾液穿刺液を含む。試料は、いくつかの実施形態の中で、個人的なアイテム(例えば、歯ブラシ、カミソリ)個体によって触れられたアイテム(例えば、飲用のグラスの縁、シャツカラー、キャップのリム、ドアノブ、ウインドガラスまたはテーブル)、蓄積された試料(例えば、堆積する精子または生検組織)、死体、犠牲者、犯人、容疑者、犯罪現場、患者、または親類(すなわち血族)から取得されてもよい。あるケースでは、試料核酸は、精製されなくてもよいし、部分的に精製されるまたは精製されてもよい。いくつかの実施形態において、試料核酸は、本質的には、標的核酸の混入がなくてもよい。他の実施形態において、試料は、標的核酸および非標的核酸の混合物を含んでいてもよい(例えば、法医学的分析のためのヒトのDNA試料は、また犬のDNAを含んでいてもよい)。例えば、試料は、生体外または生体内の試料であってもよい。一般に、試料は、標的核酸を含む、または標的核酸を含むように推測される。「試料」が、標的核酸、標的核酸を含む混合物(固体および/または液体)、または標的核酸を含むと推測される材料(固体および/または液体)を指してもよいことは理解されるべきである。
【0025】
試料は、ある程度の標的核酸を少なくとも含んでもよいし、または、標的核酸を含まなくてもよい。いくつかの実施形態において、試料における標的核酸の量は、試料を取得するために用いられる方法(すなわち収集方法)に依存してもよい。いくつかの実施形態において、収集方法は、本質的には0〜100マイクログラムの範囲内、1ピコグラム〜100のマイクログラムの範囲内、1ナノグラム〜100マイクログラムの範囲内、10ナノグラム〜100マイクログラムの範囲内、100ナノグラム〜100マイクログラムの範囲内、1ピコグラム〜10マイクログラムの範囲内、1ナノグラム〜10マイクログラムの範囲内、10ナノグラム〜10マイクログラムの範囲内、または100ナノグラム〜10マイクログラムの範囲内の標的核酸の量をもたらしてもよい。いくつかの実施形態において、収集方法によって収集された標的核酸の量は、少なくとも10倍、少なくとも100倍、少なくとも1000倍、または少なくとも10000倍で第1の試料から第2の試料に相違してもよい。
【0026】
試料は、標的核酸以外の1つ以上の合成物(もし存在するならば)を含んでもよい。例えば、試料収集流体は、試料を集める、薄める、懸濁する、または溶かすために用いられてもよい。一般に、試料収集流体は、水性であってよい。但し、試料収集流体は、水性溶媒の代わりに、またはその水性溶媒に加えて、有機溶媒をまた含んでもよい。様々な他の実施形態において、試料収集流体は、1つ以上のバッファ、スタビライザ、酵素阻害剤(例えば、ヌクレアーゼ抑制剤)、キレート試薬、塩類または他の合成物を含んでもよい。別の実施形態(試料収集流体による以下の試料の収集)において、試料は、乾燥させられてもよい(例えば、法医学的スワブ試料は、後で乾燥させられ処理されてもよい)。さらに別の実施形態において、試料収集流体は、利用されなくてもよい(例えば、乾燥したスワブが用いられてもよい)。
【0027】
いくつかの実施形態において、標的核酸は(存在するならば)、ステップ110に示すように試料から抽出(例えば、精製)されてもよい。あるケースでは、標的核酸は、マイクロ流体バイオチップの中で抽出されてもよい。但し、当業者は、当該技術分野の多くの既知の抽出方法(それらの多くは市販で入手可能である)のいずれかによって、標的核酸が抽出されてもよいことを認識するだろう。例えば、液液抽出技術は、フェノール−クロロホルム溶液を含むものなどのように、用いられてもよい。別の例において、液体の固形物抽出の技術は、試料が固体の基板上で収集され、標的核酸を分離するために(一般に複数の溶液とともに)洗浄される場合に用いられてもよい(例えば、キアゲン社(Qiagen Corporation)によって販売されているキットを参照)。核酸精製の他の例は、例えば「核酸精製(Nucleic Acid Purification)」と題され、2010年2月3日にセルデン(Selden)らによって出願された米国特許出願番号第12/699,564号(それは参考文献として本明細書に援用される)に見出される。
【0028】
細胞試料(すなわち、細胞、複数の細胞、細胞の混合物、組織内の1つ以上の細胞)から標的核酸が分離される実施形態において、細胞は、破砕開口されて(例えば、分裂または溶解されて)もよい。いくつかの実施形態において、細胞の膜脂質は洗浄剤を用いて分裂されてもよい。あるケースでは、タンパク質は、1つ以上のプロテアーゼで試料を処理することにより分解されてもよい。いくつかの実例において、タンパク質は、例えば酢酸ナトリウムまたは酢酸アンモニウムなどの酢酸塩により、沈殿によって取り除かれてもよい。いくつかの実施形態において、タンパク質は、フェノール−クロロホルム相分離を用いて取り除かれてもよい。いくつかの実施形態において、標的核酸は、例えばエタノールまたはイソプロピルアルコールなどのアルコールを用いて、沈殿させてもよい。あるケースでは、グアニジンチオシアン酸塩−フェノール−クロロホルムは、例えば、RNAまたはDNAの標的核酸を抽出するために用いられてもよい。部分的に精製された、または精製された標的核酸は、任意の適当な溶液(例えば、収集流体)、例えば、脱イオン水、トリスEDTA(TE)などのバッファに可溶化することができる。DNAおよび/またはRNAを精製するための他の技術は、当業者にとって既知であろう。
【0029】
以上に論じられたように、標的核酸を含む(または含むと推測される)任意の試料が、解析されてもよい。標的核酸は、任意の核酸であってもよい。例えば、いくつかの実施形態において、標的核酸は、DNA、RNA、またはそれらの混合物もしくは共重合体であってもよい。いくつかの実施形態において、標的核酸(および、本明細書に記載されたような、核酸の他の型)は、ゲノムDNA、染色体DNA、染色体外のDNA、プラスミドDNA、ミトコンドリアDNA、クロロプラストDNA、相補鎖DNA、リボソームRNA、メッセンジャーRNA、またはその破片であってもよい。標的核酸は、自然源(すなわち天然)から分離される、組み換え技術によって生成される、または人工的に合成されてもよい。例えば、標的核酸は、ヒト細胞、細菌細胞、菌の細胞、真核細胞、原核細胞、またはウィルスから分離されてもよい。あるケースでは、標的核酸は、合成(すなわち、増幅によって生成された産物[例えば、PCR、定量的PCR、リバース転写PCR]、結紮、または化学薬品合成)であってもよい。標的核酸は、タンパク質、酵素、抗体、レセプタ、リボザイム、リボソームなどの生物学的物体、またはその部分をコード化する核酸であってもよい。別の非限定の例として、標的核酸は、調節配列、または非コード化配列(例えば、小型干渉RNA、ミクロRNA低分子ヘアピンRNAなど)であってもよい。いくつかの実施形態において、標的は、特異的ゲノム配列または反復性ゲノム配列であってもよい。標的核酸および/または標的配列は、(例えば、およそ12、14、16、18、20、22、25、30、35、40、45、50、60、70、80、90、100、200、400、800、1600、3200、6400、またはそれ以上の)の長さの任意の数のヌクレオチドでありえる。核酸は、天然由来の塩基(例えば、アデノシンまたは「A」、チミジンまたは「T」、グアノシンまたは「G」、シチジンまたは「C」、またはウリジンまたは「U」)などの残基、またはメチル化された残基などの他の残基を含んでもよい。核酸は、ハイブリダイゼーションを容易にするために、いくつかのケースにおいて一本鎖であってもよい。
【0030】
いくつかの実施形態において、標的核酸は、また、PCR(ポリメラーゼ連鎖反応)などの核酸増幅法を用いて増幅することもできる。標的核酸の様々な複製は、シグナル伝達物体(例えば、蛍光染料)により標識されることができる。例えば、シグナル伝達物体は、任意の適当な位置の核酸(例えば、核酸配列の5’末端部位、3’末端部位、または核酸の内部部位)内に含まれていてもよい。
【0031】
いくつかの実施形態において、試料は、複数のソースに由来する標的核酸を含んでもよい。例えば、試料は、第1の標的核酸および第2の核酸を含んでもよい。あるケースでは、第1の標的核酸および第2の核酸の両方は、それぞれ第1のヒトおよび第2のヒトに由来してもよい。いくつかの実施形態において、第1の標的核酸は、ヒトに由来してもよいし。第2の標的核酸は、ヒト以外(例えば、バクテリア、マウス、犬、猫、爬虫類、ヘビ、昆虫、ヒト以外の霊長動物、など)に由来してもよい。あるケースでは、試料は、2、3、4、5、6、7、8、9、10、またはそれ以上の別の型の核酸(標的核酸の1つ、いくつか、または全部)を含んでもよい。
【0032】
いくつかの実施形態において、試料は、試験液を形成するために、ステップ120に示すように、結合剤により組み合わされてもよい。試験液は、結合剤を含む任意の試料流体であってもよい。より詳細に以下で論じられるにように、結合剤は、標的核酸に対して特に固定化させることができる物体である。以上に論じられたように、あるケースでは、試料は流体(すなわち、試料流体)であってもよい。いくつかの実施形態において、結合剤は、流体(以下「プローブ流体」)内に含まれていてもよい。いくつかの実施形態において、試料流体および/またはプローブ流体は、水性および/または有機であってもよい。あるケースでは、試料流体および/またはプローブ流体は、1つ以上のバッファ、スタビライザ、酵素阻害剤(例えば、ヌクレアーゼ抑制剤)、キレート試薬、塩類、または他の合成物を含んでもよい。
【0033】
いくつかの実施形態において、結合剤は、マイクロ流体デバイスに取り付けられてもよい。例えば、いくつかの実例において、結合剤は、マイクロ流体チャネルの壁に共有結合で取り付けられてもよい。あるケースでは、結合剤は、マイクロ流体チャネルの壁または機構に非共有結合で取り付けられてもよい。いくつかの実施形態において、標的核酸は、マイクロ流体デバイスに(すなわち、共有結合でまたは非共有結合で)取り付けられてもよい。いくつかの実施形態において、マイクロ流体チャネルは、結合剤および/または標的核酸を結合するために適した領域を有してもよい。例えば、結合剤および/または標的核酸は、機構には実質的に結合せずに、マイクロ流体チャネルの第1の領域を通じて流出され、マイクロ流体チャネルの第2の領域における機構に結合されてもよい。一部の実施形態において、標的核酸も結合剤も、分析の間に任意のマイクロ流体チャネルの壁に取り付けられない(または取り付けられるようにならない)が、むしろ試験液の中で懸濁され続ける。
【0034】
いくつかの実例において、試料流体とプローブ流体が、組み合わせられてもよい。例えば、試料流体およびプローブ流体は、マイクロ流体システムにおいて(例えば、マイクロ流体チャネル、またはマイクロ流体チャネルを含むシステムの混合区画において)組み合わせられてもよい。試料および結合剤は、任意の適切な技術を用いて混合されてもよい。例えば、試料流体およびプローブ流体は、混合試料を攪拌またはピペットで取ることにより、混合されてもよい。いくつかの実施形態において、試料流体およびプローブ流体は、マイクロ流体システムにおいて混合されることができる。当業者は、マイクロ流体システムにおいて流体を混合するためのデバイスおよびチャネル構成に気づくだろう。それらの非限定の例は、「統合化核酸分析(Integrated Nucleic Acid Analysis)」と題され、2008年4月4日にタン(Tan)らによって出願された国際特許出願第WO/2008/124104号パンフレットに開示され、その文献は参考文献として本明細書に援用される。
【0035】
結合剤は、標的配列を含む標的核酸に固定化することができる任意の物体であってもよい。いくつかの実施形態において、結合剤は、非共有結合を通じて標的核酸に固定化されるようになってもよい。例えば、非共有結合は、水素結合、ファン・デル・ワールス相互作用、疎水性相互作用などの1つ以上を含んでもよい。あるケースでは、結合剤は、1つ以上の共有結合を介して標的核酸に固定化されるようになってもよい。
【0036】
いくつかの実施形態において、結合剤が、標的核酸の標的配列に特に固定化されることができてもよい(すなわち、結合剤は、標的核酸のための独特の特異性を有する特異的結合剤であってもよい)。例えば、結合剤は、第2の配列(第1の配列とは異なる第2の配列)を有する第2の標的核酸に関して、第1の配列を有する第1の標的核酸に優先的に固定化され(例えば、混成され)てもよい。あるケースでは、結合剤は、標的核酸に非特異的に固定化されることができてもよい。例えば、結合剤は、標的核酸配列から独立して、標的核酸に実質的に挿入されてもよい。いくつかの実施形態において、結合剤は、挿入染料、挿入蛍光染料であってもよいし、または二本鎖核酸により選択的に挿入することができる挿入蛍光染料であってもよい。
【0037】
いくつかの実施形態において、結合剤は、核酸であってもよい(すなわち、結合剤は、核酸プローブであってもよい)。当業者は、核酸プローブが、所定のアニール条件の下で、核酸プローブの配列に対して少なくとも部分的に相補的な配列を有する標的核酸に混成することができる配列を有するように設計されてもよいことを認識するだろう。当業者は、また標的核酸と核酸プローブとの間の配列相同性が最適である必要がないことを認識するだろう。例えば、いくつかの実施形態において、標的核酸と核酸プローブとの対には、1つ以上のミスマッチがあってもよい。
【0038】
いくつかの実施形態において、結合剤(例えば、核酸プローブ)および標的核酸は、結合剤および標的核酸を含む試料を第1の温度に加熱し、その後、その試料を第2の温度に冷却することにより混成されてもよい。あるケースでは、第1の温度は、第2の温度に冷却する前に一時的に維持されてもよい。例えば、第1の温度は、1秒未満、5秒未満、10秒未満、30秒未満、1分未満、または5分未満の間維持されてもよい。もちろん、これらの範囲外の温度が同様に用いられてもよい。いくつかの実施形態において、第1の温度が、混成された結合剤および標的核酸を溶かす温度(すなわち、混成された相補鎖が分離する温度Tm)を超えてもよい。いくつかの実施形態において、第1の温度が、混成された結合剤および標的核酸のTm=5℃以内であってもよい。いくつかの実施形態において、第1の温度は、少なくとも30℃、少なくとも40℃、少なくとも50℃、少なくとも60℃、少なくとも70℃、少なくとも80℃、少なくとも90℃、または少なくとも95℃であってもよい。第2の温度は、第1の温度未満である少なくとも5℃、少なくとも10℃、少なくとも20℃、少なくとも30℃、少なくとも40℃、少なくとも50℃、少なくとも60℃、少なくとも70℃、少なくとも80℃、または少なくとも90℃であってもよい。いくつかの実施形態において、温度が第1の温度と第2の温度との間にサイクリングされるレートは、少なくとも1℃/秒、5℃/秒、10℃/秒、20℃/秒、30℃/秒、50℃/秒、100℃/秒、または200℃/秒であってもよい。一部のケースでは、本発明によれば、本発明の一部のシステムおよび方法によって提供される迅速な温度サイクリングは、少なくとも部分的に、標的核酸を典型的な従来手法よりも迅速に分析、検出および/または定量化することを可能にする。例えば、いくつかの実施形態において、迅速な温度サイクリングは、試料流体と結合剤とを組み合わせた後に、短期間で、試料流体における標的核酸の濃度が究明されることを可能にできる。
【0039】
以上に論じられるように、標的核酸は、1つ以上の結合剤によって認識され(例えば、混成され)てもよい。核酸結合剤は、標的核酸内の一部の配列を標的とするために、様々な実施形態において用いることができる。多くの場合、標的核酸の短い部分は、核酸プローブ(例えば、50残基未満、30残基未満、20残基未満、15残基未満、10残基未満、9残基未満、8残基未満、7残基未満、6残基未満、5残基未満、および4残基未満の配列)により関連づけられることができる。いくつかの実施形態において、核酸プローブは、少なくとも標的核酸の部分(すなわち、配列が、相補的、または少なくとも実質的に相補的である)を認識することができ、多くの場合、標的核酸の認識された部分と同様の長さを有する核酸残基の比較的短い配列を含んでもよい。例えば、核酸プローブは、10000ヌクレオチド未満、1000ヌクレオチド未満、500ヌクレオチド未満、250ヌクレオチド未満、100ヌクレオチド未満、75、50、40、35、30、25、24、22、20、18、16、14または12ヌクレオチド未満の長さを有する配列を有してもよい。核酸プローブ配列の構造、配列、長さおよびアニール条件の選択は、当該技術分野において周知である。核酸プローブは、任意の適切な技術(例えば、固相ホスホロアミダイトトリエステル法)を用いて合成されてもよい。他の方法は、当業者にとって既知であろう。核酸プローブは、また、例えばインテグレイティッドDNAテクノロジーズ社(Integrated DNA Technologies, Inc)から市販で入手してもよい。
【0040】
核酸プローブ内の核酸配列は、連続していてもよいし、またはその配列は非連続であってもよい。例えば、プローブ配列内に普遍的な残基またはギャップがあってもよい。さらに、ヘアピン、ループなどの二次構造は、あるケースにおいて存在してもよく、それは非連続配列を生成するために用いられてもよい。限定しない例として、核酸プローブは、標的核酸の連続配列に対して少なくとも実質的に相補的であって、かつ標的核酸の連続配列に対して相補的でない第3の領域によって分割される第1領域および第2領域を有してもよい。核酸プローブは、第3の領域がヘアピンを形成するように標的核酸に混成し、それによって、第1領域および第2領域が非連続型において連続した標的核酸配列に混成することを可能にする。
【0041】
あるケースでは、核酸プローブは、オーバーハングを生成せずに(すなわち核酸プローブの内にある少なくともいくつかの残基が標的核酸の末端を通過するように延びずに)、実質的に相補配列に混成してもよい。その代わりに、いくつかの実例において、核酸プローブは、核酸プローブの少なくとも1つの残基が標的核酸の末端を越えて延びるように、標的核酸に混成してもよい。
【0042】
核酸プローブは、標的核酸と完全に混成する必要はない。2つの核酸および/または核酸アナログの混成は、様々なファクタにより影響を与えられる場合があるし、所定の二本鎖内の特有の残基の混成の強度は、異なる場合がある。
【0043】
本明細書に用いられるように、第2の配列に対して「実質的に相補的である」第1の配列は、第1配列および第2配列の少なくとも75%が相補的な1つ(例えば、ワトソンクリック相補的対合を通じて)である。例えば、標的配列が長さ24塩基である状態において、それらに最大6つのベース対ミスマッチがあっても、プローブ配列は「実質的に相補的」であろう。いくつかの実施形態において、2つの配列は、少なくとも80%、85%、90%、または100%の相補形であってもよい。
【0044】
一部の実施形態において、核酸プローブは、残基の積層および/または骨格の前組織化を向上させることができる少なくとも1つの残基を含んでもよい。これは、いくつかのケースにおいて核酸プローブの熱的安定性(溶融温度)を著しく増大する場合がある。例えば、核酸プローブは、少なくとも1つのロックされた核酸(LNA)残基を含んでもよい。ロックされた核酸残基は、自然に生じる核酸残基(例えば相補的な残基により2つまたは3つの水素結合を形成していることができる)に対して同様の化学的形状を有しているが、自然に生じる核酸残基と同じ寸法において自由に回転することができない核酸アナログである。例えば、あるケースでは、メチレン橋が3’−エンド構造的コンフォメーション(それは、多くの場合DNAまたはRNAの一部の形式において見出される)においてリボースを「ロック」する場合に、ロックされた核酸残基は、2’−O、4’−Cメチレン橋を含んでもよい。あるケースでは、ロックされたリボース構成は、核酸プローブの熱的安定性を著しく増大してもよい。核酸配列の熱的安定性を増大することができる他の残基は、当業者にとって明らかである。例えば、ペプチド核酸は、あるケースにおいて核酸プローブとして用いられてもよい。
【0045】
一部の実施形態において、核酸プローブは、普遍的な残基(それは1つ以上の自然のヌクレオチドとの(およびあるケースでは自然のヌクレオチドのすべてとの)残基対合の関係を保つことができる)を含むことができる。核酸塩基(例えば、ヌクレオチドまたはPNA)の形式の重合体構造に組み込まれた場合、普遍的な塩基または普遍的な残基(例えば「N」)は、本明細書に用いられるように、核酸塩基を有している相補的な重合体構造の塩基をはっきりとは区別しない塩基を指す。例えば、普遍的な塩基は、A、T、CおよびGから選択された1つ以上のヌクレオチドに混成することができる。普遍的な残基は、当業者または通常の技術者にとって既知であろう。普遍的な残基の非限定的な例は、デオキシイノシン、3−ニトロピロール、4−ニトロインドール、6−ニトロインドール、5−ニトロインドール、6−メチル−7−アザインドール、ピロロピリジン、イミダゾピリジン、イソカルボスチリル、プロピニル−7−アザインドール、プロピニルイソカルボスチリル、アレニル−7−アザインドール、8−アザ−7−デアザ−2’−デオキシグアノシン、8−アザ−7−デアザ−2’−デオキシアデノシン、2’−デオキシシチジン、2’−デオキシウリジン、2’−デオキシアデノシン、2’−デオキシグアノシン、7−デアザ−2’−デオキシイノシン、2’−アザ−2’−デオキシイノシン、3’−ニトロアゾール、4’−ニトロインドール、5’−ニトロインドール、6’−ニトロインドール、4−ニトロベンズイミダゾール、ニトロインダゾール(例えば5’−ニトロインダゾール)、4−アミノベンズイミダゾール、イミダゾ−4,5−ジカルボキサミド、3’−ニトロイミダゾール、イミダゾール−4−カルボキシアミド、3−(4−ニトロアゾール−1−イル)−1、2−プロパンジオール、および8−アザ−7−デアザアデニンを含む。本明細書に記載されたシステムおよび方法のための有用な他の普遍的な残基は、当業者にとって既知であろう。
【0046】
いくつかの実施形態において、結合剤は、シグナリング部分を含んでもよい。シグナリング部分は、信号を生成することができる任意の物体であってもよい。いくつかの実施形態において、シグナリング部分は、結合剤に(すなわち、1つ以上の共有結合または非共有結合を通じて)取り付けられる。いくつかの実施形態において、シグナリング部分は、結合剤に取り付けられなくてもよい。例えば、あるケースでは、シグナリング部分は、標的核酸への結合剤の固定化の間に、またはその固定化の後に、結合剤により関連づけられてもよい。あるケースでは、シグナリング部分は、標的核酸により関連づけられてもよい。
【0047】
いくつかの実施形態において、シグナリング部分は、蛍光団、蛍光団/消光剤対、発色団、放射性同位体、酵素基質、発色基質、スピン標識、非放射性の同位体または質量分析(例えば電気泳動質量標識(EML))によって検出可能な同位体などの同位体、標識抗体、酵素のための結合パートナーとして役立つことができるリガンド、標識リガンド、抗原のための結合パートナーとして機能することができる抗体、比反応性を有するグループ、および/または電気化学的に検出可能な部分を含んでもよい。いくつかの実施形態において、シグナリング部分は、粒子(例えば、蛍光性の粒子、量子ドット、など)であってもよい。当業者は、他の適切なシグナリング部分を識別することができるだろう。あるケースでは、シグナリング部分は、例えば光(例えば、蛍光団または発色団の場合)により、刺激の信号を生成してもよい。いくつかの実例において、シグナリング部分は、放射性同位体の場合などのように、自然発生的な信号を生成してもよい。一部の実施形態において、シグナリング部分が、検出可能な信号を生成する能力は、シグナリング部分の第1のコンポーネントおよび第2のコンポーネントの近接度に依存してもよい。第1のコンポーネントおよび第2のコンポーネントが、1つ以上の結合を通じて連結されてもよい、または連結されてはならない(すなわち、分離可能である)ことは理解されるべきである。
【0048】
いくつかの実施形態において、シグナリング部分は、蛍光団を含んでもよい。蛍光団の非限定的な例は、市販で合成または入手することができる染料(例えば、オペロンバイオテクノロジー社(Operon Biotechnologies)、アラバマ州ハンツヴィル)を含む。(50を超える)染料の多くは、蛍光励起アプリケーションにおいてアプリケーションのために利用可能である。これらの染料は、フルオレセイン、ローダミンアレクサフルオル(rhodamine AlexaFluor)、バイオジピ、クマリンおよびシアニン染料ファミリーに由来するものを含む。蛍光団の具体例は、FAM、TET、HEX、Cy3、TMR、ROX、Texas red、LC red 640、Cy5、およびLC red 705を含むが限定されない。いくつかの実施形態において、410nm(例えば、Cascade Blue)から775run(例えば、Alexa Fluor750)への発光極大による染料は、有効であり、かつ用いることができる。もちろん、当業者は、これらの範囲外の発光極大を有する染料が、同様に用いられてもよいことを認識するだろう。あるケースでは、500nmから700nmの間の範囲の染料は、可視スペクトル内にあり、従来の光電子増倍管を用いて検出することができるという長所をもつ。いくつかの実施形態において、有効な染料の範囲は、検出範囲にわたって広がる発光波長を有する染料セットの選択を可能にする。多くの染料を識別することができる検出システムは、当該技術分野において知られている。
【0049】
いくつかの実施形態において、シグナリング部分は、結合剤に結合されてもよい。例えば、シグナリング部分および核酸プローブは、例えば、核酸の3’水酸基と、シグナリング部分に取り付けられたリンカとの間のエステル結合を形成することにより、結合されてもよい。リンカは、任意の適切なリンカであってもよい。例えば、リンカは、核酸プローブが標的核酸に混成することを可能にするための十分な長さであってもよい。他の技術は、当業者にとって既知であろう。
【0050】
いくつかの実施形態において、本明細書に別記されるように、消光剤は、背景蛍光を最小限にするためにオリゴ配列を標識するために、または蛍光団/消光剤対において利用するために用いることができる。消光剤は、当業者にとって既知である。消光剤の非限定的な例は、DDQ−I、Dabcyl、Eclipse、Iowa Black FQ、BHQ−1、QSY−7、BHQ−2、DDQ−II、Iowa Black RQ、QSY−21、およびBHQ−3を含む。いくつかの実施形態において、消光剤には、430nm(例えば、DDQ−I)から670nm(例えば、BHQ−3)まで範囲内の吸収極大があってもよい。
【0051】
いくつかの実施形態において、例えば、「探知できるように標識化されたデュアルコンフォメーションオリゴヌクレオチドのプローブ、分析、およびキット(Detectably Labeled Dual Conformation Oligonucleotide Probes, Assays and Kits)」題されて1999年7月20日にチャギ(Tyagi)らによって発行された米国特許第5,925,517号(その文献は参考文献として本明細書に援用される)において論じられるように、シグナリング部分を含む結合剤は、分子のビーコンであってもよい。結合剤(例えば、分子ビーコン)は、標的がない状態での分析状態の下で、ステム二本鎖を形成するために相互に作用する親和性対または腕の要素により側面に位置される標的核酸相補配列を有してもよい。その予め選ばれた標的配列に対する結合剤の混成は、腕を離れて押し進め、ステム二本鎖を除去して、結合剤における構造変化をもたらすことができる。結合剤の実施形態は、相互に作用する標識を利用する。それによって、その構造変化は、検出されることができる。いくつかの実施形態において、結合剤は、少なくとも所望の標的核酸に対して実質的に相補的な一本鎖核酸配列(「標的補数配列」として本明細書にて言及された)と、相補的な核酸配列または別の親和性対の付属の要素のいずれかによって可逆的に相互に作用する標的相補配列の側面に位置する5’および3’領域と、信号を生成するための相互に作用する標識部分を含むシグナリング部分とを含んでもよい。いくつかの実施形態において、結合剤は、標的相補配列が標的に結合されない場合に検出の状態の下で互いに混成することにより可逆的に相互に作用する、実質的に相補的な核酸配列、または「腕」を含む。いくつかの実施形態において、シグナリング部分を含む結合剤は、単分子であってもよい(すなわち、上記のコンポーネントのすべては、1つの分子内にあってもよい)。結合剤が2分子から成る実例において、標的相補配列の半分(またはおよそ半分)、親和性対の1つの部材および標識対の1つの要素は各分子にあってもよい。
【0052】
シグナリング部分の標識部分を生成する信号は、近接内の場合で十分に分割されていない場合に、少なくとも1つの標識部分が別の標識部分の少なくとも1つの物理的に測定可能な特性を変更することができるように、相互に作用するマッチした標識「対」を有してもよい。いくつかの実施形態において、標識部分は、親和性対の相互作用の状態によって互いに標識部分の近接度を調整することができるように、プローブに結合してもよい。標的がない状態において、標識部分は、親和性対のリンク相互作用によって互い近接して維持されてもよい。このコンフォメーションは「閉ざされた(closed)」状態と呼ばれてもよい。シグナリング部分の検出可能な信号が、閉ざされた状態で生成されない場合(それは、一般に大部分の実施形態でのケースである)、閉ざされた状態は、「オフ」状態にあると見なすことができる。
【0053】
標的相補配列がその標的に混成する実例において、構造変化が、親和性対および結果的に相互に作用する標識の標識部分を分割する結合剤内にて生じてもよい。このコンフォメーションは「開かれた」状態(それは、大部分の実施形態で「オン」状態にあると見なすことができる)と呼ばれてもよい理論に束縛されるものではないが、分離は、標的相補配列〜標的配列ヘリックスの形成の熱力学によって駆動されると考えられる。標的相補配列〜標的配列ヘリックスの形成は、完全であるか、または傷がついているかにかかわらず、分析状態下の親和性対の親和力を克服する。親和性対の分離が標識部分の相互作用を変更するので信号が生成され、結合剤に結合される少なくとも1つの標識部分の少なくとも1つの特性の差分が測定されてもよい。
【0054】
いくつかの実施形態において、相互に作用する標識を有する結合剤は、結合剤が開かれたか閉ざされたかに依存して相違する測定可能な特性(例えば、検出可能な信号)を有する。一般に、測定可能な特性は、標識部分の相互作用の機能、および、それらの分離の機能として変化するそれらの部分間の相互作用の度合いである。
【0055】
以上に論じられたように、結合剤は、閉ざされたコンフォメーションおよび開かれたコンフォメーションを有してもよい。閉ざされたコンフォメーションにおいて、標識部分は、互いに「隣接」していてもよい。すなわち、それらは、相互に作用しなくてもよい場合、信号が(例えば、検出量、品質、レベル、などにおいて)開かれたコンフォメーションとは異なるように、相互に作用するために十分に閉ざされてもよい。あるケースでは、差分が可能な限り大きなことは望ましいかもしれない。あるケースでは、「オフ」状態において、測定可能な特性が、限りなくゼロに近い信号であることは望ましいかもしれない。
【0056】
いくつかの実施形態において、測定可能な特性(例えば、検出可能な信号)は、蛍光共鳴エネルギー転移(FRET)対の少なくとも1つの要素の刺激に起因する特性的な光信号であってもよい。あるケースでは、信号は、例えば、検出可能な産物を形成するための基質上の酵素/抑制剤対または酵素/共同因子対の動作から結果として生じる色変化であってもよい。いくつかの実施形態において、シグナリング部分を含む結合剤は、標識部分が閉ざれた位置にある結合剤により隣接しているか、または開かれた位置にある結合剤により分割されるかに、そのレベルが依存する特性信号を有してもよい。
【0057】
いくつかの実施形態において、標識部分の選択は、信号が生成される状態において、規定することができる。あるケースでは、標識部分の選択は、各状態において個別の信号が生成されると規定することができる。いくつかの実施形態において、相互に作用する標識部分は、蛍光団/消光剤対であってもよい。いくつかの実例において、相互に作用する標識部分は、結合剤に共有結合で結合されてもよい。あるケースでは、相互に作用する標識部分は、標的核酸に対して相補的でない結合剤の部分に付けるために結合されてもよい。一部の実例において、結合剤が開かれた状態における標的核酸に結合され、かつ適合する光源により刺激される場合、シグナリング部分は、特有の波長の正の蛍光信号を生成することができる。
【0058】
以上に論じられたように、結合剤は、ステップ130に示すように、標的核酸に固定化されてもよい。固定化は、任意の適切な技術を用いて実行されてもよい。例えば、いくつかの実施形態において、結合剤および標的核酸は、固定化(例えば、混成)を容易にするために、一定期間にわたって加熱され、その後、冷却されてもよい。いくつかの実施形態において、固定化は、加熱/冷却サイクルの必要性なしで、生じてもよい。あるケースでは、標的核酸に結合剤を固定化する化学反応が生じてもよい。例えば、架橋試薬は、結合剤および標的核酸を共有結合で接合するために用いられてもよい。
【0059】
固定化は、本発明の一部の実施形態によれば、短期間で達成されてもよい。いくつかの実施形態において、標的核酸を定量化するための全体の所要時間は、迅速な固定化時間のおかげで、著しく低減することができる。例えば一部の実施形態において、迅速な温度サイクラーを含むマイクロ流体システムは、1時間未満で(一部の実施形態においては30分未満で、一部の実施形態においては20分未満で、一部の実施形態においては10分未満で、一部の実施形態においては5分未満で、一部の実施形態においては1分未満で、一部の実施形態においては30秒未満で、一部の実施形態においては10秒未満で、一部の実施形態においては5秒未満で、一部の実施形態においては1秒未満で、および一部の実施形態においては実質的に瞬間的に)反応が完了することができるように、結合剤および標的核酸が所望のターゲット温度を達成することを可能にするために用いられてもよい。温度サイクリングのためのデバイスおよび方法は、例えば、セルデン(Selden)らにより「標的核酸の迅速な多重化増幅のための方法(Methods for Rapid Multiplexed Amplification of Target Nucleic Acids)」と題されて、2008年4月4日に出願された米国特許出願第2009/0023603号公報(その文献は参考文献として本明細書に援用される)に記載されている。
【0060】
いくつかの実施形態において、シグナリング部分は、検出可能な信号(すなわち、測定可能な特性)を生成してもよい。いくつかの実施形態において、検出可能な信号は、光信号(例えば、蛍光または化学発光)であってもよい。以上に論じられたように、いくつかの実施形態において、検出可能な信号は、蛍光共鳴エネルギー転移(FRET)対の少なくとも1つの要素の刺激に起因する特性的な光信号であってもよい。いくつかの実施形態において、検出可能な信号は、特有の波長または波長領域を有する光の吸光度であってもよい。あるケースでは、信号は、例えば、検出可能な産物を形成するための基質上の酵素/抑制剤対または酵素/共同因子対の動作から結果として生じる色変化であってもよい。いくつかの実施形態において、検出可能な信号は、放射性同位体からなどの射光であってもよい。当業者は、他の適切な検出可能な信号を識別し、実施することができるだろう。
【0061】
いくつかの実施形態において、標的核酸は、ステップ150に示すように、定量化されてもよい。いくつかの実施形態において、定量化は、例えば、標準曲線を標的核酸濃度対生成された検出可能な信号に用いて、シグナリング部分を含む結合剤により組み合わせた標的核酸の範囲の既知濃度を含む一組の溶液の蛍光値を用いて、標的核酸の既知濃度に蛍光値をプロットして、達成されてもよい。いくつかの実施形態において、標的核酸の既知濃度を含む各溶液にとって、以上に記載されたような方法は、標的核酸に結合剤を固定化するために実行され、シグナリング部分が、その後、検出される。結果として生じたプロットに対して線形回帰などの方法を用いて、曲線を適合させることは、結合剤が標的核酸に固定化された後、試料の検出可能な信号値のを入力することにより、標的核酸の未知の濃度を有する試料における標的核酸の濃度を計算するための一般的な数式の導出を公式にあてはめることを可能にするかもしれない。
【0062】
別の実施形態において、シグナリング部分の物理的性質は、標的核酸の濃度を究明するために用いられてもよい。例えば、特有の波長における蛍光性のシグナリング部分のモル吸光係数および量子収量は、当業者に知られている溶液を用いる技術において標的核酸の濃度を究明するために用いられてもよい。一般に、標的核酸に固定化された結合剤を有する標的核酸の分数は、究明され定量化の要因の一つに含められる。標的核酸の未知の濃度を有する試料における標的核酸の濃度は、当業者により理解されるようにモル吸光係数および量子収量に対応する波長で試料の蛍光を測定することにより、モル吸光係数および量子収量を用いて究明することができる。
【0063】
一部の実施形態において、本明細書に記載された方法のための本発明により利用される技術およびシステムは、標的核酸の迅速な分析または定量化を可能にする。例えば、ステップ120、130、140、および150を含む方法は、10秒以内に、30秒以内に、1分以内に、2分以内に、5分以内に、10分以内に、20分以内に、30分以内に、45分以内に、または1時間以内に完結できる。あるケースでは、ステップ120、130、および140を含む方法は、10秒と1時間との間に、10秒と30分との間に、10秒と5分との間に、10秒と2分との間に、または10秒および1分との間に完結してもよい。
【0064】
いくつかの実施形態において、標的核酸の解析は、標的核酸の小量の定量化を可能にしてもよい。例えば、本方法は、100ナノグラム未満、50ナノグラム未満、20ナノグラム未満、10ナノグラム未満、5ナノグラム未満、2ナノグラム未満、1ナノグラム未満、100ピコグラム未満、10ピコグラム未満、1ピコグラム未満、100フェムトグラム未満、10フェムトグラム未満、または1フェムトグラム未満の標的核酸を定量化することができてもよい。あるケースでは、本方法は、1ナノグラム〜100ナノグラム、10ピコグラム〜20ナノグラム、または1フェムトグラム〜5ナノグラムの標的核酸の量を計ることができてもよい。いくつかの例において、本方法は、1ナノグラム/マイクロリットル〜50ナノグラム/マイクロリットル、1ピコグラム/マイクロリットル〜10ナノグラム/マイクロリットル、または1フェムトグラム/マイクロリットル〜5ナノグラム/マイクロリットルの標的核酸の量を計ることができてもよい。いくつかの実施形態において、本方法は、105未満の分子、か、105〜1015の分子、105〜1012の分子、105〜1011の分子、105〜1010の分子、または105〜109の分子を定量化することができてもよい。いくつかの実施形態において、定量化は、標的核酸を増幅するための必要性なしに、低濃度(例えば一部の法医学的試料)で天然の標的核酸を含む試料のためにでも、達成されてもよい。もちろん、これらの範囲外の量および/または濃度における標的核酸検出の解析または定量化は、当業者または通常の技術者により達成されてもよい。
【0065】
一部の実施形態において、標的核酸は、少容量の溶液で解析されてもよい。一部の実施形態において、マイクロ流体システムでの解析の実行は、解析の実行のための溶液の容量を低減することに有用かもしれない。いくつかのケースでは、検出は、1ミリリットル未満の溶液、100マイクロリットル未満の溶液、10マイクロリットル未満の溶液、1マイクロリットル未満の溶液、100ナノリットル未満の溶液、10ナノリットル未満の溶液、または1ナノリットル未満の溶液で実行されてもよい。いくつかの実施形態において、少容量の溶液を用いることによる解析は、大量の溶液を用いる場合よりも、より迅速に実行することができる。したがって、マイクロ流体システムでの解析の実行は、短期間で(すなわち、1時間以内で、または本明細書に別記されるようにさらに少ない時間で)の標的核酸の定量化に有用かもしれない。
【0066】
以上に論じられたように、いくつかの実施形態において、マイクロ流体システムにおいて方法を実行することは有用かもしれない。すべての実施形態ではなく、いくつかの実施形態において、本明細書に記載されたシステムおよび方法のすべてのコンポーネントは、マイクロ流体である。好適なマイクロ流体システムの例は、「統合化された核酸分析(Integrated Nucleic Acid Analysis)」と題され、2008年4月4日にタン(Tan)らによって出願された国際特許出願第WO/2008/124104号パンフレット、および「核酸およびタンパク質の解析のための耐久性が高められた装置(Ruggedized Apparatus for Analysis of Nucleic Acid and Proteins)」と題され、2005年5月19日にタン(Tan)らによって出願された米国特許出願第2006/0260941号公報において記載されており、それらの文献は参考文献として本明細書に援用される。「マイクロ流体」は、本明細書に用いられるように、少なくとも一つの寸法が1ミリメートル未満であるチャネルを指す。用語「マイクロ流体デバイス」または「バイオチップ」は、一般に、巨視的規模の分析化学装置が何百または何1000倍小さくかつ効率的なデバイスに置き換えられて、小容量(例えば、マイクロリットル、ナノリットル、またはピコリットル)の液体を操作することができる構造を作り出すために、例えば、半導体生産技術を用いることにより製造されたデバイスを指す。例えば、バイオチップのチャネルは、127ミクロン×127ミクロンから400ミクロン×400ミクロンまでの範囲の断面の寸法を有していてもよいし、リザーバは、400ミクロン×400ミクロンから1.9ミリメートル×1.6ミリメートルまでの範囲の断面であってもよい。いくつかの実施形態において、チャネルおよび/またはリザーバは、長さ0.5ミリメートルのような短い距離から数十ミリメートルの(例えば、20ミリメートルを超える、30ミリメートルを超える、40ミリメートルを超える、または50ミリメートルを超える)距離まで延伸してもよい。
【0067】
いくつかの実施形態において、マイクロ流体システムは、人間の介入の必要性を低減する自動システムであってもよい。自動システムは、標的核酸の定量化時間を低減するために有用かもしれない。例えば、自動マイクロ流体システムは、ユーザ介入の必要性を自動的に削減または低減する1つ以上のステップを実行してもよく、したがって、1つ以上のステップを実行するための時間を低減することができる。したがって、自動化は、いくつかの実施形態において、1時間以内に(または、本明細書に別記されるように、さらに短い時間で)標的核酸を定量化するための能力の一因となってもよい。
【0068】
いくつかの実施形態において、本明細書に記載された定量化方法は、別のプロシージャを試料に対して実行する前に標的核酸に対して実行されてもよい。例えば、定量化は、標的核酸上の反応(例えば、増幅反応)の前に標的核酸に対して実行されてもよい。プロシージャの他の例は、核酸精製、核酸増幅(例えば両方のシングルプレックスおよびマルチプレックス終了点PCR、リアルタイムPCRおよびリバース転写PCR)、後増幅核酸クリーンアップ、核酸配列決定、核酸結紮、核酸雑種形成、SNP分析、および電気泳動の分離を含む。あるケースでは、1つ以上のプロシージャが、同じマイクロ流体システムを用いて、標的核酸に対して実行されてもよい。例えば、標的核酸のPCRおよび定量化は、同じマイクロ流体システムを用いて実行されてもよい。いくつかの実施形態において、プロシージャは、マイクロ流体システムのアクティブな領域において実行されてもよい。あるケースでは、マイクロ流体システムは、1つ以上のアクティブな領域を含んでもよい。いくつかの実例において、各プロシージャは、別々のアクティブな領域において実行されてもよい。いくつかの実施形態において、アクティブな領域は、1つ以上のプロシージャに用いられてもよい。例えば、アクティブな領域は、試料および結合剤を混合するために用いられてもよく、試料の究明のための用いられてもよい(すなわち、アクティブな領域は混合領域および検出領域の両方であってもよい)。別の例において、マイクロ流体デバイスのアクティブな領域の少なくとも1つは、ポリメラーゼ連鎖反応(PCR)を介して核酸を増幅するように構成された領域を含んでもよい。いくつかの実施形態において、増幅ステップが、核酸を増幅するように構成されたアクティブな領域内で発生してもよい。
【0069】
いくつかの実施形態において、本明細書に記載された定量化方法は、試料のパラメータを調整するためのフィードバックを提供してもよい。例えば、標的核酸定量化の結果は、試料を薄めるべきか、濃縮するべきかを示してもよい。標的核酸定量化の結果は、また、試料をどの程度に希釈するか、濃縮するかを示してもよい。いくつかの実施形態において、正確な量の核酸が後続の処理のために利用されることを可能にするために、標的核酸定量化の結果は、自動システムにおいて用いられてもよい。あるケースでは、定量化は、例えば、他の処理ステップの前後に所定の試料で複数回実行されてもよい。あるケースでは、試料の個別の容量は、一つの定量化ステップに続く試料の並行処理を可能にするために(例えば、定量化に基づいて、個別の量の標的核酸は、PCR、SNP解析、またはDNA塩基配列決定などの後続の処理のために計量されることができる)、バイオチップの個別の領域への経路を選択することができる。
【0070】
いくつかの実施形態において、バイオチップは、試料操作のための複数のマイクロ流体チャネルおよびアクティブな領域を含んでもよい。いくつかの実施形態において、試料流体の選択された量がバイオチップのアクティブな領域を対象にしてもよい場合、本方法は、定量化ステップの後に1ステップを含んでもよい。いくつかの実施形態において、選択された量は、定量化ステップの結果に基づいて、少なくとも部分的に究明されてもよい。
【0071】
いくつかの実施形態において、PCR増幅などのプロシージャを受けた標的核酸の量を制御することは、望ましいかもしれない。以上に記載されるように、いくつかの実施形態において、標的核酸の量の制御は、標的核酸を定量化し、その後、プロシージャを受けるべき標的核酸の所望量をすることにより、達成することができる。但し、いくつかの実施形態において、プロシージャは、定量化の前に、または標的核酸の定量化なしで、標的核酸に対して実行されてもよい。例えば、いくつかの実施形態において、標的核酸のPCR増幅は、まず標的核酸を定量化せずに実行されてもよい。いくつかの実施形態において、複製可能な量の精製された標的核酸を生成するために、標的核酸が試料から精製されてもよい。例えば、標的核酸の量は「カットオフ」アプローチを用いることにより制御することができる。このアプローチにおいて、標的核酸を閾値まで結合することができる、その上に実質的に付加的な標的核酸が結合されない(すなわち、結合膜には規定された核酸結合能力があってもよい)結合膜が用いられてもよい。一般に、結合膜への標的核酸の結合は、標的核酸をする結合ために、少なくとも試料の一部を結合膜に接触することを含む。いくつかの実施形態において、核酸結合能力は、精製された標的核酸の複製可能な量と本質的には同一である。
【0072】
いくつかの実施形態において、実質的に、結合膜閾値よりも多い量のすべて標的核酸が、結合膜によって保持されないように、試料量は、試料内に含まれる標的核酸量の範囲が、結合膜閾値を超えるように選択することができる。したがって、結合膜閾値を超えた標的核酸の量を含むが、標的核酸の未知量を含む試料に対して、標的核酸の量を、定量化なしで制御することができる。このようなアプローチは、例えば、定量化ステップをなくすことにより、プロシージャを実行するための所要時間を低減するために有用かもしれない。
【0073】
あるケースでは、結合膜は1つ以上の層を含んでもよい。いくつかの実施形態において、結合膜による結合された核酸の量(すなわち、結合能力)は、結合膜における層数とともに実質的に直線的に比例する。いくつかの実施形態において、結合能力は、結合膜の直径に比例する。結合膜の直径は、例えば、少なくとも0.1ミリメートル、少なくとも0.5ミリメートル、少なくとも1ミリメートル、少なくとも2ミリメートル、少なくとも5ミリメートル、または少なくとも10mmであってもよい。いくつかの実施形態において、結合膜は、核酸を結合できるシリカ膜であってもよい。非限定的な例として、図12は、DNA投入の範囲にわたる直径1ミリメートルの結合膜の結合性能を示す。
【0074】
いくつかの実施形態において、結合膜の閾値(すなわち、飽和量)は、少なくとも50ナノグラム、100ナノグラム、少なくとも200ナノグラム、少なくとも300ナノグラム、少なくとも400ナノグラム、少なくとも500ナノグラム、少なくとも600ナノグラム、少なくとも700ナノグラム、少なくとも800ナノグラム、または、さらに多い量であってもよい。いくつかの実施形態において、結合膜の結合効率は、過剰な標的核酸が結合膜を飽和させるために必要とされるように、100%未満であってもよい。例えば、少なくとも10%以上、少なくとも20%以上、少なくとも50%以上、少なくとも100%以上、または、少なくとも200%以上の標的核酸は、結合膜の閾値よりも、結合膜を飽和させるために必要とされる。
【0075】
標的核酸は、任意の好適な方法を用いて、結合膜から溶出されてもよい。例えば、標的核酸は、特定の範囲内のpHまたは特定の範囲内の塩濃度を有する結合膜を通じて流体を流すことにより溶出されてもよい。他の好適な方法は、当業者にとって既知であろう。
【0076】
いくつかの実施形態において、定量化分析は、必要な工程ステップのすべてに互換性をもつように設計されたマイクロ流体バイオチップにおいて処理することができる。精製されたDNA溶液の一部が定量化モジュールの対象にされてもよく、かつ残存するDNAが例えばSTR増幅のために等分するために利用可能である場合、これは、例えばヒトの法鑑定ケースワークバイオチップにおいて有用になりえる。アプローチの主眼点は、増幅を受けさせるための容量を規定するために、定量化データが、利用されてもよいということである。用途に依存して、正確な容量または近似の容量は、マイクロ流体的に計量されるだろう。例えば、精製されたDNAの溶出容量が100マイクロリットルであり、定量化のために利用されたDNA溶液の容量が約1マイクロリットルであるならば、大多数のDNAは、STR増幅に利用可能だろう。核酸の量が少ないと知られているが正確な量が未知であるいくつかの実施形態(例えば、法医学的接触試料(forensic touch samples))において、10%(またはそれ以上)の溶出されたDNAは、定量化のために利用することができる。
【0077】
いくつかの実施形態において、定量化方法は、マイクロ流体システムを用いて実行されてもよい。マイクロ流体システムは、標的核酸、結合剤、および他の試薬を含む試料が、バイオチップを通じて流出されることを可能にしてもよい。例えば、単一のバイオチップは、PCR増幅、断片の分離および検出、核酸配列決定、限外ろ過、および核酸定量化のための領域を有してもよい。いくつかの実施形態において、この多機能のバイオチップは、1つ以上の試料を並列に処理してもよい。いくつかの実施形態において、試料は、1つ以上のプロシージャが実行されてもよいバイオチップにおいて、1つ以上の領域に流出されてもよい。1つ以上のプロシージャが実行される場合、試料は、流出または静止してもよい。例えば、試料はマイクロ流体デバイス内に含まれているが、検出が実行される場合、一部の実施形態において、それは必ずしも流出していなくてもよい。
【0078】
あるケースでは、2つ以上のプロシージャが同じ領域における試料に対して実行されてもよい。いくつかの実施形態において、以下に記載されるバイオチップは、以上に言及されるように、1つ以上の他のプロシージャにより標的核酸定量化の統合化を可能にしてもよい。したがって、ほとんど無限の数の組み合わせを、複雑な一組の操作がバイオチップ上で完結することを可能にする、バイオチップに設計することができる。当業者は、本発明のバイオチップが本質的には無限のプロセスの複雑性により多くの異なる型の解析を実行するように設計されることができることを、十分に理解するだろう。
【0079】
チャネルの「断面寸法」は、流体の流れの方向に対して垂直に測定される。本発明のコンポーネントにおける大部分の流体チャネルは、2ミリメートル未満の(いくつかのケースでは1ミリメートル未満の)最大断面寸法をもつ。一組の実施形態において、本発明の実施形態を含むすべての流体チャネルは、マイクロ流体であるか、または多くとも2ミリメートルまたは1ミリメートルの最大の断面寸法を有する。別の実施形態において、流体チャネルは、部分的に単一のコンポーネント(例えば、エッチング基板または成型されたユニット)により形成されてもよい。もちろん、より大きなチャネル、チューブ、チャンバ、リザーバなどを、大量に流体を蓄積し、かつ本発明のコンポーネントに流体を送るために用いることができる。一組の実施形態において、本発明の実施形態を含むチャネルの最大断面寸法は、500ミクロン未満、200ミクロン未満、100ミクロン未満、50ミクロン未満、または25ミクロン未満である。
【0080】
「チャネル」は、本明細書に用いられるように、少なくとも部分的に流体の流れを対象にするアーティクル(基質)上の、またはそのアーティクル内の機構を意味する。チャネルは、任意の断面形状(円形、楕円形、三角形、不整形、正方形、または矩形など)を有することができ、覆われるようにすることもできるし、覆れないようにすることもできる。チャネルが完全に覆われる実施形態において、チャネルの少なくとも1つの部分は、完全に包囲される断面を有することができるし、または、全体のチャネルは、その全長に沿って、その入口および出口を除いて、完全に包囲されてもよい。チャネルは、また、少なくとも2:1(より典型的には、少なくとも3:1、5:1もしくは10:1、またはそれ以上)の縦横比(平均断面寸法に対する長さ)を有してもよい。開放チャネルは、液体輸送に対する制御を容易にする特性、(例えば、構造特性(細長い刻み)および/または物理的または化学的特性(疎水性対親水性))または流体上の力(例えば、含有力)を及ぼすことができる他の特性を一般に含むだろう。チャネル内の流体は、部分的にまたは完全にチャネルを埋めてもよい。開放チャネルが用いられるいくつかのケースでは、流体は、例えば、表面張力(すなわち、凹または凸メニスカス)を用いてチャネル内に保持されてもよい。
【0081】
チャネルは、例えば、約5mmまたは2mm未満、約1mmまたは約500ミクロン未満、約200ミクロン未満、約100ミクロン未満、約60ミクロン未満、約50ミクロン未満、約40ミクロン未満、約30ミクロン未満、約25ミクロン未満、約10ミクロン未満、約3ミクロン未満、約1ミクロン未満、約300nm未満、約100nm未満、約30nm未満、または約10nm未満の流体の流れに対して垂直に最大寸法を有する任意のサイズであってもよい。あるケースでは、チャネルの寸法は、流体がアーティクルまたは基質を介して自由に流出することができるように選択されてもよい。チャネルの寸法は、また、例えば、チャネル内の流体の一定の容積レートまたは直線流レートを可能にするために選択されてもよい。もちろん、チャネルの数およびチャネルの形状は、当業者にとって既知の任意の方法により変更することができる。あるケースでは、1つ以上のチャネルが用いられてもよい。例えば、互いに内部に配置されて、互いに隣接して配置された、互いに交差するように配置されたなどの場合、2つ以上のチャネルが用いられてもよい。
【0082】
本発明のマイクロ流体チップ(すなわち、バイオチップ)は、主としてプラスチックから構成することができる。有用な種類のプラスチックは、不飽和(部分的に不飽和)または飽和環状オレフィン共重合体「COC」、不飽和(部分的に不飽和)または飽和環状オレフィンポリマー「COP」、ポリ塩化ビニル(メチル)メタクリル酸塩「PMMA」、環状オレフィンポリカーボネート「PC」、ポリプロピレン「PP」、ポリエチレン「PE」、ポリエーテルエーテルケトン「PEEK」、ポリ塩化ビニル(ジメチルシロキサン「PDMA」およびポリイミド「PI」を含むが、限定はされない。用語「ポリ塩化ビニル(メタクリル酸メチル)」または「PMMA」は、本明細書で用いられるように、米国特許第5,561,208号、第5,462,995号および第5,334,424号(各々は参考文献として本明細書に援用される)に記載されていたポリマーと同様、Plexiglas(商標)、Limacryl(商標)、R−Cast(商標)、Perspex(商標)、Plazcryl(商標)、Acrylex(商標)、ACrylite(商標)、ACrylplast(商標)、Altuglas(商標)、Polycast(商標)およびLucite(商標)の商品名として販売されるものを含む(但し限定されない)メタクリル酸メチルの合成高分子を意味する。いくつかの実施形態において、増幅反応に利用されるための最大温度よりも高いガラス遷移温度を有するプラスチックが選択されてもよい。これらのプロセスおよび材料のいくつでも、本明細書に記載されたバイオチップを製造するために用いることができる。いくつかの実施形態において、射出成形、熱型押しおよび/または機械加工を含むことが用いられてもよい。例えば、バイオチップは、プラスチック基板(例えば、COCまたはCOPベースポリマー(現在、Topas(商標)、Zeonex(商標)、Zeonor(商標)およびApel(商標)の商品名で販売))の射出成形により用意することができる。この製造方法において、形成されるべき特徴の原板から構成される射出金型および金型インサートは、機械加工および後続の表面研磨により製造されてもよい。金型およびインサートは、ともに、基板層が製造されることを可能にし、形成された基板がチャネル、反応チャンバ機構およびビアホールを含むことを可能にしてもよい。いくつかの実施形態において、基板およびカバー層は、熱および圧力の印加によって接合された拡散になりえる。射出成形品は、肉眼的特徴(液だめなどの)および/または微細な特徴(毛状のバルブなどの)を含んでもよい。あるケースでは、これらの寸法が異なる特徴の射出成形に対するアプローチが変化する場合があるので、一組のパーツの微細な特徴および別の組のより大きな特徴を生成することは好ましいかもしれない。大きなリザーバ(一辺が数ミリメートル(約1〜50ミリメートル)で、かつ深さ数ミリメートル(約1〜10ミリメートル)で測定し、数百マイクロリットルまで(または、それ以上に)適合することができる)のために、従来の成形には、機械加工された射出成形ツールを用いることができる。いくつかの実施形態において、そのツールは、ツールの原板であるべき機械加工されたグラファイト電極を用いて鋼または他の金属の中に焼きつけることができる。材料に関するより多くの情報および製造方法は、「標的核酸の迅速な多重化増幅のための方法(Methods for Rapid Multiplexed Amplification of Target Nucleic Acids)」と題され、セルデン(Selden)らによって2008年4月4日に出願された米国特許出願第2009/0023603号公報(それは参考文献として本明細書に援用される)に含まれている。
【0083】
いくつかの実施形態において、マイクロ流体システムは、計器およびマイクロ流体チップ(すなわちバイオチップ)を含んでもよく、マイクロ流体チップは、計器と関連づけられる。様々な実施形態において、バイオチップは、バイオチップに統合された複数の特徴を有してもよい。例えば、バイオチップは、試料挿入、異物の除去、干渉核酸の除去、重要な細胞の濃度、核酸の増幅、温度サイクリング、流体の混合、シグナリング部分の検出などを容易にするコンポーネントを含んでもよい。いくつかの実施形態において、バイオチップの前処理コンポーネントは、試料を受け入れ、細胞を含む微粒子および異種の核酸の初期除去を実行し、重要な細胞を少容量に濃縮する。いくつかの実施形態において、スワブを受け入れることができるサンプルチューブが用いられてもよい。溶解および抽出ステップを実行するために、試料チューブが、例えば、溶菌液により満たされてもよい。以上に論じられたように、スワブは、血痕、指紋、水、エアフィルター、または臨床部位(例えば、口腔スワブ、傷スワブ、鼻スワブ)を含む多くの細胞含有部位に接して配置することができる。
【0084】
いくつかの実施形態において、バイオチップは、パティキュレートフィルタ、精製フィルター、ビーズまたは他の材料を含んでもよい。
【0085】
以上でより詳細に記載されたように、様々な溶解および抽出方法を用いることができる。いくつかの実施形態において、溶解および抽出は、106個以下の細胞を含む試料に対して実行することができる。用途に依存して、105未満、104未満、103未満、102未満、10未満(および多複写配列が解析されることになっている場合では1未満)の少数の開始細胞は、本発明のバイオチップおよび方法において利用できない。
【0086】
いくつかの実施形態において、核酸精製は、入出力チャネルの間に精製媒体を挿入することにより達成することができる。あるケースでは、精製媒体は、シリカファイバ系であり得るし、生体サンプルを溶解し、標的核酸を露出し、標的核酸を精製媒体に結合するためにカオトロピック塩試薬を用いることができる。次に、溶解物は、核酸を結合するために精製媒体を通じて、入力チャネルを介して移送されてもよい。いくつかの実施形態において、結合された核酸は、汚染物質を取り除くためにエタノール系バッファによって洗浄されてもよい。あるケースでは、これは、精製膜を通じて、入力チャネルを介して洗浄試薬を流出することにより達成することができる。いくつかの実例において、結合された核酸は、次に、適合するバッファ(例えば、薄塩バッファ)を流出することにより、膜から溶出されてもよい。他の固相は、当業者にとって既知であろう。本質的には、従来の設定における機能的な任意の核酸精製方法も、バイオチップに適応する場合がある。
【0087】
いくつかの実施形態において、バイオチップは、また、機能モジュールの統合するための異なるコンポーネントを含んでもよい。これらのモジュールは、例えば、バイオチップ上のポイントツーポイントからの液体の移送、流量レートに依存するかもしれないプロセスのための流量レートの制御(例えば、洗浄ステップ、粒子分離、および溶出)、バイオチップ上の時間および空間における流体運動のゲーティング(例えば、ある形式のバルブの利用を通じて)、および流体の混合を含む。
【0088】
様々な方法は、液体輸送および制御される流体の流れに用いることができる。典型的な方法の1つは、流体または干渉ガスまたは流体のいずれかに接するプランジャが流体を駆動する場合の、動作中にプランジャにより排出される容量に基づいた正確な距離の容積移送式ポンピングである。このような方法の一例は、シリンジポンプである。別の典型的な方法は、空気的に、磁気的に、またはそうでなければ始動される、統合化エラストマ膜の利用である。いくつかの実施形態において、これらの膜は、規定されたスペース内に流体を含むために、および/また流体の早すぎた混合または送出を防ぐために、バルブとして用いることができる。あるケースでは、直列に用いられた場合、これらの膜は、蠕動ポンプと類似したポンプを形成することができる。例えば、同期され連続する膜の操作によって、先行側の膜が動流体を受け入れるために(およびデバイスのチャネル内の排気も排出するために)開かれながら、流体は、その後続側から「押し出される」ことができる。流体を駆動し、流量レートを制御する別の方法は、先行、後続、またはその両方の流体のメニスカスにて圧力を変更することにより、流体自体に直接真空または圧力をかけることである。適切な圧力(例えば、0.05〜30ポンド平方インチの範囲)が印加されてもよい。流量レートは、また、流体チャネルのサイズを適切に合わせることにより制御することもできる。理論に束縛されるものではないが、流量レートは、流体および水力直径の間の圧力差の4乗に比例し、チャネルまたは液体のプラグの長さおよび粘性に反比例する。液体輸送のための他の方法は、当業者にとって既知であろう。
【0089】
いくつかの実施形態において、流体ゲーティングは、様々な有効なバルブを用いて達成することができる。あるケースでは、有効なバルブは、チップに直接組み込むことができる圧電バルブまたは電磁バルブを、いくつかの実例において、含むことができる。いくつかの実施形態において、バルブは、チップの外側にあってもよいが、メインチップ本体上のポートにより流体連通する。いくつかの実施形態において、毛状のマイクロバルブなどの受動的なバルブが用いられてもよい。あるケースでは、マイクロバルブは、例えば、流体に印加された圧力がクリティカルなバルブより下流である場合に、流れを妨害するために、界面エネルギーおよび/またはシャープエッジなどの形体を用いることができる。
【0090】
混合は、様々な手段において達成することができる。いくつかの実施形態において、拡散は、例えば、単一のチャネルまたはチャンバの中に2つの流体を共同注入することにより、流体を混合するために用いることができる。いくつかの実施形態において、混合は、改善させることができる。例えば、薄層化などの技術(流体流が1回以上分離され再結合される)が用いられてもよい。別の実施形態において、流体チャネル内のカオス的移流は、例えば、チャネル内のミクロ組織の利用を通じて、生成することができる。有効なポンプおよびバルブを用いるシステムにおいて、混合は、デバイス上の2点間の流体を複数回サイクリングすることにより達成することができる。
【0091】
典型的な統合化バイオチップは、図2に示される。デバイスは、試薬の分配および計測、試料との試薬の混合、チップの温度サイクリング部への試料の送出し、および温度サイクリングの機能を統合する。この典型的なバイオチップは、PCR増幅(101)、サンガー配列決定(102)、および限外ろ過(103)、および定量化(104)を実行するいくつかの機能的な領域を有する。個別の試料(精製されていない、部分的に精製された、または精製されたDNAを含む)は、試料投入ポート(105)に移送されてもよい。PCR反応溶液は、バイオチップに移送され、PCR試薬リザーバおよびチャネル(106)上の空気式圧力を介して、4つの(101内の)増幅反応チャンバ内の試料とともに混合されてもよい。温度サイクリングに続いて、増幅された試料は、領域102の配列決定するチャンバに(空気式圧力によって再び)移送されてもよい。いくつかの実例において、配列決定する反応溶液(例えば、サンガー配列決定反応溶液)は、バイオチップに移送され、配列決定する試薬リザーバおよびチャネル(107)上の空気式圧力を介して、4つの増幅された試料とともに混合されてもよい。サイクル配列決定に続いて、試料は、限外ろ過のための領域103に移送されてもよい。配列決定された材料が蛍光性に標識されるとともに、定量化は、領域104内で実行することができる。この場合には、定量化は、適正量の材料が後続の分離および検出工程に装填されたことを保証するために利用することができる。
【0092】
いくつかの実施形態において、任意のDNA精製に続いて、DNA溶液は、結合剤とともに混合されるためのチャンバに移送され、状況に応じて事前の増幅なしで、定量化のためのチャネル、領域、またはチャンバに移送されてもよい。あるケースでは、定量化に続いて、精製されたDNAは、後続の処理のために測定されるだろう。いくつかの実施形態において、試料(例えば、試験液)は、分析チャンバに送られてもよい。いくつかの実施形態において、試験液は、検出領域(例えば、領域104)内に配置されてもよい。あるケースでは、試験液は、流出または静止していてもよい。例えば、方法は、マイクロ流体チャネル内の検出領域に試験液を流出することを含む配置ステップを含んでもよい。別の例において、本方法は、検出の間にマイクロ流体チャネルの検出領域を通じて試験液を流出することを含む配置ステップを含んでもよい。分析チャンバまたは検出領域は、いくつかの実例において、チップの温度サイクリング部内にあってもよい。いくつかの実施形態において、配置ステップは、領域で静止する試験液を保持し、かつ領域を検出領域に変換するために領域と1列に並ぶように検出器を移動することを含んでもよい。
【0093】
以上に論じられるように、本システムは、温度サイクリング機能を含んでもよい。温度サイクリング機能は、2つ以上の温度間のサイクリングができてもよい。例えば、温度サイクリング機能は、加熱/冷却ができてもよい。あるケースでは、温度サイクリング機能は、バイオチップの温度サイクリング部における試料の温度を迅速に変化することができる。例えば、温度サイクリング機能は、1℃/秒、5℃/秒、10℃/秒、20℃/秒、30℃/秒、50℃/秒、100℃/秒、または200℃/秒のレートで試料の温度を変化することができてもよい。温度サイクリング機能は、また、特定の温度で試料の温度を一時期保持することができてもよい。
【0094】
いくつかの実施形態において、分析チャンバは、入力チャネルと出力チャネルとの間に製造されてもよい。あるケースでは、本システムは、試料が分析チャンバを通じて流出されることを可能にしてもよい。いくつかの実施形態において、分析チャンバは、分析チャンバ内のシグナリング部分の検出可能な信号を検出するための検出システムに近接してもよい。例えば、いくつかの実施形態において、試料からの蛍光が測定されることを可能にするために、分析チャンバは光学的励起および検出システムに近接してもよい。
【0095】
いくつかの実施形態において、本システムは、試料と相互に作用するための励起および/または検出サブシステムを含む。いくつかの実施形態において、励起サブシステムは、1つ以上の励起源を含む。いくつかの実施形態において、励起サブシステムは、励起および検出窓における励起源に焦点を合わせるおよび/または調整するために、レンズ、ピンホール、ミラー、および対物レンズを含む光学エレメントを備えた励起ビームパスを含む(但し、限定されない)。いくつかの実施形態において、試料の光学的励起は、1つ以上のレーザ(例えば、デュアルレーザーシステム)によって達成することができる。あるケースでは、レーザー発振波長は、可視領域(例えば、400〜650ナノメートルの間)であってもよい。例えば、固体レーザーは、約460ナノメートル、488ナノメートル、および532ナノメートルの発光波長を提供することができる。これらのレーザーは、例えば、コーヒアレント(Coherent)社(カリフォルニア州サンタクララ)からのコンパス(Compass)、サファイア(Sapphire)、およびヴェルディ(Verdi)の製品を含む。ガスレーザーは、約488ナノメートル、514ナノメートル、543ナノメートル、595ナノメートル、および632ナノメートルでの可視光線にエミッションとともにアルゴンイオンおよびヘリウムネオンを含むことができる。可視領域の発光波長を備えた他のレーザーは、クリスタレーザ(CrystaLaser)社(ネバダ州リノ)から市販で入手可能である。1つの実施形態において、488nmの固体レーザーサファイア(Sapphire)488−200(コーヒアレント社(カリフォルニア州サンタクララ))が利用できる。別の実施形態において、可視範囲を超える波長を備えた光源は、可視範囲(例えば、赤外または紫外発光色素)を超える吸収および/または発光スペクトルをもつ色素の励起のために用いることができる。その代わりに、光学的励起は、発光ダイオードを含む色素励起およびランプに適切な発光波長を備えた非レーザー光源の利用によっても達成することができる。
【0096】
いくつかの実施形態において、検出サブシステムは、1つ以上の光検出器と、波長分散デバイス(それは波長分離を実行する)と、励起および検出窓にあるシグナル伝達物体から発光された蛍光を収集するためのレンズ、ピンホール、ミラー、および対物レンズを含む(但し限定されない)1つまたは一連の光学エレメントとを含む。発光された蛍光は、単一の色素、または色素の組み合わせからなりえる。信号を識別して発光色素からのその寄与を究明するために、蛍光の波長分離を利用することができる。これは、例えば、ダイクロイックミラーおよび帯域フィルターエレメント(クローマ(Chroma)社(バーモント州ロッキンガム))を含む多数のベンダーから市販で入手可能)の利用によって達成することができる。この構成において、波長の1つの部分がパスの下方へ移動し続けるようにミラーによって反射され、かつ別の部分が通過する場合、発光された蛍光は、一連のダイクロイックミラーを介して通過する。例えば、ダイクロイックミラーの端に各自配置された一連の離散的な光検出器は、波長の特定範囲上の検出光に対して用いることができる。いくつかの実施形態において、検出に先立って波長領域をさらに狭くするために、帯域フィルターは、ダイクロイックミラーと光検出器との間に配置されることができる。波長分離信号を検出するために利用することができる光検出器は、フォトダイオード、アバランシェフォトダイオード、光電子増倍管モジュール、および電荷結合素子(CCD)カメラを含む。これらの光検出器は、ハママツ(Hamamatsu)社(ニュージャージー州ブリッジウォーター)などのサプライヤから市販で入手可能である。
【0097】
ある実施形態において、単一の光学機器列を定量化およびレーザー励起蛍光検出の両方に対して用いることは有用かもしれない。例えば、所定の光学コンポーネントを2つ以上の機能に用いることによって、計器の容量、重量、およびコストを低減することが可能である。単一の光学機器列は、定量化モジュールの光学的問い合わせチャンバに対して励起源を連結し、かつ分離および検出モジュールの励起および検出窓に対して連結する光学エレメントを含んでもよい。いくつかの実施形態において、光学機器列は、また、波長分離エレメントを通じて、および光検出器に対して、定量化モジュールの光学的問い合わせチャンバ(すなわち、分析チャンバ)および分離および検出モジュールの励起および検出窓からの光を結合してもよい。いくつかの実施形態において、光学エレメントは、レンズ、ミラー、ダイクロイックミラー、帯域フィルター、スキャナ、並進ステージ、光源、および/または検出器を含む。
【0098】
一般に、光学機器列は、以下の対物レンズの1つ以上を達成してもよい。あるケースでは、光学機器列は、光学的問い合わせチャンバに対して効率的に励起源を連結することにより、励起効率を最大限にしてもよい。あるケースでは、光学機器列は、分離および検出モジュールの励起および検出窓に対して効率的に励起源を連結することにより、励起効率を最大限にしてもよい。あるケースでは、光学機器列は、光学的問い合わせチャンバと検出器との間の損失を最小限にすることにより、蛍光収集効率を最大限にしてもよい。あるケースでは、光学機器列は、励起および検出窓と検出器との間の損失を最小限にすることにより、蛍光収集効率を最大限にしてもよい。あるケースでは、光学機器列は、励起パスと検出パスとの間の共有エレメントの数を最大限にすることにより、光学エレメントの数を最小限にしてもよい。あるケースでは、光学機器列は、定量化モジュールと分離および検出モジュールとの間の共有エレメントの数を最大限にすることにより、光学コンポーネントの数を最小限にしてもよい。あるケースでは、光学機器列は、定量化モジュールと分離および検出モジュールとの励起に対して単一のレーザーを用いてもよい。あるケースでは、光学機器列は一般的な波長分離および検出モジュールをマイクロ流体工学の定量化およびマイクロ流体の分離および検出モジュールに対して用いてもよい。あるケースでは、光学機器列は、市販で入手可能なコンポーネントを用いて、における、移送の振動および温度の幅広い変動に耐えることができるコンポーネントを選択してもよい。
【0099】
図3および図4は、マイクロ流体工学の定量化および分離および検出の両方のための光学機器列構成の1つの実施形態の概略図を示す。励起パスは、バイオチップの定量化または分離および検出部分に対してビームパスが方向づけられることを可能にする、レーザー源(201)、ショートパスダイクロイックミラー(202)、並進ミラー(209)、および固定ミラー(208)対を含む。実例において、並進ミラー(209)が定量化位置にある場合、励起ビームは、レンズ(203)、第1の走査ミラー(205)、およびレンズおよび対物レンズのアセンブリ(204)に対して方向づけられてもよい。走査ミラー(205)は、バイオチップ内の定量チャネル(206)の各々に励起ビームを方向づけてもよい。その代わりに、分離および検出位置での並進ミラー(209)により、励起ビームは、レンズ(203b)、第2の走査ミラー(205b)、およびレンズおよび対物レンズのアセンブリ(204b)に対して方向づけられてもよい。第2の走査ミラー(205b)は、バイオチップ内の分離および検出チャネル(207)の各々に励起ビームを方向づけてもよい。この構成において、レーザー源(201)は、定量化および検出および分離ビームパスに対して共通である。レーザーに対する別の光学的励起ソースは、LEDおよびランプを含む。
【0100】
検出ビームパスは、波長分離および検出エレメント(211)、ピンホール(210)およびレンズ(203)を含んでもよい。検出ビームパスおよび励起ビームパスは、ダイクロイックミラー(202)から定量チャネル(206)、およびダイクロイックミラー(202)から分離および検出チャネル(207)まで、共通要素を共有してもよい。波長分離エレメントは、入射する蛍光の波長成分を分割するために一組のダイクロイックミラーおよび帯域フィルターを含んでもよい。これらは、個別素子でありうるし、個別素子は、単一の半組立部品において統合化できる。その代わりに、波長分離は、スペクトルグラフまたはプリズムにより達成することができる。検出エレメントは、複数のアノードを備えた離散的または統合化されたモジュールになりえるPMTを含む。この光学機器列構成において、波長分離および検出モジュール(211)は、定量化および分離および検出モジュールに共通であってもよい。
【0101】
この光学機器列において、並進ミラー(209)および固定ミラー(208)は、マイクロ流体の定量化、またはマイクロ流体の分離および検出のための励起および検出ビームパスを設定するために用いられてもよい。マイクロ流体の定量化のためのチャネル間の選択は、第1の走査ミラー(205)により達成されてもよいし、マイクロ流体の分離および検出のためのチャネル間の選択は、第2の走査ミラー(205b)により達成されてもよい。図3の概略図は、定量化チャンバを励起し問い合わせるように構成された光学機器列を示す。図4の概略図は、分離および検出モジュールの分離および検出チャネルから励起し検出するように構成された光学機器列を示す。
【0102】
図5および図6は、マイクロ流体の定量化および分離および検出の両方に用いることができる代替の光学機器列の概略図を示す。励起パスは、バイオチップの定量化または分離および検出部分に対してビームパスが方向づけられることを可能にするレーザー源(201)、ショートパスダイクロイックミラー(202)、並進ミラー(209)、および固定ミラー(208)対から構成される。実例において、並進ミラー(209)が定量化位置にある場合、励起ビームは、レンズ(203c)および第1ミラー(205c)および第2ミラー(205d)に対して方向づけられてもよい。次に、ビームは、並進ミラーアセンブリ(212)に対して方向づけられてもよい。このアセンブリは、プログラミング可能な並進ステージ上に搭載されてもよいミラーを含む。並進ミラーアセンブリ(212)は、バイオチップ内の定量チャンバ(206)の各々に励起ビームを方向づけることができる。その代わりに、分離および検出位置での並進ミラー(209)により、励起ビームは、レンズ(203b)、第2の走査ミラー(205b)、およびレンズおよび対物レンズのアセンブリ(204b)に対して方向づけられてもよい。第2の走査ミラー(205b)は、バイオチップ内の分離および検出チャンバ(207)の各々に励起ビームを方向づけてもよい。この構成において、レーザー源(201)は、定量化および分離および検出ビームパスに共通であってもよい。別の光学的励起ソースは、LEDおよびランプを含む。
【0103】
検出ビームパスは、波長分離および検出エレメント(211)、ピンホール(210)およびレンズ(203)を含む。検出ビームパスおよび励起ビームパスは、ダイクロイックミラー(202)から定量チャネル(206)まで、およびダイクロイックミラー(202)から分離および検出チャネル(207)まで、共通要素を共有してもよい。波長分離エレメントは、入射する蛍光の波長成分を分割するために一組のダイクロイックミラーおよび帯域フィルターを含む。これらは、個別素子でありうるし、個別素子は、単一の半組立部品において統合化できる。その代わりに、波長分離は、スペクトルグラフまたはプリズムにより達成することができる。検出エレメントは、複数のアノードを備えた離散的または統合化されたモジュールになりえるPMTを含む。この光学機器列構成において、波長分離および検出モジュール(211)は、定量化および分離および検出モジュールに共通であってもよい。
【0104】
この光学機器列において、並進ミラー(209)および固定ミラー(208)は、マイクロ流体の定量化またはマイクロ流体の分離および検出のための励起および検出ビームパスを設定するために用いられてもよい。マイクロ流体の定量化のためのチャネル間の選択は、並進ミラーアセンブリ(212)により達成されてもよいし、マイクロ流体の分離および検出のためのチャネル間の選択は、第2の走査ミラー(205b)により達成されてもよい。図5の概略図は、定量化チャンバを励起し問い合わせるように構成された光学機器列を示す。図6の概略図は、分離および検出モジュールの分離および検出チャネルから励起し検出するように構成された光学機器列を示す。
【0105】
第3のアプローチは、レーザー、LED、またはランプになりうる細密化された励起源、波長分離エレメント、および検出器(それらのすべては並進ステージ(213)(図7)上に搭載されてもよい)の利用である。並進ステージは、定量チャネル(206)の各々が問い合わせられることを可能にすることができる。このアプローチにおいて、定量化システムのための励起、波長分離および検出モジュールは、分離および検出システムから独立していてもよい。分離および検出のための光学機器列は、図3、図4、図5および図6に記載されるエレメントを含むことができる。
【0106】
定量化チャネルの問い合わせのための第4のアプローチは、レーザー、LED、またはランプを用いて定量化チャンバをすべて同時に励起することである。すべての定量化チャンバからの蛍光は、レンズによって集められ、蛍光の波長成分を空間的に分離するために回折素子を介して通過されてもよい。これは、次に、CCDカメラまたは2次元の検出器アレイ上で画像化されてもよい。この構成において、検出器アレイの1つの軸は、定量化チャンバのチャネルに関連することができ、検出器アレイの別の軸は、蛍光波長に関連することができる。分離および検出のための光学機器列は、図3、図4、図5および図6に記載されるエレメントを含むことができる。この構成において、励起源は、定量化モジュールと分離および検出モジュールの両方に共通になりえる。
【0107】
1つの実施形態において、波長成分は、ダイクロイックミラーおよび帯域フィルターの利用によって分離され、これらの波長成分は、光電子増倍管(PMT)検出器(H7732−10(ハママツ(Hamamatsu)社))により検出される。ダイクロイックミラーおよび帯域コンポーネントは、PMTの各々の入射光線が蛍光染料の発光波長に対応する狭い波長域から構成されるように、選択されることができる。帯域は、1〜50nmの波長領域の帯域を備えた蛍光発光ピークの中心に集められるように選択されてもよい。システムは、1、2、3、4、5、6、7またはさらに8つの色検出ができ、発光された蛍光を8つの別個の色に分割するために、1、2、3、4、5、6、7またはさらに8つのPMTおよび対応する一組のダイクロイックミラーおよび帯域フィルターにより設計されることができる。8以上の色素は、付加的なダイクロイックミラー、帯域フィルターおよびPMTを適用することにより検出することができる。図8は、1つの実施形態による、離散的な帯域フィルターおよびダイクロイックフィルタの具体化のためのビームパスを示す。この波長識別および検出構成の統合化バージョンは、H9797R(ハママツ(Hamamatsu)社(ニュージャージー州ブリッジウォーター))である。
【0108】
蛍光信号を作り上げる色素を識別する別の方法は、プリズム、回折格子、透過型回折格子(ソーラボ(ThorLabs)社(ニュージャージー州ニュートン)およびニューポート(Newport)社(カリフォルニア州アーヴィン)を含む多数のベンダーから市販で入手可能)、およびスペクトルグラフ(ホリバ・ジョバンイボン(Horiba Jobin−Yvon)社(ニュージャージー州エジソン)を含む多数のベンダーから市販で入手可能)などの波長分散方式エレメントおよびシステムの利用を含む。この実施形態において、蛍光の波長成分は、物理的空間にわたって分散してもよい。この物理的空間に沿って配置された検出エレメントは、光を検出し、波長との検出エレメントの物理的位置の相関を可能にしてもよい。この機能に適している典型的な検出器は、アレイ系を含み、マルチエレメントフォトダイオード、CCDカメラ、裏面薄化CCDカメラ、マルチアノードPMTを含む。当業者は、システムにおいて用いられる色素からの波長を識別することができるシステムをもたらすために、波長分散エレメントと光検出エレメントとの組み合わせを適用することができるだろう。
【0109】
別の実施形態において、励起した蛍光から波長成分を分離するために、スペクトルグラフが、二色性および帯域フィルターの代わりに用いられてもよい。典型的なスペクトルグラフ設計の詳細は、ジョン・ジェームズ(John James)「スペクトルグラフ設計原理(Spectrograph Design Fundamental)」ケンブリッジ、英国:ケンブリッジ大学出版局(2007年)において入手可能である。いくつかの実施形態において、505〜670runのスペクトル域を備えた凹面ホログラフィック格子を備えたスペクトルグラフP/N MF−34(P/N532.00.570)(ホリバ・ジョバンイボン(Horiba Jobin−Yvon)社(ニュージャージー州エジソン))は、本アプリケーションにおいて用いられてもよい。検出は、線形の32エレメントPMT検出器アレイ(H7260−20、ハママツ(Hamamatsu)社(ニュージャージー州ブリッジウォーター))により達成することができる。いくつかの実施形態において、収集された蛍光は、ピンホール上で画像化され、反射され、分散され、スペクトルグラフの出力ポートに取り付けられた線形のPMT検出器上に凹面ホログラフィック格子によって画像化されてもよい。あるケースでは、PMT系検出器の利用は、PMT検出器の低いダークノイズ、高感度、高ダイナミックレンジおよび早い応答特性を巧みに利用する。いくつかの実施形態において、励起する蛍光の検出のためのスペクトルグラフおよびマルチエレメントPMTの検出器の利用は、計器の検出システム(すなわち、ダイクロイックミラー、帯域通過および検出器)を物理的に再構成する必要性なしに、システムおよびレーン内に適用することができる色素の数および色素の発光波長における適応性を可能にする。いくつかの実施形態において、この構成から収集されるデータは、各レーンの各スキャンの可視波長範囲にわたる波長依存スペクトルであってもよい。あるケースでは、1スキャン当たりの最大限のスペクトルの生成は、試料内にありうる色素の発光波長および色素の数の両方に関して色素の適応性を提供する。さらに、分光計および線形のマルチエレメントPMT検出器の利用は、また、一連のPMTエレメントのすべてが並列に読出されてもよいような、非常に高速の読み出しレートを可能できる。図9は、1つの実施形態による、マルチエレメントPMTおよびスペクトルグラフの具体化のためのビームパスを示す。
【0110】
いくつかの実施形態において、計器は、複数のレーンを同時におよび/または複数の波長を同時に検出するために、観測動作モードを用いてもよい。1つの構成において、励起ビームは、同時にすべてのレーンで一斉に衝突されてもよい。いくつかの実施形態において、蛍光は、CCDカメラまたはCCDアレイなどの2次元の検出器によって集められてもよい。例えば、1次元の検出器は、物理的波長分離を表わしてもよいが、その一方で、別の次元は、空間またはレーン対レーンの分離を表わしていてもよい。
【0111】
複数サンプルの同時励起および検出のために、走査ミラーシステムは、バイオチップのレーンの各々を画像化するために、励起ビームパスおよび検出ビームパスの両方を操縦するために利用されてもよい。この動作モードにおいて、走査ミラーは、最初のレーンから最後のレーンまで、レーンからレーンへと連続して走査し、そして再び最初のレーンから最後のレーンまで再びプロセスを繰り返して、ビームパスを操縦する。レーンを探し出すアルゴリズムは、レーンの位置を識別するために用いられてもよい。
【0112】
同時のマルチレーンおよびマルチ色素の検出のための光検出システムの1つの実施形態は、図24に示される。蛍光励起および検出システム40は、記録(および究極的には解析)のために色素から1つ以上の光検出器に誘導された蛍光を集めて伝送する一方で、各々のマイクロチャネルの一部を通じてエネルギー源(例えば、レーザー光)を走査することにより、シグナリング部分(例えば、標的核酸に固定化されたシグナリング部分を含む結合剤のシグナリング部分)を励起する。1つの実施形態において、蛍光励起および検出アセンブリ40は、開口部42を通してレーザー60から発光されたレーザー光をテストモジュール55に伝送する(および光検出器64へ戻す)ためのレーザー60、スキャナ62、1つ以上の光検出器64、様々なミラー68、スペクトルグラフ、およびレンズ72を含む。スキャナ62は、テストモジュール55に関する様々なスキャニング位置に、入射するレーザー光を移動させる。具体的には、スキャナ62は、それぞれの別々のコンポーネントを検出するために、テストモジュール55内の各マイクロチャネルの適切な部分にレーザー光を移動させる。マルチエレメントPMT64(すなわち、光検出器)は、テストモジュール55からデータ(例えば、可変長のDNA断片からの蛍光信号)を収集し、ケーブルを通じてデータ収集およびストレージシステム(図示せず)にデータを電子的に提供する。1つの実施形態において、データ収集およびストレージシステムはオプションインダストリアルコンピュータ(Option Industrial Computers)社(カナダケベック州audreuil−Dorion13)から市販で入手可能な高耐久化コンピュータを含むことができる。
【0113】
いくつかの実施形態において、信号処理アルゴリズムは、データを訂正、フィルタリングおよび/または解析するために用いられてもよい。このプロセスは、呼出可能信号を捜し出し、信号のベースラインを訂正し、ノイズをフィルタリングし、色クロストークを除去および/または信号ピークの識別する、などのステップを含んでもよい。例えば、呼出可能信号を捜し出すステップは、閾値を用いることにより実行されてもよい。このプロシージャは、信号の先頭および末端から無関係のデータを取り除くために用いられてもよい。いくつかの実施形態において、例えば、信号がすべての検出色のための共通のベースラインを有するように、背景が信号から取り除かれてもよい。あるケースでは、信号から高周波騒音を取り除くためにローパスフィルタが適用されてもよい。
【0114】
1つの実施形態において、上記の構成物の1つ以上を含むキットが提供されてもよい。「キット」は、本明細書に用いられるように、例えば、先に記載されたように、典型的には、本発明の構成物の1つ以上を含むパッケージまたはアセンブリおよび/または本発明に関連づけられた他の構成物を定義する。キットの合成物の各々は、液体の形式で(例えば、溶液で)、固形(例えば、乾燥したパウダ)などで、提供されてもよい。本発明のキットは、あるケースでは、指示が本発明の構成物に関連づけられるためのものであることを当業者が認識するように、本発明の構成物に関して提供される任意の形式の指示を含んでもよい。例えば、その指示は、構成物および/またはキットに関連づけられた他の構成物の利用、変形、混合、希釈、保存、管理、アセンブリ、ストレージ、パッケージングおよび/または準備のための指示を含んでもよい。その指示は、このような指示(例えば、任意の方式において提供される、文書または出版物、口頭、聴覚(例えば、電話)、デジタル、光学、視覚(例えば、ビデオテープ、DVDなど)または電子通信(インターネットまたはウェブベースの通信を含む))を含むためにふさわしい手段として当業者によって認識可能な任意の形式において提供されてもよい。
【0115】
この記載において「標的核酸」「オリゴヌクレオチド」「結合剤」「核酸」「ストランド」および他の同種類のものなどの用語は、単数形で表す。当業者は、分子を記載するために用いられた多くの用語が、単数で用いられてもよく、かつ単数または多数のいずれかで表してもよいことを理解するだろう。例えば、標的核酸は、分析において結合剤によって検出されてもよいが、分析は、結合剤の多くの複製および標的核酸の多くの複製を必要としてもよい。このような実例において、用語は前後関係で理解されるべきである。このような用語は、単一の分子または複数の分子のいずれかの意味に限定されない。
【0116】
以下の例は、本発明のある実施形態を例証するように意図されるが、本発明の範囲を例示するわけではない。
【0117】
[実施例1]
この実施例は、以下において用いられるシステムを記載する。
【0118】
本システムは、標識されたDNA断片の分離および検出のための計器を含み、「標的核酸の迅速な多重化増幅のための方法(Methods for Rapid Multiplexed Amplification of Target Nucleic Acids)」と題され、セルデン(Selden)らによって2008年4月4日に出願された米国特許出願第2009/0023603号公報(その文献は参考文献として本明細書に援用される)に、より詳細に記載される。計器の耐久性は、現場および研究室での利用のため高められる。その計器は、低消費電力を有しており、低電圧指令73/23/EECの下で特徴づけられたCEである。DNA分離は、高電圧サブシステムを通して、適切なローディング、引き戻しおよび分離電圧を適用することにより、16試料のバイオチップおよびカスタムの篩マトリクス内で行われる。レーザー励起蛍光検出サブシステムは、バイオチップの励起および検出ゾーンを介して通過する標識されたDNA断片からの蛍光を励起し収集する。分離チャネルに沿って150V/cmおよび300V/cmの電界を印加することにより実行された分離は、それぞれ、28分および15分において完結する。このシステムは単一の塩基対解像度よりも効果的に高速の分離を提供し、かつ単一の複製標的のPCR増幅の産物を検出する
【0119】
[システム構成]
サブシステム(空気式サブシステム、温度サイクリングサブシステム、および分離および検出サブシステム)はラックマウント方式の耐久性を高められた工業用コンピュータによって制御される。このコンピュータは、標準サイズのデスクトップコンピュータの機能性を有しており、17インチのLCD表示装置、フルサイズのキーボード、およびマウスを含む。
【0120】
[流動性の操作計測]
バイオチップを通じての流体の流れは、流体チャネルの端部に配置されるポートに対する系統的な加圧によって達成される。毛状のバルブの破裂圧力未満の圧力が印加される場合、流体は、チャネルに沿って流出し、毛状のバルブで止まるだろう。バルブの破裂圧力よりも高い圧力が印加される場合、流体は、バルブを通じて流出するだろう。空気式系統は、また、膜を弁座に対して押しつけるための圧力の印加により、薄膜弁を閉じるために用いられる。薄膜弁の封止圧力は、適用される封止圧力に応じて増減する。選択されて出力に適用される5つの離散的な圧力レベルを供給するために、圧力は、小型の膜ポンプおよび圧力調整器によって生成される。本システムは、バイオチップ上のポートを通じて連結管に連結される8つの出力を提供する。空気式サブシステムは、所望の流れ制御を達成するためにコンピュータで制御される。このサブシステムは、バイオチップに対する特定の圧力レベルの系統的なアプリケーションを通じて、バイオチップ内の溶解およびPCRを実行するために流体の流れをもたらす。図10は、バイオチップの典型的な写真を示す。
【0121】
[温度サイクラーサブシステム]
温度サイクラーは、高性能のヒートシンクおよびファンアセンブリ(ヒートポンプ)上に取り付けられた高出力熱電モジュール(TEM)を含む。TEMと反応チャンバとの間の圧縮および効率的な熱の転送を供給するために、カバーによりバイオチップを締める。カバーに対する熱損失は、バイオチップとカバーアセンブリと間の絶縁材の層によって最小限にされる。TEMの表面および反応チャンバ内の温度センサは、設定値温度までの所望の迅速なランピングおよび前記設定値温度での安定度を可能にするためのフィードバックを行なう。TEM表面で測定された加熱/冷却レートは、21.6℃/秒および21.7℃/秒である。また、反応溶液の測定された加熱/冷却レートは、14.8℃/秒および15.4℃/秒である。反応溶液は、この温度サイクラー内で、急速の商用サイクラーと比較して7倍急速で加熱され冷却される。状態間の最小限の遷移時間は、バイオチップ内の反応溶液の迅速かつ制御された加熱/冷却を可能にする。図11および図12は、温度サイクラーの典型的な写真を示す。
【0122】
以上に記載された既存のTEM、ヒートシンク、およびファンアセンブリは、チップ室に直接取り付けられるように設計され、PCRチャンバをTEM上の中央におくように配置された。TEMの表面は、バイオチップとの接点を最大限にし、バイオチップ上のストレスを最小限にするように配置される。TEMの表面上に取り付けられた熱電対センサは、センサのためのポケットを取り付けることを可能にするようにバイオチップを設計することにより調節される。加熱における不統一を最小限にし、かつまた熱応答を最大限にするために、TEMと残りのチップ室との間の熱隔離は、断熱層により達成される。圧縮カバーは、精製モジュールおよびバイオチップの形式を収容するために変更され、TEMと反応チャンバとの間の効率的な熱転送のための所望の圧力を生成するために利用される。反応チャンバとカバーとの間の熱隔離は、反応チャンバの上に空気ポケットを組み立てることにより達成される。温度サイクラーの傾斜および性能は、バイオチップの16個のPCR反応チャンバ内の熱電対の配置により特徴づけられる。
【0123】
[分離端部検出サブシステム]
高電圧接続は、計器のカバーに取り付けられ、カバーが閉まっている場合、バイオチップに接触される。レーザー励起蛍光サブシステムは、光学ビームパスまたはサブシステムコンポーネントに対して変更なしで計器に統合化される。ヒーターサブシステムは。チップ室内に取り付けられる。
【0124】
[システムステータス]
温度サイクリングサブシステムは、サイクル番号、残りの工程所要時間、およびカレントブロックおよび溶液温度を含む装置ステータスをユーザに提供する。ユーザフィードバックは、キーボードを介して供給される。実行されたデータはすべて、制御コンピュータに格納され、イーサネットによってプロセスデータベースに転送される。計器上の分離および検出の間、制御コンピュータは、実行中であるステップを示す。さらに、分離チャネル電流および基板温度を含む16個のレーンおよびプロセスパラメータの各々のためのリアルタイムエレクトロフォレトグラムが表示される。機載コンピュータは、年次メンテナンスまでの残り時間、システム電源投入時自己診断テスト(POST)の結果、および故障または即時のメンテナンスを必要とする任意のサブシステムの名前について、ユーザに警告する。
【0125】
[実施例2]
この実施例は、TH01型ローカスプローブを用いて、マイクロ流体ピコグリーン分析によるDNA定量化を実証する。
【0126】
光学的に透明な反応チャンバを備えた射出成形の16個のレーンバイオチップは、以上に記載された光学システムを備えた反応生成物の問い合わせを可能にするために組み立てられた。バイオチップにおける各レーンは、約7マイクロリットルの反応混合を保持し、16個の個体試料の増幅を一斉に可能にする。先に記載されたように(ギース(Giese)ら「従来のマイクロ流体STR解析のための高速の多重化PCR(Fast Multiplexed PCR for Conventional and Microfluidic STR Analysis)」(2009年)日本法科学技術学会誌、54巻、6版、1287〜1296ページ)、PCR状態が実行された。
単一複製のヒトのチロシン水酸化酵素遺伝子、THO1(スワンゴ(Swango)ら「法医学的試料における核DNAの量および品質を評価するための多重qPCR分析の発展的な検証(Developmental validation of a multiplex qPCR assay for assessing the quantity and quality of nuclear DNA in forensic sample)」(2007年)、国際法医遺伝学会、170巻、1版、35〜45ページ)を標的とするために使用されたプライマー対は次のとおりだった。
TH01型フォワードプライマー:5’−AGG GTA TCT GGG CTC TGG−3’(配列ID番号:1)
TH01型リバースプライマー:5’−GCC TGA AAA GCT CCC GAT TAT−3’(配列ID番号:2)
9947AゲノムDNA(MCLab、サウスサンフランシスコ(カリフォルニア))のストック10ng/マイクロリットルは、反応混合に対して4マイクロリットル量におけるDNAの適正量を追加することにより、標準曲線を生成するために用いられた。この標準曲線は、未知の(ヒト/ヒト以外の)ゲノムDNA試料にフィットするデータに用いるためのゲノムDNA − 0ng、0.4ng、1ng、4ng、10ng、20ngおよび40ng − の7つの異なる濃縮物を含んだ。標準曲線試料は、4回繰り返して解析された。増幅は、[93℃で4秒、58℃で15秒、70℃で7秒]の28サイクルおよび70℃で90秒の最後の伸長反応によって追従された、93℃における20秒の活性化により始動された。完了時間は、約17分だった。
【0127】
増幅に続いて、ピコグリーン試薬(登録商標)(インビトロジェン(Invitrogen)社)は、TE−4(10ミリモルのトリス(pH8)、0.01mmEDTA)バッファに1:200で希釈され、9マイクロリットルの試薬が1マイクロリットルのPCR産物に追加された。結果として生じた溶液は、光から保護され、室温で5分間培養された。10のマイクロリットルの試料から、約6マイクロリットルが、計器レーザー検出のための分離および検出バイオチップのレーンの中に装填された。計器レーザーは、色素の光退色を回避するために、適切なレーザーパワー、ゲインおよび統合時間に設定された。レーザーは、20mWを出力するために設定され、OD2ニュートラルフィルター(ソーラボ(Thorlabs)社(ニュージャージー州ニュートン))は、出力電力を0.2mWに減ずるために用いられた。青色のPMTのゲインは、原寸大の30%に設定され、赤色、黄色および緑色のゲインは、0に設定され、リフレッシュレートは5Hzに設定された。
【0128】
試料は、4回繰り返して分析された。レーザシャッタが開かれると、信号は、最大値まで増加し、その後、低下し始めるだろう。最大信号からの蛍光信号強度1秒(5読み取り値)が記録された。投入DNAの増大につれて蛍光信号信号が増加したことが観察された。計器からの投入DNA対相対蛍光単位(RFU)のプロットは、R2=0.999を有しており、未知のDNA試料(図13)を推定するための標準曲線として用いられた。図14は、レーン変位の機能としてレーザー検出から出力されたRFUデータである。
【0129】
犬の口腔スワブ、バクテリア(セレウス菌)、イースト(サッカロミセス属セレビシアエ)、ヒトの口腔スワブ、およびヒトの全血が精製されたゲノムDNAは、分析を評価するために用いられた。バクテリアのDNAは、細菌細胞またはペレットから抽出された。犬(カニスファミリアス)のDNAは、口腔スワブから抽出された。ゲノムのイーストDNAは、ATCC(ヴァージニア州マナッサス)から入手された。抗凝血剤としてのEDTAを含む新鮮なヒトの全血試料は、Research Blood Components,L.L.C.(マサチューセッツ州ブライトン)から氷で入手された。ヒトの口腔スワブ試料は、ヒトの被検者の内部の頬面上で綿棒(Bode SecurSwab(商標))を上下に数回移動させることにより入手された。犬の口腔スワブ試料も同様に入手された。DNA精製はすべて、シリカDNA結合スピンカラムを介してグアニジン系溶解試薬および精製を用いて実行された。
【0130】
これらのDNA試料の濃度は、実験のときに生成された標準曲線からRFU値を推定することにより評価された。DNA濃度も、ナノドロップ(Nanodrop)分光測光器(サーモフィッシャーサイエンティフィック(Thermo Scientific)社(デラウェア州ウィルミントン))を用いて、UV吸光度によって測定された。表1に公表された値は、平均値±1標準偏差である。
【表1】

【0131】
ヒト以外のDNA試料は、ピコグリーン分析における背景蛍光信号のみを生成したが、UV吸光度によって検出することができる。対照的に、ヒト以外DNAにより混入されたヒトゲノムDNAの既知数は、ヒトのDNA寄与に対応する信号を生成した。ヒトのDNA源に対して260ナノメートルの吸光度から得られた値は、ピコグリーンカーブデータをあてはめたものからの値に接近していた。より高いヒトゲノムDNAテンプレートの存在下で出力蛍光信号が増加しただけでなく、データは、TH01型プライマーのヒトの特異性を実証した。
【0132】
従来の分析(例えば、BodeQuant;ボードテクノロジーグループ(The Bode Technology Group)社(バージニア州ロートン))に対するアプローチの有利性は、試料の量および増幅時間の両方において実質的な減少を含む。例えば、BodeQuantプロトコルに続く増幅は、25マイクロリットルの反応混合物および60分を超える10サイクルのプロファイルを必要とする。蛍光検出のために、BodeQuantは、プレートリーダー上での1ウェル当たり200のマイクロリットルの反応体積をもつ96ウェル分析を用いる。その上、プレートリーダー系分析は、マイクロ流体バイオチップ形式において統合するのが相当困難になりえる。対照的に、ここで記載されたマイクロ流体分析は、7マイクロリットルを用いており、28サイクル増幅は、17分で完結した。OD2減光フィルターの組み込みは、増幅サイクルの数および全体の工程所要時間のを著しく低減することができることを示す、レーザーパワーを100倍低減する。
【0133】
レーザー検出およびOD2光学フィルターにより、10マイクロリットルのピコグリーン反応溶液の約0.353ナノリットルが、30のマイクロメートルのレーザー励起ビーム径および0.5ミリメートルのチャンバ深さに基づいて、実際に励起され検出された。したがって、この構成において、システムの検出限界(LOD)は、DNAの0.005ピコグラムである。マイクロ流体量およびレーザー検出の組み合わせは、強力な分析に結びついた。OD2フィルターが利用されないならば、LODは0.05フェムトグラムである。チャンバ寸法は、所望すれば、均一のより小さなLODを可能にするために選択することができる。
【0134】
[実施例3]
この実施例は、Aluローカスプローブを用いて、マイクロ流体ピコグリーン分析によってDNA定量化を実証する。
【0135】
定量化のための反復性ローカスの利用は、反応時間のさらなる低減およびLODの改善を可能できる。ヒトのAlu配列は、ゲノムにおける何十万もの複製において存在する反復要素であり、Alu配列を標的とするプライマー対は、マイクロ流体の定量化に用いられた。
Aluフォワードプライマー:5’−GTC AGG AGA TCG AGA CCA TCC C−3’(配列ID番号:3)
Aluリバースプライマー:5’−TCC TGC CTC AGC CTC CCA AG−3’(配列ID番号:4)
高速のPCRサイクリングプロファイル反応および定量化は、93℃での20秒の活性化の改善された増幅プロトコルを備えた実施例2において記載されたように、[93℃で4秒、58℃で15秒、70℃で7秒]の15サイクルおよび70℃で90秒の最後の伸長反応によって追従された。完了時間は、約10分だった。計器からの投入DNA対相対蛍光単位(RFU)のプロットは、R2=0.999を有する(図15)。図16は、レーン変位の機能としてレーザー検出から出力されたRFUデータである。励起の間に、TH01型反応により用いられるものと比較して、振幅によってレーザーパワーの強度を弱めたフィルターは、色素の光退色を回避するために必然的に見出された。OD4減光フィルターは200mWに設定されたレーザーパワー、原寸大の30%に設定された青色のPMTのゲイン、0に設定された赤色、黄色および緑色のゲイン、および5Hzに設定されたリフレッシュレートとともに用いられた。レーザーパワーの設定およびフィルターの組み合わせにて、効果的なレーザーパワーは、実施例2の10%である。このデータは、増幅の間のサイクル数がさらに低減されたことを示唆する。
【0136】
この可能性をテストするために、15の試料が、10の増幅サイクル、2.5分ずつ縮める増幅時間を用いて、1、5、10および30ナノグラムの投入DNAにより各々定量化された。信号強度は、増加する投入DNAとともに増大する(図17)。1ngの投入に対して、ベースラインが差し引かれた信号強度は、10RFUの標準偏差および50%のCVを有する19.9RFUである。5ngの投入に対して、ベースラインが差し引かれた信号強度は、11RFUの標準偏差および17%のCVを有する68RFUである。
【0137】
ヒトゲノムDNA、ヒト以外のDNA、および混入されたヒトゲノムは、実施例2に示すように分析を評価するために用いられた。牛(ボースタウルス)および鶏(ガッルスドメスティクス)は、血液サンプルから抽出された。DNAはすべて、実施例2に示すように用意された。
【表2】

模擬の法医学的ケースワーク試料もまた鑑定に用いられた。スワブ上の湿式血液サンプルは、陶製タイル上に血液検査液の100マイクロリットルをピペットで取り、その後、綿棒により血液を収集することにより用意された。乾燥した血液サンプルが、同様に用意された(しかし夜通し乾くように放置された)。細胞試料は、ヒトの被検者の手のひらの上でスワブの頭(滅菌水により予め濡れている)の摩擦により収集された。接触試料は、1人のドナーによって数回処理された陶製タイル上で予め湿ったスワブを用いることにより用意された。DNA抽出はすべて、スワブからのゲノムDNAの分離のための製造業者のプロトコルに従うQIAmpキット(キアゲン(Qiagen)社(カリフォルニア州バレンシア))を用いて実行された。
【表3】

これらのデータに基づいて、マイクロ流体Aluピコグリーン分析が、ヒトのゲノムDNAの定量化に対して、非常に高感度で特有であることは明らかである。Alu増幅には、TH01型増幅よりも約100万倍の高い標的の有益性がある。したがって、増幅が100%効率的であるならば、28サイクルとは対照的に約8つの増幅サイクルの要件を表わす。Aluのケースでの10倍に低減されたレーザーパワーは、約3サイクルの付加的な必要とされるサイクルを表わす。理論上、これらの状態下では、Alu反応は、28サイクルのTH01型反応に匹敵する信号を生成するために、11サイクルを必要とする。2つのローカスの増幅は、恐らく同一ではないが、10サイクルにおいて観察された結果は、これらの理論考察とぴったり一致する。
【0138】
Aluプローブを用いて、マイクロ流体の容量とレーザー検出との組み合わせは、DNAの0.005ピコグラムのLODに対して結びつく。OD3と同等のレーザーフィルターの配置なしで、結果として生じるLODは、0.005フェムトグラムである。このLODは、TH01型プローブの利用、および実施例2の増幅および検出条件の10倍である。Aluプローブおよび状態は、また、サイクル数の大幅な減少を可能にする。いくつかの実施形態において、0.005未満のフェムトグラムのLODが必要とされるならば、増幅サイクル数、プローブの配列および効率、およびレーザーパワーの1つ以上を高めることができる。
【0139】
[実施例4]
この実施例は、サイバーグリーンI(SYBR Green I)分析によってDNA定量化を実証する。
【0140】
実施例3において記載されたAluプライマーを含む増幅反応コンポーネントは、トリスEDTAバッファ(pH8)におけるサイバーグリーンI(SYBR Green I)(インビトロジェン(Invitrogen)社)の1:60,000の稀釈液が、PCR混合に組み込まれたことを除いて用いられた。サイバーグリーンI(SYBR Green I)は、熱的に安定した蛍光染料であり、したがって、リアルタイムPCR分析におけるようにPCR混合に追加することができる。
【0141】
このより高速の分析の実行可能性をテストするために、標準較正曲線が生成され再生された。ゲノムの9947A DNA規格は、0ナノグラム、0.4ナノグラム、1ナノグラム、4ナノグラム、10ナノグラム、20ナノグラム、および30ナノグラムであった。増幅は、[93℃で4秒、58℃で15秒、70℃で7秒]の7サイクルおよび70℃で90秒の最後の伸長反応によって追従された、93℃における20秒の活性化により始動された。完了時間は6分だった。増幅に続いて、同じバイオチップは、実施例3に示したような光学的設定により、レーザー励起された。バイオチップにおけるPCRおよびレーン検出は、標準曲線の再現性を確認するために4回繰り返して実行され、その蛍光は、投入テンプレートDNAの増加とともに増大する。計器(図18)からの投入DNA対RFUのプロットは、R2=0.995により多項式のあてはめを示した。ピコグリーン色素の利用に対するこのアプローチの有利性は、全過程およびバイオチップ形式を簡易化する(例えば、ピコグリーン試薬を測定し、かつそれを後増幅反応とともに混合する必要性を省く)バイオチップの同一のチャンバにおいて増幅および検出を実行することができるということである。
【0142】
[実施例5]
この実施例は、分子ビーコンを用いて、混成分析によって事前の増幅をしないで、DNA定量化を実証する。
【0143】
増幅をしない直接混成は、ヒトのゲノムDNAを定量化するために利用された。2つのビーコンプローブは、それらが繰り返しヒトのAluエレメントを標的とするように、設計された。プローブ1は、PV92遺伝子に由来し、配列5’−GCC CGA TTT TGC GAC TTT GGA GGG C−3’(配列ID番号:5)を有する(配列ID番号:5)(ヒトAlu反復GenBank登録番号(Human Alu Repeat GenBank Accession Numbers):M57427.1/M33776、AF302689).プローブ2は、既知のAlu亜科の配列によって設計され、高度に保存された標的部位を選択していた。配列5’−CGC CTC AAA GTG CTG GGA TTA CAG GCG−3’(配列ID番号:6)は、より多くの高感度プローブであると予測された。両方のプローブは、5’末端にて取り付けられたフルオレセイン(fluorescein)(6−FAM(商標))および3’末端にて取り付けられた、アイオワブラック消光剤(Iowa Black Quencher)(IBRFQ)を有する(IDT(Integrated DNA Technologies)社(アイオワ州コーラルヴィル)。
【0144】
プローブ1に適した蛍光バッファは、40ミリモルのNaCl、5ミリモルのMgCl2、および10ミリモルのトリス−HCl(pH8.0)を含んだ。プローブ2に適した蛍光バッファは、1ミリモルのMgCl2、および20ミリモルのトリス−HCl(pH8.0)を含んだ。蛍光バッファは、高い信号対ノイズ比を示した人工のssDNA標的との混成に基づいて選択された。ハイブリッドおよびステム構体の溶融温度(Tm)は、IDT,SciToolsオリゴアナライザ(OligoAnalyzer)3.1、およびmfoldバージョン3.4プログラム(mfold version 3.4 programs)を用いて究明された。混成温度は、53℃(混成の温度Tmより下で、ステムの温度Tmよりも高い温度)に設定された。
【0145】
所望の蛍光バッファにおける22マイクロリットルの試料反応が、10マイクロリットルの分子ビーコンの2マイクロリットルにより用意され、ヒトゲノムDNAの濃度(0、4.5、9、18、32、50、100ナノグラム/マイクロリットル)を変化させた(ロシュ・アプライド・サイエンス(Roche Applied Science)社(インディアナ州インディアナポリス))。次に、約7マイクロリットルが、熱変性および混成のための実施例2〜実施例4のバイオチップに転送された。バイオチップのための温度プロフィールは、53℃で60秒間の混成および25℃で60秒間の冷却により追随される95℃で10秒間の変性の単一のサイクルにより始動された。次に、バイオチップは、続いて、計器から解析された。プローブ1が利用された場合、レーザーパワーは、20mWに設定された、青色のPMTのゲインは原寸大の30%に、残りのすべての色は0および10Hzのリフレッシュレートに設定された。但し、プローブ2に対して、OD2減光フィルターの利用は、必然的であり、残りの設定は、プローブ1のように実施された。これは、プローブ1に対してプローブ2の高められた感度を確認した。試料は、4回繰り返して評価され、一組の対照試料は、同様にしかしヒトゲノムDNAなしで、用意された。
【0146】
図19は、分子ビーコンプローブ1を用いて検出された、RFU対投入DNAの混成プロットである。陰性対照の平均RFU信号は、216RFUのSDを有する3427RFUであり、4.5ナノグラム/マイクロリットルの総投入に対して583RFUのSDを有する4641RFUであった。図20は、分子ビーコンプローブ2を用いる、混成プロットである。陰性対照の平均RFU信号は、33RFUのSDを有する3668RFUであり、4.5ナノグラム/マイクロリットルの総投入に対して83RFUのSDを有する4075RFUであった。ベースラインが差し引かれたRFUは、レーザーによって検出された実際の投入DNAに対してプロットされた。これは、0、4.5、9、18、32、50、100ナノグラム/マイクロリットルの全体のヒトゲノムDNAを、0、1.6、3.2、6.4、11.3、17.6、35.3ピコグラムのDNAにそれぞれ変換した。混成形成による信号の増加は、試料にある標的DNAの増大につれて高められた。データは、2つのプローブが、0ピコグラム〜1.6ピコグラムのDNAを連続して識別することを実証した。プローブ1を使用するLODは、1.6のピコグラムであった。プローブ2に対して、OD2レーザーフィルターなしで、分析は、約16フェムトグラムのDNAを検出することができる。このLODが、単一のヒト細胞(約6ピコグラム)内にあるDNAより1000倍少なく、微量法医学的証拠の効果的な定量化を可能にすることに留意されたい。
【0147】
当業者が認識するとともに、Aluビーコンに対する変更(例えば、より優れた消光効率を有する、より高度に保存された標的配列および連結される蛍光団を用いて)は、直接混成アプローチの感度およびLODをさらに向上させることができる。しかしながら、この実施例において用いられるAluプローブに関して、直接混成は、10サイクルのPCR−ピコグリーン分析とほぼ同じ感度を有している。但し、工程所要時間に関して、増幅分析をしない混成は、全体的な定量化を約5分短縮し、約2分のみを必要とした。さらに、直接混成は、大幅な全体経費の削減をもたらし、マイクロ流体バイオチップ上の実装場所(real estate)を必要とする酵素、dNTPs、およびPCRバッファが、反応に関係しないので、統合化マイクロ流体システムを簡易化する。最後に、臨床試料、環境上の試料、および法医学的試料において一般的であるPCR抑制剤は、混成反応を禁止するべきでない。
【0148】
[実施例6]
この実施例は、直接混成分子ビーコン分析の還元反応時間を実証する。
【0149】
分子ビーコンプローブ2のための反応状態は、実施例5のものと同様であるが、53℃で30秒間の混成および25℃で10秒間の冷却により追随される95℃で10秒間の変性が、単一サイクルにより実行された。同じ光学的設定も実施された。図21は、定量化された検出された実際のピコグラムDNAに変換されたRFU対投入DNAの混成プロットである。陰性対照の平均RFU信号は、105RFUのSDを有する3321RFUであり、1.6ピコグラムに対して61RFUのSDを有する3806RFUである。データは、分析に影響がなかった全体の定量化時間を130秒から50秒に低減することを示唆する。実際、さらなる最適化(改善されたプローブを有する(および有しない)は、分析時間を15秒未満(例えば、3秒間の変性、10秒間の混成、および1秒間の冷却)に低減することを可能にするだろう。
【0150】
[実施例7]
この実施例は、ヒト口腔スワブDNAを定量化するために、直接混成分子ビーコン分析を実証する。
【0151】
実施例6の標準曲線から、男女のヒトの被検者からの口腔スワブDNAの蛍光信号が推定され、UV吸光度から得られた値と比較された。
【表4】

【0152】
[実施例8]
この実施例は、直接混成分子ビーコン分析の特異性を実証する。記載されるように、ヒト以外のDNAが精製された。実施例6の標準曲線から、バクテリア、犬、および、鶏DNAからの蛍光信号が、再び推定され、UV吸光度から得られた値と比較された。さらに、既知のヒト口腔スワブのDNA試料は、これらの異なるバックグラウンドDNAにより混入された。
【表5】

ビーコン分析からのヒト以外のDNAは、わずかにバックグラウンドの上の蛍光信号を示したが、このアーティファクトは、恐らく緩衝効果によるものである。分析において用いられるバックグラウンドDNA試料は、蛍光バッファにおいてではなく、TE緩衝剤において再懸濁された。ビーコンバッファコンポーネントが検出された蛍光に寄与することができることは、先に示された。高速の直接混成は、不均一試料におけるヒト特有のDNA定量化を可能にする。
【0153】
[実施例9]
この実施例は、法医学的データベース試料による定量化の必要性をなくすことを実証する。
【0154】
大多数の試料は、500ナノグラム〜4マイクログラムのDNAを含むが、口腔のスワビングによって収集されたDNAの量は、高度に調整可能であり、約100ナノグラムから10マイクログラムを超えるまでの範囲に及ぶ。研究室において、精製されたDNAが定量化されるように、この可変性は、STRタイピングプロセスの全体に最小限の影響を及ぼし、DNAの所望量は、後続のPCR反応において利用される。
【0155】
口腔スワブDNAは、「核酸精製」と題され、2010年2月3日にセルデンらによって出願された米国特許出願番号第12/699,564号(それは参考文献によって本明細書に援用される)に記載されたものから改善されたグアニジン系シリカ結合アプローチを用いて精製された。実施例3に記載されたように、15人のヒトの被検者から口腔の細胞試料が入手された。スワブの軸体は、2ミリリットルの微小遠心管の中に適合させるスコアラインで切断された。グアニジン塩酸塩および清浄液を含む溶解バッファのマスタ混合およびプロテイナーゼK(キアゲン社(カリフォルニア州バレンシア)が用意された。0.5mgのプロテイナーゼKを含むこの500μLの溶菌液が、チューブの各々に転送された。その溶液は、5秒間の攪拌により徹底的に混合された。550μLの無水エタノールは、混合物に追加され、再び5秒間攪拌された。100μLの均質化された流入物は、手動でバイオチップの入力ポートの中に充填された。このバイオチップには、精製のための1.5ミリメートルのDNA結合性のシリカ膜がある。結合膜は、2ミリリットルのエタノール−イソプロピルアルコール−NaCl洗浄液により洗浄された。溶出に先立って、結合膜を30秒間乾かした。DNAは、600μLのTE−4(10ミリモルのトリス−HCl(pH8)および0.1ミリモルのEDTA)により溶出された。
【0156】
参照試料DNAの生成に続いて、7マイクロリットルのPCR反応混合物が含まれた3.4マイクロリットルのバイオチップに精製されたDNAおよび1X Powerplex16プライマー(Promega社(ウイスコンシン州マディソン))が用意された。定量化ステップが増幅に先立って実行されなかった(精製されたDNAの一定の容量が、増幅反応に対して常に用いられた)ことに留意されたい。制御として、TE−4におけるストックから希釈された標準規格の1ナノグラムの9947AゲノムDNAも増幅された。増幅は、93℃における20秒の活性化により始動され、[93℃で4秒、56℃で20秒、70℃で20秒]の30サイクルおよび70℃で90秒の最後の伸長反応によって追従された。完了時間は、約25分だった。
【0157】
計器からのDNA分析試料は、分離バイオチップの試料リザーバ内に、手動で試料をピペットで取ることにより用意された。特に、2.7マイクロリットルの増幅された産物、0.3マイクロリットルのHD400サイジング標準規格、および10マイクロリットルのHiDiは、ともに混合され、試料ウェルの中に充填された。試料およびバッファを充填した後に、バイオチップは、増幅されたDNAを分離し検出するために適用される電界により計器の中に配置された。計器および検出は、増幅された各口腔スワブDNA試料に対して複製して実行された。対応するローカスで、ヘテロ接合の対立遺伝子のピーク高さとの比較を可能にするために、所定のローカスにおけるホモ接合体の対立遺伝子のピーク高さは、2で除算された。1ナノグラムの投入する9947A制御DNAからのすべてのローカスの平均のピーク高さは、PCR反応の中への投入DNAの量を推測するために用いられた。この信号強度解析に基づいて、15の口腔スワブ抽出物からのDNAの量は、すべて1.26〜2.50ナノグラムの範囲内にあり、大部分の試料は1.5〜2.25ナノグラム/3.4マイクロリットルの範囲でPCRの中へ含まれた。
【表6】

スワブ精製における調整可能な修復および修復されたDNAの莫大な過剰量は、結合膜の結合能力を制御することにより対処された。図22は、この「カットオフ」アプローチを示す。DNA結合能力は、DNA結合に対して用いられた7ミリメートルのシリカ膜の層数に比例する。同様に、結合膜の結合能力は、また、結合膜の有効な直径に比例する。図23は、DNA投入の範囲にわたる、直径1ミリメートルの結合膜の結合性能を示す。DNA収率は、600ナノグラム未満の投入レベルに対してDNA投入レベルとともに直線的に増大し、その収率は、600ナノグラム(またはそれ以上)の投入に対して約300ナノグラムのDNAで飽和している。マイクロ流体DNA精製が増幅統合される設定(または、所望のとおり他の処理ステップ)において、修復されたDNAの範囲の情報は、バイオチップ設計における大幅な適応性を可能にする。法医学的参照試料の処理において、溶解物の破片は、精製されてもよい(溶解物材料の10分の1のみが精製されたように、PCRに用いられたDNAの1.26〜2.50ナノグラムが600マイクロリットルの溶出量における220〜440ナノグラムのDNAに変換することに留意)。精製されるべきDNAの量を低減することによって、精製媒体の結合能力は、付随的に低減されることができる。定量化をしない所定の定義された範囲内の精製された核酸を生成するための能力は、バイオチップ設計を簡易化することができ、さらに、コストを低減し、そしてさらに、プロセスタイミングを加速することができる。
【0158】
[実施例10]
この実施例は、特有の光学機器列に基づいた定量化のための励起および検出パラメータの開発を示す。
【0159】
DNAおよびピコグリーン挿入染料のマスタ混合物は、用意され、定量化バイオチップの中に挿入され、定量化計器により、励起および検出に用いられた。レーザー励起の下では、検知器信号の強度は、増加するPMTゲインとともに増大した。PMTゲインがそれらの作動範囲にわたって掃引された間、信号強度は、10RFUおよび10,600から1000倍に高められた(図24)。信号対ノイズ比は、PMTゲインの増加(30%までに設定されている)につれて増加し、30%以上のPMTゲインに対して約22で飽和させる。このデータセットは、PMTゲインが30%に設定されるとき、検出電子機器に関連づけられたノイズ寄与が無視できたことを示す。30%のゲイン設定値は、信号対雑音、信号強度、およびダイナミックレンジを最大限にするために利用のに最適であった(図25)。
【0160】
信号強度のレーザー励起の影響は、図26に示される。2つのデータセットは、光学的濃度4および2により、減光フィルターを用いて、試料での励起パワーをレーザー出力の10000倍および100倍低減するように生成された。該データは、両方のデータセットのための励起パワーとともに増加する信号強度を示す。試料上に入射される適度な励起パワー(0.02ミリワット)は、経時的に、比較的一定の信号強度を生成した。この信号強度は、試料における蛍光団の濃度に一致していた。試料上に入射されるハイレベルの励起(2ミリワット)は、試料における蛍光団数の独立したレベルに対する指数関数形崩壊を示す。試料上に入射されるハイレベルの励起は、光退色としても知られている蛍光団の光化学的破壊、および試料における蛍光活性の不可逆的損失に帰着した(図27)。これらの結果は、0.2ミリワットの試料励起パワーが定量化に最適であったことを示す。総合すれば、該結果は、30%のPMTゲインおよび0.2ミリワットの励起パワーが、最適な信号対雑音、感度、励起、および検出計器でのダイナミックレンジを達成するための設定値であることを示す。
【0161】
本発明のいくつかの実施形態が本明細書に記載され図示されたが、当業者は、本明細書に記載された機能を実行するためのおよび/または結果および/または1つ以上の有利性を取得するための様々な他の手段および/または構造を容易に予見するだろう。また、このような変更および/または変形の各々は、本発明の範囲内であるものと見なされる。より一般には、当業者は、本明細書に記載されたパラメータ、寸法、材料、および構成がすべて典型的な事例であることが目的であり、そして、実際のパラメータ、寸法、材料および/または構成は、本発明の教示が用いられる特有のアプリケーション(複数可)に依存することを、十分にかつ容易に理解するだろう。当業者は、単なるルーチン実験を用いて、本明細書に記載された本発明の特有の実施形態に対する多くの等価物を、認識または確認することができるだろう。したがって、前述の実施形態は、単なる例として示されており、本発明は、添付された請求項およびその等価物の範囲内で、特に記載され請求されたとおり以外に実施されてもよいことは理解されるべきである。本発明は、本明細書に記載された個別の特徴、システム、アーティクル、材料、キットおよび/または方法の各々を対象にする。さらに、このような特徴、システム、アーティクル、材料、キットおよび/または方法の2つ以上の任意の組み合わせは、このような特徴、システム、アーティクル、材料、キットおよび/または方法が相互に矛盾していないのであれば、本発明の範囲内に含まれている。
【0162】
すべての定義は、本明細書に定義され用いられたように、辞書の定義、参考文献によって組み込まれた文献における定義および/または定義された用語の通常の意味を統制することを理解すべきである。
【0163】
不定冠詞「1つの(a)」「1つの(an)」は、本明細書および特許請求の範囲において用いられたように、別途明示されない限り、「少なくとも1つの(at least one)」を意味することを理解するべきである。
【0164】
語句「および/または(and/or)」は、本明細書および特許請求の範囲において用いられたように、そのように結合されたエレメント(すなわち、結合的にいくつかのケースに含まれるエレメントおよび分離的に他のケースに含まれるエレメント)の「いずれか一方または両方(either or both)」を意味することを理解するべきである。「および/または(and/or)」によりリストされた複数のエレメントは、同一の種類(すなわち、そのように結合された「1つ以上の(one or more)」エレメント)であるものと解釈されるべきである。他のエレメントは、「および/または」句によって特に識別されたエレメント以外に(特に識別されたエレメントに関連してもしなくても)任意に存在してもよい。したがって、非限定的な例として、「Aおよび/またはB(A and/or B)」への言及は、「〜を備える(〜を含む)(comprising)」などの開放式の用語(open−ended language)に関連して用いられた場合、1つの実施形態において、Aのみ(状況に応じてB以外のエレメントを含む)を表わすことができるし、別の実施形態において、Bのみ(状況に応じてA以外のエレメントを含む)を表わすことができるし、さらに別の実施形態において、AおよびBの両方(状況に応じて他のエレメントを含む)を表わすことなどができる。
【0165】
明細書および特許請求の範囲において用いられたように、「または(or)」は、上記で定義されたように「および/または(and/or)」と同じ意味を有することを理解されるべきである。例えば、リストアップされたアイテムを区別する場合、「または(or)」または「および/または(and/or)」は、包括的である(すなわち、少なくとも1つの(但し、1つ以上も含む)複数の(またはリストの)エレメント(および状況に応じて付加的なリストアップされていないアイテム)の包括)と解釈されるべきである。「1つのみの(only one of)」または「厳密に1つのみの(exactly one of)」または、特許請求の範囲において用いられた場合の「〜により構成される(consisting of)」などの別途明示された用語だけは、複数の(またはリストアップされた)エレメントの厳密な1つのエレメントの包括を表わすだろう。一般に、本明細書に用いられたように、用語「または(or)」は、「いずれか(either)」「1つの(one of)」「1のみの(only one of)」または「厳密に1つの(exactly one of)」などの排他性の用語により先行された場合のみ、排他的な選択肢(すなわち「1つまたは別のもの(但し両方ではない)(one or the other but not both)」を示すものと解釈されるべきである。特許請求の範囲において用いられた場合、「〜により本質的に構成される(consisting essentially of)」は、特許法の分野において用いられるような通常の意味を有するものとする。
【0166】
明細書および特許請求の範囲において本明細書に用いられるように、語句「少なくとも1つの(at least one)」は、1つ以上のエレメントのリストを参照して、リストアップされたエレメントのいずれか1つ以上のエレメントから選択された少なくとも1つのエレメントを意味することは理解されるべきである。但し、エレメントのリストに特にリストアップされたうちのすべてのエレメントの少なくとも1つを必ずしも含まず、かつリストアップされたエレメントの任意の組み合わせを必ずしも除外しない。この定義は、また、語句「少なくとも1(at least one)」が指すエレメントのリストのうちで特に識別されたエレメント以外に(特に識別されたエレメントに関連してもしなくても)エレメントが任意に存在してもよいことを認める。したがって、非限定的な例として、「AおよびBの少なくとも1つ」(または、同等に、「AまたはBの少なくとも1つ」、または、同等に、「Aおよび/またはBの少なくとも1つ」)は、1つの実施形態において、少なくとも1つ(状況に応じて1つ以上を含む)のA(Bはない)(および状況に応じてB以外のエレメントを含む)を表わすことができ、別の実施形態において、少なくとも1つ(状況に応じて1つ以上を含む)のB(Aはない)(および状況に応じてA以外のエレメントを含む)を表わすことができ、さらに別の実施形態において、少なくとも1つ(状況に応じて1つ以上を含む)のAおよび少なくとも1つ(状況に応じて1つ以上を含む)のB(および状況に応じて他のエレメントを含む)などを表わすことができる。
【0167】
また、別途明示されない限り、1つ以上のステップまたは機能を含む本明細書において請求された任意の方法において、該方法のステップまたは機能の順序は、該方法のステップまたは機能が詳述される順序に必ずしも限定されていないことは理解されるべきである。
【0168】
特許請求の範囲において、上記明細書と同様に、「〜を備える(comprising)」「〜を含む(including)」「〜をもつ(carrying)」「〜を有する(having)」「〜を含む(containing)」「〜を含む(involving)」「〜を保持する(holding)」「〜により構成される(composed of)」などのようなすべての移行句は、開放式であるように(すなわち、含むこと意味する(但し、限定されない)ように)理解されるべきである。「〜により構成される(consisting of)」および「〜により本質的には構成される(consisting essentially of)」の移行句だけは、米国特許審査基準セクション2111.03に記載されるように、それぞれ閉鎖式の移行句または半閉鎖式の移行句であるものとする。
【特許請求の範囲】
【請求項1】
標的核酸を含むまたは含むと推測される試料流体において標的核酸を定量化する方法であって、
マイクロ流体チャネルにおいて前記試料流体とシグナリング部分を含む結合剤とを組み合わせるステップであって、前記結合剤は、試験液を形成するために前記標的核酸に対して固定化されるステップと、
前記マイクロ流体チャネルにおける検出領域に前記試験液を配置するステップと、
前記シグナリング部分を検出するステップと、
前記試料流体と前記結合剤とを組み合わせてから1時間以内に前記試料流体における前記標的核酸を定量化するステップと
を備えることを特徴とする方法。
【請求項2】
前記定量化ステップは、前記試験液における前記標的核酸の濃度を究明するステップを備えることを特徴とする請求項1に記載の方法。
【請求項3】
前記結合剤は前記標的核酸のための独特の特異性を有する特異的結合剤であることを特徴とする請求項1に記載の方法。
【請求項4】
前記配置ステップは、前記マイクロ流体チャネルにおける前記検出領域に前記試験液を流出するステップを備えることを特徴とする請求項1に記載の方法。
【請求項5】
前記配置ステップは、検出の間に前記マイクロ流体チャネルの前記検出領域を通して前記試験液を流出するステップを備えることを特徴とする請求項4に記載の方法。
【請求項6】
前記配置ステップは、前記マイクロ流体チャネルにおける領域において静止した状態で試験液を保持するステップと、前記領域を前記検出領域に転換するために前記領域に1列に並ぶように検出器を移動させるステップとを備えることを特徴とする請求項1に記載の方法。
【請求項7】
試料操作のための複数のマイクロ流体チャネルおよびアクティブな領域を備えるバイオチップに前記マイクロ流体チャネルは配置され、前記方法は、前記定量化ステップの後に、前記バイオチップのアクティブな領域に、前記試料流体の選択された量を方向づけるステップを備えるステップをさらに備え、前記選択された量は、前記定量化ステップの結果に基づいて、少なくとも部分的に究明されることを特徴とする請求項1に記載の方法。
【請求項8】
前記試料流体における前記標的核酸は、前記試料流体と前記結合剤とを組み合わせてから30分以内に定量化されることを特徴とする請求項1に記載の方法。
【請求項9】
前記試料流体における前記標的核酸は、前記試料流体と前記結合剤とを組み合わせてから10分以内に定量化されることを特徴とする請求項8に記載の方法。
【請求項10】
前記試料流体における前記標的核酸は、前記試料流体と前記結合剤とを組み合わせてから5分以内に定量化されることを特徴とする請求項9に記載の方法。
【請求項11】
前記試料流体における前記標的核酸は、前記試料流体と前記結合剤とを組み合わせてから1分以内に定量化されることを特徴とする請求項10に記載の方法。
【請求項12】
前記特異的結合剤は、前記試験液を形成するために、前記組み合わせステップにおいて前記試料流体と組み合わされるプローブ流体内に含まれることを特徴とする請求項1に記載の方法。
【請求項13】
本質的には、前記標的核酸のすべては、もし存在すれば、前記組み合わせステップの間に前記結合剤に対して固定化されることを特徴とする請求項1に記載の方法。
【請求項14】
前記特異的結合剤は、前記標的核酸に混成されることを特徴とする請求項3に記載の方法。
【請求項15】
前記特異的結合剤は、分子ビーコンプローブであることを特徴とする請求項14に記載の方法。
【請求項16】
結合を容易にするために、前記試料流体、前記プローブ流体、または前記組み合わされた流体を加熱および冷却するステップをさらに備えることを特徴とする請求項12に記載の方法。
【請求項17】
前記シグナリング部分を検出するステップは、レーザーにより前記シグナリング部分を照射するステップを備えることを特徴とする請求項1に記載の方法。
【請求項18】
前記マイクロ流体チャネルは、バイオチップ内に含まれ、前記レーザーは、前記マイクロ流体チャネルを備える前記バイオチップに連結されたシステムのコンポーネントであることを特徴とする請求項17に記載の方法。
【請求項19】
前記シグナリング部分を検出するステップは、蛍光を検出するするステップを備えることを特徴とする請求項1に記載の方法。
【請求項20】
前記標的核酸は、もし存在すれば、1ナノグラム/マイクロリットル未満の濃度を有してしている、または前記試料流体中に合計量で1ナノグラム未満含まれることを特徴とする請求項1に記載の方法。
【請求項21】
前記試料流体は、法医学的試料を備えることを特徴とする請求項1に記載の方法。
【請求項22】
前記標的核酸は、ヒト核酸であることを特徴とする請求項21に記載の方法。
【請求項23】
前記試料流体は、ヒト以外の非標的核酸をさらに備えることを特徴とする請求項22に記載の方法。
【請求項24】
前記試料における前記標的核酸は、前記組み合わせステップに先立って増幅されないことを特徴とする請求項1に記載の方法。
【請求項25】
前記標的核酸は、前記方法の実行中のいずれのポイントにおいても増幅されないことを特徴とする請求項24に記載の方法。
【請求項26】
標的核酸を含むまたは含むと推測される試料流体において標的核酸を定量化する方法であって、
マイクロ流体チャネルにおいて前記試料流体とシグナリング部分を含む結合剤とを組み合わせるステップであって、前記結合剤は、試験液を形成するために前記標的核酸に対して固定化されるステップと、
前記マイクロ流体チャネルにおける検出領域に前記試験液を配置するステップと、
前記シグナリング部分を検出するステップと、
前記試料流体における前記標的核酸を定量化するステップであって、前記標的核酸は、1ナノグラム/マイクロリットル未満の濃度を有している、または前記試料流体中に合計量で1ナノグラム未満含まれるステップと
を備えることを特徴とする方法。
【請求項27】
前記定量化ステップは、前記試験液における前記標的核酸の濃度を究明するステップを備えることを特徴とする請求項26に記載の方法。
【請求項28】
前記定量化ステップは、前記試験液における前記標的核酸の合計量を究明するステップを備えることを特徴とする請求項26に記載の方法。
【請求項29】
前記結合剤は前記標的核酸のための独特の特異性を有する特異的結合剤であることを特徴とする請求項26に記載の方法。
【請求項30】
前記配置ステップは、前記マイクロ流体チャネルにおける前記検出領域に前記試験液を流出するステップを備えることを特徴とする請求項26に記載の方法。
【請求項31】
前記配置ステップは、検出の間に前記マイクロ流体チャネルの前記検出領域を通して前記試験液を流出するステップを備えることを特徴とする請求項30に記載の方法。
【請求項32】
前記配置ステップは、前記マイクロ流体チャネルにおける領域で静止した状態で試験液を保持するステップと、前記領域を前記検出領域に転換するために前記領域に1列に並ぶように検出器を移動させるステップとを備えることを特徴とする請求項26に記載の方法。
【請求項33】
試料操作のための複数のマイクロ流体チャネルおよびアクティブな領域を備えるバイオチップに前記マイクロ流体チャネルは配置され、前記方法は、前記定量化ステップの後に、前記バイオチップのアクティブな領域に、前記試料流体の選択された量を方向づけるステップを備えるステップをさらに備え、前記選択された量は、前記定量化ステップの結果に基づいて、少なくとも部分的に究明されることを特徴とする請求項26に記載の方法。
【請求項34】
前記試料流体における前記標的核酸は、前記試料流体と前記結合剤とを組み合わせてから1時間以内に定量化されることを特徴とする請求項26に記載の方法。
【請求項35】
前記試料流体における前記標的核酸は、前記試料流体と前記結合剤とを組み合わせてから30分以内に定量化されることを特徴とする請求項34に記載の方法。
【請求項36】
前記試料流体における前記標的核酸は、前記試料流体と前記結合剤とを組み合わせてから10分以内に定量化されることを特徴とする請求項35に記載の方法。
【請求項37】
前記試料流体における前記標的核酸は、前記試料流体と前記結合剤とを組み合わせてから5分以内に定量化されることを特徴とする請求項36に記載の方法。
【請求項38】
前記試料流体における前記標的核酸は、前記試料流体と前記結合剤とを組み合わせてから1分以内に定量化されることを特徴とする請求項37に記載の方法。
【請求項39】
前記結合剤は、前記試験液を形成するために、前記組み合わせステップにおいて前記試料流体と組み合わされるプローブ流体内に含まれることを特徴とする請求項26に記載の方法。
【請求項40】
本質的には、前記標的核酸のすべては、もし存在すれば、前記組み合わせステップの間に前記結合剤に対して固定化されることを特徴とする請求項26に記載の方法。
【請求項41】
前記特異的結合剤は、前記標的核酸に混成されることを特徴とする請求項29に記載の方法。
【請求項42】
前記特異的結合剤は、分子ビーコンプローブであることを特徴とする請求項41に記載の方法。
【請求項43】
結合を容易にするために、前記試料流体、前記プローブ流体、または前記組み合わされた流体を加熱および冷却するステップをさらに備えることを特徴とする請求項39に記載の方法。
【請求項44】
前記シグナリング部分を検出するステップは、レーザーにより前記シグナリング部分を照射するステップを備えることを特徴とする請求項26に記載の方法。
【請求項45】
前記マイクロ流体チャネルは、バイオチップ内に含まれ、前記レーザーは、前記マイクロ流体チャネルを備える前記バイオチップに連結されたシステムのコンポーネントであることを特徴とする請求項44に記載の方法。
【請求項46】
前記シグナリング部分を検出するステップは、蛍光を検出するするステップを備えることを特徴とする請求項26に記載の方法。
【請求項47】
前記試料流体は、法医学的試料を備えることを特徴とする請求項26に記載の方法。
【請求項48】
前記標的核酸は、ヒト核酸であることを特徴とする請求項47に記載の方法。
【請求項49】
前記試料流体は、ヒト以外の非標的核酸をさらに備えることを特徴とする請求項48に記載の方法。
【請求項50】
前記試料における前記標的核酸は、前記組み合わせステップに先立って増幅されないことを特徴とする請求項26に記載の方法。
【請求項51】
前記標的核酸は、前記方法の実行中のいずれのポイントにおいても増幅されないことを特徴とする請求項50に記載の方法。
【請求項52】
標的核酸を含むまたは含むと推測される法医学的試料流体において標的核酸を定量化する方法であって、
マイクロ流体チャネルにおいて前記法医学的試料流体とシグナリング部分を含む結合剤を含むプローブ流体とを組み合わせるステップであって、前記法医学的試料流体における前記標的核酸は増幅されていないステップと、
前記マイクロ流体チャネルにおける検出領域に前記組み合わされた流体を配置するステップと、
前記シグナリング部分を検出するステップと、
前記試料流体における前記標的核酸を定量化するステップと
を備えることを特徴とする方法。
【請求項53】
前記定量化ステップは、前記試験液における前記標的核酸の濃度を究明するステップを備えることを特徴とする請求項52に記載の方法。
【請求項54】
前記定量化ステップは、前記試験液における前記標的核酸の合計量を究明するステップを備えることを特徴とする請求項52に記載の方法。
【請求項55】
前記結合剤は前記標的核酸のための独特の特異性を有する特異的結合剤であることを特徴とする請求項52に記載の方法。
【請求項56】
前記配置ステップは、前記マイクロ流体チャネルにおける前記検出領域に前記組み合わされた流体を流出するステップを備えることを特徴とする請求項52に記載の方法。
【請求項57】
前記配置ステップは、検出の間に前記マイクロ流体チャネルの前記検出領域を通して前記組み合わされた流体を流出するステップを備えることを特徴とする請求項56に記載の方法。
【請求項58】
前記配置ステップは、前記マイクロ流体チャネルにおける領域で静止した状態で前記組み合わされた流体を保持するステップと、前記領域を前記検出領域に転換するために前記領域に1列に並ぶように検出器を移動させるステップとを備えることを特徴とする請求項52に記載の方法。
【請求項59】
試料操作のための複数のマイクロ流体チャネルおよびアクティブな領域を備えるバイオチップに前記マイクロ流体チャネルは配置され、前記方法は、前記定量化ステップの後に、前記バイオチップのアクティブな領域に、前記試料流体の選択された量を方向づけるステップを備えるステップをさらに備え、前記選択された量は、前記定量化ステップの結果に基づいて、少なくとも部分的に究明されることを特徴とする請求項52に記載の方法。
【請求項60】
前記試料流体における前記標的核酸は、前記試料流体と前記結合剤とを組み合わせてから1時間以内に定量化されることを特徴とする請求項52に記載の方法。
【請求項61】
前記試料流体における前記標的核酸は、前記試料流体と前記結合剤とを組み合わせてから30分以内に定量化されることを特徴とする請求項60に記載の方法。
【請求項62】
前記試料流体における前記標的核酸は、前記試料流体と前記結合剤とを組み合わせてから10分以内に定量化されることを特徴とする請求項61に記載の方法。
【請求項63】
前記試料流体における前記標的核酸は、前記試料流体と前記結合剤とを組み合わせてから5分以内に定量化されることを特徴とする請求項62に記載の方法。
【請求項64】
前記試料流体における前記標的核酸は、前記試料流体と前記結合剤とを組み合わせてから1分以内に定量化されることを特徴とする請求項63に記載の方法。
【請求項65】
前記標的核酸は、もし存在すれば、1ナノグラム/マイクロリットル未満の濃度を有してしている、または前記試料流体中に合計量で1ナノグラム未満含まれることを特徴とする請求項52に記載の方法。
【請求項66】
本質的には、前記標的核酸のすべては、もし存在すれば、前記組み合わせステップの間に前記結合剤に対して固定化されることを特徴とする請求項52に記載の方法。
【請求項67】
前記特異的結合剤は、前記標的核酸に混成されることを特徴とする請求項55に記載の方法。
【請求項68】
前記特異的結合剤は、分子ビーコンプローブであることを特徴とする請求項67に記載の方法。
【請求項69】
結合を容易にするために、前記試料流体、前記プローブ流体、または前記組み合わされた流体を加熱および冷却するステップをさらに備えることを特徴とする請求項52に記載の方法。
【請求項70】
前記シグナリング部分を検出するステップは、レーザーにより前記シグナリング部分を照射するステップを備えることを特徴とする請求項52に記載の方法。
【請求項71】
前記マイクロ流体チャネルは、バイオチップ内に含まれ、前記レーザーは、前記マイクロ流体チャネルを備える前記バイオチップに連結されたシステムのコンポーネントであることを特徴とする請求項70に記載の方法。
【請求項72】
前記シグナリング部分を検出するステップは、蛍光を検出するするステップを備えることを特徴とする請求項52に記載の方法。
【請求項73】
前記標的核酸は、ヒト核酸であることを特徴とする請求項52に記載の方法。
【請求項74】
前記試料流体は、ヒト以外の非標的核酸をさらに備えることを特徴とする請求項73に記載の方法。
【請求項75】
前記標的核酸は、前記方法の実行中のいずれのポイントにおいても増幅されないことを特徴とする請求項52に記載の方法。
【請求項76】
標的核酸を含むまたは含むと推測され、混入するヒト以外の核酸をさらに含む試料流体において標的核酸を定量化する方法であって、
マイクロ流体チャネルにおいて前記試料流体とシグナリング部分を含む結合剤を含むプローブ流体とを組み合わせるステップであって、前記試料流体における前記標的核酸は増幅されていないステップと、
前記マイクロ流体チャネルにおける検出領域に前記組み合わされた流体を配置するステップと、
前記シグナリング部分を検出するステップと、
前記試料流体における前記標的核酸を定量化するステップと
を備えることを特徴とする方法。
【請求項77】
前記定量化ステップは、前記組み合わされた流体における前記標的核酸の濃度を究明するステップを備えることを特徴とする請求項76に記載の方法。
【請求項78】
前記定量化ステップは、前記組み合わされた流体における前記標的核酸の合計量を究明するステップを備えることを特徴とする請求項76に記載の方法。
【請求項79】
前記結合剤は前記標的核酸のための独特の特異性を有する特異的結合剤であることを特徴とする請求項76に記載の方法。
【請求項80】
前記配置ステップは、前記マイクロ流体チャネルにおける前記検出領域に前記組み合わされた流体を流出するステップを備えることを特徴とする請求項76に記載の方法。
【請求項81】
前記配置ステップは、検出の間に前記マイクロ流体チャネルの前記検出領域を通して前記組み合わされた流体を流出するステップを備えることを特徴とする請求項80に記載の方法。
【請求項82】
前記配置ステップは、前記マイクロ流体チャネルにおける領域で静止した状態で前記組み合わされた流体を保持するステップと、前記領域を前記検出領域に転換するために前記領域に1列に並ぶように検出器を移動させるステップとを備えることを特徴とする請求項76に記載の方法。
【請求項83】
試料操作のための複数のマイクロ流体チャネルおよびアクティブな領域を備えるバイオチップに前記マイクロ流体チャネルは配置され、前記方法は、前記定量化ステップの後に、前記バイオチップのアクティブな領域に、前記試料流体の選択された量を方向づけるステップを備えるステップをさらに備え、前記選択された量は、前記定量化ステップの結果に基づいて、少なくとも部分的に究明されることを特徴とする請求項76に記載の方法。
【請求項84】
前記試料流体における前記標的核酸は、前記試料流体と前記結合剤とを組み合わせてから1時間以内に定量化されることを特徴とする請求項76に記載の方法。
【請求項85】
前記試料流体における前記標的核酸は、前記試料流体と前記結合剤とを組み合わせてから30分以内に定量化されることを特徴とする請求項84に記載の方法。
【請求項86】
前記試料流体における前記標的核酸は、前記試料流体と前記結合剤とを組み合わせてから10分以内に定量化されることを特徴とする請求項85に記載の方法。
【請求項87】
前記試料流体における前記標的核酸は、前記試料流体と前記結合剤とを組み合わせてから5分以内に定量化されることを特徴とする請求項86に記載の方法。
【請求項88】
前記試料流体における前記標的核酸は、前記試料流体と前記結合剤とを組み合わせてから1分以内に定量化されることを特徴とする請求項87に記載の方法。
【請求項89】
前記標的核酸は、もし存在すれば、1ナノグラム/マイクロリットル未満の濃度を有してしている、または前記試料流体中に合計量で1ナノグラム未満含まれることを特徴とする請求項76に記載の方法。
【請求項90】
本質的には、前記標的核酸のすべては、もし存在すれば、前記組み合わせステップの間に前記結合剤に対して固定化されることを特徴とする請求項76に記載の方法。
【請求項91】
前記特異的結合剤は、前記標的核酸に混成されることを特徴とする請求項79に記載の方法。
【請求項92】
前記特異的結合剤は、分子ビーコンプローブであることを特徴とする請求項91に記載の方法。
【請求項93】
結合を容易にするために、前記試料流体、前記プローブ流体、または前記組み合わされた流体を加熱および冷却するステップをさらに備えることを特徴とする請求項76に記載の方法。
【請求項94】
前記シグナリング部分を検出するステップは、レーザーにより前記シグナリング部分を照射するステップを備えることを特徴とする請求項76に記載の方法。
【請求項95】
前記マイクロ流体チャネルは、バイオチップ内に含まれ、前記レーザーは、前記マイクロ流体チャネルを備える前記バイオチップに連結されたシステムのコンポーネントであることを特徴とする請求項94に記載の方法。
【請求項96】
前記シグナリング部分を検出するステップは、蛍光を検出するするステップを備えることを特徴とする請求項76に記載の方法。
【請求項97】
前記標的核酸は、ヒト核酸であることを特徴とする請求項76に記載の方法。
【請求項98】
前記試料流体は、ヒト以外の非標的核酸をさらに備えることを特徴とする請求項97に記載の方法。
【請求項99】
前記標的核酸は、前記方法の実行中のいずれのポイントにおいても増幅されないことを特徴とする請求項76に記載の方法。
【請求項100】
前記試料は、法医学的試料であることを特徴とする請求項76に記載の方法。
【請求項101】
標的核酸を含むまたは含むと推測される試料流体において標的核酸を定量化する方法であって、
統合化レーザーを備える検出器を備える電子装置に連結されたマイクロ流体デバイスを準備をするステップと、
前記マイクロ流体デバイスのマイクロ流体チャネルにおいて前記試料流体とシグナリング部分を含む結合剤とを組み合わせるステップであって、前記結合剤は、前記標的核酸に対して固定化されるステップと、
前記電子装置の前記検出器に作用する近接に配置された前記マイクロ流体チャネルの検出領域に前記組み合わされる流体を配置するステップと、
前記統合化レーザーを用いて、前記シグナリング部分を照射するステップと、
前記試料流体における前記標的核酸を定量化するステップと
を備えることを特徴とする方法。
【請求項102】
前記定量化ステップは、前記組み合わされた流体における前記標的核酸の濃度を究明するステップを備えることを特徴とする請求項101に記載の方法。
【請求項103】
前記定量化ステップは、前記組み合わされた流体における前記標的核酸の合計量を究明するステップを備えることを特徴とする請求項101に記載の方法。
【請求項104】
前記結合剤は前記標的核酸のための独特の特異性を有する特異的結合剤であることを特徴とする請求項101に記載の方法。
【請求項105】
前記配置ステップは、前記マイクロ流体チャネルにおける前記検出領域に前記組み合わされた流体を流出するステップを備えることを特徴とする請求項101に記載の方法。
【請求項106】
前記配置ステップは、検出の間に前記マイクロ流体チャネルの前記検出領域を通して前記組み合わされた流体を流出するステップを備えることを特徴とする請求項105に記載の方法。
【請求項107】
前記配置ステップは、前記マイクロ流体チャネルにおける領域で静止した状態で前記組み合わされた流体を保持するステップと、前記領域を前記検出領域に転換するために前記領域に1列に並ぶように検出器を移動させるステップとを備えることを特徴とする請求項101に記載の方法。
【請求項108】
試料操作のための複数のマイクロ流体チャネルおよびアクティブな領域を備えるバイオチップに前記マイクロ流体チャネルは配置され、前記方法は、前記定量化ステップの後に、前記バイオチップのアクティブな領域に、前記試料流体の選択された量を方向づけるステップを備えるステップをさらに備え、前記選択された量は、前記定量化ステップの結果に基づいて、少なくとも部分的に究明されることを特徴とする請求項101に記載の方法。
【請求項109】
前記試料流体における前記標的核酸は、前記試料流体と前記結合剤とを組み合わせてから1時間以内に定量化されることを特徴とする請求項101に記載の方法。
【請求項110】
前記試料流体における前記標的核酸は、前記試料流体と前記結合剤とを組み合わせてから30分以内に定量化されることを特徴とする請求項109に記載の方法。
【請求項111】
前記試料流体における前記標的核酸は、前記試料流体と前記結合剤とを組み合わせてから10分以内に定量化されることを特徴とする請求項110に記載の方法。
【請求項112】
前記試料流体における前記標的核酸は、前記試料流体と前記結合剤とを組み合わせてから5分以内に定量化されることを特徴とする請求項111に記載の方法。
【請求項113】
前記試料流体における前記標的核酸は、前記試料流体と前記結合剤とを組み合わせてから1分以内に定量化されることを特徴とする請求項112に記載の方法。
【請求項114】
前記標的核酸は、もし存在すれば、1ナノグラム/マイクロリットル未満の濃度を有してしている、または前記試料流体中に合計量で1ナノグラム未満含まれることを特徴とする請求項101に記載の方法。
【請求項115】
本質的には、前記標的核酸のすべては、もし存在すれば、前記組み合わせステップの間に前記結合剤に対して固定化されることを特徴とする請求項101に記載の方法。
【請求項116】
前記特異的結合剤は、前記標的核酸に混成されることを特徴とする請求項104に記載の方法。
【請求項117】
前記特異的結合剤は、分子ビーコンプローブであることを特徴とする請求項116に記載の方法。
【請求項118】
結合を容易にするために、前記試料流体または前記組み合わされた流体を加熱および冷却するステップをさらに備えることを特徴とする請求項101に記載の方法。
【請求項119】
前記シグナリング部分を検出するステップは、レーザーにより前記シグナリング部分を照射するステップを備えることを特徴とする請求項101に記載の方法。
【請求項120】
前記マイクロ流体チャネルは、バイオチップ内に含まれ、前記レーザーは、前記マイクロ流体チャネルを備える前記バイオチップに連結されたシステムのコンポーネントであることを特徴とする請求項119に記載の方法。
【請求項121】
前記シグナリング部分を検出するステップは、蛍光を検出するするステップを備えることを特徴とする請求項101に記載の方法。
【請求項122】
前記標的核酸は、ヒト核酸であることを特徴とする請求項101に記載の方法。
【請求項123】
前記試料流体は、ヒト以外の非標的核酸をさらに備えることを特徴とする請求項122に記載の方法。
【請求項124】
前記標的核酸は、前記方法の実行中のいずれのポイントにおいても増幅されないことを特徴とする請求項101に記載の方法。
【請求項125】
前記試料は、法医学的試料であることを特徴とする請求項101に記載の方法。
【請求項126】
標的核酸を含む試料流体において標的核酸を操作する方法であって、
検出器を備える電子装置に連結された、試料操作のための複数のマイクロ流体チャネルおよびアクティブな領域を備えるマイクロ流体デバイスを準備をするステップと、
前記マイクロ流体デバイスのマイクロ流体チャネルにおいて前記試料流体とシグナリング部分を含む結合剤とを組み合わせるステップであって、前記結合剤は、前記標的核酸に対して固定化されるステップと、
前記電子装置の前記検出器に作用する近接に配置された前記マイクロ流体チャネルの検出領域に前記組み合わされる流体を配置するステップと、
前記試料流体における前記標的核酸を定量化するステップと
前記バイオチップのアクティブな領域に、前記試料流体の選択された量を方向づけるステップであって、前記選択された量は、前記定量化ステップの結果に基づいて、少なくとも部分的に究明されるステップと
を備えることを特徴とする方法。
【請求項127】
前記定量化ステップは、前記組み合わされた流体における前記標的核酸の濃度を究明するステップを備えることを特徴とする請求項126に記載の方法。
【請求項128】
前記定量化ステップは、前記組み合わされた流体における前記標的核酸の合計量を究明するステップを備えることを特徴とする請求項126に記載の方法。
【請求項129】
前記結合剤は前記標的核酸のための独特の特異性を有する特異的結合剤であることを特徴とする請求項126に記載の方法。
【請求項130】
前記配置ステップは、前記マイクロ流体チャネルにおける前記検出領域に前記組み合わされた流体を流出するステップを備えることを特徴とする請求項126に記載の方法。
【請求項131】
前記配置ステップは、検出の間に前記マイクロ流体チャネルの前記検出領域を通して前記組み合わされた流体を流出するステップを備えることを特徴とする請求項130に記載の方法。
【請求項132】
前記配置ステップは、前記マイクロ流体チャネルにおける領域で静止した状態で前記組み合わされた流体を保持するステップと、前記領域を前記検出領域に転換するために前記領域に1列に並ぶように検出器を移動させるステップとを備えることを特徴とする請求項126に記載の方法。
【請求項133】
前記試料流体における前記標的核酸は、前記試料流体と前記結合剤とを組み合わせてから1時間以内に定量化されることを特徴とする請求項126に記載の方法。
【請求項134】
前記試料流体における前記標的核酸は、前記試料流体と前記結合剤とを組み合わせてから30分以内に定量化されることを特徴とする請求項133に記載の方法。
【請求項135】
前記試料流体における前記標的核酸は、前記試料流体と前記結合剤とを組み合わせてから10分以内に定量化されることを特徴とする請求項134に記載の方法。
【請求項136】
前記試料流体における前記標的核酸は、前記試料流体と前記結合剤とを組み合わせてから5分以内に定量化されることを特徴とする請求項135に記載の方法。
【請求項137】
前記試料流体における前記標的核酸は、前記試料流体と前記結合剤とを組み合わせてから1分以内に定量化されることを特徴とする請求項136に記載の方法。
【請求項138】
前記標的核酸は、もし存在すれば、1ナノグラム/マイクロリットル未満の濃度を有してしている、または前記試料流体中に合計量で1ナノグラム未満含まれることを特徴とする請求項126に記載の方法。
【請求項139】
本質的には、前記標的核酸のすべては、もし存在すれば、前記組み合わせステップの間に前記結合剤に対して固定化されることを特徴とする請求項126に記載の方法。
【請求項140】
前記特異的結合剤は、前記標的核酸に混成されることを特徴とする請求項129に記載の方法。
【請求項141】
前記特異的結合剤は、分子ビーコンプローブであることを特徴とする請求項140に記載の方法。
【請求項142】
結合を容易にするために、前記試料流体または前記組み合わされた流体を加熱および冷却するステップをさらに備えることを特徴とする請求項126に記載の方法。
【請求項143】
前記シグナリング部分を検出するステップは、レーザーにより前記シグナリング部分を照射するステップを備えることを特徴とする請求項126に記載の方法。
【請求項144】
前記マイクロ流体チャネルは、バイオチップ内に含まれ、前記レーザーは、前記マイクロ流体チャネルを備える前記バイオチップに連結されたシステムのコンポーネントであることを特徴とする請求項143に記載の方法。
【請求項145】
前記シグナリング部分を検出するステップは、蛍光を検出するするステップを備えることを特徴とする請求項126に記載の方法。
【請求項146】
前記標的核酸は、ヒト核酸であることを特徴とする請求項126に記載の方法。
【請求項147】
前記試料流体は、ヒト以外の非標的核酸をさらに備えることを特徴とする請求項146に記載の方法。
【請求項148】
前記標的核酸は、前記方法の実行中のいずれのポイントにおいても増幅されないことを特徴とする請求項126に記載の方法。
【請求項149】
前記試料は、法医学的試料であることを特徴とする請求項126に記載の方法。
【請求項150】
標的核酸の増幅のために前記標的核酸を備える試料を用意する方法であって、
試料操作のための少なくとも1つのマイクロ流体チャネルと、アクティブな領域とを備えるマイクロ流体デバイスを準備をするステップであって、少なくとも1つの前記領域は、試料から核酸を精製するように構成されたステップと、
標的核酸の未知の可変量をもたらす収集方法によって前記試料を取得するステップと、
前記マイクロ流体デバイスの前記マイクロ流体チャネルの中に前記試料を挿入するステップと、
複製可能な量の精製された標的核酸を生成するために試料から核酸を精製するように構成された前記マイクロ流体デバイスの領域で前記試料における前記標的核酸を精製するステップと、
前記精製された標的核酸を定量化せずに、前記精製された標的核酸の前記複製可能な量を増幅するステップと
を備えることを特徴とする方法。
【請求項151】
前記マイクロ流体デバイスの少なくとも1つの前記アクティブな領域は、ポリメラーゼ連鎖反応(PCR)を介して核酸を増幅するように構成された領域を備え、前記増幅ステップが、核酸を増幅するように構成されたアクティブな領域において行われることを特徴とする請求項150に記載の方法。
【請求項152】
前記収集方法は、口腔スワビングステップを備えることを特徴とする請求項150に記載の方法。
【請求項153】
前記収集方法によって収集された前記核酸の量は、第1の試料から第2の試料に少なくとも10倍異なることを特徴とする請求項150に記載の方法。
【請求項154】
前記収集方法によって収集された前記核酸の量は、第1の試料から第2の試料に少なくとも1000倍異なることを特徴とする請求項153に記載の方法。
【請求項155】
複製可能な量の精製された標的核酸を生成するために試料から核酸を精製するように構成された前記マイクロ流体デバイスの領域での前記試料は、明確な核酸結合能力を有する結合膜を備え、前記精製するステップは、核酸を結合するために、前記結合膜とともに少なくとも一部の前記試料と接触するステップと、前記結合膜からの精製された標的核酸の前記複製可能な量を溶出するステップとを備えることを特徴とする請求項150に記載の方法。
【請求項156】
前記結合能力は、少なくとも300ナノグラムであることを特徴とする請求項155に記載の方法。
【請求項157】
前記結合能力は、少なくとも100ナノグラムであることを特徴とする請求項155に記載の方法。
【請求項158】
前記結合膜は、シリカ膜であることを特徴とする請求項155に記載の方法。
【請求項159】
前記標的核酸は、ヒト核酸であることを特徴とする請求項150に記載の方法。
【請求項160】
前記試料流体は、ヒト以外の非標的核酸をさらに備えることを特徴とする請求項159に記載の方法。
【請求項161】
前記標的核酸は、前記方法の実行中のいずれのポイントにおいても定量化されないことを特徴とする請求項150に記載の方法。
【請求項162】
前記試料は、法医学的試料であることを特徴とする請求項150に記載の方法。
【請求項163】
標的核酸を含むまたは含むと推測される法医学的試料流体において標的核酸を定量化する方法であって、
マイクロ流体チャネルにおいて、法医学的試料流体と、シグナリング部分を備えかつ前記標的核酸のための独特の混成特異性を有する分子ビーコンプローブを含むプローブ流体とを組み合わせるステップであって、前記法医学的試料流体における前記標的核酸は増幅されていないステップと、
前記マイクロ流体チャネルにおける検出領域に前記組み合わされた流体を配置するステップと、
前記シグナリング部分を検出するステップと、
前記試料流体における前記標的核酸を定量化するステップと
を備えることを特徴とする方法。
【請求項164】
前記定量化ステップは、前記試験液における前記標的核酸の濃度を究明するステップを備えることを特徴とする請求項163に記載の方法。
【請求項165】
前記定量化ステップは、前記試験液における前記標的核酸の合計量を究明するステップを備えることを特徴とする請求項163に記載の方法。
【請求項166】
前記配置ステップは、前記マイクロ流体チャネルにおける前記検出領域に前記組み合わされた流体を流出するステップを備えることを特徴とする請求項163に記載の方法。
【請求項167】
前記配置ステップは、検出の間に前記マイクロ流体チャネルの前記検出領域を通して前記組み合わされた流体を流出するステップを備えることを特徴とする請求項166に記載の方法。
【請求項168】
前記配置ステップは、前記マイクロ流体チャネルにおける領域で静止した状態で前記組み合わされた流体を保持するステップと、前記領域を前記検出領域に転換するために前記領域に1列に並ぶように検出器を移動させるステップとを備えることを特徴とする請求項163に記載の方法。
【請求項169】
試料操作のための複数のマイクロ流体チャネルおよびアクティブな領域を備えるバイオチップに前記マイクロ流体チャネルは配置され、前記方法は、前記定量化ステップの後に、前記バイオチップのアクティブな領域に、前記試料流体の選択された量を方向づけるステップを備えるステップをさらに備え、前記選択された量は、前記定量化ステップの結果に基づいて、少なくとも部分的に究明されることを特徴とする請求項163に記載の方法。
【請求項170】
前記試料流体における前記標的核酸は、前記試料流体と前記分子ビーコンプローブとを組み合わせてから1時間以内に定量化されることを特徴とする請求項163に記載の方法。
【請求項171】
前記試料流体における前記標的核酸は、前記試料流体と前記分子ビーコンプローブとを組み合わせてから30分以内に定量化されることを特徴とする請求項163に記載の方法。
【請求項172】
前記試料流体における前記標的核酸は、前記試料流体と前記分子ビーコンプローブとを組み合わせてから10分以内に定量化されることを特徴とする請求項171に記載の方法。
【請求項173】
前記試料流体における前記標的核酸は、前記試料流体と前記分子ビーコンプローブとを組み合わせてから5分以内に定量化されることを特徴とする請求項172に記載の方法。
【請求項174】
前記試料流体における前記標的核酸は、前記試料流体と前記分子ビーコンプローブとを組み合わせてから1分以内に定量化されることを特徴とする請求項173に記載の方法。
【請求項175】
前記標的核酸は、もし存在すれば、1ナノグラム/マイクロリットル未満の濃度を有してしている、または前記試料流体中に合計量で1ナノグラム未満含まれることを特徴とする請求項163に記載の方法。
【請求項176】
本質的には、前記標的核酸のすべては、もし存在すれば、前記組み合わせステップの間に前記分子ビーコンプローブに対して固定化されることを特徴とする請求項163に記載の方法。
【請求項177】
結合を容易にするために、前記試料流体、前記プローブ流体、または前記組み合わされた流体を加熱および冷却するステップをさらに備えることを特徴とする請求項163に記載の方法。
【請求項178】
前記シグナリング部分を検出するステップは、レーザーにより前記シグナリング部分を照射するステップを備えることを特徴とする請求項163に記載の方法。
【請求項179】
前記マイクロ流体チャネルは、バイオチップ内に含まれ、前記レーザーは、前記マイクロ流体チャネルを備える前記バイオチップに連結されたシステムのコンポーネントであることを特徴とする請求項178に記載の方法。
【請求項180】
前記シグナリング部分を検出するステップは、蛍光を検出するするステップを備えることを特徴とする請求項163に記載の方法。
【請求項181】
前記標的核酸は、ヒト核酸であることを特徴とする請求項163に記載の方法。
【請求項182】
前記試料流体は、ヒト以外の非標的核酸をさらに備えることを特徴とする請求項181に記載の方法。
【請求項183】
前記標的核酸は、前記方法の実行中のいずれのポイントにおいても増幅されないことを特徴とする請求項163に記載の方法。
【請求項184】
バイオチップの複数の機能的な領域における蛍光団の励起および検出のための計器であって、
励起源と、
励起源から前記バイオチップにおける複数の機能的な領域にビームを方向づける操縦エレメントであって、前記励起源は、前記複数の機能的な領域の少なくとも1つからの前記信号が核酸の定量化を可能にするように、検出される信号を生成する前記複数の機能的な領域における蛍光団を励起する、前記操縦エレメントと
を備えることを特徴とする計器。
【請求項185】
前記操縦エレメントはミラーであることを特徴とする請求項184に記載の計器。
【請求項186】
前記バイオチップの前記定量化領域における前記定量化チャンバの各々に前記励起ビームを方向づける第1のスキャナと、
前記バイオチップの第2の機能的な領域における前記チャンバの各々に前記励起ビームを方向づける第2のスキャナと
をさらに備えることを特徴とする請求項184に記載の計器。
【請求項187】
前記バイオチップの前記定量化領域における前記定量化チャンバの各々に、前記励起ビームを方向づける並進ステージ上に取り付けたミラーと、
前記バイオチップの第2の機能的な領域における前記チャンバの各々に前記励起ビームを方向づける第2のスキャナと
をさらに備えることを特徴とする請求項184に記載の計器。
【請求項1】
標的核酸を含むまたは含むと推測される試料流体において標的核酸を定量化する方法であって、
マイクロ流体チャネルにおいて前記試料流体とシグナリング部分を含む結合剤とを組み合わせるステップであって、前記結合剤は、試験液を形成するために前記標的核酸に対して固定化されるステップと、
前記マイクロ流体チャネルにおける検出領域に前記試験液を配置するステップと、
前記シグナリング部分を検出するステップと、
前記試料流体と前記結合剤とを組み合わせてから1時間以内に前記試料流体における前記標的核酸を定量化するステップと
を備えることを特徴とする方法。
【請求項2】
前記定量化ステップは、前記試験液における前記標的核酸の濃度を究明するステップを備えることを特徴とする請求項1に記載の方法。
【請求項3】
前記結合剤は前記標的核酸のための独特の特異性を有する特異的結合剤であることを特徴とする請求項1に記載の方法。
【請求項4】
前記配置ステップは、前記マイクロ流体チャネルにおける前記検出領域に前記試験液を流出するステップを備えることを特徴とする請求項1に記載の方法。
【請求項5】
前記配置ステップは、検出の間に前記マイクロ流体チャネルの前記検出領域を通して前記試験液を流出するステップを備えることを特徴とする請求項4に記載の方法。
【請求項6】
前記配置ステップは、前記マイクロ流体チャネルにおける領域において静止した状態で試験液を保持するステップと、前記領域を前記検出領域に転換するために前記領域に1列に並ぶように検出器を移動させるステップとを備えることを特徴とする請求項1に記載の方法。
【請求項7】
試料操作のための複数のマイクロ流体チャネルおよびアクティブな領域を備えるバイオチップに前記マイクロ流体チャネルは配置され、前記方法は、前記定量化ステップの後に、前記バイオチップのアクティブな領域に、前記試料流体の選択された量を方向づけるステップを備えるステップをさらに備え、前記選択された量は、前記定量化ステップの結果に基づいて、少なくとも部分的に究明されることを特徴とする請求項1に記載の方法。
【請求項8】
前記試料流体における前記標的核酸は、前記試料流体と前記結合剤とを組み合わせてから30分以内に定量化されることを特徴とする請求項1に記載の方法。
【請求項9】
前記試料流体における前記標的核酸は、前記試料流体と前記結合剤とを組み合わせてから10分以内に定量化されることを特徴とする請求項8に記載の方法。
【請求項10】
前記試料流体における前記標的核酸は、前記試料流体と前記結合剤とを組み合わせてから5分以内に定量化されることを特徴とする請求項9に記載の方法。
【請求項11】
前記試料流体における前記標的核酸は、前記試料流体と前記結合剤とを組み合わせてから1分以内に定量化されることを特徴とする請求項10に記載の方法。
【請求項12】
前記特異的結合剤は、前記試験液を形成するために、前記組み合わせステップにおいて前記試料流体と組み合わされるプローブ流体内に含まれることを特徴とする請求項1に記載の方法。
【請求項13】
本質的には、前記標的核酸のすべては、もし存在すれば、前記組み合わせステップの間に前記結合剤に対して固定化されることを特徴とする請求項1に記載の方法。
【請求項14】
前記特異的結合剤は、前記標的核酸に混成されることを特徴とする請求項3に記載の方法。
【請求項15】
前記特異的結合剤は、分子ビーコンプローブであることを特徴とする請求項14に記載の方法。
【請求項16】
結合を容易にするために、前記試料流体、前記プローブ流体、または前記組み合わされた流体を加熱および冷却するステップをさらに備えることを特徴とする請求項12に記載の方法。
【請求項17】
前記シグナリング部分を検出するステップは、レーザーにより前記シグナリング部分を照射するステップを備えることを特徴とする請求項1に記載の方法。
【請求項18】
前記マイクロ流体チャネルは、バイオチップ内に含まれ、前記レーザーは、前記マイクロ流体チャネルを備える前記バイオチップに連結されたシステムのコンポーネントであることを特徴とする請求項17に記載の方法。
【請求項19】
前記シグナリング部分を検出するステップは、蛍光を検出するするステップを備えることを特徴とする請求項1に記載の方法。
【請求項20】
前記標的核酸は、もし存在すれば、1ナノグラム/マイクロリットル未満の濃度を有してしている、または前記試料流体中に合計量で1ナノグラム未満含まれることを特徴とする請求項1に記載の方法。
【請求項21】
前記試料流体は、法医学的試料を備えることを特徴とする請求項1に記載の方法。
【請求項22】
前記標的核酸は、ヒト核酸であることを特徴とする請求項21に記載の方法。
【請求項23】
前記試料流体は、ヒト以外の非標的核酸をさらに備えることを特徴とする請求項22に記載の方法。
【請求項24】
前記試料における前記標的核酸は、前記組み合わせステップに先立って増幅されないことを特徴とする請求項1に記載の方法。
【請求項25】
前記標的核酸は、前記方法の実行中のいずれのポイントにおいても増幅されないことを特徴とする請求項24に記載の方法。
【請求項26】
標的核酸を含むまたは含むと推測される試料流体において標的核酸を定量化する方法であって、
マイクロ流体チャネルにおいて前記試料流体とシグナリング部分を含む結合剤とを組み合わせるステップであって、前記結合剤は、試験液を形成するために前記標的核酸に対して固定化されるステップと、
前記マイクロ流体チャネルにおける検出領域に前記試験液を配置するステップと、
前記シグナリング部分を検出するステップと、
前記試料流体における前記標的核酸を定量化するステップであって、前記標的核酸は、1ナノグラム/マイクロリットル未満の濃度を有している、または前記試料流体中に合計量で1ナノグラム未満含まれるステップと
を備えることを特徴とする方法。
【請求項27】
前記定量化ステップは、前記試験液における前記標的核酸の濃度を究明するステップを備えることを特徴とする請求項26に記載の方法。
【請求項28】
前記定量化ステップは、前記試験液における前記標的核酸の合計量を究明するステップを備えることを特徴とする請求項26に記載の方法。
【請求項29】
前記結合剤は前記標的核酸のための独特の特異性を有する特異的結合剤であることを特徴とする請求項26に記載の方法。
【請求項30】
前記配置ステップは、前記マイクロ流体チャネルにおける前記検出領域に前記試験液を流出するステップを備えることを特徴とする請求項26に記載の方法。
【請求項31】
前記配置ステップは、検出の間に前記マイクロ流体チャネルの前記検出領域を通して前記試験液を流出するステップを備えることを特徴とする請求項30に記載の方法。
【請求項32】
前記配置ステップは、前記マイクロ流体チャネルにおける領域で静止した状態で試験液を保持するステップと、前記領域を前記検出領域に転換するために前記領域に1列に並ぶように検出器を移動させるステップとを備えることを特徴とする請求項26に記載の方法。
【請求項33】
試料操作のための複数のマイクロ流体チャネルおよびアクティブな領域を備えるバイオチップに前記マイクロ流体チャネルは配置され、前記方法は、前記定量化ステップの後に、前記バイオチップのアクティブな領域に、前記試料流体の選択された量を方向づけるステップを備えるステップをさらに備え、前記選択された量は、前記定量化ステップの結果に基づいて、少なくとも部分的に究明されることを特徴とする請求項26に記載の方法。
【請求項34】
前記試料流体における前記標的核酸は、前記試料流体と前記結合剤とを組み合わせてから1時間以内に定量化されることを特徴とする請求項26に記載の方法。
【請求項35】
前記試料流体における前記標的核酸は、前記試料流体と前記結合剤とを組み合わせてから30分以内に定量化されることを特徴とする請求項34に記載の方法。
【請求項36】
前記試料流体における前記標的核酸は、前記試料流体と前記結合剤とを組み合わせてから10分以内に定量化されることを特徴とする請求項35に記載の方法。
【請求項37】
前記試料流体における前記標的核酸は、前記試料流体と前記結合剤とを組み合わせてから5分以内に定量化されることを特徴とする請求項36に記載の方法。
【請求項38】
前記試料流体における前記標的核酸は、前記試料流体と前記結合剤とを組み合わせてから1分以内に定量化されることを特徴とする請求項37に記載の方法。
【請求項39】
前記結合剤は、前記試験液を形成するために、前記組み合わせステップにおいて前記試料流体と組み合わされるプローブ流体内に含まれることを特徴とする請求項26に記載の方法。
【請求項40】
本質的には、前記標的核酸のすべては、もし存在すれば、前記組み合わせステップの間に前記結合剤に対して固定化されることを特徴とする請求項26に記載の方法。
【請求項41】
前記特異的結合剤は、前記標的核酸に混成されることを特徴とする請求項29に記載の方法。
【請求項42】
前記特異的結合剤は、分子ビーコンプローブであることを特徴とする請求項41に記載の方法。
【請求項43】
結合を容易にするために、前記試料流体、前記プローブ流体、または前記組み合わされた流体を加熱および冷却するステップをさらに備えることを特徴とする請求項39に記載の方法。
【請求項44】
前記シグナリング部分を検出するステップは、レーザーにより前記シグナリング部分を照射するステップを備えることを特徴とする請求項26に記載の方法。
【請求項45】
前記マイクロ流体チャネルは、バイオチップ内に含まれ、前記レーザーは、前記マイクロ流体チャネルを備える前記バイオチップに連結されたシステムのコンポーネントであることを特徴とする請求項44に記載の方法。
【請求項46】
前記シグナリング部分を検出するステップは、蛍光を検出するするステップを備えることを特徴とする請求項26に記載の方法。
【請求項47】
前記試料流体は、法医学的試料を備えることを特徴とする請求項26に記載の方法。
【請求項48】
前記標的核酸は、ヒト核酸であることを特徴とする請求項47に記載の方法。
【請求項49】
前記試料流体は、ヒト以外の非標的核酸をさらに備えることを特徴とする請求項48に記載の方法。
【請求項50】
前記試料における前記標的核酸は、前記組み合わせステップに先立って増幅されないことを特徴とする請求項26に記載の方法。
【請求項51】
前記標的核酸は、前記方法の実行中のいずれのポイントにおいても増幅されないことを特徴とする請求項50に記載の方法。
【請求項52】
標的核酸を含むまたは含むと推測される法医学的試料流体において標的核酸を定量化する方法であって、
マイクロ流体チャネルにおいて前記法医学的試料流体とシグナリング部分を含む結合剤を含むプローブ流体とを組み合わせるステップであって、前記法医学的試料流体における前記標的核酸は増幅されていないステップと、
前記マイクロ流体チャネルにおける検出領域に前記組み合わされた流体を配置するステップと、
前記シグナリング部分を検出するステップと、
前記試料流体における前記標的核酸を定量化するステップと
を備えることを特徴とする方法。
【請求項53】
前記定量化ステップは、前記試験液における前記標的核酸の濃度を究明するステップを備えることを特徴とする請求項52に記載の方法。
【請求項54】
前記定量化ステップは、前記試験液における前記標的核酸の合計量を究明するステップを備えることを特徴とする請求項52に記載の方法。
【請求項55】
前記結合剤は前記標的核酸のための独特の特異性を有する特異的結合剤であることを特徴とする請求項52に記載の方法。
【請求項56】
前記配置ステップは、前記マイクロ流体チャネルにおける前記検出領域に前記組み合わされた流体を流出するステップを備えることを特徴とする請求項52に記載の方法。
【請求項57】
前記配置ステップは、検出の間に前記マイクロ流体チャネルの前記検出領域を通して前記組み合わされた流体を流出するステップを備えることを特徴とする請求項56に記載の方法。
【請求項58】
前記配置ステップは、前記マイクロ流体チャネルにおける領域で静止した状態で前記組み合わされた流体を保持するステップと、前記領域を前記検出領域に転換するために前記領域に1列に並ぶように検出器を移動させるステップとを備えることを特徴とする請求項52に記載の方法。
【請求項59】
試料操作のための複数のマイクロ流体チャネルおよびアクティブな領域を備えるバイオチップに前記マイクロ流体チャネルは配置され、前記方法は、前記定量化ステップの後に、前記バイオチップのアクティブな領域に、前記試料流体の選択された量を方向づけるステップを備えるステップをさらに備え、前記選択された量は、前記定量化ステップの結果に基づいて、少なくとも部分的に究明されることを特徴とする請求項52に記載の方法。
【請求項60】
前記試料流体における前記標的核酸は、前記試料流体と前記結合剤とを組み合わせてから1時間以内に定量化されることを特徴とする請求項52に記載の方法。
【請求項61】
前記試料流体における前記標的核酸は、前記試料流体と前記結合剤とを組み合わせてから30分以内に定量化されることを特徴とする請求項60に記載の方法。
【請求項62】
前記試料流体における前記標的核酸は、前記試料流体と前記結合剤とを組み合わせてから10分以内に定量化されることを特徴とする請求項61に記載の方法。
【請求項63】
前記試料流体における前記標的核酸は、前記試料流体と前記結合剤とを組み合わせてから5分以内に定量化されることを特徴とする請求項62に記載の方法。
【請求項64】
前記試料流体における前記標的核酸は、前記試料流体と前記結合剤とを組み合わせてから1分以内に定量化されることを特徴とする請求項63に記載の方法。
【請求項65】
前記標的核酸は、もし存在すれば、1ナノグラム/マイクロリットル未満の濃度を有してしている、または前記試料流体中に合計量で1ナノグラム未満含まれることを特徴とする請求項52に記載の方法。
【請求項66】
本質的には、前記標的核酸のすべては、もし存在すれば、前記組み合わせステップの間に前記結合剤に対して固定化されることを特徴とする請求項52に記載の方法。
【請求項67】
前記特異的結合剤は、前記標的核酸に混成されることを特徴とする請求項55に記載の方法。
【請求項68】
前記特異的結合剤は、分子ビーコンプローブであることを特徴とする請求項67に記載の方法。
【請求項69】
結合を容易にするために、前記試料流体、前記プローブ流体、または前記組み合わされた流体を加熱および冷却するステップをさらに備えることを特徴とする請求項52に記載の方法。
【請求項70】
前記シグナリング部分を検出するステップは、レーザーにより前記シグナリング部分を照射するステップを備えることを特徴とする請求項52に記載の方法。
【請求項71】
前記マイクロ流体チャネルは、バイオチップ内に含まれ、前記レーザーは、前記マイクロ流体チャネルを備える前記バイオチップに連結されたシステムのコンポーネントであることを特徴とする請求項70に記載の方法。
【請求項72】
前記シグナリング部分を検出するステップは、蛍光を検出するするステップを備えることを特徴とする請求項52に記載の方法。
【請求項73】
前記標的核酸は、ヒト核酸であることを特徴とする請求項52に記載の方法。
【請求項74】
前記試料流体は、ヒト以外の非標的核酸をさらに備えることを特徴とする請求項73に記載の方法。
【請求項75】
前記標的核酸は、前記方法の実行中のいずれのポイントにおいても増幅されないことを特徴とする請求項52に記載の方法。
【請求項76】
標的核酸を含むまたは含むと推測され、混入するヒト以外の核酸をさらに含む試料流体において標的核酸を定量化する方法であって、
マイクロ流体チャネルにおいて前記試料流体とシグナリング部分を含む結合剤を含むプローブ流体とを組み合わせるステップであって、前記試料流体における前記標的核酸は増幅されていないステップと、
前記マイクロ流体チャネルにおける検出領域に前記組み合わされた流体を配置するステップと、
前記シグナリング部分を検出するステップと、
前記試料流体における前記標的核酸を定量化するステップと
を備えることを特徴とする方法。
【請求項77】
前記定量化ステップは、前記組み合わされた流体における前記標的核酸の濃度を究明するステップを備えることを特徴とする請求項76に記載の方法。
【請求項78】
前記定量化ステップは、前記組み合わされた流体における前記標的核酸の合計量を究明するステップを備えることを特徴とする請求項76に記載の方法。
【請求項79】
前記結合剤は前記標的核酸のための独特の特異性を有する特異的結合剤であることを特徴とする請求項76に記載の方法。
【請求項80】
前記配置ステップは、前記マイクロ流体チャネルにおける前記検出領域に前記組み合わされた流体を流出するステップを備えることを特徴とする請求項76に記載の方法。
【請求項81】
前記配置ステップは、検出の間に前記マイクロ流体チャネルの前記検出領域を通して前記組み合わされた流体を流出するステップを備えることを特徴とする請求項80に記載の方法。
【請求項82】
前記配置ステップは、前記マイクロ流体チャネルにおける領域で静止した状態で前記組み合わされた流体を保持するステップと、前記領域を前記検出領域に転換するために前記領域に1列に並ぶように検出器を移動させるステップとを備えることを特徴とする請求項76に記載の方法。
【請求項83】
試料操作のための複数のマイクロ流体チャネルおよびアクティブな領域を備えるバイオチップに前記マイクロ流体チャネルは配置され、前記方法は、前記定量化ステップの後に、前記バイオチップのアクティブな領域に、前記試料流体の選択された量を方向づけるステップを備えるステップをさらに備え、前記選択された量は、前記定量化ステップの結果に基づいて、少なくとも部分的に究明されることを特徴とする請求項76に記載の方法。
【請求項84】
前記試料流体における前記標的核酸は、前記試料流体と前記結合剤とを組み合わせてから1時間以内に定量化されることを特徴とする請求項76に記載の方法。
【請求項85】
前記試料流体における前記標的核酸は、前記試料流体と前記結合剤とを組み合わせてから30分以内に定量化されることを特徴とする請求項84に記載の方法。
【請求項86】
前記試料流体における前記標的核酸は、前記試料流体と前記結合剤とを組み合わせてから10分以内に定量化されることを特徴とする請求項85に記載の方法。
【請求項87】
前記試料流体における前記標的核酸は、前記試料流体と前記結合剤とを組み合わせてから5分以内に定量化されることを特徴とする請求項86に記載の方法。
【請求項88】
前記試料流体における前記標的核酸は、前記試料流体と前記結合剤とを組み合わせてから1分以内に定量化されることを特徴とする請求項87に記載の方法。
【請求項89】
前記標的核酸は、もし存在すれば、1ナノグラム/マイクロリットル未満の濃度を有してしている、または前記試料流体中に合計量で1ナノグラム未満含まれることを特徴とする請求項76に記載の方法。
【請求項90】
本質的には、前記標的核酸のすべては、もし存在すれば、前記組み合わせステップの間に前記結合剤に対して固定化されることを特徴とする請求項76に記載の方法。
【請求項91】
前記特異的結合剤は、前記標的核酸に混成されることを特徴とする請求項79に記載の方法。
【請求項92】
前記特異的結合剤は、分子ビーコンプローブであることを特徴とする請求項91に記載の方法。
【請求項93】
結合を容易にするために、前記試料流体、前記プローブ流体、または前記組み合わされた流体を加熱および冷却するステップをさらに備えることを特徴とする請求項76に記載の方法。
【請求項94】
前記シグナリング部分を検出するステップは、レーザーにより前記シグナリング部分を照射するステップを備えることを特徴とする請求項76に記載の方法。
【請求項95】
前記マイクロ流体チャネルは、バイオチップ内に含まれ、前記レーザーは、前記マイクロ流体チャネルを備える前記バイオチップに連結されたシステムのコンポーネントであることを特徴とする請求項94に記載の方法。
【請求項96】
前記シグナリング部分を検出するステップは、蛍光を検出するするステップを備えることを特徴とする請求項76に記載の方法。
【請求項97】
前記標的核酸は、ヒト核酸であることを特徴とする請求項76に記載の方法。
【請求項98】
前記試料流体は、ヒト以外の非標的核酸をさらに備えることを特徴とする請求項97に記載の方法。
【請求項99】
前記標的核酸は、前記方法の実行中のいずれのポイントにおいても増幅されないことを特徴とする請求項76に記載の方法。
【請求項100】
前記試料は、法医学的試料であることを特徴とする請求項76に記載の方法。
【請求項101】
標的核酸を含むまたは含むと推測される試料流体において標的核酸を定量化する方法であって、
統合化レーザーを備える検出器を備える電子装置に連結されたマイクロ流体デバイスを準備をするステップと、
前記マイクロ流体デバイスのマイクロ流体チャネルにおいて前記試料流体とシグナリング部分を含む結合剤とを組み合わせるステップであって、前記結合剤は、前記標的核酸に対して固定化されるステップと、
前記電子装置の前記検出器に作用する近接に配置された前記マイクロ流体チャネルの検出領域に前記組み合わされる流体を配置するステップと、
前記統合化レーザーを用いて、前記シグナリング部分を照射するステップと、
前記試料流体における前記標的核酸を定量化するステップと
を備えることを特徴とする方法。
【請求項102】
前記定量化ステップは、前記組み合わされた流体における前記標的核酸の濃度を究明するステップを備えることを特徴とする請求項101に記載の方法。
【請求項103】
前記定量化ステップは、前記組み合わされた流体における前記標的核酸の合計量を究明するステップを備えることを特徴とする請求項101に記載の方法。
【請求項104】
前記結合剤は前記標的核酸のための独特の特異性を有する特異的結合剤であることを特徴とする請求項101に記載の方法。
【請求項105】
前記配置ステップは、前記マイクロ流体チャネルにおける前記検出領域に前記組み合わされた流体を流出するステップを備えることを特徴とする請求項101に記載の方法。
【請求項106】
前記配置ステップは、検出の間に前記マイクロ流体チャネルの前記検出領域を通して前記組み合わされた流体を流出するステップを備えることを特徴とする請求項105に記載の方法。
【請求項107】
前記配置ステップは、前記マイクロ流体チャネルにおける領域で静止した状態で前記組み合わされた流体を保持するステップと、前記領域を前記検出領域に転換するために前記領域に1列に並ぶように検出器を移動させるステップとを備えることを特徴とする請求項101に記載の方法。
【請求項108】
試料操作のための複数のマイクロ流体チャネルおよびアクティブな領域を備えるバイオチップに前記マイクロ流体チャネルは配置され、前記方法は、前記定量化ステップの後に、前記バイオチップのアクティブな領域に、前記試料流体の選択された量を方向づけるステップを備えるステップをさらに備え、前記選択された量は、前記定量化ステップの結果に基づいて、少なくとも部分的に究明されることを特徴とする請求項101に記載の方法。
【請求項109】
前記試料流体における前記標的核酸は、前記試料流体と前記結合剤とを組み合わせてから1時間以内に定量化されることを特徴とする請求項101に記載の方法。
【請求項110】
前記試料流体における前記標的核酸は、前記試料流体と前記結合剤とを組み合わせてから30分以内に定量化されることを特徴とする請求項109に記載の方法。
【請求項111】
前記試料流体における前記標的核酸は、前記試料流体と前記結合剤とを組み合わせてから10分以内に定量化されることを特徴とする請求項110に記載の方法。
【請求項112】
前記試料流体における前記標的核酸は、前記試料流体と前記結合剤とを組み合わせてから5分以内に定量化されることを特徴とする請求項111に記載の方法。
【請求項113】
前記試料流体における前記標的核酸は、前記試料流体と前記結合剤とを組み合わせてから1分以内に定量化されることを特徴とする請求項112に記載の方法。
【請求項114】
前記標的核酸は、もし存在すれば、1ナノグラム/マイクロリットル未満の濃度を有してしている、または前記試料流体中に合計量で1ナノグラム未満含まれることを特徴とする請求項101に記載の方法。
【請求項115】
本質的には、前記標的核酸のすべては、もし存在すれば、前記組み合わせステップの間に前記結合剤に対して固定化されることを特徴とする請求項101に記載の方法。
【請求項116】
前記特異的結合剤は、前記標的核酸に混成されることを特徴とする請求項104に記載の方法。
【請求項117】
前記特異的結合剤は、分子ビーコンプローブであることを特徴とする請求項116に記載の方法。
【請求項118】
結合を容易にするために、前記試料流体または前記組み合わされた流体を加熱および冷却するステップをさらに備えることを特徴とする請求項101に記載の方法。
【請求項119】
前記シグナリング部分を検出するステップは、レーザーにより前記シグナリング部分を照射するステップを備えることを特徴とする請求項101に記載の方法。
【請求項120】
前記マイクロ流体チャネルは、バイオチップ内に含まれ、前記レーザーは、前記マイクロ流体チャネルを備える前記バイオチップに連結されたシステムのコンポーネントであることを特徴とする請求項119に記載の方法。
【請求項121】
前記シグナリング部分を検出するステップは、蛍光を検出するするステップを備えることを特徴とする請求項101に記載の方法。
【請求項122】
前記標的核酸は、ヒト核酸であることを特徴とする請求項101に記載の方法。
【請求項123】
前記試料流体は、ヒト以外の非標的核酸をさらに備えることを特徴とする請求項122に記載の方法。
【請求項124】
前記標的核酸は、前記方法の実行中のいずれのポイントにおいても増幅されないことを特徴とする請求項101に記載の方法。
【請求項125】
前記試料は、法医学的試料であることを特徴とする請求項101に記載の方法。
【請求項126】
標的核酸を含む試料流体において標的核酸を操作する方法であって、
検出器を備える電子装置に連結された、試料操作のための複数のマイクロ流体チャネルおよびアクティブな領域を備えるマイクロ流体デバイスを準備をするステップと、
前記マイクロ流体デバイスのマイクロ流体チャネルにおいて前記試料流体とシグナリング部分を含む結合剤とを組み合わせるステップであって、前記結合剤は、前記標的核酸に対して固定化されるステップと、
前記電子装置の前記検出器に作用する近接に配置された前記マイクロ流体チャネルの検出領域に前記組み合わされる流体を配置するステップと、
前記試料流体における前記標的核酸を定量化するステップと
前記バイオチップのアクティブな領域に、前記試料流体の選択された量を方向づけるステップであって、前記選択された量は、前記定量化ステップの結果に基づいて、少なくとも部分的に究明されるステップと
を備えることを特徴とする方法。
【請求項127】
前記定量化ステップは、前記組み合わされた流体における前記標的核酸の濃度を究明するステップを備えることを特徴とする請求項126に記載の方法。
【請求項128】
前記定量化ステップは、前記組み合わされた流体における前記標的核酸の合計量を究明するステップを備えることを特徴とする請求項126に記載の方法。
【請求項129】
前記結合剤は前記標的核酸のための独特の特異性を有する特異的結合剤であることを特徴とする請求項126に記載の方法。
【請求項130】
前記配置ステップは、前記マイクロ流体チャネルにおける前記検出領域に前記組み合わされた流体を流出するステップを備えることを特徴とする請求項126に記載の方法。
【請求項131】
前記配置ステップは、検出の間に前記マイクロ流体チャネルの前記検出領域を通して前記組み合わされた流体を流出するステップを備えることを特徴とする請求項130に記載の方法。
【請求項132】
前記配置ステップは、前記マイクロ流体チャネルにおける領域で静止した状態で前記組み合わされた流体を保持するステップと、前記領域を前記検出領域に転換するために前記領域に1列に並ぶように検出器を移動させるステップとを備えることを特徴とする請求項126に記載の方法。
【請求項133】
前記試料流体における前記標的核酸は、前記試料流体と前記結合剤とを組み合わせてから1時間以内に定量化されることを特徴とする請求項126に記載の方法。
【請求項134】
前記試料流体における前記標的核酸は、前記試料流体と前記結合剤とを組み合わせてから30分以内に定量化されることを特徴とする請求項133に記載の方法。
【請求項135】
前記試料流体における前記標的核酸は、前記試料流体と前記結合剤とを組み合わせてから10分以内に定量化されることを特徴とする請求項134に記載の方法。
【請求項136】
前記試料流体における前記標的核酸は、前記試料流体と前記結合剤とを組み合わせてから5分以内に定量化されることを特徴とする請求項135に記載の方法。
【請求項137】
前記試料流体における前記標的核酸は、前記試料流体と前記結合剤とを組み合わせてから1分以内に定量化されることを特徴とする請求項136に記載の方法。
【請求項138】
前記標的核酸は、もし存在すれば、1ナノグラム/マイクロリットル未満の濃度を有してしている、または前記試料流体中に合計量で1ナノグラム未満含まれることを特徴とする請求項126に記載の方法。
【請求項139】
本質的には、前記標的核酸のすべては、もし存在すれば、前記組み合わせステップの間に前記結合剤に対して固定化されることを特徴とする請求項126に記載の方法。
【請求項140】
前記特異的結合剤は、前記標的核酸に混成されることを特徴とする請求項129に記載の方法。
【請求項141】
前記特異的結合剤は、分子ビーコンプローブであることを特徴とする請求項140に記載の方法。
【請求項142】
結合を容易にするために、前記試料流体または前記組み合わされた流体を加熱および冷却するステップをさらに備えることを特徴とする請求項126に記載の方法。
【請求項143】
前記シグナリング部分を検出するステップは、レーザーにより前記シグナリング部分を照射するステップを備えることを特徴とする請求項126に記載の方法。
【請求項144】
前記マイクロ流体チャネルは、バイオチップ内に含まれ、前記レーザーは、前記マイクロ流体チャネルを備える前記バイオチップに連結されたシステムのコンポーネントであることを特徴とする請求項143に記載の方法。
【請求項145】
前記シグナリング部分を検出するステップは、蛍光を検出するするステップを備えることを特徴とする請求項126に記載の方法。
【請求項146】
前記標的核酸は、ヒト核酸であることを特徴とする請求項126に記載の方法。
【請求項147】
前記試料流体は、ヒト以外の非標的核酸をさらに備えることを特徴とする請求項146に記載の方法。
【請求項148】
前記標的核酸は、前記方法の実行中のいずれのポイントにおいても増幅されないことを特徴とする請求項126に記載の方法。
【請求項149】
前記試料は、法医学的試料であることを特徴とする請求項126に記載の方法。
【請求項150】
標的核酸の増幅のために前記標的核酸を備える試料を用意する方法であって、
試料操作のための少なくとも1つのマイクロ流体チャネルと、アクティブな領域とを備えるマイクロ流体デバイスを準備をするステップであって、少なくとも1つの前記領域は、試料から核酸を精製するように構成されたステップと、
標的核酸の未知の可変量をもたらす収集方法によって前記試料を取得するステップと、
前記マイクロ流体デバイスの前記マイクロ流体チャネルの中に前記試料を挿入するステップと、
複製可能な量の精製された標的核酸を生成するために試料から核酸を精製するように構成された前記マイクロ流体デバイスの領域で前記試料における前記標的核酸を精製するステップと、
前記精製された標的核酸を定量化せずに、前記精製された標的核酸の前記複製可能な量を増幅するステップと
を備えることを特徴とする方法。
【請求項151】
前記マイクロ流体デバイスの少なくとも1つの前記アクティブな領域は、ポリメラーゼ連鎖反応(PCR)を介して核酸を増幅するように構成された領域を備え、前記増幅ステップが、核酸を増幅するように構成されたアクティブな領域において行われることを特徴とする請求項150に記載の方法。
【請求項152】
前記収集方法は、口腔スワビングステップを備えることを特徴とする請求項150に記載の方法。
【請求項153】
前記収集方法によって収集された前記核酸の量は、第1の試料から第2の試料に少なくとも10倍異なることを特徴とする請求項150に記載の方法。
【請求項154】
前記収集方法によって収集された前記核酸の量は、第1の試料から第2の試料に少なくとも1000倍異なることを特徴とする請求項153に記載の方法。
【請求項155】
複製可能な量の精製された標的核酸を生成するために試料から核酸を精製するように構成された前記マイクロ流体デバイスの領域での前記試料は、明確な核酸結合能力を有する結合膜を備え、前記精製するステップは、核酸を結合するために、前記結合膜とともに少なくとも一部の前記試料と接触するステップと、前記結合膜からの精製された標的核酸の前記複製可能な量を溶出するステップとを備えることを特徴とする請求項150に記載の方法。
【請求項156】
前記結合能力は、少なくとも300ナノグラムであることを特徴とする請求項155に記載の方法。
【請求項157】
前記結合能力は、少なくとも100ナノグラムであることを特徴とする請求項155に記載の方法。
【請求項158】
前記結合膜は、シリカ膜であることを特徴とする請求項155に記載の方法。
【請求項159】
前記標的核酸は、ヒト核酸であることを特徴とする請求項150に記載の方法。
【請求項160】
前記試料流体は、ヒト以外の非標的核酸をさらに備えることを特徴とする請求項159に記載の方法。
【請求項161】
前記標的核酸は、前記方法の実行中のいずれのポイントにおいても定量化されないことを特徴とする請求項150に記載の方法。
【請求項162】
前記試料は、法医学的試料であることを特徴とする請求項150に記載の方法。
【請求項163】
標的核酸を含むまたは含むと推測される法医学的試料流体において標的核酸を定量化する方法であって、
マイクロ流体チャネルにおいて、法医学的試料流体と、シグナリング部分を備えかつ前記標的核酸のための独特の混成特異性を有する分子ビーコンプローブを含むプローブ流体とを組み合わせるステップであって、前記法医学的試料流体における前記標的核酸は増幅されていないステップと、
前記マイクロ流体チャネルにおける検出領域に前記組み合わされた流体を配置するステップと、
前記シグナリング部分を検出するステップと、
前記試料流体における前記標的核酸を定量化するステップと
を備えることを特徴とする方法。
【請求項164】
前記定量化ステップは、前記試験液における前記標的核酸の濃度を究明するステップを備えることを特徴とする請求項163に記載の方法。
【請求項165】
前記定量化ステップは、前記試験液における前記標的核酸の合計量を究明するステップを備えることを特徴とする請求項163に記載の方法。
【請求項166】
前記配置ステップは、前記マイクロ流体チャネルにおける前記検出領域に前記組み合わされた流体を流出するステップを備えることを特徴とする請求項163に記載の方法。
【請求項167】
前記配置ステップは、検出の間に前記マイクロ流体チャネルの前記検出領域を通して前記組み合わされた流体を流出するステップを備えることを特徴とする請求項166に記載の方法。
【請求項168】
前記配置ステップは、前記マイクロ流体チャネルにおける領域で静止した状態で前記組み合わされた流体を保持するステップと、前記領域を前記検出領域に転換するために前記領域に1列に並ぶように検出器を移動させるステップとを備えることを特徴とする請求項163に記載の方法。
【請求項169】
試料操作のための複数のマイクロ流体チャネルおよびアクティブな領域を備えるバイオチップに前記マイクロ流体チャネルは配置され、前記方法は、前記定量化ステップの後に、前記バイオチップのアクティブな領域に、前記試料流体の選択された量を方向づけるステップを備えるステップをさらに備え、前記選択された量は、前記定量化ステップの結果に基づいて、少なくとも部分的に究明されることを特徴とする請求項163に記載の方法。
【請求項170】
前記試料流体における前記標的核酸は、前記試料流体と前記分子ビーコンプローブとを組み合わせてから1時間以内に定量化されることを特徴とする請求項163に記載の方法。
【請求項171】
前記試料流体における前記標的核酸は、前記試料流体と前記分子ビーコンプローブとを組み合わせてから30分以内に定量化されることを特徴とする請求項163に記載の方法。
【請求項172】
前記試料流体における前記標的核酸は、前記試料流体と前記分子ビーコンプローブとを組み合わせてから10分以内に定量化されることを特徴とする請求項171に記載の方法。
【請求項173】
前記試料流体における前記標的核酸は、前記試料流体と前記分子ビーコンプローブとを組み合わせてから5分以内に定量化されることを特徴とする請求項172に記載の方法。
【請求項174】
前記試料流体における前記標的核酸は、前記試料流体と前記分子ビーコンプローブとを組み合わせてから1分以内に定量化されることを特徴とする請求項173に記載の方法。
【請求項175】
前記標的核酸は、もし存在すれば、1ナノグラム/マイクロリットル未満の濃度を有してしている、または前記試料流体中に合計量で1ナノグラム未満含まれることを特徴とする請求項163に記載の方法。
【請求項176】
本質的には、前記標的核酸のすべては、もし存在すれば、前記組み合わせステップの間に前記分子ビーコンプローブに対して固定化されることを特徴とする請求項163に記載の方法。
【請求項177】
結合を容易にするために、前記試料流体、前記プローブ流体、または前記組み合わされた流体を加熱および冷却するステップをさらに備えることを特徴とする請求項163に記載の方法。
【請求項178】
前記シグナリング部分を検出するステップは、レーザーにより前記シグナリング部分を照射するステップを備えることを特徴とする請求項163に記載の方法。
【請求項179】
前記マイクロ流体チャネルは、バイオチップ内に含まれ、前記レーザーは、前記マイクロ流体チャネルを備える前記バイオチップに連結されたシステムのコンポーネントであることを特徴とする請求項178に記載の方法。
【請求項180】
前記シグナリング部分を検出するステップは、蛍光を検出するするステップを備えることを特徴とする請求項163に記載の方法。
【請求項181】
前記標的核酸は、ヒト核酸であることを特徴とする請求項163に記載の方法。
【請求項182】
前記試料流体は、ヒト以外の非標的核酸をさらに備えることを特徴とする請求項181に記載の方法。
【請求項183】
前記標的核酸は、前記方法の実行中のいずれのポイントにおいても増幅されないことを特徴とする請求項163に記載の方法。
【請求項184】
バイオチップの複数の機能的な領域における蛍光団の励起および検出のための計器であって、
励起源と、
励起源から前記バイオチップにおける複数の機能的な領域にビームを方向づける操縦エレメントであって、前記励起源は、前記複数の機能的な領域の少なくとも1つからの前記信号が核酸の定量化を可能にするように、検出される信号を生成する前記複数の機能的な領域における蛍光団を励起する、前記操縦エレメントと
を備えることを特徴とする計器。
【請求項185】
前記操縦エレメントはミラーであることを特徴とする請求項184に記載の計器。
【請求項186】
前記バイオチップの前記定量化領域における前記定量化チャンバの各々に前記励起ビームを方向づける第1のスキャナと、
前記バイオチップの第2の機能的な領域における前記チャンバの各々に前記励起ビームを方向づける第2のスキャナと
をさらに備えることを特徴とする請求項184に記載の計器。
【請求項187】
前記バイオチップの前記定量化領域における前記定量化チャンバの各々に、前記励起ビームを方向づける並進ステージ上に取り付けたミラーと、
前記バイオチップの第2の機能的な領域における前記チャンバの各々に前記励起ビームを方向づける第2のスキャナと
をさらに備えることを特徴とする請求項184に記載の計器。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24】


【図25】


【図26】


【図27】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24】


【図25】


【図26】


【図27】


【公表番号】特表2012−529908(P2012−529908A)
【公表日】平成24年11月29日(2012.11.29)
【国際特許分類】
【出願番号】特願2012−516061(P2012−516061)
【出願日】平成22年6月15日(2010.6.15)
【国際出願番号】PCT/US2010/001741
【国際公開番号】WO2010/147654
【国際公開日】平成22年12月23日(2010.12.23)
【公序良俗違反の表示】
(特許庁注:以下のものは登録商標)
1.イーサネット
【出願人】(507382050)ネットバイオ・インコーポレーテッド (7)
【氏名又は名称原語表記】NetBio, Inc.
【Fターム(参考)】
【公表日】平成24年11月29日(2012.11.29)
【国際特許分類】
【出願日】平成22年6月15日(2010.6.15)
【国際出願番号】PCT/US2010/001741
【国際公開番号】WO2010/147654
【国際公開日】平成22年12月23日(2010.12.23)
【公序良俗違反の表示】
(特許庁注:以下のものは登録商標)
1.イーサネット
【出願人】(507382050)ネットバイオ・インコーポレーテッド (7)
【氏名又は名称原語表記】NetBio, Inc.
【Fターム(参考)】
[ Back to top ]

