波長変換ナノ粒子の製造方法及び波長変換ナノ粒子
【課題】良好な発光強度を有する波長変換ナノ粒子を水系溶媒中で製造可能とすること。
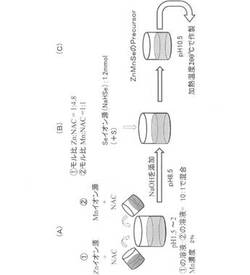
【解決手段】Znイオン源とNACとを1:4.8のモル比で含む水溶液と、Mnイオン源とNACとを1:1のモル比で含む水溶液とを混合した(A)。なお、前者の水溶液と後者の水溶液とは10:1の割合で混合した。続いて、その水溶液にNaOHを添加することによってpH8.5に調整し、更に、Seイオン源を1.2mmol添加した(B)。更に、その水溶液をpH10.5に調整した後(C)、高圧下で200℃に加熱することによって、波長変換ナノ粒子(ZnSe:Mn)を製造した。
【解決手段】Znイオン源とNACとを1:4.8のモル比で含む水溶液と、Mnイオン源とNACとを1:1のモル比で含む水溶液とを混合した(A)。なお、前者の水溶液と後者の水溶液とは10:1の割合で混合した。続いて、その水溶液にNaOHを添加することによってpH8.5に調整し、更に、Seイオン源を1.2mmol添加した(B)。更に、その水溶液をpH10.5に調整した後(C)、高圧下で200℃に加熱することによって、波長変換ナノ粒子(ZnSe:Mn)を製造した。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、吸収した光とは異なる波長の光を発生する波長変換ナノ粒子の製造方法、及び、その製造法によって製造されたナノ粒子に関する。
【背景技術】
【0002】
吸収した光とは異なる波長の光を発生する波長変換ナノ粒子は、LEDの表面に配設されて当該LEDの発光色を変更したり、太陽電池の表面に設けられて入射光の波長を変換することにより当該太陽電池の効率を向上させたりと、種々の用途に応用されている。
【0003】
従来、このような波長変換ナノ粒子としては、CdSを含むものが提案されているが、Cdは廃棄処理を誤ると環境に悪影響を与えるため、ZnSe等を使用して波長変換ナノ粒子を製造することが提案されている(例えば、非特許文献1参照)。
【0004】
ところが、非特許文献1に記載の製造方法では、有機溶媒中で波長変換ナノ粒子を製造しているため、その有機溶媒の廃棄処理を誤るとPRTR法に抵触する可能性がある。そこで、水系溶媒中で波長変換ナノ粒子を製造することも提案されている(例えば、非特許文献2,3参照)。
【先行技術文献】
【非特許文献】
【0005】
【非特許文献1】Narayan Pradhan and Xiaogang Peng,J.AM.CHEM.SOC.VOL.129,NO.11,2007,3339-3347
【非特許文献2】Narayan Pradhan,David M. Battaglia,Yongcheng Liu, and Xiaogang Peng,Nano Lett., Vol.7,No.2,2007,312-317
【非特許文献3】Abdelhay Aboulaich,Malgorzata Geszke,Lavinia Balan,Jaafar Ghanbaja,Ghouti Medjahdi,and Raphael Schneider,Inorg.Chem.,VOL.49,2010,10940-10948
【発明の概要】
【発明が解決しようとする課題】
【0006】
しかしながら、非特許文献2,3に記載の方法では、いずれも100℃以下の温度で波長変換ナノ粒子を製造しており、得られた波長変換ナノ粒子は、それほど良好な発光強度を有していなかった。そこで、本発明は、良好な発光強度を有する波長変換ナノ粒子を、水系溶媒中で製造可能とすることを目的としてなされた。
【課題を解決するための手段】
【0007】
前記目的を達するためになされた本発明は、所望の波長の光を発生する発光中心となる金属イオンを無機ナノ粒子にドープして波長変換ナノ粒子を製造する波長変換ナノ粒子の製造方法であって、前記発光中心となる金属イオンを提供するイオン源と、前記無機ナノ粒子を構成する原子を提供するイオン源と、前記無機ナノ粒子に配位する親水性の配位子と、を水系溶媒中で混合し、得られた溶液のpH調整を行う混合工程と、前記pH調整後の前記溶液を高圧下で150℃〜250℃に加熱して波長変換ナノ粒子を生成する加熱工程と、を含むことを特徴とする波長変換ナノ粒子の製造方法を、要旨としている。
【0008】
本願出願人は、水系溶媒中で波長変換ナノ粒子を製造する場合であっても、150℃〜250℃に加熱して製造すると、良好な発光強度を有する波長変換ナノ粒子が得られることを発見した。これは、高温でナノ粒子を生成することにより、きれいな結晶ができるためと考えられる。但し、250℃より高温に加熱すると、自己清浄化効果によってドープの効果が低減される傾向が生じる。すなわち、波長変換ナノ粒子では、無機ナノ粒子が吸収した光のエネルギを、その無機ナノ粒子にドープされて発光中心となる金属イオンが、他の所望波長の光に変換する。しかしながら、250℃より高温で結晶を製造した場合、無機ナノ粒子の結晶から前記発光中心となる金属イオンが排除される傾向が生じるのである。また、逆に、150℃未満の温度で波長変換ナノ粒子した場合は、加熱の効果が十分に得られず、従来の方法で水系溶媒中で生成された波長変換ナノ粒子と余り発光強度の差が出ない。
【0009】
このような、高温下での波長変換ナノ粒子の生成は、その温度に応じた適宜の高圧下にて行われる。また、その製造は、先ず、混合工程にて、前記発光中心となる金属イオンを提供するイオン源と、前記無機ナノ粒子を構成する原子を提供するイオン源と、前記無機ナノ粒子に配位する親水性の配位子と、を水系溶媒中で混合し、得られた溶液のpH調整する。続いて、加熱工程にて、前記pH調整後の前記溶液を前記高圧下で150℃〜250℃に加熱してなされる。
【0010】
なお、前記配位子は、N−アセチル−L−システインであってもよい。配位子としては、N−アセチル−L−システインの他、メルカプト酢酸,メルカプトプロピオン酸,メルカプトこはく酸等が使用可能である。
【0011】
また、前記発光中心となる金属イオンがMnイオンであってもよく、前記無機ナノ粒子を構成する原子としてZnを含んでもよい。Znを含む無機ナノ粒子は、紫外領域の光を良好に吸収し、その無機ナノ粒子にMnイオンがドープされていると、前記紫外領域の光を可視領域の光に変換して発生することができる。従って、その場合、太陽電池の効率を向上させるなどの用途に良好に応用することができる。
【0012】
そして、その場合、前記混合工程では、Mnイオンを提供する前記イオン源とN−アセチル−L−システインとを含む溶液と、Zn原子を提供する前記イオン源とN−アセチル−L−システインとを含む溶液とを、混合してもよい。その場合、Znを含む無機ナノ粒子にMnイオンがドープされた波長変換ナノ粒子を、良好に製造することができる。
【0013】
また、前記無機ナノ粒子を構成する原子として、SとSeとを含み、前記混合工程は、前記無機ナノ粒子を構成するSe以外の各原子を各々提供する前記各イオン源と、前記配位子と、を水系溶媒中で混合し、得られた溶液のpH調整を行う第1混合工程と、前記無機ナノ粒子を構成するS以外の各原子を各々提供する前記各イオン源と、前記配位子と、を水系溶媒中で混合し、得られた溶液のpH調整を行う第2混合工程と、前記第1混合工程で得られた前記pH調整後の溶液と、前記第2混合工程で得られた前記pH調整後の溶液とを混合する第3混合工程と、からなり、前記発光中心となる金属イオンを提供するイオン源は、前記第1混合工程または前記第2混合工程で前記溶液に混合されてもよい。
【0014】
無機ナノ粒子を構成する原子としてSとSeとを含む場合、混晶からなる無機ナノ粒子が生成され、SとSeとの比率を適切に調整することで前記発光強度を極めて良好に向上させることができる。ところが、SとSeとでは、そのイオン源を反応系に追加する際に適切なpHが大きく異なる。
【0015】
そこで、前述のように、第1混合工程にて、無機ナノ粒子を構成するSe以外の各原子(Sも含む)を各々提供する前記各イオン源と前記配位子とを水系溶媒中で混合して得られた溶液のpHを調整し、第2混合工程にて、無機ナノ粒子を構成するS以外の各原子(Seも含む)を各々提供する前記各イオン源と前記配位子とを水系溶媒中で混合して得られた溶液のpHを調整し、それらのpH調整後の溶液を第3混合工程で混合すればよい。なお、前記発光中心となる金属イオンを提供するイオン源は、前記第1混合工程または前記第2混合工程で前記溶液に混合される。こうすることによって、前述のような混晶からなる波長変換ナノ粒子を良好に製造することができる。
【0016】
また、前記混合工程終了後の前記溶液はpH9〜11に調整されてもよく、その場合、その溶液を高圧下で150℃〜250℃に加熱することによって、極めて良好な発光強度を有する波長変換ナノ粒子を製造することができる。
【0017】
また、本発明の波長変換ナノ粒子は、前記いずれかに記載の波長変換ナノ粒子の製造方法で製造されたことを特徴としている。このため、本発明の波長変換ナノ粒子は、極めて良好な発光強度を有している。
【図面の簡単な説明】
【0018】
【図1】第1,第2実施例の波長変換ナノ粒子の製造方法を表す説明図である。
【図2】その方法で製造された第1実施例の波長変換ナノ粒子の発光・吸収スペクトルを表すグラフである。
【図3】その第1実施例の放置による前記スペクトルの変化を表すグラフである。
【図4】その第1実施例のpHによる前記スペクトルの相違を表すグラフである。
【図5】その第1実施例の各種パラメータによる輝度の変化を表すグラフである。
【図6】前記方法で製造された第2実施例の波長変換ナノ粒子の混成比による発光スペクトルの変化を表すグラフである。
【発明を実施するための形態】
【0019】
[第1実施例]
次に、本発明の実施の形態を、具体的実施例を挙げて説明する。図1は、第1実施例及び後述の第2実施例の波長変換ナノ粒子の製造方法を表す説明図である。図1(A)に示すように、本実施例では、先ず、Znイオン源(例えば、過塩素酸亜鉛)とN−アセチル−L−システイン(以下、NACという)とを1:4.8のモル比で含む水溶液と、Mnイオン源(例えば、過塩素酸マンガン)とNACとを1:1のモル比で含む水溶液とを混合した。なお、前者の水溶液と後者の水溶液とは10:1の割合で混合し、混合後の水溶液全体に対するMnの濃度が2mol%となるようにした。
【0020】
続いて、その水溶液にNaOHを添加することによってpH8.5に調整し、更に、図1(B)に示すように、Seイオン源(例えばNaHSe)を1.2mmol添加した。なお、このときのZn:Seのモル比は(1:0.6)である。また、この水溶液(ZnMnSeのPrecursor)では、金属原子にNACのSH基が配位し、NACのカルボキシル基が水系溶媒への溶解を促進しているものと推定される。その水溶液に更にNaOHを添加することによって、図1(C)に示すようにpH10.5に調整した後、高圧下(例えば6気圧)で200℃に加熱することによって、波長変換ナノ粒子(ZnSe:Mn)を製造した。なお、加熱時間は10分とした。
【0021】
図2は、得られた波長変換ナノ粒子(ZnSe:Mn)の発光・吸収スペクトルを、前述のMnイオン源を省略して得られた無機ナノ粒子(ZnSe)の発光・吸収スペクトルと対比して表すグラフである。なお、グラフ縦軸の強度は、必ずしもカンデラ等の単位と1対1に対応するものではなく、当該グラフ中で対比された強度同士を相対的に比較した値である。また、後述のグラフにおける強度,輝度等も同様である。従って、同じ試料であっても、強度等の値は後述のグラフ等における値と必ずしも一致しない。
【0022】
図2に示すように、ZnSe系の無機ナノ粒子にMnイオンがドープされた第1実施例の波長変換ナノ粒子(ZnSe:Mn)では、540nm〜640nmの可視領域に発光強度のピークが現れた。一方、Mnイオンがドープされていない前記無機ナノ粒子(ZnSe)では、可視領域に発光強度のピークが殆ど現れなかった。また、両者の吸収スペクトルは完全に一致しており、400nm未満の紫外領域にピークを有した。このため、本実施例の波長変換ナノ粒子を太陽電池等に応用すれば、紫外線を可視光線に変換して太陽電池の効率を向上させることができる。また、本実施例の波長変換ナノ粒子では、従来の水系溶媒中で製造された波長変換ナノ粒子よりも極めて強い発光強度が得られた。これは、高温でナノ粒子を生成することにより、きれいな結晶ができるためと考えられる。
【0023】
次に、図3は、前述のように製造された波長変換ナノ粒子を、前記溶液中で放置した場合の前記スペクトルの変化を表すグラフである。なお、図3では、製造直後の発光スペクトルは10倍している。図3に示すように、両者の吸収スペクトルは完全に一致するが、発光強度は放置によって大幅に増大することが分かった。
【0024】
また、図4は、前述のように、図1(C)の工程でpH10.5に調整後に加熱して得られた第1実施例と、図1(C)の工程でpH5に調整後に加熱して得られた試料との発光・吸収スペクトルの相違を表すグラフである。図4に示すように、両者はほぼ同様のスペクトルを呈するが、pH10.5に調整後に加熱した方が広い波長領域に亘って発光強度を有することが分かる。
【0025】
図5(A)は、実施例1において加熱時間を変化させた場合の輝度の変化を表すグラフである。図5(A)に示すように、加熱時間を20分とした場合に、波長変換ナノ粒子の発光強度(輝度)が最も強くなることが分かった。なお、加熱温度によって、発光強度が最も強くなる加熱時間は変化する可能性がある。
【0026】
図5(B)は、加熱時間を20分に固定して製造した実施例1を、前記溶液中で放置した場合の輝度の変化を表すグラフである。図5(B)に示すように、20日放置した場合に、波長変換ナノ粒子の発光強度(輝度)が最も強くなることが分かった。なお、溶媒またはその添加物等によって、発光強度が最も強くなる放置時間は変化する可能性がある。
【0027】
図5(C)は、実施例1においてドーパント比(すなわち、カチオンであるZn+Mn全体のうちのMnのmol%)を変化させた場合の輝度の変化を表すグラフである。図5(C)に示すように、ドーパント比を2%とした場合に、波長変換ナノ粒子の発光強度(輝度)が最も強くなることが分かった。
【0028】
図5(D)は、実施例1において図1(C)の工程で調整するpHの値を変化させた場合の輝度の変化を表すグラフである。図5(D)に示すように、pHを10.5に調整した場合に、波長変換ナノ粒子の発光強度(輝度)が最も強くなることが分かった。
【0029】
図5(E)は、実施例1において加熱温度を変化させた場合の輝度の変化を表すグラフである。図5(E)に示すように、加熱温度を200℃とした場合に、波長変換ナノ粒子の発光強度(輝度)が最も強くなることが分かった。
【0030】
なお、前記工程において、図1の(A)〜(C)に示した工程が混合工程に、その後の加熱処理が加熱工程に、それぞれ相当する。また、本発明は前記実施例に何ら限定されるものではなく、本発明の要旨を逸脱しない範囲で種々の形態で実施することができる。例えば、Znイオン源としては、前述の過塩素酸亜鉛の他、塩化亜鉛,酢酸亜鉛,硝酸亜鉛等が使用できる。また、Mnイオン源としては、前述の過塩素酸マンガンの他、塩化マンガン,酢酸マンガン,臭化マンガン等が使用できる。また、Seイオン源としては、前述のNaHSeの他、セレノウレア,セレン化水素ガス等が使用できる。更に、配位子としては、前述のNACの他、メルカプト酢酸,メルカプトプロピオン酸,メルカプトこはく酸等が使用できる。
【0031】
また更に、Seの代わりにSを使用してもよい。その場合も、図1(A)の工程の後にはpHを10.5に調整するのが望ましい。また、その場合、図1(B)の工程で用いるSイオン源としては、硫化ナトリウム,チオ尿素,硫化水素ガス等が使用でき、Zn:Sのモル比が1:0.6となるようにするのが望ましい。
【0032】
[第2実施例]
前述のように、無機ナノ粒子を構成するアニオンとしてSeを用いる場合とSを用いる場合とでは、図1(A)の工程の後において調整すべきpHの値が異なる。そこで、次のような方法により、アニオンとしてSeとSとの両方を用いていわゆる混晶半導体としての無機ナノ粒子をMnイオンでドープした波長変換ナノ粒子を、第2実施例として製造した。
【0033】
本実施例では、前述の図1(A),(B)の工程によって製造されたZnMnSeの前駆体(Precursor)溶液と、その図1(A),(B)の工程において前述のようにSeの代わりにSを使用して製造されたZnS:Mnの前駆体溶液とを、別々に製造した。そして、pH10.5に調整の後、両者を混合して200℃で10分加熱することによって波長変換ナノ粒子を得た。この波長変換ナノ粒子では、SeとSとの比は自由に調整でき、ZnSeXS1-X:Mn(0<X<1)なる一般式で表すことができる。
【0034】
図6は、第2実施例の波長変換ナノ粒子の混成比による発光スペクトルの変化を表すグラフである。図6に示すように、波長変換ナノ粒子(ZnSe:Mn)にSを加えることで、400nm近傍の発光強度のピークが減少し、600nm近傍の発光強度のピークが強くなることが分かった。従って、SeとSとの両者を用いた波長変換ナノ粒子では、一層良好な発光強度が得られ、太陽電池等に応用すればその効率を一層向上させられることが分かった。
【0035】
なお、上記各実施の形態では、カチオンとしてZn,Mnを使用しているが、Mnの代わりにCdを用いるなど、カチオンの種類も種々に変更することができる。また、SまたはSeと、Mnと、Znとは、どういう順番で混ぜてもよい。
【技術分野】
【0001】
本発明は、吸収した光とは異なる波長の光を発生する波長変換ナノ粒子の製造方法、及び、その製造法によって製造されたナノ粒子に関する。
【背景技術】
【0002】
吸収した光とは異なる波長の光を発生する波長変換ナノ粒子は、LEDの表面に配設されて当該LEDの発光色を変更したり、太陽電池の表面に設けられて入射光の波長を変換することにより当該太陽電池の効率を向上させたりと、種々の用途に応用されている。
【0003】
従来、このような波長変換ナノ粒子としては、CdSを含むものが提案されているが、Cdは廃棄処理を誤ると環境に悪影響を与えるため、ZnSe等を使用して波長変換ナノ粒子を製造することが提案されている(例えば、非特許文献1参照)。
【0004】
ところが、非特許文献1に記載の製造方法では、有機溶媒中で波長変換ナノ粒子を製造しているため、その有機溶媒の廃棄処理を誤るとPRTR法に抵触する可能性がある。そこで、水系溶媒中で波長変換ナノ粒子を製造することも提案されている(例えば、非特許文献2,3参照)。
【先行技術文献】
【非特許文献】
【0005】
【非特許文献1】Narayan Pradhan and Xiaogang Peng,J.AM.CHEM.SOC.VOL.129,NO.11,2007,3339-3347
【非特許文献2】Narayan Pradhan,David M. Battaglia,Yongcheng Liu, and Xiaogang Peng,Nano Lett., Vol.7,No.2,2007,312-317
【非特許文献3】Abdelhay Aboulaich,Malgorzata Geszke,Lavinia Balan,Jaafar Ghanbaja,Ghouti Medjahdi,and Raphael Schneider,Inorg.Chem.,VOL.49,2010,10940-10948
【発明の概要】
【発明が解決しようとする課題】
【0006】
しかしながら、非特許文献2,3に記載の方法では、いずれも100℃以下の温度で波長変換ナノ粒子を製造しており、得られた波長変換ナノ粒子は、それほど良好な発光強度を有していなかった。そこで、本発明は、良好な発光強度を有する波長変換ナノ粒子を、水系溶媒中で製造可能とすることを目的としてなされた。
【課題を解決するための手段】
【0007】
前記目的を達するためになされた本発明は、所望の波長の光を発生する発光中心となる金属イオンを無機ナノ粒子にドープして波長変換ナノ粒子を製造する波長変換ナノ粒子の製造方法であって、前記発光中心となる金属イオンを提供するイオン源と、前記無機ナノ粒子を構成する原子を提供するイオン源と、前記無機ナノ粒子に配位する親水性の配位子と、を水系溶媒中で混合し、得られた溶液のpH調整を行う混合工程と、前記pH調整後の前記溶液を高圧下で150℃〜250℃に加熱して波長変換ナノ粒子を生成する加熱工程と、を含むことを特徴とする波長変換ナノ粒子の製造方法を、要旨としている。
【0008】
本願出願人は、水系溶媒中で波長変換ナノ粒子を製造する場合であっても、150℃〜250℃に加熱して製造すると、良好な発光強度を有する波長変換ナノ粒子が得られることを発見した。これは、高温でナノ粒子を生成することにより、きれいな結晶ができるためと考えられる。但し、250℃より高温に加熱すると、自己清浄化効果によってドープの効果が低減される傾向が生じる。すなわち、波長変換ナノ粒子では、無機ナノ粒子が吸収した光のエネルギを、その無機ナノ粒子にドープされて発光中心となる金属イオンが、他の所望波長の光に変換する。しかしながら、250℃より高温で結晶を製造した場合、無機ナノ粒子の結晶から前記発光中心となる金属イオンが排除される傾向が生じるのである。また、逆に、150℃未満の温度で波長変換ナノ粒子した場合は、加熱の効果が十分に得られず、従来の方法で水系溶媒中で生成された波長変換ナノ粒子と余り発光強度の差が出ない。
【0009】
このような、高温下での波長変換ナノ粒子の生成は、その温度に応じた適宜の高圧下にて行われる。また、その製造は、先ず、混合工程にて、前記発光中心となる金属イオンを提供するイオン源と、前記無機ナノ粒子を構成する原子を提供するイオン源と、前記無機ナノ粒子に配位する親水性の配位子と、を水系溶媒中で混合し、得られた溶液のpH調整する。続いて、加熱工程にて、前記pH調整後の前記溶液を前記高圧下で150℃〜250℃に加熱してなされる。
【0010】
なお、前記配位子は、N−アセチル−L−システインであってもよい。配位子としては、N−アセチル−L−システインの他、メルカプト酢酸,メルカプトプロピオン酸,メルカプトこはく酸等が使用可能である。
【0011】
また、前記発光中心となる金属イオンがMnイオンであってもよく、前記無機ナノ粒子を構成する原子としてZnを含んでもよい。Znを含む無機ナノ粒子は、紫外領域の光を良好に吸収し、その無機ナノ粒子にMnイオンがドープされていると、前記紫外領域の光を可視領域の光に変換して発生することができる。従って、その場合、太陽電池の効率を向上させるなどの用途に良好に応用することができる。
【0012】
そして、その場合、前記混合工程では、Mnイオンを提供する前記イオン源とN−アセチル−L−システインとを含む溶液と、Zn原子を提供する前記イオン源とN−アセチル−L−システインとを含む溶液とを、混合してもよい。その場合、Znを含む無機ナノ粒子にMnイオンがドープされた波長変換ナノ粒子を、良好に製造することができる。
【0013】
また、前記無機ナノ粒子を構成する原子として、SとSeとを含み、前記混合工程は、前記無機ナノ粒子を構成するSe以外の各原子を各々提供する前記各イオン源と、前記配位子と、を水系溶媒中で混合し、得られた溶液のpH調整を行う第1混合工程と、前記無機ナノ粒子を構成するS以外の各原子を各々提供する前記各イオン源と、前記配位子と、を水系溶媒中で混合し、得られた溶液のpH調整を行う第2混合工程と、前記第1混合工程で得られた前記pH調整後の溶液と、前記第2混合工程で得られた前記pH調整後の溶液とを混合する第3混合工程と、からなり、前記発光中心となる金属イオンを提供するイオン源は、前記第1混合工程または前記第2混合工程で前記溶液に混合されてもよい。
【0014】
無機ナノ粒子を構成する原子としてSとSeとを含む場合、混晶からなる無機ナノ粒子が生成され、SとSeとの比率を適切に調整することで前記発光強度を極めて良好に向上させることができる。ところが、SとSeとでは、そのイオン源を反応系に追加する際に適切なpHが大きく異なる。
【0015】
そこで、前述のように、第1混合工程にて、無機ナノ粒子を構成するSe以外の各原子(Sも含む)を各々提供する前記各イオン源と前記配位子とを水系溶媒中で混合して得られた溶液のpHを調整し、第2混合工程にて、無機ナノ粒子を構成するS以外の各原子(Seも含む)を各々提供する前記各イオン源と前記配位子とを水系溶媒中で混合して得られた溶液のpHを調整し、それらのpH調整後の溶液を第3混合工程で混合すればよい。なお、前記発光中心となる金属イオンを提供するイオン源は、前記第1混合工程または前記第2混合工程で前記溶液に混合される。こうすることによって、前述のような混晶からなる波長変換ナノ粒子を良好に製造することができる。
【0016】
また、前記混合工程終了後の前記溶液はpH9〜11に調整されてもよく、その場合、その溶液を高圧下で150℃〜250℃に加熱することによって、極めて良好な発光強度を有する波長変換ナノ粒子を製造することができる。
【0017】
また、本発明の波長変換ナノ粒子は、前記いずれかに記載の波長変換ナノ粒子の製造方法で製造されたことを特徴としている。このため、本発明の波長変換ナノ粒子は、極めて良好な発光強度を有している。
【図面の簡単な説明】
【0018】
【図1】第1,第2実施例の波長変換ナノ粒子の製造方法を表す説明図である。
【図2】その方法で製造された第1実施例の波長変換ナノ粒子の発光・吸収スペクトルを表すグラフである。
【図3】その第1実施例の放置による前記スペクトルの変化を表すグラフである。
【図4】その第1実施例のpHによる前記スペクトルの相違を表すグラフである。
【図5】その第1実施例の各種パラメータによる輝度の変化を表すグラフである。
【図6】前記方法で製造された第2実施例の波長変換ナノ粒子の混成比による発光スペクトルの変化を表すグラフである。
【発明を実施するための形態】
【0019】
[第1実施例]
次に、本発明の実施の形態を、具体的実施例を挙げて説明する。図1は、第1実施例及び後述の第2実施例の波長変換ナノ粒子の製造方法を表す説明図である。図1(A)に示すように、本実施例では、先ず、Znイオン源(例えば、過塩素酸亜鉛)とN−アセチル−L−システイン(以下、NACという)とを1:4.8のモル比で含む水溶液と、Mnイオン源(例えば、過塩素酸マンガン)とNACとを1:1のモル比で含む水溶液とを混合した。なお、前者の水溶液と後者の水溶液とは10:1の割合で混合し、混合後の水溶液全体に対するMnの濃度が2mol%となるようにした。
【0020】
続いて、その水溶液にNaOHを添加することによってpH8.5に調整し、更に、図1(B)に示すように、Seイオン源(例えばNaHSe)を1.2mmol添加した。なお、このときのZn:Seのモル比は(1:0.6)である。また、この水溶液(ZnMnSeのPrecursor)では、金属原子にNACのSH基が配位し、NACのカルボキシル基が水系溶媒への溶解を促進しているものと推定される。その水溶液に更にNaOHを添加することによって、図1(C)に示すようにpH10.5に調整した後、高圧下(例えば6気圧)で200℃に加熱することによって、波長変換ナノ粒子(ZnSe:Mn)を製造した。なお、加熱時間は10分とした。
【0021】
図2は、得られた波長変換ナノ粒子(ZnSe:Mn)の発光・吸収スペクトルを、前述のMnイオン源を省略して得られた無機ナノ粒子(ZnSe)の発光・吸収スペクトルと対比して表すグラフである。なお、グラフ縦軸の強度は、必ずしもカンデラ等の単位と1対1に対応するものではなく、当該グラフ中で対比された強度同士を相対的に比較した値である。また、後述のグラフにおける強度,輝度等も同様である。従って、同じ試料であっても、強度等の値は後述のグラフ等における値と必ずしも一致しない。
【0022】
図2に示すように、ZnSe系の無機ナノ粒子にMnイオンがドープされた第1実施例の波長変換ナノ粒子(ZnSe:Mn)では、540nm〜640nmの可視領域に発光強度のピークが現れた。一方、Mnイオンがドープされていない前記無機ナノ粒子(ZnSe)では、可視領域に発光強度のピークが殆ど現れなかった。また、両者の吸収スペクトルは完全に一致しており、400nm未満の紫外領域にピークを有した。このため、本実施例の波長変換ナノ粒子を太陽電池等に応用すれば、紫外線を可視光線に変換して太陽電池の効率を向上させることができる。また、本実施例の波長変換ナノ粒子では、従来の水系溶媒中で製造された波長変換ナノ粒子よりも極めて強い発光強度が得られた。これは、高温でナノ粒子を生成することにより、きれいな結晶ができるためと考えられる。
【0023】
次に、図3は、前述のように製造された波長変換ナノ粒子を、前記溶液中で放置した場合の前記スペクトルの変化を表すグラフである。なお、図3では、製造直後の発光スペクトルは10倍している。図3に示すように、両者の吸収スペクトルは完全に一致するが、発光強度は放置によって大幅に増大することが分かった。
【0024】
また、図4は、前述のように、図1(C)の工程でpH10.5に調整後に加熱して得られた第1実施例と、図1(C)の工程でpH5に調整後に加熱して得られた試料との発光・吸収スペクトルの相違を表すグラフである。図4に示すように、両者はほぼ同様のスペクトルを呈するが、pH10.5に調整後に加熱した方が広い波長領域に亘って発光強度を有することが分かる。
【0025】
図5(A)は、実施例1において加熱時間を変化させた場合の輝度の変化を表すグラフである。図5(A)に示すように、加熱時間を20分とした場合に、波長変換ナノ粒子の発光強度(輝度)が最も強くなることが分かった。なお、加熱温度によって、発光強度が最も強くなる加熱時間は変化する可能性がある。
【0026】
図5(B)は、加熱時間を20分に固定して製造した実施例1を、前記溶液中で放置した場合の輝度の変化を表すグラフである。図5(B)に示すように、20日放置した場合に、波長変換ナノ粒子の発光強度(輝度)が最も強くなることが分かった。なお、溶媒またはその添加物等によって、発光強度が最も強くなる放置時間は変化する可能性がある。
【0027】
図5(C)は、実施例1においてドーパント比(すなわち、カチオンであるZn+Mn全体のうちのMnのmol%)を変化させた場合の輝度の変化を表すグラフである。図5(C)に示すように、ドーパント比を2%とした場合に、波長変換ナノ粒子の発光強度(輝度)が最も強くなることが分かった。
【0028】
図5(D)は、実施例1において図1(C)の工程で調整するpHの値を変化させた場合の輝度の変化を表すグラフである。図5(D)に示すように、pHを10.5に調整した場合に、波長変換ナノ粒子の発光強度(輝度)が最も強くなることが分かった。
【0029】
図5(E)は、実施例1において加熱温度を変化させた場合の輝度の変化を表すグラフである。図5(E)に示すように、加熱温度を200℃とした場合に、波長変換ナノ粒子の発光強度(輝度)が最も強くなることが分かった。
【0030】
なお、前記工程において、図1の(A)〜(C)に示した工程が混合工程に、その後の加熱処理が加熱工程に、それぞれ相当する。また、本発明は前記実施例に何ら限定されるものではなく、本発明の要旨を逸脱しない範囲で種々の形態で実施することができる。例えば、Znイオン源としては、前述の過塩素酸亜鉛の他、塩化亜鉛,酢酸亜鉛,硝酸亜鉛等が使用できる。また、Mnイオン源としては、前述の過塩素酸マンガンの他、塩化マンガン,酢酸マンガン,臭化マンガン等が使用できる。また、Seイオン源としては、前述のNaHSeの他、セレノウレア,セレン化水素ガス等が使用できる。更に、配位子としては、前述のNACの他、メルカプト酢酸,メルカプトプロピオン酸,メルカプトこはく酸等が使用できる。
【0031】
また更に、Seの代わりにSを使用してもよい。その場合も、図1(A)の工程の後にはpHを10.5に調整するのが望ましい。また、その場合、図1(B)の工程で用いるSイオン源としては、硫化ナトリウム,チオ尿素,硫化水素ガス等が使用でき、Zn:Sのモル比が1:0.6となるようにするのが望ましい。
【0032】
[第2実施例]
前述のように、無機ナノ粒子を構成するアニオンとしてSeを用いる場合とSを用いる場合とでは、図1(A)の工程の後において調整すべきpHの値が異なる。そこで、次のような方法により、アニオンとしてSeとSとの両方を用いていわゆる混晶半導体としての無機ナノ粒子をMnイオンでドープした波長変換ナノ粒子を、第2実施例として製造した。
【0033】
本実施例では、前述の図1(A),(B)の工程によって製造されたZnMnSeの前駆体(Precursor)溶液と、その図1(A),(B)の工程において前述のようにSeの代わりにSを使用して製造されたZnS:Mnの前駆体溶液とを、別々に製造した。そして、pH10.5に調整の後、両者を混合して200℃で10分加熱することによって波長変換ナノ粒子を得た。この波長変換ナノ粒子では、SeとSとの比は自由に調整でき、ZnSeXS1-X:Mn(0<X<1)なる一般式で表すことができる。
【0034】
図6は、第2実施例の波長変換ナノ粒子の混成比による発光スペクトルの変化を表すグラフである。図6に示すように、波長変換ナノ粒子(ZnSe:Mn)にSを加えることで、400nm近傍の発光強度のピークが減少し、600nm近傍の発光強度のピークが強くなることが分かった。従って、SeとSとの両者を用いた波長変換ナノ粒子では、一層良好な発光強度が得られ、太陽電池等に応用すればその効率を一層向上させられることが分かった。
【0035】
なお、上記各実施の形態では、カチオンとしてZn,Mnを使用しているが、Mnの代わりにCdを用いるなど、カチオンの種類も種々に変更することができる。また、SまたはSeと、Mnと、Znとは、どういう順番で混ぜてもよい。
【特許請求の範囲】
【請求項1】
所望の波長の光を発生する発光中心となる金属イオンを無機ナノ粒子にドープして波長変換ナノ粒子を製造する波長変換ナノ粒子の製造方法であって、
前記発光中心となる金属イオンを提供するイオン源と、前記無機ナノ粒子を構成する原子を提供するイオン源と、前記無機ナノ粒子に配位する親水性の配位子と、を水系溶媒中で混合し、得られた溶液のpH調整を行う混合工程と、
前記pH調整後の前記溶液を高圧下で150℃〜250℃に加熱して波長変換ナノ粒子を生成する加熱工程と、
を含むことを特徴とする波長変換ナノ粒子の製造方法。
【請求項2】
前記配位子がN−アセチル−L−システインであることを特徴とする請求項1に記載の波長変換ナノ粒子の製造方法。
【請求項3】
前記発光中心となる金属イオンがMnイオンであることを特徴とする請求項1または2に記載の波長変換ナノ粒子の製造方法。
【請求項4】
前記無機ナノ粒子を構成する原子としてZnを含むことを特徴とする請求項3に記載の波長変換ナノ粒子の製造方法。
【請求項5】
前記混合工程では、N−アセチル−L−システインと前記イオン源中のMnイオンとを1:1のモル比で含む溶液と、N−アセチル−L−システインと前記イオン源中のZn原子とを1:4.8のモル比で含む溶液とを、混合することを特徴とする請求項4に記載の波長変換ナノ粒子の製造方法。
【請求項6】
前記無機ナノ粒子を構成する原子として、SとSeとを含み、
前記混合工程は、
前記無機ナノ粒子を構成するSe以外の各原子を各々提供する前記各イオン源と、前記配位子と、を水系溶媒中で混合し、得られた溶液のpH調整を行う第1混合工程と、
前記無機ナノ粒子を構成するS以外の各原子を各々提供する前記各イオン源と、前記配位子と、を水系溶媒中で混合し、得られた溶液のpH調整を行う第2混合工程と、
前記第1混合工程で得られた前記pH調整後の溶液と、前記第2混合工程で得られた前記pH調整後の溶液とを混合する第3混合工程と、
からなり、
前記発光中心となる金属イオンを提供するイオン源は、前記第1混合工程または前記第2混合工程で前記溶液に混合されることを特徴とする請求項1〜5のいずれか1項に記載の波長変換ナノ粒子の製造方法。
【請求項7】
前記混合工程終了後の前記溶液はpH9〜11に調整されていることを特徴とする請求項1〜6のいずれか1項に記載の波長変換ナノ粒子の製造方法。
【請求項8】
請求項1〜7のいずれか1項に記載の波長変換ナノ粒子の製造方法で製造されたことを特徴とする波長変換ナノ粒子。
【請求項1】
所望の波長の光を発生する発光中心となる金属イオンを無機ナノ粒子にドープして波長変換ナノ粒子を製造する波長変換ナノ粒子の製造方法であって、
前記発光中心となる金属イオンを提供するイオン源と、前記無機ナノ粒子を構成する原子を提供するイオン源と、前記無機ナノ粒子に配位する親水性の配位子と、を水系溶媒中で混合し、得られた溶液のpH調整を行う混合工程と、
前記pH調整後の前記溶液を高圧下で150℃〜250℃に加熱して波長変換ナノ粒子を生成する加熱工程と、
を含むことを特徴とする波長変換ナノ粒子の製造方法。
【請求項2】
前記配位子がN−アセチル−L−システインであることを特徴とする請求項1に記載の波長変換ナノ粒子の製造方法。
【請求項3】
前記発光中心となる金属イオンがMnイオンであることを特徴とする請求項1または2に記載の波長変換ナノ粒子の製造方法。
【請求項4】
前記無機ナノ粒子を構成する原子としてZnを含むことを特徴とする請求項3に記載の波長変換ナノ粒子の製造方法。
【請求項5】
前記混合工程では、N−アセチル−L−システインと前記イオン源中のMnイオンとを1:1のモル比で含む溶液と、N−アセチル−L−システインと前記イオン源中のZn原子とを1:4.8のモル比で含む溶液とを、混合することを特徴とする請求項4に記載の波長変換ナノ粒子の製造方法。
【請求項6】
前記無機ナノ粒子を構成する原子として、SとSeとを含み、
前記混合工程は、
前記無機ナノ粒子を構成するSe以外の各原子を各々提供する前記各イオン源と、前記配位子と、を水系溶媒中で混合し、得られた溶液のpH調整を行う第1混合工程と、
前記無機ナノ粒子を構成するS以外の各原子を各々提供する前記各イオン源と、前記配位子と、を水系溶媒中で混合し、得られた溶液のpH調整を行う第2混合工程と、
前記第1混合工程で得られた前記pH調整後の溶液と、前記第2混合工程で得られた前記pH調整後の溶液とを混合する第3混合工程と、
からなり、
前記発光中心となる金属イオンを提供するイオン源は、前記第1混合工程または前記第2混合工程で前記溶液に混合されることを特徴とする請求項1〜5のいずれか1項に記載の波長変換ナノ粒子の製造方法。
【請求項7】
前記混合工程終了後の前記溶液はpH9〜11に調整されていることを特徴とする請求項1〜6のいずれか1項に記載の波長変換ナノ粒子の製造方法。
【請求項8】
請求項1〜7のいずれか1項に記載の波長変換ナノ粒子の製造方法で製造されたことを特徴とする波長変換ナノ粒子。
【図5】


【図6】


【図1】


【図2】


【図3】


【図4】




【図6】


【図1】


【図2】


【図3】


【図4】


【公開番号】特開2012−219193(P2012−219193A)
【公開日】平成24年11月12日(2012.11.12)
【国際特許分類】
【出願番号】特願2011−86602(P2011−86602)
【出願日】平成23年4月8日(2011.4.8)
【出願人】(000004260)株式会社デンソー (27,639)
【出願人】(506122327)公立大学法人大阪市立大学 (122)
【Fターム(参考)】
【公開日】平成24年11月12日(2012.11.12)
【国際特許分類】
【出願日】平成23年4月8日(2011.4.8)
【出願人】(000004260)株式会社デンソー (27,639)
【出願人】(506122327)公立大学法人大阪市立大学 (122)
【Fターム(参考)】
[ Back to top ]

