洗浄剤組成物
【構成】 アルカリ側に至適pHを有し、ヒト角質ケラチン線維に対し40KFU/APU以上の分解活性を有するアルカリプロテアーゼを含有する洗浄剤組成物。
【効果】 このアルカリプロテアーゼは不溶性蛋白質に対し優れた作用を示し、広範な温度域で充分な活性を発揮するため、これを含有する洗浄剤は蛋白質汚れ洗浄力に優れたものである。
【効果】 このアルカリプロテアーゼは不溶性蛋白質に対し優れた作用を示し、広範な温度域で充分な活性を発揮するため、これを含有する洗浄剤は蛋白質汚れ洗浄力に優れたものである。
【発明の詳細な説明】
【0001】
【産業上の利用分野】本発明は洗浄剤組成物に関し、更に詳細には蛋白質汚れに対する洗浄力に優れた洗浄剤組成物に関する。
【0002】
【従来の技術】衣料用洗浄剤、自動食器洗浄機用洗浄剤等には、従来より蛋白質汚れを除去する目的で種々のプロテアーゼが配合されている。かかるプロテアーゼとしてはアルカリ領域で作用するアルカリプロテアーゼが用いられており、その代表的なものとしては、アルカラーゼ、サビナーゼ(ノボ・ノルディスク社製)API−21(昭和電工社製)、マクサカル(ギスト・ブロケイデス社製)等が挙げられるが、これらのアルカリプロテアーゼは家庭洗濯で問題となっている襟、そで口等の水不溶性蛋白質汚れに対し充分な活性を有しておらず、これを配合した洗浄剤は充分な蛋白質汚れ除去作用を発揮し得ないという問題があった。
【0003】一方、界面活性剤に安定なものとしてYa酵素(特開昭61−280278号公報)等が報告されているが、これは活性領域が高温度側にあるため、一般的に室温付近で洗浄を行う場合には適合しないという問題があった。
【0004】
【発明が解決しようとする課題】従って、広い温度範囲で活性を有し、更に水不溶性蛋白質に対し高い活性を有するアルカリプロテアーゼを配合した、蛋白質汚れ洗浄力に優れた洗浄剤組成物が望まれていた。
【0005】
【課題を解決するための手段】そこで本発明者らは、上記課題を解決すべく鋭意検討したところ、水不溶性蛋白質、特にヒト角質ケラチン線維に対して高い分解活性を有するアルカリプロテアーゼを配合すれば、蛋白質汚れ、特に襟、そで口等の水不溶性蛋白質汚れに対する洗浄力の優れた洗浄剤が得られることを見出し、本発明を完成した。
【0006】すなわち、本発明は40KFU/APU以上のヒト角質ケラチン線維に対する分解活性を有するアルカリプロテアーゼを含有することを特徴とする洗浄剤組成物を提供するものである。
【0007】本発明において、ヒト角質ケラチン線維分解活性は、ヒト角質ケラチン線維分解活性能(KFU)を水溶性蛋白質である尿素変性ヘモグロビン分解活性(APU)に対する比として示されるものであり、具体的には後記の方法により行われる。
【0008】本発明においてアルカリプロテアーゼとは、その酵素がアルカリ性領域で安定であり、プロテアーゼ活性を示すものをいい、本発明においては特に次の至適pH及び至適温度を有するものを用いるのが好ましい。
(1)至適pH(カゼイン基質,40℃10分間反応)
10.0〜12.5(2)至適温度(カゼイン基質,Ca2+無添加pH10.0で反応)
50〜60℃
【0009】本発明に用いられるアルカリプロテアーゼとしては、上記の条件を具備するものであれば特に限定されないが、具体的にはアルカリプロテアーゼK−16及びアルカリプロテアーゼK−14が挙げられる。
【0010】本発明に用いられるアルカリプロテアーゼK−16及びK−14は、バチルス(Bacillus)属に属する微生物を培養し、該培養物から採取することができるが、その微生物としては、例えば以下に示すような菌学的性質を有するものが挙げられる。
【0011】アルカリプロテアーゼK−16生産菌(A)形態的性質(a)細胞の形及び大きさ:桿菌0.8〜1.0μm ×2.2〜25μm(b)多形性:無し。
(c)運動性:周鞭毛を有し、運動性あり。
(d)胞子〔大きさ、形、位置〕:1.0〜1.2μm ×1.4〜2.2μm、楕円形、中央準端、胞子嚢の膨潤ややあり。
(e)グラム染色:陽性(f)抗酸性:陰性(g)肉汁寒天平板上での発育形態:円形、葉状、表面円滑、淡黄色、半透明のコロニー。
(h)肉汁寒天斜面上での生育:不規則な葉状、表面少しだけ粗な円滑、淡黄色、半透明のコロニー。
(i)肉汁液体培養:生育良好で混濁あり菌膜無し。
(j)肉汁ゼラチン穿刺培養:生育良好で液化する。
(k)リトマスミルク:ペプトン化するが、ミルクの凝固なし、リトマスの変化なし。
【0012】(B)生理的性質(a)硝酸塩の還元:陽性(b)脱窒反応:陰性(c)MRテスト:陰性(d)VPテスト:陽性(e)インドール生成:陰性(f)硫化水素生成:陰性(g)澱粉加水分解:陽性(h)クエン酸の利用:陽性(i)無機窒素源の利用:硝酸塩を利用するが、アンモニウム塩は利用しない。
(j)色素の生成:陰性(k)ウレアーゼ:陰性(l)オキシダーゼ:陽性(m)カタラーゼ:陽性(n)生育の温度範囲:55℃以下(o)生育のpH範囲:pH6.6〜10.3で生育可能。
(p)酸素に対する態度:好気的(q)OFテスト:酸化型(O型)
(r)塩化ナトリウムに対する耐性:10%塩化ナトリウム存在下で生育する。
(s)糖からの酸生成及びガス生成
【0013】
【表1】

【0014】以上の菌学的性質について「バージェーズ マニュアル オブ システマティック バクテリオロジー(Williams & Wilkins社,1984年)」(Bergey’s Mannual of Systematic Bacteriology)の記載に準じ検討したところ、本菌株は、バチルスズブチルス(Bacillus subtilis)に属させることが妥当である。しかし、バチルス ズブチルスがpH10の培地には全く生育しないのに対し、本菌株はpH10でも良好に生育する。また、バチルス ズブチルスが55℃では生育できないのに対し、本菌株は55℃においても生育が可能であること等の相違点が認められる。
【0015】以上の結果から明らかなように、本菌株はバチルス ズブチルスに属させることが妥当であるが、いくつかの点においてこれと相違し、また他の公知の菌株とも異なるので、本菌株をバチルス・エスピー(Bacillussp.)KSM−K16と命名し、工業技術院微生物工業技術研究所に微工研菌寄第11418号として寄託した。
【0016】アルカリプロテアーゼK−14生産菌(A)形態的性質(a)細胞の形及び大きさ:桿菌0.8〜1.0μm ×2.5〜25.5μm(b)多形性:無し。
(c)運動性:周鞭毛を有し、運動性あり。
(d)胞子〔大きさ、形、位置〕:1.0〜1.2μm ×1.5〜2.2μm、楕円形、中央準端、胞子嚢の膨潤ややあり。
(e)グラム染色:陽性(f)抗酸性:陰性
【0017】(B)生理的性質(a)硝酸塩の還元:陽性(b)脱窒反応:陰性(c)MRテスト:陰性(d)VPテスト:陽性(e)インドール生成:陰性(f)硫化水素生成:陰性(g)澱粉加水分解:陽性(h)クエン酸の利用:陽性(i)無機窒素源の利用:硝酸塩を利用するが、アンモニウム塩は利用しない。
(j)色素の生成:陰性(k)ウレアーゼ:陰性(l)オキシダーゼ:陽性(m)カタラーゼ:陽性(n)生育の温度範囲:55℃以下(o)生育のpH範囲:pH6.6〜10.3で生育可能。
(p)酸素に対する態度:好気的(q)OFテスト:酸化型(O型)
(r)塩化ナトリウムに対する耐性:10%塩化ナトリウム存在下で生育する。
(s)糖からの酸生成及びガス生成
【0018】
【表2】

【0019】以上の菌学的性質について「バージェーズ マニュアル オブ システマティック バクテリオロジー(Williams & Wilkins社,1984年)」(Bergey’s Mannual of Systematic Bacteriology)の記載に準じ検討したところ、本菌株は、バチルスズブチルス(Bacillus subtilis)に属させることが妥当である。しかし、バチルス ズブチルスがpH10の培地には全く生育しないのに対し、本菌株はpH10でも良好に生育する。また、バチルス ズブチルスが55℃では生育できないのに対し、本菌株は55℃においても生育が可能であること等の相違点が認められる。
【0020】以上の結果から明らかなように、本菌株はバチルス ズブチルスに属させることが妥当であるが、いくつかの点においてこれと相違し、また他の公知の菌株とも異なるので、本菌株をバチルス・エスピー(Bacillussp.)KSM−K14と命名し、工業技術院微生物工業技術研究所に微工研菌寄第12587号として寄託した。
【0021】これらの菌株を用いて、アルカリプロテアーゼK−16及びK−14を生産するには、当該菌体を適当な培地に接種し、常法に従って培養すればよい。
【0022】使用される培地としては、通常の微生物の培養に用いられ本菌株に利用可能なものであれば何れをも使用することができるが、該培地中には資化しうる炭素源及び窒素源を適当量含有せしめておくことが好ましい。
【0023】この炭素源及び窒素源については特に制限はないが、その例としては、窒素源としてはコーングルテンミール、大豆粉、コーンスチープリカー、カザミノ酸、酵母エキス、ファーマメディア、イワシミール、肉エキス、ペプトン、ハイプロ、アジパワー、コーンミール、ソイビーンミール、コーヒー粕、綿実油粕、カルチベーター、アミフレックス及びアジプロン、ゼスト、アジックス等が挙げられる。また、炭素源としては、資化しうる炭素源、例えばアラビノース、キシロース、グルコース、マンノース、フラクトース、ガラクトース、蔗糖、麦芽糖、乳糖、ソルビトール、マンニトール、イノシトール、グリセリン、可溶性澱粉や廉価な廃糖蜜、転化糖等、また資化しうる有機酸、例えば酢酸等が挙げられる。また、その他、リン酸、Mg2+、Ca2+、Mn2+、Zn2+、Co2+、Na+ 、K+ 等の無機塩や、必要であれば、無機、有機微量栄養源を培地中に適宜添加することもできる。
【0024】斯くして得られた培養物中からの目的物質であるアルカリプロテアーゼK−16及びK−14の採取及び精製は、一般の酵素の採取及び精製の手段に準じて行うことが出来る。
【0025】すなわち、培養物を遠心分離、又は濾過等することによって菌体を分離し、その菌体及び培養濾液から通常の分離手段、例えば、塩析法、等電点沈澱法、溶媒沈澱法(メタノール、エタノール、イソプロピルアルコール、アセトン等)によって蛋白質を沈澱させたり、また、限外濾過(例えばダイアフローメンブレンYC、アミコン社製)により濃縮させて目的とするアルカリプロテアーゼを得る。塩析法では、例えば硫安(30〜70%飽和画分)、溶媒沈澱では、例えば75%エタノール中で酵素を沈澱させた後、濾過或いは遠心分離、脱塩することによってこれを凍結乾燥粉末とすることも可能である。ここで脱塩の方法としては、透析又は、セファデックスG−25等を用いるゲル濾過法等の一般的方法が用いられる。
【0026】このようにして得られる酵素液は、そのまま使用することもできるが、更に公知の方法により精製結晶化して用いることも出来る。更に酵素を精製するには、例えばヒドロキシアパタイトクロマトグラフィー等の吸着クロマトグラフィー、DEAE−セファデックス、DEAE−セルロース、CM−セルロースやCM−バイオゲル等のイオン交換クロマトグラフィー及びセファデックスやバイオゲルのような分子篩ゲルクロマトグラフィーを適宜組み合わせて分別精製すればよい。
【0027】斯くして得られた本発明のアルカリプロテアーゼK−16及びK−14は、以下に示すような酵素学的性質を有する。尚、以下において、酵素活性の測定は次の如くして行った。
【0028】カゼイン分解活性カゼイン1%を含む50mMホウ酸−NaOH緩衝液(pH10.0)1mlを0.1mlの酵素溶液と混合し、40℃、10分間反応させた後、反応停止液(0.123Mトリクロロ酢酸−0.246M酢酸ナトリウム−0.369M酢酸)2mlを加え、30℃、20分間放置した。次に濾紙(ワットマン社製、No.2)で濾過し、濾液中の蛋白分解物をフォーリン・ローリー法(Lowry,O.H.et al.,J.Biol.Chem.,vol 193,p265(1951))の改良法によって測定した。また1P.U.は、上記反応条件下において1分間に1mmolのチロシンを遊離する酵素量とした。
【0029】ヒト角質ケラチン線維分解活性(1)尿素変性ヘモグロビンに対する分解活性アンソン−ヘモグロビン法(Anson,M.L.J.Gen.Physiol.,Vol22,p79(1938))の改良法によって測定される。即ち、基質として用いる尿素変性ヘモグロビンの終濃度を14.7mg/mlになるように調製した溶液中で、温度25℃、pH10.5にて10分間反応させた後、反応溶液にトリクロロ酢酸を終濃度31.25mg/mlになるように添加する。トリクロロ酢酸可溶分をフェノール試薬によって呈色させる。この呈色度を1mmolのチロシンの呈色度を1APUとした検量線より反応10分間あたりの活性を求め、これを1分間あたりに換算することによって測定した。すなわち、1APUとは、1mmolのチロシンがフェノール試薬により呈色するのと同じ呈色度のトリクロロ酢酸可溶分量を1分間に与えるプロテアーゼの量のことを示す。
(2)ヒト角質ケラチン線維に対する分解活性(2−1)ケラチン線維の調製ヒト踵皮(角質)をメスで削り取り、ハサミで細かく裁断したあと、イオン交換水で洗浄する。角質1gを8M尿素、25mMβ−メルカプトエタノールを含む50mMトリス−塩酸緩衝液(pH8.0)の20〜50mlに懸濁し、一晩スターラーで攪拌する。膨潤した角質をテフロンホモジナイザーを用いてすりつぶした後、遠心分離(30,000×g,30min )する。上澄液を濾紙を用いて濾過後、濾液をイオン交換水に対して透析し、凍結乾燥、粉末化したものをケラチン線維として用いる。
(2−2)分解活性の測定0.1M炭酸緩衝液(pH10.5)に、調製したケラチン線維を1mg/ml、プロテアーゼを2×10-3APU/mlになるように添加する。温度30℃、マグネチックスターラーで回転数100rpm(スターラーピース35mm)で一定時間インキュベート後、反応液にフェニルメチルスルホニルフルオライドを添加(終濃度2mM)し、0.5μm メンブレンフィルターで濾過する。濾液中の可溶化蛋白質をローリー法によりチロシン換算として測定する。
(2−3)ヒト角質ケラチン線維分解活性の算出1分間に1mgのチロシンに相当する可溶化蛋白質をヒト角質ケラチン線維から分解生成物として生成させるプロテアーゼ量を1KFUと規定する。
【0030】アルカリプロテアーゼK−16の酵素学的性質(1)作用高アルカリ性条件下で各種蛋白質に対して作用する。特にヒト角質ケラチンに対し48KFU/APUの活性を有する。
【0031】(2)基質特異性アルカリプロテアーゼK−16の各種基質に対する特異性を、他の市販プロテアーゼと比較した。用いた基質は、カゼイン、尿素変性ヘモグロビン、獣毛ケラチン、エラスチンでこれらに対する分解活性を測定した。50mMホウ酸−NaOH緩衝液(pH10.0)に各基質を1%(尿素変性ヘモグロビンは2.2%)加え、各酵素液0.5×10-4P.U.(エラスチンは3.5×10-4P.U.)を添加し、40℃、10分間反応を行った。各々の基質におけるアルカリプロテアーゼK−16の活性を100とした時の各酵素の活性を表3に示す。
【0032】
【表3】

【0033】この結果からも明らかなように、アルカリプロテアーゼK−16は水可溶性及び水不溶性の蛋白質を良好に分解し、現在洗剤用酵素として良く用いられている市販酵素A、市販酵素Bと比較して、特にエラスチンに対して優れた作用を示す。
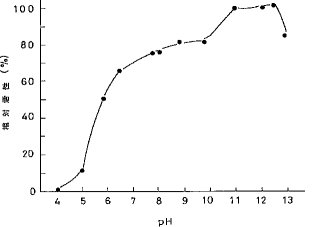
【0034】(3)至適pH各種pH緩衝液(50mM)中に最終濃度0.91%となるようにカゼインを加え、アルカリプロテアーゼK−16を5.2×10-5P.U.加えて40℃、10分間反応して活性を測定した。最適pHでの活性を100とし、各pHでの活性を相対的に表した。結果を図1に示す。図1からも明らかなようにアルカリプロテアーゼK−16の至適pHは11.0〜12.3である。尚、使用した各種緩衝液、及びそのpH範囲は次のとおりである。
酢酸緩衝液 pH3.9〜5.7リン酸緩衝液 pH6.6〜8.3炭酸緩衝液 pH9.2〜10.9リン酸−NaOH緩衝液 pH10.9〜12.7KCl−NaOH緩衝液 pH10.9〜12.6
【0035】(4)pH安定性(3)で用いたのと同じ緩衝液(20mM)中に7.9×10-3P.U.のアルカリプロテアーゼK−16を加え、25℃で48時間放置した。この処理液を50mMホウ酸−NaOH緩衝液(pH10.0)で40倍に希釈後、活性を測定した。処理前の酵素活性を100%として各pHでの相対活性を求めた。結果を図2に示す。図2から明らかなようにアルカリプロテアーゼK−16は、Ca2+非存在下ではその安定領域がpH6.0〜12.0であり、2mM Ca2+存在下ではその安定域はpH5.0〜12.0であった。
【0036】(5)至適温度基質として0.91%のカゼインを含む50mMホウ酸−NaOH緩衝液(pH10.0)に3.1×10-5P.U.のアルカリプロテアーゼK−16を加え、10分間各温度で反応を行った。40℃での活性を100%として各温度での相対活性を求めた。結果は図3に示す。図3からも明らかなように、アルカリプロテアーゼK−16の至適温度は、Ca2+非存在下では55℃であり、5mM Ca2+存在下では70℃であった。
【0037】(6)耐熱性20mMホウ酸−NaOH緩衝液(pH9.5)に1.6×10-3P.U.のアルカリプロテアーゼK−16を加え、各温度で10分間熱処理し、氷冷後、50mMホウ酸−NaOH緩衝液(pH10.0)で5倍希釈した。そして0.91%カゼインを基質として活性を測定した。未処理時の活性を100%として各処理温度での相対活性を求めた。結果を図4に示す。図4からも明らかなように、アルカリプロテアーゼK−16はCa2+非存在下で50℃、5mM Ca2+存在下では60℃まで上記熱処理条件下で、90%以上の活性が維持された。
【0038】(7)分子量アルカリプロテアーゼK−16の分子量をドデシル硫酸ナトリウム(SDS)−ポリアクリルアミドゲル電気泳動法により調べた。分子量マーカーには低分子量用マーカーキット(バイオラッド)すなわち、ホスホリラーゼb(分子量:97,400)、牛血清アルブミン(分子量:66,200)、卵白アルブミン(分子量:42,700)、カルボニックアンヒドラーゼ(分子量:31,000)、大豆トリプシンインヒビター(分子量:21,500)、リゾチーム(分子量:14,400)を用いた。この方法によりアルカリプロテアーゼK−16の分子量は28,000±1,000と決定された。
【0039】(8)等電点アルカリプロテアーゼK−16の等電点を等電点電気泳動法により調べた。カラム用の両性担体にはサーバライト9−11を用いた。この方法によりアルカリプロテアーゼK−16の等電点は10.5以上であることがわかった。
【0040】(9)金属イオンの影響各種金属イオンについて、アルカリプロテアーゼK−16に対して与える影響を調べた。まず、20mMホウ酸−NaOH緩衝液(pH9.5)に各種金属塩を1mMの濃度で添加し、そこに3.9×10-3P.U.の酵素を加えて30℃、20分間放置した。その後、50mMホウ酸−NaOH緩衝液(pH10.0)で5倍に希釈して残存活性を測定した。残存活性は、金属塩無添加で同様に処理した酵素活性に対する相対値で表した。結果を表4に示した。この結果から明らかなように、アルカリプロテアーゼK−16は、Hg2+及びCu2+により活性が阻害されることがわかる。また、前記(5)及び(6)の結果よりCa2+により熱安定性が向上することがわかる。
【0041】
【表4】

【0042】(10)阻害剤の影響一般的な酵素阻害剤について、アルカリプロテアーゼK−16に対して与える影響を調べた。10mMリン酸緩衝液(pH7.0)に各種阻害剤を所定濃度になるように加え、そこにアルカリプロテアーゼK−16 7.9×10-3P.U.を添加し、30℃で20分間放置した。その後、該処理液をイオン交換水にて20倍希釈し、残存活性を測定した。残存活性は、阻害剤無添加で同様に処理した酵素活性に対する相対値で表した。結果を表5に示した。この結果から明らかなように、アルカリプロテアーゼK−16は、セリンプロテアーゼの阻害剤であるジイソプロピルフルオロリン酸(DFP)、フェニルメタンスルホニルフルオリド(PMSF)、キモスタチンで活性が阻害されることから、活性中心にセリン残基を有するプロテアーゼであることがわかる。
【0043】
【表5】

【0044】(11)界面活性剤の影響6.6×10-2P.U.の酵素液を、所定濃度の各種界面活性剤を溶かした5mlの0.1Mトリス−塩酸緩衝液(pH9.0、エタノールを10%含む)に加え40℃で4時間放置し、その後50mMホウ酸−NaOH緩衝液(pH10.0)で20倍希釈後、残存活性を測定した。処理時間0分での活性を100%とし残存活性を相対値で表した。結果を表6に示した。この結果から明らかなようにアルカリプロテアーゼK−16は、各種界面活性剤が高濃度(1〜10%)存在しても高い安定性を示すものであった。このことより、アルカリプロテアーゼK−16は界面活性剤を含有する洗浄剤成分として有用である。
【0045】
【表6】

【0046】アルカリプロテアーゼK−14の酵素学的性質(1)作用高アルカリ性条件下で各種蛋白質に対して作用する。特にヒト角質ケラチンに対し50KFU/APUの活性を有する。
【0047】(2)至適pH前記アルカリプロテアーゼK−16の場合と同様にして検討した結果、図5から明らかなようにアルカリプロテアーゼK−14の至適pHは10.4〜12.0であった。
(3)pH安定性前記アルカリプロテアーゼK−16の場合と同様にして検討した結果、図6から明らかなようにアルカリプロテアーゼK−14はCa2+非存在下ではその安定領域がpH7〜11.5であり、2mM Ca2+存在下ではその安定領域はpH5〜12であった。
(4)至適温度前記アルカリプロテアーゼK−16の場合と同様にして検討した結果、図7から明らかなようにアルカリプロテアーゼK−14の至適温度はCa2+非存在下では55℃であり、5mM Ca2+存在下では70℃であった。
【0048】(5)耐熱性前記アルカリプロテアーゼK−16の場合と同様にして検討した結果、図8から明らかなように、アルカリプロテアーゼK−14はCa2+非存在下で50℃、5mM Ca2+存在下では60℃まで90%以上の活性が維持された。
(6)等電点アルカリプロテアーゼK−14の等電点をロトフォア等電点電気泳動法(バイオラッド社製)により測定した。その結果、アルカリプロテアーゼK−14の等電点は10.0以上であった。
【0049】本発明の洗浄剤組成物中への上記アルカリプロテアーゼの配合量は、アルカリプロテアーゼが活性を示す量であれば特に制限されないが、洗浄剤組成物1kg当たり0.1〜6,000P.U.、特に5〜400P.U.が好ましい。
【0050】また、本発明の洗浄剤組成物には、公知の洗浄剤成分を配合することができ、当該公知の洗浄剤成分としては、例えば次のものが挙げられる。
【0051】(1)界面活性剤:平均炭素数10〜16のアルキル基を有する直鎖アルキルベンゼンスルホン酸塩、平均炭素数10〜20の直鎖又は分岐鎖のアルキル基を有し、1分子内に平均0.5〜8モルのエチレンオキサイドを付加したアルキルエトキシ硫酸塩、平均炭素数10〜20のアルキル基を有するアルキル硫酸塩、平均10〜20の炭素原子を1分子中に有するオレフィンスルホン酸塩、平均10〜20の炭素原子を1分子中に有するアルカンスルホン酸塩、平均10〜20の炭素原子を1分子中に有するα−スルホ脂肪酸メチルあるいはエチルエステル塩、平均炭素数8〜20の高級脂肪酸塩、平均炭素数10〜20の直鎖又は分岐鎖のアルキル基を有し、1分子内に平均0.5〜8モルのエチレンオキサイドを付加したアルキルエーテルカルボン酸塩などのアニオン性界面活性剤;平均炭素数10〜20のアルキル基を有し、1〜20モルのエチレンオキシドを付加したポリオキシエチレンアルキルエーテル、高級脂肪酸アルカノールアミド又はそのアルキレンオキサイド付加物などの非イオン性界面活性剤;その他ベタイン型両性界面活性剤;スルホン酸型両性界面活性剤、リン酸エステル系界面活性剤、アミノ酸型界面活性剤、カチオン性界面活性剤など。これらの界面活性剤は洗浄剤組成物中5〜60重量%(以下単に%で示す)配合され、特に粉体状洗浄剤組成物については10〜45%、液体洗浄剤組成物については20〜55%配合することが好ましい。また、本発明洗浄剤組成物が漂白剤である場合、界面活性剤は一般に1〜10%、好ましくは1〜5%配合される。
【0052】(2)二価金属イオン捕捉剤:トリポリリン酸塩、ピロリン酸塩、オルソリン酸塩などの縮合リン酸塩、ゼオライトなどのアルミノケイ酸塩、合成層状結晶性ケイ酸塩、ニトリロ三酢酸塩、エチレンジアミン四酢酸塩、クエン酸塩、イソクエン酸塩、ポリアセタールカルボン酸塩など。この二価金属イオン捕捉剤は、0〜50%、好ましくは5〜40%配合される。また、リンを含有しない二価金属イオン捕捉剤を用いることがより好ましい。
【0053】(3)アルカリ剤及び無機塩:ケイ酸塩、炭酸塩、セスキ炭酸塩、硫酸塩、アルカノールアミンなど。これらは0〜80%配合される。
【0054】(4)再汚染防止剤:ポリエチレングリコール、ポリアクリル酸塩、ポリアクリル酸コポリマー、ポリビニルアルコール、ポリビニルピロリドン、カルボキシメチルセルロースなど。再汚染防止剤は0〜10%、好ましくは1〜5%配合される。
【0055】(5)酵素:セルラーゼ、アミラーゼ、リパーゼ、ヘミセルラーゼ、β−グリコシダーゼ、グルコースオキシダーゼ、コレステロールオキシダーゼ、上記アルカリプロテアーゼ以外のプロテアーゼなどの酵素。上記アルカリプロテアーゼは従来公知のアルカリプロテアーゼよりも、セルラーゼ、リパーゼ等の酵素との相性が良好であり、これらの酵素を併用すれば洗浄力をいっそう向上させることができる。
【0056】(6)水道水中の有効塩素の捕捉剤又は還元剤:有効塩素の捕捉剤として、硫酸アンモニウム、尿素、塩酸グアニジン、炭酸グアニジン、スルファミン酸グアニジン、二酸化チオ尿素、モノエタノールアミン、ジエタノールアミン、トリエタノールアミン、又グリシン、グルタミン酸ナトリウム等で代表されるアミノ酸及び牛血清アルブミン、カゼインなどの蛋白質、更には蛋白質の加水分解、肉エキス、魚肉エキスなどが挙げられる。還元剤としては、チオ硫酸塩、亜硫酸塩、亜ニチオン酸塩等のアルカリ金属塩、アルカリ土類金属塩等及びロンガリットC等が挙げられる。
【0057】(7)漂白剤:過炭酸塩、過硼酸塩、スルホン化フタロシアニン亜鉛塩又はアルミニウム塩、過酸化水素等。
【0058】(8)蛍光染料:通常洗浄剤に用いられる蛍光染料。
【0059】(9)可溶化剤:液体洗剤の場合には次のような可溶化剤を用いることができる。エタノールなどの低級アルコール、ベンゼンスルホン酸塩、p−トルエンスルホン酸塩などの低級アルキルベンゼンスルホン酸塩、プロピレングリコールなどのポリオール類など。
【0060】(10)その他:上記以外に香料、ケーキング防止剤、酵素の活性化剤、酸化防止剤、防腐剤、色素、青味付け剤、漂白活性化剤等の洗剤に常用の成分を必要に応じて配合することができる。
【0061】本発明の洗浄剤組成物は、上記アルカリプロテアーゼ及び上記公知の洗浄成分を組み合せて常法に従い、製造することができる。洗浄剤の形態は、用途に応じて選択することができ、例えば液体、粉末、顆粒等とすることができる。また、本発明洗浄剤組成物は、衣料用洗浄剤、自動食器洗浄機用洗浄剤、配水管洗浄剤、義歯洗浄剤、漂白剤等として使用することができる。
【0062】
【発明の効果】本発明の洗浄剤組成物は、アルカリ性領域において高活性を有し、且つアルカリ耐性、更に強いヒト角質ケラチン線維分解活性を有するプロテアーゼ、例えばバチルス・エスピー(Bacillus sp.)KSM−K−16(微工研菌寄第11418号)の生菌又は、バチルス・エスピー(Bacillus sp.)KSM−K−14(微工研菌寄第12587号)の生菌の生産するアルカリプロテアーゼK−16又はアルカリプロテアーゼK−14を含有し、蛋白質汚れに対して優れた洗浄力を与えるものである。
【0063】
【実施例】次に参考例及び実施例を挙げ、本発明を具体的に説明するが、本発明はこれら実施例等により限定されるものではない。尚、以下における%は特記しない限り、重量%を示す。
【0064】参考例1プロテアーゼ産生菌株の分離、採取:(1)土壌のサンプルの約1gを滅菌生理食塩水10mlに懸濁し、80℃にて20分間放置し熱処理した。熱処理上清液0.1mlをケラチンハロー寒天培地へ接種し、30℃で48時間静置培養した。用いたケラチンハロー寒天培地の組成は以下に示す通りである。
グルコース 1%酵母エキス 0.2%獣毛ケラチン 1%カルボキシメチルセルロース 1%リン酸第一カリウム 0.1%硫酸マグネシウム・7水塩 0.02%寒天 1.5%
【0065】(2)上記培地組成物に、別滅菌を施した10%炭酸ナトリウムを1%添加し、最終pHを10.5に調整後、平板培地を作製した。培養後、生育したコロニーの周囲にハローを生じたものを選抜し、同培地で2〜3回純化し、均一のプロテアーゼ生産菌を得た。
【0066】(3)上記(2)で得たこれらの菌株を以下に示す液体培地へ接種し、30℃で好気的に48時間振盪培養を行った。
グルコース 2.0%ポリペプトンS 1.0%酵母エキス 0.05%リン酸第一カリウム 0.1%硫酸マグネシウム・7水塩 0.02%炭酸ナトリウム(別滅菌) 1.0%pH 10.5培養終了後、得られた培養物を遠心分離(3000rpm;10分間)して菌を除去し、得られた培養上清を酵素液とした。
【0067】(4)上記(3)で得られた酵素液から凍結乾燥により粗酵素サンプルを調製し、市販液体洗剤中における40℃での保存安定性評価を行った。そのなかから、最も安定性に優れる酵素を生産するものの菌株としてバチルス・エスピー KSM−K16株及びバチルス・エスピー KSM−K14株を得た。
【0068】参考例2菌体の培養、アルカリプロテアーゼK−16の精製:(1)参考例1で得られた好アルカリ性細菌、バチルス・エスピー KSM−K16を以下の液体培地(3.0l) に接種し、30℃で好気的に48時間振盪培養を行い、アルカリプロテアーゼK−16を生産させた。
グルコース 2.0%魚肉エキス 1.0%大豆粉 1.0%硫酸マグネシウム 0.02%リン酸第一カリウム 0.1%pH 10.0
【0069】(2)培養終了後、得られた培養物3l を遠心分離(10,000rpm;5分間)して菌を除去し、その上清液を凍結乾燥した。凍結乾燥粉末2gをイオン交換水10mlに溶解(粗酵素液)した後、同溶液を透析膜を用いて10mMトリス−塩酸緩衝液(2mM Ca2+添加、pH7.5)に対して一晩透析し、26mlの透析処理液(活性3.15P.U./ml、比活性1.97P.U./mg蛋白)を得た。次に、10mMトリス−塩酸緩衝液(2mM Ca2+添加、pH7.5)で平衡化したCM−52セルロース担体を充填したカラムにかけ、同緩衝液でカラム内を洗浄した後、0〜0.15M塩化ナトリウムを含む同緩衝液でアルカリプロテアーゼK−16を溶出させた。この活性画分を集めたところ全量は15ml、活性は1.12P.U./ml、比活性は5.75P.U./mg蛋白であった。そして、当溶液を50mMトリス−塩酸緩衝液(10mM Ca2+、0.2M塩化ナトリウム添加、pH8.0)に対して一晩透析した後、限外濾過(アミコン社製、分画分子量5,000)により濃縮し、50mMトリス−塩酸緩衝液(10mM Ca2+、0.2M塩化ナトリウム添加、pH8.0)で平衡化したセファデックスG−50(ファルマシア社製)のゲル濾過クロマトグラフィーにかけ同緩衝液にて展開させた。ここで得られた活性画分は全量11.5ml、活性は0.9P.U./ml、比活性は6.03P.U./mg蛋白であった。当溶液を、イオン交換水に対して一晩透析後、活性0.56P.U./ml、比活性5.60P.U./mg蛋白の溶液を得た。当溶液を凍結乾燥し、酵素粉末を得た。得られた酵素の比活性は1.87P.U./mgであり、ヒト角質ケラチン線維分解活性は48KFU/APUであった。
【0070】参考例3菌体の培養、アルカリプロテアーゼK−14の精製:(1)参考例1で得られた好アルカリ性細菌、バチルス・エスピー KSM−K14を以下の液体培地(3.0l) に接種し、30℃で好気的に48時間振盪培養を行い、アルカリプロテアーゼK−14を生産させた。
グルコース 2.0%魚肉エキス 1.0%大豆粉 1.0%硫酸マグネシウム 0.02%リン酸第一カリウム 0.1%pH 10.0(2)培養終了後、得られた培養物から、参考例2と同様の方法により、アルカリプロテアーゼK−14の精製酵素粉末を得た。得られた酵素のヒト角質ケラチン線維分解活性は50KFU/APUであった。
【0071】以下の実施例における洗浄試験は次の実験条件のもとに行った。
1)天然襟布汚染布:木綿金布(♯2023布)をワイシャツの襟に縫い付け、成年男子に3日間着用させる。着用後25℃、65%RHに1ケ月放置後、汚れの程度を三段階に分け、このうち最も汚れのひどいもののうち、中心点に対し汚れが対称な布を選び出し、この汚れの対称点で布を半裁し実験に供した。
【0072】2)洗浄条件及び方法:天然汚染布を洗浄する場合、9cm×30cmの天然汚染布を対称の位置で半裁し、9cm×15cmの一対の汚染布の一方を基準洗剤である酵素無添加洗剤で洗浄し、片方を比較洗剤である本発明の洗剤でそれぞれ洗浄した。まず天然汚染布片15枚を50cm×50cmの綿布に縫い付け、粉末洗剤の場合には6l の0.417%の洗剤溶液に、この汚染布と綿製肌着を合わせて1kg入れ、30℃で2時間浸漬後、東芝製洗濯機「銀河」に移し、全量を30l とした後、強反転で10分間洗浄し、乾燥後判定に供した。液体洗剤の場合には20ccの洗剤液を汚染布に均一に塗付け、10分後、綿製肌着と合わせて1kgとし、東芝製洗濯機「銀河」に移し、全量を30l とし、強反転にて10分間洗浄し、乾燥後判定に供した。基準洗剤で洗った半裁布と本発明の洗剤で洗った半裁布とを肉眼判定による一対比較で評価した。汚れの程度を表わす10段階にランクづけした標準汚れを基準にし、洗浄布をランクづけした。洗浄性は基準洗剤の洗浄力を100としたときの本発明の洗剤の洗浄力の点数で表わした。洗浄力指数の差は0.5以上で有意の差とみなせる。
【0073】3)使用した酵素:(a)アルカリプロテアーゼK−16(参考例2で得られたものを芒硝で200倍に稀釈して造粒したもの)
(b)アルカリプロテアーゼK−14(参考例3で得られたものを芒硝で200倍に稀釈して造粒したもの)
(c)プロテアーゼ(ノボ・ノルディスク社,サビナーゼ4.0T)
(d)プロテアーゼ( ギスト・ブロケイデス社,マクサカルP−400,000)
(e)プロテアーゼ(昭和電工社,API−21H)
(f)セルラーゼ(花王,微工研菌寄第1138号,500IU/g・造粒物)
(g)セルラーゼ(ノボ・ノルディスク社,セルザイム1.0T)
(h)リパーゼ(ノボ・ノルディスク社,リポラーゼ100T)
【0074】実施例1表7に示す配合組成の弱アルカリ性粉末衣料用洗剤を調製した。
【0075】
【表7】

【0076】得られた各種洗剤による洗浄試験の結果を表8に示す。尚、表中洗剤番号は、「実施例番号−使用した酵素記号」で表示し、酵素を使用しないものは「実施例番号−◎」と表示する。(以下、同様)
表8の結果より、本発明品は天然襟汚垢に対し、従来の酵素を含有した洗剤に比べて優れた洗浄力を示すことがわかる。
【0077】
【表8】

【0078】実施例2実施例1の配合組成において、酵素を表9の如く種々組み合わせて用いて弱アルカリ性粉末洗剤を調製した。得られた各種洗剤による洗浄試験の結果を表9に示す。表9の結果より、アルカリプロテアーゼK−16とセルラーゼ及び/又はリパーゼとを組み合わせて用いることにより、天然襟汚垢に対して、相乗的な洗浄力の向上効果が得られることがわかる。
【0079】
【表9】

【0080】実施例3表10に示す配合組成の弱アルカリ性粉末衣料用洗剤を調製した。
【0081】
【表10】

【0082】得られた各種洗剤による洗浄試験の結果を表11に示す。表11の結果より、本発明洗浄剤の効果が各種ビルダーの使用下において有効に発現されることがわかる。
【0083】
【表11】

【0084】実施例4表12に示す配合組成の弱アルカリ性粉末衣料用洗剤を調製した。
【0085】
【表12】

【0086】得られた各種洗剤による洗浄試験の結果を表13に示す。表13の結果より、本発明品は天然襟汚垢に対し、従来の酵素を含有した洗剤に比べて優れた洗浄力を示すことがわかる。
【0087】
【表13】

【0088】実施例5表14に示す配合組成の弱アルカリ性粉末衣料用洗剤を調製した。
【0089】
【表14】

【0090】得られた各種洗剤による洗浄試験の結果を表15に示す。表15の結果より、本発明品は天然襟汚垢に対し、従来の酵素を含有した洗剤に比べて優れた洗浄力を示すことがわかる。
【0091】
【表15】

【0092】実施例6表16に示す配合組成の弱アルカリ性粉末衣料用洗剤を調製した。
【0093】
【表16】

【0094】得られた各種洗剤による洗浄試験の結果を表17に示す。表17の結果より、本発明品は天然襟汚垢に対し、従来の酵素を含有した洗剤に比べて優れた洗浄力を示すことがわかる。
【0095】
【表17】

【0096】実施例7表18に示す配合組成の弱アルカリ性液体洗剤を調製した。尚、洗剤原液のpHは9.6であった。
【0097】
【表18】

【0098】得られた各種液体洗剤中における酵素の安定性試験の結果を表19に示す。
1)使用した酵素(i)アルカリプロテアーゼK−16(参考例2で得られたものをグリセロール及び水で100倍に稀釈して溶解したもの)
(j)アルカリプロテアーゼK−14(参考例3で得られたものをグリセロール及び水で100倍に稀釈して溶解したもの)
(k)プロテアーゼ(ノボ・ノルディスク社,エスペラーゼ8.0L)
(l)プロテアーゼ(ノボ・ノルディスク社,サビナーゼ8.0L)
【0099】2)安定性試験各組成の液体洗剤を配合後、40℃の条件下で10日間及び20日間放置した後、以下の測定法により各酵素の活性を測定し、次式により酵素活性残存率を算出した。
【0100】
【数1】

【0101】各組成の液体洗剤を1%の水道水溶液(硬度2.5°DH)とし、自動分析機オートアナライザー(登録商標、テクニコン社)を使用して、酵素活性を測定した。測定の詳細は、下記文献に従った。
文献:Analyst,96〔2〕,p159〜163(1971)
【0102】
【表19】

【0103】
【図面の簡単な説明】
【図1】アルカリプロテアーゼK−16の活性に及ぼすpHの影響を示す図面である。
【図2】アルカリプロテアーゼK−16の安定性に及ぼすpHの影響を示す図面である。
【図3】アルカリプロテアーゼK−16の活性に及ぼす温度の影響を示す図面である。
【図4】アルカリプロテアーゼK−16の安定性に及ぼす温度の影響を示す図面である。
【図5】アルカリプロテアーゼK−14の活性に及ぼすpHの影響を示す図面である。
【図6】アルカリプロテアーゼK−14の安定性に及ぼすpHの影響を示す図面である。
【図7】アルカリプロテアーゼK−14の活性に及ぼす温度の影響を示す図面である。
【図8】アルカリプロテアーゼK−14の安定性に及ぼす温度の影響を示す図面である。
【0001】
【産業上の利用分野】本発明は洗浄剤組成物に関し、更に詳細には蛋白質汚れに対する洗浄力に優れた洗浄剤組成物に関する。
【0002】
【従来の技術】衣料用洗浄剤、自動食器洗浄機用洗浄剤等には、従来より蛋白質汚れを除去する目的で種々のプロテアーゼが配合されている。かかるプロテアーゼとしてはアルカリ領域で作用するアルカリプロテアーゼが用いられており、その代表的なものとしては、アルカラーゼ、サビナーゼ(ノボ・ノルディスク社製)API−21(昭和電工社製)、マクサカル(ギスト・ブロケイデス社製)等が挙げられるが、これらのアルカリプロテアーゼは家庭洗濯で問題となっている襟、そで口等の水不溶性蛋白質汚れに対し充分な活性を有しておらず、これを配合した洗浄剤は充分な蛋白質汚れ除去作用を発揮し得ないという問題があった。
【0003】一方、界面活性剤に安定なものとしてYa酵素(特開昭61−280278号公報)等が報告されているが、これは活性領域が高温度側にあるため、一般的に室温付近で洗浄を行う場合には適合しないという問題があった。
【0004】
【発明が解決しようとする課題】従って、広い温度範囲で活性を有し、更に水不溶性蛋白質に対し高い活性を有するアルカリプロテアーゼを配合した、蛋白質汚れ洗浄力に優れた洗浄剤組成物が望まれていた。
【0005】
【課題を解決するための手段】そこで本発明者らは、上記課題を解決すべく鋭意検討したところ、水不溶性蛋白質、特にヒト角質ケラチン線維に対して高い分解活性を有するアルカリプロテアーゼを配合すれば、蛋白質汚れ、特に襟、そで口等の水不溶性蛋白質汚れに対する洗浄力の優れた洗浄剤が得られることを見出し、本発明を完成した。
【0006】すなわち、本発明は40KFU/APU以上のヒト角質ケラチン線維に対する分解活性を有するアルカリプロテアーゼを含有することを特徴とする洗浄剤組成物を提供するものである。
【0007】本発明において、ヒト角質ケラチン線維分解活性は、ヒト角質ケラチン線維分解活性能(KFU)を水溶性蛋白質である尿素変性ヘモグロビン分解活性(APU)に対する比として示されるものであり、具体的には後記の方法により行われる。
【0008】本発明においてアルカリプロテアーゼとは、その酵素がアルカリ性領域で安定であり、プロテアーゼ活性を示すものをいい、本発明においては特に次の至適pH及び至適温度を有するものを用いるのが好ましい。
(1)至適pH(カゼイン基質,40℃10分間反応)
10.0〜12.5(2)至適温度(カゼイン基質,Ca2+無添加pH10.0で反応)
50〜60℃
【0009】本発明に用いられるアルカリプロテアーゼとしては、上記の条件を具備するものであれば特に限定されないが、具体的にはアルカリプロテアーゼK−16及びアルカリプロテアーゼK−14が挙げられる。
【0010】本発明に用いられるアルカリプロテアーゼK−16及びK−14は、バチルス(Bacillus)属に属する微生物を培養し、該培養物から採取することができるが、その微生物としては、例えば以下に示すような菌学的性質を有するものが挙げられる。
【0011】アルカリプロテアーゼK−16生産菌(A)形態的性質(a)細胞の形及び大きさ:桿菌0.8〜1.0μm ×2.2〜25μm(b)多形性:無し。
(c)運動性:周鞭毛を有し、運動性あり。
(d)胞子〔大きさ、形、位置〕:1.0〜1.2μm ×1.4〜2.2μm、楕円形、中央準端、胞子嚢の膨潤ややあり。
(e)グラム染色:陽性(f)抗酸性:陰性(g)肉汁寒天平板上での発育形態:円形、葉状、表面円滑、淡黄色、半透明のコロニー。
(h)肉汁寒天斜面上での生育:不規則な葉状、表面少しだけ粗な円滑、淡黄色、半透明のコロニー。
(i)肉汁液体培養:生育良好で混濁あり菌膜無し。
(j)肉汁ゼラチン穿刺培養:生育良好で液化する。
(k)リトマスミルク:ペプトン化するが、ミルクの凝固なし、リトマスの変化なし。
【0012】(B)生理的性質(a)硝酸塩の還元:陽性(b)脱窒反応:陰性(c)MRテスト:陰性(d)VPテスト:陽性(e)インドール生成:陰性(f)硫化水素生成:陰性(g)澱粉加水分解:陽性(h)クエン酸の利用:陽性(i)無機窒素源の利用:硝酸塩を利用するが、アンモニウム塩は利用しない。
(j)色素の生成:陰性(k)ウレアーゼ:陰性(l)オキシダーゼ:陽性(m)カタラーゼ:陽性(n)生育の温度範囲:55℃以下(o)生育のpH範囲:pH6.6〜10.3で生育可能。
(p)酸素に対する態度:好気的(q)OFテスト:酸化型(O型)
(r)塩化ナトリウムに対する耐性:10%塩化ナトリウム存在下で生育する。
(s)糖からの酸生成及びガス生成
【0013】
【表1】

【0014】以上の菌学的性質について「バージェーズ マニュアル オブ システマティック バクテリオロジー(Williams & Wilkins社,1984年)」(Bergey’s Mannual of Systematic Bacteriology)の記載に準じ検討したところ、本菌株は、バチルスズブチルス(Bacillus subtilis)に属させることが妥当である。しかし、バチルス ズブチルスがpH10の培地には全く生育しないのに対し、本菌株はpH10でも良好に生育する。また、バチルス ズブチルスが55℃では生育できないのに対し、本菌株は55℃においても生育が可能であること等の相違点が認められる。
【0015】以上の結果から明らかなように、本菌株はバチルス ズブチルスに属させることが妥当であるが、いくつかの点においてこれと相違し、また他の公知の菌株とも異なるので、本菌株をバチルス・エスピー(Bacillussp.)KSM−K16と命名し、工業技術院微生物工業技術研究所に微工研菌寄第11418号として寄託した。
【0016】アルカリプロテアーゼK−14生産菌(A)形態的性質(a)細胞の形及び大きさ:桿菌0.8〜1.0μm ×2.5〜25.5μm(b)多形性:無し。
(c)運動性:周鞭毛を有し、運動性あり。
(d)胞子〔大きさ、形、位置〕:1.0〜1.2μm ×1.5〜2.2μm、楕円形、中央準端、胞子嚢の膨潤ややあり。
(e)グラム染色:陽性(f)抗酸性:陰性
【0017】(B)生理的性質(a)硝酸塩の還元:陽性(b)脱窒反応:陰性(c)MRテスト:陰性(d)VPテスト:陽性(e)インドール生成:陰性(f)硫化水素生成:陰性(g)澱粉加水分解:陽性(h)クエン酸の利用:陽性(i)無機窒素源の利用:硝酸塩を利用するが、アンモニウム塩は利用しない。
(j)色素の生成:陰性(k)ウレアーゼ:陰性(l)オキシダーゼ:陽性(m)カタラーゼ:陽性(n)生育の温度範囲:55℃以下(o)生育のpH範囲:pH6.6〜10.3で生育可能。
(p)酸素に対する態度:好気的(q)OFテスト:酸化型(O型)
(r)塩化ナトリウムに対する耐性:10%塩化ナトリウム存在下で生育する。
(s)糖からの酸生成及びガス生成
【0018】
【表2】

【0019】以上の菌学的性質について「バージェーズ マニュアル オブ システマティック バクテリオロジー(Williams & Wilkins社,1984年)」(Bergey’s Mannual of Systematic Bacteriology)の記載に準じ検討したところ、本菌株は、バチルスズブチルス(Bacillus subtilis)に属させることが妥当である。しかし、バチルス ズブチルスがpH10の培地には全く生育しないのに対し、本菌株はpH10でも良好に生育する。また、バチルス ズブチルスが55℃では生育できないのに対し、本菌株は55℃においても生育が可能であること等の相違点が認められる。
【0020】以上の結果から明らかなように、本菌株はバチルス ズブチルスに属させることが妥当であるが、いくつかの点においてこれと相違し、また他の公知の菌株とも異なるので、本菌株をバチルス・エスピー(Bacillussp.)KSM−K14と命名し、工業技術院微生物工業技術研究所に微工研菌寄第12587号として寄託した。
【0021】これらの菌株を用いて、アルカリプロテアーゼK−16及びK−14を生産するには、当該菌体を適当な培地に接種し、常法に従って培養すればよい。
【0022】使用される培地としては、通常の微生物の培養に用いられ本菌株に利用可能なものであれば何れをも使用することができるが、該培地中には資化しうる炭素源及び窒素源を適当量含有せしめておくことが好ましい。
【0023】この炭素源及び窒素源については特に制限はないが、その例としては、窒素源としてはコーングルテンミール、大豆粉、コーンスチープリカー、カザミノ酸、酵母エキス、ファーマメディア、イワシミール、肉エキス、ペプトン、ハイプロ、アジパワー、コーンミール、ソイビーンミール、コーヒー粕、綿実油粕、カルチベーター、アミフレックス及びアジプロン、ゼスト、アジックス等が挙げられる。また、炭素源としては、資化しうる炭素源、例えばアラビノース、キシロース、グルコース、マンノース、フラクトース、ガラクトース、蔗糖、麦芽糖、乳糖、ソルビトール、マンニトール、イノシトール、グリセリン、可溶性澱粉や廉価な廃糖蜜、転化糖等、また資化しうる有機酸、例えば酢酸等が挙げられる。また、その他、リン酸、Mg2+、Ca2+、Mn2+、Zn2+、Co2+、Na+ 、K+ 等の無機塩や、必要であれば、無機、有機微量栄養源を培地中に適宜添加することもできる。
【0024】斯くして得られた培養物中からの目的物質であるアルカリプロテアーゼK−16及びK−14の採取及び精製は、一般の酵素の採取及び精製の手段に準じて行うことが出来る。
【0025】すなわち、培養物を遠心分離、又は濾過等することによって菌体を分離し、その菌体及び培養濾液から通常の分離手段、例えば、塩析法、等電点沈澱法、溶媒沈澱法(メタノール、エタノール、イソプロピルアルコール、アセトン等)によって蛋白質を沈澱させたり、また、限外濾過(例えばダイアフローメンブレンYC、アミコン社製)により濃縮させて目的とするアルカリプロテアーゼを得る。塩析法では、例えば硫安(30〜70%飽和画分)、溶媒沈澱では、例えば75%エタノール中で酵素を沈澱させた後、濾過或いは遠心分離、脱塩することによってこれを凍結乾燥粉末とすることも可能である。ここで脱塩の方法としては、透析又は、セファデックスG−25等を用いるゲル濾過法等の一般的方法が用いられる。
【0026】このようにして得られる酵素液は、そのまま使用することもできるが、更に公知の方法により精製結晶化して用いることも出来る。更に酵素を精製するには、例えばヒドロキシアパタイトクロマトグラフィー等の吸着クロマトグラフィー、DEAE−セファデックス、DEAE−セルロース、CM−セルロースやCM−バイオゲル等のイオン交換クロマトグラフィー及びセファデックスやバイオゲルのような分子篩ゲルクロマトグラフィーを適宜組み合わせて分別精製すればよい。
【0027】斯くして得られた本発明のアルカリプロテアーゼK−16及びK−14は、以下に示すような酵素学的性質を有する。尚、以下において、酵素活性の測定は次の如くして行った。
【0028】カゼイン分解活性カゼイン1%を含む50mMホウ酸−NaOH緩衝液(pH10.0)1mlを0.1mlの酵素溶液と混合し、40℃、10分間反応させた後、反応停止液(0.123Mトリクロロ酢酸−0.246M酢酸ナトリウム−0.369M酢酸)2mlを加え、30℃、20分間放置した。次に濾紙(ワットマン社製、No.2)で濾過し、濾液中の蛋白分解物をフォーリン・ローリー法(Lowry,O.H.et al.,J.Biol.Chem.,vol 193,p265(1951))の改良法によって測定した。また1P.U.は、上記反応条件下において1分間に1mmolのチロシンを遊離する酵素量とした。
【0029】ヒト角質ケラチン線維分解活性(1)尿素変性ヘモグロビンに対する分解活性アンソン−ヘモグロビン法(Anson,M.L.J.Gen.Physiol.,Vol22,p79(1938))の改良法によって測定される。即ち、基質として用いる尿素変性ヘモグロビンの終濃度を14.7mg/mlになるように調製した溶液中で、温度25℃、pH10.5にて10分間反応させた後、反応溶液にトリクロロ酢酸を終濃度31.25mg/mlになるように添加する。トリクロロ酢酸可溶分をフェノール試薬によって呈色させる。この呈色度を1mmolのチロシンの呈色度を1APUとした検量線より反応10分間あたりの活性を求め、これを1分間あたりに換算することによって測定した。すなわち、1APUとは、1mmolのチロシンがフェノール試薬により呈色するのと同じ呈色度のトリクロロ酢酸可溶分量を1分間に与えるプロテアーゼの量のことを示す。
(2)ヒト角質ケラチン線維に対する分解活性(2−1)ケラチン線維の調製ヒト踵皮(角質)をメスで削り取り、ハサミで細かく裁断したあと、イオン交換水で洗浄する。角質1gを8M尿素、25mMβ−メルカプトエタノールを含む50mMトリス−塩酸緩衝液(pH8.0)の20〜50mlに懸濁し、一晩スターラーで攪拌する。膨潤した角質をテフロンホモジナイザーを用いてすりつぶした後、遠心分離(30,000×g,30min )する。上澄液を濾紙を用いて濾過後、濾液をイオン交換水に対して透析し、凍結乾燥、粉末化したものをケラチン線維として用いる。
(2−2)分解活性の測定0.1M炭酸緩衝液(pH10.5)に、調製したケラチン線維を1mg/ml、プロテアーゼを2×10-3APU/mlになるように添加する。温度30℃、マグネチックスターラーで回転数100rpm(スターラーピース35mm)で一定時間インキュベート後、反応液にフェニルメチルスルホニルフルオライドを添加(終濃度2mM)し、0.5μm メンブレンフィルターで濾過する。濾液中の可溶化蛋白質をローリー法によりチロシン換算として測定する。
(2−3)ヒト角質ケラチン線維分解活性の算出1分間に1mgのチロシンに相当する可溶化蛋白質をヒト角質ケラチン線維から分解生成物として生成させるプロテアーゼ量を1KFUと規定する。
【0030】アルカリプロテアーゼK−16の酵素学的性質(1)作用高アルカリ性条件下で各種蛋白質に対して作用する。特にヒト角質ケラチンに対し48KFU/APUの活性を有する。
【0031】(2)基質特異性アルカリプロテアーゼK−16の各種基質に対する特異性を、他の市販プロテアーゼと比較した。用いた基質は、カゼイン、尿素変性ヘモグロビン、獣毛ケラチン、エラスチンでこれらに対する分解活性を測定した。50mMホウ酸−NaOH緩衝液(pH10.0)に各基質を1%(尿素変性ヘモグロビンは2.2%)加え、各酵素液0.5×10-4P.U.(エラスチンは3.5×10-4P.U.)を添加し、40℃、10分間反応を行った。各々の基質におけるアルカリプロテアーゼK−16の活性を100とした時の各酵素の活性を表3に示す。
【0032】
【表3】

【0033】この結果からも明らかなように、アルカリプロテアーゼK−16は水可溶性及び水不溶性の蛋白質を良好に分解し、現在洗剤用酵素として良く用いられている市販酵素A、市販酵素Bと比較して、特にエラスチンに対して優れた作用を示す。
【0034】(3)至適pH各種pH緩衝液(50mM)中に最終濃度0.91%となるようにカゼインを加え、アルカリプロテアーゼK−16を5.2×10-5P.U.加えて40℃、10分間反応して活性を測定した。最適pHでの活性を100とし、各pHでの活性を相対的に表した。結果を図1に示す。図1からも明らかなようにアルカリプロテアーゼK−16の至適pHは11.0〜12.3である。尚、使用した各種緩衝液、及びそのpH範囲は次のとおりである。
酢酸緩衝液 pH3.9〜5.7リン酸緩衝液 pH6.6〜8.3炭酸緩衝液 pH9.2〜10.9リン酸−NaOH緩衝液 pH10.9〜12.7KCl−NaOH緩衝液 pH10.9〜12.6
【0035】(4)pH安定性(3)で用いたのと同じ緩衝液(20mM)中に7.9×10-3P.U.のアルカリプロテアーゼK−16を加え、25℃で48時間放置した。この処理液を50mMホウ酸−NaOH緩衝液(pH10.0)で40倍に希釈後、活性を測定した。処理前の酵素活性を100%として各pHでの相対活性を求めた。結果を図2に示す。図2から明らかなようにアルカリプロテアーゼK−16は、Ca2+非存在下ではその安定領域がpH6.0〜12.0であり、2mM Ca2+存在下ではその安定域はpH5.0〜12.0であった。
【0036】(5)至適温度基質として0.91%のカゼインを含む50mMホウ酸−NaOH緩衝液(pH10.0)に3.1×10-5P.U.のアルカリプロテアーゼK−16を加え、10分間各温度で反応を行った。40℃での活性を100%として各温度での相対活性を求めた。結果は図3に示す。図3からも明らかなように、アルカリプロテアーゼK−16の至適温度は、Ca2+非存在下では55℃であり、5mM Ca2+存在下では70℃であった。
【0037】(6)耐熱性20mMホウ酸−NaOH緩衝液(pH9.5)に1.6×10-3P.U.のアルカリプロテアーゼK−16を加え、各温度で10分間熱処理し、氷冷後、50mMホウ酸−NaOH緩衝液(pH10.0)で5倍希釈した。そして0.91%カゼインを基質として活性を測定した。未処理時の活性を100%として各処理温度での相対活性を求めた。結果を図4に示す。図4からも明らかなように、アルカリプロテアーゼK−16はCa2+非存在下で50℃、5mM Ca2+存在下では60℃まで上記熱処理条件下で、90%以上の活性が維持された。
【0038】(7)分子量アルカリプロテアーゼK−16の分子量をドデシル硫酸ナトリウム(SDS)−ポリアクリルアミドゲル電気泳動法により調べた。分子量マーカーには低分子量用マーカーキット(バイオラッド)すなわち、ホスホリラーゼb(分子量:97,400)、牛血清アルブミン(分子量:66,200)、卵白アルブミン(分子量:42,700)、カルボニックアンヒドラーゼ(分子量:31,000)、大豆トリプシンインヒビター(分子量:21,500)、リゾチーム(分子量:14,400)を用いた。この方法によりアルカリプロテアーゼK−16の分子量は28,000±1,000と決定された。
【0039】(8)等電点アルカリプロテアーゼK−16の等電点を等電点電気泳動法により調べた。カラム用の両性担体にはサーバライト9−11を用いた。この方法によりアルカリプロテアーゼK−16の等電点は10.5以上であることがわかった。
【0040】(9)金属イオンの影響各種金属イオンについて、アルカリプロテアーゼK−16に対して与える影響を調べた。まず、20mMホウ酸−NaOH緩衝液(pH9.5)に各種金属塩を1mMの濃度で添加し、そこに3.9×10-3P.U.の酵素を加えて30℃、20分間放置した。その後、50mMホウ酸−NaOH緩衝液(pH10.0)で5倍に希釈して残存活性を測定した。残存活性は、金属塩無添加で同様に処理した酵素活性に対する相対値で表した。結果を表4に示した。この結果から明らかなように、アルカリプロテアーゼK−16は、Hg2+及びCu2+により活性が阻害されることがわかる。また、前記(5)及び(6)の結果よりCa2+により熱安定性が向上することがわかる。
【0041】
【表4】

【0042】(10)阻害剤の影響一般的な酵素阻害剤について、アルカリプロテアーゼK−16に対して与える影響を調べた。10mMリン酸緩衝液(pH7.0)に各種阻害剤を所定濃度になるように加え、そこにアルカリプロテアーゼK−16 7.9×10-3P.U.を添加し、30℃で20分間放置した。その後、該処理液をイオン交換水にて20倍希釈し、残存活性を測定した。残存活性は、阻害剤無添加で同様に処理した酵素活性に対する相対値で表した。結果を表5に示した。この結果から明らかなように、アルカリプロテアーゼK−16は、セリンプロテアーゼの阻害剤であるジイソプロピルフルオロリン酸(DFP)、フェニルメタンスルホニルフルオリド(PMSF)、キモスタチンで活性が阻害されることから、活性中心にセリン残基を有するプロテアーゼであることがわかる。
【0043】
【表5】

【0044】(11)界面活性剤の影響6.6×10-2P.U.の酵素液を、所定濃度の各種界面活性剤を溶かした5mlの0.1Mトリス−塩酸緩衝液(pH9.0、エタノールを10%含む)に加え40℃で4時間放置し、その後50mMホウ酸−NaOH緩衝液(pH10.0)で20倍希釈後、残存活性を測定した。処理時間0分での活性を100%とし残存活性を相対値で表した。結果を表6に示した。この結果から明らかなようにアルカリプロテアーゼK−16は、各種界面活性剤が高濃度(1〜10%)存在しても高い安定性を示すものであった。このことより、アルカリプロテアーゼK−16は界面活性剤を含有する洗浄剤成分として有用である。
【0045】
【表6】

【0046】アルカリプロテアーゼK−14の酵素学的性質(1)作用高アルカリ性条件下で各種蛋白質に対して作用する。特にヒト角質ケラチンに対し50KFU/APUの活性を有する。
【0047】(2)至適pH前記アルカリプロテアーゼK−16の場合と同様にして検討した結果、図5から明らかなようにアルカリプロテアーゼK−14の至適pHは10.4〜12.0であった。
(3)pH安定性前記アルカリプロテアーゼK−16の場合と同様にして検討した結果、図6から明らかなようにアルカリプロテアーゼK−14はCa2+非存在下ではその安定領域がpH7〜11.5であり、2mM Ca2+存在下ではその安定領域はpH5〜12であった。
(4)至適温度前記アルカリプロテアーゼK−16の場合と同様にして検討した結果、図7から明らかなようにアルカリプロテアーゼK−14の至適温度はCa2+非存在下では55℃であり、5mM Ca2+存在下では70℃であった。
【0048】(5)耐熱性前記アルカリプロテアーゼK−16の場合と同様にして検討した結果、図8から明らかなように、アルカリプロテアーゼK−14はCa2+非存在下で50℃、5mM Ca2+存在下では60℃まで90%以上の活性が維持された。
(6)等電点アルカリプロテアーゼK−14の等電点をロトフォア等電点電気泳動法(バイオラッド社製)により測定した。その結果、アルカリプロテアーゼK−14の等電点は10.0以上であった。
【0049】本発明の洗浄剤組成物中への上記アルカリプロテアーゼの配合量は、アルカリプロテアーゼが活性を示す量であれば特に制限されないが、洗浄剤組成物1kg当たり0.1〜6,000P.U.、特に5〜400P.U.が好ましい。
【0050】また、本発明の洗浄剤組成物には、公知の洗浄剤成分を配合することができ、当該公知の洗浄剤成分としては、例えば次のものが挙げられる。
【0051】(1)界面活性剤:平均炭素数10〜16のアルキル基を有する直鎖アルキルベンゼンスルホン酸塩、平均炭素数10〜20の直鎖又は分岐鎖のアルキル基を有し、1分子内に平均0.5〜8モルのエチレンオキサイドを付加したアルキルエトキシ硫酸塩、平均炭素数10〜20のアルキル基を有するアルキル硫酸塩、平均10〜20の炭素原子を1分子中に有するオレフィンスルホン酸塩、平均10〜20の炭素原子を1分子中に有するアルカンスルホン酸塩、平均10〜20の炭素原子を1分子中に有するα−スルホ脂肪酸メチルあるいはエチルエステル塩、平均炭素数8〜20の高級脂肪酸塩、平均炭素数10〜20の直鎖又は分岐鎖のアルキル基を有し、1分子内に平均0.5〜8モルのエチレンオキサイドを付加したアルキルエーテルカルボン酸塩などのアニオン性界面活性剤;平均炭素数10〜20のアルキル基を有し、1〜20モルのエチレンオキシドを付加したポリオキシエチレンアルキルエーテル、高級脂肪酸アルカノールアミド又はそのアルキレンオキサイド付加物などの非イオン性界面活性剤;その他ベタイン型両性界面活性剤;スルホン酸型両性界面活性剤、リン酸エステル系界面活性剤、アミノ酸型界面活性剤、カチオン性界面活性剤など。これらの界面活性剤は洗浄剤組成物中5〜60重量%(以下単に%で示す)配合され、特に粉体状洗浄剤組成物については10〜45%、液体洗浄剤組成物については20〜55%配合することが好ましい。また、本発明洗浄剤組成物が漂白剤である場合、界面活性剤は一般に1〜10%、好ましくは1〜5%配合される。
【0052】(2)二価金属イオン捕捉剤:トリポリリン酸塩、ピロリン酸塩、オルソリン酸塩などの縮合リン酸塩、ゼオライトなどのアルミノケイ酸塩、合成層状結晶性ケイ酸塩、ニトリロ三酢酸塩、エチレンジアミン四酢酸塩、クエン酸塩、イソクエン酸塩、ポリアセタールカルボン酸塩など。この二価金属イオン捕捉剤は、0〜50%、好ましくは5〜40%配合される。また、リンを含有しない二価金属イオン捕捉剤を用いることがより好ましい。
【0053】(3)アルカリ剤及び無機塩:ケイ酸塩、炭酸塩、セスキ炭酸塩、硫酸塩、アルカノールアミンなど。これらは0〜80%配合される。
【0054】(4)再汚染防止剤:ポリエチレングリコール、ポリアクリル酸塩、ポリアクリル酸コポリマー、ポリビニルアルコール、ポリビニルピロリドン、カルボキシメチルセルロースなど。再汚染防止剤は0〜10%、好ましくは1〜5%配合される。
【0055】(5)酵素:セルラーゼ、アミラーゼ、リパーゼ、ヘミセルラーゼ、β−グリコシダーゼ、グルコースオキシダーゼ、コレステロールオキシダーゼ、上記アルカリプロテアーゼ以外のプロテアーゼなどの酵素。上記アルカリプロテアーゼは従来公知のアルカリプロテアーゼよりも、セルラーゼ、リパーゼ等の酵素との相性が良好であり、これらの酵素を併用すれば洗浄力をいっそう向上させることができる。
【0056】(6)水道水中の有効塩素の捕捉剤又は還元剤:有効塩素の捕捉剤として、硫酸アンモニウム、尿素、塩酸グアニジン、炭酸グアニジン、スルファミン酸グアニジン、二酸化チオ尿素、モノエタノールアミン、ジエタノールアミン、トリエタノールアミン、又グリシン、グルタミン酸ナトリウム等で代表されるアミノ酸及び牛血清アルブミン、カゼインなどの蛋白質、更には蛋白質の加水分解、肉エキス、魚肉エキスなどが挙げられる。還元剤としては、チオ硫酸塩、亜硫酸塩、亜ニチオン酸塩等のアルカリ金属塩、アルカリ土類金属塩等及びロンガリットC等が挙げられる。
【0057】(7)漂白剤:過炭酸塩、過硼酸塩、スルホン化フタロシアニン亜鉛塩又はアルミニウム塩、過酸化水素等。
【0058】(8)蛍光染料:通常洗浄剤に用いられる蛍光染料。
【0059】(9)可溶化剤:液体洗剤の場合には次のような可溶化剤を用いることができる。エタノールなどの低級アルコール、ベンゼンスルホン酸塩、p−トルエンスルホン酸塩などの低級アルキルベンゼンスルホン酸塩、プロピレングリコールなどのポリオール類など。
【0060】(10)その他:上記以外に香料、ケーキング防止剤、酵素の活性化剤、酸化防止剤、防腐剤、色素、青味付け剤、漂白活性化剤等の洗剤に常用の成分を必要に応じて配合することができる。
【0061】本発明の洗浄剤組成物は、上記アルカリプロテアーゼ及び上記公知の洗浄成分を組み合せて常法に従い、製造することができる。洗浄剤の形態は、用途に応じて選択することができ、例えば液体、粉末、顆粒等とすることができる。また、本発明洗浄剤組成物は、衣料用洗浄剤、自動食器洗浄機用洗浄剤、配水管洗浄剤、義歯洗浄剤、漂白剤等として使用することができる。
【0062】
【発明の効果】本発明の洗浄剤組成物は、アルカリ性領域において高活性を有し、且つアルカリ耐性、更に強いヒト角質ケラチン線維分解活性を有するプロテアーゼ、例えばバチルス・エスピー(Bacillus sp.)KSM−K−16(微工研菌寄第11418号)の生菌又は、バチルス・エスピー(Bacillus sp.)KSM−K−14(微工研菌寄第12587号)の生菌の生産するアルカリプロテアーゼK−16又はアルカリプロテアーゼK−14を含有し、蛋白質汚れに対して優れた洗浄力を与えるものである。
【0063】
【実施例】次に参考例及び実施例を挙げ、本発明を具体的に説明するが、本発明はこれら実施例等により限定されるものではない。尚、以下における%は特記しない限り、重量%を示す。
【0064】参考例1プロテアーゼ産生菌株の分離、採取:(1)土壌のサンプルの約1gを滅菌生理食塩水10mlに懸濁し、80℃にて20分間放置し熱処理した。熱処理上清液0.1mlをケラチンハロー寒天培地へ接種し、30℃で48時間静置培養した。用いたケラチンハロー寒天培地の組成は以下に示す通りである。
グルコース 1%酵母エキス 0.2%獣毛ケラチン 1%カルボキシメチルセルロース 1%リン酸第一カリウム 0.1%硫酸マグネシウム・7水塩 0.02%寒天 1.5%
【0065】(2)上記培地組成物に、別滅菌を施した10%炭酸ナトリウムを1%添加し、最終pHを10.5に調整後、平板培地を作製した。培養後、生育したコロニーの周囲にハローを生じたものを選抜し、同培地で2〜3回純化し、均一のプロテアーゼ生産菌を得た。
【0066】(3)上記(2)で得たこれらの菌株を以下に示す液体培地へ接種し、30℃で好気的に48時間振盪培養を行った。
グルコース 2.0%ポリペプトンS 1.0%酵母エキス 0.05%リン酸第一カリウム 0.1%硫酸マグネシウム・7水塩 0.02%炭酸ナトリウム(別滅菌) 1.0%pH 10.5培養終了後、得られた培養物を遠心分離(3000rpm;10分間)して菌を除去し、得られた培養上清を酵素液とした。
【0067】(4)上記(3)で得られた酵素液から凍結乾燥により粗酵素サンプルを調製し、市販液体洗剤中における40℃での保存安定性評価を行った。そのなかから、最も安定性に優れる酵素を生産するものの菌株としてバチルス・エスピー KSM−K16株及びバチルス・エスピー KSM−K14株を得た。
【0068】参考例2菌体の培養、アルカリプロテアーゼK−16の精製:(1)参考例1で得られた好アルカリ性細菌、バチルス・エスピー KSM−K16を以下の液体培地(3.0l) に接種し、30℃で好気的に48時間振盪培養を行い、アルカリプロテアーゼK−16を生産させた。
グルコース 2.0%魚肉エキス 1.0%大豆粉 1.0%硫酸マグネシウム 0.02%リン酸第一カリウム 0.1%pH 10.0
【0069】(2)培養終了後、得られた培養物3l を遠心分離(10,000rpm;5分間)して菌を除去し、その上清液を凍結乾燥した。凍結乾燥粉末2gをイオン交換水10mlに溶解(粗酵素液)した後、同溶液を透析膜を用いて10mMトリス−塩酸緩衝液(2mM Ca2+添加、pH7.5)に対して一晩透析し、26mlの透析処理液(活性3.15P.U./ml、比活性1.97P.U./mg蛋白)を得た。次に、10mMトリス−塩酸緩衝液(2mM Ca2+添加、pH7.5)で平衡化したCM−52セルロース担体を充填したカラムにかけ、同緩衝液でカラム内を洗浄した後、0〜0.15M塩化ナトリウムを含む同緩衝液でアルカリプロテアーゼK−16を溶出させた。この活性画分を集めたところ全量は15ml、活性は1.12P.U./ml、比活性は5.75P.U./mg蛋白であった。そして、当溶液を50mMトリス−塩酸緩衝液(10mM Ca2+、0.2M塩化ナトリウム添加、pH8.0)に対して一晩透析した後、限外濾過(アミコン社製、分画分子量5,000)により濃縮し、50mMトリス−塩酸緩衝液(10mM Ca2+、0.2M塩化ナトリウム添加、pH8.0)で平衡化したセファデックスG−50(ファルマシア社製)のゲル濾過クロマトグラフィーにかけ同緩衝液にて展開させた。ここで得られた活性画分は全量11.5ml、活性は0.9P.U./ml、比活性は6.03P.U./mg蛋白であった。当溶液を、イオン交換水に対して一晩透析後、活性0.56P.U./ml、比活性5.60P.U./mg蛋白の溶液を得た。当溶液を凍結乾燥し、酵素粉末を得た。得られた酵素の比活性は1.87P.U./mgであり、ヒト角質ケラチン線維分解活性は48KFU/APUであった。
【0070】参考例3菌体の培養、アルカリプロテアーゼK−14の精製:(1)参考例1で得られた好アルカリ性細菌、バチルス・エスピー KSM−K14を以下の液体培地(3.0l) に接種し、30℃で好気的に48時間振盪培養を行い、アルカリプロテアーゼK−14を生産させた。
グルコース 2.0%魚肉エキス 1.0%大豆粉 1.0%硫酸マグネシウム 0.02%リン酸第一カリウム 0.1%pH 10.0(2)培養終了後、得られた培養物から、参考例2と同様の方法により、アルカリプロテアーゼK−14の精製酵素粉末を得た。得られた酵素のヒト角質ケラチン線維分解活性は50KFU/APUであった。
【0071】以下の実施例における洗浄試験は次の実験条件のもとに行った。
1)天然襟布汚染布:木綿金布(♯2023布)をワイシャツの襟に縫い付け、成年男子に3日間着用させる。着用後25℃、65%RHに1ケ月放置後、汚れの程度を三段階に分け、このうち最も汚れのひどいもののうち、中心点に対し汚れが対称な布を選び出し、この汚れの対称点で布を半裁し実験に供した。
【0072】2)洗浄条件及び方法:天然汚染布を洗浄する場合、9cm×30cmの天然汚染布を対称の位置で半裁し、9cm×15cmの一対の汚染布の一方を基準洗剤である酵素無添加洗剤で洗浄し、片方を比較洗剤である本発明の洗剤でそれぞれ洗浄した。まず天然汚染布片15枚を50cm×50cmの綿布に縫い付け、粉末洗剤の場合には6l の0.417%の洗剤溶液に、この汚染布と綿製肌着を合わせて1kg入れ、30℃で2時間浸漬後、東芝製洗濯機「銀河」に移し、全量を30l とした後、強反転で10分間洗浄し、乾燥後判定に供した。液体洗剤の場合には20ccの洗剤液を汚染布に均一に塗付け、10分後、綿製肌着と合わせて1kgとし、東芝製洗濯機「銀河」に移し、全量を30l とし、強反転にて10分間洗浄し、乾燥後判定に供した。基準洗剤で洗った半裁布と本発明の洗剤で洗った半裁布とを肉眼判定による一対比較で評価した。汚れの程度を表わす10段階にランクづけした標準汚れを基準にし、洗浄布をランクづけした。洗浄性は基準洗剤の洗浄力を100としたときの本発明の洗剤の洗浄力の点数で表わした。洗浄力指数の差は0.5以上で有意の差とみなせる。
【0073】3)使用した酵素:(a)アルカリプロテアーゼK−16(参考例2で得られたものを芒硝で200倍に稀釈して造粒したもの)
(b)アルカリプロテアーゼK−14(参考例3で得られたものを芒硝で200倍に稀釈して造粒したもの)
(c)プロテアーゼ(ノボ・ノルディスク社,サビナーゼ4.0T)
(d)プロテアーゼ( ギスト・ブロケイデス社,マクサカルP−400,000)
(e)プロテアーゼ(昭和電工社,API−21H)
(f)セルラーゼ(花王,微工研菌寄第1138号,500IU/g・造粒物)
(g)セルラーゼ(ノボ・ノルディスク社,セルザイム1.0T)
(h)リパーゼ(ノボ・ノルディスク社,リポラーゼ100T)
【0074】実施例1表7に示す配合組成の弱アルカリ性粉末衣料用洗剤を調製した。
【0075】
【表7】

【0076】得られた各種洗剤による洗浄試験の結果を表8に示す。尚、表中洗剤番号は、「実施例番号−使用した酵素記号」で表示し、酵素を使用しないものは「実施例番号−◎」と表示する。(以下、同様)
表8の結果より、本発明品は天然襟汚垢に対し、従来の酵素を含有した洗剤に比べて優れた洗浄力を示すことがわかる。
【0077】
【表8】

【0078】実施例2実施例1の配合組成において、酵素を表9の如く種々組み合わせて用いて弱アルカリ性粉末洗剤を調製した。得られた各種洗剤による洗浄試験の結果を表9に示す。表9の結果より、アルカリプロテアーゼK−16とセルラーゼ及び/又はリパーゼとを組み合わせて用いることにより、天然襟汚垢に対して、相乗的な洗浄力の向上効果が得られることがわかる。
【0079】
【表9】

【0080】実施例3表10に示す配合組成の弱アルカリ性粉末衣料用洗剤を調製した。
【0081】
【表10】

【0082】得られた各種洗剤による洗浄試験の結果を表11に示す。表11の結果より、本発明洗浄剤の効果が各種ビルダーの使用下において有効に発現されることがわかる。
【0083】
【表11】

【0084】実施例4表12に示す配合組成の弱アルカリ性粉末衣料用洗剤を調製した。
【0085】
【表12】

【0086】得られた各種洗剤による洗浄試験の結果を表13に示す。表13の結果より、本発明品は天然襟汚垢に対し、従来の酵素を含有した洗剤に比べて優れた洗浄力を示すことがわかる。
【0087】
【表13】

【0088】実施例5表14に示す配合組成の弱アルカリ性粉末衣料用洗剤を調製した。
【0089】
【表14】

【0090】得られた各種洗剤による洗浄試験の結果を表15に示す。表15の結果より、本発明品は天然襟汚垢に対し、従来の酵素を含有した洗剤に比べて優れた洗浄力を示すことがわかる。
【0091】
【表15】

【0092】実施例6表16に示す配合組成の弱アルカリ性粉末衣料用洗剤を調製した。
【0093】
【表16】

【0094】得られた各種洗剤による洗浄試験の結果を表17に示す。表17の結果より、本発明品は天然襟汚垢に対し、従来の酵素を含有した洗剤に比べて優れた洗浄力を示すことがわかる。
【0095】
【表17】

【0096】実施例7表18に示す配合組成の弱アルカリ性液体洗剤を調製した。尚、洗剤原液のpHは9.6であった。
【0097】
【表18】

【0098】得られた各種液体洗剤中における酵素の安定性試験の結果を表19に示す。
1)使用した酵素(i)アルカリプロテアーゼK−16(参考例2で得られたものをグリセロール及び水で100倍に稀釈して溶解したもの)
(j)アルカリプロテアーゼK−14(参考例3で得られたものをグリセロール及び水で100倍に稀釈して溶解したもの)
(k)プロテアーゼ(ノボ・ノルディスク社,エスペラーゼ8.0L)
(l)プロテアーゼ(ノボ・ノルディスク社,サビナーゼ8.0L)
【0099】2)安定性試験各組成の液体洗剤を配合後、40℃の条件下で10日間及び20日間放置した後、以下の測定法により各酵素の活性を測定し、次式により酵素活性残存率を算出した。
【0100】
【数1】

【0101】各組成の液体洗剤を1%の水道水溶液(硬度2.5°DH)とし、自動分析機オートアナライザー(登録商標、テクニコン社)を使用して、酵素活性を測定した。測定の詳細は、下記文献に従った。
文献:Analyst,96〔2〕,p159〜163(1971)
【0102】
【表19】

【0103】
【図面の簡単な説明】
【図1】アルカリプロテアーゼK−16の活性に及ぼすpHの影響を示す図面である。
【図2】アルカリプロテアーゼK−16の安定性に及ぼすpHの影響を示す図面である。
【図3】アルカリプロテアーゼK−16の活性に及ぼす温度の影響を示す図面である。
【図4】アルカリプロテアーゼK−16の安定性に及ぼす温度の影響を示す図面である。
【図5】アルカリプロテアーゼK−14の活性に及ぼすpHの影響を示す図面である。
【図6】アルカリプロテアーゼK−14の安定性に及ぼすpHの影響を示す図面である。
【図7】アルカリプロテアーゼK−14の活性に及ぼす温度の影響を示す図面である。
【図8】アルカリプロテアーゼK−14の安定性に及ぼす温度の影響を示す図面である。
【特許請求の範囲】
【請求項1】 40KFU/APU以上のヒト角質ケラチン線維に対する分解活性を有するアルカリプロテアーゼを含有することを特徴とする洗浄剤組成物。
【請求項2】 アルカリプロテアーゼが、次の至適pH及び至適温度を有するものである請求項1記載の洗浄剤組成物。
(1)至適pH(カゼイン基質,40℃10分間反応)
10.0〜12.5(2)至適温度(カゼイン基質,Ca2+イオン無添加pH10.0で反応)
50〜60℃
【請求項3】 アルカリプロテアーゼが、バチルス エスピー(Bacillus sp.)KSM−K16(微工研菌寄第11418号)の生産するアルカリプロテアーゼK−16又はバチルス エスピー(Bacillus sp.)KSM−K14(微工研菌寄第12587号)の生産するアルカリプロテアーゼK−14である請求項1又は2記載の洗浄剤組成物。
【請求項1】 40KFU/APU以上のヒト角質ケラチン線維に対する分解活性を有するアルカリプロテアーゼを含有することを特徴とする洗浄剤組成物。
【請求項2】 アルカリプロテアーゼが、次の至適pH及び至適温度を有するものである請求項1記載の洗浄剤組成物。
(1)至適pH(カゼイン基質,40℃10分間反応)
10.0〜12.5(2)至適温度(カゼイン基質,Ca2+イオン無添加pH10.0で反応)
50〜60℃
【請求項3】 アルカリプロテアーゼが、バチルス エスピー(Bacillus sp.)KSM−K16(微工研菌寄第11418号)の生産するアルカリプロテアーゼK−16又はバチルス エスピー(Bacillus sp.)KSM−K14(微工研菌寄第12587号)の生産するアルカリプロテアーゼK−14である請求項1又は2記載の洗浄剤組成物。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【公開番号】特開平5−25492
【公開日】平成5年(1993)2月2日
【国際特許分類】
【出願番号】特願平3−325980
【出願日】平成3年(1991)12月10日
【出願人】(000000918)花王株式会社 (8,290)
【公開日】平成5年(1993)2月2日
【国際特許分類】
【出願日】平成3年(1991)12月10日
【出願人】(000000918)花王株式会社 (8,290)
[ Back to top ]

