活性酸素種に基づいたチトクロームP450阻害ハイスループット測定法
チトクロームP450を阻害する能力に関して候補化合物をスクリーニングする方法。該方法は、該候補化合物、指標化合物前駆体、チトクロームP450基質、及び該チトクローム P450を反応させること、該チトクロームP450は、該チトクローム P450の代謝活性に関連する副反応があることを特徴とし、ここにおいて、該指標化合物前駆体と反応できる化学種を産生する;該候補化合物の存在下で産生された指標化合物の量を定量化すること、及び該候補化合物の存在下で産生された指標化合物の量を、該候補化合物の非存在下の同一条件下で産生される指標物の量と比較すること、該比較が、該候補化合物のチトクロームP450を阻害する能力を示す;の工程を含む。また、候補化合物のチトクローム P450に対する阻害能力を決定する方法を開示する。
【発明の詳細な説明】
【技術分野】
【0001】
(関連出願の相互参照)
この出願は、2004年4月5日に出願された米国仮出願第60/559,570号に基づき、優先権を主張し、その全体が、引用により本明細書中に取り込まれるものとする。
(技術分野)
本開示の主題は、チトクロームP450を阻害する能力に関して候補化合物をスクリーニングする方法に関する。特に、本開示の主題は、そのような候補化合物のチトクロームP450に対する阻害能力を測定する方法に関する。
【0002】
(略語表)
CYP-チトクロームP450
CYP1A2-チトクロームP450 1A2
CYP2B6-チトクロームP450 2B6
CYP2C8-チトクロームP450 2C8
CYP2C9-チトクロームP450 2C9
CYP2C19-チトクロームP450 2C19
CYP2D6-チトクロームP450 2D6
CYP2E1-チトクロームP450 2E1
CYP3A4-チトクロームP450 3A4
CYP3A5-チトクロームP450 3A5
CYP3A7-チトクロームP450 3A7
DCFH-2',7'-ジクロロジヒドロフルオレシン
DCFH-DA-2',7'-ジクロロジヒドロフルオレシン二酢酸塩
DCF-2',7'-ジクロロフルオレセイン
EDTA-エチレンジアミン四酢酸
FDA-米国食品医薬品局
HPLC-高速液体クロマトグラフィー
IC50-酵素活性を50%阻害するために必要な阻害剤濃度
LC-UV -液体クロマトグラフィー‐紫外線[測定法]
NADP+ -ニコチンアミドアデニンジヌクレオチドリン酸
NADPH-ニコチンアミドアデニンジヌクレオチドリン(還元型)
ROS-活性酸素種
UV-紫外線
【背景技術】
【0003】
(背景)
チトクロームP450 (CYP)系は、膜結合型ヘム含有混合機能オキシゲナーゼのスーパーファミリーであり、薬剤、環境化学物質、及び内因性化合物の代謝に関する主要酵素系である (Guengerichの論文、FASEB J 6:667-668 (1992); Eastabrookの論文、FASEB J 10:202-204 (1996); Rendic、及び Di Carloの論文、Drug Metab. Rev. 29:413-580 (1997))。これらの酵素は多くの組織で発現されているが、哺乳動物では、肝臓で最高のレベルで見い出されている。肝臓で発現された薬剤を代謝する11のCYPアイソフォームの中で、 これらのアイソフォームの5つ(CYP1A2、CYP2C9、CYP2C19、CYP2D6、及びCYP3A4)が大部分の医薬品の代謝に関与している。従って、CYPは、薬剤分子の代謝的変換を触媒し、それは、薬剤が体内から除去される重要な過程に相当する。
【0004】
2つ以上の薬剤が患者に併用することは、かなり一般的であり、薬剤‐薬剤相互作用が生じる可能性を増加させる。多くの薬剤‐薬剤相互作用は、代謝に基づくものであり、同一酵素に対して競合する2つ以上の薬剤によって生じ、これらの相互作用の大部分にはCYPが関与する。従って、第二の薬剤が、その第一の薬剤の代謝除去に関与する酵素と競合するならば、薬剤のはるかに高い血漿中濃度が達成される。狭い治療係数を有する薬剤に関しては、これは有害反応をもたらし得る。この問題を取り巻く重要性は、米国には年間起きる推定2百万の深刻な薬剤有害反応があり、そのうち100,000が致死性であることを考慮すると、より明らかである(Brennanの論文、Chem Eng News 5:63-73 (2000);米国食品医薬品局(FDA)ウェブサイト"予防可能な薬剤有害反応:薬剤相互作用への着目"の項目も参照されたい)。これらの問題から、薬剤発見/開発の間の初期に薬剤安全性を評価し、かつ望ましくない薬剤相互作用の可能性を示し得る化合物を同定し、排除する必要性が促されている。特に、後に安全性の問題のため薬剤を市場から排除しなければならないならば、薬剤発見の間に新薬剤候補の安全性を評価することにより、かなりの量の時間とお金を節約でき、かつ患者を不必要な危険に晒すことを防ぐことができる。
【0005】
CYP阻害を評価する数種類の測定法が利用でき、(1)液体クロマトグラフィー/質量分析法、(2)蛍光に基づいた方法、及び (3)放射性同位体に基づいた方法などの、新薬剤候補の阻害能力を評価する様々な戦略を用いている。 ADDIN ENRfu Crespiらの論文 (Anal. Biochem. 248:188-190 (1997))には、マイクロタイタープレートに基づいた蛍光測定法を使用し、CYP3A4、及びCYP1A2などの、いくつかの主要な生体異物代謝をするCYPアイソザイムの阻害を評価するCYP阻害剤測定法が記載されている。また、同様の測定法は、Kennedy、及びJonesの論文(Anal. Biochem. 222:217-223 (1994))、及びDonatoらの論文(Anal. Biochem. 213:29-33 (1993))に記載されている。これらの測定法を用いて、可能性がある薬剤候補のCYPと相互作用する能力を、蛍光性産物を産生するモデル基質の代謝における相対的な阻害効果に基づいて順位付けすることができる。これらの測定法は、高速液体クロマトグラフィー(HPLC)などの他の公知の方法に比べて相対的に速い。しかしながら、これらの測定法は、特定のプローブ基質の使用を必要とするという点において深刻な制限に悩まされ、従って、所定の候補化合物の、複数の基質に対するCYP代謝活性を阻害する能力を評価するのに容易に適応できない。これらの測定法は、該同一阻害剤を別の基質と用いるとき、CYP3A4などの特定のCYPが、劇的に異なる阻害プロフィールを示す(例えば、IC50により測定される)という事実により、さらに制限される。従って、現在のCYP 阻害測定法には、特定のプローブ基質の使用が必要とされ、かつ別の基質を選択する柔軟性は許されない。
【発明の開示】
【発明が解決しようとする課題】
【0006】
従って、単一の労力で、多くの化合物の、CYP による基質の代謝を阻害する能力に関するスクリーニングを可能にする測定法などの、改良測定法が必要である。
【課題を解決するための手段】
【0007】
(要約)
この要約には、本開示の主題のいくつかの実施態様が列記され、多くの場合、これらの実施態様の変形、及び置換が列記されている。この要約は、その多数多様の実施態様の単なる典型にすぎない。所定の実施態様の1つ以上の代表的な特徴の言及は、同様に典型である。通常、そのような実施態様は、言及された特徴の有無に関わらず存在し得る;同様に、それらの特徴を、この要約に列記されているかいないかに関わらず、本開示の主題の実施態様に適応させることができる。過剰な反復を避けるために、この要約では、そのような特徴のすべての可能な組合せは列記されたり、示されていない。
【0008】
本開示の主題は、チトクローム P450を阻害する能力に関して、候補化合物をスクリーニングする方法を提供する。いくつかの実施態様において、該方法は、(a)チトクローム P450基質、及びチトクローム P450を阻害する能力を有すると推測される候補化合物を提供すること;(b) 該候補化合物、該チトクロームP450基質、指標化合物前駆体、該チトクロームP450、及びNADPH、又はNADPH再生系を混合すること、ここにおいて、該チトクロームP450の主要代謝活性が副反応において化学種を産生する;(c)該副反応において該化学種を産生させること、それにより該化学種の画分が該指標化合物前駆体と反応し、指標化合物を産生する;及び(d)該候補化合物の存在下で産生される指標化合物の量を、該候補化合物の非存在下で産生される指標化合物の量と比較すること、該比較が、該チトクロームP450を阻害する該候補化合物の能力を示す;を含む。いくつかの実施態様において、該酵素の主要代謝活性による該副反応において産生された該化学種は、活性酸素種を含む。実施態様において、該指標化合物前駆体は、蛍光性化合物、発色化合物、化学発光化合物、及びそれらの組合せからなる群から選択される。いくつかの実施態様において、該指標化合物前駆体は蛍光性化合物である。いくつかの実施態様において、工程(a)から(c)を、マルチウェルプレートの少なくとも1つのウェル中で行う。
【0009】
いくつかの実施態様において、さらに、本開示の方法は、さらに、複数の候補化合物を、チトクロームP450を阻害する能力に関して同時にスクリーニングすることを含む。いくつかの実施態様において、工程(a)から(c)を、マルチウェルプレートの複数のウェル中で行う。
【0010】
該簡便法のいくつかの実施態様において、該チトクローム P450は、CYP1A、CYP2B、CYP2C、CYP2D、CYP2E、CYP3A、及びそれらの組合せからなる群から選択される。実施態様において、該基質は、CYP1A基質、CYP2B基質、CYP2C基質、CYP2D基質、CYP2E基質、CYP3A基質、及びそれらの組合せからなる群から選択される。いくつかの実施態様において、該CYP3A4基質は、テストステロン、ミダゾラム、キニジン、及びベラパミルからなる群から選択される;該CYP1A2基質はフェナセチンである;該CYP2C9基質は、ジクロフェナク、及びトルブタミドからなる群から選択される;該CYP2D6基質は、ブフラロール、イミプラミン、及びデキストロメトルファンからなる群から選択される;該CYP2C19基質は、オメプラゾール、及びS-メフェニトインからなる群から選択される;かつ/或いは該CYP2E1基質はクロルゾキサゾンである。
【0011】
いくつかの実施態様において、該チトクロームP450はヒトチトクローム P450を含む。実施態様において、該ヒトチトクローム P450は、CYP1A2、CYP2B6、CYP2C8、CYP2C9、CYP2C19、CYP2D6、CYP2E1、CYP3A4、CYP3A5、CYP3A7、及びそれらの組合せからなる群から選択される。いくつかの実施態様において、該ヒトチトクローム P450はCYP3A4である。
【0012】
実施態様において、さらに、該簡便法が、該候補化合物の存在下で産生された指標化合物の量を定量化することを含む。いくつかの実施態様において、該簡便法がさらに、ある期間にわたって形成された指標化合物を定量化し、それにより、該候補化合物の該チトクローム P450に対する阻害能力を決定することを含む。
【0013】
また、本開示の主題は、候補化合物のチトクローム P450に対する阻害能力を決定する方法を提供する。いくつかの実施態様において、該方法は、(a)チトクロームP450基質、及びチトクロームP450を阻害する能力を有すると推測される候補化合物を提供すること;(b) 該候補化合物、該チトクロームP450基質、指標化合物前駆体、該チトクロームP450、及びNADPH、又はNADPH再生系を混合すること、ここにおいて、チトクロームP450の主要代謝活性が副反応において化学種を産生する;(c)該副反応において該化学種を産生させること、それにより該化学種の画分が該指標化合物前駆体と反応し、指標化合物を産生する;(d)該指標化合物が該候補化合物の存在下で産生される速度を定量化すること;及び(e)該チトクロームP450の主要代謝活性を設定量低下させる、該候補化合物の濃度を測定し、それにより、該化合物の該チトクロームP450に対する阻害能力を決定することを含む。
【0014】
該簡便法のいくつかの実施態様において、該チトクローム P450は、CYP1A、CYP2B、CYP2C、CYP2D、CYP2E、CYP3A、及びそれらの組合せからなる群から選択される。いくつかの実施態様において、該基質は、CYP1A基質、CYP2B基質、CYP2C基質、CYP2D基質、CYP2E基質、CYP3A基質、及びそれらの組合せからなる群から選択される。実施態様において、該CYP3A4基質は、テストステロン、ミダゾラム、キニジン、及びベラパミルからなる群から選択される。実施態様において、該CYP1A2基質はフェナセチンである。いくつかの実施態様において、該CYP2C9基質は、ジクロフェナク、及びトルブタミドからなる群から選択される。いくつかの実施態様において、該CYP2D6基質は、ブフラロール、イミプラミン、及びデキストロメトルファンからなる群から選択される。いくつかの実施態様において、該CYP2C19基質は、オメプラゾール、及びS-メフェニトインからなる群から選択される。いくつかの実施態様において、該CYP2E1基質はクロルゾキサゾンである。
【0015】
該簡便法のいくつかの実施態様において、該チトクローム P450はヒトチトクローム P450を含む。いくつかの実施態様において、該ヒトチトクローム P450は、CYP1A2、CYP2B6、CYP2C8、CYP2C9、CYP2C19、CYP2D6、CYP2E1、CYP3A4、CYP3A5、CYP3A7、及びそれらの組合せからなる群から選択される。いくつかの実施態様において、該ヒトチトクロームP450はCYP3A4である。
【0016】
いくつかの実施態様において、該酵素の主要代謝活性による該副反応において産生された該化学種は、活性酸素種を含む。いくつかの実施態様において、該指標化合物前駆体は、蛍光性化合物、発色化合物、化学発光化合物、及びそれらの組合せからなる群から選択される。いくつかの実施態様において、該指標化合物は蛍光性化合物である。
【0017】
該簡便法のいくつかの実施態様において、工程(a)から(c)をマルチウェルプレートの少なくとも1つのウェル中で行う。いくつかの実施態様において、工程(a)から(c)をマルチウェルプレートの複数のウェル中で行う。
【0018】
いくつかの実施態様において、該設定量は、25%、33%、50%、67%、75%、及び90%からなる群から選択される。
いくつかの実施態様において、さらに、該簡便法は、複数の候補化合物の阻害能力を、同時に測定することを含む。いくつかの実施態様において、さらに、該簡単な方法は、該指標化合物が該候補化合物の存在下で産生される速度を、定量化することを含む。
【0019】
従って、本開示の主題の目的は、候補化合物を、チトクローム P450を阻害する能力に関してスクリーニングする方法を提供することである。この目的は、本開示の主題により、全体、又は一部において達成される。
本開示の主題の目的は、先に本明細書中に記載されてきており、他の目的は、本明細書中、下記に最善に記載のとおり、その説明が進むにつれ明らかになるであろう。
【発明を実施するための最良の形態】
【0020】
(詳細な説明)
(I. 概論)
ヒトCYPの中で、CYP3A4は、他のどのCYPより、より多くの薬剤の代謝の最終的結末に影響を及ぼす。結果として、この酵素の強力な阻害剤は、共投与される可能性がある多くの薬剤の動態に有意に影響し得る。従って、多くの製薬会社は、薬剤候補のCYP3A4に対する阻害能力を評価するスクリーニングを実施してきている。これらの測定法は、液体クロマトグラフィー−紫外線(LC-UV)、蛍光に基づいた方法、及び放射性同位体に基づいた方法を含む。通常、試験化合物の阻害能力は、CYP 活性を評価するために用いられるプローブ基質には依存しないという仮定の下に、候補化合物によるCYPの阻害を、特定のプローブ基質に対して評価する。しかしながら、この仮定は正確でなく、特にCYP3A4は、異なる基質を用いたとき同一の阻害剤が複数のIC50値を示すという点で例外である。それは、その活性部位内で複数の基質に同時に結合するこのアイソフォームの能力に起因し得る。既存のCYP阻害を評価する蛍光に基づいた測定法、及び放射測定法では、特定の非"薬剤様"プローブ基質を必要が必要とされ、従って、別の、及び/又は複数の基質を選択する柔軟性は許されない。
【0021】
(II. 定義)
他に定義されていなければ、本明細書中で用いられたすべての技術、及び科学用語は、本開示の主題に関連する当業者に一般的に理解されるとおり同じ意味を持つ。本明細書の明確さのために、特定の定義を本明細書中、下記に示す。
下記の用語は、当業者によく理解されていると考えられるが、下記の定義を記載し、本開示の主題の説明を容易にする。
【0022】
長年の特許法の慣習を受けて、"ある(a)"、及び"ある(an)"という用語は、請求項を含めてこの本出願で用いられるときは、"1つ以上"を意味する。従って、"基質 (a substrate)"という用語は、本明細書中では、1つ以上の基質のことをいうことと理解され、"CYP2C (a CYP2C)"は、本明細書中では、CYP2C のサブファミリーの1つ以上のメンバーのことをいうことと理解される。
【0023】
本開示の主題のいくつかの実施態様において、チトクロームP450を阻害する能力に関して候補化合物をスクリーニングする方法を提供する。該方法は、チトクロームP450(CYP)を阻害する能力を有すると推測される候補化合物、該CYP基質、及び指標化合物前駆体を、CYP生物活性を支持する条件下で(実施態様によっては、NADPH、又はNADPH再生系の存在下で)、該CYP と反応させること、ここにおいて、該CYPの主要代謝活性が副反応において化学種を産生する;該副反応において該化学種を産生させること、それにより該化学種の画分が該指標化合物前駆体と反応し、指標化合物を産生する; 及び該候補化合物の存在下で産生された指標物質の量を、該候補化合物の非存在下での同一条件下で産生された指標化合物と比較すること;を含む。該候補化合物の存在下で産生された指標化合物の量を、その非存在下で産生された量と比較することにより、該候補化合物の該CYPを阻害する能力を決定する。いくつかの実施態様において、該方法が、該候補化合物の存在下で産生された指標化合物の量を定量化することを含む。
【0024】
"候補化合物"という用語は、化合物のCYP を阻害する能力の特徴づけが興味深い、任意の化合物のことを言うものとする。そのようなものとして、"候補化合物"と"チトクロームP450阻害剤"という用語を、本明細書中で、置き換え可能に用いる。典型的な候補化合物は、薬剤などの生体異物、及び他の治療薬を含み、例を挙げると小分子があるが、それらに限定されない。典型的な候補化合物には、ケトコナゾール、ネルフィナビル、シクロスポリン、サキナビル、ニフェジピン、ジルチアゼム、オメプラゾール、プロゲステロン、エリスロマイシン、ベラパミル、及びプレドニゾロンなどがある。
【0025】
"チトクロームP450"という用語は、ステロイド、脂肪酸、及びプロスタグランジンなどの生物体内生物と同様に、薬剤、発癌物質、及び環境汚染物質などの生体異物を代謝できる、ヘムタンパク質酵素の大きなファミリー(よく"スーパーファミリー"と呼ばれる)のことを言うものとする。本明細書中で使われるこれらの用語は、起源の種類に関わらず、該CYP スーパーファミリーの全メンバーを含むものとする。従って、これらの用語は、微生物、無脊椎動物、及び脊椎動物起源のCYPスーパーファミリーメンバーのことを言うものとする。いくつかの実施態様において、これらの用語は、鳥類、及び哺乳動物などの温血脊椎動物種のCYP のことを言う。従って、CYPの典型的な起源には、ウシ、ブタ、ヒツジ、イヌ、ネコ、ウマ、ネズミ、及びトリ起源などがある。いくつかの実施態様において、これらの用語は、ヒト起源のCYPのことを言う。
【0026】
該CYPスーパーファミリーの全てのアイソザイム、又はアイソフォームを、本明細書中で用いられる"チトクロームP450"、及び"CYP"という用語の範囲内に入るように意図する。特に意図されたCYPアイソフォームは、これらに限定されないが、CYP1A、CYP2B、CYP2C、CYP2D、CYP2E、及びCYP3Aファミリーのメンバーなどであるのは、これらのアイソフォームがヒトにおける薬剤の代謝に最も一般的に関与するものと同定されているためである。さらなるCYPスーパーファミリーメンバーは米国特許第5,786,191号、及び第5,478,723号に記載されており、その各々の内容は、引用により本明細書中に取り込まれるものとする。
【0027】
"化学種"、及び"化学副産物"という用語は、選択された酵素の主要代謝活性と関連する副反応、又は二次反応から形成される種、又は副産物のことを言うこととする。さらに、"化学種"、及び"化学副産物"という用語は、該酵素の該代謝活性と関連する該二次反応、又は副反応から産生された該種、又は副産物が、本開示の主題の該方法に従って、指標化合物前駆体と反応できることを特徴とする。
典型的な化学種は、CYPスーパーファミリー酵素などののいくつかの酵素の副反応から産生された"活性酸素種"、又は"ROS"を含む。典型的なROSは、スーパーオキシド陰イオン(O2-)、過酸化水素(H2O2)、及びヒドロキシルラジカル(OH-)を含む。
【0028】
"指標化合物前駆体"という用語は、該酵素の代謝活性と関連する該副反応から産生された化学種と反応する、化合物のことを言うこととする。"指標化合物"という用語は、該指標化合物前駆体と該化学種の反応により産生された化合物のことを言うこととする。先に記載のとおり、該指標化合物の存在から、該選択された酵素による代謝に対する該候補化合物の感受性が示される。好ましい指標化合物は、蛍光、又は化学発光分光光度法、比色法、及びそのような標準検出技術を用いて、容易に検出可能である。
【0029】
従って、典型的な指標化合物前駆体は、蛍光性/蛍光化合物、化学発光化合物、発色指標化合物、及びそれらの組合せに変換される化合物などであるが、それらに限定されない。特に意図された指標化合物前駆体/指標化合物系は、蛍光性プローブ、2',7'-ジクロロジヒドロフルオレシン二酢酸塩 (DCFH-DA)、及びその蛍光対応物、2',7'- ジクロロフルオレセイン(DCF)を含む。しかしながら、他の指標化合物前駆体/指標化合物系を用いることができ、例を挙げると、ジヒドロローダミン123/ローダミン123、及びジヒドロエチジウム/エチズムがあるが、それらに限定されない。
【0030】
本開示の主題の実施態様において、CYPをCYP基質に反応させる。本明細書中で使われる"CYP基質"という句は、結合し、CYPの主要代謝活性の結果として、副反応において化学種を産生することに作用できる、任意の基質のことを言う。典型的なCYP基質は、テストステロン、ミダゾラム、キニジン、及びベラパミル(CYP3A4);フェナセチン(CYP1A2);ジクロフェナク、及びトルブタミド(CYP2C9);ブフラロール、イミプラミン、及びデキストロメトルファン(CYP2D6);オメプラゾール、及びS-メフェニトイン(CYP2C19);及びクロルゾキサゾン(CYP2E1)を含む。本開示の主題の該方法で使用することができる、他の医学関連のチトクロームP450基質と同様に、チトクローム P450阻害剤、及び誘導剤は、インディアナ大学医学部のDavid Flockhart博士により維持され、インディアナ大学‐パデュー大学インディアナポリス校ウェブページからアクセス可能である("薬剤相互作用"を検索されたい)、ワールドワイドウェブページに列記されたものを含むが、それらに限定されない。また、特定の分子が、特定の状況下では阻害剤として、特定の状況下では基質として働くことを提供する。例えば、特に特定の薬剤‐薬剤相互作用の場合、ある薬剤は、それが結合し、CYPにより代謝されるので、CYPの基質として考慮できる。また、その同一の薬剤は、第二の薬剤と併用して存在するときは、そのCYPとの相互作用により、その同一のCYPの該第二の薬剤を代謝する能力、又は該第二の薬剤を代謝される速度が減少するので、阻害剤と考慮できる。これは、任意の機構により起こり得る。例えば、第一と第二の薬剤が同一の活性部位に結合し、該第一の薬剤がより高い結合親和性を有する場合、又は第一と第二の薬剤が異なる活性部位に結合するが、該第一の薬剤のその活性部位への結合が、該第二の薬剤が結合する筈の該活性部位に接近不能にする場合がある。
【0031】
本明細書中で使われるNADPH とは、CYP活性の補因子であるニコチンアミドアデニンジヌクレオチドリン酸の還元型のことを言う。この化合物を、該反応に直接加えるか、或いはNADPH 再生系を用いて産生することができる。該再生系は、NADP+、及びこの化合物をNADPH に還元できる酵素系からなる。典型的なNADPH再生系は、NADP+、グルコース-6-リン酸、及びグルコース-6-リン酸デヒドロゲナーゼを含む;しかしながら、該再生酵素/基質系は、特にこれらに限定されない。従って、本開示の主題の実施態様において、NADPH再生系は、CYP生物活性を支持する反応条件の要素を含み、実施態様において、NADPH再生系は、CYP生物活性を支持する反応条件の複数の要素を含む。
【0032】
本明細書中で使われる"比較する"という用語、及びその文法的変形は、産生された指標化合物の量を評価することを言うことができる。そのようなものとして、該用語は、定量的測定(例えば検出された蛍光単位数)、又は定性的測定(例えば、いくらかの指標化合物を産生するものとして、視覚的、又は別のやり方で一実験を1つ以上の他のものと関係づける)のことを言う。さらに、比較することとは、標準に対する測定のことを言う。例えば、比較することとは、阻害剤存在下での産生(蛍光など)の、阻害剤非存在下でのその同一の産生の測定と相対的な測定のことを言うことができ、ここで、後者を100%に設定し、前者を該後者のパーセントとして測定できる。実施態様において、また、比較することとは、"より濃い"か"より薄い"、又は"より多い"か"より少ない"などの単純な相対測定のことを言う。
【0033】
本明細書中で使われる"定量化する"という用語、及びその文法的変形は、産生された指標化合物の量を決定することを言う。そのように、該用語は、(検出された蛍光単位の数値などの)定量的な測定のことを言うことができる。さらに、定量化することとは、標準と相対的な量を測定することを言うことができる。
【0034】
本明細書中で使われる"阻害する"という用語は、CYPとの反応における候補化合物に関して用いられる場合は、該CYPの活性における減少をもたらす該候補化合物の能力のことを言う。しかしながら、特定の条件下(極めて低濃度の阻害剤などの)で、阻害剤がCYPの活性の増大をもたらし得ることが理解されている。これらの状況下で、候補化合物は、ある最低限の濃度に達した後、該候補化合物が、指標化合物に変換される指標化合物前駆体の量の減少をもたらすことができるならば、阻害剤と見なされる。
【0035】
本開示の主題のいくつかの実施態様において、候補化合物のCYPに対する阻害能力を決定する方法を提供する。いくつかの実施態様において、該方法は、CYP基質、及びCYPを阻害する能力を有すると推測される候補化合物を提供すること;該候補化合物、該CYP基質、指標化合物前駆体、及び該CYPを、CYP生物活性を支持する条件下で(いくつかの実施態様では、NADPH、又はNADPH再生系の存在下で)混合すること、ここにおいて、該CYPの主要代謝活性が副反応において化学種を産生する;該副反応において該化学種を産生させること、それにより該化学種の画分が該指標化合物前駆体と反応し、指標化合物を産生する;及び該CYPの主要代謝活性を設定量低下させる、該候補化合物の濃度を測定し、それにより、該化合物のCYPに対する阻害能力を決定することを含む。いくつかの実施態様において、さらに、該方法は、該指標化合物が該候補化合物の存在下で産生される速度を定量化することを含む。
【0036】
本明細書で使われる"阻害能力"という用語は、候補化合物のCYP を設定量など阻害する能力のことを言う。本明細書中で使われる"設定量"という語句は、該候補化合物の非存在下での該CYP の活性に対する所定の量のことを言う。設定量は、該CYP の該活性のパーセントなどであり得る。典型的な設定量は、ある条件下の該CYPの活性の25%、33%、50%、67%、75%、及び90%などであるが、それらに限定されない。いくつかの実施態様において、阻害能力とは、ある条件下で該CYPの該活性を50%低下させるために必要な、該候補化合物の濃度(すなわち、IC50値)のことを言う。
【0037】
本開示の主題の方法を、当技術分野で周知のとおり、96ウェルマイクロタイタープレートなどの標準マルチウェル測定プレート内で行うことができることを意図している。従って、複数の候補化合物を、マルチウェルプレートの複数のウェル内で、CYPを阻害する能力に関して同時にスクリーニングすることができる。さらに、マルチウェルプレート、又は他の複数の貯留デバイスの使用により、個々の候補化合物のいくつかの、又は多くの濃度を、同一か、異なる基質のどちらか、及び/又はCYPスーパーファミリーメンバーで同時に測定することが可能になり得る。
【0038】
本開示の主題の開示から当業者にとって明らかなとおり、本開示の主題の該方法を、細胞フリー反応、及び/又は細胞に基づいたインビトロ反応で行うことができることも意図している。本開示の主題の該方法に従って改良に適した、典型的な細胞に基づいたインビトロプラットフォームは、Parkinsonの論文(Toxicol. Pathol. 24:45-57 (1996))に記載されている。また、本開示の主題の開示から当業者にとって明らかなとおり、本開示の主題の該方法は、指標化合物前駆体‐指標化合物の他の組み合わせに利用できることを意図する。例えば、第二鉄-EDTAは、活性酸素種の存在下で化学発光産物を生じさせることができる、指標化合物前駆体であることを意図する(Puntarulo、及びCederbaumの論文、Arch. Biochem. Biophys. 258: 510-518 (1987))。
【実施例】
【0039】
下記の実施例を、本開示の主題の典型的な様式を例示するために盛り込んでいる。本開示、及び当技術分野の一般的な水準を考慮して、当業者は、下記の実施例は典型例に過ぎないことを意図すること、及び本開示の主題の精神、及び範囲から離れることなく、多くの変更、改良、及び修正を行うことができることを認識するであろう。
【0040】
(実施例で用いられた材料)
1'-ヒドロキシミダゾラム、及び組み換え異種発現されたヒトCYPとNADPH CYP還元酵素を含有する、バキュロウイルス感染昆虫細胞から調製されたミクロソーム(SupersomesSYMBOL 228 \f "Symbol" \s 11) をGenTest社(Woburn、Massachusetts、米国)から購入した。6β-ヒドロキシテストステロン、及び11α-ヒドロキシプロゲステロンをSteraloids社(Wilton、New Hampshire、米国)から調達した。テストステロン、ミダゾラム、ケトコナゾール、イトラコナゾール、ミコナゾール、フラフィリン、ニフェジピン、ベラパミル、プロゲステロン、 ジルチアゼム、エリスロマイシン、プレドニゾロン, シクロスポリンA、オメプラゾール、キニジン、スルファフェナゾール、β-ニコチンアミドアデニンジヌクレオチドリン酸還元型四ナトリウム塩(β-NADPH)、及び2',7'-ジクロロジヒドロフルオレセイン二酢酸塩をSigma Chemical社(St. Louis、Missouri、米国)から購入した。2',7'-ジクロロフルオレセイン(DCF)をAldrich Chemical社(Milwaukee、Wisconsin、米国)から調達した。
【0041】
(ジクロロジヒドロフルオレセイン(DCFH-DA)酸化により測定された、CYP3A4を介したテストステロンの酸化の阻害)
DCFH-DA (2.5 mM)、及びNADPH (20 mM)のストック溶液を、各々メタノール、及び緩衝液中で各実験前に調製した。基質、及び阻害剤を、100%メタノール中で調製し、-20℃で保存した。他に特に明記しなければ、反応混合物は、2.5 μM DCFH-DA、50 pmol/ml CYPミクロソーム、及び50 mM トリス、又は100 mM リン酸カリウム緩衝液(3.3 mM MgCl2で補充されたpH 7.4)を含み、最終容積を200 μlにした。他に示さなければ、テストステロンを、最終濃度40 μMで、該反応物に加えた。等量のメタノールを、基質を含まない試料に加え、コントロールとした。反応を、37℃で96ウェル黒底プレート中で行った。阻害剤は、水、又はメタノール中で調製されたストック溶液から、様々な濃度で加えた。最終メタノール濃度を試料間で一定(1%、v/v)に保ち、メタノールのCYP 活性における効果による蛍光産生の速度におけるばらつきを排除した。反応物を、予め暖められたNADPH (最終濃度 1 mM)の添加以前に、37℃暗所で、振動を与えず、5分間予めインキュベートした。蛍光を、Molecular Devices蛍光マイクロプレートリーダー (Molecular Devices社、Sunnyvale、California、米国)を用いて、下記のパラメータで 5分間隔で1時間にわたって測定した;励起波長=500 nm、発光波長=529 nm、光学位置=上部、温度=37℃、プレート形式=黒底 96ウェル。該反応物中のDCF 濃度を、純正DCF で作図された標準曲線を用い、測定した。
【0042】
CYP3A4を介したテストステロンの酸化の阻害を、6β-ヒドロキシテストステロンの形成により測定した。CYP3A4による 6β-ヒドロキシテストステロン形成の反応速度を測定し、蛍光産生の速度と比較した。反応物は、様々な濃度のテストステロン、1ml当たり50 pmol のCYP3A4、及び緩衝液からなり、最終容積を1ミリリットルにした。反応を37℃で行い、1 mM NADPHの添加で開始した。分割量試料(200 μl)を、NADPH添加後0、10、及び30分後に取り、100 μlの4.5 μM 11α-ヒドロキシプロゲステロン(HPLC 内部標準)含有アセトニトリルの添加で終了させた。試料を速やかに氷上に置き、沈殿したタンパク質を、13,000 rpmで4分間遠心分離し、除去した。上清を、分析用にHPLCバイアルに移した。
【0043】
HPLC分析を、オンラインUV検出器を装備されたAgilent 1100シリーズHPLCシステム (Agilent Technologies社、Palo Alto、California、米国)を用いて行った。テストステロン、及びその代謝物である6β-ヒドロキシテストステロンを、28℃に維持したKeystoneアクアシル(Aquasil)C18 カラム(150 x 4.6 mm、粒子径5 m;Keystone Scientific社、Bellefonte、Pennsylvania、米国)上で分離した。該カラムに、毎分1ミリリットルの流速で、水/アセトニトリル/メタノール(63:2:35 v/v)の移動相で開始し、水/アセトニトリル/メタノール(18:2:80 v/v)で終了する勾配を15分間かけ、その後、後者の緩衝液を用いて3分間定組成条件にした。分析物を242 nmで検出し、定量化した。テストステロン、6β-ヒドロキシテストステロン、及び11α-ヒドロキシプロゲステロンの保持時間は、各々、約10.8、13.1、及び15.4分であり、純正標準を用いて確認した。すべての実験を、3回ずつ行った。
【0044】
(データ解析)
IC50値(CYP 活性において50%減少をもたらす阻害剤濃度)をXLfit 4 (ID Business Solutions社、Emeryville、 California、米国)を用いて計算した。データをシグモイド用量‐反応モデルに適合させた。
【0045】
(実施例の考察)
(ジクロロジヒドロフルオレシンの、CYP 代謝中に産生された活性酸素種との相互作用)
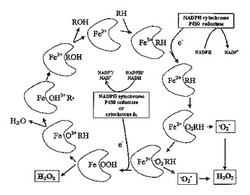
長い間、活性酸素種(ROS)は、該チトクローム P450 (CYP)触媒サイクルの副産物と同定されてきており、活性化酸素の解離から、その基質への取り込み、又は水への還元以前に生じる(図1参照)。ジクロロジヒドロフルオレシン二酢酸塩(DCFH-DA)を用いて、CYP触媒中のROS 産生を検出する技術は、米国特許第6,312,917号に記載されている。DCFH-DAは親油性分子であり、細胞膜を容易に越え、続いて、細胞エステラーゼにより脱アセチル化され、ジコロジヒドロフルオレセイン(DCFH)を形成する。DCFHは、ROSに対して反応性が高く、従って、高蛍光性産物、ジクロロフルオレセイン(DCF;図2参照)を形成する。
【0046】
(CYP3A4を介したテストステロン水酸化中のDCF形成)
DCFHは、CYPが触媒した反応の代謝活性を測定する、ROS感受性蛍光性プローブとなることができる(図2)。しかしながら、本開示の主題をこの技術の使用に関して拡張し、(1)CYP基質 (テストステロン、又は他のCYP基質など)の存在下; 及び(2)蛍光産生の速度に影響するCYP阻害剤の存在下での蛍光の減少(すなわち、DCF形成)を定量化することによりCYP阻害剤を同定する。従って、(テストステロン、又は他のCYP基質などの)基質代謝中のCYP由来の蛍光産生における減少は、該基質の酸化的代謝を阻害する推定阻害剤を示唆する。組み換えCYP3A4ミクロソーム (CYP3A4、及びNADPH-CYP還元酵素)、NADPH、DCFH-DA、及びテストステロンを含有する反応物への、有力なCYP3A4阻害剤であるケトコナゾールの添加は、図3、4A、及び4Bに示すとおり、蛍光産生の減少をもたらした。また、デキストロメトルファン、及びキニジンなどの他のCYP3A4基質を含有するCYP3A4反応物への、ケトコナゾールの添加は、蛍光シグナルにおける著しい減少をもたらした(図3参照)。
【0047】
(該ROSに基づいた蛍光測定法を用いて、推定CYP3A4阻害剤のIC50を決定すること)
13化合物に関して、IC50 (酵素活性において50%減少をもたらす阻害剤濃度)値を計算した。これらの化合物のうち11は、公知のCYP3A4阻害剤であり、2化合物は、CYP3A4に対して公知の阻害活性を示さないネガティブコントロールとした。本明細書中で開示された該ROSに基づいた蛍光測定法を用いて、IC50値を測定し、これらの結果を、6β-ヒドロキシテストステロンを定量化する従来の方法 (6β-ヒドロキシテストステロン形成のLC-UV定量)を用いて計算されたIC50値と比較した。最も有力なCYP3A4阻害剤の1つであるケトコナゾールは、DCFH、及びテストステロン存在下での蛍光産生において濃度依存性減少をもたらした(図4A、及び4B参照)。該ROSに基づいた蛍光測定法、及び該従来の測定法を用いて、ケトコナゾール阻害のIC50値は、各々、25.7 nM、及び20.1 nMであった(図4A、及び4B、並びに表1参照)。両測定法を用いて調べた該13化合物に関して、IC50値を表1に示し、該蛍光測定法を用いてそれらの阻害能力に関する順番に列記している。ケトコナゾール以外に、該蛍光測定法を用いて決定された、20 μM 以下のIC50値をもつ6化合物を、中程度に有力なCYP3A4活性の阻害剤に分類した。この群の化合物中で、該従来の測定法を用いてもたらしたIC50値に相関を示さない唯一の阻害剤は、シクロスポリンであった。ニフェジピンに関する、蛍光対6β-ヒドロキシテストステロン産生における濃度依存性減少を、図5A、及び5Bに示し (該ROSに基づいた蛍光測定法、及び該従来の測定法において、各々、6.8 μM、及び3.8 μMのIC50値)、プロゲステロンに関しては、図6A、及び6Bに示す(該ROSに基づいた蛍光測定法、及び該従来の測定法において、各々、22.6 μM、及び27.6 μMのIC50値)。
【表1】

【0048】
プロゲステロン、エリスロマイシン、ベラパミル、及びプレドニゾロンを含む、13化合物のうち4つは、該蛍光測定法を用いて計算されたIC50に基づいて、CYP3A4活性の弱い阻害剤であった。この群の阻害剤の中で該蛍光IC50値と従来のIC50値との間に相関を示さない唯一の化合物は、エリスロマイシンであった。キニジン(図7A、及び7B参照)とスルファフェナゾールの両者から、どちらの方法を用いても(約100 μM以上のIC50値を持つことから決定されるとおり)、実質上阻害活性がないことが示された。
【0049】
(参考文献)
本明細書中に引用された全ての参考文献と同様、下記に列記された参考文献は、それらが、本明細書中で使用された方法論、技術、及び/又は組成物を補足する、説明する、その背景を提供する、又は教示する範囲内において、引用により本明細書に取り込まれるものとする。
【0050】
Birkettらの論文、Trends Pharmacol. Sci. 14:151-185 (1993).
Brennanの論文、Chem Eng News 5:63-73 (2000).
Crespiらの論文、Anal. Biochem. 248:188-190 (1997).
Donatoらの論文、 Anal. Biochem. 213:29-33 (1993).
Eastabrookの論文、FASEB J 10:202-204 (1996).
Guengerichの論文、FASEB J 6:667-668 (1992).
Guengerich、及びShimadaの論文、 Chem. Res. Toxicol. 4:391-407 (1991).
Kennedy、及びJonesの論文、Anal. Biochem. 222:217-223 (1994).
Parkinsonの論文、Toxicol. Pathol. 24:45-57 (1996).
Puntarulo、及びCederbaumの論文、Arch. Biochem. Biophys. 258: 510-518 (1987).
Rendic、及びDi Carloの論文、Drug Metab. Rev. 29:413-580 (1997).
Spatnegger、及びJaegerの論文、Drug Metab. Rev. 27:397-417 (1995).
米国特許第5,478,723号
米国特許第5,786,191号
米国特許第6,312,917号
Wrightonらの論文、Drug Metab. Rev. 25:453-484 (1993).
【0051】
当然のことながら、本明細書中に示された様々な詳細を、本開示の主題の範囲から離れることなく、変更できる。さらに、先の記載は、例示の目的のためであり、限定の目的のためではない。
【図面の簡単な説明】
【0052】
【図1】図1は、活性酸素種(OH-、O2-、及びH2O2など)を産生する、チトクロームP450代謝と関連する二次、又は副反応を図式化して示す。これらの活性酸素種は、指標化合物前駆体と反応するのに使用可能であり、指標化合物を産生し、それを様々な標準的技術を用いて検出することができる。
【図2】図2は、CYP触媒中のROS産生を検出するための、典型的な指標前駆体化合物、ジクロロジヒドロフルオレシン二酢酸塩(DCFH-DA)の使用を図式化して示す。DCHFH-DAは、細胞膜を越え、続いて、細胞エステラーゼにより脱アセチル化され、ジクロロジヒドロフルオレセイン(DCFH)を形成できる。DCFHは、ROSに対して反応性が高く、蛍光性産物、ジクロロフルオレセイン(DCF)を形成する。
【図3】図3は、(i) CYP3A4を介した、テストステロン、デキストロメトルファン、及びキニジンの代謝中の蛍光産生、及び(ii)蛍光産生の阻害におけるケトコナゾール(CYP3A4阻害剤)の効果を示す。無地のバーは、ケトコナゾール存在下での蛍光産生を表し、斜線のバーは、ケトコナゾール非存在下での蛍光産生を表す。
【図4】図4A、及び4B、5A、及び5B、6A、及び6B、並びに7A、及び7Bは、各々、ケトコナゾール、ニフェジピン、プロゲステロン、及びキニジンによる、CYP3A4を介したテストステロン代謝の阻害を示す。各組の図に関して、図Aは、産物(6β-ヒドロキシテストステロン)形成を定量化する従来のLC-UV法を用いた、IC50値の計算を示し、図Bは、本明細書中に開示されたROSに基づいた蛍光測定法を用いた、IC50値の計算を示す。各図において、X 軸は、対数目盛上にプロットされた阻害剤の濃度を表し、y軸は、阻害剤非存在下で検出された蛍光の量を100%に設定して、検出された蛍光パーセントを示す。
【技術分野】
【0001】
(関連出願の相互参照)
この出願は、2004年4月5日に出願された米国仮出願第60/559,570号に基づき、優先権を主張し、その全体が、引用により本明細書中に取り込まれるものとする。
(技術分野)
本開示の主題は、チトクロームP450を阻害する能力に関して候補化合物をスクリーニングする方法に関する。特に、本開示の主題は、そのような候補化合物のチトクロームP450に対する阻害能力を測定する方法に関する。
【0002】
(略語表)
CYP-チトクロームP450
CYP1A2-チトクロームP450 1A2
CYP2B6-チトクロームP450 2B6
CYP2C8-チトクロームP450 2C8
CYP2C9-チトクロームP450 2C9
CYP2C19-チトクロームP450 2C19
CYP2D6-チトクロームP450 2D6
CYP2E1-チトクロームP450 2E1
CYP3A4-チトクロームP450 3A4
CYP3A5-チトクロームP450 3A5
CYP3A7-チトクロームP450 3A7
DCFH-2',7'-ジクロロジヒドロフルオレシン
DCFH-DA-2',7'-ジクロロジヒドロフルオレシン二酢酸塩
DCF-2',7'-ジクロロフルオレセイン
EDTA-エチレンジアミン四酢酸
FDA-米国食品医薬品局
HPLC-高速液体クロマトグラフィー
IC50-酵素活性を50%阻害するために必要な阻害剤濃度
LC-UV -液体クロマトグラフィー‐紫外線[測定法]
NADP+ -ニコチンアミドアデニンジヌクレオチドリン酸
NADPH-ニコチンアミドアデニンジヌクレオチドリン(還元型)
ROS-活性酸素種
UV-紫外線
【背景技術】
【0003】
(背景)
チトクロームP450 (CYP)系は、膜結合型ヘム含有混合機能オキシゲナーゼのスーパーファミリーであり、薬剤、環境化学物質、及び内因性化合物の代謝に関する主要酵素系である (Guengerichの論文、FASEB J 6:667-668 (1992); Eastabrookの論文、FASEB J 10:202-204 (1996); Rendic、及び Di Carloの論文、Drug Metab. Rev. 29:413-580 (1997))。これらの酵素は多くの組織で発現されているが、哺乳動物では、肝臓で最高のレベルで見い出されている。肝臓で発現された薬剤を代謝する11のCYPアイソフォームの中で、 これらのアイソフォームの5つ(CYP1A2、CYP2C9、CYP2C19、CYP2D6、及びCYP3A4)が大部分の医薬品の代謝に関与している。従って、CYPは、薬剤分子の代謝的変換を触媒し、それは、薬剤が体内から除去される重要な過程に相当する。
【0004】
2つ以上の薬剤が患者に併用することは、かなり一般的であり、薬剤‐薬剤相互作用が生じる可能性を増加させる。多くの薬剤‐薬剤相互作用は、代謝に基づくものであり、同一酵素に対して競合する2つ以上の薬剤によって生じ、これらの相互作用の大部分にはCYPが関与する。従って、第二の薬剤が、その第一の薬剤の代謝除去に関与する酵素と競合するならば、薬剤のはるかに高い血漿中濃度が達成される。狭い治療係数を有する薬剤に関しては、これは有害反応をもたらし得る。この問題を取り巻く重要性は、米国には年間起きる推定2百万の深刻な薬剤有害反応があり、そのうち100,000が致死性であることを考慮すると、より明らかである(Brennanの論文、Chem Eng News 5:63-73 (2000);米国食品医薬品局(FDA)ウェブサイト"予防可能な薬剤有害反応:薬剤相互作用への着目"の項目も参照されたい)。これらの問題から、薬剤発見/開発の間の初期に薬剤安全性を評価し、かつ望ましくない薬剤相互作用の可能性を示し得る化合物を同定し、排除する必要性が促されている。特に、後に安全性の問題のため薬剤を市場から排除しなければならないならば、薬剤発見の間に新薬剤候補の安全性を評価することにより、かなりの量の時間とお金を節約でき、かつ患者を不必要な危険に晒すことを防ぐことができる。
【0005】
CYP阻害を評価する数種類の測定法が利用でき、(1)液体クロマトグラフィー/質量分析法、(2)蛍光に基づいた方法、及び (3)放射性同位体に基づいた方法などの、新薬剤候補の阻害能力を評価する様々な戦略を用いている。 ADDIN ENRfu Crespiらの論文 (Anal. Biochem. 248:188-190 (1997))には、マイクロタイタープレートに基づいた蛍光測定法を使用し、CYP3A4、及びCYP1A2などの、いくつかの主要な生体異物代謝をするCYPアイソザイムの阻害を評価するCYP阻害剤測定法が記載されている。また、同様の測定法は、Kennedy、及びJonesの論文(Anal. Biochem. 222:217-223 (1994))、及びDonatoらの論文(Anal. Biochem. 213:29-33 (1993))に記載されている。これらの測定法を用いて、可能性がある薬剤候補のCYPと相互作用する能力を、蛍光性産物を産生するモデル基質の代謝における相対的な阻害効果に基づいて順位付けすることができる。これらの測定法は、高速液体クロマトグラフィー(HPLC)などの他の公知の方法に比べて相対的に速い。しかしながら、これらの測定法は、特定のプローブ基質の使用を必要とするという点において深刻な制限に悩まされ、従って、所定の候補化合物の、複数の基質に対するCYP代謝活性を阻害する能力を評価するのに容易に適応できない。これらの測定法は、該同一阻害剤を別の基質と用いるとき、CYP3A4などの特定のCYPが、劇的に異なる阻害プロフィールを示す(例えば、IC50により測定される)という事実により、さらに制限される。従って、現在のCYP 阻害測定法には、特定のプローブ基質の使用が必要とされ、かつ別の基質を選択する柔軟性は許されない。
【発明の開示】
【発明が解決しようとする課題】
【0006】
従って、単一の労力で、多くの化合物の、CYP による基質の代謝を阻害する能力に関するスクリーニングを可能にする測定法などの、改良測定法が必要である。
【課題を解決するための手段】
【0007】
(要約)
この要約には、本開示の主題のいくつかの実施態様が列記され、多くの場合、これらの実施態様の変形、及び置換が列記されている。この要約は、その多数多様の実施態様の単なる典型にすぎない。所定の実施態様の1つ以上の代表的な特徴の言及は、同様に典型である。通常、そのような実施態様は、言及された特徴の有無に関わらず存在し得る;同様に、それらの特徴を、この要約に列記されているかいないかに関わらず、本開示の主題の実施態様に適応させることができる。過剰な反復を避けるために、この要約では、そのような特徴のすべての可能な組合せは列記されたり、示されていない。
【0008】
本開示の主題は、チトクローム P450を阻害する能力に関して、候補化合物をスクリーニングする方法を提供する。いくつかの実施態様において、該方法は、(a)チトクローム P450基質、及びチトクローム P450を阻害する能力を有すると推測される候補化合物を提供すること;(b) 該候補化合物、該チトクロームP450基質、指標化合物前駆体、該チトクロームP450、及びNADPH、又はNADPH再生系を混合すること、ここにおいて、該チトクロームP450の主要代謝活性が副反応において化学種を産生する;(c)該副反応において該化学種を産生させること、それにより該化学種の画分が該指標化合物前駆体と反応し、指標化合物を産生する;及び(d)該候補化合物の存在下で産生される指標化合物の量を、該候補化合物の非存在下で産生される指標化合物の量と比較すること、該比較が、該チトクロームP450を阻害する該候補化合物の能力を示す;を含む。いくつかの実施態様において、該酵素の主要代謝活性による該副反応において産生された該化学種は、活性酸素種を含む。実施態様において、該指標化合物前駆体は、蛍光性化合物、発色化合物、化学発光化合物、及びそれらの組合せからなる群から選択される。いくつかの実施態様において、該指標化合物前駆体は蛍光性化合物である。いくつかの実施態様において、工程(a)から(c)を、マルチウェルプレートの少なくとも1つのウェル中で行う。
【0009】
いくつかの実施態様において、さらに、本開示の方法は、さらに、複数の候補化合物を、チトクロームP450を阻害する能力に関して同時にスクリーニングすることを含む。いくつかの実施態様において、工程(a)から(c)を、マルチウェルプレートの複数のウェル中で行う。
【0010】
該簡便法のいくつかの実施態様において、該チトクローム P450は、CYP1A、CYP2B、CYP2C、CYP2D、CYP2E、CYP3A、及びそれらの組合せからなる群から選択される。実施態様において、該基質は、CYP1A基質、CYP2B基質、CYP2C基質、CYP2D基質、CYP2E基質、CYP3A基質、及びそれらの組合せからなる群から選択される。いくつかの実施態様において、該CYP3A4基質は、テストステロン、ミダゾラム、キニジン、及びベラパミルからなる群から選択される;該CYP1A2基質はフェナセチンである;該CYP2C9基質は、ジクロフェナク、及びトルブタミドからなる群から選択される;該CYP2D6基質は、ブフラロール、イミプラミン、及びデキストロメトルファンからなる群から選択される;該CYP2C19基質は、オメプラゾール、及びS-メフェニトインからなる群から選択される;かつ/或いは該CYP2E1基質はクロルゾキサゾンである。
【0011】
いくつかの実施態様において、該チトクロームP450はヒトチトクローム P450を含む。実施態様において、該ヒトチトクローム P450は、CYP1A2、CYP2B6、CYP2C8、CYP2C9、CYP2C19、CYP2D6、CYP2E1、CYP3A4、CYP3A5、CYP3A7、及びそれらの組合せからなる群から選択される。いくつかの実施態様において、該ヒトチトクローム P450はCYP3A4である。
【0012】
実施態様において、さらに、該簡便法が、該候補化合物の存在下で産生された指標化合物の量を定量化することを含む。いくつかの実施態様において、該簡便法がさらに、ある期間にわたって形成された指標化合物を定量化し、それにより、該候補化合物の該チトクローム P450に対する阻害能力を決定することを含む。
【0013】
また、本開示の主題は、候補化合物のチトクローム P450に対する阻害能力を決定する方法を提供する。いくつかの実施態様において、該方法は、(a)チトクロームP450基質、及びチトクロームP450を阻害する能力を有すると推測される候補化合物を提供すること;(b) 該候補化合物、該チトクロームP450基質、指標化合物前駆体、該チトクロームP450、及びNADPH、又はNADPH再生系を混合すること、ここにおいて、チトクロームP450の主要代謝活性が副反応において化学種を産生する;(c)該副反応において該化学種を産生させること、それにより該化学種の画分が該指標化合物前駆体と反応し、指標化合物を産生する;(d)該指標化合物が該候補化合物の存在下で産生される速度を定量化すること;及び(e)該チトクロームP450の主要代謝活性を設定量低下させる、該候補化合物の濃度を測定し、それにより、該化合物の該チトクロームP450に対する阻害能力を決定することを含む。
【0014】
該簡便法のいくつかの実施態様において、該チトクローム P450は、CYP1A、CYP2B、CYP2C、CYP2D、CYP2E、CYP3A、及びそれらの組合せからなる群から選択される。いくつかの実施態様において、該基質は、CYP1A基質、CYP2B基質、CYP2C基質、CYP2D基質、CYP2E基質、CYP3A基質、及びそれらの組合せからなる群から選択される。実施態様において、該CYP3A4基質は、テストステロン、ミダゾラム、キニジン、及びベラパミルからなる群から選択される。実施態様において、該CYP1A2基質はフェナセチンである。いくつかの実施態様において、該CYP2C9基質は、ジクロフェナク、及びトルブタミドからなる群から選択される。いくつかの実施態様において、該CYP2D6基質は、ブフラロール、イミプラミン、及びデキストロメトルファンからなる群から選択される。いくつかの実施態様において、該CYP2C19基質は、オメプラゾール、及びS-メフェニトインからなる群から選択される。いくつかの実施態様において、該CYP2E1基質はクロルゾキサゾンである。
【0015】
該簡便法のいくつかの実施態様において、該チトクローム P450はヒトチトクローム P450を含む。いくつかの実施態様において、該ヒトチトクローム P450は、CYP1A2、CYP2B6、CYP2C8、CYP2C9、CYP2C19、CYP2D6、CYP2E1、CYP3A4、CYP3A5、CYP3A7、及びそれらの組合せからなる群から選択される。いくつかの実施態様において、該ヒトチトクロームP450はCYP3A4である。
【0016】
いくつかの実施態様において、該酵素の主要代謝活性による該副反応において産生された該化学種は、活性酸素種を含む。いくつかの実施態様において、該指標化合物前駆体は、蛍光性化合物、発色化合物、化学発光化合物、及びそれらの組合せからなる群から選択される。いくつかの実施態様において、該指標化合物は蛍光性化合物である。
【0017】
該簡便法のいくつかの実施態様において、工程(a)から(c)をマルチウェルプレートの少なくとも1つのウェル中で行う。いくつかの実施態様において、工程(a)から(c)をマルチウェルプレートの複数のウェル中で行う。
【0018】
いくつかの実施態様において、該設定量は、25%、33%、50%、67%、75%、及び90%からなる群から選択される。
いくつかの実施態様において、さらに、該簡便法は、複数の候補化合物の阻害能力を、同時に測定することを含む。いくつかの実施態様において、さらに、該簡単な方法は、該指標化合物が該候補化合物の存在下で産生される速度を、定量化することを含む。
【0019】
従って、本開示の主題の目的は、候補化合物を、チトクローム P450を阻害する能力に関してスクリーニングする方法を提供することである。この目的は、本開示の主題により、全体、又は一部において達成される。
本開示の主題の目的は、先に本明細書中に記載されてきており、他の目的は、本明細書中、下記に最善に記載のとおり、その説明が進むにつれ明らかになるであろう。
【発明を実施するための最良の形態】
【0020】
(詳細な説明)
(I. 概論)
ヒトCYPの中で、CYP3A4は、他のどのCYPより、より多くの薬剤の代謝の最終的結末に影響を及ぼす。結果として、この酵素の強力な阻害剤は、共投与される可能性がある多くの薬剤の動態に有意に影響し得る。従って、多くの製薬会社は、薬剤候補のCYP3A4に対する阻害能力を評価するスクリーニングを実施してきている。これらの測定法は、液体クロマトグラフィー−紫外線(LC-UV)、蛍光に基づいた方法、及び放射性同位体に基づいた方法を含む。通常、試験化合物の阻害能力は、CYP 活性を評価するために用いられるプローブ基質には依存しないという仮定の下に、候補化合物によるCYPの阻害を、特定のプローブ基質に対して評価する。しかしながら、この仮定は正確でなく、特にCYP3A4は、異なる基質を用いたとき同一の阻害剤が複数のIC50値を示すという点で例外である。それは、その活性部位内で複数の基質に同時に結合するこのアイソフォームの能力に起因し得る。既存のCYP阻害を評価する蛍光に基づいた測定法、及び放射測定法では、特定の非"薬剤様"プローブ基質を必要が必要とされ、従って、別の、及び/又は複数の基質を選択する柔軟性は許されない。
【0021】
(II. 定義)
他に定義されていなければ、本明細書中で用いられたすべての技術、及び科学用語は、本開示の主題に関連する当業者に一般的に理解されるとおり同じ意味を持つ。本明細書の明確さのために、特定の定義を本明細書中、下記に示す。
下記の用語は、当業者によく理解されていると考えられるが、下記の定義を記載し、本開示の主題の説明を容易にする。
【0022】
長年の特許法の慣習を受けて、"ある(a)"、及び"ある(an)"という用語は、請求項を含めてこの本出願で用いられるときは、"1つ以上"を意味する。従って、"基質 (a substrate)"という用語は、本明細書中では、1つ以上の基質のことをいうことと理解され、"CYP2C (a CYP2C)"は、本明細書中では、CYP2C のサブファミリーの1つ以上のメンバーのことをいうことと理解される。
【0023】
本開示の主題のいくつかの実施態様において、チトクロームP450を阻害する能力に関して候補化合物をスクリーニングする方法を提供する。該方法は、チトクロームP450(CYP)を阻害する能力を有すると推測される候補化合物、該CYP基質、及び指標化合物前駆体を、CYP生物活性を支持する条件下で(実施態様によっては、NADPH、又はNADPH再生系の存在下で)、該CYP と反応させること、ここにおいて、該CYPの主要代謝活性が副反応において化学種を産生する;該副反応において該化学種を産生させること、それにより該化学種の画分が該指標化合物前駆体と反応し、指標化合物を産生する; 及び該候補化合物の存在下で産生された指標物質の量を、該候補化合物の非存在下での同一条件下で産生された指標化合物と比較すること;を含む。該候補化合物の存在下で産生された指標化合物の量を、その非存在下で産生された量と比較することにより、該候補化合物の該CYPを阻害する能力を決定する。いくつかの実施態様において、該方法が、該候補化合物の存在下で産生された指標化合物の量を定量化することを含む。
【0024】
"候補化合物"という用語は、化合物のCYP を阻害する能力の特徴づけが興味深い、任意の化合物のことを言うものとする。そのようなものとして、"候補化合物"と"チトクロームP450阻害剤"という用語を、本明細書中で、置き換え可能に用いる。典型的な候補化合物は、薬剤などの生体異物、及び他の治療薬を含み、例を挙げると小分子があるが、それらに限定されない。典型的な候補化合物には、ケトコナゾール、ネルフィナビル、シクロスポリン、サキナビル、ニフェジピン、ジルチアゼム、オメプラゾール、プロゲステロン、エリスロマイシン、ベラパミル、及びプレドニゾロンなどがある。
【0025】
"チトクロームP450"という用語は、ステロイド、脂肪酸、及びプロスタグランジンなどの生物体内生物と同様に、薬剤、発癌物質、及び環境汚染物質などの生体異物を代謝できる、ヘムタンパク質酵素の大きなファミリー(よく"スーパーファミリー"と呼ばれる)のことを言うものとする。本明細書中で使われるこれらの用語は、起源の種類に関わらず、該CYP スーパーファミリーの全メンバーを含むものとする。従って、これらの用語は、微生物、無脊椎動物、及び脊椎動物起源のCYPスーパーファミリーメンバーのことを言うものとする。いくつかの実施態様において、これらの用語は、鳥類、及び哺乳動物などの温血脊椎動物種のCYP のことを言う。従って、CYPの典型的な起源には、ウシ、ブタ、ヒツジ、イヌ、ネコ、ウマ、ネズミ、及びトリ起源などがある。いくつかの実施態様において、これらの用語は、ヒト起源のCYPのことを言う。
【0026】
該CYPスーパーファミリーの全てのアイソザイム、又はアイソフォームを、本明細書中で用いられる"チトクロームP450"、及び"CYP"という用語の範囲内に入るように意図する。特に意図されたCYPアイソフォームは、これらに限定されないが、CYP1A、CYP2B、CYP2C、CYP2D、CYP2E、及びCYP3Aファミリーのメンバーなどであるのは、これらのアイソフォームがヒトにおける薬剤の代謝に最も一般的に関与するものと同定されているためである。さらなるCYPスーパーファミリーメンバーは米国特許第5,786,191号、及び第5,478,723号に記載されており、その各々の内容は、引用により本明細書中に取り込まれるものとする。
【0027】
"化学種"、及び"化学副産物"という用語は、選択された酵素の主要代謝活性と関連する副反応、又は二次反応から形成される種、又は副産物のことを言うこととする。さらに、"化学種"、及び"化学副産物"という用語は、該酵素の該代謝活性と関連する該二次反応、又は副反応から産生された該種、又は副産物が、本開示の主題の該方法に従って、指標化合物前駆体と反応できることを特徴とする。
典型的な化学種は、CYPスーパーファミリー酵素などののいくつかの酵素の副反応から産生された"活性酸素種"、又は"ROS"を含む。典型的なROSは、スーパーオキシド陰イオン(O2-)、過酸化水素(H2O2)、及びヒドロキシルラジカル(OH-)を含む。
【0028】
"指標化合物前駆体"という用語は、該酵素の代謝活性と関連する該副反応から産生された化学種と反応する、化合物のことを言うこととする。"指標化合物"という用語は、該指標化合物前駆体と該化学種の反応により産生された化合物のことを言うこととする。先に記載のとおり、該指標化合物の存在から、該選択された酵素による代謝に対する該候補化合物の感受性が示される。好ましい指標化合物は、蛍光、又は化学発光分光光度法、比色法、及びそのような標準検出技術を用いて、容易に検出可能である。
【0029】
従って、典型的な指標化合物前駆体は、蛍光性/蛍光化合物、化学発光化合物、発色指標化合物、及びそれらの組合せに変換される化合物などであるが、それらに限定されない。特に意図された指標化合物前駆体/指標化合物系は、蛍光性プローブ、2',7'-ジクロロジヒドロフルオレシン二酢酸塩 (DCFH-DA)、及びその蛍光対応物、2',7'- ジクロロフルオレセイン(DCF)を含む。しかしながら、他の指標化合物前駆体/指標化合物系を用いることができ、例を挙げると、ジヒドロローダミン123/ローダミン123、及びジヒドロエチジウム/エチズムがあるが、それらに限定されない。
【0030】
本開示の主題の実施態様において、CYPをCYP基質に反応させる。本明細書中で使われる"CYP基質"という句は、結合し、CYPの主要代謝活性の結果として、副反応において化学種を産生することに作用できる、任意の基質のことを言う。典型的なCYP基質は、テストステロン、ミダゾラム、キニジン、及びベラパミル(CYP3A4);フェナセチン(CYP1A2);ジクロフェナク、及びトルブタミド(CYP2C9);ブフラロール、イミプラミン、及びデキストロメトルファン(CYP2D6);オメプラゾール、及びS-メフェニトイン(CYP2C19);及びクロルゾキサゾン(CYP2E1)を含む。本開示の主題の該方法で使用することができる、他の医学関連のチトクロームP450基質と同様に、チトクローム P450阻害剤、及び誘導剤は、インディアナ大学医学部のDavid Flockhart博士により維持され、インディアナ大学‐パデュー大学インディアナポリス校ウェブページからアクセス可能である("薬剤相互作用"を検索されたい)、ワールドワイドウェブページに列記されたものを含むが、それらに限定されない。また、特定の分子が、特定の状況下では阻害剤として、特定の状況下では基質として働くことを提供する。例えば、特に特定の薬剤‐薬剤相互作用の場合、ある薬剤は、それが結合し、CYPにより代謝されるので、CYPの基質として考慮できる。また、その同一の薬剤は、第二の薬剤と併用して存在するときは、そのCYPとの相互作用により、その同一のCYPの該第二の薬剤を代謝する能力、又は該第二の薬剤を代謝される速度が減少するので、阻害剤と考慮できる。これは、任意の機構により起こり得る。例えば、第一と第二の薬剤が同一の活性部位に結合し、該第一の薬剤がより高い結合親和性を有する場合、又は第一と第二の薬剤が異なる活性部位に結合するが、該第一の薬剤のその活性部位への結合が、該第二の薬剤が結合する筈の該活性部位に接近不能にする場合がある。
【0031】
本明細書中で使われるNADPH とは、CYP活性の補因子であるニコチンアミドアデニンジヌクレオチドリン酸の還元型のことを言う。この化合物を、該反応に直接加えるか、或いはNADPH 再生系を用いて産生することができる。該再生系は、NADP+、及びこの化合物をNADPH に還元できる酵素系からなる。典型的なNADPH再生系は、NADP+、グルコース-6-リン酸、及びグルコース-6-リン酸デヒドロゲナーゼを含む;しかしながら、該再生酵素/基質系は、特にこれらに限定されない。従って、本開示の主題の実施態様において、NADPH再生系は、CYP生物活性を支持する反応条件の要素を含み、実施態様において、NADPH再生系は、CYP生物活性を支持する反応条件の複数の要素を含む。
【0032】
本明細書中で使われる"比較する"という用語、及びその文法的変形は、産生された指標化合物の量を評価することを言うことができる。そのようなものとして、該用語は、定量的測定(例えば検出された蛍光単位数)、又は定性的測定(例えば、いくらかの指標化合物を産生するものとして、視覚的、又は別のやり方で一実験を1つ以上の他のものと関係づける)のことを言う。さらに、比較することとは、標準に対する測定のことを言う。例えば、比較することとは、阻害剤存在下での産生(蛍光など)の、阻害剤非存在下でのその同一の産生の測定と相対的な測定のことを言うことができ、ここで、後者を100%に設定し、前者を該後者のパーセントとして測定できる。実施態様において、また、比較することとは、"より濃い"か"より薄い"、又は"より多い"か"より少ない"などの単純な相対測定のことを言う。
【0033】
本明細書中で使われる"定量化する"という用語、及びその文法的変形は、産生された指標化合物の量を決定することを言う。そのように、該用語は、(検出された蛍光単位の数値などの)定量的な測定のことを言うことができる。さらに、定量化することとは、標準と相対的な量を測定することを言うことができる。
【0034】
本明細書中で使われる"阻害する"という用語は、CYPとの反応における候補化合物に関して用いられる場合は、該CYPの活性における減少をもたらす該候補化合物の能力のことを言う。しかしながら、特定の条件下(極めて低濃度の阻害剤などの)で、阻害剤がCYPの活性の増大をもたらし得ることが理解されている。これらの状況下で、候補化合物は、ある最低限の濃度に達した後、該候補化合物が、指標化合物に変換される指標化合物前駆体の量の減少をもたらすことができるならば、阻害剤と見なされる。
【0035】
本開示の主題のいくつかの実施態様において、候補化合物のCYPに対する阻害能力を決定する方法を提供する。いくつかの実施態様において、該方法は、CYP基質、及びCYPを阻害する能力を有すると推測される候補化合物を提供すること;該候補化合物、該CYP基質、指標化合物前駆体、及び該CYPを、CYP生物活性を支持する条件下で(いくつかの実施態様では、NADPH、又はNADPH再生系の存在下で)混合すること、ここにおいて、該CYPの主要代謝活性が副反応において化学種を産生する;該副反応において該化学種を産生させること、それにより該化学種の画分が該指標化合物前駆体と反応し、指標化合物を産生する;及び該CYPの主要代謝活性を設定量低下させる、該候補化合物の濃度を測定し、それにより、該化合物のCYPに対する阻害能力を決定することを含む。いくつかの実施態様において、さらに、該方法は、該指標化合物が該候補化合物の存在下で産生される速度を定量化することを含む。
【0036】
本明細書で使われる"阻害能力"という用語は、候補化合物のCYP を設定量など阻害する能力のことを言う。本明細書中で使われる"設定量"という語句は、該候補化合物の非存在下での該CYP の活性に対する所定の量のことを言う。設定量は、該CYP の該活性のパーセントなどであり得る。典型的な設定量は、ある条件下の該CYPの活性の25%、33%、50%、67%、75%、及び90%などであるが、それらに限定されない。いくつかの実施態様において、阻害能力とは、ある条件下で該CYPの該活性を50%低下させるために必要な、該候補化合物の濃度(すなわち、IC50値)のことを言う。
【0037】
本開示の主題の方法を、当技術分野で周知のとおり、96ウェルマイクロタイタープレートなどの標準マルチウェル測定プレート内で行うことができることを意図している。従って、複数の候補化合物を、マルチウェルプレートの複数のウェル内で、CYPを阻害する能力に関して同時にスクリーニングすることができる。さらに、マルチウェルプレート、又は他の複数の貯留デバイスの使用により、個々の候補化合物のいくつかの、又は多くの濃度を、同一か、異なる基質のどちらか、及び/又はCYPスーパーファミリーメンバーで同時に測定することが可能になり得る。
【0038】
本開示の主題の開示から当業者にとって明らかなとおり、本開示の主題の該方法を、細胞フリー反応、及び/又は細胞に基づいたインビトロ反応で行うことができることも意図している。本開示の主題の該方法に従って改良に適した、典型的な細胞に基づいたインビトロプラットフォームは、Parkinsonの論文(Toxicol. Pathol. 24:45-57 (1996))に記載されている。また、本開示の主題の開示から当業者にとって明らかなとおり、本開示の主題の該方法は、指標化合物前駆体‐指標化合物の他の組み合わせに利用できることを意図する。例えば、第二鉄-EDTAは、活性酸素種の存在下で化学発光産物を生じさせることができる、指標化合物前駆体であることを意図する(Puntarulo、及びCederbaumの論文、Arch. Biochem. Biophys. 258: 510-518 (1987))。
【実施例】
【0039】
下記の実施例を、本開示の主題の典型的な様式を例示するために盛り込んでいる。本開示、及び当技術分野の一般的な水準を考慮して、当業者は、下記の実施例は典型例に過ぎないことを意図すること、及び本開示の主題の精神、及び範囲から離れることなく、多くの変更、改良、及び修正を行うことができることを認識するであろう。
【0040】
(実施例で用いられた材料)
1'-ヒドロキシミダゾラム、及び組み換え異種発現されたヒトCYPとNADPH CYP還元酵素を含有する、バキュロウイルス感染昆虫細胞から調製されたミクロソーム(SupersomesSYMBOL 228 \f "Symbol" \s 11) をGenTest社(Woburn、Massachusetts、米国)から購入した。6β-ヒドロキシテストステロン、及び11α-ヒドロキシプロゲステロンをSteraloids社(Wilton、New Hampshire、米国)から調達した。テストステロン、ミダゾラム、ケトコナゾール、イトラコナゾール、ミコナゾール、フラフィリン、ニフェジピン、ベラパミル、プロゲステロン、 ジルチアゼム、エリスロマイシン、プレドニゾロン, シクロスポリンA、オメプラゾール、キニジン、スルファフェナゾール、β-ニコチンアミドアデニンジヌクレオチドリン酸還元型四ナトリウム塩(β-NADPH)、及び2',7'-ジクロロジヒドロフルオレセイン二酢酸塩をSigma Chemical社(St. Louis、Missouri、米国)から購入した。2',7'-ジクロロフルオレセイン(DCF)をAldrich Chemical社(Milwaukee、Wisconsin、米国)から調達した。
【0041】
(ジクロロジヒドロフルオレセイン(DCFH-DA)酸化により測定された、CYP3A4を介したテストステロンの酸化の阻害)
DCFH-DA (2.5 mM)、及びNADPH (20 mM)のストック溶液を、各々メタノール、及び緩衝液中で各実験前に調製した。基質、及び阻害剤を、100%メタノール中で調製し、-20℃で保存した。他に特に明記しなければ、反応混合物は、2.5 μM DCFH-DA、50 pmol/ml CYPミクロソーム、及び50 mM トリス、又は100 mM リン酸カリウム緩衝液(3.3 mM MgCl2で補充されたpH 7.4)を含み、最終容積を200 μlにした。他に示さなければ、テストステロンを、最終濃度40 μMで、該反応物に加えた。等量のメタノールを、基質を含まない試料に加え、コントロールとした。反応を、37℃で96ウェル黒底プレート中で行った。阻害剤は、水、又はメタノール中で調製されたストック溶液から、様々な濃度で加えた。最終メタノール濃度を試料間で一定(1%、v/v)に保ち、メタノールのCYP 活性における効果による蛍光産生の速度におけるばらつきを排除した。反応物を、予め暖められたNADPH (最終濃度 1 mM)の添加以前に、37℃暗所で、振動を与えず、5分間予めインキュベートした。蛍光を、Molecular Devices蛍光マイクロプレートリーダー (Molecular Devices社、Sunnyvale、California、米国)を用いて、下記のパラメータで 5分間隔で1時間にわたって測定した;励起波長=500 nm、発光波長=529 nm、光学位置=上部、温度=37℃、プレート形式=黒底 96ウェル。該反応物中のDCF 濃度を、純正DCF で作図された標準曲線を用い、測定した。
【0042】
CYP3A4を介したテストステロンの酸化の阻害を、6β-ヒドロキシテストステロンの形成により測定した。CYP3A4による 6β-ヒドロキシテストステロン形成の反応速度を測定し、蛍光産生の速度と比較した。反応物は、様々な濃度のテストステロン、1ml当たり50 pmol のCYP3A4、及び緩衝液からなり、最終容積を1ミリリットルにした。反応を37℃で行い、1 mM NADPHの添加で開始した。分割量試料(200 μl)を、NADPH添加後0、10、及び30分後に取り、100 μlの4.5 μM 11α-ヒドロキシプロゲステロン(HPLC 内部標準)含有アセトニトリルの添加で終了させた。試料を速やかに氷上に置き、沈殿したタンパク質を、13,000 rpmで4分間遠心分離し、除去した。上清を、分析用にHPLCバイアルに移した。
【0043】
HPLC分析を、オンラインUV検出器を装備されたAgilent 1100シリーズHPLCシステム (Agilent Technologies社、Palo Alto、California、米国)を用いて行った。テストステロン、及びその代謝物である6β-ヒドロキシテストステロンを、28℃に維持したKeystoneアクアシル(Aquasil)C18 カラム(150 x 4.6 mm、粒子径5 m;Keystone Scientific社、Bellefonte、Pennsylvania、米国)上で分離した。該カラムに、毎分1ミリリットルの流速で、水/アセトニトリル/メタノール(63:2:35 v/v)の移動相で開始し、水/アセトニトリル/メタノール(18:2:80 v/v)で終了する勾配を15分間かけ、その後、後者の緩衝液を用いて3分間定組成条件にした。分析物を242 nmで検出し、定量化した。テストステロン、6β-ヒドロキシテストステロン、及び11α-ヒドロキシプロゲステロンの保持時間は、各々、約10.8、13.1、及び15.4分であり、純正標準を用いて確認した。すべての実験を、3回ずつ行った。
【0044】
(データ解析)
IC50値(CYP 活性において50%減少をもたらす阻害剤濃度)をXLfit 4 (ID Business Solutions社、Emeryville、 California、米国)を用いて計算した。データをシグモイド用量‐反応モデルに適合させた。
【0045】
(実施例の考察)
(ジクロロジヒドロフルオレシンの、CYP 代謝中に産生された活性酸素種との相互作用)
長い間、活性酸素種(ROS)は、該チトクローム P450 (CYP)触媒サイクルの副産物と同定されてきており、活性化酸素の解離から、その基質への取り込み、又は水への還元以前に生じる(図1参照)。ジクロロジヒドロフルオレシン二酢酸塩(DCFH-DA)を用いて、CYP触媒中のROS 産生を検出する技術は、米国特許第6,312,917号に記載されている。DCFH-DAは親油性分子であり、細胞膜を容易に越え、続いて、細胞エステラーゼにより脱アセチル化され、ジコロジヒドロフルオレセイン(DCFH)を形成する。DCFHは、ROSに対して反応性が高く、従って、高蛍光性産物、ジクロロフルオレセイン(DCF;図2参照)を形成する。
【0046】
(CYP3A4を介したテストステロン水酸化中のDCF形成)
DCFHは、CYPが触媒した反応の代謝活性を測定する、ROS感受性蛍光性プローブとなることができる(図2)。しかしながら、本開示の主題をこの技術の使用に関して拡張し、(1)CYP基質 (テストステロン、又は他のCYP基質など)の存在下; 及び(2)蛍光産生の速度に影響するCYP阻害剤の存在下での蛍光の減少(すなわち、DCF形成)を定量化することによりCYP阻害剤を同定する。従って、(テストステロン、又は他のCYP基質などの)基質代謝中のCYP由来の蛍光産生における減少は、該基質の酸化的代謝を阻害する推定阻害剤を示唆する。組み換えCYP3A4ミクロソーム (CYP3A4、及びNADPH-CYP還元酵素)、NADPH、DCFH-DA、及びテストステロンを含有する反応物への、有力なCYP3A4阻害剤であるケトコナゾールの添加は、図3、4A、及び4Bに示すとおり、蛍光産生の減少をもたらした。また、デキストロメトルファン、及びキニジンなどの他のCYP3A4基質を含有するCYP3A4反応物への、ケトコナゾールの添加は、蛍光シグナルにおける著しい減少をもたらした(図3参照)。
【0047】
(該ROSに基づいた蛍光測定法を用いて、推定CYP3A4阻害剤のIC50を決定すること)
13化合物に関して、IC50 (酵素活性において50%減少をもたらす阻害剤濃度)値を計算した。これらの化合物のうち11は、公知のCYP3A4阻害剤であり、2化合物は、CYP3A4に対して公知の阻害活性を示さないネガティブコントロールとした。本明細書中で開示された該ROSに基づいた蛍光測定法を用いて、IC50値を測定し、これらの結果を、6β-ヒドロキシテストステロンを定量化する従来の方法 (6β-ヒドロキシテストステロン形成のLC-UV定量)を用いて計算されたIC50値と比較した。最も有力なCYP3A4阻害剤の1つであるケトコナゾールは、DCFH、及びテストステロン存在下での蛍光産生において濃度依存性減少をもたらした(図4A、及び4B参照)。該ROSに基づいた蛍光測定法、及び該従来の測定法を用いて、ケトコナゾール阻害のIC50値は、各々、25.7 nM、及び20.1 nMであった(図4A、及び4B、並びに表1参照)。両測定法を用いて調べた該13化合物に関して、IC50値を表1に示し、該蛍光測定法を用いてそれらの阻害能力に関する順番に列記している。ケトコナゾール以外に、該蛍光測定法を用いて決定された、20 μM 以下のIC50値をもつ6化合物を、中程度に有力なCYP3A4活性の阻害剤に分類した。この群の化合物中で、該従来の測定法を用いてもたらしたIC50値に相関を示さない唯一の阻害剤は、シクロスポリンであった。ニフェジピンに関する、蛍光対6β-ヒドロキシテストステロン産生における濃度依存性減少を、図5A、及び5Bに示し (該ROSに基づいた蛍光測定法、及び該従来の測定法において、各々、6.8 μM、及び3.8 μMのIC50値)、プロゲステロンに関しては、図6A、及び6Bに示す(該ROSに基づいた蛍光測定法、及び該従来の測定法において、各々、22.6 μM、及び27.6 μMのIC50値)。
【表1】

【0048】
プロゲステロン、エリスロマイシン、ベラパミル、及びプレドニゾロンを含む、13化合物のうち4つは、該蛍光測定法を用いて計算されたIC50に基づいて、CYP3A4活性の弱い阻害剤であった。この群の阻害剤の中で該蛍光IC50値と従来のIC50値との間に相関を示さない唯一の化合物は、エリスロマイシンであった。キニジン(図7A、及び7B参照)とスルファフェナゾールの両者から、どちらの方法を用いても(約100 μM以上のIC50値を持つことから決定されるとおり)、実質上阻害活性がないことが示された。
【0049】
(参考文献)
本明細書中に引用された全ての参考文献と同様、下記に列記された参考文献は、それらが、本明細書中で使用された方法論、技術、及び/又は組成物を補足する、説明する、その背景を提供する、又は教示する範囲内において、引用により本明細書に取り込まれるものとする。
【0050】
Birkettらの論文、Trends Pharmacol. Sci. 14:151-185 (1993).
Brennanの論文、Chem Eng News 5:63-73 (2000).
Crespiらの論文、Anal. Biochem. 248:188-190 (1997).
Donatoらの論文、 Anal. Biochem. 213:29-33 (1993).
Eastabrookの論文、FASEB J 10:202-204 (1996).
Guengerichの論文、FASEB J 6:667-668 (1992).
Guengerich、及びShimadaの論文、 Chem. Res. Toxicol. 4:391-407 (1991).
Kennedy、及びJonesの論文、Anal. Biochem. 222:217-223 (1994).
Parkinsonの論文、Toxicol. Pathol. 24:45-57 (1996).
Puntarulo、及びCederbaumの論文、Arch. Biochem. Biophys. 258: 510-518 (1987).
Rendic、及びDi Carloの論文、Drug Metab. Rev. 29:413-580 (1997).
Spatnegger、及びJaegerの論文、Drug Metab. Rev. 27:397-417 (1995).
米国特許第5,478,723号
米国特許第5,786,191号
米国特許第6,312,917号
Wrightonらの論文、Drug Metab. Rev. 25:453-484 (1993).
【0051】
当然のことながら、本明細書中に示された様々な詳細を、本開示の主題の範囲から離れることなく、変更できる。さらに、先の記載は、例示の目的のためであり、限定の目的のためではない。
【図面の簡単な説明】
【0052】
【図1】図1は、活性酸素種(OH-、O2-、及びH2O2など)を産生する、チトクロームP450代謝と関連する二次、又は副反応を図式化して示す。これらの活性酸素種は、指標化合物前駆体と反応するのに使用可能であり、指標化合物を産生し、それを様々な標準的技術を用いて検出することができる。
【図2】図2は、CYP触媒中のROS産生を検出するための、典型的な指標前駆体化合物、ジクロロジヒドロフルオレシン二酢酸塩(DCFH-DA)の使用を図式化して示す。DCHFH-DAは、細胞膜を越え、続いて、細胞エステラーゼにより脱アセチル化され、ジクロロジヒドロフルオレセイン(DCFH)を形成できる。DCFHは、ROSに対して反応性が高く、蛍光性産物、ジクロロフルオレセイン(DCF)を形成する。
【図3】図3は、(i) CYP3A4を介した、テストステロン、デキストロメトルファン、及びキニジンの代謝中の蛍光産生、及び(ii)蛍光産生の阻害におけるケトコナゾール(CYP3A4阻害剤)の効果を示す。無地のバーは、ケトコナゾール存在下での蛍光産生を表し、斜線のバーは、ケトコナゾール非存在下での蛍光産生を表す。
【図4】図4A、及び4B、5A、及び5B、6A、及び6B、並びに7A、及び7Bは、各々、ケトコナゾール、ニフェジピン、プロゲステロン、及びキニジンによる、CYP3A4を介したテストステロン代謝の阻害を示す。各組の図に関して、図Aは、産物(6β-ヒドロキシテストステロン)形成を定量化する従来のLC-UV法を用いた、IC50値の計算を示し、図Bは、本明細書中に開示されたROSに基づいた蛍光測定法を用いた、IC50値の計算を示す。各図において、X 軸は、対数目盛上にプロットされた阻害剤の濃度を表し、y軸は、阻害剤非存在下で検出された蛍光の量を100%に設定して、検出された蛍光パーセントを示す。
【特許請求の範囲】
【請求項1】
チトクロームP450を阻害する能力に関して候補化合物をスクリーニングする方法であって:
(a)チトクロームP450基質、及びチトクロームP450を阻害する能力を有すると推測される候補化合物を提供すること;
(b) 該候補化合物、該チトクロームP450基質、指標化合物前駆体、該チトクロームP450、及びNADPH、又はNADPH再生系を混合すること、ここにおいて、該チトクロームP450の主要代謝活性が副反応において化学種を産生する;
(c)該副反応において該化学種を産生させること、それにより該化学種の画分が該指標化合物前駆体と反応し、指標化合物を産生する;及び
(d)該候補化合物の存在下で産生された指標化合物の量を、該候補化合物の非存在下で産生された指標化合物の量と比較すること、該比較が、該チトクロームP450を阻害する該候補化合物の能力を示す;を含む、前記方法。
【請求項2】
該酵素の主要代謝活性による該副反応において産生された該化学種が、活性酸素種を含む、請求項1記載の方法。
【請求項3】
該指標化合物前駆体が、蛍光性化合物、発色化合物、化学発光化合物、及びそれらの組合せからなる群から選択される、請求項1記載の方法。
【請求項4】
該指標化合物前駆体が、蛍光性化合物である、請求項3記載の方法。
【請求項5】
工程(a)から(c)をマルチウェルプレートの少なくとも1つのウェル中で行う、請求項1記載の方法。
【請求項6】
さらに、複数の候補化合物を、チトクロームP450を阻害する能力に関して、同時にスクリーニングすることを含む、請求項1記載の方法。
【請求項7】
工程(a)から(c)をマルチウェルプレートの複数のウェル中で行う、請求項6記載の方法。
【請求項8】
該チトクロームP450が、CYP1A、CYP2B、CYP2C、CYP2D、CYP2E、CYP3A、及びそれらの組合せからなる群から選択される、請求項1記載の方法。
【請求項9】
該基質が、CYP1A基質、CYP2B基質、CYP2C基質、CYP2D基質、CYP2E基質、CYP3A基質、及びそれらの組合せからなる群から選択される、請求項1記載の方法。
【請求項10】
該CYP3A4基質が、テストステロン、ミダゾラム、キニジン、及びベラパミルからなる群から選択される、請求項9記載の方法。
【請求項11】
該CYP1A2基質がフェナセチンである、請求項9記載の方法。
【請求項12】
該CYP2C9基質が、ジクロフェナク、及びトルブタミドからなる群から選択される、請求項9記載の方法。
【請求項13】
該CYP2D6基質が、ブフラロール、イミプラミン、及びデキストロメトルファンからなる群から選択される、請求項9記載の方法。
【請求項14】
該CYP2C19 基質が、オメプラゾール、及びS-メフェニトインからなる群から選択される、請求項9記載の方法。
【請求項15】
該CYP2E1基質がクロルゾキサゾンである、請求項9記載の方法。
【請求項16】
該チトクロームP450がヒトチトクロームP450を含む、請求項1記載の方法。
【請求項17】
該ヒトチトクロームP450が、CYP1A2、CYP2B6、CYP2C8、CYP2C9、CYP2C19、CYP2D6、CYP2E1、CYP3A4、CYP3A5、CYP3A7、及びそれらの組合せからなる群から選択される、請求項16記載の方法。
【請求項18】
該ヒトチトクロームP450がCYP3A4である、請求項17記載の方法。
【請求項19】
さらに、候補化合物の存在下で産生された指標化合物の量を定量化することを含む、請求項1記載の方法。
【請求項20】
さらに、ある期間にわたって形成された指標化合物の量を定量化し、それにより、該候補化合物の該チトクロームP450に対する阻害能力を決定することを含む、請求項19記載の方法。
【請求項21】
候補化合物のチトクロームP450に対する阻害能力を決定する方法であって:
(a)チトクロームP450基質、及びチトクロームP450を阻害する能力を有すると推測される候補化合物を提供すること;
(b) 該候補化合物、該チトクロームP450基質、指標化合物前駆体、該チトクロームP450、及びNADPH、又はNADPH再生系を混合すること、ここにおいて、チトクロームP450の主要代謝活性が副反応において化学種を産生する;
(c)該副反応において該化学種を産生させること、それにより該化学種の画分が該指標化合物前駆体と反応し、指標化合物を産生する;
(d)該指標化合物が該候補化合物の存在下で産生される速度を定量化すること;及び(e)該チトクロームP450の主要代謝活性を設定量低下させる、該候補化合物の濃度を測定し、それにより、該化合物の該チトクロームP450に対する阻害能力を決定すること;を含む、前記方法。
【請求項22】
該チトクロームP450が、CYP1A、CYP2B、CYP2C、CYP2D、CYP2E、CYP3A、及びそれらの組合せからなる群から選択される、請求項21記載の方法。
【請求項23】
該基質が、CYP1A基質、CYP2B基質、CYP2C基質、CYP2D基質、CYP2E基質、CYP3A基質、及びそれらの組合せからなる群から選択される、請求項21記載の方法。
【請求項24】
該CYP3A4基質が、テストステロン、ミダゾラム、キニジン、及びベラパミルからなる群から選択される、請求項23記載の方法。
【請求項25】
該CYP1A2基質がフェナセチンである、請求項23記載の方法。
【請求項26】
該CYP2C9基質が、ジクロフェナク、及びトルブタミドからなる群から選択される、請求項23記載の方法。
【請求項27】
該CYP2D6基質が、ブフラロール、イミプラミン、及びデキストロメトルファンからなる群から選択される、請求項23記載の方法。
【請求項28】
該CYP2C19 基質が、オメプラゾール、及びS-メフェニトインからなる群から選択される、請求項23記載の方法。
【請求項29】
該CYP2E1基質がクロルゾキサゾンである、請求項23記載の方法。
【請求項30】
該チトクロームP450がヒトチトクロームP450を含む、請求項21記載の方法。
【請求項31】
該ヒトチトクロームP450が、CYP1A2、CYP2B6、CYP2C8、CYP2C9、CYP2C19、CYP2D6、CYP2E1、CYP3A4、CYP3A5、CYP3A7、及びそれらの組合せからなる群から選択される、請求項30記載の方法。
【請求項32】
該ヒトチトクロームP450がCYP3A4である、請求項31記載の方法。
【請求項33】
該酵素の主要代謝活性による該副反応において産生された該化学種が、活性酸素種を含む、請求項21記載の方法。
【請求項34】
該指標化合物前駆体が、蛍光性化合物、発色化合物、化学発光化合物、及びそれらの組合せからなる群から選択される、請求項21記載の方法。
【請求項35】
該指標化合物前駆体が、蛍光性化合物である、請求項34記載の方法。
【請求項36】
工程(a)から(c)をマルチウェルプレートの少なくとも1つのウェル中で行う、請求項21記載の方法。
【請求項37】
該設定量が、25%、33%、50%、67%、75%、及び90%からなる群から選択される、請求項21記載の方法。
【請求項38】
さらに、複数の候補化合物の阻害能力を、同時に決定することを含む、請求項21記載の方法。
【請求項39】
工程(a)から(c)をマルチウェルプレートの複数のウェル中で行う、請求項38記載の方法。
【請求項40】
さらに、該指標化合物が該候補化合物の存在下で産生される速度を、定量化することを含む、請求項21記載の方法。
【請求項1】
チトクロームP450を阻害する能力に関して候補化合物をスクリーニングする方法であって:
(a)チトクロームP450基質、及びチトクロームP450を阻害する能力を有すると推測される候補化合物を提供すること;
(b) 該候補化合物、該チトクロームP450基質、指標化合物前駆体、該チトクロームP450、及びNADPH、又はNADPH再生系を混合すること、ここにおいて、該チトクロームP450の主要代謝活性が副反応において化学種を産生する;
(c)該副反応において該化学種を産生させること、それにより該化学種の画分が該指標化合物前駆体と反応し、指標化合物を産生する;及び
(d)該候補化合物の存在下で産生された指標化合物の量を、該候補化合物の非存在下で産生された指標化合物の量と比較すること、該比較が、該チトクロームP450を阻害する該候補化合物の能力を示す;を含む、前記方法。
【請求項2】
該酵素の主要代謝活性による該副反応において産生された該化学種が、活性酸素種を含む、請求項1記載の方法。
【請求項3】
該指標化合物前駆体が、蛍光性化合物、発色化合物、化学発光化合物、及びそれらの組合せからなる群から選択される、請求項1記載の方法。
【請求項4】
該指標化合物前駆体が、蛍光性化合物である、請求項3記載の方法。
【請求項5】
工程(a)から(c)をマルチウェルプレートの少なくとも1つのウェル中で行う、請求項1記載の方法。
【請求項6】
さらに、複数の候補化合物を、チトクロームP450を阻害する能力に関して、同時にスクリーニングすることを含む、請求項1記載の方法。
【請求項7】
工程(a)から(c)をマルチウェルプレートの複数のウェル中で行う、請求項6記載の方法。
【請求項8】
該チトクロームP450が、CYP1A、CYP2B、CYP2C、CYP2D、CYP2E、CYP3A、及びそれらの組合せからなる群から選択される、請求項1記載の方法。
【請求項9】
該基質が、CYP1A基質、CYP2B基質、CYP2C基質、CYP2D基質、CYP2E基質、CYP3A基質、及びそれらの組合せからなる群から選択される、請求項1記載の方法。
【請求項10】
該CYP3A4基質が、テストステロン、ミダゾラム、キニジン、及びベラパミルからなる群から選択される、請求項9記載の方法。
【請求項11】
該CYP1A2基質がフェナセチンである、請求項9記載の方法。
【請求項12】
該CYP2C9基質が、ジクロフェナク、及びトルブタミドからなる群から選択される、請求項9記載の方法。
【請求項13】
該CYP2D6基質が、ブフラロール、イミプラミン、及びデキストロメトルファンからなる群から選択される、請求項9記載の方法。
【請求項14】
該CYP2C19 基質が、オメプラゾール、及びS-メフェニトインからなる群から選択される、請求項9記載の方法。
【請求項15】
該CYP2E1基質がクロルゾキサゾンである、請求項9記載の方法。
【請求項16】
該チトクロームP450がヒトチトクロームP450を含む、請求項1記載の方法。
【請求項17】
該ヒトチトクロームP450が、CYP1A2、CYP2B6、CYP2C8、CYP2C9、CYP2C19、CYP2D6、CYP2E1、CYP3A4、CYP3A5、CYP3A7、及びそれらの組合せからなる群から選択される、請求項16記載の方法。
【請求項18】
該ヒトチトクロームP450がCYP3A4である、請求項17記載の方法。
【請求項19】
さらに、候補化合物の存在下で産生された指標化合物の量を定量化することを含む、請求項1記載の方法。
【請求項20】
さらに、ある期間にわたって形成された指標化合物の量を定量化し、それにより、該候補化合物の該チトクロームP450に対する阻害能力を決定することを含む、請求項19記載の方法。
【請求項21】
候補化合物のチトクロームP450に対する阻害能力を決定する方法であって:
(a)チトクロームP450基質、及びチトクロームP450を阻害する能力を有すると推測される候補化合物を提供すること;
(b) 該候補化合物、該チトクロームP450基質、指標化合物前駆体、該チトクロームP450、及びNADPH、又はNADPH再生系を混合すること、ここにおいて、チトクロームP450の主要代謝活性が副反応において化学種を産生する;
(c)該副反応において該化学種を産生させること、それにより該化学種の画分が該指標化合物前駆体と反応し、指標化合物を産生する;
(d)該指標化合物が該候補化合物の存在下で産生される速度を定量化すること;及び(e)該チトクロームP450の主要代謝活性を設定量低下させる、該候補化合物の濃度を測定し、それにより、該化合物の該チトクロームP450に対する阻害能力を決定すること;を含む、前記方法。
【請求項22】
該チトクロームP450が、CYP1A、CYP2B、CYP2C、CYP2D、CYP2E、CYP3A、及びそれらの組合せからなる群から選択される、請求項21記載の方法。
【請求項23】
該基質が、CYP1A基質、CYP2B基質、CYP2C基質、CYP2D基質、CYP2E基質、CYP3A基質、及びそれらの組合せからなる群から選択される、請求項21記載の方法。
【請求項24】
該CYP3A4基質が、テストステロン、ミダゾラム、キニジン、及びベラパミルからなる群から選択される、請求項23記載の方法。
【請求項25】
該CYP1A2基質がフェナセチンである、請求項23記載の方法。
【請求項26】
該CYP2C9基質が、ジクロフェナク、及びトルブタミドからなる群から選択される、請求項23記載の方法。
【請求項27】
該CYP2D6基質が、ブフラロール、イミプラミン、及びデキストロメトルファンからなる群から選択される、請求項23記載の方法。
【請求項28】
該CYP2C19 基質が、オメプラゾール、及びS-メフェニトインからなる群から選択される、請求項23記載の方法。
【請求項29】
該CYP2E1基質がクロルゾキサゾンである、請求項23記載の方法。
【請求項30】
該チトクロームP450がヒトチトクロームP450を含む、請求項21記載の方法。
【請求項31】
該ヒトチトクロームP450が、CYP1A2、CYP2B6、CYP2C8、CYP2C9、CYP2C19、CYP2D6、CYP2E1、CYP3A4、CYP3A5、CYP3A7、及びそれらの組合せからなる群から選択される、請求項30記載の方法。
【請求項32】
該ヒトチトクロームP450がCYP3A4である、請求項31記載の方法。
【請求項33】
該酵素の主要代謝活性による該副反応において産生された該化学種が、活性酸素種を含む、請求項21記載の方法。
【請求項34】
該指標化合物前駆体が、蛍光性化合物、発色化合物、化学発光化合物、及びそれらの組合せからなる群から選択される、請求項21記載の方法。
【請求項35】
該指標化合物前駆体が、蛍光性化合物である、請求項34記載の方法。
【請求項36】
工程(a)から(c)をマルチウェルプレートの少なくとも1つのウェル中で行う、請求項21記載の方法。
【請求項37】
該設定量が、25%、33%、50%、67%、75%、及び90%からなる群から選択される、請求項21記載の方法。
【請求項38】
さらに、複数の候補化合物の阻害能力を、同時に決定することを含む、請求項21記載の方法。
【請求項39】
工程(a)から(c)をマルチウェルプレートの複数のウェル中で行う、請求項38記載の方法。
【請求項40】
さらに、該指標化合物が該候補化合物の存在下で産生される速度を、定量化することを含む、請求項21記載の方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【公表番号】特表2007−531538(P2007−531538A)
【公表日】平成19年11月8日(2007.11.8)
【国際特許分類】
【出願番号】特願2007−507447(P2007−507447)
【出願日】平成17年4月5日(2005.4.5)
【国際出願番号】PCT/US2005/011551
【国際公開番号】WO2005/098025
【国際公開日】平成17年10月20日(2005.10.20)
【出願人】(501345323)ザ ユニバーシティ オブ ノース カロライナ アット チャペル ヒル (52)
【氏名又は名称原語表記】THE UNIVERSITY OF NORTH CAROLINA AT CHAPEL HILL
【住所又は居所原語表記】308 Bynum Hall,Campus Box 4105,Chapel Hill,North Carolina 27599−4105, United States of America
【Fターム(参考)】
【公表日】平成19年11月8日(2007.11.8)
【国際特許分類】
【出願日】平成17年4月5日(2005.4.5)
【国際出願番号】PCT/US2005/011551
【国際公開番号】WO2005/098025
【国際公開日】平成17年10月20日(2005.10.20)
【出願人】(501345323)ザ ユニバーシティ オブ ノース カロライナ アット チャペル ヒル (52)
【氏名又は名称原語表記】THE UNIVERSITY OF NORTH CAROLINA AT CHAPEL HILL
【住所又は居所原語表記】308 Bynum Hall,Campus Box 4105,Chapel Hill,North Carolina 27599−4105, United States of America
【Fターム(参考)】
[ Back to top ]

