流体デバイスを用いる熱処理装置、および流体の処理方法
【課題】 高価な手段を用いて流体の保持位置を補正する必要のない、流路を有する流体デバイスを用いて熱処理を行う装置、および該デバイス内での流体の移動を制限する方法を提供する。
【解決手段】 少なくとも一の流路を有する流体デバイス(4)を用いて熱処理を行う装置であって、前記流路の一部を温度変化させる第一の温度変化手段(1)と、前記第一の温度変化手段による前記流路内の流体の膨張または収縮を前記流路の他の一部の流体の収縮または膨張で緩衝させるための第二の温度変化手段(2)と、を有する。
【解決手段】 少なくとも一の流路を有する流体デバイス(4)を用いて熱処理を行う装置であって、前記流路の一部を温度変化させる第一の温度変化手段(1)と、前記第一の温度変化手段による前記流路内の流体の膨張または収縮を前記流路の他の一部の流体の収縮または膨張で緩衝させるための第二の温度変化手段(2)と、を有する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、流路を有する流体デバイスを用いる熱処理装置および流体の処理方法に関する。特に、温度サイクル印加時に流路内の流体の移動を制限する方法に関する。
【背景技術】
【0002】
化学および生化学反応の経過や結果を確認するために濃度、成分などの所望の情報を得ることは分析化学の基礎的な事項であり、それらの情報の取得を目的としたさまざまな装置およびセンサが発明されている。それらの装置やセンサは、精密加工や半導体製造装置などを利用してより小型化され、所望の情報を得るまでの全ての工程をマイクロデバイス上にて実現するという、マイクロ・トータル・アナリシス・システム(μ−TAS)またはラブオンチップと呼ばれるコンセプトがある。これは、採取された未精製検体や原料となる物質をマイクロデバイス中に形成された流路や微小空間を通過させることにより検体精製や化学反応などの工程を経て、最終的な検体中に含まれる成分の濃度や化学合成物などを得ることを目標とするコンセプトである。また、これらの分析や反応を司るマイクロデバイスは、必然的に微小量の溶液や気体を扱うことから、マイクロ流体デバイスと呼ばれることが多い。
【0003】
従来技術のデスクトップサイズの分析機器と比較すると、マイクロ流体デバイスを用いることによってデバイス内に含まれる流体は低容量化されるため、必要試薬量の低減および分析物量の微量化による反応時間の短縮が期待される。このような流体デバイスの利点が認知されるにつれて、μ−TASに関わる技術開発が進んでいる。
【0004】
一方、デスクトップサイズの装置をマイクロデバイス化することにより、新たな技術課題が生じる。マイクロ流路に閉じ込められた流体は、環境の変化に、より敏感に応答することが挙げられる。例えば、マイクロ流路に付与される熱により、流体の温度膨張または流体の蒸発が発生し、これを考慮しなければならない。
【0005】
デスクトップサイズの装置においては、マイクロチューブやウェルプレートなどが用いられるので、内蔵する流体の温度膨張はほとんど無視できる量である。ところが、マイクロ流路においては、流体の温度膨張や蒸発は無視できない量になり得る。このような流体位置の変動を抑制する方法として、特許文献1には、反応場に連通するマイクロ流路に一定の温度を付与する方法が開示されている。この方法により、反応場にある溶液の一部が蒸発しその位置が変動しても観測領域内に溶液を留めようとするものである。
【0006】
流体の位置の変動を抑制する方法は、温度調整による方法のみならず、マイクロバルブや磁性流体を用いる方法もある。また、流路内の溶液の位置を画像取得して流路に連通するポンプの圧力制御により溶液が一定領域内に存在するように制御する方法がある(特許文献2参照)。
【0007】
流路内の流体が保持される保持位置を制御する方法は上記したように様々存在するが、いずれにも課題がある。
【0008】
すなわち、流路内にマイクロバルブを搭載したデバイスは、そのバルブの開閉を制御するための機構が必要となる。
【0009】
また、磁性流体を流路に注入する方法は、磁界を局所的に付与する機構が必要となり、さらには磁界により反応が阻害されない用途に限定される。
【0010】
また、溶液の位置を検出して画像により流路に連通するポンプ圧力を制御する方法は、システム全体が高価にならざるを得ない。さらには、流体を保持する保持位置の精度がシステム全体のフィードバック速度に依存するという課題がある。
【先行技術文献】
【特許文献】
【0011】
【特許文献1】特開2008−151772号公報(第15項、図2)
【特許文献2】特開2008―128906号公報(第18項、図2)
【発明の概要】
【発明が解決しようとする課題】
【0012】
本発明は、このような背景技術を鑑みてなされたものであり、高価な手段を用いて流体の保持位置を補正する必要のない、流路を有する流体デバイスを用いて熱処理を行う装置、および該デバイス内での流体の移動を制限する方法を提供するものである。
【課題を解決するための手段】
【0013】
上記の課題を解決するために、本発明に係る熱処理装置は、少なくとも一の流路を有する流体デバイスを用いて熱処理を行う装置であって、前記流路の一部にある流体の温度を変化させる第一の温度変化手段と、前記第一の温度変化手段による前記流路内の流体の膨張または収縮を前記流路の他の一部の流体の収縮または膨張で緩衝させるために、流路の他の一部の流体の温度を変化させる前記第二の温度変化手段と、を有することを特徴とする。
【0014】
また、本発明に係る処理方法は、少なくとも一つの流路を有する流体デバイスを用いて流体を処理する処理方法であって、前記流路の一部の温度を上昇させるとともに、前記流路の他の一部の温度を降下させ、前記流路内の流体の移動を制限することを特徴とする。
【発明の効果】
【0015】
本発明によれば、第一の温度変化手段による流体の温度変化によって発生した流体の膨張または収縮を、第二の温度変化手段を用いて緩衝させるので、流体の温度変化による流路内の流体の移動を実質的に制限することができる。
【0016】
すなわち、検出領域の流体の位置を変化させることなく、温度変化を要する化学あるいは生化学反応を生ぜしめることができるようになる。
【0017】
そして、二つの温度変化手段による簡便な構成で実現可能であり、装置構成が高価になることなく、好適な流体デバイスを用いたシステム、および方法を提供することができる。
【図面の簡単な説明】
【0018】
【図1】本発明に係る分析装置を示す概念図である。
【図2】本発明に係る処理方法のフローチャートを示す図である。
【図3】本発明の原理を示す概念図である。
【図4】本発明の一実施態様を示す概念図である。
【発明を実施するための形態】
【0019】
以下、本発明を詳細に説明する。
【0020】
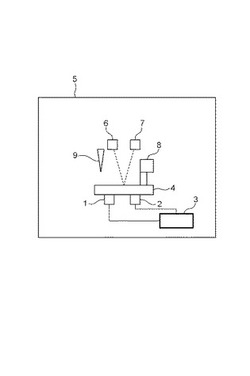
図1は、本発明に係る熱処理装置を示す概念図である。
【0021】
本発明の熱処理装置5は、流体デバイス4の流路の一部を温度変化させる第一の温度変化手段1と、第二の温度変化手段2と、を有する。
【0022】
第二の温度変化手段2は、第一の温度変化手段による流路内の流体の膨張または収縮を流路の他の一部の流体の収縮または膨張で緩衝させるための手段であり、第一の温度変化手段による第一の温度変化領域における流体の温度変化と、第二の温度変化手段による第二の温度変化領域における流体の温度変化とが、互いに逆になるように第一および第二の温度変化手段に指示を与える指示手段(温度コントローラ)3にそれぞれ接続している。
【0023】
指示手段が、第一の温度変化手段による昇温レートと、第二の温度変化手段による降温レートとが等しくなるか、あるいは第一の温度変化手段による降温レートと、第二の温度変化手段による昇温レートとが等しくなるように、第1および第2の温度変化手段に指示を与えるものであると好ましい。
【0024】
しかし、分析に影響を与えない範囲であれば、2つの昇温レートと降温レートの関係を必ずしも等しくする必要はない。
【0025】
第一および第二の温度変化手段によって加熱される一部の流路が、ともにPCRを行う一の領域であると良い。
【0026】
第一および第二の温度変化手段は、それぞれペルチェ素子であるか、流路内に配置された発熱抵抗体および流体デバイスを外部から冷却する冷却器で構成してもよい。
【0027】
また、分析装置として、レーザーやLEDなどの流路に光を照射する照射手段6や、流路からの発光を検出するCCDなどの発光検出手段7を備えることが好ましい。
【0028】
熱処理装置5は、流体デバイス4の流路中の液体を移動させる手段として、正または負の圧力を発生させる圧力手段8を有する。圧力手段8は、シリンジポンプなどのポンプ手段であり、発光検出デバイス4の排出孔に接続して流路中に圧力を発生させる。
【0029】
また、9はピペットなどの液体導入手段であり、4は、流体デバイスを示す。
【0030】
指示手段(温度コントローラ)3は、第一および第二の温度変化手段(1、2)に駆動信号を与え、それぞれの加熱または冷却を制御する。指示手段は不図示の電源に繋がっている。指示手段は、CPUを含むコンピュータであって良く、また装置内の他の手段を全て制御する制御部であってもよい。
【0031】
また、23を載置する載置部(不図示)を備え、第一および第二の温度変化手段が載置部に設けられていても良い。
【0032】
また、温度変化手段として流路内の加熱抵抗部を使用する場合、該加熱抵抗部に印加する電流値および電圧値をからこの抵抗値を算出し、流路中の流体の温度を計測する手段を設けることも好ましい。
【0033】
図3は、上記装置を用いた分析方法のフローチャート図である。
【0034】
まず、上記本発明の流体デバイス4を用意する。次に、流体デバイス4を装置5の載置部にセットする。次にデバイスの流路の入口(通常は供給用の開口を有している)に液体導入手段9により試薬等の液体を導入する。その後、圧力発生手段8により流路中に圧力差を印加し、液体を流路に導入する。指示手段3より第一および第二の温度変化手段に電力を供給し、導入された流路内の液体の温度制御を行う。温度制御には、例えば、PCRのための温度サイクル印加や、熱融解測定のための昇温などを含む。温度制御とともにあるいはその後に、流路内の反応を照射手段6および発光検出手段7によって検出を行う。検出の結果、反応の有無または量を判定し、流路内での反応を分析することができる。
【0035】
本発明の処理方法は、温度制御の際に、流路の一部の温度を上昇させるとともに、流路の他の一部の温度を降下させ、前記流路内の流体の移動を制限することを特徴としている。特に、流路の一部の昇温レートと、流路の他の一部の降温レートとを等しくすると良い。
【0036】
本発明のデバイスは、医療検査・診断に用いられる医療検査素子として使用することができる。ここで医療検査素子とは、μ−TASに代表されるが、例えばDNAチップ、Lab on a Chip、マイクロアレイ、プロテインチップなど、医療検査・診断などに使用されるものを総称して使用する。
【0037】
以下に、本発明の原理について、詳細に説明する。
【0038】
本発明に係る流体デバイスは、マイクロ流路により連通された加熱および冷却を必要とする領域を有する。
【0039】
また、図1のように流体デバイス4を用いる処理装置14は、少なくとも第一と第二の温度変化手段(1、2)を有する。流体デバイスにおいて、第一の温度変化手段と第二の温度変化手段によるそれぞれの温度変化が、互いの膨張あるいは収縮を緩衝するように、逆位相である。
【0040】
温度変化が逆位相であるとは、第一の温度変化手段が加熱し、第二の温度変化手段が同時に冷却する、または第一の温度変化手段が冷却し、第二の温度変化手段が同時に加熱するというように、温度の時間変化が逆方向への傾きを有しているものである。このような温度変化を流路内に与えることによって、一部の流体の膨張と一部の流体の収縮が全体として緩衝(相殺)されて、結果として流体の移動を制限することができるようになる。
【0041】
緩衝のために、どの程度の温度変化を緩衝領域、つまり、第2の温度変化を生ぜしめる領域にあたえるかは、流体の移動を制限し、好ましくはゼロにできる程度であればよい。
【0042】
流路の断面積や長さや流路抵抗が同じ場合には、第一の温度変化手段の加熱による流体の体積変化と第二の温度変化手段の冷却による流体の体積変化、または第一の温度変化手段の冷却による流体の体積変化と第二の温度変化手段の加熱による流体の体積変化、が等しくなるように制御することが好ましい。
【0043】
または、第一の温度変化手段の冷却による流体の体積変化よりも、第二の温度変化手段の加熱による前記流体の体積変化が大きい、あるいは第一の温度変化手段の加熱による流体の体積変化よりも、第二の温度変化手段の冷却による流体の体積変化が大きい、ことも分析に影響を与えない範囲で本発明に含まれる。
【0044】
本発明は、加熱または冷却を要する反応処理中であっても、流路内に閉じ込められた流体の温度伸縮による位置変動を補正することができる。流体の位置変動を補正するために、流路内にある流体の熱膨張と収縮を利用する。この原理について、以下に説明する。
【0045】
特定の物質や特定の温度領域を除くと、多くの物質はその物質の取り巻く環境温度の上昇とともに、一定の割合で体積が膨張する。いま、ある温度T1における流体の体積をV1とすると、加熱されて温度T2となったときの流体の体積V2は、
V2=V1{1+β(T2−T1)}
と表わされる。ここで、βは膨張の割合を示す体積膨張率であり、例えば、20℃における水は約2.1X10−4(/K)であり、エタノールは約1.1X10−3(/K)であるなど、物質ごとに特有の値を示す。なお、T2<T1のときは冷却を意味し、流体の体積は収縮(マイナスの膨張)する。既存のミリリットルやリットルオーダーの流体を扱う際には、加熱による体積膨張は0℃から100℃の範囲であれば無視できる大きさである。ところが、マイクロリットルやナノリットルオーダーの流体を扱うマイクロ流路において、例えば幅100μm、深さ20μmであれば熱膨張による流体位置の変化は、特に流路に沿った方向へのみの位置変動となって表れるため、変動量が無視できない大きさになりえる。
【0046】
マイクロ流体デバイスの材質は、耐薬品性や光学特性に基づいて決定すれば良く、各種ガラスを始め、ポリカーボネート、アクリル、などの各種ポリマー系の材質で構成すると良い。特に、製造コストの低さから、ポリマー系の材質は近年注目されている。しかしながら、蛍光観測において、ポリマーから蛍光が生じる場合があり、蛍光観測をする場合にはポリマー系の材質は必ずしも適さない。加えて、耐薬品性からガラスを選択しても良い。なお、石英ガラスをマイクロ流体デバイスとして選択した場合、石英ガラスの体積膨張率は約5.6X10−7(/K)である。すなわち、水やエタノールの体積膨張率と比較して0℃から100℃の範囲内においては著しく小さいため、石英ガラスのマイクロ流体デバイスの温度膨張は無視できると考えてよい。
【0047】
図2は本発明の原理を示す概念図であり、マイクロ流路11があるマイクロ流体デバイス10における、マイクロ流路11方向の断面図である。図2(A)において、マイクロ流路11があり、流体12がこれに注入されている。マイクロ流路11の一部分に第一領域である反応場13があり、反応場13の一部分に熱エネルギーを付与するための温度変化手段14および15がある。温度変化手段14の直上に位置する部分、つまり第1の温度変化領域内の流体12を流体16Aとし、温度変化手段の15の直上に位置する部分、つまり第2の温度変化領域内の流体12を流体17Aとする。
【0048】
マイクロ流体デバイス10は、石英ガラス、パイレックス(登録商標)ガラスなどのガラス素材、アクリル、ポリカーボネートなどのポリマー素材、シリコンなどの半導体素材、またはセラミック素材など、内部に流路を形成できる素材であれば特に限定はない。分析する物質の耐薬品性や検出の適性に基づいて決定してよいが、熱膨張率の小さい素材であることが好ましい。また、マイクロ流路11は、任意のデザインで構成されてよく、本発明に例示されるデザインに限定されない。
【0049】
温度変化手段14および15は、マイクロ流路11に充填された流体を加熱または冷却するための手段である。熱エネルギーを付与して化学あるいは生化学反応を生じさせる反応は多くあり、加熱するための装置はマイクロ流体デバイス10の外部にあるホットプレート、ペルチェ素子が代表的である。冷却する装置としては、ペルチェ素子、デバイスに接して水を循環させた水冷方式の装置、または冷風を吹き付ける装置などがある。また、マイクロ流体デバイスの基板の底面や内部に薄膜の導電体を付与して加熱または冷却してもよい。本発明においては加熱または冷却装置は限定せず、必要に応じて最適な装置が選択されればよい。また、温度変化手段14と温度変化手段15の距離、およびマイクロ流路11と温度変化手段14、15の距離は、任意でよく、マイクロ流体デバイス10の使われるアプリケーションに依存する。
【0050】
いま、反応場13の範囲内にある流体を、温度変化手段14および15を用いて加熱すると、反応場13内にある流体は、熱膨張により反応場13の範囲を超えて存在する。そのため、例えば反応場13内における反応結果を蛍光強度により観測する場合は、温度変化による蛍光強度のみならず、体積変化を考慮しなければならない。
【0051】
ここで、温度変化手段14が加熱し、流体16Aの体積が膨張して図3(B)の流体16Bになると同時に、温度変化手段15が冷却すると、図3(A)の流体17Aは図3(B)の流体17Bへと体積収縮を受ける。これらの膨張または収縮する体積は、流体の熱膨張率、温度変化前後の温度差、温度変化手段が流体におよぼす温度変化の体積より算出することができる。よって、温度変化手段14の加熱による流体16A体積膨張に等しい値の温度変化手段15の冷却による流体17Aの体積収縮を選択することができる。つまり、温度変化手段14および15の温度変化の位相を逆に設定すると、加熱による体積膨張によって生じる体積変化を低減できる冷却による体積収縮を設定することができる。よって、反応場13にもともと存在していた流体を、加熱および冷却後も反応場13の範囲にとどめることができる。
【0052】
本形態によれば、例えば流路内で反応が行われた画像を取得するさいに、流路にカメラが近接して高解像度の画像を取得することができる。
【0053】
また、反応場もしくはマイクロ流体デバイス内の流体の体積が一定に保たれるため、デバイス外部に流体の一部が流出することなく、同時に、デバイス内の体積収縮に連動したデバイス外部からの物質の混入を防ぐことができるという効果を有する。
【0054】
以下、本発明の各実施形態について詳細に説明する。
【0055】
(実施形態1)
実施形態1においては、遺伝子増幅工程中の増幅産物をリアルタイムに観測する方法を説明する。
【0056】
本形態は、上述した図3に示す流体デバイスを用いた方法である。本形態においては、流体12は、ターゲットDNAを含む液体を使用する。
【0057】
増幅する方法としてはリガーゼ連鎖反応を用い、このため液体中には、さらに該反応を生ぜしめるためのDNAリガーゼ、およびプライマーなどが含まれている。リガーゼ連鎖反応は、ライゲーション工程を含むことから、特異性が高いことが大きな特徴として挙げられる。そのため、遺伝子に含まれる1塩基の変異を検出する用途などに用いられる。
【0058】
温度変化手段14は、約95℃でDNAの変性工程を実施した後、約50℃〜70℃の間に存在する、使用しているDNAリガーゼの活性が最も高い温度に低下させてアニーリング工程とライゲーション工程を実施する。なお、本形態においては、便宜上DNAリガーゼの活性が最も高い温度を60℃として説明する。
【0059】
95℃と60℃の温度サイクルが1度実施されると、変異がないターゲットDNAは、2倍の量に増幅される。つまり、DNA増幅産物量は温度サイクルを繰り返すごとに指数関数的に増加する。
【0060】
温度変化手段14と温度変化手段15の流体12に影響を及ぼす体積はそれぞれ等しいとする。
【0061】
このとき、温度変化手段14によって95℃から60℃へ温度を低下させると同時に、温度変化手段15によって60℃から95℃へ温度変化手段14の冷却レートと等しい加熱レートで温度を上昇させると、反応場13の範囲に増幅溶液がとどまりながら目的DNAは増幅される。次の温度サイクルを実施するときには、第一の温度変化手段14を加熱し、第二の温度変化手段15を冷却することにより反応場13の範囲内でDNA増幅が実現できる。
【0062】
増幅の様子は、反応場13の上方に光学検出器を配置するなどしてインターカレータ色素の蛍光を観測することで把握することができる。温度の変化による流体位置の変位が従来技術と比較して小さいことから、例えばエリアセンサで反応場13を観測するときには、反応場13とその近傍のみを観測領域とすることができる。結果、観測範囲が狭められると同時に観測の解像度が改善される。
【0063】
さらに、温度変化手段が反応場13の範囲に3つあるときは、中央に位置する温度変化手段と、外側にある2つの温度変化手段の加熱・冷却を逆位相にし、かつ流体の熱膨張体積と熱収縮体積を等しくすると、流体を反応場13内に留めながら反応を観測できる。より具体的には、中央に位置する温度変化手段が95℃から60℃へ冷却されると同時に外側にある温度変化手段は60℃から95℃へ加熱させる。あるいは、中央に位置する温度変化手段が60℃から95℃へ加熱すると同時に外側にある温度変化手段は95℃から60℃へ冷却される。
【0064】
以上から、本実施形態の流体の制御方法は、熱膨張や流体の蒸発による流体位置の変動を抑え、1つのPCR領域の2箇所において位相の異なるPCR温度サイクルを印加することもできる。特に、アニーリング工程と伸張工程を等しい温度で達成する2ステップのPCR温度サイクルに適する。この場合、アニーリングおよび伸張工程を65℃、変性工程を95℃と設定する。65℃から95℃への加熱レートと95℃から65℃への冷却レートを等しくさせることにより一方の温度変化手段による温度変化領域の流体の膨張は他方の温度変化領域の流体の収縮によって相殺され、流体の位置変動を抑えることができる。
【0065】
また、2つの温度変化手段のみで反応を促進し、かつ流体位置の変動を低減することができる。
【0066】
(実施形態2)
実施形態2において、マイクロ流路内の温度が冷却されることにより外部からの物質の混入を低減する方法を説明する。
【0067】
図4において、マイクロ流体デバイス21は、内部にマイクロ流路22を有する。温度変化手段27および28が温度変化を付与する領域をそれぞれ23、24とし、マイクロ流路22内で領域24に存在する流体を25、領域23に存在する流体を26とする。
【0068】
いま、流体26において、DNAのプローブが配置され、浮遊しているDNA断片とハイブリダイゼーションを行うとする。ハイブリダイゼーションは35℃から60℃などと多彩な温度環境で行われるが、反応は一定温度でよい。しかし、前工程として、DNAを約90℃で変性させる工程があり、約90℃から例えば約42℃のような急激な温度変化が伴う。このとき、流体26は短い時間で冷却され、体積収縮を受ける。このため、マイクロ流路22に含まれる全流体体積も小さくなり、マイクロ流体デバイス21の外部にある物質がマイクロ流路22内に混入して観測結果に影響を及ぼす可能性がある。
【0069】
この混入を防止するために、マイクロ流路22の端部に存在する流体25を熱膨張させることにより、マイクロ流路22内の流体体積を一定に保つことができる。つまり、温度変化装置28は流体26に対して冷却すると同時に、温度変化装置27は流体25に対して加熱する。そして、熱収縮の体積と熱膨張の体積を等しくなるように設定することにより、マイクロ流路21内の体積を一定に保持することが可能になる。あるいは、流体26の体積収縮より流体25の体積膨張を大きくすることにより、マイクロ流体デバイス21外部からの物質の混入は防止できる。
【0070】
(実施形態3)
実施形態3において、マイクロ流路内の流体が加熱されることにより、マイクロ流体デバイスの外部へ流体が飛散することを防止する方法を説明する。
【0071】
図4におけるマイクロ流体デバイスを用いて、等温遺伝子増幅反応であるLAMP法を実施したとする。鎖置換型のDNAポリメラーゼの働きにより、温度変化手段27を用いて約1時間程度約60℃から65℃の間の一定温度で増幅された遺伝子は、増幅前の遺伝子量と比較して例えば1010倍程度に増加される。このとき、流体26が白濁することにより増幅の確認ができる。
【0072】
増幅反応を終了させるには、DNAポリメラーゼを失活させる必要が生じるが、失活方法は温度変化手段27を用いて80℃または95℃程度で数分間から十数分間加熱し続ける工程を踏む。マイクロ流路22内に存在する流体が急激に20℃または35℃程度上昇されると、熱膨張により多量に増幅された遺伝子を含む流体がマイクロ流体デバイス外部へ飛散し、測定環境のコンタミネーションを招く可能性がある。
【0073】
飛散を防止するために、温度変化手段28を備え、流体26の膨張体積と等しくなるように流体25を収縮させることにより、マイクロ流路22内の流体の体積を一定に保つことができる。
【0074】
(実施形態4)
本実施形態においては、細胞培養や酵素反応を行ったマイクロ流体デバイスを廃棄する際の加熱処理方法の説明をする。
【0075】
細胞を培養したシャーレなどの器具は、培養後はオートクレーブにより殺菌された上で処理される。しかしながら、マイクロ流体デバイスをオートクレーブ装置に配置した場合は、マイクロ流路内部まで効果的にオートクレーブがなされたかの保証が困難である。
【0076】
マイクロ流体デバイス21内で細胞の培養や、酵素反応を実施した場合は、細胞活性や酵素活性が完全に失活した状態でデバイスを廃却することが望ましい。いま、図4におけるマイクロ流体デバイス21は、細胞とその培養液を含む流体26を有し、必要な細胞測定などを終了したとする。このとき、温度変化手段27により、約120℃〜150℃程度に加熱し、細胞を死滅させるとともに、細胞内部にある酵素を完全に失活させることができる。
【0077】
一方、死滅させた細胞や酵素をマイクロ流体デバイス外部に飛散させることは望ましくなく、デバイス内部に留めておくことが望ましい。温度変化手段27が温度を上昇させると同時に温度変化手段28の温度を下降させ、流体25の体積収縮が流体26の熱膨張体積より大きくなるように設定することにより、細胞の破片や酵素をマイクロ流体デバイス21外部に飛散させることなく加熱処理が行える。このとき、温度変化手段27が約120℃から150℃程度まで加熱されるため、温度変化手段28は室温より低くさせる必要が生じる場合がある。そのため、温度変化手段はペルチェ素子などが好ましい。
【0078】
また、流路壁面に配置された加熱抵抗部は、温度測定手段としても使用することができ、その抵抗値から流路内の温度を測定することができるようになる。この測定結果をフィードバックすることで、より精度良く温度制御することができるようになる。
【産業上の利用可能性】
【0079】
本発明は、加熱または冷却工程を伴う、化学合成、環境分析、臨床検体分析を実施するための、マイクロ流体デバイスに利用することができる。
【符号の説明】
【0080】
1、2、14、15 温度変化手段
3 指示手段
4、10、21 マイクロ流体デバイス
11 マイクロ流路
12 流体
13 反応場
16A、17A 流体
16B、17B 流体
22 マイクロ流路
23、24 温度変化領域
25、26 流体
27、28 温度変化手段
【技術分野】
【0001】
本発明は、流路を有する流体デバイスを用いる熱処理装置および流体の処理方法に関する。特に、温度サイクル印加時に流路内の流体の移動を制限する方法に関する。
【背景技術】
【0002】
化学および生化学反応の経過や結果を確認するために濃度、成分などの所望の情報を得ることは分析化学の基礎的な事項であり、それらの情報の取得を目的としたさまざまな装置およびセンサが発明されている。それらの装置やセンサは、精密加工や半導体製造装置などを利用してより小型化され、所望の情報を得るまでの全ての工程をマイクロデバイス上にて実現するという、マイクロ・トータル・アナリシス・システム(μ−TAS)またはラブオンチップと呼ばれるコンセプトがある。これは、採取された未精製検体や原料となる物質をマイクロデバイス中に形成された流路や微小空間を通過させることにより検体精製や化学反応などの工程を経て、最終的な検体中に含まれる成分の濃度や化学合成物などを得ることを目標とするコンセプトである。また、これらの分析や反応を司るマイクロデバイスは、必然的に微小量の溶液や気体を扱うことから、マイクロ流体デバイスと呼ばれることが多い。
【0003】
従来技術のデスクトップサイズの分析機器と比較すると、マイクロ流体デバイスを用いることによってデバイス内に含まれる流体は低容量化されるため、必要試薬量の低減および分析物量の微量化による反応時間の短縮が期待される。このような流体デバイスの利点が認知されるにつれて、μ−TASに関わる技術開発が進んでいる。
【0004】
一方、デスクトップサイズの装置をマイクロデバイス化することにより、新たな技術課題が生じる。マイクロ流路に閉じ込められた流体は、環境の変化に、より敏感に応答することが挙げられる。例えば、マイクロ流路に付与される熱により、流体の温度膨張または流体の蒸発が発生し、これを考慮しなければならない。
【0005】
デスクトップサイズの装置においては、マイクロチューブやウェルプレートなどが用いられるので、内蔵する流体の温度膨張はほとんど無視できる量である。ところが、マイクロ流路においては、流体の温度膨張や蒸発は無視できない量になり得る。このような流体位置の変動を抑制する方法として、特許文献1には、反応場に連通するマイクロ流路に一定の温度を付与する方法が開示されている。この方法により、反応場にある溶液の一部が蒸発しその位置が変動しても観測領域内に溶液を留めようとするものである。
【0006】
流体の位置の変動を抑制する方法は、温度調整による方法のみならず、マイクロバルブや磁性流体を用いる方法もある。また、流路内の溶液の位置を画像取得して流路に連通するポンプの圧力制御により溶液が一定領域内に存在するように制御する方法がある(特許文献2参照)。
【0007】
流路内の流体が保持される保持位置を制御する方法は上記したように様々存在するが、いずれにも課題がある。
【0008】
すなわち、流路内にマイクロバルブを搭載したデバイスは、そのバルブの開閉を制御するための機構が必要となる。
【0009】
また、磁性流体を流路に注入する方法は、磁界を局所的に付与する機構が必要となり、さらには磁界により反応が阻害されない用途に限定される。
【0010】
また、溶液の位置を検出して画像により流路に連通するポンプ圧力を制御する方法は、システム全体が高価にならざるを得ない。さらには、流体を保持する保持位置の精度がシステム全体のフィードバック速度に依存するという課題がある。
【先行技術文献】
【特許文献】
【0011】
【特許文献1】特開2008−151772号公報(第15項、図2)
【特許文献2】特開2008―128906号公報(第18項、図2)
【発明の概要】
【発明が解決しようとする課題】
【0012】
本発明は、このような背景技術を鑑みてなされたものであり、高価な手段を用いて流体の保持位置を補正する必要のない、流路を有する流体デバイスを用いて熱処理を行う装置、および該デバイス内での流体の移動を制限する方法を提供するものである。
【課題を解決するための手段】
【0013】
上記の課題を解決するために、本発明に係る熱処理装置は、少なくとも一の流路を有する流体デバイスを用いて熱処理を行う装置であって、前記流路の一部にある流体の温度を変化させる第一の温度変化手段と、前記第一の温度変化手段による前記流路内の流体の膨張または収縮を前記流路の他の一部の流体の収縮または膨張で緩衝させるために、流路の他の一部の流体の温度を変化させる前記第二の温度変化手段と、を有することを特徴とする。
【0014】
また、本発明に係る処理方法は、少なくとも一つの流路を有する流体デバイスを用いて流体を処理する処理方法であって、前記流路の一部の温度を上昇させるとともに、前記流路の他の一部の温度を降下させ、前記流路内の流体の移動を制限することを特徴とする。
【発明の効果】
【0015】
本発明によれば、第一の温度変化手段による流体の温度変化によって発生した流体の膨張または収縮を、第二の温度変化手段を用いて緩衝させるので、流体の温度変化による流路内の流体の移動を実質的に制限することができる。
【0016】
すなわち、検出領域の流体の位置を変化させることなく、温度変化を要する化学あるいは生化学反応を生ぜしめることができるようになる。
【0017】
そして、二つの温度変化手段による簡便な構成で実現可能であり、装置構成が高価になることなく、好適な流体デバイスを用いたシステム、および方法を提供することができる。
【図面の簡単な説明】
【0018】
【図1】本発明に係る分析装置を示す概念図である。
【図2】本発明に係る処理方法のフローチャートを示す図である。
【図3】本発明の原理を示す概念図である。
【図4】本発明の一実施態様を示す概念図である。
【発明を実施するための形態】
【0019】
以下、本発明を詳細に説明する。
【0020】
図1は、本発明に係る熱処理装置を示す概念図である。
【0021】
本発明の熱処理装置5は、流体デバイス4の流路の一部を温度変化させる第一の温度変化手段1と、第二の温度変化手段2と、を有する。
【0022】
第二の温度変化手段2は、第一の温度変化手段による流路内の流体の膨張または収縮を流路の他の一部の流体の収縮または膨張で緩衝させるための手段であり、第一の温度変化手段による第一の温度変化領域における流体の温度変化と、第二の温度変化手段による第二の温度変化領域における流体の温度変化とが、互いに逆になるように第一および第二の温度変化手段に指示を与える指示手段(温度コントローラ)3にそれぞれ接続している。
【0023】
指示手段が、第一の温度変化手段による昇温レートと、第二の温度変化手段による降温レートとが等しくなるか、あるいは第一の温度変化手段による降温レートと、第二の温度変化手段による昇温レートとが等しくなるように、第1および第2の温度変化手段に指示を与えるものであると好ましい。
【0024】
しかし、分析に影響を与えない範囲であれば、2つの昇温レートと降温レートの関係を必ずしも等しくする必要はない。
【0025】
第一および第二の温度変化手段によって加熱される一部の流路が、ともにPCRを行う一の領域であると良い。
【0026】
第一および第二の温度変化手段は、それぞれペルチェ素子であるか、流路内に配置された発熱抵抗体および流体デバイスを外部から冷却する冷却器で構成してもよい。
【0027】
また、分析装置として、レーザーやLEDなどの流路に光を照射する照射手段6や、流路からの発光を検出するCCDなどの発光検出手段7を備えることが好ましい。
【0028】
熱処理装置5は、流体デバイス4の流路中の液体を移動させる手段として、正または負の圧力を発生させる圧力手段8を有する。圧力手段8は、シリンジポンプなどのポンプ手段であり、発光検出デバイス4の排出孔に接続して流路中に圧力を発生させる。
【0029】
また、9はピペットなどの液体導入手段であり、4は、流体デバイスを示す。
【0030】
指示手段(温度コントローラ)3は、第一および第二の温度変化手段(1、2)に駆動信号を与え、それぞれの加熱または冷却を制御する。指示手段は不図示の電源に繋がっている。指示手段は、CPUを含むコンピュータであって良く、また装置内の他の手段を全て制御する制御部であってもよい。
【0031】
また、23を載置する載置部(不図示)を備え、第一および第二の温度変化手段が載置部に設けられていても良い。
【0032】
また、温度変化手段として流路内の加熱抵抗部を使用する場合、該加熱抵抗部に印加する電流値および電圧値をからこの抵抗値を算出し、流路中の流体の温度を計測する手段を設けることも好ましい。
【0033】
図3は、上記装置を用いた分析方法のフローチャート図である。
【0034】
まず、上記本発明の流体デバイス4を用意する。次に、流体デバイス4を装置5の載置部にセットする。次にデバイスの流路の入口(通常は供給用の開口を有している)に液体導入手段9により試薬等の液体を導入する。その後、圧力発生手段8により流路中に圧力差を印加し、液体を流路に導入する。指示手段3より第一および第二の温度変化手段に電力を供給し、導入された流路内の液体の温度制御を行う。温度制御には、例えば、PCRのための温度サイクル印加や、熱融解測定のための昇温などを含む。温度制御とともにあるいはその後に、流路内の反応を照射手段6および発光検出手段7によって検出を行う。検出の結果、反応の有無または量を判定し、流路内での反応を分析することができる。
【0035】
本発明の処理方法は、温度制御の際に、流路の一部の温度を上昇させるとともに、流路の他の一部の温度を降下させ、前記流路内の流体の移動を制限することを特徴としている。特に、流路の一部の昇温レートと、流路の他の一部の降温レートとを等しくすると良い。
【0036】
本発明のデバイスは、医療検査・診断に用いられる医療検査素子として使用することができる。ここで医療検査素子とは、μ−TASに代表されるが、例えばDNAチップ、Lab on a Chip、マイクロアレイ、プロテインチップなど、医療検査・診断などに使用されるものを総称して使用する。
【0037】
以下に、本発明の原理について、詳細に説明する。
【0038】
本発明に係る流体デバイスは、マイクロ流路により連通された加熱および冷却を必要とする領域を有する。
【0039】
また、図1のように流体デバイス4を用いる処理装置14は、少なくとも第一と第二の温度変化手段(1、2)を有する。流体デバイスにおいて、第一の温度変化手段と第二の温度変化手段によるそれぞれの温度変化が、互いの膨張あるいは収縮を緩衝するように、逆位相である。
【0040】
温度変化が逆位相であるとは、第一の温度変化手段が加熱し、第二の温度変化手段が同時に冷却する、または第一の温度変化手段が冷却し、第二の温度変化手段が同時に加熱するというように、温度の時間変化が逆方向への傾きを有しているものである。このような温度変化を流路内に与えることによって、一部の流体の膨張と一部の流体の収縮が全体として緩衝(相殺)されて、結果として流体の移動を制限することができるようになる。
【0041】
緩衝のために、どの程度の温度変化を緩衝領域、つまり、第2の温度変化を生ぜしめる領域にあたえるかは、流体の移動を制限し、好ましくはゼロにできる程度であればよい。
【0042】
流路の断面積や長さや流路抵抗が同じ場合には、第一の温度変化手段の加熱による流体の体積変化と第二の温度変化手段の冷却による流体の体積変化、または第一の温度変化手段の冷却による流体の体積変化と第二の温度変化手段の加熱による流体の体積変化、が等しくなるように制御することが好ましい。
【0043】
または、第一の温度変化手段の冷却による流体の体積変化よりも、第二の温度変化手段の加熱による前記流体の体積変化が大きい、あるいは第一の温度変化手段の加熱による流体の体積変化よりも、第二の温度変化手段の冷却による流体の体積変化が大きい、ことも分析に影響を与えない範囲で本発明に含まれる。
【0044】
本発明は、加熱または冷却を要する反応処理中であっても、流路内に閉じ込められた流体の温度伸縮による位置変動を補正することができる。流体の位置変動を補正するために、流路内にある流体の熱膨張と収縮を利用する。この原理について、以下に説明する。
【0045】
特定の物質や特定の温度領域を除くと、多くの物質はその物質の取り巻く環境温度の上昇とともに、一定の割合で体積が膨張する。いま、ある温度T1における流体の体積をV1とすると、加熱されて温度T2となったときの流体の体積V2は、
V2=V1{1+β(T2−T1)}
と表わされる。ここで、βは膨張の割合を示す体積膨張率であり、例えば、20℃における水は約2.1X10−4(/K)であり、エタノールは約1.1X10−3(/K)であるなど、物質ごとに特有の値を示す。なお、T2<T1のときは冷却を意味し、流体の体積は収縮(マイナスの膨張)する。既存のミリリットルやリットルオーダーの流体を扱う際には、加熱による体積膨張は0℃から100℃の範囲であれば無視できる大きさである。ところが、マイクロリットルやナノリットルオーダーの流体を扱うマイクロ流路において、例えば幅100μm、深さ20μmであれば熱膨張による流体位置の変化は、特に流路に沿った方向へのみの位置変動となって表れるため、変動量が無視できない大きさになりえる。
【0046】
マイクロ流体デバイスの材質は、耐薬品性や光学特性に基づいて決定すれば良く、各種ガラスを始め、ポリカーボネート、アクリル、などの各種ポリマー系の材質で構成すると良い。特に、製造コストの低さから、ポリマー系の材質は近年注目されている。しかしながら、蛍光観測において、ポリマーから蛍光が生じる場合があり、蛍光観測をする場合にはポリマー系の材質は必ずしも適さない。加えて、耐薬品性からガラスを選択しても良い。なお、石英ガラスをマイクロ流体デバイスとして選択した場合、石英ガラスの体積膨張率は約5.6X10−7(/K)である。すなわち、水やエタノールの体積膨張率と比較して0℃から100℃の範囲内においては著しく小さいため、石英ガラスのマイクロ流体デバイスの温度膨張は無視できると考えてよい。
【0047】
図2は本発明の原理を示す概念図であり、マイクロ流路11があるマイクロ流体デバイス10における、マイクロ流路11方向の断面図である。図2(A)において、マイクロ流路11があり、流体12がこれに注入されている。マイクロ流路11の一部分に第一領域である反応場13があり、反応場13の一部分に熱エネルギーを付与するための温度変化手段14および15がある。温度変化手段14の直上に位置する部分、つまり第1の温度変化領域内の流体12を流体16Aとし、温度変化手段の15の直上に位置する部分、つまり第2の温度変化領域内の流体12を流体17Aとする。
【0048】
マイクロ流体デバイス10は、石英ガラス、パイレックス(登録商標)ガラスなどのガラス素材、アクリル、ポリカーボネートなどのポリマー素材、シリコンなどの半導体素材、またはセラミック素材など、内部に流路を形成できる素材であれば特に限定はない。分析する物質の耐薬品性や検出の適性に基づいて決定してよいが、熱膨張率の小さい素材であることが好ましい。また、マイクロ流路11は、任意のデザインで構成されてよく、本発明に例示されるデザインに限定されない。
【0049】
温度変化手段14および15は、マイクロ流路11に充填された流体を加熱または冷却するための手段である。熱エネルギーを付与して化学あるいは生化学反応を生じさせる反応は多くあり、加熱するための装置はマイクロ流体デバイス10の外部にあるホットプレート、ペルチェ素子が代表的である。冷却する装置としては、ペルチェ素子、デバイスに接して水を循環させた水冷方式の装置、または冷風を吹き付ける装置などがある。また、マイクロ流体デバイスの基板の底面や内部に薄膜の導電体を付与して加熱または冷却してもよい。本発明においては加熱または冷却装置は限定せず、必要に応じて最適な装置が選択されればよい。また、温度変化手段14と温度変化手段15の距離、およびマイクロ流路11と温度変化手段14、15の距離は、任意でよく、マイクロ流体デバイス10の使われるアプリケーションに依存する。
【0050】
いま、反応場13の範囲内にある流体を、温度変化手段14および15を用いて加熱すると、反応場13内にある流体は、熱膨張により反応場13の範囲を超えて存在する。そのため、例えば反応場13内における反応結果を蛍光強度により観測する場合は、温度変化による蛍光強度のみならず、体積変化を考慮しなければならない。
【0051】
ここで、温度変化手段14が加熱し、流体16Aの体積が膨張して図3(B)の流体16Bになると同時に、温度変化手段15が冷却すると、図3(A)の流体17Aは図3(B)の流体17Bへと体積収縮を受ける。これらの膨張または収縮する体積は、流体の熱膨張率、温度変化前後の温度差、温度変化手段が流体におよぼす温度変化の体積より算出することができる。よって、温度変化手段14の加熱による流体16A体積膨張に等しい値の温度変化手段15の冷却による流体17Aの体積収縮を選択することができる。つまり、温度変化手段14および15の温度変化の位相を逆に設定すると、加熱による体積膨張によって生じる体積変化を低減できる冷却による体積収縮を設定することができる。よって、反応場13にもともと存在していた流体を、加熱および冷却後も反応場13の範囲にとどめることができる。
【0052】
本形態によれば、例えば流路内で反応が行われた画像を取得するさいに、流路にカメラが近接して高解像度の画像を取得することができる。
【0053】
また、反応場もしくはマイクロ流体デバイス内の流体の体積が一定に保たれるため、デバイス外部に流体の一部が流出することなく、同時に、デバイス内の体積収縮に連動したデバイス外部からの物質の混入を防ぐことができるという効果を有する。
【0054】
以下、本発明の各実施形態について詳細に説明する。
【0055】
(実施形態1)
実施形態1においては、遺伝子増幅工程中の増幅産物をリアルタイムに観測する方法を説明する。
【0056】
本形態は、上述した図3に示す流体デバイスを用いた方法である。本形態においては、流体12は、ターゲットDNAを含む液体を使用する。
【0057】
増幅する方法としてはリガーゼ連鎖反応を用い、このため液体中には、さらに該反応を生ぜしめるためのDNAリガーゼ、およびプライマーなどが含まれている。リガーゼ連鎖反応は、ライゲーション工程を含むことから、特異性が高いことが大きな特徴として挙げられる。そのため、遺伝子に含まれる1塩基の変異を検出する用途などに用いられる。
【0058】
温度変化手段14は、約95℃でDNAの変性工程を実施した後、約50℃〜70℃の間に存在する、使用しているDNAリガーゼの活性が最も高い温度に低下させてアニーリング工程とライゲーション工程を実施する。なお、本形態においては、便宜上DNAリガーゼの活性が最も高い温度を60℃として説明する。
【0059】
95℃と60℃の温度サイクルが1度実施されると、変異がないターゲットDNAは、2倍の量に増幅される。つまり、DNA増幅産物量は温度サイクルを繰り返すごとに指数関数的に増加する。
【0060】
温度変化手段14と温度変化手段15の流体12に影響を及ぼす体積はそれぞれ等しいとする。
【0061】
このとき、温度変化手段14によって95℃から60℃へ温度を低下させると同時に、温度変化手段15によって60℃から95℃へ温度変化手段14の冷却レートと等しい加熱レートで温度を上昇させると、反応場13の範囲に増幅溶液がとどまりながら目的DNAは増幅される。次の温度サイクルを実施するときには、第一の温度変化手段14を加熱し、第二の温度変化手段15を冷却することにより反応場13の範囲内でDNA増幅が実現できる。
【0062】
増幅の様子は、反応場13の上方に光学検出器を配置するなどしてインターカレータ色素の蛍光を観測することで把握することができる。温度の変化による流体位置の変位が従来技術と比較して小さいことから、例えばエリアセンサで反応場13を観測するときには、反応場13とその近傍のみを観測領域とすることができる。結果、観測範囲が狭められると同時に観測の解像度が改善される。
【0063】
さらに、温度変化手段が反応場13の範囲に3つあるときは、中央に位置する温度変化手段と、外側にある2つの温度変化手段の加熱・冷却を逆位相にし、かつ流体の熱膨張体積と熱収縮体積を等しくすると、流体を反応場13内に留めながら反応を観測できる。より具体的には、中央に位置する温度変化手段が95℃から60℃へ冷却されると同時に外側にある温度変化手段は60℃から95℃へ加熱させる。あるいは、中央に位置する温度変化手段が60℃から95℃へ加熱すると同時に外側にある温度変化手段は95℃から60℃へ冷却される。
【0064】
以上から、本実施形態の流体の制御方法は、熱膨張や流体の蒸発による流体位置の変動を抑え、1つのPCR領域の2箇所において位相の異なるPCR温度サイクルを印加することもできる。特に、アニーリング工程と伸張工程を等しい温度で達成する2ステップのPCR温度サイクルに適する。この場合、アニーリングおよび伸張工程を65℃、変性工程を95℃と設定する。65℃から95℃への加熱レートと95℃から65℃への冷却レートを等しくさせることにより一方の温度変化手段による温度変化領域の流体の膨張は他方の温度変化領域の流体の収縮によって相殺され、流体の位置変動を抑えることができる。
【0065】
また、2つの温度変化手段のみで反応を促進し、かつ流体位置の変動を低減することができる。
【0066】
(実施形態2)
実施形態2において、マイクロ流路内の温度が冷却されることにより外部からの物質の混入を低減する方法を説明する。
【0067】
図4において、マイクロ流体デバイス21は、内部にマイクロ流路22を有する。温度変化手段27および28が温度変化を付与する領域をそれぞれ23、24とし、マイクロ流路22内で領域24に存在する流体を25、領域23に存在する流体を26とする。
【0068】
いま、流体26において、DNAのプローブが配置され、浮遊しているDNA断片とハイブリダイゼーションを行うとする。ハイブリダイゼーションは35℃から60℃などと多彩な温度環境で行われるが、反応は一定温度でよい。しかし、前工程として、DNAを約90℃で変性させる工程があり、約90℃から例えば約42℃のような急激な温度変化が伴う。このとき、流体26は短い時間で冷却され、体積収縮を受ける。このため、マイクロ流路22に含まれる全流体体積も小さくなり、マイクロ流体デバイス21の外部にある物質がマイクロ流路22内に混入して観測結果に影響を及ぼす可能性がある。
【0069】
この混入を防止するために、マイクロ流路22の端部に存在する流体25を熱膨張させることにより、マイクロ流路22内の流体体積を一定に保つことができる。つまり、温度変化装置28は流体26に対して冷却すると同時に、温度変化装置27は流体25に対して加熱する。そして、熱収縮の体積と熱膨張の体積を等しくなるように設定することにより、マイクロ流路21内の体積を一定に保持することが可能になる。あるいは、流体26の体積収縮より流体25の体積膨張を大きくすることにより、マイクロ流体デバイス21外部からの物質の混入は防止できる。
【0070】
(実施形態3)
実施形態3において、マイクロ流路内の流体が加熱されることにより、マイクロ流体デバイスの外部へ流体が飛散することを防止する方法を説明する。
【0071】
図4におけるマイクロ流体デバイスを用いて、等温遺伝子増幅反応であるLAMP法を実施したとする。鎖置換型のDNAポリメラーゼの働きにより、温度変化手段27を用いて約1時間程度約60℃から65℃の間の一定温度で増幅された遺伝子は、増幅前の遺伝子量と比較して例えば1010倍程度に増加される。このとき、流体26が白濁することにより増幅の確認ができる。
【0072】
増幅反応を終了させるには、DNAポリメラーゼを失活させる必要が生じるが、失活方法は温度変化手段27を用いて80℃または95℃程度で数分間から十数分間加熱し続ける工程を踏む。マイクロ流路22内に存在する流体が急激に20℃または35℃程度上昇されると、熱膨張により多量に増幅された遺伝子を含む流体がマイクロ流体デバイス外部へ飛散し、測定環境のコンタミネーションを招く可能性がある。
【0073】
飛散を防止するために、温度変化手段28を備え、流体26の膨張体積と等しくなるように流体25を収縮させることにより、マイクロ流路22内の流体の体積を一定に保つことができる。
【0074】
(実施形態4)
本実施形態においては、細胞培養や酵素反応を行ったマイクロ流体デバイスを廃棄する際の加熱処理方法の説明をする。
【0075】
細胞を培養したシャーレなどの器具は、培養後はオートクレーブにより殺菌された上で処理される。しかしながら、マイクロ流体デバイスをオートクレーブ装置に配置した場合は、マイクロ流路内部まで効果的にオートクレーブがなされたかの保証が困難である。
【0076】
マイクロ流体デバイス21内で細胞の培養や、酵素反応を実施した場合は、細胞活性や酵素活性が完全に失活した状態でデバイスを廃却することが望ましい。いま、図4におけるマイクロ流体デバイス21は、細胞とその培養液を含む流体26を有し、必要な細胞測定などを終了したとする。このとき、温度変化手段27により、約120℃〜150℃程度に加熱し、細胞を死滅させるとともに、細胞内部にある酵素を完全に失活させることができる。
【0077】
一方、死滅させた細胞や酵素をマイクロ流体デバイス外部に飛散させることは望ましくなく、デバイス内部に留めておくことが望ましい。温度変化手段27が温度を上昇させると同時に温度変化手段28の温度を下降させ、流体25の体積収縮が流体26の熱膨張体積より大きくなるように設定することにより、細胞の破片や酵素をマイクロ流体デバイス21外部に飛散させることなく加熱処理が行える。このとき、温度変化手段27が約120℃から150℃程度まで加熱されるため、温度変化手段28は室温より低くさせる必要が生じる場合がある。そのため、温度変化手段はペルチェ素子などが好ましい。
【0078】
また、流路壁面に配置された加熱抵抗部は、温度測定手段としても使用することができ、その抵抗値から流路内の温度を測定することができるようになる。この測定結果をフィードバックすることで、より精度良く温度制御することができるようになる。
【産業上の利用可能性】
【0079】
本発明は、加熱または冷却工程を伴う、化学合成、環境分析、臨床検体分析を実施するための、マイクロ流体デバイスに利用することができる。
【符号の説明】
【0080】
1、2、14、15 温度変化手段
3 指示手段
4、10、21 マイクロ流体デバイス
11 マイクロ流路
12 流体
13 反応場
16A、17A 流体
16B、17B 流体
22 マイクロ流路
23、24 温度変化領域
25、26 流体
27、28 温度変化手段
【特許請求の範囲】
【請求項1】
少なくとも一の流路を有する流体デバイスを用いて熱処理を行う装置であって、
前記流路の一部にある流体の温度を変化させる第一の温度変化手段と、
前記第一の温度変化手段による前記流路内の流体の膨張または収縮を前記流路の他の一部の流体の収縮または膨張で緩衝させるために、流路の他の一部の流体の温度を変化させる前記第二の温度変化手段と、
を有する熱処理装置。
【請求項2】
前記第一の温度変化手段による温度変化と、前記第二の温度変化手段による温度変化とが、互いに逆になるように前記第一および第二の温度変化手段に指示を与える指示手段を有する請求項1に記載の熱処理装置。
【請求項3】
前記指示手段は、前記第一の温度変化手段による昇温レートと、前記第二の温度変化手段による降温レートとが等しくなるか、あるいは前記一の温度変化手段による降温レートと、前記第二の温度変化手段による昇温レートとが等しくなるように、前記第一および第二の温度変化手段に指示を与えるものである請求項2に記載の熱処理装置。
【請求項4】
前記第一および第二の温度変化手段によって加熱される一部の流路が、ともにPCRを行う一の領域である請求項1から3のいずれか一項に記載の熱処理装置。
【請求項5】
前記第一および第二の温度変化手段が、それぞれペルチェ素子を含む請求項1から4のいずれか一項に記載の熱処理装置。
【請求項6】
前記第一および第二の温度変化手段が、流路内に配置された発熱抵抗体および前記流体デバイスを外部から冷却する冷却器を有する請求項1から5のいずれか一項に記載の熱処理装置。
【請求項7】
請求項1から5のいずれか一項に記載の熱処理装置と、前記流路からの発光を検出する発光検出手段と、を備えることを特徴とする分析装置。
【請求項8】
少なくとも一つの流路を有する流体デバイスを用いて流体を処理する処理方法であって、
前記流路の一部の温度を上昇させるとともに、前記流路の他の一部の温度を降下させ、前記流路内の流体の移動を制限することを特徴とする流体の処理方法。
【請求項9】
前記流路の一部の昇温レートと、前記流路の他の一部の降温レートとを等しくする請求項8に記載の処理方法。
【請求項1】
少なくとも一の流路を有する流体デバイスを用いて熱処理を行う装置であって、
前記流路の一部にある流体の温度を変化させる第一の温度変化手段と、
前記第一の温度変化手段による前記流路内の流体の膨張または収縮を前記流路の他の一部の流体の収縮または膨張で緩衝させるために、流路の他の一部の流体の温度を変化させる前記第二の温度変化手段と、
を有する熱処理装置。
【請求項2】
前記第一の温度変化手段による温度変化と、前記第二の温度変化手段による温度変化とが、互いに逆になるように前記第一および第二の温度変化手段に指示を与える指示手段を有する請求項1に記載の熱処理装置。
【請求項3】
前記指示手段は、前記第一の温度変化手段による昇温レートと、前記第二の温度変化手段による降温レートとが等しくなるか、あるいは前記一の温度変化手段による降温レートと、前記第二の温度変化手段による昇温レートとが等しくなるように、前記第一および第二の温度変化手段に指示を与えるものである請求項2に記載の熱処理装置。
【請求項4】
前記第一および第二の温度変化手段によって加熱される一部の流路が、ともにPCRを行う一の領域である請求項1から3のいずれか一項に記載の熱処理装置。
【請求項5】
前記第一および第二の温度変化手段が、それぞれペルチェ素子を含む請求項1から4のいずれか一項に記載の熱処理装置。
【請求項6】
前記第一および第二の温度変化手段が、流路内に配置された発熱抵抗体および前記流体デバイスを外部から冷却する冷却器を有する請求項1から5のいずれか一項に記載の熱処理装置。
【請求項7】
請求項1から5のいずれか一項に記載の熱処理装置と、前記流路からの発光を検出する発光検出手段と、を備えることを特徴とする分析装置。
【請求項8】
少なくとも一つの流路を有する流体デバイスを用いて流体を処理する処理方法であって、
前記流路の一部の温度を上昇させるとともに、前記流路の他の一部の温度を降下させ、前記流路内の流体の移動を制限することを特徴とする流体の処理方法。
【請求項9】
前記流路の一部の昇温レートと、前記流路の他の一部の降温レートとを等しくする請求項8に記載の処理方法。
【図1】


【図2】


【図3】


【図4】




【図2】


【図3】


【図4】


【公開番号】特開2012−242118(P2012−242118A)
【公開日】平成24年12月10日(2012.12.10)
【国際特許分類】
【出願番号】特願2011−109450(P2011−109450)
【出願日】平成23年5月16日(2011.5.16)
【出願人】(000001007)キヤノン株式会社 (59,756)
【Fターム(参考)】
【公開日】平成24年12月10日(2012.12.10)
【国際特許分類】
【出願日】平成23年5月16日(2011.5.16)
【出願人】(000001007)キヤノン株式会社 (59,756)
【Fターム(参考)】
[ Back to top ]

