流動性の止血用の組成物を作成する方法およびこれらの組成物を収容している装置
【課題】本発明は、流動性の止血用の組成物を作成する方法と、内部に配置されているその流動性の止血用の組成物を含んでいる装置と、に関連している。
【解決手段】流動性の止血用の組成物を形成するために、連続的な液体の相の全体に亘って実質的に均質に分散されている不連続な気体の相および固体の粒子を含んでいる実質的に均質な組成物を形成するために、所与の容積の生体適合性の液体と、所与の容積の生体適合性の気体と、所与の量の生体適合性のポリマーの固体の粒子と、が一緒に混合されている。その後、上記の組成物は、上記の液体の相の全体における気体の相および固体の粒子の実質的に均質な分散を維持するために有効な条件下において、止血を必要としている体の部位にその流動性の止血用の組成物を供給するために適している装置の中に移される。
【解決手段】流動性の止血用の組成物を形成するために、連続的な液体の相の全体に亘って実質的に均質に分散されている不連続な気体の相および固体の粒子を含んでいる実質的に均質な組成物を形成するために、所与の容積の生体適合性の液体と、所与の容積の生体適合性の気体と、所与の量の生体適合性のポリマーの固体の粒子と、が一緒に混合されている。その後、上記の組成物は、上記の液体の相の全体における気体の相および固体の粒子の実質的に均質な分散を維持するために有効な条件下において、止血を必要としている体の部位にその流動性の止血用の組成物を供給するために適している装置の中に移される。
【発明の詳細な説明】
【開示の内容】
【0001】
〔発明の分野〕
本発明は流動性の止血用の組成物を作成する方法およびこれらの組成物を収容している装置に関連している。
【0002】
〔発明の背景〕
固体のスポンジまたは粉末の両方の形態でのゼラチンを基材とする止血物質は市場において入手可能であり、外科処置において用いられている。ゼラチンの粉末は、流体と共に混合されると、特に平らでない表面または到達することが困難である領域からの、びまん性出血のための流動性で、押し出し可能の、注入可能な止血物質として有用であるペーストまたはスラリーを形成できる。この従来のスラリーは組成物の均一性を与えるために粉末および液体の機械的な攪拌および混合により使用の場所において調製される。その後、このペーストは、例えば、注射器等の、送達手段またはアプリケータの中に入れられて、傷に供給される。
【0003】
この方法の主な不都合は、必要な時にいつでも、使用の場所において、粉末を液体と共に混合し、これをペーストの状態に練り、選択した送達装置の中に後部から充填する必要性である。これらの操作は時間がかかり、潜在的に、使用の環境により、送達される製品の滅菌状態を損なう可能性がある。したがって、使用の場所において使用することがすぐにできる、または最小限の操作により製品の滅菌状態を損なう危険性を伴わずに調製することができる無菌で流動性の止血用の組成物に対する要望が存在している。
【0004】
例えば、注射器またはその他のアプリケータ等のような送達手段を含む、止血装置が止血用の組成物により予め充填されていて、さらなる操作の必要性を伴わずに、あるいは、最小限の操作または調製を伴って、使用の場所において外科医にとって利用可能であれば、望ましくなるであろう。これらの装置またはアプリケータの中に予め充填された止血用の組成物は無菌で流動性である必要があり、使用の場所において送達手段を通して押し出すか射出される場合に、最小限の調製時間および最小限の力を要する必要がある。また、市場において存在し得る上記のような組成物を作成するための方法を考案して、作業場所において許容可能な環境を維持し、流動性で物理的に安定である止血用の組成物を含んでいる予め充填されている装置を提供することも望ましくなるであろう。本発明はこのような方法を提供している。
【0005】
〔発明の概要〕
本発明は、流動性の止血用の組成物を作成する方法と、これらの流動性の止血用の組成物を供給することにおいて使用するために適している装置であって、その中に配置されている流動性の止血用の組成物を含んでいる、装置と、に関連している。流動性の止血用の組成物を作成するための方法において、第1の容積の生体適合性の液体が、その液体を混合するための手段を備えている混合用の容器の中に導入される。次に、第2の容積の生体適合性の気体が、上記の混合するための手段が上記の液体と気体を一緒に混合して発泡体を形成するために有効な条件下において動作している間に、上記の容積の液体の中に導入される。この発泡体は上記の液体を含んでいる連続的な液体の相の全体に亘って分散されている気体を含む不連続な気体の相を含んでいる。さらに、止血において使用するために適していて、上記の液体の中に実質的に不溶性である所与の量の生体適合性のポリマーの固体の粒子が上記の発泡体の中に導入され、これらの発泡体および固体の粒子は上記の不連続な気体の相と、上記の連続的な液体の相の全体に亘って実質的に均質に分散されている固体の粒子とを含んでいる実質的に均質な組成物を形成するために有効な条件下において一緒に混合される。この場合に、上記の液体の容積、気体の容積、および固体の粒子の量、の比率は、止血特性を伴う止血用の組成物を提供するために、したがって、流動性の止血用の組成物を形成するために、有効である。このようにして形成された流動性の止血用の組成物は、その後、その流動性の止血用の組成物を、上記の液体の相の全体に亘る上記の気体の相と固体の粒子との実質的に均質な分散を維持するために有効な条件下において、止血を必要としている体の部位に供給するために適している装置の中に移される。その後、このような内部に配置されている流動性の止血用の組成物を含んでいる装置は無菌で流動性の止血用の組成物を含んでいる無菌の装置を形成するために有効な条件にかけられるか、曝される。本発明の方法により作成される組成物および装置は使用の時間から十分に先立って調製することが可能であり、使用の場所において調製される必要はなく、さらに、これらは使用の場所および時間において流動性、押し出し可能性または注入可能性を示すために有効な物理的な特性を維持する。
【0006】
〔発明の詳細な説明〕
本発明の方法により作成した、滅菌処理されている、および滅菌処理されていない、両方の組成物は、その3種類の必要な成分として、止血において使用するために適している生体適合性のポリマーの固体の、多孔質または非多孔質の粒子と、生体適合性の液体と、生体適合性の気体と、を含んでいる。これらの粒子、液体および気体は、その液体を含んでいる連続的な液体の相と、その連続的な液体の相の全体に亘って均質に分散されている固体のポリマー粒子および気体を含んでいる不連続な気体の相と、を含んでいる実質的に均質な止血用の組成物を形成するために有効な条件下において組み合わされて混合される。この組成物の中に含まれている粒子の量および平均の直径、および上記の固体、液体および気体の各相の相対的な量は、以下において本明細書に説明されているように、止血のおよび物理的な特性を伴う組成物を形成するために有効である。
【0007】
上記のように形成された止血用の組成物は止血用のペースト、スラリーであり、このペーストまたはスラリーは、類似の液体/粒子の組成物の流動性の止血用の組成物であるが、その中に分散されている気体の相を含んでいない止血用の組成物に比べられる場合に、流動性、押し出し可能性および/または注入可能性の改善された特性を示す。本発明の方法により作成した組成物は、調製して、流動可能な止血用の組成物を分配するために用いられて、それぞれの目的とされる使用の時間から十分に先立って、電離放射線により滅菌されている注射器またはその他の既知のアプリケータ等のような、医療装置の中に、充填することができる。これらの組成物は、その組成物の調製を容易にするため、物理的および機械的な特性を高めるため、その組成物の止血特性を高めるため、あるいは抗菌性を与えるために、添加物をさらに含んでいてもよい。
【0008】
本明細書においては、「連続的な」および「不連続な」は分散を定めるためおよび説明するために用いられている標準的な用語体系の状況におけるこれらの用語の通常の意味で用いられている。例えば、連続的な液体の相と共に組み合わされて混合されると、その液体の相に加えられた生体適合性の気体の容積は混合により分裂されて、不連続な、すなわち、分散された、気体のポケットまたは分離されている部分を含む気体の相を形成する。
【0009】
本明細書においては、「実質的に均質な」とは、組成物またはペーストの物理的な状態を示しており、この場合に、固体および/または気体の相は、その固体:気体:液体の比率およびその組成物またはペーストの断面におけるいずれの部分の密度も実質的に同一になるように、連続的な液体の相の全体に亘って均一に分散されている。
【0010】
本明細書においては、「発泡体」は、不連続な気体の相が連続的な液体の相の中に分散されている状態、を示している。なお、この発泡体の中の気体の相はその発泡体を通して実質的に均質に分散されている必要はない。
【0011】
本明細書においては、「密度」は、発泡したペーストの単位容積当たりの固体と添加された液体との混合物の質量を定めて説明するために用いられている、標準的な用語体系の状況におけるその用語の通常の意味で用いられている。
【0012】
本明細書においては、「無菌の」とは、生きている細菌および/または微生物が実質的に無いこと、さらに、本明細書において記載されていて特許請求されている組成物および医療装置に関連している政府の基準により認められていて記載されているような状態を意味している。また、本明細書においては、「止血(用)の」または「止血特性」は、止血の技術における熟練者がこれらの用語が意味することを理解するように、さらに、本明細書の実施例において例示されているように、出血を止めるか最小限にするための能力を意味する。
【0013】
本明細書においては、「最大しぼり出し力」は、本明細書の実施例において説明されているように、14ゲージの血管カテーテルの先端部分をはめ込んでいる予備充填型のルアー注射器から組成物を押し出すために必要とされる最大の力の値である。
【0014】
本発明の組成物において用いられている上記の固体の粒子を調製するために、多様な生体適合性で、天然の、半合成の、あるいは合成の、ポリマーを用いることができる。この場合に、選択されるポリマーは特定の組成物のために選択された液体の中において実質的に不溶性である必要がある。好ましくは、機械的、化学的および/または生物学的な止血活性を示す、水に不溶性で生体分解性のポリマーが用いられている。これらの使用可能であるポリマーは、限定を伴わずに、蛋白質および多糖類を含む。さらに、使用可能である多糖類は酸化セルロース、キトサン、キチン、アルギネート、酸化アルギネート、および酸化デンプンを含む。また、上記の粒子を調製するために用いられる生体適合性のポリマーは、好ましくは、ゼラチン、コラーゲン、フィブリノゲンまたはフィブロネクチン等のような、架橋または変性されている蛋白質である。好ましいゼラチンの粉末は、ゼラチンのスポンジを、レーザー回折により決定される場合に、約40ミクロン〜約1,200ミクロン、または約100ミクロン〜約1,000ミクロンの平均の直径を有する粒子に、微粉砕することにより調製される部分的に架橋されているゼラチンの粉末である。
【0015】
本発明の方法により作成される組成物は連続的な液体の相を含んでおり、この相の中において、上記の固体の粒子および気体の相は実質的に均質に分散されている。特定の医療装置およびその用法に応じて、上記の液体は水性であっても非水性であってもよい。特定の実施形態において、上記の液体の相は水性である。このような水性の液体は、限定を伴わずに、塩化カルシウムおよび塩水等のような、生体適合性の水性の溶液を含むことができる。さらに好ましくは、上記の液体の相は塩水を含む。この液体の相および固体の粒子の相は止血を行なうことにおいて使用するために適しているペーストまたはスラリーを形成するために有効な相対的な量で存在している。なお、固体の粒子の相の過度の希釈は、上記の最大しぼり出し力をさらに減少させるために有益であるが、その材料の止血特性に有害に作用し、それゆえ、望ましくない。上記の液体に対する固体の粒子の重量比率は一般に約1:2〜約1:12である。さらに、特定の実施形態において、塩水に対する固体のゼラチンの粒子の重量比率は約1:3〜約1:6である。また、さらに別の実施形態において、塩水に対する固体のゼラチンの粒子の重量比率は約1:5である。
【0016】
空気、二酸化炭素、窒素、キセノンまたはアルゴンを含むが、これらに限定されない、任意の生体適合性の気体が本発明の組成物を調製するために使用できる。好ましくは、アルゴンまたは窒素等のような不活性な気体が用いられる。さらに、空気、窒素およびアルゴンは超音波の影響を受けやすく、体内に注入された後に上記の組成物を位置決めするための手段を与えることができる。同様に、キセノンは放射線不透過性であるので、キセノンを使用することもまた体内に配置された後に組成物を位置決めするための手段を与えることができる。加えて、二酸化炭素はpH値を下げるので、二酸化炭素の選択は上記の組成物の抗菌性を高めることができる。これらの気体は、その気体が、発泡体を形成するために、連続的な液体の相の中に分散されている不連続な気体の相を形成するように、液体の相の全体に亘って分散されるまで、連続的な液体の相と共に組み合わされて混合される。上記の発泡体の中における粒子の分散による組成物の形成時において、その組成物の中における気体の相の分散は、本明細書において記載されているように、流動性、押し出し可能性および注入可能性に関連している改善された物理的な特性を伴う組成物を与えている。このような改善された特性は、滅菌処理の間の組成物の照射の前および後の両方における、密度および最大しぼり出し力を含む、組成物の物理的な測定値として、特徴づけられる。
【0017】
本発明の組成物の上記の3種類の主な構成要素の相対的な濃度およびその組成物の実質的に均質な性質はその組成物に止血のおよび物理的な特性の両方を示すことにおいて重要である。上記の固体の粒子、液体の相および気体の相は、一般に、重量:容積:容積(g:mL:mL)に基づいて、約1:2:1〜約1:12:13の比率で本発明の方法により作成した組成物中に存在する。また、別の実施形態において、上記の比率は約1:4:1〜約1:8:9である。さらに、別の実施形態において、上記の比率は約1:5:3である。本発明の組成物の密度は約0.9g/mL〜約0.3g/mLであり、あるいは、特定の実施形態において、約0.8g/mL〜約0.6g/mLである。
【0018】
本明細書において記載されている本発明の方法により作成した特定の組成物は、これらが、所与の量の、例えば、電離放射線等により、照射されているという点において、無菌である。このような照射はe−ビームまたはガンマ線の照射を含むことができる。さらに、上記の組成物が照射される時間を含む、照射の量および滅菌処理の条件は、本明細書において定められているような、無菌の組成物を与えるものである。なお、この開示の恩恵を受けた後に、熟練者は無菌の組成物を与えるために必要な照射の量を容易に決定できるようになるであろう。
【0019】
上記の止血用の組成物は、さらに、放射線不透過剤、抗菌剤、発泡剤、発泡安定化剤、界面活性剤、酸化防止剤、保湿剤、湿潤剤、潤滑剤、増粘剤、希釈剤、例えば、ラジカル・スカベンジャー等の照射安定化剤、可塑剤、および安定化剤を含むが、これらに限定されない、有効な量の1種類以上の添加物または化合物を含有していてもよい。例えば、グリセロール(glycerol)は上記の組成物の押し出し可能性または注入可能性を高めるために添加できる。さらに、このグリセロール(glycerol)は、上記の液体の相の重量に基づいて、約20重量%まで、または約1〜約10重量%、または約1〜約5重量%まで、上記の組成物中に存在できる。加えて、上記の組成物に高められた特性を与えるために、第四級アミンを用いることができる。例えば、塩化ベンズアルコニウム(benzalkonium chloride)、ポリブレン(Polybrene)またはオナマー・エム(Onamer M)は、上記の液体の相の重量に基づいて、約1重量%までの量で使用できる。さらに、特定の実施形態において、塩化ベンズアルコニウム(benzalkonium chloride)は、上記の液体の相の重量に基づいて、約0.001〜約0.01重量%、または約0.002〜約0.006重量%の量で用いられている。また、上記の第四級アミンは多数の機能を与えることができ、抗菌剤、発泡剤、ラジカル・スカベンジャーとして、および/またはヘパリン中和剤として作用する可能性がある。
【0020】
上記の止血用の組成物は、さらに、トロンビン、フィブリノゲン、フィブリン、第Xa因子または第VIIa因子等のような、有効な量のヘパリン中和剤、前駆凝固剤または止血剤を含有していてもよい。この「有効な量」とは、上記の添加物が添加されることに対応して上記の特性を上記の組成物に与えるために必要な量を意味している。なお、添加できる最大の量は有害な生物学的な作用を生じないように制限されている。
【0021】
本発明の方法により作成した組成物は、照射の影響を受けやすい添加物が利用されている止血用の組成物において使用するために、特に有利である。例えば、水性の溶液中におけるトロンビンは、滅菌処理の照射に曝露されると、全ての前駆凝固剤の活性を失うことが分かっている。これに対して、実施例9において示されているような、本発明による組成物中に配合される場合に、トロンビンは、滅菌処理の後に、その元の酵素的な活性の約40%およびその止血の活性の全てを維持している。なお、ウシのトロンビンが本明細書において例示されているが、内容が、その全体において、このように、参照により本明細書に組み入れられている、米国特許第5,143,838号において記載されているような、ヒト由来トロンビンも本発明の組成物において使用可能である。
【0022】
本発明の止血用の組成物が利用可能である医療装置は、止血を必要としている部位または傷に、流動性のまたは注入可能な止血用のペーストまたはスラリーを供給するために現在において用いられている任意の装置を含む。このような止血を必要としている部位は傷害または外科処置の結果と考えることができる。また、上記の装置またはアプリケータの例は、ベクトン・ディッキンソン(Becton Dickinson)またはモノジェクト・ルアー・シリンジ(Monoject luer syringes)等のような、注射器を含む。さらに、別の装置が、内容が、その全体において、参照により本明細書に組み入れられている、米国特許第6,045,570号において詳細に開示されている。
【0023】
本発明の方法において、上記の液体はミキサーに加えられる。その後、気体が、その液体の連続的な液体の相を通して分散されている気体の不連続な気体の相を含んでいる発泡体を形成するために有効な条件下の混合により、その液体の中に混入される。さらに、特定の実施形態において、これらの気体および液体は約3〜約30分間にわたり混合できる。その後、上記の固体のポリマー粒子が、その固体の粒子を発泡体の全体に亘って実質的に均質に分散させるために、その発泡体の中に混入されて混合される。特定の実施形態において、これらの発泡体および粒子は約15〜約30分間にわたり混合できるが、30分を超える混合も許容可能である。上記のような実施形態において、例えば、二重遊星式ミキサー等の、ミキサーが利用できる。
【0024】
上記の液体は、上記の粒子または気体の溶液に対する添加の前に、その中に溶けている有効な量の添加物を含むことができる。例えば、グリセロール(glycerol)および塩化ベンズアルコニウム(benzalkonium chloride)を含有している塩水の溶液を調製した後に、上記のミキサーに添加してもよい。さらに、気体の供給源がそのミキサーに供給され、これにより、その気体の第1の部分を液体の溶液に加えることができる。上記の気体および液体の混合物は上記の液体の相の中にその気体を分散させるために混合され、これにより発泡体が形成される。その後、固体の粒子および気体のあらゆる追加の部分は、これらの全ての成分が添加されるまで、常に継続的な混合を伴って、そのミキサーに加えられる。この混合は、実質的に均質な組成物が上記の連続的な液体の相の全体に亘って均一に分散されている固体の粒子および不連続な気体の相を含んで形成される時間まで、続けられる。上記の液体、気体および固体の粒子の混合の密度は、所望の物理的なおよび止血の特性を伴う組成物を与えるように、その組成物が実質的に均質になる時点を決定するために、モニターすることができる。
【0025】
上記のように形成された流動性の止血用の組成物は、その後、止血を必要としている体の部位にその流動性の組成物を供給するために適している装置の中に移される。これらの充填された装置およびその中に収容されている組成物は、その後、使用の直前における現場での調製および取り扱いに関する当業界の現状の問題を回避する、無菌のすぐに使用できるシステムを提供するために滅菌される。
【0026】
上述の組成物および装置の調製は、実験室の設備等のような、小さな規模で容易に達成できるが、商業用の使用のために適している規模でのこれらの組成物および装置の調製は別の問題を与える。
【0027】
すなわち、商業用の製造設備においては、作業場所の全体の環境、雰囲気に対する曝露による固体の粒子による潜在的な増加されるバイオバーデン、およびアプリケータ装置への移動および滅菌処理の間に組成物の物理的な構造および特性を維持すること、を含む、組成物および装置の小規模の調製において容易に明らかではない特定の問題に対処しなければならない。例えば、粉末の形態の大量の微細な粒子が混合容器に加えられる時に、その粉末の状態の粒子の微細な粒度は作業場所の中に過度の塵埃を生じる可能性があり、この塵埃は、職員の安全および作業場所の全体的な維持ならびに設備の品質の高さに関連する問題を含む、環境問題を生じる可能性がある。加えて、例えば、ゼラチンを基材とする材料は、長期の期間にわたり上記のような環境に曝されると、微生物による侵入の影響を受けやすい。また、上記のような粉末の増加されたバイオバーデンは処理の間におけるゼラチンの変性を引き起こし、製品の無菌状態および生体適合性に対して有害になる可能性がある。
【0028】
過度の塵埃により生じる可能性のある環境問題を最小限にするために、一例の解決方法は、混合する前に、ペレット、顆粒または何らかの別の適当な形状等のような、物理的な本体の中に上記の粒子を詰め込むか凝縮させることが考えられる。このような粒子の本体は、複数の詰め込まれていない粒子に比べて、水性の媒体に接触して置かれると、その隙間の孔の中への水性の媒体の改善された吸収を生じるために有効な穴の容積および中央値の孔の直径を有する隙間の孔を含んでいる、複数の詰め込まれている粒子、を含んでいてもよいが、必ずしもこれを必要としない。
【0029】
あるいは、上記の固体の粒子は添加の間の雰囲気に対する粉末の粒子の曝露を避けるために、閉じられてまたは封じられている構造体または導管を通して上記の発泡体を入れている混合容器に添加できる。上記のような構造体による粒子の添加は微細な粒子の添加により生じる塵埃を最小限にすると共に、混入の前に混合容器の内壁部に以前に捕捉されていた残留の粒子における微生物の増殖のための機会を減少させる。
【0030】
上述のような環境問題に加えて、混合容器から医療装置への上記の流動性の止血用の組成物の移動は、その組成物の物理的な構造の破壊または変形、すなわち、その液体の相の全体に亘る固体の粒子および気体の相の分散状態の崩壊、につながる可能性がある。例えば、比較的に高い圧力により、実質的に均質な止血用の組成物を混合容器からアプリケータ装置に移動させようとすると、このような場合に、そのペーストを移動させるために必要とされる比較的に高い圧力により生じる可能性のある圧縮力により、その止血用の組成物の構造を維持することが困難になる可能性がある。また、このような圧縮は液体の相からの気体の相の分離につながる可能性もある。さらに、このような気体の相の損失は、例えば、照射処理の間およびその後の両方における、流動性や混合の容易さ、等のような、組成物の機械的な特性に対して有害である。
【0031】
本発明の方法は、圧縮力につながる可能性のあるかなり大きな圧力の形成または存在を避ける条件下において、その方法の全体を通して上記の組成物を移動させることにより、上記のような有害な作用を最小限にしている。好ましくは、上記の組成物は、上記のような圧縮力が実質的に存在していない、最小限の圧力の条件下において、すなわち、その組成物の構造に有害に作用することなくその組成物の効率的な移動を行なう条件下において、混合容器からアプリケータ装置の中に移される。
【0032】
最小限の圧力の条件を維持するためには、本発明の方法の特定の実施形態は上記の止血用の組成物を上記のアプリケータ装置の中に移動させるためにオーガー・スクリューを利用している。なお、本明細書において例示されている特定の実施形態においては、上記のオーガー・スクリューは装置を充填するために重力を利用するように垂直な配向で用いられているが、組成物の混合容器から充填用の装置への移動は水平なスクリューの配向で行なえることも考えられている。上記のオーガー・スクリューは、塊りの移動に対して、上記の工程を通して、その組成物の局所的な移動を行なう。このようにして、その材料の本体の全体に圧縮を生じる可能性のある組成物の塊りに加えられる大きな力は、その材料の本体の中において局在化される力に代わって、回避できる。
【0033】
本発明により調製される組成物は、上述のように、気体、液体および固体の相を含んでいるので、その組成物の構造の維持は上記のオーガー・スクリューの設計に部分的に依存している。このような構造と、組成物における、液体:気体:固体の粒子、の比率と、を許容可能なパラメータの範囲内に維持し、したがって、押し出される止血用のペーストの密度を許容可能な密度の範囲内に維持するためには、オーガー・スクリューの設計における考慮点は、そのオーガー・スクリューにおけるねじ山の幅、数およびピッチと、そのオーガー・スクリューのロッドに対するねじ山の角度と、オーガー・ボウルの設計および仕上げと、アジテータ・ブレードの直径および角度と、装置の全体の規模と、を含む。
【0034】
上記の充填用の装置の保持容器の中に移されると、その充填中に上記の組成物の構造を維持するために有効な条件を保つことは多数の状況に依存する。例えば、一例の考慮点は、オーガー・スクリューによるか組成物の塊りに加えられる重力により、その組成物に与えられる可能性のある作用の量である。また、この充填用の装置の中の組成物の存在時間はこれらの考慮点のそれぞれに関連している。すなわち、組成物が充填用の装置の中に長く保持されるほど、その組成物は充填の間にオーガー・スクリューにより形成される繰り返しの脈動している力を長く受けることになり、さらに、その組成物はその組成物自体を圧縮するように作用するその組成物の本体の重量を長く保持しなければならなくなり、これらのそれぞれは液体の相からの気体の相の分離を生じる可能性がある。加えて、オーガー・ボウルの形態および仕上げを考慮する必要がある。例えば、材料とオーガー・ボウルの面との間の摩擦を最小限にする表面の仕上げは摩擦により生じる可能性のあるあらゆる有害な作用を最小限にする。
【0035】
上記の充填用の装置の中における組成物の存在時間、その組成物に与えられる全体の作用、およびアプリケータ装置の中への組成物の移動の速度は、上述のような、有害な作用が最小限になるように、最適化できることが分かっている。また、本明細書において例示されている特定の実施形態に関連して、上記の装置の保持容器からのアプリケータ装置への組成物の移動の速度は、少なくとも約12mL/分、または少なくとも約36mL/分、または約72mL/分、さらに約100mL/分を超えていることが好都合であることが分かっている。しかしながら、組成物に与えられる存在時間の作用を最適化するために、その組成物が移動する実際の速度は充填用の装置の特定の設計および寸法ならびに充填される特定の組成物により決まることが当業者により理解されるであろう。
【0036】
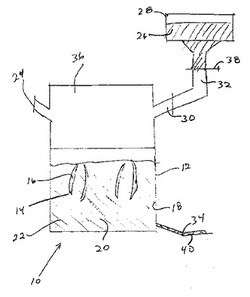
図1において示されているように、混合装置10は混合手段14を備えている混合容器12を含んでいる。混合手段14は、共通の軸において混合容器12を軌道を描いて回りながら、それぞれの軸において回転する多数の螺旋形のブレード16、を備えている。これらの螺旋形のブレード16は混合容器12の縁の周りを連続的に進行して、内側の混合容器の壁部18から材料を除去し、混合容器12の内部に移動させることにより、その材料の全体のバッチが完全に混合されることを可能にする。混合容器12は、閉じた系を形成するように、混合容器カバー36と嵌めあわされている。この混合容器カバー36は、混合容器12の中への、液体22と、気体40と、固体の粒子26と、の添加のための、添加ポート24,30および34、を含んでいる。さらに、固体の粒子26を入れているホッパー28は、雰囲気に対する固体の粒子26の曝露を最小限にするために、粉末の流れの調整弁38を含む導管32を介して混合容器カバー36に対して閉じた関係にある。
【0037】
この方法の一例の実施形態において、液体22はポート24を介して混合容器12に添加される。混合手段14は、気体40および液体22が一緒に配置される時に、これらの気体40および液体22の混合を容易にするために、約60〜約80Hzの速度で作動する。気体40はポート34を介して混合容器12の中の液体22の中に導入される。これらの液体22および気体40は上述のような発泡体を形成するために有効な速度と時間において混合される。その後、固体の粒子26は導管32を介して発泡体の中に導入される。この発泡体および固体の粒子26は、その後、その発泡体の全体に亘ってその粒子26を実質的に均質に分散させるために有効な速度および時間において混合される。この調製が終わると、その流動性の止血用の組成物は、次のアプリケータ装置の中への充填のために、図2において示されている充填装置の保持容器に移される。この保持容器への止血用の組成物の移動は、例えば、本明細書において記載されているような、無菌のスクープを使用する等のように、手動により行なうことができ、あるいは、任意の自動化された手段により行なうことも可能である。
【0038】
図2において示されているように、充填用の装置40は、流動性の止血用の組成物44を保持するための保持容器42と、保持容器42およびオーガー漏斗48の中に配置されていて、モーター54と協同しているオーガー・スクリュー46と、モーター47と協同しているアジテータ・ブレード49と、を含んでいる。オーガー・スクリュー46は保持容器42からオーガー漏斗48を通して下流側に螺旋の様式で流動性の止血用の組成物44を移動させる。アジテータ・ブレード49は材料が保持容器の壁部に蓄積することを防ぐと共に、充填中にその組成物の均質な構造を維持することにも役立つ。その後、流動性の止血用の組成物44は出口ポート50を介してアプリケータ装置52の中に移される。このようにして、組成物44は各装置52,56,58の中に充填されるとき、オーガー・スクリュー46はその移動を行なうために動作状態になる。装置52が充填されると、オーガー・スクリュー46の動作は中断されて、追加の装置56および58の次の充填を行なうために、組成物の流れが分離される。このような繰り返しの流れの中断は保持容器42の中の組成物44に脈動している力を生じる。しかしながら、このような組成物の繰り返しの機械的な操作はその組成物の特性に有害に作用する可能性がある。したがって、上述のように、オーガー・スクリュー46の設計および充填装置52,56および58の速度はそのような不都合な影響を最小限にするために最適化されている。
【0039】
本発明の方法において使用できる種類のオーガー・スクリューが図3において示されている。図示のように、このスクリュー60はオーガー・スクリュー・ロッド66に取り付けられている多数のねじ山62,64を含んでいる。図示のように、ねじ山62はねじ山64よりも大きな直径を有している。本発明の実施形態において、これらのねじ山の数、直径、角度およびねじ山間の距離は用いられる特定の装置または組成物自体に適合するように設計できる。なお、熟練者は、この開示の恩恵を受けた後に、本発明の方法において使用できる別のスクリューの設計も容易に確かめることができるであろう。
【0040】
上記のオーガー・スクリューは保持容器からアプリケータ装置の中に組成物を移す。図4aおよび図4bは上記の充填処理の間に、注射器等のような、アプリケータ装置を保持するために使用できる典型的な固定装置を示している。この固定装置70、すなわち、注射器の装填ステーションは、多数の注射器レセプタクル74を有している注射器ホルダー72と、クランプねじ76を含んでいる、固定装置70に注射器を固定するための手段と、クランプ・ロッド78と、注射器衝突ピン80と、を備えている。この注射器82は注射器レセプタクル74の中に配置されている。それぞれの注射器は上述の装置を用いて連続的な様式で同量のペーストにより後部から充填されている。この後部からの充填動作は注射器82の後端部からその注射器82の中に組成物を分配する処理を含む。この場合に、注射器82はクランプねじ76によりその位置が保持されている。充填の完了時に、注射器衝突ピン80が注射器82の外側に接触し、これにより、その注射器82に圧力が加えられて、この圧力が注射器82と充填装置のポートとの間の組成物の流れの分離を生じる。固定装置70は、その後、次の注射器82を充填位置になるように移動させるように、動作する。充填が終わると、注射器のプランジャーがその充填された注射器の後端部の中に挿入されて、適当な位置まで進行し、その注射器82に蓋が付けられる。
【0041】
あるいは、上記の注射器を固定すること、材料の流れの分離を行なうための衝突ピンの使用、垂直な移動に続く水平な移動での多数個の注射器の動作、を含む、上記の材料の装置の中への移動のための手段の基本的な設計は自動化できる。例えば、多数個のレセプタクルを含んでいる円形の固定装置を、上記装置の充填を行なうために、円形の様式で動作させてもよい。
【0042】
熟練者であれば、上記の組成物を製造して、その組成物を各装置に充填するための別の手段を想像することができる。例えば、ポンプ技法を使用することができ、これにより、粉末は発泡用の溶液の再循環ループに添加できる。この発泡用の溶液は低剪断性のポンプを利用してポンプ輸送することができ、上記の粉末は所望の特性が達成されるまで加えることができる。このようにして、液体の固体に対する望ましい比率に到達すると、気体がその再循環しているペーストの中に導入される。さらに、ペーストを膨張させるためにチャンバーを含むことができる。この場合に、そのチャンバーがいっぱいになると、所望の密度に到達して、その発泡されたペーストは各注射器の中に連続的に充填できる。
【0043】
上記の流動性の止血用の組成物の密度が各組成物の許容可能な機械的なおよび止血の特性の指示手段であるとすれば、それらの許容可能な特性を確実にするために、その流動性の止血用の組成物の密度が混合の完了時に測定される。使用する密度を評価する、本明細書において記載されている、一例の方法は、既知の密度の一連の有機溶媒の中に上記の止血用の組成物を懸濁させるか、既知の量の組成物の重量を測定することを含むが、密度を測定する別の方法も利用可能である。なお、本発明の方法における組成物の密度をモニターすることにおいて、流動性の止血用の組成物の密度は既知の密度を伴っている不活性な有機性の液体を使用することにより評価される。これらの液体は、上記の組成物との何らかの可能な相互作用が測定に影響しないように、選択されている。この場合に、その溶媒の密度の選択は止血用の組成物の所定の許容可能な密度の範囲に一致している。すなわち、上記の組成物は異なる密度の一連の溶媒の中に入れられて、その組成物がその溶媒の中において沈むか浮かぶかに基づいて、その組成物の密度が決定される。
【0044】
上述のように調製された止血用の組成物は上述のような医療装置の中に移されて、その止血用の組成物を収容している装置は、好ましくは、電離放射線により、滅菌される。さらに好ましくは、この滅菌は、本明細書において例示されているように、ガンマ線の照射により行なわれる。
【0045】
以下の実施例は本発明の特定の実施形態を説明しているが、これらは本発明の範囲を限定しているものとして解釈されるべきではなく、むしろ、本発明の完全な説明に寄与しているものとして解釈されるべきである。
【0046】
実施例
以下の実施例において調製されているサンプルを2インチ(5.08cm)/分の速度で、50ポンド(22.7kg)のロード・セル(DFG550)を用いて、シャチロン(Chatillon)TCD200により決定した場合の最大しぼり出し力について試験した。留置カテーテル・シース(寸法:12〜14ゲージ)を試験するサンプルの注射器に取り付けた。その後、この注射器を保持用の装置の中に挿入し、この保持用の装置を上記の試験器具に装填した。このようにして、最大しぼり出し力を書き留めた。
【0047】
実施例1
合計で10個のサンプルを以下のように調製した。1グラムの乾燥したサージフォーム(Surgifoam)(登録商標)の粉末をプラスチックの容器の中に入れて、4mLの塩水と混合した。この容器に蓋をして、均一な濃度の実質的に均質なペーストが得られるまで、その内容物を振盪した。このペーストを円筒形の形状に形成して、10ccのBDポリプロピレンの廃棄可能なルアー注射器(luer syringe)の中に入れた。その後、この注射器に蓋をして、その充填された注射器の内の5個を25kGyの線量でガンマ線の照射により滅菌した。次に、最大押し出し力を決定して、表1に示した。この場合に、滅菌されていないサンプルを1aとして示し、滅菌されているサンプルを1bとして示した。
【0048】
合計で10個のサンプルを以下のように調製した。1グラムの乾燥したサージフォーム(Surgifoam)(登録商標)の粉末をプラスチックの容器の中に入れて、4mLの塩水と混合した。この容器に蓋をして、均一な濃度の実質的に均質なペーストが得られるまで、その内容物を振盪した。このペーストを円筒形の形状に形成して、10ccのBDポリプロピレンの廃棄可能なルアー注射器の中に入れた。次に、3mLの窒素を収容している第2の10ccのBDルアー注射器を上記のペーストを収容している注射器に接続して、そのペーストが注射器から注射器に通過できるようにした。さらに、これらのペーストおよび気体を注射器の間で前後に押し動かして、完全に混合させ、均一な濃度の実質的に均質な発泡体様の組成物が得られるまで、そのペーストの全体に亘って気体を分散させた。その後、これらの注射器に蓋をして、その充填された注射器の内の5個を25kGyの線量で照射により滅菌した。次に、最大押し出し力を決定して、表1に示した。この場合に、滅菌されていないサンプルを1a’として示し、滅菌されているサンプルを1b’として示した。
【0049】
実施例2
合計で10個のサンプルを以下のように調整した。まず、0.005重量%の塩化ベンズアルコニウム(benzalkonium chloride)および5重量%のグリセロール(glycerol)を含有している塩水の溶液を調製した。次に、この溶液を用いて、実施例1において記載されているような均質なゼラチン粉末のペーストを調製した。このペーストを円筒形の形状に形成して、10ccのBDポリプロピレンの廃棄可能なルアー注射器の中に入れた。その後、この注射器に蓋をして、その充填された注射器の内の5個を25kGyの線量でガンマ線の照射により滅菌した。次に、最大押し出し力を決定して、表1に示した。この場合に、滅菌されていないサンプルを2aとして示し、滅菌されているサンプルを2bとして示した。
【0050】
合計で10個のサンプルを以下のように調製した。0.005重量%の塩化ベンズアルコニウム(benzalkonium chloride)および5重量%のグリセロール(glycerol)を含有している塩水の溶液を調製した。次に、この溶液を用いて、実施例1において記載されているような均質なゼラチン粉末のペーストを調製した。その後、3mLの窒素を収容している別の10ccのBDルアー注射器を上記のペーストを収容している注射器に接続して、そのペーストが注射器から注射器に通過できるようにした。さらに、これらのペーストおよび気体を注射器の間で前後に押し動かして、完全に混合させ、均一な濃度の実質的に均質な発泡体様の組成物が得られるまで、そのペーストの全体に亘って気体を分散させた。その後、これらの注射器に蓋をして、その充填された注射器の内の5個を25kGyの線量で照射により滅菌した。次に、最大押し出し力を決定して、表1に示した。この場合に、滅菌されていないサンプルを2a’として示し、滅菌されているサンプルを2b’として示した。
【表1】

【0051】
表1におけるデータが示しているように、ペーストの全体に亘って均質に分散されている気体の相を含むことは、均質に分散されている気体の相またはその他の添加物を含んでいないペーストに対して比較した場合に、滅菌処理の前にその組成物の最大しぼり出し力をかなり減少させている。したがって、均質に分散されている気体の相を含んでいる滅菌した組成物は、均質に分散されている気体の相を含んでいない滅菌したペーストのしぼり出し力よりもかなり小さいしぼり出し力を示す。実際に、気体の相を含んでいる滅菌した組成物は気体の相または添加物を全く含んでいない予備滅菌されたペーストのしぼり出し力にほぼ近い。したがって、完全に滅菌された組成物は、気体の相または添加物を全く含まない滅菌されていないペーストの最大押し出し力と同等かこれよりも良い、最大押し出し力により証明されているように、流動性および/または注入可能性を備えることができ、このことは使用の場所において健康管理の提供者にとって有益である。例えば、塩化ベンズアルコニウム(benzalkonium chloride)およびグリセロール(glycerol)等の、添加物の使用は滅菌処理において本発明の組成物の特性をさらに高めるために用いることができる。
【0052】
実施例3
25グラムのサージフォーム(Surgifoam)(登録商標)のゼラチン粉末を、均一なペーストが形成されるまで、塩水の重量に基づいて、0.005重量%の塩化ベンズアルコニウム(benzalkonium chloride)および5重量%のグリセロール(glycerol)を含有している125mlの通常の塩水と共に混合した。この結果として得られたペーストを混合用の櫂を嵌め込んでいる1/2パイント(0.237L)のドンビエル(Donvier)ミキサーの中に詰め込んだ。次に、窒素供給源に接続されている管を上記のミキサーの蓋を通して嵌め込み、フィルムの中に包むことにより、システムを環境に対して「閉じた」状態にした。このシステムを20分間にわたり窒素によりパージした。その後、このペーストを、上記の櫂を手で速やかに回転させることにより、窒素を均質に混入させるために、混合した。この混合は、組成物が利用可能な容積を充たして、気体の相の均質な分布を示した時に、終了した。次に、この組成物を60ccの注射器の中に詰め込んでから、二方向ルアー・コネクタを介して10ccのBDルアー注射器の中に分配した。この組成物の密度はおよそ0.7〜0.75グラム/mLであった。その後、これらの注射器に蓋をして、その充填された注射器の一部を25kGyの線量で照射により滅菌した。
【0053】
実施例4
塩水の重量に基づいて、0.005重量%の塩化ベンズアルコニウム(benzalkonium chloride)および5重量%のグリセロール(glycerol)を含有している2.5リットルの通常の塩水を、2ガロン(7.57L)の二重遊星式ロス(Ross)ミキサーに加えて、5分間にわたり窒素の第1の部分と共に、最大速度で混合して、発泡した液体を形成した。次に、継続した混合を伴って、12分の期間にわたり、上記の発泡した液体に、500グラムのゼラチン粉末および釣り合った量の窒素を加えた。これらすべての粉末および気体を加えた後に、その組成物をさらに10分間にわたり混合した。この結果として得られた組成物の密度は0.6グラム/mLであった。次に、この組成物を12ccのモノジェクト(Monoject)注射器の中に分配した。
【0054】
実施例5
サージフォーム(Surgifoam)(登録商標)のゼラチン粉末の1グラムのサンプルをそれぞれ0.005重量%の塩化ベンズアルコニウム(benzalkonium chloride)および5重量%のグリセロール(glycerol)を含有している5mLの塩水の溶液と共に混合して、均一なペーストを形成した。この結果として得られたペーストを10ccのBDルアー注射器の中に後部から充填した。全ての空気をこれらの注射器から押し出して、その注射器の中にペーストを詰め込んだ状態にした。第1の組の注射器は内部に気体を全く混入していない状態で照射し、サンプル5aとして示されている。第2の組のサンプルは均一なペーストを収容している注射器の中に3mLの窒素を分配することにより調製されている。その後、さらに混合することなく、これらの注射器に蓋をして、4℃において貯蔵した。これらのサンプルはサンプル5bとして示されている。次に、第3の組のサンプルを、ペーストの中に全ての窒素が均質に混入されるまで、上記の第1の注射器と3mLの窒素を収容している第2の注射器との間で前後に、そのペーストを押し動かすことにより調製した。この結果として得られた均質な組成物の充填容積はおよそ9mLであり、その組成物の密度はおよそ0.7グラム/mLであった。その後、これらの注射器に蓋をして、その予備充填された注射器の一部を25kGyの線量で照射により滅菌した。その後、上記の3組のサンプルの最大押し出し力を決定して、表2に示した。
【表2】

【0055】
表2におけるデータが示しているように、気体を全く含んでいないか、気体が内部に不十分にあるいは部分的にしか分散していないペーストに比べた場合に、ペーストの全体に亘って気体の均質な分布/分散は照射前の組成物の最大押し出し力を減少させて、照射後のその組成物の低い押し出し力を維持するために不可欠である。
【0056】
実施例6
1グラムのサージフォーム(Surgifoam)(登録商標)のゼラチン粉末を5mLの通常の塩水と共に混合して、均一なペーストを形成した。この結果として得られたペーストを10ccのBDルアー注射器の中に後部から装填した。全ての空気をその注射器から押し出して、その注射器の中にペーストを詰め込んだ状態にした。1mL〜4mLの範囲の容積を伴う窒素を収容している、第2の組の10ccの注射器を、それぞれ、二方向ルアー・コネクタを介して、上記の第1の注射器に取り付けた。その後、ペーストを、気体の中に押し込んでから、全ての気体がそのペーストの中に均質に混入されるまで、上記の2個の注射器の間で前後に通過させた。この結果として得られた組成物の充填容積はおよそ6〜10mLであり、その密度はおよそ0.60〜1.0グラム/mLであり、それぞれペーストの中に導入されたガスの量に応じている。その後、これらの注射器に蓋をして、その予備充填された注射器の一部を25kGyの線量で照射により滅菌した。
【0057】
上記の場合に、滅菌されているサンプルは、それぞれ、サンプル6a〜6eとして示されている。さらに、滅菌されているサンプルの最大押し出し力を決定して、表3において示した。
【表3】

【0058】
実施例7
1グラムのサージフォーム(Surgifoam)のゼラチン粉末を5mLの通常の塩水と共に混合して、均一なペーストを形成した。この結果として得られたペーストを10ccのBDルアー注射器の中に後部から装填した。全ての空気をその注射器から押し出して、その注射器の中にペーストを詰め込んだ状態にした。0mL〜4mLの範囲の容積を伴う空気を収容している、第2の組の10ccの注射器を、それぞれ、二方向ルアー・コネクタを介して、上記の第1の注射器に取り付けた。その後、ペーストを、気体の中に押し込んでから、全ての気体がそのペーストの中に均質に混入されるまで、上記の2個の注射器の間で前後に通過させた。この結果として得られた組成物の充填容積はおよそ6〜10mLであり、その密度はおよそ0.60〜1.0グラム/mLであり、それぞれペーストの中に導入されたガスの量に応じている。その後、これらの注射器に蓋をして、その充填された注射器の一部を25kGyの線量で照射により滅菌した。滅菌したサンプルは、それぞれ、サンプル7a〜7eとして示されている。
【0059】
さらに、滅菌したサンプルの最大押し出し力を決定して、表4において示した。
【表4】

【0060】
実施例8:ブタの脾生検パンチ・モデル内における異なる材料の止血能力
【0061】
実施例1〜7および9において調製されたサンプルの止血特性の評価において、ブタの脾生検パンチ・モデルを用いた。組織弁を3mmの深さに切断するために、6mmの生検パンチを用いた。次に、この組織弁を切り出して、0.4mLの上記の試験材料をその傷の部位に適用した。2分間にわたり、その傷の部位の上を、手による加圧により抑えた。その後、その傷の部位を、出血の徴候について、3分までにわたり、観察した。この場合に、出血が観察されれば、完全な止血が達成されるまで、その度に、30秒間にわたり手による加圧の追加の適用を行なった。表5はこの評価の結果を列挙している。なお、滅菌処理されていないサンプルまたは滅菌処理したサンプルについての結果は試験した全てのサンプルについての平均値である。
【表5】

【0062】
実施例9
凍結乾燥したウシのトロンビン(20,000単位のトロンボゲンJJMI)の2個のビンを20mLの塩水の中に再形成して、1000単位/mLの使用液を形成した。次に、実施例10において記載されているように、体外試験において、凝固活性を測定した。上記の材料の1個のビンを4〜8℃で貯蔵し、1日目、8日目、および30日目において、それぞれ、凝固活性を測定した。第2のビンはガンマ線の照射(25kGy)により滅菌して、その凝固活性を上述のように測定した。これらの、滅菌されていない、および滅菌されている、サンプルは、サンプル9aおよび9bとして、それぞれ示されている。その後、これらの、滅菌されていない、および滅菌されている、両方のサンプルをそれぞれの測定の間に4〜8℃で貯蔵した。
【0063】
20,000単位の凍結乾燥したウシのトロンビンの別の2個のビンを0.005重量%の塩化ベンズアルコニウム(benzalkonium chloride)および5重量%のグリセロール(glycerol)を含有している塩水の中において再形成した。1個のビンを4〜8℃で貯蔵し、0日目、1日目、8日目、および30日目において、凝固活性を測定した。第2のビンはガンマ線の照射(25kGy)により滅菌して、その凝固活性を上述のように測定した。測定の間に、両方の、滅菌されていない、および滅菌されている、サンプルを、4〜8℃で貯蔵した。これらの、滅菌されていない、および滅菌されている、サンプルは、サンプル9cおよび9dとして、それぞれ示されている。
【0064】
上述のトロンビンを含有しているゼラチン・ペーストの幾つかのサンプルを、1グラムのサージフォーム(Surgifoam)のゼラチン粉末と5mLのトロンビン溶液とを混合することにより、調製した。この結果として得られたペーストを10ccの注射器の中に詰め込んだ。その後、これらのサンプルを25kGyにおいて滅菌してから4〜8℃において貯蔵するか、4〜8℃において、滅菌せずに、貯蔵するだけのいずれかにした。このようにして調製したサンプルは以下において示されて識別されている。
【0065】
サンプル9e=1gのサージフォーム(Surgifoam)(登録商標)の粉末および5mLのサンプル9a、滅菌されている
サンプル9f=1gのサージフォーム(Surgifoam)(登録商標)の粉末および5mLのサンプル9aおよび3mLの窒素、発泡状態および滅菌されている
サンプル9g=1gのサージフォーム(Surgifoam)(登録商標)の粉末および5mLのサンプル9c、滅菌されていない
サンプル9h=1gのサージフォーム(Surgifoam)(登録商標)の粉末および5mLのサンプル9c、滅菌されている
サンプル9i=1gのサージフォーム(Surgifoam)(登録商標)の粉末および5mLのサンプル9cおよび3mLの窒素、発泡状態、滅菌されている
【0066】
実施例10:フィブロメーター器具(BBL)内における体外凝固試験によるトロンビン活性の測定
【0067】
トロンビンを含有している試験サンプルの一連の希釈液をベロナル(Veronal)緩衝液(pH7.2)の中において調製した。0.2mLの蓄えられた正常な血漿(シトロール・レベル(Citrol Level):1、対照血漿、デイド・ダイアグノスティクス(Dade Diagnostics))をフィブロメーターのインキュベータ・ブロックの中において37℃に加温した。次に、0.1mLの予備加温したサンプルの希釈液を上記の血漿に加えて、タイマーを同時に始動させた。凝固の形成の時間を記録した。全てのサンプルを2回試験して、平均の凝固時間を計算した。これらのデータを、log10(希釈率)対log10(凝固時間)としてグラフにし、回帰分析を行なった。この場合に、新しく調製したトロンビンは100%の活性を有していると考え、全ての他のサンプルは新しく調製したトロンビンに対する活性の比率として計算されている。これらの結果が表6および表7において示されている。
【表6】

【表7】

【表8】

【0068】
実施例11
1リットルの、0.005重量%の塩化ベンズアルコニウム(benzalkonium chloride)および5重量%のグリセロール(glycerol)を含有している、塩水の溶液を、混合容器(ロス・ミキサー(Ross Mixer)、モデルDPM2、製品番号:75308)の中にそそぎ入れて、そのミキサー・ブレードを動作モードに切り替えた。次に、窒素ガスを、継続的な泡立ちの様式で、窒素供給源に接続されている管を介して、上記の溶液の中に導入した。その後、この溶液および気体の混合物を、上述のような発泡体を形成するために、およそ10分間にわたり、70Hzで攪拌した。次に、発泡体の形成の後に、混合容器の入口ポートに取り付けた添加用の漏斗を用いて、固体の粒子の添加を開始した。この場合に、200グラムのゼラチン粉末を約3分の期間にわたり添加した。70Hzにおける全部の粉末の添加の後に、約15分間にわたり混合を継続した後に、約2分間にわたる追加の混合を約12Hzの下げたブレード速度で行なった。この混合の完了時に、密度が許容のパラメータの範囲内にあって、発泡体の中の粒子の実質的に均質な分散を示すことを確実にするために、混合容器の中の組成物の密度を上述のような溶媒法により測定した。
【0069】
上記の組成物を、7個のねじ山を有するオーガー・スクリューを備えている充填用の装置の保持容器の中に所望の量まで移した。このスクリューの上方の部分におけるねじ山の間の距離は約3.75cmであるが、このスクリューの下方の部分におけるねじ山の間の距離は約1.5cmであった。その後、組成物をこのオーガー・スクリューにより注射器に分配した。この場合に、約6ミリリットル(mL)の組成物をそれぞれの注射器に入れた。また、この充填はおよそ36mL/分〜約72mL/分の速度で注射器充填用の装置を用いて行なった。さらに、上記の量が徐々に減ると、上記の保持容器を新しい流動性の止血用の組成物により補給した。この充填処置の完了後に、その注射器の中の流動性の止血用の組成物の密度を上述のように測定した。これらの結果が表9において報告されている。
【0070】
実施例12
2リットルの、0.005重量%の塩化ベンズアルコニウム(benzalkonium chloride)および5重量%のグリセロール(glycerol)を含有している、塩水の溶液を、混合容器(ロス・ミキサー(Ross Mixer)、モデルDPM2、製品番号:75308)の中にそそぎ入れて、そのミキサー・ブレードを動作モードに切り替えた。次に、窒素ガスを、継続的な泡立ちの様式で、窒素供給源に接続されている管を介して、上記の溶液の中に導入した。その後、この溶液および気体の混合物を、上述のような発泡体を形成するために、およそ10分間にわたり、70Hzで攪拌した。次に、発泡体の形成の後に、混合容器の入口ポートに取り付けた添加用の漏斗を用いて、固体の粒子の添加を開始した。この場合に、400グラムのゼラチン粉末を約5分の期間にわたり添加した。70Hzにおける全部の粉末の添加の後に、約10分間にわたり混合を継続した後に、約2分間にわたる追加の混合を約12Hzの下げたブレード速度で行なった。この混合の完了時に、密度が許容のパラメータの範囲内にあって、発泡体の中の粒子の実質的に均質な分散を示すことを確実にするために、混合容器の中の組成物の密度を上述のような溶媒法により測定した。
【0071】
上記の組成物を、7個のねじ山を有するオーガー・スクリューを備えている充填用の装置の保持容器の中に所望の量まで移した。このスクリューの上方の部分におけるねじ山の間の距離は約3.75cmであるが、このスクリューの下方の部分におけるねじ山の間の距離は約1.5cmであった。その後、組成物をこのオーガー・スクリューにより注射器に分配した。この場合に、約6ミリリットル(mL)の組成物を、約120mL/分の速度で、それぞれの注射器に入れた。また、さらに、上記の量が徐々に減ると、上記の保持容器を新しい流動性の止血用の組成物により補給した。この充填処置の完了後に、その注射器の中の流動性の止血用の組成物の密度を上述のように測定した。これらの結果が表9において報告されている。
【表9】

【0072】
表9は、充填の速度がその結果として得られるペーストの密度において生じる可能性のある影響を示している。まず、充填の特定の速度、すなわち、1分当たりに充填される注射器の数において、特定の数の注射器に対応する特定の値よりも小さいと示されている組成物の密度がその前の数の注射器において測定された密度の値よりも大きいことが注目される。例えば、12mL/分において、25番目に充填された注射器の中の組成物の密度は0.703よりも小さいが、0.659よりも大きい。また、充填速度が高いほど、長い時間の期間にわたり組成物の濃度を許容可能なパラメータの範囲内に維持できることが注目される。記載されているように、例えば、72mL/分の比較的に高い充填速度において、組成物の密度は150番目の充填された注射器において0.703より小さく維持されているが、12mL/分の充填速度では、組成物の密度における同一の相対的な変化は25番目の充填された注射器において見られる。さらに、ここに記載されている充填の特定の速度が本明細書において開示されている特定の装置および組成物に適用可能であって、その装置の設計および組成物により実際に変化し得ることが注目される。
【0073】
〔実施の態様〕
(1)流動性の止血用の組成物を作成するための方法において、
所与の容積の生体適合性の液体を、この液体を混合するための手段を備えている混合容器の中に導入する処理と、
前記混合するための手段が、前記所与の容積の液体および所与の容積の気体を一緒に混合して発泡体を形成するのに効果的な条件で動作している間に、前記所与の容積の生体適合性の気体を前記所与の容積の液体の中に導入する処理であって、前記発泡体は不連続な気体の相を含み、当該不連続な気体の相は前記液体を含んでいる連続的な液体の相の全体に亘って実質的に均質に分散されている前記気体を含んでいる、処理と、
止血において使用するために適していて、前記液体中で実質的に不溶性である、生体適合性のポリマーの所与の量の固体粒子を、前記発泡体の中に導入する処理と、
前記連続的な液体の相の全体に亘って実質的に均質に分散されている前記不連続な気体の相および前記固体の粒子を含んでいる実質的に均質な組成物を形成するために有効な条件下において、前記発泡体および前記固体の粒子を一緒に混合する処理と、
を含んでおり、
前記所与の容積の液体、前記所与の容積の気体、および前記所与の量の固体粒子、の比率が止血特性を伴う前記実質的に均質な組成物を形成するために有効であり、これにより、前記流動性の止血用の組成物を形成する、方法。
(2)実施態様1に記載の方法において、
前記液体が水性である、方法。
(3)実施態様2に記載の方法において、
前記液体が塩水を含む、方法。
(4)実施態様3に記載の方法において、
前記生体適合性のポリマーが蛋白質および多糖類から成る群から選択される、方法。
(5)実施態様4に記載の方法において、
前記蛋白質がゼラチン、コラーゲン、フィブリノゲン、およびフィブロネクチンから成る群から選択される、方法。
(6)実施態様3に記載の方法において、
前記生体適合性のポリマーがゼラチンを含む、方法。
(7)実施態様6に記載の方法において、
前記粒子の平均の直径が40〜1200ミクロンである、方法。
(8)実施態様7に記載の方法において、
前記粒子、前記液体および前記気体が、g:mL:mLに基づいて、1:2:1ないし1:12:13の比率で、前記流動性の止血用の組成物中に存在している、方法。
(9)実施態様7に記載の方法において、
前記粒子、前記液体および前記気体が、g:mL:mLに基づいて、1:4:1ないし1:8:9の比率で、前記流動性の止血用の組成物中に存在している、方法。
(10)実施態様8に記載の方法において、
前記流動性の止血用の組成物の密度が0.9g/mL〜0.3g/mLである、方法。
(11)実施態様9に記載の方法において、
前記流動性の止血用の組成物の密度が0.8g/mL〜0.6g/mLである、方法。
(12)実施態様1に記載の方法において、
前記気体が空気、窒素、二酸化炭素、キセノン、およびアルゴンから成る群から選択される、方法。
(13)実施態様1に記載の方法において、
前記流動性の止血用の組成物が、放射線不透過剤、抗菌剤、発泡剤、発泡安定化剤、界面活性剤、酸化防止剤、保湿剤、増粘剤、希釈剤、潤滑剤、湿潤剤、照射安定化剤、可塑剤、ヘパリン中和剤、前駆凝固剤、および止血剤から成る群から選択される機能的に有効な量の添加物をさらに含有している、方法。
(14)実施態様13に記載の方法において、
前記機能的な添加物がフィブリノゲンおよびトロンビンから成る群から選択される、方法。
(15)実施態様13に記載の方法において、
前記機能的な添加物が塩化ベンズアルコニウム(benzalkonium chloride)およびグリセロール(glycerol)から成る群から選択される、方法。
(16)実施態様1に記載の方法において、
前記液体および前記気体が3分〜30分にわたり混合される、方法。
(17)実施態様16に記載の方法において、
前記発泡体および前記固体の粒子が10分〜30分にわたり一緒に混合される、方法。
(18)実施態様17に記載の方法において、
前記流動性の止血用の組成物の密度が0.9g/mL〜0.3g/mLである、方法。
(19) 止血を必要としている体の部位に流動性の止血用の組成物を供給するために適している医療装置を作成するための方法において、
所与の容積の生体適合性の液体を、この液体を混合するための手段を備えている混合容器の中に導入する処理と、
前記混合するための手段が、前記所与の容積の液体および所与の容積の気体を一緒に混合して発泡体を形成するために有効な条件下で動作している間に、前記所与の容積の生体適合性の気体を前記所与の容積の液体の中に導入する処理であって、前記発泡体は不連続な気体の相を含み、当該不連続な気体の相は前記液体を含んでいる連続的な液体の相の中に分散されている前記気体を含んでいる、処理と、
止血において使用するために適していて、前記液体中に実質的に不溶性である、生体適合性のポリマーの所与の量の固体粒子を、前記発泡体の中に導入する処理と、
前記連続的な液体の相の全体に亘って実質的に均質に分散されている、前記不連続な気体の相および前記固体の粒子を含んでいる実質的に均質な組成物を形成するために有効な条件下において、前記発泡体および固体の粒子を一緒に混合する処理であって、前記所与の容積の液体、前記所与の容積の気体、および前記所与の量の固体粒子、の比率が止血特性を伴う前記実質的に均質な組成物を形成するために有効であり、これにより、前記流動性の止血用の組成物を形成する、処理と、
前記液体の相の全体における前記気体の相および前記固体の粒子の実質的に均質な分散を維持するために有効な条件下において、前記止血を必要としている部位に前記止血用の組成物を供給するために適している装置の中にその止血用の組成物を移す処理と、
を含んでいる、方法。
(20)実施態様19に記載の方法において、
前記実質的に均質な止血用の組成物を移す処理が、その組成物の構造に有害に作用する圧縮力が実質的に存在していない状態で行なわれる、方法。
(21)実施態様19に記載の方法において、
前記移す処理がオーガー・スクリューを利用して行なわれる、方法。
(22)実施態様19に記載の方法において、
前記流動性の止血用の組成物の密度が0.9g/mL〜0.3g/mLである、方法。
(23)実施態様19に記載の方法において、
内部に前記止血用の組成物が配置された前記装置が、無菌の止血用の組成物を含んでいる無菌の装置を形成するために有効である条件に曝される、方法。
(24)実施態様19に記載の方法において、
前記組成物が、1分間当たりに少なくとも10ミリリットルの速度で、前記装置の中に移される、方法。
(25)実施態様19に記載の方法において、
前記組成物が、1分間当たりに少なくとも72ミリリットルの速度で、前記装置の中に移される、方法。
(26)実施態様19に記載の方法において、
前記組成物が、1分間当たりに少なくとも100ミリリットルの速度で、前記装置の中に移される、方法。
(27)実施態様19に記載の方法において、
内部に前記止血用の組成物が配置されている前記装置が滅菌されている、方法。
(28)実施態様27に記載の方法において、
前記装置が電離線により滅菌されている、方法。
【図面の簡単な説明】
【0074】
【図1】本発明の方法において使用される混合装置の概略的な側断面図である。
【図2】本発明の方法において使用される充填用の装置の概略的な側断面図である。
【図3】本発明の方法において使用される種類のオーガー・スクリューの側面の斜視図である。
【図4a】本発明の方法において使用される装置の側面図である。
【図4b】本発明の方法において使用される装置の側断面図である。
【開示の内容】
【0001】
〔発明の分野〕
本発明は流動性の止血用の組成物を作成する方法およびこれらの組成物を収容している装置に関連している。
【0002】
〔発明の背景〕
固体のスポンジまたは粉末の両方の形態でのゼラチンを基材とする止血物質は市場において入手可能であり、外科処置において用いられている。ゼラチンの粉末は、流体と共に混合されると、特に平らでない表面または到達することが困難である領域からの、びまん性出血のための流動性で、押し出し可能の、注入可能な止血物質として有用であるペーストまたはスラリーを形成できる。この従来のスラリーは組成物の均一性を与えるために粉末および液体の機械的な攪拌および混合により使用の場所において調製される。その後、このペーストは、例えば、注射器等の、送達手段またはアプリケータの中に入れられて、傷に供給される。
【0003】
この方法の主な不都合は、必要な時にいつでも、使用の場所において、粉末を液体と共に混合し、これをペーストの状態に練り、選択した送達装置の中に後部から充填する必要性である。これらの操作は時間がかかり、潜在的に、使用の環境により、送達される製品の滅菌状態を損なう可能性がある。したがって、使用の場所において使用することがすぐにできる、または最小限の操作により製品の滅菌状態を損なう危険性を伴わずに調製することができる無菌で流動性の止血用の組成物に対する要望が存在している。
【0004】
例えば、注射器またはその他のアプリケータ等のような送達手段を含む、止血装置が止血用の組成物により予め充填されていて、さらなる操作の必要性を伴わずに、あるいは、最小限の操作または調製を伴って、使用の場所において外科医にとって利用可能であれば、望ましくなるであろう。これらの装置またはアプリケータの中に予め充填された止血用の組成物は無菌で流動性である必要があり、使用の場所において送達手段を通して押し出すか射出される場合に、最小限の調製時間および最小限の力を要する必要がある。また、市場において存在し得る上記のような組成物を作成するための方法を考案して、作業場所において許容可能な環境を維持し、流動性で物理的に安定である止血用の組成物を含んでいる予め充填されている装置を提供することも望ましくなるであろう。本発明はこのような方法を提供している。
【0005】
〔発明の概要〕
本発明は、流動性の止血用の組成物を作成する方法と、これらの流動性の止血用の組成物を供給することにおいて使用するために適している装置であって、その中に配置されている流動性の止血用の組成物を含んでいる、装置と、に関連している。流動性の止血用の組成物を作成するための方法において、第1の容積の生体適合性の液体が、その液体を混合するための手段を備えている混合用の容器の中に導入される。次に、第2の容積の生体適合性の気体が、上記の混合するための手段が上記の液体と気体を一緒に混合して発泡体を形成するために有効な条件下において動作している間に、上記の容積の液体の中に導入される。この発泡体は上記の液体を含んでいる連続的な液体の相の全体に亘って分散されている気体を含む不連続な気体の相を含んでいる。さらに、止血において使用するために適していて、上記の液体の中に実質的に不溶性である所与の量の生体適合性のポリマーの固体の粒子が上記の発泡体の中に導入され、これらの発泡体および固体の粒子は上記の不連続な気体の相と、上記の連続的な液体の相の全体に亘って実質的に均質に分散されている固体の粒子とを含んでいる実質的に均質な組成物を形成するために有効な条件下において一緒に混合される。この場合に、上記の液体の容積、気体の容積、および固体の粒子の量、の比率は、止血特性を伴う止血用の組成物を提供するために、したがって、流動性の止血用の組成物を形成するために、有効である。このようにして形成された流動性の止血用の組成物は、その後、その流動性の止血用の組成物を、上記の液体の相の全体に亘る上記の気体の相と固体の粒子との実質的に均質な分散を維持するために有効な条件下において、止血を必要としている体の部位に供給するために適している装置の中に移される。その後、このような内部に配置されている流動性の止血用の組成物を含んでいる装置は無菌で流動性の止血用の組成物を含んでいる無菌の装置を形成するために有効な条件にかけられるか、曝される。本発明の方法により作成される組成物および装置は使用の時間から十分に先立って調製することが可能であり、使用の場所において調製される必要はなく、さらに、これらは使用の場所および時間において流動性、押し出し可能性または注入可能性を示すために有効な物理的な特性を維持する。
【0006】
〔発明の詳細な説明〕
本発明の方法により作成した、滅菌処理されている、および滅菌処理されていない、両方の組成物は、その3種類の必要な成分として、止血において使用するために適している生体適合性のポリマーの固体の、多孔質または非多孔質の粒子と、生体適合性の液体と、生体適合性の気体と、を含んでいる。これらの粒子、液体および気体は、その液体を含んでいる連続的な液体の相と、その連続的な液体の相の全体に亘って均質に分散されている固体のポリマー粒子および気体を含んでいる不連続な気体の相と、を含んでいる実質的に均質な止血用の組成物を形成するために有効な条件下において組み合わされて混合される。この組成物の中に含まれている粒子の量および平均の直径、および上記の固体、液体および気体の各相の相対的な量は、以下において本明細書に説明されているように、止血のおよび物理的な特性を伴う組成物を形成するために有効である。
【0007】
上記のように形成された止血用の組成物は止血用のペースト、スラリーであり、このペーストまたはスラリーは、類似の液体/粒子の組成物の流動性の止血用の組成物であるが、その中に分散されている気体の相を含んでいない止血用の組成物に比べられる場合に、流動性、押し出し可能性および/または注入可能性の改善された特性を示す。本発明の方法により作成した組成物は、調製して、流動可能な止血用の組成物を分配するために用いられて、それぞれの目的とされる使用の時間から十分に先立って、電離放射線により滅菌されている注射器またはその他の既知のアプリケータ等のような、医療装置の中に、充填することができる。これらの組成物は、その組成物の調製を容易にするため、物理的および機械的な特性を高めるため、その組成物の止血特性を高めるため、あるいは抗菌性を与えるために、添加物をさらに含んでいてもよい。
【0008】
本明細書においては、「連続的な」および「不連続な」は分散を定めるためおよび説明するために用いられている標準的な用語体系の状況におけるこれらの用語の通常の意味で用いられている。例えば、連続的な液体の相と共に組み合わされて混合されると、その液体の相に加えられた生体適合性の気体の容積は混合により分裂されて、不連続な、すなわち、分散された、気体のポケットまたは分離されている部分を含む気体の相を形成する。
【0009】
本明細書においては、「実質的に均質な」とは、組成物またはペーストの物理的な状態を示しており、この場合に、固体および/または気体の相は、その固体:気体:液体の比率およびその組成物またはペーストの断面におけるいずれの部分の密度も実質的に同一になるように、連続的な液体の相の全体に亘って均一に分散されている。
【0010】
本明細書においては、「発泡体」は、不連続な気体の相が連続的な液体の相の中に分散されている状態、を示している。なお、この発泡体の中の気体の相はその発泡体を通して実質的に均質に分散されている必要はない。
【0011】
本明細書においては、「密度」は、発泡したペーストの単位容積当たりの固体と添加された液体との混合物の質量を定めて説明するために用いられている、標準的な用語体系の状況におけるその用語の通常の意味で用いられている。
【0012】
本明細書においては、「無菌の」とは、生きている細菌および/または微生物が実質的に無いこと、さらに、本明細書において記載されていて特許請求されている組成物および医療装置に関連している政府の基準により認められていて記載されているような状態を意味している。また、本明細書においては、「止血(用)の」または「止血特性」は、止血の技術における熟練者がこれらの用語が意味することを理解するように、さらに、本明細書の実施例において例示されているように、出血を止めるか最小限にするための能力を意味する。
【0013】
本明細書においては、「最大しぼり出し力」は、本明細書の実施例において説明されているように、14ゲージの血管カテーテルの先端部分をはめ込んでいる予備充填型のルアー注射器から組成物を押し出すために必要とされる最大の力の値である。
【0014】
本発明の組成物において用いられている上記の固体の粒子を調製するために、多様な生体適合性で、天然の、半合成の、あるいは合成の、ポリマーを用いることができる。この場合に、選択されるポリマーは特定の組成物のために選択された液体の中において実質的に不溶性である必要がある。好ましくは、機械的、化学的および/または生物学的な止血活性を示す、水に不溶性で生体分解性のポリマーが用いられている。これらの使用可能であるポリマーは、限定を伴わずに、蛋白質および多糖類を含む。さらに、使用可能である多糖類は酸化セルロース、キトサン、キチン、アルギネート、酸化アルギネート、および酸化デンプンを含む。また、上記の粒子を調製するために用いられる生体適合性のポリマーは、好ましくは、ゼラチン、コラーゲン、フィブリノゲンまたはフィブロネクチン等のような、架橋または変性されている蛋白質である。好ましいゼラチンの粉末は、ゼラチンのスポンジを、レーザー回折により決定される場合に、約40ミクロン〜約1,200ミクロン、または約100ミクロン〜約1,000ミクロンの平均の直径を有する粒子に、微粉砕することにより調製される部分的に架橋されているゼラチンの粉末である。
【0015】
本発明の方法により作成される組成物は連続的な液体の相を含んでおり、この相の中において、上記の固体の粒子および気体の相は実質的に均質に分散されている。特定の医療装置およびその用法に応じて、上記の液体は水性であっても非水性であってもよい。特定の実施形態において、上記の液体の相は水性である。このような水性の液体は、限定を伴わずに、塩化カルシウムおよび塩水等のような、生体適合性の水性の溶液を含むことができる。さらに好ましくは、上記の液体の相は塩水を含む。この液体の相および固体の粒子の相は止血を行なうことにおいて使用するために適しているペーストまたはスラリーを形成するために有効な相対的な量で存在している。なお、固体の粒子の相の過度の希釈は、上記の最大しぼり出し力をさらに減少させるために有益であるが、その材料の止血特性に有害に作用し、それゆえ、望ましくない。上記の液体に対する固体の粒子の重量比率は一般に約1:2〜約1:12である。さらに、特定の実施形態において、塩水に対する固体のゼラチンの粒子の重量比率は約1:3〜約1:6である。また、さらに別の実施形態において、塩水に対する固体のゼラチンの粒子の重量比率は約1:5である。
【0016】
空気、二酸化炭素、窒素、キセノンまたはアルゴンを含むが、これらに限定されない、任意の生体適合性の気体が本発明の組成物を調製するために使用できる。好ましくは、アルゴンまたは窒素等のような不活性な気体が用いられる。さらに、空気、窒素およびアルゴンは超音波の影響を受けやすく、体内に注入された後に上記の組成物を位置決めするための手段を与えることができる。同様に、キセノンは放射線不透過性であるので、キセノンを使用することもまた体内に配置された後に組成物を位置決めするための手段を与えることができる。加えて、二酸化炭素はpH値を下げるので、二酸化炭素の選択は上記の組成物の抗菌性を高めることができる。これらの気体は、その気体が、発泡体を形成するために、連続的な液体の相の中に分散されている不連続な気体の相を形成するように、液体の相の全体に亘って分散されるまで、連続的な液体の相と共に組み合わされて混合される。上記の発泡体の中における粒子の分散による組成物の形成時において、その組成物の中における気体の相の分散は、本明細書において記載されているように、流動性、押し出し可能性および注入可能性に関連している改善された物理的な特性を伴う組成物を与えている。このような改善された特性は、滅菌処理の間の組成物の照射の前および後の両方における、密度および最大しぼり出し力を含む、組成物の物理的な測定値として、特徴づけられる。
【0017】
本発明の組成物の上記の3種類の主な構成要素の相対的な濃度およびその組成物の実質的に均質な性質はその組成物に止血のおよび物理的な特性の両方を示すことにおいて重要である。上記の固体の粒子、液体の相および気体の相は、一般に、重量:容積:容積(g:mL:mL)に基づいて、約1:2:1〜約1:12:13の比率で本発明の方法により作成した組成物中に存在する。また、別の実施形態において、上記の比率は約1:4:1〜約1:8:9である。さらに、別の実施形態において、上記の比率は約1:5:3である。本発明の組成物の密度は約0.9g/mL〜約0.3g/mLであり、あるいは、特定の実施形態において、約0.8g/mL〜約0.6g/mLである。
【0018】
本明細書において記載されている本発明の方法により作成した特定の組成物は、これらが、所与の量の、例えば、電離放射線等により、照射されているという点において、無菌である。このような照射はe−ビームまたはガンマ線の照射を含むことができる。さらに、上記の組成物が照射される時間を含む、照射の量および滅菌処理の条件は、本明細書において定められているような、無菌の組成物を与えるものである。なお、この開示の恩恵を受けた後に、熟練者は無菌の組成物を与えるために必要な照射の量を容易に決定できるようになるであろう。
【0019】
上記の止血用の組成物は、さらに、放射線不透過剤、抗菌剤、発泡剤、発泡安定化剤、界面活性剤、酸化防止剤、保湿剤、湿潤剤、潤滑剤、増粘剤、希釈剤、例えば、ラジカル・スカベンジャー等の照射安定化剤、可塑剤、および安定化剤を含むが、これらに限定されない、有効な量の1種類以上の添加物または化合物を含有していてもよい。例えば、グリセロール(glycerol)は上記の組成物の押し出し可能性または注入可能性を高めるために添加できる。さらに、このグリセロール(glycerol)は、上記の液体の相の重量に基づいて、約20重量%まで、または約1〜約10重量%、または約1〜約5重量%まで、上記の組成物中に存在できる。加えて、上記の組成物に高められた特性を与えるために、第四級アミンを用いることができる。例えば、塩化ベンズアルコニウム(benzalkonium chloride)、ポリブレン(Polybrene)またはオナマー・エム(Onamer M)は、上記の液体の相の重量に基づいて、約1重量%までの量で使用できる。さらに、特定の実施形態において、塩化ベンズアルコニウム(benzalkonium chloride)は、上記の液体の相の重量に基づいて、約0.001〜約0.01重量%、または約0.002〜約0.006重量%の量で用いられている。また、上記の第四級アミンは多数の機能を与えることができ、抗菌剤、発泡剤、ラジカル・スカベンジャーとして、および/またはヘパリン中和剤として作用する可能性がある。
【0020】
上記の止血用の組成物は、さらに、トロンビン、フィブリノゲン、フィブリン、第Xa因子または第VIIa因子等のような、有効な量のヘパリン中和剤、前駆凝固剤または止血剤を含有していてもよい。この「有効な量」とは、上記の添加物が添加されることに対応して上記の特性を上記の組成物に与えるために必要な量を意味している。なお、添加できる最大の量は有害な生物学的な作用を生じないように制限されている。
【0021】
本発明の方法により作成した組成物は、照射の影響を受けやすい添加物が利用されている止血用の組成物において使用するために、特に有利である。例えば、水性の溶液中におけるトロンビンは、滅菌処理の照射に曝露されると、全ての前駆凝固剤の活性を失うことが分かっている。これに対して、実施例9において示されているような、本発明による組成物中に配合される場合に、トロンビンは、滅菌処理の後に、その元の酵素的な活性の約40%およびその止血の活性の全てを維持している。なお、ウシのトロンビンが本明細書において例示されているが、内容が、その全体において、このように、参照により本明細書に組み入れられている、米国特許第5,143,838号において記載されているような、ヒト由来トロンビンも本発明の組成物において使用可能である。
【0022】
本発明の止血用の組成物が利用可能である医療装置は、止血を必要としている部位または傷に、流動性のまたは注入可能な止血用のペーストまたはスラリーを供給するために現在において用いられている任意の装置を含む。このような止血を必要としている部位は傷害または外科処置の結果と考えることができる。また、上記の装置またはアプリケータの例は、ベクトン・ディッキンソン(Becton Dickinson)またはモノジェクト・ルアー・シリンジ(Monoject luer syringes)等のような、注射器を含む。さらに、別の装置が、内容が、その全体において、参照により本明細書に組み入れられている、米国特許第6,045,570号において詳細に開示されている。
【0023】
本発明の方法において、上記の液体はミキサーに加えられる。その後、気体が、その液体の連続的な液体の相を通して分散されている気体の不連続な気体の相を含んでいる発泡体を形成するために有効な条件下の混合により、その液体の中に混入される。さらに、特定の実施形態において、これらの気体および液体は約3〜約30分間にわたり混合できる。その後、上記の固体のポリマー粒子が、その固体の粒子を発泡体の全体に亘って実質的に均質に分散させるために、その発泡体の中に混入されて混合される。特定の実施形態において、これらの発泡体および粒子は約15〜約30分間にわたり混合できるが、30分を超える混合も許容可能である。上記のような実施形態において、例えば、二重遊星式ミキサー等の、ミキサーが利用できる。
【0024】
上記の液体は、上記の粒子または気体の溶液に対する添加の前に、その中に溶けている有効な量の添加物を含むことができる。例えば、グリセロール(glycerol)および塩化ベンズアルコニウム(benzalkonium chloride)を含有している塩水の溶液を調製した後に、上記のミキサーに添加してもよい。さらに、気体の供給源がそのミキサーに供給され、これにより、その気体の第1の部分を液体の溶液に加えることができる。上記の気体および液体の混合物は上記の液体の相の中にその気体を分散させるために混合され、これにより発泡体が形成される。その後、固体の粒子および気体のあらゆる追加の部分は、これらの全ての成分が添加されるまで、常に継続的な混合を伴って、そのミキサーに加えられる。この混合は、実質的に均質な組成物が上記の連続的な液体の相の全体に亘って均一に分散されている固体の粒子および不連続な気体の相を含んで形成される時間まで、続けられる。上記の液体、気体および固体の粒子の混合の密度は、所望の物理的なおよび止血の特性を伴う組成物を与えるように、その組成物が実質的に均質になる時点を決定するために、モニターすることができる。
【0025】
上記のように形成された流動性の止血用の組成物は、その後、止血を必要としている体の部位にその流動性の組成物を供給するために適している装置の中に移される。これらの充填された装置およびその中に収容されている組成物は、その後、使用の直前における現場での調製および取り扱いに関する当業界の現状の問題を回避する、無菌のすぐに使用できるシステムを提供するために滅菌される。
【0026】
上述の組成物および装置の調製は、実験室の設備等のような、小さな規模で容易に達成できるが、商業用の使用のために適している規模でのこれらの組成物および装置の調製は別の問題を与える。
【0027】
すなわち、商業用の製造設備においては、作業場所の全体の環境、雰囲気に対する曝露による固体の粒子による潜在的な増加されるバイオバーデン、およびアプリケータ装置への移動および滅菌処理の間に組成物の物理的な構造および特性を維持すること、を含む、組成物および装置の小規模の調製において容易に明らかではない特定の問題に対処しなければならない。例えば、粉末の形態の大量の微細な粒子が混合容器に加えられる時に、その粉末の状態の粒子の微細な粒度は作業場所の中に過度の塵埃を生じる可能性があり、この塵埃は、職員の安全および作業場所の全体的な維持ならびに設備の品質の高さに関連する問題を含む、環境問題を生じる可能性がある。加えて、例えば、ゼラチンを基材とする材料は、長期の期間にわたり上記のような環境に曝されると、微生物による侵入の影響を受けやすい。また、上記のような粉末の増加されたバイオバーデンは処理の間におけるゼラチンの変性を引き起こし、製品の無菌状態および生体適合性に対して有害になる可能性がある。
【0028】
過度の塵埃により生じる可能性のある環境問題を最小限にするために、一例の解決方法は、混合する前に、ペレット、顆粒または何らかの別の適当な形状等のような、物理的な本体の中に上記の粒子を詰め込むか凝縮させることが考えられる。このような粒子の本体は、複数の詰め込まれていない粒子に比べて、水性の媒体に接触して置かれると、その隙間の孔の中への水性の媒体の改善された吸収を生じるために有効な穴の容積および中央値の孔の直径を有する隙間の孔を含んでいる、複数の詰め込まれている粒子、を含んでいてもよいが、必ずしもこれを必要としない。
【0029】
あるいは、上記の固体の粒子は添加の間の雰囲気に対する粉末の粒子の曝露を避けるために、閉じられてまたは封じられている構造体または導管を通して上記の発泡体を入れている混合容器に添加できる。上記のような構造体による粒子の添加は微細な粒子の添加により生じる塵埃を最小限にすると共に、混入の前に混合容器の内壁部に以前に捕捉されていた残留の粒子における微生物の増殖のための機会を減少させる。
【0030】
上述のような環境問題に加えて、混合容器から医療装置への上記の流動性の止血用の組成物の移動は、その組成物の物理的な構造の破壊または変形、すなわち、その液体の相の全体に亘る固体の粒子および気体の相の分散状態の崩壊、につながる可能性がある。例えば、比較的に高い圧力により、実質的に均質な止血用の組成物を混合容器からアプリケータ装置に移動させようとすると、このような場合に、そのペーストを移動させるために必要とされる比較的に高い圧力により生じる可能性のある圧縮力により、その止血用の組成物の構造を維持することが困難になる可能性がある。また、このような圧縮は液体の相からの気体の相の分離につながる可能性もある。さらに、このような気体の相の損失は、例えば、照射処理の間およびその後の両方における、流動性や混合の容易さ、等のような、組成物の機械的な特性に対して有害である。
【0031】
本発明の方法は、圧縮力につながる可能性のあるかなり大きな圧力の形成または存在を避ける条件下において、その方法の全体を通して上記の組成物を移動させることにより、上記のような有害な作用を最小限にしている。好ましくは、上記の組成物は、上記のような圧縮力が実質的に存在していない、最小限の圧力の条件下において、すなわち、その組成物の構造に有害に作用することなくその組成物の効率的な移動を行なう条件下において、混合容器からアプリケータ装置の中に移される。
【0032】
最小限の圧力の条件を維持するためには、本発明の方法の特定の実施形態は上記の止血用の組成物を上記のアプリケータ装置の中に移動させるためにオーガー・スクリューを利用している。なお、本明細書において例示されている特定の実施形態においては、上記のオーガー・スクリューは装置を充填するために重力を利用するように垂直な配向で用いられているが、組成物の混合容器から充填用の装置への移動は水平なスクリューの配向で行なえることも考えられている。上記のオーガー・スクリューは、塊りの移動に対して、上記の工程を通して、その組成物の局所的な移動を行なう。このようにして、その材料の本体の全体に圧縮を生じる可能性のある組成物の塊りに加えられる大きな力は、その材料の本体の中において局在化される力に代わって、回避できる。
【0033】
本発明により調製される組成物は、上述のように、気体、液体および固体の相を含んでいるので、その組成物の構造の維持は上記のオーガー・スクリューの設計に部分的に依存している。このような構造と、組成物における、液体:気体:固体の粒子、の比率と、を許容可能なパラメータの範囲内に維持し、したがって、押し出される止血用のペーストの密度を許容可能な密度の範囲内に維持するためには、オーガー・スクリューの設計における考慮点は、そのオーガー・スクリューにおけるねじ山の幅、数およびピッチと、そのオーガー・スクリューのロッドに対するねじ山の角度と、オーガー・ボウルの設計および仕上げと、アジテータ・ブレードの直径および角度と、装置の全体の規模と、を含む。
【0034】
上記の充填用の装置の保持容器の中に移されると、その充填中に上記の組成物の構造を維持するために有効な条件を保つことは多数の状況に依存する。例えば、一例の考慮点は、オーガー・スクリューによるか組成物の塊りに加えられる重力により、その組成物に与えられる可能性のある作用の量である。また、この充填用の装置の中の組成物の存在時間はこれらの考慮点のそれぞれに関連している。すなわち、組成物が充填用の装置の中に長く保持されるほど、その組成物は充填の間にオーガー・スクリューにより形成される繰り返しの脈動している力を長く受けることになり、さらに、その組成物はその組成物自体を圧縮するように作用するその組成物の本体の重量を長く保持しなければならなくなり、これらのそれぞれは液体の相からの気体の相の分離を生じる可能性がある。加えて、オーガー・ボウルの形態および仕上げを考慮する必要がある。例えば、材料とオーガー・ボウルの面との間の摩擦を最小限にする表面の仕上げは摩擦により生じる可能性のあるあらゆる有害な作用を最小限にする。
【0035】
上記の充填用の装置の中における組成物の存在時間、その組成物に与えられる全体の作用、およびアプリケータ装置の中への組成物の移動の速度は、上述のような、有害な作用が最小限になるように、最適化できることが分かっている。また、本明細書において例示されている特定の実施形態に関連して、上記の装置の保持容器からのアプリケータ装置への組成物の移動の速度は、少なくとも約12mL/分、または少なくとも約36mL/分、または約72mL/分、さらに約100mL/分を超えていることが好都合であることが分かっている。しかしながら、組成物に与えられる存在時間の作用を最適化するために、その組成物が移動する実際の速度は充填用の装置の特定の設計および寸法ならびに充填される特定の組成物により決まることが当業者により理解されるであろう。
【0036】
図1において示されているように、混合装置10は混合手段14を備えている混合容器12を含んでいる。混合手段14は、共通の軸において混合容器12を軌道を描いて回りながら、それぞれの軸において回転する多数の螺旋形のブレード16、を備えている。これらの螺旋形のブレード16は混合容器12の縁の周りを連続的に進行して、内側の混合容器の壁部18から材料を除去し、混合容器12の内部に移動させることにより、その材料の全体のバッチが完全に混合されることを可能にする。混合容器12は、閉じた系を形成するように、混合容器カバー36と嵌めあわされている。この混合容器カバー36は、混合容器12の中への、液体22と、気体40と、固体の粒子26と、の添加のための、添加ポート24,30および34、を含んでいる。さらに、固体の粒子26を入れているホッパー28は、雰囲気に対する固体の粒子26の曝露を最小限にするために、粉末の流れの調整弁38を含む導管32を介して混合容器カバー36に対して閉じた関係にある。
【0037】
この方法の一例の実施形態において、液体22はポート24を介して混合容器12に添加される。混合手段14は、気体40および液体22が一緒に配置される時に、これらの気体40および液体22の混合を容易にするために、約60〜約80Hzの速度で作動する。気体40はポート34を介して混合容器12の中の液体22の中に導入される。これらの液体22および気体40は上述のような発泡体を形成するために有効な速度と時間において混合される。その後、固体の粒子26は導管32を介して発泡体の中に導入される。この発泡体および固体の粒子26は、その後、その発泡体の全体に亘ってその粒子26を実質的に均質に分散させるために有効な速度および時間において混合される。この調製が終わると、その流動性の止血用の組成物は、次のアプリケータ装置の中への充填のために、図2において示されている充填装置の保持容器に移される。この保持容器への止血用の組成物の移動は、例えば、本明細書において記載されているような、無菌のスクープを使用する等のように、手動により行なうことができ、あるいは、任意の自動化された手段により行なうことも可能である。
【0038】
図2において示されているように、充填用の装置40は、流動性の止血用の組成物44を保持するための保持容器42と、保持容器42およびオーガー漏斗48の中に配置されていて、モーター54と協同しているオーガー・スクリュー46と、モーター47と協同しているアジテータ・ブレード49と、を含んでいる。オーガー・スクリュー46は保持容器42からオーガー漏斗48を通して下流側に螺旋の様式で流動性の止血用の組成物44を移動させる。アジテータ・ブレード49は材料が保持容器の壁部に蓄積することを防ぐと共に、充填中にその組成物の均質な構造を維持することにも役立つ。その後、流動性の止血用の組成物44は出口ポート50を介してアプリケータ装置52の中に移される。このようにして、組成物44は各装置52,56,58の中に充填されるとき、オーガー・スクリュー46はその移動を行なうために動作状態になる。装置52が充填されると、オーガー・スクリュー46の動作は中断されて、追加の装置56および58の次の充填を行なうために、組成物の流れが分離される。このような繰り返しの流れの中断は保持容器42の中の組成物44に脈動している力を生じる。しかしながら、このような組成物の繰り返しの機械的な操作はその組成物の特性に有害に作用する可能性がある。したがって、上述のように、オーガー・スクリュー46の設計および充填装置52,56および58の速度はそのような不都合な影響を最小限にするために最適化されている。
【0039】
本発明の方法において使用できる種類のオーガー・スクリューが図3において示されている。図示のように、このスクリュー60はオーガー・スクリュー・ロッド66に取り付けられている多数のねじ山62,64を含んでいる。図示のように、ねじ山62はねじ山64よりも大きな直径を有している。本発明の実施形態において、これらのねじ山の数、直径、角度およびねじ山間の距離は用いられる特定の装置または組成物自体に適合するように設計できる。なお、熟練者は、この開示の恩恵を受けた後に、本発明の方法において使用できる別のスクリューの設計も容易に確かめることができるであろう。
【0040】
上記のオーガー・スクリューは保持容器からアプリケータ装置の中に組成物を移す。図4aおよび図4bは上記の充填処理の間に、注射器等のような、アプリケータ装置を保持するために使用できる典型的な固定装置を示している。この固定装置70、すなわち、注射器の装填ステーションは、多数の注射器レセプタクル74を有している注射器ホルダー72と、クランプねじ76を含んでいる、固定装置70に注射器を固定するための手段と、クランプ・ロッド78と、注射器衝突ピン80と、を備えている。この注射器82は注射器レセプタクル74の中に配置されている。それぞれの注射器は上述の装置を用いて連続的な様式で同量のペーストにより後部から充填されている。この後部からの充填動作は注射器82の後端部からその注射器82の中に組成物を分配する処理を含む。この場合に、注射器82はクランプねじ76によりその位置が保持されている。充填の完了時に、注射器衝突ピン80が注射器82の外側に接触し、これにより、その注射器82に圧力が加えられて、この圧力が注射器82と充填装置のポートとの間の組成物の流れの分離を生じる。固定装置70は、その後、次の注射器82を充填位置になるように移動させるように、動作する。充填が終わると、注射器のプランジャーがその充填された注射器の後端部の中に挿入されて、適当な位置まで進行し、その注射器82に蓋が付けられる。
【0041】
あるいは、上記の注射器を固定すること、材料の流れの分離を行なうための衝突ピンの使用、垂直な移動に続く水平な移動での多数個の注射器の動作、を含む、上記の材料の装置の中への移動のための手段の基本的な設計は自動化できる。例えば、多数個のレセプタクルを含んでいる円形の固定装置を、上記装置の充填を行なうために、円形の様式で動作させてもよい。
【0042】
熟練者であれば、上記の組成物を製造して、その組成物を各装置に充填するための別の手段を想像することができる。例えば、ポンプ技法を使用することができ、これにより、粉末は発泡用の溶液の再循環ループに添加できる。この発泡用の溶液は低剪断性のポンプを利用してポンプ輸送することができ、上記の粉末は所望の特性が達成されるまで加えることができる。このようにして、液体の固体に対する望ましい比率に到達すると、気体がその再循環しているペーストの中に導入される。さらに、ペーストを膨張させるためにチャンバーを含むことができる。この場合に、そのチャンバーがいっぱいになると、所望の密度に到達して、その発泡されたペーストは各注射器の中に連続的に充填できる。
【0043】
上記の流動性の止血用の組成物の密度が各組成物の許容可能な機械的なおよび止血の特性の指示手段であるとすれば、それらの許容可能な特性を確実にするために、その流動性の止血用の組成物の密度が混合の完了時に測定される。使用する密度を評価する、本明細書において記載されている、一例の方法は、既知の密度の一連の有機溶媒の中に上記の止血用の組成物を懸濁させるか、既知の量の組成物の重量を測定することを含むが、密度を測定する別の方法も利用可能である。なお、本発明の方法における組成物の密度をモニターすることにおいて、流動性の止血用の組成物の密度は既知の密度を伴っている不活性な有機性の液体を使用することにより評価される。これらの液体は、上記の組成物との何らかの可能な相互作用が測定に影響しないように、選択されている。この場合に、その溶媒の密度の選択は止血用の組成物の所定の許容可能な密度の範囲に一致している。すなわち、上記の組成物は異なる密度の一連の溶媒の中に入れられて、その組成物がその溶媒の中において沈むか浮かぶかに基づいて、その組成物の密度が決定される。
【0044】
上述のように調製された止血用の組成物は上述のような医療装置の中に移されて、その止血用の組成物を収容している装置は、好ましくは、電離放射線により、滅菌される。さらに好ましくは、この滅菌は、本明細書において例示されているように、ガンマ線の照射により行なわれる。
【0045】
以下の実施例は本発明の特定の実施形態を説明しているが、これらは本発明の範囲を限定しているものとして解釈されるべきではなく、むしろ、本発明の完全な説明に寄与しているものとして解釈されるべきである。
【0046】
実施例
以下の実施例において調製されているサンプルを2インチ(5.08cm)/分の速度で、50ポンド(22.7kg)のロード・セル(DFG550)を用いて、シャチロン(Chatillon)TCD200により決定した場合の最大しぼり出し力について試験した。留置カテーテル・シース(寸法:12〜14ゲージ)を試験するサンプルの注射器に取り付けた。その後、この注射器を保持用の装置の中に挿入し、この保持用の装置を上記の試験器具に装填した。このようにして、最大しぼり出し力を書き留めた。
【0047】
実施例1
合計で10個のサンプルを以下のように調製した。1グラムの乾燥したサージフォーム(Surgifoam)(登録商標)の粉末をプラスチックの容器の中に入れて、4mLの塩水と混合した。この容器に蓋をして、均一な濃度の実質的に均質なペーストが得られるまで、その内容物を振盪した。このペーストを円筒形の形状に形成して、10ccのBDポリプロピレンの廃棄可能なルアー注射器(luer syringe)の中に入れた。その後、この注射器に蓋をして、その充填された注射器の内の5個を25kGyの線量でガンマ線の照射により滅菌した。次に、最大押し出し力を決定して、表1に示した。この場合に、滅菌されていないサンプルを1aとして示し、滅菌されているサンプルを1bとして示した。
【0048】
合計で10個のサンプルを以下のように調製した。1グラムの乾燥したサージフォーム(Surgifoam)(登録商標)の粉末をプラスチックの容器の中に入れて、4mLの塩水と混合した。この容器に蓋をして、均一な濃度の実質的に均質なペーストが得られるまで、その内容物を振盪した。このペーストを円筒形の形状に形成して、10ccのBDポリプロピレンの廃棄可能なルアー注射器の中に入れた。次に、3mLの窒素を収容している第2の10ccのBDルアー注射器を上記のペーストを収容している注射器に接続して、そのペーストが注射器から注射器に通過できるようにした。さらに、これらのペーストおよび気体を注射器の間で前後に押し動かして、完全に混合させ、均一な濃度の実質的に均質な発泡体様の組成物が得られるまで、そのペーストの全体に亘って気体を分散させた。その後、これらの注射器に蓋をして、その充填された注射器の内の5個を25kGyの線量で照射により滅菌した。次に、最大押し出し力を決定して、表1に示した。この場合に、滅菌されていないサンプルを1a’として示し、滅菌されているサンプルを1b’として示した。
【0049】
実施例2
合計で10個のサンプルを以下のように調整した。まず、0.005重量%の塩化ベンズアルコニウム(benzalkonium chloride)および5重量%のグリセロール(glycerol)を含有している塩水の溶液を調製した。次に、この溶液を用いて、実施例1において記載されているような均質なゼラチン粉末のペーストを調製した。このペーストを円筒形の形状に形成して、10ccのBDポリプロピレンの廃棄可能なルアー注射器の中に入れた。その後、この注射器に蓋をして、その充填された注射器の内の5個を25kGyの線量でガンマ線の照射により滅菌した。次に、最大押し出し力を決定して、表1に示した。この場合に、滅菌されていないサンプルを2aとして示し、滅菌されているサンプルを2bとして示した。
【0050】
合計で10個のサンプルを以下のように調製した。0.005重量%の塩化ベンズアルコニウム(benzalkonium chloride)および5重量%のグリセロール(glycerol)を含有している塩水の溶液を調製した。次に、この溶液を用いて、実施例1において記載されているような均質なゼラチン粉末のペーストを調製した。その後、3mLの窒素を収容している別の10ccのBDルアー注射器を上記のペーストを収容している注射器に接続して、そのペーストが注射器から注射器に通過できるようにした。さらに、これらのペーストおよび気体を注射器の間で前後に押し動かして、完全に混合させ、均一な濃度の実質的に均質な発泡体様の組成物が得られるまで、そのペーストの全体に亘って気体を分散させた。その後、これらの注射器に蓋をして、その充填された注射器の内の5個を25kGyの線量で照射により滅菌した。次に、最大押し出し力を決定して、表1に示した。この場合に、滅菌されていないサンプルを2a’として示し、滅菌されているサンプルを2b’として示した。
【表1】

【0051】
表1におけるデータが示しているように、ペーストの全体に亘って均質に分散されている気体の相を含むことは、均質に分散されている気体の相またはその他の添加物を含んでいないペーストに対して比較した場合に、滅菌処理の前にその組成物の最大しぼり出し力をかなり減少させている。したがって、均質に分散されている気体の相を含んでいる滅菌した組成物は、均質に分散されている気体の相を含んでいない滅菌したペーストのしぼり出し力よりもかなり小さいしぼり出し力を示す。実際に、気体の相を含んでいる滅菌した組成物は気体の相または添加物を全く含んでいない予備滅菌されたペーストのしぼり出し力にほぼ近い。したがって、完全に滅菌された組成物は、気体の相または添加物を全く含まない滅菌されていないペーストの最大押し出し力と同等かこれよりも良い、最大押し出し力により証明されているように、流動性および/または注入可能性を備えることができ、このことは使用の場所において健康管理の提供者にとって有益である。例えば、塩化ベンズアルコニウム(benzalkonium chloride)およびグリセロール(glycerol)等の、添加物の使用は滅菌処理において本発明の組成物の特性をさらに高めるために用いることができる。
【0052】
実施例3
25グラムのサージフォーム(Surgifoam)(登録商標)のゼラチン粉末を、均一なペーストが形成されるまで、塩水の重量に基づいて、0.005重量%の塩化ベンズアルコニウム(benzalkonium chloride)および5重量%のグリセロール(glycerol)を含有している125mlの通常の塩水と共に混合した。この結果として得られたペーストを混合用の櫂を嵌め込んでいる1/2パイント(0.237L)のドンビエル(Donvier)ミキサーの中に詰め込んだ。次に、窒素供給源に接続されている管を上記のミキサーの蓋を通して嵌め込み、フィルムの中に包むことにより、システムを環境に対して「閉じた」状態にした。このシステムを20分間にわたり窒素によりパージした。その後、このペーストを、上記の櫂を手で速やかに回転させることにより、窒素を均質に混入させるために、混合した。この混合は、組成物が利用可能な容積を充たして、気体の相の均質な分布を示した時に、終了した。次に、この組成物を60ccの注射器の中に詰め込んでから、二方向ルアー・コネクタを介して10ccのBDルアー注射器の中に分配した。この組成物の密度はおよそ0.7〜0.75グラム/mLであった。その後、これらの注射器に蓋をして、その充填された注射器の一部を25kGyの線量で照射により滅菌した。
【0053】
実施例4
塩水の重量に基づいて、0.005重量%の塩化ベンズアルコニウム(benzalkonium chloride)および5重量%のグリセロール(glycerol)を含有している2.5リットルの通常の塩水を、2ガロン(7.57L)の二重遊星式ロス(Ross)ミキサーに加えて、5分間にわたり窒素の第1の部分と共に、最大速度で混合して、発泡した液体を形成した。次に、継続した混合を伴って、12分の期間にわたり、上記の発泡した液体に、500グラムのゼラチン粉末および釣り合った量の窒素を加えた。これらすべての粉末および気体を加えた後に、その組成物をさらに10分間にわたり混合した。この結果として得られた組成物の密度は0.6グラム/mLであった。次に、この組成物を12ccのモノジェクト(Monoject)注射器の中に分配した。
【0054】
実施例5
サージフォーム(Surgifoam)(登録商標)のゼラチン粉末の1グラムのサンプルをそれぞれ0.005重量%の塩化ベンズアルコニウム(benzalkonium chloride)および5重量%のグリセロール(glycerol)を含有している5mLの塩水の溶液と共に混合して、均一なペーストを形成した。この結果として得られたペーストを10ccのBDルアー注射器の中に後部から充填した。全ての空気をこれらの注射器から押し出して、その注射器の中にペーストを詰め込んだ状態にした。第1の組の注射器は内部に気体を全く混入していない状態で照射し、サンプル5aとして示されている。第2の組のサンプルは均一なペーストを収容している注射器の中に3mLの窒素を分配することにより調製されている。その後、さらに混合することなく、これらの注射器に蓋をして、4℃において貯蔵した。これらのサンプルはサンプル5bとして示されている。次に、第3の組のサンプルを、ペーストの中に全ての窒素が均質に混入されるまで、上記の第1の注射器と3mLの窒素を収容している第2の注射器との間で前後に、そのペーストを押し動かすことにより調製した。この結果として得られた均質な組成物の充填容積はおよそ9mLであり、その組成物の密度はおよそ0.7グラム/mLであった。その後、これらの注射器に蓋をして、その予備充填された注射器の一部を25kGyの線量で照射により滅菌した。その後、上記の3組のサンプルの最大押し出し力を決定して、表2に示した。
【表2】

【0055】
表2におけるデータが示しているように、気体を全く含んでいないか、気体が内部に不十分にあるいは部分的にしか分散していないペーストに比べた場合に、ペーストの全体に亘って気体の均質な分布/分散は照射前の組成物の最大押し出し力を減少させて、照射後のその組成物の低い押し出し力を維持するために不可欠である。
【0056】
実施例6
1グラムのサージフォーム(Surgifoam)(登録商標)のゼラチン粉末を5mLの通常の塩水と共に混合して、均一なペーストを形成した。この結果として得られたペーストを10ccのBDルアー注射器の中に後部から装填した。全ての空気をその注射器から押し出して、その注射器の中にペーストを詰め込んだ状態にした。1mL〜4mLの範囲の容積を伴う窒素を収容している、第2の組の10ccの注射器を、それぞれ、二方向ルアー・コネクタを介して、上記の第1の注射器に取り付けた。その後、ペーストを、気体の中に押し込んでから、全ての気体がそのペーストの中に均質に混入されるまで、上記の2個の注射器の間で前後に通過させた。この結果として得られた組成物の充填容積はおよそ6〜10mLであり、その密度はおよそ0.60〜1.0グラム/mLであり、それぞれペーストの中に導入されたガスの量に応じている。その後、これらの注射器に蓋をして、その予備充填された注射器の一部を25kGyの線量で照射により滅菌した。
【0057】
上記の場合に、滅菌されているサンプルは、それぞれ、サンプル6a〜6eとして示されている。さらに、滅菌されているサンプルの最大押し出し力を決定して、表3において示した。
【表3】

【0058】
実施例7
1グラムのサージフォーム(Surgifoam)のゼラチン粉末を5mLの通常の塩水と共に混合して、均一なペーストを形成した。この結果として得られたペーストを10ccのBDルアー注射器の中に後部から装填した。全ての空気をその注射器から押し出して、その注射器の中にペーストを詰め込んだ状態にした。0mL〜4mLの範囲の容積を伴う空気を収容している、第2の組の10ccの注射器を、それぞれ、二方向ルアー・コネクタを介して、上記の第1の注射器に取り付けた。その後、ペーストを、気体の中に押し込んでから、全ての気体がそのペーストの中に均質に混入されるまで、上記の2個の注射器の間で前後に通過させた。この結果として得られた組成物の充填容積はおよそ6〜10mLであり、その密度はおよそ0.60〜1.0グラム/mLであり、それぞれペーストの中に導入されたガスの量に応じている。その後、これらの注射器に蓋をして、その充填された注射器の一部を25kGyの線量で照射により滅菌した。滅菌したサンプルは、それぞれ、サンプル7a〜7eとして示されている。
【0059】
さらに、滅菌したサンプルの最大押し出し力を決定して、表4において示した。
【表4】

【0060】
実施例8:ブタの脾生検パンチ・モデル内における異なる材料の止血能力
【0061】
実施例1〜7および9において調製されたサンプルの止血特性の評価において、ブタの脾生検パンチ・モデルを用いた。組織弁を3mmの深さに切断するために、6mmの生検パンチを用いた。次に、この組織弁を切り出して、0.4mLの上記の試験材料をその傷の部位に適用した。2分間にわたり、その傷の部位の上を、手による加圧により抑えた。その後、その傷の部位を、出血の徴候について、3分までにわたり、観察した。この場合に、出血が観察されれば、完全な止血が達成されるまで、その度に、30秒間にわたり手による加圧の追加の適用を行なった。表5はこの評価の結果を列挙している。なお、滅菌処理されていないサンプルまたは滅菌処理したサンプルについての結果は試験した全てのサンプルについての平均値である。
【表5】

【0062】
実施例9
凍結乾燥したウシのトロンビン(20,000単位のトロンボゲンJJMI)の2個のビンを20mLの塩水の中に再形成して、1000単位/mLの使用液を形成した。次に、実施例10において記載されているように、体外試験において、凝固活性を測定した。上記の材料の1個のビンを4〜8℃で貯蔵し、1日目、8日目、および30日目において、それぞれ、凝固活性を測定した。第2のビンはガンマ線の照射(25kGy)により滅菌して、その凝固活性を上述のように測定した。これらの、滅菌されていない、および滅菌されている、サンプルは、サンプル9aおよび9bとして、それぞれ示されている。その後、これらの、滅菌されていない、および滅菌されている、両方のサンプルをそれぞれの測定の間に4〜8℃で貯蔵した。
【0063】
20,000単位の凍結乾燥したウシのトロンビンの別の2個のビンを0.005重量%の塩化ベンズアルコニウム(benzalkonium chloride)および5重量%のグリセロール(glycerol)を含有している塩水の中において再形成した。1個のビンを4〜8℃で貯蔵し、0日目、1日目、8日目、および30日目において、凝固活性を測定した。第2のビンはガンマ線の照射(25kGy)により滅菌して、その凝固活性を上述のように測定した。測定の間に、両方の、滅菌されていない、および滅菌されている、サンプルを、4〜8℃で貯蔵した。これらの、滅菌されていない、および滅菌されている、サンプルは、サンプル9cおよび9dとして、それぞれ示されている。
【0064】
上述のトロンビンを含有しているゼラチン・ペーストの幾つかのサンプルを、1グラムのサージフォーム(Surgifoam)のゼラチン粉末と5mLのトロンビン溶液とを混合することにより、調製した。この結果として得られたペーストを10ccの注射器の中に詰め込んだ。その後、これらのサンプルを25kGyにおいて滅菌してから4〜8℃において貯蔵するか、4〜8℃において、滅菌せずに、貯蔵するだけのいずれかにした。このようにして調製したサンプルは以下において示されて識別されている。
【0065】
サンプル9e=1gのサージフォーム(Surgifoam)(登録商標)の粉末および5mLのサンプル9a、滅菌されている
サンプル9f=1gのサージフォーム(Surgifoam)(登録商標)の粉末および5mLのサンプル9aおよび3mLの窒素、発泡状態および滅菌されている
サンプル9g=1gのサージフォーム(Surgifoam)(登録商標)の粉末および5mLのサンプル9c、滅菌されていない
サンプル9h=1gのサージフォーム(Surgifoam)(登録商標)の粉末および5mLのサンプル9c、滅菌されている
サンプル9i=1gのサージフォーム(Surgifoam)(登録商標)の粉末および5mLのサンプル9cおよび3mLの窒素、発泡状態、滅菌されている
【0066】
実施例10:フィブロメーター器具(BBL)内における体外凝固試験によるトロンビン活性の測定
【0067】
トロンビンを含有している試験サンプルの一連の希釈液をベロナル(Veronal)緩衝液(pH7.2)の中において調製した。0.2mLの蓄えられた正常な血漿(シトロール・レベル(Citrol Level):1、対照血漿、デイド・ダイアグノスティクス(Dade Diagnostics))をフィブロメーターのインキュベータ・ブロックの中において37℃に加温した。次に、0.1mLの予備加温したサンプルの希釈液を上記の血漿に加えて、タイマーを同時に始動させた。凝固の形成の時間を記録した。全てのサンプルを2回試験して、平均の凝固時間を計算した。これらのデータを、log10(希釈率)対log10(凝固時間)としてグラフにし、回帰分析を行なった。この場合に、新しく調製したトロンビンは100%の活性を有していると考え、全ての他のサンプルは新しく調製したトロンビンに対する活性の比率として計算されている。これらの結果が表6および表7において示されている。
【表6】

【表7】

【表8】

【0068】
実施例11
1リットルの、0.005重量%の塩化ベンズアルコニウム(benzalkonium chloride)および5重量%のグリセロール(glycerol)を含有している、塩水の溶液を、混合容器(ロス・ミキサー(Ross Mixer)、モデルDPM2、製品番号:75308)の中にそそぎ入れて、そのミキサー・ブレードを動作モードに切り替えた。次に、窒素ガスを、継続的な泡立ちの様式で、窒素供給源に接続されている管を介して、上記の溶液の中に導入した。その後、この溶液および気体の混合物を、上述のような発泡体を形成するために、およそ10分間にわたり、70Hzで攪拌した。次に、発泡体の形成の後に、混合容器の入口ポートに取り付けた添加用の漏斗を用いて、固体の粒子の添加を開始した。この場合に、200グラムのゼラチン粉末を約3分の期間にわたり添加した。70Hzにおける全部の粉末の添加の後に、約15分間にわたり混合を継続した後に、約2分間にわたる追加の混合を約12Hzの下げたブレード速度で行なった。この混合の完了時に、密度が許容のパラメータの範囲内にあって、発泡体の中の粒子の実質的に均質な分散を示すことを確実にするために、混合容器の中の組成物の密度を上述のような溶媒法により測定した。
【0069】
上記の組成物を、7個のねじ山を有するオーガー・スクリューを備えている充填用の装置の保持容器の中に所望の量まで移した。このスクリューの上方の部分におけるねじ山の間の距離は約3.75cmであるが、このスクリューの下方の部分におけるねじ山の間の距離は約1.5cmであった。その後、組成物をこのオーガー・スクリューにより注射器に分配した。この場合に、約6ミリリットル(mL)の組成物をそれぞれの注射器に入れた。また、この充填はおよそ36mL/分〜約72mL/分の速度で注射器充填用の装置を用いて行なった。さらに、上記の量が徐々に減ると、上記の保持容器を新しい流動性の止血用の組成物により補給した。この充填処置の完了後に、その注射器の中の流動性の止血用の組成物の密度を上述のように測定した。これらの結果が表9において報告されている。
【0070】
実施例12
2リットルの、0.005重量%の塩化ベンズアルコニウム(benzalkonium chloride)および5重量%のグリセロール(glycerol)を含有している、塩水の溶液を、混合容器(ロス・ミキサー(Ross Mixer)、モデルDPM2、製品番号:75308)の中にそそぎ入れて、そのミキサー・ブレードを動作モードに切り替えた。次に、窒素ガスを、継続的な泡立ちの様式で、窒素供給源に接続されている管を介して、上記の溶液の中に導入した。その後、この溶液および気体の混合物を、上述のような発泡体を形成するために、およそ10分間にわたり、70Hzで攪拌した。次に、発泡体の形成の後に、混合容器の入口ポートに取り付けた添加用の漏斗を用いて、固体の粒子の添加を開始した。この場合に、400グラムのゼラチン粉末を約5分の期間にわたり添加した。70Hzにおける全部の粉末の添加の後に、約10分間にわたり混合を継続した後に、約2分間にわたる追加の混合を約12Hzの下げたブレード速度で行なった。この混合の完了時に、密度が許容のパラメータの範囲内にあって、発泡体の中の粒子の実質的に均質な分散を示すことを確実にするために、混合容器の中の組成物の密度を上述のような溶媒法により測定した。
【0071】
上記の組成物を、7個のねじ山を有するオーガー・スクリューを備えている充填用の装置の保持容器の中に所望の量まで移した。このスクリューの上方の部分におけるねじ山の間の距離は約3.75cmであるが、このスクリューの下方の部分におけるねじ山の間の距離は約1.5cmであった。その後、組成物をこのオーガー・スクリューにより注射器に分配した。この場合に、約6ミリリットル(mL)の組成物を、約120mL/分の速度で、それぞれの注射器に入れた。また、さらに、上記の量が徐々に減ると、上記の保持容器を新しい流動性の止血用の組成物により補給した。この充填処置の完了後に、その注射器の中の流動性の止血用の組成物の密度を上述のように測定した。これらの結果が表9において報告されている。
【表9】

【0072】
表9は、充填の速度がその結果として得られるペーストの密度において生じる可能性のある影響を示している。まず、充填の特定の速度、すなわち、1分当たりに充填される注射器の数において、特定の数の注射器に対応する特定の値よりも小さいと示されている組成物の密度がその前の数の注射器において測定された密度の値よりも大きいことが注目される。例えば、12mL/分において、25番目に充填された注射器の中の組成物の密度は0.703よりも小さいが、0.659よりも大きい。また、充填速度が高いほど、長い時間の期間にわたり組成物の濃度を許容可能なパラメータの範囲内に維持できることが注目される。記載されているように、例えば、72mL/分の比較的に高い充填速度において、組成物の密度は150番目の充填された注射器において0.703より小さく維持されているが、12mL/分の充填速度では、組成物の密度における同一の相対的な変化は25番目の充填された注射器において見られる。さらに、ここに記載されている充填の特定の速度が本明細書において開示されている特定の装置および組成物に適用可能であって、その装置の設計および組成物により実際に変化し得ることが注目される。
【0073】
〔実施の態様〕
(1)流動性の止血用の組成物を作成するための方法において、
所与の容積の生体適合性の液体を、この液体を混合するための手段を備えている混合容器の中に導入する処理と、
前記混合するための手段が、前記所与の容積の液体および所与の容積の気体を一緒に混合して発泡体を形成するのに効果的な条件で動作している間に、前記所与の容積の生体適合性の気体を前記所与の容積の液体の中に導入する処理であって、前記発泡体は不連続な気体の相を含み、当該不連続な気体の相は前記液体を含んでいる連続的な液体の相の全体に亘って実質的に均質に分散されている前記気体を含んでいる、処理と、
止血において使用するために適していて、前記液体中で実質的に不溶性である、生体適合性のポリマーの所与の量の固体粒子を、前記発泡体の中に導入する処理と、
前記連続的な液体の相の全体に亘って実質的に均質に分散されている前記不連続な気体の相および前記固体の粒子を含んでいる実質的に均質な組成物を形成するために有効な条件下において、前記発泡体および前記固体の粒子を一緒に混合する処理と、
を含んでおり、
前記所与の容積の液体、前記所与の容積の気体、および前記所与の量の固体粒子、の比率が止血特性を伴う前記実質的に均質な組成物を形成するために有効であり、これにより、前記流動性の止血用の組成物を形成する、方法。
(2)実施態様1に記載の方法において、
前記液体が水性である、方法。
(3)実施態様2に記載の方法において、
前記液体が塩水を含む、方法。
(4)実施態様3に記載の方法において、
前記生体適合性のポリマーが蛋白質および多糖類から成る群から選択される、方法。
(5)実施態様4に記載の方法において、
前記蛋白質がゼラチン、コラーゲン、フィブリノゲン、およびフィブロネクチンから成る群から選択される、方法。
(6)実施態様3に記載の方法において、
前記生体適合性のポリマーがゼラチンを含む、方法。
(7)実施態様6に記載の方法において、
前記粒子の平均の直径が40〜1200ミクロンである、方法。
(8)実施態様7に記載の方法において、
前記粒子、前記液体および前記気体が、g:mL:mLに基づいて、1:2:1ないし1:12:13の比率で、前記流動性の止血用の組成物中に存在している、方法。
(9)実施態様7に記載の方法において、
前記粒子、前記液体および前記気体が、g:mL:mLに基づいて、1:4:1ないし1:8:9の比率で、前記流動性の止血用の組成物中に存在している、方法。
(10)実施態様8に記載の方法において、
前記流動性の止血用の組成物の密度が0.9g/mL〜0.3g/mLである、方法。
(11)実施態様9に記載の方法において、
前記流動性の止血用の組成物の密度が0.8g/mL〜0.6g/mLである、方法。
(12)実施態様1に記載の方法において、
前記気体が空気、窒素、二酸化炭素、キセノン、およびアルゴンから成る群から選択される、方法。
(13)実施態様1に記載の方法において、
前記流動性の止血用の組成物が、放射線不透過剤、抗菌剤、発泡剤、発泡安定化剤、界面活性剤、酸化防止剤、保湿剤、増粘剤、希釈剤、潤滑剤、湿潤剤、照射安定化剤、可塑剤、ヘパリン中和剤、前駆凝固剤、および止血剤から成る群から選択される機能的に有効な量の添加物をさらに含有している、方法。
(14)実施態様13に記載の方法において、
前記機能的な添加物がフィブリノゲンおよびトロンビンから成る群から選択される、方法。
(15)実施態様13に記載の方法において、
前記機能的な添加物が塩化ベンズアルコニウム(benzalkonium chloride)およびグリセロール(glycerol)から成る群から選択される、方法。
(16)実施態様1に記載の方法において、
前記液体および前記気体が3分〜30分にわたり混合される、方法。
(17)実施態様16に記載の方法において、
前記発泡体および前記固体の粒子が10分〜30分にわたり一緒に混合される、方法。
(18)実施態様17に記載の方法において、
前記流動性の止血用の組成物の密度が0.9g/mL〜0.3g/mLである、方法。
(19) 止血を必要としている体の部位に流動性の止血用の組成物を供給するために適している医療装置を作成するための方法において、
所与の容積の生体適合性の液体を、この液体を混合するための手段を備えている混合容器の中に導入する処理と、
前記混合するための手段が、前記所与の容積の液体および所与の容積の気体を一緒に混合して発泡体を形成するために有効な条件下で動作している間に、前記所与の容積の生体適合性の気体を前記所与の容積の液体の中に導入する処理であって、前記発泡体は不連続な気体の相を含み、当該不連続な気体の相は前記液体を含んでいる連続的な液体の相の中に分散されている前記気体を含んでいる、処理と、
止血において使用するために適していて、前記液体中に実質的に不溶性である、生体適合性のポリマーの所与の量の固体粒子を、前記発泡体の中に導入する処理と、
前記連続的な液体の相の全体に亘って実質的に均質に分散されている、前記不連続な気体の相および前記固体の粒子を含んでいる実質的に均質な組成物を形成するために有効な条件下において、前記発泡体および固体の粒子を一緒に混合する処理であって、前記所与の容積の液体、前記所与の容積の気体、および前記所与の量の固体粒子、の比率が止血特性を伴う前記実質的に均質な組成物を形成するために有効であり、これにより、前記流動性の止血用の組成物を形成する、処理と、
前記液体の相の全体における前記気体の相および前記固体の粒子の実質的に均質な分散を維持するために有効な条件下において、前記止血を必要としている部位に前記止血用の組成物を供給するために適している装置の中にその止血用の組成物を移す処理と、
を含んでいる、方法。
(20)実施態様19に記載の方法において、
前記実質的に均質な止血用の組成物を移す処理が、その組成物の構造に有害に作用する圧縮力が実質的に存在していない状態で行なわれる、方法。
(21)実施態様19に記載の方法において、
前記移す処理がオーガー・スクリューを利用して行なわれる、方法。
(22)実施態様19に記載の方法において、
前記流動性の止血用の組成物の密度が0.9g/mL〜0.3g/mLである、方法。
(23)実施態様19に記載の方法において、
内部に前記止血用の組成物が配置された前記装置が、無菌の止血用の組成物を含んでいる無菌の装置を形成するために有効である条件に曝される、方法。
(24)実施態様19に記載の方法において、
前記組成物が、1分間当たりに少なくとも10ミリリットルの速度で、前記装置の中に移される、方法。
(25)実施態様19に記載の方法において、
前記組成物が、1分間当たりに少なくとも72ミリリットルの速度で、前記装置の中に移される、方法。
(26)実施態様19に記載の方法において、
前記組成物が、1分間当たりに少なくとも100ミリリットルの速度で、前記装置の中に移される、方法。
(27)実施態様19に記載の方法において、
内部に前記止血用の組成物が配置されている前記装置が滅菌されている、方法。
(28)実施態様27に記載の方法において、
前記装置が電離線により滅菌されている、方法。
【図面の簡単な説明】
【0074】
【図1】本発明の方法において使用される混合装置の概略的な側断面図である。
【図2】本発明の方法において使用される充填用の装置の概略的な側断面図である。
【図3】本発明の方法において使用される種類のオーガー・スクリューの側面の斜視図である。
【図4a】本発明の方法において使用される装置の側面図である。
【図4b】本発明の方法において使用される装置の側断面図である。
【特許請求の範囲】
【請求項1】
流動性の止血用の組成物を作成するための方法において、
所与の容積の生体適合性の液体を、この液体を混合するための手段を備えている混合容器の中に導入する処理と、
前記混合するための手段が、前記所与の容積の液体および所与の容積の気体を一緒に混合して発泡体を形成するのに効果的な条件で動作している間に、前記所与の容積の生体適合性の気体を前記所与の容積の液体の中に導入する処理であって、前記発泡体は不連続な気体の相を含み、当該不連続な気体の相は前記液体を含んでいる連続的な液体の相の全体に亘って実質的に均質に分散されている前記気体を含んでいる、処理と、
止血において使用するために適していて、前記液体中で実質的に不溶性である、生体適合性のポリマーの所与の量の固体粒子を、前記発泡体の中に導入する処理と、
前記連続的な液体の相の全体に亘って実質的に均質に分散されている前記不連続な気体の相および前記固体の粒子を含んでいる実質的に均質な組成物を形成するために有効な条件下において、前記発泡体および前記固体の粒子を一緒に混合する処理と、
を含んでおり、
前記所与の容積の液体、前記所与の容積の気体、および前記所与の量の固体粒子、の比率が止血特性を伴う前記実質的に均質な組成物を形成するために有効であり、これにより、前記流動性の止血用の組成物を形成する、方法。
【請求項2】
請求項1に記載の方法において、
前記液体が水性である、方法。
【請求項3】
請求項2に記載の方法において、
前記液体が塩水を含む、方法。
【請求項4】
請求項3に記載の方法において、
前記生体適合性のポリマーが蛋白質および多糖類から成る群から選択される、方法。
【請求項5】
請求項4に記載の方法において、
前記蛋白質がゼラチン、コラーゲン、フィブリノゲン、およびフィブロネクチンから成る群から選択される、方法。
【請求項6】
請求項3に記載の方法において、
前記生体適合性のポリマーがゼラチンを含む、方法。
【請求項7】
請求項6に記載の方法において、
前記粒子の平均の直径が40〜1200ミクロンである、方法。
【請求項8】
請求項7に記載の方法において、
前記粒子、前記液体、および前記気体が、g:mL:mLに基づいて、1:2:1ないし1:12:13の比率で、前記流動性の止血用の組成物中に存在している、方法。
【請求項9】
請求項7に記載の方法において、
前記粒子、前記液体、および前記気体が、g:mL:mLに基づいて、1:4:1ないし1:8:9の比率で、前記流動性の止血用の組成物中に存在している、方法。
【請求項10】
請求項8に記載の方法において、
前記流動性の止血用の組成物の密度が0.9g/mL〜0.3g/mLである、方法。
【請求項11】
請求項9に記載の方法において、
前記流動性の止血用の組成物の密度が0.8g/mL〜0.6g/mLである、方法。
【請求項12】
請求項1に記載の方法において、
前記気体が空気、窒素、二酸化炭素、キセノン、およびアルゴンから成る群から選択される、方法。
【請求項13】
請求項1に記載の方法において、
前記流動性の止血用の組成物が、放射線不透過剤、抗菌剤、発泡剤、発泡安定化剤、界面活性剤、酸化防止剤、保湿剤、増粘剤、希釈剤、潤滑剤、湿潤剤、照射安定化剤、可塑剤、ヘパリン中和剤、前駆凝固剤、および止血剤から成る群から選択される機能的に有効な量の添加物をさらに含有している、方法。
【請求項14】
請求項13に記載の方法において、
前記機能的な添加物がフィブリノゲンおよびトロンビンから成る群から選択される、方法。
【請求項15】
請求項13に記載の方法において、
前記機能的な添加物が塩化ベンズアルコニウム(benzalkonium chloride)およびグリセロール(glycerol)から成る群から選択される、方法。
【請求項16】
請求項1に記載の方法において、
前記液体および前記気体が3分〜30分にわたり混合される、方法。
【請求項17】
請求項16に記載の方法において、
前記発泡体および前記固体の粒子が10分〜30分にわたり一緒に混合される、方法。
【請求項18】
請求項17に記載の方法において、
前記流動性の止血用の組成物の密度が0.9g/mL〜0.3g/mLである、方法。
【請求項19】
止血を必要としている体の部位に流動性の止血用の組成物を供給するために適している医療装置を作成するための方法において、
所与の容積の生体適合性の液体を、この液体を混合するための手段を備えている混合容器の中に導入する処理と、
前記混合するための手段が、前記所与の容積の液体および所与の容積の気体を一緒に混合して発泡体を形成するために有効な条件下で動作している間に、前記所与の容積の生体適合性の気体を前記所与の容積の液体の中に導入する処理であって、前記発泡体は不連続な気体の相を含み、当該不連続な気体の相は前記液体を含んでいる連続的な液体の相の中に分散されている前記気体を含んでいる、処理と、
止血において使用するために適していて、前記液体中に実質的に不溶性である、生体適合性のポリマーの所与の量の固体粒子を、前記発泡体の中に導入する処理と、
前記連続的な液体の相の全体に亘って実質的に均質に分散されている、前記不連続な気体の相および前記固体の粒子を含んでいる実質的に均質な組成物を形成するために有効な条件下において、前記発泡体および固体の粒子を一緒に混合する処理であって、前記所与の容積の液体、前記所与の容積の気体、および前記所与の量の固体粒子、の比率が止血特性を伴う前記実質的に均質な組成物を形成するために有効であり、これにより、前記流動性の止血用の組成物を形成する、処理と、
前記液体の相の全体における前記気体の相および前記固体の粒子の実質的に均質な分散を維持するために有効な条件下において、前記止血を必要としている部位に前記止血用の組成物を供給するために適している装置の中にその止血用の組成物を移す処理と、
を含んでいる、方法。
【請求項20】
請求項19に記載の方法において、
前記実質的に均質な止血用の組成物を移す処理が、その組成物の構造に有害に作用する圧縮力が実質的に存在していない状態で行なわれる、方法。
【請求項21】
請求項19に記載の方法において、
前記移す処理がオーガー・スクリューを利用して行なわれる、方法。
【請求項22】
請求項19に記載の方法において、
前記流動性の止血用の組成物の密度が0.9g/mL〜0.3g/mLである、方法。
【請求項23】
請求項19に記載の方法において、
内部に前記止血用の組成物が配置された前記装置が、無菌の止血用の組成物を含んでいる無菌の装置を形成するために有効である条件に曝される、方法。
【請求項24】
請求項19に記載の方法において、
前記組成物が、1分間当たりに少なくとも10ミリリットルの速度で、前記装置の中に移される、方法。
【請求項25】
請求項19に記載の方法において、
前記組成物が、1分間当たりに少なくとも72ミリリットルの速度で、前記装置の中に移される、方法。
【請求項26】
請求項19に記載の方法において、
前記組成物が、1分間当たりに少なくとも100ミリリットルの速度で、前記装置の中に移される、方法。
【請求項27】
請求項19に記載の方法において、
内部に前記止血用の組成物が配置されている前記装置が滅菌されている、方法。
【請求項28】
請求項27に記載の方法において、前記装置が電離線により滅菌されている、方法。
【請求項1】
流動性の止血用の組成物を作成するための方法において、
所与の容積の生体適合性の液体を、この液体を混合するための手段を備えている混合容器の中に導入する処理と、
前記混合するための手段が、前記所与の容積の液体および所与の容積の気体を一緒に混合して発泡体を形成するのに効果的な条件で動作している間に、前記所与の容積の生体適合性の気体を前記所与の容積の液体の中に導入する処理であって、前記発泡体は不連続な気体の相を含み、当該不連続な気体の相は前記液体を含んでいる連続的な液体の相の全体に亘って実質的に均質に分散されている前記気体を含んでいる、処理と、
止血において使用するために適していて、前記液体中で実質的に不溶性である、生体適合性のポリマーの所与の量の固体粒子を、前記発泡体の中に導入する処理と、
前記連続的な液体の相の全体に亘って実質的に均質に分散されている前記不連続な気体の相および前記固体の粒子を含んでいる実質的に均質な組成物を形成するために有効な条件下において、前記発泡体および前記固体の粒子を一緒に混合する処理と、
を含んでおり、
前記所与の容積の液体、前記所与の容積の気体、および前記所与の量の固体粒子、の比率が止血特性を伴う前記実質的に均質な組成物を形成するために有効であり、これにより、前記流動性の止血用の組成物を形成する、方法。
【請求項2】
請求項1に記載の方法において、
前記液体が水性である、方法。
【請求項3】
請求項2に記載の方法において、
前記液体が塩水を含む、方法。
【請求項4】
請求項3に記載の方法において、
前記生体適合性のポリマーが蛋白質および多糖類から成る群から選択される、方法。
【請求項5】
請求項4に記載の方法において、
前記蛋白質がゼラチン、コラーゲン、フィブリノゲン、およびフィブロネクチンから成る群から選択される、方法。
【請求項6】
請求項3に記載の方法において、
前記生体適合性のポリマーがゼラチンを含む、方法。
【請求項7】
請求項6に記載の方法において、
前記粒子の平均の直径が40〜1200ミクロンである、方法。
【請求項8】
請求項7に記載の方法において、
前記粒子、前記液体、および前記気体が、g:mL:mLに基づいて、1:2:1ないし1:12:13の比率で、前記流動性の止血用の組成物中に存在している、方法。
【請求項9】
請求項7に記載の方法において、
前記粒子、前記液体、および前記気体が、g:mL:mLに基づいて、1:4:1ないし1:8:9の比率で、前記流動性の止血用の組成物中に存在している、方法。
【請求項10】
請求項8に記載の方法において、
前記流動性の止血用の組成物の密度が0.9g/mL〜0.3g/mLである、方法。
【請求項11】
請求項9に記載の方法において、
前記流動性の止血用の組成物の密度が0.8g/mL〜0.6g/mLである、方法。
【請求項12】
請求項1に記載の方法において、
前記気体が空気、窒素、二酸化炭素、キセノン、およびアルゴンから成る群から選択される、方法。
【請求項13】
請求項1に記載の方法において、
前記流動性の止血用の組成物が、放射線不透過剤、抗菌剤、発泡剤、発泡安定化剤、界面活性剤、酸化防止剤、保湿剤、増粘剤、希釈剤、潤滑剤、湿潤剤、照射安定化剤、可塑剤、ヘパリン中和剤、前駆凝固剤、および止血剤から成る群から選択される機能的に有効な量の添加物をさらに含有している、方法。
【請求項14】
請求項13に記載の方法において、
前記機能的な添加物がフィブリノゲンおよびトロンビンから成る群から選択される、方法。
【請求項15】
請求項13に記載の方法において、
前記機能的な添加物が塩化ベンズアルコニウム(benzalkonium chloride)およびグリセロール(glycerol)から成る群から選択される、方法。
【請求項16】
請求項1に記載の方法において、
前記液体および前記気体が3分〜30分にわたり混合される、方法。
【請求項17】
請求項16に記載の方法において、
前記発泡体および前記固体の粒子が10分〜30分にわたり一緒に混合される、方法。
【請求項18】
請求項17に記載の方法において、
前記流動性の止血用の組成物の密度が0.9g/mL〜0.3g/mLである、方法。
【請求項19】
止血を必要としている体の部位に流動性の止血用の組成物を供給するために適している医療装置を作成するための方法において、
所与の容積の生体適合性の液体を、この液体を混合するための手段を備えている混合容器の中に導入する処理と、
前記混合するための手段が、前記所与の容積の液体および所与の容積の気体を一緒に混合して発泡体を形成するために有効な条件下で動作している間に、前記所与の容積の生体適合性の気体を前記所与の容積の液体の中に導入する処理であって、前記発泡体は不連続な気体の相を含み、当該不連続な気体の相は前記液体を含んでいる連続的な液体の相の中に分散されている前記気体を含んでいる、処理と、
止血において使用するために適していて、前記液体中に実質的に不溶性である、生体適合性のポリマーの所与の量の固体粒子を、前記発泡体の中に導入する処理と、
前記連続的な液体の相の全体に亘って実質的に均質に分散されている、前記不連続な気体の相および前記固体の粒子を含んでいる実質的に均質な組成物を形成するために有効な条件下において、前記発泡体および固体の粒子を一緒に混合する処理であって、前記所与の容積の液体、前記所与の容積の気体、および前記所与の量の固体粒子、の比率が止血特性を伴う前記実質的に均質な組成物を形成するために有効であり、これにより、前記流動性の止血用の組成物を形成する、処理と、
前記液体の相の全体における前記気体の相および前記固体の粒子の実質的に均質な分散を維持するために有効な条件下において、前記止血を必要としている部位に前記止血用の組成物を供給するために適している装置の中にその止血用の組成物を移す処理と、
を含んでいる、方法。
【請求項20】
請求項19に記載の方法において、
前記実質的に均質な止血用の組成物を移す処理が、その組成物の構造に有害に作用する圧縮力が実質的に存在していない状態で行なわれる、方法。
【請求項21】
請求項19に記載の方法において、
前記移す処理がオーガー・スクリューを利用して行なわれる、方法。
【請求項22】
請求項19に記載の方法において、
前記流動性の止血用の組成物の密度が0.9g/mL〜0.3g/mLである、方法。
【請求項23】
請求項19に記載の方法において、
内部に前記止血用の組成物が配置された前記装置が、無菌の止血用の組成物を含んでいる無菌の装置を形成するために有効である条件に曝される、方法。
【請求項24】
請求項19に記載の方法において、
前記組成物が、1分間当たりに少なくとも10ミリリットルの速度で、前記装置の中に移される、方法。
【請求項25】
請求項19に記載の方法において、
前記組成物が、1分間当たりに少なくとも72ミリリットルの速度で、前記装置の中に移される、方法。
【請求項26】
請求項19に記載の方法において、
前記組成物が、1分間当たりに少なくとも100ミリリットルの速度で、前記装置の中に移される、方法。
【請求項27】
請求項19に記載の方法において、
内部に前記止血用の組成物が配置されている前記装置が滅菌されている、方法。
【請求項28】
請求項27に記載の方法において、前記装置が電離線により滅菌されている、方法。
【図1】




【図3】


【図4a】


【図4b】






【図3】


【図4a】


【図4b】


【公表番号】特表2007−501785(P2007−501785A)
【公表日】平成19年2月1日(2007.2.1)
【国際特許分類】
【出願番号】特願2006−522590(P2006−522590)
【出願日】平成16年7月23日(2004.7.23)
【国際出願番号】PCT/US2004/023779
【国際公開番号】WO2005/016257
【国際公開日】平成17年2月24日(2005.2.24)
【出願人】(591286579)エシコン・インコーポレイテッド (170)
【氏名又は名称原語表記】ETHICON, INCORPORATED
【Fターム(参考)】
【公表日】平成19年2月1日(2007.2.1)
【国際特許分類】
【出願日】平成16年7月23日(2004.7.23)
【国際出願番号】PCT/US2004/023779
【国際公開番号】WO2005/016257
【国際公開日】平成17年2月24日(2005.2.24)
【出願人】(591286579)エシコン・インコーポレイテッド (170)
【氏名又は名称原語表記】ETHICON, INCORPORATED
【Fターム(参考)】
[ Back to top ]

