流路デバイス
【課題】孔のサイズに頼る機械的原理とは全く異なる原理に基づき、分子を1個ずつ同定又は分離可能な技術を提供する。
【解決手段】分子1個が流れるナノサイズ流路12、分岐部及び複数の分岐流路12a、12bを備え、前記ナノサイズ流路の近傍であって当該ナノサイズ流路を挟むように電極対E1、E2が配置され、又は電極対の一方が前記ナノサイズ流路の近傍に配置され、他方E3、E4が前記分岐流路の近傍に配置される。これは分子1個の分離に有用である。測定部は、ナノサイズ流路12に設置された電極対の電極間に電圧(直流又は交流)を印加し、分子1個が電極間を通過するときの電気的信号を測定し分子1個を同定する。
【解決手段】分子1個が流れるナノサイズ流路12、分岐部及び複数の分岐流路12a、12bを備え、前記ナノサイズ流路の近傍であって当該ナノサイズ流路を挟むように電極対E1、E2が配置され、又は電極対の一方が前記ナノサイズ流路の近傍に配置され、他方E3、E4が前記分岐流路の近傍に配置される。これは分子1個の分離に有用である。測定部は、ナノサイズ流路12に設置された電極対の電極間に電圧(直流又は交流)を印加し、分子1個が電極間を通過するときの電気的信号を測定し分子1個を同定する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、流路デバイス及びそれを含むサンプル(ここでは「サンプル」とはサンプル液のことである)処理装置に関する。本発明は、例えば、サンプルに含まれる分子を1個ずつ同定(特定、検知、検出、測定を含む)又は分離(分画sortingを含む)することが可能である。
【背景技術】
【0002】
従来、サンプルの中から所望の分子を分離する際には、クロマトグラフィー技術を用いることが知られている。この方法は、分離担体と呼ばれるものへの分子の吸着と脱離を繰り返すもので、確率過程での移動度の違いにより分子を分離するものである(例えば、特許文献1参照)。より具体的には、例えば、多孔質の粒子(分離担体)を詰め込んだ筒(このような分離担体を詰め込んだユニットを「カラム」という)に、様々な分子を含むサンプルを流す。すると、多孔質の孔より小さい分子はその孔に入ることができるが、孔より大きな分子は孔に入り込め無くて素通りする。すなわち、孔より小さい分子は孔に入ったり出たりするため移動速度が遅くなり、孔より大きな分子は孔に入り込めないため早く移動できる。この移動速度の違いにより分子を分離する。
【先行技術文献】
【特許文献】
【0003】
【特許文献1】特開2007−279028号公報
【発明の概要】
【発明が解決しようとする課題】
【0004】
しかしながら、特許文献1に開示されるような従来のクロマトグラフィーを用いる方法では、原理的に(理想的な条件下でも)所望の分子を100%分離することは、できない。これは、分離担体の孔に分子が入ったり出たりするのは、ブラウン運動している分子が偶然(ここが確率過程)孔に入ったり、偶然出たりするためである。また、大きさが近いものは同じように孔に入ったり出たりするため、それらを区別するのが難しいからである。さらに、従来の手法によれば、多種類の分子の中から数種類程度は分離できるが、全てを網羅的に分離するのは不可能である。
【0005】
本発明は、上記のような孔のサイズに頼る機械的原理とは全く異なる原理に基づき、分子を1個ずつ同定又は分離可能な技術を提供する。
【課題を解決するための手段】
【0006】
最近、加工技術が進歩し、断面の大きさがナノメートルサイズの流路即ちナノメートルサイズ流路を手に入れることができるようになった。
【0007】
本発明者は、別途、ナノメートルサイズの分子例えば生体分子を扱っており、両者を結びつけることで、ナノメートルサイズ流路に「ナノメートルサイズの分子を含むサンプル」を流せば、その分子が1個ずつ流れることが可能なことを着想した。更に本発明者は、その分子の電気的性質に着目した。この性質には分子に電気的刺激を与えた時又はその与えている間にその分子が示す電気的性質も含まれる。
【0008】
その結果、本発明者は、分子1個が流れるナノメートルサイズ流路(ここではナノメートルサイズ流路を単にナノサイズ流路又はナノ流路ということがある)の近傍に少なくとも1つの電極対を配置した流路デバイスを着想した。この着想に基づき、分子1個が流れるナノサイズ流路を有し、その近傍に少なくとも1つの電極対が配置され、かつ前記電極に交流電圧を印加するための交流電源を有する流路デバイスを発明した(第1の基本発明)。
【0009】
図1Aは、最も簡単な構成の流路デバイスの一つを示す概略平面図である。ナノ流路12を上から見ている。ナノ流路12の周辺は基板である。ナノ流路は図1Aのように基板上に形成されたものでも、或いはパイプの内部に形成されたものであっても良く、限定されない。電極対のE1、E2を介して交流電源(AS)により分子1個1個に交流電圧が印加され、その結果、ナノ流路を1個ずつ流れる分子の電気的性質を測定することができる。このことから、分子1個1個を同定することができる。この場合、交流電圧を用いるので、高感度・高精度に同定することができる。同定の意味は広く、分子の状態、例えば、分子の立体構造(conformation)やその動的な変化(動態)を検知することも同定に含まれる。
【0010】
このように分子1個の同定(検知)ができれば、流路の出口で、その分子1個を特定的に捕捉することができる。従って、本発明の流路デバイスは、サンプルから特定の分子だけを分離することに使用できる。
【0011】
更には、分子は電気的刺激(電気信号)を受けることで力学的に固有の挙動を示すことがある。その場合には、本発明の流路デバイスの出口に複数の分岐流路(ナノメートルサイズかそれより太くとも可)を用意しておけば、流路を流れる分子1個ずつに特定の電気的刺激を与えることで、例えば第1種分子は、第1の力学的挙動を示し、その結果、第1分岐流路に誘導され、例えば第2種分子は、第2の力学的挙動を示し、その結果、第2分岐流路に誘導される。
【0012】
従って、本発明は、分子1個が流れるナノ流路、分岐部及び複数の分岐流路を備えた流路デバイスを提供する(第2の基本発明)。分岐流路の断面の大きさは、ナノメートルからマイクロメートルサイズである。
【0013】
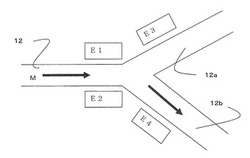
図1Bは、複数の分岐流路12a、12bを持つ流路デバイスの一つを示す概略平面図である。分離に有用な流路デバイスである。ナノ流路12を上から見ている。ナノ流路12の周辺は基板である。ナノ流路12の出口側(図に向って右側)は分岐部を介して2つの分岐流路12a、12bへと分岐し、流路全体はY字形をしている。この場合、電極対は、i)ナノ流路12を挟む電極E1とE2、又はii)ナノ流路12の近傍に配置された電極E1と分岐流路に配置された電極E3、又はiii)ナノ流路12の近傍に配置された電極E2と分岐流路に配置された電極E4である。
【0014】
電極対(E2とE4の対、又はE2とE1の対)の間に所定の電圧を印加することでサンプル中に含まれる所定の分子Mに対し電気的刺激を与えることで、分子Mは分岐流路12bへ誘導される。
【0015】
更に、本発明は、分子1個が流れるナノ流路、分岐部及び複数の分岐流路、i)前記ナノ流路の近傍であって当該ナノ流路を挟むように電極対が配置され、又はii)電極対の一方が前記ナノ流路の近傍に配置され、他方が前記分岐流路の近傍に配置された流路デバイスを提供する(第3の基本発明)。
【0016】
これらの分岐流路を有する流路デバイスは、例えば、分離に有用である。しかし、別の使い方では、分岐流路からナノ流路に向ってサンプルを流す使い方もある。
【0017】
基本的に「ある電極」に向かって引っ張る(あるいは反発させる)ことができるので、例えば図1Bにおいて向って左から右に分子Mが流れていく中で、電極E2(又は電極E4)側に引っ張れば下側分岐流路12bへ誘導でき、電極E1(又は電極E3)側に引っ張れば上側分岐流路12aへ誘導できる。この場合、電気泳動(electrophoresis)といって、分子の極性(+、−)を利用してクーロン力で誘導することもできるが、誘電泳動(dielectrophoresis)といって、「分子の極性に関係なく」誘導することも可能である。従って、誘電泳動力を使うと分子の極性を気にせずにスイッチングできるので、誘電泳動力は汎用性が高い。
【0018】
つまり、本発明の流路デバイスを使えば、サンプル中に第1種分子と第2種分子が含まれている場合、これらを分子1個ずつサンプルから分離することができる。分子1個ずつなので、原理的には純度100%で分離することができる。異なる分岐流路→出口への誘導(換言すれば、分岐流路を切り替えるスイッチング動作)には、スイッチングを行うモードとスイッチングを行わないモードの2つの操作モードがある。
【0019】
(1)スイッチングを行うモード
この場合、スイッチングにより電気的刺激を変化させるサブモード1と、スイッチングにより電極対を選択するサブモード2に分けられる。
【0020】
サブモード1では、図1Bにおいて向って左から右に分子Mが流れていく中で、予め分子の種類を検知した後、電極対(E1、E2)の間にその分子Aに固有の直流電圧あるいは固有の周波数Aの交流電圧を印加することにより分子Aを分岐流路12aへ誘導する。別の分子Bの種類を検知したときは、その分子Bに固有の直流電圧あるいは固有の周波数の交流電圧Bを電極対(E1、E2)の間に印加することにより分子Bを分岐流路12bへ誘導する。この場合、分子A、Bに固有の直流電圧又は固有の周波数を有する交流電圧は、複数ある場合もある。
【0021】
サブモード2では、図1Bに向って左から右に分子Mが流れていく中で、予め分子の種類を検知した後、その分子Aに対応する電極対(電極E1、電極E3)を選択し、それらの間に所定の直流電圧又は所定の周波数を有する交流電圧Aを印加することにより分子Aを分岐流路12aへ誘導する。別の分子Bを検知したときは、その分子Bに対応する電極対(電極E2、電極E4)を選択し、それらの間に所定の直流電圧又は所定の周波数を有する交流電圧Bを印加することにより分子Bを分岐流路12bへ誘導する。この場合、前記直流電圧又は前記周波数を有する交流電圧Aと前記直流電圧又は前記周波数を有する交流電圧Bは同一でも異なっていても良い。
【0022】
(2)スイッチングを行わないモード
予め分子を検知することなく、電極対(E1、E2)の間に、或いは電極対(E1、E3)の間に、或いは電極対(E2、E4)の間に、分子Aに固有の直流電圧又は固有の周波数の交流電圧を印加する。印加は、そこを通るどの分子にも与えておく。これにより、分子Aだけを所定の分岐路に誘導することができる。
【0023】
網羅的に全ての分子を個別に分離回収するためには、1)モードが望ましく、単に狙った分子だけを取り出すような場合は2)モードも使用することができる。
【0024】
ナノ流路から分岐部を経て複数の分岐流路への分岐の仕方は、図1Bに示すY字形に限らず、例えば、図1Cに示す形状でも、図1Dに示す形状でも良い。また分岐流路数に上限はない。
【0025】
なお、本発明にかかる流路デバイスは、分子の同定や分離に限らず、別の目的にも使用可能である。例えば、ナノ流路に順に分子Aと分子Bを流し、電極対を通じて電気的刺激を与えることにより、電気化学反応や周囲温度の上昇により分子Aと分子Bとを反応させ、分子AB連結体を合成することもできる。あるいは、ナノ流路の入口側に複数の入力部(断面の大きさはナノメートルのサイズでもマイクロメートルのサイズでもよい)を設けてもよく、その数に上限はない。
【0026】
本発明は、また、(図1A)分子1個が流れるナノ流路を有し、その近傍に少なくとも1つの電極対が配置された流路デバイス、(図1B)前記電極に交流電圧を印加するための交流電源、及び(図1B)前記流路を流れるサンプルに含まれる分子1個を同定する測定部を備えたサンプル処理装置を提供する(第4の基本発明)。
【0027】
本発明は、また、(図1A)分子1個が流れるナノ流路、分岐部及び複数の分岐流路を備え、i)前記ナノ流路の近傍であって当該ナノ流路を挟むように少なくとも1つの電極対が配置され、又はii)電極対の一方が前記ナノ流路の近傍に配置され、他方が前記分岐流路の近傍に配置された流路デバイス及び(図1B)前記ナノ流路を流れるサンプルに含まれる分子1個に前記の電極対を介して電気的刺激を与え、これにより前記分子に力学的挙動を促し、この力学的挙動により所定の分岐流路に前記分子を誘導するスイッチング部を備えたサンプル処理装置を提供する(第5の基本発明)。
【0028】
次に、電気的性質を具体化した応用発明、電気的刺激を具体化した応用発明及び力学的挙動を具体化した応用発明を本発明の一つとして説明する。
【0029】
本発明によるサンプル処理装置は、流路デバイスと、測定部と、演算処理部と、を備えている。流路デバイスは、処理対象のサンプルを注入するための注入部と、断面の大きさがナノメートルオーダーのサイズを有し、サンプルに含まれる分子を移動させるためのナノ流路と、を含有している。測定部は、ナノ流路に設置された電極対の間に電圧を印加し、分子が電極対の間を通過したときの抵抗値又はインピーダンスを測定する。また、演算処理部は、測定部によって測定された抵抗値又はインピーダンス値に基づいて、分子を同定する。
【0030】
当該サンプル処理装置は、さらに、ナノ流路を移動してきた分子を取り出すための複数の出力部と、同定された分子を分離する分子分離部と、を備えている。この場合、ナノ流路には、抵抗値又はインピーダンス値を測定する測定部が配置され、ナノ流路は分岐部を介して複数の分岐流路及びその先の出力部へと連結されている。そして、分子分離部は、同定された分子を、ナノ流路から複数の分岐流路のうち所望の分岐流路に誘導する。
【0031】
本発明によるサンプル処理装置は、サンプルに含まれる分子を種類ごとに分離する装置であって、流路デバイスと、測定部と、演算処理部と、分子分離部と、を備えている。そして、流路デバイスは、サンプルを注入するための注入部と、断面の大きさがナノメートルオーダーのサイズを有し、前記サンプルに含まれる分子を移動させるためのナノ流路と、ナノ流路を移動してきた分子を取り出すための複数の出力部と、を含んでいる。さらに、ナノ流路は、分岐部を介して複数の分岐流路及びその先の出力部へと連結されている。測定部は、ナノ流路に設置された電極対の間に電圧を印加し、分子が電極対の間を移動する(横切る)ときの抵抗又はインピーダンスを測定する。また、演算処理部は、測定部によって測定された抵抗値又はインピーダンス値と分子とを関連付ける。そして、分子分離部は、測定された抵抗値又はインピーダンス値と関連付けられた分子を、ナノ流路から複数の分岐流路のうち所望の分岐流路に誘導する。
【0032】
上述のサンプル処理装置において、ナノ流路には複数の電極対が設けられ、当該各電極対は所定の間隔を隔てて配置するようにしても良い。この場合、測定部は、分子が各電極対を通過するときの抵抗又はインピーダンスを測定する。また、演算処理部は、抵抗値又はインピーダンス値の測定時間差に基づいて、分子の移動速度を算出し、算出した分子の移動速度に基づいて電圧を印加(電場を印加する)するタイミングを制御する。
【0033】
さらに、上述の装置において、分子分離部は、ナノ流路側に設けられた電極対又は共通の電極からなる所定電極と、複数の分岐流路側にそれぞれ設けられた複数の出口電極と、所定電極間又はそれと出口電極との間に電圧を印加するための電圧印加部と、i)電極対からなる所定電極又はii)所定電極と1つの出口電極の対又はiii)所定電極と他の出口電極の対又はiv)所定電極と他の出口電極の対又はv)所定電極と他の・・・・・・を選択するためのスイッチング部と、を有している。そして、演算処理部は、同定された分子の情報に基づいて、前記i)、ii)、iii)、iv)、v)のどれかの対を決定し、直流又は交流電圧を印加するように分子分離部を制御する。
【0034】
なお、上述の装置において、流路デバイスは親水性のある絶縁体材料で構成される。この場合、サンプルは、注入部からナノ流路に毛管現象の作用により導入される。別の例として、サンプルに直流又は交流電圧を印加するための誘導用電極対の一方の電極を注入部に配置し、他方の電極をナノ流路に配置するようにしても良い。この場合、誘導用電極対間に電場を生じさせることにより、サンプルが注入部からナノ流路に誘導される。
【0035】
また、上記課題を解決するために、本発明によるサンプル処理装置は、流路デバイスと、直流あるいは交流電源と、測定部と、演算処理部と、を備えている。流路デバイスは、処理対象のサンプルを注入するための注入部と、断面の大きさがナノメートルオーダーのサイズを有し、サンプルに含まれる分子を移動させるためのナノ流路と、を含有している。測定部は、ナノ流路に設置された電極対の電極間に分子があるときに直流あるいは交流電圧を印加して抵抗あるいはインピーダンスを測定する。また、演算処理部は、測定部によって測定された抵抗値あるいはインピーダンス値に基づいて、分子を同定する。注入部の断面の大きさはナノメートルからマイクロメートルオーダーのサイズであることが好ましい。
【0036】
当該サンプル処理装置は、さらに、断面の大きさがナノメートルからマイクロメートルオーダーのサイズを有し、ナノ流路を移動してきた分子を取り出すための複数の出力部と、同定された分子を分離する分子分離部と、を備えている。この場合、ナノ流路は、分岐部を介して複数の分岐流路及びその先の出力部に連結している。そして、分子分離部は、同定された分子を、ナノ流路から複数の分岐流路のうち所望の分岐流路に誘導する。
【0037】
また、本発明による他のサンプル処理装置は、サンプルに含まれる分子を種類ごとに分離する装置であって、流路デバイスと、直流あるいは交流電源と、測定部と、演算処理部と、分子分離部と、を備えている。そして、流路デバイスは、サンプルを注入するための注入部と、断面の大きさがナノメートルオーダーのサイズを有し、サンプルに含まれる分子を移動させるためのナノ流路と、ナノ流路を移動してきた分子を取り出すための複数の出力部と、を含んでいる。ナノ流路は、分岐部を介して複数の分岐流路及びその先の出力部に連結している。測定部は、ナノ流路に設置された電極対の電極間に直流あるいは交流電圧を印加し、電極間に分子があるときの抵抗あるいはインピーダンスを測定する。また、演算処理部は、測定部によって測定された抵抗値あるいはインピーダンス値と分子とを関連付ける。そして、分子分離部は、測定されたインピーダンス値と関連付けられた分子を、ナノ流路から複数の分岐流路のうち所望の分岐流路に誘導する。
【0038】
上述のサンプル処理装置において、ナノ流路には複数の電極対が設けられ、当該各電極対は所定の間隔を隔てて配置するようにしても良い。この場合、測定部は、分子が各電極対を通過するときの抵抗あるいはインピーダンスを測定する。また、演算処理部は、測定されたインピーダンス値の測定時間差に基づいて、分子の移動速度を算出し、算出した分子の移動速度に基づいて電圧を印加する(電場を印加する)タイミングを制御する。
【0039】
さらに、上述の装置において、分子分離部は、ナノ流路側に設けられた電極対又は共通電極からなる所定電極と、複数の分岐流路側にそれぞれ設けられた複数の出口電極と、所定電極の間又はそれと出口電極との間に電圧を印加するための電圧印加部と、i)電極対からなる所定電極又はii)所定電極と1つの出口電極の対又はiii)所定電極と他の出口電極の対又はiv)所定電極と他の出口電極の対又はv)所定電極と他の・・・・・・を選択するためのスイッチング部と、を有している。そして、演算処理部は、同定された分子の情報に基づいて、前記i)、ii)、iii)、iv)、v)・・・・・のどれかの対を決定し、電圧を印加するように分子分離部を制御する。
【0040】
なお、上述の装置において、流路デバイスは親水性のある絶縁体材料で構成される。この場合、サンプルは、注入部からナノ流路に毛管現象の作用により導入される。別の例として、サンプルに電場を印加するための誘導用電極対の一方の電極を注入部に配置し、他方の電極をナノ流路に配置するようにしても良い。この場合、誘導用電極対間に電場を生じさせることにより、サンプルが注入部からナノ流路に誘導される。
【0041】
さらに、本発明によるサンプル処理装置において、交流電源は、ナノ流路に設置された電極対の電極間に、少なくとも周波数を変化させながら交流電圧を印加するものである。
【0042】
一方、測定部は、電極対間に分子を滞留させて、分子の環境を変化させるとともに、交流電源の周波数を変えながら電極間に交流電圧を印加したときのインピーダンスを測定するようにしてもよい。そして、演算処理部は、測定部によって測定されたインピーダンス値に基づいて、分子の構造やその動態を検知する。また、交流電源は、ナノ流路の電極対間に印加すべき電圧値が可変である。このとき、測定部は、交流電源の周波数及び電圧値を変えながらインピーダンスを測定する。演算処理部は、交流電源の周波数及び電圧値を変化させたときのインピーダンス値の変化によって分子の立体構造(conformation)やその動的な変化(動態)を検知する。
【0043】
さらなる本発明の特徴は、以下、本発明を実施するための最良の形態および添付図面によって明らかになるものである。
【発明の効果】
【0044】
本発明によれば、原理的に100%の同定、分離精度を実現することが可能である。少量のサンプルからも従来の手法に比べて短時間に所望の分子を同定又は分離することができる。従って、装置の小型化が可能となる。
【0045】
また、本発明によれば、分子サイズが同じでも異なる種類の分子を同定又は分離でき、生体分子の立体構造やその動的な変化(動態)を検知することができるようになる。
【図面の簡単な説明】
【0046】
【図1A】本発明の実施形態による流路デバイスを上から見た場合の概略構成例(1)を示す図である。
【図1B】本発明の実施形態による流路デバイスを上から見た場合の概略構成例(2)を示す図である。
【図1C】本発明の実施形態による流路デバイスを上から見た場合の概略構成例(3)を示す図である。
【図1D】本発明の実施形態による流路デバイスを上から見た場合の概略構成例(4)を示す図である。
【図1E】本発明の実施形態による流路デバイスを上から見た場合の概略構成例(5)を示す図である。
【図2】第1の実施形態(図1E)による流路デバイスのナノ流路を上から見た場合の詳細構成を示す図である。
【図3】図1Eに示す流路デバイスのAA’における断面を示す図である。
【図4】本発明の第1の実施形態による分子分離装置の回路構成を示すブロック図である。
【図5】本発明の第1及び第2の実施形態の変形例で用いられるサンプル導入部の概略構成を示す図である。
【図6】本発明の第1の実施形態の変形例による分子分離装置の回路構成を示すブロック図である。
【図7】本発明の第1及び第2の実施形態の変形例によるナノ流路の構成を示す図である。
【図8】サイズが15.0kbpのDNAがナノ流路を移動する様子を3.3msの間隔で撮影した図(写真)である。
【図9】サイズが15.0kbpのDNAがナノ流路を移動するときの電流値の変化を示すグラフであり
【図10】各サイズのDNA分子の電流測定値、及び各DNA分子の分離の様子を示す図である。
【図11】3つのDNA溶液の混合液を用いて、各DNA分子を同時に分離する実験の結果を示す図である。
【図12】第2の実施形態による流路デバイスのナノ流路を上から見た場合の詳細構成を示す図である。
【図13】本発明の第2の実施形態による分子分離装置の回路構成を示すブロック図である。
【図14】異なる分子(例えば、生体分子)が流路を移動する場合のインピーダンス値の変化の例を示す図である。
【図15】生体分子(例)と酵素との反応前後における分子の立体構造の動的な変化(動態)を検知する原理を説明するための図である。
【図16】交流電源の周波数を変化させ、それぞれの周波数のときに電圧を掃引したときの実験結果を示す図である。
【図17】本発明の第2の実施形態の変形例による分子分離装置の回路構成を示すブロック図である。
【図18】本発明の流路デバイスの製造工程を説明するための図である。
【図19】矩形流路とV字型流路の形成工程を説明するための図である。
【図20】基板上に形成された異なる電極パターンと得られる電場を示す図である。
【図21】電極パターンを形成する工程を説明するための図である。
【図22】電極パターン上に絶縁膜をコーティングする様子を示す図である。
【図23】矩形流路とV字型流路の特徴を比較説明するための図である。
【図24】実際に作製した流路デバイスを示す図(電子顕微鏡写真)である。
【発明を実施するための形態】
【0047】
本発明は、理想的な条件下では原理的に100%の精度で分子(同一サイズで種類の異なる分子であっても)を同定したり、分離したりすることができ(従来の方法では理想的な条件下でも100%の精度で分子を分離することは不可能であった)、また、分子の立体構造やその動的な変化(動態)を検知することができ、さらに、小型化を可能にする分子分離装置(サンプル処理装置の一例)を提供する。
【0048】
本発明の処理の対象となるサンプルは、水溶性の分子を親水性の溶媒に溶解又は懸濁したものでも良いし、疎水性の分子を疎水性の溶媒(例えば、アセトン、酢酸エチル、酢酸メチル、トルエン等)に溶解又は懸濁させて生成しても良い。この溶媒は、分子をしてナノ流路中を移動させるキャリアー媒体となる。
【0049】
以下、添付図面を参照して本発明の実施形態について説明する。ただし、本実施形態は本発明を実現するための一例に過ぎず、本発明の技術的範囲を限定するものではない。また、各図において共通の構成については同一の参照番号が付されている。
【0050】
I.第1の実施形態
第1の実施形態は、ナノ流路に設置された電極対の電極間に電圧を印加し、電極間に分子が存在するときに流れる電流から抵抗を測定し、その測定された抵抗値に基づいて、分子を同定する分子分離装置に関するものである。
【0051】
<分子分離装置における流路デバイス構成>
図1Eは、本発明の実施形態に係る分子分離装置(サンプル処理装置)で用いられる流路デバイス10の外観構成を示す図である。当該流路デバイス10は、基板上に形成された、サンプルを注入するための部位である注入部11と、分子の同定および分離処理を行う部位であるナノ流路12と、分離された分子を取り出すための部位である出力部13及び14と、を備えている。
【0052】
当該基板は、石英、ガラス、プラスチック、又はセラミック等の絶縁材料で構成することができるが、基板の親水性を利用してサンプルを処理する場合(例えば、毛管現象を利用してサンプルをナノ流路12に導入する場合)には石英やガラスで構成することが重要である。ナノ流路12は細すぎて直接サンプルを出し入れすることが難しいため、よりサイズの大きな流路をナノ流路のインターフェースとして利用することもある。この場合、注入部11、出力部13及び14は、ナノ流路である必要はなくより大きなサイズの流路でもかまわない。注入部11、出力部13及び14に関し、例えば、入出力口は直径1〜3mm、流路の幅は1〜100μm、流路の深さは1〜10μm程度である。さらに、ナノ流路12は、例えば、幅及び深さが共に数nm〜500nmである。なお、各流路の長さは特に制限はないが、装置の大きさを考慮して決定すればよい。
【0053】
図2は、ナノ流路12のより詳細な構成を示す図である。図2に示されるように、ナノ流路12は、複数の分岐流路を連結したナノ流路12と、ナノ流路を通過する分子を同定するための測定用ナノ電極122と、通過するサンプルを流れる電流から抵抗を測定するための測定用電流計123と、ナノ流路の分岐部に設置され、分子を所望の流路に誘導するためのスイッチング用ナノ電極125から構成されている。スイッチング時にサンプルの間を流れる電流から抵抗を測定し、当該分子が本来の流路に導入されているかを確認するための確認用電流計124を設置しても良い。
【0054】
測定用ナノ電極122は、複数ペアの電極で構成されることが好ましい。複数ペア設けることにより、最初の電極ペアで抵抗を測定した分子が下流の電極ペアに到達するまでの時間を測定し、ナノ流路を流れる分子の流速を検知することが可能となる。そして、この流速を基に、スイッチング用ナノ電極125に到達するまでの時間を演算することができ、各分子を適切に所望の流路に分離することができるように構成されている。ナノ流路12の分岐部分に設置されているスイッチング用ナノ電極125は、共通電極と、各出口流路に設けられた出口電極とを備え、各出口電極と共通電極との間に、所定の電圧を印加(電場換算で例えば、数MHz、数MV/m程度の電場)することにより、各分子を所望の分岐流路に誘導できる(スイッチON)ようになっている。
【0055】
図3は、流路デバイス10(図1E)のAA’(測定用ナノ電極が設けられた部分)における断面図である。流路デバイス10は、基板101にナノ流路12(実際は電極の厚さよりも浅い)を形成し、その上に測定用ナノ電極122やスイッチング用ナノ電極125を配置する。そして、接着部材16を用いてガラス板15と基板101とを接着する。なお、接着部材16としては、例えばPDMS(Polidimethylsiloxane)を用い、これをSiO2化させる。これにより、ナノ流路12の深さよりも厚い電極を覆いつつ基板に接着させることができるようになる。
【0056】
<分子分離装置の回路構成>
図4は、本発明の第1の実施形態による分子分離装置の回路構成を示すブロック図である。当該分子分離装置は、各構成要素からの情報を取得し所定の演算を行い、必要に応じて各構成要素を制御するための演算処理部40と、測定用ナノ電極122と、測定用電流計123と、電極122に電圧を印加する電源(図示せず)とを有する測定部41と、スイッチング用ナノ電極125と、確認用電流計124と、各電極と共通電極間に電圧を印加する電圧印加部(図示せず)とを有するスイッチング部42と、各種分子を含むサンプルに電圧を印加した場合の抵抗値と各種分子との対応関係を示す抵抗値‐分子対応テーブル43と、メモリ44と、ユーザが所定の指示等を入力し、分離処理の結果等を出力(表示)する情報入力/出力部45と、を備えている。
【0057】
演算処理部40は、測定部41からナノ流路12を分子が通過したときの抵抗値を取得し、この抵抗値と抵抗値‐分子対応テーブル43とを照合し、当該通過した分子の種類を同定する(測定した抵抗値はメモリ44に一時的に格納される)。サンプルに含まれる分子が未知の場合には測定抵抗値がテーブル43内にはないので、それぞれ測定した抵抗値をメモリ44に格納し、分子の種類が未知のまま分離することになる。ただし、以下の説明では電流計で電流値が計測されるため、抵抗値を測定するには、測定部41やスイッチング部42が印加電圧と電流値から抵抗値を算出する必要があることに注意すべきである。
【0058】
また、演算処理部40は、測定部41に含まれる測定用ナノ電極122の複数の電極対間を通過する分子の時間を計測し、その時間と電極対間の距離から当該分子の流速を演算する。そして、演算処理部40は、例えば測定用ナノ電極122の最後の電極対からスイッチング用ナノ電極125までの距離と演算した流速から、スイッチング用ナノ電極のどの出口電極と共通電極との間に電圧(電場)を印加するか、及び印加のタイミングをスイッチング部42に指示する。その指示に従って、スイッチング部42において、分子が所望の分岐流路に引き込まれるようになっており、分子の分離が実現できるようになっている。
【0059】
なお、スイッチング部42は、確認用電流計124によって分子が通過したときの抵抗を測定し、その測定値を演算処理部40に供給する。そして、演算処理部40は、その抵抗値と測定部41で測定した抵抗値を比較し、分離する分子の種類にエラーが無いか確認することができるようにしても良い。
【0060】
<分子分離装置の動作>
(1)サンプル注入及び流れ制御
まず、注入部11にサンプルが導入される。当該サンプルは、既知の分子や未知の分子を含んでいる。当該分子分離装置によれば、サンプルが既知の分子のみを含む場合には分子の種類ごとに分子を分類することができ、一方、サンプルが未知の分子を含む場合には分子の種類が未知のまま測定される抵抗値が同じ値を示す分子として分類することができるようになる。
【0061】
流路デバイス10は、基板101が石英又はガラスなどで構成されているので、流路の壁面が親水性を有している。そのため、サンプルは、毛管現象によって自動的に注入部11→ナノ流路12→出力部13及び14(出口側)へと吸い込まれていく。そして、出口部分から出てくる液量は極微量であるため、瞬間的に流れ出た全てのキャリアー媒体が蒸発する。そのため、蒸発で失われた液体を補うために毛細管現象でサンプルが自発的に流れ続け、一定量の流れがナノ流路12内で生じることになる。また、蒸発するのはキャリアー媒体だけなので、分子は濃縮されて分離回収される。その結果、後工程で分子を分析する場合、好都合である。これも重要な利点である。例え、回収しても、濃度が低いと従来のアッセイ分析の感度が低いので分析できない。
【0062】
また、流路デバイス10の全体あるいは一部分を冷却することによって、流速をある程度制御することができる。例えば、室温付近では、サンプルがナノ流路12から出力部13及び14にさしかかる部分で全て蒸発する。よって、この蒸発を防ぐために流路デバイス10の全体あるいは一部を冷却すると、サンプルは出口まで流れる。なお、冷却する温度は4〜25℃(室温)程度でよい。
【0063】
ここでは、毛管現象を利用してサンプルをナノ流路12に導入しているが、これに限られるものではなく、後述のように(変形例)、電気的な制御によってサンプルをナノ流路に導入することができる。
【0064】
(2)単一分子の検知
ナノ流路12のナノ流路12の幅はナノメートル単位のサイズであるため、サンプルに含まれる各分子が単一分子の形でナノ流路12を移動する。
【0065】
本発明の第1の実施形態による分子分離装置では、測定部41は、電流計123を用いて測定用ナノ電極122で電極対の間を流れる電流から抵抗値を測定している。分子が当該測定用ナノ電極122を通過すると、抵抗は変化する。また、分子(例えば分子サイズ)が異なれば、抵抗も異なっている。この性質を利用して分子を同定することが可能となる。
【0066】
演算処理部40は、この測定した抵抗値を測定部41から取得し、メモリ44に格納すると共に、当該取得した抵抗値と抵抗値‐分子対応テーブル43とを照合する。そして、演算処理部40は、取得した抵抗値に対応する分子がテーブル43に含まれていれば分子を同定して分離処理を継続し、含まれていなければ分子を同定しないまま分離処理を継続することになる。
【0067】
測定用ナノ電極122が複数ペアの電極で構成されている場合、演算処理部40は、各電極ペア間に生じる抵抗値の時間遅れから、ナノ流路12(の電極配置箇所)における移動速度(流速)を算出し、さらに、該当する分子が何秒後にナノ流路12の分岐部に到達するか算出する。このようにすることにより、特定の分子について逐一移動速度を算出することができるようになっているので、移動速度が未知の分子であっても適切に分離処理を実行することが可能となる。なお、本実施形態では、測定用ナノ電極122を複数ペアの電極で構成するようにしたが、移動速度が既知の分子であれば複数ペアの電極を設ける必要がなく、1対の電極を設置すれば足りる。
【0068】
(3)スイッチング
上述したように、分離の対象となっている分子がナノ流路12の分岐部に到達するタイミングが分かる。従って、このタイミングで、分子の種類又はその電流値に対応して、演算処理部40は、スイッチング用ナノ電極125の共通電極と、当該対象の分子を誘導すべき流路側の出口電極との間に電場を印加する。すると、ナノ流路から誘導すべき流路である分岐流路の方向に誘電泳動、電気泳動、電気浸透流(Electroosmotic flow)の何れかが働き、分子が当該分岐流路に誘導される。
【0069】
なお、本実施形態では、流路デバイス10がナノ流路とそこから分岐する2つの分岐流路を有している例が示されているが、これに限られたものではなく、分岐流路の数は分離すべき分子の種類数分設けることができるのはもちろんのことである。また、ナノ流路から複数の分岐(分岐流路)を持たせる方法としては、1つのナノ流路から同時に複数股の分岐流路を設けて分岐させても良いし、二股構成をカスケード状につなげて最終的に複数股に分岐させるような構成でも良く、分岐流路の構成は限定しない。
【0070】
<変形例>
(1)サンプル導入
(i)上述の実施形態では、毛管現象を利用してサンプルをマイクロ流路からナノ流路に導入しているが、ここでは電気的な制御によりサンプルをナノ流路に導入する手段を説明する。このように電気的な制御によってサンプル導入を実現すれば、高精度の流れ制御から測定精度や分離精度を向上することができ、さらに流路デバイス10の基板101が親水性である必要がなくなり、プラスチックやセラミックのような材料でも構成することが可能となる。
【0071】
図5は、変形例によるサンプル導入部51の構成を示す図である。サンプル導入部51は、サンプルに電場を印加するための電極対511及び512と、電源513と、を有する。ただし、電極511は注入部11側に、電極512はナノ流路12側に設けられている。
【0072】
ここでは分子は帯電しているので、マイナスに帯電している分子については、図5に示される方向に電場を印加すると、各分子はナノ流路12の方向に引き込まれる。一方、プラスに帯電しているサンプルについては、逆の方向に電場を印加すれば良い。このように、サンプルがどちらに帯電しているかによって電場を印加する方向を切り替えてサンプルの分子をナノ流路12に導入することができる。
【0073】
図6は、当該変形例による分子分離装置の回路構成を示すブロック図であり、図4との差は、サンプル導入部51を有していることのみである。サンプル導入部51の電極に印加する電圧(印加方向及び電圧値等)は、情報入力/出力部45から入力された指示に従い、演算処理部40によって制御される。
【0074】
(ii)また、電気浸透流を利用してサンプルを導入することも可能である。この場合、流路デバイス10の基板101の材料としてはガラスなどの親水性材料を用いるのが好ましい。ガラスはマイナスに帯電しているため、サンプル中のプラスイオンがガラスのマイナス電荷に引っ張られ、電気二重層が形成される。ここに電圧を印加すると、サンプル中の荷電部分が動き、これに引かれてサンプル全体が流れ出す。これが電気浸透流を用いたサンプル導入の原理である。なお、電気浸透流の場合、表面の帯電は正負どちらでも良い。
【0075】
(2)ナノ流路の構成(分子測定箇所)
図7は、流路デバイス10におけるナノ流路12の測定用ナノ電極122が配置される箇所の別の構成例を示す図である。上述したように、測定用ナノ電極122を用いて、ナノ流路を流れる分子を検知し、その移動速度を複数の電極対における電流値計測タイミングの違いによって算出しているが、より適切に分子を同定できるようにするために、抵抗測定箇所のナノ流路の幅をその箇所以外の幅に比べて狭く設定する。このようにすると、分子による電流変化分は、分子の体積/電極間の体積比に比例するため、電極間の体積が減ることによって体積比が大きくなる。その結果、分子による電流変化分が大きくなるため高感度な抵抗測定に繋がると言える。
【0076】
<実験について>
第1の実施形態で説明した原理及び動作に基づいて行った実験について説明し、本発明の有効性を示す。
【0077】
(1)ナノ流路の仕様
全体の長さが150μm、深さが50〜100nm、幅が50〜500nmの構造を有するナノ流路を用いて実験した。
【0078】
(2)使用サンプル
サイズが15.0kbp(kilo base pairs)、33.5kbp、48.5kbpの3種類のDNAについてそれぞれDNA溶液(サンプル)を作製し、実験に用いた。各サンプルの濃度は、0.1×TBE緩衝液中1fMとなるように調整した。なお、計算上の見掛けの各DNAの長さの予測値は、15.0kbpのDNAは1.1μm、33.5kbpのDNAは2.4μm、48.5kbpのDNAは3.6μmであった。
【0079】
(3)測定用ナノ電極への印加電圧
0.1V
(4)実験内容
(i)各サンプルをナノ流路に独立して導入し、i)流速度を測定し、ii)DNAの1分子を同定し、iii)各DNAに対応させた、流路の適切な出力部への誘導を実行した(実験結果については図8乃至10参照)。
(ii)各サンプルを混合した新しいサンプルから、各DNAに分離できるか実験した(実験結果については図11参照)。
【0080】
(5)実験結果
(i)図8は、サイズが15.0kbpのDNA分子がナノ流路を移動する様子を3.3msの間隔で撮影した図(写真)である。なお、ナノ流路は電極の幅(1μm)に比べて極小なので図面上では不可視であるが、白い垂直線はナノ流路を移動するDNAの位置を示している。
【0081】
図9は、サイズが15.0kbpのDNA分子がナノ流路を移動するときの電流値の変化を示すグラフであり、図9(a)はサンプルを所定時間流し続けたときの電流値の変化を示し、図9(b)は図9(a)中の点線で囲まれた部分の拡大図である。
【0082】
図9(a)において、電流値に大きな変化がある部分(電流が極小となる部分)が見られるが、この部分はDNAがナノ流路の電極部分を通過中であって、DNAによって電流の流れが遮られるため電流値に大きな変化が生じるのである。従って、図9(b)に示されるように、図8(a)の状態では、DNA分子はまだ電極部に差し掛かってないため、電流値の変化はノイズ分のみ(背景の電流値は約1pAであった)となっているが、図8(b)の状態では、DNAが電極部を通過中で電極間の電流を完全に遮っているので測定される電流値が極小となっている。上述したように、この電流値から抵抗値を求めて分子を同定したり、分子を分離することができるようになる。また、図8(c)及び(d)で示されるように、DNAと電極との重複部分が少なくなれば、電流値も図8(a)の状態に戻っていくのが分かる。
【0083】
図10は、各サイズのDNAの電流測定値、及び各DNAの分離の様子を示す図である。ここでは、三股の分岐流路を有するナノ流路において、15.0kbpサイズのDNAは左の分岐流路に誘導され(図10A参照)、33.5kbpサイズのDNAは中央の分岐流路に誘導され(図10B参照)、48.5kbpサイズのDNAは右の分岐流路に誘導される(図10C)ように制御した。
【0084】
図10の各グラフから分かるように、各DNAが電極部を通過する際には、各DNA特有の電流値の変化を示している。そして、これら分子特有の電流値の変化に基づいて抵抗値を求め、ナノ流路の分岐部においてスイッチング動作を実行することにより、所望の分子を所望の分岐流路に誘導できることが分かる。
【0085】
(ii)続いて、上記3つのDNAの混合液を用いて、各DNA分子を同時に分離する実験を行った。図11は当該混合液の分離実験の結果を示す図であり、図11(A)は各DNA分子の蛍光発光強度を示し、図11(B)は分離前後の各DNA分子の蛍光発光強度を示している。
【0086】
本実験では、各DNA分子について6000個の分子(1fMの溶液に含まれる分子数)を用意したが、時間の制約等の問題から全ての分子をカウントすることなく、最大100個の分子のみをカウントして実験を終了した。
【0087】
図11(B)からも分かるように、分離前後の各DNA分子の蛍光発光強度はほぼ一致しており、よって、本発明の分子分離装置を用いた分離処理が適切に行われたと言える。
【0088】
II.第2の実施形態
第2の実施形態は、ナノ流路に設置された電極対の電極間に分子があるときに交流電圧を印加してインピーダンスを測定し、測定されたインピーダンス値に基づいて、分子を同定する分子分離装置に関するものである。
【0089】
<分子分離装置における流路デバイス構成>
第2の実施形態で用いられる流路デバイス10の外観構成、及び流路デバイス10のAA’(測定用ナノ電極が設けられた部分)における断面構成は、第1の実施形態(図1E及び3参照)と同じなので、説明を省略する。
【0090】
図12は、第2の実施形態によるナノ流路12のより詳細な構成を示す図である。なお、図2と同じ構成には同じ参照番号は付されている。
【0091】
図12に示されるように、ナノ流路12は、複数の分岐を有するナノ流路12と、分岐前のナノ流路を通過する分子に交流電圧を印加するための測定用ナノ電極122と、測定用ナノ電極122間の分子のインピーダンスを測定するための測定部223と、ナノ流路の分岐部に設置され、分子を所望の分岐流路に誘導するためのスイッチング用ナノ電極125と、スイッチング時に分子のインピーダンスを測定し、当該分子が本来の分岐流路に誘導されているかを確認するための確認用電流計224を設置しても良い。なお、誘電率を分極率(分子1個の分極率はその内部構造の局所的な分極率の総和であり、誘電率と等価である)と表現しても差し支えない。要は、交流電圧を電極間に印加した際の位相ずれ(遅れ又は進み)を誘電率又は分極率として測定する。
【0092】
測定用ナノ電極122は、複数対の電極で構成されることが好ましい。複数対設けることにより、最初の電極対でインピーダンスを測定した分子が下流の電極対に到達するまでの時間を測定し、ナノ流路を流れる分子の流速を検知することが可能となる。そして、この流速を基に、スイッチング用ナノ電極125に到達するまでの時間を演算することができ、各分子を適切に所望の流路に誘導することができるように構成されている。ナノ流路12の分岐部分に設置されているスイッチング用ナノ電極125は、共通電極と、各出口流路に設けられた出口電極とを備え、各出口電極と共通電極との間に、所定の電圧を印加(電場の場合:例えば、数MHz、数MV/m程度の電場)を印加することにより、各分子を所望の流路に誘導する(スイッチON)ようになっている。
【0093】
<分子分離装置の回路構成>
図13は、本発明の第2の実施形態による分子分離装置の回路構成を示すブロック図である。当該分子分離装置は、各構成要素からの情報を取得し所定の演算を行い、必要に応じて各構成要素を制御するための演算処理部90と、測定用ナノ電極122と、インピーダンス測定部223とを有する測定部91と、測定部91内の測定用ナノ電極122に交流電圧を印加するための電圧・周波数可変交流電源96と、スイッチング用ナノ電極125と、確認用電流計224と、各電極と共通電極間に電圧を印加する電圧印加部(図示せず)とを有するスイッチング部92と、測定用ナノ電極122間に存在する各種分子を含むサンプルに電圧を印加した場合のインピーダンス値と各種分子との対応関係を示すインピーダンス‐分子対応テーブル93と、メモリ44と、ユーザが所定の指示等を入力し、分離処理の結果等を出力(表示)する情報入力/出力部95と、を備えている。
【0094】
演算処理部90は、測定部91からナノ流路12を分子が通過したときの抵抗値又はインピーダンス値を取得し、このインピーダンス値とインピーダンス値‐分子対応テーブル93とを照合し、当該通過した分子の種類を同定する(測定した抵抗値又はインピーダンス値はメモリ94に一時的に格納される)。サンプルに含まれる分子が未知の場合には測定抵抗値又はインピーダンス値がテーブル93内にはないので、それぞれ測定したインピーダンス値をメモリ94に格納し、インピーダンス値に従って分子の種類が未知のまま分離することになる。
【0095】
また、演算処理部90は、測定部91に含まれる測定用ナノ電極122の複数の電極対間を通過する分子の時間を計測し、その時間と電極対間の距離から当該分子の流速を演算する。そして、演算処理部90は、例えば測定用ナノ電極122の最後の電極対からスイッチング用ナノ電極125までの距離と演算した流速から、スイッチング用ナノ電極のどの出口電極と共通電極との間に電圧を印加するか、及び印加のタイミングをスイッチング部92に指示する。その指示に従って、スイッチング部92において、分子が所望の分岐流路に誘導されるようになっており、分子の分離が実現できるようになっている。
【0096】
なお、スイッチング部92は、確認用電流計224によって分子が通過したときのインピーダンスを測定し、その測定値を演算処理部90に供給する。そして、演算処理部90は、そのインピーダンス値と測定部91で測定したインピーダンス値を比較し、分離する分子の種類にエラーが無いか確認することができるようにしても良い。
【0097】
<分子分離装置の動作>
(1)サンプル注入及び流れ制御
まず、ユーザによって注入部11にサンプルが滴下される。当該サンプルは、既知の分子や未知の分子を含んでいる。当該分子分離装置によれば、サンプルが既知の分子のみを含む場合には分子の種類ごとに分子を分離することができ、一方、サンプルが未知の分子を含む場合には分子の種類が未知のまま測定されるインピーダンス値が同じ値を示す分子として分離することができるようになる。
【0098】
流路デバイス10は、基板101の全面が石英又はガラスなどで構成され、流路の壁面が親水性を有している。そのため、サンプルは、毛管現象によって自動的に注入部11→ナノ流路12→出力部13及び14(出口側)へと吸い込まれていく。そして、出口部分から出てくる液量は極微量であるため、瞬間的に流れ出た全てのキャリアー媒体が蒸発する。そのため、蒸発で失われた液体を補うために毛細管現象でサンプルが自発的に流れ続け、一定量の流れがナノ流路12内で生じることになる。
【0099】
また、流路デバイス10の全体あるいは一部分を冷却することによって、流速をある程度制御することができる。例えば、室温付近では、サンプルがナノ流路12から出力部13及び14にさしかかる部分で全て蒸発する。よって、この蒸発を防ぐために流路デバイス10の全体あるいは一部を冷却すると、サンプルは出口まで流れる。なお、冷却する温度は4〜25℃(室温)程度でよい。
【0100】
ここでは、毛管現象を利用してサンプルをナノ流路12に導入しているが、これに限られるものではなく、後述のように(変形例)、電気的な制御によってサンプルをナノ流路に導入することができる。
【0101】
(2)単一分子の検知
ナノ流路12の幅はナノメートル単位のサイズであるため、サンプルを構成する各分子が単一分子でナノ流路12を移動する。
【0102】
本発明による分子分離装置では、測定部91は、電流計223を用いて測定用ナノ電極122で電極対の間を流れる電流からインピーダンスを測定している。分子が当該測定用ナノ電極122を通過すると、インピーダンスは変化する。サイズが同一でも分子の種類が異なれば、インピーダンスは異なっている。この性質を利用して分子を同定することが可能となる。
【0103】
演算処理部90は、この測定したインピーダンス値を測定部91から取得し、メモリ94に格納すると共に、当該取得したインピーダンス値とインピーダンス‐分子対応テーブル93とを照合する。そして、演算処理部90は、取得したインピーダンス値に対応する分子がテーブル93に含まれていれば分子を同定して分離処理を継続し、含まれていなければ分子を同定しないまま分離処理を継続することになる。
【0104】
図14は、異なる分子(例えば、生体分子)が流路を移動する場合のインピーダンス値の変化の例を示す図である。図14に示されるように、例えば、生体分子B1が測定用ナノ電極122間にあるときの周波数変化に対するインピーダンス値変化の特性がP1で表され、生体分子B2が測定用ナノ電極122間にあるときの周波数変化に対するインピーダンス値変化の特性がP2で表されるものとする。この周波数変化は、電圧・周波数可変交流電源の周波数を所定範囲内で掃引させることを意味する。つまり、生体分子B1に関して、測定用ナノ電極122間に滞留させ、交流電源の周波数を変化させると、その周波数変化に対応して測定されるインピーダンス値も変化する。この変化特性をグラフで表したものがP1である。生体分子B2に関しても同様である。
【0105】
ここで、生体分子B1及びB2の分子サイズはほぼ同一であった場合、直流電流を測定用ナノ電極122間に流して測定された抵抗値の変化は両者において変らない。これでは、種類の異なる分子がほぼ同一サイズであると、分子を同定又は分離することはできなくなってしまう。この点、生体分子の代表格であるタンパク質は、元々は20種類のアミノ酸が数珠つなぎになった1本の紐状分子から構成されており(これをポリペプチドと呼ぶ)、アミノ酸同士の相互作用により自発的に規則正しく折りたたまれて(フォールディングと呼ぶ)3次元の立体構造を構成している。当然、その内部構造や全体の構造は個々の分子で異なっている。このような生体分子に外部から交流電場を印加すると、内部の局所的な構造が外部電場に引かれて分極するわけであるが、例えば周波数によって外部電場に追随して分極するところや分極が追随出来ずに遅れ(位相差)が生ずる部分が発生し、そうした局所的な内部の分極の総和として、分子全体の分極率が決定される。こうした単一分子が持つ分極特性(分極率)を電気インピーダンス測定によって測定すると、個々の分子を区別出来るようになる。そこで、本発明では、測定用ナノ電極122間に分子が存在する場合、そのサイズが同一でも種類が異なれば、インピーダンス変化が異なることに着目し、この性質を利用して分子を同定又は分離するようにしている。
【0106】
例えば、同定又は分離すべき複数の分子の種類が予め分かっている場合には、分子に固有の周波数を用いて、その周波数でのインピーダンス値を測定し、そのインピーダンス値に対応する分子をインピーダンス−分子対応テーブル43に基づいて同定すればよい。一方、同定又は分離すべき複数の分子の種類が予め分かっていない場合には、まずは1分子ずつ測定用ナノ電極122に滞留させ、交流電源における周波数を掃引させて当該分子のインピーダンス値変化特性Pk(k=1、2、・・・、n)を取得する。そして、それぞれの特性に応じて、分子を分離して、同種類の分子を所定の出力部に誘導する。
【0107】
なお、インピーダンスの検知感度が不十分である場合などには、同定又は分離すべき分子に、例えばフェロセンなどを含む導電性分子をラベルするようにしても良い。これにより、誘電率や導電率の違いを強調することができるので、インピーダンスの検知感度を高くすることが可能となる。
【0108】
また、測定用ナノ電極122が複数ペアの電極で構成されている場合、演算処理部40は、各電極ペア間に生じるインピーダンス変化の時間遅れから、ナノ流路12(の電極配置箇所)における移動速度(流速)を算出し、さらに、該当する分子が何秒後にナノ流路12の分岐部に到達するか算出する。このようにすることにより、特定の分子について逐一移動速度を算出することができるようになっているので、移動速度が未知の分子であっても適切に分離処理を実行することが可能となる。なお、本実施形態では、測定用ナノ電極122を複数ペアの電極で構成するようにしたが、移動速度が既知の分子であれば複数ペアの電極を設ける必要がなく、1対の電極を設置すれば足りる。
【0109】
(3)スイッチング
上述したように、分離の対象となっている分子がナノ流路12の分岐部に到達するタイミングが分かる。従って、このタイミングで、分子の種類又はそのインピーダンス値に対応して、演算処理部90は、スイッチング用ナノ電極125の共通電極と、当該対象の分子を誘導すべき流路側の出口電極との間に電場を印加する。すると、ナノ流路から誘導すべき流路である分岐流路の方向に誘電泳動、電気泳動、電気浸透流の何れかが働き、分子が当該分岐流路に誘導される。
【0110】
なお、本実施形態では、流路デバイス10が分岐流路とそこから分岐する2つの分岐流路を有している例が示されているが、これに限られたものではなく、分岐流路の数は分離すべき分子の種類数分設けることができるのはもちろんのことである。また、ナノ流路から複数の分岐(分岐流路)を持たせる方法としては、1つの分岐流路から同時に複数股の分岐流路を設けて分岐させても良いし、二股構成をカスケード状につなげて最終的に複数股に分岐させるような構成でも良く、分岐流路の構成は限定しない。
【0111】
(4)単一分子の立体構造の電気的動態測定
本発明の第2の実施形態による分子分離装置によれば、上述((2)及び(3))したように、異なる分子を同定又は分離することができるだけでなく、単一分子の立体構造やその動態を測定することができる。以下、単一分子の立体構造の電気的動態測定処理について説明する。
【0112】
(i)電気的動態測定の必要性について
生体分子の機能はその分子構造に由来するというのが構造生物学の基本概念であり、したがって分子構造を知ることは、その機能を理解するための最短路となる。ただし、例え膨大な労力を費やして結晶解析やNMRなどによって複雑な静的、準静的構造が決定されたとしても、生体分子の機能の本質である環境変化(反応基質濃度、pH、温度、イオン濃度等々)に伴う動的な構造変化を捉えることが出来なくては生体分子の構造と機能を理解したことにはならない。今後の分子生物学や構造生物学の発展と、プロテオーム解析や創薬などにおける大規模なタンパク質の機能解析への応用、さらには生体分子のような分子機械を人為的にデザインして創造したりするようなナノバイオテクノロジーへの応用を考えるに、生体分子の立体構造(conformation)やその動的な変化(動態)を検知する手法と、それを応用した生体分子の機能解析や同定手法の開発は必至と考えられる。
【0113】
本発明はこのような分子の動態検知における基礎研究から応用までの幅広い有効性に鑑み、電気的な生体分子の構造測定法を提供するものである。
【0114】
(ii)従来の手法及びその問題点
従来、生体分子を解析する場合には、X線回折やNMRなどの解析手法を用いており、これらにおいては分子を溶液や結晶の状態で取り扱っている。このように生体分子を懸濁液又は溶液のような多分子系で扱うと、個々の分子で起こっている反応とそれに伴う構造変化や時間応答などの情報が多分子間のランダムな動きの平均化によって失われてしまう。一方、結晶化させれば規則正しく配列している結晶の周期性を利用して静的な立体構造を得ることが出来る反面、生理的環境から逸脱してしまうため肝心の立体構造の変化といった動態に関する情報が失われてしまう。すなわち、構造解析の分解能を上げると動態に関する情報が得られず、動態の情報を得ようとすると分解能が上がらないというジレンマが、従来のX線回折やNMRなどの解析手法にはある。
【0115】
これに対して、もし1分子のみに注目した操作や分析が出来るのであれば、個々の分子における反応の素過程で分子の構造変化とその時間応答といった分子構造のダイナミクスに関する情報を得ることが出来るであろうと考えられる。ところで、従来の1分子測定系においては、その分析手法のほとんどは蛍光色素を利用した光学的な検知に限られている。例えば蛍光標識することでモータータンパク質のような「動く」タンパク質の動きを可視化したり、FRETと呼ばれる手法では2つの蛍光色素間のエネルギー移動を利用して局所的な構造変化を検知する、などである。このような手法は、極めて膨大な時間と手間を費やしてようやく1分子の一カ所のみを測定出来るため極めて汎用性に乏しいため、一般的な解析手法とはならないのが実情である。つまり、まずX線回折で立体構造を知り、かつ電気泳動や質量解析でアミノ酸の1次配列情報を得る必要がある。そして、特定のアミノ酸の部位にのみ蛍光色素が結合するような遺伝子操作をし、観察用のテスト分子を作らなくてはならない。このようにテスト分子自体を人工的に作らなくてはならなく、自然界の分子をそのまま使うことが出来ない。
【0116】
本発明の実施形態による分子分離装置によれば、自然界の分子をそのまま用いて分子の立体構造(conformation)やその動的な変化(動態)を簡単に測定することができるようになる。装置構成は上述したものと同一であるが、測定の方法が異なる。以下、当該測定方法について説明する。
【0117】
(iii)生体分子の動態変化の測定の原理について
図15は、例えば生体分子と酵素との反応前後における分子の構造やその動態を検知する原理を説明するための図である。図15において、C1は反応前の生体分子の構造を模式的に示し、C2は反応中若しくは反応後の生体分子の構造を模式的に示している。また、特性P3は、測定用ナノ電極122間にある生体分子がC1構造を採るときに、当該電極間に交流電圧を印加し、周波数をある範囲で掃引させたときのインピーダンス特性を示す。同様に、特性P4は、測定用ナノ電極122間にある同一の生体分子がC2構造を採るときに、当該電極間に交流電圧を印加し、周波数をある範囲で掃引させたときのインピーダンス特性を示す。このように、単一分子であっても構造に変化が起こると、測定されるインピーダンス値に変化が生じる。この性質を利用して、分子の構造やその動態をリアルタイムに検知することができるようになる。
【0118】
ところで、誘電泳動力は、誘電体(ここでは生体分子)に外部電場を加えた際に生ずる誘電体内の双極子の配向や周囲溶液のカウンターイオン等によって分子表面に誘起される分極電荷が外部電場と相互作用することにより得られる効果である。すなわち、十分な外部電場強度があればわずか1分子に誘起した分極電荷を利用して分子を動かせるのであれば、逆に分子の立体構造(conformation)の変化に起因するような分極率変化を電気インピーダンス測定から検知できる。さらには、誘電泳動力で強制的に分子に分極を誘起しつつ、あるいは分子の立体構造(conformation)自体を変形させつつ測定することで、例えば、タンパク質の高次構造を壊して1次構造である1本のポリペプチド鎖に戻しながらその電気インピーダンスを測定するなどして、分子の同定やその構造のダイナミクスを分析する全く新規な測定法が考えられる。
【0119】
(iv)生体分子の立体構造を電気的に制御しながらの立体構造測定の実施例
単一分子の構造の動態測定に当たっては、まず、例えば、DNAなどの生体分子を溶解したサンプルを用意する。
【0120】
次に、このサンプルを、分子分離装置における流路デバイス10の注入部10に注入し、当該DNAを1分子ずつナノ流路12の測定用ナノ電極122まで導入する。そして、当該DNA分子を測定用ナノ電極122の間に滞留させる。
【0121】
続いて、交流電源の電圧値(電場強度)を所定の値に固定し、周波数を一定範囲内で掃引したときのインピーダンスを測定する。また、上記電圧値を別の値(最初の値より大きい値)に固定し、同様に周波数を掃引してインピーダンスを測定する。このように、交流電源の電圧値を徐々に変化させ、それぞれの電圧値のときに周波数を掃引させる。DNAの分極率(誘電率)の周波数依存性を利用すると、特定の電場強度以上、かつ特定の周波数で誘電泳動力が効果的に働き、DNAがランダムコイルから直線的に引き延ばされる(図16(a)及び(b)参照:ただし、図16の実験系では、観察を容易にするため、電極間のギャップはマイクロオーダーとなっている)。これにより、誘電泳動力で強制的に分子に分極を誘起しつつ、あるいは立体構造(conformation)自体を変形させつつ測定することができるようになる。
【0122】
例えば、図16(c)で示されるように、電場強度が3MV/m、周波数が1kHz以上の場合にDNAがランダムコイルから直線的に引き延ばされることによってインピーダンスに顕著な変化が生じる。逆に、このインピーダンス値の変化が検知されると、DNAがランダムコイルから直線的DNAに構造が変化したことが判る。
【0123】
ここでは、誘電泳動力によって起こる構造変化について述べているが、これに限られず、pH変化、温度変化、イオン濃度変化、酵素反応などによって起こる構造変化についても同様に検知(測定)することができる。
【0124】
(v)ナノ流路を用いることによる顕著な効果
幅が大きい(マイクロオーダー以上)流路を用いる場合、数分子といった極微量のサンプルの測定では、周囲の水分子の数に対する測定対象の分子数が小さくなりS/Nが低下してしまう。また、液中の測定の場合、測定感度の向上のために高電圧(図中ではMV/mも印加している)を印加すると電極反応により電極が分解してしまうという問題がある。
【0125】
しかし、ナノ流路を用いれば、これらの問題を解決することができる。すなわち、ナノ流路のように測定空間を大幅に小さくすることで、測定対象となる単一分子周囲の水分子数を制限することが出来る。これによってターゲット分子の周囲を取り巻く水分子の熱運動による熱ノイズを抑制し、マクロな測定系では達成不可能な高感度化が可能となる。しかも体積が少ないため、濃度の観点からは実は1分子なのに濃度が高くなる。
【0126】
また、ギャップ長がナノメートルオーダーの電極系では、電極−溶液界面の電気2重層がオーバーラップして実質的に無視出来るようになるため、特に低周波領域での超高感度化が可能となる。通常、固−液界面には必ず電気二重層が発生し、電気測定ではこれがキャパシタンス成分として含まれてしまい測定の精度を下げるが、ナノメートルサイズ系ではこれが無くなるため絶対精度が向上する。
【0127】
さらに、電場強度は電極間隔に比例する(電場強度V=印加電圧E/ギャップ長d)ため、ギャップ長が短ければ短いほど同じ印加電圧で高電場を得ることができる。従って、ナノギャップ電極は電極間隔が極端に短いので、電気分解が生じない電圧で上述のMV/mの電場強度を得ることが出来る。
【0128】
<変形例>
(1)サンプル導入部、及びそれを有する分子分離装置の構成
(i)サンプル導入の変形例については、第1の実施形態と同じ構成(図5参照)を適用することが可能であるので、その説明は省略する。
【0129】
図17は、当該変形例による分子分離装置の回路構成を示すブロック図であり、図13との差は、サンプル導入部51を有していることのみである。サンプル導入部51の電極に印加する電圧(印加方向及び電圧値等)は、情報入力/出力部95から入力された指示に従い、演算処理部90によって制御される。
【0130】
(ii)また、電気浸透流を利用してサンプルを導入することも可能である。この場合、流路デバイス10の基板101の材料としてはガラスなどの親水性材料を用いるのが好ましい。ガラスはマイナスに帯電しているため、サンプル中のプラスイオンがガラスのマイナス電荷に引っ張られ、電気二重層が形成される。ここに電圧を書けると、サンプル中の荷電部分が動き、これに引かれてサンプル全体が流れ出す。これが電気浸透流を用いたサンプル導入の原理である。なお、電気浸透流の場合、表面の帯電は正負どちらでも良い。
【0131】
(2)ナノ流路の構成(分子検知箇所)
第1の実施形態による、流路デバイス10におけるナノ流路12の測定用ナノ電極122が配置される箇所の別の構成例(図7参照)は、第2の実施形態にも適用可能である。
【0132】
上述したように、第2の実施形態では、測定用ナノ電極122を用いて、ナノ流路を流れる分子を検知し、その移動速度を複数の電極対におけるインピーダンス計測タイミングの違いによって算出しているが、より適切に分子を同定できるようにするため、インピーダンス測定箇所のナノ流路の幅をその箇所以外の幅に比べて狭く設定する。このようにすると、分子による電流変化分は、分子の体積/電極間の体積比に比例するため、電極間の体積が減ることによって体積比が大きくなる。その結果、分子によるインピーダンス変化分が大きくなるため高感度な測定に繋がると言える。
【0133】
III.流路デバイスの製造例
以下、第1及び第2の実施形態で使用する流路デバイスの製造方法の一例を説明する。
【0134】
(1)製造工程
図18は、本発明による流路デバイス10の製造工程を説明するための図である。
【0135】
工程1:石英又はガラスで構成される基板の上にチタンを、例えば1nm厚で真空蒸着させ、その上に金を、例えば50〜200nm厚で真空蒸着させる。金は電極の材料となるものであり、チタンは金と基板を接着させるための接着剤として機能する。これにより、基板の上に電極材料が着膜される(図18(A)参照)。
【0136】
工程2:通常のフォトリソグラフィー技術を用いて、ナノ電極部分(例えば、上述のナノ電極122に相当する部分)をパターンニングする(図18(B)参照)。
【0137】
工程3:集束イオンビーム(FIB)又は反応性イオンエッチング(RIE)を用いて、工程2で作製したナノ電極パターン付き基板を削って溝(ナノ流路)を作製する。ナノ電極バターンも同時に削られるため、電極対も同時に作製される(図18(C)参照)。
【0138】
工程4:工程3で作製したナノ流路の端部をさらに削ってマイクロ流路(上述の注入部11に相当)を作製する(図18(D)参照)。
【0139】
工程5:石英又はガラスにスピンコートでシリコンゴムを例えば1μm厚でコーティングし、例えば150℃まで温めて固定させて蓋部材を作製する(図18(E)参照)。
【0140】
工程6:工程5で作製した蓋部材を工程4で作製した流路材にかぶせ、真空UV光(波長172nm)、酸素プラズマ、大気圧プラズマなどのいずれかを照射することにより、蓋部材を流路材に接着する(図18(F)参照)。
【0141】
(2)流路形状について
図19は、形状の異なる流路を作製する方法について説明するための図である。本発明では、断面が矩形の流路とV字型の流路について考える。ただし、矩形流路の場合、正確な矩形である必要はなく、例えば、底面が丸みを帯びていてもよい。また、V字型流路の場合も、正確にV字である必要はなく、例えば、流路の底面に行くにつれて流路幅が狭くなっていれば良い。
【0142】
矩形流路場合、上述の工程2によって電極パターンを形成した基板の上に電子ビームレジストを形成し(図19(A)参照)、反応性イオンエッチング(RIE)を用いて基板を削り、ナノメートルサイズの流路を形成する(図19(B)参照)。
【0143】
一方、V字型流路の場合、上述の工程2によって電極パターンを形成した基板に集束イオンビーム(FIB)を照射して基板を削って加工する(図19(A)参照)。集束イオンビーム(FIB)はビームが一点に集束するため、ビームプロファイルに沿った形状(V字形状)の溝が基板上に形成される(図19(B)参照)。
【0144】
(3)電極パターンについて
図20は、基板上に形成された異なる電極パターンについて説明するための図である。図20(A)は電極パターンが流路エッジまでしかないパターン1を示し、図20(B)は電極パターンが流路内部にまで入り込んでいる場合のパターン2を示す図である。
【0145】
パターン1の場合、電極が基板表面にしかないため、電極間に生じる電気力線(電場)が流路の底部にまで入らない。従って、パターン1では、流路の底部では通過分子の抵抗又はインピーダンスを測定することが困難となる。
【0146】
一方、パターン2の場合、電極が流路側面を覆うように形成されている。したがって、パターン2では、流路の底部においても均一な電場を作ることができるので、流路の底部でも通過分子の抵抗又はインピーダンスを測定することができる。
【0147】
(4)電極パターン形成について
図21は、図20のパターン1及びパターン2の電極パターンを形成する工程、具体的には図18(C)で示される工程3の詳細を説明するための図である。
【0148】
工程3−1:電極が表面にパターンニングされた基板を準備し(図21(A)参照)、反応性エッチング(RIE)で縦に溝を掘る、又は集束イオンビーム(FIB)でエッチングする(図21(B)参照)。パターン1(図20(A))を作製する場合にはここまでの工程で終了させれば良い。パターン2(図20(B))を作製する場合には以降の工程を継続する。
【0149】
工程3−2:矩形流路及びV字型流路の双方の場合で、反応性エッチングにおける条件を変更して(例えばプラズマ圧力を変える)、さらに基板に適用する。すると、基板に対して縦方向及び横方向にさらに溝を削ることができる。すると、電極パターンが残されるため、流路のエッジ部分を越えて延設された状態(オーバーハング)となる(図21(C)参照)。
【0150】
工程3−3:工程3−2で作製された基板を、例えば水につけて引き上げる。濡れた状態の基板を乾燥させると、表面張力で電極のオーバーハング部分が流路側面に引き寄せられる。このようにして、電極パターンが流路側面を覆う構成が実現される(図21(D)参照)。
【0151】
(5)電極の絶縁膜コーティング
図22は、電極パターン上に絶縁膜をコーティングする様子を示す図である。
【0152】
流路デバイスの使用時は、ナノ流路に設けられた電極パターンがサンプルに直接触れているので、電極を構成する金属がサンプルに溶解してしまう可能性がある。この点、直流電圧を印加して抵抗を測定する場合(第1の実施形態)には、電極はサンプルに触れている必要があるので、電極パターンを保護膜等で覆うことはできないが、交流電圧を印加してインピーダンスを測定する場合(第2の実施形態)には、高周波になればなるほど電極がサンプルに直接触れている必要はない。このため、電極パターンの表面を絶縁膜で被覆し、その絶縁膜越しにインピーダンス測定を実行することができる。よって、電解反応による電極の溶解を防止することができる。
【0153】
この絶縁膜は、例えば、SiO2やSi3N4を電極パターン上にスパッタリングして、例えば数nm〜数100nm厚の膜を付着させることにより形成することができるようになる。
【0154】
(6)矩形流路とV字型流路の比較
図23は、矩形流路とV字型流路(電極パターンがナノ流路側面にない場合)の特徴を比較するための図である。
【0155】
まず、図23(A)を参照してナノ流路において電気測定できる範囲を検証すると、矩形流路の場合、電気力線(電場)が回り込まない領域が多く、特に底面の角部には電場が存在しない。一方、V字型流路の場合、ナノ流路のV字先端部には電気力線が届いていないが、全体として電場が存在しない領域が矩形流路の場合よりも少ない。
【0156】
続いて、図23(B)を参照してナノ流路において分子が流れる位置(深さ方向)について検証すると、矩形流路の場合、底面部分の幅が分子の径よりも大きいので、分子が底面部分を流れることが多い。一方、V字型流路の場合、ナノ流路は深さ方向に幅が細くなっているので、分子は電場が在在しない領域を流れることが少ない。
【0157】
よって、図23(A)及び(B)から分かるように、V字型流路の場合、流路断面に対する電気力線の充足率が高く、測定領域の割合が広くなっている。また、V字型流路の場合、底部分が狭くなっているため、サンプルに含まれる分子は底部分を流れにくくなっており、測定領域のみに流れる可能性が高くなる。
【0158】
なお、電極パターンがナノ流路側面に存在する場合(図20(B)及び図21(D)参照)には、矩形流路であっても上述の問題は解消される。
【0159】
(7)実際の流路
図24は、上述の製造方法に従って作製した実際の流路デバイスを示す図である。図24からも分かるように、当該流路デバイスは、1つの注入部と、1つのナノ流路と3つの分岐流路からなるナノ流路と、3つの出力部と、(分子速度測定電極及び1分子同定用電極(測定用ナノ電極)と、分岐流路に振り分けるための電極(スイッチング用ナノ電極)と、を有している。
【0160】
IV.まとめ
(1)本発明により同定又は分離可能な分子は、ナノメートルサイズの分子例えばDNA、RNA、タンパク質全般、ポリペプチド、アミノ酸、多糖類、脂質、サイトカイン、シグナル伝達物質、ホルモンなどの生体分子である。生体分子の他に一般的な有機高分子、例えばポリエチレン、ポリカーボネイト、アクリルなどの合成樹脂やナイロン、ビニルなどの合成繊維、シリコーン樹脂などや、無機高分子も同定又は分離可能である。さらにナノメートルサイズの粒子状物質、例えばコロイドやナノ粒子なども同定又は分離可能である。
【0161】
(2)本発明のサンプル処理装置は、生物が関わるあらゆる業種に利用できる。例えば、病変細胞の検査、病原性のバクテリアの検知、インシュリンのモニタリングなどの携帯型センサ、動植物細胞からの有効物質の抽出、オンサイトでの血液検査チップ、病理検査チップ(血液以外のサンプル検査)、ポータブル人体モニタリング(身体状態のモニタリング)、人工臓器用センサ、オンサイトでの感染検査チップ、毒物検査チップなどの医療用途、創薬(製薬)における新規薬物の効果検証、薬物検査チップ、投薬結果分析チップなどの創薬用途、毒性バクテリアの検知、環境:病原性バクテリアの検査、バイオハザード測定チップ、環境における生物汚染をオンサイトで計測(O−157など)などの環境関係用途、プロテオミクスなどの網羅的なタンパク質解析全般、生化学:タンパク質の構造解析、生化学反応の解析全般、DNA、タンパク質のシークエンシング、プロテオーム、トランスクリプトーム、エピジェネテックなどの網羅的タンパク質分析のあらゆる分野などのライフサイエンスにおける用途、衛生モニタリング(毒性バクテリア等の繁殖モニタリング)、生産量のモニタリング(醗酵全般における状態のモニタリング(ビール、チーズなど))汚染検査チップ(O−157やBSE等のモニタリング)、醗酵装置内での酵母の活性モニタリングなどの食品・衛生分野の用途、絆創膏感覚で使えるような血液検査チップ(妊娠検査、糖尿病検査、その他、あらゆるタンパク質の測定による検知系)等の用途に利用できる。
【0162】
(3)第1の実施形態では、ナノ流路に設置された電極対の電極間で分子を移動させたときの抵抗変化を測定する。そして、演算処理部は、抵抗測定部によって測定された抵抗値に基づいて、分子を同定する。このように、ナノ流路を単一分子ずつ移動させ、分子が電極対の間を通過することによって生じる抵抗変化の情報を取得し、その情報に基づいて分子を同定する。これにより、分子を精度良く同定することができるようなると共に、ナノ流路を用いているので装置の小型化も可能となる。
【0163】
ナノ流路は、分岐部と当該分岐部から複数の出力部につながる複数の分岐流路とを備えている。そして、同定された分子を、メイン流路から複数の分岐流路のうち所望の分岐流路に誘導する。分子の誘導処理は、メイン流路側に設けられた共通電極と、複数の分岐流路側にそれぞれ設けられた複数の出口電極と、共通電極と複数の出口電極のそれぞれに電圧を印加するための電圧印加部と、共通電極と1つの出口電極のペアを選択するためのスイッチング部と、によって実現される。そして、演算処理部は、同定された分子の情報に基づいて、共通電極と出口電極のペアを決定し、電圧を印加するように制御する。このようにすることにより、所望の分子を他の分子と分離して正確に取得することができるようになる。
【0164】
また、第1の実施形態では、流路デバイスは、処理対象のサンプルを注入するための注入部(本実施形態では、マイクロメートルオーダーの幅及び深さを有しているが、サンプルを注入できればこのオーダーに限られるものではないのは当然である。)と、ナノメートルオーダーの幅及び深さを有し、サンプルに含まれる分子を移動させるためのナノ流路と、マイクロメートルオーダーの幅及び深さを有し、ナノ流路を移動してきた分子を誘導し取り出すための複数の出力部と、を含んでいる。さらに、ナノ流路は、分岐部と当該分岐部から前記複数の出力部につながる複数の分岐流路と備えている。そして、ナノ流路に設置された電極対の電極間に電圧を印加し、分子が電極間を通過したときの抵抗を測定する。また、演算処理部は、測定された抵抗値と分子とを関連付ける。そして、測定された電流値(インピーダンス値)と関連付けられた分子を、ナノ流路から複数の分岐流路のうち所望の分岐流路に誘導する。誘導処理は、ナノ流路側に設けられた共通電極と、複数の分岐流路側にそれぞれ設けられた複数の出口電極と、共通電極と複数の出口電極のそれぞれに電圧を印加するための電圧印加部と、共通電極と1つの出口電極のペアを選択するためのスイッチング部と、によって実現される。このようにすることにより、サンプルに含まれる分子の種類が未知であっても、各分子が測定用ナノ電極の前を移動するときの抵抗値に従って分子を分離することができるようになる。
【0165】
なお、上述の装置において、ナノ流路には複数の電極対が設けられ、当該各電極対は所定の間隔を隔てて配置するようにしても良い。この場合、測定部は、分子が各電極対を通過するときの抵抗を測定する。また、演算処理部は、抵抗値の測定時間差に基づいて、分子の移動速度を算出し、算出した分子の移動速度に基づいて電圧(電場でも良い)を印加するタイミングを制御する。このようにすることにより、より正確に分子を分離することができるようになる。
【0166】
また、上述の装置において、流路デバイスは親水性のある絶縁体材料で構成される。この場合、サンプルは、注入部からナノ流路に毛管現象の作用により導入される。このように毛管現象の作用を利用すれば、装置構成がさらに簡単となり、より小型化が可能となる。別の例として、新たな電極対の一方の電極を注入部に配置し、他方の電極をナノ流路に配置するようにしても良い。この場合、その電極対間に電場を生じさせることにより、サンプルが注入部からナノ流路に導入される。電気的に流れを制御出来るため、より高精度の測定が可能となる。
【0167】
(4)第2の実施形態では、ナノ流路に設置された電極対の電極間に交流電圧を印加し、電極間に分子があるときのインピーダンスを測定する。そして、演算処理部は、測定されたインピーダンス値に基づいて、分子を同定する。このように、ナノ流路を単一分子ずつ移動させ、分子が電極対の間に分子が存在するときのインピーダンス値の変化の情報を取得し、その情報に基づいて分子を同定する。これにより、同一サイズの異なる種類の分子を精度良く同定することができるようなると共に、ナノ流路を用いているので装置の小型化も可能となる。
【0168】
ナノ流路は、分岐部と当該分岐部から複数の出力部につながる複数の分岐流路を備えている。そして、同定された分子を、ナノ流路から複数の分岐流路のうち所望の分岐流路に誘導する。分子の誘導処理は、ナノ流路側に設けられた共通電極と、複数の出力流路側にそれぞれ設けられた複数の出口電極と、共通電極と複数の出口電極のそれぞれに電圧(電場)を印加するための電圧印加部(電場印加部)と、共通電極と1つの出口電極のペアを選択するためのスイッチング部と、によって実現される。そして、演算処理部は、同定された分子の情報に基づいて、共通電極と出口電極のペアを決定し、電圧を印加するように制御する。このようにすることにより、所望の分子を他の分子と分離して正確に分離することができるようになる。
【0169】
また、第2の実施形態では、流路デバイスは、マイクロメートルオーダーの幅及び高さを有し、処理対象のサンプルを注入するための注入部と、ナノメートルオーダーの幅及び深さを有し、サンプルに含まれる分子を移動させるためのナノ流路と、ナノ流路を移動してきた分子を分離するための複数の出力部と、を含んでいる。ナノ流路は、分岐部を介して当該分岐部から前記複数の出力部につながる複数の分岐流路を有している。そして、ナノ流路のメイン流路に設置された電極対の電極間に交流電圧を印加し、電極間に分子があるときのインピーダンスを測定する。また、演算処理部は、測定されたインピーダンス値と分子とを関連付ける。そして、測定されたインピーダンス値と関連付けられた分子を、ナノ流路から複数の分岐流路のうち所望の分岐流路に誘導する。誘導処理は、ナノ流路側に設けられた共通電極と、複数の分岐流路側にそれぞれ設けられた複数の出口電極と、共通電極と複数の出口電極のそれぞれに電圧を印加するための電圧印加部(電場印加部)と、共通電極と1つの出口電極のペアを選択するためのスイッチング部と、によって実現される。このようにすることにより、サンプルに含まれる分子の種類が未知であっても、各分子が測定用ナノ電極の前を移動するときのインピーダンス値に従って分子を分離することができるようになる。
【0170】
なお、上述の装置において、ナノ流路には複数の電極対が設けられ、当該各電極対は所定の間隔を隔てて配置するようにしても良い。この場合、測定部は、分子が各電極対を通過するときのインピーダンスを測定する。また、演算処理部は、インピーダンス値の測定時間差に基づいて、分子の移動速度を算出し、算出した分子の移動速度に基づいて電圧(電場)を印加するタイミングを制御する。このようにすることにより、より正確に分子を分離することができるようになる。
【0171】
また、上述の装置において、流路デバイスの基板は親水性のある絶縁体材料で構成される。この場合、サンプルは、注入部からナノ流路に毛管現象の作用により導入される。このように毛管現象の作用を利用すれば、装置構成がさらに簡単となり、より小型化が可能となる。別の例として、上記の通り、新たな電極対の一方の電極を注入部に配置し、他方の電極をナノ流路に配置するようにしても良い。この場合、その電極対間に電場を生じさせることにより、サンプルが注入部からナノ流路に導入される
【0172】
さらに、電極対間に分子(生体分子)を滞留させて、分子の環境を変化(酵素と反応させる、温度を変化させる、pHを変化させる、イオン濃度を変化させる等)させるとともに、交流電源の周波数を変えながら電極間に交流電圧を印加したときのインピーダンスを測定する。そして、測定されたインピーダンス値に基づいて、分子の立体構造やその動態を検知する。なお、交流電源は、周波数可変だけでなく、ナノ流路の電極対間に印加すべき電圧が可変である。この場合、交流電源の周波数及び電圧を変えながら、インピーダンスを測定し、交流電源の周波数及び電圧を変化させたときのインピーダンス値の変化によって分子の立体構造(conformation)とその動的な変化(動態)を検知する。これにより、分子(特に、生体分子)の構造変化を動的に捉えることができるようになるので、分子の機能を把握することができるようになる。
【0173】
(5)上述の実施形態では、流路デバイスが1つの注入部11と複数の出力部14を有している形態について説明しているが、複数の注入部と複数の出力部を有していても良い。この場合、流路デバイスは、複数の注入部と、各注入部からナノ流路につながる複数の注入用流路と、1つのナノ流路、複数の分岐流路、複数の出力部で構成される。また、流路デバイスは、1つの注入部と1つの出力部のみ有するものであっても良い。この場合、流路デバイスは、1つの注入部と、1つのナノ流路と、1つの出力部で構成される。この流路デバイスは、例えば、サンプルが1つの特定の分子を含むか否かを検査するとき等に利用される。
【符号の説明】
【0174】
M…分子
AS…交流電源
E1,E2,E3,E4,E5,E6…電極
10…流路デバイス
11…注入部
12…ナノ流路
12a、12b、12c…分岐流路
13…出力部
14…出力部
15…ガラス
16…接着部材
40…演算処理部
41…測定部
42…スイッチング部
43…電流値‐分子対応テーブル
44…メモリ
45…情報入力/出力部
51…サンプル導入部
90…演算処理部
91…測定部
92…スイッチング部
93…インピーダンス‐分子対応テーブル
94…メモリ
95…情報入力/出力部
96…交流電源
101…基板
122…測定用ナノ電極
123…電流計
124…電流計
223…インピーダンス測定部
224…確認用インピーダンス測定部
125…スイッチング用ナノ電極
511…電極
512…電極
513…電源
【技術分野】
【0001】
本発明は、流路デバイス及びそれを含むサンプル(ここでは「サンプル」とはサンプル液のことである)処理装置に関する。本発明は、例えば、サンプルに含まれる分子を1個ずつ同定(特定、検知、検出、測定を含む)又は分離(分画sortingを含む)することが可能である。
【背景技術】
【0002】
従来、サンプルの中から所望の分子を分離する際には、クロマトグラフィー技術を用いることが知られている。この方法は、分離担体と呼ばれるものへの分子の吸着と脱離を繰り返すもので、確率過程での移動度の違いにより分子を分離するものである(例えば、特許文献1参照)。より具体的には、例えば、多孔質の粒子(分離担体)を詰め込んだ筒(このような分離担体を詰め込んだユニットを「カラム」という)に、様々な分子を含むサンプルを流す。すると、多孔質の孔より小さい分子はその孔に入ることができるが、孔より大きな分子は孔に入り込め無くて素通りする。すなわち、孔より小さい分子は孔に入ったり出たりするため移動速度が遅くなり、孔より大きな分子は孔に入り込めないため早く移動できる。この移動速度の違いにより分子を分離する。
【先行技術文献】
【特許文献】
【0003】
【特許文献1】特開2007−279028号公報
【発明の概要】
【発明が解決しようとする課題】
【0004】
しかしながら、特許文献1に開示されるような従来のクロマトグラフィーを用いる方法では、原理的に(理想的な条件下でも)所望の分子を100%分離することは、できない。これは、分離担体の孔に分子が入ったり出たりするのは、ブラウン運動している分子が偶然(ここが確率過程)孔に入ったり、偶然出たりするためである。また、大きさが近いものは同じように孔に入ったり出たりするため、それらを区別するのが難しいからである。さらに、従来の手法によれば、多種類の分子の中から数種類程度は分離できるが、全てを網羅的に分離するのは不可能である。
【0005】
本発明は、上記のような孔のサイズに頼る機械的原理とは全く異なる原理に基づき、分子を1個ずつ同定又は分離可能な技術を提供する。
【課題を解決するための手段】
【0006】
最近、加工技術が進歩し、断面の大きさがナノメートルサイズの流路即ちナノメートルサイズ流路を手に入れることができるようになった。
【0007】
本発明者は、別途、ナノメートルサイズの分子例えば生体分子を扱っており、両者を結びつけることで、ナノメートルサイズ流路に「ナノメートルサイズの分子を含むサンプル」を流せば、その分子が1個ずつ流れることが可能なことを着想した。更に本発明者は、その分子の電気的性質に着目した。この性質には分子に電気的刺激を与えた時又はその与えている間にその分子が示す電気的性質も含まれる。
【0008】
その結果、本発明者は、分子1個が流れるナノメートルサイズ流路(ここではナノメートルサイズ流路を単にナノサイズ流路又はナノ流路ということがある)の近傍に少なくとも1つの電極対を配置した流路デバイスを着想した。この着想に基づき、分子1個が流れるナノサイズ流路を有し、その近傍に少なくとも1つの電極対が配置され、かつ前記電極に交流電圧を印加するための交流電源を有する流路デバイスを発明した(第1の基本発明)。
【0009】
図1Aは、最も簡単な構成の流路デバイスの一つを示す概略平面図である。ナノ流路12を上から見ている。ナノ流路12の周辺は基板である。ナノ流路は図1Aのように基板上に形成されたものでも、或いはパイプの内部に形成されたものであっても良く、限定されない。電極対のE1、E2を介して交流電源(AS)により分子1個1個に交流電圧が印加され、その結果、ナノ流路を1個ずつ流れる分子の電気的性質を測定することができる。このことから、分子1個1個を同定することができる。この場合、交流電圧を用いるので、高感度・高精度に同定することができる。同定の意味は広く、分子の状態、例えば、分子の立体構造(conformation)やその動的な変化(動態)を検知することも同定に含まれる。
【0010】
このように分子1個の同定(検知)ができれば、流路の出口で、その分子1個を特定的に捕捉することができる。従って、本発明の流路デバイスは、サンプルから特定の分子だけを分離することに使用できる。
【0011】
更には、分子は電気的刺激(電気信号)を受けることで力学的に固有の挙動を示すことがある。その場合には、本発明の流路デバイスの出口に複数の分岐流路(ナノメートルサイズかそれより太くとも可)を用意しておけば、流路を流れる分子1個ずつに特定の電気的刺激を与えることで、例えば第1種分子は、第1の力学的挙動を示し、その結果、第1分岐流路に誘導され、例えば第2種分子は、第2の力学的挙動を示し、その結果、第2分岐流路に誘導される。
【0012】
従って、本発明は、分子1個が流れるナノ流路、分岐部及び複数の分岐流路を備えた流路デバイスを提供する(第2の基本発明)。分岐流路の断面の大きさは、ナノメートルからマイクロメートルサイズである。
【0013】
図1Bは、複数の分岐流路12a、12bを持つ流路デバイスの一つを示す概略平面図である。分離に有用な流路デバイスである。ナノ流路12を上から見ている。ナノ流路12の周辺は基板である。ナノ流路12の出口側(図に向って右側)は分岐部を介して2つの分岐流路12a、12bへと分岐し、流路全体はY字形をしている。この場合、電極対は、i)ナノ流路12を挟む電極E1とE2、又はii)ナノ流路12の近傍に配置された電極E1と分岐流路に配置された電極E3、又はiii)ナノ流路12の近傍に配置された電極E2と分岐流路に配置された電極E4である。
【0014】
電極対(E2とE4の対、又はE2とE1の対)の間に所定の電圧を印加することでサンプル中に含まれる所定の分子Mに対し電気的刺激を与えることで、分子Mは分岐流路12bへ誘導される。
【0015】
更に、本発明は、分子1個が流れるナノ流路、分岐部及び複数の分岐流路、i)前記ナノ流路の近傍であって当該ナノ流路を挟むように電極対が配置され、又はii)電極対の一方が前記ナノ流路の近傍に配置され、他方が前記分岐流路の近傍に配置された流路デバイスを提供する(第3の基本発明)。
【0016】
これらの分岐流路を有する流路デバイスは、例えば、分離に有用である。しかし、別の使い方では、分岐流路からナノ流路に向ってサンプルを流す使い方もある。
【0017】
基本的に「ある電極」に向かって引っ張る(あるいは反発させる)ことができるので、例えば図1Bにおいて向って左から右に分子Mが流れていく中で、電極E2(又は電極E4)側に引っ張れば下側分岐流路12bへ誘導でき、電極E1(又は電極E3)側に引っ張れば上側分岐流路12aへ誘導できる。この場合、電気泳動(electrophoresis)といって、分子の極性(+、−)を利用してクーロン力で誘導することもできるが、誘電泳動(dielectrophoresis)といって、「分子の極性に関係なく」誘導することも可能である。従って、誘電泳動力を使うと分子の極性を気にせずにスイッチングできるので、誘電泳動力は汎用性が高い。
【0018】
つまり、本発明の流路デバイスを使えば、サンプル中に第1種分子と第2種分子が含まれている場合、これらを分子1個ずつサンプルから分離することができる。分子1個ずつなので、原理的には純度100%で分離することができる。異なる分岐流路→出口への誘導(換言すれば、分岐流路を切り替えるスイッチング動作)には、スイッチングを行うモードとスイッチングを行わないモードの2つの操作モードがある。
【0019】
(1)スイッチングを行うモード
この場合、スイッチングにより電気的刺激を変化させるサブモード1と、スイッチングにより電極対を選択するサブモード2に分けられる。
【0020】
サブモード1では、図1Bにおいて向って左から右に分子Mが流れていく中で、予め分子の種類を検知した後、電極対(E1、E2)の間にその分子Aに固有の直流電圧あるいは固有の周波数Aの交流電圧を印加することにより分子Aを分岐流路12aへ誘導する。別の分子Bの種類を検知したときは、その分子Bに固有の直流電圧あるいは固有の周波数の交流電圧Bを電極対(E1、E2)の間に印加することにより分子Bを分岐流路12bへ誘導する。この場合、分子A、Bに固有の直流電圧又は固有の周波数を有する交流電圧は、複数ある場合もある。
【0021】
サブモード2では、図1Bに向って左から右に分子Mが流れていく中で、予め分子の種類を検知した後、その分子Aに対応する電極対(電極E1、電極E3)を選択し、それらの間に所定の直流電圧又は所定の周波数を有する交流電圧Aを印加することにより分子Aを分岐流路12aへ誘導する。別の分子Bを検知したときは、その分子Bに対応する電極対(電極E2、電極E4)を選択し、それらの間に所定の直流電圧又は所定の周波数を有する交流電圧Bを印加することにより分子Bを分岐流路12bへ誘導する。この場合、前記直流電圧又は前記周波数を有する交流電圧Aと前記直流電圧又は前記周波数を有する交流電圧Bは同一でも異なっていても良い。
【0022】
(2)スイッチングを行わないモード
予め分子を検知することなく、電極対(E1、E2)の間に、或いは電極対(E1、E3)の間に、或いは電極対(E2、E4)の間に、分子Aに固有の直流電圧又は固有の周波数の交流電圧を印加する。印加は、そこを通るどの分子にも与えておく。これにより、分子Aだけを所定の分岐路に誘導することができる。
【0023】
網羅的に全ての分子を個別に分離回収するためには、1)モードが望ましく、単に狙った分子だけを取り出すような場合は2)モードも使用することができる。
【0024】
ナノ流路から分岐部を経て複数の分岐流路への分岐の仕方は、図1Bに示すY字形に限らず、例えば、図1Cに示す形状でも、図1Dに示す形状でも良い。また分岐流路数に上限はない。
【0025】
なお、本発明にかかる流路デバイスは、分子の同定や分離に限らず、別の目的にも使用可能である。例えば、ナノ流路に順に分子Aと分子Bを流し、電極対を通じて電気的刺激を与えることにより、電気化学反応や周囲温度の上昇により分子Aと分子Bとを反応させ、分子AB連結体を合成することもできる。あるいは、ナノ流路の入口側に複数の入力部(断面の大きさはナノメートルのサイズでもマイクロメートルのサイズでもよい)を設けてもよく、その数に上限はない。
【0026】
本発明は、また、(図1A)分子1個が流れるナノ流路を有し、その近傍に少なくとも1つの電極対が配置された流路デバイス、(図1B)前記電極に交流電圧を印加するための交流電源、及び(図1B)前記流路を流れるサンプルに含まれる分子1個を同定する測定部を備えたサンプル処理装置を提供する(第4の基本発明)。
【0027】
本発明は、また、(図1A)分子1個が流れるナノ流路、分岐部及び複数の分岐流路を備え、i)前記ナノ流路の近傍であって当該ナノ流路を挟むように少なくとも1つの電極対が配置され、又はii)電極対の一方が前記ナノ流路の近傍に配置され、他方が前記分岐流路の近傍に配置された流路デバイス及び(図1B)前記ナノ流路を流れるサンプルに含まれる分子1個に前記の電極対を介して電気的刺激を与え、これにより前記分子に力学的挙動を促し、この力学的挙動により所定の分岐流路に前記分子を誘導するスイッチング部を備えたサンプル処理装置を提供する(第5の基本発明)。
【0028】
次に、電気的性質を具体化した応用発明、電気的刺激を具体化した応用発明及び力学的挙動を具体化した応用発明を本発明の一つとして説明する。
【0029】
本発明によるサンプル処理装置は、流路デバイスと、測定部と、演算処理部と、を備えている。流路デバイスは、処理対象のサンプルを注入するための注入部と、断面の大きさがナノメートルオーダーのサイズを有し、サンプルに含まれる分子を移動させるためのナノ流路と、を含有している。測定部は、ナノ流路に設置された電極対の間に電圧を印加し、分子が電極対の間を通過したときの抵抗値又はインピーダンスを測定する。また、演算処理部は、測定部によって測定された抵抗値又はインピーダンス値に基づいて、分子を同定する。
【0030】
当該サンプル処理装置は、さらに、ナノ流路を移動してきた分子を取り出すための複数の出力部と、同定された分子を分離する分子分離部と、を備えている。この場合、ナノ流路には、抵抗値又はインピーダンス値を測定する測定部が配置され、ナノ流路は分岐部を介して複数の分岐流路及びその先の出力部へと連結されている。そして、分子分離部は、同定された分子を、ナノ流路から複数の分岐流路のうち所望の分岐流路に誘導する。
【0031】
本発明によるサンプル処理装置は、サンプルに含まれる分子を種類ごとに分離する装置であって、流路デバイスと、測定部と、演算処理部と、分子分離部と、を備えている。そして、流路デバイスは、サンプルを注入するための注入部と、断面の大きさがナノメートルオーダーのサイズを有し、前記サンプルに含まれる分子を移動させるためのナノ流路と、ナノ流路を移動してきた分子を取り出すための複数の出力部と、を含んでいる。さらに、ナノ流路は、分岐部を介して複数の分岐流路及びその先の出力部へと連結されている。測定部は、ナノ流路に設置された電極対の間に電圧を印加し、分子が電極対の間を移動する(横切る)ときの抵抗又はインピーダンスを測定する。また、演算処理部は、測定部によって測定された抵抗値又はインピーダンス値と分子とを関連付ける。そして、分子分離部は、測定された抵抗値又はインピーダンス値と関連付けられた分子を、ナノ流路から複数の分岐流路のうち所望の分岐流路に誘導する。
【0032】
上述のサンプル処理装置において、ナノ流路には複数の電極対が設けられ、当該各電極対は所定の間隔を隔てて配置するようにしても良い。この場合、測定部は、分子が各電極対を通過するときの抵抗又はインピーダンスを測定する。また、演算処理部は、抵抗値又はインピーダンス値の測定時間差に基づいて、分子の移動速度を算出し、算出した分子の移動速度に基づいて電圧を印加(電場を印加する)するタイミングを制御する。
【0033】
さらに、上述の装置において、分子分離部は、ナノ流路側に設けられた電極対又は共通の電極からなる所定電極と、複数の分岐流路側にそれぞれ設けられた複数の出口電極と、所定電極間又はそれと出口電極との間に電圧を印加するための電圧印加部と、i)電極対からなる所定電極又はii)所定電極と1つの出口電極の対又はiii)所定電極と他の出口電極の対又はiv)所定電極と他の出口電極の対又はv)所定電極と他の・・・・・・を選択するためのスイッチング部と、を有している。そして、演算処理部は、同定された分子の情報に基づいて、前記i)、ii)、iii)、iv)、v)のどれかの対を決定し、直流又は交流電圧を印加するように分子分離部を制御する。
【0034】
なお、上述の装置において、流路デバイスは親水性のある絶縁体材料で構成される。この場合、サンプルは、注入部からナノ流路に毛管現象の作用により導入される。別の例として、サンプルに直流又は交流電圧を印加するための誘導用電極対の一方の電極を注入部に配置し、他方の電極をナノ流路に配置するようにしても良い。この場合、誘導用電極対間に電場を生じさせることにより、サンプルが注入部からナノ流路に誘導される。
【0035】
また、上記課題を解決するために、本発明によるサンプル処理装置は、流路デバイスと、直流あるいは交流電源と、測定部と、演算処理部と、を備えている。流路デバイスは、処理対象のサンプルを注入するための注入部と、断面の大きさがナノメートルオーダーのサイズを有し、サンプルに含まれる分子を移動させるためのナノ流路と、を含有している。測定部は、ナノ流路に設置された電極対の電極間に分子があるときに直流あるいは交流電圧を印加して抵抗あるいはインピーダンスを測定する。また、演算処理部は、測定部によって測定された抵抗値あるいはインピーダンス値に基づいて、分子を同定する。注入部の断面の大きさはナノメートルからマイクロメートルオーダーのサイズであることが好ましい。
【0036】
当該サンプル処理装置は、さらに、断面の大きさがナノメートルからマイクロメートルオーダーのサイズを有し、ナノ流路を移動してきた分子を取り出すための複数の出力部と、同定された分子を分離する分子分離部と、を備えている。この場合、ナノ流路は、分岐部を介して複数の分岐流路及びその先の出力部に連結している。そして、分子分離部は、同定された分子を、ナノ流路から複数の分岐流路のうち所望の分岐流路に誘導する。
【0037】
また、本発明による他のサンプル処理装置は、サンプルに含まれる分子を種類ごとに分離する装置であって、流路デバイスと、直流あるいは交流電源と、測定部と、演算処理部と、分子分離部と、を備えている。そして、流路デバイスは、サンプルを注入するための注入部と、断面の大きさがナノメートルオーダーのサイズを有し、サンプルに含まれる分子を移動させるためのナノ流路と、ナノ流路を移動してきた分子を取り出すための複数の出力部と、を含んでいる。ナノ流路は、分岐部を介して複数の分岐流路及びその先の出力部に連結している。測定部は、ナノ流路に設置された電極対の電極間に直流あるいは交流電圧を印加し、電極間に分子があるときの抵抗あるいはインピーダンスを測定する。また、演算処理部は、測定部によって測定された抵抗値あるいはインピーダンス値と分子とを関連付ける。そして、分子分離部は、測定されたインピーダンス値と関連付けられた分子を、ナノ流路から複数の分岐流路のうち所望の分岐流路に誘導する。
【0038】
上述のサンプル処理装置において、ナノ流路には複数の電極対が設けられ、当該各電極対は所定の間隔を隔てて配置するようにしても良い。この場合、測定部は、分子が各電極対を通過するときの抵抗あるいはインピーダンスを測定する。また、演算処理部は、測定されたインピーダンス値の測定時間差に基づいて、分子の移動速度を算出し、算出した分子の移動速度に基づいて電圧を印加する(電場を印加する)タイミングを制御する。
【0039】
さらに、上述の装置において、分子分離部は、ナノ流路側に設けられた電極対又は共通電極からなる所定電極と、複数の分岐流路側にそれぞれ設けられた複数の出口電極と、所定電極の間又はそれと出口電極との間に電圧を印加するための電圧印加部と、i)電極対からなる所定電極又はii)所定電極と1つの出口電極の対又はiii)所定電極と他の出口電極の対又はiv)所定電極と他の出口電極の対又はv)所定電極と他の・・・・・・を選択するためのスイッチング部と、を有している。そして、演算処理部は、同定された分子の情報に基づいて、前記i)、ii)、iii)、iv)、v)・・・・・のどれかの対を決定し、電圧を印加するように分子分離部を制御する。
【0040】
なお、上述の装置において、流路デバイスは親水性のある絶縁体材料で構成される。この場合、サンプルは、注入部からナノ流路に毛管現象の作用により導入される。別の例として、サンプルに電場を印加するための誘導用電極対の一方の電極を注入部に配置し、他方の電極をナノ流路に配置するようにしても良い。この場合、誘導用電極対間に電場を生じさせることにより、サンプルが注入部からナノ流路に誘導される。
【0041】
さらに、本発明によるサンプル処理装置において、交流電源は、ナノ流路に設置された電極対の電極間に、少なくとも周波数を変化させながら交流電圧を印加するものである。
【0042】
一方、測定部は、電極対間に分子を滞留させて、分子の環境を変化させるとともに、交流電源の周波数を変えながら電極間に交流電圧を印加したときのインピーダンスを測定するようにしてもよい。そして、演算処理部は、測定部によって測定されたインピーダンス値に基づいて、分子の構造やその動態を検知する。また、交流電源は、ナノ流路の電極対間に印加すべき電圧値が可変である。このとき、測定部は、交流電源の周波数及び電圧値を変えながらインピーダンスを測定する。演算処理部は、交流電源の周波数及び電圧値を変化させたときのインピーダンス値の変化によって分子の立体構造(conformation)やその動的な変化(動態)を検知する。
【0043】
さらなる本発明の特徴は、以下、本発明を実施するための最良の形態および添付図面によって明らかになるものである。
【発明の効果】
【0044】
本発明によれば、原理的に100%の同定、分離精度を実現することが可能である。少量のサンプルからも従来の手法に比べて短時間に所望の分子を同定又は分離することができる。従って、装置の小型化が可能となる。
【0045】
また、本発明によれば、分子サイズが同じでも異なる種類の分子を同定又は分離でき、生体分子の立体構造やその動的な変化(動態)を検知することができるようになる。
【図面の簡単な説明】
【0046】
【図1A】本発明の実施形態による流路デバイスを上から見た場合の概略構成例(1)を示す図である。
【図1B】本発明の実施形態による流路デバイスを上から見た場合の概略構成例(2)を示す図である。
【図1C】本発明の実施形態による流路デバイスを上から見た場合の概略構成例(3)を示す図である。
【図1D】本発明の実施形態による流路デバイスを上から見た場合の概略構成例(4)を示す図である。
【図1E】本発明の実施形態による流路デバイスを上から見た場合の概略構成例(5)を示す図である。
【図2】第1の実施形態(図1E)による流路デバイスのナノ流路を上から見た場合の詳細構成を示す図である。
【図3】図1Eに示す流路デバイスのAA’における断面を示す図である。
【図4】本発明の第1の実施形態による分子分離装置の回路構成を示すブロック図である。
【図5】本発明の第1及び第2の実施形態の変形例で用いられるサンプル導入部の概略構成を示す図である。
【図6】本発明の第1の実施形態の変形例による分子分離装置の回路構成を示すブロック図である。
【図7】本発明の第1及び第2の実施形態の変形例によるナノ流路の構成を示す図である。
【図8】サイズが15.0kbpのDNAがナノ流路を移動する様子を3.3msの間隔で撮影した図(写真)である。
【図9】サイズが15.0kbpのDNAがナノ流路を移動するときの電流値の変化を示すグラフであり
【図10】各サイズのDNA分子の電流測定値、及び各DNA分子の分離の様子を示す図である。
【図11】3つのDNA溶液の混合液を用いて、各DNA分子を同時に分離する実験の結果を示す図である。
【図12】第2の実施形態による流路デバイスのナノ流路を上から見た場合の詳細構成を示す図である。
【図13】本発明の第2の実施形態による分子分離装置の回路構成を示すブロック図である。
【図14】異なる分子(例えば、生体分子)が流路を移動する場合のインピーダンス値の変化の例を示す図である。
【図15】生体分子(例)と酵素との反応前後における分子の立体構造の動的な変化(動態)を検知する原理を説明するための図である。
【図16】交流電源の周波数を変化させ、それぞれの周波数のときに電圧を掃引したときの実験結果を示す図である。
【図17】本発明の第2の実施形態の変形例による分子分離装置の回路構成を示すブロック図である。
【図18】本発明の流路デバイスの製造工程を説明するための図である。
【図19】矩形流路とV字型流路の形成工程を説明するための図である。
【図20】基板上に形成された異なる電極パターンと得られる電場を示す図である。
【図21】電極パターンを形成する工程を説明するための図である。
【図22】電極パターン上に絶縁膜をコーティングする様子を示す図である。
【図23】矩形流路とV字型流路の特徴を比較説明するための図である。
【図24】実際に作製した流路デバイスを示す図(電子顕微鏡写真)である。
【発明を実施するための形態】
【0047】
本発明は、理想的な条件下では原理的に100%の精度で分子(同一サイズで種類の異なる分子であっても)を同定したり、分離したりすることができ(従来の方法では理想的な条件下でも100%の精度で分子を分離することは不可能であった)、また、分子の立体構造やその動的な変化(動態)を検知することができ、さらに、小型化を可能にする分子分離装置(サンプル処理装置の一例)を提供する。
【0048】
本発明の処理の対象となるサンプルは、水溶性の分子を親水性の溶媒に溶解又は懸濁したものでも良いし、疎水性の分子を疎水性の溶媒(例えば、アセトン、酢酸エチル、酢酸メチル、トルエン等)に溶解又は懸濁させて生成しても良い。この溶媒は、分子をしてナノ流路中を移動させるキャリアー媒体となる。
【0049】
以下、添付図面を参照して本発明の実施形態について説明する。ただし、本実施形態は本発明を実現するための一例に過ぎず、本発明の技術的範囲を限定するものではない。また、各図において共通の構成については同一の参照番号が付されている。
【0050】
I.第1の実施形態
第1の実施形態は、ナノ流路に設置された電極対の電極間に電圧を印加し、電極間に分子が存在するときに流れる電流から抵抗を測定し、その測定された抵抗値に基づいて、分子を同定する分子分離装置に関するものである。
【0051】
<分子分離装置における流路デバイス構成>
図1Eは、本発明の実施形態に係る分子分離装置(サンプル処理装置)で用いられる流路デバイス10の外観構成を示す図である。当該流路デバイス10は、基板上に形成された、サンプルを注入するための部位である注入部11と、分子の同定および分離処理を行う部位であるナノ流路12と、分離された分子を取り出すための部位である出力部13及び14と、を備えている。
【0052】
当該基板は、石英、ガラス、プラスチック、又はセラミック等の絶縁材料で構成することができるが、基板の親水性を利用してサンプルを処理する場合(例えば、毛管現象を利用してサンプルをナノ流路12に導入する場合)には石英やガラスで構成することが重要である。ナノ流路12は細すぎて直接サンプルを出し入れすることが難しいため、よりサイズの大きな流路をナノ流路のインターフェースとして利用することもある。この場合、注入部11、出力部13及び14は、ナノ流路である必要はなくより大きなサイズの流路でもかまわない。注入部11、出力部13及び14に関し、例えば、入出力口は直径1〜3mm、流路の幅は1〜100μm、流路の深さは1〜10μm程度である。さらに、ナノ流路12は、例えば、幅及び深さが共に数nm〜500nmである。なお、各流路の長さは特に制限はないが、装置の大きさを考慮して決定すればよい。
【0053】
図2は、ナノ流路12のより詳細な構成を示す図である。図2に示されるように、ナノ流路12は、複数の分岐流路を連結したナノ流路12と、ナノ流路を通過する分子を同定するための測定用ナノ電極122と、通過するサンプルを流れる電流から抵抗を測定するための測定用電流計123と、ナノ流路の分岐部に設置され、分子を所望の流路に誘導するためのスイッチング用ナノ電極125から構成されている。スイッチング時にサンプルの間を流れる電流から抵抗を測定し、当該分子が本来の流路に導入されているかを確認するための確認用電流計124を設置しても良い。
【0054】
測定用ナノ電極122は、複数ペアの電極で構成されることが好ましい。複数ペア設けることにより、最初の電極ペアで抵抗を測定した分子が下流の電極ペアに到達するまでの時間を測定し、ナノ流路を流れる分子の流速を検知することが可能となる。そして、この流速を基に、スイッチング用ナノ電極125に到達するまでの時間を演算することができ、各分子を適切に所望の流路に分離することができるように構成されている。ナノ流路12の分岐部分に設置されているスイッチング用ナノ電極125は、共通電極と、各出口流路に設けられた出口電極とを備え、各出口電極と共通電極との間に、所定の電圧を印加(電場換算で例えば、数MHz、数MV/m程度の電場)することにより、各分子を所望の分岐流路に誘導できる(スイッチON)ようになっている。
【0055】
図3は、流路デバイス10(図1E)のAA’(測定用ナノ電極が設けられた部分)における断面図である。流路デバイス10は、基板101にナノ流路12(実際は電極の厚さよりも浅い)を形成し、その上に測定用ナノ電極122やスイッチング用ナノ電極125を配置する。そして、接着部材16を用いてガラス板15と基板101とを接着する。なお、接着部材16としては、例えばPDMS(Polidimethylsiloxane)を用い、これをSiO2化させる。これにより、ナノ流路12の深さよりも厚い電極を覆いつつ基板に接着させることができるようになる。
【0056】
<分子分離装置の回路構成>
図4は、本発明の第1の実施形態による分子分離装置の回路構成を示すブロック図である。当該分子分離装置は、各構成要素からの情報を取得し所定の演算を行い、必要に応じて各構成要素を制御するための演算処理部40と、測定用ナノ電極122と、測定用電流計123と、電極122に電圧を印加する電源(図示せず)とを有する測定部41と、スイッチング用ナノ電極125と、確認用電流計124と、各電極と共通電極間に電圧を印加する電圧印加部(図示せず)とを有するスイッチング部42と、各種分子を含むサンプルに電圧を印加した場合の抵抗値と各種分子との対応関係を示す抵抗値‐分子対応テーブル43と、メモリ44と、ユーザが所定の指示等を入力し、分離処理の結果等を出力(表示)する情報入力/出力部45と、を備えている。
【0057】
演算処理部40は、測定部41からナノ流路12を分子が通過したときの抵抗値を取得し、この抵抗値と抵抗値‐分子対応テーブル43とを照合し、当該通過した分子の種類を同定する(測定した抵抗値はメモリ44に一時的に格納される)。サンプルに含まれる分子が未知の場合には測定抵抗値がテーブル43内にはないので、それぞれ測定した抵抗値をメモリ44に格納し、分子の種類が未知のまま分離することになる。ただし、以下の説明では電流計で電流値が計測されるため、抵抗値を測定するには、測定部41やスイッチング部42が印加電圧と電流値から抵抗値を算出する必要があることに注意すべきである。
【0058】
また、演算処理部40は、測定部41に含まれる測定用ナノ電極122の複数の電極対間を通過する分子の時間を計測し、その時間と電極対間の距離から当該分子の流速を演算する。そして、演算処理部40は、例えば測定用ナノ電極122の最後の電極対からスイッチング用ナノ電極125までの距離と演算した流速から、スイッチング用ナノ電極のどの出口電極と共通電極との間に電圧(電場)を印加するか、及び印加のタイミングをスイッチング部42に指示する。その指示に従って、スイッチング部42において、分子が所望の分岐流路に引き込まれるようになっており、分子の分離が実現できるようになっている。
【0059】
なお、スイッチング部42は、確認用電流計124によって分子が通過したときの抵抗を測定し、その測定値を演算処理部40に供給する。そして、演算処理部40は、その抵抗値と測定部41で測定した抵抗値を比較し、分離する分子の種類にエラーが無いか確認することができるようにしても良い。
【0060】
<分子分離装置の動作>
(1)サンプル注入及び流れ制御
まず、注入部11にサンプルが導入される。当該サンプルは、既知の分子や未知の分子を含んでいる。当該分子分離装置によれば、サンプルが既知の分子のみを含む場合には分子の種類ごとに分子を分類することができ、一方、サンプルが未知の分子を含む場合には分子の種類が未知のまま測定される抵抗値が同じ値を示す分子として分類することができるようになる。
【0061】
流路デバイス10は、基板101が石英又はガラスなどで構成されているので、流路の壁面が親水性を有している。そのため、サンプルは、毛管現象によって自動的に注入部11→ナノ流路12→出力部13及び14(出口側)へと吸い込まれていく。そして、出口部分から出てくる液量は極微量であるため、瞬間的に流れ出た全てのキャリアー媒体が蒸発する。そのため、蒸発で失われた液体を補うために毛細管現象でサンプルが自発的に流れ続け、一定量の流れがナノ流路12内で生じることになる。また、蒸発するのはキャリアー媒体だけなので、分子は濃縮されて分離回収される。その結果、後工程で分子を分析する場合、好都合である。これも重要な利点である。例え、回収しても、濃度が低いと従来のアッセイ分析の感度が低いので分析できない。
【0062】
また、流路デバイス10の全体あるいは一部分を冷却することによって、流速をある程度制御することができる。例えば、室温付近では、サンプルがナノ流路12から出力部13及び14にさしかかる部分で全て蒸発する。よって、この蒸発を防ぐために流路デバイス10の全体あるいは一部を冷却すると、サンプルは出口まで流れる。なお、冷却する温度は4〜25℃(室温)程度でよい。
【0063】
ここでは、毛管現象を利用してサンプルをナノ流路12に導入しているが、これに限られるものではなく、後述のように(変形例)、電気的な制御によってサンプルをナノ流路に導入することができる。
【0064】
(2)単一分子の検知
ナノ流路12のナノ流路12の幅はナノメートル単位のサイズであるため、サンプルに含まれる各分子が単一分子の形でナノ流路12を移動する。
【0065】
本発明の第1の実施形態による分子分離装置では、測定部41は、電流計123を用いて測定用ナノ電極122で電極対の間を流れる電流から抵抗値を測定している。分子が当該測定用ナノ電極122を通過すると、抵抗は変化する。また、分子(例えば分子サイズ)が異なれば、抵抗も異なっている。この性質を利用して分子を同定することが可能となる。
【0066】
演算処理部40は、この測定した抵抗値を測定部41から取得し、メモリ44に格納すると共に、当該取得した抵抗値と抵抗値‐分子対応テーブル43とを照合する。そして、演算処理部40は、取得した抵抗値に対応する分子がテーブル43に含まれていれば分子を同定して分離処理を継続し、含まれていなければ分子を同定しないまま分離処理を継続することになる。
【0067】
測定用ナノ電極122が複数ペアの電極で構成されている場合、演算処理部40は、各電極ペア間に生じる抵抗値の時間遅れから、ナノ流路12(の電極配置箇所)における移動速度(流速)を算出し、さらに、該当する分子が何秒後にナノ流路12の分岐部に到達するか算出する。このようにすることにより、特定の分子について逐一移動速度を算出することができるようになっているので、移動速度が未知の分子であっても適切に分離処理を実行することが可能となる。なお、本実施形態では、測定用ナノ電極122を複数ペアの電極で構成するようにしたが、移動速度が既知の分子であれば複数ペアの電極を設ける必要がなく、1対の電極を設置すれば足りる。
【0068】
(3)スイッチング
上述したように、分離の対象となっている分子がナノ流路12の分岐部に到達するタイミングが分かる。従って、このタイミングで、分子の種類又はその電流値に対応して、演算処理部40は、スイッチング用ナノ電極125の共通電極と、当該対象の分子を誘導すべき流路側の出口電極との間に電場を印加する。すると、ナノ流路から誘導すべき流路である分岐流路の方向に誘電泳動、電気泳動、電気浸透流(Electroosmotic flow)の何れかが働き、分子が当該分岐流路に誘導される。
【0069】
なお、本実施形態では、流路デバイス10がナノ流路とそこから分岐する2つの分岐流路を有している例が示されているが、これに限られたものではなく、分岐流路の数は分離すべき分子の種類数分設けることができるのはもちろんのことである。また、ナノ流路から複数の分岐(分岐流路)を持たせる方法としては、1つのナノ流路から同時に複数股の分岐流路を設けて分岐させても良いし、二股構成をカスケード状につなげて最終的に複数股に分岐させるような構成でも良く、分岐流路の構成は限定しない。
【0070】
<変形例>
(1)サンプル導入
(i)上述の実施形態では、毛管現象を利用してサンプルをマイクロ流路からナノ流路に導入しているが、ここでは電気的な制御によりサンプルをナノ流路に導入する手段を説明する。このように電気的な制御によってサンプル導入を実現すれば、高精度の流れ制御から測定精度や分離精度を向上することができ、さらに流路デバイス10の基板101が親水性である必要がなくなり、プラスチックやセラミックのような材料でも構成することが可能となる。
【0071】
図5は、変形例によるサンプル導入部51の構成を示す図である。サンプル導入部51は、サンプルに電場を印加するための電極対511及び512と、電源513と、を有する。ただし、電極511は注入部11側に、電極512はナノ流路12側に設けられている。
【0072】
ここでは分子は帯電しているので、マイナスに帯電している分子については、図5に示される方向に電場を印加すると、各分子はナノ流路12の方向に引き込まれる。一方、プラスに帯電しているサンプルについては、逆の方向に電場を印加すれば良い。このように、サンプルがどちらに帯電しているかによって電場を印加する方向を切り替えてサンプルの分子をナノ流路12に導入することができる。
【0073】
図6は、当該変形例による分子分離装置の回路構成を示すブロック図であり、図4との差は、サンプル導入部51を有していることのみである。サンプル導入部51の電極に印加する電圧(印加方向及び電圧値等)は、情報入力/出力部45から入力された指示に従い、演算処理部40によって制御される。
【0074】
(ii)また、電気浸透流を利用してサンプルを導入することも可能である。この場合、流路デバイス10の基板101の材料としてはガラスなどの親水性材料を用いるのが好ましい。ガラスはマイナスに帯電しているため、サンプル中のプラスイオンがガラスのマイナス電荷に引っ張られ、電気二重層が形成される。ここに電圧を印加すると、サンプル中の荷電部分が動き、これに引かれてサンプル全体が流れ出す。これが電気浸透流を用いたサンプル導入の原理である。なお、電気浸透流の場合、表面の帯電は正負どちらでも良い。
【0075】
(2)ナノ流路の構成(分子測定箇所)
図7は、流路デバイス10におけるナノ流路12の測定用ナノ電極122が配置される箇所の別の構成例を示す図である。上述したように、測定用ナノ電極122を用いて、ナノ流路を流れる分子を検知し、その移動速度を複数の電極対における電流値計測タイミングの違いによって算出しているが、より適切に分子を同定できるようにするために、抵抗測定箇所のナノ流路の幅をその箇所以外の幅に比べて狭く設定する。このようにすると、分子による電流変化分は、分子の体積/電極間の体積比に比例するため、電極間の体積が減ることによって体積比が大きくなる。その結果、分子による電流変化分が大きくなるため高感度な抵抗測定に繋がると言える。
【0076】
<実験について>
第1の実施形態で説明した原理及び動作に基づいて行った実験について説明し、本発明の有効性を示す。
【0077】
(1)ナノ流路の仕様
全体の長さが150μm、深さが50〜100nm、幅が50〜500nmの構造を有するナノ流路を用いて実験した。
【0078】
(2)使用サンプル
サイズが15.0kbp(kilo base pairs)、33.5kbp、48.5kbpの3種類のDNAについてそれぞれDNA溶液(サンプル)を作製し、実験に用いた。各サンプルの濃度は、0.1×TBE緩衝液中1fMとなるように調整した。なお、計算上の見掛けの各DNAの長さの予測値は、15.0kbpのDNAは1.1μm、33.5kbpのDNAは2.4μm、48.5kbpのDNAは3.6μmであった。
【0079】
(3)測定用ナノ電極への印加電圧
0.1V
(4)実験内容
(i)各サンプルをナノ流路に独立して導入し、i)流速度を測定し、ii)DNAの1分子を同定し、iii)各DNAに対応させた、流路の適切な出力部への誘導を実行した(実験結果については図8乃至10参照)。
(ii)各サンプルを混合した新しいサンプルから、各DNAに分離できるか実験した(実験結果については図11参照)。
【0080】
(5)実験結果
(i)図8は、サイズが15.0kbpのDNA分子がナノ流路を移動する様子を3.3msの間隔で撮影した図(写真)である。なお、ナノ流路は電極の幅(1μm)に比べて極小なので図面上では不可視であるが、白い垂直線はナノ流路を移動するDNAの位置を示している。
【0081】
図9は、サイズが15.0kbpのDNA分子がナノ流路を移動するときの電流値の変化を示すグラフであり、図9(a)はサンプルを所定時間流し続けたときの電流値の変化を示し、図9(b)は図9(a)中の点線で囲まれた部分の拡大図である。
【0082】
図9(a)において、電流値に大きな変化がある部分(電流が極小となる部分)が見られるが、この部分はDNAがナノ流路の電極部分を通過中であって、DNAによって電流の流れが遮られるため電流値に大きな変化が生じるのである。従って、図9(b)に示されるように、図8(a)の状態では、DNA分子はまだ電極部に差し掛かってないため、電流値の変化はノイズ分のみ(背景の電流値は約1pAであった)となっているが、図8(b)の状態では、DNAが電極部を通過中で電極間の電流を完全に遮っているので測定される電流値が極小となっている。上述したように、この電流値から抵抗値を求めて分子を同定したり、分子を分離することができるようになる。また、図8(c)及び(d)で示されるように、DNAと電極との重複部分が少なくなれば、電流値も図8(a)の状態に戻っていくのが分かる。
【0083】
図10は、各サイズのDNAの電流測定値、及び各DNAの分離の様子を示す図である。ここでは、三股の分岐流路を有するナノ流路において、15.0kbpサイズのDNAは左の分岐流路に誘導され(図10A参照)、33.5kbpサイズのDNAは中央の分岐流路に誘導され(図10B参照)、48.5kbpサイズのDNAは右の分岐流路に誘導される(図10C)ように制御した。
【0084】
図10の各グラフから分かるように、各DNAが電極部を通過する際には、各DNA特有の電流値の変化を示している。そして、これら分子特有の電流値の変化に基づいて抵抗値を求め、ナノ流路の分岐部においてスイッチング動作を実行することにより、所望の分子を所望の分岐流路に誘導できることが分かる。
【0085】
(ii)続いて、上記3つのDNAの混合液を用いて、各DNA分子を同時に分離する実験を行った。図11は当該混合液の分離実験の結果を示す図であり、図11(A)は各DNA分子の蛍光発光強度を示し、図11(B)は分離前後の各DNA分子の蛍光発光強度を示している。
【0086】
本実験では、各DNA分子について6000個の分子(1fMの溶液に含まれる分子数)を用意したが、時間の制約等の問題から全ての分子をカウントすることなく、最大100個の分子のみをカウントして実験を終了した。
【0087】
図11(B)からも分かるように、分離前後の各DNA分子の蛍光発光強度はほぼ一致しており、よって、本発明の分子分離装置を用いた分離処理が適切に行われたと言える。
【0088】
II.第2の実施形態
第2の実施形態は、ナノ流路に設置された電極対の電極間に分子があるときに交流電圧を印加してインピーダンスを測定し、測定されたインピーダンス値に基づいて、分子を同定する分子分離装置に関するものである。
【0089】
<分子分離装置における流路デバイス構成>
第2の実施形態で用いられる流路デバイス10の外観構成、及び流路デバイス10のAA’(測定用ナノ電極が設けられた部分)における断面構成は、第1の実施形態(図1E及び3参照)と同じなので、説明を省略する。
【0090】
図12は、第2の実施形態によるナノ流路12のより詳細な構成を示す図である。なお、図2と同じ構成には同じ参照番号は付されている。
【0091】
図12に示されるように、ナノ流路12は、複数の分岐を有するナノ流路12と、分岐前のナノ流路を通過する分子に交流電圧を印加するための測定用ナノ電極122と、測定用ナノ電極122間の分子のインピーダンスを測定するための測定部223と、ナノ流路の分岐部に設置され、分子を所望の分岐流路に誘導するためのスイッチング用ナノ電極125と、スイッチング時に分子のインピーダンスを測定し、当該分子が本来の分岐流路に誘導されているかを確認するための確認用電流計224を設置しても良い。なお、誘電率を分極率(分子1個の分極率はその内部構造の局所的な分極率の総和であり、誘電率と等価である)と表現しても差し支えない。要は、交流電圧を電極間に印加した際の位相ずれ(遅れ又は進み)を誘電率又は分極率として測定する。
【0092】
測定用ナノ電極122は、複数対の電極で構成されることが好ましい。複数対設けることにより、最初の電極対でインピーダンスを測定した分子が下流の電極対に到達するまでの時間を測定し、ナノ流路を流れる分子の流速を検知することが可能となる。そして、この流速を基に、スイッチング用ナノ電極125に到達するまでの時間を演算することができ、各分子を適切に所望の流路に誘導することができるように構成されている。ナノ流路12の分岐部分に設置されているスイッチング用ナノ電極125は、共通電極と、各出口流路に設けられた出口電極とを備え、各出口電極と共通電極との間に、所定の電圧を印加(電場の場合:例えば、数MHz、数MV/m程度の電場)を印加することにより、各分子を所望の流路に誘導する(スイッチON)ようになっている。
【0093】
<分子分離装置の回路構成>
図13は、本発明の第2の実施形態による分子分離装置の回路構成を示すブロック図である。当該分子分離装置は、各構成要素からの情報を取得し所定の演算を行い、必要に応じて各構成要素を制御するための演算処理部90と、測定用ナノ電極122と、インピーダンス測定部223とを有する測定部91と、測定部91内の測定用ナノ電極122に交流電圧を印加するための電圧・周波数可変交流電源96と、スイッチング用ナノ電極125と、確認用電流計224と、各電極と共通電極間に電圧を印加する電圧印加部(図示せず)とを有するスイッチング部92と、測定用ナノ電極122間に存在する各種分子を含むサンプルに電圧を印加した場合のインピーダンス値と各種分子との対応関係を示すインピーダンス‐分子対応テーブル93と、メモリ44と、ユーザが所定の指示等を入力し、分離処理の結果等を出力(表示)する情報入力/出力部95と、を備えている。
【0094】
演算処理部90は、測定部91からナノ流路12を分子が通過したときの抵抗値又はインピーダンス値を取得し、このインピーダンス値とインピーダンス値‐分子対応テーブル93とを照合し、当該通過した分子の種類を同定する(測定した抵抗値又はインピーダンス値はメモリ94に一時的に格納される)。サンプルに含まれる分子が未知の場合には測定抵抗値又はインピーダンス値がテーブル93内にはないので、それぞれ測定したインピーダンス値をメモリ94に格納し、インピーダンス値に従って分子の種類が未知のまま分離することになる。
【0095】
また、演算処理部90は、測定部91に含まれる測定用ナノ電極122の複数の電極対間を通過する分子の時間を計測し、その時間と電極対間の距離から当該分子の流速を演算する。そして、演算処理部90は、例えば測定用ナノ電極122の最後の電極対からスイッチング用ナノ電極125までの距離と演算した流速から、スイッチング用ナノ電極のどの出口電極と共通電極との間に電圧を印加するか、及び印加のタイミングをスイッチング部92に指示する。その指示に従って、スイッチング部92において、分子が所望の分岐流路に誘導されるようになっており、分子の分離が実現できるようになっている。
【0096】
なお、スイッチング部92は、確認用電流計224によって分子が通過したときのインピーダンスを測定し、その測定値を演算処理部90に供給する。そして、演算処理部90は、そのインピーダンス値と測定部91で測定したインピーダンス値を比較し、分離する分子の種類にエラーが無いか確認することができるようにしても良い。
【0097】
<分子分離装置の動作>
(1)サンプル注入及び流れ制御
まず、ユーザによって注入部11にサンプルが滴下される。当該サンプルは、既知の分子や未知の分子を含んでいる。当該分子分離装置によれば、サンプルが既知の分子のみを含む場合には分子の種類ごとに分子を分離することができ、一方、サンプルが未知の分子を含む場合には分子の種類が未知のまま測定されるインピーダンス値が同じ値を示す分子として分離することができるようになる。
【0098】
流路デバイス10は、基板101の全面が石英又はガラスなどで構成され、流路の壁面が親水性を有している。そのため、サンプルは、毛管現象によって自動的に注入部11→ナノ流路12→出力部13及び14(出口側)へと吸い込まれていく。そして、出口部分から出てくる液量は極微量であるため、瞬間的に流れ出た全てのキャリアー媒体が蒸発する。そのため、蒸発で失われた液体を補うために毛細管現象でサンプルが自発的に流れ続け、一定量の流れがナノ流路12内で生じることになる。
【0099】
また、流路デバイス10の全体あるいは一部分を冷却することによって、流速をある程度制御することができる。例えば、室温付近では、サンプルがナノ流路12から出力部13及び14にさしかかる部分で全て蒸発する。よって、この蒸発を防ぐために流路デバイス10の全体あるいは一部を冷却すると、サンプルは出口まで流れる。なお、冷却する温度は4〜25℃(室温)程度でよい。
【0100】
ここでは、毛管現象を利用してサンプルをナノ流路12に導入しているが、これに限られるものではなく、後述のように(変形例)、電気的な制御によってサンプルをナノ流路に導入することができる。
【0101】
(2)単一分子の検知
ナノ流路12の幅はナノメートル単位のサイズであるため、サンプルを構成する各分子が単一分子でナノ流路12を移動する。
【0102】
本発明による分子分離装置では、測定部91は、電流計223を用いて測定用ナノ電極122で電極対の間を流れる電流からインピーダンスを測定している。分子が当該測定用ナノ電極122を通過すると、インピーダンスは変化する。サイズが同一でも分子の種類が異なれば、インピーダンスは異なっている。この性質を利用して分子を同定することが可能となる。
【0103】
演算処理部90は、この測定したインピーダンス値を測定部91から取得し、メモリ94に格納すると共に、当該取得したインピーダンス値とインピーダンス‐分子対応テーブル93とを照合する。そして、演算処理部90は、取得したインピーダンス値に対応する分子がテーブル93に含まれていれば分子を同定して分離処理を継続し、含まれていなければ分子を同定しないまま分離処理を継続することになる。
【0104】
図14は、異なる分子(例えば、生体分子)が流路を移動する場合のインピーダンス値の変化の例を示す図である。図14に示されるように、例えば、生体分子B1が測定用ナノ電極122間にあるときの周波数変化に対するインピーダンス値変化の特性がP1で表され、生体分子B2が測定用ナノ電極122間にあるときの周波数変化に対するインピーダンス値変化の特性がP2で表されるものとする。この周波数変化は、電圧・周波数可変交流電源の周波数を所定範囲内で掃引させることを意味する。つまり、生体分子B1に関して、測定用ナノ電極122間に滞留させ、交流電源の周波数を変化させると、その周波数変化に対応して測定されるインピーダンス値も変化する。この変化特性をグラフで表したものがP1である。生体分子B2に関しても同様である。
【0105】
ここで、生体分子B1及びB2の分子サイズはほぼ同一であった場合、直流電流を測定用ナノ電極122間に流して測定された抵抗値の変化は両者において変らない。これでは、種類の異なる分子がほぼ同一サイズであると、分子を同定又は分離することはできなくなってしまう。この点、生体分子の代表格であるタンパク質は、元々は20種類のアミノ酸が数珠つなぎになった1本の紐状分子から構成されており(これをポリペプチドと呼ぶ)、アミノ酸同士の相互作用により自発的に規則正しく折りたたまれて(フォールディングと呼ぶ)3次元の立体構造を構成している。当然、その内部構造や全体の構造は個々の分子で異なっている。このような生体分子に外部から交流電場を印加すると、内部の局所的な構造が外部電場に引かれて分極するわけであるが、例えば周波数によって外部電場に追随して分極するところや分極が追随出来ずに遅れ(位相差)が生ずる部分が発生し、そうした局所的な内部の分極の総和として、分子全体の分極率が決定される。こうした単一分子が持つ分極特性(分極率)を電気インピーダンス測定によって測定すると、個々の分子を区別出来るようになる。そこで、本発明では、測定用ナノ電極122間に分子が存在する場合、そのサイズが同一でも種類が異なれば、インピーダンス変化が異なることに着目し、この性質を利用して分子を同定又は分離するようにしている。
【0106】
例えば、同定又は分離すべき複数の分子の種類が予め分かっている場合には、分子に固有の周波数を用いて、その周波数でのインピーダンス値を測定し、そのインピーダンス値に対応する分子をインピーダンス−分子対応テーブル43に基づいて同定すればよい。一方、同定又は分離すべき複数の分子の種類が予め分かっていない場合には、まずは1分子ずつ測定用ナノ電極122に滞留させ、交流電源における周波数を掃引させて当該分子のインピーダンス値変化特性Pk(k=1、2、・・・、n)を取得する。そして、それぞれの特性に応じて、分子を分離して、同種類の分子を所定の出力部に誘導する。
【0107】
なお、インピーダンスの検知感度が不十分である場合などには、同定又は分離すべき分子に、例えばフェロセンなどを含む導電性分子をラベルするようにしても良い。これにより、誘電率や導電率の違いを強調することができるので、インピーダンスの検知感度を高くすることが可能となる。
【0108】
また、測定用ナノ電極122が複数ペアの電極で構成されている場合、演算処理部40は、各電極ペア間に生じるインピーダンス変化の時間遅れから、ナノ流路12(の電極配置箇所)における移動速度(流速)を算出し、さらに、該当する分子が何秒後にナノ流路12の分岐部に到達するか算出する。このようにすることにより、特定の分子について逐一移動速度を算出することができるようになっているので、移動速度が未知の分子であっても適切に分離処理を実行することが可能となる。なお、本実施形態では、測定用ナノ電極122を複数ペアの電極で構成するようにしたが、移動速度が既知の分子であれば複数ペアの電極を設ける必要がなく、1対の電極を設置すれば足りる。
【0109】
(3)スイッチング
上述したように、分離の対象となっている分子がナノ流路12の分岐部に到達するタイミングが分かる。従って、このタイミングで、分子の種類又はそのインピーダンス値に対応して、演算処理部90は、スイッチング用ナノ電極125の共通電極と、当該対象の分子を誘導すべき流路側の出口電極との間に電場を印加する。すると、ナノ流路から誘導すべき流路である分岐流路の方向に誘電泳動、電気泳動、電気浸透流の何れかが働き、分子が当該分岐流路に誘導される。
【0110】
なお、本実施形態では、流路デバイス10が分岐流路とそこから分岐する2つの分岐流路を有している例が示されているが、これに限られたものではなく、分岐流路の数は分離すべき分子の種類数分設けることができるのはもちろんのことである。また、ナノ流路から複数の分岐(分岐流路)を持たせる方法としては、1つの分岐流路から同時に複数股の分岐流路を設けて分岐させても良いし、二股構成をカスケード状につなげて最終的に複数股に分岐させるような構成でも良く、分岐流路の構成は限定しない。
【0111】
(4)単一分子の立体構造の電気的動態測定
本発明の第2の実施形態による分子分離装置によれば、上述((2)及び(3))したように、異なる分子を同定又は分離することができるだけでなく、単一分子の立体構造やその動態を測定することができる。以下、単一分子の立体構造の電気的動態測定処理について説明する。
【0112】
(i)電気的動態測定の必要性について
生体分子の機能はその分子構造に由来するというのが構造生物学の基本概念であり、したがって分子構造を知ることは、その機能を理解するための最短路となる。ただし、例え膨大な労力を費やして結晶解析やNMRなどによって複雑な静的、準静的構造が決定されたとしても、生体分子の機能の本質である環境変化(反応基質濃度、pH、温度、イオン濃度等々)に伴う動的な構造変化を捉えることが出来なくては生体分子の構造と機能を理解したことにはならない。今後の分子生物学や構造生物学の発展と、プロテオーム解析や創薬などにおける大規模なタンパク質の機能解析への応用、さらには生体分子のような分子機械を人為的にデザインして創造したりするようなナノバイオテクノロジーへの応用を考えるに、生体分子の立体構造(conformation)やその動的な変化(動態)を検知する手法と、それを応用した生体分子の機能解析や同定手法の開発は必至と考えられる。
【0113】
本発明はこのような分子の動態検知における基礎研究から応用までの幅広い有効性に鑑み、電気的な生体分子の構造測定法を提供するものである。
【0114】
(ii)従来の手法及びその問題点
従来、生体分子を解析する場合には、X線回折やNMRなどの解析手法を用いており、これらにおいては分子を溶液や結晶の状態で取り扱っている。このように生体分子を懸濁液又は溶液のような多分子系で扱うと、個々の分子で起こっている反応とそれに伴う構造変化や時間応答などの情報が多分子間のランダムな動きの平均化によって失われてしまう。一方、結晶化させれば規則正しく配列している結晶の周期性を利用して静的な立体構造を得ることが出来る反面、生理的環境から逸脱してしまうため肝心の立体構造の変化といった動態に関する情報が失われてしまう。すなわち、構造解析の分解能を上げると動態に関する情報が得られず、動態の情報を得ようとすると分解能が上がらないというジレンマが、従来のX線回折やNMRなどの解析手法にはある。
【0115】
これに対して、もし1分子のみに注目した操作や分析が出来るのであれば、個々の分子における反応の素過程で分子の構造変化とその時間応答といった分子構造のダイナミクスに関する情報を得ることが出来るであろうと考えられる。ところで、従来の1分子測定系においては、その分析手法のほとんどは蛍光色素を利用した光学的な検知に限られている。例えば蛍光標識することでモータータンパク質のような「動く」タンパク質の動きを可視化したり、FRETと呼ばれる手法では2つの蛍光色素間のエネルギー移動を利用して局所的な構造変化を検知する、などである。このような手法は、極めて膨大な時間と手間を費やしてようやく1分子の一カ所のみを測定出来るため極めて汎用性に乏しいため、一般的な解析手法とはならないのが実情である。つまり、まずX線回折で立体構造を知り、かつ電気泳動や質量解析でアミノ酸の1次配列情報を得る必要がある。そして、特定のアミノ酸の部位にのみ蛍光色素が結合するような遺伝子操作をし、観察用のテスト分子を作らなくてはならない。このようにテスト分子自体を人工的に作らなくてはならなく、自然界の分子をそのまま使うことが出来ない。
【0116】
本発明の実施形態による分子分離装置によれば、自然界の分子をそのまま用いて分子の立体構造(conformation)やその動的な変化(動態)を簡単に測定することができるようになる。装置構成は上述したものと同一であるが、測定の方法が異なる。以下、当該測定方法について説明する。
【0117】
(iii)生体分子の動態変化の測定の原理について
図15は、例えば生体分子と酵素との反応前後における分子の構造やその動態を検知する原理を説明するための図である。図15において、C1は反応前の生体分子の構造を模式的に示し、C2は反応中若しくは反応後の生体分子の構造を模式的に示している。また、特性P3は、測定用ナノ電極122間にある生体分子がC1構造を採るときに、当該電極間に交流電圧を印加し、周波数をある範囲で掃引させたときのインピーダンス特性を示す。同様に、特性P4は、測定用ナノ電極122間にある同一の生体分子がC2構造を採るときに、当該電極間に交流電圧を印加し、周波数をある範囲で掃引させたときのインピーダンス特性を示す。このように、単一分子であっても構造に変化が起こると、測定されるインピーダンス値に変化が生じる。この性質を利用して、分子の構造やその動態をリアルタイムに検知することができるようになる。
【0118】
ところで、誘電泳動力は、誘電体(ここでは生体分子)に外部電場を加えた際に生ずる誘電体内の双極子の配向や周囲溶液のカウンターイオン等によって分子表面に誘起される分極電荷が外部電場と相互作用することにより得られる効果である。すなわち、十分な外部電場強度があればわずか1分子に誘起した分極電荷を利用して分子を動かせるのであれば、逆に分子の立体構造(conformation)の変化に起因するような分極率変化を電気インピーダンス測定から検知できる。さらには、誘電泳動力で強制的に分子に分極を誘起しつつ、あるいは分子の立体構造(conformation)自体を変形させつつ測定することで、例えば、タンパク質の高次構造を壊して1次構造である1本のポリペプチド鎖に戻しながらその電気インピーダンスを測定するなどして、分子の同定やその構造のダイナミクスを分析する全く新規な測定法が考えられる。
【0119】
(iv)生体分子の立体構造を電気的に制御しながらの立体構造測定の実施例
単一分子の構造の動態測定に当たっては、まず、例えば、DNAなどの生体分子を溶解したサンプルを用意する。
【0120】
次に、このサンプルを、分子分離装置における流路デバイス10の注入部10に注入し、当該DNAを1分子ずつナノ流路12の測定用ナノ電極122まで導入する。そして、当該DNA分子を測定用ナノ電極122の間に滞留させる。
【0121】
続いて、交流電源の電圧値(電場強度)を所定の値に固定し、周波数を一定範囲内で掃引したときのインピーダンスを測定する。また、上記電圧値を別の値(最初の値より大きい値)に固定し、同様に周波数を掃引してインピーダンスを測定する。このように、交流電源の電圧値を徐々に変化させ、それぞれの電圧値のときに周波数を掃引させる。DNAの分極率(誘電率)の周波数依存性を利用すると、特定の電場強度以上、かつ特定の周波数で誘電泳動力が効果的に働き、DNAがランダムコイルから直線的に引き延ばされる(図16(a)及び(b)参照:ただし、図16の実験系では、観察を容易にするため、電極間のギャップはマイクロオーダーとなっている)。これにより、誘電泳動力で強制的に分子に分極を誘起しつつ、あるいは立体構造(conformation)自体を変形させつつ測定することができるようになる。
【0122】
例えば、図16(c)で示されるように、電場強度が3MV/m、周波数が1kHz以上の場合にDNAがランダムコイルから直線的に引き延ばされることによってインピーダンスに顕著な変化が生じる。逆に、このインピーダンス値の変化が検知されると、DNAがランダムコイルから直線的DNAに構造が変化したことが判る。
【0123】
ここでは、誘電泳動力によって起こる構造変化について述べているが、これに限られず、pH変化、温度変化、イオン濃度変化、酵素反応などによって起こる構造変化についても同様に検知(測定)することができる。
【0124】
(v)ナノ流路を用いることによる顕著な効果
幅が大きい(マイクロオーダー以上)流路を用いる場合、数分子といった極微量のサンプルの測定では、周囲の水分子の数に対する測定対象の分子数が小さくなりS/Nが低下してしまう。また、液中の測定の場合、測定感度の向上のために高電圧(図中ではMV/mも印加している)を印加すると電極反応により電極が分解してしまうという問題がある。
【0125】
しかし、ナノ流路を用いれば、これらの問題を解決することができる。すなわち、ナノ流路のように測定空間を大幅に小さくすることで、測定対象となる単一分子周囲の水分子数を制限することが出来る。これによってターゲット分子の周囲を取り巻く水分子の熱運動による熱ノイズを抑制し、マクロな測定系では達成不可能な高感度化が可能となる。しかも体積が少ないため、濃度の観点からは実は1分子なのに濃度が高くなる。
【0126】
また、ギャップ長がナノメートルオーダーの電極系では、電極−溶液界面の電気2重層がオーバーラップして実質的に無視出来るようになるため、特に低周波領域での超高感度化が可能となる。通常、固−液界面には必ず電気二重層が発生し、電気測定ではこれがキャパシタンス成分として含まれてしまい測定の精度を下げるが、ナノメートルサイズ系ではこれが無くなるため絶対精度が向上する。
【0127】
さらに、電場強度は電極間隔に比例する(電場強度V=印加電圧E/ギャップ長d)ため、ギャップ長が短ければ短いほど同じ印加電圧で高電場を得ることができる。従って、ナノギャップ電極は電極間隔が極端に短いので、電気分解が生じない電圧で上述のMV/mの電場強度を得ることが出来る。
【0128】
<変形例>
(1)サンプル導入部、及びそれを有する分子分離装置の構成
(i)サンプル導入の変形例については、第1の実施形態と同じ構成(図5参照)を適用することが可能であるので、その説明は省略する。
【0129】
図17は、当該変形例による分子分離装置の回路構成を示すブロック図であり、図13との差は、サンプル導入部51を有していることのみである。サンプル導入部51の電極に印加する電圧(印加方向及び電圧値等)は、情報入力/出力部95から入力された指示に従い、演算処理部90によって制御される。
【0130】
(ii)また、電気浸透流を利用してサンプルを導入することも可能である。この場合、流路デバイス10の基板101の材料としてはガラスなどの親水性材料を用いるのが好ましい。ガラスはマイナスに帯電しているため、サンプル中のプラスイオンがガラスのマイナス電荷に引っ張られ、電気二重層が形成される。ここに電圧を書けると、サンプル中の荷電部分が動き、これに引かれてサンプル全体が流れ出す。これが電気浸透流を用いたサンプル導入の原理である。なお、電気浸透流の場合、表面の帯電は正負どちらでも良い。
【0131】
(2)ナノ流路の構成(分子検知箇所)
第1の実施形態による、流路デバイス10におけるナノ流路12の測定用ナノ電極122が配置される箇所の別の構成例(図7参照)は、第2の実施形態にも適用可能である。
【0132】
上述したように、第2の実施形態では、測定用ナノ電極122を用いて、ナノ流路を流れる分子を検知し、その移動速度を複数の電極対におけるインピーダンス計測タイミングの違いによって算出しているが、より適切に分子を同定できるようにするため、インピーダンス測定箇所のナノ流路の幅をその箇所以外の幅に比べて狭く設定する。このようにすると、分子による電流変化分は、分子の体積/電極間の体積比に比例するため、電極間の体積が減ることによって体積比が大きくなる。その結果、分子によるインピーダンス変化分が大きくなるため高感度な測定に繋がると言える。
【0133】
III.流路デバイスの製造例
以下、第1及び第2の実施形態で使用する流路デバイスの製造方法の一例を説明する。
【0134】
(1)製造工程
図18は、本発明による流路デバイス10の製造工程を説明するための図である。
【0135】
工程1:石英又はガラスで構成される基板の上にチタンを、例えば1nm厚で真空蒸着させ、その上に金を、例えば50〜200nm厚で真空蒸着させる。金は電極の材料となるものであり、チタンは金と基板を接着させるための接着剤として機能する。これにより、基板の上に電極材料が着膜される(図18(A)参照)。
【0136】
工程2:通常のフォトリソグラフィー技術を用いて、ナノ電極部分(例えば、上述のナノ電極122に相当する部分)をパターンニングする(図18(B)参照)。
【0137】
工程3:集束イオンビーム(FIB)又は反応性イオンエッチング(RIE)を用いて、工程2で作製したナノ電極パターン付き基板を削って溝(ナノ流路)を作製する。ナノ電極バターンも同時に削られるため、電極対も同時に作製される(図18(C)参照)。
【0138】
工程4:工程3で作製したナノ流路の端部をさらに削ってマイクロ流路(上述の注入部11に相当)を作製する(図18(D)参照)。
【0139】
工程5:石英又はガラスにスピンコートでシリコンゴムを例えば1μm厚でコーティングし、例えば150℃まで温めて固定させて蓋部材を作製する(図18(E)参照)。
【0140】
工程6:工程5で作製した蓋部材を工程4で作製した流路材にかぶせ、真空UV光(波長172nm)、酸素プラズマ、大気圧プラズマなどのいずれかを照射することにより、蓋部材を流路材に接着する(図18(F)参照)。
【0141】
(2)流路形状について
図19は、形状の異なる流路を作製する方法について説明するための図である。本発明では、断面が矩形の流路とV字型の流路について考える。ただし、矩形流路の場合、正確な矩形である必要はなく、例えば、底面が丸みを帯びていてもよい。また、V字型流路の場合も、正確にV字である必要はなく、例えば、流路の底面に行くにつれて流路幅が狭くなっていれば良い。
【0142】
矩形流路場合、上述の工程2によって電極パターンを形成した基板の上に電子ビームレジストを形成し(図19(A)参照)、反応性イオンエッチング(RIE)を用いて基板を削り、ナノメートルサイズの流路を形成する(図19(B)参照)。
【0143】
一方、V字型流路の場合、上述の工程2によって電極パターンを形成した基板に集束イオンビーム(FIB)を照射して基板を削って加工する(図19(A)参照)。集束イオンビーム(FIB)はビームが一点に集束するため、ビームプロファイルに沿った形状(V字形状)の溝が基板上に形成される(図19(B)参照)。
【0144】
(3)電極パターンについて
図20は、基板上に形成された異なる電極パターンについて説明するための図である。図20(A)は電極パターンが流路エッジまでしかないパターン1を示し、図20(B)は電極パターンが流路内部にまで入り込んでいる場合のパターン2を示す図である。
【0145】
パターン1の場合、電極が基板表面にしかないため、電極間に生じる電気力線(電場)が流路の底部にまで入らない。従って、パターン1では、流路の底部では通過分子の抵抗又はインピーダンスを測定することが困難となる。
【0146】
一方、パターン2の場合、電極が流路側面を覆うように形成されている。したがって、パターン2では、流路の底部においても均一な電場を作ることができるので、流路の底部でも通過分子の抵抗又はインピーダンスを測定することができる。
【0147】
(4)電極パターン形成について
図21は、図20のパターン1及びパターン2の電極パターンを形成する工程、具体的には図18(C)で示される工程3の詳細を説明するための図である。
【0148】
工程3−1:電極が表面にパターンニングされた基板を準備し(図21(A)参照)、反応性エッチング(RIE)で縦に溝を掘る、又は集束イオンビーム(FIB)でエッチングする(図21(B)参照)。パターン1(図20(A))を作製する場合にはここまでの工程で終了させれば良い。パターン2(図20(B))を作製する場合には以降の工程を継続する。
【0149】
工程3−2:矩形流路及びV字型流路の双方の場合で、反応性エッチングにおける条件を変更して(例えばプラズマ圧力を変える)、さらに基板に適用する。すると、基板に対して縦方向及び横方向にさらに溝を削ることができる。すると、電極パターンが残されるため、流路のエッジ部分を越えて延設された状態(オーバーハング)となる(図21(C)参照)。
【0150】
工程3−3:工程3−2で作製された基板を、例えば水につけて引き上げる。濡れた状態の基板を乾燥させると、表面張力で電極のオーバーハング部分が流路側面に引き寄せられる。このようにして、電極パターンが流路側面を覆う構成が実現される(図21(D)参照)。
【0151】
(5)電極の絶縁膜コーティング
図22は、電極パターン上に絶縁膜をコーティングする様子を示す図である。
【0152】
流路デバイスの使用時は、ナノ流路に設けられた電極パターンがサンプルに直接触れているので、電極を構成する金属がサンプルに溶解してしまう可能性がある。この点、直流電圧を印加して抵抗を測定する場合(第1の実施形態)には、電極はサンプルに触れている必要があるので、電極パターンを保護膜等で覆うことはできないが、交流電圧を印加してインピーダンスを測定する場合(第2の実施形態)には、高周波になればなるほど電極がサンプルに直接触れている必要はない。このため、電極パターンの表面を絶縁膜で被覆し、その絶縁膜越しにインピーダンス測定を実行することができる。よって、電解反応による電極の溶解を防止することができる。
【0153】
この絶縁膜は、例えば、SiO2やSi3N4を電極パターン上にスパッタリングして、例えば数nm〜数100nm厚の膜を付着させることにより形成することができるようになる。
【0154】
(6)矩形流路とV字型流路の比較
図23は、矩形流路とV字型流路(電極パターンがナノ流路側面にない場合)の特徴を比較するための図である。
【0155】
まず、図23(A)を参照してナノ流路において電気測定できる範囲を検証すると、矩形流路の場合、電気力線(電場)が回り込まない領域が多く、特に底面の角部には電場が存在しない。一方、V字型流路の場合、ナノ流路のV字先端部には電気力線が届いていないが、全体として電場が存在しない領域が矩形流路の場合よりも少ない。
【0156】
続いて、図23(B)を参照してナノ流路において分子が流れる位置(深さ方向)について検証すると、矩形流路の場合、底面部分の幅が分子の径よりも大きいので、分子が底面部分を流れることが多い。一方、V字型流路の場合、ナノ流路は深さ方向に幅が細くなっているので、分子は電場が在在しない領域を流れることが少ない。
【0157】
よって、図23(A)及び(B)から分かるように、V字型流路の場合、流路断面に対する電気力線の充足率が高く、測定領域の割合が広くなっている。また、V字型流路の場合、底部分が狭くなっているため、サンプルに含まれる分子は底部分を流れにくくなっており、測定領域のみに流れる可能性が高くなる。
【0158】
なお、電極パターンがナノ流路側面に存在する場合(図20(B)及び図21(D)参照)には、矩形流路であっても上述の問題は解消される。
【0159】
(7)実際の流路
図24は、上述の製造方法に従って作製した実際の流路デバイスを示す図である。図24からも分かるように、当該流路デバイスは、1つの注入部と、1つのナノ流路と3つの分岐流路からなるナノ流路と、3つの出力部と、(分子速度測定電極及び1分子同定用電極(測定用ナノ電極)と、分岐流路に振り分けるための電極(スイッチング用ナノ電極)と、を有している。
【0160】
IV.まとめ
(1)本発明により同定又は分離可能な分子は、ナノメートルサイズの分子例えばDNA、RNA、タンパク質全般、ポリペプチド、アミノ酸、多糖類、脂質、サイトカイン、シグナル伝達物質、ホルモンなどの生体分子である。生体分子の他に一般的な有機高分子、例えばポリエチレン、ポリカーボネイト、アクリルなどの合成樹脂やナイロン、ビニルなどの合成繊維、シリコーン樹脂などや、無機高分子も同定又は分離可能である。さらにナノメートルサイズの粒子状物質、例えばコロイドやナノ粒子なども同定又は分離可能である。
【0161】
(2)本発明のサンプル処理装置は、生物が関わるあらゆる業種に利用できる。例えば、病変細胞の検査、病原性のバクテリアの検知、インシュリンのモニタリングなどの携帯型センサ、動植物細胞からの有効物質の抽出、オンサイトでの血液検査チップ、病理検査チップ(血液以外のサンプル検査)、ポータブル人体モニタリング(身体状態のモニタリング)、人工臓器用センサ、オンサイトでの感染検査チップ、毒物検査チップなどの医療用途、創薬(製薬)における新規薬物の効果検証、薬物検査チップ、投薬結果分析チップなどの創薬用途、毒性バクテリアの検知、環境:病原性バクテリアの検査、バイオハザード測定チップ、環境における生物汚染をオンサイトで計測(O−157など)などの環境関係用途、プロテオミクスなどの網羅的なタンパク質解析全般、生化学:タンパク質の構造解析、生化学反応の解析全般、DNA、タンパク質のシークエンシング、プロテオーム、トランスクリプトーム、エピジェネテックなどの網羅的タンパク質分析のあらゆる分野などのライフサイエンスにおける用途、衛生モニタリング(毒性バクテリア等の繁殖モニタリング)、生産量のモニタリング(醗酵全般における状態のモニタリング(ビール、チーズなど))汚染検査チップ(O−157やBSE等のモニタリング)、醗酵装置内での酵母の活性モニタリングなどの食品・衛生分野の用途、絆創膏感覚で使えるような血液検査チップ(妊娠検査、糖尿病検査、その他、あらゆるタンパク質の測定による検知系)等の用途に利用できる。
【0162】
(3)第1の実施形態では、ナノ流路に設置された電極対の電極間で分子を移動させたときの抵抗変化を測定する。そして、演算処理部は、抵抗測定部によって測定された抵抗値に基づいて、分子を同定する。このように、ナノ流路を単一分子ずつ移動させ、分子が電極対の間を通過することによって生じる抵抗変化の情報を取得し、その情報に基づいて分子を同定する。これにより、分子を精度良く同定することができるようなると共に、ナノ流路を用いているので装置の小型化も可能となる。
【0163】
ナノ流路は、分岐部と当該分岐部から複数の出力部につながる複数の分岐流路とを備えている。そして、同定された分子を、メイン流路から複数の分岐流路のうち所望の分岐流路に誘導する。分子の誘導処理は、メイン流路側に設けられた共通電極と、複数の分岐流路側にそれぞれ設けられた複数の出口電極と、共通電極と複数の出口電極のそれぞれに電圧を印加するための電圧印加部と、共通電極と1つの出口電極のペアを選択するためのスイッチング部と、によって実現される。そして、演算処理部は、同定された分子の情報に基づいて、共通電極と出口電極のペアを決定し、電圧を印加するように制御する。このようにすることにより、所望の分子を他の分子と分離して正確に取得することができるようになる。
【0164】
また、第1の実施形態では、流路デバイスは、処理対象のサンプルを注入するための注入部(本実施形態では、マイクロメートルオーダーの幅及び深さを有しているが、サンプルを注入できればこのオーダーに限られるものではないのは当然である。)と、ナノメートルオーダーの幅及び深さを有し、サンプルに含まれる分子を移動させるためのナノ流路と、マイクロメートルオーダーの幅及び深さを有し、ナノ流路を移動してきた分子を誘導し取り出すための複数の出力部と、を含んでいる。さらに、ナノ流路は、分岐部と当該分岐部から前記複数の出力部につながる複数の分岐流路と備えている。そして、ナノ流路に設置された電極対の電極間に電圧を印加し、分子が電極間を通過したときの抵抗を測定する。また、演算処理部は、測定された抵抗値と分子とを関連付ける。そして、測定された電流値(インピーダンス値)と関連付けられた分子を、ナノ流路から複数の分岐流路のうち所望の分岐流路に誘導する。誘導処理は、ナノ流路側に設けられた共通電極と、複数の分岐流路側にそれぞれ設けられた複数の出口電極と、共通電極と複数の出口電極のそれぞれに電圧を印加するための電圧印加部と、共通電極と1つの出口電極のペアを選択するためのスイッチング部と、によって実現される。このようにすることにより、サンプルに含まれる分子の種類が未知であっても、各分子が測定用ナノ電極の前を移動するときの抵抗値に従って分子を分離することができるようになる。
【0165】
なお、上述の装置において、ナノ流路には複数の電極対が設けられ、当該各電極対は所定の間隔を隔てて配置するようにしても良い。この場合、測定部は、分子が各電極対を通過するときの抵抗を測定する。また、演算処理部は、抵抗値の測定時間差に基づいて、分子の移動速度を算出し、算出した分子の移動速度に基づいて電圧(電場でも良い)を印加するタイミングを制御する。このようにすることにより、より正確に分子を分離することができるようになる。
【0166】
また、上述の装置において、流路デバイスは親水性のある絶縁体材料で構成される。この場合、サンプルは、注入部からナノ流路に毛管現象の作用により導入される。このように毛管現象の作用を利用すれば、装置構成がさらに簡単となり、より小型化が可能となる。別の例として、新たな電極対の一方の電極を注入部に配置し、他方の電極をナノ流路に配置するようにしても良い。この場合、その電極対間に電場を生じさせることにより、サンプルが注入部からナノ流路に導入される。電気的に流れを制御出来るため、より高精度の測定が可能となる。
【0167】
(4)第2の実施形態では、ナノ流路に設置された電極対の電極間に交流電圧を印加し、電極間に分子があるときのインピーダンスを測定する。そして、演算処理部は、測定されたインピーダンス値に基づいて、分子を同定する。このように、ナノ流路を単一分子ずつ移動させ、分子が電極対の間に分子が存在するときのインピーダンス値の変化の情報を取得し、その情報に基づいて分子を同定する。これにより、同一サイズの異なる種類の分子を精度良く同定することができるようなると共に、ナノ流路を用いているので装置の小型化も可能となる。
【0168】
ナノ流路は、分岐部と当該分岐部から複数の出力部につながる複数の分岐流路を備えている。そして、同定された分子を、ナノ流路から複数の分岐流路のうち所望の分岐流路に誘導する。分子の誘導処理は、ナノ流路側に設けられた共通電極と、複数の出力流路側にそれぞれ設けられた複数の出口電極と、共通電極と複数の出口電極のそれぞれに電圧(電場)を印加するための電圧印加部(電場印加部)と、共通電極と1つの出口電極のペアを選択するためのスイッチング部と、によって実現される。そして、演算処理部は、同定された分子の情報に基づいて、共通電極と出口電極のペアを決定し、電圧を印加するように制御する。このようにすることにより、所望の分子を他の分子と分離して正確に分離することができるようになる。
【0169】
また、第2の実施形態では、流路デバイスは、マイクロメートルオーダーの幅及び高さを有し、処理対象のサンプルを注入するための注入部と、ナノメートルオーダーの幅及び深さを有し、サンプルに含まれる分子を移動させるためのナノ流路と、ナノ流路を移動してきた分子を分離するための複数の出力部と、を含んでいる。ナノ流路は、分岐部を介して当該分岐部から前記複数の出力部につながる複数の分岐流路を有している。そして、ナノ流路のメイン流路に設置された電極対の電極間に交流電圧を印加し、電極間に分子があるときのインピーダンスを測定する。また、演算処理部は、測定されたインピーダンス値と分子とを関連付ける。そして、測定されたインピーダンス値と関連付けられた分子を、ナノ流路から複数の分岐流路のうち所望の分岐流路に誘導する。誘導処理は、ナノ流路側に設けられた共通電極と、複数の分岐流路側にそれぞれ設けられた複数の出口電極と、共通電極と複数の出口電極のそれぞれに電圧を印加するための電圧印加部(電場印加部)と、共通電極と1つの出口電極のペアを選択するためのスイッチング部と、によって実現される。このようにすることにより、サンプルに含まれる分子の種類が未知であっても、各分子が測定用ナノ電極の前を移動するときのインピーダンス値に従って分子を分離することができるようになる。
【0170】
なお、上述の装置において、ナノ流路には複数の電極対が設けられ、当該各電極対は所定の間隔を隔てて配置するようにしても良い。この場合、測定部は、分子が各電極対を通過するときのインピーダンスを測定する。また、演算処理部は、インピーダンス値の測定時間差に基づいて、分子の移動速度を算出し、算出した分子の移動速度に基づいて電圧(電場)を印加するタイミングを制御する。このようにすることにより、より正確に分子を分離することができるようになる。
【0171】
また、上述の装置において、流路デバイスの基板は親水性のある絶縁体材料で構成される。この場合、サンプルは、注入部からナノ流路に毛管現象の作用により導入される。このように毛管現象の作用を利用すれば、装置構成がさらに簡単となり、より小型化が可能となる。別の例として、上記の通り、新たな電極対の一方の電極を注入部に配置し、他方の電極をナノ流路に配置するようにしても良い。この場合、その電極対間に電場を生じさせることにより、サンプルが注入部からナノ流路に導入される
【0172】
さらに、電極対間に分子(生体分子)を滞留させて、分子の環境を変化(酵素と反応させる、温度を変化させる、pHを変化させる、イオン濃度を変化させる等)させるとともに、交流電源の周波数を変えながら電極間に交流電圧を印加したときのインピーダンスを測定する。そして、測定されたインピーダンス値に基づいて、分子の立体構造やその動態を検知する。なお、交流電源は、周波数可変だけでなく、ナノ流路の電極対間に印加すべき電圧が可変である。この場合、交流電源の周波数及び電圧を変えながら、インピーダンスを測定し、交流電源の周波数及び電圧を変化させたときのインピーダンス値の変化によって分子の立体構造(conformation)とその動的な変化(動態)を検知する。これにより、分子(特に、生体分子)の構造変化を動的に捉えることができるようになるので、分子の機能を把握することができるようになる。
【0173】
(5)上述の実施形態では、流路デバイスが1つの注入部11と複数の出力部14を有している形態について説明しているが、複数の注入部と複数の出力部を有していても良い。この場合、流路デバイスは、複数の注入部と、各注入部からナノ流路につながる複数の注入用流路と、1つのナノ流路、複数の分岐流路、複数の出力部で構成される。また、流路デバイスは、1つの注入部と1つの出力部のみ有するものであっても良い。この場合、流路デバイスは、1つの注入部と、1つのナノ流路と、1つの出力部で構成される。この流路デバイスは、例えば、サンプルが1つの特定の分子を含むか否かを検査するとき等に利用される。
【符号の説明】
【0174】
M…分子
AS…交流電源
E1,E2,E3,E4,E5,E6…電極
10…流路デバイス
11…注入部
12…ナノ流路
12a、12b、12c…分岐流路
13…出力部
14…出力部
15…ガラス
16…接着部材
40…演算処理部
41…測定部
42…スイッチング部
43…電流値‐分子対応テーブル
44…メモリ
45…情報入力/出力部
51…サンプル導入部
90…演算処理部
91…測定部
92…スイッチング部
93…インピーダンス‐分子対応テーブル
94…メモリ
95…情報入力/出力部
96…交流電源
101…基板
122…測定用ナノ電極
123…電流計
124…電流計
223…インピーダンス測定部
224…確認用インピーダンス測定部
125…スイッチング用ナノ電極
511…電極
512…電極
513…電源
【特許請求の範囲】
【請求項1】
分子を含むサンプル溶液が流れるナノサイズ流路と、当該ナノサイズ流路に配置され、交流電圧が印加される少なくとも1つの電極対と、を有し、
前記電極対は、前記ナノサイズ流路を流れる前記サンプル溶液に接触しないように絶縁体材料で覆われている、流路デバイス。
【請求項1】
分子を含むサンプル溶液が流れるナノサイズ流路と、当該ナノサイズ流路に配置され、交流電圧が印加される少なくとも1つの電極対と、を有し、
前記電極対は、前記ナノサイズ流路を流れる前記サンプル溶液に接触しないように絶縁体材料で覆われている、流路デバイス。
【図1A】


【図1B】


【図1C】


【図1D】


【図1E】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24】




【図1B】


【図1C】


【図1D】


【図1E】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24】


【公開番号】特開2012−137492(P2012−137492A)
【公開日】平成24年7月19日(2012.7.19)
【国際特許分類】
【出願番号】特願2012−32035(P2012−32035)
【出願日】平成24年2月16日(2012.2.16)
【分割の表示】特願2011−544208(P2011−544208)の分割
【原出願日】平成22年7月26日(2010.7.26)
【出願人】(503360115)独立行政法人科学技術振興機構 (1,734)
【Fターム(参考)】
【公開日】平成24年7月19日(2012.7.19)
【国際特許分類】
【出願日】平成24年2月16日(2012.2.16)
【分割の表示】特願2011−544208(P2011−544208)の分割
【原出願日】平成22年7月26日(2010.7.26)
【出願人】(503360115)独立行政法人科学技術振興機構 (1,734)
【Fターム(参考)】
[ Back to top ]

