海水中の溶存態無機窒素の測定方法
【課題】海水中に含まれる窒素の全体量であるDIN(溶存態無機窒素)を連続的に簡易に多点計測することは重要であると考え、本発明では、 海水を還元工程を用いて硝酸イオンと亜硝酸イオンを全てアンモニウムイオンまで還元し、 DINを連続計測する手法を求めた。
【解決手段】海水試料にキレート化剤溶液を加えてマグネシウム、カルシウムなどの金属イオンを補足し、次に、銅被覆した亜鉛粒子とアルカリ条件下に接触させ、海水中に溶存する硝酸イオンおよび亜硝酸イオンを還元してアンモニウムイオンとし、生成したアンモニウムイオンと、元来海水試料中に溶存したアンモニウムイオンとをサリチル酸を用いたインドフェノール法により定量することを特徴とする、海水中の溶存態無機窒素の測定方法を提供する。
【解決手段】海水試料にキレート化剤溶液を加えてマグネシウム、カルシウムなどの金属イオンを補足し、次に、銅被覆した亜鉛粒子とアルカリ条件下に接触させ、海水中に溶存する硝酸イオンおよび亜硝酸イオンを還元してアンモニウムイオンとし、生成したアンモニウムイオンと、元来海水試料中に溶存したアンモニウムイオンとをサリチル酸を用いたインドフェノール法により定量することを特徴とする、海水中の溶存態無機窒素の測定方法を提供する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、海水中における硝酸、亜硝酸、アンモニアなどの溶存態無機窒素(DIN)の連続計測できる方法に関するものである。
【背景技術】
【0002】
近年、沿岸海域で発生している赤潮や貧酸素水塊等の環境問題を解決するためには、環境因子の時間的・空間的変動を詳細に計測し、海域をモニタリングする必要がある。水温や塩分、流速などの物理的環境因子については、連続計測を可能とする技術が開発されてきた。
一方、化学的環境因子である溶存態無機窒素(DIN)は、植物プランクトンによる1次生産の制限因子となるなど、沿岸海域における生態系を考える上で、極めて重要な環境因子である。
しかしながら、DINの定量は、いまだに採水した試料を持ち帰って化学分析するのが一般的であり、採水した現場で自動計測する技術がほとんど開発されていないのが現状である。
海水中におけるDINは、アンモニア態窒素(NH4+)、硝酸態窒素(NO3-)、亜硝酸態窒素(NO2-)の3つの形態(窒素三態)で存在する。
本発明者らは、硝酸イオンと亜硝酸イオンが紫外域に吸光特性を有することから、海水の紫外吸光度を計測することでその濃度を定量する手法を提案している(特許文献1および非特許文献1)
この手法は、化学的な処理を必要とせず、時間応答性に優れていることから、栄養塩計測には極めて有効であるが、アンモニウムイオンを計測することができない。
また、アンモニウムイオンは沿岸海域において比較的高濃度であり、DINの中でも植物プランクトンや藻類の基礎生産において最も関係のある物質であるが、アンモニウムイオンが紫外域に吸光特性を有さないことから、紫外吸光光度法を用いた計測手法が総DINの計測手法として十分であるとは言い難い。
【0003】
更に、特許文献2には、廃水中のアンモニア態窒素濃度を測定するアンモニア態窒素測定器として、演算式にて求める方法を示している。
また、特許文献3には、ガス透過性膜を備えた反応室に蛍光反応試薬を導き、一方キャリアーとしての緩衝液に試料溶液を混入し、試料溶液中のアンモニウムイオン、硝酸イオン及び亜硝酸イオンをアンモニアに変じた上で上記の反応室に導き上記のガス透過性膜を経てアンモニアと蛍光反応試薬とを反応させ、生成した蛍光物質の蛍光を検出し、蛍光強度の時間的変化を測定し、この測定値と上記のイオン濃度との関係を示す検量線に照合することを特徴とする窒素化合物イオンの高感度測定法による測定方法が示されている。
【0004】
また、特許文献4には、水中のアンモニウムイオン濃度の測定方法として、アンモニウムイオンの発色試薬としてインドナフトール青を用いて濃度測定する方法が示されている。
【0005】
【特許文献1】特願2006−333494号公報
【特許文献2】特開平8−197076号公報
【特許文献3】特開平11−125600号公報
【特許文献4】特開2007−278921号公報
【非特許文献1】「Measurement Method For Nutrient by Ultraviolet Spectrometry」(Rei Araiら、ISOPE、2007)
【発明の開示】
【発明が解決しようとする課題】
【0006】
DINは、アンモニア態窒素(NH4+)、硝酸態窒素(NO3-)および亜硝酸態窒素(NO2-)の3つの形態(窒素三態)で存在する。これら窒素三態のうち、硝酸態窒素(NO3-)および亜硝酸態窒素(NO2-)は、紫外域に吸光特性を有することから、化学的な処理を必要とせず、海水の紫外吸光度を計測することでその濃度を定量でき、かつ時間応答性に優れている。しかしながら、アンモニウムイオンを直接計測することができないことから、総DINの計測には有効ではない。
分析化学の分野において、サンプルや試薬等を定量ポンプで流し、化学反応させることで自動的に物質の濃度を定量する手法にフロージェクション手法(FI)と呼ばれるものがあり、現在広く用いられている。
そこで、本発明者らは、採取したばかりの海水中に含まれる窒素の全体量であるDINを連続的に簡易に多点計測することは重要であると考え新規な海水中のDINの測定方法および測定装置の開発を課題とした。
すなわち、本発明者らは、還元工程を用いて海水中の硝酸イオンと亜硝酸イオンの全てをアンモニウムイオンまで還元し、DINを連続的な測定方法および測定装置の開発を課題とした。
【課題を解決するための手段】
【0007】
しかるに、本発明によれば、海水試料にキレート化剤溶液を加えてマグネシウム、カルシウムなどの金属イオンを捕捉し、
次に、銅被覆した亜鉛粒子とアルカリ条件下に接触させ、海水中に溶存する硝酸イオンおよび亜硝酸イオンを還元してアンモニウムイオンとし、
生成したアンモニウムイオンと、元来海水試料中に溶存したアンモニウムイオンとをサリチル酸を用いたインドフェノール法により定量することを特徴とする、海水中の溶存態無機窒素の測定方法が提供される。
【0008】
また、別の観点によれば、本発明によれば、本発明の第1の解決手段が、海水中の溶存態無機窒素を流れ分析によって測定する場合であって、(1)海水試料の前処理部、(2)反応部、(3)検出部を備え、
(1)前処理部において、海水試料中にEDTA(エチレンジアミン四酢酸二ナトリウム2水和物、以下EDTAと略記)を添加することにより、マグネシウム、カルシウムイオンをマスキングし、次の還元工程を経て、海水中の硝酸イオン、亜硝酸イオン、アンモニウム態を還元して、アンモニウムイオンとする工程、
(2)反応部において、これら処理した試料にサリチル酸を用いたサリチル酸ナトリウム溶液とジクロロイソシアヌル酸ナトリウム溶液を添加して発色させる工程、
(3)これらの試料を吸光光度法により、アンモニウムイオン濃度をDINの濃度として濃度測定する工程、
を備える測定方法が提供される。
【0009】
更に、前項における還元工程として、亜鉛粒に銅被覆した粒子を多数充填したカラムに試料を流す工程としたことを特徴とする。
【0010】
また、EDTAは試料とともに還元工程中に入り、この中で酸化還元電位を下げる作用をすることを特徴とする。
【0011】
更にまた、前記EDTAを海水中に添加したのち還元工程までにNaOH水溶液を添加する工程を備えることを特徴とする。
【0012】
本発明の第2の解決手段は、還元工程に使用するカラムは柱状とし、長さ方向を縦立にして中に生じたガスを上に抜けるような構造としたことを特徴とする。
【0013】
更に、前記亜鉛粒の粒子径は0.5〜2.0mmの範囲とすることを特徴とする。
【0014】
また、アンモニウムイオンの検出は、650nmの波長を用いて光度法により計測することを特徴とする。
【発明の効果】
【0015】
無機態窒素の三態全てをアンモニウムイオンに還元してまとめて一括で定量することができるので、簡便な計測が可能で、海水中の栄養塩を的確に把握することができるとともに、船上でも採取から定量までリアルタイムに定量できるので、極めて有用である。
【発明を実施するための最良の形態】
【0016】
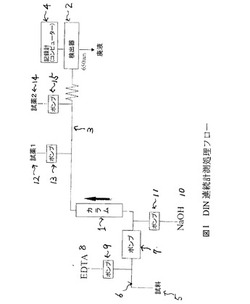
図1は、本発明1実施例のDIN計測方法のフロー模式的例示である。
図1において、1は窒素酸化物還元カラムであり、2は吸光光度計(分光光度計)であり、アンモニウムイオンを計測する装置である。
これらの間はタイゴン製チューブライン3で接続されている。4は分光結果を記録するコンピュータである。流れ分析としては、海水をポンプ(図示せず)で吸い上げ、ろ過して固形物を除去し、海水試料5とし、ポンプ7を用いてチューブライン6を通して還元カラム1に接続されている。このチューブライン6には、EDTA試薬8がポンプ9を通して注入される。
【0017】
一方、このチューブライン6には、EDTAの注入箇所より後で、かつ還元カラム1の手前のところでNaOH水溶液10がポンプ11を通してチューブライン6に注入され得る。
前処理工程でアンモニウムイオンに還元したのちは、サリチル酸ナトリウム溶液(試薬1)12がポンプ13を通してチューブライン3に注入され、その後ライン箇所にてジクロロイソシアヌル酸ナトリウム溶液(試薬2)14がポンプ15を通してチューブライン3に注入される。
なお、本発明において用いられている用語「流れ分析」とは、現場で、本発明による測定方法および/または測定装置を用いて、採水したばかりの海水試料を用いて、該試料中に含まれる溶存態無機窒素を定量分析することを意味する。
【0018】
図2は、アンモニウムイオン還元カラムの実施例正面図であり、21はタイゴンチューブ製の柱状還元カラムであり、22はカラムの蓋であり、23はカラムの底蓋である。
このカラムは、垂直方向に設置されており、その中には、粒子径1mmの銅被覆した亜鉛粒子が充填されている。このカラムの下部が試料側チューブ6に接続されており、上部は計測側チューブ3に接続されている。尚、銅被覆された亜鉛粒子の粒径は、0.5〜2.0mmの範囲で適用可能である。
【0019】
本発明では、還元部とアンモニア定量部の2つの部分からなる。前者は、銅―亜鉛(以下、Cu-Znとも表す)還元カラムを用いて、試料中の硝酸態窒素と亜硝酸態窒素をすべてアンモニア態窒素に還元する。後者は、試料中のDINである、アンモニア態窒素の総量を、流れ分析を用いてインドフェノールブルー法で定量するシステムである。
【0020】
(計測準備)
Cu-Zn還元カラムにアルカリ硫酸銅水溶液を流速2ml/分で10分程度流し入れ、劣化した還元カラムを復活させる。ただし、長期間カラムを使用していないときは、希塩酸で10分程度カラムを洗浄し、純水で希塩酸を洗い流してから、アルカリ硫酸銅水溶液を流し入れる。
【0021】
(計測開始と手順)
(1) ポンプでサンプルを吸い上げ、そこに別のポンプで吸い上げたEDTA溶液とNaOH溶液をチューブの中で混合させる。
(2) EDTA、NaOHを含んだサンプルをCu-Zn還元カラムに流し入れ、サンプル中の硝酸態窒素、亜硝酸態窒素の全てをアンモニア態窒素に還元する。
(3) チューブ内で反応させ、650nmにて吸光度計測器で計測する。
(4) 廃液は廃液タンクに入れ、実験室に持ち帰る。
【0022】
(注意事項)
(1) カラム中の銅被覆亜鉛粒子は、空気に触れると表面が酸化し、還元率に影響を与える可能性があるので、空気に触れないように計測期間中注意を払う。もちろんカラム作成や、カラム洗浄中も同様である。
(2) サリチル酸試薬、ジクロロ試薬共に直射日光を避け、屋外での計測の際は試薬パックとチューブにアルミホイルを巻く。
【0023】
分析化学の分野において、サンプルや試薬等を定量ポンプで流し、化学反応させることで自動的に物質の濃度を定量する手法としてフロージェクション手法(FI)を用いるにあたり、試料に前処理を施す部分、前処理された試料に化学反応で発色させる反応部、それらの試料を検出する検出部の3つの部分、即ち、流れ分析を検出部、前処理部、反応部に分け前処理部と反応部についてモニタリングに適した手法を検討し、検証実験を行った。なお、検出部においては、検出対象の選択性の高さ、検出器の簡便性などを考慮し吸光光度法を用いた。これらについて、本発明に適用することを検証した。
【0024】
(前処理部の検討および検証実験)
DINの定量手法には、硝酸イオンと亜硝酸イオンをCu-Cd還元法、亜鉛還元法、紫外吸光光度法などで一括して定量し、残るアンモニア態を別に定量して合算する手法も考えられるが、これらは安全面や還元率、精度などを検討した結果、モニタリングには適していないことが分かった。
システムの簡便化からしても三態をまとめて定量する手法が適していると考え、一括で定量する手法を検討した。三態の窒素を全てまとめて定量する場合には、全ての窒素を三態のうちどれか1つの形態にする必要がある。しかし、硝酸イオンは直接定量する手法がない点、また亜硝酸イオンにするには硝酸イオンに酸化し再び亜硝酸イオンに還元する必要がある点などの手間を考えると、三態全てをアンモニウムイオンに還元する手法が適していると考えられる。三態をアンモニウムイオンまで還元する手法には、NaCl還元法とCu-Zn還元法が報告されているが、NaCl還元法は還元率が低く安定しないため、Cu-Zn還元法を選択した。以上の検討結果をまとめると表1となる。
【0025】
【表1】

【0026】
前処理部における本発明のCu-Zn還元カラムにおいて、硝酸イオン、亜硝酸イオンが十分に安定してアンモニウムイオンに還元するかを検証するための実験を行った。今回製作したCu-Zn還元カラムは直径1mm程度の亜鉛粒に銅を被膜し、それを直径7mmのチューブに充填したもので、高い金属キレート形成能を持つEDTA溶液を試料に混合し、流量1〜2ml/分でカラムに流し入れることで硝酸イオン及び亜硝酸イオンをアンモニウムイオンまで還元する。このカラムの性能を検証するために、還元率・回収率・耐久性の三つの観点から実験を行った。
まず、Cu-Zn還元カラムによる硝酸態窒素及び亜硝酸態窒素の還元率を調べる実験を行った。還元実験は、沿岸海域における硝酸イオン、亜硝酸イオン濃度を想定し、20μmo/Lの硝酸イオン標準溶液および10μmo/Lの硝酸イオン標準溶液を各々Cu-Zn還元カラムに通してアンモニウムイオンに還元し、アンモニウムイオンを定量することで、その還元率を求めた。標準液は硝酸ナトリウムと亜硝酸ナトリウムの特級試薬(キシダ化学株式会社)を計量し、イオン交換水で希釈し調整した。結果は、表2に示すように硝酸イオン、亜硝酸イオンともに100%還元できることが確かめられた。
【0027】
【表2】

【0028】
次に、海水中の共存物質の還元率への影響を調べるために、硝酸態窒素の回収率を検証する実験を行った。実験には、兵庫県尼崎港において採水した試料(海水)に硝酸態窒素標準液を適当量標準添加し、前述の還元操作を行った。その結果を表3に示す。海水に添加した硝酸態窒素はアンモニウムイオンとして良好に回収できており、海水中の共存物質の影響を全く受けずに、Cu-Zn還元カラムで硝酸態窒素が十分に還元されることが検証できた。以上のことから、海水中の硝酸態窒素および亜硝酸態窒素はCu-Zn還元カラムを用いて100%還元されるため、海水中のDINの定量が可能であることが明らかになった。
【0029】
【表3】

【0030】
連続計測を行うためにはCu-Zn還元カラムの耐久性を把握する必要がある。そのため、硝酸態窒素標準液100μmol/lを24時間、200μmol/lを12時間、400μmol/lを12時間の計48時間、1ml/分で流し続け、カラムの耐久性を検証する実験を行い還元率の低下を調べた。
その結果、高濃度の試料を48時間流しても吸光度の低下は見られず、還元率は全く落ちないことが確認できた。今回作成したCu-Zn還元カラムが硝酸イオン、亜硝酸イオンをアンモニウムイオンに還元できる量は、窒素として576μmol以上はあることがわかった。これは100μmol/Lの試料を1回の計測あたり4ml使用し、10分間隔で計測を行ったとしても10日間は安定した還元率が得られることを示している。したがって、頻繁にカラムの交換を行う必要がないため、モニタリングに適した手法であるといえる。
【0031】
(反応部の検討および検証実験)
吸光光度法によるアンモニウムイオンの分析方法としては、フェノールを用いた分析方法が一般的であり、国内ではJIS、上水試験法、衛生試験法等で広く用いられている。しかし、フェノールは毒性の有機溶媒であることから、取り扱いに細心の注意が必要となるため、現地観測に適しているとは言い難い。そこで、本手法の反応部では食品等の防腐剤にも用いられているサリチル酸を用いたインドフェノール法を用い、反応部の検証実験を行った。
検証実験は、沿岸海域に含まれるアンモニウムイオン濃度を想定し、0〜100μmol/Lの範囲で5種類の標準溶液を反応部に流し込み、サリチル酸によるインドフェノール法で発色させ、吸光光度法により検量することで行った。アンモニウムイオンの標準液は塩化アンモニウムの特級試薬(キシダ化学株式会社)をイオン交換水で希釈し、調整した。
図3に示したNH4+の検量線の実験結果より、アンモニウムイオンと吸光度から良好な直線が得られ、サリチル酸を用いたインドフェノール法の流れ分析への適用は可能であることが確認できた。
【0032】
海水中には上記標準溶液と異なりマグネシウムイオンとカルシウムイオンが含まれている。これらマグネシウムイオンやカルシウムイオンは、インドフェノール法により発色させるpH13程度において白沈するため、吸光度を検出する際の妨害となることが知られている。
分析化学の分野では、EDTAを添加し、マグネシウムイオンとカルシウムイオンをキレートにすることで白沈を防ぐ手法が良く用いられる。
しかし、一方で、EDTAはインドフェノール法による発色強度を弱める、いわゆる発色妨害を起こす物質であると報告されている。すなわち、海水試料中に含まれるマグネシウムやカルシウムの量により、反応部に流入してくる試料中のEDTAの量が異なるため、反応部における発色強度が、アンモニウムイオンとは無関係に影響を受ける可能性がある。この影響を検証するため、妨害イオンであるマグネシウムイオンやカルシウムイオンを含まない、濃度の異なるアンモニウムイオン標準溶液と海水の発色強度を比較する実験を行った。
なお、海水にはアンモニウムイオン標準溶液を適宜、添加することで各種アンモニウムイオン濃度の海水試料とした。
【0033】
図4に示した標準液と海水とのNH4+の計測線の実験結果より、アンモニウムイオン標準液と海水中に含まれるアンモニウムイオンの濃度に対する発色強度の勾配に有意な差は確認されなかった。これにより反応部における、サリチル酸を用いたインドフェノール法はEDTAによる発色妨害の影響を受けず、海水に含まれるアンモニウムイオン濃度を安定して計測することが可能であることが確認できた。
【0034】
作成したDIN連続計測器が前処理部、反応部を通してDINを精度良く計測できるかを確認するために、DINの検量を行った。沿岸海水中に含まれるDIN濃度を想定した濃度の硝酸態イオン標準液を用いて検量した。流れ分析によるDINの検量線結果を図5に示す。良好な検量線が得られ、本計測装置の前処理部で硝酸イオンがアンモニウムイオンに還元され、反応部で安定して発色されており、本計測器で問題なくDINを検量できることが確認できた。
【0035】
海洋における実際の計測を実施した。計測は、海洋において、海水の表層水を汲み上げるポンプが装備され、ポンプで汲み上げた海水試料を用いてDINの計測を10分間隔で行った。同時に、水温、アレック社製Compact-CTを用い塩分とアレック社製Compact-CLWを用いクロロフィル濃度の計測も行った。また、
DIN連続計測器により計測された値の検証するため、5試料は持ち帰りJISによる化学分析に供しDIN濃度を定量した。DIN連続計測器による計測値とJISの公定法による分析値は図6の相関係数に示すように相関係数0.98と良好な結果が得られたことから、本海域におけるDIN濃度を連続計測できていることが確認できた。
【0036】
(Cu-Znカラムを用いたDIN連続計測に際するEDTA量の検証)
本計測で用いるサリチル酸法はpH11前後でもっとも強い発色強度を持つことが知られている。また、還元剤として必要なEDTAの量は、全体の溶液(サンプル+NaOH溶液+EDTA溶液)で考えて0.01Mである。(約pH10〜11の範囲において、サンプル容量10に対して、約0.52のEDTA(0.2M)が必要となる) そこで、EDTA0.01MにおいてpH11前後になるために必要なNaOH(pH調整剤)の最適量を求めるためのEDTA溶液に対するNaOH滴定実験をおこなった。その結果を図7および表4に記す。
【0037】
【表4】

【0038】
さらに海水中に含まれるアンモニアの定量を行う際にはCaやMgによる白沈を抑えるために、通常、クエン酸やEDTAが用いられるが、本手法ではEDTAを添加することで、EDTAに還元促進剤とマスキング剤という二つの役割をもたせた効果が大きいことが判った。
【0039】
白沈を抑えるのに必要なEDTAの最適量を求めるために、EDTAの滴定実験を行った。滴定対象試料は最もMgやCaが含まれると考えられる、沿岸域における尼崎港の海水を用いた。図8および表5から白沈を抑えるためには、海水サンプル10に対してEDTA3が必要であり、さらに上記図7のpH調整実験結果から、NaOH1.31が妥当であった。
(サンプル、EDTA、NaOH、全て合わせて考えると、EDTA濃度は約0.04Mになる。)
【0040】
【表5】

【0041】
(サリチル酸を用いたインドフェノールブルー法の検証)
アンモニアの定量にはフェノールを用いたインドフェノール法が一般(JIS)に用いられる。
しかしながら、このフェノールを用いる手法は、本手法で用いるEDTAにより発色妨害を受けることが知られており、さらにEDTAの濃度によって発色強度が大きく異なる。反応部の発色段階において、サンプル中のEDTA濃度が一定であれば、検量に支障はないが、残念ながら本手法では、海水中に含まれるMgやCaの濃度によりマスキングに使われるEDTA量が異なるため、発色段階のEDTAの濃度は一定とはならず、サンプルの検量を困難なものにする。
【0042】
実験室などでこの手法を用いて、海水のアンモニア態窒素を定量する場合は、大量のEDTAを投入することで、発色前のEDTA濃度の変化を少なくすることが行われているが、あまり大量のEDTAだと発色妨害の影響を大きく受けるため、検量精度が非常に悪くなる。この問題を解決するために、サンプルのNaCl濃度をあらかじめ計測し、その濃度に応じて発色妨害の変動による濃度誤差を補正する方法も提案されているが、NaCl濃度とMgやCa濃度の相関は一意とはいえず、海域や計測期間に応じて関係を検証する必要がある。
【0043】
そこで本手法では、フェノールの代用としてサリチル酸を用いたインドフェノール法を使用した。この手法を用いた場合のEDTAの発色強度に対する影響を検証した結果を図9、10に示す。CaとMgなどを全く含まないアンモニア標準液に対して検量したもの(図9)と、海水に対して検量したもの(図10)で、同量のEDTAを添加している。なお、海水に対する検量は標準添加法で行った。両者に含まれるCaとMg濃度は異なるが、アンモニアイオンに対する発色強度の変量(傾き)は同等であることから、サリチル酸を用いたインドフェノール法が発色する段階のEDTAの濃度に殆ど影響を受けていないことが解かる。これにより、マスキングに必要な必要最低限のEDTAを添加するだけで、標準液を用いた時に作成した検量線を使用しての海水サンプルの検量が可能となる。
【0044】
(Cu-Znカラムの作成方法及び粒子径などによる反応関係)
本法は、銅を皮膜した亜鉛粒を還元カラムに用い、還元時の溶液にEDTAを共存させる。EDTAの高い金属キレート生成能を利用すると、亜鉛粒から溶解して生じた亜鉛イオンは安定な錯体となり、遊離の亜鉛イオンの濃度は著しく低下する。この結果、亜鉛イオン-亜鉛粒の電位は著しく低くなり、還元カラム中の溶液の酸化・還元電位は下がる。その結果硝酸イオン、亜硝酸イオンの還元はアンモニアまで容易に進む。
【0045】
(カラムの作成方法)
(EDTA-CuSO4(aq)の作成)
EDTA・2Na 38gと硫酸銅五水和物12.5gを純水約700mlに溶かし、水酸化ナトリウム溶液(80g/l)を加えてpHを6〜8としてから水を加えて1000mlとする。
【0046】
(亜鉛粒の充填)
内径7mmのチューブを20cm程切り取り、下方の2cm程に綿をつめる。そこに、漏斗などを使用し亜鉛粒を詰め込み、上方から2cm程綿を詰める。最後にチューブジョイントをカラムの両端に取り付け、ぺリスタポンプとカラムをチューブで繋げる。
【0047】
(亜鉛粒の洗浄)
0.1Mの塩酸を約30ml、純水を約70ml混合し、ペリスタポンプを用いて流量3ml/分程度でカラム内に1時間程度流し、酸化された亜鉛粒の表面を洗い流し、活性の高い状態にする。この時、酸により水素が発生するがある程度なら全く問題ない。むしろきれいに表面が洗浄されている証拠である。その後、純水を20分程流し、塩酸を洗浄する。
【0048】
(銅の被膜)
亜鉛粒を洗浄し終わったら、先に作っておいた、EDTA-CuSO4(aq)を一晩(10時間以上)流し、硫酸銅水溶液の色が透明になるまで流す。
【0049】
(カラムの保存)
カラムの保存は亜鉛粒の酸化を防ぐため空気には触れないように注意が必要である。カラムの両端をEDTA-CuSO4(aq)で満たしたシリンジでつなげて、EDTA-CuSO4(aq)でカラム内を満たしておく。長期間放置するとカラム内の水溶液は蒸発することがあるので、注意が必要である。
【0050】
(カラムの設置方法)
カラムは還元操作を行うと多量の水素を発生することがわかっている。したがって、計測の安定性を追求するために、発生した水素がカラム内から随時均等に抜けるように、カラムを立てて計測を行った。本研究では計測時、試料は下から上に流すようにした。
【0051】
(カラムの太さに関する検証)
計測器の小型化、カラム内でのコンタミネーションを極力防ぐ必要があるため、カラム内径を細くして還元率にどのように影響するか調べる実験を行った。
実験は、カラムの内径を3mm、長さを30cmとし、50μmol/lの硝酸イオン標準液を用いて還元操作を行った。その結果、還元率は36%となり内径3mmのカラムでは100%還元しないことがわかった。
【0052】
なお、これらの実験に用いたケースでは、次の条件で行った。今回は使ったポンプの流量に制約があった為、
・サンプル→約4.4ml/分
・EDTA→約1.66ml/分
・NaOH→約0.68ml/分
・試薬→それぞれ約0.6ml/分
(サンプル、EDTA、NaOH、全て合わせて考えると、EDTA濃度は約0.05Mになる。)
で計測を行った。
【産業上の利用可能性】
【0053】
無機態窒素の三態全てをアンモニウムイオンに還元してまとめて一括で定量することができるので、簡便な計測が可能で、海水中の栄養塩を的確に把握することができるとともに、船上でも採取から定量までリアルタイムに定量でき、極めて有用である。
【図面の簡単な説明】
【0054】
【図1】本発明1実施例のDIN計測方法のフロー模式的例示である。
【図2】本発明に用いる還元カラムの正面図である。
【図3】NH4+の検量線の実験結果である。
【図4】標準液と海水とのNH4+の計測線である。
【図5】流れ分析によるDINの検量線である。
【図6】本発明DIN連続計測器による計測値とJISの公定法分析値の相関係数である。
【図7】NaOH滴定実験結果を示す。
【図8】EDTAの最適量検証実験結果を示す。
【図9】アンモニア標準液に対する検量(Mg,Caを含まない)を示す。
【図10】標準添加法による海水に対する検量(Mg,Caを含む)を示す。
【符号の説明】
【0055】
1 還元カラム
2 分光光度計
3 計測側チューブライン
4 コンピュータ
5 試料(サンプル)
6 試料側チューブライン
7、9、11、13、15 ポンプ
8 EDTA
10 NaOH
12 試薬1
14 試薬2
【技術分野】
【0001】
本発明は、海水中における硝酸、亜硝酸、アンモニアなどの溶存態無機窒素(DIN)の連続計測できる方法に関するものである。
【背景技術】
【0002】
近年、沿岸海域で発生している赤潮や貧酸素水塊等の環境問題を解決するためには、環境因子の時間的・空間的変動を詳細に計測し、海域をモニタリングする必要がある。水温や塩分、流速などの物理的環境因子については、連続計測を可能とする技術が開発されてきた。
一方、化学的環境因子である溶存態無機窒素(DIN)は、植物プランクトンによる1次生産の制限因子となるなど、沿岸海域における生態系を考える上で、極めて重要な環境因子である。
しかしながら、DINの定量は、いまだに採水した試料を持ち帰って化学分析するのが一般的であり、採水した現場で自動計測する技術がほとんど開発されていないのが現状である。
海水中におけるDINは、アンモニア態窒素(NH4+)、硝酸態窒素(NO3-)、亜硝酸態窒素(NO2-)の3つの形態(窒素三態)で存在する。
本発明者らは、硝酸イオンと亜硝酸イオンが紫外域に吸光特性を有することから、海水の紫外吸光度を計測することでその濃度を定量する手法を提案している(特許文献1および非特許文献1)
この手法は、化学的な処理を必要とせず、時間応答性に優れていることから、栄養塩計測には極めて有効であるが、アンモニウムイオンを計測することができない。
また、アンモニウムイオンは沿岸海域において比較的高濃度であり、DINの中でも植物プランクトンや藻類の基礎生産において最も関係のある物質であるが、アンモニウムイオンが紫外域に吸光特性を有さないことから、紫外吸光光度法を用いた計測手法が総DINの計測手法として十分であるとは言い難い。
【0003】
更に、特許文献2には、廃水中のアンモニア態窒素濃度を測定するアンモニア態窒素測定器として、演算式にて求める方法を示している。
また、特許文献3には、ガス透過性膜を備えた反応室に蛍光反応試薬を導き、一方キャリアーとしての緩衝液に試料溶液を混入し、試料溶液中のアンモニウムイオン、硝酸イオン及び亜硝酸イオンをアンモニアに変じた上で上記の反応室に導き上記のガス透過性膜を経てアンモニアと蛍光反応試薬とを反応させ、生成した蛍光物質の蛍光を検出し、蛍光強度の時間的変化を測定し、この測定値と上記のイオン濃度との関係を示す検量線に照合することを特徴とする窒素化合物イオンの高感度測定法による測定方法が示されている。
【0004】
また、特許文献4には、水中のアンモニウムイオン濃度の測定方法として、アンモニウムイオンの発色試薬としてインドナフトール青を用いて濃度測定する方法が示されている。
【0005】
【特許文献1】特願2006−333494号公報
【特許文献2】特開平8−197076号公報
【特許文献3】特開平11−125600号公報
【特許文献4】特開2007−278921号公報
【非特許文献1】「Measurement Method For Nutrient by Ultraviolet Spectrometry」(Rei Araiら、ISOPE、2007)
【発明の開示】
【発明が解決しようとする課題】
【0006】
DINは、アンモニア態窒素(NH4+)、硝酸態窒素(NO3-)および亜硝酸態窒素(NO2-)の3つの形態(窒素三態)で存在する。これら窒素三態のうち、硝酸態窒素(NO3-)および亜硝酸態窒素(NO2-)は、紫外域に吸光特性を有することから、化学的な処理を必要とせず、海水の紫外吸光度を計測することでその濃度を定量でき、かつ時間応答性に優れている。しかしながら、アンモニウムイオンを直接計測することができないことから、総DINの計測には有効ではない。
分析化学の分野において、サンプルや試薬等を定量ポンプで流し、化学反応させることで自動的に物質の濃度を定量する手法にフロージェクション手法(FI)と呼ばれるものがあり、現在広く用いられている。
そこで、本発明者らは、採取したばかりの海水中に含まれる窒素の全体量であるDINを連続的に簡易に多点計測することは重要であると考え新規な海水中のDINの測定方法および測定装置の開発を課題とした。
すなわち、本発明者らは、還元工程を用いて海水中の硝酸イオンと亜硝酸イオンの全てをアンモニウムイオンまで還元し、DINを連続的な測定方法および測定装置の開発を課題とした。
【課題を解決するための手段】
【0007】
しかるに、本発明によれば、海水試料にキレート化剤溶液を加えてマグネシウム、カルシウムなどの金属イオンを捕捉し、
次に、銅被覆した亜鉛粒子とアルカリ条件下に接触させ、海水中に溶存する硝酸イオンおよび亜硝酸イオンを還元してアンモニウムイオンとし、
生成したアンモニウムイオンと、元来海水試料中に溶存したアンモニウムイオンとをサリチル酸を用いたインドフェノール法により定量することを特徴とする、海水中の溶存態無機窒素の測定方法が提供される。
【0008】
また、別の観点によれば、本発明によれば、本発明の第1の解決手段が、海水中の溶存態無機窒素を流れ分析によって測定する場合であって、(1)海水試料の前処理部、(2)反応部、(3)検出部を備え、
(1)前処理部において、海水試料中にEDTA(エチレンジアミン四酢酸二ナトリウム2水和物、以下EDTAと略記)を添加することにより、マグネシウム、カルシウムイオンをマスキングし、次の還元工程を経て、海水中の硝酸イオン、亜硝酸イオン、アンモニウム態を還元して、アンモニウムイオンとする工程、
(2)反応部において、これら処理した試料にサリチル酸を用いたサリチル酸ナトリウム溶液とジクロロイソシアヌル酸ナトリウム溶液を添加して発色させる工程、
(3)これらの試料を吸光光度法により、アンモニウムイオン濃度をDINの濃度として濃度測定する工程、
を備える測定方法が提供される。
【0009】
更に、前項における還元工程として、亜鉛粒に銅被覆した粒子を多数充填したカラムに試料を流す工程としたことを特徴とする。
【0010】
また、EDTAは試料とともに還元工程中に入り、この中で酸化還元電位を下げる作用をすることを特徴とする。
【0011】
更にまた、前記EDTAを海水中に添加したのち還元工程までにNaOH水溶液を添加する工程を備えることを特徴とする。
【0012】
本発明の第2の解決手段は、還元工程に使用するカラムは柱状とし、長さ方向を縦立にして中に生じたガスを上に抜けるような構造としたことを特徴とする。
【0013】
更に、前記亜鉛粒の粒子径は0.5〜2.0mmの範囲とすることを特徴とする。
【0014】
また、アンモニウムイオンの検出は、650nmの波長を用いて光度法により計測することを特徴とする。
【発明の効果】
【0015】
無機態窒素の三態全てをアンモニウムイオンに還元してまとめて一括で定量することができるので、簡便な計測が可能で、海水中の栄養塩を的確に把握することができるとともに、船上でも採取から定量までリアルタイムに定量できるので、極めて有用である。
【発明を実施するための最良の形態】
【0016】
図1は、本発明1実施例のDIN計測方法のフロー模式的例示である。
図1において、1は窒素酸化物還元カラムであり、2は吸光光度計(分光光度計)であり、アンモニウムイオンを計測する装置である。
これらの間はタイゴン製チューブライン3で接続されている。4は分光結果を記録するコンピュータである。流れ分析としては、海水をポンプ(図示せず)で吸い上げ、ろ過して固形物を除去し、海水試料5とし、ポンプ7を用いてチューブライン6を通して還元カラム1に接続されている。このチューブライン6には、EDTA試薬8がポンプ9を通して注入される。
【0017】
一方、このチューブライン6には、EDTAの注入箇所より後で、かつ還元カラム1の手前のところでNaOH水溶液10がポンプ11を通してチューブライン6に注入され得る。
前処理工程でアンモニウムイオンに還元したのちは、サリチル酸ナトリウム溶液(試薬1)12がポンプ13を通してチューブライン3に注入され、その後ライン箇所にてジクロロイソシアヌル酸ナトリウム溶液(試薬2)14がポンプ15を通してチューブライン3に注入される。
なお、本発明において用いられている用語「流れ分析」とは、現場で、本発明による測定方法および/または測定装置を用いて、採水したばかりの海水試料を用いて、該試料中に含まれる溶存態無機窒素を定量分析することを意味する。
【0018】
図2は、アンモニウムイオン還元カラムの実施例正面図であり、21はタイゴンチューブ製の柱状還元カラムであり、22はカラムの蓋であり、23はカラムの底蓋である。
このカラムは、垂直方向に設置されており、その中には、粒子径1mmの銅被覆した亜鉛粒子が充填されている。このカラムの下部が試料側チューブ6に接続されており、上部は計測側チューブ3に接続されている。尚、銅被覆された亜鉛粒子の粒径は、0.5〜2.0mmの範囲で適用可能である。
【0019】
本発明では、還元部とアンモニア定量部の2つの部分からなる。前者は、銅―亜鉛(以下、Cu-Znとも表す)還元カラムを用いて、試料中の硝酸態窒素と亜硝酸態窒素をすべてアンモニア態窒素に還元する。後者は、試料中のDINである、アンモニア態窒素の総量を、流れ分析を用いてインドフェノールブルー法で定量するシステムである。
【0020】
(計測準備)
Cu-Zn還元カラムにアルカリ硫酸銅水溶液を流速2ml/分で10分程度流し入れ、劣化した還元カラムを復活させる。ただし、長期間カラムを使用していないときは、希塩酸で10分程度カラムを洗浄し、純水で希塩酸を洗い流してから、アルカリ硫酸銅水溶液を流し入れる。
【0021】
(計測開始と手順)
(1) ポンプでサンプルを吸い上げ、そこに別のポンプで吸い上げたEDTA溶液とNaOH溶液をチューブの中で混合させる。
(2) EDTA、NaOHを含んだサンプルをCu-Zn還元カラムに流し入れ、サンプル中の硝酸態窒素、亜硝酸態窒素の全てをアンモニア態窒素に還元する。
(3) チューブ内で反応させ、650nmにて吸光度計測器で計測する。
(4) 廃液は廃液タンクに入れ、実験室に持ち帰る。
【0022】
(注意事項)
(1) カラム中の銅被覆亜鉛粒子は、空気に触れると表面が酸化し、還元率に影響を与える可能性があるので、空気に触れないように計測期間中注意を払う。もちろんカラム作成や、カラム洗浄中も同様である。
(2) サリチル酸試薬、ジクロロ試薬共に直射日光を避け、屋外での計測の際は試薬パックとチューブにアルミホイルを巻く。
【0023】
分析化学の分野において、サンプルや試薬等を定量ポンプで流し、化学反応させることで自動的に物質の濃度を定量する手法としてフロージェクション手法(FI)を用いるにあたり、試料に前処理を施す部分、前処理された試料に化学反応で発色させる反応部、それらの試料を検出する検出部の3つの部分、即ち、流れ分析を検出部、前処理部、反応部に分け前処理部と反応部についてモニタリングに適した手法を検討し、検証実験を行った。なお、検出部においては、検出対象の選択性の高さ、検出器の簡便性などを考慮し吸光光度法を用いた。これらについて、本発明に適用することを検証した。
【0024】
(前処理部の検討および検証実験)
DINの定量手法には、硝酸イオンと亜硝酸イオンをCu-Cd還元法、亜鉛還元法、紫外吸光光度法などで一括して定量し、残るアンモニア態を別に定量して合算する手法も考えられるが、これらは安全面や還元率、精度などを検討した結果、モニタリングには適していないことが分かった。
システムの簡便化からしても三態をまとめて定量する手法が適していると考え、一括で定量する手法を検討した。三態の窒素を全てまとめて定量する場合には、全ての窒素を三態のうちどれか1つの形態にする必要がある。しかし、硝酸イオンは直接定量する手法がない点、また亜硝酸イオンにするには硝酸イオンに酸化し再び亜硝酸イオンに還元する必要がある点などの手間を考えると、三態全てをアンモニウムイオンに還元する手法が適していると考えられる。三態をアンモニウムイオンまで還元する手法には、NaCl還元法とCu-Zn還元法が報告されているが、NaCl還元法は還元率が低く安定しないため、Cu-Zn還元法を選択した。以上の検討結果をまとめると表1となる。
【0025】
【表1】

【0026】
前処理部における本発明のCu-Zn還元カラムにおいて、硝酸イオン、亜硝酸イオンが十分に安定してアンモニウムイオンに還元するかを検証するための実験を行った。今回製作したCu-Zn還元カラムは直径1mm程度の亜鉛粒に銅を被膜し、それを直径7mmのチューブに充填したもので、高い金属キレート形成能を持つEDTA溶液を試料に混合し、流量1〜2ml/分でカラムに流し入れることで硝酸イオン及び亜硝酸イオンをアンモニウムイオンまで還元する。このカラムの性能を検証するために、還元率・回収率・耐久性の三つの観点から実験を行った。
まず、Cu-Zn還元カラムによる硝酸態窒素及び亜硝酸態窒素の還元率を調べる実験を行った。還元実験は、沿岸海域における硝酸イオン、亜硝酸イオン濃度を想定し、20μmo/Lの硝酸イオン標準溶液および10μmo/Lの硝酸イオン標準溶液を各々Cu-Zn還元カラムに通してアンモニウムイオンに還元し、アンモニウムイオンを定量することで、その還元率を求めた。標準液は硝酸ナトリウムと亜硝酸ナトリウムの特級試薬(キシダ化学株式会社)を計量し、イオン交換水で希釈し調整した。結果は、表2に示すように硝酸イオン、亜硝酸イオンともに100%還元できることが確かめられた。
【0027】
【表2】

【0028】
次に、海水中の共存物質の還元率への影響を調べるために、硝酸態窒素の回収率を検証する実験を行った。実験には、兵庫県尼崎港において採水した試料(海水)に硝酸態窒素標準液を適当量標準添加し、前述の還元操作を行った。その結果を表3に示す。海水に添加した硝酸態窒素はアンモニウムイオンとして良好に回収できており、海水中の共存物質の影響を全く受けずに、Cu-Zn還元カラムで硝酸態窒素が十分に還元されることが検証できた。以上のことから、海水中の硝酸態窒素および亜硝酸態窒素はCu-Zn還元カラムを用いて100%還元されるため、海水中のDINの定量が可能であることが明らかになった。
【0029】
【表3】

【0030】
連続計測を行うためにはCu-Zn還元カラムの耐久性を把握する必要がある。そのため、硝酸態窒素標準液100μmol/lを24時間、200μmol/lを12時間、400μmol/lを12時間の計48時間、1ml/分で流し続け、カラムの耐久性を検証する実験を行い還元率の低下を調べた。
その結果、高濃度の試料を48時間流しても吸光度の低下は見られず、還元率は全く落ちないことが確認できた。今回作成したCu-Zn還元カラムが硝酸イオン、亜硝酸イオンをアンモニウムイオンに還元できる量は、窒素として576μmol以上はあることがわかった。これは100μmol/Lの試料を1回の計測あたり4ml使用し、10分間隔で計測を行ったとしても10日間は安定した還元率が得られることを示している。したがって、頻繁にカラムの交換を行う必要がないため、モニタリングに適した手法であるといえる。
【0031】
(反応部の検討および検証実験)
吸光光度法によるアンモニウムイオンの分析方法としては、フェノールを用いた分析方法が一般的であり、国内ではJIS、上水試験法、衛生試験法等で広く用いられている。しかし、フェノールは毒性の有機溶媒であることから、取り扱いに細心の注意が必要となるため、現地観測に適しているとは言い難い。そこで、本手法の反応部では食品等の防腐剤にも用いられているサリチル酸を用いたインドフェノール法を用い、反応部の検証実験を行った。
検証実験は、沿岸海域に含まれるアンモニウムイオン濃度を想定し、0〜100μmol/Lの範囲で5種類の標準溶液を反応部に流し込み、サリチル酸によるインドフェノール法で発色させ、吸光光度法により検量することで行った。アンモニウムイオンの標準液は塩化アンモニウムの特級試薬(キシダ化学株式会社)をイオン交換水で希釈し、調整した。
図3に示したNH4+の検量線の実験結果より、アンモニウムイオンと吸光度から良好な直線が得られ、サリチル酸を用いたインドフェノール法の流れ分析への適用は可能であることが確認できた。
【0032】
海水中には上記標準溶液と異なりマグネシウムイオンとカルシウムイオンが含まれている。これらマグネシウムイオンやカルシウムイオンは、インドフェノール法により発色させるpH13程度において白沈するため、吸光度を検出する際の妨害となることが知られている。
分析化学の分野では、EDTAを添加し、マグネシウムイオンとカルシウムイオンをキレートにすることで白沈を防ぐ手法が良く用いられる。
しかし、一方で、EDTAはインドフェノール法による発色強度を弱める、いわゆる発色妨害を起こす物質であると報告されている。すなわち、海水試料中に含まれるマグネシウムやカルシウムの量により、反応部に流入してくる試料中のEDTAの量が異なるため、反応部における発色強度が、アンモニウムイオンとは無関係に影響を受ける可能性がある。この影響を検証するため、妨害イオンであるマグネシウムイオンやカルシウムイオンを含まない、濃度の異なるアンモニウムイオン標準溶液と海水の発色強度を比較する実験を行った。
なお、海水にはアンモニウムイオン標準溶液を適宜、添加することで各種アンモニウムイオン濃度の海水試料とした。
【0033】
図4に示した標準液と海水とのNH4+の計測線の実験結果より、アンモニウムイオン標準液と海水中に含まれるアンモニウムイオンの濃度に対する発色強度の勾配に有意な差は確認されなかった。これにより反応部における、サリチル酸を用いたインドフェノール法はEDTAによる発色妨害の影響を受けず、海水に含まれるアンモニウムイオン濃度を安定して計測することが可能であることが確認できた。
【0034】
作成したDIN連続計測器が前処理部、反応部を通してDINを精度良く計測できるかを確認するために、DINの検量を行った。沿岸海水中に含まれるDIN濃度を想定した濃度の硝酸態イオン標準液を用いて検量した。流れ分析によるDINの検量線結果を図5に示す。良好な検量線が得られ、本計測装置の前処理部で硝酸イオンがアンモニウムイオンに還元され、反応部で安定して発色されており、本計測器で問題なくDINを検量できることが確認できた。
【0035】
海洋における実際の計測を実施した。計測は、海洋において、海水の表層水を汲み上げるポンプが装備され、ポンプで汲み上げた海水試料を用いてDINの計測を10分間隔で行った。同時に、水温、アレック社製Compact-CTを用い塩分とアレック社製Compact-CLWを用いクロロフィル濃度の計測も行った。また、
DIN連続計測器により計測された値の検証するため、5試料は持ち帰りJISによる化学分析に供しDIN濃度を定量した。DIN連続計測器による計測値とJISの公定法による分析値は図6の相関係数に示すように相関係数0.98と良好な結果が得られたことから、本海域におけるDIN濃度を連続計測できていることが確認できた。
【0036】
(Cu-Znカラムを用いたDIN連続計測に際するEDTA量の検証)
本計測で用いるサリチル酸法はpH11前後でもっとも強い発色強度を持つことが知られている。また、還元剤として必要なEDTAの量は、全体の溶液(サンプル+NaOH溶液+EDTA溶液)で考えて0.01Mである。(約pH10〜11の範囲において、サンプル容量10に対して、約0.52のEDTA(0.2M)が必要となる) そこで、EDTA0.01MにおいてpH11前後になるために必要なNaOH(pH調整剤)の最適量を求めるためのEDTA溶液に対するNaOH滴定実験をおこなった。その結果を図7および表4に記す。
【0037】
【表4】

【0038】
さらに海水中に含まれるアンモニアの定量を行う際にはCaやMgによる白沈を抑えるために、通常、クエン酸やEDTAが用いられるが、本手法ではEDTAを添加することで、EDTAに還元促進剤とマスキング剤という二つの役割をもたせた効果が大きいことが判った。
【0039】
白沈を抑えるのに必要なEDTAの最適量を求めるために、EDTAの滴定実験を行った。滴定対象試料は最もMgやCaが含まれると考えられる、沿岸域における尼崎港の海水を用いた。図8および表5から白沈を抑えるためには、海水サンプル10に対してEDTA3が必要であり、さらに上記図7のpH調整実験結果から、NaOH1.31が妥当であった。
(サンプル、EDTA、NaOH、全て合わせて考えると、EDTA濃度は約0.04Mになる。)
【0040】
【表5】

【0041】
(サリチル酸を用いたインドフェノールブルー法の検証)
アンモニアの定量にはフェノールを用いたインドフェノール法が一般(JIS)に用いられる。
しかしながら、このフェノールを用いる手法は、本手法で用いるEDTAにより発色妨害を受けることが知られており、さらにEDTAの濃度によって発色強度が大きく異なる。反応部の発色段階において、サンプル中のEDTA濃度が一定であれば、検量に支障はないが、残念ながら本手法では、海水中に含まれるMgやCaの濃度によりマスキングに使われるEDTA量が異なるため、発色段階のEDTAの濃度は一定とはならず、サンプルの検量を困難なものにする。
【0042】
実験室などでこの手法を用いて、海水のアンモニア態窒素を定量する場合は、大量のEDTAを投入することで、発色前のEDTA濃度の変化を少なくすることが行われているが、あまり大量のEDTAだと発色妨害の影響を大きく受けるため、検量精度が非常に悪くなる。この問題を解決するために、サンプルのNaCl濃度をあらかじめ計測し、その濃度に応じて発色妨害の変動による濃度誤差を補正する方法も提案されているが、NaCl濃度とMgやCa濃度の相関は一意とはいえず、海域や計測期間に応じて関係を検証する必要がある。
【0043】
そこで本手法では、フェノールの代用としてサリチル酸を用いたインドフェノール法を使用した。この手法を用いた場合のEDTAの発色強度に対する影響を検証した結果を図9、10に示す。CaとMgなどを全く含まないアンモニア標準液に対して検量したもの(図9)と、海水に対して検量したもの(図10)で、同量のEDTAを添加している。なお、海水に対する検量は標準添加法で行った。両者に含まれるCaとMg濃度は異なるが、アンモニアイオンに対する発色強度の変量(傾き)は同等であることから、サリチル酸を用いたインドフェノール法が発色する段階のEDTAの濃度に殆ど影響を受けていないことが解かる。これにより、マスキングに必要な必要最低限のEDTAを添加するだけで、標準液を用いた時に作成した検量線を使用しての海水サンプルの検量が可能となる。
【0044】
(Cu-Znカラムの作成方法及び粒子径などによる反応関係)
本法は、銅を皮膜した亜鉛粒を還元カラムに用い、還元時の溶液にEDTAを共存させる。EDTAの高い金属キレート生成能を利用すると、亜鉛粒から溶解して生じた亜鉛イオンは安定な錯体となり、遊離の亜鉛イオンの濃度は著しく低下する。この結果、亜鉛イオン-亜鉛粒の電位は著しく低くなり、還元カラム中の溶液の酸化・還元電位は下がる。その結果硝酸イオン、亜硝酸イオンの還元はアンモニアまで容易に進む。
【0045】
(カラムの作成方法)
(EDTA-CuSO4(aq)の作成)
EDTA・2Na 38gと硫酸銅五水和物12.5gを純水約700mlに溶かし、水酸化ナトリウム溶液(80g/l)を加えてpHを6〜8としてから水を加えて1000mlとする。
【0046】
(亜鉛粒の充填)
内径7mmのチューブを20cm程切り取り、下方の2cm程に綿をつめる。そこに、漏斗などを使用し亜鉛粒を詰め込み、上方から2cm程綿を詰める。最後にチューブジョイントをカラムの両端に取り付け、ぺリスタポンプとカラムをチューブで繋げる。
【0047】
(亜鉛粒の洗浄)
0.1Mの塩酸を約30ml、純水を約70ml混合し、ペリスタポンプを用いて流量3ml/分程度でカラム内に1時間程度流し、酸化された亜鉛粒の表面を洗い流し、活性の高い状態にする。この時、酸により水素が発生するがある程度なら全く問題ない。むしろきれいに表面が洗浄されている証拠である。その後、純水を20分程流し、塩酸を洗浄する。
【0048】
(銅の被膜)
亜鉛粒を洗浄し終わったら、先に作っておいた、EDTA-CuSO4(aq)を一晩(10時間以上)流し、硫酸銅水溶液の色が透明になるまで流す。
【0049】
(カラムの保存)
カラムの保存は亜鉛粒の酸化を防ぐため空気には触れないように注意が必要である。カラムの両端をEDTA-CuSO4(aq)で満たしたシリンジでつなげて、EDTA-CuSO4(aq)でカラム内を満たしておく。長期間放置するとカラム内の水溶液は蒸発することがあるので、注意が必要である。
【0050】
(カラムの設置方法)
カラムは還元操作を行うと多量の水素を発生することがわかっている。したがって、計測の安定性を追求するために、発生した水素がカラム内から随時均等に抜けるように、カラムを立てて計測を行った。本研究では計測時、試料は下から上に流すようにした。
【0051】
(カラムの太さに関する検証)
計測器の小型化、カラム内でのコンタミネーションを極力防ぐ必要があるため、カラム内径を細くして還元率にどのように影響するか調べる実験を行った。
実験は、カラムの内径を3mm、長さを30cmとし、50μmol/lの硝酸イオン標準液を用いて還元操作を行った。その結果、還元率は36%となり内径3mmのカラムでは100%還元しないことがわかった。
【0052】
なお、これらの実験に用いたケースでは、次の条件で行った。今回は使ったポンプの流量に制約があった為、
・サンプル→約4.4ml/分
・EDTA→約1.66ml/分
・NaOH→約0.68ml/分
・試薬→それぞれ約0.6ml/分
(サンプル、EDTA、NaOH、全て合わせて考えると、EDTA濃度は約0.05Mになる。)
で計測を行った。
【産業上の利用可能性】
【0053】
無機態窒素の三態全てをアンモニウムイオンに還元してまとめて一括で定量することができるので、簡便な計測が可能で、海水中の栄養塩を的確に把握することができるとともに、船上でも採取から定量までリアルタイムに定量でき、極めて有用である。
【図面の簡単な説明】
【0054】
【図1】本発明1実施例のDIN計測方法のフロー模式的例示である。
【図2】本発明に用いる還元カラムの正面図である。
【図3】NH4+の検量線の実験結果である。
【図4】標準液と海水とのNH4+の計測線である。
【図5】流れ分析によるDINの検量線である。
【図6】本発明DIN連続計測器による計測値とJISの公定法分析値の相関係数である。
【図7】NaOH滴定実験結果を示す。
【図8】EDTAの最適量検証実験結果を示す。
【図9】アンモニア標準液に対する検量(Mg,Caを含まない)を示す。
【図10】標準添加法による海水に対する検量(Mg,Caを含む)を示す。
【符号の説明】
【0055】
1 還元カラム
2 分光光度計
3 計測側チューブライン
4 コンピュータ
5 試料(サンプル)
6 試料側チューブライン
7、9、11、13、15 ポンプ
8 EDTA
10 NaOH
12 試薬1
14 試薬2
【特許請求の範囲】
【請求項1】
海水試料にキレート化剤溶液を加えてマグネシウム、カルシウムなどの金属イオンを捕捉し、
次に、銅被覆した亜鉛粒子とアルカリ条件下に接触させ、海水中に溶存する硝酸イオンおよび亜硝酸イオンを還元してアンモニウムイオンとし、
生成したアンモニウムイオンと、元来海水試料中に溶存したアンモニウムイオンとをサリチル酸を用いたインドフェノール法により定量することを特徴とする、海水中の溶存態無機窒素の測定方法。
【請求項2】
前記キレート化剤が、EDTAである請求項1に記載の海水中の溶存態無機窒素の測定方法。
【請求項3】
前記アルカリ条件が、NaOH溶液の添加による請求項1に記載の海水中の溶存態無機窒素の測定方法。
【請求項4】
前記銅被覆した亜鉛粒子が、垂直に設置された柱状カラムに充填されており、海水試料が該カラムの下部から送入され、該カラム中に生じるガスと共にカラムの上部から流出される請求項1に記載の海水中の溶存態無機窒素の測定方法。
【請求項5】
前記銅被覆した亜鉛粒子が、0.5〜2.0mmの粒子径を有する請求項1に記載の海水中の溶存態無機窒素の測定方法。
【請求項6】
前記インドフェノール法による定量が、650nmの波長を用いる吸光光度法により測定される請求項1に記載の海水中の溶存態無機窒素の測定方法。
【請求項1】
海水試料にキレート化剤溶液を加えてマグネシウム、カルシウムなどの金属イオンを捕捉し、
次に、銅被覆した亜鉛粒子とアルカリ条件下に接触させ、海水中に溶存する硝酸イオンおよび亜硝酸イオンを還元してアンモニウムイオンとし、
生成したアンモニウムイオンと、元来海水試料中に溶存したアンモニウムイオンとをサリチル酸を用いたインドフェノール法により定量することを特徴とする、海水中の溶存態無機窒素の測定方法。
【請求項2】
前記キレート化剤が、EDTAである請求項1に記載の海水中の溶存態無機窒素の測定方法。
【請求項3】
前記アルカリ条件が、NaOH溶液の添加による請求項1に記載の海水中の溶存態無機窒素の測定方法。
【請求項4】
前記銅被覆した亜鉛粒子が、垂直に設置された柱状カラムに充填されており、海水試料が該カラムの下部から送入され、該カラム中に生じるガスと共にカラムの上部から流出される請求項1に記載の海水中の溶存態無機窒素の測定方法。
【請求項5】
前記銅被覆した亜鉛粒子が、0.5〜2.0mmの粒子径を有する請求項1に記載の海水中の溶存態無機窒素の測定方法。
【請求項6】
前記インドフェノール法による定量が、650nmの波長を用いる吸光光度法により測定される請求項1に記載の海水中の溶存態無機窒素の測定方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【公開番号】特開2009−115758(P2009−115758A)
【公開日】平成21年5月28日(2009.5.28)
【国際特許分類】
【出願番号】特願2007−292202(P2007−292202)
【出願日】平成19年11月9日(2007.11.9)
【出願人】(505127721)公立大学法人大阪府立大学 (688)
【Fターム(参考)】
【公開日】平成21年5月28日(2009.5.28)
【国際特許分類】
【出願日】平成19年11月9日(2007.11.9)
【出願人】(505127721)公立大学法人大阪府立大学 (688)
【Fターム(参考)】
[ Back to top ]

