液体から溶存酸素を除去する方法、所定の溶存酸素濃度を有する液体の調製方法及び溶存酸素濃度の測定方法
【課題】溶存酸素を除去した液体の調製方法、及び溶存酸素の除去装置を提供。
【解決手段】以下の工程を含む溶存酸素を除去した液体の調製方法:(1)メタピロカテカーゼ固定化体に4−クロロカテコール溶液を接触させる工程、及び(2)工程(1)で得られた溶液とアニオン交換体を接触させる工程、並びにメタピロカテカーゼを固定化した固定化体と前記固定化体の下流側に配置されたアニオン交換体充填体を有する酸素除去モジュールを備えることを特徴とする溶存酸素の除去装置。
【解決手段】以下の工程を含む溶存酸素を除去した液体の調製方法:(1)メタピロカテカーゼ固定化体に4−クロロカテコール溶液を接触させる工程、及び(2)工程(1)で得られた溶液とアニオン交換体を接触させる工程、並びにメタピロカテカーゼを固定化した固定化体と前記固定化体の下流側に配置されたアニオン交換体充填体を有する酸素除去モジュールを備えることを特徴とする溶存酸素の除去装置。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、液体から溶存酸素を除去する方法、所定の溶存酸素濃度を有する液体の調製方法、及び試料中の溶存酸素濃度の測定方法に関する。更に、本発明は、溶存酸素の除去装置、及び溶存酸素濃度の測定装置に関する。
【背景技術】
【0002】
ヒトの体内の遊離型酸素濃度は、動脈血で約150μmol/L、毛細血管と末梢組織でそれぞれ約80μmol/Lと30〜40μmol/L、末梢での最低必要濃度は1〜10μmol/Lで、これより低くなると組織の破壊が起こる。また、大腸菌などは酸素濃度が1μmol/L未満になると酸素を使わないエネルギー代謝(嫌気的呼吸)にシフトし、一方、偏性嫌気性菌は、酸素濃度が0.1μmol/Lを超えると酸素の毒性に耐えられなくなる。このように、0.1〜40μmol/Lの低い溶存酸素濃度領域は生物学的に特に重要である。しかし、大気中に大量の酸素が存在するため、大気中の酸素の試料への流入を防ぐことが技術的に難しく、試料が微量になるほど、試料を入れる容器の壁面が試料の体積に対して大きくなるため、壁に残留する微細な空気や、容器の気密性の低い部分(試料や試薬を加える通路となる部分)からの酸素の流入の影響が非常に大きくなる。このため、微量試料、特に100μL未満の水溶液の溶存酸素濃度を空気飽和レベルよりはるかに低い、上記の生理的濃度に直接制御する方法やその濃度を絶対測定する方法は、未だ確立されていない。
【0003】
上記のように溶存酸素濃度は、ヒトを含むすべての生物にとって最も重要な環境要素である。ほとんどの微生物や体内の細胞は、空気飽和(室温なら約250μmol/L)レベルの遊離型酸素濃度よりもはるかに低い酸素濃度下で生きており、酸素不足のストレスにさらされている(図1参照)。そのために、環境の酸素濃度を複数の検出系で常にモニターし、低酸素にすぐに対応できる仕組みを持っている。これらの仕組みを解明し、環境問題や臨床に生かしていくためには、微量の組織や細胞や微生物を小さな反応槽や培養槽に入れて、その緩衝液/灌流液中の酸素濃度を低い濃度で自由にコントロールし、組織や細胞や微生物に起こる形態的変化や代謝の変化を総合的に調べる必要がある。反応槽や培養槽の溶存酸素濃度を絶対測定できる方法も必要である。大気からの酸素の流入を防ぐことができる気密性の高いミクロ反応槽/培養槽の開発も不可欠である。
【0004】
現在、緩衝液/灌流液中の溶存酸素を除く方法としては、窒素ガスやアルゴンガスを溶液中に直接バブリングする方法、酸素透過膜を介して減圧する方法、及びジチオナイト(別名ハイドロサルファイトナトリウム、Na2S2O4)を添加する方法が存在する。
【0005】
しかしながら、上記の方法には、窒素やアルゴンのバブリングで完全に溶存酸素を除去するのは困難、試料が窒素やアルゴンガスで飽和した状態になり非生理的である、酸素透過膜を介しての減圧で酸素を完全に除去するのは困難、溶存酸素を完全に除去するには過剰のジチオナイトが必要で未反応のジチオナイトが調べたい酸化還元反応を妨害する、ジチオナイトと酸素の反応は非常に複雑で反応中間体や生成物の予期しない影響が起こり得る等の問題がある。
【0006】
また、現在、緩衝液/灌流液中の溶存酸素を制御する方法としては、緩衝液/灌流液を、例えば5%酸素、10%炭酸ガス、85%窒素のように、正確な酸素濃度の混合ガスと直接接触させることで溶存酸素濃度を変える方法、及びアスコルビン酸オキシダーゼとアスコルビン酸のように、密閉した反応槽や培養槽の中で酵素反応で溶存酸素を消費して酸素濃度を変える方法が存在する。
【0007】
しかしながら、上記の方法には、正確な酸素分圧を持つ混合ガスが必要、酸素の溶解度は温度などで変動するので溶存酸素濃度そのものを直接制御していない、アスコルビン酸オキシダーゼのように酵素を使う方法では反応系に本来ない酵素や反応生成物(デヒドロアスコルビン酸)を加えることになる等の問題がある。
【0008】
シュードモナス・プチダ(Pseudomonas putida)由来のメタピロカテカーゼ(metapyrocatechase, Mpc)は、図2に示されているように4-クロロカテコール(4-chlorocatechol, 4CC)が酸素分子と反応して酸素分子の2個の酸素原子を取り込んだ5-クロロ-2-ヒドロキシムコン酸セミアルデヒド(5-chloro-2-hydroxymuconate semialdehyde, P4cc)を生成する反応(2原子酸素添加反応という)を触媒する。この反応は不可逆で、過剰の4CCが存在すると全ての酸素分子が同数のP4cc分子にトラップされるまで進行する。Mpcの触媒活性は非常に高く、酸素分子に対するKm値が10μM未満と小さいので、酸素濃度が低くても上記酵素反応は非常に速く進行する。また、4CCに対するKm値が数μM未満と小さく、酸素分子よりもわずかに過剰量あるだけでも上記酵素反応は非常に速く進行する(非特許文献1)。また、P4cc分子は非常に安定で可視部に非常に強い光吸収を示すため、その濃度を高感度に正確に測定できる。それ故、本発明者らは当該酵素反応を使用することで水溶液の酸素濃度が測定できることを報告している(非特許文献2参照)。
【先行技術文献】
【非特許文献】
【0009】
【非特許文献1】T. Ishida, H. Tanaka, and K. Horiike, J. Biochem., 135, 721-730(2004)
【非特許文献2】H. Nakajima, T. Ishida, H. Tanaka, and K. Horiike, J. Biochem., 131, 523-531(2002)
【発明の概要】
【発明が解決しようとする課題】
【0010】
そこで、本発明は、従来技術の問題点が改善された、溶存酸素を除去した液体の調製方法、所定の溶存酸素濃度を有する液体の調製方法、及び溶存酸素の除去装置を提供することを目的とする。更に、本発明は、溶存酸素濃度が低い試料であっても溶存酸素濃度の絶対測定が可能な、溶存酸素濃度の測定方法、及び溶存酸素濃度の測定装置を提供することを目的とする。
【課題を解決するための手段】
【0011】
本発明者らは、メタピロカテカーゼを固定化した固定化体に4-クロロカテコール溶液を接触させて酸素をP4ccに変換させ、このP4ccをアニオン交換樹脂を用いて除去することにより、溶存酸素が除去された溶液を調製することができ、上記目的を達成することができるという知見を得た。また、当該溶存酸素が除去された溶液を利用することによって、溶存酸素濃度の制御、及び試料中の溶存酸素濃度の測定が可能になり上記目的を達成することができるという知見も得た。
【0012】
本発明は、これら知見に基づき、更に検討を重ねて完成されたものであり、次の溶存酸素を除去した液体の調製方法、所定の溶存酸素濃度を有する液体の調製方法、試料中の溶存酸素濃度の測定方法等を提供するものである。
【0013】
項1.以下の工程を含む溶存酸素を除去した液体の調製方法:
(1)メタピロカテカーゼ固定化体に4-クロロカテコール溶液を接触させる工程、及び
(2)工程(1)で得られた溶液とアニオン交換体を接触させる工程。
【0014】
項2.以下の工程を含む所定の溶存酸素濃度を有する液体の調製方法:
(1)メタピロカテカーゼ固定化体に4-クロロカテコール溶液を接触させる工程、
(2)工程(1)で得られた溶液とアニオン交換体を接触させる工程、及び
(3)所定の溶存酸素濃度が得られる比率で、工程(2)で得られた溶液と、溶存酸素を含む液体を混合する工程。
【0015】
項3.以下の工程を含む試料中の溶存酸素濃度の測定方法:
(1)メタピロカテカーゼ固定化体に4-クロロカテコール溶液を接触させる工程、
(2)工程(1)で得られた溶液とアニオン交換体を接触させる工程、
(3)工程(2)で得られた溶液と試料を混合する工程、
(4)工程(3)で得られた試料をメタピロカテカーゼ固定化体に接触させる工程、及び
(5)工程(4)で生成する5-クロロ-2-ヒドロキシムコン酸セミアルデヒド量を測定する工程。
【0016】
項4.第一液体と第二液体の混合液の溶存酸素濃度を測定する装置であって、
メタピロカテカーゼを固定化した第一固定化体と前記第一固定化体の下流側に配置されたアニオン交換体充填体を有する酸素除去モジュールと、
第一液体及び前記酸素除去モジュールを介した第二液体が供給され、メタピロカテカーゼを固定化した第二固定化体と、
第二固定化体での反応によって生成した5-クロロ-2-ヒドロキシムコン酸セミアルデヒドを検知する検出機構
を備えることを特徴とする測定装置。
【0017】
項5.前記第二固定化体に供給する第一液体をオーバーフローさせるサンプルループを更に備えた、項4に記載の装置。
【0018】
項6.前記測定装置により取得された溶存酸素濃度に基づいて第一液体及び第二液体の供給速度を調整する制御手段を更に備えた、項4に記載の装置。
【0019】
項7.メタピロカテカーゼを固定化した固定化体と前記固定化体の下流側に配置されたアニオン交換体充填体を有する酸素除去モジュールを備えることを特徴とする溶存酸素の除去装置。
【発明の効果】
【0020】
本発明の方法及び装置によれば、従来技術のような問題点が無く、微小な反応槽や培養槽(容量100μl未満)に溶存酸素濃度を任意の値に(低い溶存酸素濃度であっても)正確に制御した液体を長時間安定して供給すること、及び溶存酸素が1μmol/L未満まで除去された液体を長時間安定して供給することが可能となる。また、本発明の方法及び装置によれば、溶存酸素濃度が低い試料でも25μl未満の微量で溶存酸素濃度を正確に絶対測定することが可能となる。それ故、本発明は微量試料の溶存酸素濃度の絶対測定や微小な反応槽や培養槽の溶存酸素濃度の制御に始めて道を開くものである。
【0021】
本発明により、微小反応槽や培養槽を利用した微生物や培養細胞などの低酸素応答の研究など、これまでできなかった研究が可能になる。
【図面の簡単な説明】
【0022】
【図1】ヒト体内の溶存酸素濃度を示す図である。
【図2】4-クロロカテコールへの酸素添加反応を示す図である。
【図3】参考例1におけるO2除去モジュール(直接混合法)を示す図である。
【図4】参考例1における時間と酸素電極出力の関係を示すグラフである。
【図5】実施例1におけるO2測定用Mpcカラムの評価に用いた実験系を示す図である。
【図6】実施例1における時間と波長380 nmでの吸光度の関係を示すグラフである。
【図7】実施例2におけるO2除去モジュールの評価に用いた実験系を示す図である。
【図8】実施例2における時間と波長380 nmでの吸光度の関係を示すグラフである。
【図9】実施例3におけるO2濃度の直接制御を実証する実験系を示す図である。
【図10】実施例3における時間と波長380 nmでの吸光度の関係を示すグラフである。
【図11】実施例4における溶存酸素濃度絶対測定装置を示す図である。
【図12】実施例4における時間と波長380 nmでの吸光度の関係を示すグラフである。
【発明を実施するための形態】
【0023】
以下、本発明について詳細に説明する。
【0024】
溶存酸素を除去した液体の調製方法
本発明の溶存酸素を除去した液体の調製方法は、以下の工程を含むことを特徴とする:
(1)メタピロカテカーゼ固定化体に4-クロロカテコール溶液を接触させる工程、及び
(2)工程(1)で得られた溶液とアニオン交換体を接触させる工程。
【0025】
上記方法は、1μmol/L未満まで溶存酸素を除去することができる上、窒素やアルゴンで液体が飽和した状態になることや未反応のジチオナイトが残るというような従来技術の問題点を有さない。また、工程(1)で生成するP4ccは工程(2)で完全に取り除かれ、メタピロカテカーゼ固定化体を用いるので、工程(1)で当該酵素は液体に入り込まない。
【0026】
溶存酸素とは、液相中に溶解している分子状の酸素のことである。
【0027】
本発明におけるタピロカテカーゼ(EC 1.13.11.2、別名カテコール2,3-ジオキシゲナーゼ)は、4-クロロカテコールに酸素を添加し、5-クロロ-2-ヒドロキシムコン酸セミアルデヒドを生成する微生物由来の酵素である。中でも、シュードモナス・プチダ由来のメタピロカテカーゼは、既知の同類の酵素の中でも4-クロロカテコールに酸素を添加し、5-クロロ-2-ヒドロキシムコン酸セミアルデヒドを生成する触媒活性が非常に高く、酵素活性の安定性・酵素活性の強さ・基質特異性において優れている。
【0028】
図2には、本発明が利用するメタピロカテカーゼの4-クロロカテコールへの酸素付加反応が示されている。当該反応は100%右に進み、メタピロカテカーゼの4-クロロカテコールに対するKm値は数μmol/Lで低酸素濃度下でも速く反応が進行する。
【0029】
メタピロカテカーゼは、非常に多くのカテコール類を反応の基質にするが、本発明における基質は4-クロロカテコールである。4CCに酸素分子の2個の酸素原子がMpcの触媒下で添加されて生成する 5-クロロ-2-ヒドロキシムコン酸セミアルデヒドは、非常に安定で、室温で1日以上保存しても可視部の強い光吸収が変化しない。また、P4ccのpKa値は5.4で、汎用される実験条件や生理的条件でのpH は6以上であるので、P4ccはほとんどがアニオン型で存在し、分子吸光係数4.3×104 M-1cm-1を用いることができる。
【0030】
本明細書において、微生物由来の酵素とは微生物が産生する酵素、及び該酵素のアミノ酸配列において、1又はそれ以上のアミノ酸を置換、付加、欠失、挿入させることで得られる改変体を広く包含する。このようなアミノ酸を置換、欠失又は付加させる技術は公知である。
【0031】
メタピロカテカーゼは、公知の遺伝子配列の情報を利用して遺伝子を取得し形質転換体を作製することにより生産することができ、特に大腸菌で非常に高い効率で生産することが可能である(J. Biochem. 117, 614-622(1995))。生産した酵素の精製は、アセトン分画、イオン交換クロマトグラフィー、及び結晶化により行うことが出来る。
【0032】
本発明における4-クロロカテコール溶液とは、溶存酸素を除去する対象の液体に必要量の4-クロロカテコールを溶解した溶液のことである。ここで、必要量の4-クロロカテコールとは、液体から溶存酸素を全て除去できる量であり、液体に含まれる溶存酸素の量を考慮し必要最少量に、例えば溶存酸素濃度より数十μM程度高くなるようにすれば良く、また、溶存酸素が除去された溶液を溶存酸素濃度の測定に用いる場合には、過剰量の4-クロロカテコールが残留している方がいいので、4-クロロカテコールを多めに、例えば500μmol/L程度溶解させる。4-クロロカテコールは公知の方法により合成することもできるし、市販品を容易に入手することも可能である。
【0033】
溶存酸素を除去する対象の液体としては、本発明の方法により溶存酸素を除去できるものであれば特に限定されないが、例えば、水、水溶液、緩衝液、灌流液等が挙げられる。上記緩衝液としては、緩衝作用を有する溶液であれば良く、例えば、PBS (リン酸緩衝化生理食塩水)、リン酸緩衝液、クエン酸緩衝液、リン酸カリウム緩衝液、トリス-塩酸緩衝液、グリシン-塩酸緩衝液、酢酸緩衝液等が挙げられる。
【0034】
本発明においてメタピロカテカーゼを4-クロロカテコール溶液に作用させる条件としては、使用する酵素の特性に応じて適宜設定することができるが、pHは通常6〜10、温度は通常5〜50℃である。メタピロカテカーゼを作用させる時間は、溶存酸素濃度等に応じて適宜設定されるが、通常1〜3分である。また、使用するメタピロカテカーゼ固定化体の量は、4-クロロカテコール溶液と接触させる際の流速と接触時間(通常1〜3分)との積を目安に設定すれば良い。例えば、流速が10μL/分ならメタピロカテカーゼ固定化体の量を、余裕を持たせて90μL程度にする。
【0035】
本発明においてメタピロカテカーゼ固定化体に4-クロロカテコール溶液を接触させる方法としては、メタピロカテカーゼを不溶性担体に共有結合で固定化し当該担体を充填したカラムに4-クロロカテコール溶液を通過させる方法が望ましい。不溶性担体は、各種市販のものを使用することが出来、耐圧性等を考慮して適宜選択し得る。酵素を共有結合で固定化する方法としては公知の方法、例えば不溶性担体にタンパク質のアミノ基と反応する官能基(トレシル基やN-ヒドロキシスクシンイミド基など)を導入し、メタピロカテカーゼのアミノ基と反応させる方法等を利用できる。
【0036】
メタピロカテカーゼを4-クロロカテコール溶液に作用させることにより生成するP4ccは可視部に強い光吸収を示すので、微小反応槽や培養槽を利用した微生物や培養細胞などの分光学的な観察や測定の妨げになり、また、溶存酸素の測定においてはバックグラウンドの吸収を高めて感度の低下の原因になるので取り除く必要がある。pH6以上ではP4ccはほとんどがアニオンの状態で存在するので、工程(1)で得られた溶液をアニオン交換体と接触させることでP4ccを当該溶液から取り除くことができる。
【0037】
本発明におけるアニオン交換体としては、イオン交換樹脂、イオン交換繊維、イオン交換膜等が挙げられ、中でもイオン交換樹脂が好適に用いられる。アニオン交換樹脂としては、特に限定されないが、強塩基性アニオン交換樹脂、弱塩基性アニオン交換樹脂等が挙げられ、市販品としてはToyopearl QAE-550C(東ソー)等がある。P4ccを全て取り除くために、できるだけ交換容量の大きいアニオン交換体を利用することが好ましい。
【0038】
本発明において工程(1)で得られた溶液とアニオン交換体を接触させる条件としては、P4ccを取り除くことができる条件であれば良く、pHは通常6〜10、温度は通常5〜50℃である。
【0039】
本発明において工程(1)で得られた溶液とアニオン交換体を接触させる方法としては、アニオン交換体を充填したカラムに工程(1)で得られた溶液を通過させる方法が挙げられる。
【0040】
本発明の方法により調製される溶存酸素を除去した液体は、完全に溶存酸素が除去されたものであることが望ましいが、使用目的によっては完全に溶存酸素が除去されたものに限定されるものではなく、溶存酸素濃度が20μmol/L以下、好ましくは5μmol/L以下の溶液であっても良い。
【0041】
試料中の溶存酸素濃度の測定方法
本発明の試料中の溶存酸素濃度の測定方法は、以下の工程を含むことを特徴とする:
(1)メタピロカテカーゼ固定化体に4-クロロカテコール溶液を接触させる工程、
(2)工程(1)で得られた溶液とアニオン交換体を接触させる工程、
(3)工程(2)で得られた溶液と試料を混合する工程、
(4)工程(3)で得られた試料をメタピロカテカーゼ個定化体に接触させる工程、及び
(5)工程(4)で生成する5-クロロ-2-ヒドロキシムコン酸セミアルデヒド量を測定する工程。
【0042】
上記方法は、溶存酸素濃度が低い(例えば、5μmol/L以下)25μl未満の試料の溶存酸素濃度を正確に絶対測定することが可能である。
【0043】
工程(1)及び(2)は前述した工程と同様である。
【0044】
工程(3)において、工程(1)及び(2)の処理により溶存酸素が除去された溶液と溶存酸素の測定対象の試料を混合する。このように溶存酸素が除去された4CCを過剰に含む溶液に試料を混合することにより、試料中の溶存酸素のみが工程(4)でP4ccに変換されるので、わずかの量の酸素であっても高いS/N比で測定できる。
【0045】
本発明における試料としては、例えば、水、水溶液、緩衝液、灌流液、ヒト又は動物の血液、血漿又は血清、微生物、植物、ヒト又は動物の細胞抽出液等が挙げられる。緩衝液としては前述するものが挙げられる。
【0046】
試料と工程(2)で得られた溶液の混合は、工程(4)で試料中の溶存酸素が完全にP4ccに変換されるように行えば良く、混合される試料の量は工程(2)で得られた溶液の5分の1以下が好ましい。尚、後の工程での試料中の溶存酸素濃度の測定が可能となるために、工程(2)で得られた溶液には4-クロロカテコールが残存している必要があり、工程(1)の4-クロロカテコール溶液の濃度は高めに、例えば500μmol/L程度にする。
【0047】
工程(4)におけるメタピロカテカーゼを作用させる方法は前述するものと同様であるが、工程(4)のメタピロカテカーゼ固定化体の量は、工程(1)でのメタピロカテカーゼ固定化体の量の三分の一以下で十分である。
【0048】
工程(5)における5-クロロ-2-ヒドロキシムコン酸セミアルデヒド量を測定する方法は、当該化合物を定量できる方法であればいずれの方法を使用しても良いが、好適には波長380 nmの吸光度を測定する方法が使用できる。5-クロロ-2-ヒドロキシムコン酸セミアルデヒド分子数は酸素分子数に対応するので、5-クロロ-2-ヒドロキシムコン酸セミアルデヒド量から酸素分子数を求めることができる。
【0049】
所定の溶存酸素濃度を有する液体の調製方法
本発明の所定の溶存酸素濃度を有する液体の調製方法は以下の工程を含むことを特徴とする:
(1)メタピロカテカーゼ固定化体に4-クロロカテコール溶液を接触させる工程、
(2)工程(1)で得られた溶液とアニオン交換体を接触させる工程、及び
(3)所定の溶存酸素濃度が得られる比率で、工程(2)で得られた溶液と、溶存酸素を含む液体を混合する工程。
【0050】
上記方法は、100μl未満の微小な反応槽や培養槽の溶存酸素濃度を任意の値に(低い溶存酸素濃度(例えば、5μmol/L以下)であっても)正確に制御することが可能である上に、正確な酸素分圧も持つ混合ガスが必要なことや反応系に本来ない酵素や低分子化合物(酸素分子との反応生成物)が残留するといった従来技術の問題点を有しない。
【0051】
工程(1)及び(2)は前述した工程と同様である。
【0052】
工程(3)において、工程(1)及び(2)の処理により溶存酸素が除去された溶液と溶存酸素を含む液体を混合する。溶存酸素を含む液体としては、例えば、水、水溶液、緩衝液、灌流液等が挙げられる。上記緩衝液としては前述するものと同様のものが挙げられる。溶存酸素を含む液体の溶存酸素濃度は任意であり、例えば、空気飽和の状態であれば約250μmol/Lである。特に低酸素濃度領域を制御する場合には、酸素透過性膜を用いる脱気モジュールを通した液体を用いるとよく、その溶存酸素濃度は約30μmol/Lである。
【0053】
所定の溶存酸素濃度が得られる比率は、工程(2)で得られた溶液と溶存酸素を含む液体を任意の比率で混合した混合液の溶存酸素濃度を測定し、所定の溶存酸素濃度が得られるように混合比率を変更していくことにより求めることができる。また、溶存酸素を含む液体の溶存酸素濃度を予め測定しておくことにより、所定の溶存酸素濃度を有する液体を得るための、溶存酸素が除去された溶液との混合比率を計算により求めても良い。
【0054】
上記溶存酸素濃度の測定は、前述した(4-クロロカテコールを含む)試料をメタピロカテカーゼ固定化体に接触させ、生成する5-クロロ-2-ヒドロキシムコン酸セミアルデヒド量を測定する方法により測定することが望ましい。
【0055】
本発明の方法により得られる液体の溶存酸素濃度は、特に限定されないが、例えば、溶存酸素濃度が0の緩衝液と溶存酸素濃度が250μmol/Lの緩衝液を混合することで、溶存酸素濃度が0〜250μmol/Lの範囲に制御された緩衝液を得ることができる。
【0056】
溶存酸素の除去装置
本発明の溶存酸素の除去装置は、メタピロカテカーゼを固定化した固定化体と前記固定化体の下流側に配置されたアニオン交換体充填体を有する酸素除去モジュールを備えることを特徴とする。
【0057】
上記装置により、1μmol/L未満まで溶存酸素を除去することができる上、窒素やアルゴンで液体が飽和した状態になることや未反応のジチオナイトが残るというような従来技術の問題も生じない。
【0058】
メタピロカテカーゼ、その固定化方法、及びアニオン交換体については前述するものと同様である。アニオン交換体充填体としては、例えば、アニオン交換体が充填されたカラムが挙げられる。
【0059】
メタピロカテカーゼを固定化した固定化体では、4-クロロカテコール溶液が供給され、メタピロカテカーゼが4-クロロカテコール溶液に作用しP4ccが生成する。反応後の溶液は次のアニオン交換体充填体に送られる。当該固定化体は、酵素が反応できる温度に設定するために加温装置を備えていることが好ましい。
【0060】
アニオン交換体充填体では、上記固定化体を通過した溶液が供給され、上記固定化体での反応で生成したP4ccが取り除かれる。アニオン交換体充填体を通過した溶液は、溶存酸素及びP4ccが取り除かれている。
【0061】
溶存酸素濃度の測定装置
本発明の第一液体と第二液体の混合液の溶存酸素濃度を測定する装置は、
メタピロカテカーゼを固定化した第一固定化体と前記第一固定化体の下流側に配置されたアニオン交換体充填体を有する酸素除去モジュールと、
第一液体及び前記酸素除去モジュールを介した第二液体が供給され、メタピロカテカーゼを固定化した第二固定化体と、
第二固定化体での反応によって生成した5-クロロ-2-ヒドロキシムコン酸セミアルデヒドを検知する検出機構
を備えることを特徴とする。
【0062】
<溶存酸素濃度の測定について>
上記装置により、溶存酸素濃度が低い(例えば、5μmol/L以下)25μl未満の微量試料の溶存酸素濃度を正確に絶対測定することができる。また、安価で持ち運び可能な装置が実現できる。
【0063】
メタピロカテカーゼ、その固定化方法、及び酸素除去モジュールについては、前述したものと同様である。
【0064】
酸素除去モジュールでは、第二液体(4-クロロカテコール溶液)が供給され、溶存酸素が除去された溶液が得られる。得られた第二液体は第一液体(試料)と混合され、第二固定化体に送られる。
【0065】
第二固定化体では、第一液体(試料)及び上記酸素除去モジュールを介した第二液体(溶存酸素が除去された溶液)の混合液が供給され、メタピロカテカーゼが4-クロロカテコールを含む試料に作用しP4ccが生成する。反応後の試料は次の検出機構に送られる。第二固定化体は、酵素が反応できる温度に設定するために加温装置を備えていることが好ましい。
【0066】
上記装置は、第二固定化体に供給する第一液体をオーバーフローさせるサンプルループを更に備えていることが好ましい。これにより試料注入ポートのデッドスペースや大気中からの酸素の持ち込みを防ぐことができる。
【0067】
検出機構では、第二固定化体を通過した試料が供給され、第二固定化体での反応で生成したP4ccを検知する。検知後の試料は回収又は廃棄される。
【0068】
P4ccを検知する検出機構としては、P4ccを検知できる検出機構であればいずれの機構を用いても良いが、好適には波長380 nmの吸光度を測定するP4ccを検知する検出機構である。
【0069】
<溶存酸素濃度の調整>
また、上記装置により、100μl未満の微小な反応槽や培養槽の溶存酸素濃度を任意の値に(低い溶存酸素濃度(例えば、5μmol/L以下)であっても)正確に制御することができる上に、正確な酸素分圧も持つ混合ガスが必要なことや反応系に本来ない酵素や低分子化合物を加える必要があるといった従来技術の問題点も生じない。
【0070】
このような用途に用いる場合、上記装置は、取得された溶存酸素濃度に基づいて第一液体及び第二液体の供給速度を調整する制御手段を更に備えていることが好ましい。当該制御手段としては、第一液体及び第二液体の一方又は両方の流量を調整できる手段であれば良く特に限定されない。
【0071】
この場合、第二固定化体には、第一液体(溶存酸素を含む液体)と第二液体(溶存酸素が除去された溶液)の混合液が供給される。そして、取得された混合液の溶存酸素濃度に基づき、所定の溶存酸素濃度となるように第一液体及び第二液体の供給速度の調整を行う。所定の溶存酸素濃度への調整後は、混合液を第二固定化体に供給せずに直接回収することで、所定の溶存酸素濃度を有する液体を得ることができる。
【実施例】
【0072】
以下、本発明を更に詳しく説明するため実施例を挙げる。しかし、本発明はこれら実施例等になんら限定されるものではない。
【0073】
Mpc固定化充填材の製法
(I) Mpc結晶を遠心で集め、最少量の1 mol/Lリン酸カリウム緩衝液(pH 8.0、20 mMジチオスレイトール、10 mM アスコルビン酸、200μM 2-ヒドロキシピリジンN-オキシド(Aldrich Chemical Company)を含む)で溶解した。このMpc溶液を1 mol/Lリン酸カリウム緩衝液(pH 8.0、200μM 2-ヒドロキシピリジンN-オキシドを含む、以下緩衝液Aという)で平衡化したゲルろ過カラム(Sephadex G-25、1.5×7.0 cm)にアプライし、緩衝液交換を行った。以上の方法で、緩衝液Aに溶解した濃度が約50 mg/mLのMpc溶液が2 mL程度調製できる。
(II) (I)で調製したMpc溶液を緩衝液Aで希釈し、Mpc濃度が15 mg/mLのMpc溶液を 7.0 mLを調製した。15-mLのポリプロピレン製遠心管(Thermo Scientific)に乾燥Tresyl Toyopearl (東ソー)を700 mg秤量し、この希釈Mpc溶液の全量を加え、室温で4時間、遠心管をゆっくり反転回転させながらインキュベーションした。
(III) 低速遠心で(II)のゲルを集め、0.5 mol/L塩化ナトリウム水溶液約10 mLに分散させ、洗浄した。洗浄したゲルを、0.1 mol/L Tris-HCl緩衝液(pH 8.0、0.5 mol/L塩化ナトリウム、200μM 2-ヒドロキシピリジンN-オキシドを含む)約10 mLに分散させ、洗浄した。洗浄したゲルを、このTris-HCl緩衝液10 mLに分散させ、室温で1時間、遠心管をゆっくり反転回転させながらインキュベーションした。
(IV) 低速遠心で(III)のゲルを集め、50 mmol/L HEPES-NaOH緩衝液(pH 7.5、イオン強度0.15 mol/L、200μMの2-ヒドロキシピリジンN-オキシドを含む)で3回洗浄した。洗浄後、このHEPES緩衝液にゲルを分散させ、4℃で保存した。
【0074】
上記の方法で99%以上の効率でMpcがトヨパールに固定される。Mpcの比活性は100 U/mgタンパク質以上あるので、Mpc固定化充填材は、ゲル1 mL当たり5000 U以上の活性を持つ(1μLの微量のゲルでも5 U以上の活性がある)。
【0075】
Mpc固定化充填材は、特異的な活性保護剤である2-ヒドロキシピリジンN-オキシドの存在下で保存するので、3年以上の長期保存でも活性が保持されることを確認している。
【0076】
Mpc結晶は公知の方法により製造することができる(J. Biochem. 117, 614-622(1995))。
【0077】
本実施例で使用した4CCの再結晶化法
(I) 市販の4CC (東京化成) 2 gを、油浴で約100℃に加熱したトルエン約20 mLで溶解し、円筒濾紙でろ過し、ろ液を容量50 mLのガラス瓶に受けた。
(II) (I)のろ液を室温まで冷ました後、-20℃で一晩静置した。
(III) (II)で析出した結晶をブフナー型ガラスろ過器で集め、完全に乾燥させた。
【0078】
O2測定用Mpcカラム(最大流速20μL/分用)
・ミクロMpcカラム(内径1.0 mm、外形1/16”、長さ4.0 cm、ゲル容量31μL、酵素活性150 U以上)
空カラムとして内径1.0 mm、外形1/16”、長さ4.0 cmのpeek製チューブ(Upchurch Scientific)を利用し、自家製充填装置でMpc固定化充填材を充填した。出口側フィルターには、市販のプレカラムフィルター(Upchurch Scientific、A-355)を利用した。流速10μL/分では、このカラムの通過時間が約3分間で、この通過時間の間に酸素分子は過剰に存在する4CCと完全に反応して、酸素分子と同数のP4ccに変換される。
【0079】
最大流速流速5μL/分で使用する場合には、キャピラリーMpcカラムを使う。内径0.5 mmまでなら、同じ方法でpeekチューブに充填できる。
【0080】
O2除去用Mpcカラム(最大処理量25 mL、使用流速20μL/分以下用)
・セミミクロMpcカラム(内径1/16”、外形1/8”、長さ5.0 cm、ゲル容量 94μL、酵素活性470 U以上)
空カラムとして内径1/16”、外形1/8”、長さ5.0 cmのradel製チューブ(Upchurch Scientific)を利用し、カラム出入り口フィルターには2ミクロンフィルター付きのフェラル(Upchurch Scientific、P-374x)を用いた。自家製簡易充填法で充填した。このカラムを約5分以上かけて通過する間に酸素分子は過剰に存在する4CCと完全に反応して、酸素分子と同数のP4ccに変換され、完全に取り除かれた。
【0081】
P4cc除去カラム(最大処理量25 mL用)
・セミミクロP4cc除去カラム(内径 2 mm、外形1/8”、長さ5.0 cm、ゲル容量 160μL)
空カラムとして内径2 mm、外形1/8”、長さ5.0 cmのpeek製チューブ(Upchurch Scientific)を利用し、カラム出入り口フィルターには2ミクロンフィルター付きのフェラル(Upchurch Scientific、P-374x)を用いた。自家製簡易充填法で、Toyopearl QAE-550C(東ソー)を充填した。このカラムを通過する間P4ccは完全に取り除かれた。参考例1では、約100 mLが処理できるように、内径が4 mmのカラムを用いた(参考例1以外はここで記載したものを使用した)。
【0082】
参考例1:O2除去モジュール(直接混合法)
モジュールの構成を図3に示す(4CC溶液の流速60μl/分)。本参考例でのみ、容量の大きいP4cc除去カラムを使用した。本参考例では、モジュールからの溶出液を、クラーク型酸素電極(Yellow Spring Instrument、model 5331)を装着した容量2 mLのガラス製反応槽(アルテグラス、特注品)に直接注入し、反応槽内の溶存酸素濃度の変化を連続的に記録した。測定結果を図4に示す。本結果は、原理的に、本タイプのモジュールで2 mLの比較的気密性の低い反応槽でも、その酸素濃度を6μMの低酸素レベルまでコントロールできることを示している。図3で、Mpc溶液の送液には、ケーワイエーテクノロジーズのDina Sシリンジポンプを、4CC溶液の送液には、AquathのNano8600-TRシリンジポンプを用いた。酸素電極の出力は、ケーワイエーテクノロジーズのSmart Chromデータ処理装置で記録・解析した。
【0083】
実施例1:O2測定用Mpcカラムの評価
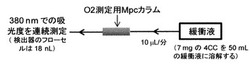
実験系の構成を図5に示す。本実施例では、50 mLの緩衝液(50 mmol/L HEPES、pH 7.4、イオン強度0.15 mol/L)に7 mgの4CCを加え(4CC濃度は970μmol/L)、流速10μL/分で送液(AquathのNano8600-TRシリンジポンプを使用)し、波長380 nmでの吸光度を容量18 nLのフローセルを装着した紫外可視部検出器(ジーエルサイエンス、MU701)で測定した。そして、ミクロMpcカラム(内径1.0 mm、長さ4.0 cm)を流路に挿入した時の検出器からの溶出液を集め、紫外可視部分光器(島津、UV-2550)でその吸収スペクトルを測定し、溶存酸素が完全に等量のP4ccに変換されることを確認した。測定結果を図6に示す。
【0084】
実施例2:O2除去モジュールの評価(カラム連結方式)
モジュールの構成を図7に示す。本実施例では、O2除去用Mpcカラム(内径1.55 mm、長さ5.0 cm)とP4cc除去カラム(内径2 mm、長さ5.0 cm)をこの順に直結したものをO2除去モジュールとして使用した。緩衝液(50 mmol/L HEPES、pH 7.4、イオン強度0.15 mol/L)28 mLに4CCを2 mgを加えた液を、流速10μL/分でこのモジュールに送液し、モジュールからの溶出液をO2測定用Mpcカラムに導き、その溶出液の波長380 nmでの吸光度を容量18 nLのフローセルを装着した紫外可視部検出器(ジーエルサイエンス、MU701)でモニターした。測定結果を図8に示す。流速が10μl/分であるので、カラムを含む流路内のすべての酸素分子が取り除かれるまでに一定の時間を要するが、その後は安定して溶存酸素がほとんどゼロの緩衝液が供給できていた(240分付近のなだらかなピークは、実験で使用したシリンジポンプ(Aquath、Nano8600-TR、シリンジ容量が3 mL)が吸引モードに入りしばらく送液が停止したことによる)。本モジュールで、緩衝液から完全にO2が除去され、O2濃度ゼロの緩衝液が得られることが実証された。
【0085】
実施例3:O2濃度の直接制御
実験システムの構成を図9に示す。本実施例では、O2除去モジュールを装着した送液系(Aquath、Nano8600-TRで送液)からのO2濃度ゼロ緩衝液(50 mmol/L HEPES、pH 7.4、イオン強度0.15 mol/L)と、もう一つの送液系(ケーワイエーテクノロジーズ、Dina Sで送液)からの空気飽和の緩衝液(50 mmol/L HEPES、pH 7.4、イオン強度0.15 mol/L)とを、総流速を10μL/分にして、任意の比率で混合することにより、目的の酸素濃度の緩衝液を供給できることを実証した。本システムから供給される緩衝液の酸素濃度は、O2測定用Mpcカラムに連続的に緩衝液を導入し、波長380 nmでの吸光度を容量18 nLのフローセルを装着した紫外可視部検出器(ジーエルサイエンス、MU701)でモニターした。測定結果を図10に示す。図10のグラフは、図9の流速xを0、1、2、3μL/分と増加させたときの酸素濃度の変化を示している(0, 48, 87, 160μmol/Lと段階的に変化している)。本発明の方法で原理的に自由に酸素濃度をコントロールできることが明らかになった。
【0086】
実施例4:O2濃度の絶対測定
測定システムの構成を図11に示す。本実施例では、カラム連結型のO2除去モジュールを利用し、AquathのNano8600-TRシリンジポンプで流速10μL/分で送液した。一本のカラムにMpc固定充填剤とアニオン交換樹脂をこの順に充填した複合型カラムによるO2除去モジュールを用いることもできる。測定したい試料を25μLのガスタイトシリンジ(ハミルトン)でサンプリングし、そのうちの20μLを2μLのサンプルループにオーバーフローさせ、バルブ(Valco Instruments、C2-0006EH)を切り替えて、O2測定用Mpcカラムに導入した。測定結果を図12に示す。酸素分子がP4ccのピークとして検出された。ピーク面積から試料2μLに含まれていた酸素分子数が求められる。図12で、嫌気チャンバーの中の水のピークからその溶存酸素濃度が9.1μmol/Lと求められるが、この測定結果はガスタイトシリンジで嫌気チャンバーから水を取り出して測定する操作中に大気から水に混入した酸素を反映していると考えられる(嫌気チャンバー内の酸素は25 ppm未満なので)。9.1μmol/Lでもこれだけ明瞭なピークとして検出されているので、サブμmol/Lの濃度レベルまで十分測定可能なことが分かった。
【技術分野】
【0001】
本発明は、液体から溶存酸素を除去する方法、所定の溶存酸素濃度を有する液体の調製方法、及び試料中の溶存酸素濃度の測定方法に関する。更に、本発明は、溶存酸素の除去装置、及び溶存酸素濃度の測定装置に関する。
【背景技術】
【0002】
ヒトの体内の遊離型酸素濃度は、動脈血で約150μmol/L、毛細血管と末梢組織でそれぞれ約80μmol/Lと30〜40μmol/L、末梢での最低必要濃度は1〜10μmol/Lで、これより低くなると組織の破壊が起こる。また、大腸菌などは酸素濃度が1μmol/L未満になると酸素を使わないエネルギー代謝(嫌気的呼吸)にシフトし、一方、偏性嫌気性菌は、酸素濃度が0.1μmol/Lを超えると酸素の毒性に耐えられなくなる。このように、0.1〜40μmol/Lの低い溶存酸素濃度領域は生物学的に特に重要である。しかし、大気中に大量の酸素が存在するため、大気中の酸素の試料への流入を防ぐことが技術的に難しく、試料が微量になるほど、試料を入れる容器の壁面が試料の体積に対して大きくなるため、壁に残留する微細な空気や、容器の気密性の低い部分(試料や試薬を加える通路となる部分)からの酸素の流入の影響が非常に大きくなる。このため、微量試料、特に100μL未満の水溶液の溶存酸素濃度を空気飽和レベルよりはるかに低い、上記の生理的濃度に直接制御する方法やその濃度を絶対測定する方法は、未だ確立されていない。
【0003】
上記のように溶存酸素濃度は、ヒトを含むすべての生物にとって最も重要な環境要素である。ほとんどの微生物や体内の細胞は、空気飽和(室温なら約250μmol/L)レベルの遊離型酸素濃度よりもはるかに低い酸素濃度下で生きており、酸素不足のストレスにさらされている(図1参照)。そのために、環境の酸素濃度を複数の検出系で常にモニターし、低酸素にすぐに対応できる仕組みを持っている。これらの仕組みを解明し、環境問題や臨床に生かしていくためには、微量の組織や細胞や微生物を小さな反応槽や培養槽に入れて、その緩衝液/灌流液中の酸素濃度を低い濃度で自由にコントロールし、組織や細胞や微生物に起こる形態的変化や代謝の変化を総合的に調べる必要がある。反応槽や培養槽の溶存酸素濃度を絶対測定できる方法も必要である。大気からの酸素の流入を防ぐことができる気密性の高いミクロ反応槽/培養槽の開発も不可欠である。
【0004】
現在、緩衝液/灌流液中の溶存酸素を除く方法としては、窒素ガスやアルゴンガスを溶液中に直接バブリングする方法、酸素透過膜を介して減圧する方法、及びジチオナイト(別名ハイドロサルファイトナトリウム、Na2S2O4)を添加する方法が存在する。
【0005】
しかしながら、上記の方法には、窒素やアルゴンのバブリングで完全に溶存酸素を除去するのは困難、試料が窒素やアルゴンガスで飽和した状態になり非生理的である、酸素透過膜を介しての減圧で酸素を完全に除去するのは困難、溶存酸素を完全に除去するには過剰のジチオナイトが必要で未反応のジチオナイトが調べたい酸化還元反応を妨害する、ジチオナイトと酸素の反応は非常に複雑で反応中間体や生成物の予期しない影響が起こり得る等の問題がある。
【0006】
また、現在、緩衝液/灌流液中の溶存酸素を制御する方法としては、緩衝液/灌流液を、例えば5%酸素、10%炭酸ガス、85%窒素のように、正確な酸素濃度の混合ガスと直接接触させることで溶存酸素濃度を変える方法、及びアスコルビン酸オキシダーゼとアスコルビン酸のように、密閉した反応槽や培養槽の中で酵素反応で溶存酸素を消費して酸素濃度を変える方法が存在する。
【0007】
しかしながら、上記の方法には、正確な酸素分圧を持つ混合ガスが必要、酸素の溶解度は温度などで変動するので溶存酸素濃度そのものを直接制御していない、アスコルビン酸オキシダーゼのように酵素を使う方法では反応系に本来ない酵素や反応生成物(デヒドロアスコルビン酸)を加えることになる等の問題がある。
【0008】
シュードモナス・プチダ(Pseudomonas putida)由来のメタピロカテカーゼ(metapyrocatechase, Mpc)は、図2に示されているように4-クロロカテコール(4-chlorocatechol, 4CC)が酸素分子と反応して酸素分子の2個の酸素原子を取り込んだ5-クロロ-2-ヒドロキシムコン酸セミアルデヒド(5-chloro-2-hydroxymuconate semialdehyde, P4cc)を生成する反応(2原子酸素添加反応という)を触媒する。この反応は不可逆で、過剰の4CCが存在すると全ての酸素分子が同数のP4cc分子にトラップされるまで進行する。Mpcの触媒活性は非常に高く、酸素分子に対するKm値が10μM未満と小さいので、酸素濃度が低くても上記酵素反応は非常に速く進行する。また、4CCに対するKm値が数μM未満と小さく、酸素分子よりもわずかに過剰量あるだけでも上記酵素反応は非常に速く進行する(非特許文献1)。また、P4cc分子は非常に安定で可視部に非常に強い光吸収を示すため、その濃度を高感度に正確に測定できる。それ故、本発明者らは当該酵素反応を使用することで水溶液の酸素濃度が測定できることを報告している(非特許文献2参照)。
【先行技術文献】
【非特許文献】
【0009】
【非特許文献1】T. Ishida, H. Tanaka, and K. Horiike, J. Biochem., 135, 721-730(2004)
【非特許文献2】H. Nakajima, T. Ishida, H. Tanaka, and K. Horiike, J. Biochem., 131, 523-531(2002)
【発明の概要】
【発明が解決しようとする課題】
【0010】
そこで、本発明は、従来技術の問題点が改善された、溶存酸素を除去した液体の調製方法、所定の溶存酸素濃度を有する液体の調製方法、及び溶存酸素の除去装置を提供することを目的とする。更に、本発明は、溶存酸素濃度が低い試料であっても溶存酸素濃度の絶対測定が可能な、溶存酸素濃度の測定方法、及び溶存酸素濃度の測定装置を提供することを目的とする。
【課題を解決するための手段】
【0011】
本発明者らは、メタピロカテカーゼを固定化した固定化体に4-クロロカテコール溶液を接触させて酸素をP4ccに変換させ、このP4ccをアニオン交換樹脂を用いて除去することにより、溶存酸素が除去された溶液を調製することができ、上記目的を達成することができるという知見を得た。また、当該溶存酸素が除去された溶液を利用することによって、溶存酸素濃度の制御、及び試料中の溶存酸素濃度の測定が可能になり上記目的を達成することができるという知見も得た。
【0012】
本発明は、これら知見に基づき、更に検討を重ねて完成されたものであり、次の溶存酸素を除去した液体の調製方法、所定の溶存酸素濃度を有する液体の調製方法、試料中の溶存酸素濃度の測定方法等を提供するものである。
【0013】
項1.以下の工程を含む溶存酸素を除去した液体の調製方法:
(1)メタピロカテカーゼ固定化体に4-クロロカテコール溶液を接触させる工程、及び
(2)工程(1)で得られた溶液とアニオン交換体を接触させる工程。
【0014】
項2.以下の工程を含む所定の溶存酸素濃度を有する液体の調製方法:
(1)メタピロカテカーゼ固定化体に4-クロロカテコール溶液を接触させる工程、
(2)工程(1)で得られた溶液とアニオン交換体を接触させる工程、及び
(3)所定の溶存酸素濃度が得られる比率で、工程(2)で得られた溶液と、溶存酸素を含む液体を混合する工程。
【0015】
項3.以下の工程を含む試料中の溶存酸素濃度の測定方法:
(1)メタピロカテカーゼ固定化体に4-クロロカテコール溶液を接触させる工程、
(2)工程(1)で得られた溶液とアニオン交換体を接触させる工程、
(3)工程(2)で得られた溶液と試料を混合する工程、
(4)工程(3)で得られた試料をメタピロカテカーゼ固定化体に接触させる工程、及び
(5)工程(4)で生成する5-クロロ-2-ヒドロキシムコン酸セミアルデヒド量を測定する工程。
【0016】
項4.第一液体と第二液体の混合液の溶存酸素濃度を測定する装置であって、
メタピロカテカーゼを固定化した第一固定化体と前記第一固定化体の下流側に配置されたアニオン交換体充填体を有する酸素除去モジュールと、
第一液体及び前記酸素除去モジュールを介した第二液体が供給され、メタピロカテカーゼを固定化した第二固定化体と、
第二固定化体での反応によって生成した5-クロロ-2-ヒドロキシムコン酸セミアルデヒドを検知する検出機構
を備えることを特徴とする測定装置。
【0017】
項5.前記第二固定化体に供給する第一液体をオーバーフローさせるサンプルループを更に備えた、項4に記載の装置。
【0018】
項6.前記測定装置により取得された溶存酸素濃度に基づいて第一液体及び第二液体の供給速度を調整する制御手段を更に備えた、項4に記載の装置。
【0019】
項7.メタピロカテカーゼを固定化した固定化体と前記固定化体の下流側に配置されたアニオン交換体充填体を有する酸素除去モジュールを備えることを特徴とする溶存酸素の除去装置。
【発明の効果】
【0020】
本発明の方法及び装置によれば、従来技術のような問題点が無く、微小な反応槽や培養槽(容量100μl未満)に溶存酸素濃度を任意の値に(低い溶存酸素濃度であっても)正確に制御した液体を長時間安定して供給すること、及び溶存酸素が1μmol/L未満まで除去された液体を長時間安定して供給することが可能となる。また、本発明の方法及び装置によれば、溶存酸素濃度が低い試料でも25μl未満の微量で溶存酸素濃度を正確に絶対測定することが可能となる。それ故、本発明は微量試料の溶存酸素濃度の絶対測定や微小な反応槽や培養槽の溶存酸素濃度の制御に始めて道を開くものである。
【0021】
本発明により、微小反応槽や培養槽を利用した微生物や培養細胞などの低酸素応答の研究など、これまでできなかった研究が可能になる。
【図面の簡単な説明】
【0022】
【図1】ヒト体内の溶存酸素濃度を示す図である。
【図2】4-クロロカテコールへの酸素添加反応を示す図である。
【図3】参考例1におけるO2除去モジュール(直接混合法)を示す図である。
【図4】参考例1における時間と酸素電極出力の関係を示すグラフである。
【図5】実施例1におけるO2測定用Mpcカラムの評価に用いた実験系を示す図である。
【図6】実施例1における時間と波長380 nmでの吸光度の関係を示すグラフである。
【図7】実施例2におけるO2除去モジュールの評価に用いた実験系を示す図である。
【図8】実施例2における時間と波長380 nmでの吸光度の関係を示すグラフである。
【図9】実施例3におけるO2濃度の直接制御を実証する実験系を示す図である。
【図10】実施例3における時間と波長380 nmでの吸光度の関係を示すグラフである。
【図11】実施例4における溶存酸素濃度絶対測定装置を示す図である。
【図12】実施例4における時間と波長380 nmでの吸光度の関係を示すグラフである。
【発明を実施するための形態】
【0023】
以下、本発明について詳細に説明する。
【0024】
溶存酸素を除去した液体の調製方法
本発明の溶存酸素を除去した液体の調製方法は、以下の工程を含むことを特徴とする:
(1)メタピロカテカーゼ固定化体に4-クロロカテコール溶液を接触させる工程、及び
(2)工程(1)で得られた溶液とアニオン交換体を接触させる工程。
【0025】
上記方法は、1μmol/L未満まで溶存酸素を除去することができる上、窒素やアルゴンで液体が飽和した状態になることや未反応のジチオナイトが残るというような従来技術の問題点を有さない。また、工程(1)で生成するP4ccは工程(2)で完全に取り除かれ、メタピロカテカーゼ固定化体を用いるので、工程(1)で当該酵素は液体に入り込まない。
【0026】
溶存酸素とは、液相中に溶解している分子状の酸素のことである。
【0027】
本発明におけるタピロカテカーゼ(EC 1.13.11.2、別名カテコール2,3-ジオキシゲナーゼ)は、4-クロロカテコールに酸素を添加し、5-クロロ-2-ヒドロキシムコン酸セミアルデヒドを生成する微生物由来の酵素である。中でも、シュードモナス・プチダ由来のメタピロカテカーゼは、既知の同類の酵素の中でも4-クロロカテコールに酸素を添加し、5-クロロ-2-ヒドロキシムコン酸セミアルデヒドを生成する触媒活性が非常に高く、酵素活性の安定性・酵素活性の強さ・基質特異性において優れている。
【0028】
図2には、本発明が利用するメタピロカテカーゼの4-クロロカテコールへの酸素付加反応が示されている。当該反応は100%右に進み、メタピロカテカーゼの4-クロロカテコールに対するKm値は数μmol/Lで低酸素濃度下でも速く反応が進行する。
【0029】
メタピロカテカーゼは、非常に多くのカテコール類を反応の基質にするが、本発明における基質は4-クロロカテコールである。4CCに酸素分子の2個の酸素原子がMpcの触媒下で添加されて生成する 5-クロロ-2-ヒドロキシムコン酸セミアルデヒドは、非常に安定で、室温で1日以上保存しても可視部の強い光吸収が変化しない。また、P4ccのpKa値は5.4で、汎用される実験条件や生理的条件でのpH は6以上であるので、P4ccはほとんどがアニオン型で存在し、分子吸光係数4.3×104 M-1cm-1を用いることができる。
【0030】
本明細書において、微生物由来の酵素とは微生物が産生する酵素、及び該酵素のアミノ酸配列において、1又はそれ以上のアミノ酸を置換、付加、欠失、挿入させることで得られる改変体を広く包含する。このようなアミノ酸を置換、欠失又は付加させる技術は公知である。
【0031】
メタピロカテカーゼは、公知の遺伝子配列の情報を利用して遺伝子を取得し形質転換体を作製することにより生産することができ、特に大腸菌で非常に高い効率で生産することが可能である(J. Biochem. 117, 614-622(1995))。生産した酵素の精製は、アセトン分画、イオン交換クロマトグラフィー、及び結晶化により行うことが出来る。
【0032】
本発明における4-クロロカテコール溶液とは、溶存酸素を除去する対象の液体に必要量の4-クロロカテコールを溶解した溶液のことである。ここで、必要量の4-クロロカテコールとは、液体から溶存酸素を全て除去できる量であり、液体に含まれる溶存酸素の量を考慮し必要最少量に、例えば溶存酸素濃度より数十μM程度高くなるようにすれば良く、また、溶存酸素が除去された溶液を溶存酸素濃度の測定に用いる場合には、過剰量の4-クロロカテコールが残留している方がいいので、4-クロロカテコールを多めに、例えば500μmol/L程度溶解させる。4-クロロカテコールは公知の方法により合成することもできるし、市販品を容易に入手することも可能である。
【0033】
溶存酸素を除去する対象の液体としては、本発明の方法により溶存酸素を除去できるものであれば特に限定されないが、例えば、水、水溶液、緩衝液、灌流液等が挙げられる。上記緩衝液としては、緩衝作用を有する溶液であれば良く、例えば、PBS (リン酸緩衝化生理食塩水)、リン酸緩衝液、クエン酸緩衝液、リン酸カリウム緩衝液、トリス-塩酸緩衝液、グリシン-塩酸緩衝液、酢酸緩衝液等が挙げられる。
【0034】
本発明においてメタピロカテカーゼを4-クロロカテコール溶液に作用させる条件としては、使用する酵素の特性に応じて適宜設定することができるが、pHは通常6〜10、温度は通常5〜50℃である。メタピロカテカーゼを作用させる時間は、溶存酸素濃度等に応じて適宜設定されるが、通常1〜3分である。また、使用するメタピロカテカーゼ固定化体の量は、4-クロロカテコール溶液と接触させる際の流速と接触時間(通常1〜3分)との積を目安に設定すれば良い。例えば、流速が10μL/分ならメタピロカテカーゼ固定化体の量を、余裕を持たせて90μL程度にする。
【0035】
本発明においてメタピロカテカーゼ固定化体に4-クロロカテコール溶液を接触させる方法としては、メタピロカテカーゼを不溶性担体に共有結合で固定化し当該担体を充填したカラムに4-クロロカテコール溶液を通過させる方法が望ましい。不溶性担体は、各種市販のものを使用することが出来、耐圧性等を考慮して適宜選択し得る。酵素を共有結合で固定化する方法としては公知の方法、例えば不溶性担体にタンパク質のアミノ基と反応する官能基(トレシル基やN-ヒドロキシスクシンイミド基など)を導入し、メタピロカテカーゼのアミノ基と反応させる方法等を利用できる。
【0036】
メタピロカテカーゼを4-クロロカテコール溶液に作用させることにより生成するP4ccは可視部に強い光吸収を示すので、微小反応槽や培養槽を利用した微生物や培養細胞などの分光学的な観察や測定の妨げになり、また、溶存酸素の測定においてはバックグラウンドの吸収を高めて感度の低下の原因になるので取り除く必要がある。pH6以上ではP4ccはほとんどがアニオンの状態で存在するので、工程(1)で得られた溶液をアニオン交換体と接触させることでP4ccを当該溶液から取り除くことができる。
【0037】
本発明におけるアニオン交換体としては、イオン交換樹脂、イオン交換繊維、イオン交換膜等が挙げられ、中でもイオン交換樹脂が好適に用いられる。アニオン交換樹脂としては、特に限定されないが、強塩基性アニオン交換樹脂、弱塩基性アニオン交換樹脂等が挙げられ、市販品としてはToyopearl QAE-550C(東ソー)等がある。P4ccを全て取り除くために、できるだけ交換容量の大きいアニオン交換体を利用することが好ましい。
【0038】
本発明において工程(1)で得られた溶液とアニオン交換体を接触させる条件としては、P4ccを取り除くことができる条件であれば良く、pHは通常6〜10、温度は通常5〜50℃である。
【0039】
本発明において工程(1)で得られた溶液とアニオン交換体を接触させる方法としては、アニオン交換体を充填したカラムに工程(1)で得られた溶液を通過させる方法が挙げられる。
【0040】
本発明の方法により調製される溶存酸素を除去した液体は、完全に溶存酸素が除去されたものであることが望ましいが、使用目的によっては完全に溶存酸素が除去されたものに限定されるものではなく、溶存酸素濃度が20μmol/L以下、好ましくは5μmol/L以下の溶液であっても良い。
【0041】
試料中の溶存酸素濃度の測定方法
本発明の試料中の溶存酸素濃度の測定方法は、以下の工程を含むことを特徴とする:
(1)メタピロカテカーゼ固定化体に4-クロロカテコール溶液を接触させる工程、
(2)工程(1)で得られた溶液とアニオン交換体を接触させる工程、
(3)工程(2)で得られた溶液と試料を混合する工程、
(4)工程(3)で得られた試料をメタピロカテカーゼ個定化体に接触させる工程、及び
(5)工程(4)で生成する5-クロロ-2-ヒドロキシムコン酸セミアルデヒド量を測定する工程。
【0042】
上記方法は、溶存酸素濃度が低い(例えば、5μmol/L以下)25μl未満の試料の溶存酸素濃度を正確に絶対測定することが可能である。
【0043】
工程(1)及び(2)は前述した工程と同様である。
【0044】
工程(3)において、工程(1)及び(2)の処理により溶存酸素が除去された溶液と溶存酸素の測定対象の試料を混合する。このように溶存酸素が除去された4CCを過剰に含む溶液に試料を混合することにより、試料中の溶存酸素のみが工程(4)でP4ccに変換されるので、わずかの量の酸素であっても高いS/N比で測定できる。
【0045】
本発明における試料としては、例えば、水、水溶液、緩衝液、灌流液、ヒト又は動物の血液、血漿又は血清、微生物、植物、ヒト又は動物の細胞抽出液等が挙げられる。緩衝液としては前述するものが挙げられる。
【0046】
試料と工程(2)で得られた溶液の混合は、工程(4)で試料中の溶存酸素が完全にP4ccに変換されるように行えば良く、混合される試料の量は工程(2)で得られた溶液の5分の1以下が好ましい。尚、後の工程での試料中の溶存酸素濃度の測定が可能となるために、工程(2)で得られた溶液には4-クロロカテコールが残存している必要があり、工程(1)の4-クロロカテコール溶液の濃度は高めに、例えば500μmol/L程度にする。
【0047】
工程(4)におけるメタピロカテカーゼを作用させる方法は前述するものと同様であるが、工程(4)のメタピロカテカーゼ固定化体の量は、工程(1)でのメタピロカテカーゼ固定化体の量の三分の一以下で十分である。
【0048】
工程(5)における5-クロロ-2-ヒドロキシムコン酸セミアルデヒド量を測定する方法は、当該化合物を定量できる方法であればいずれの方法を使用しても良いが、好適には波長380 nmの吸光度を測定する方法が使用できる。5-クロロ-2-ヒドロキシムコン酸セミアルデヒド分子数は酸素分子数に対応するので、5-クロロ-2-ヒドロキシムコン酸セミアルデヒド量から酸素分子数を求めることができる。
【0049】
所定の溶存酸素濃度を有する液体の調製方法
本発明の所定の溶存酸素濃度を有する液体の調製方法は以下の工程を含むことを特徴とする:
(1)メタピロカテカーゼ固定化体に4-クロロカテコール溶液を接触させる工程、
(2)工程(1)で得られた溶液とアニオン交換体を接触させる工程、及び
(3)所定の溶存酸素濃度が得られる比率で、工程(2)で得られた溶液と、溶存酸素を含む液体を混合する工程。
【0050】
上記方法は、100μl未満の微小な反応槽や培養槽の溶存酸素濃度を任意の値に(低い溶存酸素濃度(例えば、5μmol/L以下)であっても)正確に制御することが可能である上に、正確な酸素分圧も持つ混合ガスが必要なことや反応系に本来ない酵素や低分子化合物(酸素分子との反応生成物)が残留するといった従来技術の問題点を有しない。
【0051】
工程(1)及び(2)は前述した工程と同様である。
【0052】
工程(3)において、工程(1)及び(2)の処理により溶存酸素が除去された溶液と溶存酸素を含む液体を混合する。溶存酸素を含む液体としては、例えば、水、水溶液、緩衝液、灌流液等が挙げられる。上記緩衝液としては前述するものと同様のものが挙げられる。溶存酸素を含む液体の溶存酸素濃度は任意であり、例えば、空気飽和の状態であれば約250μmol/Lである。特に低酸素濃度領域を制御する場合には、酸素透過性膜を用いる脱気モジュールを通した液体を用いるとよく、その溶存酸素濃度は約30μmol/Lである。
【0053】
所定の溶存酸素濃度が得られる比率は、工程(2)で得られた溶液と溶存酸素を含む液体を任意の比率で混合した混合液の溶存酸素濃度を測定し、所定の溶存酸素濃度が得られるように混合比率を変更していくことにより求めることができる。また、溶存酸素を含む液体の溶存酸素濃度を予め測定しておくことにより、所定の溶存酸素濃度を有する液体を得るための、溶存酸素が除去された溶液との混合比率を計算により求めても良い。
【0054】
上記溶存酸素濃度の測定は、前述した(4-クロロカテコールを含む)試料をメタピロカテカーゼ固定化体に接触させ、生成する5-クロロ-2-ヒドロキシムコン酸セミアルデヒド量を測定する方法により測定することが望ましい。
【0055】
本発明の方法により得られる液体の溶存酸素濃度は、特に限定されないが、例えば、溶存酸素濃度が0の緩衝液と溶存酸素濃度が250μmol/Lの緩衝液を混合することで、溶存酸素濃度が0〜250μmol/Lの範囲に制御された緩衝液を得ることができる。
【0056】
溶存酸素の除去装置
本発明の溶存酸素の除去装置は、メタピロカテカーゼを固定化した固定化体と前記固定化体の下流側に配置されたアニオン交換体充填体を有する酸素除去モジュールを備えることを特徴とする。
【0057】
上記装置により、1μmol/L未満まで溶存酸素を除去することができる上、窒素やアルゴンで液体が飽和した状態になることや未反応のジチオナイトが残るというような従来技術の問題も生じない。
【0058】
メタピロカテカーゼ、その固定化方法、及びアニオン交換体については前述するものと同様である。アニオン交換体充填体としては、例えば、アニオン交換体が充填されたカラムが挙げられる。
【0059】
メタピロカテカーゼを固定化した固定化体では、4-クロロカテコール溶液が供給され、メタピロカテカーゼが4-クロロカテコール溶液に作用しP4ccが生成する。反応後の溶液は次のアニオン交換体充填体に送られる。当該固定化体は、酵素が反応できる温度に設定するために加温装置を備えていることが好ましい。
【0060】
アニオン交換体充填体では、上記固定化体を通過した溶液が供給され、上記固定化体での反応で生成したP4ccが取り除かれる。アニオン交換体充填体を通過した溶液は、溶存酸素及びP4ccが取り除かれている。
【0061】
溶存酸素濃度の測定装置
本発明の第一液体と第二液体の混合液の溶存酸素濃度を測定する装置は、
メタピロカテカーゼを固定化した第一固定化体と前記第一固定化体の下流側に配置されたアニオン交換体充填体を有する酸素除去モジュールと、
第一液体及び前記酸素除去モジュールを介した第二液体が供給され、メタピロカテカーゼを固定化した第二固定化体と、
第二固定化体での反応によって生成した5-クロロ-2-ヒドロキシムコン酸セミアルデヒドを検知する検出機構
を備えることを特徴とする。
【0062】
<溶存酸素濃度の測定について>
上記装置により、溶存酸素濃度が低い(例えば、5μmol/L以下)25μl未満の微量試料の溶存酸素濃度を正確に絶対測定することができる。また、安価で持ち運び可能な装置が実現できる。
【0063】
メタピロカテカーゼ、その固定化方法、及び酸素除去モジュールについては、前述したものと同様である。
【0064】
酸素除去モジュールでは、第二液体(4-クロロカテコール溶液)が供給され、溶存酸素が除去された溶液が得られる。得られた第二液体は第一液体(試料)と混合され、第二固定化体に送られる。
【0065】
第二固定化体では、第一液体(試料)及び上記酸素除去モジュールを介した第二液体(溶存酸素が除去された溶液)の混合液が供給され、メタピロカテカーゼが4-クロロカテコールを含む試料に作用しP4ccが生成する。反応後の試料は次の検出機構に送られる。第二固定化体は、酵素が反応できる温度に設定するために加温装置を備えていることが好ましい。
【0066】
上記装置は、第二固定化体に供給する第一液体をオーバーフローさせるサンプルループを更に備えていることが好ましい。これにより試料注入ポートのデッドスペースや大気中からの酸素の持ち込みを防ぐことができる。
【0067】
検出機構では、第二固定化体を通過した試料が供給され、第二固定化体での反応で生成したP4ccを検知する。検知後の試料は回収又は廃棄される。
【0068】
P4ccを検知する検出機構としては、P4ccを検知できる検出機構であればいずれの機構を用いても良いが、好適には波長380 nmの吸光度を測定するP4ccを検知する検出機構である。
【0069】
<溶存酸素濃度の調整>
また、上記装置により、100μl未満の微小な反応槽や培養槽の溶存酸素濃度を任意の値に(低い溶存酸素濃度(例えば、5μmol/L以下)であっても)正確に制御することができる上に、正確な酸素分圧も持つ混合ガスが必要なことや反応系に本来ない酵素や低分子化合物を加える必要があるといった従来技術の問題点も生じない。
【0070】
このような用途に用いる場合、上記装置は、取得された溶存酸素濃度に基づいて第一液体及び第二液体の供給速度を調整する制御手段を更に備えていることが好ましい。当該制御手段としては、第一液体及び第二液体の一方又は両方の流量を調整できる手段であれば良く特に限定されない。
【0071】
この場合、第二固定化体には、第一液体(溶存酸素を含む液体)と第二液体(溶存酸素が除去された溶液)の混合液が供給される。そして、取得された混合液の溶存酸素濃度に基づき、所定の溶存酸素濃度となるように第一液体及び第二液体の供給速度の調整を行う。所定の溶存酸素濃度への調整後は、混合液を第二固定化体に供給せずに直接回収することで、所定の溶存酸素濃度を有する液体を得ることができる。
【実施例】
【0072】
以下、本発明を更に詳しく説明するため実施例を挙げる。しかし、本発明はこれら実施例等になんら限定されるものではない。
【0073】
Mpc固定化充填材の製法
(I) Mpc結晶を遠心で集め、最少量の1 mol/Lリン酸カリウム緩衝液(pH 8.0、20 mMジチオスレイトール、10 mM アスコルビン酸、200μM 2-ヒドロキシピリジンN-オキシド(Aldrich Chemical Company)を含む)で溶解した。このMpc溶液を1 mol/Lリン酸カリウム緩衝液(pH 8.0、200μM 2-ヒドロキシピリジンN-オキシドを含む、以下緩衝液Aという)で平衡化したゲルろ過カラム(Sephadex G-25、1.5×7.0 cm)にアプライし、緩衝液交換を行った。以上の方法で、緩衝液Aに溶解した濃度が約50 mg/mLのMpc溶液が2 mL程度調製できる。
(II) (I)で調製したMpc溶液を緩衝液Aで希釈し、Mpc濃度が15 mg/mLのMpc溶液を 7.0 mLを調製した。15-mLのポリプロピレン製遠心管(Thermo Scientific)に乾燥Tresyl Toyopearl (東ソー)を700 mg秤量し、この希釈Mpc溶液の全量を加え、室温で4時間、遠心管をゆっくり反転回転させながらインキュベーションした。
(III) 低速遠心で(II)のゲルを集め、0.5 mol/L塩化ナトリウム水溶液約10 mLに分散させ、洗浄した。洗浄したゲルを、0.1 mol/L Tris-HCl緩衝液(pH 8.0、0.5 mol/L塩化ナトリウム、200μM 2-ヒドロキシピリジンN-オキシドを含む)約10 mLに分散させ、洗浄した。洗浄したゲルを、このTris-HCl緩衝液10 mLに分散させ、室温で1時間、遠心管をゆっくり反転回転させながらインキュベーションした。
(IV) 低速遠心で(III)のゲルを集め、50 mmol/L HEPES-NaOH緩衝液(pH 7.5、イオン強度0.15 mol/L、200μMの2-ヒドロキシピリジンN-オキシドを含む)で3回洗浄した。洗浄後、このHEPES緩衝液にゲルを分散させ、4℃で保存した。
【0074】
上記の方法で99%以上の効率でMpcがトヨパールに固定される。Mpcの比活性は100 U/mgタンパク質以上あるので、Mpc固定化充填材は、ゲル1 mL当たり5000 U以上の活性を持つ(1μLの微量のゲルでも5 U以上の活性がある)。
【0075】
Mpc固定化充填材は、特異的な活性保護剤である2-ヒドロキシピリジンN-オキシドの存在下で保存するので、3年以上の長期保存でも活性が保持されることを確認している。
【0076】
Mpc結晶は公知の方法により製造することができる(J. Biochem. 117, 614-622(1995))。
【0077】
本実施例で使用した4CCの再結晶化法
(I) 市販の4CC (東京化成) 2 gを、油浴で約100℃に加熱したトルエン約20 mLで溶解し、円筒濾紙でろ過し、ろ液を容量50 mLのガラス瓶に受けた。
(II) (I)のろ液を室温まで冷ました後、-20℃で一晩静置した。
(III) (II)で析出した結晶をブフナー型ガラスろ過器で集め、完全に乾燥させた。
【0078】
O2測定用Mpcカラム(最大流速20μL/分用)
・ミクロMpcカラム(内径1.0 mm、外形1/16”、長さ4.0 cm、ゲル容量31μL、酵素活性150 U以上)
空カラムとして内径1.0 mm、外形1/16”、長さ4.0 cmのpeek製チューブ(Upchurch Scientific)を利用し、自家製充填装置でMpc固定化充填材を充填した。出口側フィルターには、市販のプレカラムフィルター(Upchurch Scientific、A-355)を利用した。流速10μL/分では、このカラムの通過時間が約3分間で、この通過時間の間に酸素分子は過剰に存在する4CCと完全に反応して、酸素分子と同数のP4ccに変換される。
【0079】
最大流速流速5μL/分で使用する場合には、キャピラリーMpcカラムを使う。内径0.5 mmまでなら、同じ方法でpeekチューブに充填できる。
【0080】
O2除去用Mpcカラム(最大処理量25 mL、使用流速20μL/分以下用)
・セミミクロMpcカラム(内径1/16”、外形1/8”、長さ5.0 cm、ゲル容量 94μL、酵素活性470 U以上)
空カラムとして内径1/16”、外形1/8”、長さ5.0 cmのradel製チューブ(Upchurch Scientific)を利用し、カラム出入り口フィルターには2ミクロンフィルター付きのフェラル(Upchurch Scientific、P-374x)を用いた。自家製簡易充填法で充填した。このカラムを約5分以上かけて通過する間に酸素分子は過剰に存在する4CCと完全に反応して、酸素分子と同数のP4ccに変換され、完全に取り除かれた。
【0081】
P4cc除去カラム(最大処理量25 mL用)
・セミミクロP4cc除去カラム(内径 2 mm、外形1/8”、長さ5.0 cm、ゲル容量 160μL)
空カラムとして内径2 mm、外形1/8”、長さ5.0 cmのpeek製チューブ(Upchurch Scientific)を利用し、カラム出入り口フィルターには2ミクロンフィルター付きのフェラル(Upchurch Scientific、P-374x)を用いた。自家製簡易充填法で、Toyopearl QAE-550C(東ソー)を充填した。このカラムを通過する間P4ccは完全に取り除かれた。参考例1では、約100 mLが処理できるように、内径が4 mmのカラムを用いた(参考例1以外はここで記載したものを使用した)。
【0082】
参考例1:O2除去モジュール(直接混合法)
モジュールの構成を図3に示す(4CC溶液の流速60μl/分)。本参考例でのみ、容量の大きいP4cc除去カラムを使用した。本参考例では、モジュールからの溶出液を、クラーク型酸素電極(Yellow Spring Instrument、model 5331)を装着した容量2 mLのガラス製反応槽(アルテグラス、特注品)に直接注入し、反応槽内の溶存酸素濃度の変化を連続的に記録した。測定結果を図4に示す。本結果は、原理的に、本タイプのモジュールで2 mLの比較的気密性の低い反応槽でも、その酸素濃度を6μMの低酸素レベルまでコントロールできることを示している。図3で、Mpc溶液の送液には、ケーワイエーテクノロジーズのDina Sシリンジポンプを、4CC溶液の送液には、AquathのNano8600-TRシリンジポンプを用いた。酸素電極の出力は、ケーワイエーテクノロジーズのSmart Chromデータ処理装置で記録・解析した。
【0083】
実施例1:O2測定用Mpcカラムの評価
実験系の構成を図5に示す。本実施例では、50 mLの緩衝液(50 mmol/L HEPES、pH 7.4、イオン強度0.15 mol/L)に7 mgの4CCを加え(4CC濃度は970μmol/L)、流速10μL/分で送液(AquathのNano8600-TRシリンジポンプを使用)し、波長380 nmでの吸光度を容量18 nLのフローセルを装着した紫外可視部検出器(ジーエルサイエンス、MU701)で測定した。そして、ミクロMpcカラム(内径1.0 mm、長さ4.0 cm)を流路に挿入した時の検出器からの溶出液を集め、紫外可視部分光器(島津、UV-2550)でその吸収スペクトルを測定し、溶存酸素が完全に等量のP4ccに変換されることを確認した。測定結果を図6に示す。
【0084】
実施例2:O2除去モジュールの評価(カラム連結方式)
モジュールの構成を図7に示す。本実施例では、O2除去用Mpcカラム(内径1.55 mm、長さ5.0 cm)とP4cc除去カラム(内径2 mm、長さ5.0 cm)をこの順に直結したものをO2除去モジュールとして使用した。緩衝液(50 mmol/L HEPES、pH 7.4、イオン強度0.15 mol/L)28 mLに4CCを2 mgを加えた液を、流速10μL/分でこのモジュールに送液し、モジュールからの溶出液をO2測定用Mpcカラムに導き、その溶出液の波長380 nmでの吸光度を容量18 nLのフローセルを装着した紫外可視部検出器(ジーエルサイエンス、MU701)でモニターした。測定結果を図8に示す。流速が10μl/分であるので、カラムを含む流路内のすべての酸素分子が取り除かれるまでに一定の時間を要するが、その後は安定して溶存酸素がほとんどゼロの緩衝液が供給できていた(240分付近のなだらかなピークは、実験で使用したシリンジポンプ(Aquath、Nano8600-TR、シリンジ容量が3 mL)が吸引モードに入りしばらく送液が停止したことによる)。本モジュールで、緩衝液から完全にO2が除去され、O2濃度ゼロの緩衝液が得られることが実証された。
【0085】
実施例3:O2濃度の直接制御
実験システムの構成を図9に示す。本実施例では、O2除去モジュールを装着した送液系(Aquath、Nano8600-TRで送液)からのO2濃度ゼロ緩衝液(50 mmol/L HEPES、pH 7.4、イオン強度0.15 mol/L)と、もう一つの送液系(ケーワイエーテクノロジーズ、Dina Sで送液)からの空気飽和の緩衝液(50 mmol/L HEPES、pH 7.4、イオン強度0.15 mol/L)とを、総流速を10μL/分にして、任意の比率で混合することにより、目的の酸素濃度の緩衝液を供給できることを実証した。本システムから供給される緩衝液の酸素濃度は、O2測定用Mpcカラムに連続的に緩衝液を導入し、波長380 nmでの吸光度を容量18 nLのフローセルを装着した紫外可視部検出器(ジーエルサイエンス、MU701)でモニターした。測定結果を図10に示す。図10のグラフは、図9の流速xを0、1、2、3μL/分と増加させたときの酸素濃度の変化を示している(0, 48, 87, 160μmol/Lと段階的に変化している)。本発明の方法で原理的に自由に酸素濃度をコントロールできることが明らかになった。
【0086】
実施例4:O2濃度の絶対測定
測定システムの構成を図11に示す。本実施例では、カラム連結型のO2除去モジュールを利用し、AquathのNano8600-TRシリンジポンプで流速10μL/分で送液した。一本のカラムにMpc固定充填剤とアニオン交換樹脂をこの順に充填した複合型カラムによるO2除去モジュールを用いることもできる。測定したい試料を25μLのガスタイトシリンジ(ハミルトン)でサンプリングし、そのうちの20μLを2μLのサンプルループにオーバーフローさせ、バルブ(Valco Instruments、C2-0006EH)を切り替えて、O2測定用Mpcカラムに導入した。測定結果を図12に示す。酸素分子がP4ccのピークとして検出された。ピーク面積から試料2μLに含まれていた酸素分子数が求められる。図12で、嫌気チャンバーの中の水のピークからその溶存酸素濃度が9.1μmol/Lと求められるが、この測定結果はガスタイトシリンジで嫌気チャンバーから水を取り出して測定する操作中に大気から水に混入した酸素を反映していると考えられる(嫌気チャンバー内の酸素は25 ppm未満なので)。9.1μmol/Lでもこれだけ明瞭なピークとして検出されているので、サブμmol/Lの濃度レベルまで十分測定可能なことが分かった。
【特許請求の範囲】
【請求項1】
以下の工程を含む溶存酸素を除去した液体の調製方法:
(1)メタピロカテカーゼ固定化体に4−クロロカテコール溶液を接触させる工程、及び
(2)工程(1)で得られた溶液とアニオン交換体を接触させる工程。
【請求項2】
以下の工程を含む所定の溶存酸素濃度を有する液体の調製方法:
(1)メタピロカテカーゼ固定化体に4-クロロカテコール溶液を接触させる工程、
(2)工程(1)で得られた溶液とアニオン交換体を接触させる工程、及び
(3)所定の溶存酸素濃度が得られる比率で、工程(2)で得られた溶液と、溶存酸素を含む液体を混合する工程。
【請求項3】
以下の工程を含む試料中の溶存酸素濃度の測定方法:
(1)メタピロカテカーゼ固定化体に4-クロロカテコール溶液を接触させる工程、
(2)工程(1)で得られた溶液とアニオン交換体を接触させる工程、
(3)工程(2)で得られた溶液と試料を混合する工程、
(4)工程(3)で得られた試料をメタピロカテカーゼ固定化体に接触させる工程、及び
(5)工程(4)で生成する5-クロロ-2-ヒドロキシムコン酸セミアルデヒド量を測定する工程。
【請求項4】
第一液体と第二液体の混合液の溶存酸素濃度を測定する装置であって、
メタピロカテカーゼを固定化した第一固定化体と前記第一固定化体の下流側に配置されたアニオン交換体充填体を有する酸素除去モジュールと、
第一液体及び前記酸素除去モジュールを介した第二液体が供給され、メタピロカテカーゼを固定化した第二固定化体と、
第二固定化体での反応によって生成した5-クロロ-2-ヒドロキシムコン酸セミアルデヒドを検知する検出機構
を備えることを特徴とする測定装置。
【請求項5】
前記第二固定化体に供給する第一液体をオーバーフローさせるサンプルループを更に備えた、請求項4に記載の装置。
【請求項6】
前記測定装置により取得された溶存酸素濃度に基づいて第一液体及び第二液体の供給速度を調整する制御手段を更に備えた、請求項4に記載の装置。
【請求項7】
メタピロカテカーゼを固定化した固定化体と前記固定化体の下流側に配置されたアニオン交換体充填体を有する酸素除去モジュールを備えることを特徴とする溶存酸素の除去装置。
【請求項1】
以下の工程を含む溶存酸素を除去した液体の調製方法:
(1)メタピロカテカーゼ固定化体に4−クロロカテコール溶液を接触させる工程、及び
(2)工程(1)で得られた溶液とアニオン交換体を接触させる工程。
【請求項2】
以下の工程を含む所定の溶存酸素濃度を有する液体の調製方法:
(1)メタピロカテカーゼ固定化体に4-クロロカテコール溶液を接触させる工程、
(2)工程(1)で得られた溶液とアニオン交換体を接触させる工程、及び
(3)所定の溶存酸素濃度が得られる比率で、工程(2)で得られた溶液と、溶存酸素を含む液体を混合する工程。
【請求項3】
以下の工程を含む試料中の溶存酸素濃度の測定方法:
(1)メタピロカテカーゼ固定化体に4-クロロカテコール溶液を接触させる工程、
(2)工程(1)で得られた溶液とアニオン交換体を接触させる工程、
(3)工程(2)で得られた溶液と試料を混合する工程、
(4)工程(3)で得られた試料をメタピロカテカーゼ固定化体に接触させる工程、及び
(5)工程(4)で生成する5-クロロ-2-ヒドロキシムコン酸セミアルデヒド量を測定する工程。
【請求項4】
第一液体と第二液体の混合液の溶存酸素濃度を測定する装置であって、
メタピロカテカーゼを固定化した第一固定化体と前記第一固定化体の下流側に配置されたアニオン交換体充填体を有する酸素除去モジュールと、
第一液体及び前記酸素除去モジュールを介した第二液体が供給され、メタピロカテカーゼを固定化した第二固定化体と、
第二固定化体での反応によって生成した5-クロロ-2-ヒドロキシムコン酸セミアルデヒドを検知する検出機構
を備えることを特徴とする測定装置。
【請求項5】
前記第二固定化体に供給する第一液体をオーバーフローさせるサンプルループを更に備えた、請求項4に記載の装置。
【請求項6】
前記測定装置により取得された溶存酸素濃度に基づいて第一液体及び第二液体の供給速度を調整する制御手段を更に備えた、請求項4に記載の装置。
【請求項7】
メタピロカテカーゼを固定化した固定化体と前記固定化体の下流側に配置されたアニオン交換体充填体を有する酸素除去モジュールを備えることを特徴とする溶存酸素の除去装置。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【公開番号】特開2012−200240(P2012−200240A)
【公開日】平成24年10月22日(2012.10.22)
【国際特許分類】
【出願番号】特願2011−70277(P2011−70277)
【出願日】平成23年3月28日(2011.3.28)
【出願人】(504177284)国立大学法人滋賀医科大学 (41)
【Fターム(参考)】
【公開日】平成24年10月22日(2012.10.22)
【国際特許分類】
【出願日】平成23年3月28日(2011.3.28)
【出願人】(504177284)国立大学法人滋賀医科大学 (41)
【Fターム(参考)】
[ Back to top ]

