清浄表面を有する金属材料の製造方法
【課題】大量のH2ガスを必要とせず、処理対象が粉末であっても組織の粗大化や焼結を生じさせることがなく、しかも比較的短時間で表面近傍の酸素や炭素を除去することが可能な清浄表面を有する金属材料の製造方法を提供すること。
【解決手段】チャンバー内に、H2ガスを原子状Hに分解するための触媒として機能するヒーターと、水素還元可能な金属元素を含む金属材料(但し、その融点がSnの融点以下であるものを除く)とを所定の間隔を置いて配置する設置工程と、前記チャンバー内を排気する排気工程と、前記ヒーターの加熱と前記チャンバー内へ前記H2ガスの導入とを同時に又は段階的に行い、前記ヒーターの表面において原子状Hを発生させ、前記原子状Hと前記金属材料とを反応させる反応工程とを備えた清浄表面を有する金属材料の製造方法。
【解決手段】チャンバー内に、H2ガスを原子状Hに分解するための触媒として機能するヒーターと、水素還元可能な金属元素を含む金属材料(但し、その融点がSnの融点以下であるものを除く)とを所定の間隔を置いて配置する設置工程と、前記チャンバー内を排気する排気工程と、前記ヒーターの加熱と前記チャンバー内へ前記H2ガスの導入とを同時に又は段階的に行い、前記ヒーターの表面において原子状Hを発生させ、前記原子状Hと前記金属材料とを反応させる反応工程とを備えた清浄表面を有する金属材料の製造方法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、清浄表面を有する金属材料の製造方法に関し、さらに詳しくは、主として金属材料の表面近傍に存在する酸素や炭素を除去することができ、これによって清浄な表面を有する金属材料を低コストかつ高効率で製造することが可能な清浄表面を有する金属材料の製造方法に関する。
【背景技術】
【0002】
近年、金属粉末に対する需要が増加傾向にある。バルク材に対する金属粉末のメリットは、結晶粒を微細化できること、成分偏析を抑制できること、ニアネットシェイプ化が可能であること等にある。しかしながら、金属粉末は、バルク材に比べて比表面積が増加するため、材料中の酸素が増加したり、プロセスに起因する他の元素(例えば、溶剤などの有機物に由来する炭素)の汚染を受けやすいというデメリットがある。そのため、表面の清浄性が求められる用途に使用される金属材料には、酸素や炭素を低減するための処理が必要となる。
【0003】
一般に、金属粉末の酸素低減(還元)には、高温水素雰囲気での熱処理が用いられている(例えば、特許文献1参照)。しかしながら、高温水素雰囲気での熱処理は、通常、大気圧下で水素ガスをフローさせた状態で処理を行うため、大量のH2ガスが必要となる。また、酸化物の水素還元には高温が必要となるため、金属粉末の融点近くまで反応温度を上昇させる必要がある。そのため、金属粉末の製造直後には微細化されていた組織が反応中に粗大化したり、あるいは、粒度の細かい粉末が反応中に焼結する場合がある。さらに、水素還元には、一般的に数時間から数日の反応時間が必要となる。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特開2001−181713号公報
【発明の概要】
【発明が解決しようとする課題】
【0005】
本発明が解決しようとする課題は、大量のH2ガスを必要とせず、処理対象が粉末であっても組織の粗大化や焼結を生じさせることがなく、しかも比較的短時間で表面近傍の酸素や炭素を除去することができ、これによって清浄な表面を有する金属材料を低コストかつ高効率で製造することが可能な清浄表面を有する金属材料の製造方法を提供することにある。
また、本発明が解決しようとする他の課題は、相対的に水素還元されにくい金属材料であっても、表面近傍の酸素含有量及び炭素含有量を低コストかつ高効率で低減することが可能な清浄表面を有する金属材料の製造方法を提供することにある。
【課題を解決するための手段】
【0006】
上記課題を解決するために本発明に係る清浄表面を有する金属材料の製造方法は、
チャンバー内に、H2ガスを原子状Hに分解するための触媒として機能するヒーターと、水素還元可能な金属元素を含む金属材料(但し、その融点がSnの融点以下であるものを除く)とを所定の間隔を置いて配置する設置工程と、
前記チャンバー内を排気する排気工程と、
前記ヒーターの加熱と前記チャンバー内へ前記H2ガスの導入とを同時に又は段階的に行い、前記ヒーターの表面において原子状Hを発生させ、前記原子状Hと前記金属材料とを反応させる反応工程と
を備えていることを要旨とする。
この場合、前記チャンバーとして、リーク率が1.0×10-3(Lusec)以下であるものを用い、
前記排気工程は、前記チャンバー内の真空度が1.0×10-3Pa以下となるまで前記チャンバー内を排気するのが好ましい。
【発明の効果】
【0007】
触媒能を有するヒーターを所定の温度に加熱し、ヒーター表面にH2ガスを接触させると、H2ガスが原子状Hに分解する。そのため、ヒーターから所定の間隔を置いて金属材料を配置すると、金属材料の表面近傍に存在する金属酸化物が原子状Hにより容易に還元される。また、原子状Hは、材料表面近傍に存在する炭素とも反応するので、表面近傍の脱酸と同時に脱炭も進行する。
【0008】
本発明に係る方法は、活性の高い原子状Hを用いて金属表面の脱酸及び脱炭を行うので、大量のH2ガスを必要としない。また、原子状Hと金属材料とを反応させる際、金属材料をヒーターに近づける必要がないので、金属材料が微細な粉末である場合であっても、組織の粗大化や粉末の焼結を抑制することができる。また、原子状Hは、H2ガスに比べて活性が高いので、脱酸及び脱炭を短時間で行うことができる。
さらに、チャンバーのリーク率及びH2ガス導入前のチャンバーの真空度(到達圧力)を最適化すると、相対的に水素還元されにくい金属材料であっても、金属材料の表面近傍に存在する酸素及び炭素を低コストかつ高効率で低減することができる。
【図面の簡単な説明】
【0009】
【図1】本発明に係る方法に用いられる水素還元装置の概略構成図である。
【図2】還元処理前の試料#0(酸化膜厚さd=50nm)(左図)及び還元処理後の試料#1(右図)の外観写真である。
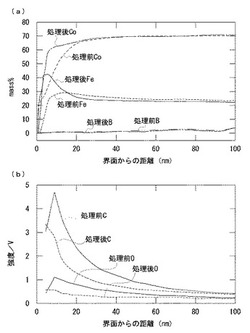
【図3】図3(a)は、還元処理前の試料(酸化膜厚さd=50nm)及び還元処理後の試料のFe、Co及びBの深さ方向分析の結果である。図3(b)は、還元処理前の試料(酸化膜厚さd=50nm)及び還元処理後の試料のO及びCの深さ方向分析の結果である。
【図4】図4(a)は、還元処理前の試料(酸化膜厚さd=2000nm)及び還元処理後の試料の薄膜XRDパターンである。図4(b)は、還元処理前の試料(酸化膜厚さd=1360nm)及び還元処理後の試料の薄膜XRDパターンである。
【0010】
【図5】還元処理前の試料No.0、及び、種々の条件下で還元処理を行った試料No.1〜No.6の外観写真である。
【図6】還元処理前の試料(酸化膜厚さd=500nm)及び還元処理後の試料のO、C、Wの発光強度の深さ方向分布である。
【図7】リーク率の異なるチャンバーを用いて還元処理された試料#1〜#4の外観写真である。
【図8】図7に示す試料の試料番号とリーク率との関係を示す図である。
【図9】還元処理前及び還元処理後の粉末試料のオージェ電子分光分析及びフーリエ変換赤外分光分析(FT−IR)の結果である。
【図10】チャンバーのリーク率と表面酸化物中の酸素量との関係を示す図である。
【図11】真空引き時のチャンバーの到達圧力と表面酸化物中の酸素量との関係を示す図である。
【発明を実施するための形態】
【0011】
以下、本発明の一実施の形態について詳細に説明する。
[1. 水素還元装置]
図1に、本発明に係る方法に用いられる水素還元装置の概略構成図を示す。図1において、水素還元装置10は、チャンバー12と、ヒーター14と、H2ガス供給手段16とを備えている。
【0012】
[1.1. チャンバー]
チャンバー12は、内部を所定の真空度に維持した状態で、原子状Hを発生させるための容器である。チャンバー12は、内部を所定の真空度に維持することができ、内部に被処理物(金属材料)18を保持することができ、かつ、内部に所定量のH2ガスを導入可能なものであれば良い。チャンバー12の形状や容量は、特に限定されるものではなく、目的に応じて任意に選択することができる。
チャンバー12内には、被処理物18を載置するためのホルダー12aが設けられている。さらに、チャンバー12は、図示しない排気手段(ポンプ)に接続されており、内部を所定の真空度に維持できるようになっている。
【0013】
チャンバー12のリーク率は、還元処理後の被処理物18の表面状態に影響を与える。チャンバー12内での還元処理は、減圧状態で行われる。そのため、チャンバー12のリーク率が高いと、ヒーター14を加熱する際に、チャンバー12内に侵入した酸素によってヒーター14が酸化される場合がある。ヒーター14が酸化されると、ヒーター14を構成する金属の酸化物が被処理物18表面に付着したり、ヒーター14表面が酸化物で覆われ、H2の分解反応が抑制される場合がある。
また、チャンバー12のリーク率が高いと、
(a)チャンバー12内に導入されたH2ガスが原子状Hに分解する前に酸化され、
(b)原子状Hにより清浄化された被処理物18表面が再酸化され、あるいは、
(c)チャンバー12内に導入されたH2ガスが原子状Hに分解後、O2と衝突してH2又はH2Oになる
場合もある。従って、チャンバー12のリーク率は、低いほど良い。
清浄な表面を持つ被処理物18を得るためには、チャンバー12のリーク率は、1.0×10-3(Lusec)以下が好ましい。リーク率は、さらに好ましくは、1.0×10-4(Lusec)以下である。
【0014】
[1.2. ヒーター]
ヒーター14は、チャンバー12内に導入されたH2ガスを原子状Hに分解させるための触媒として機能する。そのため、ヒーター14には、H2ガスを原子状Hに分解させる触媒能を有する材料が用いられる。このような材料としては、例えば、W、Mo、Ta、Nbなどがある。
ヒーター14は、図示しない電源に接続されており、ヒーター14を所定の温度に加熱できるようになっている。また、ヒーター14は、ホルダ12a上に載置される被処理物18の上方に支持されている。
【0015】
ヒーター14の形状や大きさは、特に限定されるものではなく、H2ガスを原子状Hに効率よく分解することができる形状や大きさであれば良い。図1に示す例において、ヒーター14は、ワイヤー状になっており、ワイヤー状のヒーター14は、フレーム14aにより支持されている。
【0016】
[1.3. H2ガス供給手段]
H2ガス供給手段16は、チャンバー12内に所定量のH2ガスを供給するためのものである。図1に示す例において、H2ガス供給手段16は、多数のガス噴出孔16a、16a…を備えた円板16bと、円板16bに接続された配管16cとを備えている。配管16cの他端は、図示しないH2ガス源に接続されている。
円板16bは、チャンバー12内のヒーター14の上方に固定されている。H2ガス供給手段16から供給されるH2ガスは、円板16bのガス噴出孔16a、16a…からヒーター14に向かって噴射されるようになっている。
【0017】
[1.4. 被処理物]
水素還元装置10で還元処理される被処理物(金属材料)18の形状は、特に限定されるものではなく、棒、板、粉末等、いずれの形状であっても良い。
図1に示す例において、被処理物18は、金属粉末からなる。金属粉末からなる被処理物18は、ボート20に入れられ、ボート20は、ホルダ12a上に載置されている。
【0018】
水素還元装置10で還元処理される被処理物18は、水素還元可能な金属元素を含む金属材料であれば良い。但し、被処理物18は、その融点がSnの融点以下であるものを除く。Sn(融点:231.93℃)と同等以下の融点を持つ金属材料は、一般に比較的短時間かつ低温で表面近傍の酸素や炭素を除去することができるので、本発明を適用しても顕著な効果を得ることは期待できない。一方、Snより高い融点を持つ金属材料の場合、一般に、水素還元には大量のH2ガスと高温・長時間の処理が必要となる。そのため、水素還元時に結晶粒の粗大化、粉末の焼結などが生じるおそれがある。
これに対し、Snより高い融点を有する金属材料に対して本発明を適用すると、結晶粒の粗大化や焼結などを生じさせることなく、表面近傍の酸素や炭素を効率的に除去することができる。
【0019】
ある金属の酸化物が水素還元可能か否かは、エリンガム図により判断することができる。試料温度(400℃)における酸化物の標準生成自由エネルギーΔG0(=RTlnPO2)が−720kJ/mol以上である金属元素の酸化物は、本発明に係る方法を用いて水素還元することが可能である。
水素還元が可能な金属酸化物としては、例えば、CuO、Fe2O3、Fe3O4などがある。一方、水素還元が困難な金属酸化物としては、例えば、Al2O3、SiO2、TiO2などがある。
【0020】
本発明が適用できる金属材料としては、具体的には、
(1)Co−Fe合金などのFe合金、
(2)Cu−Zn合金、Cu−Sn合金などのCu合金、
(3)Ni−Cr−Fe合金、Ni−Cr合金などのNi合金、
などがある。
ここで「Fe合金」、「Cu合金」又は「Ni合金」とは、とは、主要元素としてFe、Cu又はNiを含む合金又は金属間化合物をいう。
【0021】
特に、Fe合金は、他の合金に比べて融点が高いので、Fe合金に対して本発明を適用すると、従来の方法に比べて顕著な効果(例えば、組織の粗大化の抑制や粉末の焼結の抑制)が得られる。ここで、Feの融点は1538℃、Cuの融点は1084℃、Niの融点は1455℃である。
例えば、Fe合金からなるスパッタリングターゲットには、微細結晶粒であること、及び、低酸素量であることが求められる。一般に、ターゲットの結晶粒が粗くなるほど、薄膜に偏析が生じたり、あるいは、薄膜の膜厚のバラツキが大きくなる。また、ターゲット中の酸素量が増大するほど、薄膜上にゴミ(パーティクル)が生成しやすくなる。
しかしながら、結晶粒を微細化するためにFe合金粉末を焼結させてターゲットを製造すると、Fe合金粉末の酸化によってターゲット中の酸素量が増大する。一方、ターゲット中の酸素量を低減するために、焼結前のFe合金粉末を高温で水素還元すると、結晶粒の粗大化や粉末の焼結が進行する。そのため、従来の方法では、微細結晶粒と低酸素量とを両立させることが困難であった。
これに対し、Fe合金粉末に対して本発明を適用すると、微細結晶粒と低酸素量とを兼ね備えたスパッタリングターゲットが得られる。
【0022】
[2. 清浄表面を有する金属材料の製造方法]
本発明に係る清浄表面を有する金属材料の製造方法は、設置工程と、排気工程と、反応工程とを備えている。
【0023】
[2.1. 設置工程]
設置工程は、図1に示すように、チャンバー12内に、H2ガスを原子状Hに分解するための触媒として機能するヒーター14と、水素還元可能な金属元素を含む金属材料18(但し、その融点がSnの融点以下であるものを除く)とを所定の間隔を置いて配置する工程である。
チャンバー12、ヒーター14及び金属材料18の詳細については、上述した通りであるので説明を省略する。
ヒーター14と金属材料18との間隔は、特に限定されるものではなく、金属材料18の温度が所定の温度に維持され、かつ、反応が効率よく進行するように、金属材料18の組成や反応条件に応じて、最適な間隔を選択すれば良い。
【0024】
[2.2. 排気工程]
排気工程は、チャンバー12内を排気する工程である。
チャンバー12内での還元処理は、減圧状態で行われる。そのため、チャンバー12の真空度が不十分であると、ヒーター14を加熱する際に、チャンバー12内に残存している酸素によってヒーター14が酸化される場合がある。ヒーター14が酸化されると、ヒーター14を構成する金属の酸化物が被処理物(金属材料)18表面に付着したり、ヒーター14表面が酸化物で覆われ、H2の分解反応が抑制される場合がある。
また、チャンバー12の真空度が低いと、
(a)チャンバー12内に導入されたH2ガスが原子状Hに分解する前に酸化され、
(b)原子状Hにより清浄化された被処理物18表面が再酸化され、あるいは、
(c)チャンバー12内に導入されたH2ガスが原子状Hに分解後、O2と衝突してH2又はH2Oになる
場合もある。従って、チャンバー12の真空度は、高い程良い。
清浄な表面を持つ被処理物18を得るためには、チャンバー12の真空度(真空引き時の到達圧力)は、1.0×10-3Pa以下が好ましい。真空度は、さらに好ましくは、1.0×10-4Pa以下である。
【0025】
[2.3. 反応工程]
反応工程は、ヒーター14の加熱とチャンバー12内へ前記H2ガスの導入とを同時に又は段階的に行い、ヒーター14の表面において原子状Hを発生させ、原子状Hと金属材料18とを反応させる工程である。
ヒーター14の加熱とチャンバー12内へのH2ガスの導入は、同時に行っても良く、あるいは、段階的に(すなわち、いずれか一方を先に)行っても良い。チャンバー12内に導入したH2ガスを効率よく原子状Hに分解するためには、先にヒーター14を所定の温度(H2ガスを効率よく原子状Hに分解可能な温度)まで加熱し、次いでチャンバー12内にH2ガスを導入するのが好ましい。
【0026】
ヒーター14の加熱温度は、H2ガスを効率よく原子状Hに分解できる温度であればよい。ヒーター14の加熱温度は、通常、1600〜1800℃である。
【0027】
チャンバー12内へのH2ガスの導入量は、反応効率に影響を与える。H2ガスの導入量が少なすぎると、反応効率が低下する。従って、反応工程は、チャンバー12内の圧力が0.5Pa以上に維持されるようにH2ガスを導入するのが好ましい。チャンバー12内の圧力は、さらに好ましくは、7.0Pa以上、さらに好ましくは、10.0Pa以上である。
一方、必要以上にH2ガスを導入するのは、実益がないだけでなく、水素消費量の増大を招く。従って、反応工程は、チャンバー12内の圧力が66.7Pa以下に維持されるようにH2ガスを導入するのが好ましい。チャンバー12内の圧力は、さらに好ましくは30Pa以下、さらに好ましくは、25Pa以下である。
【0028】
[3. 清浄表面を有する金属材料の製造方法の作用]
まず、図1に示す水素還元装置10のホルダー12a上に金属材料18を載せる。次いで、図示しない排気手段を用いて、チャンバー12内の排気を行う。チャンバー12内が所定の真空度に達したところで、触媒能を有するヒーター14を所定の温度に加熱し、チャンバー12内に所定量のH2ガスを流す。所定の温度に加熱されたヒーター14表面にH2ガスが接触すると、H2ガスが原子状Hに分解する。そのため、ヒーター14から所定の間隔を置いて金属材料18を配置すると、金属材料18の表面近傍に存在する金属酸化物が原子状Hにより容易に還元される。
また、金属材料18は、有為成分として炭素を含む場合がある。また、有為成分として炭素を含まない場合であっても、金属材料18の表面には、溶剤等に由来する炭素が存在している場合がある。原子状Hは、固溶(合金成分として入っている)炭素は除去できないが、金属材料18の表面に付着している炭素や有機物は除去できるので、表面近傍の脱酸と同時に脱炭も進行する。
【0029】
本発明に係る方法は、活性の高い原子状Hを用いて金属材料18表面の脱酸及び脱炭を行うので、大量のH2ガスを必要としない。また、原子状Hと金属材料18とを反応させる際、金属材料18をヒーター14に近づける必要がないので、金属材料18が微細な粉末である場合であっても、組織の粗大化や粉末の焼結を抑制することができる。また、原子状Hは、H2ガスに比べて活性が高いので、脱酸及び脱炭を短時間で行うことができる。
さらに、チャンバー12のリーク率及びH2ガス導入前のチャンバー12の真空度を最適化すると、相対的に水素還元されにくい金属材料18であっても、金属材料18の表面近傍に存在する酸素及び炭素を低コストかつ高効率で低減することができる。
【実施例】
【0030】
(実施例1)
[1. 試料の作製]
試料には、Co40−Fe40−B20(at%)合金(以下、「CoFeB合金」という)からなる板材を用いた。板材は、所定形状に加工した後、大気中、500℃で1分間〜40分間加熱した。酸化膜厚さdは、50〜2000nmであった。
この板材を図1に示す水素還元装置10を用いて還元処理した。チャンバー12のリーク率は、1×10-4(Lusec)であった。また、処理条件は、排気直後の真空度:5×10-4Pa、ヒーター(触媒)14の温度Tcat:1800℃、処理時間:10分、H2ガス導入時のチャンバー12内の圧力Pg:7.1Pa、とした。
【0031】
[2. 試験方法]
[2.1. 外観]
目視により外観を評価した。
[2.2. 深さ方向分析及び表層酸素量]
グロー放電発光分光分析(GD−OES)を用いて、各元素の深さ方向分析を行った。
また、ヘリウム中融解赤外線吸光法を用いて、表層酸素量を求めた。
[2.3. 薄膜XRD]
入射X線を低角度入射(0.5°)させて分析深さを浅くする薄膜XRD法を用いて、表面層を分析した。
【0032】
[3. 結果]
図2に、処理前の試料#0(酸化膜厚さd=50nm)(左図)及び処理後(右図)の試料#1の外観写真を示す。処理前の試料の表面は、表面酸化のために金属光沢が見られない。また、表層酸素量は、5.2ppmであった。一方、処理後の試料の表面は、金属光沢があり、表層酸素量は、0.9ppmであった。
図3(a)に、処理前の試料(酸化膜厚さd=50nm)及び処理後の試料のFe、Co及びBの深さ方向分析の結果を示す。また、図3(b)に、処理前の試料(酸化膜厚さd=50nm)及び処理後の試料のO及びCの深さ方向分析の結果を示す。図3より、水素還元により表面近傍のOとCが低減していることがわかる。これは、原子状HによりOがH2Oとして除去され、CがCHxとして除去されたためと考えられる。
【0033】
図4(a)に、還元処理前の試料(酸化膜厚さd=2000nm、処理時間=40分)及び還元処理後の試料の薄膜XRDパターンを示す。図4(b)に、還元処理前の試料(酸化膜厚さd=1360nm、処理時間=30分)及び還元処理後の試料の薄膜XRDパターンを示す。図4より、還元処理前に存在していたCoFeBの表面酸化物(Fe2O3、Fe3O4、Fe2O(BO3)など)が還元処理によって除去されていることがわかる。
【0034】
(実施例2)
[1. 試料の作製]
試料には、CoFeB合金からなる板材を用いた。板材は、所定形状に加工した後、大気中、650℃で10分間加熱した。酸化膜厚さd=500nmであった。
この板材を図1に示す水素還元装置10を用いて還元処理した。チャンバー12のリーク率は、1×10-4(Lusec)であった。また、処理条件は、排気直後の真空度:5×10-4Pa、ヒーター(触媒)14の温度Tcat:1400℃〜1800℃、試料の温度Tsamp:335〜561℃、処理時間:30分、H2ガス導入時のチャンバー12内の圧力Pg:7.1〜43Pa、水素流量Q:20cm3/min〜80cm3/min、とした。
【0035】
[2. 試験方法]
[2.1. 外観]
目視により外観を評価した。
[2.2. 深さ方向分析]
グロー放電発光分光分析(GD−OES)によりO、C、Wの深さ方向分析を行った。
【0036】
[3. 結果]
図5に、還元処理前の試料No.0、及び、種々の条件下で還元処理を行った試料No.1〜No.6の外観写真を示す。図5より、以下のことがわかる。
(1)還元処理前の試料No.0の表面には金属光沢がないのに対し、還元処理後の試料No.1〜No.6の表面は、いずれも金属光沢を呈していた。
(2)チャンバー12内圧力Pg、水素流量Q、ヒーター温度Tcat及び試料温度Tsampを広範囲に変化させても還元が可能であった。
(3)試料温度Tsamp=335℃でも還元が可能であった。
【0037】
図6に、還元処理前の試料(酸化膜厚さd=500nm)及び還元処理後の試料のO、C、Wの発光強度の深さ方向分布を示す。図6より、以下のことがわかる。
(1)還元処理条件によらず、還元処理後の表面及び深さ方向のOの発光強度は、還元処理前に比べて減少した。
(2)還元処理条件によらず、還元処理後の深さ方向のCの発光強度は、還元処理前に比べて減少した。
(3)還元処理条件によらず、還元処理後の表面のWの発光強度は、還元処理前に比べて増大した。これは、ヒーター14の酸化物(W2O3)が試料表面に付着したためと考えられる。
【0038】
(実施例3)
[1. 試料の作製]
試料には、CoFeB合金からなる板材を用いた。板材は、所定形状に加工した後、大気中、650℃で10分間加熱した。酸化膜厚さd=500nmであった。
この板材を図1に示す水素還元装置10を用いて還元処理した。チャンバー12のリーク率は、1×10-4〜2×101(Lusec)の範囲で変化させた。また、処理条件は、排気直後の真空度:5×10-4Pa、ヒーター(触媒)14の温度Tcat:1800℃、試料の温度Tsamp:350℃、処理時間:30分、H2ガス導入時のチャンバー12内の圧力Pg:50Pa、水素流量Q:50cm3/min、とした。
【0039】
[2. 結果]
図7に、リーク率の異なるチャンバー12を用いて還元処理された試料#1〜#4の外観写真を示す。また、図8に、図7に示す試料の試料番号とリーク率との関係を示す。図7及び図8より、以下のことがわかる。
(1)リーク率が低くなるほど、試料表面の清浄度が増す。
(2)リーク率が2×10-2(Lusec(Torr・L/s))以上である試料#1〜3は、金属光沢を有する表面が得られなかった。一方、リーク率が10-4(Lusec)である試料#4は、金属光沢を有する試料表面が得られた。
【0040】
(実施例4)
[1. 試料の作製]
アトマイズ法を用いて、CoFeB合金からなる粉末を作製した。粉末粒度は、106/75μmであった。この粉末を、500℃/O2/1.5minの条件下で酸化させた。
この粉末を図1に示す水素還元装置10を用いて還元処理した。チャンバー12のリーク率は、1×10-4(Lusec)とした。また、処理条件は、排気直後の真空度:5×10-4Pa、ヒーター(触媒)14の温度Tcat:1600℃、試料の温度Tsamp:400℃、処理時間:30分、H2ガス導入時のチャンバー12内の圧力Pg:0.7Pa、水素流量Q:200cm3/min、とした。
【0041】
[2. 試験方法]
[2.1. オージェ電子分光分析]
オージェ電子分光分析により、表面近傍の元素分布を測定した。
[2.2. フーリエ変化赤外分光法(FT−IR)]
FT−IRにより、材料表面に存在する化合物の同定を行った。
【0042】
図9に、還元処理前及び還元処理後の粉末試料のオージェ電子分光分析及びフーリエ変換赤外分光分析(FT−IR)の結果を示す。図9より、以下のことがわかる。
(1)オージェ電子分光分析より、表面酸化層の厚さは、還元により15nmから2nmに減少することがわかった。
(2)FT−IRより、還元処理によってFe2O3のピークが消失することがわかった。また、還元処理によって表面付着水に起因するピークが減少することがわかった。
(3)試料形状が粉末であっても、本発明に係る方法により低温還元が可能である。
【0043】
(実施例5)
[1. 試料の作製]
試料には、CoFeB合金からなる板材を用いた。板材は、所定形状に加工した後、大気中、650℃で10分間加熱した。酸化膜厚さd=500nmであった。
この板材を図1に示す水素還元装置10を用いて還元処理した。チャンバー12のリーク率は、1×10-4〜102(Lusec)の範囲で変化させた。排気直後の真空度は、1×10-4〜4×102Paの範囲で変化させた。その他の処理条件は、ヒーター(触媒)14の温度Tcat:1600℃、試料の温度Tsamp:400℃、処理時間:30分、H2ガス導入時のチャンバー12内の圧力Pg:43Pa、水素流量Q:80cm3/min、とした。
【0044】
[2. 試験方法]
グロー放電質量分析(GDMS)により、試料表面に付着した酸化物(W2O3)中のWを分析した。試料表面の生成物は、W2O3であるため、組成比から酸化物中の酸素量を算出した。
【0045】
[3. 結果]
図10に、チャンバー12のリーク率と表面酸化物中の酸素量との関係を示す。また、図11に、真空引き時のチャンバー12の到達圧力と表面酸化物中の酸素量との関係を示す。図10及び図11より、以下のことがわかる。
(1)チャーバー12のリーク率が高い場合、及び、真空引き時のチャンバー12の到達圧力が高い場合のいずれも、表面酸化物中の酸素量が多い。これは、チャンバー12内に存在する酸素がヒーター14を酸化させ、酸化によりヒーター14表面に生成したW2O3が蒸発し、試料表面に付着したためと考えられる。W2O3の付着量が多いほど、酸素量は多くなり、試料表面の還元がおこっていないことを示している。
(2)チャンバー12のリーク率が5×10-1(Lusec)以下になると、表面酸化物中の酸素量(W2O3の付着量)は、2(massppm)以下となる。
(3)真空引き時のチャンバー12の到達圧力が1×10-3Pa以下になると、表面酸化物中の酸素量(W2O3の付着量)は、2(massppm)以下となる。
【0046】
以上、本発明の実施の形態について詳細に説明したが、本発明は、上記実施の形態に何ら限定されるものではなく、本発明の要旨を逸脱しない範囲内で種々の改変が可能である。
【産業上の利用可能性】
【0047】
本発明に係る金属材料の製造方法は、各種金属材料の表面の脱酸処理、及び脱炭処理に使用することができる。
【符号の説明】
【0048】
10 水素還元装置
12 チャンバー
14 ヒーター
16 水素ガス供給手段
18 被処理物(金属材料)
【技術分野】
【0001】
本発明は、清浄表面を有する金属材料の製造方法に関し、さらに詳しくは、主として金属材料の表面近傍に存在する酸素や炭素を除去することができ、これによって清浄な表面を有する金属材料を低コストかつ高効率で製造することが可能な清浄表面を有する金属材料の製造方法に関する。
【背景技術】
【0002】
近年、金属粉末に対する需要が増加傾向にある。バルク材に対する金属粉末のメリットは、結晶粒を微細化できること、成分偏析を抑制できること、ニアネットシェイプ化が可能であること等にある。しかしながら、金属粉末は、バルク材に比べて比表面積が増加するため、材料中の酸素が増加したり、プロセスに起因する他の元素(例えば、溶剤などの有機物に由来する炭素)の汚染を受けやすいというデメリットがある。そのため、表面の清浄性が求められる用途に使用される金属材料には、酸素や炭素を低減するための処理が必要となる。
【0003】
一般に、金属粉末の酸素低減(還元)には、高温水素雰囲気での熱処理が用いられている(例えば、特許文献1参照)。しかしながら、高温水素雰囲気での熱処理は、通常、大気圧下で水素ガスをフローさせた状態で処理を行うため、大量のH2ガスが必要となる。また、酸化物の水素還元には高温が必要となるため、金属粉末の融点近くまで反応温度を上昇させる必要がある。そのため、金属粉末の製造直後には微細化されていた組織が反応中に粗大化したり、あるいは、粒度の細かい粉末が反応中に焼結する場合がある。さらに、水素還元には、一般的に数時間から数日の反応時間が必要となる。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特開2001−181713号公報
【発明の概要】
【発明が解決しようとする課題】
【0005】
本発明が解決しようとする課題は、大量のH2ガスを必要とせず、処理対象が粉末であっても組織の粗大化や焼結を生じさせることがなく、しかも比較的短時間で表面近傍の酸素や炭素を除去することができ、これによって清浄な表面を有する金属材料を低コストかつ高効率で製造することが可能な清浄表面を有する金属材料の製造方法を提供することにある。
また、本発明が解決しようとする他の課題は、相対的に水素還元されにくい金属材料であっても、表面近傍の酸素含有量及び炭素含有量を低コストかつ高効率で低減することが可能な清浄表面を有する金属材料の製造方法を提供することにある。
【課題を解決するための手段】
【0006】
上記課題を解決するために本発明に係る清浄表面を有する金属材料の製造方法は、
チャンバー内に、H2ガスを原子状Hに分解するための触媒として機能するヒーターと、水素還元可能な金属元素を含む金属材料(但し、その融点がSnの融点以下であるものを除く)とを所定の間隔を置いて配置する設置工程と、
前記チャンバー内を排気する排気工程と、
前記ヒーターの加熱と前記チャンバー内へ前記H2ガスの導入とを同時に又は段階的に行い、前記ヒーターの表面において原子状Hを発生させ、前記原子状Hと前記金属材料とを反応させる反応工程と
を備えていることを要旨とする。
この場合、前記チャンバーとして、リーク率が1.0×10-3(Lusec)以下であるものを用い、
前記排気工程は、前記チャンバー内の真空度が1.0×10-3Pa以下となるまで前記チャンバー内を排気するのが好ましい。
【発明の効果】
【0007】
触媒能を有するヒーターを所定の温度に加熱し、ヒーター表面にH2ガスを接触させると、H2ガスが原子状Hに分解する。そのため、ヒーターから所定の間隔を置いて金属材料を配置すると、金属材料の表面近傍に存在する金属酸化物が原子状Hにより容易に還元される。また、原子状Hは、材料表面近傍に存在する炭素とも反応するので、表面近傍の脱酸と同時に脱炭も進行する。
【0008】
本発明に係る方法は、活性の高い原子状Hを用いて金属表面の脱酸及び脱炭を行うので、大量のH2ガスを必要としない。また、原子状Hと金属材料とを反応させる際、金属材料をヒーターに近づける必要がないので、金属材料が微細な粉末である場合であっても、組織の粗大化や粉末の焼結を抑制することができる。また、原子状Hは、H2ガスに比べて活性が高いので、脱酸及び脱炭を短時間で行うことができる。
さらに、チャンバーのリーク率及びH2ガス導入前のチャンバーの真空度(到達圧力)を最適化すると、相対的に水素還元されにくい金属材料であっても、金属材料の表面近傍に存在する酸素及び炭素を低コストかつ高効率で低減することができる。
【図面の簡単な説明】
【0009】
【図1】本発明に係る方法に用いられる水素還元装置の概略構成図である。
【図2】還元処理前の試料#0(酸化膜厚さd=50nm)(左図)及び還元処理後の試料#1(右図)の外観写真である。
【図3】図3(a)は、還元処理前の試料(酸化膜厚さd=50nm)及び還元処理後の試料のFe、Co及びBの深さ方向分析の結果である。図3(b)は、還元処理前の試料(酸化膜厚さd=50nm)及び還元処理後の試料のO及びCの深さ方向分析の結果である。
【図4】図4(a)は、還元処理前の試料(酸化膜厚さd=2000nm)及び還元処理後の試料の薄膜XRDパターンである。図4(b)は、還元処理前の試料(酸化膜厚さd=1360nm)及び還元処理後の試料の薄膜XRDパターンである。
【0010】
【図5】還元処理前の試料No.0、及び、種々の条件下で還元処理を行った試料No.1〜No.6の外観写真である。
【図6】還元処理前の試料(酸化膜厚さd=500nm)及び還元処理後の試料のO、C、Wの発光強度の深さ方向分布である。
【図7】リーク率の異なるチャンバーを用いて還元処理された試料#1〜#4の外観写真である。
【図8】図7に示す試料の試料番号とリーク率との関係を示す図である。
【図9】還元処理前及び還元処理後の粉末試料のオージェ電子分光分析及びフーリエ変換赤外分光分析(FT−IR)の結果である。
【図10】チャンバーのリーク率と表面酸化物中の酸素量との関係を示す図である。
【図11】真空引き時のチャンバーの到達圧力と表面酸化物中の酸素量との関係を示す図である。
【発明を実施するための形態】
【0011】
以下、本発明の一実施の形態について詳細に説明する。
[1. 水素還元装置]
図1に、本発明に係る方法に用いられる水素還元装置の概略構成図を示す。図1において、水素還元装置10は、チャンバー12と、ヒーター14と、H2ガス供給手段16とを備えている。
【0012】
[1.1. チャンバー]
チャンバー12は、内部を所定の真空度に維持した状態で、原子状Hを発生させるための容器である。チャンバー12は、内部を所定の真空度に維持することができ、内部に被処理物(金属材料)18を保持することができ、かつ、内部に所定量のH2ガスを導入可能なものであれば良い。チャンバー12の形状や容量は、特に限定されるものではなく、目的に応じて任意に選択することができる。
チャンバー12内には、被処理物18を載置するためのホルダー12aが設けられている。さらに、チャンバー12は、図示しない排気手段(ポンプ)に接続されており、内部を所定の真空度に維持できるようになっている。
【0013】
チャンバー12のリーク率は、還元処理後の被処理物18の表面状態に影響を与える。チャンバー12内での還元処理は、減圧状態で行われる。そのため、チャンバー12のリーク率が高いと、ヒーター14を加熱する際に、チャンバー12内に侵入した酸素によってヒーター14が酸化される場合がある。ヒーター14が酸化されると、ヒーター14を構成する金属の酸化物が被処理物18表面に付着したり、ヒーター14表面が酸化物で覆われ、H2の分解反応が抑制される場合がある。
また、チャンバー12のリーク率が高いと、
(a)チャンバー12内に導入されたH2ガスが原子状Hに分解する前に酸化され、
(b)原子状Hにより清浄化された被処理物18表面が再酸化され、あるいは、
(c)チャンバー12内に導入されたH2ガスが原子状Hに分解後、O2と衝突してH2又はH2Oになる
場合もある。従って、チャンバー12のリーク率は、低いほど良い。
清浄な表面を持つ被処理物18を得るためには、チャンバー12のリーク率は、1.0×10-3(Lusec)以下が好ましい。リーク率は、さらに好ましくは、1.0×10-4(Lusec)以下である。
【0014】
[1.2. ヒーター]
ヒーター14は、チャンバー12内に導入されたH2ガスを原子状Hに分解させるための触媒として機能する。そのため、ヒーター14には、H2ガスを原子状Hに分解させる触媒能を有する材料が用いられる。このような材料としては、例えば、W、Mo、Ta、Nbなどがある。
ヒーター14は、図示しない電源に接続されており、ヒーター14を所定の温度に加熱できるようになっている。また、ヒーター14は、ホルダ12a上に載置される被処理物18の上方に支持されている。
【0015】
ヒーター14の形状や大きさは、特に限定されるものではなく、H2ガスを原子状Hに効率よく分解することができる形状や大きさであれば良い。図1に示す例において、ヒーター14は、ワイヤー状になっており、ワイヤー状のヒーター14は、フレーム14aにより支持されている。
【0016】
[1.3. H2ガス供給手段]
H2ガス供給手段16は、チャンバー12内に所定量のH2ガスを供給するためのものである。図1に示す例において、H2ガス供給手段16は、多数のガス噴出孔16a、16a…を備えた円板16bと、円板16bに接続された配管16cとを備えている。配管16cの他端は、図示しないH2ガス源に接続されている。
円板16bは、チャンバー12内のヒーター14の上方に固定されている。H2ガス供給手段16から供給されるH2ガスは、円板16bのガス噴出孔16a、16a…からヒーター14に向かって噴射されるようになっている。
【0017】
[1.4. 被処理物]
水素還元装置10で還元処理される被処理物(金属材料)18の形状は、特に限定されるものではなく、棒、板、粉末等、いずれの形状であっても良い。
図1に示す例において、被処理物18は、金属粉末からなる。金属粉末からなる被処理物18は、ボート20に入れられ、ボート20は、ホルダ12a上に載置されている。
【0018】
水素還元装置10で還元処理される被処理物18は、水素還元可能な金属元素を含む金属材料であれば良い。但し、被処理物18は、その融点がSnの融点以下であるものを除く。Sn(融点:231.93℃)と同等以下の融点を持つ金属材料は、一般に比較的短時間かつ低温で表面近傍の酸素や炭素を除去することができるので、本発明を適用しても顕著な効果を得ることは期待できない。一方、Snより高い融点を持つ金属材料の場合、一般に、水素還元には大量のH2ガスと高温・長時間の処理が必要となる。そのため、水素還元時に結晶粒の粗大化、粉末の焼結などが生じるおそれがある。
これに対し、Snより高い融点を有する金属材料に対して本発明を適用すると、結晶粒の粗大化や焼結などを生じさせることなく、表面近傍の酸素や炭素を効率的に除去することができる。
【0019】
ある金属の酸化物が水素還元可能か否かは、エリンガム図により判断することができる。試料温度(400℃)における酸化物の標準生成自由エネルギーΔG0(=RTlnPO2)が−720kJ/mol以上である金属元素の酸化物は、本発明に係る方法を用いて水素還元することが可能である。
水素還元が可能な金属酸化物としては、例えば、CuO、Fe2O3、Fe3O4などがある。一方、水素還元が困難な金属酸化物としては、例えば、Al2O3、SiO2、TiO2などがある。
【0020】
本発明が適用できる金属材料としては、具体的には、
(1)Co−Fe合金などのFe合金、
(2)Cu−Zn合金、Cu−Sn合金などのCu合金、
(3)Ni−Cr−Fe合金、Ni−Cr合金などのNi合金、
などがある。
ここで「Fe合金」、「Cu合金」又は「Ni合金」とは、とは、主要元素としてFe、Cu又はNiを含む合金又は金属間化合物をいう。
【0021】
特に、Fe合金は、他の合金に比べて融点が高いので、Fe合金に対して本発明を適用すると、従来の方法に比べて顕著な効果(例えば、組織の粗大化の抑制や粉末の焼結の抑制)が得られる。ここで、Feの融点は1538℃、Cuの融点は1084℃、Niの融点は1455℃である。
例えば、Fe合金からなるスパッタリングターゲットには、微細結晶粒であること、及び、低酸素量であることが求められる。一般に、ターゲットの結晶粒が粗くなるほど、薄膜に偏析が生じたり、あるいは、薄膜の膜厚のバラツキが大きくなる。また、ターゲット中の酸素量が増大するほど、薄膜上にゴミ(パーティクル)が生成しやすくなる。
しかしながら、結晶粒を微細化するためにFe合金粉末を焼結させてターゲットを製造すると、Fe合金粉末の酸化によってターゲット中の酸素量が増大する。一方、ターゲット中の酸素量を低減するために、焼結前のFe合金粉末を高温で水素還元すると、結晶粒の粗大化や粉末の焼結が進行する。そのため、従来の方法では、微細結晶粒と低酸素量とを両立させることが困難であった。
これに対し、Fe合金粉末に対して本発明を適用すると、微細結晶粒と低酸素量とを兼ね備えたスパッタリングターゲットが得られる。
【0022】
[2. 清浄表面を有する金属材料の製造方法]
本発明に係る清浄表面を有する金属材料の製造方法は、設置工程と、排気工程と、反応工程とを備えている。
【0023】
[2.1. 設置工程]
設置工程は、図1に示すように、チャンバー12内に、H2ガスを原子状Hに分解するための触媒として機能するヒーター14と、水素還元可能な金属元素を含む金属材料18(但し、その融点がSnの融点以下であるものを除く)とを所定の間隔を置いて配置する工程である。
チャンバー12、ヒーター14及び金属材料18の詳細については、上述した通りであるので説明を省略する。
ヒーター14と金属材料18との間隔は、特に限定されるものではなく、金属材料18の温度が所定の温度に維持され、かつ、反応が効率よく進行するように、金属材料18の組成や反応条件に応じて、最適な間隔を選択すれば良い。
【0024】
[2.2. 排気工程]
排気工程は、チャンバー12内を排気する工程である。
チャンバー12内での還元処理は、減圧状態で行われる。そのため、チャンバー12の真空度が不十分であると、ヒーター14を加熱する際に、チャンバー12内に残存している酸素によってヒーター14が酸化される場合がある。ヒーター14が酸化されると、ヒーター14を構成する金属の酸化物が被処理物(金属材料)18表面に付着したり、ヒーター14表面が酸化物で覆われ、H2の分解反応が抑制される場合がある。
また、チャンバー12の真空度が低いと、
(a)チャンバー12内に導入されたH2ガスが原子状Hに分解する前に酸化され、
(b)原子状Hにより清浄化された被処理物18表面が再酸化され、あるいは、
(c)チャンバー12内に導入されたH2ガスが原子状Hに分解後、O2と衝突してH2又はH2Oになる
場合もある。従って、チャンバー12の真空度は、高い程良い。
清浄な表面を持つ被処理物18を得るためには、チャンバー12の真空度(真空引き時の到達圧力)は、1.0×10-3Pa以下が好ましい。真空度は、さらに好ましくは、1.0×10-4Pa以下である。
【0025】
[2.3. 反応工程]
反応工程は、ヒーター14の加熱とチャンバー12内へ前記H2ガスの導入とを同時に又は段階的に行い、ヒーター14の表面において原子状Hを発生させ、原子状Hと金属材料18とを反応させる工程である。
ヒーター14の加熱とチャンバー12内へのH2ガスの導入は、同時に行っても良く、あるいは、段階的に(すなわち、いずれか一方を先に)行っても良い。チャンバー12内に導入したH2ガスを効率よく原子状Hに分解するためには、先にヒーター14を所定の温度(H2ガスを効率よく原子状Hに分解可能な温度)まで加熱し、次いでチャンバー12内にH2ガスを導入するのが好ましい。
【0026】
ヒーター14の加熱温度は、H2ガスを効率よく原子状Hに分解できる温度であればよい。ヒーター14の加熱温度は、通常、1600〜1800℃である。
【0027】
チャンバー12内へのH2ガスの導入量は、反応効率に影響を与える。H2ガスの導入量が少なすぎると、反応効率が低下する。従って、反応工程は、チャンバー12内の圧力が0.5Pa以上に維持されるようにH2ガスを導入するのが好ましい。チャンバー12内の圧力は、さらに好ましくは、7.0Pa以上、さらに好ましくは、10.0Pa以上である。
一方、必要以上にH2ガスを導入するのは、実益がないだけでなく、水素消費量の増大を招く。従って、反応工程は、チャンバー12内の圧力が66.7Pa以下に維持されるようにH2ガスを導入するのが好ましい。チャンバー12内の圧力は、さらに好ましくは30Pa以下、さらに好ましくは、25Pa以下である。
【0028】
[3. 清浄表面を有する金属材料の製造方法の作用]
まず、図1に示す水素還元装置10のホルダー12a上に金属材料18を載せる。次いで、図示しない排気手段を用いて、チャンバー12内の排気を行う。チャンバー12内が所定の真空度に達したところで、触媒能を有するヒーター14を所定の温度に加熱し、チャンバー12内に所定量のH2ガスを流す。所定の温度に加熱されたヒーター14表面にH2ガスが接触すると、H2ガスが原子状Hに分解する。そのため、ヒーター14から所定の間隔を置いて金属材料18を配置すると、金属材料18の表面近傍に存在する金属酸化物が原子状Hにより容易に還元される。
また、金属材料18は、有為成分として炭素を含む場合がある。また、有為成分として炭素を含まない場合であっても、金属材料18の表面には、溶剤等に由来する炭素が存在している場合がある。原子状Hは、固溶(合金成分として入っている)炭素は除去できないが、金属材料18の表面に付着している炭素や有機物は除去できるので、表面近傍の脱酸と同時に脱炭も進行する。
【0029】
本発明に係る方法は、活性の高い原子状Hを用いて金属材料18表面の脱酸及び脱炭を行うので、大量のH2ガスを必要としない。また、原子状Hと金属材料18とを反応させる際、金属材料18をヒーター14に近づける必要がないので、金属材料18が微細な粉末である場合であっても、組織の粗大化や粉末の焼結を抑制することができる。また、原子状Hは、H2ガスに比べて活性が高いので、脱酸及び脱炭を短時間で行うことができる。
さらに、チャンバー12のリーク率及びH2ガス導入前のチャンバー12の真空度を最適化すると、相対的に水素還元されにくい金属材料18であっても、金属材料18の表面近傍に存在する酸素及び炭素を低コストかつ高効率で低減することができる。
【実施例】
【0030】
(実施例1)
[1. 試料の作製]
試料には、Co40−Fe40−B20(at%)合金(以下、「CoFeB合金」という)からなる板材を用いた。板材は、所定形状に加工した後、大気中、500℃で1分間〜40分間加熱した。酸化膜厚さdは、50〜2000nmであった。
この板材を図1に示す水素還元装置10を用いて還元処理した。チャンバー12のリーク率は、1×10-4(Lusec)であった。また、処理条件は、排気直後の真空度:5×10-4Pa、ヒーター(触媒)14の温度Tcat:1800℃、処理時間:10分、H2ガス導入時のチャンバー12内の圧力Pg:7.1Pa、とした。
【0031】
[2. 試験方法]
[2.1. 外観]
目視により外観を評価した。
[2.2. 深さ方向分析及び表層酸素量]
グロー放電発光分光分析(GD−OES)を用いて、各元素の深さ方向分析を行った。
また、ヘリウム中融解赤外線吸光法を用いて、表層酸素量を求めた。
[2.3. 薄膜XRD]
入射X線を低角度入射(0.5°)させて分析深さを浅くする薄膜XRD法を用いて、表面層を分析した。
【0032】
[3. 結果]
図2に、処理前の試料#0(酸化膜厚さd=50nm)(左図)及び処理後(右図)の試料#1の外観写真を示す。処理前の試料の表面は、表面酸化のために金属光沢が見られない。また、表層酸素量は、5.2ppmであった。一方、処理後の試料の表面は、金属光沢があり、表層酸素量は、0.9ppmであった。
図3(a)に、処理前の試料(酸化膜厚さd=50nm)及び処理後の試料のFe、Co及びBの深さ方向分析の結果を示す。また、図3(b)に、処理前の試料(酸化膜厚さd=50nm)及び処理後の試料のO及びCの深さ方向分析の結果を示す。図3より、水素還元により表面近傍のOとCが低減していることがわかる。これは、原子状HによりOがH2Oとして除去され、CがCHxとして除去されたためと考えられる。
【0033】
図4(a)に、還元処理前の試料(酸化膜厚さd=2000nm、処理時間=40分)及び還元処理後の試料の薄膜XRDパターンを示す。図4(b)に、還元処理前の試料(酸化膜厚さd=1360nm、処理時間=30分)及び還元処理後の試料の薄膜XRDパターンを示す。図4より、還元処理前に存在していたCoFeBの表面酸化物(Fe2O3、Fe3O4、Fe2O(BO3)など)が還元処理によって除去されていることがわかる。
【0034】
(実施例2)
[1. 試料の作製]
試料には、CoFeB合金からなる板材を用いた。板材は、所定形状に加工した後、大気中、650℃で10分間加熱した。酸化膜厚さd=500nmであった。
この板材を図1に示す水素還元装置10を用いて還元処理した。チャンバー12のリーク率は、1×10-4(Lusec)であった。また、処理条件は、排気直後の真空度:5×10-4Pa、ヒーター(触媒)14の温度Tcat:1400℃〜1800℃、試料の温度Tsamp:335〜561℃、処理時間:30分、H2ガス導入時のチャンバー12内の圧力Pg:7.1〜43Pa、水素流量Q:20cm3/min〜80cm3/min、とした。
【0035】
[2. 試験方法]
[2.1. 外観]
目視により外観を評価した。
[2.2. 深さ方向分析]
グロー放電発光分光分析(GD−OES)によりO、C、Wの深さ方向分析を行った。
【0036】
[3. 結果]
図5に、還元処理前の試料No.0、及び、種々の条件下で還元処理を行った試料No.1〜No.6の外観写真を示す。図5より、以下のことがわかる。
(1)還元処理前の試料No.0の表面には金属光沢がないのに対し、還元処理後の試料No.1〜No.6の表面は、いずれも金属光沢を呈していた。
(2)チャンバー12内圧力Pg、水素流量Q、ヒーター温度Tcat及び試料温度Tsampを広範囲に変化させても還元が可能であった。
(3)試料温度Tsamp=335℃でも還元が可能であった。
【0037】
図6に、還元処理前の試料(酸化膜厚さd=500nm)及び還元処理後の試料のO、C、Wの発光強度の深さ方向分布を示す。図6より、以下のことがわかる。
(1)還元処理条件によらず、還元処理後の表面及び深さ方向のOの発光強度は、還元処理前に比べて減少した。
(2)還元処理条件によらず、還元処理後の深さ方向のCの発光強度は、還元処理前に比べて減少した。
(3)還元処理条件によらず、還元処理後の表面のWの発光強度は、還元処理前に比べて増大した。これは、ヒーター14の酸化物(W2O3)が試料表面に付着したためと考えられる。
【0038】
(実施例3)
[1. 試料の作製]
試料には、CoFeB合金からなる板材を用いた。板材は、所定形状に加工した後、大気中、650℃で10分間加熱した。酸化膜厚さd=500nmであった。
この板材を図1に示す水素還元装置10を用いて還元処理した。チャンバー12のリーク率は、1×10-4〜2×101(Lusec)の範囲で変化させた。また、処理条件は、排気直後の真空度:5×10-4Pa、ヒーター(触媒)14の温度Tcat:1800℃、試料の温度Tsamp:350℃、処理時間:30分、H2ガス導入時のチャンバー12内の圧力Pg:50Pa、水素流量Q:50cm3/min、とした。
【0039】
[2. 結果]
図7に、リーク率の異なるチャンバー12を用いて還元処理された試料#1〜#4の外観写真を示す。また、図8に、図7に示す試料の試料番号とリーク率との関係を示す。図7及び図8より、以下のことがわかる。
(1)リーク率が低くなるほど、試料表面の清浄度が増す。
(2)リーク率が2×10-2(Lusec(Torr・L/s))以上である試料#1〜3は、金属光沢を有する表面が得られなかった。一方、リーク率が10-4(Lusec)である試料#4は、金属光沢を有する試料表面が得られた。
【0040】
(実施例4)
[1. 試料の作製]
アトマイズ法を用いて、CoFeB合金からなる粉末を作製した。粉末粒度は、106/75μmであった。この粉末を、500℃/O2/1.5minの条件下で酸化させた。
この粉末を図1に示す水素還元装置10を用いて還元処理した。チャンバー12のリーク率は、1×10-4(Lusec)とした。また、処理条件は、排気直後の真空度:5×10-4Pa、ヒーター(触媒)14の温度Tcat:1600℃、試料の温度Tsamp:400℃、処理時間:30分、H2ガス導入時のチャンバー12内の圧力Pg:0.7Pa、水素流量Q:200cm3/min、とした。
【0041】
[2. 試験方法]
[2.1. オージェ電子分光分析]
オージェ電子分光分析により、表面近傍の元素分布を測定した。
[2.2. フーリエ変化赤外分光法(FT−IR)]
FT−IRにより、材料表面に存在する化合物の同定を行った。
【0042】
図9に、還元処理前及び還元処理後の粉末試料のオージェ電子分光分析及びフーリエ変換赤外分光分析(FT−IR)の結果を示す。図9より、以下のことがわかる。
(1)オージェ電子分光分析より、表面酸化層の厚さは、還元により15nmから2nmに減少することがわかった。
(2)FT−IRより、還元処理によってFe2O3のピークが消失することがわかった。また、還元処理によって表面付着水に起因するピークが減少することがわかった。
(3)試料形状が粉末であっても、本発明に係る方法により低温還元が可能である。
【0043】
(実施例5)
[1. 試料の作製]
試料には、CoFeB合金からなる板材を用いた。板材は、所定形状に加工した後、大気中、650℃で10分間加熱した。酸化膜厚さd=500nmであった。
この板材を図1に示す水素還元装置10を用いて還元処理した。チャンバー12のリーク率は、1×10-4〜102(Lusec)の範囲で変化させた。排気直後の真空度は、1×10-4〜4×102Paの範囲で変化させた。その他の処理条件は、ヒーター(触媒)14の温度Tcat:1600℃、試料の温度Tsamp:400℃、処理時間:30分、H2ガス導入時のチャンバー12内の圧力Pg:43Pa、水素流量Q:80cm3/min、とした。
【0044】
[2. 試験方法]
グロー放電質量分析(GDMS)により、試料表面に付着した酸化物(W2O3)中のWを分析した。試料表面の生成物は、W2O3であるため、組成比から酸化物中の酸素量を算出した。
【0045】
[3. 結果]
図10に、チャンバー12のリーク率と表面酸化物中の酸素量との関係を示す。また、図11に、真空引き時のチャンバー12の到達圧力と表面酸化物中の酸素量との関係を示す。図10及び図11より、以下のことがわかる。
(1)チャーバー12のリーク率が高い場合、及び、真空引き時のチャンバー12の到達圧力が高い場合のいずれも、表面酸化物中の酸素量が多い。これは、チャンバー12内に存在する酸素がヒーター14を酸化させ、酸化によりヒーター14表面に生成したW2O3が蒸発し、試料表面に付着したためと考えられる。W2O3の付着量が多いほど、酸素量は多くなり、試料表面の還元がおこっていないことを示している。
(2)チャンバー12のリーク率が5×10-1(Lusec)以下になると、表面酸化物中の酸素量(W2O3の付着量)は、2(massppm)以下となる。
(3)真空引き時のチャンバー12の到達圧力が1×10-3Pa以下になると、表面酸化物中の酸素量(W2O3の付着量)は、2(massppm)以下となる。
【0046】
以上、本発明の実施の形態について詳細に説明したが、本発明は、上記実施の形態に何ら限定されるものではなく、本発明の要旨を逸脱しない範囲内で種々の改変が可能である。
【産業上の利用可能性】
【0047】
本発明に係る金属材料の製造方法は、各種金属材料の表面の脱酸処理、及び脱炭処理に使用することができる。
【符号の説明】
【0048】
10 水素還元装置
12 チャンバー
14 ヒーター
16 水素ガス供給手段
18 被処理物(金属材料)
【特許請求の範囲】
【請求項1】
チャンバー内に、H2ガスを原子状Hに分解するための触媒として機能するヒーターと、水素還元可能な金属元素を含む金属材料(但し、その融点がSnの融点以下であるものを除く)とを所定の間隔を置いて配置する設置工程と、
前記チャンバー内を排気する排気工程と、
前記ヒーターの加熱と前記チャンバー内へ前記H2ガスの導入とを同時に又は段階的に行い、前記ヒーターの表面において原子状Hを発生させ、前記原子状Hと前記金属材料とを反応させる反応工程と
を備えた清浄表面を有する金属材料の製造方法。
【請求項2】
前記チャンバーとして、リーク率が1.0×10-3(Lusec)以下であるものを用い、
前記排気工程は、前記チャンバー内の真空度が1.0×10-3Pa以下となるまで前記チャンバー内を排気するものである
請求項1に記載の清浄表面を有する金属材料の製造方法。
【請求項3】
前記反応工程は、前記チャンバー内の圧力が0.5Pa以上66.7Pa以下に維持されるように前記チャンバー内へ前記H2ガスを導入するものである請求項1又は2に記載の清浄表面を有する金属材料の製造方法。
【請求項4】
前記金属材料は、Fe合金である請求項1から3までのいずれかに記載の清浄表面を有する金属材料の製造方法。
【請求項1】
チャンバー内に、H2ガスを原子状Hに分解するための触媒として機能するヒーターと、水素還元可能な金属元素を含む金属材料(但し、その融点がSnの融点以下であるものを除く)とを所定の間隔を置いて配置する設置工程と、
前記チャンバー内を排気する排気工程と、
前記ヒーターの加熱と前記チャンバー内へ前記H2ガスの導入とを同時に又は段階的に行い、前記ヒーターの表面において原子状Hを発生させ、前記原子状Hと前記金属材料とを反応させる反応工程と
を備えた清浄表面を有する金属材料の製造方法。
【請求項2】
前記チャンバーとして、リーク率が1.0×10-3(Lusec)以下であるものを用い、
前記排気工程は、前記チャンバー内の真空度が1.0×10-3Pa以下となるまで前記チャンバー内を排気するものである
請求項1に記載の清浄表面を有する金属材料の製造方法。
【請求項3】
前記反応工程は、前記チャンバー内の圧力が0.5Pa以上66.7Pa以下に維持されるように前記チャンバー内へ前記H2ガスを導入するものである請求項1又は2に記載の清浄表面を有する金属材料の製造方法。
【請求項4】
前記金属材料は、Fe合金である請求項1から3までのいずれかに記載の清浄表面を有する金属材料の製造方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【公開番号】特開2013−67822(P2013−67822A)
【公開日】平成25年4月18日(2013.4.18)
【国際特許分類】
【出願番号】特願2011−205096(P2011−205096)
【出願日】平成23年9月20日(2011.9.20)
【出願人】(000003713)大同特殊鋼株式会社 (916)
【Fターム(参考)】
【公開日】平成25年4月18日(2013.4.18)
【国際特許分類】
【出願日】平成23年9月20日(2011.9.20)
【出願人】(000003713)大同特殊鋼株式会社 (916)
【Fターム(参考)】
[ Back to top ]

