減少した正味の正電荷を有する抗体
【課題】癌の診断および処置に有用なモノクローナル抗体誘導体の提供。
【解決手段】遊離アミノ基と反応性の物質で化学的複合体化されることにより修飾された抗体。使用される化学的物質は、ヘテロ二官能性剤およびビオチンである。修飾抗体はまた、癌および他の哺乳動物の疾患の診断および治療に使用される。診断的使用は、免疫シントグラフィを含む。修飾抗体は、診断および治療に使用される標識または生理学的に活性な分子と更に複合体化され得る。修飾抗体は、これらの目的のための薬学的組成物に配合され得る。
【解決手段】遊離アミノ基と反応性の物質で化学的複合体化されることにより修飾された抗体。使用される化学的物質は、ヘテロ二官能性剤およびビオチンである。修飾抗体はまた、癌および他の哺乳動物の疾患の診断および治療に使用される。診断的使用は、免疫シントグラフィを含む。修飾抗体は、診断および治療に使用される標識または生理学的に活性な分子と更に複合体化され得る。修飾抗体は、これらの目的のための薬学的組成物に配合され得る。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、一般に、修飾された抗体の分野に関する。より詳細には、本発明は、増大した結合特異性、改善した薬物動態および局在化能力を有する、化学的に修飾された抗体に関する。これらの修飾された抗体は、癌および他の哺乳動物の疾患の診断および治療に特に有効である。
【背景技術】
【0002】
抗体、特にモノクローナル抗体("MAb's")の使用は、癌の診断および処置に極めて有用なアプローチとなる可能性を有する。MAb'sの重要な特性は、単一抗原に対するその特異性である。
【0003】
腫瘍細胞抗原に特異的なMAb'sが産生されてきた。また、MAb'sが放射性核種のような添加剤と効果的にカップリングし得ることも示されてきた。そのような放射性標識されたMAb'sは、g-カメラ画像または放射性免疫画像としても知られる免疫シントグラフィ(immunoscintography)からの腫瘍画像のような臨床データを提供するのに有効である。免疫シントグラフィでは、MAb'sは、MAb'sに認識される抗原を有する特定の組織または腫瘍タイプに結合させられる。放射性核種は、次に、ゲルマニウムカメラの使用のような適切な技術を用いて視覚化される。腫瘍および他のタイプの組織の免疫シントグラフィでのそれらの適用を可能にするのは、MAb'sのユニークな特異性である。
【0004】
しかしながら、免疫シントグラフィでのMAb'sの使用は、高いバックグラウンドレベルおよびMAb'sのその抗原に対する低い結合能力のために、制限されてきた。実験的研究は、放射性標識されたMAb'sの生体分布が、抗体の特異性およびクリアランス時間を含む多くの要因に依存していることを示唆する。免疫シントグラフィによる腫瘍の効果的な診断のために、腫瘍細胞表面で密であり均一である抗原に結合する抗体が選択されるべきである。免疫シントグラフィによる腫瘍の効果的診断はまた、選ばれた抗体が腫瘍抗原に効果的に結合することを要求する。しかしながら、適切な抗原に結合するMAb'sはしばしば、要求された高い結合親和性を提供しない。さらに、他のMAb'sと比較して高い親和性を有して結合するMAb'sを使用しても、高レベルの非特異的結合をそれでも生じ、免疫シントグラフィで使用されるとき高いバックグラウンドを生じる。従って、診断的ツールとして免疫シントグラフィを改善するには、MAb'sの結合の有効性を改善する方法が必要である。
【0005】
さらに、MAb'sの細胞障害性効果は、放射性核種、薬剤または毒素にカップリングすることによって顕著に増大され得る。MAb'sのユニークな特異性は、免疫療法の進歩に対して期待を膨らませた。免疫療法では、生物学的に活性な物質は、腫瘍細胞のような特定の望ましくない細胞タイプにMAb'sを使用して運搬され、被験体の他の細胞に影響を及ぼすことなく、望ましくない細胞タイプに影響を与える。しかしながら、免疫療法は、健康な組織に影響するのを避けるために、極めて高い特異性の抗体を要求する。従って、MAb'sの特異性を増大させる方法は、安全で効果的な免疫療法の目的を達成するのに、非常に有利となるであろう。
【0006】
多くのMAb'sは、被験体に導入された後、数日間、循環中に維持される。これは、少なくとも2つの理由から、望ましくない。第1の理由は、循環MAb'sが、免疫シントグラフィで高いバックグラウンドレベルを生じることである。第2の理由は、放射性核種または他の潜在的に細胞障害性物質にカップリングした循環MAb'sが、時間長期暴露後の被験体で望ましくない副作用を生じるかもしれないことである。従って、MAb'sのクリアランス時間を減少させる方法が必要である。無論、減少が大きすぎると、MAb'sの任意の有効な使用が為される前に、MAb'sが除去されることになるであろう。従って、腫瘍または他の標的組織へのMAb'sの取込みに実質的に影響することなしに、MAb'sのクリアランス時間を減少させる方法が特に必要である。
【0007】
抗体の特異性およびクリアランス時間の両方を決定するのに決定的である1つのファクターは、抗体の形態である。本明細書で使用されるとき、「完全な(intact)」抗体分子は、2本の重鎖および2本の軽鎖を含む修飾されない抗体分子を指す。完全な全体の抗体分子は、図1の化学式の反応体側に見られる。図1に見られるように、完全な分子は、FcおよびFabドメインに分割される。Fabフラグメントの二価の形態である、F(ab')2は、プロテアーゼによるFcドメインの消化により産生される。
【0008】
2本の重鎖(図1で"H"で示される)は、1以上のジスルフィド架橋でつながれている。完全な分子では、これらのジスルフィド架橋は、通常は還元剤から保護される。しかしながら、Fcドメインの除去は、ジスルフィド架橋の迅速な還元を可能にすることが見い出された。従って、一価の形態である、F(ab')は、穏やかな還元剤の作用によりF(ab')2から産生され得る。その開示が本明細書に参考として援用されているパーハム,ピー.(Parham,P.) 0n the Fragmentation of Monoclonal IgG1, IgG2a and IgG2b from BALB/c Mice, J. Immunol. 131: 2895(1983)は、F(ab')およびF(ab')2の産生方法を記載している。この方法で生起すると考えられる変化の図式的説明は、図1の化学式に示される。
【0009】
Fcは、抗体分子の非特異的結合の多くに関連があると見い出されてきた。該フラグメントの分子量は糸球体濾過に関する閾値より低いので、フラグメントの迅速な除去が可能になることも考えられている。従って、放射性画像化で使用するために抗体のクリアランス時間を増加する1つのアプローチは、完全な抗体を、Fabおよびその二価形態であるF(ab')2のような様々なフラグメントに分解することであった。予想されたように、これらのフラグメントは、身体から非常に迅速に排除される(cleared)ので、それらの有用性は減少される。さらに、これらのフラグメントは、完全な抗体と比較して、腫瘍または他の標的組織による取込みの減少をもたらすかもしれない。従って、免疫シントグラフィでのこれらのフラグメントの使用は、完全なMAb'sを使用するよりもバックグラウンド比率に対するより優れたクリアランスとより高い標的組織を提供するが、MAb'sが結合する抗原を含む標的組織中のMAb'sの絶対濃度は、完全なMAb'sを使用する方がフラグメントのいずれかを使用するよりも3倍以上であることが見い出された。さらに、フラグメントの両タイプとも、血流から非常に速く除去される。従って、これらのフラグメントを用いる、診断的または治療的技術での有効時間は非常に短い。
【0010】
ヘテロ二官能性(heterobifunctional)試薬は、異なる反応に参加し得る2つの基を有する試薬である。例えば、スクシニミジル3-(2-ピリジルジチオ)プロピオナート(SPDP)は、ヘテロ二官能性であり、即ち、そのN-ヒドロキシスクシンイミドエステル基はアミノ基と反応し、2-ピリジルジスルフィド構造は脂肪族チオールと反応する。
【0011】
オーランジ(0rlandi)ら、Change in Binding Reactivity of an Anti-Tumor Monoclonal Antibody After the Introduction of 2-Pyridyl Disulphide Groups, Hybridoma 5:1-8 (1986)は、ヒト卵巣癌に対するMAb'sのインビトロ結合の増加が、ヘテロ二官能性試薬SPDPと化学的に複合した後に得られ得ることを報告した。
【0012】
オーランジらに使用された複合体化MAb'sは、分子当り平均して11のPDP基を有した。オーランジらは、修飾されたMAb'sが、それらの結合活性をインビトロで、非修飾MAb'sにより検出されない分子が検出できる程度まで増加することを見い出した。これらの研究者は、複合体化されたMAb'sのインビボでの使用についての研究は報告しなかった。さらに、これらの研究者は、非常に少ない数の抗原性部位を有する分子が複合体化MAb'sにより検出されると考えた。従って、PDP修飾されたMAb'sは、非修飾の同等物に比較して、標的細胞特異性を大きく減少させた。
【先行技術文献】
【非特許文献】
【0013】
【非特許文献1】Parham, P., 0n the Fragmentation of Monoclonal IgG1, IgG2a and IgG2b from BALB/c Mice, J. Immunol. 131: 2895(1983)
【非特許文献2】Orlandi et al., Change in Binding Reactivity of an Anti-Tumor Monoclonal Antibody After the Introduction of 2-Pyridyl Disulphide Groups, Hybridoma 5:1-8 (1986)
【発明の概要】
【発明が解決しようとする課題】
【0014】
従って、上記の進歩にもかかわらず、腫瘍抗原に対するより大きな特異的活性を発揮し、抗体のより高い絶対濃度を腫瘍に蓄積させ、さらに、治療的または診断的有効性を減少させるほどには迅速でないが比較的に迅速な血液プールからのクリアランス時間を有する、修飾された抗体フラグメントの必要性が維持されている。
【課題を解決するための手段】
【0015】
本発明の1つの局面は、修飾された抗体を産生するために、抗体上に配置される複数の遊離アミノ基の少なくとも1つで、化学的試薬と複合体化された抗体に関する。抗体は、完全な抗体と比較すると減少した正味の(net)正電荷を有する。抗体はまた、F(ab')2フラグメントと、同じタイプとの完全な抗体のクリアランス速度との間の、インビボ・クリアランス速度を有する。本発明のこの局面での抗体では、化学的試薬は、ヘテロ二官能性剤ではない。抗体は、それに結合した化学的部分(chemical moiety)も有する。抗体は、モノクローナル抗体またはポリクローナル抗体であり得る。化学的試薬は、ビオチンN2S2またはN2S4のようなメチルキレート、EDTA、DPTAまたはTETAのような他のキレート化剤、或いはFITCのような染料であり得る。化学的部分は、しばしば放射性核種のような標識である。放射性核種は、テクニシウム(Technicium)または125Iまたは131Iのようなハロゲン放射性核種であり得る。特定の実施態様では、標識は磁気共鳴画像で検出される。化学的部分は、毒素、薬剤およびキレートのような生物学的に活性な分子であり得る。好適な薬剤は、メトトレキセート、5-フルオロ-ウラシル、シスプラチン(cis-platinum)およびアドリアマイシンを含む。好適な毒素は、リシンA鎖である。
【0016】
本発明の他の局面は、免疫シントグラフィのための薬学的組成物である。該組成物は、抗体が完全な抗体と比較して減少した正味の正電荷を有するように、標識抗体上に配置された遊離アミノ基で化学的試薬と複合体化した標識抗体、免疫シントグラフィに許容される薬学的な賦形剤、担体または基剤を含む。
【0017】
本発明のさらに他の局面は、増大した抗原結合特異性、減少した非特異的結合および減少したインビボでのクリアランス時間を有する、標識された修飾抗体を調製する方法である。該方法は下記の工程を含む:検出されるべき抗原に対する結合特異性を有する完全な抗体を得ること、天然の抗体はその上に配置された複数の遊離アミノ基を有する、遊離アミノ基の少なくとも1つを化学的物質と反応させて修飾抗体を作製し、修飾抗体が完全な抗体の等電点よりも低い等電点を有するようにすること、および修飾抗体を検出可能な標識で標識すること。該方法は、標識された修飾抗体を産生する。この方法の標識は、ガンマカメラのような免疫シントグラフィによって検出され得る。
【0018】
本発明の更に他の局面は、哺乳動物で抗原を局在化する方法である。この方法は、局在化されるべき抗原に関する結合特異性を有する標識された修飾抗体を得ることを含む。標識された修飾抗体は、同じタイプの非修飾抗体と比較して、より少ない遊離アミノ基および低い等電点を有し、その中に組込まれた検出可能な標識を有する。標識された修飾抗体は、哺乳動物に投与される。この方法は、抗原および標識された修飾抗体をインビボで結合可能にする。抗原に結合した標識された修飾抗体は検出され、よって抗原を局在化する。抗体は、遊離アミノ基で化学的に修飾された完全な抗体であり得る。そのような完全な抗体は、ヘテロ二官能性試薬で化学的に複合体化されるか又はビオチンで化学的に複合体化され得る。
【0019】
本発明のさらなる局面は、哺乳動物の疾患状態を処置する方法に関する。この方法は、哺乳動物の疾患組織に特異的な完全な抗体を得ることを包含する。完全な抗体は、その上に複数の遊離アミノ基を配置している。該方法はまた、修飾抗体を産生するために、ヘテロ二官能性試薬以外の化学的試薬で複合体化することにより遊離アミノ基の少なくとも1つを修飾することを包含する。修飾抗体は、完全な抗体と比較して減少した等電点を有する。生物学的に活性な分子は、化学的試薬の部位以外の、修飾抗体上に配置された第一の付着部位に付着される。次に、抗体は、哺乳動物に投与され、それにより疾患状態を処置する。
【図面の簡単な説明】
【0020】
【図1】図1は、F(ab')およびF(ab')2フラグメントを産生する方法で起こると考えられる変化の図式的説明を示す。
【図2】図2は、無胸腺ヌードマウスでの、放射性標識MAb'sLym-1の異なる調製物の全身の保有を示す。
【図3】図3は、注射から7日後のヒトリンパ腫を担持するヌードマウスでの生体分布を、MAb's Lym-1および修飾されたLym-1の注射用量/グラムの%として示す。
【図4】図4は、注射から7日後のヒトリンパ腫を担持するヌードマウスでの生体分布を、MAb'sLym-1および修飾されたLym-1の腫瘍/臓器比として示す。
【図5】図5は、注射から5日後のヒトリンパ腫を担持するヌードマウスでの生体分布を、MAb's Lym-1 F(ab')2および修飾されたLym-1の注射用量/グラムの%として示す。
【図6】図6は、注射から5日後のヒトリンパ腫を担持するヌードマウスでの生体分布を、MAb's Lym-1 F(ab')2および修飾されたLym-1腫瘍/臓器比として示す。
【図7】図7は、I-131標識した完全なLym-1注射から7日目に得られた画像を示す。
【図8】図8は、I-131標識した修飾したLym-1注射から7日目に得られた画像を示す。
【図9】図9は、I-131標識した修飾したLym-1注射から7日目に得られた画像を示す。
【図10】図10は、I-131標識した修飾したLym-1注射から5日目に得られた画像を示す。
【図11】図11は、無胸腺ヌードマウスでの、放射性標識モノクローナル抗体B72.3の異なる調製物の全身の保有を示す。
【図12】図12は、注射から4日後のLS174T結腸癌担持ヌードマウスでの生体分布を、MAb'sB72.3および修飾B72.3の注射用量/グラムの%として示す。
【図13】図13は、注射から4日後のLS174T結腸癌担持ヌードマウスでの生体分布を、MAb'sB72.3および修飾B72.3の腫瘍/臓器比として示す。
【図14】図14は、I-131標識した修飾したB72.3の注射から1日後に得られた画像を示す。
【図15】図15は、I-131標識した修飾したB72.3の注射から4日後に得られた画像を示す。
【図16】図16は、無胸腺ヌードマウスでの、放射性標識MAb's TNT-1の異なる調製物の全身の保有を示す。
【図17A】図17A−Dは、一連の棒グラフを示す。図17Aは、注射された完全なTNT-1並びにビオチン化TNT-1の腫瘍および様々な組織に局在するパーセンテージを示す。
【図17B】図17Bは、腫瘍および様々な臓器に局在化する標識抗体の比率を示す。
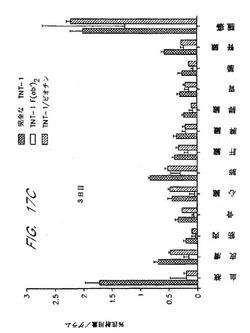
【図17C】図17Cは、注射された完全なTNT-1並びにビオチン化TNT-1の腫瘍および様々な組織に局在するパーセンテージを示す。
【図17D】図17Dは、腫瘍および様々な臓器に局在化する標識抗体の比率を示す。
【図18】図18は、Ba1b/cマウスでの、完全なTNT-1、修飾TNT-1およびF(ab')2フラグメントの全身クリアランスを表示する線グラフを示す。
【図19】図19は、Ba1b/cマウスでの、完全なLym-1、修飾Lym-1およびF(ab')2フラグメントの全身クリアランスを表示する線グラフを示す。
【発明を実施するための形態】
【0021】
我々は、MAb's、ヒト抗体、遺伝子工学的に作製された抗体、キメラ抗体、合成抗体およびポリクローナル抗体を含む抗体の、遊離アミノ基を修飾する試薬を用いた複合体による化学的修飾が、抗原結合特異性を増加し、非特異的結合を減少し、インビボでのクリアランス時間を減少できることを発見した。そのように修飾された抗体は、完全な抗体と比較すると、減少した正味の正電荷を有する。本発明に従い、我々が遊離アミノ基を修飾するのに使用した試薬の例は、SPDPのようなヘテロ二官能性試薬またはビオチン化試薬を含む。しかしながら、当業者は、広範囲の化学的試薬が遊離アミノ基を修飾するのに使用され、それにより抗体の全体的な等電点を減少させ得ることを認識する。従って、例えば、N2S2またはN2S4のようなメチルキレート、EDTA、DPTAまたはTETAのような他のキレート化剤、およびFITCのような多くの染料が全て、本発明に従い効果的な結果を達成するのに使用できる。Nuc1. Med. Biol., 18:179-185(1991)には、N2S4の抗体への結合の説明が、本発明に従い、本明細書中に記載される以外の目的で記載されている。この文献は、本明細書中に参考として援用されている。
【0022】
遊離アミノ基に対する化学的修飾は、驚くべきことに、抗体が結合する抗原を含む標的細胞での、修飾抗体の増強された蓄積をもたらす。スルホスクシニミジル2(p-アジドサリチルアミド)エチル1-1,3'-ジチオプロピオナート(SASD)、スルホスクシニミジル2-(m-アジド-o-ニトロベンズアミド)-エチル-1,3'-ジチオプロピオナート(SAND)、スルホスクシニミジル(4-アジドフェニル-ジチオ)プロピオナート(スルホ-SADP)および2-アミノチオラン・HCl(Traut's試薬)を含む、SPDP以外のヘテロ二官能性試薬は、本発明に従い抗体と複合体化されるとき、同様の結果をもたらすと考えられる。
【0023】
本発明の修飾抗体は、他の化学的部分に好都合に連結して、特定の診断的または治療的利益をもたらすことができる。例えば、放射性核種または酵素のような様々な周知の標識のいずれも付着され得る。抗腫瘍性化合物または毒素のような治療的部分も付着され得る。
【0024】
ヘテロ二官能性剤およびビオチンは以前、標識および他の部分を抗体に付着させるリンカーとして使用されていた。ビオチン自身は、特定の環境で標識として機能できる。しかしながら、ビオチンもヘテロ二官能性剤も、増強された結合特異性、減少した非特異的結合および減少したインビボ・クリアランス時間を達成するために、抗体を修飾する目的では使用されなかった。従って、本発明とは違い、以前の抗体は、ヘテロ二官能性剤またはビオチンのような修飾化剤をその第一部位に付着させ、および付着標識または他の化学的部分をその第二部位に付着させてはいなかった。本発明では、第二付着部位は一般に、第一付着部位に付着した修飾化剤と同じタイプの付着した修飾化剤を有しない。
【0025】
修飾抗体の蓄積増強は、増強された特異的結合能力によると考えられる。我々は、抗体分子当り平均して1個のみのPDP基を複合体化することにより、非修飾抗体に比較して、その標的細胞に対する分子の特異性の劇的な増大が起こることを見出した。同様の結果が、ビオチン化抗体を用いて得られた。
【0026】
我々はまた、ヘテロ二官能性試薬またはビオチンによる複合体化によりIgG上の遊離アミノ基の化学修飾が、有利なことに、正常の組織からのクリアランスを増強することを発見した。この効果について、いかなる特別の説明と結合することも望まないが、そのような修飾が、糸球体濾過に対する閾値以下の分子量を有する形態に抗体を断片化させ、この結果、フラグメントの迅速な除去が可能になると考えられる。抗体の一価形態への、抗体の断片化が起こることさえも可能である。得られるフラグメントの正確な形態が何であろうと、これらのフラグメントの除去は、有利なことに、修飾抗体の診断的または治療的有効性を縮小するほどには迅速ではない。
【0027】
前記で開示されたように、本発明の実施に有用な修飾抗体は、遊離アミノ基で化学的に修飾され、さらに検出可能な標識で標識されている。重要なこととして、抗体自身または遊離アミノ基を修飾するのに使用される化学的試薬のいずれかが標識されると、我々は、修飾抗体の遊離アミノ基以外の部位での標識が、本発明の実施に有用な抗体を提供できることも示した。さらに、試薬がヘテロ二官能性試薬であるときは、抗体の遊離アミノ基での化学的修飾の前または後であっても標識が抗体に化学的に複合体化されるとき、その標識は、遊離アミノ基以外の部位で、およびアミノ基修飾試薬の部位以外の部位で、抗体に付着され得る。特に本明細書に開示されるように、抗体タンパク質に存在するチロシン残基は、放射性ヨウ素化により修飾できる。しかしながら、抗体のチロシン残基に付着できる検出可能な標識は、ヨウ素に限定されない。抗体のチロシン残基に付着できる他の標識は、F、C1、Br、Iおよびその他のようなハロゲン放射性核種を含む。そのようなハロゲン放射性核種の抗体への付着は、ウィルバー(Wilbur)、Bioconj. Chem., 3:433-470(1992)に記載され、その開示は本明細書中に参考として援用されている。テクニシウム放射性核種は、抗体分子上で他の残基に結合する。さらに、抗体タンパク質を標識する他の標識および方法は、当業者に容易に明らかであるように、本発明の実施に有用である。当業者は、抗体タンパク質のアミノ酸側鎖上の官能基(functional groups)が、標識付着部位として役割を果たし得ることを認識する。標識、結合部位並びに標識および抗体を複合体化する方法の選択は、当業者に認識される。本発明の操作性に関する重要な規定は、修飾抗体が標識を付着することである。
【0028】
一般に、我々は、非修飾抗体に比較して減少した等電点(pIs)を有するように化学的に修飾された抗体が、改善された標的特異性を発揮することを発見した。より詳細には、我々の結果は、抗体上の遊離アミノ基の化学的修飾が、この改善された標的特異性を付与できることを実証した。これらの化学的修飾は、上述のようなヘテロ二官能性剤およびビオチンのような物質による修飾を含み得るが、それらに限定されない。実際、抗体のpIを効果的に減少させる抗体上に存在する遊離アミノ基のあらゆる化学的修飾が、改善された標的特異性を提供する。
【0029】
この改善の根源を説明するのに、いかなる特定の理論に限定されることも望まないが、我々は非特異的抗体結合が非特異的静電気的相互作用に、部分的に起因すると仮定している。これは、MAb'sが生理学的pHで正に荷電しているが、哺乳動物細胞は負に荷電しているという観察に照らして合理的である(アイヒマン(Eichmann)ら、J.Exp. Med. 131:207(1970):シルバ ヒルホ(Silva Filho)ら、J. Leukocyte Biol. 41:143(1987))。従って、完全な抗体の正電荷特性の変化が、負に荷電した組織と正に荷電した抗体タンパク質との相互作用により、非特異的結合を効果的に減少させる。これら非特異的相互作用を最少化することにより、抗体の抗原結合ドメインに起因する抗体特異性は、主として結合特異性を決定するのに関連する。従って、抗体のpIが非修飾抗体と比較して減少するように修飾された、複数のアミノシド部分(aminoside moiety)を有するあらゆる抗体は、非同族抗原との非特異的相互作用を減少した故に、改善された標的特異性を発揮する。しかしながら、我々はまた、本発明により修飾された抗体の第二の特徴がそれらを、インビボでの抗原局在化に特に有用にさせることを発見した。
【0030】
シグナル対ノイズ比を改善でき、抗体に基づく抗原画像化手順における「腫瘍/臓器比」として表され得る2つの要素は、(1)増大した腫瘍局在性、および(2)減少したレベルの非特異的結合した標識抗体である。我々は、現在、非修飾の完全なMAbと比較して減少した等電点を有するように化学的に修飾されたMAb'sが、非修飾抗体と比較して非特異的結合を減少させ全身クリアランス時間を減少させながら、結合特異性を有利に増大し得ることを発見した。
【0031】
我々はさらに、増大した抗体特異性および局在化能力が、その上に検出可能な標識が配置されている化学的に修飾された抗体を用いて達成できることを発見した。そのような標識は、例えば、放射性核種であり得る。より詳細には、我々は現在、ビオチン部分を含むよう修飾された抗体が抗原結合に関する実質的に改善された能力を発揮することを発見した。以下で開示されるように、標識されたビオチン化抗体は、インビボで腫瘍細胞を局在化する方法で使用された。本発明の実施では、化学的修飾抗体が直接的に標識されることが必須である。これは、その開示が本明細書中に参考として援用されているクワーリ(Khawli)ら、Antibody, Immunoconjugates, and Radiopharmaceuticals, 6:13(1993)に記載される、間接的に標識された抗体を用いる方法と対照的である。
【0032】
従って、改善された腫瘍局在化のための手順に有用な試薬は、所望の標的抗原に関する結合特異性を有する抗体を得、抗体上の遊離アミノ基をヘテロ二官能性試薬またはビオチンのような試薬を用いて化学的に修飾し、および続いて、放射性核種のような検出可能な標識で抗体を標識することによって作製できる。実際には、化学的修飾工程と放射性標識工程の順序は任意である。さらに、実質的に精製された抗体を放射性標識する工程は、もしその手順で使用される抗体がMAb'sである場合、およびもしそれらのMAb'sを産生するハイブリドーマが、ハイブリドーマのMAb産物に取込まれる標識化前駆体を含む増殖培地で増殖される場合には、除外され得る。従って、例えば、本発明に関連して有用な放射性標識化されビオチン化されたMAb'sは、放射性標識したアミノ酸を含む増殖培地でMAb産生細胞系を増殖させ、放射性標識MAb'sを集め、放射性標識MAb'sをビオチン化することによって産生され得る。ビオチン化工程の前または後であろうと、抗体を標識する他の方法は、当業者に明らかである。
【0033】
本明細書に記載される方法は、上記のクワーリ(Khawli)ら、Antibody, Immunoconjugates, and Radiopharmaceuticalsに開示されるものと関連して、有利なことに、インビボで腫瘍細胞抗原を画像化するのにより少ない工程を必要とし、ビオチン基を欠く標識抗体を単に用いるよりも予想外に優れた結果をもたらす。従って、我々は本明細書で、非ビオチン化抗体と比較したときビオチン化抗体が、改善された標的化を発揮することを開示する。本発明に関連して有用な抗体が抗体上に保持される(carried)標識により検出され得るので、標識抗体上のビオチン基の存在は標識化および検出に関して明らかな利点を提供する。従って、本発明に関連して有用な抗体の必須の特徴は、抗体が、(1)修飾抗体のpIが非修飾抗体と比較して減少されるように化学的に修飾されたアミノシド部分を有し、および(2)検出手段によって検出され得る標識を保持(harbor)していることである。
【0034】
本発明の修飾抗体は、有利なことに、F(ab')またはF(ab')2のような抗体のフラグメントと比較して、驚くべきほど増強された診断的および治療的有用性を有する。
【実施例】
【0035】
下記の実施例は、平均して1個のPDP基をモノクローナル抗体に導入する明示的な方法を示す。
【0036】
実施例1
Lym−1のSPDPによる修飾
下記の実施例は、平均して1個のPDP基をモノクローナル抗体に導入する明示的な方法を示す。B細胞リンパ腫に対するモノクローナル抗体であるLym-1(IgG2a)を、その開示が本明細書中に参考として援用されているエプシュタイン,エー.エル.(Epstein,A.L.)ら、Two New Monoclonal antibodies,Lym-1 and Lym-2, Reative with Human B-Lymphocytes and Derived Tumors, with immunodiagnostic and Immunoreactive Potential, Cancer Res.47: 830-840(1987)のようにして得た。Lym-1 MAb'sは、その開示が本明細書中に参考として援用されているカールソン,ジェイ.(Carlson,J.)ら、Protein Thiolation and Reversible Protein-Protein Conjugation: N-succinimidyl 3-(2-pyridyldithio)propionate, A New Heterobifunctional Reagent, Biochem. J. 173: 723-737(1978)のように、抗体上の遊離アミノ基と反応するヘテロ二官能性試薬であるSPDPを用いて機能性化された。PBS、pH 7.2中に1 mLのLym-1(10 mg/mL)を含む5 mL試験管に、20μLの1 mLエタノール中3 mg SPDPおよび40μL N,N-ジメチルホルムアミドを加えた。この混合物を、オービタルシェイカー装置を通常速度で用いて、連続的に混合しながら、室温で15分間インキュベートした。インキュベーション後、機能性化されたLym-1溶液を、PBSで平衡化したPD-10カラムを通過させて精製した。
【0037】
SPDPによるLym-1の機能性化の程度は、その開示が本明細書中に参考として援用されているグラセッティ,ディー.アール.(Grassetti,D.R.)およびマレー,ジェイ.エフ.(Murray,J.F.) Determination of Sulfhydryl Groups with 2,2'-or 4,4'-dithiodipyridine, Arch. Biochem. Biophys. 119: 41-49(1967)のように、Lym-1溶液のアリコートをリン酸緩衝食塩水(PBS)、pH 7.2中過剰モルの7 mgジチオエリスリトールで還元した後、ピリジン-2-チオンの放出を343 nmで測定して、分子当り平均して1個のPDP基であることを決定した。
【0038】
実施例1からの修飾抗体は、タンパク質高速液体クロマトグラフィー(FPLC)により分析して、抗体が実質的に完全である(intact)ことを示した。この分析を、実施例2で示す。
【0039】
実施例2
修飾Lym−1のタンパク質高速液体クロマトグラフィー(FPLC)による分析
下記の実施例は、平均して1個のPDP基をモノクローナル抗体に導入する明示的な方法を示す。実施例1からの修飾抗体の分析は、280 nmにセットされた固定波長UV分光光度計を備えたタンパク質高速液体クロマトグラフィー(FPLC)で行った。サイズ排除クロマトグラフィーは、溶媒システムとしてPBS pH 7.2を用いてスペロース-12カラム(ファルマシア(Pharmacia))上で、流速1 mL/分で溶出して行った。修飾Lym-1は、690秒の保有時間で、非標識の完全なLym-1の保有時間と同一であると見えた。
【0040】
従って、実施例2は、SPDP-修飾された抗体が、FPLCにおいて非修飾抗体と実質的に同一に挙動したことを示す。このデータは、修飾が、インビトロで完全な分子の分解を同様には導かなかったことを示す。
【0041】
修飾MAb'sをインビボ試験でさらに研究するために、修飾MAb'sの放射性標識を行った。放射性標識を、実施例3で示す。
【0042】
実施例3
修飾Lym−1の直接的放射性ヨウ素化
PDPで修飾されたLym-1および完全なLym-1の1バッチを125Iで、他のバッチを131Iで、その開示が本明細書中に参考として援用されているミルズ,エス.エル.(Mills,S.L.)ら、125I Radiolabelling of Monoclonal antibodies for In Vivo Procedures, Hybridoma 5: 265-275(1986)の改変クロラミンT法を用いてヨウ素化した。簡単に述べると、100μL PBS中に100μgのモノクローナル抗体を含む5 mL試験管に、バッチに依存して125Iまたは131Iの適切なヨウ素アイソトープ、および10μLの43 mMクロラミンT水溶液を加えた。20μLの120 mMメタ重亜硫酸ナトリウム溶液を用いて、3分後に反応をしずめた。放射性標識抗体を、セファデックスG-25カラムを用いて精製した。このカラムは、端を綿で栓したプラスチック製血清ピペット(8 mm×200 mm)からなっていた(Vo=4.5 mL)Vt=12 mL)。それぞれの反応混合物を、カラムにロードし、PBS、pH 7.2で溶出した。1 mLアリコートを含むそれぞれの試験管をカウントし、放射性標識抗体を試験管6に85-90%収率で回収した。これらの放射性標識抗体を、冷蔵庫に貯蔵し、標識から4時間以内にマウスに投与した。
【0043】
実施例3からの放射性標識したMAb'sを、即時薄層クロマトグラフィー(ITLC)に供して、標識MAb'sの純度を測定した。この分析は、実施例4で示す。
【0044】
実施例4
放射性標識した修飾Lym−1の即時薄層クロマトグラフィー(ITLC)による分析
実施例3のクロラミンT法により131Iで放射性標識した修飾Lym-1および125Iで放射性標識した修飾Lym-1を、シリカゲルを含浸したグラスファイバーからなる分析用ITLCを用いて分析した。使用する前にストリップ(2×20 cm)を、110-1/2℃で15分間加熱して活性化し;サンプル1μLでスポットし;風乾してMeOH/H2O(80:20)で約12 cm溶出し.;再び風乾し、半分に切断しカウントして、タンパク質結合および非タンパク質結合放射能を測定した。放射性標識Lym-1抗体の両形態とも、Rf値が0を有し、放射性化学的純度≧99%を示した。実施例3と同じように標識した完全なLym-1の分析をすると、同じ純度を明示した。
【0045】
従って、実施例4は、高純度の放射性標識抗体を得ることができたことを示す。これらの放射性標識MAb'sの免疫反応性は、Raji細胞に結合するそれらの能力によりテストされた。この分析を、実施例5で示す。
【0046】
実施例5
放射性標識した修飾Lym−1の免疫反応性評価による分析
放射性標識した修飾Lym-1および完全なLym-1のインビトロでの免疫反応性を、上記エプシュタイン,エー.エル.らの方法により、106個のRaji細胞/試験管の慣用されている生アッセイにより評価した。簡単に述べると、PBS中1%ウシ血清アルブミンの100μLに再懸濁させたRaji細胞を、三重セットの試験管にピペットで加えた。100μLの標識Lym-1を、それぞれの試験管(100,100 cpm/試験管)に加え、オービタルシェイカーを用いて連続的に混合しながら、30分間室温でインキュベートした。インキュベーション後、1000 rpmで5分間試験管をスピンし、上清をデカントし、200μL PBSに細胞を再懸濁することによって、細胞をPBS中1%ウシ血清で3回洗浄した。洗浄が完了した後、ガンマカウンターを用いて、細胞に結合した放射能を測定することにより、結合したLym-1を検出した。結果は、修飾Lym-1の結合活性が87%であるが、標準コントロールとしての役割を果たす完全なLym-1が80%の結合活性を有することを示した。
【0047】
従って、実施例5は、修飾Lym-1が非修飾Lym-1よりも、インビトロでより免疫活性であったことを示す。修飾抗体のインビボでの活性の安定性の予備的評価を得るために、実施例6に示されるように、修飾MAb'sを血清中でのそれらの安定性について分析した。
【0048】
実施例6
放射性標識した修飾lym−1の血清安定性の分析
修飾Lym-1およびI-125で直接的に標識された完全なLym-1のモノクローナル抗体を、新鮮なマウス血清の3重セットの幾つかのそれぞれに、最終濃度100μg/mLまで加えた。試験管を、空気中5%CO2に維持された湿潤インキュベーター中で、37-1/2℃でインキュベートした。0日と8日の間の時点で、900μLの100%トリクロロ酢酸(TCA)を100μLのアリコートに添加することによって、タンパク質結合活性を測定した。室温で5分間インキュベーション後、タンパク質沈降物を遠心分離により分離し、500μLの上清を各試験管から取り出し、ガンマカウンターで放射能をカウントした。データは、コントロール試験管のものを差し引いた、沈降した平均カウントパーセンテージとして表わされた。結果は、インキュベーション後の各時点で、修飾125I-Lym-1が、標準コントロールとしての役割を果たす125Iで標識した完全なLym-1と同じほど安定であることを示した。結果はさらに、8日間37-1/2℃でインキュベーションした後に、修飾Lym-1に存在する活性の≧92%がTCA沈降されることを示した。
【0049】
従って、実施例6は、修飾抗体の活性の安定性が血清中で少なくとも8日間維持されることを示した。血清中でインキュベーション後に修飾Lym-1が完全に維持されるかどうか評価するために、インキュベーション後の修飾Lym-1のHPLC分析が、実施例7に示されるように行われた。
【0050】
実施例7
修飾Lym−1のHPLCによる分析
HPLC分析を、サイズ排除カラム(SW 300)を備えたウォーターズ・システム(Waters system)上で、溶出溶媒として0.1M中性リン酸緩衝液および流速1 mL/分を用いて行った。溶出液を、ラジオアイソトープ検出器を用いて検出した。実施例6からの標識された修飾Lym-1産物の混合物は、750秒の溶出時間の低分子量種の1つの主要なピーク、プラス690秒での少量を示した。完全なLym-1は、690秒の保有時間を有する単一ピークを示した。
【0051】
従って、実施例7は、血清でインキュベートされた修飾Lym-1サンプルが、HPLC分析で、完全なLym-1のものよりも低い見かけの分子量を有したことを示す。対照的に、実施例2は、インキュベートされなかった修飾Lym-1が、完全なLym-1と同一の保有時間を有すことを示した。従って、修飾Lym-1は、FPLC分析では、血清中でインキュベーションすると、分子量の明らかな損失を示した。
【0052】
血清中でインキュベーションすることによる修飾Lym-1の分子量の明らかな損失をさらに証明するために、サンプルのポリアクリルアミドゲル電気泳動を、実施例8に示されるように行った。
【0053】
実施例8
放射性標識した修飾Lym−1のSDS−ポリアクリルアミドゲル電気泳動(SDS−P AGE)による分析
実施例6からのそれぞれのインキュベートされた血清混合物の同じアリコートを、非還元SDS-PAGEにより連続的にチェックした。この研究のために、サンプルを10%アクリルアミドゲル上にランし、注意深く乾燥し、その開示が本明細書中に参考として援用されているラエムリ,ユー.ケー.(Laemmli,U.K.)、Cleavage of Structura1 Proteins During the Assembly of the Head of Bacteriophage T4, Nature 227: 680-685(1970)のように、写真フィルムに通常の方法で露出した。この分析は、完全な125I-Lym-1が、Mr 200,000で明らかであるが、修飾125I-Lym-1は、約Mr 116,000で、より小さい分子量に対応する異なるバンドで観察されることを明示した。従って、本実施例は、血清中の修飾抗体のインキュベーションが、アクリルアミドゲル上で修飾された見かけの分子量を生じることを示し、HPLC分析の結果を立証する。
【0054】
実施例9
血清中の標識Lym−1の脱ヨウ素化に関するテスト
実施例6からの同じサンプルを、放射性標識Lym-1からの放射能の幾らかの損失があったかどうか見るために、8日間かけて再び検査した;そのような損失は、血清中の脱ヨウ素の証拠として解釈できる。データは、この期間に亘る、放射能の実質的ないかなる損失も示さなかったので、ヨウ素の非常に安定な付着が、これらの免疫複合体で得られたことを確認する。
【0055】
従って、実施例7−9は、修飾抗体が血清中のインキュベーション後に実質的に十分な活性を維持しながら、見かけの分子量116,000の分子に分解させるように見えたことを示す。上述のように、分子量のこの損失は、抗体のその一価形態への分解によることが可能である。いずれにしても、見かけの分子量の損失は、修飾抗体のそのフラグメントへの分解によると考えられる。
【0056】
血清中でインキュベートされたとき、修飾抗体の見かけの分子量の前記の予想しない変化を発見した後、我々は、修飾MAb'sのインビボでの安定性をテストした。我々は、これらをインビボテストで行い、全身のクリアランス時間を測定した。これらのテストの例は、実施例10で示される。
【0057】
実施例10
全身のクリアランス
無胸腺ヌードマウス(n=5)の3群が、(a)完全な抗体、(b)F(ab')2フラグメント、または(c)クロラミンT法を用いてI-131で標識されたLym-1の修飾抗体を腹腔内注射される実験を行った。注射時の及びその後の連続的な全身の活性を、線量計で測定した。この研究は、放射能の全身のクリアランスが、抗体の作製とともに変動することを実証した。結果を、図2に示す。
【0058】
図2は、修飾Lym-1が20時間の生物学的半減期(t1/2)を有して、完全なLym-1 (t1/2=5日)よりも速く全身から排除されたことを示す。しかしながら、F(ab')2フラグメントのクリアランスは、10時間の生物学的半減期を有し、修飾Lym-1よりも2倍速かった。データは、修飾Lym-1が、迅速に排除されるF(ab')2フラグメントとゆっくり排除される完全な抗体との間の中間的な速度で排除されることを示した。
【0059】
従って、実施例10のデータから、修飾抗体は身体から、比較的高く持続する完全な抗体よりも迅速に排除されるが、F(ab')2フラグメントほどには迅速でないことが見出され得る。
【0060】
免疫療法のための理想的な物質は、所望の毒性効果を生じるのに十分に長い時間、血流の中に残存するであろうが、意図されない毒性の副作用を生じるほどには長くないものである。実施例10からのデータは、免疫療法で使用されるとき、修飾抗体が潜在的に理想的な持続時間を発揮することを示唆した。
【0061】
先に考察したように、免疫療法用の物質はまた、その標的細胞に対して高度に特異的でもあるであろう。従って、我々は、下記の実施例で、完全なMAb'sおよびF(ab')2フラグメントの両方と比較される、修飾MAb'sの特異性をテストした。実施例11は、以降の生体分布研究の全てで使用される方法を示す。
【0062】
実施例11
生体分布研究
2群の6週齢のヌードマウスを、その大腿部にRaji細胞(107)を皮下注射した。腫瘍は、それらの径が1 cmより大きくなるまで、3週間増殖させた。下記に記載されるように、対標識(paired-label)研究を、各群のマウスを用いて行った。第一群(n=6)では、各マウスは、I=131を12μCi/μg(120μCi/マウス)で標識した10μgの修飾Lym-1、およびI-125を2.5μCi/μg(25μCi/マウス)で標識した10μgの完全なLym-1を含む、0.2 mLの接種材料をi.p.で注射した。第二群(n=4)では、マウスは、I-131を12μCi/μg(120μCi/マウス)で標識した10μg修飾Lym-1、およびI-125を2.5μCi/μg(25μCi/マウス)で標識した10μgのF(ab')2フラグメントを含む、0.2 mLの接種材料を受けた。全ての実験で、マウスは、注射後の予め選択された時間に頸部脱臼により殺され、様々な臓器、血液および腫瘍を摘出し分析用天秤で重量測定した。次に、サンプルをガンマカウンターでカウントし、131Iおよび125I活性を測定した。125Iカウントは、1282コンピュガンマ(Compugamma)ガンマカウンター(LKB)を用いて、実験的に決定された式である131Iチャンネルカウントの17%を引き算して、131Iチャンネルからのクロスオーバーのために調節された。データはまた、動物が殺された日による、131Iアイソトープの放射性崩壊に関して較正された。各マウスについて、データを、腫瘍グラム当りのcpm/臓器グラム当りのcpm、%用量/グラム、および%用量/臓器で表わした。これらのデータから、平均および標準偏差を、それぞれの群について計算した。
【0063】
実施例12は、実施例11の方法を用いて、修飾MAb'sの生体分布を、完全なMAb'sと比較している。
【0064】
実施例12
修飾Lym−1対完全なLym−1の生体分布研究
この研究のために、実施例11の方法の中で、完全なLym-1抗体を修飾Lym-1抗体と比較した。表Iに報告されるように、完全なLym-1は、注射から7日後に、0.64% ID/gの血液活性を生じた。同じ時間間隔の終りでは、腫瘍は、3.92% ID/gの活性を有した。
【0065】
表Iに報告されるように、完全なLym-1と比較すると、修飾Lym-1は血中からより速く排除され、7日目に0.14% ID/gの血液活性を生じた。同じ時間間隔の終りに、腫瘍は7.7%生じ、それは完全なLym-1の対応する活性よりも有意に高い傾向があった。
【0066】
幾つかの臓器における実施例12からの抗体反応性の結果は、表Iに報告され、図3(%用量/グラム)および図4(腫瘍/臓器)にグラフで示される。
【0067】
表I
注射から7日後のRaii腫瘍担持ヌードマウス(N=6)における修飾および完全なモノクローナル抗体LYM−1の生体分布
【0068】
【表1】

【0069】
図3から、修飾抗体は、完全な抗体よりも、腫瘍中でより高いシグナルを生じたことが見い出され得る。さらに、修飾抗体は完全なMAb'sよりも、腎臓を例外としてあらゆるテストされた臓器で、反応が弱かった。腎臓でより高いシグナルが見出されるのは、抗体がこの臓器から排除されるのが予想されるので、予想されないことではない。実施例10で見られた完全なMAb'sと比較して、修飾MAb'sのより迅速なクリアランス速度により、腎臓ではより高い量の修飾MAb'sが予想されるであろう。
【0070】
図3と同じデータを異なる形態で示す図4を参照すると、修飾MAb'sは、完全なMAb'sよりも、腎臓を例外としてあらゆるテストされた臓器で有意に高い腫瘍/臓器比を生じたことが見い出され得る。従って、免疫シントグラフィで使用されるとき、修飾抗体は有意に低いバックグラウンドを生じることが予想されるであろう。さらに、免疫療法で使用されるとき、修飾抗体は、その腫瘍へのより高い親和性および非標的組織へのより低い親和性の両方により、より効果的であることも予想されるであろう。従って、免疫シントグラフィで使用されるとき、修飾抗体は、腫瘍に対するより高い毒性および非標的組織に対するより低い毒性であることが予想されるであろう。本発明の修飾抗体の免疫療法的使用は、これ以降さらに詳しく説明される。
【0071】
我々は次に、修飾MAb'sの生体分布を、他の非修飾抗体のF(ab')2フラグメントと比較した。実施例13は、これらの実験を例示するものである。
【0072】
実施例13
修飾Lym−1対Lym−1のF(ab’)2フラグメントの生体分布研究
この研究のために、F(ab')2フラグメントを、修飾Lym-1 MAb'sと比較した。実験を、実施例11でのように行った。結果を表IIに報告し、図4および5にグラフで示す。
【0073】
表II
注射から5日後の Raji腫瘍担持ヌードマウス(N=4)における 修飾および完全なモノクローナル抗体LYM−1 の生体分布
【0074】
【表2】

【0075】
表IIは、修飾Lym-1が、F(ab')2フラグメントよりも、血液からゆっくりと排除されたことを示す。修飾Lym-1は、注射後5日目に、フラグメント(0.05%)よりも高い0.09%ID/gの血液活性を生じた。図5は、修飾Lym-1の腫瘍活性が、F(ab')2フラグメントの対応する活性よりも、約2.5倍高かったことを示す。修飾Lym-1の活性は、腎臓を含むテストされた様々な臓器の全てについて、F(ab')2フラグメントよりも高かった。これは、より迅速に排除される抗体が腎臓に蓄積するという理論と一致する。
【0076】
さらに、図6は、修飾Lym-1に関する腫瘍対臓器比が、テストされた臓器の全てにおいて、F(ab')2フラグメントのものよりも高いことを示す。従って、実施例12および13の実験は、本発明の修飾抗体が完全なMAb'sまたはF(ab')2フラグメントのいずれかよりも、それらの標的腫瘍に関して高い活性を有することを確認する。さらに、これらの実験の腫瘍対臓器データは、修飾抗体が完全なMAb'sまたはF(ab')2フラグメントのいずれかよりも、腫瘍に関して高い特異性を有することを示す。
【0077】
従って、我々は、改善された免疫シントグラフィ結果を生じる本発明の修飾MAb'sの能力をテストした。これらのテストの1例を、実施例14に示す。
【0078】
実施例14
Lym−1の画像化研究
腫瘍担持ヌードマウスを、ピンホール・コリメーターおよびスペクトル91ガンマカメラ(レイゼオン(Raytheon))を用いて画像化した。これらの動物の画像分析は、注射後の腫瘍/全身の抗体分布の評価を与えた。注射から7日後、マウスを2 mgケタミンHCIで麻酔し、0.4 mgキシラジンを0.2 mL s.c.接種として投与した。次に、固定されたマウスは、10,000カウント記録するためにプリセットされたカメラで、背部位で画像化された。いかなるバックグラウンド引き算も行わなかった。写真画像は、ポラロイド(登録商標)のタイプ330パックフィルムを用いて得られた。各画像に2つの領域が、定められた:(a)領域1、全身;(b)領域2、腫瘍。図6−8は、これらの実験で作製された例示的なシントグラフ(シントグラムとしても公知)を示す。
【0079】
完全なLym-1による免疫シントグラフィ画像化は、注射から7日後に試みられ、図6に示されるように十分ではなかった。図6は、腫瘍が視覚化されたけれども、動物の残りも視覚化されたことを示す。図7および8は、注射後の同じ時点で、標識された修飾Lym-1を注射された2種の異なるRaji腫瘍担持動物の画像を示す。図7および8は共に、図6に見られるように、完全なLym-1による、産生された腫瘍でのものよりもより高いレベルで、腫瘍での標識された修飾Lym-1の濃度を示すことが見出され得る。より重要なこととして、修飾Lym-1により産生されたマウス全体のバックグラウンドに対する、腫瘍での標識の比は、完全なLym-1のそれの数倍も高かった。従って、図7および8は、バックグラウンドの放射能を殆ど又は全く有さない、腫瘍の明確な限定(definition)を示す。
【0080】
さらに、修飾Lym-1を使用するとき、注射から5日後に、腫瘍の満足な視覚化を得ることができた。図10は、7日目に図9で示されるのと同じ動物で撮られた5日目の画像を示す。見て判るように、図10の5日目の画像は、7日目の完全なLym-1で得られた画像よりも有意に優れていた(図7)。結果は、テストされた全動物で、同様であった。
【0081】
この研究は、修飾抗体フラグメントを使用すると、腫瘍抗原に対するより大きな特異的活性が発揮され、抗体のより多くの絶対的濃度が腫瘍に蓄積するのを可能にすることを示唆する。これは、修飾Lym-1フラグメントの絶対的濃度が注射から7日後の完全なLym-1濃度の約2倍であり、5日後のF(ab')2フラグメントの約2.5倍である、という我々の結果によって確認される。
【0082】
修飾Lym-1フラグメントのかなり速いクリアランスはまた、腫瘍対バックグラウンドの高い比に到達するのに要求される時間を有意に減少させ、この結果、完全な抗体よりも少ない時間でより優れた画像化を生じる。
【0083】
本発明の修飾の、抗体の特異性および活性の改善における一般的な有用性を実証するために、我々はさらなるMAb'sを修飾した。これらの様々な修飾MAb'sのテストを、実施例15-18に示す。
【0084】
実施例15
モノクローナル抗体B72.3のクリアランス速度
結腸癌に対するモノクローナル抗体であるB72.3(IgG1)を、その開示が本明細書中に参考として援用されているコルチャー,ディー.(Colcher,D.)ら、A Spectrum of Monoclonal antibodies Reactive with Human Mammary Tumor Cells, Proc. Natl. Acad. Scl. 78: 3199-3203(1981)のようにして得た。B72.3 MAb'sを、実施例1の方法に従い分子当り平均して1個のPDP基で機能性化した。
【0085】
修飾B72.3MAb'sを、実施例3の方法により放射性標識した。全身のクリアランス時間を、実施例10でのように測定した。図11は、これらの全身クリアランス実験の結果を示す。修飾抗体は、完全なMAb'sの約6日目から修飾抗体の約2.5日目までの全身のハーフタイム・クリアランスの減少を示した。F(ab')2フラグメントのハーフタイム・クリアランスは、Lym-1フラグメントについて、修飾抗体よりも速く、約12時間のハーフタイムを有した。従って、結果は、修飾B72.3が、F(ab')2フラグメントと完全な抗体の中間のハーフタイム・クリアランスを有することにおいて、修飾Lym-1と類似した挙動をすることを示した。
【0086】
実施例16
B72.3の生体分布
対標識(paired-label)生体分布研究を、ヒトLS174T結腸癌を担持する無胸腺ヌードマウスで、各5匹の2群のマウスについて行った。1群は、完全なI-125で標識したB72.3を注射され、他の群は、修飾されたI-131で標識したB72.3を注射された。実験はまた、腫瘍、血液および様々な臓器における生体分布を比較した。使用された方法は、実施例11-13のものであった。データを表IIIに報告し、図11および12にグラフで示す。
【0087】
表III
ヒトLS174T結腸癌担持ヌードマウス(N=5)における注射から4日後の修飾および完全な モノクローナル抗体B72.3の生体分布
【0088】
【表3】

【0089】
表IIIに見て判るように、完全なB72.3抗体は、注射から4日目に、1.34% ID/gの血液活性を生じ、腫瘍では4.04%の活性が表IIIに示されている。完全なB72.3と比較すると、修飾B72.3は4日目に、より低い血液活性(1.1% ID/g)およびより高い腫瘍活性(6.02% ID/g)を生じた。
【0090】
図13に見て判るように、様々な臓器活性の全ては、より迅速に排除される抗体について予想された腎臓を例外として、修飾B72.3ではより高かった。従って、図14に示されるように、修飾B72.3に関する腫瘍対臓器比は、完全なB72.3に関する対応する比よりも有意に高かった。腫瘍対臓器比は、腎臓に関しては、腫瘍部位での修飾抗体のより高い活性により、改善されさえした。
【0091】
実施例17
腫瘍担持マウスでのB72.3の両像化
修飾B72.3を注射されたLS174T腫瘍担持マウスの画像分析は、注射後の腫瘍/全抗体分布の推定をもたらした。図14は、注射から1日目の免疫シントグラフィを示す。画像は、バックグラウンドの放射能を殆ど示さない腫瘍の明確な限定を示す。図15は、注射から4日目の免疫シントグラフィを示す。4日までに、腫瘍は鮮明に見られ、動物の血液プールには殆ど放射能が残っていなかった。結果は、全動物で同様であった。
【0092】
従って、修飾B72.3は、B72.3に反応性の腫瘍の注射から短時間で高画質の免疫シントグラフィを得るのに非常に有用であることが見出された。
【0093】
TNT-1は、ヒト癌にそれらが選択的に結合する標的として壊死性腫瘍を利用する、IgG2aモノクローナル抗体である。我々は、実施例1でのように、分子当り平均して1個のPDP基でこの抗体を修飾し、実施例18に示されるように全身の保有時間を分析した。
【0094】
実施例18
モノクローナル抗体TNT−1の使用
我々は、TNT-1を、その開示が本明細書中に参考として援用されているエプシュタイン,エー.エル.ら、A Novel Method for the Detection of Necrotic Lesions in Human Cancer, Cancer Res. 48:5842-5848 (1988)のようにして得た。
【0095】
TNT-1 MAb'sを、実施例3の方法で放射性標識した。全身のクリアランス時間を、実施例10でのように測定した。図16は、これらの全身クリアランス実験の結果を示す。修飾TNT-1 MAb'sは、完全なTNT-1と比較した全身のハーフタイム・クリアランス時間の減少、およびTNT-1のF(ab')2フラグメントと比較した増加を示した。
【0096】
従って、修飾TNT-1は、他の修飾抗体と同様な挙動をした。我々は、従って、修飾TNT-1MAb'sの利用性が、テストされた他の修飾抗体に等しいものであると予想する。
【0097】
実施例19は、ビオチン化抗体を調製するのに有用な1つの方法を記載する。
【0098】
実施例19
ビオチン化抗体の調製
TNT-1およびLym-1MAb'sを、そのスルホN-ヒドロキシスクシンイミドエステル(NHS-LC-ビオチン)と反応させることにより、6-(ビオチンアミド)ヘキサノエートに別々に複合体化した。代表的には、1 mLの0.9%食塩水中2 mgNHS-LC-ビオチンの標準的な溶液を調製した。炭酸水素ナトリウム緩衝液、pH 8.5中1 mLの抗体(10 mg/mL)を含む5 mL試験管に、1 mLのNHS-LC-ビオチン標準溶液(モル比50:1 NHS-LC-ビオチン/MAb)を加えた。試薬混合物を、2.5時間室温で、低速で連続的に攪拌しながら、インキュベートした。インキュベーション後、カップリングされた抗体を、PBS、pH 7.2で平衡にしたPD-10カラム(ファルマシア)上でクロマトグラフィーした。カップリング抗体調製物の純度を、スペロース・12カラムを用いてFPLCで評価した。これらの手順の結果は、ビオチン化抗体が少なくとも99%の純度で得られたことを示した。
【0099】
それぞれの抗体分子にカップリングされたビオチン基の平均数は、グリーン(Green)、Biochem J. 94:23c-24c(1965)に記載される方法により、分光光度計で測定された。簡単に述べると、ビオチン化抗体を、37℃で4時間、1%プロテアーゼで酵素的に消化した。0.1 M PBS、pH 7.2中800μLの100μM HABAを含む5 mL溶液に、70μLの17μMストレプトアビジン溶液を加えた。次に、ストレプトアビジン-HABA溶液を、消化されたビオチン化抗体溶液の容量を増加させながら滴定し、吸光度の変化を500 nmで測定した。この処理から、プロテアーゼ処理した抗体溶液中のビオチン濃度を、ビオチン溶液の標準曲線を用いて計算した。結果は、平均して3〜4個のビオチン部分が、各抗体分子に組込まれたことを示した。
【0100】
ビオチン-抗体複合体を、本質的に実施例3に記載されるように、クロラミンT法を用いて125Iで放射性標識した。
【0101】
実施例20は、抗体および抗体フラグメントの放射性ヨウ素化に使用される方法を記載する。
【0102】
実施例20
抗体の直接的放射性ヨウ素化
全ての抗体(完全な、修飾された、およびF(ab')2フラグメント)を、本質的に実施例3に記載されるように、修飾されたクロラミンT法を用いて、125Iまたは131Iでヨウ素化した。代表的には、0.5-1.0 mCiのヨウ素-125またはヨウ素-131および10μLの43 mMクロラミンT水溶液を、100μL PBS中50-100μgのモノクローナル抗体を含む試験管に加えた。3分後、20μLの120 mMメタ重亜硫酸ナトリウム溶液で、反応をしずめた。放射性標識した抗体を、セファデックスG-25カラムを用いて精製した。このカラムは、プラスチック製血清ピペット(8×200 mm)からなり、端を綿で栓されていた(Vo=4.5 mL、Vt=12 mL)。それぞれの反応混合物を、カラムにロードし、PBS、pH 7.2で溶出した。1 mLのアリコートを含む個々の試験管を、シンチレーション・カウンターでカウントした。放射性標識された抗体は、代表的には収率85-90%で回収された。クロラミンT法で放射性標識された全ての抗体が、シリカゲルを含浸したグラスファイバー上で、分析用即時薄膜クロマトグラフィー(ITLC)システムを用いて分析された。ストリップ(2×20 cm)を、使用前に110℃で15分間加熱により活性化し、1μLのサンプルでスポットし、風乾し、メタノール/H2O(80:20)で約12 cmを溶出し、再び風乾し、半分に切断し、カウントして、結合タンパク質および非タンパク質結合の放射能を測定した。この手順の結果は、抗体の99%以上が結合タンパク質であったことを示し、よって、機能性放射性標識されたビオチン化抗体が高純度で得られたことを確認した。
【0103】
上記の手順により調製された放射性標識されたビオチン化抗体を、4℃で貯蔵し、標識から4時間以内にマウスに投与した。
【0104】
下記の2つの実施例は、放射性標識されたビオチン化抗体が、標的抗原に結合する能力を保持し、血清成分の存在下では安定であったことを証明するために使用された、分析的手順の結果を開示する。
【0105】
実施例21は、ビオチン化および放射性標識により修飾された抗体が、抗原結合能力および構造的完全性(integrity)を共に保持したことを実証するのに使用された方法を記載する。
【0106】
実施例21
免疫反応性評価
放射性標識Lym-1調製物のインビトロでの免疫反応性を、エプシュタインら、Cancer Res. 47:830 (1987)に記載される方法により、Raji細胞を用いて生細胞アッセイで評価した。Raji細胞(106個/試験管)を、PBS中1%ウシ血清アルブミン(BSA)の100μLに再懸濁させた。標識Lym-l(l00μl)を、それぞれの試験管(約10μCi/μg;100,000 cpm/試験管)に三重に加え、オービタルシェイカーを用いて連続的に混合しながら、1時間室温でインキュベートした。インキュベーション後、1000 rpmで5分間試験管を遠心分離し、上清をデカントし、200μL PBSに細胞を再懸濁することによって、細胞をPBS中1% BSAで3回洗浄した。洗浄が完了した後、ガンマカウンターを用いて、細胞ペレットに結合した(associated)放射性標識を測定することにより、結合したLym-1を検出した。この手順の結果は、実施例6に示されたものと実質的に同一であった。
【0107】
より詳細には、放射性標識された完全なLym-1の75%、および放射性標識されたビオチン化Lym-1の75%が標的細胞に結合した。これは、放射性標識されたビオチン化Lym-1の抗原結合活性が、標準コントロールとしての役割を果たす放射性標識された完全なLym-1のそれに比肩することを示した。
【0108】
修飾TNT-1 MAbの免疫反応性を、ガッファー(Gaffar)ら、J. Immunoassay, 2:11 (1991)に記載される固定細胞ラジオイムノアッセイを用いて評価した。簡単に述べると、放射性標識したTNT-1および放射性標識したビオチン化TNT-1を、PBS中20%パラホルムアルデヒドで予め固定されていたRaji細胞とともに、30分間室温でインキュベートし、その後アセトンで-20℃で処理した。次に、細胞をPBS中1% BSAで洗浄し、ガンマカウンターでカウントした。この手順の結果は、両方の抗体調製物の約60%が固定細胞に結合することを示した。これは、放射性標識したビオチン化TNT-1の抗原結合活性が、標準コントロールとしての役割を果たす放射性標識した完全なTNT-1のそれに比肩することを示した。
【0109】
実施例22は、放射性標識したビオチン化抗体が血清の存在下では通常には分解に供されることを証明するために使用される方法を記載する。
【0110】
実施例22
修飾抗体の血清安定性
125Iで直接標識されたMAb'sを、新鮮なマウス血清を含む試験管の三重セットに、最終濃度100μg/mLまで加えた。全サンプルを、空気中5%CO2に維持された湿潤インキュベーター中で、37℃でインキュベートした。0日と8日の間の各時点で、タンパク質結合放射性標識を、900μLの100%トリクロロ酢酸(TCA)を各サンプルの100μLのアリコートに添加し、室温で5分間インキュベーション後、タンパク質沈降物を遠心分離により回収することにより測定した。上清のアリコート(500μL)を各試験管から取り出し、ガンマカウンターを用いて放射能をカウントした。結果は、放射性標識したビオチン化抗体がインビトロで全ての時点で安定であることを示した。より詳細には、8日間インキュベーションした後、少なくとも放射性標識の97%がタンパク質結合を維持した。これは、MAb's上に存在するビオチン部分が、タンパク質結合した放射性標識の安定性に対して、全く不利な効果を及ぼさないことを確認した。
【0111】
それぞれのインキュベートされた血清混合物の同じアリコートも、非還元SDS-PAGEおよびオートラジオグラフィによって、連続的にチェックされた。この研究のために、サンプルを10%ポリアクリルアミドゲル上で電気泳動し、X線フィルムに露出して視覚化した。サンプルの分子量を、分子量スタンダードと比較して決定した。これらの手順の結果は、放射性標識された完全なMAbおよび放射性標識されたビオチン化MAbが、実質的に同様の分子量を有することを示した。より詳細には、放射性標識Lym-1および放射性標識されたビオチン化Lym-1に関する主要なバンドが、約200,000のMrsを有することを示した。同様に、放射性標識TNT-1および放射性標識されたビオチン化TNT-1に関する主要なバンドは、約150,000のMrsを有した。
【0112】
ポリアクリルアミドゲルでの等電点電気泳動を、バイオラッド(BioRad)モデル111ミニIEF細胞で行った。サンプルを、1.2% 3/10両性電解質および0.8% 5/8両性電解質の濃度でのバイオライト(BioLyte)両性電解質(バイオラッド)の混合物で構築されたpH勾配により、バイオラッドに作成されたプロトコールに従い、電気泳動した。IEFスタンダード(バイオラッド)を、plの較正のために各ランに含めた。IEFゲルを、クーマシーブルーR-250で染色し、終夜乾燥した。これらの手順の結果は、MAb'sのビオチン化は実質的に、マクロ分子の電荷特性を変化させたことを確認した。放射性標識Lym-1は7-8のpI値を有したが、放射性標識されたビオチン化Lym-1は5-6のpI値を有した。同様に、放射性標識TNT-1 MAbは5.5-6.5のpI値を有したが、放射性標識されたビオチン化TNT-1 MAbは4.5-5.0のpI値を有した。従って、予想されたとおり、ビオチン化抗体のより少ない塩基性に実証されるように、MAbタンパク質上の遊離アミノ基の修飾が、タンパク質上の正電荷の幾らかを効果的に除去したか又は中和した。
【0113】
実施例23は、天然の抗体と比較して減少したpIを有するマクロ分子を生じるように化学的に修飾されたアミノシド部分を有するMAb'sが、有利なことに、(1)標的特異性の増大、(2)非特異的結合の減少、および(3)クリアランス時間の減少を発揮したことを実証するのに使用される方法を記載する。
【0114】
実施例23
生体分布研究
2群の6週齢のヌードマウスを、クワーリら、Antibody, Immunoconjugates, and Radiopharmaceutica1s, 6:13(1993)に記載される方法に従い、Rajiリンパ腫細胞、LS-174T結腸癌細胞、または子宮頚部癌ME-180を注射した。腫瘍は、それらの径が約1 cmになるまで、10-21日間増殖させた。
【0115】
(a)対標識研究 第一群のマウス(n=6)では、各マウスは、120μCi/10μgの修飾された131I標識MAbおよび25μCi/10μgの完全な131I標識MAbを含む、0.2 mLの接種材料を静脈内注射した。第二群(n=4)では、マウスは、120μCi/10μgの修飾された131I標識MAbおよび25μCi/10μgの125I標識MAb F(ab')2を含む、0.2 mLの接種材料を受けた。全ての実験で、マウスは、注射後の予め選択された時間に頸部脱臼により殺され、様々な臓器、血液および腫瘍を摘出し、重量測定された。次に、サンプルをカウンターでカウントし、131Iおよび125I活性を一測定した。125Iカウントは、1282コンピュガンマ(Compugamma)カウンターを用いて、実験的に決定された式である131Iチャンネルカウントの17%を引き算して、131Iチャンネルからのクロスオーバーのために、調節された。データはまた、動物が殺された時点による、131Iアイソトープの放射性崩壊に関して較正された。各マウスについて、データを、腫瘍グラム当りのcpm/臓器グラム当りのcpmおよび%用量/グラムで表した。これらのデータから、平均および標準偏差を、それぞれの群について計算した。同じ対標識生体分布研究を、Rajiリンパ腫モデルのLym-1、およびLS-174Tヒト結腸癌モデルのB72.3を用いて行なった。
【0116】
これらの手順の結果を、図17に示す。パネル17Aに示されるように、完全なTNT-1およびTNT-1/ビオチン修飾されたMAb'sの両方とも、注射後1日目に腫瘍組織に局在化し、ビオチン化抗体は、%注射用量/腫瘍グラムで測定されるように、より大きい局在化を示した。2つの標識MAb'Sの非特異的結合も各組織において明らかであった。重要なこととして、これらの組織と非特異的に結合するビオチン化TNT-1の量は、そのような非特異的結合を示した完全なTNT-1の量よりも画一的に少なかった。従って、特異的結合のレベルは増大し、非特異的結合のレベルはビオチン化抗体では非修飾抗体に比較して減少した。修飾抗体の利点は、図17Bに定量的に示され、そこでは、腫瘍に局在化した抗体対非特異的に局在化した抗体の比が各組織について示されている。示されているように、画像化試薬としてのビオチン化抗体の利点は、筋肉および膵臓で特に明らかである。
【0117】
同様の傾向は、注射後3日目に為された測定について観察された。図17Cは、ビオチン化TNT-1抗体が、ビオチン化されない同等の抗体よりも、より効果的に腫瘍組織に局在化したことを示す。同時に、非特異的結合の量は、ビオチン化種で有利に低かった。図17Dは、様々な組織でのシグナル対ノイズ比を反映する腫瘍/臓器比が、筋肉および膵臓で最も高かったことを定量的に確認する。注目すべきこととして、図17Cおよび17Dは、迅速な全身クリアランス速度を有するTNT-1 F(ab')2フラグメントを用いて得られた結果を含む。腫瘍/臓器比は、幾つかの組織タイプでのビオチン化TNT-1と比較すると、抗体フラグメントに関してより高いけれども、腫瘍に局在化した注射されたビオチン化TNT-1のフラクションは有利により高かった。これらの結果は、ビオチン化MAbが、非修飾の完全なMAb、またはF(ab')2MAbフラグメントのいずれかよりも優れた様式で、腫瘍組織に局在化することを示した。
【0118】
(b)全身クリアランス Ba1b/cマウス(n=45)の異なる群が、放射性標識抗体の静脈内注射を受ける実験が行われた。注射時の及びその後の選択された時点での全身の活性を、用量カリブレーターで測定した。
【0119】
図18および19は、TNT-1およびLym-1抗体並びにそれらの誘導体に関する、全身クリアランス速度研究の結果を開示する。図18に示される結果は、SPDPまたはビオチンで修飾されたTNT-1 MAbが、完全な抗体と比較してクリアランス時間を減少させることを示した。テストされた全ての抗体のうち最速のクリアランス速度を有したF(ab')2TNT-1フラグメントが、この手順で陽性コントロールとして使用された。従って、ビオチン化TNT-1 MAbは、非ビオチン化抗体よりも、より迅速なクリアランス速度を有利に示した。同様に、図19に示される結果は、SPDPまたはビオチンで修飾されたLym-1 MAbが、完全な抗体と比較してクリアランス時間を減少させることを示した。これは、抗体のpIを減少させるために遊離アミノ基部分を化学的修飾した物質が、抗体結合特異性および全身クリアランス速度を有利に増加させることを示した。
【0120】
我々は、本発明の方法を用いる、あらゆる抗体の修飾が、腫瘍画像化の改善に有用な試薬を提供すると考えている。本発明の方法を用いて、あらゆる所望の組織タイプの画像を作製するために、その組織タイプに対する抗体が最初に得られなければならない。ポリクローナル抗体は、当業者に公知である慣用されている方法で得られ得る。或いは、モノクローナル抗体は、当業者にも公知であるように、これらの抗体により提供される特異性の増大を得るために調製され得る。次に、抗体は、ヘテロ二官能性剤、ビオチン、または他の物質と複合体化することによって遊離アミノ基で化学的に修飾され、該物質は、非修飾抗体の等電点よりも低い等電点を有する修飾抗体生成物をもたらす。複合体化の後、好適な標識が、修飾抗体に適用される。
【0121】
前記の実施例は、ガンマ放射線を放出する放射性核種を含む標識の画像化を利用するけれども、多くの他の標識タイプおよび画像化システムが、本発明の範囲内に意図される。例えば、バリウム、セシウムまたはヨウ素のような放射線不透剤が、慣用されているX線を用いて画像化され得る。常磁性または超磁性の粒子が、標識としてMRI画像化技術で使用され得、抗体の局在化の画像を作製する。さらに、テクニシウムが、標識として使用され得る。これらの代替的標識は、慣用されている方法を用いて修飾抗体に複合体化されても良い。
【0122】
標識抗体は、薬学的に許容される賦形剤、担体、または基剤を含む、被験体への標識の導入のための薬学的調製物に含まれ得る。好適な賦形剤、担体、または基剤は、食塩水、リン酸緩衝生理食塩水、グリセロール、炭酸カルシウムなどを含む。次に、これらの組成物は、局所注射、静脈内注射のような、或いは、シグナル強度の減少が要求される場合または口腔組織の画像化が望まれる場合には経口投与のような様々な手段のいずれかで、導入される。しかしながら、好ましくは、標的組織が抗体に最大に曝されるように、投与は全身的注射で行われる。
【0123】
我々は、本発明に従い対応する非修飾完全抗体よりも低い等電点を有する修飾抗体を生じる、ヘテロ二官能性剤、ビオチン、または他の物質の付加により、抗体上に配置された遊離アミノ基の化学的修飾が、これらの修飾抗体が免疫治療剤に組込まれるときに、有意に改善された結果を生じる、と考えている。そのような治療剤は、一般に、腫瘍または他の疾患組織に特異的な抗体を、1種以上の生物学的に活性な分子と組合せて含む。そのような物質において機能する好適な生物学的に活性な分子は、ジフテリア毒素(リシン)A鎖または当業者に公知の様々な植物毒素のいずれかのような毒素;イットリウム、ヨウ素、リン、および他の通常使用される放射性治療剤の放射性同位元素;メトトレキセート、5-フルオロ−ウラシル、またはアドリアマイシンのような薬剤;EDTAおよびEGTAを含むキレート;シスプラチンおよび他の毒性有機金属剤、および任意の他の治療剤である。
【0124】
これまで、効果的な免疫療法の見込みは、十分に実現されていなかった。我々は、本発明の修飾抗体の増大した活性および特異性が、それらの標的組織に関する十分な活性および特異性を有する免疫療法剤を生じさせ、従来の免疫療法剤の欠点を克服すると考えている。従って、被験体に適切な免疫療法剤が注射されるとき、被験体の健康な組織に重要な影響を与えることなく、標的疾患組織は殺滅され得る。
【0125】
これらの免疫療法剤の使用では、特定の所望されない組織タイプに特異的な抗体が、第一に得られなければならない。所望の抗体が入手されない場合、当業者に公知のように、生物に抗原を注射し、哺乳動物から血清を得ることによって、適切な生物の中で抗体を生じさせても良い。或いは、好ましくは、当業者に公知の方法で、モノクローナル抗体を生じさせ得る。次に、抗体は、抗体分子上に存在する遊離アミノ基を修飾できる、ヘテロ二官能性剤、ビオチン、または他の物質のような物質を化学的に複合体化される。複合体化した後、得られた修飾抗体はさらに、上述した治療剤または検出可能標識のような生物学的に活性な物質と複合体化して修飾される。抗体は、薬学的に許容される担体、賦形剤、または基剤を含む薬学的組成物に組込まれる。そのような薬学的に許容される担体、賦形剤、または基剤は、全身的注射用の通常の生理食塩水、グリセロール、炭酸カルシウムを含む。続いて、組成物は、患者、例えば哺乳動物への導入の準備が整う。
【0126】
次に、抗体は、公知の投与経路で被験体に導入される。例えば、組成物は全身的注射で導入され得、冒された組織への局所注射は外部的に冒された組織に局所的に適用され得、シグナル強度の減少が要求される場合または口腔組織の治療が望まれる場合には経口的に摂取され得る。
【0127】
抗体を含む生物学的に活性な物質の投与量は、毒素に対する標的組織の感受性、冒された組織の量、投与経路、抗体への親和性、クリアランス速度および他のファクターに依存する。しかしながら、代表的な投与量は、一般に、1μg/全身質量kg〜1 mg/kgの範囲である。殆どの適用において、用量は、好ましくは5〜200μg/kgである。
【0128】
下記の実施例は、マウスにおけるRaji細胞に対して免疫治療学的な有効性を例示する。PDP-修飾された抗体は、実施例で使用されるけれども、対応する完全な抗体よりも低いpIを有する修飾抗体を産生する、ビオチンのような他の物質で修飾された遊離アミノ基を有する抗体は、十分に等しく機能することが予想される。
【0129】
実施例24
マウスでのRaii腫瘍の処置
PDP-修飾されたLym-1を、実施例1でのように得た。次に、修飾抗体を処理して、抗体分子当り平均して1個のリシンA鎖を導入する。完全なLym-1およびF(ab')2フラグメントを、同様にして毒素と組合わせる。
【0130】
25匹のマウスを、5群に分ける。I群は、8週間の間、週に一度、リン酸緩衝食塩水(PBS)中リシン-PDP-修飾Lym-1を、腹腔内注射で10μg/全体重kgを受ける。II群は、等しい量のリシン-完全なLym-1の注射を受ける。III群は、等しい量のリシン-Lym-1のF(ab')2フラグメントを受ける。IV群は、等しい量の複合体化されないリシンを受ける。V群は、PBSのみを受ける。
【0131】
8週間後、実施例14の方法を用いて、生存マウスの全ての免疫シントグラフィを行なった。I群のマウスは、他の群のいずれと比較しても、腫瘍の視覚化の減少を示す。生存するII群およびIII群のマウスは、幾らかの改善を示すが、I群のマウスほど劇的ではない。IV群のマウスは、ひどく不調になるか死亡する。
【0132】
従って、実施例24は、本発明の修飾抗体を用いる、腫瘍の1つの特定の処置を示す。実施例19は、本発明のPDP-修飾抗体を用いるときに得られる、優れた結果を示す。
【0133】
マウスまたはヒトのような他の哺乳動物で、他の腫瘍または疾患組織に特異的な他の抗体の使用に置き換えると、それらの特定の腫瘍または疾患組織を処置するのに、同様に効果的な結果を生じると考えられる。さらに、他の公知の毒素と置き換えても、同様に効果的な結果を生じると考えられる。実施例20は、ヒトの膵臓癌に対するのと同様に効果的な治療の使用を示す。PDP-修飾された抗体は、実施例で使用されるけれども、対応する完全な抗体よりも低いpIを有する修飾抗体を産生する、ビオチンのような他の物質で修飾された遊離アミノ基を有する抗体は、十分に等しく機能することが予想される。
【0134】
実施例25
ヒト膵臓癌の処置
ヒト膵臓腫瘍で見られる抗原に特異的であるモノクローナル抗体を得る。この抗体は、実施例1でのように、抗体分子当り平均して1個のPDP基に複合体化して修飾される。次に、メトトレキセートを、実施例19でリシンについで記載されたように、これらの修飾抗体に複合体化される。
【0135】
10人の膵臓癌患者の2つの群が処置される。第一群は、週を基礎として、PBS中薬剤-PDP-MAbの静脈内注射を20μg/全体重kgで、慣用されている療法と組合せて受ける。第二群は、コントロールとして、PBSの注射を慣用されている療法と組合せて受ける。10週間後、生存患者の免疫シントグラフィを行なう。
【0136】
免疫シントグラフィによると、第一群の患者で画像化された腫瘍の平均サイズが、コントロール群と比較すると減少する。
【0137】
従って、上記の実施例は、ヒトでの免疫療法における修飾抗体の利用性を示す。
【0138】
上述のように、本発明の1つの好ましい形態では、修飾抗体が薬学的組成物に配合される。従って、免疫療法のために薬剤と複合体化されるPDP-修飾抗体は、本発明の修飾抗体-毒素複合体の細胞障害的有効量を有する注射可能な組成物に組込まれても良い。下記は、ヒトのB細胞リンパ腫に対して効果的な細胞障害的に有効な組成物の例である。
【0139】
実施例26
ヒトのB細胞リンパ腫に対して効果的な薬学的組成物
実施例18からの修飾された放射性標識Lym-1 10 mg/mL
バランス リン酸緩衝食塩水(0.9%)
さらに、放射性標識された修飾MAb'sが、免疫シントグラフィにおいて、それらの特異的抗原を視覚化するのに有効な組成物に配合されても良い。下記は、そのような組成物の1例である。
【0140】
実施例27
結腸癌の免疫シントグラフィに効果的な薬学的組成物
実施例15からの修飾された放射性標識B72.3 10 mg/mL
バランス リン酸緩衝食塩水(0.9%)
実施例23は、放射性標識されたビオチン化抗体を局在化する1つの方法を例示するけれども、当業者は、標識抗体を局在化する代替される方法も適用されることを認識する。例えば、放射性標識されたビオチン化抗体の分布は、実施例14に記載されるように、正確に免疫シントグラフィで画像化して局在化され得る。従って、例えば、腫瘍抗原に関する結合特異性を有する放射ヨウ素化されたビオチン化MAbは、診断手順に有用であるであろう。下記の実施例は、そのような画像化手順がどのように為され得るかを記載する。
【0141】
実施例28は、放射性標識されたビオチン化MAb'sが、インビボで腫瘍細胞を画像化する1つの方法を記載する。
【0142】
実施例28
メラノーマ腫瘍細胞の画像化
転移性メラノーマと診断されたヒト患者を、まず同定する。免疫組織学的分析は、患者のメラノーマが、抗メラノーマMAbで染色可能な細胞表而抗原を発現することを示す。抗メラノーマMAbは、実施例19の方法により遊離アミノ基のビオチン化で最初に化学的修飾され、実施例20の方法により131Iで放射ヨウ素化される。次に、実質的に純粋な放射性標識されたビオチン化抗メラノーマMAbが、薬学的に許容される賦形剤と組合され、患者に投与される。3日後、注射された修飾MAb'sは、メラノーマ抗原を発現する細胞に実質的に局在化される。続いて、局在化されたMAb'sは、ピンホール・コリメーターおよびレイゼオンから得られるスペクトル91ガンマカメラを用いて、免疫シントグラフィによる画像化により視覚化される。写真による記録は、患者の皮膚上の放射能の小領域を示し、よって二次的腫瘍を同定する。
【0143】
特定の機械的または化学的なバリエーションが、それら自身を、当業者に提案し得ることが認識される。上記の実施例および詳細な説明は、例示によって与えられるものとして明確に理解され、本発明の精神および範囲は添付の請求の範囲によってのみ限定される。
【技術分野】
【0001】
本発明は、一般に、修飾された抗体の分野に関する。より詳細には、本発明は、増大した結合特異性、改善した薬物動態および局在化能力を有する、化学的に修飾された抗体に関する。これらの修飾された抗体は、癌および他の哺乳動物の疾患の診断および治療に特に有効である。
【背景技術】
【0002】
抗体、特にモノクローナル抗体("MAb's")の使用は、癌の診断および処置に極めて有用なアプローチとなる可能性を有する。MAb'sの重要な特性は、単一抗原に対するその特異性である。
【0003】
腫瘍細胞抗原に特異的なMAb'sが産生されてきた。また、MAb'sが放射性核種のような添加剤と効果的にカップリングし得ることも示されてきた。そのような放射性標識されたMAb'sは、g-カメラ画像または放射性免疫画像としても知られる免疫シントグラフィ(immunoscintography)からの腫瘍画像のような臨床データを提供するのに有効である。免疫シントグラフィでは、MAb'sは、MAb'sに認識される抗原を有する特定の組織または腫瘍タイプに結合させられる。放射性核種は、次に、ゲルマニウムカメラの使用のような適切な技術を用いて視覚化される。腫瘍および他のタイプの組織の免疫シントグラフィでのそれらの適用を可能にするのは、MAb'sのユニークな特異性である。
【0004】
しかしながら、免疫シントグラフィでのMAb'sの使用は、高いバックグラウンドレベルおよびMAb'sのその抗原に対する低い結合能力のために、制限されてきた。実験的研究は、放射性標識されたMAb'sの生体分布が、抗体の特異性およびクリアランス時間を含む多くの要因に依存していることを示唆する。免疫シントグラフィによる腫瘍の効果的な診断のために、腫瘍細胞表面で密であり均一である抗原に結合する抗体が選択されるべきである。免疫シントグラフィによる腫瘍の効果的診断はまた、選ばれた抗体が腫瘍抗原に効果的に結合することを要求する。しかしながら、適切な抗原に結合するMAb'sはしばしば、要求された高い結合親和性を提供しない。さらに、他のMAb'sと比較して高い親和性を有して結合するMAb'sを使用しても、高レベルの非特異的結合をそれでも生じ、免疫シントグラフィで使用されるとき高いバックグラウンドを生じる。従って、診断的ツールとして免疫シントグラフィを改善するには、MAb'sの結合の有効性を改善する方法が必要である。
【0005】
さらに、MAb'sの細胞障害性効果は、放射性核種、薬剤または毒素にカップリングすることによって顕著に増大され得る。MAb'sのユニークな特異性は、免疫療法の進歩に対して期待を膨らませた。免疫療法では、生物学的に活性な物質は、腫瘍細胞のような特定の望ましくない細胞タイプにMAb'sを使用して運搬され、被験体の他の細胞に影響を及ぼすことなく、望ましくない細胞タイプに影響を与える。しかしながら、免疫療法は、健康な組織に影響するのを避けるために、極めて高い特異性の抗体を要求する。従って、MAb'sの特異性を増大させる方法は、安全で効果的な免疫療法の目的を達成するのに、非常に有利となるであろう。
【0006】
多くのMAb'sは、被験体に導入された後、数日間、循環中に維持される。これは、少なくとも2つの理由から、望ましくない。第1の理由は、循環MAb'sが、免疫シントグラフィで高いバックグラウンドレベルを生じることである。第2の理由は、放射性核種または他の潜在的に細胞障害性物質にカップリングした循環MAb'sが、時間長期暴露後の被験体で望ましくない副作用を生じるかもしれないことである。従って、MAb'sのクリアランス時間を減少させる方法が必要である。無論、減少が大きすぎると、MAb'sの任意の有効な使用が為される前に、MAb'sが除去されることになるであろう。従って、腫瘍または他の標的組織へのMAb'sの取込みに実質的に影響することなしに、MAb'sのクリアランス時間を減少させる方法が特に必要である。
【0007】
抗体の特異性およびクリアランス時間の両方を決定するのに決定的である1つのファクターは、抗体の形態である。本明細書で使用されるとき、「完全な(intact)」抗体分子は、2本の重鎖および2本の軽鎖を含む修飾されない抗体分子を指す。完全な全体の抗体分子は、図1の化学式の反応体側に見られる。図1に見られるように、完全な分子は、FcおよびFabドメインに分割される。Fabフラグメントの二価の形態である、F(ab')2は、プロテアーゼによるFcドメインの消化により産生される。
【0008】
2本の重鎖(図1で"H"で示される)は、1以上のジスルフィド架橋でつながれている。完全な分子では、これらのジスルフィド架橋は、通常は還元剤から保護される。しかしながら、Fcドメインの除去は、ジスルフィド架橋の迅速な還元を可能にすることが見い出された。従って、一価の形態である、F(ab')は、穏やかな還元剤の作用によりF(ab')2から産生され得る。その開示が本明細書に参考として援用されているパーハム,ピー.(Parham,P.) 0n the Fragmentation of Monoclonal IgG1, IgG2a and IgG2b from BALB/c Mice, J. Immunol. 131: 2895(1983)は、F(ab')およびF(ab')2の産生方法を記載している。この方法で生起すると考えられる変化の図式的説明は、図1の化学式に示される。
【0009】
Fcは、抗体分子の非特異的結合の多くに関連があると見い出されてきた。該フラグメントの分子量は糸球体濾過に関する閾値より低いので、フラグメントの迅速な除去が可能になることも考えられている。従って、放射性画像化で使用するために抗体のクリアランス時間を増加する1つのアプローチは、完全な抗体を、Fabおよびその二価形態であるF(ab')2のような様々なフラグメントに分解することであった。予想されたように、これらのフラグメントは、身体から非常に迅速に排除される(cleared)ので、それらの有用性は減少される。さらに、これらのフラグメントは、完全な抗体と比較して、腫瘍または他の標的組織による取込みの減少をもたらすかもしれない。従って、免疫シントグラフィでのこれらのフラグメントの使用は、完全なMAb'sを使用するよりもバックグラウンド比率に対するより優れたクリアランスとより高い標的組織を提供するが、MAb'sが結合する抗原を含む標的組織中のMAb'sの絶対濃度は、完全なMAb'sを使用する方がフラグメントのいずれかを使用するよりも3倍以上であることが見い出された。さらに、フラグメントの両タイプとも、血流から非常に速く除去される。従って、これらのフラグメントを用いる、診断的または治療的技術での有効時間は非常に短い。
【0010】
ヘテロ二官能性(heterobifunctional)試薬は、異なる反応に参加し得る2つの基を有する試薬である。例えば、スクシニミジル3-(2-ピリジルジチオ)プロピオナート(SPDP)は、ヘテロ二官能性であり、即ち、そのN-ヒドロキシスクシンイミドエステル基はアミノ基と反応し、2-ピリジルジスルフィド構造は脂肪族チオールと反応する。
【0011】
オーランジ(0rlandi)ら、Change in Binding Reactivity of an Anti-Tumor Monoclonal Antibody After the Introduction of 2-Pyridyl Disulphide Groups, Hybridoma 5:1-8 (1986)は、ヒト卵巣癌に対するMAb'sのインビトロ結合の増加が、ヘテロ二官能性試薬SPDPと化学的に複合した後に得られ得ることを報告した。
【0012】
オーランジらに使用された複合体化MAb'sは、分子当り平均して11のPDP基を有した。オーランジらは、修飾されたMAb'sが、それらの結合活性をインビトロで、非修飾MAb'sにより検出されない分子が検出できる程度まで増加することを見い出した。これらの研究者は、複合体化されたMAb'sのインビボでの使用についての研究は報告しなかった。さらに、これらの研究者は、非常に少ない数の抗原性部位を有する分子が複合体化MAb'sにより検出されると考えた。従って、PDP修飾されたMAb'sは、非修飾の同等物に比較して、標的細胞特異性を大きく減少させた。
【先行技術文献】
【非特許文献】
【0013】
【非特許文献1】Parham, P., 0n the Fragmentation of Monoclonal IgG1, IgG2a and IgG2b from BALB/c Mice, J. Immunol. 131: 2895(1983)
【非特許文献2】Orlandi et al., Change in Binding Reactivity of an Anti-Tumor Monoclonal Antibody After the Introduction of 2-Pyridyl Disulphide Groups, Hybridoma 5:1-8 (1986)
【発明の概要】
【発明が解決しようとする課題】
【0014】
従って、上記の進歩にもかかわらず、腫瘍抗原に対するより大きな特異的活性を発揮し、抗体のより高い絶対濃度を腫瘍に蓄積させ、さらに、治療的または診断的有効性を減少させるほどには迅速でないが比較的に迅速な血液プールからのクリアランス時間を有する、修飾された抗体フラグメントの必要性が維持されている。
【課題を解決するための手段】
【0015】
本発明の1つの局面は、修飾された抗体を産生するために、抗体上に配置される複数の遊離アミノ基の少なくとも1つで、化学的試薬と複合体化された抗体に関する。抗体は、完全な抗体と比較すると減少した正味の(net)正電荷を有する。抗体はまた、F(ab')2フラグメントと、同じタイプとの完全な抗体のクリアランス速度との間の、インビボ・クリアランス速度を有する。本発明のこの局面での抗体では、化学的試薬は、ヘテロ二官能性剤ではない。抗体は、それに結合した化学的部分(chemical moiety)も有する。抗体は、モノクローナル抗体またはポリクローナル抗体であり得る。化学的試薬は、ビオチンN2S2またはN2S4のようなメチルキレート、EDTA、DPTAまたはTETAのような他のキレート化剤、或いはFITCのような染料であり得る。化学的部分は、しばしば放射性核種のような標識である。放射性核種は、テクニシウム(Technicium)または125Iまたは131Iのようなハロゲン放射性核種であり得る。特定の実施態様では、標識は磁気共鳴画像で検出される。化学的部分は、毒素、薬剤およびキレートのような生物学的に活性な分子であり得る。好適な薬剤は、メトトレキセート、5-フルオロ-ウラシル、シスプラチン(cis-platinum)およびアドリアマイシンを含む。好適な毒素は、リシンA鎖である。
【0016】
本発明の他の局面は、免疫シントグラフィのための薬学的組成物である。該組成物は、抗体が完全な抗体と比較して減少した正味の正電荷を有するように、標識抗体上に配置された遊離アミノ基で化学的試薬と複合体化した標識抗体、免疫シントグラフィに許容される薬学的な賦形剤、担体または基剤を含む。
【0017】
本発明のさらに他の局面は、増大した抗原結合特異性、減少した非特異的結合および減少したインビボでのクリアランス時間を有する、標識された修飾抗体を調製する方法である。該方法は下記の工程を含む:検出されるべき抗原に対する結合特異性を有する完全な抗体を得ること、天然の抗体はその上に配置された複数の遊離アミノ基を有する、遊離アミノ基の少なくとも1つを化学的物質と反応させて修飾抗体を作製し、修飾抗体が完全な抗体の等電点よりも低い等電点を有するようにすること、および修飾抗体を検出可能な標識で標識すること。該方法は、標識された修飾抗体を産生する。この方法の標識は、ガンマカメラのような免疫シントグラフィによって検出され得る。
【0018】
本発明の更に他の局面は、哺乳動物で抗原を局在化する方法である。この方法は、局在化されるべき抗原に関する結合特異性を有する標識された修飾抗体を得ることを含む。標識された修飾抗体は、同じタイプの非修飾抗体と比較して、より少ない遊離アミノ基および低い等電点を有し、その中に組込まれた検出可能な標識を有する。標識された修飾抗体は、哺乳動物に投与される。この方法は、抗原および標識された修飾抗体をインビボで結合可能にする。抗原に結合した標識された修飾抗体は検出され、よって抗原を局在化する。抗体は、遊離アミノ基で化学的に修飾された完全な抗体であり得る。そのような完全な抗体は、ヘテロ二官能性試薬で化学的に複合体化されるか又はビオチンで化学的に複合体化され得る。
【0019】
本発明のさらなる局面は、哺乳動物の疾患状態を処置する方法に関する。この方法は、哺乳動物の疾患組織に特異的な完全な抗体を得ることを包含する。完全な抗体は、その上に複数の遊離アミノ基を配置している。該方法はまた、修飾抗体を産生するために、ヘテロ二官能性試薬以外の化学的試薬で複合体化することにより遊離アミノ基の少なくとも1つを修飾することを包含する。修飾抗体は、完全な抗体と比較して減少した等電点を有する。生物学的に活性な分子は、化学的試薬の部位以外の、修飾抗体上に配置された第一の付着部位に付着される。次に、抗体は、哺乳動物に投与され、それにより疾患状態を処置する。
【図面の簡単な説明】
【0020】
【図1】図1は、F(ab')およびF(ab')2フラグメントを産生する方法で起こると考えられる変化の図式的説明を示す。
【図2】図2は、無胸腺ヌードマウスでの、放射性標識MAb'sLym-1の異なる調製物の全身の保有を示す。
【図3】図3は、注射から7日後のヒトリンパ腫を担持するヌードマウスでの生体分布を、MAb's Lym-1および修飾されたLym-1の注射用量/グラムの%として示す。
【図4】図4は、注射から7日後のヒトリンパ腫を担持するヌードマウスでの生体分布を、MAb'sLym-1および修飾されたLym-1の腫瘍/臓器比として示す。
【図5】図5は、注射から5日後のヒトリンパ腫を担持するヌードマウスでの生体分布を、MAb's Lym-1 F(ab')2および修飾されたLym-1の注射用量/グラムの%として示す。
【図6】図6は、注射から5日後のヒトリンパ腫を担持するヌードマウスでの生体分布を、MAb's Lym-1 F(ab')2および修飾されたLym-1腫瘍/臓器比として示す。
【図7】図7は、I-131標識した完全なLym-1注射から7日目に得られた画像を示す。
【図8】図8は、I-131標識した修飾したLym-1注射から7日目に得られた画像を示す。
【図9】図9は、I-131標識した修飾したLym-1注射から7日目に得られた画像を示す。
【図10】図10は、I-131標識した修飾したLym-1注射から5日目に得られた画像を示す。
【図11】図11は、無胸腺ヌードマウスでの、放射性標識モノクローナル抗体B72.3の異なる調製物の全身の保有を示す。
【図12】図12は、注射から4日後のLS174T結腸癌担持ヌードマウスでの生体分布を、MAb'sB72.3および修飾B72.3の注射用量/グラムの%として示す。
【図13】図13は、注射から4日後のLS174T結腸癌担持ヌードマウスでの生体分布を、MAb'sB72.3および修飾B72.3の腫瘍/臓器比として示す。
【図14】図14は、I-131標識した修飾したB72.3の注射から1日後に得られた画像を示す。
【図15】図15は、I-131標識した修飾したB72.3の注射から4日後に得られた画像を示す。
【図16】図16は、無胸腺ヌードマウスでの、放射性標識MAb's TNT-1の異なる調製物の全身の保有を示す。
【図17A】図17A−Dは、一連の棒グラフを示す。図17Aは、注射された完全なTNT-1並びにビオチン化TNT-1の腫瘍および様々な組織に局在するパーセンテージを示す。
【図17B】図17Bは、腫瘍および様々な臓器に局在化する標識抗体の比率を示す。
【図17C】図17Cは、注射された完全なTNT-1並びにビオチン化TNT-1の腫瘍および様々な組織に局在するパーセンテージを示す。
【図17D】図17Dは、腫瘍および様々な臓器に局在化する標識抗体の比率を示す。
【図18】図18は、Ba1b/cマウスでの、完全なTNT-1、修飾TNT-1およびF(ab')2フラグメントの全身クリアランスを表示する線グラフを示す。
【図19】図19は、Ba1b/cマウスでの、完全なLym-1、修飾Lym-1およびF(ab')2フラグメントの全身クリアランスを表示する線グラフを示す。
【発明を実施するための形態】
【0021】
我々は、MAb's、ヒト抗体、遺伝子工学的に作製された抗体、キメラ抗体、合成抗体およびポリクローナル抗体を含む抗体の、遊離アミノ基を修飾する試薬を用いた複合体による化学的修飾が、抗原結合特異性を増加し、非特異的結合を減少し、インビボでのクリアランス時間を減少できることを発見した。そのように修飾された抗体は、完全な抗体と比較すると、減少した正味の正電荷を有する。本発明に従い、我々が遊離アミノ基を修飾するのに使用した試薬の例は、SPDPのようなヘテロ二官能性試薬またはビオチン化試薬を含む。しかしながら、当業者は、広範囲の化学的試薬が遊離アミノ基を修飾するのに使用され、それにより抗体の全体的な等電点を減少させ得ることを認識する。従って、例えば、N2S2またはN2S4のようなメチルキレート、EDTA、DPTAまたはTETAのような他のキレート化剤、およびFITCのような多くの染料が全て、本発明に従い効果的な結果を達成するのに使用できる。Nuc1. Med. Biol., 18:179-185(1991)には、N2S4の抗体への結合の説明が、本発明に従い、本明細書中に記載される以外の目的で記載されている。この文献は、本明細書中に参考として援用されている。
【0022】
遊離アミノ基に対する化学的修飾は、驚くべきことに、抗体が結合する抗原を含む標的細胞での、修飾抗体の増強された蓄積をもたらす。スルホスクシニミジル2(p-アジドサリチルアミド)エチル1-1,3'-ジチオプロピオナート(SASD)、スルホスクシニミジル2-(m-アジド-o-ニトロベンズアミド)-エチル-1,3'-ジチオプロピオナート(SAND)、スルホスクシニミジル(4-アジドフェニル-ジチオ)プロピオナート(スルホ-SADP)および2-アミノチオラン・HCl(Traut's試薬)を含む、SPDP以外のヘテロ二官能性試薬は、本発明に従い抗体と複合体化されるとき、同様の結果をもたらすと考えられる。
【0023】
本発明の修飾抗体は、他の化学的部分に好都合に連結して、特定の診断的または治療的利益をもたらすことができる。例えば、放射性核種または酵素のような様々な周知の標識のいずれも付着され得る。抗腫瘍性化合物または毒素のような治療的部分も付着され得る。
【0024】
ヘテロ二官能性剤およびビオチンは以前、標識および他の部分を抗体に付着させるリンカーとして使用されていた。ビオチン自身は、特定の環境で標識として機能できる。しかしながら、ビオチンもヘテロ二官能性剤も、増強された結合特異性、減少した非特異的結合および減少したインビボ・クリアランス時間を達成するために、抗体を修飾する目的では使用されなかった。従って、本発明とは違い、以前の抗体は、ヘテロ二官能性剤またはビオチンのような修飾化剤をその第一部位に付着させ、および付着標識または他の化学的部分をその第二部位に付着させてはいなかった。本発明では、第二付着部位は一般に、第一付着部位に付着した修飾化剤と同じタイプの付着した修飾化剤を有しない。
【0025】
修飾抗体の蓄積増強は、増強された特異的結合能力によると考えられる。我々は、抗体分子当り平均して1個のみのPDP基を複合体化することにより、非修飾抗体に比較して、その標的細胞に対する分子の特異性の劇的な増大が起こることを見出した。同様の結果が、ビオチン化抗体を用いて得られた。
【0026】
我々はまた、ヘテロ二官能性試薬またはビオチンによる複合体化によりIgG上の遊離アミノ基の化学修飾が、有利なことに、正常の組織からのクリアランスを増強することを発見した。この効果について、いかなる特別の説明と結合することも望まないが、そのような修飾が、糸球体濾過に対する閾値以下の分子量を有する形態に抗体を断片化させ、この結果、フラグメントの迅速な除去が可能になると考えられる。抗体の一価形態への、抗体の断片化が起こることさえも可能である。得られるフラグメントの正確な形態が何であろうと、これらのフラグメントの除去は、有利なことに、修飾抗体の診断的または治療的有効性を縮小するほどには迅速ではない。
【0027】
前記で開示されたように、本発明の実施に有用な修飾抗体は、遊離アミノ基で化学的に修飾され、さらに検出可能な標識で標識されている。重要なこととして、抗体自身または遊離アミノ基を修飾するのに使用される化学的試薬のいずれかが標識されると、我々は、修飾抗体の遊離アミノ基以外の部位での標識が、本発明の実施に有用な抗体を提供できることも示した。さらに、試薬がヘテロ二官能性試薬であるときは、抗体の遊離アミノ基での化学的修飾の前または後であっても標識が抗体に化学的に複合体化されるとき、その標識は、遊離アミノ基以外の部位で、およびアミノ基修飾試薬の部位以外の部位で、抗体に付着され得る。特に本明細書に開示されるように、抗体タンパク質に存在するチロシン残基は、放射性ヨウ素化により修飾できる。しかしながら、抗体のチロシン残基に付着できる検出可能な標識は、ヨウ素に限定されない。抗体のチロシン残基に付着できる他の標識は、F、C1、Br、Iおよびその他のようなハロゲン放射性核種を含む。そのようなハロゲン放射性核種の抗体への付着は、ウィルバー(Wilbur)、Bioconj. Chem., 3:433-470(1992)に記載され、その開示は本明細書中に参考として援用されている。テクニシウム放射性核種は、抗体分子上で他の残基に結合する。さらに、抗体タンパク質を標識する他の標識および方法は、当業者に容易に明らかであるように、本発明の実施に有用である。当業者は、抗体タンパク質のアミノ酸側鎖上の官能基(functional groups)が、標識付着部位として役割を果たし得ることを認識する。標識、結合部位並びに標識および抗体を複合体化する方法の選択は、当業者に認識される。本発明の操作性に関する重要な規定は、修飾抗体が標識を付着することである。
【0028】
一般に、我々は、非修飾抗体に比較して減少した等電点(pIs)を有するように化学的に修飾された抗体が、改善された標的特異性を発揮することを発見した。より詳細には、我々の結果は、抗体上の遊離アミノ基の化学的修飾が、この改善された標的特異性を付与できることを実証した。これらの化学的修飾は、上述のようなヘテロ二官能性剤およびビオチンのような物質による修飾を含み得るが、それらに限定されない。実際、抗体のpIを効果的に減少させる抗体上に存在する遊離アミノ基のあらゆる化学的修飾が、改善された標的特異性を提供する。
【0029】
この改善の根源を説明するのに、いかなる特定の理論に限定されることも望まないが、我々は非特異的抗体結合が非特異的静電気的相互作用に、部分的に起因すると仮定している。これは、MAb'sが生理学的pHで正に荷電しているが、哺乳動物細胞は負に荷電しているという観察に照らして合理的である(アイヒマン(Eichmann)ら、J.Exp. Med. 131:207(1970):シルバ ヒルホ(Silva Filho)ら、J. Leukocyte Biol. 41:143(1987))。従って、完全な抗体の正電荷特性の変化が、負に荷電した組織と正に荷電した抗体タンパク質との相互作用により、非特異的結合を効果的に減少させる。これら非特異的相互作用を最少化することにより、抗体の抗原結合ドメインに起因する抗体特異性は、主として結合特異性を決定するのに関連する。従って、抗体のpIが非修飾抗体と比較して減少するように修飾された、複数のアミノシド部分(aminoside moiety)を有するあらゆる抗体は、非同族抗原との非特異的相互作用を減少した故に、改善された標的特異性を発揮する。しかしながら、我々はまた、本発明により修飾された抗体の第二の特徴がそれらを、インビボでの抗原局在化に特に有用にさせることを発見した。
【0030】
シグナル対ノイズ比を改善でき、抗体に基づく抗原画像化手順における「腫瘍/臓器比」として表され得る2つの要素は、(1)増大した腫瘍局在性、および(2)減少したレベルの非特異的結合した標識抗体である。我々は、現在、非修飾の完全なMAbと比較して減少した等電点を有するように化学的に修飾されたMAb'sが、非修飾抗体と比較して非特異的結合を減少させ全身クリアランス時間を減少させながら、結合特異性を有利に増大し得ることを発見した。
【0031】
我々はさらに、増大した抗体特異性および局在化能力が、その上に検出可能な標識が配置されている化学的に修飾された抗体を用いて達成できることを発見した。そのような標識は、例えば、放射性核種であり得る。より詳細には、我々は現在、ビオチン部分を含むよう修飾された抗体が抗原結合に関する実質的に改善された能力を発揮することを発見した。以下で開示されるように、標識されたビオチン化抗体は、インビボで腫瘍細胞を局在化する方法で使用された。本発明の実施では、化学的修飾抗体が直接的に標識されることが必須である。これは、その開示が本明細書中に参考として援用されているクワーリ(Khawli)ら、Antibody, Immunoconjugates, and Radiopharmaceuticals, 6:13(1993)に記載される、間接的に標識された抗体を用いる方法と対照的である。
【0032】
従って、改善された腫瘍局在化のための手順に有用な試薬は、所望の標的抗原に関する結合特異性を有する抗体を得、抗体上の遊離アミノ基をヘテロ二官能性試薬またはビオチンのような試薬を用いて化学的に修飾し、および続いて、放射性核種のような検出可能な標識で抗体を標識することによって作製できる。実際には、化学的修飾工程と放射性標識工程の順序は任意である。さらに、実質的に精製された抗体を放射性標識する工程は、もしその手順で使用される抗体がMAb'sである場合、およびもしそれらのMAb'sを産生するハイブリドーマが、ハイブリドーマのMAb産物に取込まれる標識化前駆体を含む増殖培地で増殖される場合には、除外され得る。従って、例えば、本発明に関連して有用な放射性標識化されビオチン化されたMAb'sは、放射性標識したアミノ酸を含む増殖培地でMAb産生細胞系を増殖させ、放射性標識MAb'sを集め、放射性標識MAb'sをビオチン化することによって産生され得る。ビオチン化工程の前または後であろうと、抗体を標識する他の方法は、当業者に明らかである。
【0033】
本明細書に記載される方法は、上記のクワーリ(Khawli)ら、Antibody, Immunoconjugates, and Radiopharmaceuticalsに開示されるものと関連して、有利なことに、インビボで腫瘍細胞抗原を画像化するのにより少ない工程を必要とし、ビオチン基を欠く標識抗体を単に用いるよりも予想外に優れた結果をもたらす。従って、我々は本明細書で、非ビオチン化抗体と比較したときビオチン化抗体が、改善された標的化を発揮することを開示する。本発明に関連して有用な抗体が抗体上に保持される(carried)標識により検出され得るので、標識抗体上のビオチン基の存在は標識化および検出に関して明らかな利点を提供する。従って、本発明に関連して有用な抗体の必須の特徴は、抗体が、(1)修飾抗体のpIが非修飾抗体と比較して減少されるように化学的に修飾されたアミノシド部分を有し、および(2)検出手段によって検出され得る標識を保持(harbor)していることである。
【0034】
本発明の修飾抗体は、有利なことに、F(ab')またはF(ab')2のような抗体のフラグメントと比較して、驚くべきほど増強された診断的および治療的有用性を有する。
【実施例】
【0035】
下記の実施例は、平均して1個のPDP基をモノクローナル抗体に導入する明示的な方法を示す。
【0036】
実施例1
Lym−1のSPDPによる修飾
下記の実施例は、平均して1個のPDP基をモノクローナル抗体に導入する明示的な方法を示す。B細胞リンパ腫に対するモノクローナル抗体であるLym-1(IgG2a)を、その開示が本明細書中に参考として援用されているエプシュタイン,エー.エル.(Epstein,A.L.)ら、Two New Monoclonal antibodies,Lym-1 and Lym-2, Reative with Human B-Lymphocytes and Derived Tumors, with immunodiagnostic and Immunoreactive Potential, Cancer Res.47: 830-840(1987)のようにして得た。Lym-1 MAb'sは、その開示が本明細書中に参考として援用されているカールソン,ジェイ.(Carlson,J.)ら、Protein Thiolation and Reversible Protein-Protein Conjugation: N-succinimidyl 3-(2-pyridyldithio)propionate, A New Heterobifunctional Reagent, Biochem. J. 173: 723-737(1978)のように、抗体上の遊離アミノ基と反応するヘテロ二官能性試薬であるSPDPを用いて機能性化された。PBS、pH 7.2中に1 mLのLym-1(10 mg/mL)を含む5 mL試験管に、20μLの1 mLエタノール中3 mg SPDPおよび40μL N,N-ジメチルホルムアミドを加えた。この混合物を、オービタルシェイカー装置を通常速度で用いて、連続的に混合しながら、室温で15分間インキュベートした。インキュベーション後、機能性化されたLym-1溶液を、PBSで平衡化したPD-10カラムを通過させて精製した。
【0037】
SPDPによるLym-1の機能性化の程度は、その開示が本明細書中に参考として援用されているグラセッティ,ディー.アール.(Grassetti,D.R.)およびマレー,ジェイ.エフ.(Murray,J.F.) Determination of Sulfhydryl Groups with 2,2'-or 4,4'-dithiodipyridine, Arch. Biochem. Biophys. 119: 41-49(1967)のように、Lym-1溶液のアリコートをリン酸緩衝食塩水(PBS)、pH 7.2中過剰モルの7 mgジチオエリスリトールで還元した後、ピリジン-2-チオンの放出を343 nmで測定して、分子当り平均して1個のPDP基であることを決定した。
【0038】
実施例1からの修飾抗体は、タンパク質高速液体クロマトグラフィー(FPLC)により分析して、抗体が実質的に完全である(intact)ことを示した。この分析を、実施例2で示す。
【0039】
実施例2
修飾Lym−1のタンパク質高速液体クロマトグラフィー(FPLC)による分析
下記の実施例は、平均して1個のPDP基をモノクローナル抗体に導入する明示的な方法を示す。実施例1からの修飾抗体の分析は、280 nmにセットされた固定波長UV分光光度計を備えたタンパク質高速液体クロマトグラフィー(FPLC)で行った。サイズ排除クロマトグラフィーは、溶媒システムとしてPBS pH 7.2を用いてスペロース-12カラム(ファルマシア(Pharmacia))上で、流速1 mL/分で溶出して行った。修飾Lym-1は、690秒の保有時間で、非標識の完全なLym-1の保有時間と同一であると見えた。
【0040】
従って、実施例2は、SPDP-修飾された抗体が、FPLCにおいて非修飾抗体と実質的に同一に挙動したことを示す。このデータは、修飾が、インビトロで完全な分子の分解を同様には導かなかったことを示す。
【0041】
修飾MAb'sをインビボ試験でさらに研究するために、修飾MAb'sの放射性標識を行った。放射性標識を、実施例3で示す。
【0042】
実施例3
修飾Lym−1の直接的放射性ヨウ素化
PDPで修飾されたLym-1および完全なLym-1の1バッチを125Iで、他のバッチを131Iで、その開示が本明細書中に参考として援用されているミルズ,エス.エル.(Mills,S.L.)ら、125I Radiolabelling of Monoclonal antibodies for In Vivo Procedures, Hybridoma 5: 265-275(1986)の改変クロラミンT法を用いてヨウ素化した。簡単に述べると、100μL PBS中に100μgのモノクローナル抗体を含む5 mL試験管に、バッチに依存して125Iまたは131Iの適切なヨウ素アイソトープ、および10μLの43 mMクロラミンT水溶液を加えた。20μLの120 mMメタ重亜硫酸ナトリウム溶液を用いて、3分後に反応をしずめた。放射性標識抗体を、セファデックスG-25カラムを用いて精製した。このカラムは、端を綿で栓したプラスチック製血清ピペット(8 mm×200 mm)からなっていた(Vo=4.5 mL)Vt=12 mL)。それぞれの反応混合物を、カラムにロードし、PBS、pH 7.2で溶出した。1 mLアリコートを含むそれぞれの試験管をカウントし、放射性標識抗体を試験管6に85-90%収率で回収した。これらの放射性標識抗体を、冷蔵庫に貯蔵し、標識から4時間以内にマウスに投与した。
【0043】
実施例3からの放射性標識したMAb'sを、即時薄層クロマトグラフィー(ITLC)に供して、標識MAb'sの純度を測定した。この分析は、実施例4で示す。
【0044】
実施例4
放射性標識した修飾Lym−1の即時薄層クロマトグラフィー(ITLC)による分析
実施例3のクロラミンT法により131Iで放射性標識した修飾Lym-1および125Iで放射性標識した修飾Lym-1を、シリカゲルを含浸したグラスファイバーからなる分析用ITLCを用いて分析した。使用する前にストリップ(2×20 cm)を、110-1/2℃で15分間加熱して活性化し;サンプル1μLでスポットし;風乾してMeOH/H2O(80:20)で約12 cm溶出し.;再び風乾し、半分に切断しカウントして、タンパク質結合および非タンパク質結合放射能を測定した。放射性標識Lym-1抗体の両形態とも、Rf値が0を有し、放射性化学的純度≧99%を示した。実施例3と同じように標識した完全なLym-1の分析をすると、同じ純度を明示した。
【0045】
従って、実施例4は、高純度の放射性標識抗体を得ることができたことを示す。これらの放射性標識MAb'sの免疫反応性は、Raji細胞に結合するそれらの能力によりテストされた。この分析を、実施例5で示す。
【0046】
実施例5
放射性標識した修飾Lym−1の免疫反応性評価による分析
放射性標識した修飾Lym-1および完全なLym-1のインビトロでの免疫反応性を、上記エプシュタイン,エー.エル.らの方法により、106個のRaji細胞/試験管の慣用されている生アッセイにより評価した。簡単に述べると、PBS中1%ウシ血清アルブミンの100μLに再懸濁させたRaji細胞を、三重セットの試験管にピペットで加えた。100μLの標識Lym-1を、それぞれの試験管(100,100 cpm/試験管)に加え、オービタルシェイカーを用いて連続的に混合しながら、30分間室温でインキュベートした。インキュベーション後、1000 rpmで5分間試験管をスピンし、上清をデカントし、200μL PBSに細胞を再懸濁することによって、細胞をPBS中1%ウシ血清で3回洗浄した。洗浄が完了した後、ガンマカウンターを用いて、細胞に結合した放射能を測定することにより、結合したLym-1を検出した。結果は、修飾Lym-1の結合活性が87%であるが、標準コントロールとしての役割を果たす完全なLym-1が80%の結合活性を有することを示した。
【0047】
従って、実施例5は、修飾Lym-1が非修飾Lym-1よりも、インビトロでより免疫活性であったことを示す。修飾抗体のインビボでの活性の安定性の予備的評価を得るために、実施例6に示されるように、修飾MAb'sを血清中でのそれらの安定性について分析した。
【0048】
実施例6
放射性標識した修飾lym−1の血清安定性の分析
修飾Lym-1およびI-125で直接的に標識された完全なLym-1のモノクローナル抗体を、新鮮なマウス血清の3重セットの幾つかのそれぞれに、最終濃度100μg/mLまで加えた。試験管を、空気中5%CO2に維持された湿潤インキュベーター中で、37-1/2℃でインキュベートした。0日と8日の間の時点で、900μLの100%トリクロロ酢酸(TCA)を100μLのアリコートに添加することによって、タンパク質結合活性を測定した。室温で5分間インキュベーション後、タンパク質沈降物を遠心分離により分離し、500μLの上清を各試験管から取り出し、ガンマカウンターで放射能をカウントした。データは、コントロール試験管のものを差し引いた、沈降した平均カウントパーセンテージとして表わされた。結果は、インキュベーション後の各時点で、修飾125I-Lym-1が、標準コントロールとしての役割を果たす125Iで標識した完全なLym-1と同じほど安定であることを示した。結果はさらに、8日間37-1/2℃でインキュベーションした後に、修飾Lym-1に存在する活性の≧92%がTCA沈降されることを示した。
【0049】
従って、実施例6は、修飾抗体の活性の安定性が血清中で少なくとも8日間維持されることを示した。血清中でインキュベーション後に修飾Lym-1が完全に維持されるかどうか評価するために、インキュベーション後の修飾Lym-1のHPLC分析が、実施例7に示されるように行われた。
【0050】
実施例7
修飾Lym−1のHPLCによる分析
HPLC分析を、サイズ排除カラム(SW 300)を備えたウォーターズ・システム(Waters system)上で、溶出溶媒として0.1M中性リン酸緩衝液および流速1 mL/分を用いて行った。溶出液を、ラジオアイソトープ検出器を用いて検出した。実施例6からの標識された修飾Lym-1産物の混合物は、750秒の溶出時間の低分子量種の1つの主要なピーク、プラス690秒での少量を示した。完全なLym-1は、690秒の保有時間を有する単一ピークを示した。
【0051】
従って、実施例7は、血清でインキュベートされた修飾Lym-1サンプルが、HPLC分析で、完全なLym-1のものよりも低い見かけの分子量を有したことを示す。対照的に、実施例2は、インキュベートされなかった修飾Lym-1が、完全なLym-1と同一の保有時間を有すことを示した。従って、修飾Lym-1は、FPLC分析では、血清中でインキュベーションすると、分子量の明らかな損失を示した。
【0052】
血清中でインキュベーションすることによる修飾Lym-1の分子量の明らかな損失をさらに証明するために、サンプルのポリアクリルアミドゲル電気泳動を、実施例8に示されるように行った。
【0053】
実施例8
放射性標識した修飾Lym−1のSDS−ポリアクリルアミドゲル電気泳動(SDS−P AGE)による分析
実施例6からのそれぞれのインキュベートされた血清混合物の同じアリコートを、非還元SDS-PAGEにより連続的にチェックした。この研究のために、サンプルを10%アクリルアミドゲル上にランし、注意深く乾燥し、その開示が本明細書中に参考として援用されているラエムリ,ユー.ケー.(Laemmli,U.K.)、Cleavage of Structura1 Proteins During the Assembly of the Head of Bacteriophage T4, Nature 227: 680-685(1970)のように、写真フィルムに通常の方法で露出した。この分析は、完全な125I-Lym-1が、Mr 200,000で明らかであるが、修飾125I-Lym-1は、約Mr 116,000で、より小さい分子量に対応する異なるバンドで観察されることを明示した。従って、本実施例は、血清中の修飾抗体のインキュベーションが、アクリルアミドゲル上で修飾された見かけの分子量を生じることを示し、HPLC分析の結果を立証する。
【0054】
実施例9
血清中の標識Lym−1の脱ヨウ素化に関するテスト
実施例6からの同じサンプルを、放射性標識Lym-1からの放射能の幾らかの損失があったかどうか見るために、8日間かけて再び検査した;そのような損失は、血清中の脱ヨウ素の証拠として解釈できる。データは、この期間に亘る、放射能の実質的ないかなる損失も示さなかったので、ヨウ素の非常に安定な付着が、これらの免疫複合体で得られたことを確認する。
【0055】
従って、実施例7−9は、修飾抗体が血清中のインキュベーション後に実質的に十分な活性を維持しながら、見かけの分子量116,000の分子に分解させるように見えたことを示す。上述のように、分子量のこの損失は、抗体のその一価形態への分解によることが可能である。いずれにしても、見かけの分子量の損失は、修飾抗体のそのフラグメントへの分解によると考えられる。
【0056】
血清中でインキュベートされたとき、修飾抗体の見かけの分子量の前記の予想しない変化を発見した後、我々は、修飾MAb'sのインビボでの安定性をテストした。我々は、これらをインビボテストで行い、全身のクリアランス時間を測定した。これらのテストの例は、実施例10で示される。
【0057】
実施例10
全身のクリアランス
無胸腺ヌードマウス(n=5)の3群が、(a)完全な抗体、(b)F(ab')2フラグメント、または(c)クロラミンT法を用いてI-131で標識されたLym-1の修飾抗体を腹腔内注射される実験を行った。注射時の及びその後の連続的な全身の活性を、線量計で測定した。この研究は、放射能の全身のクリアランスが、抗体の作製とともに変動することを実証した。結果を、図2に示す。
【0058】
図2は、修飾Lym-1が20時間の生物学的半減期(t1/2)を有して、完全なLym-1 (t1/2=5日)よりも速く全身から排除されたことを示す。しかしながら、F(ab')2フラグメントのクリアランスは、10時間の生物学的半減期を有し、修飾Lym-1よりも2倍速かった。データは、修飾Lym-1が、迅速に排除されるF(ab')2フラグメントとゆっくり排除される完全な抗体との間の中間的な速度で排除されることを示した。
【0059】
従って、実施例10のデータから、修飾抗体は身体から、比較的高く持続する完全な抗体よりも迅速に排除されるが、F(ab')2フラグメントほどには迅速でないことが見出され得る。
【0060】
免疫療法のための理想的な物質は、所望の毒性効果を生じるのに十分に長い時間、血流の中に残存するであろうが、意図されない毒性の副作用を生じるほどには長くないものである。実施例10からのデータは、免疫療法で使用されるとき、修飾抗体が潜在的に理想的な持続時間を発揮することを示唆した。
【0061】
先に考察したように、免疫療法用の物質はまた、その標的細胞に対して高度に特異的でもあるであろう。従って、我々は、下記の実施例で、完全なMAb'sおよびF(ab')2フラグメントの両方と比較される、修飾MAb'sの特異性をテストした。実施例11は、以降の生体分布研究の全てで使用される方法を示す。
【0062】
実施例11
生体分布研究
2群の6週齢のヌードマウスを、その大腿部にRaji細胞(107)を皮下注射した。腫瘍は、それらの径が1 cmより大きくなるまで、3週間増殖させた。下記に記載されるように、対標識(paired-label)研究を、各群のマウスを用いて行った。第一群(n=6)では、各マウスは、I=131を12μCi/μg(120μCi/マウス)で標識した10μgの修飾Lym-1、およびI-125を2.5μCi/μg(25μCi/マウス)で標識した10μgの完全なLym-1を含む、0.2 mLの接種材料をi.p.で注射した。第二群(n=4)では、マウスは、I-131を12μCi/μg(120μCi/マウス)で標識した10μg修飾Lym-1、およびI-125を2.5μCi/μg(25μCi/マウス)で標識した10μgのF(ab')2フラグメントを含む、0.2 mLの接種材料を受けた。全ての実験で、マウスは、注射後の予め選択された時間に頸部脱臼により殺され、様々な臓器、血液および腫瘍を摘出し分析用天秤で重量測定した。次に、サンプルをガンマカウンターでカウントし、131Iおよび125I活性を測定した。125Iカウントは、1282コンピュガンマ(Compugamma)ガンマカウンター(LKB)を用いて、実験的に決定された式である131Iチャンネルカウントの17%を引き算して、131Iチャンネルからのクロスオーバーのために調節された。データはまた、動物が殺された日による、131Iアイソトープの放射性崩壊に関して較正された。各マウスについて、データを、腫瘍グラム当りのcpm/臓器グラム当りのcpm、%用量/グラム、および%用量/臓器で表わした。これらのデータから、平均および標準偏差を、それぞれの群について計算した。
【0063】
実施例12は、実施例11の方法を用いて、修飾MAb'sの生体分布を、完全なMAb'sと比較している。
【0064】
実施例12
修飾Lym−1対完全なLym−1の生体分布研究
この研究のために、実施例11の方法の中で、完全なLym-1抗体を修飾Lym-1抗体と比較した。表Iに報告されるように、完全なLym-1は、注射から7日後に、0.64% ID/gの血液活性を生じた。同じ時間間隔の終りでは、腫瘍は、3.92% ID/gの活性を有した。
【0065】
表Iに報告されるように、完全なLym-1と比較すると、修飾Lym-1は血中からより速く排除され、7日目に0.14% ID/gの血液活性を生じた。同じ時間間隔の終りに、腫瘍は7.7%生じ、それは完全なLym-1の対応する活性よりも有意に高い傾向があった。
【0066】
幾つかの臓器における実施例12からの抗体反応性の結果は、表Iに報告され、図3(%用量/グラム)および図4(腫瘍/臓器)にグラフで示される。
【0067】
表I
注射から7日後のRaii腫瘍担持ヌードマウス(N=6)における修飾および完全なモノクローナル抗体LYM−1の生体分布
【0068】
【表1】

【0069】
図3から、修飾抗体は、完全な抗体よりも、腫瘍中でより高いシグナルを生じたことが見い出され得る。さらに、修飾抗体は完全なMAb'sよりも、腎臓を例外としてあらゆるテストされた臓器で、反応が弱かった。腎臓でより高いシグナルが見出されるのは、抗体がこの臓器から排除されるのが予想されるので、予想されないことではない。実施例10で見られた完全なMAb'sと比較して、修飾MAb'sのより迅速なクリアランス速度により、腎臓ではより高い量の修飾MAb'sが予想されるであろう。
【0070】
図3と同じデータを異なる形態で示す図4を参照すると、修飾MAb'sは、完全なMAb'sよりも、腎臓を例外としてあらゆるテストされた臓器で有意に高い腫瘍/臓器比を生じたことが見い出され得る。従って、免疫シントグラフィで使用されるとき、修飾抗体は有意に低いバックグラウンドを生じることが予想されるであろう。さらに、免疫療法で使用されるとき、修飾抗体は、その腫瘍へのより高い親和性および非標的組織へのより低い親和性の両方により、より効果的であることも予想されるであろう。従って、免疫シントグラフィで使用されるとき、修飾抗体は、腫瘍に対するより高い毒性および非標的組織に対するより低い毒性であることが予想されるであろう。本発明の修飾抗体の免疫療法的使用は、これ以降さらに詳しく説明される。
【0071】
我々は次に、修飾MAb'sの生体分布を、他の非修飾抗体のF(ab')2フラグメントと比較した。実施例13は、これらの実験を例示するものである。
【0072】
実施例13
修飾Lym−1対Lym−1のF(ab’)2フラグメントの生体分布研究
この研究のために、F(ab')2フラグメントを、修飾Lym-1 MAb'sと比較した。実験を、実施例11でのように行った。結果を表IIに報告し、図4および5にグラフで示す。
【0073】
表II
注射から5日後の Raji腫瘍担持ヌードマウス(N=4)における 修飾および完全なモノクローナル抗体LYM−1 の生体分布
【0074】
【表2】

【0075】
表IIは、修飾Lym-1が、F(ab')2フラグメントよりも、血液からゆっくりと排除されたことを示す。修飾Lym-1は、注射後5日目に、フラグメント(0.05%)よりも高い0.09%ID/gの血液活性を生じた。図5は、修飾Lym-1の腫瘍活性が、F(ab')2フラグメントの対応する活性よりも、約2.5倍高かったことを示す。修飾Lym-1の活性は、腎臓を含むテストされた様々な臓器の全てについて、F(ab')2フラグメントよりも高かった。これは、より迅速に排除される抗体が腎臓に蓄積するという理論と一致する。
【0076】
さらに、図6は、修飾Lym-1に関する腫瘍対臓器比が、テストされた臓器の全てにおいて、F(ab')2フラグメントのものよりも高いことを示す。従って、実施例12および13の実験は、本発明の修飾抗体が完全なMAb'sまたはF(ab')2フラグメントのいずれかよりも、それらの標的腫瘍に関して高い活性を有することを確認する。さらに、これらの実験の腫瘍対臓器データは、修飾抗体が完全なMAb'sまたはF(ab')2フラグメントのいずれかよりも、腫瘍に関して高い特異性を有することを示す。
【0077】
従って、我々は、改善された免疫シントグラフィ結果を生じる本発明の修飾MAb'sの能力をテストした。これらのテストの1例を、実施例14に示す。
【0078】
実施例14
Lym−1の画像化研究
腫瘍担持ヌードマウスを、ピンホール・コリメーターおよびスペクトル91ガンマカメラ(レイゼオン(Raytheon))を用いて画像化した。これらの動物の画像分析は、注射後の腫瘍/全身の抗体分布の評価を与えた。注射から7日後、マウスを2 mgケタミンHCIで麻酔し、0.4 mgキシラジンを0.2 mL s.c.接種として投与した。次に、固定されたマウスは、10,000カウント記録するためにプリセットされたカメラで、背部位で画像化された。いかなるバックグラウンド引き算も行わなかった。写真画像は、ポラロイド(登録商標)のタイプ330パックフィルムを用いて得られた。各画像に2つの領域が、定められた:(a)領域1、全身;(b)領域2、腫瘍。図6−8は、これらの実験で作製された例示的なシントグラフ(シントグラムとしても公知)を示す。
【0079】
完全なLym-1による免疫シントグラフィ画像化は、注射から7日後に試みられ、図6に示されるように十分ではなかった。図6は、腫瘍が視覚化されたけれども、動物の残りも視覚化されたことを示す。図7および8は、注射後の同じ時点で、標識された修飾Lym-1を注射された2種の異なるRaji腫瘍担持動物の画像を示す。図7および8は共に、図6に見られるように、完全なLym-1による、産生された腫瘍でのものよりもより高いレベルで、腫瘍での標識された修飾Lym-1の濃度を示すことが見出され得る。より重要なこととして、修飾Lym-1により産生されたマウス全体のバックグラウンドに対する、腫瘍での標識の比は、完全なLym-1のそれの数倍も高かった。従って、図7および8は、バックグラウンドの放射能を殆ど又は全く有さない、腫瘍の明確な限定(definition)を示す。
【0080】
さらに、修飾Lym-1を使用するとき、注射から5日後に、腫瘍の満足な視覚化を得ることができた。図10は、7日目に図9で示されるのと同じ動物で撮られた5日目の画像を示す。見て判るように、図10の5日目の画像は、7日目の完全なLym-1で得られた画像よりも有意に優れていた(図7)。結果は、テストされた全動物で、同様であった。
【0081】
この研究は、修飾抗体フラグメントを使用すると、腫瘍抗原に対するより大きな特異的活性が発揮され、抗体のより多くの絶対的濃度が腫瘍に蓄積するのを可能にすることを示唆する。これは、修飾Lym-1フラグメントの絶対的濃度が注射から7日後の完全なLym-1濃度の約2倍であり、5日後のF(ab')2フラグメントの約2.5倍である、という我々の結果によって確認される。
【0082】
修飾Lym-1フラグメントのかなり速いクリアランスはまた、腫瘍対バックグラウンドの高い比に到達するのに要求される時間を有意に減少させ、この結果、完全な抗体よりも少ない時間でより優れた画像化を生じる。
【0083】
本発明の修飾の、抗体の特異性および活性の改善における一般的な有用性を実証するために、我々はさらなるMAb'sを修飾した。これらの様々な修飾MAb'sのテストを、実施例15-18に示す。
【0084】
実施例15
モノクローナル抗体B72.3のクリアランス速度
結腸癌に対するモノクローナル抗体であるB72.3(IgG1)を、その開示が本明細書中に参考として援用されているコルチャー,ディー.(Colcher,D.)ら、A Spectrum of Monoclonal antibodies Reactive with Human Mammary Tumor Cells, Proc. Natl. Acad. Scl. 78: 3199-3203(1981)のようにして得た。B72.3 MAb'sを、実施例1の方法に従い分子当り平均して1個のPDP基で機能性化した。
【0085】
修飾B72.3MAb'sを、実施例3の方法により放射性標識した。全身のクリアランス時間を、実施例10でのように測定した。図11は、これらの全身クリアランス実験の結果を示す。修飾抗体は、完全なMAb'sの約6日目から修飾抗体の約2.5日目までの全身のハーフタイム・クリアランスの減少を示した。F(ab')2フラグメントのハーフタイム・クリアランスは、Lym-1フラグメントについて、修飾抗体よりも速く、約12時間のハーフタイムを有した。従って、結果は、修飾B72.3が、F(ab')2フラグメントと完全な抗体の中間のハーフタイム・クリアランスを有することにおいて、修飾Lym-1と類似した挙動をすることを示した。
【0086】
実施例16
B72.3の生体分布
対標識(paired-label)生体分布研究を、ヒトLS174T結腸癌を担持する無胸腺ヌードマウスで、各5匹の2群のマウスについて行った。1群は、完全なI-125で標識したB72.3を注射され、他の群は、修飾されたI-131で標識したB72.3を注射された。実験はまた、腫瘍、血液および様々な臓器における生体分布を比較した。使用された方法は、実施例11-13のものであった。データを表IIIに報告し、図11および12にグラフで示す。
【0087】
表III
ヒトLS174T結腸癌担持ヌードマウス(N=5)における注射から4日後の修飾および完全な モノクローナル抗体B72.3の生体分布
【0088】
【表3】

【0089】
表IIIに見て判るように、完全なB72.3抗体は、注射から4日目に、1.34% ID/gの血液活性を生じ、腫瘍では4.04%の活性が表IIIに示されている。完全なB72.3と比較すると、修飾B72.3は4日目に、より低い血液活性(1.1% ID/g)およびより高い腫瘍活性(6.02% ID/g)を生じた。
【0090】
図13に見て判るように、様々な臓器活性の全ては、より迅速に排除される抗体について予想された腎臓を例外として、修飾B72.3ではより高かった。従って、図14に示されるように、修飾B72.3に関する腫瘍対臓器比は、完全なB72.3に関する対応する比よりも有意に高かった。腫瘍対臓器比は、腎臓に関しては、腫瘍部位での修飾抗体のより高い活性により、改善されさえした。
【0091】
実施例17
腫瘍担持マウスでのB72.3の両像化
修飾B72.3を注射されたLS174T腫瘍担持マウスの画像分析は、注射後の腫瘍/全抗体分布の推定をもたらした。図14は、注射から1日目の免疫シントグラフィを示す。画像は、バックグラウンドの放射能を殆ど示さない腫瘍の明確な限定を示す。図15は、注射から4日目の免疫シントグラフィを示す。4日までに、腫瘍は鮮明に見られ、動物の血液プールには殆ど放射能が残っていなかった。結果は、全動物で同様であった。
【0092】
従って、修飾B72.3は、B72.3に反応性の腫瘍の注射から短時間で高画質の免疫シントグラフィを得るのに非常に有用であることが見出された。
【0093】
TNT-1は、ヒト癌にそれらが選択的に結合する標的として壊死性腫瘍を利用する、IgG2aモノクローナル抗体である。我々は、実施例1でのように、分子当り平均して1個のPDP基でこの抗体を修飾し、実施例18に示されるように全身の保有時間を分析した。
【0094】
実施例18
モノクローナル抗体TNT−1の使用
我々は、TNT-1を、その開示が本明細書中に参考として援用されているエプシュタイン,エー.エル.ら、A Novel Method for the Detection of Necrotic Lesions in Human Cancer, Cancer Res. 48:5842-5848 (1988)のようにして得た。
【0095】
TNT-1 MAb'sを、実施例3の方法で放射性標識した。全身のクリアランス時間を、実施例10でのように測定した。図16は、これらの全身クリアランス実験の結果を示す。修飾TNT-1 MAb'sは、完全なTNT-1と比較した全身のハーフタイム・クリアランス時間の減少、およびTNT-1のF(ab')2フラグメントと比較した増加を示した。
【0096】
従って、修飾TNT-1は、他の修飾抗体と同様な挙動をした。我々は、従って、修飾TNT-1MAb'sの利用性が、テストされた他の修飾抗体に等しいものであると予想する。
【0097】
実施例19は、ビオチン化抗体を調製するのに有用な1つの方法を記載する。
【0098】
実施例19
ビオチン化抗体の調製
TNT-1およびLym-1MAb'sを、そのスルホN-ヒドロキシスクシンイミドエステル(NHS-LC-ビオチン)と反応させることにより、6-(ビオチンアミド)ヘキサノエートに別々に複合体化した。代表的には、1 mLの0.9%食塩水中2 mgNHS-LC-ビオチンの標準的な溶液を調製した。炭酸水素ナトリウム緩衝液、pH 8.5中1 mLの抗体(10 mg/mL)を含む5 mL試験管に、1 mLのNHS-LC-ビオチン標準溶液(モル比50:1 NHS-LC-ビオチン/MAb)を加えた。試薬混合物を、2.5時間室温で、低速で連続的に攪拌しながら、インキュベートした。インキュベーション後、カップリングされた抗体を、PBS、pH 7.2で平衡にしたPD-10カラム(ファルマシア)上でクロマトグラフィーした。カップリング抗体調製物の純度を、スペロース・12カラムを用いてFPLCで評価した。これらの手順の結果は、ビオチン化抗体が少なくとも99%の純度で得られたことを示した。
【0099】
それぞれの抗体分子にカップリングされたビオチン基の平均数は、グリーン(Green)、Biochem J. 94:23c-24c(1965)に記載される方法により、分光光度計で測定された。簡単に述べると、ビオチン化抗体を、37℃で4時間、1%プロテアーゼで酵素的に消化した。0.1 M PBS、pH 7.2中800μLの100μM HABAを含む5 mL溶液に、70μLの17μMストレプトアビジン溶液を加えた。次に、ストレプトアビジン-HABA溶液を、消化されたビオチン化抗体溶液の容量を増加させながら滴定し、吸光度の変化を500 nmで測定した。この処理から、プロテアーゼ処理した抗体溶液中のビオチン濃度を、ビオチン溶液の標準曲線を用いて計算した。結果は、平均して3〜4個のビオチン部分が、各抗体分子に組込まれたことを示した。
【0100】
ビオチン-抗体複合体を、本質的に実施例3に記載されるように、クロラミンT法を用いて125Iで放射性標識した。
【0101】
実施例20は、抗体および抗体フラグメントの放射性ヨウ素化に使用される方法を記載する。
【0102】
実施例20
抗体の直接的放射性ヨウ素化
全ての抗体(完全な、修飾された、およびF(ab')2フラグメント)を、本質的に実施例3に記載されるように、修飾されたクロラミンT法を用いて、125Iまたは131Iでヨウ素化した。代表的には、0.5-1.0 mCiのヨウ素-125またはヨウ素-131および10μLの43 mMクロラミンT水溶液を、100μL PBS中50-100μgのモノクローナル抗体を含む試験管に加えた。3分後、20μLの120 mMメタ重亜硫酸ナトリウム溶液で、反応をしずめた。放射性標識した抗体を、セファデックスG-25カラムを用いて精製した。このカラムは、プラスチック製血清ピペット(8×200 mm)からなり、端を綿で栓されていた(Vo=4.5 mL、Vt=12 mL)。それぞれの反応混合物を、カラムにロードし、PBS、pH 7.2で溶出した。1 mLのアリコートを含む個々の試験管を、シンチレーション・カウンターでカウントした。放射性標識された抗体は、代表的には収率85-90%で回収された。クロラミンT法で放射性標識された全ての抗体が、シリカゲルを含浸したグラスファイバー上で、分析用即時薄膜クロマトグラフィー(ITLC)システムを用いて分析された。ストリップ(2×20 cm)を、使用前に110℃で15分間加熱により活性化し、1μLのサンプルでスポットし、風乾し、メタノール/H2O(80:20)で約12 cmを溶出し、再び風乾し、半分に切断し、カウントして、結合タンパク質および非タンパク質結合の放射能を測定した。この手順の結果は、抗体の99%以上が結合タンパク質であったことを示し、よって、機能性放射性標識されたビオチン化抗体が高純度で得られたことを確認した。
【0103】
上記の手順により調製された放射性標識されたビオチン化抗体を、4℃で貯蔵し、標識から4時間以内にマウスに投与した。
【0104】
下記の2つの実施例は、放射性標識されたビオチン化抗体が、標的抗原に結合する能力を保持し、血清成分の存在下では安定であったことを証明するために使用された、分析的手順の結果を開示する。
【0105】
実施例21は、ビオチン化および放射性標識により修飾された抗体が、抗原結合能力および構造的完全性(integrity)を共に保持したことを実証するのに使用された方法を記載する。
【0106】
実施例21
免疫反応性評価
放射性標識Lym-1調製物のインビトロでの免疫反応性を、エプシュタインら、Cancer Res. 47:830 (1987)に記載される方法により、Raji細胞を用いて生細胞アッセイで評価した。Raji細胞(106個/試験管)を、PBS中1%ウシ血清アルブミン(BSA)の100μLに再懸濁させた。標識Lym-l(l00μl)を、それぞれの試験管(約10μCi/μg;100,000 cpm/試験管)に三重に加え、オービタルシェイカーを用いて連続的に混合しながら、1時間室温でインキュベートした。インキュベーション後、1000 rpmで5分間試験管を遠心分離し、上清をデカントし、200μL PBSに細胞を再懸濁することによって、細胞をPBS中1% BSAで3回洗浄した。洗浄が完了した後、ガンマカウンターを用いて、細胞ペレットに結合した(associated)放射性標識を測定することにより、結合したLym-1を検出した。この手順の結果は、実施例6に示されたものと実質的に同一であった。
【0107】
より詳細には、放射性標識された完全なLym-1の75%、および放射性標識されたビオチン化Lym-1の75%が標的細胞に結合した。これは、放射性標識されたビオチン化Lym-1の抗原結合活性が、標準コントロールとしての役割を果たす放射性標識された完全なLym-1のそれに比肩することを示した。
【0108】
修飾TNT-1 MAbの免疫反応性を、ガッファー(Gaffar)ら、J. Immunoassay, 2:11 (1991)に記載される固定細胞ラジオイムノアッセイを用いて評価した。簡単に述べると、放射性標識したTNT-1および放射性標識したビオチン化TNT-1を、PBS中20%パラホルムアルデヒドで予め固定されていたRaji細胞とともに、30分間室温でインキュベートし、その後アセトンで-20℃で処理した。次に、細胞をPBS中1% BSAで洗浄し、ガンマカウンターでカウントした。この手順の結果は、両方の抗体調製物の約60%が固定細胞に結合することを示した。これは、放射性標識したビオチン化TNT-1の抗原結合活性が、標準コントロールとしての役割を果たす放射性標識した完全なTNT-1のそれに比肩することを示した。
【0109】
実施例22は、放射性標識したビオチン化抗体が血清の存在下では通常には分解に供されることを証明するために使用される方法を記載する。
【0110】
実施例22
修飾抗体の血清安定性
125Iで直接標識されたMAb'sを、新鮮なマウス血清を含む試験管の三重セットに、最終濃度100μg/mLまで加えた。全サンプルを、空気中5%CO2に維持された湿潤インキュベーター中で、37℃でインキュベートした。0日と8日の間の各時点で、タンパク質結合放射性標識を、900μLの100%トリクロロ酢酸(TCA)を各サンプルの100μLのアリコートに添加し、室温で5分間インキュベーション後、タンパク質沈降物を遠心分離により回収することにより測定した。上清のアリコート(500μL)を各試験管から取り出し、ガンマカウンターを用いて放射能をカウントした。結果は、放射性標識したビオチン化抗体がインビトロで全ての時点で安定であることを示した。より詳細には、8日間インキュベーションした後、少なくとも放射性標識の97%がタンパク質結合を維持した。これは、MAb's上に存在するビオチン部分が、タンパク質結合した放射性標識の安定性に対して、全く不利な効果を及ぼさないことを確認した。
【0111】
それぞれのインキュベートされた血清混合物の同じアリコートも、非還元SDS-PAGEおよびオートラジオグラフィによって、連続的にチェックされた。この研究のために、サンプルを10%ポリアクリルアミドゲル上で電気泳動し、X線フィルムに露出して視覚化した。サンプルの分子量を、分子量スタンダードと比較して決定した。これらの手順の結果は、放射性標識された完全なMAbおよび放射性標識されたビオチン化MAbが、実質的に同様の分子量を有することを示した。より詳細には、放射性標識Lym-1および放射性標識されたビオチン化Lym-1に関する主要なバンドが、約200,000のMrsを有することを示した。同様に、放射性標識TNT-1および放射性標識されたビオチン化TNT-1に関する主要なバンドは、約150,000のMrsを有した。
【0112】
ポリアクリルアミドゲルでの等電点電気泳動を、バイオラッド(BioRad)モデル111ミニIEF細胞で行った。サンプルを、1.2% 3/10両性電解質および0.8% 5/8両性電解質の濃度でのバイオライト(BioLyte)両性電解質(バイオラッド)の混合物で構築されたpH勾配により、バイオラッドに作成されたプロトコールに従い、電気泳動した。IEFスタンダード(バイオラッド)を、plの較正のために各ランに含めた。IEFゲルを、クーマシーブルーR-250で染色し、終夜乾燥した。これらの手順の結果は、MAb'sのビオチン化は実質的に、マクロ分子の電荷特性を変化させたことを確認した。放射性標識Lym-1は7-8のpI値を有したが、放射性標識されたビオチン化Lym-1は5-6のpI値を有した。同様に、放射性標識TNT-1 MAbは5.5-6.5のpI値を有したが、放射性標識されたビオチン化TNT-1 MAbは4.5-5.0のpI値を有した。従って、予想されたとおり、ビオチン化抗体のより少ない塩基性に実証されるように、MAbタンパク質上の遊離アミノ基の修飾が、タンパク質上の正電荷の幾らかを効果的に除去したか又は中和した。
【0113】
実施例23は、天然の抗体と比較して減少したpIを有するマクロ分子を生じるように化学的に修飾されたアミノシド部分を有するMAb'sが、有利なことに、(1)標的特異性の増大、(2)非特異的結合の減少、および(3)クリアランス時間の減少を発揮したことを実証するのに使用される方法を記載する。
【0114】
実施例23
生体分布研究
2群の6週齢のヌードマウスを、クワーリら、Antibody, Immunoconjugates, and Radiopharmaceutica1s, 6:13(1993)に記載される方法に従い、Rajiリンパ腫細胞、LS-174T結腸癌細胞、または子宮頚部癌ME-180を注射した。腫瘍は、それらの径が約1 cmになるまで、10-21日間増殖させた。
【0115】
(a)対標識研究 第一群のマウス(n=6)では、各マウスは、120μCi/10μgの修飾された131I標識MAbおよび25μCi/10μgの完全な131I標識MAbを含む、0.2 mLの接種材料を静脈内注射した。第二群(n=4)では、マウスは、120μCi/10μgの修飾された131I標識MAbおよび25μCi/10μgの125I標識MAb F(ab')2を含む、0.2 mLの接種材料を受けた。全ての実験で、マウスは、注射後の予め選択された時間に頸部脱臼により殺され、様々な臓器、血液および腫瘍を摘出し、重量測定された。次に、サンプルをカウンターでカウントし、131Iおよび125I活性を一測定した。125Iカウントは、1282コンピュガンマ(Compugamma)カウンターを用いて、実験的に決定された式である131Iチャンネルカウントの17%を引き算して、131Iチャンネルからのクロスオーバーのために、調節された。データはまた、動物が殺された時点による、131Iアイソトープの放射性崩壊に関して較正された。各マウスについて、データを、腫瘍グラム当りのcpm/臓器グラム当りのcpmおよび%用量/グラムで表した。これらのデータから、平均および標準偏差を、それぞれの群について計算した。同じ対標識生体分布研究を、Rajiリンパ腫モデルのLym-1、およびLS-174Tヒト結腸癌モデルのB72.3を用いて行なった。
【0116】
これらの手順の結果を、図17に示す。パネル17Aに示されるように、完全なTNT-1およびTNT-1/ビオチン修飾されたMAb'sの両方とも、注射後1日目に腫瘍組織に局在化し、ビオチン化抗体は、%注射用量/腫瘍グラムで測定されるように、より大きい局在化を示した。2つの標識MAb'Sの非特異的結合も各組織において明らかであった。重要なこととして、これらの組織と非特異的に結合するビオチン化TNT-1の量は、そのような非特異的結合を示した完全なTNT-1の量よりも画一的に少なかった。従って、特異的結合のレベルは増大し、非特異的結合のレベルはビオチン化抗体では非修飾抗体に比較して減少した。修飾抗体の利点は、図17Bに定量的に示され、そこでは、腫瘍に局在化した抗体対非特異的に局在化した抗体の比が各組織について示されている。示されているように、画像化試薬としてのビオチン化抗体の利点は、筋肉および膵臓で特に明らかである。
【0117】
同様の傾向は、注射後3日目に為された測定について観察された。図17Cは、ビオチン化TNT-1抗体が、ビオチン化されない同等の抗体よりも、より効果的に腫瘍組織に局在化したことを示す。同時に、非特異的結合の量は、ビオチン化種で有利に低かった。図17Dは、様々な組織でのシグナル対ノイズ比を反映する腫瘍/臓器比が、筋肉および膵臓で最も高かったことを定量的に確認する。注目すべきこととして、図17Cおよび17Dは、迅速な全身クリアランス速度を有するTNT-1 F(ab')2フラグメントを用いて得られた結果を含む。腫瘍/臓器比は、幾つかの組織タイプでのビオチン化TNT-1と比較すると、抗体フラグメントに関してより高いけれども、腫瘍に局在化した注射されたビオチン化TNT-1のフラクションは有利により高かった。これらの結果は、ビオチン化MAbが、非修飾の完全なMAb、またはF(ab')2MAbフラグメントのいずれかよりも優れた様式で、腫瘍組織に局在化することを示した。
【0118】
(b)全身クリアランス Ba1b/cマウス(n=45)の異なる群が、放射性標識抗体の静脈内注射を受ける実験が行われた。注射時の及びその後の選択された時点での全身の活性を、用量カリブレーターで測定した。
【0119】
図18および19は、TNT-1およびLym-1抗体並びにそれらの誘導体に関する、全身クリアランス速度研究の結果を開示する。図18に示される結果は、SPDPまたはビオチンで修飾されたTNT-1 MAbが、完全な抗体と比較してクリアランス時間を減少させることを示した。テストされた全ての抗体のうち最速のクリアランス速度を有したF(ab')2TNT-1フラグメントが、この手順で陽性コントロールとして使用された。従って、ビオチン化TNT-1 MAbは、非ビオチン化抗体よりも、より迅速なクリアランス速度を有利に示した。同様に、図19に示される結果は、SPDPまたはビオチンで修飾されたLym-1 MAbが、完全な抗体と比較してクリアランス時間を減少させることを示した。これは、抗体のpIを減少させるために遊離アミノ基部分を化学的修飾した物質が、抗体結合特異性および全身クリアランス速度を有利に増加させることを示した。
【0120】
我々は、本発明の方法を用いる、あらゆる抗体の修飾が、腫瘍画像化の改善に有用な試薬を提供すると考えている。本発明の方法を用いて、あらゆる所望の組織タイプの画像を作製するために、その組織タイプに対する抗体が最初に得られなければならない。ポリクローナル抗体は、当業者に公知である慣用されている方法で得られ得る。或いは、モノクローナル抗体は、当業者にも公知であるように、これらの抗体により提供される特異性の増大を得るために調製され得る。次に、抗体は、ヘテロ二官能性剤、ビオチン、または他の物質と複合体化することによって遊離アミノ基で化学的に修飾され、該物質は、非修飾抗体の等電点よりも低い等電点を有する修飾抗体生成物をもたらす。複合体化の後、好適な標識が、修飾抗体に適用される。
【0121】
前記の実施例は、ガンマ放射線を放出する放射性核種を含む標識の画像化を利用するけれども、多くの他の標識タイプおよび画像化システムが、本発明の範囲内に意図される。例えば、バリウム、セシウムまたはヨウ素のような放射線不透剤が、慣用されているX線を用いて画像化され得る。常磁性または超磁性の粒子が、標識としてMRI画像化技術で使用され得、抗体の局在化の画像を作製する。さらに、テクニシウムが、標識として使用され得る。これらの代替的標識は、慣用されている方法を用いて修飾抗体に複合体化されても良い。
【0122】
標識抗体は、薬学的に許容される賦形剤、担体、または基剤を含む、被験体への標識の導入のための薬学的調製物に含まれ得る。好適な賦形剤、担体、または基剤は、食塩水、リン酸緩衝生理食塩水、グリセロール、炭酸カルシウムなどを含む。次に、これらの組成物は、局所注射、静脈内注射のような、或いは、シグナル強度の減少が要求される場合または口腔組織の画像化が望まれる場合には経口投与のような様々な手段のいずれかで、導入される。しかしながら、好ましくは、標的組織が抗体に最大に曝されるように、投与は全身的注射で行われる。
【0123】
我々は、本発明に従い対応する非修飾完全抗体よりも低い等電点を有する修飾抗体を生じる、ヘテロ二官能性剤、ビオチン、または他の物質の付加により、抗体上に配置された遊離アミノ基の化学的修飾が、これらの修飾抗体が免疫治療剤に組込まれるときに、有意に改善された結果を生じる、と考えている。そのような治療剤は、一般に、腫瘍または他の疾患組織に特異的な抗体を、1種以上の生物学的に活性な分子と組合せて含む。そのような物質において機能する好適な生物学的に活性な分子は、ジフテリア毒素(リシン)A鎖または当業者に公知の様々な植物毒素のいずれかのような毒素;イットリウム、ヨウ素、リン、および他の通常使用される放射性治療剤の放射性同位元素;メトトレキセート、5-フルオロ−ウラシル、またはアドリアマイシンのような薬剤;EDTAおよびEGTAを含むキレート;シスプラチンおよび他の毒性有機金属剤、および任意の他の治療剤である。
【0124】
これまで、効果的な免疫療法の見込みは、十分に実現されていなかった。我々は、本発明の修飾抗体の増大した活性および特異性が、それらの標的組織に関する十分な活性および特異性を有する免疫療法剤を生じさせ、従来の免疫療法剤の欠点を克服すると考えている。従って、被験体に適切な免疫療法剤が注射されるとき、被験体の健康な組織に重要な影響を与えることなく、標的疾患組織は殺滅され得る。
【0125】
これらの免疫療法剤の使用では、特定の所望されない組織タイプに特異的な抗体が、第一に得られなければならない。所望の抗体が入手されない場合、当業者に公知のように、生物に抗原を注射し、哺乳動物から血清を得ることによって、適切な生物の中で抗体を生じさせても良い。或いは、好ましくは、当業者に公知の方法で、モノクローナル抗体を生じさせ得る。次に、抗体は、抗体分子上に存在する遊離アミノ基を修飾できる、ヘテロ二官能性剤、ビオチン、または他の物質のような物質を化学的に複合体化される。複合体化した後、得られた修飾抗体はさらに、上述した治療剤または検出可能標識のような生物学的に活性な物質と複合体化して修飾される。抗体は、薬学的に許容される担体、賦形剤、または基剤を含む薬学的組成物に組込まれる。そのような薬学的に許容される担体、賦形剤、または基剤は、全身的注射用の通常の生理食塩水、グリセロール、炭酸カルシウムを含む。続いて、組成物は、患者、例えば哺乳動物への導入の準備が整う。
【0126】
次に、抗体は、公知の投与経路で被験体に導入される。例えば、組成物は全身的注射で導入され得、冒された組織への局所注射は外部的に冒された組織に局所的に適用され得、シグナル強度の減少が要求される場合または口腔組織の治療が望まれる場合には経口的に摂取され得る。
【0127】
抗体を含む生物学的に活性な物質の投与量は、毒素に対する標的組織の感受性、冒された組織の量、投与経路、抗体への親和性、クリアランス速度および他のファクターに依存する。しかしながら、代表的な投与量は、一般に、1μg/全身質量kg〜1 mg/kgの範囲である。殆どの適用において、用量は、好ましくは5〜200μg/kgである。
【0128】
下記の実施例は、マウスにおけるRaji細胞に対して免疫治療学的な有効性を例示する。PDP-修飾された抗体は、実施例で使用されるけれども、対応する完全な抗体よりも低いpIを有する修飾抗体を産生する、ビオチンのような他の物質で修飾された遊離アミノ基を有する抗体は、十分に等しく機能することが予想される。
【0129】
実施例24
マウスでのRaii腫瘍の処置
PDP-修飾されたLym-1を、実施例1でのように得た。次に、修飾抗体を処理して、抗体分子当り平均して1個のリシンA鎖を導入する。完全なLym-1およびF(ab')2フラグメントを、同様にして毒素と組合わせる。
【0130】
25匹のマウスを、5群に分ける。I群は、8週間の間、週に一度、リン酸緩衝食塩水(PBS)中リシン-PDP-修飾Lym-1を、腹腔内注射で10μg/全体重kgを受ける。II群は、等しい量のリシン-完全なLym-1の注射を受ける。III群は、等しい量のリシン-Lym-1のF(ab')2フラグメントを受ける。IV群は、等しい量の複合体化されないリシンを受ける。V群は、PBSのみを受ける。
【0131】
8週間後、実施例14の方法を用いて、生存マウスの全ての免疫シントグラフィを行なった。I群のマウスは、他の群のいずれと比較しても、腫瘍の視覚化の減少を示す。生存するII群およびIII群のマウスは、幾らかの改善を示すが、I群のマウスほど劇的ではない。IV群のマウスは、ひどく不調になるか死亡する。
【0132】
従って、実施例24は、本発明の修飾抗体を用いる、腫瘍の1つの特定の処置を示す。実施例19は、本発明のPDP-修飾抗体を用いるときに得られる、優れた結果を示す。
【0133】
マウスまたはヒトのような他の哺乳動物で、他の腫瘍または疾患組織に特異的な他の抗体の使用に置き換えると、それらの特定の腫瘍または疾患組織を処置するのに、同様に効果的な結果を生じると考えられる。さらに、他の公知の毒素と置き換えても、同様に効果的な結果を生じると考えられる。実施例20は、ヒトの膵臓癌に対するのと同様に効果的な治療の使用を示す。PDP-修飾された抗体は、実施例で使用されるけれども、対応する完全な抗体よりも低いpIを有する修飾抗体を産生する、ビオチンのような他の物質で修飾された遊離アミノ基を有する抗体は、十分に等しく機能することが予想される。
【0134】
実施例25
ヒト膵臓癌の処置
ヒト膵臓腫瘍で見られる抗原に特異的であるモノクローナル抗体を得る。この抗体は、実施例1でのように、抗体分子当り平均して1個のPDP基に複合体化して修飾される。次に、メトトレキセートを、実施例19でリシンについで記載されたように、これらの修飾抗体に複合体化される。
【0135】
10人の膵臓癌患者の2つの群が処置される。第一群は、週を基礎として、PBS中薬剤-PDP-MAbの静脈内注射を20μg/全体重kgで、慣用されている療法と組合せて受ける。第二群は、コントロールとして、PBSの注射を慣用されている療法と組合せて受ける。10週間後、生存患者の免疫シントグラフィを行なう。
【0136】
免疫シントグラフィによると、第一群の患者で画像化された腫瘍の平均サイズが、コントロール群と比較すると減少する。
【0137】
従って、上記の実施例は、ヒトでの免疫療法における修飾抗体の利用性を示す。
【0138】
上述のように、本発明の1つの好ましい形態では、修飾抗体が薬学的組成物に配合される。従って、免疫療法のために薬剤と複合体化されるPDP-修飾抗体は、本発明の修飾抗体-毒素複合体の細胞障害的有効量を有する注射可能な組成物に組込まれても良い。下記は、ヒトのB細胞リンパ腫に対して効果的な細胞障害的に有効な組成物の例である。
【0139】
実施例26
ヒトのB細胞リンパ腫に対して効果的な薬学的組成物
実施例18からの修飾された放射性標識Lym-1 10 mg/mL
バランス リン酸緩衝食塩水(0.9%)
さらに、放射性標識された修飾MAb'sが、免疫シントグラフィにおいて、それらの特異的抗原を視覚化するのに有効な組成物に配合されても良い。下記は、そのような組成物の1例である。
【0140】
実施例27
結腸癌の免疫シントグラフィに効果的な薬学的組成物
実施例15からの修飾された放射性標識B72.3 10 mg/mL
バランス リン酸緩衝食塩水(0.9%)
実施例23は、放射性標識されたビオチン化抗体を局在化する1つの方法を例示するけれども、当業者は、標識抗体を局在化する代替される方法も適用されることを認識する。例えば、放射性標識されたビオチン化抗体の分布は、実施例14に記載されるように、正確に免疫シントグラフィで画像化して局在化され得る。従って、例えば、腫瘍抗原に関する結合特異性を有する放射ヨウ素化されたビオチン化MAbは、診断手順に有用であるであろう。下記の実施例は、そのような画像化手順がどのように為され得るかを記載する。
【0141】
実施例28は、放射性標識されたビオチン化MAb'sが、インビボで腫瘍細胞を画像化する1つの方法を記載する。
【0142】
実施例28
メラノーマ腫瘍細胞の画像化
転移性メラノーマと診断されたヒト患者を、まず同定する。免疫組織学的分析は、患者のメラノーマが、抗メラノーマMAbで染色可能な細胞表而抗原を発現することを示す。抗メラノーマMAbは、実施例19の方法により遊離アミノ基のビオチン化で最初に化学的修飾され、実施例20の方法により131Iで放射ヨウ素化される。次に、実質的に純粋な放射性標識されたビオチン化抗メラノーマMAbが、薬学的に許容される賦形剤と組合され、患者に投与される。3日後、注射された修飾MAb'sは、メラノーマ抗原を発現する細胞に実質的に局在化される。続いて、局在化されたMAb'sは、ピンホール・コリメーターおよびレイゼオンから得られるスペクトル91ガンマカメラを用いて、免疫シントグラフィによる画像化により視覚化される。写真による記録は、患者の皮膚上の放射能の小領域を示し、よって二次的腫瘍を同定する。
【0143】
特定の機械的または化学的なバリエーションが、それら自身を、当業者に提案し得ることが認識される。上記の実施例および詳細な説明は、例示によって与えられるものとして明確に理解され、本発明の精神および範囲は添付の請求の範囲によってのみ限定される。
【特許請求の範囲】
【請求項1】
修飾された抗体を産生するために抗体上に配置された複数の遊離アミノ基の少なくとも1個で化学的試薬と複合体化された抗体、該抗体は完全な抗体と比較して減少した正味の正電荷を有し、該抗体はF(ab')2フラグメントおよび同じタイプの完全な抗体のクリアランス速度の間のインビボ・クリアランス速度を有する、但し、該化学的試薬はヘテロ二官能性剤ではない;および、
修飾された抗体に付着した化学的部分、
を含む物質の組成物。
【請求項2】
前記抗体がモノクローナル抗体およびポリクローナル抗体からなる群から選択される、請求項1に記載の組成物。
【請求項3】
前記化学的試薬がビオチンである、請求項1に記載の組成物。
【請求項4】
前記化学的試薬がメチルキレート、他のキレート剤および染料からなる群から選択される、請求項1に記載の組成物。
【請求項5】
前記化学的試薬がN2S2、N2S4、EDTA、DPTA、TETAおよびFITCからなる群から選択される、請求項4に記載の組成物。
【請求項6】
化学的部分が標識である、請求項1に記載の組成物。
【請求項7】
標識が放射性核種である、請求項6に記載の組成物。
【請求項8】
放射性核種がハロゲン放射性核種およびテクニシウムからなる群から選択される、請求項7に記載の組成物。
【請求項9】
前記ハロゲン放射性核種が125Iおよび131Iからなる群から選択される、請求項8に記載の組成物。
【請求項10】
前記標識が磁気共鳴画像化により検出できる、請求項6に記載の組成物。
【請求項11】
化学的部分が生物学的に活性な分子である、請求項1に記載の組成物。
【請求項12】
前記化学的に活性な分子が毒素、薬剤およびキレートからなる群から選択される、請求項11に記載の組成物。
【請求項13】
前記薬剤がメトトレキセート、5-フルオロ-ウラシル、シス-プラチンおよびアドリアマイシンからなる群から選択される、請求項12に記載の組成物。
【請求項14】
前記毒素がリシンA鎖を含む、請求項12に記載の組成物。
【請求項15】
標識された抗体上に配置された遊離アミノ基で化学的試薬と複合体化された標識抗体、その結果、該抗体は完全な抗体と比較して減少した正味の正電荷を有する、但し、該化学的試薬はヘテロ二官能性剤ではない;および、
免疫シントグラフィに許容される薬学的な賦形剤、担体または基剤、
を含む、免疫シントグラフィのための薬学的組成物。
【請求項16】
抗体が放射性核種で標識されている、請求項15に記載の組成物。
【請求項17】
化学的試薬がビオチンである、請求項15に記載の組成物。
【請求項18】
前記化学的試薬がメチルキレート、他のキレート剤および染料からなる群から選択される、請求項15に記載の組成物。
【請求項19】
前記化学的試薬がN2S2、N2S4、EDTA、DPTA、TETAおよびFITCからなる群から選択される、請求項18に記載の組成物。
【請求項20】
増大した抗原結合特異性、減少した非特異性結合および減少したインビボ・クリアランス時間を有する標識された修飾抗体を調製する方法であって、
検出されるべき抗原に対する結合特異性を有する完全な抗体を得る工程、該天然の抗体はその上に配置された複数の遊離アミノ基を有する;
遊離アミノ基の少なくとも1つを化学的物質と反応させて修飾抗体を作製する工程、修飾抗体が完全な抗体の等電点よりも低い等電点を有するようにする;および
修飾抗体を検出可能な標識で標識し、それにより標識された修飾抗体を産生する工程、
を包含する方法。
【請求項21】
前記化学的物質がビオチンである、請求項20に記載の方法。
【請求項22】
前記化学的試薬がメチルキレート、他のキレート剤および染料からなる群から選択される、請求項20に記載の方法。
【請求項23】
前記化学的試薬がN2S2、N2S4、EDTA、DPTA、TFTAおよびFITCからなる群から選択される、請求項22に記載の方法。
【請求項24】
該標識はハロゲン放射性核種およびテクニシウムからなる群から選択される放射性核種である、請求項20に記載の方法。
【請求項25】
該標識が125Iおよび131Iからなる群から選択される、請求項20に記載の方法。
【請求項26】
前記標識が免疫シントグラフィにより検出可能である、請求項20に記載の方法。
【請求項27】
標識がガンマカメラにより検出可能である、請求項26に記載の方法。
【請求項28】
哺乳動物において抗原を局在化するのに使用されるための、請求項1−19のいずれかに記載の組成物。
【請求項29】
免疫シントグラフィで使用されるための、請求項28に記載の組成物。
【請求項30】
ガンマカメラ免疫シントグラフィで使用されるための、請求項28に記載の組成物。
【請求項31】
哺乳動物において疾患状態を処置するのに使用されるための、請求項1−19のいずれかに記載の組成物。
【請求項32】
哺乳動物で抗原を局在化する方法であって、
局在化されるべき抗原に関する結合特異性を有する標識された修飾抗体を得る工程、該標識された修飾抗体は同じタイプの非修飾抗体と比較して、より少ない遊離アミノ基および低い等電点を有し、該修飾された修飾抗体はその中に検出可能な標識を組込んで有する;
標識された修飾抗体を哺乳動物に投与して抗原および標識された修飾抗体をインビボで結合させる工程;および
抗原に結合した標識された修飾抗体を検出して抗原を局在化する工程、
を包含する方法。
【請求項33】
標識された修飾抗体が放射性核種で標識されている、請求項32に記載の方法。
【請求項34】
放射性核種がハロゲン放射性核種およびテクニシウムからなる群から選択される、請求項33に記載の方法。
【請求項35】
検出工程が免疫シントグラフィを含む、請求項32に記載の方法。
【請求項36】
免疫シントグラフィがガンマカメラの使用を含む、請求項35に記載の方法。
【請求項37】
標識された修飾抗体が遊離のアミノ基で化学的に修飾された完全な抗体を含む、請求項32に記載の方法。
【請求項38】
完全な抗体がヘテロ二官能性試薬と化学的に複合体化される、請求項37に記載の方法。
【請求項39】
前記完全な抗体がビオチンと化学的に複合体化される、請求項37に記載の方法。
【請求項40】
前記化学的試薬がメチルキレート、他のキレート化剤および染料からなる群から選択される、請求項32に記載の方法。
【請求項41】
前記化学的試薬がN2S2、N2S4、EDTA、DPTA、TETAおよびFITCからなる群から選択される、請求項40に記載の方法。
【請求項42】
哺乳動物の疾患状態を処置する方法であって、哺乳動物の疾患組織に特異的な完全な抗体を得ること、該完全な抗体は、その上に複数の遊離アミノ基を配置している;
遊離アミノ基の少なくとも1つを化学的試薬と複合体化して修飾して修飾抗体を産生すること、該修飾抗体は、完全な抗体と比較して減少した等電点を有する、但し該化学的試薬はヘテロ二官能性試薬ではない;
化学的試薬による修飾部位以外の修飾抗体上に配置された付着部位に生物学的に活性な分子を付着する;および
該抗体を哺乳動物に投与し、それにより疾患状態を処置する、
ことを包含する方法。
【請求項43】
前記化学的試薬がビオチンである、請求項42に記載の方法。
【請求項44】
前記化学的試薬がメチルキレート、他のキレート剤および染料からなる群から選択される、請求項42に記載の方法。
【請求項45】
前記化学的試薬がN2S2、N2S4、EDTA、DPTA、TETAおよびFITCからなる群から選択される、請求項44に記載の方法。
【請求項46】
生物学的に活性な分子が植物毒素、薬剤およびキレートからなる群から選択される、請求項45に記載の方法。
【請求項47】
前記薬剤がメトトレキセート、5-フルオロ-ウラシル、シス-プラチンおよびアドリアマイシンからなる群から選択される、請求項42に記載の組成物。
【請求項1】
修飾された抗体を産生するために抗体上に配置された複数の遊離アミノ基の少なくとも1個で化学的試薬と複合体化された抗体、該抗体は完全な抗体と比較して減少した正味の正電荷を有し、該抗体はF(ab')2フラグメントおよび同じタイプの完全な抗体のクリアランス速度の間のインビボ・クリアランス速度を有する、但し、該化学的試薬はヘテロ二官能性剤ではない;および、
修飾された抗体に付着した化学的部分、
を含む物質の組成物。
【請求項2】
前記抗体がモノクローナル抗体およびポリクローナル抗体からなる群から選択される、請求項1に記載の組成物。
【請求項3】
前記化学的試薬がビオチンである、請求項1に記載の組成物。
【請求項4】
前記化学的試薬がメチルキレート、他のキレート剤および染料からなる群から選択される、請求項1に記載の組成物。
【請求項5】
前記化学的試薬がN2S2、N2S4、EDTA、DPTA、TETAおよびFITCからなる群から選択される、請求項4に記載の組成物。
【請求項6】
化学的部分が標識である、請求項1に記載の組成物。
【請求項7】
標識が放射性核種である、請求項6に記載の組成物。
【請求項8】
放射性核種がハロゲン放射性核種およびテクニシウムからなる群から選択される、請求項7に記載の組成物。
【請求項9】
前記ハロゲン放射性核種が125Iおよび131Iからなる群から選択される、請求項8に記載の組成物。
【請求項10】
前記標識が磁気共鳴画像化により検出できる、請求項6に記載の組成物。
【請求項11】
化学的部分が生物学的に活性な分子である、請求項1に記載の組成物。
【請求項12】
前記化学的に活性な分子が毒素、薬剤およびキレートからなる群から選択される、請求項11に記載の組成物。
【請求項13】
前記薬剤がメトトレキセート、5-フルオロ-ウラシル、シス-プラチンおよびアドリアマイシンからなる群から選択される、請求項12に記載の組成物。
【請求項14】
前記毒素がリシンA鎖を含む、請求項12に記載の組成物。
【請求項15】
標識された抗体上に配置された遊離アミノ基で化学的試薬と複合体化された標識抗体、その結果、該抗体は完全な抗体と比較して減少した正味の正電荷を有する、但し、該化学的試薬はヘテロ二官能性剤ではない;および、
免疫シントグラフィに許容される薬学的な賦形剤、担体または基剤、
を含む、免疫シントグラフィのための薬学的組成物。
【請求項16】
抗体が放射性核種で標識されている、請求項15に記載の組成物。
【請求項17】
化学的試薬がビオチンである、請求項15に記載の組成物。
【請求項18】
前記化学的試薬がメチルキレート、他のキレート剤および染料からなる群から選択される、請求項15に記載の組成物。
【請求項19】
前記化学的試薬がN2S2、N2S4、EDTA、DPTA、TETAおよびFITCからなる群から選択される、請求項18に記載の組成物。
【請求項20】
増大した抗原結合特異性、減少した非特異性結合および減少したインビボ・クリアランス時間を有する標識された修飾抗体を調製する方法であって、
検出されるべき抗原に対する結合特異性を有する完全な抗体を得る工程、該天然の抗体はその上に配置された複数の遊離アミノ基を有する;
遊離アミノ基の少なくとも1つを化学的物質と反応させて修飾抗体を作製する工程、修飾抗体が完全な抗体の等電点よりも低い等電点を有するようにする;および
修飾抗体を検出可能な標識で標識し、それにより標識された修飾抗体を産生する工程、
を包含する方法。
【請求項21】
前記化学的物質がビオチンである、請求項20に記載の方法。
【請求項22】
前記化学的試薬がメチルキレート、他のキレート剤および染料からなる群から選択される、請求項20に記載の方法。
【請求項23】
前記化学的試薬がN2S2、N2S4、EDTA、DPTA、TFTAおよびFITCからなる群から選択される、請求項22に記載の方法。
【請求項24】
該標識はハロゲン放射性核種およびテクニシウムからなる群から選択される放射性核種である、請求項20に記載の方法。
【請求項25】
該標識が125Iおよび131Iからなる群から選択される、請求項20に記載の方法。
【請求項26】
前記標識が免疫シントグラフィにより検出可能である、請求項20に記載の方法。
【請求項27】
標識がガンマカメラにより検出可能である、請求項26に記載の方法。
【請求項28】
哺乳動物において抗原を局在化するのに使用されるための、請求項1−19のいずれかに記載の組成物。
【請求項29】
免疫シントグラフィで使用されるための、請求項28に記載の組成物。
【請求項30】
ガンマカメラ免疫シントグラフィで使用されるための、請求項28に記載の組成物。
【請求項31】
哺乳動物において疾患状態を処置するのに使用されるための、請求項1−19のいずれかに記載の組成物。
【請求項32】
哺乳動物で抗原を局在化する方法であって、
局在化されるべき抗原に関する結合特異性を有する標識された修飾抗体を得る工程、該標識された修飾抗体は同じタイプの非修飾抗体と比較して、より少ない遊離アミノ基および低い等電点を有し、該修飾された修飾抗体はその中に検出可能な標識を組込んで有する;
標識された修飾抗体を哺乳動物に投与して抗原および標識された修飾抗体をインビボで結合させる工程;および
抗原に結合した標識された修飾抗体を検出して抗原を局在化する工程、
を包含する方法。
【請求項33】
標識された修飾抗体が放射性核種で標識されている、請求項32に記載の方法。
【請求項34】
放射性核種がハロゲン放射性核種およびテクニシウムからなる群から選択される、請求項33に記載の方法。
【請求項35】
検出工程が免疫シントグラフィを含む、請求項32に記載の方法。
【請求項36】
免疫シントグラフィがガンマカメラの使用を含む、請求項35に記載の方法。
【請求項37】
標識された修飾抗体が遊離のアミノ基で化学的に修飾された完全な抗体を含む、請求項32に記載の方法。
【請求項38】
完全な抗体がヘテロ二官能性試薬と化学的に複合体化される、請求項37に記載の方法。
【請求項39】
前記完全な抗体がビオチンと化学的に複合体化される、請求項37に記載の方法。
【請求項40】
前記化学的試薬がメチルキレート、他のキレート化剤および染料からなる群から選択される、請求項32に記載の方法。
【請求項41】
前記化学的試薬がN2S2、N2S4、EDTA、DPTA、TETAおよびFITCからなる群から選択される、請求項40に記載の方法。
【請求項42】
哺乳動物の疾患状態を処置する方法であって、哺乳動物の疾患組織に特異的な完全な抗体を得ること、該完全な抗体は、その上に複数の遊離アミノ基を配置している;
遊離アミノ基の少なくとも1つを化学的試薬と複合体化して修飾して修飾抗体を産生すること、該修飾抗体は、完全な抗体と比較して減少した等電点を有する、但し該化学的試薬はヘテロ二官能性試薬ではない;
化学的試薬による修飾部位以外の修飾抗体上に配置された付着部位に生物学的に活性な分子を付着する;および
該抗体を哺乳動物に投与し、それにより疾患状態を処置する、
ことを包含する方法。
【請求項43】
前記化学的試薬がビオチンである、請求項42に記載の方法。
【請求項44】
前記化学的試薬がメチルキレート、他のキレート剤および染料からなる群から選択される、請求項42に記載の方法。
【請求項45】
前記化学的試薬がN2S2、N2S4、EDTA、DPTA、TETAおよびFITCからなる群から選択される、請求項44に記載の方法。
【請求項46】
生物学的に活性な分子が植物毒素、薬剤およびキレートからなる群から選択される、請求項45に記載の方法。
【請求項47】
前記薬剤がメトトレキセート、5-フルオロ-ウラシル、シス-プラチンおよびアドリアマイシンからなる群から選択される、請求項42に記載の組成物。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17A】


【図17B】


【図17C】


【図17D】


【図18】


【図19】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17A】


【図17B】


【図17C】


【図17D】


【図18】


【図19】


【公開番号】特開2012−131808(P2012−131808A)
【公開日】平成24年7月12日(2012.7.12)
【国際特許分類】
【外国語出願】
【出願番号】特願2012−24825(P2012−24825)
【出願日】平成24年2月8日(2012.2.8)
【分割の表示】特願平9−525384の分割
【原出願日】平成9年1月6日(1997.1.6)
【出願人】(506048038)ペレグリン ファーマシューティカルズ,インコーポレーテッド (2)
【Fターム(参考)】
【公開日】平成24年7月12日(2012.7.12)
【国際特許分類】
【出願番号】特願2012−24825(P2012−24825)
【出願日】平成24年2月8日(2012.2.8)
【分割の表示】特願平9−525384の分割
【原出願日】平成9年1月6日(1997.1.6)
【出願人】(506048038)ペレグリン ファーマシューティカルズ,インコーポレーテッド (2)
【Fターム(参考)】
[ Back to top ]

