温熱療法におけるサセプタとその使用法
【解決手段】 温熱療法適用において集団的挙動及び増強加熱能力を示す非標的磁気ナノ粒子が記載され、そのような非標的磁気ナノ粒子を用いた方法も同様に記載されるものである。
【発明の詳細な説明】
【技術分野】
【0001】
本出願は2007年1月19日付けで出願された「Thermotherapy Susceptors,Pharmaceutical Compositions Containing Thermotherapy Susceptors and Methods of Using Same」と題する米国仮特許出願第60/885,726号への優先および利益を主張するものであり、内容は全て本明細書に参照として完全に組み込まれるものである。
【背景技術】
【0002】
癌および病原体による疾患などに対する従来の治療法の中には侵襲的ものがあり、有害な副作用(正常細胞に対する毒性、身体の正常機能の破壊、など)を伴い、治療を耐えられないものとし、その反面得られる成果はわずかであることも多い。例えば、癌に対する従来の治療法の中には、手術に続いて放射線照射および/または化学療法を行うものがある。これらの方法は必ずしも有効でなく、また、たとえ有効であっても外観を損なったり、標的組織の除去を不完全なものとし再発を生じることがある。さらに、放射線療法および化学療法はつらく、再発に対し完全に有効ではない。そのため、患者にとっては低侵襲的で負担が少なく、病変組織、病原体、または身体中の他の好ましくない物体などの標的部位に対してのみ効果を発揮する方法が望ましい。
【発明の概要】
【課題を解決するための手段】
【0003】
本明細書に記載した本発明の実施形態は、相互作用半径が約100nm〜50μmの複数個の非標的磁性ナノ粒子および薬学的に許容可能な担体を含有する治療用組成物を対象としており、一部の実施形態においては前記複数個の非標的磁性ナノ粒子の相互作用半径は約200nm〜25μmである。
【0004】
様々な実施形態において、前記複数個の非標的磁性ナノ粒子は、安定的な単一磁区ナノ粒子、超常磁性粒子、およびそれらの組合せであり、そのような実施形態においては前記非標的磁性ナノ粒子は磁場に晒されると明らかに熱的に遮蔽され加熱される。一部の実施形態において、複数個の非標的磁性ナノ粒子の平均サイズは約1μm未満であり、他の実施形態においては複数個の非標的磁性ナノ粒子の平均サイズは約0.1〜800nmである。特定の実施形態において、前記複数個の非標的磁性ナノ粒子の多分散性は約0.1〜1.5である。複数個の非標的磁性ナノ粒子は、Fe3O4、γ−Fe2O3、FeCo/SiO2、Co36C64、Bi3Fe5O12、BaFe12O19、NiFe、CoNiFe、Co−Fe3O4、FePt−Ag、およびそれらの組合せなどの材料から生成される。
【0005】
特定の実施形態において、前記複数個の非標的磁性ナノ粒子にはコアおよびコーティングが含まれる。そのような実施形態においては、コアにはFe3O4、γ−Fe2O3、FeCo/SiO2、Co36C64、Bi3Fe5O12、BaFe12O19、NiFe、CoNiFe、Co−Fe3O4、FePt−Agおよびそれらの組合せなどの物質が含まれ、コーティングにはポリマー、生物材料、無機コーティング材料、およびそれらの組合せなどの物質が含まれるがそれらに限定されない。一部の実施形態において、前記ポリマーは例えばアクリレート、シロキサン、スチレン、アセテート、アルキレングリコール、アルキレン、アルキレンオキシド、パリレン、乳酸、グリコール酸、ヒドロゲルポリマー、ヒスチジン含有ポリマー、およびそれらの組合せである。他の実施形態において、前記生物材料はヘパリン、ヘパリン硫酸、コンドロイチン硫酸、キチン、キトサン、セルロース、デキストラン、アルギン酸塩、でんぷん、炭水化物、グリコサミノグリカン、細胞外基質タンパク質、プロテオグリカン、糖タンパク質、アルブミン、ゼラチン、およびそれらの組合せのいずれでもよく、またそれらに限定されない。また、さらに別の実施形態において、前記無機コーティング材料は金属、金属合金、またはセラミックである。特定の実施形態において、前記コアはマグネタイトであり、前記コーティングはデキストランであり、前記コーティングは少なくとも2層のデキストランから成る。
【0006】
一部の実施形態において、前記複数個の非標的磁性ナノ粒子の飽和磁気は約10〜100kA−m2/gであり、他の実施形態においては交流磁場に曝露された場合の前記複数個の非標的磁性ナノ粒子の比吸収率(SAR)は約100〜1500W/gである。
【0007】
様々な実施形態において、前記薬学的に許容可能な担体には、水、緩衝用水、生理食塩水、リンゲル液、グリシン、ヒアルロン酸、デキストロース、アルブミン溶液、オイル、またはそれらの組合せが含まれ(それらに限定されるものではないが)、一部の実施形態においては前記組成にはさらに、安定剤、抗酸化剤、浸透圧調整剤、緩衝液、pH調整剤、キレート剤、カルシウムキレー錯体、塩類、またはそれらの組合せなどのうち1若しくはそれ以上の添加剤が含まれる(それらに限定されるものではない)。様々な実施形態の治療用組成物は、液体、ゲル、軟膏、ローション、固形物、または半固形物として製造される。一部の実施形態において、前記組成物には標的磁性ナノ粒子が含まれ、他の実施形態においては前記組成物には化学療法剤、放射線療法剤、血管浸透性強化剤、抗炎症剤、麻酔剤、鎮痛剤、鎮静剤、抗生剤(これらに限定されない)、およびそれらの組合せなどのうち1若しくはそれ以上の補助剤が含まれる。
【0008】
本発明の他の実施形態は、相互作用半径が約100nm〜約50μmの複数個の非標的磁性ナノ粒子および薬学的に許容可能な担体または賦形剤を含有する有効量の治療用組成物の投与、および複数個の非標的磁性ナノ粒子の加熱を誘発できるエネルギーへの患者の曝露による腫瘍原性組織の治療法を対象とする。特定の実施形態において、前記複数個の非標的磁性ナノ粒子の相互作用半径は約200nm〜25μmである。
【0009】
様々な実施形態において、前記腫瘍原性組織は充実性腫瘍である。一部の実施形態における投与には当該腫瘍原性組織と当該治療用組成物との直接的接触が含まれる。他の実施形態において、投与には当該治療用組成物の当該腫瘍原性組織への直接的適用が含まれ、さらに別の実施形態においては、投与には腫瘍への当該治療用組成物の注入が含まれる。
【0010】
特定の実施形態において、そのような方法は放射線療法、化学療法、外照射療法、手術、光線力学療法(photodynamic therapy:PDT)、生物剤を用いた治療法、またはそれらの組合せにより実施される。
【0011】
実施形態のエネルギーは、交流磁場(Alternating magnetic field:AMF)として例えばマイクロ波エネルギー、音響エネルギー、およびそれらの組合せであり、特定の実施形態において当該エネルギーは交流磁場(AMF)である。そのような実施形態において、交流磁場の周波数は約80〜800kHzであり、他の実施形態において交流磁場の振幅は約1〜120kA/mである。
【0012】
本発明のさらに別の実施形態には、相互作用半径が約100nm〜約50μmの複数個の非標的磁性ナノ粒子および薬学的に許容可能な担体または賦形剤を含有する有効量の治療用組成物を投与する工程、および複数個の非標的磁性ナノ粒子の加熱を誘発できるエネルギーへの患者へ曝露する工程による関節炎症の治療法が含まれる。特定の実施形態において、前記複数個の非標的磁性ナノ粒子の相互作用半径は約200nm〜25μmである。
【0013】
一部の実施形態における投与には、炎症を起こした滑膜組織、瘢痕組織、免疫細胞、およびそれらの組合せを前記治療用組成物に直接接触させる工程が含まれる。他の実施形態において、投与には当該治療用組成物を当該関節に直接適用する工程を含むものであり、さらに別の実施形態においては、投与には当該治療用組成物の当該関節への注入が含まれる。特定の実施形態において、投与にはさらに1若しくはそれ以上の抗炎症剤、麻酔剤、鎮痛剤、鎮静剤、抗生剤またはそれらの組合せの投与が含まれる。
【0014】
様々な実施形態において、前記エネルギーは交流磁場(AMF)、マイクロ波エネルギー、音響エネルギー、およびそれらの組合せである。一部の実施形態において、曝露には少なくとも患者の一部分への交流磁場(AMF)の印加が含まれる。特定の実施形態において、前記交流磁場の周波数は約80〜800kHzであり、他の実施形態において前記交流磁場の振幅は約1〜120kA/mである。
【0015】
関節炎症は実施形態を通じて様々であり、例えば外傷、疾病、関節炎、およびそれらの組合せの結果として発生する。一部の実施形態において関節炎は一般的関節炎、関節リウマチ、骨関節炎、腱炎、滑液包炎、線維筋痛、およびそれらの組合せであり、他の実施形態において疾患は痛風、ループス、くる病、強直性脊椎炎、シェーグレン症候群、またはそれらの組合せなどである。
【図面の簡単な説明】
【0016】
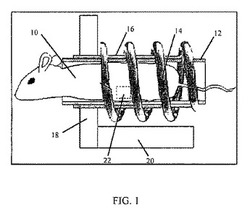
【図1】図1はインビボマウス試験に用いられた交流磁場ソレノイドの概略を示したものである。
【図2】図2はサンプルA(A.)およびサンプルB(B.)の透過電子顕微鏡写真を示したものである。
【図3】図3はH2O中(黒色)およびD2O中(濃灰色)のサンプルAおよびH2O中(中灰色)およびD2O中(淡灰色)のサンプルBに関するSANS/USANSデータを示している。エラーバーは±1標準偏差を示したものである。
【図4】図4はサンプルA(灰色三角)およびサンプルB(黒色円)に関し酸化鉄塊に正規化した295Kにおけるヒステリシスループを示したものである。
【図5】図5は100%H2O中(灰色)および100%D2O中(黒色)のサンプルBに関するSANS/USANSデータを示したものである。100%H2O中(淡灰色ライン)のサンプルBのフィットも示している。
【図6】図6は100%H2O(黒色)、50%H2O(淡灰色)、25%H2O(濃灰色)、および10%H2O(中灰色)中のサンプルBに関するSANSデータおよびフィット(生データ上のライン)を示したものである。
【図7】図7はサンプルB(黒色円)およびサンプルC(灰色三角)に関する酸化鉄塊に正規化した295Kにおけるヒステリシスループを示したものである。挿入部分は0および86kA/mの磁場におけるデータのクローズアップを示している(1080 Oe)。
【発明を実施するための形態】
【0017】
本組成物および方法について記載する前に、本発明は、記載の特定のプロセス、組成物、または方法論に限定されない(これらは様々であり得る)ことにつて理解することが必要である。記載に用いられた用語は、特定の見解または実施形態の記述のみを目的に用いられたものであり、添付の請求項によってのみ限定される本発明の範囲の限定を意図したものではないことについても理解されることが必要である。
【0018】
本明細書および添付請求項に記載したように、文脈から明らかに他の意味が示される場合を除き、単数形「一つの」および「前記」には複数への言及が含まれることに留意する必要がある。特に別の指定がない限り、本明細書に記載された技術用語および科学用語はいずれも当業者によって一般に理解されるものと同じ意味を有する。本発明の実施形態の実践または試験には、本明細書に記載したものと同様または同等の任意の方法が使用可能であるが、好ましい方法を記載する。本明細書に記載した出版物および参考文献はいずれも参照により組み込まれている。本明細書に記載した何ごとも、先行発明のため本発明がそのような開示に先行する資格がないことを認めたものと解釈されるべきではない。
【0019】
本明細書において使用される、「約」の用語は共に用いられる数値±10%を意味する。したがって、約50%は45%〜55%を意味する。
【0020】
「選択的」または「選択的に」は、それに続いて記載される構造、事象、または状況が生じる場合と生じない場合とがあることを意味すると考えてよく、またその記載にはその事象が生じる場合および生じない場合が含まれると考えてよい。
【0021】
治療薬との関連で用いられる「投与」とは、薬剤を標的組織内または標的組織上に直接投与するか、標的とする組織にプラスの影響を及ぼすように患者に薬剤を施すことを意味する。組成物の「投与」は注射または注入により、またはいずれかの方法を他の既知の技法と組み合わせることにより達成される。そのような結合手法には加熱、放射、および超音波が含まれる。
【0022】
本明細書での使用における「標的」の用語は、非活性化、破裂、崩壊、または破壊が望ましい物質を指す。例えば、異常細胞、病原体、または感染物質は患者において望ましくない物質と見なしてよく、治療の標的である。
【0023】
一般的に言えば、「組織」の用語は特定機能の遂行において結束した、同様に分化した細胞の集合体を指す。
【0024】
本明細書での使用における「病変組織」の用語は、骨、肺、血管、神経、大腸、卵巣、乳房、および前立腺の癌など(それらに限定されない)、任意の種類の固形腫瘍癌を含む病態または症状に関連した組織または細胞群を指す。他の種類の「病変組織」には炎症性滑膜組織などの関節炎組織が含まれる。
【0025】
用語「改善する」は、本発明の提供、適用、または投与の対象となる組織の外観、形状、特性、および/または物理的属性を変化させることを意味する。
【0026】
本明細書での使用において、「治療薬」の用語は患者の好ましくない状態または疾病を治療、対抗、改善、または予防するのに用いられる薬剤を意味する。
【0027】
本明細書での使用における組成物の「治療的有効量」または「有効量」とは、望ましい効果を達成するように計算された所定量を指す。
【0028】
本明細書での使用において、「ハイパーサーミア」の用語とは組織を約40〜60℃に加熱することを指す。
【0029】
本明細書での使用における「交流磁場」または「AMF」の用語は、通常は正弦波、三角波、矩形波、または同様の形状パターンにより、自らのベクト方向を周波数約80〜800kHzで定期的に変化させる磁場を指す。生じる磁場ベクトルのAMF部分のみが方向を変えるように、静磁場にAMFを加えられることもある。交流磁場には交流電場が伴っており、実際は電磁気であることが理解されるであろう。
【0030】
本明細書での使用における「エネルギー源」の用語は、治療薬の潜在的放射能源を活性化する目的でAMF以外の形態のエネルギーを治療薬に送達することのできる装置を指す。
【0031】
本明細書での使用における用語「負荷サイクル」は、一つのオン−オフサイクルにおいてエネルギー源がオンおよびオフである合計時間に対するエネルギー源がオンの時間の比を指す。
【0032】
温熱療法は、細胞の瞬間壊死(通常「温熱切除」と呼ばれる)および/または熱ショック応答を誘発(古典的ハイパーサーミア)し当該細胞内に一連の生化学変化を介した細胞死を引起すことから、癌および他の疾患の治療法として期待される。約40〜46℃の温度は病変細胞に不可逆的な損傷を与える一方で、正常細胞は最大46.5℃の温度への曝露に耐えられるため、病変組織において細胞の温度を約40〜46℃まで上昇させることにより、正常組織には損傷を与えずに病変細胞を選択的に破壊するという治療選択肢が得られる。46℃を超える温度は、瞬間的な温熱切除反応を引起すことによって癌および他の疾患の治療に有効である可能性がある。
【0033】
位相同期輪状配列システム(APAS)など、マイクロ波またはラジオ周波数(RF)ハイパーサーミアを用いた最先端のシステムは、深部腫瘍の局所加熱用エネルギーの調整を試みるものである。そのような技法は組織電気伝導率および高度灌流組織の不均一性によって制限される。これは非標的組織における「ホットスポット」とともに所望領域における用量不足という未解決の問題を引起す。その結果、治療比はしばしば予想を下回り、所望領域に送達された熱量を十分な精度で測定できないという特有の困難を生じる。後者は、治療後に再生可能かつ予測可能な患者利益を確保するために必要な規範的臨床試験計画書の作成を不可能にする。これらの要素のいずれもが、そのようなシステムによる特定領域の選択的加熱を極めて困難にする。
【0034】
本明細書で提案される発明の様々な実施形態は、温熱療法化合物およびそのような温熱療法化合物の病変組織治療への使用法を対象とする。本明細書に記載された温熱療法組成物は任意の方法で処方可能である。例えば一部の実施形態において、当該温熱療法組成物は被験者に送達され治療に利用される治療薬として生成される。他の実施形態において、本発明の温熱療法組成物は被験者に薬剤として送達される医薬組成物として生成される。さらに別の実施形態において、当該温熱療法組成物は温熱療法使用法に連動して被験者に投与される。
【0035】
一般に、実施形態の温熱療法には、交流磁場(AMF)などのエネルギー源の存在下に磁気ヒステリシス損失により発熱するエネルギー感受性物質である複数個の磁性ナノ粒子または「サセプタ」が含まれる。本明細書に記載された方法は一般に、治療を必要とする対象への温熱療法化合物の有効量を投与する工程、および同対象へエネルギーを適用する工程から成る。エネルギーの適用によって磁性ナノ粒子は誘導加温され、温熱療法化合物が投与された組織は組織除去に十分なほど加熱される。
【0036】
発生する熱は、当該物質の磁性が印加交流磁場に応じて振動する際のエネルギー損失に相当する。磁場サイクル当たりの熱発生量およびエネルギー損失に関与するメカニズムは、サセプタおよび磁場両方の固有の性質に左右される。サセプタはAMFに晒されるとキュリー温度として知られる特有の温度まで加熱される。キュリー温度は、磁性材料が強磁性体から常磁性体へ可逆的変化を起こす温度である。この温度未満では磁性材料は印加AMF中で加熱される。しかし、キュリー温度を上回ると当該磁性材料は常磁性となり、その磁区はAMFに反応しなくなる。したがって、キュリー温度を上回るAMFに曝露された場合、当該材料は熱を発生しない。当該材料がキュリー温度未満に冷めると磁性を回復し、当該AMFが存在する限り加熱を再開する。このサイクルはAMFへの曝露期間中継続的に繰り返される。したがって、磁性材料は加熱温度を自己調節することができる。サセプタがどこまで加熱されるかは、とりわけ当該材料の磁性、当該磁場の特性、および当該標的部位の冷却能力に依存する。
【0037】
材料組成、サイズ、および形状といったサセプタに関する多くの特徴が加熱特性に直接影響を及ぼし、これらの特徴は組織型内に見られる特定の条件一式に対する加熱特性を同時に調整するようにデザインされている。例えば、サセプタの粒径範囲および構成材料は特定の適用に依存する。さらに、磁性材料およびAMF特性の選択は、特定組織または標的タイプの治療効果を最適化するように調整される。様々な実施形態において、サセプタはキュリー温度約40〜500℃を達成するように生成される。
【0038】
様々な実施形態のサセプタには一般に磁性ナノ粒子またはその集合体が含まれ、特定の実施形態においては当該サセプタは単一磁区粒子である。磁場を維持できる材料はいずれも実施形態の磁性ナノ粒子の作成に用いることができ、本分野で知られた単一磁区粒子はいずれもサセプタとして有用である。例えば、サセプタにはマグネタイト(Fe3O4)、マグヘマイト(γ−Fe2O3)およびFeCo/SiO2などの材料が含まれ(これらに限定されない)、一部の実施形態においてはサセプタには例えばCo36C64、Bi3Fe5O12、BaFe12O19、NiFe、CoNiFe、Co−Fe3O4、およびFePt−Agなどの超常磁性粒子の集合体が含まれ、当該集合体の状態は磁気遮蔽を誘発する。他の実施形態においては、例えばMnNまたはMnxNyなどの窒素をドープしたMnクラスター(xおよびyはゼロ以外の数字)が磁気サセプタとして使用される。密度関数理論に基づく計算により、小Mnクラスターの安定性および磁性は窒素の存在によって根本的に変わり得ることが示される。そのような組成物は強磁性体であり、大きな磁気モーメントを有する。さらに、それらの結合エネルギーは大幅に増強され、Mn部位における当該磁気モーメント間の結合はそれらのサイズまたは形状に関わらず依然として強磁性である。さらに別の実施形態において、サセプタはNd1−xCaxFeO3である。理論に束縛されるものではないが、弱い強磁性の自発磁化はCa含有量または粒子サイズが増すにつれて低下する。
【0039】
本発明の実施形態において有用な例示的サセプタには、例えばFerrotec Corp.(ニューハンプシャー州Nashua)のシリーズEMG700およびEMG1111酸化鉄粒子(直径約110nm)(Oerstedt流速密度1,300、周波数150kHzで比吸収率(SAR)約310ワット/グラム)、およびInframat Corp.(コネチカット州Willington)のFeCo/SiO2粒子(同じ磁場条件においてSAR約400ワット/グラム)などがある。
【0040】
一部の実施形態において、サセプタの材料組成は特定の標的によって様々である。さらに具体的に言えば、磁性材料の自己限定的キュリー温度は送達熱総量と同様に当該材料組成と直接的に関連しているため、磁性粒子組成は異なった組織または標的タイプに合わせることが可能である。各標的タイプは、組成および身体内の位置を考えた場合、特有の加熱および冷却能を有するため、これは必要である。例えば、血液供給に乏しい部位に位置する腫瘍および比較的絶縁部位に位置する腫瘍は大血管の近くに位置する腫瘍に比べて低いキュリー温度材料が必要である。血流内の標的も異なったキュリー温度材料が必要である。したがって、例えばマグネタイトでできたサセプタには、コバルト、鉄、希土類金属などの元素、またはさらに別の元素の組合せが含まれる可能性がある。
【0041】
一部の実施形態において、サセプタは組織の環境からサセプタを保護するため、またはサセプタの特性を増強または調整するためにコーティングされる。コーティングに適した材料としては、合成高分子、生体高分子、共重合体、ポリマーブレンド、および無機材料が挙げられる。
【0042】
高分子材料としては、アクリレート、シロキサン、スチレン、アセテート、アルキレングリコール、アルキレン、アルキレンオキシド、パリレン、乳酸、グリコール酸、ヒドロゲルポリマー、ヒスチジン含有ポリマー、およびそれらの組合せなどが挙げられるが、それらに限定されるものではない。特定の実施形態において、高分子材料はヒドロゲルポリマーとヒスチジン含有ポリマーとの組合せである。
【0043】
サセプタのコーティングに用いられる生物材料としては、多糖類、ポリアミノ酸、タンパク質、脂質、グリセロール、脂肪酸など、およびそれらの組合せがある。例えば、ヘパリン、ヘパリン硫酸、コンドロイチン硫酸、キチン、セルロース、デキストラン、アルギン酸塩、でんぷん、炭水化物、グリコサミノグリカンなどの生物材料、およびそれらの組合せ、または細胞外基質タンパク質、プロテオグリカン、糖タンパク質、アルブミン、ゼラチンなどのタンパク質、およびそれらの組合せをサセプタのコーティングに用いる。
【0044】
無機コーティング材料としては例えば、金属、金属合金、ヒドロキシアパタイトなどのセラミック、炭化ケイ素、カルボン酸塩、スルホン酸塩、リン酸塩、フェライト、ホスホン酸塩、および元素周期表のグループIV元素の酸化物などによる任意の組合せが挙げられる。特定の実施形態において、これらの材料は1若しくはそれ以上の生体高分子または合成高分子を含有する複合コーティングを形成する。一部の実施形態において、前記コーティングには放射性元素または潜在的放射性元素も含まれる。
【0045】
一実施形態において、前記コーティング材料は金である。理論に束縛されるものではないが、金は生体適合性がある一方で、保護コーティングを形成し、サセプタにおける酸化などの化学的変化を予防する可能性がある。さらに、金は良導体としてAMF加熱に関連した渦電流加熱を増強する可能性がある。別の実施形態において、コーティング中の金は例えばチオールによって化学修正され、シラン、カルボキシル、アミン、または水酸基、またはそれらの組合せに結合する可能性がある。コーティング材料表面を修正するための他の化学的手法も利用可能である。
【0046】
他の実施形態において、上記のようなコーティング材料にはサセプタの細胞内への輸送を促進する1若しくはそれ以上のトランスフェクション剤が含まれる。例えば、特定の実施形態において、コーティング材料にはプラスミド、ウイルス、ファージ、ビリオンなどのベクター、プリオン、多糖類、カチオン性リポソーム、両親媒性物質、非リポソーム性脂質、またはそれらの組合せが含まれる。他の実施形態において、前記コーティング材料はトランスフェクション剤と有機および無機材料との混合物または組合せであり、そのような混合物は対象内の特定の種類の病変組織および特定の場所に合わせて作成される。
【0047】
特定の実施形態において、サセプタは保護コーティングを必要とし、コーティング材料の使用はコア材料を薬品による腐食から保護するため、また対象をコア材料の有毒作用から保護するために重要である。例えば、イオン、コバルト、他の磁性金属、および安定性に劣るそれらの酸化物をコーティングして酸化を予防する。さらに、これら金属の磁性は酸化によって著しく変化する可能性がある。特定の例において、コーティングされていないマグネタイトFe3O4は投与されると酸化してマグヘマイト(γ−Fe2O3)および最終的にはヘマタイト(α−Fe2O3)を形成し、酸化に伴ってマグネタイト・サセプタの磁性は低下する。他の実施例において、インビボにおいて前記サセプタ材料がヒトおよび動物に毒性リスクを及ぼす可能性がある場合に保護コーティングが使用される。
【0048】
一部の実施形態のサセプタにはさらに1若しくはそれ以上の放射性同位体が含まれ、病態治療に対し放射および加熱の相乗効果が得られることがある。疾患の治療に有用な任意の放射性同位体がそのような実施形態での使用に適しており、標的温熱療法の治療可能比を高める可能性がある。適切な放射性同位体としては例えば、ヨウ素−131、コバルト−60、イリジウム−192、イットリウム−90、ストロンチウム−89、サマリウム−153、レニウム−186、およびテクネチウム−99mが挙げられるが、それらに限定されない。一部の実施形態の放射性同位体は患者に通常量として約20〜60Gyを送達するように選択される。他の実施形態において、前記放射性同位体は化学療法の前に致死未満量(20Gy未満)を送達し、温熱療法開始時または終了時に致死量の放射線を送達する。放射線の線量レベルは放射性同位体の選択により、当該サセプタ組成における放射性同位体の組み込みを調節することによって、またはそれらの組合せにより調節可能である。放射線量のさらなる調節は、放射性サセプタおよび非放射性サセプタの混合物を含んだサセプタ懸濁液の使用により達成可能である。
【0049】
さらなる実施形態のサセプタには、ニュートロンまたはプロトンなどの素粒子およびX線などのイオン化放射線に対する高吸収性断面を有し、非放射性であるが不安定な核を有する、1若しくはそれ以上の同位体が含まれる。これらの同位体の核は放射線または素粒子を吸収し、核は不安定となってその崩壊に伴い放射線を放出する。例えば、ホウ素−10はニュートロンの捕獲に伴って放射線を放出することが知られている。ニュートロン高吸収性断面を有する同位体としては、例えばサマリウム−149、ガドリニウム−157、およびガドリニウム−155などのランタニドが挙げられる。特定の実施形態において、磁性であり、また磁性ナノ粒子に組み込むことによって当該ナノ粒子の磁性を高め得ることからサマリウムが使用される。
【0050】
さらに別の実施形態において、サセプタには1若しくはそれ以上の画像用アイソトープが含まれる。本明細書に記載されたサセプタの磁気的性質により、当該サセプタは核磁気共鳴画像法(MRI)または超電導量子干渉素子(SQUID)に基づいた方法などの磁気画像法のための適切な造影剤となる。画像用アイソトープには、鉄、酸化Fe3O4またはFe2O3などのフェライトの小常磁性または超常磁性粒子が含まれる。一部の実施形態において、温熱療法およびMRI、PET、SPECT、生体インピーダンスなどの画像法を組合せ、当該サセプタの投与前、投与中、または投与後に視覚化が行われる。例えば、サセプタをサンプルの臓器内または組織中に注入する。次にMRI造影用アイソトープを用いて標的臓器または組織を視覚化し、AMFを用いて当該標的組織を破壊する。さらに別の実施形態において、モリブデン−99、テクネチウム−99m、クロミウム−51、銅−64、ジスプロシウム−165、イッテルビウム−169、インジウム−111、ヨウ素−125、ヨウ素−131、イリジウム−192、鉄−59、リン−2、カリウム−42、ロジウム−186、レニウム−188、サマリウム−153、セレニウム−75、ナトリウム−24、ストロンチウム−89、キセノン−133、キセノン−127、およびイットリウム−90など(これらに限定されない)の放射線画像分子をサセプタ中に組み込むことも可能である。次にこれらの放射線画像分子を用いて標的臓器または組織を視覚化し、AMFを用いて当該標的組織または臓器を破壊する。
【0051】
当該サセプタのサイズは本発明の実施形態によって様々である。一般に、サセプタサイズの下限は、その下に単一磁区構造が存在する直径である。大きな磁性体は磁区またはブロッホ壁で分割され、磁壁によって提供されるエネルギーに加え、静磁エネルギー、交換エネルギー、および異方性エネルギーを含む全粒子エネルギーを最小化する、一様に磁化された領域となる。エネルギーの最終バランスが磁性材料内の磁区の数と形状の両方を決定し、磁性粒子のサイズが縮小するにしたがって磁区のサイズも縮小する。したがって磁壁形成にも、磁区の一区画を一定の数およびサイズに制限する関連エネルギーコストが伴う。下限は「単一磁区粒子」と称され、寸法制限は自発磁化および磁気異方性および交換エネルギーに応じて約0.1〜800nmである。しかし、一部の実施形態において、サセプタの粒子サイズは最大約1μmである。他の実施形態において、サセプタ粒子サイズは約1〜750nmであり、さらに別の実施形態において、サセプタ粒子サイズは約5〜500nmである。特定の実施形態において、サセプタの粒子サイズは約10〜250nmである。
【0052】
理論に束縛されるものではないが、粒子サイズが減少するほど、粒子表面および/または界面領域に曝露される原子の割合は上昇し、このことは粒子の磁性に及ぼす表面および界面電子構造の重要性を高める。したがって自発磁化および磁気結晶異方性など材料に内在する磁性は粒子サイズに強く影響される可能性がある。例えば、磁気異方性エネルギー総量は、表面異方性部分の割合が増えるため、粒子サイズが減少するにしたがって増加する可能性がある。さらに、静磁場、形状、およびストレスが、粒子サイズが減少するにつれてますます重要となる可能性があり、磁気結晶異方性と相まって単一磁区粒子の総磁気異方性エネルギーを決定する可能性がある。様々な実施形態において、強化された異方性は交流磁場(AMF)に晒された場合にこれらの材料のヒステリシス損失を増加させる可能性があり、これはひいてはより高い比吸収率(SAR)および加熱能の向上をもたらす。
【0053】
例えば、単一磁区を有する磁性体、すなわち単一磁区粒子、磁気モーメントmの作用は磁性粒子の総磁気異方性エネルギーに左右される可能性がある。変数mは、当該磁区の磁化の規模および方向を、時間、環境(温度、外部磁場、など)、および当該磁性ナノ粒子の結晶軸に対する磁気モーメントの方向に関連して規定するベクトルのことである。さらに、mは過去および現在の両方における当該磁気異方性エネルギーおよび物理的環境の産物である可能性がある。
【0054】
さらに具体的には、交流磁場(AMF)に曝露された際の単一磁区粒子のヒステリシス損失を介した熱生成能は、当該粒子内のエネルギーバランスによって決定される。これらのうち、磁気異方性エネルギーの合計が当該磁気モーメントmの方向変化に対するエネルギー障壁EBを示す。したがって、時間との兼ね合いにおけるmの安定性はEBの値が上昇するにつれて上昇する。粒子容積VおよびEBが結合して粒子の固有特性である特性緩和時間τOを定義する。これは十分に強力な磁場によって強制的に方向を変えられた後に、開始値に向けてmの方向に自然変動または自発的弛緩するのに要する時間である。したがって、τOは粒子内の対称性およびmが利用できる緩和経路に加え、粒子の組成、容積、および形状など様々なパラメータに依存する。
【0055】
単一磁区粒子における磁気異方性エネルギー、または潜在的ヒステリシス損失は第一近似において当該粒子の容積に比例する。したがって、大きな単一磁区粒子の場合、磁気異方性エネルギーが高すぎて磁化反転に対するエネルギー障壁は当該材料のキュリー温度未満では熱エネルギーによって越えることができない。当該粒子のmが変動しない場合、単一磁区粒子は安定的と言え、mが時間との兼ね合いで変動しない場合、当該粒子は本質的に安定した単一磁区作用を示す。当該粒子が磁気異方性エネルギーを克服するのに十分なほど強い外部磁場に曝露され、mの変化若しくは反転が強いられた場合、本質的に安定した単一磁区において磁化反転が生じる可能性がある。磁気異方性エネルギーは磁気モーメントの回転に対する障壁であるため、このベクトルにおけるそのような空間的変化には熱の形態によるエネルギーの放出が伴う。したがって放出熱の量は第一近似において当該磁気異方性エネルギーと比例する。
【0056】
さらに、AMFに曝露された際に単一磁区粒子のヒステリシス損失を通じて実現される熱の量は実験条件によって異なる。実験温度がEBと当該システムに利用できるエネルギーとの間の相対的差異を決定し、実験的緩和時間またはτを設定する。この関係は方程式1によって定義される。
【0057】
【数1】

【0058】
熱エネルギーは生成物κTによって規定され、κはボルツマン定数、Tはケルビン温度である。
【0059】
さらに、前記AMFの振動周期1/ν(νはAMFの振動数)とτとの関係がヒステリシス損失を通じて生成された熱量に直接つながる可能性がある。例えば、1/νがτよりもはるかに大きい場合、磁気モーメントは遮蔽されていないように見え、EBを自然に乗り越えヒステリシス損失を示さずに無作為に方向を変え、熱は発生しない。逆に、1/νがτよりもはるかに小さい場合、磁気モーメントは遮蔽されたように見え、方向変化に抵抗する。したがって、AMFの周波数を上げることによりmはEBを乗り越えることを強いられ、変化の間に熱が放出される可能性がある。
【0060】
磁場が取除かれると、磁気モーメントはもとの方向に戻る前の一時期に磁場によって印加された方向を保持する。磁場が取除かれた後にそのような方向変化が生じるのに必要な時間は「緩和時間」と言われ、当該粒子の磁気異方性エネルギーおよびκTの両方の結果としての粒子の特性を示す。本質的に安定的な単一磁区粒子において、前記緩和時間は109秒を上回ることがある。したがって、磁気異方性エネルギーが当該物質のキュリー(またはニール)温度(強磁性から超常磁性状態への移行が生じる温度として定義される)を上限とする全ての温度に関する磁気スピンシステムの自発的回転に対する乗り越えられない障壁となることから、磁気モーメントは遮蔽されているように見える可能性がある。
【0061】
単一磁区内における粒子容積が低下するに従い、磁気異方性エネルギーも低下する。特定の特徴的粒子サイズ未満において、磁気異方性エネルギーはゼロを上回る任意のT値に対しκTと同等またはそれを下回るようになる。ゼロを上回る任意の温度において磁気異方性エネルギーがκT未満であることから、同エネルギーは磁化反転に対する障壁とはならず、磁化反転に対するエネルギー障壁が克服可能であることを示している。したがって粒子の総磁気モーメントは結晶軸に関し常磁性体における回転と同様、熱的に変動する可能性があり、単一磁区粒子内での回転システムの自発的回転を可能にする一方で粒子に対する磁気的結合を維持する。これはバルク材に見られる常磁性との類似から通常超常磁性と呼ばれ、このような単一磁区粒子は本質的に不安定な磁区を有するか、または本質的に超常磁性であると言える。
【0062】
超常磁性粒子を外部磁場に曝露することにより、磁気モーメントは同時にエネルギーを放出することなく磁場ベクトルの方向を向くことになる。磁場が粒子から取除かれると、磁気モーメントの方向の自発的変動は当該外部磁場によって印加された全ての足跡を迅速に破壊することになる。したがって、本質的超常磁性粒子の特性緩和時間は非常に短く、通常は約10−9秒のレベルであり、本質的超常磁性材料の磁気モーメントは全ての実験的温度において遮蔽されず、常に特性緩和時間よりも長い。
【0063】
したがって、緩和時間は温度によって規定され、磁性反転は測定時間が特性緩和時間よりも短ければ遮蔽されたように見える可能性がある。この場合、当該材料は安定的単一磁区と同様の作用を示し、特性緩和時間よりも短い時間AMF中に置かれた場合には熱を生成する。そのような材料は遮蔽されたと定義され、これらの条件下では明らかに安定的な単一磁区である。
【0064】
逆に、AFM期間の測定が当該粒子の特性緩和時間を超える場合には、遮蔽されていないまたは明らかに超常磁性の作用が観察される。この例における特性緩和時間は測定時間またはAMF期間よりもはるかに短いため、磁化再配列および磁化反転が磁気異方性エネルギー障壁による明らかな抵抗なしに無作為に生じる。したがって、熱放出はない可能性がある。
【0065】
明らかに安定的な単一磁区(または遮蔽された)作用を明らかな超常磁性(または遮蔽されていない)作用から区別するために、温度も非常に重要である。したがって、類推により、単一磁区を有する粒子の磁気モーメントの特性緩和時間は、一定期間AMFに曝露された場合、実験温度Texpが特性値未満であれば遮蔽されたように見えるであろう。もしTexpがこの特性温度よりも高ければ、磁気モーメントは同じ一定期間AMFに曝露された場合、遮蔽されていないように見える。この特性温度はブロッキング温度Tbとして定義される。したがって、単一磁区を有する粒子が一定周波数のAMF内に置かれた場合、粒子温度がブロッキング温度未満である間、磁気モーメントの強制振動により熱が放出される可能性がある。粒子温度がブロッキング温度を上回ると磁気モーメントは遮蔽されず、AMFへのさらなる曝露による熱放出は全て停止する。これは、κTで定義される熱エネルギーが磁気異方性エネルギーを凌駕し、それによってスピンシステムに過剰のエネルギーを提供し、磁気結晶エネルギー障壁を乗り越えるためである。
【0066】
個々の単一磁区粒子の作用は上記のとおりである。しかし、本発明の実施形態には、単一磁区粒子または適切な媒体に懸濁され磁性ナノ粒子の懸濁液など複数個のサセプタの集合である磁性ナノ粒子が含まれ、上記のものとは異なった特性を有する可能性がある。そのような複数個のサセプタにおて、個々の磁気サセプタのサイズは様々であり、様々な容積の1若しくはそれ以上の単一磁区粒子を有する。
【0067】
印加AMFにおける緩和時間、結果として生じるヒステリシス損失、および磁性ナノ粒子懸濁液からの生成熱について詳述したことにより、一定容積を有する個々の単一磁区粒子の性質の説明に必要な因子をはるかに上回る多くの因子を含めることが必要となる。容積は単一磁区粒子の固有特性でありEBに直接影響を及ぼすため、様々な容積の粒子群のτ0およびτの測定にはサイズ分布に関する知識が必要とされる。平均容積は特定の温度およびAMF周波数においてmを遮蔽するのに十分なEB値と関連するが、集合体中には容積およびEBが著しく低い粒子片が相当量存在する可能性がある。正味の影響は平均容積から予想されるよりもはるかに低い熱出力である可能性がある。逆に、粒子群の平均容積はEB値がmを遮蔽するのに必要なものよりも低い可能性がある。この粒子群は超常磁性に見える可能性があり、AMFにおいてヒステリシスを示すことは期待されない。
【0068】
粒子間相互作用は、単一磁区粒子群におけるヒステリシス作用を十分に説明するために必要なもう一つの要素である。磁力は定義によれば遠距離力である。つまり、影響の範囲は磁区の境界をはるかに越えて広がる可能性がある。したがって、一つ以上の単一磁区粒子による集合体は各粒子の磁性の合計よりも大きな特性を示す可能性がある。これは、磁気異方性エネルギーへの追加的寄与は各粒子のmの他の粒子のmとの集合的寄与に起因する可能性があり、これらの修正磁気異方性エネルギーは個々の非相互作用粒子の状態に特徴的でない作用を示す集合状態を生じ、明らかなEBの上昇と不均質なブロッキングプロセスを生じる可能性があるためである。したがって、磁性ナノ粒子または超常磁性粒子の集合体は遮蔽されたように見えることがあり、適切な条件下ではヒステリシスを示すことさえある。しかし、ブロッキングプロセスは不均一であるため、観察されるヒステリシス作用は当該集合体に匹敵する容積の単一磁区粒子のものよりも相当に弱い可能性があり、当該集合体はいかなる状況においても超常磁性および安定的単一磁区のいずれとも定義され得ない。
【0069】
安定的かつ超常磁性粒子または純粋に超常磁性の単一磁区粒子を含む磁性ナノ粒子の集合体の完全評価は、必要とされる測定数およびこれらの測定の一部の結果が不確定または場合によっては相反することさえあるため、困難かつ非現実的である。しかし、総平均磁気異方性エネルギーを定義することにより個々の磁性ナノ粒子の集合体および総磁性ナノ粒子の磁性を定義することは可能である。続いて総平均磁気異方性エネルギーを用いて、特定の温度、特定のAMFにおける平均特性緩和時間および当該集合体の平均作用を定義することができる。実験的温度270〜380K、振幅約1〜120kA/m(特定の実施形態では約7〜105kA/m)で周波数約100〜600kHzのAMFへの曝露においては、SARの測定値を用いて個々の単一磁区粒子の集合体および総単一磁区粒子に関し、明らかに遮蔽された作用と明らかに遮蔽されていない作用を区別することができる。例えば、遮蔽されていないまたは明らかに超常磁性の粒子の集合体は、一般に特定の条件下において粒子当たり10W/g未満を生成する。それに比べ、相互に作用しない本質的に超常磁性のナノ粒子の集合体は、定義によりちょうど0W/g粒子を生成する。逆に、明らかに遮蔽された個々のサセプタは10〜150W/g粒子を生成する。さらに、本質的に遮蔽された、または安定的単一磁区粒子の集合体は、超常磁性汚染が一部存在するにしても、ヒステリシス加熱により特定条件下に160W/g粒子以上を生成する可能性がある。
【0070】
集合作用を示すサセプタは組織加熱用プラットフォームとして有用である可能性がある。例えば、上記のような非標的(裸の)磁性ナノ粒子を、患者の病変または炎症組織部位に有効量を直接投与することが可能である。いったん投与すれば、当該標的組織を含む領域はAMFに晒され、非標的磁性ナノ粒子のヒステリシス加熱が生じる。特定の実施形態において、印加したAMFの結果として生成された熱は、投与粒子群が集合作用を示すことから、投与された粒子の数および種類から予想されるであろうものよりも大きい可能性がある。したがって、一群のサセプタが標的組織に投与された場合、標的組織へのAMF印加の結果生じる熱が高められる。
【0071】
本明細書での使用において、用語「非標的」または「裸の」サセプタとは、特定の細胞種または分子と相互作用するように修正されていないサセプタを意味する。その一方、「標的」サセプタは、例えば当該サセプタに共有結合した抗体を用いて特定の分子と相互作用するように修正されている。非標的または裸サセプタにはそのような標的メカニズムは備わっていない。
【0072】
様々な実施形態において、投与された磁気サセプタは集合作用を示すか、または当該組織中に集合的磁性状態で存在する。個々の磁気サセプタはゆるやかな集合体としての溶液中を移動する。その中で当該粒子は互いに近接するが物理的に接触しない。理論に束縛されるものではないが、特定の特性を有する非標的磁気サセプタは生物組織において集合的磁気状態を達成する可能性がある。したがって、投与された場合、これらのサセプタは当該組織中の細胞または細胞間隙において集合体を形成する。さらに、理論に束縛されるものではないが、磁性ナノ粒子の濃度は総産生熱に直接影響を及ぼす可能性がある。
【0073】
集合的磁気状態を達成することのできる磁気サセプタのサイズ、形状、多分散性は様々であり、様々な磁性を有する可能性がある。例えば一実施形態において、集合的磁気状態を達成可能な磁気サセプタの相互作用半径は75mm未満である。別の実施形態において、当該磁気サセプタの相互作用半径は約100nm〜50μmであり、さらに別の実施形態においては、当該磁気サセプタの相互作用半径は約200nm〜25μmである。そのような粒子はゆるやかな集合体として、または物理的接触のない個々の粒子の塊としてふるまう。
【0074】
本発明によって具体化される様々な磁気サセプタの相互作用半径の規模は、本分野で知られた様々な方法によって変更可能である。一部の実施形態において、当該相互作用半径は磁気サセプタのコアに少なくとも2層若しくはそれ以上のコーティング材料を提供することによって減らすことが可能である。例えば一実施形態において、2層のデキストランを磁気サセプタに適用させて相互作用半径を許容可能な範囲内に減らし、そのような粒子群が集合的磁気状態を達成できるようにすることができる。他の実施形態において、上記の高分子または生物学的コーティング材料のいずれもが当該相互作用半径に同様の作用を引起す可能性がある。
【0075】
さらに別の実施形態において、コーティング粒子は当該磁性ナノ粒子による集合作用の発現を可能にするコーティング材料のネットワークを形成する。例えば一実施形態において、デキストランでコーティングされた磁性ナノ粒子は、当該デキストランコーティングが通常はコーティングされた粒子の相互反発を招くにもかかわらず、デキストランネットワークを形成する。理論に束縛されるものではないが、コーティング粒子による磁性の発現によりデキストランコーティングネットワークが形成され、それが磁性ナノ粒子コアにおける集合作用を刺激する。
【0076】
また、集合的磁気状態を達成する磁気サセプタは、磁場がサセプタに印加された場合、個々のサセプタを組み合わせたものまたは当該粒子が物理的に接触する集合体よりも大きな比吸収率(SAR)を示す可能性がある。例えば一部の実施形態において、集合的磁気状態で作用する複数個のサセプタは、鉄含有量に応じ、約150〜1750W/gのSAR、または他の実施形態において約175〜1500W/gのSARを達成する。さらに別の実施形態において、SARは1500W/gを上回る可能性があり、当該磁気サセプタの生成に用いられた材料次第である。さらに、上記SARの上昇は集合体中の粒子数に応じて調整可能である。例えば、非標的磁気サセプタの大集合が投与される実施形態においては、より小さな集合の非標的磁気サセプタが投与される実施形態に比べSARは増幅される可能性がある。したがって、磁気サセプタの増強された加熱能は濃度依存性である可能性がある。
【0077】
理論に束縛されるものではないが、粒子の飽和磁性は集合的磁気作用を示す磁気サセプタの高加熱能に寄与せず、様々な実施形態において当該飽和磁性は約10〜100kA−m2/gである。磁気サセプタのサイズも集合的磁気作用に直接の影響を及ぼさず、したがって、本発明の実施形態に利用される粒子のサイズは上記のごとく約0.1μm未満である。上記のごとく粒子サイズが加熱に直接影響を及ぼす可能性があることも指摘される。さらに、集合的磁気状態で作用するサセプタは、当該集合作用に影響を及ぼすことなく広範な多分散性を有する可能性がある。例えば一実施形態において、サセプタ群の多分散性は約0.1〜1.5である。
【0078】
特定の実施形態において、集合的磁気状態を発現する複数個の非標的磁気サセプタには、溶液中で当該非標的サセプタとともに集合的磁気状態を維持する1若しくはそれ以上の標的磁気サセプタが含まれる。理論に束縛されるものではないが、そのような非標的および標的サセプタを組み合わせた集合は、集合的磁気状態を損なうことなく特定の組織、細胞、またはタンパク質を標的とすることを可能にすると考えられる。したがって、非標的サセプタによって示される利益は標的システムに受け継がれる可能性がある。
【0079】
非標的サセプタを用いて加熱が治療の一形態を提供し得る任意の数の疾患徴候の治療を行うことができ、本発明の実施形態には多数の疾患の治療法が含まれる。様々な実施形態において、非標的サセプタを病変組織に直接投与し、加熱により組織を除去し病態治療を行うことが可能である。例えば一実施形態において、非標的サセプタを例えば直接注入により固形腫瘍に直接投与してもよく、AMFを患者の腫瘍含有部分に印加することが可能である。当該サセプタは当該腫瘍において集合的磁気状態を発現し、腫瘍組織を加熱、除去し、それによって腫瘍組織を削減または排除する。集合的磁気状態を発現するサセプタを用いた治療法はあらゆる種類の癌の治療に用いることができ、一部の実施形態においてそのような治療法は例えば皮膚癌、頭頸部癌、舌癌、咽喉癌、喉頭癌、脳腫瘍、乳癌、肝臓癌、膵臓癌、リンパ節腫瘍、関節または滑膜腫瘍、子宮癌、子宮頸癌、腹膜腫瘍などの治療に用いられる。他の実施形態において、集合的磁気状態を発現するサセプタは白血病およびリンパ腫(それぞれ造血細胞およびリンパ組織の癌)の治療に用いられる。
【0080】
別の例示的実施形態において、非標的サセプタを投与し、例えば関節の滑膜組織中に直接注入することによって関節炎症および/または関節腫脹を治療することが可能である。AMFが印加されるとサセプタは集合的磁気状態を発現し加熱される。加熱されたサセプタは関節の瘢痕組織または炎症滑膜組織を除去し、それによって症状を軽減または除去する。集合的磁気状態を発現するサセプタは任意の種類の関節炎症の治療に有用であり、例えば一般的関節炎、関節リウマチ、骨関節炎、腱炎、滑液包炎、線維筋痛など(それらに限定されない)、既知の任意の形態の関節炎がそのような方法で治療可能である。他の実施形態において、そのようなサセプタは、腫脹、痛風、ループス、くる病、強直性関節炎、脊椎炎、シェーグレン症候群など、他の炎症性疾患の治療に用いられる。さらに別の実施形態において、そのようなサセプタは外傷の治療に用いられる。
【0081】
さらに別の実施形態において、前記非標的サセプタはゲル、ローション、軟膏、または洗浄液を用いて病変組織または病変組織周辺部位に直接適用する。例えば一実施形態において、腫瘍などの病変組織を除去する外科処置後に、当該腫瘍周辺部位を軟膏、ゲル、洗浄液、または非標的サセプタ含有溶液で洗浄する。続いてAMFを当該部位に印加し、腫瘍摘出術後に同部位に残存する発癌性組織を除去または破壊する。同様に、非標的サセプタ含有のゲル、軟膏、または溶液を用いて、切除部位または任意の外科処置部位における感染または炎症を軽減または除去する。さらに別の実施形態において、ゲル、軟膏、、またはローションを患者の皮膚に直接適用し、AMFを用いて組織を除去することなく患者の組織に熱を適用し、関節または筋の痛みまたは硬直を治療する。
【0082】
上記の様々な実施形態における非標的サセプタは、水または生理食塩水などの溶液中に混ぜ合わせることによって患者への投与に適切なものとすることができ、または他の成分または活性薬剤を含む治療製剤として作成することも可能である。本発明の非標的サセプタは、本分野で知られ実践されている技術に基づき、治療用組成物として製剤可能である。「治療用組成物」は一般に少なくとも無菌かつ発熱原が含まれていないものと見なされ、本明細書での使用における用語「治療製剤」または「治療用組成物」にはヒトおよび家畜に使用される製剤が含まれる。本発明の様々な実施形態の治療用組成物は、Remington's Pharmaceutical Science,17版、Mack Publishing Company,ペンシルバニア州Easton(1985)に記載されたように生成される。開示全体が本明細書に参照として組み込まれている。
【0083】
本発明の実施形態に含まれる治療用組成物は様々である。例えば一部の実施形態において、本発明の治療用組成物には水、緩衝用水、生理食塩水、0.4%生理食塩水、0.3%グリシン、ヒアルロン酸などの生理学的に受容可能な担体媒体と混ぜた非標的サセプタ約0.01〜95重量%が含まれる。他の実施形態において、非標的磁気サセプタは治療用組成物の約1〜90重量%を占める。治療用組成物の他の実施形態には適切な医薬品グレードの界面活性剤(例えばTWEEN)などの安定剤が含まれ、単糖類(例えばデキストロース)もそのような治療用組成物に組み込まれることがある。本発明に含まれる治療用組成物には従来の賦形剤および/または添加剤も含まれる。例えば、適切な医薬賦形剤としては、安定剤、抗酸化剤、浸透圧調節剤、緩衝剤、pH調整剤などが挙げられ、適切な添加剤としては、生理学的生体適合緩衝液(塩酸トロメタミンなど)、キレート(DTPAまたはDTPA−ビスアマイドなど)、カルシウムキレート錯体(カルシウムDTPA、CaNaDTPA−ビスアマイドなど)、または選択的にカルシウムまたは硫酸塩(塩化カルシウム、アスコルビン酸カルシウム、グルコン酸カルシウム、乳酸カルシウムなど)などが挙げられる。そのような本発明の治療用組成物は使用のために液体またはゲル状とし、特定の実施形態においてはそのような治療用組成物は凍結乾燥される。特定の実施形態において、非標的サセプタは水、生理食塩水、リンゲル液、デキストロース、アルブミン溶液、油などに溶いて注射製剤とする。
【0084】
他の実施形態において、本発明の治療用組成物は、固形物、半固形物、懸濁液、分散液、乳濁液として使用するのために包装されていても良い。従来の非毒性固形担体をそのような組成物中に組み込むことができ、医薬品グレードのマンニトール、ラクトース、でんぷん、ステアリン酸マグネシウム、サッカリンナトリウム、タルカム、セルロース、グルコース、スクロース、マグネシウム、炭酸などが含まれる。例えば、上記の任意の担体および賦形剤約1〜95重量%、さらなる例では25〜75重量%を本発明の非標的サセプタと混合する。
【0085】
一部の実施形態において、実施形態の治療用組成物にはさらに1若しくはそれ以上の補助活性薬剤が含まれる。例えば一実施形態において、1若しくはそれ以上の化学療法剤が非標的サセプタと組み合わされ、当該サセプタの治療効果を高める。そのような使用に適した化学療法剤の例としては、アルキル化剤、植物アルカロイド、抗腫瘍抗生物質、代謝拮抗物質、トポイソメラーゼ阻害剤、ホルモン剤、成長因子、サイトカイン、分裂抑制剤、それらの組合せなどが挙げられるが、それらに限定されるものではない。特定の実施形態において、化学療法剤はカルマスティン(BCNU)、5−フルオロウラシル(5−FU)、シタラビン(Ara−C)、ゲムシタビン、メトトレキセート、ダウノルビシン、ドキソルビシン、デキサメサゾン、トポテカン、エトポシド、パクリタキセル、ビンクリスチン、タモキシフェン、サリドマイド、メルファラン、シクロホスファミド、スルホン酸アルキル、ニトロソウレア、エチレンイミン、トリアゼン、葉酸拮抗剤、プリン類似薬、ピリミジン類似薬、アントラサイクリン、ブレオマイシン、マイトマイシン、ダクチノマイシン、プリカマイシン、ビンカアルカロイド、エピポドフィルトキシン、タキサン、糖質コルチコイド、L−アスパラギナーゼ、エストロゲン、アンドロゲン、プロゲスチン、黄体形成ホルモン、酢酸オクトレオチド、ヒドロキシウレア、プロカルバジン、ミトタン、ヘキサメチルメラミン、カルボプラチン、ミトキサントロン、モノクローナル抗体、レバミゾール、インターフェロン、インターロイキン、フィルグラスチム、サルグラモスチム、白金錯体(シスプラチン、カルボプラチン、オキサリプラチンなど)のうちの1若しくはそれ以上である。化学療法剤に関するそれ以上の例については「Modern Pharmacology with Clinical Applications」6版、Craig&Stitzel,第56章639〜656ページ(2004)に記載されており、参照として本明細書にそのまま組み込まれている。別の実施形態において、実施形態の治療用組成物にはさらに1若しくはそれ以上の抗炎症剤、1若しくはそれ以上の麻酔剤、1若しくはそれ以上の鎮痛剤、1若しくはそれ以上の鎮静剤、1若しくはそれ以上の抗生物質等、およびそれらの組合せが含まれる。
【0086】
本明細書に記載された実施形態に関する非標的サセプタまたは非標的サセプタを含有する治療用組成物は、本分野で知られた任意の方法で投与可能であり、投与量は例えば当該病変組織の種類および部位によって異なる。例えば、非標的サセプタは静脈内投与、組織周辺または組織内注射、皮下注射または皮下沈殿または皮下注入、腹腔内注射、臓器内注射、筋肉内注射、および病変組織またはその近辺への直接投与など(それらに限定されない)の方法による非経口的な投与が可能であり、当該病変組織の効果的な治療が促進される。特定の実施形態において、血管内投与には静脈内ボーラス注射、静脈内注入、動脈内ボーラス注射、動脈内注入、およびカテーテルによる血管内への点滴が含まれ、他の実施形態において、組織周辺および組織内注射には腫瘍内注射および滑膜内または関節内注射が含まれる。例えば、皮下注射を用いて乳房組織の腫瘍にサセプタを送達することができ、また臓器内注射を用いて肝臓組織の腫瘍にサセプタを送達することができる。他の実施形態において、サセプタは、スポンジを用いた洗浄のような洗浄、浄化により、または手術前後の投与技術などの他の術布により送達される。例えば、癌性腫瘍の除去後に組織をふき取るために、懸濁液、軟膏、またはローション中のサセプタを吸収したスポンジを用いることが出来る。
【0087】
本発明の非標的サセプタは、本発明の様々な実施形態において、単回投与或いは反復投与により投与され得る。当業者であれば、所定の対象へサセプタを投与するための適切な投与計画を容易に決定することができ、その投与計画は、病状及び個人の健康に依存して変わる。例えば、前記非標的サセプタは、例えば病変組織へ或いはその付近に、単回の注射又は沈着(deposition)として、1回前記対象へ投与することが可能である。或いは、非標的サセプタは、約1日から約28日の期間で、或いは約1日から約10日の期間で対象者へ1日1回或いは2回投与することが可能である。例えば、一部の実施形態において、非標的サセプタは、7日目まで1日1回、病変組織の部位に或いはその付近に注射される。一度患者へ投与されると、標的部位へのサセプタの運搬は、前記サセプタの磁性特性のために、前記標的領域へ静磁場を適用することによって補助される。補助運搬は、前記標的の位置に依存する。
【0088】
エネルギーは、標的細胞、標的組織へ、体内(intracorporeally)(体の中)に或いは体外(extracorporeally)(体の外)に投与されるか、若しくはエネルギーは対象の体の一部或いは全身へ適用される。前記エネルギーの適用は、前記サセプタの単一投与の完了後すぐに開始し、各投与後或いは複数投与の完了後毎日繰り返されるものである。或いは、誘導加熱は、例えば、前記サセプタの投与の完了後数分から数日という期間の後開始するものである。各誘導加熱セッションの持続期間は、5分から5時間である。論理に束縛されることなく、前記サセプタの投与からエネルギー適用までの期間は、前記サセプタが前記標的組織内の細胞によって取り込まれることを可能にする。例えば、いくつかの実施形態において、標的組織は、例えば単球或いは白血球などの炎症に関与する細胞を含み、これらは投与後前記粒子を貪食するものである。サセプタを貪食した細胞へエネルギーを適用することは、これら細胞が加熱の結果として破壊され、炎症が軽減する可能性を増加するものである。
【0089】
様々な形態のエネルギーは、これに限定されるものではないが、AMF、マイクロ波、音響エネルギー、或いはそれらの組み合わせを含む、非標的サセプタの誘導加熱を提供するために本分野で知られているあらゆる手段によって患者へ適用される。例えば、1実施形態において、適切な周波数及び振幅でのAMFが患者へ適用され、別の実施形態においては、適切な周波数でのマイクロ波エネルギーが適用される。さらなる別の実施形態において、付加的エネルギーは、AMF、マイクロ波或いは音響エネルギーとの組み合わせで使用され、これはサセプタが電離放射線(例えば、中性子、アルファ、ベータ、ガンマなど)を放出するのを可能にするものである。特定の実施形態において、AMFエネルギーは、対象へ適用され、非標的サセプタの加熱を誘導し、前記非標的サセプタの治療的加熱を産生するものであり、そのような実施形態において、前記AMFの周波数は約80kHzから約800kHzの範囲内である。
【0090】
AMF、マイクロ波及び音響エネルギーの様々な供給源は本分野において利用可能であり、そのような供給源の全ては本発明の実施形態において利用される。例えば、いくつかの実施形態において、米国出願番号第10/176,950号及び第10/200,082号(この参照によってそれら全体は本明細書に組込まれるものである)に記載された装置は、本発明のサセプタの加熱を誘導するために対象へ広く適用されるAMFエネルギーの供給源として使用される。他の実施形態において、AMFを産生するために使用される供給源は、焦点を併せた及び/若しくは均一な場を提供する。例えば、1実施形態において、図1に描写されたような磁性ソレノイドコイルは、ヒト肢或いは小動物などの対象の一部の組織へ適用されたサセプタを加熱するために使用される。図1の実施例に対して、特定の組織22へ局所的に投与されたサセプタを有するマウス10は、磁性ソレノイドコイル14が巻かれたチューブ12に保持される。フェルト裏打ち16はチューブ12を取り囲み、前記チューブ12のパッドとして働く。磁束集線器リング18は前記チューブ12の一部を取り囲み、磁束集線器基部20と連結している。そのような実施形態における磁性コイル14は、図1に描写されたようなコイル、或いは低磁気抵抗磁性物質の回状のドーナッツ型リングであり、これは望ましい周波数で作動する磁性コアのために特別に形成されたものである。例えば、いくつかの実施形態における作動周波数は、約80kHzから約800kHzである、或いは特定の実施形態において、約150kHzである。このアプローチによって、前記対象へのより高い磁場強度の適用が可能になり、渦電流加熱が減少した。加えて、回状ドーナッツ型リング及び集束バーは、前記磁場の電界強度をソレノイドコイルのかなり外側に外れさせる(drop off)。従って、磁性ソレノイドコイルは、頭及び重要器官などの、前記対象の非標的部分を保護する一方、AMFを集束する。
【0091】
他の実施形態において、マイクロ波共鳴加熱は、共鳴加熱を介して対象へ投与されたサセプタを加熱するために使用される。そのような実施形態において、サセプタ物質は、前記物質の内部化学結合が特定の周波数で共鳴する、或いは特定の磁性、電気的或いは電気双極子構造を有する物質とのマイクロ波エネルギーの相互作用を利用することによって共鳴するようなものが選択される。一般的に、共鳴加熱は、前記標的物質が比較的低パワーのエネルギー供給源から大量のエネルギーを吸収するので、有利である。従って、組織などの非標的物質は、前記サセプタのものとは異なる共鳴周波数を有しており、同程度まで加熱しない。加熱の直接モードに加えて、共鳴加熱は間接的にも使用される。例えば、1実施形態において、サセプタは、それらが付着する前記組織の共鳴周波数におけるシフトを誘導する、磁性或いは電気特性を有するものが選択される。従って、前記サセプタに非常に近接した前記組織の分子は、適切な周波数に同調されたエネルギー場が前記組織に適用された場合、優先的に加熱されるであろう。
【0092】
特定の実施形態において、病変組織は前記対象から除去し、エネルギーを体外で前記組織へ適用した。そのような実施形態において、非標的サセプタは、前記病変組織の除去前に前記対象へ投与される、若しくは非標的サセプタは、除去後前記病変組織へ適用される。以前記載した実施形態にあるように、非標的サセプタを含む前記病変組織をエネルギー源へ曝露することは、前記病変組織の一部の溶解を引き起こす、若しくは他の損傷を起こし、その結果前記病変組織を治療する。治療した組織は次に、前記対象の体に戻される。例えば、1実施形態において、抽出した組織は血液であり、血清或いは血漿に運ばれる標的細胞を含むサセプタは、他の血液成分から体外で分離され、前記標的を破壊或いは不活性化するためにエネルギー源へ曝露される。曝露後、処理した成分は他の血液成分と再び組み合わせて、対象の体に戻した。別の実施形態において、前記サセプタは、抽出組織へ導入する一方、前記抽出組織は対象の体或いは体の一部の外側である。例えば、対象からの抽出血液は、エネルギー源へ曝露する前に体の外側を循環する血液における前記サセプタへ導入される。さらなる別の実施形態において、サセプタは、血液、血清或いは血漿が流れる血管或いはカラムに含まれる。前記血管或いはカラムは、対象の体へ血液を戻す前に前記標的細胞を破壊或いは不活性化するように、エネルギー源へ曝露される。
【0093】
前記サセプタへ体外でエネルギーを提供することの利点は、より高い温度で加熱する及び/若しくはより素早く加熱し効率を増強する一方、周囲の体組織への加熱及び障害を最小限にする能力、及びエネルギー源から前記エネルギーへの体の曝露を減少させる能力を含む。前記サセプタが対象の体の外側を循環する血液へ導入される実施形態において、体から抽出された血清或いは血漿、サセプタは、体に直接導入される必要はなく、より高い濃度のサセプタは標的へ導入され得る。さらに、体外で処理される対象の一部は、多数の適用可能な方法を用いて、外部で冷却され得る一方、エネルギーは治療効果を軽減することなく前記サセプタへ提供される。加えて、前記冷却は、エネルギーの投与以前及び/若しくは以後に行われる。
【0094】
さらなる他の実施形態において、処理サセプタ及び関連標的は、対象の体へ戻される必要がない。例えば、前記サセプタ及び関連標的が対象から抽出された血液内に含まれる場合、前記処理サセプタ及び関連標的は、対象の体へ血液が戻る前に血液から分離されるであろう。前記サセプタが磁性成分を含む実施形態において、サセプタを含む組織は、磁場勾配を通過し、前記抽出組織からサセプタ及び関連組織を分離する。そうしている間に、対象の体に戻されるサセプタ及び処理病変物質の量は軽減される。
【0095】
体外で処理するさらなる別の実施形態において、加熱することが選択された組織は、手術手順の間に対象の体から完全に或いは部分的に除去される。前記組織は、体へ連結し続けることができる、或いは治療後解離され再接着され得る。さらなる別の実施形態において、前記組織は、1人のドナー対象の体或いは体の一部から除去され、治療後レシピエント対象の体へ移植される。
【0096】
本明細書に記載された病変組織を治療するサセプタ及び方法の様々な実施形態は、単独で、或いは別の形態の治療法との組み合わせで使用される。例えば、サセプタは、これに限定されるものではないが、放射線療法、化学療法、外照射療法、手術、光線力学的治療(PDT)、生物学的製剤を用いた治療、或いは治療のあらゆる組み合わせを含む治療の前、中或いは後に病変組織へ導入される。
【0097】
本発明の1実施形態において、放射線療法或いは放射線治療は、本明細書で開示される温熱療法との組み合わせで使用される。放射線療法は、サセプタ投与の前、中或いは後、或いはそれらのあらゆる組み合わせで、少なくとも1回適用される。放射線治療としても言及される放射線療法は、イオン化放射線を利用した癌及び他の疾患の治療である。イオン化放射線は、その遺伝物質を傷害することによって、治療される領域の細胞(「標的組織」)を障害或いは破壊し、これらの細胞が増殖し続けることを不可能にするようなエネルギーを蓄積している。放射線は癌細胞及び正常細胞の両者を傷害するが、非感染細胞は、それら自身を修復し適切に機能することができる。
【0098】
1実施形態において、X線或いはガンマ線療法が利用される。それらが有するエネルギーの量に依存して、X或いはガンマ線は、標的組織へより深く透過するために使用されるより高いエネルギーのX或いはガンマ線を有して、体の表面或いは深部で癌細胞を破壊するために使用され得る。
【0099】
本発明の1実施形態において、外照射放射線療法は、本明細書に開示された温熱療法との組み合わせで使用される。そのような実施形態において、X線などの放射線の焦点を合わせる機械は、外照射放射線療法として一般的に言及される治療の一種において癌に対して使用される。照射は外界から遮断され、規定体領域へこれら照射の「焦点を合わせる」ために特別な遮断物を使用する。いくつかの実施形態において、温熱療法及び放射線療法は同時に使用され、AMFシステムはX−線照射が入るための分離開口部を含む。或いは、前記照射は、患者における開口部を通して通過する(患者ガントリー)。別の実施形態において、大線量の外照射は、手術中の照射技術のため、手術中腫瘍を処理し組織周辺にあるサセプタに対して行われる。
【0100】
ガンマ線は、X線の代わりに上述されたあらゆる実施形態において利用される。ガンマ線は、特定の元素(ラジウム、ウラニウム及びコバルト60など)として自然に産生され、それらが分解する或いは崩壊するにつれて放射線を放出する。各元素は、特定の割合で分解し、ガンマ線及び他の粒子の形態でエネルギーを放射する。X線及びガンマ線は一般的に癌細胞に対して同じ効果を有している。
【0101】
別の実施形態には、温熱療法との組み合わせにおける粒子照射放射線療法の使用を含み、1実施形態において、高LET療法は本明細書で開示された標的温熱療法との組み合わせで使用される。粒子照射療法の間、粒子加速器によって産生された高速亜原子粒子は、局所癌を治療するために使用される。いくつかの粒子(中性子、パイ中間子及び重イオン)は、それらが組織を通過する軌道に沿って、X線或いはガンマ線より高いエネルギーを蓄積し、従ってそれらが接する細胞へより大きな傷害を引き起こす。このタイプの放射線はしばしば、高線エネルギー付与(高LET)放射線として言及される。
【0102】
さらなる他の実施形態において、放射線は、腫瘍内或いは腫瘍上、若しくは体腔に直接置かれた放射活性移植片を通して癌細胞へ運搬され、本発明の実施形態において、内照射療法は、本明細書に記載された標的温熱療法との組み合わせで使用される。これは、内照射療法として言及され、例えば密封小線源治療、組織内照射、及び内照射療法の腔内照射タイプなどに対して一般的に使用される。この治療の間、放射線線量は、小さい領域に集中している。そのような実施形態において、前記移植片は、渦電流或いはヒステリシス加熱によってAMF治療の間加熱する物質、若しくは、プラスティック、セラミック、ガラス或いは移植されたヒト組織などのAMF曝露下では加熱しない物質を含む。
【0103】
さらなる別の実施形態において、対象へ注射された場合活動的に癌細胞を探し出し、放射線を用いてその細胞を破壊する放射線標識抗体は、標的温熱療法との組み合わせで、癌部位へ直接放射線の線量を運搬するために使用される。いくつかのそのような実施形態において、放射線標識抗体はサセプタとは別に投与され、他の実施形態においては、放射線標識抗体はサセプタと同時に投与される。さらなる他の実施形態において、少なくとも1つの放射性同位元素はサセプタに接着され、前記サセプタは二重治療サセプタとなり得る。
【0104】
本明細書での使用に適した放射性同位元素の例としては、これに限定されるものではないが、モリブデン−99、テクネチウム−99m、クロミウム−51、コバルト−60、銅−64d、ジスプロシウム−165、イッテルビウム−169、イオジン−125、イオジン−131、イリジウム−192、鉄−59、リン−32、カリウム−42、レニウム−188(タングステン−188由来)、サマリウム−153、セレニウム−75、ナトリウム−24、ストロンチウム−89、キセノン−133、キセノン−127、イットリウム−90を含む。
【0105】
いくつかの実施形態において、上述したような温熱療法は、化学療法との組み合わせで使用される。化学療法は、薬剤による癌などの病気の治療法である。最も多いタイプの癌に対して、化学療法はしばしば多数の異なる薬剤或いは医薬品の使用を必要とし;これは併用化学療法として言及される。様々な実施形態において、化学療法は、例えば、静脈内(IV;静脈内は最も一般的)、筋肉内(IM;筋肉への注射)、経口(口によって)、皮下(SC;皮膚下に注射)、病巣内(IL;癌領域へ直接的に)、髄腔内(IT;脊髄の周りの液体へ)、局所的(皮膚へ適用)及びそれらと同等のものなどの、本分野で既知のあらゆる方法で投与される。様々な化学療法剤に耐性を示す腫瘍細胞は、臨床腫瘍学における主要な問題を示している。
【0106】
本発明の実施形態で使用される化学療法剤は、例えば、S、M、G1或いはG2の間のあらゆる段階で細胞周期を停止させる。例えば、S期依存性薬剤には、アペルシタビン(Apercitabine)、シタラビン、ドキソルビシン、フルダラビン、フロクスウリジン、フルオロウラシル、ゲムシタビン、ヒドロキシウレア、メルカプトプリン、メトトレキセート、プレドニゾン、プロカルバジン及びチオグアニンなどの代謝拮抗剤が含まれる。M期依存性薬剤には、ビンブラスチン、ビンクリスチン及びビノレルビンなどのビンカアルカロイド;エトポシド及びテニポシドなどのポドフィロトキシン;ドセタキセル(Doxetaxel)を含むタキサン;及びパクリタキセルを含む。G2期依存性薬剤には、ブレオマイシン、イリノテカン、ミトキサントロン及びトポテカンが含まれ、G1期依存性薬剤にはアスパラギナーゼ及びコルチコステロイドが含まれる。
【0107】
さらに、本発明の実施形態において使用される化学療法剤は、作用機序によって分類される。例えば、細胞機能を障害するアルキル化剤;局所性発疱薬であり、メクロレタミン、マスタージェン(Mustargen)、シクロホスファミド、イホスファミド、イフェックス(Ifex)、クロラムブシル、及びロイケリン(Leukeran)を含むナイトロジェンマスタード;それらの高い脂質可溶性及び化学不安定性、2つの高度反応性中間体へ素早く自然に分解することで区別されるニトロソ尿素;クロロエチルジアゾ水酸化物及びイソシアン酸;シスプラチン、プラチノール(Platinol)、カルボプラチン及びパラプラチンを含むプラチナ製剤;及び代謝拮抗薬は、ヌクレオチド合成の重大な経路を変化させる、DNA及びRNA合成に関連した天然由来代謝産物の構造類似体である。植物、真菌及び細菌などの天然物質から単離された抗腫瘍活性を有する天然産物も実施形態において使用される。例えば、ブレオマイシン或いはブレノキサン(Blenoxane);アントラサイクリン;エトポシド、VP−16、VePesidなどのエピポドフィロトキシン、及び他のものなどの抗腫瘍抗生物質は、DNA−トポイソメラーゼII複合体を安定化することによってトポイソメラーゼII活性を阻害し、その結果DNAの合成を無力化し、細胞周期はG1期で停止させ;ニチニチソウであるVinca rosea由来のビンカアルカロイド;及び中国鑑賞樹であるCamptotheca acuminate由来のカンプトテシン及びカンプトテシン類似体は、トポイソメラーゼIを阻害しDNA複製の延長期を中断する。
【0108】
化学療法剤或いは医薬品はさらに前記サセプタへも接着され、そのようなサセプタは二重治療サセプタを構成するであろう。
【0109】
本発明の1実施形態において、温熱療法は、MAB'sに接着した化学療法剤或いは医薬品と組み合わされる。モノクローナル抗体(MAB's)は、化学療法剤と連結され得る。この組み合わせによって、細胞を攻撃する2つのメカニズム:1)化学療法からの化学物質、及び2)MABによる免疫反応、が可能となる。化学療法は、細胞がMABによって弱められた場合、より効果的となり得る。これらの薬剤は、温熱療法投与の前、中或いは後で投与され得る。
【0110】
別の実施形態において、温熱療法剤は、例えば化学療法剤には接着しない抗体などの生物学的因子に関連する治療と組み合わせで使用される。例えば、化学療法剤に接着しないMABが投与される。そのようなMABは、癌組織に対する免疫反応を誘導し、治療を促進する。
【0111】
さらなる別の実施形態において、化学療法医薬品或いは薬剤は、誘導性加熱によって前記サセプタから放出されるように、AMF曝露の間に活性化される。前記医薬品或いは薬剤も、AMFの電源を入れた場合、破壊され得る。代わりの実施形態において、前記医薬品或いは薬剤は、サセプタコーティングへ取り込まれ、AMFが適用された場合放出される。そのようなコーティングは、1若しくはそれ以上の層を含み、その層は同じ或いは異なる物質から成り、前記医薬品或いは薬剤は、1若しくはそれ以上のコーテイング層に取り込まれる。
【0112】
さらなる他の実施形態において、温熱療法及び化学療法は、治療剤が癌細胞へより多く到達し、より実質的に殺傷することを可能にする、腫瘍内の血管の透過性を増加する薬剤と共に投与される。例えば、血管透過性増強剤(VEA's)は、腫瘍部位での治療剤及び画像化剤の癌細胞による取り込みを増強し、潜在的な結果として優れた有効性を生じるように設計された薬剤である。VEA'sは、モノクローナル抗体、若しくは他の生物学的活性標的化剤を用いることによって作用し、既知血管作動性化合物(すなわち、組織をより高い透過性を有するようにする分子)を選択的に固形腫瘍へ運搬する。一度腫瘍部位へ局在すると、VEA'sは、腫瘍を補給する血管及び毛細血管の生理機能及び透過性を変化させる。前臨床研究において、VEA'sが治療の数時間前に投与された場合、薬剤取り込みは固形腫瘍において400%まで増加した。VEA'sは、ほとんどの実存癌治療及び画像化剤に対する前処理として使用することを目的としている。VEA'sは、複数の腫瘍タイプを越えて有効である。VEA'sの実施例には、商業的に利用可能なCotara(商標)及びOncolym(登録商標)(Peregrine Pharmaceuticals,Inc.,Tustin,カリフォルニア)が含まれる。VEA'sは、標的化温熱療法と共に使用し、血流を増加し、結果腫瘍細胞でのサセプタの取り込みを増加することができる。
【0113】
本発明のいくつかの実施形態において、温熱療法は、観血的手術或いは低侵襲手術と、若しくは他の介入性技術と組み合わされる。そのような実施形態において、サセプタは、手術或いは介入中にAMFで加熱され得る。AMFエネルギー源は、一部の操作スペースとなるので、滅菌物質で覆った。そのような場合において、全ての手術ツールは、プラスティック、セラミック、ガラス或いは非磁性物質、若しくは金属合金(チタン)などの非磁性物質から作られる。AMFエネルギー源は滅菌手術部位の隣に置き、患者は手動或いは自動でAMFエネルギー場を出たり入ったり動かされ得る。
【0114】
例えば、1実施形態において、臓器は患者の体の外へ持ち上げられるように外科的に準備されるが、解剖学的及び生理学的に体に接着したままであり、サセプタは臓器へ注入され、前記臓器は体外でAMFに照射される。処理された臓器は次に、患者の体に再配置される。そのような技術は、標的臓器のみへのAMFの選択性の増強を可能にし、体の他の部分はAMFに曝露されない。別の実施形態において、温熱療法は、手術或いは他の介入技術、若しくはそれらのあらゆる組み合わせの前に少なくとも一度、最中に少なくとも一度、或いは後に少なくとも一度投与され得る。
【0115】
さらなる他の実施形態において、温熱療法は、骨髄及び/若しくは幹細胞移植と組み合わされる。本発明の1実施形態において、温熱療法は骨髄或いは幹細胞移植の前、最中或いは後、若しくはそれらのあらゆる組み合わせで投与される。別の実施形態において、温熱療法は、移植前に移植骨髄或いは幹細胞へ体外的に投与され得る。骨髄は、血液細胞を産生する幹細胞として言及される未熟細胞を含む。ほとんどの幹細胞は、骨髄で見出されるが、末梢血幹細胞(PBSC's)として言及されるいくつかの幹細胞は、血流中に見出される。幹細胞はさらなる幹細胞を形成するように分裂する、若しくはそれらは白血球、赤血球或いは血小板へと成熟することができる。健康な骨髄がなく、患者は酸素を運ぶのに必要な血球、感染を防御する血球及び出血を防止する血球を作ることができないので、骨髄移植(BMT)及び末梢血幹細胞移植(PBSCT)は、高線量の化学療法及び/若しくは放射線療法によって破壊された幹細胞を回復する手順である。処理によって破壊された幹細胞は、BMT及びPBSCTを用いて回復される。
【0116】
さらなる他の実施形態において、温熱療法は、光線力学的治療(PDT)と組み合わされる。PDTは、腫瘍細胞に集まる光感受性分子である光増感剤(PS's)に基づいている。適切な波長の光で照射した場合、PS'sは光を吸収し励起し、そのエネルギーを近接分子酸素へ移し、反応性酸素種(ROS's)を形成し、これは近接腫瘍細胞の重要な構成成分を次々に酸化し傷害するものである。実施形態において、サセプタは、PDTの前、最中或いはその後に対象へ投与され、同時に或いはお互い別に活性化され、他の実施形態においては、サセプタは、光感受性薬剤でコーティングされる。例えば、1実施形態において、磁性コアを有するシリカ−ベース或いは他の任意の活性化ナノ粒子が産生され、PDT薬剤はこれらナノ粒子をコーティングするために使用される。これらのサセプタは次に、薬剤を活性化するために光に照射され、それらは加熱を介してさらに破壊するために標的温熱療法システムのAMFで後にも照射される。前記サセプタは光で及び同時にAMFでも照射される。特定の実施形態において、温熱療法との組み合わせにおける光線力学的治療は、単独で、或いは化学療法、手術或いはその両者との組み合わせで使用される。
【0117】
本明細書で記載された治療法及び併用療法はさらに、本発明の実施形態において、患者に対して適切であると考えられるあらゆる組み合わせで組み合わされ得る。2つ(二重療法)或いはそれ以上の治療法で治療され得る疾患が存在する。別の治療法との組み合わせでナノ−サイズ粒子を用いる標的温熱療法は、2若しくはそれ以上の疾患を治療する。
【0118】
上述したように、本発明は、病変物質を治療するための温熱療法組成物、及びそのような組成物を利用した標的治療の方法に適用可能である。本発明は、上述した特定の実施形態に制限されると考えられるべきではなく、むしろ添付の請求項に正確に記載されたように、本発明の全ての観点をカバーすると理解されるべきである。様々な修飾、同等な工程、さらに本発明が適用可能な多数の構造は、本明細書の検討によって、本発明が対象とする本分野の当業者にとって容易に明らかであろう。請求項は、そのような修飾及び装置をカバーすることを意図するものである。
【0119】
実施例
本明細書に記載されたサセプタを物理学的に特徴付けするために、様々な分析技術を応用した。
【0120】
ナノ粒子の密度、及び酸化鉄コアに対する正確なサイズとサイズ分布を決定するために分析超遠心分離法(Analytical ultracentrifugation:AUC)を使用した。
【0121】
完全コア/殻構造の平均サイズ及びサイズ分布を決定するために光子相関分光法(Photon Correlation Spectroscopy:PCS)を使用した。
【0122】
Quantum DesignからのMPMS SQUID磁気計を用いてヒステリシスループを測定した。全測定は、コロイドを保持するため、LakeShore CryotronicsからのKel−F液体カプセルホルダーを用いて室温(298K)で行い、磁場範囲は±3.98MA/m(±50,000Oe)であった。
【0123】
透過型電子顕微鏡(TEM)は、300keVでのJEOL JEM3010 TEMで行った。コロイドは、容量で1/100に希釈し、次に乾燥させるためにカーボンコーティングTEMグリッドへ滴下した。
【0124】
小角中性子散乱(Small Angle Neutron Scattering:SANS)実験は、8.4Åの波長を有する中性子を用いて、NIST Center for Neutron Research(NCNR)におけるNG−3ビームラインで行った。データは、3x10−5から5x10−1Å−1の散乱ベクターQの範囲を測るために、3つの異なるサンプル−検出器距離にて、二次元検出器を有する透過型モデルにおいて回収した。これらのデータは、空セルからバックグラウンド及び検出器のゆがみに対して補正した。
【0125】
より小さいQ値を探索するために、NCNRにおけるBT5熱中性子複結晶装置を用いてUltra−SANS(USANS)実験を行った。サンプルは、2.4Åの中性子波長にてそれぞれ8時間実行した。空ビームによるバックグラウンドは、全データから減算し、減算されたデータは、直進ビーム強度の使用によって絶対スケールで処理した。Q(水平面における波ベクター構成成分)範囲は、500から20,000nmの探索長さスケールに一致する。SANS及びUSANS測定の全ては、室温及びゼロ磁場で行われた。H2Oにおけるサンプルは1mm厚水晶セル中に保持し、D2Oにおけるサンプルは4mm厚水晶セル中に保持した。一連の濃度(スペースを考慮して示さない)は、適合させるためのパラメータを制限するのを助けるためにも使用した。コア−殻モデルは、データを適合させるために使用した。全てのSANS及びUSANS減少及び適合は、相互作用的IGOR手順[17]を用いて実行した。
【0126】
ナノ粒子の熱投与量を決定するための比吸収率(SAR)測定は、150kHzの周波数で変動磁場振幅下、修飾交番磁界(AMF)カロリメータにおいて行った。SAR値は、粒子懸濁液がソレノイドコイルにおいて産生されたAMFによって加熱された場合、カロリメータ、コイル及び水の熱特性補正後、水において測定された温度上昇率から計算した。その値は、鉄含有量で規準化した。
【0127】
インビボマウス試験は、3.5cm内径誘導コイルの内側の1cm幅バンド範囲内に高−振幅磁場を限定するAMFインダクタにおいて実行した(図1)。マウスは、振幅及び曝露の持続時間を調節することによってAMFの様々な組み合わせに曝した。曝露の負荷サイクルは100%(常時オン)であり、中波数は150kHzに固定した。曝露の持続時間は15分、若しくはマウスの直腸温が41.5℃に達した時に制限した。ナノ粒子は、5分間かけて腫瘍の中心部へ直接的に注射した。温度は、RF−感受性ではなく、腫瘍の中心、腫瘍にすぐ近接して、及び直腸内に置かれた0.4mm直径光ファイバー温度評価プローブを用いて連続して記録した。
【実施例1】
【0128】
殻を形成するためにデキストランでコーティングされ、50nm以下の直径を有する、酸化鉄(マグネタイト)コアを有する磁性サセプタの2つの異なるサンプルは、米国特許出願第2005/0271745号に記載されたコア/殻法に従った、高圧ホモジナイズを用いて合成した。その2つのサンプルは、それらのコアにおいて名目上同一である。しかしながら、前記デキストラン層が変えられている:サンプルAは単一デキストラン層を含み、サンプルBは二重デキストラン層を含む。
【0129】
AUCでは、5.18g/cm3の原体(bulk)酸化鉄の密度よりわずかに少ない、3.20g/cm3の密度を生じ、ナノ粒子コアに対する44±13nmのサイズ分布を生じた。PCSでは、より大きなサイズで96.5±32.4nmのサイズ分布を生じた。この数は、強度によって決定されようが容積によって決定されようが同じであった。しかしながら、PCS装置によって、溶媒を動くストークス・アインシュタイン(Stokes−Einstein)の球に基づいた水力学的半径を推測し、従って溶媒が浸潤したデキストラン層の厚さの推測が含まれた。
【0130】
26nmのデキストラン長は、使用した40.000ダルトンデキストランに対しては相応である。AUCデータも50nm以下のコア直径を示すTEM画像(図2)と一致している。デキストラン層厚は、(i)それは乾燥サンプルであり、(ii)この励起エネルギーにて、TEMグリッドをコーティングしている無定形カーボンフィルムからの無定形デキストランの分離が難しかったため、TEMからは決定できなかった。TEM画像の精密な検査によって、サンプルAでは存在しない(図1A)、サンプルBにおける酸化鉄の端での暗いリングの存在が明らかになった(図1B)。さらに、サンプルAのコア(図1A)は、球で予想されたように、端より密であった。サンプルBにおけるこの暗いリング(図1B)は、2つの事象の1つに由来する:前記ナノ粒子は中心よりも端でより厚く、端はコアとは異なる密度を有している。酸化鉄の密度が原体の約62%のみであることを考えると、前記リングはたぶん、コアとは異なる密度を有する端に由来するものである。
【0131】
SANS/USANSデータも、TEMに対しては相応である。異なる対照条件下でのサンプルA及びサンプルB両者に対するデータは、図3に示した。H2O及びD2Oはそれぞれ、サンプルコントラストを変えることによってシステムの異なる特性を強調した。H2Oの場合において、散乱は、酸化鉄及びH2Oの間の大きなコントラストによって優位である一方、デキストランではコントラストが少ないことを示していた。D2Oにおいて、コアからの散乱の強度は、より減少していた一方、デキストランのコントラストは増強されていた。D2Oにおけるこれらのサンプルの両者は、大規模凝集において粒子を結合するように作用するデキストランネットワークの存在に由来する、低Qにおける強い散乱強度を示した。この解釈は、デキストラン溶液の他の観察に一致していた。しかしながら、D2O SANSデータはさらに、2つのコア間の著しい違いも強調した。多分散コア−殻モデルは、殻サイズに対するコアの比を一定に維持することによってH2Oデータを適合するために使用した。これによって、28.30±0.02nmの総粒子直径を生じた。これは、PCS或いはAUCによって見られたサイズより小さく、この違いは、中性子散乱は多分散システムにおける半径の第一モーメントの分布に対して感受性があり、一方PCS及びAUCは第三モーメントに感受性があることに起因していた。さらに、前記粒子の放射状密度特性は、TEMから見られたように、単純に均一なコア及び殻ではないということが可能である。加えて、半径の増加に伴ってデキストランの密度勾配が減少することが予想された。
【0132】
前記システムの磁性特性は、室温でヒステリシスループを測定することによって特徴付けした。これらのループ(図4)は、液体カプセルホルダーに付加された溶液の質量、Anton Paar DMA5000濃度計で決定されたようなその濃度、及び凍結乾燥1mlのコロイドによって決定されたようなコロイドにおける物質の質量濃度を用いてコロイドに存在する粒子の質量で規準化した。最も顕著な点は、サンプルBの飽和磁化が41.08±0.03kA−m2/gであり、61.64±0.03kA−m2/gのサンプルAの飽和磁性より33%小さいことであった。大きさ(magnitude)におけるこの有意な違いは、TEMで見られたより暗いリングに関連していた。
【0133】
SAR値は、H=85.9kA/m(1080Oe)及びf=150kHzに対して測定し、鉄濃度で規準化した。サンプルBは、5mg/mlのコロイド濃度を有しており、一方サンプルAは、5.5mg/mlのわずかに高い濃度を有していた。サンプルBはFeの209W/gの測定SARを有しており、一方サンプルAはFeの537W/gの測定SARを有しており、2.5倍の違いがあった。この違いのほとんどは、飽和磁化における違いに起因するが、それが全てではない。付加的な寄与は、それらの相互作用における違いによる、ナノ粒子の集団挙動に起因する。
【0134】
5つの群におけるこの治療の有効性を定量化するためのin vivo特徴付けは、表1に記載した。最初の4群は、磁場振幅の効果を研究し、第5群は、適用した磁場で注射した酸化鉄ナノ粒子を持たないコントロール群であった。最後の3つの列には、達成された最高温度、蓄積した熱投与量の規準化率、及び適用した総規準化熱投与量も含む。従来は、より高い熱投与量はより大きな温度変化を生じ、より大きな効果を生じるべきであると予想されていた。しかしながら、どのようにナノ粒子が熱傷害を産生するかというメカニズムとして、腫瘍細胞は未知であり、熱を運搬したナノ粒子の放散もよく特徴付けされていないので、これはあまりに単純化された視点であった。代わりに、このデータより、最高温度は、最大磁場振幅及び最短時間で生じる最大用量率によって生じるということが明らかとなった。これは、マウスの生理学的反応の結果であろう。あらゆる吸熱動物において、体温は熱排出である血管を拡張することによって、若しくは震える及び皮膚に近い血管を収縮することによって調節し、熱を内部に産生/保存する。前者の工程は確かに、酸化鉄ナノ粒子から局所的に産生された対流熱を除去する因子となるであろう。これは動的工程であるので、熱が局所領域へより早く蓄積するにつれて、生理学的反応前により大きな熱変化がそれを除去することができるであろう。しかしながら、46℃から48℃のより高い温度での加熱による血管への傷害などの他の生理学的反応は、予想された加熱状況よりも高いものを形成するそのような血流を制限或いは停止し、それによってこの単純な観点の適用性を制限するであろう。この理由により、物理的特徴付けは、有効性を決定するのには不十分であった。生理学的反応が考慮されるべきであり、in vivo研究は治療の有効性を本当に決定するために実行されなくてはならない。
【0135】
【表1】

【0136】
飽和磁性化、粒子構造及び粒子間相互作用全てはSARに影響を及ぼした。しかしながら、それぞれは異なった方法及び異なった規模で寄与し、それぞれ競合する。本発明者らの予備研究における生物学的反応は、測定された腫瘍内温度及び熱投与量(時間及び温度)と相関し、これは従来の高熱療法(hyperthermia)のものと同様に、これらのナノ粒子が「全体的な」温熱療法効果を持つように見えるように導くものである。最終的に、従来の高熱療法の効果に対して通常主要な影響を持つ生理学的効果(例えば、動的熱輸送メカニズム)は、ナノ粒子高熱療法において同じ役割を持たなかった。これは、従来の高熱療法の熱源が外部であるからというよりも、ナノ粒子高熱療法に対する熱源が内部であり、ナノ粒子高熱療法の細胞標的が全く異なるという事実に起因しているようである。哺乳類における熱傷害及び熱放散のメカニズムを理解するためにはさらなる研究が必要である。
【実施例2】
【0137】
殻を形成するためにデキストランでコーティングされ、50nm以下の直径を有する酸化鉄(マグネタイト)コアを有する磁性サセプタの2つの異なるサンプルは、米国特許出願第2005/0271745号に記載されたコア/殻法に従った高圧ホモジナイズを用いて合成した。その2つのサンプルは、変動するデキストラン層を有するそれらのコアにおいて名目上同一である:サンプルBは二重デキストラン層を含み、サンプルCはコーテイングされ単一デキストラン層を含む。
【0138】
AUCでは、3.20g/cm3の密度を生じ、これは5.18g/cm3である原体酸化鉄の密度よりわずかに小さく、ナノ粒子コアに対して44±13nmのサイズ分布を生じた。PCSでは、より大きなサイズ及び92±14nmのサイズ分布を生じた。この数は、強度によって決定されようと容積によって決定されようと同じであった。しかしながら、PCS装置では、溶媒を動くストークス・アインシュタイン(Stokes−Einstein)の球に基づいた水力学的半径を推測し、従って溶媒が浸潤したデキストラン層の厚さの推測が含まれた。24nmのデキストラン長は、使用した40.000ダルトンデキストランに対しては相応であった。AUCデータも50nm以下のコア直径を示すTEM画像と一致していた。上述したように、前記デキストラン層厚は、TEMからは決定できなかった。
【0139】
SANS/USANSデータも、これらの数に十分に一致していた。H2O及びD2O両者のサンプルBデータは、図5に示した。H2O及びD2Oはそれぞれ、サンプルコントラストを変えることによって前記システムの異なる特性を強調した。H2Oの場合において、散乱は酸化鉄及びH2Oの間の大きなコントラストによって決定されたが、一方デキストランではコントラストが小さかった。D2Oにおいて、コアからの散乱の強度は有意に減少していた一方、デキストランのコントラストは増強していた。D2OデータにおけるサンプルBは、大規模凝集において粒子を結合するように働くデキストランネットワークの存在に起因する低Qでの強い散乱強度を示していた。この解釈は、デキストラン溶液の他の観察と一致していた。多分散コア−殻モデルは、殻サイズに対するコアの比を一定に維持することによって、H2Oデータを適合させるために使用した。これによって、28.30±0.02nmの総粒子直径を生じた。これは、PCS或いはAUCによって見られたサイズより小さく、この違いは、中性子散乱は多分散システムにおける半径の分布の第一モーメントに対して感受性があり、一方PCS及びAUCは第三モーメントに感受性があることに起因していた。さらに、前記粒子の放射状密度特性は、均一なコア及び殻ではないということが可能である。例えば、半径は大きくなるがデキストランの密度勾配が減少するものが存在する。最終的に、硬性球相互作用半径は、69.5±0.2nmであると決定し、これは、中性子で見られる粒子サイズより大きな長さスケールに対する相互作用が存在することを示唆している。
【0140】
サンプルCからのSANSデータは、図6に示した。H2Oにおける濃度系列を示したが、図5に示されたものと類似のD2Oデータは除外した。ここでは直径は27.2±0.5nmであり、サンプルBで見出されたものと類似であったが、相互作用半径は200nm以上であり、サンプルBのものより3倍大きかった。相互作用半径におけるこの増加は、容積分画での変化によってではなく、AUC及びPCS両者によって早期に決定されたような平均直径における変化に起因するものには見えなかった。SANS/USANSから、両サンプルの容積分画は、多分散(0.6)と同様に、ほとんど同等(サンプルBでは0.1075±0.0005であり、サンプルCでは0.1050±0.0003であった)であり、これはサイズ分布の指標であった。粒子寸法における違いはないが相互作用半径におけるこの違いによって、単純硬性球相互作用モデルは物理学的に正確ではなく、より良いモデルは立体的、静電気的及び磁性相互作用を考慮にいれた方がよいことを示唆していた。
【0141】
前記システムの磁性特性は、室温でのヒステリシスループを測定することによって特徴付けした。これらのループ(図7)は、液体カプセルホルダーに付加された溶液の質量、Anton Paar DMA5000濃度計で決定されたようなその濃度、及び凍結乾燥1mlのコロイドによって決定されたようなコロイドにおける物質の質量濃度を用いてコロイドに存在する粒子の質量で規準化した。最も顕著な点は、サンプルBの飽和磁化が41.08±0.03kA−m2/gであり、サンプルC(45.34±0.02kA−m2/g)の飽和磁性よりわずかに小さいことであった。大きさにおけるこのわずかな違い以外、2つのヒステリシスループの形はほとんど同一であった。SANSデータによって、2つのサンプルに対してゼロ磁場において有意に異なる相互作用半径を示されたけれども、SQUIDデータによって、SAR測定に使用された磁場ではほとんど同一の磁性モーメントが示されたことは注目に値する。
【0142】
SAR値は、名目上等しい濃度のコロイドを用い、次に鉄濃度で規準化した、H=86kA/m(1080Oe)及びf=150kHzに対して測定した。サンプルBはFeの1075W/gの測定SARを有しており、一方サンプルCはFeの150W/gの測定SARを有しており、7倍の違いがあった。これは、反対の傾向を持ち、約10%のみ異なることを示した飽和磁性化における違いに起因するものではなく、ほとんど同じになった3つの物理学的技術(TEM、AUC及びPCS)を通じて示されたような物理的サイズ或いはサイズ分布における違いに起因するものでもなかった。従って、第一の違いは、相互作用挙動におけるSANS/USANSデータに存在するように見られた。特に、サンプルBの二重デキストラン層は、より小さい相互作用半径を有するように見られ、これはほとんど3倍であった。この小さな相互作用半径は、2倍の効果:(1)双極性相互作用は有意に強く、ナノ粒子が磁場を変動しその結果加熱が増幅する条件下でそれらの挙動と共役することを可能にする、及び(2)より小さい相互作用半径は、より多くの粒子がより近く集まり、より小さな領域における局所熱出力を増強する、を有するであろう。
【0143】
サンプルの磁性特性(飽和磁性化、異方性及び容積)は、交流磁場の影響下で磁性ナノ粒子によって供給される熱投与量に対して著しい効果を有するが、個々のナノ粒子特性は唯一の考察ではない。磁性ナノ粒子の回収の挙動は、2つの名目上同一である50nm以下の酸化鉄コア/殻ナノ粒子のサンプルによって決定されたように、熱投与量を決定する場合に等しく重要であった。密接に関連したシステムは、Feの1075W/gの測定SARを有しており、一方よりゆるく関連したシステムは、Feの150W/gの測定SARを有していた。
【0144】
本発明は、その特定の好ましい実施形態を参照することによってかなり詳細に記載されているが、他のバージョンが可能である。従って、添付された請求項の観点及び範囲は、その記載及び本明細書内に含まれた好ましいバージョンに制限されるべきではない。
【技術分野】
【0001】
本出願は2007年1月19日付けで出願された「Thermotherapy Susceptors,Pharmaceutical Compositions Containing Thermotherapy Susceptors and Methods of Using Same」と題する米国仮特許出願第60/885,726号への優先および利益を主張するものであり、内容は全て本明細書に参照として完全に組み込まれるものである。
【背景技術】
【0002】
癌および病原体による疾患などに対する従来の治療法の中には侵襲的ものがあり、有害な副作用(正常細胞に対する毒性、身体の正常機能の破壊、など)を伴い、治療を耐えられないものとし、その反面得られる成果はわずかであることも多い。例えば、癌に対する従来の治療法の中には、手術に続いて放射線照射および/または化学療法を行うものがある。これらの方法は必ずしも有効でなく、また、たとえ有効であっても外観を損なったり、標的組織の除去を不完全なものとし再発を生じることがある。さらに、放射線療法および化学療法はつらく、再発に対し完全に有効ではない。そのため、患者にとっては低侵襲的で負担が少なく、病変組織、病原体、または身体中の他の好ましくない物体などの標的部位に対してのみ効果を発揮する方法が望ましい。
【発明の概要】
【課題を解決するための手段】
【0003】
本明細書に記載した本発明の実施形態は、相互作用半径が約100nm〜50μmの複数個の非標的磁性ナノ粒子および薬学的に許容可能な担体を含有する治療用組成物を対象としており、一部の実施形態においては前記複数個の非標的磁性ナノ粒子の相互作用半径は約200nm〜25μmである。
【0004】
様々な実施形態において、前記複数個の非標的磁性ナノ粒子は、安定的な単一磁区ナノ粒子、超常磁性粒子、およびそれらの組合せであり、そのような実施形態においては前記非標的磁性ナノ粒子は磁場に晒されると明らかに熱的に遮蔽され加熱される。一部の実施形態において、複数個の非標的磁性ナノ粒子の平均サイズは約1μm未満であり、他の実施形態においては複数個の非標的磁性ナノ粒子の平均サイズは約0.1〜800nmである。特定の実施形態において、前記複数個の非標的磁性ナノ粒子の多分散性は約0.1〜1.5である。複数個の非標的磁性ナノ粒子は、Fe3O4、γ−Fe2O3、FeCo/SiO2、Co36C64、Bi3Fe5O12、BaFe12O19、NiFe、CoNiFe、Co−Fe3O4、FePt−Ag、およびそれらの組合せなどの材料から生成される。
【0005】
特定の実施形態において、前記複数個の非標的磁性ナノ粒子にはコアおよびコーティングが含まれる。そのような実施形態においては、コアにはFe3O4、γ−Fe2O3、FeCo/SiO2、Co36C64、Bi3Fe5O12、BaFe12O19、NiFe、CoNiFe、Co−Fe3O4、FePt−Agおよびそれらの組合せなどの物質が含まれ、コーティングにはポリマー、生物材料、無機コーティング材料、およびそれらの組合せなどの物質が含まれるがそれらに限定されない。一部の実施形態において、前記ポリマーは例えばアクリレート、シロキサン、スチレン、アセテート、アルキレングリコール、アルキレン、アルキレンオキシド、パリレン、乳酸、グリコール酸、ヒドロゲルポリマー、ヒスチジン含有ポリマー、およびそれらの組合せである。他の実施形態において、前記生物材料はヘパリン、ヘパリン硫酸、コンドロイチン硫酸、キチン、キトサン、セルロース、デキストラン、アルギン酸塩、でんぷん、炭水化物、グリコサミノグリカン、細胞外基質タンパク質、プロテオグリカン、糖タンパク質、アルブミン、ゼラチン、およびそれらの組合せのいずれでもよく、またそれらに限定されない。また、さらに別の実施形態において、前記無機コーティング材料は金属、金属合金、またはセラミックである。特定の実施形態において、前記コアはマグネタイトであり、前記コーティングはデキストランであり、前記コーティングは少なくとも2層のデキストランから成る。
【0006】
一部の実施形態において、前記複数個の非標的磁性ナノ粒子の飽和磁気は約10〜100kA−m2/gであり、他の実施形態においては交流磁場に曝露された場合の前記複数個の非標的磁性ナノ粒子の比吸収率(SAR)は約100〜1500W/gである。
【0007】
様々な実施形態において、前記薬学的に許容可能な担体には、水、緩衝用水、生理食塩水、リンゲル液、グリシン、ヒアルロン酸、デキストロース、アルブミン溶液、オイル、またはそれらの組合せが含まれ(それらに限定されるものではないが)、一部の実施形態においては前記組成にはさらに、安定剤、抗酸化剤、浸透圧調整剤、緩衝液、pH調整剤、キレート剤、カルシウムキレー錯体、塩類、またはそれらの組合せなどのうち1若しくはそれ以上の添加剤が含まれる(それらに限定されるものではない)。様々な実施形態の治療用組成物は、液体、ゲル、軟膏、ローション、固形物、または半固形物として製造される。一部の実施形態において、前記組成物には標的磁性ナノ粒子が含まれ、他の実施形態においては前記組成物には化学療法剤、放射線療法剤、血管浸透性強化剤、抗炎症剤、麻酔剤、鎮痛剤、鎮静剤、抗生剤(これらに限定されない)、およびそれらの組合せなどのうち1若しくはそれ以上の補助剤が含まれる。
【0008】
本発明の他の実施形態は、相互作用半径が約100nm〜約50μmの複数個の非標的磁性ナノ粒子および薬学的に許容可能な担体または賦形剤を含有する有効量の治療用組成物の投与、および複数個の非標的磁性ナノ粒子の加熱を誘発できるエネルギーへの患者の曝露による腫瘍原性組織の治療法を対象とする。特定の実施形態において、前記複数個の非標的磁性ナノ粒子の相互作用半径は約200nm〜25μmである。
【0009】
様々な実施形態において、前記腫瘍原性組織は充実性腫瘍である。一部の実施形態における投与には当該腫瘍原性組織と当該治療用組成物との直接的接触が含まれる。他の実施形態において、投与には当該治療用組成物の当該腫瘍原性組織への直接的適用が含まれ、さらに別の実施形態においては、投与には腫瘍への当該治療用組成物の注入が含まれる。
【0010】
特定の実施形態において、そのような方法は放射線療法、化学療法、外照射療法、手術、光線力学療法(photodynamic therapy:PDT)、生物剤を用いた治療法、またはそれらの組合せにより実施される。
【0011】
実施形態のエネルギーは、交流磁場(Alternating magnetic field:AMF)として例えばマイクロ波エネルギー、音響エネルギー、およびそれらの組合せであり、特定の実施形態において当該エネルギーは交流磁場(AMF)である。そのような実施形態において、交流磁場の周波数は約80〜800kHzであり、他の実施形態において交流磁場の振幅は約1〜120kA/mである。
【0012】
本発明のさらに別の実施形態には、相互作用半径が約100nm〜約50μmの複数個の非標的磁性ナノ粒子および薬学的に許容可能な担体または賦形剤を含有する有効量の治療用組成物を投与する工程、および複数個の非標的磁性ナノ粒子の加熱を誘発できるエネルギーへの患者へ曝露する工程による関節炎症の治療法が含まれる。特定の実施形態において、前記複数個の非標的磁性ナノ粒子の相互作用半径は約200nm〜25μmである。
【0013】
一部の実施形態における投与には、炎症を起こした滑膜組織、瘢痕組織、免疫細胞、およびそれらの組合せを前記治療用組成物に直接接触させる工程が含まれる。他の実施形態において、投与には当該治療用組成物を当該関節に直接適用する工程を含むものであり、さらに別の実施形態においては、投与には当該治療用組成物の当該関節への注入が含まれる。特定の実施形態において、投与にはさらに1若しくはそれ以上の抗炎症剤、麻酔剤、鎮痛剤、鎮静剤、抗生剤またはそれらの組合せの投与が含まれる。
【0014】
様々な実施形態において、前記エネルギーは交流磁場(AMF)、マイクロ波エネルギー、音響エネルギー、およびそれらの組合せである。一部の実施形態において、曝露には少なくとも患者の一部分への交流磁場(AMF)の印加が含まれる。特定の実施形態において、前記交流磁場の周波数は約80〜800kHzであり、他の実施形態において前記交流磁場の振幅は約1〜120kA/mである。
【0015】
関節炎症は実施形態を通じて様々であり、例えば外傷、疾病、関節炎、およびそれらの組合せの結果として発生する。一部の実施形態において関節炎は一般的関節炎、関節リウマチ、骨関節炎、腱炎、滑液包炎、線維筋痛、およびそれらの組合せであり、他の実施形態において疾患は痛風、ループス、くる病、強直性脊椎炎、シェーグレン症候群、またはそれらの組合せなどである。
【図面の簡単な説明】
【0016】
【図1】図1はインビボマウス試験に用いられた交流磁場ソレノイドの概略を示したものである。
【図2】図2はサンプルA(A.)およびサンプルB(B.)の透過電子顕微鏡写真を示したものである。
【図3】図3はH2O中(黒色)およびD2O中(濃灰色)のサンプルAおよびH2O中(中灰色)およびD2O中(淡灰色)のサンプルBに関するSANS/USANSデータを示している。エラーバーは±1標準偏差を示したものである。
【図4】図4はサンプルA(灰色三角)およびサンプルB(黒色円)に関し酸化鉄塊に正規化した295Kにおけるヒステリシスループを示したものである。
【図5】図5は100%H2O中(灰色)および100%D2O中(黒色)のサンプルBに関するSANS/USANSデータを示したものである。100%H2O中(淡灰色ライン)のサンプルBのフィットも示している。
【図6】図6は100%H2O(黒色)、50%H2O(淡灰色)、25%H2O(濃灰色)、および10%H2O(中灰色)中のサンプルBに関するSANSデータおよびフィット(生データ上のライン)を示したものである。
【図7】図7はサンプルB(黒色円)およびサンプルC(灰色三角)に関する酸化鉄塊に正規化した295Kにおけるヒステリシスループを示したものである。挿入部分は0および86kA/mの磁場におけるデータのクローズアップを示している(1080 Oe)。
【発明を実施するための形態】
【0017】
本組成物および方法について記載する前に、本発明は、記載の特定のプロセス、組成物、または方法論に限定されない(これらは様々であり得る)ことにつて理解することが必要である。記載に用いられた用語は、特定の見解または実施形態の記述のみを目的に用いられたものであり、添付の請求項によってのみ限定される本発明の範囲の限定を意図したものではないことについても理解されることが必要である。
【0018】
本明細書および添付請求項に記載したように、文脈から明らかに他の意味が示される場合を除き、単数形「一つの」および「前記」には複数への言及が含まれることに留意する必要がある。特に別の指定がない限り、本明細書に記載された技術用語および科学用語はいずれも当業者によって一般に理解されるものと同じ意味を有する。本発明の実施形態の実践または試験には、本明細書に記載したものと同様または同等の任意の方法が使用可能であるが、好ましい方法を記載する。本明細書に記載した出版物および参考文献はいずれも参照により組み込まれている。本明細書に記載した何ごとも、先行発明のため本発明がそのような開示に先行する資格がないことを認めたものと解釈されるべきではない。
【0019】
本明細書において使用される、「約」の用語は共に用いられる数値±10%を意味する。したがって、約50%は45%〜55%を意味する。
【0020】
「選択的」または「選択的に」は、それに続いて記載される構造、事象、または状況が生じる場合と生じない場合とがあることを意味すると考えてよく、またその記載にはその事象が生じる場合および生じない場合が含まれると考えてよい。
【0021】
治療薬との関連で用いられる「投与」とは、薬剤を標的組織内または標的組織上に直接投与するか、標的とする組織にプラスの影響を及ぼすように患者に薬剤を施すことを意味する。組成物の「投与」は注射または注入により、またはいずれかの方法を他の既知の技法と組み合わせることにより達成される。そのような結合手法には加熱、放射、および超音波が含まれる。
【0022】
本明細書での使用における「標的」の用語は、非活性化、破裂、崩壊、または破壊が望ましい物質を指す。例えば、異常細胞、病原体、または感染物質は患者において望ましくない物質と見なしてよく、治療の標的である。
【0023】
一般的に言えば、「組織」の用語は特定機能の遂行において結束した、同様に分化した細胞の集合体を指す。
【0024】
本明細書での使用における「病変組織」の用語は、骨、肺、血管、神経、大腸、卵巣、乳房、および前立腺の癌など(それらに限定されない)、任意の種類の固形腫瘍癌を含む病態または症状に関連した組織または細胞群を指す。他の種類の「病変組織」には炎症性滑膜組織などの関節炎組織が含まれる。
【0025】
用語「改善する」は、本発明の提供、適用、または投与の対象となる組織の外観、形状、特性、および/または物理的属性を変化させることを意味する。
【0026】
本明細書での使用において、「治療薬」の用語は患者の好ましくない状態または疾病を治療、対抗、改善、または予防するのに用いられる薬剤を意味する。
【0027】
本明細書での使用における組成物の「治療的有効量」または「有効量」とは、望ましい効果を達成するように計算された所定量を指す。
【0028】
本明細書での使用において、「ハイパーサーミア」の用語とは組織を約40〜60℃に加熱することを指す。
【0029】
本明細書での使用における「交流磁場」または「AMF」の用語は、通常は正弦波、三角波、矩形波、または同様の形状パターンにより、自らのベクト方向を周波数約80〜800kHzで定期的に変化させる磁場を指す。生じる磁場ベクトルのAMF部分のみが方向を変えるように、静磁場にAMFを加えられることもある。交流磁場には交流電場が伴っており、実際は電磁気であることが理解されるであろう。
【0030】
本明細書での使用における「エネルギー源」の用語は、治療薬の潜在的放射能源を活性化する目的でAMF以外の形態のエネルギーを治療薬に送達することのできる装置を指す。
【0031】
本明細書での使用における用語「負荷サイクル」は、一つのオン−オフサイクルにおいてエネルギー源がオンおよびオフである合計時間に対するエネルギー源がオンの時間の比を指す。
【0032】
温熱療法は、細胞の瞬間壊死(通常「温熱切除」と呼ばれる)および/または熱ショック応答を誘発(古典的ハイパーサーミア)し当該細胞内に一連の生化学変化を介した細胞死を引起すことから、癌および他の疾患の治療法として期待される。約40〜46℃の温度は病変細胞に不可逆的な損傷を与える一方で、正常細胞は最大46.5℃の温度への曝露に耐えられるため、病変組織において細胞の温度を約40〜46℃まで上昇させることにより、正常組織には損傷を与えずに病変細胞を選択的に破壊するという治療選択肢が得られる。46℃を超える温度は、瞬間的な温熱切除反応を引起すことによって癌および他の疾患の治療に有効である可能性がある。
【0033】
位相同期輪状配列システム(APAS)など、マイクロ波またはラジオ周波数(RF)ハイパーサーミアを用いた最先端のシステムは、深部腫瘍の局所加熱用エネルギーの調整を試みるものである。そのような技法は組織電気伝導率および高度灌流組織の不均一性によって制限される。これは非標的組織における「ホットスポット」とともに所望領域における用量不足という未解決の問題を引起す。その結果、治療比はしばしば予想を下回り、所望領域に送達された熱量を十分な精度で測定できないという特有の困難を生じる。後者は、治療後に再生可能かつ予測可能な患者利益を確保するために必要な規範的臨床試験計画書の作成を不可能にする。これらの要素のいずれもが、そのようなシステムによる特定領域の選択的加熱を極めて困難にする。
【0034】
本明細書で提案される発明の様々な実施形態は、温熱療法化合物およびそのような温熱療法化合物の病変組織治療への使用法を対象とする。本明細書に記載された温熱療法組成物は任意の方法で処方可能である。例えば一部の実施形態において、当該温熱療法組成物は被験者に送達され治療に利用される治療薬として生成される。他の実施形態において、本発明の温熱療法組成物は被験者に薬剤として送達される医薬組成物として生成される。さらに別の実施形態において、当該温熱療法組成物は温熱療法使用法に連動して被験者に投与される。
【0035】
一般に、実施形態の温熱療法には、交流磁場(AMF)などのエネルギー源の存在下に磁気ヒステリシス損失により発熱するエネルギー感受性物質である複数個の磁性ナノ粒子または「サセプタ」が含まれる。本明細書に記載された方法は一般に、治療を必要とする対象への温熱療法化合物の有効量を投与する工程、および同対象へエネルギーを適用する工程から成る。エネルギーの適用によって磁性ナノ粒子は誘導加温され、温熱療法化合物が投与された組織は組織除去に十分なほど加熱される。
【0036】
発生する熱は、当該物質の磁性が印加交流磁場に応じて振動する際のエネルギー損失に相当する。磁場サイクル当たりの熱発生量およびエネルギー損失に関与するメカニズムは、サセプタおよび磁場両方の固有の性質に左右される。サセプタはAMFに晒されるとキュリー温度として知られる特有の温度まで加熱される。キュリー温度は、磁性材料が強磁性体から常磁性体へ可逆的変化を起こす温度である。この温度未満では磁性材料は印加AMF中で加熱される。しかし、キュリー温度を上回ると当該磁性材料は常磁性となり、その磁区はAMFに反応しなくなる。したがって、キュリー温度を上回るAMFに曝露された場合、当該材料は熱を発生しない。当該材料がキュリー温度未満に冷めると磁性を回復し、当該AMFが存在する限り加熱を再開する。このサイクルはAMFへの曝露期間中継続的に繰り返される。したがって、磁性材料は加熱温度を自己調節することができる。サセプタがどこまで加熱されるかは、とりわけ当該材料の磁性、当該磁場の特性、および当該標的部位の冷却能力に依存する。
【0037】
材料組成、サイズ、および形状といったサセプタに関する多くの特徴が加熱特性に直接影響を及ぼし、これらの特徴は組織型内に見られる特定の条件一式に対する加熱特性を同時に調整するようにデザインされている。例えば、サセプタの粒径範囲および構成材料は特定の適用に依存する。さらに、磁性材料およびAMF特性の選択は、特定組織または標的タイプの治療効果を最適化するように調整される。様々な実施形態において、サセプタはキュリー温度約40〜500℃を達成するように生成される。
【0038】
様々な実施形態のサセプタには一般に磁性ナノ粒子またはその集合体が含まれ、特定の実施形態においては当該サセプタは単一磁区粒子である。磁場を維持できる材料はいずれも実施形態の磁性ナノ粒子の作成に用いることができ、本分野で知られた単一磁区粒子はいずれもサセプタとして有用である。例えば、サセプタにはマグネタイト(Fe3O4)、マグヘマイト(γ−Fe2O3)およびFeCo/SiO2などの材料が含まれ(これらに限定されない)、一部の実施形態においてはサセプタには例えばCo36C64、Bi3Fe5O12、BaFe12O19、NiFe、CoNiFe、Co−Fe3O4、およびFePt−Agなどの超常磁性粒子の集合体が含まれ、当該集合体の状態は磁気遮蔽を誘発する。他の実施形態においては、例えばMnNまたはMnxNyなどの窒素をドープしたMnクラスター(xおよびyはゼロ以外の数字)が磁気サセプタとして使用される。密度関数理論に基づく計算により、小Mnクラスターの安定性および磁性は窒素の存在によって根本的に変わり得ることが示される。そのような組成物は強磁性体であり、大きな磁気モーメントを有する。さらに、それらの結合エネルギーは大幅に増強され、Mn部位における当該磁気モーメント間の結合はそれらのサイズまたは形状に関わらず依然として強磁性である。さらに別の実施形態において、サセプタはNd1−xCaxFeO3である。理論に束縛されるものではないが、弱い強磁性の自発磁化はCa含有量または粒子サイズが増すにつれて低下する。
【0039】
本発明の実施形態において有用な例示的サセプタには、例えばFerrotec Corp.(ニューハンプシャー州Nashua)のシリーズEMG700およびEMG1111酸化鉄粒子(直径約110nm)(Oerstedt流速密度1,300、周波数150kHzで比吸収率(SAR)約310ワット/グラム)、およびInframat Corp.(コネチカット州Willington)のFeCo/SiO2粒子(同じ磁場条件においてSAR約400ワット/グラム)などがある。
【0040】
一部の実施形態において、サセプタの材料組成は特定の標的によって様々である。さらに具体的に言えば、磁性材料の自己限定的キュリー温度は送達熱総量と同様に当該材料組成と直接的に関連しているため、磁性粒子組成は異なった組織または標的タイプに合わせることが可能である。各標的タイプは、組成および身体内の位置を考えた場合、特有の加熱および冷却能を有するため、これは必要である。例えば、血液供給に乏しい部位に位置する腫瘍および比較的絶縁部位に位置する腫瘍は大血管の近くに位置する腫瘍に比べて低いキュリー温度材料が必要である。血流内の標的も異なったキュリー温度材料が必要である。したがって、例えばマグネタイトでできたサセプタには、コバルト、鉄、希土類金属などの元素、またはさらに別の元素の組合せが含まれる可能性がある。
【0041】
一部の実施形態において、サセプタは組織の環境からサセプタを保護するため、またはサセプタの特性を増強または調整するためにコーティングされる。コーティングに適した材料としては、合成高分子、生体高分子、共重合体、ポリマーブレンド、および無機材料が挙げられる。
【0042】
高分子材料としては、アクリレート、シロキサン、スチレン、アセテート、アルキレングリコール、アルキレン、アルキレンオキシド、パリレン、乳酸、グリコール酸、ヒドロゲルポリマー、ヒスチジン含有ポリマー、およびそれらの組合せなどが挙げられるが、それらに限定されるものではない。特定の実施形態において、高分子材料はヒドロゲルポリマーとヒスチジン含有ポリマーとの組合せである。
【0043】
サセプタのコーティングに用いられる生物材料としては、多糖類、ポリアミノ酸、タンパク質、脂質、グリセロール、脂肪酸など、およびそれらの組合せがある。例えば、ヘパリン、ヘパリン硫酸、コンドロイチン硫酸、キチン、セルロース、デキストラン、アルギン酸塩、でんぷん、炭水化物、グリコサミノグリカンなどの生物材料、およびそれらの組合せ、または細胞外基質タンパク質、プロテオグリカン、糖タンパク質、アルブミン、ゼラチンなどのタンパク質、およびそれらの組合せをサセプタのコーティングに用いる。
【0044】
無機コーティング材料としては例えば、金属、金属合金、ヒドロキシアパタイトなどのセラミック、炭化ケイ素、カルボン酸塩、スルホン酸塩、リン酸塩、フェライト、ホスホン酸塩、および元素周期表のグループIV元素の酸化物などによる任意の組合せが挙げられる。特定の実施形態において、これらの材料は1若しくはそれ以上の生体高分子または合成高分子を含有する複合コーティングを形成する。一部の実施形態において、前記コーティングには放射性元素または潜在的放射性元素も含まれる。
【0045】
一実施形態において、前記コーティング材料は金である。理論に束縛されるものではないが、金は生体適合性がある一方で、保護コーティングを形成し、サセプタにおける酸化などの化学的変化を予防する可能性がある。さらに、金は良導体としてAMF加熱に関連した渦電流加熱を増強する可能性がある。別の実施形態において、コーティング中の金は例えばチオールによって化学修正され、シラン、カルボキシル、アミン、または水酸基、またはそれらの組合せに結合する可能性がある。コーティング材料表面を修正するための他の化学的手法も利用可能である。
【0046】
他の実施形態において、上記のようなコーティング材料にはサセプタの細胞内への輸送を促進する1若しくはそれ以上のトランスフェクション剤が含まれる。例えば、特定の実施形態において、コーティング材料にはプラスミド、ウイルス、ファージ、ビリオンなどのベクター、プリオン、多糖類、カチオン性リポソーム、両親媒性物質、非リポソーム性脂質、またはそれらの組合せが含まれる。他の実施形態において、前記コーティング材料はトランスフェクション剤と有機および無機材料との混合物または組合せであり、そのような混合物は対象内の特定の種類の病変組織および特定の場所に合わせて作成される。
【0047】
特定の実施形態において、サセプタは保護コーティングを必要とし、コーティング材料の使用はコア材料を薬品による腐食から保護するため、また対象をコア材料の有毒作用から保護するために重要である。例えば、イオン、コバルト、他の磁性金属、および安定性に劣るそれらの酸化物をコーティングして酸化を予防する。さらに、これら金属の磁性は酸化によって著しく変化する可能性がある。特定の例において、コーティングされていないマグネタイトFe3O4は投与されると酸化してマグヘマイト(γ−Fe2O3)および最終的にはヘマタイト(α−Fe2O3)を形成し、酸化に伴ってマグネタイト・サセプタの磁性は低下する。他の実施例において、インビボにおいて前記サセプタ材料がヒトおよび動物に毒性リスクを及ぼす可能性がある場合に保護コーティングが使用される。
【0048】
一部の実施形態のサセプタにはさらに1若しくはそれ以上の放射性同位体が含まれ、病態治療に対し放射および加熱の相乗効果が得られることがある。疾患の治療に有用な任意の放射性同位体がそのような実施形態での使用に適しており、標的温熱療法の治療可能比を高める可能性がある。適切な放射性同位体としては例えば、ヨウ素−131、コバルト−60、イリジウム−192、イットリウム−90、ストロンチウム−89、サマリウム−153、レニウム−186、およびテクネチウム−99mが挙げられるが、それらに限定されない。一部の実施形態の放射性同位体は患者に通常量として約20〜60Gyを送達するように選択される。他の実施形態において、前記放射性同位体は化学療法の前に致死未満量(20Gy未満)を送達し、温熱療法開始時または終了時に致死量の放射線を送達する。放射線の線量レベルは放射性同位体の選択により、当該サセプタ組成における放射性同位体の組み込みを調節することによって、またはそれらの組合せにより調節可能である。放射線量のさらなる調節は、放射性サセプタおよび非放射性サセプタの混合物を含んだサセプタ懸濁液の使用により達成可能である。
【0049】
さらなる実施形態のサセプタには、ニュートロンまたはプロトンなどの素粒子およびX線などのイオン化放射線に対する高吸収性断面を有し、非放射性であるが不安定な核を有する、1若しくはそれ以上の同位体が含まれる。これらの同位体の核は放射線または素粒子を吸収し、核は不安定となってその崩壊に伴い放射線を放出する。例えば、ホウ素−10はニュートロンの捕獲に伴って放射線を放出することが知られている。ニュートロン高吸収性断面を有する同位体としては、例えばサマリウム−149、ガドリニウム−157、およびガドリニウム−155などのランタニドが挙げられる。特定の実施形態において、磁性であり、また磁性ナノ粒子に組み込むことによって当該ナノ粒子の磁性を高め得ることからサマリウムが使用される。
【0050】
さらに別の実施形態において、サセプタには1若しくはそれ以上の画像用アイソトープが含まれる。本明細書に記載されたサセプタの磁気的性質により、当該サセプタは核磁気共鳴画像法(MRI)または超電導量子干渉素子(SQUID)に基づいた方法などの磁気画像法のための適切な造影剤となる。画像用アイソトープには、鉄、酸化Fe3O4またはFe2O3などのフェライトの小常磁性または超常磁性粒子が含まれる。一部の実施形態において、温熱療法およびMRI、PET、SPECT、生体インピーダンスなどの画像法を組合せ、当該サセプタの投与前、投与中、または投与後に視覚化が行われる。例えば、サセプタをサンプルの臓器内または組織中に注入する。次にMRI造影用アイソトープを用いて標的臓器または組織を視覚化し、AMFを用いて当該標的組織を破壊する。さらに別の実施形態において、モリブデン−99、テクネチウム−99m、クロミウム−51、銅−64、ジスプロシウム−165、イッテルビウム−169、インジウム−111、ヨウ素−125、ヨウ素−131、イリジウム−192、鉄−59、リン−2、カリウム−42、ロジウム−186、レニウム−188、サマリウム−153、セレニウム−75、ナトリウム−24、ストロンチウム−89、キセノン−133、キセノン−127、およびイットリウム−90など(これらに限定されない)の放射線画像分子をサセプタ中に組み込むことも可能である。次にこれらの放射線画像分子を用いて標的臓器または組織を視覚化し、AMFを用いて当該標的組織または臓器を破壊する。
【0051】
当該サセプタのサイズは本発明の実施形態によって様々である。一般に、サセプタサイズの下限は、その下に単一磁区構造が存在する直径である。大きな磁性体は磁区またはブロッホ壁で分割され、磁壁によって提供されるエネルギーに加え、静磁エネルギー、交換エネルギー、および異方性エネルギーを含む全粒子エネルギーを最小化する、一様に磁化された領域となる。エネルギーの最終バランスが磁性材料内の磁区の数と形状の両方を決定し、磁性粒子のサイズが縮小するにしたがって磁区のサイズも縮小する。したがって磁壁形成にも、磁区の一区画を一定の数およびサイズに制限する関連エネルギーコストが伴う。下限は「単一磁区粒子」と称され、寸法制限は自発磁化および磁気異方性および交換エネルギーに応じて約0.1〜800nmである。しかし、一部の実施形態において、サセプタの粒子サイズは最大約1μmである。他の実施形態において、サセプタ粒子サイズは約1〜750nmであり、さらに別の実施形態において、サセプタ粒子サイズは約5〜500nmである。特定の実施形態において、サセプタの粒子サイズは約10〜250nmである。
【0052】
理論に束縛されるものではないが、粒子サイズが減少するほど、粒子表面および/または界面領域に曝露される原子の割合は上昇し、このことは粒子の磁性に及ぼす表面および界面電子構造の重要性を高める。したがって自発磁化および磁気結晶異方性など材料に内在する磁性は粒子サイズに強く影響される可能性がある。例えば、磁気異方性エネルギー総量は、表面異方性部分の割合が増えるため、粒子サイズが減少するにしたがって増加する可能性がある。さらに、静磁場、形状、およびストレスが、粒子サイズが減少するにつれてますます重要となる可能性があり、磁気結晶異方性と相まって単一磁区粒子の総磁気異方性エネルギーを決定する可能性がある。様々な実施形態において、強化された異方性は交流磁場(AMF)に晒された場合にこれらの材料のヒステリシス損失を増加させる可能性があり、これはひいてはより高い比吸収率(SAR)および加熱能の向上をもたらす。
【0053】
例えば、単一磁区を有する磁性体、すなわち単一磁区粒子、磁気モーメントmの作用は磁性粒子の総磁気異方性エネルギーに左右される可能性がある。変数mは、当該磁区の磁化の規模および方向を、時間、環境(温度、外部磁場、など)、および当該磁性ナノ粒子の結晶軸に対する磁気モーメントの方向に関連して規定するベクトルのことである。さらに、mは過去および現在の両方における当該磁気異方性エネルギーおよび物理的環境の産物である可能性がある。
【0054】
さらに具体的には、交流磁場(AMF)に曝露された際の単一磁区粒子のヒステリシス損失を介した熱生成能は、当該粒子内のエネルギーバランスによって決定される。これらのうち、磁気異方性エネルギーの合計が当該磁気モーメントmの方向変化に対するエネルギー障壁EBを示す。したがって、時間との兼ね合いにおけるmの安定性はEBの値が上昇するにつれて上昇する。粒子容積VおよびEBが結合して粒子の固有特性である特性緩和時間τOを定義する。これは十分に強力な磁場によって強制的に方向を変えられた後に、開始値に向けてmの方向に自然変動または自発的弛緩するのに要する時間である。したがって、τOは粒子内の対称性およびmが利用できる緩和経路に加え、粒子の組成、容積、および形状など様々なパラメータに依存する。
【0055】
単一磁区粒子における磁気異方性エネルギー、または潜在的ヒステリシス損失は第一近似において当該粒子の容積に比例する。したがって、大きな単一磁区粒子の場合、磁気異方性エネルギーが高すぎて磁化反転に対するエネルギー障壁は当該材料のキュリー温度未満では熱エネルギーによって越えることができない。当該粒子のmが変動しない場合、単一磁区粒子は安定的と言え、mが時間との兼ね合いで変動しない場合、当該粒子は本質的に安定した単一磁区作用を示す。当該粒子が磁気異方性エネルギーを克服するのに十分なほど強い外部磁場に曝露され、mの変化若しくは反転が強いられた場合、本質的に安定した単一磁区において磁化反転が生じる可能性がある。磁気異方性エネルギーは磁気モーメントの回転に対する障壁であるため、このベクトルにおけるそのような空間的変化には熱の形態によるエネルギーの放出が伴う。したがって放出熱の量は第一近似において当該磁気異方性エネルギーと比例する。
【0056】
さらに、AMFに曝露された際に単一磁区粒子のヒステリシス損失を通じて実現される熱の量は実験条件によって異なる。実験温度がEBと当該システムに利用できるエネルギーとの間の相対的差異を決定し、実験的緩和時間またはτを設定する。この関係は方程式1によって定義される。
【0057】
【数1】

【0058】
熱エネルギーは生成物κTによって規定され、κはボルツマン定数、Tはケルビン温度である。
【0059】
さらに、前記AMFの振動周期1/ν(νはAMFの振動数)とτとの関係がヒステリシス損失を通じて生成された熱量に直接つながる可能性がある。例えば、1/νがτよりもはるかに大きい場合、磁気モーメントは遮蔽されていないように見え、EBを自然に乗り越えヒステリシス損失を示さずに無作為に方向を変え、熱は発生しない。逆に、1/νがτよりもはるかに小さい場合、磁気モーメントは遮蔽されたように見え、方向変化に抵抗する。したがって、AMFの周波数を上げることによりmはEBを乗り越えることを強いられ、変化の間に熱が放出される可能性がある。
【0060】
磁場が取除かれると、磁気モーメントはもとの方向に戻る前の一時期に磁場によって印加された方向を保持する。磁場が取除かれた後にそのような方向変化が生じるのに必要な時間は「緩和時間」と言われ、当該粒子の磁気異方性エネルギーおよびκTの両方の結果としての粒子の特性を示す。本質的に安定的な単一磁区粒子において、前記緩和時間は109秒を上回ることがある。したがって、磁気異方性エネルギーが当該物質のキュリー(またはニール)温度(強磁性から超常磁性状態への移行が生じる温度として定義される)を上限とする全ての温度に関する磁気スピンシステムの自発的回転に対する乗り越えられない障壁となることから、磁気モーメントは遮蔽されているように見える可能性がある。
【0061】
単一磁区内における粒子容積が低下するに従い、磁気異方性エネルギーも低下する。特定の特徴的粒子サイズ未満において、磁気異方性エネルギーはゼロを上回る任意のT値に対しκTと同等またはそれを下回るようになる。ゼロを上回る任意の温度において磁気異方性エネルギーがκT未満であることから、同エネルギーは磁化反転に対する障壁とはならず、磁化反転に対するエネルギー障壁が克服可能であることを示している。したがって粒子の総磁気モーメントは結晶軸に関し常磁性体における回転と同様、熱的に変動する可能性があり、単一磁区粒子内での回転システムの自発的回転を可能にする一方で粒子に対する磁気的結合を維持する。これはバルク材に見られる常磁性との類似から通常超常磁性と呼ばれ、このような単一磁区粒子は本質的に不安定な磁区を有するか、または本質的に超常磁性であると言える。
【0062】
超常磁性粒子を外部磁場に曝露することにより、磁気モーメントは同時にエネルギーを放出することなく磁場ベクトルの方向を向くことになる。磁場が粒子から取除かれると、磁気モーメントの方向の自発的変動は当該外部磁場によって印加された全ての足跡を迅速に破壊することになる。したがって、本質的超常磁性粒子の特性緩和時間は非常に短く、通常は約10−9秒のレベルであり、本質的超常磁性材料の磁気モーメントは全ての実験的温度において遮蔽されず、常に特性緩和時間よりも長い。
【0063】
したがって、緩和時間は温度によって規定され、磁性反転は測定時間が特性緩和時間よりも短ければ遮蔽されたように見える可能性がある。この場合、当該材料は安定的単一磁区と同様の作用を示し、特性緩和時間よりも短い時間AMF中に置かれた場合には熱を生成する。そのような材料は遮蔽されたと定義され、これらの条件下では明らかに安定的な単一磁区である。
【0064】
逆に、AFM期間の測定が当該粒子の特性緩和時間を超える場合には、遮蔽されていないまたは明らかに超常磁性の作用が観察される。この例における特性緩和時間は測定時間またはAMF期間よりもはるかに短いため、磁化再配列および磁化反転が磁気異方性エネルギー障壁による明らかな抵抗なしに無作為に生じる。したがって、熱放出はない可能性がある。
【0065】
明らかに安定的な単一磁区(または遮蔽された)作用を明らかな超常磁性(または遮蔽されていない)作用から区別するために、温度も非常に重要である。したがって、類推により、単一磁区を有する粒子の磁気モーメントの特性緩和時間は、一定期間AMFに曝露された場合、実験温度Texpが特性値未満であれば遮蔽されたように見えるであろう。もしTexpがこの特性温度よりも高ければ、磁気モーメントは同じ一定期間AMFに曝露された場合、遮蔽されていないように見える。この特性温度はブロッキング温度Tbとして定義される。したがって、単一磁区を有する粒子が一定周波数のAMF内に置かれた場合、粒子温度がブロッキング温度未満である間、磁気モーメントの強制振動により熱が放出される可能性がある。粒子温度がブロッキング温度を上回ると磁気モーメントは遮蔽されず、AMFへのさらなる曝露による熱放出は全て停止する。これは、κTで定義される熱エネルギーが磁気異方性エネルギーを凌駕し、それによってスピンシステムに過剰のエネルギーを提供し、磁気結晶エネルギー障壁を乗り越えるためである。
【0066】
個々の単一磁区粒子の作用は上記のとおりである。しかし、本発明の実施形態には、単一磁区粒子または適切な媒体に懸濁され磁性ナノ粒子の懸濁液など複数個のサセプタの集合である磁性ナノ粒子が含まれ、上記のものとは異なった特性を有する可能性がある。そのような複数個のサセプタにおて、個々の磁気サセプタのサイズは様々であり、様々な容積の1若しくはそれ以上の単一磁区粒子を有する。
【0067】
印加AMFにおける緩和時間、結果として生じるヒステリシス損失、および磁性ナノ粒子懸濁液からの生成熱について詳述したことにより、一定容積を有する個々の単一磁区粒子の性質の説明に必要な因子をはるかに上回る多くの因子を含めることが必要となる。容積は単一磁区粒子の固有特性でありEBに直接影響を及ぼすため、様々な容積の粒子群のτ0およびτの測定にはサイズ分布に関する知識が必要とされる。平均容積は特定の温度およびAMF周波数においてmを遮蔽するのに十分なEB値と関連するが、集合体中には容積およびEBが著しく低い粒子片が相当量存在する可能性がある。正味の影響は平均容積から予想されるよりもはるかに低い熱出力である可能性がある。逆に、粒子群の平均容積はEB値がmを遮蔽するのに必要なものよりも低い可能性がある。この粒子群は超常磁性に見える可能性があり、AMFにおいてヒステリシスを示すことは期待されない。
【0068】
粒子間相互作用は、単一磁区粒子群におけるヒステリシス作用を十分に説明するために必要なもう一つの要素である。磁力は定義によれば遠距離力である。つまり、影響の範囲は磁区の境界をはるかに越えて広がる可能性がある。したがって、一つ以上の単一磁区粒子による集合体は各粒子の磁性の合計よりも大きな特性を示す可能性がある。これは、磁気異方性エネルギーへの追加的寄与は各粒子のmの他の粒子のmとの集合的寄与に起因する可能性があり、これらの修正磁気異方性エネルギーは個々の非相互作用粒子の状態に特徴的でない作用を示す集合状態を生じ、明らかなEBの上昇と不均質なブロッキングプロセスを生じる可能性があるためである。したがって、磁性ナノ粒子または超常磁性粒子の集合体は遮蔽されたように見えることがあり、適切な条件下ではヒステリシスを示すことさえある。しかし、ブロッキングプロセスは不均一であるため、観察されるヒステリシス作用は当該集合体に匹敵する容積の単一磁区粒子のものよりも相当に弱い可能性があり、当該集合体はいかなる状況においても超常磁性および安定的単一磁区のいずれとも定義され得ない。
【0069】
安定的かつ超常磁性粒子または純粋に超常磁性の単一磁区粒子を含む磁性ナノ粒子の集合体の完全評価は、必要とされる測定数およびこれらの測定の一部の結果が不確定または場合によっては相反することさえあるため、困難かつ非現実的である。しかし、総平均磁気異方性エネルギーを定義することにより個々の磁性ナノ粒子の集合体および総磁性ナノ粒子の磁性を定義することは可能である。続いて総平均磁気異方性エネルギーを用いて、特定の温度、特定のAMFにおける平均特性緩和時間および当該集合体の平均作用を定義することができる。実験的温度270〜380K、振幅約1〜120kA/m(特定の実施形態では約7〜105kA/m)で周波数約100〜600kHzのAMFへの曝露においては、SARの測定値を用いて個々の単一磁区粒子の集合体および総単一磁区粒子に関し、明らかに遮蔽された作用と明らかに遮蔽されていない作用を区別することができる。例えば、遮蔽されていないまたは明らかに超常磁性の粒子の集合体は、一般に特定の条件下において粒子当たり10W/g未満を生成する。それに比べ、相互に作用しない本質的に超常磁性のナノ粒子の集合体は、定義によりちょうど0W/g粒子を生成する。逆に、明らかに遮蔽された個々のサセプタは10〜150W/g粒子を生成する。さらに、本質的に遮蔽された、または安定的単一磁区粒子の集合体は、超常磁性汚染が一部存在するにしても、ヒステリシス加熱により特定条件下に160W/g粒子以上を生成する可能性がある。
【0070】
集合作用を示すサセプタは組織加熱用プラットフォームとして有用である可能性がある。例えば、上記のような非標的(裸の)磁性ナノ粒子を、患者の病変または炎症組織部位に有効量を直接投与することが可能である。いったん投与すれば、当該標的組織を含む領域はAMFに晒され、非標的磁性ナノ粒子のヒステリシス加熱が生じる。特定の実施形態において、印加したAMFの結果として生成された熱は、投与粒子群が集合作用を示すことから、投与された粒子の数および種類から予想されるであろうものよりも大きい可能性がある。したがって、一群のサセプタが標的組織に投与された場合、標的組織へのAMF印加の結果生じる熱が高められる。
【0071】
本明細書での使用において、用語「非標的」または「裸の」サセプタとは、特定の細胞種または分子と相互作用するように修正されていないサセプタを意味する。その一方、「標的」サセプタは、例えば当該サセプタに共有結合した抗体を用いて特定の分子と相互作用するように修正されている。非標的または裸サセプタにはそのような標的メカニズムは備わっていない。
【0072】
様々な実施形態において、投与された磁気サセプタは集合作用を示すか、または当該組織中に集合的磁性状態で存在する。個々の磁気サセプタはゆるやかな集合体としての溶液中を移動する。その中で当該粒子は互いに近接するが物理的に接触しない。理論に束縛されるものではないが、特定の特性を有する非標的磁気サセプタは生物組織において集合的磁気状態を達成する可能性がある。したがって、投与された場合、これらのサセプタは当該組織中の細胞または細胞間隙において集合体を形成する。さらに、理論に束縛されるものではないが、磁性ナノ粒子の濃度は総産生熱に直接影響を及ぼす可能性がある。
【0073】
集合的磁気状態を達成することのできる磁気サセプタのサイズ、形状、多分散性は様々であり、様々な磁性を有する可能性がある。例えば一実施形態において、集合的磁気状態を達成可能な磁気サセプタの相互作用半径は75mm未満である。別の実施形態において、当該磁気サセプタの相互作用半径は約100nm〜50μmであり、さらに別の実施形態においては、当該磁気サセプタの相互作用半径は約200nm〜25μmである。そのような粒子はゆるやかな集合体として、または物理的接触のない個々の粒子の塊としてふるまう。
【0074】
本発明によって具体化される様々な磁気サセプタの相互作用半径の規模は、本分野で知られた様々な方法によって変更可能である。一部の実施形態において、当該相互作用半径は磁気サセプタのコアに少なくとも2層若しくはそれ以上のコーティング材料を提供することによって減らすことが可能である。例えば一実施形態において、2層のデキストランを磁気サセプタに適用させて相互作用半径を許容可能な範囲内に減らし、そのような粒子群が集合的磁気状態を達成できるようにすることができる。他の実施形態において、上記の高分子または生物学的コーティング材料のいずれもが当該相互作用半径に同様の作用を引起す可能性がある。
【0075】
さらに別の実施形態において、コーティング粒子は当該磁性ナノ粒子による集合作用の発現を可能にするコーティング材料のネットワークを形成する。例えば一実施形態において、デキストランでコーティングされた磁性ナノ粒子は、当該デキストランコーティングが通常はコーティングされた粒子の相互反発を招くにもかかわらず、デキストランネットワークを形成する。理論に束縛されるものではないが、コーティング粒子による磁性の発現によりデキストランコーティングネットワークが形成され、それが磁性ナノ粒子コアにおける集合作用を刺激する。
【0076】
また、集合的磁気状態を達成する磁気サセプタは、磁場がサセプタに印加された場合、個々のサセプタを組み合わせたものまたは当該粒子が物理的に接触する集合体よりも大きな比吸収率(SAR)を示す可能性がある。例えば一部の実施形態において、集合的磁気状態で作用する複数個のサセプタは、鉄含有量に応じ、約150〜1750W/gのSAR、または他の実施形態において約175〜1500W/gのSARを達成する。さらに別の実施形態において、SARは1500W/gを上回る可能性があり、当該磁気サセプタの生成に用いられた材料次第である。さらに、上記SARの上昇は集合体中の粒子数に応じて調整可能である。例えば、非標的磁気サセプタの大集合が投与される実施形態においては、より小さな集合の非標的磁気サセプタが投与される実施形態に比べSARは増幅される可能性がある。したがって、磁気サセプタの増強された加熱能は濃度依存性である可能性がある。
【0077】
理論に束縛されるものではないが、粒子の飽和磁性は集合的磁気作用を示す磁気サセプタの高加熱能に寄与せず、様々な実施形態において当該飽和磁性は約10〜100kA−m2/gである。磁気サセプタのサイズも集合的磁気作用に直接の影響を及ぼさず、したがって、本発明の実施形態に利用される粒子のサイズは上記のごとく約0.1μm未満である。上記のごとく粒子サイズが加熱に直接影響を及ぼす可能性があることも指摘される。さらに、集合的磁気状態で作用するサセプタは、当該集合作用に影響を及ぼすことなく広範な多分散性を有する可能性がある。例えば一実施形態において、サセプタ群の多分散性は約0.1〜1.5である。
【0078】
特定の実施形態において、集合的磁気状態を発現する複数個の非標的磁気サセプタには、溶液中で当該非標的サセプタとともに集合的磁気状態を維持する1若しくはそれ以上の標的磁気サセプタが含まれる。理論に束縛されるものではないが、そのような非標的および標的サセプタを組み合わせた集合は、集合的磁気状態を損なうことなく特定の組織、細胞、またはタンパク質を標的とすることを可能にすると考えられる。したがって、非標的サセプタによって示される利益は標的システムに受け継がれる可能性がある。
【0079】
非標的サセプタを用いて加熱が治療の一形態を提供し得る任意の数の疾患徴候の治療を行うことができ、本発明の実施形態には多数の疾患の治療法が含まれる。様々な実施形態において、非標的サセプタを病変組織に直接投与し、加熱により組織を除去し病態治療を行うことが可能である。例えば一実施形態において、非標的サセプタを例えば直接注入により固形腫瘍に直接投与してもよく、AMFを患者の腫瘍含有部分に印加することが可能である。当該サセプタは当該腫瘍において集合的磁気状態を発現し、腫瘍組織を加熱、除去し、それによって腫瘍組織を削減または排除する。集合的磁気状態を発現するサセプタを用いた治療法はあらゆる種類の癌の治療に用いることができ、一部の実施形態においてそのような治療法は例えば皮膚癌、頭頸部癌、舌癌、咽喉癌、喉頭癌、脳腫瘍、乳癌、肝臓癌、膵臓癌、リンパ節腫瘍、関節または滑膜腫瘍、子宮癌、子宮頸癌、腹膜腫瘍などの治療に用いられる。他の実施形態において、集合的磁気状態を発現するサセプタは白血病およびリンパ腫(それぞれ造血細胞およびリンパ組織の癌)の治療に用いられる。
【0080】
別の例示的実施形態において、非標的サセプタを投与し、例えば関節の滑膜組織中に直接注入することによって関節炎症および/または関節腫脹を治療することが可能である。AMFが印加されるとサセプタは集合的磁気状態を発現し加熱される。加熱されたサセプタは関節の瘢痕組織または炎症滑膜組織を除去し、それによって症状を軽減または除去する。集合的磁気状態を発現するサセプタは任意の種類の関節炎症の治療に有用であり、例えば一般的関節炎、関節リウマチ、骨関節炎、腱炎、滑液包炎、線維筋痛など(それらに限定されない)、既知の任意の形態の関節炎がそのような方法で治療可能である。他の実施形態において、そのようなサセプタは、腫脹、痛風、ループス、くる病、強直性関節炎、脊椎炎、シェーグレン症候群など、他の炎症性疾患の治療に用いられる。さらに別の実施形態において、そのようなサセプタは外傷の治療に用いられる。
【0081】
さらに別の実施形態において、前記非標的サセプタはゲル、ローション、軟膏、または洗浄液を用いて病変組織または病変組織周辺部位に直接適用する。例えば一実施形態において、腫瘍などの病変組織を除去する外科処置後に、当該腫瘍周辺部位を軟膏、ゲル、洗浄液、または非標的サセプタ含有溶液で洗浄する。続いてAMFを当該部位に印加し、腫瘍摘出術後に同部位に残存する発癌性組織を除去または破壊する。同様に、非標的サセプタ含有のゲル、軟膏、または溶液を用いて、切除部位または任意の外科処置部位における感染または炎症を軽減または除去する。さらに別の実施形態において、ゲル、軟膏、、またはローションを患者の皮膚に直接適用し、AMFを用いて組織を除去することなく患者の組織に熱を適用し、関節または筋の痛みまたは硬直を治療する。
【0082】
上記の様々な実施形態における非標的サセプタは、水または生理食塩水などの溶液中に混ぜ合わせることによって患者への投与に適切なものとすることができ、または他の成分または活性薬剤を含む治療製剤として作成することも可能である。本発明の非標的サセプタは、本分野で知られ実践されている技術に基づき、治療用組成物として製剤可能である。「治療用組成物」は一般に少なくとも無菌かつ発熱原が含まれていないものと見なされ、本明細書での使用における用語「治療製剤」または「治療用組成物」にはヒトおよび家畜に使用される製剤が含まれる。本発明の様々な実施形態の治療用組成物は、Remington's Pharmaceutical Science,17版、Mack Publishing Company,ペンシルバニア州Easton(1985)に記載されたように生成される。開示全体が本明細書に参照として組み込まれている。
【0083】
本発明の実施形態に含まれる治療用組成物は様々である。例えば一部の実施形態において、本発明の治療用組成物には水、緩衝用水、生理食塩水、0.4%生理食塩水、0.3%グリシン、ヒアルロン酸などの生理学的に受容可能な担体媒体と混ぜた非標的サセプタ約0.01〜95重量%が含まれる。他の実施形態において、非標的磁気サセプタは治療用組成物の約1〜90重量%を占める。治療用組成物の他の実施形態には適切な医薬品グレードの界面活性剤(例えばTWEEN)などの安定剤が含まれ、単糖類(例えばデキストロース)もそのような治療用組成物に組み込まれることがある。本発明に含まれる治療用組成物には従来の賦形剤および/または添加剤も含まれる。例えば、適切な医薬賦形剤としては、安定剤、抗酸化剤、浸透圧調節剤、緩衝剤、pH調整剤などが挙げられ、適切な添加剤としては、生理学的生体適合緩衝液(塩酸トロメタミンなど)、キレート(DTPAまたはDTPA−ビスアマイドなど)、カルシウムキレート錯体(カルシウムDTPA、CaNaDTPA−ビスアマイドなど)、または選択的にカルシウムまたは硫酸塩(塩化カルシウム、アスコルビン酸カルシウム、グルコン酸カルシウム、乳酸カルシウムなど)などが挙げられる。そのような本発明の治療用組成物は使用のために液体またはゲル状とし、特定の実施形態においてはそのような治療用組成物は凍結乾燥される。特定の実施形態において、非標的サセプタは水、生理食塩水、リンゲル液、デキストロース、アルブミン溶液、油などに溶いて注射製剤とする。
【0084】
他の実施形態において、本発明の治療用組成物は、固形物、半固形物、懸濁液、分散液、乳濁液として使用するのために包装されていても良い。従来の非毒性固形担体をそのような組成物中に組み込むことができ、医薬品グレードのマンニトール、ラクトース、でんぷん、ステアリン酸マグネシウム、サッカリンナトリウム、タルカム、セルロース、グルコース、スクロース、マグネシウム、炭酸などが含まれる。例えば、上記の任意の担体および賦形剤約1〜95重量%、さらなる例では25〜75重量%を本発明の非標的サセプタと混合する。
【0085】
一部の実施形態において、実施形態の治療用組成物にはさらに1若しくはそれ以上の補助活性薬剤が含まれる。例えば一実施形態において、1若しくはそれ以上の化学療法剤が非標的サセプタと組み合わされ、当該サセプタの治療効果を高める。そのような使用に適した化学療法剤の例としては、アルキル化剤、植物アルカロイド、抗腫瘍抗生物質、代謝拮抗物質、トポイソメラーゼ阻害剤、ホルモン剤、成長因子、サイトカイン、分裂抑制剤、それらの組合せなどが挙げられるが、それらに限定されるものではない。特定の実施形態において、化学療法剤はカルマスティン(BCNU)、5−フルオロウラシル(5−FU)、シタラビン(Ara−C)、ゲムシタビン、メトトレキセート、ダウノルビシン、ドキソルビシン、デキサメサゾン、トポテカン、エトポシド、パクリタキセル、ビンクリスチン、タモキシフェン、サリドマイド、メルファラン、シクロホスファミド、スルホン酸アルキル、ニトロソウレア、エチレンイミン、トリアゼン、葉酸拮抗剤、プリン類似薬、ピリミジン類似薬、アントラサイクリン、ブレオマイシン、マイトマイシン、ダクチノマイシン、プリカマイシン、ビンカアルカロイド、エピポドフィルトキシン、タキサン、糖質コルチコイド、L−アスパラギナーゼ、エストロゲン、アンドロゲン、プロゲスチン、黄体形成ホルモン、酢酸オクトレオチド、ヒドロキシウレア、プロカルバジン、ミトタン、ヘキサメチルメラミン、カルボプラチン、ミトキサントロン、モノクローナル抗体、レバミゾール、インターフェロン、インターロイキン、フィルグラスチム、サルグラモスチム、白金錯体(シスプラチン、カルボプラチン、オキサリプラチンなど)のうちの1若しくはそれ以上である。化学療法剤に関するそれ以上の例については「Modern Pharmacology with Clinical Applications」6版、Craig&Stitzel,第56章639〜656ページ(2004)に記載されており、参照として本明細書にそのまま組み込まれている。別の実施形態において、実施形態の治療用組成物にはさらに1若しくはそれ以上の抗炎症剤、1若しくはそれ以上の麻酔剤、1若しくはそれ以上の鎮痛剤、1若しくはそれ以上の鎮静剤、1若しくはそれ以上の抗生物質等、およびそれらの組合せが含まれる。
【0086】
本明細書に記載された実施形態に関する非標的サセプタまたは非標的サセプタを含有する治療用組成物は、本分野で知られた任意の方法で投与可能であり、投与量は例えば当該病変組織の種類および部位によって異なる。例えば、非標的サセプタは静脈内投与、組織周辺または組織内注射、皮下注射または皮下沈殿または皮下注入、腹腔内注射、臓器内注射、筋肉内注射、および病変組織またはその近辺への直接投与など(それらに限定されない)の方法による非経口的な投与が可能であり、当該病変組織の効果的な治療が促進される。特定の実施形態において、血管内投与には静脈内ボーラス注射、静脈内注入、動脈内ボーラス注射、動脈内注入、およびカテーテルによる血管内への点滴が含まれ、他の実施形態において、組織周辺および組織内注射には腫瘍内注射および滑膜内または関節内注射が含まれる。例えば、皮下注射を用いて乳房組織の腫瘍にサセプタを送達することができ、また臓器内注射を用いて肝臓組織の腫瘍にサセプタを送達することができる。他の実施形態において、サセプタは、スポンジを用いた洗浄のような洗浄、浄化により、または手術前後の投与技術などの他の術布により送達される。例えば、癌性腫瘍の除去後に組織をふき取るために、懸濁液、軟膏、またはローション中のサセプタを吸収したスポンジを用いることが出来る。
【0087】
本発明の非標的サセプタは、本発明の様々な実施形態において、単回投与或いは反復投与により投与され得る。当業者であれば、所定の対象へサセプタを投与するための適切な投与計画を容易に決定することができ、その投与計画は、病状及び個人の健康に依存して変わる。例えば、前記非標的サセプタは、例えば病変組織へ或いはその付近に、単回の注射又は沈着(deposition)として、1回前記対象へ投与することが可能である。或いは、非標的サセプタは、約1日から約28日の期間で、或いは約1日から約10日の期間で対象者へ1日1回或いは2回投与することが可能である。例えば、一部の実施形態において、非標的サセプタは、7日目まで1日1回、病変組織の部位に或いはその付近に注射される。一度患者へ投与されると、標的部位へのサセプタの運搬は、前記サセプタの磁性特性のために、前記標的領域へ静磁場を適用することによって補助される。補助運搬は、前記標的の位置に依存する。
【0088】
エネルギーは、標的細胞、標的組織へ、体内(intracorporeally)(体の中)に或いは体外(extracorporeally)(体の外)に投与されるか、若しくはエネルギーは対象の体の一部或いは全身へ適用される。前記エネルギーの適用は、前記サセプタの単一投与の完了後すぐに開始し、各投与後或いは複数投与の完了後毎日繰り返されるものである。或いは、誘導加熱は、例えば、前記サセプタの投与の完了後数分から数日という期間の後開始するものである。各誘導加熱セッションの持続期間は、5分から5時間である。論理に束縛されることなく、前記サセプタの投与からエネルギー適用までの期間は、前記サセプタが前記標的組織内の細胞によって取り込まれることを可能にする。例えば、いくつかの実施形態において、標的組織は、例えば単球或いは白血球などの炎症に関与する細胞を含み、これらは投与後前記粒子を貪食するものである。サセプタを貪食した細胞へエネルギーを適用することは、これら細胞が加熱の結果として破壊され、炎症が軽減する可能性を増加するものである。
【0089】
様々な形態のエネルギーは、これに限定されるものではないが、AMF、マイクロ波、音響エネルギー、或いはそれらの組み合わせを含む、非標的サセプタの誘導加熱を提供するために本分野で知られているあらゆる手段によって患者へ適用される。例えば、1実施形態において、適切な周波数及び振幅でのAMFが患者へ適用され、別の実施形態においては、適切な周波数でのマイクロ波エネルギーが適用される。さらなる別の実施形態において、付加的エネルギーは、AMF、マイクロ波或いは音響エネルギーとの組み合わせで使用され、これはサセプタが電離放射線(例えば、中性子、アルファ、ベータ、ガンマなど)を放出するのを可能にするものである。特定の実施形態において、AMFエネルギーは、対象へ適用され、非標的サセプタの加熱を誘導し、前記非標的サセプタの治療的加熱を産生するものであり、そのような実施形態において、前記AMFの周波数は約80kHzから約800kHzの範囲内である。
【0090】
AMF、マイクロ波及び音響エネルギーの様々な供給源は本分野において利用可能であり、そのような供給源の全ては本発明の実施形態において利用される。例えば、いくつかの実施形態において、米国出願番号第10/176,950号及び第10/200,082号(この参照によってそれら全体は本明細書に組込まれるものである)に記載された装置は、本発明のサセプタの加熱を誘導するために対象へ広く適用されるAMFエネルギーの供給源として使用される。他の実施形態において、AMFを産生するために使用される供給源は、焦点を併せた及び/若しくは均一な場を提供する。例えば、1実施形態において、図1に描写されたような磁性ソレノイドコイルは、ヒト肢或いは小動物などの対象の一部の組織へ適用されたサセプタを加熱するために使用される。図1の実施例に対して、特定の組織22へ局所的に投与されたサセプタを有するマウス10は、磁性ソレノイドコイル14が巻かれたチューブ12に保持される。フェルト裏打ち16はチューブ12を取り囲み、前記チューブ12のパッドとして働く。磁束集線器リング18は前記チューブ12の一部を取り囲み、磁束集線器基部20と連結している。そのような実施形態における磁性コイル14は、図1に描写されたようなコイル、或いは低磁気抵抗磁性物質の回状のドーナッツ型リングであり、これは望ましい周波数で作動する磁性コアのために特別に形成されたものである。例えば、いくつかの実施形態における作動周波数は、約80kHzから約800kHzである、或いは特定の実施形態において、約150kHzである。このアプローチによって、前記対象へのより高い磁場強度の適用が可能になり、渦電流加熱が減少した。加えて、回状ドーナッツ型リング及び集束バーは、前記磁場の電界強度をソレノイドコイルのかなり外側に外れさせる(drop off)。従って、磁性ソレノイドコイルは、頭及び重要器官などの、前記対象の非標的部分を保護する一方、AMFを集束する。
【0091】
他の実施形態において、マイクロ波共鳴加熱は、共鳴加熱を介して対象へ投与されたサセプタを加熱するために使用される。そのような実施形態において、サセプタ物質は、前記物質の内部化学結合が特定の周波数で共鳴する、或いは特定の磁性、電気的或いは電気双極子構造を有する物質とのマイクロ波エネルギーの相互作用を利用することによって共鳴するようなものが選択される。一般的に、共鳴加熱は、前記標的物質が比較的低パワーのエネルギー供給源から大量のエネルギーを吸収するので、有利である。従って、組織などの非標的物質は、前記サセプタのものとは異なる共鳴周波数を有しており、同程度まで加熱しない。加熱の直接モードに加えて、共鳴加熱は間接的にも使用される。例えば、1実施形態において、サセプタは、それらが付着する前記組織の共鳴周波数におけるシフトを誘導する、磁性或いは電気特性を有するものが選択される。従って、前記サセプタに非常に近接した前記組織の分子は、適切な周波数に同調されたエネルギー場が前記組織に適用された場合、優先的に加熱されるであろう。
【0092】
特定の実施形態において、病変組織は前記対象から除去し、エネルギーを体外で前記組織へ適用した。そのような実施形態において、非標的サセプタは、前記病変組織の除去前に前記対象へ投与される、若しくは非標的サセプタは、除去後前記病変組織へ適用される。以前記載した実施形態にあるように、非標的サセプタを含む前記病変組織をエネルギー源へ曝露することは、前記病変組織の一部の溶解を引き起こす、若しくは他の損傷を起こし、その結果前記病変組織を治療する。治療した組織は次に、前記対象の体に戻される。例えば、1実施形態において、抽出した組織は血液であり、血清或いは血漿に運ばれる標的細胞を含むサセプタは、他の血液成分から体外で分離され、前記標的を破壊或いは不活性化するためにエネルギー源へ曝露される。曝露後、処理した成分は他の血液成分と再び組み合わせて、対象の体に戻した。別の実施形態において、前記サセプタは、抽出組織へ導入する一方、前記抽出組織は対象の体或いは体の一部の外側である。例えば、対象からの抽出血液は、エネルギー源へ曝露する前に体の外側を循環する血液における前記サセプタへ導入される。さらなる別の実施形態において、サセプタは、血液、血清或いは血漿が流れる血管或いはカラムに含まれる。前記血管或いはカラムは、対象の体へ血液を戻す前に前記標的細胞を破壊或いは不活性化するように、エネルギー源へ曝露される。
【0093】
前記サセプタへ体外でエネルギーを提供することの利点は、より高い温度で加熱する及び/若しくはより素早く加熱し効率を増強する一方、周囲の体組織への加熱及び障害を最小限にする能力、及びエネルギー源から前記エネルギーへの体の曝露を減少させる能力を含む。前記サセプタが対象の体の外側を循環する血液へ導入される実施形態において、体から抽出された血清或いは血漿、サセプタは、体に直接導入される必要はなく、より高い濃度のサセプタは標的へ導入され得る。さらに、体外で処理される対象の一部は、多数の適用可能な方法を用いて、外部で冷却され得る一方、エネルギーは治療効果を軽減することなく前記サセプタへ提供される。加えて、前記冷却は、エネルギーの投与以前及び/若しくは以後に行われる。
【0094】
さらなる他の実施形態において、処理サセプタ及び関連標的は、対象の体へ戻される必要がない。例えば、前記サセプタ及び関連標的が対象から抽出された血液内に含まれる場合、前記処理サセプタ及び関連標的は、対象の体へ血液が戻る前に血液から分離されるであろう。前記サセプタが磁性成分を含む実施形態において、サセプタを含む組織は、磁場勾配を通過し、前記抽出組織からサセプタ及び関連組織を分離する。そうしている間に、対象の体に戻されるサセプタ及び処理病変物質の量は軽減される。
【0095】
体外で処理するさらなる別の実施形態において、加熱することが選択された組織は、手術手順の間に対象の体から完全に或いは部分的に除去される。前記組織は、体へ連結し続けることができる、或いは治療後解離され再接着され得る。さらなる別の実施形態において、前記組織は、1人のドナー対象の体或いは体の一部から除去され、治療後レシピエント対象の体へ移植される。
【0096】
本明細書に記載された病変組織を治療するサセプタ及び方法の様々な実施形態は、単独で、或いは別の形態の治療法との組み合わせで使用される。例えば、サセプタは、これに限定されるものではないが、放射線療法、化学療法、外照射療法、手術、光線力学的治療(PDT)、生物学的製剤を用いた治療、或いは治療のあらゆる組み合わせを含む治療の前、中或いは後に病変組織へ導入される。
【0097】
本発明の1実施形態において、放射線療法或いは放射線治療は、本明細書で開示される温熱療法との組み合わせで使用される。放射線療法は、サセプタ投与の前、中或いは後、或いはそれらのあらゆる組み合わせで、少なくとも1回適用される。放射線治療としても言及される放射線療法は、イオン化放射線を利用した癌及び他の疾患の治療である。イオン化放射線は、その遺伝物質を傷害することによって、治療される領域の細胞(「標的組織」)を障害或いは破壊し、これらの細胞が増殖し続けることを不可能にするようなエネルギーを蓄積している。放射線は癌細胞及び正常細胞の両者を傷害するが、非感染細胞は、それら自身を修復し適切に機能することができる。
【0098】
1実施形態において、X線或いはガンマ線療法が利用される。それらが有するエネルギーの量に依存して、X或いはガンマ線は、標的組織へより深く透過するために使用されるより高いエネルギーのX或いはガンマ線を有して、体の表面或いは深部で癌細胞を破壊するために使用され得る。
【0099】
本発明の1実施形態において、外照射放射線療法は、本明細書に開示された温熱療法との組み合わせで使用される。そのような実施形態において、X線などの放射線の焦点を合わせる機械は、外照射放射線療法として一般的に言及される治療の一種において癌に対して使用される。照射は外界から遮断され、規定体領域へこれら照射の「焦点を合わせる」ために特別な遮断物を使用する。いくつかの実施形態において、温熱療法及び放射線療法は同時に使用され、AMFシステムはX−線照射が入るための分離開口部を含む。或いは、前記照射は、患者における開口部を通して通過する(患者ガントリー)。別の実施形態において、大線量の外照射は、手術中の照射技術のため、手術中腫瘍を処理し組織周辺にあるサセプタに対して行われる。
【0100】
ガンマ線は、X線の代わりに上述されたあらゆる実施形態において利用される。ガンマ線は、特定の元素(ラジウム、ウラニウム及びコバルト60など)として自然に産生され、それらが分解する或いは崩壊するにつれて放射線を放出する。各元素は、特定の割合で分解し、ガンマ線及び他の粒子の形態でエネルギーを放射する。X線及びガンマ線は一般的に癌細胞に対して同じ効果を有している。
【0101】
別の実施形態には、温熱療法との組み合わせにおける粒子照射放射線療法の使用を含み、1実施形態において、高LET療法は本明細書で開示された標的温熱療法との組み合わせで使用される。粒子照射療法の間、粒子加速器によって産生された高速亜原子粒子は、局所癌を治療するために使用される。いくつかの粒子(中性子、パイ中間子及び重イオン)は、それらが組織を通過する軌道に沿って、X線或いはガンマ線より高いエネルギーを蓄積し、従ってそれらが接する細胞へより大きな傷害を引き起こす。このタイプの放射線はしばしば、高線エネルギー付与(高LET)放射線として言及される。
【0102】
さらなる他の実施形態において、放射線は、腫瘍内或いは腫瘍上、若しくは体腔に直接置かれた放射活性移植片を通して癌細胞へ運搬され、本発明の実施形態において、内照射療法は、本明細書に記載された標的温熱療法との組み合わせで使用される。これは、内照射療法として言及され、例えば密封小線源治療、組織内照射、及び内照射療法の腔内照射タイプなどに対して一般的に使用される。この治療の間、放射線線量は、小さい領域に集中している。そのような実施形態において、前記移植片は、渦電流或いはヒステリシス加熱によってAMF治療の間加熱する物質、若しくは、プラスティック、セラミック、ガラス或いは移植されたヒト組織などのAMF曝露下では加熱しない物質を含む。
【0103】
さらなる別の実施形態において、対象へ注射された場合活動的に癌細胞を探し出し、放射線を用いてその細胞を破壊する放射線標識抗体は、標的温熱療法との組み合わせで、癌部位へ直接放射線の線量を運搬するために使用される。いくつかのそのような実施形態において、放射線標識抗体はサセプタとは別に投与され、他の実施形態においては、放射線標識抗体はサセプタと同時に投与される。さらなる他の実施形態において、少なくとも1つの放射性同位元素はサセプタに接着され、前記サセプタは二重治療サセプタとなり得る。
【0104】
本明細書での使用に適した放射性同位元素の例としては、これに限定されるものではないが、モリブデン−99、テクネチウム−99m、クロミウム−51、コバルト−60、銅−64d、ジスプロシウム−165、イッテルビウム−169、イオジン−125、イオジン−131、イリジウム−192、鉄−59、リン−32、カリウム−42、レニウム−188(タングステン−188由来)、サマリウム−153、セレニウム−75、ナトリウム−24、ストロンチウム−89、キセノン−133、キセノン−127、イットリウム−90を含む。
【0105】
いくつかの実施形態において、上述したような温熱療法は、化学療法との組み合わせで使用される。化学療法は、薬剤による癌などの病気の治療法である。最も多いタイプの癌に対して、化学療法はしばしば多数の異なる薬剤或いは医薬品の使用を必要とし;これは併用化学療法として言及される。様々な実施形態において、化学療法は、例えば、静脈内(IV;静脈内は最も一般的)、筋肉内(IM;筋肉への注射)、経口(口によって)、皮下(SC;皮膚下に注射)、病巣内(IL;癌領域へ直接的に)、髄腔内(IT;脊髄の周りの液体へ)、局所的(皮膚へ適用)及びそれらと同等のものなどの、本分野で既知のあらゆる方法で投与される。様々な化学療法剤に耐性を示す腫瘍細胞は、臨床腫瘍学における主要な問題を示している。
【0106】
本発明の実施形態で使用される化学療法剤は、例えば、S、M、G1或いはG2の間のあらゆる段階で細胞周期を停止させる。例えば、S期依存性薬剤には、アペルシタビン(Apercitabine)、シタラビン、ドキソルビシン、フルダラビン、フロクスウリジン、フルオロウラシル、ゲムシタビン、ヒドロキシウレア、メルカプトプリン、メトトレキセート、プレドニゾン、プロカルバジン及びチオグアニンなどの代謝拮抗剤が含まれる。M期依存性薬剤には、ビンブラスチン、ビンクリスチン及びビノレルビンなどのビンカアルカロイド;エトポシド及びテニポシドなどのポドフィロトキシン;ドセタキセル(Doxetaxel)を含むタキサン;及びパクリタキセルを含む。G2期依存性薬剤には、ブレオマイシン、イリノテカン、ミトキサントロン及びトポテカンが含まれ、G1期依存性薬剤にはアスパラギナーゼ及びコルチコステロイドが含まれる。
【0107】
さらに、本発明の実施形態において使用される化学療法剤は、作用機序によって分類される。例えば、細胞機能を障害するアルキル化剤;局所性発疱薬であり、メクロレタミン、マスタージェン(Mustargen)、シクロホスファミド、イホスファミド、イフェックス(Ifex)、クロラムブシル、及びロイケリン(Leukeran)を含むナイトロジェンマスタード;それらの高い脂質可溶性及び化学不安定性、2つの高度反応性中間体へ素早く自然に分解することで区別されるニトロソ尿素;クロロエチルジアゾ水酸化物及びイソシアン酸;シスプラチン、プラチノール(Platinol)、カルボプラチン及びパラプラチンを含むプラチナ製剤;及び代謝拮抗薬は、ヌクレオチド合成の重大な経路を変化させる、DNA及びRNA合成に関連した天然由来代謝産物の構造類似体である。植物、真菌及び細菌などの天然物質から単離された抗腫瘍活性を有する天然産物も実施形態において使用される。例えば、ブレオマイシン或いはブレノキサン(Blenoxane);アントラサイクリン;エトポシド、VP−16、VePesidなどのエピポドフィロトキシン、及び他のものなどの抗腫瘍抗生物質は、DNA−トポイソメラーゼII複合体を安定化することによってトポイソメラーゼII活性を阻害し、その結果DNAの合成を無力化し、細胞周期はG1期で停止させ;ニチニチソウであるVinca rosea由来のビンカアルカロイド;及び中国鑑賞樹であるCamptotheca acuminate由来のカンプトテシン及びカンプトテシン類似体は、トポイソメラーゼIを阻害しDNA複製の延長期を中断する。
【0108】
化学療法剤或いは医薬品はさらに前記サセプタへも接着され、そのようなサセプタは二重治療サセプタを構成するであろう。
【0109】
本発明の1実施形態において、温熱療法は、MAB'sに接着した化学療法剤或いは医薬品と組み合わされる。モノクローナル抗体(MAB's)は、化学療法剤と連結され得る。この組み合わせによって、細胞を攻撃する2つのメカニズム:1)化学療法からの化学物質、及び2)MABによる免疫反応、が可能となる。化学療法は、細胞がMABによって弱められた場合、より効果的となり得る。これらの薬剤は、温熱療法投与の前、中或いは後で投与され得る。
【0110】
別の実施形態において、温熱療法剤は、例えば化学療法剤には接着しない抗体などの生物学的因子に関連する治療と組み合わせで使用される。例えば、化学療法剤に接着しないMABが投与される。そのようなMABは、癌組織に対する免疫反応を誘導し、治療を促進する。
【0111】
さらなる別の実施形態において、化学療法医薬品或いは薬剤は、誘導性加熱によって前記サセプタから放出されるように、AMF曝露の間に活性化される。前記医薬品或いは薬剤も、AMFの電源を入れた場合、破壊され得る。代わりの実施形態において、前記医薬品或いは薬剤は、サセプタコーティングへ取り込まれ、AMFが適用された場合放出される。そのようなコーティングは、1若しくはそれ以上の層を含み、その層は同じ或いは異なる物質から成り、前記医薬品或いは薬剤は、1若しくはそれ以上のコーテイング層に取り込まれる。
【0112】
さらなる他の実施形態において、温熱療法及び化学療法は、治療剤が癌細胞へより多く到達し、より実質的に殺傷することを可能にする、腫瘍内の血管の透過性を増加する薬剤と共に投与される。例えば、血管透過性増強剤(VEA's)は、腫瘍部位での治療剤及び画像化剤の癌細胞による取り込みを増強し、潜在的な結果として優れた有効性を生じるように設計された薬剤である。VEA'sは、モノクローナル抗体、若しくは他の生物学的活性標的化剤を用いることによって作用し、既知血管作動性化合物(すなわち、組織をより高い透過性を有するようにする分子)を選択的に固形腫瘍へ運搬する。一度腫瘍部位へ局在すると、VEA'sは、腫瘍を補給する血管及び毛細血管の生理機能及び透過性を変化させる。前臨床研究において、VEA'sが治療の数時間前に投与された場合、薬剤取り込みは固形腫瘍において400%まで増加した。VEA'sは、ほとんどの実存癌治療及び画像化剤に対する前処理として使用することを目的としている。VEA'sは、複数の腫瘍タイプを越えて有効である。VEA'sの実施例には、商業的に利用可能なCotara(商標)及びOncolym(登録商標)(Peregrine Pharmaceuticals,Inc.,Tustin,カリフォルニア)が含まれる。VEA'sは、標的化温熱療法と共に使用し、血流を増加し、結果腫瘍細胞でのサセプタの取り込みを増加することができる。
【0113】
本発明のいくつかの実施形態において、温熱療法は、観血的手術或いは低侵襲手術と、若しくは他の介入性技術と組み合わされる。そのような実施形態において、サセプタは、手術或いは介入中にAMFで加熱され得る。AMFエネルギー源は、一部の操作スペースとなるので、滅菌物質で覆った。そのような場合において、全ての手術ツールは、プラスティック、セラミック、ガラス或いは非磁性物質、若しくは金属合金(チタン)などの非磁性物質から作られる。AMFエネルギー源は滅菌手術部位の隣に置き、患者は手動或いは自動でAMFエネルギー場を出たり入ったり動かされ得る。
【0114】
例えば、1実施形態において、臓器は患者の体の外へ持ち上げられるように外科的に準備されるが、解剖学的及び生理学的に体に接着したままであり、サセプタは臓器へ注入され、前記臓器は体外でAMFに照射される。処理された臓器は次に、患者の体に再配置される。そのような技術は、標的臓器のみへのAMFの選択性の増強を可能にし、体の他の部分はAMFに曝露されない。別の実施形態において、温熱療法は、手術或いは他の介入技術、若しくはそれらのあらゆる組み合わせの前に少なくとも一度、最中に少なくとも一度、或いは後に少なくとも一度投与され得る。
【0115】
さらなる他の実施形態において、温熱療法は、骨髄及び/若しくは幹細胞移植と組み合わされる。本発明の1実施形態において、温熱療法は骨髄或いは幹細胞移植の前、最中或いは後、若しくはそれらのあらゆる組み合わせで投与される。別の実施形態において、温熱療法は、移植前に移植骨髄或いは幹細胞へ体外的に投与され得る。骨髄は、血液細胞を産生する幹細胞として言及される未熟細胞を含む。ほとんどの幹細胞は、骨髄で見出されるが、末梢血幹細胞(PBSC's)として言及されるいくつかの幹細胞は、血流中に見出される。幹細胞はさらなる幹細胞を形成するように分裂する、若しくはそれらは白血球、赤血球或いは血小板へと成熟することができる。健康な骨髄がなく、患者は酸素を運ぶのに必要な血球、感染を防御する血球及び出血を防止する血球を作ることができないので、骨髄移植(BMT)及び末梢血幹細胞移植(PBSCT)は、高線量の化学療法及び/若しくは放射線療法によって破壊された幹細胞を回復する手順である。処理によって破壊された幹細胞は、BMT及びPBSCTを用いて回復される。
【0116】
さらなる他の実施形態において、温熱療法は、光線力学的治療(PDT)と組み合わされる。PDTは、腫瘍細胞に集まる光感受性分子である光増感剤(PS's)に基づいている。適切な波長の光で照射した場合、PS'sは光を吸収し励起し、そのエネルギーを近接分子酸素へ移し、反応性酸素種(ROS's)を形成し、これは近接腫瘍細胞の重要な構成成分を次々に酸化し傷害するものである。実施形態において、サセプタは、PDTの前、最中或いはその後に対象へ投与され、同時に或いはお互い別に活性化され、他の実施形態においては、サセプタは、光感受性薬剤でコーティングされる。例えば、1実施形態において、磁性コアを有するシリカ−ベース或いは他の任意の活性化ナノ粒子が産生され、PDT薬剤はこれらナノ粒子をコーティングするために使用される。これらのサセプタは次に、薬剤を活性化するために光に照射され、それらは加熱を介してさらに破壊するために標的温熱療法システムのAMFで後にも照射される。前記サセプタは光で及び同時にAMFでも照射される。特定の実施形態において、温熱療法との組み合わせにおける光線力学的治療は、単独で、或いは化学療法、手術或いはその両者との組み合わせで使用される。
【0117】
本明細書で記載された治療法及び併用療法はさらに、本発明の実施形態において、患者に対して適切であると考えられるあらゆる組み合わせで組み合わされ得る。2つ(二重療法)或いはそれ以上の治療法で治療され得る疾患が存在する。別の治療法との組み合わせでナノ−サイズ粒子を用いる標的温熱療法は、2若しくはそれ以上の疾患を治療する。
【0118】
上述したように、本発明は、病変物質を治療するための温熱療法組成物、及びそのような組成物を利用した標的治療の方法に適用可能である。本発明は、上述した特定の実施形態に制限されると考えられるべきではなく、むしろ添付の請求項に正確に記載されたように、本発明の全ての観点をカバーすると理解されるべきである。様々な修飾、同等な工程、さらに本発明が適用可能な多数の構造は、本明細書の検討によって、本発明が対象とする本分野の当業者にとって容易に明らかであろう。請求項は、そのような修飾及び装置をカバーすることを意図するものである。
【0119】
実施例
本明細書に記載されたサセプタを物理学的に特徴付けするために、様々な分析技術を応用した。
【0120】
ナノ粒子の密度、及び酸化鉄コアに対する正確なサイズとサイズ分布を決定するために分析超遠心分離法(Analytical ultracentrifugation:AUC)を使用した。
【0121】
完全コア/殻構造の平均サイズ及びサイズ分布を決定するために光子相関分光法(Photon Correlation Spectroscopy:PCS)を使用した。
【0122】
Quantum DesignからのMPMS SQUID磁気計を用いてヒステリシスループを測定した。全測定は、コロイドを保持するため、LakeShore CryotronicsからのKel−F液体カプセルホルダーを用いて室温(298K)で行い、磁場範囲は±3.98MA/m(±50,000Oe)であった。
【0123】
透過型電子顕微鏡(TEM)は、300keVでのJEOL JEM3010 TEMで行った。コロイドは、容量で1/100に希釈し、次に乾燥させるためにカーボンコーティングTEMグリッドへ滴下した。
【0124】
小角中性子散乱(Small Angle Neutron Scattering:SANS)実験は、8.4Åの波長を有する中性子を用いて、NIST Center for Neutron Research(NCNR)におけるNG−3ビームラインで行った。データは、3x10−5から5x10−1Å−1の散乱ベクターQの範囲を測るために、3つの異なるサンプル−検出器距離にて、二次元検出器を有する透過型モデルにおいて回収した。これらのデータは、空セルからバックグラウンド及び検出器のゆがみに対して補正した。
【0125】
より小さいQ値を探索するために、NCNRにおけるBT5熱中性子複結晶装置を用いてUltra−SANS(USANS)実験を行った。サンプルは、2.4Åの中性子波長にてそれぞれ8時間実行した。空ビームによるバックグラウンドは、全データから減算し、減算されたデータは、直進ビーム強度の使用によって絶対スケールで処理した。Q(水平面における波ベクター構成成分)範囲は、500から20,000nmの探索長さスケールに一致する。SANS及びUSANS測定の全ては、室温及びゼロ磁場で行われた。H2Oにおけるサンプルは1mm厚水晶セル中に保持し、D2Oにおけるサンプルは4mm厚水晶セル中に保持した。一連の濃度(スペースを考慮して示さない)は、適合させるためのパラメータを制限するのを助けるためにも使用した。コア−殻モデルは、データを適合させるために使用した。全てのSANS及びUSANS減少及び適合は、相互作用的IGOR手順[17]を用いて実行した。
【0126】
ナノ粒子の熱投与量を決定するための比吸収率(SAR)測定は、150kHzの周波数で変動磁場振幅下、修飾交番磁界(AMF)カロリメータにおいて行った。SAR値は、粒子懸濁液がソレノイドコイルにおいて産生されたAMFによって加熱された場合、カロリメータ、コイル及び水の熱特性補正後、水において測定された温度上昇率から計算した。その値は、鉄含有量で規準化した。
【0127】
インビボマウス試験は、3.5cm内径誘導コイルの内側の1cm幅バンド範囲内に高−振幅磁場を限定するAMFインダクタにおいて実行した(図1)。マウスは、振幅及び曝露の持続時間を調節することによってAMFの様々な組み合わせに曝した。曝露の負荷サイクルは100%(常時オン)であり、中波数は150kHzに固定した。曝露の持続時間は15分、若しくはマウスの直腸温が41.5℃に達した時に制限した。ナノ粒子は、5分間かけて腫瘍の中心部へ直接的に注射した。温度は、RF−感受性ではなく、腫瘍の中心、腫瘍にすぐ近接して、及び直腸内に置かれた0.4mm直径光ファイバー温度評価プローブを用いて連続して記録した。
【実施例1】
【0128】
殻を形成するためにデキストランでコーティングされ、50nm以下の直径を有する、酸化鉄(マグネタイト)コアを有する磁性サセプタの2つの異なるサンプルは、米国特許出願第2005/0271745号に記載されたコア/殻法に従った、高圧ホモジナイズを用いて合成した。その2つのサンプルは、それらのコアにおいて名目上同一である。しかしながら、前記デキストラン層が変えられている:サンプルAは単一デキストラン層を含み、サンプルBは二重デキストラン層を含む。
【0129】
AUCでは、5.18g/cm3の原体(bulk)酸化鉄の密度よりわずかに少ない、3.20g/cm3の密度を生じ、ナノ粒子コアに対する44±13nmのサイズ分布を生じた。PCSでは、より大きなサイズで96.5±32.4nmのサイズ分布を生じた。この数は、強度によって決定されようが容積によって決定されようが同じであった。しかしながら、PCS装置によって、溶媒を動くストークス・アインシュタイン(Stokes−Einstein)の球に基づいた水力学的半径を推測し、従って溶媒が浸潤したデキストラン層の厚さの推測が含まれた。
【0130】
26nmのデキストラン長は、使用した40.000ダルトンデキストランに対しては相応である。AUCデータも50nm以下のコア直径を示すTEM画像(図2)と一致している。デキストラン層厚は、(i)それは乾燥サンプルであり、(ii)この励起エネルギーにて、TEMグリッドをコーティングしている無定形カーボンフィルムからの無定形デキストランの分離が難しかったため、TEMからは決定できなかった。TEM画像の精密な検査によって、サンプルAでは存在しない(図1A)、サンプルBにおける酸化鉄の端での暗いリングの存在が明らかになった(図1B)。さらに、サンプルAのコア(図1A)は、球で予想されたように、端より密であった。サンプルBにおけるこの暗いリング(図1B)は、2つの事象の1つに由来する:前記ナノ粒子は中心よりも端でより厚く、端はコアとは異なる密度を有している。酸化鉄の密度が原体の約62%のみであることを考えると、前記リングはたぶん、コアとは異なる密度を有する端に由来するものである。
【0131】
SANS/USANSデータも、TEMに対しては相応である。異なる対照条件下でのサンプルA及びサンプルB両者に対するデータは、図3に示した。H2O及びD2Oはそれぞれ、サンプルコントラストを変えることによってシステムの異なる特性を強調した。H2Oの場合において、散乱は、酸化鉄及びH2Oの間の大きなコントラストによって優位である一方、デキストランではコントラストが少ないことを示していた。D2Oにおいて、コアからの散乱の強度は、より減少していた一方、デキストランのコントラストは増強されていた。D2Oにおけるこれらのサンプルの両者は、大規模凝集において粒子を結合するように作用するデキストランネットワークの存在に由来する、低Qにおける強い散乱強度を示した。この解釈は、デキストラン溶液の他の観察に一致していた。しかしながら、D2O SANSデータはさらに、2つのコア間の著しい違いも強調した。多分散コア−殻モデルは、殻サイズに対するコアの比を一定に維持することによってH2Oデータを適合するために使用した。これによって、28.30±0.02nmの総粒子直径を生じた。これは、PCS或いはAUCによって見られたサイズより小さく、この違いは、中性子散乱は多分散システムにおける半径の第一モーメントの分布に対して感受性があり、一方PCS及びAUCは第三モーメントに感受性があることに起因していた。さらに、前記粒子の放射状密度特性は、TEMから見られたように、単純に均一なコア及び殻ではないということが可能である。加えて、半径の増加に伴ってデキストランの密度勾配が減少することが予想された。
【0132】
前記システムの磁性特性は、室温でヒステリシスループを測定することによって特徴付けした。これらのループ(図4)は、液体カプセルホルダーに付加された溶液の質量、Anton Paar DMA5000濃度計で決定されたようなその濃度、及び凍結乾燥1mlのコロイドによって決定されたようなコロイドにおける物質の質量濃度を用いてコロイドに存在する粒子の質量で規準化した。最も顕著な点は、サンプルBの飽和磁化が41.08±0.03kA−m2/gであり、61.64±0.03kA−m2/gのサンプルAの飽和磁性より33%小さいことであった。大きさ(magnitude)におけるこの有意な違いは、TEMで見られたより暗いリングに関連していた。
【0133】
SAR値は、H=85.9kA/m(1080Oe)及びf=150kHzに対して測定し、鉄濃度で規準化した。サンプルBは、5mg/mlのコロイド濃度を有しており、一方サンプルAは、5.5mg/mlのわずかに高い濃度を有していた。サンプルBはFeの209W/gの測定SARを有しており、一方サンプルAはFeの537W/gの測定SARを有しており、2.5倍の違いがあった。この違いのほとんどは、飽和磁化における違いに起因するが、それが全てではない。付加的な寄与は、それらの相互作用における違いによる、ナノ粒子の集団挙動に起因する。
【0134】
5つの群におけるこの治療の有効性を定量化するためのin vivo特徴付けは、表1に記載した。最初の4群は、磁場振幅の効果を研究し、第5群は、適用した磁場で注射した酸化鉄ナノ粒子を持たないコントロール群であった。最後の3つの列には、達成された最高温度、蓄積した熱投与量の規準化率、及び適用した総規準化熱投与量も含む。従来は、より高い熱投与量はより大きな温度変化を生じ、より大きな効果を生じるべきであると予想されていた。しかしながら、どのようにナノ粒子が熱傷害を産生するかというメカニズムとして、腫瘍細胞は未知であり、熱を運搬したナノ粒子の放散もよく特徴付けされていないので、これはあまりに単純化された視点であった。代わりに、このデータより、最高温度は、最大磁場振幅及び最短時間で生じる最大用量率によって生じるということが明らかとなった。これは、マウスの生理学的反応の結果であろう。あらゆる吸熱動物において、体温は熱排出である血管を拡張することによって、若しくは震える及び皮膚に近い血管を収縮することによって調節し、熱を内部に産生/保存する。前者の工程は確かに、酸化鉄ナノ粒子から局所的に産生された対流熱を除去する因子となるであろう。これは動的工程であるので、熱が局所領域へより早く蓄積するにつれて、生理学的反応前により大きな熱変化がそれを除去することができるであろう。しかしながら、46℃から48℃のより高い温度での加熱による血管への傷害などの他の生理学的反応は、予想された加熱状況よりも高いものを形成するそのような血流を制限或いは停止し、それによってこの単純な観点の適用性を制限するであろう。この理由により、物理的特徴付けは、有効性を決定するのには不十分であった。生理学的反応が考慮されるべきであり、in vivo研究は治療の有効性を本当に決定するために実行されなくてはならない。
【0135】
【表1】

【0136】
飽和磁性化、粒子構造及び粒子間相互作用全てはSARに影響を及ぼした。しかしながら、それぞれは異なった方法及び異なった規模で寄与し、それぞれ競合する。本発明者らの予備研究における生物学的反応は、測定された腫瘍内温度及び熱投与量(時間及び温度)と相関し、これは従来の高熱療法(hyperthermia)のものと同様に、これらのナノ粒子が「全体的な」温熱療法効果を持つように見えるように導くものである。最終的に、従来の高熱療法の効果に対して通常主要な影響を持つ生理学的効果(例えば、動的熱輸送メカニズム)は、ナノ粒子高熱療法において同じ役割を持たなかった。これは、従来の高熱療法の熱源が外部であるからというよりも、ナノ粒子高熱療法に対する熱源が内部であり、ナノ粒子高熱療法の細胞標的が全く異なるという事実に起因しているようである。哺乳類における熱傷害及び熱放散のメカニズムを理解するためにはさらなる研究が必要である。
【実施例2】
【0137】
殻を形成するためにデキストランでコーティングされ、50nm以下の直径を有する酸化鉄(マグネタイト)コアを有する磁性サセプタの2つの異なるサンプルは、米国特許出願第2005/0271745号に記載されたコア/殻法に従った高圧ホモジナイズを用いて合成した。その2つのサンプルは、変動するデキストラン層を有するそれらのコアにおいて名目上同一である:サンプルBは二重デキストラン層を含み、サンプルCはコーテイングされ単一デキストラン層を含む。
【0138】
AUCでは、3.20g/cm3の密度を生じ、これは5.18g/cm3である原体酸化鉄の密度よりわずかに小さく、ナノ粒子コアに対して44±13nmのサイズ分布を生じた。PCSでは、より大きなサイズ及び92±14nmのサイズ分布を生じた。この数は、強度によって決定されようと容積によって決定されようと同じであった。しかしながら、PCS装置では、溶媒を動くストークス・アインシュタイン(Stokes−Einstein)の球に基づいた水力学的半径を推測し、従って溶媒が浸潤したデキストラン層の厚さの推測が含まれた。24nmのデキストラン長は、使用した40.000ダルトンデキストランに対しては相応であった。AUCデータも50nm以下のコア直径を示すTEM画像と一致していた。上述したように、前記デキストラン層厚は、TEMからは決定できなかった。
【0139】
SANS/USANSデータも、これらの数に十分に一致していた。H2O及びD2O両者のサンプルBデータは、図5に示した。H2O及びD2Oはそれぞれ、サンプルコントラストを変えることによって前記システムの異なる特性を強調した。H2Oの場合において、散乱は酸化鉄及びH2Oの間の大きなコントラストによって決定されたが、一方デキストランではコントラストが小さかった。D2Oにおいて、コアからの散乱の強度は有意に減少していた一方、デキストランのコントラストは増強していた。D2OデータにおけるサンプルBは、大規模凝集において粒子を結合するように働くデキストランネットワークの存在に起因する低Qでの強い散乱強度を示していた。この解釈は、デキストラン溶液の他の観察と一致していた。多分散コア−殻モデルは、殻サイズに対するコアの比を一定に維持することによって、H2Oデータを適合させるために使用した。これによって、28.30±0.02nmの総粒子直径を生じた。これは、PCS或いはAUCによって見られたサイズより小さく、この違いは、中性子散乱は多分散システムにおける半径の分布の第一モーメントに対して感受性があり、一方PCS及びAUCは第三モーメントに感受性があることに起因していた。さらに、前記粒子の放射状密度特性は、均一なコア及び殻ではないということが可能である。例えば、半径は大きくなるがデキストランの密度勾配が減少するものが存在する。最終的に、硬性球相互作用半径は、69.5±0.2nmであると決定し、これは、中性子で見られる粒子サイズより大きな長さスケールに対する相互作用が存在することを示唆している。
【0140】
サンプルCからのSANSデータは、図6に示した。H2Oにおける濃度系列を示したが、図5に示されたものと類似のD2Oデータは除外した。ここでは直径は27.2±0.5nmであり、サンプルBで見出されたものと類似であったが、相互作用半径は200nm以上であり、サンプルBのものより3倍大きかった。相互作用半径におけるこの増加は、容積分画での変化によってではなく、AUC及びPCS両者によって早期に決定されたような平均直径における変化に起因するものには見えなかった。SANS/USANSから、両サンプルの容積分画は、多分散(0.6)と同様に、ほとんど同等(サンプルBでは0.1075±0.0005であり、サンプルCでは0.1050±0.0003であった)であり、これはサイズ分布の指標であった。粒子寸法における違いはないが相互作用半径におけるこの違いによって、単純硬性球相互作用モデルは物理学的に正確ではなく、より良いモデルは立体的、静電気的及び磁性相互作用を考慮にいれた方がよいことを示唆していた。
【0141】
前記システムの磁性特性は、室温でのヒステリシスループを測定することによって特徴付けした。これらのループ(図7)は、液体カプセルホルダーに付加された溶液の質量、Anton Paar DMA5000濃度計で決定されたようなその濃度、及び凍結乾燥1mlのコロイドによって決定されたようなコロイドにおける物質の質量濃度を用いてコロイドに存在する粒子の質量で規準化した。最も顕著な点は、サンプルBの飽和磁化が41.08±0.03kA−m2/gであり、サンプルC(45.34±0.02kA−m2/g)の飽和磁性よりわずかに小さいことであった。大きさにおけるこのわずかな違い以外、2つのヒステリシスループの形はほとんど同一であった。SANSデータによって、2つのサンプルに対してゼロ磁場において有意に異なる相互作用半径を示されたけれども、SQUIDデータによって、SAR測定に使用された磁場ではほとんど同一の磁性モーメントが示されたことは注目に値する。
【0142】
SAR値は、名目上等しい濃度のコロイドを用い、次に鉄濃度で規準化した、H=86kA/m(1080Oe)及びf=150kHzに対して測定した。サンプルBはFeの1075W/gの測定SARを有しており、一方サンプルCはFeの150W/gの測定SARを有しており、7倍の違いがあった。これは、反対の傾向を持ち、約10%のみ異なることを示した飽和磁性化における違いに起因するものではなく、ほとんど同じになった3つの物理学的技術(TEM、AUC及びPCS)を通じて示されたような物理的サイズ或いはサイズ分布における違いに起因するものでもなかった。従って、第一の違いは、相互作用挙動におけるSANS/USANSデータに存在するように見られた。特に、サンプルBの二重デキストラン層は、より小さい相互作用半径を有するように見られ、これはほとんど3倍であった。この小さな相互作用半径は、2倍の効果:(1)双極性相互作用は有意に強く、ナノ粒子が磁場を変動しその結果加熱が増幅する条件下でそれらの挙動と共役することを可能にする、及び(2)より小さい相互作用半径は、より多くの粒子がより近く集まり、より小さな領域における局所熱出力を増強する、を有するであろう。
【0143】
サンプルの磁性特性(飽和磁性化、異方性及び容積)は、交流磁場の影響下で磁性ナノ粒子によって供給される熱投与量に対して著しい効果を有するが、個々のナノ粒子特性は唯一の考察ではない。磁性ナノ粒子の回収の挙動は、2つの名目上同一である50nm以下の酸化鉄コア/殻ナノ粒子のサンプルによって決定されたように、熱投与量を決定する場合に等しく重要であった。密接に関連したシステムは、Feの1075W/gの測定SARを有しており、一方よりゆるく関連したシステムは、Feの150W/gの測定SARを有していた。
【0144】
本発明は、その特定の好ましい実施形態を参照することによってかなり詳細に記載されているが、他のバージョンが可能である。従って、添付された請求項の観点及び範囲は、その記載及び本明細書内に含まれた好ましいバージョンに制限されるべきではない。
【特許請求の範囲】
【請求項1】
治療用組成物であって、
約100nmから約50μmの相互作用半径を有する多数の非標的磁性ナノ粒子と、
薬学的に許容可能な担体と
を有する、治療用組成物。
【請求項2】
請求項1記載の治療用組成物において、前記多数の非標的磁性ナノ粒子は、安定単一磁区ナノ粒子、超常磁性粒子、及びそれらの組み合わせを有するものである。
【請求項3】
請求項1記載の治療用組成物において、前記多数の非標的磁性ナノ粒子は、磁場に曝露され加熱された場合、明らかに熱的に遮断されるものである。
【請求項4】
請求項1記載の治療用組成物において、前記多数の非標的磁性ナノ粒子は、約1μm未満の平均粒子サイズを有するものである。
【請求項5】
請求項1記載の治療用組成物において、前記多数の非標的磁性ナノ粒子は、約0.1nmから約800nmの平均粒子サイズを有するものである。
【請求項6】
請求項1記載の治療用組成物において、前記多数の非標的磁性ナノ粒子は、約0.1から約1.5の多分散を有するものである。
【請求項7】
請求項1記載の治療用組成物において、前記多数の非標的磁性ナノ粒子は、Fe3O4、γ−Fe2O3、FeCo/SiO2、Co36C64、Bi3Fe5O12、BaFe12O19、NiFe、CoNiFe、Co−Fe3O4、FePt−Ag、及びそれらの組み合わせを含む物質から調製されるものである。
【請求項8】
請求項1記載の治療用組成物において、前記多数の非標的磁性ナノ粒子は、コア及びコーティングを有するものである。
【請求項9】
請求項8記載の治療用組成物において、前記コアは、Fe3O4、γ−Fe2O3、FeCo/SiO2、Co36C64、Bi3Fe5O12、BaFe12O19、NiFe、CoNiFe、Co−Fe3O4、FePt−Ag、及びそれらの組み合わせから選択される物質を有するものである。
【請求項10】
請求項8記載の治療用組成物において、前記コーティングは、ポリマー、生物学的物質、無機コーティング物質、及びそれらの組み合わせから選択される物質を有するものである。
【請求項11】
請求項10記載の治療用組成物において、前記ポリマーは、アクリル酸、シロキサン、スチレン、酢酸、アルキレングリコール、アルキレン、酸化アルキレン、パリレン、乳酸、グリコール酸、ハイドロゲルポリマー、ヒスチジン含有ポリマー、及びそれらの組み合わせから選択されるものである。
【請求項12】
請求項10記載の治療用組成物において、前記生物学的物質は、ヘパリン、ヘパリン硫酸、コンドロイチン硫酸、キチン、キトサン、セルロース、デキストラン、アルギン酸、スターチ、糖質、グリコサミノグリカン、細胞外マトリックスタンパク質、プロテオグリカン、グリコプロテイン、アルブミン、ゼラチン、及びそれらの組み合わせから選択されるものである。
【請求項13】
請求項10記載の治療用組成物において、前記無機コーティング物質は、金属、金属合金、及びセラミックから選択されるものである。
【請求項14】
請求項8の治療用組成物において、前記コアはマグネタイトであり、前記コーテイングはデキストランである。
【請求項15】
請求項14記載の治療用組成物において、前記コーティングは、少なくとも二層のデキストランを有するものである。
【請求項16】
請求項1記載の治療用組成物において、前記多数の非標的磁性ナノ粒子は、約200nmから約25μmの相互作用半径を有するものである。
【請求項17】
請求項1記載の治療用組成物において、前記多数の非標的磁性ナノ粒子は、約10kA−m2/gから約100kA−m2/gの飽和磁性を有するものである。
【請求項18】
請求項1記載の治療用組成物において、前記多数の非標的磁性ナノ粒子は、交流磁場に曝露された場合、約100W/gから約1500W/gの比吸収率(SAR)を有するものである。
【請求項19】
請求項1記載の治療用組成物において、前記薬学的に許容可能な担体は、水、緩衝用水、生理食塩水、リンガー液、グリシン、ヒアルロン酸、ブドウ糖、アルブミン溶液、油、或いはそれらの組み合わせから選択されるものである。
【請求項20】
請求項19記載の治療用組成物であって、この治療用組成物は、さらに、安定剤、抗酸化剤、浸透圧調整剤、緩衝液、pH調整剤、キレート化剤、カルシウムキレート複合体、塩類、或いはそれらの組み合わせから選択される1若しくはそれ以上の添加物を有するものである。
【請求項21】
請求項1記載の治療用組成物において、前記治療用組成物は、液体、ゲル、軟膏、ローション、固形物、或いは半流動物として処方されるものである。
【請求項22】
請求項1記載の治療用組成物であって、この治療用組成物は、さらに、標的磁性ナノ粒子を有するものである。
【請求項23】
請求項1記載の治療用組成物であってさらに、この治療用組成物は、さらに、化学療法剤、放射線療法剤、血管透過性増強剤、抗炎症剤、麻酔薬、鎮痛薬、鎮静剤(sedatives)、抗生物質、及びそれらの組み合わせから選択される1若しくはそれ以上の第二の薬剤を有するものである。
【請求項24】
腫瘍原性組織を治療する方法であって、
約100nmから約50μmの相互作用半径を有する多数の非標的磁性ナノ粒子と、
薬学的に許容可能な担体或いは賦形剤とを有する治療用組成物の有効量を治療が必要な患者に投与する工程と、
前記多数の非標的磁性ナノ粒子の加熱を誘導するエネルギーに前記患者を曝露する工程と
を有する、方法。
【請求項25】
請求項24記載の方法において、前記腫瘍原性組織は、固形腫瘍である。
【請求項26】
請求項24記載の方法において、前記投与する工程は、前記腫瘍原性組織を前記治療用組成物と直接接触させる工程を有するものである。
【請求項27】
請求項24記載の方法において、前記投与する工程は、前記治療用組成物を直接前記腫瘍原性組織へ適用する工程を有するものである。
【請求項28】
請求項24記載の方法において、前記投与する工程は、前記治療用組成物を腫瘍に注射する工程を有するものである。
【請求項29】
請求項24記載の方法において、前記方法は、放射線療法、化学療法、外照射療法、手術、光線力学的療法(PDT)、生物学的製剤を用いた治療、或いはこれらの組み合わせを組み合わせて実行されるものである。
【請求項30】
請求項24記載の方法において、前記多数の非標的磁性ナノ粒子は、約200nmから約25μmの相互作用半径を有するものである。
【請求項31】
請求項24記載の方法において、前記エネルギーは、交流磁場(AMF)、マイクロ波エネルギー、音響エネルギー、及びこれらの組み合わせから選択されるものである。
【請求項32】
請求項24記載の方法において、前記エネルギーは、交流磁場(AMF)である。
【請求項33】
請求項32記載の方法において、前記交流磁場は、約80kHzから約800kHzの周波数範囲を有するものである。
【請求項34】
請求項32記載の方法において、前記交流磁場は、約1kA/mから約120kA/mの振幅を有するものである。
【請求項35】
関節炎症を治療する方法であって、
約100nmから約50μmの相互作用半径を有する多数の非標的磁性ナノ粒子と、薬学的に許容可能な担体或いは賦形剤とを有する治療用組成物の有効量を治療が必要な患者に投与する工程と、
前記多数の非標的磁性ナノ粒子の加熱を誘導するエネルギーに前記患者を曝露する工程と
を有する、方法。
【請求項36】
請求項35記載の方法において、前記投与する工程は、前記治療用組成物を、炎症性滑膜組織、瘢痕組織、免疫細胞、及びそれらの組み合わせに直接接触させる工程を有するものである。
【請求項37】
請求項35記載の方法において、前記投与する工程は、前記治療用組成物を直接前記関節に適用する工程を有するものである。
【請求項38】
請求項35記載の方法において、前記投与する工程は、前記治療用組成物を前記関節に注射する工程を有するものである。
【請求項39】
請求項35記載の方法において、前記投与する工程は、1若しくはそれ以上の抗炎症剤、麻酔薬、鎮痛薬、鎮静剤(sedatives)、抗生物質、及びそれらの組み合わせを投与する工程をさらに有するものである。
【請求項40】
請求項35記載の方法において、前記多数の非標的磁性ナノ粒子は、約200nmから約25μmの相互作用半径を有するものである。
【請求項41】
請求項35記載の方法において、前記エネルギーは、交流磁場(AMF)、マイクロ波エネルギー、音響エネルギー、及びこれらの組み合わせから選択されるものである。
【請求項42】
請求項35記載の方法において、前記曝露する工程は、交流磁場(AMF)を前記患者の少なくとも一部に適用する工程を有するものである。
【請求項43】
請求項42記載の方法において、前記交流磁場は、約80kHzから約800kHzの周波数範囲を有するものである。
【請求項44】
請求項42記載の方法において、前記交流磁場は、約1kA/mから約120kA/mの振幅を有するものである。
【請求項45】
請求項35の方法において、前記関節炎症は、傷害、疾患、関節炎、及びそれらの組み合わせの結果として生じたものである。
【請求項46】
請求項45記載の方法において、前記関節炎は、全身性関節炎、リウマチ性関節炎、変形性関節炎、腱炎、滑液包炎、線維筋痛症、及びそれらの組み合わせから選択されるものである。
【請求項47】
請求項45記載の方法において、前記疾患は、痛風、ループス、くる病、強直性脊椎炎、シェーグレン症候群、及びそれらの組み合わせから選択されるものである。
【請求項1】
治療用組成物であって、
約100nmから約50μmの相互作用半径を有する多数の非標的磁性ナノ粒子と、
薬学的に許容可能な担体と
を有する、治療用組成物。
【請求項2】
請求項1記載の治療用組成物において、前記多数の非標的磁性ナノ粒子は、安定単一磁区ナノ粒子、超常磁性粒子、及びそれらの組み合わせを有するものである。
【請求項3】
請求項1記載の治療用組成物において、前記多数の非標的磁性ナノ粒子は、磁場に曝露され加熱された場合、明らかに熱的に遮断されるものである。
【請求項4】
請求項1記載の治療用組成物において、前記多数の非標的磁性ナノ粒子は、約1μm未満の平均粒子サイズを有するものである。
【請求項5】
請求項1記載の治療用組成物において、前記多数の非標的磁性ナノ粒子は、約0.1nmから約800nmの平均粒子サイズを有するものである。
【請求項6】
請求項1記載の治療用組成物において、前記多数の非標的磁性ナノ粒子は、約0.1から約1.5の多分散を有するものである。
【請求項7】
請求項1記載の治療用組成物において、前記多数の非標的磁性ナノ粒子は、Fe3O4、γ−Fe2O3、FeCo/SiO2、Co36C64、Bi3Fe5O12、BaFe12O19、NiFe、CoNiFe、Co−Fe3O4、FePt−Ag、及びそれらの組み合わせを含む物質から調製されるものである。
【請求項8】
請求項1記載の治療用組成物において、前記多数の非標的磁性ナノ粒子は、コア及びコーティングを有するものである。
【請求項9】
請求項8記載の治療用組成物において、前記コアは、Fe3O4、γ−Fe2O3、FeCo/SiO2、Co36C64、Bi3Fe5O12、BaFe12O19、NiFe、CoNiFe、Co−Fe3O4、FePt−Ag、及びそれらの組み合わせから選択される物質を有するものである。
【請求項10】
請求項8記載の治療用組成物において、前記コーティングは、ポリマー、生物学的物質、無機コーティング物質、及びそれらの組み合わせから選択される物質を有するものである。
【請求項11】
請求項10記載の治療用組成物において、前記ポリマーは、アクリル酸、シロキサン、スチレン、酢酸、アルキレングリコール、アルキレン、酸化アルキレン、パリレン、乳酸、グリコール酸、ハイドロゲルポリマー、ヒスチジン含有ポリマー、及びそれらの組み合わせから選択されるものである。
【請求項12】
請求項10記載の治療用組成物において、前記生物学的物質は、ヘパリン、ヘパリン硫酸、コンドロイチン硫酸、キチン、キトサン、セルロース、デキストラン、アルギン酸、スターチ、糖質、グリコサミノグリカン、細胞外マトリックスタンパク質、プロテオグリカン、グリコプロテイン、アルブミン、ゼラチン、及びそれらの組み合わせから選択されるものである。
【請求項13】
請求項10記載の治療用組成物において、前記無機コーティング物質は、金属、金属合金、及びセラミックから選択されるものである。
【請求項14】
請求項8の治療用組成物において、前記コアはマグネタイトであり、前記コーテイングはデキストランである。
【請求項15】
請求項14記載の治療用組成物において、前記コーティングは、少なくとも二層のデキストランを有するものである。
【請求項16】
請求項1記載の治療用組成物において、前記多数の非標的磁性ナノ粒子は、約200nmから約25μmの相互作用半径を有するものである。
【請求項17】
請求項1記載の治療用組成物において、前記多数の非標的磁性ナノ粒子は、約10kA−m2/gから約100kA−m2/gの飽和磁性を有するものである。
【請求項18】
請求項1記載の治療用組成物において、前記多数の非標的磁性ナノ粒子は、交流磁場に曝露された場合、約100W/gから約1500W/gの比吸収率(SAR)を有するものである。
【請求項19】
請求項1記載の治療用組成物において、前記薬学的に許容可能な担体は、水、緩衝用水、生理食塩水、リンガー液、グリシン、ヒアルロン酸、ブドウ糖、アルブミン溶液、油、或いはそれらの組み合わせから選択されるものである。
【請求項20】
請求項19記載の治療用組成物であって、この治療用組成物は、さらに、安定剤、抗酸化剤、浸透圧調整剤、緩衝液、pH調整剤、キレート化剤、カルシウムキレート複合体、塩類、或いはそれらの組み合わせから選択される1若しくはそれ以上の添加物を有するものである。
【請求項21】
請求項1記載の治療用組成物において、前記治療用組成物は、液体、ゲル、軟膏、ローション、固形物、或いは半流動物として処方されるものである。
【請求項22】
請求項1記載の治療用組成物であって、この治療用組成物は、さらに、標的磁性ナノ粒子を有するものである。
【請求項23】
請求項1記載の治療用組成物であってさらに、この治療用組成物は、さらに、化学療法剤、放射線療法剤、血管透過性増強剤、抗炎症剤、麻酔薬、鎮痛薬、鎮静剤(sedatives)、抗生物質、及びそれらの組み合わせから選択される1若しくはそれ以上の第二の薬剤を有するものである。
【請求項24】
腫瘍原性組織を治療する方法であって、
約100nmから約50μmの相互作用半径を有する多数の非標的磁性ナノ粒子と、
薬学的に許容可能な担体或いは賦形剤とを有する治療用組成物の有効量を治療が必要な患者に投与する工程と、
前記多数の非標的磁性ナノ粒子の加熱を誘導するエネルギーに前記患者を曝露する工程と
を有する、方法。
【請求項25】
請求項24記載の方法において、前記腫瘍原性組織は、固形腫瘍である。
【請求項26】
請求項24記載の方法において、前記投与する工程は、前記腫瘍原性組織を前記治療用組成物と直接接触させる工程を有するものである。
【請求項27】
請求項24記載の方法において、前記投与する工程は、前記治療用組成物を直接前記腫瘍原性組織へ適用する工程を有するものである。
【請求項28】
請求項24記載の方法において、前記投与する工程は、前記治療用組成物を腫瘍に注射する工程を有するものである。
【請求項29】
請求項24記載の方法において、前記方法は、放射線療法、化学療法、外照射療法、手術、光線力学的療法(PDT)、生物学的製剤を用いた治療、或いはこれらの組み合わせを組み合わせて実行されるものである。
【請求項30】
請求項24記載の方法において、前記多数の非標的磁性ナノ粒子は、約200nmから約25μmの相互作用半径を有するものである。
【請求項31】
請求項24記載の方法において、前記エネルギーは、交流磁場(AMF)、マイクロ波エネルギー、音響エネルギー、及びこれらの組み合わせから選択されるものである。
【請求項32】
請求項24記載の方法において、前記エネルギーは、交流磁場(AMF)である。
【請求項33】
請求項32記載の方法において、前記交流磁場は、約80kHzから約800kHzの周波数範囲を有するものである。
【請求項34】
請求項32記載の方法において、前記交流磁場は、約1kA/mから約120kA/mの振幅を有するものである。
【請求項35】
関節炎症を治療する方法であって、
約100nmから約50μmの相互作用半径を有する多数の非標的磁性ナノ粒子と、薬学的に許容可能な担体或いは賦形剤とを有する治療用組成物の有効量を治療が必要な患者に投与する工程と、
前記多数の非標的磁性ナノ粒子の加熱を誘導するエネルギーに前記患者を曝露する工程と
を有する、方法。
【請求項36】
請求項35記載の方法において、前記投与する工程は、前記治療用組成物を、炎症性滑膜組織、瘢痕組織、免疫細胞、及びそれらの組み合わせに直接接触させる工程を有するものである。
【請求項37】
請求項35記載の方法において、前記投与する工程は、前記治療用組成物を直接前記関節に適用する工程を有するものである。
【請求項38】
請求項35記載の方法において、前記投与する工程は、前記治療用組成物を前記関節に注射する工程を有するものである。
【請求項39】
請求項35記載の方法において、前記投与する工程は、1若しくはそれ以上の抗炎症剤、麻酔薬、鎮痛薬、鎮静剤(sedatives)、抗生物質、及びそれらの組み合わせを投与する工程をさらに有するものである。
【請求項40】
請求項35記載の方法において、前記多数の非標的磁性ナノ粒子は、約200nmから約25μmの相互作用半径を有するものである。
【請求項41】
請求項35記載の方法において、前記エネルギーは、交流磁場(AMF)、マイクロ波エネルギー、音響エネルギー、及びこれらの組み合わせから選択されるものである。
【請求項42】
請求項35記載の方法において、前記曝露する工程は、交流磁場(AMF)を前記患者の少なくとも一部に適用する工程を有するものである。
【請求項43】
請求項42記載の方法において、前記交流磁場は、約80kHzから約800kHzの周波数範囲を有するものである。
【請求項44】
請求項42記載の方法において、前記交流磁場は、約1kA/mから約120kA/mの振幅を有するものである。
【請求項45】
請求項35の方法において、前記関節炎症は、傷害、疾患、関節炎、及びそれらの組み合わせの結果として生じたものである。
【請求項46】
請求項45記載の方法において、前記関節炎は、全身性関節炎、リウマチ性関節炎、変形性関節炎、腱炎、滑液包炎、線維筋痛症、及びそれらの組み合わせから選択されるものである。
【請求項47】
請求項45記載の方法において、前記疾患は、痛風、ループス、くる病、強直性脊椎炎、シェーグレン症候群、及びそれらの組み合わせから選択されるものである。
【図1】


【図2A】


【図2B】


【図3】


【図4】


【図5】


【図6】


【図7】




【図2A】


【図2B】


【図3】


【図4】


【図5】


【図6】


【図7】


【公表番号】特表2010−516705(P2010−516705A)
【公表日】平成22年5月20日(2010.5.20)
【国際特許分類】
【出願番号】特願2009−546571(P2009−546571)
【出願日】平成20年1月22日(2008.1.22)
【国際出願番号】PCT/US2008/051646
【国際公開番号】WO2008/089478
【国際公開日】平成20年7月24日(2008.7.24)
【出願人】(503461995)トリトン バイオシステムズ、インク. (5)
【Fターム(参考)】
【公表日】平成22年5月20日(2010.5.20)
【国際特許分類】
【出願日】平成20年1月22日(2008.1.22)
【国際出願番号】PCT/US2008/051646
【国際公開番号】WO2008/089478
【国際公開日】平成20年7月24日(2008.7.24)
【出願人】(503461995)トリトン バイオシステムズ、インク. (5)
【Fターム(参考)】
[ Back to top ]

