測定チップ、センサシステムおよび測定方法
【課題】迅速に検査結果を得ることができる測定チップ、センサシステム、測定方法を提供する。
【解決手段】捕捉物質スポット101と、非捕捉物質スポット102とを測定チップ1の測定流路12に固定し、この測定流路12にサンプルを流通させ、サンプルが測定流路12を流れる際の流速とサンプル中の物質と各捕捉物質との吸着速度を測定する。これにより、ダイアグラムの各ノードに示される検査を並列に実行できるので、測定時間を短縮することができる。
【解決手段】捕捉物質スポット101と、非捕捉物質スポット102とを測定チップ1の測定流路12に固定し、この測定流路12にサンプルを流通させ、サンプルが測定流路12を流れる際の流速とサンプル中の物質と各捕捉物質との吸着速度を測定する。これにより、ダイアグラムの各ノードに示される検査を並列に実行できるので、測定時間を短縮することができる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、生体由来サンプル中の物質を判別するための測定チップ、この測定チップを搭載したセンサシステムおよび測定方法に関するものである。
【背景技術】
【0002】
食品の安全性検査や感染症の診断の際に行われる食品や体液由来サンプル中の菌の判別は、食品の安全性を確保したり、感染の拡大を防止したり、適正な投薬を行ったりするのに不可欠である。その判別方法としては、従来よりダイアグラムに従ってサンプル(以下、試料液体とも称する。)を順次検査する方法が採られている。ダイアグラムとは、測定対象に関係する生体物質の相互作用をグラフ化したものであり、測定対象を判別するのに必要な測定を示す複数のノードが、その測定順序に沿って紐付けられたものである。図15に示すように、1つのノードに示される検査を行った後、この検査結果に基づいて、次のノードに進んでこのノードに示される検査を行うものである。また、ノードによっては、その検査結果をそのまま出力したり、検査結果となる可能性のリストを出力したりする場合もある。
【0003】
例えば、菌を判別する場合には、図16,図17に示すようなダイアグラムが用いられている(例えば、非特許文献1参照。)。これらのダイアグラムでは、まず図16の最初のノードにおいて、採取したサンプルを培地で希釈培養してコロニーを形成させ、このコロニーの形状で分類を行った後、図17に示すノードに移行して、対応するノードでの検査結果に基づき次のノードに移行して種々の検査を逐次行うことにより、菌の種類の絞り込みを実現している。
また、疾病を診断する場合には、ダイアグラムに基づいて疾病を特徴付ける種々のマーカー分子の濃度または濃度比、時間的な変化を測定することによって、疾病の判断や原因の推定などが行われている。一例として、血液の凝固能の検査では、血液凝固系の転換系(例えば、非特許文献2,3参照。)と、活性化経路とが知られており、図18に示すようなダイアグラムが用いられている。このダイアグラムによれば、分子濃度と凝固の状態を測定することにより、凝固能の異常を引き起こしている原因を推定することができる。
【0004】
上述したようなダイアグラムを用いた菌の判別や疾病の診断の具体的な検査方法としては、例えば、感染の疑いがある体液をサンプルとして培養法でコロニーを形成した後、単一コロニーをサンプルとして種々の生理活性と栄養要求性などによって判別する方法がある。また、コロニー単離後にサンプルからDNAを抽出し、その塩基配列を調べて既知のデータベースと照合する、または、PCR(Polymerase Chain Reaction)による特定塩基配列の有無を調べるなどの方法で菌を判別する方法もある。さらに、特定の菌に特徴的な物質を非捕捉物質または活性物質とし、この物質に対する抗体を捕捉物質として免疫測定で非捕捉物質の有無を調べるまたは基質を反応物質として活性を調べる方法もある(例えば、非特許文献4参照。)。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】国際公開第2009/088021
【特許文献2】特開2010−101646号公報
【非特許文献】
【0006】
【非特許文献1】C. R. Mahon, D. C. Lehman, G. Manuselis、“Textbook of Diagnostic microbiology”、W. B. Saunders、 p. 318,319,322,325、2011
【非特許文献2】藤巻道男、「血液凝固検査ハンドブック」、宇宙堂八木書店、昭和62年
【非特許文献3】河合忠、屋形稔、伊藤喜久、「異常値のでるメカニズム第5版」、医学書院、2008年
【非特許文献4】JOURNAL OF CLINICAL MICROBIOLOGY、18、1983、pp.722-724
【非特許文献5】“Cytokine_networks”、[on line]、Abcam Poster library、インターネット、<http://docs.abcam.com/pdf/immunology/cytokine_networks.pdf>
【非特許文献6】「メタボリックパスウェイマップ 第22版」、Sigma-Aldrich M3782
【非特許文献7】Y.Iwasaki, M.seyama, T.Miura, T.Horiuchi, E.Tamechika、“In-situ sub-micrometer surface flow velocity measurement”、15th International Conference on Miniaturized System for Chemistry and Life Sciences、予稿集 pp.906-908、October 2, 2011
【発明の概要】
【発明が解決しようとする課題】
【0007】
しかしながら、上述したようなダイアグラムを用いた方法では、前段のノードの検査結果に応じて次のノードを決定して検査を行うというように、ノードに示される検査を逐次行うことにより検査が進められてゆくので、検査の終了までに時間がかかっていた。このとき、体液サンプルから菌を単離するための培養やDNAの抽出増幅操作など培養や免疫反応を使う検査が含まれていたり、反応のインキュベーション(潜伏)時間がかかったり、サンプルの前処理に手間がかかったりする場合には、それぞれの処理だけで数時間から数日の時間が必要となることがあるので、これらを逐次行うことによりさらに時間がかかっていた。
【0008】
そこで、本発明は、迅速に検査結果を得ることができる測定チップ、センサシステム、測定方法を提供することを目的とする。
【課題を解決するための手段】
【0009】
上述した課題を解決するために、本発明に係る測定チップは、基板表面に形成された金属膜と、この金属膜上に形成された流路と、流路内の金属膜上に固定され、被捕捉物質を特異的に捕捉する捕捉物質と、流路内の金属膜上に固定され、被捕捉物質を捕捉しない非捕捉物質とを備え、捕捉物質は、流路を流れる流体中の測定対象に関係する生体物質の相互作用を示すダイアグラムの各ノードに関わる物質からなることを特徴とするものである。
【0010】
上記測定チップにおいて、捕捉物質は、抗α溶血素、抗β溶血素、プロトロンビン、抗黄色ブドウ球菌病原因子およびhIgG、抗連鎖球菌属病原因子並びに阻害剤であるようにしてもよい。
【0011】
また、上記測定チップにおいて、捕捉物質は、15-merのDNAであるようにしてもよい。
【0012】
また、本発明に係るセンサシステムは、基板表面に形成された金属膜、この金属膜上に形成された流路、および、流路内の金属膜上に固定され、被捕捉物質を特異的に捕捉する捕捉物質を備えた測定チップと、流路を流れる流体の流速を測定する流速測定手段と、流体中の物質と捕捉物質との吸着速度を測定する吸着速度測定手段とを備え、捕捉物質は、流路を流れる流体中の測定対象に関係する生体物質の相互作用を示すダイアグラムの各ノードに関わる物質からなることを特徴とするものである。
【0013】
上記センサシステムにおいて、流速測定手段および吸着速度測定手段は、金属膜表面における屈折率に基づいて測定を行うようにしてもよい。
【0014】
また、上記センサシステムにおいて、流速測定手段および吸着速度測定手段の測定結果に基づいて、被捕捉物質それぞれの濃度を測定する濃度測定手段と、流体中に含まれる被捕捉物質の濃度と測定対象との関係を記憶する記憶手段と、濃度測定手段による測定結果と、記憶手段に記憶された関係とに基づいて、流体中に含まれる測定対象を判別する判別手段とをさらに備えるようにしてもよい。
【0015】
また、本発明に係る測定方法は、基板表面に形成された金属膜、この金属膜上に形成された流路、および、流路内の金属膜上に固定され、被捕捉物質を特異的に捕捉する捕捉物質を備えた測定チップの流路を流れる流体の流速を測定する流速測定ステップと、流体中の物質と捕捉物質との吸着速度を測定する吸着速度測定ステップとを有し、捕捉物質は、流路を流れる流体中の測定対象に関係する生体物質の相互作用を示すダイアグラムの各ノードに関わる物質からなることを特徴とするものである。
【発明の効果】
【0016】
本発明によれば、測定チップの流路中の金属膜上に、この流路を流れる流体中の測定対象に関係する生体分子の相互作用を示すダイアグラムの各ノードに関わる被捕捉物質を特異的に捕捉する捕捉物質を固定することにより、ダイアグラムの各ノードにおける検査を並列に実行できるので、測定時間を短縮することができる。
【図面の簡単な説明】
【0017】
【図1】図1は、本発明の第1の実施の形態に係るセンサシステムの構成を模式的に示す正面図である。
【図2】図2は、図1における測定チップの構成を模式的に示す斜視図である。
【図3】図3は、図2の測定チップの分解斜視図である。
【図4】図4は、図2の測定チップの平面図である。
【図5】図5は、捕捉物質スポットおよび非捕捉物質スポットの構成を模式的に示す平面図である。
【図6】図6は、スポッター装置の構成を模式的に示す図である。
【図7】図7は、第1の実施の形態における捕捉物質と被捕捉物質を説明するための図である。
【図8】図8は、第1の実施の形態において実際に作成した測定チップを示す図である。
【図9】図9は、第1の実施の形態においてSPRセンサ2による測定結果を示す図である。
【図10A】図10Aは、Staphylococcus aureusを測定対象としたときの濃度の算出結果を示す図である。
【図10B】図10Bは、Coagulase-negative Staphylococcus sppを測定対象としたときの濃度の算出結果を示す図である。
【図11】図11は、屈折率の時間変化を示す図である。
【図12】図12は、捕捉物質の選択方法を説明するための図である。
【図13】図13は、第2の実施の形態で行われる判別を説明するための図である。
【図14A】図14Aは、捕捉物質スポットの形成方法を説明するための図である。
【図14B】図14Bは、捕捉物質スポットの形成方法を説明するための図である。
【図14C】図14Cは、捕捉物質スポットの形成方法を説明するための図である。
【図14D】図14Dは、捕捉物質スポットの形成方法を説明するための図である。
【図15】図15は、ダイアグラムの基本構成を説明するための図である。
【図16】図16は、菌の判別に関するダイアグラムを示す図である。
【図17】図17は、菌の判別に関するダイアグラムを示す図である。
【図18】図18は、血液の凝固能に関するダイアグラムを示す図である。
【発明を実施するための形態】
【0018】
[発明の原理]
上述したようにサンプルに含まれる菌の判別や疾病の診断は、図16〜図18で示したようなダイアグラムに表すことができる。また、糖・脂質・アミノ酸・核酸などの代謝物の経路やサイトカイン類の反応経路も、同様のダイアグラムで表すことができる(例えば、非特許文献5,6参照。)。従来では、このようなダイアグラムに沿ってサンプルに含まれる物質の測定を行っていたが、この測定に要する時間は、(2)ダイアグラムの各ノードを逐次実行するための累積時間、(2)ダイアグラムの各ノードにおける測定時間、によって長くなっていた。
【0019】
このようなダイアグラムのような順次検査を行う方法に代わって、近年では、バイオセンサおよびバイオチップ(以下、「測定チップ」と言う。)を用いた方法が脚光を浴びている。この方法は、抗体、酵素、DNAといった特異性を有する捕捉物質を固定した基板を用い、生化学的反応に基づいてサンプル内に存在する被捕捉物質(以下、「ターゲット物質」とも称する。)を分析するものである。このような分析方法は、人や家畜の健康管理、食品や医療品などの製造管理、環境測定、医療現場での迅速で簡便な計測への応用が期待されている。その中でも、マイクロTAS(Total Analysis Systems)技術を用いた検査が注目を浴びている。このマイクロTAS技術とは、微細加工技術を使って液体のサンプルが流れる微細な流路を形成し、この流路中に捕捉物質を固定化することにより、μL単位のサンプルで免疫測定や酵素反応の測定を行うものである。このようなマイクロTAS技術を用いることによって、少ないサンプルで迅速にターゲット物質の検出と濃度測定を行うことができるセンサを構築することができる。特に、1つのチップに捕捉物質を多数アレイ化しておくと、一度に多数の分析対象を検出することができる。このように多数の分析対象の物質(被捕捉物質)を検出できると、単に多くの指標を得られるだけでなく、応答のパターン解析をすることによってより高度な情報として菌の判別、診断などに関する情報に変換することも可能となる。
【0020】
このようなマイクロTAS技術を使ったセンサにおいて、多数の被捕捉物質を同時に測定する場合、サンプル量が少なくてよいとともに、サンプル中の被捕捉物質と捕捉物質とを同じ条件で反応させることができるので、成分の時間変化があっても多数の捕捉物質に対して同じサンプル状態(温度、捕捉物質の活性化度)で反応させることができる。このため、多数の捕捉物質を個別に反応させる場合と比べて、より正しい被捕捉物質の濃度比や捕捉物質の時間変化を測定することが可能となる。
【0021】
そこで、本発明は、測定対象に関係する生体分子の相互作用を示すダイアグラムの各分岐点に関わる被捕捉物質に対する捕捉物質と、非捕捉物質とを測定チップの流路に固定し、この流路にサンプルを流通させ、サンプルが流路を流れる際の流速およびサンプル中の物質と各捕捉物質との吸着速度を同時に測定することにより、サンプルに含まれる物質を判別して、そのサンプルに含まれる菌を判定したり、疾病を診断したりするものである。このように、本発明は、ダイアグラムといった既存の診断方法を測定チップを用いた単一の測定方法に置き換えたものである。
このような構成を採ることにより、(1)については、各捕捉物質を流路に固定して、この流路にサンプルを流通させることによりダイアグラムの各ノードに示される検査を並列に実行することによって、全体の測定時間を短縮することができる。また、(2)については、各ノードにおける個々の検査を、吸着量を経時的に測定することにより吸着速度を算出して、この吸着速度から被捕捉物質の濃度を測定することによって測定時間を短縮することができる。
【0022】
本発明のような多項目測定では、被捕捉物質と捕捉物質の吸着を測定する方法を適宜自由に選択することができる。捕捉物質として抗体を使えば、多くの被捕捉物質に対して捕捉物質を作製することができ、測定可能な判定項目を選びやすい。抗体のほかにはアプタマーを使うことができる。また、特定の基質を吸着する酵素も使うことができる。何れの場合でも、吸着量を経時的に測定し、吸着速度を測定すると、吸着平衡までインキュベーションする時間を必要とせず、被捕捉物質の濃度を迅速に計測することができる。このような、吸着量の経時的測定は、表面プラズモン共鳴(SPR:Surface plasmon resonance)法、QCM(Quarts Crystal Microbalance)法などで実現できる。この中でも、SPR法は多項目の測定に適している。
【0023】
なお、本発明では、速度、温度、サンプルの経過時間を揃える必要があるので、同じサンプルで全てのダイアグラムの判定項目を同時に測定することが望ましい。
また、サンプルの前処理にかかる時間を省略するために、サンプルを直接センサに導入することにより、サンプルの粘度、密度の変位、差異等によって生じる流路中の流れの変動を測定し、この測定結果から被捕捉物質の濃度を補正する。
また、ダイアグラムの判定項目が非常に多い場合には、ダイアグラムの中から、最終判断に近い位置の判定項目を選択する。それ以外の判定項目は、エピトープ((epitope) は、抗体が認識する抗原の一部分のこと)の異なる複数のモノクロナル抗体(単一の抗体産生細胞に由来するクローンから得られた抗体(免疫グロブリン)分子)を用いるか、ポリクロナル抗体(動物に抗原を投与して得られる抗体分子の総称)を用いるのが好ましい。
さらに、マイクロTAS技術を使ったセンサでは、サンプルの粘度や密度の違いによってマイクロ流路が詰まる可能性がある。このように性状の一定しない生体サンプルを測定する場合には、分散剤、界面活性剤、安定剤等を含むコンディショニングバッファでサンプルを希釈したり、遠心分離やフィルターで大粒径成分を除去したりするなどの方法を採ることが望ましい。
【0024】
[第1の実施の形態]
次に、本発明に係る第1の実施の形態について詳細に説明する。
【0025】
<センサシステムの構成>
本実施の形態に係るセンサシステムは、牛乳中の菌を判別するためのセンサシステムであって、図1に示すように、自己送液型マイクロ流路チップを構成する測定チップ1と、この測定チップ1を搭載するマルチチャンネル屈曲率センサ(以下、「SPRセンサ」と言う。)20と、この屈曲率センサ20からの出力に基づいて各種演算を行う演算装置30とを備えている。
【0026】
≪測定チップの構成≫
図2〜図4に示すように、測定チップ1は、平面視略矩形の基板2と、この基板2上に配設されるスペーサ部材3と、このスペーサ部材3上に配設されるキャピラリーポンプユニット4とから構成されている。
このような測定チップ1には、試料液体が導入される導入部11と、この導入部11に一端が接続された測定流路12と、この測定流路12の他端から二手に分岐される分岐流路13と、この分岐流路13に接続して測定流路12の両脇に配置された吸引流路14と、この吸引流路14上に配置されたキャピラリーポンプ15と、このキャピラリーポンプ15の上部に配置された排出部16とが設けられている。なお、排出部16は必ずしも設けられていなくともよい。
【0027】
基板2は、例えばBK7等の光学ガラスまたはポリマー系の材料から成形され、一定の厚みを有する板状に形成されている。本実施の形態では、基板2として、16mm×16mmで厚さが1mmのBK7ガラスを用いた。このような基板2の下面にはマッチングシート5が配設されており、基板2の上面には金属膜6が配設されている。
ここで、マッチングシート5は、測定チップ1をSPRセンサ20に搭載する際に、マッチングシート5が接触するプリズム21および基板2の屈折率に整合したシリコン系のゴムやゲル状の透明シートから構成される。本実施の形態においては、2液混合タイプで硬化後の屈折率が1.53の透明シリコンゴムを基板2の下面に滴下し、塗布しすることにより、厚さ0.1mmのマッチングシート5を形成した。このようなマッチングシート5を設けることにより、容易にプリズム21と測定チップ1を光学的に接着することができ、迅速な測定チップの交換が可能になり、また、プリズム21面上の埃を測定チップの交換の度に除去できる。
また、金属膜6は、基板2上面に形成された金属の薄膜から構成される。本実施の形態においては、蒸着によってチタンを基板2上面に設けることにより、厚さ約50ナノメートルの金属膜6を形成する。
【0028】
スペーサ部材3は、基板2と同一の外周寸法の平面視矩形状をなし、例えば樹脂フィルムから成形されており、その厚みは基板2よりも小さいものとされている。この矩形状のスペーサ部材3において、1組の対辺における一方の辺寄りの領域であって、その一方の延在方向における略中央部の領域には、円形孔3aが開口されており、また、一端がこの円形孔3aに接続され、その1組の対辺における他方の辺に向かって延びる流路溝3bが開口されている。さらに、流路溝3bの他端から両脇に向かって二手に分岐する分岐溝3cおよびこれら分岐溝3cにそれぞれ接続される矩形孔3dが形成されている。
【0029】
キャピラリーポンプユニット4は、基板2と同一の外周寸法の平面視矩形状をなし、例えばアクリル、ガラス、金属、セラミック等から成形されており、その厚さは0.5〜5mm程度とされている。なお、キャピラリーポンプユニット4は、複数のシート状基材が積層されることで構成されるようにしてもよい。
【0030】
キャピラリーポンプユニット4には、キャピラリーポンプユニット4の上面側に形成された導入部分4aと、キャピラリーポンプユニット4の下面側に形成された連通部分4bとから構成されている。ここで、導入部分4aは、連通部分4bより広く形成され、導入部分4aから連通部分4bにかけて階段状に形成されている。したがって、導入部分4aを平面視した場合、連通部分4bの底面に加え、導入部分4aおよび連通部分4bからなる階段部分の上面が、目視可能となる。
また、キャピラリーポンプユニット4には、スペーサ部材3における分岐溝3cおよび矩形孔3dに対応するようにして円柱孔4cが形成されており、より詳細には、分岐溝3cに対応する箇所には、分岐溝3cの幅方向に1つが配設されてるように円柱孔4cが形成されており、さらに、矩形孔3dに対応する箇所には、矩形孔3d上に二次元的に配設されるように円柱孔4cが形成されている。なお、分岐溝3cに対応する箇所には、分岐溝3cの幅方向に2つ以上の円柱孔4cが配置されていてもよい。
ここで、円柱孔4cの径は、試料液体に対して毛細管現象が発現する大きさとされている。これにより、複数の円柱孔4cが毛細管現象により試料液体を吸引するキャピラリーポンプ15として機能することとなる。
【0031】
このようなキャピラリーポンプユニット4がスぺーサ部材3を介して基板2上に設けられることによって、本実施の形態の測定チップ1が構成される。
この際、キャピラリーポンプユニット4の連通部分4bとスペーサ部材3の円形孔3aとが重なり合うことにより、試料液体が導入される導入部11が形成される。
また、スペーサ部材3の流路溝3bの下方が基板2上面の金属膜6、流路溝3bの上方がキャピラリーポンプユニット4の下面によってそれぞれ閉塞されることにより、導入部11に導入された試料液体が流通する測定流路12が形成される。
同様にして、スペーサ部材3の分岐溝3cの上方がキャピラリーポンプユニット4の下面によって閉塞されることで、測定流路12を通った試料液体が流通する分岐流路13が形成される。また、スペーサ部材3の矩形孔3dの上方がキャピラリーポンプユニット4の下面によって閉塞されることで、キャピラリーポンプ15によって試料液体が吸引される吸引流路14が形成される。
【0032】
これら測定流路12、分岐流路13および吸引流路14の上下方向の間隔、すなわち、スペーサ部材3の厚みは、試料液体に対して毛細管現象が発現する大きさとされている。また、上述したように貫通孔13cの径は、試料液体に対して毛細管現象が発現する大きさとされている。
これにより、導入部11に導入された試料液体は、測定流路12、分岐流路13および吸引流路14内を毛細管現象により進行していくことになる。また、分岐流路13および吸引流路14に到達した試料液体は、毛細管現象により貫通孔13cに吸い上げられる。すると、測定流路12内を試料液体が所定の流速で移送されることとなる。この測定流路12を通過する際にSPR装置20により表面プラズモン共鳴現象を利用した測定が実施される。この表面プラズモン共鳴現象を利用した測定は、測定対象のサンプルが接触した金属(本実施の形態においては金属膜6)の表面における、エバネッセント波と表面プラズモン波との共鳴を用いるものである。したがって、金属膜6上の測定流路12の領域がSPR装置20による観測領域となる。
【0033】
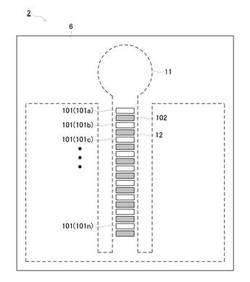
この観測領域に対応する測定流路12を構成する金属膜6上には、図5に示すように、捕捉物質により形成された捕捉物質スポット101と、非捕捉物質により形成された非捕捉物質スポット102とが、測定流路12の延在方向に所定間隔を隔てて互い違いに複数設けた捕捉物質アレイが形成されている。
【0034】
捕捉物質スポット101は、互いに異なるn種の捕捉物質からなるスポットが複数設けられている(捕捉物質スポット101a〜101n)。捕捉物質は、ターゲット分子を特異的に捕捉する物質であり、抗体、酵素、DNA、DNAおよびRNAのうちの何れかからなるアプタマー、またはタンパク質等が用いられる。
本実施の形態においては、後述するように、牛乳中の菌を判別するための9個の捕捉物質スポット101を設けている。
【0035】
一方、非捕捉物質スポット102を構成する非捕捉物質は、捕捉物質が捕捉するターゲット分子および試料液体中に含まれる夾雑物質の吸着を妨げる物質であり、測定対象物と同じものを主成分としていない物質から構成される。ここで、非捕捉物質の主成分とは、総量とすると水中に0.1−5%含まれている天然由来または人工のタンパク質、核酸、界面活性剤等のことを示すが、後述するスポッター装置の性能に適合させるために、その濃度は薄めても、または、濃縮してもよい。
また、捕捉物質スポット101および非捕捉物質スポット102は、免疫測定で用いられるブロッキング剤で形成されている。例えば、DSファーマバイオメディカル(登録商標)社製ブロックエースを用いることができる。
被捕捉物質と捕捉物質のスポットは、そのスポット内では均一な屈折率を有することが望ましい。
【0036】
このような被捕捉物質スポット101および非捕捉物質スポット102は、図6に示すようなインクジェット型のスポッター装置40により、それぞれ異なる捕捉物質41〜43、または、非捕捉物質44を吸引し、基板2上面の金属膜6の所定の位置に吐出させることにより形成される。なお、本実施の形態では、インクジェット型のスポッター装置60を用いるが、ピンを押しつけるタイプのアレイヤーや圧力式のスポッター装置を用いてもよい。
また、捕捉物質スポット101および非捕捉物質スポット102を形成した後に、基板2上に非特異吸着を防ぐブロッキング処理を施して、捕捉物質スポット101および非捕捉物質スポット102の上にブロッキング剤が設けられた状態とするようにしてもよい。
【0037】
≪SPRセンサの構成≫
SPRセンサ20は、図1に示すように、光源22からプリズム21を介して測定チップ1に対して光を照射し、CCDカメラ23によって測定チップ1により反射された反射光の強度を測定することで、測定チップ1上に生じるエバネッセンス波と表面プラズモンとの共鳴角度を測定する。これらの測定結果は、演算装置30に出力される。なお、図1において、符号24は、光源22からの光を透過するレンズ、符号25は、測定チップ1から反射された反射光を透過するレンズを示している。このようなSPRセンサ20に対して、測定チップ1はプリズム21上にマウントされた状態で用いられる。このようなSPRセンサ20を用いることにより、測定チップ1の測定流路12中の流速を測定することができる(例えば、非特許文献7参照。)。
【0038】
本実施の形態では、SPRセンサ20としてSPR測定装置(NTTアドバンステクノロジ(登録商標)社製 smart SPR)に測定チップ1を装着して、この測定チップ1に固定した捕捉物質とサンプル中の非捕捉物質の反応量を経時的に測定した。そのSPR測定装置は、全反射光学系の焦線方向に観測可能な領域があり、長手方向は約5ミリメートル、幅は光源の収束幅に依存するが約0.3ミリメートル程度の領域となっている。観測領域における分解能力は、10マイクロメートルである。
また、被捕捉物質と捕捉物質の反応は固定されている捕捉物質の厚さと同程度の液体の厚さの流速が実効的である。したがって、SPRセンサ20により測定すべき流速は、測定流路12の捕捉物質固定面から100ナノメートル程度の極薄層とすることが望ましい。
【0039】
≪演算装置の構成≫
演算装置30は、図1に示すように、I/F部31と、吸着速度算出部32と、流速算出部33と、濃度算出部34と、判定部35と、記憶部36とを備えている。
【0040】
I/F部31は、SPRセンサ20との間で各種信号の送受信を行うインターフェース回路から構成される。このようなI/F部31は、SPRセンサ20に搭載された測定チップ1にサンプルが供給されたときのSPRセンサ20のCCDカメラ23による測定結果を受信すると、これを吸着速度算出部32および流速算出部33に送出する。
【0041】
吸着速度算出部32は、CCDカメラ23による測定結果に基づいて、測定チップ1の測定流路12に固定された捕捉物質スポット101を構成する捕捉物質に、被捕捉物質が捕捉される速度を算出する機能部である。この算出結果は、濃度算出部34に送出される。
【0042】
流速算出部33は、CCDカメラ23による測定結果に基づいて、測定チップ1の測定流路12を流れるサンプルの流速を算出する機能部である。この算出結果は、濃度算出部34に送出される。
【0043】
濃度算出部34は、吸着速度算出部32および流速算出部33による算出結果に基づいて、サンプル中の各被捕捉分子の濃度を算出する機能部である。この算出結果は、判定部35に送出される。
【0044】
判定部35は、濃度算出部34による算出結果と、記憶部36に記憶された所定のサンプルに含まれる測定対象に関連する各被捕捉分子の濃度に関する情報とを比較し、この比較結果に基づいて測定チップ1に供給されたサンプルに含まれる物質を判定する機能部である。
【0045】
記憶部36は、所定のサンプルに含まれる各被捕捉分子の濃度と測定対象との関係を予め記憶しているメモリ装置から構成されている。このような記憶部には、その関係が複数記憶されている。なお、判定部35により、濃度算出部34による算出結果と一致する情報が存在しないと判定された場合、その算出結果を新たなサンプルとして記憶部36に記憶するようにしてもよい。これにより、判定部35による判定精度を向上させることができる。
【0046】
このような演算装置30は、CPU等の演算装置と、メモリ、HDD(Hard Disk Drive)等の記憶装置と、キーボード、マウス、ポインティングデバイス、ボタン、タッチパネル等の外部から情報の入力を検出する入力装置と、インターネット、LAN(Local Area Network)、WAN(Wide Area Network)等の通信回線を介して各種情報の送受信を行うI/F装置と、LCD(Liquid Crystal Display)や有機EL(Electro Luminescence)ディスプレイ等の表示装置を備えたコンピュータと、このコンピュータにインストールされたプログラムとから構成される。すなわちハードウェア装置とソフトウェアとが協働することによって、上記のハードウェア資源がプログラムによって制御され、I/F部31、吸着速度算出部32、流速算出部33、濃度算出部34、判定部35および記憶部36が実現される。なお、上記プログラムは、CD−ROM、DVD−ROM、メモリカードなどの記録媒体に記録された状態で提供されるようにしてもよい。
【0047】
<判別動作>
次に、本実施の形態に係るセンサシステムによる判別動作について説明する。本実施の形態では、測定チップ1に流すサンプルとして牛乳を用いた。この測定チップ1を用いた測定の特徴は、サンプルである菌に感染した牛乳を前処理することなく送液でき、サンプルを構成する分子の分布から感染菌に特徴的な分子を抗体で選び出し、その吸着反応をリアルタイムに測定し、経時変化量から被捕捉物質の濃度を推定し、その結果サンプル中の菌を迅速に判定できることである。本実施の形態では、牛乳中に含まれていると考えられる連鎖球菌族(Streptococcus spp)、黄色ブドウ球菌(Staphylococcus aureus)、コアグラーゼ陰性ブドウ球菌属(Coagulase-negative Staphylococcus spp)を測定対象とし、図16,図17のダイアグラムから9個の判定ステップ(ノード)を選択した図7に示すダイアグラムを作成した。さらに、このダイアグラムに基づいて捕捉物質を選択し、この捕捉物質から図5を参照して説明した方法により9個の捕捉物質スポット101a〜101iを作成した。具体的には、被捕捉物質であるα溶血素(α-Hemolysin)に対する捕捉物質として抗α溶血素(抗α-Hemolysin)、β-Hemolysinの2個の被捕捉物質(SPEB、SPEC)に対する捕捉物質として抗SPEB、抗SPECの2個を選択している。また、被捕捉物質であるコアグラーゼ(Coagulase)に対する捕捉物質としてプロトロンビン(Prothrombin)、黄色ブドウ球菌の病原因子(Staphylococcus aureus virulence factors)における被捕捉物質としてprotain A、SEB、SEDの3個を選択し、これらの捕捉物質として抗protain A、抗SEB、抗SED、ヒトIgGの4個を選択している。また、被捕捉物質である連鎖球菌の病原因子(Streptococcus virulence factor)に対する捕捉物質として、抗連鎖球菌の病原因子(抗Streptococcus virulence factor)を選択するとともに、ブロッキング剤(阻害剤:Blocking reagent)を選択した。このため、捕捉物質は合計で9個となる。このようにして作成した実際の測定チップ1を図8に示す。
なお、図5のダイアグラムにおいては、便宜上判別を「+」と「−」で表しているが、本実施の形態においては、各ノードにおける判定では定量的な値が得られている。
【0048】
このような測定チップ1をSPRセンサ20に装着し、牛乳中に含まれる菌の判別動作を行った。
【0049】
まず、測定チップ1に、非捕捉物質スポット102と同等の非捕捉物質を含むブロッキング剤を流した後、牛乳を流通させた。このときに得られたSPRセンサ20による測定結果を図9に示す。この図9において、縦軸は共鳴角度、横軸は時間を示している。
【0050】
図9の符号aで示す時間までは、測定流路12内をブロッキング剤が流れているので、各捕捉物質は反応しておらず、被捕捉物質の捕捉物質への吸着による屈折率の変化も見られない。一方、符号aで示す時間を経過して測定流路12内に牛乳が流れると、屈折率が変化しており、各捕捉物質が牛乳中の被捕捉物質と反応していることがわかる。
【0051】
このような測定結果が得られると、演算装置30の吸着速度算出部32は、その屈折率の時間変化を測定することによって、被捕捉物質の吸着速度を算出する。また、濃度算出部34は、吸着速度算出部32により算出された初期の吸着速度に基づいて、被捕捉分子の濃度を算出する。この算出結果を図10A,図10Bに示す。ここで、図10Aは黄色ブドウ球菌(Staphylococcus aureus)、図10Bはコアグラーゼ陰性ブドウ球菌属(Coagulase-negative Staphylococcus spp)をそれぞれ測定対象としており、縦軸は濃度、横軸は被捕捉分子を表している。その縦軸は、各ノードの結果を定量的に表しており、横軸に付された数字1〜9は、捕捉物質スポット101a〜101iに1対1に対応している。
なお、濃度は、捕捉物質スポット101の両側の被捕捉物質スポットでの反応速度を基準として算出するので、図10A,図10Bに示すように負の値として算出されることがある。また、サンプルの流速が遅い場合には捕捉物質に対する非捕捉物質の吸着が拡散律速になるが、どのような流速であっても正しく被捕捉物質の濃度を計算できるように、本実施の形態では、初期吸着速度から濃度を求める際に拡散律速となる場合を考慮したモデルを用いている。
【0052】
被捕捉物質の濃度は、吸着速度算出部32により算出された初期の吸着速度に比例する。したがって、事前に被捕捉物質の濃度が既知のサンプルを測定して、検量線を作成しておけば、測定された初期の吸着速度か被捕捉物質の濃度を求めることができる。一方、センサの判定結果を得るためには、濃度の絶対値は必ずしも必要ではないので、初期の吸着速度を濃度と読み替えてもよい。
【0053】
また、流速算出部33は、SPRセンサ2の測定結果に基づいて流速を算出する。この流速の算出には、図11に示すようなSPRセンサ2から得られる測定流路12中における屈折率の時間変化を表す図を用いた。この図11において、縦軸は測定流路12に沿った流れ方向の位置、横軸は時間を示しており、この座標中における色は屈折率を表している。図11の縦軸に示す符号は、捕捉物質スポット101a〜101i(1−9)と非捕捉物質スポット102(BLK)を示しており、これらが交互に並んでいる。この図11からわかるように、測定流路12にブロッキング剤と牛乳を順次流すと、上流から下流に屈折率の境界が移動している。そこで、流速算出部33は、その境界で表されるサンプルの移動速度、すなわち符号bで示す三角形の斜辺の傾きから流速を求める。
【0054】
このように、図10A,図10Bに示すような測定する牛乳中の菌に応じて選択した9個の捕捉物質に対応する非捕捉物質とそれぞれの濃度を表す棒グラフ(以下、「パターン」と言う。)と、測定流路12中を流れるサンプルの流速が算出されると、判定部35は、算出されたパターンと、記憶部36に予め記憶されたパターンとを比較して、一致するパターンを抽出し、この一致したパターンに対応する物質を判定結果として出力する。これにより、サンプル中に含まれる物質を判別することができる。なお、判定部35は、流速算出部33により算出された流速に基づいて、濃度算出部34により算出されたパターンを記憶部36に記憶されたパターンを得たときの流速と対応するように補正する。これにより、濃度算出部34により算出されたパターンと記憶部35に記憶されたパターンとの比較をより正確に行うことができる。
【0055】
以上説明したように、本実施の形態によれば、捕捉物質スポット101と、非捕捉物質スポット102とを測定チップ1の測定流路12に固定し、この測定流路12にサンプルを流通させ、サンプルが測定流路12を流れる際の流速とサンプル中の物質と各捕捉物質との吸着速度を測定することにより、ダイアグラムの各ノードにおける検査を並列に実行できるので、測定時間を短縮することができる。
【0056】
ダイアグラムのノードの数が増えると、測定流路12中に高密度で捕捉物質スポット101をスポットする必要があるが、ノードの判定方法を確実に実現するためには、各捕捉物質が混ざることなく、活性が分離するようにスポットを形成する必要がある。そこで、本実施の形態では、被捕捉物質からなる非捕捉物質スポット102を設けている。これにより、隣り合う捕捉物質の活性の混合を防止でき、さらに大きな非特異吸着の起きるサンプルでも捕捉物質スポット101と非捕捉物質スポット102との吸着速度の差分測定を行うことにより、捕捉物質の濃度をより正確に測定することができる。
なお、測定対象の主成分とは、捕捉物質を製造または設計する際に、捕捉対象とする分子のことである。動物に免役させて作製する抗体の場合には、その抗原となる分子が主成分である。また、人工的に設計するアプタマーの場合には、設計の際に使う捕捉対象分子のことである。
【0057】
また、本実施の形態によれば、単一の測定チップ1で多数の物質を計測するので計測に必要なサンプル体積を小さくできる。また、同じ条件で生化学的反応を行うことができるのでサンプルの時間的な変化の影響を排除できるとともに時間的な変化を追跡することができる。さらに、サンプルを分割して多数のセンサで並列または順次測定する場合と比べて、被捕捉物質の濃度間の相関に対する変動要因を小さくすることができるので、菌の判別や診断をより正しく行うことができる。
【0058】
また、ダイアグラムを逐次実行する場合、最終結果に到達する経路にあるノードだけで判定が行われるが、本実施の形態によれば、測定流路12に固定した全捕捉物質との反応が測定される。そこで、必要とされる測定以外の捕捉物質とサンプルとの反応性を予め調べておくことによって、最終結果の妥当性を検証するデータを得ることができる。これにより、ダイアグラムの作製を想定していなかった特異なサンプルや、混合物があっても、菌の判別や、診断を正しく行う可能性が高くなる。例えば菌の判別では、図16,図17で示した判定は目視で行われるために、曖昧さを含むものとなっている。また、図18の判定では、菌をどのような培養条件でも判定関連分子(カタラーゼ、コアグラーゼ、Virulence factor)を産生するかは不明である。ダイアグラムを逐次実行する判定では最大4つのノードがあり、得られる4つのデータをもとに判別が行われることになるが、予めn(>4)個の判定関連分子に対するサンプルの反応を調べて記憶部36に記憶させておけば、n個のデータをもとに判別することになり、サンプルの変異に対応することができる。
【0059】
また、ダイアグラムから選択する捕捉物質は、図12に示すように、想定しうる菌の集合に対して、ノードの上流では符号A,B,C,Dのようにカバー範囲が広い判定を行える捕捉物質を選択し、ノードの下流では符号E,F,Gのようにカバー範囲が狭い捕捉物質を選択することが望ましい。実際のカバー範囲の重なりは、多次元で複雑である。カバー範囲の狭い判定は、特異性の高い抗体に相当する。カバー範囲の狭い判定では決定的で正確な判定が期待できるが、1つのノードで1つの菌しか判定できないので、実際には多数のノードが必要になる。一方、カバー範囲が広い判定は、特定の結果には結びつかないが、判定結果の集合をより等しい範囲に分割することができる。このように捕捉物質を選択することにより、ノードの上流での大まかな判定と、ノードの下流での細かい判定の組み合わせて、少ないノード数で多くの判別をより正確に行うことができる。一方、ノードの判定が特定の菌に決定的である場合には、n個のデータではn種の菌しか判別できない。また、ノードの判定が菌の集合を分割する場合には、各データに閾値を設けて判定すると最大で2n個の判定を行うことができるので、捕捉物質を節約することができる。さらに、閾値を設けずに定量的なパターンで判定する場合には、捕捉物質のカバー範囲を必要な判別に適切に設定することにより、正確に判別できる数を多くできる。
【0060】
また、本実施の形態によれば、簡便に測定が行えるので、サンプルを取得した場所で測定することができる。また、迅速に測定できるために、サンプルが劣化しやすい、または菌の判定ではサンプリング中に雑菌が混入した場合でも、サンプルの輸送時間で劣化が進んだり、培養する必要がないために混入した菌が増殖する前に測定することができ、正しい測定を行うことができる。
【0061】
[第2の実施の形態]
次に、本発明の第2の実施の形態について説明する。本実施の形態は、サンプルとして血液を用いて血液の凝固系を測定するものであり、上述した第1の実施の形態と捕捉物質スポット101を構成する捕捉物質およびこの捕捉物質に捕捉される非捕捉物質が異なるものである。したがって、上述した第1の実施の形態と同等の構成要素については同じ名称および符号を付し、適宜説明を省略する。
【0062】
本実施の形態は、図13に示すように図18のダイアグラムから選択した血液の凝固系に関する1つのノードについて判別を行うものであり、15−merのDNA(5’−B−TTTTTGGTTGGTGTGGTTGG−3’)をアプタマーとして用い、捕捉物質とした捕捉物質スポット101を作成した。この捕捉物質には第IIa因子(prothrombin)を吸着するので、この第IIa因子が被捕捉物質となる。
【0063】
そして、15−merのDNAからなる捕捉物質スポット101を備えた測定チップ1に血清サンプルを流通し、上述した第1の実施の形態と同等の方法により被捕捉物質の濃度と流速を測定する。この結果、被捕捉物質の濃度に関するパターンと流速を測定することができる。得られたパターンは、プロソロンビン時間と相関があり、血液凝固に関する診断を行うことができる。さらに、第IIa因子の濃度を測定できるので、凝固の異常が第IIa因子を経由した経路で起きていか否かの判断ができる。
【0064】
このように、本実施の形態によれば、15−merのDNAからなる捕捉物質スポット101を測定チップ1の測定流路12に固定し、この測定流路12に血清サンプルを流通させ、サンプルが測定流路12を流れる際の流速とサンプル中の物質と各捕捉物質との吸着速度を測定することにより、測定時間を短縮することができる。
【0065】
なお、本実施の形態では、バイオハザード材料である血液をサンプルとするので、採取できる体積が小さいほど望ましく、その凝固を測定するとともにサンプリングから測定までに時間がかかると凝固が進んでしまうので、サンプルの取得から限られた時間で測定を行う必要があり、かつ、測定後も測定チップを衛生的に処分する必要がある。そこで、本実施の形態における測定チップ1は、小型であり、かつ、使い捨てであることが望ましい。
【0066】
また、本実施の形態では、捕捉物質を金属膜6上に固定する方法は第1の実施の形態で説明した方法に限定されず、図14A〜図14Dに示す方法であってもよい。この方法について以下に説明する。
【0067】
まず、図14Aに示すように、基板2上の金属膜3の表面にUV処理を行い、親水性処理を行う。
【0068】
次に、図14Bに示すように、金属膜3上に、一末端にビオチンを付加し、他末端にSH基を付加したPEG溶液をチップ表面に塗布し、基板修飾を行いポリマー層7を形成した。この場合、基板2全面に表面からおよそ300(オングストローム)離れた領域にビオチンが提示されるようにした。このように離間させることで、最終的に均一な距離で捕捉物質が整列すると同時に反応の空間自由度が増す。なお、金属膜3は金から構成されている。
【0069】
次に、図14Cに示すように、表面修飾した基板2上にスポッター装置40を使って、ストレプトアビジン(SA)103のスポットを隣接させて2つ形成する。
【0070】
次に、図14Dに示すように、隣接する2つのストレプトアビジン103の中央にビオチン付きの捕捉物質からなる捕捉物質スポット101を形成する。その後は、接続分子の反応のため5分静置し、その後は、ビオチン付き20塩基のポリミチンを混合したブロッキング剤を基板2表面全体に乗せた後、超純水で洗浄を行い風乾して測定まで4℃で保管する。
【0071】
このようにして捕捉物質スポット101を形成することにより、高精度に位置決めでき、フレキシブルな設計が可能となる。
【産業上の利用可能性】
【0072】
本発明は、食品検査、生乳検査、人畜の疾病診断、環境指標の検定等に適用することができる。
【符号の説明】
【0073】
1…測定チップ、2…基板、3…スペーサ部材、3a…円形孔、3b…流路溝、3c…分岐溝、3d…矩形孔、4…キャピラリーポンプユニット、4a…導入部分、4b…連通部分、4c…円柱孔、5…マッチングシート、6…金属膜、11…導入部、12…測定流路、13…分岐流路、14…吸引流路、15…キャピラリーポンプ、16…排出部、20…SPRセンサ、21…プリズム、22…光源、23…CCDカメラ、24,25…レンズ、30…演算装置、31…I/F部、32…吸着速度算出部、33…流速算出部、34…濃度算出部、35…判定部、36…記憶部、40…スポッター装置、101…捕捉物質スポット、102…非捕捉物質スポット。
【技術分野】
【0001】
本発明は、生体由来サンプル中の物質を判別するための測定チップ、この測定チップを搭載したセンサシステムおよび測定方法に関するものである。
【背景技術】
【0002】
食品の安全性検査や感染症の診断の際に行われる食品や体液由来サンプル中の菌の判別は、食品の安全性を確保したり、感染の拡大を防止したり、適正な投薬を行ったりするのに不可欠である。その判別方法としては、従来よりダイアグラムに従ってサンプル(以下、試料液体とも称する。)を順次検査する方法が採られている。ダイアグラムとは、測定対象に関係する生体物質の相互作用をグラフ化したものであり、測定対象を判別するのに必要な測定を示す複数のノードが、その測定順序に沿って紐付けられたものである。図15に示すように、1つのノードに示される検査を行った後、この検査結果に基づいて、次のノードに進んでこのノードに示される検査を行うものである。また、ノードによっては、その検査結果をそのまま出力したり、検査結果となる可能性のリストを出力したりする場合もある。
【0003】
例えば、菌を判別する場合には、図16,図17に示すようなダイアグラムが用いられている(例えば、非特許文献1参照。)。これらのダイアグラムでは、まず図16の最初のノードにおいて、採取したサンプルを培地で希釈培養してコロニーを形成させ、このコロニーの形状で分類を行った後、図17に示すノードに移行して、対応するノードでの検査結果に基づき次のノードに移行して種々の検査を逐次行うことにより、菌の種類の絞り込みを実現している。
また、疾病を診断する場合には、ダイアグラムに基づいて疾病を特徴付ける種々のマーカー分子の濃度または濃度比、時間的な変化を測定することによって、疾病の判断や原因の推定などが行われている。一例として、血液の凝固能の検査では、血液凝固系の転換系(例えば、非特許文献2,3参照。)と、活性化経路とが知られており、図18に示すようなダイアグラムが用いられている。このダイアグラムによれば、分子濃度と凝固の状態を測定することにより、凝固能の異常を引き起こしている原因を推定することができる。
【0004】
上述したようなダイアグラムを用いた菌の判別や疾病の診断の具体的な検査方法としては、例えば、感染の疑いがある体液をサンプルとして培養法でコロニーを形成した後、単一コロニーをサンプルとして種々の生理活性と栄養要求性などによって判別する方法がある。また、コロニー単離後にサンプルからDNAを抽出し、その塩基配列を調べて既知のデータベースと照合する、または、PCR(Polymerase Chain Reaction)による特定塩基配列の有無を調べるなどの方法で菌を判別する方法もある。さらに、特定の菌に特徴的な物質を非捕捉物質または活性物質とし、この物質に対する抗体を捕捉物質として免疫測定で非捕捉物質の有無を調べるまたは基質を反応物質として活性を調べる方法もある(例えば、非特許文献4参照。)。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】国際公開第2009/088021
【特許文献2】特開2010−101646号公報
【非特許文献】
【0006】
【非特許文献1】C. R. Mahon, D. C. Lehman, G. Manuselis、“Textbook of Diagnostic microbiology”、W. B. Saunders、 p. 318,319,322,325、2011
【非特許文献2】藤巻道男、「血液凝固検査ハンドブック」、宇宙堂八木書店、昭和62年
【非特許文献3】河合忠、屋形稔、伊藤喜久、「異常値のでるメカニズム第5版」、医学書院、2008年
【非特許文献4】JOURNAL OF CLINICAL MICROBIOLOGY、18、1983、pp.722-724
【非特許文献5】“Cytokine_networks”、[on line]、Abcam Poster library、インターネット、<http://docs.abcam.com/pdf/immunology/cytokine_networks.pdf>
【非特許文献6】「メタボリックパスウェイマップ 第22版」、Sigma-Aldrich M3782
【非特許文献7】Y.Iwasaki, M.seyama, T.Miura, T.Horiuchi, E.Tamechika、“In-situ sub-micrometer surface flow velocity measurement”、15th International Conference on Miniaturized System for Chemistry and Life Sciences、予稿集 pp.906-908、October 2, 2011
【発明の概要】
【発明が解決しようとする課題】
【0007】
しかしながら、上述したようなダイアグラムを用いた方法では、前段のノードの検査結果に応じて次のノードを決定して検査を行うというように、ノードに示される検査を逐次行うことにより検査が進められてゆくので、検査の終了までに時間がかかっていた。このとき、体液サンプルから菌を単離するための培養やDNAの抽出増幅操作など培養や免疫反応を使う検査が含まれていたり、反応のインキュベーション(潜伏)時間がかかったり、サンプルの前処理に手間がかかったりする場合には、それぞれの処理だけで数時間から数日の時間が必要となることがあるので、これらを逐次行うことによりさらに時間がかかっていた。
【0008】
そこで、本発明は、迅速に検査結果を得ることができる測定チップ、センサシステム、測定方法を提供することを目的とする。
【課題を解決するための手段】
【0009】
上述した課題を解決するために、本発明に係る測定チップは、基板表面に形成された金属膜と、この金属膜上に形成された流路と、流路内の金属膜上に固定され、被捕捉物質を特異的に捕捉する捕捉物質と、流路内の金属膜上に固定され、被捕捉物質を捕捉しない非捕捉物質とを備え、捕捉物質は、流路を流れる流体中の測定対象に関係する生体物質の相互作用を示すダイアグラムの各ノードに関わる物質からなることを特徴とするものである。
【0010】
上記測定チップにおいて、捕捉物質は、抗α溶血素、抗β溶血素、プロトロンビン、抗黄色ブドウ球菌病原因子およびhIgG、抗連鎖球菌属病原因子並びに阻害剤であるようにしてもよい。
【0011】
また、上記測定チップにおいて、捕捉物質は、15-merのDNAであるようにしてもよい。
【0012】
また、本発明に係るセンサシステムは、基板表面に形成された金属膜、この金属膜上に形成された流路、および、流路内の金属膜上に固定され、被捕捉物質を特異的に捕捉する捕捉物質を備えた測定チップと、流路を流れる流体の流速を測定する流速測定手段と、流体中の物質と捕捉物質との吸着速度を測定する吸着速度測定手段とを備え、捕捉物質は、流路を流れる流体中の測定対象に関係する生体物質の相互作用を示すダイアグラムの各ノードに関わる物質からなることを特徴とするものである。
【0013】
上記センサシステムにおいて、流速測定手段および吸着速度測定手段は、金属膜表面における屈折率に基づいて測定を行うようにしてもよい。
【0014】
また、上記センサシステムにおいて、流速測定手段および吸着速度測定手段の測定結果に基づいて、被捕捉物質それぞれの濃度を測定する濃度測定手段と、流体中に含まれる被捕捉物質の濃度と測定対象との関係を記憶する記憶手段と、濃度測定手段による測定結果と、記憶手段に記憶された関係とに基づいて、流体中に含まれる測定対象を判別する判別手段とをさらに備えるようにしてもよい。
【0015】
また、本発明に係る測定方法は、基板表面に形成された金属膜、この金属膜上に形成された流路、および、流路内の金属膜上に固定され、被捕捉物質を特異的に捕捉する捕捉物質を備えた測定チップの流路を流れる流体の流速を測定する流速測定ステップと、流体中の物質と捕捉物質との吸着速度を測定する吸着速度測定ステップとを有し、捕捉物質は、流路を流れる流体中の測定対象に関係する生体物質の相互作用を示すダイアグラムの各ノードに関わる物質からなることを特徴とするものである。
【発明の効果】
【0016】
本発明によれば、測定チップの流路中の金属膜上に、この流路を流れる流体中の測定対象に関係する生体分子の相互作用を示すダイアグラムの各ノードに関わる被捕捉物質を特異的に捕捉する捕捉物質を固定することにより、ダイアグラムの各ノードにおける検査を並列に実行できるので、測定時間を短縮することができる。
【図面の簡単な説明】
【0017】
【図1】図1は、本発明の第1の実施の形態に係るセンサシステムの構成を模式的に示す正面図である。
【図2】図2は、図1における測定チップの構成を模式的に示す斜視図である。
【図3】図3は、図2の測定チップの分解斜視図である。
【図4】図4は、図2の測定チップの平面図である。
【図5】図5は、捕捉物質スポットおよび非捕捉物質スポットの構成を模式的に示す平面図である。
【図6】図6は、スポッター装置の構成を模式的に示す図である。
【図7】図7は、第1の実施の形態における捕捉物質と被捕捉物質を説明するための図である。
【図8】図8は、第1の実施の形態において実際に作成した測定チップを示す図である。
【図9】図9は、第1の実施の形態においてSPRセンサ2による測定結果を示す図である。
【図10A】図10Aは、Staphylococcus aureusを測定対象としたときの濃度の算出結果を示す図である。
【図10B】図10Bは、Coagulase-negative Staphylococcus sppを測定対象としたときの濃度の算出結果を示す図である。
【図11】図11は、屈折率の時間変化を示す図である。
【図12】図12は、捕捉物質の選択方法を説明するための図である。
【図13】図13は、第2の実施の形態で行われる判別を説明するための図である。
【図14A】図14Aは、捕捉物質スポットの形成方法を説明するための図である。
【図14B】図14Bは、捕捉物質スポットの形成方法を説明するための図である。
【図14C】図14Cは、捕捉物質スポットの形成方法を説明するための図である。
【図14D】図14Dは、捕捉物質スポットの形成方法を説明するための図である。
【図15】図15は、ダイアグラムの基本構成を説明するための図である。
【図16】図16は、菌の判別に関するダイアグラムを示す図である。
【図17】図17は、菌の判別に関するダイアグラムを示す図である。
【図18】図18は、血液の凝固能に関するダイアグラムを示す図である。
【発明を実施するための形態】
【0018】
[発明の原理]
上述したようにサンプルに含まれる菌の判別や疾病の診断は、図16〜図18で示したようなダイアグラムに表すことができる。また、糖・脂質・アミノ酸・核酸などの代謝物の経路やサイトカイン類の反応経路も、同様のダイアグラムで表すことができる(例えば、非特許文献5,6参照。)。従来では、このようなダイアグラムに沿ってサンプルに含まれる物質の測定を行っていたが、この測定に要する時間は、(2)ダイアグラムの各ノードを逐次実行するための累積時間、(2)ダイアグラムの各ノードにおける測定時間、によって長くなっていた。
【0019】
このようなダイアグラムのような順次検査を行う方法に代わって、近年では、バイオセンサおよびバイオチップ(以下、「測定チップ」と言う。)を用いた方法が脚光を浴びている。この方法は、抗体、酵素、DNAといった特異性を有する捕捉物質を固定した基板を用い、生化学的反応に基づいてサンプル内に存在する被捕捉物質(以下、「ターゲット物質」とも称する。)を分析するものである。このような分析方法は、人や家畜の健康管理、食品や医療品などの製造管理、環境測定、医療現場での迅速で簡便な計測への応用が期待されている。その中でも、マイクロTAS(Total Analysis Systems)技術を用いた検査が注目を浴びている。このマイクロTAS技術とは、微細加工技術を使って液体のサンプルが流れる微細な流路を形成し、この流路中に捕捉物質を固定化することにより、μL単位のサンプルで免疫測定や酵素反応の測定を行うものである。このようなマイクロTAS技術を用いることによって、少ないサンプルで迅速にターゲット物質の検出と濃度測定を行うことができるセンサを構築することができる。特に、1つのチップに捕捉物質を多数アレイ化しておくと、一度に多数の分析対象を検出することができる。このように多数の分析対象の物質(被捕捉物質)を検出できると、単に多くの指標を得られるだけでなく、応答のパターン解析をすることによってより高度な情報として菌の判別、診断などに関する情報に変換することも可能となる。
【0020】
このようなマイクロTAS技術を使ったセンサにおいて、多数の被捕捉物質を同時に測定する場合、サンプル量が少なくてよいとともに、サンプル中の被捕捉物質と捕捉物質とを同じ条件で反応させることができるので、成分の時間変化があっても多数の捕捉物質に対して同じサンプル状態(温度、捕捉物質の活性化度)で反応させることができる。このため、多数の捕捉物質を個別に反応させる場合と比べて、より正しい被捕捉物質の濃度比や捕捉物質の時間変化を測定することが可能となる。
【0021】
そこで、本発明は、測定対象に関係する生体分子の相互作用を示すダイアグラムの各分岐点に関わる被捕捉物質に対する捕捉物質と、非捕捉物質とを測定チップの流路に固定し、この流路にサンプルを流通させ、サンプルが流路を流れる際の流速およびサンプル中の物質と各捕捉物質との吸着速度を同時に測定することにより、サンプルに含まれる物質を判別して、そのサンプルに含まれる菌を判定したり、疾病を診断したりするものである。このように、本発明は、ダイアグラムといった既存の診断方法を測定チップを用いた単一の測定方法に置き換えたものである。
このような構成を採ることにより、(1)については、各捕捉物質を流路に固定して、この流路にサンプルを流通させることによりダイアグラムの各ノードに示される検査を並列に実行することによって、全体の測定時間を短縮することができる。また、(2)については、各ノードにおける個々の検査を、吸着量を経時的に測定することにより吸着速度を算出して、この吸着速度から被捕捉物質の濃度を測定することによって測定時間を短縮することができる。
【0022】
本発明のような多項目測定では、被捕捉物質と捕捉物質の吸着を測定する方法を適宜自由に選択することができる。捕捉物質として抗体を使えば、多くの被捕捉物質に対して捕捉物質を作製することができ、測定可能な判定項目を選びやすい。抗体のほかにはアプタマーを使うことができる。また、特定の基質を吸着する酵素も使うことができる。何れの場合でも、吸着量を経時的に測定し、吸着速度を測定すると、吸着平衡までインキュベーションする時間を必要とせず、被捕捉物質の濃度を迅速に計測することができる。このような、吸着量の経時的測定は、表面プラズモン共鳴(SPR:Surface plasmon resonance)法、QCM(Quarts Crystal Microbalance)法などで実現できる。この中でも、SPR法は多項目の測定に適している。
【0023】
なお、本発明では、速度、温度、サンプルの経過時間を揃える必要があるので、同じサンプルで全てのダイアグラムの判定項目を同時に測定することが望ましい。
また、サンプルの前処理にかかる時間を省略するために、サンプルを直接センサに導入することにより、サンプルの粘度、密度の変位、差異等によって生じる流路中の流れの変動を測定し、この測定結果から被捕捉物質の濃度を補正する。
また、ダイアグラムの判定項目が非常に多い場合には、ダイアグラムの中から、最終判断に近い位置の判定項目を選択する。それ以外の判定項目は、エピトープ((epitope) は、抗体が認識する抗原の一部分のこと)の異なる複数のモノクロナル抗体(単一の抗体産生細胞に由来するクローンから得られた抗体(免疫グロブリン)分子)を用いるか、ポリクロナル抗体(動物に抗原を投与して得られる抗体分子の総称)を用いるのが好ましい。
さらに、マイクロTAS技術を使ったセンサでは、サンプルの粘度や密度の違いによってマイクロ流路が詰まる可能性がある。このように性状の一定しない生体サンプルを測定する場合には、分散剤、界面活性剤、安定剤等を含むコンディショニングバッファでサンプルを希釈したり、遠心分離やフィルターで大粒径成分を除去したりするなどの方法を採ることが望ましい。
【0024】
[第1の実施の形態]
次に、本発明に係る第1の実施の形態について詳細に説明する。
【0025】
<センサシステムの構成>
本実施の形態に係るセンサシステムは、牛乳中の菌を判別するためのセンサシステムであって、図1に示すように、自己送液型マイクロ流路チップを構成する測定チップ1と、この測定チップ1を搭載するマルチチャンネル屈曲率センサ(以下、「SPRセンサ」と言う。)20と、この屈曲率センサ20からの出力に基づいて各種演算を行う演算装置30とを備えている。
【0026】
≪測定チップの構成≫
図2〜図4に示すように、測定チップ1は、平面視略矩形の基板2と、この基板2上に配設されるスペーサ部材3と、このスペーサ部材3上に配設されるキャピラリーポンプユニット4とから構成されている。
このような測定チップ1には、試料液体が導入される導入部11と、この導入部11に一端が接続された測定流路12と、この測定流路12の他端から二手に分岐される分岐流路13と、この分岐流路13に接続して測定流路12の両脇に配置された吸引流路14と、この吸引流路14上に配置されたキャピラリーポンプ15と、このキャピラリーポンプ15の上部に配置された排出部16とが設けられている。なお、排出部16は必ずしも設けられていなくともよい。
【0027】
基板2は、例えばBK7等の光学ガラスまたはポリマー系の材料から成形され、一定の厚みを有する板状に形成されている。本実施の形態では、基板2として、16mm×16mmで厚さが1mmのBK7ガラスを用いた。このような基板2の下面にはマッチングシート5が配設されており、基板2の上面には金属膜6が配設されている。
ここで、マッチングシート5は、測定チップ1をSPRセンサ20に搭載する際に、マッチングシート5が接触するプリズム21および基板2の屈折率に整合したシリコン系のゴムやゲル状の透明シートから構成される。本実施の形態においては、2液混合タイプで硬化後の屈折率が1.53の透明シリコンゴムを基板2の下面に滴下し、塗布しすることにより、厚さ0.1mmのマッチングシート5を形成した。このようなマッチングシート5を設けることにより、容易にプリズム21と測定チップ1を光学的に接着することができ、迅速な測定チップの交換が可能になり、また、プリズム21面上の埃を測定チップの交換の度に除去できる。
また、金属膜6は、基板2上面に形成された金属の薄膜から構成される。本実施の形態においては、蒸着によってチタンを基板2上面に設けることにより、厚さ約50ナノメートルの金属膜6を形成する。
【0028】
スペーサ部材3は、基板2と同一の外周寸法の平面視矩形状をなし、例えば樹脂フィルムから成形されており、その厚みは基板2よりも小さいものとされている。この矩形状のスペーサ部材3において、1組の対辺における一方の辺寄りの領域であって、その一方の延在方向における略中央部の領域には、円形孔3aが開口されており、また、一端がこの円形孔3aに接続され、その1組の対辺における他方の辺に向かって延びる流路溝3bが開口されている。さらに、流路溝3bの他端から両脇に向かって二手に分岐する分岐溝3cおよびこれら分岐溝3cにそれぞれ接続される矩形孔3dが形成されている。
【0029】
キャピラリーポンプユニット4は、基板2と同一の外周寸法の平面視矩形状をなし、例えばアクリル、ガラス、金属、セラミック等から成形されており、その厚さは0.5〜5mm程度とされている。なお、キャピラリーポンプユニット4は、複数のシート状基材が積層されることで構成されるようにしてもよい。
【0030】
キャピラリーポンプユニット4には、キャピラリーポンプユニット4の上面側に形成された導入部分4aと、キャピラリーポンプユニット4の下面側に形成された連通部分4bとから構成されている。ここで、導入部分4aは、連通部分4bより広く形成され、導入部分4aから連通部分4bにかけて階段状に形成されている。したがって、導入部分4aを平面視した場合、連通部分4bの底面に加え、導入部分4aおよび連通部分4bからなる階段部分の上面が、目視可能となる。
また、キャピラリーポンプユニット4には、スペーサ部材3における分岐溝3cおよび矩形孔3dに対応するようにして円柱孔4cが形成されており、より詳細には、分岐溝3cに対応する箇所には、分岐溝3cの幅方向に1つが配設されてるように円柱孔4cが形成されており、さらに、矩形孔3dに対応する箇所には、矩形孔3d上に二次元的に配設されるように円柱孔4cが形成されている。なお、分岐溝3cに対応する箇所には、分岐溝3cの幅方向に2つ以上の円柱孔4cが配置されていてもよい。
ここで、円柱孔4cの径は、試料液体に対して毛細管現象が発現する大きさとされている。これにより、複数の円柱孔4cが毛細管現象により試料液体を吸引するキャピラリーポンプ15として機能することとなる。
【0031】
このようなキャピラリーポンプユニット4がスぺーサ部材3を介して基板2上に設けられることによって、本実施の形態の測定チップ1が構成される。
この際、キャピラリーポンプユニット4の連通部分4bとスペーサ部材3の円形孔3aとが重なり合うことにより、試料液体が導入される導入部11が形成される。
また、スペーサ部材3の流路溝3bの下方が基板2上面の金属膜6、流路溝3bの上方がキャピラリーポンプユニット4の下面によってそれぞれ閉塞されることにより、導入部11に導入された試料液体が流通する測定流路12が形成される。
同様にして、スペーサ部材3の分岐溝3cの上方がキャピラリーポンプユニット4の下面によって閉塞されることで、測定流路12を通った試料液体が流通する分岐流路13が形成される。また、スペーサ部材3の矩形孔3dの上方がキャピラリーポンプユニット4の下面によって閉塞されることで、キャピラリーポンプ15によって試料液体が吸引される吸引流路14が形成される。
【0032】
これら測定流路12、分岐流路13および吸引流路14の上下方向の間隔、すなわち、スペーサ部材3の厚みは、試料液体に対して毛細管現象が発現する大きさとされている。また、上述したように貫通孔13cの径は、試料液体に対して毛細管現象が発現する大きさとされている。
これにより、導入部11に導入された試料液体は、測定流路12、分岐流路13および吸引流路14内を毛細管現象により進行していくことになる。また、分岐流路13および吸引流路14に到達した試料液体は、毛細管現象により貫通孔13cに吸い上げられる。すると、測定流路12内を試料液体が所定の流速で移送されることとなる。この測定流路12を通過する際にSPR装置20により表面プラズモン共鳴現象を利用した測定が実施される。この表面プラズモン共鳴現象を利用した測定は、測定対象のサンプルが接触した金属(本実施の形態においては金属膜6)の表面における、エバネッセント波と表面プラズモン波との共鳴を用いるものである。したがって、金属膜6上の測定流路12の領域がSPR装置20による観測領域となる。
【0033】
この観測領域に対応する測定流路12を構成する金属膜6上には、図5に示すように、捕捉物質により形成された捕捉物質スポット101と、非捕捉物質により形成された非捕捉物質スポット102とが、測定流路12の延在方向に所定間隔を隔てて互い違いに複数設けた捕捉物質アレイが形成されている。
【0034】
捕捉物質スポット101は、互いに異なるn種の捕捉物質からなるスポットが複数設けられている(捕捉物質スポット101a〜101n)。捕捉物質は、ターゲット分子を特異的に捕捉する物質であり、抗体、酵素、DNA、DNAおよびRNAのうちの何れかからなるアプタマー、またはタンパク質等が用いられる。
本実施の形態においては、後述するように、牛乳中の菌を判別するための9個の捕捉物質スポット101を設けている。
【0035】
一方、非捕捉物質スポット102を構成する非捕捉物質は、捕捉物質が捕捉するターゲット分子および試料液体中に含まれる夾雑物質の吸着を妨げる物質であり、測定対象物と同じものを主成分としていない物質から構成される。ここで、非捕捉物質の主成分とは、総量とすると水中に0.1−5%含まれている天然由来または人工のタンパク質、核酸、界面活性剤等のことを示すが、後述するスポッター装置の性能に適合させるために、その濃度は薄めても、または、濃縮してもよい。
また、捕捉物質スポット101および非捕捉物質スポット102は、免疫測定で用いられるブロッキング剤で形成されている。例えば、DSファーマバイオメディカル(登録商標)社製ブロックエースを用いることができる。
被捕捉物質と捕捉物質のスポットは、そのスポット内では均一な屈折率を有することが望ましい。
【0036】
このような被捕捉物質スポット101および非捕捉物質スポット102は、図6に示すようなインクジェット型のスポッター装置40により、それぞれ異なる捕捉物質41〜43、または、非捕捉物質44を吸引し、基板2上面の金属膜6の所定の位置に吐出させることにより形成される。なお、本実施の形態では、インクジェット型のスポッター装置60を用いるが、ピンを押しつけるタイプのアレイヤーや圧力式のスポッター装置を用いてもよい。
また、捕捉物質スポット101および非捕捉物質スポット102を形成した後に、基板2上に非特異吸着を防ぐブロッキング処理を施して、捕捉物質スポット101および非捕捉物質スポット102の上にブロッキング剤が設けられた状態とするようにしてもよい。
【0037】
≪SPRセンサの構成≫
SPRセンサ20は、図1に示すように、光源22からプリズム21を介して測定チップ1に対して光を照射し、CCDカメラ23によって測定チップ1により反射された反射光の強度を測定することで、測定チップ1上に生じるエバネッセンス波と表面プラズモンとの共鳴角度を測定する。これらの測定結果は、演算装置30に出力される。なお、図1において、符号24は、光源22からの光を透過するレンズ、符号25は、測定チップ1から反射された反射光を透過するレンズを示している。このようなSPRセンサ20に対して、測定チップ1はプリズム21上にマウントされた状態で用いられる。このようなSPRセンサ20を用いることにより、測定チップ1の測定流路12中の流速を測定することができる(例えば、非特許文献7参照。)。
【0038】
本実施の形態では、SPRセンサ20としてSPR測定装置(NTTアドバンステクノロジ(登録商標)社製 smart SPR)に測定チップ1を装着して、この測定チップ1に固定した捕捉物質とサンプル中の非捕捉物質の反応量を経時的に測定した。そのSPR測定装置は、全反射光学系の焦線方向に観測可能な領域があり、長手方向は約5ミリメートル、幅は光源の収束幅に依存するが約0.3ミリメートル程度の領域となっている。観測領域における分解能力は、10マイクロメートルである。
また、被捕捉物質と捕捉物質の反応は固定されている捕捉物質の厚さと同程度の液体の厚さの流速が実効的である。したがって、SPRセンサ20により測定すべき流速は、測定流路12の捕捉物質固定面から100ナノメートル程度の極薄層とすることが望ましい。
【0039】
≪演算装置の構成≫
演算装置30は、図1に示すように、I/F部31と、吸着速度算出部32と、流速算出部33と、濃度算出部34と、判定部35と、記憶部36とを備えている。
【0040】
I/F部31は、SPRセンサ20との間で各種信号の送受信を行うインターフェース回路から構成される。このようなI/F部31は、SPRセンサ20に搭載された測定チップ1にサンプルが供給されたときのSPRセンサ20のCCDカメラ23による測定結果を受信すると、これを吸着速度算出部32および流速算出部33に送出する。
【0041】
吸着速度算出部32は、CCDカメラ23による測定結果に基づいて、測定チップ1の測定流路12に固定された捕捉物質スポット101を構成する捕捉物質に、被捕捉物質が捕捉される速度を算出する機能部である。この算出結果は、濃度算出部34に送出される。
【0042】
流速算出部33は、CCDカメラ23による測定結果に基づいて、測定チップ1の測定流路12を流れるサンプルの流速を算出する機能部である。この算出結果は、濃度算出部34に送出される。
【0043】
濃度算出部34は、吸着速度算出部32および流速算出部33による算出結果に基づいて、サンプル中の各被捕捉分子の濃度を算出する機能部である。この算出結果は、判定部35に送出される。
【0044】
判定部35は、濃度算出部34による算出結果と、記憶部36に記憶された所定のサンプルに含まれる測定対象に関連する各被捕捉分子の濃度に関する情報とを比較し、この比較結果に基づいて測定チップ1に供給されたサンプルに含まれる物質を判定する機能部である。
【0045】
記憶部36は、所定のサンプルに含まれる各被捕捉分子の濃度と測定対象との関係を予め記憶しているメモリ装置から構成されている。このような記憶部には、その関係が複数記憶されている。なお、判定部35により、濃度算出部34による算出結果と一致する情報が存在しないと判定された場合、その算出結果を新たなサンプルとして記憶部36に記憶するようにしてもよい。これにより、判定部35による判定精度を向上させることができる。
【0046】
このような演算装置30は、CPU等の演算装置と、メモリ、HDD(Hard Disk Drive)等の記憶装置と、キーボード、マウス、ポインティングデバイス、ボタン、タッチパネル等の外部から情報の入力を検出する入力装置と、インターネット、LAN(Local Area Network)、WAN(Wide Area Network)等の通信回線を介して各種情報の送受信を行うI/F装置と、LCD(Liquid Crystal Display)や有機EL(Electro Luminescence)ディスプレイ等の表示装置を備えたコンピュータと、このコンピュータにインストールされたプログラムとから構成される。すなわちハードウェア装置とソフトウェアとが協働することによって、上記のハードウェア資源がプログラムによって制御され、I/F部31、吸着速度算出部32、流速算出部33、濃度算出部34、判定部35および記憶部36が実現される。なお、上記プログラムは、CD−ROM、DVD−ROM、メモリカードなどの記録媒体に記録された状態で提供されるようにしてもよい。
【0047】
<判別動作>
次に、本実施の形態に係るセンサシステムによる判別動作について説明する。本実施の形態では、測定チップ1に流すサンプルとして牛乳を用いた。この測定チップ1を用いた測定の特徴は、サンプルである菌に感染した牛乳を前処理することなく送液でき、サンプルを構成する分子の分布から感染菌に特徴的な分子を抗体で選び出し、その吸着反応をリアルタイムに測定し、経時変化量から被捕捉物質の濃度を推定し、その結果サンプル中の菌を迅速に判定できることである。本実施の形態では、牛乳中に含まれていると考えられる連鎖球菌族(Streptococcus spp)、黄色ブドウ球菌(Staphylococcus aureus)、コアグラーゼ陰性ブドウ球菌属(Coagulase-negative Staphylococcus spp)を測定対象とし、図16,図17のダイアグラムから9個の判定ステップ(ノード)を選択した図7に示すダイアグラムを作成した。さらに、このダイアグラムに基づいて捕捉物質を選択し、この捕捉物質から図5を参照して説明した方法により9個の捕捉物質スポット101a〜101iを作成した。具体的には、被捕捉物質であるα溶血素(α-Hemolysin)に対する捕捉物質として抗α溶血素(抗α-Hemolysin)、β-Hemolysinの2個の被捕捉物質(SPEB、SPEC)に対する捕捉物質として抗SPEB、抗SPECの2個を選択している。また、被捕捉物質であるコアグラーゼ(Coagulase)に対する捕捉物質としてプロトロンビン(Prothrombin)、黄色ブドウ球菌の病原因子(Staphylococcus aureus virulence factors)における被捕捉物質としてprotain A、SEB、SEDの3個を選択し、これらの捕捉物質として抗protain A、抗SEB、抗SED、ヒトIgGの4個を選択している。また、被捕捉物質である連鎖球菌の病原因子(Streptococcus virulence factor)に対する捕捉物質として、抗連鎖球菌の病原因子(抗Streptococcus virulence factor)を選択するとともに、ブロッキング剤(阻害剤:Blocking reagent)を選択した。このため、捕捉物質は合計で9個となる。このようにして作成した実際の測定チップ1を図8に示す。
なお、図5のダイアグラムにおいては、便宜上判別を「+」と「−」で表しているが、本実施の形態においては、各ノードにおける判定では定量的な値が得られている。
【0048】
このような測定チップ1をSPRセンサ20に装着し、牛乳中に含まれる菌の判別動作を行った。
【0049】
まず、測定チップ1に、非捕捉物質スポット102と同等の非捕捉物質を含むブロッキング剤を流した後、牛乳を流通させた。このときに得られたSPRセンサ20による測定結果を図9に示す。この図9において、縦軸は共鳴角度、横軸は時間を示している。
【0050】
図9の符号aで示す時間までは、測定流路12内をブロッキング剤が流れているので、各捕捉物質は反応しておらず、被捕捉物質の捕捉物質への吸着による屈折率の変化も見られない。一方、符号aで示す時間を経過して測定流路12内に牛乳が流れると、屈折率が変化しており、各捕捉物質が牛乳中の被捕捉物質と反応していることがわかる。
【0051】
このような測定結果が得られると、演算装置30の吸着速度算出部32は、その屈折率の時間変化を測定することによって、被捕捉物質の吸着速度を算出する。また、濃度算出部34は、吸着速度算出部32により算出された初期の吸着速度に基づいて、被捕捉分子の濃度を算出する。この算出結果を図10A,図10Bに示す。ここで、図10Aは黄色ブドウ球菌(Staphylococcus aureus)、図10Bはコアグラーゼ陰性ブドウ球菌属(Coagulase-negative Staphylococcus spp)をそれぞれ測定対象としており、縦軸は濃度、横軸は被捕捉分子を表している。その縦軸は、各ノードの結果を定量的に表しており、横軸に付された数字1〜9は、捕捉物質スポット101a〜101iに1対1に対応している。
なお、濃度は、捕捉物質スポット101の両側の被捕捉物質スポットでの反応速度を基準として算出するので、図10A,図10Bに示すように負の値として算出されることがある。また、サンプルの流速が遅い場合には捕捉物質に対する非捕捉物質の吸着が拡散律速になるが、どのような流速であっても正しく被捕捉物質の濃度を計算できるように、本実施の形態では、初期吸着速度から濃度を求める際に拡散律速となる場合を考慮したモデルを用いている。
【0052】
被捕捉物質の濃度は、吸着速度算出部32により算出された初期の吸着速度に比例する。したがって、事前に被捕捉物質の濃度が既知のサンプルを測定して、検量線を作成しておけば、測定された初期の吸着速度か被捕捉物質の濃度を求めることができる。一方、センサの判定結果を得るためには、濃度の絶対値は必ずしも必要ではないので、初期の吸着速度を濃度と読み替えてもよい。
【0053】
また、流速算出部33は、SPRセンサ2の測定結果に基づいて流速を算出する。この流速の算出には、図11に示すようなSPRセンサ2から得られる測定流路12中における屈折率の時間変化を表す図を用いた。この図11において、縦軸は測定流路12に沿った流れ方向の位置、横軸は時間を示しており、この座標中における色は屈折率を表している。図11の縦軸に示す符号は、捕捉物質スポット101a〜101i(1−9)と非捕捉物質スポット102(BLK)を示しており、これらが交互に並んでいる。この図11からわかるように、測定流路12にブロッキング剤と牛乳を順次流すと、上流から下流に屈折率の境界が移動している。そこで、流速算出部33は、その境界で表されるサンプルの移動速度、すなわち符号bで示す三角形の斜辺の傾きから流速を求める。
【0054】
このように、図10A,図10Bに示すような測定する牛乳中の菌に応じて選択した9個の捕捉物質に対応する非捕捉物質とそれぞれの濃度を表す棒グラフ(以下、「パターン」と言う。)と、測定流路12中を流れるサンプルの流速が算出されると、判定部35は、算出されたパターンと、記憶部36に予め記憶されたパターンとを比較して、一致するパターンを抽出し、この一致したパターンに対応する物質を判定結果として出力する。これにより、サンプル中に含まれる物質を判別することができる。なお、判定部35は、流速算出部33により算出された流速に基づいて、濃度算出部34により算出されたパターンを記憶部36に記憶されたパターンを得たときの流速と対応するように補正する。これにより、濃度算出部34により算出されたパターンと記憶部35に記憶されたパターンとの比較をより正確に行うことができる。
【0055】
以上説明したように、本実施の形態によれば、捕捉物質スポット101と、非捕捉物質スポット102とを測定チップ1の測定流路12に固定し、この測定流路12にサンプルを流通させ、サンプルが測定流路12を流れる際の流速とサンプル中の物質と各捕捉物質との吸着速度を測定することにより、ダイアグラムの各ノードにおける検査を並列に実行できるので、測定時間を短縮することができる。
【0056】
ダイアグラムのノードの数が増えると、測定流路12中に高密度で捕捉物質スポット101をスポットする必要があるが、ノードの判定方法を確実に実現するためには、各捕捉物質が混ざることなく、活性が分離するようにスポットを形成する必要がある。そこで、本実施の形態では、被捕捉物質からなる非捕捉物質スポット102を設けている。これにより、隣り合う捕捉物質の活性の混合を防止でき、さらに大きな非特異吸着の起きるサンプルでも捕捉物質スポット101と非捕捉物質スポット102との吸着速度の差分測定を行うことにより、捕捉物質の濃度をより正確に測定することができる。
なお、測定対象の主成分とは、捕捉物質を製造または設計する際に、捕捉対象とする分子のことである。動物に免役させて作製する抗体の場合には、その抗原となる分子が主成分である。また、人工的に設計するアプタマーの場合には、設計の際に使う捕捉対象分子のことである。
【0057】
また、本実施の形態によれば、単一の測定チップ1で多数の物質を計測するので計測に必要なサンプル体積を小さくできる。また、同じ条件で生化学的反応を行うことができるのでサンプルの時間的な変化の影響を排除できるとともに時間的な変化を追跡することができる。さらに、サンプルを分割して多数のセンサで並列または順次測定する場合と比べて、被捕捉物質の濃度間の相関に対する変動要因を小さくすることができるので、菌の判別や診断をより正しく行うことができる。
【0058】
また、ダイアグラムを逐次実行する場合、最終結果に到達する経路にあるノードだけで判定が行われるが、本実施の形態によれば、測定流路12に固定した全捕捉物質との反応が測定される。そこで、必要とされる測定以外の捕捉物質とサンプルとの反応性を予め調べておくことによって、最終結果の妥当性を検証するデータを得ることができる。これにより、ダイアグラムの作製を想定していなかった特異なサンプルや、混合物があっても、菌の判別や、診断を正しく行う可能性が高くなる。例えば菌の判別では、図16,図17で示した判定は目視で行われるために、曖昧さを含むものとなっている。また、図18の判定では、菌をどのような培養条件でも判定関連分子(カタラーゼ、コアグラーゼ、Virulence factor)を産生するかは不明である。ダイアグラムを逐次実行する判定では最大4つのノードがあり、得られる4つのデータをもとに判別が行われることになるが、予めn(>4)個の判定関連分子に対するサンプルの反応を調べて記憶部36に記憶させておけば、n個のデータをもとに判別することになり、サンプルの変異に対応することができる。
【0059】
また、ダイアグラムから選択する捕捉物質は、図12に示すように、想定しうる菌の集合に対して、ノードの上流では符号A,B,C,Dのようにカバー範囲が広い判定を行える捕捉物質を選択し、ノードの下流では符号E,F,Gのようにカバー範囲が狭い捕捉物質を選択することが望ましい。実際のカバー範囲の重なりは、多次元で複雑である。カバー範囲の狭い判定は、特異性の高い抗体に相当する。カバー範囲の狭い判定では決定的で正確な判定が期待できるが、1つのノードで1つの菌しか判定できないので、実際には多数のノードが必要になる。一方、カバー範囲が広い判定は、特定の結果には結びつかないが、判定結果の集合をより等しい範囲に分割することができる。このように捕捉物質を選択することにより、ノードの上流での大まかな判定と、ノードの下流での細かい判定の組み合わせて、少ないノード数で多くの判別をより正確に行うことができる。一方、ノードの判定が特定の菌に決定的である場合には、n個のデータではn種の菌しか判別できない。また、ノードの判定が菌の集合を分割する場合には、各データに閾値を設けて判定すると最大で2n個の判定を行うことができるので、捕捉物質を節約することができる。さらに、閾値を設けずに定量的なパターンで判定する場合には、捕捉物質のカバー範囲を必要な判別に適切に設定することにより、正確に判別できる数を多くできる。
【0060】
また、本実施の形態によれば、簡便に測定が行えるので、サンプルを取得した場所で測定することができる。また、迅速に測定できるために、サンプルが劣化しやすい、または菌の判定ではサンプリング中に雑菌が混入した場合でも、サンプルの輸送時間で劣化が進んだり、培養する必要がないために混入した菌が増殖する前に測定することができ、正しい測定を行うことができる。
【0061】
[第2の実施の形態]
次に、本発明の第2の実施の形態について説明する。本実施の形態は、サンプルとして血液を用いて血液の凝固系を測定するものであり、上述した第1の実施の形態と捕捉物質スポット101を構成する捕捉物質およびこの捕捉物質に捕捉される非捕捉物質が異なるものである。したがって、上述した第1の実施の形態と同等の構成要素については同じ名称および符号を付し、適宜説明を省略する。
【0062】
本実施の形態は、図13に示すように図18のダイアグラムから選択した血液の凝固系に関する1つのノードについて判別を行うものであり、15−merのDNA(5’−B−TTTTTGGTTGGTGTGGTTGG−3’)をアプタマーとして用い、捕捉物質とした捕捉物質スポット101を作成した。この捕捉物質には第IIa因子(prothrombin)を吸着するので、この第IIa因子が被捕捉物質となる。
【0063】
そして、15−merのDNAからなる捕捉物質スポット101を備えた測定チップ1に血清サンプルを流通し、上述した第1の実施の形態と同等の方法により被捕捉物質の濃度と流速を測定する。この結果、被捕捉物質の濃度に関するパターンと流速を測定することができる。得られたパターンは、プロソロンビン時間と相関があり、血液凝固に関する診断を行うことができる。さらに、第IIa因子の濃度を測定できるので、凝固の異常が第IIa因子を経由した経路で起きていか否かの判断ができる。
【0064】
このように、本実施の形態によれば、15−merのDNAからなる捕捉物質スポット101を測定チップ1の測定流路12に固定し、この測定流路12に血清サンプルを流通させ、サンプルが測定流路12を流れる際の流速とサンプル中の物質と各捕捉物質との吸着速度を測定することにより、測定時間を短縮することができる。
【0065】
なお、本実施の形態では、バイオハザード材料である血液をサンプルとするので、採取できる体積が小さいほど望ましく、その凝固を測定するとともにサンプリングから測定までに時間がかかると凝固が進んでしまうので、サンプルの取得から限られた時間で測定を行う必要があり、かつ、測定後も測定チップを衛生的に処分する必要がある。そこで、本実施の形態における測定チップ1は、小型であり、かつ、使い捨てであることが望ましい。
【0066】
また、本実施の形態では、捕捉物質を金属膜6上に固定する方法は第1の実施の形態で説明した方法に限定されず、図14A〜図14Dに示す方法であってもよい。この方法について以下に説明する。
【0067】
まず、図14Aに示すように、基板2上の金属膜3の表面にUV処理を行い、親水性処理を行う。
【0068】
次に、図14Bに示すように、金属膜3上に、一末端にビオチンを付加し、他末端にSH基を付加したPEG溶液をチップ表面に塗布し、基板修飾を行いポリマー層7を形成した。この場合、基板2全面に表面からおよそ300(オングストローム)離れた領域にビオチンが提示されるようにした。このように離間させることで、最終的に均一な距離で捕捉物質が整列すると同時に反応の空間自由度が増す。なお、金属膜3は金から構成されている。
【0069】
次に、図14Cに示すように、表面修飾した基板2上にスポッター装置40を使って、ストレプトアビジン(SA)103のスポットを隣接させて2つ形成する。
【0070】
次に、図14Dに示すように、隣接する2つのストレプトアビジン103の中央にビオチン付きの捕捉物質からなる捕捉物質スポット101を形成する。その後は、接続分子の反応のため5分静置し、その後は、ビオチン付き20塩基のポリミチンを混合したブロッキング剤を基板2表面全体に乗せた後、超純水で洗浄を行い風乾して測定まで4℃で保管する。
【0071】
このようにして捕捉物質スポット101を形成することにより、高精度に位置決めでき、フレキシブルな設計が可能となる。
【産業上の利用可能性】
【0072】
本発明は、食品検査、生乳検査、人畜の疾病診断、環境指標の検定等に適用することができる。
【符号の説明】
【0073】
1…測定チップ、2…基板、3…スペーサ部材、3a…円形孔、3b…流路溝、3c…分岐溝、3d…矩形孔、4…キャピラリーポンプユニット、4a…導入部分、4b…連通部分、4c…円柱孔、5…マッチングシート、6…金属膜、11…導入部、12…測定流路、13…分岐流路、14…吸引流路、15…キャピラリーポンプ、16…排出部、20…SPRセンサ、21…プリズム、22…光源、23…CCDカメラ、24,25…レンズ、30…演算装置、31…I/F部、32…吸着速度算出部、33…流速算出部、34…濃度算出部、35…判定部、36…記憶部、40…スポッター装置、101…捕捉物質スポット、102…非捕捉物質スポット。
【特許請求の範囲】
【請求項1】
基板表面に形成された金属膜と、
この金属膜上に形成された流路と、
前記流路内の前記金属膜上に固定され、被捕捉物質を特異的に捕捉する捕捉物質と、
前記流路内の前記金属膜上に固定され、前記被捕捉物質を捕捉しない非捕捉物質と
を備え、
前記捕捉物質は、前記流路を流れる流体中の測定対象に関係する生体物質の相互作用を示すダイアグラムの各ノードに関わる物質からなる
ことを特徴とする測定チップ。
【請求項2】
請求項1記載の測定チップにおいて、
前記捕捉物質は、抗α溶血素、抗β溶血素、プロトロンビン、抗黄色ブドウ球菌病原因子およびhIgG、抗連鎖球菌属病原因子並びに阻害剤である
ことを特徴とする測定チップ。
【請求項3】
請求項1記載の測定チップにおいて、
前記捕捉物質は、15-merのDNAである
ことを特徴とする測定チップ。
【請求項4】
基板表面に形成された金属膜、この金属膜上に形成された流路、および、前記流路内の前記金属膜上に固定され、被捕捉物質を特異的に捕捉する捕捉物質を備えた測定チップと、
前記流路を流れる流体の流速を測定する流速測定手段と、
前記流体中の物質と前記捕捉物質との吸着速度を測定する吸着速度測定手段と
を備え、
捕捉物質は、前記流路を流れる流体中の測定対象に関係する生体物質の相互作用を示すダイアグラムの各ノードに関わる物質からなる
ことを特徴とするセンサシステム。
【請求項5】
請求項4記載のセンサシステムにおいて、
前記流速測定手段および前記吸着速度測定手段は、前記金属膜表面における屈折率に基づいて測定を行う
ことを特徴とするセンサシステム。
【請求項6】
請求項4または5記載のセンサシステムにおいて、
前記流速測定手段および前記吸着速度測定手段の測定結果に基づいて、前記被捕捉物質それぞれの濃度を測定する濃度測定手段と、
流体中に含まれる被捕捉物質の濃度と測定対象との関係を記憶する記憶手段と、
前記濃度測定手段による測定結果と、前記記憶手段に記憶された前記関係とに基づいて、前記流体中に含まれる測定対象を判別する判別手段と
をさらに備えたことを特徴とするセンサシステム。
【請求項7】
基板表面に形成された金属膜、この金属膜上に形成された流路、および、前記流路内の前記金属膜上に固定され、被捕捉物質を特異的に捕捉する捕捉物質を備えた測定チップの前記流路を流れる流体の流速を測定する流速測定ステップと、
前記流体中の物質と前記捕捉物質との吸着速度を測定する吸着速度測定ステップと
を有し、
前記捕捉物質は、前記流路を流れる流体中の測定対象に関係する生体物質の相互作用を示すダイアグラムの各ノードに関わる物質からなる
ことを特徴とする測定方法。
【請求項1】
基板表面に形成された金属膜と、
この金属膜上に形成された流路と、
前記流路内の前記金属膜上に固定され、被捕捉物質を特異的に捕捉する捕捉物質と、
前記流路内の前記金属膜上に固定され、前記被捕捉物質を捕捉しない非捕捉物質と
を備え、
前記捕捉物質は、前記流路を流れる流体中の測定対象に関係する生体物質の相互作用を示すダイアグラムの各ノードに関わる物質からなる
ことを特徴とする測定チップ。
【請求項2】
請求項1記載の測定チップにおいて、
前記捕捉物質は、抗α溶血素、抗β溶血素、プロトロンビン、抗黄色ブドウ球菌病原因子およびhIgG、抗連鎖球菌属病原因子並びに阻害剤である
ことを特徴とする測定チップ。
【請求項3】
請求項1記載の測定チップにおいて、
前記捕捉物質は、15-merのDNAである
ことを特徴とする測定チップ。
【請求項4】
基板表面に形成された金属膜、この金属膜上に形成された流路、および、前記流路内の前記金属膜上に固定され、被捕捉物質を特異的に捕捉する捕捉物質を備えた測定チップと、
前記流路を流れる流体の流速を測定する流速測定手段と、
前記流体中の物質と前記捕捉物質との吸着速度を測定する吸着速度測定手段と
を備え、
捕捉物質は、前記流路を流れる流体中の測定対象に関係する生体物質の相互作用を示すダイアグラムの各ノードに関わる物質からなる
ことを特徴とするセンサシステム。
【請求項5】
請求項4記載のセンサシステムにおいて、
前記流速測定手段および前記吸着速度測定手段は、前記金属膜表面における屈折率に基づいて測定を行う
ことを特徴とするセンサシステム。
【請求項6】
請求項4または5記載のセンサシステムにおいて、
前記流速測定手段および前記吸着速度測定手段の測定結果に基づいて、前記被捕捉物質それぞれの濃度を測定する濃度測定手段と、
流体中に含まれる被捕捉物質の濃度と測定対象との関係を記憶する記憶手段と、
前記濃度測定手段による測定結果と、前記記憶手段に記憶された前記関係とに基づいて、前記流体中に含まれる測定対象を判別する判別手段と
をさらに備えたことを特徴とするセンサシステム。
【請求項7】
基板表面に形成された金属膜、この金属膜上に形成された流路、および、前記流路内の前記金属膜上に固定され、被捕捉物質を特異的に捕捉する捕捉物質を備えた測定チップの前記流路を流れる流体の流速を測定する流速測定ステップと、
前記流体中の物質と前記捕捉物質との吸着速度を測定する吸着速度測定ステップと
を有し、
前記捕捉物質は、前記流路を流れる流体中の測定対象に関係する生体物質の相互作用を示すダイアグラムの各ノードに関わる物質からなる
ことを特徴とする測定方法。
【図1】


【図4】


【図6】


【図7】


【図12】


【図13】


【図14A】


【図14B】


【図14C】


【図14D】


【図15】


【図16】


【図17】


【図18】


【図2】


【図3】


【図5】


【図8】


【図9】


【図10A】


【図10B】


【図11】




【図4】


【図6】


【図7】


【図12】


【図13】


【図14A】


【図14B】


【図14C】


【図14D】


【図15】


【図16】


【図17】


【図18】


【図2】


【図3】


【図5】


【図8】


【図9】


【図10A】


【図10B】


【図11】


【公開番号】特開2013−113764(P2013−113764A)
【公開日】平成25年6月10日(2013.6.10)
【国際特許分類】
【出願番号】特願2011−261756(P2011−261756)
【出願日】平成23年11月30日(2011.11.30)
【出願人】(000004226)日本電信電話株式会社 (13,992)
【Fターム(参考)】
【公開日】平成25年6月10日(2013.6.10)
【国際特許分類】
【出願日】平成23年11月30日(2011.11.30)
【出願人】(000004226)日本電信電話株式会社 (13,992)
【Fターム(参考)】
[ Back to top ]

