溶解性フィルムおよびそれを含む方法
【課題】1または複数の物質が容器中の他の物質および構成要素と適切に結合することを妨げる方法で容器の壁にくっつくことを減少させる装置および方法を提供する。
【解決手段】容器10を準備する工程、該容器10に物質30を導入する工程、および容易に溶解するフィルム40を該容器10に導入してその溶解性フィルム40が容器中の物質30の上に重なるようにする工程を含む。物質30は、磁気反応性粒子を含むことができる。フィルム40は、物質30が容器10の底に実質的に閉じ込められ、それによって物質30の転置を実質的に防ぎ、その結果、物質30の容器10の側壁に沿った望ましくない散乱を防ぐ形で物質30の上に重なる。
【解決手段】容器10を準備する工程、該容器10に物質30を導入する工程、および容易に溶解するフィルム40を該容器10に導入してその溶解性フィルム40が容器中の物質30の上に重なるようにする工程を含む。物質30は、磁気反応性粒子を含むことができる。フィルム40は、物質30が容器10の底に実質的に閉じ込められ、それによって物質30の転置を実質的に防ぎ、その結果、物質30の容器10の側壁に沿った望ましくない散乱を防ぐ形で物質30の上に重なる。
【発明の詳細な説明】
【技術分野】
【0001】
本出願は、参照により本明細書に組み込まれている2004年6月28日に出願した米国特許仮出願第60/582,821号の優先権を主張するものである。
【0002】
本発明は、溶解性の膜もしくはフィルムおよびそれを含む方法に関する。例えば、本発明は、容器、物質および溶解性の膜を含む装置ならびにそれを含む方法に関する。
【背景技術】
【0003】
以下の論議においては、いくつかの物品および方法を、背景および序文のために記載する。ここに含まれるものはいずれも従来技術の「是認」と解釈すべきではない。出願人は、適用できる法による規定のもとで、その物品および方法が、従来技術を構成しないことを適宜明らかにする権利を明確に留保する。
【0004】
極めて正確な量の1または複数の物質の容器中への導入を必要とする多くの科学的および産業上の装置および方法が存在する。導入される物質の性質、容器の構成および特性、ならびにこれらの物質を導入するために用いられる技法等のさまざまな要因によって、容器に導入される物質の幾分かが、その容器中の他の物質と混合および/または相互作用することを防ぐように容器の壁にくっつくことは、よく見受けられることである。さまざまな物質が正確な量で混合されることを方法の本質が必要とするとき、上記の「くっつき」の問題は、その方法の望ましい結果に対して重大かつ好ましくない影響を与え得る。
【0005】
さらに、物質の導入の自動化は望ましいけれども、少量の物質を正確に供給することは困難であることが分かる。したがって、物質の正確な量が要求されるときは、これらの物質を手動で測定して容器に導入するのが一般的なやり方である。この手間のかかる手順は、能率の立場からは明らかに理想的とは言えない。
【0006】
前記の科学的または産業的方法の様式の一例は、試料からの生物学的要素の単離および/または分離である。この単離および/または分離を達成する1種の方法には、生物学的試料、磁化できる粒子、および場合によりその他の物質を、通常は重量測定法によるかまたはピペットによって管に導入することが含まれる。管中に存在する1または複数の生物学的要素は、磁化できる粒子と結合するようになる。そのとき磁石を管の壁(1または複数)に緊密に接近した状態にさせ、磁化できる粒子が、結合している生物学的要素(1または複数)と共に管の壁(1または複数)に引き寄せられるようになる。次いで、管に存在する残りの成分を除去し、その結果、生物学的要素(1または複数)を分離することができる。さまざまなさらなる方法の工程を、所望の目標を達成するために用いることができる。
【0007】
管の壁およびピペットの先端は、そこに物質を引き寄せることができる表面電荷をしばしば持つ。したがって、例えば、磁化できる粒子の管中への導入によって、管内の残りの成分と該粒子自体が結合することを妨げる方法で、該粒子が管の壁またはピペットに、しばしばくっつき得るという上記の問題を引き起こす。その上、粒子を最初に導入するときに、そのくっつきの問題を防ぐための配慮をしたとしても、粒子が入っている管のその後の移動によって、粒子が管の壁にまき散らされて、壁にくっつくことが起こり得る。上記のような方法は、望ましい結果もしくは正確な結果を得るために、しばしば小さなサンプルサイズを必要とし、および/または、一緒に混合する正確な量のさまざまな物質に依存するため、くっつきの現象は、上記の単離および/または分離技術の正確性および信頼性における重大な問題を引き起こす。
【0008】
それ故、一般に、物質のより正確な導入および容器内での結合を容易にする装置および方法を提供する必要性が当技術分野には存在する。また、試料からの生物学的要素の単離および/または分離で必要とされる物質のより正確で効率的な導入および結合を促進する装置および方法に対する必要性も当技術分野には存在する。
【先行技術文献】
【特許文献】
【0009】
【特許文献1】米国特許第6,419,903号明細書
【特許文献2】米国特許第5,973,138号明細書
【特許文献3】米国特許第6,433,160号明細書
【特許文献4】米国特許出願第10/359,179号明細書
【特許文献5】米国特許出願第10/359,180号明細書
【特許文献6】米国特許第6,672,458号明細書
【非特許文献】
【0010】
【非特許文献1】"Hansen Solubility Parameter System," DuPont Nylon Intermediates and Specialties, publication W-400473, 12/2000
【発明の概要】
【発明が解決しようとする課題】
【0011】
本発明は、1または複数の物質が容器中の他の物質および構成要素と適切に結合することを妨げる方法で容器の壁にくっつくことを除去するとはいかないまでも減少させる装置および方法を提供することによって上記の必要性などを満足させる。本発明は、また、自動化を容易にする装置および技術を提供する。本発明は、さらに、正確な量の物質を容器内に導入することを可能にする装置および方法を提供する。
【課題を解決するための手段】
【0012】
一態様によれば、本発明の方法は、(i)容器を準備する工程、(ii)該容器に第1物質を導入する工程、および(iii)容易に溶解するフィルムを該容器内に導入し、その溶解性フィルムが容器中の第1物質の上に重なるようにする工程を含む。
【0013】
さらなる態様によれば、本発明は、(i)容器を準備する工程、(ii)第1物質を担持している容易に溶解するフィルムを準備する工程、および(iii)該フィルムを容器内に導入する工程を含む。
【0014】
本発明の別の態様によれば、上記方法のいずれもが、第2物質を容器に加える工程、ならびに以下の、(v)フィルムを溶解する工程、および(vi)第1および第2物質を含む混合物を作り出す工程、(vii)第1物質と第2物質とを互いに結合させ、それによって複合体を形成する工程、(viii)容器に磁場を加え、それによって複合体を容器の所定の領域に引き寄せる工程、(ix)生物試料の少なくとも一部を容器から取り除く工程、(x)磁場を容器から取り除く工程、(xi)第1物質と第2物質とを互いから引き離す工程、(xii)磁場を容器に再び加え、それによって、第1物質を容器の所定の領域に引き寄せる工程、(xiii)第2物質を容器から取り除く工程、(ix)第2物質に増幅処置を施す工程、ならびに(x)第2物質中の標的検体の存在および/または濃度を検出するアッセイを実施する工程の1または複数をさらに含み得る。上記工程の1または複数は、自動化ロボット装置により実施することができる。
【0015】
さらなる態様によれば、本発明は、i)容器、ii)該容器中の第1物質、およびiii)該容器中にあって該第1物質にかぶせてある容易に溶解するフィルムを含むキットを提供する。さらに別の態様によれば、本発明は、i)容器、およびii)容易に溶解するフィルムにより担持されている第1物質を含むアッセイを実施するためのキットを提供する。
【図面の簡単な説明】
【0016】
【図1】本発明の第1の態様の原理による方法および装置の略図である。
【図2】本発明の第2の態様の原理による方法および装置の略図である。
【図3】本発明の原理の遂行により実施可能なさらなる方法および装置の略図である。
【図4】本発明の一態様により実施したPCR法の結果の画像である。
【発明を実施するための形態】
【0017】
上記その他の本発明の特徴、態様および利点は、以下の記述、添付の特許請求の範囲および下記に簡単に説明されている図面に示されている典型的な実施形態から明らかになろう。他に特記されていない限り、同じ要素は同一の記号を有していることに注意されたい。
【0018】
本発明の原理を、その原理の説明のための特定の実施形態の以下の論議および後掲の図面を参照することにより、これからさらに説明する。
【0019】
本明細書で使用するとき、「生物試料」とは、血液、血漿、血清、尿、骨髄穿刺液、脳脊髄液、細胞組織、細胞、食物、糞、唾液、毛髪、口内分泌物、鼻汁、頬側細胞、気管支洗浄液、頚管粘液、リンパ液、痰、および前記のいずれかを含むスワブを含むがこれらには限定されない体液または身体物質を含む任意の物質を意味する。上記の体液または身体物質は、任意の供給源から採取することができる。例えば、その供給源はヒトには限定されない。
【0020】
本明細書で使用するとき、「磁気反応性粒子」とは、与えられた磁気モーメントを有することができる粒子、さもなければ、磁場の作用で可動する粒子を意味する。
【0021】
本明細書で使用するとき、「上に重なる」とは、関係する普通の使用または場の中で、関係する対象または物質の真上にある幾何学的配置を意味する。
【0022】
本明細書で使用するとき、「容易に溶解する」とは、材料またはフィルムが、選択された物質(1または複数)と接触したとき、その材料が、所望の科学的または産業的方法において過度の遅れを引き起こすことなく容易に利用することができるように、一定の速度で、一定の程度まで分解することができることを指す。例えば、「容易に溶解する」とは、選択された溶媒に対するハンセンパラメータが、ハンセン溶解度マップにプロットしたとき、その材料に対する溶解度容積もしくは面積内にあることを意味する。例えば、非特許文献1を参照。
【0023】
本明細書で使用するとき、「非特異的に結合した」とは、特定の標的物質と選択的に結合する受容体、捕捉剤などを介して起こらない結合機構を意味する。
【0024】
本明細書で使用するとき、「特異的に結合した」とは、特定の標的物質と選択的に結合する受容体、捕捉剤、または同種のものを介しては起こる結合機構を意味する。
【0025】
本明細書で使用するとき、「フィルム」とは、対立する主要な表面をもった部材を意味する。用語「フィルム」は、特定の幾何学的配置または形状に限定することを意図してはいない。例えば、本発明では、フィルムは、実質的に平面であってもよく、あるいは中実多角形もしくは中空多角形、球形、または矩形体の形で提供されてもよいと考えられる。用語「フィルム」と「膜」は、本明細書では同じ意味で用いられる。
【0026】
前述のように、本発明は、容易に溶解するフィルムおよびそれを含む方法に関する。本発明により利用される溶解性フィルムは、本明細書に記載されている機能的な目的を達成する限り、任意の適切な組成を有することができる。本発明の容易に溶解するフィルムは、少なくとも部分的には既知の溶解する物質から形成することができる。例えば、容易に溶解することを特徴とする有機または無機の任意のポリマー材料または1または複数のそのような材料から誘導された材料を利用することができよう。そのような物質としては、低粘度ヒドロキシアルキルメチルセルロースまたはカルボキシメチルセルロース等のセルロース系またはセルロースから誘導された物質が挙げられる。その他の適当な材料としては、カルボン酸ヒドロキシアルキルエステルモノマーと、エトキシル化またはプロポキシル化ヒドロキシアルキル(メタ)アクリレートと、ポリエチレングリコール(PEG)、およびポリビニルアルコール(PVA)の組合せが挙げられる。上記の物質のさまざまな量または組合せを含有する配合も考えられる。
【0027】
上記の既知物質は、例えば、口臭消臭剤のための担体として使用される溶解性フィルムを作製するために利用される。そのようなフィルムの1種は、その全体の内容が参照により本明細書に組み込まれている特許文献1に記載されている。そこに記載されているフィルムは、低粘度のヒドロキシアルキルメチルセルロース、デンプンおよび着香料の組合せから一般に構成されている。本発明との関連で利用されるフィルムは、場合により、香味料、着色料、抗菌剤および口臭消臭剤などの成分を省いてもよい。
【0028】
本発明との関連で使用するのが適切なフィルムは、当業者にはよく知られている技術、例えば、特許文献1に記載されている技術等によって作製することができる。適当な技術は、フィルムの構成要素を含有している溶液またはスラリーを形成する工程、その溶液またはスラリーを注型して乾燥し、フィルムを形成する工程を一般に含む。一旦乾燥したらフィルムはセグメントに切断することができる。別法では、フィルムは、連続的に注型し、ロール状に蓄積することができる。物質または成分をフィルムに組み込むための任意の技術は、あらゆる適当な技術によりフィルムを生産する工程、および表面塗装技術によって成分または物質をフィルム中に組み込む工程を含み得る。例えば、フィルムは、完全には乾燥または硬化していない状態であってよく、成分または物質を、次にその表面上に導入し、乾燥または硬化の方法を完了させる。得られたフィルムは、フィルムの表面上またはその近くに該成分を含む。この技術の修正も可能である。例えば、完全に乾燥または硬化したフィルムが出発材料を形成することができる。乾燥または硬化したフィルムを、次に、加熱または湿潤等の方法にかけ、表面を改質して成分または物質をより容易に受け入れられるようにすることができる。次いで、成分または物質を改質した表面に加え、フィルムを乾燥または冷却し、フィルムの表面でその中に組み込まれた成分または物質を含むフィルムを与えることができる。別法では、物質またはさらなる成分は、完全に乾燥または硬化したフィルムの表面に単純に塗布することができる。本発明の1種の利点は、フィルムから放出され、周囲の媒体中に導入される物質の量を、フィルム中に存在する物質の濃度および利用するフィルムの断片の大きさを調節することによって正確に制御できることである。
【0029】
本発明との関連で利用されるフィルムは、場合によって香料を含むことができる。生物試料の分析等のある一定の方法において、芳香剤の包含は上記試料によってしばしば放たれる臭いを隠し、それによって作業環境を改善することができる。
【0030】
溶解性フィルムと一緒に任意の適当な物質を使用または提供することができることが本発明により理解される。一実施形態によれば、フィルムは磁気反応性粒子と共に利用される。この実施形態においては、磁気反応性粒子は任意の適当な方法でフィルムから分離するかまたはフィルム中に導入することができる。例えば、上記のように、フィルムが、成型および乾燥の際に溶解性基質中に分散され捕捉された磁気反応性粒子を含むように、粒子はフィルムを形成する溶液またはスラリー中に導入することができる。別法では、粒子は、上記タイプの表面塗装技術のいずれかによってフィルム中に組み込むことができる。フィルムを溶解した際、磁気粒子は開放され、例えば、溶媒として作用する物質または混合物中に分散することができる。
【0031】
磁気反応性粒子は、被覆または脱被覆、処理または脱処理することができ、および/またはいかなるタイプの表面改質を欠いてもよい。本発明の磁気反応性粒子は、標的物質に特定的にまたは非特定的に結合するように設計することができる。磁気反応性粒子は、標的物質に静電気引力等の任意の適当な機構によって結合させることができる。そのような結合技術は、例えば、全体の内容が参照により本明細書に組み込まれている特許文献2、および特許文献3に記載されている。
【0032】
適当な磁気反応性粒子は、水性の環境で低い溶解性を有する水酸化第二鉄および四酸化三鉄等の形態の酸化鉄からなることができる。硫化鉄および塩化鉄等のその他の鉄粒子もまた標的物質への結合に適している。さらに、その粒子は、シリカを被覆した磁気反応性粒子からなることもできる。
【0033】
該物質は、溶解剤またはタンパク質変性剤、非プロトン性溶媒、アルカリ化剤、あるいは中和緩衝液等の1または複数の試薬を含むことができる。その試薬(1または複数)は、液体または乾燥した形態のいずれかで利用することができる。該物質は、また、塩、金属、酵素、オリゴヌクレオチド、プライマー、追加の核酸、またはタンパク質等の1または複数の反応成分を含むことができる。典型的な塩としては、EDTA、塩化ナトリウムおよび塩化カリウムが挙げられる。金属の例としては、マグネシウム、マンガン、カルシウムその他の微量金属が挙げられる。さらに、該物質は、安定化成分または媒体成分を含むことができる。
【0034】
該物質は、核酸その他の生物剤を、純化、抽出、増幅または検出するために使用する材料(磁気反応性粒子以外)を含むことができる。上記方法および物質は、例えば、全体の内容が参照により本明細書に組み込まれている特許文献4および特許文献5に記載されている。この関連で、該物質は、シリカ粒子、シリカ被覆粒子、シリカ被覆膜、シリカゲル、水和およびヒドロキシル化シリカ表面、ガラス粉末、ガラス繊維マット、ガラス膜、ゼオライト、セラミック、金属酸化物または金属塩を被覆したポリマー粒子等の核酸に可逆的に結合させるために使用する材料を含むことができる。
【0035】
1または複数の物質の組合せを、容易に溶解するフィルムと一緒に利用することができることが、本発明により理解される。例えば、上記の物質の1または複数の組合せを利用することができる。
【0036】
物質が微粒子の形態をしているとき、その粒子の形状は、本発明にとって重要ではない。その粒子は例えば、球形、立方体、楕円、カプセル型、錠剤型、特徴のないランダム形状などを含むさまざまな形状のものであってよく、均一な形状または不均一な形状であり得る。該粒子はまた任意の適当な大きさを有することができる。例えば、該粒子は、サブミクロンの寸法から数ミクロンの範囲の平均直径を有することができる。
【0037】
本発明に関連して利用されるフィルムのさまざまな実施形態および特徴を説明してきたが、該フィルムを利用するさまざまな典型的な方法をこれから説明する。
【0038】
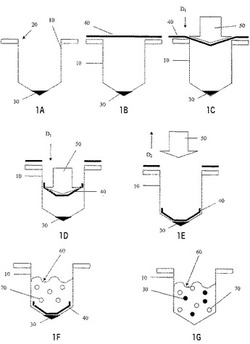
本発明の第1の実施形態は、図1の1A〜1Gに概略的に示されている。そこに示されているように、容器内に適当な開口部20を含んでいてもよい容器10を準備する。容器10は、任意の適当な形状をとることができる。例示の実施形態によれば、容器10は、一般に管の形状をしている。しかしながら、マイクロウェルもしくはマイクロウェルのアレイ、ビン、またはペトリ皿等のその他の構成も考えられる。物質30は、最初に容器中に導入される(図1の1A)。物質30は、容易に溶解するフィルムと共に使用するための上記に特定したあらゆる材料の任意の適当な組成を有することができる。本発明の一実施形態によれば、物質30は、上記説明に準じた組成および形態を有する磁気反応性粒子を含むことができる。物質30を導入するために任意の適当な技術を利用することができる。例えば、物質30は、手動または自動化ロボット装置により導入することができる。
【0039】
容易に溶解するフィルム40を、次に、容器10の開口部20の上に配置する(図1の1B)。フィルム40は、例えば本明細書で先に説明した任意の組成および/または構造のあらゆる適当な組成および/または構成を有することができる。フィルム40は、十分に長くて開口部20にわたり、好ましくは、開口部20の境界をはるかに越えて伸びるセグメントの形態をしていてもよい。あるいは、フィルム40は、容器の開口部20の上に供給されるようなフィルムの「連続した」ウェブまたはロールの形態をしていてもよい(図示されていない)。フィルム40は、次いで任意の適当なメカニズムにより容器10中に導入される(図1の1Cおよび1D)。一実施形態によれば、フィルム40は、プランジャー/パンチ装置50により容器中に導入される。
【0040】
フィルム40を容器10内に配置する。フィルム40は、容器10内の任意の適切な場所に配置することができる。例示の実施形態によれば、フィルム40は、物質30の上に重なるように配置する。任意の適当なメカニズムまたは技術を、フィルム40を容器10内に位置付けるために利用することができる。例示の実施形態によれば、フィルム40は、プランジャー/パンチ装置50をD1として示されている長軸方向に移動させることによって容器中に押し下げる(図1の1Cおよび1D)。一旦フィルム40が適切に置かれたら、プランジャー/パンチ装置50は、反対の長軸方向D2にそのプランジャー/パンチ装置50を引き出すことによって容器10から引き出す(図1の1E)。フィルム40を配置するためのその他の技術または機構も考えられる。例えば、フィルム40を、適当な大きさを有する断片に切断し、任意で落とし口または漏斗を通して管内に重力送りをすることができる。フィルムは、また、管内に重力送りをする前に折りたたむこともできる。もう1つの別法では、フィルムを特定の寸法に切断し、次いで減圧または正の空気圧の1または複数の使用により管内に供給する。例えば、フィルムを管の上部で切断し、正の空気圧を用いてその切断したフィルムを管内に押し込む。あるいは、フィルムを管に対して離れた場所で切断し、減圧を用いる吸引装置を用いてフィルムを付着させ、管の開口部の近くにそれを移動させる。減圧を次いで逆転し、フィルムを正の空気圧で管内に押し込むことができる。
【0041】
例示の実施形態に示されているように、フィルム40は、物質30が容器10の底に実質的に閉じ込められ、それによって物質30の転置を実質的に防ぎ、その結果、物質30の容器10の側壁に沿った望ましくない散乱を防ぐ形で物質30の上に重なる(図1の1E)。
【0042】
上記の実施形態との関連で、さらなる任意の工程を実施してもよい。例えば、材料または混合物60を、また、容器10の中に導入することができる(図1の1F)。材料または混合物60は、第2物質70を場合によって含む。材料または混合物60は、第2物質70に加えて他の物質を含んでもよいことが意図される。材料または混合物60ならびに第2物質70は、任意の適当な形態または組成を有することができる。一実施形態によれば、材料または混合物60は、生物試料を含み、第2物質70は、その構成要素、例えば、細胞、微生物、核酸、タンパク質、脂質または炭水化物を含む。材料または混合物60は、溶媒として作用してフィルム40を溶解する。材料または混合物60は、それらと組み合わせた1または複数の添加試薬を場合によって含むことができる。フィルム40が溶解したときに、容器10の底に予め閉じ込めておいた物質30は、自由となり、材料または混合物60の中に分配され得る(図1の1G)。
【0043】
上記方法の説明ならびに下記のさらなる方法の説明は、それらの方法が、本明細書に記載されている工程からなるかまたはもっぱらそれらに限定され得ること、本明細書に明確に記載されているものと別の工程を、記載されている方法に組み込むことができること、本明細書に記載されているさまざまな工程のサブコンビネーションを含む方法が実施できること、および本明細書に記載されているものと異なる順序で実施する工程を含む方法も実施できることが考えられることを理解して読むべきである。これらの変更のすべては本発明に包含される。
【0044】
本発明の第2の実施形態は、図2の2A〜2Gに概略的に示されている。一般的に言えば、この例示の本発明の実施形態は、前に記載した実施形態と実質的に類似している。したがって、上述した第1の実施形態との関連で上記した構成要素および工程は、以下の記述で特段にはっきりと指摘されていない限り、第2の実施形態にも同様にあてはまるべきである。図示されているように、好ましくは開口部20を有する適当な容器10を準備する。溶解性フィルム40’を容器10の開口部20の上に重なるように位置付ける(図2の2B)。溶解性フィルム40’は、以下の主要な差異はあるが、前記の溶解性フィルムと実質的には類似している。すなわち、溶解性フィルム40’は、物質30’がその中に組み込まれるように形成される。物質30’は、物質30と同じものであり得る。前記のように、この構成を有するフィルムは、任意の適当な技術によって形成することができる。例えば、物質30’を含む溶解性フィルム40’の構成要素を含むスラリー溶液を形成することができる。そのスラリーまたは溶液を注型して乾燥すると、溶解性基質中に捕捉されて閉じ込められた物質30’を有する溶解性基質からなる溶解性フィルム40’が提供される。別法では、物質30は、前記の表面塗装技術のいずれかによってフィルム中に組み込むことができる。
【0045】
溶解性フィルム40’は、次に、容器10の中の任意の適当な場所に、任意の適当なメカニズムまたは技術により導入し位置付ける。図示されているように、溶解性フィルム40’は、長軸方向に移動できるプランジャー/パンチ装置50により導入し位置付けることができる。プランジャー/パンチ装置50は、第1の長軸方向D1に移動させる(図2の2Cおよび2D)。溶解性フィルム40’を一旦容器10内に適切に位置付けされたら、プランジャー/パンチ装置50は、反対の長軸方向D2に移動させることにより引き出す(図2の2E)。フィルム40’は、また、第1の実施形態との関連で、上記した別の技術のいずれかにより容器内に位置付けることができる。図2の2Eに示されているように、溶解性フィルム40’を、容器10の底に位置付け、それによってフィルム40’の全体を、容器10内に導入し得る追加の物質と確実に接触させる。
【0046】
さらなる任意の工程を上記の方法と共に実施することができる。すなわち、最初の例示の実施形態との関連で説明したように、材料または混合物60を、容器10内に導入することができる(図2の2F)。材料または混合物60は、その中に含有される第2物質70を含んでいてもよい。材料または混合物60は、また、1または複数の試薬を場合によって含むことができる。材料または混合物60ならびに第2物質70は、任意の適当な組成または形態を有することができる。1の任意の実施形態によれば、材料または混合物60は、生物試料を含み、第2物質70は、それの構成要素、例えば、細胞、微生物、核酸、タンパク質、脂質、または炭水化物を含む。材料または混合物60は、溶媒として作用し、それによって、フィルム40’の溶解性基質を分裂させて、物質30'を放出する。一旦放出されると、物質30’は、材料または混合物60の中に分配することができる。
【0047】
本発明の上記の原理は、多くの様々な科学的および産業的な場面に用いることができる。一般的に言って、本発明の原理は、さまざまな構成要素の正確な量の組合せが必要であるかまたは望ましいあらゆる装置および/または方法においても有用である。
【0048】
本発明の原理の1つの可能性のある用途は、生物試料中に含まれている構成要素の単離および/または分離である。これに関連して、容器10は、抽出管を含み、物質30(または30’)は、磁気反応性粒子を含み、材料または混合物60は、場合により追加の薬剤または成分と組み合わせて生物試料を含み、その結果、混合物を形成しており、第2物質70は、混合物60の中に存在する構成要素、例えば、細胞、微生物、または核酸を含む。
【0049】
図1の1A〜1Gおよび図2の2A〜2Gで示した実施形態の記述と関連付けて上記に開示した方法は、上記の単離または分離技術の初期段階として用いることができる。図3の3A〜3Fは、例証となる単離および/または分離技術を行うために前記の工程と関連して実施することができるさらなる工程を概略的に示している。本発明の原理は、非常に多くのタイプの抽出および/または単離技術と共に使用することができ、以下に記載されている例示の実施形態に限定されるものとして見るべきではないことを理解すべきである。
【0050】
上記のようにして形成され、例えば図1の1Gおよび図2の2Gに示されている物質30(または30’)および生物試料70の標的構成要素を含む混合物60は、磁気反応性粒子30と構成要素70とが共に結合し、それによって複合体を形成するように処理する(図3の3A)。磁気粒子30を構成要素と結合させるためには任意の適当な技術を利用することができる。そのような1の技術には、混合物60のpHを変更し、それによって磁気粒子30および/または構成要素70の間の相互の吸引力がその2つを一緒に結合させるのに十分であるように磁気粒子30および/または構成要素70の表面誘引特性を改めることが含まれる。次いで、1または複数の磁石80を、容器の1または複数の壁に密着して導入し、それによって上記の複合体を、磁石80によって磁界に置かれている容器10の壁(1または複数)に引き寄せる(図3の3B)。次いで、混合物60の残りは、図3の3Bに示されているように容器から除去することができる。複合体は、次いで、1または複数の洗浄工程にかけることができる。一旦、残りが除去されると(図3の3C)、第2の材料または混合物90を次に容器10内に導入することができる。第2の材料または混合物90は、磁気粒子30と構成要素70とを解離させる溶離液または混合物を含むことができる(図3の3D)。磁石80を次に、図3の3Eに示されるように容器10の1または複数の壁と密着した状態に戻すことができる。構成要素70は、次いで、容器から除去し、さらなる任意の方法の工程を受けることができる(図3の3E〜3F)。
【0051】
図3の3Fに示されている工程の後、構成要素70は、標的の検体を検出しおよび/または定量するための技術等のさらなる方法を受けることができる。例えば、任意の適当な増幅の方法を本発明の方法において使用することができる。そのような方法としては、例えば、ポリメラーゼ連鎖反応(「PCR])、ストランド置換増幅反応(「SDA」)、好熱性ストランド置換増幅反応(「tSDA」)、自立配列複製(Self−Sustained Sequence Replication)(「3SR」)、核酸配列を基礎とした増幅法(Nucleic Acid Sequence−Based Amplification)(「NASBA」)、Qβレプリカーゼシステム;リガーゼ連鎖反応(「LCR」)、および転写介在増幅法(Transcription−Mediated Amplification)(TMA)が挙げられる。
【0052】
培養または増幅の後、アッセイを行うことができる。例えば、クラミジアトラコマチス(CT)、淋菌(GC)、レジオネラニューモフィラ、肺炎マイコプラズマ、クラミジア科、単純ヘルペスウイルス1型、単純ヘルペスウイルス2型、エンテロウイルス、HIV、HCV、HBV、HPV、ウエストナイルウイルス、A型インフルエンザ菌、B型インフルエンザ菌、呼吸器合胞体ウイルス、メタニューモウイルス、非定型抗酸菌複合体の直、B群連鎖球菌、CMVの定性、CMVの定量、パラインフルエンザ1/2/3、アデノウイルス、レジオネラ原基、レジオネラミクダディ(Legionell micdadei)、百日咳菌、パラ百日咳菌(Bordetella parapertussis)、結核菌、結核菌培養確認、非定型抗酸菌複合体培養確認およびカンサシー菌(M.Kansasii)培養確認等、分析を行って病原体の存在を判断することができる。この分析を実施するための適切な技術としては、Becton,Dickinson and Company社により製造されたBDProbeTec(商標)製品に具体化されている技術が挙げられる。また、試料中に存在する核酸の遺伝子検査を行うこともできる。
【0053】
上記の図1の1A〜1G、図2の2A〜2Gおよび図3の3A〜3Fの工程ならびに上記の増幅技術は、手動、自動化方式または手動と自動化の組合せの工程で行うことができる。その自動化工程は、自動化したピペッティング、混合、および磁石位置合わせ機能を含んでいてもよい含む自動化ロボット装置により実施することができる。自動化ロボット装置は、コンピュータ制御することができる。例えば、本発明は、その内容がすべて参照により本明細書に組み込まれている特許文献6に記載されているタイプのシステムおよび方法と関連付けて利用することができる。
【0054】
本発明の方法で役立つキットは、例えば、容器、第1物質および容易に溶解するフィルムを含む本明細書に既に記載した成分の少なくともいくつかを含む。1種の実施形態においては、容易に溶解するフィルムは、第1物質を包含する。さらなる実施形態においては、第1物質と容易に溶解するフィルムは別々である。キットは、本明細書で前述した以下の成分;試薬、反応成分、安定化成分、媒体成分、磁気反応性粒子、および核酸を可逆的に結び付ける材料、の1または複数を場合によって含有することができる。場合によって上記キットには、製品の製造、使用または販売を統制する政府機関による所定の形式の通告が伴うことがあり得、その通告には、行政管理のための製造、使用または販売に対する政府機関による認可が示されている。そのパックまたはキットは、1回の使用単位の成分のものであるかまたはそれは複数回使用のものであり得る。
【0055】
(実施例)
本発明の原理をこれから以下の説明のためであって非限定の実施例を参照しながら記述する。
【実施例1】
【0056】
標的検体を検出する方法に溶解性フィルムを組み込むことの実施可能性を判断するために実験を行った。特にクラミジアトラコマチス(CT)または淋菌(GC)についてのアッセイを下記のようにして行い、溶解性フィルムを当該方法に包含させることの効果の解析を行った。
【0057】
以下の手法により抽出管の形態をした容器に鉄粒子の形態の磁気反応性粒子を供給した:(1)約8mgの磁気反応性粒子を複数の抽出管に手で分配し(対照として)、(2)約8mgの磁気反応性粒子を複数の抽出管に手動のピペットで取り、次いで以下の市販品から得た溶解性フィルム:(a)Listerine Cool Mint(登録商標)細片、(b)Listerine Fresh Burst(登録商標)細片、(c)Listerine Cinnamon(登録商標)細片の形態の溶解性フィルムで覆い、(3)溶解性カルボキシメチルセルロース材料から形成された溶解性フィルムに酸化鉄粒子を充填した。フィルム中に存在する酸化鉄粒子の密度は、約8.89mg/1.5cm2である。この充填フィルムを次にパンチ/プランジャー型装置のついた抽出管内に導入した。
【0058】
水酸化カリウム(KOH)の溶液を、磁気反応性粒子を含有する各抽出管に分配した。pHの高いKOH溶液は、自動化ロボット装置、すなわち、BDバイパー(Viper)(商標)自動化抽出装置により分配した。
【0059】
次に、尿の試料を同じく自動化ロボット装置により抽出管に分配した。その尿試料は、250CT Ebs〜250GCパーツ/mlのレベルにスパイクし、高いpHの溶液と混合して試料中に含まれている目的の有機体(1または複数)を溶解し、それによって核酸を放出させた。低いpHの第2の溶液をその試料に加え、放出された核酸を磁気反応性粒子に結び付けた。この溶液は、硫酸を含んでいた。
【0060】
抽出管の内容物に磁界を適用した。自動化ロボット装置により、一対の対向する磁石を管の外側に密着するように持ってゆき、それによって複合体を管内部の周辺に引き寄せた。自動化ロボット装置は、次に、複合体を管内に残して管の内容物を吸引し、磁界を容器から取り除いた。
【0061】
その複合体を、次に0.01%のTween(登録商標)20を含む1mM濃度の溶液で洗浄した。洗浄後、磁界を再びかけて管内部周辺に複合体を引き寄せ、洗浄液を管から吸引した。
【0062】
次に溶離緩衝液を抽出管に加え、混合して複合体から核酸を溶離した。その溶離緩衝液は、KOHとビシン(Bicine)の組合せに基づく混合物を含んでいた。その溶離バッファーは、自動化ロボット装置により加え、混合した。次に、溶離された試料の核酸を分離し、次いでストランド置換増幅反応法(SDA法)を行った。
【0063】
検体の特異的結合部分をオリゴヌクレオチド部分に結合し、上記の溶離バッファーと混合した。標的を含有する溶離バッファーを、SDAプライマーCTpB4.S2.3、CTpB4.S1.3、またはGCINT3.APR1、GCINT3.APL2、アダプターICAdpt.l0、GCINT3.R2、またはCTAdpt−F5、バンパーGCINT3.BR3、GCINT3.BL2、またはCTpB4.B6、CTpB4.B7およびレポータープローブMPC−DR、MPC3.FD、またはMPC−FDを含有するプライミングマイクロウェルに加えた。室温で20分後、その混合物を、次に72〜73℃に10分間加熱した。100μlのその混合物を次に53.5〜54.5℃の増幅ウェルに加えた。具体的には、市販のBDProbeTec(商標)増幅ウェルを使用した。
【0064】
BsoB1制限エンドヌクレアーゼおよびBst DNAポリメラーゼをその増幅ウェルに加え、等温増幅を51.2〜52.8℃で60分間行った。増幅方法は、レポータープローブの変化に伴う蛍光の増加を検出するBDProbeTec(商標)の読み取り機で監視した。その読み取り機は、増幅方法の間、上記の蛍光の検出に基づいてMOTA値を生み出す。上記の試料に対してもたらされたMOTA値を、以下の表Iおよび表IIに記載する。
【0065】
【表1】

【0066】
【表2】

【0067】
上記のアッセイの場合には、2,000を超えるMOTA値が、CTまたはGCの標的に対して陽性の結果を示すと考えられる。これらの基準を念頭に置くと、上記のデータは、溶解性フィルムの当該方法への包含により、アッセイ中に標的の存在の陽性表示を得る際に標的配列の抽出または増幅が顕著には阻害されなかったことを示している。
【実施例2】
【0068】
RNA標的、すなわちSARS Co−V標的配列を増幅および検出する方法に溶解性フィルムを組み込むことの実施可能性を判断するために、下記のようにして実験を行った。
【0069】
SARS Co−Vの陽性対照管を、RT−SDAアッセイに対する標的として使用した。SARS Co−Vの陽性対照管は、SAR Co−Vの陽性対照RNA転写物、酵母RNA、およびRNアーゼ阻害剤を包含した。酵母RNA、およびRNアーゼ阻害剤を包含している陰性のSARS Co−Vの対照も用いた。各SARS Co−Vの対照管を、ヌクレアーゼを含まない950μlの水で再水和し、ボルテックスした。
【0070】
ワーキングストックのRTバッファーを、主要成分のヌクレアーゼを含まない水、RNアーゼ阻害剤、SARS Co−V内部増幅対照、逆転写酵素、KOHおよびビシンを混合することによって調製した。
【0071】
この実験で用いた溶解性フィルムは、透明なカルボキシメチルセルロース(酸化鉄なし)である。そのフィルムを異なる大きさのセグメントに切断し、ヌクレオチドdCsTP、dATP、dGTP、dTTP、SDAプライマーSARSrpC、SARfpC、アダプターSARSiacadC、SARSmpcadC、バンパーSARSCrtB24、およびレポータープローブMPC−DRおよびMPC2.FDを含有するSARS Co−V RTプライミングマイクロウェル中に配置した。
【0072】
陽性または陰性の対照およびワーキングストックのRTバッファーを、それぞれのSARS Co−V RTプライミングマイクロウェルごとに加えた。そのSARS Co−V RTプライミングマイクロウェルを48℃で20分間加熱した後、主としてビシンおよびKOHからなる第2のバッファーを各反応系に加えた。そのSARS Co−V RTプライミングマイクロウェルを、次に72〜73℃に10分間加熱した。100μlのその混合物を次に53.5〜54.5℃の増幅ウェルに加えた。
【0073】
BsoB1制限エンドヌクレアーゼおよびBst DNAポリメラーゼをその増幅ウェルに加え、等温増幅を51.2〜52.8℃で60分間行った。増幅方法は、レポータープローブの変化に伴う蛍光の増加を検出するBDProbeTec(商標)読み取り機で監視した。その読み取り機は、増幅方法中の上記の蛍光の検出に基づいてMOTA値を生み出す。これらの値は、増幅の開始から3〜7分後に測定を開始する。上記の試料に対してもたらされたMOTA値を、以下の表IIIに記載する。
【0074】
【表3】

【0075】
上記のデータは、RT−SDA反応への溶解性フィルムの包含により、アッセイ中に標的の存在の陽性表示を得る際に標的配列のRNAのDNAへの逆転写または増幅が阻害されなかったことを示している。
【実施例3】
【0076】
下記のようにして実施されるPCR増幅法の中に溶解性フィルムを包含させることの実施可能性を判断するために実験を行った。PCR法に対する鋳型としてプラスミドコンストラクトpUC19−トリコモナスバジナリス(T.vaginalis)を用いた。
【0077】
実験で用いたフィルムは、カルボキシメチルセルロースであった。フィルムをさまざまな大きさのセグメントに切断し、次いでPCRサーモウェル管中に配置し、以下に示すラベル付けをした。
【0078】
一連のPCR管を、表IVに示す以下の反応を実施するために用意した。
【0079】
【表4】

【0080】
1回のPCR反応の溶液を調製して、各管に加えた。その溶液は、表Vの組成に従って調製した。
【0081】
【表5】

【0082】
1回の溶液の98.88μLのアリコートを、8個の反応管のそれぞれに導入した。TV1の1.12μL分量を、管1、4、5、6、7および8に加え、1.12μLの水を管2および3のそれぞれに加えた。その管を、次に、MJ Research Peltier Thermal Cycler(モデルPTC−200)中に入れ、表VIに詳しく記されている条件下で培養した。
【0083】
【表6】

【0084】
PCR反応生成物のゲル解析を次に実施し、PCR増幅方法の結果を評価した。これに関連して、1%アガロースゲルを調製した。臭化エチジウムを加えて0.5μg/mLの最終濃度にした(5mg/mLのストックの場合、100mLのアガロース混合物中に10μg)。表VIIに示したスケジュールに従って40ml量のゲルを注ぎ、90Vで1時間、1×TBE中で運転した。
【0085】
【表7】

【0086】
ゲル実験の結果は、図4に示されていてPCR法が成功したことを指し示しており、それによって溶解性フィルムの存在が、阻害物質として作用しなかったことまたはPCR法を中断させなかったことを示している。図4に示されているように、30mm2までの大きさの溶解性フィルムの存在は、PCR法を阻害しない。
【実施例4】
【0087】
DNA標的、すなわちクラミジアトラコマチス(CT)または淋菌(GC)の標的配列を増幅および検出する方法に溶解性フィルムを組み込むことの実施可能性を判断するために下記のようにして実験を行った。
【0088】
CT/GC Diplex SDAアッセイに対する標的としてはCT/GC陽性対照管を用いた。CT/GC陽性対照管は、CT/GC陽性対照プラスミド、サケ精子のDNA、およびドライダウンした対照希釈剤を含んだ。CT/GC陰性対照管も、サケ精子のDNA、およびドライダウンした対照希釈剤を含むものを用いた。各CT/GC対照管は、2mlの試料希釈剤により再水和し、ボルテックスした。
【0089】
すべての対照管を114℃で30分間加熱溶解した。各対照管は、次いでテスト前の少なくとも15分間、放冷した。
【0090】
この実験で用いた溶解性フィルムは、透明なカルボキシメチルセルロース(酸化鉄なし)である。そのフィルムを異なる大きさのセグメントに切断し、SDAプライマーCTpB4.S2.3、CTpB4.S1.3、またはGCINT3.APRl、GCINT3.APL2、アダプターICAdpt.10、GCINT3.R2、またはCTAdpt−F5、バンパーGCINT3.BR3、GCINT3.BL2、CTpB4.BまたはCTpB4.B7およびレポータープローブMPC−DR、MPC3.FD、またはMPC−FDを含有するCT/GCプライミングマイクロウェル中に配置した。
【0091】
陽性および陰性対照をそれぞれのCT/GCプライミングマイクロウェルごとに加えた。そのCT/GCプライミングマイクロウェルを、次いで72〜73℃に10分間加熱した。その混合物の100μlを、次に53.5〜54.5℃のCT/GC増幅マイクロウェルに加えた。
【0092】
その増幅マイクロウェルを、次にBD ProbeTec(商標)モデル1334読み取り機に加え、そこで51.2〜52.8℃で60分間、等温増幅反応を行った。増幅方法は、探知したレポーターの変換に伴う蛍光の増加を観察することによって監視された。その読み取り機は、増幅方法中の上記の基準値の検出に基づいてMOTA値を生み出す。これらの値は、増幅を開始してから3〜7分後に測定を開始する。上記の試料に対してもたらされたMOTA値を、以下の表VIII(CT)および表IX(GC)に記載する。
【0093】
【表8】

【0094】
【表9】

【0095】
上に示されているデータは、溶解性フィルムを直接Diplex SDA反応で使用することの実施可能性を明らかにしている。SDA増幅マイクロウェル中にフィルムを直接挿入しても反応は阻害されない。
【実施例5】
【0096】
溶解性フィルムが抽出処置を妨害するかどうかを判定するために実験を行った。抽出対照(EC)は、抽出混合物を含む標識オリゴヌクレオチドである。抽出方法が成功するかどうかを判定するためにその標識の蛍光を監視する。2つの溶解性フィルム(酸化鉄を含有する)および2種類の酸化鉄粒子について、抽出方法におけるそれらの効果があるか否かの測定するテストをした。
【0097】
磁気反応性粒子を含む抽出管の形態の容器を以下の方法により準備した。(1)約9mgの鉄粒子(粒子試料Aまたは粒子試料B)を抽出管内に分配するか、または(2)溶解性フィルム(フィルム試料Aまたはフィルム試料B)に9.9mg/1.77cm2の濃度で鉄粒子を充填した。陽性対照管には、蛍光標識した抽出対照のオリゴヌクレオチドを含ませ、一方、陰性対照には、抽出対照を含有させなかった。抽出方法のその他は実施例1で記載したようにして完了させた。標識されたECオリゴヌクレオチドの蛍光を次に測定し、抽出が成功したかどうかを判定した。試料に対して増幅工程は実施しなかった。
【0098】
抽出の結果を、表X(CT)およびXI(GC)に示す。これらの表は、陽性の結果に対して0.5の値を用いるEC測定基準を表示している。0.5より低い値は、陰性の結果としてみなす。
【0099】
【表10】

【0100】
【表11】

【0101】
データを、溶解性フィルムに埋め込むか遊離した鉄粒子のどちらの場合においても、鉄粒子が組み込まれた抽出対照を抽出する能力に対して悪影響はないことを示している。すべての溶解性フィルム試料に対して陽性の平均値(0.7および0.8)が記録されたことは、抽出方法がうまくいくことを示している。
【実施例6】
【0102】
異なる種類の試料中の標的検体を検出する方法に溶解性フィルムを組み込むことの実現可能性を判断するために実験を行った。特に、CTまたはGCに対するアッセイを下記のようにして行った。溶解性フィルムの影響の解析を行った。
【0103】
本アッセイにおいては4種類の試料、尿、試料希釈剤、臨床尿、膣スワブを用いた。「尿」試料は、健康なドナーから採取した組織内試料プールである。「試料希釈剤」とは、スワブを発現する対照管ならびに基質を再水和するために使用する現下のBD ProbeTec(商標)試料バッファーを指す。「臨床尿」とは、健康状態または病気の診断を受けた人から得た尿検体を指す。抽出管に、酸化鉄粒子をそれぞれ9.7mg/1.77cm2および10.6mg/cm2の濃度で充填した2種類の溶解性フィルム(試料フィルムAおよび試料フィルムB)のうちの1の形態で磁気反応性粒子を供給した。試料は、実施例1に記したようにして抽出および増幅をした。上記の試料に対して生じたMOTA値を、以下の表XIIおよびXIIIに記す。
【0104】
【表12】

【0105】
【表13】

【0106】
上記のデータは、いずれの種類の溶解性フィルムを包含しても、標的配列の抽出または増幅を顕著に阻害することは4つの試料の種類のいずれにおいてもなかったことを示している。
【実施例7】
【0107】
鉄粉末または溶解性フィルムの形態の磁気反応性粒子が、標的検体を検出する方法において妨害するかどうかを判断するために実験を行った。実験は、SDAモノプレックス系およびダイプレックス系の両方の溶解性フィルムの影響を評価した。特に下記のようにして、試料希釈剤および尿プール試料を用いるCTに対するアッセイを行った。
【0108】
モノプレックスアッセイにおいては、標的のリアルタイム蛍光エネルギー伝達の検出のために万能型検出プローブを用いた。ダイプレックスアッセイは、その検出プローブに加えて内部増幅対照(IAC)を用いる。このIACは、SDA反応の阻害物質を含有することもあり得る試料を識別するために標的DNAと一緒に増幅させた。
【0109】
本実施例においては、抽出管に、遊離型の鉄粉末または鉄粒子を約9.0mg/1.77cm2の濃度で充填した溶解性フィルムの形態の鉄粒子を供給した。その試料は、実施例1で前掲したようにして抽出および増幅をした。結果を表XIVおよびXVに示す。これらの表は、「PAT」値を示している。「PAT」とは、閾値後のパス(Passes After Threshold)、すなわち陽性試料を判断するのに使用するアルゴリズムを指す。信号は予め定められた閾値に調節されるが、そのとき、BD ProbeTec(商標)が実行するパスの数を差し引きする。より高い最終のPAT値は、試料が、より低い値の試料よりも速い速度で陽性の結果をもたらす閾値に到達したことを示す。ゼロに等しいPATは、陰性と考えられる。したがって、ゼロより大きい値は、陽性の結果を示す。
【0110】
【表14】

【0111】
【表15】

【0112】
表XIVおよびXVに示したデータは、溶解性フィルムが、遊離型の粉末と同様にモノプレックスアッセイおよびダイプレックスアッセイの両方で機能したことを示している。陽性のPAT値は、両方のアッセイにおいて標的の増幅が成功することを示している。
【実施例8】
【0113】
酸化鉄を組み込んだ溶解性フィルムの溶解を確実にするBD Viper(商標)自動抽出装置の最適な混合パラメータを決定するために実験を行った。この実験は、鉄粒子によって結合および捕捉されるのに十分な時間を標的DNAに与える。この実験により、BD Viper(商標)器具についての多数の混合パラメータを評価した。
【0114】
本実験についての抽出手順は、実施例1で記載したのと同じものに以下の修正を付け足したものである。表XVIに記載の8個の異なる試料の条件をテストした。各条件用に6つの二重管を準備した。抽出管には、鉄粒子を9.8mg/1.77cm2の濃度で含有する溶解性フィルムを供給した。次に、試料希釈剤を抽出管に加え、特定の容積およびスピードで混合した。この実験は、このBD Viper(商標)プログラム中の20秒の中断を削除して行った。対照の抽出管は、KOHにさらし、5回混合した。その管を次に溶解させるために20秒間インキュベートした。インキュベート後に、3.75Mの硫酸および抽出対照を含有する結合酸混合物との1の混合工程を続けた。その後の試験条件においては、KOHの混合および溶解のための中断は取り除いた。混合スピードおよび混合の繰返しの数もまた表XVIに示したように変化させた。BD Viper(商標)器具の試料チップ内の流動体の色を視覚的に記録した。酸化鉄粉末は黒であり、試料希釈剤は透明である。それ故、試料チップの流動体が完全に黒のときは完全な混合を示し、容認することができる混合結果が得られたことになる。チップ内で得られた色を、次のようにランク付けした:(0)=劣る、(1)=中程度、(2)=良好、(3)=非常に良好
【0115】
【表16】

【0116】
上の実験により、条件#8(438μlの混合容積で15回の混合回数の後、700μlの混合容積で10回の混合回数)が溶解性フィルムの完全な溶解に対して理想的であるものと判定した。この条件は、目視検査で「非常に良好」の結果を与えた。
【実施例9】
【0117】
実施例8で記載した最適化パラメータをテストするために実験を行った。特に、下記のようにCTアッセイを行った。
【0118】
抽出管に、鉄粉末(試料粉末Aまたは試料粉末B)または鉄粒子を充填した溶解性フィルムのいずれかを供給した。その抽出管に膣スワブを加えた。その試料を実施例8で概説したように混合し(438μlの混合容積で15回の混合回数の後、700μlの混合容積で10回の混合回数)、実施例1で記載したようにして増幅した。結果を表XVIIに示し、PACスコアとして表示した。
【0119】
【表17】

【0120】
上のデータは、実施例8で決定した最適化混合パラメータにより、標的およびIACの両方に対して陽性(>0)のPATスコアが示されているように、抽出および増幅反応の成功がもたらされたことを示している。
【実施例10】
【0121】
1カ月にわたるさまざまな温度における溶解性フィルムの安定性をテストするために実験を行った。フィルムを3つの一貫した温度範囲(2〜8℃、15℃および33℃)のうちの1種で1カ月間保存した。試薬を貯蔵庫から取り出し、周囲温度で抽出/増幅反応をテストした。表XVIII〜XXIIIは、各温度範囲で貯蔵した試薬について行ったCTおよびGCアッセイの結果を示す。実験は、実施例1で前記したようにして行った。陽性(標的)の値は、増幅したCT標的を示す。陰性(IAC)の値は、内部増幅対照の蛍光を示す。データは、PATスコアとして記録されている。
【0122】
【表18】

【0123】
【表19】

【0124】
【表20】

【0125】
【表21】

【0126】
【表22】

【0127】
【表23】

【0128】
表XVIIIからXXIIIに含まれているデータは、溶解性フィルムの2〜8℃、15℃および33℃での1カ月の保存後の増幅反応が成功したことを示している。
【符号の説明】
【0129】
10 容器
20 開口部
30、30’ 物質
40、40’ フィルム
60 材料または混合物
70 第2物質
80 磁石
【技術分野】
【0001】
本出願は、参照により本明細書に組み込まれている2004年6月28日に出願した米国特許仮出願第60/582,821号の優先権を主張するものである。
【0002】
本発明は、溶解性の膜もしくはフィルムおよびそれを含む方法に関する。例えば、本発明は、容器、物質および溶解性の膜を含む装置ならびにそれを含む方法に関する。
【背景技術】
【0003】
以下の論議においては、いくつかの物品および方法を、背景および序文のために記載する。ここに含まれるものはいずれも従来技術の「是認」と解釈すべきではない。出願人は、適用できる法による規定のもとで、その物品および方法が、従来技術を構成しないことを適宜明らかにする権利を明確に留保する。
【0004】
極めて正確な量の1または複数の物質の容器中への導入を必要とする多くの科学的および産業上の装置および方法が存在する。導入される物質の性質、容器の構成および特性、ならびにこれらの物質を導入するために用いられる技法等のさまざまな要因によって、容器に導入される物質の幾分かが、その容器中の他の物質と混合および/または相互作用することを防ぐように容器の壁にくっつくことは、よく見受けられることである。さまざまな物質が正確な量で混合されることを方法の本質が必要とするとき、上記の「くっつき」の問題は、その方法の望ましい結果に対して重大かつ好ましくない影響を与え得る。
【0005】
さらに、物質の導入の自動化は望ましいけれども、少量の物質を正確に供給することは困難であることが分かる。したがって、物質の正確な量が要求されるときは、これらの物質を手動で測定して容器に導入するのが一般的なやり方である。この手間のかかる手順は、能率の立場からは明らかに理想的とは言えない。
【0006】
前記の科学的または産業的方法の様式の一例は、試料からの生物学的要素の単離および/または分離である。この単離および/または分離を達成する1種の方法には、生物学的試料、磁化できる粒子、および場合によりその他の物質を、通常は重量測定法によるかまたはピペットによって管に導入することが含まれる。管中に存在する1または複数の生物学的要素は、磁化できる粒子と結合するようになる。そのとき磁石を管の壁(1または複数)に緊密に接近した状態にさせ、磁化できる粒子が、結合している生物学的要素(1または複数)と共に管の壁(1または複数)に引き寄せられるようになる。次いで、管に存在する残りの成分を除去し、その結果、生物学的要素(1または複数)を分離することができる。さまざまなさらなる方法の工程を、所望の目標を達成するために用いることができる。
【0007】
管の壁およびピペットの先端は、そこに物質を引き寄せることができる表面電荷をしばしば持つ。したがって、例えば、磁化できる粒子の管中への導入によって、管内の残りの成分と該粒子自体が結合することを妨げる方法で、該粒子が管の壁またはピペットに、しばしばくっつき得るという上記の問題を引き起こす。その上、粒子を最初に導入するときに、そのくっつきの問題を防ぐための配慮をしたとしても、粒子が入っている管のその後の移動によって、粒子が管の壁にまき散らされて、壁にくっつくことが起こり得る。上記のような方法は、望ましい結果もしくは正確な結果を得るために、しばしば小さなサンプルサイズを必要とし、および/または、一緒に混合する正確な量のさまざまな物質に依存するため、くっつきの現象は、上記の単離および/または分離技術の正確性および信頼性における重大な問題を引き起こす。
【0008】
それ故、一般に、物質のより正確な導入および容器内での結合を容易にする装置および方法を提供する必要性が当技術分野には存在する。また、試料からの生物学的要素の単離および/または分離で必要とされる物質のより正確で効率的な導入および結合を促進する装置および方法に対する必要性も当技術分野には存在する。
【先行技術文献】
【特許文献】
【0009】
【特許文献1】米国特許第6,419,903号明細書
【特許文献2】米国特許第5,973,138号明細書
【特許文献3】米国特許第6,433,160号明細書
【特許文献4】米国特許出願第10/359,179号明細書
【特許文献5】米国特許出願第10/359,180号明細書
【特許文献6】米国特許第6,672,458号明細書
【非特許文献】
【0010】
【非特許文献1】"Hansen Solubility Parameter System," DuPont Nylon Intermediates and Specialties, publication W-400473, 12/2000
【発明の概要】
【発明が解決しようとする課題】
【0011】
本発明は、1または複数の物質が容器中の他の物質および構成要素と適切に結合することを妨げる方法で容器の壁にくっつくことを除去するとはいかないまでも減少させる装置および方法を提供することによって上記の必要性などを満足させる。本発明は、また、自動化を容易にする装置および技術を提供する。本発明は、さらに、正確な量の物質を容器内に導入することを可能にする装置および方法を提供する。
【課題を解決するための手段】
【0012】
一態様によれば、本発明の方法は、(i)容器を準備する工程、(ii)該容器に第1物質を導入する工程、および(iii)容易に溶解するフィルムを該容器内に導入し、その溶解性フィルムが容器中の第1物質の上に重なるようにする工程を含む。
【0013】
さらなる態様によれば、本発明は、(i)容器を準備する工程、(ii)第1物質を担持している容易に溶解するフィルムを準備する工程、および(iii)該フィルムを容器内に導入する工程を含む。
【0014】
本発明の別の態様によれば、上記方法のいずれもが、第2物質を容器に加える工程、ならびに以下の、(v)フィルムを溶解する工程、および(vi)第1および第2物質を含む混合物を作り出す工程、(vii)第1物質と第2物質とを互いに結合させ、それによって複合体を形成する工程、(viii)容器に磁場を加え、それによって複合体を容器の所定の領域に引き寄せる工程、(ix)生物試料の少なくとも一部を容器から取り除く工程、(x)磁場を容器から取り除く工程、(xi)第1物質と第2物質とを互いから引き離す工程、(xii)磁場を容器に再び加え、それによって、第1物質を容器の所定の領域に引き寄せる工程、(xiii)第2物質を容器から取り除く工程、(ix)第2物質に増幅処置を施す工程、ならびに(x)第2物質中の標的検体の存在および/または濃度を検出するアッセイを実施する工程の1または複数をさらに含み得る。上記工程の1または複数は、自動化ロボット装置により実施することができる。
【0015】
さらなる態様によれば、本発明は、i)容器、ii)該容器中の第1物質、およびiii)該容器中にあって該第1物質にかぶせてある容易に溶解するフィルムを含むキットを提供する。さらに別の態様によれば、本発明は、i)容器、およびii)容易に溶解するフィルムにより担持されている第1物質を含むアッセイを実施するためのキットを提供する。
【図面の簡単な説明】
【0016】
【図1】本発明の第1の態様の原理による方法および装置の略図である。
【図2】本発明の第2の態様の原理による方法および装置の略図である。
【図3】本発明の原理の遂行により実施可能なさらなる方法および装置の略図である。
【図4】本発明の一態様により実施したPCR法の結果の画像である。
【発明を実施するための形態】
【0017】
上記その他の本発明の特徴、態様および利点は、以下の記述、添付の特許請求の範囲および下記に簡単に説明されている図面に示されている典型的な実施形態から明らかになろう。他に特記されていない限り、同じ要素は同一の記号を有していることに注意されたい。
【0018】
本発明の原理を、その原理の説明のための特定の実施形態の以下の論議および後掲の図面を参照することにより、これからさらに説明する。
【0019】
本明細書で使用するとき、「生物試料」とは、血液、血漿、血清、尿、骨髄穿刺液、脳脊髄液、細胞組織、細胞、食物、糞、唾液、毛髪、口内分泌物、鼻汁、頬側細胞、気管支洗浄液、頚管粘液、リンパ液、痰、および前記のいずれかを含むスワブを含むがこれらには限定されない体液または身体物質を含む任意の物質を意味する。上記の体液または身体物質は、任意の供給源から採取することができる。例えば、その供給源はヒトには限定されない。
【0020】
本明細書で使用するとき、「磁気反応性粒子」とは、与えられた磁気モーメントを有することができる粒子、さもなければ、磁場の作用で可動する粒子を意味する。
【0021】
本明細書で使用するとき、「上に重なる」とは、関係する普通の使用または場の中で、関係する対象または物質の真上にある幾何学的配置を意味する。
【0022】
本明細書で使用するとき、「容易に溶解する」とは、材料またはフィルムが、選択された物質(1または複数)と接触したとき、その材料が、所望の科学的または産業的方法において過度の遅れを引き起こすことなく容易に利用することができるように、一定の速度で、一定の程度まで分解することができることを指す。例えば、「容易に溶解する」とは、選択された溶媒に対するハンセンパラメータが、ハンセン溶解度マップにプロットしたとき、その材料に対する溶解度容積もしくは面積内にあることを意味する。例えば、非特許文献1を参照。
【0023】
本明細書で使用するとき、「非特異的に結合した」とは、特定の標的物質と選択的に結合する受容体、捕捉剤などを介して起こらない結合機構を意味する。
【0024】
本明細書で使用するとき、「特異的に結合した」とは、特定の標的物質と選択的に結合する受容体、捕捉剤、または同種のものを介しては起こる結合機構を意味する。
【0025】
本明細書で使用するとき、「フィルム」とは、対立する主要な表面をもった部材を意味する。用語「フィルム」は、特定の幾何学的配置または形状に限定することを意図してはいない。例えば、本発明では、フィルムは、実質的に平面であってもよく、あるいは中実多角形もしくは中空多角形、球形、または矩形体の形で提供されてもよいと考えられる。用語「フィルム」と「膜」は、本明細書では同じ意味で用いられる。
【0026】
前述のように、本発明は、容易に溶解するフィルムおよびそれを含む方法に関する。本発明により利用される溶解性フィルムは、本明細書に記載されている機能的な目的を達成する限り、任意の適切な組成を有することができる。本発明の容易に溶解するフィルムは、少なくとも部分的には既知の溶解する物質から形成することができる。例えば、容易に溶解することを特徴とする有機または無機の任意のポリマー材料または1または複数のそのような材料から誘導された材料を利用することができよう。そのような物質としては、低粘度ヒドロキシアルキルメチルセルロースまたはカルボキシメチルセルロース等のセルロース系またはセルロースから誘導された物質が挙げられる。その他の適当な材料としては、カルボン酸ヒドロキシアルキルエステルモノマーと、エトキシル化またはプロポキシル化ヒドロキシアルキル(メタ)アクリレートと、ポリエチレングリコール(PEG)、およびポリビニルアルコール(PVA)の組合せが挙げられる。上記の物質のさまざまな量または組合せを含有する配合も考えられる。
【0027】
上記の既知物質は、例えば、口臭消臭剤のための担体として使用される溶解性フィルムを作製するために利用される。そのようなフィルムの1種は、その全体の内容が参照により本明細書に組み込まれている特許文献1に記載されている。そこに記載されているフィルムは、低粘度のヒドロキシアルキルメチルセルロース、デンプンおよび着香料の組合せから一般に構成されている。本発明との関連で利用されるフィルムは、場合により、香味料、着色料、抗菌剤および口臭消臭剤などの成分を省いてもよい。
【0028】
本発明との関連で使用するのが適切なフィルムは、当業者にはよく知られている技術、例えば、特許文献1に記載されている技術等によって作製することができる。適当な技術は、フィルムの構成要素を含有している溶液またはスラリーを形成する工程、その溶液またはスラリーを注型して乾燥し、フィルムを形成する工程を一般に含む。一旦乾燥したらフィルムはセグメントに切断することができる。別法では、フィルムは、連続的に注型し、ロール状に蓄積することができる。物質または成分をフィルムに組み込むための任意の技術は、あらゆる適当な技術によりフィルムを生産する工程、および表面塗装技術によって成分または物質をフィルム中に組み込む工程を含み得る。例えば、フィルムは、完全には乾燥または硬化していない状態であってよく、成分または物質を、次にその表面上に導入し、乾燥または硬化の方法を完了させる。得られたフィルムは、フィルムの表面上またはその近くに該成分を含む。この技術の修正も可能である。例えば、完全に乾燥または硬化したフィルムが出発材料を形成することができる。乾燥または硬化したフィルムを、次に、加熱または湿潤等の方法にかけ、表面を改質して成分または物質をより容易に受け入れられるようにすることができる。次いで、成分または物質を改質した表面に加え、フィルムを乾燥または冷却し、フィルムの表面でその中に組み込まれた成分または物質を含むフィルムを与えることができる。別法では、物質またはさらなる成分は、完全に乾燥または硬化したフィルムの表面に単純に塗布することができる。本発明の1種の利点は、フィルムから放出され、周囲の媒体中に導入される物質の量を、フィルム中に存在する物質の濃度および利用するフィルムの断片の大きさを調節することによって正確に制御できることである。
【0029】
本発明との関連で利用されるフィルムは、場合によって香料を含むことができる。生物試料の分析等のある一定の方法において、芳香剤の包含は上記試料によってしばしば放たれる臭いを隠し、それによって作業環境を改善することができる。
【0030】
溶解性フィルムと一緒に任意の適当な物質を使用または提供することができることが本発明により理解される。一実施形態によれば、フィルムは磁気反応性粒子と共に利用される。この実施形態においては、磁気反応性粒子は任意の適当な方法でフィルムから分離するかまたはフィルム中に導入することができる。例えば、上記のように、フィルムが、成型および乾燥の際に溶解性基質中に分散され捕捉された磁気反応性粒子を含むように、粒子はフィルムを形成する溶液またはスラリー中に導入することができる。別法では、粒子は、上記タイプの表面塗装技術のいずれかによってフィルム中に組み込むことができる。フィルムを溶解した際、磁気粒子は開放され、例えば、溶媒として作用する物質または混合物中に分散することができる。
【0031】
磁気反応性粒子は、被覆または脱被覆、処理または脱処理することができ、および/またはいかなるタイプの表面改質を欠いてもよい。本発明の磁気反応性粒子は、標的物質に特定的にまたは非特定的に結合するように設計することができる。磁気反応性粒子は、標的物質に静電気引力等の任意の適当な機構によって結合させることができる。そのような結合技術は、例えば、全体の内容が参照により本明細書に組み込まれている特許文献2、および特許文献3に記載されている。
【0032】
適当な磁気反応性粒子は、水性の環境で低い溶解性を有する水酸化第二鉄および四酸化三鉄等の形態の酸化鉄からなることができる。硫化鉄および塩化鉄等のその他の鉄粒子もまた標的物質への結合に適している。さらに、その粒子は、シリカを被覆した磁気反応性粒子からなることもできる。
【0033】
該物質は、溶解剤またはタンパク質変性剤、非プロトン性溶媒、アルカリ化剤、あるいは中和緩衝液等の1または複数の試薬を含むことができる。その試薬(1または複数)は、液体または乾燥した形態のいずれかで利用することができる。該物質は、また、塩、金属、酵素、オリゴヌクレオチド、プライマー、追加の核酸、またはタンパク質等の1または複数の反応成分を含むことができる。典型的な塩としては、EDTA、塩化ナトリウムおよび塩化カリウムが挙げられる。金属の例としては、マグネシウム、マンガン、カルシウムその他の微量金属が挙げられる。さらに、該物質は、安定化成分または媒体成分を含むことができる。
【0034】
該物質は、核酸その他の生物剤を、純化、抽出、増幅または検出するために使用する材料(磁気反応性粒子以外)を含むことができる。上記方法および物質は、例えば、全体の内容が参照により本明細書に組み込まれている特許文献4および特許文献5に記載されている。この関連で、該物質は、シリカ粒子、シリカ被覆粒子、シリカ被覆膜、シリカゲル、水和およびヒドロキシル化シリカ表面、ガラス粉末、ガラス繊維マット、ガラス膜、ゼオライト、セラミック、金属酸化物または金属塩を被覆したポリマー粒子等の核酸に可逆的に結合させるために使用する材料を含むことができる。
【0035】
1または複数の物質の組合せを、容易に溶解するフィルムと一緒に利用することができることが、本発明により理解される。例えば、上記の物質の1または複数の組合せを利用することができる。
【0036】
物質が微粒子の形態をしているとき、その粒子の形状は、本発明にとって重要ではない。その粒子は例えば、球形、立方体、楕円、カプセル型、錠剤型、特徴のないランダム形状などを含むさまざまな形状のものであってよく、均一な形状または不均一な形状であり得る。該粒子はまた任意の適当な大きさを有することができる。例えば、該粒子は、サブミクロンの寸法から数ミクロンの範囲の平均直径を有することができる。
【0037】
本発明に関連して利用されるフィルムのさまざまな実施形態および特徴を説明してきたが、該フィルムを利用するさまざまな典型的な方法をこれから説明する。
【0038】
本発明の第1の実施形態は、図1の1A〜1Gに概略的に示されている。そこに示されているように、容器内に適当な開口部20を含んでいてもよい容器10を準備する。容器10は、任意の適当な形状をとることができる。例示の実施形態によれば、容器10は、一般に管の形状をしている。しかしながら、マイクロウェルもしくはマイクロウェルのアレイ、ビン、またはペトリ皿等のその他の構成も考えられる。物質30は、最初に容器中に導入される(図1の1A)。物質30は、容易に溶解するフィルムと共に使用するための上記に特定したあらゆる材料の任意の適当な組成を有することができる。本発明の一実施形態によれば、物質30は、上記説明に準じた組成および形態を有する磁気反応性粒子を含むことができる。物質30を導入するために任意の適当な技術を利用することができる。例えば、物質30は、手動または自動化ロボット装置により導入することができる。
【0039】
容易に溶解するフィルム40を、次に、容器10の開口部20の上に配置する(図1の1B)。フィルム40は、例えば本明細書で先に説明した任意の組成および/または構造のあらゆる適当な組成および/または構成を有することができる。フィルム40は、十分に長くて開口部20にわたり、好ましくは、開口部20の境界をはるかに越えて伸びるセグメントの形態をしていてもよい。あるいは、フィルム40は、容器の開口部20の上に供給されるようなフィルムの「連続した」ウェブまたはロールの形態をしていてもよい(図示されていない)。フィルム40は、次いで任意の適当なメカニズムにより容器10中に導入される(図1の1Cおよび1D)。一実施形態によれば、フィルム40は、プランジャー/パンチ装置50により容器中に導入される。
【0040】
フィルム40を容器10内に配置する。フィルム40は、容器10内の任意の適切な場所に配置することができる。例示の実施形態によれば、フィルム40は、物質30の上に重なるように配置する。任意の適当なメカニズムまたは技術を、フィルム40を容器10内に位置付けるために利用することができる。例示の実施形態によれば、フィルム40は、プランジャー/パンチ装置50をD1として示されている長軸方向に移動させることによって容器中に押し下げる(図1の1Cおよび1D)。一旦フィルム40が適切に置かれたら、プランジャー/パンチ装置50は、反対の長軸方向D2にそのプランジャー/パンチ装置50を引き出すことによって容器10から引き出す(図1の1E)。フィルム40を配置するためのその他の技術または機構も考えられる。例えば、フィルム40を、適当な大きさを有する断片に切断し、任意で落とし口または漏斗を通して管内に重力送りをすることができる。フィルムは、また、管内に重力送りをする前に折りたたむこともできる。もう1つの別法では、フィルムを特定の寸法に切断し、次いで減圧または正の空気圧の1または複数の使用により管内に供給する。例えば、フィルムを管の上部で切断し、正の空気圧を用いてその切断したフィルムを管内に押し込む。あるいは、フィルムを管に対して離れた場所で切断し、減圧を用いる吸引装置を用いてフィルムを付着させ、管の開口部の近くにそれを移動させる。減圧を次いで逆転し、フィルムを正の空気圧で管内に押し込むことができる。
【0041】
例示の実施形態に示されているように、フィルム40は、物質30が容器10の底に実質的に閉じ込められ、それによって物質30の転置を実質的に防ぎ、その結果、物質30の容器10の側壁に沿った望ましくない散乱を防ぐ形で物質30の上に重なる(図1の1E)。
【0042】
上記の実施形態との関連で、さらなる任意の工程を実施してもよい。例えば、材料または混合物60を、また、容器10の中に導入することができる(図1の1F)。材料または混合物60は、第2物質70を場合によって含む。材料または混合物60は、第2物質70に加えて他の物質を含んでもよいことが意図される。材料または混合物60ならびに第2物質70は、任意の適当な形態または組成を有することができる。一実施形態によれば、材料または混合物60は、生物試料を含み、第2物質70は、その構成要素、例えば、細胞、微生物、核酸、タンパク質、脂質または炭水化物を含む。材料または混合物60は、溶媒として作用してフィルム40を溶解する。材料または混合物60は、それらと組み合わせた1または複数の添加試薬を場合によって含むことができる。フィルム40が溶解したときに、容器10の底に予め閉じ込めておいた物質30は、自由となり、材料または混合物60の中に分配され得る(図1の1G)。
【0043】
上記方法の説明ならびに下記のさらなる方法の説明は、それらの方法が、本明細書に記載されている工程からなるかまたはもっぱらそれらに限定され得ること、本明細書に明確に記載されているものと別の工程を、記載されている方法に組み込むことができること、本明細書に記載されているさまざまな工程のサブコンビネーションを含む方法が実施できること、および本明細書に記載されているものと異なる順序で実施する工程を含む方法も実施できることが考えられることを理解して読むべきである。これらの変更のすべては本発明に包含される。
【0044】
本発明の第2の実施形態は、図2の2A〜2Gに概略的に示されている。一般的に言えば、この例示の本発明の実施形態は、前に記載した実施形態と実質的に類似している。したがって、上述した第1の実施形態との関連で上記した構成要素および工程は、以下の記述で特段にはっきりと指摘されていない限り、第2の実施形態にも同様にあてはまるべきである。図示されているように、好ましくは開口部20を有する適当な容器10を準備する。溶解性フィルム40’を容器10の開口部20の上に重なるように位置付ける(図2の2B)。溶解性フィルム40’は、以下の主要な差異はあるが、前記の溶解性フィルムと実質的には類似している。すなわち、溶解性フィルム40’は、物質30’がその中に組み込まれるように形成される。物質30’は、物質30と同じものであり得る。前記のように、この構成を有するフィルムは、任意の適当な技術によって形成することができる。例えば、物質30’を含む溶解性フィルム40’の構成要素を含むスラリー溶液を形成することができる。そのスラリーまたは溶液を注型して乾燥すると、溶解性基質中に捕捉されて閉じ込められた物質30’を有する溶解性基質からなる溶解性フィルム40’が提供される。別法では、物質30は、前記の表面塗装技術のいずれかによってフィルム中に組み込むことができる。
【0045】
溶解性フィルム40’は、次に、容器10の中の任意の適当な場所に、任意の適当なメカニズムまたは技術により導入し位置付ける。図示されているように、溶解性フィルム40’は、長軸方向に移動できるプランジャー/パンチ装置50により導入し位置付けることができる。プランジャー/パンチ装置50は、第1の長軸方向D1に移動させる(図2の2Cおよび2D)。溶解性フィルム40’を一旦容器10内に適切に位置付けされたら、プランジャー/パンチ装置50は、反対の長軸方向D2に移動させることにより引き出す(図2の2E)。フィルム40’は、また、第1の実施形態との関連で、上記した別の技術のいずれかにより容器内に位置付けることができる。図2の2Eに示されているように、溶解性フィルム40’を、容器10の底に位置付け、それによってフィルム40’の全体を、容器10内に導入し得る追加の物質と確実に接触させる。
【0046】
さらなる任意の工程を上記の方法と共に実施することができる。すなわち、最初の例示の実施形態との関連で説明したように、材料または混合物60を、容器10内に導入することができる(図2の2F)。材料または混合物60は、その中に含有される第2物質70を含んでいてもよい。材料または混合物60は、また、1または複数の試薬を場合によって含むことができる。材料または混合物60ならびに第2物質70は、任意の適当な組成または形態を有することができる。1の任意の実施形態によれば、材料または混合物60は、生物試料を含み、第2物質70は、それの構成要素、例えば、細胞、微生物、核酸、タンパク質、脂質、または炭水化物を含む。材料または混合物60は、溶媒として作用し、それによって、フィルム40’の溶解性基質を分裂させて、物質30'を放出する。一旦放出されると、物質30’は、材料または混合物60の中に分配することができる。
【0047】
本発明の上記の原理は、多くの様々な科学的および産業的な場面に用いることができる。一般的に言って、本発明の原理は、さまざまな構成要素の正確な量の組合せが必要であるかまたは望ましいあらゆる装置および/または方法においても有用である。
【0048】
本発明の原理の1つの可能性のある用途は、生物試料中に含まれている構成要素の単離および/または分離である。これに関連して、容器10は、抽出管を含み、物質30(または30’)は、磁気反応性粒子を含み、材料または混合物60は、場合により追加の薬剤または成分と組み合わせて生物試料を含み、その結果、混合物を形成しており、第2物質70は、混合物60の中に存在する構成要素、例えば、細胞、微生物、または核酸を含む。
【0049】
図1の1A〜1Gおよび図2の2A〜2Gで示した実施形態の記述と関連付けて上記に開示した方法は、上記の単離または分離技術の初期段階として用いることができる。図3の3A〜3Fは、例証となる単離および/または分離技術を行うために前記の工程と関連して実施することができるさらなる工程を概略的に示している。本発明の原理は、非常に多くのタイプの抽出および/または単離技術と共に使用することができ、以下に記載されている例示の実施形態に限定されるものとして見るべきではないことを理解すべきである。
【0050】
上記のようにして形成され、例えば図1の1Gおよび図2の2Gに示されている物質30(または30’)および生物試料70の標的構成要素を含む混合物60は、磁気反応性粒子30と構成要素70とが共に結合し、それによって複合体を形成するように処理する(図3の3A)。磁気粒子30を構成要素と結合させるためには任意の適当な技術を利用することができる。そのような1の技術には、混合物60のpHを変更し、それによって磁気粒子30および/または構成要素70の間の相互の吸引力がその2つを一緒に結合させるのに十分であるように磁気粒子30および/または構成要素70の表面誘引特性を改めることが含まれる。次いで、1または複数の磁石80を、容器の1または複数の壁に密着して導入し、それによって上記の複合体を、磁石80によって磁界に置かれている容器10の壁(1または複数)に引き寄せる(図3の3B)。次いで、混合物60の残りは、図3の3Bに示されているように容器から除去することができる。複合体は、次いで、1または複数の洗浄工程にかけることができる。一旦、残りが除去されると(図3の3C)、第2の材料または混合物90を次に容器10内に導入することができる。第2の材料または混合物90は、磁気粒子30と構成要素70とを解離させる溶離液または混合物を含むことができる(図3の3D)。磁石80を次に、図3の3Eに示されるように容器10の1または複数の壁と密着した状態に戻すことができる。構成要素70は、次いで、容器から除去し、さらなる任意の方法の工程を受けることができる(図3の3E〜3F)。
【0051】
図3の3Fに示されている工程の後、構成要素70は、標的の検体を検出しおよび/または定量するための技術等のさらなる方法を受けることができる。例えば、任意の適当な増幅の方法を本発明の方法において使用することができる。そのような方法としては、例えば、ポリメラーゼ連鎖反応(「PCR])、ストランド置換増幅反応(「SDA」)、好熱性ストランド置換増幅反応(「tSDA」)、自立配列複製(Self−Sustained Sequence Replication)(「3SR」)、核酸配列を基礎とした増幅法(Nucleic Acid Sequence−Based Amplification)(「NASBA」)、Qβレプリカーゼシステム;リガーゼ連鎖反応(「LCR」)、および転写介在増幅法(Transcription−Mediated Amplification)(TMA)が挙げられる。
【0052】
培養または増幅の後、アッセイを行うことができる。例えば、クラミジアトラコマチス(CT)、淋菌(GC)、レジオネラニューモフィラ、肺炎マイコプラズマ、クラミジア科、単純ヘルペスウイルス1型、単純ヘルペスウイルス2型、エンテロウイルス、HIV、HCV、HBV、HPV、ウエストナイルウイルス、A型インフルエンザ菌、B型インフルエンザ菌、呼吸器合胞体ウイルス、メタニューモウイルス、非定型抗酸菌複合体の直、B群連鎖球菌、CMVの定性、CMVの定量、パラインフルエンザ1/2/3、アデノウイルス、レジオネラ原基、レジオネラミクダディ(Legionell micdadei)、百日咳菌、パラ百日咳菌(Bordetella parapertussis)、結核菌、結核菌培養確認、非定型抗酸菌複合体培養確認およびカンサシー菌(M.Kansasii)培養確認等、分析を行って病原体の存在を判断することができる。この分析を実施するための適切な技術としては、Becton,Dickinson and Company社により製造されたBDProbeTec(商標)製品に具体化されている技術が挙げられる。また、試料中に存在する核酸の遺伝子検査を行うこともできる。
【0053】
上記の図1の1A〜1G、図2の2A〜2Gおよび図3の3A〜3Fの工程ならびに上記の増幅技術は、手動、自動化方式または手動と自動化の組合せの工程で行うことができる。その自動化工程は、自動化したピペッティング、混合、および磁石位置合わせ機能を含んでいてもよい含む自動化ロボット装置により実施することができる。自動化ロボット装置は、コンピュータ制御することができる。例えば、本発明は、その内容がすべて参照により本明細書に組み込まれている特許文献6に記載されているタイプのシステムおよび方法と関連付けて利用することができる。
【0054】
本発明の方法で役立つキットは、例えば、容器、第1物質および容易に溶解するフィルムを含む本明細書に既に記載した成分の少なくともいくつかを含む。1種の実施形態においては、容易に溶解するフィルムは、第1物質を包含する。さらなる実施形態においては、第1物質と容易に溶解するフィルムは別々である。キットは、本明細書で前述した以下の成分;試薬、反応成分、安定化成分、媒体成分、磁気反応性粒子、および核酸を可逆的に結び付ける材料、の1または複数を場合によって含有することができる。場合によって上記キットには、製品の製造、使用または販売を統制する政府機関による所定の形式の通告が伴うことがあり得、その通告には、行政管理のための製造、使用または販売に対する政府機関による認可が示されている。そのパックまたはキットは、1回の使用単位の成分のものであるかまたはそれは複数回使用のものであり得る。
【0055】
(実施例)
本発明の原理をこれから以下の説明のためであって非限定の実施例を参照しながら記述する。
【実施例1】
【0056】
標的検体を検出する方法に溶解性フィルムを組み込むことの実施可能性を判断するために実験を行った。特にクラミジアトラコマチス(CT)または淋菌(GC)についてのアッセイを下記のようにして行い、溶解性フィルムを当該方法に包含させることの効果の解析を行った。
【0057】
以下の手法により抽出管の形態をした容器に鉄粒子の形態の磁気反応性粒子を供給した:(1)約8mgの磁気反応性粒子を複数の抽出管に手で分配し(対照として)、(2)約8mgの磁気反応性粒子を複数の抽出管に手動のピペットで取り、次いで以下の市販品から得た溶解性フィルム:(a)Listerine Cool Mint(登録商標)細片、(b)Listerine Fresh Burst(登録商標)細片、(c)Listerine Cinnamon(登録商標)細片の形態の溶解性フィルムで覆い、(3)溶解性カルボキシメチルセルロース材料から形成された溶解性フィルムに酸化鉄粒子を充填した。フィルム中に存在する酸化鉄粒子の密度は、約8.89mg/1.5cm2である。この充填フィルムを次にパンチ/プランジャー型装置のついた抽出管内に導入した。
【0058】
水酸化カリウム(KOH)の溶液を、磁気反応性粒子を含有する各抽出管に分配した。pHの高いKOH溶液は、自動化ロボット装置、すなわち、BDバイパー(Viper)(商標)自動化抽出装置により分配した。
【0059】
次に、尿の試料を同じく自動化ロボット装置により抽出管に分配した。その尿試料は、250CT Ebs〜250GCパーツ/mlのレベルにスパイクし、高いpHの溶液と混合して試料中に含まれている目的の有機体(1または複数)を溶解し、それによって核酸を放出させた。低いpHの第2の溶液をその試料に加え、放出された核酸を磁気反応性粒子に結び付けた。この溶液は、硫酸を含んでいた。
【0060】
抽出管の内容物に磁界を適用した。自動化ロボット装置により、一対の対向する磁石を管の外側に密着するように持ってゆき、それによって複合体を管内部の周辺に引き寄せた。自動化ロボット装置は、次に、複合体を管内に残して管の内容物を吸引し、磁界を容器から取り除いた。
【0061】
その複合体を、次に0.01%のTween(登録商標)20を含む1mM濃度の溶液で洗浄した。洗浄後、磁界を再びかけて管内部周辺に複合体を引き寄せ、洗浄液を管から吸引した。
【0062】
次に溶離緩衝液を抽出管に加え、混合して複合体から核酸を溶離した。その溶離緩衝液は、KOHとビシン(Bicine)の組合せに基づく混合物を含んでいた。その溶離バッファーは、自動化ロボット装置により加え、混合した。次に、溶離された試料の核酸を分離し、次いでストランド置換増幅反応法(SDA法)を行った。
【0063】
検体の特異的結合部分をオリゴヌクレオチド部分に結合し、上記の溶離バッファーと混合した。標的を含有する溶離バッファーを、SDAプライマーCTpB4.S2.3、CTpB4.S1.3、またはGCINT3.APR1、GCINT3.APL2、アダプターICAdpt.l0、GCINT3.R2、またはCTAdpt−F5、バンパーGCINT3.BR3、GCINT3.BL2、またはCTpB4.B6、CTpB4.B7およびレポータープローブMPC−DR、MPC3.FD、またはMPC−FDを含有するプライミングマイクロウェルに加えた。室温で20分後、その混合物を、次に72〜73℃に10分間加熱した。100μlのその混合物を次に53.5〜54.5℃の増幅ウェルに加えた。具体的には、市販のBDProbeTec(商標)増幅ウェルを使用した。
【0064】
BsoB1制限エンドヌクレアーゼおよびBst DNAポリメラーゼをその増幅ウェルに加え、等温増幅を51.2〜52.8℃で60分間行った。増幅方法は、レポータープローブの変化に伴う蛍光の増加を検出するBDProbeTec(商標)の読み取り機で監視した。その読み取り機は、増幅方法の間、上記の蛍光の検出に基づいてMOTA値を生み出す。上記の試料に対してもたらされたMOTA値を、以下の表Iおよび表IIに記載する。
【0065】
【表1】

【0066】
【表2】

【0067】
上記のアッセイの場合には、2,000を超えるMOTA値が、CTまたはGCの標的に対して陽性の結果を示すと考えられる。これらの基準を念頭に置くと、上記のデータは、溶解性フィルムの当該方法への包含により、アッセイ中に標的の存在の陽性表示を得る際に標的配列の抽出または増幅が顕著には阻害されなかったことを示している。
【実施例2】
【0068】
RNA標的、すなわちSARS Co−V標的配列を増幅および検出する方法に溶解性フィルムを組み込むことの実施可能性を判断するために、下記のようにして実験を行った。
【0069】
SARS Co−Vの陽性対照管を、RT−SDAアッセイに対する標的として使用した。SARS Co−Vの陽性対照管は、SAR Co−Vの陽性対照RNA転写物、酵母RNA、およびRNアーゼ阻害剤を包含した。酵母RNA、およびRNアーゼ阻害剤を包含している陰性のSARS Co−Vの対照も用いた。各SARS Co−Vの対照管を、ヌクレアーゼを含まない950μlの水で再水和し、ボルテックスした。
【0070】
ワーキングストックのRTバッファーを、主要成分のヌクレアーゼを含まない水、RNアーゼ阻害剤、SARS Co−V内部増幅対照、逆転写酵素、KOHおよびビシンを混合することによって調製した。
【0071】
この実験で用いた溶解性フィルムは、透明なカルボキシメチルセルロース(酸化鉄なし)である。そのフィルムを異なる大きさのセグメントに切断し、ヌクレオチドdCsTP、dATP、dGTP、dTTP、SDAプライマーSARSrpC、SARfpC、アダプターSARSiacadC、SARSmpcadC、バンパーSARSCrtB24、およびレポータープローブMPC−DRおよびMPC2.FDを含有するSARS Co−V RTプライミングマイクロウェル中に配置した。
【0072】
陽性または陰性の対照およびワーキングストックのRTバッファーを、それぞれのSARS Co−V RTプライミングマイクロウェルごとに加えた。そのSARS Co−V RTプライミングマイクロウェルを48℃で20分間加熱した後、主としてビシンおよびKOHからなる第2のバッファーを各反応系に加えた。そのSARS Co−V RTプライミングマイクロウェルを、次に72〜73℃に10分間加熱した。100μlのその混合物を次に53.5〜54.5℃の増幅ウェルに加えた。
【0073】
BsoB1制限エンドヌクレアーゼおよびBst DNAポリメラーゼをその増幅ウェルに加え、等温増幅を51.2〜52.8℃で60分間行った。増幅方法は、レポータープローブの変化に伴う蛍光の増加を検出するBDProbeTec(商標)読み取り機で監視した。その読み取り機は、増幅方法中の上記の蛍光の検出に基づいてMOTA値を生み出す。これらの値は、増幅の開始から3〜7分後に測定を開始する。上記の試料に対してもたらされたMOTA値を、以下の表IIIに記載する。
【0074】
【表3】

【0075】
上記のデータは、RT−SDA反応への溶解性フィルムの包含により、アッセイ中に標的の存在の陽性表示を得る際に標的配列のRNAのDNAへの逆転写または増幅が阻害されなかったことを示している。
【実施例3】
【0076】
下記のようにして実施されるPCR増幅法の中に溶解性フィルムを包含させることの実施可能性を判断するために実験を行った。PCR法に対する鋳型としてプラスミドコンストラクトpUC19−トリコモナスバジナリス(T.vaginalis)を用いた。
【0077】
実験で用いたフィルムは、カルボキシメチルセルロースであった。フィルムをさまざまな大きさのセグメントに切断し、次いでPCRサーモウェル管中に配置し、以下に示すラベル付けをした。
【0078】
一連のPCR管を、表IVに示す以下の反応を実施するために用意した。
【0079】
【表4】

【0080】
1回のPCR反応の溶液を調製して、各管に加えた。その溶液は、表Vの組成に従って調製した。
【0081】
【表5】

【0082】
1回の溶液の98.88μLのアリコートを、8個の反応管のそれぞれに導入した。TV1の1.12μL分量を、管1、4、5、6、7および8に加え、1.12μLの水を管2および3のそれぞれに加えた。その管を、次に、MJ Research Peltier Thermal Cycler(モデルPTC−200)中に入れ、表VIに詳しく記されている条件下で培養した。
【0083】
【表6】

【0084】
PCR反応生成物のゲル解析を次に実施し、PCR増幅方法の結果を評価した。これに関連して、1%アガロースゲルを調製した。臭化エチジウムを加えて0.5μg/mLの最終濃度にした(5mg/mLのストックの場合、100mLのアガロース混合物中に10μg)。表VIIに示したスケジュールに従って40ml量のゲルを注ぎ、90Vで1時間、1×TBE中で運転した。
【0085】
【表7】

【0086】
ゲル実験の結果は、図4に示されていてPCR法が成功したことを指し示しており、それによって溶解性フィルムの存在が、阻害物質として作用しなかったことまたはPCR法を中断させなかったことを示している。図4に示されているように、30mm2までの大きさの溶解性フィルムの存在は、PCR法を阻害しない。
【実施例4】
【0087】
DNA標的、すなわちクラミジアトラコマチス(CT)または淋菌(GC)の標的配列を増幅および検出する方法に溶解性フィルムを組み込むことの実施可能性を判断するために下記のようにして実験を行った。
【0088】
CT/GC Diplex SDAアッセイに対する標的としてはCT/GC陽性対照管を用いた。CT/GC陽性対照管は、CT/GC陽性対照プラスミド、サケ精子のDNA、およびドライダウンした対照希釈剤を含んだ。CT/GC陰性対照管も、サケ精子のDNA、およびドライダウンした対照希釈剤を含むものを用いた。各CT/GC対照管は、2mlの試料希釈剤により再水和し、ボルテックスした。
【0089】
すべての対照管を114℃で30分間加熱溶解した。各対照管は、次いでテスト前の少なくとも15分間、放冷した。
【0090】
この実験で用いた溶解性フィルムは、透明なカルボキシメチルセルロース(酸化鉄なし)である。そのフィルムを異なる大きさのセグメントに切断し、SDAプライマーCTpB4.S2.3、CTpB4.S1.3、またはGCINT3.APRl、GCINT3.APL2、アダプターICAdpt.10、GCINT3.R2、またはCTAdpt−F5、バンパーGCINT3.BR3、GCINT3.BL2、CTpB4.BまたはCTpB4.B7およびレポータープローブMPC−DR、MPC3.FD、またはMPC−FDを含有するCT/GCプライミングマイクロウェル中に配置した。
【0091】
陽性および陰性対照をそれぞれのCT/GCプライミングマイクロウェルごとに加えた。そのCT/GCプライミングマイクロウェルを、次いで72〜73℃に10分間加熱した。その混合物の100μlを、次に53.5〜54.5℃のCT/GC増幅マイクロウェルに加えた。
【0092】
その増幅マイクロウェルを、次にBD ProbeTec(商標)モデル1334読み取り機に加え、そこで51.2〜52.8℃で60分間、等温増幅反応を行った。増幅方法は、探知したレポーターの変換に伴う蛍光の増加を観察することによって監視された。その読み取り機は、増幅方法中の上記の基準値の検出に基づいてMOTA値を生み出す。これらの値は、増幅を開始してから3〜7分後に測定を開始する。上記の試料に対してもたらされたMOTA値を、以下の表VIII(CT)および表IX(GC)に記載する。
【0093】
【表8】

【0094】
【表9】

【0095】
上に示されているデータは、溶解性フィルムを直接Diplex SDA反応で使用することの実施可能性を明らかにしている。SDA増幅マイクロウェル中にフィルムを直接挿入しても反応は阻害されない。
【実施例5】
【0096】
溶解性フィルムが抽出処置を妨害するかどうかを判定するために実験を行った。抽出対照(EC)は、抽出混合物を含む標識オリゴヌクレオチドである。抽出方法が成功するかどうかを判定するためにその標識の蛍光を監視する。2つの溶解性フィルム(酸化鉄を含有する)および2種類の酸化鉄粒子について、抽出方法におけるそれらの効果があるか否かの測定するテストをした。
【0097】
磁気反応性粒子を含む抽出管の形態の容器を以下の方法により準備した。(1)約9mgの鉄粒子(粒子試料Aまたは粒子試料B)を抽出管内に分配するか、または(2)溶解性フィルム(フィルム試料Aまたはフィルム試料B)に9.9mg/1.77cm2の濃度で鉄粒子を充填した。陽性対照管には、蛍光標識した抽出対照のオリゴヌクレオチドを含ませ、一方、陰性対照には、抽出対照を含有させなかった。抽出方法のその他は実施例1で記載したようにして完了させた。標識されたECオリゴヌクレオチドの蛍光を次に測定し、抽出が成功したかどうかを判定した。試料に対して増幅工程は実施しなかった。
【0098】
抽出の結果を、表X(CT)およびXI(GC)に示す。これらの表は、陽性の結果に対して0.5の値を用いるEC測定基準を表示している。0.5より低い値は、陰性の結果としてみなす。
【0099】
【表10】

【0100】
【表11】

【0101】
データを、溶解性フィルムに埋め込むか遊離した鉄粒子のどちらの場合においても、鉄粒子が組み込まれた抽出対照を抽出する能力に対して悪影響はないことを示している。すべての溶解性フィルム試料に対して陽性の平均値(0.7および0.8)が記録されたことは、抽出方法がうまくいくことを示している。
【実施例6】
【0102】
異なる種類の試料中の標的検体を検出する方法に溶解性フィルムを組み込むことの実現可能性を判断するために実験を行った。特に、CTまたはGCに対するアッセイを下記のようにして行った。溶解性フィルムの影響の解析を行った。
【0103】
本アッセイにおいては4種類の試料、尿、試料希釈剤、臨床尿、膣スワブを用いた。「尿」試料は、健康なドナーから採取した組織内試料プールである。「試料希釈剤」とは、スワブを発現する対照管ならびに基質を再水和するために使用する現下のBD ProbeTec(商標)試料バッファーを指す。「臨床尿」とは、健康状態または病気の診断を受けた人から得た尿検体を指す。抽出管に、酸化鉄粒子をそれぞれ9.7mg/1.77cm2および10.6mg/cm2の濃度で充填した2種類の溶解性フィルム(試料フィルムAおよび試料フィルムB)のうちの1の形態で磁気反応性粒子を供給した。試料は、実施例1に記したようにして抽出および増幅をした。上記の試料に対して生じたMOTA値を、以下の表XIIおよびXIIIに記す。
【0104】
【表12】

【0105】
【表13】

【0106】
上記のデータは、いずれの種類の溶解性フィルムを包含しても、標的配列の抽出または増幅を顕著に阻害することは4つの試料の種類のいずれにおいてもなかったことを示している。
【実施例7】
【0107】
鉄粉末または溶解性フィルムの形態の磁気反応性粒子が、標的検体を検出する方法において妨害するかどうかを判断するために実験を行った。実験は、SDAモノプレックス系およびダイプレックス系の両方の溶解性フィルムの影響を評価した。特に下記のようにして、試料希釈剤および尿プール試料を用いるCTに対するアッセイを行った。
【0108】
モノプレックスアッセイにおいては、標的のリアルタイム蛍光エネルギー伝達の検出のために万能型検出プローブを用いた。ダイプレックスアッセイは、その検出プローブに加えて内部増幅対照(IAC)を用いる。このIACは、SDA反応の阻害物質を含有することもあり得る試料を識別するために標的DNAと一緒に増幅させた。
【0109】
本実施例においては、抽出管に、遊離型の鉄粉末または鉄粒子を約9.0mg/1.77cm2の濃度で充填した溶解性フィルムの形態の鉄粒子を供給した。その試料は、実施例1で前掲したようにして抽出および増幅をした。結果を表XIVおよびXVに示す。これらの表は、「PAT」値を示している。「PAT」とは、閾値後のパス(Passes After Threshold)、すなわち陽性試料を判断するのに使用するアルゴリズムを指す。信号は予め定められた閾値に調節されるが、そのとき、BD ProbeTec(商標)が実行するパスの数を差し引きする。より高い最終のPAT値は、試料が、より低い値の試料よりも速い速度で陽性の結果をもたらす閾値に到達したことを示す。ゼロに等しいPATは、陰性と考えられる。したがって、ゼロより大きい値は、陽性の結果を示す。
【0110】
【表14】

【0111】
【表15】

【0112】
表XIVおよびXVに示したデータは、溶解性フィルムが、遊離型の粉末と同様にモノプレックスアッセイおよびダイプレックスアッセイの両方で機能したことを示している。陽性のPAT値は、両方のアッセイにおいて標的の増幅が成功することを示している。
【実施例8】
【0113】
酸化鉄を組み込んだ溶解性フィルムの溶解を確実にするBD Viper(商標)自動抽出装置の最適な混合パラメータを決定するために実験を行った。この実験は、鉄粒子によって結合および捕捉されるのに十分な時間を標的DNAに与える。この実験により、BD Viper(商標)器具についての多数の混合パラメータを評価した。
【0114】
本実験についての抽出手順は、実施例1で記載したのと同じものに以下の修正を付け足したものである。表XVIに記載の8個の異なる試料の条件をテストした。各条件用に6つの二重管を準備した。抽出管には、鉄粒子を9.8mg/1.77cm2の濃度で含有する溶解性フィルムを供給した。次に、試料希釈剤を抽出管に加え、特定の容積およびスピードで混合した。この実験は、このBD Viper(商標)プログラム中の20秒の中断を削除して行った。対照の抽出管は、KOHにさらし、5回混合した。その管を次に溶解させるために20秒間インキュベートした。インキュベート後に、3.75Mの硫酸および抽出対照を含有する結合酸混合物との1の混合工程を続けた。その後の試験条件においては、KOHの混合および溶解のための中断は取り除いた。混合スピードおよび混合の繰返しの数もまた表XVIに示したように変化させた。BD Viper(商標)器具の試料チップ内の流動体の色を視覚的に記録した。酸化鉄粉末は黒であり、試料希釈剤は透明である。それ故、試料チップの流動体が完全に黒のときは完全な混合を示し、容認することができる混合結果が得られたことになる。チップ内で得られた色を、次のようにランク付けした:(0)=劣る、(1)=中程度、(2)=良好、(3)=非常に良好
【0115】
【表16】

【0116】
上の実験により、条件#8(438μlの混合容積で15回の混合回数の後、700μlの混合容積で10回の混合回数)が溶解性フィルムの完全な溶解に対して理想的であるものと判定した。この条件は、目視検査で「非常に良好」の結果を与えた。
【実施例9】
【0117】
実施例8で記載した最適化パラメータをテストするために実験を行った。特に、下記のようにCTアッセイを行った。
【0118】
抽出管に、鉄粉末(試料粉末Aまたは試料粉末B)または鉄粒子を充填した溶解性フィルムのいずれかを供給した。その抽出管に膣スワブを加えた。その試料を実施例8で概説したように混合し(438μlの混合容積で15回の混合回数の後、700μlの混合容積で10回の混合回数)、実施例1で記載したようにして増幅した。結果を表XVIIに示し、PACスコアとして表示した。
【0119】
【表17】

【0120】
上のデータは、実施例8で決定した最適化混合パラメータにより、標的およびIACの両方に対して陽性(>0)のPATスコアが示されているように、抽出および増幅反応の成功がもたらされたことを示している。
【実施例10】
【0121】
1カ月にわたるさまざまな温度における溶解性フィルムの安定性をテストするために実験を行った。フィルムを3つの一貫した温度範囲(2〜8℃、15℃および33℃)のうちの1種で1カ月間保存した。試薬を貯蔵庫から取り出し、周囲温度で抽出/増幅反応をテストした。表XVIII〜XXIIIは、各温度範囲で貯蔵した試薬について行ったCTおよびGCアッセイの結果を示す。実験は、実施例1で前記したようにして行った。陽性(標的)の値は、増幅したCT標的を示す。陰性(IAC)の値は、内部増幅対照の蛍光を示す。データは、PATスコアとして記録されている。
【0122】
【表18】

【0123】
【表19】

【0124】
【表20】

【0125】
【表21】

【0126】
【表22】

【0127】
【表23】

【0128】
表XVIIIからXXIIIに含まれているデータは、溶解性フィルムの2〜8℃、15℃および33℃での1カ月の保存後の増幅反応が成功したことを示している。
【符号の説明】
【0129】
10 容器
20 開口部
30、30’ 物質
40、40’ フィルム
60 材料または混合物
70 第2物質
80 磁石
【特許請求の範囲】
【請求項1】
(i)容器を準備する工程、
(ii)該容器に第1物質を導入する工程、および
(iii)容易に溶解するフィルムを容器内の第1物質の上に重ねて、該フィルムの下から第1物質が転置することを実質的に防ぐように該フィルムを該容器に導入する工程を含む、第1物質を容器に導入する方法であって、
容易に溶解するフィルムが、容器内の物質に溶解し、
第1物質が、磁気反応性粒子を含む
ことを特徴とする方法。
【請求項2】
フィルムは、平面、中実多角形、中空多角形、球形、立方体、楕円形、カプセル型、錠剤型、および矩形体の少なくとも1種を含む形を有することを特徴とする請求項1に記載の方法。
【請求項3】
フィルムは、ヒドロキシアルキルメチルセルロース、カルボキシメチルセルロース、カルボン酸ヒドロキシアルキルエステルモノマー、エトキシル化ヒドロキシアルキル(メタ)アクリレート、プロポキシル化ヒドロキシアルキル(メタ)アクリレート、ポリエチレングリコール(PEG)、ポリビニルアルコール(PVA)、およびそれらの組合せの少なくとも1種を含む材料から形成されていることを特徴とする請求項1に記載の方法。
【請求項4】
フィルムは、香料を含むことを特徴とする請求項1に記載の方法。
【請求項5】
第1物質は、溶解剤、タンパク質変性剤、非プロトン性溶媒、アルカリ化剤、中和緩衝液、塩、金属、酵素、オリゴヌクレオチド、プライマー、核酸、タンパク質、安定化成分、媒体成分、およびそれらの組合せの少なくとも1種を含むことを特徴とする請求項1に記載の方法。
【請求項6】
磁気反応性粒子は、酸化鉄、水酸化第二鉄、四酸化三鉄、硫化鉄、および塩化鉄の少なくとも1種を含むことを特徴とする請求項1に記載の方法。
【請求項7】
第1物質は、シリカ、シリカ被覆粒子、シリカ被覆膜、シリカゲル、水和およびヒドロキシル化シリカ表面、ガラス粉末、ガラス繊維マット、ガラス膜、ゼオライト、セラミック、金属酸化物または金属塩を被覆したポリマー粒子、およびそれらの組合せの少なくとも1種を含むことを特徴とする請求項1に記載の方法。
【請求項8】
容器は、開管、底を有する閉管、マイクロウェル、マイクロウェルのアレイ、ビン、およびペトリ皿の少なくとも1種を含むことを特徴とする請求項1に記載の方法。
【請求項9】
容器は、底を含み、工程(ii)は、第1物質を容器の底に位置付ける工程をさらに含むことを特徴とする請求項1に記載の方法。
【請求項10】
工程(iii)は、フィルムを容器の開口部の上に配置する工程、そのフィルムを移動できるプランジャーで係合する工程、および容器に対して第1の長軸方向にプランジャーを動かすことによって開口部を通してフィルムを容器中に押し込む工程をさらに含むことを特徴とする請求項9に記載の方法。
【請求項11】
フィルムは、容器の開口部に及ぶ大きさのセグメントの形態であることを特徴とする請求項10に記載の方法。
【請求項12】
フィルムは、連続したウェブまたはロールの形態をしており、工程(iii)は、そのフィルムを容器の開口部の上に供給する工程、および容器に導入する際にそのロールからそのフィルム部分を切断する工程をさらに含むことを特徴とする請求項10に記載の方法。
【請求項13】
工程(iii)は、フィルムを容器の開口部上に配置する工程、およびそのフィルムを重力送りにより容器中に導入する工程をさらに含むことを特徴とする請求項9に記載の方法。
【請求項14】
工程(iii)は、フィルムを容器の開口部の上に配置する工程、およびそのフィルムを加圧または減圧の少なくとも1により容器中に導入する工程をさらに含むことを特徴とする請求項9に記載の方法。
【請求項15】
(iv)第2物質を容器に加える工程
をさらに含むことを特徴とする請求項1に記載の方法。
【請求項16】
第2物質は、細胞、微生物、核酸、タンパク質、脂質、炭水化物、およびそれらの組合せの少なくとも1種を含むことを特徴とする請求項15に記載の方法。
【請求項17】
工程(iv)は、材料または混合物を容器に導入する工程を含み、その材料または混合物は、第2物質を含むことを特徴とする請求項16に記載の方法。
【請求項18】
材料または混合物は、生物試料を含むことを特徴とする請求項17に記載の方法。
【請求項19】
生物試料は、尿、臨床尿、膣スワブ、およびそれらの組合せの少なくとも1種を含むことを特徴とする請求項18に記載の方法。
【請求項20】
(v)フィルムを溶解する工程、および
(vi)第1および第2物質を含む混合物を作り出す工程
をさらに含むことを特徴とする請求項18に記載の方法。
【請求項21】
(vii)第1物質と第2物質とを互いに結合させ、それによって複合体を形成する工程、
(viii)容器に磁場を加え、それによって複合体を容器の所定の領域に引き寄せる工程、
(ix)生物試料の少なくとも一部を容器から取り除く工程、
(x)磁場を容器から取り除く工程、
(xi)第1物質と第2物質とを互いから引き離す工程、
(xii)磁場を容器に再び加え、それによって、第1物質を容器の所定の領域に引き寄せる工程、および
(xiii)第2物質を容器から取り除く工程
をさらに含むことを特徴とする請求項20に記載の方法。
【請求項22】
(ix)第2物質に増幅処置を施す工程、および
(x)第2物質中の標的検体の存在および/または濃度を検出するアッセイを実施する工程
の少なくとも1種をさらに含むことを特徴とする請求項21に記載の方法。
【請求項23】
工程(i)から(x)の少なくとも1種を、自動化ロボット装置により実施することを特徴とする請求項22に記載の方法。
【請求項24】
i)容器、
ii)該容器中の第1物質、および
iii)該容器中にあって該第1物質にかぶせてある容易に溶解するフィルム
を含むキットであって、
第1物質が、磁気反応性粒子を含むことを特徴とするキット。
【請求項1】
(i)容器を準備する工程、
(ii)該容器に第1物質を導入する工程、および
(iii)容易に溶解するフィルムを容器内の第1物質の上に重ねて、該フィルムの下から第1物質が転置することを実質的に防ぐように該フィルムを該容器に導入する工程を含む、第1物質を容器に導入する方法であって、
容易に溶解するフィルムが、容器内の物質に溶解し、
第1物質が、磁気反応性粒子を含む
ことを特徴とする方法。
【請求項2】
フィルムは、平面、中実多角形、中空多角形、球形、立方体、楕円形、カプセル型、錠剤型、および矩形体の少なくとも1種を含む形を有することを特徴とする請求項1に記載の方法。
【請求項3】
フィルムは、ヒドロキシアルキルメチルセルロース、カルボキシメチルセルロース、カルボン酸ヒドロキシアルキルエステルモノマー、エトキシル化ヒドロキシアルキル(メタ)アクリレート、プロポキシル化ヒドロキシアルキル(メタ)アクリレート、ポリエチレングリコール(PEG)、ポリビニルアルコール(PVA)、およびそれらの組合せの少なくとも1種を含む材料から形成されていることを特徴とする請求項1に記載の方法。
【請求項4】
フィルムは、香料を含むことを特徴とする請求項1に記載の方法。
【請求項5】
第1物質は、溶解剤、タンパク質変性剤、非プロトン性溶媒、アルカリ化剤、中和緩衝液、塩、金属、酵素、オリゴヌクレオチド、プライマー、核酸、タンパク質、安定化成分、媒体成分、およびそれらの組合せの少なくとも1種を含むことを特徴とする請求項1に記載の方法。
【請求項6】
磁気反応性粒子は、酸化鉄、水酸化第二鉄、四酸化三鉄、硫化鉄、および塩化鉄の少なくとも1種を含むことを特徴とする請求項1に記載の方法。
【請求項7】
第1物質は、シリカ、シリカ被覆粒子、シリカ被覆膜、シリカゲル、水和およびヒドロキシル化シリカ表面、ガラス粉末、ガラス繊維マット、ガラス膜、ゼオライト、セラミック、金属酸化物または金属塩を被覆したポリマー粒子、およびそれらの組合せの少なくとも1種を含むことを特徴とする請求項1に記載の方法。
【請求項8】
容器は、開管、底を有する閉管、マイクロウェル、マイクロウェルのアレイ、ビン、およびペトリ皿の少なくとも1種を含むことを特徴とする請求項1に記載の方法。
【請求項9】
容器は、底を含み、工程(ii)は、第1物質を容器の底に位置付ける工程をさらに含むことを特徴とする請求項1に記載の方法。
【請求項10】
工程(iii)は、フィルムを容器の開口部の上に配置する工程、そのフィルムを移動できるプランジャーで係合する工程、および容器に対して第1の長軸方向にプランジャーを動かすことによって開口部を通してフィルムを容器中に押し込む工程をさらに含むことを特徴とする請求項9に記載の方法。
【請求項11】
フィルムは、容器の開口部に及ぶ大きさのセグメントの形態であることを特徴とする請求項10に記載の方法。
【請求項12】
フィルムは、連続したウェブまたはロールの形態をしており、工程(iii)は、そのフィルムを容器の開口部の上に供給する工程、および容器に導入する際にそのロールからそのフィルム部分を切断する工程をさらに含むことを特徴とする請求項10に記載の方法。
【請求項13】
工程(iii)は、フィルムを容器の開口部上に配置する工程、およびそのフィルムを重力送りにより容器中に導入する工程をさらに含むことを特徴とする請求項9に記載の方法。
【請求項14】
工程(iii)は、フィルムを容器の開口部の上に配置する工程、およびそのフィルムを加圧または減圧の少なくとも1により容器中に導入する工程をさらに含むことを特徴とする請求項9に記載の方法。
【請求項15】
(iv)第2物質を容器に加える工程
をさらに含むことを特徴とする請求項1に記載の方法。
【請求項16】
第2物質は、細胞、微生物、核酸、タンパク質、脂質、炭水化物、およびそれらの組合せの少なくとも1種を含むことを特徴とする請求項15に記載の方法。
【請求項17】
工程(iv)は、材料または混合物を容器に導入する工程を含み、その材料または混合物は、第2物質を含むことを特徴とする請求項16に記載の方法。
【請求項18】
材料または混合物は、生物試料を含むことを特徴とする請求項17に記載の方法。
【請求項19】
生物試料は、尿、臨床尿、膣スワブ、およびそれらの組合せの少なくとも1種を含むことを特徴とする請求項18に記載の方法。
【請求項20】
(v)フィルムを溶解する工程、および
(vi)第1および第2物質を含む混合物を作り出す工程
をさらに含むことを特徴とする請求項18に記載の方法。
【請求項21】
(vii)第1物質と第2物質とを互いに結合させ、それによって複合体を形成する工程、
(viii)容器に磁場を加え、それによって複合体を容器の所定の領域に引き寄せる工程、
(ix)生物試料の少なくとも一部を容器から取り除く工程、
(x)磁場を容器から取り除く工程、
(xi)第1物質と第2物質とを互いから引き離す工程、
(xii)磁場を容器に再び加え、それによって、第1物質を容器の所定の領域に引き寄せる工程、および
(xiii)第2物質を容器から取り除く工程
をさらに含むことを特徴とする請求項20に記載の方法。
【請求項22】
(ix)第2物質に増幅処置を施す工程、および
(x)第2物質中の標的検体の存在および/または濃度を検出するアッセイを実施する工程
の少なくとも1種をさらに含むことを特徴とする請求項21に記載の方法。
【請求項23】
工程(i)から(x)の少なくとも1種を、自動化ロボット装置により実施することを特徴とする請求項22に記載の方法。
【請求項24】
i)容器、
ii)該容器中の第1物質、および
iii)該容器中にあって該第1物質にかぶせてある容易に溶解するフィルム
を含むキットであって、
第1物質が、磁気反応性粒子を含むことを特徴とするキット。
【図1】


【図2】


【図3】


【図4】




【図2】


【図3】


【図4】


【公開番号】特開2012−108149(P2012−108149A)
【公開日】平成24年6月7日(2012.6.7)
【国際特許分類】
【出願番号】特願2012−21872(P2012−21872)
【出願日】平成24年2月3日(2012.2.3)
【分割の表示】特願2007−519383(P2007−519383)の分割
【原出願日】平成17年6月27日(2005.6.27)
【出願人】(595117091)ベクトン・ディキンソン・アンド・カンパニー (539)
【氏名又は名称原語表記】BECTON, DICKINSON AND COMPANY
【住所又は居所原語表記】1 BECTON DRIVE, FRANKLIN LAKES, NEW JERSEY 07417−1880, UNITED STATES OF AMERICA
【Fターム(参考)】
【公開日】平成24年6月7日(2012.6.7)
【国際特許分類】
【出願日】平成24年2月3日(2012.2.3)
【分割の表示】特願2007−519383(P2007−519383)の分割
【原出願日】平成17年6月27日(2005.6.27)
【出願人】(595117091)ベクトン・ディキンソン・アンド・カンパニー (539)
【氏名又は名称原語表記】BECTON, DICKINSON AND COMPANY
【住所又は居所原語表記】1 BECTON DRIVE, FRANKLIN LAKES, NEW JERSEY 07417−1880, UNITED STATES OF AMERICA
【Fターム(参考)】
[ Back to top ]

