炎症性疾患、自己免疫疾患及び循環器疾患におけるエオタキシン−2(CCL24)阻害剤
本発明は、ポリクローナル抗体又はモノクローナル抗体によるエオタキシン−2の阻害が、たとえば、関節リウマチ、実験的自己免疫脳脊髄炎(EAE)、大腸炎、糖尿病、及びアテローム性動脈硬化症のような炎症性疾患の動物モデルで有意な予防効果を有するという知見に基づく。従って、本発明は、炎症性疾患、自己免疫疾患及び循環器疾患の治療において単独で使用する、又はそのほかの治療剤との併用で使用するための特異的抗エオタキシン−2抗体を含む医薬組成物を提供する。本発明はまた、特異的抗エオタキシン−2モノクローナル抗体及び本発明の抗体を利用した治療方法も提供する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、炎症性疾患、自己免疫疾患及び循環器疾患の治療におけるエオタキシン−2(CCL24)の阻害剤の使用、特に抗エオタキシン−2ポリクローナル抗体又はモノクローナル抗体に関する。
【背景技術】
【0002】
ケモカインは、白血球の化学誘引物質として作用し、これら細胞の恒常的な輸送と共に、炎症部位への特異的な細胞集団の動員の双方を調節する小型サイトカインである。ケモカインの調節不全は、炎症及び自己免疫を含む免疫系に関与する広範なヒトの疾患で役割を担うと考えられる(1)。
【0003】
ヒトのエオタキシンファミリーには、CCケモカインファミリーに属する3つの既知のサイトカインが含まれる。
【0004】
エオタキシン1(好酸球走化性タンパク質1;エオタキシン又はケモカイン(C−Cモチーフ)リガンド11(CCL11)とも呼ばれる)は、その走化性を誘導することによって好酸球を選択的に動員することが知られているので、アレルギー反応に関係するとみなされている。
【0005】
エオタキシン2(好酸球走化性タンパク質2;ケモカイン(C−Cモチーフ)リガンド24(CCL24)、骨髄性前駆細胞阻害因子2(MPIF−2)とも呼ばれる)は、好酸球(2〜4)、好塩基球(4)、Th2型リンパ球(5)及び好中球を含む炎症性細胞の強力な化学誘引物質である。エオタキシン−2は、種々の型の内皮細胞で発現され(5〜9)、内皮細胞(10)及び平滑筋細胞(11)において血管新生反応及び遊走性反応を誘導する。
【0006】
エオタキシン3(好酸球走化性タンパク質3;ケモカイン(C−Cモチーフ)リガンド26(CCL26)、マクロファージ炎症性タンパク質−4α(MIP−4α)、胸腺間質ケモカイン−1(TSC−1)及びIMAC)は、好酸球と好塩基球に対して走化性である。
【0007】
エオタキシン−2はエオタキシンとたった39%相同であるにすぎず、2つのポリペプチドはNH2−末端領域にてほぼ完全に異なる(12)。エオタキシン−2は染色体7q11.23に局在し、エオタキシンは染色体17q21.1に局在する。エオタキシン−3の遺伝子は、第7染色体上でエオタキシン−2の近くにあるが、それとは33%の相同性を共有するにすぎない。これらのケモカインはCCR3受容体に特異的に結合する。エオタキシンの受容体であるCCR3は、好酸球を始めとして、マクロファージや内皮細胞を含む多種多様な細胞で発現される、7回膜貫通型のGタンパク質共役受容体である(13)。
【0008】
WO97/00960は、ヒトのエオタキシン(CCL11)をコードする核酸、並びに単離された又は組換えのヒトのエオタキシンタンパク質を開示している。WO97/00960はまた、特定部位への好酸球の動員又はアレルギー状態の治療におけるエオタキシンタンパク質の使用方法も開示している。
【0009】
CCR3の発現は元々、喘息及びアレルギーの発病機序で検討され、それは治療目標として役立ち続けている(14)。しかしながら、さらに最近、この経路の役割は、炎症性大腸炎(15)、多発性硬化症(16)及び関節リウマチ(RA)を含むさらなる炎症性疾患及び自己免疫性疾患の研究にて明らかになっている。
【0010】
関節リウマチ(RA)は、広範な炎症性細胞による滑膜組織への激しい破壊的な浸潤を特徴とする一般的な慢性の炎症性疾患である(17)。マクロファージ及び線維芽細胞に由来する複数のサイトカインが(RA)(18) におけるサイトカイン及びケモカイン双方の分泌に関与する。関節腔における白血球の蓄積は、サイトカイン及びマトリクス分解酵素を含む組織分解因子の分泌をもたらす。
【0011】
ケモカインの阻害は、一般に使用されるRAの動物モデルであるアジュバント誘発の関節炎における治療の選択肢として以前検討された(19)。同じモデルを用いて、CCR3は、滑膜組織への白血球の動員で役割を担うことが示された(20)。多数のケモカイン及びサイトカインの受容体の差次的発現もRA患者の血清や滑膜組織で実証された(21)。
【0012】
サイトカインやケモカインが関与する炎症は、アテローム性動脈硬化症のプラーク増殖、及び脱安定化し、その後破裂させる傾向を促進することにおいて極めて重要な役割を担うと考えられている(22,23)。エオタキシン/CCL24の受容体(CCR3)はプラークのマクロファージで発現されている(24)。臨床試験によって、健常人のコホートにてエオタキシン遺伝子の非保存的多型が心筋梗塞の高いリスクを関連していることが明らかにされた(25)。その後の試験で、高いレベルの循環エオタキシンは冠状動脈のアテローム性動脈硬化症と虚血の存在に関連することが見い出された(26,27)。
【0013】
アテローム性動脈硬化症は、脂肪沈着が動脈壁で進行し、管腔の進行性の狭窄をもたらす過程である。成熟したプラークは、2つの基本構造:脂質のコアと線維性のキャップから構成される。脂質のコアが小さければ小さいほど、線維性のキャップは厚く、さらに安定なプラークとなるということは、破裂し、心筋梗塞又は不安定狭心症を起こす傾向が低下することを意味する。急性の冠状動脈症候群(たとえば、心筋梗塞及び不安定狭心症)の原因となるプラークのほとんどが、<70%の狭窄を有することが血管造影で示されることは今や明らかである(28、29にて概説された)。これらの病変のおよそ60%は、大きな血栓形成性の脂質コアと壊死性の残渣(マクロファージ、T細胞、古い出血、血管形成及びカルシウムの病巣を含む)を伴ったプラークの破裂が原因で生じる。おそらく、マクロファージがプラークを移動するにつれてそれを消化するマトリクスメタロプロテイナーゼを分泌し、平滑筋(プラークの要素を支えている)が、たとえば、炎症性サイトカインのような幾つかの因子によって生じる老化又はアポトーシスのために激減するために、破裂したキャップは薄い。
【0014】
WO06/93932は、個体の血清にてエオタキシンのレベルを測定することによってアテローム性動脈硬化症を検出する又は診断する方法を開示している。その出願はさらに、血清における高いレベルのエオタキシンが症状の発症前にアテローム性動脈硬化症を診断する手段を提供する可能性があることを示唆している。
【0015】
上記の出版物はいずれも、炎症性疾患、自己免疫疾患又は循環器疾患の治療のための治療的介入についての標的としてのエオタキシン−2を教示していないし、示唆もしていない。
【発明の概要】
【発明が解決しようとする課題】
【0016】
本発明は、ポリクローナル抗体又はモノクローナル抗体によるエオタキシン−2の阻害が、たとえば、関節リウマチ、実験的自己免疫脳脊髄炎(EAE)、大腸炎、糖尿病及びアテローム性動脈硬化症のような炎症性疾患の動物モデルにおいて十分な予防効果を有するという知見に基づく。理論によって束縛されることを望まないで、予防効果は、少なくとも部分的には、活性のある炎症性細胞(リンパ球及び単核細胞)の接着性及び遊走性の減衰が介在し得た。従って、本発明は、炎症性疾患及び/又は自己免疫疾患を治療するための治療剤を開発するための新規標的としてエオタキシン−2を導入する。本発明はまた、そのような疾患の治療において単独で使用するための又はほかの治療剤と併用するための特異的な抗エオタキシン−2抗体を提供する。
【0017】
炎症性疾患及び/又は自己免疫疾患には、たとえば、乾癬、炎症性大腸疾患(IBD)、(潰瘍性大腸炎及びクローン病を含む)、関節リウマチ、糖尿病、多発性硬化症、全身性エリテマトーデス(SLE)、強皮症及び天疱瘡が挙げられる。
【課題を解決するための手段】
【0018】
従って、その態様の第1によって、本発明は、少なくとも1つのエオタキシン−2拮抗物質と薬学上許容可能なキャリア又は賦形剤を含む、炎症性疾患、自己免疫疾患又は循環器疾患を治療するための医薬組成物を提供する。
【0019】
一実施形態では、上記エオタキシン−2拮抗物質は、抗エオタキシン−2抗体又は該抗体の結合活性を保持するその断片である。
【0020】
抗エオタキシン−2抗体は、モノクローナル抗体であってもポリクローナル抗体であってもよい。特定の実施形態では、抗エオタキシン−2抗体は、ヒト型抗体、ヒト化抗体又はキメラ抗体である。
【0021】
特定の実施形態では、抗エオタキシン−2抗体は、ハイブリドーマD8(ECACC受入番号D809081702)、ハイブリドーマG7又はハイブリドーマG8(ECACC受入番号G80908170)によって分泌されるモノクローナル抗体又は該抗体の結合活性を保持するその断片である。
【0022】
特定の特別な実施形態では、上記抗エオタキシン−2抗体は、
(a)配列番号1と少なくとも90%の相同性を有する核酸によってコードされる重鎖と配列番号2と少なくとも90%の相同性を有する核酸によってコードされる軽鎖を含むモノクローナル抗体;
(b)配列番号3と少なくとも90%の相同性を有する核酸によってコードされる重鎖と配列番号4と少なくとも90%の相同性を有する核酸によってコードされる軽鎖を含むモノクローナル抗体;
(c)配列番号5と少なくとも90%の相同性を有する核酸によってコードされる重鎖と配列番号6と少なくとも90%の相同性を有する核酸によってコードされる軽鎖を含むモノクローナル抗体;
(d)ハイブリドーマD8(ECACC受入番号D809081702)、ハイブリドーマG7又はハイブリドーマG8(ECACC受入番号G80908170)によって分泌されるモノクローナル抗体の重鎖をコードする核酸と少なくとも90%の相同性を有する核酸によってコードされる重鎖と、ハイブリドーマD8(ECACC受入番号D809081702)、ハイブリドーマG7又はハイブリドーマG8(ECACC受入番号G80908170)によって分泌されるモノクローナル抗体の軽鎖をコードする核酸と少なくとも90%の相同性を有する核酸によってコードされる軽鎖を含むモノクローナル抗体;及び
(e)該抗体の結合活性を保持する(a)〜(d)の抗体の断片
から成る群から選択されるモノクローナル抗体である。
【0023】
別の実施形態では、エオタキシン−2拮抗物質は、エオタキシン−2のmRNAに対して向けられたアンチセンス分子又はsiRNA分子である。
【0024】
別の実施形態では、エオタキシン−2拮抗物質は、小分子化合物である。
【0025】
特定の実施形態では、上記の炎症性疾患、自己免疫疾患又は循環器疾患は、アテローム性動脈硬化症、関節リウマチ、炎症性大腸疾患、多発性硬化症及び糖尿病から成る群から選択される。
【0026】
別の態様によって、本発明は、治療上有効な量の本発明のエオタキシン−2拮抗物質又は医薬組成物をそれが必要な患者に投与することを含む、炎症性疾患又は自己免疫疾患を治療する方法を提供する。
【0027】
本発明の特定の実施形態によれば、上記自己免疫疾患は、関節リウマチ、炎症性大腸疾患(たとえば、大腸炎)、多発性硬化症及び糖尿病から成る群から選択される。
【0028】
さらに別の態様によって、本発明は、治療上有効な量の本発明のエオタキシン−2拮抗物質又は医薬組成物をそれが必要な患者に投与することを含む、アテローム硬化性プラーク形成を阻害する方法を提供する。
【0029】
本発明は、治療上有効な量の本発明のエオタキシン−2拮抗物質又は医薬組成物をそれが必要な患者に投与することを含む、アテローム硬化性プラークを安定化させる方法を提供する。
【0030】
本発明は、治療上有効な量の本発明のエオタキシン−2拮抗物質又は医薬組成物を上記患者に投与することを含む、急性冠状動脈症候群の患者において主要な心血管系事象を予防する方法を提供する。
【0031】
本発明の方法はまた、少なくとも1つの追加の治療剤との併用で上記エオタキシン−2拮抗物質又は上記医薬組成物を投与することも包含する。
【0032】
特定の実施形態によれば、上記少なくとも1つの追加の治療剤は、化学療法剤、サイトカイン、ペプチド、抗体及び抗生剤から成る群から選択される。
【0033】
関節リウマチの治療については、上記追加の治療剤には、メソトレキセート、ステロイド、抗TNFα抗体、抗TNF受容体抗体、抗IL−6受容体抗体又は抗CD20抗体が挙げられるが、これらに限定されない。
【0034】
IBD(炎症性大腸疾患)の治療については、上記追加の治療剤には、シクロスポリン、NSAIDS(非ステロイド性抗炎症剤)、ステロイド又は抗TNF抗体(たとえば、インフリキシマブ)が挙げられるが、これらに限定されない。
【0035】
多発性硬化症の治療については、上記追加の治療剤には、コパキソン、インターフェロン−β、静脈内免疫グロブリン(IVIG)又はVLA−4に対するモノクローナル抗体(たとえば、チサブリ)が挙げられるが、これらに限定されない。
【0036】
本発明の一実施形態によれば、上記少なくとも1つの追加の治療剤は、エオタキシン−2拮抗物質又は上記医薬組成物と同時に投与される。
【0037】
本発明の別の実施形態によれば、上記少なくとも1つの追加の治療剤と上記エオタキシン−2拮抗物質又は上記医薬組成物は順次投与される。
【0038】
別の態様では、本発明は、抗エオタキシン−2モノクローナル抗体を分泌するハイブリドーマ細胞株を提供するが、上記ハイブリドーマは、D8(ECACC受入番号D809081702)、G7又はG8(ECACC受入番号G809081701)から成る群から選択される。
【0039】
本発明はまた、エオタキシン−2に向けられたモノクローナル抗体又はエオタキシン−2への結合活性を保持するその断片も提供するが、上記モノクローナル抗体は、ハイブリドーマD8(ECACC受入番号D809081702)、G7又はG8(ECACC受入番号G809081701)から分泌される。
【0040】
特定の実施形態では、本発明は、エオタキシン−2に向けられたモノクローナル抗体を提供するが、上記抗体は、
(a)配列番号1と少なくとも90%の相同性を有する核酸によってコードされる重鎖と配列番号2と少なくとも90%の相同性を有する核酸によってコードされる軽鎖を含むモノクローナル抗体;
(b)配列番号3と少なくとも90%の相同性を有する核酸によってコードされる重鎖と配列番号4と少なくとも90%の相同性を有する核酸によってコードされる軽鎖を含むモノクローナル抗体;
(c)配列番号5と少なくとも90%の相同性を有する核酸によってコードされる重鎖と配列番号6と少なくとも90%の相同性を有する核酸によってコードされる軽鎖を含むモノクローナル抗体;
(d)ハイブリドーマD8(ECACC受入番号D809081702)、G7又はG8(ECACC受入番号G809081701)によって分泌される抗体の重鎖をコードする核酸と少なくとも90%の相同性を有する核酸によってコードされる重鎖と、ハイブリドーマD8(ECACC受入番号D809081702)、G7又はG8(ECACC受入番号G809081701)によって分泌される抗体の軽鎖をコードする核酸と少なくとも90%の相同性を有する核酸によってコードされる軽鎖を含むモノクローナル抗体;及び
(e)該抗体の結合活性を保持する(a)〜(d)の抗体の断片
から成る群から選択されるモノクローナル抗体である。
【0041】
本発明はさらに、本発明のモノクローナル抗体又はその抗原結合部分をコードする単離された核酸分子に関すると共に、核酸分子を含む発現ベクターと該発現ベクターを含む宿主細胞に関する。
【0042】
特定の実施形態では、発現ベクターは、原核細胞株又は真核細胞株にて複製することが可能である。
【0043】
別の態様では、本発明はまた、炎症性疾患及び自己免疫疾患の治療におけるエオタキシン−2拮抗物質の使用を提供する。一実施形態では、上記エオタキシン−2拮抗物質は抗体である。
【0044】
本発明はまた、炎症性疾患及び自己免疫疾患の治療のための医薬組成物の調製におけるエオタキシン−2拮抗物質の使用も包含する。一実施形態では、上記エオタキシン−2拮抗物質は抗体である。
【図面の簡単な説明】
【0045】
本発明を理解し、それがどのように実践的に実行されてもよいかを理解するために、貼付の図面を参照して、非限定の例示としてのみ、実施形態を説明する。
【図1】エオタキシンと対比したエオタキシン−2への抗エオタキシン−2mAb(D8)の結合を示すグラフである。405nmでの光学密度(OD)の読み取りとして結果を提示する。種々の抗体濃度(5μ/mL〜50μ/mLの間)を測定した。
【図2A】D8で処理した細胞のフィブロネクチンに対する接着のレベルを示すグラフである。マウスIgGで処理した対照細胞と比較した接着比率として結果を示す。3種の細胞、マウス脾細胞、ラット脾細胞及びヒトPBMCを調べた。
【図2B】D8で処理した細胞のVEGFに向かった遊走を示すグラフである。マウスIgG(50μg)で処理した対照細胞と比較した遊走比率として結果を示す。グラフは、種々のD8の量(12.5、25及び50μg)を用いて、ラット脾細胞及びヒトPBMCから得た結果を示す。
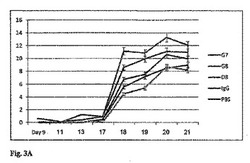
【図3A】疾患の発症からの時間の関数としてのラットの関節炎スコア(AS)に対する抗エオタキシン−2モノクローナル抗体(G7、G8、D8)、IgG及びPBSによる処理の効果(±標準誤差)を示すグラフである。0日目は関節炎を誘発した日である。
【図3B】ラットの遊走スコアに対する抗エオタキシン−2モノクローナル抗体(G7、G8、D8)、IgG及びPBSによる処理の効果(±標準誤差)を示すグラフである。
【図3C】足首の直径(mm)に対する抗エオタキシン−2モノクローナル抗体(G7、G8、D8)、IgG及びPBSによる処理の効果(±標準誤差)を示すグラフである。
【図4A】PBS、IgG、D8、G7及びG8の抗体で処理したラットの関節の組織学的スコアを示すグラフである。
【図4B】D8(図4B)又はPBS(図4C)で処理したラットの関節の代表的な所見を示す写真(ヘマトキシリンエオシン(H&E)染色)である。
【図4C】D8(図4B)又はPBS(図4C)で処理したラットの関節の代表的な所見を示す写真(ヘマトキシリンエオシン(H&E)染色)である。
【図5】アジュバントで誘発した関節炎のラットの体重(グラム)に対する、時間(日)の関数としての、抗エオタキシン−2モノクローナル抗体(G7、G8、D8)、IgG及びPBSによる処理の効果(±標準誤差)を示すグラフである。
【図6A】アジュバントで誘発した関節炎における関節炎スコア(AS;Y軸)に対する、時間(日)の関数としての、3つの用量(20μg、100μg及び1000μg)での予防モードにおける抗エオタキシン−2抗体による処理の効果(±標準誤差、比率)を示すグラフである。
【図6B】アジュバントで誘発した関節炎における関節炎スコア(AS;Y軸)に対する、時間(日)の関数としての、3つの用量(20μg、100μg及び1000μg)での治療モード(関節炎の出現と共に投与)における抗エオタキシン−2抗体による処理の効果(±標準誤差、比率)を示すグラフである。
【図7】時間(日)の関数としての予防モード(±標準誤差)におけるアジュバントで誘発した関節炎の関節炎スコアに対する、PBSで処理した対照と比較した、D8(100μg)、メソトレキセート(0.25mg/kg)、及びD8(100μg)と併用したメソトレキセートの予防効果を示すグラフである。
【図8】PBS(図8A)及びD8(図8B)で処理したラットの関節の死後X線解析の写真である。足首の脱灰と早期の骨侵食(矢印頭)と同様に、強度の関節周囲の軟組織の腫脹が、PBSで処理したラット(星印)で明らかである(代表的な図)。
【図9A】時間(日)の関数としての、DSSで誘発した大腸炎のマウスにおける体重の増減比率を示すグラフである。5μg又は25μgの抗エオタキシン−2抗体D8でマウスを処理した。対照動物は、PBS又はIgGで処理した。
【図9B】DSSで誘発した大腸炎のマウスにおける%MPO活性を示すグラフである。5μg、25μg、100μg又は200μgの抗エオタキシン−2抗体D8でマウスを処理した。対照動物は、PBS又はIgGで処理した。
【図9C】抗エオタキシン−2抗体D8(5μg)又は対照(PBS)で処理した、DSS誘導大腸炎のマウスの血清における種々のサイトカイン(IL−10、IL−12p70、IL−6、MCP−1(単球化学誘引タンパク質−1)、及びTNF)のレベルを示すグラフである。
【図9D】5μg、25μg、100μg又は200μgの抗エオタキシン−2抗体D8で処理したDSS誘発大腸炎のマウスの結腸の組織学的解析のグラフによる表示である。対照動物は、PBS又はIgGで処理した。[I]病変の程度(大きさ)を表し、[II]炎症(炎症性細胞の浸潤)を表し、[III]損傷(組織の破壊)を表す。
【図10】PBS、IgG、抗エオタキシン−2抗体D8(25μg)又は抗エオタキシン−2抗体D8(100μg)のいずれかで処理した、誘発EAEマウスにおける時間の関数としての疾患の重症度の平均を示すグラフである。
【図11A】PBS又は抗エオタキシン−2抗体(D8)のいずれかで処理したNODマウスにおける時間の関数としての疾患の発生率(糖尿病マウスの比率)を示すグラフである。
【図11B】PBS又は抗エオタキシン−2抗体(D8)のいずれかで処理したNODマウスの血清におけるエオタキシン−2のレベル(pg/mL)を示すグラフである。
【図12A】不安定なプラークと対比した安定したプラークにおける炎症性因子の発現の定量的解析を示すグラフである。各群で4つのプラークを解析した。
【図12B】代表的な例を提供する画像である。
【図13】マウスのアテロームにおけるエオタキシン−2の免疫組織化学的な局在を示す画像である。図13Aは、特徴的な脂肪線条(AHA、クラスI〜II)を示し、図13Bは、中間的なプラーク(AHA、クラスII)を示し、図13Cは、アテローム性病変(AHA、クラスIII〜IV)を示し、図13Dは、無関係なIgGで染色された陰性対照を示す。太い矢印はエオタキシン−2陽性の代表的な内皮細胞を示すが、細い矢印はプラークのマクロファージでの各染色を示す。
【図14】図14Aは、若齢又は老齢のKOApoEマウスの大動脈におけるエオタキシン−2とTGFβのmRNAの発現を示すゲルの画像である。図14Bは、oxLDLと共にインキュベートしたマウスH5Vの内皮細胞におけるエオタキシン−2とTGFβのmRNAの発現を示すゲルの画像である。
【図15】図15Aは、内皮への単核細胞(脾細胞)の接着に対するエオタキシン−2の阻止の効果を示すグラフである。図15Bは、本質的に類似のプロトコールにて単球/マクロファージ細胞株で行った代表的な結果を示す。*p<0.05
【図16】図16Aは、抗エオタキシン−2抗体による4週間の処理に反応した病変(プラーク)の大きさを示すグラフである。図16Bは、抗エオタキシン−2抗体による10週間の処理に反応した病変(プラーク)の大きさを示すグラフである。図16Cは、抗エオタキシン−2抗体による10週間の処理に反応した線維領域の比率を示すグラフである。*p<0.01、**p<0.05.
【図17】エオタキシン−2に対する阻止抗体で処理したapoEマウスの代表的な切片の画像である。図17A〜Cは、それぞれ、PBS、対照IgG、エオタキシン−2抗体による処理の脂肪線条病変の代表的なオイルレッド染色を示す。図17D〜Fは、類似のマウス群でのさらに長い処理試験におけるさらに進んだ病変の類似の評価を示す。図17G〜I及びJ〜Lはそれぞれ、PBS、対照IgG、エオタキシン−2抗体による処理のMassonの三色組織化学試験及びvon Giessonの組織化学試験(それぞれ)を示す。
【発明を実施するための形態】
【0046】
本発明は、エオタキシン−2(CCL24)に特異的に結合し、その機能を阻害する抗体に関する。さらに、本発明は、該抗体を含む医薬組成物、並びに炎症性疾患、自己免疫疾患及び循環器疾患の治療のためのそれらの使用に関する。
【0047】
本発明がさらに理解され易いように、詳細な説明の全体にわたって種々の定義が示される。
【0048】
態様の1つに従って、本発明の治療方法は、エオタキシン−2の活性及び/又は発現を低減することができる治療上有効な量のエオタキシン−2拮抗物質をそれが必要な患者に提供することによって達成され、それによって患者において炎症性疾患、自己免疫疾患又はアテローム性動脈硬化症疾患を軽減する。
【0049】
本明細書で使用されるとき、用語「患者」は、哺乳類(たとえば、イヌ、ネコ、ブタ、ウマ、ウシ、又はヒト)のような、本発明から恩恵を受けてもよい対象を指す。特定の一実施形態では、患者はヒトである。
【0050】
本明細書で使用されるとき、用語「治療」は、エオタキシン−2が介在する疾患又は症状の有害な効果を軽減すること、予防すること、治癒させること、覆すこと、減衰すること、緩和すること、できるだけ抑えること、又は止めることを指す。
【0051】
用語「エオタキシン−2」(好酸球走化性タンパク質2)、「CCL24」(ケモカイン(C−Cモチーフ)リガンド24)、又は「MPIF−2」(骨髄性前駆細胞阻害因子2)は相互交換可能に使用され、ヒトCCL24遺伝子によってコードされ、ヒト第7染色体上に局在し、当該技術で既知であるCCケモカインファミリーに属するサイトカインを指す。
【0052】
CCL24は、ケモカイン受容体CCR3と相互作用する。CCL24の活性は、好酸球、好塩基球、T細胞及び好中球における走化性の誘導、並びに内皮細胞及び平滑筋細胞における血管新生反応及び遊走反応の誘導を指す。
【0053】
本明細書で使用されるとき、用語「炎症」は、たとえば、病原体や損傷細胞(たとえば、火傷、外傷、腫瘍が原因となる)のような有害な刺激、又は化学物質、熱若しくは寒冷のような刺激物に対する免疫系の複雑な生物反応を指す。用語「炎症性疾患」は、アテローム性動脈硬化症や種々の自己免疫疾患を含むが、これらに限定されない炎症に関連した疾患を指す。
【0054】
本明細書で使用されるとき、用語「アテローム性動脈硬化症」(アテローム硬化性血管疾患又はASVDとしても知られる)は、コレステロールのような脂肪物質の蓄積の結果、動脈壁が厚くなる病態症状である。この過程は、動脈の壁における慢性の炎症反応の結果であり、大部分は、機能的な高密度リポタンパク質(HDL)によるマクロファージからの脂肪やコレステロールの適当な除去かないままに、マクロファージの蓄積によるものであり、低密度のリポタンパク質によって助長される。動脈のこの硬化又は裏打ちは、動脈内での複数のプラークの形成によって引き起こされる。
【0055】
「アテローム硬化性プラーク」又は「アテローム」は、脂質(コレステロールと脂肪酸)、カルシウム及び種々の量の線維性結合組織を含有する細胞(ほとんどマクロファージ細胞)又は細胞残渣から構成される動脈壁の蓄積及び腫脹である。アテローム及び動脈壁の変化は、管腔径の変化なしで余分な壁の厚さを補填するのにちょうど十分な大きさの小型の動脈瘤(拡張)を普通生じる。成熟プラークは2つの基本構造:脂質コアと線維性のキャップから構成される。脂質コアが小さければ小さいほど、線維性のキャップは厚く、プラークはさらに安定であるということは、破裂し、心筋梗塞や不安定狭心症を起こす傾向が低下することを意味する。急性の冠状動脈症候群(たとえば、心筋梗塞及び不安定狭心症)の原因となるプラークのほとんどが、<70%の狭窄を有することが血管造影で示されることは今や明らかである(28、29にて概説された)。これらの病変のおよそ60%は、大きな血栓形成性の脂質コアと壊死性の残渣(マクロファージ、T細胞、古い出血、血管形成及びカルシウムの病巣を含む)を伴ったプラークの破裂が原因で生じる。
【0056】
本明細書で使用されるとき、用語「循環器疾患」(CVD)は、心臓(心)及び/又は全身性の血管(血管系)を冒し得る疾患を指す。循環器疾患のほとんどは、慢性の症状−長い間にわたって進展している又は持続している症状を反映する。しかしながら、循環器疾患の転帰の一部は、たとえば、心臓又は脳に血液を供給する血管が遮断されるときに突然起きる心臓発作や卒中のような急性の事象であり得る。CVDはまた、アテローム性動脈硬化症、冠状動脈心疾患(CHD)及び冠状動脈疾患(CAD)に関連する疾患−狭心症(不安定狭心症及び初発狭心症を含む)を招き得る心臓に供給する血管の疾患−強い胸部の痛み又は均一な心臓発作−心筋梗塞、及びST−又は非ST−上昇を包含する。
【0057】
本明細書で使用されるとき、用語「自己免疫疾患」は、生体に正常に存在する物質や組織に対する生体の過剰な免疫応答の結果生じる病態を記載する。免疫系は生体の一部を病原体と誤解し、それを攻撃する。これは、特定の臓器に限定されてもよく、又は肺と腎臓の双方にて基底膜を冒し得る、異なった部位における特定の組織を含んでもよい。たとえば、関節リウマチ、多発性硬化症及び大腸炎のような例となる疾患の少なくともすべてを含む自己免疫疾患の例、並びに顕著な例には、とりわけ、セリアック病、1型糖尿病(IDDM)、全身性エリテマトーデス(SLE)、シューグレン症候群、チャーグ・ストラウス症候群、橋本病、グラーベ病、乾癬、炎症性大腸疾患(潰瘍性大腸炎及びクローン病)、強皮症及び天疱瘡が挙げられる。
【0058】
本明細書で使用されるとき、用語「エオタキシン−2拮抗物質」は、エオタキシン−2/CCL24と相互作用し、正常な活性又はサイトカインの発現を阻止する又は抑える分子を指す。本発明のこの態様に従って多数の剤を使用することができる。従って、たとえば、拮抗物質は、エオタキシン−2の活性を阻害する抗体、小分子化合物、siRNA、DNAzye、リボザイム、又はアンチセンスポリヌクレオチドであることができる。
【0059】
本発明の文脈で、用語「抗エオタキシン−2抗体」は、ポリクローナル抗体及びモノクローナル抗体を包含する。さらに、抗体は、たとえば、マウスの抗体、キメラ抗体、ヒト化抗体及びヒト型抗体であってもよい。用語は、抗体全分子、並びに、たとえば、単鎖(SC)抗体、Fab、F(ab’)2又はFv抗体断片のような、エオタキシン−2に結合することが可能であるその機能的断片、並びにそれらの組み合わせを指す。
【0060】
血清免疫グロブリン(「ポリクローナル抗体」)又はその反応性部分の精製方法は、硫酸アンモニウム又は硫酸ナトリウムによる沈殿、その後の透析、イオン交換クロマトグラフィ、アフィニティクロマトグラフィ及びゲル濾過を含めて当該技術で周知である。
【0061】
本明細書で使用されるとき、用語「モノクローナル抗体」(mAb又はmoAbとも呼ばれる)は、単クローンの細胞から産生される同一の単一特異性の抗体を指す。モノクローナル抗体を生成し、単離する方法は、たとえば、以下の実施例の区分で示されるように、当該技術で周知である。本発明はまた、キメラ抗体又はヒト化抗体も包含する。本明細書で使用されるとき、用語「ヒト化抗体」は、ヒトの主鎖を有し、非ヒト由来の相補性決定領域(CDR)を持つ抗体又はその断片を指す。非ヒトCDRは、たとえば、所望の特異性、親和性及び/又は能力を有するマウス、ラット、ウサギ又はヤギの抗体から得ることができる。特定の実施形態では、ヒト抗体の枠組みにて追加のアミノ酸が非ヒトの相方によって置き換えられて抗体の結合特性を改善する。本明細書で使用されるとき、「キメラ抗体」は、異なった種を起源とするポリペプチドを含有する抗体又はその断片であり、たとえば、マウス−ヒト抗体キメラは、抗体のマウスFc領域をヒトのそれで置き換えることによって得られる。
【0062】
ヒト化抗体を作製する方法は当該技術で周知である。ヒト化抗体は、ヒト抗体の「枠組み」に適当なCDRをコードする断片(所望の結合特性に関与する)を挿入することによって調製することができる。適当なベクターと宿主細胞(たとえば、哺乳類細胞)における発現を用いた組換えDNA法を介してこれを達成する。すなわち、所望の特性を有するモノクローナル抗体をマウス(又はほかの非ヒト動物)で作出した後、その抗体をコードするDNAを単離し、ベクターにクローニングして配列を決定する。次いで抗体のCDRに相当するDNA配列を決定する。いったん、所望のCDRの正確な配列が判明すれば、ヒト型抗体の変異体のためのDNAを含有する構築物にこれらの配列を適宜挿入するために戦略を考案することができる。
【0063】
本発明はさらに、エオタキシン−2への結合活性を保持する、抗エオタキシン−2抗体の断片を包含する。
【0064】
本明細書で使用されるとき、用語「Fab」は、抗体分子の単一の一価の抗原結合断片を含有する断片を指す。Fabは、一方の未処理の軽鎖と一部の重鎖を含み、抗体全体のパパインによる消化によって生成することができる。
【0065】
本明細書で使用されるとき、用語「(Fab)2」は、抗体全体のペプシンによる消化によって得られる抗体断片を指す。ペプシン消化によってFc部分にて抗体の切断を生じ、その結果、2つのFab断片を含有する二価の断片と小さな部分のFc断片を生じ、それらはS−S結合で接合される。「Fab」は、S−S結合の開裂を生じる(Fab)2の還元によって得られる。
【0066】
本明細書で使用されるとき、用語「Fv」は、軽鎖の可変領域と重鎖の可変領域を含有する遺伝子操作された断片を指す。
【0067】
本明細書で使用されるとき、用語「単鎖抗体」は、好適なリンカー(たとえば、ポリペプチド)によって連結された、軽鎖の可変領域と重鎖の可変領域を含有する遺伝子操作された分子を指す。単鎖抗体は通常、軽鎖と重鎖の可変領域とリンカーを含む融合ポリペプチドをコードする単一のポリヌクレオチドを発現させることによって調製される。単鎖抗体を調製する方法は、当該技術で周知であり、たとえば、米国特許第4,946,778号を参照のこと。
【0068】
本発明に係る抗体断片は、好適なプロテアーゼ、たとえば、パパイン若しくはペプシンを用いた抗体のタンパク分解加水分解によって、又は細菌(たとえば、大腸菌)若しくは哺乳類細胞(たとえば、チャイニーズハムスターの卵巣(CHO)細胞)のような宿主細胞における抗体断片をコードする核酸の組換え発現によって調製することができる。
【0069】
本発明の抗体は、発現ベクターを用いて好適な宿主細胞にて抗体をコードする核酸を発現させることによって組換え的に製造されてもよい。本明細書で使用されるとき、用語「発現ベクター」は、抗エオタキシン−2抗体の鎖をコードする遺伝情報を細胞に移すことが可能である核酸構築物を指す。挿入物は標的細胞で発現され、抗体が産生され、細胞の培地に分泌されるか、又は細胞から直接抽出される。ベクターは、たとえば、プラスミド、バクテリオファージ、及びそのほかのウイルス、コスミド、及び人工染色体に限定されない種々の起源のものであり得る。通常、操作されたベクターは、複製開始点、クローニング部位、選抜可能なマーカー及び本発明の抗体をコードする非相同の核酸を含む。ウイルスベクターは一般に、非感染性にしてあるが、ウイルスのプロモータと非相同の核酸を依然として含有するので、ウイルスのプロモータを用いて非相同の核酸を翻訳することができる、修飾されたウイルスのDNA又はRNAを運ぶ遺伝子操作されたウイルスである。ウイルスベクターの非限定例は、組換えレトロウイルス(レンチウイルスを含む)、アデノウイルス、アデノ関連ウイルス、SV40、単純性ヘルペスウイルス及びワクシニアウイルスである。
【0070】
特定の実施形態では、本発明はまた、免疫抱合体と、本発明の抗体を含む二重特異性分子も包含する。
【0071】
本明細書で使用されるとき、用語「アンチセンス療法」は、特定の疾患に影響を及ぼすことが知られる遺伝子の発現の阻害を含む治療の形態を指す。本発明の文脈では、アンチセンス療法は、エオタキシン−2のmRNAの発現を阻害することを目的とする。従って、療法には、エオタキシン−2のmRNA又はその断片の配列に相補的であり(アンチセンスオリゴヌクレオチド)、その遺伝子によって産生されるメッセンジャーRNA(mRNA)に結合し、それを不活化し、その遺伝子のスイッチを効果的に「切る」核酸(DNA、RNA、又は化学的類似体)の鎖の合成が関与する。
【0072】
本明細書で使用されるとき、用語「siRNA」(小型干渉RNA)は、短鎖干渉RNA又はスプライシングRNAとしても知られ、生物学において様々な役割を担う通常、長さ20〜25ヌクレオチドの二本鎖RNA分子の部類である。最も顕著には、siRNAは、RNA干渉(RNAi)の経路に関与し、特定の遺伝子の発現に干渉する。
【0073】
本明細書で使用されるとき、用語「小分子化合物」は、有機化合物を指す。小分子の分子量の上限はおよそ800ダルトンである。
【0074】
本明細書で使用されるとき、用語「メソトレキセート」は、癌及び自己免疫疾患の治療に使用される代謝拮抗剤及び抗葉酸剤を指す。
【0075】
本発明の抗体を含む医薬組成物は、非経口投与、すなわち、皮下に、筋肉内に及び静脈内に投与するのに有用である。非経口投与用の組成物は一般に、許容可能なキャリア又は賦形剤、好ましくは水性キャリアに溶解された抗体を含む。種々の水性キャリア、たとえば、水、緩衝水、生理食塩水、PBS(リン酸緩衝化生理食塩水)、などを使用することができる。これらの溶液は無菌であり、一般に粒子状物質を含まない。組成物は必要に応じて生理的条件に近づける薬学上許容可能な補助物質、たとえば、pH調整剤及び緩衝化剤、毒性調整剤など、たとえば、酢酸ナトリウム、塩化ナトリウム、塩化カリウム、塩化カルシウム、乳酸ナトリウム、ヒスチジン及びアルギニンを含有してもよい。
【0076】
非経口投与用の組成物を調製する方法は、当業者に既知であり、又は明らかであり、たとえば、Remington’s Pharmaceutical Science(15th Ed., Mack Publishing Company, Easton, Pa., 1980)にさらに詳細に記載されている。
【0077】
本発明の抗体は、保存用に凍結する又は凍結乾燥することができ、使用前に好適なキャリアで再構成することができる。この技法は従来の免疫グロブリンで有効であることが示され、技術で知られる凍結乾燥法及び再構成法を使用することができる。
【0078】
治療目的で、症状及びその合併症を治療する又は少なくとも部分的に緩和するのに十分な量で組成物を投与する。これを達成するのに適切な量を「治療上有効な量」と定義する。この使用に効果的な量は、症状の重症度及び患者自身の免疫系の一般状態に左右されるが、一般に、1回当たり約0.01〜約150mgの抗体の範囲である。1日、1週間又は1ヵ月における単回又は複数回の投与の計画は、用量レベルで実施することができ、パターンは主治医によって選択される。
実施例
【0079】
モノクローナル抗体の製造
標準のプロトコールに従って、幾つかのクローンのmAbを製造した。手短には、20μgのエオタキシン−2(Peprotec、米国)でBalb/Cマウスを免疫し、その後4回追加免疫した。血清中に抗エオタキシン−2ポリクローナルAbの存在を確認した後、マウスを屠殺し、脾臓から細胞を単離し、NS/0骨髄腫細胞とハイブリッドを形成させ、その後、エオタキシン−2への結合についてクローンをスクリーニングした。次いで、無血清培地にて2〜3週間、ハイブリドーマを増殖させ、培地を回収し、100kDaのセントリコン(Biological Industries、イスラエル)によって濃縮した。mAbの1つ(D8)のマウスのエオタキシン−2との交差反応性をELISAによって確認した。
【0080】
モノクローナル抗体D8、G8及びG7の核酸配列を決定するのに以下のプライマーを用いた:
重鎖(IgGγ−1)
正方向(配列番号7)
5’−CGAAGAGACAGTGACCAGAGTCCCTTGGCCCCAGTAAGCAAAGCTATTACCGAAGGTACAGTAATACACGGCCGTGTC−3’
逆方向(配列番号8)
5’−CGGGGAAGTAGTCCTTGACCAGGC−3’
軽鎖(κ)
正方向(配列番号9)
(変性)5’−RRHRYYBWDMTVACHARWC−3’
又は(配列番号10)
5’GATGTCTTGTGAGTGGCCTCAC−3’
逆方向(配列番号11)
5’−TGGGATAGAAGTTATTCAGCAGGC−3’
【0081】
結合アッセイ
1μg/mLのエオタキシン又はエオタキシン−2(炭酸緩衝液中)のいずれかでプレートを4℃にて一晩被覆した。プレートをPBSで3回洗浄し、2%BSAによって37℃にて45分間ブロックした。PBSによって連続希釈した抗エオタキシン−2抗体(D8クローン)を37℃にて1.5時間入れた。上記のように洗浄を繰り返し、ペルオキシダーゼ結合のヤギ抗マウス抗体と共にプレートを37℃にて1時間インキュベートした。上記のように洗浄を繰り返し、発色基質を用いて結合を検出した。
【0082】
脾細胞接着アッセイ
接着アッセイでは、C57BlマウスとLewisラットの脾細胞をファイコール勾配で分離し、一晩のインキュベート用に10cmのシャーレに入れた。翌日細胞を回収し、上昇濃度のD8又はマウスの総IgG(5〜50μg/mL)によって回転しながら2時間予備処理した。次いで、細胞を遠心し、フィブロネクチンで予備被覆した96穴プレートに入れた。1時間のインキュベートの後、非付着細胞を洗い流し、付着細胞の量をXTTキット(Biological Industries、イスラエル)を用いて分析した。健常な供与者から回収した末梢血単核細胞(PBMC)を用いて同様の接着アッセイを行った。
【0083】
遊走アッセイ
D8(30μg/mL)で予備処理したラット脾細胞及びヒトPBMCと同様にC57BL/6J由来の脾細胞をTrans−Well系の上部チャンバーに入れた。下部チャンバーは、VEGF(血管内皮増殖因子)(20ng/mL)を補完した無血清培地を含有した。4時間後、下部チャンバーの培地を回収し、フローサイトメトリーを用いて細胞を計数した(1分当たりに回収される細胞数)。
【0084】
プラーク及び心血管系の試験管内試験:
I.ヒトの頚動脈プラークの調製とタンパク質アレイ
ヒトのアテローム硬化性プラークを2群の患者から回収した。無症候性の重度アテローム性頚動脈硬化症の患者の動脈内膜切除検体から安定プラーク(n=4)を得た。不安定プラークの代表的なものは、急性心筋梗塞の患者の責任血管の経皮冠動脈形成の際得られた検体だった(n=4)。専用の吸引装置によって血栓切除を行った。得られた材料は、赤色血栓、白色血栓、及び責任動脈の不安定プラークの断片から成る。洗浄と溶解の後、残りの組織は、大部分、破裂したアテローム硬化性プラークの断片を含む。
安定及び不安定のヒトのプラークにて40のサイトカイン、ケモカイン及び増殖因子を検出するのにRayBio(商標)ヒト炎症抗体アレイ3.1(Ray Biotech、米国)を用いた。手短には、ペレット乳棒を用いてキット内で提供された溶解緩衝液にてプラークをホモジナイズした。各試料の500mgのタンパク質と共にアレイをインキュベートし、製造元の指示書に従って進展させた。TINA2.0プログラムを用いて結果を解析した。
【0085】
II.毛細管細胞
10%のウシ胎児血清(FCS)(Invitrogen)と1%のペニシリン/硫酸ストレプトマイシン(Biological Industries、イスラエル)を補完したDMEMF−12(Biological Industries、イスラエル)にてマウスの毛細管細胞(H5V)を培養した。8%CO2と共に多湿インキュベータにて37℃で細胞を維持した。1%のFCSと1%のペニシリン/硫酸ストレプトマイシンを含有する完全培地RPMI1640にて106個の細胞/mLの濃度で単球様のU937細胞を培養した。5%CO2の多湿インキュベータにて37℃で細胞を維持した。
【0086】
III.内皮細胞による接着アッセイ
接着アッセイにて、oxLDL、1μg/mL(以前記載されたように調製した、33)の存在下でH5Vマウス内皮細胞を72時間インキュベートした。次いで、oxLDL、1μg/mLの存在下、4×103個/ウェルの濃度で96穴プレートに細胞を一晩入れた。翌日、中和ヤギ抗マウスエオタキシン−2抗体(Cytolab、米国)又はヤギIgGで細胞を1時間予備処理した後、U937細胞又はApoEマウスの脾臓由来の細胞を8×104個/ウェルの濃度で加えた。1時間のインキュベートの後、非付着細胞を洗い流し、付着細胞の量をXTTキット(Biological Industries、イスラエル)を用いて分析した。
【0087】
IV.大動脈とH5V内皮細胞のPCR解析
製造元のプロトコールに従ってEZ−RNAキット(Biological Industries、イスラエル)を用いてチオシアン酸グアニジニウムとフェノールクロロホルムの方法によって組織試料及びH5V内皮細胞からRNAを単離した。従来の熱サイクラーにてAMV逆転写酵素(TaKaRaのRNAPCRキット、日本のタカラ)を用いてRT−PCRを実施した。ホットスタートTaKaRaExTaqDNAポリメラーゼを用いて特定の遺伝子の増幅を実施した。エオタキシン−2とTGFβのマウスmRNAについて、イントロン配列を補う特定のプライマーを設計した(表1)。G3PDHとTGFβについて以下のPCR条件:95℃で2分間、次いで95℃で2秒間と55℃で45秒間と72℃で1分間を27サイクル(G3PDH)又は35サイクル(TGFβ)での試料のインキュベートを用いた。出発温度70℃と、30サイクルの増幅と、60℃でのアニーリング温度によって、エオタキシン−2mRNAの発現の解析にタッチダウンPCR増幅プロトコールを用いた。PCR試料を2%アガロースゲル上で泳動させ、Gelstar核酸染色(Gambrex、USA)で染色し、300nmのUVトランスイルミネータによってPCR産物を可視化し、ポラロイドカメラ方式によって撮影した。逆転写に先立って精製したRNA試料にてグリセルアルデヒド−3−リン酸脱水素酵素(G3PDH)のPCR反応を行うことによって単離されたRNAのゲノムの混入の非存在を確認した。ヌクレアーゼを含まない水の陰性対照は、試料の試行すべてに含めた。各RNA試料は数回解析した。
【0088】
V.大動脈洞の免疫組織化学的な解析
間接免疫ペルオキシダーゼ染色によって大動脈洞のクリオスタット切片(厚さ5μm)を評価した。その後、スライドをメイヤーのヘマトキシリンで対比染色し、グリセロール(Dako)で標本にした。親和性精製したヤギ抗マウスエオタキシン−2(Cytolab、イスラエル)を用いて免疫組織化学的な染色を行った。
【0089】
統計的解析
一方向ANOVA検定によって群間の比較を行った。p<0.05を統計的に有意であるとみなした。結果は平均値と標準誤差として表す。
【0090】
実施例1:抗エオタキシン−2mAb(D8)の特異性と抗炎症効果
上述のように抗エオタキシン−2マウスモノクローナル抗体(mAb)の幾つかのクローンを調製した。
D8抗体の重鎖をコードする核酸配列は配列番号1として示される:
GGGCAGCAGANCCGGGGCNGNGGATAGACAGANGGGGGNNGNCGTTTTGGCTGA
GGAGACGGTGACTGAGGTTCCTTGACCCCAGTTGTCCATAGCGTAGCTACTACCGTAGGA ATGACTTGCACAGAAATATG
TAGCCGTGTCCTCATTTCTGAGGTTGTTGATCTGCAAATAGGCAGTGCTGGCAGAGGTTTC
CAAAGAGAGGGCAAACCGT
CCCTTGAAGTCATCAGTATATGTTGGCTCTCCATTGTAGGTGTTGATCCAGCCCATCCACTT
TAAACCCTTTCCTGGAGC CTGCTTTACCCAGTTCATTCCAGAGTTTGTGAAGGGATACCCAGAAGCCCTGCAGGAGATC
TTGACTGTGTCTCCAGGCT
TCTTCAGCTCANGTCCAGACTGCACCAACTGGATCTGGGCCATGGCCNGCTA
【0091】
D8抗体の軽鎖(κ)をコードする核酸配列は配列番号2として示される:
GGGCCAATGGNNGAGGACGCGGATGGGGGTGTCGNNGTGC
CTTNGTCGNNNNCTNNTTGNNCANCNTCNACNNCNNNNANNNNANNGNNNNNTGNAANA
NNGATGGNNNTNNNCNACANN
NTGGNNTCCTNNNNNNNTNNNNTGNNNNNGACNNCANANACANNNNCNACNNNATGANC
NNCNNNCNNNNNTTGANNNNN
GNCNANTATGAACNANNNAANNNNNNTACCTGNNANGCCACTCACAAGACATCA
【0092】
G8抗体の重鎖をコードする核酸配列は配列番号3として示される:
GGGCAGCAGNTCCAGGGGCCAGNGGATAGACAGANGGGGGNGTCGTTTTGGCTG
AGGAGACGGTGACTGAGGTTCCTTGACCCCAGTTGTCCATAGCGTAGCTACTACCGTAGG
AATGACT
TGCACAGAAATAT
GTAGCCGTGTCCTCATTTCTGAGGTTGTTGATCTGCAAATAGGCAGTGCTGGCAGAGGTTT CCAAAGAGAGGGCAAACCG
TCCCTTGAAGTCATCAGTATATGTTGGCTCTCCATTGTAGGTGTTGATCCAGCCCATCCACT
TTAAACCCTTTCCTGGAG
CCTGCTTTACCCAGTTCATTCCAGAGTTTGTGAAGGGATACCCAGAAGCCCTGCAGGAGAT
CTTGACTGTGTCTCCAGGC TTCTTCAGCTCAGGTCCAGACTGCACCAACTGGATCTGGGCCATGGCCGGCTANN
【0093】
G8抗体の軽鎖(κ)をコードする核酸配列は配列番号4として示される:
GGGCCAATGGNNGAGGACGCGGATGGGGGTGTCGNNGTGCCT
TNGTCGNGTGCTTNTTGAACAACTTCTACCCCNNANACNTNANNGTNNNNTGGAANATTG ATGGCNGTGAACGACAAAAT
GGCGTCCTGAACANTTGGACTGATCCANGACAGCAAANACANCNCCTACAGCATGAGCAG
CACCCTCACGTTGACNNNNG
ACNANTNTGAACGACGTANNNNCNNTACCTGTNANGCCACTCACAAGACATCA
【0094】
G7抗体の重鎖をコードする核酸配列は配列番号5として示される:
GGGCAGCAGNTCCAGGGGCCAGNNGGATAGACAGANGGGGGNGNCGTTTTGGCT
GAGGAGACGGTGACTGAGGTTCCTTGACCCCAGTTGTCCATAGCGTAGCTACTACCGTAG
GAATGACTTGCACAGAAATA
TGTAGCCGTGTCCTCATTTCTGAGGTTGTTGATCTGCAAATAGGCAGTGCTGGCAGAGGTT
TCCAAAGAGAGGGCAAACC
GTCCCTTGAAGTCATCAGTATATGTTGGCTCTCCATTGTAGGTGTTGATCCAGCCCATCCA
CTTTAAACCCTTTCCTGGA
GCCTGCTTTACCCAGTTCATTCCAGAGTTTGTGAAGGGATACCCAGAAGCCCTGCAGGAG
ATCTTGACTGTGTCTCCAGG
CTTCTTCAGCTCAGGTCCAGACTGCACCAACTGGATCTGGGCCATGGCCGGCTANN
【0095】
G7抗体の軽鎖(κ)をコードする核酸配列は配列番号6として示される:
GGGCCTTTGGNNGAGGACGCGGATGGGGGTGTCCNNGTGCCT
TNGTCGNGTGCTTNTTGAACAACTTCTACCCCNNANACNTNANNGTNNNNTGGAANATTG
ATGGCNGTGAACGACAAAAT
GGCGTCCTGAACANTTGGACTGATCCANGACAGCAAATACANCNCCTACAGCATGAGCAG
CACCCTCACGTTGACNNNNG
ACNANTNTGAACGACGTANNNNCNNTACCTGTNANGCCACTCACAAGACATCA
【0096】
上記核酸配列における文字Nは、ヌクレオチドA、T、C又はGのいずれかの存在を表す。
【0097】
D8モノクローナル抗体を産生するハイブリドーマは、受入番号D809081702のもとで2009年8月17日、英国ウィルトシャー州、ソールズベリーのヨーロッパコレクションオブセルカルチャー(ECACC)に寄託された。
【0098】
G8モノクローナル抗体を産生するハイブリドーマは、受入番号G809081701のもとで2009年8月17日、ECACCに寄託された。
【0099】
新規の抗エオタキシン−2抗体(D8)の特異性は、結合アッセイにて評価された。エオタキシン又はエオタキシン−2を被覆したプレートに、クローンD8にて産生されたmAbの連続希釈を一晩のインキュベートのために加えた。洗浄の後、ペルオキシダーゼ結合のヤギ抗マウス抗体と共にプレートをインキュベートし、再び洗浄し、発色基質を用いて結合を検出した。
【0100】
図1に示されるように、クローンD8のmAbは調べた希釈の全範囲にて、エオタキシン−2への有意な結合を示したが、エオタキシンへの結合は示さなかった。
【0101】
ヒトのPBMCと同様にマウス若しくはラットの脾細胞のフィブロネクチンへの接着を阻害する能力、又はVEGFへの遊走を減衰する能力についても抗体を調べた。D8(50μg)は、ヒトのPBMCと同様にマウス若しくはラットの脾細胞のフィブロネクチン(FN)への接着を35〜55%(図2A)阻害することが見い出された。VEGFへの遊走も用量依存性に減衰した(図2B)ということは、抗体の抗炎症性効果の可能性を裏付けている。
【0102】
実施例2:クローンD8mAbの抗炎症性の能力(生体内データ)
A.関節リウマチのモデル
フロインド不完全アジュバントの注射によってLewisラット(イスラエル、Harlanから得た6週齢オスLewisラット)でアジュバント関節炎を誘発した。フロインド不完全アジュバントは、熱で殺したMycobacterium Tuberculosisを10mg/mLにて鉱物油に懸濁することによって調製した。尾の付け根の皮下で10μLのアジュバントをラットに注射した。
アジュバント誘発の関節炎に対する、対照としての非特異的IgG及びPBSと比べた抗エオタキシン−2抗体の効果の評価
【0103】
エオタキシン−2に対するモノクローナル抗体(G7、G8、D8)による週3回の腹腔内(IP)注射によってラット(群当たり8匹)を処理した。対照は、マウスの総(非特異的)IgG又はPBSで処理した。注射はアジュバント投与後3日目に開始し、ラットを屠殺するまで週3回行った。
用量反応実験
【0104】
実験の第2の設定では、アジュバント誘発の関節炎モデルで最良の予防成績を示す抗エオタキシン−2抗体D8を用量反応モデルで調べた。上述のプロトコールに従ってアジュバント関節炎を誘発した。アジュバント注射の3日後に開始し、週3回、20μg、100μg又は1000μgの用量でのD8によって腹腔内でラット(群当たり6匹)を処理した。動物の別の設定(各群6匹)は、関節炎が発症した後、すなわち、関節炎がすでに明らかであるとき、同一用量で処理した(D8処理群)。
【0105】
既知の有効性の従来の抗炎症剤の有効性とD8の抗炎症性の有効性を比較するために、アジュバント注射の3日後に開始する0.25mg/kg、週1回のメソトレキセート(ip)で一群を処理した(メソトレキセート予防群)。追加の群は、3日目に開始する週3回の100μgのD8(ip注射)と併用して週1回の0.25mg/kgのメソトレキセートで処理した(併用D8−メソトレキセート予防群)。対照群は実験全体を通してPBSで処理した。
関節炎の重症度の評価
【0106】
体重、足の腫脹、関節炎スコア及び動物の全体的な動きを測定することによって関節炎の重症度を評価した。病理評価のために試料関節を得たが、足首関節の死後X線検査を実施して侵食を記録した。
【0107】
全身性の炎症の指標として2日に1回、グラムでの体重を測定した。
【0108】
(足腫脹の評価)キャリパを用いて、足首及び手首の径をmm(小数点第1位まで)で週3回記録した。
【0109】
(関節炎スコアの測定)以下:0=正常、1=足首又は手首の軽い紅斑及び/又は腫脹、2=足首又は手首の中程度の紅斑及び/又は腫脹、3=足首又は手首の重度の紅斑及び/又は腫脹、4=足指又は手指及び足首又は手首の完全な紅斑及び/又は腫脹及び足首又は手首を曲げることが不可能、のような腫脹、紅斑及び変形の程度(4つの手足すべてについて動物当たり、最大スコアは16)について0〜4の尺度で手足をスコア化した。
【0110】
その部分的な寄与に従って手指及び足指の腫脹を記録した。足首(足):各足指を0.2とスコア化した;手首:各手指を0.25とスコア化した。関節の合計を算出した。
【0111】
(運動性スコア)以下の定義:0=正常、1=やや損傷、2=主な損傷、3=足を踏みつけない、4=動かない;に従って0〜4の間で動物の全体的な運動性をスコア化した。
【0112】
(統計的解析)統計的解析には、QuickCalcsソフトウエア(カリフォルニア州、サンディエゴのGraph−Pad Software)を用いた。スチューデントのt検定を実施して実験群間の有意差を特定した。
結果
A.関節炎モデル
【0113】
免疫グロブリン(IgG)又はPBSで処理したものに比べて、抗エオタキシン−2抗体で処理したラットでは関節炎の有意な抑制が認められた。図3A〜3Cで明らかにされるように、抗体による抑制は調べたパラメータすべて(関節炎スコア、運動性スコア及び足首径)で明らかだった。D8と記された抗体は最も有意な効果を示した。関節炎スコア試験(図3A)では、PBSで処理したラット又はIgGで処理したラットとD8で処理したラットを比べると、13日目〜21日目まですべての測定で統計的に有意な差異(p<0.05)が得られた。予防効果は、注射後17日目で関節炎が出現すると即座に明らかになった。21日目の実験終了まで、その程度は増大し続けた。
【0114】
運動性スコア試験では、17日目から、PBSで処理したラットとD8で処理したラットを比べたとき、及び18日目から、PBSで処理したラット又はIgGで処理したラットとD8で処理したラットを比べたとき、あらゆる測定で統計的に有意な差異(p<0.05)が得られた。従って、21日目では、PBSで処理した動物の2.43に比べて、D8で処理した動物の運動性スコアの平均は1.37だった(p=0.005)。
【0115】
足首径試験では、19日目時点でのD8とPBSの間で統計的に有意な差異(p<0.05)が得られた。D8とIgGの間の差異は統計的な有意性に達しなかった。
【0116】
上記で示されたように、D8で処理したラットは、PBSで処理したラットよりも低い、2.6〜3.0の範囲の関節炎スコアを有した(図4A)。組織学的スコアについては、定義:0=正常、1=炎症性浸潤及び滑膜過形成、2=パンヌス形成及び軟骨侵食、3=重大な軟骨侵食と骨破壊、4=関節の整合性の喪失の程度について0〜4のスコアで各手足をスコア化した。関節炎ラットの関節の組織学的分析は、D8で処理したラットの関節が滑膜の過形成と散発的な炎症性浸潤を有するが、PBSで処理したラット(対照群)のほとんどはパンヌス形成と強度の炎症性浸潤を伴う重度の滑膜炎を有する(図4C)ことを示した。
【0117】
全身性の炎症反応に対する抗エオタキシン−2抗体による処理の効果を評価するために、動物の平均体重を記録した。図5に示されるように、抗エオタキシン−2抗体処理は、アジュバント関節炎によって誘発される全身性の炎症反応が原因で起きる体重減少を有意に改善した。再び、最大の予防効果は、D8抗体で処理した動物で認められ、それは実験全体を通して体重を増やし続けた。D8とPBSの間における体重の統計的に有意な差(p<0.05)は17日目に得られた。
用量反応実験
【0118】
関節炎のD8による予防
一連の用量反応実験では、低用量(20μg)群及び高用量(1000μg)群に比べて、100μgでのD8が有意に優れた予防効果を有した(図6A)。運動性スコア、足首径及び動物の体重についても同様の結果が得られた(データは示さず)。100μgのD8で処理したラットをPBSで処理したラットと比較した場合、17日目〜24日目であらゆる測定にて統計的に有意な差異(p<0.05)が得られた。
【0119】
関節炎のD8による処理
関節炎の出現時に腹腔内で開始したD8抗体による処理も、PBSで処理した動物に比べて関節炎スコアの重症度で有意な軽減を生じた(図6B)。運動性スコア、体重及び足首径についても同様の結果が得られた。図6Bで示されるように、この実験設定では、100μg〜1000μgの用量群で同様の結果が得られた。
関節炎のD8/メソトレキセート併用での予防
【0120】
メソトレキセートと100μgのD8が双方共、関節炎スコア(PBS処理対照と比べた)によって測定したとき、関節炎の進展に対して有意な、匹敵する予防を生じた一方で、メソトレキセートとD8の併用は、図7に示すように向上した(相乗の)予防効果を生じた。
【0121】
100μgのD8とMTX双方の処理はPBSに比べて13日目時点で統計的に有意な効果(p<0.05)を引き起こした。実験の終了まで、24日目まで、MTX単独で処理したラットとMTX+100μgのD8で処理したラットの間で関節炎スコアの統計的に有意な差が認められた。有意差は、これらの群間で、24日目の平均足首幅でも認められた(示さず)。
【0122】
X線検査の結果
死後X線検査は、D8で処理したラットの最少限の腫脹に比べて、PBSで処理したラットでは関節周囲軟組織の強度の腫脹を示した(図8)。加えて、対照ラットは、脱灰の兆候と早期の侵食を示したが、それは、D8で処理した動物では見られなかった。このことは、D8で処理した動物における炎症の有意な低下を示している。
【0123】
前肢のX線検査においても同様の結果が見られた(示さず)。
B.大腸炎モデル
【0124】
慢性の大腸炎を誘発するために、10週齢のC57BLマウスに、飲料水中のデキストラン硫酸(DSS)への5日間の暴露に続いて通常の水道水で10日間の間隔を置くことを3サイクル経験させた。第1のサイクルの終了時に、マウスを無作為に6つの処理群:ビヒクル対照(PBS)、マウスの総IgG、並びに5μM、25μM、100μM及び200μMの上昇用量で与えたD8に分けた。処理は週3回の計画にて腹腔内(ip)注射で行った。週2回体重を測定した。最終サイクルの終了時までにマウスを屠殺し、誘導した炎症の程度を評価するために、結腸の近位部分は免疫組織化学解析に、遠位部分はミエロペルオキシダーゼ活性のアッセイ(標準のプロトコールに従って)に利用した。動物の血清における炎症性サイトカインのレベルはフローサイトメトリーによって検出した。
【0125】
IgG又はD8による処理は、ビヒクル処理の動物に比べて体重低下を有意に減衰する。試験全体を通して、最高の体重は5μgのD8処理群で認められた(図9A)。34日目のMPO活性は、mIgGを含むその他すべての群に比べて5μgのD8処理群で有意に低下した(図9B)。加えて、D8で処理した動物の血清における炎症性サイトカインのレベルは対照動物で検出されたものよりも低かった(図9C)。近位結腸の免疫組織化学解析は、炎症の範囲及び程度と同様に結腸組織への損傷のレベルでも抑制を裏付けた(図9D)。熟練病理医によって炎症性浸潤の範囲が評価された。
C.EAE
【0126】
EAEは、ヒトの疾患である多発性硬化症の治療能を検討する典型的な動物モデルとして役立つ(30)。
【0127】
10週齢のC57BLマウスに、完全フロインドアジュバント中で懸濁した200μgのMOG(ミエリンオリゴデンドロサイトの糖タンパク質)ペプチドを皮下注射し、その後、1週間後に2回目の注射をした。疾患の誘発後1日目(すなわち、2回目の注射の1日後)、対照(PBS)、マウス総IgG、25μgのD8及び100μgのD8による処理(週3回、ip注射)を開始した。標準のEAEスコア化方式(31)に従って、週3回、疾患の重症度と進行を記録した。
【0128】
25μg、さらに有意には100μgのD8による処理は、実験の全過程の間、EAEの兆候の進行を減衰した。高い方の用量(100μg)でのD8は、約90%(ほかの処理群すべて)の疾患の発生率をたった55%(図10)に下げたということは、EAEの治療にてD8の治療上の利点の可能性を説明している。
D.糖尿病
【0129】
非肥満型糖尿病(NOD)マウスは、自己免疫性糖尿病の動物モデルとして役立つ(32)。
【0130】
6週齢のNODマウスをD8又はビヒクル対照(PBS)で週3回処理した。49〜112日目の間で、市販の尿テストを用いて糖尿病の発生を調べ、112日目の血清のエオタキシン−2のレベルをELISA(マウスCCL24/エオタキシン−2/MPIF−2、Duoset、R&D)を用いて測定した。
【0131】
糖尿病の発生率は、未処理の対照と比べてD8処理群では顕著に低下した(図11A)。臨床的な改善と一致して、対照と比べて抗エオタキシン−2で処理した動物の血清では、エオタキシン−2のレベルは大きく低下した(図11B)。
E.アテローム硬化性プラーク形成の抑制
【0132】
種々の炎症性のサイトカイン及びケモカインの発現レベルをアテローム硬化性病変(プラーク)で測定した。急性心筋梗塞の患者の責任冠状動脈から回収した不安定プラークを動脈内膜切除試料から得た安定プラークと比較した。タンパク質アレイによるプラークの分析を図12に示す。材料と方法の項で記載したとおりに処理を行った。
【0133】
様々に発現されたタンパク質の間で、有意な変化は、以下のタンパク質:VCAM−1、エオタキシン−2、IL−10、MCP−1及びTIMP−2に見い出され、安定プラークに対比して不安定プラークではすべて2倍を超える発現の低下を示した(図12A)。
【0134】
アテローム性動脈硬化症の傾向にあるマウス(apoEKOマウス)における免疫組織化学的な検討では、若齢マウスから老齢マウスまで脂肪線条と進行した病変が、材料と方法で記載したように抗エオタキシン−2抗体によって染色された。エオタキシン−2は、内皮細胞の中及びプラークのマクロファージの中に存在することが示された(図13)。
【0135】
若齢(6週齢)のapoEKOマウスとアテローム硬化性apoEKOマウスでmRNAの発現を測定した。マウスから大動脈を得て、材料と方法に記載したようにRT−PCRに供した。エオタキシン−2とTGF−βのmRNAレベルを比較してアッセイした。エオタキシン−2のmRNAレベルは、老齢マウスに対比して若齢マウスで有意に高いことが見い出され、この発現パターンは動脈硬化防止剤であるTGF−βに関して認められたものと並行した。図14Aは、各群の代表的な試料を示す。
【0136】
酸化LDLはアテローム発生を促進するのに重要な役割を担うと考えられている。マウスのH5V内皮細胞を酸化LDL(oxLDL)(1μg/mL)と共にインキュベートした。oxLDLは、マウスH5V内皮細胞にてエオタキシン−2のmRNAレベルを有意に上方調節した(図14B)。
【0137】
プラークの炎症の細胞性成分の接着においてエオタキシン−2が役割を有するかどうかを判定するために、培養内皮細胞にて接着アッセイを行った。若齢又は老齢のアテローム硬化性apoEKOマウスの脾細胞を脾臓から単離した。マウスの内皮細胞をoxLDL(1μg/mL)と共にインキュベートし、エオタキシン−2抗体又は対照のIgG抗体の存在下で脾細胞の内皮細胞への接着を調べた(図15A)。エオタキシン−2に対する阻止抗体との内皮細胞の予備インキュベートは、脾細胞のこれら細胞への接着を減衰することが見い出された(図15A)。この効果は、若齢非アテローム硬化性マウス(6週齢)から得たものに比べて、アテローム硬化性apoEKOマウス(6週齢)のリンパ球でさらに強力だった。単球/マクロファージ細胞株(U937細胞)を培養内皮細胞(H5Vマウス内皮細胞株)に接着させた場合、これらの知見も明らかだった(図15B)。
【0138】
本発明のモノクローナル抗体と同様に、市販の抗エオタキシン−2抗体を用いて、初期の及び進行したアテローム硬化性プラークに対するエオタキシン遮断の効果を測定した。予備試験では、5μgの週2回用量の抗エオタキシン−2阻止抗体(Peprotech)は、マウスの大動脈でエオタキシン−2mRNAのレベルを有意に下げるのに十分だった。次に、抗エオタキシン−2抗体の短期投与の効果を調べた。若齢apoEKOマウスを週2回のエオタキシン−2抗体(5μgのip注射)又は対照IgG又はPBSで4週間処理し、脂肪線条に対する効果を測定した。オイルレッドOで染色した後、プラークの大きさを解析するためにマウスを屠殺した。抗エオタキシン−2はマウスIgGに比べて脂肪線条の形成をおよそ72パーセント劇的に低下させた(図16A)。双方の群で総コレステロール及びトリグリセリドは類似していたので、この効果は脂質特性の変化とは関連しなかった(データは示さず)。さらに、対照のマウスIgGによる処理は、PBS注射に比べてプラークの進行に影響しなかった。
【0139】
次に、プラークの構造がさらに複雑である長期モデルにてエオタキシン−2の遮断の効果を調べた。本明細書では、エオタキシン−2抗体(5μg/用量)の週2回の注射の10週後、老齢のapoEKOマウスの心臓で測定したプラークの大きさに関して有意差は明らかではなかった(図16B)。しかしながら、線維性領域によって測定されるプラークの安定性をアッセイした場合、エオタキシン−2に対する抗体は、より小さな脂質コアを犠牲にしたより大きな線維性領域によって明らかな有意にさらに安定したプラークの表現型を誘導した(図16C)。再び、これらの知見は、群間に差異のない脂質レベルにかかわりなかった。代表的な、オイルレッドO染色した及びMassonの三色染色した切片を図17に提供する。
【0140】
アテローム性動脈硬化症は、脂肪の沈着が動脈壁で進行し、内腔の進行性の狭窄をもたらす過程である。成熟プラークは2つの基本構造:脂質のコアと線維性のキャップで構成される。脂質のコアが小さければ小さいほど、線維性のキャップは厚く、さらに安定なプラークとなるということは、破裂し、心筋梗塞又は不安定狭心症を起こす傾向が低下することを意味する。急性の冠状動脈症候群(たとえば、心筋梗塞及び不安定狭心症)の原因となるプラークのほとんどが、<70%の狭窄を有することが血管造影で示されることは今や明らかである(28、29にて概説された)。これらの病変のおよそ60%は、大きな血栓形成性の脂質コアと壊死性の残渣(マクロファージ、T細胞、古い出血、血管形成及びカルシウムの病巣を含む)を伴ったプラークの破裂が原因で生じる。おそらく、マクロファージがプラークを移動するにつれてそれを消化するマトリクスメタロプロテイナーゼを分泌し、平滑筋(プラークの要素を支えている)が、たとえば、炎症性サイトカインのような幾つかの因子によって生じる老化又はアポトーシスのために激減するために、破裂したキャップは薄い。
【0141】
態様の1つでは、本発明は、エオタキシン−2がヒトの安定した及び不安定なアテローム硬化性プラークで差次的に発現するという知見に基づく。apoEノックアウト(KO)[20]マウスモデルにてエオタキシン−2の経路を遮断することによって、本発明者らは、脂肪線条形成(初期動脈硬化病変を示す)の抑制とプラーク安定化の延長の双方を実証することができた。
【0142】
本発明の発明者らは、当該技術での以前の報告を支持している、アテローム硬化性と非アテローム硬化性のマウス動脈の内皮にエオタキシン−2が発現されていることを見い出した。しかしながら、本発明者らはまた、エオタキシン−2がプラークのマクロファージで発現されていることも見い出した。エオタキシン−2は、アテローム硬化性apoEKOマウスに比べて若齢apoEKOマウスの大動脈でさらに豊富に発現された。エオタキシン−2が、内皮への単球/マクロファージの細胞/細胞接着を含む、アテローム性動脈硬化症の最初の段階に関与することを示唆すること。実際、以下に記載される試験管内の試験は、エオタキシン−2を遮断することはoxLDLで誘導した内皮細胞へのリンパ球の接着を低下させ、生体内でのプラーク形成におけるエオタキシン−2の役割を支持することを示している。
【0143】
徹底した研究にもかかわらず、安定なプラークから不安定なプラークへの移行を支配する因子は不明瞭なままである。ヒトの安定プラークと不安定プラークの炎症性タンパク質アレイ解析に基づいて、本発明は、安定型と不安定型の間のプラークの移行に関与する可能性のある標的タンパク質、エオタキシン−2を提供する。VCAM−1、IL−10及びMCP−1とのアテローム性動脈硬化症の関係に関する揺るぎないデータが存在し、それらは、安定プラークと不安定プラークで差次的に発現されることが本発明者らによっても見い出されているが、そのようなデータはエオタキシン−2については存在しない。
【0144】
加えて、エオタキシン−2は、アテローム硬化性及び非アテローム硬化性のマウス動脈の内皮で発現されていることが本発明者らによって見い出されたので、以前の報告を支持している。しかしながら、それはプラークのマクロファージでも発現されていることが本発明者らによって見い出された。興味深いことに、内皮への単球/マクロファージの細胞/細胞接着を含む、アテローム性動脈硬化症の最初の段階に相当するアテローム硬化性apoEKOマウスに対比して、エオタキシン−2は、若齢apoEKOマウスでさらに豊富に発現された。実際、試験管内の試験は、生体内では上手く生じてもよいoxLDLが介在する接着におけるエオタキシン−2の遮断の役割を支持している。マウスのアテローム性動脈硬化症の早期段階におけるエオタキシン−2のさらに強力な発現はまた、短期の脂肪線条モデルにおけるこの経路を阻害する印象的な効果も説明する。理論に束縛されることを望まないで、内皮への炎症性細胞の接着を阻止することは、この効果に一義的に関与するのかも知れない。
【0145】
線維性領域によって明らかなようなプラークの安定化に対するエオタキシン−2遮断の効果に関して、炎症性細胞の動員がエオタキシン−2遮断のために減衰されるとすると、サイトカイン環境が安定な表現型に対してさらに好都合であることが十分に理解されてもよい。これらの知見は、プラークの蓄積が、エオタキシン−2の遮断によって変化しなかった脂質特性によって影響を受ける可能性がさらに高いので、アテローム性動脈硬化症の程度の低下に必ずしも反映されなくてもよい。
文献
1.Viola A LA. ケモカインとその受容体:免疫及び炎症における薬剤標的。Annu Rev Pharmacol Toxicol 2008;48:171-97.
2.Jose PJ,
Griffiths-Johnson DA, Collins PD et al., エオタキシン:アレルギー性気道炎症のモルモットモデルで検出された強力な好酸球走化性サイトカイン。J Exp Med 1994; 179: 881-887.
3.Kitaura M, Nakajima T,
Imai T, et al., ヒトエオタキシン、好酸球選択性のCCケモカインの分子クローニング及び特異的好酸球エオタキシン受容体、CCケモカイン受容体3の特定。J Biol Chem 1996; 271 : 7725-7730.
4.Ponath PD, Qin S,
Ringler DJ, et al., ヒト好酸球化学誘引物質、エオタキシンのクローニング。発現、受容体結合及び機能的特性は好酸球の選択的動員のメカニズムを示唆する。J Clin Invest 1996; 97: 604-612.
5.Bocchino V, Bertorelli G, Bertrand CP, et al., 慢性気管支炎の悪化にてエオタキシンとCCR3は上方調節される。Allergy 2002; 57: 17-22.
6.Romagnani P, Annunziato F, Lasagni L, Lazzeri E, Beltrame C,
Francalanci M,. Uguccioni M, Galli G, Cosmi L, Maurenzig L, et al. 内皮細胞によるCXCケモカイン受容体3の細胞周期依存性の発現は血管新生抑制活性に介在する。J. Clin. Invest. 2001; 107:53.
7.Berger O, Gan X, Gujuluva C, Burns AR, Sulur G, Stins M, Way D5
Witte M, Weinand M, Said J, Kim KS, Taub D, Graves MC, Fiala M. 冠状動脈及び脳の内皮におけるCXC及びCCケモカインの受容体。MoI Med. 1999; 5: 795-805.
8.Cheng SS, Lukacs NW,
Kunkel SL. エオタキシン/CCLIIは、ヒト皮膚の微小血管の内皮細胞から分泌されるIL−8/CXCLCZCL8を抑制する。J Immunol 2002; 168 2887-2894.
9.Salcedo, R., J. H. Resau, D. Halverson, E. A. Hudson, M. Dambach, D.
Powell, K. Wasserman, J. J. Oppenheim. 2000.ヒトの微小血管内皮細胞と臍静脈内皮細胞によるケモカイン受容体(CXCR1〜3)の差次的な発現と反応性。FASEB J. 14:2055.
10.Salcedo, R., H. A. Young, M. L. Ponce, J. M. Ward, H. K. Kleinman,
W. J. Murphy, J. J. Oppenheim. 2001. エオタキシン(CCL11)は、ヒトのCCR3+内皮細胞による生体内の血管新生反応を誘導する。J. Immunol. 166:7571
11.R.B. Kodali, WJ. Kim and I.I. Galaria et al., CCL11(エオタキシン)は、CCR−3依存性の平滑筋細胞の遊走を誘導する。Arterioscler Thromb Vase Biol 24 (2004), pp. 1211-1216.
12.Forssmann U. et al. エオタキシン−2、ケモカイン受容体CCR3に選択的であり、ヒトの好酸球と好塩基球に対してエオタキシンのように作用する新規のCCケモカイン。J.Exp.Med. 1997; 185:2171-2176
13.Romagnani P AF,
Lasagni L, Lazzeri E, Beltrame C, Francalanci M, Uguccioni M, Galli G, Cosmi L,
Maurenzig L, Baggiolini M, Maggi E, Romagnani S,Serio M. 内皮細胞によるCXCケモカイン受容体3の細胞周期依存性の発現は血管新生活性に介在する。J Clin Invest 2001;107(l):53-63.
14.Garcia G GV, Humbert
M. 新しいケモカインは喘息の治療法を標的とする。ep 2005;5(2): 155-60.
15.Zimmerman NP VR, Wendt MK, Dwinell MB. 炎症性大腸疾患における腸管内皮バリアでの粘膜恒常性におけるケモカインとケモカイン受容体。Dis 2008;14(7):1000-ll.
16.Simpson J RP, Newcombe J, Cuzner ML, Male D, Woodroofe MN.多発性硬化症の中枢神経系組織におけるβ−ケモカイン、CCR2、CCR3及びCCR5の発現。J Neuroimmunol 2000;108(l-2):192-200.
17.Firestein GS. 関節リウマチの発展する概念。Nature
2003;423(6937):356-6.
18.Arend WP.関節リウマチにおけるサイトカイン経路の生理学。Arthritis Rheum 2001;45(l):101-6.
19.Guglielmotti A DOE, Coletta I, Aquilini L, Milanese C3 Pinza M. ビンダリット、MCP−1の阻害剤とTNF−αの産生を伴う治療によるラットのアジュバント関節炎の改善。Inflamm Res 2002;51(5):252-8.
20.Haas CS MR, Attia N, Haines GK 3rd, Campbell PL, Koch AE. ラットのアジュバント誘導の関節炎におけるケモカイン受容体の発現。Arthritis Rheum 2005; 52(12) :3718-30.
21.Haringman JJ ST,
Reinders-Blankert P, Tak PP. 関節リウマチ、変形性関節症及び反応性関節炎の患者の対になった末梢血単核細胞と滑膜組織におけるケモカインとケモカイン受容体の発現。Ann Rheum Dis 2006;65(3):294-300.
22.Charo IF, Taubman MB. 血管疾患の病因におけるケモカイン。Circ
Res. 2004; 95: 858-66.
23.Sheikine S, Hansson GK. アテローム性動脈硬化症における治療標的の可能性としてのケモカイン。Curr Drug Targets 2006; 7: 13-28.
24.Haley KJ, Lilly CM, Yang JH, et al., ヒトのアテローム性動脈硬化症におけるエオタキシンとCCR3受容体の過剰発現:ゲノム技術を用いて血管炎症の新規の経路の可能性を特定する。Circulation 2000; 102: 2185-2189.
25.Sheikine Y, Olsen B, Gharizadeh B, Jatta K, Tornvall P, Ghaderi M. 心筋梗塞生存者と健常対照におけるエオタキシンの血漿濃度に対するエオタキシン67G>A多型の影響。Atherosclerosis. 2006; 189: 458-63.
26.Emanuele E, Falcone C, D'Angelo A, Minoretti P, Buzzi MP5 Bertona M,
Geroldi D. 血管造影冠状動脈疾患の存在及び程度とエオタキシンの血漿濃度の関連。Atherosclerosis.
2006 May;186(l):140-5.
27.E. Economou, D. Tousoulis and A. Katinioti et al., 虚血性心疾患の患者におけるケモカイン及び冠状血管形成の効果。Int J Cardiol 80 (2001), pp. 55-60.
28.Naghavi M, et al. 不安定プラークから不安定患者へ:新しい定義とリスク評価戦略への呼びかけ、第I部.Circulation. 2003; 108: 1664-72.
29.Naghavi M, et al. 不安定プラークから不安定患者へ:新しい定義とリスク評価戦略への呼びかけ、第II部.Circulation. 2003; 108: 1772-8.
30.Mendel I et al. Eur J
Immunol 1995 25:1951-9
31.argari M et al. Neurosci Lett. 2007. 412: 24-8
32.Delovitch TL, and
Singh B. Immunity 1997 Dec; 7(6):727-38.
33.George J, Afek A, Gilburd B, Aron-Maor A Shaish A, Levkovitz H,
Blank M, Harats D, Shoenfeld Y. ベータ2糖タンパク質Iで免疫したLDL受容体欠損マウスにおける早期アテローム性動脈硬化症の誘導。Circulation. 1998; 15: 1108-1115.
【表1】

【技術分野】
【0001】
本発明は、炎症性疾患、自己免疫疾患及び循環器疾患の治療におけるエオタキシン−2(CCL24)の阻害剤の使用、特に抗エオタキシン−2ポリクローナル抗体又はモノクローナル抗体に関する。
【背景技術】
【0002】
ケモカインは、白血球の化学誘引物質として作用し、これら細胞の恒常的な輸送と共に、炎症部位への特異的な細胞集団の動員の双方を調節する小型サイトカインである。ケモカインの調節不全は、炎症及び自己免疫を含む免疫系に関与する広範なヒトの疾患で役割を担うと考えられる(1)。
【0003】
ヒトのエオタキシンファミリーには、CCケモカインファミリーに属する3つの既知のサイトカインが含まれる。
【0004】
エオタキシン1(好酸球走化性タンパク質1;エオタキシン又はケモカイン(C−Cモチーフ)リガンド11(CCL11)とも呼ばれる)は、その走化性を誘導することによって好酸球を選択的に動員することが知られているので、アレルギー反応に関係するとみなされている。
【0005】
エオタキシン2(好酸球走化性タンパク質2;ケモカイン(C−Cモチーフ)リガンド24(CCL24)、骨髄性前駆細胞阻害因子2(MPIF−2)とも呼ばれる)は、好酸球(2〜4)、好塩基球(4)、Th2型リンパ球(5)及び好中球を含む炎症性細胞の強力な化学誘引物質である。エオタキシン−2は、種々の型の内皮細胞で発現され(5〜9)、内皮細胞(10)及び平滑筋細胞(11)において血管新生反応及び遊走性反応を誘導する。
【0006】
エオタキシン3(好酸球走化性タンパク質3;ケモカイン(C−Cモチーフ)リガンド26(CCL26)、マクロファージ炎症性タンパク質−4α(MIP−4α)、胸腺間質ケモカイン−1(TSC−1)及びIMAC)は、好酸球と好塩基球に対して走化性である。
【0007】
エオタキシン−2はエオタキシンとたった39%相同であるにすぎず、2つのポリペプチドはNH2−末端領域にてほぼ完全に異なる(12)。エオタキシン−2は染色体7q11.23に局在し、エオタキシンは染色体17q21.1に局在する。エオタキシン−3の遺伝子は、第7染色体上でエオタキシン−2の近くにあるが、それとは33%の相同性を共有するにすぎない。これらのケモカインはCCR3受容体に特異的に結合する。エオタキシンの受容体であるCCR3は、好酸球を始めとして、マクロファージや内皮細胞を含む多種多様な細胞で発現される、7回膜貫通型のGタンパク質共役受容体である(13)。
【0008】
WO97/00960は、ヒトのエオタキシン(CCL11)をコードする核酸、並びに単離された又は組換えのヒトのエオタキシンタンパク質を開示している。WO97/00960はまた、特定部位への好酸球の動員又はアレルギー状態の治療におけるエオタキシンタンパク質の使用方法も開示している。
【0009】
CCR3の発現は元々、喘息及びアレルギーの発病機序で検討され、それは治療目標として役立ち続けている(14)。しかしながら、さらに最近、この経路の役割は、炎症性大腸炎(15)、多発性硬化症(16)及び関節リウマチ(RA)を含むさらなる炎症性疾患及び自己免疫性疾患の研究にて明らかになっている。
【0010】
関節リウマチ(RA)は、広範な炎症性細胞による滑膜組織への激しい破壊的な浸潤を特徴とする一般的な慢性の炎症性疾患である(17)。マクロファージ及び線維芽細胞に由来する複数のサイトカインが(RA)(18) におけるサイトカイン及びケモカイン双方の分泌に関与する。関節腔における白血球の蓄積は、サイトカイン及びマトリクス分解酵素を含む組織分解因子の分泌をもたらす。
【0011】
ケモカインの阻害は、一般に使用されるRAの動物モデルであるアジュバント誘発の関節炎における治療の選択肢として以前検討された(19)。同じモデルを用いて、CCR3は、滑膜組織への白血球の動員で役割を担うことが示された(20)。多数のケモカイン及びサイトカインの受容体の差次的発現もRA患者の血清や滑膜組織で実証された(21)。
【0012】
サイトカインやケモカインが関与する炎症は、アテローム性動脈硬化症のプラーク増殖、及び脱安定化し、その後破裂させる傾向を促進することにおいて極めて重要な役割を担うと考えられている(22,23)。エオタキシン/CCL24の受容体(CCR3)はプラークのマクロファージで発現されている(24)。臨床試験によって、健常人のコホートにてエオタキシン遺伝子の非保存的多型が心筋梗塞の高いリスクを関連していることが明らかにされた(25)。その後の試験で、高いレベルの循環エオタキシンは冠状動脈のアテローム性動脈硬化症と虚血の存在に関連することが見い出された(26,27)。
【0013】
アテローム性動脈硬化症は、脂肪沈着が動脈壁で進行し、管腔の進行性の狭窄をもたらす過程である。成熟したプラークは、2つの基本構造:脂質のコアと線維性のキャップから構成される。脂質のコアが小さければ小さいほど、線維性のキャップは厚く、さらに安定なプラークとなるということは、破裂し、心筋梗塞又は不安定狭心症を起こす傾向が低下することを意味する。急性の冠状動脈症候群(たとえば、心筋梗塞及び不安定狭心症)の原因となるプラークのほとんどが、<70%の狭窄を有することが血管造影で示されることは今や明らかである(28、29にて概説された)。これらの病変のおよそ60%は、大きな血栓形成性の脂質コアと壊死性の残渣(マクロファージ、T細胞、古い出血、血管形成及びカルシウムの病巣を含む)を伴ったプラークの破裂が原因で生じる。おそらく、マクロファージがプラークを移動するにつれてそれを消化するマトリクスメタロプロテイナーゼを分泌し、平滑筋(プラークの要素を支えている)が、たとえば、炎症性サイトカインのような幾つかの因子によって生じる老化又はアポトーシスのために激減するために、破裂したキャップは薄い。
【0014】
WO06/93932は、個体の血清にてエオタキシンのレベルを測定することによってアテローム性動脈硬化症を検出する又は診断する方法を開示している。その出願はさらに、血清における高いレベルのエオタキシンが症状の発症前にアテローム性動脈硬化症を診断する手段を提供する可能性があることを示唆している。
【0015】
上記の出版物はいずれも、炎症性疾患、自己免疫疾患又は循環器疾患の治療のための治療的介入についての標的としてのエオタキシン−2を教示していないし、示唆もしていない。
【発明の概要】
【発明が解決しようとする課題】
【0016】
本発明は、ポリクローナル抗体又はモノクローナル抗体によるエオタキシン−2の阻害が、たとえば、関節リウマチ、実験的自己免疫脳脊髄炎(EAE)、大腸炎、糖尿病及びアテローム性動脈硬化症のような炎症性疾患の動物モデルにおいて十分な予防効果を有するという知見に基づく。理論によって束縛されることを望まないで、予防効果は、少なくとも部分的には、活性のある炎症性細胞(リンパ球及び単核細胞)の接着性及び遊走性の減衰が介在し得た。従って、本発明は、炎症性疾患及び/又は自己免疫疾患を治療するための治療剤を開発するための新規標的としてエオタキシン−2を導入する。本発明はまた、そのような疾患の治療において単独で使用するための又はほかの治療剤と併用するための特異的な抗エオタキシン−2抗体を提供する。
【0017】
炎症性疾患及び/又は自己免疫疾患には、たとえば、乾癬、炎症性大腸疾患(IBD)、(潰瘍性大腸炎及びクローン病を含む)、関節リウマチ、糖尿病、多発性硬化症、全身性エリテマトーデス(SLE)、強皮症及び天疱瘡が挙げられる。
【課題を解決するための手段】
【0018】
従って、その態様の第1によって、本発明は、少なくとも1つのエオタキシン−2拮抗物質と薬学上許容可能なキャリア又は賦形剤を含む、炎症性疾患、自己免疫疾患又は循環器疾患を治療するための医薬組成物を提供する。
【0019】
一実施形態では、上記エオタキシン−2拮抗物質は、抗エオタキシン−2抗体又は該抗体の結合活性を保持するその断片である。
【0020】
抗エオタキシン−2抗体は、モノクローナル抗体であってもポリクローナル抗体であってもよい。特定の実施形態では、抗エオタキシン−2抗体は、ヒト型抗体、ヒト化抗体又はキメラ抗体である。
【0021】
特定の実施形態では、抗エオタキシン−2抗体は、ハイブリドーマD8(ECACC受入番号D809081702)、ハイブリドーマG7又はハイブリドーマG8(ECACC受入番号G80908170)によって分泌されるモノクローナル抗体又は該抗体の結合活性を保持するその断片である。
【0022】
特定の特別な実施形態では、上記抗エオタキシン−2抗体は、
(a)配列番号1と少なくとも90%の相同性を有する核酸によってコードされる重鎖と配列番号2と少なくとも90%の相同性を有する核酸によってコードされる軽鎖を含むモノクローナル抗体;
(b)配列番号3と少なくとも90%の相同性を有する核酸によってコードされる重鎖と配列番号4と少なくとも90%の相同性を有する核酸によってコードされる軽鎖を含むモノクローナル抗体;
(c)配列番号5と少なくとも90%の相同性を有する核酸によってコードされる重鎖と配列番号6と少なくとも90%の相同性を有する核酸によってコードされる軽鎖を含むモノクローナル抗体;
(d)ハイブリドーマD8(ECACC受入番号D809081702)、ハイブリドーマG7又はハイブリドーマG8(ECACC受入番号G80908170)によって分泌されるモノクローナル抗体の重鎖をコードする核酸と少なくとも90%の相同性を有する核酸によってコードされる重鎖と、ハイブリドーマD8(ECACC受入番号D809081702)、ハイブリドーマG7又はハイブリドーマG8(ECACC受入番号G80908170)によって分泌されるモノクローナル抗体の軽鎖をコードする核酸と少なくとも90%の相同性を有する核酸によってコードされる軽鎖を含むモノクローナル抗体;及び
(e)該抗体の結合活性を保持する(a)〜(d)の抗体の断片
から成る群から選択されるモノクローナル抗体である。
【0023】
別の実施形態では、エオタキシン−2拮抗物質は、エオタキシン−2のmRNAに対して向けられたアンチセンス分子又はsiRNA分子である。
【0024】
別の実施形態では、エオタキシン−2拮抗物質は、小分子化合物である。
【0025】
特定の実施形態では、上記の炎症性疾患、自己免疫疾患又は循環器疾患は、アテローム性動脈硬化症、関節リウマチ、炎症性大腸疾患、多発性硬化症及び糖尿病から成る群から選択される。
【0026】
別の態様によって、本発明は、治療上有効な量の本発明のエオタキシン−2拮抗物質又は医薬組成物をそれが必要な患者に投与することを含む、炎症性疾患又は自己免疫疾患を治療する方法を提供する。
【0027】
本発明の特定の実施形態によれば、上記自己免疫疾患は、関節リウマチ、炎症性大腸疾患(たとえば、大腸炎)、多発性硬化症及び糖尿病から成る群から選択される。
【0028】
さらに別の態様によって、本発明は、治療上有効な量の本発明のエオタキシン−2拮抗物質又は医薬組成物をそれが必要な患者に投与することを含む、アテローム硬化性プラーク形成を阻害する方法を提供する。
【0029】
本発明は、治療上有効な量の本発明のエオタキシン−2拮抗物質又は医薬組成物をそれが必要な患者に投与することを含む、アテローム硬化性プラークを安定化させる方法を提供する。
【0030】
本発明は、治療上有効な量の本発明のエオタキシン−2拮抗物質又は医薬組成物を上記患者に投与することを含む、急性冠状動脈症候群の患者において主要な心血管系事象を予防する方法を提供する。
【0031】
本発明の方法はまた、少なくとも1つの追加の治療剤との併用で上記エオタキシン−2拮抗物質又は上記医薬組成物を投与することも包含する。
【0032】
特定の実施形態によれば、上記少なくとも1つの追加の治療剤は、化学療法剤、サイトカイン、ペプチド、抗体及び抗生剤から成る群から選択される。
【0033】
関節リウマチの治療については、上記追加の治療剤には、メソトレキセート、ステロイド、抗TNFα抗体、抗TNF受容体抗体、抗IL−6受容体抗体又は抗CD20抗体が挙げられるが、これらに限定されない。
【0034】
IBD(炎症性大腸疾患)の治療については、上記追加の治療剤には、シクロスポリン、NSAIDS(非ステロイド性抗炎症剤)、ステロイド又は抗TNF抗体(たとえば、インフリキシマブ)が挙げられるが、これらに限定されない。
【0035】
多発性硬化症の治療については、上記追加の治療剤には、コパキソン、インターフェロン−β、静脈内免疫グロブリン(IVIG)又はVLA−4に対するモノクローナル抗体(たとえば、チサブリ)が挙げられるが、これらに限定されない。
【0036】
本発明の一実施形態によれば、上記少なくとも1つの追加の治療剤は、エオタキシン−2拮抗物質又は上記医薬組成物と同時に投与される。
【0037】
本発明の別の実施形態によれば、上記少なくとも1つの追加の治療剤と上記エオタキシン−2拮抗物質又は上記医薬組成物は順次投与される。
【0038】
別の態様では、本発明は、抗エオタキシン−2モノクローナル抗体を分泌するハイブリドーマ細胞株を提供するが、上記ハイブリドーマは、D8(ECACC受入番号D809081702)、G7又はG8(ECACC受入番号G809081701)から成る群から選択される。
【0039】
本発明はまた、エオタキシン−2に向けられたモノクローナル抗体又はエオタキシン−2への結合活性を保持するその断片も提供するが、上記モノクローナル抗体は、ハイブリドーマD8(ECACC受入番号D809081702)、G7又はG8(ECACC受入番号G809081701)から分泌される。
【0040】
特定の実施形態では、本発明は、エオタキシン−2に向けられたモノクローナル抗体を提供するが、上記抗体は、
(a)配列番号1と少なくとも90%の相同性を有する核酸によってコードされる重鎖と配列番号2と少なくとも90%の相同性を有する核酸によってコードされる軽鎖を含むモノクローナル抗体;
(b)配列番号3と少なくとも90%の相同性を有する核酸によってコードされる重鎖と配列番号4と少なくとも90%の相同性を有する核酸によってコードされる軽鎖を含むモノクローナル抗体;
(c)配列番号5と少なくとも90%の相同性を有する核酸によってコードされる重鎖と配列番号6と少なくとも90%の相同性を有する核酸によってコードされる軽鎖を含むモノクローナル抗体;
(d)ハイブリドーマD8(ECACC受入番号D809081702)、G7又はG8(ECACC受入番号G809081701)によって分泌される抗体の重鎖をコードする核酸と少なくとも90%の相同性を有する核酸によってコードされる重鎖と、ハイブリドーマD8(ECACC受入番号D809081702)、G7又はG8(ECACC受入番号G809081701)によって分泌される抗体の軽鎖をコードする核酸と少なくとも90%の相同性を有する核酸によってコードされる軽鎖を含むモノクローナル抗体;及び
(e)該抗体の結合活性を保持する(a)〜(d)の抗体の断片
から成る群から選択されるモノクローナル抗体である。
【0041】
本発明はさらに、本発明のモノクローナル抗体又はその抗原結合部分をコードする単離された核酸分子に関すると共に、核酸分子を含む発現ベクターと該発現ベクターを含む宿主細胞に関する。
【0042】
特定の実施形態では、発現ベクターは、原核細胞株又は真核細胞株にて複製することが可能である。
【0043】
別の態様では、本発明はまた、炎症性疾患及び自己免疫疾患の治療におけるエオタキシン−2拮抗物質の使用を提供する。一実施形態では、上記エオタキシン−2拮抗物質は抗体である。
【0044】
本発明はまた、炎症性疾患及び自己免疫疾患の治療のための医薬組成物の調製におけるエオタキシン−2拮抗物質の使用も包含する。一実施形態では、上記エオタキシン−2拮抗物質は抗体である。
【図面の簡単な説明】
【0045】
本発明を理解し、それがどのように実践的に実行されてもよいかを理解するために、貼付の図面を参照して、非限定の例示としてのみ、実施形態を説明する。
【図1】エオタキシンと対比したエオタキシン−2への抗エオタキシン−2mAb(D8)の結合を示すグラフである。405nmでの光学密度(OD)の読み取りとして結果を提示する。種々の抗体濃度(5μ/mL〜50μ/mLの間)を測定した。
【図2A】D8で処理した細胞のフィブロネクチンに対する接着のレベルを示すグラフである。マウスIgGで処理した対照細胞と比較した接着比率として結果を示す。3種の細胞、マウス脾細胞、ラット脾細胞及びヒトPBMCを調べた。
【図2B】D8で処理した細胞のVEGFに向かった遊走を示すグラフである。マウスIgG(50μg)で処理した対照細胞と比較した遊走比率として結果を示す。グラフは、種々のD8の量(12.5、25及び50μg)を用いて、ラット脾細胞及びヒトPBMCから得た結果を示す。
【図3A】疾患の発症からの時間の関数としてのラットの関節炎スコア(AS)に対する抗エオタキシン−2モノクローナル抗体(G7、G8、D8)、IgG及びPBSによる処理の効果(±標準誤差)を示すグラフである。0日目は関節炎を誘発した日である。
【図3B】ラットの遊走スコアに対する抗エオタキシン−2モノクローナル抗体(G7、G8、D8)、IgG及びPBSによる処理の効果(±標準誤差)を示すグラフである。
【図3C】足首の直径(mm)に対する抗エオタキシン−2モノクローナル抗体(G7、G8、D8)、IgG及びPBSによる処理の効果(±標準誤差)を示すグラフである。
【図4A】PBS、IgG、D8、G7及びG8の抗体で処理したラットの関節の組織学的スコアを示すグラフである。
【図4B】D8(図4B)又はPBS(図4C)で処理したラットの関節の代表的な所見を示す写真(ヘマトキシリンエオシン(H&E)染色)である。
【図4C】D8(図4B)又はPBS(図4C)で処理したラットの関節の代表的な所見を示す写真(ヘマトキシリンエオシン(H&E)染色)である。
【図5】アジュバントで誘発した関節炎のラットの体重(グラム)に対する、時間(日)の関数としての、抗エオタキシン−2モノクローナル抗体(G7、G8、D8)、IgG及びPBSによる処理の効果(±標準誤差)を示すグラフである。
【図6A】アジュバントで誘発した関節炎における関節炎スコア(AS;Y軸)に対する、時間(日)の関数としての、3つの用量(20μg、100μg及び1000μg)での予防モードにおける抗エオタキシン−2抗体による処理の効果(±標準誤差、比率)を示すグラフである。
【図6B】アジュバントで誘発した関節炎における関節炎スコア(AS;Y軸)に対する、時間(日)の関数としての、3つの用量(20μg、100μg及び1000μg)での治療モード(関節炎の出現と共に投与)における抗エオタキシン−2抗体による処理の効果(±標準誤差、比率)を示すグラフである。
【図7】時間(日)の関数としての予防モード(±標準誤差)におけるアジュバントで誘発した関節炎の関節炎スコアに対する、PBSで処理した対照と比較した、D8(100μg)、メソトレキセート(0.25mg/kg)、及びD8(100μg)と併用したメソトレキセートの予防効果を示すグラフである。
【図8】PBS(図8A)及びD8(図8B)で処理したラットの関節の死後X線解析の写真である。足首の脱灰と早期の骨侵食(矢印頭)と同様に、強度の関節周囲の軟組織の腫脹が、PBSで処理したラット(星印)で明らかである(代表的な図)。
【図9A】時間(日)の関数としての、DSSで誘発した大腸炎のマウスにおける体重の増減比率を示すグラフである。5μg又は25μgの抗エオタキシン−2抗体D8でマウスを処理した。対照動物は、PBS又はIgGで処理した。
【図9B】DSSで誘発した大腸炎のマウスにおける%MPO活性を示すグラフである。5μg、25μg、100μg又は200μgの抗エオタキシン−2抗体D8でマウスを処理した。対照動物は、PBS又はIgGで処理した。
【図9C】抗エオタキシン−2抗体D8(5μg)又は対照(PBS)で処理した、DSS誘導大腸炎のマウスの血清における種々のサイトカイン(IL−10、IL−12p70、IL−6、MCP−1(単球化学誘引タンパク質−1)、及びTNF)のレベルを示すグラフである。
【図9D】5μg、25μg、100μg又は200μgの抗エオタキシン−2抗体D8で処理したDSS誘発大腸炎のマウスの結腸の組織学的解析のグラフによる表示である。対照動物は、PBS又はIgGで処理した。[I]病変の程度(大きさ)を表し、[II]炎症(炎症性細胞の浸潤)を表し、[III]損傷(組織の破壊)を表す。
【図10】PBS、IgG、抗エオタキシン−2抗体D8(25μg)又は抗エオタキシン−2抗体D8(100μg)のいずれかで処理した、誘発EAEマウスにおける時間の関数としての疾患の重症度の平均を示すグラフである。
【図11A】PBS又は抗エオタキシン−2抗体(D8)のいずれかで処理したNODマウスにおける時間の関数としての疾患の発生率(糖尿病マウスの比率)を示すグラフである。
【図11B】PBS又は抗エオタキシン−2抗体(D8)のいずれかで処理したNODマウスの血清におけるエオタキシン−2のレベル(pg/mL)を示すグラフである。
【図12A】不安定なプラークと対比した安定したプラークにおける炎症性因子の発現の定量的解析を示すグラフである。各群で4つのプラークを解析した。
【図12B】代表的な例を提供する画像である。
【図13】マウスのアテロームにおけるエオタキシン−2の免疫組織化学的な局在を示す画像である。図13Aは、特徴的な脂肪線条(AHA、クラスI〜II)を示し、図13Bは、中間的なプラーク(AHA、クラスII)を示し、図13Cは、アテローム性病変(AHA、クラスIII〜IV)を示し、図13Dは、無関係なIgGで染色された陰性対照を示す。太い矢印はエオタキシン−2陽性の代表的な内皮細胞を示すが、細い矢印はプラークのマクロファージでの各染色を示す。
【図14】図14Aは、若齢又は老齢のKOApoEマウスの大動脈におけるエオタキシン−2とTGFβのmRNAの発現を示すゲルの画像である。図14Bは、oxLDLと共にインキュベートしたマウスH5Vの内皮細胞におけるエオタキシン−2とTGFβのmRNAの発現を示すゲルの画像である。
【図15】図15Aは、内皮への単核細胞(脾細胞)の接着に対するエオタキシン−2の阻止の効果を示すグラフである。図15Bは、本質的に類似のプロトコールにて単球/マクロファージ細胞株で行った代表的な結果を示す。*p<0.05
【図16】図16Aは、抗エオタキシン−2抗体による4週間の処理に反応した病変(プラーク)の大きさを示すグラフである。図16Bは、抗エオタキシン−2抗体による10週間の処理に反応した病変(プラーク)の大きさを示すグラフである。図16Cは、抗エオタキシン−2抗体による10週間の処理に反応した線維領域の比率を示すグラフである。*p<0.01、**p<0.05.
【図17】エオタキシン−2に対する阻止抗体で処理したapoEマウスの代表的な切片の画像である。図17A〜Cは、それぞれ、PBS、対照IgG、エオタキシン−2抗体による処理の脂肪線条病変の代表的なオイルレッド染色を示す。図17D〜Fは、類似のマウス群でのさらに長い処理試験におけるさらに進んだ病変の類似の評価を示す。図17G〜I及びJ〜Lはそれぞれ、PBS、対照IgG、エオタキシン−2抗体による処理のMassonの三色組織化学試験及びvon Giessonの組織化学試験(それぞれ)を示す。
【発明を実施するための形態】
【0046】
本発明は、エオタキシン−2(CCL24)に特異的に結合し、その機能を阻害する抗体に関する。さらに、本発明は、該抗体を含む医薬組成物、並びに炎症性疾患、自己免疫疾患及び循環器疾患の治療のためのそれらの使用に関する。
【0047】
本発明がさらに理解され易いように、詳細な説明の全体にわたって種々の定義が示される。
【0048】
態様の1つに従って、本発明の治療方法は、エオタキシン−2の活性及び/又は発現を低減することができる治療上有効な量のエオタキシン−2拮抗物質をそれが必要な患者に提供することによって達成され、それによって患者において炎症性疾患、自己免疫疾患又はアテローム性動脈硬化症疾患を軽減する。
【0049】
本明細書で使用されるとき、用語「患者」は、哺乳類(たとえば、イヌ、ネコ、ブタ、ウマ、ウシ、又はヒト)のような、本発明から恩恵を受けてもよい対象を指す。特定の一実施形態では、患者はヒトである。
【0050】
本明細書で使用されるとき、用語「治療」は、エオタキシン−2が介在する疾患又は症状の有害な効果を軽減すること、予防すること、治癒させること、覆すこと、減衰すること、緩和すること、できるだけ抑えること、又は止めることを指す。
【0051】
用語「エオタキシン−2」(好酸球走化性タンパク質2)、「CCL24」(ケモカイン(C−Cモチーフ)リガンド24)、又は「MPIF−2」(骨髄性前駆細胞阻害因子2)は相互交換可能に使用され、ヒトCCL24遺伝子によってコードされ、ヒト第7染色体上に局在し、当該技術で既知であるCCケモカインファミリーに属するサイトカインを指す。
【0052】
CCL24は、ケモカイン受容体CCR3と相互作用する。CCL24の活性は、好酸球、好塩基球、T細胞及び好中球における走化性の誘導、並びに内皮細胞及び平滑筋細胞における血管新生反応及び遊走反応の誘導を指す。
【0053】
本明細書で使用されるとき、用語「炎症」は、たとえば、病原体や損傷細胞(たとえば、火傷、外傷、腫瘍が原因となる)のような有害な刺激、又は化学物質、熱若しくは寒冷のような刺激物に対する免疫系の複雑な生物反応を指す。用語「炎症性疾患」は、アテローム性動脈硬化症や種々の自己免疫疾患を含むが、これらに限定されない炎症に関連した疾患を指す。
【0054】
本明細書で使用されるとき、用語「アテローム性動脈硬化症」(アテローム硬化性血管疾患又はASVDとしても知られる)は、コレステロールのような脂肪物質の蓄積の結果、動脈壁が厚くなる病態症状である。この過程は、動脈の壁における慢性の炎症反応の結果であり、大部分は、機能的な高密度リポタンパク質(HDL)によるマクロファージからの脂肪やコレステロールの適当な除去かないままに、マクロファージの蓄積によるものであり、低密度のリポタンパク質によって助長される。動脈のこの硬化又は裏打ちは、動脈内での複数のプラークの形成によって引き起こされる。
【0055】
「アテローム硬化性プラーク」又は「アテローム」は、脂質(コレステロールと脂肪酸)、カルシウム及び種々の量の線維性結合組織を含有する細胞(ほとんどマクロファージ細胞)又は細胞残渣から構成される動脈壁の蓄積及び腫脹である。アテローム及び動脈壁の変化は、管腔径の変化なしで余分な壁の厚さを補填するのにちょうど十分な大きさの小型の動脈瘤(拡張)を普通生じる。成熟プラークは2つの基本構造:脂質コアと線維性のキャップから構成される。脂質コアが小さければ小さいほど、線維性のキャップは厚く、プラークはさらに安定であるということは、破裂し、心筋梗塞や不安定狭心症を起こす傾向が低下することを意味する。急性の冠状動脈症候群(たとえば、心筋梗塞及び不安定狭心症)の原因となるプラークのほとんどが、<70%の狭窄を有することが血管造影で示されることは今や明らかである(28、29にて概説された)。これらの病変のおよそ60%は、大きな血栓形成性の脂質コアと壊死性の残渣(マクロファージ、T細胞、古い出血、血管形成及びカルシウムの病巣を含む)を伴ったプラークの破裂が原因で生じる。
【0056】
本明細書で使用されるとき、用語「循環器疾患」(CVD)は、心臓(心)及び/又は全身性の血管(血管系)を冒し得る疾患を指す。循環器疾患のほとんどは、慢性の症状−長い間にわたって進展している又は持続している症状を反映する。しかしながら、循環器疾患の転帰の一部は、たとえば、心臓又は脳に血液を供給する血管が遮断されるときに突然起きる心臓発作や卒中のような急性の事象であり得る。CVDはまた、アテローム性動脈硬化症、冠状動脈心疾患(CHD)及び冠状動脈疾患(CAD)に関連する疾患−狭心症(不安定狭心症及び初発狭心症を含む)を招き得る心臓に供給する血管の疾患−強い胸部の痛み又は均一な心臓発作−心筋梗塞、及びST−又は非ST−上昇を包含する。
【0057】
本明細書で使用されるとき、用語「自己免疫疾患」は、生体に正常に存在する物質や組織に対する生体の過剰な免疫応答の結果生じる病態を記載する。免疫系は生体の一部を病原体と誤解し、それを攻撃する。これは、特定の臓器に限定されてもよく、又は肺と腎臓の双方にて基底膜を冒し得る、異なった部位における特定の組織を含んでもよい。たとえば、関節リウマチ、多発性硬化症及び大腸炎のような例となる疾患の少なくともすべてを含む自己免疫疾患の例、並びに顕著な例には、とりわけ、セリアック病、1型糖尿病(IDDM)、全身性エリテマトーデス(SLE)、シューグレン症候群、チャーグ・ストラウス症候群、橋本病、グラーベ病、乾癬、炎症性大腸疾患(潰瘍性大腸炎及びクローン病)、強皮症及び天疱瘡が挙げられる。
【0058】
本明細書で使用されるとき、用語「エオタキシン−2拮抗物質」は、エオタキシン−2/CCL24と相互作用し、正常な活性又はサイトカインの発現を阻止する又は抑える分子を指す。本発明のこの態様に従って多数の剤を使用することができる。従って、たとえば、拮抗物質は、エオタキシン−2の活性を阻害する抗体、小分子化合物、siRNA、DNAzye、リボザイム、又はアンチセンスポリヌクレオチドであることができる。
【0059】
本発明の文脈で、用語「抗エオタキシン−2抗体」は、ポリクローナル抗体及びモノクローナル抗体を包含する。さらに、抗体は、たとえば、マウスの抗体、キメラ抗体、ヒト化抗体及びヒト型抗体であってもよい。用語は、抗体全分子、並びに、たとえば、単鎖(SC)抗体、Fab、F(ab’)2又はFv抗体断片のような、エオタキシン−2に結合することが可能であるその機能的断片、並びにそれらの組み合わせを指す。
【0060】
血清免疫グロブリン(「ポリクローナル抗体」)又はその反応性部分の精製方法は、硫酸アンモニウム又は硫酸ナトリウムによる沈殿、その後の透析、イオン交換クロマトグラフィ、アフィニティクロマトグラフィ及びゲル濾過を含めて当該技術で周知である。
【0061】
本明細書で使用されるとき、用語「モノクローナル抗体」(mAb又はmoAbとも呼ばれる)は、単クローンの細胞から産生される同一の単一特異性の抗体を指す。モノクローナル抗体を生成し、単離する方法は、たとえば、以下の実施例の区分で示されるように、当該技術で周知である。本発明はまた、キメラ抗体又はヒト化抗体も包含する。本明細書で使用されるとき、用語「ヒト化抗体」は、ヒトの主鎖を有し、非ヒト由来の相補性決定領域(CDR)を持つ抗体又はその断片を指す。非ヒトCDRは、たとえば、所望の特異性、親和性及び/又は能力を有するマウス、ラット、ウサギ又はヤギの抗体から得ることができる。特定の実施形態では、ヒト抗体の枠組みにて追加のアミノ酸が非ヒトの相方によって置き換えられて抗体の結合特性を改善する。本明細書で使用されるとき、「キメラ抗体」は、異なった種を起源とするポリペプチドを含有する抗体又はその断片であり、たとえば、マウス−ヒト抗体キメラは、抗体のマウスFc領域をヒトのそれで置き換えることによって得られる。
【0062】
ヒト化抗体を作製する方法は当該技術で周知である。ヒト化抗体は、ヒト抗体の「枠組み」に適当なCDRをコードする断片(所望の結合特性に関与する)を挿入することによって調製することができる。適当なベクターと宿主細胞(たとえば、哺乳類細胞)における発現を用いた組換えDNA法を介してこれを達成する。すなわち、所望の特性を有するモノクローナル抗体をマウス(又はほかの非ヒト動物)で作出した後、その抗体をコードするDNAを単離し、ベクターにクローニングして配列を決定する。次いで抗体のCDRに相当するDNA配列を決定する。いったん、所望のCDRの正確な配列が判明すれば、ヒト型抗体の変異体のためのDNAを含有する構築物にこれらの配列を適宜挿入するために戦略を考案することができる。
【0063】
本発明はさらに、エオタキシン−2への結合活性を保持する、抗エオタキシン−2抗体の断片を包含する。
【0064】
本明細書で使用されるとき、用語「Fab」は、抗体分子の単一の一価の抗原結合断片を含有する断片を指す。Fabは、一方の未処理の軽鎖と一部の重鎖を含み、抗体全体のパパインによる消化によって生成することができる。
【0065】
本明細書で使用されるとき、用語「(Fab)2」は、抗体全体のペプシンによる消化によって得られる抗体断片を指す。ペプシン消化によってFc部分にて抗体の切断を生じ、その結果、2つのFab断片を含有する二価の断片と小さな部分のFc断片を生じ、それらはS−S結合で接合される。「Fab」は、S−S結合の開裂を生じる(Fab)2の還元によって得られる。
【0066】
本明細書で使用されるとき、用語「Fv」は、軽鎖の可変領域と重鎖の可変領域を含有する遺伝子操作された断片を指す。
【0067】
本明細書で使用されるとき、用語「単鎖抗体」は、好適なリンカー(たとえば、ポリペプチド)によって連結された、軽鎖の可変領域と重鎖の可変領域を含有する遺伝子操作された分子を指す。単鎖抗体は通常、軽鎖と重鎖の可変領域とリンカーを含む融合ポリペプチドをコードする単一のポリヌクレオチドを発現させることによって調製される。単鎖抗体を調製する方法は、当該技術で周知であり、たとえば、米国特許第4,946,778号を参照のこと。
【0068】
本発明に係る抗体断片は、好適なプロテアーゼ、たとえば、パパイン若しくはペプシンを用いた抗体のタンパク分解加水分解によって、又は細菌(たとえば、大腸菌)若しくは哺乳類細胞(たとえば、チャイニーズハムスターの卵巣(CHO)細胞)のような宿主細胞における抗体断片をコードする核酸の組換え発現によって調製することができる。
【0069】
本発明の抗体は、発現ベクターを用いて好適な宿主細胞にて抗体をコードする核酸を発現させることによって組換え的に製造されてもよい。本明細書で使用されるとき、用語「発現ベクター」は、抗エオタキシン−2抗体の鎖をコードする遺伝情報を細胞に移すことが可能である核酸構築物を指す。挿入物は標的細胞で発現され、抗体が産生され、細胞の培地に分泌されるか、又は細胞から直接抽出される。ベクターは、たとえば、プラスミド、バクテリオファージ、及びそのほかのウイルス、コスミド、及び人工染色体に限定されない種々の起源のものであり得る。通常、操作されたベクターは、複製開始点、クローニング部位、選抜可能なマーカー及び本発明の抗体をコードする非相同の核酸を含む。ウイルスベクターは一般に、非感染性にしてあるが、ウイルスのプロモータと非相同の核酸を依然として含有するので、ウイルスのプロモータを用いて非相同の核酸を翻訳することができる、修飾されたウイルスのDNA又はRNAを運ぶ遺伝子操作されたウイルスである。ウイルスベクターの非限定例は、組換えレトロウイルス(レンチウイルスを含む)、アデノウイルス、アデノ関連ウイルス、SV40、単純性ヘルペスウイルス及びワクシニアウイルスである。
【0070】
特定の実施形態では、本発明はまた、免疫抱合体と、本発明の抗体を含む二重特異性分子も包含する。
【0071】
本明細書で使用されるとき、用語「アンチセンス療法」は、特定の疾患に影響を及ぼすことが知られる遺伝子の発現の阻害を含む治療の形態を指す。本発明の文脈では、アンチセンス療法は、エオタキシン−2のmRNAの発現を阻害することを目的とする。従って、療法には、エオタキシン−2のmRNA又はその断片の配列に相補的であり(アンチセンスオリゴヌクレオチド)、その遺伝子によって産生されるメッセンジャーRNA(mRNA)に結合し、それを不活化し、その遺伝子のスイッチを効果的に「切る」核酸(DNA、RNA、又は化学的類似体)の鎖の合成が関与する。
【0072】
本明細書で使用されるとき、用語「siRNA」(小型干渉RNA)は、短鎖干渉RNA又はスプライシングRNAとしても知られ、生物学において様々な役割を担う通常、長さ20〜25ヌクレオチドの二本鎖RNA分子の部類である。最も顕著には、siRNAは、RNA干渉(RNAi)の経路に関与し、特定の遺伝子の発現に干渉する。
【0073】
本明細書で使用されるとき、用語「小分子化合物」は、有機化合物を指す。小分子の分子量の上限はおよそ800ダルトンである。
【0074】
本明細書で使用されるとき、用語「メソトレキセート」は、癌及び自己免疫疾患の治療に使用される代謝拮抗剤及び抗葉酸剤を指す。
【0075】
本発明の抗体を含む医薬組成物は、非経口投与、すなわち、皮下に、筋肉内に及び静脈内に投与するのに有用である。非経口投与用の組成物は一般に、許容可能なキャリア又は賦形剤、好ましくは水性キャリアに溶解された抗体を含む。種々の水性キャリア、たとえば、水、緩衝水、生理食塩水、PBS(リン酸緩衝化生理食塩水)、などを使用することができる。これらの溶液は無菌であり、一般に粒子状物質を含まない。組成物は必要に応じて生理的条件に近づける薬学上許容可能な補助物質、たとえば、pH調整剤及び緩衝化剤、毒性調整剤など、たとえば、酢酸ナトリウム、塩化ナトリウム、塩化カリウム、塩化カルシウム、乳酸ナトリウム、ヒスチジン及びアルギニンを含有してもよい。
【0076】
非経口投与用の組成物を調製する方法は、当業者に既知であり、又は明らかであり、たとえば、Remington’s Pharmaceutical Science(15th Ed., Mack Publishing Company, Easton, Pa., 1980)にさらに詳細に記載されている。
【0077】
本発明の抗体は、保存用に凍結する又は凍結乾燥することができ、使用前に好適なキャリアで再構成することができる。この技法は従来の免疫グロブリンで有効であることが示され、技術で知られる凍結乾燥法及び再構成法を使用することができる。
【0078】
治療目的で、症状及びその合併症を治療する又は少なくとも部分的に緩和するのに十分な量で組成物を投与する。これを達成するのに適切な量を「治療上有効な量」と定義する。この使用に効果的な量は、症状の重症度及び患者自身の免疫系の一般状態に左右されるが、一般に、1回当たり約0.01〜約150mgの抗体の範囲である。1日、1週間又は1ヵ月における単回又は複数回の投与の計画は、用量レベルで実施することができ、パターンは主治医によって選択される。
実施例
【0079】
モノクローナル抗体の製造
標準のプロトコールに従って、幾つかのクローンのmAbを製造した。手短には、20μgのエオタキシン−2(Peprotec、米国)でBalb/Cマウスを免疫し、その後4回追加免疫した。血清中に抗エオタキシン−2ポリクローナルAbの存在を確認した後、マウスを屠殺し、脾臓から細胞を単離し、NS/0骨髄腫細胞とハイブリッドを形成させ、その後、エオタキシン−2への結合についてクローンをスクリーニングした。次いで、無血清培地にて2〜3週間、ハイブリドーマを増殖させ、培地を回収し、100kDaのセントリコン(Biological Industries、イスラエル)によって濃縮した。mAbの1つ(D8)のマウスのエオタキシン−2との交差反応性をELISAによって確認した。
【0080】
モノクローナル抗体D8、G8及びG7の核酸配列を決定するのに以下のプライマーを用いた:
重鎖(IgGγ−1)
正方向(配列番号7)
5’−CGAAGAGACAGTGACCAGAGTCCCTTGGCCCCAGTAAGCAAAGCTATTACCGAAGGTACAGTAATACACGGCCGTGTC−3’
逆方向(配列番号8)
5’−CGGGGAAGTAGTCCTTGACCAGGC−3’
軽鎖(κ)
正方向(配列番号9)
(変性)5’−RRHRYYBWDMTVACHARWC−3’
又は(配列番号10)
5’GATGTCTTGTGAGTGGCCTCAC−3’
逆方向(配列番号11)
5’−TGGGATAGAAGTTATTCAGCAGGC−3’
【0081】
結合アッセイ
1μg/mLのエオタキシン又はエオタキシン−2(炭酸緩衝液中)のいずれかでプレートを4℃にて一晩被覆した。プレートをPBSで3回洗浄し、2%BSAによって37℃にて45分間ブロックした。PBSによって連続希釈した抗エオタキシン−2抗体(D8クローン)を37℃にて1.5時間入れた。上記のように洗浄を繰り返し、ペルオキシダーゼ結合のヤギ抗マウス抗体と共にプレートを37℃にて1時間インキュベートした。上記のように洗浄を繰り返し、発色基質を用いて結合を検出した。
【0082】
脾細胞接着アッセイ
接着アッセイでは、C57BlマウスとLewisラットの脾細胞をファイコール勾配で分離し、一晩のインキュベート用に10cmのシャーレに入れた。翌日細胞を回収し、上昇濃度のD8又はマウスの総IgG(5〜50μg/mL)によって回転しながら2時間予備処理した。次いで、細胞を遠心し、フィブロネクチンで予備被覆した96穴プレートに入れた。1時間のインキュベートの後、非付着細胞を洗い流し、付着細胞の量をXTTキット(Biological Industries、イスラエル)を用いて分析した。健常な供与者から回収した末梢血単核細胞(PBMC)を用いて同様の接着アッセイを行った。
【0083】
遊走アッセイ
D8(30μg/mL)で予備処理したラット脾細胞及びヒトPBMCと同様にC57BL/6J由来の脾細胞をTrans−Well系の上部チャンバーに入れた。下部チャンバーは、VEGF(血管内皮増殖因子)(20ng/mL)を補完した無血清培地を含有した。4時間後、下部チャンバーの培地を回収し、フローサイトメトリーを用いて細胞を計数した(1分当たりに回収される細胞数)。
【0084】
プラーク及び心血管系の試験管内試験:
I.ヒトの頚動脈プラークの調製とタンパク質アレイ
ヒトのアテローム硬化性プラークを2群の患者から回収した。無症候性の重度アテローム性頚動脈硬化症の患者の動脈内膜切除検体から安定プラーク(n=4)を得た。不安定プラークの代表的なものは、急性心筋梗塞の患者の責任血管の経皮冠動脈形成の際得られた検体だった(n=4)。専用の吸引装置によって血栓切除を行った。得られた材料は、赤色血栓、白色血栓、及び責任動脈の不安定プラークの断片から成る。洗浄と溶解の後、残りの組織は、大部分、破裂したアテローム硬化性プラークの断片を含む。
安定及び不安定のヒトのプラークにて40のサイトカイン、ケモカイン及び増殖因子を検出するのにRayBio(商標)ヒト炎症抗体アレイ3.1(Ray Biotech、米国)を用いた。手短には、ペレット乳棒を用いてキット内で提供された溶解緩衝液にてプラークをホモジナイズした。各試料の500mgのタンパク質と共にアレイをインキュベートし、製造元の指示書に従って進展させた。TINA2.0プログラムを用いて結果を解析した。
【0085】
II.毛細管細胞
10%のウシ胎児血清(FCS)(Invitrogen)と1%のペニシリン/硫酸ストレプトマイシン(Biological Industries、イスラエル)を補完したDMEMF−12(Biological Industries、イスラエル)にてマウスの毛細管細胞(H5V)を培養した。8%CO2と共に多湿インキュベータにて37℃で細胞を維持した。1%のFCSと1%のペニシリン/硫酸ストレプトマイシンを含有する完全培地RPMI1640にて106個の細胞/mLの濃度で単球様のU937細胞を培養した。5%CO2の多湿インキュベータにて37℃で細胞を維持した。
【0086】
III.内皮細胞による接着アッセイ
接着アッセイにて、oxLDL、1μg/mL(以前記載されたように調製した、33)の存在下でH5Vマウス内皮細胞を72時間インキュベートした。次いで、oxLDL、1μg/mLの存在下、4×103個/ウェルの濃度で96穴プレートに細胞を一晩入れた。翌日、中和ヤギ抗マウスエオタキシン−2抗体(Cytolab、米国)又はヤギIgGで細胞を1時間予備処理した後、U937細胞又はApoEマウスの脾臓由来の細胞を8×104個/ウェルの濃度で加えた。1時間のインキュベートの後、非付着細胞を洗い流し、付着細胞の量をXTTキット(Biological Industries、イスラエル)を用いて分析した。
【0087】
IV.大動脈とH5V内皮細胞のPCR解析
製造元のプロトコールに従ってEZ−RNAキット(Biological Industries、イスラエル)を用いてチオシアン酸グアニジニウムとフェノールクロロホルムの方法によって組織試料及びH5V内皮細胞からRNAを単離した。従来の熱サイクラーにてAMV逆転写酵素(TaKaRaのRNAPCRキット、日本のタカラ)を用いてRT−PCRを実施した。ホットスタートTaKaRaExTaqDNAポリメラーゼを用いて特定の遺伝子の増幅を実施した。エオタキシン−2とTGFβのマウスmRNAについて、イントロン配列を補う特定のプライマーを設計した(表1)。G3PDHとTGFβについて以下のPCR条件:95℃で2分間、次いで95℃で2秒間と55℃で45秒間と72℃で1分間を27サイクル(G3PDH)又は35サイクル(TGFβ)での試料のインキュベートを用いた。出発温度70℃と、30サイクルの増幅と、60℃でのアニーリング温度によって、エオタキシン−2mRNAの発現の解析にタッチダウンPCR増幅プロトコールを用いた。PCR試料を2%アガロースゲル上で泳動させ、Gelstar核酸染色(Gambrex、USA)で染色し、300nmのUVトランスイルミネータによってPCR産物を可視化し、ポラロイドカメラ方式によって撮影した。逆転写に先立って精製したRNA試料にてグリセルアルデヒド−3−リン酸脱水素酵素(G3PDH)のPCR反応を行うことによって単離されたRNAのゲノムの混入の非存在を確認した。ヌクレアーゼを含まない水の陰性対照は、試料の試行すべてに含めた。各RNA試料は数回解析した。
【0088】
V.大動脈洞の免疫組織化学的な解析
間接免疫ペルオキシダーゼ染色によって大動脈洞のクリオスタット切片(厚さ5μm)を評価した。その後、スライドをメイヤーのヘマトキシリンで対比染色し、グリセロール(Dako)で標本にした。親和性精製したヤギ抗マウスエオタキシン−2(Cytolab、イスラエル)を用いて免疫組織化学的な染色を行った。
【0089】
統計的解析
一方向ANOVA検定によって群間の比較を行った。p<0.05を統計的に有意であるとみなした。結果は平均値と標準誤差として表す。
【0090】
実施例1:抗エオタキシン−2mAb(D8)の特異性と抗炎症効果
上述のように抗エオタキシン−2マウスモノクローナル抗体(mAb)の幾つかのクローンを調製した。
D8抗体の重鎖をコードする核酸配列は配列番号1として示される:
GGGCAGCAGANCCGGGGCNGNGGATAGACAGANGGGGGNNGNCGTTTTGGCTGA
GGAGACGGTGACTGAGGTTCCTTGACCCCAGTTGTCCATAGCGTAGCTACTACCGTAGGA ATGACTTGCACAGAAATATG
TAGCCGTGTCCTCATTTCTGAGGTTGTTGATCTGCAAATAGGCAGTGCTGGCAGAGGTTTC
CAAAGAGAGGGCAAACCGT
CCCTTGAAGTCATCAGTATATGTTGGCTCTCCATTGTAGGTGTTGATCCAGCCCATCCACTT
TAAACCCTTTCCTGGAGC CTGCTTTACCCAGTTCATTCCAGAGTTTGTGAAGGGATACCCAGAAGCCCTGCAGGAGATC
TTGACTGTGTCTCCAGGCT
TCTTCAGCTCANGTCCAGACTGCACCAACTGGATCTGGGCCATGGCCNGCTA
【0091】
D8抗体の軽鎖(κ)をコードする核酸配列は配列番号2として示される:
GGGCCAATGGNNGAGGACGCGGATGGGGGTGTCGNNGTGC
CTTNGTCGNNNNCTNNTTGNNCANCNTCNACNNCNNNNANNNNANNGNNNNNTGNAANA
NNGATGGNNNTNNNCNACANN
NTGGNNTCCTNNNNNNNTNNNNTGNNNNNGACNNCANANACANNNNCNACNNNATGANC
NNCNNNCNNNNNTTGANNNNN
GNCNANTATGAACNANNNAANNNNNNTACCTGNNANGCCACTCACAAGACATCA
【0092】
G8抗体の重鎖をコードする核酸配列は配列番号3として示される:
GGGCAGCAGNTCCAGGGGCCAGNGGATAGACAGANGGGGGNGTCGTTTTGGCTG
AGGAGACGGTGACTGAGGTTCCTTGACCCCAGTTGTCCATAGCGTAGCTACTACCGTAGG
AATGACT
TGCACAGAAATAT
GTAGCCGTGTCCTCATTTCTGAGGTTGTTGATCTGCAAATAGGCAGTGCTGGCAGAGGTTT CCAAAGAGAGGGCAAACCG
TCCCTTGAAGTCATCAGTATATGTTGGCTCTCCATTGTAGGTGTTGATCCAGCCCATCCACT
TTAAACCCTTTCCTGGAG
CCTGCTTTACCCAGTTCATTCCAGAGTTTGTGAAGGGATACCCAGAAGCCCTGCAGGAGAT
CTTGACTGTGTCTCCAGGC TTCTTCAGCTCAGGTCCAGACTGCACCAACTGGATCTGGGCCATGGCCGGCTANN
【0093】
G8抗体の軽鎖(κ)をコードする核酸配列は配列番号4として示される:
GGGCCAATGGNNGAGGACGCGGATGGGGGTGTCGNNGTGCCT
TNGTCGNGTGCTTNTTGAACAACTTCTACCCCNNANACNTNANNGTNNNNTGGAANATTG ATGGCNGTGAACGACAAAAT
GGCGTCCTGAACANTTGGACTGATCCANGACAGCAAANACANCNCCTACAGCATGAGCAG
CACCCTCACGTTGACNNNNG
ACNANTNTGAACGACGTANNNNCNNTACCTGTNANGCCACTCACAAGACATCA
【0094】
G7抗体の重鎖をコードする核酸配列は配列番号5として示される:
GGGCAGCAGNTCCAGGGGCCAGNNGGATAGACAGANGGGGGNGNCGTTTTGGCT
GAGGAGACGGTGACTGAGGTTCCTTGACCCCAGTTGTCCATAGCGTAGCTACTACCGTAG
GAATGACTTGCACAGAAATA
TGTAGCCGTGTCCTCATTTCTGAGGTTGTTGATCTGCAAATAGGCAGTGCTGGCAGAGGTT
TCCAAAGAGAGGGCAAACC
GTCCCTTGAAGTCATCAGTATATGTTGGCTCTCCATTGTAGGTGTTGATCCAGCCCATCCA
CTTTAAACCCTTTCCTGGA
GCCTGCTTTACCCAGTTCATTCCAGAGTTTGTGAAGGGATACCCAGAAGCCCTGCAGGAG
ATCTTGACTGTGTCTCCAGG
CTTCTTCAGCTCAGGTCCAGACTGCACCAACTGGATCTGGGCCATGGCCGGCTANN
【0095】
G7抗体の軽鎖(κ)をコードする核酸配列は配列番号6として示される:
GGGCCTTTGGNNGAGGACGCGGATGGGGGTGTCCNNGTGCCT
TNGTCGNGTGCTTNTTGAACAACTTCTACCCCNNANACNTNANNGTNNNNTGGAANATTG
ATGGCNGTGAACGACAAAAT
GGCGTCCTGAACANTTGGACTGATCCANGACAGCAAATACANCNCCTACAGCATGAGCAG
CACCCTCACGTTGACNNNNG
ACNANTNTGAACGACGTANNNNCNNTACCTGTNANGCCACTCACAAGACATCA
【0096】
上記核酸配列における文字Nは、ヌクレオチドA、T、C又はGのいずれかの存在を表す。
【0097】
D8モノクローナル抗体を産生するハイブリドーマは、受入番号D809081702のもとで2009年8月17日、英国ウィルトシャー州、ソールズベリーのヨーロッパコレクションオブセルカルチャー(ECACC)に寄託された。
【0098】
G8モノクローナル抗体を産生するハイブリドーマは、受入番号G809081701のもとで2009年8月17日、ECACCに寄託された。
【0099】
新規の抗エオタキシン−2抗体(D8)の特異性は、結合アッセイにて評価された。エオタキシン又はエオタキシン−2を被覆したプレートに、クローンD8にて産生されたmAbの連続希釈を一晩のインキュベートのために加えた。洗浄の後、ペルオキシダーゼ結合のヤギ抗マウス抗体と共にプレートをインキュベートし、再び洗浄し、発色基質を用いて結合を検出した。
【0100】
図1に示されるように、クローンD8のmAbは調べた希釈の全範囲にて、エオタキシン−2への有意な結合を示したが、エオタキシンへの結合は示さなかった。
【0101】
ヒトのPBMCと同様にマウス若しくはラットの脾細胞のフィブロネクチンへの接着を阻害する能力、又はVEGFへの遊走を減衰する能力についても抗体を調べた。D8(50μg)は、ヒトのPBMCと同様にマウス若しくはラットの脾細胞のフィブロネクチン(FN)への接着を35〜55%(図2A)阻害することが見い出された。VEGFへの遊走も用量依存性に減衰した(図2B)ということは、抗体の抗炎症性効果の可能性を裏付けている。
【0102】
実施例2:クローンD8mAbの抗炎症性の能力(生体内データ)
A.関節リウマチのモデル
フロインド不完全アジュバントの注射によってLewisラット(イスラエル、Harlanから得た6週齢オスLewisラット)でアジュバント関節炎を誘発した。フロインド不完全アジュバントは、熱で殺したMycobacterium Tuberculosisを10mg/mLにて鉱物油に懸濁することによって調製した。尾の付け根の皮下で10μLのアジュバントをラットに注射した。
アジュバント誘発の関節炎に対する、対照としての非特異的IgG及びPBSと比べた抗エオタキシン−2抗体の効果の評価
【0103】
エオタキシン−2に対するモノクローナル抗体(G7、G8、D8)による週3回の腹腔内(IP)注射によってラット(群当たり8匹)を処理した。対照は、マウスの総(非特異的)IgG又はPBSで処理した。注射はアジュバント投与後3日目に開始し、ラットを屠殺するまで週3回行った。
用量反応実験
【0104】
実験の第2の設定では、アジュバント誘発の関節炎モデルで最良の予防成績を示す抗エオタキシン−2抗体D8を用量反応モデルで調べた。上述のプロトコールに従ってアジュバント関節炎を誘発した。アジュバント注射の3日後に開始し、週3回、20μg、100μg又は1000μgの用量でのD8によって腹腔内でラット(群当たり6匹)を処理した。動物の別の設定(各群6匹)は、関節炎が発症した後、すなわち、関節炎がすでに明らかであるとき、同一用量で処理した(D8処理群)。
【0105】
既知の有効性の従来の抗炎症剤の有効性とD8の抗炎症性の有効性を比較するために、アジュバント注射の3日後に開始する0.25mg/kg、週1回のメソトレキセート(ip)で一群を処理した(メソトレキセート予防群)。追加の群は、3日目に開始する週3回の100μgのD8(ip注射)と併用して週1回の0.25mg/kgのメソトレキセートで処理した(併用D8−メソトレキセート予防群)。対照群は実験全体を通してPBSで処理した。
関節炎の重症度の評価
【0106】
体重、足の腫脹、関節炎スコア及び動物の全体的な動きを測定することによって関節炎の重症度を評価した。病理評価のために試料関節を得たが、足首関節の死後X線検査を実施して侵食を記録した。
【0107】
全身性の炎症の指標として2日に1回、グラムでの体重を測定した。
【0108】
(足腫脹の評価)キャリパを用いて、足首及び手首の径をmm(小数点第1位まで)で週3回記録した。
【0109】
(関節炎スコアの測定)以下:0=正常、1=足首又は手首の軽い紅斑及び/又は腫脹、2=足首又は手首の中程度の紅斑及び/又は腫脹、3=足首又は手首の重度の紅斑及び/又は腫脹、4=足指又は手指及び足首又は手首の完全な紅斑及び/又は腫脹及び足首又は手首を曲げることが不可能、のような腫脹、紅斑及び変形の程度(4つの手足すべてについて動物当たり、最大スコアは16)について0〜4の尺度で手足をスコア化した。
【0110】
その部分的な寄与に従って手指及び足指の腫脹を記録した。足首(足):各足指を0.2とスコア化した;手首:各手指を0.25とスコア化した。関節の合計を算出した。
【0111】
(運動性スコア)以下の定義:0=正常、1=やや損傷、2=主な損傷、3=足を踏みつけない、4=動かない;に従って0〜4の間で動物の全体的な運動性をスコア化した。
【0112】
(統計的解析)統計的解析には、QuickCalcsソフトウエア(カリフォルニア州、サンディエゴのGraph−Pad Software)を用いた。スチューデントのt検定を実施して実験群間の有意差を特定した。
結果
A.関節炎モデル
【0113】
免疫グロブリン(IgG)又はPBSで処理したものに比べて、抗エオタキシン−2抗体で処理したラットでは関節炎の有意な抑制が認められた。図3A〜3Cで明らかにされるように、抗体による抑制は調べたパラメータすべて(関節炎スコア、運動性スコア及び足首径)で明らかだった。D8と記された抗体は最も有意な効果を示した。関節炎スコア試験(図3A)では、PBSで処理したラット又はIgGで処理したラットとD8で処理したラットを比べると、13日目〜21日目まですべての測定で統計的に有意な差異(p<0.05)が得られた。予防効果は、注射後17日目で関節炎が出現すると即座に明らかになった。21日目の実験終了まで、その程度は増大し続けた。
【0114】
運動性スコア試験では、17日目から、PBSで処理したラットとD8で処理したラットを比べたとき、及び18日目から、PBSで処理したラット又はIgGで処理したラットとD8で処理したラットを比べたとき、あらゆる測定で統計的に有意な差異(p<0.05)が得られた。従って、21日目では、PBSで処理した動物の2.43に比べて、D8で処理した動物の運動性スコアの平均は1.37だった(p=0.005)。
【0115】
足首径試験では、19日目時点でのD8とPBSの間で統計的に有意な差異(p<0.05)が得られた。D8とIgGの間の差異は統計的な有意性に達しなかった。
【0116】
上記で示されたように、D8で処理したラットは、PBSで処理したラットよりも低い、2.6〜3.0の範囲の関節炎スコアを有した(図4A)。組織学的スコアについては、定義:0=正常、1=炎症性浸潤及び滑膜過形成、2=パンヌス形成及び軟骨侵食、3=重大な軟骨侵食と骨破壊、4=関節の整合性の喪失の程度について0〜4のスコアで各手足をスコア化した。関節炎ラットの関節の組織学的分析は、D8で処理したラットの関節が滑膜の過形成と散発的な炎症性浸潤を有するが、PBSで処理したラット(対照群)のほとんどはパンヌス形成と強度の炎症性浸潤を伴う重度の滑膜炎を有する(図4C)ことを示した。
【0117】
全身性の炎症反応に対する抗エオタキシン−2抗体による処理の効果を評価するために、動物の平均体重を記録した。図5に示されるように、抗エオタキシン−2抗体処理は、アジュバント関節炎によって誘発される全身性の炎症反応が原因で起きる体重減少を有意に改善した。再び、最大の予防効果は、D8抗体で処理した動物で認められ、それは実験全体を通して体重を増やし続けた。D8とPBSの間における体重の統計的に有意な差(p<0.05)は17日目に得られた。
用量反応実験
【0118】
関節炎のD8による予防
一連の用量反応実験では、低用量(20μg)群及び高用量(1000μg)群に比べて、100μgでのD8が有意に優れた予防効果を有した(図6A)。運動性スコア、足首径及び動物の体重についても同様の結果が得られた(データは示さず)。100μgのD8で処理したラットをPBSで処理したラットと比較した場合、17日目〜24日目であらゆる測定にて統計的に有意な差異(p<0.05)が得られた。
【0119】
関節炎のD8による処理
関節炎の出現時に腹腔内で開始したD8抗体による処理も、PBSで処理した動物に比べて関節炎スコアの重症度で有意な軽減を生じた(図6B)。運動性スコア、体重及び足首径についても同様の結果が得られた。図6Bで示されるように、この実験設定では、100μg〜1000μgの用量群で同様の結果が得られた。
関節炎のD8/メソトレキセート併用での予防
【0120】
メソトレキセートと100μgのD8が双方共、関節炎スコア(PBS処理対照と比べた)によって測定したとき、関節炎の進展に対して有意な、匹敵する予防を生じた一方で、メソトレキセートとD8の併用は、図7に示すように向上した(相乗の)予防効果を生じた。
【0121】
100μgのD8とMTX双方の処理はPBSに比べて13日目時点で統計的に有意な効果(p<0.05)を引き起こした。実験の終了まで、24日目まで、MTX単独で処理したラットとMTX+100μgのD8で処理したラットの間で関節炎スコアの統計的に有意な差が認められた。有意差は、これらの群間で、24日目の平均足首幅でも認められた(示さず)。
【0122】
X線検査の結果
死後X線検査は、D8で処理したラットの最少限の腫脹に比べて、PBSで処理したラットでは関節周囲軟組織の強度の腫脹を示した(図8)。加えて、対照ラットは、脱灰の兆候と早期の侵食を示したが、それは、D8で処理した動物では見られなかった。このことは、D8で処理した動物における炎症の有意な低下を示している。
【0123】
前肢のX線検査においても同様の結果が見られた(示さず)。
B.大腸炎モデル
【0124】
慢性の大腸炎を誘発するために、10週齢のC57BLマウスに、飲料水中のデキストラン硫酸(DSS)への5日間の暴露に続いて通常の水道水で10日間の間隔を置くことを3サイクル経験させた。第1のサイクルの終了時に、マウスを無作為に6つの処理群:ビヒクル対照(PBS)、マウスの総IgG、並びに5μM、25μM、100μM及び200μMの上昇用量で与えたD8に分けた。処理は週3回の計画にて腹腔内(ip)注射で行った。週2回体重を測定した。最終サイクルの終了時までにマウスを屠殺し、誘導した炎症の程度を評価するために、結腸の近位部分は免疫組織化学解析に、遠位部分はミエロペルオキシダーゼ活性のアッセイ(標準のプロトコールに従って)に利用した。動物の血清における炎症性サイトカインのレベルはフローサイトメトリーによって検出した。
【0125】
IgG又はD8による処理は、ビヒクル処理の動物に比べて体重低下を有意に減衰する。試験全体を通して、最高の体重は5μgのD8処理群で認められた(図9A)。34日目のMPO活性は、mIgGを含むその他すべての群に比べて5μgのD8処理群で有意に低下した(図9B)。加えて、D8で処理した動物の血清における炎症性サイトカインのレベルは対照動物で検出されたものよりも低かった(図9C)。近位結腸の免疫組織化学解析は、炎症の範囲及び程度と同様に結腸組織への損傷のレベルでも抑制を裏付けた(図9D)。熟練病理医によって炎症性浸潤の範囲が評価された。
C.EAE
【0126】
EAEは、ヒトの疾患である多発性硬化症の治療能を検討する典型的な動物モデルとして役立つ(30)。
【0127】
10週齢のC57BLマウスに、完全フロインドアジュバント中で懸濁した200μgのMOG(ミエリンオリゴデンドロサイトの糖タンパク質)ペプチドを皮下注射し、その後、1週間後に2回目の注射をした。疾患の誘発後1日目(すなわち、2回目の注射の1日後)、対照(PBS)、マウス総IgG、25μgのD8及び100μgのD8による処理(週3回、ip注射)を開始した。標準のEAEスコア化方式(31)に従って、週3回、疾患の重症度と進行を記録した。
【0128】
25μg、さらに有意には100μgのD8による処理は、実験の全過程の間、EAEの兆候の進行を減衰した。高い方の用量(100μg)でのD8は、約90%(ほかの処理群すべて)の疾患の発生率をたった55%(図10)に下げたということは、EAEの治療にてD8の治療上の利点の可能性を説明している。
D.糖尿病
【0129】
非肥満型糖尿病(NOD)マウスは、自己免疫性糖尿病の動物モデルとして役立つ(32)。
【0130】
6週齢のNODマウスをD8又はビヒクル対照(PBS)で週3回処理した。49〜112日目の間で、市販の尿テストを用いて糖尿病の発生を調べ、112日目の血清のエオタキシン−2のレベルをELISA(マウスCCL24/エオタキシン−2/MPIF−2、Duoset、R&D)を用いて測定した。
【0131】
糖尿病の発生率は、未処理の対照と比べてD8処理群では顕著に低下した(図11A)。臨床的な改善と一致して、対照と比べて抗エオタキシン−2で処理した動物の血清では、エオタキシン−2のレベルは大きく低下した(図11B)。
E.アテローム硬化性プラーク形成の抑制
【0132】
種々の炎症性のサイトカイン及びケモカインの発現レベルをアテローム硬化性病変(プラーク)で測定した。急性心筋梗塞の患者の責任冠状動脈から回収した不安定プラークを動脈内膜切除試料から得た安定プラークと比較した。タンパク質アレイによるプラークの分析を図12に示す。材料と方法の項で記載したとおりに処理を行った。
【0133】
様々に発現されたタンパク質の間で、有意な変化は、以下のタンパク質:VCAM−1、エオタキシン−2、IL−10、MCP−1及びTIMP−2に見い出され、安定プラークに対比して不安定プラークではすべて2倍を超える発現の低下を示した(図12A)。
【0134】
アテローム性動脈硬化症の傾向にあるマウス(apoEKOマウス)における免疫組織化学的な検討では、若齢マウスから老齢マウスまで脂肪線条と進行した病変が、材料と方法で記載したように抗エオタキシン−2抗体によって染色された。エオタキシン−2は、内皮細胞の中及びプラークのマクロファージの中に存在することが示された(図13)。
【0135】
若齢(6週齢)のapoEKOマウスとアテローム硬化性apoEKOマウスでmRNAの発現を測定した。マウスから大動脈を得て、材料と方法に記載したようにRT−PCRに供した。エオタキシン−2とTGF−βのmRNAレベルを比較してアッセイした。エオタキシン−2のmRNAレベルは、老齢マウスに対比して若齢マウスで有意に高いことが見い出され、この発現パターンは動脈硬化防止剤であるTGF−βに関して認められたものと並行した。図14Aは、各群の代表的な試料を示す。
【0136】
酸化LDLはアテローム発生を促進するのに重要な役割を担うと考えられている。マウスのH5V内皮細胞を酸化LDL(oxLDL)(1μg/mL)と共にインキュベートした。oxLDLは、マウスH5V内皮細胞にてエオタキシン−2のmRNAレベルを有意に上方調節した(図14B)。
【0137】
プラークの炎症の細胞性成分の接着においてエオタキシン−2が役割を有するかどうかを判定するために、培養内皮細胞にて接着アッセイを行った。若齢又は老齢のアテローム硬化性apoEKOマウスの脾細胞を脾臓から単離した。マウスの内皮細胞をoxLDL(1μg/mL)と共にインキュベートし、エオタキシン−2抗体又は対照のIgG抗体の存在下で脾細胞の内皮細胞への接着を調べた(図15A)。エオタキシン−2に対する阻止抗体との内皮細胞の予備インキュベートは、脾細胞のこれら細胞への接着を減衰することが見い出された(図15A)。この効果は、若齢非アテローム硬化性マウス(6週齢)から得たものに比べて、アテローム硬化性apoEKOマウス(6週齢)のリンパ球でさらに強力だった。単球/マクロファージ細胞株(U937細胞)を培養内皮細胞(H5Vマウス内皮細胞株)に接着させた場合、これらの知見も明らかだった(図15B)。
【0138】
本発明のモノクローナル抗体と同様に、市販の抗エオタキシン−2抗体を用いて、初期の及び進行したアテローム硬化性プラークに対するエオタキシン遮断の効果を測定した。予備試験では、5μgの週2回用量の抗エオタキシン−2阻止抗体(Peprotech)は、マウスの大動脈でエオタキシン−2mRNAのレベルを有意に下げるのに十分だった。次に、抗エオタキシン−2抗体の短期投与の効果を調べた。若齢apoEKOマウスを週2回のエオタキシン−2抗体(5μgのip注射)又は対照IgG又はPBSで4週間処理し、脂肪線条に対する効果を測定した。オイルレッドOで染色した後、プラークの大きさを解析するためにマウスを屠殺した。抗エオタキシン−2はマウスIgGに比べて脂肪線条の形成をおよそ72パーセント劇的に低下させた(図16A)。双方の群で総コレステロール及びトリグリセリドは類似していたので、この効果は脂質特性の変化とは関連しなかった(データは示さず)。さらに、対照のマウスIgGによる処理は、PBS注射に比べてプラークの進行に影響しなかった。
【0139】
次に、プラークの構造がさらに複雑である長期モデルにてエオタキシン−2の遮断の効果を調べた。本明細書では、エオタキシン−2抗体(5μg/用量)の週2回の注射の10週後、老齢のapoEKOマウスの心臓で測定したプラークの大きさに関して有意差は明らかではなかった(図16B)。しかしながら、線維性領域によって測定されるプラークの安定性をアッセイした場合、エオタキシン−2に対する抗体は、より小さな脂質コアを犠牲にしたより大きな線維性領域によって明らかな有意にさらに安定したプラークの表現型を誘導した(図16C)。再び、これらの知見は、群間に差異のない脂質レベルにかかわりなかった。代表的な、オイルレッドO染色した及びMassonの三色染色した切片を図17に提供する。
【0140】
アテローム性動脈硬化症は、脂肪の沈着が動脈壁で進行し、内腔の進行性の狭窄をもたらす過程である。成熟プラークは2つの基本構造:脂質のコアと線維性のキャップで構成される。脂質のコアが小さければ小さいほど、線維性のキャップは厚く、さらに安定なプラークとなるということは、破裂し、心筋梗塞又は不安定狭心症を起こす傾向が低下することを意味する。急性の冠状動脈症候群(たとえば、心筋梗塞及び不安定狭心症)の原因となるプラークのほとんどが、<70%の狭窄を有することが血管造影で示されることは今や明らかである(28、29にて概説された)。これらの病変のおよそ60%は、大きな血栓形成性の脂質コアと壊死性の残渣(マクロファージ、T細胞、古い出血、血管形成及びカルシウムの病巣を含む)を伴ったプラークの破裂が原因で生じる。おそらく、マクロファージがプラークを移動するにつれてそれを消化するマトリクスメタロプロテイナーゼを分泌し、平滑筋(プラークの要素を支えている)が、たとえば、炎症性サイトカインのような幾つかの因子によって生じる老化又はアポトーシスのために激減するために、破裂したキャップは薄い。
【0141】
態様の1つでは、本発明は、エオタキシン−2がヒトの安定した及び不安定なアテローム硬化性プラークで差次的に発現するという知見に基づく。apoEノックアウト(KO)[20]マウスモデルにてエオタキシン−2の経路を遮断することによって、本発明者らは、脂肪線条形成(初期動脈硬化病変を示す)の抑制とプラーク安定化の延長の双方を実証することができた。
【0142】
本発明の発明者らは、当該技術での以前の報告を支持している、アテローム硬化性と非アテローム硬化性のマウス動脈の内皮にエオタキシン−2が発現されていることを見い出した。しかしながら、本発明者らはまた、エオタキシン−2がプラークのマクロファージで発現されていることも見い出した。エオタキシン−2は、アテローム硬化性apoEKOマウスに比べて若齢apoEKOマウスの大動脈でさらに豊富に発現された。エオタキシン−2が、内皮への単球/マクロファージの細胞/細胞接着を含む、アテローム性動脈硬化症の最初の段階に関与することを示唆すること。実際、以下に記載される試験管内の試験は、エオタキシン−2を遮断することはoxLDLで誘導した内皮細胞へのリンパ球の接着を低下させ、生体内でのプラーク形成におけるエオタキシン−2の役割を支持することを示している。
【0143】
徹底した研究にもかかわらず、安定なプラークから不安定なプラークへの移行を支配する因子は不明瞭なままである。ヒトの安定プラークと不安定プラークの炎症性タンパク質アレイ解析に基づいて、本発明は、安定型と不安定型の間のプラークの移行に関与する可能性のある標的タンパク質、エオタキシン−2を提供する。VCAM−1、IL−10及びMCP−1とのアテローム性動脈硬化症の関係に関する揺るぎないデータが存在し、それらは、安定プラークと不安定プラークで差次的に発現されることが本発明者らによっても見い出されているが、そのようなデータはエオタキシン−2については存在しない。
【0144】
加えて、エオタキシン−2は、アテローム硬化性及び非アテローム硬化性のマウス動脈の内皮で発現されていることが本発明者らによって見い出されたので、以前の報告を支持している。しかしながら、それはプラークのマクロファージでも発現されていることが本発明者らによって見い出された。興味深いことに、内皮への単球/マクロファージの細胞/細胞接着を含む、アテローム性動脈硬化症の最初の段階に相当するアテローム硬化性apoEKOマウスに対比して、エオタキシン−2は、若齢apoEKOマウスでさらに豊富に発現された。実際、試験管内の試験は、生体内では上手く生じてもよいoxLDLが介在する接着におけるエオタキシン−2の遮断の役割を支持している。マウスのアテローム性動脈硬化症の早期段階におけるエオタキシン−2のさらに強力な発現はまた、短期の脂肪線条モデルにおけるこの経路を阻害する印象的な効果も説明する。理論に束縛されることを望まないで、内皮への炎症性細胞の接着を阻止することは、この効果に一義的に関与するのかも知れない。
【0145】
線維性領域によって明らかなようなプラークの安定化に対するエオタキシン−2遮断の効果に関して、炎症性細胞の動員がエオタキシン−2遮断のために減衰されるとすると、サイトカイン環境が安定な表現型に対してさらに好都合であることが十分に理解されてもよい。これらの知見は、プラークの蓄積が、エオタキシン−2の遮断によって変化しなかった脂質特性によって影響を受ける可能性がさらに高いので、アテローム性動脈硬化症の程度の低下に必ずしも反映されなくてもよい。
文献
1.Viola A LA. ケモカインとその受容体:免疫及び炎症における薬剤標的。Annu Rev Pharmacol Toxicol 2008;48:171-97.
2.Jose PJ,
Griffiths-Johnson DA, Collins PD et al., エオタキシン:アレルギー性気道炎症のモルモットモデルで検出された強力な好酸球走化性サイトカイン。J Exp Med 1994; 179: 881-887.
3.Kitaura M, Nakajima T,
Imai T, et al., ヒトエオタキシン、好酸球選択性のCCケモカインの分子クローニング及び特異的好酸球エオタキシン受容体、CCケモカイン受容体3の特定。J Biol Chem 1996; 271 : 7725-7730.
4.Ponath PD, Qin S,
Ringler DJ, et al., ヒト好酸球化学誘引物質、エオタキシンのクローニング。発現、受容体結合及び機能的特性は好酸球の選択的動員のメカニズムを示唆する。J Clin Invest 1996; 97: 604-612.
5.Bocchino V, Bertorelli G, Bertrand CP, et al., 慢性気管支炎の悪化にてエオタキシンとCCR3は上方調節される。Allergy 2002; 57: 17-22.
6.Romagnani P, Annunziato F, Lasagni L, Lazzeri E, Beltrame C,
Francalanci M,. Uguccioni M, Galli G, Cosmi L, Maurenzig L, et al. 内皮細胞によるCXCケモカイン受容体3の細胞周期依存性の発現は血管新生抑制活性に介在する。J. Clin. Invest. 2001; 107:53.
7.Berger O, Gan X, Gujuluva C, Burns AR, Sulur G, Stins M, Way D5
Witte M, Weinand M, Said J, Kim KS, Taub D, Graves MC, Fiala M. 冠状動脈及び脳の内皮におけるCXC及びCCケモカインの受容体。MoI Med. 1999; 5: 795-805.
8.Cheng SS, Lukacs NW,
Kunkel SL. エオタキシン/CCLIIは、ヒト皮膚の微小血管の内皮細胞から分泌されるIL−8/CXCLCZCL8を抑制する。J Immunol 2002; 168 2887-2894.
9.Salcedo, R., J. H. Resau, D. Halverson, E. A. Hudson, M. Dambach, D.
Powell, K. Wasserman, J. J. Oppenheim. 2000.ヒトの微小血管内皮細胞と臍静脈内皮細胞によるケモカイン受容体(CXCR1〜3)の差次的な発現と反応性。FASEB J. 14:2055.
10.Salcedo, R., H. A. Young, M. L. Ponce, J. M. Ward, H. K. Kleinman,
W. J. Murphy, J. J. Oppenheim. 2001. エオタキシン(CCL11)は、ヒトのCCR3+内皮細胞による生体内の血管新生反応を誘導する。J. Immunol. 166:7571
11.R.B. Kodali, WJ. Kim and I.I. Galaria et al., CCL11(エオタキシン)は、CCR−3依存性の平滑筋細胞の遊走を誘導する。Arterioscler Thromb Vase Biol 24 (2004), pp. 1211-1216.
12.Forssmann U. et al. エオタキシン−2、ケモカイン受容体CCR3に選択的であり、ヒトの好酸球と好塩基球に対してエオタキシンのように作用する新規のCCケモカイン。J.Exp.Med. 1997; 185:2171-2176
13.Romagnani P AF,
Lasagni L, Lazzeri E, Beltrame C, Francalanci M, Uguccioni M, Galli G, Cosmi L,
Maurenzig L, Baggiolini M, Maggi E, Romagnani S,Serio M. 内皮細胞によるCXCケモカイン受容体3の細胞周期依存性の発現は血管新生活性に介在する。J Clin Invest 2001;107(l):53-63.
14.Garcia G GV, Humbert
M. 新しいケモカインは喘息の治療法を標的とする。ep 2005;5(2): 155-60.
15.Zimmerman NP VR, Wendt MK, Dwinell MB. 炎症性大腸疾患における腸管内皮バリアでの粘膜恒常性におけるケモカインとケモカイン受容体。Dis 2008;14(7):1000-ll.
16.Simpson J RP, Newcombe J, Cuzner ML, Male D, Woodroofe MN.多発性硬化症の中枢神経系組織におけるβ−ケモカイン、CCR2、CCR3及びCCR5の発現。J Neuroimmunol 2000;108(l-2):192-200.
17.Firestein GS. 関節リウマチの発展する概念。Nature
2003;423(6937):356-6.
18.Arend WP.関節リウマチにおけるサイトカイン経路の生理学。Arthritis Rheum 2001;45(l):101-6.
19.Guglielmotti A DOE, Coletta I, Aquilini L, Milanese C3 Pinza M. ビンダリット、MCP−1の阻害剤とTNF−αの産生を伴う治療によるラットのアジュバント関節炎の改善。Inflamm Res 2002;51(5):252-8.
20.Haas CS MR, Attia N, Haines GK 3rd, Campbell PL, Koch AE. ラットのアジュバント誘導の関節炎におけるケモカイン受容体の発現。Arthritis Rheum 2005; 52(12) :3718-30.
21.Haringman JJ ST,
Reinders-Blankert P, Tak PP. 関節リウマチ、変形性関節症及び反応性関節炎の患者の対になった末梢血単核細胞と滑膜組織におけるケモカインとケモカイン受容体の発現。Ann Rheum Dis 2006;65(3):294-300.
22.Charo IF, Taubman MB. 血管疾患の病因におけるケモカイン。Circ
Res. 2004; 95: 858-66.
23.Sheikine S, Hansson GK. アテローム性動脈硬化症における治療標的の可能性としてのケモカイン。Curr Drug Targets 2006; 7: 13-28.
24.Haley KJ, Lilly CM, Yang JH, et al., ヒトのアテローム性動脈硬化症におけるエオタキシンとCCR3受容体の過剰発現:ゲノム技術を用いて血管炎症の新規の経路の可能性を特定する。Circulation 2000; 102: 2185-2189.
25.Sheikine Y, Olsen B, Gharizadeh B, Jatta K, Tornvall P, Ghaderi M. 心筋梗塞生存者と健常対照におけるエオタキシンの血漿濃度に対するエオタキシン67G>A多型の影響。Atherosclerosis. 2006; 189: 458-63.
26.Emanuele E, Falcone C, D'Angelo A, Minoretti P, Buzzi MP5 Bertona M,
Geroldi D. 血管造影冠状動脈疾患の存在及び程度とエオタキシンの血漿濃度の関連。Atherosclerosis.
2006 May;186(l):140-5.
27.E. Economou, D. Tousoulis and A. Katinioti et al., 虚血性心疾患の患者におけるケモカイン及び冠状血管形成の効果。Int J Cardiol 80 (2001), pp. 55-60.
28.Naghavi M, et al. 不安定プラークから不安定患者へ:新しい定義とリスク評価戦略への呼びかけ、第I部.Circulation. 2003; 108: 1664-72.
29.Naghavi M, et al. 不安定プラークから不安定患者へ:新しい定義とリスク評価戦略への呼びかけ、第II部.Circulation. 2003; 108: 1772-8.
30.Mendel I et al. Eur J
Immunol 1995 25:1951-9
31.argari M et al. Neurosci Lett. 2007. 412: 24-8
32.Delovitch TL, and
Singh B. Immunity 1997 Dec; 7(6):727-38.
33.George J, Afek A, Gilburd B, Aron-Maor A Shaish A, Levkovitz H,
Blank M, Harats D, Shoenfeld Y. ベータ2糖タンパク質Iで免疫したLDL受容体欠損マウスにおける早期アテローム性動脈硬化症の誘導。Circulation. 1998; 15: 1108-1115.
【表1】

【特許請求の範囲】
【請求項1】
少なくとも1つのエオタキシン−2拮抗物質と薬学上許容可能なキャリア又は賦形剤を含む、炎症性疾患、自己免疫疾患又は循環器疾患を治療するための医薬組成物。
【請求項2】
少なくとも1つのエオタキシン−2拮抗物質が、抗エオタキシン−2抗体又は前記抗体の結合活性を保持するその断片である請求項1に記載の医薬組成物。
【請求項3】
前記抗体が、ハイブリドーマD8(ECACC受入番号D809081702)、ハイブリドーマG8(ECACC受入番号G80908170)によって分泌されるモノクローナル抗体又は前記抗体の結合活性を保持するその断片である請求項2に記載の医薬組成物。
【請求項4】
前記抗エオタキシン−2抗体が、
(a)配列番号1と少なくとも90%の相同性を有する核酸によってコードされる重鎖と配列番号2と少なくとも90%の相同性を有する核酸によってコードされる軽鎖を含むモノクローナル抗体;
(b)配列番号3と少なくとも90%の相同性を有する核酸によってコードされる重鎖と配列番号4と少なくとも90%の相同性を有する核酸によってコードされる軽鎖を含むモノクローナル抗体;
(c)配列番号5と少なくとも90%の相同性を有する核酸によってコードされる重鎖と配列番号6と少なくとも90%の相同性を有する核酸によってコードされる軽鎖を含むモノクローナル抗体;
(d)ハイブリドーマD8(ECACC受入番号D809081702)、ハイブリドーマG7又はハイブリドーマG8(ECACC受入番号G80908170)によって分泌されるモノクローナル抗体の重鎖をコードする核酸と少なくとも90%の相同性を有する核酸によってコードされる重鎖と、ハイブリドーマD8(ECACC受入番号D809081702)、ハイブリドーマG7又はハイブリドーマG8(ECACC受入番号G80908170)によって分泌されるモノクローナル抗体の軽鎖をコードする核酸と少なくとも90%の相同性を有する核酸によってコードされる軽鎖を含むモノクローナル抗体;及び
(e)該抗体の結合活性を保持する(a)〜(d)の抗体の断片
から成る群から選択されるモノクローナル抗体である請求項2に記載の医薬組成物。
【請求項5】
エオタキシン−2拮抗物質が、エオタキシン−2mRNAに向けられたアンチセンス又はsiRNA分子である請求項1に記載の医薬組成物。
【請求項6】
前記炎症性疾患、自己免疫疾患又は循環器疾患が、アテローム性動脈硬化症、関節リウマチ、炎症性大腸疾患、多発性硬化症及び糖尿病から成る群から選択される請求項1〜6のいずれかに記載の医薬組成物。
【請求項7】
治療上有効な用量のエオタキシン−2拮抗物質又は請求項1〜6のいずれかに記載の医薬組成物をそれが必要な患者に投与することを含む、炎症性疾患又は自己免疫疾患を治療する方法。
【請求項8】
治療上有効な用量のエオタキシン−2拮抗物質又は請求項1〜6のいずれかに記載の医薬組成物をそれが必要な患者に投与することを含む、アテローム硬化性プラーク形成を阻害する又はアテローム硬化性プラークを安定化させる方法。
【請求項9】
治療上有効な用量のエオタキシン−2拮抗物質又は請求項1〜6のいずれかに記載の医薬組成物をそれが必要な患者に投与することを含む、急性冠状動脈症候群の患者における主要な心血管系事象を防ぐ方法。
【請求項10】
前記エオタキシン−2拮抗物質又は前記医薬組成物が、少なくとも1つの追加の治療剤と併用で投与される請求項7〜9のいずれかに記載の方法。
【請求項11】
前記少なくとも1つの追加の治療剤が、化学療法剤、サイトカイン、ペプチド、抗体及び抗生剤から成る群から選択される請求項10に記載の方法。
【請求項12】
前記少なくとも1つの追加の治療剤が、シクロスポリン、ステロイド、NSAIDS(非ステロイド性抗炎症剤)、抗TNFα抗体、抗TNF受容体抗体、抗IL−6受容体抗体、抗CD20抗体、抗VLA−4抗体、静脈内免疫グロブリン(IVIG)、コパキソン及びインターフェロン−βから成る群から選択される請求項10に記載の方法。
【請求項13】
前記少なくとも1つの追加の治療剤が、メソトレキセートである請求項10に記載の方法。
【請求項14】
前記少なくとも1つの追加の治療剤と前記エオタキシン−2拮抗物質又は前記医薬組成物が順次又は同時に投与される請求項10に記載の方法。
【請求項15】
ハイブリドーマが、D8(ECACC受入番号D809081702)、G7又はG8(ECACC受入番号G809081701)である抗エオタキシン−2モノクローナル抗体を分泌するハイブリドーマ。
【請求項16】
モノクローナル抗体が、D8(ECACC受入番号D809081702)、G7又はG8(ECACC受入番号G809081701)から分泌される、エオタキシン−2に向けられたモノクローナル抗体、又はエオタキシン−2に結合することが可能であるその断片。
【請求項17】
エオタキシン−2に向けられたモノクローナル抗体であって、
前記抗体が、
(a)配列番号1と少なくとも90%の相同性を有する核酸によってコードされる重鎖と配列番号2と少なくとも90%の相同性を有する核酸によってコードされる軽鎖を含むモノクローナル抗体;
(b)配列番号3と少なくとも90%の相同性を有する核酸によってコードされる重鎖と配列番号4と少なくとも90%の相同性を有する核酸によってコードされる軽鎖を含むモノクローナル抗体;
(c)配列番号5と少なくとも90%の相同性を有する核酸によってコードされる重鎖と配列番号6と少なくとも90%の相同性を有する核酸によってコードされる軽鎖を含むモノクローナル抗体;
(d)請求項16の抗体の重鎖をコードする核酸と少なくとも90%の相同性を有する核酸によってコードされる重鎖と、請求項16の抗体の軽鎖をコードする核酸と少なくとも90%の相同性を有する核酸によってコードされる軽鎖を含むモノクローナル抗体;及び
(e)該抗体の結合活性を保持する(a)〜(d)の抗体の断片
から成る群から選択されるモノクローナル抗体であるエオタキシン−2に向けられたモノクローナル抗体。
【請求項18】
請求項16又は17のいずれかのモノクローナル抗体又はその抗原結合部分をコードする単離された核酸分子。
【請求項19】
請求項18の核酸分子を含む発現ベクター。
【請求項20】
請求項19の発現ベクターを含む宿主細胞。
【請求項21】
炎症性疾患、自己免疫疾患及び循環器疾患を治療するのに使用するための請求項16又は17のモノクローナル抗体。
【請求項22】
炎症性疾患、自己免疫疾患及び循環器疾患を治療することにおけるエオタキシン−2拮抗物質の使用。
【請求項23】
炎症性疾患、自己免疫疾患及び循環器疾患を治療するための医薬組成物を調製することにおけるエオタキシン−2拮抗物質の使用。
【請求項24】
前記エオタキシン−2拮抗物質が抗体である請求項21又は22のいずれかに記載の使用。
【請求項1】
少なくとも1つのエオタキシン−2拮抗物質と薬学上許容可能なキャリア又は賦形剤を含む、炎症性疾患、自己免疫疾患又は循環器疾患を治療するための医薬組成物。
【請求項2】
少なくとも1つのエオタキシン−2拮抗物質が、抗エオタキシン−2抗体又は前記抗体の結合活性を保持するその断片である請求項1に記載の医薬組成物。
【請求項3】
前記抗体が、ハイブリドーマD8(ECACC受入番号D809081702)、ハイブリドーマG8(ECACC受入番号G80908170)によって分泌されるモノクローナル抗体又は前記抗体の結合活性を保持するその断片である請求項2に記載の医薬組成物。
【請求項4】
前記抗エオタキシン−2抗体が、
(a)配列番号1と少なくとも90%の相同性を有する核酸によってコードされる重鎖と配列番号2と少なくとも90%の相同性を有する核酸によってコードされる軽鎖を含むモノクローナル抗体;
(b)配列番号3と少なくとも90%の相同性を有する核酸によってコードされる重鎖と配列番号4と少なくとも90%の相同性を有する核酸によってコードされる軽鎖を含むモノクローナル抗体;
(c)配列番号5と少なくとも90%の相同性を有する核酸によってコードされる重鎖と配列番号6と少なくとも90%の相同性を有する核酸によってコードされる軽鎖を含むモノクローナル抗体;
(d)ハイブリドーマD8(ECACC受入番号D809081702)、ハイブリドーマG7又はハイブリドーマG8(ECACC受入番号G80908170)によって分泌されるモノクローナル抗体の重鎖をコードする核酸と少なくとも90%の相同性を有する核酸によってコードされる重鎖と、ハイブリドーマD8(ECACC受入番号D809081702)、ハイブリドーマG7又はハイブリドーマG8(ECACC受入番号G80908170)によって分泌されるモノクローナル抗体の軽鎖をコードする核酸と少なくとも90%の相同性を有する核酸によってコードされる軽鎖を含むモノクローナル抗体;及び
(e)該抗体の結合活性を保持する(a)〜(d)の抗体の断片
から成る群から選択されるモノクローナル抗体である請求項2に記載の医薬組成物。
【請求項5】
エオタキシン−2拮抗物質が、エオタキシン−2mRNAに向けられたアンチセンス又はsiRNA分子である請求項1に記載の医薬組成物。
【請求項6】
前記炎症性疾患、自己免疫疾患又は循環器疾患が、アテローム性動脈硬化症、関節リウマチ、炎症性大腸疾患、多発性硬化症及び糖尿病から成る群から選択される請求項1〜6のいずれかに記載の医薬組成物。
【請求項7】
治療上有効な用量のエオタキシン−2拮抗物質又は請求項1〜6のいずれかに記載の医薬組成物をそれが必要な患者に投与することを含む、炎症性疾患又は自己免疫疾患を治療する方法。
【請求項8】
治療上有効な用量のエオタキシン−2拮抗物質又は請求項1〜6のいずれかに記載の医薬組成物をそれが必要な患者に投与することを含む、アテローム硬化性プラーク形成を阻害する又はアテローム硬化性プラークを安定化させる方法。
【請求項9】
治療上有効な用量のエオタキシン−2拮抗物質又は請求項1〜6のいずれかに記載の医薬組成物をそれが必要な患者に投与することを含む、急性冠状動脈症候群の患者における主要な心血管系事象を防ぐ方法。
【請求項10】
前記エオタキシン−2拮抗物質又は前記医薬組成物が、少なくとも1つの追加の治療剤と併用で投与される請求項7〜9のいずれかに記載の方法。
【請求項11】
前記少なくとも1つの追加の治療剤が、化学療法剤、サイトカイン、ペプチド、抗体及び抗生剤から成る群から選択される請求項10に記載の方法。
【請求項12】
前記少なくとも1つの追加の治療剤が、シクロスポリン、ステロイド、NSAIDS(非ステロイド性抗炎症剤)、抗TNFα抗体、抗TNF受容体抗体、抗IL−6受容体抗体、抗CD20抗体、抗VLA−4抗体、静脈内免疫グロブリン(IVIG)、コパキソン及びインターフェロン−βから成る群から選択される請求項10に記載の方法。
【請求項13】
前記少なくとも1つの追加の治療剤が、メソトレキセートである請求項10に記載の方法。
【請求項14】
前記少なくとも1つの追加の治療剤と前記エオタキシン−2拮抗物質又は前記医薬組成物が順次又は同時に投与される請求項10に記載の方法。
【請求項15】
ハイブリドーマが、D8(ECACC受入番号D809081702)、G7又はG8(ECACC受入番号G809081701)である抗エオタキシン−2モノクローナル抗体を分泌するハイブリドーマ。
【請求項16】
モノクローナル抗体が、D8(ECACC受入番号D809081702)、G7又はG8(ECACC受入番号G809081701)から分泌される、エオタキシン−2に向けられたモノクローナル抗体、又はエオタキシン−2に結合することが可能であるその断片。
【請求項17】
エオタキシン−2に向けられたモノクローナル抗体であって、
前記抗体が、
(a)配列番号1と少なくとも90%の相同性を有する核酸によってコードされる重鎖と配列番号2と少なくとも90%の相同性を有する核酸によってコードされる軽鎖を含むモノクローナル抗体;
(b)配列番号3と少なくとも90%の相同性を有する核酸によってコードされる重鎖と配列番号4と少なくとも90%の相同性を有する核酸によってコードされる軽鎖を含むモノクローナル抗体;
(c)配列番号5と少なくとも90%の相同性を有する核酸によってコードされる重鎖と配列番号6と少なくとも90%の相同性を有する核酸によってコードされる軽鎖を含むモノクローナル抗体;
(d)請求項16の抗体の重鎖をコードする核酸と少なくとも90%の相同性を有する核酸によってコードされる重鎖と、請求項16の抗体の軽鎖をコードする核酸と少なくとも90%の相同性を有する核酸によってコードされる軽鎖を含むモノクローナル抗体;及び
(e)該抗体の結合活性を保持する(a)〜(d)の抗体の断片
から成る群から選択されるモノクローナル抗体であるエオタキシン−2に向けられたモノクローナル抗体。
【請求項18】
請求項16又は17のいずれかのモノクローナル抗体又はその抗原結合部分をコードする単離された核酸分子。
【請求項19】
請求項18の核酸分子を含む発現ベクター。
【請求項20】
請求項19の発現ベクターを含む宿主細胞。
【請求項21】
炎症性疾患、自己免疫疾患及び循環器疾患を治療するのに使用するための請求項16又は17のモノクローナル抗体。
【請求項22】
炎症性疾患、自己免疫疾患及び循環器疾患を治療することにおけるエオタキシン−2拮抗物質の使用。
【請求項23】
炎症性疾患、自己免疫疾患及び循環器疾患を治療するための医薬組成物を調製することにおけるエオタキシン−2拮抗物質の使用。
【請求項24】
前記エオタキシン−2拮抗物質が抗体である請求項21又は22のいずれかに記載の使用。
【図1】


【図2A】


【図2B】


【図3A】


【図3B】


【図3C】


【図4A】


【図4B】


【図4C】


【図5】


【図6A】


【図6B】


【図7】


【図8A】


【図8B】


【図9A】


【図9B】


【図9C】


【図9D】


【図10】


【図11A】


【図11B】


【図12A】


【図12B】


【図13A】


【図13B】


【図13C】


【図13D】


【図14A】


【図14B】


【図15A】


【図15B】


【図16A】


【図16B】


【図16C】


【図17A】


【図17B】


【図17C】


【図17D】


【図17E】


【図17F】


【図17G】


【図17H】


【図17I】


【図17J】


【図17K】


【図17L】




【図2A】


【図2B】


【図3A】


【図3B】


【図3C】


【図4A】


【図4B】


【図4C】


【図5】


【図6A】


【図6B】


【図7】


【図8A】


【図8B】


【図9A】


【図9B】


【図9C】


【図9D】


【図10】


【図11A】


【図11B】


【図12A】


【図12B】


【図13A】


【図13B】


【図13C】


【図13D】


【図14A】


【図14B】


【図15A】


【図15B】


【図16A】


【図16B】


【図16C】


【図17A】


【図17B】


【図17C】


【図17D】


【図17E】


【図17F】


【図17G】


【図17H】


【図17I】


【図17J】


【図17K】


【図17L】


【公表番号】特表2012−516150(P2012−516150A)
【公表日】平成24年7月19日(2012.7.19)
【国際特許分類】
【出願番号】特願2011−547057(P2011−547057)
【出願日】平成22年1月28日(2010.1.28)
【国際出願番号】PCT/IL2010/000073
【国際公開番号】WO2010/086854
【国際公開日】平成22年8月5日(2010.8.5)
【公序良俗違反の表示】
(特許庁注:以下のものは登録商標)
1.ポラロイド
【出願人】(511176137)ザ メディカル リサーチ,インフラストラクチュア,アンド ヘルス サービシーズ ファンド オブ ザ テル アビブ メディカル センター (1)
【Fターム(参考)】
【公表日】平成24年7月19日(2012.7.19)
【国際特許分類】
【出願日】平成22年1月28日(2010.1.28)
【国際出願番号】PCT/IL2010/000073
【国際公開番号】WO2010/086854
【国際公開日】平成22年8月5日(2010.8.5)
【公序良俗違反の表示】
(特許庁注:以下のものは登録商標)
1.ポラロイド
【出願人】(511176137)ザ メディカル リサーチ,インフラストラクチュア,アンド ヘルス サービシーズ ファンド オブ ザ テル アビブ メディカル センター (1)
【Fターム(参考)】
[ Back to top ]

