炎症性腸疾患の診断、病期分類、及び監視
胃腸粘膜試料又は胃腸粘膜を排出するセンチネルリンパ節由来の試料において活動性と不活動性のIBDを識別する方法であって、試料から単一細胞の懸濁液を調製するステップと;懸濁液を、直接標識された蛍光DC69抗体を用いてCD4+ヘルパーT細胞の炎症活性化マーカーCD69の発現について分析するステップと;試料中のDC69を発現しているヘルパーT細胞の数を、対応する健常個体の試料から得られる数と比較するステップとを含み、CDD69を発現しているヘルパーT細胞のレベルの有意な増大が活動性IBDの存在を表し、ヘルパーT細胞の有意な増大レベルが低いことが不活動性IBDの存在を表す方法。また、潰瘍性大腸(UC)とクローン病(CD)を識別する方法、UC及びCDを検出する方法、並びにIBD患者のステロイド治療に対する感受性を決定する方法も開示する。
【発明の詳細な説明】
【発明の詳細な説明】
【0001】
[発明の分野]
本発明は、炎症性腸疾患の診断、病期分類、及び監視に関する。
【0002】
[発明の背景]
炎症性腸疾患(IBD)は、クローン病(CD)及び潰瘍性大腸炎(UC)を含み、両方とも腸に長期にわたる損傷を引き起こす。近年、IBDには、顕微鏡的大腸炎、コラーゲン蓄積大腸炎、及びリンパ球性大腸炎も含まれている。外来抗原、免疫反応障害、及び遺伝要因の組合せがIBDの病因となっているようであるが、腸炎の発生機序には不明な点が残っている(1)。今までのところ、例えば、腸へのCMV感染(2)及び持続性麻疹ウイルス感染(3)に由来する抗原等の、多くの可能性のある抗原が提唱されている。
【0003】
腸間膜リンパ節は、腸の内容物を排出するものであるが、これがIBDにおける炎症の発生及び維持にとって重要な部位である可能性が最も高い。炎症を誘発する抗原は、免疫系への提示のために、腸壁からリンパ節に能動的に輸送される(1、4)。腸の排出病理領域である、第1リンパ節を同定する技術、及び手術中にこれらの節を回収する技術が開発されてきた(5)。本発明は、細胞表面のマーカー発現及びmRNA発現アレイプロファイリングに基づいて、様々なIBDの診断及び病期分類を表すために構築されたアッセイを開示する。これらのパターンは、腸炎の種類及び活動性に関連し、それ故、療法に対する応答を含む、疾患活動性の診断、病期分類、及び監視に有用である。
【0004】
スウェーデンでは、毎年1400人が新たにIBDであると診断される。新たに診断される人の数は、近年増加している。IBD発生率のピークは、20歳である(6、7)。腸は、免疫担当細胞が広範な内因性及び外因性因子と出会う複雑な微環境である。これらの相互作用は、固有層におけるT細胞の豊富さが反映される、連続的で悪性度の低い炎症を生じる(8)。T細胞は、常時、有害な病原体に対しては作用することができるが、無害な食餌性抗原又は正常な常在性細菌叢のメンバーは無視する。腸免疫系の耐性と反応との間の平衡が崩れたとき、結果的にIBDになることがある。
【0005】
CD及びUCはIBDの2つの主要な形である。CDでは、腸のいずれの部分が罹患する場合もあるが、最も一般的なのは回盲領域(50%)及び結腸(30%)の罹患である。患者の約3分の1が、随伴性肛門周囲疾患も有している。小腸のいくつかの小区画が罹患する場合もあり、しばしば区域性病変として知られている。組織病理学的に、炎症は貫壁性であり、肉芽腫のリンパ球及びマクロファージの密度の濃い浸潤が、患者の最大60%に見られる。UCは通常直腸が関与し、近位方向に伸長し、この伸長は個々の患者間で変動するが、疾患は常に結腸に限定されたままである。全結腸炎という用語は、炎症に右結腸曲が関与するときにも用いられる。微視的には、粘膜炎症は表在性であり、リンパ球及び顆粒球が豊富である。潰瘍形成及び陰窩膿瘍が一般的である(1)。下痢(多くの場合、血液を含む)、栄養失調、発熱及び痛みのような長期の炎症に起因する症状とともに、患者はまた上皮異形成及び最終的には腸癌が発生する長期的なリスクを有する(9)。IBD患者の約15%が病型不定型大腸炎を有し、それ故CD又はUCの確定診断をすることができない。更により重要なことに、劇症大腸炎の患者の中には、診断に関して不確実性が存在する場合が多い。正確な診断は、早急に必要な内科治療、及び長期的展望では、最良の外科治療について決定するときに重要である。CDの外科治療としては、炎症区画の切除、狭窄形成術による狭窄の治療、罹患区画の大腸切除、又は重篤な大腸炎の場合は結腸全摘及び回腸造瘻が挙げられる。CDにおける再建手術は、腸の連続性を回復させるための回腸直腸吻合であることが多い。骨盤内パウチは、回腸直腸吻合領域における瘻孔形成に関連する合併症のリスクが高いため、ほとんど選択されない。一部の患者は、最後に永続的回腸造瘻を行う。UCのため重篤な大腸炎の患者は、緊急処置として結腸切除及び回腸造瘻により治療される場合が多い。約6カ月後、回腸直腸吻合又は骨盤内パウチのいずれかを、確定した外科治療として選択することができるが、一部の例では永続的回腸造瘻のみが選択し得る解決法となることもある。
【0006】
いくつかの証拠から、CDは正常な腸管細菌叢に対する耐性の崩壊の結果であることが暗示されている。ヒトでは、患者の固有層の単核細胞は自己糞便抽出物に応答することが示されているが、これは正常にコントロールされている場合には当てはまらない(10)。T細胞の刺激に対する抗原への依存性は、自己腸内細菌の超音波処理に対してCD患者由来のリンパ球がインビトロで増殖したことが観察されたことから明らかであり、この場合増殖は抗MHCクラスII抗体により阻害された(11)。UCに関して、微環境の役割はそれほど明確にはなっておらず、炎症は、免疫グロブリン(IgG)に依存すると考えられる自己免疫様病因、硬化性胆管炎のような自己免疫疾患との関連、自己抗体の発生頻度、及び大腸粘膜の特異性に基づくと思われる(12)。仮説上、腸に対する免疫反応は、制御性T細胞の不十分な阻害作用の結果である可能性がある(1、4、10)。
【0007】
活動性UCは、結腸粘膜内の活性化顆粒球、及び単球/マクロファージの湿潤を特徴とする。これらの浸潤細胞は、炎症促進性サイトカインの主な供給源である。IBD患者は、内科治療に対して耐性が生じる場合がある。可能性のある原因は、顆粒球、サイトカイン、又はステロイド受容体の発現を含む免疫細胞の機能特性の分布変化である。
【0008】
今日、IBDの診断及び病期分類は、内視鏡的基準及び組織病理学に加えて、臨床的パラメータ(アルブミン、SR、CRP、発熱、便の数)の組合せに基づく。炎症活動性は、顕微鏡により評価されるが、生検に存在する一般的な型及び数の細胞しか考慮されない。活動特性は決定されない。
【0009】
[発明の目的]
本発明の目的は、活動性と不活動性腸疾患(IBD)を識別できる方法を提供することである。
【0010】
本発明の別の目的は、IBD患者においてクローン病(CD)と潰瘍性大腸炎(UC)を識別できる診断方法を提供することである。
【0011】
本発明の更なる目的は、病型不定型大腸炎の患者においてクローン病と潰瘍性大腸炎を識別できる方法を提供することである。
【0012】
本発明の追加の目的は、発明の概要における研究、図面及び添付する「特許請求の範囲」に例示されるその好ましい実施形態から明らかとなる。
【0013】
[発明の概要]
本発明は、腸抗原が、粘膜樹状細胞により局所領域腸間膜リンパ節に連続的に輸送されるという洞察に基づいている。このプロセスでは、制御性T細胞は、エフェクターT細胞の調節、ひいては正常抗原に対する応答の阻止において極めて重要な役割を担うことができる。
【0014】
動物モデルでは、エフェクターT細胞応答の2つの異なる経路を識別することができる。最初の種類の免疫開始は、活性化ヘルパーT細胞タイプ1(Th1)によって駆動され、これはIL−12、IFN−ガンマ及びTNF−アルファのようなサイトカインの産生を特徴とする。炎症部位は、マクロファージ及び細胞傷害性エフェクターT細胞(CD8+)の細胞介在浸潤により支配される。この種の炎症は、CD病変に類似している。ヘルパーT細胞タイプ2(TH2)の免疫活性化では、体液性の免疫防御系(免疫グロブリン)が、炎症部位で見られる細胞傷害性T細胞並びにIL−4及びIL−5のようなサイトカイン、並びにIgG1と併せて、重要な役割を果たしている。動物モデルでは、Th2型炎症はヒトUCと共通した特性を有する。
【0015】
本発明によれば、炎症組織の生検試料から単離される単一細胞を多色フローサイトメトリーにかけることにより、IBD患者においてクローン病及び潰瘍性大腸炎を識別する方法を開示する。活性化マーカー及びサイトカイン産物の定量により、局部的免疫反応の状態を高精度で決定することが可能になる。本発明の方法はまた、IBD患者における病期分類及び療法の評価にも有用である。
【0016】
本発明の第1の好ましい態様によれば、ヒトにおいてIBDの存在を決定する方法であって、疾患が疑われる遠位回腸粘膜若しくは結腸粘膜由来、又は前記遠位回腸粘膜若しくは結腸粘膜を排出するセンチネルリンパ節由来の生検試料を提供するステップと、CD69活性化マーカーを発現しているCD4 T細胞の数を定量するステップと、前記CD4 T細胞の数を、健常個体及び活動性若しくは不活動性状態のIBDを有するヒトから得られる対応するT細胞の数と比較するステップとを含む方法を提供する。
【0017】
本発明の第2の好ましい態様によれば、IBD患者において潰瘍性大腸炎とクローン病を識別する方法を提供する。この方法は、罹患した腸粘膜又はこのような粘膜を排出するセンチネルリンパ節由来の生検試料を提供するステップと、CDの指標である活性化ヘルパーT細胞タイプ1(Th1)によって駆動される免疫活性化で産生されるサイトカインの1種又は複数、及びUCの指標である活性化ヘルパーT細胞タイプ2(Th2)によって駆動される免疫活性化で産生されるサイトカインの1種又は複数を定量するステップと、Th1及びTh2サイトカインの量を、顕在化しているCD及び/又はUCの患者で通常見出されるTh1並びにTh2の量と比較するステップとを含む。好ましいTh1サイトカインはIL−12、IFN−γ及びTNF−α、特にIFN−γを含む。好ましいTh2サイトカインは、IL−4及びIL−5、特にIL−4を含む。この方法では、独立して又は追加して、クローン病のマーカーとしてIgG1を定量することも好ましい。
【0018】
本発明の好ましい態様によれば、IBD生検由来の免疫細胞のmRNA発現プロファイリング(13)をIBDの診断、病期分類、療法及び療法の監視に用いる。
【0019】
本発明の更に好ましい態様によれば、ステロイド治療に対するIBD患者の感受性を決定する方法であって、前記患者から得られるCD4+ヘルパーT細胞におけるグルココルチコイド受容体発現量を決定するステップを含む方法を開示する。
【0020】
本出願では、「病期分類」は、IBDにおける活性化段階、炎症の重篤度、炎症の種類等の決定に関連し、一方「監視」は患者におけるIBDの発達を監視することに関連する。
【0021】
本発明の更に好ましい態様は、多数の図を含む図面、及び添付する特許請求の範囲に例示する、以下のその好ましい実施形態の記述に開示する。
【0022】
本発明は、ここで、図面に例示される多数の好ましい実施形態を参照することにより、より詳細に説明される。
【図面の簡単な説明】
【0023】
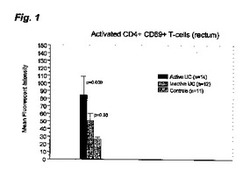
【図1】フローサイトメトリー並びにCD4及び活性化マーカーCD69に対する抗体を用いた、活動性又は不活動性UCの患者由来、及び健常対照由来の生検の単一細胞懸濁液の調査を示すグラフであり、CD4+細胞の平均蛍光強度をy軸にとる。
【図2】健常対照、活動性又は不活動性UCの患者、及び不活動性CDの患者からの生検を調査したフローサイトメトリー(FACS)で見られる活性化CD69+CD4+T細胞の百分率の相互関係を示すグラフである。
【図3】異なる病期段階の疾患の患者のIBDスコアの、生検を調査したFACSにおける活性化CD69+CD4+T細胞の百分率との相互関係を示すグラフである。
【図4】CD患者の炎症領域を排出する、非センチネル節、センチネル節1、及びセンチネル節2由来の培養上清中のIFN−γの産生を示すグラフである。
【図5】UC患者の炎症領域を排出する、非センチネル節(NSLN)及びセンチネル節(SLN)由来の培養上清中のIL−4の産生を示すグラフである。
【図6】グルココルチコイド治療に応答しないIBD患者由来のCD4+ヘルパーT細胞中のグルココルチコイド受容体の細胞内発現レベルの低下を示すグラフである。
【図7】活動性CDの患者の腸管由来のCD4+ヘルパーT細胞においてTbet発現は上昇するが、一方不活動性相におけるTbet発現は低いことを示すグラフである。
【図8】活動性CDの患者の腸管由来のCD4+ヘルパーT細胞においてTbet発現は上昇するが、一方不活動性相におけるTbet発現は低いことを示すグラフである。更に、UCの患者由来のCD4+ヘルパーT細胞におけるTbet発現は、活動性CDに見られるTbet発現に比べて低い。
【図9】活動性UCの患者の腸管由来のCD4+ヘルパーT細胞においてGATA−3発現は上昇するが、一方不活動性相におけるGATA−3発現は低いことを示すグラフである。
【0024】
[発明の詳細な説明]
材料及び方法
単一細胞懸濁液を新鮮な生検から作製した。フローサイトメトリー(FACS)は、4つを組み合わせたFITC、PE、PerCp、APCコンジュゲートを用いて、直接標識された蛍光抗体CD4、CD8、CD69、CD25、CD14、CD9、CD66b、CD19を用いて実施した。アイソタイプ抗体を対照として用いた。CD及びUCでは、炎症を起こした腸及び罹患していない正常腸を排出するセンチネル節を、比較分析のために炎症領域の周りに注入した、トレーサー物質であるパテントブルー(Patent Blue)を用いて同定した。また、各患者から静脈血試料を採取した。
【0025】
サイトカインIL−4及びIFN−γの分析は、サンドイッチELISA(R&D systems)を用いて生検又はセンチネル節由来の単一細胞培養上清で実施した。
【0026】
グルココルチコイド受容体の発現の分析は、マウス抗ヒトグルココルチコイド受容体抗体を用い、続いてサポニン透過化単一細胞の抗マウスIgG FITCのコンジュゲートした検出抗体を用いて実施した。
【0027】
単一細胞懸濁液からのRNA単離は、トリゾール(TRIZOL)試薬(Invitrogen、カタログ番号15596−026)を用いて実施した。サンプルあたり100ngのRNAを加え、製造業者のプロトコルにしたがって、アイスクリプト(iScript)(商標)cDNA合成キットを用いた逆転写酵素反応を行った。定量PCRは、2×IQ(商標)SYBR(登録商標)グリーンスーパーミックス(Green Supermix)を用いてアイサイクラー(iCycler)IQで実施した。サイクル閾値は、BIO−RAD製のアイサイクラーIQ(商標)光学系ソフトウェアバージョン3.1を用いて得た。発現レベルは、2−ΔΔCt法を用いてRPIIに正規化した。或いは、単離したRNAをcDNA合成、FAM標識に供し、その後Affymetrixヒトアレイチップを用いて分析した。
【0028】
プライマー配列 QT−PCR:
IFNγ QT Fwrd GCAGGTCATTCAGATGTAGCGG
IFNγ QT Rev TGTCTTCCTTGATGGTCTCCACAC
IL−4 QT Fwrd CACAACTGAGAAGGGAAACCTTCTG
IL−4 QT Rev CTCTCTCATGATCGTCTTTAGCCTTTC
T−bet QT Fwrd CACTACAGGATGTTTGTGGACGTG
T−bet QT Rev CCCCTTGTTGTTTGTGAGCTTTAG
GATA3 QT Fwrd AACTGTCAGACCACCACAACCACAC
GATA3 QT Rev GGATGCCTTCCTTCTTCATAGTCAGG
【0029】
実施例1
粘膜又はIBDに罹患している領域を排出するセンチネルリンパ節内の免疫細胞の調査。粘膜又はIBDに罹患している領域を排出するセンチネルリンパ節内の免疫細胞のフローサイトメトリーによる調査は、健常対照と比較して、CD4+ヘルパーT細胞における活性化マーカーCD69の発現(図1)及び活動性IBDの患者のCD8+細胞傷害性T細胞の発現の有意な増大(p<0.009)を示す。不活動性IBDの患者(有能な病理学者の判断において)は、それにもかかわらず、活性化マーカーCD69の発現上昇に加えて、CD4+T細胞の活性化の有意な増大(p<0.03)を示す(図1)。CD4+CD69+T細胞の数はまた、健常対照及び報告された不活動性IBDの患者と比較して、潰瘍性大腸炎及びクローン病の両方において活動性IBDの患者で増加する(図2)。
【0030】
実施例2
患者のIBDスコアとフローサイトメトリープロファイルとの相互関係。フローサイトメトリープロファイルによる、S−アルブミン、CRP、及び1日あたりの血液を含む便の数を含む患者のIBDスコアを図3に示す。CD69活性化マーカーを発現しているCD4+T細胞の数は、IBDスコア(SEO指数)とよく相関していた。
【0031】
SEO指数を利用して、結果と疾患の活動性との相互関係を示した。この指数は、臨床的(便の頻度及び血便)及び検査パラメータ(Hb、アルブミン、及び赤血球沈降速度)を用いる。本発明者らの材料では、赤血球沈降速度はCRP(C−反応性タンパク質)により置き換えられた。
【0032】
実施例3
CD及びUCの両方における、腸の病変領域を排出するセンチネル節、並びに罹患していないセグメントを排出する節での免疫反応。現在、CDにおける免疫反応は、Th1応答と見なされており、一方UCは非定型Th2活性化に類似している場合がある。この見解は、主に、人工的な手段により大腸炎を刺激する動物モデルに基づいているように思われる。ヒトでは、IBDの炎症経路の特徴付けは限られている;結腸のかん流検査に加えて末梢血液細胞の分析は、動物モデルの観察結果の一部を支持するが、病態生理の概要は不完全である。本発明によるCD及びUCの両方における、腸の病変領域を排出するセンチネル節、及び罹患していないセグメントを排出する節における免疫反応及びサイトカインパターンの判定は、サイトカインの放出をCD及びUC診断で用い得ることを示唆する。
【0033】
普及している基準により、IBD患者の15%は、病型不定型大腸炎を有すると考えられる、すなわち、確定診断することができない。しかしながら、正確な診断は、それにもかかわらず、更なる治療時の判断において重要である。また、劇症大腸炎においてCD及びUCを識別する(differ)ことは不可能である場合が多く、これは適切な内科治療を遅延させ、結腸切除による早期外科的介入を必要とすることがある。多量のIFN−γが、現在、CD患者の胃腸炎症部位で同定されている(図4)。対照的に、UC患者の胃腸炎症部位は、大量のTh2サイトカインIL−4を含有することが見出されている(図5)。これらの所見により、胃腸生検試料中の高IFN−γ含量とCDとを関係づけること、IL−4の大量産生とUCとを関係づけることが可能になる。これらのマーカーにより、正確な診断が困難である場合が多い、劇症大腸炎においてもCD及びUCを識別することが可能になる。腸生検から得られる情報を用いて、より正確なテーラーメイド医療のため、かつ一部の患者における結腸全摘及び回腸造瘻による外科的介入を防ぐために、早期に正確な診断をすることができる。
【0034】
同様の方式で、好中球、好酸球、NK細胞、NKT細胞、制御性T細胞、及びB細胞のような他の免疫細胞の活性化マーカーの多色フローサイトメトリー分析は、IBDの診断、病期分類、及び監視に有用であり得る。
【0035】
実施例4
ステロイド受容体の発現プロファイルの決定。一部のIBD患者がステロイド治療に対して耐性になる場合があることは、周知の問題である。本発明によれば、これらの細胞がステロイド治療に対して感受性であるかどうかを決定するための、ウエスタンブロット又は生検由来の単一細胞の細胞内フローサイトメトリーを用いる、IBD患者のステロイド受容体発現プロファイルの調査を開示する。ステロイドに感受性応答する患者又はステロイド治療に感受性を有しない患者由来の腸生検又は単一細胞懸濁液を、細胞内フローサイトメトリーにより、ステロイド受容体発現の程度について調査した。ステロイド不応性IBDの患者は全て、グルココルチコイド受容体の発現レベルが低いが、一方ステロイド治療により腸治癒し及び低いSEO指数を示す患者はより高いレベルで発現した(図6)。したがって、腸リンパ球におけるステロイド受容体の発現レベルは、治療に対する感受性と相関する。
【0036】
実施例5
サイトカイン発現アレイプロファイリング。本発明によれば、IBD患者由来の生検中の免疫細胞のサイトカイン発現パターンのより詳細な像が、発現アレイプロファイリングにより得られる。この種のプロファイリングは、20kのAffymetrixチップを用いて実施した。CD患者で見られるTh1活性化パターンは、CD69及びTbet、IFN−γ及びTIM−3のmRNAの発現増加により引き起こされると思われる。対照的に、Th2の発現パターンは、UC患者で見られ、CD69に加えて、GATA−3及びIL−4、IL−5の発現増加が注目される。アレイでの所見は、リアルタイム定量PCR(QT−PCR)により確認された。したがって、CD患者由来の細胞は、高いTbet転写産物の発現レベルを示し(図8)、一方GATA−3転写産物はUC患者由来の細胞で増加した(図9)。Tbetの発現は、更に、活動性相のCD患者において実質的に増加することが見出された(図7)。それ故、発現プロファイルのパネルに基づいて、CDにおけるTh1の優位性は、Tbet、IFN−γ及びTIM−3の発現増加により予測できる。結果として、Th2の優位性及びUCは、GATA−3及びIL−4、IL−5転写産物の発現増加により予測できる。
【0037】
参考文献
1. Bouma G, Strober W. The immunological and genetic basis of inflammatory bowel disease. Nature Reviews Immunology 2003; 3: 521−533.
2. Rahbar A, Bostrom L, Lagerstedt U, Magnusson 1, Soderberg−Naucler C, Sundqvist VA. Evidence of active cytomegalovirus infection and increased production of IL−6 in tissue specimens obtained from patients with inflammatory bowel diseases. Inflamm Bowel Dis 2003; 3:154−61.
3. Wakefield E, AJ, Ekblom A, Dhillon AP, Pittilo RM, Pounder RE. Crohn ’s disease: pathogenesis and persistent measles virus infection. Gastroenterology 108:911−916, 1995.
4. Toms C, Powrie F. Control of intestinal inflammation by regulatory T cells. Microbes and infection. 2001; 3: 929−935.
5. Thorn M. Lymphatic mapping and sentinel node biopsy: is the method applicable to patients with colorectal and gastric cancer? Eur J Surg. 2000; 166: 755−758.
6. Lapidus A, Bernell O, Hellers G, Persson PG, Lofberg R. Incidence of Crohn’s disease in Stockholm County 1955−1989. Gut. 1997; 41: 480−486.
7. Tysk C, Jarnerot G. Ulcerative proctocolitis in Orebro, Sweden. A retrospective epidemiologic study, 1963−1987. Scand J Gastroenterol. 1992; 27: 945−50.
8. Wittig BM, Zeitz M. The gut as an organ of immunology. International Journal of Colorectal Disease. 2002: e−journal.
9. Ekbom A, Helmick C, Zack M, Adami HO. Ulcerative colitis and colorectal cancer. A population−based study. N Engl J Med 1990; 323: 1228−33.
10. Strober W, Kelsall, B. To be responsive or not to be responsive, that is the mucosal question. Gastroenterology 1998; 114: 214−217.
11. Duchmann R, Kaiser I, Hermann E, Mayet W, Ewe K, Meyer−zum−Buschenfelde KH. Tolerance exists towards resident intestinal flora but is broken in active inflammatory bowel disease. Clin Exp Immunol 1995; 102: 448−455.
12. Macdonald TT, Monteleone G, Pender SLF. Recent developments in the immunology of inflammatory bowel disease. Scan J Immunol. 2000; 51: 2−9.
13. DeRisi J, Penland L, Brown PO, Bittner ML, Meltzer PS, Ray M, Chen Y, Su YA, Trent JM. Use of a cDNA microarray to analyse gene expression patterns in human cancer. Nat Genet. 1996 14(4):457−60.
【発明の詳細な説明】
【0001】
[発明の分野]
本発明は、炎症性腸疾患の診断、病期分類、及び監視に関する。
【0002】
[発明の背景]
炎症性腸疾患(IBD)は、クローン病(CD)及び潰瘍性大腸炎(UC)を含み、両方とも腸に長期にわたる損傷を引き起こす。近年、IBDには、顕微鏡的大腸炎、コラーゲン蓄積大腸炎、及びリンパ球性大腸炎も含まれている。外来抗原、免疫反応障害、及び遺伝要因の組合せがIBDの病因となっているようであるが、腸炎の発生機序には不明な点が残っている(1)。今までのところ、例えば、腸へのCMV感染(2)及び持続性麻疹ウイルス感染(3)に由来する抗原等の、多くの可能性のある抗原が提唱されている。
【0003】
腸間膜リンパ節は、腸の内容物を排出するものであるが、これがIBDにおける炎症の発生及び維持にとって重要な部位である可能性が最も高い。炎症を誘発する抗原は、免疫系への提示のために、腸壁からリンパ節に能動的に輸送される(1、4)。腸の排出病理領域である、第1リンパ節を同定する技術、及び手術中にこれらの節を回収する技術が開発されてきた(5)。本発明は、細胞表面のマーカー発現及びmRNA発現アレイプロファイリングに基づいて、様々なIBDの診断及び病期分類を表すために構築されたアッセイを開示する。これらのパターンは、腸炎の種類及び活動性に関連し、それ故、療法に対する応答を含む、疾患活動性の診断、病期分類、及び監視に有用である。
【0004】
スウェーデンでは、毎年1400人が新たにIBDであると診断される。新たに診断される人の数は、近年増加している。IBD発生率のピークは、20歳である(6、7)。腸は、免疫担当細胞が広範な内因性及び外因性因子と出会う複雑な微環境である。これらの相互作用は、固有層におけるT細胞の豊富さが反映される、連続的で悪性度の低い炎症を生じる(8)。T細胞は、常時、有害な病原体に対しては作用することができるが、無害な食餌性抗原又は正常な常在性細菌叢のメンバーは無視する。腸免疫系の耐性と反応との間の平衡が崩れたとき、結果的にIBDになることがある。
【0005】
CD及びUCはIBDの2つの主要な形である。CDでは、腸のいずれの部分が罹患する場合もあるが、最も一般的なのは回盲領域(50%)及び結腸(30%)の罹患である。患者の約3分の1が、随伴性肛門周囲疾患も有している。小腸のいくつかの小区画が罹患する場合もあり、しばしば区域性病変として知られている。組織病理学的に、炎症は貫壁性であり、肉芽腫のリンパ球及びマクロファージの密度の濃い浸潤が、患者の最大60%に見られる。UCは通常直腸が関与し、近位方向に伸長し、この伸長は個々の患者間で変動するが、疾患は常に結腸に限定されたままである。全結腸炎という用語は、炎症に右結腸曲が関与するときにも用いられる。微視的には、粘膜炎症は表在性であり、リンパ球及び顆粒球が豊富である。潰瘍形成及び陰窩膿瘍が一般的である(1)。下痢(多くの場合、血液を含む)、栄養失調、発熱及び痛みのような長期の炎症に起因する症状とともに、患者はまた上皮異形成及び最終的には腸癌が発生する長期的なリスクを有する(9)。IBD患者の約15%が病型不定型大腸炎を有し、それ故CD又はUCの確定診断をすることができない。更により重要なことに、劇症大腸炎の患者の中には、診断に関して不確実性が存在する場合が多い。正確な診断は、早急に必要な内科治療、及び長期的展望では、最良の外科治療について決定するときに重要である。CDの外科治療としては、炎症区画の切除、狭窄形成術による狭窄の治療、罹患区画の大腸切除、又は重篤な大腸炎の場合は結腸全摘及び回腸造瘻が挙げられる。CDにおける再建手術は、腸の連続性を回復させるための回腸直腸吻合であることが多い。骨盤内パウチは、回腸直腸吻合領域における瘻孔形成に関連する合併症のリスクが高いため、ほとんど選択されない。一部の患者は、最後に永続的回腸造瘻を行う。UCのため重篤な大腸炎の患者は、緊急処置として結腸切除及び回腸造瘻により治療される場合が多い。約6カ月後、回腸直腸吻合又は骨盤内パウチのいずれかを、確定した外科治療として選択することができるが、一部の例では永続的回腸造瘻のみが選択し得る解決法となることもある。
【0006】
いくつかの証拠から、CDは正常な腸管細菌叢に対する耐性の崩壊の結果であることが暗示されている。ヒトでは、患者の固有層の単核細胞は自己糞便抽出物に応答することが示されているが、これは正常にコントロールされている場合には当てはまらない(10)。T細胞の刺激に対する抗原への依存性は、自己腸内細菌の超音波処理に対してCD患者由来のリンパ球がインビトロで増殖したことが観察されたことから明らかであり、この場合増殖は抗MHCクラスII抗体により阻害された(11)。UCに関して、微環境の役割はそれほど明確にはなっておらず、炎症は、免疫グロブリン(IgG)に依存すると考えられる自己免疫様病因、硬化性胆管炎のような自己免疫疾患との関連、自己抗体の発生頻度、及び大腸粘膜の特異性に基づくと思われる(12)。仮説上、腸に対する免疫反応は、制御性T細胞の不十分な阻害作用の結果である可能性がある(1、4、10)。
【0007】
活動性UCは、結腸粘膜内の活性化顆粒球、及び単球/マクロファージの湿潤を特徴とする。これらの浸潤細胞は、炎症促進性サイトカインの主な供給源である。IBD患者は、内科治療に対して耐性が生じる場合がある。可能性のある原因は、顆粒球、サイトカイン、又はステロイド受容体の発現を含む免疫細胞の機能特性の分布変化である。
【0008】
今日、IBDの診断及び病期分類は、内視鏡的基準及び組織病理学に加えて、臨床的パラメータ(アルブミン、SR、CRP、発熱、便の数)の組合せに基づく。炎症活動性は、顕微鏡により評価されるが、生検に存在する一般的な型及び数の細胞しか考慮されない。活動特性は決定されない。
【0009】
[発明の目的]
本発明の目的は、活動性と不活動性腸疾患(IBD)を識別できる方法を提供することである。
【0010】
本発明の別の目的は、IBD患者においてクローン病(CD)と潰瘍性大腸炎(UC)を識別できる診断方法を提供することである。
【0011】
本発明の更なる目的は、病型不定型大腸炎の患者においてクローン病と潰瘍性大腸炎を識別できる方法を提供することである。
【0012】
本発明の追加の目的は、発明の概要における研究、図面及び添付する「特許請求の範囲」に例示されるその好ましい実施形態から明らかとなる。
【0013】
[発明の概要]
本発明は、腸抗原が、粘膜樹状細胞により局所領域腸間膜リンパ節に連続的に輸送されるという洞察に基づいている。このプロセスでは、制御性T細胞は、エフェクターT細胞の調節、ひいては正常抗原に対する応答の阻止において極めて重要な役割を担うことができる。
【0014】
動物モデルでは、エフェクターT細胞応答の2つの異なる経路を識別することができる。最初の種類の免疫開始は、活性化ヘルパーT細胞タイプ1(Th1)によって駆動され、これはIL−12、IFN−ガンマ及びTNF−アルファのようなサイトカインの産生を特徴とする。炎症部位は、マクロファージ及び細胞傷害性エフェクターT細胞(CD8+)の細胞介在浸潤により支配される。この種の炎症は、CD病変に類似している。ヘルパーT細胞タイプ2(TH2)の免疫活性化では、体液性の免疫防御系(免疫グロブリン)が、炎症部位で見られる細胞傷害性T細胞並びにIL−4及びIL−5のようなサイトカイン、並びにIgG1と併せて、重要な役割を果たしている。動物モデルでは、Th2型炎症はヒトUCと共通した特性を有する。
【0015】
本発明によれば、炎症組織の生検試料から単離される単一細胞を多色フローサイトメトリーにかけることにより、IBD患者においてクローン病及び潰瘍性大腸炎を識別する方法を開示する。活性化マーカー及びサイトカイン産物の定量により、局部的免疫反応の状態を高精度で決定することが可能になる。本発明の方法はまた、IBD患者における病期分類及び療法の評価にも有用である。
【0016】
本発明の第1の好ましい態様によれば、ヒトにおいてIBDの存在を決定する方法であって、疾患が疑われる遠位回腸粘膜若しくは結腸粘膜由来、又は前記遠位回腸粘膜若しくは結腸粘膜を排出するセンチネルリンパ節由来の生検試料を提供するステップと、CD69活性化マーカーを発現しているCD4 T細胞の数を定量するステップと、前記CD4 T細胞の数を、健常個体及び活動性若しくは不活動性状態のIBDを有するヒトから得られる対応するT細胞の数と比較するステップとを含む方法を提供する。
【0017】
本発明の第2の好ましい態様によれば、IBD患者において潰瘍性大腸炎とクローン病を識別する方法を提供する。この方法は、罹患した腸粘膜又はこのような粘膜を排出するセンチネルリンパ節由来の生検試料を提供するステップと、CDの指標である活性化ヘルパーT細胞タイプ1(Th1)によって駆動される免疫活性化で産生されるサイトカインの1種又は複数、及びUCの指標である活性化ヘルパーT細胞タイプ2(Th2)によって駆動される免疫活性化で産生されるサイトカインの1種又は複数を定量するステップと、Th1及びTh2サイトカインの量を、顕在化しているCD及び/又はUCの患者で通常見出されるTh1並びにTh2の量と比較するステップとを含む。好ましいTh1サイトカインはIL−12、IFN−γ及びTNF−α、特にIFN−γを含む。好ましいTh2サイトカインは、IL−4及びIL−5、特にIL−4を含む。この方法では、独立して又は追加して、クローン病のマーカーとしてIgG1を定量することも好ましい。
【0018】
本発明の好ましい態様によれば、IBD生検由来の免疫細胞のmRNA発現プロファイリング(13)をIBDの診断、病期分類、療法及び療法の監視に用いる。
【0019】
本発明の更に好ましい態様によれば、ステロイド治療に対するIBD患者の感受性を決定する方法であって、前記患者から得られるCD4+ヘルパーT細胞におけるグルココルチコイド受容体発現量を決定するステップを含む方法を開示する。
【0020】
本出願では、「病期分類」は、IBDにおける活性化段階、炎症の重篤度、炎症の種類等の決定に関連し、一方「監視」は患者におけるIBDの発達を監視することに関連する。
【0021】
本発明の更に好ましい態様は、多数の図を含む図面、及び添付する特許請求の範囲に例示する、以下のその好ましい実施形態の記述に開示する。
【0022】
本発明は、ここで、図面に例示される多数の好ましい実施形態を参照することにより、より詳細に説明される。
【図面の簡単な説明】
【0023】
【図1】フローサイトメトリー並びにCD4及び活性化マーカーCD69に対する抗体を用いた、活動性又は不活動性UCの患者由来、及び健常対照由来の生検の単一細胞懸濁液の調査を示すグラフであり、CD4+細胞の平均蛍光強度をy軸にとる。
【図2】健常対照、活動性又は不活動性UCの患者、及び不活動性CDの患者からの生検を調査したフローサイトメトリー(FACS)で見られる活性化CD69+CD4+T細胞の百分率の相互関係を示すグラフである。
【図3】異なる病期段階の疾患の患者のIBDスコアの、生検を調査したFACSにおける活性化CD69+CD4+T細胞の百分率との相互関係を示すグラフである。
【図4】CD患者の炎症領域を排出する、非センチネル節、センチネル節1、及びセンチネル節2由来の培養上清中のIFN−γの産生を示すグラフである。
【図5】UC患者の炎症領域を排出する、非センチネル節(NSLN)及びセンチネル節(SLN)由来の培養上清中のIL−4の産生を示すグラフである。
【図6】グルココルチコイド治療に応答しないIBD患者由来のCD4+ヘルパーT細胞中のグルココルチコイド受容体の細胞内発現レベルの低下を示すグラフである。
【図7】活動性CDの患者の腸管由来のCD4+ヘルパーT細胞においてTbet発現は上昇するが、一方不活動性相におけるTbet発現は低いことを示すグラフである。
【図8】活動性CDの患者の腸管由来のCD4+ヘルパーT細胞においてTbet発現は上昇するが、一方不活動性相におけるTbet発現は低いことを示すグラフである。更に、UCの患者由来のCD4+ヘルパーT細胞におけるTbet発現は、活動性CDに見られるTbet発現に比べて低い。
【図9】活動性UCの患者の腸管由来のCD4+ヘルパーT細胞においてGATA−3発現は上昇するが、一方不活動性相におけるGATA−3発現は低いことを示すグラフである。
【0024】
[発明の詳細な説明]
材料及び方法
単一細胞懸濁液を新鮮な生検から作製した。フローサイトメトリー(FACS)は、4つを組み合わせたFITC、PE、PerCp、APCコンジュゲートを用いて、直接標識された蛍光抗体CD4、CD8、CD69、CD25、CD14、CD9、CD66b、CD19を用いて実施した。アイソタイプ抗体を対照として用いた。CD及びUCでは、炎症を起こした腸及び罹患していない正常腸を排出するセンチネル節を、比較分析のために炎症領域の周りに注入した、トレーサー物質であるパテントブルー(Patent Blue)を用いて同定した。また、各患者から静脈血試料を採取した。
【0025】
サイトカインIL−4及びIFN−γの分析は、サンドイッチELISA(R&D systems)を用いて生検又はセンチネル節由来の単一細胞培養上清で実施した。
【0026】
グルココルチコイド受容体の発現の分析は、マウス抗ヒトグルココルチコイド受容体抗体を用い、続いてサポニン透過化単一細胞の抗マウスIgG FITCのコンジュゲートした検出抗体を用いて実施した。
【0027】
単一細胞懸濁液からのRNA単離は、トリゾール(TRIZOL)試薬(Invitrogen、カタログ番号15596−026)を用いて実施した。サンプルあたり100ngのRNAを加え、製造業者のプロトコルにしたがって、アイスクリプト(iScript)(商標)cDNA合成キットを用いた逆転写酵素反応を行った。定量PCRは、2×IQ(商標)SYBR(登録商標)グリーンスーパーミックス(Green Supermix)を用いてアイサイクラー(iCycler)IQで実施した。サイクル閾値は、BIO−RAD製のアイサイクラーIQ(商標)光学系ソフトウェアバージョン3.1を用いて得た。発現レベルは、2−ΔΔCt法を用いてRPIIに正規化した。或いは、単離したRNAをcDNA合成、FAM標識に供し、その後Affymetrixヒトアレイチップを用いて分析した。
【0028】
プライマー配列 QT−PCR:
IFNγ QT Fwrd GCAGGTCATTCAGATGTAGCGG
IFNγ QT Rev TGTCTTCCTTGATGGTCTCCACAC
IL−4 QT Fwrd CACAACTGAGAAGGGAAACCTTCTG
IL−4 QT Rev CTCTCTCATGATCGTCTTTAGCCTTTC
T−bet QT Fwrd CACTACAGGATGTTTGTGGACGTG
T−bet QT Rev CCCCTTGTTGTTTGTGAGCTTTAG
GATA3 QT Fwrd AACTGTCAGACCACCACAACCACAC
GATA3 QT Rev GGATGCCTTCCTTCTTCATAGTCAGG
【0029】
実施例1
粘膜又はIBDに罹患している領域を排出するセンチネルリンパ節内の免疫細胞の調査。粘膜又はIBDに罹患している領域を排出するセンチネルリンパ節内の免疫細胞のフローサイトメトリーによる調査は、健常対照と比較して、CD4+ヘルパーT細胞における活性化マーカーCD69の発現(図1)及び活動性IBDの患者のCD8+細胞傷害性T細胞の発現の有意な増大(p<0.009)を示す。不活動性IBDの患者(有能な病理学者の判断において)は、それにもかかわらず、活性化マーカーCD69の発現上昇に加えて、CD4+T細胞の活性化の有意な増大(p<0.03)を示す(図1)。CD4+CD69+T細胞の数はまた、健常対照及び報告された不活動性IBDの患者と比較して、潰瘍性大腸炎及びクローン病の両方において活動性IBDの患者で増加する(図2)。
【0030】
実施例2
患者のIBDスコアとフローサイトメトリープロファイルとの相互関係。フローサイトメトリープロファイルによる、S−アルブミン、CRP、及び1日あたりの血液を含む便の数を含む患者のIBDスコアを図3に示す。CD69活性化マーカーを発現しているCD4+T細胞の数は、IBDスコア(SEO指数)とよく相関していた。
【0031】
SEO指数を利用して、結果と疾患の活動性との相互関係を示した。この指数は、臨床的(便の頻度及び血便)及び検査パラメータ(Hb、アルブミン、及び赤血球沈降速度)を用いる。本発明者らの材料では、赤血球沈降速度はCRP(C−反応性タンパク質)により置き換えられた。
【0032】
実施例3
CD及びUCの両方における、腸の病変領域を排出するセンチネル節、並びに罹患していないセグメントを排出する節での免疫反応。現在、CDにおける免疫反応は、Th1応答と見なされており、一方UCは非定型Th2活性化に類似している場合がある。この見解は、主に、人工的な手段により大腸炎を刺激する動物モデルに基づいているように思われる。ヒトでは、IBDの炎症経路の特徴付けは限られている;結腸のかん流検査に加えて末梢血液細胞の分析は、動物モデルの観察結果の一部を支持するが、病態生理の概要は不完全である。本発明によるCD及びUCの両方における、腸の病変領域を排出するセンチネル節、及び罹患していないセグメントを排出する節における免疫反応及びサイトカインパターンの判定は、サイトカインの放出をCD及びUC診断で用い得ることを示唆する。
【0033】
普及している基準により、IBD患者の15%は、病型不定型大腸炎を有すると考えられる、すなわち、確定診断することができない。しかしながら、正確な診断は、それにもかかわらず、更なる治療時の判断において重要である。また、劇症大腸炎においてCD及びUCを識別する(differ)ことは不可能である場合が多く、これは適切な内科治療を遅延させ、結腸切除による早期外科的介入を必要とすることがある。多量のIFN−γが、現在、CD患者の胃腸炎症部位で同定されている(図4)。対照的に、UC患者の胃腸炎症部位は、大量のTh2サイトカインIL−4を含有することが見出されている(図5)。これらの所見により、胃腸生検試料中の高IFN−γ含量とCDとを関係づけること、IL−4の大量産生とUCとを関係づけることが可能になる。これらのマーカーにより、正確な診断が困難である場合が多い、劇症大腸炎においてもCD及びUCを識別することが可能になる。腸生検から得られる情報を用いて、より正確なテーラーメイド医療のため、かつ一部の患者における結腸全摘及び回腸造瘻による外科的介入を防ぐために、早期に正確な診断をすることができる。
【0034】
同様の方式で、好中球、好酸球、NK細胞、NKT細胞、制御性T細胞、及びB細胞のような他の免疫細胞の活性化マーカーの多色フローサイトメトリー分析は、IBDの診断、病期分類、及び監視に有用であり得る。
【0035】
実施例4
ステロイド受容体の発現プロファイルの決定。一部のIBD患者がステロイド治療に対して耐性になる場合があることは、周知の問題である。本発明によれば、これらの細胞がステロイド治療に対して感受性であるかどうかを決定するための、ウエスタンブロット又は生検由来の単一細胞の細胞内フローサイトメトリーを用いる、IBD患者のステロイド受容体発現プロファイルの調査を開示する。ステロイドに感受性応答する患者又はステロイド治療に感受性を有しない患者由来の腸生検又は単一細胞懸濁液を、細胞内フローサイトメトリーにより、ステロイド受容体発現の程度について調査した。ステロイド不応性IBDの患者は全て、グルココルチコイド受容体の発現レベルが低いが、一方ステロイド治療により腸治癒し及び低いSEO指数を示す患者はより高いレベルで発現した(図6)。したがって、腸リンパ球におけるステロイド受容体の発現レベルは、治療に対する感受性と相関する。
【0036】
実施例5
サイトカイン発現アレイプロファイリング。本発明によれば、IBD患者由来の生検中の免疫細胞のサイトカイン発現パターンのより詳細な像が、発現アレイプロファイリングにより得られる。この種のプロファイリングは、20kのAffymetrixチップを用いて実施した。CD患者で見られるTh1活性化パターンは、CD69及びTbet、IFN−γ及びTIM−3のmRNAの発現増加により引き起こされると思われる。対照的に、Th2の発現パターンは、UC患者で見られ、CD69に加えて、GATA−3及びIL−4、IL−5の発現増加が注目される。アレイでの所見は、リアルタイム定量PCR(QT−PCR)により確認された。したがって、CD患者由来の細胞は、高いTbet転写産物の発現レベルを示し(図8)、一方GATA−3転写産物はUC患者由来の細胞で増加した(図9)。Tbetの発現は、更に、活動性相のCD患者において実質的に増加することが見出された(図7)。それ故、発現プロファイルのパネルに基づいて、CDにおけるTh1の優位性は、Tbet、IFN−γ及びTIM−3の発現増加により予測できる。結果として、Th2の優位性及びUCは、GATA−3及びIL−4、IL−5転写産物の発現増加により予測できる。
【0037】
参考文献
1. Bouma G, Strober W. The immunological and genetic basis of inflammatory bowel disease. Nature Reviews Immunology 2003; 3: 521−533.
2. Rahbar A, Bostrom L, Lagerstedt U, Magnusson 1, Soderberg−Naucler C, Sundqvist VA. Evidence of active cytomegalovirus infection and increased production of IL−6 in tissue specimens obtained from patients with inflammatory bowel diseases. Inflamm Bowel Dis 2003; 3:154−61.
3. Wakefield E, AJ, Ekblom A, Dhillon AP, Pittilo RM, Pounder RE. Crohn ’s disease: pathogenesis and persistent measles virus infection. Gastroenterology 108:911−916, 1995.
4. Toms C, Powrie F. Control of intestinal inflammation by regulatory T cells. Microbes and infection. 2001; 3: 929−935.
5. Thorn M. Lymphatic mapping and sentinel node biopsy: is the method applicable to patients with colorectal and gastric cancer? Eur J Surg. 2000; 166: 755−758.
6. Lapidus A, Bernell O, Hellers G, Persson PG, Lofberg R. Incidence of Crohn’s disease in Stockholm County 1955−1989. Gut. 1997; 41: 480−486.
7. Tysk C, Jarnerot G. Ulcerative proctocolitis in Orebro, Sweden. A retrospective epidemiologic study, 1963−1987. Scand J Gastroenterol. 1992; 27: 945−50.
8. Wittig BM, Zeitz M. The gut as an organ of immunology. International Journal of Colorectal Disease. 2002: e−journal.
9. Ekbom A, Helmick C, Zack M, Adami HO. Ulcerative colitis and colorectal cancer. A population−based study. N Engl J Med 1990; 323: 1228−33.
10. Strober W, Kelsall, B. To be responsive or not to be responsive, that is the mucosal question. Gastroenterology 1998; 114: 214−217.
11. Duchmann R, Kaiser I, Hermann E, Mayet W, Ewe K, Meyer−zum−Buschenfelde KH. Tolerance exists towards resident intestinal flora but is broken in active inflammatory bowel disease. Clin Exp Immunol 1995; 102: 448−455.
12. Macdonald TT, Monteleone G, Pender SLF. Recent developments in the immunology of inflammatory bowel disease. Scan J Immunol. 2000; 51: 2−9.
13. DeRisi J, Penland L, Brown PO, Bittner ML, Meltzer PS, Ray M, Chen Y, Su YA, Trent JM. Use of a cDNA microarray to analyse gene expression patterns in human cancer. Nat Genet. 1996 14(4):457−60.
【特許請求の範囲】
【請求項1】
患者において活動性IBDと不活動性IBDとを識別する方法であって、
疾患が疑われる胃腸粘膜、特に遠位回腸粘膜若しくは結腸粘膜、の生検試料又は前記胃腸粘膜を排出するセンチネルリンパ節に由来する生検試料を提供するステップと、
前記試料から単一細胞の懸濁液を調製するステップと、
前記単一細胞の懸濁液を、直接標識された蛍光CD69抗体を用いてCD4+ヘルパーT細胞の炎症活性化マーカーCD69の発現について分析するステップと、
そのように測定されたCD69を発現しているヘルパーT細胞の数を、対応する健常個体の腸組織から得られた単一細胞の懸濁液で測定されたCD69を発現しているヘルパーT細胞の数と比較するステップと、を含み、
CD69を発現しているヘルパーT細胞の増加度合いが著しい場合に活動性IBDが存在することを示し、一方Tの増加度合いがそれほど著しくない場合に不活動性IBDが存在することを示す方法。
【請求項2】
分析がフローサイトメトリーによるものである、請求項1に記載の方法。
【請求項3】
前記抗体が直接標識された抗体である、請求項1又は2に記載の方法。
【請求項4】
前記抗体が蛍光抗体である、請求項1〜3のいずれか一項に記載の方法。
【請求項5】
前記増加度合いが著しい場合が、p<0.009によって特徴付けられる、請求項1〜4のいずれか一項に記載の方法。
【請求項6】
前記増加度合いがそれほど著しくない場合が、0.03<P>0.009によって特徴付けられる、請求項1〜5のいずれか一項に記載の方法。
【請求項7】
IBD患者において潰瘍性大腸炎とクローン病とを識別する方法であって、
罹患した腸粘膜又はこのような粘膜を排出するセンチネルリンパ節から得られる患者の生検試料を提供するステップと、
前記試料から単一細胞の懸濁液を調製するステップと、
前記懸濁液又はその上清中の、クローン病の指標である活性化ヘルパーT細胞タイプ1(Th1)によって駆動される免疫活性化で産生されるサイトカインの1種又は複数、及び潰瘍性大腸炎の指標である活性化ヘルパーT細胞タイプ2(Th2)によって駆動される免疫活性化で産生されるサイトカインの1種又は複数を定量するステップと、
前記定量したTh1及びTh2サイトカインの量を、対応する顕在化しているクローン病及び/又は潰瘍性大腸炎の患者で見出される量と比較するステップと、を含む方法。
【請求項8】
活性化ヘルパーT細胞タイプ1によって駆動される免疫活性化で産生されるサイトカインが、IL−12、IFN−γ及びTNF−αから選択される、請求項7に記載の方法。
【請求項9】
活性化ヘルパーT細胞タイプ2によって駆動される免疫活性化で産生されるサイトカインが、IL−4及びIL−5から選択される、請求項7又は8に記載の方法。
【請求項10】
クローン病のマーカーとして、試料中のIgG1を定量するステップを更に含む、請求項7〜9のいずれか一項に記載の方法。
【請求項11】
前記上清中でIL−12、IFN−γ及びTNF−αのいずれかが定量される、請求項8に記載の方法。
【請求項12】
前記上清中でIL−4及びIL−5のいずれかが定量される、請求項9に記載の方法。
【請求項13】
患者においてクローン病の存在を決定する方法であって、
疾患が疑われる胃腸粘膜、特に遠位回腸粘膜若しくは結腸粘膜、の生検試料又は前記胃腸粘膜を排出するセンチネルリンパ節に由来する生検試料を提供するステップと、
前記試料から単一細胞の懸濁液を調製するステップと、
前記単一細胞の懸濁液からmRNAを単離するステップと、
前記単離したmRNAを、CD69、Tbet、IFN−γ、TIM−3のうち2種以上のmRNAについて分析するステップと、
前記分析結果を、健常個体から同様にして得られたmRNA中の対応するCD69、Tbet、IFN−γ、TIM−3のうち2種以上のmRNAの分析結果と比較するステップと、を含み、
前記患者のmRNA試料中のCD69、Tbet、IFN−γ、TIM−3のうち2種以上のmRNAの発現増加が、クローン病の指標である方法。
【請求項14】
クローン病の病期分類又はクローン病の療法の監視における、請求項13に記載の方法の使用。
【請求項15】
患者において潰瘍性大腸炎の存在を決定する方法であって、
疾患が疑われる胃腸粘膜、特に遠位回腸粘膜若しくは結腸粘膜、の生検試料又は前記胃腸粘膜を排出するセンチネルリンパ節に由来する生検試料を提供するステップと、
前記試料から単一細胞の懸濁液を調製するステップと、
前記単一細胞の懸濁液からmRNAを単離するステップと、
前記単離したmRNAを、CD69、GATA−3、IL−4、IL−5のうち2種以上のmRNAについて分析するステップと、
前記分析結果を、健常個体から同様にして得られたmRNA中の対応するCD69、GATA−3、IL−4、IL−5のうち2種以上のmRNAの分析結果と比較するステップと、を含み、
前記患者のmRNA試料中のCD69、GATA−3、IL−4、IL−5のうち2種以上のmRNAの発現増加が、潰瘍性大腸炎の指標である方法。
【請求項16】
潰瘍性大腸炎の病期分類又は潰瘍性大腸炎の療法の監視における、請求項15に記載の方法の使用。
【請求項17】
生検試料中のTbet発現量の、前記生検試料を採取した患者のクローン病の病期分類のマーカーとしての使用。
【請求項18】
生検試料中のTbet発現量の、前記生検試料を採取した患者のクローン病の活動性相と不活動性相を識別するためのマーカーとしての使用。
【請求項19】
生検試料中のGATA−3発現量の、前記生検試料を採取した患者における潰瘍性大腸炎の活動性相と不活動性相を識別するためのマーカーとしての使用。
【請求項20】
IBD患者のステロイド治療に対する感受性を決定する方法であって、
前記患者から得られるCD4+ヘルパーT細胞におけるグルココルチコイド受容体の発現量を決定するステップを含む方法。
【請求項21】
前記決定された発現量を、ステロイド治療に応答するIBD患者若しくはIBD患者群における対応する発現量及び/又はステロイド治療に応答しないIBD患者若しくはIBD患者群における対応する発現量と比較する、請求項20に記載の方法。
【請求項22】
前記IBD患者における前記決定された発現量が、非応答IBD患者群における平均発現量に対して50%増加することが、前記患者がステロイド治療に感受性であることを80%以上示す、請求項21に記載の方法。
【請求項23】
前記非応答IBD患者群を選択するための唯一の基準が、ステロイド治療に対して非応答性であることである、請求項22に記載の方法。
【請求項1】
患者において活動性IBDと不活動性IBDとを識別する方法であって、
疾患が疑われる胃腸粘膜、特に遠位回腸粘膜若しくは結腸粘膜、の生検試料又は前記胃腸粘膜を排出するセンチネルリンパ節に由来する生検試料を提供するステップと、
前記試料から単一細胞の懸濁液を調製するステップと、
前記単一細胞の懸濁液を、直接標識された蛍光CD69抗体を用いてCD4+ヘルパーT細胞の炎症活性化マーカーCD69の発現について分析するステップと、
そのように測定されたCD69を発現しているヘルパーT細胞の数を、対応する健常個体の腸組織から得られた単一細胞の懸濁液で測定されたCD69を発現しているヘルパーT細胞の数と比較するステップと、を含み、
CD69を発現しているヘルパーT細胞の増加度合いが著しい場合に活動性IBDが存在することを示し、一方Tの増加度合いがそれほど著しくない場合に不活動性IBDが存在することを示す方法。
【請求項2】
分析がフローサイトメトリーによるものである、請求項1に記載の方法。
【請求項3】
前記抗体が直接標識された抗体である、請求項1又は2に記載の方法。
【請求項4】
前記抗体が蛍光抗体である、請求項1〜3のいずれか一項に記載の方法。
【請求項5】
前記増加度合いが著しい場合が、p<0.009によって特徴付けられる、請求項1〜4のいずれか一項に記載の方法。
【請求項6】
前記増加度合いがそれほど著しくない場合が、0.03<P>0.009によって特徴付けられる、請求項1〜5のいずれか一項に記載の方法。
【請求項7】
IBD患者において潰瘍性大腸炎とクローン病とを識別する方法であって、
罹患した腸粘膜又はこのような粘膜を排出するセンチネルリンパ節から得られる患者の生検試料を提供するステップと、
前記試料から単一細胞の懸濁液を調製するステップと、
前記懸濁液又はその上清中の、クローン病の指標である活性化ヘルパーT細胞タイプ1(Th1)によって駆動される免疫活性化で産生されるサイトカインの1種又は複数、及び潰瘍性大腸炎の指標である活性化ヘルパーT細胞タイプ2(Th2)によって駆動される免疫活性化で産生されるサイトカインの1種又は複数を定量するステップと、
前記定量したTh1及びTh2サイトカインの量を、対応する顕在化しているクローン病及び/又は潰瘍性大腸炎の患者で見出される量と比較するステップと、を含む方法。
【請求項8】
活性化ヘルパーT細胞タイプ1によって駆動される免疫活性化で産生されるサイトカインが、IL−12、IFN−γ及びTNF−αから選択される、請求項7に記載の方法。
【請求項9】
活性化ヘルパーT細胞タイプ2によって駆動される免疫活性化で産生されるサイトカインが、IL−4及びIL−5から選択される、請求項7又は8に記載の方法。
【請求項10】
クローン病のマーカーとして、試料中のIgG1を定量するステップを更に含む、請求項7〜9のいずれか一項に記載の方法。
【請求項11】
前記上清中でIL−12、IFN−γ及びTNF−αのいずれかが定量される、請求項8に記載の方法。
【請求項12】
前記上清中でIL−4及びIL−5のいずれかが定量される、請求項9に記載の方法。
【請求項13】
患者においてクローン病の存在を決定する方法であって、
疾患が疑われる胃腸粘膜、特に遠位回腸粘膜若しくは結腸粘膜、の生検試料又は前記胃腸粘膜を排出するセンチネルリンパ節に由来する生検試料を提供するステップと、
前記試料から単一細胞の懸濁液を調製するステップと、
前記単一細胞の懸濁液からmRNAを単離するステップと、
前記単離したmRNAを、CD69、Tbet、IFN−γ、TIM−3のうち2種以上のmRNAについて分析するステップと、
前記分析結果を、健常個体から同様にして得られたmRNA中の対応するCD69、Tbet、IFN−γ、TIM−3のうち2種以上のmRNAの分析結果と比較するステップと、を含み、
前記患者のmRNA試料中のCD69、Tbet、IFN−γ、TIM−3のうち2種以上のmRNAの発現増加が、クローン病の指標である方法。
【請求項14】
クローン病の病期分類又はクローン病の療法の監視における、請求項13に記載の方法の使用。
【請求項15】
患者において潰瘍性大腸炎の存在を決定する方法であって、
疾患が疑われる胃腸粘膜、特に遠位回腸粘膜若しくは結腸粘膜、の生検試料又は前記胃腸粘膜を排出するセンチネルリンパ節に由来する生検試料を提供するステップと、
前記試料から単一細胞の懸濁液を調製するステップと、
前記単一細胞の懸濁液からmRNAを単離するステップと、
前記単離したmRNAを、CD69、GATA−3、IL−4、IL−5のうち2種以上のmRNAについて分析するステップと、
前記分析結果を、健常個体から同様にして得られたmRNA中の対応するCD69、GATA−3、IL−4、IL−5のうち2種以上のmRNAの分析結果と比較するステップと、を含み、
前記患者のmRNA試料中のCD69、GATA−3、IL−4、IL−5のうち2種以上のmRNAの発現増加が、潰瘍性大腸炎の指標である方法。
【請求項16】
潰瘍性大腸炎の病期分類又は潰瘍性大腸炎の療法の監視における、請求項15に記載の方法の使用。
【請求項17】
生検試料中のTbet発現量の、前記生検試料を採取した患者のクローン病の病期分類のマーカーとしての使用。
【請求項18】
生検試料中のTbet発現量の、前記生検試料を採取した患者のクローン病の活動性相と不活動性相を識別するためのマーカーとしての使用。
【請求項19】
生検試料中のGATA−3発現量の、前記生検試料を採取した患者における潰瘍性大腸炎の活動性相と不活動性相を識別するためのマーカーとしての使用。
【請求項20】
IBD患者のステロイド治療に対する感受性を決定する方法であって、
前記患者から得られるCD4+ヘルパーT細胞におけるグルココルチコイド受容体の発現量を決定するステップを含む方法。
【請求項21】
前記決定された発現量を、ステロイド治療に応答するIBD患者若しくはIBD患者群における対応する発現量及び/又はステロイド治療に応答しないIBD患者若しくはIBD患者群における対応する発現量と比較する、請求項20に記載の方法。
【請求項22】
前記IBD患者における前記決定された発現量が、非応答IBD患者群における平均発現量に対して50%増加することが、前記患者がステロイド治療に感受性であることを80%以上示す、請求項21に記載の方法。
【請求項23】
前記非応答IBD患者群を選択するための唯一の基準が、ステロイド治療に対して非応答性であることである、請求項22に記載の方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【公表番号】特表2010−535336(P2010−535336A)
【公表日】平成22年11月18日(2010.11.18)
【国際特許分類】
【出願番号】特願2010−519171(P2010−519171)
【出願日】平成20年7月29日(2008.7.29)
【国際出願番号】PCT/SE2008/000464
【国際公開番号】WO2009/017444
【国際公開日】平成21年2月5日(2009.2.5)
【出願人】(510021719)アイエスエス イミューン システム スティミュレーション アーベー (2)
【Fターム(参考)】
【公表日】平成22年11月18日(2010.11.18)
【国際特許分類】
【出願日】平成20年7月29日(2008.7.29)
【国際出願番号】PCT/SE2008/000464
【国際公開番号】WO2009/017444
【国際公開日】平成21年2月5日(2009.2.5)
【出願人】(510021719)アイエスエス イミューン システム スティミュレーション アーベー (2)
【Fターム(参考)】
[ Back to top ]

