炎症関連疾患の治療法
【課題】前炎症性サイトカインの発現及び/又は抗炎症性サイトカインの発現減少に伴う炎症関連疾患を治療するための医薬組成物及び方法の提供。
【解決手段】イソインジゴ、インジゴ、インジルビン、又はそれらの誘導体、例えばメイソインジゴ及びNATURAから選ばれる一つ以上の化合物の投与を含む。好ましくは、該医薬組成物は、イソインジゴ、インジゴ、インジルビン、又はそれらの誘導体から選ばれる一つ以上の化合物、抗炎症薬、及び製薬学的に許容しうる担体を含む。
【解決手段】イソインジゴ、インジゴ、インジルビン、又はそれらの誘導体、例えばメイソインジゴ及びNATURAから選ばれる一つ以上の化合物の投与を含む。好ましくは、該医薬組成物は、イソインジゴ、インジゴ、インジルビン、又はそれらの誘導体から選ばれる一つ以上の化合物、抗炎症薬、及び製薬学的に許容しうる担体を含む。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、前炎症性サイトカインの発現及び/又は抗炎症性サイトカインの発現減少に伴う炎症関連疾患を治療するための医薬組成物及び方法に関する。該方法は、典型的には、イソインジゴ(isoindigo)、インジゴ(indigo)、インジルビン(indirubin)、又はそれらの誘導体、例えばメイソインジゴ(Meisoindigo)及びNATURAから選ばれる一つ以上の化合物の投与を含む。
【発明の背景】
【0002】
非定型及び/又は異常炎症は、多様なヒト疾患の主要な要素である。多発性の変性障害を患うヒトは血中に過剰レベルの前炎症性マーカーを示すことが多い。そのような前炎症性マーカーの一つのタイプは、IL−1α、β、IL−2、IL−3、IL−6、IL−7、IL−9、IL−12、IL−17、IL−18、TNF−α、LT、LIF、オンコスタチン、及びIFNc1α、β、γを含む前炎症性徴候サイトカインである。
【0003】
炎症性サイトカインが直接の原因となって惹起される一般的な医学的問題の非制限的リストは下記の通りである。関節炎:炎症性サイトカインによる破壊が滑膜における病変や関節軟骨及び骨の破壊をもたらす;腎不全:炎症性サイトカインが循環を制限し、ネフロンを損傷する;狼瘡:炎症性サイトカインが自己免疫攻撃を誘発する;喘息:炎症性サイトカインが気道を閉塞する;乾癬:炎症性サイトカインが皮膚炎を誘発する;膵炎:炎症性サイトカインが膵細胞損傷を誘発する;アレルギー:炎症性サイトカインが自己免疫反応を誘発する;線維症:炎症性サイトカインが外傷組織を攻撃する;外科的合併症:炎症性サイトカインが治癒を妨害する;貧血:炎症性サイトカインがエリスロポエチン産生を攻撃する;及び線維筋痛:炎症性サイトカインが線維筋痛患者で上昇している。慢性炎症に伴うその他の疾患は、がん:慢性炎症によって引き起こされる;心臓発作:慢性炎症が冠状動脈のアテローム性硬化に寄与している;アルツハイマー病:慢性炎症が脳細胞を破壊する;うっ血性心不全:慢性炎症が心筋消耗を起こす;脳卒中:慢性炎症が血栓塞栓イベントを促進する;そして大動脈弁狭窄症:慢性炎症が心臓弁を損傷する、などである。動脈硬化、骨粗鬆症、パーキンソン病、感染、クローン病及び潰瘍性大腸炎を含む炎症性腸疾患、並びに多発性硬化症(典型的な自己免疫性の炎症関連疾患)も炎症に関連している(1−18)。進行した段階の一部の疾患は生命の脅威にもなりうる。そのような炎症性疾患の治療にいくつかの方法が利用できるが、結果は一般的に、効果の欠如及び治療に伴う薬物関連の副作用からも明らかなように満足のいくものではない。
【0004】
炎症性腸疾患
炎症性腸疾患(IBD)はクローン病(CD)及び潰瘍性大腸炎(UC)を含む。いずれも特発性の慢性疾患で、世界各地で発生頻度が増加している。米国では毎年600,000人を超える人が罹患している。IBDは小腸及び大腸のいずれか又は両方が関与しうる。CDは消化管のあらゆる部分が関与しうるが、好発部位は小腸末端及び結腸である。直腸は病変を免れることもあるが、直腸周辺の排膿に伴い炎症又は感染を起こすこともある。UCは通常大腸下部に潰瘍を生じる。直腸が起点になることが多い。症状は多様であるが、下痢、発熱、及び疼痛を含みうる。UCを長期間患う患者は結腸がんの発生リスクが増大する。IBDの原因が依然として不明なため(感染及び免疫的機序が提唱されてはいるが)、現在のところ満足のいく治療法がない。IBDの治療は炎症症状のコントロールを目指しているので、従来的にはコルチコステロイド、アミノサリチル酸及び標準的免疫抑制剤、例えばアザチオプリン(6−メルカプトプリン)、メトトレキサート及びシクロスポリンなどが使用されている。これらのうち、唯一の疾患修飾性療法は免疫抑制剤のアザチオプリン及びメトトレキサートであるが、どちらも作用の発現が緩やかで、中等度の効果しかない。長期療法は肝損傷(線維症又は肝硬変)及び骨髄抑制を起こしうる。また、患者はそのような治療に反応しなくなることが多い。他の治療体制は対症療法にすぎない(19,20)。
【0005】
乾癬
乾癬は最もありふれた免疫媒介性の慢性皮膚疾患の一つで、形態も重症度も様々である。米国では人口の約2%又は450万人を超える人が罹患し、そのうちの150万人が中等度〜重度の疾患形態を有するとみなされている。乾癬患者の10〜30%は関節炎の一形態、すなわち乾癬性関節炎も併発している。これは関節周囲の骨及び結合組織を損傷する。乾癬は白色の鱗屑で覆われた盛り上がった皮膚の紅斑として現れる。吹き出物状(膿疱性乾癬)又は火傷状(紅皮性)外観を有することもある。乾癬は強度の痒み及び灼熱感も起こす。患者は肉体的のみならず精神的苦痛を受ける。現在、乾癬の治療にいくつかの治療法が利用可能である。例えば、局所治療、光線療法、及び全身塗布などである。しかしながら、それらは一般的に疾患抑制的及び疾患修飾的な治療法にすぎないとみなされている。いずれも疾患治癒的でない。その上、多くの治療法が、美容上望ましくない、長期使用に不便、又はかなりの毒性を伴う、のいずれかである。
【0006】
この20年の間に乾癬の生物学的特性の理解が進み、この疾患の炎症的性質の原因となっているTリンパ球及びサイトカインの活性を標的にする生物学的療法が利用できるようになった。現在、乾癬に処方される薬物は、最初はリウマチ様関節炎(RA)治療に使用されていたTNF−α阻害薬のENBREL(登録商標)(エタネルセプトetanercept)、REMICADE(登録商標)(インフリキシマブinfliximab)及びHUMIRA(登録商標)(アダリムマブadalimumab)、並びにT細胞阻害薬のAMEVIVE(登録商標)(アレファセプトalefacept)(Biogen社、2002年認可)及びRAPTIVA(登録商標)(エファリズマブEfalizumab)(Genetech/Xoma社、2003年認可)などである(21)。AMEVIVE ALEFACEPT(登録商標)は免疫グロブリン融合タンパク質で、ヒトLFA−3の第一細胞外ドメインがヒトIgGのヒンジ部、C(H)2及びC(H)3ドメインに融合して構成されている(1)。これは、NK細胞を通してT細胞の増殖を阻害する(22)。RAPTIVA(登録商標)も抗CD11a、すなわちT細胞接着分子の白血球機能関連抗原1(LFA−1)を標的とするヒト化モノクローナル抗体として知られている。LFA−1のそのリガンド(ICAM−1、細胞間接着分子−1)への結合を防止すると、リンパ球の活性化及び移動が阻害されるのでリンパ球の浸潤が減少し、乾癬の徴候及び症状をもたらすイベントのカスケードが最終的には制限される(23)。しかしながら、TNF−α阻害薬の潜在的副作用は、リンパ腫の発生(24)、うっ血性心不全の悪化など重篤で、重症感染及び敗血症、並びに多発性硬化症及び中枢神経系の問題の増悪をもたらす(25,26)。T細胞阻害薬のAMEVIVE(登録商標)/RAPTIVA(登録商標)の副作用は乾癬治療においては耐容可能であるが、RAPTIVA(登録商標)は免疫抑制剤である。免疫抑制剤は、感染、再活性化の遅れ、慢性感染のリスクを増大、又はがん発生のリスクを増大させる可能性がある。
【0007】
この20年の間に乾癬の生物学的特性の理解に多大な進展があり、前述のような乾癬の非従来的治療も利用できるようになったが、それに由来する苦痛の多くはまだ適切に対処されていない。米国乾癬財団(National Psoriasis Foundation)が1998年に実施した40,000人を超える米国人乾癬患者に対する調査によれば、若年患者の79%が治療の効果のなさに不満を感じていることが示された。重症疾患を有する患者のうち32%が治療が十分積極的でないと感じていた(27,28)。
【0008】
リウマチ様関節炎
リウマチ様関節炎(RA)も厄介な炎症性障害の別の例である。これは、関節の内膜(滑膜)及び/又はその他の内臓における慢性炎症を特徴とするありふれた慢性の炎症関連疾患である。炎症細胞は骨及び軟骨をも侵襲し損傷できる。患部の関節はその形状及び配置構造(アラインメント)を喪失しうるので、動きも失うことになる。RA患者には、関節の疼痛、硬直、温覚、発赤及び腫脹と、その他の全身的症状、例えば発熱、疲労、及び貧血がみられる。米国人口の約1%又は210万人が現在罹患しており、女性(150万人)のほうが男性(60万人)より多い。RAの病理は十分理解されていないが、機序として不適切な免疫反応が仮定されている。従来の治療は残念なことにRAには不十分である(29)。該疾患は、1950年代より使用されているコルチコステロイド及び非ステロイド系抗炎症薬(NSAID)を含む対症薬物療法に完全に反応するわけではない。またこれらの薬物療法には重大な有害作用のリスクもある。メトトレキサート(MTX)のような疾患修飾性抗リウマチ薬(DMARD)の治療効果は一貫性に欠け、一時的であることが多い。
【0009】
最近、RA治療のための新規クラスの生物学的DMARD(疾患修飾性抗リウマチ薬)が、炎症プロセスにおけるサイトカイン、すなわちTNF−α及びIL−1の役割の理解に基づいて開発された。FDAはいくつかのそのようなDMARDを認可している。例えば、1998年にImmunex/Amgen Inc.社のENBREL(登録商標)(エタネルセプト)、2002年にCentocor/Johnson & Johnson社のREMICADE(登録商標)(インフリキシマブ)、Abbott Laboratories Inc.社のHUMIRA(登録商標)(アダリムマブ)、及び2001年にAmgen社のKINERET(登録商標)(アナキンラanakinra)などである。ENBREL(登録商標)は可溶性のTNF受容体(TNFR)組換えタンパク質である。REMICADE(登録商標)はヒト化マウス(キメラ)抗TNF−αモノクローナル抗体である。HUMIRA(登録商標)は、ファージディスプレイ技術を用いて創製された完全ヒト抗TNFモノクローナル抗体で、ヒト由来H及びL鎖可変部とヒトIgG1:k定常部を持つ抗体である。これら3つのタンパク質系薬物はいずれもTNF−αを標的にして結合し、TNF−αの作用を遮断する。KINERET(登録商標)は組換えIL−1受容体アンタゴニストで、そのアミノ末端に単一のメチオニン残基が付加されている以外は天然ヒトIL−1Raに類似している。KINERET(登録商標)は、IL−1のIL−1のI型受容体(IL−1RI)への結合を競合的に阻害することによってIL−1の生物活性を遮断し、結果的にIL−1の前炎症作用を削減する。
【0010】
これらの生物学的DMARDによる治療は、中等度〜重度の活動性RAを有する患者の症状を緩和し、構造的損傷の進行を抑制し、そして身体機能を改善する。市販されているこの3種類のTNF−α遮断薬は、広く使用されているDMARDのMTXと組み合わせると、RA患者の治療に同様の効果を発揮する(30)。これらの生物学的治療は、短期及び中期の場合、著明な効果と良好な総体的安全性プロフィールを多くのRA患者に提供するが、肝臓などに重篤な問題及び長期副作用を生じうるので、まだ評価の必要がある。ENBREL(登録商標)又はREMICADE(登録商標)のどちらも、その使用とリンパ腫発症との間には気がかりな関連性がある(24)。前述のように、いくつかの報告によれば、ENBREL(登録商標)又はREMICADE(登録商標)で治療された患者は、うっ血性心不全の悪化、重症感染及び敗血症の発症、そして多発性硬化症及びその他の中枢神経系の問題の増悪が示されている(26,27)。
【0011】
多発性硬化症
多発性硬化症(MS)は自己免疫疾患で、米国で350,000〜500,000人の人がその診断を受けている。複数領域に見られる脳や脊髄のミエリンの炎症と瘢痕化がこの疾患を意味している。MS患者はミエリンの瘢痕化の位置と範囲によって様々な程度の神経学的障害を示す。MSの一般的症状は、疲労、衰弱、痙直、バランスの問題、膀胱及び腸の問題、しびれ、失明、振戦及びうつなどである。MSの現在の治療は症状を緩和するだけ又は障害の進行を遅らせるだけである。幹細胞移植及び遺伝子療法を含むMSのいくつかの新規治療は保存療法的である(31,32)。抗TNF抗体は実験的自己免疫性脳脊髄炎(EAE)で保護的効果を示したが、MS患者では疾患をより一層悪化させるので、TNF−αの阻害のみでは不十分であることが示唆される。
【0012】
神経変性障害
アルツハイマー病(AD)とパーキンソン病(PK)が2大神経変性障害である。ADは脳の障害である。この疾患は人の日常活動遂行能力に深刻な影響を及ぼす。思考、記憶、及び言語を司る脳の部分が冒される。約400万人の米国人、通常は60歳以降、がADを患っていると推定されている。
【0013】
PKは中枢神経系の進行性障害で、米国では150万人を超える人が罹患している。臨床的には、該疾患は、自然な動きの減退、歩行困難、姿勢の不安定、硬直及び振戦を特徴とする。PKは、脳の黒質の色素性ニューロンの変性によって起こるので、ドパミン供給力が低下する。これらの神経変性障害の原因が不明なので、現在これらの疾患の治癒法はない。
【0014】
このように、上記及びその他の炎症関連疾患の治療に対する新規アプローチが求められている。炎症関連疾患が起こる機序はまだ不明であり、相互に異なることも多いが、サイトカインの調節異常によって起こる免疫系の機能不全が炎症の開始と進行に重要な役割を果たしていることが示されている(表1)(27,34,35)。
【0015】
サイトカインは一般的に3つのタイプに分類できる。すなわち、前炎症性(IL−1α、β、IL−2、IL−3、IL−6、IL−7、IL−9、IL−12、IL−17、IL−18、TNF−α、LT、LIF、オンコスタチン、及びIFNc1α、β、γ);抗炎症性(IL−4、IL−10、IL−11、W−13及びTGFβ);そしてケモカイン(IL−8、Groα、MIP−1、MCP−1、ENA−78、及びRANTES)である。
【0016】
多くの炎症状態において、前炎症性サイトカイン、特にTNF−α、IL−1β、及びIL−6、並びに抗炎症性サイトカインのIL−10が各種炎症関連疾患の病因に重要な役割を演じているとみられるので、可能性ある治療標的として役立ちそうである。例えば、一部の前炎症性サイトカイン(TNF−α、IFNγ、IL−1、IL−2、IL−6及びIL−12)及びケモカイン(IL−8、MCP−1及びRANTES)のレベル上昇が、CD、乾癬、RA、グレーブス病及び橋本甲状腺炎(橋本病)のようないくつかの炎症関連疾患で観察されている(34)。これは、可溶性TNF受容体、IL−1受容体アンタゴニスト及び抗炎症性サイトカインIL−10の増加と並行する(36,37)。IL−10は、インビトロではLPMC培養物及びインビボでは患者の両方で、上昇した前炎症性サイトカイン産生を抑制することが示されている(38)。IL−10で処置されたCD患者の応答が良好なことから、CDでは前炎症性及び抗炎症性サイトカイン産生との間に不均衡もあるかもしれないことが示されている。
【0017】
要するに、炎症関連疾患を治療するためのアプローチは近年、一部はこれらの疾患の重篤性に対する関心の高まりの結果として、また一部はそれらの免疫−病因におけるサイトカインの重要な役割の理解が相当進んだために、進化的変化を遂げてきた。努力の大部分はTNF−α及びIL−1を標的にすることに傾けられ(39)、前述のようにRA、乾癬及びIBD治療用のいくつかの製品(TNF−α阻害薬:モノクローナル抗TNF−α抗体のインフリキシマブ;及びp75 TNF−α受容体であるエタネルセプト)が現在市販又は臨床試験中である。IL−1(40)、IL−6又はIL−10を標的とするいくつかのその他の薬物候補又は戦略も開発中である(40−42)。これらの生物学的治療は多くのRA患者に短期及び中期で相当の効果を提供している(43−46)。これらの薬物はよく寛容され、良好な総体的安全性プロフィールも有しているが、活発な医薬品安全性監視が必要である。その作用機序、及び従前の多様な有害作用の通知に基づいて、血液学的、感染学的、神経学的、腫瘍学的及び免疫学的影響を含む長期の副作用リスクを調べる必要がある。
【0018】
抗炎症療法として単一の前炎症性サイトカインを標的にする戦略は非常に重要な事実を無視している。すなわち、炎症関連疾患は複雑なサイトカインネットワーク“系”が関与しているという事実である。例えば、IL−8に関連する免疫分子のファミリーであるケモカインは、約50個のリガンドと20個の受容体を含有し、しばしば重複的に作用するので、適当な特異的アンタゴニストの選択を困難にしているだけでなく、長期の効果にも欠ける。その上、現在市販されている製品又は開発中の製品は主としてタンパク質系の薬剤であるので、製造に費用がかかり、しかも投与(すなわち注入)に不便である。従って、免疫系の機能は前炎症性及び抗炎症性メディエータ又はサイトカインの活動によって精巧に均衡が保たれているので、一つだけの特定の前炎症性サイトカインを遮断する代わりに、小分子によって複数の前/抗炎症性サイトカインを調節することが、少ない副作用でより良い治療効果が達成されるだけでなく、小分子薬物の多くの利点をも有することになるはずである。
【0019】
この概念に基づき、我々はいくつかの種類の小分子について、それらの複数のサイトカイン調節能力を試験して検討し、様々な炎症関連疾患の治療にそれらを臨床応用できる可能性を探った。
【0020】
メイソインジゴはインジルビンの誘導体で、中国で慢性骨髄性白血病(CML)の治療 に使用されており、副作用も少ない(47)。我々の以前の特許(米国特許第6,566,341号)で、我々はメイソインジゴ及びその誘導体が、サイクリン依存性キナーゼを阻害し、細胞分化を誘導し、アポトーシスを促進するそれらの能力によって充実性腫瘍に対して活性であることを示した。本発明で、我々は、齧歯類並びにヒトにおける炎症性腸疾患及び乾癬を含む様々な炎症関連疾患の治療におけるこのクラスの分子の新規な治療的活性を示す。我々は、このタイプの薬剤が細胞系においてIL−1β、IL−6及びTNF−αを含む複数の前炎症性サイトカインの分泌及び発現を阻害し、抗炎症性サイトカインIL−10の産生を促進することを示す。ヒトの一事例で、メイソインジゴはIBDに対しても非常に効果的であり、顕著な副作用も観察されないことが証明された。
【0021】
EisenbrandらによるEP1079826、発明の名称“サイクリン依存性キナーゼ阻害医薬品の製造におけるインジゴイドビスインドール誘導体の使用(Use of Indigoid Bisindole Derivatives for the Manufacture of a Medicament to Inhibit Cyclin Dependent Kinases)”は、増殖制御の喪失に伴う疾患を治療するための医薬品の製造におけるインジゴイドビスインドール誘導体の使用に関する。EP1079826によれば、乾癬、心臓血管疾患、感染症、腎臓病、神経変性障害及びウィルス感染はいずれも細胞増殖制御の喪失に伴う疾患である。EP1079826は、該医薬品がサイクリン依存性キナーゼ(CDK)を阻害することにより、増殖制御の喪失に伴うこれらの疾患の治療に有効であることを教えている。
【0022】
一方、本出願人らは、イソインジゴ、インジゴ、インジルビン、及びそれらの誘導体が前炎症性サイトカイン、例えばTNF−α、IL−1及びIL−6の発現を抑制又は阻害し、サイトカイン発現に伴う炎症関連疾患を治療するのに使用できることを発見した。
【0023】
EP1079826に細胞増殖制御の喪失に伴う疾患と記載されているある種の疾患はサイトカイン発現とも関連しているが、出願人らは、サイトカインレベルの阻害によるこれらの対応疾患の治療に要する治療薬の量は、EP1079826に教示されているCDKの阻害に必要な量より著しく少ないことを見出した。
【発明の概要】
【0024】
本発明は、動物におけるサイトカイン発現レベルに伴う様々な炎症関連疾患を、メイソインジゴ並びにイソインジゴ、インジゴ及びインジルビンのその他の誘導体を用いて前炎症性サイトカインの発現を阻害することによって治療するための医薬組成物及び方法を提供する。これらの組成物及び方法は、最小限の副作用で様々な炎症関連疾患の治療を可能にする。本発明の最も重要な利点の一つは、治療用化合物が様々な炎症関連疾患の症状に対処するだけでなく、複数の前炎症性サイトカイン(IL−1α、β、IL−2、IL−3、IL−6、IL−7、IL−9、IL−12、IL−17、IL−18、TNF−α、LT、LIF、オンコスタチン、又はIFNc1α、β、γ)の発現/分泌の抑制を通じて、及び/又は抗炎症性サイトカイン(IL−4、IL−10、IL−11、W−13又はTGFβ)の発現の刺激によって、疾患も修飾することである。
【0025】
本発明はしばしば、単に疾患の症状の一時的な寛解ではなく治癒をもたらす。これに対し、既存の炎症関連疾患の療法はほとんどの場合、単に症状を短期間緩和するだけである。さらに、本発明の治療用化合物は、単純、化学的に安定、しかも製造及び投与が実質的に容易な小分子である。さらに、出願人らは、患者において前炎症性サイトカインを実質的に阻害するのに比較的低用量/濃度の化合物で一般的に十分であり、治療に伴う副作用のリスクも軽減されることを見出した。
【0026】
本明細書中に記載の医薬組成物は、好ましくは、イソインジゴ、インジゴ、インジルビン又はそれらの誘導体から選ばれる少なくとも一つの化合物、抗炎症薬及び製薬学的に許容しうる担体を含む。
【図面の簡単な説明】
【0027】
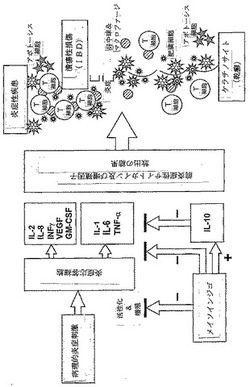
【図1】慢性炎症関連疾患の病理過程における前/抗炎症性サイトカイン及び増殖因子の役割、並びにメイソインジゴの作用部位を示す概略図である。
【図2】LPS刺激ヒト単球THP−1細胞におけるIL−1βの分泌に及ぼすメイソインジゴの作用を示す図である。LPS刺激ヒト単球THP−1細胞におけるIL−1β産生に対するメイソインジゴの阻害効果。THP−1細胞を1μgのリポ多糖(LPS,Sigma)を使って及び使わずに処理/刺激し、一連の濃度のメイソインジゴ(31.25nM〜16,000nM)に24時間暴露した。トリパンブルー染色後、顕微鏡下で細胞の生存を調べた。培地中に分泌されたIL−1βのタンパク質レベルを、下記実施例1の材料及び方法に記載のように、R&D Systems社のアッセイキットを用い、ELISAによって測定し、その標準曲線(パネルA)から算出した。スチューデントt−テストを用いて統計的有意性を判定した。***はP<0.001を示す。パネルBに示されているように、メイソインジゴはわずか31nMの濃度でIL−1βの産生を著しく阻害する。
【図3】LPS刺激ヒト単球THP−1細胞におけるIL−6の分泌及び発現に及ぼすメイソインジゴの作用を示す図である。LPS刺激THP−1細胞におけるIL−6の産生(パネルB)及び転写(パネルC)に対するメイソインジゴの作用:THP−1細胞を1.0μg/mlのLPSを使って及び使わずに処理/刺激し、一連の濃度のメイソインジゴ(0.031〜16μM)に24時間暴露した。下記実施例2の材料及び方法に記載のように、培地中のIL−6タンパク質はELISAによって、細胞中のIL−6転写はリアルタイムPCRによって測定した。パネルA:純IL−6タンパク質を用いて構築した標準曲線で、パネルBのタンパク質産生の計算に使用された;パネルC:IL−6の転写に関するリアルタイムPCRアッセイ。***:P<0.001。パネルB及びCに示されているように、メイソインジゴは、IL−6の分泌及び転写とも著しく阻害する。
【図4】ヒト単球THP−1細胞におけるTNF−αの分泌及び発現に及ぼすメイソインジゴの作用を示す図である。LPS刺激THP−1細胞におけるTNF−αのタンパク質産生(パネルB)及び遺伝子転写(パネルC)に対するメイソインジゴの作用:THP−1細胞を1.0μg/mlのLPSを使って及び使わずに処理/刺激し、一連の濃度のメイソインジゴ(0.031〜16μM)に24時間暴露した。下記実施例3の材料及び方法に記載のように、培地中のTNF−αタンパク質はELISAによって、細胞中のその転写はリアルタイムPCR技術によって測定した。パネルA:純TNF−αタンパク質を用いて構築した標準曲線で、パネルBのタンパク質産生の計算に使用された。TNF−α分泌に対してメイソインジゴによる濃度依存性の阻害が得られた(パネルB)。パネルC:TNF−αの転写に関するリアルタイムPCRアッセイ。TNF−α転写に対する該薬剤の作用は観察されなかった。***:P<0.001。
【図5】THP−1細胞におけるIL−10のメイソインジゴによる刺激を示す図である。LPS処理THP−1細胞におけるIL−10の産生に対するメイソインジゴの刺激:THP−1細胞を1.0μg/mlのLPSを使って及び使わずに処理し、一連の濃度のメイソインジゴ(0.031〜16μM)に24時間暴露した。下記実施例4の材料及び方法に記載のように、培地中のIL−10タンパク質をELISAによって測定した。パネルA:純IL−10タンパク質を用いて構築した標準曲線で、パネルBのタンパク質産生の計算に使用された。炎症性刺激物のLPSはIL−10のタンパク質レベルを低下させたが、メイソインジゴはタンパク質産生を著しく増加させ、最大の刺激効果は62.5nMで発生し、IL−10分泌の約2倍の増加であった(パネルB)。**:P<0.01。
【図6】THP−1細胞における前炎症性サイトカイン及びサイクリン依存性キナーゼの発現に及ぼすメイソインジゴ及びNATURAの作用を示す図である:指数増殖したTHP−1細胞を1μgのLPSを使って(パネルA及びB)及び使わずに(パネルC)刺激し、示された濃度のメイソインジゴ又はNATURAに24時間暴露した。細胞の生存をトリパンブルー除外アッセイで調べた。培地中に分泌されたIL−1β、IL−6及びIL−10のタンパク質レベルを、下記実施例5の材料及び方法に記載のようにR&D Systems社のアッセイキットを用いて、上記例に記載のようにELISAによって測定した。スチューデントt−テストを用いて統計的有意性を判定した。*はP<0.001を示す。メイソインジゴ及びNATURAは、31.25及び62.5nMの濃度でIL−1β及びIL−6の産生を著しく阻害し、IL−10の産生を促進した。これに対し、同一の実験条件下でCDK2に対する該化合物の阻害作用は低濃度(31.25及び62.5nM)では観察されなかった。
【図7】メイソインジゴがマウスにおけるDSS誘導急性潰瘍性大腸炎に対して有効であることを示す図である。メイソインジゴを使って及び使わずに処置したBalb/cマウスの5%DSS誘導急性潰瘍性大腸炎から取った結腸壁の組織化学の例(H&E染色、原寸倍率 ×100)。DSS誘導とメイソインジゴ処置は下記実施例7の材料及び方法に記載のように実施した。パネルAは、DSSを含まない飲料水を与えられた正常対照群の動物由来の結腸壁の正常な形態学を示す。パネルBは、5%DSSで誘導された急性潰瘍性大腸炎を持つマウス由来の結腸壁を示し、炎症細胞の重度の浸潤の存在(リンパ濾胞、赤い矢印)及び粘膜腺窩の局所的消失(びらん病変、青い矢印)が見られる。パネルCは、5%DSSで誘導された急性潰瘍性大腸炎を持つメイソインジゴ処置マウス由来の結腸壁を示す。形態学は正常対照(パネルA)で示されているのと類似しており、メイソインジゴがマウスにおけるDSS誘導急性潰瘍性大腸炎に対して有効であることを示している。
【図8】炎症性腸疾患患者のメイソインジゴによる処置前後のフレキシブルS状結腸鏡検査の写真である。上のパネルは、2カ所の炎症部位(A及びB)の写真で、重度の浮腫を伴う炎症を明らかに示している。ニューヨーク市のマウントサイナイメディカルセンターの病理学者が実施した病理検査は、“特発性炎症性腸疾患を示唆するびらん及び特徴を有する重度の活動性慢性直腸結腸炎”との結論であった。下のパネルは、患者をメイソインジゴで治療9週間後の同じ場所のフレキシブルS状結腸鏡検査の写真である。治療後、結腸の表面は正常になり、浮腫は消失し、血管がはっきりと見えた。ただし、寛解中、Bの場所には瘢痕が存在している(下のパネル)。病理報告の結論は、“特発性炎症性腸疾患を示唆する非活動性慢性直腸結腸炎”であった。
【好適な態様の詳細な説明】
【0028】
本発明は、前炎症性サイトカインの発現及び/又は抗炎症性サイトカインの発現減少に伴う炎症関連疾患を治療するための医薬組成物及び方法に関する。本発明の好適な方法は、そのような治療を必要とする動物に、イソインジゴ、インジゴ、インジルビン、又はそれらの誘導体からなる群から選ばれる一つ以上の化合物を投与することを含む。好適な態様において、投与される化合物は、前炎症性サイトカインの発現を阻害することによって及び/又は抗炎症性サイトカインを刺激することによって炎症関連疾患を治療するに足る量であるが、その量はサイクリン依存性キナーゼ(CDK)を実質的に阻害するに足る量より少ない。
【0029】
本明細書中で使用している“CDKを実質的に阻害する”とは、30%、さらに好ましくは40%を阻害するに足る濃度、最も好ましくはCDKの50%阻害濃度(IC50)以上の濃度を意味する。阻害されるCDKは、好ましくは、CDK1、CDK2、CDK4、CDK5、及びCDK6からなる群から選ばれる一つ以上のCDKである。
【0030】
本方法は、病理の進行に関与するサイトカインを調節することによって疾患に伴う炎症を防止し、このようにして炎症関連疾患の開始を予防することによって炎症関連疾患を治療することを含むが、これに限定されないことは理解されるべきである。
【0031】
炎症関連疾患は、好ましくは、関節炎、リウマチ様関節炎、炎症性腸疾患;乾癬;多発性硬化症;神経変性障害;うっ血性心不全;脳卒中;大動脈弁狭窄症;腎不全;狼瘡;膵炎;アレルギー;線維症;貧血;アテローム性動脈硬化症;代謝性疾患;骨疾患;心臓血管疾患;化学療法/放射線関連合併症;I型糖尿病;II型糖尿病;肝疾患;胃腸障害;眼科的疾患;アレルギー性結膜炎;糖尿病性網膜症;シェーグレン症候群;ブドウ膜炎;肺障害、腎疾患;皮膚炎;HIV関連悪液質;大脳マラリア;強直性脊椎炎;らい病;貧血;及び線維筋痛からなる群から選ばれる。
【0032】
好ましくは、神経変性障害はアルツハイマー病及びパーキンソン病からなる群から選ばれ;炎症性腸疾患はクローン病又は潰瘍性大腸炎からなる群から選ばれ;消化器合併症は下痢であり;肝疾患は、自己免疫性肝炎、C型肝炎、原発性胆汁性肝硬変、原発性硬化性胆管炎、又は劇症肝炎からなる群から選ばれ;胃腸障害はセリアック病及び非特異性大腸炎からなる群から選ばれ;骨疾患は骨粗鬆症であり;肺障害は、アレルギー性鼻炎、喘息、慢性閉塞性肺疾患、慢性肉芽腫性炎症、嚢胞性線維症、及びサルコイドーシスからなる群から選ばれ;心臓血管疾患は、アテローム硬化性心疾患、うっ血性心不全及び再狭窄からなる群から選ばれ;そして腎疾患は糸球体腎炎及び脈管炎からなる群から選ばれる。
【0033】
好適な態様において、疾患は、特にクローン病及び潰瘍性大腸炎を含む炎症性腸疾患(IBD)である。別の好適な態様において、治療される疾患は、関節炎、リウマチ様関節炎、乾癬、アルツハイマー病、又はパーキンソン病である。さらに別の好適な態様において、疾患は放射線治療後関連疾患又はアテローム性動脈硬化症である。
【0034】
好ましくは、化合物は、前炎症性サイトカインの発現を阻害及び/又は抗炎症性サイトカインの発現を刺激する量である。一態様において、化合物は、好ましくは、IL−1α、β、IL−2、IL−3、IL−6、IL−7、IL−9、IL−12、IL−17、IL−18、TNF−α、LT、LIF、オンコスタチン、及びIFNc1α、β、γからなる群から選ばれる一つ以上の前炎症性サイトカインの少なくとも30%の発現を阻害する量である。さらに好ましくはサイトカインの少なくとも40%の発現が阻害され、最も好ましくは50%以上が阻害される。別の態様において、化合物は、好ましくは抗炎症性サイトカインの発現を刺激する量である。本態様において化合物は好ましくは、サイトカインIL−4、IL−10、IL−11、W−13又はTGFβからなる群から選ばれる抗炎症性サイトカインを少なくとも25%、さらに好ましくは少なくとも50%、最も好ましくは少なくとも75%増加させる量である。
【0035】
化学構造:
本発明は、イソインジゴ、インジゴ、インジルビン及びそれらの誘導体を含む特定の化合物群に関する。好ましくは、該化合物は、式(I)、(II)及び(III):
【0036】
【化1】

【0037】
[式中、R3、R4、R5、R6、R7、R8、R9、及びR10は、同じ又は異なり、水素原子;ヒドロキシ基;ニトロソ基;ニトロ基;モノサッカリド;ジサッカリド;ハロゲン原子;ヒドロカルビル基;又は官能性ヒドロカルビル基(非置換又は1個以上のヒドロキシ部分、カルボキシ部分、ニトロキシ部分、モノサッカリド、ジサッカリド、アミン、アミド、チオール、スルフェート、スルホネート、スルホンアミドもしくはハロゲンで置換されており、ヒドロカルビルは1〜8個の炭素原子を有する);−R11R12基{R11及びR12は、同じ又は異なっていてよく、水素原子、1〜18個の炭素原子を有する直鎖又は分枝鎖アルキル基(1個以上のヒドロキシ及び/又はアミノ基をさらに持っていてもよい)、置換又は非置換アリール基(1個以上のヘテロ原子を含んでいてもよい)、又はアシル基を表すか、又はR11とR12は一緒になって2〜6個の、置換されていてもよいCH2基を有する環を形成する};アゾ基−N=N−R13{R13は芳香族系(1個以上のカルボキシル基及び/又はホスホリル基で置換されていてもよい)又は糖、アミノ酸、ペプチドもしくはステロイドホルモンからなる群から選ばれる基を表す}を表すか;又はR1とR6及びR2とR7は、それぞれ、互いから独立して、1〜4個の、置換されていてもよいCH2基を有する環を一緒になって形成し;
基R1及びR2は、同じ又は異なり、水素原子;ハロゲン原子;ヒドロキシ基;ヒドロカルビル基、又は官能性ヒドロカルビル基(非置換又は1個以上のヒドロキシ部分、カルボキシ部分、ニトロキシ部分、モノサッカリド、ジサッカリド、アミン、アミド、チオール、スルフェート、スルホネート、スルホンアミドもしくはハロゲンで置換されており、ヒドロカルビルは1〜8個の炭素原子を有する);モノ−、ジ−又はトリアルキルシリル基(互いに独立して各場合において直鎖又は分枝鎖アルキル基に1〜6個の炭素原子を有する);モノ−、ジ−又はトリアリールシリル基(互いに独立して各場合において置換又は非置換アリール基を有する);−NR17R18基{R17及びR18は、同じ又は異なっていてよく、水素原子、1〜18個の炭素原子を有する直鎖又は分枝鎖アルキル基(1個以上のヒドロキシ及び/又はアミノ基をさらに持っていてもよい)、置換又は非置換アリール基(1個以上のヘテロ原子を含んでいてもよい)、又はアシル基を表す};メチレンアミノ基−CH2−NR17R18(R17及びR18は上記定義を有する);アミドとして窒素に結合している生理的アミノ酸残基、置換又は非置換モノサッカリド、ジサッカリド又はオリゴサッカリド;又は糖、アミノ酸、ペプチドもしくはステロイドホルモンを表す]である。
【0038】
好適な化合物は、少なくとも一つのR1、R2、R3、R4、R5、R6、R7、R8、R9、又はR10が、独立して、モノサッカリド、ジサッカリド、又はヒドロカルビル基もしくは官能性ヒドロカルビル基(1個以上のヒドロキシ部分、カルボキシ部分、ニトロキシ部分、モノサッカリド、ジサッカリド、アミン、アミド、チオール、又はハロゲンで置換されており、ヒドロカルビルは1〜8個の炭素原子を有する)であり;そしてR1、R2、R3、R4、R5、R6、R7、R8、R9、又はR10の少なくとも一つが化合物の生物活性又はバイオアベイラビリティを増強するものである。
【0039】
R1、R2、R3、R4、R5、R6、R7、R8、R9、又はR10は、化合物の溶解度を増大することによって化合物の生物活性又はバイオアベイラビリティを増強するのが好ましい。一つ以上のR1、R2、R3、R4、R5、R6、R7、R8、R9、又はR10によって生物活性及びバイオアベイラビリティの両方とも増大するのがさらに好ましい。
【0040】
好適な化合物は、少なくともR1又はR2が、モノサッカリド;ジサッカリド(非置換又は1個以上のヒドロキシ部分もしくはカルボキシ部分で置換されている);ハロゲン;ヒドロカルビル基、又は官能性ヒドロカルビル基(非置換又は1個以上のヒドロキシ部分、カルボキシ部分、ニトロキシ部分、モノサッカリド、ジサッカリド、アミン、アミド、チオール、スルフェート、スルホネート、スルホンアミドもしくはハロゲンで置換されており、ヒドロカルビルは1〜8個の炭素原子を有する)である化合物である。多くの場合、R1又はR2の一方だけが列挙した部分の一つでなければならず、最も好適な置換基の一つはCH2CH2OHである。
【0041】
式(I)、(II)、及び(III)のさらに好適な化合物は、R1又はR2がグリコシド分子、最も好ましくはモノサッカリド、そして最も好ましくはアセチル化モノサッカリドである化合物である。
【0042】
本発明の一態様において、該化合物は、式(IV)、(V)、及び(VI):
【0043】
【化2】

【0044】
としてそれぞれ示されているメイソインジゴ、トリアセチル化グリコ−メイソインジゴ(プロドラッグ)及びNATURAである。
以下に提供する実施例は、単に本発明の異なる態様を示すためのものであって、本発明の範囲をそれに限定することを意図しているのでは決してない。
【0045】
本発明の文脈中、及び上記式中の“ヒドロカルビル”という用語は、広く一価の炭化水素基を意味する。価数は炭素原子から水素を取り去ることによって誘導される。ヒドロカルビルは、例えば、脂肪族(直鎖及び分枝鎖)、脂環式、芳香族及び混合特性基(例えばアラルキル及びアルカリール)などである。ヒドロカルビルはまた、内部不飽和及び活性化不飽和を有するような基も含む。さらに詳しくは、ヒドロカルビルは、アルキル、シクロアルキル、アリール、アラルキル、アルカリール、アルケニル、シクロアルケニル及びアルキニルのような基(これらに限定されない)を含み、好ましくは12個までの炭素原子を有する。好適な態様は、ヒドロカルビル基が1〜8個の炭素原子を有するものを含む。これら及びその他のヒドロカルビル基は、鎖又は環の中に1個又は複数個のカルボニル基(これも炭素数のカウントに含める)及び/又は1個もしくは複数個のヘテロ原子(少なくとも1個の酸素、硫黄、窒素又はケイ素)を含有していてもよい。
【0046】
本発明の文脈中、及び上記式中の“官能性ヒドロカルビル”という用語は、側鎖及び/又は末端“反応性”及び/又は“潜在反応性”官能基及び/又は脱離基を持つヒドロカルビルを広く意味する。反応性官能基とは、関連分野の当業者には周知の通常条件下で普通のモノマー/ポリマーと反応する官能基のことである。反応性官能基の例は、活性水素含有基、例えばヒドロキシル、アミノ、カルボキシル、チオ、アミド、カルバモイル及び活性化メチレン;イソシアナト、シアノ及びエポキシ基;エチレン性不飽和基、例えばアリル及びメタリル;及び活性化不飽和基、例えばアクリロイル及びメタクリロイル、並びにマレエート及びマレイミド(それとブタジエンのようなジエンとのディールス−アルダー付加物も含む)である。本発明の意味の中での潜在反応性官能基とは、関連分野の当業者には明らかに分かる通り、早期反応を防止するために遮蔽又はマスクされている反応性官能基のことである。潜在反応性官能基の例は、ケチミン及びアルジミン(アミンがそれぞれケトン及びアルデヒドで遮蔽されている);アミン−カルボン酸塩;及び遮蔽イソシアネート、例えばアルコール(カルバメート)、オキシム及びカプロラクタム遮蔽形である。本発明の意味の中での“脱離”基とは、関連分野の当業者には明らかに分かる通り、ヒドロカルビル鎖又は環に結合している置換基で、反応中に追い出されてヒドロカルビル鎖又は環中の炭素又はヘテロ原子上に原子価を作り出す。脱離基の例は、ハロゲン原子、例えば塩素、臭素及びヨウ素;第四級アンモニウム塩;スルホニウム塩;及びスルホネートである。
【0047】
本発明のモノサッカリド又はジサッカリドは、好ましくは、グルコース、フルクトース、リブロース、ガラクトース、マンノース、セロビオース、アロース、アルトロース、リボース、キシロース、アラビノース、スクロース、又はラクトースである。最も好ましくは、D−グルコース、D−リボース、D−ガラクトース、D−ラクトース、D−キシロース又はD−スクロースである。
【0048】
一つの好適な態様において、モノサッカリド又はジサッカリドはアセチル化されており、好ましくは少なくともジアセチル、さらに好ましくはトリアセチル化されている。
“ハロゲン”という用語は、フッ素、塩素、臭素、又はヨウ素を示す。好ましくはフッ素又は塩素である。
【0049】
本明細書中で使用しているアミノ酸はL−又はD−アミノ酸(又はその残基)、好ましくはL−を意味し、アラニン、アルギニン、アスパラギン、アスパラギン酸、システイン、グルタミン、グルタミン酸、グリシン、ヒスチジン、イソロイシン、ロイシン、リジン、メチオニン、フェニルアラニン、プロリン、セリン、トレオニン、トリプトファン、チロシン、又はバリンからなる群から選ばれる。ペプチドという用語は、2個以上のアミノ酸がペプチド結合によって連結したもので、好ましくは2〜8個のアミノ酸、さらに好ましくは2〜6個のアミノ酸を含有する。
【0050】
医薬用製剤及び投与
本発明は炎症関連疾患を有する動物を治療するために使用されうる。ここで動物は哺乳動物であるのが好ましく、ヒトであるのがさらに好ましい。
【0051】
治療的利益は、典型的には少なくとも1、2、3個以上の化合物を同時又は順次投与することによって実現されることにも注意すべきである。本発明の化合物はその他の療法と組み合わせて併用治療に効果的な量を提供することもできる。該化合物は、例えば、追加の薬剤、好ましくは抗炎症薬と組み合わせて投与できる。
【0052】
好適な態様において、前炎症性サイトカインの発現に伴う炎症関連疾患を治療するための医薬組成物は、前述の通り、イソインジゴ、インジゴ、インジルビン、又はそれらの誘導体から選ばれる一つ以上の化合物;抗炎症薬、及び製薬学的に許容しうる担体を含む。ここで、抗炎症薬は、鎮痛薬;抗リウマチ薬;胃腸薬;痛風用製剤;グルココルチコイド;眼科用製剤;呼吸器薬;鼻用製剤;及び粘膜薬からなる群から選ばれる。
【0053】
好ましくは、鎮痛薬は、ナプロキセン、インドメタシン、イブプロフェン、ケトロラクトロメタミン、コリンマグネシウムトリサリチル酸及びロフェコキシブからなる群から選ばれ;抗リウマチ薬は、シクロスポリン、スルファサラジン、バルデコキシブ、ペニシラミン及びデキサメタゾンからなる群から選ばれ;胃腸薬は、メサラミン、バルサラジド二ナトリウム及びオルサラジンナトリウムからなる群から選ばれ;痛風用製剤はスリンダクであり;グルココルチコイドは、デキサメタゾン、リン酸デキサメタゾン、酢酸メチルプレドニゾロン、ヒドロコルチゾン及びリン酸ヒドロコルチゾンナトリウムからなる群から選ばれ;鼻用製剤は、ジプロピオン酸ベクロメタゾン一水和物、プロピオン酸フルチカゾン、トリアムシノロンアセトニド、フルニソリド、フランカルボン酸モメタゾン一水和物及びブデソニドからなる群から選ばれ;眼科用製剤はケトロラクトロメタミンであり;呼吸器薬はネドクロミルナトリウムであり;そして粘膜薬は、ジプロピオン酸アルクロメタゾン、酪酸ヒドロコルチゾン、フルランドレノリド、吉草酸ベタメタゾン及びプロピオン酸クロベタゾールからなる群から選ばれる。
【0054】
別の好適な態様において、医薬組成物は、メイソインジゴ及び/又はNATURAを含む。典型的には製薬学的に許容しうる担体は不活性希釈剤である。
さらに、また別の態様において、化合物−イソインジゴ、インジゴ、インジルビン、又はそれらの誘導体−は、前炎症性サイトカインの発現を阻害することによって及び/又は抗炎症性サイトカインの発現を刺激することによって炎症関連疾患を治療するに足る量であるが、サイクリン依存性キナーゼを実質的に阻害するに足る量より少ない。この態様において、前述の追加の抗炎症薬は組成物を有効なものにするために必要というわけではないが、追加すれば利益がある。
【0055】
本発明の医薬組成物は、前述のように、選択投与経路に適応された様々な形態を取りうる。当業者であれば本明細書中に記載の化合物の非毒性の製薬学的に許容しうる組成物の製造に使用できる様々な合成法は認識しているであろう。当業者であれば本発明の化合物の溶媒和物の製造に使用できる様々な非毒性の製薬学的に許容しうる溶媒は認識しているであろう。例えば水、エタノール、鉱油、植物油、及びジメチルスルホキシドである。
【0056】
本発明の組成物は、従来の非毒性の製薬学的に許容しうる担体、アジュバント及びビヒクルを含有する用量単位製剤として、経口、局所、非経口、吸入又はスプレーによって、又は直腸投与できる。最善の投与法は方法の併用であろうことはさらに当然である。ピル、カプセル、エリキシル、シロップ、ロゼンジ、トローチなどの形態での経口投与が特に好適である。本明細書中で使用している非経口という用語は、皮下注射、皮内、血管内(例えば静脈内)、筋肉内、脊髄、髄腔内注射もしくは類似の注射又は注入技術を含む。
【0057】
本発明の化合物を含有する医薬組成物は、好ましくは、例えば、錠剤、トローチ、ロゼンジ、水性又は油性懸濁液、分散性粉末剤又は顆粒剤、エマルジョン、硬質もしくは軟質カプセル、又はシロップもしくはエリキシルとして、経口使用に適切な形態である。
【0058】
経口使用を意図した組成物は、医薬組成物の製造に関して業界で公知の任意の方法に従って製造できる。そうした組成物は、製薬学的に上品で口当たりのよい製剤を提供するために、甘味剤、着香剤、着色剤及び保存剤からなる群から選ばれる一つ以上の薬剤を含有してもよい。錠剤は、活性成分を、錠剤の製造に適切な非毒性の製薬学的に許容しうる賦形剤と混合して含有しうる。このような賦形剤は、例えば、不活性希釈剤、例えば炭酸カルシウム、炭酸ナトリウム、ラクトース、リン酸カルシウム又はリン酸ナトリウム;顆粒化剤及び崩壊剤、例えばコーンスターチ、又はアルギン酸;結合剤、例えばデンプン、ゼラチン又はアカシア;並びに滑沢剤、例えばステアリン酸マグネシウム、ステアリン酸又はタルクなどでありうる。錠剤はコートされていなくてもよいが、公知技術によってコートされて消化管での崩壊及び吸収を遅らせることにより、長期にわたる持続作用を提供してもよい。例えば、モノステアリン酸グリセリン又はジステアリン酸グリセリンのような時間遅延物質が使用できる。
【0059】
経口用の製剤は、活性成分を不活性の固体希釈剤、例えば炭酸カルシウム、リン酸カルシウム又はカオリンと混合した硬質ゼラチンカプセルとして、又は活性成分を水又は油性媒体、例えば落花生油、流動パラフィン又はオリーブ油と混合した軟質ゼラチンカプセルとして提供することもできる。
【0060】
水性懸濁液は、水性懸濁液の製造に適切な賦形剤と混合した活性物質を含有する。そのような賦形剤は、懸濁化剤、例えばナトリウムカルボキシメチルセルロース、メチルセルロース、ヒドロキシプロピルメチルセルロース、アルギン酸ナトリウム、ポリビニルピロリドン、トラガカントゴム及びアカシアゴム;並びに分散剤又は湿潤剤、おそらくは天然ホスファチド、例えばレシチン、又はアルキレンオキシドと脂肪酸の縮合物、例えばステアリン酸ポリオキシエチレン、又はエチレンオキシドと長鎖脂肪族アルコールの縮合物、例えばヘプタデカエチレンオキシセタノール、又はエチレンオキシドと部分エステル(脂肪酸とヘキシトールから誘導された)の縮合物、例えばモノオレイン酸ポリオキシエチレンソルビトール、又はエチレンオキシドと部分エステル(脂肪酸と無水ヘキシトールから誘導された)の縮合物、例えばモノオレイン酸ポリエチレンソルビタンである。水性懸濁液は、1種類以上の保存剤、例えばエチル、又はn−プロピルp−ヒドロキシベンゾエート、1種類以上の着色剤、1種類以上の着香剤、及び1種類以上の甘味剤、例えばスクロース又はサッカリンも含有していてもよい。
【0061】
油性懸濁液は、活性成分を、植物油、例えば落花生油、オリーブ油、ゴマ油もしくはヤシ油、又は流動パラフィンのような鉱油中に懸濁させることによって製剤化できる。油性懸濁液は、増粘剤、例えば蜜蝋、固形パラフィン又はセチルアルコールを含有していてもよい。前述のような甘味剤及び着香剤を加えて、口当たりのよい経口用製剤にすることもできる。これらの組成物は、アスコルビン酸のような抗酸化剤を加えることによって保存できる。
【0062】
水を添加して水性懸濁液を製造するのに適切な分散性の粉末剤及び顆粒剤は、活性成分を分散剤又は湿潤剤、懸濁化剤及び一つ以上の保存剤と混合して提供される。適切な分散剤又は湿潤剤及び懸濁化剤は既に上で例示した。追加の賦形剤、例えば甘味剤、着香剤及び着色剤も存在してよい。
【0063】
本発明の医薬組成物は水中油エマルジョンの形態でもよい。油性相は、植物油、例えばオリーブ油もしくは落花生油、又は鉱油、例えば流動パラフィン、又はこれらの混合物であろう。適切な乳化剤は、天然ゴム、例えばアカシアゴム又はトラガカントゴム;天然ホスファチド、例えば大豆、レシチン、及び脂肪酸とヘキシトール(無水物)から誘導されたエステル又は部分エステル、例えばモノオレイン酸ソルビタン;及び前記部分エステルとエチレンオキシドの縮合物、例えばモノオレイン酸ポリオキシエチレンソルビタンであろう。該エマルジョンは、甘味剤及び着香剤を含有していてもよい。
【0064】
シロップ及びエリキシルは、甘味剤、例えばグリセロール、プロピレングリコール、ソルビトール又はスクロースとともに製剤化できる。そのような製剤は、粘滑剤、保存剤、並びに着香及び着色剤も含有していてよい。医薬組成物は、無菌の注射用水性又は油性懸濁液の形態でもよい。この懸濁液は、前述のような適切な分散剤又は湿潤剤及び懸濁化剤を用い、公知技術に従って製剤化できる。無菌の注射用製剤は、非経口用として許容しうる非毒性の希釈剤又は溶媒中の無菌注射用溶液又は懸濁液、例えば1,3−ブタンジオール中の溶液とすることもできる。使用できる許容可能なビヒクル及び溶媒は、水、リンガー溶液及び等張食塩水である。さらに、無菌の不揮発性油も溶媒又は懸濁化媒体として従来使用されている。この目的のためには合成モノ−又はジグリセリドを含む任意の無刺激性不揮発性油が使用できる。さらに、オレイン酸のような脂肪酸も注射用製剤の製造に使用される。
【0065】
本発明の組成物は、例えば薬物の直腸投与のために坐剤の形態で投与することもできる。これらの組成物は薬物を適切な非刺激性賦形剤と混合して製造できる。該賦形剤は常温では固体であるが直腸温度では液体になるので、直腸内で融解して薬物を放出する。そのような材料はカカオ脂及びポリエチレングリコールである。
【0066】
あるいは、組成物は無菌媒体に入れて非経口投与することもできる。薬物は、使用するビヒクル及び濃度に応じてビヒクル中に懸濁又は溶解できる。局部麻酔薬、保存剤及び緩衝剤のようなアジュバントをビヒクルに溶解するのも有益であろう。
【0067】
ヒト以外の動物への投与の場合、治療用化合物を含有する組成物を動物の飼料又は飲料水に加えることができる。動物が適切な量の化合物をその食餌で取ることができるように、動物用の飼料及び飲料水製品を製造するのも好都合であろう。さらに、化合物を飼料又は飲料水に添加するためのプレミックスとしての組成物に入れるのも都合がよい。該組成物は、ヒトの食用又は飲用サプリメントとして添加することもできる。
【0068】
体重1kgあたり1日約5mg〜約250mg、さらに好ましくは体重1kgあたり1日約25mg〜約150mg程度の用量レベルが前述の状態の治療に有用である。単一剤形を製造するために担体材料と混和されうる活性成分の量は、治療される状態及び特定の投与様式に応じて変動するであろう。単位剤形は、一般的に約1mg〜約500mgの活性成分を含有することになろう。用量は、好ましくは、サイトカイン調節によって炎症性疾患を治療する場合、CDK阻害によって増殖性疾患を治療する場合の用量の3分の1以下である。例えば、CMLを治療するためのメイソインジゴの用量は一般的に1日約125mgであるが、IBDを治療するためのメイソインジゴの用量は典型的には1日わずか25mgである。これは、このクラスの分子がサイトカインを調節するのに必要な量が、CDKを調節するのに要する量より著しく少なくてすむためである。
【0069】
投与頻度も、使用される化合物及び治療される特定の疾患に応じて変動しうる。しかしながら、ほとんどの疾患の治療の場合、1日4回以下の投与計画が好適である。しかしながら、任意の特定の患者に対する特定の用量レベルは、使用される特定の化合物の活性、年齢、体重、全般的健康状態、性別、食事、投与時間、投与経路及び排出速度、薬物の組合せ及び治療中の特定の疾患の重症度を含む様々な因子に応じて異なることは理解されるであろう。
【0070】
本発明の好適な化合物は望ましい薬理学的性質、すなわち、経口バイオアベイラビリティ、低毒性、低い血清タンパク質結合性並びに望ましいインビトロ及びインビボ半減期(これらに限定されない)を有することになろう。CNS障害を治療するのに使用される化合物にとっては血液脳関門の透過性が必要であるが、末梢障害の治療に使用される化合物の脳内濃度は低いほうが好適であることが多い。
【0071】
アッセイを使用することにより、これらの望ましい薬理学的性質を予測することができる。バイオアベイラビリティの予測に使用されるアッセイは、Caco−2細胞単層を含むヒト腸細胞単層を越える輸送などである。培養肝細胞に対する毒性は化合物の毒性を予測するのに使用できる。ヒトにおける化合物の血液脳関門の透過は、化合物を静脈内投与された実験動物の脳内濃度から予測できる。
【0072】
血清タンパク質結合性はアルブミン結合アッセイから予測できる。そのようなアッセイは、Oravcovaらによるレビューに記載されている(Journal of Chromatography B(1996)677巻、1−27ページ)。
【0073】
化合物の半減期は化合物の投与頻度に反比例する。化合物のインビトロ半減期は、Kuhnz及びGieschenが報告したミクロソームの半減期アッセイから予測できる(Drug Metabolism and Disposition,(1998)、26巻、1120−1127ページ)。
【0074】
前述の内容は本発明の好適な態様を記載しているのであって、特許請求の範囲に示されている本発明の精神又は範囲にもとることなくその中で変形が可能であることは理解されるであろう。発明とみなされる主題を特別に指摘し明白に主張するために、下記特許請求の範囲を以て本明細書を締めくくる。
【0075】
治療に使用するのに必要な組成物の量は、選択した特定の化合物だけでなく、投与経路、治療される状態の性質並びに患者の年齢及び状態によっても変動するであろう。最終的には担当医の指示による。
【0076】
メイソインジゴ並びにイソインジゴ、インジゴ及びインジルビンのその他の誘導体の治療的適応:
本発明は、動物における様々な炎症関連疾患の治療のために、あるクラスの小分子、メイソインジゴ並びにイソインジゴ、インジゴ及びインジルビンの誘導体を用いる方法を提供する。これらの炎症関連疾患は、炎症性腸疾患(IBD)、乾癬、リウマチ様関節炎(RA)、多発性硬化症(MS)、神経変性障害、心臓血管疾患(CVD)及びアテローム性動脈硬化症、及び代謝性疾患(メタボリックシンドローム及び糖尿病)、並びに感染関連炎症などであるが、これらに限定されない。
【0077】
この10年間、TNF−α及びその他のサイトカインの阻害薬の開発は、様々な炎症関連疾患の治療のための薬物開発の最も活発な領域の一つとなっている。そのような特異的阻害薬を様々な炎症関連疾患の治療に適用した短期の臨床成績は有望かつエキサイティングですらあり、抗TNF−α及び抗サイトカイン療法の今後の開発も一般に興味深いが(34)、これらの治療の長期的効果は、炎症関連疾患の病理過程には単一の経路だけでなく複雑なサイトカインネットワーク系が関与しているという事実によって課題を突きつけられている。
【0078】
前炎症性サイトカインは、抗炎症性サイトカインの発現低下と同様、広範囲の炎症病理過程に関与している。
図1に、様々なサイトカイン及び増殖因子が関与するヒトの炎症関連疾患の病理過程の概略を示す。慢性炎症関連疾患の病理過程における前/抗炎症性サイトカイン及び増殖因子の役割、及びメイソインジゴのような誘導体の作用部位を示す概略図も提供する。すなわち、炎症の病理的刺激が炎症応答細胞(リンパ球、単球、好中球、内皮細胞、組織マクロファージ及び肥満細胞)を起爆し、前炎症性サイトカイン及び増殖因子を放出させる。今度はこれらの前炎症性サイトカイン及び増殖因子が、血液供給から免疫細胞、好中球及び血液単球を引き出し、炎症部位におけるそれらの蓄積をもたらす。これらが結果的に様々な炎症関連疾患、及び/又は自己免疫障害を引き起こす。これらの疾患は、炎症性腸疾患(IBD)、乾癬、リウマチ様関節炎、神経変性などである。メイソインジゴは、低濃度(例えば30nM)で、IL−1β、IL−6、及びTNF−αを含む複数の前炎症性サイトカインの産生を阻害し、抗炎症性サイトカインIL−10を刺激する。
【0079】
表1に、自己免疫障害の病理過程における様々なサイトカインの関与をまとめた。様々な前炎症性サイトカインの顕著な増加が自己免疫疾患の組織/器官に見られるが、一部の調節性サイトカインは中等度に上昇して過活性化した前炎症性サイトカインのバランスを保っている。自己免疫障害は前炎症性サイトカインと調節性サイトカインとの間の不均衡が原因とも考えられている(48)。
【0080】
本発明における我々の観察に基づくと、メイソインジゴはいくつかの主要な前炎症性サイトカイン:TNF−α、IL−1及びIL−6の分泌/発現をダウンレギュレートし、抗炎症性サイトカインIL−10をアップレギュレートすることが示されている。“前炎症性サイトカイン及び増殖因子の放出の結果”という用語は、T細胞の表皮向性(epidermotropism)、K6/16過増殖の誘導、ライニングマクロファージ、活性化好中球及びT細胞の浸潤、肥満細胞の増加と活性化、ICAM−1及びMHC クラスIIの誘導、血管新生、血管透過性の変化、アポトーシス、脳及び中枢神経系への損傷、滑膜細胞増殖の調節、軟骨分解及び骨吸収のことを言う。
【0081】
【表1】

【0082】
炎症性腸疾患(IBD):IBDはクローン病(CD)と潰瘍性大腸炎(UC)を含む。これらは免疫系の調節異常によって起こる2つの重なり合った消化管の慢性炎症関連疾患である(20)。IBD患者は腸上皮のバリア機能が欠損しているため、上皮の細菌コロニー化を許している。その結果、細菌産物及び前炎症性サイトカイン(TNF−α、IL−1及びIL−6)が持続性の炎症刺激をもたらす。細菌抗原が粘膜の樹状細胞及びマクロファージによって免疫系に導入される。これに応答して、腸の食細胞(主に単球及び好中球)が増殖し、前炎症性サイトカインの発現と分泌を増大させる。メイソインジゴ並びにイソインジゴ、インジゴ及びインジルビンの誘導体は、我々の以前の特許で細胞成長阻害薬及び細胞分化誘導物質として示されているが、これらの炎症細胞の過活動増殖を効果的に阻害しながら、それらの前炎症性サイトカインの発現/分泌を抑制することが実施例1〜4に示されている。この結論は実施例7〜8に示すとおり動物モデル及びIBD患者で確認されている。
【0083】
乾癬:サイトカインは、皮膚の炎症の発生と維持に重要な役割を有する細胞間メッセンジャーである。いくつかのサイトカインが炎症性皮膚障害の病因に重大な役割を演じていることが報告されている。IL−1、TNF−α、及びIFN−γは、ICAM−1及び主要組織適合性遺伝子複合体(MHC)のクラスIIの発現を誘導する(48,49)。IL−1、TNF−α、及び顆粒球マクロファージコロニー刺激因子は、樹状細胞の活性化、成熟化、及び移動の誘導が可能であり、IL−1は肥満細胞を活性化する(50)。IL−6及びTGF−αはケラチノサイト増殖を増進する。IL−1、TNF−α、TGF−α、及びVEGFは血管新生を誘導し、炎症細胞を誘引する(51−53)。皮膚の免疫応答の誘導におけるサイトカインの第一義的重要性は、サイトカインを新規生物学的応答調節薬の非常に魅力あるターゲットにしている(18)。従って、本発明でクレームされている小分子のメイソインジゴ並びにイソインジゴ、及びインジルビンの誘導体は、複数のサイトカインの調節薬として、乾癬に対しても有効であろう。実施例6に示するように、我々は、齧歯類モデルでメイソインジゴは乾癬に対して用量依存的に真に効果的であり、その効果は陽性対照のMTXより良好であることを示した。
【0084】
リウマチ様関節炎(RA):RAにおける炎症の媒介と関節破壊におけるサイトカインネットワークの役割は近年大々的に研究されている。TNF−αに加えて、IL−1もRAの病因及び臨床症状に中心的役割を果たしている(54)。IL−1の、炎症と関節侵食を推進し、組織修復プロセスを阻害する能力は、インビトロ系及び動物モデルで明らかに確立されているので、RA患者の炎症症状の緩和はIL−1の遮断によって達成されている(55)。IL−6は、免疫応答、造血、急性期応答、及び炎症を調節する多機能性サイトカインである。IL−6産生の異常は、RAを含むいくつかの疾患の病理に関わっている。IL−6シグナルを遮断する治療的アプローチは、ヒト化抗IL−6R抗体を用いて疾患の中でも特にRAのために実施されている(11,56)。IL−10は抗炎症性サイトカインである。IL−10の発現は、動物モデルで関節炎を予防又は該疾患を改善することが示されている(57,58)。TNF−α、IL−1、IL−6及びIL−10のようなサイトカインは独立した役割を有していることは明らかであるが、それらはRAではある種の病理生理学的過程の媒介に協力的に作用している。本発明に記載のクラスの分子の発見は、該分子がこれらの異なるサイトカインを調節することができるので、RAの治療に劇的な治療的進歩をもたらすであろう。
【0085】
多発性硬化症(MS):MSは自己免疫性の炎症性障害である。MS患者において体が自分自身のミエリンを攻撃する原因は不明であるが、サイトカイン異常が該疾患のプロセスに関与していることは明らかである。実験的自己免疫性脳脊髄炎(EAE)(自己免疫、組織病理、遺伝子及び臨床的類似性に基づいてMSの研究に広く使用されているモデル)を用いることにより、EAEもMSも早期活動期においてCNSにばらまかれた血管周囲の炎症性カフの存在を特徴とすることが示されている。これは化学走化性サイトカイン(ケモカイン)が重要な役割を果たすプロセスである。CNSの自己免疫性炎症時におけるケモカイン(IL−8ファミリーメンバー)の発現は、TNFなどの一部の前炎症性サイトカインによって調節されているという証拠がある(59)。IL−1β、IL−6及びIL−10のようなその他の前/抗炎症性サイトカインの役割もEAE動物モデル(60−62)並びにヒト(63)で確認されている。IL−1βはMS病変部に存在する。IL−1受容体アンタゴニスト(IL−1Ra)は実験的自己免疫性脳脊髄炎(EAE)の誘導を緩和する。MSのリスク増大は高IL−1のヒトにみられる(IL−1Ra産生比より3高い、及びIL−10産生比より高いTNF)(63)。
【0086】
神経変性障害:アルツハイマー病(AD)及びパーキンソン病(PK)は神経炎症に関連する2つの最も一般的な神経変性障害である。神経炎症は、いくつかの神経変性障害で病的に冒された組織の特徴である。これらの変化はAD例の患部脳領域で特に観察される(64)。サイトカインの役割はADの病因に関与しているが、サイトカインが病因に寄与する機序は十分わかっていない。ADでは、特にアミロイド沈着に随伴しているミクログリアは、クラスII主要組織適合抗原及び炎症性サイトカイン、IL−1β及びTNF−αに対する抗体との免疫反応性を含む活性化状態に一致する表現型を有している(65)。ADの主な神経病理学的特徴の一つは脳における老人斑の沈着で、この老人斑は、主として毒性のアミロイドβ−ペプチド(Abeta)で構成される(AbetaはAbeta含有前駆体タンパク質(AbetaPP)のファミリーから生成する)。サイトカインはAbetaPPの転写の遺伝子発現を刺激することが示されている(66)。AD及びPKで発症年齢をコントロールする遺伝子座の遺伝子連鎖を分析したところ、ADとグルタチオンS−トランスフェラーゼのオメガ−1及び2(GSTO1、GSTO2)遺伝子との重要な関連が明らかになった(7)。GSTO1の機能は、前炎症性サイトカインIL−1βの翻訳後プロセシングに関連しているようである(67)。
【0087】
放射線治療後関連炎症:直腸及びS状結腸に対する放射線障害関連炎症性疾患は、骨盤領域のがん(子宮頸部、子宮、前立腺、膀胱、及び精巣のがんを含む)の放射線療法に伴う最も一般的な合併症である。放射線直腸S状結腸炎は、骨盤照射後の臨床的に明白な最も一般的な結腸損傷の形態で、発生頻度は5%〜20%である。患者は、典型的には、しぶり、出血、少量下痢、及び直腸痛の症状を呈する。稀に軽度の閉塞又は隣接臓器への瘻管を起こすこともある。
【0088】
放射線療法のメカニズムは、活発に増殖している細胞のDNAに損傷を与えることによる。腸/結腸に対する局所的放射線療法後の病理的損傷は急性期と慢性期に分けられる。初期の病理的変化は、粘膜固有層におけるリンパ球の喪失並びに粘膜上皮細胞及び血管内皮細胞に対する顕微鏡的損傷などである。これらの変化は、絨毛の鈍化及び腺窩新生細胞の減少、次いで血管透過性の増大を伴う顕著な粘膜下浮腫として現れる。
【0089】
進行性の動脈内膜炎が慢性的影響を起こす主たる機序のようである。これは後に進行性の線維症として現れ、これが元で粘膜の萎縮、狭窄の形成、及び血栓症を招き、二次的虚血障害を起こす。慢性期の放射線大腸炎は、非常に著明な腺窩細胞変形、末梢血管拡張症及び粘膜固有層の線維症を呈する。興味深いことに、これらの病理的変化の一部は長期IBDにも見られる(68)。
【0090】
従って、サイトカインは、炎症がかなりの部分にみられる様々な消化管疾患において主要な役割を果たしていると思われる。最近の研究は慢性IBDにおけるサイトカインの重大な役割に焦点が絞られている(69−74)。放射線直腸炎におけるサイトカインの役割を解明するために、Indaramら(75)は、放射線直腸炎患者の結腸粘膜のサイトカインレベルを調べ、これらの値を正常対照及びIBD患者から得られたそれと比較した。彼らは、IL−2、IL−6、及びIL−8の粘膜中レベルが正常対照のそれ(1.74±0.23、0.67±0.05、4.99±1.39pg/mg)と比べて著しく高く、放射線直腸炎群では病変粘膜(5.62±0.13、1.60±0.31、21.45±4.03pg/mg)及び正常に見える粘膜(3.83±0.78、1.36±0.34、13.45±3.18pg/mg)の両方で統計的に有意(p<0.05)であることを見出した。
【0091】
このように、これらの所見は、放射線直腸炎及びIBD患者で同じようなサイトカインの活性化を示している。放射線直腸炎患者の場合、粘膜中のIL−2、IL−6、及びIL−8レベルが正常対照と比べて著しく高いことが示された。これに比べて、IBD(UC及びCD)患者は、正常対照と比較してIL−1、IL−2、IL−6、及びIL−8を含むサイトカインのレベルが著しく高いことが示された。
【0092】
これら2つの疾患の粘膜サイトカイン発現における類似性は、疾患の強度の炎症性に直接関連していると考えるのが妥当である。これら2疾患のサイトカイン活性化におけるこの類似性が、慢性IBDと放射線直腸炎に見られる同様の病理変化をもたらしていると考えられている。この仮説は、放射線直腸炎の医学的管理は、多少不満足ながらも、経口又は局所投与される各種アミノサリチル酸誘導体及びコルチコステロイドによる治療を含むという事実によって裏付けられている。これらの治療選択はIBDの管理と同一である。
【0093】
本発明で示されているとおり、メイソインジゴとそのクラスの小分子は、IL−1β、IL−6及びTNF−αのダウンレギュレーションと、調節性サイトカインIL−10のアップレギュレーションが可能なので、この治療の高い効果と低い副作用が期待される。
【0094】
その他のサイトカイン異常関連疾患:心臓血管疾患(CVD)、アテローム性動脈硬化症、及び代謝性疾患(メタボリックシンドローム)も前/抗炎症性サイトカインの不適切な分泌/発現に関連している(10,12−14,76)。
【0095】
糖尿病:II型糖尿病の根本的障害はインスリン抵抗性で、インスリンが肝臓からのグルコース産生の抑制と末梢組織による消費の促進を行えず、その結果として高血糖になる。膵臓β細胞は、インスリン抵抗性の影響を克服するために、より多くのインスリンを分泌することによって過剰の血漿中グルコースに応答する。インスリン抵抗性が進行し、β細胞がインスリンの分泌量を増やすという要求にもはや応じられなくなると、血漿中グルコース濃度が増大し、II型糖尿病を発症する。
【0096】
II型糖尿病の発症には多数の因子が寄与しうる。II型糖尿病患者の80%は肥満で、肥満は常にインスリン抵抗性と関連しているので、肥満とインスリン抵抗性を結ぶ分子メディエータについて広く研究中である。様々な因子が肥満及び肥満関連II型糖尿病におけるインスリン抵抗性の寄与原因と確認されている。注目すべきは脂肪組織から産生される、FFA(遊離脂肪酸)、TNFα、IL−6、レプチン、アディポネクチン、及びレジスチンである。TNFαのmRNA及びタンパク質中レベルの両方とも肥満動物(77)及びヒト被験者(78)の脂肪組織で高度に増加している。脂肪組織中の全ての異なるタイプの細胞がサイトカインを産生可能である。脂肪細胞はTNFα受容体を発現すると同時に主たるTNFα源でもあるので、脂肪組織中で主にオートクリン/パラクリン的に機能していると考えられている。
【0097】
培養細胞(79)又は動物(80)をTNFαに長期暴露するとインスリン抵抗性が誘導されるが、TNFαの中和はインスリン感受性を増大し、II型糖尿病動物モデル(81)における高血糖を低下させる。遺伝子ノックアウトによってTNFα又はTNFα受容体をなくすと、肥満動物モデル(82)でインスリン感受性が著しく改善される。
【0098】
脂肪細胞並びに全身におけるTNFα誘導インスリン抵抗性の機序が提唱されている(83)。TNFαは、インスリン受容体及びインスリン受容体基質−1(IRS−1)のリン酸化をインヒビターkBキナーゼ−β(IKK−β)によって阻害する。TNFαによるNF−κBの活性化は、脂肪細胞に高発現する脂肪細胞機能に必須の遺伝子の抑制に不可欠であるだけでなく、PPAR−γ媒介遺伝子転写を阻害するのにも十分である。TNFαは、脂肪組織における脂肪分解とその他のサイトカイン発現も刺激し、FFA放出を起こす。実際、一部のインスリン抵抗性動物モデルでは高血糖が顕在化する前に血漿中のFFA濃度が増加する(83)。全身的インスリン抵抗性の誘導及び進行に過剰の血漿中FFAが関係していることを示す多数の証拠がある。肝細胞ではFFAは過剰のグルコース及びVLDL産生に寄与している。筋細胞では高濃度のFFAがインスリンのシグナリングを障害し、FFAの酸化を促進して、グルコースの酸化を大きく低下させる。
【0099】
現在入手できるインスリン増感薬は、PPAR−γアゴニストに属するが、TNFαが誘導する脂肪細胞の遺伝子発現像をNF−κB経路を通じて阻害する(84)。脂肪細胞由来TNFαはオートクリン又はパラクリン因子として機能するので、TNFα抗体を全身的に供給したところで脂肪組織に局所発現したTNFαの生物活性を遮断するのには効果的でないだろう(85)。単純拡散を通じて分配される新しいタイプの小分子TNFα阻害薬を表すNATURAは、従って局所発現されたTNFαの機能を遮断する薬剤として有効であり、II型糖尿病の治療に有用な可能性がある。
【0100】
I型糖尿病は、単核細胞のランゲルハンス島への浸潤とインスリン産生ベータ細胞の選択的破壊を特徴とする自己免疫疾患である。CD8+T細胞が重要なイニシエータであろうが、CD4+T細胞(86)及びマクロファージ(87,88)も、ベータ細胞を死に至らしめる免疫プロセスの主要な細胞エフェクタである。活性化マクロファージは、直接的にIL−1β、IL−6、IL−12、TNFαを分泌し、間接的に活性化T細胞からのINFγ産生を誘発する。I型糖尿病の病因におけるTNFα、INFγ、IL−1β、IL−6及びIL−10のようなサイトカインの関与は、サイトカイン発現とI型糖尿病発症の相関研究、サイトカイン増強研究、及びサイトカイン欠乏研究を通じてよく明らかにされている(89)。サイトカイン中和抗体及び可溶性サイトカイン受容体のほか、抗炎症性化合物も動物モデルでI型糖尿病発症の遅延又は予防効果を示している。
【0101】
インスリン炎からベータ細胞の完全破壊に至る糖尿病の発症機序は比較的慢性のプロセスである。メイソインジゴ、NATURA及びその他の誘導体は、前炎症性サイトカインを阻害し抗炎症性サイトカインを刺激するので、該疾患を治療するだけでなく、該疾患の発症を防止又は遅らせる薬剤として使用できる。
【0102】
要するに、サイトカインの調節異常は、炎症関連疾患及び普通は炎症関連疾患とみなされない疾患を含む様々な疾患に関与している。前及び抗炎症性サイトカインの両方を調節できる分子は、これらの炎症成分の機能障害に関連するあらゆる種類の疾患に対して最小限の副作用で治療的利益を提供するはずである。本発明に示したように、イソインジゴ、インジゴ及びインジルビンの代表的小分子誘導体であるメイソインジゴの、複数の前/抗炎症性サイトカインの発現/分泌の調節に対する性質は、このクラスの化合物を、前炎症性サイトカイン発現に伴う様々な炎症関連疾患の治療に効果的に使用することを可能にしている。
【0103】
実施例
実施例1:メイソインジゴはヒト単球細胞系THP−1細胞におけるIL−1β分泌を削減する
材料及び方法
材料:メイソインジゴ及びNATURAは、Natrogen Therapeutics,Incにより合成、高速液体クロマトグラフィー(HPLC)で精製され、純度98.5%であった。構造は質量分析及び核磁気共鳴(NMR)で確認された。メイソインジゴは暗赤色結晶で分子量376である。ジメチルスルホキシド(DMSO)の溶液中で製造し、インビトロでの実験のために−20℃で保管した。ヒト単球細胞系、THP−1(90)はATCCから購入した。細胞は供給元の取扱説明書に従って維持した。約1×105細胞/mlを、10%FBSを補充した変法RPMI−1640培地(Invitrogen)中、37℃、5%CO2で24時間培養した。
【0104】
方法:細胞を1μMのリポ多糖(LPS,Sigma)を使って又は使わずに刺激し、異なる濃度のメイソインジゴ(31.25nM〜16,000nM)に24時間暴露した。トリパンブルー染色後、顕微鏡下で細胞の生存を調べた。次に、R&D Systems社のアッセイキットを取扱説明書に従って用い、細胞によって培地中に分泌されたIL−1βのタンパク質レベルをELISAによって測定し、その標準曲線から算出した。方法は、得られた良好な標準曲線によって確立及び確認された。標準曲線の一例を図2のパネルAに示す。
【0105】
統計分析:全データを平均±SDで表した。対照(LPS)と実験群間の何らかの差の統計的有意性はスチューデントt−テストによって判定した。2群間のP値は、統計的に有意とみなすには少なくとも0.05より小さくなくてはならない。
【0106】
結果及び考察
IL−1βは、様々な炎症関連疾患の病理過程に関与している多形質発現性の前炎症性サイトカインである。インジゴ、イソインジゴ及びインジルビンの代表的小分子誘導体であるメイソインジゴの炎症に対する活性を解明するために、我々は、ヒト単球THP−1細胞におけるIL−1βの分泌に対するメイソインジゴの活性を調べた。図2のパネルBに示されているように、ヒト単球THP−1細胞におけるIL−1βの基礎レベルは検出不能であることが分かった。リポ多糖(LPS)に応答してタンパク質IL−1β及びmRNAレベルが増加するのは主に遺伝子の転写の増加の結果であることがこれまでに示されている(91,92)。本発明で、我々もLPSで刺激するとTHP−1細胞は大量のIL−1βを培地中に分泌することを観察した(92.38±3.667pg/ml、図2、パネルB)。興味深いことに、刺激されたIL−1βの分泌は、細胞をメイソインジゴに同時に暴露することによって著しく阻害された。最も重要なことは、我々はメイソインジゴが強力ではあるが穏やかなIL−1β阻害薬であるのを見出したことである。
【0107】
この特徴は、それを炎症性障害の治療に使用する場合、高効果で低副作用のため患者に有益であろう。強力という理由は、細胞をわずか31.25nMのメイソインジゴに暴露した場合にLPS媒介IL−1β分泌の50%を超える削減が繰り返し達成されたためであり;穏やかという理由は、メイソインジゴの濃度を8μMまで増加してもそれ以上の分泌削減が得られず、活性が最大に達したことが示されたからである。これは、メイソインジゴ又はNATURAの、サイクリン依存性キナーゼ(CDK)の阻害に対する効果とは異なる。CDK阻害の場合、我々の前特許で示したようにLNCaP前立腺がん細胞においてCDK活性を50%阻害するにはかなり高濃度が必要である(約1.6μM)。
【0108】
先行技術EP1079826はサイトカインではなくCDKの阻害を示しているだけなので、この最後の点は重要である。結果として、本発明では先行技術に比べてかなり低濃度の医薬品が使用される。さらに、特定の誘導体は、CDKの阻害に比べてサイトカインの阻害により一層適切なこともある。
【0109】
実施例2:メイソインジゴはヒト単球細胞系THP−1細胞におけるIL−6の分泌及び発現を阻害する
材料及び方法
材料:代表的誘導体のメイソインジゴを使用した。細胞系とELISAの手順は実施例1に記載したのと同じであった。細胞(メイソインジゴの存在下又は不在下におけるLPS刺激又は非刺激細胞)によって培地中に分泌されたIL−6の計算のための標準曲線は標準的IL−6タンパク質を用いて構築した。典型的な標準曲線を図3のパネルAに示す。統計分析も実施例1に記載の方法に準じた。
【0110】
方法:
リアルタイムPCR:メイソインジゴがIL−6の転写に及ぼす影響(RNAレベル)をリアルタイムポリメラーゼ連鎖反応(リアルタイムPCR)の技術によって調べた。全RNAをQiagen Rneasy minitキットを用いて抽出し、HPRT遺伝子を内部対照として用いた。
【0111】
指数増殖期のヒト単球THP−1細胞を、1μg/mlのLPS、1μMのメイソインジゴ、又は1μg/mlのLPS+1μMのメイソインジゴに24時間暴露した。次に細胞を収穫し、洗浄して全RNAをリアルタイムPCRアッセイ用に抽出した。全RNA(300ng)をDNアーゼI(Promega、ウィスコンシン州マディソン)で処理し、SuperScript II(Invitrogen、カリフォルニア州カールズバッド)及びオリゴ(dT)を取扱説明書に従って逆転写に使用した。リアルタイムPCR反応は、希釈cDNA、Sybr Green PCR Master Mix(Applied Biosystems)、及び各2.5μMのIL−6遺伝子特異的プライマー:R:5’−TCAATTCGTTCTGAAGAGG(配列番号1)及びF:5’−CCCCCAGGAGAAGATTCC(配列番号2)を含有する25μL体積中で実施した。ABI SDS7700アナライザ(Applied Biosystems)を用いて、50℃で2分間及び95℃で10分間、次いで95℃で15秒間及び60℃で1分間を40サイクル実施した。試験cDNAの結果は、同じプレート上で測定したHPRT内部標準に標準化した。サイクル後、増幅特異性を、PCR産物の緩徐な変性による融解曲線の作製と次いでゲル電気泳動によって確認した。
【0112】
結果及び考察
IL−6は炎症に関与する別の主要な前炎症性サイトカインである。そこで、メイソインジゴが分泌/発現に及ぼす影響を調べた。IL−1βと同様、IL−6の基礎レベルもヒト単球THP−1細胞で検出不能であった。1μg/mlのLPSで刺激すると、細胞はIL−6を培地に穏やかに分泌した(33.64±3.29pg/ml)。メイソインジゴは、LPS刺激THP−1細胞でIL−6の分泌を強く阻害することが分かった。刺激細胞を実験の最低濃度の31.25nMのメイソインジゴに暴露したところ、約85%の分泌削減が観察された(P<0.001)(図3,パネルB)。
【0113】
メイソインジゴによって媒介されたIL−6分泌の削減がLPSで刺激されたIL−6の発現に対する阻害によるものであるかどうかを調べるため、リアルタイムPCRを利用してIL−6のmRNA転写に対するメイソインジゴの作用を測定した。図3のパネルCに示されているように、THP−1細胞を1μg/mlのLPSに暴露するとIL−6転写の顕著な誘導が観察された。これは以前の報告と一致する(93)。興味深いことに、LPSで誘導されたIL−6の転写は、LPS刺激THP−1細胞を1μMのメイソインジゴに暴露することによって完全に抑制されるようである(P<0.001)。従ってこの所見は、LPS刺激によるIL−6分泌に対するメイソインジゴの阻害は、おそらくTHP−1細胞においてLPSが媒介するIL−6の産生を該薬剤が抑制した結果であることを示している。
【0114】
ヒト単球へのLPS刺激でIL−6転写シグナリング経路が活性化される。LPSは、LPS結合タンパク質(LBP)という名のタンパク質に結合できる。LPSは、LBPによってCD14受容体に運ばれた後、シグナリング受容体TLR4及びアクセサリータンパク質MD−2と相互作用することが示されている。この相互作用の結果、NF−κB及び3つのMAPキナーゼが活性化し、IL−6転写が増加する(94,95)。LPSが媒介するIL−6転写に対するメイソインジゴの抑制が情報伝達経路の妨害によるものであるかどうかについてはさらに調査の必要がある。
【0115】
実施例3:メイソインジゴはヒト単球THP−1細胞におけるTNF−α分泌を抑制する
材料及び方法
代表的誘導体のメイソインジゴを使用した。TNF−αの分泌を測定する細胞系とELISAの手順は実施例1に記載したのと同じであった。ただし、細胞(メイソインジゴの存在下又は不在下におけるLPS刺激又は非刺激細胞)によって培地中に分泌されたタンパク質の計算のための標準曲線は標準的TNF−αタンパク質を用いて構築した。典型的な標準曲線を図4のパネルAに示す。
【0116】
メイソインジゴがTNF−αの転写に及ぼす影響(RNAレベル)を実施例2に記載したのと同じ手順を用いてリアルタイムPCRの技術によって調べた。ただし、下記のようなTNF−αの特異的プライマーを用いた。5’−TGCCCAGACTCGGCAAAG(配列番号3)、及び5’−GGAGAAGGGTGACCGACT(配列番号4)。全RNAをQiagen Rneasy minitキットを用いて抽出し、HPRT遺伝子を内部対照として用いた。
【0117】
指数増殖したヒト単球THP−1細胞を、0.1μg/mlのLPS、4μMのメイソインジゴ、又は1μg/mlのLPS+4μMのメイソインジゴに24時間暴露した。次に細胞を収穫し、洗浄して全RNAを実施例2に記載のようにリアルタイムPCRアッセイ用に抽出した。
【0118】
結果及び考察
TNF−αは、がんに対するその重要な生物学的機能及び炎症性障害におけるその病理的役割のために、この10年間広く研究された重要な前炎症性サイトカインである。いくつかのTNF−α阻害薬が各種炎症関連疾患の治療用として市販されている。可能性ある抗炎症薬として、我々は本発明でTNF−αの調節におけるメイソインジゴの役割を探った。
【0119】
確立されたモデル系として、LPSによるTHP−1細胞の刺激でTNF−αの膨大な分泌が起きた(図4,パネルB)。しかしながら、メイソインジゴはLPS刺激THP−1細胞でTNF−αの分泌を濃度依存的に効果的に阻害した(図4,パネルB)。刺激細胞を2.0μMのメイソインジゴに24時間暴露すると約50%の分泌削減が達成された(P<0.001,LPS+メイソインジゴをLPSのみと比較した場合)。その時点でトリパンブルー染色を用いたところアポトーシスを起こした細胞は観察されなかった。メイソインジゴの濃度を8μMまで増加してもTNF−α分泌の更なる削減は起きず、細胞死も観察されなかった。しかしながら、刺激細胞を16μMのメイソインジゴで処理すると完全阻害が得られた。その場合でもアポトーシス細胞は20%しか見られなかった。
【0120】
リアルタイムPCRアッセイによれば、メイソインジゴ(4μM)はTNF−αのmRNAレベルには影響を及ぼさず(図4、パネルC)、メイソインジゴによるLPS刺激THP−1細胞におけるTNF−α産生減少は転写後レベルで発生することを示していた。TNF−αのmRNAの3’UTR中のAUリッチエレメント(ARE)がmRNAの安定性及び翻訳効率に関与していることはよく確立されている(96)。TNF−αのAREは、mRNA安定化因子HuRの標的である(97)。TNF−αのmRNAの成熟化は3’UTR中のシスエレメント(2−APRE)の影響を受ける。シスエレメントは、RNA活性化プロテインキナーゼ(PKR)の活性化に応じてTNF−α前駆体転写産物のスプライシングを起こさせる(98)。
【0121】
メイソインジゴがLPS刺激THP−1細胞におけるTNF−αの分泌を阻害する機序は確立される必要があるが、メイソインジゴは細胞毒性なしにTNF−αを阻害する新規小分子である。このため、メイソインジゴは各種炎症関連疾患治療のための理想的な薬剤になると思われる。
【0122】
実施例4:メイソインジゴはヒト単球THP−1細胞におけるIL−10分泌を刺激する
材料及び方法
本実施例で使用したメイソインジゴ及びTHP−1細胞系は、実施例1に記載したのと同じであった。IL−10の分泌を測定するELISAの手順も実施例1に記載の手順に準じた。ただし、細胞(メイソインジゴの存在下又は不在下におけるLPS刺激又は非刺激細胞)によって培地中に分泌されたタンパク質の計算のための標準曲線(図5,パネルA)は標準的IL−10タンパク質を用いて構築した。
【0123】
結果及び考察
免疫系の機能は、前炎症性及び調節性メディエータ又はサイトカインの活動によって繊細に調整されており、炎症関連疾患はこれらのタイプの分子間の不均衡の結果と考えられている(41,46)。本発明でクレームしている小分子の抗炎症作用が調節性サイトカインを誘導できるかどうかを理解するために、メイソインジゴのIL−10分泌に及ぼす作用を調べた。図5のパネルBに示すように、THP−1細胞で中等度ではあるが顕著なIL−10分泌刺激が観察された。THP−1細胞を0.0625μMのメイソインジゴで処理すると、IL−10の分泌に約60%の増加が達成された(P<0.05)。これに対し、炎症刺激物質のLPSはサイトカイン分泌をわずかに減少させた。
【0124】
実施例5:メイソインジゴ及びその誘導体は低濃度では第一分子標的としてCDKではなくサイトカインを選択する
材料及び方法
材料:メイソインジゴ及びNATURAは、上記実施例で記載の通り、Natrogen Therapeutics,Incにより合成された。
【0125】
ヒト単球細胞系、THP−1(90)はATCCから購入した。細胞は供給元の取扱説明書に従って維持した。約1×105細胞/mlを、10%FBSを補充した変法RPMI−1640培地(Invitrogen)中、37℃、5%CO2で24時間培養した。
【0126】
方法:
1)メイソインジゴ及びNATURAの、サイトカインIL−1β、IL−6、IL−10の発現/分泌に及ぼす作用:指数増殖したヒト単球THP−1細胞を1μMのリポ多糖(LPS,Sigma)を使って又は使わずに刺激し、異なる濃度のメイソインジゴ及びNATURA(31.25nM及び62.5nMから)にそれぞれ24時間暴露した。細胞の生存をトリパンブルー除外アッセイで調べた。次に、実施例1〜4に記載のように、R&D Systems社のアッセイキットを取扱説明書に従って用い、細胞によって培地中に分泌されたIL−1βのタンパク質レベルをELISAによって測定し、その標準曲線から算出した。
【0127】
2)メイソインジゴ及び/又はNATURAの、THP−1細胞におけるサイクリン依存性キナーゼ(CDK)の活性に及ぼす作用(99):指数増殖したTHP−1細胞を31.25、62.5、及び1500nMのメイソインジゴ又はNATURAにそれぞれ24時間暴露した。前述のように細胞を収穫し、洗浄して全タンパク質を抽出した(100)。100μgのタンパク質を、cdk2、cdk4/6又はサイクリンD1のいずれかに対する抗体を用い、プロテアーゼインヒビターカクテルの存在下、4℃で一晩、免疫沈降させた。免疫沈降物をタンパク質抽出バッファで4回、キナーゼアッセイバッファで1回洗浄し、[γ−32P]−ATP(10μCi/10μM)の存在下、75μg/mlのヒストンH1と反応させた。リン酸化ヒストンH1(cdk活性を表す)をシンチレーション計数又はSDS−ポリアクリルアミドゲル電気泳動によって測定した(101,102)。
【0128】
3)統計分析:全データを平均±SDで表した。対照(LPS)と実験群間の何らかの差の統計的有意性はスチューデントt−テストによって判定した。2群間のP値は、統計的に有意とみなすには少なくとも0.05より小さくなくてはならない。
【0129】
結果及び考察
インジルビン及びその誘導体はサイクリン依存性キナーゼを阻害することが示されているので、該化合物はCDKの阻害によって増殖制御の喪失に伴う疾患の有効な治療となりうる。どちらの細胞分子がこのクラスの化合物の抗炎症性に関して第一の標的となるかを調べるため、我々は、メイソインジゴ及びNATURAが同じ実験的低濃度条件下でCDK及びサイトカインのn活性をいかに調節するかを比較した。
【0130】
図6に示されているように、実施例1、2及び4で示された観察と同様、LPS刺激によるIL−1β及びIL−6の産生増加は、細胞をわずか31.25nMのメイソインジゴ及びNATURAに暴露することによって著しく阻害された。一方、THP−1細胞においてLPS媒介によって抑制されたIL−10は、同様の濃度下でメイソインジゴ及びNATURAによって約2倍に上昇した(図6A)。
【0131】
これに対し、同じ暴露下で、メイソインジゴ及びNATURAはどちらもサイクリン依存性2、4及び6の活性、ならびにサイクリンD1のレベル(データ示さず)を阻害できなかった。細胞を1.5μM(48倍高濃度)のメイソインジゴ又はNATURAいずれかで処理した場合に、これらの化合物の部分阻害(23%)が達成されただけであった(図6B)。
【0132】
さらに、本発明ではNATURAのグリコーゲンシンターゼキナーゼ−3β(GSK−3β)に対する作用も調べた。なぜならば、CDK阻害薬は通常GSK−3βの阻害薬でもあるからである。しかしながら、細胞を50μMもの高さのNATURAに暴露しても活性は観察されなかった(データ示さず)。
【0133】
このように、本実施例のデータは明らかにメイソインジゴ及び関連クラスの分子が様々なサイトカインを極めて低い濃度(そこではCDK活性に対する阻害効果は何ら達成されない)で著しく調節できる(前炎症性サイトカインを阻害し、抗炎症性サイトカインを刺激する)ことを示している。このことは、CDKの阻害に必要な濃度と比べて低い濃度でメイソインジゴ及びその誘導体はサイクリン依存性キナーゼではなくサイトカインを第一の標的にしていることを示している。この結論は、インジルビン及びその誘導体は真に生物学的CDK阻害薬でない(なぜならば、これらの化合物によるCDKの阻害は生物学的反応ではなく物理的凝集によるものだからである)という最近の観察によって裏付けられている(103)。さらに我々の結論は、慢性骨髄性白血病(CML)の最大寛解を達成するには合計8696mgの用量のメイソインジゴが必要であるが(104)、炎症性腸疾患の完全治癒を得るには525mgの薬物しか必要ないという臨床観察によっても裏付けられている。
【0134】
要約
THP−1細胞は、LPSによる24時間の刺激後、IL−1β、IL−6、IL−8及びTNF−αを分泌したが、IL−2、IL−4、IL−10及びIL−12は分泌しなかった(これらのサイトカインの基礎レベルはELISAでは検出不能)。このことは過去の報告と一致している(93,105)。イソインジゴ、インジゴ、及びインジルビン(構造は式I、II、及びIIIに示す)の誘導体のクラスの小分子が各種炎症関連疾患の治療に臨床応用できる可能性を評価するために、我々は例としてヒト単球THP−1細胞モデルにおけるメイソインジゴの前及び抗炎症性サイトカインの分泌及び発現に及ぼす調節作用を検証した。データを表2にまとめた。メイソインジゴは、LPS刺激THP−1細胞において前炎症性サイトカインIL−1β、IL−6、及びTNF−αの分泌を著しく阻害し、調節性サイトカインIL−10の分泌を刺激したが、IL−2に対しては何の作用も観察されなかった。これは単に該細胞が刺激によってこれらの前炎症性サイトカインを分泌できなかったためである。これらのサイトカインの最大削減又は刺激を表2にまとめた。
【0135】
【表2】

【0136】
LPS刺激THP−1細胞でIL−6の分泌がメイソインジゴによって削減されるのは、リアルタイムPCR技術によれば、サイトカイン遺伝子の転写のダウンレギュレーションの結果のようである。リアルタイムPCRアッセイは、メイソインジゴがLPS刺激THP−1細胞でIL−15に対して中等度の阻害をすることも示した(データ示さず)。TNF−α遺伝子に対しては同じ技術を用いて調べてもそのようなダウンレギュレーションは観察されなかった。メイソインジゴ及びこのクラスの分子が前及び抗炎症性サイトカインを調節する機序はさらに調査する必要があるが、本発明における我々のデータは、このクラスの小分子が様々な炎症関連疾患に関わる重要なサイトカインを調節できることを示している。
【0137】
この数年間、前炎症性サイトカインを標的にする戦略によって、様々な炎症性障害を治療するためのいくつかのタンパク質系薬剤が創製されている。例えば、TNF−α阻害薬のエタネルセプト(ENBREL(登録商標))、インフリキシマブ(REMICADE(登録商標);Centocor社)、アダリムマブ(HUMIRA(登録商標);Abbott社)及びIL−1受容体アンタゴニストのKINERET(登録商標)などである。これらの薬剤の初期段階の臨床応用の示すところによれば、これらの画期的治療薬は、IBD、RA、及び乾癬のような自己免疫疾患の治療に進歩をもたらした。しかしながら、現在の注射用タンパク質系治療薬は、悪性腫瘍増加の可能性、感染及びうっ血性心不全の増加を含む随伴リスクを有している(42)。さらに、そのような戦略は限界もあり、複雑なサイトカインネットワーク系によっても課題を突きつけられている。TNF−α及びNF−κBの阻害薬のようないくつかのタイプの小分子が特異的前炎症性サイトカイン阻害薬であること、そしてタンパク質系薬剤に優る様々な利点を有していることが示されているものの、単一の前炎症性サイトカインを標的にするだけでは炎症病理経路を妨害するに足るほど強力でなく、これがそれらの臨床効果を限定的なものにしている。
【0138】
これに対し、臨床応用における小分子のあらゆる利点(例えば製造が容易で投与に便利という事実)以外に、最も重要なことは、本発明でクレームしている分子は、様々な前炎症性サイトカイン、すなわちIL−1β、IL−6、及びTNF−αを同時に抑制するだけでなく、抗炎症性サイトカインIL−10も刺激することである。さらに、これらの分子は我々の前特許で、高濃度では細胞分化を誘導し、細胞増殖を阻害することも示されている。従って、それらはより大きい臨床活性を提供する。この結論は、IBD患者の治療にメイソインジゴを用いて何ら副作用のない効果が達成されたという卓越した成果によって裏付けられている。この例証は本発明の実施例7に提供されている。
【0139】
実施例6:メイソインジゴは齧歯類において表皮細胞分化を増強し、過形成及び過角化を阻害する
材料及び方法
材料:メイソインジゴは、Natrogen Therapeutics,Inc社によって合成、精製及びその構造の特徴付けがなされた。化合物の純度は上記実施例に記載のように98.5%であった。メイソインジゴの懸濁液を0.5%ナトリウムメチルセルロース中に新たに調製し、下記の動物試験のために経口投与した。下記実験で使用したその他の化学薬品はSigma社から購入した。
【0140】
12週齢、体重22〜25gの雌の無菌クンミンマウスをケージに5匹ずつ収容し、新鮮な水道水及び市販の齧歯類用ペレットを自由に与えた。動物室は24±2℃、相対湿度60±5%及び12時間の明/暗サイクル(07:00〜19:00時)に制御された。
【0141】
方法:
メイソインジゴがマウス尾の表皮細胞分化に及ぼす作用:60匹の雌クンミンマウスを、1つの対照群に20匹、及び4つの薬物試験群に各10匹ずつの計5群に無作為に分けた。メイソインジゴは、0.5%ナトリウムメチルセルロース中懸濁液として新たに調製した。薬物は、それぞれ50、100、及び200mg/kgの用量で1日1回13日間経口投与した。陽性対照としてメトトレキサート(MTX)を1mg/kgの用量で2日に1回同一期間腹腔内投与(i.p.)した。メイソインジゴ懸濁液に使用したのと同一の体積及びビヒクルを陰性対照として使用した。最後の投与24時間後、動物を犠死させ、それらの尾を基部から1.5cmカットした。組織学的検査のためにスライドを作製したが、原文献はBosmanらによる(106)。スライドは尾を縦断面にカットし、ヘマトキシリン−エオジン(H&E)染色して作製した。次にスライドを光学顕微鏡で検査し、正角化(OK,orthokeratosis)及び表皮過形成の程度を評価した。前者は、1個の鱗屑内の十分に発達した顆粒層の水平長をその全長に対して測定することによって行った。薬物活性は、2個の毛包間に顆粒層を含有する(顆粒層を消失していない)陽性鱗屑細胞の増加で定義した。
【0142】
メイソインジゴがマウス膣上皮に及ぼす抗有糸分裂作用:60匹の雌クンミンマウスを、1つの対照群に20匹、及び4つの薬物試験群に各10匹ずつの計5群に無作為に分けた。全マウスにエストロゲンを0.2mg/動物の用量で3日間投与し、エストロゲンホルモンの刺激下で膣上皮細胞を発達させた。メイソインジゴは、0.5%ナトリウムメチルセルロース中懸濁液として新たに調製した。薬物は、それぞれ50、100、及び200mg/kgの用量で1日1回3日間経口投与した。陽性対照としてメトトレキサート(MTX)を1mg/kgの用量で1日に1回同一期間腹腔内投与(i.p.)した。メイソインジゴ懸濁液に使用したのと同一の体積及びビヒクルを陰性対照として使用した。最後の投与1時間後、動物にコルヒチンを2mg/kg腹腔内投与して細胞をM期で停止させた。5時間後動物を犠死させ、膣組織を10%ホルマリン中に固定し、パラフィンに包埋してスライドを作製した。スライドをH&Eで染色し、少なくとも500個の基底細胞を顕微鏡下で検査した。分裂指数(有糸核分裂細胞のパーセント)を計算した。
【0143】
結果及び考察
本実施例では一般的なマウス尾モデルを用いて、本発明でクレームしている化合物が表皮細胞の分化を増強し、それによって過形成及び過角化を減少できるかを定量的に測定した。このモデルは当初Jarrett A(107)が報告し、Bosmanら(106)が修正したものであるが、現在は他の人にも使用されている(108−110)。
【0144】
メイソインジゴがマウス尾の鱗屑上皮細胞の顆粒層形成に及ぼす作用を表3に示す。マウスをメイソインジゴで13日間処置すると、マウス尾上皮における顆粒層の形成が用量依存的に著しく増加していることが観察された。全3用量の治療効果は、マウスに乾癬治療用として臨床利用可能な薬物MTXを投与した陽性対照よりも良好であった。
【0145】
【表3】

【0146】
MTXは、細胞の有糸分裂を著しく阻害する免疫抑制性の化学療法薬である。メイソインジゴがMTXと同様の機序を通じて表皮細胞分化を増強し、それによって過形成及び過角化を減少させているのかを検証するために、メイソインジゴがマウス膣上皮の分裂指数(MI)に及ぼす作用を調べた。表4に示すように、マウスをMTXで3日間処置すると、未処置対照と比べてMIに著しい減少がもたらされた(MTX処置群14.76±4.29 vs 対照20.04±3.71、P<0.001)。これに対し、表4に示すように、同一実験条件下でメイソインジゴは低用量でMIに顕著な影響は与えなかった(50及び100mg/kg、P>0.05)。高用量(200mg/kg)でMIのわずかな減少が観察されただけであった(処置群16.06±2.66 vs 対照20.04±3.71、P<0.05)。
【0147】
我々のデータによれば、メイソインジゴはマウス尾上皮における顆粒層の形成を著しく刺激したが、MIに対する影響は観察されず、メイソインジゴが上皮細胞分化を誘導し、不完全分化鱗屑上皮細胞の成熟化を促進することが示された。このインビボの観察は、メイソインジゴがML−1細胞の分化をインビトロで誘導できるという我々の以前の報告をさらに裏付けるものである(111)。
【0148】
【表4】

【0149】
本実施例で使用したマウス尾モデルは、乾癬治療用薬剤の治療的価値を評価するための一般に使用されているインビボモデルである。従って、本実施例における我々の観察は、本発明でクレームされている小分子が炎症関連疾患の乾癬を治療できることを強く示唆するものである。しかしながら、これらの小分子の抗乾癬活性の機序は、メイソインジゴが細胞の有糸分裂に及ぼす直接的影響が観察されないため、免疫抑制及び化学治療薬のMTXとは異なっている。むしろ、本発明の実施例1〜4で示した様々な異なる種類のサイトカインの分泌/発現の調節とこれらの分子の細胞分化誘導能力が、おそらく抗乾癬作用の分子的基礎であろう。
【0150】
実施例7:メイソインジゴは、Balb/cマウスにおける誘導された急性潰瘍性大腸炎を抑制する
材料及び方法
材料:メイソインジゴは、上記実施例に記載のように、Natrogen Therapeutics,Inc社によって合成、精製及びその構造の特徴付けがなされた。メイソインジゴを0.5%ナトリウムメチルセルロース中に新たに調製し、下記の動物試験のために経口投与した。DSS(デキストラン硫酸ナトリウム塩、分子量:36,000〜44,000)はICN Biomedicals社から購入した。下記実験で使用したその他の化学薬品はSigma社から購入した。
【0151】
12週齢、体重22〜25gの雌の無菌Balb/cマウスをケージに5匹ずつ収容し、新鮮な水道水及び市販の齧歯類用ペレットを自由に与えた。動物室は24±2℃、相対湿度60±5%及び12時間の明/暗サイクル(07:00〜19:00時)に制御された。
【0152】
Balb/cマウスにおける急性潰瘍性大腸炎DSS誘導大腸炎の誘導:大腸炎は、以前の報告の通り、飲料水中のDSS(MW36,000〜50,000、ICN Biomedicals)によって誘導された(112)。手短に言うと、マウスを各10匹ずつの3群に無作為に分けた。陰性対照群(グループ1)ではマウスに新鮮な水道水を自由に、そしてMFペレットを週2回新たに交換して7日間与えた。陽性対照群(DSS群、又はグループ2)では、水道水中5%DSSを7日間投与して大腸炎を誘導した。マウスはMFペレットで飼育した。DSS−メイソインジゴ群(試験群又はグループ3)では、マウスに5%DSS飲料水を与え、メイソインジゴを1日1回50mg/kgの用量で連続7日間経口投与した。体重及び糞の性質(軟便及び/又は出血もしくは潜血)を含む大腸炎の糞徴候を毎日記録した。その後マウスを犠死させた。結腸組織を取り出し、10%ホルマリン/PBS中に固定し、パラフィンに包埋した。物理的人為要素を最小限にするために、取り出した結腸は伸ばさずに厚い定性ろ紙上に置いた。次に縦方向にカットして裏返し、露出させた。スライドをH&Eで染色し、3人の技術者/病理学者が組織化学的に盲検した。
【0153】
統計分析
全データとも平均±SDで表した。対照と実験群間の何らかの差の統計的有意性はスチューデントt−テストで少なくとも<0.05のP値を以て判定した。
【0154】
結果及び考察
陽性対照群の全動物は、第4日に5%DSSを飲用後、次第に軟便、潜血、及び体重減少の徴候を現した。いくつかの重症例では(7/10)、上記症状のほかに肛門に付着した血液が肉眼で観察された。本実験で潰瘍性大腸炎を誘導する手法は非常に積極的なものであり、発生する症状も極めて急性的(4日以内に発現)であるが、メイソインジゴ処置群における潜血は動物の40%(4/10)にしか発生しなかった。軟便のような他の症状も対照群のそれより軽度であった。大腸炎の症状は陰性対照群の動物(正常マウス)には観察されなかった。図7、パネルA。
【0155】
組織学的検査によれば、陽性対照群の全動物の組織は、多形核白血球及び多数のびらん性病変(スコア、1〜3)を含め、炎症細胞浸潤によって明らかなように、重度の潰瘍性大腸炎様病変を発現していた。腺窩膿瘍及び再生上皮も結腸粘膜に見られた(図7、パネルB)。主観的判断を避けるために、陽性対照群及びメイソインジゴ処置群両方のマウスの結腸の潰瘍性損傷は3人の個人技術者/病理学者が顕微鏡下で定量的及び盲検的にカウントした。メイソインジゴ処置群の動物では陽性対照群と比較した場合に潰瘍の55%の削減が観察された(メイソインジゴ処置群2.89±1.46対陽性対照群6.38±2.20)。図7のパネルCに、5%DSSで誘導した急性潰瘍性大腸炎を有するメイソインジゴ処置マウスの結腸壁を示す。形態学は正常対照(パネルA)に示されたものと同様で、メイソインジゴがマウスのDSS誘導急性潰瘍性大腸炎に対して有効であることを示している。
【0156】
実施例8:メイソインジゴは患者における特発性炎症性腸疾患を完全に抑止した
患者:43歳女性が4年間にわたる特発性炎症性腸疾患を示唆するびらん及び特徴を有する活動性慢性直腸結腸炎の1症例であると診断された。最初の診断は1999年にニューヨーク州ロングアイランドのノースショア大学病院マンハセット(North Shore University Hospital Manhasset)で結腸鏡によりなされた。主症状は、下痢、軟便及び出血であったが、全般的な健康状態は優れているとみなされた。CAIスコア(Clinical Activity Index)(表5)(113)は7〜8と判定された。担当医はヒドロコルチゾンフォームを処方し、彼女はこれを医師の指示に従って10日間服用した。しかしながら、この薬剤からは何の治療効果も得られなかった。2000年2月、彼女は中国の家に戻り、何回か中国人医師を訪ね、示唆された様々な漢方薬を試したが治療効果は観察されなかった。2002年早期、彼女は有名で評価の高い北京の中国医療病院(Chinese Medical Hospital)に行き、そこでフレキシブルS状結腸鏡検査を受けた。そこでも活動性炎症性腸疾患と診断された。
【0157】
【表5】

【0158】
このとき、以前の治療に効果がなかったので、主治医はいくつかの伝統的中国薬を処方した。彼女はこれらを数ヶ月間服用したが、それでも症状に改善は得られなかった。2000年2月〜2002年夏にかけて、彼女は、疾患が継続し、非常に厄介な性質のものであったため、様々なその他の伝統的中国薬も試してみたが、いずれも成功しなかった。2002年に米国に戻り、炎症性腸疾患の治療で国家的に承認された米国のセンターであるマウントサイナイメディカルセンター(Mount Sinai Medical Center)に行った。2002年10月、新しい主治医が再度結腸鏡検査と2つの生検標本(A及びB)の組織学的検査を実施した(図8、パネルA、治療前)。検査の結果、2カ所(A及びB)の炎症は“特発性炎症性腸疾患を示唆するびらん及び特徴を有する重度の活動性慢性直腸結腸炎”との結論に至った。医師は、最近FDAに認可された薬物で、彼女の状態に利用できる最善の薬物と考えられたCANASA(登録商標)(坐剤形のメサラミン)を処方した。
【0159】
CANASA(登録商標)を7日間服用後、彼女の症状は緩和されたかのようであったが、同時に重大な副作用が発生した。例えば、皮膚の痒み、腹部痙攣、疼痛及び出血などであった。そこで彼女は医師のアドバイスを求め、この薬物を断続的に使用することを指示された。しかしながら、副作用は薬物を使用するごとに実際悪化し続けた。そこで彼女はこの薬物療法を全て中止した。
【0160】
メイソインジゴはいくつかの前炎症性サイトカインを抑制でき、サイトカインIL−10のような抗炎症性サイトカインを刺激できるという我々の知見に基づき、メイソインジゴが見込みのある治療法として示唆された。中国で慢性骨髄性白血病の治療に使用されているこの医薬品は1日150mgという用量で極めてわずかな副作用しか報告されていなかったので、メイソインジゴが勧められた。
【0161】
患者は自発的に、勧告用量25mgのメイソインジゴを1日1回、計画された3週間の治療期間中服用した。最初の3回の投与後、患者は完全寛解を得(治療3日後)、全ての炎症症状も消失した。この結果、CAIスコアは0となった(表5)。9週間の寛解後(3週間の投薬、3週間の中止、そして3週間の再投薬)、患者は再受診し、この寛解が主観的なものか客観的なものかを判断するためにフレキシブルS状結腸鏡検査を依頼した。フレキシブルS状結腸鏡検査は2003年11月4日に実施された。結果を検討後、主治医は彼女の炎症は完全に抑止されていると結論づけた。病理学的検査でもこの結論が裏付けられ、A及びBの標本は、今度は“特発性炎症性腸疾患を示唆する非活動性慢性直腸結腸炎”と明言された。図8に、同じ医師が実施した結腸鏡検査で同じ炎症部位の治療前(パネルA、2002年10月)及び治療後(パネルB、2003年11月4日)の写真を示す。
【0162】
実施例9:Balb/cマウスにおける慢性潰瘍性大腸炎に及ぼすメイソインジゴの治療効果
メイソインジゴは、様々な炎症性疾患の病理過程及び維持に関与していることが知られている複数のサイトカインIL−1β、IL−6、IL−10及びTNF−αの調節器(レギュレーター)であることが示されている。メイソインジゴはまた、急速に成長する細胞増殖を阻害し、細胞分化及び成熟化を促進する細胞増殖抑制薬であることも示されている。
【0163】
前の実験で、メイソインジゴは、Balb/cマウスにおけるデキストラン硫酸ナトリウム(DSS)誘導性の急性進行性潰瘍性大腸炎に治癒効果を有することを示した。これらの結果は、メイソインジゴが炎症性腸疾患(IBD)を含む様々な慢性炎症性疾患に対して効果的な薬剤であることを示している。
【0164】
この実験では、DSS誘導慢性潰瘍性大腸炎モデルを用いて、インビボにおける分子標的を確認し、メイソインジゴのIBDに対する活性を評価した。
材料及び方法
材料:メイソインジゴは、Natrogen Therapeutics,Inc社によって合成、精製及び構造の特徴付けがなされていた。メイソインジゴの懸濁液を0.5%ナトリウムメチルセルロース中に新たに調製し、4℃で保管した。該薬物懸濁液を下記の動物試験のために経口投与した。5−アミノサリチル酸(5−ASA)はSigma社から購入した。DSS(デキストラン硫酸ナトリウム塩、分子量:36,000〜44,000)はICN Biomedicals社から購入した。下記実験で使用したその他の化学薬品はSigma社から購入した。
【0165】
12週齢、体重22〜25gの無菌Balb/cマウスをケージに5匹ずつ収容し、新鮮な水道水及び市販の齧歯類用ペレットを自由に与えた。動物室は24±2℃、相対湿度60±5%及び12時間の明/暗サイクル(07:00〜19:00時)に制御された。
【0166】
方法:Balb/cマウスにおける慢性潰瘍性大腸炎DSS誘導大腸炎の誘導:慢性潰瘍性大腸炎は、以前の報告の通り、飲料水中のDSS(MW36,000〜44,000、ICN Biomedicals)によって誘導された[4]。手短に言うと、60匹のマウスを各12匹ずつ5群に無作為に分けた。グループ1は陰性対照群(疾患誘導なし)として使用し、新鮮な水道水を自由に、そして餌ペレットを週2回新たに交換して実験の開始から完了まで与えた。グループ2〜5は、潰瘍性大腸炎を慢性的に誘導し、メイソインジゴの活性を調べるのに使用した。グループ2〜5の動物は、陰性対照群と同様、正常に給餌され、さらに5%DSS(MW36,000〜44,000)を含有する飲料水を7日間、蒸留水をその後の10日間与えられた。動物は再度5%DSSを含有する飲料水を7日間、蒸留水をその後さらに10日間与えられた。この操作を合計3サイクル繰り返した。
【0167】
3サイクル後、慢性潰瘍性大腸炎が発現し、記載のように安定化された。グループ2(陽性対照群)は生理食塩水で飼育、グループ3は陽性薬物ベースの対照として胃管投与による50mg/kg/日の5−ASAで処置された。グループ4及び5は、1日1回12日間、25及び75mg/kgの用量のメイソインジゴで処置された。
【0168】
実験期間中、以前報告された方法に従って、体重、便の硬さ、及び潜血又は肉眼的直腸出血の発生を反映する疾患活動性指数(DAI,disease activity index)を判定し、独立した調査員が毎日記録した[114,116]。それらの臨床パラメータは、ヒトの潰瘍性大腸炎(UC)で観察される主観的臨床症状に類似する包括的機能測定で、腺窩スコア(crypt score)として測定される組織学的治癒度とよく相関する[114−116]。次にマウスを犠死させた。脾臓、結腸、並びにその他の組織/臓器を摘出し、外観を調べ、それらの重量を記録した。物理的人為要素を最小限にするために、取り出した結腸は伸ばさずに厚い定性ろ紙上に置いた。結腸を縦方向にカットして裏返し、露出させた。すべての結腸組織を、10%ホルマリン/PBS固定、パラフィン包埋、そしてスライド用に切断した。スライドを組織検査用にH&Eで染色した。スライドは技術者/病理学者が盲検し、写真撮影した。潰瘍性大腸炎の重症度は0〜3のスケールで等級付けし、標準のスコアリングシステムに従って病理指数として表した。すなわち、0、正常;1、多形核白血球を含む局所的炎症細胞浸潤;2、炎症細胞浸潤、腺脱落、及び腺窩膿瘍;3、粘膜潰瘍である。結腸の医学的縦断面におけるリンパ濾胞の潰瘍性損傷数を光学顕微鏡下でカウントした。
【0169】
統計分析
全データとも平均±SDで表した。対照と実験群間の何らかの差の統計的有意性はスチューデントt−テストで少なくとも<0.05のP値を以て判定した。
【0170】
結果及び考察
疾患活動性指数(DAI):5%DSSを7日間飲用後、全マウスにまず下痢、便潜血が現れ、体重も著しく減少した。一方、蒸留水で飼育された動物にはそのような症状は観察されなかった。しかしながら、これらの徴候は次の10日間マウスに蒸留水を与えた後は消失した(DAIは8〜9日で底値に達した)。しかしながら、その後のDSS投与(3投与サイクル)で、これらの臨床症状は回復せず、それどころか10日間の蒸留水消費期間中も悪化した。
【0171】
第3のDSS給餌サイクル後、動物を12日間、胃管投与によってビヒクル、50mg/kg/日の5−ASA、25又は75mg/kg/日のメイソインジゴで処置した。最後の投与24時間後、5群全てに対してDAIスコアを判定した。以下の表6に示されているように、DSS給餌を12日間中止した後、DAIはビヒクル処置群で50%減少したが、これはおそらく自然治癒によるものであった[117]。しかしながら、5−ASAと2種類のメイソインジゴ処置群ではDAI減少度が著しく向上し、70%までに達した。これは薬物治療による治療的応答を反映している。両用量のメイソインジゴの効果は5−ASAのそれと同等であった。
【0172】
【表6】

【0173】
潜血スコア:
以下の表7に、処置又は非処置動物の全群における潜血スコアを示す。DSS給餌中止12日後、ビヒクル処置群の動物はわずかな回復(27.2%)を示した。これは以前の報告にあるとおり、3連続DSS給餌サイクルによって誘導された大腸炎の慢性的性質と一致するものであった[4]。これに対し、5−ASAとメイソインジゴ処置群では顕著な改善が観察された。低用量のメイソインジゴ群の動物は、高用量群の75.7%と比べて最善の治療的応答(87%)を示した。低用量は、80%回復の陽性対照5−ASAよりも良かった。動物でDSS誘導IBDの出血がメイソインジゴで治癒したことは、メイソインジゴによる処置で潰瘍性大腸炎患者の出血が迅速に終結したという以前の観察とも一致している。
【0174】
定性組織学:
マウス結腸の横断面(中央部)をホルマリン中に調製し、パラフィン包埋用とした。スライドはH&Eで染色した。各群から2匹のマウスをスライド標本用、スライド標本及び染色の品質検査用に使用した。
【0175】
ビヒクル処置群の動物の組織学は、表面上皮の喪失、腺の喪失、及び慢性炎症の存在を示していた。両メイソインジゴ処置群の動物のスライドは、IBDマウスのそれと比べて少ないびらん及び軽度の炎症性浸潤物を示した5−ASA群にむしろ近かった。
【0176】
【表7】

【0177】
【表8−1】

【0178】
【表8−2】

【0179】
【表8−3】

【0180】
【表8−4】

【0181】
【表8−5】

【0182】
【表8−6】

【0183】
【表8−7】

【0184】
【表8−8】

【0185】
【表8−9】

【0186】
【表8−10】

【0187】
【表8−11】

【技術分野】
【0001】
本発明は、前炎症性サイトカインの発現及び/又は抗炎症性サイトカインの発現減少に伴う炎症関連疾患を治療するための医薬組成物及び方法に関する。該方法は、典型的には、イソインジゴ(isoindigo)、インジゴ(indigo)、インジルビン(indirubin)、又はそれらの誘導体、例えばメイソインジゴ(Meisoindigo)及びNATURAから選ばれる一つ以上の化合物の投与を含む。
【発明の背景】
【0002】
非定型及び/又は異常炎症は、多様なヒト疾患の主要な要素である。多発性の変性障害を患うヒトは血中に過剰レベルの前炎症性マーカーを示すことが多い。そのような前炎症性マーカーの一つのタイプは、IL−1α、β、IL−2、IL−3、IL−6、IL−7、IL−9、IL−12、IL−17、IL−18、TNF−α、LT、LIF、オンコスタチン、及びIFNc1α、β、γを含む前炎症性徴候サイトカインである。
【0003】
炎症性サイトカインが直接の原因となって惹起される一般的な医学的問題の非制限的リストは下記の通りである。関節炎:炎症性サイトカインによる破壊が滑膜における病変や関節軟骨及び骨の破壊をもたらす;腎不全:炎症性サイトカインが循環を制限し、ネフロンを損傷する;狼瘡:炎症性サイトカインが自己免疫攻撃を誘発する;喘息:炎症性サイトカインが気道を閉塞する;乾癬:炎症性サイトカインが皮膚炎を誘発する;膵炎:炎症性サイトカインが膵細胞損傷を誘発する;アレルギー:炎症性サイトカインが自己免疫反応を誘発する;線維症:炎症性サイトカインが外傷組織を攻撃する;外科的合併症:炎症性サイトカインが治癒を妨害する;貧血:炎症性サイトカインがエリスロポエチン産生を攻撃する;及び線維筋痛:炎症性サイトカインが線維筋痛患者で上昇している。慢性炎症に伴うその他の疾患は、がん:慢性炎症によって引き起こされる;心臓発作:慢性炎症が冠状動脈のアテローム性硬化に寄与している;アルツハイマー病:慢性炎症が脳細胞を破壊する;うっ血性心不全:慢性炎症が心筋消耗を起こす;脳卒中:慢性炎症が血栓塞栓イベントを促進する;そして大動脈弁狭窄症:慢性炎症が心臓弁を損傷する、などである。動脈硬化、骨粗鬆症、パーキンソン病、感染、クローン病及び潰瘍性大腸炎を含む炎症性腸疾患、並びに多発性硬化症(典型的な自己免疫性の炎症関連疾患)も炎症に関連している(1−18)。進行した段階の一部の疾患は生命の脅威にもなりうる。そのような炎症性疾患の治療にいくつかの方法が利用できるが、結果は一般的に、効果の欠如及び治療に伴う薬物関連の副作用からも明らかなように満足のいくものではない。
【0004】
炎症性腸疾患
炎症性腸疾患(IBD)はクローン病(CD)及び潰瘍性大腸炎(UC)を含む。いずれも特発性の慢性疾患で、世界各地で発生頻度が増加している。米国では毎年600,000人を超える人が罹患している。IBDは小腸及び大腸のいずれか又は両方が関与しうる。CDは消化管のあらゆる部分が関与しうるが、好発部位は小腸末端及び結腸である。直腸は病変を免れることもあるが、直腸周辺の排膿に伴い炎症又は感染を起こすこともある。UCは通常大腸下部に潰瘍を生じる。直腸が起点になることが多い。症状は多様であるが、下痢、発熱、及び疼痛を含みうる。UCを長期間患う患者は結腸がんの発生リスクが増大する。IBDの原因が依然として不明なため(感染及び免疫的機序が提唱されてはいるが)、現在のところ満足のいく治療法がない。IBDの治療は炎症症状のコントロールを目指しているので、従来的にはコルチコステロイド、アミノサリチル酸及び標準的免疫抑制剤、例えばアザチオプリン(6−メルカプトプリン)、メトトレキサート及びシクロスポリンなどが使用されている。これらのうち、唯一の疾患修飾性療法は免疫抑制剤のアザチオプリン及びメトトレキサートであるが、どちらも作用の発現が緩やかで、中等度の効果しかない。長期療法は肝損傷(線維症又は肝硬変)及び骨髄抑制を起こしうる。また、患者はそのような治療に反応しなくなることが多い。他の治療体制は対症療法にすぎない(19,20)。
【0005】
乾癬
乾癬は最もありふれた免疫媒介性の慢性皮膚疾患の一つで、形態も重症度も様々である。米国では人口の約2%又は450万人を超える人が罹患し、そのうちの150万人が中等度〜重度の疾患形態を有するとみなされている。乾癬患者の10〜30%は関節炎の一形態、すなわち乾癬性関節炎も併発している。これは関節周囲の骨及び結合組織を損傷する。乾癬は白色の鱗屑で覆われた盛り上がった皮膚の紅斑として現れる。吹き出物状(膿疱性乾癬)又は火傷状(紅皮性)外観を有することもある。乾癬は強度の痒み及び灼熱感も起こす。患者は肉体的のみならず精神的苦痛を受ける。現在、乾癬の治療にいくつかの治療法が利用可能である。例えば、局所治療、光線療法、及び全身塗布などである。しかしながら、それらは一般的に疾患抑制的及び疾患修飾的な治療法にすぎないとみなされている。いずれも疾患治癒的でない。その上、多くの治療法が、美容上望ましくない、長期使用に不便、又はかなりの毒性を伴う、のいずれかである。
【0006】
この20年の間に乾癬の生物学的特性の理解が進み、この疾患の炎症的性質の原因となっているTリンパ球及びサイトカインの活性を標的にする生物学的療法が利用できるようになった。現在、乾癬に処方される薬物は、最初はリウマチ様関節炎(RA)治療に使用されていたTNF−α阻害薬のENBREL(登録商標)(エタネルセプトetanercept)、REMICADE(登録商標)(インフリキシマブinfliximab)及びHUMIRA(登録商標)(アダリムマブadalimumab)、並びにT細胞阻害薬のAMEVIVE(登録商標)(アレファセプトalefacept)(Biogen社、2002年認可)及びRAPTIVA(登録商標)(エファリズマブEfalizumab)(Genetech/Xoma社、2003年認可)などである(21)。AMEVIVE ALEFACEPT(登録商標)は免疫グロブリン融合タンパク質で、ヒトLFA−3の第一細胞外ドメインがヒトIgGのヒンジ部、C(H)2及びC(H)3ドメインに融合して構成されている(1)。これは、NK細胞を通してT細胞の増殖を阻害する(22)。RAPTIVA(登録商標)も抗CD11a、すなわちT細胞接着分子の白血球機能関連抗原1(LFA−1)を標的とするヒト化モノクローナル抗体として知られている。LFA−1のそのリガンド(ICAM−1、細胞間接着分子−1)への結合を防止すると、リンパ球の活性化及び移動が阻害されるのでリンパ球の浸潤が減少し、乾癬の徴候及び症状をもたらすイベントのカスケードが最終的には制限される(23)。しかしながら、TNF−α阻害薬の潜在的副作用は、リンパ腫の発生(24)、うっ血性心不全の悪化など重篤で、重症感染及び敗血症、並びに多発性硬化症及び中枢神経系の問題の増悪をもたらす(25,26)。T細胞阻害薬のAMEVIVE(登録商標)/RAPTIVA(登録商標)の副作用は乾癬治療においては耐容可能であるが、RAPTIVA(登録商標)は免疫抑制剤である。免疫抑制剤は、感染、再活性化の遅れ、慢性感染のリスクを増大、又はがん発生のリスクを増大させる可能性がある。
【0007】
この20年の間に乾癬の生物学的特性の理解に多大な進展があり、前述のような乾癬の非従来的治療も利用できるようになったが、それに由来する苦痛の多くはまだ適切に対処されていない。米国乾癬財団(National Psoriasis Foundation)が1998年に実施した40,000人を超える米国人乾癬患者に対する調査によれば、若年患者の79%が治療の効果のなさに不満を感じていることが示された。重症疾患を有する患者のうち32%が治療が十分積極的でないと感じていた(27,28)。
【0008】
リウマチ様関節炎
リウマチ様関節炎(RA)も厄介な炎症性障害の別の例である。これは、関節の内膜(滑膜)及び/又はその他の内臓における慢性炎症を特徴とするありふれた慢性の炎症関連疾患である。炎症細胞は骨及び軟骨をも侵襲し損傷できる。患部の関節はその形状及び配置構造(アラインメント)を喪失しうるので、動きも失うことになる。RA患者には、関節の疼痛、硬直、温覚、発赤及び腫脹と、その他の全身的症状、例えば発熱、疲労、及び貧血がみられる。米国人口の約1%又は210万人が現在罹患しており、女性(150万人)のほうが男性(60万人)より多い。RAの病理は十分理解されていないが、機序として不適切な免疫反応が仮定されている。従来の治療は残念なことにRAには不十分である(29)。該疾患は、1950年代より使用されているコルチコステロイド及び非ステロイド系抗炎症薬(NSAID)を含む対症薬物療法に完全に反応するわけではない。またこれらの薬物療法には重大な有害作用のリスクもある。メトトレキサート(MTX)のような疾患修飾性抗リウマチ薬(DMARD)の治療効果は一貫性に欠け、一時的であることが多い。
【0009】
最近、RA治療のための新規クラスの生物学的DMARD(疾患修飾性抗リウマチ薬)が、炎症プロセスにおけるサイトカイン、すなわちTNF−α及びIL−1の役割の理解に基づいて開発された。FDAはいくつかのそのようなDMARDを認可している。例えば、1998年にImmunex/Amgen Inc.社のENBREL(登録商標)(エタネルセプト)、2002年にCentocor/Johnson & Johnson社のREMICADE(登録商標)(インフリキシマブ)、Abbott Laboratories Inc.社のHUMIRA(登録商標)(アダリムマブ)、及び2001年にAmgen社のKINERET(登録商標)(アナキンラanakinra)などである。ENBREL(登録商標)は可溶性のTNF受容体(TNFR)組換えタンパク質である。REMICADE(登録商標)はヒト化マウス(キメラ)抗TNF−αモノクローナル抗体である。HUMIRA(登録商標)は、ファージディスプレイ技術を用いて創製された完全ヒト抗TNFモノクローナル抗体で、ヒト由来H及びL鎖可変部とヒトIgG1:k定常部を持つ抗体である。これら3つのタンパク質系薬物はいずれもTNF−αを標的にして結合し、TNF−αの作用を遮断する。KINERET(登録商標)は組換えIL−1受容体アンタゴニストで、そのアミノ末端に単一のメチオニン残基が付加されている以外は天然ヒトIL−1Raに類似している。KINERET(登録商標)は、IL−1のIL−1のI型受容体(IL−1RI)への結合を競合的に阻害することによってIL−1の生物活性を遮断し、結果的にIL−1の前炎症作用を削減する。
【0010】
これらの生物学的DMARDによる治療は、中等度〜重度の活動性RAを有する患者の症状を緩和し、構造的損傷の進行を抑制し、そして身体機能を改善する。市販されているこの3種類のTNF−α遮断薬は、広く使用されているDMARDのMTXと組み合わせると、RA患者の治療に同様の効果を発揮する(30)。これらの生物学的治療は、短期及び中期の場合、著明な効果と良好な総体的安全性プロフィールを多くのRA患者に提供するが、肝臓などに重篤な問題及び長期副作用を生じうるので、まだ評価の必要がある。ENBREL(登録商標)又はREMICADE(登録商標)のどちらも、その使用とリンパ腫発症との間には気がかりな関連性がある(24)。前述のように、いくつかの報告によれば、ENBREL(登録商標)又はREMICADE(登録商標)で治療された患者は、うっ血性心不全の悪化、重症感染及び敗血症の発症、そして多発性硬化症及びその他の中枢神経系の問題の増悪が示されている(26,27)。
【0011】
多発性硬化症
多発性硬化症(MS)は自己免疫疾患で、米国で350,000〜500,000人の人がその診断を受けている。複数領域に見られる脳や脊髄のミエリンの炎症と瘢痕化がこの疾患を意味している。MS患者はミエリンの瘢痕化の位置と範囲によって様々な程度の神経学的障害を示す。MSの一般的症状は、疲労、衰弱、痙直、バランスの問題、膀胱及び腸の問題、しびれ、失明、振戦及びうつなどである。MSの現在の治療は症状を緩和するだけ又は障害の進行を遅らせるだけである。幹細胞移植及び遺伝子療法を含むMSのいくつかの新規治療は保存療法的である(31,32)。抗TNF抗体は実験的自己免疫性脳脊髄炎(EAE)で保護的効果を示したが、MS患者では疾患をより一層悪化させるので、TNF−αの阻害のみでは不十分であることが示唆される。
【0012】
神経変性障害
アルツハイマー病(AD)とパーキンソン病(PK)が2大神経変性障害である。ADは脳の障害である。この疾患は人の日常活動遂行能力に深刻な影響を及ぼす。思考、記憶、及び言語を司る脳の部分が冒される。約400万人の米国人、通常は60歳以降、がADを患っていると推定されている。
【0013】
PKは中枢神経系の進行性障害で、米国では150万人を超える人が罹患している。臨床的には、該疾患は、自然な動きの減退、歩行困難、姿勢の不安定、硬直及び振戦を特徴とする。PKは、脳の黒質の色素性ニューロンの変性によって起こるので、ドパミン供給力が低下する。これらの神経変性障害の原因が不明なので、現在これらの疾患の治癒法はない。
【0014】
このように、上記及びその他の炎症関連疾患の治療に対する新規アプローチが求められている。炎症関連疾患が起こる機序はまだ不明であり、相互に異なることも多いが、サイトカインの調節異常によって起こる免疫系の機能不全が炎症の開始と進行に重要な役割を果たしていることが示されている(表1)(27,34,35)。
【0015】
サイトカインは一般的に3つのタイプに分類できる。すなわち、前炎症性(IL−1α、β、IL−2、IL−3、IL−6、IL−7、IL−9、IL−12、IL−17、IL−18、TNF−α、LT、LIF、オンコスタチン、及びIFNc1α、β、γ);抗炎症性(IL−4、IL−10、IL−11、W−13及びTGFβ);そしてケモカイン(IL−8、Groα、MIP−1、MCP−1、ENA−78、及びRANTES)である。
【0016】
多くの炎症状態において、前炎症性サイトカイン、特にTNF−α、IL−1β、及びIL−6、並びに抗炎症性サイトカインのIL−10が各種炎症関連疾患の病因に重要な役割を演じているとみられるので、可能性ある治療標的として役立ちそうである。例えば、一部の前炎症性サイトカイン(TNF−α、IFNγ、IL−1、IL−2、IL−6及びIL−12)及びケモカイン(IL−8、MCP−1及びRANTES)のレベル上昇が、CD、乾癬、RA、グレーブス病及び橋本甲状腺炎(橋本病)のようないくつかの炎症関連疾患で観察されている(34)。これは、可溶性TNF受容体、IL−1受容体アンタゴニスト及び抗炎症性サイトカインIL−10の増加と並行する(36,37)。IL−10は、インビトロではLPMC培養物及びインビボでは患者の両方で、上昇した前炎症性サイトカイン産生を抑制することが示されている(38)。IL−10で処置されたCD患者の応答が良好なことから、CDでは前炎症性及び抗炎症性サイトカイン産生との間に不均衡もあるかもしれないことが示されている。
【0017】
要するに、炎症関連疾患を治療するためのアプローチは近年、一部はこれらの疾患の重篤性に対する関心の高まりの結果として、また一部はそれらの免疫−病因におけるサイトカインの重要な役割の理解が相当進んだために、進化的変化を遂げてきた。努力の大部分はTNF−α及びIL−1を標的にすることに傾けられ(39)、前述のようにRA、乾癬及びIBD治療用のいくつかの製品(TNF−α阻害薬:モノクローナル抗TNF−α抗体のインフリキシマブ;及びp75 TNF−α受容体であるエタネルセプト)が現在市販又は臨床試験中である。IL−1(40)、IL−6又はIL−10を標的とするいくつかのその他の薬物候補又は戦略も開発中である(40−42)。これらの生物学的治療は多くのRA患者に短期及び中期で相当の効果を提供している(43−46)。これらの薬物はよく寛容され、良好な総体的安全性プロフィールも有しているが、活発な医薬品安全性監視が必要である。その作用機序、及び従前の多様な有害作用の通知に基づいて、血液学的、感染学的、神経学的、腫瘍学的及び免疫学的影響を含む長期の副作用リスクを調べる必要がある。
【0018】
抗炎症療法として単一の前炎症性サイトカインを標的にする戦略は非常に重要な事実を無視している。すなわち、炎症関連疾患は複雑なサイトカインネットワーク“系”が関与しているという事実である。例えば、IL−8に関連する免疫分子のファミリーであるケモカインは、約50個のリガンドと20個の受容体を含有し、しばしば重複的に作用するので、適当な特異的アンタゴニストの選択を困難にしているだけでなく、長期の効果にも欠ける。その上、現在市販されている製品又は開発中の製品は主としてタンパク質系の薬剤であるので、製造に費用がかかり、しかも投与(すなわち注入)に不便である。従って、免疫系の機能は前炎症性及び抗炎症性メディエータ又はサイトカインの活動によって精巧に均衡が保たれているので、一つだけの特定の前炎症性サイトカインを遮断する代わりに、小分子によって複数の前/抗炎症性サイトカインを調節することが、少ない副作用でより良い治療効果が達成されるだけでなく、小分子薬物の多くの利点をも有することになるはずである。
【0019】
この概念に基づき、我々はいくつかの種類の小分子について、それらの複数のサイトカイン調節能力を試験して検討し、様々な炎症関連疾患の治療にそれらを臨床応用できる可能性を探った。
【0020】
メイソインジゴはインジルビンの誘導体で、中国で慢性骨髄性白血病(CML)の治療 に使用されており、副作用も少ない(47)。我々の以前の特許(米国特許第6,566,341号)で、我々はメイソインジゴ及びその誘導体が、サイクリン依存性キナーゼを阻害し、細胞分化を誘導し、アポトーシスを促進するそれらの能力によって充実性腫瘍に対して活性であることを示した。本発明で、我々は、齧歯類並びにヒトにおける炎症性腸疾患及び乾癬を含む様々な炎症関連疾患の治療におけるこのクラスの分子の新規な治療的活性を示す。我々は、このタイプの薬剤が細胞系においてIL−1β、IL−6及びTNF−αを含む複数の前炎症性サイトカインの分泌及び発現を阻害し、抗炎症性サイトカインIL−10の産生を促進することを示す。ヒトの一事例で、メイソインジゴはIBDに対しても非常に効果的であり、顕著な副作用も観察されないことが証明された。
【0021】
EisenbrandらによるEP1079826、発明の名称“サイクリン依存性キナーゼ阻害医薬品の製造におけるインジゴイドビスインドール誘導体の使用(Use of Indigoid Bisindole Derivatives for the Manufacture of a Medicament to Inhibit Cyclin Dependent Kinases)”は、増殖制御の喪失に伴う疾患を治療するための医薬品の製造におけるインジゴイドビスインドール誘導体の使用に関する。EP1079826によれば、乾癬、心臓血管疾患、感染症、腎臓病、神経変性障害及びウィルス感染はいずれも細胞増殖制御の喪失に伴う疾患である。EP1079826は、該医薬品がサイクリン依存性キナーゼ(CDK)を阻害することにより、増殖制御の喪失に伴うこれらの疾患の治療に有効であることを教えている。
【0022】
一方、本出願人らは、イソインジゴ、インジゴ、インジルビン、及びそれらの誘導体が前炎症性サイトカイン、例えばTNF−α、IL−1及びIL−6の発現を抑制又は阻害し、サイトカイン発現に伴う炎症関連疾患を治療するのに使用できることを発見した。
【0023】
EP1079826に細胞増殖制御の喪失に伴う疾患と記載されているある種の疾患はサイトカイン発現とも関連しているが、出願人らは、サイトカインレベルの阻害によるこれらの対応疾患の治療に要する治療薬の量は、EP1079826に教示されているCDKの阻害に必要な量より著しく少ないことを見出した。
【発明の概要】
【0024】
本発明は、動物におけるサイトカイン発現レベルに伴う様々な炎症関連疾患を、メイソインジゴ並びにイソインジゴ、インジゴ及びインジルビンのその他の誘導体を用いて前炎症性サイトカインの発現を阻害することによって治療するための医薬組成物及び方法を提供する。これらの組成物及び方法は、最小限の副作用で様々な炎症関連疾患の治療を可能にする。本発明の最も重要な利点の一つは、治療用化合物が様々な炎症関連疾患の症状に対処するだけでなく、複数の前炎症性サイトカイン(IL−1α、β、IL−2、IL−3、IL−6、IL−7、IL−9、IL−12、IL−17、IL−18、TNF−α、LT、LIF、オンコスタチン、又はIFNc1α、β、γ)の発現/分泌の抑制を通じて、及び/又は抗炎症性サイトカイン(IL−4、IL−10、IL−11、W−13又はTGFβ)の発現の刺激によって、疾患も修飾することである。
【0025】
本発明はしばしば、単に疾患の症状の一時的な寛解ではなく治癒をもたらす。これに対し、既存の炎症関連疾患の療法はほとんどの場合、単に症状を短期間緩和するだけである。さらに、本発明の治療用化合物は、単純、化学的に安定、しかも製造及び投与が実質的に容易な小分子である。さらに、出願人らは、患者において前炎症性サイトカインを実質的に阻害するのに比較的低用量/濃度の化合物で一般的に十分であり、治療に伴う副作用のリスクも軽減されることを見出した。
【0026】
本明細書中に記載の医薬組成物は、好ましくは、イソインジゴ、インジゴ、インジルビン又はそれらの誘導体から選ばれる少なくとも一つの化合物、抗炎症薬及び製薬学的に許容しうる担体を含む。
【図面の簡単な説明】
【0027】
【図1】慢性炎症関連疾患の病理過程における前/抗炎症性サイトカイン及び増殖因子の役割、並びにメイソインジゴの作用部位を示す概略図である。
【図2】LPS刺激ヒト単球THP−1細胞におけるIL−1βの分泌に及ぼすメイソインジゴの作用を示す図である。LPS刺激ヒト単球THP−1細胞におけるIL−1β産生に対するメイソインジゴの阻害効果。THP−1細胞を1μgのリポ多糖(LPS,Sigma)を使って及び使わずに処理/刺激し、一連の濃度のメイソインジゴ(31.25nM〜16,000nM)に24時間暴露した。トリパンブルー染色後、顕微鏡下で細胞の生存を調べた。培地中に分泌されたIL−1βのタンパク質レベルを、下記実施例1の材料及び方法に記載のように、R&D Systems社のアッセイキットを用い、ELISAによって測定し、その標準曲線(パネルA)から算出した。スチューデントt−テストを用いて統計的有意性を判定した。***はP<0.001を示す。パネルBに示されているように、メイソインジゴはわずか31nMの濃度でIL−1βの産生を著しく阻害する。
【図3】LPS刺激ヒト単球THP−1細胞におけるIL−6の分泌及び発現に及ぼすメイソインジゴの作用を示す図である。LPS刺激THP−1細胞におけるIL−6の産生(パネルB)及び転写(パネルC)に対するメイソインジゴの作用:THP−1細胞を1.0μg/mlのLPSを使って及び使わずに処理/刺激し、一連の濃度のメイソインジゴ(0.031〜16μM)に24時間暴露した。下記実施例2の材料及び方法に記載のように、培地中のIL−6タンパク質はELISAによって、細胞中のIL−6転写はリアルタイムPCRによって測定した。パネルA:純IL−6タンパク質を用いて構築した標準曲線で、パネルBのタンパク質産生の計算に使用された;パネルC:IL−6の転写に関するリアルタイムPCRアッセイ。***:P<0.001。パネルB及びCに示されているように、メイソインジゴは、IL−6の分泌及び転写とも著しく阻害する。
【図4】ヒト単球THP−1細胞におけるTNF−αの分泌及び発現に及ぼすメイソインジゴの作用を示す図である。LPS刺激THP−1細胞におけるTNF−αのタンパク質産生(パネルB)及び遺伝子転写(パネルC)に対するメイソインジゴの作用:THP−1細胞を1.0μg/mlのLPSを使って及び使わずに処理/刺激し、一連の濃度のメイソインジゴ(0.031〜16μM)に24時間暴露した。下記実施例3の材料及び方法に記載のように、培地中のTNF−αタンパク質はELISAによって、細胞中のその転写はリアルタイムPCR技術によって測定した。パネルA:純TNF−αタンパク質を用いて構築した標準曲線で、パネルBのタンパク質産生の計算に使用された。TNF−α分泌に対してメイソインジゴによる濃度依存性の阻害が得られた(パネルB)。パネルC:TNF−αの転写に関するリアルタイムPCRアッセイ。TNF−α転写に対する該薬剤の作用は観察されなかった。***:P<0.001。
【図5】THP−1細胞におけるIL−10のメイソインジゴによる刺激を示す図である。LPS処理THP−1細胞におけるIL−10の産生に対するメイソインジゴの刺激:THP−1細胞を1.0μg/mlのLPSを使って及び使わずに処理し、一連の濃度のメイソインジゴ(0.031〜16μM)に24時間暴露した。下記実施例4の材料及び方法に記載のように、培地中のIL−10タンパク質をELISAによって測定した。パネルA:純IL−10タンパク質を用いて構築した標準曲線で、パネルBのタンパク質産生の計算に使用された。炎症性刺激物のLPSはIL−10のタンパク質レベルを低下させたが、メイソインジゴはタンパク質産生を著しく増加させ、最大の刺激効果は62.5nMで発生し、IL−10分泌の約2倍の増加であった(パネルB)。**:P<0.01。
【図6】THP−1細胞における前炎症性サイトカイン及びサイクリン依存性キナーゼの発現に及ぼすメイソインジゴ及びNATURAの作用を示す図である:指数増殖したTHP−1細胞を1μgのLPSを使って(パネルA及びB)及び使わずに(パネルC)刺激し、示された濃度のメイソインジゴ又はNATURAに24時間暴露した。細胞の生存をトリパンブルー除外アッセイで調べた。培地中に分泌されたIL−1β、IL−6及びIL−10のタンパク質レベルを、下記実施例5の材料及び方法に記載のようにR&D Systems社のアッセイキットを用いて、上記例に記載のようにELISAによって測定した。スチューデントt−テストを用いて統計的有意性を判定した。*はP<0.001を示す。メイソインジゴ及びNATURAは、31.25及び62.5nMの濃度でIL−1β及びIL−6の産生を著しく阻害し、IL−10の産生を促進した。これに対し、同一の実験条件下でCDK2に対する該化合物の阻害作用は低濃度(31.25及び62.5nM)では観察されなかった。
【図7】メイソインジゴがマウスにおけるDSS誘導急性潰瘍性大腸炎に対して有効であることを示す図である。メイソインジゴを使って及び使わずに処置したBalb/cマウスの5%DSS誘導急性潰瘍性大腸炎から取った結腸壁の組織化学の例(H&E染色、原寸倍率 ×100)。DSS誘導とメイソインジゴ処置は下記実施例7の材料及び方法に記載のように実施した。パネルAは、DSSを含まない飲料水を与えられた正常対照群の動物由来の結腸壁の正常な形態学を示す。パネルBは、5%DSSで誘導された急性潰瘍性大腸炎を持つマウス由来の結腸壁を示し、炎症細胞の重度の浸潤の存在(リンパ濾胞、赤い矢印)及び粘膜腺窩の局所的消失(びらん病変、青い矢印)が見られる。パネルCは、5%DSSで誘導された急性潰瘍性大腸炎を持つメイソインジゴ処置マウス由来の結腸壁を示す。形態学は正常対照(パネルA)で示されているのと類似しており、メイソインジゴがマウスにおけるDSS誘導急性潰瘍性大腸炎に対して有効であることを示している。
【図8】炎症性腸疾患患者のメイソインジゴによる処置前後のフレキシブルS状結腸鏡検査の写真である。上のパネルは、2カ所の炎症部位(A及びB)の写真で、重度の浮腫を伴う炎症を明らかに示している。ニューヨーク市のマウントサイナイメディカルセンターの病理学者が実施した病理検査は、“特発性炎症性腸疾患を示唆するびらん及び特徴を有する重度の活動性慢性直腸結腸炎”との結論であった。下のパネルは、患者をメイソインジゴで治療9週間後の同じ場所のフレキシブルS状結腸鏡検査の写真である。治療後、結腸の表面は正常になり、浮腫は消失し、血管がはっきりと見えた。ただし、寛解中、Bの場所には瘢痕が存在している(下のパネル)。病理報告の結論は、“特発性炎症性腸疾患を示唆する非活動性慢性直腸結腸炎”であった。
【好適な態様の詳細な説明】
【0028】
本発明は、前炎症性サイトカインの発現及び/又は抗炎症性サイトカインの発現減少に伴う炎症関連疾患を治療するための医薬組成物及び方法に関する。本発明の好適な方法は、そのような治療を必要とする動物に、イソインジゴ、インジゴ、インジルビン、又はそれらの誘導体からなる群から選ばれる一つ以上の化合物を投与することを含む。好適な態様において、投与される化合物は、前炎症性サイトカインの発現を阻害することによって及び/又は抗炎症性サイトカインを刺激することによって炎症関連疾患を治療するに足る量であるが、その量はサイクリン依存性キナーゼ(CDK)を実質的に阻害するに足る量より少ない。
【0029】
本明細書中で使用している“CDKを実質的に阻害する”とは、30%、さらに好ましくは40%を阻害するに足る濃度、最も好ましくはCDKの50%阻害濃度(IC50)以上の濃度を意味する。阻害されるCDKは、好ましくは、CDK1、CDK2、CDK4、CDK5、及びCDK6からなる群から選ばれる一つ以上のCDKである。
【0030】
本方法は、病理の進行に関与するサイトカインを調節することによって疾患に伴う炎症を防止し、このようにして炎症関連疾患の開始を予防することによって炎症関連疾患を治療することを含むが、これに限定されないことは理解されるべきである。
【0031】
炎症関連疾患は、好ましくは、関節炎、リウマチ様関節炎、炎症性腸疾患;乾癬;多発性硬化症;神経変性障害;うっ血性心不全;脳卒中;大動脈弁狭窄症;腎不全;狼瘡;膵炎;アレルギー;線維症;貧血;アテローム性動脈硬化症;代謝性疾患;骨疾患;心臓血管疾患;化学療法/放射線関連合併症;I型糖尿病;II型糖尿病;肝疾患;胃腸障害;眼科的疾患;アレルギー性結膜炎;糖尿病性網膜症;シェーグレン症候群;ブドウ膜炎;肺障害、腎疾患;皮膚炎;HIV関連悪液質;大脳マラリア;強直性脊椎炎;らい病;貧血;及び線維筋痛からなる群から選ばれる。
【0032】
好ましくは、神経変性障害はアルツハイマー病及びパーキンソン病からなる群から選ばれ;炎症性腸疾患はクローン病又は潰瘍性大腸炎からなる群から選ばれ;消化器合併症は下痢であり;肝疾患は、自己免疫性肝炎、C型肝炎、原発性胆汁性肝硬変、原発性硬化性胆管炎、又は劇症肝炎からなる群から選ばれ;胃腸障害はセリアック病及び非特異性大腸炎からなる群から選ばれ;骨疾患は骨粗鬆症であり;肺障害は、アレルギー性鼻炎、喘息、慢性閉塞性肺疾患、慢性肉芽腫性炎症、嚢胞性線維症、及びサルコイドーシスからなる群から選ばれ;心臓血管疾患は、アテローム硬化性心疾患、うっ血性心不全及び再狭窄からなる群から選ばれ;そして腎疾患は糸球体腎炎及び脈管炎からなる群から選ばれる。
【0033】
好適な態様において、疾患は、特にクローン病及び潰瘍性大腸炎を含む炎症性腸疾患(IBD)である。別の好適な態様において、治療される疾患は、関節炎、リウマチ様関節炎、乾癬、アルツハイマー病、又はパーキンソン病である。さらに別の好適な態様において、疾患は放射線治療後関連疾患又はアテローム性動脈硬化症である。
【0034】
好ましくは、化合物は、前炎症性サイトカインの発現を阻害及び/又は抗炎症性サイトカインの発現を刺激する量である。一態様において、化合物は、好ましくは、IL−1α、β、IL−2、IL−3、IL−6、IL−7、IL−9、IL−12、IL−17、IL−18、TNF−α、LT、LIF、オンコスタチン、及びIFNc1α、β、γからなる群から選ばれる一つ以上の前炎症性サイトカインの少なくとも30%の発現を阻害する量である。さらに好ましくはサイトカインの少なくとも40%の発現が阻害され、最も好ましくは50%以上が阻害される。別の態様において、化合物は、好ましくは抗炎症性サイトカインの発現を刺激する量である。本態様において化合物は好ましくは、サイトカインIL−4、IL−10、IL−11、W−13又はTGFβからなる群から選ばれる抗炎症性サイトカインを少なくとも25%、さらに好ましくは少なくとも50%、最も好ましくは少なくとも75%増加させる量である。
【0035】
化学構造:
本発明は、イソインジゴ、インジゴ、インジルビン及びそれらの誘導体を含む特定の化合物群に関する。好ましくは、該化合物は、式(I)、(II)及び(III):
【0036】
【化1】

【0037】
[式中、R3、R4、R5、R6、R7、R8、R9、及びR10は、同じ又は異なり、水素原子;ヒドロキシ基;ニトロソ基;ニトロ基;モノサッカリド;ジサッカリド;ハロゲン原子;ヒドロカルビル基;又は官能性ヒドロカルビル基(非置換又は1個以上のヒドロキシ部分、カルボキシ部分、ニトロキシ部分、モノサッカリド、ジサッカリド、アミン、アミド、チオール、スルフェート、スルホネート、スルホンアミドもしくはハロゲンで置換されており、ヒドロカルビルは1〜8個の炭素原子を有する);−R11R12基{R11及びR12は、同じ又は異なっていてよく、水素原子、1〜18個の炭素原子を有する直鎖又は分枝鎖アルキル基(1個以上のヒドロキシ及び/又はアミノ基をさらに持っていてもよい)、置換又は非置換アリール基(1個以上のヘテロ原子を含んでいてもよい)、又はアシル基を表すか、又はR11とR12は一緒になって2〜6個の、置換されていてもよいCH2基を有する環を形成する};アゾ基−N=N−R13{R13は芳香族系(1個以上のカルボキシル基及び/又はホスホリル基で置換されていてもよい)又は糖、アミノ酸、ペプチドもしくはステロイドホルモンからなる群から選ばれる基を表す}を表すか;又はR1とR6及びR2とR7は、それぞれ、互いから独立して、1〜4個の、置換されていてもよいCH2基を有する環を一緒になって形成し;
基R1及びR2は、同じ又は異なり、水素原子;ハロゲン原子;ヒドロキシ基;ヒドロカルビル基、又は官能性ヒドロカルビル基(非置換又は1個以上のヒドロキシ部分、カルボキシ部分、ニトロキシ部分、モノサッカリド、ジサッカリド、アミン、アミド、チオール、スルフェート、スルホネート、スルホンアミドもしくはハロゲンで置換されており、ヒドロカルビルは1〜8個の炭素原子を有する);モノ−、ジ−又はトリアルキルシリル基(互いに独立して各場合において直鎖又は分枝鎖アルキル基に1〜6個の炭素原子を有する);モノ−、ジ−又はトリアリールシリル基(互いに独立して各場合において置換又は非置換アリール基を有する);−NR17R18基{R17及びR18は、同じ又は異なっていてよく、水素原子、1〜18個の炭素原子を有する直鎖又は分枝鎖アルキル基(1個以上のヒドロキシ及び/又はアミノ基をさらに持っていてもよい)、置換又は非置換アリール基(1個以上のヘテロ原子を含んでいてもよい)、又はアシル基を表す};メチレンアミノ基−CH2−NR17R18(R17及びR18は上記定義を有する);アミドとして窒素に結合している生理的アミノ酸残基、置換又は非置換モノサッカリド、ジサッカリド又はオリゴサッカリド;又は糖、アミノ酸、ペプチドもしくはステロイドホルモンを表す]である。
【0038】
好適な化合物は、少なくとも一つのR1、R2、R3、R4、R5、R6、R7、R8、R9、又はR10が、独立して、モノサッカリド、ジサッカリド、又はヒドロカルビル基もしくは官能性ヒドロカルビル基(1個以上のヒドロキシ部分、カルボキシ部分、ニトロキシ部分、モノサッカリド、ジサッカリド、アミン、アミド、チオール、又はハロゲンで置換されており、ヒドロカルビルは1〜8個の炭素原子を有する)であり;そしてR1、R2、R3、R4、R5、R6、R7、R8、R9、又はR10の少なくとも一つが化合物の生物活性又はバイオアベイラビリティを増強するものである。
【0039】
R1、R2、R3、R4、R5、R6、R7、R8、R9、又はR10は、化合物の溶解度を増大することによって化合物の生物活性又はバイオアベイラビリティを増強するのが好ましい。一つ以上のR1、R2、R3、R4、R5、R6、R7、R8、R9、又はR10によって生物活性及びバイオアベイラビリティの両方とも増大するのがさらに好ましい。
【0040】
好適な化合物は、少なくともR1又はR2が、モノサッカリド;ジサッカリド(非置換又は1個以上のヒドロキシ部分もしくはカルボキシ部分で置換されている);ハロゲン;ヒドロカルビル基、又は官能性ヒドロカルビル基(非置換又は1個以上のヒドロキシ部分、カルボキシ部分、ニトロキシ部分、モノサッカリド、ジサッカリド、アミン、アミド、チオール、スルフェート、スルホネート、スルホンアミドもしくはハロゲンで置換されており、ヒドロカルビルは1〜8個の炭素原子を有する)である化合物である。多くの場合、R1又はR2の一方だけが列挙した部分の一つでなければならず、最も好適な置換基の一つはCH2CH2OHである。
【0041】
式(I)、(II)、及び(III)のさらに好適な化合物は、R1又はR2がグリコシド分子、最も好ましくはモノサッカリド、そして最も好ましくはアセチル化モノサッカリドである化合物である。
【0042】
本発明の一態様において、該化合物は、式(IV)、(V)、及び(VI):
【0043】
【化2】

【0044】
としてそれぞれ示されているメイソインジゴ、トリアセチル化グリコ−メイソインジゴ(プロドラッグ)及びNATURAである。
以下に提供する実施例は、単に本発明の異なる態様を示すためのものであって、本発明の範囲をそれに限定することを意図しているのでは決してない。
【0045】
本発明の文脈中、及び上記式中の“ヒドロカルビル”という用語は、広く一価の炭化水素基を意味する。価数は炭素原子から水素を取り去ることによって誘導される。ヒドロカルビルは、例えば、脂肪族(直鎖及び分枝鎖)、脂環式、芳香族及び混合特性基(例えばアラルキル及びアルカリール)などである。ヒドロカルビルはまた、内部不飽和及び活性化不飽和を有するような基も含む。さらに詳しくは、ヒドロカルビルは、アルキル、シクロアルキル、アリール、アラルキル、アルカリール、アルケニル、シクロアルケニル及びアルキニルのような基(これらに限定されない)を含み、好ましくは12個までの炭素原子を有する。好適な態様は、ヒドロカルビル基が1〜8個の炭素原子を有するものを含む。これら及びその他のヒドロカルビル基は、鎖又は環の中に1個又は複数個のカルボニル基(これも炭素数のカウントに含める)及び/又は1個もしくは複数個のヘテロ原子(少なくとも1個の酸素、硫黄、窒素又はケイ素)を含有していてもよい。
【0046】
本発明の文脈中、及び上記式中の“官能性ヒドロカルビル”という用語は、側鎖及び/又は末端“反応性”及び/又は“潜在反応性”官能基及び/又は脱離基を持つヒドロカルビルを広く意味する。反応性官能基とは、関連分野の当業者には周知の通常条件下で普通のモノマー/ポリマーと反応する官能基のことである。反応性官能基の例は、活性水素含有基、例えばヒドロキシル、アミノ、カルボキシル、チオ、アミド、カルバモイル及び活性化メチレン;イソシアナト、シアノ及びエポキシ基;エチレン性不飽和基、例えばアリル及びメタリル;及び活性化不飽和基、例えばアクリロイル及びメタクリロイル、並びにマレエート及びマレイミド(それとブタジエンのようなジエンとのディールス−アルダー付加物も含む)である。本発明の意味の中での潜在反応性官能基とは、関連分野の当業者には明らかに分かる通り、早期反応を防止するために遮蔽又はマスクされている反応性官能基のことである。潜在反応性官能基の例は、ケチミン及びアルジミン(アミンがそれぞれケトン及びアルデヒドで遮蔽されている);アミン−カルボン酸塩;及び遮蔽イソシアネート、例えばアルコール(カルバメート)、オキシム及びカプロラクタム遮蔽形である。本発明の意味の中での“脱離”基とは、関連分野の当業者には明らかに分かる通り、ヒドロカルビル鎖又は環に結合している置換基で、反応中に追い出されてヒドロカルビル鎖又は環中の炭素又はヘテロ原子上に原子価を作り出す。脱離基の例は、ハロゲン原子、例えば塩素、臭素及びヨウ素;第四級アンモニウム塩;スルホニウム塩;及びスルホネートである。
【0047】
本発明のモノサッカリド又はジサッカリドは、好ましくは、グルコース、フルクトース、リブロース、ガラクトース、マンノース、セロビオース、アロース、アルトロース、リボース、キシロース、アラビノース、スクロース、又はラクトースである。最も好ましくは、D−グルコース、D−リボース、D−ガラクトース、D−ラクトース、D−キシロース又はD−スクロースである。
【0048】
一つの好適な態様において、モノサッカリド又はジサッカリドはアセチル化されており、好ましくは少なくともジアセチル、さらに好ましくはトリアセチル化されている。
“ハロゲン”という用語は、フッ素、塩素、臭素、又はヨウ素を示す。好ましくはフッ素又は塩素である。
【0049】
本明細書中で使用しているアミノ酸はL−又はD−アミノ酸(又はその残基)、好ましくはL−を意味し、アラニン、アルギニン、アスパラギン、アスパラギン酸、システイン、グルタミン、グルタミン酸、グリシン、ヒスチジン、イソロイシン、ロイシン、リジン、メチオニン、フェニルアラニン、プロリン、セリン、トレオニン、トリプトファン、チロシン、又はバリンからなる群から選ばれる。ペプチドという用語は、2個以上のアミノ酸がペプチド結合によって連結したもので、好ましくは2〜8個のアミノ酸、さらに好ましくは2〜6個のアミノ酸を含有する。
【0050】
医薬用製剤及び投与
本発明は炎症関連疾患を有する動物を治療するために使用されうる。ここで動物は哺乳動物であるのが好ましく、ヒトであるのがさらに好ましい。
【0051】
治療的利益は、典型的には少なくとも1、2、3個以上の化合物を同時又は順次投与することによって実現されることにも注意すべきである。本発明の化合物はその他の療法と組み合わせて併用治療に効果的な量を提供することもできる。該化合物は、例えば、追加の薬剤、好ましくは抗炎症薬と組み合わせて投与できる。
【0052】
好適な態様において、前炎症性サイトカインの発現に伴う炎症関連疾患を治療するための医薬組成物は、前述の通り、イソインジゴ、インジゴ、インジルビン、又はそれらの誘導体から選ばれる一つ以上の化合物;抗炎症薬、及び製薬学的に許容しうる担体を含む。ここで、抗炎症薬は、鎮痛薬;抗リウマチ薬;胃腸薬;痛風用製剤;グルココルチコイド;眼科用製剤;呼吸器薬;鼻用製剤;及び粘膜薬からなる群から選ばれる。
【0053】
好ましくは、鎮痛薬は、ナプロキセン、インドメタシン、イブプロフェン、ケトロラクトロメタミン、コリンマグネシウムトリサリチル酸及びロフェコキシブからなる群から選ばれ;抗リウマチ薬は、シクロスポリン、スルファサラジン、バルデコキシブ、ペニシラミン及びデキサメタゾンからなる群から選ばれ;胃腸薬は、メサラミン、バルサラジド二ナトリウム及びオルサラジンナトリウムからなる群から選ばれ;痛風用製剤はスリンダクであり;グルココルチコイドは、デキサメタゾン、リン酸デキサメタゾン、酢酸メチルプレドニゾロン、ヒドロコルチゾン及びリン酸ヒドロコルチゾンナトリウムからなる群から選ばれ;鼻用製剤は、ジプロピオン酸ベクロメタゾン一水和物、プロピオン酸フルチカゾン、トリアムシノロンアセトニド、フルニソリド、フランカルボン酸モメタゾン一水和物及びブデソニドからなる群から選ばれ;眼科用製剤はケトロラクトロメタミンであり;呼吸器薬はネドクロミルナトリウムであり;そして粘膜薬は、ジプロピオン酸アルクロメタゾン、酪酸ヒドロコルチゾン、フルランドレノリド、吉草酸ベタメタゾン及びプロピオン酸クロベタゾールからなる群から選ばれる。
【0054】
別の好適な態様において、医薬組成物は、メイソインジゴ及び/又はNATURAを含む。典型的には製薬学的に許容しうる担体は不活性希釈剤である。
さらに、また別の態様において、化合物−イソインジゴ、インジゴ、インジルビン、又はそれらの誘導体−は、前炎症性サイトカインの発現を阻害することによって及び/又は抗炎症性サイトカインの発現を刺激することによって炎症関連疾患を治療するに足る量であるが、サイクリン依存性キナーゼを実質的に阻害するに足る量より少ない。この態様において、前述の追加の抗炎症薬は組成物を有効なものにするために必要というわけではないが、追加すれば利益がある。
【0055】
本発明の医薬組成物は、前述のように、選択投与経路に適応された様々な形態を取りうる。当業者であれば本明細書中に記載の化合物の非毒性の製薬学的に許容しうる組成物の製造に使用できる様々な合成法は認識しているであろう。当業者であれば本発明の化合物の溶媒和物の製造に使用できる様々な非毒性の製薬学的に許容しうる溶媒は認識しているであろう。例えば水、エタノール、鉱油、植物油、及びジメチルスルホキシドである。
【0056】
本発明の組成物は、従来の非毒性の製薬学的に許容しうる担体、アジュバント及びビヒクルを含有する用量単位製剤として、経口、局所、非経口、吸入又はスプレーによって、又は直腸投与できる。最善の投与法は方法の併用であろうことはさらに当然である。ピル、カプセル、エリキシル、シロップ、ロゼンジ、トローチなどの形態での経口投与が特に好適である。本明細書中で使用している非経口という用語は、皮下注射、皮内、血管内(例えば静脈内)、筋肉内、脊髄、髄腔内注射もしくは類似の注射又は注入技術を含む。
【0057】
本発明の化合物を含有する医薬組成物は、好ましくは、例えば、錠剤、トローチ、ロゼンジ、水性又は油性懸濁液、分散性粉末剤又は顆粒剤、エマルジョン、硬質もしくは軟質カプセル、又はシロップもしくはエリキシルとして、経口使用に適切な形態である。
【0058】
経口使用を意図した組成物は、医薬組成物の製造に関して業界で公知の任意の方法に従って製造できる。そうした組成物は、製薬学的に上品で口当たりのよい製剤を提供するために、甘味剤、着香剤、着色剤及び保存剤からなる群から選ばれる一つ以上の薬剤を含有してもよい。錠剤は、活性成分を、錠剤の製造に適切な非毒性の製薬学的に許容しうる賦形剤と混合して含有しうる。このような賦形剤は、例えば、不活性希釈剤、例えば炭酸カルシウム、炭酸ナトリウム、ラクトース、リン酸カルシウム又はリン酸ナトリウム;顆粒化剤及び崩壊剤、例えばコーンスターチ、又はアルギン酸;結合剤、例えばデンプン、ゼラチン又はアカシア;並びに滑沢剤、例えばステアリン酸マグネシウム、ステアリン酸又はタルクなどでありうる。錠剤はコートされていなくてもよいが、公知技術によってコートされて消化管での崩壊及び吸収を遅らせることにより、長期にわたる持続作用を提供してもよい。例えば、モノステアリン酸グリセリン又はジステアリン酸グリセリンのような時間遅延物質が使用できる。
【0059】
経口用の製剤は、活性成分を不活性の固体希釈剤、例えば炭酸カルシウム、リン酸カルシウム又はカオリンと混合した硬質ゼラチンカプセルとして、又は活性成分を水又は油性媒体、例えば落花生油、流動パラフィン又はオリーブ油と混合した軟質ゼラチンカプセルとして提供することもできる。
【0060】
水性懸濁液は、水性懸濁液の製造に適切な賦形剤と混合した活性物質を含有する。そのような賦形剤は、懸濁化剤、例えばナトリウムカルボキシメチルセルロース、メチルセルロース、ヒドロキシプロピルメチルセルロース、アルギン酸ナトリウム、ポリビニルピロリドン、トラガカントゴム及びアカシアゴム;並びに分散剤又は湿潤剤、おそらくは天然ホスファチド、例えばレシチン、又はアルキレンオキシドと脂肪酸の縮合物、例えばステアリン酸ポリオキシエチレン、又はエチレンオキシドと長鎖脂肪族アルコールの縮合物、例えばヘプタデカエチレンオキシセタノール、又はエチレンオキシドと部分エステル(脂肪酸とヘキシトールから誘導された)の縮合物、例えばモノオレイン酸ポリオキシエチレンソルビトール、又はエチレンオキシドと部分エステル(脂肪酸と無水ヘキシトールから誘導された)の縮合物、例えばモノオレイン酸ポリエチレンソルビタンである。水性懸濁液は、1種類以上の保存剤、例えばエチル、又はn−プロピルp−ヒドロキシベンゾエート、1種類以上の着色剤、1種類以上の着香剤、及び1種類以上の甘味剤、例えばスクロース又はサッカリンも含有していてもよい。
【0061】
油性懸濁液は、活性成分を、植物油、例えば落花生油、オリーブ油、ゴマ油もしくはヤシ油、又は流動パラフィンのような鉱油中に懸濁させることによって製剤化できる。油性懸濁液は、増粘剤、例えば蜜蝋、固形パラフィン又はセチルアルコールを含有していてもよい。前述のような甘味剤及び着香剤を加えて、口当たりのよい経口用製剤にすることもできる。これらの組成物は、アスコルビン酸のような抗酸化剤を加えることによって保存できる。
【0062】
水を添加して水性懸濁液を製造するのに適切な分散性の粉末剤及び顆粒剤は、活性成分を分散剤又は湿潤剤、懸濁化剤及び一つ以上の保存剤と混合して提供される。適切な分散剤又は湿潤剤及び懸濁化剤は既に上で例示した。追加の賦形剤、例えば甘味剤、着香剤及び着色剤も存在してよい。
【0063】
本発明の医薬組成物は水中油エマルジョンの形態でもよい。油性相は、植物油、例えばオリーブ油もしくは落花生油、又は鉱油、例えば流動パラフィン、又はこれらの混合物であろう。適切な乳化剤は、天然ゴム、例えばアカシアゴム又はトラガカントゴム;天然ホスファチド、例えば大豆、レシチン、及び脂肪酸とヘキシトール(無水物)から誘導されたエステル又は部分エステル、例えばモノオレイン酸ソルビタン;及び前記部分エステルとエチレンオキシドの縮合物、例えばモノオレイン酸ポリオキシエチレンソルビタンであろう。該エマルジョンは、甘味剤及び着香剤を含有していてもよい。
【0064】
シロップ及びエリキシルは、甘味剤、例えばグリセロール、プロピレングリコール、ソルビトール又はスクロースとともに製剤化できる。そのような製剤は、粘滑剤、保存剤、並びに着香及び着色剤も含有していてよい。医薬組成物は、無菌の注射用水性又は油性懸濁液の形態でもよい。この懸濁液は、前述のような適切な分散剤又は湿潤剤及び懸濁化剤を用い、公知技術に従って製剤化できる。無菌の注射用製剤は、非経口用として許容しうる非毒性の希釈剤又は溶媒中の無菌注射用溶液又は懸濁液、例えば1,3−ブタンジオール中の溶液とすることもできる。使用できる許容可能なビヒクル及び溶媒は、水、リンガー溶液及び等張食塩水である。さらに、無菌の不揮発性油も溶媒又は懸濁化媒体として従来使用されている。この目的のためには合成モノ−又はジグリセリドを含む任意の無刺激性不揮発性油が使用できる。さらに、オレイン酸のような脂肪酸も注射用製剤の製造に使用される。
【0065】
本発明の組成物は、例えば薬物の直腸投与のために坐剤の形態で投与することもできる。これらの組成物は薬物を適切な非刺激性賦形剤と混合して製造できる。該賦形剤は常温では固体であるが直腸温度では液体になるので、直腸内で融解して薬物を放出する。そのような材料はカカオ脂及びポリエチレングリコールである。
【0066】
あるいは、組成物は無菌媒体に入れて非経口投与することもできる。薬物は、使用するビヒクル及び濃度に応じてビヒクル中に懸濁又は溶解できる。局部麻酔薬、保存剤及び緩衝剤のようなアジュバントをビヒクルに溶解するのも有益であろう。
【0067】
ヒト以外の動物への投与の場合、治療用化合物を含有する組成物を動物の飼料又は飲料水に加えることができる。動物が適切な量の化合物をその食餌で取ることができるように、動物用の飼料及び飲料水製品を製造するのも好都合であろう。さらに、化合物を飼料又は飲料水に添加するためのプレミックスとしての組成物に入れるのも都合がよい。該組成物は、ヒトの食用又は飲用サプリメントとして添加することもできる。
【0068】
体重1kgあたり1日約5mg〜約250mg、さらに好ましくは体重1kgあたり1日約25mg〜約150mg程度の用量レベルが前述の状態の治療に有用である。単一剤形を製造するために担体材料と混和されうる活性成分の量は、治療される状態及び特定の投与様式に応じて変動するであろう。単位剤形は、一般的に約1mg〜約500mgの活性成分を含有することになろう。用量は、好ましくは、サイトカイン調節によって炎症性疾患を治療する場合、CDK阻害によって増殖性疾患を治療する場合の用量の3分の1以下である。例えば、CMLを治療するためのメイソインジゴの用量は一般的に1日約125mgであるが、IBDを治療するためのメイソインジゴの用量は典型的には1日わずか25mgである。これは、このクラスの分子がサイトカインを調節するのに必要な量が、CDKを調節するのに要する量より著しく少なくてすむためである。
【0069】
投与頻度も、使用される化合物及び治療される特定の疾患に応じて変動しうる。しかしながら、ほとんどの疾患の治療の場合、1日4回以下の投与計画が好適である。しかしながら、任意の特定の患者に対する特定の用量レベルは、使用される特定の化合物の活性、年齢、体重、全般的健康状態、性別、食事、投与時間、投与経路及び排出速度、薬物の組合せ及び治療中の特定の疾患の重症度を含む様々な因子に応じて異なることは理解されるであろう。
【0070】
本発明の好適な化合物は望ましい薬理学的性質、すなわち、経口バイオアベイラビリティ、低毒性、低い血清タンパク質結合性並びに望ましいインビトロ及びインビボ半減期(これらに限定されない)を有することになろう。CNS障害を治療するのに使用される化合物にとっては血液脳関門の透過性が必要であるが、末梢障害の治療に使用される化合物の脳内濃度は低いほうが好適であることが多い。
【0071】
アッセイを使用することにより、これらの望ましい薬理学的性質を予測することができる。バイオアベイラビリティの予測に使用されるアッセイは、Caco−2細胞単層を含むヒト腸細胞単層を越える輸送などである。培養肝細胞に対する毒性は化合物の毒性を予測するのに使用できる。ヒトにおける化合物の血液脳関門の透過は、化合物を静脈内投与された実験動物の脳内濃度から予測できる。
【0072】
血清タンパク質結合性はアルブミン結合アッセイから予測できる。そのようなアッセイは、Oravcovaらによるレビューに記載されている(Journal of Chromatography B(1996)677巻、1−27ページ)。
【0073】
化合物の半減期は化合物の投与頻度に反比例する。化合物のインビトロ半減期は、Kuhnz及びGieschenが報告したミクロソームの半減期アッセイから予測できる(Drug Metabolism and Disposition,(1998)、26巻、1120−1127ページ)。
【0074】
前述の内容は本発明の好適な態様を記載しているのであって、特許請求の範囲に示されている本発明の精神又は範囲にもとることなくその中で変形が可能であることは理解されるであろう。発明とみなされる主題を特別に指摘し明白に主張するために、下記特許請求の範囲を以て本明細書を締めくくる。
【0075】
治療に使用するのに必要な組成物の量は、選択した特定の化合物だけでなく、投与経路、治療される状態の性質並びに患者の年齢及び状態によっても変動するであろう。最終的には担当医の指示による。
【0076】
メイソインジゴ並びにイソインジゴ、インジゴ及びインジルビンのその他の誘導体の治療的適応:
本発明は、動物における様々な炎症関連疾患の治療のために、あるクラスの小分子、メイソインジゴ並びにイソインジゴ、インジゴ及びインジルビンの誘導体を用いる方法を提供する。これらの炎症関連疾患は、炎症性腸疾患(IBD)、乾癬、リウマチ様関節炎(RA)、多発性硬化症(MS)、神経変性障害、心臓血管疾患(CVD)及びアテローム性動脈硬化症、及び代謝性疾患(メタボリックシンドローム及び糖尿病)、並びに感染関連炎症などであるが、これらに限定されない。
【0077】
この10年間、TNF−α及びその他のサイトカインの阻害薬の開発は、様々な炎症関連疾患の治療のための薬物開発の最も活発な領域の一つとなっている。そのような特異的阻害薬を様々な炎症関連疾患の治療に適用した短期の臨床成績は有望かつエキサイティングですらあり、抗TNF−α及び抗サイトカイン療法の今後の開発も一般に興味深いが(34)、これらの治療の長期的効果は、炎症関連疾患の病理過程には単一の経路だけでなく複雑なサイトカインネットワーク系が関与しているという事実によって課題を突きつけられている。
【0078】
前炎症性サイトカインは、抗炎症性サイトカインの発現低下と同様、広範囲の炎症病理過程に関与している。
図1に、様々なサイトカイン及び増殖因子が関与するヒトの炎症関連疾患の病理過程の概略を示す。慢性炎症関連疾患の病理過程における前/抗炎症性サイトカイン及び増殖因子の役割、及びメイソインジゴのような誘導体の作用部位を示す概略図も提供する。すなわち、炎症の病理的刺激が炎症応答細胞(リンパ球、単球、好中球、内皮細胞、組織マクロファージ及び肥満細胞)を起爆し、前炎症性サイトカイン及び増殖因子を放出させる。今度はこれらの前炎症性サイトカイン及び増殖因子が、血液供給から免疫細胞、好中球及び血液単球を引き出し、炎症部位におけるそれらの蓄積をもたらす。これらが結果的に様々な炎症関連疾患、及び/又は自己免疫障害を引き起こす。これらの疾患は、炎症性腸疾患(IBD)、乾癬、リウマチ様関節炎、神経変性などである。メイソインジゴは、低濃度(例えば30nM)で、IL−1β、IL−6、及びTNF−αを含む複数の前炎症性サイトカインの産生を阻害し、抗炎症性サイトカインIL−10を刺激する。
【0079】
表1に、自己免疫障害の病理過程における様々なサイトカインの関与をまとめた。様々な前炎症性サイトカインの顕著な増加が自己免疫疾患の組織/器官に見られるが、一部の調節性サイトカインは中等度に上昇して過活性化した前炎症性サイトカインのバランスを保っている。自己免疫障害は前炎症性サイトカインと調節性サイトカインとの間の不均衡が原因とも考えられている(48)。
【0080】
本発明における我々の観察に基づくと、メイソインジゴはいくつかの主要な前炎症性サイトカイン:TNF−α、IL−1及びIL−6の分泌/発現をダウンレギュレートし、抗炎症性サイトカインIL−10をアップレギュレートすることが示されている。“前炎症性サイトカイン及び増殖因子の放出の結果”という用語は、T細胞の表皮向性(epidermotropism)、K6/16過増殖の誘導、ライニングマクロファージ、活性化好中球及びT細胞の浸潤、肥満細胞の増加と活性化、ICAM−1及びMHC クラスIIの誘導、血管新生、血管透過性の変化、アポトーシス、脳及び中枢神経系への損傷、滑膜細胞増殖の調節、軟骨分解及び骨吸収のことを言う。
【0081】
【表1】

【0082】
炎症性腸疾患(IBD):IBDはクローン病(CD)と潰瘍性大腸炎(UC)を含む。これらは免疫系の調節異常によって起こる2つの重なり合った消化管の慢性炎症関連疾患である(20)。IBD患者は腸上皮のバリア機能が欠損しているため、上皮の細菌コロニー化を許している。その結果、細菌産物及び前炎症性サイトカイン(TNF−α、IL−1及びIL−6)が持続性の炎症刺激をもたらす。細菌抗原が粘膜の樹状細胞及びマクロファージによって免疫系に導入される。これに応答して、腸の食細胞(主に単球及び好中球)が増殖し、前炎症性サイトカインの発現と分泌を増大させる。メイソインジゴ並びにイソインジゴ、インジゴ及びインジルビンの誘導体は、我々の以前の特許で細胞成長阻害薬及び細胞分化誘導物質として示されているが、これらの炎症細胞の過活動増殖を効果的に阻害しながら、それらの前炎症性サイトカインの発現/分泌を抑制することが実施例1〜4に示されている。この結論は実施例7〜8に示すとおり動物モデル及びIBD患者で確認されている。
【0083】
乾癬:サイトカインは、皮膚の炎症の発生と維持に重要な役割を有する細胞間メッセンジャーである。いくつかのサイトカインが炎症性皮膚障害の病因に重大な役割を演じていることが報告されている。IL−1、TNF−α、及びIFN−γは、ICAM−1及び主要組織適合性遺伝子複合体(MHC)のクラスIIの発現を誘導する(48,49)。IL−1、TNF−α、及び顆粒球マクロファージコロニー刺激因子は、樹状細胞の活性化、成熟化、及び移動の誘導が可能であり、IL−1は肥満細胞を活性化する(50)。IL−6及びTGF−αはケラチノサイト増殖を増進する。IL−1、TNF−α、TGF−α、及びVEGFは血管新生を誘導し、炎症細胞を誘引する(51−53)。皮膚の免疫応答の誘導におけるサイトカインの第一義的重要性は、サイトカインを新規生物学的応答調節薬の非常に魅力あるターゲットにしている(18)。従って、本発明でクレームされている小分子のメイソインジゴ並びにイソインジゴ、及びインジルビンの誘導体は、複数のサイトカインの調節薬として、乾癬に対しても有効であろう。実施例6に示するように、我々は、齧歯類モデルでメイソインジゴは乾癬に対して用量依存的に真に効果的であり、その効果は陽性対照のMTXより良好であることを示した。
【0084】
リウマチ様関節炎(RA):RAにおける炎症の媒介と関節破壊におけるサイトカインネットワークの役割は近年大々的に研究されている。TNF−αに加えて、IL−1もRAの病因及び臨床症状に中心的役割を果たしている(54)。IL−1の、炎症と関節侵食を推進し、組織修復プロセスを阻害する能力は、インビトロ系及び動物モデルで明らかに確立されているので、RA患者の炎症症状の緩和はIL−1の遮断によって達成されている(55)。IL−6は、免疫応答、造血、急性期応答、及び炎症を調節する多機能性サイトカインである。IL−6産生の異常は、RAを含むいくつかの疾患の病理に関わっている。IL−6シグナルを遮断する治療的アプローチは、ヒト化抗IL−6R抗体を用いて疾患の中でも特にRAのために実施されている(11,56)。IL−10は抗炎症性サイトカインである。IL−10の発現は、動物モデルで関節炎を予防又は該疾患を改善することが示されている(57,58)。TNF−α、IL−1、IL−6及びIL−10のようなサイトカインは独立した役割を有していることは明らかであるが、それらはRAではある種の病理生理学的過程の媒介に協力的に作用している。本発明に記載のクラスの分子の発見は、該分子がこれらの異なるサイトカインを調節することができるので、RAの治療に劇的な治療的進歩をもたらすであろう。
【0085】
多発性硬化症(MS):MSは自己免疫性の炎症性障害である。MS患者において体が自分自身のミエリンを攻撃する原因は不明であるが、サイトカイン異常が該疾患のプロセスに関与していることは明らかである。実験的自己免疫性脳脊髄炎(EAE)(自己免疫、組織病理、遺伝子及び臨床的類似性に基づいてMSの研究に広く使用されているモデル)を用いることにより、EAEもMSも早期活動期においてCNSにばらまかれた血管周囲の炎症性カフの存在を特徴とすることが示されている。これは化学走化性サイトカイン(ケモカイン)が重要な役割を果たすプロセスである。CNSの自己免疫性炎症時におけるケモカイン(IL−8ファミリーメンバー)の発現は、TNFなどの一部の前炎症性サイトカインによって調節されているという証拠がある(59)。IL−1β、IL−6及びIL−10のようなその他の前/抗炎症性サイトカインの役割もEAE動物モデル(60−62)並びにヒト(63)で確認されている。IL−1βはMS病変部に存在する。IL−1受容体アンタゴニスト(IL−1Ra)は実験的自己免疫性脳脊髄炎(EAE)の誘導を緩和する。MSのリスク増大は高IL−1のヒトにみられる(IL−1Ra産生比より3高い、及びIL−10産生比より高いTNF)(63)。
【0086】
神経変性障害:アルツハイマー病(AD)及びパーキンソン病(PK)は神経炎症に関連する2つの最も一般的な神経変性障害である。神経炎症は、いくつかの神経変性障害で病的に冒された組織の特徴である。これらの変化はAD例の患部脳領域で特に観察される(64)。サイトカインの役割はADの病因に関与しているが、サイトカインが病因に寄与する機序は十分わかっていない。ADでは、特にアミロイド沈着に随伴しているミクログリアは、クラスII主要組織適合抗原及び炎症性サイトカイン、IL−1β及びTNF−αに対する抗体との免疫反応性を含む活性化状態に一致する表現型を有している(65)。ADの主な神経病理学的特徴の一つは脳における老人斑の沈着で、この老人斑は、主として毒性のアミロイドβ−ペプチド(Abeta)で構成される(AbetaはAbeta含有前駆体タンパク質(AbetaPP)のファミリーから生成する)。サイトカインはAbetaPPの転写の遺伝子発現を刺激することが示されている(66)。AD及びPKで発症年齢をコントロールする遺伝子座の遺伝子連鎖を分析したところ、ADとグルタチオンS−トランスフェラーゼのオメガ−1及び2(GSTO1、GSTO2)遺伝子との重要な関連が明らかになった(7)。GSTO1の機能は、前炎症性サイトカインIL−1βの翻訳後プロセシングに関連しているようである(67)。
【0087】
放射線治療後関連炎症:直腸及びS状結腸に対する放射線障害関連炎症性疾患は、骨盤領域のがん(子宮頸部、子宮、前立腺、膀胱、及び精巣のがんを含む)の放射線療法に伴う最も一般的な合併症である。放射線直腸S状結腸炎は、骨盤照射後の臨床的に明白な最も一般的な結腸損傷の形態で、発生頻度は5%〜20%である。患者は、典型的には、しぶり、出血、少量下痢、及び直腸痛の症状を呈する。稀に軽度の閉塞又は隣接臓器への瘻管を起こすこともある。
【0088】
放射線療法のメカニズムは、活発に増殖している細胞のDNAに損傷を与えることによる。腸/結腸に対する局所的放射線療法後の病理的損傷は急性期と慢性期に分けられる。初期の病理的変化は、粘膜固有層におけるリンパ球の喪失並びに粘膜上皮細胞及び血管内皮細胞に対する顕微鏡的損傷などである。これらの変化は、絨毛の鈍化及び腺窩新生細胞の減少、次いで血管透過性の増大を伴う顕著な粘膜下浮腫として現れる。
【0089】
進行性の動脈内膜炎が慢性的影響を起こす主たる機序のようである。これは後に進行性の線維症として現れ、これが元で粘膜の萎縮、狭窄の形成、及び血栓症を招き、二次的虚血障害を起こす。慢性期の放射線大腸炎は、非常に著明な腺窩細胞変形、末梢血管拡張症及び粘膜固有層の線維症を呈する。興味深いことに、これらの病理的変化の一部は長期IBDにも見られる(68)。
【0090】
従って、サイトカインは、炎症がかなりの部分にみられる様々な消化管疾患において主要な役割を果たしていると思われる。最近の研究は慢性IBDにおけるサイトカインの重大な役割に焦点が絞られている(69−74)。放射線直腸炎におけるサイトカインの役割を解明するために、Indaramら(75)は、放射線直腸炎患者の結腸粘膜のサイトカインレベルを調べ、これらの値を正常対照及びIBD患者から得られたそれと比較した。彼らは、IL−2、IL−6、及びIL−8の粘膜中レベルが正常対照のそれ(1.74±0.23、0.67±0.05、4.99±1.39pg/mg)と比べて著しく高く、放射線直腸炎群では病変粘膜(5.62±0.13、1.60±0.31、21.45±4.03pg/mg)及び正常に見える粘膜(3.83±0.78、1.36±0.34、13.45±3.18pg/mg)の両方で統計的に有意(p<0.05)であることを見出した。
【0091】
このように、これらの所見は、放射線直腸炎及びIBD患者で同じようなサイトカインの活性化を示している。放射線直腸炎患者の場合、粘膜中のIL−2、IL−6、及びIL−8レベルが正常対照と比べて著しく高いことが示された。これに比べて、IBD(UC及びCD)患者は、正常対照と比較してIL−1、IL−2、IL−6、及びIL−8を含むサイトカインのレベルが著しく高いことが示された。
【0092】
これら2つの疾患の粘膜サイトカイン発現における類似性は、疾患の強度の炎症性に直接関連していると考えるのが妥当である。これら2疾患のサイトカイン活性化におけるこの類似性が、慢性IBDと放射線直腸炎に見られる同様の病理変化をもたらしていると考えられている。この仮説は、放射線直腸炎の医学的管理は、多少不満足ながらも、経口又は局所投与される各種アミノサリチル酸誘導体及びコルチコステロイドによる治療を含むという事実によって裏付けられている。これらの治療選択はIBDの管理と同一である。
【0093】
本発明で示されているとおり、メイソインジゴとそのクラスの小分子は、IL−1β、IL−6及びTNF−αのダウンレギュレーションと、調節性サイトカインIL−10のアップレギュレーションが可能なので、この治療の高い効果と低い副作用が期待される。
【0094】
その他のサイトカイン異常関連疾患:心臓血管疾患(CVD)、アテローム性動脈硬化症、及び代謝性疾患(メタボリックシンドローム)も前/抗炎症性サイトカインの不適切な分泌/発現に関連している(10,12−14,76)。
【0095】
糖尿病:II型糖尿病の根本的障害はインスリン抵抗性で、インスリンが肝臓からのグルコース産生の抑制と末梢組織による消費の促進を行えず、その結果として高血糖になる。膵臓β細胞は、インスリン抵抗性の影響を克服するために、より多くのインスリンを分泌することによって過剰の血漿中グルコースに応答する。インスリン抵抗性が進行し、β細胞がインスリンの分泌量を増やすという要求にもはや応じられなくなると、血漿中グルコース濃度が増大し、II型糖尿病を発症する。
【0096】
II型糖尿病の発症には多数の因子が寄与しうる。II型糖尿病患者の80%は肥満で、肥満は常にインスリン抵抗性と関連しているので、肥満とインスリン抵抗性を結ぶ分子メディエータについて広く研究中である。様々な因子が肥満及び肥満関連II型糖尿病におけるインスリン抵抗性の寄与原因と確認されている。注目すべきは脂肪組織から産生される、FFA(遊離脂肪酸)、TNFα、IL−6、レプチン、アディポネクチン、及びレジスチンである。TNFαのmRNA及びタンパク質中レベルの両方とも肥満動物(77)及びヒト被験者(78)の脂肪組織で高度に増加している。脂肪組織中の全ての異なるタイプの細胞がサイトカインを産生可能である。脂肪細胞はTNFα受容体を発現すると同時に主たるTNFα源でもあるので、脂肪組織中で主にオートクリン/パラクリン的に機能していると考えられている。
【0097】
培養細胞(79)又は動物(80)をTNFαに長期暴露するとインスリン抵抗性が誘導されるが、TNFαの中和はインスリン感受性を増大し、II型糖尿病動物モデル(81)における高血糖を低下させる。遺伝子ノックアウトによってTNFα又はTNFα受容体をなくすと、肥満動物モデル(82)でインスリン感受性が著しく改善される。
【0098】
脂肪細胞並びに全身におけるTNFα誘導インスリン抵抗性の機序が提唱されている(83)。TNFαは、インスリン受容体及びインスリン受容体基質−1(IRS−1)のリン酸化をインヒビターkBキナーゼ−β(IKK−β)によって阻害する。TNFαによるNF−κBの活性化は、脂肪細胞に高発現する脂肪細胞機能に必須の遺伝子の抑制に不可欠であるだけでなく、PPAR−γ媒介遺伝子転写を阻害するのにも十分である。TNFαは、脂肪組織における脂肪分解とその他のサイトカイン発現も刺激し、FFA放出を起こす。実際、一部のインスリン抵抗性動物モデルでは高血糖が顕在化する前に血漿中のFFA濃度が増加する(83)。全身的インスリン抵抗性の誘導及び進行に過剰の血漿中FFAが関係していることを示す多数の証拠がある。肝細胞ではFFAは過剰のグルコース及びVLDL産生に寄与している。筋細胞では高濃度のFFAがインスリンのシグナリングを障害し、FFAの酸化を促進して、グルコースの酸化を大きく低下させる。
【0099】
現在入手できるインスリン増感薬は、PPAR−γアゴニストに属するが、TNFαが誘導する脂肪細胞の遺伝子発現像をNF−κB経路を通じて阻害する(84)。脂肪細胞由来TNFαはオートクリン又はパラクリン因子として機能するので、TNFα抗体を全身的に供給したところで脂肪組織に局所発現したTNFαの生物活性を遮断するのには効果的でないだろう(85)。単純拡散を通じて分配される新しいタイプの小分子TNFα阻害薬を表すNATURAは、従って局所発現されたTNFαの機能を遮断する薬剤として有効であり、II型糖尿病の治療に有用な可能性がある。
【0100】
I型糖尿病は、単核細胞のランゲルハンス島への浸潤とインスリン産生ベータ細胞の選択的破壊を特徴とする自己免疫疾患である。CD8+T細胞が重要なイニシエータであろうが、CD4+T細胞(86)及びマクロファージ(87,88)も、ベータ細胞を死に至らしめる免疫プロセスの主要な細胞エフェクタである。活性化マクロファージは、直接的にIL−1β、IL−6、IL−12、TNFαを分泌し、間接的に活性化T細胞からのINFγ産生を誘発する。I型糖尿病の病因におけるTNFα、INFγ、IL−1β、IL−6及びIL−10のようなサイトカインの関与は、サイトカイン発現とI型糖尿病発症の相関研究、サイトカイン増強研究、及びサイトカイン欠乏研究を通じてよく明らかにされている(89)。サイトカイン中和抗体及び可溶性サイトカイン受容体のほか、抗炎症性化合物も動物モデルでI型糖尿病発症の遅延又は予防効果を示している。
【0101】
インスリン炎からベータ細胞の完全破壊に至る糖尿病の発症機序は比較的慢性のプロセスである。メイソインジゴ、NATURA及びその他の誘導体は、前炎症性サイトカインを阻害し抗炎症性サイトカインを刺激するので、該疾患を治療するだけでなく、該疾患の発症を防止又は遅らせる薬剤として使用できる。
【0102】
要するに、サイトカインの調節異常は、炎症関連疾患及び普通は炎症関連疾患とみなされない疾患を含む様々な疾患に関与している。前及び抗炎症性サイトカインの両方を調節できる分子は、これらの炎症成分の機能障害に関連するあらゆる種類の疾患に対して最小限の副作用で治療的利益を提供するはずである。本発明に示したように、イソインジゴ、インジゴ及びインジルビンの代表的小分子誘導体であるメイソインジゴの、複数の前/抗炎症性サイトカインの発現/分泌の調節に対する性質は、このクラスの化合物を、前炎症性サイトカイン発現に伴う様々な炎症関連疾患の治療に効果的に使用することを可能にしている。
【0103】
実施例
実施例1:メイソインジゴはヒト単球細胞系THP−1細胞におけるIL−1β分泌を削減する
材料及び方法
材料:メイソインジゴ及びNATURAは、Natrogen Therapeutics,Incにより合成、高速液体クロマトグラフィー(HPLC)で精製され、純度98.5%であった。構造は質量分析及び核磁気共鳴(NMR)で確認された。メイソインジゴは暗赤色結晶で分子量376である。ジメチルスルホキシド(DMSO)の溶液中で製造し、インビトロでの実験のために−20℃で保管した。ヒト単球細胞系、THP−1(90)はATCCから購入した。細胞は供給元の取扱説明書に従って維持した。約1×105細胞/mlを、10%FBSを補充した変法RPMI−1640培地(Invitrogen)中、37℃、5%CO2で24時間培養した。
【0104】
方法:細胞を1μMのリポ多糖(LPS,Sigma)を使って又は使わずに刺激し、異なる濃度のメイソインジゴ(31.25nM〜16,000nM)に24時間暴露した。トリパンブルー染色後、顕微鏡下で細胞の生存を調べた。次に、R&D Systems社のアッセイキットを取扱説明書に従って用い、細胞によって培地中に分泌されたIL−1βのタンパク質レベルをELISAによって測定し、その標準曲線から算出した。方法は、得られた良好な標準曲線によって確立及び確認された。標準曲線の一例を図2のパネルAに示す。
【0105】
統計分析:全データを平均±SDで表した。対照(LPS)と実験群間の何らかの差の統計的有意性はスチューデントt−テストによって判定した。2群間のP値は、統計的に有意とみなすには少なくとも0.05より小さくなくてはならない。
【0106】
結果及び考察
IL−1βは、様々な炎症関連疾患の病理過程に関与している多形質発現性の前炎症性サイトカインである。インジゴ、イソインジゴ及びインジルビンの代表的小分子誘導体であるメイソインジゴの炎症に対する活性を解明するために、我々は、ヒト単球THP−1細胞におけるIL−1βの分泌に対するメイソインジゴの活性を調べた。図2のパネルBに示されているように、ヒト単球THP−1細胞におけるIL−1βの基礎レベルは検出不能であることが分かった。リポ多糖(LPS)に応答してタンパク質IL−1β及びmRNAレベルが増加するのは主に遺伝子の転写の増加の結果であることがこれまでに示されている(91,92)。本発明で、我々もLPSで刺激するとTHP−1細胞は大量のIL−1βを培地中に分泌することを観察した(92.38±3.667pg/ml、図2、パネルB)。興味深いことに、刺激されたIL−1βの分泌は、細胞をメイソインジゴに同時に暴露することによって著しく阻害された。最も重要なことは、我々はメイソインジゴが強力ではあるが穏やかなIL−1β阻害薬であるのを見出したことである。
【0107】
この特徴は、それを炎症性障害の治療に使用する場合、高効果で低副作用のため患者に有益であろう。強力という理由は、細胞をわずか31.25nMのメイソインジゴに暴露した場合にLPS媒介IL−1β分泌の50%を超える削減が繰り返し達成されたためであり;穏やかという理由は、メイソインジゴの濃度を8μMまで増加してもそれ以上の分泌削減が得られず、活性が最大に達したことが示されたからである。これは、メイソインジゴ又はNATURAの、サイクリン依存性キナーゼ(CDK)の阻害に対する効果とは異なる。CDK阻害の場合、我々の前特許で示したようにLNCaP前立腺がん細胞においてCDK活性を50%阻害するにはかなり高濃度が必要である(約1.6μM)。
【0108】
先行技術EP1079826はサイトカインではなくCDKの阻害を示しているだけなので、この最後の点は重要である。結果として、本発明では先行技術に比べてかなり低濃度の医薬品が使用される。さらに、特定の誘導体は、CDKの阻害に比べてサイトカインの阻害により一層適切なこともある。
【0109】
実施例2:メイソインジゴはヒト単球細胞系THP−1細胞におけるIL−6の分泌及び発現を阻害する
材料及び方法
材料:代表的誘導体のメイソインジゴを使用した。細胞系とELISAの手順は実施例1に記載したのと同じであった。細胞(メイソインジゴの存在下又は不在下におけるLPS刺激又は非刺激細胞)によって培地中に分泌されたIL−6の計算のための標準曲線は標準的IL−6タンパク質を用いて構築した。典型的な標準曲線を図3のパネルAに示す。統計分析も実施例1に記載の方法に準じた。
【0110】
方法:
リアルタイムPCR:メイソインジゴがIL−6の転写に及ぼす影響(RNAレベル)をリアルタイムポリメラーゼ連鎖反応(リアルタイムPCR)の技術によって調べた。全RNAをQiagen Rneasy minitキットを用いて抽出し、HPRT遺伝子を内部対照として用いた。
【0111】
指数増殖期のヒト単球THP−1細胞を、1μg/mlのLPS、1μMのメイソインジゴ、又は1μg/mlのLPS+1μMのメイソインジゴに24時間暴露した。次に細胞を収穫し、洗浄して全RNAをリアルタイムPCRアッセイ用に抽出した。全RNA(300ng)をDNアーゼI(Promega、ウィスコンシン州マディソン)で処理し、SuperScript II(Invitrogen、カリフォルニア州カールズバッド)及びオリゴ(dT)を取扱説明書に従って逆転写に使用した。リアルタイムPCR反応は、希釈cDNA、Sybr Green PCR Master Mix(Applied Biosystems)、及び各2.5μMのIL−6遺伝子特異的プライマー:R:5’−TCAATTCGTTCTGAAGAGG(配列番号1)及びF:5’−CCCCCAGGAGAAGATTCC(配列番号2)を含有する25μL体積中で実施した。ABI SDS7700アナライザ(Applied Biosystems)を用いて、50℃で2分間及び95℃で10分間、次いで95℃で15秒間及び60℃で1分間を40サイクル実施した。試験cDNAの結果は、同じプレート上で測定したHPRT内部標準に標準化した。サイクル後、増幅特異性を、PCR産物の緩徐な変性による融解曲線の作製と次いでゲル電気泳動によって確認した。
【0112】
結果及び考察
IL−6は炎症に関与する別の主要な前炎症性サイトカインである。そこで、メイソインジゴが分泌/発現に及ぼす影響を調べた。IL−1βと同様、IL−6の基礎レベルもヒト単球THP−1細胞で検出不能であった。1μg/mlのLPSで刺激すると、細胞はIL−6を培地に穏やかに分泌した(33.64±3.29pg/ml)。メイソインジゴは、LPS刺激THP−1細胞でIL−6の分泌を強く阻害することが分かった。刺激細胞を実験の最低濃度の31.25nMのメイソインジゴに暴露したところ、約85%の分泌削減が観察された(P<0.001)(図3,パネルB)。
【0113】
メイソインジゴによって媒介されたIL−6分泌の削減がLPSで刺激されたIL−6の発現に対する阻害によるものであるかどうかを調べるため、リアルタイムPCRを利用してIL−6のmRNA転写に対するメイソインジゴの作用を測定した。図3のパネルCに示されているように、THP−1細胞を1μg/mlのLPSに暴露するとIL−6転写の顕著な誘導が観察された。これは以前の報告と一致する(93)。興味深いことに、LPSで誘導されたIL−6の転写は、LPS刺激THP−1細胞を1μMのメイソインジゴに暴露することによって完全に抑制されるようである(P<0.001)。従ってこの所見は、LPS刺激によるIL−6分泌に対するメイソインジゴの阻害は、おそらくTHP−1細胞においてLPSが媒介するIL−6の産生を該薬剤が抑制した結果であることを示している。
【0114】
ヒト単球へのLPS刺激でIL−6転写シグナリング経路が活性化される。LPSは、LPS結合タンパク質(LBP)という名のタンパク質に結合できる。LPSは、LBPによってCD14受容体に運ばれた後、シグナリング受容体TLR4及びアクセサリータンパク質MD−2と相互作用することが示されている。この相互作用の結果、NF−κB及び3つのMAPキナーゼが活性化し、IL−6転写が増加する(94,95)。LPSが媒介するIL−6転写に対するメイソインジゴの抑制が情報伝達経路の妨害によるものであるかどうかについてはさらに調査の必要がある。
【0115】
実施例3:メイソインジゴはヒト単球THP−1細胞におけるTNF−α分泌を抑制する
材料及び方法
代表的誘導体のメイソインジゴを使用した。TNF−αの分泌を測定する細胞系とELISAの手順は実施例1に記載したのと同じであった。ただし、細胞(メイソインジゴの存在下又は不在下におけるLPS刺激又は非刺激細胞)によって培地中に分泌されたタンパク質の計算のための標準曲線は標準的TNF−αタンパク質を用いて構築した。典型的な標準曲線を図4のパネルAに示す。
【0116】
メイソインジゴがTNF−αの転写に及ぼす影響(RNAレベル)を実施例2に記載したのと同じ手順を用いてリアルタイムPCRの技術によって調べた。ただし、下記のようなTNF−αの特異的プライマーを用いた。5’−TGCCCAGACTCGGCAAAG(配列番号3)、及び5’−GGAGAAGGGTGACCGACT(配列番号4)。全RNAをQiagen Rneasy minitキットを用いて抽出し、HPRT遺伝子を内部対照として用いた。
【0117】
指数増殖したヒト単球THP−1細胞を、0.1μg/mlのLPS、4μMのメイソインジゴ、又は1μg/mlのLPS+4μMのメイソインジゴに24時間暴露した。次に細胞を収穫し、洗浄して全RNAを実施例2に記載のようにリアルタイムPCRアッセイ用に抽出した。
【0118】
結果及び考察
TNF−αは、がんに対するその重要な生物学的機能及び炎症性障害におけるその病理的役割のために、この10年間広く研究された重要な前炎症性サイトカインである。いくつかのTNF−α阻害薬が各種炎症関連疾患の治療用として市販されている。可能性ある抗炎症薬として、我々は本発明でTNF−αの調節におけるメイソインジゴの役割を探った。
【0119】
確立されたモデル系として、LPSによるTHP−1細胞の刺激でTNF−αの膨大な分泌が起きた(図4,パネルB)。しかしながら、メイソインジゴはLPS刺激THP−1細胞でTNF−αの分泌を濃度依存的に効果的に阻害した(図4,パネルB)。刺激細胞を2.0μMのメイソインジゴに24時間暴露すると約50%の分泌削減が達成された(P<0.001,LPS+メイソインジゴをLPSのみと比較した場合)。その時点でトリパンブルー染色を用いたところアポトーシスを起こした細胞は観察されなかった。メイソインジゴの濃度を8μMまで増加してもTNF−α分泌の更なる削減は起きず、細胞死も観察されなかった。しかしながら、刺激細胞を16μMのメイソインジゴで処理すると完全阻害が得られた。その場合でもアポトーシス細胞は20%しか見られなかった。
【0120】
リアルタイムPCRアッセイによれば、メイソインジゴ(4μM)はTNF−αのmRNAレベルには影響を及ぼさず(図4、パネルC)、メイソインジゴによるLPS刺激THP−1細胞におけるTNF−α産生減少は転写後レベルで発生することを示していた。TNF−αのmRNAの3’UTR中のAUリッチエレメント(ARE)がmRNAの安定性及び翻訳効率に関与していることはよく確立されている(96)。TNF−αのAREは、mRNA安定化因子HuRの標的である(97)。TNF−αのmRNAの成熟化は3’UTR中のシスエレメント(2−APRE)の影響を受ける。シスエレメントは、RNA活性化プロテインキナーゼ(PKR)の活性化に応じてTNF−α前駆体転写産物のスプライシングを起こさせる(98)。
【0121】
メイソインジゴがLPS刺激THP−1細胞におけるTNF−αの分泌を阻害する機序は確立される必要があるが、メイソインジゴは細胞毒性なしにTNF−αを阻害する新規小分子である。このため、メイソインジゴは各種炎症関連疾患治療のための理想的な薬剤になると思われる。
【0122】
実施例4:メイソインジゴはヒト単球THP−1細胞におけるIL−10分泌を刺激する
材料及び方法
本実施例で使用したメイソインジゴ及びTHP−1細胞系は、実施例1に記載したのと同じであった。IL−10の分泌を測定するELISAの手順も実施例1に記載の手順に準じた。ただし、細胞(メイソインジゴの存在下又は不在下におけるLPS刺激又は非刺激細胞)によって培地中に分泌されたタンパク質の計算のための標準曲線(図5,パネルA)は標準的IL−10タンパク質を用いて構築した。
【0123】
結果及び考察
免疫系の機能は、前炎症性及び調節性メディエータ又はサイトカインの活動によって繊細に調整されており、炎症関連疾患はこれらのタイプの分子間の不均衡の結果と考えられている(41,46)。本発明でクレームしている小分子の抗炎症作用が調節性サイトカインを誘導できるかどうかを理解するために、メイソインジゴのIL−10分泌に及ぼす作用を調べた。図5のパネルBに示すように、THP−1細胞で中等度ではあるが顕著なIL−10分泌刺激が観察された。THP−1細胞を0.0625μMのメイソインジゴで処理すると、IL−10の分泌に約60%の増加が達成された(P<0.05)。これに対し、炎症刺激物質のLPSはサイトカイン分泌をわずかに減少させた。
【0124】
実施例5:メイソインジゴ及びその誘導体は低濃度では第一分子標的としてCDKではなくサイトカインを選択する
材料及び方法
材料:メイソインジゴ及びNATURAは、上記実施例で記載の通り、Natrogen Therapeutics,Incにより合成された。
【0125】
ヒト単球細胞系、THP−1(90)はATCCから購入した。細胞は供給元の取扱説明書に従って維持した。約1×105細胞/mlを、10%FBSを補充した変法RPMI−1640培地(Invitrogen)中、37℃、5%CO2で24時間培養した。
【0126】
方法:
1)メイソインジゴ及びNATURAの、サイトカインIL−1β、IL−6、IL−10の発現/分泌に及ぼす作用:指数増殖したヒト単球THP−1細胞を1μMのリポ多糖(LPS,Sigma)を使って又は使わずに刺激し、異なる濃度のメイソインジゴ及びNATURA(31.25nM及び62.5nMから)にそれぞれ24時間暴露した。細胞の生存をトリパンブルー除外アッセイで調べた。次に、実施例1〜4に記載のように、R&D Systems社のアッセイキットを取扱説明書に従って用い、細胞によって培地中に分泌されたIL−1βのタンパク質レベルをELISAによって測定し、その標準曲線から算出した。
【0127】
2)メイソインジゴ及び/又はNATURAの、THP−1細胞におけるサイクリン依存性キナーゼ(CDK)の活性に及ぼす作用(99):指数増殖したTHP−1細胞を31.25、62.5、及び1500nMのメイソインジゴ又はNATURAにそれぞれ24時間暴露した。前述のように細胞を収穫し、洗浄して全タンパク質を抽出した(100)。100μgのタンパク質を、cdk2、cdk4/6又はサイクリンD1のいずれかに対する抗体を用い、プロテアーゼインヒビターカクテルの存在下、4℃で一晩、免疫沈降させた。免疫沈降物をタンパク質抽出バッファで4回、キナーゼアッセイバッファで1回洗浄し、[γ−32P]−ATP(10μCi/10μM)の存在下、75μg/mlのヒストンH1と反応させた。リン酸化ヒストンH1(cdk活性を表す)をシンチレーション計数又はSDS−ポリアクリルアミドゲル電気泳動によって測定した(101,102)。
【0128】
3)統計分析:全データを平均±SDで表した。対照(LPS)と実験群間の何らかの差の統計的有意性はスチューデントt−テストによって判定した。2群間のP値は、統計的に有意とみなすには少なくとも0.05より小さくなくてはならない。
【0129】
結果及び考察
インジルビン及びその誘導体はサイクリン依存性キナーゼを阻害することが示されているので、該化合物はCDKの阻害によって増殖制御の喪失に伴う疾患の有効な治療となりうる。どちらの細胞分子がこのクラスの化合物の抗炎症性に関して第一の標的となるかを調べるため、我々は、メイソインジゴ及びNATURAが同じ実験的低濃度条件下でCDK及びサイトカインのn活性をいかに調節するかを比較した。
【0130】
図6に示されているように、実施例1、2及び4で示された観察と同様、LPS刺激によるIL−1β及びIL−6の産生増加は、細胞をわずか31.25nMのメイソインジゴ及びNATURAに暴露することによって著しく阻害された。一方、THP−1細胞においてLPS媒介によって抑制されたIL−10は、同様の濃度下でメイソインジゴ及びNATURAによって約2倍に上昇した(図6A)。
【0131】
これに対し、同じ暴露下で、メイソインジゴ及びNATURAはどちらもサイクリン依存性2、4及び6の活性、ならびにサイクリンD1のレベル(データ示さず)を阻害できなかった。細胞を1.5μM(48倍高濃度)のメイソインジゴ又はNATURAいずれかで処理した場合に、これらの化合物の部分阻害(23%)が達成されただけであった(図6B)。
【0132】
さらに、本発明ではNATURAのグリコーゲンシンターゼキナーゼ−3β(GSK−3β)に対する作用も調べた。なぜならば、CDK阻害薬は通常GSK−3βの阻害薬でもあるからである。しかしながら、細胞を50μMもの高さのNATURAに暴露しても活性は観察されなかった(データ示さず)。
【0133】
このように、本実施例のデータは明らかにメイソインジゴ及び関連クラスの分子が様々なサイトカインを極めて低い濃度(そこではCDK活性に対する阻害効果は何ら達成されない)で著しく調節できる(前炎症性サイトカインを阻害し、抗炎症性サイトカインを刺激する)ことを示している。このことは、CDKの阻害に必要な濃度と比べて低い濃度でメイソインジゴ及びその誘導体はサイクリン依存性キナーゼではなくサイトカインを第一の標的にしていることを示している。この結論は、インジルビン及びその誘導体は真に生物学的CDK阻害薬でない(なぜならば、これらの化合物によるCDKの阻害は生物学的反応ではなく物理的凝集によるものだからである)という最近の観察によって裏付けられている(103)。さらに我々の結論は、慢性骨髄性白血病(CML)の最大寛解を達成するには合計8696mgの用量のメイソインジゴが必要であるが(104)、炎症性腸疾患の完全治癒を得るには525mgの薬物しか必要ないという臨床観察によっても裏付けられている。
【0134】
要約
THP−1細胞は、LPSによる24時間の刺激後、IL−1β、IL−6、IL−8及びTNF−αを分泌したが、IL−2、IL−4、IL−10及びIL−12は分泌しなかった(これらのサイトカインの基礎レベルはELISAでは検出不能)。このことは過去の報告と一致している(93,105)。イソインジゴ、インジゴ、及びインジルビン(構造は式I、II、及びIIIに示す)の誘導体のクラスの小分子が各種炎症関連疾患の治療に臨床応用できる可能性を評価するために、我々は例としてヒト単球THP−1細胞モデルにおけるメイソインジゴの前及び抗炎症性サイトカインの分泌及び発現に及ぼす調節作用を検証した。データを表2にまとめた。メイソインジゴは、LPS刺激THP−1細胞において前炎症性サイトカインIL−1β、IL−6、及びTNF−αの分泌を著しく阻害し、調節性サイトカインIL−10の分泌を刺激したが、IL−2に対しては何の作用も観察されなかった。これは単に該細胞が刺激によってこれらの前炎症性サイトカインを分泌できなかったためである。これらのサイトカインの最大削減又は刺激を表2にまとめた。
【0135】
【表2】

【0136】
LPS刺激THP−1細胞でIL−6の分泌がメイソインジゴによって削減されるのは、リアルタイムPCR技術によれば、サイトカイン遺伝子の転写のダウンレギュレーションの結果のようである。リアルタイムPCRアッセイは、メイソインジゴがLPS刺激THP−1細胞でIL−15に対して中等度の阻害をすることも示した(データ示さず)。TNF−α遺伝子に対しては同じ技術を用いて調べてもそのようなダウンレギュレーションは観察されなかった。メイソインジゴ及びこのクラスの分子が前及び抗炎症性サイトカインを調節する機序はさらに調査する必要があるが、本発明における我々のデータは、このクラスの小分子が様々な炎症関連疾患に関わる重要なサイトカインを調節できることを示している。
【0137】
この数年間、前炎症性サイトカインを標的にする戦略によって、様々な炎症性障害を治療するためのいくつかのタンパク質系薬剤が創製されている。例えば、TNF−α阻害薬のエタネルセプト(ENBREL(登録商標))、インフリキシマブ(REMICADE(登録商標);Centocor社)、アダリムマブ(HUMIRA(登録商標);Abbott社)及びIL−1受容体アンタゴニストのKINERET(登録商標)などである。これらの薬剤の初期段階の臨床応用の示すところによれば、これらの画期的治療薬は、IBD、RA、及び乾癬のような自己免疫疾患の治療に進歩をもたらした。しかしながら、現在の注射用タンパク質系治療薬は、悪性腫瘍増加の可能性、感染及びうっ血性心不全の増加を含む随伴リスクを有している(42)。さらに、そのような戦略は限界もあり、複雑なサイトカインネットワーク系によっても課題を突きつけられている。TNF−α及びNF−κBの阻害薬のようないくつかのタイプの小分子が特異的前炎症性サイトカイン阻害薬であること、そしてタンパク質系薬剤に優る様々な利点を有していることが示されているものの、単一の前炎症性サイトカインを標的にするだけでは炎症病理経路を妨害するに足るほど強力でなく、これがそれらの臨床効果を限定的なものにしている。
【0138】
これに対し、臨床応用における小分子のあらゆる利点(例えば製造が容易で投与に便利という事実)以外に、最も重要なことは、本発明でクレームしている分子は、様々な前炎症性サイトカイン、すなわちIL−1β、IL−6、及びTNF−αを同時に抑制するだけでなく、抗炎症性サイトカインIL−10も刺激することである。さらに、これらの分子は我々の前特許で、高濃度では細胞分化を誘導し、細胞増殖を阻害することも示されている。従って、それらはより大きい臨床活性を提供する。この結論は、IBD患者の治療にメイソインジゴを用いて何ら副作用のない効果が達成されたという卓越した成果によって裏付けられている。この例証は本発明の実施例7に提供されている。
【0139】
実施例6:メイソインジゴは齧歯類において表皮細胞分化を増強し、過形成及び過角化を阻害する
材料及び方法
材料:メイソインジゴは、Natrogen Therapeutics,Inc社によって合成、精製及びその構造の特徴付けがなされた。化合物の純度は上記実施例に記載のように98.5%であった。メイソインジゴの懸濁液を0.5%ナトリウムメチルセルロース中に新たに調製し、下記の動物試験のために経口投与した。下記実験で使用したその他の化学薬品はSigma社から購入した。
【0140】
12週齢、体重22〜25gの雌の無菌クンミンマウスをケージに5匹ずつ収容し、新鮮な水道水及び市販の齧歯類用ペレットを自由に与えた。動物室は24±2℃、相対湿度60±5%及び12時間の明/暗サイクル(07:00〜19:00時)に制御された。
【0141】
方法:
メイソインジゴがマウス尾の表皮細胞分化に及ぼす作用:60匹の雌クンミンマウスを、1つの対照群に20匹、及び4つの薬物試験群に各10匹ずつの計5群に無作為に分けた。メイソインジゴは、0.5%ナトリウムメチルセルロース中懸濁液として新たに調製した。薬物は、それぞれ50、100、及び200mg/kgの用量で1日1回13日間経口投与した。陽性対照としてメトトレキサート(MTX)を1mg/kgの用量で2日に1回同一期間腹腔内投与(i.p.)した。メイソインジゴ懸濁液に使用したのと同一の体積及びビヒクルを陰性対照として使用した。最後の投与24時間後、動物を犠死させ、それらの尾を基部から1.5cmカットした。組織学的検査のためにスライドを作製したが、原文献はBosmanらによる(106)。スライドは尾を縦断面にカットし、ヘマトキシリン−エオジン(H&E)染色して作製した。次にスライドを光学顕微鏡で検査し、正角化(OK,orthokeratosis)及び表皮過形成の程度を評価した。前者は、1個の鱗屑内の十分に発達した顆粒層の水平長をその全長に対して測定することによって行った。薬物活性は、2個の毛包間に顆粒層を含有する(顆粒層を消失していない)陽性鱗屑細胞の増加で定義した。
【0142】
メイソインジゴがマウス膣上皮に及ぼす抗有糸分裂作用:60匹の雌クンミンマウスを、1つの対照群に20匹、及び4つの薬物試験群に各10匹ずつの計5群に無作為に分けた。全マウスにエストロゲンを0.2mg/動物の用量で3日間投与し、エストロゲンホルモンの刺激下で膣上皮細胞を発達させた。メイソインジゴは、0.5%ナトリウムメチルセルロース中懸濁液として新たに調製した。薬物は、それぞれ50、100、及び200mg/kgの用量で1日1回3日間経口投与した。陽性対照としてメトトレキサート(MTX)を1mg/kgの用量で1日に1回同一期間腹腔内投与(i.p.)した。メイソインジゴ懸濁液に使用したのと同一の体積及びビヒクルを陰性対照として使用した。最後の投与1時間後、動物にコルヒチンを2mg/kg腹腔内投与して細胞をM期で停止させた。5時間後動物を犠死させ、膣組織を10%ホルマリン中に固定し、パラフィンに包埋してスライドを作製した。スライドをH&Eで染色し、少なくとも500個の基底細胞を顕微鏡下で検査した。分裂指数(有糸核分裂細胞のパーセント)を計算した。
【0143】
結果及び考察
本実施例では一般的なマウス尾モデルを用いて、本発明でクレームしている化合物が表皮細胞の分化を増強し、それによって過形成及び過角化を減少できるかを定量的に測定した。このモデルは当初Jarrett A(107)が報告し、Bosmanら(106)が修正したものであるが、現在は他の人にも使用されている(108−110)。
【0144】
メイソインジゴがマウス尾の鱗屑上皮細胞の顆粒層形成に及ぼす作用を表3に示す。マウスをメイソインジゴで13日間処置すると、マウス尾上皮における顆粒層の形成が用量依存的に著しく増加していることが観察された。全3用量の治療効果は、マウスに乾癬治療用として臨床利用可能な薬物MTXを投与した陽性対照よりも良好であった。
【0145】
【表3】

【0146】
MTXは、細胞の有糸分裂を著しく阻害する免疫抑制性の化学療法薬である。メイソインジゴがMTXと同様の機序を通じて表皮細胞分化を増強し、それによって過形成及び過角化を減少させているのかを検証するために、メイソインジゴがマウス膣上皮の分裂指数(MI)に及ぼす作用を調べた。表4に示すように、マウスをMTXで3日間処置すると、未処置対照と比べてMIに著しい減少がもたらされた(MTX処置群14.76±4.29 vs 対照20.04±3.71、P<0.001)。これに対し、表4に示すように、同一実験条件下でメイソインジゴは低用量でMIに顕著な影響は与えなかった(50及び100mg/kg、P>0.05)。高用量(200mg/kg)でMIのわずかな減少が観察されただけであった(処置群16.06±2.66 vs 対照20.04±3.71、P<0.05)。
【0147】
我々のデータによれば、メイソインジゴはマウス尾上皮における顆粒層の形成を著しく刺激したが、MIに対する影響は観察されず、メイソインジゴが上皮細胞分化を誘導し、不完全分化鱗屑上皮細胞の成熟化を促進することが示された。このインビボの観察は、メイソインジゴがML−1細胞の分化をインビトロで誘導できるという我々の以前の報告をさらに裏付けるものである(111)。
【0148】
【表4】

【0149】
本実施例で使用したマウス尾モデルは、乾癬治療用薬剤の治療的価値を評価するための一般に使用されているインビボモデルである。従って、本実施例における我々の観察は、本発明でクレームされている小分子が炎症関連疾患の乾癬を治療できることを強く示唆するものである。しかしながら、これらの小分子の抗乾癬活性の機序は、メイソインジゴが細胞の有糸分裂に及ぼす直接的影響が観察されないため、免疫抑制及び化学治療薬のMTXとは異なっている。むしろ、本発明の実施例1〜4で示した様々な異なる種類のサイトカインの分泌/発現の調節とこれらの分子の細胞分化誘導能力が、おそらく抗乾癬作用の分子的基礎であろう。
【0150】
実施例7:メイソインジゴは、Balb/cマウスにおける誘導された急性潰瘍性大腸炎を抑制する
材料及び方法
材料:メイソインジゴは、上記実施例に記載のように、Natrogen Therapeutics,Inc社によって合成、精製及びその構造の特徴付けがなされた。メイソインジゴを0.5%ナトリウムメチルセルロース中に新たに調製し、下記の動物試験のために経口投与した。DSS(デキストラン硫酸ナトリウム塩、分子量:36,000〜44,000)はICN Biomedicals社から購入した。下記実験で使用したその他の化学薬品はSigma社から購入した。
【0151】
12週齢、体重22〜25gの雌の無菌Balb/cマウスをケージに5匹ずつ収容し、新鮮な水道水及び市販の齧歯類用ペレットを自由に与えた。動物室は24±2℃、相対湿度60±5%及び12時間の明/暗サイクル(07:00〜19:00時)に制御された。
【0152】
Balb/cマウスにおける急性潰瘍性大腸炎DSS誘導大腸炎の誘導:大腸炎は、以前の報告の通り、飲料水中のDSS(MW36,000〜50,000、ICN Biomedicals)によって誘導された(112)。手短に言うと、マウスを各10匹ずつの3群に無作為に分けた。陰性対照群(グループ1)ではマウスに新鮮な水道水を自由に、そしてMFペレットを週2回新たに交換して7日間与えた。陽性対照群(DSS群、又はグループ2)では、水道水中5%DSSを7日間投与して大腸炎を誘導した。マウスはMFペレットで飼育した。DSS−メイソインジゴ群(試験群又はグループ3)では、マウスに5%DSS飲料水を与え、メイソインジゴを1日1回50mg/kgの用量で連続7日間経口投与した。体重及び糞の性質(軟便及び/又は出血もしくは潜血)を含む大腸炎の糞徴候を毎日記録した。その後マウスを犠死させた。結腸組織を取り出し、10%ホルマリン/PBS中に固定し、パラフィンに包埋した。物理的人為要素を最小限にするために、取り出した結腸は伸ばさずに厚い定性ろ紙上に置いた。次に縦方向にカットして裏返し、露出させた。スライドをH&Eで染色し、3人の技術者/病理学者が組織化学的に盲検した。
【0153】
統計分析
全データとも平均±SDで表した。対照と実験群間の何らかの差の統計的有意性はスチューデントt−テストで少なくとも<0.05のP値を以て判定した。
【0154】
結果及び考察
陽性対照群の全動物は、第4日に5%DSSを飲用後、次第に軟便、潜血、及び体重減少の徴候を現した。いくつかの重症例では(7/10)、上記症状のほかに肛門に付着した血液が肉眼で観察された。本実験で潰瘍性大腸炎を誘導する手法は非常に積極的なものであり、発生する症状も極めて急性的(4日以内に発現)であるが、メイソインジゴ処置群における潜血は動物の40%(4/10)にしか発生しなかった。軟便のような他の症状も対照群のそれより軽度であった。大腸炎の症状は陰性対照群の動物(正常マウス)には観察されなかった。図7、パネルA。
【0155】
組織学的検査によれば、陽性対照群の全動物の組織は、多形核白血球及び多数のびらん性病変(スコア、1〜3)を含め、炎症細胞浸潤によって明らかなように、重度の潰瘍性大腸炎様病変を発現していた。腺窩膿瘍及び再生上皮も結腸粘膜に見られた(図7、パネルB)。主観的判断を避けるために、陽性対照群及びメイソインジゴ処置群両方のマウスの結腸の潰瘍性損傷は3人の個人技術者/病理学者が顕微鏡下で定量的及び盲検的にカウントした。メイソインジゴ処置群の動物では陽性対照群と比較した場合に潰瘍の55%の削減が観察された(メイソインジゴ処置群2.89±1.46対陽性対照群6.38±2.20)。図7のパネルCに、5%DSSで誘導した急性潰瘍性大腸炎を有するメイソインジゴ処置マウスの結腸壁を示す。形態学は正常対照(パネルA)に示されたものと同様で、メイソインジゴがマウスのDSS誘導急性潰瘍性大腸炎に対して有効であることを示している。
【0156】
実施例8:メイソインジゴは患者における特発性炎症性腸疾患を完全に抑止した
患者:43歳女性が4年間にわたる特発性炎症性腸疾患を示唆するびらん及び特徴を有する活動性慢性直腸結腸炎の1症例であると診断された。最初の診断は1999年にニューヨーク州ロングアイランドのノースショア大学病院マンハセット(North Shore University Hospital Manhasset)で結腸鏡によりなされた。主症状は、下痢、軟便及び出血であったが、全般的な健康状態は優れているとみなされた。CAIスコア(Clinical Activity Index)(表5)(113)は7〜8と判定された。担当医はヒドロコルチゾンフォームを処方し、彼女はこれを医師の指示に従って10日間服用した。しかしながら、この薬剤からは何の治療効果も得られなかった。2000年2月、彼女は中国の家に戻り、何回か中国人医師を訪ね、示唆された様々な漢方薬を試したが治療効果は観察されなかった。2002年早期、彼女は有名で評価の高い北京の中国医療病院(Chinese Medical Hospital)に行き、そこでフレキシブルS状結腸鏡検査を受けた。そこでも活動性炎症性腸疾患と診断された。
【0157】
【表5】

【0158】
このとき、以前の治療に効果がなかったので、主治医はいくつかの伝統的中国薬を処方した。彼女はこれらを数ヶ月間服用したが、それでも症状に改善は得られなかった。2000年2月〜2002年夏にかけて、彼女は、疾患が継続し、非常に厄介な性質のものであったため、様々なその他の伝統的中国薬も試してみたが、いずれも成功しなかった。2002年に米国に戻り、炎症性腸疾患の治療で国家的に承認された米国のセンターであるマウントサイナイメディカルセンター(Mount Sinai Medical Center)に行った。2002年10月、新しい主治医が再度結腸鏡検査と2つの生検標本(A及びB)の組織学的検査を実施した(図8、パネルA、治療前)。検査の結果、2カ所(A及びB)の炎症は“特発性炎症性腸疾患を示唆するびらん及び特徴を有する重度の活動性慢性直腸結腸炎”との結論に至った。医師は、最近FDAに認可された薬物で、彼女の状態に利用できる最善の薬物と考えられたCANASA(登録商標)(坐剤形のメサラミン)を処方した。
【0159】
CANASA(登録商標)を7日間服用後、彼女の症状は緩和されたかのようであったが、同時に重大な副作用が発生した。例えば、皮膚の痒み、腹部痙攣、疼痛及び出血などであった。そこで彼女は医師のアドバイスを求め、この薬物を断続的に使用することを指示された。しかしながら、副作用は薬物を使用するごとに実際悪化し続けた。そこで彼女はこの薬物療法を全て中止した。
【0160】
メイソインジゴはいくつかの前炎症性サイトカインを抑制でき、サイトカインIL−10のような抗炎症性サイトカインを刺激できるという我々の知見に基づき、メイソインジゴが見込みのある治療法として示唆された。中国で慢性骨髄性白血病の治療に使用されているこの医薬品は1日150mgという用量で極めてわずかな副作用しか報告されていなかったので、メイソインジゴが勧められた。
【0161】
患者は自発的に、勧告用量25mgのメイソインジゴを1日1回、計画された3週間の治療期間中服用した。最初の3回の投与後、患者は完全寛解を得(治療3日後)、全ての炎症症状も消失した。この結果、CAIスコアは0となった(表5)。9週間の寛解後(3週間の投薬、3週間の中止、そして3週間の再投薬)、患者は再受診し、この寛解が主観的なものか客観的なものかを判断するためにフレキシブルS状結腸鏡検査を依頼した。フレキシブルS状結腸鏡検査は2003年11月4日に実施された。結果を検討後、主治医は彼女の炎症は完全に抑止されていると結論づけた。病理学的検査でもこの結論が裏付けられ、A及びBの標本は、今度は“特発性炎症性腸疾患を示唆する非活動性慢性直腸結腸炎”と明言された。図8に、同じ医師が実施した結腸鏡検査で同じ炎症部位の治療前(パネルA、2002年10月)及び治療後(パネルB、2003年11月4日)の写真を示す。
【0162】
実施例9:Balb/cマウスにおける慢性潰瘍性大腸炎に及ぼすメイソインジゴの治療効果
メイソインジゴは、様々な炎症性疾患の病理過程及び維持に関与していることが知られている複数のサイトカインIL−1β、IL−6、IL−10及びTNF−αの調節器(レギュレーター)であることが示されている。メイソインジゴはまた、急速に成長する細胞増殖を阻害し、細胞分化及び成熟化を促進する細胞増殖抑制薬であることも示されている。
【0163】
前の実験で、メイソインジゴは、Balb/cマウスにおけるデキストラン硫酸ナトリウム(DSS)誘導性の急性進行性潰瘍性大腸炎に治癒効果を有することを示した。これらの結果は、メイソインジゴが炎症性腸疾患(IBD)を含む様々な慢性炎症性疾患に対して効果的な薬剤であることを示している。
【0164】
この実験では、DSS誘導慢性潰瘍性大腸炎モデルを用いて、インビボにおける分子標的を確認し、メイソインジゴのIBDに対する活性を評価した。
材料及び方法
材料:メイソインジゴは、Natrogen Therapeutics,Inc社によって合成、精製及び構造の特徴付けがなされていた。メイソインジゴの懸濁液を0.5%ナトリウムメチルセルロース中に新たに調製し、4℃で保管した。該薬物懸濁液を下記の動物試験のために経口投与した。5−アミノサリチル酸(5−ASA)はSigma社から購入した。DSS(デキストラン硫酸ナトリウム塩、分子量:36,000〜44,000)はICN Biomedicals社から購入した。下記実験で使用したその他の化学薬品はSigma社から購入した。
【0165】
12週齢、体重22〜25gの無菌Balb/cマウスをケージに5匹ずつ収容し、新鮮な水道水及び市販の齧歯類用ペレットを自由に与えた。動物室は24±2℃、相対湿度60±5%及び12時間の明/暗サイクル(07:00〜19:00時)に制御された。
【0166】
方法:Balb/cマウスにおける慢性潰瘍性大腸炎DSS誘導大腸炎の誘導:慢性潰瘍性大腸炎は、以前の報告の通り、飲料水中のDSS(MW36,000〜44,000、ICN Biomedicals)によって誘導された[4]。手短に言うと、60匹のマウスを各12匹ずつ5群に無作為に分けた。グループ1は陰性対照群(疾患誘導なし)として使用し、新鮮な水道水を自由に、そして餌ペレットを週2回新たに交換して実験の開始から完了まで与えた。グループ2〜5は、潰瘍性大腸炎を慢性的に誘導し、メイソインジゴの活性を調べるのに使用した。グループ2〜5の動物は、陰性対照群と同様、正常に給餌され、さらに5%DSS(MW36,000〜44,000)を含有する飲料水を7日間、蒸留水をその後の10日間与えられた。動物は再度5%DSSを含有する飲料水を7日間、蒸留水をその後さらに10日間与えられた。この操作を合計3サイクル繰り返した。
【0167】
3サイクル後、慢性潰瘍性大腸炎が発現し、記載のように安定化された。グループ2(陽性対照群)は生理食塩水で飼育、グループ3は陽性薬物ベースの対照として胃管投与による50mg/kg/日の5−ASAで処置された。グループ4及び5は、1日1回12日間、25及び75mg/kgの用量のメイソインジゴで処置された。
【0168】
実験期間中、以前報告された方法に従って、体重、便の硬さ、及び潜血又は肉眼的直腸出血の発生を反映する疾患活動性指数(DAI,disease activity index)を判定し、独立した調査員が毎日記録した[114,116]。それらの臨床パラメータは、ヒトの潰瘍性大腸炎(UC)で観察される主観的臨床症状に類似する包括的機能測定で、腺窩スコア(crypt score)として測定される組織学的治癒度とよく相関する[114−116]。次にマウスを犠死させた。脾臓、結腸、並びにその他の組織/臓器を摘出し、外観を調べ、それらの重量を記録した。物理的人為要素を最小限にするために、取り出した結腸は伸ばさずに厚い定性ろ紙上に置いた。結腸を縦方向にカットして裏返し、露出させた。すべての結腸組織を、10%ホルマリン/PBS固定、パラフィン包埋、そしてスライド用に切断した。スライドを組織検査用にH&Eで染色した。スライドは技術者/病理学者が盲検し、写真撮影した。潰瘍性大腸炎の重症度は0〜3のスケールで等級付けし、標準のスコアリングシステムに従って病理指数として表した。すなわち、0、正常;1、多形核白血球を含む局所的炎症細胞浸潤;2、炎症細胞浸潤、腺脱落、及び腺窩膿瘍;3、粘膜潰瘍である。結腸の医学的縦断面におけるリンパ濾胞の潰瘍性損傷数を光学顕微鏡下でカウントした。
【0169】
統計分析
全データとも平均±SDで表した。対照と実験群間の何らかの差の統計的有意性はスチューデントt−テストで少なくとも<0.05のP値を以て判定した。
【0170】
結果及び考察
疾患活動性指数(DAI):5%DSSを7日間飲用後、全マウスにまず下痢、便潜血が現れ、体重も著しく減少した。一方、蒸留水で飼育された動物にはそのような症状は観察されなかった。しかしながら、これらの徴候は次の10日間マウスに蒸留水を与えた後は消失した(DAIは8〜9日で底値に達した)。しかしながら、その後のDSS投与(3投与サイクル)で、これらの臨床症状は回復せず、それどころか10日間の蒸留水消費期間中も悪化した。
【0171】
第3のDSS給餌サイクル後、動物を12日間、胃管投与によってビヒクル、50mg/kg/日の5−ASA、25又は75mg/kg/日のメイソインジゴで処置した。最後の投与24時間後、5群全てに対してDAIスコアを判定した。以下の表6に示されているように、DSS給餌を12日間中止した後、DAIはビヒクル処置群で50%減少したが、これはおそらく自然治癒によるものであった[117]。しかしながら、5−ASAと2種類のメイソインジゴ処置群ではDAI減少度が著しく向上し、70%までに達した。これは薬物治療による治療的応答を反映している。両用量のメイソインジゴの効果は5−ASAのそれと同等であった。
【0172】
【表6】

【0173】
潜血スコア:
以下の表7に、処置又は非処置動物の全群における潜血スコアを示す。DSS給餌中止12日後、ビヒクル処置群の動物はわずかな回復(27.2%)を示した。これは以前の報告にあるとおり、3連続DSS給餌サイクルによって誘導された大腸炎の慢性的性質と一致するものであった[4]。これに対し、5−ASAとメイソインジゴ処置群では顕著な改善が観察された。低用量のメイソインジゴ群の動物は、高用量群の75.7%と比べて最善の治療的応答(87%)を示した。低用量は、80%回復の陽性対照5−ASAよりも良かった。動物でDSS誘導IBDの出血がメイソインジゴで治癒したことは、メイソインジゴによる処置で潰瘍性大腸炎患者の出血が迅速に終結したという以前の観察とも一致している。
【0174】
定性組織学:
マウス結腸の横断面(中央部)をホルマリン中に調製し、パラフィン包埋用とした。スライドはH&Eで染色した。各群から2匹のマウスをスライド標本用、スライド標本及び染色の品質検査用に使用した。
【0175】
ビヒクル処置群の動物の組織学は、表面上皮の喪失、腺の喪失、及び慢性炎症の存在を示していた。両メイソインジゴ処置群の動物のスライドは、IBDマウスのそれと比べて少ないびらん及び軽度の炎症性浸潤物を示した5−ASA群にむしろ近かった。
【0176】
【表7】

【0177】
【表8−1】

【0178】
【表8−2】

【0179】
【表8−3】

【0180】
【表8−4】

【0181】
【表8−5】

【0182】
【表8−6】

【0183】
【表8−7】

【0184】
【表8−8】

【0185】
【表8−9】

【0186】
【表8−10】

【0187】
【表8−11】

【特許請求の範囲】
【請求項1】
サイトカイン発現レベルに伴う炎症関連疾患の治療法であって、そのような治療を必要とする動物に、式(I)、(II)又は(III):
【化1】

[式中、
R3、R4、R5、R6、R7、R8、R9、及びR10は、同じ又は異なり、水素原子;ヒドロキシ基;ニトロソ基;ニトロ基;モノサッカリド;ジサッカリド;ハロゲン原子;ヒドロカルビル基、又は官能性ヒドロカルビル基(非置換又は1個以上のヒドロキシ部分、カルボキシ部分、ニトロキシ部分、モノサッカリド、ジサッカリド、アミン、アミド、チオール、スルフェート、スルホネート、スルホンアミドもしくはハロゲンで置換されており、ヒドロカルビルは1〜8個の炭素原子を有する);−R11R12基{R11及びR12は、同じ又は異なっていてよく、水素原子、1〜18個の炭素原子を有する直鎖又は分枝鎖アルキル基(1個以上のヒドロキシ及び/又はアミノ基をさらに持っていてもよい)、置換又は非置換アリール基(1個以上のヘテロ原子を含んでいてもよい)、又はアシル基を表すか、又はR11とR12は一緒になって2〜6個の、置換されていてもよいCH2基を有する環を形成する};アゾ基−N=N−R13{R13は芳香族系(1個以上のカルボキシル基及び/又はホスホリル基で置換されていてもよい)又は糖、アミノ酸、ペプチドもしくはステロイドホルモンからなる群から選ばれる基を表す}を表すか;又はR1とR6及びR2とR7は、それぞれ、互いから独立して、1〜4個の、置換されていてもよいCH2基を有する環を一緒になって形成し;そして
R1及びR2は、同じ又は異なり、水素原子;ハロゲン原子;ヒドロキシ基;ヒドロカルビル基、又は官能性ヒドロカルビル基(非置換又は1個以上のヒドロキシ部分、カルボキシ部分、ニトロキシ部分、モノサッカリド、ジサッカリド、アミン、アミド、チオール、スルフェート、スルホネート、スルホンアミドもしくはハロゲンで置換されており、ヒドロカルビルは1〜8個の炭素原子を有する);モノ−、ジ−又はトリアルキルシリル基(互いに独立して各場合において直鎖又は分枝鎖アルキル基に1〜6個の炭素原子を有する);モノ−、ジ−又はトリアリールシリル基(互いに独立して各場合において置換又は非置換アリール基を有する);−NR17R18基{R17及びR18は、同じ又は異なっていてよく、水素原子、1〜18個の炭素原子を有する直鎖又は分枝鎖アルキル基(1個以上のヒドロキシ及び/又はアミノ基をさらに持っていてもよい)、置換又は非置換アリール基(1個以上のヘテロ原子を含んでいてもよい)、又はアシル基を表す};メチレンアミノ基−CH2−NR17R18(R17及びR18は上記定義を有する);アミドとして窒素に結合している生理的アミノ酸残基、置換又は非置換モノサッカリド、ジサッカリド又はオリゴサッカリド;又は糖、アミノ酸、ペプチドもしくはステロイドホルモンを表す]の少なくとも一つの化合物を投与することを含み、
前記化合物は、前炎症性サイトカインの発現を阻害することによって又は抗炎症性サイトカインの発現を刺激することによって炎症関連疾患を治療するに足る量投与されるが、その量はサイクリン依存性キナーゼを実質的に阻害するに足る量より少ない、炎症関連疾患の治療法。
【請求項2】
少なくともR1又はR2が、モノサッカリド、ジサッカリド(非置換又は1個以上のヒドロキシ部分もしくはカルボキシ部分で置換されている);ハロゲン;ヒドロカルビル基、又は官能性ヒドロカルビル基(非置換又は1個以上のヒドロキシ部分、カルボキシ部分、ニトロキシ部分、モノサッカリド、ジサッカリド、アミン、アミド、チオール、スルフェート、スルホネート、スルホンアミドもしくはハロゲンで置換されており、ヒドロカルビルは1〜8個の炭素原子を有する)である、請求項1に記載の方法。
【請求項3】
少なくともR1又はR2が化合物の溶解度を増大する基である、請求項2に記載の方法。
【請求項4】
少なくともR1又はR2がトリアセチル化モノサッカリドである、請求項2に記載の方法。
【請求項5】
少なくともR1又はR2がメチル基である、請求項2に記載の方法。
【請求項6】
R1又はR2がアセチル化モノサッカリドである、請求項5に記載の方法。
【請求項7】
動物がヒトである、請求項1に記載の方法。
【請求項8】
化合物の少なくとも二つが同時又は順次投与される、請求項1に記載の方法。
【請求項9】
化合物が抗炎症薬と組み合わせて投与される、請求項1に記載の方法。
【請求項10】
抗炎症薬が、鎮痛薬;抗リウマチ薬;胃腸薬;痛風用製剤;グルココルチコイド;眼科用製剤;呼吸器薬;鼻用製剤;及び粘膜薬からなる群から選ばれる、請求項9に記載の方法。
【請求項11】
鎮痛薬が、ナプロキセン、インドメタシン、イブプロフェン、ケトロラクトロメタミン、コリンマグネシウムトリサリチル酸及びロフェコキシブからなる群から選ばれ;抗リウマチ薬が、シクロスポリン、スルファサラジン、バルデコキシブ、ペニシラミン及びデキサメタゾンからなる群から選ばれ;胃腸薬が、メサラミン、バルサラジド二ナトリウム及びオルサラジンナトリウムからなる群から選ばれ;痛風用製剤がスリンダクであり;グルココルチコイドが、デキサメタゾン、リン酸デキサメタゾン、酢酸メチルプレドニゾロン、ヒドロコルチゾン及びリン酸ヒドロコルチゾンナトリウムからなる群から選ばれ;鼻用製剤が、ジプロピオン酸ベクロメタゾン一水和物、プロピオン酸フルチカゾン、トリアムシノロンアセトニド、フルニソリド、フランカルボン酸モメタゾン一水和物及びブデソニドからなる群から選ばれ;眼科用製剤がケトロラクトロメタミンであり;呼吸器薬がネドクロミルナトリウムであり;そして粘膜薬が、ジプロピオン酸アルクロメタゾン、酪酸ヒドロコルチゾン、フルランドレノリド、吉草酸ベタメタゾン及びプロピオン酸クロベタゾールからなる群から選ばれる、請求項10に記載の方法。
【請求項12】
疾患が、関節炎、リウマチ様関節炎、関節炎、リウマチ様関節炎、炎症性腸疾患;乾癬;多発性硬化症;神経変性障害;うっ血性心不全;脳卒中;大動脈弁狭窄症;腎不全;狼瘡;膵炎;アレルギー;線維症;貧血;アテローム性動脈硬化症;代謝性疾患;骨疾患;心臓血管疾患;化学療法/放射線関連合併症;I型糖尿病;II型糖尿病;肝疾患;胃腸障害;眼科的疾患;アレルギー性結膜炎;糖尿病性網膜症;シェーグレン症候群;ブドウ膜炎;肺障害、腎疾患;皮膚炎;HIV関連悪液質;大脳マラリア;強直性脊椎炎;らい病;貧血;及び線維筋痛からなる群から選ばれる、請求項2に記載の方法。
【請求項13】
神経変性障害がアルツハイマー病及びパーキンソン病からなる群から選ばれ;炎症性腸疾患がクローン病又は潰瘍性大腸炎からなる群から選ばれ;消化器合併症が下痢であり;肝疾患が、自己免疫性肝炎、C型肝炎、原発性胆汁性肝硬変、原発性硬化性胆管炎、又は劇症肝炎からなる群から選ばれ;胃腸障害がセリアック病及び非特異性大腸炎からなる群から選ばれ;肺障害が、アレルギー性鼻炎、喘息、慢性閉塞性肺疾患、慢性肉芽腫性炎症、嚢胞性線維症、及びサルコイドーシスからなる群から選ばれ;心臓血管疾患が、アテローム硬化性心疾患、うっ血性心不全及び再狭窄からなる群から選ばれ;そして腎疾患が糸球体腎炎及び脈管炎からなる群から選ばれる、請求項12に記載の方法。
【請求項14】
疾患がクローン病又は潰瘍性大腸炎である、請求項13に記載の方法。
【請求項15】
疾患が乾癬である、請求項13に記載の方法。
【請求項16】
疾患がアルツハイマー病又はパーキンソン病である、請求項13に記載の方法。
【請求項17】
化合物が、サイトカインIL−1α、β、IL−2、IL−3、IL−6、IL−7、IL−9、IL−12、IL−17、IL−18、TNF−α、LT、LIF、オンコスタチン、又はIFNc1α、β、γを阻害するに足る濃度で投与される、請求項1に記載の方法。
【請求項18】
化合物が、サイトカインIL−4、IL−10、IL−11、W−13又はTGFβの発現を刺激するに足る濃度で投与される、請求項1に記載の方法。
【請求項19】
動物におけるサイトカイン発現レベルに伴う炎症関連疾患の治療法であって、治療される炎症関連疾患は、炎症性腸疾患、リウマチ様関節炎;狼瘡;消化器合併症;化学療法/放射線関連合併症;I型糖尿病;II型糖尿病;肝疾患;胃腸障害;眼科的疾患;アレルギー性結膜炎;糖尿病性網膜症;シェーグレン症候群;ブドウ膜炎;肺障害、腎疾患;皮膚炎;HIV関連悪液質;大脳マラリア;強直性脊椎炎;らい病;関節炎;多発性硬化症;脳卒中;腎不全;膵炎;アレルギー;線維症;貧血;及び線維筋痛からなる群から選ばれ、該方法は、そのような治療を必要とする動物に、式(I)、(II)又は(III):
【化2】

[式中、
R3、R4、R5、R6、R7、R8、R9、及びR10は、同じ又は異なり、水素原子;ヒドロキシ基;ニトロソ基;ニトロ基;モノサッカリド;ジサッカリド;ハロゲン原子;ヒドロカルビル基、又は官能性ヒドロカルビル基(非置換又は1個以上のヒドロキシ部分、カルボキシ部分、ニトロキシ部分、モノサッカリド、ジサッカリド、アミン、アミド、チオール、スルフェート、スルホネート、スルホンアミドもしくはハロゲンで置換されており、ヒドロカルビルは1〜8個の炭素原子を有する);−R11R12基{R11及びR12は、同じ又は異なっていてよく、水素原子、1〜18個の炭素原子を有する直鎖又は分枝鎖アルキル基(1個以上のヒドロキシ及び/又はアミノ基をさらに持っていてもよい)、置換又は非置換アリール基(1個以上のヘテロ原子を含んでいてもよい)、又はアシル基を表すか、又はR11とR12は一緒になって2〜6個の、置換されていてもよいCH2基を有する環を形成する};アゾ基−N=N−R13{R13は芳香族系(1個以上のカルボキシル基及び/又はホスホリル基で置換されていてもよい)又は糖、アミノ酸、ペプチドもしくはステロイドホルモンからなる群から選ばれる基を表す}を表すか;又はR1とR6及びR2とR7は、それぞれ、互いから独立して、1〜4個の、置換されていてもよいCH2基を有する環を一緒になって形成し;そして
R1及びR2は、同じ又は異なり、水素原子;ハロゲン原子;ヒドロキシ基;ヒドロカルビル基、又は官能性ヒドロカルビル基(非置換又は1個以上のヒドロキシ部分、カルボキシ部分、ニトロキシ部分、モノサッカリド、ジサッカリド、アミン、アミド、チオール、スルフェート、スルホネート、スルホンアミドもしくはハロゲンで置換されており、ヒドロカルビルは1〜8個の炭素原子を有する);モノ−、ジ−又はトリアルキルシリル基(互いに独立して各場合において直鎖又は分枝鎖アルキル基に1〜6個の炭素原子を有する);モノ−、ジ−又はトリアリールシリル基(互いに独立して各場合において置換又は非置換アリール基を有する);−NR17R18基{R17及びR18は、同じ又は異なっていてよく、水素原子、1〜18個の炭素原子を有する直鎖又は分枝鎖アルキル基(1個以上のヒドロキシ及び/又はアミノ基をさらに持っていてもよい)、置換又は非置換アリール基(1個以上のヘテロ原子を含んでいてもよい)、又はアシル基を表す};メチレンアミノ基−CH2−NR17R18(R17及びR18は上記定義を有する);アミドとして窒素に結合している生理的アミノ酸残基、置換又は非置換モノサッカリド、ジサッカリド又はオリゴサッカリド;又は糖、アミノ酸、ペプチドもしくはステロイドホルモンを表す]の少なくとも一つの化合物を投与することを含み、
前記化合物は、サイトカイン誘導性炎症関連疾患を治療するに足る量投与される、炎症関連疾患の治療法。
【請求項20】
炎症性腸疾患がクローン病又は潰瘍性大腸炎であり;消化器合併症が下痢であり;肝疾患が、自己免疫性肝炎、C型肝炎、原発性胆汁性肝硬変、原発性硬化性胆管炎、又は劇症肝炎からなる群から選ばれ;胃腸障害がセリアック病及び非特異性大腸炎からなる群から選ばれ;肺障害が、アレルギー性鼻炎、喘息、慢性閉塞性肺疾患、慢性肉芽腫性炎症、嚢胞性線維症、及びサルコイドーシスからなる群から選ばれ;そして腎疾患が糸球体腎炎及び脈管炎からなる群から選ばれる、請求項19に記載の方法。
【請求項21】
少なくともR1又はR2が、モノサッカリド、ジサッカリド(非置換又は1個以上のヒドロキシ部分もしくはカルボキシ部分で置換されている);ハロゲン;ヒドロカルビル基、又は官能性ヒドロカルビル基(非置換又は1個以上のヒドロキシ部分、カルボキシ部分、ニトロキシ部分、モノサッカリド、ジサッカリド、アミン、アミド、チオール、スルフェート、スルホネート、スルホンアミドもしくはハロゲンで置換されており、ヒドロカルビルは1〜8個の炭素原子を有する)である、請求項19に記載の方法。
【請求項22】
少なくともR1又はR2が化合物の溶解度を増大する基である、請求項21に記載の方法。
【請求項23】
少なくともR1又はR2がアセチル化モノサッカリドである、請求項21に記載の方法。
【請求項24】
少なくともR1又はR2がメチル基である、請求項21に記載の方法。
【請求項25】
化合物の少なくとも二つが同時又は順次投与される、請求項19に記載の方法。
【請求項26】
化合物が抗炎症薬と組み合わせて投与される、請求項19に記載の方法。
【請求項27】
抗炎症薬が、鎮痛薬;抗リウマチ薬;胃腸薬;痛風用製剤;グルココルチコイド;眼科用製剤;呼吸器薬;鼻用製剤;及び粘膜薬からなる群から選ばれる、請求項26に記載の方法。
【請求項28】
鎮痛薬が、ナプロキセン、インドメタシン、イブプロフェン、ケトロラクトロメタミン、コリンマグネシウムトリサリチル酸及びロフェコキシブからなる群から選ばれ;抗リウマチ薬が、シクロスポリン、スルファサラジン、バルデコキシブ、ペニシラミン及びデキサメタゾンからなる群から選ばれ;胃腸薬が、メサラミン、バルサラジド二ナトリウム及びオルサラジンナトリウムからなる群から選ばれ;痛風用製剤がスリンダクであり;グルココルチコイドが、デキサメタゾン、リン酸デキサメタゾン、酢酸メチルプレドニゾロン、ヒドロコルチゾン及びリン酸ヒドロコルチゾンナトリウムからなる群から選ばれ;鼻用製剤が、ジプロピオン酸ベクロメタゾン一水和物、プロピオン酸フルチカゾン、トリアムシノロンアセトニド、フルニソリド、フランカルボン酸モメタゾン一水和物及びブデソニドからなる群から選ばれ;眼科用製剤がケトロラクトロメタミンであり;呼吸器薬がネドクロミルナトリウムであり;そして粘膜薬が、ジプロピオン酸アルクロメタゾン、酪酸ヒドロコルチゾン、フルランドレノリド、吉草酸ベタメタゾン及びプロピオン酸クロベタゾールからなる群から選ばれる、請求項27に記載の方法。
【請求項29】
化合物が、サイトカインIL−1α、β、IL−2、IL−3、IL−6、IL−7、IL−9、IL−12、IL−17、IL−18、TNF−α、LT、LIF、オンコスタチン、又はIFNc1α、β、γを阻害するに足る濃度で投与される、請求項19に記載の方法。
【請求項30】
化合物が、サイトカインIL−4、IL−10、IL−11、W−13又はTGFβの発現を刺激するに足る濃度で投与される、請求項19に記載の方法。
【請求項31】
動物におけるサイトカイン発現レベルに伴う炎症関連疾患を治療するための医薬組成物であって、イソインジゴ、インジゴ、インジルビン、又はそれらの誘導体から選ばれる一つ以上の化合物;抗炎症薬、及び製薬学的に許容しうる担体を含み、抗炎症薬は、鎮痛薬;抗リウマチ薬;胃腸薬;痛風用製剤;グルココルチコイド;眼科用製剤;呼吸器薬;鼻用製剤;及び粘膜薬からなる群から選ばれる医薬組成物。
【請求項32】
鎮痛薬が、ナプロキセン、インドメタシン、イブプロフェン、ケトロラクトロメタミン、コリンマグネシウムトリサリチル酸及びロフェコキシブからなる群から選ばれ;抗リウマチ薬が、シクロスポリン、スルファサラジン、バルデコキシブ、ペニシラミン及びデキサメタゾンからなる群から選ばれ;胃腸薬が、メサラミン、バルサラジド二ナトリウム及びオルサラジンナトリウムからなる群から選ばれ;痛風用製剤がスリンダクであり;グルココルチコイドが、デキサメタゾン、リン酸デキサメタゾン、酢酸メチルプレドニゾロン、ヒドロコルチゾン及びリン酸ヒドロコルチゾンナトリウムからなる群から選ばれ;鼻用製剤が、ジプロピオン酸ベクロメタゾン一水和物、プロピオン酸フルチカゾン、トリアムシノロンアセトニド、フルニソリド、フランカルボン酸モメタゾン一水和物及びブデソニドからなる群から選ばれ;眼科用製剤がケトロラクトロメタミンであり;呼吸器薬がネドクロミルナトリウムであり;そして粘膜薬が、ジプロピオン酸アルクロメタゾン、酪酸ヒドロコルチゾン、フルランドレノリド、吉草酸ベタメタゾン及びプロピオン酸クロベタゾールからなる群から選ばれる、請求項29に記載の医薬組成物。
【請求項33】
誘導体が、式(IV)、(V)、及び(VI):
【化3】

としてそれぞれ示されているメイソインジゴ、トリアセチル化グリコ−メイソインジゴ(プロドラッグ)又はNATURAである、請求項31に記載の医薬組成物。
【請求項34】
製薬学的に許容しうる担体が不活性希釈剤である、請求項31に記載の医薬組成物。
【請求項1】
サイトカイン発現レベルに伴う炎症関連疾患の治療法であって、そのような治療を必要とする動物に、式(I)、(II)又は(III):
【化1】

[式中、
R3、R4、R5、R6、R7、R8、R9、及びR10は、同じ又は異なり、水素原子;ヒドロキシ基;ニトロソ基;ニトロ基;モノサッカリド;ジサッカリド;ハロゲン原子;ヒドロカルビル基、又は官能性ヒドロカルビル基(非置換又は1個以上のヒドロキシ部分、カルボキシ部分、ニトロキシ部分、モノサッカリド、ジサッカリド、アミン、アミド、チオール、スルフェート、スルホネート、スルホンアミドもしくはハロゲンで置換されており、ヒドロカルビルは1〜8個の炭素原子を有する);−R11R12基{R11及びR12は、同じ又は異なっていてよく、水素原子、1〜18個の炭素原子を有する直鎖又は分枝鎖アルキル基(1個以上のヒドロキシ及び/又はアミノ基をさらに持っていてもよい)、置換又は非置換アリール基(1個以上のヘテロ原子を含んでいてもよい)、又はアシル基を表すか、又はR11とR12は一緒になって2〜6個の、置換されていてもよいCH2基を有する環を形成する};アゾ基−N=N−R13{R13は芳香族系(1個以上のカルボキシル基及び/又はホスホリル基で置換されていてもよい)又は糖、アミノ酸、ペプチドもしくはステロイドホルモンからなる群から選ばれる基を表す}を表すか;又はR1とR6及びR2とR7は、それぞれ、互いから独立して、1〜4個の、置換されていてもよいCH2基を有する環を一緒になって形成し;そして
R1及びR2は、同じ又は異なり、水素原子;ハロゲン原子;ヒドロキシ基;ヒドロカルビル基、又は官能性ヒドロカルビル基(非置換又は1個以上のヒドロキシ部分、カルボキシ部分、ニトロキシ部分、モノサッカリド、ジサッカリド、アミン、アミド、チオール、スルフェート、スルホネート、スルホンアミドもしくはハロゲンで置換されており、ヒドロカルビルは1〜8個の炭素原子を有する);モノ−、ジ−又はトリアルキルシリル基(互いに独立して各場合において直鎖又は分枝鎖アルキル基に1〜6個の炭素原子を有する);モノ−、ジ−又はトリアリールシリル基(互いに独立して各場合において置換又は非置換アリール基を有する);−NR17R18基{R17及びR18は、同じ又は異なっていてよく、水素原子、1〜18個の炭素原子を有する直鎖又は分枝鎖アルキル基(1個以上のヒドロキシ及び/又はアミノ基をさらに持っていてもよい)、置換又は非置換アリール基(1個以上のヘテロ原子を含んでいてもよい)、又はアシル基を表す};メチレンアミノ基−CH2−NR17R18(R17及びR18は上記定義を有する);アミドとして窒素に結合している生理的アミノ酸残基、置換又は非置換モノサッカリド、ジサッカリド又はオリゴサッカリド;又は糖、アミノ酸、ペプチドもしくはステロイドホルモンを表す]の少なくとも一つの化合物を投与することを含み、
前記化合物は、前炎症性サイトカインの発現を阻害することによって又は抗炎症性サイトカインの発現を刺激することによって炎症関連疾患を治療するに足る量投与されるが、その量はサイクリン依存性キナーゼを実質的に阻害するに足る量より少ない、炎症関連疾患の治療法。
【請求項2】
少なくともR1又はR2が、モノサッカリド、ジサッカリド(非置換又は1個以上のヒドロキシ部分もしくはカルボキシ部分で置換されている);ハロゲン;ヒドロカルビル基、又は官能性ヒドロカルビル基(非置換又は1個以上のヒドロキシ部分、カルボキシ部分、ニトロキシ部分、モノサッカリド、ジサッカリド、アミン、アミド、チオール、スルフェート、スルホネート、スルホンアミドもしくはハロゲンで置換されており、ヒドロカルビルは1〜8個の炭素原子を有する)である、請求項1に記載の方法。
【請求項3】
少なくともR1又はR2が化合物の溶解度を増大する基である、請求項2に記載の方法。
【請求項4】
少なくともR1又はR2がトリアセチル化モノサッカリドである、請求項2に記載の方法。
【請求項5】
少なくともR1又はR2がメチル基である、請求項2に記載の方法。
【請求項6】
R1又はR2がアセチル化モノサッカリドである、請求項5に記載の方法。
【請求項7】
動物がヒトである、請求項1に記載の方法。
【請求項8】
化合物の少なくとも二つが同時又は順次投与される、請求項1に記載の方法。
【請求項9】
化合物が抗炎症薬と組み合わせて投与される、請求項1に記載の方法。
【請求項10】
抗炎症薬が、鎮痛薬;抗リウマチ薬;胃腸薬;痛風用製剤;グルココルチコイド;眼科用製剤;呼吸器薬;鼻用製剤;及び粘膜薬からなる群から選ばれる、請求項9に記載の方法。
【請求項11】
鎮痛薬が、ナプロキセン、インドメタシン、イブプロフェン、ケトロラクトロメタミン、コリンマグネシウムトリサリチル酸及びロフェコキシブからなる群から選ばれ;抗リウマチ薬が、シクロスポリン、スルファサラジン、バルデコキシブ、ペニシラミン及びデキサメタゾンからなる群から選ばれ;胃腸薬が、メサラミン、バルサラジド二ナトリウム及びオルサラジンナトリウムからなる群から選ばれ;痛風用製剤がスリンダクであり;グルココルチコイドが、デキサメタゾン、リン酸デキサメタゾン、酢酸メチルプレドニゾロン、ヒドロコルチゾン及びリン酸ヒドロコルチゾンナトリウムからなる群から選ばれ;鼻用製剤が、ジプロピオン酸ベクロメタゾン一水和物、プロピオン酸フルチカゾン、トリアムシノロンアセトニド、フルニソリド、フランカルボン酸モメタゾン一水和物及びブデソニドからなる群から選ばれ;眼科用製剤がケトロラクトロメタミンであり;呼吸器薬がネドクロミルナトリウムであり;そして粘膜薬が、ジプロピオン酸アルクロメタゾン、酪酸ヒドロコルチゾン、フルランドレノリド、吉草酸ベタメタゾン及びプロピオン酸クロベタゾールからなる群から選ばれる、請求項10に記載の方法。
【請求項12】
疾患が、関節炎、リウマチ様関節炎、関節炎、リウマチ様関節炎、炎症性腸疾患;乾癬;多発性硬化症;神経変性障害;うっ血性心不全;脳卒中;大動脈弁狭窄症;腎不全;狼瘡;膵炎;アレルギー;線維症;貧血;アテローム性動脈硬化症;代謝性疾患;骨疾患;心臓血管疾患;化学療法/放射線関連合併症;I型糖尿病;II型糖尿病;肝疾患;胃腸障害;眼科的疾患;アレルギー性結膜炎;糖尿病性網膜症;シェーグレン症候群;ブドウ膜炎;肺障害、腎疾患;皮膚炎;HIV関連悪液質;大脳マラリア;強直性脊椎炎;らい病;貧血;及び線維筋痛からなる群から選ばれる、請求項2に記載の方法。
【請求項13】
神経変性障害がアルツハイマー病及びパーキンソン病からなる群から選ばれ;炎症性腸疾患がクローン病又は潰瘍性大腸炎からなる群から選ばれ;消化器合併症が下痢であり;肝疾患が、自己免疫性肝炎、C型肝炎、原発性胆汁性肝硬変、原発性硬化性胆管炎、又は劇症肝炎からなる群から選ばれ;胃腸障害がセリアック病及び非特異性大腸炎からなる群から選ばれ;肺障害が、アレルギー性鼻炎、喘息、慢性閉塞性肺疾患、慢性肉芽腫性炎症、嚢胞性線維症、及びサルコイドーシスからなる群から選ばれ;心臓血管疾患が、アテローム硬化性心疾患、うっ血性心不全及び再狭窄からなる群から選ばれ;そして腎疾患が糸球体腎炎及び脈管炎からなる群から選ばれる、請求項12に記載の方法。
【請求項14】
疾患がクローン病又は潰瘍性大腸炎である、請求項13に記載の方法。
【請求項15】
疾患が乾癬である、請求項13に記載の方法。
【請求項16】
疾患がアルツハイマー病又はパーキンソン病である、請求項13に記載の方法。
【請求項17】
化合物が、サイトカインIL−1α、β、IL−2、IL−3、IL−6、IL−7、IL−9、IL−12、IL−17、IL−18、TNF−α、LT、LIF、オンコスタチン、又はIFNc1α、β、γを阻害するに足る濃度で投与される、請求項1に記載の方法。
【請求項18】
化合物が、サイトカインIL−4、IL−10、IL−11、W−13又はTGFβの発現を刺激するに足る濃度で投与される、請求項1に記載の方法。
【請求項19】
動物におけるサイトカイン発現レベルに伴う炎症関連疾患の治療法であって、治療される炎症関連疾患は、炎症性腸疾患、リウマチ様関節炎;狼瘡;消化器合併症;化学療法/放射線関連合併症;I型糖尿病;II型糖尿病;肝疾患;胃腸障害;眼科的疾患;アレルギー性結膜炎;糖尿病性網膜症;シェーグレン症候群;ブドウ膜炎;肺障害、腎疾患;皮膚炎;HIV関連悪液質;大脳マラリア;強直性脊椎炎;らい病;関節炎;多発性硬化症;脳卒中;腎不全;膵炎;アレルギー;線維症;貧血;及び線維筋痛からなる群から選ばれ、該方法は、そのような治療を必要とする動物に、式(I)、(II)又は(III):
【化2】

[式中、
R3、R4、R5、R6、R7、R8、R9、及びR10は、同じ又は異なり、水素原子;ヒドロキシ基;ニトロソ基;ニトロ基;モノサッカリド;ジサッカリド;ハロゲン原子;ヒドロカルビル基、又は官能性ヒドロカルビル基(非置換又は1個以上のヒドロキシ部分、カルボキシ部分、ニトロキシ部分、モノサッカリド、ジサッカリド、アミン、アミド、チオール、スルフェート、スルホネート、スルホンアミドもしくはハロゲンで置換されており、ヒドロカルビルは1〜8個の炭素原子を有する);−R11R12基{R11及びR12は、同じ又は異なっていてよく、水素原子、1〜18個の炭素原子を有する直鎖又は分枝鎖アルキル基(1個以上のヒドロキシ及び/又はアミノ基をさらに持っていてもよい)、置換又は非置換アリール基(1個以上のヘテロ原子を含んでいてもよい)、又はアシル基を表すか、又はR11とR12は一緒になって2〜6個の、置換されていてもよいCH2基を有する環を形成する};アゾ基−N=N−R13{R13は芳香族系(1個以上のカルボキシル基及び/又はホスホリル基で置換されていてもよい)又は糖、アミノ酸、ペプチドもしくはステロイドホルモンからなる群から選ばれる基を表す}を表すか;又はR1とR6及びR2とR7は、それぞれ、互いから独立して、1〜4個の、置換されていてもよいCH2基を有する環を一緒になって形成し;そして
R1及びR2は、同じ又は異なり、水素原子;ハロゲン原子;ヒドロキシ基;ヒドロカルビル基、又は官能性ヒドロカルビル基(非置換又は1個以上のヒドロキシ部分、カルボキシ部分、ニトロキシ部分、モノサッカリド、ジサッカリド、アミン、アミド、チオール、スルフェート、スルホネート、スルホンアミドもしくはハロゲンで置換されており、ヒドロカルビルは1〜8個の炭素原子を有する);モノ−、ジ−又はトリアルキルシリル基(互いに独立して各場合において直鎖又は分枝鎖アルキル基に1〜6個の炭素原子を有する);モノ−、ジ−又はトリアリールシリル基(互いに独立して各場合において置換又は非置換アリール基を有する);−NR17R18基{R17及びR18は、同じ又は異なっていてよく、水素原子、1〜18個の炭素原子を有する直鎖又は分枝鎖アルキル基(1個以上のヒドロキシ及び/又はアミノ基をさらに持っていてもよい)、置換又は非置換アリール基(1個以上のヘテロ原子を含んでいてもよい)、又はアシル基を表す};メチレンアミノ基−CH2−NR17R18(R17及びR18は上記定義を有する);アミドとして窒素に結合している生理的アミノ酸残基、置換又は非置換モノサッカリド、ジサッカリド又はオリゴサッカリド;又は糖、アミノ酸、ペプチドもしくはステロイドホルモンを表す]の少なくとも一つの化合物を投与することを含み、
前記化合物は、サイトカイン誘導性炎症関連疾患を治療するに足る量投与される、炎症関連疾患の治療法。
【請求項20】
炎症性腸疾患がクローン病又は潰瘍性大腸炎であり;消化器合併症が下痢であり;肝疾患が、自己免疫性肝炎、C型肝炎、原発性胆汁性肝硬変、原発性硬化性胆管炎、又は劇症肝炎からなる群から選ばれ;胃腸障害がセリアック病及び非特異性大腸炎からなる群から選ばれ;肺障害が、アレルギー性鼻炎、喘息、慢性閉塞性肺疾患、慢性肉芽腫性炎症、嚢胞性線維症、及びサルコイドーシスからなる群から選ばれ;そして腎疾患が糸球体腎炎及び脈管炎からなる群から選ばれる、請求項19に記載の方法。
【請求項21】
少なくともR1又はR2が、モノサッカリド、ジサッカリド(非置換又は1個以上のヒドロキシ部分もしくはカルボキシ部分で置換されている);ハロゲン;ヒドロカルビル基、又は官能性ヒドロカルビル基(非置換又は1個以上のヒドロキシ部分、カルボキシ部分、ニトロキシ部分、モノサッカリド、ジサッカリド、アミン、アミド、チオール、スルフェート、スルホネート、スルホンアミドもしくはハロゲンで置換されており、ヒドロカルビルは1〜8個の炭素原子を有する)である、請求項19に記載の方法。
【請求項22】
少なくともR1又はR2が化合物の溶解度を増大する基である、請求項21に記載の方法。
【請求項23】
少なくともR1又はR2がアセチル化モノサッカリドである、請求項21に記載の方法。
【請求項24】
少なくともR1又はR2がメチル基である、請求項21に記載の方法。
【請求項25】
化合物の少なくとも二つが同時又は順次投与される、請求項19に記載の方法。
【請求項26】
化合物が抗炎症薬と組み合わせて投与される、請求項19に記載の方法。
【請求項27】
抗炎症薬が、鎮痛薬;抗リウマチ薬;胃腸薬;痛風用製剤;グルココルチコイド;眼科用製剤;呼吸器薬;鼻用製剤;及び粘膜薬からなる群から選ばれる、請求項26に記載の方法。
【請求項28】
鎮痛薬が、ナプロキセン、インドメタシン、イブプロフェン、ケトロラクトロメタミン、コリンマグネシウムトリサリチル酸及びロフェコキシブからなる群から選ばれ;抗リウマチ薬が、シクロスポリン、スルファサラジン、バルデコキシブ、ペニシラミン及びデキサメタゾンからなる群から選ばれ;胃腸薬が、メサラミン、バルサラジド二ナトリウム及びオルサラジンナトリウムからなる群から選ばれ;痛風用製剤がスリンダクであり;グルココルチコイドが、デキサメタゾン、リン酸デキサメタゾン、酢酸メチルプレドニゾロン、ヒドロコルチゾン及びリン酸ヒドロコルチゾンナトリウムからなる群から選ばれ;鼻用製剤が、ジプロピオン酸ベクロメタゾン一水和物、プロピオン酸フルチカゾン、トリアムシノロンアセトニド、フルニソリド、フランカルボン酸モメタゾン一水和物及びブデソニドからなる群から選ばれ;眼科用製剤がケトロラクトロメタミンであり;呼吸器薬がネドクロミルナトリウムであり;そして粘膜薬が、ジプロピオン酸アルクロメタゾン、酪酸ヒドロコルチゾン、フルランドレノリド、吉草酸ベタメタゾン及びプロピオン酸クロベタゾールからなる群から選ばれる、請求項27に記載の方法。
【請求項29】
化合物が、サイトカインIL−1α、β、IL−2、IL−3、IL−6、IL−7、IL−9、IL−12、IL−17、IL−18、TNF−α、LT、LIF、オンコスタチン、又はIFNc1α、β、γを阻害するに足る濃度で投与される、請求項19に記載の方法。
【請求項30】
化合物が、サイトカインIL−4、IL−10、IL−11、W−13又はTGFβの発現を刺激するに足る濃度で投与される、請求項19に記載の方法。
【請求項31】
動物におけるサイトカイン発現レベルに伴う炎症関連疾患を治療するための医薬組成物であって、イソインジゴ、インジゴ、インジルビン、又はそれらの誘導体から選ばれる一つ以上の化合物;抗炎症薬、及び製薬学的に許容しうる担体を含み、抗炎症薬は、鎮痛薬;抗リウマチ薬;胃腸薬;痛風用製剤;グルココルチコイド;眼科用製剤;呼吸器薬;鼻用製剤;及び粘膜薬からなる群から選ばれる医薬組成物。
【請求項32】
鎮痛薬が、ナプロキセン、インドメタシン、イブプロフェン、ケトロラクトロメタミン、コリンマグネシウムトリサリチル酸及びロフェコキシブからなる群から選ばれ;抗リウマチ薬が、シクロスポリン、スルファサラジン、バルデコキシブ、ペニシラミン及びデキサメタゾンからなる群から選ばれ;胃腸薬が、メサラミン、バルサラジド二ナトリウム及びオルサラジンナトリウムからなる群から選ばれ;痛風用製剤がスリンダクであり;グルココルチコイドが、デキサメタゾン、リン酸デキサメタゾン、酢酸メチルプレドニゾロン、ヒドロコルチゾン及びリン酸ヒドロコルチゾンナトリウムからなる群から選ばれ;鼻用製剤が、ジプロピオン酸ベクロメタゾン一水和物、プロピオン酸フルチカゾン、トリアムシノロンアセトニド、フルニソリド、フランカルボン酸モメタゾン一水和物及びブデソニドからなる群から選ばれ;眼科用製剤がケトロラクトロメタミンであり;呼吸器薬がネドクロミルナトリウムであり;そして粘膜薬が、ジプロピオン酸アルクロメタゾン、酪酸ヒドロコルチゾン、フルランドレノリド、吉草酸ベタメタゾン及びプロピオン酸クロベタゾールからなる群から選ばれる、請求項29に記載の医薬組成物。
【請求項33】
誘導体が、式(IV)、(V)、及び(VI):
【化3】

としてそれぞれ示されているメイソインジゴ、トリアセチル化グリコ−メイソインジゴ(プロドラッグ)又はNATURAである、請求項31に記載の医薬組成物。
【請求項34】
製薬学的に許容しうる担体が不活性希釈剤である、請求項31に記載の医薬組成物。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【公開番号】特開2012−176956(P2012−176956A)
【公開日】平成24年9月13日(2012.9.13)
【国際特許分類】
【外国語出願】
【出願番号】特願2012−92614(P2012−92614)
【出願日】平成24年4月16日(2012.4.16)
【分割の表示】特願2006−549356(P2006−549356)の分割
【原出願日】平成17年1月6日(2005.1.6)
【出願人】(504227936)ナトロジェン・セラピューティクス・インターナショナル,インコーポレーテッド (2)
【Fターム(参考)】
【公開日】平成24年9月13日(2012.9.13)
【国際特許分類】
【出願番号】特願2012−92614(P2012−92614)
【出願日】平成24年4月16日(2012.4.16)
【分割の表示】特願2006−549356(P2006−549356)の分割
【原出願日】平成17年1月6日(2005.1.6)
【出願人】(504227936)ナトロジェン・セラピューティクス・インターナショナル,インコーポレーテッド (2)
【Fターム(参考)】
[ Back to top ]

