炭化水素の脱水素触媒及び廃熱回収システム
【課題】 炭化水素の脱水素化を効率よく行い、300[℃]以下の廃熱を回収する。
【解決手段】炭化水素の脱水素触媒であって、炭化水素の脱水素反応に対して触媒作用を有する2〜4価の遷移金属からなる中心金属22と、この中心金属22に対し配位された有機配位子と、で三次元の骨格構造を構成した多孔性の金属錯体を含み、有機配位子は、次の一般式(I)で表され、
n1(HOOC)−R−(COOH)n2 ・・・(I)
ここに、Rは有機化合物、n1及びn2は1〜3の整数であり、少なくとも2つのカルボキシレート基を有することを特徴とする。
【解決手段】炭化水素の脱水素触媒であって、炭化水素の脱水素反応に対して触媒作用を有する2〜4価の遷移金属からなる中心金属22と、この中心金属22に対し配位された有機配位子と、で三次元の骨格構造を構成した多孔性の金属錯体を含み、有機配位子は、次の一般式(I)で表され、
n1(HOOC)−R−(COOH)n2 ・・・(I)
ここに、Rは有機化合物、n1及びn2は1〜3の整数であり、少なくとも2つのカルボキシレート基を有することを特徴とする。
【発明の詳細な説明】
【技術分野】
【0001】
この発明は、炭化水素の脱水素触媒及び炭化水素の脱水素触媒を用いた廃熱回収システムに関する。
【背景技術】
【0002】
飽和炭化水素から脱水素反応を行い水素を発生させるシステムが提案されている(特許文献1参照)。これらの技術では、発生した水素を燃料電池システム又は内燃機関システムで利用することを目的としている。この反応を行う際に使用する触媒として、白金、ロジウム、パラジウム、ルテニウム、イリジウム等の金属の微粒子を、シリカ、アルミナ等の酸化物に担持した触媒が使用されている。
【0003】
飽和炭化水素の脱水素反応は吸熱反応のため、温度が高いほど反応は進行する。しかし、脱水素反応を効率よく行うためには、できるだけ低温で反応させた方が、熱効率及び副反応の抑制の観点から好ましい。このように、反応効率を上げるためには、触媒の性能向上が最も有効である。
【特許文献1】特開2006−104000号公報
【発明の開示】
【発明が解決しようとする課題】
【0004】
しかしながら、従来の貴金属粒子を用いた触媒系では、もっとも脱水素化反応が起こりやすいシクロパラフィンであっても、十分な転化率を得るためには300[℃]以上の高温が必要である。つまり、炭化水素の脱水素化反応においては300[℃]以下の熱は利用できず、特に300[℃]以下の廃熱回収は不可能であり、エネルギー有効利用の観点からも改善が必要である。
【0005】
また、炭化水素としてエタノールを用い、脱水素反応によりエタノールの改質を行う場合には、従来の触媒系で80[%]以上の転化率を得るためには反応温度が350[℃]以上の高温であることを必要とする。このため、脱水反応により副生成物としてエチレンが発生しやすくなり、このエチレンの生成が原因によるポリマー炭素化が起こり、エタノールの燃料としての利用価値を下げる場合もある。
【課題を解決するための手段】
【0006】
本発明は、上記課題を解決するためになされたものであり、本発明に係る炭化水素の脱水素触媒は、炭化水素の脱水素反応に対して触媒作用を有する2〜4価の遷移金属からなる中心金属と、中心金属に対し配位された有機配位子と、で三次元の骨格構造を構成した多孔性の金属錯体を含み、有機配位子は、次の一般式(I)で表され、
n1(HOOC)−R−(COOH)n2 ・・・(I)
ここに、Rは有機化合物、n1及びn2は1〜3の整数であり、少なくとも2つのカルボキシレート基を有することを特徴とする。
【0007】
本発明に係る廃熱回収システムは、本発明に係る炭化水素の脱水素触媒を廃熱を回収する熱交換器に設け、廃熱を熱源として発生させた水素と脱水素化された炭化水素とを燃料として供給することにより、燃料の発熱量を向上させることを特徴とする。
【発明の効果】
【0008】
本発明によれば、炭化水素の脱水素化を効率よく行うことが可能となる。
【0009】
本発明によれば、300[℃]以下の廃熱を回収することが可能となる。
【発明を実施するための最良の形態】
【0010】
以下、本発明の実施の形態に係る炭化水素の脱水素触媒及び廃熱回収システムを説明する。
【0011】
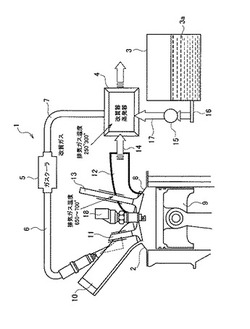
図1は、本発明の実施形態に係る廃熱回収システム1を模式的に示した図である。図2は、本発明の実施形態に係る炭化水素の脱水素触媒を模式的に示した図であり、テレフタル酸ルビジウム(II)−トリエチレンジアミン24の結晶構造21を示している。
【0012】
廃熱回収システム1は、エンジン2と、炭化水素からなる燃料3aを含む燃料タンク3と、燃料を改質・蒸発させる改質器・蒸発器4を含む。燃料タンク3と送液ポンプ15との間は、管路16によって接続され、送液ポンプ15と改質器・蒸発器4との間は、燃料供給管路17によって接続される。改質器・蒸発器4は、粉末状の炭化水素の脱水素触媒(以下、単に触媒と呼ぶ場合もある。)を備える。改質器・蒸発器4で改質・蒸発された燃料は、管路7を通ってガスクーラ5に送られ、ガスクーラ5で冷却された後、管路6を伝ってエンジン1のインテークバルブ11を通り、エンジン1のインテークマニホールド10に送られる。
【0013】
図1に示すように、エンジン1は、インテークマニホールド10と、シリンダー8と、クランクシャフト9と、インテークバルブ11と、点火プラグ18と、エキゾーストバルブ13と、エキゾーストマニホールド12と、管路14とから構成される。インテークマニホールド10に送られた燃料は、インテークバルブ11によってシリンダー8内に吸入される。シリンダー8内で圧縮された燃料は、点火プラグ18の作用により燃焼し、ここで発生した排気ガスはエキゾーストバルブ13によってエキゾーストマニホールド12に排出される。エキゾーストマニホールド12と改質器・蒸発器4との間は管路14で接続され、エキゾーストマニホールド12に排出されたガスは、改質器・蒸発器4に供給される。エキゾーストマニホールド12内における排気ガスの温度は650〜700[℃]であり、改質器・蒸発器4内における排気ガスの温度は250〜300[℃]である。
【0014】
図2に、本発明の実施形態に係る炭化水素の脱水素触媒の一例であるテレフタル酸ロジウム(II)−トリエチレンジアミンの結晶構造21を示す。ここでは、中心金属(ロジウム)22の間の結合には、有機配位子(テレフタル酸)23と架橋配位子(トリエチレンジアミン)24の二種類を配位子として用いている。つまり、本発明の実施形態に係る炭化水素の脱水素触媒は、炭化水素の脱水素反応に対して触媒作用を有する2〜4価の遷移金属からなる中心金属22と、中心金属22に対し配位された有機配位子と、で三次元の骨格構造を構成した多孔性の金属錯体を含み、有機配位子は、次の一般式(I)で表され、
n1(HOOC)−R−(COOH)n2 ・・・(I)
ここに、Rは有機化合物、n1及びn2は1〜3の整数であり、少なくとも2つのカルボキシレート基を有する。
【0015】
この結晶構造21は、2個のロジウムイオンを中心金属22とした二核錯体であり、中心金属22の周りに有機配位子としてテレフタル酸イオンが配位されて配位結合部23を形成する。テレフタル酸イオンは2つのカルボキシレート基を有し、このカルボキシレート基の2つの酸素原子を介して中心金属22であるロジウムイオンに配位することにより、2つのロジウムイオンを格子点とする環(空隙)が縮合した格子状の2次元構造(カルボン酸金属錯体)M1が形成される。この二次元格子構造M1を単位モチーフ、つまり、基本的繰り返しパターンとして積層し、各二次元格子構造M1を架橋配位子24であるトリエチレンジアミンで架橋することにより三次元的多孔性骨格構造が形成される。架橋配位子24であるトリエチレンジアミンは、2個の配位基で中心金属22であるロジウムイオンに配位する二座配位子である。この構造21では、中心金属22と配位結合部23によって画成された空隙GP1を有し、複数の二次元構造M1の各空隙列が一列に整列するため、一次元のチャネルを複数形成する。
【0016】
このような構造を有する多孔性架橋金属錯体の触媒21は、例えば、有機配位子の塩を第1の金属塩として調製し、中心金属22の塩を第2の金属塩として調製し、第1及び第2の金属塩を反応させることにより製造する。この反応において、中心金属22の塩に2座配位可能な架橋配位子24を加える。この反応では、ロジウムイオンとテレフタル酸イオンとから形成される二次元格子構造M1からなる単位モチーフが形成されると同時に、中心金属22に2座配位可能な架橋配位子24を加えることにより、架橋配位子24が二次元格子構造M1間を架橋して三次元的多孔性骨格構造を有する触媒21を形成する。この場合、同時に反応させることにより、より大きな表面積を得られる。また、有機配位子となる塩と中心金属となる塩を反応させて二次元構造M1を形成した後に、架橋配位子となる化合物を反応させて、三次元的多孔性骨格構造を得ても良い。
【0017】
この触媒21では、その骨格内に多くの分子(炭化水素及び水素)が吸着され、触媒作用を有する中心金属22に近づくことが可能となる。このため、炭化水素の脱水素化を効率よく行うことが可能となる。一般的に、より低温で、効率よく吸熱反応(脱水素反応)を行うためには、ゲスト分子を触媒作用を有する金属に効率よく近づける必要がある。それを達成するには、触媒の表面積の向上が有効であり、少なくとも500[m2/g]、望ましくは1000[m2/g]以上のBET表面積を有する細孔を持った触媒とする必要がある。このように、表面積が大きいほど、反応させるゲスト分子が触媒の細孔に吸着されて触媒に近づくことが可能となり、化学反応をより効率的に行うことができる。しかし、従来のシリカ、アルミナ、ゼオライト等の無機の多孔体に貴金属触媒を担持した材料では、触媒を担持した状態におけるBET表面積は概ね100[m2/g]以下であり、500[m2/g]を超えることは困難であった。これに対し、本発明の実施の形態に係る炭化水素の脱水素触媒では、三次元的多孔性骨格構造を有することにより、BET表面積が500[m2/g]以上、細孔容積が0.75[cm3/g]以上を達成することができる。このようにこの触媒は高表面積であるため、反応の対象となる多くのゲスト分子(ここでは炭化水素)をその骨格内に吸着し、触媒の活性点である中心金属22に接触させることが可能となる。そして、この中心金属22が触媒作用を発揮して、炭化水素からなる燃料の脱水素する。しかも、中心金属が全て表面にあり、活性点として有効に働く。このような現象は従来の原子が集まって形成された粒子で働くバルク触媒と全く異なる性能である。また、化学反応においてミクロ細孔はゲスト分子(ここでは炭化水素)にストレスを与える特別な空間である。そして、この細孔内で反応がおき易いことは、これまでの研究で判明しており、表面積が大きいほどゲスト分子はたくさん細孔内に取り込まれ、反応の確率が高くなる。このように、本発明の実施の形態に係る炭化水素の脱水素触媒は、従来の触媒と比較して低い温度で触媒作用を発揮し、炭化水素の脱水素を行うことが可能となる。
【0018】
また、脱水素反応は吸熱反応であるため、反応促進のためには熱の供給が必要となる。そして、低い温度で反応が進行するほど高効率である。従来のバルク触媒を用いた飽和炭化水素の脱水素化反応における反応温度では300[℃]以上の熱が必要であるが、本発明の実施の形態に係る炭化水素の脱水素触媒を用いることにより、限りなく平衡転化率に近づけることができるようになり、300[℃]以下での脱水素化反応を可能とする。もしくは、反応速度が向上する。また、反応温度が低いため、従来の触媒(バルク触媒)で問題となるシンタリング等による材料の劣化を予防でき、反応温度を低下させることにより、燃料である炭素化等の副反応も抑制することが可能となる。このように、本発明の実施の形態に係る炭化水素の脱水素触媒は、300[℃]以下での脱水素化反応を効率良く行うことができ、この炭化水素の脱水素触媒を用いた本発明の実施の形態に係る廃熱回収システムでは、燃料である炭化水素の脱水素触媒を廃熱を回収する熱交換器(改質器・蒸発器4)に設け、250〜300[℃]の温度を有する廃熱を熱源として、発生させた水素と脱水素化された炭化水素とを更に燃料として供給することにより、燃料の発熱量を向上させることが可能となる。このように、排気ガスの廃熱を利用して、炭化水素の脱水素を行うことにより、特に300[℃]以下の廃熱回収が可能となり、エネルギーの有効利用率が改善される。
【0019】
燃料としてエタノールを用いた場合には、エタノールの改質反応は吸熱反応であるため、反応促進のためには熱の供給が必要となる。この場合、低い温度で反応が進行するほど高効率である。従来のバルク触媒によって転化率80[%]以上の収率でエタノールを改質するためには、改質温度が300[℃]以上であることが必要であるが、本発明の実施の形態に係る触媒を用いることにより、300[℃]以下の反応温度であってもエタノール転化率80[%]以上の収率で所望の燃料を得ることが可能となる。図3に、予想されるエタノールの改質反応機構を示す。エタノール31の脱水素反応(a)により、アルデヒド32及び水素33が生成する。この反応は、吸熱反応であり、エタノールの改質反応における正反応である。アルデヒド32は、分解反応(b)により、メタン34及び一酸化炭素35に分解される。その一方、後述するエタノール31の分子内脱水反応(d)により得られた水40(36)を利用したSR反応(スチームリフォーム反応)(c)により、アルデヒド32と水36とが反応して二酸化炭素37と水素38が生成する。また、エタノール31の改質反応の副反応である分子内脱水反応(d)により、エチレン39と水40が生成する。エチレン39は、水素41の付加反応(e)によりエタン42となる。エタノール31の改質反応において、副反応である分子内脱水反応(d)が起こると、エチレン39は重合したり炭化することにより、燃料のポリマー炭素化が起こり、エタノールは燃料としての利用価値が下げる場合がある。これに対し、本発明の実施の形態に係る炭化水素の脱水素触媒を利用した場合には、300[℃]以下の反応温度でエタノール31の改質を行うため、副反応が抑えられ、正反応であるエタノール脱水素反応が進行する。このように、本発明の実施の形態に係る廃熱回収システムでは、燃料であるエタノール31の脱水素触媒を廃熱を回収する熱交換器(改質器・蒸発器4)に設け、250〜300[℃]の温度を有する廃熱を熱源として、発生させた水素33と脱水素化されたアルデヒド32とを更に燃料として供給することにより、燃料の発熱量を向上させることが可能となる。このように、排気ガスの廃熱を利用してエタノール31の脱水素を行うことにより、特に300[℃]以下の廃熱回収が可能となり、エネルギーの有効利用率が改善され、エタノールの脱水素化を効率よく行うことが可能となる。
【0020】
なお、本発明の実施の形態では、反応温度を低く抑えられることに加えて、炭化水素の脱水素触媒として均一な形状の細孔を有する多孔性金属錯体を使用したことにより、ゲスト分子である炭化水素に与えるストレス(立体配座)も均一になるため、副反応を抑制する効果も生まれる。特にエタノールの改質においては、副反応であるエタノールの脱水反応によるエチレン生成の抑制に効果がある。
【0021】
有機配位子は、次の一般式(II)
HOOC−R−COOH ・・・(II)
で表されるジカルボン酸誘導体を含むことが好ましい。大きな表面積、化学的に安定な触媒を得るために、ジカルボン酸以上であることが望ましい。モノカルボン酸では、触媒の表面積が300[m2/g]程度であることが分っている。これに対し、ジカルボン酸、トリカルボン酸では安定、つまり、耐熱性良好であり、1000〜4000[m2/g]程度の高表面積が得られる。
【0022】
Rは、アルキレン基、アルキニレン基、アルケニレン基、アリーレン基及びシクロアルキレン基から選択される炭化水素基を含むことが好ましい。触媒の高表面積と、化合物の安定性、つまり、耐熱性を確保するためである。
【0023】
Rはアリーレン基を含むことが好ましく、中でもアリーレン基は置換基を有することが好ましい。この場合には、触媒は、安定性、つまり、耐熱性に優れている。また、原料も安く、コスト的にも有利であると考えられる。
【0024】
Rは、次の一般式(III)〜(XII)
【化1】

【0025】
のいずれか一つで表される配位子を含むことが好ましい。触媒の骨格構造は、中心金属に2座配位可能な架橋配位子を含むことが好ましい。架橋配位子を含むことにより、更に耐熱性が増し、表面積も大きくなると考えられるためである。化合物により異なるが、架橋配位子を有することにより、例えば、表面積が1000[m2/g]であったものが1500[m2/g]、2000[m2/g]であったものが2500[m2/g]に拡大すると考えられる。これは、2次元錯体が3次元錯体になるためであると考えられる。
【0026】
架橋配位子は、トリエチレンジアミン、ピラジン、及びこれらの誘導体であることが好ましい。これまでの知見では、これら3種類で安定な化合物が得られているためである。
【0027】
中心金属は、2価の遷移金属を含むことが好ましい。触媒を構成する中心金属は、2〜4価の遷移金属であれば三次元の骨格構造を有する触媒(錯体)を形成するが、特に2価の金属を用いると、化学的に安定な錯体を形成する。
【0028】
中心金属は、Cu、Zn、Co、Mo、Ru、Cr、Ni、Rh、Pd、W、Re及びIrを含む金属群から選択される金属を含むことが好ましい。これらの金属は、水素に対すてアフィニティーを有するため、脱水素触媒の中心金属としてこれらの金属を用いた場合には、炭化水素の脱水素触媒としての機能を発揮する。中でも、中心金属は、Co、Ru、Ni、Rh、Pd、W、Re及びIrを含む金属群から選択される金属を含むことがより好ましい。これらの金属は、特に水素に対してアフィニティーが高いため、これらの金属を中心金属として使用した場合には、特に触媒機能が強く発現し、より低温で転化率の高い反応が可能となる。
【0029】
骨格構造は、中心金属と有機配位子のカルボキシレート基の酸素との結合によって形成された二次元格子構造の集積によって構成された三次元の骨格構造であり、BET表面積が500[m2/g]以上、細孔容積が0.75[cm3/g]以上であることが好ましい。この場合には、触媒機能が強く発現する。特に、BET表面積は1000[m2/g]以上、細孔容積が1.0[cm3/g]以上であることが好ましく、この場合には、更に触媒機能が強く発現する。なお、本発明の実施の形態に係る炭化水素の脱水素触媒は、有機配位子を選択する、つまり、Rを適宜選択することにより、表面積を変えることが可能であり、BET表面積は1000[m2/g]以上、細孔容積が1.0[cm3/g]以上である触媒を得ることが可能となる。
【0030】
脱水素化反応のゲスト分子となる炭化水素は、ベンゼン、トルエン、キシレン、メシチレン、ナフタレン、メチルナフタレン、アントラセン、ビフェニル及びフェナンスレンを含む炭化水素群から選択される炭化水素の、置換又は非置換の水素化物から選ばれる炭化水素を含むことが好ましい。また、脱水素化反応のゲスト分子となる炭化水素は、アルコールを含んでいても良く、炭化水素は、不飽和炭化水素を含んでいても良い。
【0031】
上記したように、本発明の実施の形態に係る炭化水素の脱水素触媒の最も有効な用途としては、内燃機関の廃熱回収が挙げられる。この場合、内燃機関に用いられる燃料に飽和炭化水素(脱水素化が可能な炭化水素)が含まれていることが条件となるが、吸熱反応である脱水素化反応を内燃機関等で発生する廃熱を熱源として用い、脱水素化反応で得られた水素と脱水素化された炭化水素を燃料として供給することにより、供給する燃料の発熱量を向上させることが可能となる。
【0032】
また、従来のバルク触媒では300[℃]以下における効率的な脱水素化反応は不可能であったが、表面積が500[m2/g]以上を示す多孔性金属錯体を触媒として用いた場合には、300[℃]以下の低温においても、炭化水素の脱水素化反応の転化率も大きく改善され、結果として内燃機関の燃費を向上させることが可能となる。
【実施例】
【0033】
以下、実施例及び比較例により本発明の実施の形態について更に具体的に説明するが、本発明の範囲はこれらに限定されるものではない。
【0034】
実施例1 {Rh(OOC−C6H4−COO)2−C6H12N2}nの合成
ジカルボン酸としてテレフタル酸を、架橋配位子としてトリエチレンジアミンを、中心金属の原料となる金属塩として酢酸ロジウム二水和物を用いた。テレフタル酸 2.10[g]、トリエチレンジアミン0.56[g]、酢酸ロジウム二水和物2.39[g]を酢酸エチルを入れた容器に加え、オートクレーブ中100[℃]で混合・攪拌し、その後室温にて48[時間]放置した。析出した固体を吸引濾過により回収し、メタノールで洗浄した。その後、150[℃]で2[時間]真空乾燥を行い、目的物である{{Rh(OOC−C6H4−COO)2−C6H12N2}nを得た。BET法によって測定して得られた化合物の比表面積は1260[m2/g]、細孔容積は1.12[cm3/g]であった。
【0035】
実施例2 {Rh(OOC−C6H8−COO)2−C6H12N2}nの合成
ジカルボン酸として1,4−トランスシクロヘキサンジカルボン酸を、架橋配位子としてトリエチレンジアミンを、中心金属の原料となる金属塩として酢酸ロジウム二水和物を用いた。シクロヘキサンジカルボン酸2.20[g]、トリエチレンジアミン0.56[g]、酢酸ロジウム二水和物2.39[g]を酢酸エチルを入れた容器に加え、オートクレーブ中100[℃]で混合・攪拌し、その後室温にて48[時間]放置した。析出した固体を吸引濾過により回収し、メタノールで洗浄した。その後、80[℃]で2[時間]真空乾燥を行い、目的物である{Rh(OOC−C6H8−COO)2−C6H12N2}nを得た。BET法によって測定して得られた化合物の比表面積は840[m2/g]、細孔容積は1.12[cm3/g]であった。
【0036】
実施例3 {Ru(OOC−C6H4−COO)2−C6H12N2}nの合成
ジカルボン酸としてテレフタル酸を、架橋配位子としてトリエチレンジアミンを、中心金属の原料となる金属塩として酢酸ルテニウム二水和物を用いた。テレフタル酸2.10[g]、トリエチレンジアミン0.56[g]、酢酸ルテニウム2.05[g]を酢酸エチルを入れた容器に加え、オートクレーブ中100[℃]で混合・攪拌し、その後室温にて48[時間]放置した。析出した固体を吸引濾過により回収し、メタノールで洗浄した。その後、150[℃]で2[時間]真空乾燥を行い、目的物である{Ru(OOC−C6H4−COO)2−C6H12N2}nを得た。BET法によって測定して得られた化合物の比表面積は1080[m2/g]、細孔容積は1.02[cm3/g]であった。
【0037】
比較例1
特公平6−72005号公報に記載の実施例1を参考に、γ−アルミナ担体を製造した。熱希硫酸中に激しく撹拌しながら瞬時にアルミン酸ソーダ水溶液を加えることにより水酸化アルミニウムスラリーの懸濁液(pH=10)を得た。これを種子水酸化アルミニウムとして、撹拌を続けながら熱希硫酸とアルミン酸ソーダ水溶液を交互に一定時間おいて加える操作を繰り返し、ろ過洗浄ケーキを得た。これを押し出し成形して乾燥した後、500[℃]で3[時間]焼成した。得られたγ−アルミナ担体のBET法によって測定して得られた化合物の比表面積は240[m2/g]、細孔容積は0.71[cm3/g]であった。
【0038】
上記のように調製したγ−アルミナ担体20[g]に、pH値が2.0になるように調製した0.4[wt%]−塩化白金酸水溶液79[g]を添加し、3[時間]放置して含浸させた後、デカンテーションにより水を除去した。次いで、120[℃]で3[時間]乾燥させてからマッフル炉により空気流通下に400[℃]で3[時間]焼成した。得られた焼成物をデシケーター中で常温まで冷却した後、これに0.52[wt%]−硝酸カリウム水溶液を10[g]を添加し、3[時間]放置して含浸せしめ、次いでエバポレーターにより水分を除去した。その後、120[℃]で3[時間]乾燥させ、水素流通下に400[時間]で15[時間]還元し、脱水素触媒を調製した。
【0039】
BET表面積は次のようにして測定した。
【0040】
<窒素吸着BET一点法>
装置は堀場製作所製 連続流動式表面積計 SA−9601を用いた。前処理として測定容器への試料充填を、N2雰囲気グローブボックス内で行った。その後、120[℃]、30[分]の条件で乾燥した後、測定を開始した。
【0041】
実施例1〜実施例3及び比較例1については、次に示す反応試験1を行った。
【0042】
<反応試験1>
上記で得られた実施例1〜実施例3及び比較例1の脱水素触媒の転化率を図4に示す装置51を用いて測定した。装置51は、熱電対用保護管を備えたステンレス製反応管52と、ステンレス製反応管52の温度を制御する環状のヒータ53a〜53fとを備える。ステンレス製反応管52は、上部52aと、中部52bと、下部53cとからなる。ステンレス製反応管52の中部52bには、触媒層54が設けられている。ステンレス製反応管52には、蒸発器535によって気化された反応ガスが管路56を通って供給される。ステンレス製反応管52には、ガス温度を測るための温度計57が挿入されている。温度計57の先端は、触媒層54の上部から200[mm]以下となるように設置されている。また、ステンレス製反応管52には触媒の温度を測るための温度計58が挿入されている。温度計58の先端は、触媒層54の上部から20[mm]程度となるように設置されている。触媒層54の下部には、触媒の出口の温度を測るための温度計59が設置されている。また、触媒層54の下部には、気液分離器60を設け、脱水素反応により生成したトルエン等の液状生成物と水素ガス等の気体とを分離し、それぞれが管路61を通って回収され、液状生成物と気体とを各々ガスクロマトグラフィで分析した。
【0043】
なお、ステンレス製反応管52は内径17[mmφ]サイズであり、反応管断面の中心には、外形1/8インチの熱電対用保護管を備えた。テンレス製反応管52の長さ方向の中心に触媒層54の中心が位置するように触媒5[cm3]を充填し、触媒層54の上側に予熱層として1[mmφ]の球状α−アルミナビーズ10[cm3]を充填した。水素流通(LHSV=5;50[cm3/hr]下において、触媒層54の中心温度が所定の温度になるまで徐々に昇温した。次いで、メチルシクロヘキサン(MCH)を高速液体クロマトグラフィ(HPLC)用送液ポンプ(HPLCポンプ)によってLHSV=4.0(40[cm3/hr])に相当する量をステンレス製反応管52に供給した。評価は150〜300[℃]の範囲で実施し、反応は触媒層54の中心温度が所定の温度になるようにヒータ53a〜53fの出力を調整して反応試験を行った。なお、ここでLHVとは、Lower Heating Value(低位発熱量)の略である。
【0044】
図5に、MCHの理論上の平衡転化率、及び実施例1、比較例1の反応開始30[分]後における各温度における転化率のプロットを示す。また、表1には280[℃]におけるMCH転化率、トルエン選択率、トルエン収率、水素発生量及びエネルギー回収率を解析の一例として示す。
【表1】

【0045】
図5の特定曲線5Aに示すように、反応温度280[℃]におけるMCHの理論上の平衡転化率は約68[%]である。実施例1では、特定曲線5Bに示すように、転化率は若干低くなった。比較例1では、特定曲線4Cに示すように、転化率は低くなった。反応試験1の条件下において、実施例1〜実施例3はいずれも50[%]以上の転化率で反応が進行したが、比較例1では2.1[%]であり、転化率は大きく異なった。
【0046】
また、本反応におけるエネルギー回収率は以下の式から得られた転化率を基に計算した。
【0047】
C7H14(g)→C7H8(g)+3H2(g) ΔH=205[kj/mol]
C7H14(g)+10.5O2(g)→7CO2(g)+7H2O ΔH=−4292[kj/mol]
C7H8+3H2(g)→7CO2(g)+7H2O ΔH=−4497[kj/mol]
280[℃]における、実施例1〜実施例3では、エネルギー回収率は2.5[%]を超えたが、比較例1では0.1[%]程度であり、ほとんどエネルギー回収はできていないことが分かった。
【0048】
<反応試験2>
反応試験2では、反応試験1の条件において、メチルシクロヘキサン(MCH)をLHSV=8.0(80[cm3/hr])に相当する量をステンレス製反応管52に供給し、その他の条件は、反応試験1と同一条件とした。評価に用いた試料は実施例1と比較例1で調整した触媒とし、それぞれ実施例4及び比較例2とした。評価は100〜300[℃]の範囲で実施した。
【0049】
図6に、MCHの理論上の平衡転化率、及び実施例1、比較例1の反応開始30[分]後における各温度における転化率のプロットを示す。また、表2には280[℃]におけるMCH転化率、トルエン選択率、トルエン収率、水素発生量及びエネルギー回収率を解析の一例として示す。
【表2】

【0050】
図6の特定曲線6Aに示すように、反応温度280[℃]におけるMCHの理論上の平衡転化率は約70[%]である。実施例4では、特定曲線6Bに示すように、転化率は若干低くなった。比較例2では、特定曲線6Cに示すように、転化率は低くなった。280[℃]における解析結果の例を表2に示す。280[℃]における、実施例4のエネルギー回収率は1.7[%]、比較例2はほぼ0[%]であり、ゲスト分子の供給速度を上げると転化率は減少したが、水素発生率では反応試験1より大きな差となって現れ、脱水素反応が促進されていることが分かった。
【0051】
<反応試験3>
反応試験3では、反応試験1の条件において、メチルシクロヘキサン(MCH)の変わりにシクロヘキサン(CH)をLHSV=4.0(40[cm3/hr])に相当する量をステンレス製反応管52に供給し、その他の条件は、反応試験1と同一条件とした。評価に用いた試料は実施例1と比較例1で調整した触媒とし、それぞれ実施例5及び比較例3とした。評価は100〜300[℃]の範囲で実施した。
【0052】
図7にMCHの理論上の平衡転化率、および実施例5及び比較例3の反応開始30分後における各温度における転化率のプロットを示す。また、表3には260[℃]における、MCH転化率、トルエン選択率、トルエン収率、水素発生量及びエネルギー回収率を解析の一例として示す。
【表3】

【0053】
反応温度260[℃]におけるCHの理論上の平衡転化率は、図7の特定曲線7Aに示すように、約87[%]である。実施例6では、特定曲線7Bに示すように、転化率は若干低くなった。比較例3では、特定曲線7Cに示すように、転化率は低くなった。反応試験3の条件下において、実施例5は76[%]の転化率で反応が進行したが、比較例3では6.2[%]であり、転化率に大きな差となって現れた。
【0054】
また、本反応におけるエネルギー回収率は以下の式から得られた転化率を基に計算した。
C6H12(g)→C6H6(g)+3H2(g) ΔH=242[kj/mol]
C6H12(g)+9O2(g)→6CO2(g)+6H2O ΔH=−3653[kj/mol]
C6H6+3H2(g)+9O2(g)→6CO2(g)+6H2O ΔH=−3895[kj/mol]
260[℃]における、実施例5のエネルギー回収率は5.1[%]、比較例3は0.3[%]であり、実施例5の触媒を用いることにより、脱水素反応が促進され、エネルギー回収率も向上することが分かった。
【0055】
<反応試験4>
反応試験4では、反応試験1の条件において、メチルシクロヘキサン(MCH)の代わりにデカリン(DL)をLHSV=4.0(40[cm3/hr])に相当する量を反応器に供給し、その他の条件は、反応試験1と同一条件とした。評価に用いた試料は実施例1と比較例1で調整した触媒とし、それぞれ実施例6、比較例4とした。評価は100〜300[℃]の範囲で実施した。
【0056】
図8に反応開始30[分]後におけるDL転化率、ナフタレン選択率、ナフタレン収率、水素発生量([cm3/cm3/h/cc−cat])及びエネルギー回収率を求めた。また、240[℃]における解析結果の一例を表4に示す。
【表4】

【0057】
反応温度240[℃]におけるデカリンの理論上の平衡転化率は図8に示す特定曲線8Aより約90[%]ある。実施例6では、特定曲線8Bに示すように、転化率は若干低くなった。比較例4では、特定曲線8Cに示すように、転化率は低くなった。反応試験4の条件下において、実施例6は82[%]の転化率で反応が進行したが、比較例4では8.6[%]であり、転化率に大きな差となって現れた。
【0058】
また、本反応におけるエネルギー回収率は以下の式から得られた転化率を基に計算した。
C10H18(g)→C10H8(g)+5H2(g) ΔH=397[kj/mol]
C10H18(g)+14.5O2(g)→10CO2(g)+9H2O
ΔH=−5865[kj/mol]
C10H8(g)+5H2(g)+14.5O2(g)→10CO2(g)+9H2O
ΔH=−6262[kj/mol]
240[℃]における、実施例6のエネルギー回収率は5.7[%]、比較例4は0.4[%]であり、実施例6の触媒を用いることにより、脱水素反応が促進され、エネルギー回収率も向上することが分かった。
【0059】
実施例1〜実施例6において、各実施例におけるエネルギー回収率は、1.7〜6.6[%]であるが、発生する水素は内燃機関の希薄燃焼を可能にする。ガソリンのみを内燃機関に供給した場合とガソリン中に水素を3[%]ほど添加して供給した場合では、空燃比(A/F)の上限が23.9から31.7に上昇するという報告がある(科学技術振興機構 新技術コンセプト・モデル化推進事業課題 希薄燃焼ガソリンエンジンのNOx、HCの低減及びディーゼルエンジンのすす低減システム報告書)。これによると、リーン領域では添加した水素エネルギーよりも減少した燃料エネルギーの方が大きく、エネルギー的に有利になるとされている。また、水素の供給によりNOX、COの低減効果も期待できる。本発明の実施の形態に係る炭化水素の脱水素触媒を用いた廃熱回収システムでは、上記効果が期待できる。
【0060】
<反応試験5>
反応試験5では、反応試験1の条件と同一とした。反応試験5では、反応試験1の条件において評価に用いた試料は実施例1〜実施例3及び比較例1で調整した触媒とし、それぞれ実施例7〜実施例9及び比較例5とした。これらの試料は図4に示す装置51を用いて測定した。そして、エタノールを高速液体クロマトグラフィ(HPLC)用送液ポンプ(HPLCポンプ)によってLHSV=4.0(40[cm3/hr])に相当する量をステンレス製反応管52に供給した。評価は150〜300[℃]の範囲で実施し、反応は触媒層54の中心温度が所定の温度になるようにヒータ53a〜53fの出力を調整して反応試験を行った。
【0061】
分析の結果、H2、CH3、CO、C2H4、C2H6が主成分として観測され、エタノールの改質反応が図3のメカニズムで進行していることが示唆された。
【0062】
次に、図9に、エタノールの理論上の平衡転化率、及び実施例7、比較例5の反応開始30[分]後における各温度における転化率のプロットを示す。また、表5には250[℃]におけるエタノール転化率、発生したガスの組成、改質ガス発生量及びエネルギー回収率を解析の一例として示す。
【表5】

【0063】
実施例7では、特定曲線9Aに示すように、エタノール転化率は約90.0[%]である。比較例5では、特定曲線9Bに示すように、転化率は低くなり、触媒の低温活性が向上していることが分かった。反応試験5の条件下において、実施例7〜実施例9はいずれも80[%]以上の転化率で反応が進行したが、比較例5では13.5[%]であり、転化率は大きく異なった。
【0064】
また、本反応におけるエネルギー回収率は以下の式から得られたガスの濃度から換算して算出した。
エネルギー回収率(%)=
(生成系(H2+CO+CH4+・・・・・)LHV−原系LHV)/原系(C2H5OH)LHV
なお、ここでLHVとは、Lower Heating Value(低位発熱量)の略である。
C2H5OH(g)+3O2(g)→2CO2(g)+3H2O(g)
ΔH=−1275[kj/mol]
H2(g)+0.5O2(g)→H2O(g) ΔH=−244[kj/mol]
C2H4+3O2(g)→2CO2(g)+2H2O(g)
ΔH=−1321[kj/mol]
CH4(g)+ 3O2(g)→CO2(g)+2H2O(g)
ΔH=−801[kj/mol]
CO(g)+0.5O2(g)→CO2(g) ΔH=−284[kj/mol]
C2H6O(g)+3O2(g)→2CO2(g)+3H2O(g)
ΔH=−1425[kj/mol]
エネルギー回収率を計算した結果、比較例5では僅か0.3[%]の回収率であったが、実施例では2.4〜2.7[%]に向上していることが分かった。
【0065】
<反応試験6>
反応試験6では、反応試験5の条件において、エタノールをLHSV=8.0(80[cm3/hr])に相当する量をステンレス製反応管52に供給し、その他の条件は、反応試験5と同一条件とした。評価に用いた試料は実施例1〜実施例3及び比較例1で調整した触媒とし、それぞれ実施例10〜実施例12及び比較例6とした。評価は100〜300[℃]の範囲で実施した。
【0066】
図10に、実施例10及び比較例6の反応開始30[分]後における各温度の転化率のプロットを示す。また、表6には250[℃]におけるエタノール転化率、発生したガスの組成、改質ガス発生量及びエネルギー回収率を解析の一例として示す。
【表6】

【0067】
図10の特定曲線10Aに示すように、実施例4では、エタノール転化率は54.0[%]だった。比較例6では、特定曲線10Bに示すように、エタノール転化率は4.0[%]と低くなった。エタノールの供給速度を上げることにより、反応試験5と比較してエタノール転化率は低下したが、反応試験6の条件下において、実施例10〜実施例12はいずれも50[%]以上の転化率で反応が進行したが、比較例6では4.0[%]であり、転化率は大きく異なった。エネルギー回収率は、実施例10〜実施例12では、1.5〜1.6[%]の転化率を示した。一方、比較例2では、0.0[%]であり、エネルギーの回収はほとんどできていないことが分かった。
【0068】
<反応試験7>
反応試験7では、他の炭化水素化合物とエタノールとを混合させた場合を想定して、反応試験5の条件において、シクロヘキサン(CH)とエタノールのモル比1:1の混合液をLHSV=4.0(40[cm3/hr])に相当する量をステンレス製反応管52に供給し、その他の条件は、反応試験5と同一条件とした。評価に用いた試料は実施例1〜実施例3及び比較例1で調整した触媒とし、それぞれ実施例13〜実施例15及び比較例7とした。評価は100〜300[℃]の範囲で実施した。
【0069】
図11に、実施例13及び比較例7の反応開始30[分]後における各温度の転化率のプロットを示す。また、表7には250[℃]におけるエタノール転化率、発生したガスの組成、改質ガス発生量及びエネルギー回収率を解析の一例として示す。
【表7】

250[℃]における、比較例7のエタノール転化率、シクロヘキサン転化率は、それぞれ12.8[%]、2.3[%]であったが、実施例13〜実施例15では、エタノール転化率は80[%]以上、シクロヘキサン転化率も約50[%]となり、触媒の低温活性が向上していることが分かった。また、本反応におけるエネルギー回収率は以下の式から得られた転化率を基に計算した。
C6H12(g)+9O2(g)→6CO2(g)+6H2O(g)
ΔH= −3656[kj/mol]
C6H6(g)+7.5O2(g)→6CO2(g)+3H2O(g)
ΔH=−3167[kj/mol]
エネルギー回収率を計算した結果、比較例7では僅か0.2[%]の回収率であったが、各実施例では2.7〜3.1[%]に向上していることが分かった。
【0070】
実施例7〜実施例13におけるエネルギー回収率は5[%]以下であるが、発生する水素及び一酸化炭素は内燃機関の希薄燃焼を可能にする。上記したように、ガソリンのみを内燃機関に供給した場合とガソリン中に水素を3[%]ほど添加して供給した場合では、空燃比(A/F)の上限が23.9から31.7に上昇する。これによると、リーン領域では添加した水素エネルギーよりも減少した燃料エネルギーの方が大きく、エネルギー的に有利になるとされている。また、水素の供給によりNOX、COの低減効果も期待できる。本発明の実施の形態に係る炭化水素の脱水素触媒を用いた廃熱回収システムでは、上記効果が期待できる。
【0071】
以上、本実施の形態について説明したが、上記実施の形態の開示の一部をなす論述及び図面はこの発明を限定するものであると理解するべきではない。この開示から当業者には様々な代替実施の形態、実施例及び運用技術が明らかとなろう。
【図面の簡単な説明】
【0072】
【図1】本発明の実施形態に係る廃熱回収システムを模式的に示した図である。
【図2】本発明の実施形態に係る炭化水素の脱水素触媒を模式的に示した図である。
【図3】予想されるエタノール改質の反応機構を表す図である。
【図4】各反応試験に用いる装置の模式図である。
【図5】MCHの理論上の平衡転化率、実施例1及び比較例1の各温度における転化率を示す図である。
【図6】MCHの理論上の平衡転化率、実施例4及び比較例2の各温度における転化率を示す図である。
【図7】CHの理論上の平衡転化率、実施例5及び比較例3の各温度における転化率を示す図である。
【図8】デカリンの理論上の平衡転化率、実施例6及び比較例4の各温度における転化率を示す図である。
【図9】実施例7及び比較例5の各温度におけるエタノール転化率を示す図である。
【図10】実施例10及び比較例6の各温度におけるエタノール転化率を示す図である。
【図11】実施例13及び比較例7の各温度におけるエタノール転化率を示す図である。
【符号の説明】
【0073】
1 廃熱回収システム
2 エンジン
3 燃料タンク
4 改質器・蒸発器
5 ガスクーラ
6、7 管路
8 シリンダー
9 クランクシャフト
10 インテークマニホールド
11 インテークバルブ
12 エキゾーストマニホールド
13 エキゾーストバルブ
14 管路
15 送液ポンプ
16 管路
【技術分野】
【0001】
この発明は、炭化水素の脱水素触媒及び炭化水素の脱水素触媒を用いた廃熱回収システムに関する。
【背景技術】
【0002】
飽和炭化水素から脱水素反応を行い水素を発生させるシステムが提案されている(特許文献1参照)。これらの技術では、発生した水素を燃料電池システム又は内燃機関システムで利用することを目的としている。この反応を行う際に使用する触媒として、白金、ロジウム、パラジウム、ルテニウム、イリジウム等の金属の微粒子を、シリカ、アルミナ等の酸化物に担持した触媒が使用されている。
【0003】
飽和炭化水素の脱水素反応は吸熱反応のため、温度が高いほど反応は進行する。しかし、脱水素反応を効率よく行うためには、できるだけ低温で反応させた方が、熱効率及び副反応の抑制の観点から好ましい。このように、反応効率を上げるためには、触媒の性能向上が最も有効である。
【特許文献1】特開2006−104000号公報
【発明の開示】
【発明が解決しようとする課題】
【0004】
しかしながら、従来の貴金属粒子を用いた触媒系では、もっとも脱水素化反応が起こりやすいシクロパラフィンであっても、十分な転化率を得るためには300[℃]以上の高温が必要である。つまり、炭化水素の脱水素化反応においては300[℃]以下の熱は利用できず、特に300[℃]以下の廃熱回収は不可能であり、エネルギー有効利用の観点からも改善が必要である。
【0005】
また、炭化水素としてエタノールを用い、脱水素反応によりエタノールの改質を行う場合には、従来の触媒系で80[%]以上の転化率を得るためには反応温度が350[℃]以上の高温であることを必要とする。このため、脱水反応により副生成物としてエチレンが発生しやすくなり、このエチレンの生成が原因によるポリマー炭素化が起こり、エタノールの燃料としての利用価値を下げる場合もある。
【課題を解決するための手段】
【0006】
本発明は、上記課題を解決するためになされたものであり、本発明に係る炭化水素の脱水素触媒は、炭化水素の脱水素反応に対して触媒作用を有する2〜4価の遷移金属からなる中心金属と、中心金属に対し配位された有機配位子と、で三次元の骨格構造を構成した多孔性の金属錯体を含み、有機配位子は、次の一般式(I)で表され、
n1(HOOC)−R−(COOH)n2 ・・・(I)
ここに、Rは有機化合物、n1及びn2は1〜3の整数であり、少なくとも2つのカルボキシレート基を有することを特徴とする。
【0007】
本発明に係る廃熱回収システムは、本発明に係る炭化水素の脱水素触媒を廃熱を回収する熱交換器に設け、廃熱を熱源として発生させた水素と脱水素化された炭化水素とを燃料として供給することにより、燃料の発熱量を向上させることを特徴とする。
【発明の効果】
【0008】
本発明によれば、炭化水素の脱水素化を効率よく行うことが可能となる。
【0009】
本発明によれば、300[℃]以下の廃熱を回収することが可能となる。
【発明を実施するための最良の形態】
【0010】
以下、本発明の実施の形態に係る炭化水素の脱水素触媒及び廃熱回収システムを説明する。
【0011】
図1は、本発明の実施形態に係る廃熱回収システム1を模式的に示した図である。図2は、本発明の実施形態に係る炭化水素の脱水素触媒を模式的に示した図であり、テレフタル酸ルビジウム(II)−トリエチレンジアミン24の結晶構造21を示している。
【0012】
廃熱回収システム1は、エンジン2と、炭化水素からなる燃料3aを含む燃料タンク3と、燃料を改質・蒸発させる改質器・蒸発器4を含む。燃料タンク3と送液ポンプ15との間は、管路16によって接続され、送液ポンプ15と改質器・蒸発器4との間は、燃料供給管路17によって接続される。改質器・蒸発器4は、粉末状の炭化水素の脱水素触媒(以下、単に触媒と呼ぶ場合もある。)を備える。改質器・蒸発器4で改質・蒸発された燃料は、管路7を通ってガスクーラ5に送られ、ガスクーラ5で冷却された後、管路6を伝ってエンジン1のインテークバルブ11を通り、エンジン1のインテークマニホールド10に送られる。
【0013】
図1に示すように、エンジン1は、インテークマニホールド10と、シリンダー8と、クランクシャフト9と、インテークバルブ11と、点火プラグ18と、エキゾーストバルブ13と、エキゾーストマニホールド12と、管路14とから構成される。インテークマニホールド10に送られた燃料は、インテークバルブ11によってシリンダー8内に吸入される。シリンダー8内で圧縮された燃料は、点火プラグ18の作用により燃焼し、ここで発生した排気ガスはエキゾーストバルブ13によってエキゾーストマニホールド12に排出される。エキゾーストマニホールド12と改質器・蒸発器4との間は管路14で接続され、エキゾーストマニホールド12に排出されたガスは、改質器・蒸発器4に供給される。エキゾーストマニホールド12内における排気ガスの温度は650〜700[℃]であり、改質器・蒸発器4内における排気ガスの温度は250〜300[℃]である。
【0014】
図2に、本発明の実施形態に係る炭化水素の脱水素触媒の一例であるテレフタル酸ロジウム(II)−トリエチレンジアミンの結晶構造21を示す。ここでは、中心金属(ロジウム)22の間の結合には、有機配位子(テレフタル酸)23と架橋配位子(トリエチレンジアミン)24の二種類を配位子として用いている。つまり、本発明の実施形態に係る炭化水素の脱水素触媒は、炭化水素の脱水素反応に対して触媒作用を有する2〜4価の遷移金属からなる中心金属22と、中心金属22に対し配位された有機配位子と、で三次元の骨格構造を構成した多孔性の金属錯体を含み、有機配位子は、次の一般式(I)で表され、
n1(HOOC)−R−(COOH)n2 ・・・(I)
ここに、Rは有機化合物、n1及びn2は1〜3の整数であり、少なくとも2つのカルボキシレート基を有する。
【0015】
この結晶構造21は、2個のロジウムイオンを中心金属22とした二核錯体であり、中心金属22の周りに有機配位子としてテレフタル酸イオンが配位されて配位結合部23を形成する。テレフタル酸イオンは2つのカルボキシレート基を有し、このカルボキシレート基の2つの酸素原子を介して中心金属22であるロジウムイオンに配位することにより、2つのロジウムイオンを格子点とする環(空隙)が縮合した格子状の2次元構造(カルボン酸金属錯体)M1が形成される。この二次元格子構造M1を単位モチーフ、つまり、基本的繰り返しパターンとして積層し、各二次元格子構造M1を架橋配位子24であるトリエチレンジアミンで架橋することにより三次元的多孔性骨格構造が形成される。架橋配位子24であるトリエチレンジアミンは、2個の配位基で中心金属22であるロジウムイオンに配位する二座配位子である。この構造21では、中心金属22と配位結合部23によって画成された空隙GP1を有し、複数の二次元構造M1の各空隙列が一列に整列するため、一次元のチャネルを複数形成する。
【0016】
このような構造を有する多孔性架橋金属錯体の触媒21は、例えば、有機配位子の塩を第1の金属塩として調製し、中心金属22の塩を第2の金属塩として調製し、第1及び第2の金属塩を反応させることにより製造する。この反応において、中心金属22の塩に2座配位可能な架橋配位子24を加える。この反応では、ロジウムイオンとテレフタル酸イオンとから形成される二次元格子構造M1からなる単位モチーフが形成されると同時に、中心金属22に2座配位可能な架橋配位子24を加えることにより、架橋配位子24が二次元格子構造M1間を架橋して三次元的多孔性骨格構造を有する触媒21を形成する。この場合、同時に反応させることにより、より大きな表面積を得られる。また、有機配位子となる塩と中心金属となる塩を反応させて二次元構造M1を形成した後に、架橋配位子となる化合物を反応させて、三次元的多孔性骨格構造を得ても良い。
【0017】
この触媒21では、その骨格内に多くの分子(炭化水素及び水素)が吸着され、触媒作用を有する中心金属22に近づくことが可能となる。このため、炭化水素の脱水素化を効率よく行うことが可能となる。一般的に、より低温で、効率よく吸熱反応(脱水素反応)を行うためには、ゲスト分子を触媒作用を有する金属に効率よく近づける必要がある。それを達成するには、触媒の表面積の向上が有効であり、少なくとも500[m2/g]、望ましくは1000[m2/g]以上のBET表面積を有する細孔を持った触媒とする必要がある。このように、表面積が大きいほど、反応させるゲスト分子が触媒の細孔に吸着されて触媒に近づくことが可能となり、化学反応をより効率的に行うことができる。しかし、従来のシリカ、アルミナ、ゼオライト等の無機の多孔体に貴金属触媒を担持した材料では、触媒を担持した状態におけるBET表面積は概ね100[m2/g]以下であり、500[m2/g]を超えることは困難であった。これに対し、本発明の実施の形態に係る炭化水素の脱水素触媒では、三次元的多孔性骨格構造を有することにより、BET表面積が500[m2/g]以上、細孔容積が0.75[cm3/g]以上を達成することができる。このようにこの触媒は高表面積であるため、反応の対象となる多くのゲスト分子(ここでは炭化水素)をその骨格内に吸着し、触媒の活性点である中心金属22に接触させることが可能となる。そして、この中心金属22が触媒作用を発揮して、炭化水素からなる燃料の脱水素する。しかも、中心金属が全て表面にあり、活性点として有効に働く。このような現象は従来の原子が集まって形成された粒子で働くバルク触媒と全く異なる性能である。また、化学反応においてミクロ細孔はゲスト分子(ここでは炭化水素)にストレスを与える特別な空間である。そして、この細孔内で反応がおき易いことは、これまでの研究で判明しており、表面積が大きいほどゲスト分子はたくさん細孔内に取り込まれ、反応の確率が高くなる。このように、本発明の実施の形態に係る炭化水素の脱水素触媒は、従来の触媒と比較して低い温度で触媒作用を発揮し、炭化水素の脱水素を行うことが可能となる。
【0018】
また、脱水素反応は吸熱反応であるため、反応促進のためには熱の供給が必要となる。そして、低い温度で反応が進行するほど高効率である。従来のバルク触媒を用いた飽和炭化水素の脱水素化反応における反応温度では300[℃]以上の熱が必要であるが、本発明の実施の形態に係る炭化水素の脱水素触媒を用いることにより、限りなく平衡転化率に近づけることができるようになり、300[℃]以下での脱水素化反応を可能とする。もしくは、反応速度が向上する。また、反応温度が低いため、従来の触媒(バルク触媒)で問題となるシンタリング等による材料の劣化を予防でき、反応温度を低下させることにより、燃料である炭素化等の副反応も抑制することが可能となる。このように、本発明の実施の形態に係る炭化水素の脱水素触媒は、300[℃]以下での脱水素化反応を効率良く行うことができ、この炭化水素の脱水素触媒を用いた本発明の実施の形態に係る廃熱回収システムでは、燃料である炭化水素の脱水素触媒を廃熱を回収する熱交換器(改質器・蒸発器4)に設け、250〜300[℃]の温度を有する廃熱を熱源として、発生させた水素と脱水素化された炭化水素とを更に燃料として供給することにより、燃料の発熱量を向上させることが可能となる。このように、排気ガスの廃熱を利用して、炭化水素の脱水素を行うことにより、特に300[℃]以下の廃熱回収が可能となり、エネルギーの有効利用率が改善される。
【0019】
燃料としてエタノールを用いた場合には、エタノールの改質反応は吸熱反応であるため、反応促進のためには熱の供給が必要となる。この場合、低い温度で反応が進行するほど高効率である。従来のバルク触媒によって転化率80[%]以上の収率でエタノールを改質するためには、改質温度が300[℃]以上であることが必要であるが、本発明の実施の形態に係る触媒を用いることにより、300[℃]以下の反応温度であってもエタノール転化率80[%]以上の収率で所望の燃料を得ることが可能となる。図3に、予想されるエタノールの改質反応機構を示す。エタノール31の脱水素反応(a)により、アルデヒド32及び水素33が生成する。この反応は、吸熱反応であり、エタノールの改質反応における正反応である。アルデヒド32は、分解反応(b)により、メタン34及び一酸化炭素35に分解される。その一方、後述するエタノール31の分子内脱水反応(d)により得られた水40(36)を利用したSR反応(スチームリフォーム反応)(c)により、アルデヒド32と水36とが反応して二酸化炭素37と水素38が生成する。また、エタノール31の改質反応の副反応である分子内脱水反応(d)により、エチレン39と水40が生成する。エチレン39は、水素41の付加反応(e)によりエタン42となる。エタノール31の改質反応において、副反応である分子内脱水反応(d)が起こると、エチレン39は重合したり炭化することにより、燃料のポリマー炭素化が起こり、エタノールは燃料としての利用価値が下げる場合がある。これに対し、本発明の実施の形態に係る炭化水素の脱水素触媒を利用した場合には、300[℃]以下の反応温度でエタノール31の改質を行うため、副反応が抑えられ、正反応であるエタノール脱水素反応が進行する。このように、本発明の実施の形態に係る廃熱回収システムでは、燃料であるエタノール31の脱水素触媒を廃熱を回収する熱交換器(改質器・蒸発器4)に設け、250〜300[℃]の温度を有する廃熱を熱源として、発生させた水素33と脱水素化されたアルデヒド32とを更に燃料として供給することにより、燃料の発熱量を向上させることが可能となる。このように、排気ガスの廃熱を利用してエタノール31の脱水素を行うことにより、特に300[℃]以下の廃熱回収が可能となり、エネルギーの有効利用率が改善され、エタノールの脱水素化を効率よく行うことが可能となる。
【0020】
なお、本発明の実施の形態では、反応温度を低く抑えられることに加えて、炭化水素の脱水素触媒として均一な形状の細孔を有する多孔性金属錯体を使用したことにより、ゲスト分子である炭化水素に与えるストレス(立体配座)も均一になるため、副反応を抑制する効果も生まれる。特にエタノールの改質においては、副反応であるエタノールの脱水反応によるエチレン生成の抑制に効果がある。
【0021】
有機配位子は、次の一般式(II)
HOOC−R−COOH ・・・(II)
で表されるジカルボン酸誘導体を含むことが好ましい。大きな表面積、化学的に安定な触媒を得るために、ジカルボン酸以上であることが望ましい。モノカルボン酸では、触媒の表面積が300[m2/g]程度であることが分っている。これに対し、ジカルボン酸、トリカルボン酸では安定、つまり、耐熱性良好であり、1000〜4000[m2/g]程度の高表面積が得られる。
【0022】
Rは、アルキレン基、アルキニレン基、アルケニレン基、アリーレン基及びシクロアルキレン基から選択される炭化水素基を含むことが好ましい。触媒の高表面積と、化合物の安定性、つまり、耐熱性を確保するためである。
【0023】
Rはアリーレン基を含むことが好ましく、中でもアリーレン基は置換基を有することが好ましい。この場合には、触媒は、安定性、つまり、耐熱性に優れている。また、原料も安く、コスト的にも有利であると考えられる。
【0024】
Rは、次の一般式(III)〜(XII)
【化1】

【0025】
のいずれか一つで表される配位子を含むことが好ましい。触媒の骨格構造は、中心金属に2座配位可能な架橋配位子を含むことが好ましい。架橋配位子を含むことにより、更に耐熱性が増し、表面積も大きくなると考えられるためである。化合物により異なるが、架橋配位子を有することにより、例えば、表面積が1000[m2/g]であったものが1500[m2/g]、2000[m2/g]であったものが2500[m2/g]に拡大すると考えられる。これは、2次元錯体が3次元錯体になるためであると考えられる。
【0026】
架橋配位子は、トリエチレンジアミン、ピラジン、及びこれらの誘導体であることが好ましい。これまでの知見では、これら3種類で安定な化合物が得られているためである。
【0027】
中心金属は、2価の遷移金属を含むことが好ましい。触媒を構成する中心金属は、2〜4価の遷移金属であれば三次元の骨格構造を有する触媒(錯体)を形成するが、特に2価の金属を用いると、化学的に安定な錯体を形成する。
【0028】
中心金属は、Cu、Zn、Co、Mo、Ru、Cr、Ni、Rh、Pd、W、Re及びIrを含む金属群から選択される金属を含むことが好ましい。これらの金属は、水素に対すてアフィニティーを有するため、脱水素触媒の中心金属としてこれらの金属を用いた場合には、炭化水素の脱水素触媒としての機能を発揮する。中でも、中心金属は、Co、Ru、Ni、Rh、Pd、W、Re及びIrを含む金属群から選択される金属を含むことがより好ましい。これらの金属は、特に水素に対してアフィニティーが高いため、これらの金属を中心金属として使用した場合には、特に触媒機能が強く発現し、より低温で転化率の高い反応が可能となる。
【0029】
骨格構造は、中心金属と有機配位子のカルボキシレート基の酸素との結合によって形成された二次元格子構造の集積によって構成された三次元の骨格構造であり、BET表面積が500[m2/g]以上、細孔容積が0.75[cm3/g]以上であることが好ましい。この場合には、触媒機能が強く発現する。特に、BET表面積は1000[m2/g]以上、細孔容積が1.0[cm3/g]以上であることが好ましく、この場合には、更に触媒機能が強く発現する。なお、本発明の実施の形態に係る炭化水素の脱水素触媒は、有機配位子を選択する、つまり、Rを適宜選択することにより、表面積を変えることが可能であり、BET表面積は1000[m2/g]以上、細孔容積が1.0[cm3/g]以上である触媒を得ることが可能となる。
【0030】
脱水素化反応のゲスト分子となる炭化水素は、ベンゼン、トルエン、キシレン、メシチレン、ナフタレン、メチルナフタレン、アントラセン、ビフェニル及びフェナンスレンを含む炭化水素群から選択される炭化水素の、置換又は非置換の水素化物から選ばれる炭化水素を含むことが好ましい。また、脱水素化反応のゲスト分子となる炭化水素は、アルコールを含んでいても良く、炭化水素は、不飽和炭化水素を含んでいても良い。
【0031】
上記したように、本発明の実施の形態に係る炭化水素の脱水素触媒の最も有効な用途としては、内燃機関の廃熱回収が挙げられる。この場合、内燃機関に用いられる燃料に飽和炭化水素(脱水素化が可能な炭化水素)が含まれていることが条件となるが、吸熱反応である脱水素化反応を内燃機関等で発生する廃熱を熱源として用い、脱水素化反応で得られた水素と脱水素化された炭化水素を燃料として供給することにより、供給する燃料の発熱量を向上させることが可能となる。
【0032】
また、従来のバルク触媒では300[℃]以下における効率的な脱水素化反応は不可能であったが、表面積が500[m2/g]以上を示す多孔性金属錯体を触媒として用いた場合には、300[℃]以下の低温においても、炭化水素の脱水素化反応の転化率も大きく改善され、結果として内燃機関の燃費を向上させることが可能となる。
【実施例】
【0033】
以下、実施例及び比較例により本発明の実施の形態について更に具体的に説明するが、本発明の範囲はこれらに限定されるものではない。
【0034】
実施例1 {Rh(OOC−C6H4−COO)2−C6H12N2}nの合成
ジカルボン酸としてテレフタル酸を、架橋配位子としてトリエチレンジアミンを、中心金属の原料となる金属塩として酢酸ロジウム二水和物を用いた。テレフタル酸 2.10[g]、トリエチレンジアミン0.56[g]、酢酸ロジウム二水和物2.39[g]を酢酸エチルを入れた容器に加え、オートクレーブ中100[℃]で混合・攪拌し、その後室温にて48[時間]放置した。析出した固体を吸引濾過により回収し、メタノールで洗浄した。その後、150[℃]で2[時間]真空乾燥を行い、目的物である{{Rh(OOC−C6H4−COO)2−C6H12N2}nを得た。BET法によって測定して得られた化合物の比表面積は1260[m2/g]、細孔容積は1.12[cm3/g]であった。
【0035】
実施例2 {Rh(OOC−C6H8−COO)2−C6H12N2}nの合成
ジカルボン酸として1,4−トランスシクロヘキサンジカルボン酸を、架橋配位子としてトリエチレンジアミンを、中心金属の原料となる金属塩として酢酸ロジウム二水和物を用いた。シクロヘキサンジカルボン酸2.20[g]、トリエチレンジアミン0.56[g]、酢酸ロジウム二水和物2.39[g]を酢酸エチルを入れた容器に加え、オートクレーブ中100[℃]で混合・攪拌し、その後室温にて48[時間]放置した。析出した固体を吸引濾過により回収し、メタノールで洗浄した。その後、80[℃]で2[時間]真空乾燥を行い、目的物である{Rh(OOC−C6H8−COO)2−C6H12N2}nを得た。BET法によって測定して得られた化合物の比表面積は840[m2/g]、細孔容積は1.12[cm3/g]であった。
【0036】
実施例3 {Ru(OOC−C6H4−COO)2−C6H12N2}nの合成
ジカルボン酸としてテレフタル酸を、架橋配位子としてトリエチレンジアミンを、中心金属の原料となる金属塩として酢酸ルテニウム二水和物を用いた。テレフタル酸2.10[g]、トリエチレンジアミン0.56[g]、酢酸ルテニウム2.05[g]を酢酸エチルを入れた容器に加え、オートクレーブ中100[℃]で混合・攪拌し、その後室温にて48[時間]放置した。析出した固体を吸引濾過により回収し、メタノールで洗浄した。その後、150[℃]で2[時間]真空乾燥を行い、目的物である{Ru(OOC−C6H4−COO)2−C6H12N2}nを得た。BET法によって測定して得られた化合物の比表面積は1080[m2/g]、細孔容積は1.02[cm3/g]であった。
【0037】
比較例1
特公平6−72005号公報に記載の実施例1を参考に、γ−アルミナ担体を製造した。熱希硫酸中に激しく撹拌しながら瞬時にアルミン酸ソーダ水溶液を加えることにより水酸化アルミニウムスラリーの懸濁液(pH=10)を得た。これを種子水酸化アルミニウムとして、撹拌を続けながら熱希硫酸とアルミン酸ソーダ水溶液を交互に一定時間おいて加える操作を繰り返し、ろ過洗浄ケーキを得た。これを押し出し成形して乾燥した後、500[℃]で3[時間]焼成した。得られたγ−アルミナ担体のBET法によって測定して得られた化合物の比表面積は240[m2/g]、細孔容積は0.71[cm3/g]であった。
【0038】
上記のように調製したγ−アルミナ担体20[g]に、pH値が2.0になるように調製した0.4[wt%]−塩化白金酸水溶液79[g]を添加し、3[時間]放置して含浸させた後、デカンテーションにより水を除去した。次いで、120[℃]で3[時間]乾燥させてからマッフル炉により空気流通下に400[℃]で3[時間]焼成した。得られた焼成物をデシケーター中で常温まで冷却した後、これに0.52[wt%]−硝酸カリウム水溶液を10[g]を添加し、3[時間]放置して含浸せしめ、次いでエバポレーターにより水分を除去した。その後、120[℃]で3[時間]乾燥させ、水素流通下に400[時間]で15[時間]還元し、脱水素触媒を調製した。
【0039】
BET表面積は次のようにして測定した。
【0040】
<窒素吸着BET一点法>
装置は堀場製作所製 連続流動式表面積計 SA−9601を用いた。前処理として測定容器への試料充填を、N2雰囲気グローブボックス内で行った。その後、120[℃]、30[分]の条件で乾燥した後、測定を開始した。
【0041】
実施例1〜実施例3及び比較例1については、次に示す反応試験1を行った。
【0042】
<反応試験1>
上記で得られた実施例1〜実施例3及び比較例1の脱水素触媒の転化率を図4に示す装置51を用いて測定した。装置51は、熱電対用保護管を備えたステンレス製反応管52と、ステンレス製反応管52の温度を制御する環状のヒータ53a〜53fとを備える。ステンレス製反応管52は、上部52aと、中部52bと、下部53cとからなる。ステンレス製反応管52の中部52bには、触媒層54が設けられている。ステンレス製反応管52には、蒸発器535によって気化された反応ガスが管路56を通って供給される。ステンレス製反応管52には、ガス温度を測るための温度計57が挿入されている。温度計57の先端は、触媒層54の上部から200[mm]以下となるように設置されている。また、ステンレス製反応管52には触媒の温度を測るための温度計58が挿入されている。温度計58の先端は、触媒層54の上部から20[mm]程度となるように設置されている。触媒層54の下部には、触媒の出口の温度を測るための温度計59が設置されている。また、触媒層54の下部には、気液分離器60を設け、脱水素反応により生成したトルエン等の液状生成物と水素ガス等の気体とを分離し、それぞれが管路61を通って回収され、液状生成物と気体とを各々ガスクロマトグラフィで分析した。
【0043】
なお、ステンレス製反応管52は内径17[mmφ]サイズであり、反応管断面の中心には、外形1/8インチの熱電対用保護管を備えた。テンレス製反応管52の長さ方向の中心に触媒層54の中心が位置するように触媒5[cm3]を充填し、触媒層54の上側に予熱層として1[mmφ]の球状α−アルミナビーズ10[cm3]を充填した。水素流通(LHSV=5;50[cm3/hr]下において、触媒層54の中心温度が所定の温度になるまで徐々に昇温した。次いで、メチルシクロヘキサン(MCH)を高速液体クロマトグラフィ(HPLC)用送液ポンプ(HPLCポンプ)によってLHSV=4.0(40[cm3/hr])に相当する量をステンレス製反応管52に供給した。評価は150〜300[℃]の範囲で実施し、反応は触媒層54の中心温度が所定の温度になるようにヒータ53a〜53fの出力を調整して反応試験を行った。なお、ここでLHVとは、Lower Heating Value(低位発熱量)の略である。
【0044】
図5に、MCHの理論上の平衡転化率、及び実施例1、比較例1の反応開始30[分]後における各温度における転化率のプロットを示す。また、表1には280[℃]におけるMCH転化率、トルエン選択率、トルエン収率、水素発生量及びエネルギー回収率を解析の一例として示す。
【表1】

【0045】
図5の特定曲線5Aに示すように、反応温度280[℃]におけるMCHの理論上の平衡転化率は約68[%]である。実施例1では、特定曲線5Bに示すように、転化率は若干低くなった。比較例1では、特定曲線4Cに示すように、転化率は低くなった。反応試験1の条件下において、実施例1〜実施例3はいずれも50[%]以上の転化率で反応が進行したが、比較例1では2.1[%]であり、転化率は大きく異なった。
【0046】
また、本反応におけるエネルギー回収率は以下の式から得られた転化率を基に計算した。
【0047】
C7H14(g)→C7H8(g)+3H2(g) ΔH=205[kj/mol]
C7H14(g)+10.5O2(g)→7CO2(g)+7H2O ΔH=−4292[kj/mol]
C7H8+3H2(g)→7CO2(g)+7H2O ΔH=−4497[kj/mol]
280[℃]における、実施例1〜実施例3では、エネルギー回収率は2.5[%]を超えたが、比較例1では0.1[%]程度であり、ほとんどエネルギー回収はできていないことが分かった。
【0048】
<反応試験2>
反応試験2では、反応試験1の条件において、メチルシクロヘキサン(MCH)をLHSV=8.0(80[cm3/hr])に相当する量をステンレス製反応管52に供給し、その他の条件は、反応試験1と同一条件とした。評価に用いた試料は実施例1と比較例1で調整した触媒とし、それぞれ実施例4及び比較例2とした。評価は100〜300[℃]の範囲で実施した。
【0049】
図6に、MCHの理論上の平衡転化率、及び実施例1、比較例1の反応開始30[分]後における各温度における転化率のプロットを示す。また、表2には280[℃]におけるMCH転化率、トルエン選択率、トルエン収率、水素発生量及びエネルギー回収率を解析の一例として示す。
【表2】

【0050】
図6の特定曲線6Aに示すように、反応温度280[℃]におけるMCHの理論上の平衡転化率は約70[%]である。実施例4では、特定曲線6Bに示すように、転化率は若干低くなった。比較例2では、特定曲線6Cに示すように、転化率は低くなった。280[℃]における解析結果の例を表2に示す。280[℃]における、実施例4のエネルギー回収率は1.7[%]、比較例2はほぼ0[%]であり、ゲスト分子の供給速度を上げると転化率は減少したが、水素発生率では反応試験1より大きな差となって現れ、脱水素反応が促進されていることが分かった。
【0051】
<反応試験3>
反応試験3では、反応試験1の条件において、メチルシクロヘキサン(MCH)の変わりにシクロヘキサン(CH)をLHSV=4.0(40[cm3/hr])に相当する量をステンレス製反応管52に供給し、その他の条件は、反応試験1と同一条件とした。評価に用いた試料は実施例1と比較例1で調整した触媒とし、それぞれ実施例5及び比較例3とした。評価は100〜300[℃]の範囲で実施した。
【0052】
図7にMCHの理論上の平衡転化率、および実施例5及び比較例3の反応開始30分後における各温度における転化率のプロットを示す。また、表3には260[℃]における、MCH転化率、トルエン選択率、トルエン収率、水素発生量及びエネルギー回収率を解析の一例として示す。
【表3】

【0053】
反応温度260[℃]におけるCHの理論上の平衡転化率は、図7の特定曲線7Aに示すように、約87[%]である。実施例6では、特定曲線7Bに示すように、転化率は若干低くなった。比較例3では、特定曲線7Cに示すように、転化率は低くなった。反応試験3の条件下において、実施例5は76[%]の転化率で反応が進行したが、比較例3では6.2[%]であり、転化率に大きな差となって現れた。
【0054】
また、本反応におけるエネルギー回収率は以下の式から得られた転化率を基に計算した。
C6H12(g)→C6H6(g)+3H2(g) ΔH=242[kj/mol]
C6H12(g)+9O2(g)→6CO2(g)+6H2O ΔH=−3653[kj/mol]
C6H6+3H2(g)+9O2(g)→6CO2(g)+6H2O ΔH=−3895[kj/mol]
260[℃]における、実施例5のエネルギー回収率は5.1[%]、比較例3は0.3[%]であり、実施例5の触媒を用いることにより、脱水素反応が促進され、エネルギー回収率も向上することが分かった。
【0055】
<反応試験4>
反応試験4では、反応試験1の条件において、メチルシクロヘキサン(MCH)の代わりにデカリン(DL)をLHSV=4.0(40[cm3/hr])に相当する量を反応器に供給し、その他の条件は、反応試験1と同一条件とした。評価に用いた試料は実施例1と比較例1で調整した触媒とし、それぞれ実施例6、比較例4とした。評価は100〜300[℃]の範囲で実施した。
【0056】
図8に反応開始30[分]後におけるDL転化率、ナフタレン選択率、ナフタレン収率、水素発生量([cm3/cm3/h/cc−cat])及びエネルギー回収率を求めた。また、240[℃]における解析結果の一例を表4に示す。
【表4】

【0057】
反応温度240[℃]におけるデカリンの理論上の平衡転化率は図8に示す特定曲線8Aより約90[%]ある。実施例6では、特定曲線8Bに示すように、転化率は若干低くなった。比較例4では、特定曲線8Cに示すように、転化率は低くなった。反応試験4の条件下において、実施例6は82[%]の転化率で反応が進行したが、比較例4では8.6[%]であり、転化率に大きな差となって現れた。
【0058】
また、本反応におけるエネルギー回収率は以下の式から得られた転化率を基に計算した。
C10H18(g)→C10H8(g)+5H2(g) ΔH=397[kj/mol]
C10H18(g)+14.5O2(g)→10CO2(g)+9H2O
ΔH=−5865[kj/mol]
C10H8(g)+5H2(g)+14.5O2(g)→10CO2(g)+9H2O
ΔH=−6262[kj/mol]
240[℃]における、実施例6のエネルギー回収率は5.7[%]、比較例4は0.4[%]であり、実施例6の触媒を用いることにより、脱水素反応が促進され、エネルギー回収率も向上することが分かった。
【0059】
実施例1〜実施例6において、各実施例におけるエネルギー回収率は、1.7〜6.6[%]であるが、発生する水素は内燃機関の希薄燃焼を可能にする。ガソリンのみを内燃機関に供給した場合とガソリン中に水素を3[%]ほど添加して供給した場合では、空燃比(A/F)の上限が23.9から31.7に上昇するという報告がある(科学技術振興機構 新技術コンセプト・モデル化推進事業課題 希薄燃焼ガソリンエンジンのNOx、HCの低減及びディーゼルエンジンのすす低減システム報告書)。これによると、リーン領域では添加した水素エネルギーよりも減少した燃料エネルギーの方が大きく、エネルギー的に有利になるとされている。また、水素の供給によりNOX、COの低減効果も期待できる。本発明の実施の形態に係る炭化水素の脱水素触媒を用いた廃熱回収システムでは、上記効果が期待できる。
【0060】
<反応試験5>
反応試験5では、反応試験1の条件と同一とした。反応試験5では、反応試験1の条件において評価に用いた試料は実施例1〜実施例3及び比較例1で調整した触媒とし、それぞれ実施例7〜実施例9及び比較例5とした。これらの試料は図4に示す装置51を用いて測定した。そして、エタノールを高速液体クロマトグラフィ(HPLC)用送液ポンプ(HPLCポンプ)によってLHSV=4.0(40[cm3/hr])に相当する量をステンレス製反応管52に供給した。評価は150〜300[℃]の範囲で実施し、反応は触媒層54の中心温度が所定の温度になるようにヒータ53a〜53fの出力を調整して反応試験を行った。
【0061】
分析の結果、H2、CH3、CO、C2H4、C2H6が主成分として観測され、エタノールの改質反応が図3のメカニズムで進行していることが示唆された。
【0062】
次に、図9に、エタノールの理論上の平衡転化率、及び実施例7、比較例5の反応開始30[分]後における各温度における転化率のプロットを示す。また、表5には250[℃]におけるエタノール転化率、発生したガスの組成、改質ガス発生量及びエネルギー回収率を解析の一例として示す。
【表5】

【0063】
実施例7では、特定曲線9Aに示すように、エタノール転化率は約90.0[%]である。比較例5では、特定曲線9Bに示すように、転化率は低くなり、触媒の低温活性が向上していることが分かった。反応試験5の条件下において、実施例7〜実施例9はいずれも80[%]以上の転化率で反応が進行したが、比較例5では13.5[%]であり、転化率は大きく異なった。
【0064】
また、本反応におけるエネルギー回収率は以下の式から得られたガスの濃度から換算して算出した。
エネルギー回収率(%)=
(生成系(H2+CO+CH4+・・・・・)LHV−原系LHV)/原系(C2H5OH)LHV
なお、ここでLHVとは、Lower Heating Value(低位発熱量)の略である。
C2H5OH(g)+3O2(g)→2CO2(g)+3H2O(g)
ΔH=−1275[kj/mol]
H2(g)+0.5O2(g)→H2O(g) ΔH=−244[kj/mol]
C2H4+3O2(g)→2CO2(g)+2H2O(g)
ΔH=−1321[kj/mol]
CH4(g)+ 3O2(g)→CO2(g)+2H2O(g)
ΔH=−801[kj/mol]
CO(g)+0.5O2(g)→CO2(g) ΔH=−284[kj/mol]
C2H6O(g)+3O2(g)→2CO2(g)+3H2O(g)
ΔH=−1425[kj/mol]
エネルギー回収率を計算した結果、比較例5では僅か0.3[%]の回収率であったが、実施例では2.4〜2.7[%]に向上していることが分かった。
【0065】
<反応試験6>
反応試験6では、反応試験5の条件において、エタノールをLHSV=8.0(80[cm3/hr])に相当する量をステンレス製反応管52に供給し、その他の条件は、反応試験5と同一条件とした。評価に用いた試料は実施例1〜実施例3及び比較例1で調整した触媒とし、それぞれ実施例10〜実施例12及び比較例6とした。評価は100〜300[℃]の範囲で実施した。
【0066】
図10に、実施例10及び比較例6の反応開始30[分]後における各温度の転化率のプロットを示す。また、表6には250[℃]におけるエタノール転化率、発生したガスの組成、改質ガス発生量及びエネルギー回収率を解析の一例として示す。
【表6】

【0067】
図10の特定曲線10Aに示すように、実施例4では、エタノール転化率は54.0[%]だった。比較例6では、特定曲線10Bに示すように、エタノール転化率は4.0[%]と低くなった。エタノールの供給速度を上げることにより、反応試験5と比較してエタノール転化率は低下したが、反応試験6の条件下において、実施例10〜実施例12はいずれも50[%]以上の転化率で反応が進行したが、比較例6では4.0[%]であり、転化率は大きく異なった。エネルギー回収率は、実施例10〜実施例12では、1.5〜1.6[%]の転化率を示した。一方、比較例2では、0.0[%]であり、エネルギーの回収はほとんどできていないことが分かった。
【0068】
<反応試験7>
反応試験7では、他の炭化水素化合物とエタノールとを混合させた場合を想定して、反応試験5の条件において、シクロヘキサン(CH)とエタノールのモル比1:1の混合液をLHSV=4.0(40[cm3/hr])に相当する量をステンレス製反応管52に供給し、その他の条件は、反応試験5と同一条件とした。評価に用いた試料は実施例1〜実施例3及び比較例1で調整した触媒とし、それぞれ実施例13〜実施例15及び比較例7とした。評価は100〜300[℃]の範囲で実施した。
【0069】
図11に、実施例13及び比較例7の反応開始30[分]後における各温度の転化率のプロットを示す。また、表7には250[℃]におけるエタノール転化率、発生したガスの組成、改質ガス発生量及びエネルギー回収率を解析の一例として示す。
【表7】

250[℃]における、比較例7のエタノール転化率、シクロヘキサン転化率は、それぞれ12.8[%]、2.3[%]であったが、実施例13〜実施例15では、エタノール転化率は80[%]以上、シクロヘキサン転化率も約50[%]となり、触媒の低温活性が向上していることが分かった。また、本反応におけるエネルギー回収率は以下の式から得られた転化率を基に計算した。
C6H12(g)+9O2(g)→6CO2(g)+6H2O(g)
ΔH= −3656[kj/mol]
C6H6(g)+7.5O2(g)→6CO2(g)+3H2O(g)
ΔH=−3167[kj/mol]
エネルギー回収率を計算した結果、比較例7では僅か0.2[%]の回収率であったが、各実施例では2.7〜3.1[%]に向上していることが分かった。
【0070】
実施例7〜実施例13におけるエネルギー回収率は5[%]以下であるが、発生する水素及び一酸化炭素は内燃機関の希薄燃焼を可能にする。上記したように、ガソリンのみを内燃機関に供給した場合とガソリン中に水素を3[%]ほど添加して供給した場合では、空燃比(A/F)の上限が23.9から31.7に上昇する。これによると、リーン領域では添加した水素エネルギーよりも減少した燃料エネルギーの方が大きく、エネルギー的に有利になるとされている。また、水素の供給によりNOX、COの低減効果も期待できる。本発明の実施の形態に係る炭化水素の脱水素触媒を用いた廃熱回収システムでは、上記効果が期待できる。
【0071】
以上、本実施の形態について説明したが、上記実施の形態の開示の一部をなす論述及び図面はこの発明を限定するものであると理解するべきではない。この開示から当業者には様々な代替実施の形態、実施例及び運用技術が明らかとなろう。
【図面の簡単な説明】
【0072】
【図1】本発明の実施形態に係る廃熱回収システムを模式的に示した図である。
【図2】本発明の実施形態に係る炭化水素の脱水素触媒を模式的に示した図である。
【図3】予想されるエタノール改質の反応機構を表す図である。
【図4】各反応試験に用いる装置の模式図である。
【図5】MCHの理論上の平衡転化率、実施例1及び比較例1の各温度における転化率を示す図である。
【図6】MCHの理論上の平衡転化率、実施例4及び比較例2の各温度における転化率を示す図である。
【図7】CHの理論上の平衡転化率、実施例5及び比較例3の各温度における転化率を示す図である。
【図8】デカリンの理論上の平衡転化率、実施例6及び比較例4の各温度における転化率を示す図である。
【図9】実施例7及び比較例5の各温度におけるエタノール転化率を示す図である。
【図10】実施例10及び比較例6の各温度におけるエタノール転化率を示す図である。
【図11】実施例13及び比較例7の各温度におけるエタノール転化率を示す図である。
【符号の説明】
【0073】
1 廃熱回収システム
2 エンジン
3 燃料タンク
4 改質器・蒸発器
5 ガスクーラ
6、7 管路
8 シリンダー
9 クランクシャフト
10 インテークマニホールド
11 インテークバルブ
12 エキゾーストマニホールド
13 エキゾーストバルブ
14 管路
15 送液ポンプ
16 管路
【特許請求の範囲】
【請求項1】
炭化水素の脱水素反応に対して触媒作用を有する2〜4価の遷移金属からなる中心金属と、
前記中心金属に対し配位された有機配位子と、で三次元の骨格構造を構成した多孔性の金属錯体を含み、
前記有機配位子は、次の一般式(I)で表され、
n1(HOOC)−R−(COOH)n2 ・・・(I)
ここに、Rは有機化合物、n1及びn2は1〜3の整数であり、少なくとも2つのカルボキシレート基を有することを特徴とする炭化水素の脱水素触媒。
【請求項2】
前記有機配位子は、次の一般式(II)
HOOC−R−COOH ・・・(II)
で表されるジカルボン酸誘導体を含むことを特徴とする請求項1に記載の炭化水素の脱水素触媒。
【請求項3】
前記Rは、アルキレン基、アルキニレン基、アルケニレン基、アリーレン基及びシクロアルキレン基の中から選択される炭化水素基を含むことを特徴とする請求項1又は請求項2に記載の炭化水素の脱水素触媒。
【請求項4】
前記Rはアリーレン基を含むことを特徴とする請求項1乃至請求項3のいずれか一項に記載の炭化水素の脱水素触媒。
【請求項5】
前記アリーレン基は置換基を有することを特徴とする請求項4に記載の炭化水素の脱水素触媒。
【請求項6】
前記Rは、次の一般式(III)〜(XII)
【化1】

のいずれか一つで表される配位子を含むことを特徴とする請求項4又は請求項5に記載の炭化水素の脱水素触媒。
【請求項7】
前記骨格構造は、前記中心金属に2座配位可能な架橋配位子を含むことを特徴とする請求項1乃至請求項6のいずれか一項に記載の炭化水素の脱水素触媒。
【請求項8】
前記架橋配位子は、トリエチレンジアミン、ピラジン、及びこれらの誘導体の中から選ばれる化合物を含むことを特徴とする請求項7に記載の炭化水素の脱水素触媒。
【請求項9】
前記中心金属は、2価の遷移金属を含むことを特徴とする請求項1乃至請求項8のいずれか一項に記載の炭化水素の脱水素触媒。
【請求項10】
前記中心金属は、Cu、Zn、Co、Mo、Ru、Cr、Ni、Rh、Pd、W、Re及びIrを含む金属群から選択される金属を含むことを特徴とする請求項9に記載の炭化水素の脱水素触媒。
【請求項11】
前記中心金属は、Co、Ru、Ni、Rh、Pd、W、Re及びIrを含む金属群から選択される金属を含むことを特徴とする請求項10に記載の炭化水素の脱水素触媒。
【請求項12】
前記骨格構造は、前記中心金属と前記有機配位子のカルボキシレート基の酸素との結合によって形成された二次元格子構造の集積によって構成された三次元の骨格構造であり、BET表面積が500[m2/g]以上、細孔容積が0.75[cm3/g]以上であることを特徴とする請求項1乃至請求項11のいずれか一項に記載の炭化水素の脱水素触媒。
【請求項13】
前記BET表面積は1000[m2/g]以上、前記細孔容積が1.0[cm3/g]以上であることを特徴とする請求項12に記載の炭化水素の脱水素触媒。
【請求項14】
脱水素化反応のゲスト分子となる炭化水素は、ベンゼン、トルエン、キシレン、メシチレン、ナフタレン、メチルナフタレン、アントラセン、ビフェニル及びフェナンスレンを含む炭化水素群から選択される炭化水素の、置換又は非置換の水素化物から選ばれる炭化水素を含むことを特徴とする請求項1乃至請求項13のいずれか一項に記載の炭化水素の脱水素触媒。
【請求項15】
脱水素化反応のゲスト分子となる炭化水素は、アルコールを含むことを特徴とする請求項1乃至請求項13のいずれか一項に記載の炭化水素の脱水素触媒。
【請求項16】
前記炭化水素は、不飽和炭化水素を含むことを特徴とする請求項1乃至請求項13のいずれか一項に記載の炭化水素の脱水素触媒。
【請求項17】
請求項1乃至16のいずれか一項に係る炭化水素の脱水素触媒を廃熱を回収する熱交換器に設け、
前記廃熱を熱源として発生させた水素と脱水素化された炭化水素とを燃料として供給することにより、燃料の発熱量を向上させることを特徴とする廃熱回収システム。
【請求項18】
前記炭化水素はエタノールであり、前記炭化水素の脱水素触媒により前記エタノールを改質することを特徴とする請求項17に記載の廃熱回収システム。
【請求項1】
炭化水素の脱水素反応に対して触媒作用を有する2〜4価の遷移金属からなる中心金属と、
前記中心金属に対し配位された有機配位子と、で三次元の骨格構造を構成した多孔性の金属錯体を含み、
前記有機配位子は、次の一般式(I)で表され、
n1(HOOC)−R−(COOH)n2 ・・・(I)
ここに、Rは有機化合物、n1及びn2は1〜3の整数であり、少なくとも2つのカルボキシレート基を有することを特徴とする炭化水素の脱水素触媒。
【請求項2】
前記有機配位子は、次の一般式(II)
HOOC−R−COOH ・・・(II)
で表されるジカルボン酸誘導体を含むことを特徴とする請求項1に記載の炭化水素の脱水素触媒。
【請求項3】
前記Rは、アルキレン基、アルキニレン基、アルケニレン基、アリーレン基及びシクロアルキレン基の中から選択される炭化水素基を含むことを特徴とする請求項1又は請求項2に記載の炭化水素の脱水素触媒。
【請求項4】
前記Rはアリーレン基を含むことを特徴とする請求項1乃至請求項3のいずれか一項に記載の炭化水素の脱水素触媒。
【請求項5】
前記アリーレン基は置換基を有することを特徴とする請求項4に記載の炭化水素の脱水素触媒。
【請求項6】
前記Rは、次の一般式(III)〜(XII)
【化1】

のいずれか一つで表される配位子を含むことを特徴とする請求項4又は請求項5に記載の炭化水素の脱水素触媒。
【請求項7】
前記骨格構造は、前記中心金属に2座配位可能な架橋配位子を含むことを特徴とする請求項1乃至請求項6のいずれか一項に記載の炭化水素の脱水素触媒。
【請求項8】
前記架橋配位子は、トリエチレンジアミン、ピラジン、及びこれらの誘導体の中から選ばれる化合物を含むことを特徴とする請求項7に記載の炭化水素の脱水素触媒。
【請求項9】
前記中心金属は、2価の遷移金属を含むことを特徴とする請求項1乃至請求項8のいずれか一項に記載の炭化水素の脱水素触媒。
【請求項10】
前記中心金属は、Cu、Zn、Co、Mo、Ru、Cr、Ni、Rh、Pd、W、Re及びIrを含む金属群から選択される金属を含むことを特徴とする請求項9に記載の炭化水素の脱水素触媒。
【請求項11】
前記中心金属は、Co、Ru、Ni、Rh、Pd、W、Re及びIrを含む金属群から選択される金属を含むことを特徴とする請求項10に記載の炭化水素の脱水素触媒。
【請求項12】
前記骨格構造は、前記中心金属と前記有機配位子のカルボキシレート基の酸素との結合によって形成された二次元格子構造の集積によって構成された三次元の骨格構造であり、BET表面積が500[m2/g]以上、細孔容積が0.75[cm3/g]以上であることを特徴とする請求項1乃至請求項11のいずれか一項に記載の炭化水素の脱水素触媒。
【請求項13】
前記BET表面積は1000[m2/g]以上、前記細孔容積が1.0[cm3/g]以上であることを特徴とする請求項12に記載の炭化水素の脱水素触媒。
【請求項14】
脱水素化反応のゲスト分子となる炭化水素は、ベンゼン、トルエン、キシレン、メシチレン、ナフタレン、メチルナフタレン、アントラセン、ビフェニル及びフェナンスレンを含む炭化水素群から選択される炭化水素の、置換又は非置換の水素化物から選ばれる炭化水素を含むことを特徴とする請求項1乃至請求項13のいずれか一項に記載の炭化水素の脱水素触媒。
【請求項15】
脱水素化反応のゲスト分子となる炭化水素は、アルコールを含むことを特徴とする請求項1乃至請求項13のいずれか一項に記載の炭化水素の脱水素触媒。
【請求項16】
前記炭化水素は、不飽和炭化水素を含むことを特徴とする請求項1乃至請求項13のいずれか一項に記載の炭化水素の脱水素触媒。
【請求項17】
請求項1乃至16のいずれか一項に係る炭化水素の脱水素触媒を廃熱を回収する熱交換器に設け、
前記廃熱を熱源として発生させた水素と脱水素化された炭化水素とを燃料として供給することにより、燃料の発熱量を向上させることを特徴とする廃熱回収システム。
【請求項18】
前記炭化水素はエタノールであり、前記炭化水素の脱水素触媒により前記エタノールを改質することを特徴とする請求項17に記載の廃熱回収システム。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【公開番号】特開2008−178853(P2008−178853A)
【公開日】平成20年8月7日(2008.8.7)
【国際特許分類】
【出願番号】特願2007−76870(P2007−76870)
【出願日】平成19年3月23日(2007.3.23)
【出願人】(000003997)日産自動車株式会社 (16,386)
【Fターム(参考)】
【公開日】平成20年8月7日(2008.8.7)
【国際特許分類】
【出願日】平成19年3月23日(2007.3.23)
【出願人】(000003997)日産自動車株式会社 (16,386)
【Fターム(参考)】
[ Back to top ]

