炭化水素酸化装置、および炭化水素の酸化方法
【課題】新規な炭化水素酸化装置を提供することを目的とする。
【解決手段】炭化水素酸化装置は、炭化水素と酸素を含む反応器1と、前記反応器1の外側に配置された外部電極3と、前記反応器1の内側に配置された内部電極2と、前記反応器1に液体を供給する供給手段5を有する。また、前記液体は酸化剤を含む場合がある。ここで、炭化水素は、炭素数1〜10の飽和炭化水素、炭素数2〜10の不飽和炭化水素、炭素数6〜20の芳香族炭化水素、常温常圧で流動性のある炭化水素であることが好ましい。また、液体は、蒸留水、純水、過酸化水素水溶液、アルカリ水溶液、酸性水溶液から選ばれるいずれか1種、またはいずれか2種以上の混合物であることが好ましい。また、酸化剤は過酸化水素であることが好ましい。
【解決手段】炭化水素酸化装置は、炭化水素と酸素を含む反応器1と、前記反応器1の外側に配置された外部電極3と、前記反応器1の内側に配置された内部電極2と、前記反応器1に液体を供給する供給手段5を有する。また、前記液体は酸化剤を含む場合がある。ここで、炭化水素は、炭素数1〜10の飽和炭化水素、炭素数2〜10の不飽和炭化水素、炭素数6〜20の芳香族炭化水素、常温常圧で流動性のある炭化水素であることが好ましい。また、液体は、蒸留水、純水、過酸化水素水溶液、アルカリ水溶液、酸性水溶液から選ばれるいずれか1種、またはいずれか2種以上の混合物であることが好ましい。また、酸化剤は過酸化水素であることが好ましい。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、新規な炭化水素酸化装置に関する。
また、本発明は、炭化水素の新規な酸化方法に関する。
【背景技術】
【0002】
近年、化石燃料のより一層の有効利用、ないしは化石燃料に代替すべき新エネルギー源の一つとして、天然ガス(通常はメタンおよびエタンが主成分;石油、石炭と同時に、ないしはそれらに由来する天然ガスもある)、バイオガス、炭鉱メタン、埋立地ガス、メタンハイドレート等の炭化水素(特にメタン)を液体(例えば、液体燃料)に直接変換して有効活用することが、脚光を浴びている。これらの炭化水素の中でも、メタンは、その分子中に豊富に水素を含むことによりクリーンな炭素資源とされているが、他方で、飽和炭化水素中で特に安定な化合物であるため、そのメタンの液体への変換には困難な問題が多い。
【0003】
メタンを始めとする炭化水素の液体への変換方法としては、熱化学的手法により、天然ガスから中問ガスの合成ガス(H2+CO)を生成させ、その後で灯油・軽油、ガソリン、DME、メタノール、水素、エタノール、酢酸、蟻酸、オレフィン等に液化することが一般的に行われて来た。
【0004】
このような熱化学的手法のうち、商業化されているプロセスにおいては水蒸気改質法が主流で、その他に部分酸化、自己熱改質、CO2改質等がある。
【0005】
前記の水蒸気改質法においては、多管式反応器に触媒が充填され、その外側から熱が加えられるため、反応のためのエネルギー消費が大きいとされている。すなわち、この熱化学的手法(水蒸気改質法)は、燃料に、O2、CO2、H2Oを加えて反応させ、一旦合成ガスとするが、この合成ガス形成反応が多大な吸熱反応であるため、通常800℃以上の高温を必要とする。
【0006】
更には、この熱化学的手法は、中間生成物として合成ガスを経由する間接法であるため、エネルギー効率が低いという問題がある。このため、熱化学的手法はプロセスの高効率化において改良の余地が最も大きく、その改良プロセスが求められている。
【0007】
上記熱化学的手法に対する改善手法の一つして検討されている、酸素を利用する部分酸化法は化学平衡の制約を受けず天然ガスを100%転換できるため、熱力学的に優位なプロセスであるが、爆発的に進行する酸化反応を抑制することが課題である。プロセスの低温化によって完全酸化反応を抑制できるが、触媒を活性化させる点から、500℃以下の低温化は困難とされている。
【0008】
一方、非平衡プラズマ装置を用いてメタンからメタノールを製造する際に、メタン−酸素−水の系で反応を行ったことが報告されている(非特許文献1参照)。
【0009】
また、マイクロ波プラズマによる反応でメタノールを合成する際、メタンと水、そして過酸化水素との反応のうち、メタン−酸素−水の系が最も良い結果が得られたとの報告がある(非特許文献2参照)。
【0010】
また、非平衡プラズマにメタン、酸素、水蒸気を導入しメタノールに変換したとの報告がある(特許文献1参照)。
【0011】
また、大気圧非平衡プラズマを使ったメタンの直接転換による液体燃料化プロセスが提案されている(非特許文献3参照)。これは、電子温度が数万度、ガス温度が常温に留まった、大気圧非平衡プラズマと呼ばれる方法で、例えば酸素の共存下メタンを活性化し部分酸化させる。大気圧非平衡プラズマを発生させる方法として最もポピュラーな「誘電体バリア放電」を利用している。高エネルギー電子を分子に衝突させるため、常温でも安定なメタンを活性化できる。他方、放電自体は1〜10nsで生成と消滅を繰り返す過渡的な放電であるため、ガス温度はほとんど上昇しない。さらに、反応場を減圧する必要がないため、簡単な反応装置でエネルギー消費を大幅に低減できる。常温常圧でメタンの部分酸化反応を実現できるため、一般的な熱化学手法より有意なプロセスと考えられている。
【0012】
また、マイクロプラズマリアクタによるメタンの液体燃料化プロセスが提案されている(特許文献2および非特許文献4参照)。このプロセスは、誘電体バリア放電を用いてメタンの部分酸化反応を制御するが、非平衡プラズマをマイクロ空間で形成することが特徴である。プラズマが反応器壁と接触する割合が大きい(比表面積が大きい)ことが特徴で、そのメリットは次に示すとおりである。すなわち、部分酸化反応によって発生する熱を効果的に除去し、反応温度を常温付近に保つことができる。また、液体成分は反応器壁に凝縮して気相反応場から速やかに隔離されるため、気相でプラズマによる再分解が抑制される。
【先行技術文献】
【特許文献】
【0013】
【特許文献1】特開平10−182521号公報
【特許文献2】特開2004−285187号公報
【非特許文献】
【0014】
【非特許文献1】B.S. Rajanikanth et al., 静電気学会講演論文集, 1995, p.5-8.
【非特許文献2】M.V. Badani et al., Res. Chem. Intermed., 1995, Vol.21, No.6, p.621-630.
【非特許文献3】D W Larkin, L L Lobban, R.G Mallinson, “The direct partial oxidation of methane to organic oxygenates using a dielectric barrier discharge reactor as a catalytic reactor analog”, Catalysis Today 71(2001) 199.
【非特許文献4】T Nozaki, A Hattori, K Okazaki, “Partial oxidation of methane using a microscale non-equilibrium plasma reactor”, Catalysis Today, 98 (2004) 607-616.
【発明の概要】
【発明が解決しようとする課題】
【0015】
しかしながら、上述した非特許文献1〜3、および特許文献1においては、部分酸化反応によって発生する熱により、反応場の温度が上昇している可能性がある。メタンを活性化する過程で、液体成分(メタノール、ホルムアルデヒド、ギ酸など)の分解がプラズマ中(気相)で同時に進行する。液体成分はメタンよりはるかに反応性が高い。つまり、メタンの活性化と液体成分の再分解を抑制することは相反する条件であり、この相反する条件を同時に満たすことは極めて実現困難である。問題解決のためには、液体成分の再分解を防ぐための工夫が必要になる。
【0016】
また、特許文献2および非特許文献4においては、マイクロリアクターと大気圧非平衡プラズマを組み合わせることで、液体成分を高い収率で合成することが可能になった。ただし、反応器壁に凝集した液体生成物の反応器内での滞在時間は制御できておらず、凝集した液体成分は反応器内に長く滞在する傾向がある。その場合、結局、プラズマによる液体成分の再分解が進行してしまう。液体成分の滞在時間は制御できていないため、実験条件によっては早く排出されたり、長時間滞在することもある。結果として炭素収支は70%程度と低く、さらに実験の再現性も低い。反応器壁に凝縮させた後、液体成分を効率よく反応器外に排出する工夫が必要である。
【0017】
そのため、このような課題を解決する、新規な炭化水素酸化装置、および炭化水素の新規な酸化方法の開発が望まれている。
【0018】
本発明は、このような課題に鑑みてなされたものであり、新規な炭化水素酸化装置を提供することを目的とする。
また、本発明は、炭化水素の新規な酸化方法を提供することを目的とする。
【課題を解決するための手段】
【0019】
上記課題を解決し、本発明の目的を達成するため、本発明の炭化水素酸化装置は、炭化水素と酸素を含む反応器と、前記反応器の外側に配置された外部電極と、前記反応器の内側に配置された内部電極と、前記反応器に液体を供給する供給手段を有する。また、前記液体は酸化剤を含む場合がある。
【0020】
ここで、限定されるわけではないが、炭化水素は、炭素数1〜10の飽和炭化水素、炭素数2〜10の不飽和炭化水素、炭素数6〜20の芳香族炭化水素、常温常圧で流動性のある炭化水素であることが好ましい。また、限定されるわけではないが、液体は、蒸留水、純水、過酸化水素水溶液、アルカリ水溶液、酸性水溶液から選ばれるいずれか1種、またはいずれか2種以上の混合物であることが好ましい。また、限定されるわけではないが、酸化剤は過酸化水素であることが好ましい。
【0021】
本発明の炭化水素の酸化方法は、炭化水素と酸素を含むガスに液体を供給し、非平衡プラズマで処理する方法である。また、前記液体は酸化剤を含む場合がある。
【0022】
ここで、限定されるわけではないが、炭化水素は、炭素数1〜10の飽和炭化水素、炭素数2〜10の不飽和炭化水素、炭素数6〜20の芳香族炭化水素、常温常圧で流動性のある炭化水素であることが好ましい。また、限定されるわけではないが、液体は、蒸留水、純水、過酸化水素水溶液、アルカリ水溶液、酸性水溶液から選ばれるいずれか1種、またはいずれか2種以上の混合物であることが好ましい。また、限定されるわけではないが、酸化剤は過酸化水素であることが好ましい。
【発明の効果】
【0023】
本発明は、以下に記載されるような効果を奏する。
【0024】
本発明の炭化水素酸化装置は、炭化水素と酸素を含む反応器と、前記反応器の外側に配置された外部電極と、前記反応器の内側に配置された内部電極と、前記反応器に液体を供給する供給手段を有するので、新規な炭化水素酸化装置を提供することができる。
【0025】
本発明の炭化水素の酸化方法は、炭化水素と酸素を含むガスに液体を供給し、非平衡プラズマで処理するので、炭化水素の新規な酸化方法を提供することができる。
【図面の簡単な説明】
【0026】
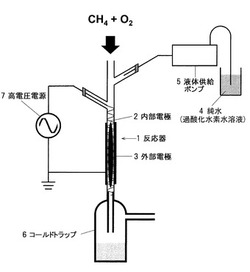
【図1】炭化水素酸化装置の概要を示す図である。
【図2】純水、または過酸化水素水溶液をパルス状に供給する方法を示す図である。
【図3】純水の供給間隔を変化させたときの生成物選択率を示す図である。
【図4】H2O2濃度の増加に伴うメタン転換率の増大を示す図である。
【図5】H2O2濃度の増加に伴う生成物選択率の増大を示す図である。
【発明を実施するための形態】
【0027】
以下、炭化水素酸化装置、および炭化水素の酸化方法にかかる発明を実施するための形態について説明する。
【0028】
炭化水素酸化装置は、炭化水素と酸素を含む反応器と、前記反応器の外側に配置された外部電極と、前記反応器の内側に配置された内部電極と、前記反応器に液体を供給する供給手段を有するものである。ここで、前記液体は、酸化剤を含む場合がある。
【0029】
炭化水素の酸化方法は、炭化水素と酸素を含むガスに液体を供給し、非平衡プラズマで処理する方法である。ここで、前記液体は、酸化剤を含む場合がある。
【0030】
反応器の材質としては、ガラス、セラミックなど非電気伝導性の材料を採用することができる。
【0031】
反応器の内径は0.05〜5.0mmの範囲内にあることが好ましい。反応器の内径が5.0mmより大きいと、反応場の冷却効果が低くなり、炭化水素の部分酸化ではなく完全酸化が生じやすくなる欠点がある。反応器の内径が0.05mm未満であると、大気圧環境で非平衡プラズマを生成できなくなる問題が生じる。
【0032】
反応器の肉厚は0.1〜3.0mmの範囲内にあることが好ましい。反応器の肉厚が3.0mmより大きいと、プラズマの発生が困難になる。反応器の肉厚が0.1mm未満であると、反応器が破損しやすく長時間の反応が困難になる。
【0033】
反応器の長さは10〜300mmの範囲内にあることが好ましい。反応器の長さが10mm以上であると、メタンの転換率が高くなる利点がある。反応器の長さが300mm以下であると、炭化水素の完全酸化を抑制して部分酸化反応を促進し液体成分の選択率を高くできるという利点がある。
【0034】
内部電極の材質としては、ステンレス、銅、プラチナ、銅−亜鉛合金などの種々の金属、合金、および電気伝導性の種々の触媒を採用することができる。
【0035】
内部電極の形状的特徴としては、断面が円形、四角形、三角形、楕円形などのワイヤ、金属粉などの粉体、などを採用することができる。
【0036】
内部電極が円形断面のワイヤである場合、ワイヤの直径は0.1mm以上であり、かつ反応器の内径より若干小さいことが好ましい。ガスを流すために、ワイヤの直径は反応器の内径より若干小さくなければいけない。なお、ワイヤの直径が細いほど低い電圧でプラズマを形成できる利点があるが、ワイヤの直径が0.1mm未満であると、ワイヤが切れやすいという欠点がある。
【0037】
内部電極は、ワイヤを塑性加工し形状を変更して採用することができる。変形後の形状としては、螺旋形状、種々の突起がついたワイヤなどを採用することができる。このほか、棒電極、歯車型電極などを採用することができる。
【0038】
内部電極の長さは10〜300mmの範囲内にあることが好ましい。内部電極の長さが10mm以上であると、メタンの転換率が高くなる利点がある。内部電極の長さが300mm以下であると、炭化水素の完全酸化を抑制して部分酸化反応を促進し液体成分の選択率を高く取れるという利点がある。
【0039】
内部電極がワイヤを螺旋形状にしたものである場合、螺旋のピッチは、ワイヤ直径〜5mmの範囲内にあることが好ましい。螺旋のピッチが、ワイヤ直径以上であると、プラズマを発生しやすくなるという利点がある。螺旋のピッチが5mm以下であると、実効的なワイヤ電極の長さを外部電極の長さ以上にして放電領域を広く取れるという利点がある。
【0040】
外部電極の材質としては、銅、アルミニウム、鉄など、電気伝導性の金属を採用することができる。
【0041】
外部電極の長さは10〜300mmの範囲内にあることが好ましい。外部電極の長さが10mm以上であると、メタンの転換率が高くなる利点がある。外部電極の長さが300mm以下であると、炭化水素の完全酸化を抑制して部分酸化反応を促進し液体成分の選択率を高く取れるという利点がある。
【0042】
反応器の冷却方法としては、外部電極により吸熱する方法、水冷する方法、油冷する方法、空冷する方法などを採用することができる。また、液体を反応器の内部に供給することでも反応器の冷却効果が得られる。
【0043】
本発明において、「非平衡プラズマ」とは、電子温度が反応場の温度(ないしガス温度)と等しくないプラズマを言う。
【0044】
本発明において使用可能な非平衡プラズマ発生方法は、該方法により非平衡プラズマを発生させることが可能である限り、特に制限されない。この非平衡プラズマ発生方法としては、例えば、マイクロプラズマリアクタ方式、マイクロ波プラズマリアクタ方式、誘電体バリア放電、コロナ放電、スパーク放電、マイクロ波放電等が挙げられる。なお、「マイクロ波プラズマ」と「マイクロプラズマ」は全く異なるプラズマである。マイクロ波プラズマとは、1000MHz以上の高周波電源を用いてプラズマを発生させるものを言う。
【0045】
ここで、「マイクロプラズマリアクタ」とは、そのリアクタスケールが被処理ガスたる炭化水素/酸素火炎の消炎(クェンチング)距離より小さいリアクタを言う。被処理ガスがメタンを主成分として含む場合、このメタン/酸素火炎の消炎距離は約2000μmである(この「消炎距離」の詳細については、例えば、B Lewis et al, Combustion, flames and explosions of gases 3rd ed., Academic press, INC. 1987を参照することができる)。なお、本発明において、反応器の内径は前記消炎距離に必ずしも拘束されるものではない。
【0046】
非平衡プラズマ発生方法としてマイクロプラズマリアクタ方式を採用する場合、電圧の形状としては、サイン形状、パルス形状、のこぎり波形状、三角波形状、矩形波形状などを採用することができる。 このほか、直流を採用することができる。
【0047】
マイクロプラズマリアクタ方式を採用する場合、電圧(ピーク値)は5〜30 kVの範囲内にあることが好ましい。電圧が5〜30 kVの範囲内にあると、反応器内部の広い範囲をプラズマ化でき、炭化水素の部分酸化を促進できるという利点がある。
【0048】
マイクロプラズマリアクタ方式を採用する場合、電圧の周波数は1〜100kHzの範囲内にあることが好ましい。電圧の周波数が1kHz以上であると、短い滞留時間で炭化水素を処理できるため、マイクロリアクターでも十分な炭化水素転換率を得ることができるという利点がある。電圧の周波数が100 kHz以下であると、マイクロリアクターをよりコンパクトにして、かつ短い滞留時間でより多くの炭化水素を転換できるという利点がある。
【0049】
炭化水素としては、炭素数1〜10の飽和炭化水素、炭素数2〜10の不飽和炭化水素、炭素数6〜20の芳香族炭化水素、常温常圧で流動性のある炭化水素などを採用することができる。
【0050】
02/炭化水素(CnHmと表す)のモル比は0.1×(n+m/4)〜(n+m/4)の範囲内にあることが好ましい。部分酸化反応を引き起こすためには、02/炭化水素のモル比が0.1×(n+m/4)以上であることが好ましい。02/炭化水素のモル比が(n+m/4)以下であると、炭化水素の完全酸化を抑制して中間生成物である液体燃料を合成できるという利点がある。
【0051】
反応温度は-30〜25℃の範囲内にあることが好ましい。反応温度が-30℃より低いと、液体成分が凝固して反応器を閉塞させる可能性がある。反応温度が25℃を越えると、プラズマ反応場で合成された液体燃料が反応器壁で凝集しにくくなり、気相で生成物が再分解されてしまう。
【0052】
反応圧力は10〜200kPaの範囲内にあることが好ましい。反応圧力が10 kPa未満では、液体成分が凝縮し難くなり、気相で再分解される。また、減圧装置などが必要になりプロセスが煩雑になり炭化水素の大量処理が困難になる。反応圧力200 kPaを超えると、液体の供給、O2/炭化水素のモル比の調整などの合成条件の自由度が損なわれる。
【0053】
反応時間は10〜1000msの範囲にあることが好ましい。反応時間が10ms以上であると、メタンの転換率を高くできる利点がある。反応時間が1000ms以下であると、炭化水素の完全酸化を抑制して部分酸化反応を促進し液体成分の選択率を高くできるという利点がある。
【0054】
液体としては、蒸留水、純水、過酸化水素水溶液、アルカリ水溶液、酸性水溶液などから選ばれるいずれか1種、またはいずれか2種以上の混合物を採用することができる。
【0055】
液体を供給する供給手段としては、一般的に市販されている微量液体ポンプなどを採用することができる。
【0056】
液体の供給方法のパターンとしては、液体をパルス状に供給する方法、連続的に供給する方法などを採用することができる。
【0057】
液体をパルス状に供給する理由は次のとおりである。すなわち、液体を供給することでプラズマの発光が弱くなり、炭化水素転換率が低下する。したがって、液体がない時間帯に炭化水素の部分酸化反応を促進し、合成された液体成分を間欠的に反応器の外へ排出させるために液体をパルス状に供給する。
【0058】
液体をパルス状に供給する場合、液体を供給する時間(パルスの幅)は5〜30secの範囲内にあることが好ましい。液体を供給する時間が5secより短くなると、ポンプの性能によって正確な液体の供給が難しくなる。液体を供給する時間が30secより長くなると、連続的に液体を供給する場合の結果に近づく。つまり、過剰に液体を供給しても液体成分の再分解を抑制して選択性を増加させる効果がないだけでなく、炭化水素転換率が低下するため液体成分の収率が低下する。
【0059】
液体をパルス状に供給する場合、液体を供給しない時間(パルス間隔)は30〜500secの範囲内にあることが好ましい。液体を供給しない時間が30 secより短くなると、連続的に液体水を供給する場合の結果に近づく。つまり、プラズマの効果が液体によって相殺され、炭化水素の転換率を高く保つことが難しくなる。液体を供給しない時間が500 secより長くなると、液体を供給しない場合の結果に近づく。つまり、液体成分の再酸化が促進され選択性が低下する。
【0060】
液体をパルス状に供給する場合、液体の供給速度(液体体積換算)は0.1〜10cm3/minの範囲内にあることが好ましい。液体の供給速度が0.1〜10cm3/minの範囲内にあると、効率よく液体成分を排出できるという利点がある。
【0061】
酸化剤としては、過酸化水素(H2O2)などを採用することができる。
液体中の酸化剤の濃度は0.1〜5質量%の範囲内にあることが好ましい。酸化剤の濃度が0.1質量%未満では、気相ガス成分と酸化剤の相互作用が弱く十分な炭化水素転換率が得られない。酸化剤の濃度が5質量%を越えると、液体成分の過剰な分解が生じてしまう。
【0062】
以上のことから、本発明を実施するための形態によれば、炭化水素酸化装置は、炭化水素と酸素を含む反応器と、前記反応器の外側に配置された外部電極と、前記反応器の内側に配置された内部電極と、前記反応器に液体を供給する供給手段を有するものであり、また、前記液体は酸化剤を含む場合があるので、液体燃料を効率よく生成することができる。
【0063】
また、炭化水素の酸化方法は、炭化水素と酸素を含むガスに液体を供給し、非平衡プラズマで処理する方法であり、また、前記液体は酸化剤を含む場合があるので、液体燃料を効率よく生成することができる。
【0064】
ここで、液体燃料とは、原料の炭化水素を部分酸化して生成した液体成分、具体的には原料の炭化水素を酸化して生成したアルコール、アルデヒド、カルボン酸、ケトン、エーテル等の液体成分を言う。
【0065】
液体燃料は、液体燃料の用途に限定されない。このほか液体燃料は、水素、合成ガス(CO+H2)、ガソリン、灯油、軽油、ギ酸メチル、酢酸、エチレングリコール、アルコール類、アルコール混合物、オレフィン、パラフィンなどに転換され、工業的に利用できる。
【0066】
なお、本発明は上述の発明を実施するための形態に限らず本発明の要旨を逸脱することなくその他種々の構成を採り得ることはもちろんである。
【実施例】
【0067】
つぎに、本発明にかかる実施例について具体的に説明する。ただし、本発明はこれら実施例に限定されるものではないことはもちろんである。
【0068】
<液体の供給の効果>
【0069】
評価方法
図1は、本実施例で用いる炭化水素酸化装置の概要を示す図である。
反応器1は、内径1.5mm、肉厚1.5mm、長さ100mmの石英管を用いた。
反応器1の中に内部電極2を設置した。内部電極2としては、直径0.5 mmの円形断面を有するステンレスワイヤを用いた。このステンレスワイヤをらせん状に塑性加工をした。らせんのピッチは約2mmである。このらせん状の内部電極の長さは約100 mmである。
【0070】
反応器1の外周に外部電極3を設置した。外部電極3としては、反応器1の外周にアルミニウム箔を何重にも巻き付け、厚さ1mmとした。外部電極3の長さは50 mmである。
【0071】
内部電極2と外部電極3に高電圧電源7を接続した。高電圧電源7から発生する電圧の形状は両極性パルスであり、電圧はピーク値で20kVである。また、電圧の周波数は10kHzである。
【0072】
反応器1の上部からは、メタン(CH4)と酸素(O2)を混合して供給した。メタンと酸素の供給速度は、ともに20cm3/minである。すなわち、酸素(02)/ メタン(CH4)のモル比は1である。
また、反応器1の上部からは、純水4を供給した。純水4を供給する手段としては、液体供給ポンプ5を使用した。純水4の供給方法のパターン、及び供給速度については後述する。
【0073】
反応器1を氷水に浸漬して低温に維持した。氷水には熱電対を設置し温度を測定した。反応器1の上から、メタン(CH4)と酸素(O2)を供給し、また純水を供給するとともに、内部電極2と外部電極3の間に両極性パルス高電圧をかけることにより非平衡プラズマを発生させた。メタン(CH4)と酸素(O2)は非平衡プラズマを通過しながら反応をした。反応後の液体生成物と純水はコールドトラップ6で捕集し、気体はサンプリングバッグで捕集した。
反応中、氷水は0〜5℃に保持されていた。反応器2内の反応温度は、0〜20℃の範囲に維持されているものと推定される。反応圧力は、大気圧(101kPa)であった。原料ガス(メタンと酸素)の反応器1内での反応時間は132msであった。
【0074】
純水の供給方法のパターン、及び供給速度について、図2、表1を用いて説明する。図2、表1において、「b」は純水を供給する時間を示し、ここでは全て10secで統一した。また、「a」は純水を供給しない時間を示し、1〜5minと変化させた。また、「f」は純水の供給速度を示し、0.6〜3.0cm3/minと変化させた。
【0075】
表1において、「Synthesis time」は反応時間を示す。パルスの回数をN(回)としたとき、「Synthesis time(min)=a(min)×N」で表せる。また、「Inj. water」は純水の供給総量を示す。パルスの回数をN(回)としたとき、「Inj. Water(cm3)=f×(b/60)×N」で表せる。
【0076】
【表1】

【0077】
生成物の分析は次のように行った。前記の条件で、供給する原料ガスはGC((株)島津製作所製、GC-8A)で分析した。反対側から出る生成物は、コールドトラップにより液体成分を捕集し、常温常圧で液体成分となるものはGC-MS((株)島津製作所製、GC-17A,QP-5000)で、ガス成分はGC((株)島津製作所製、GC-8A)で分析した。
【0078】
評価結果
図3を用いて、実験結果を説明する。純水をパルス状に供給してメタンの部分酸化反応を実施した。純水の供給方法は図2に示した通りで、パルス間隔(図2でaに相当する)を1分、2分、3分、5分と変化させた。さらに、純水を供給しない条件「No injection」の結果も併記している。
【0079】
ここで、「Selectivity」(選択率)とは、反応したメタンの炭素のうち、Liquid(液体成分),CO,CO2,C2+C3などに分配された割合を百分率で示したものである。「C2+C3」において、C2は、炭素を2つ含む炭化水素で、エタン、エチレン、アセチレンを指す。また、C3は、炭素を3つ含む炭化水素で、プロパン、プロペン、プロピンを指す。「Liquid」(液体成分)とは、常温常圧で液体状にある物質であり、実験で得られたものとして、メタノール、ホルムアルデヒド、ギ酸の3成分を加えたものである。
【0080】
純水を供給しない「No injection」と比較して、純水を供給すると全ての条件においてLiquid(液体成分)が増加した。Liquid(液体成分)の選択率は、パルス間隔が1分の時に20.4%、パルス間隔が2分の時に21.3%、パルス間隔が3分の時に26.8%、パルス間隔が5分の時に20.6%である。純水を加えない場合は17.0%である。パルス間隔が3分の時に最大値を示している。パルス間隔が長すぎると、実質的に「No injection」に近い条件になるため、パルス間隔には最適値が存在すると思われる。
【0081】
<酸化剤含有液体の供給の効果>
【0082】
評価方法
本実施例では、過酸化水素を純水に添加し、過酸化水素水溶液を作製した。この過酸化水素水溶液4を反応器1の上から供給した。過酸化水素4の濃度は0.2〜2質量%と変化させた。また、過酸化水素水溶液4を供給する時間(b)は10secとし、過酸化水素水溶液4を供給しない時間(a)は3minとした。このほかの条件は、純水を供給した上述の実験条件と同様である。
【0083】
評価結果
図4を用いて、メタン転換率の結果を説明する。ここで、「転換率(Conversion)」とは、供給したメタンの炭素数に着目し、反応前後で減少したメタンの割合を百分率で表したものをいう。すなわち、以下の式で表すことができる。
転換率(%)={(供給したメタン)−(反応後のメタン)}/(供給したメタン)×100
【0084】
図4において、H2O2濃度が0.2質量%のとき、メタン転換率は15.1%であり、H2O2濃度が1質量%のとき、メタン転換率は17.6%であり、H2O2濃度が2質量%のとき、メタン転換率は24%に達した。なお、H2O2が0質量%(純水)のとき、メタン転換率は13.5%であった。このように、過酸化水素水溶液中のH2O2濃度を増加させると、メタンの転換率は単調に増加することが確認された。
【0085】
図5を用いて、選択率の結果を説明する。図5においてLiquid(液体成分)をみると、H2O2濃度が0.2質量%のとき、選択率は39%であり、H2O2濃度が1質量%のとき、選択率は55%であり、H2O2濃度が2質量%のとき、選択率は39%であった。なお、H2O2が0質量%(純水)のとき、選択率は27%であった。このように、過酸化水素水溶液中のH2O2濃度を増加させると、Liquid(液体成分)の選択率は増加するが、H2O2が1質量%のとき最大値を示すことが確認された。
【0086】
表2を用いて、収率の結果を説明する。ここで、各生成物に対する「収率(Yield)」の定義は以下の通りである。
各生成物の収率={メタン転換率(図4)}×{各生成物の選択率(図5)}
【0087】
この定義に従い、メタンの転換率と各生成物の選択率から、各生成物の収率を算出した。表2からわかるように、転換率、選択性が共に高いほどLiquid(液体成分)の収率は大きくなる。メタン転換率はH2O2濃度ともに単調に増加するが、Liquid(液体成分)の選択率には最大値があるので、Liquid(液体成分)の収率はH2O2が1質量%のとき、最大値9.7%を得ることが確認された。
【0088】
【表2】

【0089】
以上のことから、本実施例によれば、Liquid(液体成分)を効率よく生成することができる。
【符号の説明】
【0090】
1‥‥反応器、2‥‥内部電極、3‥‥外部電極、4‥‥純水(過酸化水素水溶液)、5‥‥液体供給ポンプ、6‥‥コールドトラップ、7‥‥高電圧電源
【技術分野】
【0001】
本発明は、新規な炭化水素酸化装置に関する。
また、本発明は、炭化水素の新規な酸化方法に関する。
【背景技術】
【0002】
近年、化石燃料のより一層の有効利用、ないしは化石燃料に代替すべき新エネルギー源の一つとして、天然ガス(通常はメタンおよびエタンが主成分;石油、石炭と同時に、ないしはそれらに由来する天然ガスもある)、バイオガス、炭鉱メタン、埋立地ガス、メタンハイドレート等の炭化水素(特にメタン)を液体(例えば、液体燃料)に直接変換して有効活用することが、脚光を浴びている。これらの炭化水素の中でも、メタンは、その分子中に豊富に水素を含むことによりクリーンな炭素資源とされているが、他方で、飽和炭化水素中で特に安定な化合物であるため、そのメタンの液体への変換には困難な問題が多い。
【0003】
メタンを始めとする炭化水素の液体への変換方法としては、熱化学的手法により、天然ガスから中問ガスの合成ガス(H2+CO)を生成させ、その後で灯油・軽油、ガソリン、DME、メタノール、水素、エタノール、酢酸、蟻酸、オレフィン等に液化することが一般的に行われて来た。
【0004】
このような熱化学的手法のうち、商業化されているプロセスにおいては水蒸気改質法が主流で、その他に部分酸化、自己熱改質、CO2改質等がある。
【0005】
前記の水蒸気改質法においては、多管式反応器に触媒が充填され、その外側から熱が加えられるため、反応のためのエネルギー消費が大きいとされている。すなわち、この熱化学的手法(水蒸気改質法)は、燃料に、O2、CO2、H2Oを加えて反応させ、一旦合成ガスとするが、この合成ガス形成反応が多大な吸熱反応であるため、通常800℃以上の高温を必要とする。
【0006】
更には、この熱化学的手法は、中間生成物として合成ガスを経由する間接法であるため、エネルギー効率が低いという問題がある。このため、熱化学的手法はプロセスの高効率化において改良の余地が最も大きく、その改良プロセスが求められている。
【0007】
上記熱化学的手法に対する改善手法の一つして検討されている、酸素を利用する部分酸化法は化学平衡の制約を受けず天然ガスを100%転換できるため、熱力学的に優位なプロセスであるが、爆発的に進行する酸化反応を抑制することが課題である。プロセスの低温化によって完全酸化反応を抑制できるが、触媒を活性化させる点から、500℃以下の低温化は困難とされている。
【0008】
一方、非平衡プラズマ装置を用いてメタンからメタノールを製造する際に、メタン−酸素−水の系で反応を行ったことが報告されている(非特許文献1参照)。
【0009】
また、マイクロ波プラズマによる反応でメタノールを合成する際、メタンと水、そして過酸化水素との反応のうち、メタン−酸素−水の系が最も良い結果が得られたとの報告がある(非特許文献2参照)。
【0010】
また、非平衡プラズマにメタン、酸素、水蒸気を導入しメタノールに変換したとの報告がある(特許文献1参照)。
【0011】
また、大気圧非平衡プラズマを使ったメタンの直接転換による液体燃料化プロセスが提案されている(非特許文献3参照)。これは、電子温度が数万度、ガス温度が常温に留まった、大気圧非平衡プラズマと呼ばれる方法で、例えば酸素の共存下メタンを活性化し部分酸化させる。大気圧非平衡プラズマを発生させる方法として最もポピュラーな「誘電体バリア放電」を利用している。高エネルギー電子を分子に衝突させるため、常温でも安定なメタンを活性化できる。他方、放電自体は1〜10nsで生成と消滅を繰り返す過渡的な放電であるため、ガス温度はほとんど上昇しない。さらに、反応場を減圧する必要がないため、簡単な反応装置でエネルギー消費を大幅に低減できる。常温常圧でメタンの部分酸化反応を実現できるため、一般的な熱化学手法より有意なプロセスと考えられている。
【0012】
また、マイクロプラズマリアクタによるメタンの液体燃料化プロセスが提案されている(特許文献2および非特許文献4参照)。このプロセスは、誘電体バリア放電を用いてメタンの部分酸化反応を制御するが、非平衡プラズマをマイクロ空間で形成することが特徴である。プラズマが反応器壁と接触する割合が大きい(比表面積が大きい)ことが特徴で、そのメリットは次に示すとおりである。すなわち、部分酸化反応によって発生する熱を効果的に除去し、反応温度を常温付近に保つことができる。また、液体成分は反応器壁に凝縮して気相反応場から速やかに隔離されるため、気相でプラズマによる再分解が抑制される。
【先行技術文献】
【特許文献】
【0013】
【特許文献1】特開平10−182521号公報
【特許文献2】特開2004−285187号公報
【非特許文献】
【0014】
【非特許文献1】B.S. Rajanikanth et al., 静電気学会講演論文集, 1995, p.5-8.
【非特許文献2】M.V. Badani et al., Res. Chem. Intermed., 1995, Vol.21, No.6, p.621-630.
【非特許文献3】D W Larkin, L L Lobban, R.G Mallinson, “The direct partial oxidation of methane to organic oxygenates using a dielectric barrier discharge reactor as a catalytic reactor analog”, Catalysis Today 71(2001) 199.
【非特許文献4】T Nozaki, A Hattori, K Okazaki, “Partial oxidation of methane using a microscale non-equilibrium plasma reactor”, Catalysis Today, 98 (2004) 607-616.
【発明の概要】
【発明が解決しようとする課題】
【0015】
しかしながら、上述した非特許文献1〜3、および特許文献1においては、部分酸化反応によって発生する熱により、反応場の温度が上昇している可能性がある。メタンを活性化する過程で、液体成分(メタノール、ホルムアルデヒド、ギ酸など)の分解がプラズマ中(気相)で同時に進行する。液体成分はメタンよりはるかに反応性が高い。つまり、メタンの活性化と液体成分の再分解を抑制することは相反する条件であり、この相反する条件を同時に満たすことは極めて実現困難である。問題解決のためには、液体成分の再分解を防ぐための工夫が必要になる。
【0016】
また、特許文献2および非特許文献4においては、マイクロリアクターと大気圧非平衡プラズマを組み合わせることで、液体成分を高い収率で合成することが可能になった。ただし、反応器壁に凝集した液体生成物の反応器内での滞在時間は制御できておらず、凝集した液体成分は反応器内に長く滞在する傾向がある。その場合、結局、プラズマによる液体成分の再分解が進行してしまう。液体成分の滞在時間は制御できていないため、実験条件によっては早く排出されたり、長時間滞在することもある。結果として炭素収支は70%程度と低く、さらに実験の再現性も低い。反応器壁に凝縮させた後、液体成分を効率よく反応器外に排出する工夫が必要である。
【0017】
そのため、このような課題を解決する、新規な炭化水素酸化装置、および炭化水素の新規な酸化方法の開発が望まれている。
【0018】
本発明は、このような課題に鑑みてなされたものであり、新規な炭化水素酸化装置を提供することを目的とする。
また、本発明は、炭化水素の新規な酸化方法を提供することを目的とする。
【課題を解決するための手段】
【0019】
上記課題を解決し、本発明の目的を達成するため、本発明の炭化水素酸化装置は、炭化水素と酸素を含む反応器と、前記反応器の外側に配置された外部電極と、前記反応器の内側に配置された内部電極と、前記反応器に液体を供給する供給手段を有する。また、前記液体は酸化剤を含む場合がある。
【0020】
ここで、限定されるわけではないが、炭化水素は、炭素数1〜10の飽和炭化水素、炭素数2〜10の不飽和炭化水素、炭素数6〜20の芳香族炭化水素、常温常圧で流動性のある炭化水素であることが好ましい。また、限定されるわけではないが、液体は、蒸留水、純水、過酸化水素水溶液、アルカリ水溶液、酸性水溶液から選ばれるいずれか1種、またはいずれか2種以上の混合物であることが好ましい。また、限定されるわけではないが、酸化剤は過酸化水素であることが好ましい。
【0021】
本発明の炭化水素の酸化方法は、炭化水素と酸素を含むガスに液体を供給し、非平衡プラズマで処理する方法である。また、前記液体は酸化剤を含む場合がある。
【0022】
ここで、限定されるわけではないが、炭化水素は、炭素数1〜10の飽和炭化水素、炭素数2〜10の不飽和炭化水素、炭素数6〜20の芳香族炭化水素、常温常圧で流動性のある炭化水素であることが好ましい。また、限定されるわけではないが、液体は、蒸留水、純水、過酸化水素水溶液、アルカリ水溶液、酸性水溶液から選ばれるいずれか1種、またはいずれか2種以上の混合物であることが好ましい。また、限定されるわけではないが、酸化剤は過酸化水素であることが好ましい。
【発明の効果】
【0023】
本発明は、以下に記載されるような効果を奏する。
【0024】
本発明の炭化水素酸化装置は、炭化水素と酸素を含む反応器と、前記反応器の外側に配置された外部電極と、前記反応器の内側に配置された内部電極と、前記反応器に液体を供給する供給手段を有するので、新規な炭化水素酸化装置を提供することができる。
【0025】
本発明の炭化水素の酸化方法は、炭化水素と酸素を含むガスに液体を供給し、非平衡プラズマで処理するので、炭化水素の新規な酸化方法を提供することができる。
【図面の簡単な説明】
【0026】
【図1】炭化水素酸化装置の概要を示す図である。
【図2】純水、または過酸化水素水溶液をパルス状に供給する方法を示す図である。
【図3】純水の供給間隔を変化させたときの生成物選択率を示す図である。
【図4】H2O2濃度の増加に伴うメタン転換率の増大を示す図である。
【図5】H2O2濃度の増加に伴う生成物選択率の増大を示す図である。
【発明を実施するための形態】
【0027】
以下、炭化水素酸化装置、および炭化水素の酸化方法にかかる発明を実施するための形態について説明する。
【0028】
炭化水素酸化装置は、炭化水素と酸素を含む反応器と、前記反応器の外側に配置された外部電極と、前記反応器の内側に配置された内部電極と、前記反応器に液体を供給する供給手段を有するものである。ここで、前記液体は、酸化剤を含む場合がある。
【0029】
炭化水素の酸化方法は、炭化水素と酸素を含むガスに液体を供給し、非平衡プラズマで処理する方法である。ここで、前記液体は、酸化剤を含む場合がある。
【0030】
反応器の材質としては、ガラス、セラミックなど非電気伝導性の材料を採用することができる。
【0031】
反応器の内径は0.05〜5.0mmの範囲内にあることが好ましい。反応器の内径が5.0mmより大きいと、反応場の冷却効果が低くなり、炭化水素の部分酸化ではなく完全酸化が生じやすくなる欠点がある。反応器の内径が0.05mm未満であると、大気圧環境で非平衡プラズマを生成できなくなる問題が生じる。
【0032】
反応器の肉厚は0.1〜3.0mmの範囲内にあることが好ましい。反応器の肉厚が3.0mmより大きいと、プラズマの発生が困難になる。反応器の肉厚が0.1mm未満であると、反応器が破損しやすく長時間の反応が困難になる。
【0033】
反応器の長さは10〜300mmの範囲内にあることが好ましい。反応器の長さが10mm以上であると、メタンの転換率が高くなる利点がある。反応器の長さが300mm以下であると、炭化水素の完全酸化を抑制して部分酸化反応を促進し液体成分の選択率を高くできるという利点がある。
【0034】
内部電極の材質としては、ステンレス、銅、プラチナ、銅−亜鉛合金などの種々の金属、合金、および電気伝導性の種々の触媒を採用することができる。
【0035】
内部電極の形状的特徴としては、断面が円形、四角形、三角形、楕円形などのワイヤ、金属粉などの粉体、などを採用することができる。
【0036】
内部電極が円形断面のワイヤである場合、ワイヤの直径は0.1mm以上であり、かつ反応器の内径より若干小さいことが好ましい。ガスを流すために、ワイヤの直径は反応器の内径より若干小さくなければいけない。なお、ワイヤの直径が細いほど低い電圧でプラズマを形成できる利点があるが、ワイヤの直径が0.1mm未満であると、ワイヤが切れやすいという欠点がある。
【0037】
内部電極は、ワイヤを塑性加工し形状を変更して採用することができる。変形後の形状としては、螺旋形状、種々の突起がついたワイヤなどを採用することができる。このほか、棒電極、歯車型電極などを採用することができる。
【0038】
内部電極の長さは10〜300mmの範囲内にあることが好ましい。内部電極の長さが10mm以上であると、メタンの転換率が高くなる利点がある。内部電極の長さが300mm以下であると、炭化水素の完全酸化を抑制して部分酸化反応を促進し液体成分の選択率を高く取れるという利点がある。
【0039】
内部電極がワイヤを螺旋形状にしたものである場合、螺旋のピッチは、ワイヤ直径〜5mmの範囲内にあることが好ましい。螺旋のピッチが、ワイヤ直径以上であると、プラズマを発生しやすくなるという利点がある。螺旋のピッチが5mm以下であると、実効的なワイヤ電極の長さを外部電極の長さ以上にして放電領域を広く取れるという利点がある。
【0040】
外部電極の材質としては、銅、アルミニウム、鉄など、電気伝導性の金属を採用することができる。
【0041】
外部電極の長さは10〜300mmの範囲内にあることが好ましい。外部電極の長さが10mm以上であると、メタンの転換率が高くなる利点がある。外部電極の長さが300mm以下であると、炭化水素の完全酸化を抑制して部分酸化反応を促進し液体成分の選択率を高く取れるという利点がある。
【0042】
反応器の冷却方法としては、外部電極により吸熱する方法、水冷する方法、油冷する方法、空冷する方法などを採用することができる。また、液体を反応器の内部に供給することでも反応器の冷却効果が得られる。
【0043】
本発明において、「非平衡プラズマ」とは、電子温度が反応場の温度(ないしガス温度)と等しくないプラズマを言う。
【0044】
本発明において使用可能な非平衡プラズマ発生方法は、該方法により非平衡プラズマを発生させることが可能である限り、特に制限されない。この非平衡プラズマ発生方法としては、例えば、マイクロプラズマリアクタ方式、マイクロ波プラズマリアクタ方式、誘電体バリア放電、コロナ放電、スパーク放電、マイクロ波放電等が挙げられる。なお、「マイクロ波プラズマ」と「マイクロプラズマ」は全く異なるプラズマである。マイクロ波プラズマとは、1000MHz以上の高周波電源を用いてプラズマを発生させるものを言う。
【0045】
ここで、「マイクロプラズマリアクタ」とは、そのリアクタスケールが被処理ガスたる炭化水素/酸素火炎の消炎(クェンチング)距離より小さいリアクタを言う。被処理ガスがメタンを主成分として含む場合、このメタン/酸素火炎の消炎距離は約2000μmである(この「消炎距離」の詳細については、例えば、B Lewis et al, Combustion, flames and explosions of gases 3rd ed., Academic press, INC. 1987を参照することができる)。なお、本発明において、反応器の内径は前記消炎距離に必ずしも拘束されるものではない。
【0046】
非平衡プラズマ発生方法としてマイクロプラズマリアクタ方式を採用する場合、電圧の形状としては、サイン形状、パルス形状、のこぎり波形状、三角波形状、矩形波形状などを採用することができる。 このほか、直流を採用することができる。
【0047】
マイクロプラズマリアクタ方式を採用する場合、電圧(ピーク値)は5〜30 kVの範囲内にあることが好ましい。電圧が5〜30 kVの範囲内にあると、反応器内部の広い範囲をプラズマ化でき、炭化水素の部分酸化を促進できるという利点がある。
【0048】
マイクロプラズマリアクタ方式を採用する場合、電圧の周波数は1〜100kHzの範囲内にあることが好ましい。電圧の周波数が1kHz以上であると、短い滞留時間で炭化水素を処理できるため、マイクロリアクターでも十分な炭化水素転換率を得ることができるという利点がある。電圧の周波数が100 kHz以下であると、マイクロリアクターをよりコンパクトにして、かつ短い滞留時間でより多くの炭化水素を転換できるという利点がある。
【0049】
炭化水素としては、炭素数1〜10の飽和炭化水素、炭素数2〜10の不飽和炭化水素、炭素数6〜20の芳香族炭化水素、常温常圧で流動性のある炭化水素などを採用することができる。
【0050】
02/炭化水素(CnHmと表す)のモル比は0.1×(n+m/4)〜(n+m/4)の範囲内にあることが好ましい。部分酸化反応を引き起こすためには、02/炭化水素のモル比が0.1×(n+m/4)以上であることが好ましい。02/炭化水素のモル比が(n+m/4)以下であると、炭化水素の完全酸化を抑制して中間生成物である液体燃料を合成できるという利点がある。
【0051】
反応温度は-30〜25℃の範囲内にあることが好ましい。反応温度が-30℃より低いと、液体成分が凝固して反応器を閉塞させる可能性がある。反応温度が25℃を越えると、プラズマ反応場で合成された液体燃料が反応器壁で凝集しにくくなり、気相で生成物が再分解されてしまう。
【0052】
反応圧力は10〜200kPaの範囲内にあることが好ましい。反応圧力が10 kPa未満では、液体成分が凝縮し難くなり、気相で再分解される。また、減圧装置などが必要になりプロセスが煩雑になり炭化水素の大量処理が困難になる。反応圧力200 kPaを超えると、液体の供給、O2/炭化水素のモル比の調整などの合成条件の自由度が損なわれる。
【0053】
反応時間は10〜1000msの範囲にあることが好ましい。反応時間が10ms以上であると、メタンの転換率を高くできる利点がある。反応時間が1000ms以下であると、炭化水素の完全酸化を抑制して部分酸化反応を促進し液体成分の選択率を高くできるという利点がある。
【0054】
液体としては、蒸留水、純水、過酸化水素水溶液、アルカリ水溶液、酸性水溶液などから選ばれるいずれか1種、またはいずれか2種以上の混合物を採用することができる。
【0055】
液体を供給する供給手段としては、一般的に市販されている微量液体ポンプなどを採用することができる。
【0056】
液体の供給方法のパターンとしては、液体をパルス状に供給する方法、連続的に供給する方法などを採用することができる。
【0057】
液体をパルス状に供給する理由は次のとおりである。すなわち、液体を供給することでプラズマの発光が弱くなり、炭化水素転換率が低下する。したがって、液体がない時間帯に炭化水素の部分酸化反応を促進し、合成された液体成分を間欠的に反応器の外へ排出させるために液体をパルス状に供給する。
【0058】
液体をパルス状に供給する場合、液体を供給する時間(パルスの幅)は5〜30secの範囲内にあることが好ましい。液体を供給する時間が5secより短くなると、ポンプの性能によって正確な液体の供給が難しくなる。液体を供給する時間が30secより長くなると、連続的に液体を供給する場合の結果に近づく。つまり、過剰に液体を供給しても液体成分の再分解を抑制して選択性を増加させる効果がないだけでなく、炭化水素転換率が低下するため液体成分の収率が低下する。
【0059】
液体をパルス状に供給する場合、液体を供給しない時間(パルス間隔)は30〜500secの範囲内にあることが好ましい。液体を供給しない時間が30 secより短くなると、連続的に液体水を供給する場合の結果に近づく。つまり、プラズマの効果が液体によって相殺され、炭化水素の転換率を高く保つことが難しくなる。液体を供給しない時間が500 secより長くなると、液体を供給しない場合の結果に近づく。つまり、液体成分の再酸化が促進され選択性が低下する。
【0060】
液体をパルス状に供給する場合、液体の供給速度(液体体積換算)は0.1〜10cm3/minの範囲内にあることが好ましい。液体の供給速度が0.1〜10cm3/minの範囲内にあると、効率よく液体成分を排出できるという利点がある。
【0061】
酸化剤としては、過酸化水素(H2O2)などを採用することができる。
液体中の酸化剤の濃度は0.1〜5質量%の範囲内にあることが好ましい。酸化剤の濃度が0.1質量%未満では、気相ガス成分と酸化剤の相互作用が弱く十分な炭化水素転換率が得られない。酸化剤の濃度が5質量%を越えると、液体成分の過剰な分解が生じてしまう。
【0062】
以上のことから、本発明を実施するための形態によれば、炭化水素酸化装置は、炭化水素と酸素を含む反応器と、前記反応器の外側に配置された外部電極と、前記反応器の内側に配置された内部電極と、前記反応器に液体を供給する供給手段を有するものであり、また、前記液体は酸化剤を含む場合があるので、液体燃料を効率よく生成することができる。
【0063】
また、炭化水素の酸化方法は、炭化水素と酸素を含むガスに液体を供給し、非平衡プラズマで処理する方法であり、また、前記液体は酸化剤を含む場合があるので、液体燃料を効率よく生成することができる。
【0064】
ここで、液体燃料とは、原料の炭化水素を部分酸化して生成した液体成分、具体的には原料の炭化水素を酸化して生成したアルコール、アルデヒド、カルボン酸、ケトン、エーテル等の液体成分を言う。
【0065】
液体燃料は、液体燃料の用途に限定されない。このほか液体燃料は、水素、合成ガス(CO+H2)、ガソリン、灯油、軽油、ギ酸メチル、酢酸、エチレングリコール、アルコール類、アルコール混合物、オレフィン、パラフィンなどに転換され、工業的に利用できる。
【0066】
なお、本発明は上述の発明を実施するための形態に限らず本発明の要旨を逸脱することなくその他種々の構成を採り得ることはもちろんである。
【実施例】
【0067】
つぎに、本発明にかかる実施例について具体的に説明する。ただし、本発明はこれら実施例に限定されるものではないことはもちろんである。
【0068】
<液体の供給の効果>
【0069】
評価方法
図1は、本実施例で用いる炭化水素酸化装置の概要を示す図である。
反応器1は、内径1.5mm、肉厚1.5mm、長さ100mmの石英管を用いた。
反応器1の中に内部電極2を設置した。内部電極2としては、直径0.5 mmの円形断面を有するステンレスワイヤを用いた。このステンレスワイヤをらせん状に塑性加工をした。らせんのピッチは約2mmである。このらせん状の内部電極の長さは約100 mmである。
【0070】
反応器1の外周に外部電極3を設置した。外部電極3としては、反応器1の外周にアルミニウム箔を何重にも巻き付け、厚さ1mmとした。外部電極3の長さは50 mmである。
【0071】
内部電極2と外部電極3に高電圧電源7を接続した。高電圧電源7から発生する電圧の形状は両極性パルスであり、電圧はピーク値で20kVである。また、電圧の周波数は10kHzである。
【0072】
反応器1の上部からは、メタン(CH4)と酸素(O2)を混合して供給した。メタンと酸素の供給速度は、ともに20cm3/minである。すなわち、酸素(02)/ メタン(CH4)のモル比は1である。
また、反応器1の上部からは、純水4を供給した。純水4を供給する手段としては、液体供給ポンプ5を使用した。純水4の供給方法のパターン、及び供給速度については後述する。
【0073】
反応器1を氷水に浸漬して低温に維持した。氷水には熱電対を設置し温度を測定した。反応器1の上から、メタン(CH4)と酸素(O2)を供給し、また純水を供給するとともに、内部電極2と外部電極3の間に両極性パルス高電圧をかけることにより非平衡プラズマを発生させた。メタン(CH4)と酸素(O2)は非平衡プラズマを通過しながら反応をした。反応後の液体生成物と純水はコールドトラップ6で捕集し、気体はサンプリングバッグで捕集した。
反応中、氷水は0〜5℃に保持されていた。反応器2内の反応温度は、0〜20℃の範囲に維持されているものと推定される。反応圧力は、大気圧(101kPa)であった。原料ガス(メタンと酸素)の反応器1内での反応時間は132msであった。
【0074】
純水の供給方法のパターン、及び供給速度について、図2、表1を用いて説明する。図2、表1において、「b」は純水を供給する時間を示し、ここでは全て10secで統一した。また、「a」は純水を供給しない時間を示し、1〜5minと変化させた。また、「f」は純水の供給速度を示し、0.6〜3.0cm3/minと変化させた。
【0075】
表1において、「Synthesis time」は反応時間を示す。パルスの回数をN(回)としたとき、「Synthesis time(min)=a(min)×N」で表せる。また、「Inj. water」は純水の供給総量を示す。パルスの回数をN(回)としたとき、「Inj. Water(cm3)=f×(b/60)×N」で表せる。
【0076】
【表1】

【0077】
生成物の分析は次のように行った。前記の条件で、供給する原料ガスはGC((株)島津製作所製、GC-8A)で分析した。反対側から出る生成物は、コールドトラップにより液体成分を捕集し、常温常圧で液体成分となるものはGC-MS((株)島津製作所製、GC-17A,QP-5000)で、ガス成分はGC((株)島津製作所製、GC-8A)で分析した。
【0078】
評価結果
図3を用いて、実験結果を説明する。純水をパルス状に供給してメタンの部分酸化反応を実施した。純水の供給方法は図2に示した通りで、パルス間隔(図2でaに相当する)を1分、2分、3分、5分と変化させた。さらに、純水を供給しない条件「No injection」の結果も併記している。
【0079】
ここで、「Selectivity」(選択率)とは、反応したメタンの炭素のうち、Liquid(液体成分),CO,CO2,C2+C3などに分配された割合を百分率で示したものである。「C2+C3」において、C2は、炭素を2つ含む炭化水素で、エタン、エチレン、アセチレンを指す。また、C3は、炭素を3つ含む炭化水素で、プロパン、プロペン、プロピンを指す。「Liquid」(液体成分)とは、常温常圧で液体状にある物質であり、実験で得られたものとして、メタノール、ホルムアルデヒド、ギ酸の3成分を加えたものである。
【0080】
純水を供給しない「No injection」と比較して、純水を供給すると全ての条件においてLiquid(液体成分)が増加した。Liquid(液体成分)の選択率は、パルス間隔が1分の時に20.4%、パルス間隔が2分の時に21.3%、パルス間隔が3分の時に26.8%、パルス間隔が5分の時に20.6%である。純水を加えない場合は17.0%である。パルス間隔が3分の時に最大値を示している。パルス間隔が長すぎると、実質的に「No injection」に近い条件になるため、パルス間隔には最適値が存在すると思われる。
【0081】
<酸化剤含有液体の供給の効果>
【0082】
評価方法
本実施例では、過酸化水素を純水に添加し、過酸化水素水溶液を作製した。この過酸化水素水溶液4を反応器1の上から供給した。過酸化水素4の濃度は0.2〜2質量%と変化させた。また、過酸化水素水溶液4を供給する時間(b)は10secとし、過酸化水素水溶液4を供給しない時間(a)は3minとした。このほかの条件は、純水を供給した上述の実験条件と同様である。
【0083】
評価結果
図4を用いて、メタン転換率の結果を説明する。ここで、「転換率(Conversion)」とは、供給したメタンの炭素数に着目し、反応前後で減少したメタンの割合を百分率で表したものをいう。すなわち、以下の式で表すことができる。
転換率(%)={(供給したメタン)−(反応後のメタン)}/(供給したメタン)×100
【0084】
図4において、H2O2濃度が0.2質量%のとき、メタン転換率は15.1%であり、H2O2濃度が1質量%のとき、メタン転換率は17.6%であり、H2O2濃度が2質量%のとき、メタン転換率は24%に達した。なお、H2O2が0質量%(純水)のとき、メタン転換率は13.5%であった。このように、過酸化水素水溶液中のH2O2濃度を増加させると、メタンの転換率は単調に増加することが確認された。
【0085】
図5を用いて、選択率の結果を説明する。図5においてLiquid(液体成分)をみると、H2O2濃度が0.2質量%のとき、選択率は39%であり、H2O2濃度が1質量%のとき、選択率は55%であり、H2O2濃度が2質量%のとき、選択率は39%であった。なお、H2O2が0質量%(純水)のとき、選択率は27%であった。このように、過酸化水素水溶液中のH2O2濃度を増加させると、Liquid(液体成分)の選択率は増加するが、H2O2が1質量%のとき最大値を示すことが確認された。
【0086】
表2を用いて、収率の結果を説明する。ここで、各生成物に対する「収率(Yield)」の定義は以下の通りである。
各生成物の収率={メタン転換率(図4)}×{各生成物の選択率(図5)}
【0087】
この定義に従い、メタンの転換率と各生成物の選択率から、各生成物の収率を算出した。表2からわかるように、転換率、選択性が共に高いほどLiquid(液体成分)の収率は大きくなる。メタン転換率はH2O2濃度ともに単調に増加するが、Liquid(液体成分)の選択率には最大値があるので、Liquid(液体成分)の収率はH2O2が1質量%のとき、最大値9.7%を得ることが確認された。
【0088】
【表2】

【0089】
以上のことから、本実施例によれば、Liquid(液体成分)を効率よく生成することができる。
【符号の説明】
【0090】
1‥‥反応器、2‥‥内部電極、3‥‥外部電極、4‥‥純水(過酸化水素水溶液)、5‥‥液体供給ポンプ、6‥‥コールドトラップ、7‥‥高電圧電源
【特許請求の範囲】
【請求項1】
炭化水素と酸素を含む反応器と、
前記反応器の外側に配置された外部電極と、
前記反応器の内側に配置された内部電極と、
前記反応器に液体を供給する供給手段を有する
炭化水素酸化装置。
【請求項2】
液体は、酸化剤を含む
請求項1記載の炭化水素酸化装置。
【請求項3】
炭化水素は、炭素数1〜10の飽和炭化水素、炭素数2〜10の不飽和炭化水素、炭素数6〜20の芳香族炭化水素、常温常圧で流動性のある炭化水素である
請求項1または2記載の炭化水素酸化装置。
【請求項4】
液体は、蒸留水、純水、過酸化水素水溶液、アルカリ水溶液、酸性水溶液から選ばれるいずれか1種、またはいずれか2種以上の混合物である
請求項1または2記載の炭化水素酸化装置。
【請求項5】
酸化剤は、過酸化水素である
請求項2記載の炭化水素酸化装置。
【請求項6】
炭化水素は、炭素数1〜10の飽和炭化水素、炭素数2〜10の不飽和炭化水素、炭素数6〜20の芳香族炭化水素、常温常圧で流動性のある炭化水素であり、
液体は、蒸留水、純水、過酸化水素水溶液、アルカリ水溶液、酸性水溶液から選ばれるいずれか1種、またはいずれか2種以上の混合物である
請求項1記載の炭化水素酸化装置。
【請求項7】
炭化水素は、炭素数1〜10の飽和炭化水素、炭素数2〜10の不飽和炭化水素、炭素数6〜20の芳香族炭化水素、常温常圧で流動性のある炭化水素であり、
液体は、蒸留水、純水、過酸化水素水溶液、アルカリ水溶液、酸性水溶液から選ばれるいずれか1種、またはいずれか2種以上の混合物であり、
酸化剤は、過酸化水素である
請求項2記載の炭化水素酸化装置。
【請求項8】
炭化水素と酸素を含むガスに液体を供給し、非平衡プラズマで処理する
炭化水素の酸化方法。
【請求項9】
液体は、酸化剤を含む
請求項8記載の炭化水素の酸化方法。
【請求項10】
炭化水素は、炭素数1〜10の飽和炭化水素、炭素数2〜10の不飽和炭化水素、炭素数6〜20の芳香族炭化水素、常温常圧で流動性のある炭化水素である
請求項8または9記載の炭化水素の酸化方法。
【請求項11】
液体は、蒸留水、純水、過酸化水素水溶液、アルカリ水溶液、酸性水溶液から選ばれるいずれか1種、またはいずれか2種以上の混合物である
請求項8または9記載の炭化水素の酸化方法。
【請求項12】
酸化剤は、過酸化水素である
請求項9記載の炭化水素の酸化方法。
【請求項13】
炭化水素は、炭素数1〜10の飽和炭化水素、炭素数2〜10の不飽和炭化水素、炭素数6〜20の芳香族炭化水素、常温常圧で流動性のある炭化水素であり、
液体は、蒸留水、純水、過酸化水素水溶液、アルカリ水溶液、酸性水溶液から選ばれるいずれか1種、またはいずれか2種以上の混合物である
請求項8記載の炭化水素の酸化方法。
【請求項14】
炭化水素は、炭素数1〜10の飽和炭化水素、炭素数2〜10の不飽和炭化水素、炭素数6〜20の芳香族炭化水素、常温常圧で流動性のある炭化水素であり、
液体は、蒸留水、純水、過酸化水素水溶液、アルカリ水溶液、酸性水溶液から選ばれるいずれか1種、またはいずれか2種以上の混合物であり、
酸化剤は、過酸化水素である
請求項9記載の炭化水素の酸化方法。
【請求項1】
炭化水素と酸素を含む反応器と、
前記反応器の外側に配置された外部電極と、
前記反応器の内側に配置された内部電極と、
前記反応器に液体を供給する供給手段を有する
炭化水素酸化装置。
【請求項2】
液体は、酸化剤を含む
請求項1記載の炭化水素酸化装置。
【請求項3】
炭化水素は、炭素数1〜10の飽和炭化水素、炭素数2〜10の不飽和炭化水素、炭素数6〜20の芳香族炭化水素、常温常圧で流動性のある炭化水素である
請求項1または2記載の炭化水素酸化装置。
【請求項4】
液体は、蒸留水、純水、過酸化水素水溶液、アルカリ水溶液、酸性水溶液から選ばれるいずれか1種、またはいずれか2種以上の混合物である
請求項1または2記載の炭化水素酸化装置。
【請求項5】
酸化剤は、過酸化水素である
請求項2記載の炭化水素酸化装置。
【請求項6】
炭化水素は、炭素数1〜10の飽和炭化水素、炭素数2〜10の不飽和炭化水素、炭素数6〜20の芳香族炭化水素、常温常圧で流動性のある炭化水素であり、
液体は、蒸留水、純水、過酸化水素水溶液、アルカリ水溶液、酸性水溶液から選ばれるいずれか1種、またはいずれか2種以上の混合物である
請求項1記載の炭化水素酸化装置。
【請求項7】
炭化水素は、炭素数1〜10の飽和炭化水素、炭素数2〜10の不飽和炭化水素、炭素数6〜20の芳香族炭化水素、常温常圧で流動性のある炭化水素であり、
液体は、蒸留水、純水、過酸化水素水溶液、アルカリ水溶液、酸性水溶液から選ばれるいずれか1種、またはいずれか2種以上の混合物であり、
酸化剤は、過酸化水素である
請求項2記載の炭化水素酸化装置。
【請求項8】
炭化水素と酸素を含むガスに液体を供給し、非平衡プラズマで処理する
炭化水素の酸化方法。
【請求項9】
液体は、酸化剤を含む
請求項8記載の炭化水素の酸化方法。
【請求項10】
炭化水素は、炭素数1〜10の飽和炭化水素、炭素数2〜10の不飽和炭化水素、炭素数6〜20の芳香族炭化水素、常温常圧で流動性のある炭化水素である
請求項8または9記載の炭化水素の酸化方法。
【請求項11】
液体は、蒸留水、純水、過酸化水素水溶液、アルカリ水溶液、酸性水溶液から選ばれるいずれか1種、またはいずれか2種以上の混合物である
請求項8または9記載の炭化水素の酸化方法。
【請求項12】
酸化剤は、過酸化水素である
請求項9記載の炭化水素の酸化方法。
【請求項13】
炭化水素は、炭素数1〜10の飽和炭化水素、炭素数2〜10の不飽和炭化水素、炭素数6〜20の芳香族炭化水素、常温常圧で流動性のある炭化水素であり、
液体は、蒸留水、純水、過酸化水素水溶液、アルカリ水溶液、酸性水溶液から選ばれるいずれか1種、またはいずれか2種以上の混合物である
請求項8記載の炭化水素の酸化方法。
【請求項14】
炭化水素は、炭素数1〜10の飽和炭化水素、炭素数2〜10の不飽和炭化水素、炭素数6〜20の芳香族炭化水素、常温常圧で流動性のある炭化水素であり、
液体は、蒸留水、純水、過酸化水素水溶液、アルカリ水溶液、酸性水溶液から選ばれるいずれか1種、またはいずれか2種以上の混合物であり、
酸化剤は、過酸化水素である
請求項9記載の炭化水素の酸化方法。
【図1】


【図2】


【図3】


【図4】


【図5】




【図2】


【図3】


【図4】


【図5】


【公開番号】特開2011−1322(P2011−1322A)
【公開日】平成23年1月6日(2011.1.6)
【国際特許分類】
【出願番号】特願2009−147043(P2009−147043)
【出願日】平成21年6月19日(2009.6.19)
【出願人】(304021417)国立大学法人東京工業大学 (1,821)
【Fターム(参考)】
【公開日】平成23年1月6日(2011.1.6)
【国際特許分類】
【出願日】平成21年6月19日(2009.6.19)
【出願人】(304021417)国立大学法人東京工業大学 (1,821)
【Fターム(参考)】
[ Back to top ]

