炭酸ガスの固定法及びそのシステム
【課題】
大気中の炭酸ガスを固定する方法において、高濃度の炭酸ガスを使用しても培養が可能となり、また炭酸ガスを溶存する培養液を培養槽にほぼ均一に導入することが可能となり、更に、培養槽中の炭酸ガス溶存濃度を簡便に制御できる方法とシステムを提供する。
【解決手段】
本発明は、少なくとも炭酸ガスを供給する炭酸ガス源と、葉緑体保有原生動植物を培養するための培養液を少なくとも有する培養システムと、該炭酸ガス源から供給される炭酸ガスを少なくとも含む気体と培養液とから炭酸ガス溶存培養液を調製する炭酸ガス溶存培養液調製システムと、該炭酸ガス源と該炭酸ガス溶存培養液調製システムとを流体連通する少なくとも一本の炭酸ガス連通管と、該培養システムと該炭酸ガス溶存培養液調製システムとを流体連通する少なくとも2本の培養液連通管とを備えることを特徴とする炭酸ガス固定システムと、該システムを活用した炭酸ガス固定法である。
大気中の炭酸ガスを固定する方法において、高濃度の炭酸ガスを使用しても培養が可能となり、また炭酸ガスを溶存する培養液を培養槽にほぼ均一に導入することが可能となり、更に、培養槽中の炭酸ガス溶存濃度を簡便に制御できる方法とシステムを提供する。
【解決手段】
本発明は、少なくとも炭酸ガスを供給する炭酸ガス源と、葉緑体保有原生動植物を培養するための培養液を少なくとも有する培養システムと、該炭酸ガス源から供給される炭酸ガスを少なくとも含む気体と培養液とから炭酸ガス溶存培養液を調製する炭酸ガス溶存培養液調製システムと、該炭酸ガス源と該炭酸ガス溶存培養液調製システムとを流体連通する少なくとも一本の炭酸ガス連通管と、該培養システムと該炭酸ガス溶存培養液調製システムとを流体連通する少なくとも2本の培養液連通管とを備えることを特徴とする炭酸ガス固定システムと、該システムを活用した炭酸ガス固定法である。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は大気中に含まれる不要な炭酸ガスを固定して除去する方法及びそのシステムに関する。
【背景技術】
【0002】
大気中の炭酸ガスの濃度の上昇による地球的規模の問題が社会問題化している。この地球的規模の問題を解決する手段には各種の方法が提案されているが、これらの中でも、ユーグレナに属する原生動物や藻類により炭酸ガスを固定する方法が注目されている(特許文献1、特許文献2)。
【発明の開示】
【発明が解決しようとする課題】
【0003】
一般的に、ユーグレナに属する原生動物や淡水や海水中に生息する藻類(以下、「葉緑体保有原生動植物」と総称する)の細胞内の葉緑素による光合成においては、炭酸ガス濃度が高ければ高いほど、光合成スピードが速くなることが期待できる。
【0004】
また、葉緑体保有原生動植物の生息密度を高める方が設備スペースの節約にもなり好ましいので、そのような生息密度の高いコロニーの個々の葉緑体保有原生動植物にまんべんなく炭酸ガスを供給する為にも培養液中の炭酸ガスの溶存濃度を高める必要がある。
【0005】
しかしながら、ユーグレナに属する原生動物を使用する方法においては、培養液中に通気する気体中の炭酸ガス濃度が上昇すると、該原生動物の細胞中の炭酸同化タンパク質が変質してしまい、通気する炭酸ガスの濃度が約50%を超えると、当該原生動物が死滅すると言う問題があると言われている(非特許文献1)。
【0006】
非特許文献1には、下図に示すように、培養液中に通気する気体中の炭酸ガス濃度が15〜20%をピークとして、その濃度が上昇するに従ってユーグレナの増殖速度が減少し、60〜80%にも達すると逆に死滅するというユーグレナのユニークな特性が開示されている。
【0007】

出典:非特許文献1
【0008】
本発明者らは、この特性を確認すべく、下記に記載の比較例1にあるような実験条件で追試を行った結果、炭酸ガス濃度がほぼ100%になる気体をユーグレナの培養液中に直接通気したところ、確かに、殆どのユーグレナが死滅し、かつ、その死滅後の細胞の破片が培養液中に散乱すると言う現象を確認した(図8参照)。
【0009】
一方、淡水や海水中に生息する藻類により炭酸ガスを固定する場合においても培養液中に炭酸ガスを通気させることが一般的に行われているが、この場合、培養液中に通気する気体中の炭酸ガス濃度が上昇すると、培養液中に炭酸水素イオンや炭酸イオンが生成され、その結果、培養液のpHが低下して藻類が死滅すると言う問題が特許文献2に指摘されている。
【0010】
この問題を解決するために、特許文献2においては、培養液を電気分解することによりアルカリ性になるよう制御するためにpH調整手段を具備することが開示されているが、システム操作が複雑になると言う問題がある。例えば、電解質を含む水溶液を電気分解してアルカリ性を維持するとしても、アルカリ性が維持できる領域は陰極の周囲のみであり、陽極には電解質中の金属イオンが析出すると共に、その周囲には酸性領域を形成してしまうと言う問題があり、また、水溶液中の分子やイオンの拡散速度は極めて緩慢であるので、藻類を入れた槽が大きくなると槽内の水溶液のpHを均一に維持することが困難となる等々の問題があった。
【0011】
また、特許文献3に開示された低pH耐性の新規微細藻類であっても、非特許文献1に記載されたようなユーグレナの場合と同様な問題、即ち、培養液中に通気する気体中の炭酸ガス濃度がある値をピークとして、その濃度が上昇するに従って増殖速度が減少し、逆に死滅することが開示されている(下図参照)が、特許文献2にはこのような問題は認識されていなく、その解決手段も教示されていない。
【0012】

(出典:特許文献3)
【0013】
上記のような従来技術に内在する課題の原因について、本発明の技術的範囲を何ら制約することなく考察を加えるとすれば、以下のようなことが想定される。即ち、培養液中に炭酸ガスを含む気体を通気する場合には、その気体と培養液との接触面積を増大するために、炭酸ガスを含む気体ができるだけ小さなサイズの気泡となるように多孔質セラミックや中空糸等を介して培養液に通気することが一般的に行われているが、通気手段の如何を問わず、培養液中に現れる気泡中の圧力は大気圧を超えざるを得ない。このような場合、周知のヘンリーの法則により、気泡と液体との界面のごく近傍では、気泡から遠く離れた場所に比べて、また、大気圧下の場合と比較して、気泡中の炭酸ガスがより多く溶解することが想定される。これまた周知の通り、炭酸ガスが液体中に溶解すると、その液体のpHが低下し、極端な場合には、1とか2のような強酸性となることも想定される。例えば、特許文献3には、緩衝作用の強い海水ベースの培養液に炭酸ガスの分圧が20%の気体を吹き込むとpHが4程度まで低下することが開示されている。すると、偶然このような界面近傍に存在した個々の葉緑素保有原生動植物は、その細胞膜が強酸により溶解されることが想定される。このような現象は、通気により培養液中に発生した炭酸ガス含有気体の気泡の大きさよりも遙かに小さいサイズの葉緑体保有原生動植物においては顕著に現れることが想定される。
【0014】
しかしながら、水中を浮遊しつつ光合成を行う原生動物や微細藻類を活用する炭酸ガス固定法に関する特許文献1乃至特許文献3に代表される従来技術においては、上記のような課題は何ら認識されて来なかった。
【0015】
そこで、本発明者らは、炭酸ガスを簡便に効率良く固定し、更に固定された有機物を有効に活用できる炭酸ガス固定法を提供することを目的として鋭意研究した結果、驚くべきことに、炭酸ガスを培養液中に直接通気しない限りにおいては、あるいは、通気された炭酸ガス含有気体の気泡とユーグレナとが直接接触しない限りにおいては、炭酸ガスが実質的に飽和濃度(大気圧下)で溶解した培養液であっても、ユーグレナが死滅することなく、また、その光合成機能が何ら損なわれることがないことをここに初めて見いだし、この知見に基づいて、炭酸ガスの固定に使用される公知の葉緑体保有原生動植物を使いつつも培養液のpHを調整する必要もない簡便な炭酸ガス固定法及びそのシステムを開発し本発明を為すに至った。
【0016】
【特許文献1】特開2002−262858号公報
【特許文献2】特開2008−22740号公報
【特許文献3】特開平7−51051号公報
【非特許文献1】中野長久他、CELSS学会誌、10(21)、12−23ページ、1995
【非特許文献2】気象研究所技術報告、第41号、2000年、6頁
【課題を解決するための手段】
【0017】
すなわち本発明は、本発明と同じ発明者らにより発明された気液混合装置(国際出願番号PCT/JP2007/066197に開示の気液混合装置)を用い、炭酸ガスを大気圧下で実質的に飽和濃度で溶解する溶液中に炭酸ガスを封入したナノメートルサイズの気泡を含む(以下、「溶存」)炭酸ガス高濃度溶存培養液を別途調製し、この培養液をユーグレナに属する原生動物又は淡水や海水中に生息する藻類(特に、浮遊型微細藻類)の培養槽に供給することを特徴とする炭酸ガス固定法及びそのシステムである。
【0018】
本発明に好適に使用できるユーグレナに属する原生動物には、公知のユーグレナ・グラシリス(Euglena gracilis)株、ユーグレナ・グラシリス・クレブス(Klebs)株、ユーグレナ・グラシリス・バル・バチラリス(var bacillaris)株等や、これらの突然変異タイプや遺伝子組み換えタイプのものがあるが、これらに限定されることはない。
【0019】
また、本発明に好適に使用できる藻類は、公知の昆布、ワカメ、ヒジキ、モズク等の褐藻類、アサクサノリやテングサ等の紅藻類、アオコやアオノリ等の緑藻類があり、また、浮遊型藻類には、公知のクロレラやスピルリナ等の原生水中植物があるが、細胞内に葉緑体を含むものであれば、これらに限定されることはない。
【0020】
本発明に用いる培養液は光独立栄養型であっても光従属栄養型、あるいは従属栄養型であってもよいが、炭酸ガスを固定するという本発明の意図からすれば炭素ガスからの炭素以外には炭素源を含有しない光独立栄養型を用いるのが好ましい。
【0021】
炭素源を有する培養液としては、具体的にはクレマー−マイヤーズ(Cramer-Myers)型培養液(Arch. Microbiol., 17, 384〜402(1952))、やハットナー(Hutner)型培養液(Methods Enzymol., 23, 143〜162(1971))、コーレン−ハットナー(Koren-Hutner)型培養液(J. Protozool., 14, Suppl.17(1967))等の公知の培養液が好適に使用できる。また、これら各種の培養液を天然水、水道水、または海水等で希釈したもの、または栄養塩を含む海水や淡水も好適に使用できることは論を待たない。
【0022】
炭酸ガスを培養液に溶存させる方法としては、散気管等を使用した通常の通気による方法や超音波を活用する方法等々各種あるが、培養液中に溶解または溶存した炭酸ガスが大気中に散逸する速度を極力低減させると言う観点からは、本発明者らにより別途開発された気液混合方法が好適に使用される。
【0023】
窒素源としては、公知の有機窒素源である、硝酸アンモニウム、硫酸アンモニウム、第二リン酸アンモニウム、炭酸水素アンモニウムなどの公知の無機窒素源、グルタミン酸、アスパラギン酸、アルギニンなどのアミノ酸またはペプトン、酵母エキス、コーンスチーブリカー等々が使用できる。
【0024】
培養液に加える無機塩としては公知のカリウム、マグネシウム、カルシウム、鉄、マンガン、コバルト、亜鉛、ナトリウム、銅、ニッケル等々がある。
【0025】
微量栄養素としてビタミンB1、ビタミンB12などの公知の微量栄養素を添加して培養するのが好ましいが、必要に応じてその他の微量栄養素を添加してもよい。
【0026】
炭素源としては炭酸ガスから得られる炭素で足りるが、必要に応じて、公知の炭素源、例えば、グルコース、デンプン加水分解物、糖蜜加水分解物、グルタミン酸、酢酸、エタノール、メバロン酸、ラノステロール、エルゴステロール、ファルネソール、ゲラニオール、各種脂肪酸(C3〜C18)および各種脂肪アルコール(C3〜C18)などを添加してもよい。
【0027】
具体的に上記葉緑体保有原生動植物に炭酸ガスを固定させる方法の特徴は、これらの培養槽から培養液を取り出し、この取り出した培養液に本発明者らにより開発された気液混合装置を使用して炭酸ガスを溶存させることで調製された炭酸ガス溶存培養液を調製し、この調製された炭酸ガス溶存培養液を葉緑体保有原生動植物の培養槽に循環させることである。
【0028】
本発明に好適に使用される炭酸ガス溶存培養液は、その中に炭酸ガスを溶解した液体部分と、炭酸ガスあるいは炭酸ガスを含む気体を気体状で封入した気泡部分とから構成されているのが好ましいが、この気泡部分の存在は必ずしも必須ではない。この気泡部分が存在する場合には、その気泡のサイズは、培養する葉緑体保有原生動植物の体長(例えば、ユーグレナの場合は体長が30〜50μmであるので、その約100分の1(300〜500nm))よりも小さく、好ましくは、100nmより小さく、より好ましくは、2〜20nm程度の個々のナノバブル(直径がナノメートルサイズの気泡)から構成されていることを特徴とする培養液である。なお、このようなナノメートルサイズの気泡を以下、ナノバブルと呼称し、炭酸ガスを封入したナノバブルを、以下、炭酸ガス封入ナノバブルと呼称する。
【0029】
本発明に好適に使用される炭酸ガス封入ナノバブルの場合は、そのナノバブルの内圧は大気圧とナノバブルの存在する溶液中おいて加えられる液圧を超えることがないので、このような炭酸ガス封入ナノバブルを含む培養液は、常温常圧下に放置されても液中からの炭酸ガス封入ナノバブルの散逸が極めて緩慢である。特に、粒径が2〜20nm程度の場合は、これが顕著に見られる。従って、炭酸ガス封入ナノバブルの周辺の溶液中に溶解した炭酸ガスがユーグレナや浮遊型藻類に消費されることによりその周辺の溶液のpHが上昇しても、炭酸ガス封入ナノバブルの中に含まれている炭酸ガスがヘンリーの法則により平衡を保とうとしてその減少した分だけの炭酸ガスが周囲の溶液中に溶解されることが予期されるので、炭酸ガスを溶存させた培養液のpHの変動も少なくなることが予期される。
【0030】
炭酸ガスを含む気泡のサイズが約50nmを超えると液中からの気泡の散逸速度が大きくなり好ましいとは言えないが、本発明においては、このような大きなサイズの炭酸ガス含有気泡を含む培養液を排除するものではない。また、培養液中に炭酸ガスが所定濃度溶存するのであれば、炭酸ガス封入ナノバブルが全く培養液中に存在しなくてもかまわない。
【0031】
培養は炭酸ガス溶存培養液が循環される環境下でありさえすれば、静置培養であってもよいが、効率の良い培養を行うためには流動、振盪または撹拌しながら行うことが好ましい。この流動や攪拌には公知の方法が好適に使用できるが、循環される炭酸ガス溶存培養液を培養槽に戻すときにそれを培養槽に小さなノズルから圧入することによる攪拌効果を活用することもできる。また、炭酸ガス溶存培養液が培養槽中に均一に供給されるように多数の小さなノズルが略均等に具備されたプレート等を介して圧入することもできる。
【0032】
葉緑体保有原生動植物の培養は常温から30℃の条件下で行えばよいが、28〜30℃で行うのが最も好ましい。培養液のpHは培養液の組成や溶存させる炭酸ガスの濃度および炭酸ガス溶存培養液の注入量により異なるが、ユーグレナの場合を一例とすると、そのpHが2.8〜6.0であれば培養が可能でありpH3〜5で特に良好な生育を示すと言われている。本発明による固定法においてユーグレナを使用した場合には、ユーグレナは炭酸ガス溶存培養液のpHが2.8という酸性条件においても生育を示す為、特に培養液のpHの調整を行う必要はない。但し、培養液を所望によりアルカリでpHを調整することを完全に排除するものでもない。
【0033】
ここで、本発明の技術的範囲を何ら制約することなくユーグレナの特性について考察を加えるとすれば、以下のようなことが想定される。即ち、周知の通り、炭酸ガスは溶液中でCO2*(aq)とHCO3-とCO32-との間が平衡状態になるように存在し、それらの比率は溶液のpHによって変化する(下図参照)。

(出典:非特許文献2)
【0034】
一方、葉緑体保有原生動植物が細胞内の葉緑体で炭酸同化作用を行うには、その細胞膜を通して細胞の外から二酸化炭素を細胞内に一旦取り入れなくてならない。その場合、細胞膜の外側表面に有する炭酸脱水素酵素でもって周囲の炭酸水素イオンを二酸化炭素に変換した上で細胞内に取り込むもの(炭酸水素イオン利用型)と、そのような酵素を有することなく周囲から二酸化炭素の状態のままで細胞内に取り込むもの(炭酸水素イオン非利用型)とがある(一般的に、生物の細胞膜には二酸化炭素のような極性のない分子であれば通過できる孔があることが知られている)と言われている。ここで、例えば、ユーグレナの場合には、pHが4〜5付近で大きな増殖速度を呈すると言われているので、上記の平衡図を鑑みると、ユーグレナは炭酸水素イオン非利用型であることが予想される。してみると、特にユーグレナの場合には、培養液中に炭酸ガス封入ナノバブルが存在する場合の方がその生育環境的には好ましいことが期待される。
【0035】
炭酸ガスを効率よく固定するためには培養を常時光照射下で行うことが好ましいが、大量の炭酸ガスを経済的に処理するためには屋外に培養槽を置き、自然状態(日中太陽光照射、夜間は無照射)で培養を行っても良い。
【0036】
本発明によれば、ユーグレナに属する原生動物やクロレラ等の浮遊型藻類による公知の機能を活用することで炭酸ガスを効率良く固定するだけでなく、固定された有機物を栄養源として、また有用脂肪酸等の原料として用いることが可能である。
【0037】
培養液よりユーグレナに属する原生動物やクロレラ等の浮遊型藻類を分離するには、沈殿法、濾過もしくは遠心分離などの通常の固液分離法を用いればよい。ユーグレナに属する原生動物やクロレラ等の浮遊型藻類の菌体は比較的大きいため通常の方法で容易に回収できる。
【0038】
分離したユーグレナに属する原生動物やクロレラ等の浮遊型藻類は凍結乾燥、加熱乾燥、天日乾燥等の通常の方法で乾燥させた後、栄養源として家畜、魚類、稚蚕等の飼料に用いることができる。また、細胞成分の分離によりパラミロン、トレハロース、高度不飽和脂肪酸、ワックスエステル、ビタミン類が得られ、それぞれの特性に応じて高度な利用が可能である。
【0039】
本願発明の炭酸ガスの固定方法は、火力発電の排気ガス中に含まれる炭酸ガスや天然ガスの精製時に放出される炭酸ガス等の化石燃料の使用により放出される炭酸ガスを除去するのに特に有用である。例えば火力発電の排気ガス中には炭酸ガスが9%含有されているが、この排気ガス中の炭酸ガスを適当な方法で濃縮し、ユーグレナに属する原生動物やクロレラ等の浮遊型藻類の培養槽に導き有用な有機物として固定することにより炭酸ガスの大気中への放出を大幅に減少させることができる。
【発明の効果】
【0040】
本発明の方法により、培養槽に炭酸ガス(又は炭酸ガスを含む気体)を直接通気する方法と比較して、高濃度の炭酸ガスを使用しても培養が可能となり、また炭酸ガスを溶存する培養液を培養槽にほぼ均一に導入することが可能となり、更に、培養槽中の炭酸ガス溶存濃度を簡便に制御できるシステムを提供することで、炭酸ガスを効率良く簡便に資化固定することが可能となる。さらに本発明による炭酸ガスの固定により得られる有機物は様々な用途に有用である。
【発明を実施するための最良の形態】
【0041】
次に、本発明に係る炭酸ガス固定システムの一実施態様について図面を参照して説明する。
【0042】
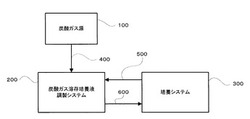
図1は本実施態様の炭酸ガス固定システムの概念図を示す。同図に示すように、本実施態様の炭酸ガス固定システムは、炭酸ガス源100と、炭酸ガス溶存培養液調製システム200と、ユーグレナに属する原生動物やクロレラ等の浮遊型藻類の培養システム300とを備えている。
【0043】
培養液に溶存させる炭酸ガスは、炭酸ガス源100から連通管400を通って培養液調製システム200に供給される。この場合に供給される炭酸ガスは大気圧以上に加圧されていてもいなくても良い。なお、炭酸ガス源として火力発電所等からの排ガスを使用する場合には、その排ガス中に含まれるNOxやSOxを公知の方法で除去する必要があることは論を待たない。
【0044】
培養システムにおいてユーグレナに属する原生動物やクロレラ等の浮遊型藻類を光独立型栄養により培養する場合には、増殖に伴い培養液中の炭酸ガスが消費されて炭酸ガスの溶存濃度が低下するが、この炭酸ガスの溶存濃度が低下した培養液は培養システム300と培養液調製システム200とを流体的に連通する培養液連通管500を通じて培養液調製システム200に供給される。
【0045】
培養液連通管500を通じて培養液調製システム200に供給された炭酸ガスの溶存濃度が低下した培養液は、この培養液調製システム200の中で以下詳述するように磁場内に設置されたベンチュリー管を利用して炭酸ガス源100から連通管400を通って供給される炭酸ガスと気液混合される。
【0046】
培養液調製システム200により炭酸ガスを所定の濃度溶存するように調製された炭酸ガス溶存培養液は培養液調製システム200と培養システム300とを流体的に連通する炭酸ガス溶存培養液連通管600を通じて培養システム300に供給される。
【0047】
図2は図1における炭酸ガス溶存培養液調製システム200の概念図である。同図に示すように、培養液調製システム200は、排気装置210と、脱気装置220と、エジェクター(又はベンチュリー管)230と、磁気発生装置240と、炭酸ガス溶存培養液貯蔵タンク250と、第1ポンプ260と、第2ポンプ270とを備え、これらが図示されるように相互に流体連通している。
【0048】
培養液貯蔵タンク250に一旦貯蔵された培養液は、第1ポンプ260により培養液貯蔵タンク250から取り出されて、磁気発生装置240の中に具備されたエジェクター230の中を圧送させられる。
【0049】
本発明を何ら限定することなくエジェクター230の中での現象を推察すると以下のようになろう。この圧送される過程でアスピレーション作用により炭酸ガス源100から炭酸ガス(又は炭酸ガスを含む気体)が吸引されると共にエジェクター230を通過して急激に減圧されて噴霧状あるいは蒸気状になった培養液とが混合される。このとき培養液の微細な液滴の周囲には炭酸ガスが充満しているので、ヘンリーの法則により、この液滴の表面を介して炭酸ガスが個々の液滴の中に溶解する。次に、炭酸ガスを溶解した液滴と炭酸ガスとの混合物が磁場内で個々の液滴の表面張力により再度相互に合体する過程で更に炭酸ガスを気体のまま極めて微細(ナノメートルのオーダー)な気泡の中に封入する。このようにして炭酸ガスを溶解した培養液の中にナノサイズの炭酸ガス気泡を含む炭酸ガス溶存培養液が生成される。
【0050】
但し、この段階で生成された炭酸ガス溶存培養液には、ナノサイズの炭酸ガス気泡の他にミクロンサイズやミリサイズのような巨大な炭酸ガス気泡も含まれるので、これを脱気装置220に移してこのような巨大な炭酸ガス気泡を除去する。
【0051】
脱気装置220の中で巨大な炭酸ガス気泡が除去された炭酸ガス溶存培養液は、再度、培養液貯蔵タンク250に移され、炭酸ガスの溶存濃度及び炭酸ガスのナノバブルの粒径分布の特性が所定の値になるまで上記ステップが繰り返される。
【0052】
ここで注目すべき点は、以下に述べるように、本発明のシステムにおいては、炭酸ガスの溶存濃度は所定の処理時間が経過すると自動的に平衡に達するので、エジェクター230の中で気液混合する気体の中に含まれる炭酸ガスの比率を制御しさえすれば、ヘンリーの法則により、炭酸ガスの分圧に応じた溶解挙動を呈するので、培養液中にはこの分圧に応じた炭酸ガスが溶解されることである。このことにより、炭酸ガス溶存培養液調製システム200には炭酸ガス溶存濃度計を具備する必要がなく、システムが簡便になると言うメリットがある。
【0053】
炭酸ガス溶存濃度は、例えば、エジェクター230の中を圧送される培養液の供給速度が6リットル/分で、炭酸ガスほぼ100%の気体を4リットル/分気液混合した場合は、この繰り返し時間が160分から180分で平衡に達する。図3は、オルガノ製18MΩのイオン交換純水装置により処理して得られた純水に上記の方法で炭酸ガスを気液混合した場合の炭酸ガス溶存濃度(縦軸)と処理時間(横軸)との関係を示すグラフである。このときの水の総量は180リットルで、炭酸ガス溶存濃度は水酸化ナトリウムによる適定方式で計測した。
【0054】
また、この平衡状態に達した炭酸ガス溶存水の中に含まれる炭酸ガス封入ナノバブルの大きさを堀場製作所製の動的光散乱式粒度分布測定装置(LB−550)により測定した得られた粒度分布結果を図4に示す。同図において縦軸は頻度(%)を表し横軸は粒子径(nm)を対数軸で表す。同図に示すように、炭酸ガス封入ナノバブルの殆どが2〜20nmの範囲のサイズで存在することが理解できる。
【0055】
炭酸ガスを封入した気泡をこのようなナノメートルサイズにするメリットの一つには、浮力の効果が実質的に無くなることであり、この結果、炭酸ガス封入ナノバブルが液中から散逸しなくなる、あるいは、散逸したとしても、極めて少量となることである。このことは、ひいては、炭酸ガスナノバブルを含有すると同時に炭酸ガスを液中に溶解している培養液の場合には、溶液中に溶解した炭酸ガスがユーグレナや浮遊型藻類に消費されることによりその周辺の溶液のpHが上昇しても、炭酸ガス含有ナノバブルの中に含まれている炭酸ガスがヘンリーの法則により平衡を保とうとしてその減少した分だけの炭酸ガスが溶解されることが期待されるので、炭酸ガスを溶存させた培養液のpHの変動も少なくなることが期待される。
【0056】
炭酸ガス溶存培養液調製システム200において調整されて所定の炭酸ガス溶存濃度を有するようになった炭酸ガス溶存培養液は、次に、炭酸ガス溶存培養液連通管600を通じて培養システム300に供給される。
【0057】
光独立型栄養による培養の場合における炭酸ガス溶存培養液の供給量は、ユーグレナを一例とすると、乾重量20gのユーグレナはパラミンとして二酸化炭素を約3g〜14g固定すると言われているので、この比率に合わせて適宜選択される。
【0058】
本発明においては、炭酸ガス溶解濃度が20℃大気圧で飽和濃度になる炭酸ガス溶存培養液を使用することを基本としているが、その場合の供給量が後述するように培養槽中のユーグレナや浮遊型藻類の攪拌に必要な流量に達しない場合には、炭酸ガス溶存培養液調製システム200に供給される炭酸ガス含有気体中の炭酸ガスの比率を低下させることで炭酸ガス溶存培養液調製システム200により調製される炭酸ガス溶存培養液中の炭酸ガス濃度を低減させ、その反面、供給される二酸化炭素の総量が同一となるように供給量を適宜増大させることができる。
【0059】
また、培養する微生物の種類によっては、炭酸ガスと共に酸素も必要とする場合があるが、そのような場合には、炭酸ガス溶存培養液調製システム200と同様な機構の酸素溶存培養液調製システムを更に加えることも可能である。また、炭酸ガス源として炭酸ガスと酸素とを所定の比率で含む気体を使用することにより、それぞれの分圧に応じた溶存濃度を有する培養液を得ることも可能である。
【0060】
図5は本発明による培養システム300の概念図である。同図に示すように、培養システム300は、培養増310と、供給培養液分散手段320と、ヒーター360(オプショナル)と、ロータリースクリーン330と、光源340(室内培養の場合)とを備えている。
【0061】
培養槽310の設置場所は屋外、屋内いずれに設置しても良い。屋外の場合は、例えば陸上、海上に設置される。
【0062】
培養槽310において培養するユーグレナ等の葉緑体保有原生動植物のコロニー密度は特に制限は無いが葉緑体保有原生動植物は供給される炭酸ガスを消費して増殖するので、所定の期間増殖された後には培養槽310から取り出して、適宜最適な密度に保つようにすることが好ましい。
【0063】
炭酸ガス溶存培養液調製システム200にて調製された炭酸ガス溶存培養液は、流体連通管600を通り、供給培養液分散手段320を介して培養槽310に供給される。
【0064】
供給培養液分散手段320は、液体中の炭酸ガスや炭酸水素イオン等の拡散速度が極めて緩慢なので、培養槽310中のユーグレナ等の微生物にできる限り均一に炭酸ガスが供給されるようにすると同時に、炭酸ガス溶存培養液を圧入するときに発生する乱流を活用して培養槽310の内部を攪拌する効果をも期待されるが、本発明においては、必須ではない。
【0065】
培養槽310にはその周囲にヒーター360を具備しても良いが、このヒーター360は必須ではない。
【0066】
ロータリースクリーン330は、培養槽310から葉緑体保有原生動植物共々培養液を取り出し葉緑体保有原生動植物と培養液とを分離し、分離された葉緑体保有原生動植物を培養槽310に戻り管350を介して戻し、培養液のみを流体連通管500を介して炭酸ガス溶存培養液調製システム200に供給するためのものである。
【0067】
室内で培養する場合には、光源340には、赤色、緑色、青色のLED群を有する照明からの光源、あるいは、白色LED群を有する照明からの光源が好適に使用できる。また、屋外の太陽光を光ファイバでもって培養槽310内に導光して照射するようにしても良い。これによって室内でも葉緑体保有原生動植物の培養が可能となる。
【0068】
LEDを利用して室内で培養する場合には、培養槽310の底に光検出器710(図示せず)を設置して、この光検出器710からの信号を図6にその概念図を示す制御システムに出力させ、図6の制御システムにより照射光量を調節できるようにしても良い。
【0069】
図6にその概念図を示す制御システムは、公知の技術を使用して、照射光量と共に炭酸ガス溶存濃度をも制御できるように構成されているが、この場合、培養槽310中の溶存炭酸ガス濃度検出器740(図6中には図示せず)からの信号に基づいて図2中に参照番号280で示された電磁バルブが操作されるように構成できる(制御配線等は図示せず)。
【0070】
一般に、液体中のガスやイオンの拡散速度は極めて緩慢であるので、培養槽310に直接炭酸ガス(あるいは炭酸ガスを含む気体)を通気することで溶存炭酸ガス濃度を所望のレベルに正確に維持することは、通気により発生する気泡の近傍ではヘンリーの法則によりその気泡の中の炭酸ガスの分圧に等しい濃度の炭酸ガス溶存培養液が得られるが、その気泡から離れた箇所の炭酸ガス溶存濃度は依然変化しないと言う現象が生じるので、非常に困難であるが、本発明の場合には、予め均一に炭酸ガスが溶存した培養液を培養槽310に導入するので培養槽310中の溶存炭酸ガス濃度の制御がより容易になる。
【0071】
以上が最良な実施形態であるが、上述した実施態様や変形実施態様の一部又は全部を適宜組み合わせても良いし、本発明は上記実施態様に限定されることなく、その趣旨を逸脱しない範囲で種々の変形が可能であることは言うまでもない。
【0072】
以下本願発明を実施例を用いてさらに詳細に説明する。
使用したユーグレナ:独立行政法人国立環境研究所から、ユーグレナ・グラシリス(Euglena gracilis)(分類番号NIES-48)の入った15ml入り培養原液を4本入手して、これを、寒天培地を含むハットナー(Hutner)培地4リットルを、3段階で液増量しながら、各段階7日間で培養した。このときのユーグレナのサイズは、体長が30μm〜50μmである。培養中は恒温水槽にて水温を25〜26℃に保持し、12時間太陽光に加えてLEDランプ(培養に用いた三角フラスコ表面で1700ルクス以上)を照射し、次に12時間無光状態にて保持して、ユーグレナ培養原液を調製した。どちらの場合にも、適量の大気の散気管による通気を行った。
【0073】
実施例1:図2の炭酸ガス溶存培養液調製システムを使用して炭酸ガス溶存培養液を調製した。このとき使用した培養液は、オルガノ製18MΩのイオン交換純水装置により処理して得られた30リットルの純水に5%濃度でHUT培地(但し、寒天培地は含まない)を1.5リットル加えて混合して調製した。得られた培養液を図2の炭酸ガス溶存培養液調製システムに投入して、タンク他配管内の液総量を30リットルのレベルに調整し、毎分4リットル(常温常圧)の炭酸ガス(ほぼ100%濃度)を磁気作用併用エジェクターにて循環混合して炭酸ガス溶存培養液を調製した。これにより得られた炭酸ガス溶存培養液中の炭酸ガス溶解濃度は1670ppmであった。このとき用いた炭酸ガス溶解濃度計測装置は、島津製作所製の5000Aであった。次に、この炭酸ガス溶解培養液900ミリリットルを100ミリリットルの上記ユーグレナ培養原液の入ったガラス容器に加えてユーグレナを培養した。
【0074】
比較例1:実施例1と同様にしてオルガノ製18MΩのイオン交換純水装置により処理して得られた30リットルの純水に5%濃度でHUT培地(但し、寒天培地は含まない)を1.5リットル加えて混合して炭酸ガスを溶解しない培養液を調製した。この培養液900ミリリットルを100ミリリットルの上記ユーグレナ培養原液の入ったガラス容器に加えてユーグレナを培養した。次に、このガラス容器の中のユーグレナ培養液に、実施例1の混合炭酸ガス量(120リットル(4リットル×30分)を30リットルの培養液と気液混合した)と同じになるように、毎分1リットルの炭酸ガス(ほぼ100%濃度)を炭酸ガスボンベから直接、4分間、散気管を介して通気した。
【0075】
ユーグレナの生育状態の確認:上記実施例1と比較例1で培養したユーグレナの一部を東京都産業技術センター駒沢支所に持ち込み顕微鏡下で生育状態の確認を行った結果、顕微鏡写真1及び2にある小さな升80枠にある数をカウントし、その1000倍が1ミリリットル中の数として算出したときの数は、それぞれ以下の通りとなった。
実施例1:275個×1000倍=275,000個(図7参照)
比較例1:8個×1000倍=8,000個(図8参照)
なお、比較例1においては、ユーグレナが破壊分解したと思われる破片が多数確認されると共に、生きているユーグレナも殆ど動かず健康ではないと思われた。
【図面の簡単な説明】
【0076】
【図1】図1は、本発明の炭酸ガス固定システムの概念図である。
【図2】図2は、本発明の炭酸ガス溶存培養液調製システムの概念図である。
【図3】図3は、オルガノ製18MΩのイオン交換純水装置により処理して得られた純水に本発明の方法で炭酸ガスを気液混合した場合の炭酸ガス溶存濃度(縦軸)と処理時間(横軸)との関係を示すグラフである。
【図4】図4は、図3において平衡状態に達した炭酸ガス溶存水の中に含まれる炭酸ガス封入ナノバブルの大きさを堀場製作所製の動的光散乱式粒度分布測定装置(LB−550)により測定した得られた粒度分布結果を示す。
【図5】図5は、本発明の培養システムの概念図である。
【図6】図6は、本発明に使用できる照射光・炭酸ガス溶存濃度制御システムの概念図である。
【図7】図7は、実施例1によるユーグレナの生育状態を示す顕微鏡写真(×1,000)である。
【図8】図8は、比較例1によるユーグレナの死滅状態を示す顕微鏡写真(×1,000)である。
【符号の説明】
【0077】
100 炭酸ガス源
200 炭酸ガス溶存培養液調製システム
210 排気装置
230 エジェクター
240 磁気発生装置
250 タンク
260 第1ポンプ
270 第2ポンプ
300 培養システム
310 戻り管
320 供給培養液分散手段
330 ロータリースクリーン
340 排出管
360 ヒーター
700 制御システム
710 光検出器
720 光制御部
730 照明装置
740 溶存炭酸ガス濃度検出器
750 濃度制御部
760 炭酸ガス溶存培養液
【技術分野】
【0001】
本発明は大気中に含まれる不要な炭酸ガスを固定して除去する方法及びそのシステムに関する。
【背景技術】
【0002】
大気中の炭酸ガスの濃度の上昇による地球的規模の問題が社会問題化している。この地球的規模の問題を解決する手段には各種の方法が提案されているが、これらの中でも、ユーグレナに属する原生動物や藻類により炭酸ガスを固定する方法が注目されている(特許文献1、特許文献2)。
【発明の開示】
【発明が解決しようとする課題】
【0003】
一般的に、ユーグレナに属する原生動物や淡水や海水中に生息する藻類(以下、「葉緑体保有原生動植物」と総称する)の細胞内の葉緑素による光合成においては、炭酸ガス濃度が高ければ高いほど、光合成スピードが速くなることが期待できる。
【0004】
また、葉緑体保有原生動植物の生息密度を高める方が設備スペースの節約にもなり好ましいので、そのような生息密度の高いコロニーの個々の葉緑体保有原生動植物にまんべんなく炭酸ガスを供給する為にも培養液中の炭酸ガスの溶存濃度を高める必要がある。
【0005】
しかしながら、ユーグレナに属する原生動物を使用する方法においては、培養液中に通気する気体中の炭酸ガス濃度が上昇すると、該原生動物の細胞中の炭酸同化タンパク質が変質してしまい、通気する炭酸ガスの濃度が約50%を超えると、当該原生動物が死滅すると言う問題があると言われている(非特許文献1)。
【0006】
非特許文献1には、下図に示すように、培養液中に通気する気体中の炭酸ガス濃度が15〜20%をピークとして、その濃度が上昇するに従ってユーグレナの増殖速度が減少し、60〜80%にも達すると逆に死滅するというユーグレナのユニークな特性が開示されている。
【0007】

出典:非特許文献1
【0008】
本発明者らは、この特性を確認すべく、下記に記載の比較例1にあるような実験条件で追試を行った結果、炭酸ガス濃度がほぼ100%になる気体をユーグレナの培養液中に直接通気したところ、確かに、殆どのユーグレナが死滅し、かつ、その死滅後の細胞の破片が培養液中に散乱すると言う現象を確認した(図8参照)。
【0009】
一方、淡水や海水中に生息する藻類により炭酸ガスを固定する場合においても培養液中に炭酸ガスを通気させることが一般的に行われているが、この場合、培養液中に通気する気体中の炭酸ガス濃度が上昇すると、培養液中に炭酸水素イオンや炭酸イオンが生成され、その結果、培養液のpHが低下して藻類が死滅すると言う問題が特許文献2に指摘されている。
【0010】
この問題を解決するために、特許文献2においては、培養液を電気分解することによりアルカリ性になるよう制御するためにpH調整手段を具備することが開示されているが、システム操作が複雑になると言う問題がある。例えば、電解質を含む水溶液を電気分解してアルカリ性を維持するとしても、アルカリ性が維持できる領域は陰極の周囲のみであり、陽極には電解質中の金属イオンが析出すると共に、その周囲には酸性領域を形成してしまうと言う問題があり、また、水溶液中の分子やイオンの拡散速度は極めて緩慢であるので、藻類を入れた槽が大きくなると槽内の水溶液のpHを均一に維持することが困難となる等々の問題があった。
【0011】
また、特許文献3に開示された低pH耐性の新規微細藻類であっても、非特許文献1に記載されたようなユーグレナの場合と同様な問題、即ち、培養液中に通気する気体中の炭酸ガス濃度がある値をピークとして、その濃度が上昇するに従って増殖速度が減少し、逆に死滅することが開示されている(下図参照)が、特許文献2にはこのような問題は認識されていなく、その解決手段も教示されていない。
【0012】

(出典:特許文献3)
【0013】
上記のような従来技術に内在する課題の原因について、本発明の技術的範囲を何ら制約することなく考察を加えるとすれば、以下のようなことが想定される。即ち、培養液中に炭酸ガスを含む気体を通気する場合には、その気体と培養液との接触面積を増大するために、炭酸ガスを含む気体ができるだけ小さなサイズの気泡となるように多孔質セラミックや中空糸等を介して培養液に通気することが一般的に行われているが、通気手段の如何を問わず、培養液中に現れる気泡中の圧力は大気圧を超えざるを得ない。このような場合、周知のヘンリーの法則により、気泡と液体との界面のごく近傍では、気泡から遠く離れた場所に比べて、また、大気圧下の場合と比較して、気泡中の炭酸ガスがより多く溶解することが想定される。これまた周知の通り、炭酸ガスが液体中に溶解すると、その液体のpHが低下し、極端な場合には、1とか2のような強酸性となることも想定される。例えば、特許文献3には、緩衝作用の強い海水ベースの培養液に炭酸ガスの分圧が20%の気体を吹き込むとpHが4程度まで低下することが開示されている。すると、偶然このような界面近傍に存在した個々の葉緑素保有原生動植物は、その細胞膜が強酸により溶解されることが想定される。このような現象は、通気により培養液中に発生した炭酸ガス含有気体の気泡の大きさよりも遙かに小さいサイズの葉緑体保有原生動植物においては顕著に現れることが想定される。
【0014】
しかしながら、水中を浮遊しつつ光合成を行う原生動物や微細藻類を活用する炭酸ガス固定法に関する特許文献1乃至特許文献3に代表される従来技術においては、上記のような課題は何ら認識されて来なかった。
【0015】
そこで、本発明者らは、炭酸ガスを簡便に効率良く固定し、更に固定された有機物を有効に活用できる炭酸ガス固定法を提供することを目的として鋭意研究した結果、驚くべきことに、炭酸ガスを培養液中に直接通気しない限りにおいては、あるいは、通気された炭酸ガス含有気体の気泡とユーグレナとが直接接触しない限りにおいては、炭酸ガスが実質的に飽和濃度(大気圧下)で溶解した培養液であっても、ユーグレナが死滅することなく、また、その光合成機能が何ら損なわれることがないことをここに初めて見いだし、この知見に基づいて、炭酸ガスの固定に使用される公知の葉緑体保有原生動植物を使いつつも培養液のpHを調整する必要もない簡便な炭酸ガス固定法及びそのシステムを開発し本発明を為すに至った。
【0016】
【特許文献1】特開2002−262858号公報
【特許文献2】特開2008−22740号公報
【特許文献3】特開平7−51051号公報
【非特許文献1】中野長久他、CELSS学会誌、10(21)、12−23ページ、1995
【非特許文献2】気象研究所技術報告、第41号、2000年、6頁
【課題を解決するための手段】
【0017】
すなわち本発明は、本発明と同じ発明者らにより発明された気液混合装置(国際出願番号PCT/JP2007/066197に開示の気液混合装置)を用い、炭酸ガスを大気圧下で実質的に飽和濃度で溶解する溶液中に炭酸ガスを封入したナノメートルサイズの気泡を含む(以下、「溶存」)炭酸ガス高濃度溶存培養液を別途調製し、この培養液をユーグレナに属する原生動物又は淡水や海水中に生息する藻類(特に、浮遊型微細藻類)の培養槽に供給することを特徴とする炭酸ガス固定法及びそのシステムである。
【0018】
本発明に好適に使用できるユーグレナに属する原生動物には、公知のユーグレナ・グラシリス(Euglena gracilis)株、ユーグレナ・グラシリス・クレブス(Klebs)株、ユーグレナ・グラシリス・バル・バチラリス(var bacillaris)株等や、これらの突然変異タイプや遺伝子組み換えタイプのものがあるが、これらに限定されることはない。
【0019】
また、本発明に好適に使用できる藻類は、公知の昆布、ワカメ、ヒジキ、モズク等の褐藻類、アサクサノリやテングサ等の紅藻類、アオコやアオノリ等の緑藻類があり、また、浮遊型藻類には、公知のクロレラやスピルリナ等の原生水中植物があるが、細胞内に葉緑体を含むものであれば、これらに限定されることはない。
【0020】
本発明に用いる培養液は光独立栄養型であっても光従属栄養型、あるいは従属栄養型であってもよいが、炭酸ガスを固定するという本発明の意図からすれば炭素ガスからの炭素以外には炭素源を含有しない光独立栄養型を用いるのが好ましい。
【0021】
炭素源を有する培養液としては、具体的にはクレマー−マイヤーズ(Cramer-Myers)型培養液(Arch. Microbiol., 17, 384〜402(1952))、やハットナー(Hutner)型培養液(Methods Enzymol., 23, 143〜162(1971))、コーレン−ハットナー(Koren-Hutner)型培養液(J. Protozool., 14, Suppl.17(1967))等の公知の培養液が好適に使用できる。また、これら各種の培養液を天然水、水道水、または海水等で希釈したもの、または栄養塩を含む海水や淡水も好適に使用できることは論を待たない。
【0022】
炭酸ガスを培養液に溶存させる方法としては、散気管等を使用した通常の通気による方法や超音波を活用する方法等々各種あるが、培養液中に溶解または溶存した炭酸ガスが大気中に散逸する速度を極力低減させると言う観点からは、本発明者らにより別途開発された気液混合方法が好適に使用される。
【0023】
窒素源としては、公知の有機窒素源である、硝酸アンモニウム、硫酸アンモニウム、第二リン酸アンモニウム、炭酸水素アンモニウムなどの公知の無機窒素源、グルタミン酸、アスパラギン酸、アルギニンなどのアミノ酸またはペプトン、酵母エキス、コーンスチーブリカー等々が使用できる。
【0024】
培養液に加える無機塩としては公知のカリウム、マグネシウム、カルシウム、鉄、マンガン、コバルト、亜鉛、ナトリウム、銅、ニッケル等々がある。
【0025】
微量栄養素としてビタミンB1、ビタミンB12などの公知の微量栄養素を添加して培養するのが好ましいが、必要に応じてその他の微量栄養素を添加してもよい。
【0026】
炭素源としては炭酸ガスから得られる炭素で足りるが、必要に応じて、公知の炭素源、例えば、グルコース、デンプン加水分解物、糖蜜加水分解物、グルタミン酸、酢酸、エタノール、メバロン酸、ラノステロール、エルゴステロール、ファルネソール、ゲラニオール、各種脂肪酸(C3〜C18)および各種脂肪アルコール(C3〜C18)などを添加してもよい。
【0027】
具体的に上記葉緑体保有原生動植物に炭酸ガスを固定させる方法の特徴は、これらの培養槽から培養液を取り出し、この取り出した培養液に本発明者らにより開発された気液混合装置を使用して炭酸ガスを溶存させることで調製された炭酸ガス溶存培養液を調製し、この調製された炭酸ガス溶存培養液を葉緑体保有原生動植物の培養槽に循環させることである。
【0028】
本発明に好適に使用される炭酸ガス溶存培養液は、その中に炭酸ガスを溶解した液体部分と、炭酸ガスあるいは炭酸ガスを含む気体を気体状で封入した気泡部分とから構成されているのが好ましいが、この気泡部分の存在は必ずしも必須ではない。この気泡部分が存在する場合には、その気泡のサイズは、培養する葉緑体保有原生動植物の体長(例えば、ユーグレナの場合は体長が30〜50μmであるので、その約100分の1(300〜500nm))よりも小さく、好ましくは、100nmより小さく、より好ましくは、2〜20nm程度の個々のナノバブル(直径がナノメートルサイズの気泡)から構成されていることを特徴とする培養液である。なお、このようなナノメートルサイズの気泡を以下、ナノバブルと呼称し、炭酸ガスを封入したナノバブルを、以下、炭酸ガス封入ナノバブルと呼称する。
【0029】
本発明に好適に使用される炭酸ガス封入ナノバブルの場合は、そのナノバブルの内圧は大気圧とナノバブルの存在する溶液中おいて加えられる液圧を超えることがないので、このような炭酸ガス封入ナノバブルを含む培養液は、常温常圧下に放置されても液中からの炭酸ガス封入ナノバブルの散逸が極めて緩慢である。特に、粒径が2〜20nm程度の場合は、これが顕著に見られる。従って、炭酸ガス封入ナノバブルの周辺の溶液中に溶解した炭酸ガスがユーグレナや浮遊型藻類に消費されることによりその周辺の溶液のpHが上昇しても、炭酸ガス封入ナノバブルの中に含まれている炭酸ガスがヘンリーの法則により平衡を保とうとしてその減少した分だけの炭酸ガスが周囲の溶液中に溶解されることが予期されるので、炭酸ガスを溶存させた培養液のpHの変動も少なくなることが予期される。
【0030】
炭酸ガスを含む気泡のサイズが約50nmを超えると液中からの気泡の散逸速度が大きくなり好ましいとは言えないが、本発明においては、このような大きなサイズの炭酸ガス含有気泡を含む培養液を排除するものではない。また、培養液中に炭酸ガスが所定濃度溶存するのであれば、炭酸ガス封入ナノバブルが全く培養液中に存在しなくてもかまわない。
【0031】
培養は炭酸ガス溶存培養液が循環される環境下でありさえすれば、静置培養であってもよいが、効率の良い培養を行うためには流動、振盪または撹拌しながら行うことが好ましい。この流動や攪拌には公知の方法が好適に使用できるが、循環される炭酸ガス溶存培養液を培養槽に戻すときにそれを培養槽に小さなノズルから圧入することによる攪拌効果を活用することもできる。また、炭酸ガス溶存培養液が培養槽中に均一に供給されるように多数の小さなノズルが略均等に具備されたプレート等を介して圧入することもできる。
【0032】
葉緑体保有原生動植物の培養は常温から30℃の条件下で行えばよいが、28〜30℃で行うのが最も好ましい。培養液のpHは培養液の組成や溶存させる炭酸ガスの濃度および炭酸ガス溶存培養液の注入量により異なるが、ユーグレナの場合を一例とすると、そのpHが2.8〜6.0であれば培養が可能でありpH3〜5で特に良好な生育を示すと言われている。本発明による固定法においてユーグレナを使用した場合には、ユーグレナは炭酸ガス溶存培養液のpHが2.8という酸性条件においても生育を示す為、特に培養液のpHの調整を行う必要はない。但し、培養液を所望によりアルカリでpHを調整することを完全に排除するものでもない。
【0033】
ここで、本発明の技術的範囲を何ら制約することなくユーグレナの特性について考察を加えるとすれば、以下のようなことが想定される。即ち、周知の通り、炭酸ガスは溶液中でCO2*(aq)とHCO3-とCO32-との間が平衡状態になるように存在し、それらの比率は溶液のpHによって変化する(下図参照)。

(出典:非特許文献2)
【0034】
一方、葉緑体保有原生動植物が細胞内の葉緑体で炭酸同化作用を行うには、その細胞膜を通して細胞の外から二酸化炭素を細胞内に一旦取り入れなくてならない。その場合、細胞膜の外側表面に有する炭酸脱水素酵素でもって周囲の炭酸水素イオンを二酸化炭素に変換した上で細胞内に取り込むもの(炭酸水素イオン利用型)と、そのような酵素を有することなく周囲から二酸化炭素の状態のままで細胞内に取り込むもの(炭酸水素イオン非利用型)とがある(一般的に、生物の細胞膜には二酸化炭素のような極性のない分子であれば通過できる孔があることが知られている)と言われている。ここで、例えば、ユーグレナの場合には、pHが4〜5付近で大きな増殖速度を呈すると言われているので、上記の平衡図を鑑みると、ユーグレナは炭酸水素イオン非利用型であることが予想される。してみると、特にユーグレナの場合には、培養液中に炭酸ガス封入ナノバブルが存在する場合の方がその生育環境的には好ましいことが期待される。
【0035】
炭酸ガスを効率よく固定するためには培養を常時光照射下で行うことが好ましいが、大量の炭酸ガスを経済的に処理するためには屋外に培養槽を置き、自然状態(日中太陽光照射、夜間は無照射)で培養を行っても良い。
【0036】
本発明によれば、ユーグレナに属する原生動物やクロレラ等の浮遊型藻類による公知の機能を活用することで炭酸ガスを効率良く固定するだけでなく、固定された有機物を栄養源として、また有用脂肪酸等の原料として用いることが可能である。
【0037】
培養液よりユーグレナに属する原生動物やクロレラ等の浮遊型藻類を分離するには、沈殿法、濾過もしくは遠心分離などの通常の固液分離法を用いればよい。ユーグレナに属する原生動物やクロレラ等の浮遊型藻類の菌体は比較的大きいため通常の方法で容易に回収できる。
【0038】
分離したユーグレナに属する原生動物やクロレラ等の浮遊型藻類は凍結乾燥、加熱乾燥、天日乾燥等の通常の方法で乾燥させた後、栄養源として家畜、魚類、稚蚕等の飼料に用いることができる。また、細胞成分の分離によりパラミロン、トレハロース、高度不飽和脂肪酸、ワックスエステル、ビタミン類が得られ、それぞれの特性に応じて高度な利用が可能である。
【0039】
本願発明の炭酸ガスの固定方法は、火力発電の排気ガス中に含まれる炭酸ガスや天然ガスの精製時に放出される炭酸ガス等の化石燃料の使用により放出される炭酸ガスを除去するのに特に有用である。例えば火力発電の排気ガス中には炭酸ガスが9%含有されているが、この排気ガス中の炭酸ガスを適当な方法で濃縮し、ユーグレナに属する原生動物やクロレラ等の浮遊型藻類の培養槽に導き有用な有機物として固定することにより炭酸ガスの大気中への放出を大幅に減少させることができる。
【発明の効果】
【0040】
本発明の方法により、培養槽に炭酸ガス(又は炭酸ガスを含む気体)を直接通気する方法と比較して、高濃度の炭酸ガスを使用しても培養が可能となり、また炭酸ガスを溶存する培養液を培養槽にほぼ均一に導入することが可能となり、更に、培養槽中の炭酸ガス溶存濃度を簡便に制御できるシステムを提供することで、炭酸ガスを効率良く簡便に資化固定することが可能となる。さらに本発明による炭酸ガスの固定により得られる有機物は様々な用途に有用である。
【発明を実施するための最良の形態】
【0041】
次に、本発明に係る炭酸ガス固定システムの一実施態様について図面を参照して説明する。
【0042】
図1は本実施態様の炭酸ガス固定システムの概念図を示す。同図に示すように、本実施態様の炭酸ガス固定システムは、炭酸ガス源100と、炭酸ガス溶存培養液調製システム200と、ユーグレナに属する原生動物やクロレラ等の浮遊型藻類の培養システム300とを備えている。
【0043】
培養液に溶存させる炭酸ガスは、炭酸ガス源100から連通管400を通って培養液調製システム200に供給される。この場合に供給される炭酸ガスは大気圧以上に加圧されていてもいなくても良い。なお、炭酸ガス源として火力発電所等からの排ガスを使用する場合には、その排ガス中に含まれるNOxやSOxを公知の方法で除去する必要があることは論を待たない。
【0044】
培養システムにおいてユーグレナに属する原生動物やクロレラ等の浮遊型藻類を光独立型栄養により培養する場合には、増殖に伴い培養液中の炭酸ガスが消費されて炭酸ガスの溶存濃度が低下するが、この炭酸ガスの溶存濃度が低下した培養液は培養システム300と培養液調製システム200とを流体的に連通する培養液連通管500を通じて培養液調製システム200に供給される。
【0045】
培養液連通管500を通じて培養液調製システム200に供給された炭酸ガスの溶存濃度が低下した培養液は、この培養液調製システム200の中で以下詳述するように磁場内に設置されたベンチュリー管を利用して炭酸ガス源100から連通管400を通って供給される炭酸ガスと気液混合される。
【0046】
培養液調製システム200により炭酸ガスを所定の濃度溶存するように調製された炭酸ガス溶存培養液は培養液調製システム200と培養システム300とを流体的に連通する炭酸ガス溶存培養液連通管600を通じて培養システム300に供給される。
【0047】
図2は図1における炭酸ガス溶存培養液調製システム200の概念図である。同図に示すように、培養液調製システム200は、排気装置210と、脱気装置220と、エジェクター(又はベンチュリー管)230と、磁気発生装置240と、炭酸ガス溶存培養液貯蔵タンク250と、第1ポンプ260と、第2ポンプ270とを備え、これらが図示されるように相互に流体連通している。
【0048】
培養液貯蔵タンク250に一旦貯蔵された培養液は、第1ポンプ260により培養液貯蔵タンク250から取り出されて、磁気発生装置240の中に具備されたエジェクター230の中を圧送させられる。
【0049】
本発明を何ら限定することなくエジェクター230の中での現象を推察すると以下のようになろう。この圧送される過程でアスピレーション作用により炭酸ガス源100から炭酸ガス(又は炭酸ガスを含む気体)が吸引されると共にエジェクター230を通過して急激に減圧されて噴霧状あるいは蒸気状になった培養液とが混合される。このとき培養液の微細な液滴の周囲には炭酸ガスが充満しているので、ヘンリーの法則により、この液滴の表面を介して炭酸ガスが個々の液滴の中に溶解する。次に、炭酸ガスを溶解した液滴と炭酸ガスとの混合物が磁場内で個々の液滴の表面張力により再度相互に合体する過程で更に炭酸ガスを気体のまま極めて微細(ナノメートルのオーダー)な気泡の中に封入する。このようにして炭酸ガスを溶解した培養液の中にナノサイズの炭酸ガス気泡を含む炭酸ガス溶存培養液が生成される。
【0050】
但し、この段階で生成された炭酸ガス溶存培養液には、ナノサイズの炭酸ガス気泡の他にミクロンサイズやミリサイズのような巨大な炭酸ガス気泡も含まれるので、これを脱気装置220に移してこのような巨大な炭酸ガス気泡を除去する。
【0051】
脱気装置220の中で巨大な炭酸ガス気泡が除去された炭酸ガス溶存培養液は、再度、培養液貯蔵タンク250に移され、炭酸ガスの溶存濃度及び炭酸ガスのナノバブルの粒径分布の特性が所定の値になるまで上記ステップが繰り返される。
【0052】
ここで注目すべき点は、以下に述べるように、本発明のシステムにおいては、炭酸ガスの溶存濃度は所定の処理時間が経過すると自動的に平衡に達するので、エジェクター230の中で気液混合する気体の中に含まれる炭酸ガスの比率を制御しさえすれば、ヘンリーの法則により、炭酸ガスの分圧に応じた溶解挙動を呈するので、培養液中にはこの分圧に応じた炭酸ガスが溶解されることである。このことにより、炭酸ガス溶存培養液調製システム200には炭酸ガス溶存濃度計を具備する必要がなく、システムが簡便になると言うメリットがある。
【0053】
炭酸ガス溶存濃度は、例えば、エジェクター230の中を圧送される培養液の供給速度が6リットル/分で、炭酸ガスほぼ100%の気体を4リットル/分気液混合した場合は、この繰り返し時間が160分から180分で平衡に達する。図3は、オルガノ製18MΩのイオン交換純水装置により処理して得られた純水に上記の方法で炭酸ガスを気液混合した場合の炭酸ガス溶存濃度(縦軸)と処理時間(横軸)との関係を示すグラフである。このときの水の総量は180リットルで、炭酸ガス溶存濃度は水酸化ナトリウムによる適定方式で計測した。
【0054】
また、この平衡状態に達した炭酸ガス溶存水の中に含まれる炭酸ガス封入ナノバブルの大きさを堀場製作所製の動的光散乱式粒度分布測定装置(LB−550)により測定した得られた粒度分布結果を図4に示す。同図において縦軸は頻度(%)を表し横軸は粒子径(nm)を対数軸で表す。同図に示すように、炭酸ガス封入ナノバブルの殆どが2〜20nmの範囲のサイズで存在することが理解できる。
【0055】
炭酸ガスを封入した気泡をこのようなナノメートルサイズにするメリットの一つには、浮力の効果が実質的に無くなることであり、この結果、炭酸ガス封入ナノバブルが液中から散逸しなくなる、あるいは、散逸したとしても、極めて少量となることである。このことは、ひいては、炭酸ガスナノバブルを含有すると同時に炭酸ガスを液中に溶解している培養液の場合には、溶液中に溶解した炭酸ガスがユーグレナや浮遊型藻類に消費されることによりその周辺の溶液のpHが上昇しても、炭酸ガス含有ナノバブルの中に含まれている炭酸ガスがヘンリーの法則により平衡を保とうとしてその減少した分だけの炭酸ガスが溶解されることが期待されるので、炭酸ガスを溶存させた培養液のpHの変動も少なくなることが期待される。
【0056】
炭酸ガス溶存培養液調製システム200において調整されて所定の炭酸ガス溶存濃度を有するようになった炭酸ガス溶存培養液は、次に、炭酸ガス溶存培養液連通管600を通じて培養システム300に供給される。
【0057】
光独立型栄養による培養の場合における炭酸ガス溶存培養液の供給量は、ユーグレナを一例とすると、乾重量20gのユーグレナはパラミンとして二酸化炭素を約3g〜14g固定すると言われているので、この比率に合わせて適宜選択される。
【0058】
本発明においては、炭酸ガス溶解濃度が20℃大気圧で飽和濃度になる炭酸ガス溶存培養液を使用することを基本としているが、その場合の供給量が後述するように培養槽中のユーグレナや浮遊型藻類の攪拌に必要な流量に達しない場合には、炭酸ガス溶存培養液調製システム200に供給される炭酸ガス含有気体中の炭酸ガスの比率を低下させることで炭酸ガス溶存培養液調製システム200により調製される炭酸ガス溶存培養液中の炭酸ガス濃度を低減させ、その反面、供給される二酸化炭素の総量が同一となるように供給量を適宜増大させることができる。
【0059】
また、培養する微生物の種類によっては、炭酸ガスと共に酸素も必要とする場合があるが、そのような場合には、炭酸ガス溶存培養液調製システム200と同様な機構の酸素溶存培養液調製システムを更に加えることも可能である。また、炭酸ガス源として炭酸ガスと酸素とを所定の比率で含む気体を使用することにより、それぞれの分圧に応じた溶存濃度を有する培養液を得ることも可能である。
【0060】
図5は本発明による培養システム300の概念図である。同図に示すように、培養システム300は、培養増310と、供給培養液分散手段320と、ヒーター360(オプショナル)と、ロータリースクリーン330と、光源340(室内培養の場合)とを備えている。
【0061】
培養槽310の設置場所は屋外、屋内いずれに設置しても良い。屋外の場合は、例えば陸上、海上に設置される。
【0062】
培養槽310において培養するユーグレナ等の葉緑体保有原生動植物のコロニー密度は特に制限は無いが葉緑体保有原生動植物は供給される炭酸ガスを消費して増殖するので、所定の期間増殖された後には培養槽310から取り出して、適宜最適な密度に保つようにすることが好ましい。
【0063】
炭酸ガス溶存培養液調製システム200にて調製された炭酸ガス溶存培養液は、流体連通管600を通り、供給培養液分散手段320を介して培養槽310に供給される。
【0064】
供給培養液分散手段320は、液体中の炭酸ガスや炭酸水素イオン等の拡散速度が極めて緩慢なので、培養槽310中のユーグレナ等の微生物にできる限り均一に炭酸ガスが供給されるようにすると同時に、炭酸ガス溶存培養液を圧入するときに発生する乱流を活用して培養槽310の内部を攪拌する効果をも期待されるが、本発明においては、必須ではない。
【0065】
培養槽310にはその周囲にヒーター360を具備しても良いが、このヒーター360は必須ではない。
【0066】
ロータリースクリーン330は、培養槽310から葉緑体保有原生動植物共々培養液を取り出し葉緑体保有原生動植物と培養液とを分離し、分離された葉緑体保有原生動植物を培養槽310に戻り管350を介して戻し、培養液のみを流体連通管500を介して炭酸ガス溶存培養液調製システム200に供給するためのものである。
【0067】
室内で培養する場合には、光源340には、赤色、緑色、青色のLED群を有する照明からの光源、あるいは、白色LED群を有する照明からの光源が好適に使用できる。また、屋外の太陽光を光ファイバでもって培養槽310内に導光して照射するようにしても良い。これによって室内でも葉緑体保有原生動植物の培養が可能となる。
【0068】
LEDを利用して室内で培養する場合には、培養槽310の底に光検出器710(図示せず)を設置して、この光検出器710からの信号を図6にその概念図を示す制御システムに出力させ、図6の制御システムにより照射光量を調節できるようにしても良い。
【0069】
図6にその概念図を示す制御システムは、公知の技術を使用して、照射光量と共に炭酸ガス溶存濃度をも制御できるように構成されているが、この場合、培養槽310中の溶存炭酸ガス濃度検出器740(図6中には図示せず)からの信号に基づいて図2中に参照番号280で示された電磁バルブが操作されるように構成できる(制御配線等は図示せず)。
【0070】
一般に、液体中のガスやイオンの拡散速度は極めて緩慢であるので、培養槽310に直接炭酸ガス(あるいは炭酸ガスを含む気体)を通気することで溶存炭酸ガス濃度を所望のレベルに正確に維持することは、通気により発生する気泡の近傍ではヘンリーの法則によりその気泡の中の炭酸ガスの分圧に等しい濃度の炭酸ガス溶存培養液が得られるが、その気泡から離れた箇所の炭酸ガス溶存濃度は依然変化しないと言う現象が生じるので、非常に困難であるが、本発明の場合には、予め均一に炭酸ガスが溶存した培養液を培養槽310に導入するので培養槽310中の溶存炭酸ガス濃度の制御がより容易になる。
【0071】
以上が最良な実施形態であるが、上述した実施態様や変形実施態様の一部又は全部を適宜組み合わせても良いし、本発明は上記実施態様に限定されることなく、その趣旨を逸脱しない範囲で種々の変形が可能であることは言うまでもない。
【0072】
以下本願発明を実施例を用いてさらに詳細に説明する。
使用したユーグレナ:独立行政法人国立環境研究所から、ユーグレナ・グラシリス(Euglena gracilis)(分類番号NIES-48)の入った15ml入り培養原液を4本入手して、これを、寒天培地を含むハットナー(Hutner)培地4リットルを、3段階で液増量しながら、各段階7日間で培養した。このときのユーグレナのサイズは、体長が30μm〜50μmである。培養中は恒温水槽にて水温を25〜26℃に保持し、12時間太陽光に加えてLEDランプ(培養に用いた三角フラスコ表面で1700ルクス以上)を照射し、次に12時間無光状態にて保持して、ユーグレナ培養原液を調製した。どちらの場合にも、適量の大気の散気管による通気を行った。
【0073】
実施例1:図2の炭酸ガス溶存培養液調製システムを使用して炭酸ガス溶存培養液を調製した。このとき使用した培養液は、オルガノ製18MΩのイオン交換純水装置により処理して得られた30リットルの純水に5%濃度でHUT培地(但し、寒天培地は含まない)を1.5リットル加えて混合して調製した。得られた培養液を図2の炭酸ガス溶存培養液調製システムに投入して、タンク他配管内の液総量を30リットルのレベルに調整し、毎分4リットル(常温常圧)の炭酸ガス(ほぼ100%濃度)を磁気作用併用エジェクターにて循環混合して炭酸ガス溶存培養液を調製した。これにより得られた炭酸ガス溶存培養液中の炭酸ガス溶解濃度は1670ppmであった。このとき用いた炭酸ガス溶解濃度計測装置は、島津製作所製の5000Aであった。次に、この炭酸ガス溶解培養液900ミリリットルを100ミリリットルの上記ユーグレナ培養原液の入ったガラス容器に加えてユーグレナを培養した。
【0074】
比較例1:実施例1と同様にしてオルガノ製18MΩのイオン交換純水装置により処理して得られた30リットルの純水に5%濃度でHUT培地(但し、寒天培地は含まない)を1.5リットル加えて混合して炭酸ガスを溶解しない培養液を調製した。この培養液900ミリリットルを100ミリリットルの上記ユーグレナ培養原液の入ったガラス容器に加えてユーグレナを培養した。次に、このガラス容器の中のユーグレナ培養液に、実施例1の混合炭酸ガス量(120リットル(4リットル×30分)を30リットルの培養液と気液混合した)と同じになるように、毎分1リットルの炭酸ガス(ほぼ100%濃度)を炭酸ガスボンベから直接、4分間、散気管を介して通気した。
【0075】
ユーグレナの生育状態の確認:上記実施例1と比較例1で培養したユーグレナの一部を東京都産業技術センター駒沢支所に持ち込み顕微鏡下で生育状態の確認を行った結果、顕微鏡写真1及び2にある小さな升80枠にある数をカウントし、その1000倍が1ミリリットル中の数として算出したときの数は、それぞれ以下の通りとなった。
実施例1:275個×1000倍=275,000個(図7参照)
比較例1:8個×1000倍=8,000個(図8参照)
なお、比較例1においては、ユーグレナが破壊分解したと思われる破片が多数確認されると共に、生きているユーグレナも殆ど動かず健康ではないと思われた。
【図面の簡単な説明】
【0076】
【図1】図1は、本発明の炭酸ガス固定システムの概念図である。
【図2】図2は、本発明の炭酸ガス溶存培養液調製システムの概念図である。
【図3】図3は、オルガノ製18MΩのイオン交換純水装置により処理して得られた純水に本発明の方法で炭酸ガスを気液混合した場合の炭酸ガス溶存濃度(縦軸)と処理時間(横軸)との関係を示すグラフである。
【図4】図4は、図3において平衡状態に達した炭酸ガス溶存水の中に含まれる炭酸ガス封入ナノバブルの大きさを堀場製作所製の動的光散乱式粒度分布測定装置(LB−550)により測定した得られた粒度分布結果を示す。
【図5】図5は、本発明の培養システムの概念図である。
【図6】図6は、本発明に使用できる照射光・炭酸ガス溶存濃度制御システムの概念図である。
【図7】図7は、実施例1によるユーグレナの生育状態を示す顕微鏡写真(×1,000)である。
【図8】図8は、比較例1によるユーグレナの死滅状態を示す顕微鏡写真(×1,000)である。
【符号の説明】
【0077】
100 炭酸ガス源
200 炭酸ガス溶存培養液調製システム
210 排気装置
230 エジェクター
240 磁気発生装置
250 タンク
260 第1ポンプ
270 第2ポンプ
300 培養システム
310 戻り管
320 供給培養液分散手段
330 ロータリースクリーン
340 排出管
360 ヒーター
700 制御システム
710 光検出器
720 光制御部
730 照明装置
740 溶存炭酸ガス濃度検出器
750 濃度制御部
760 炭酸ガス溶存培養液
【特許請求の範囲】
【請求項1】
炭酸ガスを葉緑体保有原生動植物を用いて固定する方法において、
該原生動植物の培養槽から培養液の一部を抽出する第1ステップと、
該抽出された培養液を炭酸ガス高濃度溶存培養液に変換する第2ステップと、
該変換ステップで調製された炭酸ガス高濃度溶存培養液を該培養槽に戻す第3ステップとを含む
ことを特徴とする炭酸ガス固定法。
【請求項2】
前記第1乃至3ステップを間歇的又は連続的に繰り返す
ことを特徴とする請求項1記載の炭酸ガス固定法。
【請求項3】
前記炭酸ガス高濃度溶存培養液が、少なくとも炭酸ガスを溶解して存在する液体部分と、少なくとも炭酸ガスを封入して存在するナノバブルとから構成される
ことを特徴とする請求項1乃至2のいずれか一項に記載の炭酸ガス固定法。
【請求項4】
前記ナノバブルの中の炭酸ガス濃度が、80体積%を超え100体積%以下である
ことを特徴とする請求項1乃至3のいずれか一項に記載の炭酸ガス固定法。
【請求項5】
前記ナノバブルの粒径が、前記葉緑体保有原生動植物の体長の100分の1未満である
ことを特徴とする請求項1乃至4のいずれか一項に記載の炭酸ガス固定法。
【請求項6】
前記ナノバブルの粒径が、2nm〜20nmの範囲に入る
ことを特徴とする請求項1乃至5のいずれか一項に記載の炭酸ガス固定法。
【請求項7】
前記炭酸ガスが、化石燃料の使用により発生した炭酸ガスである
ことを特徴とする請求項1乃至6のいずれか一項に記載の炭酸ガス固定法。
【請求項8】
前記葉緑体保有原生動植物の前記培養液中における増殖時の炭素原が前記炭酸ガスであることを特徴とする請求項1乃至6のいずれか一項に記載の炭酸ガス固定法。
【請求項9】
オプションとして、更に、上記培養液中の炭酸ガス溶存濃度及び/又は上記原生動植物の光合成用の光強度を自動制御するステップを含む
請求項1乃至7のいずれか一項に記載の炭酸ガス固定法。
【請求項10】
炭酸ガスを葉緑体保有原生動植物を用いて固定するシステムにおいて、
少なくとも炭酸ガスを供給する炭酸ガス源と、
葉緑体保有原生動植物を培養するための培養液を少なくとも有する培養システムと、
該炭酸ガス源から供給される炭酸ガスを少なくとも含む気体と培養液とから炭酸ガス溶存培養液を調製する炭酸ガス溶存培養液調製システムとを備え、
該炭酸ガス源と該炭酸ガス溶存培養液調製システムとが流体連通し、
該培養システムと該炭酸ガス溶存培養液調製システムとが流体連通している
ことを特徴とする炭酸ガス固定システム。
【請求項11】
前記培養システムと前記炭酸ガス溶存培養液調製システムとの間の流体連通が二本の連通管により提供され、
該二本の連通管の一方には前記培養システムから前記培養液の一部を抽出するための第1ポンプが具備され、
該二本の連通管の他方には前記炭酸ガス溶存培養液調製システムで調製された炭酸ガス溶存培養液を該培養システムに戻すための第2ポンプが具備され、
前記第1ポンプと前記培養システムの間には培養システム内の葉緑体保有原生動植物と培養液とを分離する分離手段が具備されている
ことを特徴とする請求項9記載の炭酸ガス固定システム。
【請求項12】
オプションとして、更に、上記培養液中の炭酸ガス溶存濃度及び/又は上記原生動植物の光合成用の光強度を自動制御する自動制御手段を含む
請求項9乃至10のいずれか一項に記載の炭酸ガス固定システム。
【請求項13】
前記炭酸ガス溶存培養液調製システムが、少なくとも磁場内に配置されたエジェクターを含む
ことを特徴とする請求項9乃至11のいずれか一項に記載の炭酸ガス固定システム。
【請求項14】
前記炭酸ガス溶存培養液調製システムが、少なくとも炭酸ガスを溶解して存在する液体部分と、少なくとも炭酸ガスを含む気体を封入して存在するナノバブルとから構成される炭酸ガス溶存培養液を調製することができる
ことを特徴とする請求項12に記載の炭酸ガス固定システム。
【請求項15】
前記ナノバブルに封入された気体中の炭酸ガス濃度が80体積%を超え100体積%以下である
ことを特徴とする請求項13に記載の炭酸ガス固定システム。
【請求項16】
前記ナノバブルの粒径が、前記葉緑体保有原生動植物の体長の100分の1未満である
ことを特徴とする請求項13乃至14のいずれか一項に記載の炭酸ガス固定システム。
【請求項17】
前記ナノバブルの粒径が、2nm〜20nmの範囲に入る
ことを特徴とする請求項13乃至15のいずれか一項に記載の炭酸ガス固定システム。
【請求項18】
前記炭酸ガスが、化石燃料の使用により発生した炭酸ガスである
ことを特徴とする請求項9乃至16のいずれか一項に記載の炭酸ガス固定システム。
【請求項1】
炭酸ガスを葉緑体保有原生動植物を用いて固定する方法において、
該原生動植物の培養槽から培養液の一部を抽出する第1ステップと、
該抽出された培養液を炭酸ガス高濃度溶存培養液に変換する第2ステップと、
該変換ステップで調製された炭酸ガス高濃度溶存培養液を該培養槽に戻す第3ステップとを含む
ことを特徴とする炭酸ガス固定法。
【請求項2】
前記第1乃至3ステップを間歇的又は連続的に繰り返す
ことを特徴とする請求項1記載の炭酸ガス固定法。
【請求項3】
前記炭酸ガス高濃度溶存培養液が、少なくとも炭酸ガスを溶解して存在する液体部分と、少なくとも炭酸ガスを封入して存在するナノバブルとから構成される
ことを特徴とする請求項1乃至2のいずれか一項に記載の炭酸ガス固定法。
【請求項4】
前記ナノバブルの中の炭酸ガス濃度が、80体積%を超え100体積%以下である
ことを特徴とする請求項1乃至3のいずれか一項に記載の炭酸ガス固定法。
【請求項5】
前記ナノバブルの粒径が、前記葉緑体保有原生動植物の体長の100分の1未満である
ことを特徴とする請求項1乃至4のいずれか一項に記載の炭酸ガス固定法。
【請求項6】
前記ナノバブルの粒径が、2nm〜20nmの範囲に入る
ことを特徴とする請求項1乃至5のいずれか一項に記載の炭酸ガス固定法。
【請求項7】
前記炭酸ガスが、化石燃料の使用により発生した炭酸ガスである
ことを特徴とする請求項1乃至6のいずれか一項に記載の炭酸ガス固定法。
【請求項8】
前記葉緑体保有原生動植物の前記培養液中における増殖時の炭素原が前記炭酸ガスであることを特徴とする請求項1乃至6のいずれか一項に記載の炭酸ガス固定法。
【請求項9】
オプションとして、更に、上記培養液中の炭酸ガス溶存濃度及び/又は上記原生動植物の光合成用の光強度を自動制御するステップを含む
請求項1乃至7のいずれか一項に記載の炭酸ガス固定法。
【請求項10】
炭酸ガスを葉緑体保有原生動植物を用いて固定するシステムにおいて、
少なくとも炭酸ガスを供給する炭酸ガス源と、
葉緑体保有原生動植物を培養するための培養液を少なくとも有する培養システムと、
該炭酸ガス源から供給される炭酸ガスを少なくとも含む気体と培養液とから炭酸ガス溶存培養液を調製する炭酸ガス溶存培養液調製システムとを備え、
該炭酸ガス源と該炭酸ガス溶存培養液調製システムとが流体連通し、
該培養システムと該炭酸ガス溶存培養液調製システムとが流体連通している
ことを特徴とする炭酸ガス固定システム。
【請求項11】
前記培養システムと前記炭酸ガス溶存培養液調製システムとの間の流体連通が二本の連通管により提供され、
該二本の連通管の一方には前記培養システムから前記培養液の一部を抽出するための第1ポンプが具備され、
該二本の連通管の他方には前記炭酸ガス溶存培養液調製システムで調製された炭酸ガス溶存培養液を該培養システムに戻すための第2ポンプが具備され、
前記第1ポンプと前記培養システムの間には培養システム内の葉緑体保有原生動植物と培養液とを分離する分離手段が具備されている
ことを特徴とする請求項9記載の炭酸ガス固定システム。
【請求項12】
オプションとして、更に、上記培養液中の炭酸ガス溶存濃度及び/又は上記原生動植物の光合成用の光強度を自動制御する自動制御手段を含む
請求項9乃至10のいずれか一項に記載の炭酸ガス固定システム。
【請求項13】
前記炭酸ガス溶存培養液調製システムが、少なくとも磁場内に配置されたエジェクターを含む
ことを特徴とする請求項9乃至11のいずれか一項に記載の炭酸ガス固定システム。
【請求項14】
前記炭酸ガス溶存培養液調製システムが、少なくとも炭酸ガスを溶解して存在する液体部分と、少なくとも炭酸ガスを含む気体を封入して存在するナノバブルとから構成される炭酸ガス溶存培養液を調製することができる
ことを特徴とする請求項12に記載の炭酸ガス固定システム。
【請求項15】
前記ナノバブルに封入された気体中の炭酸ガス濃度が80体積%を超え100体積%以下である
ことを特徴とする請求項13に記載の炭酸ガス固定システム。
【請求項16】
前記ナノバブルの粒径が、前記葉緑体保有原生動植物の体長の100分の1未満である
ことを特徴とする請求項13乃至14のいずれか一項に記載の炭酸ガス固定システム。
【請求項17】
前記ナノバブルの粒径が、2nm〜20nmの範囲に入る
ことを特徴とする請求項13乃至15のいずれか一項に記載の炭酸ガス固定システム。
【請求項18】
前記炭酸ガスが、化石燃料の使用により発生した炭酸ガスである
ことを特徴とする請求項9乃至16のいずれか一項に記載の炭酸ガス固定システム。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【公開番号】特開2010−148433(P2010−148433A)
【公開日】平成22年7月8日(2010.7.8)
【国際特許分類】
【出願番号】特願2008−330184(P2008−330184)
【出願日】平成20年12月25日(2008.12.25)
【出願人】(503428747)
【出願人】(503428471)
【Fターム(参考)】
【公開日】平成22年7月8日(2010.7.8)
【国際特許分類】
【出願日】平成20年12月25日(2008.12.25)
【出願人】(503428747)

【出願人】(503428471)

【Fターム(参考)】
[ Back to top ]

