無機硫黄化合物加水分解酵素の製造方法
【課題】本発明は、無機硫黄化合物加水分解酵素の新規製造方法を提供することを課題とする。より詳しくは、遺伝子組換え技術を用いた無機硫黄化合物加水分解酵素の製造方法を提供することを課題とする。
【解決手段】無機硫黄化合物加水分解酵素をコードする遺伝子を組み込んだ宿主細胞を培養液中で培養することにより該無機硫黄化合物加水分解酵素を産生する場合において、宿主細胞を少なくともトリプトン、酵母エキス、グリセロールを含むTerrific Broth培地をpH 7.0〜7.4に調整し、さらにグルコースを添加した培養液中で培養することによる。さらには、発現した封入体の組換え目的酵素を可溶化した後、pH 1.5〜4.5の溶液でリフォールディングすることによる。
【解決手段】無機硫黄化合物加水分解酵素をコードする遺伝子を組み込んだ宿主細胞を培養液中で培養することにより該無機硫黄化合物加水分解酵素を産生する場合において、宿主細胞を少なくともトリプトン、酵母エキス、グリセロールを含むTerrific Broth培地をpH 7.0〜7.4に調整し、さらにグルコースを添加した培養液中で培養することによる。さらには、発現した封入体の組換え目的酵素を可溶化した後、pH 1.5〜4.5の溶液でリフォールディングすることによる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、無機硫黄化合物加水分解酵素の製造方法および前記製造方法により得られた酵素の利用方法に関する。
【背景技術】
【0002】
大気汚染や酸性雨の原因となる石油燃料に含まれる硫黄成分は、ほとんど全て除去されるべきである。この点については、各石油会社の企業努力により、基準を下回るサルファフリー(硫黄分が殆ど0)が市場に供給するに至っている。一方で石油中より除かれた脱硫硫黄が大量に余剰するという新たな問題が生じている。これらは、主に中国において農業肥料として廃棄物同然に扱われているのが現状であり、必ずしも有効な解決策となっておらず、廃棄の場の枯渇に伴い深刻化しつつある。すなわち、現状では石油の脱硫に伴い、大量に生成する脱硫余剰硫黄の有効な利用または処理の技術がないことが大きな問題がある。
【0003】
無機硫黄化合物加水分解酵素の一種であるテトラチオン酸ハイドロラーゼは、好酸性細菌であるAcidithiobacillus属細菌(一部Acidiphilium属細菌を含む)において活性が検出された酵素であり、硫黄化合物をエネルギー源として生育するAcidithiobacillus属細菌に特徴的な酵素として学術的な興味の対象であった。これまでに、本酵素の精製と諸性質の検討について報告がなされてきた(非特許文献1〜4)。
【0004】
硫黄をエネルギー源として生育する鉄硫黄酸化細菌の1種であるAcidithiobacillus ferrooxidans(以下、A. ferrooxidans)より、還元型無機硫黄化合物の1種であるテトラチオン酸を加水分解する酵素(テトラチオン酸ハイドロラーゼ)を精製したものについて、本発明者による報告がある。本酵素は、Acidithiobacillus属細菌からのみ(例外として近年Acidiphilium属に改名された細菌1種を含む)活性の検出が報告されており、本発明者により本酵素をコードする遺伝子が同定され、その情報がDDBJ, Accession No.AB259312に登録されている(非特許文献5)。本遺伝子をAf-tthと表す。本遺伝子は1500bpであり、499アミノ酸からなるタンパク質をコードする。当該遺伝子の配列が明らかになったことにより、A. ferrooxidansや一部の好熱性好酸性始原菌(Archaea)において、全く機能不明であった外膜タンパク質が、Af-tthと相同性を有することが明らかになった。これにより本遺伝子を持つ生物の硫黄代謝などを推定することができ、学術的にも重要な情報を提供できることとなる。
【0005】
本発明者が同定したAf-tthから推定されたタンパク質の一次構造よりデータベースで類似する構造を持つタンパク質を検索したところ、相当する遺伝子産物の機能は不明で、その殆どが全ゲノム配列解析による推定上の構造遺伝子にコードされたもの、または単なる外膜タンパク質としてのみ認識されていた。
【0006】
酵素は立体構造を持ち、基質特異性を有する触媒である。このため、酵素により処理する場合は、無機触媒を利用した場合と異なり、高い基質特異性、常温・常圧下で高い触媒能を持つために省エネルギーの化学反応が可能となることなど様々な利点がある。従来、無機硫黄化合物の化学反応において、酵素を用いる試みは全く行われておらず、無機硫黄化合物の酵素を用いた有用物質の生産には結びついていない。無機硫黄化合物の酵素化学は、硫黄酸化細菌のエネルギー代謝として学術的な興味の範囲でのみ研究が行われてきた。
【0007】
例えば、遺伝子情報が明らかになった場合でも、組換えタンパク質発現系において、活性型タンパク質の大量発現が困難な場合がある。困難な場合の例として、目的タンパク質が、宿主細胞に対して何らかの毒性を有する場合には、そのタンパク質の合成は抑制されて発現量が低下する、あるいは毒性タンパク質を合成した細胞は死滅してしまうために宿主細胞は増殖すらできなくなることが挙げられる。さらに、タンパク質の多くは生成後に折り畳が施され、一定の三次元構造を成して初めて機能を発現するところ、目的タンパク質が発現しても折り畳みがうまく行かずに酵素としての機能を果たさなかったり、封入体を形成してしまう場合もある。このような封入体が一旦形成されると、たとえ可溶化してリフォールディングを行っても、効果的なリフォールディングがなされなければ最終的に得られる活性型タンパク質の量は極めて少量である場合が多い。そこで、封入体の形成を抑制する方法についても、各種検討がなされており、報告されている(非特許文献6、特許文献1)。また、目的タンパク質が可溶性タンパク質として発現しても、宿主の分泌するプロテアーゼによって分解されてしまう場合には、生産量が極めて少なくなる。
【0008】
通常のLB (Luria-Broth, L-Broth) 栄養培地を用いたAf-tthの組換え大腸菌による誘導発現では、組換えタンパク質は殆ど発現せず、大量発現が困難であった。また、大腸菌で僅かに発現した組換えタンパク質も、活性を持たない封入体を形成するため、本酵素遺伝子を同定する直接的な証拠を得ることは困難であった。従って、テトラチオン酸ハイドロラーゼの大量生産方法については未だ報告がなく、本酵素の実用化には至っていないのが現状である。
【非特許文献1】Eur. J. Biochem. 271, 272-280 (2004)
【非特許文献2】Biosci. Biotechnol. Biochem. 60, 224-227 (1996)
【非特許文献3】Eur. J. Biochem. 243, 678-683 (1997)
【非特許文献4】Microbiology 143, 499-504 (1997)
【非特許文献5】DNA Data Bank of Japan, Accession No.AB259312
【非特許文献6】Gene 67, 31-40 (1998)
【特許文献1】特開2005-269936号公報
【発明の開示】
【発明が解決しようとする課題】
【0009】
本発明は、無機硫黄化合物加水分解酵素を大量に発現しうる製造方法を提供することを課題とする。より詳しくは、遺伝子組換え技術を用いた無機硫黄化合物加水分解酵素の製造方法を提供することを課題し、更には、得られた無機硫黄化合物加水分解酵素の利用方法を提供することを課題とする。
【課題を解決するための手段】
【0010】
本発明者らは、上記課題を解決するために無機硫黄化合物加水分解酵素の製造方法について鋭意研究を重ねた結果、当該酵素をコードする遺伝子を組み込んだ宿主の培養方法、および発現して得られた当該酵素のリフォールディングの方法を工夫することにより、効果的に無機硫黄化合物加水分解酵素を製造しうることを見出し、本発明を完成した。
【0011】
即ち本発明は、以下よりなる。
1.無機硫黄化合物加水分解酵素をコードする遺伝子を組み込んだ宿主細胞を培養液中で培養することにより該無機硫黄化合物加水分解酵素を発現させ、製造する場合において、前記宿主細胞を、トリプトン、酵母エキス、グリセロールを含むTerrific Broth培地をpH 7.0〜7.4に調整し、さらにグルコースを添加した培養液中で培養する事を特徴とする、無機硫黄化合物加水分解酵素の製造方法。
2.Terrific Broth培地に添加するグルコース濃度が、20〜60 mMである、前項1に記載の製造方法。
3.宿主が、大腸菌である前項1または2に記載の製造方法。
4.発現した無機硫黄化合物加水分解酵素が封入体の場合に、該封入体を、塩酸グアニジンを含む溶液で可溶化した後、pH 1.5〜4.5の緩衝液で処理することにより発現無機硫黄化合物加水分解酵素をリフォールディングさせ、活性型無機硫黄化合物加水分解酵素を産生する、前項1〜3の何れかに記載の製造方法。
5.無機硫黄化合物加水分解酵素が、テトラチオン酸ハイドロラーゼである前項1〜4の何れかに記載の製造方法。
6.無機硫黄化合物加水分解酵素をコードする遺伝子が、以下より選択されるいずれかである前項1〜5の何れかに記載の製造方法:
1)配列表の配列番号1で示される塩基配列からなるDNA;
2)配列表の配列番号1で示される塩基配列のうち、1〜複数個の遺伝子が置換、欠失、挿入または付加といった変異された塩基配列を含み、実質的に無機硫黄化合物加水分解酵素を産生しうる塩基配列からなるDNA;
3)前記1)または2)に記載のDNAの相補鎖からなるDNA;
4)前記1)または2)に記載のDNAとストリンジェントな条件下でハイブリッド形成しうるDNA;
5)前記1)または2)に記載のDNAとはハイブリッド形成しないが、遺伝子コドン縮重のため、配列番号2に記載のアミノ酸配列からなるタンパク質を産生しうる塩基配列からなるDNA。
7.前項1〜6のいずれか1に記載の製造方法に使用される培養液。
8.前項1〜6のいずれか1に記載の製造方法により得られた無機硫黄化合物加水分解酵素を用いて硫黄成分を処理することを特徴とする硫黄成分の加水分解処理方法。
9.前項8に記載の加水分解処理方法を含む硫黄成分の除去方法。
【発明の効果】
【0012】
本発明の無機硫黄化合物加水分解酵素の製造方法により、当該無機硫黄化合物加水分解酵素の組換えタンパク質が大量発現可能となり、さらにリフォールディングによる活性型酵素を容易に取得可能となった。これにより、本酵素の反応機構や結晶化による立体構造の解析など、更なる研究を行うことができる。また、本酵素を用いて硫黄成分加水分解することにより、例えば石油の脱硫に伴い生成される大量の無機硫黄化合物を処理することができ、更には有用物質生産への可能性が開かれる。
【発明を実施するための最良の形態】
【0013】
本発明は、無機硫黄化合物加水分解酵素の製造方法および前記製造方法により得られた酵素の利用方法に関する。本発明において、無機硫黄化合物加水分解酵素とは、無機硫黄化合物を加水分解しうる酵素であればよく、特に制限されないが、例えばテトラチオン酸ハイドロラーゼが挙げられる。テトラチオン酸ハイドロラーゼをコードする遺伝子はAf-tthで示され、その塩基配列は配列表の配列番号1に示され、すでにDDBJ, Accession No.AB259312(非特許文献5)にも登録されている。
【0014】
本発明において、無機硫黄化合物加水分解酵素をコードする遺伝子は以下の1)〜5)より選択されるいずれかであり、発現したタンパク質は、無機硫黄化合物を加水分解しうる機能を有するものであればよい。
1)配列表の配列番号1で示される塩基配列からなるDNA。
2)配列表の配列番号1で示される塩基配列のうち、1〜複数個の遺伝子が置換、欠失、挿入または付加といった変異された塩基配列を含み、実質的に機硫黄化合物加水分解酵素を産生しうる塩基配列からなるDNA。
3)前記1)または2)に記載のDNAの相補鎖からなるDNA。
4)前記1)または2)に記載のDNAとストリンジェントな条件下でハイブリッド形成しうるDNA。
5)前記1)または2)に記載のDNAとはハイブリッド形成しないが、遺伝子コドン縮重のため、配列番号2に記載のアミノ酸配列からなるタンパク質を産生しうる塩基配列からなるDNA。
【0015】
本発明において、配列表の配列番号1で示される塩基配列のうち、1〜複数個の遺伝子が置換、欠失、挿入または付加といった変異された塩基配列を含み、実質的に機硫黄化合物加水分解酵素を産生しうる塩基配列とは、実質的に機硫黄化合物加水分解酵素活性を有するタンパク質を産生可能であれば、遺伝子において複数個の変異があってもよいことを意味する。また、上記1)または2)に記載のDNAの相補鎖からなるDNAであっても実質的に機硫黄化合物加水分解酵素活性を有するタンパク質を産生可能であればよい。
【0016】
さらに、ストリンジェントなハイブリダイゼーション条件は一般に知られたものを選択することができる。その一例としては、50%ホルムアミド、5×SSC(150 mM NaCl、15 mM クエン酸三ナトリウム)、50 mMリン酸ナトリウム、pH7.6、5×デンハーツ溶液、10%デキストラン硫酸、及び20μg/mlのDNAを含む溶液中、42℃で一晩ハイブリダイゼーションした後、室温で2×SSC・0.1% SDS中で一次洗浄し、次いで、約65℃において0.1×SSC・0.1% SDSで二次洗浄といった条件があげられる。
【0017】
本発明の無機硫黄化合物加水分解酵素の製造方法は、遺伝子工学技術を応用したタンパク質の生産方法を対象とし、該無機硫黄化合物加水分解酵素をコードする遺伝子を組み込んだ宿主細胞を培養液中で培養することにより該無機硫黄化合物加水分解酵素を生産する方法による。
【0018】
ここで、無機硫黄化合物加水分解酵素をコードする遺伝子を宿主細胞に組み込む場合の宿主細胞や遺伝子を組み込む方法は、自体公知の細胞や方法を用いることができる。宿主細胞としては原核細胞が好ましく、例えば連鎖球菌属(streptococci)、ブドウ球菌属(staphylococci)、大腸菌(E.coli)、ストレプトミセス菌属(Streptomyces)および枯草菌(Bacillus subtilis)等が挙げられ、好適には大腸菌が挙げられる。
【0019】
また、遺伝子を組み込むために、DNAがベクターに挿入された組換えプラスミドを用いることができる。ベクターは、選択した宿主の種類により選別され、発現目的の遺伝子配列と複製そして制御に関する情報を担持した遺伝子配列とを構成要素とする。本発明では、原核細胞に使用可能なものが好ましく、例えば細菌プラスミド由来、バクテリオファージ由来、トランスポゾン由来、並びにそれらを組み合わせたベクター、例えばプラスミドおよびバクテリオファージの遺伝学的エレメント由来のベクター、例えばコスミドおよびファージミド等が挙げられる。
【0020】
形質転換方法は、自体公知の方法を用いることができる。形質転換体は、宿主の培養条件に最適な条件で培養される。無機硫黄化合物加水分解酵素の大腸菌による組換え発現を試みた場合、大腸菌の培養において通常よく用いられるLB 培地では主に細胞毒性に起因する溶菌現象などが観察され、誘導発現が非常に困難であった。
【0021】
本発明において、最適な条件で大腸菌などの組換え宿主細胞での組換え細胞によるタンパク質の生産を高めるために、TB (Terrific Broth, T-Broth)培地を基に改良を行った。スケールアップによる大量培養および大量発現においては、宿主細胞である菌体生育に伴う培地の酸性化によってアンピシリンが分解され、組換えプラスミドを保持しない大腸菌が優先的に生育する。本発明の製造方法に用いられる培養液は、少なくともトリプトン、酵母エキス、グリセロールを含むTB 培地である。組換えプラスミドを保持しない大腸菌の生育を避けるために、培地のpHを検討した結果、pH 7.0〜7.4が好適である。pH の調整は、例えば基本培地に、0.9〜1.0 Mのリン酸緩衝液を添加することによる。0.9〜1.0 Mのリン酸緩衝液の調製には、通常一般的に用いられるKH2PO4およびK2HPO4を用いることができる。このようにしてリン酸緩衝液を添加して培地のpHの低下を防ぐことができる。
【0022】
さらにグルコースを培地に添加することで、基底状態(未誘導状態)での組換えタンパク質の発現を抑制することができる。本発明において、グルコースの添加濃度は20〜60 mMとすることができ、より好適には50〜60 mMとすることができる。上記培養条件により、無機硫黄化合物加水分解酵素を大量に発現させることができ、製造することができる。
【0023】
また、本発明において無機硫黄化合物加水分解酵素を原核細胞で発現させる場合は、封入体が形成されるため、発現した無機硫黄化合物加水分解酵素は不溶化されている。封入体を効果的に形成させ、発現量を増加させるための培地は、LB 培地よりもTB 培地がより効果的といえる。
【0024】
本発明は、上記製造方法において用いられる培養液にも及ぶ。具体的には、少なくともトリプトン、酵母エキス、グリセロールを含むTB 培地に、グルコースが20〜60 mM、好適には50〜60 mM添加され、pHをpH 7.0〜7.4に調整された培養液が挙げられる。さらにはアンピシリンを終濃度50〜100 g/mlとなるように添加することができる。
【0025】
形成した封入体から無機硫黄化合物加水分解酵素の活性型酵素を取得するために、宿主細胞を緩衝液で洗浄した後に超音波などを用いて細胞を破砕または溶解し、市販の試薬、例えばBugBuster(R)(タカラバイオ株式会社)を用いて封入体を抽出することができる。前記封入体を含む抽出液から、遠心分離等により不溶性画分を得ることができる。得られた不溶性画分には目的の封入体の他、宿主由来の疎水性膜タンパク質等が含まれるため、界面活性剤を含む緩衝液を用いて洗浄し、目的酵素以外のタンパク質を除去する。洗浄後の不溶性画分を目的酵素の封入体画分として、以下のリフォールディング操作に供することができる。ここにおいて、封入体画分はペレットの状態で凍結保存することができる。
【0026】
上記封入体画分について、化学変性剤を用いて目的酵素を可溶化することができる。化学変性剤として、0〜6 M、好適には約6 Mの塩酸グアニジン溶液を用いることができる。可溶化した目的酵素をpH 1.5〜4.5、好適にはpH 2.5〜3.5の緩衝液で処理することができる。例えば、透析チューブに封入体画分を注入し、上記緩衝液で処理することで、化学変性剤を緩やかに除去し、目的酵素のリフォールディングを行うことができる。本発明の無機硫黄化合物加水分解酵素は外膜に局在する膜タンパク質であるため、そのままでは正常に折りたたまれた活性型酵素も不溶化する。そこで、可溶化処理後の緩衝液のイオン強度を上げることにより目的酵素のリフォールディングをより効果的に行うことができる。緩衝液のイオン強度を上げる方法として、例えば0.1〜0.5 M、好適には約0.4 M硫酸アンモニウムを添加することができる。
【0027】
上記可溶化された目的酵素を含む溶液を遠心分離し、上清を回収することで活性型の目的酵素を得ることができる。
【0028】
本発明の製造方法およびリフォールディング操作により得られた活性型の目的酵素は、無機硫黄化合物を加水分解することができる。例えば石油の脱硫に伴い生成される大量の無機硫黄化合物を、本発明の製造方法により得られた酵素で処理することで、脱硫余剰硫黄の処理が可能となる。したがって、本発明は、得られた活性型の目的酵素を用いることによる硫黄成分の加水分解処理方法に及ぶ。さらには、加水分解処理された物質を除去することを含む硫黄成分の除去方法にも及ぶ。
【実施例】
【0029】
以下に比較例及び実施例を示して本発明をさらに具体的に説明するが、本発明はこれらにより限定されるものではない。
【0030】
(実施例1)テトラチオン酸ハイドロラーゼの遺伝子組換えによる発現
テトラチオン酸ハイドロラーゼをコードする遺伝子はAf-tthで示され、その塩基配列は配列表の配列番号1に示され、すでにDDBJ, Accession No.AB259312(非特許文献5)にも登録されている。
【0031】
TB 培養液(TB 基本培地に20〜60 mMのグルコースを添加したもの)を用いて、Af-tthを導入した組換え大腸菌で、テトラチオン酸ハイドロラーゼ(以下、「目的酵素」という。)の発現を試みた。Af-tth (Accession No. AB259312)の全遺伝子全長より、シグナルペプチドと推定されるN-末端側から32アミノ酸をコードした部分を除去した遺伝子をpET21aプラスミドに組み込み、大腸菌に形質転換した。
【0032】
本発明の培養に用いたTB 培養液は、以下により調製した。
トリプトン12 g、酵母エキス24 g、グリセロール4 mlを900 mlの脱塩水または水道水(tap Water)にてメスアップした。前記メスアップした溶液と0.9〜1.0 Mのリン酸カリウム緩衝液100 mlを別々に121℃、20分間オートクレーブ滅菌した。滅菌して室温まで冷却した後、両者をクリンベンチ内で無菌的に混合した(pH 7.0〜7.4)。終濃度が20〜60 mMとなるようにグルコースを添加し、さらにアンピシリンを終濃度50〜100 g/mlとなるように添加した。
形質転換した大腸菌を、Isopropyl-β-D-thiogalactopyranoside (IPTG)を終濃度1 mMで添加したTB 培養液中で室温36時間培養し、組換え目的酵素を誘導発現させた。
【0033】
上記により得られた組換え目的酵素とA. ferrooxidansから生成された外膜タンパク質を、SDS-PAGE(CBB染色)およびウエスタンブロッティングにより確認したところ、いずれもほぼ50 kDaの部分にバンドが認められた(図1)。なお、ウエスタンブロッティングには、比較例1で作製した抗テトラチオン酸ハイドロラーゼ抗体を用いた。
【0034】
遺伝子の一次配列より計算された分子量は49714であり、生成酵素の分子質量50 kDaに一致した。テトラチオン酸ハイドロラーゼを構成するアミノ酸のうち、N-末端から32アミノ酸はSec型の分泌シグナル配列を有する。その直後の13アミノ酸は、A. ferrooxidansから生成されたテトラチオン酸ハイドロラーゼのN-末端アミノ酸配列に完全に一致することが確認された。
【0035】
(実施例2)封入体のリフォールディング
実施例1の組換え目的酵素を誘導発現した大腸菌を遠心分離により回収し、1.0 Mリン酸カリウム緩衝液(pH 7.0)にて洗浄した。洗浄菌体を同緩衝液に懸濁後、超音波などにより菌体を破砕し、BugBuster(TM)(タカラバイオ株式会社)を用いて菌体を溶解した。
【0036】
菌体抽出液を遠心分離し、不溶性画分を回収した。これにより得た、菌体抽出液(W)、不溶性画分(I)および可溶性画分(上清画分:S)について、ウエスタンブロッティング(?)により確認したところ、不溶性画分にバンドが認められ、封入体として存在することが確認された(図2)。
なお、ウエスタンブロッティングには、後述の比較例1において発現させた組換えテトラチオン酸ハイドロラーゼを用いて作製した抗体を用いた。
【0037】
上記不溶性画分には目的酵素の封入体の他、宿主由来の疎水性膜タンパク質などが含まれる。目的酵素封入体以外のタンパク質の除去のため、4%(v/v)界面活性剤(Triton X-100)を含む0.1M リン酸カリウム緩衝液(pH 7.0)を用いて3回洗浄した。その後、滅菌済みの純水にて3回洗浄し、界面活性剤を除去した。これを目的酵素の封入体画分として、以下のリフォールディング実験に用いた。封入体画分はペレットの状態で凍結保存が可能である。
【0038】
封入体画分に6M-塩酸グアニジンを添加して可溶化した。可溶化した目的酵素溶液を透析チューブ内に注入し、0.1 M -Ala-SO42- 緩衝液 (pH 3.0), 0.4 M 硫酸アンモニウムで希釈しながら透析し、塩酸グアニジンを緩やかに除去することで目的酵素のリフォールディングを行った。
【0039】
本目的酵素は外膜に局在する膜タンパク質であるため、そのままでは正常に折りたたまれた活性型酵素も不溶化する。そこで、希釈緩衝液に0.4 M 硫酸アンモニウムを添加することでイオン強度を上げることにより目的酵素の活性体での可溶化に成功した。
最後に遠心分離によって上清を回収することで活性型の組換え目的酵素を確保した。
【0040】
(比較例1)LB 培地による遺伝子組換え目的酵素の発現
LB 培地においてAf-tthを導入した組換え大腸菌で、目的酵素の発現を試みた。培地をLB 培地とした他は、実施例1と同手法であった。
LB 培地での目的酵素の発現量は僅かではあったが、これを基に抗テトラチオン酸ハイドロラーゼ抗体を作製した。
【0041】
(実験例1)目的酵素の発現量の確認
実施例1および比較例1で得られた不溶性画分について、目的酵素の発現量をSDS-PAGEにより確認した。
その結果、比較例1の方法で発現させた場合は小スケール(5 ml程度)でのみ発現が認められたが、100 ml以上にスケールアップすると全く発現が認められなかった。一方、実施例1の方法で発現させた場合は、100 ml以上にスケールアップした場合でも組換え発現を可能とし、組換え型目的酵素を大量に獲得できるようになった。
【0042】
100 ml以上にスケールアップしたときの発現量を、SDS-PAGEで調べた(図3)。その結果、実施例1の培養液を用いてIPTG誘導した場合に50 kDaの部分に強いバンドが認められ、効果的に目的酵素を発現することが確認された。
【0043】
(実験例2)目的酵素の加水分解能の確認
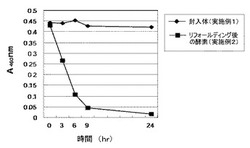
実施例1で得た封入体の不溶性の目的酵素および実施例2によるリフォールディングにより得られた目的酵素について、テ加水分解能をトラチオン酸の加水分解反応による効果を、吸光度(A480nm)にて確認した(図4)。その結果、実施例1で得た不溶性目的酵素では加水分解活性は認められなかったが、実施例2で得られた目的酵素は加水分解能を有することが確認された。
反応機構は S4O62- + H2O -> S0 + S2O32- + SO42- +2H+ であることをHPLC分析によって確認した。
【産業上の利用可能性】
【0044】
以上詳述したように、本発明の無機硫黄化合物加水分解酵素の製造方法により、無機硫黄化合物加水分解酵素の組換えタンパク質が大量発現可能となり、さらにリフォールディングによる活性型酵素の取得方法が開発できた。これにより、本酵素の反応機構や結晶化による立体構造の解析など、更なる研究を行うことができ、無機硫黄化合物の生産や有用物質生産への可能性が開かれる。無機硫黄化合物加水分解酵素の詳細な反応機構を理解することで、遺伝子工学的手法により基質特異性を変化させ、硫黄(通常8分子の硫黄が互いにS-S結合することで8員環を形成)を加水分解できる可能性がある。
【0045】
通常は水に不溶性の硫黄を、無機硫黄化合物加水分解酵素で加水分解することで水和できれば、特に生物的な親和性を高めることになり、反応性が飛躍的に高まり、硫黄の有効利用あるいは高効率な生物的処理への応用の可能性が期待できる。生物的処理法は、一般に常温・常圧で行われ、省エネルギーで環境に対する負荷も少ない技術として有用である。
【0046】
特に石油脱硫硫黄の大量余剰問題は深刻化しており、本発明の製造方法により、この問題の有用な解決法に繋がる可能性がある。本発明の方法により生産された無機硫黄化合物加水分解酵素を用いて、石油脱硫余剰硫黄を処理することで、選択性の高い、または省エネルギー可能な反応が期待され、環境・食糧・エネルギーなどの諸問題の有効な解決策の一つとして期待できる。
【0047】
また、本発明の製造方法により得られた組換え無機硫黄化合物加水分解酵素は、A. ferrooxidansの外膜タンパク質と同等のものであることが明らかになったことから、無機硫黄化合物加水分解酵素をコードする遺伝子を有する生物を有効利用することも可能となる。
【図面の簡単な説明】
【0048】
【図1】大腸菌により産生した組換えテトラチオン酸ハイドロラーゼが、A. ferrooxidansから生成された外膜タンパク質(酵素)と同等のタンパク質であることを示す図である。(実施例2)
【図2】大腸菌により産生した組換えテトラチオン酸ハイドロラーゼが封入体で存在することを示す図である。(実施例2)
【図3】従来法および本発明の方法による組換えテトラチオン酸ハイドロラーゼの発現量を示す図である。(実験例1)
【図4】本発明の方法によりリフォールディングして得られた組換えテトラチオン酸ハイドロラーゼの加水分解活性を示す図である。(実験例2)
【技術分野】
【0001】
本発明は、無機硫黄化合物加水分解酵素の製造方法および前記製造方法により得られた酵素の利用方法に関する。
【背景技術】
【0002】
大気汚染や酸性雨の原因となる石油燃料に含まれる硫黄成分は、ほとんど全て除去されるべきである。この点については、各石油会社の企業努力により、基準を下回るサルファフリー(硫黄分が殆ど0)が市場に供給するに至っている。一方で石油中より除かれた脱硫硫黄が大量に余剰するという新たな問題が生じている。これらは、主に中国において農業肥料として廃棄物同然に扱われているのが現状であり、必ずしも有効な解決策となっておらず、廃棄の場の枯渇に伴い深刻化しつつある。すなわち、現状では石油の脱硫に伴い、大量に生成する脱硫余剰硫黄の有効な利用または処理の技術がないことが大きな問題がある。
【0003】
無機硫黄化合物加水分解酵素の一種であるテトラチオン酸ハイドロラーゼは、好酸性細菌であるAcidithiobacillus属細菌(一部Acidiphilium属細菌を含む)において活性が検出された酵素であり、硫黄化合物をエネルギー源として生育するAcidithiobacillus属細菌に特徴的な酵素として学術的な興味の対象であった。これまでに、本酵素の精製と諸性質の検討について報告がなされてきた(非特許文献1〜4)。
【0004】
硫黄をエネルギー源として生育する鉄硫黄酸化細菌の1種であるAcidithiobacillus ferrooxidans(以下、A. ferrooxidans)より、還元型無機硫黄化合物の1種であるテトラチオン酸を加水分解する酵素(テトラチオン酸ハイドロラーゼ)を精製したものについて、本発明者による報告がある。本酵素は、Acidithiobacillus属細菌からのみ(例外として近年Acidiphilium属に改名された細菌1種を含む)活性の検出が報告されており、本発明者により本酵素をコードする遺伝子が同定され、その情報がDDBJ, Accession No.AB259312に登録されている(非特許文献5)。本遺伝子をAf-tthと表す。本遺伝子は1500bpであり、499アミノ酸からなるタンパク質をコードする。当該遺伝子の配列が明らかになったことにより、A. ferrooxidansや一部の好熱性好酸性始原菌(Archaea)において、全く機能不明であった外膜タンパク質が、Af-tthと相同性を有することが明らかになった。これにより本遺伝子を持つ生物の硫黄代謝などを推定することができ、学術的にも重要な情報を提供できることとなる。
【0005】
本発明者が同定したAf-tthから推定されたタンパク質の一次構造よりデータベースで類似する構造を持つタンパク質を検索したところ、相当する遺伝子産物の機能は不明で、その殆どが全ゲノム配列解析による推定上の構造遺伝子にコードされたもの、または単なる外膜タンパク質としてのみ認識されていた。
【0006】
酵素は立体構造を持ち、基質特異性を有する触媒である。このため、酵素により処理する場合は、無機触媒を利用した場合と異なり、高い基質特異性、常温・常圧下で高い触媒能を持つために省エネルギーの化学反応が可能となることなど様々な利点がある。従来、無機硫黄化合物の化学反応において、酵素を用いる試みは全く行われておらず、無機硫黄化合物の酵素を用いた有用物質の生産には結びついていない。無機硫黄化合物の酵素化学は、硫黄酸化細菌のエネルギー代謝として学術的な興味の範囲でのみ研究が行われてきた。
【0007】
例えば、遺伝子情報が明らかになった場合でも、組換えタンパク質発現系において、活性型タンパク質の大量発現が困難な場合がある。困難な場合の例として、目的タンパク質が、宿主細胞に対して何らかの毒性を有する場合には、そのタンパク質の合成は抑制されて発現量が低下する、あるいは毒性タンパク質を合成した細胞は死滅してしまうために宿主細胞は増殖すらできなくなることが挙げられる。さらに、タンパク質の多くは生成後に折り畳が施され、一定の三次元構造を成して初めて機能を発現するところ、目的タンパク質が発現しても折り畳みがうまく行かずに酵素としての機能を果たさなかったり、封入体を形成してしまう場合もある。このような封入体が一旦形成されると、たとえ可溶化してリフォールディングを行っても、効果的なリフォールディングがなされなければ最終的に得られる活性型タンパク質の量は極めて少量である場合が多い。そこで、封入体の形成を抑制する方法についても、各種検討がなされており、報告されている(非特許文献6、特許文献1)。また、目的タンパク質が可溶性タンパク質として発現しても、宿主の分泌するプロテアーゼによって分解されてしまう場合には、生産量が極めて少なくなる。
【0008】
通常のLB (Luria-Broth, L-Broth) 栄養培地を用いたAf-tthの組換え大腸菌による誘導発現では、組換えタンパク質は殆ど発現せず、大量発現が困難であった。また、大腸菌で僅かに発現した組換えタンパク質も、活性を持たない封入体を形成するため、本酵素遺伝子を同定する直接的な証拠を得ることは困難であった。従って、テトラチオン酸ハイドロラーゼの大量生産方法については未だ報告がなく、本酵素の実用化には至っていないのが現状である。
【非特許文献1】Eur. J. Biochem. 271, 272-280 (2004)
【非特許文献2】Biosci. Biotechnol. Biochem. 60, 224-227 (1996)
【非特許文献3】Eur. J. Biochem. 243, 678-683 (1997)
【非特許文献4】Microbiology 143, 499-504 (1997)
【非特許文献5】DNA Data Bank of Japan, Accession No.AB259312
【非特許文献6】Gene 67, 31-40 (1998)
【特許文献1】特開2005-269936号公報
【発明の開示】
【発明が解決しようとする課題】
【0009】
本発明は、無機硫黄化合物加水分解酵素を大量に発現しうる製造方法を提供することを課題とする。より詳しくは、遺伝子組換え技術を用いた無機硫黄化合物加水分解酵素の製造方法を提供することを課題し、更には、得られた無機硫黄化合物加水分解酵素の利用方法を提供することを課題とする。
【課題を解決するための手段】
【0010】
本発明者らは、上記課題を解決するために無機硫黄化合物加水分解酵素の製造方法について鋭意研究を重ねた結果、当該酵素をコードする遺伝子を組み込んだ宿主の培養方法、および発現して得られた当該酵素のリフォールディングの方法を工夫することにより、効果的に無機硫黄化合物加水分解酵素を製造しうることを見出し、本発明を完成した。
【0011】
即ち本発明は、以下よりなる。
1.無機硫黄化合物加水分解酵素をコードする遺伝子を組み込んだ宿主細胞を培養液中で培養することにより該無機硫黄化合物加水分解酵素を発現させ、製造する場合において、前記宿主細胞を、トリプトン、酵母エキス、グリセロールを含むTerrific Broth培地をpH 7.0〜7.4に調整し、さらにグルコースを添加した培養液中で培養する事を特徴とする、無機硫黄化合物加水分解酵素の製造方法。
2.Terrific Broth培地に添加するグルコース濃度が、20〜60 mMである、前項1に記載の製造方法。
3.宿主が、大腸菌である前項1または2に記載の製造方法。
4.発現した無機硫黄化合物加水分解酵素が封入体の場合に、該封入体を、塩酸グアニジンを含む溶液で可溶化した後、pH 1.5〜4.5の緩衝液で処理することにより発現無機硫黄化合物加水分解酵素をリフォールディングさせ、活性型無機硫黄化合物加水分解酵素を産生する、前項1〜3の何れかに記載の製造方法。
5.無機硫黄化合物加水分解酵素が、テトラチオン酸ハイドロラーゼである前項1〜4の何れかに記載の製造方法。
6.無機硫黄化合物加水分解酵素をコードする遺伝子が、以下より選択されるいずれかである前項1〜5の何れかに記載の製造方法:
1)配列表の配列番号1で示される塩基配列からなるDNA;
2)配列表の配列番号1で示される塩基配列のうち、1〜複数個の遺伝子が置換、欠失、挿入または付加といった変異された塩基配列を含み、実質的に無機硫黄化合物加水分解酵素を産生しうる塩基配列からなるDNA;
3)前記1)または2)に記載のDNAの相補鎖からなるDNA;
4)前記1)または2)に記載のDNAとストリンジェントな条件下でハイブリッド形成しうるDNA;
5)前記1)または2)に記載のDNAとはハイブリッド形成しないが、遺伝子コドン縮重のため、配列番号2に記載のアミノ酸配列からなるタンパク質を産生しうる塩基配列からなるDNA。
7.前項1〜6のいずれか1に記載の製造方法に使用される培養液。
8.前項1〜6のいずれか1に記載の製造方法により得られた無機硫黄化合物加水分解酵素を用いて硫黄成分を処理することを特徴とする硫黄成分の加水分解処理方法。
9.前項8に記載の加水分解処理方法を含む硫黄成分の除去方法。
【発明の効果】
【0012】
本発明の無機硫黄化合物加水分解酵素の製造方法により、当該無機硫黄化合物加水分解酵素の組換えタンパク質が大量発現可能となり、さらにリフォールディングによる活性型酵素を容易に取得可能となった。これにより、本酵素の反応機構や結晶化による立体構造の解析など、更なる研究を行うことができる。また、本酵素を用いて硫黄成分加水分解することにより、例えば石油の脱硫に伴い生成される大量の無機硫黄化合物を処理することができ、更には有用物質生産への可能性が開かれる。
【発明を実施するための最良の形態】
【0013】
本発明は、無機硫黄化合物加水分解酵素の製造方法および前記製造方法により得られた酵素の利用方法に関する。本発明において、無機硫黄化合物加水分解酵素とは、無機硫黄化合物を加水分解しうる酵素であればよく、特に制限されないが、例えばテトラチオン酸ハイドロラーゼが挙げられる。テトラチオン酸ハイドロラーゼをコードする遺伝子はAf-tthで示され、その塩基配列は配列表の配列番号1に示され、すでにDDBJ, Accession No.AB259312(非特許文献5)にも登録されている。
【0014】
本発明において、無機硫黄化合物加水分解酵素をコードする遺伝子は以下の1)〜5)より選択されるいずれかであり、発現したタンパク質は、無機硫黄化合物を加水分解しうる機能を有するものであればよい。
1)配列表の配列番号1で示される塩基配列からなるDNA。
2)配列表の配列番号1で示される塩基配列のうち、1〜複数個の遺伝子が置換、欠失、挿入または付加といった変異された塩基配列を含み、実質的に機硫黄化合物加水分解酵素を産生しうる塩基配列からなるDNA。
3)前記1)または2)に記載のDNAの相補鎖からなるDNA。
4)前記1)または2)に記載のDNAとストリンジェントな条件下でハイブリッド形成しうるDNA。
5)前記1)または2)に記載のDNAとはハイブリッド形成しないが、遺伝子コドン縮重のため、配列番号2に記載のアミノ酸配列からなるタンパク質を産生しうる塩基配列からなるDNA。
【0015】
本発明において、配列表の配列番号1で示される塩基配列のうち、1〜複数個の遺伝子が置換、欠失、挿入または付加といった変異された塩基配列を含み、実質的に機硫黄化合物加水分解酵素を産生しうる塩基配列とは、実質的に機硫黄化合物加水分解酵素活性を有するタンパク質を産生可能であれば、遺伝子において複数個の変異があってもよいことを意味する。また、上記1)または2)に記載のDNAの相補鎖からなるDNAであっても実質的に機硫黄化合物加水分解酵素活性を有するタンパク質を産生可能であればよい。
【0016】
さらに、ストリンジェントなハイブリダイゼーション条件は一般に知られたものを選択することができる。その一例としては、50%ホルムアミド、5×SSC(150 mM NaCl、15 mM クエン酸三ナトリウム)、50 mMリン酸ナトリウム、pH7.6、5×デンハーツ溶液、10%デキストラン硫酸、及び20μg/mlのDNAを含む溶液中、42℃で一晩ハイブリダイゼーションした後、室温で2×SSC・0.1% SDS中で一次洗浄し、次いで、約65℃において0.1×SSC・0.1% SDSで二次洗浄といった条件があげられる。
【0017】
本発明の無機硫黄化合物加水分解酵素の製造方法は、遺伝子工学技術を応用したタンパク質の生産方法を対象とし、該無機硫黄化合物加水分解酵素をコードする遺伝子を組み込んだ宿主細胞を培養液中で培養することにより該無機硫黄化合物加水分解酵素を生産する方法による。
【0018】
ここで、無機硫黄化合物加水分解酵素をコードする遺伝子を宿主細胞に組み込む場合の宿主細胞や遺伝子を組み込む方法は、自体公知の細胞や方法を用いることができる。宿主細胞としては原核細胞が好ましく、例えば連鎖球菌属(streptococci)、ブドウ球菌属(staphylococci)、大腸菌(E.coli)、ストレプトミセス菌属(Streptomyces)および枯草菌(Bacillus subtilis)等が挙げられ、好適には大腸菌が挙げられる。
【0019】
また、遺伝子を組み込むために、DNAがベクターに挿入された組換えプラスミドを用いることができる。ベクターは、選択した宿主の種類により選別され、発現目的の遺伝子配列と複製そして制御に関する情報を担持した遺伝子配列とを構成要素とする。本発明では、原核細胞に使用可能なものが好ましく、例えば細菌プラスミド由来、バクテリオファージ由来、トランスポゾン由来、並びにそれらを組み合わせたベクター、例えばプラスミドおよびバクテリオファージの遺伝学的エレメント由来のベクター、例えばコスミドおよびファージミド等が挙げられる。
【0020】
形質転換方法は、自体公知の方法を用いることができる。形質転換体は、宿主の培養条件に最適な条件で培養される。無機硫黄化合物加水分解酵素の大腸菌による組換え発現を試みた場合、大腸菌の培養において通常よく用いられるLB 培地では主に細胞毒性に起因する溶菌現象などが観察され、誘導発現が非常に困難であった。
【0021】
本発明において、最適な条件で大腸菌などの組換え宿主細胞での組換え細胞によるタンパク質の生産を高めるために、TB (Terrific Broth, T-Broth)培地を基に改良を行った。スケールアップによる大量培養および大量発現においては、宿主細胞である菌体生育に伴う培地の酸性化によってアンピシリンが分解され、組換えプラスミドを保持しない大腸菌が優先的に生育する。本発明の製造方法に用いられる培養液は、少なくともトリプトン、酵母エキス、グリセロールを含むTB 培地である。組換えプラスミドを保持しない大腸菌の生育を避けるために、培地のpHを検討した結果、pH 7.0〜7.4が好適である。pH の調整は、例えば基本培地に、0.9〜1.0 Mのリン酸緩衝液を添加することによる。0.9〜1.0 Mのリン酸緩衝液の調製には、通常一般的に用いられるKH2PO4およびK2HPO4を用いることができる。このようにしてリン酸緩衝液を添加して培地のpHの低下を防ぐことができる。
【0022】
さらにグルコースを培地に添加することで、基底状態(未誘導状態)での組換えタンパク質の発現を抑制することができる。本発明において、グルコースの添加濃度は20〜60 mMとすることができ、より好適には50〜60 mMとすることができる。上記培養条件により、無機硫黄化合物加水分解酵素を大量に発現させることができ、製造することができる。
【0023】
また、本発明において無機硫黄化合物加水分解酵素を原核細胞で発現させる場合は、封入体が形成されるため、発現した無機硫黄化合物加水分解酵素は不溶化されている。封入体を効果的に形成させ、発現量を増加させるための培地は、LB 培地よりもTB 培地がより効果的といえる。
【0024】
本発明は、上記製造方法において用いられる培養液にも及ぶ。具体的には、少なくともトリプトン、酵母エキス、グリセロールを含むTB 培地に、グルコースが20〜60 mM、好適には50〜60 mM添加され、pHをpH 7.0〜7.4に調整された培養液が挙げられる。さらにはアンピシリンを終濃度50〜100 g/mlとなるように添加することができる。
【0025】
形成した封入体から無機硫黄化合物加水分解酵素の活性型酵素を取得するために、宿主細胞を緩衝液で洗浄した後に超音波などを用いて細胞を破砕または溶解し、市販の試薬、例えばBugBuster(R)(タカラバイオ株式会社)を用いて封入体を抽出することができる。前記封入体を含む抽出液から、遠心分離等により不溶性画分を得ることができる。得られた不溶性画分には目的の封入体の他、宿主由来の疎水性膜タンパク質等が含まれるため、界面活性剤を含む緩衝液を用いて洗浄し、目的酵素以外のタンパク質を除去する。洗浄後の不溶性画分を目的酵素の封入体画分として、以下のリフォールディング操作に供することができる。ここにおいて、封入体画分はペレットの状態で凍結保存することができる。
【0026】
上記封入体画分について、化学変性剤を用いて目的酵素を可溶化することができる。化学変性剤として、0〜6 M、好適には約6 Mの塩酸グアニジン溶液を用いることができる。可溶化した目的酵素をpH 1.5〜4.5、好適にはpH 2.5〜3.5の緩衝液で処理することができる。例えば、透析チューブに封入体画分を注入し、上記緩衝液で処理することで、化学変性剤を緩やかに除去し、目的酵素のリフォールディングを行うことができる。本発明の無機硫黄化合物加水分解酵素は外膜に局在する膜タンパク質であるため、そのままでは正常に折りたたまれた活性型酵素も不溶化する。そこで、可溶化処理後の緩衝液のイオン強度を上げることにより目的酵素のリフォールディングをより効果的に行うことができる。緩衝液のイオン強度を上げる方法として、例えば0.1〜0.5 M、好適には約0.4 M硫酸アンモニウムを添加することができる。
【0027】
上記可溶化された目的酵素を含む溶液を遠心分離し、上清を回収することで活性型の目的酵素を得ることができる。
【0028】
本発明の製造方法およびリフォールディング操作により得られた活性型の目的酵素は、無機硫黄化合物を加水分解することができる。例えば石油の脱硫に伴い生成される大量の無機硫黄化合物を、本発明の製造方法により得られた酵素で処理することで、脱硫余剰硫黄の処理が可能となる。したがって、本発明は、得られた活性型の目的酵素を用いることによる硫黄成分の加水分解処理方法に及ぶ。さらには、加水分解処理された物質を除去することを含む硫黄成分の除去方法にも及ぶ。
【実施例】
【0029】
以下に比較例及び実施例を示して本発明をさらに具体的に説明するが、本発明はこれらにより限定されるものではない。
【0030】
(実施例1)テトラチオン酸ハイドロラーゼの遺伝子組換えによる発現
テトラチオン酸ハイドロラーゼをコードする遺伝子はAf-tthで示され、その塩基配列は配列表の配列番号1に示され、すでにDDBJ, Accession No.AB259312(非特許文献5)にも登録されている。
【0031】
TB 培養液(TB 基本培地に20〜60 mMのグルコースを添加したもの)を用いて、Af-tthを導入した組換え大腸菌で、テトラチオン酸ハイドロラーゼ(以下、「目的酵素」という。)の発現を試みた。Af-tth (Accession No. AB259312)の全遺伝子全長より、シグナルペプチドと推定されるN-末端側から32アミノ酸をコードした部分を除去した遺伝子をpET21aプラスミドに組み込み、大腸菌に形質転換した。
【0032】
本発明の培養に用いたTB 培養液は、以下により調製した。
トリプトン12 g、酵母エキス24 g、グリセロール4 mlを900 mlの脱塩水または水道水(tap Water)にてメスアップした。前記メスアップした溶液と0.9〜1.0 Mのリン酸カリウム緩衝液100 mlを別々に121℃、20分間オートクレーブ滅菌した。滅菌して室温まで冷却した後、両者をクリンベンチ内で無菌的に混合した(pH 7.0〜7.4)。終濃度が20〜60 mMとなるようにグルコースを添加し、さらにアンピシリンを終濃度50〜100 g/mlとなるように添加した。
形質転換した大腸菌を、Isopropyl-β-D-thiogalactopyranoside (IPTG)を終濃度1 mMで添加したTB 培養液中で室温36時間培養し、組換え目的酵素を誘導発現させた。
【0033】
上記により得られた組換え目的酵素とA. ferrooxidansから生成された外膜タンパク質を、SDS-PAGE(CBB染色)およびウエスタンブロッティングにより確認したところ、いずれもほぼ50 kDaの部分にバンドが認められた(図1)。なお、ウエスタンブロッティングには、比較例1で作製した抗テトラチオン酸ハイドロラーゼ抗体を用いた。
【0034】
遺伝子の一次配列より計算された分子量は49714であり、生成酵素の分子質量50 kDaに一致した。テトラチオン酸ハイドロラーゼを構成するアミノ酸のうち、N-末端から32アミノ酸はSec型の分泌シグナル配列を有する。その直後の13アミノ酸は、A. ferrooxidansから生成されたテトラチオン酸ハイドロラーゼのN-末端アミノ酸配列に完全に一致することが確認された。
【0035】
(実施例2)封入体のリフォールディング
実施例1の組換え目的酵素を誘導発現した大腸菌を遠心分離により回収し、1.0 Mリン酸カリウム緩衝液(pH 7.0)にて洗浄した。洗浄菌体を同緩衝液に懸濁後、超音波などにより菌体を破砕し、BugBuster(TM)(タカラバイオ株式会社)を用いて菌体を溶解した。
【0036】
菌体抽出液を遠心分離し、不溶性画分を回収した。これにより得た、菌体抽出液(W)、不溶性画分(I)および可溶性画分(上清画分:S)について、ウエスタンブロッティング(?)により確認したところ、不溶性画分にバンドが認められ、封入体として存在することが確認された(図2)。
なお、ウエスタンブロッティングには、後述の比較例1において発現させた組換えテトラチオン酸ハイドロラーゼを用いて作製した抗体を用いた。
【0037】
上記不溶性画分には目的酵素の封入体の他、宿主由来の疎水性膜タンパク質などが含まれる。目的酵素封入体以外のタンパク質の除去のため、4%(v/v)界面活性剤(Triton X-100)を含む0.1M リン酸カリウム緩衝液(pH 7.0)を用いて3回洗浄した。その後、滅菌済みの純水にて3回洗浄し、界面活性剤を除去した。これを目的酵素の封入体画分として、以下のリフォールディング実験に用いた。封入体画分はペレットの状態で凍結保存が可能である。
【0038】
封入体画分に6M-塩酸グアニジンを添加して可溶化した。可溶化した目的酵素溶液を透析チューブ内に注入し、0.1 M -Ala-SO42- 緩衝液 (pH 3.0), 0.4 M 硫酸アンモニウムで希釈しながら透析し、塩酸グアニジンを緩やかに除去することで目的酵素のリフォールディングを行った。
【0039】
本目的酵素は外膜に局在する膜タンパク質であるため、そのままでは正常に折りたたまれた活性型酵素も不溶化する。そこで、希釈緩衝液に0.4 M 硫酸アンモニウムを添加することでイオン強度を上げることにより目的酵素の活性体での可溶化に成功した。
最後に遠心分離によって上清を回収することで活性型の組換え目的酵素を確保した。
【0040】
(比較例1)LB 培地による遺伝子組換え目的酵素の発現
LB 培地においてAf-tthを導入した組換え大腸菌で、目的酵素の発現を試みた。培地をLB 培地とした他は、実施例1と同手法であった。
LB 培地での目的酵素の発現量は僅かではあったが、これを基に抗テトラチオン酸ハイドロラーゼ抗体を作製した。
【0041】
(実験例1)目的酵素の発現量の確認
実施例1および比較例1で得られた不溶性画分について、目的酵素の発現量をSDS-PAGEにより確認した。
その結果、比較例1の方法で発現させた場合は小スケール(5 ml程度)でのみ発現が認められたが、100 ml以上にスケールアップすると全く発現が認められなかった。一方、実施例1の方法で発現させた場合は、100 ml以上にスケールアップした場合でも組換え発現を可能とし、組換え型目的酵素を大量に獲得できるようになった。
【0042】
100 ml以上にスケールアップしたときの発現量を、SDS-PAGEで調べた(図3)。その結果、実施例1の培養液を用いてIPTG誘導した場合に50 kDaの部分に強いバンドが認められ、効果的に目的酵素を発現することが確認された。
【0043】
(実験例2)目的酵素の加水分解能の確認
実施例1で得た封入体の不溶性の目的酵素および実施例2によるリフォールディングにより得られた目的酵素について、テ加水分解能をトラチオン酸の加水分解反応による効果を、吸光度(A480nm)にて確認した(図4)。その結果、実施例1で得た不溶性目的酵素では加水分解活性は認められなかったが、実施例2で得られた目的酵素は加水分解能を有することが確認された。
反応機構は S4O62- + H2O -> S0 + S2O32- + SO42- +2H+ であることをHPLC分析によって確認した。
【産業上の利用可能性】
【0044】
以上詳述したように、本発明の無機硫黄化合物加水分解酵素の製造方法により、無機硫黄化合物加水分解酵素の組換えタンパク質が大量発現可能となり、さらにリフォールディングによる活性型酵素の取得方法が開発できた。これにより、本酵素の反応機構や結晶化による立体構造の解析など、更なる研究を行うことができ、無機硫黄化合物の生産や有用物質生産への可能性が開かれる。無機硫黄化合物加水分解酵素の詳細な反応機構を理解することで、遺伝子工学的手法により基質特異性を変化させ、硫黄(通常8分子の硫黄が互いにS-S結合することで8員環を形成)を加水分解できる可能性がある。
【0045】
通常は水に不溶性の硫黄を、無機硫黄化合物加水分解酵素で加水分解することで水和できれば、特に生物的な親和性を高めることになり、反応性が飛躍的に高まり、硫黄の有効利用あるいは高効率な生物的処理への応用の可能性が期待できる。生物的処理法は、一般に常温・常圧で行われ、省エネルギーで環境に対する負荷も少ない技術として有用である。
【0046】
特に石油脱硫硫黄の大量余剰問題は深刻化しており、本発明の製造方法により、この問題の有用な解決法に繋がる可能性がある。本発明の方法により生産された無機硫黄化合物加水分解酵素を用いて、石油脱硫余剰硫黄を処理することで、選択性の高い、または省エネルギー可能な反応が期待され、環境・食糧・エネルギーなどの諸問題の有効な解決策の一つとして期待できる。
【0047】
また、本発明の製造方法により得られた組換え無機硫黄化合物加水分解酵素は、A. ferrooxidansの外膜タンパク質と同等のものであることが明らかになったことから、無機硫黄化合物加水分解酵素をコードする遺伝子を有する生物を有効利用することも可能となる。
【図面の簡単な説明】
【0048】
【図1】大腸菌により産生した組換えテトラチオン酸ハイドロラーゼが、A. ferrooxidansから生成された外膜タンパク質(酵素)と同等のタンパク質であることを示す図である。(実施例2)
【図2】大腸菌により産生した組換えテトラチオン酸ハイドロラーゼが封入体で存在することを示す図である。(実施例2)
【図3】従来法および本発明の方法による組換えテトラチオン酸ハイドロラーゼの発現量を示す図である。(実験例1)
【図4】本発明の方法によりリフォールディングして得られた組換えテトラチオン酸ハイドロラーゼの加水分解活性を示す図である。(実験例2)
【特許請求の範囲】
【請求項1】
無機硫黄化合物加水分解酵素をコードする遺伝子を組み込んだ宿主細胞を培養液中で培養することにより該無機硫黄化合物加水分解酵素を発現させ、製造する場合において、前記宿主細胞を、トリプトン、酵母エキス、グリセロールを含むTerrific Broth培地をpH 7.0〜7.4に調整し、さらにグルコースを添加した培養液中で培養する事を特徴とする、無機硫黄化合物加水分解酵素の製造方法。
【請求項2】
Terrific Broth培地に添加するグルコース濃度が、20〜60 mMである、請求項1に記載の製造方法。
【請求項3】
宿主が、大腸菌である請求項1または2に記載の製造方法。
【請求項4】
発現した無機硫黄化合物加水分解酵素が封入体の場合に、該封入体を、塩酸グアニジンを含む溶液で可溶化した後、pH 1.5〜4.5の緩衝液で処理することにより発現無機硫黄化合物加水分解酵素をリフォールディングさせ、活性型無機硫黄化合物加水分解酵素を産生する、請求項1〜3の何れかに記載の製造方法。
【請求項5】
無機硫黄化合物加水分解酵素が、テトラチオン酸ハイドロラーゼである請求項1〜4の何れかに記載の製造方法。
【請求項6】
無機硫黄化合物加水分解酵素をコードする遺伝子が、以下より選択されるいずれかである請求項1〜5の何れかに記載の製造方法:
1)配列表の配列番号1で示される塩基配列からなるDNA;
2)配列表の配列番号1で示される塩基配列のうち、1〜複数個の遺伝子が置換、欠失、挿入または付加といった変異された塩基配列を含み、実質的に無機硫黄化合物加水分解酵素を産生しうる塩基配列からなるDNA;
3)前記1)または2)に記載のDNAの相補鎖からなるDNA;
4)前記1)または2)に記載のDNAとストリンジェントな条件下でハイブリッド形成しうるDNA;
5)前記1)または2)に記載のDNAとはハイブリッド形成しないが、遺伝子コドン縮重のため、配列番号2に記載のアミノ酸配列からなるタンパク質を産生しうる塩基配列からなるDNA。
【請求項7】
請求項1〜6のいずれか1に記載の製造方法に使用される培養液。
【請求項8】
請求項1〜6のいずれか1に記載の製造方法により得られた無機硫黄化合物加水分解酵素を用いて硫黄成分を処理することを特徴とする硫黄成分の加水分解処理方法。
【請求項9】
請求項8に記載の加水分解処理方法を含む硫黄成分の除去方法。
【請求項1】
無機硫黄化合物加水分解酵素をコードする遺伝子を組み込んだ宿主細胞を培養液中で培養することにより該無機硫黄化合物加水分解酵素を発現させ、製造する場合において、前記宿主細胞を、トリプトン、酵母エキス、グリセロールを含むTerrific Broth培地をpH 7.0〜7.4に調整し、さらにグルコースを添加した培養液中で培養する事を特徴とする、無機硫黄化合物加水分解酵素の製造方法。
【請求項2】
Terrific Broth培地に添加するグルコース濃度が、20〜60 mMである、請求項1に記載の製造方法。
【請求項3】
宿主が、大腸菌である請求項1または2に記載の製造方法。
【請求項4】
発現した無機硫黄化合物加水分解酵素が封入体の場合に、該封入体を、塩酸グアニジンを含む溶液で可溶化した後、pH 1.5〜4.5の緩衝液で処理することにより発現無機硫黄化合物加水分解酵素をリフォールディングさせ、活性型無機硫黄化合物加水分解酵素を産生する、請求項1〜3の何れかに記載の製造方法。
【請求項5】
無機硫黄化合物加水分解酵素が、テトラチオン酸ハイドロラーゼである請求項1〜4の何れかに記載の製造方法。
【請求項6】
無機硫黄化合物加水分解酵素をコードする遺伝子が、以下より選択されるいずれかである請求項1〜5の何れかに記載の製造方法:
1)配列表の配列番号1で示される塩基配列からなるDNA;
2)配列表の配列番号1で示される塩基配列のうち、1〜複数個の遺伝子が置換、欠失、挿入または付加といった変異された塩基配列を含み、実質的に無機硫黄化合物加水分解酵素を産生しうる塩基配列からなるDNA;
3)前記1)または2)に記載のDNAの相補鎖からなるDNA;
4)前記1)または2)に記載のDNAとストリンジェントな条件下でハイブリッド形成しうるDNA;
5)前記1)または2)に記載のDNAとはハイブリッド形成しないが、遺伝子コドン縮重のため、配列番号2に記載のアミノ酸配列からなるタンパク質を産生しうる塩基配列からなるDNA。
【請求項7】
請求項1〜6のいずれか1に記載の製造方法に使用される培養液。
【請求項8】
請求項1〜6のいずれか1に記載の製造方法により得られた無機硫黄化合物加水分解酵素を用いて硫黄成分を処理することを特徴とする硫黄成分の加水分解処理方法。
【請求項9】
請求項8に記載の加水分解処理方法を含む硫黄成分の除去方法。
【図4】


【図1】


【図2】


【図3】




【図1】


【図2】


【図3】


【公開番号】特開2009−112204(P2009−112204A)
【公開日】平成21年5月28日(2009.5.28)
【国際特許分類】
【出願番号】特願2007−285817(P2007−285817)
【出願日】平成19年11月2日(2007.11.2)
【出願人】(504147243)国立大学法人 岡山大学 (444)
【Fターム(参考)】
【公開日】平成21年5月28日(2009.5.28)
【国際特許分類】
【出願日】平成19年11月2日(2007.11.2)
【出願人】(504147243)国立大学法人 岡山大学 (444)
【Fターム(参考)】
[ Back to top ]

