熱化学的分解による水素の製造方法
【課題】 高温高圧の水と発生ガス吸収物質を用いて、熱力学的化学平衡を維持したまま、超臨界に比べて比較的低い圧力で、水を熱化学的分解することにより水素を製造する方法を提供する。
【課題を解決する手段】 炭素を含有する物質を高温高圧の水と反応させ、炭素を含有する物質を熱化学的に分解しつつ、水を還元して水素を生成させる方法であって、二酸化炭素吸収物質を、少なくとも生成したすべての二酸化炭素を吸収できる量反応系に存在させ、かつ、圧力80気圧以上温度600℃以上の条件で実質上酸化剤を加えることなく熱化学的分解を行う。
【課題を解決する手段】 炭素を含有する物質を高温高圧の水と反応させ、炭素を含有する物質を熱化学的に分解しつつ、水を還元して水素を生成させる方法であって、二酸化炭素吸収物質を、少なくとも生成したすべての二酸化炭素を吸収できる量反応系に存在させ、かつ、圧力80気圧以上温度600℃以上の条件で実質上酸化剤を加えることなく熱化学的分解を行う。
【発明の詳細な説明】
【0001】
【発明の属する技術分野】石炭や石油などの有機物を高温高圧で熱分解し水素ガスを製造する水素製造方法や、水性ガスからの水素の製造方法、水を電気分解する水素の製造方法等は、従来から知られている。本発明は、このような水素を製造する技術分野に属し、その特徴とするところは、有機物中の炭素を酸化する際に発生する熱を利用し、高温高圧の水を熱化学的に分解し水素を選択的に製造する方法に関するものである。
【0002】
【従来の技術】石炭、石油、プラスチックス、バイオマス、等の有機物を分解してガス化するプロセスは幾つかあるが、酸化分解法が最も多く利用されている。酸化分解法の中でも超臨界水を利用する酸化分解法は分解速度が高いので最近はよく利用される。図1に従来の超臨界水を利用した有機物の酸化分解法を示す。有機物は水と混合され、水が超臨界状態となる反応装置1にポンプ2で圧送され400℃程度の温度の反応器内での一定時間反応時間を確保した後、冷却器3で冷却され、減圧され生成したガス状の酸化分解生成物、水、固体残渣に分離される。このとき、酸化剤として空気または酸素を別途反応器3に供給し、発生する熱が不足する場合には外部から熱を加えることにより超臨界状態を維持する。この様な操作条件では、ガス状の酸化分解生成物は二酸化炭素と有機物中の窒素分から生成された窒素ガスが大部分を占めている。酸化剤を加えずに外部からの熱のみで400〜600℃の温度で熱分解を超臨界水中で行う分解法もあるが、この場合は一酸化炭素、二酸化炭素、低級炭化水素、水素、窒素を主成分とするガス状の熱分解生成物と多くの場合液状の生成物が得られる。高温で熱分解するほどガスの収率は高くなるが、水素の収率は低い。従来は、有機物を超臨界水中で分解して、有機物由来のガスを取り出すことに関して、いろいろ研究が行われていたが、有機物中の炭素を用いて、水を還元して水素を取り出すことは、着目されていなかったし、考えられたこともなかった。本発明者は、このような観点から、いかに水の熱化学的分解を起こし、効率よく超臨界水を還元できるかに的を絞って、鋭意研究した結果、実質上酸化剤を加えることなく、特定条件の超臨界の水と二酸化炭素吸収物質を組み合わせれば良いことを見出し、既に特願平10−356846号及び特願平10−365994号として出願している。また、1500°F近辺の高温と20気圧程度の圧力下で、二酸化炭素吸収物質の存在下、石炭等と水を反応させ、水素と一酸化炭素、二酸化炭素の混合気体を得ることも米国特許4,231,760号に記載されている。しかし、この技術はいわゆる合成ガスを作る技術であり、二酸化炭素吸収物質を用いて石炭等と水を反応させる点は類似しているが、副生する炭素の化合物は炭化の酸化物である点において、本発明と決定的に異なる。すなわち、本発明では水素が大量に発生し、副生する炭素の化合物は、メタンを主成分とする炭化水素である。
【0003】
【発明が解決しようとする課題】しかし、220気圧以上、600℃の超臨界という条件は、装置を作る上や、操業の安全性の点で厳しいものがあり、この発明を装置として具体化してゆくことを念頭において、もう少し緩やかな条件での水素の製造方法を探っていた。600℃以上という温度条件は変らないが、圧力が80気圧程度でも、それほど効率が悪くならないことを見出して、この発明を完成するに至った。この条件は、超臨界の条件を探っていた我々にとっては思いもよらない結果であった。温度は600℃以下例えば500℃になると、圧力を250気圧に上げても、水素の収率が下がることも分かった。しかし、圧力に関しては、超臨界の下限値の約4割弱の80気圧まで下げても、水素の収率が思ったほど低下しないことが確認された。ただし、80気圧以下にすると、副生する炭化水素に炭素の酸化物が混入し始めるので好ましくない。本発明は、特定条件の高温高圧の水と発生ガス吸収物質を用いて、熱力学的化学平衡を維持したまま、エネルギー効率を良くし、超臨界に達するまでの比較的低い圧力で水素を製造できる条件を発見したものである。さらに、硫黄やハロゲンを反応器で捕捉し、生成するガス中に移行させることなく、最終的に水溶性の塩として回収できることも超臨界で行う場合と同様である。本発明において、実質上酸化剤を加えないという意味は、酸化剤を加える必要がないという意味のほか、試料ないし原料を反応装置に装填するに際して、試料ないし原料の中に含まれる空気等をわざわざ除く必要はないという意味でもあり、この点についても、超臨界で行う場合と同様に、本発明の重要な構成要件の一つである。
【0004】
【課題を解決する手段】本発明は、「炭素を含有する物質を高温高圧の水と反応させ、炭素を含有する物質を熱化学的に分解しつつ、水を還元して水素を生成させる方法であって、二酸化炭素吸収物質を、少なくとも生成したすべての二酸化炭素を吸収できる量反応系に存在させ、かつ、圧力80気圧以上温度600℃以上の条件で実質上酸化剤を加えることなく熱化学的分解を行う水素の製造方法。」であって、本発明の基本的な理論を説明すると超臨界で行う場合と同様に、次ぎのことが言える。炭素を含有する物質と超臨界状態の水との反応で形成されたガス中の一酸化炭素、水蒸気、二酸化炭素、水素は、化学平衡にある。平衡反応は、CO+H2O=CO2 +H2 ・・・・・(1)
の関係で記述される。ここで反応器の温度、圧力の条件で二酸化炭素と反応し固体として固定する作用をし、それ自身はこの化学平衡関係になんら影響を与えない物質(二酸化炭素吸収物質)を予め過剰に反応場に共存させれば、ガス中の二酸化炭素の量はこの物質との反応により減少する。
【0005】この減少した二酸化炭素の量に対し前述の化学平衡関係を維持するためには、必然的にCOとH2Oとの反応によりCO2とH2を生成する方向に反応が進行する。生じたCO2は二酸化炭素吸収剤と反応し、ガスから除去される。この結果最終的にはガス中には極く少量の一酸化炭素と二酸化炭素および多量の水蒸気と水素が存在する形で化学平衡となる。ガスと固体(有機物中の灰分、未反応の二酸化炭吸収剤および二酸化炭素を吸収して生じた固体物質の混合物)は冷却することにより水蒸気は水に戻るため分離することが可能となる。この結果有機物から水素を主成分とするガスを製造することが可能になる。今、二酸化炭素吸収剤をXとすると化学反応式はC+2H2O+X=(XCO2)+2H2 ・・・・・(2)
で記述できる。生成する水素ガスは水を起源とするもので、上記の総括反応式は有機物中の炭素と水から選択的に水素を製造することを示し、これは水の熱化学的分解反応と見ることができる。
【0006】反応を駆動する熱源としては有機物の保有する炭素を酸化する際に発生する燃焼熱のほか、反応系に加える二酸化炭素吸収物質例えばCaOなどは水と反応してCa(OH)2になるとき反応熱を放出するから当然このような熱も利用することができるが、不足する場合は外部から熱を加えることにより(2)式を進行させることができる。物質Xを二酸化炭素吸収剤として用いる場合、X+CO2 =XCO2 ・・・・・(3)
の反応を生じるためには、熱力学的に定まる温度以上でなければならない。したがって、本発明の反応系の温度は必然的に上記反応式(3)の生じる温度以上となる。二酸化炭素吸収剤としてはCaO、MgO、酸化鉄(FeO,Fe2O3,Fe3O4)等の金属酸化物及び同種金属の水酸化物(Ca(OH)2,Mg(OH)2,Fe(OH)2,Fe(OH)3等)が代表的なものである。経済的な理由からCaO、Ca(OH)2が最も推奨される物質である。また、実施例としては挙げなかったが、MgO、Mg(OH)2、FeO、Fe2O3、Fe3O4も有効であることを確認している。水酸化物は高温の条件では脱水反応 Ca(OH)2 =CaO+H2O ・・・・・(4)
Mg(OH)2 =MgO+H2O ・・・・・(5)
を生じるので、同種金属酸化物を最初から加えた場合と反応場は等しくなる。有機物中の硫黄分は上記の反応過程でXと反応して硫酸塩として固定されるが、この場合水に難溶性の硫酸塩を生成してしまい好ましくない。これを防ぐため、Xとは別に一旦ガス化で生じるH2Sと反応しやすい物質Yを加えYとH2Sとの反応で水溶性の物質を形成させる。
【0007】この結果、有機物中の硫黄は水溶性となるため、反応後の二酸化炭素吸収物質や未反応の二酸化炭素吸収物質、有機物中の灰分等、他の固体から分離することができる。ハロゲンについても同様に水溶性の塩として固定可能である。物質Yとしては、NaOH,Na2CO3、KOH,K2CO3がある。また多くの場合物質Yは、有機物と超臨界状態の水との反応を促進する触媒として作用するので好都合である。また、実施例としてはNa2CO3を用いた場合を示したが、NaOH、KOH、K2CO3も同様の作用をすることを確認している。反応が進行するかどうかの見極めには熱力学的な検討が必要である。主反応の反応熱はC+H2O=CO+H2 31.4 kcal (吸熱反応) (6)
H2O+CO=CO2+H2 −9.9 kcal (発熱反応) (7)
CaO+CO2=CaCO2 −42.5 kcal (発熱反応) (8)
従って総括の反応は、C+2H2O+CaO=CaCO3+2H2 −21.0kcal (発熱反応) (9)
となり、少なくとも正味発熱反応であり、熱力学的には自発的に進行することが予想できた。
【0008】
【発明の実施の形態】本発明の実施の形態は以下のとおりである。
(1) 炭素を含有する物質を高温高圧の水と反応させ、炭素を含有する物質を熱化学的に分解しつつ、水を還元して水素を生成させる方法であって、二酸化炭素吸収物質を、少なくとも生成したすべての二酸化炭素を吸収できる量反応系に存在させ、かつ、圧力80気圧以上温度600℃以上の条件で実質上酸化剤を加えることなく熱化学的分解を行う水素の製造方法。
(2) 炭素を含有する物質と二酸化炭素吸収物質を反応系に供給し、生成した水素と炭酸塩を反応系から取り出す上記(1)に記載された水素の製造方法。
(3) 炭酸塩を加熱分解し、二酸化炭素吸収物質に変え、再び反応系に戻す請求項1または上記(2)に記載された水素の製造方法。
(4) 二酸化炭素を吸収する物質としてCaO、MgOまたは酸化鉄(FeO,Fe2O3,Fe3O4)を用いる上記(1)ないし上記(3)のいずれかの一つに記載された水素の製造方法。
(5) 炭素を含有する物質が、石炭、石油、プラスチックス、バイオマス、汚泥、有機廃棄物のいずれか一つ、または二つ以上である上記(1)ないし上記(4)のいずれかの一つに記載された水素の製造方法。
(6) 反応温度が650℃〜800℃である上記(1)ないし上記(5)のいずれかの一つに記載された水素の製造方法。
(7) 二酸化炭素吸収物質と共に、硫黄やハロゲンと水溶性の塩を形成する物質を、少なくとも生成した硫黄やハロゲンをすべて吸収する量反応系に存在させる上記(1)ないし上記(6)のいずれかの一つに記載された水素の製造方法。
(8) 硫黄やハロゲンと水溶性の塩を形成する物質として、NaOH、 Na2CO3と、KOH、K2CO3からなる群より選ばれる化合物の1種または2種以上を用いる上記(1)ないし上記(7)のいずれかの一つに記載された水素の製造方法。
【0009】
【発明の具体的実施の説明】図2に示す外径58mm内径13mm反応空間部の長さ130mmのマイクロオートクレーブ5を用いて実施した。マイクロオートクレーブ5は、基本的に反応空間となる本体51、計測器具連結部装着蓋52、締付部材53からなる。計測器具連結部装着蓋52は本体51の上部で締付部材53で締め付けられる。計測器具連結部装着蓋52は本体51より外径がわずかに小さくできており、締め付けは、締付部材53の内側のネジと本体51の上部の外周に切られたネジを旋回させることにより行われる。本体51と計測器具連結部装着蓋52は、取り外しすることができ、ここから試料を入れることが出来る。試料を装填し、締付部材53と本体51を十分に締め付けた後、ボルト54でさらに強固に本体51と計測器具連結部装着蓋52を押圧することができる。計測器具連結部装着蓋52は、バルブ6に通じる微細管55と熱電対の導線56と圧力計9に通じる微細管57を有する。バルブ6で調節することにより、反応空間部の圧力を予め調整することが出来るほか、反応終了後バルブ6を全開して生成した気体を分析計7に送り込む。熱電対の導線は、反応空間部まで伸びている。
【0010】既に出願した特願平10−356846号及び特願平10−365994号の実施においては、反応系に添加する水の量を測定し、気体の状態方程式により、反応圧力を推定していたが、このような実験装置を用いた結果、反応系の圧力を実測することができた。本発明では、圧力はすべて実測した値を記載している。また、反応温度も反応空間に直接熱電対を挿入することができるから、より正確な値を得ることができた。
【0011】
【実施例1】反応容器6内に粉砕した太平洋炭(炭素含有量76%)0.1gと過剰当量のCa(OH)2粉末0.6gとNaOH 0.1gと純水8.0ccを混合し、本体51の内部に装填した。計測器具連結部装着蓋52をかぶせて締付部材53と本体51を十分に締め付けた後、ボルト54でさらに強固に本体51と計測器具連結部装着蓋52を押圧した。電気炉を用い、熱電対が650℃を示すまで加熱し、その温度で20分間反応させた。反応後冷却し、バルブ6を開いて、発生したガスを分析計に送り込み、生成ガスの体積と生成ガスの種類を測定した。本体51の内部に残された固体と液体は回収し分析を行った。
【0012】
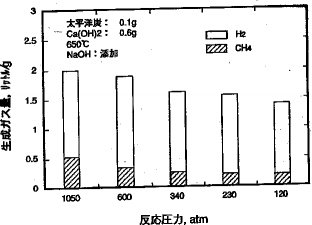
【実施例2〜5】純水の装填量を6cc,4cc,3cc及び2ccにすることによって、反応圧力を、それぞれ600気圧、340気圧、230気圧、120気圧に調整したほかは実施例1と同じことを繰り返した。実施した結果を図3に示す。反応圧力を下げると生成するガス量は減少するが、ガス中の水素の割合は高いままであり、単に反応速度が低下しただけであることが証明された。(9)式より、炭素1モルより2モルの水素が製造されるので、理論的には石炭(炭素分76%)の場合は、2.83Nm3/kgの水素が製造可能である。実験の結果からは水素の他に若干のCH4が副生する。これはCO2とH2との反応により生じるものと考えられる。NaOHを加えない場合は石炭中のS分はCaSO4として固定されるが非水溶性であるので他の固体物質からの分離は困難である。しかし、NaOHを添加することにより、石炭中のSは最終的に水溶性のNa2SO4として捕捉され、水処理により系外へ抜き出すことができるので有利になることは、超臨界で行う場合と同じである。
【0013】
【実施例6〜9】木くず、ポリ塩化ビニル、ポリエチレン、黒ゴムの4種類の有機物をこの順番で、それぞれ0.1gを試料とし、これに、二酸化炭素吸収物質であるCa(OH)2を0.6g、水を4cc及び反応の触媒を兼ねた硫黄分捕捉剤としてNa2CO3を0.1g混合し、電気炉で外部加熱し、反応温度650℃、120気圧、反応時間20分の条件で反応させた。反応後冷却し、バルブ6を解放し、発生したガスは分析装置に導いて、発生ガス量を測定すると共に、組成はガスクロマトグラフにより測定した。反応器内部の固体と液体は回収し分析を行った。石炭以外の有機物においても、超臨界で行う場合と同様に、炭素分を含む物質は全て本方法の対象となり得ることが確認できた。
【0014】
【発明の効果】本発明において特徴的なのは、超臨界で行う場合と同様に、本方法が石炭以外の有機物にも広く適応可能な点である。このフレキシビリティーの高さも注目に値する。本プロセスは原料系によりおおまかに下記の様に分類される。
(1)石炭を原料とするプロセス(2)重質油、減圧残油等を原料とするプロセス(3)プラスチック類を原料とするプロセス(4)バイオマスを原料とするプロセス(5)汚泥、有機廃棄物を原料とするプロセスプロセス的には若干の相違はあるものの、それぞれの原料に対しプロセスを組むことが可能で、高効率で水素を製造し、かつ有害な元素の環境への排出を防止できる。水素はエネルギー回収と物質回収の両面で考えることが可能である。また、副生するCO2は高濃度で回収することも可能で地球温暖化ガスであるCO2の処理、利用の観点からも非常に有利で、環境に与えるインパクトも少ない。石炭、石油、バイオマス、プラスチック、汚泥、有機廃棄物などの炭素含有の熱源物質と水、空気、石灰石、炭酸ナトリウムという安価で一般的な物質の組み合わせのみで水素を選択的に製造可能な技術を提供することができる。具体的な効果としては、(1)化石燃料資源(特に石炭)、バイオマスを環境への負荷を与えず、クリーンな水素エネルギーに変換できる。水素はエネルギーとして高効率で使用する方法が各種開発されており、この結果化石燃料資源の延命化ができる。
(2)褐炭等水分を多量に含む場合でも、従来の様に乾燥させずにそのまま利用することが可能になる。
(3)炭素含有物質中の硫黄、塩素等の環境汚染の原因となる物質などをも捕捉することが可能である。
(4)プラスチックス類については熱エネルギーの形ではなく水素に転換可能で、エネルギー回収、物質リサイクルどちらの方式にも対応可能。焼却で問題となる、ダイオキシンの発生や塩化水素の発生がない。
(5)汚泥、有機廃棄物等については、乾燥させることなく、処理できるのでエネルギーの無駄遣いが減り、廃棄物の分別回収の必要がなくなる。など、超臨界で行う場合と同様の効果が挙げられる。
【図面の簡単な説明】
【図1】従来技術による超臨界水を利用した有機物の熱分解酸化プロセスの一例を示した説明図
【図2】本発明の実施に用いた装置の断面図
【図3】本発明の条件での石炭の水との反応で生成したガス量とその組成に関する実験結果を示す説明図
【符号の説明】
1…超臨界水反応装置
2…ポンプ
3…冷却器
4…気体分離器
5…マイクロオートクレーブ
51…本体
52…計測器具連結部装着蓋
53…締付部材
54…ボルト
55…バルブ6に通じる微細管
56…熱電対の導線
57…圧力計9に通じる微細管
6…バルブ
7…分析計
8…熱電対
9…圧力計
【0001】
【発明の属する技術分野】石炭や石油などの有機物を高温高圧で熱分解し水素ガスを製造する水素製造方法や、水性ガスからの水素の製造方法、水を電気分解する水素の製造方法等は、従来から知られている。本発明は、このような水素を製造する技術分野に属し、その特徴とするところは、有機物中の炭素を酸化する際に発生する熱を利用し、高温高圧の水を熱化学的に分解し水素を選択的に製造する方法に関するものである。
【0002】
【従来の技術】石炭、石油、プラスチックス、バイオマス、等の有機物を分解してガス化するプロセスは幾つかあるが、酸化分解法が最も多く利用されている。酸化分解法の中でも超臨界水を利用する酸化分解法は分解速度が高いので最近はよく利用される。図1に従来の超臨界水を利用した有機物の酸化分解法を示す。有機物は水と混合され、水が超臨界状態となる反応装置1にポンプ2で圧送され400℃程度の温度の反応器内での一定時間反応時間を確保した後、冷却器3で冷却され、減圧され生成したガス状の酸化分解生成物、水、固体残渣に分離される。このとき、酸化剤として空気または酸素を別途反応器3に供給し、発生する熱が不足する場合には外部から熱を加えることにより超臨界状態を維持する。この様な操作条件では、ガス状の酸化分解生成物は二酸化炭素と有機物中の窒素分から生成された窒素ガスが大部分を占めている。酸化剤を加えずに外部からの熱のみで400〜600℃の温度で熱分解を超臨界水中で行う分解法もあるが、この場合は一酸化炭素、二酸化炭素、低級炭化水素、水素、窒素を主成分とするガス状の熱分解生成物と多くの場合液状の生成物が得られる。高温で熱分解するほどガスの収率は高くなるが、水素の収率は低い。従来は、有機物を超臨界水中で分解して、有機物由来のガスを取り出すことに関して、いろいろ研究が行われていたが、有機物中の炭素を用いて、水を還元して水素を取り出すことは、着目されていなかったし、考えられたこともなかった。本発明者は、このような観点から、いかに水の熱化学的分解を起こし、効率よく超臨界水を還元できるかに的を絞って、鋭意研究した結果、実質上酸化剤を加えることなく、特定条件の超臨界の水と二酸化炭素吸収物質を組み合わせれば良いことを見出し、既に特願平10−356846号及び特願平10−365994号として出願している。また、1500°F近辺の高温と20気圧程度の圧力下で、二酸化炭素吸収物質の存在下、石炭等と水を反応させ、水素と一酸化炭素、二酸化炭素の混合気体を得ることも米国特許4,231,760号に記載されている。しかし、この技術はいわゆる合成ガスを作る技術であり、二酸化炭素吸収物質を用いて石炭等と水を反応させる点は類似しているが、副生する炭素の化合物は炭化の酸化物である点において、本発明と決定的に異なる。すなわち、本発明では水素が大量に発生し、副生する炭素の化合物は、メタンを主成分とする炭化水素である。
【0003】
【発明が解決しようとする課題】しかし、220気圧以上、600℃の超臨界という条件は、装置を作る上や、操業の安全性の点で厳しいものがあり、この発明を装置として具体化してゆくことを念頭において、もう少し緩やかな条件での水素の製造方法を探っていた。600℃以上という温度条件は変らないが、圧力が80気圧程度でも、それほど効率が悪くならないことを見出して、この発明を完成するに至った。この条件は、超臨界の条件を探っていた我々にとっては思いもよらない結果であった。温度は600℃以下例えば500℃になると、圧力を250気圧に上げても、水素の収率が下がることも分かった。しかし、圧力に関しては、超臨界の下限値の約4割弱の80気圧まで下げても、水素の収率が思ったほど低下しないことが確認された。ただし、80気圧以下にすると、副生する炭化水素に炭素の酸化物が混入し始めるので好ましくない。本発明は、特定条件の高温高圧の水と発生ガス吸収物質を用いて、熱力学的化学平衡を維持したまま、エネルギー効率を良くし、超臨界に達するまでの比較的低い圧力で水素を製造できる条件を発見したものである。さらに、硫黄やハロゲンを反応器で捕捉し、生成するガス中に移行させることなく、最終的に水溶性の塩として回収できることも超臨界で行う場合と同様である。本発明において、実質上酸化剤を加えないという意味は、酸化剤を加える必要がないという意味のほか、試料ないし原料を反応装置に装填するに際して、試料ないし原料の中に含まれる空気等をわざわざ除く必要はないという意味でもあり、この点についても、超臨界で行う場合と同様に、本発明の重要な構成要件の一つである。
【0004】
【課題を解決する手段】本発明は、「炭素を含有する物質を高温高圧の水と反応させ、炭素を含有する物質を熱化学的に分解しつつ、水を還元して水素を生成させる方法であって、二酸化炭素吸収物質を、少なくとも生成したすべての二酸化炭素を吸収できる量反応系に存在させ、かつ、圧力80気圧以上温度600℃以上の条件で実質上酸化剤を加えることなく熱化学的分解を行う水素の製造方法。」であって、本発明の基本的な理論を説明すると超臨界で行う場合と同様に、次ぎのことが言える。炭素を含有する物質と超臨界状態の水との反応で形成されたガス中の一酸化炭素、水蒸気、二酸化炭素、水素は、化学平衡にある。平衡反応は、CO+H2O=CO2 +H2 ・・・・・(1)
の関係で記述される。ここで反応器の温度、圧力の条件で二酸化炭素と反応し固体として固定する作用をし、それ自身はこの化学平衡関係になんら影響を与えない物質(二酸化炭素吸収物質)を予め過剰に反応場に共存させれば、ガス中の二酸化炭素の量はこの物質との反応により減少する。
【0005】この減少した二酸化炭素の量に対し前述の化学平衡関係を維持するためには、必然的にCOとH2Oとの反応によりCO2とH2を生成する方向に反応が進行する。生じたCO2は二酸化炭素吸収剤と反応し、ガスから除去される。この結果最終的にはガス中には極く少量の一酸化炭素と二酸化炭素および多量の水蒸気と水素が存在する形で化学平衡となる。ガスと固体(有機物中の灰分、未反応の二酸化炭吸収剤および二酸化炭素を吸収して生じた固体物質の混合物)は冷却することにより水蒸気は水に戻るため分離することが可能となる。この結果有機物から水素を主成分とするガスを製造することが可能になる。今、二酸化炭素吸収剤をXとすると化学反応式はC+2H2O+X=(XCO2)+2H2 ・・・・・(2)
で記述できる。生成する水素ガスは水を起源とするもので、上記の総括反応式は有機物中の炭素と水から選択的に水素を製造することを示し、これは水の熱化学的分解反応と見ることができる。
【0006】反応を駆動する熱源としては有機物の保有する炭素を酸化する際に発生する燃焼熱のほか、反応系に加える二酸化炭素吸収物質例えばCaOなどは水と反応してCa(OH)2になるとき反応熱を放出するから当然このような熱も利用することができるが、不足する場合は外部から熱を加えることにより(2)式を進行させることができる。物質Xを二酸化炭素吸収剤として用いる場合、X+CO2 =XCO2 ・・・・・(3)
の反応を生じるためには、熱力学的に定まる温度以上でなければならない。したがって、本発明の反応系の温度は必然的に上記反応式(3)の生じる温度以上となる。二酸化炭素吸収剤としてはCaO、MgO、酸化鉄(FeO,Fe2O3,Fe3O4)等の金属酸化物及び同種金属の水酸化物(Ca(OH)2,Mg(OH)2,Fe(OH)2,Fe(OH)3等)が代表的なものである。経済的な理由からCaO、Ca(OH)2が最も推奨される物質である。また、実施例としては挙げなかったが、MgO、Mg(OH)2、FeO、Fe2O3、Fe3O4も有効であることを確認している。水酸化物は高温の条件では脱水反応 Ca(OH)2 =CaO+H2O ・・・・・(4)
Mg(OH)2 =MgO+H2O ・・・・・(5)
を生じるので、同種金属酸化物を最初から加えた場合と反応場は等しくなる。有機物中の硫黄分は上記の反応過程でXと反応して硫酸塩として固定されるが、この場合水に難溶性の硫酸塩を生成してしまい好ましくない。これを防ぐため、Xとは別に一旦ガス化で生じるH2Sと反応しやすい物質Yを加えYとH2Sとの反応で水溶性の物質を形成させる。
【0007】この結果、有機物中の硫黄は水溶性となるため、反応後の二酸化炭素吸収物質や未反応の二酸化炭素吸収物質、有機物中の灰分等、他の固体から分離することができる。ハロゲンについても同様に水溶性の塩として固定可能である。物質Yとしては、NaOH,Na2CO3、KOH,K2CO3がある。また多くの場合物質Yは、有機物と超臨界状態の水との反応を促進する触媒として作用するので好都合である。また、実施例としてはNa2CO3を用いた場合を示したが、NaOH、KOH、K2CO3も同様の作用をすることを確認している。反応が進行するかどうかの見極めには熱力学的な検討が必要である。主反応の反応熱はC+H2O=CO+H2 31.4 kcal (吸熱反応) (6)
H2O+CO=CO2+H2 −9.9 kcal (発熱反応) (7)
CaO+CO2=CaCO2 −42.5 kcal (発熱反応) (8)
従って総括の反応は、C+2H2O+CaO=CaCO3+2H2 −21.0kcal (発熱反応) (9)
となり、少なくとも正味発熱反応であり、熱力学的には自発的に進行することが予想できた。
【0008】
【発明の実施の形態】本発明の実施の形態は以下のとおりである。
(1) 炭素を含有する物質を高温高圧の水と反応させ、炭素を含有する物質を熱化学的に分解しつつ、水を還元して水素を生成させる方法であって、二酸化炭素吸収物質を、少なくとも生成したすべての二酸化炭素を吸収できる量反応系に存在させ、かつ、圧力80気圧以上温度600℃以上の条件で実質上酸化剤を加えることなく熱化学的分解を行う水素の製造方法。
(2) 炭素を含有する物質と二酸化炭素吸収物質を反応系に供給し、生成した水素と炭酸塩を反応系から取り出す上記(1)に記載された水素の製造方法。
(3) 炭酸塩を加熱分解し、二酸化炭素吸収物質に変え、再び反応系に戻す請求項1または上記(2)に記載された水素の製造方法。
(4) 二酸化炭素を吸収する物質としてCaO、MgOまたは酸化鉄(FeO,Fe2O3,Fe3O4)を用いる上記(1)ないし上記(3)のいずれかの一つに記載された水素の製造方法。
(5) 炭素を含有する物質が、石炭、石油、プラスチックス、バイオマス、汚泥、有機廃棄物のいずれか一つ、または二つ以上である上記(1)ないし上記(4)のいずれかの一つに記載された水素の製造方法。
(6) 反応温度が650℃〜800℃である上記(1)ないし上記(5)のいずれかの一つに記載された水素の製造方法。
(7) 二酸化炭素吸収物質と共に、硫黄やハロゲンと水溶性の塩を形成する物質を、少なくとも生成した硫黄やハロゲンをすべて吸収する量反応系に存在させる上記(1)ないし上記(6)のいずれかの一つに記載された水素の製造方法。
(8) 硫黄やハロゲンと水溶性の塩を形成する物質として、NaOH、 Na2CO3と、KOH、K2CO3からなる群より選ばれる化合物の1種または2種以上を用いる上記(1)ないし上記(7)のいずれかの一つに記載された水素の製造方法。
【0009】
【発明の具体的実施の説明】図2に示す外径58mm内径13mm反応空間部の長さ130mmのマイクロオートクレーブ5を用いて実施した。マイクロオートクレーブ5は、基本的に反応空間となる本体51、計測器具連結部装着蓋52、締付部材53からなる。計測器具連結部装着蓋52は本体51の上部で締付部材53で締め付けられる。計測器具連結部装着蓋52は本体51より外径がわずかに小さくできており、締め付けは、締付部材53の内側のネジと本体51の上部の外周に切られたネジを旋回させることにより行われる。本体51と計測器具連結部装着蓋52は、取り外しすることができ、ここから試料を入れることが出来る。試料を装填し、締付部材53と本体51を十分に締め付けた後、ボルト54でさらに強固に本体51と計測器具連結部装着蓋52を押圧することができる。計測器具連結部装着蓋52は、バルブ6に通じる微細管55と熱電対の導線56と圧力計9に通じる微細管57を有する。バルブ6で調節することにより、反応空間部の圧力を予め調整することが出来るほか、反応終了後バルブ6を全開して生成した気体を分析計7に送り込む。熱電対の導線は、反応空間部まで伸びている。
【0010】既に出願した特願平10−356846号及び特願平10−365994号の実施においては、反応系に添加する水の量を測定し、気体の状態方程式により、反応圧力を推定していたが、このような実験装置を用いた結果、反応系の圧力を実測することができた。本発明では、圧力はすべて実測した値を記載している。また、反応温度も反応空間に直接熱電対を挿入することができるから、より正確な値を得ることができた。
【0011】
【実施例1】反応容器6内に粉砕した太平洋炭(炭素含有量76%)0.1gと過剰当量のCa(OH)2粉末0.6gとNaOH 0.1gと純水8.0ccを混合し、本体51の内部に装填した。計測器具連結部装着蓋52をかぶせて締付部材53と本体51を十分に締め付けた後、ボルト54でさらに強固に本体51と計測器具連結部装着蓋52を押圧した。電気炉を用い、熱電対が650℃を示すまで加熱し、その温度で20分間反応させた。反応後冷却し、バルブ6を開いて、発生したガスを分析計に送り込み、生成ガスの体積と生成ガスの種類を測定した。本体51の内部に残された固体と液体は回収し分析を行った。
【0012】
【実施例2〜5】純水の装填量を6cc,4cc,3cc及び2ccにすることによって、反応圧力を、それぞれ600気圧、340気圧、230気圧、120気圧に調整したほかは実施例1と同じことを繰り返した。実施した結果を図3に示す。反応圧力を下げると生成するガス量は減少するが、ガス中の水素の割合は高いままであり、単に反応速度が低下しただけであることが証明された。(9)式より、炭素1モルより2モルの水素が製造されるので、理論的には石炭(炭素分76%)の場合は、2.83Nm3/kgの水素が製造可能である。実験の結果からは水素の他に若干のCH4が副生する。これはCO2とH2との反応により生じるものと考えられる。NaOHを加えない場合は石炭中のS分はCaSO4として固定されるが非水溶性であるので他の固体物質からの分離は困難である。しかし、NaOHを添加することにより、石炭中のSは最終的に水溶性のNa2SO4として捕捉され、水処理により系外へ抜き出すことができるので有利になることは、超臨界で行う場合と同じである。
【0013】
【実施例6〜9】木くず、ポリ塩化ビニル、ポリエチレン、黒ゴムの4種類の有機物をこの順番で、それぞれ0.1gを試料とし、これに、二酸化炭素吸収物質であるCa(OH)2を0.6g、水を4cc及び反応の触媒を兼ねた硫黄分捕捉剤としてNa2CO3を0.1g混合し、電気炉で外部加熱し、反応温度650℃、120気圧、反応時間20分の条件で反応させた。反応後冷却し、バルブ6を解放し、発生したガスは分析装置に導いて、発生ガス量を測定すると共に、組成はガスクロマトグラフにより測定した。反応器内部の固体と液体は回収し分析を行った。石炭以外の有機物においても、超臨界で行う場合と同様に、炭素分を含む物質は全て本方法の対象となり得ることが確認できた。
【0014】
【発明の効果】本発明において特徴的なのは、超臨界で行う場合と同様に、本方法が石炭以外の有機物にも広く適応可能な点である。このフレキシビリティーの高さも注目に値する。本プロセスは原料系によりおおまかに下記の様に分類される。
(1)石炭を原料とするプロセス(2)重質油、減圧残油等を原料とするプロセス(3)プラスチック類を原料とするプロセス(4)バイオマスを原料とするプロセス(5)汚泥、有機廃棄物を原料とするプロセスプロセス的には若干の相違はあるものの、それぞれの原料に対しプロセスを組むことが可能で、高効率で水素を製造し、かつ有害な元素の環境への排出を防止できる。水素はエネルギー回収と物質回収の両面で考えることが可能である。また、副生するCO2は高濃度で回収することも可能で地球温暖化ガスであるCO2の処理、利用の観点からも非常に有利で、環境に与えるインパクトも少ない。石炭、石油、バイオマス、プラスチック、汚泥、有機廃棄物などの炭素含有の熱源物質と水、空気、石灰石、炭酸ナトリウムという安価で一般的な物質の組み合わせのみで水素を選択的に製造可能な技術を提供することができる。具体的な効果としては、(1)化石燃料資源(特に石炭)、バイオマスを環境への負荷を与えず、クリーンな水素エネルギーに変換できる。水素はエネルギーとして高効率で使用する方法が各種開発されており、この結果化石燃料資源の延命化ができる。
(2)褐炭等水分を多量に含む場合でも、従来の様に乾燥させずにそのまま利用することが可能になる。
(3)炭素含有物質中の硫黄、塩素等の環境汚染の原因となる物質などをも捕捉することが可能である。
(4)プラスチックス類については熱エネルギーの形ではなく水素に転換可能で、エネルギー回収、物質リサイクルどちらの方式にも対応可能。焼却で問題となる、ダイオキシンの発生や塩化水素の発生がない。
(5)汚泥、有機廃棄物等については、乾燥させることなく、処理できるのでエネルギーの無駄遣いが減り、廃棄物の分別回収の必要がなくなる。など、超臨界で行う場合と同様の効果が挙げられる。
【図面の簡単な説明】
【図1】従来技術による超臨界水を利用した有機物の熱分解酸化プロセスの一例を示した説明図
【図2】本発明の実施に用いた装置の断面図
【図3】本発明の条件での石炭の水との反応で生成したガス量とその組成に関する実験結果を示す説明図
【符号の説明】
1…超臨界水反応装置
2…ポンプ
3…冷却器
4…気体分離器
5…マイクロオートクレーブ
51…本体
52…計測器具連結部装着蓋
53…締付部材
54…ボルト
55…バルブ6に通じる微細管
56…熱電対の導線
57…圧力計9に通じる微細管
6…バルブ
7…分析計
8…熱電対
9…圧力計
【特許請求の範囲】
【請求項1】 炭素を含有する物質を高温高圧の水と反応させ、炭素を含有する物質を熱化学的に分解しつつ、水を還元して水素を生成させる方法であって、二酸化炭素吸収物質を、少なくとも生成したすべての二酸化炭素を吸収できる量反応系に存在させ、かつ、圧力80気圧以上温度600℃以上の条件で実質上酸化剤を加えることなく熱化学的分解を行う水素の製造方法。
【請求項2】 炭素を含有する物質と二酸化炭素吸収物質を反応系に供給し、水素と炭酸塩を反応系から取り出す請求項1に記載された水素の製造方法。
【請求項3】 炭酸塩を加熱分解し、二酸化炭素吸収物質に変え、再び反応系に戻す請求項1または請求項2に記載された水素の製造方法。
【請求項4】 二酸化炭素を吸収する物質としてCaO、MgOまたは酸化鉄を用いる請求項1ないし請求項3のいずれかの一つに記載された水素の製造方法。
【請求項5】 炭素を含有する物質が、石炭、石油、プラスチックス、バイオマス、汚泥、有機廃棄物のいずれか一つ、または二つ以上である請求項1ないし請求項4のいずれかの一つに記載された水素の製造方法。
【請求項6】 反応温度が650℃〜800℃である請求項1ないし請求項5のいずれかの一つに記載された水素の製造方法。
【請求項7】 二酸化炭素吸収物質と共に、硫黄やハロゲンと水溶性の塩を形成する物質を、少なくとも生成した硫黄やハロゲンをすべて吸収する量反応系に存在させる請求項1ないし請求項6のいずれかの一つに記載された水素の製造方法。
【請求項8】 硫黄やハロゲンと水溶性の塩を形成する物質として、NaOH、Na2CO3と、KOH、K2CO3からなる群より選ばれる化合物の1種または2種以上を用いる請求項1ないし請求項7のいずれかの一つに記載された水素の製造方法。
【請求項1】 炭素を含有する物質を高温高圧の水と反応させ、炭素を含有する物質を熱化学的に分解しつつ、水を還元して水素を生成させる方法であって、二酸化炭素吸収物質を、少なくとも生成したすべての二酸化炭素を吸収できる量反応系に存在させ、かつ、圧力80気圧以上温度600℃以上の条件で実質上酸化剤を加えることなく熱化学的分解を行う水素の製造方法。
【請求項2】 炭素を含有する物質と二酸化炭素吸収物質を反応系に供給し、水素と炭酸塩を反応系から取り出す請求項1に記載された水素の製造方法。
【請求項3】 炭酸塩を加熱分解し、二酸化炭素吸収物質に変え、再び反応系に戻す請求項1または請求項2に記載された水素の製造方法。
【請求項4】 二酸化炭素を吸収する物質としてCaO、MgOまたは酸化鉄を用いる請求項1ないし請求項3のいずれかの一つに記載された水素の製造方法。
【請求項5】 炭素を含有する物質が、石炭、石油、プラスチックス、バイオマス、汚泥、有機廃棄物のいずれか一つ、または二つ以上である請求項1ないし請求項4のいずれかの一つに記載された水素の製造方法。
【請求項6】 反応温度が650℃〜800℃である請求項1ないし請求項5のいずれかの一つに記載された水素の製造方法。
【請求項7】 二酸化炭素吸収物質と共に、硫黄やハロゲンと水溶性の塩を形成する物質を、少なくとも生成した硫黄やハロゲンをすべて吸収する量反応系に存在させる請求項1ないし請求項6のいずれかの一つに記載された水素の製造方法。
【請求項8】 硫黄やハロゲンと水溶性の塩を形成する物質として、NaOH、Na2CO3と、KOH、K2CO3からなる群より選ばれる化合物の1種または2種以上を用いる請求項1ないし請求項7のいずれかの一つに記載された水素の製造方法。
【図1】


【図2】


【図3】




【図2】


【図3】


【公開番号】特開2001−19402(P2001−19402A)
【公開日】平成13年1月23日(2001.1.23)
【国際特許分類】
【出願番号】特願平11−224362
【出願日】平成11年7月5日(1999.7.5)
【出願人】(598172653)財団法人石炭利用総合センター (1)
【上記1名の代理人】
【識別番号】100112173
【弁理士】
【氏名又は名称】中野 修身
【出願人】(000001144)工業技術院長 (75)
【上記1名の復代理人】
【識別番号】100112173
【弁理士】
【氏名又は名称】中野 修身 (外1名)
【Fターム(参考)】
【公開日】平成13年1月23日(2001.1.23)
【国際特許分類】
【出願日】平成11年7月5日(1999.7.5)
【出願人】(598172653)財団法人石炭利用総合センター (1)
【上記1名の代理人】
【識別番号】100112173
【弁理士】
【氏名又は名称】中野 修身
【出願人】(000001144)工業技術院長 (75)
【上記1名の復代理人】
【識別番号】100112173
【弁理士】
【氏名又は名称】中野 修身 (外1名)
【Fターム(参考)】
[ Back to top ]

