燐光発光性化合物、燐光発光性組成物、有機発光素子、及び表示装置
【課題】有機発光素子の材料において、有機溶剤や水からの溶液から湿式法で成膜でき、大面積化が低コストで実現でき、かつ安定、長寿命であって、超高効率の発光が実現できる有機高分子の燐光発光性化合物を提供し、また前記燐光発光性化合物を用いた有機発光素子を提供することを目的とする。
【解決手段】燐光発光性化合物は、有機溶剤又は水に可溶であり、高分子の主鎖又は側鎖に、燐光を発光し得る繰り返し単位である燐光発光性単位と、キャリアを輸送し得る繰り返し単位であるキャリア輸送性単位とを含む。
【解決手段】燐光発光性化合物は、有機溶剤又は水に可溶であり、高分子の主鎖又は側鎖に、燐光を発光し得る繰り返し単位である燐光発光性単位と、キャリアを輸送し得る繰り返し単位であるキャリア輸送性単位とを含む。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は有機発光素子の材料として使用する有機高分子の燐光発光性化合物、燐光発光性組成物、有機発光素子及び表示装置に関する。
【背景技術】
【0002】
フラットパネルディスプレイなどの表示装置やバックライトなどの照明器具として、有機化合物からなる薄膜から電界発光する有機発光素子が、低電圧で高輝度の発光を得られる素子として注目されている。
【0003】
有機発光素子における薄膜材料として、有機溶媒や水に可溶な発光性有機高分子を用いた大面積化の研究開発が、スチレン系やフルオレン系の有機高分子で活発に行われてきている。このような有機高分子の成膜法としては、スピンコート法、印刷法、インクジェト法などの湿式法が用いられている。特にインクジェット法は、フルカラーディスプレイの表示画面の現実的な画素形成法として期待され、すでに小型のフルカラー試作パネルも開示されている。
【0004】
一方、真空蒸着法で成膜される低分子化合物系で、発光の超高効率化の研究が活発に行われており、有機化合物の三重項励起状態からの発光である燐光を活用する白金やイリジウムの有機金属錯体が報告されている。この燐光発光性化合物を利用した有機発光素子の外部発光量子効率は、従来の蛍光発光を利用した素子の5%を凌ぎ、8%と高効率が得られ、ごく最近では、素子の構成を工夫することで15%もの超高効率も達成されている(Appl.Phys.Lett.,77,904(2000))。
【0005】
この低分子燐光化合物を有機高分子に分散したドープ型有機高分子発光素子の研究報告もあり、イリジウム錯体をポリ(N−ビニルカルバゾール)(PVK)にドープした素子では、外部発光量子効率として4%ほどの値が得られ、大幅な改善が認められている(Jpn.J.Appl.Phys,39,L828(2000))。また、ルテニウム錯体を含む有機高分子では、電気化学的な発光が報告されている(J.Mater.Chem.,9,2103(1999))。
【0006】
しかしながら大面積化を低コストで実現することを意図した従来の有機高分子発光素子では、発光効率の点でまだ十分ではない。この原因は、従来の有機高分子の一重項励起状態からの発光である蛍光を利用している為、理論的な外部発光効率として、5%の上限の壁が存在する為である。有機高分子の発光素子は、有機高分子層が有機溶剤や水の溶液から湿式法により成膜できるという大きな特徴を有するが、さらなる発光効率の改善が将来の実用化に対する課題となっている。
【0007】
また有機高分子の発光素子に低分子の燐光発光性化合物を分散させることで、発光の超高効率化が試みられているが、ホストとなる高分子内に分散されている低分子は安定ではなく、長期信頼性に耐え得る長寿命の表示装置は実現できない。
【0008】
従って、有機発光素子の将来の実用化を考慮して、有機溶剤や水の溶液から湿式法で成膜でき、これにより大面積化が低コストで実現でき、かつ安定即ち長寿命であって、超高効率の発光が実現できる新しい有機高分子の発光材料の開発が望まれる。
【先行技術文献】
【非特許文献】
【0009】
【非特許文献1】Appl.Phys.Lett.,77,904(2000)
【非特許文献2】Jpn.J.Appl.Phys,39,L828(2000)
【非特許文献3】J.Mater.Chem.,9,2103(1999)
【発明の概要】
【発明が解決しようとする課題】
【0010】
本発明は、上記問題に鑑みなされたものであり、有機発光素子の材料として使用され、安定で、超高効率の燐光を発光する有機高分子の燐光発光性化合物及び燐光発光性組成物を提供することを目的とする。
【0011】
また本発明は、前記有機高分子の燐光発光性化合物及び燐光発光性組成物を用いた有機発光素子並びにこの有機発光素子を用いた表示装置を提供することを目的とする。
【課題を解決するための手段】
【0012】
(1)に記載の発明は、有機発光素子に使用される燐光を発光する中性の有機高分子の燐光発光性化合物であって、燐光を発光する繰り返し単位である燐光発光性単位と、キャリアを輸送する繰り返し単位であるキャリア輸送性単位と、を含むことを特徴とする。
【0013】
(1)に記載の発明によれば、有機発光素子に使用される燐光を発光する中性の有機高分子の燐光発光性化合物であって、燐光を発光する繰り返し単位である燐光発光性単位と、キャリアを輸送する繰り返し単位であるキャリア輸送性単位と、を含むので、有機発光素子の材料として使用され、安定で、超高効率の燐光を発光する有機高分子の燐光発光性化合物を提供することができる。
【0014】
(2)に記載の発明は、(1)に記載の燐光発光性化合物において、前記燐光発光性単位の繰り返し数m、及び前記キャリア輸送性単位の繰り返し数nは、m<nの関係を満たすことを特徴とする。
【0015】
(2)に記載の発明によれば、前記燐光発光性単位の繰り返し数m、及び前記キャリア輸送性単位の繰り返し数nは、m<nの関係を満たすので、燐光の発光効率をより向上させることができる。
【0016】
(3)に記載の発明は、(2)に記載の燐光発光性化合物において、前記燐光発光性単位の繰り返し数m、及び前記キャリア輸送性単位の繰り返し数nは、0.0001≦m/(m+n)≦0.2の関係を満たすことを特徴とする。
【0017】
(3)に記載の発明によれば、前記燐光発光性単位の繰り返し数m、及び前記キャリア輸送性単位の繰り返し数nは、0.0001≦m/(m+n)≦0.2の関係を満たすので、更に効率良く燐光を発生させることができる。
【0018】
(4)に記載の発明は、(1)乃至(3)のいずれか一つに記載の燐光発光性化合物において、前記燐光発光性化合物が有機溶剤又は水に可溶であることを特徴とする。
【0019】
(4)に記載の発明によれば、前記燐光発光性化合物が有機溶剤又は水に可溶であるので、溶液からの湿式法による成膜が可能となる。
【0020】
(5)に記載の発明は、(1)乃至(4)のいずれか一つに記載の燐光発光性化合物において、前記燐光発光性化合物の重合度が5乃至5000であることを特徴とする。
【0021】
(5)に記載の発明によれば、前記燐光発光性化合物の重合度が5乃至5000であるので、有機溶剤に可溶であり、均一かつ安定な膜を成膜することができる。
【0022】
(6)に記載の発明は、(1)乃至(5)のいずれか一つに記載の燐光発光性化合物において、前記燐光発光性単位の燐光発光性部位、及び/又は前記キャリア輸送性単位のキャリア輸送性部位が前記燐光発光性化合物の側鎖を構成していることを特徴とする。
【0023】
(6)に記載の発明によれば、前記燐光発光性単位の燐光発光性部位、及び/又は前記キャリア輸送性単位のキャリア輸送性部位が前記燐光発光性化合物の側鎖を構成しているので、合成することが容易であり、有機溶剤に溶解し易い燐光発光性化合物とすることができる。
【0024】
(7)に記載の発明は、(1)乃至(5)のいずれか一つに記載の燐光発光性化合物において、前記燐光発光性単位の燐光発光性部位、及び/又は前記キャリア輸送性単位のキャリア輸送性部位が前記燐光発光性化合物の主鎖を構成していることを特徴とする。
【0025】
(7)に記載の発明によれば、前記燐光発光性単位の燐光発光性部位、及び/又は前記キャリア輸送性単位のキャリア輸送性部位が前記燐光発光性化合物の主鎖を構成しているので、錯体部分の運動が抑えられ、高温でも安定な燐光発光性化合物を得ることができる。
【0026】
(8)に記載の発明は、(1)乃至(7)のいずれか一つに記載の燐光発光性化合物において、前記キャリア輸送性単位のキャリア輸送性部位がホール輸送性部位であることを特徴とする。
【0027】
(8)に記載の発明によれば、前記キャリア輸送性単位のキャリア輸送性部位がホール輸送性部位であるので、燐光発光性部位とホール輸送性部位の比率を変えることで、キャリアバランスが良好で発光効率の高い燐光発光性化合物を得ることができる。
【0028】
(9)に記載の発明は、(1)乃至(7)のいずれか一つに記載の燐光発光性化合物において、前記キャリア輸送性単位のキャリア輸送性部位が電子輸送性部位であることを特徴とする。
【0029】
(9)に記載の発明によれば、前記キャリア輸送性単位のキャリア輸送性部位が電子輸送性部位であるので、燐光発光性部位と電子輸送性部位の比率を変えることで、キャリアバランスが良好で発光効率の高い燐光発光性化合物を得ることができる。
【0030】
(10)に記載の発明は、(1)乃至(7)のいずれか一つに記載の燐光発光性化合物において、前記キャリア輸送性単位のキャリア輸送性部位がホール輸送性部位及び電子輸送性部位からなることを特徴とする。
【0031】
(10)に記載の発明によれば、(1)乃至(7)のいずれか一つに記載の燐光発光性化合物において、前記キャリア輸送性単位のキャリア輸送性部位がホール輸送性部位及び電子輸送性部位からなるので、発光性、ホール輸送性及び電子輸送性の全ての機能を備え、他の有機材料を配合することなく、熱的に安定で長寿命である。
【0032】
(11)に記載の発明は、(1)乃至(10)のいずれか一つに記載の燐光発光性化合物において、前記燐光発光性単位は、燐光発光性部位が遷移金属又は希土類金属の錯体の一価基又は二価基であることを特徴とする。
【0033】
(11)に記載の発明によれば、前記燐光発光性単位の燐光発光性部位が遷移金属又は希土類金属の錯体の一価基又は二価基であるので、燐光の発光効率が高い燐光発光性部位とすることができる。
【0034】
(12)に記載の発明は、(11)に記載の燐光発光性化合物において、前記遷移金属又は希土類金属の錯体の一価基は、主鎖に対してスペーサー部分を介して側鎖として結合し、該スペーサー部分は、ヘテロ原子を有していてもよい炭素数1乃至30の有機基又は炭素原子を有しないヘテロ原子数1乃至10の無機基を含むことを特徴とする。
【0035】
(12)に記載の発明によれば、前記遷移金属又は希土類金属の錯体の一価基は、主鎖に対してスペーサー部分を介して側鎖として結合し、該スペーサー部分は、ヘテロ原子を有していてもよい炭素数1乃至30の有機基又は炭素原子を有しないヘテロ原子数1乃至10の無機基を含むので、錯体部分の運動の自由度が高まり、有機溶剤への溶解性が高められ、均一な薄膜を塗布法で作製できることで、安定で、高い発光効率を得ることができる。
【0036】
(13)に記載の発明は、(1)乃至(11)のいずれか一つに記載の燐光発光性化合物において、前記キャリア輸送性単位のキャリア輸送性部位がカルバゾールの一価基、第3級アミンの一価基、イミダゾール誘導体の一価基、トリアゾール誘導体の一価基、オキサジアゾール誘導体の一価基、スチレンの二価基、及びフルオレンの二価基からなる基の群、並びに該基を置換基で置換した基の群より、少なくとも1種類以上選択される基を含むことを特徴とする。
【0037】
(13)に記載の発明によれば、前記キャリア輸送性単位は、キャリア輸送性部位がカルバゾールの一価基、第3級アミンの一価基、イミダゾール誘導体の一価基、トリアゾール誘導体の一価基、オキサジアゾール誘導体の一価基、スチレンの二価基、及びフルオレンの二価基からなる基の群、並びに該基を置換基で置換した基の群より、少なくとも1種類以上選択される基を含むので、キャリアを輸送する性能が高いキャリア輸送性部位とすることができる。
【0038】
(14)に記載の発明は、(1)乃至(13)のいずれか一つに記載の燐光発光性化合物において、所定の1色に発光する1種類又は所定の相互に異なる2色以上に発光する2種類以上の燐光発光性単位を有することを特徴とする。
【0039】
(14)に記載の発明によれば、所定の1色に発光する1種類又は所定の相互に異なる2色以上に発光する2種類以上の燐光発光性単位を有するので、任意に選択した単色又は複数の色に好適に発光することができる。
【0040】
(15)に記載の発明は、(14)に記載の燐光発光性化合物において、前記燐光発光性単位は、青色若しくは緑色及び黄色若しくは赤色に発光する2種類からなり、全体として白色に発光することを特徴とする。
【0041】
(15)に記載の発明によれば、前記燐光発光性単位は、青色若しくは緑色及び黄色若しくは赤色に発光する2種類からなり、全体として白色に発光するので、白色の色に好適に発光することができる。
【0042】
(16)に記載の発明は、(14)に記載の燐光発光性化合物において、前記燐光発光性単位は、青色、緑色及び赤色に発光する3種類のからなり、全体として白色に発光することを特徴とする。
【0043】
(16)に記載の発明によれば、前記燐光発光性単位は、青色、緑色及び赤色に発光する3種類からなり、全体として白色に発光するので、白色の色に好適に発光することができる。
【0044】
(17)に記載の発明は、(1)乃至(16)のいずれか一つに記載の燐光発光性化合物を含むことを特徴とする燐光発光性組成物である。
【0045】
(17)に記載の発明によれば、(1)乃至(16)のいずれか一つに記載の燐光発光性化合物を含むので、好適な燐光発光性組成物を提供することができる。
【0046】
(18)に記載の発明は、(14)に記載の燐光発光性化合物であって相互に異なる色に発光する燐光発光性単位を1又は2種類以上有するものを複数配合してなることを特徴とする燐光発光性組成物である。
【0047】
(18)に記載の発明によれば、(14)に記載の燐光発光性化合物であって相互に異なる色に発光する燐光発光性単位を1又は2種類以上有するものを複数配合してなるので、好適な燐光発光性組成物を提供することができる。
【0048】
(19)に記載の発明は、(18)に記載の燐光発光性組成物において、全体として白色に発光することを特徴とする。
【0049】
(19)に記載の発明によれば、全体として白色に発光するので、好適な燐光発光性組成物を提供することができる。
【0050】
(20)に記載の発明は、(18)に記載の燐光発光性組成物において、青色若しくは緑色に発光する燐光発光性単位を有する燐光発光性化合物及び黄色若しくは赤色に発光する燐光発光性単位を有する燐光発光性化合物を配合してなり、全体として白色に発光することを特徴とする。
【0051】
(20)に記載の発明によれば、青色若しくは緑色に発光する燐光発光性単位を有する燐光発光性化合物及び黄色若しくは赤色に発光する燐光発光性単位を有する燐光発光性化合物を配合してなり、全体として白色に発光するので、好適な燐光発光性組成物を提供することができる。
【0052】
(21)に記載の発明は、(1)乃至(20)のいずれか一つに記載の燐光発光性化合物若しくは燐光発光性組成物及びキャリア輸送性高分子化合物を配合してなることを特徴とする燐光発光性組成物である。
【0053】
(21)に記載の発明によれば、燐光発光性組成物が(1)乃至(20)のいずれか一つに記載の燐光発光性化合物若しくは燐光発光性組成物及びキャリア輸送性高分子化合物を配合してなるので、安定で長寿命である。また、燐光発光性化合物及びキャリア輸送性高分子化合物の比率を変えることで、キャリアバランスが良好で発光効率の高い燐光発光性組成物を提供することができる。
【0054】
(22)に記載の発明は、(21)に記載の燐光発光性組成物において、前記キャリア輸送性高分子化合物は、ホール輸送性高分子化合物であることを特徴とする。
【0055】
(22)に記載の発明によれば、前記キャリア輸送性高分子化合物は、ホール輸送性高分子化合物であるので、安定で長寿命である。また、燐光発光性化合物及びホール輸送性高分子化合物の比率を変えることで、キャリアバランスが良好で発光効率の高い燐光発光性組成物を提供することができる。
【0056】
(23)に記載の発明は、(21)に記載の燐光発光性組成物において、前記キャリア輸送性高分子化合物は、電子輸送性高分子化合物であることを特徴とする。
【0057】
(23)に記載の発明によれば、前記キャリア輸送性高分子化合物は、電子輸送性高分子化合物であるので、安定で長寿命である。また、燐光発光性化合物及び電子輸送性高分子化合物の比率を変えることで、キャリアバランスが良好で発光効率の高い燐光発光性組成物を提供することができる。
【0058】
(24)に記載の発明は、(1)乃至(20)のいずれか一つに記載の燐光発光性化合物及びキャリア輸送性低分子化合物を配合してなることを特徴とする燐光発光性組成物である。
【0059】
(24)に記載の発明によれば、燐光発光性組成物が(1)乃至(20)のいずれか一つに記載の燐光発光性化合物及びキャリア輸送性低分子化合物を配合してなるので、安定で長寿命である。また、燐光発光性化合物及びキャリア輸送性低分子化合物の比率を変えることで、キャリアバランスが良好で発光効率の高い燐光発光性組成物を提供することができる。
【0060】
(25)に記載の発明は、(24)に記載の燐光発光性組成物において、前記キャリア輸送性低分子化合物は、ホール輸送性低分子化合物であることを特徴とする。
【0061】
(25)に記載の発明によれば、前記キャリア輸送性低分子化合物は、ホール輸送性低分子化合物であるので、安定で長寿命である。また、燐光発光性化合物及びホー輸送性低分子化合物の比率を変えることで、キャリアバランスが良好で発光効率の高い燐光発光性組成物を提供することができる。
【0062】
(26)に記載の発明は、(24)に記載の燐光発光性組成物において、前記キャリア輸送性低分子化合物は、電子輸送性低分子化合物であることを特徴とする。
【0063】
(26)に記載の発明によれば、前記キャリア輸送性低分子化合物は、電子輸送性低分子化合物であるので、安定で長寿命である。また、燐光発光性化合物及び電子輸送性低分子化合物の比率を変えることで、キャリアバランスが良好で発光効率の高い燐光発光性組成物を提供することができる。
【0064】
(27)に記載の発明は、陽極と陰極に挟まれた一又は複数の有機高分子層を含む有機発光素子において、前記有機高分子層の少なくとも一層は、(1)乃至(26)のいずれか一つに記載の燐光発光性化合物又は燐光発光性組成物を含むことを特徴とする。
【0065】
(27)に記載の発明によれば、前記有機高分子層の少なくとも一層は、(1)乃至(26)のいずれか一つに記載の燐光発光性化合物又は燐光発光性組成物を含むので、安定で、超高効率の燐光を発光する有機発光素子を提供することができる。
【0066】
(28)に記載の発明は、陽極と陰極に挟まれた一又は複数の有機高分子層を含む有機発光素子において、陽極と、陽極が設けられる透明基板との間にカラーフィルターが配設され、前記有機高分子層の少なくとも一層は、(15)若しくは(16)に記載の燐光発光性化合物又は(19)若しくは(20)記載の燐光発光性組成物を含むことを特徴とする。
【0067】
(28)に記載の発明によれば、陽極と、陽極が設けられる透明基板との間にカラーフィルターが配設され、前記有機高分子層の少なくとも一層は、(15)若しくは(16)に記載の燐光発光性化合物又は(19)若しくは(20)に記載の燐光発光性組成物を含むので、安定で、超高効率のカラー光を発光する有機発光素子を提供することができる。
【0068】
(29)に記載の発明は、(27)又は(28)に記載の有機発光素子において、前記陽極は、プラスチック基板上に形成されることを特徴とする。
【0069】
(29)に記載の発明によれば、前記陽極は、プラスチック基板上に形成されるので、柔軟な有機発光素子を提供することができる。
【0070】
(30)に記載の発明は、(27)乃至(29)に記載の有機発光素子において、前記有機高分子層は、インクジェット法又は印刷法により形成されることを特徴とする。
【0071】
(30)に記載の発明によれば、前記有機高分子層は、インクジェット法又は印刷法により形成されるので、大面積の有機高分子層を簡便に製造することができる。
【0072】
(31)に記載の発明は、表示画面を有する表示装置において、前記表示画面の各画素は、(27)乃至(30)のいずれか一つに記載の有機発光素子からなり、前記各画素は、二又はそれ以上のトランジスタにより駆動されることを特徴とする。
【0073】
(31)に記載の発明によれば、表示画面の各画素は、(27)乃至(30)のいずれか一つに記載の有機発光素子からなり、前記各画素は、二又はそれ以上のトランジスタを有するので、アクティブマトリックス方式の表示装置を提供することができる。
【発明の効果】
【0074】
本発明によれば、有機発光素子の材料として使用され、安定で、超高効率の燐光を発光する有機高分子の燐光発光性化合物を提供する。また本発明は、前記有機高分子の燐光発光性化合物を用いた有機発光素子を提供する。
【図面の簡単な説明】
【0075】
【図1】本発明の有機高分子の燐光発光性化合物の典型的な構造を説明する図である。
【図2】本発明の有機発光素子の積層構造を説明する図である。
【図3】実施例6−3で作製した有機発光素子の発光スペクトルを示す図である。
【図4】実施例7−2で作製した有機発光素子の発光スペクトルを示す図である。
【発明を実施するための形態】
【0076】
次に、本発明の実施の形態について図面と共に説明する。
【0077】
本発明は、有機発光素子の材料として使用する有機高分子の燐光発光性化合物の発明であって、燐光を発光する繰り返し単位(燐光発光性単位と呼ぶ)と電子やホールなどのキャリアを輸送する繰り返し単位(キャリア輸送性単位と呼ぶ)とを含む。本発明の有機高分子の燐光発光性化合物は、燐光発光性単位とキャリア輸送性単位とが高分子鎖中に不規則に配列されるランダム共重合体であってもよく、また非イオン性、即ち中性の高分子である。本発明の燐光発光性化合物では、燐光発光性単位とキャリア輸送単位とが高分子鎖に連結しており、燐光発光性単位の凝集は抑制される為、安定即ち長寿命であり、かつ蛍光ではなく燐光発光性単位を有する為、超高効率の発光を実現できる。
【0078】
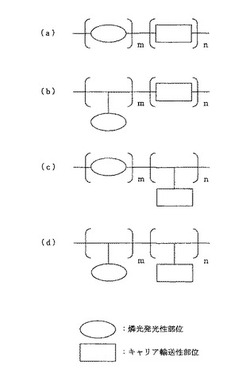
本発明の燐光発光性化合物の構造は、典型的には図1に示すように、燐光発光性単位とキャリア輸送性単位とを形成する単量体の種類によって、(a)燐光発光性部位とキャリア輸送性部位とが共に高分子の主鎖内にある場合、(b)燐光発光性部位は高分子の側鎖にあり、キャリア輸送性部位は高分子の主鎖内にある場合、(c)燐光発光性部位は高分子の主鎖内にあり、キャリア輸送性部位は高分子の側鎖にある場合、(d)燐光発光性部位とキャリア輸送性部位とが共に高分子の側鎖にある場合、の四通りがある。ただし燐光発光性部位とは、燐光発光性単位中で燐光を発光する機能を有する部分を示し、キャリア輸送性部位とは、キャリア輸送性単位中で、キャリアを輸送する機能を有する部分を表す。
【0079】
ここで、燐光発光性部位、キャリア輸送性部位の少なくとも一方は、燐光発光性化合物の高分子の主鎖に、側鎖として結合していることが望ましい(図1(b)〜(d))。この場合には、燐光発光性化合物を合成することが容易であり、また有機溶剤に溶解し易い燐光発光性化合物とすることができる。
【0080】
さらに燐光の発光効率が高い燐光発光性部位とする為に、燐光発光性部位は、遷移金属又は希土類金属の錯体の一価基又は二価基であることが望ましい。
【0081】
燐光発光性部位の具体例としては
【0082】
【化1】

に示す群から選択される配位子を含む、遷移金属錯体の一価基若しくは二価基又は希土類金属錯体の一価基若しくは二価基がある。上記の遷移金属錯体に使用される遷移金属は、周期表の第一遷移元素系列すなわち原子番号21のScから30のZnまで、第二遷移元素系列すなわち原子番号39のYから48のCdまで、第三遷移元素系列すなわち原子番号72のHfから80のHgまで、を含む。また上記の希土類金属錯体に使用される希土類金属は、周期表のランタノイド系列すなわち原子番号57のLaから71のLuまでを含む。なお配位子は、上記の配位子と異なる配位子であってもよい。
【0083】
キャリアを輸送する性能の高いキャリア輸送性部位の具体例は、本発明の有機高分子の燐光発光性化合物がホール輸送性高分子の場合と電子輸送性高分子の場合とで異なる。
【0084】
ホール輸送性高分子の場合には、
【0085】
【化2】

に示す、第3級アミンであるカルバゾール(HT−1)、トリフェニルアミン(HT−2)、それらの多量体(HT−3)などの一価基が代表的であり、これらの一価基は、置換基で置換されていてもよい。
【0086】
電子輸送性高分子の場合では、
【0087】
【化3】

に示すオキサジアゾール誘導体(ET−1、2)、トリアゾール誘導体(ET−4)、又はイミダゾール誘導体(ET−3)の一価基が挙げられる。これら誘導体の一価基の芳香環は、置換基で置換されていてもよい。また、
【0088】
【化4】

に示すような、蛍光性高分子においてホールの輸送能力を有し主鎖が共役系となる高分子を形成する、置換基で置換された、チオフェンの二価基(TF)、ベンゼンの二価基(PP)、スチレンの二価基(PV)、又はフルオレンの二価基(FO)を用いてもよい。ここで置換基Rは、アルキル基又はアルコキシ基を表す。本発明の燐光発光性化合物において、これらの二価基は燐光発光性部位として、高分子の主鎖に組み込まれる。
【0089】
上述の繰り返し単位を含む共重合高分子の例としては、
【0090】
【化5】

に示すような、主鎖であるビニル構造の側鎖に、燐光発光性部位のイリジウム錯体又は白金錯体の一価基と、ホール(キャリア)輸送性部位としてのカルバゾール、又はその誘導体の一価基とを有する高分子(P1、P3、P4)があり、また電子(キャリア)輸送性部位として、側鎖にオキサジアゾール誘導体の一価基を使用した高分子(P2)がある。これら共重合高分子は、ビニル化合物から反応開始剤を使ったラジカル共重合で合成できる。イリジウム錯体の配位子の一つをビニル基で置換した単量体は
【0091】
【化6】

のように、イリジウム錯体の配位子置換反応の途中で、ビニル基で置換されたフェニルピリジンを反応させて生成し単離する。
【0092】
さらに、
【0093】
【化7】

に示すような、イリジウム錯体の配位子の一つがアセチルアセトン又はピコリン酸であって、このアセチルアセトン等を介してイリジウム錯体が高分子の主鎖に結合した構造の共重合高分子もある。ここで、化学式中の*印は、高分子の化学式中に示した置換基Rに接続する部分(結合)であることを示す。
【0094】
また、上記の共重合高分子のように、燐光発光性部位としてのイリジウム錯体などの遷移金属錯体部分あるいは希土類金属錯体部分が高分子の主鎖に対して側鎖として結合する場合には、遷移金属錯体あるいは希土類金属錯体の一価基と高分子の主鎖との間にスペーサー部分を介在させることが好ましい。
【0095】
スペーサー部分とは、主鎖を構成する高分子化合物における置換可能な原子が結合している多価原子と、燐光発光部位の元となる低分子化合物における置換可能な原子が結合している多価原子との間を結合する部分をいう。このようなスペーサー部分は、ヘテロ原子を有していてもよい炭素数1乃至30の有機基又は炭素原子を有しないヘテロ原子数1乃至10の無機基を含む構造であることが好ましい。
【0096】
スペーサー部分として、例えば、炭素数1乃至20のアルキレン基や、
【0097】
【化8】

【0098】
【化9】

に示す、(S−1)から(S−15)のような連結基などを挙げることができるが、これらに限定されるものではない。
【0099】
なお、(S−1)から(S−15)において、R1、R2及びR3はそれぞれ独立にメチレン基又は置換若しくは未置換のフェニレン基を示し、k、m及びnはそれぞれ独立に0、1、又は2である。
【0100】
また、燐光発光性部位及びキャリア輸送性部位を側鎖ではなく、主鎖に組み込んだ構造の共重合高分子もある。
【0101】
【化10】

に示すように、置換された、チオフェン、ベンゼン、フルオレンの二価基とイリジウム錯体の二価基とが重合して主鎖を形成している。
【0102】
以上、共重合高分子の例として、ホール輸送性部位あるいは電子輸送性部位のうちのいずれか一方と燐光性発光部位との共重合体を挙げたが、本発明の燐光発光性化合物は、ホール輸送性部位、電子輸送性部位及び燐光性発光部位の共重合体であってもよい。この場合、ホール輸送性部位、電子輸送性部位及び燐光性発光部位は、それぞれ独立に共重合体の主鎖を構成していてもよく、また、側鎖を構成していてもよい。
【0103】
燐光発光性単位の繰り返し数をm、キャリア輸送性単位の繰り返し数をnとすると、本発明においては、燐光の発光効率を向上させる為には、m<nの関係、即ち燐光発光性単位の繰り返し数がキャリア輸送性単位の繰り返し数より小さいこと望ましい。ただしm、nは両方とも、1又はそれ以上の自然数である。逆にm≧nの場合には、濃度消光により燐光の発光が抑制されてしまう。なお燐光の超高効率の発光を実現する為には、燐光発光性単位及びキャリア輸送性単位の総数の内、燐光発光性単位の繰り返し数の割合は0.2以下が好ましい。また、燐光発光性単位の繰り返し数の割合が小さすぎると、燐光発光部性位が少なくなって発光効率が落ちる。この為、燐光発光性単位の繰り返し数の割合は、少なすぎてはならず、0.0001以上であることが望ましい。即ち、
0.0001≦m/(m+n)≦0.2
であることが望ましい。
【0104】
本発明の燐光発光性化合物は、1色に発光する1種類の燐光発光性単位を有してもよく、又、相互に異なる2色以上に発光する2種類以上の燐光発光性単位を有してもよい。
【0105】
本発明の燐光発光性化合物は、相互に異なる2色以上に発光する2種類以上の燐光発光性単位を導入することにより、1色に発光する1種類の燐光発光性単位のみを有する燐光発光性化合物では得られない発光色を得ることができる。
【0106】
例えば、それぞれ青色、緑色及び赤色に発光する3種類の燐光発光性単位を適当な比率で1つの化合物に導入することにより、白色発光用の燐光発光性化合物が得られる。ここで、青色、緑色又は赤色に発光する燐光発光性単位とは、それぞれ単独に用いて1つの燐光発光性化合物を形成した場合に、フォトルミネッセンスの発光色がそれぞれ青色、緑色又は赤色を示すものか、又はさらに後述の有機発光素子を作製して発光させた場合に、その発光色がそれぞれ青色、緑色又は赤色を示すものをいう。
【0107】
なお、ここでいう発光色の青色は、発光スペクトルにおけるピーク波長が400〜490nmであるものをいう。同様に、緑色は、ピーク波長が490〜570nmであるものをいい、赤色は、ピーク波長が570〜700nmであるものをいう。
【0108】
また、白色発光用の燐光発光性化合物は、それぞれ青色若しくは緑色および黄色若しくは赤色に発光する2種類の燐光発光性単位を適当な比率で1つの化合物に導入することによっても得られる。
【0109】
なお、ここでいう発光色の青色若しくは緑色は発光スペクトルにおけるピーク波長が400〜570nmであるものをいい、同様に、黄色若しくは赤色はピーク波長が570〜700nmであるものをいう。
【0110】
また、白色発光用の燐光発光性材料は、上記のような単一の燐光発光性化合物としてだけではなく、相互に異なる発光色を示す1種類以上の燐光発光性単位を有する複数の燐光発光性化合物を配合した組成物としても得ることができる。
【0111】
例えば、青色に発光する燐光発光性単位及び緑色に発光する燐光発光性単位の2種類の燐光発光性単位を有する第1の燐光発光性化合物と、赤色に発光する1種類の燐光発光性単位を有する第2の燐光発光性化合物を配合した燐光発光性組成物、それぞれ青色、緑色及び赤色に発光する燐光発光性単位を1種類ずつ有する3つの燐光発光性化合物を配合した燐光発光性組成物、それぞれ青色および橙色に発光する燐光発光性単位を1種類ずつ有する2つの燐光発光性化合物を配合した燐光発光性組成物等を挙げることができるが、何らこれらに限定されるものではない。
【0112】
本発明の有機高分子の燐光発光性化合物は、湿式法で成膜できることが望ましい。湿式法では燐光発光性化合物を溶液とするので、有機溶剤又は水に可溶であることが必要である。特に燐光発光性化合物を有機溶媒に可溶とする為には、燐光発光性部位にアルキル基又はアルコキシ基などの比較的長い炭素鎖で置換した金属錯体を使用することが望ましい。
【0113】
本発明の有機高分子の燐光発光性化合物は、重合度が5乃至5000であることが好ましい。重合度が5より小さいと、均一な膜の形成が困難になり、また結晶化が起こり易く膜の安定性が悪くなる。また重合度が5000より大きい有機高分子は、生成が困難であり、有機溶剤に溶けにくくなる。従って重合度を5乃至5000とすることで、均一かつ安定な膜を成膜することができる。
【0114】
つぎに、本発明の有機発光素子について説明する。
【0115】
本発明の有機発光素子は、以上説明した本発明の有機高分子の燐光発光性化合物を発光材料として用いることができる。
【0116】
また、本発明の有機発光素子は、本発明の燐光発光性化合物のキャリア輸送性をさらに高めるために、本発明の燐光発光性化合物とキャリア輸送性化合物とを配合した組成物を発光材料として用いることができる。
【0117】
すなわち、本発明の燐光発光性化合物がホール輸送性の場合は電子輸送性化合物を混合することができ、また、本発明の燐光発光性化合物が電子輸送性の場合はホール輸送性化合物を混合することができる。このとき、電子輸送性化合物及びホール輸送性化合物は、それぞれ低分子化合物であってもよく、また、高分子化合物であってもよい。
【0118】
本発明の燐光発光性化合物に配合する低分子のホール輸送性化合物としては、TPD(N,N'−ジフェニル−N,N'−(3−メチルフェニル)−1,1'−ビフェニル−4,4'−ジアミン)、α−NPD(4,4'−ビス〔N−(1−ナフチル)−N−フェニルアミノ〕ビフェニル)、m−MTDATA(4,4',4"−トリス(3−メチルフェニルフェニルアミノ)トリフェニルアミン)などのトリフェニルアミン誘導体、CBP(4,4'−N−N'−ジカルバゾール−ビフェニル)などのカルバゾール誘導体をはじめとする既知のホール輸送材料が使用できるが、これらに限定されるものではない。
【0119】
また、本発明の燐光発光性化合物に配合する高分子のホール輸送性化合物としては、ポリビニルカルバゾール、トリフェニルアミン系の低分子化合物に重合性官能基を導入して高分子化したもの、例えば、特開平8−157575号公報に開示されているトリフェニルアミン骨格の高分子化合物などが使用できるが、これらに限定されるものではない。
【0120】
一方、本発明の燐光発光性化合物に配合する低分子の電子輸送性化合物としては、Alq3(トリスアルミニウムキノリノール)などのキノリノール誘導体金属錯体、オキサジアゾール誘導体、トリアゾール誘導体、イミダゾール誘導体、トリアジン誘導体などが使用できるが、これらに限定されるものではない。
【0121】
また、本発明の燐光発光性化合物に配合する高分子の電子輸送性化合物としては、上記の低分子の電子輸送性化合物に重合性官能基を導入して高分子化したもの、例えば、特開平10−1665号公報に開示されているポリPBDなどが使用できるが、これらに限定されるものではない。
【0122】
また、成膜して得られる膜の物性などをさらに改良する目的で、本発明の燐光発光性化合物あるいは燐光発光性組成物に、発光特性には関与しない高分子化合物を混合して組成物とし、これを発光材料として用いることもできる。例えば、膜に柔軟性を付与するためにPMMA(ポリメチルメタクリレート)を混合することができるが、これに限定されるものではない。
【0123】
本発明はまた、少なくとも一層に上述の有機高分子の燐光発光性化合物を含むことを特徴とする有機発光素子を提供する。本発明の有機発光素子は、燐光発光性化合物の燐光発光性単位とキャリア輸送単位とが高分子鎖に連結している為、有機発光素子の連続駆動や過熱による燐光発光性化合物の燐光発光性単位の凝集が抑制され、安定な表示装置を提供でき、かつ蛍光ではなく燐光発光性単位を有する為、超高効率の発光を実現できる。
【0124】
本発明の燐光発光性化合物を用いた有機発光素子は、図2(a)に示すように、本発明の燐光発光性化合物を一対の陽極と陰極で挟んだ一層構成でも機能するが、燐光の発光効率を高める為には、図2(b)のような電子輸送性高分子を用いた電子輸送層との積層構成、又は図2(c)のようなホール輸送性高分子を用いたホール輸送層との積層構成が望ましい。これらのキャリア(電子、ホール)輸送性高分子としては
【0125】
【化11】

のような第3級アミン及びその誘導体(HTP1、2)、オキサジアゾール誘導体(ETP1、2)、イミダゾール誘導体(ETP3)の基を含む高分子、ポリパラフェニレンビニレン(CP1)、ポリジアルキルフルオレン(CP2)などが挙げられる。
【0126】
図2(b)の積層構成を有する発光素子において、燐光発光性化合物として前記P1の高分子を用い、電子輸送性高分子としてオキサジアゾール誘導体の基を含む高分子ETP2を用いた有機発光素子で、発光機構を簡単に説明する。金属陰極から注入された電子は、電子輸送層を通じて輸送され、燐光発光性化合物P1の層へ注入され、一方、ITO陽極から注入されたホールは燐光発光性化合物P1のカルバゾール環を含む繰り返し単位を伝導する。注入された電子がカルバゾール環上でホールと再結合することによって、カルバゾール環の繰り返し単位の励起状態が生成し、次にイリジウム錯体の繰り返し単位ヘエネルキー移動する。その結果、イリジウム錯体の繰り返し単位において励起三重項状態が形成され、エネルギー緩和により燐光の発光が観察される。ただし、注入されたホールと電子の再結合がイリジウム錯体の繰り返し単位上で起こる機構も考えられる。
【0127】
陽極は、一般には透明基板であるガラス基板上に形成され、発光透過性材料を用いる。ITO(酸化スズインジウム)、酸化インジウム、酸化スズ、又は酸化インジウム酸化亜鉛合金が好ましい。金、白金、銀、マグネシウムなどの金属の薄膜を用いてもよい。ポリアニリン、ポリチオフェン、ポリピロール、及びそれらの誘導体からなる導電性高分子も使用可能である。
【0128】
陰極には、仕事関数の低いLi、Kなどのアルカり金属やMg、Caなどのアルカリ土類金属を用いるのが、電子注入効率の観点から好ましい。また、これらの金属と比較して化学的に安定なAlなどを用いることも望ましい。電子注入効率と化学的安定性とを両立させるために2種以上の材料を含む層にしてもよい。それらの材料については特開平2−15595、特開平5−121172などに記載されており、セシウム、カルシウム、ストロンチウム、バリウムなどのアルカリ金属やアルカリ土類金属の薄層(0.01〜10μm程度)をAl層の下に(陰極側を上側、陽極側を下側とする)挟んでもよい。
【0129】
陽極と陰極は、真空蒸着法、スパッタリング法、イオンプレーティング法などの公知の方法で形成できる。また、電極(特に発光透過性材料の電極)のパターニングは、フォトリソグラフィーなどによる化学的エッチング、レーザーなどを用いた物理的エッチングなどにより行うことが好ましい。また、マスクを重ねて真空蒸着やスパッタリングなどを行なってパターニングしてもよい。
【0130】
本発明において、透明基板として通常のガラス基板の他にプラスチック基板を使用することができる。基板として用いるプラスチックは耐熱性、寸法安定性、耐溶剤性、電気絶縁性、加工性、低通気性及び低吸湿性に優れていることが必要である。このようなプラスチックとしては、ポリエチレンテレフタレート、ポリエチレンナフタレート、ポリスチレン、ポリカーボネート、ポリエーテルスルホン、ポリアリレート、ポリイミドなどが挙げられる。これら柔軟な基板を用いることで、柔軟な有機発光素子を提供できる。基板の電極側の面、電極と反対側の面、又はその両方の面に透湿防止層(ガスバリア層)を設置することが好ましい。透湿防止層を構成する材料としては窒化ケイ素や酸化ケイ素などの無機物が好ましい。透湿防止層は高周波スパッタリング法などにより成膜できる。また、必要に応じてハードコート層やアンダーコート層を設けてもよい。
【0131】
燐光発光性化合物、電子輸送性高分子、ホール輸送性高分子などの有機高分子層の成膜法としては、溶液からのスピンコート法が一般的であり、そのほかにも大面積の有機高分子層を簡便に製造することができる方法として印刷法、インクジェット法、スプレー法、ディスペンサー法などを挙げることができるが、何らこれらに限定されるものではない。これにより表示画面の各画素が本発明の有機発光素子からなる表示装置において、画素ごとに有機高分子を塗り別けることができ、表示装置の表示画面をフルカラー化することができる。特にインクジェット法は、この画素ごとの塗り別け、表示画面のフルカラー化を容易に行うことができる。
【0132】
表示画面の各画素が本発明の有機発光素子からなる表示装置において、画素ごとに二個以上のトランジスタを配置し、これらのトランジスタによる画素のアドレスと駆動によって、アクティブマトリックス方式の表示装置を提供できる。最低限必要な二個のトランジスタの内、一個は画素を構成する有機発光素子に電流を注入する駆動用トランジスタであり、他の一個は、この駆動用トランジスタへの電流注入のオン/オフを制御する切り換え用トランジスタである。さらにこれらのトランジスタを有機トランジスタにすることで、プラスチック基板への適用も可能となる。
【0133】
[実施例]
以下に本発明の燐光発光性化合物の実施例、及びその合成法を説明する。これらの実施例は、説明の為の単なる例示であって、本発明は、これらの実施例に制限されない。
【0134】
(実施例1−1)燐光発光性化合物の単量体:[2−(3−メタクリルフェニル)ピリジン]ビス[2−(3−プロピオニルフェニル)ピリジン]イリジウム(III)(以下、Ir(MPPy)(PrCOPPy)2と略す)の合成
まず、スキーム(1)の常法に従い2−(3−メトキシフェニル)ピリジン(MeOPPy)を合成した。
【0135】
【化12】

具体的には、3−ブロモアニソール8.98g(48mmol)を脱水テトラヒドロフラン(THF)60ml中でMgを用いて3−メトキシフェニルマグネシウムブロミドを合成した。さらに、2−ブロモピリジン6.32g(40mmo1)、[1,2−ビス(ジフェニルホスフィノ)エタン]ジクロロニッケル(0)(Ni(dppe)Cl2)0.74gを脱水THF40mlに溶解した溶液に、先に得られた3−メトキシフェニルマグネシウムブロミドを添加し、室温で12時間反応させることにより無色透明の2−(3−メトキシフェニル)ピリジン(MeOPPy)を6.03g(32.4mmol)得た。同定はCHN元素分析、NMR、IRで行った。
【0136】
次に、スキーム(1)で得られたMeOPPyとトリス(アセチルアセトナト)イリジウム(III)(Ir(acac)3)を、スキーム(2)に示すように、高温で反応させ、トリス(2−(3−メトキシフェニル)ピリジン)イリジウム(III)(Ir(MeOPPy)3)を合成した。
【0137】
【化13】

具体的には、MeOPPy0.50g(2.70mmol)とIr(acac)30.20g(0.41mmol)をグリセロール20ml中、250℃で9時間反応させ、カラムで精製することにより、蛍光性黄色粉末としてIr(MeOPPy)30.020g(0.027mmol)を得た。同定はCHN及びIr元素分析、IRで行った。
【0138】
スキーム(2)で得られたIr(MeOPPy)3を、スキーム(3)の常法に従い、塩酸水溶液中でMeO基を加水分解してOH基とし、粉末のトリス(2−(3−ヒドロキシフェニル)ピリジン)イリジウム(III)(Ir(HOPPy)3)を得た。
【0139】
【化14】

スキーム(3)で得られたIr(HOPPy)3を、スキーム(4)に従い、メタクリル酸クロリドとモル比1:1で反応させることにより、OH基の一部分をメタクリル化させIr(MPPy)(HOPPy)2が主成分となる錯体を合成した。次いで残りのOH基をプロピオン酸クロリド(PrCOCl)と反応させ、Ir(MPPy)(PrCOPPy)2が主成分となる錯体を得た。
【0140】
【化15】

具体的には、反応容器に脱水THF8ml、Ir(HOPPy)30.706g(1mmol)、脱酸剤としてトリエチルアミン0.600g(5.9mmo1)を入れた後、メタクリル酸クロリド0.106g(1mmol)を脱水THF4mlに溶解した溶液を30分かけて滴下し、20℃で5時間反応させた。この反応溶液に更にプロピオン酸クロリド0.370g(4mmol)を脱水THF4mlに溶解した溶液を30分かけて滴下し、20℃で5時間反応させることにより残りのOH基を反応させ、トリエチルアミンの塩酸塩を濾別した。濾液の溶媒を蒸発乾固し、得られた固形成分はクロロホルム/メタノール混合溶媒にて再結晶を2回行うことによって精製し、目的とするIr(MPPy)(PrCOPPy)20.523g(0.59mmol)を粉末として得た。この錯体の同定はCHN及びIrの元素分析、IRで行った。
【0141】
(実施例1−2)燐光発光性化合物:[2−(3−メタクリルフェニル)ピリジン]ビス[2−(3−プロピオニルフェニル)ピリジン]イリジウム(III)/N−ビニルカルバゾール共重合体(以下、Ir(MPPy)(PrCOPPy)2/VCz共重合体と略す)の合成
スキーム(5)に従って、反応容器に実施例1で合成したIr(MPPy)(PrCOPPy)2錯体0.222g(0.25mmol)、N−ビニルカルバゾール(VCz)0.918g(4.75mmol)(Ir(MPPy)(PrCOPPy)2とVCzがモル比で5:95)、2,2'−アゾビス(イソブチロニトリル)(AIBN)0.010g(0.061mmol)、酢酸ブチル10mlを入れて窒素置換を行った後、80℃で10時間反応させた。
【0142】
【化16】

反応後、生成物をアセトンに投入して再沈殿を行い、濾過により共重合体を回収した。回収した共重合体のクロロホルム溶液をメタノール中に投入して再沈殿させることを更に2回行うことにより精製し、沈殿回収後に真空乾燥して、目的とするIr(MPPy)(PrCOPPy)2/VCz共重合体0.946gを粉末として得た。得られた共重合体のCHN及びIrの元素分析は、Ir(MPPy)(PrCOPPy)2とVCzが5:95のモル比で共重合していることを支持していた。即ち燐光発光性単位の繰り返し数m/キャリア輸送性単位の繰り返し数n=5/95であると考えられる。また、共重合体のクロロホルム中のGPCから、重量平均分子量はポリスチレン換算で12000であった(重量平均分子量から計算される平均の重合度は37)。さらに本発明の燐光発光性化合物はクロロホルムなどの有機溶剤に可溶である。
【0143】
(実施例1−3)有機発光素子の試作
Ir(MPPy)(PrCOPPy)2/VCz共重合体と電子輸送材料であるオキサジアゾール誘導体(tBu−PBD)のクロロホルム溶液を調製した。比率は、Ir(MPPy)(PrCOPPy)2/VCz共重合体が65重量パーセントに対しtBu−PBDを35重量パーセントとした。この溶液を透明電極である酸化スズインジウム(ITO)がついたガラス基板上にスピンコートして厚さ100nmの膜を形成し、その上に真空蒸着法でCaを10nm、Alを100nm蒸着し陰極とした。この有機発光素子のITO側に正の、Al側に負の電圧を印加したところ、イリジウム錯体に起因した緑色の発光が観察された。発光量子効率は約4%であった。
【0144】
(実施例2−1)燐光発光性化合物の単量体:{2−[3−(2−メタクリロイルオキシエチル)カルバモイルオキシフェニル]ピリジン}ビス[2−(3−プロピオニルフェニル)ピリジン]イリジウム(III)(以下、Ir(MiPPy)(PrCOPPy)2と略す)の合成
実施例1−1で合成した単量体の中間体Ir(HOPPy)3をスキーム(6)に示すように、メタクリロイルオキシエチルイソシアナート(MOI、昭和電工製)と1:1で反応させ、次いで残りのOH基をPrCOClと反応させ、Ir(MiPPy)(PrCOPPy)2が主成分となる錯体を得た。
【0145】
【化17】

具体的には、反応容器に脱水THF8ml、Ir(HOPPy)30.706g(1mmol)、MOI0.106g(1mmol)を入れて、20℃で5時間反応させた。ごの反応溶液に脱酸剤としてトリエチルアミン0.600g(5.9mmo1)を加えた後、プロピオニルクロリド0.370g(4mmol)を脱水THF4mlに溶解させた溶液を30分かけて滴下し、更に20℃で5時間反応させることにより残りのOH基を反応させ、トリエチルアミンの塩酸塩を濾別した。濾液の溶媒を蒸発乾固し、得られた固形成分はクロロホルム/メタノール混合溶媒で再結晶を2回行うことにより精製し、目的とするIr(MiPPy)(PrCOPPy)20.613g(0.63mmol)を粉末として得た。この同定はCHN及びIrの元素分析、IRで行った。
【0146】
(実施例2−2)燐光発光性化合物:{2−[3−(2−メタクリロイルオキシエチル)カルバモイルオキシフェニル]ピリジン}ビス[2−(3−プロピオニルフェニル)ピリジン]イリジウム(III)/N−ビニルカルバゾール共重合体(以下、Ir(MiPPy)(PrCOPPy)2/VCz共重合体と略す)の合成
スキーム(7)に従って、反応容器に実施例3で合成したIr(MiPPy)(PrCOPPy)2錯体0.243g(0.25mmol)、N−ビニルカルバゾール(VCz)0.918g(4.75mmol)(Ir(MiPPy)(PrCOPPy)2とVCzがモル比で5:95)、2,2'−アゾビス(イソブチロニトリル)(AIBN)0.010g(0.061mmol)、酢酸ブチル10mlを入れて窒素置換を行った後、80℃で10時間反応させた。
【0147】
【化18】

反応後、アセトンに投入して再沈殿を行い、濾過により共重合体を回収した。回収した共重合体のクロロホルム溶液をメタノール中に投入して再沈殿させることを更に2回行うことにより精製し、沈殿回収後に真空乾燥して、目的とするIr(MiPPy)(PrCOPPy)2/VCz共重合体1.053gを粉末として得た。得られた共重合体のCHN及びIrの元素分析はIr(MiPPy)(PrCOPPy)2とVCzが5:95のモル比で共重合していることを支持していた。即ち燐光発光性単位の繰り返し数m/キャリア輸送性単位の繰り返し数n=5/95であると考えられる。また、共重合体のクロロホルム中のGPCから、重量平均分子量はポリスチレン換算で23000であった(重量平均分子量から計算される平均の重合度は64)。さらに本発明の燐光発光性化合物はクロロホルムなどの有機溶剤に可溶である。
【0148】
(実施例2−3)有機発光素子の試作
Ir(MiPPy)(PrCOPPy)2/VCz共重合体とtBu−PBDのクロロホルム溶液を調製した。比率は、Ir(MiPPy)(PrCOPPy)2/VCz共重合体が65重量パーセントに対しtBu−PBDを35重量パーセントとした。この溶液をITOがついたガラス基板上にスピンコートして厚さ100nmの膜を形成し、その上に真空蒸着法でCaを10nm、Alを100nm蒸着し陰極とした。この有機発光素子のITO側に正の、Al側に負の電圧を印加したところ、イリジウム錯体に起因した緑色の発光が観察された。発光量子効率は約3%であった。
【0149】
(実施例3−1)燐光発光性化合物:[2−(3−ヘキシルフェニル)ピリジン]ビス(2−フェニルピリジン)イリジウム(III)/3−ヘキシルチオフェン共重合体(以下、Ir(HPPy)PPy2/HT共重合体と略す)の合成
スキーム(8)に示すように、5−ブロモ−2−(4−ブロモ−3−ヘキシルフェニル)ピリジン(HPPyBr2)0.099g(0.25mmol)と3−ヘキシル−2,5−ジブロモチオフェン(HTBr2)1.549g(4.75mmol)((HPPyBr2)と(HTBr2)がモル比で5:95)とを常法に従い、ジメチルホルムアミド(DMF)10ml中でNi(COD)2(0)(ただしCODはシクロオクタジエニル基を示す)触媒で共重合し、2−(3−ヘキシルフェニル)ピリジン/3−ヘキシルチオフェン共重合体(HPPy/HT共重合体)を合成した。次に、このHPPy/HT共重合体0.625g(4mmol)とIr(acac)30.099g(0.2mmol)をメタクレゾール中で溶解し、250℃で10時間反応させた。さらにこの溶液にフェニルピリジン(PPy)を0.062g(0.4mmol)を加え、250℃で10時間反応させた。
【0150】
【化19】

反応後、アセトンに投入して再沈殿を行い、濾過により共重合体を回収した。回収した共重合体のDMF溶液をアセトン中に投入して再沈殿を更に2回行うことにより精製し、沈殿回収後に真空乾燥して、目的とするIr(HPPy)PPy2/HT共重合体0.564gを粉末として得た。
【0151】
共重合体のCHN及びIrの元素分析は推定構造を支持していた。即ち燐光発光性単位の繰り返し数m/キャリア輸送性単位の繰り返し数n=5/95であると考えられる。また、ヘキサフルオロイソプロパノール中の共重合体のGPCから、重量平均分子量はポリスチレン換算で18000であった(重量平均分子量から計算される平均の重合度は68)。さらに本発明の燐光発光性化合物はDMFなどの有機溶剤に可溶である。
【0152】
(実施例3−2)有機発光素子の試作
Ir(HPPy)PPy2/HT共重合体とtBu−PBDのクロロホルム溶液を調製した。比率は、Ir(HPPy)PPy2/HT共重合体が65重量パーセントに対しtBu−PBDを35重量パーセントとした。この溶液をITOがついたガラス基板上にスピンコートして厚さ100nmの膜を形成し、その上に真空蒸着法でCaを10nm、Alを100nm蒸着し陰極とした。この有機発光素子のITO側に正の、Al側に負の電圧を印加したところ、イリジウム錯体に起因した黄色の発光が観察された。発光量子効率は約1%であった。
【0153】
(実施例4−1)電子輸送性化合物の単量体:2−(4−tert−ブチル−フェニル)−(4'−ビニル−ビフェニル−4−イル)−[1,3,4]オキサジアゾール(以下、VPBDと略す。)の合成
特開平10−1665号公報に開示されている方法に従い、VPBDを合成した。
【0154】
(実施例4−2)燐光発光性化合物:[2−(3−メタクリルフェニル)ピリジン]ビス[2−(3−プロピオニルフェニル)ピリジン]イリジウム(III)/N−ビニルカルバゾール/2−(4−tert−ブチル−フェニル)−5−(4'−ビニル−ビフェニル−4−イル)−[1,3,4]オキサジアゾール共重合体(以下、Ir(MPPy)(PrCOPPy)2/VCz/VPBD共重合体と略す。)の合成
下記スキーム(9)に従って、実施例1−1で合成したIr(MPPy)(PrCOPPy)2錯体0.222g(0.25mmol)、VCz0.628g(3.25mmol)、上記実施例4−1で合成したVPBD0.571g(1.50mmol)(モル比がIr(MPPy)(PrCOPPy)2:VCz:VPBD=5:65:30)、2,2'−アゾビス(イソブチロニトリル)(AIBN)0.010g(0.061mmol)、ベンゼン10mlを反応容器にいれて窒素置換を行った後、80℃で10時間反応させた。
【0155】
反応後、生成物をアセトンに投入して再沈殿を行い、濾過により共重合体を回収した。回収した共重合体のクロロホルム溶液をメタノール中に投入して再沈殿させることをさらに2回行うことにより精製し、沈殿回収後に真空乾燥して、目的とするIr(MPPy)(PrCOPPy)2/VCz/VPBD共重合体0.080gを粉末として得た。
【0156】
【化20】

得られた共重合体(燐光発光性化合物)のCHN及びIrの元素分析は、モル比がIr(MPPy)(PrCOPPy)2:VCz:VPBD=5:65:25で共重合していることを支持していた。すなわち、(燐光発光性単位の繰り返し数:k)/(キャリア輸送単位の繰り返し数m+n)=5/90であると考えられる。また、共重合体のクロロホルム中のGPCから、共重合体の重量平均分子量はポリスチレン換算で30000であった(重量平均分子量から計算される平均の重合度は2.5)。この共重合体は、クロロホルムなどの有機溶剤に可溶である。
【0157】
(実施例4−3)有機発光素子の試作
実施例4−2で得られたIr(MPPy)(PrCOPPy)2/VCz/VPBD共重合体のクロロホルム溶液を調製した。この溶液を透明電極である酸化スズインジウム(ITO)が付いたガラス基板上にスピンコートして厚さ100nmの膜を形成し、その上に真空蒸着法でCaを10nm、Alを100nm蒸着して陰極とし、有機発光素子を得た。この有機発光素子のITO側を正とし、Al側を負として電圧を印加したところ、イリジウム錯体に起因した緑色の発光が観察された。発光量子効率は約3%であった。
【0158】
(実施例5−1)電子輸送性高分子化合物:ポリ−VPBD(以下、PVPBDと略す。)の合成
特開平10−1655号公報に開示されている方法に従いPVPBDを合成した。
【0159】
(実施例5−2)
実施例1−2で得られたIr(MPPy)(PrCOPPy)2/VCz共重合体と実施例5−1で得られたPVPBDのクロロホルム溶液を調製した。比率は、Ir(MPPy)(PrCOPPy)2/VCz共重合体が65重量%に対しPVPBDを35重量%とした。この溶液を透明電極である酸化スズインジウム(ITO)が付いたガラス基板上にスピンコートして厚さ100nmの膜を形成し、その上に真空蒸着法でCaを10nm、Alを100nm蒸着して陰極とし、有機発光素子を得た。この有機発光素子のITO側を正とし、Al側を負として電圧を印加したところ、イリジウム錯体に起因した緑色の発光が観察された。発光量子効率は約4.5%であった。
【0160】
(実施例6−1)青色燐光発光部位を有する単量体:イリジウム(III)ビス(2−(2,4−ジフルオロフェニル)ピリジナート)(5−メタクリロイロキシメチルピコリナート)(以下、Ir(2,4−F−ppy)2(5−CH2MA−pic)と略す。)の合成
スキーム(10)に示すように、イリジウム(III)ビス(2−(2,4−ジフルオロフェニル)ピリジナート)(5−(ヒドロキシメチル)ピコリナート)(以下、Ir(2,4−F−ppy)2(5−CH2OH−pic)と略す。)を合成した。即ち、[Ir(2,4−F−ppy)2Cl]2121.6mg(0.1mmol)、5−ヒドロキシメチルピコリン酸45.9mg(0.3mmol)、炭酸ナトリウム106.0mg(1.0mmol)にアルゴン気流下において脱水N,N−ジメチルホルムアミド10mlを加え、80℃で2時間攪拌した。反応液に50mlの水を加えた後、酢酸エチルで抽出した。その溶液を硫酸マグネシウムで乾燥後、濃縮し、カラムクロマトグラフィー(シリカゲル、メタノール:クロロホルム=1:19(体積比))で精製した。さらにそれをヘキサン/クロロホルムより再結晶することにより黄色の結晶としてIr(2,4−F−ppy)2(5−CH2OH−pic)108.7mgを得た。収率75%。同定は1H−NMRとCHN元素分析で行った。1H−NMR(270MHz,DMSO−d6),ppm:8.54(d,1H,J=4.6),8.3−8.2(m,2H),8.1−8.0(m,4H),7.70(s,1H),7.61(d,1H,J=4.9),7.49(dd,1H,J=6.6,.6.6),7.32(dd,1H,J=6.6,.6.6),6.9−6.7(m,2H),5.71(dd,1H,J=8.9,2.4),5.46(dd,1H,J=8.5,2.3),5.42(t,1H,J=4.6),4.49(d,2H,J=4.6).Anal.Found:C48.05,H2.54,N5.86.Calcd:C48.06,H2.50,N5.80.
【0161】
【化21】

次いで、スキーム(11)に示すように、Ir(2,4−F−ppy)2(5−CH2MA−pic)を合成した。即ち、Ir(2,4−F−ppy)2(5−CH2OH−pic)72.5mg(0.1mmol)と2,6−ジ−tert−4−メチルフェノール0.2mgをアルゴン気流下に脱水ジクロロメタン10mlに溶解し、トリエチルアミン101.2mg(1.0mmol)とメタクリル酸クロライド52.3mg(0.5mmol)を加え、室温で2時間攪拌した。反応液に水50mlを加え、クロロホルムで抽出した。その溶液を硫酸マグネシウムで乾燥後、濃縮し、カラムクロマトグラフィー(シリカゲル、メタノール:クロロホルム=3:97(体積比))で精製した。さらにそれをヘキサン/クロロホルムより再結晶することにより黄色の結晶としてIr(2,4−F−ppy)2(5−CH2MA−pic)70.6mgを得た。収率89%。同定は1H−NMRとCHN元素分析で行った。1H−NMR(270MHz,DMSO−d6),ppm:8.53(d,1H,J=5.1),8.28(d,1H,J=8.4),8.22(d,1H,J=8.6),8.1−8.0(m,4H),7.70(s,1H),7.66(d,1H,J=4.9),7.48(dd,1H,J=6.5,.6.5),7.31(dd,1H,J=6.5,.6.5),6.9−6.7(m,2H),5.84(s,1H),5.7−5.6(m,2H),5.47(dd,1H,J=8.8,2.6),5.24(d,2H,J=2.7),1.78(s,3H).Anal.Found:C49.92,H2.87,N5.28.Calcd:C50.00,H2.80,N5.30.
【0162】
【化22】

(実施例6−2)緑色の燐光発光性部位を有する単量体:[6−(4−ビニルフェニル)−2,4−ヘキサンジオナート]ビス(2−フェニルピリジン)イリジウム(III)(以下Ir(ppy)2[1−(StMe)−acac]と略す)の合成
スキーム(12)に示すように、アセチルアセトンと4−ビニルベンジルクロライドを反応させて6−(4−ビニルフェニル)−2,4−ヘキサジオンを合成した。即ち、水素化ナトリウム1.23g(60% in oil)(31mmol)を窒素雰囲気下で秤量し、これに乾燥テトラヒドロフラン(以下THFと略す)60mlを加えて氷浴で0℃に冷却した。この懸濁液にアセチルアセトン2.5g(24mmol)とヘキサメチルホスホリックトリアミド1mlの混合溶液を滴下すると無色の沈殿が生成した。0℃で10分間攪拌した後、n−ブチルリチウムのヘキサン溶液(1.6M)17.5ml(28mmol)を滴下すると沈殿が溶解し、更に0℃で20分間攪拌した。得られた薄黄色の溶液に4−ビニルベンジルクロライド4.0g(26mmol)を滴下し、反応液を室温に戻して20分間攪拌後、希塩酸を加えて水層を酸性にした。有機層を飽和塩化ナトリウム水溶液で洗浄し、硫酸マグネシウムで乾燥した後、ロータリーエバポレータで溶媒を留去した。得られた反応混合物をシリカゲルカラムに加えてヘキサン/ジクロロメタンの1:1(体積比)混合溶媒で展開し、主生成物を分取した。得られた溶液から減圧で溶媒を留去することにより、目的とする6−(4−ビニルフェニル)−2,4−ヘキサジオン3.0g(14mmol)を褐色の液体として得た。収率56%。同定はCHN元素分析、1H−NMRで行った。1H NMR(CDCl3):enol;δ7.33(d,J=8.1Hz,2H,aromatic),7.14(d,J=8.4Hz,2H,aromatic),6.68(dd,J=8.1Hz,1H,vinylic),5.70(d,J=17.0Hz,1H,vinylic),5.46(s,1H,diketonate−methine),5.20(d,J=11.1Hz,1H,vinylic),2.91(t,J=5.7Hz,2H,methylene),2.58(t,J=7.3Hz,2H,methylene),2.03(s,3H,methyl).keto;δ7.33(d,J=8.1Hz,2H,aromatic),7.14(d,J=8.4Hz,2H,aromatic),6.68(dd,J=8.1Hz,1H,vinylic),5.70(d,J=17.0Hz,1H,vinylic),5.20(d,J=11.1Hz,1H,vinylic),3.53(s,2H,C(=O)CH2C(=O)),2.89(m,4H,ethylene),2.19(s,3H,methyl).enol:keto=6:1.E.A.:Calcd for C14H9O2:C,77.75;H,7.46.Found:C,77.49;H,7.52.
【0163】
【化23】

次いで、スキーム(13)に示すように、この6−(4−ビニルフェニル)−2,4−ヘキサンジオンと常法に従い合成した[Ir(ppy)2Cl]2を反応させてIr(ppy)2[1−(StMe)−acac]を合成した。即ち、[Ir(ppy)2Cl]2342mg(0.32mmol)、炭酸ナトリウム158mg(1.5mmol)および2,6−ジ−tert−ブチル−4−メチルフェノール5mg(0.023mmol)を5mlのN,N−ジメチルホルムアミド(以下DMFと略す)に溶解し、これに6−(4−ビニルフェニル)−2,4−ヘキサンジオン210mg(0.97mmol)を加えて65℃で1時間加熱攪拌した。次に室温まで冷却した反応溶液に希塩酸水溶液を加えた後、薄黄色の成分をクロロホルムで抽出した。ロータリーエバポレータを用いて溶媒を留去後、残渣を少量のジクロロメタンに溶解し、シリカゲルカラムクロマトグラフィー(展開液:ジクロロメタン)で黄色の主生成物を分取した。この溶液を減圧乾固し、ジクロロメタン−ヘキサン混合溶液を加えて−20℃で再結晶を行い、目的とするIr(ppy)2[1−(StMe)−acac]354mg(0.49mmol)を薄黄色結晶として得た。収率78%。同定はCHN元素分析、1H−NMRで行った。1H NMR(CDCl3):δ8.47(d,J=5.7Hz,1H,ppy),8.21(d,J=5.7Hz,1H,ppy),7.9-7.5(m,6H,ppy),7.18(d,J=8.1Hz,2H,stylyl−aromatic),7.00(m,2H,ppy),6.89(d,J=8.1Hz,2H,stylyl−aromatic),6.75(m,5H,ppy and vinylic),6.28(t,J=7.3Hz,2H,ppy),7.67(d,J=17.6Hz,1H,vinylic),5.19(d,J=9.5Hz,1H,vinylic),5.17(s,1H,diketonate−methine),2.60(t,J=7.3Hz,2H,ethylene),2.36(m,2H,ethylene),1.75(s,3H,methyl).E.A.:Calcd for C36H31IrN2O2:C,60.40;H,4.36;N,3.91.Found:C,61.35;H,4.34;N,3.83.
【0164】
【化24】

(実施例6−3)赤色の燐光発光性部位を有する単量体:[6−(4−ビニルフェニル)−2,4−ヘキサンジオナート]ビス[2−(2−ピリジル)ベンゾチエニル]イリジウム(III){以下Ir(btp)2[1−(StMe)−acac]と略す}の合成
スキーム(14)に示すように、アセチルアセトンと4−ビニルベンジルクロライドを反応させて6−(4−ビニルフェニル)−2,4−ヘキサンジオンを合成した。即ち、水素化ナトリウム1.23g(60% in oil)(31mmol)を窒素雰囲気下で秤量し、これに乾燥テトラヒドロフラン(以下THFと略す)60mlを加えて氷浴で0℃に冷却した。この懸濁液にアセチルアセトン2.5g(24mmol)とヘキサメチルホスホリックトリアミド(以下HMPAと略す)1mlの混合溶液を滴下すると無色の沈殿が生成した。0℃で10分間撹拌した後、n−ブチルリチウムのヘキサン溶液(1.6M)17.5ml(28mol)を滴下すると沈殿が溶解し、更に0℃で20分間撹拌した。得られた薄黄色の溶液に4−ビニルベンジルクロライド4.0g(26mmol)を滴下し、反応液を室温に戻して20分間撹拌後、希塩酸を加えて水層を酸性にした。有機層を飽和塩化ナトリウム水溶液で洗浄し、硫酸マグネシウムで乾燥した後、ロータリーエバポレータで溶媒を留去した。得られた反応混合物をシリカゲルカラムに加えてヘキサン/ジクロロメタンの1:1(体積比)混合溶媒で展開し、主生成物を分取した。得られた溶液から減圧で溶媒を留去することにより、目的とする6−(4−ビニルフェニル)−2,4−ヘキサンジオン3.0g(14mmol)を褐色の液体として得た。収率56%。同定はCHN元素分析、1H−NMRで行った。1H NMR:enol;δ7.33(d,J=8.1Hz,2H,aromatic),7.14(d,J=8.4Hz,2H,aromatic),6.68(dd,J=8.1Hz,1H,vinylic),5.70(d,J=17.0Hz,1H,vinylic),5.46(s,1H,enol−methine),5.20(d,J=11.1Hz,1H,vinylic),2.91(t,J=5.7Hz,2H,methylene),2.58(t,J=7.3Hz,2H,methylene),2.03(s,3H,methyl).keto;δ7.33(d,J=8.1Hz,2H,aromatic),7.14(d,J=8.4Hz,2H,aromatic),6.68(dd,J=8.1Hz,1H,vinylic),5.70(d,J=17.0Hz,1H,vinylic),5.20(d,J=11.1Hz,1H,vinylic),3.53(s,2H,C(=O)CH2C(=O)),2.89(m,4H,ethylene),2.19(s,3H,methyl).enol:keto=6:1.E.A.:Calcd for C14H9O2:C,77.75;H,7.46.Found:C,77.49;H,7.52.
【0165】
【化25】

次いで、スキーム(15)に示すように、この6−(4−ビニルフェニル)−2,4−ヘキサンジオンと常法(例えばS.Lamansky,et al.,Inorganic Chemistry,40,1704(2001)に記載)に従い合成したジ(μ−クロロ)テトラキス(2−(2−ピリジル)ベンゾチエニル)ジイリジウム(以下、[Ir(btp)2Cl]2と略す。)を反応させてIr(btp)2[1−(St−Me)−acac]を合成した。即ち、[Ir(btp)2Cl]2253mg(0.20mmol)を10mlのN,N−ジメチルホルムアミド(以下DMFと略す)に懸濁させ、161mgの6−(4−ビニルフェニル)−2,4−ヘキサンジオン(0.74mmol)と64mgの炭酸ナトリウムおよび1.9mgの2,6−ジ−tert−ブチル−4−、メチルフェノール(以下BHTと略す)(0.0086mmol)を加えて80℃で1時間加熱撹拌した。得られた反応混合物に100mlの水と50mlのクロロホルムを加えてよく振とうし、有機層を硫酸マグネシウムで乾燥後、ロータリーエバポレータで減圧乾固した。次にジクロロメタンを溶出液として、粗精製物をシリカゲルカラムで精製し、赤褐色の溶液を得た。この溶液を減圧下で濃縮し、ヘキサンを加えて−20℃で再結晶することによって目的とするIr(btp)2[1−(StMe)−acac]153mg(0.18mmol)を赤褐色の固体として得た(収率47%)。同定はCHN元素分析、1H−NMRで行った。1H NMR:δ8.40(d,J=5.4Hz,1H,btp),7.97(d,J=5.4Hz,1H,btp),7.65(m,6H,btp),7.1-6.7(m,10H,aromatic),6.63(dd,J=17.8,11.1Hz,1H,vinylic),6.24(d,J=8.1Hz,1H,btp),6.16(d,J=7.8Hz,1H,btp),5.65(d,J=17.8Hz,1H,vinylic),5.22(s,1H,diketonate−methine),5.18(d,J=11.1Hz,1H,vinylic),2.56(m,2H,ethylene),2.37(m,2H,ethylene),1.75(s,3H,methyl).E.A.:Calcd for C40H31IrN2O2S2:C,58.02;H,3.77;N,3.38.Found:C,57.79;H,3.81;N,3.55.
【0166】
【化26】

(実施例6−4)白色燐光発光性化合物の合成
実施例6−1〜6−3で合成した発光機能を有する3種類の単量体及びホール輸送機能を有するN−ビニルカルバゾールを含有する共重合体を合成した。
【0167】
N−ビニルカルバゾール1.55g(8.0mmol)、Ir(2,4−F−ppy)2(3−ST−pic)58.0mg(0.08mmol)、Ir(ppy)2[1−(St−Me)−acac]1.1mg(0.0015mmol)、Ir(btp)2[1−(StMe)−acac]1.2mg(0.0015mmol)、AIBN13mg(0.08mmol)を脱水トルエン40mlに溶解させ、さらに1時間アルゴンを吹き込んだ。この溶液を80℃まで昇温し、重合反応を開始させ、そのまま8時間攪拌した。冷却後、反応液をメタノール250ml中に滴下して重合物を沈殿させ、濾過により回収した。さらに、回収した重合物をクロロホルム25mlに溶解させ、この溶液をメタノール250ml中に滴下して再沈殿させることにより精製した後、60℃で12時間真空乾燥させることにより目的とする青色、緑色及び赤色に発光する3種類の燐光発光性単位を有する白色燐光発光性化合物116.3mgを得た。
【0168】
得られた共重合体(燐光発光性化合物)のIrの元素分析結果から、Ir錯体(燐光発光性単位)の含有量は1.07mol%であった。又、共重合体のクロロホルム中のGPCから、重量平均分子量はポリスチレン換算で12400であった。
【0169】
(実施例6−5)有機発光素子の試作
Ir(MPPy)(PrCOPPy)2/VCz共重合体に替えて、実施例6−2で合成した共重合体を用いること以外は実施例1−3と同様にして有機発光素子の試作を行った。
【0170】
この有機発光素子のITO側に正の、Al側に負の電圧を印加したところ、肉眼で白色の発光が観察された。
【0171】
有機発光素子の発光スペクトルを図3に示す。3種類の燐光発光性単位(青、緑、赤)に対応する発光ピークがそれぞれ、480nm、520nm、620nmに観測された。発光色の色度は(0.32、0.33)であった。
(実施例7−1)青色の燐光発光性部位を有する単量体:イリジウム(III)ビス(2−(2,4−ジフルオロフェニル)ピリジナート)(3−(4−ビニルフェニル)メトキシピコリナート)(以下、Ir(2,4−F−ppy)2(3−ST−pic)と略す。)の合成
スキーム(16)に示すように、2−(2,4−ジフルオロフェニル)ピリジンを合成した。即ち、アルゴン気流下において2−ブロモピリジン8.69g(55.0mmol)を脱水テトラヒドロフラン200mlに溶解して−78℃まで冷却し、1.6M n−ブチルリチウムのヘキサン溶液38.7ml(61.9mmol)を30分かけて滴下した。滴下後、さらに塩化亜鉛7.5g(55.0mmol)を脱水テトラヒドロフラン(THF)50mlに溶解した溶液を30分かけて滴下した。滴下後、0℃までゆっくりと昇温し、1−ブロモ−2,4−ジフルオロベンゼン9.65g(55.0mmol)とテトラキス(トリフェニルホスフィン)パラジウム(0)2.31g(2.0mmol)を加え、還流下に6時間攪拌した後、反応液に飽和食塩水200mlを加えジエチルエーテルで抽出した。抽出液を乾燥後、濃縮し、カラムクロマトグラフィー(シリカゲル;クロロホルム:ヘキサン=1:1(体積比))で精製することにより、2−(2,4−ジフルオロフェニル)ピリジンを無色透明のオイルとして得た。収量6.00g。収率63%。同定は1H−NMRとCHN元素分析で行った。1H−NMR(270MHz,CDCl3),ppm:8.71(d,1H,J=4.6Hz),8.00(td,1H,J=8.9,6.5Hz),7.8−7.7(m,2H),7.3−7.2(over wrapped with CHCl3,1H),7.1−6.8(m,2H).Anal.Found:C68.98,H3.80,N7.31.Calcd:C69.11,H3.69,N7.33.
【0172】
【化27】

次いで、スキーム(17)に示すように、イリジウムの2核錯体、ビス(μ−クロロ)テトラキス(2−(2,4−ジフルオロフェニル)ピリジン)ジイリジウム(III)(以下、[Ir(2,4−F−ppy)2Cl]2と略す。)を合成した。即ち、2−(2,4−ジフルオロフェニル)ピリジン0.96g(5.0mmol)とヘキサクロロイリジウム(III)酸ナトリウムn水和物(和光純薬工業製)1.00gを2−エトキシエタノール:水=3:1の混合溶媒40mlに溶解し、30分間アルゴンガスを吹き込んだ後、還流下に5時間攪拌した。生じた沈殿をろ取し、エタノールと少量のアセトンで洗浄し、真空下で5時間乾燥することにより、[Ir(2,4−F−ppy)2Cl]2を黄色粉末として得た。収量0.79g。収率86%。同定は1H−NMRとCHN元素分析で行った。1H−NMR(270MHz,CDCl3),ppm:9.12(d,4H,J=5.7Hz),8.31(d,4H,J=8.6Hz),7.83(dd,4H,J=7.6,7.6Hz),6.82(dd,4H,J=7.3,7.3Hz),6.34(ddd,4H,J=11.6,10.0,2.4Hz),5.29(dd,4H,J=9.5,2.4Hz).Anal.Found:C43.69,H3.53,N3.54.Calcd:C43.88,H3.45,N3.56.
【0173】
【化28】

次いで、スキーム(18)に示すように、イリジウム(III)ビス(2−(2,4−ジフルオロフェニル)ピリジナート)(3−ヒドロキシピコリナート)(以下、Ir(2,4−F−ppy)2(3−OH−pic)と略す。)を合成した。即ち、[Ir(2,4−F−ppy)2Cl]2121.6mg(0.1mmol)、3−ヒドロキシピコリン酸41.7mg(0.3mmol)、炭酸ナトリウム106.0mg(1.0mmol)にアルゴン気流下において脱水N,N−ジメチルホルムアミド(DMF)10mlを加え、80℃で2時間攪拌した。反応液に50mlの水を加えた後、酢酸エチルで抽出した。その溶液を硫酸マグネシウムで乾燥後、濃縮し、カラムクロマトグラフィー(シリカゲル、メタノール:クロロホルム=3:97(体積比))で精製した。さらにそれをヘキサン/クロロホルムより再結晶することにより黄色の結晶としてIr(2,4−F−ppy)2(3−OH−pic)101.0mgを得た。収率71%。同定は1H−NMRとCHN元素分析で行った。1H−NMR(270MHz,DMSO−d6),ppm:13.6(br,1H),8.50(d,1H,J=5.9Hz),8.25(d,2H,J=11.1Hz),8.1−8.0(m,2H),7.69(d,1H,J=5.7Hz),7.62(d,1H,J=8.1Hz),7.53(d,1H,J=4.6Hz),7.50(d,1H,J=5.7Hz),7.36(t,1H,J=4.5Hz),7.24(d,1H,J=5.1Hz),6.9−6.7(m,2H),5.66(dd,1H,J=8.6,2.4Hz),5.48(dd,1H,J=8.6,2.4Hz).Anal.Found:C47.29,H2.33,N5.86.Calcd:C47.32,H2.27,N5.91.
【0174】
【化29】

次いで、スキーム(19)に示すように、Ir(2,4−F−ppy)2(3−ST−pic)を合成した。即ち、Ir(2,4−F−ppy)2(3−OH−pic)106.5mg(0.15mmol)、炭酸カリウム207.3mg(1.5mmol)、2,6−ジ−t−ブチルヒドロキシトルエン0.3mgにアルゴン気流下において脱水N,N−ジメチルホルムアミド15mlを加え、さらに4−ビニルベンジルクロライド91.5mg(0.6mmol)を加え、80℃で4時間攪拌した。反応液に水100mlを加えて生成物を沈殿させてろ取し、カラムクロマトグラフィー(シリカゲル、メタノール:クロロホルム=3:97(体積比))で精製した。さらにそれをヘキサン/クロロホルムより再結晶することにより黄色の結晶としてIr(2,4−F−ppy)2(3−ST−pic)72.0mgを得た。収率58%。同定は1H−NMRとCHN元素分析で行った。1H−NMR(270MHz,DMSO−d6),ppm:8.59(d,1H,J=5.1Hz),8.3−8.2(m,2H),8.1−8.0(m,2H),7.9(d,1H,J=8.6Hz),7.67(d,1H,J=5.1Hz),7.6−7.3(m,7H),6.9−6.7(m,3H),5.85(d,1H,J=17.8Hz),5.67(dd,1H,J=8.9,2.4Hz),5.45(dd,1H,J=8.9,2.4Hz),5.29(s,2H),5.27(d,1H,J=11.1Hz).Anal.Found:C53.71,H2.90,N5.03.Calcd:C53.75,H2.93,N5.08.
【0175】
【化30】

(実施例7−2)青色燐光発光部位を有するIr(2,4−F−ppy)2(3−ST−pic)とホール輸送性機能を有するビニルカルバゾールの共重合体(以下、Ir(2,4−F−ppy)2(3−ST−pic)/VCz共重合体と略す。)の合成
N−ビニルカルバゾール966mg(5.0mmol)および実施例7−1で合成したIr(2,4−F−ppy)2(3−ST−pic)41(0.05mmol)、AIBN8.2mg(0.05mmol)を脱水トルエン25mlに溶解させ、さらに1時間アルゴンを吹き込んだ。この溶液を80℃まで昇温し、重合反応を開始させ、そのまま8時間攪拌した。冷却後、反応液をメタノール250ml中に滴下して重合物を沈殿させ、濾過により回収した。さらに、回収した重合物をクロロホルム25mlに溶解させ、この溶液をメタノール250ml中に滴下して再沈殿させることにより精製した後、60℃で12時間真空乾燥させることにより目的物であるIr(2,4−F−ppy)2(3−ST−pic)/VCz共重合体722mgを得た。
【0176】
得られた共重合体(燐光発光性化合物)のIrの元素分析結果から、Ir錯体(燐光発光性単位)の含有量は1.04mol%であった。また、共重合体のクロロホルム中のGPCから、重量平均分子量はポリスチレン換算で11400であった。
【0177】
(実施例7−3)赤色燐光発光部位を有する[6−(4−ビニルフェニル)−2,4−ヘキサンジオナート]ビス[2−(2−ピリジル)ベンゾチエニル]イリジウム(III)とホール輸送性機能を有するビニルカルバゾールの共重合体(以下、Ir(btp)2[1−(StMe)−acac]/VCz共重合体と略す。)の合成
N−ビニルカルバゾール1.55g(8.0mmol)、実施例6−3で合成したIr(btp)2[1−(StMe)−acac]33.1mg(0.04mmol)、AIBN13mg(0.08mmol)を脱水トルエン40mlに溶解させ、さらに1時間アルゴンを吹き込んだ。この溶液を80℃まで昇温し、重合反応を開始させ、そのまま8時間攪拌した。冷却後、反応液をメタノール250ml中に滴下して重合物を沈殿させ、濾過により回収した。さらに、回収した重合物をクロロホルム25mlに溶解させ、この溶液をメタノール250ml中に滴下して再沈殿させることにより精製した後、60℃で12時間真空乾燥させることにより目的物であるIr(btp)2[1−(StMe)−acac]/VCz共重合体1.12gを得た。
【0178】
得られた共重合体(燐光発光性化合物)のIrの元素分析結果から、Ir錯体(燐光発光性単位)の含有量は0.59mol%であった。また、共重合体のクロロホルム中のGPCから、重量平均分子量はポリスチレン換算で10800であった。
【0179】
(実施例7−4)有機発光素子の試作
実施例7−2で合成したIr(2,4−F−ppy)2(3−ST−pic)/VCz共重合体、実施例7−3で合成したIr(btp)2[1−(StMe)−acac]/VCz共重合体並びにtBu―PBDのクロロホルム溶液を調製した。比率は、Ir(2,4−F−ppy)2(3−ST−pic)/VCz共重合体が66.85質量%、Ir(btp)2[1−(StMe)−acac]/VCz共重合体が3.15質量%、tBu―PBDが30.00質量%とした。
【0180】
この溶液をITOが付いたガラス基板上にスピンコートして厚さ100nmの膜を形成し、その上に真空蒸着法でCaを10nm、Alを100nm蒸着し陰極とした。
【0181】
得られた有機発光素子のITO側に正の、Al側に負の電圧を印加したところ、肉眼で白色の発光が観察された。
【0182】
有機発光素子の発光スペクトルを図4に示す。Ir(2,4−F−ppy)2(3−ST−pic)/VCz共重合体及びIr(btp)2[1−(StMe)−acac]/VCz共重合体に対応する発光ピークがそれぞれ、480nm付近と620nm付近に観測された。色度座標は(0.30、0.35)であった。
【0183】
[付記]
付記(1):
有機発光素子に使用され、燐光を発光する中性の有機高分子の燐光発光性化合物であって、
燐光を発光する繰り返し単位である燐光発光性単位と、
キャリアを輸送する繰り返し単位であるキャリア輸送性単位と、
を含むことを特徴とする燐光発光性化合物。
【0184】
付記(2):
前記燐光発光性単位の繰り返し数m、及び前記キャリア輸送性単位の繰り返し数nは、
m<n
の関係を満たすことを特徴とする付記(1)に記載の燐光発光性化合物。
【0185】
付記(3):
前記燐光発光性単位の繰り返し数m、及び前記キャリア輸送性単位の繰り返し数nは、
0.0001≦m/(m+n)≦0.2
の関係を満たすことを特徴とする付記(2)に記載の燐光発光性化合物。
【0186】
付記(4):
有機溶剤又は水に可溶であることを特徴とする付記(1)乃至(3)のいずれか一つに記載の燐光発光性化合物。
【0187】
付記(5):
重合度が5乃至5000であることを特徴とする付記(1)乃至(4)のいずれか一つに記載の燐光発光性化合物。
【0188】
付記(6):
前記燐光発光性単位の燐光発光性部位、及び/又は前記キャリア輸送性単位のキャリア輸送性部位が側鎖を構成していることを特徴とする付記(1)乃至(5)のいずれか一つに記載の燐光発光性化合物。
【0189】
付記(7):
前記燐光発光性単位の燐光発光性部位、及び/又は前記キャリア輸送性単位のキャリア輸送性部位が主鎖を構成していることを特徴とする付記(1)乃至(5)のいずれか一つに記載の燐光発光性化合物。
【0190】
付記(8):
前記キャリア輸送性単位のキャリア輸送性部位がホール輸送性部位であることを特徴とする付記(1)乃至(7)のいずれか一つに記載の燐光発光性化合物。
【0191】
付記(9):
前記キャリア輸送性単位のキャリア輸送性部位が電子輸送性部位であることを特徴とする付記(1)乃至(7)のいずれか一つに記載の燐光発光性化合物。
【0192】
付記(10):
前記キャリア輸送性単位のキャリア輸送性部位がホール輸送性部位及び電子輸送性部位からなることを特徴とする付記(1)乃至(7)のいずれか一つに記載の燐光発光性化合物。
【0193】
付記(11):
前記燐光発光性単位の燐光発光性部位が遷移金属又は希土類金属の錯体の一価基又は二価基であることを特徴とする付記(1)乃至(10)のいずれか一つに記載の燐光発光性化合物。
【0194】
付記(12):
前記遷移金属又は希土類金属の錯体の一価基は、主鎖に対してスペーサー部分を介して側鎖として結合し、
該スペーサー部分は、ヘテロ原子を有していてもよい炭素数1乃至30の有機基又は炭素原子を有しないヘテロ原子数1乃至10の無機基を含むことを特徴とする付記(11)に記載の燐光発光性化合物。
【0195】
付記(13):
前記キャリア輸送性単位のキャリア輸送性部位がカルバゾールの一価基、第3級アミンの一価基、イミダゾール誘導体の一価基、トリアゾール誘導体の一価基、オキサジアゾール誘導体の一価基、スチレンの二価基、及びフルオレンの二価基からなる基の群、並びに該基を置換基で置換した基の群より、少なくとも1種類以上選択される基を含むことを特徴とする付記(1)乃至(12)のいずれか一つに記載の燐光発光性化合物。
【0196】
付記(14):
所定の1色に発光する1種類又は所定の相互に異なる2色以上に発光する2種類以上の燐光発光性単位を有することを特徴とする付記(1)乃至(13)のいずれか一つに記載の燐光発光性化合物。
【0197】
付記(15):
前記燐光発光性単位は、青色若しくは緑色及び黄色若しくは赤色に発光する2種類からなり、全体として白色に発光することを特徴とする付記(14)に記載の燐光発光性化合物。
【0198】
付記(16):
前記燐光発光性単位は、青色、緑色及び赤色に発光する3種類からなり、全体として白色に発光することを特徴とする付記(14)に記載の燐光発光性化合物。
【0199】
付記(17):
付記(1)乃至(16)のいずれか一つに記載の燐光発光性化合物を含むことを特徴とする燐光発光性組成物。
【0200】
付記(18):
付記(14)に記載の燐光発光性化合物であって相互に異なる色に発光する燐光発光性単位を1又は2種類以上有するものを複数配合してなることを特徴とする燐光発光性組成物。
【0201】
付記(19):
全体として白色に発光することを特徴とする付記(18)に記載の燐光発光性組成物。
【0202】
付記(20):
青色若しくは緑色に発光する燐光発光性単位を有する燐光発光性化合物及び黄色若しくは赤色に発光する燐光発光性単位を有する燐光発光性化合物を配合してなり、全体として白色に発光することを特徴とする付記(18)に記載の燐光発光性組成物。
【0203】
付記(21):
付記(1)乃至(20)のいずれか一つに記載の燐光発光性化合物若しくは燐光発光性組成物及びキャリア輸送性高分子化合物を配合してなることを特徴とする燐光発光性組成物。
【0204】
付記(22):
前記キャリア輸送性高分子化合物は、ホール輸送性高分子化合物であることを特徴とする付記(21)に記載の燐光発光性組成物。
【0205】
付記(23):
前記キャリア輸送性高分子化合物は、電子輸送性高分子化合物であることを特徴とする付記(21)に記載の燐光発光性組成物。
【0206】
付記(24):
付記(1)乃至(20)のいずれか一つに記載の燐光発光性化合物若しくは燐光発光性組成物及びキャリア輸送性低分子化合物を配合してなることを特徴とする燐光発光性組成物。
【0207】
付記(25):
前記キャリア輸送性低分子化合物は、ホール輸送性低分子化合物であることを特徴とする付記(24)に記載の燐光発光性組成物。
【0208】
付記(26):
前記キャリア輸送性低分子化合物は、電子輸送性低分子化合物であることを特徴とする付記(24)に記載の燐光発光性組成物。
【0209】
付記(27):
陽極と陰極に挟まれた一又は複数の有機高分子層を含む有機発光素子において、
前記有機高分子層の少なくとも一層は、付記(1)乃至(26)のいずれか一つに記載の燐光発光性化合物又は燐光発光性組成物を含むことを特徴とする有機発光素子。
【0210】
付記(28):
陽極と陰極に挟まれた一又は複数の有機高分子層を含む有機発光素子において、
陽極と、陽極が設けられる透明基板との間にカラーフィルターが配設され、
前記有機高分子層の少なくとも一層は、付記(15)若しくは(16)に記載の燐光発光性化合物又は付記(19)若しくは(20)に記載の燐光発光性組成物を含むことを特徴とする有機発光素子。
【0211】
付記(29):
前記陽極は、プラスチック基板上に形成されることを特徴とする付記(27)又は(28)に記載の有機発光素子。
【0212】
付記(30):
前記有機高分子層は、インクジェット法又は印刷法により形成されることを特徴とする付記(27)乃至(29)のいずれか一つに記載の有機発光素子。
【0213】
付記(31):
表示画面を有する表示装置において、
前記表示画面の各画素は、付記(27)乃至(30)のいずれか一つに記載の有機発光素子からなり、
前記各画素は、二又はそれ以上のトランジスタを有することを特徴とする表示装置。
【技術分野】
【0001】
本発明は有機発光素子の材料として使用する有機高分子の燐光発光性化合物、燐光発光性組成物、有機発光素子及び表示装置に関する。
【背景技術】
【0002】
フラットパネルディスプレイなどの表示装置やバックライトなどの照明器具として、有機化合物からなる薄膜から電界発光する有機発光素子が、低電圧で高輝度の発光を得られる素子として注目されている。
【0003】
有機発光素子における薄膜材料として、有機溶媒や水に可溶な発光性有機高分子を用いた大面積化の研究開発が、スチレン系やフルオレン系の有機高分子で活発に行われてきている。このような有機高分子の成膜法としては、スピンコート法、印刷法、インクジェト法などの湿式法が用いられている。特にインクジェット法は、フルカラーディスプレイの表示画面の現実的な画素形成法として期待され、すでに小型のフルカラー試作パネルも開示されている。
【0004】
一方、真空蒸着法で成膜される低分子化合物系で、発光の超高効率化の研究が活発に行われており、有機化合物の三重項励起状態からの発光である燐光を活用する白金やイリジウムの有機金属錯体が報告されている。この燐光発光性化合物を利用した有機発光素子の外部発光量子効率は、従来の蛍光発光を利用した素子の5%を凌ぎ、8%と高効率が得られ、ごく最近では、素子の構成を工夫することで15%もの超高効率も達成されている(Appl.Phys.Lett.,77,904(2000))。
【0005】
この低分子燐光化合物を有機高分子に分散したドープ型有機高分子発光素子の研究報告もあり、イリジウム錯体をポリ(N−ビニルカルバゾール)(PVK)にドープした素子では、外部発光量子効率として4%ほどの値が得られ、大幅な改善が認められている(Jpn.J.Appl.Phys,39,L828(2000))。また、ルテニウム錯体を含む有機高分子では、電気化学的な発光が報告されている(J.Mater.Chem.,9,2103(1999))。
【0006】
しかしながら大面積化を低コストで実現することを意図した従来の有機高分子発光素子では、発光効率の点でまだ十分ではない。この原因は、従来の有機高分子の一重項励起状態からの発光である蛍光を利用している為、理論的な外部発光効率として、5%の上限の壁が存在する為である。有機高分子の発光素子は、有機高分子層が有機溶剤や水の溶液から湿式法により成膜できるという大きな特徴を有するが、さらなる発光効率の改善が将来の実用化に対する課題となっている。
【0007】
また有機高分子の発光素子に低分子の燐光発光性化合物を分散させることで、発光の超高効率化が試みられているが、ホストとなる高分子内に分散されている低分子は安定ではなく、長期信頼性に耐え得る長寿命の表示装置は実現できない。
【0008】
従って、有機発光素子の将来の実用化を考慮して、有機溶剤や水の溶液から湿式法で成膜でき、これにより大面積化が低コストで実現でき、かつ安定即ち長寿命であって、超高効率の発光が実現できる新しい有機高分子の発光材料の開発が望まれる。
【先行技術文献】
【非特許文献】
【0009】
【非特許文献1】Appl.Phys.Lett.,77,904(2000)
【非特許文献2】Jpn.J.Appl.Phys,39,L828(2000)
【非特許文献3】J.Mater.Chem.,9,2103(1999)
【発明の概要】
【発明が解決しようとする課題】
【0010】
本発明は、上記問題に鑑みなされたものであり、有機発光素子の材料として使用され、安定で、超高効率の燐光を発光する有機高分子の燐光発光性化合物及び燐光発光性組成物を提供することを目的とする。
【0011】
また本発明は、前記有機高分子の燐光発光性化合物及び燐光発光性組成物を用いた有機発光素子並びにこの有機発光素子を用いた表示装置を提供することを目的とする。
【課題を解決するための手段】
【0012】
(1)に記載の発明は、有機発光素子に使用される燐光を発光する中性の有機高分子の燐光発光性化合物であって、燐光を発光する繰り返し単位である燐光発光性単位と、キャリアを輸送する繰り返し単位であるキャリア輸送性単位と、を含むことを特徴とする。
【0013】
(1)に記載の発明によれば、有機発光素子に使用される燐光を発光する中性の有機高分子の燐光発光性化合物であって、燐光を発光する繰り返し単位である燐光発光性単位と、キャリアを輸送する繰り返し単位であるキャリア輸送性単位と、を含むので、有機発光素子の材料として使用され、安定で、超高効率の燐光を発光する有機高分子の燐光発光性化合物を提供することができる。
【0014】
(2)に記載の発明は、(1)に記載の燐光発光性化合物において、前記燐光発光性単位の繰り返し数m、及び前記キャリア輸送性単位の繰り返し数nは、m<nの関係を満たすことを特徴とする。
【0015】
(2)に記載の発明によれば、前記燐光発光性単位の繰り返し数m、及び前記キャリア輸送性単位の繰り返し数nは、m<nの関係を満たすので、燐光の発光効率をより向上させることができる。
【0016】
(3)に記載の発明は、(2)に記載の燐光発光性化合物において、前記燐光発光性単位の繰り返し数m、及び前記キャリア輸送性単位の繰り返し数nは、0.0001≦m/(m+n)≦0.2の関係を満たすことを特徴とする。
【0017】
(3)に記載の発明によれば、前記燐光発光性単位の繰り返し数m、及び前記キャリア輸送性単位の繰り返し数nは、0.0001≦m/(m+n)≦0.2の関係を満たすので、更に効率良く燐光を発生させることができる。
【0018】
(4)に記載の発明は、(1)乃至(3)のいずれか一つに記載の燐光発光性化合物において、前記燐光発光性化合物が有機溶剤又は水に可溶であることを特徴とする。
【0019】
(4)に記載の発明によれば、前記燐光発光性化合物が有機溶剤又は水に可溶であるので、溶液からの湿式法による成膜が可能となる。
【0020】
(5)に記載の発明は、(1)乃至(4)のいずれか一つに記載の燐光発光性化合物において、前記燐光発光性化合物の重合度が5乃至5000であることを特徴とする。
【0021】
(5)に記載の発明によれば、前記燐光発光性化合物の重合度が5乃至5000であるので、有機溶剤に可溶であり、均一かつ安定な膜を成膜することができる。
【0022】
(6)に記載の発明は、(1)乃至(5)のいずれか一つに記載の燐光発光性化合物において、前記燐光発光性単位の燐光発光性部位、及び/又は前記キャリア輸送性単位のキャリア輸送性部位が前記燐光発光性化合物の側鎖を構成していることを特徴とする。
【0023】
(6)に記載の発明によれば、前記燐光発光性単位の燐光発光性部位、及び/又は前記キャリア輸送性単位のキャリア輸送性部位が前記燐光発光性化合物の側鎖を構成しているので、合成することが容易であり、有機溶剤に溶解し易い燐光発光性化合物とすることができる。
【0024】
(7)に記載の発明は、(1)乃至(5)のいずれか一つに記載の燐光発光性化合物において、前記燐光発光性単位の燐光発光性部位、及び/又は前記キャリア輸送性単位のキャリア輸送性部位が前記燐光発光性化合物の主鎖を構成していることを特徴とする。
【0025】
(7)に記載の発明によれば、前記燐光発光性単位の燐光発光性部位、及び/又は前記キャリア輸送性単位のキャリア輸送性部位が前記燐光発光性化合物の主鎖を構成しているので、錯体部分の運動が抑えられ、高温でも安定な燐光発光性化合物を得ることができる。
【0026】
(8)に記載の発明は、(1)乃至(7)のいずれか一つに記載の燐光発光性化合物において、前記キャリア輸送性単位のキャリア輸送性部位がホール輸送性部位であることを特徴とする。
【0027】
(8)に記載の発明によれば、前記キャリア輸送性単位のキャリア輸送性部位がホール輸送性部位であるので、燐光発光性部位とホール輸送性部位の比率を変えることで、キャリアバランスが良好で発光効率の高い燐光発光性化合物を得ることができる。
【0028】
(9)に記載の発明は、(1)乃至(7)のいずれか一つに記載の燐光発光性化合物において、前記キャリア輸送性単位のキャリア輸送性部位が電子輸送性部位であることを特徴とする。
【0029】
(9)に記載の発明によれば、前記キャリア輸送性単位のキャリア輸送性部位が電子輸送性部位であるので、燐光発光性部位と電子輸送性部位の比率を変えることで、キャリアバランスが良好で発光効率の高い燐光発光性化合物を得ることができる。
【0030】
(10)に記載の発明は、(1)乃至(7)のいずれか一つに記載の燐光発光性化合物において、前記キャリア輸送性単位のキャリア輸送性部位がホール輸送性部位及び電子輸送性部位からなることを特徴とする。
【0031】
(10)に記載の発明によれば、(1)乃至(7)のいずれか一つに記載の燐光発光性化合物において、前記キャリア輸送性単位のキャリア輸送性部位がホール輸送性部位及び電子輸送性部位からなるので、発光性、ホール輸送性及び電子輸送性の全ての機能を備え、他の有機材料を配合することなく、熱的に安定で長寿命である。
【0032】
(11)に記載の発明は、(1)乃至(10)のいずれか一つに記載の燐光発光性化合物において、前記燐光発光性単位は、燐光発光性部位が遷移金属又は希土類金属の錯体の一価基又は二価基であることを特徴とする。
【0033】
(11)に記載の発明によれば、前記燐光発光性単位の燐光発光性部位が遷移金属又は希土類金属の錯体の一価基又は二価基であるので、燐光の発光効率が高い燐光発光性部位とすることができる。
【0034】
(12)に記載の発明は、(11)に記載の燐光発光性化合物において、前記遷移金属又は希土類金属の錯体の一価基は、主鎖に対してスペーサー部分を介して側鎖として結合し、該スペーサー部分は、ヘテロ原子を有していてもよい炭素数1乃至30の有機基又は炭素原子を有しないヘテロ原子数1乃至10の無機基を含むことを特徴とする。
【0035】
(12)に記載の発明によれば、前記遷移金属又は希土類金属の錯体の一価基は、主鎖に対してスペーサー部分を介して側鎖として結合し、該スペーサー部分は、ヘテロ原子を有していてもよい炭素数1乃至30の有機基又は炭素原子を有しないヘテロ原子数1乃至10の無機基を含むので、錯体部分の運動の自由度が高まり、有機溶剤への溶解性が高められ、均一な薄膜を塗布法で作製できることで、安定で、高い発光効率を得ることができる。
【0036】
(13)に記載の発明は、(1)乃至(11)のいずれか一つに記載の燐光発光性化合物において、前記キャリア輸送性単位のキャリア輸送性部位がカルバゾールの一価基、第3級アミンの一価基、イミダゾール誘導体の一価基、トリアゾール誘導体の一価基、オキサジアゾール誘導体の一価基、スチレンの二価基、及びフルオレンの二価基からなる基の群、並びに該基を置換基で置換した基の群より、少なくとも1種類以上選択される基を含むことを特徴とする。
【0037】
(13)に記載の発明によれば、前記キャリア輸送性単位は、キャリア輸送性部位がカルバゾールの一価基、第3級アミンの一価基、イミダゾール誘導体の一価基、トリアゾール誘導体の一価基、オキサジアゾール誘導体の一価基、スチレンの二価基、及びフルオレンの二価基からなる基の群、並びに該基を置換基で置換した基の群より、少なくとも1種類以上選択される基を含むので、キャリアを輸送する性能が高いキャリア輸送性部位とすることができる。
【0038】
(14)に記載の発明は、(1)乃至(13)のいずれか一つに記載の燐光発光性化合物において、所定の1色に発光する1種類又は所定の相互に異なる2色以上に発光する2種類以上の燐光発光性単位を有することを特徴とする。
【0039】
(14)に記載の発明によれば、所定の1色に発光する1種類又は所定の相互に異なる2色以上に発光する2種類以上の燐光発光性単位を有するので、任意に選択した単色又は複数の色に好適に発光することができる。
【0040】
(15)に記載の発明は、(14)に記載の燐光発光性化合物において、前記燐光発光性単位は、青色若しくは緑色及び黄色若しくは赤色に発光する2種類からなり、全体として白色に発光することを特徴とする。
【0041】
(15)に記載の発明によれば、前記燐光発光性単位は、青色若しくは緑色及び黄色若しくは赤色に発光する2種類からなり、全体として白色に発光するので、白色の色に好適に発光することができる。
【0042】
(16)に記載の発明は、(14)に記載の燐光発光性化合物において、前記燐光発光性単位は、青色、緑色及び赤色に発光する3種類のからなり、全体として白色に発光することを特徴とする。
【0043】
(16)に記載の発明によれば、前記燐光発光性単位は、青色、緑色及び赤色に発光する3種類からなり、全体として白色に発光するので、白色の色に好適に発光することができる。
【0044】
(17)に記載の発明は、(1)乃至(16)のいずれか一つに記載の燐光発光性化合物を含むことを特徴とする燐光発光性組成物である。
【0045】
(17)に記載の発明によれば、(1)乃至(16)のいずれか一つに記載の燐光発光性化合物を含むので、好適な燐光発光性組成物を提供することができる。
【0046】
(18)に記載の発明は、(14)に記載の燐光発光性化合物であって相互に異なる色に発光する燐光発光性単位を1又は2種類以上有するものを複数配合してなることを特徴とする燐光発光性組成物である。
【0047】
(18)に記載の発明によれば、(14)に記載の燐光発光性化合物であって相互に異なる色に発光する燐光発光性単位を1又は2種類以上有するものを複数配合してなるので、好適な燐光発光性組成物を提供することができる。
【0048】
(19)に記載の発明は、(18)に記載の燐光発光性組成物において、全体として白色に発光することを特徴とする。
【0049】
(19)に記載の発明によれば、全体として白色に発光するので、好適な燐光発光性組成物を提供することができる。
【0050】
(20)に記載の発明は、(18)に記載の燐光発光性組成物において、青色若しくは緑色に発光する燐光発光性単位を有する燐光発光性化合物及び黄色若しくは赤色に発光する燐光発光性単位を有する燐光発光性化合物を配合してなり、全体として白色に発光することを特徴とする。
【0051】
(20)に記載の発明によれば、青色若しくは緑色に発光する燐光発光性単位を有する燐光発光性化合物及び黄色若しくは赤色に発光する燐光発光性単位を有する燐光発光性化合物を配合してなり、全体として白色に発光するので、好適な燐光発光性組成物を提供することができる。
【0052】
(21)に記載の発明は、(1)乃至(20)のいずれか一つに記載の燐光発光性化合物若しくは燐光発光性組成物及びキャリア輸送性高分子化合物を配合してなることを特徴とする燐光発光性組成物である。
【0053】
(21)に記載の発明によれば、燐光発光性組成物が(1)乃至(20)のいずれか一つに記載の燐光発光性化合物若しくは燐光発光性組成物及びキャリア輸送性高分子化合物を配合してなるので、安定で長寿命である。また、燐光発光性化合物及びキャリア輸送性高分子化合物の比率を変えることで、キャリアバランスが良好で発光効率の高い燐光発光性組成物を提供することができる。
【0054】
(22)に記載の発明は、(21)に記載の燐光発光性組成物において、前記キャリア輸送性高分子化合物は、ホール輸送性高分子化合物であることを特徴とする。
【0055】
(22)に記載の発明によれば、前記キャリア輸送性高分子化合物は、ホール輸送性高分子化合物であるので、安定で長寿命である。また、燐光発光性化合物及びホール輸送性高分子化合物の比率を変えることで、キャリアバランスが良好で発光効率の高い燐光発光性組成物を提供することができる。
【0056】
(23)に記載の発明は、(21)に記載の燐光発光性組成物において、前記キャリア輸送性高分子化合物は、電子輸送性高分子化合物であることを特徴とする。
【0057】
(23)に記載の発明によれば、前記キャリア輸送性高分子化合物は、電子輸送性高分子化合物であるので、安定で長寿命である。また、燐光発光性化合物及び電子輸送性高分子化合物の比率を変えることで、キャリアバランスが良好で発光効率の高い燐光発光性組成物を提供することができる。
【0058】
(24)に記載の発明は、(1)乃至(20)のいずれか一つに記載の燐光発光性化合物及びキャリア輸送性低分子化合物を配合してなることを特徴とする燐光発光性組成物である。
【0059】
(24)に記載の発明によれば、燐光発光性組成物が(1)乃至(20)のいずれか一つに記載の燐光発光性化合物及びキャリア輸送性低分子化合物を配合してなるので、安定で長寿命である。また、燐光発光性化合物及びキャリア輸送性低分子化合物の比率を変えることで、キャリアバランスが良好で発光効率の高い燐光発光性組成物を提供することができる。
【0060】
(25)に記載の発明は、(24)に記載の燐光発光性組成物において、前記キャリア輸送性低分子化合物は、ホール輸送性低分子化合物であることを特徴とする。
【0061】
(25)に記載の発明によれば、前記キャリア輸送性低分子化合物は、ホール輸送性低分子化合物であるので、安定で長寿命である。また、燐光発光性化合物及びホー輸送性低分子化合物の比率を変えることで、キャリアバランスが良好で発光効率の高い燐光発光性組成物を提供することができる。
【0062】
(26)に記載の発明は、(24)に記載の燐光発光性組成物において、前記キャリア輸送性低分子化合物は、電子輸送性低分子化合物であることを特徴とする。
【0063】
(26)に記載の発明によれば、前記キャリア輸送性低分子化合物は、電子輸送性低分子化合物であるので、安定で長寿命である。また、燐光発光性化合物及び電子輸送性低分子化合物の比率を変えることで、キャリアバランスが良好で発光効率の高い燐光発光性組成物を提供することができる。
【0064】
(27)に記載の発明は、陽極と陰極に挟まれた一又は複数の有機高分子層を含む有機発光素子において、前記有機高分子層の少なくとも一層は、(1)乃至(26)のいずれか一つに記載の燐光発光性化合物又は燐光発光性組成物を含むことを特徴とする。
【0065】
(27)に記載の発明によれば、前記有機高分子層の少なくとも一層は、(1)乃至(26)のいずれか一つに記載の燐光発光性化合物又は燐光発光性組成物を含むので、安定で、超高効率の燐光を発光する有機発光素子を提供することができる。
【0066】
(28)に記載の発明は、陽極と陰極に挟まれた一又は複数の有機高分子層を含む有機発光素子において、陽極と、陽極が設けられる透明基板との間にカラーフィルターが配設され、前記有機高分子層の少なくとも一層は、(15)若しくは(16)に記載の燐光発光性化合物又は(19)若しくは(20)記載の燐光発光性組成物を含むことを特徴とする。
【0067】
(28)に記載の発明によれば、陽極と、陽極が設けられる透明基板との間にカラーフィルターが配設され、前記有機高分子層の少なくとも一層は、(15)若しくは(16)に記載の燐光発光性化合物又は(19)若しくは(20)に記載の燐光発光性組成物を含むので、安定で、超高効率のカラー光を発光する有機発光素子を提供することができる。
【0068】
(29)に記載の発明は、(27)又は(28)に記載の有機発光素子において、前記陽極は、プラスチック基板上に形成されることを特徴とする。
【0069】
(29)に記載の発明によれば、前記陽極は、プラスチック基板上に形成されるので、柔軟な有機発光素子を提供することができる。
【0070】
(30)に記載の発明は、(27)乃至(29)に記載の有機発光素子において、前記有機高分子層は、インクジェット法又は印刷法により形成されることを特徴とする。
【0071】
(30)に記載の発明によれば、前記有機高分子層は、インクジェット法又は印刷法により形成されるので、大面積の有機高分子層を簡便に製造することができる。
【0072】
(31)に記載の発明は、表示画面を有する表示装置において、前記表示画面の各画素は、(27)乃至(30)のいずれか一つに記載の有機発光素子からなり、前記各画素は、二又はそれ以上のトランジスタにより駆動されることを特徴とする。
【0073】
(31)に記載の発明によれば、表示画面の各画素は、(27)乃至(30)のいずれか一つに記載の有機発光素子からなり、前記各画素は、二又はそれ以上のトランジスタを有するので、アクティブマトリックス方式の表示装置を提供することができる。
【発明の効果】
【0074】
本発明によれば、有機発光素子の材料として使用され、安定で、超高効率の燐光を発光する有機高分子の燐光発光性化合物を提供する。また本発明は、前記有機高分子の燐光発光性化合物を用いた有機発光素子を提供する。
【図面の簡単な説明】
【0075】
【図1】本発明の有機高分子の燐光発光性化合物の典型的な構造を説明する図である。
【図2】本発明の有機発光素子の積層構造を説明する図である。
【図3】実施例6−3で作製した有機発光素子の発光スペクトルを示す図である。
【図4】実施例7−2で作製した有機発光素子の発光スペクトルを示す図である。
【発明を実施するための形態】
【0076】
次に、本発明の実施の形態について図面と共に説明する。
【0077】
本発明は、有機発光素子の材料として使用する有機高分子の燐光発光性化合物の発明であって、燐光を発光する繰り返し単位(燐光発光性単位と呼ぶ)と電子やホールなどのキャリアを輸送する繰り返し単位(キャリア輸送性単位と呼ぶ)とを含む。本発明の有機高分子の燐光発光性化合物は、燐光発光性単位とキャリア輸送性単位とが高分子鎖中に不規則に配列されるランダム共重合体であってもよく、また非イオン性、即ち中性の高分子である。本発明の燐光発光性化合物では、燐光発光性単位とキャリア輸送単位とが高分子鎖に連結しており、燐光発光性単位の凝集は抑制される為、安定即ち長寿命であり、かつ蛍光ではなく燐光発光性単位を有する為、超高効率の発光を実現できる。
【0078】
本発明の燐光発光性化合物の構造は、典型的には図1に示すように、燐光発光性単位とキャリア輸送性単位とを形成する単量体の種類によって、(a)燐光発光性部位とキャリア輸送性部位とが共に高分子の主鎖内にある場合、(b)燐光発光性部位は高分子の側鎖にあり、キャリア輸送性部位は高分子の主鎖内にある場合、(c)燐光発光性部位は高分子の主鎖内にあり、キャリア輸送性部位は高分子の側鎖にある場合、(d)燐光発光性部位とキャリア輸送性部位とが共に高分子の側鎖にある場合、の四通りがある。ただし燐光発光性部位とは、燐光発光性単位中で燐光を発光する機能を有する部分を示し、キャリア輸送性部位とは、キャリア輸送性単位中で、キャリアを輸送する機能を有する部分を表す。
【0079】
ここで、燐光発光性部位、キャリア輸送性部位の少なくとも一方は、燐光発光性化合物の高分子の主鎖に、側鎖として結合していることが望ましい(図1(b)〜(d))。この場合には、燐光発光性化合物を合成することが容易であり、また有機溶剤に溶解し易い燐光発光性化合物とすることができる。
【0080】
さらに燐光の発光効率が高い燐光発光性部位とする為に、燐光発光性部位は、遷移金属又は希土類金属の錯体の一価基又は二価基であることが望ましい。
【0081】
燐光発光性部位の具体例としては
【0082】
【化1】

に示す群から選択される配位子を含む、遷移金属錯体の一価基若しくは二価基又は希土類金属錯体の一価基若しくは二価基がある。上記の遷移金属錯体に使用される遷移金属は、周期表の第一遷移元素系列すなわち原子番号21のScから30のZnまで、第二遷移元素系列すなわち原子番号39のYから48のCdまで、第三遷移元素系列すなわち原子番号72のHfから80のHgまで、を含む。また上記の希土類金属錯体に使用される希土類金属は、周期表のランタノイド系列すなわち原子番号57のLaから71のLuまでを含む。なお配位子は、上記の配位子と異なる配位子であってもよい。
【0083】
キャリアを輸送する性能の高いキャリア輸送性部位の具体例は、本発明の有機高分子の燐光発光性化合物がホール輸送性高分子の場合と電子輸送性高分子の場合とで異なる。
【0084】
ホール輸送性高分子の場合には、
【0085】
【化2】

に示す、第3級アミンであるカルバゾール(HT−1)、トリフェニルアミン(HT−2)、それらの多量体(HT−3)などの一価基が代表的であり、これらの一価基は、置換基で置換されていてもよい。
【0086】
電子輸送性高分子の場合では、
【0087】
【化3】

に示すオキサジアゾール誘導体(ET−1、2)、トリアゾール誘導体(ET−4)、又はイミダゾール誘導体(ET−3)の一価基が挙げられる。これら誘導体の一価基の芳香環は、置換基で置換されていてもよい。また、
【0088】
【化4】

に示すような、蛍光性高分子においてホールの輸送能力を有し主鎖が共役系となる高分子を形成する、置換基で置換された、チオフェンの二価基(TF)、ベンゼンの二価基(PP)、スチレンの二価基(PV)、又はフルオレンの二価基(FO)を用いてもよい。ここで置換基Rは、アルキル基又はアルコキシ基を表す。本発明の燐光発光性化合物において、これらの二価基は燐光発光性部位として、高分子の主鎖に組み込まれる。
【0089】
上述の繰り返し単位を含む共重合高分子の例としては、
【0090】
【化5】

に示すような、主鎖であるビニル構造の側鎖に、燐光発光性部位のイリジウム錯体又は白金錯体の一価基と、ホール(キャリア)輸送性部位としてのカルバゾール、又はその誘導体の一価基とを有する高分子(P1、P3、P4)があり、また電子(キャリア)輸送性部位として、側鎖にオキサジアゾール誘導体の一価基を使用した高分子(P2)がある。これら共重合高分子は、ビニル化合物から反応開始剤を使ったラジカル共重合で合成できる。イリジウム錯体の配位子の一つをビニル基で置換した単量体は
【0091】
【化6】

のように、イリジウム錯体の配位子置換反応の途中で、ビニル基で置換されたフェニルピリジンを反応させて生成し単離する。
【0092】
さらに、
【0093】
【化7】

に示すような、イリジウム錯体の配位子の一つがアセチルアセトン又はピコリン酸であって、このアセチルアセトン等を介してイリジウム錯体が高分子の主鎖に結合した構造の共重合高分子もある。ここで、化学式中の*印は、高分子の化学式中に示した置換基Rに接続する部分(結合)であることを示す。
【0094】
また、上記の共重合高分子のように、燐光発光性部位としてのイリジウム錯体などの遷移金属錯体部分あるいは希土類金属錯体部分が高分子の主鎖に対して側鎖として結合する場合には、遷移金属錯体あるいは希土類金属錯体の一価基と高分子の主鎖との間にスペーサー部分を介在させることが好ましい。
【0095】
スペーサー部分とは、主鎖を構成する高分子化合物における置換可能な原子が結合している多価原子と、燐光発光部位の元となる低分子化合物における置換可能な原子が結合している多価原子との間を結合する部分をいう。このようなスペーサー部分は、ヘテロ原子を有していてもよい炭素数1乃至30の有機基又は炭素原子を有しないヘテロ原子数1乃至10の無機基を含む構造であることが好ましい。
【0096】
スペーサー部分として、例えば、炭素数1乃至20のアルキレン基や、
【0097】
【化8】

【0098】
【化9】

に示す、(S−1)から(S−15)のような連結基などを挙げることができるが、これらに限定されるものではない。
【0099】
なお、(S−1)から(S−15)において、R1、R2及びR3はそれぞれ独立にメチレン基又は置換若しくは未置換のフェニレン基を示し、k、m及びnはそれぞれ独立に0、1、又は2である。
【0100】
また、燐光発光性部位及びキャリア輸送性部位を側鎖ではなく、主鎖に組み込んだ構造の共重合高分子もある。
【0101】
【化10】

に示すように、置換された、チオフェン、ベンゼン、フルオレンの二価基とイリジウム錯体の二価基とが重合して主鎖を形成している。
【0102】
以上、共重合高分子の例として、ホール輸送性部位あるいは電子輸送性部位のうちのいずれか一方と燐光性発光部位との共重合体を挙げたが、本発明の燐光発光性化合物は、ホール輸送性部位、電子輸送性部位及び燐光性発光部位の共重合体であってもよい。この場合、ホール輸送性部位、電子輸送性部位及び燐光性発光部位は、それぞれ独立に共重合体の主鎖を構成していてもよく、また、側鎖を構成していてもよい。
【0103】
燐光発光性単位の繰り返し数をm、キャリア輸送性単位の繰り返し数をnとすると、本発明においては、燐光の発光効率を向上させる為には、m<nの関係、即ち燐光発光性単位の繰り返し数がキャリア輸送性単位の繰り返し数より小さいこと望ましい。ただしm、nは両方とも、1又はそれ以上の自然数である。逆にm≧nの場合には、濃度消光により燐光の発光が抑制されてしまう。なお燐光の超高効率の発光を実現する為には、燐光発光性単位及びキャリア輸送性単位の総数の内、燐光発光性単位の繰り返し数の割合は0.2以下が好ましい。また、燐光発光性単位の繰り返し数の割合が小さすぎると、燐光発光部性位が少なくなって発光効率が落ちる。この為、燐光発光性単位の繰り返し数の割合は、少なすぎてはならず、0.0001以上であることが望ましい。即ち、
0.0001≦m/(m+n)≦0.2
であることが望ましい。
【0104】
本発明の燐光発光性化合物は、1色に発光する1種類の燐光発光性単位を有してもよく、又、相互に異なる2色以上に発光する2種類以上の燐光発光性単位を有してもよい。
【0105】
本発明の燐光発光性化合物は、相互に異なる2色以上に発光する2種類以上の燐光発光性単位を導入することにより、1色に発光する1種類の燐光発光性単位のみを有する燐光発光性化合物では得られない発光色を得ることができる。
【0106】
例えば、それぞれ青色、緑色及び赤色に発光する3種類の燐光発光性単位を適当な比率で1つの化合物に導入することにより、白色発光用の燐光発光性化合物が得られる。ここで、青色、緑色又は赤色に発光する燐光発光性単位とは、それぞれ単独に用いて1つの燐光発光性化合物を形成した場合に、フォトルミネッセンスの発光色がそれぞれ青色、緑色又は赤色を示すものか、又はさらに後述の有機発光素子を作製して発光させた場合に、その発光色がそれぞれ青色、緑色又は赤色を示すものをいう。
【0107】
なお、ここでいう発光色の青色は、発光スペクトルにおけるピーク波長が400〜490nmであるものをいう。同様に、緑色は、ピーク波長が490〜570nmであるものをいい、赤色は、ピーク波長が570〜700nmであるものをいう。
【0108】
また、白色発光用の燐光発光性化合物は、それぞれ青色若しくは緑色および黄色若しくは赤色に発光する2種類の燐光発光性単位を適当な比率で1つの化合物に導入することによっても得られる。
【0109】
なお、ここでいう発光色の青色若しくは緑色は発光スペクトルにおけるピーク波長が400〜570nmであるものをいい、同様に、黄色若しくは赤色はピーク波長が570〜700nmであるものをいう。
【0110】
また、白色発光用の燐光発光性材料は、上記のような単一の燐光発光性化合物としてだけではなく、相互に異なる発光色を示す1種類以上の燐光発光性単位を有する複数の燐光発光性化合物を配合した組成物としても得ることができる。
【0111】
例えば、青色に発光する燐光発光性単位及び緑色に発光する燐光発光性単位の2種類の燐光発光性単位を有する第1の燐光発光性化合物と、赤色に発光する1種類の燐光発光性単位を有する第2の燐光発光性化合物を配合した燐光発光性組成物、それぞれ青色、緑色及び赤色に発光する燐光発光性単位を1種類ずつ有する3つの燐光発光性化合物を配合した燐光発光性組成物、それぞれ青色および橙色に発光する燐光発光性単位を1種類ずつ有する2つの燐光発光性化合物を配合した燐光発光性組成物等を挙げることができるが、何らこれらに限定されるものではない。
【0112】
本発明の有機高分子の燐光発光性化合物は、湿式法で成膜できることが望ましい。湿式法では燐光発光性化合物を溶液とするので、有機溶剤又は水に可溶であることが必要である。特に燐光発光性化合物を有機溶媒に可溶とする為には、燐光発光性部位にアルキル基又はアルコキシ基などの比較的長い炭素鎖で置換した金属錯体を使用することが望ましい。
【0113】
本発明の有機高分子の燐光発光性化合物は、重合度が5乃至5000であることが好ましい。重合度が5より小さいと、均一な膜の形成が困難になり、また結晶化が起こり易く膜の安定性が悪くなる。また重合度が5000より大きい有機高分子は、生成が困難であり、有機溶剤に溶けにくくなる。従って重合度を5乃至5000とすることで、均一かつ安定な膜を成膜することができる。
【0114】
つぎに、本発明の有機発光素子について説明する。
【0115】
本発明の有機発光素子は、以上説明した本発明の有機高分子の燐光発光性化合物を発光材料として用いることができる。
【0116】
また、本発明の有機発光素子は、本発明の燐光発光性化合物のキャリア輸送性をさらに高めるために、本発明の燐光発光性化合物とキャリア輸送性化合物とを配合した組成物を発光材料として用いることができる。
【0117】
すなわち、本発明の燐光発光性化合物がホール輸送性の場合は電子輸送性化合物を混合することができ、また、本発明の燐光発光性化合物が電子輸送性の場合はホール輸送性化合物を混合することができる。このとき、電子輸送性化合物及びホール輸送性化合物は、それぞれ低分子化合物であってもよく、また、高分子化合物であってもよい。
【0118】
本発明の燐光発光性化合物に配合する低分子のホール輸送性化合物としては、TPD(N,N'−ジフェニル−N,N'−(3−メチルフェニル)−1,1'−ビフェニル−4,4'−ジアミン)、α−NPD(4,4'−ビス〔N−(1−ナフチル)−N−フェニルアミノ〕ビフェニル)、m−MTDATA(4,4',4"−トリス(3−メチルフェニルフェニルアミノ)トリフェニルアミン)などのトリフェニルアミン誘導体、CBP(4,4'−N−N'−ジカルバゾール−ビフェニル)などのカルバゾール誘導体をはじめとする既知のホール輸送材料が使用できるが、これらに限定されるものではない。
【0119】
また、本発明の燐光発光性化合物に配合する高分子のホール輸送性化合物としては、ポリビニルカルバゾール、トリフェニルアミン系の低分子化合物に重合性官能基を導入して高分子化したもの、例えば、特開平8−157575号公報に開示されているトリフェニルアミン骨格の高分子化合物などが使用できるが、これらに限定されるものではない。
【0120】
一方、本発明の燐光発光性化合物に配合する低分子の電子輸送性化合物としては、Alq3(トリスアルミニウムキノリノール)などのキノリノール誘導体金属錯体、オキサジアゾール誘導体、トリアゾール誘導体、イミダゾール誘導体、トリアジン誘導体などが使用できるが、これらに限定されるものではない。
【0121】
また、本発明の燐光発光性化合物に配合する高分子の電子輸送性化合物としては、上記の低分子の電子輸送性化合物に重合性官能基を導入して高分子化したもの、例えば、特開平10−1665号公報に開示されているポリPBDなどが使用できるが、これらに限定されるものではない。
【0122】
また、成膜して得られる膜の物性などをさらに改良する目的で、本発明の燐光発光性化合物あるいは燐光発光性組成物に、発光特性には関与しない高分子化合物を混合して組成物とし、これを発光材料として用いることもできる。例えば、膜に柔軟性を付与するためにPMMA(ポリメチルメタクリレート)を混合することができるが、これに限定されるものではない。
【0123】
本発明はまた、少なくとも一層に上述の有機高分子の燐光発光性化合物を含むことを特徴とする有機発光素子を提供する。本発明の有機発光素子は、燐光発光性化合物の燐光発光性単位とキャリア輸送単位とが高分子鎖に連結している為、有機発光素子の連続駆動や過熱による燐光発光性化合物の燐光発光性単位の凝集が抑制され、安定な表示装置を提供でき、かつ蛍光ではなく燐光発光性単位を有する為、超高効率の発光を実現できる。
【0124】
本発明の燐光発光性化合物を用いた有機発光素子は、図2(a)に示すように、本発明の燐光発光性化合物を一対の陽極と陰極で挟んだ一層構成でも機能するが、燐光の発光効率を高める為には、図2(b)のような電子輸送性高分子を用いた電子輸送層との積層構成、又は図2(c)のようなホール輸送性高分子を用いたホール輸送層との積層構成が望ましい。これらのキャリア(電子、ホール)輸送性高分子としては
【0125】
【化11】

のような第3級アミン及びその誘導体(HTP1、2)、オキサジアゾール誘導体(ETP1、2)、イミダゾール誘導体(ETP3)の基を含む高分子、ポリパラフェニレンビニレン(CP1)、ポリジアルキルフルオレン(CP2)などが挙げられる。
【0126】
図2(b)の積層構成を有する発光素子において、燐光発光性化合物として前記P1の高分子を用い、電子輸送性高分子としてオキサジアゾール誘導体の基を含む高分子ETP2を用いた有機発光素子で、発光機構を簡単に説明する。金属陰極から注入された電子は、電子輸送層を通じて輸送され、燐光発光性化合物P1の層へ注入され、一方、ITO陽極から注入されたホールは燐光発光性化合物P1のカルバゾール環を含む繰り返し単位を伝導する。注入された電子がカルバゾール環上でホールと再結合することによって、カルバゾール環の繰り返し単位の励起状態が生成し、次にイリジウム錯体の繰り返し単位ヘエネルキー移動する。その結果、イリジウム錯体の繰り返し単位において励起三重項状態が形成され、エネルギー緩和により燐光の発光が観察される。ただし、注入されたホールと電子の再結合がイリジウム錯体の繰り返し単位上で起こる機構も考えられる。
【0127】
陽極は、一般には透明基板であるガラス基板上に形成され、発光透過性材料を用いる。ITO(酸化スズインジウム)、酸化インジウム、酸化スズ、又は酸化インジウム酸化亜鉛合金が好ましい。金、白金、銀、マグネシウムなどの金属の薄膜を用いてもよい。ポリアニリン、ポリチオフェン、ポリピロール、及びそれらの誘導体からなる導電性高分子も使用可能である。
【0128】
陰極には、仕事関数の低いLi、Kなどのアルカり金属やMg、Caなどのアルカリ土類金属を用いるのが、電子注入効率の観点から好ましい。また、これらの金属と比較して化学的に安定なAlなどを用いることも望ましい。電子注入効率と化学的安定性とを両立させるために2種以上の材料を含む層にしてもよい。それらの材料については特開平2−15595、特開平5−121172などに記載されており、セシウム、カルシウム、ストロンチウム、バリウムなどのアルカリ金属やアルカリ土類金属の薄層(0.01〜10μm程度)をAl層の下に(陰極側を上側、陽極側を下側とする)挟んでもよい。
【0129】
陽極と陰極は、真空蒸着法、スパッタリング法、イオンプレーティング法などの公知の方法で形成できる。また、電極(特に発光透過性材料の電極)のパターニングは、フォトリソグラフィーなどによる化学的エッチング、レーザーなどを用いた物理的エッチングなどにより行うことが好ましい。また、マスクを重ねて真空蒸着やスパッタリングなどを行なってパターニングしてもよい。
【0130】
本発明において、透明基板として通常のガラス基板の他にプラスチック基板を使用することができる。基板として用いるプラスチックは耐熱性、寸法安定性、耐溶剤性、電気絶縁性、加工性、低通気性及び低吸湿性に優れていることが必要である。このようなプラスチックとしては、ポリエチレンテレフタレート、ポリエチレンナフタレート、ポリスチレン、ポリカーボネート、ポリエーテルスルホン、ポリアリレート、ポリイミドなどが挙げられる。これら柔軟な基板を用いることで、柔軟な有機発光素子を提供できる。基板の電極側の面、電極と反対側の面、又はその両方の面に透湿防止層(ガスバリア層)を設置することが好ましい。透湿防止層を構成する材料としては窒化ケイ素や酸化ケイ素などの無機物が好ましい。透湿防止層は高周波スパッタリング法などにより成膜できる。また、必要に応じてハードコート層やアンダーコート層を設けてもよい。
【0131】
燐光発光性化合物、電子輸送性高分子、ホール輸送性高分子などの有機高分子層の成膜法としては、溶液からのスピンコート法が一般的であり、そのほかにも大面積の有機高分子層を簡便に製造することができる方法として印刷法、インクジェット法、スプレー法、ディスペンサー法などを挙げることができるが、何らこれらに限定されるものではない。これにより表示画面の各画素が本発明の有機発光素子からなる表示装置において、画素ごとに有機高分子を塗り別けることができ、表示装置の表示画面をフルカラー化することができる。特にインクジェット法は、この画素ごとの塗り別け、表示画面のフルカラー化を容易に行うことができる。
【0132】
表示画面の各画素が本発明の有機発光素子からなる表示装置において、画素ごとに二個以上のトランジスタを配置し、これらのトランジスタによる画素のアドレスと駆動によって、アクティブマトリックス方式の表示装置を提供できる。最低限必要な二個のトランジスタの内、一個は画素を構成する有機発光素子に電流を注入する駆動用トランジスタであり、他の一個は、この駆動用トランジスタへの電流注入のオン/オフを制御する切り換え用トランジスタである。さらにこれらのトランジスタを有機トランジスタにすることで、プラスチック基板への適用も可能となる。
【0133】
[実施例]
以下に本発明の燐光発光性化合物の実施例、及びその合成法を説明する。これらの実施例は、説明の為の単なる例示であって、本発明は、これらの実施例に制限されない。
【0134】
(実施例1−1)燐光発光性化合物の単量体:[2−(3−メタクリルフェニル)ピリジン]ビス[2−(3−プロピオニルフェニル)ピリジン]イリジウム(III)(以下、Ir(MPPy)(PrCOPPy)2と略す)の合成
まず、スキーム(1)の常法に従い2−(3−メトキシフェニル)ピリジン(MeOPPy)を合成した。
【0135】
【化12】

具体的には、3−ブロモアニソール8.98g(48mmol)を脱水テトラヒドロフラン(THF)60ml中でMgを用いて3−メトキシフェニルマグネシウムブロミドを合成した。さらに、2−ブロモピリジン6.32g(40mmo1)、[1,2−ビス(ジフェニルホスフィノ)エタン]ジクロロニッケル(0)(Ni(dppe)Cl2)0.74gを脱水THF40mlに溶解した溶液に、先に得られた3−メトキシフェニルマグネシウムブロミドを添加し、室温で12時間反応させることにより無色透明の2−(3−メトキシフェニル)ピリジン(MeOPPy)を6.03g(32.4mmol)得た。同定はCHN元素分析、NMR、IRで行った。
【0136】
次に、スキーム(1)で得られたMeOPPyとトリス(アセチルアセトナト)イリジウム(III)(Ir(acac)3)を、スキーム(2)に示すように、高温で反応させ、トリス(2−(3−メトキシフェニル)ピリジン)イリジウム(III)(Ir(MeOPPy)3)を合成した。
【0137】
【化13】

具体的には、MeOPPy0.50g(2.70mmol)とIr(acac)30.20g(0.41mmol)をグリセロール20ml中、250℃で9時間反応させ、カラムで精製することにより、蛍光性黄色粉末としてIr(MeOPPy)30.020g(0.027mmol)を得た。同定はCHN及びIr元素分析、IRで行った。
【0138】
スキーム(2)で得られたIr(MeOPPy)3を、スキーム(3)の常法に従い、塩酸水溶液中でMeO基を加水分解してOH基とし、粉末のトリス(2−(3−ヒドロキシフェニル)ピリジン)イリジウム(III)(Ir(HOPPy)3)を得た。
【0139】
【化14】

スキーム(3)で得られたIr(HOPPy)3を、スキーム(4)に従い、メタクリル酸クロリドとモル比1:1で反応させることにより、OH基の一部分をメタクリル化させIr(MPPy)(HOPPy)2が主成分となる錯体を合成した。次いで残りのOH基をプロピオン酸クロリド(PrCOCl)と反応させ、Ir(MPPy)(PrCOPPy)2が主成分となる錯体を得た。
【0140】
【化15】

具体的には、反応容器に脱水THF8ml、Ir(HOPPy)30.706g(1mmol)、脱酸剤としてトリエチルアミン0.600g(5.9mmo1)を入れた後、メタクリル酸クロリド0.106g(1mmol)を脱水THF4mlに溶解した溶液を30分かけて滴下し、20℃で5時間反応させた。この反応溶液に更にプロピオン酸クロリド0.370g(4mmol)を脱水THF4mlに溶解した溶液を30分かけて滴下し、20℃で5時間反応させることにより残りのOH基を反応させ、トリエチルアミンの塩酸塩を濾別した。濾液の溶媒を蒸発乾固し、得られた固形成分はクロロホルム/メタノール混合溶媒にて再結晶を2回行うことによって精製し、目的とするIr(MPPy)(PrCOPPy)20.523g(0.59mmol)を粉末として得た。この錯体の同定はCHN及びIrの元素分析、IRで行った。
【0141】
(実施例1−2)燐光発光性化合物:[2−(3−メタクリルフェニル)ピリジン]ビス[2−(3−プロピオニルフェニル)ピリジン]イリジウム(III)/N−ビニルカルバゾール共重合体(以下、Ir(MPPy)(PrCOPPy)2/VCz共重合体と略す)の合成
スキーム(5)に従って、反応容器に実施例1で合成したIr(MPPy)(PrCOPPy)2錯体0.222g(0.25mmol)、N−ビニルカルバゾール(VCz)0.918g(4.75mmol)(Ir(MPPy)(PrCOPPy)2とVCzがモル比で5:95)、2,2'−アゾビス(イソブチロニトリル)(AIBN)0.010g(0.061mmol)、酢酸ブチル10mlを入れて窒素置換を行った後、80℃で10時間反応させた。
【0142】
【化16】

反応後、生成物をアセトンに投入して再沈殿を行い、濾過により共重合体を回収した。回収した共重合体のクロロホルム溶液をメタノール中に投入して再沈殿させることを更に2回行うことにより精製し、沈殿回収後に真空乾燥して、目的とするIr(MPPy)(PrCOPPy)2/VCz共重合体0.946gを粉末として得た。得られた共重合体のCHN及びIrの元素分析は、Ir(MPPy)(PrCOPPy)2とVCzが5:95のモル比で共重合していることを支持していた。即ち燐光発光性単位の繰り返し数m/キャリア輸送性単位の繰り返し数n=5/95であると考えられる。また、共重合体のクロロホルム中のGPCから、重量平均分子量はポリスチレン換算で12000であった(重量平均分子量から計算される平均の重合度は37)。さらに本発明の燐光発光性化合物はクロロホルムなどの有機溶剤に可溶である。
【0143】
(実施例1−3)有機発光素子の試作
Ir(MPPy)(PrCOPPy)2/VCz共重合体と電子輸送材料であるオキサジアゾール誘導体(tBu−PBD)のクロロホルム溶液を調製した。比率は、Ir(MPPy)(PrCOPPy)2/VCz共重合体が65重量パーセントに対しtBu−PBDを35重量パーセントとした。この溶液を透明電極である酸化スズインジウム(ITO)がついたガラス基板上にスピンコートして厚さ100nmの膜を形成し、その上に真空蒸着法でCaを10nm、Alを100nm蒸着し陰極とした。この有機発光素子のITO側に正の、Al側に負の電圧を印加したところ、イリジウム錯体に起因した緑色の発光が観察された。発光量子効率は約4%であった。
【0144】
(実施例2−1)燐光発光性化合物の単量体:{2−[3−(2−メタクリロイルオキシエチル)カルバモイルオキシフェニル]ピリジン}ビス[2−(3−プロピオニルフェニル)ピリジン]イリジウム(III)(以下、Ir(MiPPy)(PrCOPPy)2と略す)の合成
実施例1−1で合成した単量体の中間体Ir(HOPPy)3をスキーム(6)に示すように、メタクリロイルオキシエチルイソシアナート(MOI、昭和電工製)と1:1で反応させ、次いで残りのOH基をPrCOClと反応させ、Ir(MiPPy)(PrCOPPy)2が主成分となる錯体を得た。
【0145】
【化17】

具体的には、反応容器に脱水THF8ml、Ir(HOPPy)30.706g(1mmol)、MOI0.106g(1mmol)を入れて、20℃で5時間反応させた。ごの反応溶液に脱酸剤としてトリエチルアミン0.600g(5.9mmo1)を加えた後、プロピオニルクロリド0.370g(4mmol)を脱水THF4mlに溶解させた溶液を30分かけて滴下し、更に20℃で5時間反応させることにより残りのOH基を反応させ、トリエチルアミンの塩酸塩を濾別した。濾液の溶媒を蒸発乾固し、得られた固形成分はクロロホルム/メタノール混合溶媒で再結晶を2回行うことにより精製し、目的とするIr(MiPPy)(PrCOPPy)20.613g(0.63mmol)を粉末として得た。この同定はCHN及びIrの元素分析、IRで行った。
【0146】
(実施例2−2)燐光発光性化合物:{2−[3−(2−メタクリロイルオキシエチル)カルバモイルオキシフェニル]ピリジン}ビス[2−(3−プロピオニルフェニル)ピリジン]イリジウム(III)/N−ビニルカルバゾール共重合体(以下、Ir(MiPPy)(PrCOPPy)2/VCz共重合体と略す)の合成
スキーム(7)に従って、反応容器に実施例3で合成したIr(MiPPy)(PrCOPPy)2錯体0.243g(0.25mmol)、N−ビニルカルバゾール(VCz)0.918g(4.75mmol)(Ir(MiPPy)(PrCOPPy)2とVCzがモル比で5:95)、2,2'−アゾビス(イソブチロニトリル)(AIBN)0.010g(0.061mmol)、酢酸ブチル10mlを入れて窒素置換を行った後、80℃で10時間反応させた。
【0147】
【化18】

反応後、アセトンに投入して再沈殿を行い、濾過により共重合体を回収した。回収した共重合体のクロロホルム溶液をメタノール中に投入して再沈殿させることを更に2回行うことにより精製し、沈殿回収後に真空乾燥して、目的とするIr(MiPPy)(PrCOPPy)2/VCz共重合体1.053gを粉末として得た。得られた共重合体のCHN及びIrの元素分析はIr(MiPPy)(PrCOPPy)2とVCzが5:95のモル比で共重合していることを支持していた。即ち燐光発光性単位の繰り返し数m/キャリア輸送性単位の繰り返し数n=5/95であると考えられる。また、共重合体のクロロホルム中のGPCから、重量平均分子量はポリスチレン換算で23000であった(重量平均分子量から計算される平均の重合度は64)。さらに本発明の燐光発光性化合物はクロロホルムなどの有機溶剤に可溶である。
【0148】
(実施例2−3)有機発光素子の試作
Ir(MiPPy)(PrCOPPy)2/VCz共重合体とtBu−PBDのクロロホルム溶液を調製した。比率は、Ir(MiPPy)(PrCOPPy)2/VCz共重合体が65重量パーセントに対しtBu−PBDを35重量パーセントとした。この溶液をITOがついたガラス基板上にスピンコートして厚さ100nmの膜を形成し、その上に真空蒸着法でCaを10nm、Alを100nm蒸着し陰極とした。この有機発光素子のITO側に正の、Al側に負の電圧を印加したところ、イリジウム錯体に起因した緑色の発光が観察された。発光量子効率は約3%であった。
【0149】
(実施例3−1)燐光発光性化合物:[2−(3−ヘキシルフェニル)ピリジン]ビス(2−フェニルピリジン)イリジウム(III)/3−ヘキシルチオフェン共重合体(以下、Ir(HPPy)PPy2/HT共重合体と略す)の合成
スキーム(8)に示すように、5−ブロモ−2−(4−ブロモ−3−ヘキシルフェニル)ピリジン(HPPyBr2)0.099g(0.25mmol)と3−ヘキシル−2,5−ジブロモチオフェン(HTBr2)1.549g(4.75mmol)((HPPyBr2)と(HTBr2)がモル比で5:95)とを常法に従い、ジメチルホルムアミド(DMF)10ml中でNi(COD)2(0)(ただしCODはシクロオクタジエニル基を示す)触媒で共重合し、2−(3−ヘキシルフェニル)ピリジン/3−ヘキシルチオフェン共重合体(HPPy/HT共重合体)を合成した。次に、このHPPy/HT共重合体0.625g(4mmol)とIr(acac)30.099g(0.2mmol)をメタクレゾール中で溶解し、250℃で10時間反応させた。さらにこの溶液にフェニルピリジン(PPy)を0.062g(0.4mmol)を加え、250℃で10時間反応させた。
【0150】
【化19】

反応後、アセトンに投入して再沈殿を行い、濾過により共重合体を回収した。回収した共重合体のDMF溶液をアセトン中に投入して再沈殿を更に2回行うことにより精製し、沈殿回収後に真空乾燥して、目的とするIr(HPPy)PPy2/HT共重合体0.564gを粉末として得た。
【0151】
共重合体のCHN及びIrの元素分析は推定構造を支持していた。即ち燐光発光性単位の繰り返し数m/キャリア輸送性単位の繰り返し数n=5/95であると考えられる。また、ヘキサフルオロイソプロパノール中の共重合体のGPCから、重量平均分子量はポリスチレン換算で18000であった(重量平均分子量から計算される平均の重合度は68)。さらに本発明の燐光発光性化合物はDMFなどの有機溶剤に可溶である。
【0152】
(実施例3−2)有機発光素子の試作
Ir(HPPy)PPy2/HT共重合体とtBu−PBDのクロロホルム溶液を調製した。比率は、Ir(HPPy)PPy2/HT共重合体が65重量パーセントに対しtBu−PBDを35重量パーセントとした。この溶液をITOがついたガラス基板上にスピンコートして厚さ100nmの膜を形成し、その上に真空蒸着法でCaを10nm、Alを100nm蒸着し陰極とした。この有機発光素子のITO側に正の、Al側に負の電圧を印加したところ、イリジウム錯体に起因した黄色の発光が観察された。発光量子効率は約1%であった。
【0153】
(実施例4−1)電子輸送性化合物の単量体:2−(4−tert−ブチル−フェニル)−(4'−ビニル−ビフェニル−4−イル)−[1,3,4]オキサジアゾール(以下、VPBDと略す。)の合成
特開平10−1665号公報に開示されている方法に従い、VPBDを合成した。
【0154】
(実施例4−2)燐光発光性化合物:[2−(3−メタクリルフェニル)ピリジン]ビス[2−(3−プロピオニルフェニル)ピリジン]イリジウム(III)/N−ビニルカルバゾール/2−(4−tert−ブチル−フェニル)−5−(4'−ビニル−ビフェニル−4−イル)−[1,3,4]オキサジアゾール共重合体(以下、Ir(MPPy)(PrCOPPy)2/VCz/VPBD共重合体と略す。)の合成
下記スキーム(9)に従って、実施例1−1で合成したIr(MPPy)(PrCOPPy)2錯体0.222g(0.25mmol)、VCz0.628g(3.25mmol)、上記実施例4−1で合成したVPBD0.571g(1.50mmol)(モル比がIr(MPPy)(PrCOPPy)2:VCz:VPBD=5:65:30)、2,2'−アゾビス(イソブチロニトリル)(AIBN)0.010g(0.061mmol)、ベンゼン10mlを反応容器にいれて窒素置換を行った後、80℃で10時間反応させた。
【0155】
反応後、生成物をアセトンに投入して再沈殿を行い、濾過により共重合体を回収した。回収した共重合体のクロロホルム溶液をメタノール中に投入して再沈殿させることをさらに2回行うことにより精製し、沈殿回収後に真空乾燥して、目的とするIr(MPPy)(PrCOPPy)2/VCz/VPBD共重合体0.080gを粉末として得た。
【0156】
【化20】

得られた共重合体(燐光発光性化合物)のCHN及びIrの元素分析は、モル比がIr(MPPy)(PrCOPPy)2:VCz:VPBD=5:65:25で共重合していることを支持していた。すなわち、(燐光発光性単位の繰り返し数:k)/(キャリア輸送単位の繰り返し数m+n)=5/90であると考えられる。また、共重合体のクロロホルム中のGPCから、共重合体の重量平均分子量はポリスチレン換算で30000であった(重量平均分子量から計算される平均の重合度は2.5)。この共重合体は、クロロホルムなどの有機溶剤に可溶である。
【0157】
(実施例4−3)有機発光素子の試作
実施例4−2で得られたIr(MPPy)(PrCOPPy)2/VCz/VPBD共重合体のクロロホルム溶液を調製した。この溶液を透明電極である酸化スズインジウム(ITO)が付いたガラス基板上にスピンコートして厚さ100nmの膜を形成し、その上に真空蒸着法でCaを10nm、Alを100nm蒸着して陰極とし、有機発光素子を得た。この有機発光素子のITO側を正とし、Al側を負として電圧を印加したところ、イリジウム錯体に起因した緑色の発光が観察された。発光量子効率は約3%であった。
【0158】
(実施例5−1)電子輸送性高分子化合物:ポリ−VPBD(以下、PVPBDと略す。)の合成
特開平10−1655号公報に開示されている方法に従いPVPBDを合成した。
【0159】
(実施例5−2)
実施例1−2で得られたIr(MPPy)(PrCOPPy)2/VCz共重合体と実施例5−1で得られたPVPBDのクロロホルム溶液を調製した。比率は、Ir(MPPy)(PrCOPPy)2/VCz共重合体が65重量%に対しPVPBDを35重量%とした。この溶液を透明電極である酸化スズインジウム(ITO)が付いたガラス基板上にスピンコートして厚さ100nmの膜を形成し、その上に真空蒸着法でCaを10nm、Alを100nm蒸着して陰極とし、有機発光素子を得た。この有機発光素子のITO側を正とし、Al側を負として電圧を印加したところ、イリジウム錯体に起因した緑色の発光が観察された。発光量子効率は約4.5%であった。
【0160】
(実施例6−1)青色燐光発光部位を有する単量体:イリジウム(III)ビス(2−(2,4−ジフルオロフェニル)ピリジナート)(5−メタクリロイロキシメチルピコリナート)(以下、Ir(2,4−F−ppy)2(5−CH2MA−pic)と略す。)の合成
スキーム(10)に示すように、イリジウム(III)ビス(2−(2,4−ジフルオロフェニル)ピリジナート)(5−(ヒドロキシメチル)ピコリナート)(以下、Ir(2,4−F−ppy)2(5−CH2OH−pic)と略す。)を合成した。即ち、[Ir(2,4−F−ppy)2Cl]2121.6mg(0.1mmol)、5−ヒドロキシメチルピコリン酸45.9mg(0.3mmol)、炭酸ナトリウム106.0mg(1.0mmol)にアルゴン気流下において脱水N,N−ジメチルホルムアミド10mlを加え、80℃で2時間攪拌した。反応液に50mlの水を加えた後、酢酸エチルで抽出した。その溶液を硫酸マグネシウムで乾燥後、濃縮し、カラムクロマトグラフィー(シリカゲル、メタノール:クロロホルム=1:19(体積比))で精製した。さらにそれをヘキサン/クロロホルムより再結晶することにより黄色の結晶としてIr(2,4−F−ppy)2(5−CH2OH−pic)108.7mgを得た。収率75%。同定は1H−NMRとCHN元素分析で行った。1H−NMR(270MHz,DMSO−d6),ppm:8.54(d,1H,J=4.6),8.3−8.2(m,2H),8.1−8.0(m,4H),7.70(s,1H),7.61(d,1H,J=4.9),7.49(dd,1H,J=6.6,.6.6),7.32(dd,1H,J=6.6,.6.6),6.9−6.7(m,2H),5.71(dd,1H,J=8.9,2.4),5.46(dd,1H,J=8.5,2.3),5.42(t,1H,J=4.6),4.49(d,2H,J=4.6).Anal.Found:C48.05,H2.54,N5.86.Calcd:C48.06,H2.50,N5.80.
【0161】
【化21】

次いで、スキーム(11)に示すように、Ir(2,4−F−ppy)2(5−CH2MA−pic)を合成した。即ち、Ir(2,4−F−ppy)2(5−CH2OH−pic)72.5mg(0.1mmol)と2,6−ジ−tert−4−メチルフェノール0.2mgをアルゴン気流下に脱水ジクロロメタン10mlに溶解し、トリエチルアミン101.2mg(1.0mmol)とメタクリル酸クロライド52.3mg(0.5mmol)を加え、室温で2時間攪拌した。反応液に水50mlを加え、クロロホルムで抽出した。その溶液を硫酸マグネシウムで乾燥後、濃縮し、カラムクロマトグラフィー(シリカゲル、メタノール:クロロホルム=3:97(体積比))で精製した。さらにそれをヘキサン/クロロホルムより再結晶することにより黄色の結晶としてIr(2,4−F−ppy)2(5−CH2MA−pic)70.6mgを得た。収率89%。同定は1H−NMRとCHN元素分析で行った。1H−NMR(270MHz,DMSO−d6),ppm:8.53(d,1H,J=5.1),8.28(d,1H,J=8.4),8.22(d,1H,J=8.6),8.1−8.0(m,4H),7.70(s,1H),7.66(d,1H,J=4.9),7.48(dd,1H,J=6.5,.6.5),7.31(dd,1H,J=6.5,.6.5),6.9−6.7(m,2H),5.84(s,1H),5.7−5.6(m,2H),5.47(dd,1H,J=8.8,2.6),5.24(d,2H,J=2.7),1.78(s,3H).Anal.Found:C49.92,H2.87,N5.28.Calcd:C50.00,H2.80,N5.30.
【0162】
【化22】

(実施例6−2)緑色の燐光発光性部位を有する単量体:[6−(4−ビニルフェニル)−2,4−ヘキサンジオナート]ビス(2−フェニルピリジン)イリジウム(III)(以下Ir(ppy)2[1−(StMe)−acac]と略す)の合成
スキーム(12)に示すように、アセチルアセトンと4−ビニルベンジルクロライドを反応させて6−(4−ビニルフェニル)−2,4−ヘキサジオンを合成した。即ち、水素化ナトリウム1.23g(60% in oil)(31mmol)を窒素雰囲気下で秤量し、これに乾燥テトラヒドロフラン(以下THFと略す)60mlを加えて氷浴で0℃に冷却した。この懸濁液にアセチルアセトン2.5g(24mmol)とヘキサメチルホスホリックトリアミド1mlの混合溶液を滴下すると無色の沈殿が生成した。0℃で10分間攪拌した後、n−ブチルリチウムのヘキサン溶液(1.6M)17.5ml(28mmol)を滴下すると沈殿が溶解し、更に0℃で20分間攪拌した。得られた薄黄色の溶液に4−ビニルベンジルクロライド4.0g(26mmol)を滴下し、反応液を室温に戻して20分間攪拌後、希塩酸を加えて水層を酸性にした。有機層を飽和塩化ナトリウム水溶液で洗浄し、硫酸マグネシウムで乾燥した後、ロータリーエバポレータで溶媒を留去した。得られた反応混合物をシリカゲルカラムに加えてヘキサン/ジクロロメタンの1:1(体積比)混合溶媒で展開し、主生成物を分取した。得られた溶液から減圧で溶媒を留去することにより、目的とする6−(4−ビニルフェニル)−2,4−ヘキサジオン3.0g(14mmol)を褐色の液体として得た。収率56%。同定はCHN元素分析、1H−NMRで行った。1H NMR(CDCl3):enol;δ7.33(d,J=8.1Hz,2H,aromatic),7.14(d,J=8.4Hz,2H,aromatic),6.68(dd,J=8.1Hz,1H,vinylic),5.70(d,J=17.0Hz,1H,vinylic),5.46(s,1H,diketonate−methine),5.20(d,J=11.1Hz,1H,vinylic),2.91(t,J=5.7Hz,2H,methylene),2.58(t,J=7.3Hz,2H,methylene),2.03(s,3H,methyl).keto;δ7.33(d,J=8.1Hz,2H,aromatic),7.14(d,J=8.4Hz,2H,aromatic),6.68(dd,J=8.1Hz,1H,vinylic),5.70(d,J=17.0Hz,1H,vinylic),5.20(d,J=11.1Hz,1H,vinylic),3.53(s,2H,C(=O)CH2C(=O)),2.89(m,4H,ethylene),2.19(s,3H,methyl).enol:keto=6:1.E.A.:Calcd for C14H9O2:C,77.75;H,7.46.Found:C,77.49;H,7.52.
【0163】
【化23】

次いで、スキーム(13)に示すように、この6−(4−ビニルフェニル)−2,4−ヘキサンジオンと常法に従い合成した[Ir(ppy)2Cl]2を反応させてIr(ppy)2[1−(StMe)−acac]を合成した。即ち、[Ir(ppy)2Cl]2342mg(0.32mmol)、炭酸ナトリウム158mg(1.5mmol)および2,6−ジ−tert−ブチル−4−メチルフェノール5mg(0.023mmol)を5mlのN,N−ジメチルホルムアミド(以下DMFと略す)に溶解し、これに6−(4−ビニルフェニル)−2,4−ヘキサンジオン210mg(0.97mmol)を加えて65℃で1時間加熱攪拌した。次に室温まで冷却した反応溶液に希塩酸水溶液を加えた後、薄黄色の成分をクロロホルムで抽出した。ロータリーエバポレータを用いて溶媒を留去後、残渣を少量のジクロロメタンに溶解し、シリカゲルカラムクロマトグラフィー(展開液:ジクロロメタン)で黄色の主生成物を分取した。この溶液を減圧乾固し、ジクロロメタン−ヘキサン混合溶液を加えて−20℃で再結晶を行い、目的とするIr(ppy)2[1−(StMe)−acac]354mg(0.49mmol)を薄黄色結晶として得た。収率78%。同定はCHN元素分析、1H−NMRで行った。1H NMR(CDCl3):δ8.47(d,J=5.7Hz,1H,ppy),8.21(d,J=5.7Hz,1H,ppy),7.9-7.5(m,6H,ppy),7.18(d,J=8.1Hz,2H,stylyl−aromatic),7.00(m,2H,ppy),6.89(d,J=8.1Hz,2H,stylyl−aromatic),6.75(m,5H,ppy and vinylic),6.28(t,J=7.3Hz,2H,ppy),7.67(d,J=17.6Hz,1H,vinylic),5.19(d,J=9.5Hz,1H,vinylic),5.17(s,1H,diketonate−methine),2.60(t,J=7.3Hz,2H,ethylene),2.36(m,2H,ethylene),1.75(s,3H,methyl).E.A.:Calcd for C36H31IrN2O2:C,60.40;H,4.36;N,3.91.Found:C,61.35;H,4.34;N,3.83.
【0164】
【化24】

(実施例6−3)赤色の燐光発光性部位を有する単量体:[6−(4−ビニルフェニル)−2,4−ヘキサンジオナート]ビス[2−(2−ピリジル)ベンゾチエニル]イリジウム(III){以下Ir(btp)2[1−(StMe)−acac]と略す}の合成
スキーム(14)に示すように、アセチルアセトンと4−ビニルベンジルクロライドを反応させて6−(4−ビニルフェニル)−2,4−ヘキサンジオンを合成した。即ち、水素化ナトリウム1.23g(60% in oil)(31mmol)を窒素雰囲気下で秤量し、これに乾燥テトラヒドロフラン(以下THFと略す)60mlを加えて氷浴で0℃に冷却した。この懸濁液にアセチルアセトン2.5g(24mmol)とヘキサメチルホスホリックトリアミド(以下HMPAと略す)1mlの混合溶液を滴下すると無色の沈殿が生成した。0℃で10分間撹拌した後、n−ブチルリチウムのヘキサン溶液(1.6M)17.5ml(28mol)を滴下すると沈殿が溶解し、更に0℃で20分間撹拌した。得られた薄黄色の溶液に4−ビニルベンジルクロライド4.0g(26mmol)を滴下し、反応液を室温に戻して20分間撹拌後、希塩酸を加えて水層を酸性にした。有機層を飽和塩化ナトリウム水溶液で洗浄し、硫酸マグネシウムで乾燥した後、ロータリーエバポレータで溶媒を留去した。得られた反応混合物をシリカゲルカラムに加えてヘキサン/ジクロロメタンの1:1(体積比)混合溶媒で展開し、主生成物を分取した。得られた溶液から減圧で溶媒を留去することにより、目的とする6−(4−ビニルフェニル)−2,4−ヘキサンジオン3.0g(14mmol)を褐色の液体として得た。収率56%。同定はCHN元素分析、1H−NMRで行った。1H NMR:enol;δ7.33(d,J=8.1Hz,2H,aromatic),7.14(d,J=8.4Hz,2H,aromatic),6.68(dd,J=8.1Hz,1H,vinylic),5.70(d,J=17.0Hz,1H,vinylic),5.46(s,1H,enol−methine),5.20(d,J=11.1Hz,1H,vinylic),2.91(t,J=5.7Hz,2H,methylene),2.58(t,J=7.3Hz,2H,methylene),2.03(s,3H,methyl).keto;δ7.33(d,J=8.1Hz,2H,aromatic),7.14(d,J=8.4Hz,2H,aromatic),6.68(dd,J=8.1Hz,1H,vinylic),5.70(d,J=17.0Hz,1H,vinylic),5.20(d,J=11.1Hz,1H,vinylic),3.53(s,2H,C(=O)CH2C(=O)),2.89(m,4H,ethylene),2.19(s,3H,methyl).enol:keto=6:1.E.A.:Calcd for C14H9O2:C,77.75;H,7.46.Found:C,77.49;H,7.52.
【0165】
【化25】

次いで、スキーム(15)に示すように、この6−(4−ビニルフェニル)−2,4−ヘキサンジオンと常法(例えばS.Lamansky,et al.,Inorganic Chemistry,40,1704(2001)に記載)に従い合成したジ(μ−クロロ)テトラキス(2−(2−ピリジル)ベンゾチエニル)ジイリジウム(以下、[Ir(btp)2Cl]2と略す。)を反応させてIr(btp)2[1−(St−Me)−acac]を合成した。即ち、[Ir(btp)2Cl]2253mg(0.20mmol)を10mlのN,N−ジメチルホルムアミド(以下DMFと略す)に懸濁させ、161mgの6−(4−ビニルフェニル)−2,4−ヘキサンジオン(0.74mmol)と64mgの炭酸ナトリウムおよび1.9mgの2,6−ジ−tert−ブチル−4−、メチルフェノール(以下BHTと略す)(0.0086mmol)を加えて80℃で1時間加熱撹拌した。得られた反応混合物に100mlの水と50mlのクロロホルムを加えてよく振とうし、有機層を硫酸マグネシウムで乾燥後、ロータリーエバポレータで減圧乾固した。次にジクロロメタンを溶出液として、粗精製物をシリカゲルカラムで精製し、赤褐色の溶液を得た。この溶液を減圧下で濃縮し、ヘキサンを加えて−20℃で再結晶することによって目的とするIr(btp)2[1−(StMe)−acac]153mg(0.18mmol)を赤褐色の固体として得た(収率47%)。同定はCHN元素分析、1H−NMRで行った。1H NMR:δ8.40(d,J=5.4Hz,1H,btp),7.97(d,J=5.4Hz,1H,btp),7.65(m,6H,btp),7.1-6.7(m,10H,aromatic),6.63(dd,J=17.8,11.1Hz,1H,vinylic),6.24(d,J=8.1Hz,1H,btp),6.16(d,J=7.8Hz,1H,btp),5.65(d,J=17.8Hz,1H,vinylic),5.22(s,1H,diketonate−methine),5.18(d,J=11.1Hz,1H,vinylic),2.56(m,2H,ethylene),2.37(m,2H,ethylene),1.75(s,3H,methyl).E.A.:Calcd for C40H31IrN2O2S2:C,58.02;H,3.77;N,3.38.Found:C,57.79;H,3.81;N,3.55.
【0166】
【化26】

(実施例6−4)白色燐光発光性化合物の合成
実施例6−1〜6−3で合成した発光機能を有する3種類の単量体及びホール輸送機能を有するN−ビニルカルバゾールを含有する共重合体を合成した。
【0167】
N−ビニルカルバゾール1.55g(8.0mmol)、Ir(2,4−F−ppy)2(3−ST−pic)58.0mg(0.08mmol)、Ir(ppy)2[1−(St−Me)−acac]1.1mg(0.0015mmol)、Ir(btp)2[1−(StMe)−acac]1.2mg(0.0015mmol)、AIBN13mg(0.08mmol)を脱水トルエン40mlに溶解させ、さらに1時間アルゴンを吹き込んだ。この溶液を80℃まで昇温し、重合反応を開始させ、そのまま8時間攪拌した。冷却後、反応液をメタノール250ml中に滴下して重合物を沈殿させ、濾過により回収した。さらに、回収した重合物をクロロホルム25mlに溶解させ、この溶液をメタノール250ml中に滴下して再沈殿させることにより精製した後、60℃で12時間真空乾燥させることにより目的とする青色、緑色及び赤色に発光する3種類の燐光発光性単位を有する白色燐光発光性化合物116.3mgを得た。
【0168】
得られた共重合体(燐光発光性化合物)のIrの元素分析結果から、Ir錯体(燐光発光性単位)の含有量は1.07mol%であった。又、共重合体のクロロホルム中のGPCから、重量平均分子量はポリスチレン換算で12400であった。
【0169】
(実施例6−5)有機発光素子の試作
Ir(MPPy)(PrCOPPy)2/VCz共重合体に替えて、実施例6−2で合成した共重合体を用いること以外は実施例1−3と同様にして有機発光素子の試作を行った。
【0170】
この有機発光素子のITO側に正の、Al側に負の電圧を印加したところ、肉眼で白色の発光が観察された。
【0171】
有機発光素子の発光スペクトルを図3に示す。3種類の燐光発光性単位(青、緑、赤)に対応する発光ピークがそれぞれ、480nm、520nm、620nmに観測された。発光色の色度は(0.32、0.33)であった。
(実施例7−1)青色の燐光発光性部位を有する単量体:イリジウム(III)ビス(2−(2,4−ジフルオロフェニル)ピリジナート)(3−(4−ビニルフェニル)メトキシピコリナート)(以下、Ir(2,4−F−ppy)2(3−ST−pic)と略す。)の合成
スキーム(16)に示すように、2−(2,4−ジフルオロフェニル)ピリジンを合成した。即ち、アルゴン気流下において2−ブロモピリジン8.69g(55.0mmol)を脱水テトラヒドロフラン200mlに溶解して−78℃まで冷却し、1.6M n−ブチルリチウムのヘキサン溶液38.7ml(61.9mmol)を30分かけて滴下した。滴下後、さらに塩化亜鉛7.5g(55.0mmol)を脱水テトラヒドロフラン(THF)50mlに溶解した溶液を30分かけて滴下した。滴下後、0℃までゆっくりと昇温し、1−ブロモ−2,4−ジフルオロベンゼン9.65g(55.0mmol)とテトラキス(トリフェニルホスフィン)パラジウム(0)2.31g(2.0mmol)を加え、還流下に6時間攪拌した後、反応液に飽和食塩水200mlを加えジエチルエーテルで抽出した。抽出液を乾燥後、濃縮し、カラムクロマトグラフィー(シリカゲル;クロロホルム:ヘキサン=1:1(体積比))で精製することにより、2−(2,4−ジフルオロフェニル)ピリジンを無色透明のオイルとして得た。収量6.00g。収率63%。同定は1H−NMRとCHN元素分析で行った。1H−NMR(270MHz,CDCl3),ppm:8.71(d,1H,J=4.6Hz),8.00(td,1H,J=8.9,6.5Hz),7.8−7.7(m,2H),7.3−7.2(over wrapped with CHCl3,1H),7.1−6.8(m,2H).Anal.Found:C68.98,H3.80,N7.31.Calcd:C69.11,H3.69,N7.33.
【0172】
【化27】

次いで、スキーム(17)に示すように、イリジウムの2核錯体、ビス(μ−クロロ)テトラキス(2−(2,4−ジフルオロフェニル)ピリジン)ジイリジウム(III)(以下、[Ir(2,4−F−ppy)2Cl]2と略す。)を合成した。即ち、2−(2,4−ジフルオロフェニル)ピリジン0.96g(5.0mmol)とヘキサクロロイリジウム(III)酸ナトリウムn水和物(和光純薬工業製)1.00gを2−エトキシエタノール:水=3:1の混合溶媒40mlに溶解し、30分間アルゴンガスを吹き込んだ後、還流下に5時間攪拌した。生じた沈殿をろ取し、エタノールと少量のアセトンで洗浄し、真空下で5時間乾燥することにより、[Ir(2,4−F−ppy)2Cl]2を黄色粉末として得た。収量0.79g。収率86%。同定は1H−NMRとCHN元素分析で行った。1H−NMR(270MHz,CDCl3),ppm:9.12(d,4H,J=5.7Hz),8.31(d,4H,J=8.6Hz),7.83(dd,4H,J=7.6,7.6Hz),6.82(dd,4H,J=7.3,7.3Hz),6.34(ddd,4H,J=11.6,10.0,2.4Hz),5.29(dd,4H,J=9.5,2.4Hz).Anal.Found:C43.69,H3.53,N3.54.Calcd:C43.88,H3.45,N3.56.
【0173】
【化28】

次いで、スキーム(18)に示すように、イリジウム(III)ビス(2−(2,4−ジフルオロフェニル)ピリジナート)(3−ヒドロキシピコリナート)(以下、Ir(2,4−F−ppy)2(3−OH−pic)と略す。)を合成した。即ち、[Ir(2,4−F−ppy)2Cl]2121.6mg(0.1mmol)、3−ヒドロキシピコリン酸41.7mg(0.3mmol)、炭酸ナトリウム106.0mg(1.0mmol)にアルゴン気流下において脱水N,N−ジメチルホルムアミド(DMF)10mlを加え、80℃で2時間攪拌した。反応液に50mlの水を加えた後、酢酸エチルで抽出した。その溶液を硫酸マグネシウムで乾燥後、濃縮し、カラムクロマトグラフィー(シリカゲル、メタノール:クロロホルム=3:97(体積比))で精製した。さらにそれをヘキサン/クロロホルムより再結晶することにより黄色の結晶としてIr(2,4−F−ppy)2(3−OH−pic)101.0mgを得た。収率71%。同定は1H−NMRとCHN元素分析で行った。1H−NMR(270MHz,DMSO−d6),ppm:13.6(br,1H),8.50(d,1H,J=5.9Hz),8.25(d,2H,J=11.1Hz),8.1−8.0(m,2H),7.69(d,1H,J=5.7Hz),7.62(d,1H,J=8.1Hz),7.53(d,1H,J=4.6Hz),7.50(d,1H,J=5.7Hz),7.36(t,1H,J=4.5Hz),7.24(d,1H,J=5.1Hz),6.9−6.7(m,2H),5.66(dd,1H,J=8.6,2.4Hz),5.48(dd,1H,J=8.6,2.4Hz).Anal.Found:C47.29,H2.33,N5.86.Calcd:C47.32,H2.27,N5.91.
【0174】
【化29】

次いで、スキーム(19)に示すように、Ir(2,4−F−ppy)2(3−ST−pic)を合成した。即ち、Ir(2,4−F−ppy)2(3−OH−pic)106.5mg(0.15mmol)、炭酸カリウム207.3mg(1.5mmol)、2,6−ジ−t−ブチルヒドロキシトルエン0.3mgにアルゴン気流下において脱水N,N−ジメチルホルムアミド15mlを加え、さらに4−ビニルベンジルクロライド91.5mg(0.6mmol)を加え、80℃で4時間攪拌した。反応液に水100mlを加えて生成物を沈殿させてろ取し、カラムクロマトグラフィー(シリカゲル、メタノール:クロロホルム=3:97(体積比))で精製した。さらにそれをヘキサン/クロロホルムより再結晶することにより黄色の結晶としてIr(2,4−F−ppy)2(3−ST−pic)72.0mgを得た。収率58%。同定は1H−NMRとCHN元素分析で行った。1H−NMR(270MHz,DMSO−d6),ppm:8.59(d,1H,J=5.1Hz),8.3−8.2(m,2H),8.1−8.0(m,2H),7.9(d,1H,J=8.6Hz),7.67(d,1H,J=5.1Hz),7.6−7.3(m,7H),6.9−6.7(m,3H),5.85(d,1H,J=17.8Hz),5.67(dd,1H,J=8.9,2.4Hz),5.45(dd,1H,J=8.9,2.4Hz),5.29(s,2H),5.27(d,1H,J=11.1Hz).Anal.Found:C53.71,H2.90,N5.03.Calcd:C53.75,H2.93,N5.08.
【0175】
【化30】

(実施例7−2)青色燐光発光部位を有するIr(2,4−F−ppy)2(3−ST−pic)とホール輸送性機能を有するビニルカルバゾールの共重合体(以下、Ir(2,4−F−ppy)2(3−ST−pic)/VCz共重合体と略す。)の合成
N−ビニルカルバゾール966mg(5.0mmol)および実施例7−1で合成したIr(2,4−F−ppy)2(3−ST−pic)41(0.05mmol)、AIBN8.2mg(0.05mmol)を脱水トルエン25mlに溶解させ、さらに1時間アルゴンを吹き込んだ。この溶液を80℃まで昇温し、重合反応を開始させ、そのまま8時間攪拌した。冷却後、反応液をメタノール250ml中に滴下して重合物を沈殿させ、濾過により回収した。さらに、回収した重合物をクロロホルム25mlに溶解させ、この溶液をメタノール250ml中に滴下して再沈殿させることにより精製した後、60℃で12時間真空乾燥させることにより目的物であるIr(2,4−F−ppy)2(3−ST−pic)/VCz共重合体722mgを得た。
【0176】
得られた共重合体(燐光発光性化合物)のIrの元素分析結果から、Ir錯体(燐光発光性単位)の含有量は1.04mol%であった。また、共重合体のクロロホルム中のGPCから、重量平均分子量はポリスチレン換算で11400であった。
【0177】
(実施例7−3)赤色燐光発光部位を有する[6−(4−ビニルフェニル)−2,4−ヘキサンジオナート]ビス[2−(2−ピリジル)ベンゾチエニル]イリジウム(III)とホール輸送性機能を有するビニルカルバゾールの共重合体(以下、Ir(btp)2[1−(StMe)−acac]/VCz共重合体と略す。)の合成
N−ビニルカルバゾール1.55g(8.0mmol)、実施例6−3で合成したIr(btp)2[1−(StMe)−acac]33.1mg(0.04mmol)、AIBN13mg(0.08mmol)を脱水トルエン40mlに溶解させ、さらに1時間アルゴンを吹き込んだ。この溶液を80℃まで昇温し、重合反応を開始させ、そのまま8時間攪拌した。冷却後、反応液をメタノール250ml中に滴下して重合物を沈殿させ、濾過により回収した。さらに、回収した重合物をクロロホルム25mlに溶解させ、この溶液をメタノール250ml中に滴下して再沈殿させることにより精製した後、60℃で12時間真空乾燥させることにより目的物であるIr(btp)2[1−(StMe)−acac]/VCz共重合体1.12gを得た。
【0178】
得られた共重合体(燐光発光性化合物)のIrの元素分析結果から、Ir錯体(燐光発光性単位)の含有量は0.59mol%であった。また、共重合体のクロロホルム中のGPCから、重量平均分子量はポリスチレン換算で10800であった。
【0179】
(実施例7−4)有機発光素子の試作
実施例7−2で合成したIr(2,4−F−ppy)2(3−ST−pic)/VCz共重合体、実施例7−3で合成したIr(btp)2[1−(StMe)−acac]/VCz共重合体並びにtBu―PBDのクロロホルム溶液を調製した。比率は、Ir(2,4−F−ppy)2(3−ST−pic)/VCz共重合体が66.85質量%、Ir(btp)2[1−(StMe)−acac]/VCz共重合体が3.15質量%、tBu―PBDが30.00質量%とした。
【0180】
この溶液をITOが付いたガラス基板上にスピンコートして厚さ100nmの膜を形成し、その上に真空蒸着法でCaを10nm、Alを100nm蒸着し陰極とした。
【0181】
得られた有機発光素子のITO側に正の、Al側に負の電圧を印加したところ、肉眼で白色の発光が観察された。
【0182】
有機発光素子の発光スペクトルを図4に示す。Ir(2,4−F−ppy)2(3−ST−pic)/VCz共重合体及びIr(btp)2[1−(StMe)−acac]/VCz共重合体に対応する発光ピークがそれぞれ、480nm付近と620nm付近に観測された。色度座標は(0.30、0.35)であった。
【0183】
[付記]
付記(1):
有機発光素子に使用され、燐光を発光する中性の有機高分子の燐光発光性化合物であって、
燐光を発光する繰り返し単位である燐光発光性単位と、
キャリアを輸送する繰り返し単位であるキャリア輸送性単位と、
を含むことを特徴とする燐光発光性化合物。
【0184】
付記(2):
前記燐光発光性単位の繰り返し数m、及び前記キャリア輸送性単位の繰り返し数nは、
m<n
の関係を満たすことを特徴とする付記(1)に記載の燐光発光性化合物。
【0185】
付記(3):
前記燐光発光性単位の繰り返し数m、及び前記キャリア輸送性単位の繰り返し数nは、
0.0001≦m/(m+n)≦0.2
の関係を満たすことを特徴とする付記(2)に記載の燐光発光性化合物。
【0186】
付記(4):
有機溶剤又は水に可溶であることを特徴とする付記(1)乃至(3)のいずれか一つに記載の燐光発光性化合物。
【0187】
付記(5):
重合度が5乃至5000であることを特徴とする付記(1)乃至(4)のいずれか一つに記載の燐光発光性化合物。
【0188】
付記(6):
前記燐光発光性単位の燐光発光性部位、及び/又は前記キャリア輸送性単位のキャリア輸送性部位が側鎖を構成していることを特徴とする付記(1)乃至(5)のいずれか一つに記載の燐光発光性化合物。
【0189】
付記(7):
前記燐光発光性単位の燐光発光性部位、及び/又は前記キャリア輸送性単位のキャリア輸送性部位が主鎖を構成していることを特徴とする付記(1)乃至(5)のいずれか一つに記載の燐光発光性化合物。
【0190】
付記(8):
前記キャリア輸送性単位のキャリア輸送性部位がホール輸送性部位であることを特徴とする付記(1)乃至(7)のいずれか一つに記載の燐光発光性化合物。
【0191】
付記(9):
前記キャリア輸送性単位のキャリア輸送性部位が電子輸送性部位であることを特徴とする付記(1)乃至(7)のいずれか一つに記載の燐光発光性化合物。
【0192】
付記(10):
前記キャリア輸送性単位のキャリア輸送性部位がホール輸送性部位及び電子輸送性部位からなることを特徴とする付記(1)乃至(7)のいずれか一つに記載の燐光発光性化合物。
【0193】
付記(11):
前記燐光発光性単位の燐光発光性部位が遷移金属又は希土類金属の錯体の一価基又は二価基であることを特徴とする付記(1)乃至(10)のいずれか一つに記載の燐光発光性化合物。
【0194】
付記(12):
前記遷移金属又は希土類金属の錯体の一価基は、主鎖に対してスペーサー部分を介して側鎖として結合し、
該スペーサー部分は、ヘテロ原子を有していてもよい炭素数1乃至30の有機基又は炭素原子を有しないヘテロ原子数1乃至10の無機基を含むことを特徴とする付記(11)に記載の燐光発光性化合物。
【0195】
付記(13):
前記キャリア輸送性単位のキャリア輸送性部位がカルバゾールの一価基、第3級アミンの一価基、イミダゾール誘導体の一価基、トリアゾール誘導体の一価基、オキサジアゾール誘導体の一価基、スチレンの二価基、及びフルオレンの二価基からなる基の群、並びに該基を置換基で置換した基の群より、少なくとも1種類以上選択される基を含むことを特徴とする付記(1)乃至(12)のいずれか一つに記載の燐光発光性化合物。
【0196】
付記(14):
所定の1色に発光する1種類又は所定の相互に異なる2色以上に発光する2種類以上の燐光発光性単位を有することを特徴とする付記(1)乃至(13)のいずれか一つに記載の燐光発光性化合物。
【0197】
付記(15):
前記燐光発光性単位は、青色若しくは緑色及び黄色若しくは赤色に発光する2種類からなり、全体として白色に発光することを特徴とする付記(14)に記載の燐光発光性化合物。
【0198】
付記(16):
前記燐光発光性単位は、青色、緑色及び赤色に発光する3種類からなり、全体として白色に発光することを特徴とする付記(14)に記載の燐光発光性化合物。
【0199】
付記(17):
付記(1)乃至(16)のいずれか一つに記載の燐光発光性化合物を含むことを特徴とする燐光発光性組成物。
【0200】
付記(18):
付記(14)に記載の燐光発光性化合物であって相互に異なる色に発光する燐光発光性単位を1又は2種類以上有するものを複数配合してなることを特徴とする燐光発光性組成物。
【0201】
付記(19):
全体として白色に発光することを特徴とする付記(18)に記載の燐光発光性組成物。
【0202】
付記(20):
青色若しくは緑色に発光する燐光発光性単位を有する燐光発光性化合物及び黄色若しくは赤色に発光する燐光発光性単位を有する燐光発光性化合物を配合してなり、全体として白色に発光することを特徴とする付記(18)に記載の燐光発光性組成物。
【0203】
付記(21):
付記(1)乃至(20)のいずれか一つに記載の燐光発光性化合物若しくは燐光発光性組成物及びキャリア輸送性高分子化合物を配合してなることを特徴とする燐光発光性組成物。
【0204】
付記(22):
前記キャリア輸送性高分子化合物は、ホール輸送性高分子化合物であることを特徴とする付記(21)に記載の燐光発光性組成物。
【0205】
付記(23):
前記キャリア輸送性高分子化合物は、電子輸送性高分子化合物であることを特徴とする付記(21)に記載の燐光発光性組成物。
【0206】
付記(24):
付記(1)乃至(20)のいずれか一つに記載の燐光発光性化合物若しくは燐光発光性組成物及びキャリア輸送性低分子化合物を配合してなることを特徴とする燐光発光性組成物。
【0207】
付記(25):
前記キャリア輸送性低分子化合物は、ホール輸送性低分子化合物であることを特徴とする付記(24)に記載の燐光発光性組成物。
【0208】
付記(26):
前記キャリア輸送性低分子化合物は、電子輸送性低分子化合物であることを特徴とする付記(24)に記載の燐光発光性組成物。
【0209】
付記(27):
陽極と陰極に挟まれた一又は複数の有機高分子層を含む有機発光素子において、
前記有機高分子層の少なくとも一層は、付記(1)乃至(26)のいずれか一つに記載の燐光発光性化合物又は燐光発光性組成物を含むことを特徴とする有機発光素子。
【0210】
付記(28):
陽極と陰極に挟まれた一又は複数の有機高分子層を含む有機発光素子において、
陽極と、陽極が設けられる透明基板との間にカラーフィルターが配設され、
前記有機高分子層の少なくとも一層は、付記(15)若しくは(16)に記載の燐光発光性化合物又は付記(19)若しくは(20)に記載の燐光発光性組成物を含むことを特徴とする有機発光素子。
【0211】
付記(29):
前記陽極は、プラスチック基板上に形成されることを特徴とする付記(27)又は(28)に記載の有機発光素子。
【0212】
付記(30):
前記有機高分子層は、インクジェット法又は印刷法により形成されることを特徴とする付記(27)乃至(29)のいずれか一つに記載の有機発光素子。
【0213】
付記(31):
表示画面を有する表示装置において、
前記表示画面の各画素は、付記(27)乃至(30)のいずれか一つに記載の有機発光素子からなり、
前記各画素は、二又はそれ以上のトランジスタを有することを特徴とする表示装置。
【特許請求の範囲】
【請求項1】
燐光を発光する中性の有機高分子の燐光発光性化合物であって、
前記有機高分子は、ビニル化合物をラジカル重合することによって得られると共に燐光を発光する繰り返し単位である燐光発光性単位、及び、ビニル化合物をラジカル重合することによって得られると共にキャリアを輸送する繰り返し単位であるキャリア輸送性単位を含むと共に、
前記燐光発光性単位の燐光発光性部位は、イリジウム又は白金の錯体の一価基であると共に、
前記イリジウム又は白金の錯体の一価基は、前記有機高分子の主鎖に対してスペーサー部分を介して側鎖として結合すると共に、
該スペーサー部分は、ヘテロ原子を有してもよい炭素数1から30までの有機基又は炭素原子を有しないヘテロ原子数1から10までの無機基を含む
ことを特徴とする、燐光発光性化合物。
【請求項2】
請求項1に記載の燐光発光性化合物において、
前記燐光発光性単位の繰り返し数m及び前記キャリア輸送性単位の繰り返し数nは、
m<n
の関係を満たす
ことを特徴とする、燐光発光性化合物。
【請求項3】
請求項2に記載の燐光発光性化合物において、
前記燐光発光性単位の繰り返し数m及び前記キャリア輸送性単位の繰り返し数nは、
0.0001≦m/(m+n)≦0.2
の関係を満たす
ことを特徴とする、燐光発光性化合物。
【請求項4】
請求項1から3までのいずれか一項に記載の燐光発光性化合物において、
前記有機高分子は、有機溶剤又は水に可溶である
ことを特徴とする、燐光発光性化合物。
【請求項5】
請求項1から4までのいずれか一項に記載の燐光発光性化合物において、
前記有機高分子の重合度は、5から5000までである
ことを特徴とする、燐光発光性化合物。
【請求項6】
請求項1から5までのいずれか一項に記載の燐光発光性化合物において、
前記キャリア輸送性単位のキャリア輸送性部位は、ホール輸送性部位である
ことを特徴とする、燐光発光性化合物。
【請求項7】
請求項1から5までのいずれか一項に記載の燐光発光性化合物において、
前記キャリア輸送性単位のキャリア輸送性部位は、電子輸送性部位である
ことを特徴とする、燐光発光性化合物。
【請求項8】
請求項1から5までのいずれか一項に記載の燐光発光性化合物において、
前記キャリア輸送性単位のキャリア輸送性部位は、ホール輸送性部位及び電子輸送性部位からなる
ことを特徴とする、燐光発光性化合物。
【請求項9】
請求項1から8までのいずれか一項に記載の燐光発光性化合物において、
前記キャリア輸送性単位のキャリア輸送性部位は、カルバゾールの一価基、第3級アミンの一価基、イミダゾール誘導体の一価基、トリアゾール誘導体の一価基、オキサジアゾール誘導体の一価基、及び該基を置換基で置換した基の群より選択された少なくとも一種類以上の基を含む
ことを特徴とする、燐光発光性化合物。
【請求項10】
請求項1から9までのいずれか一項に記載の燐光発光性化合物において、
前記有機高分子は、所定の一色に発光する一種類の又は所定の相互に異なる二色以上に発光する二種類以上の燐光発光性単位を有する
ことを特徴とする、燐光発光性化合物(ただし、化学式
【化31】

によって表される化合物を除く)。
【請求項11】
請求項10に記載の燐光発光性化合物において、
前記燐光発光性単位は、青色又は緑色及び黄色又は赤色に発光する二種類の燐光発光性単位からなると共に、
前記燐光発光性化合物は、全体として白色に発光する
ことを特徴とする、燐光発光性化合物。
【請求項12】
請求項10に記載の燐光発光性化合物において、
前記燐光発光性単位は、青色、緑色、及び赤色に発光する三種類の燐光発光性単位からなると共に、
前記燐光発光性化合物は、全体として白色に発光する
ことを特徴とする、燐光発光性化合物。
【請求項13】
請求項1から12までのいずれか一項に記載の燐光発光性化合物を含むことを特徴とする、燐光発光性組成物。
【請求項14】
相互に異なる色に発光する複数種類の請求項10に記載の燐光発光性化合物を含むことを特徴とする、燐光発光性組成物(ただし、化学式
【化32】

によって表される化合物からなる組成物を除く。)。
【請求項15】
請求項14に記載の燐光発光性組成物において、
前記燐光発光性組成物は、全体として白色に発光する
ことを特徴とする、燐光発光性組成物。
【請求項16】
請求項15に記載の燐光発光性組成物において、
前記燐光発光性組成物は、青色又は緑色に発光する前記燐光発光性化合物及び黄色又は赤色に発光する前記燐光発光性化合物を含む
ことを特徴とする、燐光発光性組成物。
【請求項17】
請求項1から12までのいずれか一項に記載の燐光発光性化合物又は請求項13から16までのいずれか一項に記載の燐光発光性組成物及びキャリア輸送性高分子化合物を含むことを特徴とする、燐光発光性組成物。
【請求項18】
請求項17に記載の燐光発光性組成物において、
前記キャリア輸送性高分子化合物は、ホール輸送性高分子化合物である
ことを特徴とする、燐光発光性組成物。
【請求項19】
請求項17に記載の燐光発光性組成物において、
前記キャリア輸送性高分子化合物は、電子輸送性高分子化合物である
ことを特徴とする、燐光発光性組成物。
【請求項20】
請求項1から12までのいずれか一項に記載の燐光発光性化合物又は請求項13から16までのいずれか一項に記載の燐光発光性組成物及びキャリア輸送性低分子化合物を含むことを特徴とする、燐光発光性組成物。
【請求項21】
請求項20に記載の燐光発光性組成物において、
前記キャリア輸送性低分子化合物は、ホール輸送性低分子化合物である
ことを特徴とする、燐光発光性組成物。
【請求項22】
請求項20に記載の燐光発光性組成物において、
前記キャリア輸送性低分子化合物は、電子輸送性低分子化合物である
ことを特徴とする、燐光発光性組成物。
【請求項23】
陽極及び陰極に挟まれた一つの又は複数の有機高分子層を含む有機発光素子において、
前記有機高分子層の少なくとも一つの層は、請求項1から12までのいずれか一項に記載の燐光発光性化合物又は請求項13から22までのいずれか一項に記載の燐光発光性組成物を含むことを特徴とする、有機発光素子。
【請求項24】
陽極及び陰極に挟まれた一つの又は複数の有機高分子層を含む有機発光素子において、
前記陽極及び前記陽極が設けられる透明基板の間にカラーフィルターを有すると共に、
前記有機高分子層の少なくとも一つの層は、請求項11又は12に記載の燐光発光性化合物又は請求項15又は16に記載の燐光発光性組成物を含む
ことを特徴とする、有機発光素子。
【請求項25】
請求項23又は24に記載の有機発光素子において、
前記陽極は、プラスチック基板上に形成されたものである
ことを特徴とする、有機発光素子。
【請求項26】
請求項23から25までのいずれか一項に記載の有機発光素子において、
前記有機高分子層は、インクジェット法又は印刷法によって形成されたものである
ことを特徴とする、有機発光素子。
【請求項27】
表示画面を有する表示装置において、
前記表示画面の各画素は、請求項23から26までのいずれか一項に記載の有機発光素子を含むと共に、
前記各画素は、二個以上のトランジスタを有する
ことを特徴とする、表示装置。
【請求項1】
燐光を発光する中性の有機高分子の燐光発光性化合物であって、
前記有機高分子は、ビニル化合物をラジカル重合することによって得られると共に燐光を発光する繰り返し単位である燐光発光性単位、及び、ビニル化合物をラジカル重合することによって得られると共にキャリアを輸送する繰り返し単位であるキャリア輸送性単位を含むと共に、
前記燐光発光性単位の燐光発光性部位は、イリジウム又は白金の錯体の一価基であると共に、
前記イリジウム又は白金の錯体の一価基は、前記有機高分子の主鎖に対してスペーサー部分を介して側鎖として結合すると共に、
該スペーサー部分は、ヘテロ原子を有してもよい炭素数1から30までの有機基又は炭素原子を有しないヘテロ原子数1から10までの無機基を含む
ことを特徴とする、燐光発光性化合物。
【請求項2】
請求項1に記載の燐光発光性化合物において、
前記燐光発光性単位の繰り返し数m及び前記キャリア輸送性単位の繰り返し数nは、
m<n
の関係を満たす
ことを特徴とする、燐光発光性化合物。
【請求項3】
請求項2に記載の燐光発光性化合物において、
前記燐光発光性単位の繰り返し数m及び前記キャリア輸送性単位の繰り返し数nは、
0.0001≦m/(m+n)≦0.2
の関係を満たす
ことを特徴とする、燐光発光性化合物。
【請求項4】
請求項1から3までのいずれか一項に記載の燐光発光性化合物において、
前記有機高分子は、有機溶剤又は水に可溶である
ことを特徴とする、燐光発光性化合物。
【請求項5】
請求項1から4までのいずれか一項に記載の燐光発光性化合物において、
前記有機高分子の重合度は、5から5000までである
ことを特徴とする、燐光発光性化合物。
【請求項6】
請求項1から5までのいずれか一項に記載の燐光発光性化合物において、
前記キャリア輸送性単位のキャリア輸送性部位は、ホール輸送性部位である
ことを特徴とする、燐光発光性化合物。
【請求項7】
請求項1から5までのいずれか一項に記載の燐光発光性化合物において、
前記キャリア輸送性単位のキャリア輸送性部位は、電子輸送性部位である
ことを特徴とする、燐光発光性化合物。
【請求項8】
請求項1から5までのいずれか一項に記載の燐光発光性化合物において、
前記キャリア輸送性単位のキャリア輸送性部位は、ホール輸送性部位及び電子輸送性部位からなる
ことを特徴とする、燐光発光性化合物。
【請求項9】
請求項1から8までのいずれか一項に記載の燐光発光性化合物において、
前記キャリア輸送性単位のキャリア輸送性部位は、カルバゾールの一価基、第3級アミンの一価基、イミダゾール誘導体の一価基、トリアゾール誘導体の一価基、オキサジアゾール誘導体の一価基、及び該基を置換基で置換した基の群より選択された少なくとも一種類以上の基を含む
ことを特徴とする、燐光発光性化合物。
【請求項10】
請求項1から9までのいずれか一項に記載の燐光発光性化合物において、
前記有機高分子は、所定の一色に発光する一種類の又は所定の相互に異なる二色以上に発光する二種類以上の燐光発光性単位を有する
ことを特徴とする、燐光発光性化合物(ただし、化学式
【化31】

によって表される化合物を除く)。
【請求項11】
請求項10に記載の燐光発光性化合物において、
前記燐光発光性単位は、青色又は緑色及び黄色又は赤色に発光する二種類の燐光発光性単位からなると共に、
前記燐光発光性化合物は、全体として白色に発光する
ことを特徴とする、燐光発光性化合物。
【請求項12】
請求項10に記載の燐光発光性化合物において、
前記燐光発光性単位は、青色、緑色、及び赤色に発光する三種類の燐光発光性単位からなると共に、
前記燐光発光性化合物は、全体として白色に発光する
ことを特徴とする、燐光発光性化合物。
【請求項13】
請求項1から12までのいずれか一項に記載の燐光発光性化合物を含むことを特徴とする、燐光発光性組成物。
【請求項14】
相互に異なる色に発光する複数種類の請求項10に記載の燐光発光性化合物を含むことを特徴とする、燐光発光性組成物(ただし、化学式
【化32】

によって表される化合物からなる組成物を除く。)。
【請求項15】
請求項14に記載の燐光発光性組成物において、
前記燐光発光性組成物は、全体として白色に発光する
ことを特徴とする、燐光発光性組成物。
【請求項16】
請求項15に記載の燐光発光性組成物において、
前記燐光発光性組成物は、青色又は緑色に発光する前記燐光発光性化合物及び黄色又は赤色に発光する前記燐光発光性化合物を含む
ことを特徴とする、燐光発光性組成物。
【請求項17】
請求項1から12までのいずれか一項に記載の燐光発光性化合物又は請求項13から16までのいずれか一項に記載の燐光発光性組成物及びキャリア輸送性高分子化合物を含むことを特徴とする、燐光発光性組成物。
【請求項18】
請求項17に記載の燐光発光性組成物において、
前記キャリア輸送性高分子化合物は、ホール輸送性高分子化合物である
ことを特徴とする、燐光発光性組成物。
【請求項19】
請求項17に記載の燐光発光性組成物において、
前記キャリア輸送性高分子化合物は、電子輸送性高分子化合物である
ことを特徴とする、燐光発光性組成物。
【請求項20】
請求項1から12までのいずれか一項に記載の燐光発光性化合物又は請求項13から16までのいずれか一項に記載の燐光発光性組成物及びキャリア輸送性低分子化合物を含むことを特徴とする、燐光発光性組成物。
【請求項21】
請求項20に記載の燐光発光性組成物において、
前記キャリア輸送性低分子化合物は、ホール輸送性低分子化合物である
ことを特徴とする、燐光発光性組成物。
【請求項22】
請求項20に記載の燐光発光性組成物において、
前記キャリア輸送性低分子化合物は、電子輸送性低分子化合物である
ことを特徴とする、燐光発光性組成物。
【請求項23】
陽極及び陰極に挟まれた一つの又は複数の有機高分子層を含む有機発光素子において、
前記有機高分子層の少なくとも一つの層は、請求項1から12までのいずれか一項に記載の燐光発光性化合物又は請求項13から22までのいずれか一項に記載の燐光発光性組成物を含むことを特徴とする、有機発光素子。
【請求項24】
陽極及び陰極に挟まれた一つの又は複数の有機高分子層を含む有機発光素子において、
前記陽極及び前記陽極が設けられる透明基板の間にカラーフィルターを有すると共に、
前記有機高分子層の少なくとも一つの層は、請求項11又は12に記載の燐光発光性化合物又は請求項15又は16に記載の燐光発光性組成物を含む
ことを特徴とする、有機発光素子。
【請求項25】
請求項23又は24に記載の有機発光素子において、
前記陽極は、プラスチック基板上に形成されたものである
ことを特徴とする、有機発光素子。
【請求項26】
請求項23から25までのいずれか一項に記載の有機発光素子において、
前記有機高分子層は、インクジェット法又は印刷法によって形成されたものである
ことを特徴とする、有機発光素子。
【請求項27】
表示画面を有する表示装置において、
前記表示画面の各画素は、請求項23から26までのいずれか一項に記載の有機発光素子を含むと共に、
前記各画素は、二個以上のトランジスタを有する
ことを特徴とする、表示装置。
【図1】


【図2】


【図3】


【図4】




【図2】


【図3】


【図4】


【公開番号】特開2011−1553(P2011−1553A)
【公開日】平成23年1月6日(2011.1.6)
【国際特許分類】
【出願番号】特願2010−166645(P2010−166645)
【出願日】平成22年7月26日(2010.7.26)
【分割の表示】特願2002−112352(P2002−112352)の分割
【原出願日】平成14年4月15日(2002.4.15)
【出願人】(000004352)日本放送協会 (2,206)
【出願人】(000002004)昭和電工株式会社 (3,251)
【Fターム(参考)】
【公開日】平成23年1月6日(2011.1.6)
【国際特許分類】
【出願日】平成22年7月26日(2010.7.26)
【分割の表示】特願2002−112352(P2002−112352)の分割
【原出願日】平成14年4月15日(2002.4.15)
【出願人】(000004352)日本放送協会 (2,206)
【出願人】(000002004)昭和電工株式会社 (3,251)
【Fターム(参考)】
[ Back to top ]

