物質の相互作用探索システム
本発明は、生理活性物質と同じ分子の相互作用を探索する方法と、生体内および試験管内の両方ともから標的分子をスクリーニングする方法に関する。本発明は、第1の探索物質と第2の探索物質を提供し、ここで第1の探索物質は外部から印加される作用力により位置が移動する移動反応物質(localizer)と結合し、第2の探索物質は標識物質(label)と結合する。
したがって、第1の探索物質と第2の探索物質の複合体は、外部から印加される作用力の強さを変化させることによって可逆的に探索され、これによって標的分子を効果的にスクリーニングすることができる。
したがって、第1の探索物質と第2の探索物質の複合体は、外部から印加される作用力の強さを変化させることによって可逆的に探索され、これによって標的分子を効果的にスクリーニングすることができる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、in vitroおよびin vivoで相互作用を分析するための物質、例えば、生理活性物質等の相互作用(interaction)をリアルタイムで躍動的に探索する方法に関する。また、本発明は、in vitroおよびin vivoで相互作用を分析するための物質、例えば、生理活性物質等の相互作用を探索し、目的とする標的物質を検出する方法に関する。
【背景技術】
【0002】
一般に生理活性化合物(chemical compound)は、生体内でタンパク質、核酸、糖または脂質などを含む生体物質と結合し、これらの機能または活性を調節する化合物を意味する。このような生理活性化合物は、有機体から抽出される、或いは化学的合成により収得される。例えば、臓器移植時発生する免疫拒否反応を軽減させるために用いられる”サイクロスポリンA”(Novartis AG)および”FK506”(Fujisawa)を始めとし、多くの抗生物質等(antibiotics)が微生物、植物または海洋生物から分離された。このような天然または合成生理活性化合物は、これの薬理活性をテストし、動物およびヒトをモデルとした臨床試験を経て一つの新薬として開発される。しかし、天然生理活性化合物の中の多くがその構造の複雑性、精製および分離技術の限界などを理由に産業的大量生産に適していない。したがって、有用な生理活性化合物を大量に生産するための方法として合成化学(combinatorial chemicals)および新しい有機合成法が研究された(参考文献:Schreiber,S.,2000,Target-oriented and diversity-oriented organic synthesis in drug discovery,Science 287,1964-1969)。
【0003】
生体内のタンパク質は、他のタンパク質と結合することによりその機能を表す。一般に相補的な構造の二つのタンパク質は相互作用し、生理活性化合物はタンパク質三次構造の特定部位に特異的に結合する。一般に二つのタンパク質間の相互作用は、これらのタンパク質が機能的に関連があるということを強く暗示し、タンパク質の特定部位に特異的に結合する生理活性化合物は、そのタンパク質の活性を調節することにより、例えば、疾患関連のタンパク質の場合、疾患を診断、予防、治療または軽減させることができる治療剤としての開発の可能性を提示する。したがって、新薬開発分野ではすでにその機能および特性が明らかにされた物質である”ベイト”と、探索および検出の対象となる相互作用パートナーである”プレイ”の相互作用を確認することによって新規標的タンパク質を検出したり、或いは新薬候補物質として生理活性物質をスクリーニングするための多様な方法が研究されている。現在まで疾患と関連し、約500個の標的タンパク質が明らかにされており、今後数年内に約5,000個以上まで増加するものと予想される。
【0004】
ヒトゲノムの解析以後、生理活性物質が細胞内の数々の代謝および信号伝達過程において行う役割についての多様な研究がより急速になされた。化学遺伝体学(chemical genomics)、化学生物学(chemical biology)および化学タンパク質体学(chemical proteomics)等の研究分野が出てき、これらは分析デザイン(analysis design)、機能遺伝体学(functional genomics)、タンパク質体学(proteomics)、自動化工学(automatic engineering)および生物情報学(bioinformatics)等、多様な技術の発達と関係する。
【0005】
タンパク質間の相互作用を探索するためのin vitro方法として、通常、生物化学的方法、例えば、交差結合(cross-linking)、放射性標識リガンド結合(radiolabeled ligand binding)、X-線クリスタログラフィーおよび親和クロマトグラフィー(affinity chromatography)、親和ブロッティング(affinity blotting)、免疫沈降法(immunoprecipitation)および質量分析法(mass spectrometry)等が、開発され利用された(参考文献:E.M.Phizicky and S.Fields,Microbiol.Rev.,59:94-123,1995;A.R.Mendelsohn and R.Brent,Science,284:1948-1950,1999)。
【0006】
しかしながら、これらの方法は多くの努力を要するタンパク質の生産および分離過程を要求し、in vitroで行われる相互作用であるため、細胞内の相互作用と一致する情報を提供することができないという短所がある。
【0007】
このような短所を克服するためにいくつかの機能的クローニング(functional cloning)、例えば、イースト・ツー・ハイブリッド(yeast two-hybrid;Y2H)、イースト・スリー・ハイブリッド(Y3H;参考文献:Licitra、E.J.,and Liu,J.O.,1996,A three-hybrid system for detecting small ligand-protein receptor interactions.Proc.Natl.Acad.Sci.USA 93,12817-12821)、ドラッグ-ウェスタン(drug-western;参考文献:Tanaka,H.,Ohima,N.,and Hidaka,H.1999,Isolation of cDNAs encoding cellular drug-binding proteins using a novel expression cloning procedure:drug-western.Mol.Pharmacol.55,356-363)、ファージディスプレイクローニング(参考文献:Sche,P.P.,McKenzie,K.M.,White,J.D.,and Austin,D.J.1999,Display cloning:functional identification of natural product receptors using cDNA-phage display.Chem.Biol.6,707-716)、蛍光共鳴エネルギー転移(fluorescence resonance energy transfer,FRET;参考文献:MoshinskyDJ,Ruslim L.,Blake RA,Tang F.,A widely applicable,high-throughput TR-FRET assay for the measurement of kinase autophosphorylation:VEGFR-2 as a prototype.J Biomol Screen.2003 Aug;8(4):447-52)およびmRNAディスプレイクローニング(参考文献:McPherson,M.,Yang,Y.,Hammond,P.W.,and Kreider,B.L.,2002,Drug receptor identification from multiple tissues using cellular-derived RNA display libraries.Chem.Biol.9,691-698)等が、開発された。
【0008】
ところが、これらの中、イースト・ツー・ハイブリッド(yeast two-hybrid)システムは、ゲノムの大きさが大きく、且つ複雑な場合、結果に対する信頼度が低く、解析が難しくなるため、これをヒトに対して適用するに困難がある。また、タンパク質の本来の細胞内の分布位置によりシステムを選択しなければならず、良質のライブラリー確保の問題および細胞の代謝および成長によって転写活性に影響を与えられ得、ハイブリッド・タンパク質が毒性を示すことがある。
【0009】
一方、Y3Hは、生理活性化合物とタンパク質との相互作用に対する探索が生きている細胞内でなされるという点を特徴とする。しかしながら、Y3HもやはりY2Hと同じように、酵母細胞のような単純な細胞内で行われなければならない限界があり、全長膜タンパク質(full-length membrane protein)の分析に適しておらず、酵母の内因性タンパク質の翻訳後修飾(post translational modification)または付加のタンパク質(accessory protein)が必要な生理活性化合物とタンパク質間の相互作用には適用が難しい。特に、酵母細胞は、ほ乳動物細胞に比して、生理活性化合物に対して遺伝的により低い透過性を有するという問題がある。
【0010】
その他に生物情報学的方法を用いてタンパク質間の相互作用を予測する生物情報学的方法が開発された。この方法は、データベース化されたゲノム序列情報に基づいて系統分類学的または複数のシーケンスアラインメント(multiple sequence alignment)を介し、タンパク質間の相互作用を予測する方法である。また、構造遺伝体学(structural genomics)、分子指紋(molecular fingerprint)および多様なクラスター分析法などは、比較的、最近開発されたもので、バーチャルスクリーニング(virtual screening)法である。
【0011】
このようにタンパク質間の相互作用を探索するための多くの方法が提案されたが、より効果的で、且つ操作が容易な方法に対する要求は持続している。
また、標的タンパク質との相互作用を利用して生理活性化合物を探索するための多様な技術が開発された。例えば、生化学的方法として、ディングなど(Ding,S.et al.)は親和クロマトグラフィー(affinity chromatography)を用いてプリン系分子(purine-like molecules)のライブラリーをスクリーニングしてP19幹細胞を神経細胞に分化誘導する化合物を検出した(参考文献:Ding,S.,T.Y.H.,Brinker,A.,Peters,E.C.,Hur,W.,Gray,N.S.,and Schultz,P.G.2003,Synthetic small molecules that control stem cell fate.Proc.Natl.Acad.Sci.USA 100、7632-7637)。
【0012】
しかしながら、この方法は親和力が極めて高くなければ探索に適用できないという短所があり、さらに、標的タンパク質が多量に存在してこそ始めて効果的な検出が可能である。また、大部分の生理活性化合物は、疏水性(hydrophobic)であって、水溶性の環境において目的とする標的分子と競争的に結合するため、生理活性化合物を固定化させたアガロース(agarose)または他の支持体に検出対象の抽出物を通過させる場合、タンパク質は特異的結合パートナーのみならず非特異的結合パートナーとも結合を形成する。したがって、この方法の場合、親和力の低い結合分子を除去するための洗滌段階が必須に要求される。
【0013】
このような生化学的方法の短所を克服するため、遺伝的方法が提案された。ジョン等(Zheng et al.)は、異型接合体(heterozygote)および宿主で増加した薬物感受性を探索するため、イースト・スリー・ハイブリッド・システムを利用した。このような遺伝的方法の最も大きな長所は、表現型と遺伝型間の強力な連関性である。すなわち、このシステムを利用した探索の結果、発見される一つのヒットは、標的タンパク質に対する遺伝子のクローンを直接的に提供する(参考文献:Jaeger,S.,Eriani,G.,and Martin,F.2004,Results and prospects of the yeast three-hybrid system.FEBS Lett.566,7-12)。このシステムでは新規標的タンパク質候補が多価タンパク質複合体の一部として融合して利用され得る。ところが、このシステムはイーストに限定され利用しなければならないという短所がある。
【0014】
化学遺伝学は、遺伝子突然変異(mutations)が細胞に及ぼす影響を示すために生理活性化合物を用いるものであって、化合物群または組合せライブラリー(combinatorial library)より目的とする活性化合物を同定する(参考文献:Schreiber,S.L.2003,The small molecule approach to biology.Chem.& Eng.1199 News 81,51-61;Crews,C.M.,and Splittgerber,U.1999,chemical genetics:exploring and controlling cellular processes with chemical probes.Trends Biochem.Sci.24,317-320)。この方法は、通常マイクロタイター用プレートのウェル内に、目的とする表現型を探索するために遺伝子操作された細胞と共に数百ないし数千個の化合物を配列することによって行われる(参考文献:Clemons,P.A.,Koehler,A.N.,Wager,B.K.,Springs,T.G.,Spring,D.R.,King,R.W.,Schreiber,S.L.,and Foley,M.A.2001,A one-bead,one-stock solution approach to chemical genetics:part 2.Chem.Biol.6,71-83)。例えば、目的とする結果が特定遺伝子または遺伝子群の発現を誘発させるものである場合、細胞は緑色蛍光タンパク質(GFP)または他の常用マーカー(marker)の発現を誘発する関連したプロモーター(promoter)が挿入されたリポーター構成物を含む。しかしながら、この方法もやはり次のような2つの大きな問題点があることが明らかにされた。第一に、化学遺伝学は、微量のnM単位で作用する生理活性化合物を探索するに適していない。第二に、この方法は典型的には数十万個の物質に対するスクリーニングを介し、わずか何個かの活性物質しか捜し出すことができない。
【0015】
上述の通り、タンパク質間の相互作用を探索する、或いはタンパク質と生理活性化合物間の相互作用を探索するための従来技術は、大部分in vitroで行われるか、酵母またはバクテリアなど制限された細胞内だけで行われることができ、遺伝子操作および発現の過程を経なければならないため、DNAの大きさが制限され、その他に他の媒介変数による高い偽陽性率(false positive hit)によって検出された結果の信頼度が落ちる。
【0016】
これに本発明者等は、前記従来技術の問題点を克服し、in vitroだけでなくin vivoで生理活性物質等の相互作用をリアルタイムで躍動的に探索するために研究したところ、磁場によって移動することができる磁性を示す物質または磁性物質を含む粒子(magnetic-material/-particle)に生理活性物質を結合させ、探索のための標識物質が結びついた他の生理活性物質を細胞内に導入した後、細胞に磁場を印加し、磁場下において移動した標識の位置を測定し、これらの生理活性物質等間の結合有無を探索、検証することによって本発明が完成した。
【発明の開示】
【発明が解決しようとする課題】
【0017】
一般に本発明はin vivoすなわち、細胞内、組織内または生体内およびin vitroすなわち、細胞外で相互作用を分析しようとする物質等(molecules)、例えば、生理活性物質等間の相互作用をリアルタイムで探索して標的物質を検出するための方法を提供することを目的とする。具体的に本発明はin vitroおよびin vivoにおいて特定生理活性物質である”第1の探索物質”と、探索および検出対象の生理活性物質である”第2の探索物質”との間の相互作用を直接的に探索する方法を提供することを目的とする。
【0018】
また、本発明はin vitroおよびin vivoにおいて”第1の探索物質”と”第2の探索物質”との相互作用を直接的に探索して目的とする標的物質を検出する方法に関する。
【0019】
また、本発明はin vitroおよびin vivoにおいて”第1の探索物質”と”第2の探索物質”との相互作用を直接的に探索するためのキット(kit)またはチップ(chip)を提供することを目的とする。
【0020】
また、本発明は”第1の探索物質”と”第2の探索物質”との相互作用を抑制(blocking)または阻害(inhibiting)させる、或いは促進(activating)または誘導(inducing)させるための標的物質を探索して目的とする標的物質を検出する方法として利用され得る。
【0021】
また、本発明はin vitroおよびin vivoにおいて細胞の形態または機能変化を観察し、”第1の探索物質”と”第2の探索物質”との相互作用を間接的に探索する方法に関する。
【発明を実施するための最良の形態】
【0022】
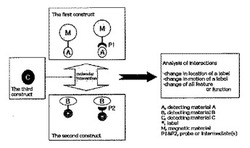
前記の目的を達成するために本発明者等は、2つの構成物(constructs)をデザインした。具体的に、外部から印加される作用力(externally applied driving force)により位置が変化する移動反応物質(localizer)を提供し、この物質に分析しようとする一つ以上の”第1の探索物質”、例えば、生理活性物質を直接またはリンカーなどを用いて間接的に結合させた第1構成物を製作した。第1構成物の移動反応物質と分析しようとする探索物質は、直接的に融合した一つの構成物に提供され得る。また、第1構成物は、分析しようとする探索物質を認識できる探針(probe)が融合した移動反応物質と分析しようとする一つ以上の探索物質とが間接的に結びついた二つ以上の構成物に提供され得る。第2構成物は、探索が可能なように、一つ以上の標識物質(label)が結びついた1個または数個の第2の探索物質、例えば、生理活性物質を含む。
【0023】
第2構成物の標識物質と分析しようとする生理活性物質は、直接的に融合した一つの構成物に提供され得る。また、第2構成物は分析しようとする生理活性物質を認識できる探針(probe)が融合した標識物質と分析しようとする一つ以上の生理活性物質とが間接的に結びついた二つ以上の構成物に提供され得る。前記第1構成物および第2構成物を同じフィールド(field)またはシステム(system)において相互作用(interaction)できる位置に接近させた後、外部から作用力を印加し、位置または動きが変化した標識を簡単な装置で測定することによって相互作用により形成された複合体(complex)をリアルタイムで躍動的に探索することができる。また、細胞の形態または機能の変化を測定し、相互作用を間接的に探索することができる。本発明において第1の探索物質が”ベイト(bait)”となった場合、第2の探索物質は”プレイ(prey)”となり、第2の探索物質が”ベイト”となった場合、第1の探索物質は”プレイ”として利用され得る。本発明において標識の位置または動きの変化は顕微鏡を含む光学的方法、スキャナー(scanner)、放射性標識感知手段、FPリーダー(fluorescence polarization reader)、スペクトロフォトメーター(spectrophotometer)、MRI(magnetic resonance imaging)、SQUID、蛍光検出器、発光検出器など、一般に広く知られた方法を用いて測定することができる。
【0024】
具体的に、本発明において物質の相互作用探索方法は、i)外部作用力(externally applied driving force)により位置移動する移動反応物質(localizer)と第1の探索物質とを結合させた第1構成物(construct)を提供する段階と、ii)探索のための標識物質(label)が結びついた第2の探索物質を含む第2構成物を提供する段階と、iii)同じフィールド(field)またはシステム(system)において前記第1構成物と第2構成物を相互作用が可能な位置に接近させる段階と、iv)外部作用力を印加して位置または動きが変化した標識を測定する段階と、を含む。
【0025】
また、本発明において標的物質の検出方法は、i)外部作用力により位置移動する移動反応物質と第1の探索物質とを結合させた第1構成物を提供する段階と、ii)探索のための標識物質(label)が結びついた第2の探索物質を含む第2構成物を提供する段階と、iii)同じフィールドまたはシステムにおいて前記第1構成物と第2構成物を相互作用が可能な位置に接近させる段階と、iv)外部作用力を印加し、位置または動きが変化した標識を測定する段階と、v) 第2構成物に含まれた物質を分離して同定する段階と、を含む。標的物質の検出は、公知の方法、例えば、RT-PCR、ゲノムDNAに対するPCRまたは質量分析(Mass Spectroscopy)により行われ得る。
【0026】
また、本発明は3つの構成物を製造し、物質の相互作用を探索して標的物質を検出することができる。具体的に、i)外部作用力により位置移動する移動反応物質と第1の探索物質とを結合させた第1構成物を提供する段階と、ii)標識物質(label)が結びついた第2の探索物質を含む第2構成物を提供する段階と、iii)探索のための物質を含む第3構成物を提供する段階と、iv)同じフィールドまたはシステムにおいて前記第1構成物、第2構成物と第3構成物を相互作用が可能な位置に接近させる段階と、v)外部作用力を印加し、位置または動きが変化した標識を測定する段階とを含む物質の相互作用を探索する段階と、vi) 第3構成物に含まれた物質を分離して同定する段階と、を含む。標的物質の検出は公知の方法、例えば、RT-PCR、ゲノムDNAに対するPCRまたは質量分析(Mass Spectroscopy)により行われ得る。
【0027】
本発明において第1構成物、第2構成物または第3構成物を構成する、探索しようとする対象物質はライブラリー(library)形態に提供され得る。
【0028】
一具体例として、本発明は外部から印加される作用力として磁気力(magnetic force)を利用した。第1構成物を構成する移動反応物質として、磁性物質を含むナノ粒子(nano-particle)、好ましくは直径5 nmないし2,000 nmの物質を提供し、前記移動反応物質に特定物質、例えば生理活性物質を結合またはコーティングして用いる。移動反応物質は2つ以上の特定物質と結合される、或いはこれら物質でコーティングされ提供され得る。第2構成物は第1構成物の中の生理活性物質と相互作用するパートナーとして探索のための標識が付着した他の生理活性物質を製造して利用する。前記第1構成物と第2構成物を同じ細胞内に導入し、外部から磁場を印加した後、磁場下において移動した標識を測定することによって目的とする標的物質をリアルタイムで探索する。また、磁場の強さを変化させることによってより躍動的な探索を行うことができ、磁場の強さを変化させる間、位置変化する、或いは変化しない物質を陽性または陰性対照区として用いて比較探索することができる。
【0029】
もう一つの例として、本発明はi)特定の生理活性化合物を磁性粒子にコーティングして提供する段階と、ii)段階i)のコーティングされた磁性粒子を標識物質が結びついたタンパク質を含む細胞内に伝達する段階と、iii)段階ii)の細胞に対して磁場を印加し、細胞内磁性粒子を移動させる段階と、iv)標識の位置または動きを測定する段階と、v)標識が位置または動きの変化を示す細胞から標識が付着した標的物質を検出、糾明する段階と、を含む。
【0030】
本発明をin vivoで行った場合、真核細胞、原核細胞、ほ乳動物の生体内、組織内および細胞内、植物の生体内、組織内および細胞内で行うことができる。特に、本発明はゼブラフィッシュ(Zebra fish)、線虫(C.elegans)、酵母(Yeast)、ミバエ(Fly)またはカエル(Frog)の細胞内、組織内または生体内でも行われ得る。本発明において第1構成物および第2構成物は細胞伝達性ペプチド(transducible peptideまたはfusogenic peptide)、脂質遺伝子伝達体(lipidまたはliposome)またはこれらの結合体を用いる、或いは第1構成物および第2構成物をOpti-MEM培地で細胞と培養する、或いはエレクトロポレーション(electroporation)またはマグネトフェクション(magnetofection)等、一般に広く知られた方法により容易に細胞内に伝達することができる。特に、本発明の方法を細胞内で行った場合、培養プレート(culture plate/dish)またはマイクロアレイ(microarray)化された生きている細胞内で行うことができる。
【0031】
本発明において外部から印加される作用力は、第1構成物に含まれる移動反応物質の物理的、化学的、生物学的および静電気的特性を含む特性により適切に選択することができる。例えば、光ピンセット(optical tweezer)等を含む光学機構を利用して外部作用力を印加することができる。
【0032】
本発明において”生理活性物質”は、核酸(nucleic acid)、ヌクレオチド(mono-/oligo-/poly-nucleotide)、タンパク質(protein)、ペプチド(mono-/oligo-/poly-peptide)、アミノ酸(amino acid)、糖(mono-/oligo-/poly-saccharide)、脂質(lipid)、ビタミン、化合物(chemical compoundなど)とこれらを構成する要素などをはじめとし、生体内で生理的な活性を示すすべての物質を含む。
【0033】
本発明において”ベイト(bait)”は、他の生理活性物質との相互作用を探索するのに利用される生理活性物質を意味する。
【0034】
本発明において”プレイ(prey)”は、前記”ベイト”の相互作用パートナーとして探索または検出しようとする対象となる生理活性物質を意味する。
【0035】
本発明において”標的物質”とは、”ベイト”と相互作用する”プレイ”または”ベイト”と”プレイ”物質の相互作用を促進(activating)または誘導(inducing)する、或いは抑制(blocking)または阻害(inhibiting)する、糾明しようとするすべての物質を意味する。
本発明において”移動反応物質”(localizer)とは、外部から印加される作用力(externally applied driving force)に反応して位置移動する物質を意味する。
【0036】
本発明において外部から印加される”作用力”は、電気力、電磁気力、磁気力および重力を含み、第1構成物の中、前記定義された移動反応物質の位置変化をもたらすことができるすべての種類の力(force)を指す。
【0037】
本発明において第2構成物を構成し、探索に用いられる標識物質はそれ自体として蛍光を示したり、他の物質との相互作用により蛍光性を示す蛍光物質(fluorescent material)、例えば、FITC、rhodamine などの蛍光染料とGFP、YFP、CFPおよびRFPなどの蛍光タンパク質およびテトラシステーン蛍光性モチーフ(tetracystein motif)であるか、それ自体として発光を出したり、第1構成物または他の物質との相互作用により発光を示す発光体(luminescent material)、例えば、ルシフェラーゼ(luciferase)等と、放射性標識(radioactive label)、例えば、32P、35S、3Hおよび14Cなどを含み、一般に使用可能な標識をすべて含む。
【0038】
本発明において生理活性物質と移動反応物質間の結合または生理活性物質と標識物質間の結合は、物理的、化学的、静電気的および生物学的な直接または間接結合を含み、生理活性物質は移動反応物質または標識物質の表面にコーティングされて利用され得る。
【0039】
本発明において第1構成物または第2構成物を構成して探索に利用される探針(probe)は、生理活性物質と物理的、化学的、静電気的および生物学的に結合し、探索物質と位置調節因子または生理活性物質と標識物質を直接または間接的に結合させることができる物質、例えば、抗体(antibody)、タンパク質(protein)、タンパク質ドメイン(domain)、タンパク質モチーフ(motif)、ペプチドなどをいずれも含む。
【0040】
以下では本発明を実施例に基づいてより詳細に記述する。本発明の下記実施例は本発明を具体化するだけのものであって、当然ながら本発明の権利範囲を制限したり、限定するものではない。本発明の詳細な説明および実施例から本発明が属す技術分野の専門家が容易に類推できるということは本発明の権利範囲に属すとして解釈される。本発明において引用された参考文献は、本発明に参考として統合される。
【実施例1】
【0041】
蛍光染料であるFITCでコーティングされたナノ粒子を用いた細胞内の位置変化の確認
ストレプトアビジンをコンジュゲーションしたスーパーパラマグネティックナノ粒子(50 nm;ストレプトアビジンナノ粒子)をFITC-ビオチンおよびTATHA2-ビオチンと反応させ、スーパーパラマグネチックナノ粒子(MNPs)をFITCでコーティングしたFITC-MNP-TATHA2複合体を収得した。TATHA2ペプチドは従来技術により合成して(参考文献:Wadia,et al.,Nat Med.10:310-315 (2004))、N-末端部をビオチンで標識した。陰性対照区では外部印加された磁場により位置変化を起こさないナノ粒子であるQD565をTATHA2-ビオチンと反応させてQD565-TATHA2複合体を収得した。あらかじめ培養されたヘラ細胞(HeLa cell、ATCCから購入)を血清を含まないDMEMで洗滌した後、Opti-MEM(Invitrogen)培地にFITC-MNP-TATHA2複合体とQD565-TATHA2複合体とを各々混合した溶液を細胞に処理し、細胞を37°Cに固定されたCO2インキュベーターで12時間の間、培養してFITC-MNP-TATHA2およびQD565-TATHA2複合体をHeLa細胞内に導入した。細胞を共焦点顕微鏡の焦点プレート上に移して底面に市販中の永久磁石または電磁石で磁気力を印加した。共焦点顕微鏡の焦点プレートを調節して細胞底面に移動したナノ粒子の蛍光を観察した(図2)。FITC-MNP-TATHA2が導入された細胞でのみ外部磁場によりFITC-MNP-TATHA2複合体が位置移動することが確認されており、陰性対照区(negative control)として用いたQD565-TATHA2が導入された細胞では磁場による位置の変化が見られなかった。
【実施例2】
【0042】
多様な生理活性物質間の細胞内の相互作用の探索
1)蛍光タンパク質との融合タンパク質と生理活性低分子化合物がコーティングされたナノ粒子を用いた細胞内の相互作用の探索;ストレプトアビジンナノ粒子をFK506-ビオチンと反応させてスーパーパラマグネチックナノ粒子(MNPs)を生理活性低分子(FK506)でコーティングした(MNP-FK506)。EGFPタンパク質とFKBP-RFP融合タンパク質を発現するヘラ細胞(HeLa cell)を血清を含まないDMEMで洗滌した後、細胞を37°Cに固定されたCO2インキュベーターで12時間の間MNP-FK506とOpti-MEM(Invitrogen)を混合した培地で培養し、MNP-FK506を HeLa 細胞内に導入した。細胞を共焦点顕微鏡の焦点プレート上に移して底面に永久磁石または電磁石で磁気力を印加した。
【0043】
共焦点顕微鏡の焦点プレートを調節して細胞底面に移動した蛍光タンパク質を観察した(図3)。FKBP12-RFP融合タンパク質を発現する細胞(赤色)のみが外部磁場により位置移動し、陰性対照区(negative control)として用いたEGFPを発現する細胞(緑色)の場合、磁場による位置変化が見られなかった。
【0044】
2) FK506とこれの薬剤学的に関連した結合パートナーであるFKBP12(FK506 binding protein 12)の細胞内の相互作用の検証:ストレプトアビジンナノ粒子をFK506-ビオチンおよびTATHA2-ビオチンと4°Cで1時間の間、混合しながら反応させてFK506-MNPs複合体を収得した。結合しないリガンドを除去するために反応溶液を電磁石あるいは永久磁石を用いて精製した。HeLa細胞にRFPと融合したFHBP12(FKBP-RFP)またはEGFPを発現させるプラスミドをそれぞれ導入した後、この細胞を採って混ぜた後、培養器で共に培養した。次にこれらの細胞に前記製造したFK506-MNPs複合体を導入した後、永久磁性体または電磁石を用いて磁場(M.F.,Magnetic Field)を外部から印加した。
【0045】
共焦点レーザー顕微鏡(Carl Zeiss)を用いて磁場下において、および磁場を印加しない状態で生きている細胞の共焦点映像を撮影した。図4の写真においてRFPと融合したFKBP12を発現する細胞(赤色矢印で表す)だけ外部磁場により位置移動し、陰性対照区として用いたEGFPを発現する細胞(緑色矢印で表す)の場合、磁場による位置変化が見られなかった。
【0046】
3)キャスペース-3抑制剤(caspase-3 inhibitor)ペプチドとこれの結合パートナーであるキャスペース-3の細胞内相互作用の検証:ストレプトアビジンナノ粒子をキャスペース-3抑制剤II[caspase-3 inhibitorII(DEVD)]-ビオチンコンジュゲート(biotin conjugate;CALBIOCHEM)およびTATHA2-ビオチンと4°Cで1時間の間、混合しながら反応させてDEVD-MNPs複合体を収得した。結合しないリガンドを除去するために複合体を永久磁性体を用いて精製した。HeLa細胞にmRFPと融合したキャスペース-3(mRFP-Caspase3)またはEGFPを発現させるプラスミドをそれぞれ導入した後、この細胞を採って混ぜた後、培養器で共に培養した。次にこれらの細胞に前記製造したRDEVD-MNPsを導入した後、永久磁性体または電磁石を用いて、磁場を外部から印加した。
【0047】
共焦点レーザー顕微鏡(Carl Zeiss)を用いて、磁場下において、および磁場を印加しない状態で生きている細胞の共焦点映像を撮影した。図5の写真においてmRFP-Caspase3を発現する細胞(赤色矢印で表す)のみが外部磁場により位置移動し、陰性対照区(negative control)として用いたEGFPを発現する細胞(緑色矢印で表す)の場合、磁場による位置変化が見られなかった。
【0048】
4) IκBαタンパク質とこれの結合パートナーであるRelAタンパク質の細胞内の相互作用の検証:ストレプトアビジンナノ粒子をFK506-ビオチンおよびTATHA2-ビオチンと4°Cで1時間の間、混合しながら反応させてFK506-MNPs複合体を収得した。結合しないリガンドを除去するために複合体を永久磁性体を用いて精製した。
【0049】
HeLa細胞にEGFPおよびEFKBP12と融合したIκBα(IκBα-ECFP-FKBP12)およびEYFPと融合したRelA(EYFP-RelA)を発現させるプラスミドを共に導入した上、これら細胞に前記製造したFK506-MNPsを導入した後、永久磁性体または電磁石を用いて磁場を外部から印加した。共焦点レーザー顕微鏡(Carl Zeiss)を用いて、磁場下において、および磁場を印加しない状態で生きている細胞の共焦点映像を撮影した。図6の写真から見られるように外部印加された磁場によりIκBα-ECFP-FKBP12融合タンパク質とEYFP-RelA融合タンパク質が外部印加された磁場により位置移動した。
【0050】
5) IκBαタンパク質とこれに対する抗体であるanti-phospho-IB抗体の細胞内相互作用の検証:ストレプトアビジンナノ粒子をanti-phospho-IκBα-ビオチンおよびTATHA2-ビオチンと4°Cで1時間の間、混合しながら反応させてanti-phospho-IκBα-MNPs複合体を収得した。結合しないリガンドを除去するために複合体を永久磁性体を用いて精製した。HeLa細胞にmRFPと融合したIκBα(IκBα-mRFP)を発現させるプラスミドを導入した上、TNFを5分間処理してから永久磁性体または電磁石を用いて磁場を外部から印加した。共焦点レーザー顕微鏡(Carl Zeiss)を用いて、磁場下において、および磁場を印加しない状態で生きている細胞の共焦点映像を撮影した(図7)。
【0051】
6) GAL4タンパク質とGAL4タンパク質との結合部位を有するオリゴヌクレオチド(UAS)の細胞内の相互作用の検証:酵母の転写活性因子であるGAL4タンパク質が結合できるDNA塩基配列であるUAS (配列番号:1)を含むオリゴヌクレオチド、ビオチン-CCGAGTTTCTAGACGGAG(UAS-ビオチン)を合成した。ストレプトアビジンナノ粒子をUAS-ビオチンおよびTATHA2-ビオチンと4°Cで1時間の間、混合しながら反応させてUAS-MNPs複合体を収得した。結合しないリガンドを除去するために複合体を永久磁性体を用いて精製した。HeLa細胞にEGFPと融合したGAL4(GAL4-EGFP)を発現させるプラスミドを導入した上、これら細胞に前記製造したUAS-MNPsを導入した後、永久磁性体または電磁石を用いて磁場を外部から印加した。共焦点レーザー顕微鏡(Carl Zeiss)を用いて、磁場下において、および磁場を印加しない状態で生きている細胞の共焦点映像を撮影した(図8)。
【0052】
7) miRNAとmRNAの細胞内の相互作用の検証:miRNAとその細胞内の標的であるmRNAの相互作用を検証するために、lin-28 mRNAに結合するlet-7b miRNA(配列番号:2)を選択した(図9)。let-7b miRNAはUGAGGUAGUAGGUUGUGUGGUU-ビオチンの構造で合成して(let-7b-ビオチン)、lin-28 mRNA (配列番号:3)を標識するため、FITC-CCCTATAGTGAGTCGTATTA(FITC-lin28p)を合成した。ストレプトアビジンナノ粒子をlet-7b-ビオチンおよびTATHA2-ビオチンと4°Cで1時間の間、混合しながら反応させてlet7b-MNPs複合体を収得した。結合しないリガンドを除去するために複合体を永久磁性体を用いて精製した。HeLa細胞にlin-28 mRNAを発現させるプラスミドを導入した上、これら細胞に前記製造したlet7b-MNPsとFITC-lin28pを導入した後、永久磁性体または電磁石を用いて磁場を外部から印加した。共焦点レーザー顕微鏡(Carl Zeiss)を用いて、磁場下において、および磁場を印加しない状態で生きている細胞の共焦点映像を撮影した(図10)。
【0053】
8)ベータ-サイクロデキストリンとMBPタンパク質の細胞内の相互作用の検証:ベータ-サイクロデキストリン(Sigma)はEZ-Link NHS-PEO Solid Phase Biotinylation kit(Pierce)を用いてビオチン化(CD-ビオチン)した。ストレプトアビジンをCD-ビオチンおよびTATHA2-ビオチンと4°Cで1時間の間、混合しながら反応させてCD-MNPs複合体を収得した。結合しないリガンドを除去するために複合体を永久磁性体を用いて精製した。HeLa細胞にEGFPと融合したMBP(MBP-GFP)を発現させるプラスミドを導入した上、永久磁性体または電磁石を用いて磁場を外部から印加した。共焦点レーザー顕微鏡(Carl Zeiss)を用いて、磁場下において、および磁場を印加しない状態で生きている細胞の共焦点映像を撮影した(図11)。
【実施例3】
【0054】
マイクロアレイ化された細胞内で結合パートナータンパク質の検証
1,000個余りのヒト由来の完全長ORFs(open reading frames)遺伝子は、ヒト遺伝体機能研究事業団より分譲を受けた。1,000個余りの遺伝子を大腸菌細胞で増殖させた上、プラスミドDNAを抽出し、動物細胞で遺伝子を発現させるためにpcDNA-GFP-DESTベクター(Invitrogen)にクローニングした。pcDNA-GFP-DESTベクターに挿入された遺伝子は、目的タンパク質のC-末端にGFPタンパク質が融合した融合タンパク質を造るようになる。マイクロアレイ化された細胞は、従来の技術により製作し[参考文献:Ziauddin and Sabatini,Nature 411:107-110(2001)]、融合したGFP蛍光タンパク質の発現で検証した。マイクロアレイ化された細胞に前記実施例6と同じ方法で収得したFK506-MNPsを実施例1と同じ方法で導入した後、永久磁性体または電磁石を用いて磁場を外部から印加した。共焦点レーザー顕微鏡を用いて、磁場下において、および磁場を印加しない状態で生きている細胞の共焦点映像を撮影した。陽性クローンに対するRT-PCRおよびmRNAの序列分析により陽性クローンがFK506の薬剤学的に関連した標的であるFKBP12であることが確認された(図12)。
【実施例4】
【0055】
細胞信号伝達(signal transduction)によるタンパク質の翻訳後修飾およびタンパク質複合体の変化の検証
細胞信号伝達によるタンパク質の翻訳後修飾とタンパク質複合体の変化を細胞内で検証するためにTNF-α/IκBα信号伝達系を選択した。IκBαはNF-κBタンパク質であるRelA/p65、p50、c-Relなどと複合体を成して多様な信号を調節する。細胞にTNF-αを処理すると、IκB kinase(IKK)の活性が増加してIκBαの32番目および36番目のセリンがリン酸化され、その結果IκBαとβTrCPタンパク質の結合が起こるようになる[参考文献:Brown,et al.,Science 267:1485,(1995)]。このようにTNF-α処理によるIκBαのリン酸化とIκBα-βTrCP複合体形成を検証するために次のような発現構成物を製作した(図13)。IκBα遺伝子とmRFP遺伝子を融合させた発現ベクターを製作してIκBα-mRFP融合タンパク質が発現するようにした。また、IκBα遺伝子とECFP遺伝子およびFKBP12遺伝子を融合させた発現ベクターを製作してIκBα-ECFP-FKBP12融合タンパク質が発現されるようにした。
【0056】
mRFP-βTrCP融合タンパク質もやはり、それぞれの遺伝子を融合させた発現ベクターを製作して使用した。Anti-phospho-IκBα抗体(Cell Signaling Technology)は、EZ-Link NHS-PEO Solid Phase Biotinylation kit(Pierce)を用いてビオチン化し、ウェスタンブロットで検証した。
【0057】
1)細胞信号伝達によるタンパク質リン酸化の検証:ストレプトアビジンナノ粒子とビオチン-SS-FITC、ビオチン-TATHA2およびビオチン-anti-phopho-IκBα(Ser32)抗体を4°Cで1時間の間、混合しIκBα(Ser32)-MNPs複合体を収得した。IκBα-mRFP発現ベクターが導入されたHeLa細胞にIκBα(Ser32)-MNPs複合体を実施例1と同じ方法で導入させた上、10 ng/mlのTNF-αを5分間処理し、共焦点レーザー顕微鏡を用いて、磁場下において、および磁場を印加しない状態で生きている細胞の共焦点映像を撮影した(図14および15)。IKK阻害剤であるSC-514は1mM濃度で処理した。TNF-α処理によりリン酸化されたIκBαは、IκBα(Ser32)-MNPs複合体と結合し、外部印加された磁気力により、位置移動するのを確認し、IKK阻害剤であるSC-514を処理すると、IκBαのリン酸化が形成されず、位置移動が起こらないことを検証した。
【0058】
2)信号伝達によるタンパク質複合体の形成を確認するために次の実験が行われた。HeLa細胞にIκBα-ECFP-FKBP12融合タンパク質発現ベクターと、EYFP-RelA融合タンパク質発現ベクターと、mRFP-βTrCP融合タンパク質発現ベクターとを同時に導入し、前記HeLa細胞を形質転換し、FK506-MNPs複合体を実施例1と同じ方法で収得し、細胞に導入した。10 ng/mlのTNF-αを5分間処理し、共焦点レーザー顕微鏡を用いて、磁場下において、および磁場を印加しない状態で生きている細胞の共焦点映像を撮影した(図16および17)。信号伝達とは関係なく複合体を成すIκBα-ECFP-FKBP12融合タンパク質とEYFP-RelA融合タンパク質は、外部印加された磁気力による位置移動を起こすのに対し、信号伝達によりリン酸化されたIκBαと結合するmRFP-αTrCP融合タンパク質は、TNF-αを処理した場合にのみ位置移動をした。IKK阻害剤であるSC-514は、IκBα-ECFP-FKBP12融合タンパク質とEYFP-RelA融合タンパク質との結合の妨げにはならず、IκBα-ECFP-FKBP12融合タンパク質とmRFP-βTrCP融合タンパク質との結合のみを阻害した。
【実施例5】
【0059】
遺伝体水準のcDNA発現ライブラリーより生理活性物質と結合パートナータンパク質との細胞内の相互作用のスクリーニング、探索および検証
1)遺伝体水準のcDNA発現ライブラリーよりFK506とその結合パートナータンパク質との細胞内の相互作用のスクリーニング、探索および検証:発現ライブラリーの製造のためのレトロウイルス構成体を製作した。図18に示された構造のpBabe-puroベクターを骨格(backbone)として用いた[参考文献:Morgenstern,et al.,Nucleic Acids Res.18:3587-3596 (1990)]。構成されたレトロウイルスにおいては5' LTRより転写され、EGFP融合タンパク質とmRFPのいずれも含むバイシストロニック(bicistronic) mRNAが発現する。フレームを三種類に異ならして、挿入体(insert)がEGFPに対して最大限インフレーム(in-frame)に入られるようにした(図18)。EGFPの3'または5'末端への無作為なcDNA融合を従来技術により行った(参考文献:Escobar,et al.,Plant Cell 15:1507-1523 (2003))。図19に示すような構造のFK506-ビオチン(biotin)を従来技術により合成し(参考文献:McPherson,et al.,Chem Biol.9:691-698 (2002))、MALDIMSを用いて検証した。ストレプトアビジンナノ粒子をFK506-ビオチンおよびTATHA2-ビオチンと4°Cで1時間の間、混合しながら、反応させてFK506-MNPs複合体を収得した。ジュルカット細胞(Jurkat cells)からEGFP-融合タンパク質発現ライブラリーを従来技術により製造した[参考文献:Escobar,et al.,Plant Cell 15:1507-1523 (2003)]。米国スタンフォード大学のG.P.Nolanより提供されたパッケージング細胞株(Phoenix-ampho)をレトロウイルス発現ライブラリーで形質転換させ、感染性レトロウイルスを製造した。形質転換後、48時間目に形質転換させたパッケージング細胞から上澄み液を収集して0.45μmフィルター(Millipore)でろ過した後、HeLa細胞の感染に用いた。HeLa細胞を4μg/mlポリブレンを添加したウイルス上澄み液で感染させた。2日後、感染された細胞にピューロマイシン(puromycin;1μg/ml)を注入して3日間、選択培養した。次にこれらの細胞に前記製造したFK506-MNPsを実施例1と同じ方法で導入した後、永久磁性体あるいは電磁石を用いて磁場を外部から印加した。共焦点レーザー顕微鏡を用いて、磁場下において、および磁場を印加しない状態で生きている細胞の共焦点映像を撮影した。EGFPと同時発現されたmRFPを偽陽性(false positive)信号として同時にモニターした。図20の写真において、矢印は陽性クローンを意味する。前記陽性クローンに対するRT-PCRおよびmRNAの序列分析により陽性クローンがFK506の薬剤学的に関連した標的であるFKBP12およびFKBP52であることが確認された。陽性クローンに対するRT-PCRおよび序列分析が従来技術により行われた(参考文献:Escobar,et al.,Plant Cell 15:1507-1523 (2003))。
【0060】
2)遺伝体水準のcDNA発現ライブラリーよりCGK1026とその結合パートナータンパク質との細胞内の相互作用のスクリーニング、探索および検証:CGK1026はヒトのテロメラーゼ活性を増進させる生理活性物質であることが明らかにされた(図21;参考文献:Won,et al.,PNAS,101:11328-11333 (2004))。CGK1026と結合する細胞内タンパク質をスクリーニングするためにGCK1026-ビオチン誘導体を製作した。ストレプトアビジンナノ粒子をCGK1026-ビオチンおよびTATHA2-ビオチンと4°Cで1時間の間、混合しながら反応させてCGK1026-MNPs複合体を収得した。実施例5の1)と同じ方法でレトロウイルス発現ライブラリーを用い、CGK1026と結合するタンパク質がHDACであることを確認し、既に知られたHDAC阻害剤であるTSAと比較して類似する程度にHDAC活性を阻害することが確認された(図22;参考文献:Won,et al.,PNAS,101:11328-11333 (2004))。
【実施例6】
【0061】
相互作用の抑制剤および促進剤の薬剤学的探索(drug screening)
1)相互作用の促進剤の探索:実施例4の1)と同じ方法でIκBα-mRFP融合タンパク質発現ベクターとIκBα(Ser32)-MNPs複合体をHeLa細胞に導入した後、多様な化合物と成長促進因子を処理し、外部磁気力を印加してIκBα-mRFP融合タンパク質の位置移動を共焦点顕微鏡で観察した。細胞に処理した生理活性物質の中、TNF-α、IL-2、LPS、Fasなどのみが外部磁気力によるIκBα-mRFP融合タンパク質の位置移動を起こすことが確認された(図15および17)。
【0062】
2) FK506による相互作用抑制:FK506-MNPs複合体とFKBP12-mRFP発現ベクターを実施例3と同じ方法で細胞に導入した後、多様な化合物を処理してFKBP12-mRFP融合タンパク質の位置移動を観察した。処理された化合物の中、FK506のみが競争的にFKBP12-mRFP融合タンパク質の位置移動を阻害することが確認された(図23)。
【0063】
3)相互作用抑制剤の探索:CGK606は、ATM (ataxia telangiectasia)リン酸化酵素の阻害剤として探索された。ストレプトアビジンナノ粒子をCGK606およびTATHA2でコーティングしてCGK606-MNPs複合体を収得した。ATM-mRFP融合タンパク質を発現するベクターをHeLa細胞に導入した後、CGK606-MNPsを前と同じ方法で細胞内に導入した。色々な生理活性低分子化合物を処理した後、外部磁気力を印加してATM-mRFP融合タンパク質の位置移動を共焦点顕微鏡で観察した。細胞に処理した生理活性物質の中、ワルトマニン(wortmannin)のみが陰性対照区と比較し、外部磁気力によるATM-mRFP融合タンパク質の位置移動を抑制することが確認された(図24)。
【産業上の利用可能性】
【0064】
このように、本発明によれば外部から印加される作用力により位置変化する移動反応物質と生理活性物質の第1構成物と、探索のための標識が付着した他の生理活性物質を含む第2構成物を同一作用システム(system)またはフィールド(field)で反応させることにより、相互作用により形成された結合体(complex)を位置変化した標識からリアルタイムで直接探索することができる。また、結合体の位置変化は、外部作用力の強さに応じて躍動的に測定することができ、且つ可逆的(reversible)である。したがって、本発明は、生理活性物質間の相互作用を探索および検出しようとする標的物質の大きさに制限されることなく、細胞を破壊しないでin vitroおよびin vivoで効果的に行うことができるため、新薬開発のための標的タンパク質および新薬候補物質の探索および検出のみならず、既存の薬物を改良する、或いは新しい薬剤学的用途を発見するのに非常に有用に利用されることができる。
【図面の簡単な説明】
【0065】
【図1】本発明の方法に対する概略図を示す。
【図2】緑色蛍光染料であるFITCでコーティングされたナノ粒子を細胞内に導入した後、外部から磁場を印加し、FITCでコーティングされたナノ粒子の位置が変化するのを観察した共焦点顕微鏡写真である。
【図3】EGFPを発現する細胞(緑色)と比較してFKBP12-RFP融合タンパク質を発現する細胞(赤色)の位置移動を示す共焦点顕微鏡写真である。
【図4】FKBP12-RFP融合タンパク質とこれの薬剤学的結合パートナーであるK506-MNPs間の相互作用の結果、細胞(赤色矢印で表す)に外部印加された磁場の可逆的な変動下における結合体の位置移動を示す共焦点顕微鏡写真である。
【図5】mRFP-Caspase3を発現する細胞(赤色矢印で標識)の外部印加された磁場の可逆的な変動下における位置移動を示す共焦点顕微鏡写真である。
【図6】IκBαタンパク質とRelAタンパク質との相互作用の結果、外部印加された磁場の可逆的な変動下においてIκBαタンパク質とRelAタンパク質複合体の位置移動を示す共焦点顕微鏡写真である。
【図7】anti-phospho-IκBα抗体を用いてリン酸化されたIκBαタンパク質を検出した結果、外部印加された磁場の可逆的な変動下におけるanti-phospho- IκBα抗体-IκBαタンパク質複合体の位置移動を示す共焦点顕微鏡写真である。
【図8】外部印加された磁場の可逆的な変動下におけるUASオリゴヌクレオチドとGAL4タンパク質複合体の位置移動を示す共焦点顕微鏡写真である。
【図9】miRNAであるlet-7hとこれに結合するmRNAであるlin-28の相互作用に伴う複合体形成とその位置移動を示す概念図である。
【図10】外部印加された磁場の可逆的な変動下におけるmiRNAとmRNA複合体の位置移動を示す共焦点顕微鏡写真である。
【図11】外部印加された磁場の可逆的な変動下におけるベータ-CDとMBPタンパク質複合体の位置移動を示す共焦点顕微鏡写真である。
【図12】マイクロアレイ化された細胞内で結合パートナータンパク質を検証する実験の概念図である。
【図13】IκBα-mRFP、IκBα-ECFP-FKBP12、EYFP-RelAおよびmRFP-TrCP融合タンパク質の模式図である。
【図14】TNF-α処理後、リン酸化されたIκBα-mRFPがanti-phospho-IκBα(Ser32)抗体によりナノ粒子と結合することを示す模式図である。
【図15】図14の模式図のようにTNF-α処理後に形成されたナノ粒子複合体(nano-particle complex)が外部印加された磁場により、位置変化するのを観察した共焦点顕微鏡写真である。
【図16】図13に説明された融合タンパク質がTNF-α処理後、ナノ粒子複合体を形成することを示す模式図である。
【図17】図16の模式図のように形成されたナノ粒子複合体が外部印加された磁場により、位置変化するのを観察した共焦点顕微鏡写真である。
【図18】発現ライブラリーを製造するためのレトロウイルス構成体を示す。
【図19】標的物質の同定のために用いられたFK506とFK506-ビオチン(biotin)の化学構造を示す。
【図20】外部印加された磁場下において特異的に移動したEGFPと融合したタンパク質を示す共焦点顕微鏡写真である。発現ライブラリーの中、特異な融合したタンパク質はFK506の標的なFKBP12およびFKBP52であることを確認した。
【図21】CGK1026の化学構造を示す。
【図22】CGK1026によるHDACタンパク質の活性阻害を確認した結果である。
【図23】FK506の処理によりビオチン-FK506とFKBP12との結合が競争的に阻害されることを示す共焦点顕微鏡写真である。
【図24】ATMリン酸化酵素とCGK606との相互作用抑制剤の探索の結果、ワルトマニン(WT)による阻害結果を示す共焦点顕微鏡写真である。
【技術分野】
【0001】
本発明は、in vitroおよびin vivoで相互作用を分析するための物質、例えば、生理活性物質等の相互作用(interaction)をリアルタイムで躍動的に探索する方法に関する。また、本発明は、in vitroおよびin vivoで相互作用を分析するための物質、例えば、生理活性物質等の相互作用を探索し、目的とする標的物質を検出する方法に関する。
【背景技術】
【0002】
一般に生理活性化合物(chemical compound)は、生体内でタンパク質、核酸、糖または脂質などを含む生体物質と結合し、これらの機能または活性を調節する化合物を意味する。このような生理活性化合物は、有機体から抽出される、或いは化学的合成により収得される。例えば、臓器移植時発生する免疫拒否反応を軽減させるために用いられる”サイクロスポリンA”(Novartis AG)および”FK506”(Fujisawa)を始めとし、多くの抗生物質等(antibiotics)が微生物、植物または海洋生物から分離された。このような天然または合成生理活性化合物は、これの薬理活性をテストし、動物およびヒトをモデルとした臨床試験を経て一つの新薬として開発される。しかし、天然生理活性化合物の中の多くがその構造の複雑性、精製および分離技術の限界などを理由に産業的大量生産に適していない。したがって、有用な生理活性化合物を大量に生産するための方法として合成化学(combinatorial chemicals)および新しい有機合成法が研究された(参考文献:Schreiber,S.,2000,Target-oriented and diversity-oriented organic synthesis in drug discovery,Science 287,1964-1969)。
【0003】
生体内のタンパク質は、他のタンパク質と結合することによりその機能を表す。一般に相補的な構造の二つのタンパク質は相互作用し、生理活性化合物はタンパク質三次構造の特定部位に特異的に結合する。一般に二つのタンパク質間の相互作用は、これらのタンパク質が機能的に関連があるということを強く暗示し、タンパク質の特定部位に特異的に結合する生理活性化合物は、そのタンパク質の活性を調節することにより、例えば、疾患関連のタンパク質の場合、疾患を診断、予防、治療または軽減させることができる治療剤としての開発の可能性を提示する。したがって、新薬開発分野ではすでにその機能および特性が明らかにされた物質である”ベイト”と、探索および検出の対象となる相互作用パートナーである”プレイ”の相互作用を確認することによって新規標的タンパク質を検出したり、或いは新薬候補物質として生理活性物質をスクリーニングするための多様な方法が研究されている。現在まで疾患と関連し、約500個の標的タンパク質が明らかにされており、今後数年内に約5,000個以上まで増加するものと予想される。
【0004】
ヒトゲノムの解析以後、生理活性物質が細胞内の数々の代謝および信号伝達過程において行う役割についての多様な研究がより急速になされた。化学遺伝体学(chemical genomics)、化学生物学(chemical biology)および化学タンパク質体学(chemical proteomics)等の研究分野が出てき、これらは分析デザイン(analysis design)、機能遺伝体学(functional genomics)、タンパク質体学(proteomics)、自動化工学(automatic engineering)および生物情報学(bioinformatics)等、多様な技術の発達と関係する。
【0005】
タンパク質間の相互作用を探索するためのin vitro方法として、通常、生物化学的方法、例えば、交差結合(cross-linking)、放射性標識リガンド結合(radiolabeled ligand binding)、X-線クリスタログラフィーおよび親和クロマトグラフィー(affinity chromatography)、親和ブロッティング(affinity blotting)、免疫沈降法(immunoprecipitation)および質量分析法(mass spectrometry)等が、開発され利用された(参考文献:E.M.Phizicky and S.Fields,Microbiol.Rev.,59:94-123,1995;A.R.Mendelsohn and R.Brent,Science,284:1948-1950,1999)。
【0006】
しかしながら、これらの方法は多くの努力を要するタンパク質の生産および分離過程を要求し、in vitroで行われる相互作用であるため、細胞内の相互作用と一致する情報を提供することができないという短所がある。
【0007】
このような短所を克服するためにいくつかの機能的クローニング(functional cloning)、例えば、イースト・ツー・ハイブリッド(yeast two-hybrid;Y2H)、イースト・スリー・ハイブリッド(Y3H;参考文献:Licitra、E.J.,and Liu,J.O.,1996,A three-hybrid system for detecting small ligand-protein receptor interactions.Proc.Natl.Acad.Sci.USA 93,12817-12821)、ドラッグ-ウェスタン(drug-western;参考文献:Tanaka,H.,Ohima,N.,and Hidaka,H.1999,Isolation of cDNAs encoding cellular drug-binding proteins using a novel expression cloning procedure:drug-western.Mol.Pharmacol.55,356-363)、ファージディスプレイクローニング(参考文献:Sche,P.P.,McKenzie,K.M.,White,J.D.,and Austin,D.J.1999,Display cloning:functional identification of natural product receptors using cDNA-phage display.Chem.Biol.6,707-716)、蛍光共鳴エネルギー転移(fluorescence resonance energy transfer,FRET;参考文献:MoshinskyDJ,Ruslim L.,Blake RA,Tang F.,A widely applicable,high-throughput TR-FRET assay for the measurement of kinase autophosphorylation:VEGFR-2 as a prototype.J Biomol Screen.2003 Aug;8(4):447-52)およびmRNAディスプレイクローニング(参考文献:McPherson,M.,Yang,Y.,Hammond,P.W.,and Kreider,B.L.,2002,Drug receptor identification from multiple tissues using cellular-derived RNA display libraries.Chem.Biol.9,691-698)等が、開発された。
【0008】
ところが、これらの中、イースト・ツー・ハイブリッド(yeast two-hybrid)システムは、ゲノムの大きさが大きく、且つ複雑な場合、結果に対する信頼度が低く、解析が難しくなるため、これをヒトに対して適用するに困難がある。また、タンパク質の本来の細胞内の分布位置によりシステムを選択しなければならず、良質のライブラリー確保の問題および細胞の代謝および成長によって転写活性に影響を与えられ得、ハイブリッド・タンパク質が毒性を示すことがある。
【0009】
一方、Y3Hは、生理活性化合物とタンパク質との相互作用に対する探索が生きている細胞内でなされるという点を特徴とする。しかしながら、Y3HもやはりY2Hと同じように、酵母細胞のような単純な細胞内で行われなければならない限界があり、全長膜タンパク質(full-length membrane protein)の分析に適しておらず、酵母の内因性タンパク質の翻訳後修飾(post translational modification)または付加のタンパク質(accessory protein)が必要な生理活性化合物とタンパク質間の相互作用には適用が難しい。特に、酵母細胞は、ほ乳動物細胞に比して、生理活性化合物に対して遺伝的により低い透過性を有するという問題がある。
【0010】
その他に生物情報学的方法を用いてタンパク質間の相互作用を予測する生物情報学的方法が開発された。この方法は、データベース化されたゲノム序列情報に基づいて系統分類学的または複数のシーケンスアラインメント(multiple sequence alignment)を介し、タンパク質間の相互作用を予測する方法である。また、構造遺伝体学(structural genomics)、分子指紋(molecular fingerprint)および多様なクラスター分析法などは、比較的、最近開発されたもので、バーチャルスクリーニング(virtual screening)法である。
【0011】
このようにタンパク質間の相互作用を探索するための多くの方法が提案されたが、より効果的で、且つ操作が容易な方法に対する要求は持続している。
また、標的タンパク質との相互作用を利用して生理活性化合物を探索するための多様な技術が開発された。例えば、生化学的方法として、ディングなど(Ding,S.et al.)は親和クロマトグラフィー(affinity chromatography)を用いてプリン系分子(purine-like molecules)のライブラリーをスクリーニングしてP19幹細胞を神経細胞に分化誘導する化合物を検出した(参考文献:Ding,S.,T.Y.H.,Brinker,A.,Peters,E.C.,Hur,W.,Gray,N.S.,and Schultz,P.G.2003,Synthetic small molecules that control stem cell fate.Proc.Natl.Acad.Sci.USA 100、7632-7637)。
【0012】
しかしながら、この方法は親和力が極めて高くなければ探索に適用できないという短所があり、さらに、標的タンパク質が多量に存在してこそ始めて効果的な検出が可能である。また、大部分の生理活性化合物は、疏水性(hydrophobic)であって、水溶性の環境において目的とする標的分子と競争的に結合するため、生理活性化合物を固定化させたアガロース(agarose)または他の支持体に検出対象の抽出物を通過させる場合、タンパク質は特異的結合パートナーのみならず非特異的結合パートナーとも結合を形成する。したがって、この方法の場合、親和力の低い結合分子を除去するための洗滌段階が必須に要求される。
【0013】
このような生化学的方法の短所を克服するため、遺伝的方法が提案された。ジョン等(Zheng et al.)は、異型接合体(heterozygote)および宿主で増加した薬物感受性を探索するため、イースト・スリー・ハイブリッド・システムを利用した。このような遺伝的方法の最も大きな長所は、表現型と遺伝型間の強力な連関性である。すなわち、このシステムを利用した探索の結果、発見される一つのヒットは、標的タンパク質に対する遺伝子のクローンを直接的に提供する(参考文献:Jaeger,S.,Eriani,G.,and Martin,F.2004,Results and prospects of the yeast three-hybrid system.FEBS Lett.566,7-12)。このシステムでは新規標的タンパク質候補が多価タンパク質複合体の一部として融合して利用され得る。ところが、このシステムはイーストに限定され利用しなければならないという短所がある。
【0014】
化学遺伝学は、遺伝子突然変異(mutations)が細胞に及ぼす影響を示すために生理活性化合物を用いるものであって、化合物群または組合せライブラリー(combinatorial library)より目的とする活性化合物を同定する(参考文献:Schreiber,S.L.2003,The small molecule approach to biology.Chem.& Eng.1199 News 81,51-61;Crews,C.M.,and Splittgerber,U.1999,chemical genetics:exploring and controlling cellular processes with chemical probes.Trends Biochem.Sci.24,317-320)。この方法は、通常マイクロタイター用プレートのウェル内に、目的とする表現型を探索するために遺伝子操作された細胞と共に数百ないし数千個の化合物を配列することによって行われる(参考文献:Clemons,P.A.,Koehler,A.N.,Wager,B.K.,Springs,T.G.,Spring,D.R.,King,R.W.,Schreiber,S.L.,and Foley,M.A.2001,A one-bead,one-stock solution approach to chemical genetics:part 2.Chem.Biol.6,71-83)。例えば、目的とする結果が特定遺伝子または遺伝子群の発現を誘発させるものである場合、細胞は緑色蛍光タンパク質(GFP)または他の常用マーカー(marker)の発現を誘発する関連したプロモーター(promoter)が挿入されたリポーター構成物を含む。しかしながら、この方法もやはり次のような2つの大きな問題点があることが明らかにされた。第一に、化学遺伝学は、微量のnM単位で作用する生理活性化合物を探索するに適していない。第二に、この方法は典型的には数十万個の物質に対するスクリーニングを介し、わずか何個かの活性物質しか捜し出すことができない。
【0015】
上述の通り、タンパク質間の相互作用を探索する、或いはタンパク質と生理活性化合物間の相互作用を探索するための従来技術は、大部分in vitroで行われるか、酵母またはバクテリアなど制限された細胞内だけで行われることができ、遺伝子操作および発現の過程を経なければならないため、DNAの大きさが制限され、その他に他の媒介変数による高い偽陽性率(false positive hit)によって検出された結果の信頼度が落ちる。
【0016】
これに本発明者等は、前記従来技術の問題点を克服し、in vitroだけでなくin vivoで生理活性物質等の相互作用をリアルタイムで躍動的に探索するために研究したところ、磁場によって移動することができる磁性を示す物質または磁性物質を含む粒子(magnetic-material/-particle)に生理活性物質を結合させ、探索のための標識物質が結びついた他の生理活性物質を細胞内に導入した後、細胞に磁場を印加し、磁場下において移動した標識の位置を測定し、これらの生理活性物質等間の結合有無を探索、検証することによって本発明が完成した。
【発明の開示】
【発明が解決しようとする課題】
【0017】
一般に本発明はin vivoすなわち、細胞内、組織内または生体内およびin vitroすなわち、細胞外で相互作用を分析しようとする物質等(molecules)、例えば、生理活性物質等間の相互作用をリアルタイムで探索して標的物質を検出するための方法を提供することを目的とする。具体的に本発明はin vitroおよびin vivoにおいて特定生理活性物質である”第1の探索物質”と、探索および検出対象の生理活性物質である”第2の探索物質”との間の相互作用を直接的に探索する方法を提供することを目的とする。
【0018】
また、本発明はin vitroおよびin vivoにおいて”第1の探索物質”と”第2の探索物質”との相互作用を直接的に探索して目的とする標的物質を検出する方法に関する。
【0019】
また、本発明はin vitroおよびin vivoにおいて”第1の探索物質”と”第2の探索物質”との相互作用を直接的に探索するためのキット(kit)またはチップ(chip)を提供することを目的とする。
【0020】
また、本発明は”第1の探索物質”と”第2の探索物質”との相互作用を抑制(blocking)または阻害(inhibiting)させる、或いは促進(activating)または誘導(inducing)させるための標的物質を探索して目的とする標的物質を検出する方法として利用され得る。
【0021】
また、本発明はin vitroおよびin vivoにおいて細胞の形態または機能変化を観察し、”第1の探索物質”と”第2の探索物質”との相互作用を間接的に探索する方法に関する。
【発明を実施するための最良の形態】
【0022】
前記の目的を達成するために本発明者等は、2つの構成物(constructs)をデザインした。具体的に、外部から印加される作用力(externally applied driving force)により位置が変化する移動反応物質(localizer)を提供し、この物質に分析しようとする一つ以上の”第1の探索物質”、例えば、生理活性物質を直接またはリンカーなどを用いて間接的に結合させた第1構成物を製作した。第1構成物の移動反応物質と分析しようとする探索物質は、直接的に融合した一つの構成物に提供され得る。また、第1構成物は、分析しようとする探索物質を認識できる探針(probe)が融合した移動反応物質と分析しようとする一つ以上の探索物質とが間接的に結びついた二つ以上の構成物に提供され得る。第2構成物は、探索が可能なように、一つ以上の標識物質(label)が結びついた1個または数個の第2の探索物質、例えば、生理活性物質を含む。
【0023】
第2構成物の標識物質と分析しようとする生理活性物質は、直接的に融合した一つの構成物に提供され得る。また、第2構成物は分析しようとする生理活性物質を認識できる探針(probe)が融合した標識物質と分析しようとする一つ以上の生理活性物質とが間接的に結びついた二つ以上の構成物に提供され得る。前記第1構成物および第2構成物を同じフィールド(field)またはシステム(system)において相互作用(interaction)できる位置に接近させた後、外部から作用力を印加し、位置または動きが変化した標識を簡単な装置で測定することによって相互作用により形成された複合体(complex)をリアルタイムで躍動的に探索することができる。また、細胞の形態または機能の変化を測定し、相互作用を間接的に探索することができる。本発明において第1の探索物質が”ベイト(bait)”となった場合、第2の探索物質は”プレイ(prey)”となり、第2の探索物質が”ベイト”となった場合、第1の探索物質は”プレイ”として利用され得る。本発明において標識の位置または動きの変化は顕微鏡を含む光学的方法、スキャナー(scanner)、放射性標識感知手段、FPリーダー(fluorescence polarization reader)、スペクトロフォトメーター(spectrophotometer)、MRI(magnetic resonance imaging)、SQUID、蛍光検出器、発光検出器など、一般に広く知られた方法を用いて測定することができる。
【0024】
具体的に、本発明において物質の相互作用探索方法は、i)外部作用力(externally applied driving force)により位置移動する移動反応物質(localizer)と第1の探索物質とを結合させた第1構成物(construct)を提供する段階と、ii)探索のための標識物質(label)が結びついた第2の探索物質を含む第2構成物を提供する段階と、iii)同じフィールド(field)またはシステム(system)において前記第1構成物と第2構成物を相互作用が可能な位置に接近させる段階と、iv)外部作用力を印加して位置または動きが変化した標識を測定する段階と、を含む。
【0025】
また、本発明において標的物質の検出方法は、i)外部作用力により位置移動する移動反応物質と第1の探索物質とを結合させた第1構成物を提供する段階と、ii)探索のための標識物質(label)が結びついた第2の探索物質を含む第2構成物を提供する段階と、iii)同じフィールドまたはシステムにおいて前記第1構成物と第2構成物を相互作用が可能な位置に接近させる段階と、iv)外部作用力を印加し、位置または動きが変化した標識を測定する段階と、v) 第2構成物に含まれた物質を分離して同定する段階と、を含む。標的物質の検出は、公知の方法、例えば、RT-PCR、ゲノムDNAに対するPCRまたは質量分析(Mass Spectroscopy)により行われ得る。
【0026】
また、本発明は3つの構成物を製造し、物質の相互作用を探索して標的物質を検出することができる。具体的に、i)外部作用力により位置移動する移動反応物質と第1の探索物質とを結合させた第1構成物を提供する段階と、ii)標識物質(label)が結びついた第2の探索物質を含む第2構成物を提供する段階と、iii)探索のための物質を含む第3構成物を提供する段階と、iv)同じフィールドまたはシステムにおいて前記第1構成物、第2構成物と第3構成物を相互作用が可能な位置に接近させる段階と、v)外部作用力を印加し、位置または動きが変化した標識を測定する段階とを含む物質の相互作用を探索する段階と、vi) 第3構成物に含まれた物質を分離して同定する段階と、を含む。標的物質の検出は公知の方法、例えば、RT-PCR、ゲノムDNAに対するPCRまたは質量分析(Mass Spectroscopy)により行われ得る。
【0027】
本発明において第1構成物、第2構成物または第3構成物を構成する、探索しようとする対象物質はライブラリー(library)形態に提供され得る。
【0028】
一具体例として、本発明は外部から印加される作用力として磁気力(magnetic force)を利用した。第1構成物を構成する移動反応物質として、磁性物質を含むナノ粒子(nano-particle)、好ましくは直径5 nmないし2,000 nmの物質を提供し、前記移動反応物質に特定物質、例えば生理活性物質を結合またはコーティングして用いる。移動反応物質は2つ以上の特定物質と結合される、或いはこれら物質でコーティングされ提供され得る。第2構成物は第1構成物の中の生理活性物質と相互作用するパートナーとして探索のための標識が付着した他の生理活性物質を製造して利用する。前記第1構成物と第2構成物を同じ細胞内に導入し、外部から磁場を印加した後、磁場下において移動した標識を測定することによって目的とする標的物質をリアルタイムで探索する。また、磁場の強さを変化させることによってより躍動的な探索を行うことができ、磁場の強さを変化させる間、位置変化する、或いは変化しない物質を陽性または陰性対照区として用いて比較探索することができる。
【0029】
もう一つの例として、本発明はi)特定の生理活性化合物を磁性粒子にコーティングして提供する段階と、ii)段階i)のコーティングされた磁性粒子を標識物質が結びついたタンパク質を含む細胞内に伝達する段階と、iii)段階ii)の細胞に対して磁場を印加し、細胞内磁性粒子を移動させる段階と、iv)標識の位置または動きを測定する段階と、v)標識が位置または動きの変化を示す細胞から標識が付着した標的物質を検出、糾明する段階と、を含む。
【0030】
本発明をin vivoで行った場合、真核細胞、原核細胞、ほ乳動物の生体内、組織内および細胞内、植物の生体内、組織内および細胞内で行うことができる。特に、本発明はゼブラフィッシュ(Zebra fish)、線虫(C.elegans)、酵母(Yeast)、ミバエ(Fly)またはカエル(Frog)の細胞内、組織内または生体内でも行われ得る。本発明において第1構成物および第2構成物は細胞伝達性ペプチド(transducible peptideまたはfusogenic peptide)、脂質遺伝子伝達体(lipidまたはliposome)またはこれらの結合体を用いる、或いは第1構成物および第2構成物をOpti-MEM培地で細胞と培養する、或いはエレクトロポレーション(electroporation)またはマグネトフェクション(magnetofection)等、一般に広く知られた方法により容易に細胞内に伝達することができる。特に、本発明の方法を細胞内で行った場合、培養プレート(culture plate/dish)またはマイクロアレイ(microarray)化された生きている細胞内で行うことができる。
【0031】
本発明において外部から印加される作用力は、第1構成物に含まれる移動反応物質の物理的、化学的、生物学的および静電気的特性を含む特性により適切に選択することができる。例えば、光ピンセット(optical tweezer)等を含む光学機構を利用して外部作用力を印加することができる。
【0032】
本発明において”生理活性物質”は、核酸(nucleic acid)、ヌクレオチド(mono-/oligo-/poly-nucleotide)、タンパク質(protein)、ペプチド(mono-/oligo-/poly-peptide)、アミノ酸(amino acid)、糖(mono-/oligo-/poly-saccharide)、脂質(lipid)、ビタミン、化合物(chemical compoundなど)とこれらを構成する要素などをはじめとし、生体内で生理的な活性を示すすべての物質を含む。
【0033】
本発明において”ベイト(bait)”は、他の生理活性物質との相互作用を探索するのに利用される生理活性物質を意味する。
【0034】
本発明において”プレイ(prey)”は、前記”ベイト”の相互作用パートナーとして探索または検出しようとする対象となる生理活性物質を意味する。
【0035】
本発明において”標的物質”とは、”ベイト”と相互作用する”プレイ”または”ベイト”と”プレイ”物質の相互作用を促進(activating)または誘導(inducing)する、或いは抑制(blocking)または阻害(inhibiting)する、糾明しようとするすべての物質を意味する。
本発明において”移動反応物質”(localizer)とは、外部から印加される作用力(externally applied driving force)に反応して位置移動する物質を意味する。
【0036】
本発明において外部から印加される”作用力”は、電気力、電磁気力、磁気力および重力を含み、第1構成物の中、前記定義された移動反応物質の位置変化をもたらすことができるすべての種類の力(force)を指す。
【0037】
本発明において第2構成物を構成し、探索に用いられる標識物質はそれ自体として蛍光を示したり、他の物質との相互作用により蛍光性を示す蛍光物質(fluorescent material)、例えば、FITC、rhodamine などの蛍光染料とGFP、YFP、CFPおよびRFPなどの蛍光タンパク質およびテトラシステーン蛍光性モチーフ(tetracystein motif)であるか、それ自体として発光を出したり、第1構成物または他の物質との相互作用により発光を示す発光体(luminescent material)、例えば、ルシフェラーゼ(luciferase)等と、放射性標識(radioactive label)、例えば、32P、35S、3Hおよび14Cなどを含み、一般に使用可能な標識をすべて含む。
【0038】
本発明において生理活性物質と移動反応物質間の結合または生理活性物質と標識物質間の結合は、物理的、化学的、静電気的および生物学的な直接または間接結合を含み、生理活性物質は移動反応物質または標識物質の表面にコーティングされて利用され得る。
【0039】
本発明において第1構成物または第2構成物を構成して探索に利用される探針(probe)は、生理活性物質と物理的、化学的、静電気的および生物学的に結合し、探索物質と位置調節因子または生理活性物質と標識物質を直接または間接的に結合させることができる物質、例えば、抗体(antibody)、タンパク質(protein)、タンパク質ドメイン(domain)、タンパク質モチーフ(motif)、ペプチドなどをいずれも含む。
【0040】
以下では本発明を実施例に基づいてより詳細に記述する。本発明の下記実施例は本発明を具体化するだけのものであって、当然ながら本発明の権利範囲を制限したり、限定するものではない。本発明の詳細な説明および実施例から本発明が属す技術分野の専門家が容易に類推できるということは本発明の権利範囲に属すとして解釈される。本発明において引用された参考文献は、本発明に参考として統合される。
【実施例1】
【0041】
蛍光染料であるFITCでコーティングされたナノ粒子を用いた細胞内の位置変化の確認
ストレプトアビジンをコンジュゲーションしたスーパーパラマグネティックナノ粒子(50 nm;ストレプトアビジンナノ粒子)をFITC-ビオチンおよびTATHA2-ビオチンと反応させ、スーパーパラマグネチックナノ粒子(MNPs)をFITCでコーティングしたFITC-MNP-TATHA2複合体を収得した。TATHA2ペプチドは従来技術により合成して(参考文献:Wadia,et al.,Nat Med.10:310-315 (2004))、N-末端部をビオチンで標識した。陰性対照区では外部印加された磁場により位置変化を起こさないナノ粒子であるQD565をTATHA2-ビオチンと反応させてQD565-TATHA2複合体を収得した。あらかじめ培養されたヘラ細胞(HeLa cell、ATCCから購入)を血清を含まないDMEMで洗滌した後、Opti-MEM(Invitrogen)培地にFITC-MNP-TATHA2複合体とQD565-TATHA2複合体とを各々混合した溶液を細胞に処理し、細胞を37°Cに固定されたCO2インキュベーターで12時間の間、培養してFITC-MNP-TATHA2およびQD565-TATHA2複合体をHeLa細胞内に導入した。細胞を共焦点顕微鏡の焦点プレート上に移して底面に市販中の永久磁石または電磁石で磁気力を印加した。共焦点顕微鏡の焦点プレートを調節して細胞底面に移動したナノ粒子の蛍光を観察した(図2)。FITC-MNP-TATHA2が導入された細胞でのみ外部磁場によりFITC-MNP-TATHA2複合体が位置移動することが確認されており、陰性対照区(negative control)として用いたQD565-TATHA2が導入された細胞では磁場による位置の変化が見られなかった。
【実施例2】
【0042】
多様な生理活性物質間の細胞内の相互作用の探索
1)蛍光タンパク質との融合タンパク質と生理活性低分子化合物がコーティングされたナノ粒子を用いた細胞内の相互作用の探索;ストレプトアビジンナノ粒子をFK506-ビオチンと反応させてスーパーパラマグネチックナノ粒子(MNPs)を生理活性低分子(FK506)でコーティングした(MNP-FK506)。EGFPタンパク質とFKBP-RFP融合タンパク質を発現するヘラ細胞(HeLa cell)を血清を含まないDMEMで洗滌した後、細胞を37°Cに固定されたCO2インキュベーターで12時間の間MNP-FK506とOpti-MEM(Invitrogen)を混合した培地で培養し、MNP-FK506を HeLa 細胞内に導入した。細胞を共焦点顕微鏡の焦点プレート上に移して底面に永久磁石または電磁石で磁気力を印加した。
【0043】
共焦点顕微鏡の焦点プレートを調節して細胞底面に移動した蛍光タンパク質を観察した(図3)。FKBP12-RFP融合タンパク質を発現する細胞(赤色)のみが外部磁場により位置移動し、陰性対照区(negative control)として用いたEGFPを発現する細胞(緑色)の場合、磁場による位置変化が見られなかった。
【0044】
2) FK506とこれの薬剤学的に関連した結合パートナーであるFKBP12(FK506 binding protein 12)の細胞内の相互作用の検証:ストレプトアビジンナノ粒子をFK506-ビオチンおよびTATHA2-ビオチンと4°Cで1時間の間、混合しながら反応させてFK506-MNPs複合体を収得した。結合しないリガンドを除去するために反応溶液を電磁石あるいは永久磁石を用いて精製した。HeLa細胞にRFPと融合したFHBP12(FKBP-RFP)またはEGFPを発現させるプラスミドをそれぞれ導入した後、この細胞を採って混ぜた後、培養器で共に培養した。次にこれらの細胞に前記製造したFK506-MNPs複合体を導入した後、永久磁性体または電磁石を用いて磁場(M.F.,Magnetic Field)を外部から印加した。
【0045】
共焦点レーザー顕微鏡(Carl Zeiss)を用いて磁場下において、および磁場を印加しない状態で生きている細胞の共焦点映像を撮影した。図4の写真においてRFPと融合したFKBP12を発現する細胞(赤色矢印で表す)だけ外部磁場により位置移動し、陰性対照区として用いたEGFPを発現する細胞(緑色矢印で表す)の場合、磁場による位置変化が見られなかった。
【0046】
3)キャスペース-3抑制剤(caspase-3 inhibitor)ペプチドとこれの結合パートナーであるキャスペース-3の細胞内相互作用の検証:ストレプトアビジンナノ粒子をキャスペース-3抑制剤II[caspase-3 inhibitorII(DEVD)]-ビオチンコンジュゲート(biotin conjugate;CALBIOCHEM)およびTATHA2-ビオチンと4°Cで1時間の間、混合しながら反応させてDEVD-MNPs複合体を収得した。結合しないリガンドを除去するために複合体を永久磁性体を用いて精製した。HeLa細胞にmRFPと融合したキャスペース-3(mRFP-Caspase3)またはEGFPを発現させるプラスミドをそれぞれ導入した後、この細胞を採って混ぜた後、培養器で共に培養した。次にこれらの細胞に前記製造したRDEVD-MNPsを導入した後、永久磁性体または電磁石を用いて、磁場を外部から印加した。
【0047】
共焦点レーザー顕微鏡(Carl Zeiss)を用いて、磁場下において、および磁場を印加しない状態で生きている細胞の共焦点映像を撮影した。図5の写真においてmRFP-Caspase3を発現する細胞(赤色矢印で表す)のみが外部磁場により位置移動し、陰性対照区(negative control)として用いたEGFPを発現する細胞(緑色矢印で表す)の場合、磁場による位置変化が見られなかった。
【0048】
4) IκBαタンパク質とこれの結合パートナーであるRelAタンパク質の細胞内の相互作用の検証:ストレプトアビジンナノ粒子をFK506-ビオチンおよびTATHA2-ビオチンと4°Cで1時間の間、混合しながら反応させてFK506-MNPs複合体を収得した。結合しないリガンドを除去するために複合体を永久磁性体を用いて精製した。
【0049】
HeLa細胞にEGFPおよびEFKBP12と融合したIκBα(IκBα-ECFP-FKBP12)およびEYFPと融合したRelA(EYFP-RelA)を発現させるプラスミドを共に導入した上、これら細胞に前記製造したFK506-MNPsを導入した後、永久磁性体または電磁石を用いて磁場を外部から印加した。共焦点レーザー顕微鏡(Carl Zeiss)を用いて、磁場下において、および磁場を印加しない状態で生きている細胞の共焦点映像を撮影した。図6の写真から見られるように外部印加された磁場によりIκBα-ECFP-FKBP12融合タンパク質とEYFP-RelA融合タンパク質が外部印加された磁場により位置移動した。
【0050】
5) IκBαタンパク質とこれに対する抗体であるanti-phospho-IB抗体の細胞内相互作用の検証:ストレプトアビジンナノ粒子をanti-phospho-IκBα-ビオチンおよびTATHA2-ビオチンと4°Cで1時間の間、混合しながら反応させてanti-phospho-IκBα-MNPs複合体を収得した。結合しないリガンドを除去するために複合体を永久磁性体を用いて精製した。HeLa細胞にmRFPと融合したIκBα(IκBα-mRFP)を発現させるプラスミドを導入した上、TNFを5分間処理してから永久磁性体または電磁石を用いて磁場を外部から印加した。共焦点レーザー顕微鏡(Carl Zeiss)を用いて、磁場下において、および磁場を印加しない状態で生きている細胞の共焦点映像を撮影した(図7)。
【0051】
6) GAL4タンパク質とGAL4タンパク質との結合部位を有するオリゴヌクレオチド(UAS)の細胞内の相互作用の検証:酵母の転写活性因子であるGAL4タンパク質が結合できるDNA塩基配列であるUAS (配列番号:1)を含むオリゴヌクレオチド、ビオチン-CCGAGTTTCTAGACGGAG(UAS-ビオチン)を合成した。ストレプトアビジンナノ粒子をUAS-ビオチンおよびTATHA2-ビオチンと4°Cで1時間の間、混合しながら反応させてUAS-MNPs複合体を収得した。結合しないリガンドを除去するために複合体を永久磁性体を用いて精製した。HeLa細胞にEGFPと融合したGAL4(GAL4-EGFP)を発現させるプラスミドを導入した上、これら細胞に前記製造したUAS-MNPsを導入した後、永久磁性体または電磁石を用いて磁場を外部から印加した。共焦点レーザー顕微鏡(Carl Zeiss)を用いて、磁場下において、および磁場を印加しない状態で生きている細胞の共焦点映像を撮影した(図8)。
【0052】
7) miRNAとmRNAの細胞内の相互作用の検証:miRNAとその細胞内の標的であるmRNAの相互作用を検証するために、lin-28 mRNAに結合するlet-7b miRNA(配列番号:2)を選択した(図9)。let-7b miRNAはUGAGGUAGUAGGUUGUGUGGUU-ビオチンの構造で合成して(let-7b-ビオチン)、lin-28 mRNA (配列番号:3)を標識するため、FITC-CCCTATAGTGAGTCGTATTA(FITC-lin28p)を合成した。ストレプトアビジンナノ粒子をlet-7b-ビオチンおよびTATHA2-ビオチンと4°Cで1時間の間、混合しながら反応させてlet7b-MNPs複合体を収得した。結合しないリガンドを除去するために複合体を永久磁性体を用いて精製した。HeLa細胞にlin-28 mRNAを発現させるプラスミドを導入した上、これら細胞に前記製造したlet7b-MNPsとFITC-lin28pを導入した後、永久磁性体または電磁石を用いて磁場を外部から印加した。共焦点レーザー顕微鏡(Carl Zeiss)を用いて、磁場下において、および磁場を印加しない状態で生きている細胞の共焦点映像を撮影した(図10)。
【0053】
8)ベータ-サイクロデキストリンとMBPタンパク質の細胞内の相互作用の検証:ベータ-サイクロデキストリン(Sigma)はEZ-Link NHS-PEO Solid Phase Biotinylation kit(Pierce)を用いてビオチン化(CD-ビオチン)した。ストレプトアビジンをCD-ビオチンおよびTATHA2-ビオチンと4°Cで1時間の間、混合しながら反応させてCD-MNPs複合体を収得した。結合しないリガンドを除去するために複合体を永久磁性体を用いて精製した。HeLa細胞にEGFPと融合したMBP(MBP-GFP)を発現させるプラスミドを導入した上、永久磁性体または電磁石を用いて磁場を外部から印加した。共焦点レーザー顕微鏡(Carl Zeiss)を用いて、磁場下において、および磁場を印加しない状態で生きている細胞の共焦点映像を撮影した(図11)。
【実施例3】
【0054】
マイクロアレイ化された細胞内で結合パートナータンパク質の検証
1,000個余りのヒト由来の完全長ORFs(open reading frames)遺伝子は、ヒト遺伝体機能研究事業団より分譲を受けた。1,000個余りの遺伝子を大腸菌細胞で増殖させた上、プラスミドDNAを抽出し、動物細胞で遺伝子を発現させるためにpcDNA-GFP-DESTベクター(Invitrogen)にクローニングした。pcDNA-GFP-DESTベクターに挿入された遺伝子は、目的タンパク質のC-末端にGFPタンパク質が融合した融合タンパク質を造るようになる。マイクロアレイ化された細胞は、従来の技術により製作し[参考文献:Ziauddin and Sabatini,Nature 411:107-110(2001)]、融合したGFP蛍光タンパク質の発現で検証した。マイクロアレイ化された細胞に前記実施例6と同じ方法で収得したFK506-MNPsを実施例1と同じ方法で導入した後、永久磁性体または電磁石を用いて磁場を外部から印加した。共焦点レーザー顕微鏡を用いて、磁場下において、および磁場を印加しない状態で生きている細胞の共焦点映像を撮影した。陽性クローンに対するRT-PCRおよびmRNAの序列分析により陽性クローンがFK506の薬剤学的に関連した標的であるFKBP12であることが確認された(図12)。
【実施例4】
【0055】
細胞信号伝達(signal transduction)によるタンパク質の翻訳後修飾およびタンパク質複合体の変化の検証
細胞信号伝達によるタンパク質の翻訳後修飾とタンパク質複合体の変化を細胞内で検証するためにTNF-α/IκBα信号伝達系を選択した。IκBαはNF-κBタンパク質であるRelA/p65、p50、c-Relなどと複合体を成して多様な信号を調節する。細胞にTNF-αを処理すると、IκB kinase(IKK)の活性が増加してIκBαの32番目および36番目のセリンがリン酸化され、その結果IκBαとβTrCPタンパク質の結合が起こるようになる[参考文献:Brown,et al.,Science 267:1485,(1995)]。このようにTNF-α処理によるIκBαのリン酸化とIκBα-βTrCP複合体形成を検証するために次のような発現構成物を製作した(図13)。IκBα遺伝子とmRFP遺伝子を融合させた発現ベクターを製作してIκBα-mRFP融合タンパク質が発現するようにした。また、IκBα遺伝子とECFP遺伝子およびFKBP12遺伝子を融合させた発現ベクターを製作してIκBα-ECFP-FKBP12融合タンパク質が発現されるようにした。
【0056】
mRFP-βTrCP融合タンパク質もやはり、それぞれの遺伝子を融合させた発現ベクターを製作して使用した。Anti-phospho-IκBα抗体(Cell Signaling Technology)は、EZ-Link NHS-PEO Solid Phase Biotinylation kit(Pierce)を用いてビオチン化し、ウェスタンブロットで検証した。
【0057】
1)細胞信号伝達によるタンパク質リン酸化の検証:ストレプトアビジンナノ粒子とビオチン-SS-FITC、ビオチン-TATHA2およびビオチン-anti-phopho-IκBα(Ser32)抗体を4°Cで1時間の間、混合しIκBα(Ser32)-MNPs複合体を収得した。IκBα-mRFP発現ベクターが導入されたHeLa細胞にIκBα(Ser32)-MNPs複合体を実施例1と同じ方法で導入させた上、10 ng/mlのTNF-αを5分間処理し、共焦点レーザー顕微鏡を用いて、磁場下において、および磁場を印加しない状態で生きている細胞の共焦点映像を撮影した(図14および15)。IKK阻害剤であるSC-514は1mM濃度で処理した。TNF-α処理によりリン酸化されたIκBαは、IκBα(Ser32)-MNPs複合体と結合し、外部印加された磁気力により、位置移動するのを確認し、IKK阻害剤であるSC-514を処理すると、IκBαのリン酸化が形成されず、位置移動が起こらないことを検証した。
【0058】
2)信号伝達によるタンパク質複合体の形成を確認するために次の実験が行われた。HeLa細胞にIκBα-ECFP-FKBP12融合タンパク質発現ベクターと、EYFP-RelA融合タンパク質発現ベクターと、mRFP-βTrCP融合タンパク質発現ベクターとを同時に導入し、前記HeLa細胞を形質転換し、FK506-MNPs複合体を実施例1と同じ方法で収得し、細胞に導入した。10 ng/mlのTNF-αを5分間処理し、共焦点レーザー顕微鏡を用いて、磁場下において、および磁場を印加しない状態で生きている細胞の共焦点映像を撮影した(図16および17)。信号伝達とは関係なく複合体を成すIκBα-ECFP-FKBP12融合タンパク質とEYFP-RelA融合タンパク質は、外部印加された磁気力による位置移動を起こすのに対し、信号伝達によりリン酸化されたIκBαと結合するmRFP-αTrCP融合タンパク質は、TNF-αを処理した場合にのみ位置移動をした。IKK阻害剤であるSC-514は、IκBα-ECFP-FKBP12融合タンパク質とEYFP-RelA融合タンパク質との結合の妨げにはならず、IκBα-ECFP-FKBP12融合タンパク質とmRFP-βTrCP融合タンパク質との結合のみを阻害した。
【実施例5】
【0059】
遺伝体水準のcDNA発現ライブラリーより生理活性物質と結合パートナータンパク質との細胞内の相互作用のスクリーニング、探索および検証
1)遺伝体水準のcDNA発現ライブラリーよりFK506とその結合パートナータンパク質との細胞内の相互作用のスクリーニング、探索および検証:発現ライブラリーの製造のためのレトロウイルス構成体を製作した。図18に示された構造のpBabe-puroベクターを骨格(backbone)として用いた[参考文献:Morgenstern,et al.,Nucleic Acids Res.18:3587-3596 (1990)]。構成されたレトロウイルスにおいては5' LTRより転写され、EGFP融合タンパク質とmRFPのいずれも含むバイシストロニック(bicistronic) mRNAが発現する。フレームを三種類に異ならして、挿入体(insert)がEGFPに対して最大限インフレーム(in-frame)に入られるようにした(図18)。EGFPの3'または5'末端への無作為なcDNA融合を従来技術により行った(参考文献:Escobar,et al.,Plant Cell 15:1507-1523 (2003))。図19に示すような構造のFK506-ビオチン(biotin)を従来技術により合成し(参考文献:McPherson,et al.,Chem Biol.9:691-698 (2002))、MALDIMSを用いて検証した。ストレプトアビジンナノ粒子をFK506-ビオチンおよびTATHA2-ビオチンと4°Cで1時間の間、混合しながら、反応させてFK506-MNPs複合体を収得した。ジュルカット細胞(Jurkat cells)からEGFP-融合タンパク質発現ライブラリーを従来技術により製造した[参考文献:Escobar,et al.,Plant Cell 15:1507-1523 (2003)]。米国スタンフォード大学のG.P.Nolanより提供されたパッケージング細胞株(Phoenix-ampho)をレトロウイルス発現ライブラリーで形質転換させ、感染性レトロウイルスを製造した。形質転換後、48時間目に形質転換させたパッケージング細胞から上澄み液を収集して0.45μmフィルター(Millipore)でろ過した後、HeLa細胞の感染に用いた。HeLa細胞を4μg/mlポリブレンを添加したウイルス上澄み液で感染させた。2日後、感染された細胞にピューロマイシン(puromycin;1μg/ml)を注入して3日間、選択培養した。次にこれらの細胞に前記製造したFK506-MNPsを実施例1と同じ方法で導入した後、永久磁性体あるいは電磁石を用いて磁場を外部から印加した。共焦点レーザー顕微鏡を用いて、磁場下において、および磁場を印加しない状態で生きている細胞の共焦点映像を撮影した。EGFPと同時発現されたmRFPを偽陽性(false positive)信号として同時にモニターした。図20の写真において、矢印は陽性クローンを意味する。前記陽性クローンに対するRT-PCRおよびmRNAの序列分析により陽性クローンがFK506の薬剤学的に関連した標的であるFKBP12およびFKBP52であることが確認された。陽性クローンに対するRT-PCRおよび序列分析が従来技術により行われた(参考文献:Escobar,et al.,Plant Cell 15:1507-1523 (2003))。
【0060】
2)遺伝体水準のcDNA発現ライブラリーよりCGK1026とその結合パートナータンパク質との細胞内の相互作用のスクリーニング、探索および検証:CGK1026はヒトのテロメラーゼ活性を増進させる生理活性物質であることが明らかにされた(図21;参考文献:Won,et al.,PNAS,101:11328-11333 (2004))。CGK1026と結合する細胞内タンパク質をスクリーニングするためにGCK1026-ビオチン誘導体を製作した。ストレプトアビジンナノ粒子をCGK1026-ビオチンおよびTATHA2-ビオチンと4°Cで1時間の間、混合しながら反応させてCGK1026-MNPs複合体を収得した。実施例5の1)と同じ方法でレトロウイルス発現ライブラリーを用い、CGK1026と結合するタンパク質がHDACであることを確認し、既に知られたHDAC阻害剤であるTSAと比較して類似する程度にHDAC活性を阻害することが確認された(図22;参考文献:Won,et al.,PNAS,101:11328-11333 (2004))。
【実施例6】
【0061】
相互作用の抑制剤および促進剤の薬剤学的探索(drug screening)
1)相互作用の促進剤の探索:実施例4の1)と同じ方法でIκBα-mRFP融合タンパク質発現ベクターとIκBα(Ser32)-MNPs複合体をHeLa細胞に導入した後、多様な化合物と成長促進因子を処理し、外部磁気力を印加してIκBα-mRFP融合タンパク質の位置移動を共焦点顕微鏡で観察した。細胞に処理した生理活性物質の中、TNF-α、IL-2、LPS、Fasなどのみが外部磁気力によるIκBα-mRFP融合タンパク質の位置移動を起こすことが確認された(図15および17)。
【0062】
2) FK506による相互作用抑制:FK506-MNPs複合体とFKBP12-mRFP発現ベクターを実施例3と同じ方法で細胞に導入した後、多様な化合物を処理してFKBP12-mRFP融合タンパク質の位置移動を観察した。処理された化合物の中、FK506のみが競争的にFKBP12-mRFP融合タンパク質の位置移動を阻害することが確認された(図23)。
【0063】
3)相互作用抑制剤の探索:CGK606は、ATM (ataxia telangiectasia)リン酸化酵素の阻害剤として探索された。ストレプトアビジンナノ粒子をCGK606およびTATHA2でコーティングしてCGK606-MNPs複合体を収得した。ATM-mRFP融合タンパク質を発現するベクターをHeLa細胞に導入した後、CGK606-MNPsを前と同じ方法で細胞内に導入した。色々な生理活性低分子化合物を処理した後、外部磁気力を印加してATM-mRFP融合タンパク質の位置移動を共焦点顕微鏡で観察した。細胞に処理した生理活性物質の中、ワルトマニン(wortmannin)のみが陰性対照区と比較し、外部磁気力によるATM-mRFP融合タンパク質の位置移動を抑制することが確認された(図24)。
【産業上の利用可能性】
【0064】
このように、本発明によれば外部から印加される作用力により位置変化する移動反応物質と生理活性物質の第1構成物と、探索のための標識が付着した他の生理活性物質を含む第2構成物を同一作用システム(system)またはフィールド(field)で反応させることにより、相互作用により形成された結合体(complex)を位置変化した標識からリアルタイムで直接探索することができる。また、結合体の位置変化は、外部作用力の強さに応じて躍動的に測定することができ、且つ可逆的(reversible)である。したがって、本発明は、生理活性物質間の相互作用を探索および検出しようとする標的物質の大きさに制限されることなく、細胞を破壊しないでin vitroおよびin vivoで効果的に行うことができるため、新薬開発のための標的タンパク質および新薬候補物質の探索および検出のみならず、既存の薬物を改良する、或いは新しい薬剤学的用途を発見するのに非常に有用に利用されることができる。
【図面の簡単な説明】
【0065】
【図1】本発明の方法に対する概略図を示す。
【図2】緑色蛍光染料であるFITCでコーティングされたナノ粒子を細胞内に導入した後、外部から磁場を印加し、FITCでコーティングされたナノ粒子の位置が変化するのを観察した共焦点顕微鏡写真である。
【図3】EGFPを発現する細胞(緑色)と比較してFKBP12-RFP融合タンパク質を発現する細胞(赤色)の位置移動を示す共焦点顕微鏡写真である。
【図4】FKBP12-RFP融合タンパク質とこれの薬剤学的結合パートナーであるK506-MNPs間の相互作用の結果、細胞(赤色矢印で表す)に外部印加された磁場の可逆的な変動下における結合体の位置移動を示す共焦点顕微鏡写真である。
【図5】mRFP-Caspase3を発現する細胞(赤色矢印で標識)の外部印加された磁場の可逆的な変動下における位置移動を示す共焦点顕微鏡写真である。
【図6】IκBαタンパク質とRelAタンパク質との相互作用の結果、外部印加された磁場の可逆的な変動下においてIκBαタンパク質とRelAタンパク質複合体の位置移動を示す共焦点顕微鏡写真である。
【図7】anti-phospho-IκBα抗体を用いてリン酸化されたIκBαタンパク質を検出した結果、外部印加された磁場の可逆的な変動下におけるanti-phospho- IκBα抗体-IκBαタンパク質複合体の位置移動を示す共焦点顕微鏡写真である。
【図8】外部印加された磁場の可逆的な変動下におけるUASオリゴヌクレオチドとGAL4タンパク質複合体の位置移動を示す共焦点顕微鏡写真である。
【図9】miRNAであるlet-7hとこれに結合するmRNAであるlin-28の相互作用に伴う複合体形成とその位置移動を示す概念図である。
【図10】外部印加された磁場の可逆的な変動下におけるmiRNAとmRNA複合体の位置移動を示す共焦点顕微鏡写真である。
【図11】外部印加された磁場の可逆的な変動下におけるベータ-CDとMBPタンパク質複合体の位置移動を示す共焦点顕微鏡写真である。
【図12】マイクロアレイ化された細胞内で結合パートナータンパク質を検証する実験の概念図である。
【図13】IκBα-mRFP、IκBα-ECFP-FKBP12、EYFP-RelAおよびmRFP-TrCP融合タンパク質の模式図である。
【図14】TNF-α処理後、リン酸化されたIκBα-mRFPがanti-phospho-IκBα(Ser32)抗体によりナノ粒子と結合することを示す模式図である。
【図15】図14の模式図のようにTNF-α処理後に形成されたナノ粒子複合体(nano-particle complex)が外部印加された磁場により、位置変化するのを観察した共焦点顕微鏡写真である。
【図16】図13に説明された融合タンパク質がTNF-α処理後、ナノ粒子複合体を形成することを示す模式図である。
【図17】図16の模式図のように形成されたナノ粒子複合体が外部印加された磁場により、位置変化するのを観察した共焦点顕微鏡写真である。
【図18】発現ライブラリーを製造するためのレトロウイルス構成体を示す。
【図19】標的物質の同定のために用いられたFK506とFK506-ビオチン(biotin)の化学構造を示す。
【図20】外部印加された磁場下において特異的に移動したEGFPと融合したタンパク質を示す共焦点顕微鏡写真である。発現ライブラリーの中、特異な融合したタンパク質はFK506の標的なFKBP12およびFKBP52であることを確認した。
【図21】CGK1026の化学構造を示す。
【図22】CGK1026によるHDACタンパク質の活性阻害を確認した結果である。
【図23】FK506の処理によりビオチン-FK506とFKBP12との結合が競争的に阻害されることを示す共焦点顕微鏡写真である。
【図24】ATMリン酸化酵素とCGK606との相互作用抑制剤の探索の結果、ワルトマニン(WT)による阻害結果を示す共焦点顕微鏡写真である。
【特許請求の範囲】
【請求項1】
i)外部作用力(externally applied driving force)により位置が移動する移動反応物質(localizer)と第1の探索物質とを結合させた第1構成物を提供する段階と、
ii)探索のための標識物質(label)が結びついた第2の探索物質を含む第2構成物を提供する段階と、
iii)同じフィールド(field)またはシステム(system)において前記第1構成物と第2構成物を相互作用が可能な位置に接近させる段階と、
iv)外部作用力を印加し、位置(location)または動き(motion)が変化した標識を測定し、物質の相互作用を探索する段階を含み、物質の相互作用による細胞の形態または機能変化を探索する段階を含む、或いは含まない、物質の相互作用を探索する方法。
【請求項2】
物質が生理活性物質(bioactive molecule)であることを特徴とする請求項1に記載の方法。
【請求項3】
生理活性物質が核酸、ヌクレオチド、タンパク質、ペプチド、アミノ酸、糖、脂質(lipid)、ビタミン、化合物(chemical compound)およびこれらを構成する要素で構成された群から選択された一つ以上の物質であることを特徴とする請求項2に記載の方法。
【請求項4】
外部作用力が磁場であることを特徴とする請求項1ないし3のいずれかに記載の方法。
【請求項5】
磁場が電磁気場または永久磁気場であることを特徴とする請求項4に記載の方法。
【請求項6】
磁場の強さを変動させながら、可逆的(reversible)に探索することを特徴とする請求項4ないし5のいずれかに記載の方法。
【請求項7】
移動反応物質が磁性物質(magnetic material)を含むことを特徴とする請求項4ないし6のいずれかに記載の方法。
【請求項8】
磁性物質を有する移動反応物質の粒径が5nmないし2,000nmであることを特徴とする請求項7に記載の方法。
【請求項9】
標識物質が放射性標識、蛍光性物質または発光性物質であることを特徴とする請求項1ないし8のいずれかに記載の方法。
【請求項10】
蛍光性または発光性物質がそれ自体として蛍光または発光を示す、或いは第1構成物の特定物質または他の物質と結合することにより、蛍光性または発光性を示すことを特徴とする請求項9に記載の方法。
【請求項11】
蛍光性物質が蛍光染料およびテトラシステーン蛍光性モチーフ(tetracystein motif)またはGFP、YFP、CFPおよびRFPを含む蛍光タンパク質または蛍光を示すナノ粒子であることを特徴とする請求項10に記載の方法。
【請求項12】
第1構成物において移動反応物質が2つ以上の特定物質と直接または間接的に結びついたり、コーティングされることを特徴とする請求項1ないし11のいずれかに記載の方法。
【請求項13】
第1構成物において移動反応物質と第1の探索物質との結合が静電気的、物理的、化学的または生物学的結合であることを特徴とする請求項1ないし12のいずれかに記載の方法。
【請求項14】
第2構成物において標識物質(label)が第2の探索物質と直接または間接的に結びついたり、コーティングされることを特徴とする請求項1ないし13のいずれかに記載の方法。
【請求項15】
第2構成物において標識物質と第2の探索物質との結合が静電気的、物理的、化学的または生物学的結合であることを特徴とする請求項1ないし14のいずれかに記載の方法。
【請求項16】
第1構成物または第2構成物において移動反応物質または標識物質と探索物質との結合に抗体(antibody)をはじめとする生理活性物質およびこれらを構成する要素で構成された群から選択された一つ以上の物質を土台にした探針(probe)を用いることを特徴とする請求項1ないし15のいずれかに記載の方法。
【請求項17】
段階iii)の第1構成物と第2構成物の反応がin vivoで行われることを特徴とする請求項1ないし16のいずれかに記載の方法。
【請求項18】
細胞が真核細胞または原核細胞であることを特徴とする請求項17に記載の方法。
【請求項19】
第1構成物および第2構成物の細胞内伝達が細胞伝達性ペプチド(transducible peptideまたはfusogenic peptide)、脂質遺伝子伝達体(lipidまたはliposome)またはこれらの結合体、エレクトロポレーション(electroporation)、Opti-MEM培地で細胞と培養する、或いは磁場下において行われることを特徴とする請求項17または18に記載の方法。
【請求項20】
物質の相互作用が培養プレート(culture plate/dish)またはマイクロアレイ(microarray)化された生きている細胞内で行われることを特徴とする請求項17ないし19のいずれかに記載の方法。
【請求項21】
段階iii)の第1構成物と第2構成物の反応がin vitroで行われることを特徴とする請求項1ないし16のいずれかに記載の方法。
【請求項22】
磁場の強さを変動させるとき、位置変化する、或いは変化しない物質を陰性または陽性対照区として比較探索することを特徴とする請求項4ないし21のいずれかに記載の方法。
【請求項23】
第1構成物または第2構成物の探索物質がライブラリー(library)で提供されることを特徴とする請求項1ないし22のいずれかに記載の
方法。
【請求項24】
第1項ないし第23項のいずれかひとつの項の方法により物質の相互作用を探索した後、第2構成物に含まれた物質を分離して同定する段階をさらに含み、標的物質を検出する方法。
【請求項25】
第1構成物または第2構成物の探索物質がライブラリー(library)で提供されることを特徴とする請求項24に記載の方法。
【請求項26】
i)外部作用力(externally applied driving force)により位置移動する移動反応物質(localizer)と第1の探索物質とを結合させた第1構成物を提供する段階と、
ii)標識物質(label)が結びついた第2の探索物質を含む第2構成物を提供する段階と、
iii)探索のための物質を含む第3構成物を提供する段階と、
iv)同一なフィールド(field)またはシステム(system)において前記第1構成物、第2構成物と第3構成物を相互作用が可能な位置に接近させる段階と、
v)外部作用力を印加し、位置(location)または動き(motion)が変化した標識を測定し、物質の相互作用を探索する段階を含み、物質の相互作用に伴う細胞の形態または機能変化を探索する段階を含む、或いは含まない、物質の相互作用を探索する段階と、
vi)第3構成物に含まれた物質を分離して同定する段階と、を含み、標的物質を検出する方法。
【請求項27】
第1構成物、第2構成物または第3構成物の探索物質がライブラリー(library)で提供されることを特徴とする請求項26に記載の方法。
【請求項28】
外部作用力(externally applied driving force)により位置移動する移動反応物質(localizer)と第1の探索物質とを結合させた第1構成物(constructs)、または探索のための標識(label)が付着した第2の探索物質を含む第2構成物を含有する、同一または他の細胞がマイクロアレイ化され、前記細胞に第2構成物または第1構成物を加え、第1構成物と第2構成物の相互作用を探索するためのチップ(chip)。
【請求項1】
i)外部作用力(externally applied driving force)により位置が移動する移動反応物質(localizer)と第1の探索物質とを結合させた第1構成物を提供する段階と、
ii)探索のための標識物質(label)が結びついた第2の探索物質を含む第2構成物を提供する段階と、
iii)同じフィールド(field)またはシステム(system)において前記第1構成物と第2構成物を相互作用が可能な位置に接近させる段階と、
iv)外部作用力を印加し、位置(location)または動き(motion)が変化した標識を測定し、物質の相互作用を探索する段階を含み、物質の相互作用による細胞の形態または機能変化を探索する段階を含む、或いは含まない、物質の相互作用を探索する方法。
【請求項2】
物質が生理活性物質(bioactive molecule)であることを特徴とする請求項1に記載の方法。
【請求項3】
生理活性物質が核酸、ヌクレオチド、タンパク質、ペプチド、アミノ酸、糖、脂質(lipid)、ビタミン、化合物(chemical compound)およびこれらを構成する要素で構成された群から選択された一つ以上の物質であることを特徴とする請求項2に記載の方法。
【請求項4】
外部作用力が磁場であることを特徴とする請求項1ないし3のいずれかに記載の方法。
【請求項5】
磁場が電磁気場または永久磁気場であることを特徴とする請求項4に記載の方法。
【請求項6】
磁場の強さを変動させながら、可逆的(reversible)に探索することを特徴とする請求項4ないし5のいずれかに記載の方法。
【請求項7】
移動反応物質が磁性物質(magnetic material)を含むことを特徴とする請求項4ないし6のいずれかに記載の方法。
【請求項8】
磁性物質を有する移動反応物質の粒径が5nmないし2,000nmであることを特徴とする請求項7に記載の方法。
【請求項9】
標識物質が放射性標識、蛍光性物質または発光性物質であることを特徴とする請求項1ないし8のいずれかに記載の方法。
【請求項10】
蛍光性または発光性物質がそれ自体として蛍光または発光を示す、或いは第1構成物の特定物質または他の物質と結合することにより、蛍光性または発光性を示すことを特徴とする請求項9に記載の方法。
【請求項11】
蛍光性物質が蛍光染料およびテトラシステーン蛍光性モチーフ(tetracystein motif)またはGFP、YFP、CFPおよびRFPを含む蛍光タンパク質または蛍光を示すナノ粒子であることを特徴とする請求項10に記載の方法。
【請求項12】
第1構成物において移動反応物質が2つ以上の特定物質と直接または間接的に結びついたり、コーティングされることを特徴とする請求項1ないし11のいずれかに記載の方法。
【請求項13】
第1構成物において移動反応物質と第1の探索物質との結合が静電気的、物理的、化学的または生物学的結合であることを特徴とする請求項1ないし12のいずれかに記載の方法。
【請求項14】
第2構成物において標識物質(label)が第2の探索物質と直接または間接的に結びついたり、コーティングされることを特徴とする請求項1ないし13のいずれかに記載の方法。
【請求項15】
第2構成物において標識物質と第2の探索物質との結合が静電気的、物理的、化学的または生物学的結合であることを特徴とする請求項1ないし14のいずれかに記載の方法。
【請求項16】
第1構成物または第2構成物において移動反応物質または標識物質と探索物質との結合に抗体(antibody)をはじめとする生理活性物質およびこれらを構成する要素で構成された群から選択された一つ以上の物質を土台にした探針(probe)を用いることを特徴とする請求項1ないし15のいずれかに記載の方法。
【請求項17】
段階iii)の第1構成物と第2構成物の反応がin vivoで行われることを特徴とする請求項1ないし16のいずれかに記載の方法。
【請求項18】
細胞が真核細胞または原核細胞であることを特徴とする請求項17に記載の方法。
【請求項19】
第1構成物および第2構成物の細胞内伝達が細胞伝達性ペプチド(transducible peptideまたはfusogenic peptide)、脂質遺伝子伝達体(lipidまたはliposome)またはこれらの結合体、エレクトロポレーション(electroporation)、Opti-MEM培地で細胞と培養する、或いは磁場下において行われることを特徴とする請求項17または18に記載の方法。
【請求項20】
物質の相互作用が培養プレート(culture plate/dish)またはマイクロアレイ(microarray)化された生きている細胞内で行われることを特徴とする請求項17ないし19のいずれかに記載の方法。
【請求項21】
段階iii)の第1構成物と第2構成物の反応がin vitroで行われることを特徴とする請求項1ないし16のいずれかに記載の方法。
【請求項22】
磁場の強さを変動させるとき、位置変化する、或いは変化しない物質を陰性または陽性対照区として比較探索することを特徴とする請求項4ないし21のいずれかに記載の方法。
【請求項23】
第1構成物または第2構成物の探索物質がライブラリー(library)で提供されることを特徴とする請求項1ないし22のいずれかに記載の
方法。
【請求項24】
第1項ないし第23項のいずれかひとつの項の方法により物質の相互作用を探索した後、第2構成物に含まれた物質を分離して同定する段階をさらに含み、標的物質を検出する方法。
【請求項25】
第1構成物または第2構成物の探索物質がライブラリー(library)で提供されることを特徴とする請求項24に記載の方法。
【請求項26】
i)外部作用力(externally applied driving force)により位置移動する移動反応物質(localizer)と第1の探索物質とを結合させた第1構成物を提供する段階と、
ii)標識物質(label)が結びついた第2の探索物質を含む第2構成物を提供する段階と、
iii)探索のための物質を含む第3構成物を提供する段階と、
iv)同一なフィールド(field)またはシステム(system)において前記第1構成物、第2構成物と第3構成物を相互作用が可能な位置に接近させる段階と、
v)外部作用力を印加し、位置(location)または動き(motion)が変化した標識を測定し、物質の相互作用を探索する段階を含み、物質の相互作用に伴う細胞の形態または機能変化を探索する段階を含む、或いは含まない、物質の相互作用を探索する段階と、
vi)第3構成物に含まれた物質を分離して同定する段階と、を含み、標的物質を検出する方法。
【請求項27】
第1構成物、第2構成物または第3構成物の探索物質がライブラリー(library)で提供されることを特徴とする請求項26に記載の方法。
【請求項28】
外部作用力(externally applied driving force)により位置移動する移動反応物質(localizer)と第1の探索物質とを結合させた第1構成物(constructs)、または探索のための標識(label)が付着した第2の探索物質を含む第2構成物を含有する、同一または他の細胞がマイクロアレイ化され、前記細胞に第2構成物または第1構成物を加え、第1構成物と第2構成物の相互作用を探索するためのチップ(chip)。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24】


【公表番号】特表2008−507269(P2008−507269A)
【公表日】平成20年3月13日(2008.3.13)
【国際特許分類】
【出願番号】特願2007−522425(P2007−522425)
【出願日】平成17年7月20日(2005.7.20)
【国際出願番号】PCT/KR2005/002352
【国際公開番号】WO2006/009398
【国際公開日】平成18年1月26日(2006.1.26)
【出願人】(507014726)シージーケー カンパニー リミテッド (1)
【Fターム(参考)】
【公表日】平成20年3月13日(2008.3.13)
【国際特許分類】
【出願日】平成17年7月20日(2005.7.20)
【国際出願番号】PCT/KR2005/002352
【国際公開番号】WO2006/009398
【国際公開日】平成18年1月26日(2006.1.26)
【出願人】(507014726)シージーケー カンパニー リミテッド (1)
【Fターム(参考)】
[ Back to top ]

