物質相互作用をリアルタイムに可視化する技術
【課題】物質と物質との相互作用をリアルタイムに可視化するための技術、詳細には、タンパク質相互作用を顕微鏡下でリアルタイムに観察するために有用な顕微鏡観察用プレート、当該顕微鏡観察用プレートを備えた顕微鏡観察用プレート載置装置、及び当該顕微鏡観察用プレートまたは顕微鏡観察用プレート載置装置を用いたタンパク質相互作用の検出方法を提供する。
【解決手段】タンパク質等の物質同士の相互作用の検出に、光透過性を有しかつ非発光性の樹脂材料により形成された平板状のものであり、一方の表面10に、流体の流路を構成する凹部2を少なくとも1つ備え、前記凹部の底面22には、ビーズを収容可能な窪み部3が複数形成されている顕微鏡観察用プレート1を用いる。
【解決手段】タンパク質等の物質同士の相互作用の検出に、光透過性を有しかつ非発光性の樹脂材料により形成された平板状のものであり、一方の表面10に、流体の流路を構成する凹部2を少なくとも1つ備え、前記凹部の底面22には、ビーズを収容可能な窪み部3が複数形成されている顕微鏡観察用プレート1を用いる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、物質、特にタンパク質の相互作用をリアルタイムに可視化するための技術に関する。より詳細には、タンパク質相互作用を顕微鏡下でリアルタイムに観察するために有用な顕微鏡観察用プレート、当該顕微鏡観察用プレートを備えた顕微鏡観察用プレート載置装置、及び当該顕微鏡観察用プレートまたは顕微鏡観察用プレート載置装置を用いたタンパク質相互作用の検出方法に関する。
【背景技術】
【0002】
興味あるタンパク質の生命現象における機能を探索するうえで、他のタンパク質との「結合」と「解離」から成立する相互作用を無視した研究はもはや不可能である。このため、従来からタンパク質間の相互作用を解析するさまざまな方法や機器が開発されている。例えば、タンパク質間の相互作用を検討する方法として、古典的にはpull-downアッセイが知られている。当該方法は、担体に固定化したタグ付きタンパク質(ベイト)に測定対象のタンパク質を含む溶液を反応させ、次いでベイトに結合したタンパク質を溶出分離し、その結果から両者タンパク質間の相互作用を評価する方法である。しかし、かかる方法によれば、タンパク質間相互作用を評価するのに半日以上要し、また当該方法は、タンパク質間の反応がリアルタイムでは検出できないという問題がある。
【0003】
しかし、相互作用をリアルタイムに検出できる機器は、表面プラズモン共鳴現象(SPR)を利用したBiacoreのタンパク質相互作用解析システムなど、1000万円を超える高額なものばかりであり、安価にタンパク質間相互作用をリアルタイムに可視化できる装置は皆無である(例えば、非特許文献1及び2など参照)。
【先行技術文献】
【非特許文献】
【0004】
【非特許文献1】表面プラズモン共鳴(SPR)現象の利用(GE Healthcare)<URL:http://www.biacore.com/jp/lifesciences/technology/introduction/data_interaction/index.html>
【非特許文献2】タグ付きタンパク質を用いたタンパク質相互作用解析(GE imagination at work)<URL: http://www.gelifesciences.co.jp/newsletter/protein_sciences/tag_interaction.asp>
【発明の概要】
【発明が解決しようとする課題】
【0005】
本発明は、安価にしかも簡便に、物質間の相互作用をリアルタイムに可視化検出するための方法、当該方法に使用するためのツール、具体的には顕微鏡観察用プレート及びそれを備えた顕微鏡観察用プレート載置装置といった顕微鏡のアプリケーターを提供することを目的とする。
【課題を解決するための手段】
【0006】
本発明者らは、上記課題を解決すべく鋭意検討していたところ、例えばタンパク質等の、物質と物質との相互作用を検出するにあたり、一方の物質をビーズに結合させ、他方の物質を蛍光色素などで標識化し、当該ビーズに結合させた物質と標識物質との結合(相互作用)を、ビーズの標識の有無を指標にすることで可視的に検出することができること;さらに当該ビーズに結合させた物質と標識物質との結合(相互作用)を、流体の流路として、底部に上記ビーズを収容(捕捉)可能な窪み部が複数形成されてなる凹部を備えた顕微鏡観察用プレート(マイクロ流路付きプレート)上で、これを顕微鏡ステージに載せた状態で、反応液と洗浄液を通液しながら行うことにより、顕微鏡観察によりリアルタイムに検出することができることを見出した。
【0007】
特に、顕微鏡ステージに載せ置きした上記顕微鏡観察用プレートの流路(凹部)において、ビーズに結合させた物質と標識物質とを一旦結合させた後に任意の洗浄液で通液することにより、流路(凹部)の底面の窪み部に捕捉収容されたビーズに一旦結合した標識物質が、ビーズに結合した物質とのアフィニティーに応じて解離するため、両物質同士の相互作用(結合と解離)や両者のアフィニティーをリアルタイムに観察することができる。
【0008】
本発明はかかる知見に基づいて開発したものであり、下記の実施形態を備えるものである。
【0009】
(I)顕微鏡観察用プレート
(I-1)光透過性を有しかつ非発光性の樹脂材料により形成された平板状のものであり、
一方の表面に、流体の流路を構成する凹部を少なくとも1つ備え、
前記凹部の底面には、ビーズを収容可能な窪み部が複数形成されている顕微鏡観察用プレート。
(I-2)前記凹部を2つ以上備え、各凹部が互いに並行に設けられていることを特徴とする(I-1)に記載の顕微鏡観察用プレート。
(I-3)前記ビーズが球状であり、前記窪み部の深さが前記ビーズの直径の1/2よりも小さいことを特徴とする(I-1)または(I-2)に記載の顕微鏡観察用プレート。
(I-4)上記樹脂材料が親水加工処理されてなるものである、(I-1)乃至(I-3)のいずれかに記載する顕微鏡観察用プレート。
(I-5)親水加工処理が、プラズマ放電処理またはコロナ放電処理である(I-4)に記載する顕微鏡観察用プレート。
(I-6)上記樹脂材料がポリジメチルシロキサンである、(I-1)乃至(I-5)のいずれかに記載する顕微鏡観察用プレート。
【0010】
(II)顕微鏡観察用プレート載置装置
(II-1)内部に(I-1)乃至(I-6)のいずれかに記載の顕微鏡観察用プレートを載置可能な試料容器と、前記試料容器を収容可能な収容具と、前記収容具を保持可能であり顕微鏡ステージに載置される支持ユニットと、前記支持ユニットの上面側開口を覆う蓋とを有し、
前記試料容器は、上面が開口した本体と前記本体の上面を塞ぐ蓋体とを備えており、前記蓋体の上面または前記本体の側面には、少なくとも2つのホース接続部が一体に形成されており、前記ホース接続部には、前記試料容器内に反応液または洗浄液を供給もしくは排出するためのホースを挿通可能なホース挿入穴が形成されている顕微鏡観察用プレート載置装置。
【0011】
(III)物質と物質との相互作用を検出する方法
(III-1)被験物質と標識物質との結合を検出する方法であって、
顕微鏡ステージに載せ置きした、(I-1)乃至(I-6)のいずれかに記載する顕微鏡観察用プレート上で、下記(a)、(b)及び(c)の工程を行う方法:
(a)反応液の存在下、被験物質を結合させたビーズと標識物質とを接触させる工程、
(b)顕微鏡観察用プレートの凹部の目に並行して洗浄液を通液する工程、
(c)標識物質に由来する標識を検出する工程。
(III-2)被験物質と標識物質との結合を検出する方法であって、
顕微鏡ステージに載せ置きした、(I-1)乃至(I-6)のいずれかに記載する顕微鏡観察用プレート上で、下記(a’)、(b)及び(c)の工程を行う方法:
(a’)顕微鏡観察用プレートに、その凹部の目に並行して、被験物質を結合させたビーズと標識物質を含む溶液を通液する工程、
(b)顕微鏡観察用プレートの凹部の目に並行して洗浄液を通液する工程、
(c)標識物質に由来する標識を検出する工程。
(III-3)被験物質または標識物質が、ペプチド、タンパク質、核酸、糖類、脂質、酵素、酵素基質、受容体、リガンド、抗体、抗原、レクチン、ハプテン、その他の低分子または高分子化合物からなる群から選択される少なくとも一種である、(III-1)または(III-2)に記載する方法。
(III-4)被験物質または標識物質が、ペプチドまたはタンパク質である、(III-1)または(III-2)に記載する方法。
(III-5)被験物質がタグ付き物質である、(III-1)乃至(III-4)のいずれかに記載する方法。
(III-6)タグ付き物質のタグが、GSTタグ、MBPタグ、Hisタグ、Strep(II)タグ、FLAGタグ、HAタグ、mycタグ、及びBCCPタグからなる群から選択される少なくとも1つである、(III-5)に記載する方法。
(III-7)被験物質または標識物質の一方の物質として、核移行シグナルを有するタンパク質を用い、他方の物質として、核移行シグナルを認識し結合するタンパク質を用いることを特徴とする、(III-1)乃至(III-6)のいずれかに記載する方法。
(III-8)核移行シグナルが、NAC-1(nucleus accumbens-associated protein 1)の核移行シグナル、またはnucleoplasmin の核移行シグナルである(III-7)に記載する方法。
(III-9)核移行シグナルを認識し結合するタンパク質が、importin αである、(III-7)または(III-8)に記載する方法。
(III-10)被験物質と標識物質との相互作用を評価する方法である、(III-1)乃至(III-9)のいずれかに記載する方法。
(III-11)被験物質と標識物質とのアフィニティーを評価する方法である、(III-1)乃至(III-9)のいずれかに記載する方法。
【発明の効果】
【0012】
本発明の方法によれば、物質と物質との相互作用、特にタンパク質とタンパク質との相互作用を、底面に窪み部が形成されてなる凹部を、流体の流路として備えた特定形状の顕微鏡観察用プレート(マイクロ流路付きプレート)上で、当該プレートを顕微鏡ステージに載せた状態で行うことにより、顕微鏡観察によりリアルタイムに可視的に検出することができる。特に、顕微鏡ステージに載せ置きした上記顕微鏡観察用プレートの流路(凹部)において、ビーズ結合物質と標識物質とを一旦結合させた後に任意の洗浄液で通液することにより、流路(凹部)の底面の窪み部に捕捉収容されたビーズに一旦結合した標識物質が、ビーズに結合した物質とのアフィニティーに応じて解離するため、両物質同士の相互作用(結合と解離)や両者のアフィニティーをリアルタイムに観察することができる。
【0013】
本発明の顕微鏡観察用プレート及びそれを備えた顕微鏡観察用プレート載置装置は、物質と物質との相互作用、特にタンパク質とタンパク質との相互作用を、顕微鏡を用いて、可視的に且つリアルタイムに検出するために好適に用いられる顕微鏡のアプリケーターとして有用である。
【図面の簡単な説明】
【0014】
【図1】本発明の一実施形態に係る顕微鏡観察用プレートの外観構成を示す斜視図である。
【図2】図1のA−A線に沿う断面図である。
【図3】図1のB−B線に沿う断面図である。
【図4】他の実施形態に係る顕微鏡観察用プレートの外観構成を示す正面図である。
【図5】窪み部の構成を示す断面図である。
【図6】本発明の一実施形態に係る顕微鏡観察用プレート載置装置の分解斜視図である。
【図7】顕微鏡観察用プレート載置装置に用いられる試料容器の斜視図である。
【図8】図7に示す試料容器を分離して示す斜視図である。
【図9】図7のA−A線に沿う断面図である。
【図10】pull-down法により、グルタチオンビーズに結合させたGST融合importin α3(野生型)タンパク質(図中、「wild-type」と標記)及びGST融合importin α3(W179A、N183A)タンパク質(図中、「WN→AA」と標記)をそれぞれ各テストサンプル〔mCherry融合NAC-1(180-207)[図中、「mC-NAC-1(180-207)」と標記]、mCherry融合nucleoplasmin-NLS [図中、「mC-nucleoplasmin(NLS)」と標記]、mCherry [図中、「mC」と標記])と混合し、次いで溶出させ、SDS-PAGEに供した結果を示す(実験例1)。図中、「input」のレーンは、各テストサンプル(mCherry融合NAC-1(180-207)、mCherry融合nucleoplasmin-NLS、mCherry)そのものをSDS-PAGEに供したstandard結果を示す。また図中「mC fusion proteins」は、mCherry融合NAC-1(180-207)及びmCherry融合nucleoplasmin-NLSを意味する。
【図11】カバーガラス上で「on beads 顕微鏡アッセイ(その1)」(実験例2)を行う概略を示す図である。
【図12】カバーガラス上で「on beads 顕微鏡アッセイ(その1)」(実験例2)を行った観察データを示す。GST融合importin α3(野生型)タンパク質(図中、「wild-type」と標記)及びGST融合importin α3(W179A、N183A)タンパク質(図中、「WN→AA」と標記)の各結果において、黒く見える左側の図は蛍光観察結果を、灰色に見える右側の図は透過光観察結果を示す。上段、中段及び下段に、テストサンプルとして、mCherry、mCherry融合nucleoplasmin-NLS [図中、「mCherry-nucleoplasmin(NLS)」と標記]、及びmCherry融合NAC-1(180-207)[図中、「mCherry-NAC-1(180-207)」と標記]を用いた場合の、ビーズに結合したGST融合importin α3タンパク質との相互作用をそれぞれ示す。
【図13】カバーガラス上での「on beads 顕微鏡アッセイ(その1)」(実験例2)の観察データを統計処理した結果を示す。
【図14】カバーガラス上で希釈しながら行った「on beads 顕微鏡アッセイ(その2)」(実験例3)の観察データを示す。上の2段は、反応液中でGST融合importin α3(野生型)タンパク質を結合させたグルタチオンビーズと mCherry融合nucleoplasmin-NLSとを混合し、順次、当該反応液を回収しながら洗浄液(1% Triton-X 100を含むPBS)を添加して希釈したものである。下の2段は、GST融合importin α3(W179A、N183A) タンパク質を結合させたグルタチオンビーズと mCherry融合nucleoplasmin-NLS とを混合し、順次、当該反応液を回収しながら洗浄液(1% Triton-X 100を含むPBS)を添加して希釈したものである。上と下の各2段において、黒く見える上一列の図は蛍光観察結果を、灰色に見える下一列の図は透過光観察結果を示す。
【図15】カバーガラス上で希釈しながら行った「on beads 顕微鏡アッセイ(その2)」(実験例3)の観察データを統計処理した結果を示す。
【図16】本発明の顕微鏡観察用プレート(マイクロ流路付きプレート)上での「on beads 顕微鏡アッセイ(その3)」(実験例4)の概略を示す図である。図に示す平面部は、顕微鏡観察用プレートの流路(凹部)の、窪み部3が形成された底面22を意味する。
【発明を実施するための形態】
【0015】
(I)顕微鏡観察用プレート
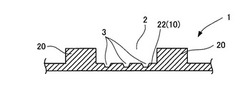
図1は、本発明の一実施形態に係る顕微鏡観察用プレート1の外観構成を示している。また、図2は、図1の顕微鏡観察用プレート1のA−A線に沿う断面図を、図3は、図1の顕微鏡観察用プレート1(以下、単に「プレート1」とも称する)のB−B線に沿う断面図を、それぞれ示している。
【0016】
本実施形態のプレート1は、光透過性を有するとともに非発光性の樹脂材料によって平板状に形成されている。かかる樹脂材料としては、例えば、ポリエチレンテレフタレート、ポリ塩化ビニル、ポリメタクリル酸、ポリスチレン、ポリカーボネート、ポリエチレン、ポリプロピレン、ポリ酢酸ビニル、ナイロン、ポリメチルペンテン、ポリエーテルサイフォン、ポリサルフォン、ポリイソブレン、ポリジメチルシロキサン、またはこれらの共重合体等が挙げられる。光透過性及び非発光性であり、しかも加工がしやすい樹脂材料であるという点で、好ましくはポリジメチルシロキサンである。
【0017】
これらの樹脂材料からなる本実施形態のプレート1は、その表面の少なくとも検体と接触する部分、具体的には、プレート1における流体の流路を構成する凹部2が窪み部3を含めて親水加工処理されていることが好ましい。親水加工処理方法は、特に制限されないが、例えばプラズマ放電処理またはコロナ放電処理を例示することができる。
【0018】
ちなみに、プラズマ放電処理は、気体分子に電場をかけることで、気体中に存在する自由電子が加速されて速度エネルギーをもち、その電子と衝突した気体分子が解離して種々の化学種を含むいわゆるプラズマを形成し、このプラズマを材料表面に照射することにより表面改質する方法である。また、コロナ放電処理は、極性基の少ない材料表面に、高周波及び高電圧を用いて大気中でコロナ放電を発生させ、それによって生成される反応基と共に、電子を直接材料表面に照射することにより表面改質する方法である。かかる処理により、プレート1の表面の少なくとも検体と接触する部分が親水加工される。ここで親水加工されたプレート1の表面の濡れ張力は、制限されないものの、3.5×10−2〜9.5×10−2N/mになるように調製することもできる。当該濡れ張力は、水の接触角を測定することにより算出することもできるし、また表面張力測定試薬を用いて測定し算出することもできる。
【0019】
このプレート1の一方の表面10(プレート1の他方の表面と区別するために、「上面10」ともいう)には、プレート1の長さ方向に延びる凹部2が少なくとも1つ(図1に示す実施形態では5つ)設けられている。この凹部2は、反応液や洗浄液等の流体を、流通可能な状態で溜め置き、また流通させるための流路として機能するものであり、それぞれが互いに並行に、プレート1の一端部から他端部まで障壁なく連通するように設けられている。
【0020】
プレート1に形成される当該凹部2の数は、少なくとも1以上であればよく、その上限は特に制限されず、プレート1の幅方向の長さと凹部2の横幅の長さから適宜設定することができる。例えば、プレート1の大きさとして、幅方向と長さ方向の長さ(幅方向×長さ方向)が、通常10〜25mm×10〜60mm、好ましくは10〜25mm×15〜40mm、より好ましくは15〜25mm×20〜30mmを例示することができる。また、プレート1の片方表面に形成される凹部2の横幅の長さとしては、通常0.8〜2.2mm、好ましくは1〜2mm、より好ましくは1.2〜1.8mmを例示することができる。制限されないが、凹部2の数の上限として10以下、好ましくは8以下、より好ましくは7以下、特に好ましくは6以下を例示することができる。
【0021】
本実施形態では、プレート1の表面10(上面10)上には、6つの立壁20が所定の間隔をあけて互いに平行に立設されており、隣り合う2つの立壁20とその間に挟まれたプレート1の上面10とによって凹部2が形成されている。ここで隣り合う2つの立壁20により形成された凹部2の内側の底面は、プレート1の上面10であると同時に凹部2の底面22でもある(図2及び3参照)。なお、必ずしもこれに限られるものではなく、図4に示すように、平板状のプレート1の上面10に、1以上の溝21を互いに平行に凹設することによっても(図4では3つの溝21を形成した実施形態を示す)、反応液や洗浄液等の流体の流路となる凹部2を形成することが可能である。この場合、溝21を凹設することによって形成された凹部2の内側の底面は、凹部2の底面22でもあると同時にプレート1の上面10でもある。
【0022】
斯くして調製される各凹部2の底面22(図1〜図4)には、図5に示すように、物質を結合したビーズMを収容することが可能な窪み部3が複数形成されている(図2、図3および図4参照)。
【0023】
この窪み部3は、プレート1の凹部2に、ビーズMを含む反応液等の流体を流通させたときにビーズMを窪み部3内に捕捉収容し、またそれに引き続いて洗浄液等の流体を流通させたときに、当該流体の流れによってビーズMが窪み部3から出ないよう窪み部3内に拘束するためのものである。そのため、窪み部3は、ビーズMが窪み部3内に捕捉収容されるように、また一旦捕捉収容されたビーズMが、窪み部3内から飛び出さずに、窪み部3内に嵌まって保持されるよう、ビーズMの大きさに沿った大きさおよび形状に形成される。
【0024】
ここでビーズMの形状は、略球状、好ましくは球状である。またその大きさは、制限されないが、通常、直径20〜150μm程度、好ましくは30〜100μm程度、より好ましくは50〜100μm程度を例示することができる。
【0025】
本実施形態では、窪み部3は、断面視形状が円形の円錐台状に形成されている(図5)。円錐台状に形成することで、流体とともに凹部2内を流れるビーズMを窪み部3に捕捉収容しやすくすることができる。なお、窪み部3の形状は、必ずしもこれに限られるものではなく、断面視形状が正方形の角錐台状に形成されていてもよい。また、一旦捕捉したビーズMを窪み部3内にしっかりと保持するために、窪み部3の側周面30を、図5に示されているように窪み部3の上端から下端に向けて内方に傾斜させるよりも、まっすぐ下方に垂下させて、窪み部3を円柱状もしくは角柱状に構成することもできる。
【0026】
一方、窪み部3の深さDは、ビーズMを窪み部3内にしっかりと保持するためにはより深く設計されるのが望ましいが、後述するように反応液によってビーズMの外周中央部の円状の蛍光シグナルSを標識として付けるためには、少なくともビーズMの上半分は窪み部3の上方に露出している必要がある。よって、窪み部3の深さDとしては、ビーズMの直径rの1/2よりも小さく設定されているのが望ましい。好ましくは1/2未満1/4以上、より好ましくは1/2未満1/3以上である。
【0027】
各窪み部3は、本実施形態では、図2および図3に示すように、凹部2の長さ方向に5個、所定の間隔をあけて並列配置されているとともに(図3参照)、この窪み部3の列が凹部2の幅方向に3列(図2参照)、所定の間隔をあけて設けられることで、計15個の窪み部3がマトリクス状に配置されている。この15個の窪み部3は、各凹部2の長さ方向の中央部に密集するようにかためて配置されている。当該長さ方向の中央部は、プレート1を顕微鏡ステージに載せ置きした場合に、観察できる実視野領域に相当する部分である。つまり、窪み部3を凹部2の長さ方向中央部に密集するように配置することで、窪み部3に捕捉収容されたビーズMにおいて、当該ビーズMに結合させたタンパク質と他のタンパク質(標識タンパク質)との間の相互作用を効率よく観察することができる。
【0028】
ただし、プレート1の凹部2の底面22における窪み部3の配置の仕方は、必ずしもこれに限られるものではなく、1列に設ける窪み部3の数を5個から増減させることも可能であるし、列の数を3列から増減させることも可能である。また、窪み部3が各凹部2の長さ方向のほぼ全域にわたって散在するように各窪み部3を配置させることも可能である。このように、各窪み部3は、凹部2の底面22の任意の位置に配置させることができる。
【0029】
凹部2の底面22の窪み部3が配置されていない領域には、適宜、傾斜溝4が形成されている。この傾斜溝4は、反応液や洗浄液等の流体の流れる方向F(図3で示す例では、右から左に向かう方向)に向かって低くなるように傾斜する傾斜面40と、傾斜面40の傾斜下端に連続して形成された垂直面41とを備えている。反応液や洗浄液等の流体の流れによって、ビーズMが仮に窪み部3内から飛び出して、流れに乗って凹部2内を移動すると、このビーズMが、別の窪み部3内に保持されているビーズMに勢いよく衝突することで、正常に窪み部3内に保持されているビーズMが押し出されてしまうおそれがある。この傾斜溝4は、上記した問題を解消するためのもので、窪み部3内から飛び出したビーズMを傾斜面40を介して下端の底部42に向けて落とし込むことで、ビーズMを捕らえて、ビーズMが凹部2内を移動することを規制している。
【0030】
以上で説明する本発明の顕微鏡観察用プレートは、下記(II)顕微鏡観察用プレート載置装置に組み込んだ形で、またはそのままの形態で、後述する(III)に記載の方法において好適に用いることができる。
【0031】
(II)顕微鏡観察用プレート載置装置
顕微鏡観察用プレート載置装置5は、図6に示すように、支持ユニット6、収容具7および蓋8によって構成されている。支持ユニット61は、略長方形型の枠状に形成された本体部60を有している。この本体部60は、外壁61、内壁62および底壁63によって構成されており、上面には上面側開口64が、下面には下面側開口65が、それぞれ形成されている。内壁62の内側面の下端部には、内側へ突き出す支持部66が形成されている。本体部60の底壁62の裏面には、ヒータ74が設けられている。このヒータ74は、金属板にニクロム線が埋設状に備えられた構成のものであり、底壁62の裏面に密着した状態に貼り付けられ、底壁62の下面側開口65はこのヒータ74によって覆われている。ヒータ74には長方形状の孔75が形成されている。なお、図6中、67は電気コードであり、電気コード67はヒータ74のニクロム線に電気的に接続されている。
【0032】
収容具7は、略長方形型の板状のベース70を有しており、このベース70は外縁が本体部60の支持部66に載る寸法に形成されている。ベース70の中央部には孔71が形成され、孔71の周辺には凹部72が形成されている。この凹部72内に後述するディッシュなどの試料容器9が着脱自在に装着されるようになっている。また、ベース70には、一対の押えバネ73が回動自在に設けられており、試料容器9が凹部72内に設けられた状態では、押えバネ73によって試料容器9が固定される。
【0033】
蓋8は、略長方形型の枠体80と、枠体80により保持されている透明なガラス81により構成されている。
【0034】
図7中、試料容器9は、透明なプラスチックまたはガラスにより形成されており、やや深めの円形皿状をした本体90と、これに被せる蓋体91とで構成されている。本体90の底面92上に、上記した顕微鏡観察用プレート1が載置される。蓋体91には、その上面から突き出たホース接続部93が一体に2つ形成されている。各ホース接続部93は、蒲鉾形をしていて、蓋体91の中心を挟んで互いに反対側に位置しており、いずれもホース挿入穴94が形成されている。このホース挿入穴94は、その一端がホース接続部93の一側面に開口するとともに他端が蓋体91の底面に開口したL字形に屈曲しており、各ホース挿入穴94の一端側の開口は互いに反対側に向かって開口している。一方のホース挿入穴94には反応液や洗浄液を試料容器9内に供給するための供給ホース95が、他方のホース挿入穴94には試料容器9内の反応液や洗浄液を試料容器9外に排出するための排出ホース96が、それぞれ挿入されており、各ホース95,96の先端は蓋体91の底面より下方へ引き出される。各ホース95,96の他端は、蓋8の内周面まで延び、ホースホルダー97を介して顕微鏡観察用プレート載置装置5の外部も延びている。なお、本実施形態では、各ホース接続部93が試料容器9の蓋体91の上面に形成されているが、本体90の側面に一体形成されていてもよい。また、反応液と洗浄液とを別々のルートで試料容器9内に供給/排出するために、反応液の供給/排出用のホース接続部93、および、洗浄液の供給/排出用のホース接続部93を少なくとも2つずつ設けるようにしてもよい。
【0035】
(III)物質と物質との相互作用を検出する方法
本発明は、上記(I)顕微鏡観察用プレートまたは当該プレートを備えた(II)顕微鏡観察用プレート載置装置を用いて、顕微鏡を用いて、物質と物質との結合をリアルタイムに検出する方法である。
【0036】
当該方法は、具体的には、上記顕微鏡観察用プレートまたは当該プレートを備えた顕微鏡観察用プレート載置装置を顕微鏡ステージに載せ置きし、その状態で、顕微鏡観察用プレートのうえで、下記(a)〜(c)の工程を行うことによって実施することができる。なお、(c)の工程は、(a)及び(b)の工程と同時並行して行われるか、少なくとも(b)の工程と同時並行して行われる。
(a)反応液の存在下、被験物質を結合させたビーズと標識物質とを接触させる工程、
(b)顕微鏡観察用プレートの凹部の目に並行して洗浄液を通液する工程、
(c)標識物質に由来する標識を検出する工程。
【0037】
また、上記(a)工程に代えて、下記(a’)工程を行ってもよい。
(a’)顕微鏡観察用プレートに、その凹部の目に並行して、被験物質を結合させたビーズと標識物質を含む溶液を通液する工程。
【0038】
以下、各工程について説明する。
(a)工程
当該(a)工程は、反応液中で物質と物質とを接触させる工程である。
【0039】
ここで物質は、お互いの相互作用を評価する対象の物質である。制限されないが、一方の物質と他方の物質とが、静電的相互作用、水素結合作用、イオン結合作用、疎水性相互作用または親水性相互作用等の1以上の作用によって、お互いに特異的に相互作用することが予想される物質を例示することができる。特異的な結合の例としては、抗原と抗体との結合、受容体とそのリガンド(アンタゴニストまたはアゴニスト)との結合、酵素と基質との結合、アプタマー(ペプチドまたは核酸)とそれに結合する物質との結合、レクチンと糖鎖を有する物質(糖類、糖タンパク質)との結合、複合体を構成するサブユニット同士の結合、シグナル伝達過程におけるタンパク質を初めとする物質同士の結合を例示することができる。
【0040】
しかし、このような結合様式にかかわらず、本発明が対象とする物質には、ペプチド(例えば、アプタマーが含まれる)、タンパク質(例えば、酵素、抗体、受容体、抗原、レクチン、糖タンパク質が含まれる)、核酸(例えば、ポリヌクレオチド、DNA、RNA、アプタマーが含まれる)、糖類(例えば、レクチンに結合する糖類が含まれる)、脂質、酵素に対する基質(例えば、低分子及び高分子化合物が含まれる)、受容体に対するリガンド(例えば、低分子及び高分子化合物が含まれる)、抗体に対する抗原やハプテン、並びにタンパク質等に結合することにより、その機能阻害することのできる低分子あるいは高分子化合物等が、制限なく含まれる。
【0041】
一方の物質として、好ましくはペプチドまたはタンパク質を挙げることができ、他方の物質として、上記ペプチドまたはタンパク質に結合しえる各種の物質を挙げることができる。当該各種の物質には、前述するように、例えばペプチドアプタマーに結合する物質、酵素に結合する基質、レクチンに結合する糖類または糖タンパク質、抗体に結合する抗原やハプテン、抗原に結合する抗体、受容体に結合するリガンド、シグナル伝達過程等においてタンパク質等に結合する相手方の物質等を挙げることができる。また、一方の物質が、核移行シグナルを有するペプチドまたはタンパク質である場合は、他方の物質として核移行シグナルを認識し結合するペプチドまたはタンパク質を例示することができる。
【0042】
ここで、核移行シグナル(nuclear localization signal:NLS)としては、特に制限されないが、後述する実験例で用いるNAC-1(nucleus accumbens-associated protein 1)の核移行シグナル(NLS)、またはnucleoplasmin の核移行シグナル(NLS)を例示することができる。これらの核移行シグナル(NLS)を認識し結合するタンパク質としては、細胞の核膜に存在し、NLS依存的にタンパク質を核内に運び込むことが知られているimportin αを例示することができる。
【0043】
importin αの由来は特に制限されず、植物やヒトを含む動物に由来するimportin αを制限なく挙げることができるが、好ましくはヒト由来のimportin α3である。当該ヒトimportin α3の遺伝子の塩基配列を配列表の配列番号1に示す。当該塩基配列において、塩基番号10-1575の領域が、ヒトimportin α3(野生型)のコーディング領域(CDS領域)である。また、そのアミノ酸配列を配列番号2に示す。
【0044】
なお、後述する実験例に示すように、当該ヒトimportin α3(野生型)のN末端から179番目のトリプトファンと183番目のアスパラギンをいずれもアラニンに置換することで、NLSに対する結合能が消失する(Conti, e. et al., Cell 94; 193-204, 1998)。
【0045】
一方、NAC-1(nucleus accumbens-associated protein 1)は、核内転写制御タンパク質である(Nakayama, K., et al., Proc. Natl Acad. Sci. USA, 103: 18739-18744, 2006)。NAC-1は核移行シグナルを有するものであればよく、ヒト由来に限られず、ヒト以外の動物由来のものであってもよい。当該ヒトNAC-1のアミノ酸配列を配列番号5に示す。当該アミノ酸配列において、アミノ酸番号183〜205の領域が、核移行シグナル(NLS)に相当する領域である。
【0046】
またnucleoplasminについても、その由来も特に制限されず、ヒトを含む動物に由来するnucleoplasmin を制限なく挙げることができる。一例として、後述の実験例で使用するアフリカツメガエルのnucleoplasminを挙げることができる。当該nucleoplasminのアミノ酸配列を配列番号6に示す。当該アミノ酸配列において、アミノ酸番号155〜172の領域が、核移行シグナル(NLS)に相当する領域である。
【0047】
本発明が対象とする物質は、ペプチドやタンパク質を初め、天然由来のものであっても、また化学合成、発酵、及び遺伝子組み換えなどの技術によって人工的に合成されたものであってもよい。またこれらの物質は、ペプチドやタンパク質を初め、糖や核酸やその他の物質(ペプチドやタンパク質を含む)で修飾されるか、若しくはこれらの物質と融合してなるものであってもよい。さらに、本発明においてペプチドとは、オリゴペプチド及びポリペプチドを含む意味で用いられる。また、
本発明において、一方の物質は、発色性または化学発光性の可視化プローブにより予め標識し、標識物質として調製しておくことが好ましい。可視化プローブとしては、好ましくは蛍光プローブを挙げることができる。なお、標識化は、定法に従って行うことができる。
【0048】
蛍光プローブとは、特別な波長の光への曝露により励起されるときに、異なる波長で光を放出する化合物(フルオロフォア)を意味する。当該フルオロフォアは、蛍光タンパク質と称されるタンパク質と、非タンパク質とに分類される。
【0049】
蛍光タンパク質としては、AcGFP1やZsGreen1等の緑色蛍光タンパク質:AmCyan1などの青色蛍光タンパク質:ZsYellow1やmBanana等の黄色蛍光タンパク質:DsRed-Monomer、DsRed2、DsRed-Express、DsRed-Express2、AsRed2、tdTomato、mCherry、mStrawberry、mOrange等の赤色蛍光タンパク質;HcRed1などの真紅色蛍光タンパク質等を、制限なく、例示することができる。標識する対象の物質が、ペプチドまたはタンパク質である場合、標識物質は、当該対象物質(ペプチドまたはタンパク質)に上記の蛍光タンパク質を融合させることによって調製することができる。
【0050】
非タンパク質に分類されるフルオロフォアは、その発光プロフィールまたは「色」によって特徴付けられる。緑色のフルオロフォア(例えばFITC、及びオレゴングリーン)は、概して515〜540nmの範囲の波長でのその発光を特徴とする。赤色のフルオロフォア(例えば、テキサスレッド、Cy5、及びテトラメチルローダミン)は、概して590〜690nmの範囲の波長でのその発光を特徴とする場合がある。フルオロフォアの例には、限定されないが、4-アセトアミド-4'-イソチオシアナートスチルベン-2,2'-ジスルホン酸、アクリジン、アクリジン及びアクリジンイソチオシアネートの誘導体、5-(2'-アミノエチル)アミノナフタレン-1-スルホン酸(EDANS)、4-アミノ-N-[3-ビニルスルホニル)フェニル]ナフタルイミド-3,5-ジスルホネート(ルシファーイエローVS)、N-(4-アニリノ-1-ナフチル)マレイミド、アントラニルアミド、ブリリアントイエロー、クマリン、クマリン誘導体、7-アミノ-4-メチルクマリン(AMC、クマリン120)、7-アミノ-トリフルオロメチルクマリン(クマリン151)、シアノシン;4',6-ジアミニジノ-2-フェニルインドール(DAPI)、5',5”-ジブロモピロガロール-スルホンフタレイン(ブロモピロガロールレッド)、7-ジエチルアミノ-3-(4'-イソチオシアナートフェニル)-4-メチルクマリン、4,4'-ジイソチオシアナートジヒドロ-スチルベン-2,2'-ジスルホン酸、4,4'-ジイソチオシアナートスチルベン-2,2'-ジスルホン酸、5-[ジメチルアミノ]ナフタレン-1-スルホニルクロリド(DNS、ダンシルクロリド)、エオジン、エオジンイソチオシアネートのようなエオジンの誘導体、エリスロシン、エリスロシンB及びイソチオシアン酸エリスロシンのようなエリスロシンの誘導体;エチジウム;フルオレセインと5-カルボキシフルオレセイン(FAM)、5-(4,6-ジクロロトリアジン-2-イル)アミノフルオレセイン(DTAF)、2',7'-ジメトキシ-4',5'-ジクロロ-6-カルボキシフルオレセイン(JOE)、フルオレセイン、フルオレセインイソチオシアネート(FITC)、QFITC(XRITC)のような誘導体;フルオレスカミン誘導体(アミンとの反応時に蛍光);IR144;IR1446;マラカイトグリーンイソチオシアネート;4-メチルウンベリフェロン;オルトクレゾールフタレイン;ニトロチロシン;パラローズアニリン;フェノールレッド、B-フィコエリスリン;o-フタルジアルデヒド誘導体(アミンとの反応時に蛍光);ピレンとピレン、ピレンブチレート、及びスクシンイミジル1-ピレンブチレートのような誘導体;リアクティブレッド4(Cibacron.RTM.ブリリアントレッド3B-A)、ローダミンと6-カルボキシ-X-ローダミン(ROX)、6-カルボキシローダミン(R6G)、リサミンローダミンBスルホニルクロリド、ローダミン(Rhod)、ローダミンB、ローダミン123、ローダミンXイソチオシアネート、スルホローダミンB、スルホローダミン101、及びスルホローダミン101のスルホニルクロリド誘導体(テキサスレッド);N,N,N',N'-テトラメチル-6-カルボキシローダミン(TAMRA);テトラメチルローダミン、テトラメチルローダミンイソチオシアネート(TRITC)のような誘導体;リボフラビン;ロゾール酸とランタニドキレート誘導体、量子ドット、シアニン、ピレリウム(pyrelium)色素、及びスクアライン(squaraine)が含まれる。
【0051】
また他方の物質(本発明では、上記「標識物質」に対して「被験物質」と称する)は、予めビーズに結合させておくことが好ましい。ここでビーズは、本発明の方法において、前述する本発明の顕微鏡観察用プレートにおいて、その凹部2の底面22に形成された窪み部3に捕捉収容させて用いられるものであり、好ましくは球状である。その大きさは、制限されないが、通常、直径20〜150μm程度、好ましくは30〜100μm程度、より好ましくは50〜100μm程度を例示することができる。
【0052】
その素材は、特に制限されないが、例えば、シリカ、アガロースゲル、セルロース、ポリエチレンイミン、ポリスチレン、ポリメタクリル酸、ポリメタクリル酸メチル、スチレン−マレイン酸共重合体、磁性体(マグネタイト、及びマグネタイト−デキストラン架橋複合体やマグネタイト−シリカ架橋複合体等のマグネタイトの複合体)、生体高分子(キトサン等)、生分解性ポリマー(ポリ乳酸等)を例示することができる。
【0053】
これらのビーズは、表面に被験物質を結合できるように、表面に活性エステル基、またはカルボキシル基若しくはアミノ基を提示した形態で、または、被験物質に結合させたタグを認識し結合するリガンドを表面に提示した形態で、アフィニティービーズまたは機能性ナノ・マイクロビーズとして市販されており、商業的に入手することができる。
【0054】
被験物質は、好ましくは、タグで標識されているか、タグ(タンパク質タグ)と融合された状態で用いられる。ここでタグとしては、ニッケルなどの金属イオンと特異的に結合するポリヒスチジン(Hisタグ);グルタチオンと特異的に結合するGST(glutathione S-transferase)(GSTタグ);マルトースやデキストリンと特異的に結合するマルトース結合タンパク質(MBPタグ);StrepTactinと特異的に結合するStrep(II)タグ;Biotin Carboxyl Carrier Protein(BCCP)タグ(ビオチン化ペプチド);その他、インフルエンザ凝集素HA(HAタグ)、ヒトc-myc(mycタグ)、FLAG、水疱性口内炎ウイルス糖タンパク質(VSV-GP)、T7遺伝子10タンパク質(T7タグ)、ヒト単純ヘルペスウイルス糖タンパク質(HSVタグ)、Eタグ(モノクローナルファージ上のエピトープ)等のエピトープタグを例示することができる。被験物質として、このようなタグで標識された被験物質を用いる場合、前述するビーズは、上記タグに結合するリガンドで標識されたものが使用される。
【0055】
本発明方法の(a)工程は、上記被験物質を結合させたビーズと前述する標識物質とを、顕微鏡観察用プレート1上の好ましくは流路内(凹部2内)で、反応液中で接触させる工程である。接触させる方法は、特に制限されないが、例えば、後述する実験例4で説明するように、先に被験物質(被験タンパク質)を結合させたビーズを含む反応液を顕微鏡観察用プレート1上の流路内(凹部2内)に通液し、被験物質(被験タンパク質)結合ビーズを、凹部2の底面22に形成された窪み部3に捕捉収容させた状態で、次いで標識物質(標識タンパク質)を通液する方法によって行うことができる、ここで、反応液は、対象とする物質が変性しない塩濃度範囲とpH範囲と温度範囲を有する水溶液であればよく、その範囲で目的に応じて、適宜に設定することができる。例えば、体内でのタンパク質とタンパク質の相互作用を検出し評価する場合は、生理的条件(塩濃度[NaClまたはKCl] 150mM程度、pH 7.2-7.6程度、20-40℃程度)と同一またはそれに近似する条件にある水溶液として調製することが好ましい。
【0056】
接触させる時間も特に制限なく、1秒〜30分の範囲で適宜設定することができる。また、かかる接触は、被験物質を結合させたビーズを捕捉収容させた顕微鏡観察用プレート1の流路内(凹部2内)に、前述の標識物質を含む反応液を溜め置き(静置)して行ってもよいし、当該標識物質を含む反応液を、例えば本発明の顕微鏡観察用プレート載置装置を用いて、顕微鏡観察用プレート1の流路内(凹部2内)に連続して通液しながら行ってもよい。
【0057】
(a’)工程
当該(a’)工程は、物質と物質との接触反応を顕微鏡観察用プレート上で行う上記(a)工程とは異なり、予め被験物質を結合させたビーズ(被験物質結合ビーズ)と標識物質を試験管やペトリ皿などに入れた反応液中で混合して、当該被験物質結合ビーズと標識物質を含む反応液を、顕微鏡観察用プレート1の流路内(凹部2内)に供し、その目に並行して通液する工程である。反応液の条件や接触させる時間は、上記(a)工程に関して説明した通りである。
【0058】
顕微鏡観察用プレート1の流路内(凹部2内)への反応液の通液は、例えばピペット等を用いて手動で行ってもよいし、また例えば本発明の顕微鏡観察用プレート載置装置を用いて、顕微鏡観察用プレート1の流路内(凹部2内)に反応液を連続して通液若しくは循環させながら行ってもよい。
【0059】
(b)工程
当該(b)工程は、上記(a)工程で標識物質を接触させた被験物質結合ビーズを洗浄する工程である。被験物質に対するアフィニティーが弱い標識物質は、(a)工程において、被験物質を介して一旦はビーズに結合しているものの、当該(b)工程により当該ビーズから解離する。
【0060】
当該(b)工程は、被験物質を結合させたビーズと標識物質との接触と結合が行われた顕微鏡観察用プレート1の流路内(凹部2内)に、その流路の目に並行して洗浄液を通液することによって行うことができる。当該洗浄液の通液は、例えばピペット等を用いて手動で行ってもよいし、また例えば本発明の顕微鏡観察用プレート載置装置を用いて、顕微鏡観察用プレート1の流路内(凹部2内)に洗浄液を連続して通液しながら行ってもよい。
【0061】
ここで、洗浄液は、反応液と同様に、対象とする物質が変性しない塩濃度範囲とpH範囲と温度範囲を有する水溶液であればよく、その範囲で目的に応じて、適宜に設定することができる。例えば、体内でのタンパク質とタンパク質との相互作用を検出評価する場合は、生理的条件と同一またはそれに近似する条件にある水溶液として調製することが好ましい。
【0062】
洗浄に要する時間も特に制限なく、1秒〜30分の範囲で適宜設定することができる。
【0063】
(c)工程
当該(c)工程は、標識物質に由来する標識を検出する工程である。当該工程は、前述する(a)と(b)の工程または(a’)と(b)の工程と同時並行して行われるか、少なくとも(b)の工程と同時並行して行われる。
【0064】
当該標識は、前述するように好ましくは蛍光プローブであり、蛍光プローブで標識された物質の当該蛍光プローブは、蛍光が検出できる蛍光顕微鏡により検出することができる。蛍光顕微鏡としては、具体的には、例えば透過型蛍光顕微鏡、落射型蛍光頭微鏡、コンフォーカルレーザー顕微鏡、及び全反射照明蛍光顕微鏡の各種の蛍光顕微鏡を挙げることができる。好ましくはコンフォーカルレーザー顕微鏡である。
【0065】
前述するように、本発明の顕微鏡観察用プレート1は、ビーズを捕捉収容し得る窪み部3を、凹部2の長さ方向の中央部に密集するようにかためて配置した形態を有するものであることが好ましい。この場合、当該凹部2の長さ方向中央部が、顕微鏡で観察できる実観察領域にくるように、当該顕微鏡観察用プレート1を顕微鏡のステージに載せ置きすることで、当該窪み部3に捕捉収容されたビーズに標識物質が結合する様子や標識物質が解離する様子が、標識(例えば、蛍光プローブ)をシグナルとして可視的に、かつリアルタイムに検出することができる。
【0066】
このように、本発明の方法は、物質(被験物質)と物質(標識物質)との相互作用(結合、アフィニティー)を、顕微鏡という比較的簡単な装置を用いて、可視的にかつリアルタイムに測定し評価することができる方法として、有用である。
【実施例】
【0067】
以下、本発明を、実験例を利用してより詳細に説明する。但し、本発明はこれらの実施例によって何ら制限されるものではない。
【0068】
実験例1:pull-downアッセイ
(1)実験方法
(1-1)GST融合importin α3タンパク質の調製
importin αは細胞の核膜に存在し、タンパク質に存在する核移行シグナル(NLS)を認識し結合するタンパク質で、NLS依存的にタンパク質を核内へ運び込むことが知られている。当該importin αは、C末端領域のアルマジロ反復配列に存在する、種を超えて高度に保存されているアミノ酸を変異させることでその結合能が消失することが知られている(Goldfarb D. et al., Trends Cell Biol., 14: 505-514, 2004 および Lange A., et al., J. Biol. Chem., 282: 5101-5105, 2007)。中でもヒトimportin α3は、N末端側から179番目のトリプトファン(W)と183番目のアスパラギン(N)をアラニン(A)に変異することでその結合能が消失する(Conti, E. et al., Cell 94: 193-204, 1998)。
【0069】
以下、ヒトimportin α3の野生型(importin α3 [Homo sapiens]、GenBank: AAC25605.1、GI:1928975)を「ヒトimportin α3(野生型)」若しくは「importin α3(野生型)」と称し、またその上記変異体を「ヒトimportin α3(W179A、N183A)」若しくは「importin α3(W179A、N183A)」と称する。なお、ヒトimportin α3(野生型)の遺伝子の塩基配列を配列表の配列番号1に示す(NCBI Reference Sequence: NM_002268.2)。当該塩基配列において、塩基番号10-1575の領域がヒトimportin α3(野生型)のコーディング領域(CDS領域)である。またそのアミノ酸配列を配列番号2に示す。
【0070】
(i)GST融合importin α3(野生型)タンパク質の調製
ヒトimportin α3 (GenBank: AAC25605.1、GI:1928975)のcDNA(アミノ酸配列では65-521)を組み込んだGST融合タンパク質発現用ベクターpGEX-6P-1(GEヘルスケア・ジャパン社)(Kosugi S. et al., J. Biol. Chem., 284: 478-485, 2008)を用いて、大腸菌の形質転換を行った。イソプロピルチオガラクトシド(IPTG)誘導されたGST融合importin α3(野生型)タンパク質を含む大腸菌溶解液から、グルタチオンアガロースビーズ(Sigma社)を用いて、GST融合importin α3(野生型)タンパク質を精製した。
【0071】
(ii)GST融合importin α3(W179A、N183A)タンパク質の調製
ヒトimportin α3のcDNA を鋳型として、下記のプライマーを用いて常法に従ってoverlap PCR 法を行い、ヒトimportin α3(W179A、N183A)cDNAを作成した。ヒトimportin α3(W179A、N183A)のcDNA(アミノ酸配列では65-521)を組み込んだGST融合タンパク質発現用ベクターpGEX-6P-1(GEヘルスケア・ジャパン社)を用いて、大腸菌の形質転換を行った。イソプロピルチオガラクトシド(IPTG)誘導されたGST融合importin α3(W179A、N183A)タンパク質を含む大腸菌溶解液から、グルタチオンアガロースビーズ(Sigma社)を用いて、GST融合importin α3(W179A、N183A)タンパク質を精製した。
【0072】
プライマー
W179A N183A-S:
5′-TGT GAG CAA GCA GTG GCG GCA TTG GGA GCT ATC ATA GGT GAT GGG- 3’(配列番号3)
W179A N183A-AS:
5′-CCC ATC ACC TAT GAT AGC TCC CAA TGC CGC CAC TGC TTG CTC ACA- 3’(配列番号4)。
【0073】
(1-2)テストサンプルの調製
テストサンプルとして、赤色蛍光タンパク質mCherryを融合させた「NAC-1(180-207)」、赤色蛍光タンパク質mCherryを融合させた「nucleoplasmin-NLS」、及び対照例として赤色蛍光タンパク質mCherryを調製した。
【0074】
なお、ここで「NAC-1(180-207)」は、核内転写制御タンパク質であるヒトNAC-1(nucleus accumbens-associated protein 1)(Nakayama, K., et al., Proc. Natl Acad. Sci. USA, 103: 18739-18744, 2006)の核移行シグナル(NLS)(183〜205配列)を含む180-207領域のアミノ酸配列からなるペプチド断片である。ヒトNAC-1のアミノ酸配列を配列表の配列番号5に示す。当該アミノ酸配列において、アミノ酸番号183〜205の領域が核移行シグナル(NLS)に相当する領域である。
【0075】
また、「nucleoplasmin-NLS」は、既にヒトimportin α3(野生型)と結合することが知られているnucleoplasmin(Robbins, J., wt al., Cell 64: 615-623, 1991)の核移行シグナル(NLS)である。アフリカツメガエルのnucleoplasmin のアミノ酸配列を配列表の配列番号6に示す。当該アミノ酸配列において、アミノ酸番号155〜172の領域が核移行シグナル(NLS)に相当する領域である。
【0076】
(1-3)pull-downアッセイ
上記で調製したGST融合importin α3(野生型)タンパク質、及びGST融合importin α3(W179A、N183A)タンパク質を、それぞれ定法に従ってグルタチオンビーズに結合させ、次いでこれらを各テストサンプル(mCherry融合NAC-1(180-207)、mCherry融合nucleoplasmin-NLS、mCherry)と混合した。得られたビーズを遠心処理して沈降させ、1% Triton X-100を含むPBSで複数回洗浄した後、SDSサンプル緩衝液を加え加熱してビーズから各タンパク質を遊離した。ビーズから遊離したタンパク質を、SDS-PAGE法により分離し、クマシー染色してタンパク質を同定した。
【0077】
(2)実験結果
結果を図11に示す。図11中、「input」のレーンは、各テストサンプル(mCherry融合NAC-1(180-207)、mCherry融合nucleoplasmin-NLS、mCherry)の標品そのものをSDS-PAGEに供したstandard結果を示す。
【0078】
図11のレーン5及び6に示すように、テストサンプル(mCherry融合NAC-1(180-207)、mCherry融合nucleoplasmin-NLS)のバンドが検出できたことから、核移行シグナル(NLS)を認識し結合するヒトimportin α3(野生型)により、核移行シグナル(NLS)を含むnucleoplasmin-NLS、及びNAC-1(180-207)はいずれも、pull-downすることができた。しかし、レーン8及び9に示すように、ヒトimportin α3(野生型)に代えて、ヒトimportin α3の変異体であるimportin α3(W179A、N183A)を用いた場合には、nucleoplasmin-NLS、及びNAC-1(180-207)はいずれもpull-downできなかった。
【0079】
以上のことから、nucleoplasminやNAC-1等の核移行シグナル(NLS)は、importin α3(野生型)タンパク質と直接結合すること、また種を超えて高度に保存されているアミノ酸に変異を導入したimportin α3変異体(例えば、importin α3(W179A、N183A))にはいずれも結合しないことが確認された。つまり、importin α3(野生型)タンパク質とそのアミノ酸配列の179位と183位を変異させた変異体(例えば、importin α3(W179A、N183A))を用いることで、NLSを介したタンパク質の相互作用を検出し評価できることが確認された。
【0080】
しかし、pull-down法及びそれに続く電気泳動法は、タンパク質相互作用を検出し評価する古典的な実験方法であり、その実験には少なくとも半日以上の時間を要する。従って、これをより短時間に、またタンパク質の相互作用が経時的に観察できる方法を確立する必要がある。
【0081】
実験例2:on beads 顕微鏡アッセイ(その1)
(1)実験方法
市販のカバーガラスの上で、グルタチオンビーズ(実験例1で調製した、GST融合importin α3(野生型)タンパク質またはGST融合importin α3(W179A、N183A)タンパク質を結合させたグルタチオンビーズ)とテストサンプル(実験例1で調製したmCherry融合NAC-1(180-207)、mCherry融合nucleoplasmin-NLS、mCherry)を、1% Triton X-100を含むPBS(反応溶液)中でそれぞれ混合し、蛍光顕微鏡(コンフォーカルレーザー顕微鏡;オリンパス社製)を用いて観察した。図11にアッセイの概略を示す。単に混ぜるだけで、1分もかけないでアッセイできる簡単な方法である。
【0082】
(2)実験結果
実際の観察データを図12に示す。左図は蛍光観察結果であり、右図は透過光観察結果である。コンフォーカル顕微鏡を用いているため、グルタチオンビーズに結合させたタンパク質とテストサンプルのタンパク質との間にタンパク質相互作用がある場合、蛍光観察で、ビーズの周囲に円状に赤色蛍光タンパク質mCherryに起因するシグナルが観察される。ビーズ12個分の蛍光強度を測定し、統計処理した結果を図13に示す。ここでは、図11のレーン8に示すように実験例1のpull-downアッセイでは結合が見られなかったヒトimportin α3(W179A、N183A)とnucleoplasmin-NLSとの結合を示すシグナルが認められた(図12:右側の中段、図13:右から3番目)。
【0083】
この結果から、標識タンパク質を含むテストサンプルを、被験タンパク質を結合させたビーズ上で反応させるだけでは、標識タンパク質と被験タンパク質との相互作用(結合と解離)を定量的に評価することができないことが判明した。
【0084】
実験例3:on beads 顕微鏡アッセイ(その2)
実験例2の実験において、顕微鏡観察用の市販のカバーガラス上の反応溶液(1% Triton X-100を含むPBS)を一部回収し、洗浄液(1% Triton X-100を含むPBS)をその容量分追加するという方法によって、反応溶液の希釈を繰り返し、顕微鏡観察を行った。
【0085】
実際の観察データを図14に示す。上2段は、GST融合importin α3(野生型)タンパク質を結合させたグルタチオンビーズにmCherry 融合nucleoplasmin-NLSを混合し、順次希釈したものである(2段中、上一列は蛍光観察結果、下一列は透過光観察結果を示す)。下2段は、GST融合importin α3(W179A、N183A)タンパク質を結合させたグルタチオンビーズにmCherry 融合nucleoplasmin-NLSを混合し、順次希釈したものである(2段中、上一列は蛍光観察結果、下一列は透過光観察結果を示す)。ビーズ5個分の蛍光強度を測定し、統計処理した結果を図15に示す。
【0086】
この結果からわかるように、GST融合importin α3(W179A、N183A)タンパク質は、希釈前はGST融合importin α3(野生型)タンパク質と遜色なくmCherry融合nucleoplasmin-NLSと結合していたが、希釈するに従って、GST融合importin α3(野生型)タンパク質と比べて速やかに解離していく様子が観察された。
【0087】
この結果から、カバーガラス上の反応溶液を順次希釈していくことで、顕微鏡下でリアルタイムにタンパク質同士の相互作用(結合と解離)が観察できることが確認された。
【0088】
実験例4:on beads 顕微鏡アッセイ(その3)
市販のカバーガラスに代えて、本発明の顕微鏡観察用プレート(マイクロ流路付きプレート)(図1参照)を用いて、グルタチオンビーズ(実験例1で調製したGST融合importin α3(野生型)タンパク質、またはGST融合importin α3(W179A、N183A)タンパク質を結合させたビーズ)とテストサンプル(実験例1で調製したmCherry融合nucleoplasmin-NLS)との相互作用を蛍光顕微鏡(コンフォーカルレーザー顕微鏡;オリンパス社製)を用いて観察した。
【0089】
この顕微鏡観察用プレート上での一連の反応を、リアルタイムで蛍光顕微鏡で観察した結果、グルタチオンビーズとしてGST融合importin α3(W179A、N183A)タンパク質を結合させたビーズを用いた場合は、mCherry融合nucleoplasmin-NLSは、一旦は結合するものの、洗浄液を通液することで速やかに解離した(図16のStep 3の右図)。これに対して、グルタチオンビーズとしてGST融合importin α3(野生型)タンパク質を結合させたビーズを用いた場合は、mCherry融合nucleoplasmin-NLSと結合し、またその結合が洗浄液の通液にも関わらず安定して維持されることが観察された(図16のStep 3の左図)。
【0090】
この顕微鏡観察用プレート上での一連の反応を、リアルタイムで蛍光顕微鏡観察した結果、実験例4と同様に、グルタチオンビーズとしてGST融合importin α3(W179A、N183A)タンパク質を結合させたビーズを用いた場合は、mCherry融合nucleoplasmin-NLSは、一旦は結合するものの、洗浄液を通液することで速やかに解離したのに対して、グルタチオンビーズとしてGST融合importin α3(野生型)タンパク質を結合させたビーズを用いた場合は、mCherry融合nucleoplasmin-NLSと結合し、またその結合が洗浄液の通液にも関わらず安定して維持されることが観察された。
【0091】
以上のことから、本発明の顕微鏡観察用プレートによれば、顕微鏡という簡便な装置を用いてタンパク質同士の相互作用をリアルタイムに観察測定できることが確認された。
【符号の説明】
【0092】
1 顕微鏡観察用プレート
2 凹部
3 窪み部
5 顕微鏡観察用プレート載置装置
6 支持ユニット
7 収容具
8 蓋
9 試料容器
10 プレートの表面
22 凹部の底面
90 本体
91 蓋体
93 ホース接続部
94 ホース挿入穴
M ビーズ
【配列表フリーテキスト】
【0093】
配列番号3及び4は、ヒトimportin α3のcDNA を鋳型として、overlap PCR 法を用いてヒトimportin α3(W179A、N183A)cDNAを作成するために使用したプライマー(W179A N183A-SとW179A N183A-AS)を意味する。
【技術分野】
【0001】
本発明は、物質、特にタンパク質の相互作用をリアルタイムに可視化するための技術に関する。より詳細には、タンパク質相互作用を顕微鏡下でリアルタイムに観察するために有用な顕微鏡観察用プレート、当該顕微鏡観察用プレートを備えた顕微鏡観察用プレート載置装置、及び当該顕微鏡観察用プレートまたは顕微鏡観察用プレート載置装置を用いたタンパク質相互作用の検出方法に関する。
【背景技術】
【0002】
興味あるタンパク質の生命現象における機能を探索するうえで、他のタンパク質との「結合」と「解離」から成立する相互作用を無視した研究はもはや不可能である。このため、従来からタンパク質間の相互作用を解析するさまざまな方法や機器が開発されている。例えば、タンパク質間の相互作用を検討する方法として、古典的にはpull-downアッセイが知られている。当該方法は、担体に固定化したタグ付きタンパク質(ベイト)に測定対象のタンパク質を含む溶液を反応させ、次いでベイトに結合したタンパク質を溶出分離し、その結果から両者タンパク質間の相互作用を評価する方法である。しかし、かかる方法によれば、タンパク質間相互作用を評価するのに半日以上要し、また当該方法は、タンパク質間の反応がリアルタイムでは検出できないという問題がある。
【0003】
しかし、相互作用をリアルタイムに検出できる機器は、表面プラズモン共鳴現象(SPR)を利用したBiacoreのタンパク質相互作用解析システムなど、1000万円を超える高額なものばかりであり、安価にタンパク質間相互作用をリアルタイムに可視化できる装置は皆無である(例えば、非特許文献1及び2など参照)。
【先行技術文献】
【非特許文献】
【0004】
【非特許文献1】表面プラズモン共鳴(SPR)現象の利用(GE Healthcare)<URL:http://www.biacore.com/jp/lifesciences/technology/introduction/data_interaction/index.html>
【非特許文献2】タグ付きタンパク質を用いたタンパク質相互作用解析(GE imagination at work)<URL: http://www.gelifesciences.co.jp/newsletter/protein_sciences/tag_interaction.asp>
【発明の概要】
【発明が解決しようとする課題】
【0005】
本発明は、安価にしかも簡便に、物質間の相互作用をリアルタイムに可視化検出するための方法、当該方法に使用するためのツール、具体的には顕微鏡観察用プレート及びそれを備えた顕微鏡観察用プレート載置装置といった顕微鏡のアプリケーターを提供することを目的とする。
【課題を解決するための手段】
【0006】
本発明者らは、上記課題を解決すべく鋭意検討していたところ、例えばタンパク質等の、物質と物質との相互作用を検出するにあたり、一方の物質をビーズに結合させ、他方の物質を蛍光色素などで標識化し、当該ビーズに結合させた物質と標識物質との結合(相互作用)を、ビーズの標識の有無を指標にすることで可視的に検出することができること;さらに当該ビーズに結合させた物質と標識物質との結合(相互作用)を、流体の流路として、底部に上記ビーズを収容(捕捉)可能な窪み部が複数形成されてなる凹部を備えた顕微鏡観察用プレート(マイクロ流路付きプレート)上で、これを顕微鏡ステージに載せた状態で、反応液と洗浄液を通液しながら行うことにより、顕微鏡観察によりリアルタイムに検出することができることを見出した。
【0007】
特に、顕微鏡ステージに載せ置きした上記顕微鏡観察用プレートの流路(凹部)において、ビーズに結合させた物質と標識物質とを一旦結合させた後に任意の洗浄液で通液することにより、流路(凹部)の底面の窪み部に捕捉収容されたビーズに一旦結合した標識物質が、ビーズに結合した物質とのアフィニティーに応じて解離するため、両物質同士の相互作用(結合と解離)や両者のアフィニティーをリアルタイムに観察することができる。
【0008】
本発明はかかる知見に基づいて開発したものであり、下記の実施形態を備えるものである。
【0009】
(I)顕微鏡観察用プレート
(I-1)光透過性を有しかつ非発光性の樹脂材料により形成された平板状のものであり、
一方の表面に、流体の流路を構成する凹部を少なくとも1つ備え、
前記凹部の底面には、ビーズを収容可能な窪み部が複数形成されている顕微鏡観察用プレート。
(I-2)前記凹部を2つ以上備え、各凹部が互いに並行に設けられていることを特徴とする(I-1)に記載の顕微鏡観察用プレート。
(I-3)前記ビーズが球状であり、前記窪み部の深さが前記ビーズの直径の1/2よりも小さいことを特徴とする(I-1)または(I-2)に記載の顕微鏡観察用プレート。
(I-4)上記樹脂材料が親水加工処理されてなるものである、(I-1)乃至(I-3)のいずれかに記載する顕微鏡観察用プレート。
(I-5)親水加工処理が、プラズマ放電処理またはコロナ放電処理である(I-4)に記載する顕微鏡観察用プレート。
(I-6)上記樹脂材料がポリジメチルシロキサンである、(I-1)乃至(I-5)のいずれかに記載する顕微鏡観察用プレート。
【0010】
(II)顕微鏡観察用プレート載置装置
(II-1)内部に(I-1)乃至(I-6)のいずれかに記載の顕微鏡観察用プレートを載置可能な試料容器と、前記試料容器を収容可能な収容具と、前記収容具を保持可能であり顕微鏡ステージに載置される支持ユニットと、前記支持ユニットの上面側開口を覆う蓋とを有し、
前記試料容器は、上面が開口した本体と前記本体の上面を塞ぐ蓋体とを備えており、前記蓋体の上面または前記本体の側面には、少なくとも2つのホース接続部が一体に形成されており、前記ホース接続部には、前記試料容器内に反応液または洗浄液を供給もしくは排出するためのホースを挿通可能なホース挿入穴が形成されている顕微鏡観察用プレート載置装置。
【0011】
(III)物質と物質との相互作用を検出する方法
(III-1)被験物質と標識物質との結合を検出する方法であって、
顕微鏡ステージに載せ置きした、(I-1)乃至(I-6)のいずれかに記載する顕微鏡観察用プレート上で、下記(a)、(b)及び(c)の工程を行う方法:
(a)反応液の存在下、被験物質を結合させたビーズと標識物質とを接触させる工程、
(b)顕微鏡観察用プレートの凹部の目に並行して洗浄液を通液する工程、
(c)標識物質に由来する標識を検出する工程。
(III-2)被験物質と標識物質との結合を検出する方法であって、
顕微鏡ステージに載せ置きした、(I-1)乃至(I-6)のいずれかに記載する顕微鏡観察用プレート上で、下記(a’)、(b)及び(c)の工程を行う方法:
(a’)顕微鏡観察用プレートに、その凹部の目に並行して、被験物質を結合させたビーズと標識物質を含む溶液を通液する工程、
(b)顕微鏡観察用プレートの凹部の目に並行して洗浄液を通液する工程、
(c)標識物質に由来する標識を検出する工程。
(III-3)被験物質または標識物質が、ペプチド、タンパク質、核酸、糖類、脂質、酵素、酵素基質、受容体、リガンド、抗体、抗原、レクチン、ハプテン、その他の低分子または高分子化合物からなる群から選択される少なくとも一種である、(III-1)または(III-2)に記載する方法。
(III-4)被験物質または標識物質が、ペプチドまたはタンパク質である、(III-1)または(III-2)に記載する方法。
(III-5)被験物質がタグ付き物質である、(III-1)乃至(III-4)のいずれかに記載する方法。
(III-6)タグ付き物質のタグが、GSTタグ、MBPタグ、Hisタグ、Strep(II)タグ、FLAGタグ、HAタグ、mycタグ、及びBCCPタグからなる群から選択される少なくとも1つである、(III-5)に記載する方法。
(III-7)被験物質または標識物質の一方の物質として、核移行シグナルを有するタンパク質を用い、他方の物質として、核移行シグナルを認識し結合するタンパク質を用いることを特徴とする、(III-1)乃至(III-6)のいずれかに記載する方法。
(III-8)核移行シグナルが、NAC-1(nucleus accumbens-associated protein 1)の核移行シグナル、またはnucleoplasmin の核移行シグナルである(III-7)に記載する方法。
(III-9)核移行シグナルを認識し結合するタンパク質が、importin αである、(III-7)または(III-8)に記載する方法。
(III-10)被験物質と標識物質との相互作用を評価する方法である、(III-1)乃至(III-9)のいずれかに記載する方法。
(III-11)被験物質と標識物質とのアフィニティーを評価する方法である、(III-1)乃至(III-9)のいずれかに記載する方法。
【発明の効果】
【0012】
本発明の方法によれば、物質と物質との相互作用、特にタンパク質とタンパク質との相互作用を、底面に窪み部が形成されてなる凹部を、流体の流路として備えた特定形状の顕微鏡観察用プレート(マイクロ流路付きプレート)上で、当該プレートを顕微鏡ステージに載せた状態で行うことにより、顕微鏡観察によりリアルタイムに可視的に検出することができる。特に、顕微鏡ステージに載せ置きした上記顕微鏡観察用プレートの流路(凹部)において、ビーズ結合物質と標識物質とを一旦結合させた後に任意の洗浄液で通液することにより、流路(凹部)の底面の窪み部に捕捉収容されたビーズに一旦結合した標識物質が、ビーズに結合した物質とのアフィニティーに応じて解離するため、両物質同士の相互作用(結合と解離)や両者のアフィニティーをリアルタイムに観察することができる。
【0013】
本発明の顕微鏡観察用プレート及びそれを備えた顕微鏡観察用プレート載置装置は、物質と物質との相互作用、特にタンパク質とタンパク質との相互作用を、顕微鏡を用いて、可視的に且つリアルタイムに検出するために好適に用いられる顕微鏡のアプリケーターとして有用である。
【図面の簡単な説明】
【0014】
【図1】本発明の一実施形態に係る顕微鏡観察用プレートの外観構成を示す斜視図である。
【図2】図1のA−A線に沿う断面図である。
【図3】図1のB−B線に沿う断面図である。
【図4】他の実施形態に係る顕微鏡観察用プレートの外観構成を示す正面図である。
【図5】窪み部の構成を示す断面図である。
【図6】本発明の一実施形態に係る顕微鏡観察用プレート載置装置の分解斜視図である。
【図7】顕微鏡観察用プレート載置装置に用いられる試料容器の斜視図である。
【図8】図7に示す試料容器を分離して示す斜視図である。
【図9】図7のA−A線に沿う断面図である。
【図10】pull-down法により、グルタチオンビーズに結合させたGST融合importin α3(野生型)タンパク質(図中、「wild-type」と標記)及びGST融合importin α3(W179A、N183A)タンパク質(図中、「WN→AA」と標記)をそれぞれ各テストサンプル〔mCherry融合NAC-1(180-207)[図中、「mC-NAC-1(180-207)」と標記]、mCherry融合nucleoplasmin-NLS [図中、「mC-nucleoplasmin(NLS)」と標記]、mCherry [図中、「mC」と標記])と混合し、次いで溶出させ、SDS-PAGEに供した結果を示す(実験例1)。図中、「input」のレーンは、各テストサンプル(mCherry融合NAC-1(180-207)、mCherry融合nucleoplasmin-NLS、mCherry)そのものをSDS-PAGEに供したstandard結果を示す。また図中「mC fusion proteins」は、mCherry融合NAC-1(180-207)及びmCherry融合nucleoplasmin-NLSを意味する。
【図11】カバーガラス上で「on beads 顕微鏡アッセイ(その1)」(実験例2)を行う概略を示す図である。
【図12】カバーガラス上で「on beads 顕微鏡アッセイ(その1)」(実験例2)を行った観察データを示す。GST融合importin α3(野生型)タンパク質(図中、「wild-type」と標記)及びGST融合importin α3(W179A、N183A)タンパク質(図中、「WN→AA」と標記)の各結果において、黒く見える左側の図は蛍光観察結果を、灰色に見える右側の図は透過光観察結果を示す。上段、中段及び下段に、テストサンプルとして、mCherry、mCherry融合nucleoplasmin-NLS [図中、「mCherry-nucleoplasmin(NLS)」と標記]、及びmCherry融合NAC-1(180-207)[図中、「mCherry-NAC-1(180-207)」と標記]を用いた場合の、ビーズに結合したGST融合importin α3タンパク質との相互作用をそれぞれ示す。
【図13】カバーガラス上での「on beads 顕微鏡アッセイ(その1)」(実験例2)の観察データを統計処理した結果を示す。
【図14】カバーガラス上で希釈しながら行った「on beads 顕微鏡アッセイ(その2)」(実験例3)の観察データを示す。上の2段は、反応液中でGST融合importin α3(野生型)タンパク質を結合させたグルタチオンビーズと mCherry融合nucleoplasmin-NLSとを混合し、順次、当該反応液を回収しながら洗浄液(1% Triton-X 100を含むPBS)を添加して希釈したものである。下の2段は、GST融合importin α3(W179A、N183A) タンパク質を結合させたグルタチオンビーズと mCherry融合nucleoplasmin-NLS とを混合し、順次、当該反応液を回収しながら洗浄液(1% Triton-X 100を含むPBS)を添加して希釈したものである。上と下の各2段において、黒く見える上一列の図は蛍光観察結果を、灰色に見える下一列の図は透過光観察結果を示す。
【図15】カバーガラス上で希釈しながら行った「on beads 顕微鏡アッセイ(その2)」(実験例3)の観察データを統計処理した結果を示す。
【図16】本発明の顕微鏡観察用プレート(マイクロ流路付きプレート)上での「on beads 顕微鏡アッセイ(その3)」(実験例4)の概略を示す図である。図に示す平面部は、顕微鏡観察用プレートの流路(凹部)の、窪み部3が形成された底面22を意味する。
【発明を実施するための形態】
【0015】
(I)顕微鏡観察用プレート
図1は、本発明の一実施形態に係る顕微鏡観察用プレート1の外観構成を示している。また、図2は、図1の顕微鏡観察用プレート1のA−A線に沿う断面図を、図3は、図1の顕微鏡観察用プレート1(以下、単に「プレート1」とも称する)のB−B線に沿う断面図を、それぞれ示している。
【0016】
本実施形態のプレート1は、光透過性を有するとともに非発光性の樹脂材料によって平板状に形成されている。かかる樹脂材料としては、例えば、ポリエチレンテレフタレート、ポリ塩化ビニル、ポリメタクリル酸、ポリスチレン、ポリカーボネート、ポリエチレン、ポリプロピレン、ポリ酢酸ビニル、ナイロン、ポリメチルペンテン、ポリエーテルサイフォン、ポリサルフォン、ポリイソブレン、ポリジメチルシロキサン、またはこれらの共重合体等が挙げられる。光透過性及び非発光性であり、しかも加工がしやすい樹脂材料であるという点で、好ましくはポリジメチルシロキサンである。
【0017】
これらの樹脂材料からなる本実施形態のプレート1は、その表面の少なくとも検体と接触する部分、具体的には、プレート1における流体の流路を構成する凹部2が窪み部3を含めて親水加工処理されていることが好ましい。親水加工処理方法は、特に制限されないが、例えばプラズマ放電処理またはコロナ放電処理を例示することができる。
【0018】
ちなみに、プラズマ放電処理は、気体分子に電場をかけることで、気体中に存在する自由電子が加速されて速度エネルギーをもち、その電子と衝突した気体分子が解離して種々の化学種を含むいわゆるプラズマを形成し、このプラズマを材料表面に照射することにより表面改質する方法である。また、コロナ放電処理は、極性基の少ない材料表面に、高周波及び高電圧を用いて大気中でコロナ放電を発生させ、それによって生成される反応基と共に、電子を直接材料表面に照射することにより表面改質する方法である。かかる処理により、プレート1の表面の少なくとも検体と接触する部分が親水加工される。ここで親水加工されたプレート1の表面の濡れ張力は、制限されないものの、3.5×10−2〜9.5×10−2N/mになるように調製することもできる。当該濡れ張力は、水の接触角を測定することにより算出することもできるし、また表面張力測定試薬を用いて測定し算出することもできる。
【0019】
このプレート1の一方の表面10(プレート1の他方の表面と区別するために、「上面10」ともいう)には、プレート1の長さ方向に延びる凹部2が少なくとも1つ(図1に示す実施形態では5つ)設けられている。この凹部2は、反応液や洗浄液等の流体を、流通可能な状態で溜め置き、また流通させるための流路として機能するものであり、それぞれが互いに並行に、プレート1の一端部から他端部まで障壁なく連通するように設けられている。
【0020】
プレート1に形成される当該凹部2の数は、少なくとも1以上であればよく、その上限は特に制限されず、プレート1の幅方向の長さと凹部2の横幅の長さから適宜設定することができる。例えば、プレート1の大きさとして、幅方向と長さ方向の長さ(幅方向×長さ方向)が、通常10〜25mm×10〜60mm、好ましくは10〜25mm×15〜40mm、より好ましくは15〜25mm×20〜30mmを例示することができる。また、プレート1の片方表面に形成される凹部2の横幅の長さとしては、通常0.8〜2.2mm、好ましくは1〜2mm、より好ましくは1.2〜1.8mmを例示することができる。制限されないが、凹部2の数の上限として10以下、好ましくは8以下、より好ましくは7以下、特に好ましくは6以下を例示することができる。
【0021】
本実施形態では、プレート1の表面10(上面10)上には、6つの立壁20が所定の間隔をあけて互いに平行に立設されており、隣り合う2つの立壁20とその間に挟まれたプレート1の上面10とによって凹部2が形成されている。ここで隣り合う2つの立壁20により形成された凹部2の内側の底面は、プレート1の上面10であると同時に凹部2の底面22でもある(図2及び3参照)。なお、必ずしもこれに限られるものではなく、図4に示すように、平板状のプレート1の上面10に、1以上の溝21を互いに平行に凹設することによっても(図4では3つの溝21を形成した実施形態を示す)、反応液や洗浄液等の流体の流路となる凹部2を形成することが可能である。この場合、溝21を凹設することによって形成された凹部2の内側の底面は、凹部2の底面22でもあると同時にプレート1の上面10でもある。
【0022】
斯くして調製される各凹部2の底面22(図1〜図4)には、図5に示すように、物質を結合したビーズMを収容することが可能な窪み部3が複数形成されている(図2、図3および図4参照)。
【0023】
この窪み部3は、プレート1の凹部2に、ビーズMを含む反応液等の流体を流通させたときにビーズMを窪み部3内に捕捉収容し、またそれに引き続いて洗浄液等の流体を流通させたときに、当該流体の流れによってビーズMが窪み部3から出ないよう窪み部3内に拘束するためのものである。そのため、窪み部3は、ビーズMが窪み部3内に捕捉収容されるように、また一旦捕捉収容されたビーズMが、窪み部3内から飛び出さずに、窪み部3内に嵌まって保持されるよう、ビーズMの大きさに沿った大きさおよび形状に形成される。
【0024】
ここでビーズMの形状は、略球状、好ましくは球状である。またその大きさは、制限されないが、通常、直径20〜150μm程度、好ましくは30〜100μm程度、より好ましくは50〜100μm程度を例示することができる。
【0025】
本実施形態では、窪み部3は、断面視形状が円形の円錐台状に形成されている(図5)。円錐台状に形成することで、流体とともに凹部2内を流れるビーズMを窪み部3に捕捉収容しやすくすることができる。なお、窪み部3の形状は、必ずしもこれに限られるものではなく、断面視形状が正方形の角錐台状に形成されていてもよい。また、一旦捕捉したビーズMを窪み部3内にしっかりと保持するために、窪み部3の側周面30を、図5に示されているように窪み部3の上端から下端に向けて内方に傾斜させるよりも、まっすぐ下方に垂下させて、窪み部3を円柱状もしくは角柱状に構成することもできる。
【0026】
一方、窪み部3の深さDは、ビーズMを窪み部3内にしっかりと保持するためにはより深く設計されるのが望ましいが、後述するように反応液によってビーズMの外周中央部の円状の蛍光シグナルSを標識として付けるためには、少なくともビーズMの上半分は窪み部3の上方に露出している必要がある。よって、窪み部3の深さDとしては、ビーズMの直径rの1/2よりも小さく設定されているのが望ましい。好ましくは1/2未満1/4以上、より好ましくは1/2未満1/3以上である。
【0027】
各窪み部3は、本実施形態では、図2および図3に示すように、凹部2の長さ方向に5個、所定の間隔をあけて並列配置されているとともに(図3参照)、この窪み部3の列が凹部2の幅方向に3列(図2参照)、所定の間隔をあけて設けられることで、計15個の窪み部3がマトリクス状に配置されている。この15個の窪み部3は、各凹部2の長さ方向の中央部に密集するようにかためて配置されている。当該長さ方向の中央部は、プレート1を顕微鏡ステージに載せ置きした場合に、観察できる実視野領域に相当する部分である。つまり、窪み部3を凹部2の長さ方向中央部に密集するように配置することで、窪み部3に捕捉収容されたビーズMにおいて、当該ビーズMに結合させたタンパク質と他のタンパク質(標識タンパク質)との間の相互作用を効率よく観察することができる。
【0028】
ただし、プレート1の凹部2の底面22における窪み部3の配置の仕方は、必ずしもこれに限られるものではなく、1列に設ける窪み部3の数を5個から増減させることも可能であるし、列の数を3列から増減させることも可能である。また、窪み部3が各凹部2の長さ方向のほぼ全域にわたって散在するように各窪み部3を配置させることも可能である。このように、各窪み部3は、凹部2の底面22の任意の位置に配置させることができる。
【0029】
凹部2の底面22の窪み部3が配置されていない領域には、適宜、傾斜溝4が形成されている。この傾斜溝4は、反応液や洗浄液等の流体の流れる方向F(図3で示す例では、右から左に向かう方向)に向かって低くなるように傾斜する傾斜面40と、傾斜面40の傾斜下端に連続して形成された垂直面41とを備えている。反応液や洗浄液等の流体の流れによって、ビーズMが仮に窪み部3内から飛び出して、流れに乗って凹部2内を移動すると、このビーズMが、別の窪み部3内に保持されているビーズMに勢いよく衝突することで、正常に窪み部3内に保持されているビーズMが押し出されてしまうおそれがある。この傾斜溝4は、上記した問題を解消するためのもので、窪み部3内から飛び出したビーズMを傾斜面40を介して下端の底部42に向けて落とし込むことで、ビーズMを捕らえて、ビーズMが凹部2内を移動することを規制している。
【0030】
以上で説明する本発明の顕微鏡観察用プレートは、下記(II)顕微鏡観察用プレート載置装置に組み込んだ形で、またはそのままの形態で、後述する(III)に記載の方法において好適に用いることができる。
【0031】
(II)顕微鏡観察用プレート載置装置
顕微鏡観察用プレート載置装置5は、図6に示すように、支持ユニット6、収容具7および蓋8によって構成されている。支持ユニット61は、略長方形型の枠状に形成された本体部60を有している。この本体部60は、外壁61、内壁62および底壁63によって構成されており、上面には上面側開口64が、下面には下面側開口65が、それぞれ形成されている。内壁62の内側面の下端部には、内側へ突き出す支持部66が形成されている。本体部60の底壁62の裏面には、ヒータ74が設けられている。このヒータ74は、金属板にニクロム線が埋設状に備えられた構成のものであり、底壁62の裏面に密着した状態に貼り付けられ、底壁62の下面側開口65はこのヒータ74によって覆われている。ヒータ74には長方形状の孔75が形成されている。なお、図6中、67は電気コードであり、電気コード67はヒータ74のニクロム線に電気的に接続されている。
【0032】
収容具7は、略長方形型の板状のベース70を有しており、このベース70は外縁が本体部60の支持部66に載る寸法に形成されている。ベース70の中央部には孔71が形成され、孔71の周辺には凹部72が形成されている。この凹部72内に後述するディッシュなどの試料容器9が着脱自在に装着されるようになっている。また、ベース70には、一対の押えバネ73が回動自在に設けられており、試料容器9が凹部72内に設けられた状態では、押えバネ73によって試料容器9が固定される。
【0033】
蓋8は、略長方形型の枠体80と、枠体80により保持されている透明なガラス81により構成されている。
【0034】
図7中、試料容器9は、透明なプラスチックまたはガラスにより形成されており、やや深めの円形皿状をした本体90と、これに被せる蓋体91とで構成されている。本体90の底面92上に、上記した顕微鏡観察用プレート1が載置される。蓋体91には、その上面から突き出たホース接続部93が一体に2つ形成されている。各ホース接続部93は、蒲鉾形をしていて、蓋体91の中心を挟んで互いに反対側に位置しており、いずれもホース挿入穴94が形成されている。このホース挿入穴94は、その一端がホース接続部93の一側面に開口するとともに他端が蓋体91の底面に開口したL字形に屈曲しており、各ホース挿入穴94の一端側の開口は互いに反対側に向かって開口している。一方のホース挿入穴94には反応液や洗浄液を試料容器9内に供給するための供給ホース95が、他方のホース挿入穴94には試料容器9内の反応液や洗浄液を試料容器9外に排出するための排出ホース96が、それぞれ挿入されており、各ホース95,96の先端は蓋体91の底面より下方へ引き出される。各ホース95,96の他端は、蓋8の内周面まで延び、ホースホルダー97を介して顕微鏡観察用プレート載置装置5の外部も延びている。なお、本実施形態では、各ホース接続部93が試料容器9の蓋体91の上面に形成されているが、本体90の側面に一体形成されていてもよい。また、反応液と洗浄液とを別々のルートで試料容器9内に供給/排出するために、反応液の供給/排出用のホース接続部93、および、洗浄液の供給/排出用のホース接続部93を少なくとも2つずつ設けるようにしてもよい。
【0035】
(III)物質と物質との相互作用を検出する方法
本発明は、上記(I)顕微鏡観察用プレートまたは当該プレートを備えた(II)顕微鏡観察用プレート載置装置を用いて、顕微鏡を用いて、物質と物質との結合をリアルタイムに検出する方法である。
【0036】
当該方法は、具体的には、上記顕微鏡観察用プレートまたは当該プレートを備えた顕微鏡観察用プレート載置装置を顕微鏡ステージに載せ置きし、その状態で、顕微鏡観察用プレートのうえで、下記(a)〜(c)の工程を行うことによって実施することができる。なお、(c)の工程は、(a)及び(b)の工程と同時並行して行われるか、少なくとも(b)の工程と同時並行して行われる。
(a)反応液の存在下、被験物質を結合させたビーズと標識物質とを接触させる工程、
(b)顕微鏡観察用プレートの凹部の目に並行して洗浄液を通液する工程、
(c)標識物質に由来する標識を検出する工程。
【0037】
また、上記(a)工程に代えて、下記(a’)工程を行ってもよい。
(a’)顕微鏡観察用プレートに、その凹部の目に並行して、被験物質を結合させたビーズと標識物質を含む溶液を通液する工程。
【0038】
以下、各工程について説明する。
(a)工程
当該(a)工程は、反応液中で物質と物質とを接触させる工程である。
【0039】
ここで物質は、お互いの相互作用を評価する対象の物質である。制限されないが、一方の物質と他方の物質とが、静電的相互作用、水素結合作用、イオン結合作用、疎水性相互作用または親水性相互作用等の1以上の作用によって、お互いに特異的に相互作用することが予想される物質を例示することができる。特異的な結合の例としては、抗原と抗体との結合、受容体とそのリガンド(アンタゴニストまたはアゴニスト)との結合、酵素と基質との結合、アプタマー(ペプチドまたは核酸)とそれに結合する物質との結合、レクチンと糖鎖を有する物質(糖類、糖タンパク質)との結合、複合体を構成するサブユニット同士の結合、シグナル伝達過程におけるタンパク質を初めとする物質同士の結合を例示することができる。
【0040】
しかし、このような結合様式にかかわらず、本発明が対象とする物質には、ペプチド(例えば、アプタマーが含まれる)、タンパク質(例えば、酵素、抗体、受容体、抗原、レクチン、糖タンパク質が含まれる)、核酸(例えば、ポリヌクレオチド、DNA、RNA、アプタマーが含まれる)、糖類(例えば、レクチンに結合する糖類が含まれる)、脂質、酵素に対する基質(例えば、低分子及び高分子化合物が含まれる)、受容体に対するリガンド(例えば、低分子及び高分子化合物が含まれる)、抗体に対する抗原やハプテン、並びにタンパク質等に結合することにより、その機能阻害することのできる低分子あるいは高分子化合物等が、制限なく含まれる。
【0041】
一方の物質として、好ましくはペプチドまたはタンパク質を挙げることができ、他方の物質として、上記ペプチドまたはタンパク質に結合しえる各種の物質を挙げることができる。当該各種の物質には、前述するように、例えばペプチドアプタマーに結合する物質、酵素に結合する基質、レクチンに結合する糖類または糖タンパク質、抗体に結合する抗原やハプテン、抗原に結合する抗体、受容体に結合するリガンド、シグナル伝達過程等においてタンパク質等に結合する相手方の物質等を挙げることができる。また、一方の物質が、核移行シグナルを有するペプチドまたはタンパク質である場合は、他方の物質として核移行シグナルを認識し結合するペプチドまたはタンパク質を例示することができる。
【0042】
ここで、核移行シグナル(nuclear localization signal:NLS)としては、特に制限されないが、後述する実験例で用いるNAC-1(nucleus accumbens-associated protein 1)の核移行シグナル(NLS)、またはnucleoplasmin の核移行シグナル(NLS)を例示することができる。これらの核移行シグナル(NLS)を認識し結合するタンパク質としては、細胞の核膜に存在し、NLS依存的にタンパク質を核内に運び込むことが知られているimportin αを例示することができる。
【0043】
importin αの由来は特に制限されず、植物やヒトを含む動物に由来するimportin αを制限なく挙げることができるが、好ましくはヒト由来のimportin α3である。当該ヒトimportin α3の遺伝子の塩基配列を配列表の配列番号1に示す。当該塩基配列において、塩基番号10-1575の領域が、ヒトimportin α3(野生型)のコーディング領域(CDS領域)である。また、そのアミノ酸配列を配列番号2に示す。
【0044】
なお、後述する実験例に示すように、当該ヒトimportin α3(野生型)のN末端から179番目のトリプトファンと183番目のアスパラギンをいずれもアラニンに置換することで、NLSに対する結合能が消失する(Conti, e. et al., Cell 94; 193-204, 1998)。
【0045】
一方、NAC-1(nucleus accumbens-associated protein 1)は、核内転写制御タンパク質である(Nakayama, K., et al., Proc. Natl Acad. Sci. USA, 103: 18739-18744, 2006)。NAC-1は核移行シグナルを有するものであればよく、ヒト由来に限られず、ヒト以外の動物由来のものであってもよい。当該ヒトNAC-1のアミノ酸配列を配列番号5に示す。当該アミノ酸配列において、アミノ酸番号183〜205の領域が、核移行シグナル(NLS)に相当する領域である。
【0046】
またnucleoplasminについても、その由来も特に制限されず、ヒトを含む動物に由来するnucleoplasmin を制限なく挙げることができる。一例として、後述の実験例で使用するアフリカツメガエルのnucleoplasminを挙げることができる。当該nucleoplasminのアミノ酸配列を配列番号6に示す。当該アミノ酸配列において、アミノ酸番号155〜172の領域が、核移行シグナル(NLS)に相当する領域である。
【0047】
本発明が対象とする物質は、ペプチドやタンパク質を初め、天然由来のものであっても、また化学合成、発酵、及び遺伝子組み換えなどの技術によって人工的に合成されたものであってもよい。またこれらの物質は、ペプチドやタンパク質を初め、糖や核酸やその他の物質(ペプチドやタンパク質を含む)で修飾されるか、若しくはこれらの物質と融合してなるものであってもよい。さらに、本発明においてペプチドとは、オリゴペプチド及びポリペプチドを含む意味で用いられる。また、
本発明において、一方の物質は、発色性または化学発光性の可視化プローブにより予め標識し、標識物質として調製しておくことが好ましい。可視化プローブとしては、好ましくは蛍光プローブを挙げることができる。なお、標識化は、定法に従って行うことができる。
【0048】
蛍光プローブとは、特別な波長の光への曝露により励起されるときに、異なる波長で光を放出する化合物(フルオロフォア)を意味する。当該フルオロフォアは、蛍光タンパク質と称されるタンパク質と、非タンパク質とに分類される。
【0049】
蛍光タンパク質としては、AcGFP1やZsGreen1等の緑色蛍光タンパク質:AmCyan1などの青色蛍光タンパク質:ZsYellow1やmBanana等の黄色蛍光タンパク質:DsRed-Monomer、DsRed2、DsRed-Express、DsRed-Express2、AsRed2、tdTomato、mCherry、mStrawberry、mOrange等の赤色蛍光タンパク質;HcRed1などの真紅色蛍光タンパク質等を、制限なく、例示することができる。標識する対象の物質が、ペプチドまたはタンパク質である場合、標識物質は、当該対象物質(ペプチドまたはタンパク質)に上記の蛍光タンパク質を融合させることによって調製することができる。
【0050】
非タンパク質に分類されるフルオロフォアは、その発光プロフィールまたは「色」によって特徴付けられる。緑色のフルオロフォア(例えばFITC、及びオレゴングリーン)は、概して515〜540nmの範囲の波長でのその発光を特徴とする。赤色のフルオロフォア(例えば、テキサスレッド、Cy5、及びテトラメチルローダミン)は、概して590〜690nmの範囲の波長でのその発光を特徴とする場合がある。フルオロフォアの例には、限定されないが、4-アセトアミド-4'-イソチオシアナートスチルベン-2,2'-ジスルホン酸、アクリジン、アクリジン及びアクリジンイソチオシアネートの誘導体、5-(2'-アミノエチル)アミノナフタレン-1-スルホン酸(EDANS)、4-アミノ-N-[3-ビニルスルホニル)フェニル]ナフタルイミド-3,5-ジスルホネート(ルシファーイエローVS)、N-(4-アニリノ-1-ナフチル)マレイミド、アントラニルアミド、ブリリアントイエロー、クマリン、クマリン誘導体、7-アミノ-4-メチルクマリン(AMC、クマリン120)、7-アミノ-トリフルオロメチルクマリン(クマリン151)、シアノシン;4',6-ジアミニジノ-2-フェニルインドール(DAPI)、5',5”-ジブロモピロガロール-スルホンフタレイン(ブロモピロガロールレッド)、7-ジエチルアミノ-3-(4'-イソチオシアナートフェニル)-4-メチルクマリン、4,4'-ジイソチオシアナートジヒドロ-スチルベン-2,2'-ジスルホン酸、4,4'-ジイソチオシアナートスチルベン-2,2'-ジスルホン酸、5-[ジメチルアミノ]ナフタレン-1-スルホニルクロリド(DNS、ダンシルクロリド)、エオジン、エオジンイソチオシアネートのようなエオジンの誘導体、エリスロシン、エリスロシンB及びイソチオシアン酸エリスロシンのようなエリスロシンの誘導体;エチジウム;フルオレセインと5-カルボキシフルオレセイン(FAM)、5-(4,6-ジクロロトリアジン-2-イル)アミノフルオレセイン(DTAF)、2',7'-ジメトキシ-4',5'-ジクロロ-6-カルボキシフルオレセイン(JOE)、フルオレセイン、フルオレセインイソチオシアネート(FITC)、QFITC(XRITC)のような誘導体;フルオレスカミン誘導体(アミンとの反応時に蛍光);IR144;IR1446;マラカイトグリーンイソチオシアネート;4-メチルウンベリフェロン;オルトクレゾールフタレイン;ニトロチロシン;パラローズアニリン;フェノールレッド、B-フィコエリスリン;o-フタルジアルデヒド誘導体(アミンとの反応時に蛍光);ピレンとピレン、ピレンブチレート、及びスクシンイミジル1-ピレンブチレートのような誘導体;リアクティブレッド4(Cibacron.RTM.ブリリアントレッド3B-A)、ローダミンと6-カルボキシ-X-ローダミン(ROX)、6-カルボキシローダミン(R6G)、リサミンローダミンBスルホニルクロリド、ローダミン(Rhod)、ローダミンB、ローダミン123、ローダミンXイソチオシアネート、スルホローダミンB、スルホローダミン101、及びスルホローダミン101のスルホニルクロリド誘導体(テキサスレッド);N,N,N',N'-テトラメチル-6-カルボキシローダミン(TAMRA);テトラメチルローダミン、テトラメチルローダミンイソチオシアネート(TRITC)のような誘導体;リボフラビン;ロゾール酸とランタニドキレート誘導体、量子ドット、シアニン、ピレリウム(pyrelium)色素、及びスクアライン(squaraine)が含まれる。
【0051】
また他方の物質(本発明では、上記「標識物質」に対して「被験物質」と称する)は、予めビーズに結合させておくことが好ましい。ここでビーズは、本発明の方法において、前述する本発明の顕微鏡観察用プレートにおいて、その凹部2の底面22に形成された窪み部3に捕捉収容させて用いられるものであり、好ましくは球状である。その大きさは、制限されないが、通常、直径20〜150μm程度、好ましくは30〜100μm程度、より好ましくは50〜100μm程度を例示することができる。
【0052】
その素材は、特に制限されないが、例えば、シリカ、アガロースゲル、セルロース、ポリエチレンイミン、ポリスチレン、ポリメタクリル酸、ポリメタクリル酸メチル、スチレン−マレイン酸共重合体、磁性体(マグネタイト、及びマグネタイト−デキストラン架橋複合体やマグネタイト−シリカ架橋複合体等のマグネタイトの複合体)、生体高分子(キトサン等)、生分解性ポリマー(ポリ乳酸等)を例示することができる。
【0053】
これらのビーズは、表面に被験物質を結合できるように、表面に活性エステル基、またはカルボキシル基若しくはアミノ基を提示した形態で、または、被験物質に結合させたタグを認識し結合するリガンドを表面に提示した形態で、アフィニティービーズまたは機能性ナノ・マイクロビーズとして市販されており、商業的に入手することができる。
【0054】
被験物質は、好ましくは、タグで標識されているか、タグ(タンパク質タグ)と融合された状態で用いられる。ここでタグとしては、ニッケルなどの金属イオンと特異的に結合するポリヒスチジン(Hisタグ);グルタチオンと特異的に結合するGST(glutathione S-transferase)(GSTタグ);マルトースやデキストリンと特異的に結合するマルトース結合タンパク質(MBPタグ);StrepTactinと特異的に結合するStrep(II)タグ;Biotin Carboxyl Carrier Protein(BCCP)タグ(ビオチン化ペプチド);その他、インフルエンザ凝集素HA(HAタグ)、ヒトc-myc(mycタグ)、FLAG、水疱性口内炎ウイルス糖タンパク質(VSV-GP)、T7遺伝子10タンパク質(T7タグ)、ヒト単純ヘルペスウイルス糖タンパク質(HSVタグ)、Eタグ(モノクローナルファージ上のエピトープ)等のエピトープタグを例示することができる。被験物質として、このようなタグで標識された被験物質を用いる場合、前述するビーズは、上記タグに結合するリガンドで標識されたものが使用される。
【0055】
本発明方法の(a)工程は、上記被験物質を結合させたビーズと前述する標識物質とを、顕微鏡観察用プレート1上の好ましくは流路内(凹部2内)で、反応液中で接触させる工程である。接触させる方法は、特に制限されないが、例えば、後述する実験例4で説明するように、先に被験物質(被験タンパク質)を結合させたビーズを含む反応液を顕微鏡観察用プレート1上の流路内(凹部2内)に通液し、被験物質(被験タンパク質)結合ビーズを、凹部2の底面22に形成された窪み部3に捕捉収容させた状態で、次いで標識物質(標識タンパク質)を通液する方法によって行うことができる、ここで、反応液は、対象とする物質が変性しない塩濃度範囲とpH範囲と温度範囲を有する水溶液であればよく、その範囲で目的に応じて、適宜に設定することができる。例えば、体内でのタンパク質とタンパク質の相互作用を検出し評価する場合は、生理的条件(塩濃度[NaClまたはKCl] 150mM程度、pH 7.2-7.6程度、20-40℃程度)と同一またはそれに近似する条件にある水溶液として調製することが好ましい。
【0056】
接触させる時間も特に制限なく、1秒〜30分の範囲で適宜設定することができる。また、かかる接触は、被験物質を結合させたビーズを捕捉収容させた顕微鏡観察用プレート1の流路内(凹部2内)に、前述の標識物質を含む反応液を溜め置き(静置)して行ってもよいし、当該標識物質を含む反応液を、例えば本発明の顕微鏡観察用プレート載置装置を用いて、顕微鏡観察用プレート1の流路内(凹部2内)に連続して通液しながら行ってもよい。
【0057】
(a’)工程
当該(a’)工程は、物質と物質との接触反応を顕微鏡観察用プレート上で行う上記(a)工程とは異なり、予め被験物質を結合させたビーズ(被験物質結合ビーズ)と標識物質を試験管やペトリ皿などに入れた反応液中で混合して、当該被験物質結合ビーズと標識物質を含む反応液を、顕微鏡観察用プレート1の流路内(凹部2内)に供し、その目に並行して通液する工程である。反応液の条件や接触させる時間は、上記(a)工程に関して説明した通りである。
【0058】
顕微鏡観察用プレート1の流路内(凹部2内)への反応液の通液は、例えばピペット等を用いて手動で行ってもよいし、また例えば本発明の顕微鏡観察用プレート載置装置を用いて、顕微鏡観察用プレート1の流路内(凹部2内)に反応液を連続して通液若しくは循環させながら行ってもよい。
【0059】
(b)工程
当該(b)工程は、上記(a)工程で標識物質を接触させた被験物質結合ビーズを洗浄する工程である。被験物質に対するアフィニティーが弱い標識物質は、(a)工程において、被験物質を介して一旦はビーズに結合しているものの、当該(b)工程により当該ビーズから解離する。
【0060】
当該(b)工程は、被験物質を結合させたビーズと標識物質との接触と結合が行われた顕微鏡観察用プレート1の流路内(凹部2内)に、その流路の目に並行して洗浄液を通液することによって行うことができる。当該洗浄液の通液は、例えばピペット等を用いて手動で行ってもよいし、また例えば本発明の顕微鏡観察用プレート載置装置を用いて、顕微鏡観察用プレート1の流路内(凹部2内)に洗浄液を連続して通液しながら行ってもよい。
【0061】
ここで、洗浄液は、反応液と同様に、対象とする物質が変性しない塩濃度範囲とpH範囲と温度範囲を有する水溶液であればよく、その範囲で目的に応じて、適宜に設定することができる。例えば、体内でのタンパク質とタンパク質との相互作用を検出評価する場合は、生理的条件と同一またはそれに近似する条件にある水溶液として調製することが好ましい。
【0062】
洗浄に要する時間も特に制限なく、1秒〜30分の範囲で適宜設定することができる。
【0063】
(c)工程
当該(c)工程は、標識物質に由来する標識を検出する工程である。当該工程は、前述する(a)と(b)の工程または(a’)と(b)の工程と同時並行して行われるか、少なくとも(b)の工程と同時並行して行われる。
【0064】
当該標識は、前述するように好ましくは蛍光プローブであり、蛍光プローブで標識された物質の当該蛍光プローブは、蛍光が検出できる蛍光顕微鏡により検出することができる。蛍光顕微鏡としては、具体的には、例えば透過型蛍光顕微鏡、落射型蛍光頭微鏡、コンフォーカルレーザー顕微鏡、及び全反射照明蛍光顕微鏡の各種の蛍光顕微鏡を挙げることができる。好ましくはコンフォーカルレーザー顕微鏡である。
【0065】
前述するように、本発明の顕微鏡観察用プレート1は、ビーズを捕捉収容し得る窪み部3を、凹部2の長さ方向の中央部に密集するようにかためて配置した形態を有するものであることが好ましい。この場合、当該凹部2の長さ方向中央部が、顕微鏡で観察できる実観察領域にくるように、当該顕微鏡観察用プレート1を顕微鏡のステージに載せ置きすることで、当該窪み部3に捕捉収容されたビーズに標識物質が結合する様子や標識物質が解離する様子が、標識(例えば、蛍光プローブ)をシグナルとして可視的に、かつリアルタイムに検出することができる。
【0066】
このように、本発明の方法は、物質(被験物質)と物質(標識物質)との相互作用(結合、アフィニティー)を、顕微鏡という比較的簡単な装置を用いて、可視的にかつリアルタイムに測定し評価することができる方法として、有用である。
【実施例】
【0067】
以下、本発明を、実験例を利用してより詳細に説明する。但し、本発明はこれらの実施例によって何ら制限されるものではない。
【0068】
実験例1:pull-downアッセイ
(1)実験方法
(1-1)GST融合importin α3タンパク質の調製
importin αは細胞の核膜に存在し、タンパク質に存在する核移行シグナル(NLS)を認識し結合するタンパク質で、NLS依存的にタンパク質を核内へ運び込むことが知られている。当該importin αは、C末端領域のアルマジロ反復配列に存在する、種を超えて高度に保存されているアミノ酸を変異させることでその結合能が消失することが知られている(Goldfarb D. et al., Trends Cell Biol., 14: 505-514, 2004 および Lange A., et al., J. Biol. Chem., 282: 5101-5105, 2007)。中でもヒトimportin α3は、N末端側から179番目のトリプトファン(W)と183番目のアスパラギン(N)をアラニン(A)に変異することでその結合能が消失する(Conti, E. et al., Cell 94: 193-204, 1998)。
【0069】
以下、ヒトimportin α3の野生型(importin α3 [Homo sapiens]、GenBank: AAC25605.1、GI:1928975)を「ヒトimportin α3(野生型)」若しくは「importin α3(野生型)」と称し、またその上記変異体を「ヒトimportin α3(W179A、N183A)」若しくは「importin α3(W179A、N183A)」と称する。なお、ヒトimportin α3(野生型)の遺伝子の塩基配列を配列表の配列番号1に示す(NCBI Reference Sequence: NM_002268.2)。当該塩基配列において、塩基番号10-1575の領域がヒトimportin α3(野生型)のコーディング領域(CDS領域)である。またそのアミノ酸配列を配列番号2に示す。
【0070】
(i)GST融合importin α3(野生型)タンパク質の調製
ヒトimportin α3 (GenBank: AAC25605.1、GI:1928975)のcDNA(アミノ酸配列では65-521)を組み込んだGST融合タンパク質発現用ベクターpGEX-6P-1(GEヘルスケア・ジャパン社)(Kosugi S. et al., J. Biol. Chem., 284: 478-485, 2008)を用いて、大腸菌の形質転換を行った。イソプロピルチオガラクトシド(IPTG)誘導されたGST融合importin α3(野生型)タンパク質を含む大腸菌溶解液から、グルタチオンアガロースビーズ(Sigma社)を用いて、GST融合importin α3(野生型)タンパク質を精製した。
【0071】
(ii)GST融合importin α3(W179A、N183A)タンパク質の調製
ヒトimportin α3のcDNA を鋳型として、下記のプライマーを用いて常法に従ってoverlap PCR 法を行い、ヒトimportin α3(W179A、N183A)cDNAを作成した。ヒトimportin α3(W179A、N183A)のcDNA(アミノ酸配列では65-521)を組み込んだGST融合タンパク質発現用ベクターpGEX-6P-1(GEヘルスケア・ジャパン社)を用いて、大腸菌の形質転換を行った。イソプロピルチオガラクトシド(IPTG)誘導されたGST融合importin α3(W179A、N183A)タンパク質を含む大腸菌溶解液から、グルタチオンアガロースビーズ(Sigma社)を用いて、GST融合importin α3(W179A、N183A)タンパク質を精製した。
【0072】
プライマー
W179A N183A-S:
5′-TGT GAG CAA GCA GTG GCG GCA TTG GGA GCT ATC ATA GGT GAT GGG- 3’(配列番号3)
W179A N183A-AS:
5′-CCC ATC ACC TAT GAT AGC TCC CAA TGC CGC CAC TGC TTG CTC ACA- 3’(配列番号4)。
【0073】
(1-2)テストサンプルの調製
テストサンプルとして、赤色蛍光タンパク質mCherryを融合させた「NAC-1(180-207)」、赤色蛍光タンパク質mCherryを融合させた「nucleoplasmin-NLS」、及び対照例として赤色蛍光タンパク質mCherryを調製した。
【0074】
なお、ここで「NAC-1(180-207)」は、核内転写制御タンパク質であるヒトNAC-1(nucleus accumbens-associated protein 1)(Nakayama, K., et al., Proc. Natl Acad. Sci. USA, 103: 18739-18744, 2006)の核移行シグナル(NLS)(183〜205配列)を含む180-207領域のアミノ酸配列からなるペプチド断片である。ヒトNAC-1のアミノ酸配列を配列表の配列番号5に示す。当該アミノ酸配列において、アミノ酸番号183〜205の領域が核移行シグナル(NLS)に相当する領域である。
【0075】
また、「nucleoplasmin-NLS」は、既にヒトimportin α3(野生型)と結合することが知られているnucleoplasmin(Robbins, J., wt al., Cell 64: 615-623, 1991)の核移行シグナル(NLS)である。アフリカツメガエルのnucleoplasmin のアミノ酸配列を配列表の配列番号6に示す。当該アミノ酸配列において、アミノ酸番号155〜172の領域が核移行シグナル(NLS)に相当する領域である。
【0076】
(1-3)pull-downアッセイ
上記で調製したGST融合importin α3(野生型)タンパク質、及びGST融合importin α3(W179A、N183A)タンパク質を、それぞれ定法に従ってグルタチオンビーズに結合させ、次いでこれらを各テストサンプル(mCherry融合NAC-1(180-207)、mCherry融合nucleoplasmin-NLS、mCherry)と混合した。得られたビーズを遠心処理して沈降させ、1% Triton X-100を含むPBSで複数回洗浄した後、SDSサンプル緩衝液を加え加熱してビーズから各タンパク質を遊離した。ビーズから遊離したタンパク質を、SDS-PAGE法により分離し、クマシー染色してタンパク質を同定した。
【0077】
(2)実験結果
結果を図11に示す。図11中、「input」のレーンは、各テストサンプル(mCherry融合NAC-1(180-207)、mCherry融合nucleoplasmin-NLS、mCherry)の標品そのものをSDS-PAGEに供したstandard結果を示す。
【0078】
図11のレーン5及び6に示すように、テストサンプル(mCherry融合NAC-1(180-207)、mCherry融合nucleoplasmin-NLS)のバンドが検出できたことから、核移行シグナル(NLS)を認識し結合するヒトimportin α3(野生型)により、核移行シグナル(NLS)を含むnucleoplasmin-NLS、及びNAC-1(180-207)はいずれも、pull-downすることができた。しかし、レーン8及び9に示すように、ヒトimportin α3(野生型)に代えて、ヒトimportin α3の変異体であるimportin α3(W179A、N183A)を用いた場合には、nucleoplasmin-NLS、及びNAC-1(180-207)はいずれもpull-downできなかった。
【0079】
以上のことから、nucleoplasminやNAC-1等の核移行シグナル(NLS)は、importin α3(野生型)タンパク質と直接結合すること、また種を超えて高度に保存されているアミノ酸に変異を導入したimportin α3変異体(例えば、importin α3(W179A、N183A))にはいずれも結合しないことが確認された。つまり、importin α3(野生型)タンパク質とそのアミノ酸配列の179位と183位を変異させた変異体(例えば、importin α3(W179A、N183A))を用いることで、NLSを介したタンパク質の相互作用を検出し評価できることが確認された。
【0080】
しかし、pull-down法及びそれに続く電気泳動法は、タンパク質相互作用を検出し評価する古典的な実験方法であり、その実験には少なくとも半日以上の時間を要する。従って、これをより短時間に、またタンパク質の相互作用が経時的に観察できる方法を確立する必要がある。
【0081】
実験例2:on beads 顕微鏡アッセイ(その1)
(1)実験方法
市販のカバーガラスの上で、グルタチオンビーズ(実験例1で調製した、GST融合importin α3(野生型)タンパク質またはGST融合importin α3(W179A、N183A)タンパク質を結合させたグルタチオンビーズ)とテストサンプル(実験例1で調製したmCherry融合NAC-1(180-207)、mCherry融合nucleoplasmin-NLS、mCherry)を、1% Triton X-100を含むPBS(反応溶液)中でそれぞれ混合し、蛍光顕微鏡(コンフォーカルレーザー顕微鏡;オリンパス社製)を用いて観察した。図11にアッセイの概略を示す。単に混ぜるだけで、1分もかけないでアッセイできる簡単な方法である。
【0082】
(2)実験結果
実際の観察データを図12に示す。左図は蛍光観察結果であり、右図は透過光観察結果である。コンフォーカル顕微鏡を用いているため、グルタチオンビーズに結合させたタンパク質とテストサンプルのタンパク質との間にタンパク質相互作用がある場合、蛍光観察で、ビーズの周囲に円状に赤色蛍光タンパク質mCherryに起因するシグナルが観察される。ビーズ12個分の蛍光強度を測定し、統計処理した結果を図13に示す。ここでは、図11のレーン8に示すように実験例1のpull-downアッセイでは結合が見られなかったヒトimportin α3(W179A、N183A)とnucleoplasmin-NLSとの結合を示すシグナルが認められた(図12:右側の中段、図13:右から3番目)。
【0083】
この結果から、標識タンパク質を含むテストサンプルを、被験タンパク質を結合させたビーズ上で反応させるだけでは、標識タンパク質と被験タンパク質との相互作用(結合と解離)を定量的に評価することができないことが判明した。
【0084】
実験例3:on beads 顕微鏡アッセイ(その2)
実験例2の実験において、顕微鏡観察用の市販のカバーガラス上の反応溶液(1% Triton X-100を含むPBS)を一部回収し、洗浄液(1% Triton X-100を含むPBS)をその容量分追加するという方法によって、反応溶液の希釈を繰り返し、顕微鏡観察を行った。
【0085】
実際の観察データを図14に示す。上2段は、GST融合importin α3(野生型)タンパク質を結合させたグルタチオンビーズにmCherry 融合nucleoplasmin-NLSを混合し、順次希釈したものである(2段中、上一列は蛍光観察結果、下一列は透過光観察結果を示す)。下2段は、GST融合importin α3(W179A、N183A)タンパク質を結合させたグルタチオンビーズにmCherry 融合nucleoplasmin-NLSを混合し、順次希釈したものである(2段中、上一列は蛍光観察結果、下一列は透過光観察結果を示す)。ビーズ5個分の蛍光強度を測定し、統計処理した結果を図15に示す。
【0086】
この結果からわかるように、GST融合importin α3(W179A、N183A)タンパク質は、希釈前はGST融合importin α3(野生型)タンパク質と遜色なくmCherry融合nucleoplasmin-NLSと結合していたが、希釈するに従って、GST融合importin α3(野生型)タンパク質と比べて速やかに解離していく様子が観察された。
【0087】
この結果から、カバーガラス上の反応溶液を順次希釈していくことで、顕微鏡下でリアルタイムにタンパク質同士の相互作用(結合と解離)が観察できることが確認された。
【0088】
実験例4:on beads 顕微鏡アッセイ(その3)
市販のカバーガラスに代えて、本発明の顕微鏡観察用プレート(マイクロ流路付きプレート)(図1参照)を用いて、グルタチオンビーズ(実験例1で調製したGST融合importin α3(野生型)タンパク質、またはGST融合importin α3(W179A、N183A)タンパク質を結合させたビーズ)とテストサンプル(実験例1で調製したmCherry融合nucleoplasmin-NLS)との相互作用を蛍光顕微鏡(コンフォーカルレーザー顕微鏡;オリンパス社製)を用いて観察した。
【0089】
この顕微鏡観察用プレート上での一連の反応を、リアルタイムで蛍光顕微鏡で観察した結果、グルタチオンビーズとしてGST融合importin α3(W179A、N183A)タンパク質を結合させたビーズを用いた場合は、mCherry融合nucleoplasmin-NLSは、一旦は結合するものの、洗浄液を通液することで速やかに解離した(図16のStep 3の右図)。これに対して、グルタチオンビーズとしてGST融合importin α3(野生型)タンパク質を結合させたビーズを用いた場合は、mCherry融合nucleoplasmin-NLSと結合し、またその結合が洗浄液の通液にも関わらず安定して維持されることが観察された(図16のStep 3の左図)。
【0090】
この顕微鏡観察用プレート上での一連の反応を、リアルタイムで蛍光顕微鏡観察した結果、実験例4と同様に、グルタチオンビーズとしてGST融合importin α3(W179A、N183A)タンパク質を結合させたビーズを用いた場合は、mCherry融合nucleoplasmin-NLSは、一旦は結合するものの、洗浄液を通液することで速やかに解離したのに対して、グルタチオンビーズとしてGST融合importin α3(野生型)タンパク質を結合させたビーズを用いた場合は、mCherry融合nucleoplasmin-NLSと結合し、またその結合が洗浄液の通液にも関わらず安定して維持されることが観察された。
【0091】
以上のことから、本発明の顕微鏡観察用プレートによれば、顕微鏡という簡便な装置を用いてタンパク質同士の相互作用をリアルタイムに観察測定できることが確認された。
【符号の説明】
【0092】
1 顕微鏡観察用プレート
2 凹部
3 窪み部
5 顕微鏡観察用プレート載置装置
6 支持ユニット
7 収容具
8 蓋
9 試料容器
10 プレートの表面
22 凹部の底面
90 本体
91 蓋体
93 ホース接続部
94 ホース挿入穴
M ビーズ
【配列表フリーテキスト】
【0093】
配列番号3及び4は、ヒトimportin α3のcDNA を鋳型として、overlap PCR 法を用いてヒトimportin α3(W179A、N183A)cDNAを作成するために使用したプライマー(W179A N183A-SとW179A N183A-AS)を意味する。
【特許請求の範囲】
【請求項1】
光透過性を有しかつ非発光性の樹脂材料により形成された平板状のものであり、
一方の表面に、流体の流路を構成する凹部を少なくとも1つ備え、
前記凹部の底面には、ビーズを収容可能な窪み部が複数形成されている顕微鏡観察用プレート。
【請求項2】
前記凹部を2つ以上備え、各凹部が互いに並行に設けられていることを特徴とする請求項1に記載の顕微鏡観察用プレート。
【請求項3】
前記ビーズが球状であり、前記窪み部の深さが前記ビーズの直径の1/2よりも小さいことを特徴とする請求項1または2に記載の顕微鏡観察用プレート。
【請求項4】
上記樹脂材料が、表面が親水加工処理されてなる樹脂材料である、請求項1乃至3のいずれかに記載する顕微鏡観察用プレート。
【請求項5】
親水加工処理された樹脂材料が、プラズマ放電処理またはコロナ放電処理により親水加工処理されたポリジメチルシロキサンである、請求項4に記載する顕微鏡観察用プレート。
【請求項6】
内部に請求項1〜5のいずれかに記載の顕微鏡観察用プレートを載置可能な試料容器と、前記試料容器を収容可能な収容具と、前記収容具を保持可能な顕微鏡ステージに載置される支持ユニットと、前記支持ユニットの上面側開口を覆う蓋とを有し、
前記試料容器は、上面が開口した本体と前記本体の上面を塞ぐ蓋体とを備えており、前記蓋体の上面または前記本体の側面には、少なくとも2つのホース接続部が一体に形成されており、前記ホース接続部には、前記試料容器内に反応液または洗浄液を供給もしくは排出するためのホースを挿通可能なホース挿入穴が形成されている顕微鏡観察用プレート載置装置。
【請求項7】
被験物質と標識物質との結合を検出する方法であって、
顕微鏡ステージに載せ置きした、請求項1乃至5のいずれかに記載する顕微鏡観察用プレート上で、下記(a)、(b)及び(c)の工程を行う方法:
(a)反応液の存在下、被験物質を結合させたビーズと標識物質とを接触させる工程、
(b)顕微鏡観察用プレートの凹部の目に並行して洗浄液を通液する工程、
(c)標識物質に由来する標識を検出する工程。
【請求項8】
被験物質と標識物質との結合を検出する方法であって、
顕微鏡ステージに載せ置きした、請求項1乃至5のいずれかに記載する顕微鏡観察用プレート上で、下記(a’)、(b)及び(c)の工程を行う方法:
(a’)顕微鏡観察用プレートに、その凹部の目に並行して、被験物質を結合させたビーズと標識物質を含む溶液を通液する工程、
(b)顕微鏡観察用プレートの凹部の目に並行して洗浄液を通液する工程、
(c)標識物質に由来する標識を検出する工程。
【請求項9】
被験物質または標識物質の一方の物質として、核移行シグナルを有するタンパク質を用い、他方の物質として、核移行シグナルを認識し結合するタンパク質を用いることを特徴とする、請求項7または8に記載する方法。
【請求項10】
核移行シグナルが、NAC-1(nucleus accumbens-associated protein 1)の核移行シグナル、またはnucleoplasmin の核移行シグナルであるか、または
核移行シグナルを認識し結合するタンパク質が、importin αである、
請求項9に記載する方法。
【請求項1】
光透過性を有しかつ非発光性の樹脂材料により形成された平板状のものであり、
一方の表面に、流体の流路を構成する凹部を少なくとも1つ備え、
前記凹部の底面には、ビーズを収容可能な窪み部が複数形成されている顕微鏡観察用プレート。
【請求項2】
前記凹部を2つ以上備え、各凹部が互いに並行に設けられていることを特徴とする請求項1に記載の顕微鏡観察用プレート。
【請求項3】
前記ビーズが球状であり、前記窪み部の深さが前記ビーズの直径の1/2よりも小さいことを特徴とする請求項1または2に記載の顕微鏡観察用プレート。
【請求項4】
上記樹脂材料が、表面が親水加工処理されてなる樹脂材料である、請求項1乃至3のいずれかに記載する顕微鏡観察用プレート。
【請求項5】
親水加工処理された樹脂材料が、プラズマ放電処理またはコロナ放電処理により親水加工処理されたポリジメチルシロキサンである、請求項4に記載する顕微鏡観察用プレート。
【請求項6】
内部に請求項1〜5のいずれかに記載の顕微鏡観察用プレートを載置可能な試料容器と、前記試料容器を収容可能な収容具と、前記収容具を保持可能な顕微鏡ステージに載置される支持ユニットと、前記支持ユニットの上面側開口を覆う蓋とを有し、
前記試料容器は、上面が開口した本体と前記本体の上面を塞ぐ蓋体とを備えており、前記蓋体の上面または前記本体の側面には、少なくとも2つのホース接続部が一体に形成されており、前記ホース接続部には、前記試料容器内に反応液または洗浄液を供給もしくは排出するためのホースを挿通可能なホース挿入穴が形成されている顕微鏡観察用プレート載置装置。
【請求項7】
被験物質と標識物質との結合を検出する方法であって、
顕微鏡ステージに載せ置きした、請求項1乃至5のいずれかに記載する顕微鏡観察用プレート上で、下記(a)、(b)及び(c)の工程を行う方法:
(a)反応液の存在下、被験物質を結合させたビーズと標識物質とを接触させる工程、
(b)顕微鏡観察用プレートの凹部の目に並行して洗浄液を通液する工程、
(c)標識物質に由来する標識を検出する工程。
【請求項8】
被験物質と標識物質との結合を検出する方法であって、
顕微鏡ステージに載せ置きした、請求項1乃至5のいずれかに記載する顕微鏡観察用プレート上で、下記(a’)、(b)及び(c)の工程を行う方法:
(a’)顕微鏡観察用プレートに、その凹部の目に並行して、被験物質を結合させたビーズと標識物質を含む溶液を通液する工程、
(b)顕微鏡観察用プレートの凹部の目に並行して洗浄液を通液する工程、
(c)標識物質に由来する標識を検出する工程。
【請求項9】
被験物質または標識物質の一方の物質として、核移行シグナルを有するタンパク質を用い、他方の物質として、核移行シグナルを認識し結合するタンパク質を用いることを特徴とする、請求項7または8に記載する方法。
【請求項10】
核移行シグナルが、NAC-1(nucleus accumbens-associated protein 1)の核移行シグナル、またはnucleoplasmin の核移行シグナルであるか、または
核移行シグナルを認識し結合するタンパク質が、importin αである、
請求項9に記載する方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【公開番号】特開2012−211960(P2012−211960A)
【公開日】平成24年11月1日(2012.11.1)
【国際特許分類】
【出願番号】特願2011−76772(P2011−76772)
【出願日】平成23年3月30日(2011.3.30)
【出願人】(504155293)国立大学法人島根大学 (113)
【Fターム(参考)】
【公開日】平成24年11月1日(2012.11.1)
【国際特許分類】
【出願日】平成23年3月30日(2011.3.30)
【出願人】(504155293)国立大学法人島根大学 (113)
【Fターム(参考)】
[ Back to top ]

