物質間相互作用検出部とセンサーチップ
【課題】ノイズによる検出精度低下の問題を根本的に解決できる物質間の相互作用検出技術を提供すること。
【解決手段】物質間の相互作用が進行する場を提供し得る反応領域2と、前記反応領域2に連通する領域であって、前記反応領域から移動してきた物質を標識する場を提供し得る標識領域3と、前記標識領域3に連通する領域であって、前記標識物質から発せられる検出信号によって物質間の相互作用情報を取得する場を提供し得る検出領域4と、から構成され、検出精度の高い物質間相互作用検出部1aを提供する。
【解決手段】物質間の相互作用が進行する場を提供し得る反応領域2と、前記反応領域2に連通する領域であって、前記反応領域から移動してきた物質を標識する場を提供し得る標識領域3と、前記標識領域3に連通する領域であって、前記標識物質から発せられる検出信号によって物質間の相互作用情報を取得する場を提供し得る検出領域4と、から構成され、検出精度の高い物質間相互作用検出部1aを提供する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、物質間の相互作用を検出する際に特に有用な技術に関する。より詳細には、反応領域から検出されるノイズ(ノイズ信号)による検出精度の低下を根本的に解決できる物質間の相互作用検出技術に関する。
【背景技術】
【0002】
近年、基板などの表面(界面)において、物質間の相互作用や反応を進行させて、これらを物理的手段や光学的手段等によって検出する技術が進展している。当該技術は、疾病診断、薬物等の化合物スクリーニング、法医学、遺伝情報の網羅的解析、生体物質の機能解析、プロテオーム解析、生体内反応の解析などの分野では、既に重要な基幹技術となりつつある。
【0003】
検出目的とされる相互作用(あるいは反応)は、例えば、核酸鎖(相補鎖)間のハイブリダイゼーション、タンパク質間の相互作用、抗原抗体反応、酵素反応、ホルモン応答反応、低分子化合物が関与する諸反応など様々である。検出技術において最も代表的な手法を例示すれば、蛍光検出技術である。
【0004】
この蛍光検出技術は、所定の反応領域で目的の相互作用を進行させた後に、当該反応領域から発せられる蛍光を捕捉して、この蛍光強度を解析する手法である。例えば、DNAチップ(DNAマイクロアレイ)は、一般に、基板上の反応領域に固定された核酸鎖と試料核酸中に存在する蛍光標識された核酸鎖とのハイブリダイゼーションを進行させ、該反応領域から不要な遊離物質を洗浄除去した後、二本鎖状態で反応領域に留まる前記ターゲット核酸鎖から発せられる蛍光強度を測定することにより、前記ハイブリダイゼーションを検出する。また、ハイブリダイゼーションに係わる核酸鎖の蛍光標識を行なうことなく、二本鎖に特異的に結合する性質を持つ蛍光インターカレーターを用いて、ハイブリダイゼーションを検出する方法も開発されている。
【0005】
しかし、この種の検出技術においては、種々の原因により、ハイブリダイゼーションとは全く無関係の蛍光(以下、ノイズ蛍光)が反応領域内で発生して、検出精度を低下させてしまうという問題を抱えている。このため、いわゆるS/N比の向上が重要な技術的課題となっている。
【0006】
この技術的課題を解決するために提案された主な従来技術として、第1には、チップ用の担体表面の材料に蛍光物質含有量の少ない材料であるポリオレフィンを用いる技術(特許文献1参照)、第2には、プローブDNAの構造を工夫し、ハイブリダイゼーションしたプローブDNAのみから蛍光が発せられるようにする技術(特許文献2参照)、第3には、消光剤を用いてノイズ蛍光を低減する技術(特許文献3)などを挙げることができる。
【特許文献1】特開2003−28867号公報。
【特許文献2】特開2003−329676号公報。
【特許文献3】特開2003−084002号公報。
【発明の開示】
【発明が解決しようとする課題】
【0007】
しかしながら、上掲したような従来技術のアプローチは、反応領域内でのノイズを極力発生させないように工夫したり(特許文献1、2)、発生したノイズを極力低減するように工夫したり(特許文献3)する技術であるため、S/N比向上をある程度達成できても、反応領域において発生するノイズ蛍光を完全に排除することはできない。即ち、従来技術ではS/N比向上に一定の限界があった。
【0008】
そこで、本発明は、ノイズによる検出精度低下の問題を根本的に解決できる物質間の相互作用検出技術を提供することを主な目的とする。
【課題を解決するための手段】
【0009】
本願発明者は、ノイズによる検出精度低下の問題を解決するための従来の発想から大きく転換し、ノイズの発生を完全に回避することが困難である反応領域において検出作業を行わないように工夫した。即ち、反応領域と検出領域を共通の領域とせず全く別の領域とし、反応領域内で相互作用が進行した物質のみを検出領域に移動させてから検出することによって、反応領域からのノイズ信号を一切検出しないようにするという新規着想の基に、以下の本発明を完成させた。
【0010】
本発明は、物質間の相互作用が進行する場を提供し得る「反応領域」と、前記第1領域に連通する領域であって、前記第1領域から移動してきた物質を標識する場を提供し得る「標識領域」と、前記標識領域に連通する領域であって、前記標識後の物質から発せられる検出信号によって物質間の相互作用情報を取得する場を提供し得る「検出領域」と、から構成された物質間相互作用検出部、並びに、該物質間相互作用検出部が設けられたセンサーチップ、特に、上方外観視、円盤状をなすセンサーチップを提供する。
【0011】
本発明においては、物質間の相互作用が進行する反応領域と検出信号を取得する検出領域が物理的に区別された構成を採用している。そのため、未反応物質等のノイズ原因が、検出領域内へ侵入することを防止できる。従って、反応領域内において発生するノイズが、検出領域内での検出信号中に混在してしまうという問題を根本的に解決することができる。
【0012】
本発明においては、少なくとも反応領域及び標識領域と、検出領域とが物理的に区別された構成であれば、その構成は特に限定されない。例えば、反応領域内において、相互作用する物質を標識してもよい。即ち、反応領域が、同時に標識領域の役割も担うように構成することも自由である。
【0013】
本発明における検出領域の形態や該検出領域への物質の移動原理等は、特に限定されない。検出領域の有力な形態例の一つは、キャピラリである。また、検出領域への物質の移動原理の有力例は、前記キャピラリにおける毛細管現象や遠心力による沈降平衡に基づいて物質の分子量に依存した濃度勾配の形成(沈降平衡原理)である。
【0014】
沈降平衡原理を採用した場合、標識領域からキャピラリへ送られてくる溶媒中に存在する物質(溶質)を、遠心力の作用によってキャピラリの先端側に向かって沈降させて、この沈降力とこれに逆らう拡散力が平衡(沈降平衡)した時点での分子量に依存した濃度勾配を形成することができる。その結果、キャピラリ内の特定位置に、相互作用状態にある物質を他の物質と分離して集積することが可能となる。なお、円盤状の基板の半径方向にキャピラリを形成しておく構成により、該基板を所定速度で回転させることで該キャピラリに遠心力を形成することができる。
【0015】
また、本発明では、反応領域と標識領域の間に、物質の通過を制御可能な領域を設けておくことによって、反応領域から標識領域への物質の移動を制御し、必要なタイミングで、物質間の相互作用を進行させる段階から後続の段階(標識段階と検出段階)へと移行できるようになる。
【0016】
例えば、親媒性原理を利用すれば、親水性の物質の通過を疎水性領域によって通常状態で遮断しておき、必要に応じて当該疎水性領域を親水性へ変換したり、圧力や遠心力等によって強制的に疎水性領域を通過させたりすることができる。
【0017】
ここで、本発明における「相互作用」は、物質間の非共有結合、共有結合、水素結合を含む化学的結合あるいは解離を広く意味し、例えば、核酸分子間のハイブリダイゼーション、タンパク質間の相互作用、抗原抗体反応などの物質間の化学的結合あるいは解離を広く含む。
【0018】
また、本発明における「標識」とは、相互作用を検出するための検出信号を発する方法を全て包含する。例えば、蛍光物質、放射性物質、又はインターカレーターなどの標識物質を物質へ吸着又は結合させる方法、また、FRETの原理のように、物質間相互作用により、その物質の蛍光色等を変化させる方法などを広く含む概念である。
【0019】
以下、本発明に係る関連技術用語について説明する。
【0020】
「ノイズ」とは、その発生原因や信号の種類を問わず、物質間の相互作用を検出に真に役立つ信号以外の信号を広く意味し、バックグラウンドノイズという概念も包含する。「S/N比」は、検出に有用な正規検出信号(S)と検出に有用でないノイズ信号(N)との比を意味し、この比の値が大きいほど、検出精度が高い。
【0021】
「核酸鎖」とは、プリンまたはピリミジン塩基と糖がグリコシド結合したヌクレオシドのリン酸エステルの重合体(ヌクレオチド鎖)を意味し、プローブDNAを含むオリゴヌクレオチド、ポリヌクレオチド、プリンヌクレオチドとピリミジンヌクレオチオドが重合したDNA(全長あるいはその断片)、逆転写により得られるcDNA(cプローブDNA)等を広く含む。天然由来のもの、人工的に合成したものも含む。
【0022】
「ハイブリダイゼーション」は、核酸鎖間の相補結合形成反応であり、DNA−DNA、DNA−RNA、RNA−RNA間の相補結合などを広く含む。なお、「ミスハイブリダイゼーション」は、ミスマッチな塩基間(不適合な塩基間)で相補結合した部位を有する状態で二本鎖を形成する反応を言う。
【0023】
「センサーチップ」は、物質間の相互作用を進行させ、これを検出(センシング)し得る基板を広く包含し、当該基板を構成する基材の材料や層構造等は特に限定されないない。いわゆるDNAチップ(DNAマイクロアレイ)と一般に称されるヌクレオチドチップ、たんぱくチップを少なくとも含む。
【発明の効果】
【0024】
本発明によれば、物質間の相互作用を検出する際のノイズを排除することができ、ひいては、検出精度を高めることができる。
【発明を実施するための最良の形態】
【0025】
以下、本発明に係る実施形態例ついて、添付図面を参照しながら説明する。
なお、添付図面に示された各実施形態は、本発明に係わる代表的な実施形態の一例を示したものであり、これにより本発明の範囲が狭く解釈されることはない。
【0026】
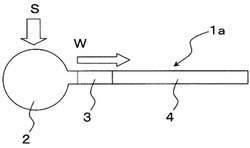
まず、図1、及び図2を用いて、本発明に係る物質間相互作用検出部の構成を説明する。図1は、本発明に係る物質間相互作用検出部1aの一実施形態を示す上方外観視平面図であり、図2は、本発明に係る物質間相互作用検出部1の一実施形態を示す側方外観視平面図である。
【0027】
本発明に係る物質間相互作用検出部1aは大別して、反応領域2と、標識領域3と、検出領域4と、から構成する。なお、図1中符号Sは検出の対象となるサンプル溶液等を示し、矢印Wは、サンプル溶液等の移動方向を示している。
【0028】
反応領域2は、サンプルSを投入し、物質間の相互作用が進行する場である。反応領域2において進行する物質間相互作用は、特に限定されない。一例としては、核酸分子間のハイブリダイゼーション、タンパク質間の相互作用、抗原抗体反応などの物質間の化学的結合あるいは解離が挙げられ、物質間の非共有結合、共有結合、水素結合を含む化学的結合あるいは解離などを広く包含する。
【0029】
標識領域3は、反応領域2に連通する領域であって、反応領域2から移動してきた物質を標識する場である。標識領域3における標識方法は、特に限定されない。一例としては、物質に蛍光物質又は放射性物質などの標識物質を吸着又は結合させる方法が挙げられる。また、核酸鎖間のハイブリダイゼーションを検出する場合等には、インターカレーターなどによる標識方法も採用することができる。
【0030】
ここで、インターカレーターとは、二本鎖核酸の相補鎖部位に結合して蛍光等を発する物質であって、ハイブリダイゼーション検出に用いられる物質である。例えば、POPO−1やTOTO−3、SYBR(登録商標)GreenI、PicoGreen、Hoechst33258などを挙げることができる。なお、このインターカレーターは、正規な(フルマッチな)相補鎖部分以外に、場合により、ミスマッチ二本鎖核酸の相補鎖部位、自己ループ構造部位、遊離状態又は固定化された状態の一本鎖核酸、二本鎖核酸の余剰の一本鎖部位などにも非特異的に結合又は吸着してしまい、ノイズ蛍光を発する場合がある。
【0031】
標識領域3では、物質間の相互作用を進行させると同時に、該物質を標識することもできる。即ち、標識領域3を、同時に反応領域2の役割も担う構成とすることも可能である。例えば、予め一方の物質を標識物質で標識しておけば、相互作用と同時に相互作用後の物質を標識することができる。また、FRETなどの原理を利用して、蛍光物質間の蛍光エネルギーが移動することにより、物質自体の蛍光を変化させることによって標識することも可能である。
【0032】
検出領域4は、標識領域3に連通する領域であって、前記標識後の物質から発せられる検出信号によって物質間の相互作用情報を取得する場である。本発明においては、物質間の相互作用が進行する反応領域2、及び物質を標識する標識領域3と、検出信号を取得する検出領域4とを、物理的に区別した構成を採用している。そのため、未反応物質等のノイズ原因となるものが、反応領域2及び標識領域3から、検出領域4内へ移動することを防止できる。従って、反応領域2及び標識領域3内において発生するノイズが、検出領域4内での検出信号中に混在してしまうという問題を根本的に解決することができる。その結果、S/N比の向上を図り、検出精度の高い物質間相互作用検出部1aを提供することができる。
【0033】
検出領域4で行う検出方法は、特に限定されない。一例としては、図2に示すように、検出領域4へ向けて、所定波長の蛍光励起光Qを光源5から出射して、検出領域4内で励起された蛍光Fを、光ディテクタ6で検出し、蛍光強度等を測定する方法が挙げられる。
【0034】
検出領域4は、物質間相互作用情報を取得しうる領域であれば、その形態は特に限定されない。好適な一例としては、キャピラリが挙げられる。キャピラリを用いることにより、毛細管現象の原理に基づいて、物質を検出領域4へ移動させることができる。
【0035】
検出領域4への物質の移動方法は、上記毛細管現象等に以外にもあらゆる方法を用いることができる。好適な一例としては、遠心力による沈降平衡に基づいた方法である。この方法を用いれば、物質の分子量に依存した濃度勾配を形成することができる(沈降平衡原理)。沈降平衡原理に基づく方法を、図3を用いて詳しく説明する。
【0036】
図3は、沈降平衡原理を用いて、物質を検出領域4へ移動させる様子を示す図である。図3中矢印Cの方向へ遠心力を加えると、溶媒中に存在する物質(溶質)にも沈降力が加わる。物質(溶質)は、この沈降力と逆らう拡散力が平衡した箇所に留まる。そして、分子量に依存した濃度勾配を形成する。
【0037】
この沈降平衡原理を用いれば、例えば、図3に示すように、予め相互作用後の物質の分子量から特定位置4aを求めておき、該特定位置4aから得られる光情報や放射線情報を捕捉することによって、物質間相互作用の有無を検出することができる。
【0038】
図4は、図1、2とは異なる実施形態である物質間相互作用検出部1bを示す上方外観視平面図である。
【0039】
本実施形態では、反応領域2と標識領域3の間に、物質の通過を制御可能な通過制御領域7を設けている。通過制御領域7を設けることにより、反応領域2から標識領域3への物質の移動を制御し、必要なタイミングで、物質間の相互作用を進行させる相互作用段階から標識段階へと移行することができる。
【0040】
また、図示しないが、標識領域3と検出領域4の間に、通過制御領域7を設けることも自由である。同様に、標識領域3から検出領域4への物質の移動を制御し、必要なタイミングで、標識段階から、相互作用情報を取得する検出段階へと移行することができる。
【0041】
通過制御領域7で行う制御方法は、特に限定されない。一例を挙げると、親媒性原理を利用することができる。具体的には、通過制御領域7を疎水性領域とし、親水性の物質の通過を遮断する。そして、必要に応じて当該疎水性領域を親水性へ変換して親水性の物質を通過させたり、圧力や遠心力等によって親水性の物質を強制的に通過させたりすることができる。
【0042】
疎水性領域の形成方法は特に限定されない。好適な一例としては、疎水性領域を酸化チタンで形成する方法が挙げられる。酸化チタンは、通常は疎水性であるが、紫外線を照射することにより親水性へと変化する物質である。そのため、通過制御領域7を酸化チタンで形成すれば、通常は親水性の物質の通過を遮断することができ、必要に応じて紫外線を照射し、その性質を親水性へと変換させることにより、親水性の物質を通過させることができる。
【0043】
次に、図5から図8を用いて、本発明に係る物質間相互作用検出部1a(1b)を用いて検出し得る物質間相互作用の例を説明する。
【0044】
図5は、本発明に係る物質間相互作用検出部1a(1b)を用いて、核酸鎖間のハイブリダイゼーションを検出する方法を示す模式図である。
【0045】
物質間相互作用検出部1a(1b)の反応領域2において、予めプローブ核酸Nが待ち受けている。プローブ核酸Nは、サンプル液S中の相補的なターゲット核酸Xとハイブリダイゼーションする(図5中(I)参照)。
【0046】
そして、プローブ核酸Nとターゲット核酸Xは二本鎖を形成したまま、標識領域3へ移動する。移動方法は、特に限定されず、毛細管現象、遠心力による沈降平衡原理、負圧吸引、正圧押出、又は通過制御領域を設けるなど、あらゆる方法を採用することができる。
【0047】
標識領域3において、二本鎖を形成するプローブ核酸Nとターゲット核酸Xに対して、標識が行われる(図5中(II)参照)。図5では、インターカレーター8が、二本鎖核酸の相補鎖部位に結合することにより蛍光等を発する標識方法を例示しているが、標識方法は特に限定されない。物質間の相互作用情報を検出し得る方法であれば、あらゆる標識方法を用いることができる。
【0048】
次に、標識された二本鎖は、検出領域4へと移動する。移動方法は特に限定されず、毛細管現象、遠心力による沈降平衡原理、負圧吸引、正圧押出、又は通過制御領域を設けるなど、あらゆる方法を採用することができる。
【0049】
本発明では、反応領域2及び標識領域3と、検出領域4とを物理的に区別した構成を採用しているので、反応領域2、及び標識領域4内において発生するノイズが検出信号中に混在してしまうという問題を根本的に解決することができる。例えば、サンプルS中の核酸鎖であって、プローブ核酸Nと相補結合を形成しない核酸は、標識領域3や検出領域4へ移動しないため、該核酸鎖から生じるノイズを根本的に排除することができる。また、二本鎖核酸の相補鎖部位に結合せず、ミスマッチ二本鎖核酸の相補鎖部位、自己ループ構造部位、遊離状態又は固定化された状態の一本鎖核酸、又は二本鎖核酸の余剰の一本鎖部位などに非特異的に結合又は吸着したインターカレーター8も、検出領域4へは移動しないため、正規結合していないインターカレーター8から生じるノイズも根本的に排除することができる。
【0050】
検出領域4中の所定の箇所で、図示しないが、標識物質等から得られる光情報や放射線情報などを捕捉することによって、物質間相互作用の有無を検出する。
【0051】
図6は、図5とは異なる実施形態であって、本発明に係る物質間相互作用検出部1a(1b)を用いて、核酸鎖間のハイブリダイゼーションを検出する方法を示す図である。
【0052】
物質間相互作用検出部1a(1b)の反応領域2において、プローブ核酸Nが待ち受けている。該プローブ核酸Nには、予め標識物質9が結合している。プローブ核酸Nは、サンプルS中の相補的なターゲット核酸Xとハイブリダイゼーションする(図6中(I)参照)。
【0053】
この時、プローブ核酸Nには、予め標識物質9が結合しているため、ハイブリダイゼーションと同時に、形成された二本鎖への標識が行われる。即ち、本実施形態に係る物質間相互作用検出部1a(1b)では、反応領域2が同時に標識領域3の役割も担う構成となっている。図6では、プローブ核酸Nに対して、予め標識物質9を結合させているが、この方法に限定されず、逆にターゲット核酸X側へ予め標識物質9を結合させておくことも自由である。
【0054】
相互作用、及び標識が行われた二本鎖は、検出領域へと移動する(図6中(II)参照)。そして、標識物質等から得られる光情報や放射線情報などを捕捉することによって、物質間相互作用の有無を検出する。
【0055】
図7は、本発明に係る物質間相互作用検出部1a(1b)を用いてタンパク質間の相互作用を検出する方法を示す図である。
【0056】
物質間相互作用検出部1a(1b)の反応領域2において、予めタンパク質A1が待ち受けている。タンパク質A1は、サンプルS中のタンパク質B1と相互作用する(図7中(I)参照)。図7では、相互作用の一例として、タンパク質A1とタンパク質B1とが複合体を形成する様子を挙げているが、相互作用の形態は特に限定されない。例えば、タンパク質B1がタンパク質A1に何らかの作用をすることにより、タンパク質A1の性質を変化させるような相互作用であってもよい。
【0057】
タンパク質A1とタンパク質B1の複合体は相互作用後、標識領域3へ移動する。移動方法は、特に限定されず、毛細管現象、遠心力による沈降平衡原理、負圧吸引、正圧押出、又は通過制御領域を設けるなど、あらゆる方法を採用することができる。
【0058】
標識領域3において、タンパク質A1とタンパク質B1の複合体に対して、標識が行われる(図7中(II)参照)。図7では、標識物質9が、前記タンパク質複合体に結合することにより蛍光等を発する標識方法を例示しているが、標識方法は特に限定されない。物質間の相互作用情報を検出し得る方法であれば、あらゆる標識方法を用いることができる。
【0059】
次に、標識された前記タンパク質複合体は、検出領域4へと移動する(図7中(III)参照)。移動方法は特に限定されず、毛細管現象、遠心力による沈降平衡原理、負圧吸引、正圧押出、又は通過制御領域を設けるなど、あらゆる方法を採用することができる。そして、標識物質等から得られる光情報や放射線情報などを捕捉することによって、物質間相互作用の有無を検出する。
【0060】
図8は、図7とは異なる実施形態であって、本発明に係る物質間相互作用検出部1a(1b)を用いて、タンパク質間の相互作用を検出する方法を示す図である。
【0061】
物質間相互作用検出部1a(1b)の反応領域2において、予め蛍光タンパク質A2が待ち受けている。そして、サンプル液S中の蛍光タンパク質B2と相互作用する(図8中(I)参照)。
【0062】
蛍光タンパク質A2及びB2が相互作用することにより、蛍光タンパク質B2から蛍光タンパク質A2へ、蛍光エネルギーが移動し、蛍光タンパク質A2が別の波長の蛍光を示すようになる(FRET法)。この場合、蛍光タンパク質A2と蛍光タンパク質B2との相互作用と同時に、標識が行われる。即ち、本実施形態に係る物質間相互作用検出部1a(1b)は、反応領域2が同時に、標識領域3の役割も担う構成である。
【0063】
次に、蛍光タンパク質A2と蛍光タンパク質B2との複合体は、検出領域4へと移動する(図7中(III)参照)。移動方法は特に限定されず、毛細管現象、遠心力による沈降平衡原理、負圧吸引、正圧押出、又は通過制御領域を設けるなど、あらゆる方法を採用することができる。図8では、蛍光タンパク質A2と蛍光タンパク質B2とが複合体を形成したまま、検出領域4へと移動しているが、これに限定されない。例えば、蛍光色が変化した蛍光タンパク質A2のみを、検出領域4へと移動させる方法を採用することも自由である。
【0064】
そして、蛍光タンパク質A2の蛍光色から得られる光情報を捕捉することによって、物質間相互作用の有無を検出する。
【0065】
図9は、本発明に係るセンサーチップ10の一実施形態を示す上方外観視平面図である。
【0066】
図9に示すセンサーチップ10は、上方外観視、円盤状をなした形状を例示しているが、その形状は特に限定されず、自由に設計することができる。センサーチップ10には、物質間相互作用検出部1a(1b)を、反応領域2部分を中心部近傍に、検出領域4を外周方向に向かって複数設置している。
【0067】
センサーチップ10には、その中心部に中心孔101を設けている。この中心孔101は、例えば、センサーチップ10に遠心力を加える際などに、図示しない中心軸を設けるためなどに用いることができる。このとき、中心軸を中心に本発明に係るセンサーチップ10を、図9中矢印R方向へ回転させることで、物質間相互作用検出部1a(1b)に遠心力を加えることができる。遠心力により、前述のように、物質を反応領域2及び標識領域3から検出領域4へと移動させることができる。
【0068】
本発明に係るセンサーチップ10では、一度に複数の物質間相互作用検出が可能である。例えば、種々の疾病発現原因遺伝子に係わる塩基配列を有するプローブ核酸Nを、それぞれ物質間相互作用検出部1a(1b)の反応領域2へ予め投入しておき、被験者の細胞、血液などから抽出されたmRNAを含むサンプルSを投入すれば、このmRNAに対してプローブ核酸Nがハイブリダイズするか否かを判定することで、複数の疾病発症検査などを一度に行うことができる。
【0069】
本発明に係るセンサーチップ10には、回収路102を設けることもできる。回収路102は、相互作用検出を終えた物質、及びサンプルS等を、回収する役割を担う。回収路102を設けておけば、相互作用検出を終えた物質を回収し、さらに質量分析、構造解析などを行うことが可能である。
【0070】
なお、図9では、回収路102を全ての物質間相互作用検出部1a(1b)と連通しているが、この構成に限定されない。例えば、それぞれの物質間相互作用検出部1a(1b)に、各々回収路102を設けることも自由である。回収路102を連通しておけば、全ての物質、及びサンプルS等を一度に回収することができる。あるいは物質間相互作用検出部1a(1b)に各々回収路102を設ければ、それぞれの物質を分離して回収することができ、さらなる各種解析を好適に行うことができる。
【産業上の利用可能性】
【0071】
本発明に係る物質間相互作用検出部では、反応領域及び標識領域と、検出領域とを物理的に区別した構成を採用しているので、反応領域及び標識領域内において発生するノイズが、検出信号中に混在してしまうという問題を根本的に解決することができる。そのため、物質間相互作用検出の際のS/N比の向上を図り、検出精度を向上させることができる。
【0072】
また、本発明に係る物質間相互作用検出部を複数備えたセンサーチップは、検出精度向上に加え、検出時間の短縮、検出効率の改善などを図り、あらゆる分野におけるターゲット物質の検出、若しくは含有量、構成成分、又は機能等の解析などに利用することができる。
【図面の簡単な説明】
【0073】
【図1】本発明に係る物質間相互作用検出部1aの一実施形態を示す上方視平面図である。
【図2】本発明に係る物質間相互作用検出部1aの一実施形態を示す側方視平面図である。
【図3】沈降平衡原理を用いて、物質を検出領域4へ移動させる様子を示す図である。
【図4】図1、2とは異なる実施形態である物質間相互作用検出部1bを示す上方視平面図である。
【図5】本発明に係る物質間相互作用検出部1a(1b)を用いて、核酸鎖間のハイブリダイゼーションを検出する方法を示す図である。
【図6】図5とは異なる実施形態であって、本発明に係る物質間相互作用検出部1a(1b)を用いて、核酸鎖間のハイブリダイゼーションを検出する方法を示す図である。
【図7】本発明に係る物質間相互作用検出部1a(1b)を用いてタンパク質間の相互作用を検出する方法を示す図である。
【図8】図7とは異なる実施形態であって、本発明に係る物質間相互作用検出部1a(1b)を用いてタンパク質間の相互作用を検出する方法を示す図である。
【図9】本発明に係るセンサーチップ10の一実施形態を示す上方視平面図である。
【符号の説明】
【0074】
1a、1b 物質間相互作用検出部
2 反応領域
3 標識領域
4 検出領域
5 光源
6 光ディテクタ
7 通過制御領域
8 インターカレーター
9 標識物質
10 センサーチップ
101 中心孔
102 回収路
N プローブ核酸
X ターゲット核酸
A1、B1 タンパク質
A2、B2 蛍光タンパク質
【技術分野】
【0001】
本発明は、物質間の相互作用を検出する際に特に有用な技術に関する。より詳細には、反応領域から検出されるノイズ(ノイズ信号)による検出精度の低下を根本的に解決できる物質間の相互作用検出技術に関する。
【背景技術】
【0002】
近年、基板などの表面(界面)において、物質間の相互作用や反応を進行させて、これらを物理的手段や光学的手段等によって検出する技術が進展している。当該技術は、疾病診断、薬物等の化合物スクリーニング、法医学、遺伝情報の網羅的解析、生体物質の機能解析、プロテオーム解析、生体内反応の解析などの分野では、既に重要な基幹技術となりつつある。
【0003】
検出目的とされる相互作用(あるいは反応)は、例えば、核酸鎖(相補鎖)間のハイブリダイゼーション、タンパク質間の相互作用、抗原抗体反応、酵素反応、ホルモン応答反応、低分子化合物が関与する諸反応など様々である。検出技術において最も代表的な手法を例示すれば、蛍光検出技術である。
【0004】
この蛍光検出技術は、所定の反応領域で目的の相互作用を進行させた後に、当該反応領域から発せられる蛍光を捕捉して、この蛍光強度を解析する手法である。例えば、DNAチップ(DNAマイクロアレイ)は、一般に、基板上の反応領域に固定された核酸鎖と試料核酸中に存在する蛍光標識された核酸鎖とのハイブリダイゼーションを進行させ、該反応領域から不要な遊離物質を洗浄除去した後、二本鎖状態で反応領域に留まる前記ターゲット核酸鎖から発せられる蛍光強度を測定することにより、前記ハイブリダイゼーションを検出する。また、ハイブリダイゼーションに係わる核酸鎖の蛍光標識を行なうことなく、二本鎖に特異的に結合する性質を持つ蛍光インターカレーターを用いて、ハイブリダイゼーションを検出する方法も開発されている。
【0005】
しかし、この種の検出技術においては、種々の原因により、ハイブリダイゼーションとは全く無関係の蛍光(以下、ノイズ蛍光)が反応領域内で発生して、検出精度を低下させてしまうという問題を抱えている。このため、いわゆるS/N比の向上が重要な技術的課題となっている。
【0006】
この技術的課題を解決するために提案された主な従来技術として、第1には、チップ用の担体表面の材料に蛍光物質含有量の少ない材料であるポリオレフィンを用いる技術(特許文献1参照)、第2には、プローブDNAの構造を工夫し、ハイブリダイゼーションしたプローブDNAのみから蛍光が発せられるようにする技術(特許文献2参照)、第3には、消光剤を用いてノイズ蛍光を低減する技術(特許文献3)などを挙げることができる。
【特許文献1】特開2003−28867号公報。
【特許文献2】特開2003−329676号公報。
【特許文献3】特開2003−084002号公報。
【発明の開示】
【発明が解決しようとする課題】
【0007】
しかしながら、上掲したような従来技術のアプローチは、反応領域内でのノイズを極力発生させないように工夫したり(特許文献1、2)、発生したノイズを極力低減するように工夫したり(特許文献3)する技術であるため、S/N比向上をある程度達成できても、反応領域において発生するノイズ蛍光を完全に排除することはできない。即ち、従来技術ではS/N比向上に一定の限界があった。
【0008】
そこで、本発明は、ノイズによる検出精度低下の問題を根本的に解決できる物質間の相互作用検出技術を提供することを主な目的とする。
【課題を解決するための手段】
【0009】
本願発明者は、ノイズによる検出精度低下の問題を解決するための従来の発想から大きく転換し、ノイズの発生を完全に回避することが困難である反応領域において検出作業を行わないように工夫した。即ち、反応領域と検出領域を共通の領域とせず全く別の領域とし、反応領域内で相互作用が進行した物質のみを検出領域に移動させてから検出することによって、反応領域からのノイズ信号を一切検出しないようにするという新規着想の基に、以下の本発明を完成させた。
【0010】
本発明は、物質間の相互作用が進行する場を提供し得る「反応領域」と、前記第1領域に連通する領域であって、前記第1領域から移動してきた物質を標識する場を提供し得る「標識領域」と、前記標識領域に連通する領域であって、前記標識後の物質から発せられる検出信号によって物質間の相互作用情報を取得する場を提供し得る「検出領域」と、から構成された物質間相互作用検出部、並びに、該物質間相互作用検出部が設けられたセンサーチップ、特に、上方外観視、円盤状をなすセンサーチップを提供する。
【0011】
本発明においては、物質間の相互作用が進行する反応領域と検出信号を取得する検出領域が物理的に区別された構成を採用している。そのため、未反応物質等のノイズ原因が、検出領域内へ侵入することを防止できる。従って、反応領域内において発生するノイズが、検出領域内での検出信号中に混在してしまうという問題を根本的に解決することができる。
【0012】
本発明においては、少なくとも反応領域及び標識領域と、検出領域とが物理的に区別された構成であれば、その構成は特に限定されない。例えば、反応領域内において、相互作用する物質を標識してもよい。即ち、反応領域が、同時に標識領域の役割も担うように構成することも自由である。
【0013】
本発明における検出領域の形態や該検出領域への物質の移動原理等は、特に限定されない。検出領域の有力な形態例の一つは、キャピラリである。また、検出領域への物質の移動原理の有力例は、前記キャピラリにおける毛細管現象や遠心力による沈降平衡に基づいて物質の分子量に依存した濃度勾配の形成(沈降平衡原理)である。
【0014】
沈降平衡原理を採用した場合、標識領域からキャピラリへ送られてくる溶媒中に存在する物質(溶質)を、遠心力の作用によってキャピラリの先端側に向かって沈降させて、この沈降力とこれに逆らう拡散力が平衡(沈降平衡)した時点での分子量に依存した濃度勾配を形成することができる。その結果、キャピラリ内の特定位置に、相互作用状態にある物質を他の物質と分離して集積することが可能となる。なお、円盤状の基板の半径方向にキャピラリを形成しておく構成により、該基板を所定速度で回転させることで該キャピラリに遠心力を形成することができる。
【0015】
また、本発明では、反応領域と標識領域の間に、物質の通過を制御可能な領域を設けておくことによって、反応領域から標識領域への物質の移動を制御し、必要なタイミングで、物質間の相互作用を進行させる段階から後続の段階(標識段階と検出段階)へと移行できるようになる。
【0016】
例えば、親媒性原理を利用すれば、親水性の物質の通過を疎水性領域によって通常状態で遮断しておき、必要に応じて当該疎水性領域を親水性へ変換したり、圧力や遠心力等によって強制的に疎水性領域を通過させたりすることができる。
【0017】
ここで、本発明における「相互作用」は、物質間の非共有結合、共有結合、水素結合を含む化学的結合あるいは解離を広く意味し、例えば、核酸分子間のハイブリダイゼーション、タンパク質間の相互作用、抗原抗体反応などの物質間の化学的結合あるいは解離を広く含む。
【0018】
また、本発明における「標識」とは、相互作用を検出するための検出信号を発する方法を全て包含する。例えば、蛍光物質、放射性物質、又はインターカレーターなどの標識物質を物質へ吸着又は結合させる方法、また、FRETの原理のように、物質間相互作用により、その物質の蛍光色等を変化させる方法などを広く含む概念である。
【0019】
以下、本発明に係る関連技術用語について説明する。
【0020】
「ノイズ」とは、その発生原因や信号の種類を問わず、物質間の相互作用を検出に真に役立つ信号以外の信号を広く意味し、バックグラウンドノイズという概念も包含する。「S/N比」は、検出に有用な正規検出信号(S)と検出に有用でないノイズ信号(N)との比を意味し、この比の値が大きいほど、検出精度が高い。
【0021】
「核酸鎖」とは、プリンまたはピリミジン塩基と糖がグリコシド結合したヌクレオシドのリン酸エステルの重合体(ヌクレオチド鎖)を意味し、プローブDNAを含むオリゴヌクレオチド、ポリヌクレオチド、プリンヌクレオチドとピリミジンヌクレオチオドが重合したDNA(全長あるいはその断片)、逆転写により得られるcDNA(cプローブDNA)等を広く含む。天然由来のもの、人工的に合成したものも含む。
【0022】
「ハイブリダイゼーション」は、核酸鎖間の相補結合形成反応であり、DNA−DNA、DNA−RNA、RNA−RNA間の相補結合などを広く含む。なお、「ミスハイブリダイゼーション」は、ミスマッチな塩基間(不適合な塩基間)で相補結合した部位を有する状態で二本鎖を形成する反応を言う。
【0023】
「センサーチップ」は、物質間の相互作用を進行させ、これを検出(センシング)し得る基板を広く包含し、当該基板を構成する基材の材料や層構造等は特に限定されないない。いわゆるDNAチップ(DNAマイクロアレイ)と一般に称されるヌクレオチドチップ、たんぱくチップを少なくとも含む。
【発明の効果】
【0024】
本発明によれば、物質間の相互作用を検出する際のノイズを排除することができ、ひいては、検出精度を高めることができる。
【発明を実施するための最良の形態】
【0025】
以下、本発明に係る実施形態例ついて、添付図面を参照しながら説明する。
なお、添付図面に示された各実施形態は、本発明に係わる代表的な実施形態の一例を示したものであり、これにより本発明の範囲が狭く解釈されることはない。
【0026】
まず、図1、及び図2を用いて、本発明に係る物質間相互作用検出部の構成を説明する。図1は、本発明に係る物質間相互作用検出部1aの一実施形態を示す上方外観視平面図であり、図2は、本発明に係る物質間相互作用検出部1の一実施形態を示す側方外観視平面図である。
【0027】
本発明に係る物質間相互作用検出部1aは大別して、反応領域2と、標識領域3と、検出領域4と、から構成する。なお、図1中符号Sは検出の対象となるサンプル溶液等を示し、矢印Wは、サンプル溶液等の移動方向を示している。
【0028】
反応領域2は、サンプルSを投入し、物質間の相互作用が進行する場である。反応領域2において進行する物質間相互作用は、特に限定されない。一例としては、核酸分子間のハイブリダイゼーション、タンパク質間の相互作用、抗原抗体反応などの物質間の化学的結合あるいは解離が挙げられ、物質間の非共有結合、共有結合、水素結合を含む化学的結合あるいは解離などを広く包含する。
【0029】
標識領域3は、反応領域2に連通する領域であって、反応領域2から移動してきた物質を標識する場である。標識領域3における標識方法は、特に限定されない。一例としては、物質に蛍光物質又は放射性物質などの標識物質を吸着又は結合させる方法が挙げられる。また、核酸鎖間のハイブリダイゼーションを検出する場合等には、インターカレーターなどによる標識方法も採用することができる。
【0030】
ここで、インターカレーターとは、二本鎖核酸の相補鎖部位に結合して蛍光等を発する物質であって、ハイブリダイゼーション検出に用いられる物質である。例えば、POPO−1やTOTO−3、SYBR(登録商標)GreenI、PicoGreen、Hoechst33258などを挙げることができる。なお、このインターカレーターは、正規な(フルマッチな)相補鎖部分以外に、場合により、ミスマッチ二本鎖核酸の相補鎖部位、自己ループ構造部位、遊離状態又は固定化された状態の一本鎖核酸、二本鎖核酸の余剰の一本鎖部位などにも非特異的に結合又は吸着してしまい、ノイズ蛍光を発する場合がある。
【0031】
標識領域3では、物質間の相互作用を進行させると同時に、該物質を標識することもできる。即ち、標識領域3を、同時に反応領域2の役割も担う構成とすることも可能である。例えば、予め一方の物質を標識物質で標識しておけば、相互作用と同時に相互作用後の物質を標識することができる。また、FRETなどの原理を利用して、蛍光物質間の蛍光エネルギーが移動することにより、物質自体の蛍光を変化させることによって標識することも可能である。
【0032】
検出領域4は、標識領域3に連通する領域であって、前記標識後の物質から発せられる検出信号によって物質間の相互作用情報を取得する場である。本発明においては、物質間の相互作用が進行する反応領域2、及び物質を標識する標識領域3と、検出信号を取得する検出領域4とを、物理的に区別した構成を採用している。そのため、未反応物質等のノイズ原因となるものが、反応領域2及び標識領域3から、検出領域4内へ移動することを防止できる。従って、反応領域2及び標識領域3内において発生するノイズが、検出領域4内での検出信号中に混在してしまうという問題を根本的に解決することができる。その結果、S/N比の向上を図り、検出精度の高い物質間相互作用検出部1aを提供することができる。
【0033】
検出領域4で行う検出方法は、特に限定されない。一例としては、図2に示すように、検出領域4へ向けて、所定波長の蛍光励起光Qを光源5から出射して、検出領域4内で励起された蛍光Fを、光ディテクタ6で検出し、蛍光強度等を測定する方法が挙げられる。
【0034】
検出領域4は、物質間相互作用情報を取得しうる領域であれば、その形態は特に限定されない。好適な一例としては、キャピラリが挙げられる。キャピラリを用いることにより、毛細管現象の原理に基づいて、物質を検出領域4へ移動させることができる。
【0035】
検出領域4への物質の移動方法は、上記毛細管現象等に以外にもあらゆる方法を用いることができる。好適な一例としては、遠心力による沈降平衡に基づいた方法である。この方法を用いれば、物質の分子量に依存した濃度勾配を形成することができる(沈降平衡原理)。沈降平衡原理に基づく方法を、図3を用いて詳しく説明する。
【0036】
図3は、沈降平衡原理を用いて、物質を検出領域4へ移動させる様子を示す図である。図3中矢印Cの方向へ遠心力を加えると、溶媒中に存在する物質(溶質)にも沈降力が加わる。物質(溶質)は、この沈降力と逆らう拡散力が平衡した箇所に留まる。そして、分子量に依存した濃度勾配を形成する。
【0037】
この沈降平衡原理を用いれば、例えば、図3に示すように、予め相互作用後の物質の分子量から特定位置4aを求めておき、該特定位置4aから得られる光情報や放射線情報を捕捉することによって、物質間相互作用の有無を検出することができる。
【0038】
図4は、図1、2とは異なる実施形態である物質間相互作用検出部1bを示す上方外観視平面図である。
【0039】
本実施形態では、反応領域2と標識領域3の間に、物質の通過を制御可能な通過制御領域7を設けている。通過制御領域7を設けることにより、反応領域2から標識領域3への物質の移動を制御し、必要なタイミングで、物質間の相互作用を進行させる相互作用段階から標識段階へと移行することができる。
【0040】
また、図示しないが、標識領域3と検出領域4の間に、通過制御領域7を設けることも自由である。同様に、標識領域3から検出領域4への物質の移動を制御し、必要なタイミングで、標識段階から、相互作用情報を取得する検出段階へと移行することができる。
【0041】
通過制御領域7で行う制御方法は、特に限定されない。一例を挙げると、親媒性原理を利用することができる。具体的には、通過制御領域7を疎水性領域とし、親水性の物質の通過を遮断する。そして、必要に応じて当該疎水性領域を親水性へ変換して親水性の物質を通過させたり、圧力や遠心力等によって親水性の物質を強制的に通過させたりすることができる。
【0042】
疎水性領域の形成方法は特に限定されない。好適な一例としては、疎水性領域を酸化チタンで形成する方法が挙げられる。酸化チタンは、通常は疎水性であるが、紫外線を照射することにより親水性へと変化する物質である。そのため、通過制御領域7を酸化チタンで形成すれば、通常は親水性の物質の通過を遮断することができ、必要に応じて紫外線を照射し、その性質を親水性へと変換させることにより、親水性の物質を通過させることができる。
【0043】
次に、図5から図8を用いて、本発明に係る物質間相互作用検出部1a(1b)を用いて検出し得る物質間相互作用の例を説明する。
【0044】
図5は、本発明に係る物質間相互作用検出部1a(1b)を用いて、核酸鎖間のハイブリダイゼーションを検出する方法を示す模式図である。
【0045】
物質間相互作用検出部1a(1b)の反応領域2において、予めプローブ核酸Nが待ち受けている。プローブ核酸Nは、サンプル液S中の相補的なターゲット核酸Xとハイブリダイゼーションする(図5中(I)参照)。
【0046】
そして、プローブ核酸Nとターゲット核酸Xは二本鎖を形成したまま、標識領域3へ移動する。移動方法は、特に限定されず、毛細管現象、遠心力による沈降平衡原理、負圧吸引、正圧押出、又は通過制御領域を設けるなど、あらゆる方法を採用することができる。
【0047】
標識領域3において、二本鎖を形成するプローブ核酸Nとターゲット核酸Xに対して、標識が行われる(図5中(II)参照)。図5では、インターカレーター8が、二本鎖核酸の相補鎖部位に結合することにより蛍光等を発する標識方法を例示しているが、標識方法は特に限定されない。物質間の相互作用情報を検出し得る方法であれば、あらゆる標識方法を用いることができる。
【0048】
次に、標識された二本鎖は、検出領域4へと移動する。移動方法は特に限定されず、毛細管現象、遠心力による沈降平衡原理、負圧吸引、正圧押出、又は通過制御領域を設けるなど、あらゆる方法を採用することができる。
【0049】
本発明では、反応領域2及び標識領域3と、検出領域4とを物理的に区別した構成を採用しているので、反応領域2、及び標識領域4内において発生するノイズが検出信号中に混在してしまうという問題を根本的に解決することができる。例えば、サンプルS中の核酸鎖であって、プローブ核酸Nと相補結合を形成しない核酸は、標識領域3や検出領域4へ移動しないため、該核酸鎖から生じるノイズを根本的に排除することができる。また、二本鎖核酸の相補鎖部位に結合せず、ミスマッチ二本鎖核酸の相補鎖部位、自己ループ構造部位、遊離状態又は固定化された状態の一本鎖核酸、又は二本鎖核酸の余剰の一本鎖部位などに非特異的に結合又は吸着したインターカレーター8も、検出領域4へは移動しないため、正規結合していないインターカレーター8から生じるノイズも根本的に排除することができる。
【0050】
検出領域4中の所定の箇所で、図示しないが、標識物質等から得られる光情報や放射線情報などを捕捉することによって、物質間相互作用の有無を検出する。
【0051】
図6は、図5とは異なる実施形態であって、本発明に係る物質間相互作用検出部1a(1b)を用いて、核酸鎖間のハイブリダイゼーションを検出する方法を示す図である。
【0052】
物質間相互作用検出部1a(1b)の反応領域2において、プローブ核酸Nが待ち受けている。該プローブ核酸Nには、予め標識物質9が結合している。プローブ核酸Nは、サンプルS中の相補的なターゲット核酸Xとハイブリダイゼーションする(図6中(I)参照)。
【0053】
この時、プローブ核酸Nには、予め標識物質9が結合しているため、ハイブリダイゼーションと同時に、形成された二本鎖への標識が行われる。即ち、本実施形態に係る物質間相互作用検出部1a(1b)では、反応領域2が同時に標識領域3の役割も担う構成となっている。図6では、プローブ核酸Nに対して、予め標識物質9を結合させているが、この方法に限定されず、逆にターゲット核酸X側へ予め標識物質9を結合させておくことも自由である。
【0054】
相互作用、及び標識が行われた二本鎖は、検出領域へと移動する(図6中(II)参照)。そして、標識物質等から得られる光情報や放射線情報などを捕捉することによって、物質間相互作用の有無を検出する。
【0055】
図7は、本発明に係る物質間相互作用検出部1a(1b)を用いてタンパク質間の相互作用を検出する方法を示す図である。
【0056】
物質間相互作用検出部1a(1b)の反応領域2において、予めタンパク質A1が待ち受けている。タンパク質A1は、サンプルS中のタンパク質B1と相互作用する(図7中(I)参照)。図7では、相互作用の一例として、タンパク質A1とタンパク質B1とが複合体を形成する様子を挙げているが、相互作用の形態は特に限定されない。例えば、タンパク質B1がタンパク質A1に何らかの作用をすることにより、タンパク質A1の性質を変化させるような相互作用であってもよい。
【0057】
タンパク質A1とタンパク質B1の複合体は相互作用後、標識領域3へ移動する。移動方法は、特に限定されず、毛細管現象、遠心力による沈降平衡原理、負圧吸引、正圧押出、又は通過制御領域を設けるなど、あらゆる方法を採用することができる。
【0058】
標識領域3において、タンパク質A1とタンパク質B1の複合体に対して、標識が行われる(図7中(II)参照)。図7では、標識物質9が、前記タンパク質複合体に結合することにより蛍光等を発する標識方法を例示しているが、標識方法は特に限定されない。物質間の相互作用情報を検出し得る方法であれば、あらゆる標識方法を用いることができる。
【0059】
次に、標識された前記タンパク質複合体は、検出領域4へと移動する(図7中(III)参照)。移動方法は特に限定されず、毛細管現象、遠心力による沈降平衡原理、負圧吸引、正圧押出、又は通過制御領域を設けるなど、あらゆる方法を採用することができる。そして、標識物質等から得られる光情報や放射線情報などを捕捉することによって、物質間相互作用の有無を検出する。
【0060】
図8は、図7とは異なる実施形態であって、本発明に係る物質間相互作用検出部1a(1b)を用いて、タンパク質間の相互作用を検出する方法を示す図である。
【0061】
物質間相互作用検出部1a(1b)の反応領域2において、予め蛍光タンパク質A2が待ち受けている。そして、サンプル液S中の蛍光タンパク質B2と相互作用する(図8中(I)参照)。
【0062】
蛍光タンパク質A2及びB2が相互作用することにより、蛍光タンパク質B2から蛍光タンパク質A2へ、蛍光エネルギーが移動し、蛍光タンパク質A2が別の波長の蛍光を示すようになる(FRET法)。この場合、蛍光タンパク質A2と蛍光タンパク質B2との相互作用と同時に、標識が行われる。即ち、本実施形態に係る物質間相互作用検出部1a(1b)は、反応領域2が同時に、標識領域3の役割も担う構成である。
【0063】
次に、蛍光タンパク質A2と蛍光タンパク質B2との複合体は、検出領域4へと移動する(図7中(III)参照)。移動方法は特に限定されず、毛細管現象、遠心力による沈降平衡原理、負圧吸引、正圧押出、又は通過制御領域を設けるなど、あらゆる方法を採用することができる。図8では、蛍光タンパク質A2と蛍光タンパク質B2とが複合体を形成したまま、検出領域4へと移動しているが、これに限定されない。例えば、蛍光色が変化した蛍光タンパク質A2のみを、検出領域4へと移動させる方法を採用することも自由である。
【0064】
そして、蛍光タンパク質A2の蛍光色から得られる光情報を捕捉することによって、物質間相互作用の有無を検出する。
【0065】
図9は、本発明に係るセンサーチップ10の一実施形態を示す上方外観視平面図である。
【0066】
図9に示すセンサーチップ10は、上方外観視、円盤状をなした形状を例示しているが、その形状は特に限定されず、自由に設計することができる。センサーチップ10には、物質間相互作用検出部1a(1b)を、反応領域2部分を中心部近傍に、検出領域4を外周方向に向かって複数設置している。
【0067】
センサーチップ10には、その中心部に中心孔101を設けている。この中心孔101は、例えば、センサーチップ10に遠心力を加える際などに、図示しない中心軸を設けるためなどに用いることができる。このとき、中心軸を中心に本発明に係るセンサーチップ10を、図9中矢印R方向へ回転させることで、物質間相互作用検出部1a(1b)に遠心力を加えることができる。遠心力により、前述のように、物質を反応領域2及び標識領域3から検出領域4へと移動させることができる。
【0068】
本発明に係るセンサーチップ10では、一度に複数の物質間相互作用検出が可能である。例えば、種々の疾病発現原因遺伝子に係わる塩基配列を有するプローブ核酸Nを、それぞれ物質間相互作用検出部1a(1b)の反応領域2へ予め投入しておき、被験者の細胞、血液などから抽出されたmRNAを含むサンプルSを投入すれば、このmRNAに対してプローブ核酸Nがハイブリダイズするか否かを判定することで、複数の疾病発症検査などを一度に行うことができる。
【0069】
本発明に係るセンサーチップ10には、回収路102を設けることもできる。回収路102は、相互作用検出を終えた物質、及びサンプルS等を、回収する役割を担う。回収路102を設けておけば、相互作用検出を終えた物質を回収し、さらに質量分析、構造解析などを行うことが可能である。
【0070】
なお、図9では、回収路102を全ての物質間相互作用検出部1a(1b)と連通しているが、この構成に限定されない。例えば、それぞれの物質間相互作用検出部1a(1b)に、各々回収路102を設けることも自由である。回収路102を連通しておけば、全ての物質、及びサンプルS等を一度に回収することができる。あるいは物質間相互作用検出部1a(1b)に各々回収路102を設ければ、それぞれの物質を分離して回収することができ、さらなる各種解析を好適に行うことができる。
【産業上の利用可能性】
【0071】
本発明に係る物質間相互作用検出部では、反応領域及び標識領域と、検出領域とを物理的に区別した構成を採用しているので、反応領域及び標識領域内において発生するノイズが、検出信号中に混在してしまうという問題を根本的に解決することができる。そのため、物質間相互作用検出の際のS/N比の向上を図り、検出精度を向上させることができる。
【0072】
また、本発明に係る物質間相互作用検出部を複数備えたセンサーチップは、検出精度向上に加え、検出時間の短縮、検出効率の改善などを図り、あらゆる分野におけるターゲット物質の検出、若しくは含有量、構成成分、又は機能等の解析などに利用することができる。
【図面の簡単な説明】
【0073】
【図1】本発明に係る物質間相互作用検出部1aの一実施形態を示す上方視平面図である。
【図2】本発明に係る物質間相互作用検出部1aの一実施形態を示す側方視平面図である。
【図3】沈降平衡原理を用いて、物質を検出領域4へ移動させる様子を示す図である。
【図4】図1、2とは異なる実施形態である物質間相互作用検出部1bを示す上方視平面図である。
【図5】本発明に係る物質間相互作用検出部1a(1b)を用いて、核酸鎖間のハイブリダイゼーションを検出する方法を示す図である。
【図6】図5とは異なる実施形態であって、本発明に係る物質間相互作用検出部1a(1b)を用いて、核酸鎖間のハイブリダイゼーションを検出する方法を示す図である。
【図7】本発明に係る物質間相互作用検出部1a(1b)を用いてタンパク質間の相互作用を検出する方法を示す図である。
【図8】図7とは異なる実施形態であって、本発明に係る物質間相互作用検出部1a(1b)を用いてタンパク質間の相互作用を検出する方法を示す図である。
【図9】本発明に係るセンサーチップ10の一実施形態を示す上方視平面図である。
【符号の説明】
【0074】
1a、1b 物質間相互作用検出部
2 反応領域
3 標識領域
4 検出領域
5 光源
6 光ディテクタ
7 通過制御領域
8 インターカレーター
9 標識物質
10 センサーチップ
101 中心孔
102 回収路
N プローブ核酸
X ターゲット核酸
A1、B1 タンパク質
A2、B2 蛍光タンパク質
【特許請求の範囲】
【請求項1】
物質間の相互作用が進行する場を提供し得る反応領域と、
前記反応領域に連通する領域であって、前記反応領域から移動してきた物質を標識する場を提供し得る標識領域と、
前記標識領域に連通する領域であって、前記標識後の物質から発せられる検出信号によって物質間の相互作用情報を取得する場を提供し得る検出領域と、
から構成された物質間相互作用検出部。
【請求項2】
前記反応領域が、同時に前記標識領域であることを特徴とする請求項1記載の物質間相互作用検出部。
【請求項3】
前記検出領域は、キャピラリであることを特徴とする請求項1記載の物質間相互作用検出部。
【請求項4】
前記キャピラリは、遠心力による沈降平衡に基づいて物質の濃度勾配を形成できることを特徴とする請求項3記載の物質間相互作用検出部。
【請求項5】
前記反応領域と前記標識領域の間に、物質の通過を制御可能な領域を設けたことを特徴とする請求項1記載の物質間相互作用検出部。
【請求項6】
物質の通過を制御可能な領域は、疎水性領域であることを特徴とする請求項5記載の物質間相互作用検出部。
【請求項7】
前記相互作用は、核酸鎖間のハイブリダイゼーションであることを特徴とする請求項1記載の物質間相互作用検出部。
【請求項8】
前記相互作用は、タンパク質間の相互作用であることを特徴とする請求項1記載の物質間相互作用検出部。
【請求項9】
請求項1記載の物質間相互作用検出部が形成されたことを特徴とするセンサーチップ。
【請求項10】
上方外観視、円盤状をなすことを特徴とする請求項9記載のセンサーチップ。
【請求項1】
物質間の相互作用が進行する場を提供し得る反応領域と、
前記反応領域に連通する領域であって、前記反応領域から移動してきた物質を標識する場を提供し得る標識領域と、
前記標識領域に連通する領域であって、前記標識後の物質から発せられる検出信号によって物質間の相互作用情報を取得する場を提供し得る検出領域と、
から構成された物質間相互作用検出部。
【請求項2】
前記反応領域が、同時に前記標識領域であることを特徴とする請求項1記載の物質間相互作用検出部。
【請求項3】
前記検出領域は、キャピラリであることを特徴とする請求項1記載の物質間相互作用検出部。
【請求項4】
前記キャピラリは、遠心力による沈降平衡に基づいて物質の濃度勾配を形成できることを特徴とする請求項3記載の物質間相互作用検出部。
【請求項5】
前記反応領域と前記標識領域の間に、物質の通過を制御可能な領域を設けたことを特徴とする請求項1記載の物質間相互作用検出部。
【請求項6】
物質の通過を制御可能な領域は、疎水性領域であることを特徴とする請求項5記載の物質間相互作用検出部。
【請求項7】
前記相互作用は、核酸鎖間のハイブリダイゼーションであることを特徴とする請求項1記載の物質間相互作用検出部。
【請求項8】
前記相互作用は、タンパク質間の相互作用であることを特徴とする請求項1記載の物質間相互作用検出部。
【請求項9】
請求項1記載の物質間相互作用検出部が形成されたことを特徴とするセンサーチップ。
【請求項10】
上方外観視、円盤状をなすことを特徴とする請求項9記載のセンサーチップ。
【図1】


【図2】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図3】




【図2】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図3】


【公開番号】特開2008−107227(P2008−107227A)
【公開日】平成20年5月8日(2008.5.8)
【国際特許分類】
【出願番号】特願2006−291036(P2006−291036)
【出願日】平成18年10月26日(2006.10.26)
【出願人】(000002185)ソニー株式会社 (34,172)
【Fターム(参考)】
【公開日】平成20年5月8日(2008.5.8)
【国際特許分類】
【出願日】平成18年10月26日(2006.10.26)
【出願人】(000002185)ソニー株式会社 (34,172)
【Fターム(参考)】
[ Back to top ]

