特定の構造の複素環化合物を含む抗鬱剤、脳保護剤、アミロイドβ沈着抑制剤または老化抑制剤
【課題】優れた治療効果を有する抗鬱剤、脳保護剤、アミロイドβ沈着抑制剤または老化抑制剤を提供する。
【解決手段】下記一般式(I)で示す複素環化合物を含む抗鬱剤、脳保護剤、アミロイドβ沈着抑制剤または老化抑制剤。

【解決手段】下記一般式(I)で示す複素環化合物を含む抗鬱剤、脳保護剤、アミロイドβ沈着抑制剤または老化抑制剤。

【発明の詳細な説明】
【技術分野】
【0001】
本発明は、特定の構造の複素環化合物を含む抗鬱剤、脳保護剤、アミロイドβ沈着抑制剤または老化抑制剤に関する。
【背景技術】
【0002】
現在、うつ病やパニック障害に対する薬物治療の選択肢としては、1991年にマレイン酸フルボキサミン、2000年に塩酸パロキセチンが、選択的セロトニン再取り込み阻害剤(SSRI)として加わり、国内外においては急性期治療のみならず、維持治療においてもSSRIがうつ病やパニック障害の治療の第一選択薬となっている。しかしながら、SSRIには、慢性投与でしか薬効が発現しないことや、有害事象による投薬中止や退薬症状や認知機能に対する影響など副作用の課題が存在し、速効性があり副作用の少ない有効な薬剤の開発が強く望まれている。
【0003】
さらに、老化の原因として酸化的ストレスが挙げられ、抗酸化作用を持つものが抗老化作用を持つものとして報告されている。例えば、抗老化に効果があるのは、抗酸化物質を含むウーロン茶であるとされている(非特許文献1)。また、生存率を増加させる物質としてdeprenylが報告されており、モノアミンオキシデースB阻害剤としてパーキンソン病治療薬として用いられているが、抗酸化作用によるものと確認されている(非特許文献2)。しかしながら、これらの抗酸化物質による抗老化作用、生存率の増加は、満足のいく水準ではない。
【0004】
また、脳保護剤として、抗酸化作用を持つフリーラジカルスカベンジャーであるエダラボンが用いられているが、効果はそれ程強くなく、腎機能障害等の各種副作用が報告されている(非特許文献3)。
【0005】
また、カレーに多く含まれるウコン(Curcuma longa)の成分であり、処方薬の非ステロイド性抗炎症剤(NSAID)に匹敵する抗炎症作用や抗酸化作用などを持つcurcuminがアミロイド病理を抑制することが様々な研究でわかってきている(非特許文献4)。しかしながら、curcuminによるβアミロイド沈着抑制効果は、満足のいく水準ではない。
【0006】
なお、特許文献1および特許文献2において、特定の構造の複素環化合物を含む脳機能改善剤が開示されている。しかしながら、この複素環化合物は、老人性痴呆、アルツハイマー病等における記憶障害治療、記憶獲得・保持障害治療等につながる脳機能改善剤として開示されており、抗鬱剤、脳保護剤、アミロイドβ沈着抑制剤および老化抑制剤などとしての他の作用効果は開示されていない。
【0007】
【特許文献1】国際公開第01/009131号パンフレット
【特許文献2】国際公開第2002/060907号パンフレット
【非特許文献1】Biol Pharm Bull Vol 26 No 5 739-742 2003
【非特許文献2】Mech Ageing Dev Vol 46 No 1-3 237-262 1988
【非特許文献3】独立行政法人 医薬品医療機器総合機構「医薬品医療機器情報提供ホームページ」、医薬品・医療用具等安全性情報、No.198、重要な副作用等に関する情報、エダラボン(http://www.info.pmda.go.jp/iyaku_anzen/PMDSI198d.html#chapter1)
【非特許文献4】ファルマシア、日本薬学会、Vol.38、No.9、891−892、2002
【発明の開示】
【発明が解決しようとする課題】
【0008】
本発明は上記事情に鑑みてなされたものであり、優れた治療効果を有する抗鬱剤、脳保護剤、アミロイドβ沈着抑制剤または老化抑制剤を提供することを目的とする。
【課題を解決するための手段】
【0009】
本発明によれば、下記一般式(I)で示す複素環化合物を含む抗鬱剤、脳保護剤、アミロイドβ沈着抑制剤または老化抑制剤が提供される。
【0010】
【化21】

【0011】
ここで、上記一般式(I)中、下記一般式(II)で示される構造単位は、下記一般式(III)で示す複数種の構造単位から選ばれる1種以上の構造単位である。
【0012】
【化22】

【0013】
【化23】

【0014】
また、上記一般式(I)において、R1、R2は、それぞれ独立に、水素原子、ハロゲン原子、ヒドロキシ基、アミノ基、アセチルアミノ基、ベンジルアミノ基、トリフルオロメチル基、C1−C6アルキル基、C1−C6アルコキシ基または−O−(CH2)n−R5(R5はビニル基、C3−C6シクロアルキル基、フェニル基、nは0または1)からなる群から選ばれる1種以上の官能基を示す。
【0015】
さらに、上記一般式(I)において、R3、R4は、それぞれ独立に、水素原子、C1−C6アルキル基、C3−C8シクロアルキル基、−CH(R7)−R6からなる群から選ばれる1種以上の官能基を示すか、あるいはR3とR4とが結合して下記一般式(IV)に示すスピロ環を形成してもよい。
【0016】
【化24】

【0017】
ここで、上記R6は、ビニル基、エチニル基、フェニル(C1−C6アルキル基、C1−C6アルコキシ基、ヒドロキシ基、1〜2個のハロゲン原子、ジC1−C6アルキルアミノ基、シアノ基、ニトロ基、カルボキシ基、フェニル基で置換されていてもよい)フェネチル基、ピリジル基、チエニル基、フリル基からなる群から選ばれる1種以上の官能基を示す。また、上記R7は、水素原子またはC1−C6アルキル基を示す。
【0018】
さらに、上記一般式(IV)中、構造単位Bは、下記一般式(V)で示す複数種の構造単位から選ばれる1種以上の構造単位である。なお、構造単位Bは、一般式(V)中において、記号*で示した位置で結合してスピロ環を形成する。
【0019】
【化25】

【0020】
そして、上記R8は、水素原子、ハロゲン原子、ヒドロキシ基、C1−C6アルコキシ基、シアノ基、トリフルオロメチル基からなる群から選ばれる1種以上の官能基を示す。
【0021】
上記の特定の構造の複素環化合物を含む抗鬱剤、脳保護剤、アミロイドβ沈着抑制剤または老化抑制剤によれば、それぞれ優れた抗鬱効果、脳保護効果、アミロイドβ沈着抑制効果または老化抑制効果が奏される。
【発明の効果】
【0022】
本発明によれば、特定の構造の複素環化合物を含むため、優れた抗鬱効果、脳保護効果、アミロイドβ沈着抑制効果または老化抑制効果が奏される。
【発明を実施するための最良の形態】
【0023】
以下、本発明の実施の形態について説明する。なお、下記の実施形態は、上記の特定の構造の複素環化合物(アザインドリジン誘導体)並びに医薬として許容される担体または希釈剤を含む、抗鬱剤、脳保護剤、アミロイドβ沈着抑制剤または老化抑制剤に関する。
【0024】
<複素環化合物の構造>
後述する各実施形態に係る抗鬱剤、脳保護剤、アミロイドβ沈着抑制剤または老化抑制剤は、いずれも下記一般式(I)で示す複素環化合物を含む。
【0025】
【化26】

【0026】
ここで、上記一般式(I)中、下記一般式(II)で示される構造単位は、下記一般式(III)で示す複数種の構造単位から選ばれる1種以上の構造単位である。
【0027】
【化27】

【0028】
【化28】

【0029】
また、上記一般式(I)において、R1、R2は、それぞれ独立に、水素原子、ハロゲン原子、ヒドロキシ基、アミノ基、アセチルアミノ基、ベンジルアミノ基、トリフルオロメチル基、C1−C6アルキル基、C1−C6アルコキシ基または−O−(CH2)n−R5(R5はビニル基、C3−C6シクロアルキル基、フェニル基、nは0または1)からなる群から選ばれる1種以上の官能基を示す。
【0030】
さらに、上記一般式(I)において、R3、R4は、それぞれ独立に、水素原子、C1−C6アルキル基、C3−C8シクロアルキル基、−CH(R7)−R6からなる群から選ばれる1種以上の官能基を示すか、あるいはR3とR4とが結合して下記一般式(IV)に示すスピロ環を形成してもよい。
【0031】
【化29】

【0032】
ここで、上記R6は、ビニル基、エチニル基、フェニル(C1−C6アルキル基、C1−C6アルコキシ基、ヒドロキシ基、1〜2個のハロゲン原子、ジC1−C6アルキルアミノ基、シアノ基、ニトロ基、カルボキシ基、フェニル基で置換されていてもよい)フェネチル基、ピリジル基、チエニル基、フリル基からなる群から選ばれる1種以上の官能基を示す。また、上記R7は、水素原子またはC1−C6アルキル基を示す。
【0033】
さらに、上記一般式(IV)中、構造単位Bは、下記一般式(V)で示す複数種の構造単位から選ばれる1種以上の構造単位である。なお、構造単位Bは、一般式(V)中において、記号*で示した位置で結合してスピロ環を形成する。
【0034】
【化30】

【0035】
そして、上記R8は、水素原子、ハロゲン原子、ヒドロキシ基、C1−C6アルコキシ基、シアノ基、トリフルオロメチル基からなる群から選ばれる1種以上の官能基を示す。
【0036】
なお、上記の一般式(I)で示される複素環化合物は、その構造中に不斉炭素原子を有する場合、不斉炭素原子由来の異性体及びそれらの混合物(ラセミ体)が存在するが、それらはいずれも、後述する各実施形態で用いる複素環化合物に含むものとする。
【0037】
<用語の定義>
上記の複素環化合物は、一般式(I)で示されるが、この式中の各記号の定義に使用する語句の意味と例を以下に説明する。
【0038】
「C1−C6」とは、限定がなければ炭素数1〜6個を有する基を意味する。「C3−C8」とは、限定がなければ炭素数3〜8個を有する基を意味する。「C1−C6アルキル」としてはメチル、エチル、n−プロピル、イソプロピル、n−ブチル、tert−ブチル、sec−ブチル、n−ペンチル、n−ヘキシル等の直鎖又は分枝鎖状のアルキル基が挙げられる。「C1−C6アルコキシ」としては、メトキシ、エトキシ、n−プロポキシ、イソプロポキシ、n−ブトキシ、tert−ブトキシ、sec−ブトキシ、n−ペンチルオキシ、n−ヘキシルオキシ等の直鎖又は分枝鎖状のアルコキシ基が挙げられる。「C3−C8シクロアルキル」としては、シクロプロピル、シクロブチル、シクロペンチル、シクロヘキシル、シクロヘプチル、シクロオクチルが挙げられる。「ハロゲン原子」としては、フッ素、塩素、臭素、ヨウ素が挙げられる。
【0039】
<複素環化合物の例>
後述する各実施形態に係る抗鬱剤、脳保護剤、アミロイドβ沈着抑制剤または老化抑制剤に含まれる複素環化合物としては、上記の特定の構造を有していればよく、特に限定するものではないが、例えば、下記に列挙する化合物を用いることができる。
【0040】
3,3−ジメチルイミダゾ[1,2−a]ピリジン−2(3H)−オン、3,3−ジプロピルイミダゾ[1,2−a]ピリジン−2(3H)−オン、3,3−ジブチルイミダゾ[1,2−a]ピリジン−2(3H)−オン、3,3−ジアリルイミダゾ[1,2−a]ピリジン−2(3H)−オン、3,3−ジアリル−8−ベンジルオキシイミダゾ[1,2−a]ピリジン−2(3H)−オン、3,3−ジ(2−プロピニル)イミダゾ[1,2−a]ピリジン−2(3H)−オン、3,3−ジベンジルイミダゾ[1,2−a]ピリジン−2(3H)−オン、3,3−ジベンジル−8−メチルイミダゾ[1,2−a]ピリジン−2(3H)−オン、3,3−ジベンジル−5,7−ジメチルイミダゾ[1,2−a]ピリジン−2(3H)−オン、3,3−ジベンジル−8−ヒドロキシイミダゾ[1,2−a]ピリジン−2(3H)−オン、3,3−ジベンジル−8−メトキシイミダゾ[1,2−a]ピリジン−2(3H)−オン、3,3−ジベンジル−8−エトキシイミダゾ[1,2−a]ピリジン−2(3H)−オン、8−アリルオキシ−3,3−ジベンジルイミダゾ[1,2−a]ピリジン−2(3H)−オン、3,3−ジベンジル−8−イソプロポキシイミダゾ[1,2−a]ピリジン−2(3H)−オン、3,3−ジベンジル−8−シクロプロピルメチルオキシイミダゾ[1,2−a]ピリジン−2(3H)−オン、3,3−ジベンジル−8−シクロヘプチルオキシイミダゾ[1,2−a]ピリジン−2(3H)−オン、3,3−ジベンジル−6−クロロイミダゾ[1,2−a]ピリジン−2(3H)−オン、3,3−ジベンジル−6,8−ジクロロイミダゾ[1,2−a]ピリジン−2(3H)−オン、3,3−ジベンジル−8−クロロ−6−トリフルオロメチルイミダゾ[1,2−a]ピリジン−2(3H)−オン、3,3−ジベンジル−8−ベンジルオキシイミダゾ[1,2−a]ピリジン−2(3H)−オン、8−アミノ−3,3−ジベンジルイミダゾ[1,2−a]ピリジン−2(3H)−オン、8−アセチルアミノ−3,3−ジベンジルイミダゾ[1,2−a]ピリジン−2(3H)−オン、3,3−ジベンジル−8−ベンジルアミノイミダゾ[1,2−a]ピリジン−2(3H)−オン、3,3−ビス(3−クロロベンジル)イミダゾ[1,2−a]ピリジン−2(3H)−オン、3,3−ビス(3−フルオロベンジル)イミダゾ[1,2−a]ピリジン−2(3H)−オン、3,3−ビス(4−フルオロベンジル)イミダゾ[1,2−a]ピリジン−2(3H)−オン、3,3−ビス(2,4−ジクロロベンジル)イミダゾ[1,2−a]ピリジン−2(3H)−オン、3,3−ビス(4−ジメチルアミノベンジル)イミダゾ[1,2−a]ピリジン−2(3H)−オン、3,3−ビス(4−メトキシベンジル)イミダゾ[1,2−a]ピリジン−2(3H)−オン、3,3−ビス(4−ビフェニルメチル)イミダゾ[1,2−a]ピリジン−2(3H)−オン、3,3−ビス(4−シアノベンジル)イミダゾ[1,2−a]ピリジン−2(3H)−オン、3,3−ビス(4−ヒドロキシベンジル)イミダゾ[1,2−a]ピリジン−2(3H)−オン、3,3−ビス(3−フェニル−1−プロピル)イミダゾ[1,2−a]ピリジン−2(3H)−オン、3,3−ビス(2,4−ジフルオロベンジル)イミダゾ[1,2−a]ピリジン−2(3H)−オン、3,3−ビス(4−ニトロベンジル)イミダゾ[1,2−a]ピリジン−2(3H)−オン、3,3−ビス(4−カルボキシベンジル)イミダゾ[1,2−a]ピリジン−2(3H)−オン、8−ベンジルオキシ−3,3−ビス(1−フェニルエチル)イミダゾ[1,2−a]ピリジン−2(3H)−オン、8−ベンジルオキシ−3,3−ビス(3−メチルベンジル)イミダゾ[1,2−a]ピリジン−2(3H)−オン、8−ベンジルオキシ−3,3−ビス(4−メチルベンジル)イミダゾ[1,2−a]ピリジン−2(3H)−オン、3−ベンジル−3−(4−フルオロベンジル)イミダゾ[1,2−a]ピリジン−2(3H)−オン、3−エチル−3(4−フルオロベンジル)イミダゾ[1,2−a]ピリジン−2(3H)−オン、8−メチル−3,3−ビス(3−ピリジルメチル)イミダゾ[1,2−a]ピリジン−2(3H)−オン、8−メチル−3,3−ビス(4−ピリジルメチル)イミダゾ[1,2−a]ピリジン−2(3H)−オン、3,3−ビス(2−チエニルメチル)イミダゾ[1,2−a]ピリジン−2(3H)−オン、3,3−ビス(2−フリルメチル)イミダゾ[1,2−a]ピリジン−2(3H)−オン、スピロ[イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−インダン]、スピロ[イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−[2,3]ジヒドロフェナレン]
【0041】
スピロ[イミダゾ[2,1−b]チアゾール−6(5H)−オン−5,2’−ベンゾ[f]インダン]、スピロ[イミダゾ[1,2−b]チアゾール−6(5H)−オン−5,2’−インダン]、スピロ[2−メチルイミダゾ[1,2−b]チアゾール−6(5H)−オン−5,2’−ベンゾ[f]インダン]、5,5−ビス(4−フルオロベンジル)イミダゾ[2,1−b]チアゾール−6(5H)−オン、5,5−ジベンジルイミダゾ[2,1−b]チアゾール−6(5H)−オン、5,5−ビス(4−メチルベンジル)イミダゾ[2,1−b]チアゾール−6(5H)−オン、5,5−ビス(4−シアノベンジル)イミダゾ[2,1−b]チアゾール−6(5H)−オン、5,5−ジベンジル−2−メチルイミダゾ[2,1−b]チアゾール−6(5H)−オン、5,5−ビス(4−フルオロベンジル)−2−メチルイミダゾ[2,1−b]チアゾール−6(5H)−オン、5,5−ジシクロヘキシル−2−メチルイミダゾ[2,1−b]チアゾール−6(5H)−オン、5,5−ビス(4−シアノベンジル)−2−メチルイミダゾ[2,1−b]チアゾール−6(5H)−オン、5,5−ジ(2−ブテニル)イミダゾ[2,1−b]チアゾール−6(5H)−オン、5,5−ジブチルイミダゾ[2,1−b]チアゾール−6(5H)−オン、5,5−ジシクロヘキシルイミダゾ[2,1−b]チアゾール−6(5H)−オン、5,5−ビス(2−チエニルメチル)イミダゾ[2,1−b]チアゾール−6(5H)−オン、スピロ[2,3−ジヒドロイミダゾ[2,1−b]チアゾール−6(5H)−オン−5,2’−ベンゾ[f]インダン]、5,5−ジブチル−2,3−ジヒドロイミダゾ[2,1−b]チアゾール−6(5H)−オン、5,5−ジ(2−ブテニル)−2,3−ジヒドロイミダゾ[2,1−b]チアゾール−6(5H)−オン、5,5−ビス(4−メチルベンジル)−2,3−ジヒドロイミダゾ[2,1−b]チアゾール−6(5H)−オン、5,5−ビス(2−チエニルメチル)−2,3−ジヒドロイミダゾ[2,1−b]チアゾール−6(5H)−オン、5,5−ビス(4−フルオロベンジル)−2,3−ジヒドロイミダゾ[2,1−b]チアゾール−6(5H)−オン、5,5−ジベンジル−2,3−ジヒドロイミダゾ[2,1−b]チアゾール−6(5H)−オン、スピロ[イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−ベンゾ[f]インダン]、2−ヒドロキシ−3−(2−ナフチルメチル)−イミダゾ[1,2−a]ピリジン、3−ベンジルイミダゾ[1,2−a]ピリジン−2(3H)−オン、スピロ[5,6,7,8−テトラヒドロイミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−ベンゾ[f]インダン]、3,3−ジシクロヘキシル−5,6,7,8−テトラヒドロイミダゾ[1,2−a]ピリジン−2(3H)−オン、3,3−ビス(2−チエニルメチル)−5,6,7,8−テトラヒドロイミダゾ[1,2−a]ピリジン−2(3H)−オン、3,3−ジブチル−5,6,7,8−テトラヒドロイミダゾ[1,2−a]ピリジン−2(3H)−オン、3,3−ジプロピル−5,6,7,8−テトラヒドロイミダゾ[1,2−a]ピリジン−2(3H)−オン、スピロ[イミダゾ[1,2−a]ピリミジン−2(3H)−オン−3,2’−ベンゾ[f]インダン]、3,3−ジ(2−ブテニル)イミダゾ[1,2−a]ピリミジン−2(3H)−オン、3,3−ビス(2−チエニルメチル)イミダゾ[1,2−a]ピリミジン−2(3H)−オン、3,3−ビス(4−フルオロベンジル)イミダゾ[1,2−a]ピリミジン−2(3H)−オン、3,3−ジシクロヘキシルイミダゾ[1,2−a]ピリミジン−2(3H)−オン、3,3−ビス(4−シアノベンジル)イミダゾ[1,2−a]ピリミジン−2(3H)−オン、3,3−ビス(4−メチルベンジル)イミダゾ[1,2−a]ピリミジン−2(3H)−オン、4,4−ジベンジル−1−メチル−5−オキソ−4,5−ジヒドロイミダゾール、スピロ[イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−(4’−フルオロインダン)]、スピロ[イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−(5’−メトキシインダン)]、スピロ[イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−(5’−ヨードインダン)]、スピロ[イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−(4’−シアノインダン)]、スピロ[イミダゾ[2,1−a]イソキノリン−2(3H)−オン−3,2’−インダン]、スピロ[イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−((1,2,5−チアジアゾ)[4,5−c]インダン)]、スピロ[イミダゾ[2,1−a]イソキノリン−2(3H)−オン−3,2’−((1,2,5−チアジアゾ)[4,5−c]インダン)]、スピロ[イミダゾ[1,2−a]ピリミジン−2(3H)−オン−3,4’−(1’−シクロペンテン)]、スピロ[イミダゾ[1,2−a]ピリミジン−2(3H)−オン−3,2’−インダン]、スピロ[イミダゾ[1,2−a]ピリミジン−2(3H)−オン−3,2’−((1,2,5−チアジアゾ)[4,5−c]インダン)]、スピロ[イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−(5’−トリフルオロメチルインダン)]、スピロ[イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−ベンゾ[e]インダン]、スピロ[イミダゾ[2,1−a]イソキノリン−2(3H)−オン−3,1’−(3’−シクロペンテン)]、スピロ[8−ベンジルオキシイミダゾ[1,2−a]ピリジン−2(3H)−オン−3,1’−(3’−シクロペンテン)]、スピロ[7,8,9,10−テトラヒドロイミダゾ[2,1−a]イソキノリン−2(3H)−オン−3,1’−シクロペンタン]、スピロ[イミダゾ[2,1−a]イソキノリン−2(3H)−オン−3,1’−シクロペンタン]、スピロ[5,6,7,8−テトラヒドロイミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−インダン]
【0042】
<その他各実施形態に共通の事項>
後述する各実施形態に係る抗鬱剤、脳保護剤、アミロイドβ沈着抑制剤または老化抑制剤に含まれる複素環化合物は、薬学的に許容される塩として酸付加塩の形体をとってもよい。適当な酸付加塩としては、無機酸塩では例えば塩酸塩、硫酸塩、臭化水素酸塩、硝酸塩、リン酸塩等、有機酸塩では例えば酢酸塩、シュウ酸塩、プロピオン酸塩、グリコール酸塩、乳酸塩、ピルビン酸塩、マロン酸塩、コハク酸塩、マレイン酸塩、フマル酸塩、リンゴ酸塩、酒石酸塩、クエン酸塩、安息香酸塩、桂皮酸塩、メタンスルホン酸塩、ベンゼンスルホン酸塩、p−トルエンスルホン酸塩、サリチル酸塩等が挙げられる。
【0043】
次に、上記の複素環化合物を哺乳類とりわけ人に適用する場合の投与方法、剤型、投与量について説明する。これらの複素環化合物は、経口的又は非経口的に投与可能である。経口投与の剤型としては、錠剤、コーティング錠剤、散剤、顆粒剤、カプセル剤、マイクロカプセル剤、シロップ剤等が使用できる。また、非経口投与の剤型としては、注射剤(用時溶解して用いる注射用凍結乾燥剤を含む)、貼付剤、坐剤等が使用できる。
【0044】
これらの剤型の調製は、薬学的に許容される賦形剤、結合剤、滑沢剤、崩壊剤、懸濁化剤、乳化剤、防腐剤、安定化剤及び分散剤、例えば乳糖、白糖、でんぷん、デキストリン、結晶セルロース、カオリン、炭酸カルシウム、タルク、ステアリン酸マグネシウム、蒸留水又は生理用食塩水を用いて行うことができる。投与量は患者の症状、年齢、体重等に応じて異なるが、成人に対する一日量として0.1〜50mgを1〜3回に分けて投与することができる。
【0045】
<実施形態1:抗鬱剤>
本実施形態に係る抗鬱剤は、既述した特定の構造(一般式(I)の構造)の複素環化合物を含む抗鬱剤である。
【0046】
本発明者らは、上記の特定の構造の複素環化合物が実施例で後述するように強制水泳試験や尾懸垂試験において抗うつ作用を示すことを明らかにした。また、上記の化合物誘導体を用いて、抗うつ作用のスクリーニングを実施したところ、後述するジベンジル基やインダン環をスピロ環形成したアザインドリジノン誘導体が、強い抗うつ作用があることを見出した。上記の化合物は、セロトニン再取り込み阻害作用を持たない新規の機序に基づいて抗鬱効果を示し、また既に前臨床試験において極めて安全性の高い化合物であることが確認されている。
【0047】
すなわち、本実施形態に係る抗鬱剤は、優れた抗鬱効果を奏する。さらに具体的には、本実施形態に係る抗鬱剤は、哺乳動物の鬱病、躁鬱病、強迫性障害、パニック障害、不安障害からなる群から選ばれる1種以上の気分障害を抑制する機能を有する。
【0048】
なお、本実施形態に係る抗鬱剤に含まれる複素環化合物は、以下に列挙する化合物であることが好ましい。これらの化合物については、後述する実施例で示すように、抗鬱作用を試験するための代表的な試験方法であるマウス尾懸垂試験において、優れた抗鬱作用を示す試験結果が得られることを確認しているためである。
【0049】
3,3−ジベンジルイミダゾ[1,2−a]ピリジン−2(3H)−オン、スピロ[イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−インダン]、3,3−ジプロピルイミダゾ[1,2−a]ピリジン−2(3H)−オン、3,3−ジブチルイミダゾ[1,2−a]ピリジン−2(3H)−オン、5,5−ジベンジルイミダゾ[2,1−b]チアゾール−6(5H)−オン、3,3−ジベンジルイミダゾ[1,2−a]ピリミジン−2(3H)−オン、スピロ[イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−(5’−メトキシインダン)]、スピロ[イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−(4’−シアノインダン)]、スピロ[イミダゾ[2,1−a]イソキノリン−2(3H)−オン−3,2’−インダン]、スピロ[イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−((1,2,5−チアジアゾ)[4,5−c]インダン)]、スピロ[イミダゾ[1,2−a]ピリミジン−2(3H)−オン−3,2’−インダン]、スピロ[イミダゾ[2,1−a]イソキノリン−2(3H)−オン−3,4’−(1’−シクロペンテン)]、3,3−ビス(4−クロロベンジル)イミダゾ[1,2−a]ピリジン−2(3H)−オン、8−シクロプロピルメチルオキシ−3,3−ジアリルイミダゾ[1,2−a]ピリジン−2(3H)−オン、スピロ[イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−(4’−ヒドロキシインダン)]、スピロ[8−ヒドロキシ−イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−インダン]、スピロ[8−メトキシ−イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,4’−(1’−シクロペンテン)]、スピロ[8−シクロプロピルメチルオキシイミダゾ[1,2−a]ピリジン−2(3H)−オン−3,4’−(1’−シクロペンテン)]
【0050】
なお、本実施形態に係る抗鬱剤は、経口投与型であることが好ましい。なお、この抗鬱剤は貼付剤としても好適に使用できる。すなわち、抗鬱剤の剤型は、錠剤、コーティング錠剤、散剤、顆粒剤、カプセル剤、マイクロカプセル剤、シロップ剤等であることが好ましい。抗鬱剤が経口投与型であれば、ヒトをはじめとする哺乳動物への投与が容易になるためである。
【0051】
また、本実施形態に係る抗鬱剤の有効経口投与量は、体重1kgあたり0.0005mg以上であることが好ましく、体重1kgあたり0.005mg以上であればより好ましく、体重1kgあたり0.05mg以上であれば特に好ましい。抗鬱剤の有効経口投与量がこれらの下限以上であれば、ヒトをはじめとする哺乳動物への抗鬱作用が向上するためである。
【0052】
<実施形態2:脳保護剤>
本実施形態に係る脳保護剤は、既述した特定の構造(一般式(I)の構造)の複素環化合物を含む脳保護剤である。
【0053】
本発明者らは、上記の特定の構造の複素環化合物が実施例で後述するようにスナネズミ一過性前脳虚血モデルにおける海馬CA1領域の遅延神経細胞死軽減効果を指標とする試験において脳保護作用を示すことを明らかにした。また、上記の化合物誘導体を用いて、脳保護作用のスクリーニングを実施したところ、後述するジベンジル基やインダン環をスピロ環形成したアザインドリジノン誘導体が、強い脳保護作用を持つことを見出した。上記の化合物は、抗酸化作用とは異なる新規の機序に基づいて脳保護効果を示し、また既に前臨床試験において極めて安全性の高い化合物であることが確認されている。
【0054】
上記の複素環化合物を含む脳保護剤は、抗酸化作用を有する脳保護剤であるエダラボンとは異なる機序に基づき低用量で効果があることから、エダラボンで報告されている腎機能障害等の各種副作用の発現を抑えた新規な脳保護剤である。
【0055】
すなわち、本実施形態に係る脳保護剤は、優れた脳保護効果を奏する。さらに具体的には、本実施形態に係る脳保護剤は、哺乳動物の一過性脳虚血発作、脳出血、くも膜下出血、頭蓋内出血、脳梗塞、高血圧性脳症からなる群から選ばれる1種以上の脳血管障害を抑制する機能を有する。
【0056】
なお、本実施形態に係る脳保護剤に含まれる複素環化合物は、スピロ[イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−インダン]であることが好ましい。この化合物については、後述する実施例で示すように、脳保護作用を試験するための代表的な試験方法であるスナネズミ一過性前脳虚血モデルにおける海馬CA1領域の遅延神経細胞死軽減効果を指標とする試験において、優れた脳保護作用を示す試験結果が得られることを確認しているためである。
【0057】
なお、本実施形態に係る脳保護剤は、経口投与型であることが好ましい。なお、この脳保護剤は貼付剤としても好適に使用できる。すなわち、脳保護剤の剤型は、錠剤、コーティング錠剤、散剤、顆粒剤、カプセル剤、マイクロカプセル剤、シロップ剤等であることが好ましい。脳保護剤が経口投与型であれば、ヒトをはじめとする哺乳動物への投与が容易になるためである。
【0058】
また、本実施形態に係る脳保護剤の有効経口投与量は、体重1kgあたり0.005mg以上であることが好ましく、体重1kgあたり0.05mg以上であればより好ましく、体重1kgあたり0.5mg以上であれば特に好ましい。脳保護剤の有効経口投与量がこれらの下限以上であれば、ヒトをはじめとする哺乳動物への脳保護作用が向上するためである。
【0059】
<実施形態3:アミロイドβ沈着抑制剤>
本実施形態に係るアミロイドβ沈着抑制剤は、既述した特定の構造(一般式(I)の構造)の複素環化合物を含むアミロイドβ沈着抑制剤である。
【0060】
本発明者らは、上記の特定の構造の複素環化合物が実施例で後述するように海馬におけるアミロイドβの免疫陽性反応試験においてアミロイドβ沈着抑制作用を示すことを明らかにした。また、上記の化合物誘導体を用いて、アミロイドβ沈着抑制作用のスクリーニングを実施したところ、後述するジベンジル基やインダン環をスピロ環形成したアザインドリジノン誘導体が、強いアミロイドβ沈着抑制作用を持つことを見出した。上記の化合物は、抗酸化作用とは異なる新規の機序に基づいてアミロイドβ沈着抑制効果を示し、また既に前臨床試験において極めて安全性の高い化合物であることが確認されている。
【0061】
上記の複素環化合物を含むアミロイドβ沈着抑制剤は、カレーに多く含まれるウコン(Curcuma longa)の成分であり、抗酸化作用を有するcurcuminとは異なる機序に基づき低用量で効果があることから、curcuminとは作用機序の異なる新規なアミロイドβ沈着抑制剤である。
【0062】
すなわち、本実施形態に係るアミロイドβ沈着抑制剤は、優れたアミロイドβ沈着抑制効果を奏する。さらに具体的には、本実施形態に係るアミロイドβ沈着抑制剤は、哺乳動物のアミロイドーシス、脳アミロイド血管炎、白内障、加齢黄斑変性症、リウマチ、骨粗鬆症、メタボリックシンドローム、しわ、脱毛、からなる群から選ばれる1種以上のアミロイド病理を抑制する機能を有する。
【0063】
なお、本実施形態に係るアミロイドβ沈着抑制剤に含まれる複素環化合物は、スピロ[イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−インダン]であることが好ましい。この化合物については、後述する実施例で示すように、アミロイドβ沈着抑制作用を試験するための代表的な試験方法である海馬におけるアミロイドβの免疫陽性反応試験において、優れたアミロイドβ沈着抑制作用を示す試験結果が得られることを確認しているためである。
【0064】
なお、本実施形態に係るアミロイドβ沈着抑制剤は、経口投与型であることが好ましい。なお、このアミロイドβ沈着抑制剤は貼付剤としても好適に使用できる。すなわち、アミロイドβ沈着抑制剤の剤型は、錠剤、コーティング錠剤、散剤、顆粒剤、カプセル剤、マイクロカプセル剤、シロップ剤等であることが好ましい。アミロイドβ沈着抑制剤が経口投与型であれば、ヒトをはじめとする哺乳動物への投与が容易になるためである。
【0065】
また、本実施形態に係るアミロイドβ沈着抑制剤の有効経口投与量は、体重1kgあたり0.0005mg以上であることが好ましい。アミロイドβ沈着抑制剤の有効経口投与量がこの下限以上であれば、ヒトをはじめとする哺乳動物へのアミロイドβ沈着抑制作用が向上するためである。
【0066】
<実施形態4:老化抑制剤>
本実施形態に係る老化抑制剤は、既述した特定の構造(一般式(I)の構造)の複素環化合物を含む老化抑制剤である。
【0067】
本発明者らは、上記の特定の構造の複素環化合物が実施例で後述するように老化促進マウスの老化指標(Grading Score)の測定試験において老化抑制作用を示すことを明らかにした。また、上記の化合物誘導体を用いて、老化抑制作用のスクリーニングを実施したところ、後述するジベンジル基やインダン環をスピロ環形成したアザインドリジノン誘導体が、強い老化抑制作用を持つことを見出した。上記の化合物は、抗酸化作用とは異なる新規の機序に基づいて老化抑制効果を示し、また既に前臨床試験において極めて安全性の高い化合物であることが確認されている。
【0068】
上記の複素環化合物を含む老化抑制剤は、抗酸化作用を有するウーロン茶またはdeprenylとは異なる機序に基づき低用量で効果があることから、ウーロン茶またはdeprenylとは作用機序の異なる新規な老化抑制剤である。すなわち、上記の複素環化合物を用いれば、抗酸化作用とは異なる新規の機序を有する、極めて低用量で効果が上がる抗老化薬を開発することができる。
【0069】
すなわち、本実施形態に係る老化抑制剤は、優れた老化抑制効果を奏する。また、本実施形態に係る老化抑制剤は、ヒトをはじめとする哺乳動物の老化を抑制する結果、ヒトをはじめとする哺乳動物の平均寿命を延長する機能を有する。
【0070】
なお、本実施形態に係る老化抑制剤に含まれる複素環化合物は、スピロ[イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−インダン]であることが好ましい。この化合物については、後述する実施例で示すように、老化抑制作用を試験するための代表的な試験方法である老化促進マウスの老化指標(Grading Score)の測定試験において、優れた老化抑制作用を示す試験結果が得られることを確認しているためである。また、この化合物については、後述する実施例で示すように、老化促進マウスの平均寿命の延長作用を示すことを確認している。
【0071】
なお、本実施形態に係る老化抑制剤は、経口投与型であることが好ましい。なお、この老化抑制剤は貼付剤としても好適に使用できる。すなわち、老化抑制剤の剤型は、錠剤、コーティング錠剤、散剤、顆粒剤、カプセル剤、マイクロカプセル剤、シロップ剤等であることが好ましい。老化抑制剤が経口投与型であれば、ヒトをはじめとする哺乳動物への投与が容易になるためである。
【0072】
また、本実施形態に係る老化抑制剤の有効経口投与量は、体重1kgあたり0.0005mg以上であることが好ましく、体重1kgあたり0.005mg以上であることがより好ましく、体重1kgあたり0.05mg以上であることが特に好ましい。老化抑制剤の有効経口投与量がこれらの下限以上であれば、ヒトをはじめとする哺乳動物への老化抑制作用が向上するためである。
【0073】
また、老化抑制剤の有効経口投与量は、平均寿命の延長を目的とする場合には、体重1kgあたり0.005mg以上であることが好ましい。老化抑制剤の有効経口投与量がこの下限以上であれば、ヒトをはじめとする哺乳動物の平均寿命の延長作用が向上するためである。
【0074】
以上、本発明の実施形態について述べたが、これらは本発明の例示であり、上記以外の様々な構成を採用することもできる。
【0075】
例えば、上記実施の形態では経口投与の場合の有効投与量について好ましい範囲を規定したが、他の投与形態の場合にはその形態に応じた別の範囲の有効投与量であってもよい。例えば、注射による投与を行う場合には、適宜好ましい範囲の有効投与量により投与することができる。また、投与形態に応じて、有効投与量だけでなく、投与間隔についても適宜好ましい範囲の投与間隔により投与することができる。
【実施例】
【0076】
以下、本発明を実施例によりさらに説明するが、本発明はこれらに限定されるものではない。
【0077】
<実施例1:抗鬱作用>
実施形態1で説明した特定の構造の複素環化合物に抗鬱作用があることを確認するために、ICR系マウス(雄)を用い、Tail suspension test(尾懸垂試験)で検討した。まず、検体を0.001、0.01及び0.1mg/kgの用量で経口投与した1時間後に、マウスの尾の先端から約1cmの部位をクリップではさみ、吊り下げた状態で6分間の観察を実施し、後半4分間の無動時間を測定した。無動時間が90秒以下になった場合を抗鬱効果有りと判定した。
【0078】
【表1】

【0079】
上記のように、いずれの化合物についても、マウスの尾懸垂試験の無動時間は90秒以下であるため、抗鬱効果が有ると認められる。すなわち、この尾懸垂試験により、実施形態1で説明した特定の構造の複素環化合物に抗鬱作用があることを確認することができた。なお、上記の化合物の構造および名称については、後述する製造例において説明する。
【0080】
<実施例2:脳保護作用>
実施形態2で説明した特定の構造の複素環化合物に脳保護作用があることを確認するために、化合物24の脳保護効果を、スナネズミ一過性前脳虚血モデルにおける海馬CA1領域の遅延神経細胞死軽減効果を指標として検討した。
【0081】
スナネズミ(雄、体重55〜80g前後)を2%ハロタン吸入麻酔下に両側総頸動脈露出マイクロクリップで挟んで血流を停止し、脳を虚血した。虚血4分後にマイクロクリップをはずして脳虚血を再還流し、ただちに麻酔を停止した。再還流4日後に脳を摘出、ホルマリン固定後、厚さ4μmの薄切標本を作製し、hematoxylin−eosin染色を行った。顕微鏡下にマイクロメーターを用いて各標本の両面海馬CA1全領域における生存細胞数を数え、生存細胞数/0.5mmとして算出した。
【0082】
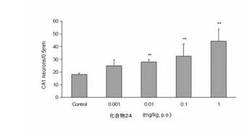
化合物24は、1%HPCに懸濁し、脳虚血1時間前および再還流5時間後に経口投与し、さらに翌日から再還流3日後まで2回/日、連日経口投与した。海馬CA1領域生存細胞数は平均値±標準誤差で表し、有意差検定にはMann−Whitney’s U testを用いた。また、横軸は、化合物24の有効経口投与量を示し、縦軸は、生存細胞数/0.5mmを示す。
【0083】
偽手術群(n=7)の海馬CA1領域における生存細胞数は117.3±2.3/0.5mmであった。これに対して溶媒対照群(n=7)では18.1±1.0/0.5mmを示し、脳虚血・再還流による海馬CA1領域における生存細胞数の著名な減少すなわち遅延神経細胞死の発現が認められた。
【0084】
図1は、スナネズミ一過性前脳虚血モデルにおける化合物24の海馬CA1領域保護効果について説明するためのグラフである。なお、図1において、**は、p<0.01 vs Controlを示す。
【0085】
図2は、スナネズミ一過性前脳虚血モデルにおける海馬CA1領域の遅延神経細胞に対する脳保護効果を説明するための写真である。左側の写真は、化合物24を投与しない場合であり、右側の写真は化合物24を投与した場合である。
【0086】
化合物24を0.001〜20mg/kg経口投与すると、0.01mg/kg(n=7)、0.1mg/kg(n=8)、1mg/kg(n=9)の各投与群で、図1および図2に示すように、海馬CA1領域における生存細胞数の用量依存的かつ有意な増加(**)が認められた(生存細胞数:0.01mg/kg;27.8±1.9/0.5mm、0.1mg/kg;32.5±9.4/0.5mm、1mg/kg;44.3±9.4/0.5mm)。
【0087】
本結果から、化合物24には神経細胞死を抑制し、脳保護剤としての有用性を有することが示された。そのため、化合物24は、脳保護剤として、一過性脳虚血発作、脳出血、くも膜下出血、脳動静脈奇形を伴う頭蓋内出血、脳梗塞、高血圧性脳症等の脳血管障害に有効である。
【0088】
すなわち、このスナネズミ一過性前脳虚血モデルにおける海馬CA1領域の遅延神経細胞死軽減効果を指標とした試験により、実施形態2で説明した特定の構造の複素環化合物に脳保護作用があることを確認することができた。
【0089】
<実施例3:アミロイドβ沈着抑制作用>
実施形態3で説明した特定の構造の複素環化合物にアミロイドβ沈着抑制作用があることを確認するために、アミロイドβ沈着に対する化合物24の効果を検討した。
【0090】
老化促進マウス(SAMP8)(雄、実験開始時8ヶ月齢)を実験に用いた。化合物24は約0.1mg/kg/dayの用量で飲水投与した。投与8週間後にマウスの脳を摘出し、メタカーン固定液(メタノール:クロロホルム:酢酸=6:3:1)で固定し、パラフィン包埋し、ミクロトームを用いて8mmの厚さで切片を作製した。
【0091】
切片はVECTASTATIN ABCキットを用いてストレプトアビジンービオチン法で免疫染色を行った。10%ヤギ正常血清で1時間インキュベートした後、抗アミロイドβ(Aβ)抗体をPBSで10倍に希釈して、4℃で一晩インキュベートした。翌日、PBSで洗浄後、ビオチン化抗ウサギ2次抗体で1.5時間インキュベートしたあと、PBSで洗浄し、ペルオキシダーゼ標識ストレプトアビジンで1.5時間インキュベートした。免疫反応は、DABで可視化して、標本を作製した。
【0092】
顕微鏡観察では、海馬における抗Aβ抗体の免疫陽性顆粒の数を測定した。Aβ免疫陽性反応は、海馬の細胞質の褐色の沈着として認められた。1個体に付き1切片を測定した。
【0093】
図3は、老化促進マウス(SAMP8)マウスにおけるアミロイドβの抗体に陽性の細胞の数に対する化合物24の影響を説明するための写真である。上欄の写真は、8ヶ月齢の老化促進マウス(SAMP8)に水道水を2ヶ月間飲水投与した場合の海馬の抗アミロイドβ染色像の写真であり、下欄の写真は、同様に化合物24を体重1kgあたり0.1mgの有効経口投与量により2ヶ月間投与した老化促進マウス(SAMP8)群の海馬の抗アミロイドβ染色像の写真である。
【0094】
また、図4は、老化促進マウス(SAMP8)におけるアミロイドβの抗体に陽性の細胞の数に対する化合物24の影響を説明するためのグラフである。横軸は、化合物24の有効経口投与量を示し、縦軸は、アミロイドβの抗体に陽性の顆粒数を示す。化合物24を投与しなかった老化促進マウス(SAMP8)のN数は3であり、化合物24を体重1kgあたり0.1mgの有効経口投与量で投与した老化促進マウス(SAMP8)のN数は6である。
【0095】
図3および図4に示すように、8ヶ月齢の老化促進マウス(SAMP8)に水道水を2ヶ月間飲水投与した場合、海馬においてアミロイドβの免疫陽性反応が認められた。それに対して、化合物24を約0.1mg/kg/dayの用量で2ヶ月間飲水投与すると、アミロイドβ免疫陽性反応が減少していた。アミロイドβ免疫陽性顆粒数を測定したところ、化合物24の投与によって有意(*)に減少していた。
【0096】
上記のように、化合物24は、アミロイドβ沈着を抑制する。ここで、化合物24が治療に好適に用いられるアミロイド病理としては、アミロイドβが疾患の一因であると想定されている、白内障、加齢黄斑変性症、リウマチ、骨粗鬆症、メタボリックシンドローム、しわ、脱毛が挙げられる。また、化合物24は、アミロイドベータ沈着を抑制するため、アミロイドが繊維化して沈着するアミロイドーシス、脳アミロイド血管炎(アミロイドアンギオパシー)についても効果がある。
【0097】
すなわち、このアミロイドβの免疫陽性反応試験により、実施形態3で説明した特定の構造の複素環化合物にアミロイドベータ沈着抑制作用があることを確認することができた。
【0098】
<実施例4:老化抑制作用>
実施形態4で説明した特定の構造の複素環化合物に老化抑制作用があることを確認するために、老化促進マウス(SAM)の毛並み悪化抑制及びSAMの平均寿命の延長に対する化合物24の効果を検討した。
【0099】
老化促進マウス(SAMP8)(雄、実験開始時8ヶ月齢)を実験に使用した。
【0100】
老化促進マウスへの薬物投与については、化合物24を水道水に溶解して、0.001、0.01、0.1 mg/kg/dayの用量で飲水投与した。コントロールには、水道水を飲水投与した。
【0101】
老化促進マウスの老化の程度を示す指標として、Grading score(Takeda et al., 1981)を、短期試験では、上記の飲水投与開始0、4、8、12、16週後に測定し、長期試験では、上記の飲水投与開始12、16、20、24、28、32週後に測定した。
【0102】
図5は、老化促進マウス(SAMP8)の老化指標(Grading score)に対する化合物24の影響を説明するためのグラフである。図5(A)は短期試験の結果を示し、図5(B)は長期試験の結果を示す。なお、いずれのグラフにおいても、横軸は、投与後の週を示し、縦軸は、老化指標(Grading score)を示す。
【0103】
上記の測定の結果、図5(A)に示すように、老化促進マウス(SAMP8)の水投与群では、飲水投与開始12週目以降、老化の指標であるGrading scoreの増加が認められたが、化合物24を飲水投与した群では、Grading scoreの増加が抑制された。この効果は、図5(A)に示すように、0.001、0.01および0.1 mg/kg/dayの有効経口投与量で化合物24を飲水投与した群で16週目に有意差(*)が確認され、0.1 mg/kg/day の有効経口投与量で化合物24を飲水投与した群で顕著だった。
【0104】
また、図5(B)に示すように、0.01mg/kg/dayの有効経口投与量で化合物24を飲水投与した群で20〜32週目に有意差(*,**)が確認され、0.1mg/kg/dayの有効経口投与量で化合物24を飲水投与した群で16〜32週目に有意差(*,**)が確認された。これらの測定結果から、化合物24は、老化促進マウス(SAMP8)の老化の進行を有意に抑制した。
【0105】
また、図6は、老化促進マウス(SAMP8)の生存率に対する化合物24の影響を説明するためのグラフである。横軸は、マウスの月齢を示し、縦軸は、生存率(%)を示す。
【0106】
上記の測定の結果、図6に示すように、対照群である老化促進マウス(SAMP8)の水道水投与群に対して、0.01 mg/kg/dayの有効経口投与量で化合物24を飲水投与した群は、いずれの月齢においても平均寿命が延長されている。すなわち、化合物24は、老化促進マウス(SAMP8)の平均寿命を延長することが確認された。
【0107】
すなわち、上記のように老化促進マウス(SAM)の毛並み悪化抑制及びSAMの平均寿命の延長に対する化合物24の効果を検討したことにより、実施形態4で説明した特定の構造の複素環化合物に老化抑制作用および平均寿命延長作用があることを確認することができた。
【0108】
<実施形態で列挙した化合物の製造方法>
以下、特許文献1の実施例の方法を用いて製造した一般式(I)で示される複素環化合物の幾つかの例を示す。具体的には、国際公開第01/09131号パンフレット(特許文献1)および国際公開第2002/060907号パンフレットを参照して合成した。
【0109】
<製造例1>
下記の一般式で構造が示される、3,3−ジベンジル−8−イソプロポキシイミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物1)の製造例を以下に示す。
【0110】
【化31】

【0111】
金属ナトリウム81mgを無水エタノール3.0mlに加え、室温で1時間撹拌した後、2−アミノ−3−イソプロポキシ−1−(エトキシカルボニルメチル)ピリジニウムブロマイド586mg(1.77mmol)を加え、さらに室温で1時間撹拌した。次いで、その反応混合物にベンジルブロミド605mg(3.54mmol)を0℃にて加え、室温で4時間撹拌したのち析出した結晶をロ取し、乾燥した。得た結晶をエタノールより再結晶し、標記化合物588mg(収率92%)を得た。
【0112】
得られた化合物の各種分析結果を、以下に示す。これらの分析結果から、獲られた化合物が目的の化合物であることを確認した。
【0113】
融点:247−248℃
NMR(CDCl3)δ:1.03(6H,d,J=6Hz),3.15(2H,d,J=14Hz),3.56(2H,d,J=14Hz),4.60(1H,sept.,J=6Hz),6.48(1H,t,J=7Hz),6.79(1H,d,J=8Hz),6.9−7.2(11H,m)
MS m/z:372(M+)
【0114】
<製造例2>
製造例1と同様にして、相当する出発原料から対応する一般式で構造が示される化合物2〜40をそれぞれ製造した。また、得られた化合物の各種分析結果を、対応箇所に示す。これらの分析から、得られた化合物が目的の化合物2〜40であることをそれぞれ確認した。
【0115】
・3,3−ジベンジル−8−メトキシイミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物2)
【化32】

融点:274−275℃.
NMR(CDCl3)δ:3.17(2H,d,J=14Hz),3.56(2H,d,J=14Hz),3.69(3H,s),6.49(1H,t,J=7Hz),6.67(1H,d,J=8Hz),6.9−7.2(11H,m).
MS m/z:344(M+).
【0116】
・3,3−ジベンジル−8−シクロプロピルメチルオキシイミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物3)
【化33】

融点:236−237℃.
NMR(CDCl3)δ:0.12(2H,q,J=5Hz),0.45(2H,q,J=6Hz),0.99(1H,m),3.16(2H,d,J=14Hz),3.55(2H,d,J=14Hz),3.73(2H,d,J=7Hz),6.47(1H,t,J=7Hz),6.76(1H,d,J=8Hz),7.0−7.2(11H,m).
MS m/z:384(M+).
【0117】
・3,3−ジベンジル−6−クロロイミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物4)
【化34】

融点:246−248℃.
NMR(CDCl3)δ:3.16(2H,d,J=14Hz),3.55(2H,d,J=14Hz),6.70(1H,d,J=10Hz),7.0−7.2(12H,m).
MS m/z:348(M+).
【0118】
・8−アリルオキシ−3,3−ジベンジルイミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物5)
【化35】

融点:214−215℃.
NMR(CDCl3)δ:3.16(2H,d,J=14Hz),3.56(2H,d,J=14Hz),4.4−4.5(2H,m),5.0−5.2(2H,m),5.7−5.9(1H,m),6.47(1H,t,J=7Hz),6.74(1H,d,J=8Hz),6.9−7.2(11H,m).
MS m/z:370(M+).
【0119】
・3,3−ジベンジル−8−ベンジルオキシイミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物6)
【化36】

融点:240−241℃.
NMR(CDCl3)δ:3.17(2H,d,J=14Hz),3.57(2H,d,J=14Hz),5.03(2H,s),6.39(1H,t,J=8Hz),6.65(1H,d,J=8Hz),7.0−7.2(16H,m).
MS m/z:420(M+).
【0120】
・8−ベンジルオキシ−3,3−ビス(1−フェニルエチル)イミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物7)
【化37】

融点:234−235℃.
NMR(CDCl3)δ:1.52(6H,d,J=7Hz),3.51(2H,q,J=7Hz),5.11(2H,s),6.14(1H,t,J=7Hz),6.41(1H,d,J=7Hz),6.63(1H,d,J=8Hz),7.0−7.2(15H,m).
MS m/z:448(M+).
【0121】
・3,3−ジベンジル−8−メチルイミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物8)
【化38】

融点:262−263℃.
NMR(CDCl3)δ:2.05(3H,s),3.31(2H,d,J=14Hz),3.56(2H,d,J=14Hz),6.60(1H,t,J=7Hz),6.9−7.2(12H,m).
MS m/z:328(M+).
・3,3−ジベンジル−5,7−ジメチルイミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物9)
【化39】

融点:237−238℃.
NMR(CDCl3)δ:2.07(3H,s),2.80(3H,s),3.40(2H,d,J=15Hz),3.71(2H,d,J=15Hz),6.11(1H,s),6.34(1H,s),7.0−7.2(10H,m).
MS m/z:342(M+).
【0122】
・3,3−ジベンジルイミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物10)
【化40】

融点:>300℃.
NMR(DMSO−D6)δ:3.39(4H,s),6.60(1H,d,J=9Hz),6.8−7.2(11H,m),7.56(1H,t,J=7Hz),8.75(1H,d,J=7Hz).
MS m/z:314(M+).
【0123】
・3,3−ジベンジル−8−シクロペンチルオキシイミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物11)
【化41】

融点:268−269℃.
NMR(CDCl3)δ:1.4−1.7(8H,m),3.15(2H,d,J=14Hz),3.55(1H,d,J=14Hz),4.7−4.9(1H,m),6.47(1H,t,J=7Hz),6.72(1H,d,J=8Hz),6.9−7.2(11H,m).
MS m/z:398(M+).
【0124】
・3,3−ジベンジル−6,8−ジクロロイミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物12)
【化42】

融点:260−261℃.
NMR(CDCl3)δ:3.17(2H,d,J=14Hz),3.55(2H,d,J=14Hz),6.9−7.3(11H,m),7.41(1H,d,J=2Hz).
MS m/z:382(M+).
【0125】
・3,3−ジベンジル−8−クロロ−6−トリフルオロメチルイミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物13)
【化43】

融点:234−236℃.
NMR(CDCl3)δ:3.22(2H,d,J=14Hz),3.55(2H,d,J=14Hz),6.9−7.0(4H,m),7.1−7.4(7H,m),7.51(1H,d,J=2Hz).
MS m/z:416(M+).
【0126】
・8−ベンジルオキシ−3,3−ビス(3−メチルベンジル)イミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物14)
【化44】

融点:233−235℃.
NMR(CDCl3)δ:2.20(6H,s),3.14(2H,d,J=14Hz),3.48(2H,d,J=14Hz),5.05(2H,s),6.38(1H,t,J=7Hz),6.68(1H,d,J=8Hz),6.7−7.3(14H,m).
MS m/z:448(M+).
【0127】
・8−メチル−3,3−ビス(4−ピリジルメチル)イミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物15)
【化45】

融点:228−230℃.
NMR(CDCl3)δ:2.01(3H,s),3.13(2H,d,J=14Hz),3.60(2H,d,J=14Hz),6.60(1H,t,J=7Hz),6.95(4H,d,J=6Hz),7.22(1H,d,J=7Hz),7.46(1H,d,J=7Hz),8.40(4H,d,J=6Hz).
MS m/z:330(M+).
【0128】
・3,3−ビス(4−フルオロベンジル)イミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物16)
【化46】

融点:290−292℃.
NMR(CDCl3)δ:3.13(2H,d,J=14Hz),3.56(2H,d,J=14Hz),6.62(1H,t,J=7Hz),6.7−6.9(5H,m),6.9−7.1(4H,m),7.39(1H,t,J=7Hz),7.52(1H,brd,J=7Hz).
MS m/z:350(M+).
【0129】
・3,3−ビス(4−ジメチルアミノベンジル)イミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物17)
【化47】

融点:>300℃.
NMR(CDCl3)δ:2.86(12H,s),3.09(2H,d,J=14Hz),3.37(2H,d,J=14Hz),6.4−6.6(5H,m),6.7−6.9(5H,m),7.2−7.3(1H,m),7.37(1H,t,J=7Hz).
MS m/z:400(M+).
【0130】
・3,3−ビス(3−クロロベンジル)イミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物18)
【化48】

融点:271−272℃.
NMR(CDCl3)δ:3.14(2H,d,J=14Hz),3.53(2H,d,J=14Hz),6.66(1H,t,J=7Hz),6.80(1H,d,J=7Hz),6.9−7.2(8H,m),7.43(1H,t,J=7Hz),7.51(1H,brd,J=7Hz).
MS m/z:382(M+).
【0131】
・3,3−ビス(4−メトキシベンジル)イミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物19)
【化49】

融点:248−251℃.
NMR(CDCl3)δ:3.66(6H,s),3.67(2H,d,J=15Hz),4.00(2H,d,J=15Hz),6.59(4H,d,J=9Hz),6.93(4H,d,J=9Hz),7.50(1H,1,J=7Hz),6.71(1H,d,J=7Hz),7.91(1H,t,J=7Hz),9.78(1H,d,J=7Hz).
MS m/z:374(M+).
【0132】
・3,3−ビス(4−ビフェニルメチル)イミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物20)
【化50】

融点:>300℃.
NMR(CDCl3)δ:3.25(2H,d,J=14Hz),3.62(2H,d,J=14Hz),6.58(1H,t,J=7Hz),6.77(1H,d,J=7Hz),7.11(4H,d,J=7Hz),7.3−7.6(16H,m).
MS m/z:466(M+).
【0133】
・3,3−ビス(4−シアノベンジル)イミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物21)
【化51】

融点:294℃(分解).
NMR(CDCl3)δ:3.19(2H,d,J=14Hz),3.70(2H,d,J=14Hz),6.6−6.8(2H,m),7.13(4H,d,J=7Hz),7.43(1H,t,J=7Hz),7.45(4H,d,J=7Hz),7.62(1H,brd,J=7Hz).
MS m/z:364(M+).
【0134】
・3,3−ビス(4−ヒドロキシベンジル)イミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物22)
【化52】

融点:276.5−277.5℃.
NMR(CD3OD−CDCl3(1:1))δ:3.62(2H,d,J=14Hz),3.66(2H,d,J=14Hz),6.58(4H,d,J=9Hz),6.78(4H,d,J=9Hz),7.17(1H,d,J=7Hz),7.63(1H,t,J=7Hz),8.12(1H,t,J=7Hz),9.25(1H,d,J=7Hz).
MS m/z:346(M+).
【0135】
・3,3−ジアリルイミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物23)
【化53】

融点:64−66℃.
NMR(CDCl3)δ:2.56(2H,dd,J=9Hz,J=14Hz),2.86(2H,dd,J=6Hz,J=14Hz),4.99(2H,dd,J=1Hz,J=7Hz),5.04(2H,d,J=1Hz),5.4−5.6(2H,m),6.67(1H,t,J=7Hz),7.17(1H,d,J=7Hz),7.52(1H,d,J=7Hz),7.59(1H,d,J=7Hz).
MS m/z:214(M+).
【0136】
・スピロ[イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−インダン](化合物24)
【化54】

融点:206℃(分解).
NMR(CDCl3)δ:3.16(2H,d,J=16Hz),3.89(2H,d,J=16Hz),6.49(1H,t,J=7Hz),7.1−7.2(2H,m),7.2−7.3(4H,m),7.61(1H,t,J=7Hz).
MS m/z:236(M+).
【0137】
・3,3−ジアリル−8−ベンジルオキシイミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物25)
【化55】

融点:160−162℃.
NMR(CDCl3)δ:2.54(2H,dd,J=8Hz,J=14Hz),2.86(2H,dd,J=6Hz,J=14Hz),4.96(2H,dd,J=1Hz,J=5Hz),5.01(2H,d,J=1Hz),5.29(2H,s),5.4−5.6(2H,m),6.53(1H,dd,J=7Hz,J=8Hz),6.94(1H,d,J=7Hz),7.16(1H,d,J=8Hz),7.3−7.5(5H,m).
MS m/z:320(M+).
【0138】
・3,3−ビス(3−フェニル−1−プロピル)イミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物26)
【化56】

融点:227−228℃.
NMR(CDCl3)δ:0.9−1.1(2H,m),1.4−1.6(2H,m),1.6−1.8(2H,m),2.0−2.2(2H,m),2.3−2.5(2H,m),2.5−2.7(2H,m),6.61(1H,t,J=7Hz),7.0−7.1(4H,m),7.1−7.3(8H,m),7.58(1H,t,J=7Hz).
MS m/z:370(M+).
【0139】
・スピロ[イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−[2,3]ジヒドロフェナレン](化合物27)
【化57】

融点:262℃(分解).
NMR(CDCl3):3.12(2H,d,J=17Hz),3.98(2H,d,J=17Hz),6.18(1H,t,J=7Hz),6.48(1H,d,J=7Hz),7.24(1H,d,J=7Hz),7.34(2H,d,J=7Hz),7.4−7.6(3H,m),7.86(2H,d,J=7Hz).
MS m/z:286(M+).
【0140】
・3,3−ビス(2,4−ジフルオロベンジル)イミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物28)
【化58】

融点:269−271℃.
NMR(CDCl3)δ:3.38(2H,d,J=14Hz),3.47(2H,d,J=14Hz),6.5−6.7(3H,m),6.7−6.8(3H,m),7.2−7.5(3H,m),7.6−7.7(1H,m).
MS m/z:368(M+).
【0141】
・3,3−ジプロピルイミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物29)
【化59】

融点:73−75℃.
NMR(CDCl3)δ:0.7−0.9(8H,m),1.1−1.3(2H,m),1.6−1.8(2H,m),2.0−2.2(2H,m),6.73(1H,t,J=7Hz),7.19(1H,d,J=7Hz),7.50(1H,d,J=7Hz),7.63(1H,t,J=7Hz).
MS m/z:218(M+).
【0142】
・3,3−ビス(2−チエニルメチル)イミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物30)
【化60】

融点:289.5℃(分解).
NMR(CDCl3)δ:3.41(2H,d,J=15Hz),3.70(2H,d,J=15Hz),6.64(1H,t,J=7Hz),6.7−7.0(5H,m),7.07(2H,dd,J=1Hz,J=5Hz),7.38(1H,d,J=7Hz),7.48(1H,t,J=7Hz).
MS m/z:326(M+).
【0143】
・8−アセチルアミノ−3,3−ジベンジルイミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物31)
【化61】

融点:235−237℃.
NMR(CDCl3)δ:2.05(3H,s),3.20(2H,d,J=14Hz),3.55(2H,d,J=14Hz),6.61(1H,t,J=7Hz),6.9−7.1(4H,m),7.1−7.2(7H,m),7.78(1H,brs),8.39(1H,d,J=7Hz).
MS m/z:371(M+).
【0144】
・3,3−ビス(2−フリルメチル)イミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物32)
【化62】

融点:205℃(分解).
NMR(CDCl3)δ:3.37(4H,s),6.11(2H,d,J=3Hz),6.23(2H,dd,J=2Hz,J=3Hz),6.56(1H,t,J=7Hz),6.97(1H,d,J=7Hz),7.20(2H,d,J=2Hz),7.22(1H,d,J=7Hz),7.51(1H,t,J=7Hz).
MS m/z:294(M+).
【0145】
・3,3−ジメチルイミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物33)
【化63】

融点:200−202℃.
NMR(CD3OD−CDCl3(1:1))δ:1.93(6H,s),7.72(1H,t,J=7Hz),7.78(1H,d,J=7Hz),8.50(1H,t,J=7Hz),9.01(1H,d,J=7Hz).
MS m/z:162(M+).
【0146】
・3,3−ジブチルイミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物34)
【化64】

融点:100.5−102℃.
NMR(CDCl3)δ:0.6−0.9(8H,m),1.0−1.3(6H,m),1.6−1.8(2H,m),2.0−2.2(2H,m),6.71(1H,t,J=7Hz),7.19(1H,d,J=7Hz),7.50(1H,d,J=7Hz),7.62(1H,t,J=7Hz).
MS m/z:246(M+).
【0147】
・3,3−ジ(2−プロピニル)イミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物35)
【化65】

融点:172−175℃.
NMR(CDCl3)δ:2.07(2H,t,J=3Hz),2.80(2H,dd,J=3Hz,J=17Hz),3.08(2H,dd,J=2.6Hz,J=17Hz),6.75(1H,t,J=7Hz),7.24(1H,d,J=7Hz),7.69(1H,t,J=7Hz),8.02(1H,d,J=7Hz).
MS m/z:210(M+).
【0148】
・3,3−ジベンジル−8−ヒドロキシイミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物36)
【化66】

融点:283−285℃.
NMR(CDCl3)δ:3.20(2H,d,J=14Hz),3.55(2H,d,J=14Hz),6.58(1H,t,J=7Hz),6.87(1H,d,J=7Hz),6.9−7.0(4H,m),7.07(1H,d,J=7Hz),7.1−7.2(6H,m).
MS m/z:330(M+).
【0149】
・3,3−ジベンジル−8−ベンジルアミノイミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物37)
【化67】

融点:250℃.
NMR(CDCl3)δ:3.42(2H,d,J=14Hz),3.70(2H,d,J=14Hz),4.35(2H,d,J=6Hz),6.93(1H,d,J=7Hz),7.0−7.3(16H,m),7.48(1H,d,J=7Hz),8.66(1H,brs).
MS m/z:419(M+).
【0150】
・3,3−ビス(4−ニトロベンジル)イミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物38)
【化68】

融点:>300℃.
NMR(CD3OD−CDCl3(1:1))δ:3.21(2H,d,J=14Hz),3.67(2H,d,J=14Hz),6.66(1H,t,J=7Hz),6.75(1H,d,J=7Hz),7.15(4H,d,J=9Hz),7.39(1H,t,J=7Hz),7.42(4H,d,J=9Hz),7.56(1H,d,J=7Hz).
MS m/z:404(M+).
【0151】
・8−アミノ−3,3−ジベンジルイミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物39)
【化69】

融点:283−285℃.
NMR(CDCl3)δ:3.17(2H,d,J=14Hz),3.53(2H,d,J=14Hz),4.06(2H,brs),6.4−6.5(2H,m),6.94(1H,t,J=7Hz),7.0−7.1(4H,m),7.1−7.2(6H,m).
MS m/z:330(M+).
【0152】
・3,3−ビス(4−メトキシカルボニルベンジル)イミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物40)
【化70】

融点:289−290℃.
NMR(CDCl3)δ:3.22(2H,d,J=14Hz),3.66(2H,d,J=14Hz),3.86(6H,s),6.60(1H,t,J=7Hz),6.70(1H,d,J=7Hz),7.0−7.1(4H,m),7.35(1H,t,J=7Hz),7.50(1H,d,J=7Hz),7.8−7.9(4H,m).
MS m/z:430(M+).
【0153】
<製造例3>
下記の一般式で構造が示される、5,5−ビス(4−フルオロベンジル)イミダゾ[2,1−b]チアゾール−6(5H)−オン(化合物43)の製造例を以下に示す。
【0154】
【化71】

【0155】
金属ナトリウム210mg(9.0mmol)から調製したナトリウムエトキシドのエタノール溶液(10ml)に、氷冷下、2−アミノ−3−エトキシカルボニルメチルチアゾリウムブロマイド300mg(1.4mmol)、次いでp−フルオロベンジルブロマイド1.15ml(9.0mmol)を加え、室温で1晩撹拌した。減圧下溶媒を留去した後、残渣に水を加え、酢酸エチルで数回抽出し、飽和食塩水で水洗後、無水硫酸マグネシウムで乾燥した。減圧下溶媒を留去し、残渣をシリカゲルカラムクロマトグラフィー(酢酸エチル:メタノール=10:1)にて分離し、標記化合物を結晶として852mg(80.0%)得た。エタノールから再結晶を行い、融点>300℃の白色結晶を得た。
【0156】
得られた化合物の各種分析結果を、以下に示す。これらの分析結果から、得られた化合物が目的の化合物であることを確認した。
【0157】
NMR(CD3OD−CDCl3(1:1))δ:3.23(2H,d,J=14Hz),3.43(2H,d,J=14Hz),6.66(1H,d,J=4Hz),6.8−6.9(4H,m),6.9−7.1(4H,m),7.28(1H,d,J=4Hz).
MS m/z:356(M+).
【0158】
<製造例4>
製造例3と同様にして、相当する出発原料から対応する一般式で構造が示される化合物44〜68をそれぞれ製造した。また、得られた化合物の各種分析結果を、対応箇所に示す。これらの分析から、得られた化合物が目的の化合物44〜68であることをそれぞれ確認した。
【0159】
・5,5−ジベンジルイミダゾ[2,1−b]チアゾール−6(5H)−オン(化合物44)
【化72】

融点:>300℃.
NMR(DMSO−d6)δ:3.69(2H,d,J=15Hz),3.74(2H,d,J=15Hz),7.27(1H,d,J=4Hz),7.3−7.4(4H,m),7.5−7.6(6H,m),8.44(1H,d,J=4Hz).
MS m/z:320(M+).
【0160】
・3,3−ジベンジルイミダゾ[1,2−a]ピリミジン−2(3H)−オン(化合物45)
【化73】

融点:>300℃.
NMR(DMSO−d6)δ:3.42(4H,dd,J=14Hz,J=16Hz),6.9−7.0(5H,m),7.1−7.2(6H,m),8.46(1H,dd,J=3Hz,J=5Hz),9.07(1H,dd,J=2Hz,J=6Hz).
MS m/z:315(M+).
【0161】
・5,5−ビス(4−メチルベンジル)イミダゾ[2,1−b]チアゾール−6(5H)−オン(化合物46)
【化74】

融点:>300℃.
NMR(DMSO−d6)δ:2.20(6H,s),3.24(2H,d,J=14Hz),3.36(2H,d,J=14Hz),6.84(4H,d,J=8Hz),6.89(1H,d,J=4Hz),6.97(4H,d,J=8Hz),8.03(4H,d,J=4Hz).
MS m/z:348(M+).
【0162】
・5,5−ビス(4−シアノベンジル)イミダゾ[2,1−b]チアゾール−6(5H)−オン(化合物47)
【化75】

融点:264−267℃.
NMR(CDCl3)δ:3.23(2H,d,J=14Hz),3.56(2H,d,J=14Hz),6.54(1H,d,J=6Hz),7.02(1H,d,J=6Hz),7.15(4H,d,J=9Hz),7.51(4H,d,J=9Hz).
MS m/z:370(M+).
【0163】
・5,5−ジベンジル−2−メチルイミダゾ[2,1−b]チアゾール−6(5H)−オン(化合物48)
【化76】

融点:>300℃.
NMR(CD3OD−CDCl3(1:1))δ:2.34(3H,d,J=1Hz),3.28(2H,d,J=13Hz),3.43(2H,d,J=13Hz),7.0−7.1(4H,m),7.1−7.3(7H,m).
MS m/z:334(M+).
【0164】
・5,5−ビス(2−チエニルメチル)イミダゾ[2,1−b]チアゾール−6(5H)−オン(化合物49)
【化77】

融点:286℃(分解).
NMR(CDCl3)δ:3.43(2H,d,J=15Hz),3.60(2H,d,J=15Hz),6.49(1H,d,J=5Hz),6.7−7.0(5H,m),7.12(2H,dd,J=1Hz,J=6Hz).
MS m/z:332(M+).
【0165】
・3,3−ビス(2−チエニルメチル)イミダゾ[1,2−a]ピリミジン−2(3H)−オン(化合物50)
【化78】

融点:192℃(分解).
NMR(CD3OD−CDCl3(1:1))δ:3.54(2H,d,J=15Hz),3.76(2H,d,J=15Hz),6.7−6.9(5H,m),7.11(2H,dd,J=1Hz,J=5Hz),8.23(1H,dd,J=2Hz,J=6Hz),8.62(1H,dd,J=2Hz,J=4Hz).
MS m/z:327(M+).
【0166】
・5,5−ジベンジル−2,3−ジヒドロイミダゾ[2,1−b]チアゾール−6(5H)−オン(化合物51)
【化79】

融点:233−236℃.
NMR(CDCl3)δ:3.03(2H,d,J=14Hz),3.23(2H,t,J=7Hz),3.41(2H,d,J=14Hz),3.63(2H,t,J=7Hz),7.1−7.2(4H,m),7.2−7.3(6H,m).
MS m/z:322(M+).
【0167】
・2−ヒドロキシ−3−(2−ナフチルメチル)イミダゾ[1,2−a]ピリジン(化合物52)
【化80】

融点:205℃(分解).
NMR(CD3OD−CDCl3(1:1))δ:3.41(1H,d,J=15Hz),3.76(1H,d,J=15Hz),6.72(1H,t,J=7Hz),7.02(1H,d,J=9Hz),7.29(1H,d,J=9Hz),7.4−7.5(2H,m),7.58(2H,brs),7.6−7.9(4H,m).
MS m/z:274(M+).
【0168】
・スピロ[イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−ベンゾ[f]インダン](化合物53)
【化81】

融点:214℃(分解).
NMR(CD3OD−CDCl3(1:1))δ:3.33(2H,d,J=16Hz),4.02(2H,d,J=16Hz),6.58(1H,t,J=7Hz),7.16(1H,d,J=7Hz),7.24(1H,d,J=9Hz),7.5−7.6(2H,m),7.74(1H,t,J=8Hz),7.8−7.9(4H,m).
MS m/z:286(M+).
【0169】
・3−ベンジルイミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物54)
【化82】

融点:182℃(分解).
NMR(CDCl3)δ:3.09(1H,dd,J=8Hz,J=15Hz),3.64(1H,dd,J=4Hz,J=15Hz),4.58(1H,dd,J=4Hz,J=8Hz),6.47(1H,t,J=7Hz),7.0−7.1(2H,m),7.1−7.2(2H,m),7.3−7.4(3H,m),7.54(1H,t,J=7Hz).
MS m/z:224(M+).
【0170】
・3,3−ジ(2−ブテニル)イミダゾ[1,2−a]ピリミジン−2(3H)−オン(化合物55)
【化83】

融点:149.5℃(分解).
NMR(CDCl3)δ:1.55(6H,d,J=6Hz),2.51(2H,dd,J=8Hz,J=15Hz),2.76(2H,dd,J=8Hz,J=15Hz),5.1−5.3(2H,m),5.4−5.7(2H,m),6.69(1H,dd,J=5Hz,J=6Hz),7.75(1H,dd,J=2Hz,J=6Hz),8.7(1H,dd,J=2Hz,J=5Hz).
MS m/z:243(M+).
【0171】
・スピロ[イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−(4’−フルオロインダン)](化合物56)
【化84】

融点:148.0℃(分解).
NMR(CDCl3)δ:3.24(2H,dd,J=18Hz,J=22Hz),3.88(2H,t,J=18Hz),6.55(1H,t,J=7Hz),7.01(1H,t,J=9Hz),7.10(1H,d,J=7Hz),7.2−7.3(3H,m),7.63(1H,t,J=8Hz).
MS m/z:254(M+).
【0172】
・スピロ[イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−(5’−メトキシインダン)](化合物57)
【化85】

融点:150.0−152.0℃.
NMR(CDCl3)δ:3.08(2H,dd,J=6Hz,J=17Hz),3.8−4.0(5H,m),6.49(1H,t,J=7Hz),6.8−6.9(2H,m),7.1−7.3(3H,m),7.60(1H,t,J=7Hz).
MS m/z:266(M+).
【0173】
・スピロ[イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−(5’−ヨードインダン)](化合物58)
【化86】

融点:167−171℃.
NMR(CDCl3)δ:3.14(2H,dd,J=6Hz,J=17Hz),3.82(2H,dd,J=17Hz,J=18Hz),6.57(1H,t,J=7Hz),7.08(1H,d,J=8Hz),7.1−7.3(2H,m),7.6−7.7(3H,m).
MS m/z:362(M+).
【0174】
・スピロ[イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−(4’−シアノインダン)](化合物59)
【化87】

融点:247.7℃(分解).
NMR(CDCl3)δ:3.26(2H,dd,J=3Hz,J=18Hz),3.93(2H,dd,J=6Hz,J=18Hz),6.56(1H,t,J=7Hz),7.15(1H,d,J=7Hz),7.23(1H,d,J=9Hz),7.44(1H,d,J=8Hz),7.6−7.7(3H,m).
MS m/z:261(M+).
【0175】
・スピロ[イミダゾ[2,1−a]イソキノリン−2(3H)−オン−3,2’−インダン](化合物60)
【化88】

融点:201−203℃.
NMR(CDCl3)δ:3.22(2H,d,J=17Hz),3.91(2H,d,J=17Hz),6.74(1H,d,J=7Hz),6.89(1H,d,J=7Hz),7.32(4H,s),7.6−7.7(2H,m),7.79(1H,t,J=7Hz),8.63(1H,d,J=8Hz).
MS m/z:286(M+).
【0176】
・スピロ[イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−((1,2,5−チアジアゾ)[4,5−c]インダン)](化合物61)
【化89】

融点:86−88℃.
NMR(CDCl3−CD3OD(1:1))δ:3.44(2H,d,J=18Hz),4.00(2H,d,J=18Hz),6.71(1H,t,J=7Hz),7.2−7.4(2H,m),7.81(1H,t,J=7Hz),7.97(2H,s).
MS m/z:294(M+).
【0177】
・スピロ[イミダゾ[2,1−a]イソキノリン−2(3H)−オン−3,2’−((1,2,5−チアジアゾ)[4,5−c]インダン)](化合物62)
【化90】

融点:271.5℃(分解).
NMR(CDCl3)δ:3.39(2H,d,J=16Hz),4.04(2H,brd,J=16Hz),6.77(1H,d,J=7Hz),6.81(1H,d,J=7Hz),7.6−7.8(2H,m),7.82(1H,brt,J=8Hz),7.95(2H,brs),8.65(1H,d,J=8Hz).
MS m/z:344(M+).
【0178】
・スピロ[イミダゾ[1,2−a]ピリミジン−2(3H)−オン−3,2’−インダン](化合物63)
【化91】

融点:195.5℃(分解).
NMR(CDCl3)δ:3.17(2H,d,J=17Hz),3.92(2H,d,J=17Hz),6.53(1H,dd,J=5Hz,J=6Hz),7.44(1H,dd,J=2Hz,J=6Hz),7.32(4H,s),8.72(1H,dd,J=2Hz,J=5Hz).
MS m/z:237(M+).
【0179】
・スピロ[イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−(5’−トリフルオロメチルインダン)](化合物64)
【化92】

融点:176.5−179.5℃.
NMR(CDCl3)δ:3.25(2H,d,J=17Hz),3.92(2H,d,J=17Hz),6.57(1H,t,J=7Hz),7.1−7.2(2H,m),7.44(1H,d,J=8Hz),8.5−8.7(3H,m).
MS m/z:304(M+).
【0180】
・スピロ[イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−ベンゾ[e]インダン](化合物65)
【化93】

融点:256.0℃(分解).
NMR(CDCl3)δ:3.33(1H,d,J=17Hz),3.56(1H,d,J=17Hz),4.09(2H,t,J=17Hz),6.50(1H,t,J=7Hz),7.22(1H,d,J=9Hz),7.29(1H,d,J=7Hz),7.42(1H,d,J=8Hz),7.5−7.7(4H,m),7.83(1H,d,J=8Hz),7.92(1H,d,J=6Hz).
MS m/z:286(M+).
【0181】
・3,3−ジアリルイミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物66)
【化94】

融点:64−66℃.
NMR(CDCl3)δ:2.56(2H,dd,J=9Hz,J=14Hz),2.86(2H,dd,J=6Hz,J=14Hz),4.99(2H,dd,J=1Hz,J=7Hz),5.40(2H,d,J=1Hz),5.4−5.6(2H,m),6.67(1H,t,J=7Hz),7.17(1H,d,J=7Hz),7.52(1H,d,J=7Hz),7.59(1H,d,J=7Hz).
MS m/z:214(M+).
【0182】
・3,3−ビス(2−シクロヘキセニル)イミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物67)
【化95】

融点:245−247℃.
NMR(CDCl3)δ:1.4−2.0(12H,m),2.9−3.1(2H,m),5.29(1H,brd,J=10Hz),5.8−6.0(3H,m),6.62(1H,t,J=7Hz),7.17(1H,d,J=9Hz),7.5−7.7(2H,m).
MS m/z:294(M+).
【0183】
・3,3−ジアリルイミダゾ[2,1−a]イソキノリン−2(3H)−オン(化合物68)
【化96】

融点:108−110℃.
NMR(CDCl3)δ:2.62(2H,dd,J=8Hz,J=14Hz),2.89(2H,dd,J=6Hz,J=14Hz),4.9−5.1(4H,m),5.4−5.6(2H,m),6.91(1H,d,J=7Hz),7.25(1H,d,J=7Hz),7.6−7.7(2H,m),7.80(1H,t,J=8Hz),8.57(1H,d,J=8Hz).
MS m/z:264(M+).
【0184】
<製造例5>
下記の一般式で構造が示される、スピロ[イミダゾ[2,1−a]イソキノリン−2(3H)−オン−3,4’−(1’−シクロペンテン)](化合物69)の製造例を以下に示す。
【0185】
【化97】

【0186】
アルゴン雰囲気下、製造例1と同様の方法で得た3,3−ジアリルイミダゾ[2,1−a]イソキノリン−2(3H)−オン1.0g(3.8mmol)のクロロホルム溶液(80ml)に、80mgのグラッブス試薬(0.24mmol)を加え、14時間加熱還流した。反応混合物を放冷したのち、減圧下溶媒を留去した。得られた残渣に水を加え、ジクロロメタンで数回抽出し、抽出層をまとめて、飽和食塩水で水洗後、無水硫酸マグネシウムで乾燥した。減圧下溶媒を留去し、残渣をシリカゲルカラムクロマトグラフィー(酢酸エチル:メタノール=10:1)にて分離精製し、標記化合物748mg(83.5%)を淡褐色結晶として得た。
【0187】
得られた化合物の各種分析結果を、以下に示す。これらの分析結果から、得られた化合物が目的の化合物であることを確認した。
【0188】
融点:173.5℃(分解).
NMR(CDCl3)δ:2.70(2H,d,J=17Hz),3.30(2H,d,J=17Hz),5.92(2H,s),6.89(1H,d,J=7Hz),7.33(1H,d,J=7Hz),7.6−7.8(2H,m),7.79(1H,t,J=7Hz),8.60(1H,d,J=7Hz).
MS m/z:236(M+).
【0189】
<製造例6>
製造例5と同様にして、相当する出発原料から対応する一般式で構造が示される化合物70を製造した。また、得られた化合物の各種分析結果を、対応箇所に示す。これらの分析から、得られた化合物が目的の化合物70であることを確認した。
【0190】
・スピロ[8−ベンジルオキシイミダゾ[1,2−a]ピリジン−2(3H)−オン−3,4’−(1’−シクロペンテン)](化合物70)
【化98】

融点:178.5−180.5℃.
NMR(CDCl3)δ:2.64(2H,d,J=16Hz),3.29(2H,d,J=16Hz),5.30(2H,s),5.88(2H,s),6.49(1H,dd,J=6Hz,J=8Hz),6.94(1H,dd,J=6Hz,J=8Hz),6.94(1H,d,J=8Hz),7.2−7.5(5H,m).
MS m/z:292(M+).
【0191】
<製造例7>
下記の一般式で構造が示される、3,3−ジプロピル−5,6,7,8−テトラヒドロイミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物71)の製造例を以下に示す。
【0192】
【化99】

【0193】
製造例5と同様の方法で得た3,3−ジアリルイミダゾ[1,2−a]ピリジン−2(3H)−オン300mg(1.4mmol)のエタノール溶液(30ml)に10%パラジウム炭素100mgを加え、水素雰囲気下、室温で1晩接触還元した。不溶物を濾別し、濾液から減圧下溶媒を留去した。残渣をシリカゲルカラムクロマトグラフィー(ヘキサン:酢酸エチル=10:1)にて分離し、標記化合物を結晶として281mg(90.3%)得た。ヘキサン−酢酸エチル(10:1)から再結晶を行い、融点98.5−101℃の白色結晶を得た。
【0194】
得られた化合物の各種分析結果を、以下に示す。これらの分析結果から、得られた化合物が目的の化合物であることを確認した。
【0195】
NMR(CDCl3)δ:0.86(6H,t,J=7Hz),0.9−1.1(2H,m),1.1−1.2(2H,m),1.4−1.6(2H,m),1.7−2.0(6H,m),2.79(2H,t,J=6Hz),3.19(2H,t,J=6Hz).
MS m/z:222(M+).
【0196】
<製造例8>
製造例7と同様にして、相当する出発原料から対応する一般式で構造が示される化合物72〜77をそれぞれ製造した。また、得られた化合物の各種分析結果を、対応箇所に示す。これらの分析から、得られた化合物が目的の化合物72〜77であることをそれぞれ確認した。
【0197】
・3,3−ジシクロヘキシル−5,6,7,8−テトラヒドロイミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物72)
【化100】

融点:218−220℃.
NMR(CDCl3)δ:0.9−1.4(8H,m),1.5−2.0(18H,m),2.79(2H,t,J=6Hz),3.30(2H,t,J=6Hz).
MS m/z:302(M+).
【0198】
・3,3−ジブチル−5,6,7,8−テトラヒドロイミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物73)
【化101】

融点:35−40℃.
NMR(CDCl3)δ:0.88(6H,t,J=7Hz),0.9−1.4(8H,m),1.6−2.2(8H,m),3.2−3.4(4H,m).
MS m/z:250(M+).
【0199】
・スピロ[7,8,9,10−テトラヒドロイミダゾ[2,1−a]イソキノリン−2(3H)−オン−3,1’−シクロペンタン](化合物74)
【化102】

融点:270.5℃(分解).
NMR(CDCl3)δ:1.8−2.2(10H,m),2.3−2.5(2H,m),2.6−2.8(4H,m),6.44(1H,d,J=7Hz),7.35(1H,d,J=7Hz).
MS m/z:242(M+).
【0200】
・スピロ[イミダゾ[2,1−a]イソキノリン−2(3H)−オン−3,1’−シクロペンタン](化合物75)
【化103】

融点:164.5−167.5℃.
NMR(CDCl3)δ:1.8−2.3(6H,m),2.4−2.6(2H,m),6.94(1H,d,J=7Hz),7.33(1H,d,J=7Hz),7.6−7.7(2H,m),7.79(1H,t,J=6Hz),8.60(1H,d,J=8Hz).
MS m/z:238(M+).
【0201】
・スピロ[5,6,7,8−テトラヒドロイミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−ベンゾ[f]インダン](化合物76)
【化104】

融点:252.5℃(分解).
NMR(CDCl3−CD3OD(1:1))δ:1.9−2.1(4H,m),3.0−3.2(4H,m),3.50(2H,d,J=18Hz),3.79(2H,d,J=18Hz),7.4−7.5(2H,m),7.75(2H,s),7.8−7.9(2H,m).
MS m/z:290(M+).
【0202】
・スピロ[5,6,7,8−テトラヒドロイミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−インダン](化合物77)
【化105】

融点:276.5℃(分解).
NMR(CDCl3−CD3OD(1:1))δ:1.9−2.1(4H,m),3.0−3.3(4H,m),3.45(2H,d,J=17Hz),3.66(2H,d,J=17Hz),7.30(4H,s).
MS m/z:240(M+).
【0203】
<製造例9>
製造例1と同様にして、相当する出発原料から対応する一般式で構造が示される化合物78〜81をそれぞれ製造した。また、得られた化合物の各種分析結果を、対応箇所に示す。これらの分析から、得られた化合物が目的の化合物78〜81であることをそれぞれ確認した。
【0204】
・3,3−ビス(4−クロロベンジル)イミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物78)
【化106】

融点: 293.0―296.0(℃).
1H−NMR(CDCl3)δ:3.11(2H, d, J=14Hz), 3.55(2H, d, J= 14Hz), 6.62(1H, t, J=7Hz), 6.78(1H, d, J=8Hz), 6.94(4H, d, J=8Hz), 7.12(4H, d, J=8Hz), 7.40(1H, t, J=7Hz), 7.47(1H, d, J=7Hz).
MS m/z: 382(M+)
【0205】
・8−シクロプロピルメチルオキシ−3,3−ジアリルイミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物79)
【化107】

融点: 139.0−142.0(℃)
1H−NMR(CDCl3)δ: 0.35−0.40 (2H, m), 0.60−0.65(2H, m), 1.30−1.40 (1H, m) 2.50−2.60(2H, m), 2.80−2.30(2H, m) , 3.94(2H, d, J=7Hz), 4.96(2H, brs), 5.02(2H, brs), 5.40−5.65(2H, m) , 6.57(1H, t, J=7Hz, J=8Hz), 6.91(1H, d, J=8Hz), 7.16(1H, d, J=7Hz)
MS m/z: 284(M+).
【0206】
・スピロ[イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−(4’−ヒドロキシインダン)] (化合物80)
【化108】

融点: 240.0℃(dec.).
1H−NMR(CD3OD)δ:3.17(1H, d, J=17Hz),3.19(1H, d, J=17Hz), 3.50(1H, d, J=17Hz), 3.61(1H, d, J=17Hz), 6.63(1H, d, J=8Hz), 6.70−6.80(2H, m), 7.07(1H, d, J=8Hz), 7.12(1H, d, J=9Hz), 7.51(1H, d, J=7Hz), 7.81(1H, d, J=8Hz)
MS m/z: 352(M+).
【0207】
・スピロ[8−ヒドロキシ−イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−インダン](化合物81)
【化109】

融点: 285.0―290.0℃.
1H−NMR(CDCl3)δ:3.22(2H, d, J=17Hz), 3.91(2H, d, J=17Hz), 6.57(1H, dd, J=6Hz, J=7Hz), 6.82(1H, d, J=6Hz), 7.27(1H, d, J=7Hz), 7.31 (4H, s)
MS m/z: 352(M+).
【0208】
<製造例10>
製造例5と同様にして、相当する出発原料から対応する一般式で構造が示される化合物82〜83をそれぞれ製造した。また、得られた化合物の各種分析結果を、対応箇所に示す。これらの分析から、得られた化合物が目的の化合物82〜83であることをそれぞれ確認した。
【0209】
・スピロ[8−メトキシ−イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,4’−(1’−シクロペンテン)](化合物82)
【化110】

融点: 200.0―202.0℃
1H−NMR(CDCl3): 2.64(2H, d, J=17Hz), 3.29(2H, d, J=17Hz), 3.96(3H, s), 5.88(2H, s), 6.57(1H, dd, J=7Hz, J=8Hz), 6.91(1H, d, J=8Hz), 7.29(1H, d, J=7Hz)
MS m/z: 216(M+).
【0210】
・スピロ[8−シクロプロピルメチルオキシイミダゾ[1,2−a]ピリジン−2(3H)−オン−3,4’−(1'−シクロペンテン)](化合物83)
【化111】

融点: 134.0−137.0℃
1H−NMR(CDCl3)δ:0.35−0.40 (2H, m), 0.60−0.70 (2H, m), 1.30−1.40(1H, m) 2.64(2H, d, J=16Hz), 3.28(2H, d, J=16Hz), 3.98(2H, d, J=7Hz), 5.88(2H, s), 6.54(1H, dd, J=7Hz, J=8Hz), 6.92(1H, d, J=8Hz), 7.28(1H, d, J=7Hz)
MS m/z: 256(M+).
【0211】
以上、本発明を実施例に基づいて説明した。この実施例はあくまで例示であり、種々の変形例が可能なこと、またそうした変形例も本発明の範囲にあることは当業者に理解されるところである。
【0212】
たとえば、上記実施例では、哺乳動物としてマウスを用いたが、ヒトをはじめとする他の哺乳動物であってもよい。この場合であっても、上記の化合物1〜83は、ヒトをはじめとする他の哺乳動物に対して、抗鬱作用、脳保護作用、アミロイドβ沈着抑制作用または老化抑制作用を奏するためである。
【図面の簡単な説明】
【0213】
【図1】スナネズミ一過性前脳虚血モデルにおける化合物24の海馬CA1領域保護効果について説明するためのグラフである。
【図2】スナネズミ一過性前脳虚血モデルにおける海馬CA1領域の神経細胞死遅延による脳保護効果を説明するための写真である。
【図3】老化促進マウス(SAMP8)におけるアミロイドβの抗体に陽性の細胞の数に対する化合物24の影響を説明するための写真である。
【図4】老化促進マウス(SAMP8)におけるアミロイドβの抗体に陽性の細胞の数に対する化合物24の影響を説明するためのグラフである。
【図5】老化促進マウス(SAMP8)の老化指標(Grading score)に対する化合物24の影響を説明するためのグラフである。
【図6】老化促進マウス(SAMP8)の生存率に対する化合物24の影響を説明するためのグラフである。
【技術分野】
【0001】
本発明は、特定の構造の複素環化合物を含む抗鬱剤、脳保護剤、アミロイドβ沈着抑制剤または老化抑制剤に関する。
【背景技術】
【0002】
現在、うつ病やパニック障害に対する薬物治療の選択肢としては、1991年にマレイン酸フルボキサミン、2000年に塩酸パロキセチンが、選択的セロトニン再取り込み阻害剤(SSRI)として加わり、国内外においては急性期治療のみならず、維持治療においてもSSRIがうつ病やパニック障害の治療の第一選択薬となっている。しかしながら、SSRIには、慢性投与でしか薬効が発現しないことや、有害事象による投薬中止や退薬症状や認知機能に対する影響など副作用の課題が存在し、速効性があり副作用の少ない有効な薬剤の開発が強く望まれている。
【0003】
さらに、老化の原因として酸化的ストレスが挙げられ、抗酸化作用を持つものが抗老化作用を持つものとして報告されている。例えば、抗老化に効果があるのは、抗酸化物質を含むウーロン茶であるとされている(非特許文献1)。また、生存率を増加させる物質としてdeprenylが報告されており、モノアミンオキシデースB阻害剤としてパーキンソン病治療薬として用いられているが、抗酸化作用によるものと確認されている(非特許文献2)。しかしながら、これらの抗酸化物質による抗老化作用、生存率の増加は、満足のいく水準ではない。
【0004】
また、脳保護剤として、抗酸化作用を持つフリーラジカルスカベンジャーであるエダラボンが用いられているが、効果はそれ程強くなく、腎機能障害等の各種副作用が報告されている(非特許文献3)。
【0005】
また、カレーに多く含まれるウコン(Curcuma longa)の成分であり、処方薬の非ステロイド性抗炎症剤(NSAID)に匹敵する抗炎症作用や抗酸化作用などを持つcurcuminがアミロイド病理を抑制することが様々な研究でわかってきている(非特許文献4)。しかしながら、curcuminによるβアミロイド沈着抑制効果は、満足のいく水準ではない。
【0006】
なお、特許文献1および特許文献2において、特定の構造の複素環化合物を含む脳機能改善剤が開示されている。しかしながら、この複素環化合物は、老人性痴呆、アルツハイマー病等における記憶障害治療、記憶獲得・保持障害治療等につながる脳機能改善剤として開示されており、抗鬱剤、脳保護剤、アミロイドβ沈着抑制剤および老化抑制剤などとしての他の作用効果は開示されていない。
【0007】
【特許文献1】国際公開第01/009131号パンフレット
【特許文献2】国際公開第2002/060907号パンフレット
【非特許文献1】Biol Pharm Bull Vol 26 No 5 739-742 2003
【非特許文献2】Mech Ageing Dev Vol 46 No 1-3 237-262 1988
【非特許文献3】独立行政法人 医薬品医療機器総合機構「医薬品医療機器情報提供ホームページ」、医薬品・医療用具等安全性情報、No.198、重要な副作用等に関する情報、エダラボン(http://www.info.pmda.go.jp/iyaku_anzen/PMDSI198d.html#chapter1)
【非特許文献4】ファルマシア、日本薬学会、Vol.38、No.9、891−892、2002
【発明の開示】
【発明が解決しようとする課題】
【0008】
本発明は上記事情に鑑みてなされたものであり、優れた治療効果を有する抗鬱剤、脳保護剤、アミロイドβ沈着抑制剤または老化抑制剤を提供することを目的とする。
【課題を解決するための手段】
【0009】
本発明によれば、下記一般式(I)で示す複素環化合物を含む抗鬱剤、脳保護剤、アミロイドβ沈着抑制剤または老化抑制剤が提供される。
【0010】
【化21】

【0011】
ここで、上記一般式(I)中、下記一般式(II)で示される構造単位は、下記一般式(III)で示す複数種の構造単位から選ばれる1種以上の構造単位である。
【0012】
【化22】

【0013】
【化23】

【0014】
また、上記一般式(I)において、R1、R2は、それぞれ独立に、水素原子、ハロゲン原子、ヒドロキシ基、アミノ基、アセチルアミノ基、ベンジルアミノ基、トリフルオロメチル基、C1−C6アルキル基、C1−C6アルコキシ基または−O−(CH2)n−R5(R5はビニル基、C3−C6シクロアルキル基、フェニル基、nは0または1)からなる群から選ばれる1種以上の官能基を示す。
【0015】
さらに、上記一般式(I)において、R3、R4は、それぞれ独立に、水素原子、C1−C6アルキル基、C3−C8シクロアルキル基、−CH(R7)−R6からなる群から選ばれる1種以上の官能基を示すか、あるいはR3とR4とが結合して下記一般式(IV)に示すスピロ環を形成してもよい。
【0016】
【化24】

【0017】
ここで、上記R6は、ビニル基、エチニル基、フェニル(C1−C6アルキル基、C1−C6アルコキシ基、ヒドロキシ基、1〜2個のハロゲン原子、ジC1−C6アルキルアミノ基、シアノ基、ニトロ基、カルボキシ基、フェニル基で置換されていてもよい)フェネチル基、ピリジル基、チエニル基、フリル基からなる群から選ばれる1種以上の官能基を示す。また、上記R7は、水素原子またはC1−C6アルキル基を示す。
【0018】
さらに、上記一般式(IV)中、構造単位Bは、下記一般式(V)で示す複数種の構造単位から選ばれる1種以上の構造単位である。なお、構造単位Bは、一般式(V)中において、記号*で示した位置で結合してスピロ環を形成する。
【0019】
【化25】

【0020】
そして、上記R8は、水素原子、ハロゲン原子、ヒドロキシ基、C1−C6アルコキシ基、シアノ基、トリフルオロメチル基からなる群から選ばれる1種以上の官能基を示す。
【0021】
上記の特定の構造の複素環化合物を含む抗鬱剤、脳保護剤、アミロイドβ沈着抑制剤または老化抑制剤によれば、それぞれ優れた抗鬱効果、脳保護効果、アミロイドβ沈着抑制効果または老化抑制効果が奏される。
【発明の効果】
【0022】
本発明によれば、特定の構造の複素環化合物を含むため、優れた抗鬱効果、脳保護効果、アミロイドβ沈着抑制効果または老化抑制効果が奏される。
【発明を実施するための最良の形態】
【0023】
以下、本発明の実施の形態について説明する。なお、下記の実施形態は、上記の特定の構造の複素環化合物(アザインドリジン誘導体)並びに医薬として許容される担体または希釈剤を含む、抗鬱剤、脳保護剤、アミロイドβ沈着抑制剤または老化抑制剤に関する。
【0024】
<複素環化合物の構造>
後述する各実施形態に係る抗鬱剤、脳保護剤、アミロイドβ沈着抑制剤または老化抑制剤は、いずれも下記一般式(I)で示す複素環化合物を含む。
【0025】
【化26】

【0026】
ここで、上記一般式(I)中、下記一般式(II)で示される構造単位は、下記一般式(III)で示す複数種の構造単位から選ばれる1種以上の構造単位である。
【0027】
【化27】

【0028】
【化28】

【0029】
また、上記一般式(I)において、R1、R2は、それぞれ独立に、水素原子、ハロゲン原子、ヒドロキシ基、アミノ基、アセチルアミノ基、ベンジルアミノ基、トリフルオロメチル基、C1−C6アルキル基、C1−C6アルコキシ基または−O−(CH2)n−R5(R5はビニル基、C3−C6シクロアルキル基、フェニル基、nは0または1)からなる群から選ばれる1種以上の官能基を示す。
【0030】
さらに、上記一般式(I)において、R3、R4は、それぞれ独立に、水素原子、C1−C6アルキル基、C3−C8シクロアルキル基、−CH(R7)−R6からなる群から選ばれる1種以上の官能基を示すか、あるいはR3とR4とが結合して下記一般式(IV)に示すスピロ環を形成してもよい。
【0031】
【化29】

【0032】
ここで、上記R6は、ビニル基、エチニル基、フェニル(C1−C6アルキル基、C1−C6アルコキシ基、ヒドロキシ基、1〜2個のハロゲン原子、ジC1−C6アルキルアミノ基、シアノ基、ニトロ基、カルボキシ基、フェニル基で置換されていてもよい)フェネチル基、ピリジル基、チエニル基、フリル基からなる群から選ばれる1種以上の官能基を示す。また、上記R7は、水素原子またはC1−C6アルキル基を示す。
【0033】
さらに、上記一般式(IV)中、構造単位Bは、下記一般式(V)で示す複数種の構造単位から選ばれる1種以上の構造単位である。なお、構造単位Bは、一般式(V)中において、記号*で示した位置で結合してスピロ環を形成する。
【0034】
【化30】

【0035】
そして、上記R8は、水素原子、ハロゲン原子、ヒドロキシ基、C1−C6アルコキシ基、シアノ基、トリフルオロメチル基からなる群から選ばれる1種以上の官能基を示す。
【0036】
なお、上記の一般式(I)で示される複素環化合物は、その構造中に不斉炭素原子を有する場合、不斉炭素原子由来の異性体及びそれらの混合物(ラセミ体)が存在するが、それらはいずれも、後述する各実施形態で用いる複素環化合物に含むものとする。
【0037】
<用語の定義>
上記の複素環化合物は、一般式(I)で示されるが、この式中の各記号の定義に使用する語句の意味と例を以下に説明する。
【0038】
「C1−C6」とは、限定がなければ炭素数1〜6個を有する基を意味する。「C3−C8」とは、限定がなければ炭素数3〜8個を有する基を意味する。「C1−C6アルキル」としてはメチル、エチル、n−プロピル、イソプロピル、n−ブチル、tert−ブチル、sec−ブチル、n−ペンチル、n−ヘキシル等の直鎖又は分枝鎖状のアルキル基が挙げられる。「C1−C6アルコキシ」としては、メトキシ、エトキシ、n−プロポキシ、イソプロポキシ、n−ブトキシ、tert−ブトキシ、sec−ブトキシ、n−ペンチルオキシ、n−ヘキシルオキシ等の直鎖又は分枝鎖状のアルコキシ基が挙げられる。「C3−C8シクロアルキル」としては、シクロプロピル、シクロブチル、シクロペンチル、シクロヘキシル、シクロヘプチル、シクロオクチルが挙げられる。「ハロゲン原子」としては、フッ素、塩素、臭素、ヨウ素が挙げられる。
【0039】
<複素環化合物の例>
後述する各実施形態に係る抗鬱剤、脳保護剤、アミロイドβ沈着抑制剤または老化抑制剤に含まれる複素環化合物としては、上記の特定の構造を有していればよく、特に限定するものではないが、例えば、下記に列挙する化合物を用いることができる。
【0040】
3,3−ジメチルイミダゾ[1,2−a]ピリジン−2(3H)−オン、3,3−ジプロピルイミダゾ[1,2−a]ピリジン−2(3H)−オン、3,3−ジブチルイミダゾ[1,2−a]ピリジン−2(3H)−オン、3,3−ジアリルイミダゾ[1,2−a]ピリジン−2(3H)−オン、3,3−ジアリル−8−ベンジルオキシイミダゾ[1,2−a]ピリジン−2(3H)−オン、3,3−ジ(2−プロピニル)イミダゾ[1,2−a]ピリジン−2(3H)−オン、3,3−ジベンジルイミダゾ[1,2−a]ピリジン−2(3H)−オン、3,3−ジベンジル−8−メチルイミダゾ[1,2−a]ピリジン−2(3H)−オン、3,3−ジベンジル−5,7−ジメチルイミダゾ[1,2−a]ピリジン−2(3H)−オン、3,3−ジベンジル−8−ヒドロキシイミダゾ[1,2−a]ピリジン−2(3H)−オン、3,3−ジベンジル−8−メトキシイミダゾ[1,2−a]ピリジン−2(3H)−オン、3,3−ジベンジル−8−エトキシイミダゾ[1,2−a]ピリジン−2(3H)−オン、8−アリルオキシ−3,3−ジベンジルイミダゾ[1,2−a]ピリジン−2(3H)−オン、3,3−ジベンジル−8−イソプロポキシイミダゾ[1,2−a]ピリジン−2(3H)−オン、3,3−ジベンジル−8−シクロプロピルメチルオキシイミダゾ[1,2−a]ピリジン−2(3H)−オン、3,3−ジベンジル−8−シクロヘプチルオキシイミダゾ[1,2−a]ピリジン−2(3H)−オン、3,3−ジベンジル−6−クロロイミダゾ[1,2−a]ピリジン−2(3H)−オン、3,3−ジベンジル−6,8−ジクロロイミダゾ[1,2−a]ピリジン−2(3H)−オン、3,3−ジベンジル−8−クロロ−6−トリフルオロメチルイミダゾ[1,2−a]ピリジン−2(3H)−オン、3,3−ジベンジル−8−ベンジルオキシイミダゾ[1,2−a]ピリジン−2(3H)−オン、8−アミノ−3,3−ジベンジルイミダゾ[1,2−a]ピリジン−2(3H)−オン、8−アセチルアミノ−3,3−ジベンジルイミダゾ[1,2−a]ピリジン−2(3H)−オン、3,3−ジベンジル−8−ベンジルアミノイミダゾ[1,2−a]ピリジン−2(3H)−オン、3,3−ビス(3−クロロベンジル)イミダゾ[1,2−a]ピリジン−2(3H)−オン、3,3−ビス(3−フルオロベンジル)イミダゾ[1,2−a]ピリジン−2(3H)−オン、3,3−ビス(4−フルオロベンジル)イミダゾ[1,2−a]ピリジン−2(3H)−オン、3,3−ビス(2,4−ジクロロベンジル)イミダゾ[1,2−a]ピリジン−2(3H)−オン、3,3−ビス(4−ジメチルアミノベンジル)イミダゾ[1,2−a]ピリジン−2(3H)−オン、3,3−ビス(4−メトキシベンジル)イミダゾ[1,2−a]ピリジン−2(3H)−オン、3,3−ビス(4−ビフェニルメチル)イミダゾ[1,2−a]ピリジン−2(3H)−オン、3,3−ビス(4−シアノベンジル)イミダゾ[1,2−a]ピリジン−2(3H)−オン、3,3−ビス(4−ヒドロキシベンジル)イミダゾ[1,2−a]ピリジン−2(3H)−オン、3,3−ビス(3−フェニル−1−プロピル)イミダゾ[1,2−a]ピリジン−2(3H)−オン、3,3−ビス(2,4−ジフルオロベンジル)イミダゾ[1,2−a]ピリジン−2(3H)−オン、3,3−ビス(4−ニトロベンジル)イミダゾ[1,2−a]ピリジン−2(3H)−オン、3,3−ビス(4−カルボキシベンジル)イミダゾ[1,2−a]ピリジン−2(3H)−オン、8−ベンジルオキシ−3,3−ビス(1−フェニルエチル)イミダゾ[1,2−a]ピリジン−2(3H)−オン、8−ベンジルオキシ−3,3−ビス(3−メチルベンジル)イミダゾ[1,2−a]ピリジン−2(3H)−オン、8−ベンジルオキシ−3,3−ビス(4−メチルベンジル)イミダゾ[1,2−a]ピリジン−2(3H)−オン、3−ベンジル−3−(4−フルオロベンジル)イミダゾ[1,2−a]ピリジン−2(3H)−オン、3−エチル−3(4−フルオロベンジル)イミダゾ[1,2−a]ピリジン−2(3H)−オン、8−メチル−3,3−ビス(3−ピリジルメチル)イミダゾ[1,2−a]ピリジン−2(3H)−オン、8−メチル−3,3−ビス(4−ピリジルメチル)イミダゾ[1,2−a]ピリジン−2(3H)−オン、3,3−ビス(2−チエニルメチル)イミダゾ[1,2−a]ピリジン−2(3H)−オン、3,3−ビス(2−フリルメチル)イミダゾ[1,2−a]ピリジン−2(3H)−オン、スピロ[イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−インダン]、スピロ[イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−[2,3]ジヒドロフェナレン]
【0041】
スピロ[イミダゾ[2,1−b]チアゾール−6(5H)−オン−5,2’−ベンゾ[f]インダン]、スピロ[イミダゾ[1,2−b]チアゾール−6(5H)−オン−5,2’−インダン]、スピロ[2−メチルイミダゾ[1,2−b]チアゾール−6(5H)−オン−5,2’−ベンゾ[f]インダン]、5,5−ビス(4−フルオロベンジル)イミダゾ[2,1−b]チアゾール−6(5H)−オン、5,5−ジベンジルイミダゾ[2,1−b]チアゾール−6(5H)−オン、5,5−ビス(4−メチルベンジル)イミダゾ[2,1−b]チアゾール−6(5H)−オン、5,5−ビス(4−シアノベンジル)イミダゾ[2,1−b]チアゾール−6(5H)−オン、5,5−ジベンジル−2−メチルイミダゾ[2,1−b]チアゾール−6(5H)−オン、5,5−ビス(4−フルオロベンジル)−2−メチルイミダゾ[2,1−b]チアゾール−6(5H)−オン、5,5−ジシクロヘキシル−2−メチルイミダゾ[2,1−b]チアゾール−6(5H)−オン、5,5−ビス(4−シアノベンジル)−2−メチルイミダゾ[2,1−b]チアゾール−6(5H)−オン、5,5−ジ(2−ブテニル)イミダゾ[2,1−b]チアゾール−6(5H)−オン、5,5−ジブチルイミダゾ[2,1−b]チアゾール−6(5H)−オン、5,5−ジシクロヘキシルイミダゾ[2,1−b]チアゾール−6(5H)−オン、5,5−ビス(2−チエニルメチル)イミダゾ[2,1−b]チアゾール−6(5H)−オン、スピロ[2,3−ジヒドロイミダゾ[2,1−b]チアゾール−6(5H)−オン−5,2’−ベンゾ[f]インダン]、5,5−ジブチル−2,3−ジヒドロイミダゾ[2,1−b]チアゾール−6(5H)−オン、5,5−ジ(2−ブテニル)−2,3−ジヒドロイミダゾ[2,1−b]チアゾール−6(5H)−オン、5,5−ビス(4−メチルベンジル)−2,3−ジヒドロイミダゾ[2,1−b]チアゾール−6(5H)−オン、5,5−ビス(2−チエニルメチル)−2,3−ジヒドロイミダゾ[2,1−b]チアゾール−6(5H)−オン、5,5−ビス(4−フルオロベンジル)−2,3−ジヒドロイミダゾ[2,1−b]チアゾール−6(5H)−オン、5,5−ジベンジル−2,3−ジヒドロイミダゾ[2,1−b]チアゾール−6(5H)−オン、スピロ[イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−ベンゾ[f]インダン]、2−ヒドロキシ−3−(2−ナフチルメチル)−イミダゾ[1,2−a]ピリジン、3−ベンジルイミダゾ[1,2−a]ピリジン−2(3H)−オン、スピロ[5,6,7,8−テトラヒドロイミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−ベンゾ[f]インダン]、3,3−ジシクロヘキシル−5,6,7,8−テトラヒドロイミダゾ[1,2−a]ピリジン−2(3H)−オン、3,3−ビス(2−チエニルメチル)−5,6,7,8−テトラヒドロイミダゾ[1,2−a]ピリジン−2(3H)−オン、3,3−ジブチル−5,6,7,8−テトラヒドロイミダゾ[1,2−a]ピリジン−2(3H)−オン、3,3−ジプロピル−5,6,7,8−テトラヒドロイミダゾ[1,2−a]ピリジン−2(3H)−オン、スピロ[イミダゾ[1,2−a]ピリミジン−2(3H)−オン−3,2’−ベンゾ[f]インダン]、3,3−ジ(2−ブテニル)イミダゾ[1,2−a]ピリミジン−2(3H)−オン、3,3−ビス(2−チエニルメチル)イミダゾ[1,2−a]ピリミジン−2(3H)−オン、3,3−ビス(4−フルオロベンジル)イミダゾ[1,2−a]ピリミジン−2(3H)−オン、3,3−ジシクロヘキシルイミダゾ[1,2−a]ピリミジン−2(3H)−オン、3,3−ビス(4−シアノベンジル)イミダゾ[1,2−a]ピリミジン−2(3H)−オン、3,3−ビス(4−メチルベンジル)イミダゾ[1,2−a]ピリミジン−2(3H)−オン、4,4−ジベンジル−1−メチル−5−オキソ−4,5−ジヒドロイミダゾール、スピロ[イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−(4’−フルオロインダン)]、スピロ[イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−(5’−メトキシインダン)]、スピロ[イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−(5’−ヨードインダン)]、スピロ[イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−(4’−シアノインダン)]、スピロ[イミダゾ[2,1−a]イソキノリン−2(3H)−オン−3,2’−インダン]、スピロ[イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−((1,2,5−チアジアゾ)[4,5−c]インダン)]、スピロ[イミダゾ[2,1−a]イソキノリン−2(3H)−オン−3,2’−((1,2,5−チアジアゾ)[4,5−c]インダン)]、スピロ[イミダゾ[1,2−a]ピリミジン−2(3H)−オン−3,4’−(1’−シクロペンテン)]、スピロ[イミダゾ[1,2−a]ピリミジン−2(3H)−オン−3,2’−インダン]、スピロ[イミダゾ[1,2−a]ピリミジン−2(3H)−オン−3,2’−((1,2,5−チアジアゾ)[4,5−c]インダン)]、スピロ[イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−(5’−トリフルオロメチルインダン)]、スピロ[イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−ベンゾ[e]インダン]、スピロ[イミダゾ[2,1−a]イソキノリン−2(3H)−オン−3,1’−(3’−シクロペンテン)]、スピロ[8−ベンジルオキシイミダゾ[1,2−a]ピリジン−2(3H)−オン−3,1’−(3’−シクロペンテン)]、スピロ[7,8,9,10−テトラヒドロイミダゾ[2,1−a]イソキノリン−2(3H)−オン−3,1’−シクロペンタン]、スピロ[イミダゾ[2,1−a]イソキノリン−2(3H)−オン−3,1’−シクロペンタン]、スピロ[5,6,7,8−テトラヒドロイミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−インダン]
【0042】
<その他各実施形態に共通の事項>
後述する各実施形態に係る抗鬱剤、脳保護剤、アミロイドβ沈着抑制剤または老化抑制剤に含まれる複素環化合物は、薬学的に許容される塩として酸付加塩の形体をとってもよい。適当な酸付加塩としては、無機酸塩では例えば塩酸塩、硫酸塩、臭化水素酸塩、硝酸塩、リン酸塩等、有機酸塩では例えば酢酸塩、シュウ酸塩、プロピオン酸塩、グリコール酸塩、乳酸塩、ピルビン酸塩、マロン酸塩、コハク酸塩、マレイン酸塩、フマル酸塩、リンゴ酸塩、酒石酸塩、クエン酸塩、安息香酸塩、桂皮酸塩、メタンスルホン酸塩、ベンゼンスルホン酸塩、p−トルエンスルホン酸塩、サリチル酸塩等が挙げられる。
【0043】
次に、上記の複素環化合物を哺乳類とりわけ人に適用する場合の投与方法、剤型、投与量について説明する。これらの複素環化合物は、経口的又は非経口的に投与可能である。経口投与の剤型としては、錠剤、コーティング錠剤、散剤、顆粒剤、カプセル剤、マイクロカプセル剤、シロップ剤等が使用できる。また、非経口投与の剤型としては、注射剤(用時溶解して用いる注射用凍結乾燥剤を含む)、貼付剤、坐剤等が使用できる。
【0044】
これらの剤型の調製は、薬学的に許容される賦形剤、結合剤、滑沢剤、崩壊剤、懸濁化剤、乳化剤、防腐剤、安定化剤及び分散剤、例えば乳糖、白糖、でんぷん、デキストリン、結晶セルロース、カオリン、炭酸カルシウム、タルク、ステアリン酸マグネシウム、蒸留水又は生理用食塩水を用いて行うことができる。投与量は患者の症状、年齢、体重等に応じて異なるが、成人に対する一日量として0.1〜50mgを1〜3回に分けて投与することができる。
【0045】
<実施形態1:抗鬱剤>
本実施形態に係る抗鬱剤は、既述した特定の構造(一般式(I)の構造)の複素環化合物を含む抗鬱剤である。
【0046】
本発明者らは、上記の特定の構造の複素環化合物が実施例で後述するように強制水泳試験や尾懸垂試験において抗うつ作用を示すことを明らかにした。また、上記の化合物誘導体を用いて、抗うつ作用のスクリーニングを実施したところ、後述するジベンジル基やインダン環をスピロ環形成したアザインドリジノン誘導体が、強い抗うつ作用があることを見出した。上記の化合物は、セロトニン再取り込み阻害作用を持たない新規の機序に基づいて抗鬱効果を示し、また既に前臨床試験において極めて安全性の高い化合物であることが確認されている。
【0047】
すなわち、本実施形態に係る抗鬱剤は、優れた抗鬱効果を奏する。さらに具体的には、本実施形態に係る抗鬱剤は、哺乳動物の鬱病、躁鬱病、強迫性障害、パニック障害、不安障害からなる群から選ばれる1種以上の気分障害を抑制する機能を有する。
【0048】
なお、本実施形態に係る抗鬱剤に含まれる複素環化合物は、以下に列挙する化合物であることが好ましい。これらの化合物については、後述する実施例で示すように、抗鬱作用を試験するための代表的な試験方法であるマウス尾懸垂試験において、優れた抗鬱作用を示す試験結果が得られることを確認しているためである。
【0049】
3,3−ジベンジルイミダゾ[1,2−a]ピリジン−2(3H)−オン、スピロ[イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−インダン]、3,3−ジプロピルイミダゾ[1,2−a]ピリジン−2(3H)−オン、3,3−ジブチルイミダゾ[1,2−a]ピリジン−2(3H)−オン、5,5−ジベンジルイミダゾ[2,1−b]チアゾール−6(5H)−オン、3,3−ジベンジルイミダゾ[1,2−a]ピリミジン−2(3H)−オン、スピロ[イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−(5’−メトキシインダン)]、スピロ[イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−(4’−シアノインダン)]、スピロ[イミダゾ[2,1−a]イソキノリン−2(3H)−オン−3,2’−インダン]、スピロ[イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−((1,2,5−チアジアゾ)[4,5−c]インダン)]、スピロ[イミダゾ[1,2−a]ピリミジン−2(3H)−オン−3,2’−インダン]、スピロ[イミダゾ[2,1−a]イソキノリン−2(3H)−オン−3,4’−(1’−シクロペンテン)]、3,3−ビス(4−クロロベンジル)イミダゾ[1,2−a]ピリジン−2(3H)−オン、8−シクロプロピルメチルオキシ−3,3−ジアリルイミダゾ[1,2−a]ピリジン−2(3H)−オン、スピロ[イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−(4’−ヒドロキシインダン)]、スピロ[8−ヒドロキシ−イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−インダン]、スピロ[8−メトキシ−イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,4’−(1’−シクロペンテン)]、スピロ[8−シクロプロピルメチルオキシイミダゾ[1,2−a]ピリジン−2(3H)−オン−3,4’−(1’−シクロペンテン)]
【0050】
なお、本実施形態に係る抗鬱剤は、経口投与型であることが好ましい。なお、この抗鬱剤は貼付剤としても好適に使用できる。すなわち、抗鬱剤の剤型は、錠剤、コーティング錠剤、散剤、顆粒剤、カプセル剤、マイクロカプセル剤、シロップ剤等であることが好ましい。抗鬱剤が経口投与型であれば、ヒトをはじめとする哺乳動物への投与が容易になるためである。
【0051】
また、本実施形態に係る抗鬱剤の有効経口投与量は、体重1kgあたり0.0005mg以上であることが好ましく、体重1kgあたり0.005mg以上であればより好ましく、体重1kgあたり0.05mg以上であれば特に好ましい。抗鬱剤の有効経口投与量がこれらの下限以上であれば、ヒトをはじめとする哺乳動物への抗鬱作用が向上するためである。
【0052】
<実施形態2:脳保護剤>
本実施形態に係る脳保護剤は、既述した特定の構造(一般式(I)の構造)の複素環化合物を含む脳保護剤である。
【0053】
本発明者らは、上記の特定の構造の複素環化合物が実施例で後述するようにスナネズミ一過性前脳虚血モデルにおける海馬CA1領域の遅延神経細胞死軽減効果を指標とする試験において脳保護作用を示すことを明らかにした。また、上記の化合物誘導体を用いて、脳保護作用のスクリーニングを実施したところ、後述するジベンジル基やインダン環をスピロ環形成したアザインドリジノン誘導体が、強い脳保護作用を持つことを見出した。上記の化合物は、抗酸化作用とは異なる新規の機序に基づいて脳保護効果を示し、また既に前臨床試験において極めて安全性の高い化合物であることが確認されている。
【0054】
上記の複素環化合物を含む脳保護剤は、抗酸化作用を有する脳保護剤であるエダラボンとは異なる機序に基づき低用量で効果があることから、エダラボンで報告されている腎機能障害等の各種副作用の発現を抑えた新規な脳保護剤である。
【0055】
すなわち、本実施形態に係る脳保護剤は、優れた脳保護効果を奏する。さらに具体的には、本実施形態に係る脳保護剤は、哺乳動物の一過性脳虚血発作、脳出血、くも膜下出血、頭蓋内出血、脳梗塞、高血圧性脳症からなる群から選ばれる1種以上の脳血管障害を抑制する機能を有する。
【0056】
なお、本実施形態に係る脳保護剤に含まれる複素環化合物は、スピロ[イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−インダン]であることが好ましい。この化合物については、後述する実施例で示すように、脳保護作用を試験するための代表的な試験方法であるスナネズミ一過性前脳虚血モデルにおける海馬CA1領域の遅延神経細胞死軽減効果を指標とする試験において、優れた脳保護作用を示す試験結果が得られることを確認しているためである。
【0057】
なお、本実施形態に係る脳保護剤は、経口投与型であることが好ましい。なお、この脳保護剤は貼付剤としても好適に使用できる。すなわち、脳保護剤の剤型は、錠剤、コーティング錠剤、散剤、顆粒剤、カプセル剤、マイクロカプセル剤、シロップ剤等であることが好ましい。脳保護剤が経口投与型であれば、ヒトをはじめとする哺乳動物への投与が容易になるためである。
【0058】
また、本実施形態に係る脳保護剤の有効経口投与量は、体重1kgあたり0.005mg以上であることが好ましく、体重1kgあたり0.05mg以上であればより好ましく、体重1kgあたり0.5mg以上であれば特に好ましい。脳保護剤の有効経口投与量がこれらの下限以上であれば、ヒトをはじめとする哺乳動物への脳保護作用が向上するためである。
【0059】
<実施形態3:アミロイドβ沈着抑制剤>
本実施形態に係るアミロイドβ沈着抑制剤は、既述した特定の構造(一般式(I)の構造)の複素環化合物を含むアミロイドβ沈着抑制剤である。
【0060】
本発明者らは、上記の特定の構造の複素環化合物が実施例で後述するように海馬におけるアミロイドβの免疫陽性反応試験においてアミロイドβ沈着抑制作用を示すことを明らかにした。また、上記の化合物誘導体を用いて、アミロイドβ沈着抑制作用のスクリーニングを実施したところ、後述するジベンジル基やインダン環をスピロ環形成したアザインドリジノン誘導体が、強いアミロイドβ沈着抑制作用を持つことを見出した。上記の化合物は、抗酸化作用とは異なる新規の機序に基づいてアミロイドβ沈着抑制効果を示し、また既に前臨床試験において極めて安全性の高い化合物であることが確認されている。
【0061】
上記の複素環化合物を含むアミロイドβ沈着抑制剤は、カレーに多く含まれるウコン(Curcuma longa)の成分であり、抗酸化作用を有するcurcuminとは異なる機序に基づき低用量で効果があることから、curcuminとは作用機序の異なる新規なアミロイドβ沈着抑制剤である。
【0062】
すなわち、本実施形態に係るアミロイドβ沈着抑制剤は、優れたアミロイドβ沈着抑制効果を奏する。さらに具体的には、本実施形態に係るアミロイドβ沈着抑制剤は、哺乳動物のアミロイドーシス、脳アミロイド血管炎、白内障、加齢黄斑変性症、リウマチ、骨粗鬆症、メタボリックシンドローム、しわ、脱毛、からなる群から選ばれる1種以上のアミロイド病理を抑制する機能を有する。
【0063】
なお、本実施形態に係るアミロイドβ沈着抑制剤に含まれる複素環化合物は、スピロ[イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−インダン]であることが好ましい。この化合物については、後述する実施例で示すように、アミロイドβ沈着抑制作用を試験するための代表的な試験方法である海馬におけるアミロイドβの免疫陽性反応試験において、優れたアミロイドβ沈着抑制作用を示す試験結果が得られることを確認しているためである。
【0064】
なお、本実施形態に係るアミロイドβ沈着抑制剤は、経口投与型であることが好ましい。なお、このアミロイドβ沈着抑制剤は貼付剤としても好適に使用できる。すなわち、アミロイドβ沈着抑制剤の剤型は、錠剤、コーティング錠剤、散剤、顆粒剤、カプセル剤、マイクロカプセル剤、シロップ剤等であることが好ましい。アミロイドβ沈着抑制剤が経口投与型であれば、ヒトをはじめとする哺乳動物への投与が容易になるためである。
【0065】
また、本実施形態に係るアミロイドβ沈着抑制剤の有効経口投与量は、体重1kgあたり0.0005mg以上であることが好ましい。アミロイドβ沈着抑制剤の有効経口投与量がこの下限以上であれば、ヒトをはじめとする哺乳動物へのアミロイドβ沈着抑制作用が向上するためである。
【0066】
<実施形態4:老化抑制剤>
本実施形態に係る老化抑制剤は、既述した特定の構造(一般式(I)の構造)の複素環化合物を含む老化抑制剤である。
【0067】
本発明者らは、上記の特定の構造の複素環化合物が実施例で後述するように老化促進マウスの老化指標(Grading Score)の測定試験において老化抑制作用を示すことを明らかにした。また、上記の化合物誘導体を用いて、老化抑制作用のスクリーニングを実施したところ、後述するジベンジル基やインダン環をスピロ環形成したアザインドリジノン誘導体が、強い老化抑制作用を持つことを見出した。上記の化合物は、抗酸化作用とは異なる新規の機序に基づいて老化抑制効果を示し、また既に前臨床試験において極めて安全性の高い化合物であることが確認されている。
【0068】
上記の複素環化合物を含む老化抑制剤は、抗酸化作用を有するウーロン茶またはdeprenylとは異なる機序に基づき低用量で効果があることから、ウーロン茶またはdeprenylとは作用機序の異なる新規な老化抑制剤である。すなわち、上記の複素環化合物を用いれば、抗酸化作用とは異なる新規の機序を有する、極めて低用量で効果が上がる抗老化薬を開発することができる。
【0069】
すなわち、本実施形態に係る老化抑制剤は、優れた老化抑制効果を奏する。また、本実施形態に係る老化抑制剤は、ヒトをはじめとする哺乳動物の老化を抑制する結果、ヒトをはじめとする哺乳動物の平均寿命を延長する機能を有する。
【0070】
なお、本実施形態に係る老化抑制剤に含まれる複素環化合物は、スピロ[イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−インダン]であることが好ましい。この化合物については、後述する実施例で示すように、老化抑制作用を試験するための代表的な試験方法である老化促進マウスの老化指標(Grading Score)の測定試験において、優れた老化抑制作用を示す試験結果が得られることを確認しているためである。また、この化合物については、後述する実施例で示すように、老化促進マウスの平均寿命の延長作用を示すことを確認している。
【0071】
なお、本実施形態に係る老化抑制剤は、経口投与型であることが好ましい。なお、この老化抑制剤は貼付剤としても好適に使用できる。すなわち、老化抑制剤の剤型は、錠剤、コーティング錠剤、散剤、顆粒剤、カプセル剤、マイクロカプセル剤、シロップ剤等であることが好ましい。老化抑制剤が経口投与型であれば、ヒトをはじめとする哺乳動物への投与が容易になるためである。
【0072】
また、本実施形態に係る老化抑制剤の有効経口投与量は、体重1kgあたり0.0005mg以上であることが好ましく、体重1kgあたり0.005mg以上であることがより好ましく、体重1kgあたり0.05mg以上であることが特に好ましい。老化抑制剤の有効経口投与量がこれらの下限以上であれば、ヒトをはじめとする哺乳動物への老化抑制作用が向上するためである。
【0073】
また、老化抑制剤の有効経口投与量は、平均寿命の延長を目的とする場合には、体重1kgあたり0.005mg以上であることが好ましい。老化抑制剤の有効経口投与量がこの下限以上であれば、ヒトをはじめとする哺乳動物の平均寿命の延長作用が向上するためである。
【0074】
以上、本発明の実施形態について述べたが、これらは本発明の例示であり、上記以外の様々な構成を採用することもできる。
【0075】
例えば、上記実施の形態では経口投与の場合の有効投与量について好ましい範囲を規定したが、他の投与形態の場合にはその形態に応じた別の範囲の有効投与量であってもよい。例えば、注射による投与を行う場合には、適宜好ましい範囲の有効投与量により投与することができる。また、投与形態に応じて、有効投与量だけでなく、投与間隔についても適宜好ましい範囲の投与間隔により投与することができる。
【実施例】
【0076】
以下、本発明を実施例によりさらに説明するが、本発明はこれらに限定されるものではない。
【0077】
<実施例1:抗鬱作用>
実施形態1で説明した特定の構造の複素環化合物に抗鬱作用があることを確認するために、ICR系マウス(雄)を用い、Tail suspension test(尾懸垂試験)で検討した。まず、検体を0.001、0.01及び0.1mg/kgの用量で経口投与した1時間後に、マウスの尾の先端から約1cmの部位をクリップではさみ、吊り下げた状態で6分間の観察を実施し、後半4分間の無動時間を測定した。無動時間が90秒以下になった場合を抗鬱効果有りと判定した。
【0078】
【表1】

【0079】
上記のように、いずれの化合物についても、マウスの尾懸垂試験の無動時間は90秒以下であるため、抗鬱効果が有ると認められる。すなわち、この尾懸垂試験により、実施形態1で説明した特定の構造の複素環化合物に抗鬱作用があることを確認することができた。なお、上記の化合物の構造および名称については、後述する製造例において説明する。
【0080】
<実施例2:脳保護作用>
実施形態2で説明した特定の構造の複素環化合物に脳保護作用があることを確認するために、化合物24の脳保護効果を、スナネズミ一過性前脳虚血モデルにおける海馬CA1領域の遅延神経細胞死軽減効果を指標として検討した。
【0081】
スナネズミ(雄、体重55〜80g前後)を2%ハロタン吸入麻酔下に両側総頸動脈露出マイクロクリップで挟んで血流を停止し、脳を虚血した。虚血4分後にマイクロクリップをはずして脳虚血を再還流し、ただちに麻酔を停止した。再還流4日後に脳を摘出、ホルマリン固定後、厚さ4μmの薄切標本を作製し、hematoxylin−eosin染色を行った。顕微鏡下にマイクロメーターを用いて各標本の両面海馬CA1全領域における生存細胞数を数え、生存細胞数/0.5mmとして算出した。
【0082】
化合物24は、1%HPCに懸濁し、脳虚血1時間前および再還流5時間後に経口投与し、さらに翌日から再還流3日後まで2回/日、連日経口投与した。海馬CA1領域生存細胞数は平均値±標準誤差で表し、有意差検定にはMann−Whitney’s U testを用いた。また、横軸は、化合物24の有効経口投与量を示し、縦軸は、生存細胞数/0.5mmを示す。
【0083】
偽手術群(n=7)の海馬CA1領域における生存細胞数は117.3±2.3/0.5mmであった。これに対して溶媒対照群(n=7)では18.1±1.0/0.5mmを示し、脳虚血・再還流による海馬CA1領域における生存細胞数の著名な減少すなわち遅延神経細胞死の発現が認められた。
【0084】
図1は、スナネズミ一過性前脳虚血モデルにおける化合物24の海馬CA1領域保護効果について説明するためのグラフである。なお、図1において、**は、p<0.01 vs Controlを示す。
【0085】
図2は、スナネズミ一過性前脳虚血モデルにおける海馬CA1領域の遅延神経細胞に対する脳保護効果を説明するための写真である。左側の写真は、化合物24を投与しない場合であり、右側の写真は化合物24を投与した場合である。
【0086】
化合物24を0.001〜20mg/kg経口投与すると、0.01mg/kg(n=7)、0.1mg/kg(n=8)、1mg/kg(n=9)の各投与群で、図1および図2に示すように、海馬CA1領域における生存細胞数の用量依存的かつ有意な増加(**)が認められた(生存細胞数:0.01mg/kg;27.8±1.9/0.5mm、0.1mg/kg;32.5±9.4/0.5mm、1mg/kg;44.3±9.4/0.5mm)。
【0087】
本結果から、化合物24には神経細胞死を抑制し、脳保護剤としての有用性を有することが示された。そのため、化合物24は、脳保護剤として、一過性脳虚血発作、脳出血、くも膜下出血、脳動静脈奇形を伴う頭蓋内出血、脳梗塞、高血圧性脳症等の脳血管障害に有効である。
【0088】
すなわち、このスナネズミ一過性前脳虚血モデルにおける海馬CA1領域の遅延神経細胞死軽減効果を指標とした試験により、実施形態2で説明した特定の構造の複素環化合物に脳保護作用があることを確認することができた。
【0089】
<実施例3:アミロイドβ沈着抑制作用>
実施形態3で説明した特定の構造の複素環化合物にアミロイドβ沈着抑制作用があることを確認するために、アミロイドβ沈着に対する化合物24の効果を検討した。
【0090】
老化促進マウス(SAMP8)(雄、実験開始時8ヶ月齢)を実験に用いた。化合物24は約0.1mg/kg/dayの用量で飲水投与した。投与8週間後にマウスの脳を摘出し、メタカーン固定液(メタノール:クロロホルム:酢酸=6:3:1)で固定し、パラフィン包埋し、ミクロトームを用いて8mmの厚さで切片を作製した。
【0091】
切片はVECTASTATIN ABCキットを用いてストレプトアビジンービオチン法で免疫染色を行った。10%ヤギ正常血清で1時間インキュベートした後、抗アミロイドβ(Aβ)抗体をPBSで10倍に希釈して、4℃で一晩インキュベートした。翌日、PBSで洗浄後、ビオチン化抗ウサギ2次抗体で1.5時間インキュベートしたあと、PBSで洗浄し、ペルオキシダーゼ標識ストレプトアビジンで1.5時間インキュベートした。免疫反応は、DABで可視化して、標本を作製した。
【0092】
顕微鏡観察では、海馬における抗Aβ抗体の免疫陽性顆粒の数を測定した。Aβ免疫陽性反応は、海馬の細胞質の褐色の沈着として認められた。1個体に付き1切片を測定した。
【0093】
図3は、老化促進マウス(SAMP8)マウスにおけるアミロイドβの抗体に陽性の細胞の数に対する化合物24の影響を説明するための写真である。上欄の写真は、8ヶ月齢の老化促進マウス(SAMP8)に水道水を2ヶ月間飲水投与した場合の海馬の抗アミロイドβ染色像の写真であり、下欄の写真は、同様に化合物24を体重1kgあたり0.1mgの有効経口投与量により2ヶ月間投与した老化促進マウス(SAMP8)群の海馬の抗アミロイドβ染色像の写真である。
【0094】
また、図4は、老化促進マウス(SAMP8)におけるアミロイドβの抗体に陽性の細胞の数に対する化合物24の影響を説明するためのグラフである。横軸は、化合物24の有効経口投与量を示し、縦軸は、アミロイドβの抗体に陽性の顆粒数を示す。化合物24を投与しなかった老化促進マウス(SAMP8)のN数は3であり、化合物24を体重1kgあたり0.1mgの有効経口投与量で投与した老化促進マウス(SAMP8)のN数は6である。
【0095】
図3および図4に示すように、8ヶ月齢の老化促進マウス(SAMP8)に水道水を2ヶ月間飲水投与した場合、海馬においてアミロイドβの免疫陽性反応が認められた。それに対して、化合物24を約0.1mg/kg/dayの用量で2ヶ月間飲水投与すると、アミロイドβ免疫陽性反応が減少していた。アミロイドβ免疫陽性顆粒数を測定したところ、化合物24の投与によって有意(*)に減少していた。
【0096】
上記のように、化合物24は、アミロイドβ沈着を抑制する。ここで、化合物24が治療に好適に用いられるアミロイド病理としては、アミロイドβが疾患の一因であると想定されている、白内障、加齢黄斑変性症、リウマチ、骨粗鬆症、メタボリックシンドローム、しわ、脱毛が挙げられる。また、化合物24は、アミロイドベータ沈着を抑制するため、アミロイドが繊維化して沈着するアミロイドーシス、脳アミロイド血管炎(アミロイドアンギオパシー)についても効果がある。
【0097】
すなわち、このアミロイドβの免疫陽性反応試験により、実施形態3で説明した特定の構造の複素環化合物にアミロイドベータ沈着抑制作用があることを確認することができた。
【0098】
<実施例4:老化抑制作用>
実施形態4で説明した特定の構造の複素環化合物に老化抑制作用があることを確認するために、老化促進マウス(SAM)の毛並み悪化抑制及びSAMの平均寿命の延長に対する化合物24の効果を検討した。
【0099】
老化促進マウス(SAMP8)(雄、実験開始時8ヶ月齢)を実験に使用した。
【0100】
老化促進マウスへの薬物投与については、化合物24を水道水に溶解して、0.001、0.01、0.1 mg/kg/dayの用量で飲水投与した。コントロールには、水道水を飲水投与した。
【0101】
老化促進マウスの老化の程度を示す指標として、Grading score(Takeda et al., 1981)を、短期試験では、上記の飲水投与開始0、4、8、12、16週後に測定し、長期試験では、上記の飲水投与開始12、16、20、24、28、32週後に測定した。
【0102】
図5は、老化促進マウス(SAMP8)の老化指標(Grading score)に対する化合物24の影響を説明するためのグラフである。図5(A)は短期試験の結果を示し、図5(B)は長期試験の結果を示す。なお、いずれのグラフにおいても、横軸は、投与後の週を示し、縦軸は、老化指標(Grading score)を示す。
【0103】
上記の測定の結果、図5(A)に示すように、老化促進マウス(SAMP8)の水投与群では、飲水投与開始12週目以降、老化の指標であるGrading scoreの増加が認められたが、化合物24を飲水投与した群では、Grading scoreの増加が抑制された。この効果は、図5(A)に示すように、0.001、0.01および0.1 mg/kg/dayの有効経口投与量で化合物24を飲水投与した群で16週目に有意差(*)が確認され、0.1 mg/kg/day の有効経口投与量で化合物24を飲水投与した群で顕著だった。
【0104】
また、図5(B)に示すように、0.01mg/kg/dayの有効経口投与量で化合物24を飲水投与した群で20〜32週目に有意差(*,**)が確認され、0.1mg/kg/dayの有効経口投与量で化合物24を飲水投与した群で16〜32週目に有意差(*,**)が確認された。これらの測定結果から、化合物24は、老化促進マウス(SAMP8)の老化の進行を有意に抑制した。
【0105】
また、図6は、老化促進マウス(SAMP8)の生存率に対する化合物24の影響を説明するためのグラフである。横軸は、マウスの月齢を示し、縦軸は、生存率(%)を示す。
【0106】
上記の測定の結果、図6に示すように、対照群である老化促進マウス(SAMP8)の水道水投与群に対して、0.01 mg/kg/dayの有効経口投与量で化合物24を飲水投与した群は、いずれの月齢においても平均寿命が延長されている。すなわち、化合物24は、老化促進マウス(SAMP8)の平均寿命を延長することが確認された。
【0107】
すなわち、上記のように老化促進マウス(SAM)の毛並み悪化抑制及びSAMの平均寿命の延長に対する化合物24の効果を検討したことにより、実施形態4で説明した特定の構造の複素環化合物に老化抑制作用および平均寿命延長作用があることを確認することができた。
【0108】
<実施形態で列挙した化合物の製造方法>
以下、特許文献1の実施例の方法を用いて製造した一般式(I)で示される複素環化合物の幾つかの例を示す。具体的には、国際公開第01/09131号パンフレット(特許文献1)および国際公開第2002/060907号パンフレットを参照して合成した。
【0109】
<製造例1>
下記の一般式で構造が示される、3,3−ジベンジル−8−イソプロポキシイミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物1)の製造例を以下に示す。
【0110】
【化31】

【0111】
金属ナトリウム81mgを無水エタノール3.0mlに加え、室温で1時間撹拌した後、2−アミノ−3−イソプロポキシ−1−(エトキシカルボニルメチル)ピリジニウムブロマイド586mg(1.77mmol)を加え、さらに室温で1時間撹拌した。次いで、その反応混合物にベンジルブロミド605mg(3.54mmol)を0℃にて加え、室温で4時間撹拌したのち析出した結晶をロ取し、乾燥した。得た結晶をエタノールより再結晶し、標記化合物588mg(収率92%)を得た。
【0112】
得られた化合物の各種分析結果を、以下に示す。これらの分析結果から、獲られた化合物が目的の化合物であることを確認した。
【0113】
融点:247−248℃
NMR(CDCl3)δ:1.03(6H,d,J=6Hz),3.15(2H,d,J=14Hz),3.56(2H,d,J=14Hz),4.60(1H,sept.,J=6Hz),6.48(1H,t,J=7Hz),6.79(1H,d,J=8Hz),6.9−7.2(11H,m)
MS m/z:372(M+)
【0114】
<製造例2>
製造例1と同様にして、相当する出発原料から対応する一般式で構造が示される化合物2〜40をそれぞれ製造した。また、得られた化合物の各種分析結果を、対応箇所に示す。これらの分析から、得られた化合物が目的の化合物2〜40であることをそれぞれ確認した。
【0115】
・3,3−ジベンジル−8−メトキシイミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物2)
【化32】

融点:274−275℃.
NMR(CDCl3)δ:3.17(2H,d,J=14Hz),3.56(2H,d,J=14Hz),3.69(3H,s),6.49(1H,t,J=7Hz),6.67(1H,d,J=8Hz),6.9−7.2(11H,m).
MS m/z:344(M+).
【0116】
・3,3−ジベンジル−8−シクロプロピルメチルオキシイミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物3)
【化33】

融点:236−237℃.
NMR(CDCl3)δ:0.12(2H,q,J=5Hz),0.45(2H,q,J=6Hz),0.99(1H,m),3.16(2H,d,J=14Hz),3.55(2H,d,J=14Hz),3.73(2H,d,J=7Hz),6.47(1H,t,J=7Hz),6.76(1H,d,J=8Hz),7.0−7.2(11H,m).
MS m/z:384(M+).
【0117】
・3,3−ジベンジル−6−クロロイミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物4)
【化34】

融点:246−248℃.
NMR(CDCl3)δ:3.16(2H,d,J=14Hz),3.55(2H,d,J=14Hz),6.70(1H,d,J=10Hz),7.0−7.2(12H,m).
MS m/z:348(M+).
【0118】
・8−アリルオキシ−3,3−ジベンジルイミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物5)
【化35】

融点:214−215℃.
NMR(CDCl3)δ:3.16(2H,d,J=14Hz),3.56(2H,d,J=14Hz),4.4−4.5(2H,m),5.0−5.2(2H,m),5.7−5.9(1H,m),6.47(1H,t,J=7Hz),6.74(1H,d,J=8Hz),6.9−7.2(11H,m).
MS m/z:370(M+).
【0119】
・3,3−ジベンジル−8−ベンジルオキシイミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物6)
【化36】

融点:240−241℃.
NMR(CDCl3)δ:3.17(2H,d,J=14Hz),3.57(2H,d,J=14Hz),5.03(2H,s),6.39(1H,t,J=8Hz),6.65(1H,d,J=8Hz),7.0−7.2(16H,m).
MS m/z:420(M+).
【0120】
・8−ベンジルオキシ−3,3−ビス(1−フェニルエチル)イミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物7)
【化37】

融点:234−235℃.
NMR(CDCl3)δ:1.52(6H,d,J=7Hz),3.51(2H,q,J=7Hz),5.11(2H,s),6.14(1H,t,J=7Hz),6.41(1H,d,J=7Hz),6.63(1H,d,J=8Hz),7.0−7.2(15H,m).
MS m/z:448(M+).
【0121】
・3,3−ジベンジル−8−メチルイミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物8)
【化38】

融点:262−263℃.
NMR(CDCl3)δ:2.05(3H,s),3.31(2H,d,J=14Hz),3.56(2H,d,J=14Hz),6.60(1H,t,J=7Hz),6.9−7.2(12H,m).
MS m/z:328(M+).
・3,3−ジベンジル−5,7−ジメチルイミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物9)
【化39】

融点:237−238℃.
NMR(CDCl3)δ:2.07(3H,s),2.80(3H,s),3.40(2H,d,J=15Hz),3.71(2H,d,J=15Hz),6.11(1H,s),6.34(1H,s),7.0−7.2(10H,m).
MS m/z:342(M+).
【0122】
・3,3−ジベンジルイミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物10)
【化40】

融点:>300℃.
NMR(DMSO−D6)δ:3.39(4H,s),6.60(1H,d,J=9Hz),6.8−7.2(11H,m),7.56(1H,t,J=7Hz),8.75(1H,d,J=7Hz).
MS m/z:314(M+).
【0123】
・3,3−ジベンジル−8−シクロペンチルオキシイミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物11)
【化41】

融点:268−269℃.
NMR(CDCl3)δ:1.4−1.7(8H,m),3.15(2H,d,J=14Hz),3.55(1H,d,J=14Hz),4.7−4.9(1H,m),6.47(1H,t,J=7Hz),6.72(1H,d,J=8Hz),6.9−7.2(11H,m).
MS m/z:398(M+).
【0124】
・3,3−ジベンジル−6,8−ジクロロイミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物12)
【化42】

融点:260−261℃.
NMR(CDCl3)δ:3.17(2H,d,J=14Hz),3.55(2H,d,J=14Hz),6.9−7.3(11H,m),7.41(1H,d,J=2Hz).
MS m/z:382(M+).
【0125】
・3,3−ジベンジル−8−クロロ−6−トリフルオロメチルイミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物13)
【化43】

融点:234−236℃.
NMR(CDCl3)δ:3.22(2H,d,J=14Hz),3.55(2H,d,J=14Hz),6.9−7.0(4H,m),7.1−7.4(7H,m),7.51(1H,d,J=2Hz).
MS m/z:416(M+).
【0126】
・8−ベンジルオキシ−3,3−ビス(3−メチルベンジル)イミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物14)
【化44】

融点:233−235℃.
NMR(CDCl3)δ:2.20(6H,s),3.14(2H,d,J=14Hz),3.48(2H,d,J=14Hz),5.05(2H,s),6.38(1H,t,J=7Hz),6.68(1H,d,J=8Hz),6.7−7.3(14H,m).
MS m/z:448(M+).
【0127】
・8−メチル−3,3−ビス(4−ピリジルメチル)イミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物15)
【化45】

融点:228−230℃.
NMR(CDCl3)δ:2.01(3H,s),3.13(2H,d,J=14Hz),3.60(2H,d,J=14Hz),6.60(1H,t,J=7Hz),6.95(4H,d,J=6Hz),7.22(1H,d,J=7Hz),7.46(1H,d,J=7Hz),8.40(4H,d,J=6Hz).
MS m/z:330(M+).
【0128】
・3,3−ビス(4−フルオロベンジル)イミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物16)
【化46】

融点:290−292℃.
NMR(CDCl3)δ:3.13(2H,d,J=14Hz),3.56(2H,d,J=14Hz),6.62(1H,t,J=7Hz),6.7−6.9(5H,m),6.9−7.1(4H,m),7.39(1H,t,J=7Hz),7.52(1H,brd,J=7Hz).
MS m/z:350(M+).
【0129】
・3,3−ビス(4−ジメチルアミノベンジル)イミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物17)
【化47】

融点:>300℃.
NMR(CDCl3)δ:2.86(12H,s),3.09(2H,d,J=14Hz),3.37(2H,d,J=14Hz),6.4−6.6(5H,m),6.7−6.9(5H,m),7.2−7.3(1H,m),7.37(1H,t,J=7Hz).
MS m/z:400(M+).
【0130】
・3,3−ビス(3−クロロベンジル)イミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物18)
【化48】

融点:271−272℃.
NMR(CDCl3)δ:3.14(2H,d,J=14Hz),3.53(2H,d,J=14Hz),6.66(1H,t,J=7Hz),6.80(1H,d,J=7Hz),6.9−7.2(8H,m),7.43(1H,t,J=7Hz),7.51(1H,brd,J=7Hz).
MS m/z:382(M+).
【0131】
・3,3−ビス(4−メトキシベンジル)イミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物19)
【化49】

融点:248−251℃.
NMR(CDCl3)δ:3.66(6H,s),3.67(2H,d,J=15Hz),4.00(2H,d,J=15Hz),6.59(4H,d,J=9Hz),6.93(4H,d,J=9Hz),7.50(1H,1,J=7Hz),6.71(1H,d,J=7Hz),7.91(1H,t,J=7Hz),9.78(1H,d,J=7Hz).
MS m/z:374(M+).
【0132】
・3,3−ビス(4−ビフェニルメチル)イミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物20)
【化50】

融点:>300℃.
NMR(CDCl3)δ:3.25(2H,d,J=14Hz),3.62(2H,d,J=14Hz),6.58(1H,t,J=7Hz),6.77(1H,d,J=7Hz),7.11(4H,d,J=7Hz),7.3−7.6(16H,m).
MS m/z:466(M+).
【0133】
・3,3−ビス(4−シアノベンジル)イミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物21)
【化51】

融点:294℃(分解).
NMR(CDCl3)δ:3.19(2H,d,J=14Hz),3.70(2H,d,J=14Hz),6.6−6.8(2H,m),7.13(4H,d,J=7Hz),7.43(1H,t,J=7Hz),7.45(4H,d,J=7Hz),7.62(1H,brd,J=7Hz).
MS m/z:364(M+).
【0134】
・3,3−ビス(4−ヒドロキシベンジル)イミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物22)
【化52】

融点:276.5−277.5℃.
NMR(CD3OD−CDCl3(1:1))δ:3.62(2H,d,J=14Hz),3.66(2H,d,J=14Hz),6.58(4H,d,J=9Hz),6.78(4H,d,J=9Hz),7.17(1H,d,J=7Hz),7.63(1H,t,J=7Hz),8.12(1H,t,J=7Hz),9.25(1H,d,J=7Hz).
MS m/z:346(M+).
【0135】
・3,3−ジアリルイミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物23)
【化53】

融点:64−66℃.
NMR(CDCl3)δ:2.56(2H,dd,J=9Hz,J=14Hz),2.86(2H,dd,J=6Hz,J=14Hz),4.99(2H,dd,J=1Hz,J=7Hz),5.04(2H,d,J=1Hz),5.4−5.6(2H,m),6.67(1H,t,J=7Hz),7.17(1H,d,J=7Hz),7.52(1H,d,J=7Hz),7.59(1H,d,J=7Hz).
MS m/z:214(M+).
【0136】
・スピロ[イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−インダン](化合物24)
【化54】

融点:206℃(分解).
NMR(CDCl3)δ:3.16(2H,d,J=16Hz),3.89(2H,d,J=16Hz),6.49(1H,t,J=7Hz),7.1−7.2(2H,m),7.2−7.3(4H,m),7.61(1H,t,J=7Hz).
MS m/z:236(M+).
【0137】
・3,3−ジアリル−8−ベンジルオキシイミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物25)
【化55】

融点:160−162℃.
NMR(CDCl3)δ:2.54(2H,dd,J=8Hz,J=14Hz),2.86(2H,dd,J=6Hz,J=14Hz),4.96(2H,dd,J=1Hz,J=5Hz),5.01(2H,d,J=1Hz),5.29(2H,s),5.4−5.6(2H,m),6.53(1H,dd,J=7Hz,J=8Hz),6.94(1H,d,J=7Hz),7.16(1H,d,J=8Hz),7.3−7.5(5H,m).
MS m/z:320(M+).
【0138】
・3,3−ビス(3−フェニル−1−プロピル)イミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物26)
【化56】

融点:227−228℃.
NMR(CDCl3)δ:0.9−1.1(2H,m),1.4−1.6(2H,m),1.6−1.8(2H,m),2.0−2.2(2H,m),2.3−2.5(2H,m),2.5−2.7(2H,m),6.61(1H,t,J=7Hz),7.0−7.1(4H,m),7.1−7.3(8H,m),7.58(1H,t,J=7Hz).
MS m/z:370(M+).
【0139】
・スピロ[イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−[2,3]ジヒドロフェナレン](化合物27)
【化57】

融点:262℃(分解).
NMR(CDCl3):3.12(2H,d,J=17Hz),3.98(2H,d,J=17Hz),6.18(1H,t,J=7Hz),6.48(1H,d,J=7Hz),7.24(1H,d,J=7Hz),7.34(2H,d,J=7Hz),7.4−7.6(3H,m),7.86(2H,d,J=7Hz).
MS m/z:286(M+).
【0140】
・3,3−ビス(2,4−ジフルオロベンジル)イミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物28)
【化58】

融点:269−271℃.
NMR(CDCl3)δ:3.38(2H,d,J=14Hz),3.47(2H,d,J=14Hz),6.5−6.7(3H,m),6.7−6.8(3H,m),7.2−7.5(3H,m),7.6−7.7(1H,m).
MS m/z:368(M+).
【0141】
・3,3−ジプロピルイミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物29)
【化59】

融点:73−75℃.
NMR(CDCl3)δ:0.7−0.9(8H,m),1.1−1.3(2H,m),1.6−1.8(2H,m),2.0−2.2(2H,m),6.73(1H,t,J=7Hz),7.19(1H,d,J=7Hz),7.50(1H,d,J=7Hz),7.63(1H,t,J=7Hz).
MS m/z:218(M+).
【0142】
・3,3−ビス(2−チエニルメチル)イミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物30)
【化60】

融点:289.5℃(分解).
NMR(CDCl3)δ:3.41(2H,d,J=15Hz),3.70(2H,d,J=15Hz),6.64(1H,t,J=7Hz),6.7−7.0(5H,m),7.07(2H,dd,J=1Hz,J=5Hz),7.38(1H,d,J=7Hz),7.48(1H,t,J=7Hz).
MS m/z:326(M+).
【0143】
・8−アセチルアミノ−3,3−ジベンジルイミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物31)
【化61】

融点:235−237℃.
NMR(CDCl3)δ:2.05(3H,s),3.20(2H,d,J=14Hz),3.55(2H,d,J=14Hz),6.61(1H,t,J=7Hz),6.9−7.1(4H,m),7.1−7.2(7H,m),7.78(1H,brs),8.39(1H,d,J=7Hz).
MS m/z:371(M+).
【0144】
・3,3−ビス(2−フリルメチル)イミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物32)
【化62】

融点:205℃(分解).
NMR(CDCl3)δ:3.37(4H,s),6.11(2H,d,J=3Hz),6.23(2H,dd,J=2Hz,J=3Hz),6.56(1H,t,J=7Hz),6.97(1H,d,J=7Hz),7.20(2H,d,J=2Hz),7.22(1H,d,J=7Hz),7.51(1H,t,J=7Hz).
MS m/z:294(M+).
【0145】
・3,3−ジメチルイミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物33)
【化63】

融点:200−202℃.
NMR(CD3OD−CDCl3(1:1))δ:1.93(6H,s),7.72(1H,t,J=7Hz),7.78(1H,d,J=7Hz),8.50(1H,t,J=7Hz),9.01(1H,d,J=7Hz).
MS m/z:162(M+).
【0146】
・3,3−ジブチルイミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物34)
【化64】

融点:100.5−102℃.
NMR(CDCl3)δ:0.6−0.9(8H,m),1.0−1.3(6H,m),1.6−1.8(2H,m),2.0−2.2(2H,m),6.71(1H,t,J=7Hz),7.19(1H,d,J=7Hz),7.50(1H,d,J=7Hz),7.62(1H,t,J=7Hz).
MS m/z:246(M+).
【0147】
・3,3−ジ(2−プロピニル)イミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物35)
【化65】

融点:172−175℃.
NMR(CDCl3)δ:2.07(2H,t,J=3Hz),2.80(2H,dd,J=3Hz,J=17Hz),3.08(2H,dd,J=2.6Hz,J=17Hz),6.75(1H,t,J=7Hz),7.24(1H,d,J=7Hz),7.69(1H,t,J=7Hz),8.02(1H,d,J=7Hz).
MS m/z:210(M+).
【0148】
・3,3−ジベンジル−8−ヒドロキシイミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物36)
【化66】

融点:283−285℃.
NMR(CDCl3)δ:3.20(2H,d,J=14Hz),3.55(2H,d,J=14Hz),6.58(1H,t,J=7Hz),6.87(1H,d,J=7Hz),6.9−7.0(4H,m),7.07(1H,d,J=7Hz),7.1−7.2(6H,m).
MS m/z:330(M+).
【0149】
・3,3−ジベンジル−8−ベンジルアミノイミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物37)
【化67】

融点:250℃.
NMR(CDCl3)δ:3.42(2H,d,J=14Hz),3.70(2H,d,J=14Hz),4.35(2H,d,J=6Hz),6.93(1H,d,J=7Hz),7.0−7.3(16H,m),7.48(1H,d,J=7Hz),8.66(1H,brs).
MS m/z:419(M+).
【0150】
・3,3−ビス(4−ニトロベンジル)イミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物38)
【化68】

融点:>300℃.
NMR(CD3OD−CDCl3(1:1))δ:3.21(2H,d,J=14Hz),3.67(2H,d,J=14Hz),6.66(1H,t,J=7Hz),6.75(1H,d,J=7Hz),7.15(4H,d,J=9Hz),7.39(1H,t,J=7Hz),7.42(4H,d,J=9Hz),7.56(1H,d,J=7Hz).
MS m/z:404(M+).
【0151】
・8−アミノ−3,3−ジベンジルイミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物39)
【化69】

融点:283−285℃.
NMR(CDCl3)δ:3.17(2H,d,J=14Hz),3.53(2H,d,J=14Hz),4.06(2H,brs),6.4−6.5(2H,m),6.94(1H,t,J=7Hz),7.0−7.1(4H,m),7.1−7.2(6H,m).
MS m/z:330(M+).
【0152】
・3,3−ビス(4−メトキシカルボニルベンジル)イミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物40)
【化70】

融点:289−290℃.
NMR(CDCl3)δ:3.22(2H,d,J=14Hz),3.66(2H,d,J=14Hz),3.86(6H,s),6.60(1H,t,J=7Hz),6.70(1H,d,J=7Hz),7.0−7.1(4H,m),7.35(1H,t,J=7Hz),7.50(1H,d,J=7Hz),7.8−7.9(4H,m).
MS m/z:430(M+).
【0153】
<製造例3>
下記の一般式で構造が示される、5,5−ビス(4−フルオロベンジル)イミダゾ[2,1−b]チアゾール−6(5H)−オン(化合物43)の製造例を以下に示す。
【0154】
【化71】

【0155】
金属ナトリウム210mg(9.0mmol)から調製したナトリウムエトキシドのエタノール溶液(10ml)に、氷冷下、2−アミノ−3−エトキシカルボニルメチルチアゾリウムブロマイド300mg(1.4mmol)、次いでp−フルオロベンジルブロマイド1.15ml(9.0mmol)を加え、室温で1晩撹拌した。減圧下溶媒を留去した後、残渣に水を加え、酢酸エチルで数回抽出し、飽和食塩水で水洗後、無水硫酸マグネシウムで乾燥した。減圧下溶媒を留去し、残渣をシリカゲルカラムクロマトグラフィー(酢酸エチル:メタノール=10:1)にて分離し、標記化合物を結晶として852mg(80.0%)得た。エタノールから再結晶を行い、融点>300℃の白色結晶を得た。
【0156】
得られた化合物の各種分析結果を、以下に示す。これらの分析結果から、得られた化合物が目的の化合物であることを確認した。
【0157】
NMR(CD3OD−CDCl3(1:1))δ:3.23(2H,d,J=14Hz),3.43(2H,d,J=14Hz),6.66(1H,d,J=4Hz),6.8−6.9(4H,m),6.9−7.1(4H,m),7.28(1H,d,J=4Hz).
MS m/z:356(M+).
【0158】
<製造例4>
製造例3と同様にして、相当する出発原料から対応する一般式で構造が示される化合物44〜68をそれぞれ製造した。また、得られた化合物の各種分析結果を、対応箇所に示す。これらの分析から、得られた化合物が目的の化合物44〜68であることをそれぞれ確認した。
【0159】
・5,5−ジベンジルイミダゾ[2,1−b]チアゾール−6(5H)−オン(化合物44)
【化72】

融点:>300℃.
NMR(DMSO−d6)δ:3.69(2H,d,J=15Hz),3.74(2H,d,J=15Hz),7.27(1H,d,J=4Hz),7.3−7.4(4H,m),7.5−7.6(6H,m),8.44(1H,d,J=4Hz).
MS m/z:320(M+).
【0160】
・3,3−ジベンジルイミダゾ[1,2−a]ピリミジン−2(3H)−オン(化合物45)
【化73】

融点:>300℃.
NMR(DMSO−d6)δ:3.42(4H,dd,J=14Hz,J=16Hz),6.9−7.0(5H,m),7.1−7.2(6H,m),8.46(1H,dd,J=3Hz,J=5Hz),9.07(1H,dd,J=2Hz,J=6Hz).
MS m/z:315(M+).
【0161】
・5,5−ビス(4−メチルベンジル)イミダゾ[2,1−b]チアゾール−6(5H)−オン(化合物46)
【化74】

融点:>300℃.
NMR(DMSO−d6)δ:2.20(6H,s),3.24(2H,d,J=14Hz),3.36(2H,d,J=14Hz),6.84(4H,d,J=8Hz),6.89(1H,d,J=4Hz),6.97(4H,d,J=8Hz),8.03(4H,d,J=4Hz).
MS m/z:348(M+).
【0162】
・5,5−ビス(4−シアノベンジル)イミダゾ[2,1−b]チアゾール−6(5H)−オン(化合物47)
【化75】

融点:264−267℃.
NMR(CDCl3)δ:3.23(2H,d,J=14Hz),3.56(2H,d,J=14Hz),6.54(1H,d,J=6Hz),7.02(1H,d,J=6Hz),7.15(4H,d,J=9Hz),7.51(4H,d,J=9Hz).
MS m/z:370(M+).
【0163】
・5,5−ジベンジル−2−メチルイミダゾ[2,1−b]チアゾール−6(5H)−オン(化合物48)
【化76】

融点:>300℃.
NMR(CD3OD−CDCl3(1:1))δ:2.34(3H,d,J=1Hz),3.28(2H,d,J=13Hz),3.43(2H,d,J=13Hz),7.0−7.1(4H,m),7.1−7.3(7H,m).
MS m/z:334(M+).
【0164】
・5,5−ビス(2−チエニルメチル)イミダゾ[2,1−b]チアゾール−6(5H)−オン(化合物49)
【化77】

融点:286℃(分解).
NMR(CDCl3)δ:3.43(2H,d,J=15Hz),3.60(2H,d,J=15Hz),6.49(1H,d,J=5Hz),6.7−7.0(5H,m),7.12(2H,dd,J=1Hz,J=6Hz).
MS m/z:332(M+).
【0165】
・3,3−ビス(2−チエニルメチル)イミダゾ[1,2−a]ピリミジン−2(3H)−オン(化合物50)
【化78】

融点:192℃(分解).
NMR(CD3OD−CDCl3(1:1))δ:3.54(2H,d,J=15Hz),3.76(2H,d,J=15Hz),6.7−6.9(5H,m),7.11(2H,dd,J=1Hz,J=5Hz),8.23(1H,dd,J=2Hz,J=6Hz),8.62(1H,dd,J=2Hz,J=4Hz).
MS m/z:327(M+).
【0166】
・5,5−ジベンジル−2,3−ジヒドロイミダゾ[2,1−b]チアゾール−6(5H)−オン(化合物51)
【化79】

融点:233−236℃.
NMR(CDCl3)δ:3.03(2H,d,J=14Hz),3.23(2H,t,J=7Hz),3.41(2H,d,J=14Hz),3.63(2H,t,J=7Hz),7.1−7.2(4H,m),7.2−7.3(6H,m).
MS m/z:322(M+).
【0167】
・2−ヒドロキシ−3−(2−ナフチルメチル)イミダゾ[1,2−a]ピリジン(化合物52)
【化80】

融点:205℃(分解).
NMR(CD3OD−CDCl3(1:1))δ:3.41(1H,d,J=15Hz),3.76(1H,d,J=15Hz),6.72(1H,t,J=7Hz),7.02(1H,d,J=9Hz),7.29(1H,d,J=9Hz),7.4−7.5(2H,m),7.58(2H,brs),7.6−7.9(4H,m).
MS m/z:274(M+).
【0168】
・スピロ[イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−ベンゾ[f]インダン](化合物53)
【化81】

融点:214℃(分解).
NMR(CD3OD−CDCl3(1:1))δ:3.33(2H,d,J=16Hz),4.02(2H,d,J=16Hz),6.58(1H,t,J=7Hz),7.16(1H,d,J=7Hz),7.24(1H,d,J=9Hz),7.5−7.6(2H,m),7.74(1H,t,J=8Hz),7.8−7.9(4H,m).
MS m/z:286(M+).
【0169】
・3−ベンジルイミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物54)
【化82】

融点:182℃(分解).
NMR(CDCl3)δ:3.09(1H,dd,J=8Hz,J=15Hz),3.64(1H,dd,J=4Hz,J=15Hz),4.58(1H,dd,J=4Hz,J=8Hz),6.47(1H,t,J=7Hz),7.0−7.1(2H,m),7.1−7.2(2H,m),7.3−7.4(3H,m),7.54(1H,t,J=7Hz).
MS m/z:224(M+).
【0170】
・3,3−ジ(2−ブテニル)イミダゾ[1,2−a]ピリミジン−2(3H)−オン(化合物55)
【化83】

融点:149.5℃(分解).
NMR(CDCl3)δ:1.55(6H,d,J=6Hz),2.51(2H,dd,J=8Hz,J=15Hz),2.76(2H,dd,J=8Hz,J=15Hz),5.1−5.3(2H,m),5.4−5.7(2H,m),6.69(1H,dd,J=5Hz,J=6Hz),7.75(1H,dd,J=2Hz,J=6Hz),8.7(1H,dd,J=2Hz,J=5Hz).
MS m/z:243(M+).
【0171】
・スピロ[イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−(4’−フルオロインダン)](化合物56)
【化84】

融点:148.0℃(分解).
NMR(CDCl3)δ:3.24(2H,dd,J=18Hz,J=22Hz),3.88(2H,t,J=18Hz),6.55(1H,t,J=7Hz),7.01(1H,t,J=9Hz),7.10(1H,d,J=7Hz),7.2−7.3(3H,m),7.63(1H,t,J=8Hz).
MS m/z:254(M+).
【0172】
・スピロ[イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−(5’−メトキシインダン)](化合物57)
【化85】

融点:150.0−152.0℃.
NMR(CDCl3)δ:3.08(2H,dd,J=6Hz,J=17Hz),3.8−4.0(5H,m),6.49(1H,t,J=7Hz),6.8−6.9(2H,m),7.1−7.3(3H,m),7.60(1H,t,J=7Hz).
MS m/z:266(M+).
【0173】
・スピロ[イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−(5’−ヨードインダン)](化合物58)
【化86】

融点:167−171℃.
NMR(CDCl3)δ:3.14(2H,dd,J=6Hz,J=17Hz),3.82(2H,dd,J=17Hz,J=18Hz),6.57(1H,t,J=7Hz),7.08(1H,d,J=8Hz),7.1−7.3(2H,m),7.6−7.7(3H,m).
MS m/z:362(M+).
【0174】
・スピロ[イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−(4’−シアノインダン)](化合物59)
【化87】

融点:247.7℃(分解).
NMR(CDCl3)δ:3.26(2H,dd,J=3Hz,J=18Hz),3.93(2H,dd,J=6Hz,J=18Hz),6.56(1H,t,J=7Hz),7.15(1H,d,J=7Hz),7.23(1H,d,J=9Hz),7.44(1H,d,J=8Hz),7.6−7.7(3H,m).
MS m/z:261(M+).
【0175】
・スピロ[イミダゾ[2,1−a]イソキノリン−2(3H)−オン−3,2’−インダン](化合物60)
【化88】

融点:201−203℃.
NMR(CDCl3)δ:3.22(2H,d,J=17Hz),3.91(2H,d,J=17Hz),6.74(1H,d,J=7Hz),6.89(1H,d,J=7Hz),7.32(4H,s),7.6−7.7(2H,m),7.79(1H,t,J=7Hz),8.63(1H,d,J=8Hz).
MS m/z:286(M+).
【0176】
・スピロ[イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−((1,2,5−チアジアゾ)[4,5−c]インダン)](化合物61)
【化89】

融点:86−88℃.
NMR(CDCl3−CD3OD(1:1))δ:3.44(2H,d,J=18Hz),4.00(2H,d,J=18Hz),6.71(1H,t,J=7Hz),7.2−7.4(2H,m),7.81(1H,t,J=7Hz),7.97(2H,s).
MS m/z:294(M+).
【0177】
・スピロ[イミダゾ[2,1−a]イソキノリン−2(3H)−オン−3,2’−((1,2,5−チアジアゾ)[4,5−c]インダン)](化合物62)
【化90】

融点:271.5℃(分解).
NMR(CDCl3)δ:3.39(2H,d,J=16Hz),4.04(2H,brd,J=16Hz),6.77(1H,d,J=7Hz),6.81(1H,d,J=7Hz),7.6−7.8(2H,m),7.82(1H,brt,J=8Hz),7.95(2H,brs),8.65(1H,d,J=8Hz).
MS m/z:344(M+).
【0178】
・スピロ[イミダゾ[1,2−a]ピリミジン−2(3H)−オン−3,2’−インダン](化合物63)
【化91】

融点:195.5℃(分解).
NMR(CDCl3)δ:3.17(2H,d,J=17Hz),3.92(2H,d,J=17Hz),6.53(1H,dd,J=5Hz,J=6Hz),7.44(1H,dd,J=2Hz,J=6Hz),7.32(4H,s),8.72(1H,dd,J=2Hz,J=5Hz).
MS m/z:237(M+).
【0179】
・スピロ[イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−(5’−トリフルオロメチルインダン)](化合物64)
【化92】

融点:176.5−179.5℃.
NMR(CDCl3)δ:3.25(2H,d,J=17Hz),3.92(2H,d,J=17Hz),6.57(1H,t,J=7Hz),7.1−7.2(2H,m),7.44(1H,d,J=8Hz),8.5−8.7(3H,m).
MS m/z:304(M+).
【0180】
・スピロ[イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−ベンゾ[e]インダン](化合物65)
【化93】

融点:256.0℃(分解).
NMR(CDCl3)δ:3.33(1H,d,J=17Hz),3.56(1H,d,J=17Hz),4.09(2H,t,J=17Hz),6.50(1H,t,J=7Hz),7.22(1H,d,J=9Hz),7.29(1H,d,J=7Hz),7.42(1H,d,J=8Hz),7.5−7.7(4H,m),7.83(1H,d,J=8Hz),7.92(1H,d,J=6Hz).
MS m/z:286(M+).
【0181】
・3,3−ジアリルイミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物66)
【化94】

融点:64−66℃.
NMR(CDCl3)δ:2.56(2H,dd,J=9Hz,J=14Hz),2.86(2H,dd,J=6Hz,J=14Hz),4.99(2H,dd,J=1Hz,J=7Hz),5.40(2H,d,J=1Hz),5.4−5.6(2H,m),6.67(1H,t,J=7Hz),7.17(1H,d,J=7Hz),7.52(1H,d,J=7Hz),7.59(1H,d,J=7Hz).
MS m/z:214(M+).
【0182】
・3,3−ビス(2−シクロヘキセニル)イミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物67)
【化95】

融点:245−247℃.
NMR(CDCl3)δ:1.4−2.0(12H,m),2.9−3.1(2H,m),5.29(1H,brd,J=10Hz),5.8−6.0(3H,m),6.62(1H,t,J=7Hz),7.17(1H,d,J=9Hz),7.5−7.7(2H,m).
MS m/z:294(M+).
【0183】
・3,3−ジアリルイミダゾ[2,1−a]イソキノリン−2(3H)−オン(化合物68)
【化96】

融点:108−110℃.
NMR(CDCl3)δ:2.62(2H,dd,J=8Hz,J=14Hz),2.89(2H,dd,J=6Hz,J=14Hz),4.9−5.1(4H,m),5.4−5.6(2H,m),6.91(1H,d,J=7Hz),7.25(1H,d,J=7Hz),7.6−7.7(2H,m),7.80(1H,t,J=8Hz),8.57(1H,d,J=8Hz).
MS m/z:264(M+).
【0184】
<製造例5>
下記の一般式で構造が示される、スピロ[イミダゾ[2,1−a]イソキノリン−2(3H)−オン−3,4’−(1’−シクロペンテン)](化合物69)の製造例を以下に示す。
【0185】
【化97】

【0186】
アルゴン雰囲気下、製造例1と同様の方法で得た3,3−ジアリルイミダゾ[2,1−a]イソキノリン−2(3H)−オン1.0g(3.8mmol)のクロロホルム溶液(80ml)に、80mgのグラッブス試薬(0.24mmol)を加え、14時間加熱還流した。反応混合物を放冷したのち、減圧下溶媒を留去した。得られた残渣に水を加え、ジクロロメタンで数回抽出し、抽出層をまとめて、飽和食塩水で水洗後、無水硫酸マグネシウムで乾燥した。減圧下溶媒を留去し、残渣をシリカゲルカラムクロマトグラフィー(酢酸エチル:メタノール=10:1)にて分離精製し、標記化合物748mg(83.5%)を淡褐色結晶として得た。
【0187】
得られた化合物の各種分析結果を、以下に示す。これらの分析結果から、得られた化合物が目的の化合物であることを確認した。
【0188】
融点:173.5℃(分解).
NMR(CDCl3)δ:2.70(2H,d,J=17Hz),3.30(2H,d,J=17Hz),5.92(2H,s),6.89(1H,d,J=7Hz),7.33(1H,d,J=7Hz),7.6−7.8(2H,m),7.79(1H,t,J=7Hz),8.60(1H,d,J=7Hz).
MS m/z:236(M+).
【0189】
<製造例6>
製造例5と同様にして、相当する出発原料から対応する一般式で構造が示される化合物70を製造した。また、得られた化合物の各種分析結果を、対応箇所に示す。これらの分析から、得られた化合物が目的の化合物70であることを確認した。
【0190】
・スピロ[8−ベンジルオキシイミダゾ[1,2−a]ピリジン−2(3H)−オン−3,4’−(1’−シクロペンテン)](化合物70)
【化98】

融点:178.5−180.5℃.
NMR(CDCl3)δ:2.64(2H,d,J=16Hz),3.29(2H,d,J=16Hz),5.30(2H,s),5.88(2H,s),6.49(1H,dd,J=6Hz,J=8Hz),6.94(1H,dd,J=6Hz,J=8Hz),6.94(1H,d,J=8Hz),7.2−7.5(5H,m).
MS m/z:292(M+).
【0191】
<製造例7>
下記の一般式で構造が示される、3,3−ジプロピル−5,6,7,8−テトラヒドロイミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物71)の製造例を以下に示す。
【0192】
【化99】

【0193】
製造例5と同様の方法で得た3,3−ジアリルイミダゾ[1,2−a]ピリジン−2(3H)−オン300mg(1.4mmol)のエタノール溶液(30ml)に10%パラジウム炭素100mgを加え、水素雰囲気下、室温で1晩接触還元した。不溶物を濾別し、濾液から減圧下溶媒を留去した。残渣をシリカゲルカラムクロマトグラフィー(ヘキサン:酢酸エチル=10:1)にて分離し、標記化合物を結晶として281mg(90.3%)得た。ヘキサン−酢酸エチル(10:1)から再結晶を行い、融点98.5−101℃の白色結晶を得た。
【0194】
得られた化合物の各種分析結果を、以下に示す。これらの分析結果から、得られた化合物が目的の化合物であることを確認した。
【0195】
NMR(CDCl3)δ:0.86(6H,t,J=7Hz),0.9−1.1(2H,m),1.1−1.2(2H,m),1.4−1.6(2H,m),1.7−2.0(6H,m),2.79(2H,t,J=6Hz),3.19(2H,t,J=6Hz).
MS m/z:222(M+).
【0196】
<製造例8>
製造例7と同様にして、相当する出発原料から対応する一般式で構造が示される化合物72〜77をそれぞれ製造した。また、得られた化合物の各種分析結果を、対応箇所に示す。これらの分析から、得られた化合物が目的の化合物72〜77であることをそれぞれ確認した。
【0197】
・3,3−ジシクロヘキシル−5,6,7,8−テトラヒドロイミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物72)
【化100】

融点:218−220℃.
NMR(CDCl3)δ:0.9−1.4(8H,m),1.5−2.0(18H,m),2.79(2H,t,J=6Hz),3.30(2H,t,J=6Hz).
MS m/z:302(M+).
【0198】
・3,3−ジブチル−5,6,7,8−テトラヒドロイミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物73)
【化101】

融点:35−40℃.
NMR(CDCl3)δ:0.88(6H,t,J=7Hz),0.9−1.4(8H,m),1.6−2.2(8H,m),3.2−3.4(4H,m).
MS m/z:250(M+).
【0199】
・スピロ[7,8,9,10−テトラヒドロイミダゾ[2,1−a]イソキノリン−2(3H)−オン−3,1’−シクロペンタン](化合物74)
【化102】

融点:270.5℃(分解).
NMR(CDCl3)δ:1.8−2.2(10H,m),2.3−2.5(2H,m),2.6−2.8(4H,m),6.44(1H,d,J=7Hz),7.35(1H,d,J=7Hz).
MS m/z:242(M+).
【0200】
・スピロ[イミダゾ[2,1−a]イソキノリン−2(3H)−オン−3,1’−シクロペンタン](化合物75)
【化103】

融点:164.5−167.5℃.
NMR(CDCl3)δ:1.8−2.3(6H,m),2.4−2.6(2H,m),6.94(1H,d,J=7Hz),7.33(1H,d,J=7Hz),7.6−7.7(2H,m),7.79(1H,t,J=6Hz),8.60(1H,d,J=8Hz).
MS m/z:238(M+).
【0201】
・スピロ[5,6,7,8−テトラヒドロイミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−ベンゾ[f]インダン](化合物76)
【化104】

融点:252.5℃(分解).
NMR(CDCl3−CD3OD(1:1))δ:1.9−2.1(4H,m),3.0−3.2(4H,m),3.50(2H,d,J=18Hz),3.79(2H,d,J=18Hz),7.4−7.5(2H,m),7.75(2H,s),7.8−7.9(2H,m).
MS m/z:290(M+).
【0202】
・スピロ[5,6,7,8−テトラヒドロイミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−インダン](化合物77)
【化105】

融点:276.5℃(分解).
NMR(CDCl3−CD3OD(1:1))δ:1.9−2.1(4H,m),3.0−3.3(4H,m),3.45(2H,d,J=17Hz),3.66(2H,d,J=17Hz),7.30(4H,s).
MS m/z:240(M+).
【0203】
<製造例9>
製造例1と同様にして、相当する出発原料から対応する一般式で構造が示される化合物78〜81をそれぞれ製造した。また、得られた化合物の各種分析結果を、対応箇所に示す。これらの分析から、得られた化合物が目的の化合物78〜81であることをそれぞれ確認した。
【0204】
・3,3−ビス(4−クロロベンジル)イミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物78)
【化106】

融点: 293.0―296.0(℃).
1H−NMR(CDCl3)δ:3.11(2H, d, J=14Hz), 3.55(2H, d, J= 14Hz), 6.62(1H, t, J=7Hz), 6.78(1H, d, J=8Hz), 6.94(4H, d, J=8Hz), 7.12(4H, d, J=8Hz), 7.40(1H, t, J=7Hz), 7.47(1H, d, J=7Hz).
MS m/z: 382(M+)
【0205】
・8−シクロプロピルメチルオキシ−3,3−ジアリルイミダゾ[1,2−a]ピリジン−2(3H)−オン(化合物79)
【化107】

融点: 139.0−142.0(℃)
1H−NMR(CDCl3)δ: 0.35−0.40 (2H, m), 0.60−0.65(2H, m), 1.30−1.40 (1H, m) 2.50−2.60(2H, m), 2.80−2.30(2H, m) , 3.94(2H, d, J=7Hz), 4.96(2H, brs), 5.02(2H, brs), 5.40−5.65(2H, m) , 6.57(1H, t, J=7Hz, J=8Hz), 6.91(1H, d, J=8Hz), 7.16(1H, d, J=7Hz)
MS m/z: 284(M+).
【0206】
・スピロ[イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−(4’−ヒドロキシインダン)] (化合物80)
【化108】

融点: 240.0℃(dec.).
1H−NMR(CD3OD)δ:3.17(1H, d, J=17Hz),3.19(1H, d, J=17Hz), 3.50(1H, d, J=17Hz), 3.61(1H, d, J=17Hz), 6.63(1H, d, J=8Hz), 6.70−6.80(2H, m), 7.07(1H, d, J=8Hz), 7.12(1H, d, J=9Hz), 7.51(1H, d, J=7Hz), 7.81(1H, d, J=8Hz)
MS m/z: 352(M+).
【0207】
・スピロ[8−ヒドロキシ−イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−インダン](化合物81)
【化109】

融点: 285.0―290.0℃.
1H−NMR(CDCl3)δ:3.22(2H, d, J=17Hz), 3.91(2H, d, J=17Hz), 6.57(1H, dd, J=6Hz, J=7Hz), 6.82(1H, d, J=6Hz), 7.27(1H, d, J=7Hz), 7.31 (4H, s)
MS m/z: 352(M+).
【0208】
<製造例10>
製造例5と同様にして、相当する出発原料から対応する一般式で構造が示される化合物82〜83をそれぞれ製造した。また、得られた化合物の各種分析結果を、対応箇所に示す。これらの分析から、得られた化合物が目的の化合物82〜83であることをそれぞれ確認した。
【0209】
・スピロ[8−メトキシ−イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,4’−(1’−シクロペンテン)](化合物82)
【化110】

融点: 200.0―202.0℃
1H−NMR(CDCl3): 2.64(2H, d, J=17Hz), 3.29(2H, d, J=17Hz), 3.96(3H, s), 5.88(2H, s), 6.57(1H, dd, J=7Hz, J=8Hz), 6.91(1H, d, J=8Hz), 7.29(1H, d, J=7Hz)
MS m/z: 216(M+).
【0210】
・スピロ[8−シクロプロピルメチルオキシイミダゾ[1,2−a]ピリジン−2(3H)−オン−3,4’−(1'−シクロペンテン)](化合物83)
【化111】

融点: 134.0−137.0℃
1H−NMR(CDCl3)δ:0.35−0.40 (2H, m), 0.60−0.70 (2H, m), 1.30−1.40(1H, m) 2.64(2H, d, J=16Hz), 3.28(2H, d, J=16Hz), 3.98(2H, d, J=7Hz), 5.88(2H, s), 6.54(1H, dd, J=7Hz, J=8Hz), 6.92(1H, d, J=8Hz), 7.28(1H, d, J=7Hz)
MS m/z: 256(M+).
【0211】
以上、本発明を実施例に基づいて説明した。この実施例はあくまで例示であり、種々の変形例が可能なこと、またそうした変形例も本発明の範囲にあることは当業者に理解されるところである。
【0212】
たとえば、上記実施例では、哺乳動物としてマウスを用いたが、ヒトをはじめとする他の哺乳動物であってもよい。この場合であっても、上記の化合物1〜83は、ヒトをはじめとする他の哺乳動物に対して、抗鬱作用、脳保護作用、アミロイドβ沈着抑制作用または老化抑制作用を奏するためである。
【図面の簡単な説明】
【0213】
【図1】スナネズミ一過性前脳虚血モデルにおける化合物24の海馬CA1領域保護効果について説明するためのグラフである。
【図2】スナネズミ一過性前脳虚血モデルにおける海馬CA1領域の神経細胞死遅延による脳保護効果を説明するための写真である。
【図3】老化促進マウス(SAMP8)におけるアミロイドβの抗体に陽性の細胞の数に対する化合物24の影響を説明するための写真である。
【図4】老化促進マウス(SAMP8)におけるアミロイドβの抗体に陽性の細胞の数に対する化合物24の影響を説明するためのグラフである。
【図5】老化促進マウス(SAMP8)の老化指標(Grading score)に対する化合物24の影響を説明するためのグラフである。
【図6】老化促進マウス(SAMP8)の生存率に対する化合物24の影響を説明するためのグラフである。
【特許請求の範囲】
【請求項1】
下記一般式(I)
【化1】

で示す複素環化合物を含む抗鬱剤であって、
前記一般式(I)中、下記一般式(II)で示される構造単位は、
【化2】

下記一般式(III)で示す複数種の構造単位から選ばれる1種以上の構造単位であり、
【化3】

前記一般式(I)において、
前記R1、R2は、それぞれ独立に、水素原子、ハロゲン原子、ヒドロキシ基、アミノ基、アセチルアミノ基、ベンジルアミノ基、トリフルオロメチル基、C1−C6アルキル基、C1−C6アルコキシ基または−O−(CH2)n−R5(前記R5はビニル基、C3−C6シクロアルキル基、フェニル基、nは0または1)からなる群から選ばれる1種以上の官能基を示し、
前記R3、前記R4は、それぞれ独立に、水素原子、C1−C6アルキル基、C3−C8シクロアルキル基、−CH(R7)−R6からなる群から選ばれる1種以上の官能基を示すか、あるいは前記R3と前記R4とが結合して下記一般式(IV)に示すスピロ環を形成してもよく、
【化4】

前記R6は、ビニル基、エチニル基、フェニル(C1−C6アルキル基、C1−C6アルコキシ基、ヒドロキシ基、1〜2個のハロゲン原子、ジC1−C6アルキルアミノ基、シアノ基、ニトロ基、カルボキシ基、フェニル基で置換されていてもよい)フェネチル基、ピリジル基、チエニル基、フリル基からなる群から選ばれる1種以上の官能基を示し、
前記R7は、水素原子またはC1−C6アルキル基を示し、
前記一般式(IV)中、前記構造単位Bは、下記一般式(V)で示す複数種の構造単位から選ばれる1種以上の構造単位であり、
【化5】

前記構造単位Bは、前記一般式(V)中において、前記記号*で示した位置で結合してスピロ環を形成し、
前記R8は、水素原子、ハロゲン原子、ヒドロキシ基、C1−C6アルコキシ基、シアノ基、トリフルオロメチル基からなる群から選ばれる1種以上の官能基を示す、
抗鬱剤。
【請求項2】
請求項1記載の抗鬱剤において、
前記複素環化合物は、
3,3−ジベンジルイミダゾ[1,2−a]ピリジン−2(3H)−オン、スピロ[イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−インダン]、3,3−ジプロピルイミダゾ[1,2−a]ピリジン−2(3H)−オン、3,3−ジブチルイミダゾ[1,2−a]ピリジン−2(3H)−オン、5,5−ジベンジルイミダゾ[2,1−b]チアゾール−6(5H)−オン、3,3−ジベンジルイミダゾ[1,2−a]ピリミジン−2(3H)−オン、スピロ[イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−(4’−フルオロインダン)]、スピロ[イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−(5’−メトキシインダン)]、スピロ[イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−(4’−シアノインダン)]、スピロ[イミダゾ[2,1−a]イソキノリン−2(3H)−オン−3,2’−インダン]、スピロ[イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−((1,2,5−チアジアゾ)[4,5−c]インダン)]、スピロ[イミダゾ[1,2−a]ピリミジン−2(3H)−オン−3,2’−インダン]、スピロ[イミダゾ[2,1−a]イソキノリン−2(3H)−オン−3,4’−(1’−シクロペンテン)]、3,3−ビス(4−クロロベンジル)イミダゾ[1,2−a]ピリジン−2(3H)−オン、8−シクロプロピルメチルオキシ−3,3−ジアリルイミダゾ[1,2−a]ピリジン−2(3H)−オン、スピロ[イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−(4’−ヒドロキシインダン)]、スピロ[8−ヒドロキシ−イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−インダン]、スピロ[8−メトキシ−イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,4’−(1’-シクロペンテン)]、スピロ[8−シクロプロピルメチルオキシイミダゾ[1,2−a]ピリジン−2(3H)−オン−3,4’−(1’-シクロペンテン)]からなる群から選ばれる1種以上の複素環化合物である、
抗鬱剤。
【請求項3】
請求項1または2記載の抗鬱剤において、
経口投与型である、抗鬱剤。
【請求項4】
請求項1乃至3いずれかに記載の抗鬱剤において、
哺乳動物の鬱病、躁鬱病、強迫性障害、パニック障害、不安障害からなる群から選ばれる1種以上の気分障害を抑制する機能を有する、抗鬱剤。
【請求項5】
下記一般式(I)
【化6】

で示す複素環化合物を含む脳保護剤であって、
前記一般式(I)中、下記一般式(II)で示される構造単位は、
【化7】

下記一般式(III)で示す複数種の構造単位から選ばれる1種以上の構造単位であり、
【化8】

前記一般式(I)において、
前記R1、R2は、それぞれ独立に、水素原子、ハロゲン原子、ヒドロキシ基、アミノ基、アセチルアミノ基、ベンジルアミノ基、トリフルオロメチル基、C1−C6アルキル基、C1−C6アルコキシ基または−O−(CH2)n−R5(前記R5はビニル基、C3−C6シクロアルキル基、フェニル基、nは0または1)からなる群から選ばれる1種以上の官能基を示し、
前記R3、前記R4は、それぞれ独立に、水素原子、C1−C6アルキル基、C3−C8シクロアルキル基、−CH(R7)−R6からなる群から選ばれる1種以上の官能基を示すか、あるいは前記R3と前記R4とが結合して下記一般式(IV)に示すスピロ環を形成してもよく、
【化9】

前記R6は、ビニル基、エチニル基、フェニル(C1−C6アルキル基、C1−C6アルコキシ基、ヒドロキシ基、1〜2個のハロゲン原子、ジC1−C6アルキルアミノ基、シアノ基、ニトロ基、カルボキシ基、フェニル基で置換されていてもよい)フェネチル基、ピリジル基、チエニル基、フリル基からなる群から選ばれる1種以上の官能基を示し、
前記R7は、水素原子またはC1−C6アルキル基を示し、
前記一般式(IV)中、前記構造単位Bは、下記一般式(V)で示す複数種の構造単位から選ばれる1種以上の構造単位であり、
【化10】

前記構造単位Bは、前記一般式(V)中において、前記記号*で示した位置で結合してスピロ環を形成し、
前記R8は、水素原子、ハロゲン原子、ヒドロキシ基、C1−C6アルコキシ基、シアノ基、トリフルオロメチル基からなる群から選ばれる1種以上の官能基を示す、
脳保護剤。
【請求項6】
請求項5記載の脳保護剤において、
前記複素環化合物は、スピロ[イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−インダン]である、
脳保護剤。
【請求項7】
請求項5または6記載の脳保護剤において、
経口投与型である、脳保護剤。
【請求項8】
請求項5乃至7いずれかに記載の脳保護剤において、
哺乳動物の一過性脳虚血発作、脳出血、くも膜下出血、頭蓋内出血、脳梗塞、高血圧性脳症からなる群から選ばれる1種以上の脳血管障害を抑制する機能を有する、脳保護剤。
【請求項9】
下記一般式(I)
【化11】

で示す複素環化合物を含むアミロイドβ沈着抑制剤であって、
前記一般式(I)中、下記一般式(II)で示される構造単位は、
【化12】

下記一般式(III)で示す複数種の構造単位から選ばれる1種以上の構造単位であり、
【化13】

前記一般式(I)において、
前記R1、R2は、それぞれ独立に、水素原子、ハロゲン原子、ヒドロキシ基、アミノ基、アセチルアミノ基、ベンジルアミノ基、トリフルオロメチル基、C1−C6アルキル基、C1−C6アルコキシ基または−O−(CH2)n−R5(前記R5はビニル基、C3−C6シクロアルキル基、フェニル基、nは0または1)からなる群から選ばれる1種以上の官能基を示し、
前記R3、前記R4は、それぞれ独立に、水素原子、C1−C6アルキル基、C3−C8シクロアルキル基、−CH(R7)−R6からなる群から選ばれる1種以上の官能基を示すか、あるいは前記R3と前記R4とが結合して下記一般式(IV)に示すスピロ環を形成してもよく、
【化14】

前記R6は、ビニル基、エチニル基、フェニル(C1−C6アルキル基、C1−C6アルコキシ基、ヒドロキシ基、1〜2個のハロゲン原子、ジC1−C6アルキルアミノ基、シアノ基、ニトロ基、カルボキシ基、フェニル基で置換されていてもよい)フェネチル基、ピリジル基、チエニル基、フリル基からなる群から選ばれる1種以上の官能基を示し、
前記R7は、水素原子またはC1−C6アルキル基を示し、
前記一般式(IV)中、前記構造単位Bは、下記一般式(V)で示す複数種の構造単位から選ばれる1種以上の構造単位であり、
【化15】

前記構造単位Bは、前記一般式(V)中において、前記記号*で示した位置で結合してスピロ環を形成し、
前記R8は、水素原子、ハロゲン原子、ヒドロキシ基、C1−C6アルコキシ基、シアノ基、トリフルオロメチル基からなる群から選ばれる1種以上の官能基を示す、
アミロイドβ沈着抑制剤。
【請求項10】
請求項9記載のアミロイドβ沈着抑制剤において、
前記複素環化合物は、スピロ[イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−インダン]である、
アミロイドβ沈着抑制剤。
【請求項11】
請求項9または10記載のアミロイドβ沈着抑制剤において、
経口投与型である、アミロイドβ沈着抑制剤。
【請求項12】
請求項9乃至11いずれかに記載のアミロイドβ沈着抑制剤において、
哺乳動物のアミロイドーシス、脳アミロイド血管炎、白内障、加齢黄斑変性症、リウマチ、骨粗鬆症、メタボリックシンドローム、しわ、脱毛、からなる群から選ばれる1種以上のアミロイド病理を抑制する機能を有する、アミロイドβ沈着抑制剤。
【請求項13】
下記一般式(I)
【化16】

で示す複素環化合物を含む老化抑制剤であって、
前記一般式(I)中、下記一般式(II)で示される構造単位は、
【化17】

下記一般式(III)で示す複数種の構造単位から選ばれる1種以上の構造単位であり、
【化18】

前記一般式(I)において、
前記R1、R2は、それぞれ独立に、水素原子、ハロゲン原子、ヒドロキシ基、アミノ基、アセチルアミノ基、ベンジルアミノ基、トリフルオロメチル基、C1−C6アルキル基、C1−C6アルコキシ基または−O−(CH2)n−R5(前記R5はビニル基、C3−C6シクロアルキル基、フェニル基、nは0または1)からなる群から選ばれる1種以上の官能基を示し、
前記R3、前記R4は、それぞれ独立に、水素原子、C1−C6アルキル基、C3−C8シクロアルキル基、−CH(R7)−R6からなる群から選ばれる1種以上の官能基を示すか、あるいは前記R3と前記R4とが結合して下記一般式(IV)に示すスピロ環を形成してもよく、
【化19】

前記R6は、ビニル基、エチニル基、フェニル(C1−C6アルキル基、C1−C6アルコキシ基、ヒドロキシ基、1〜2個のハロゲン原子、ジC1−C6アルキルアミノ基、シアノ基、ニトロ基、カルボキシ基、フェニル基で置換されていてもよい)フェネチル基、ピリジル基、チエニル基、フリル基からなる群から選ばれる1種以上の官能基を示し、
前記R7は、水素原子またはC1−C6アルキル基を示し、
前記一般式(IV)中、前記構造単位Bは、下記一般式(V)で示す複数種の構造単位から選ばれる1種以上の構造単位であり、
【化20】

前記構造単位Bは、前記一般式(V)中において、前記記号*で示した位置で結合してスピロ環を形成し、
前記R8は、水素原子、ハロゲン原子、ヒドロキシ基、C1−C6アルコキシ基、シアノ基、トリフルオロメチル基からなる群から選ばれる1種以上の官能基を示す、
老化抑制剤。
【請求項14】
請求項13記載の老化抑制剤において、
前記複素環化合物は、スピロ[イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−インダン]である、
老化抑制剤。
【請求項15】
請求項13または14記載の老化抑制剤において、
経口投与型である、老化抑制剤。
【請求項16】
請求項13乃至15いずれかに記載の老化抑制剤において、
哺乳動物の平均寿命を延長する機能を有する、老化抑制剤。
【請求項1】
下記一般式(I)
【化1】

で示す複素環化合物を含む抗鬱剤であって、
前記一般式(I)中、下記一般式(II)で示される構造単位は、
【化2】

下記一般式(III)で示す複数種の構造単位から選ばれる1種以上の構造単位であり、
【化3】

前記一般式(I)において、
前記R1、R2は、それぞれ独立に、水素原子、ハロゲン原子、ヒドロキシ基、アミノ基、アセチルアミノ基、ベンジルアミノ基、トリフルオロメチル基、C1−C6アルキル基、C1−C6アルコキシ基または−O−(CH2)n−R5(前記R5はビニル基、C3−C6シクロアルキル基、フェニル基、nは0または1)からなる群から選ばれる1種以上の官能基を示し、
前記R3、前記R4は、それぞれ独立に、水素原子、C1−C6アルキル基、C3−C8シクロアルキル基、−CH(R7)−R6からなる群から選ばれる1種以上の官能基を示すか、あるいは前記R3と前記R4とが結合して下記一般式(IV)に示すスピロ環を形成してもよく、
【化4】

前記R6は、ビニル基、エチニル基、フェニル(C1−C6アルキル基、C1−C6アルコキシ基、ヒドロキシ基、1〜2個のハロゲン原子、ジC1−C6アルキルアミノ基、シアノ基、ニトロ基、カルボキシ基、フェニル基で置換されていてもよい)フェネチル基、ピリジル基、チエニル基、フリル基からなる群から選ばれる1種以上の官能基を示し、
前記R7は、水素原子またはC1−C6アルキル基を示し、
前記一般式(IV)中、前記構造単位Bは、下記一般式(V)で示す複数種の構造単位から選ばれる1種以上の構造単位であり、
【化5】

前記構造単位Bは、前記一般式(V)中において、前記記号*で示した位置で結合してスピロ環を形成し、
前記R8は、水素原子、ハロゲン原子、ヒドロキシ基、C1−C6アルコキシ基、シアノ基、トリフルオロメチル基からなる群から選ばれる1種以上の官能基を示す、
抗鬱剤。
【請求項2】
請求項1記載の抗鬱剤において、
前記複素環化合物は、
3,3−ジベンジルイミダゾ[1,2−a]ピリジン−2(3H)−オン、スピロ[イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−インダン]、3,3−ジプロピルイミダゾ[1,2−a]ピリジン−2(3H)−オン、3,3−ジブチルイミダゾ[1,2−a]ピリジン−2(3H)−オン、5,5−ジベンジルイミダゾ[2,1−b]チアゾール−6(5H)−オン、3,3−ジベンジルイミダゾ[1,2−a]ピリミジン−2(3H)−オン、スピロ[イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−(4’−フルオロインダン)]、スピロ[イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−(5’−メトキシインダン)]、スピロ[イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−(4’−シアノインダン)]、スピロ[イミダゾ[2,1−a]イソキノリン−2(3H)−オン−3,2’−インダン]、スピロ[イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−((1,2,5−チアジアゾ)[4,5−c]インダン)]、スピロ[イミダゾ[1,2−a]ピリミジン−2(3H)−オン−3,2’−インダン]、スピロ[イミダゾ[2,1−a]イソキノリン−2(3H)−オン−3,4’−(1’−シクロペンテン)]、3,3−ビス(4−クロロベンジル)イミダゾ[1,2−a]ピリジン−2(3H)−オン、8−シクロプロピルメチルオキシ−3,3−ジアリルイミダゾ[1,2−a]ピリジン−2(3H)−オン、スピロ[イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−(4’−ヒドロキシインダン)]、スピロ[8−ヒドロキシ−イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−インダン]、スピロ[8−メトキシ−イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,4’−(1’-シクロペンテン)]、スピロ[8−シクロプロピルメチルオキシイミダゾ[1,2−a]ピリジン−2(3H)−オン−3,4’−(1’-シクロペンテン)]からなる群から選ばれる1種以上の複素環化合物である、
抗鬱剤。
【請求項3】
請求項1または2記載の抗鬱剤において、
経口投与型である、抗鬱剤。
【請求項4】
請求項1乃至3いずれかに記載の抗鬱剤において、
哺乳動物の鬱病、躁鬱病、強迫性障害、パニック障害、不安障害からなる群から選ばれる1種以上の気分障害を抑制する機能を有する、抗鬱剤。
【請求項5】
下記一般式(I)
【化6】

で示す複素環化合物を含む脳保護剤であって、
前記一般式(I)中、下記一般式(II)で示される構造単位は、
【化7】

下記一般式(III)で示す複数種の構造単位から選ばれる1種以上の構造単位であり、
【化8】

前記一般式(I)において、
前記R1、R2は、それぞれ独立に、水素原子、ハロゲン原子、ヒドロキシ基、アミノ基、アセチルアミノ基、ベンジルアミノ基、トリフルオロメチル基、C1−C6アルキル基、C1−C6アルコキシ基または−O−(CH2)n−R5(前記R5はビニル基、C3−C6シクロアルキル基、フェニル基、nは0または1)からなる群から選ばれる1種以上の官能基を示し、
前記R3、前記R4は、それぞれ独立に、水素原子、C1−C6アルキル基、C3−C8シクロアルキル基、−CH(R7)−R6からなる群から選ばれる1種以上の官能基を示すか、あるいは前記R3と前記R4とが結合して下記一般式(IV)に示すスピロ環を形成してもよく、
【化9】

前記R6は、ビニル基、エチニル基、フェニル(C1−C6アルキル基、C1−C6アルコキシ基、ヒドロキシ基、1〜2個のハロゲン原子、ジC1−C6アルキルアミノ基、シアノ基、ニトロ基、カルボキシ基、フェニル基で置換されていてもよい)フェネチル基、ピリジル基、チエニル基、フリル基からなる群から選ばれる1種以上の官能基を示し、
前記R7は、水素原子またはC1−C6アルキル基を示し、
前記一般式(IV)中、前記構造単位Bは、下記一般式(V)で示す複数種の構造単位から選ばれる1種以上の構造単位であり、
【化10】

前記構造単位Bは、前記一般式(V)中において、前記記号*で示した位置で結合してスピロ環を形成し、
前記R8は、水素原子、ハロゲン原子、ヒドロキシ基、C1−C6アルコキシ基、シアノ基、トリフルオロメチル基からなる群から選ばれる1種以上の官能基を示す、
脳保護剤。
【請求項6】
請求項5記載の脳保護剤において、
前記複素環化合物は、スピロ[イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−インダン]である、
脳保護剤。
【請求項7】
請求項5または6記載の脳保護剤において、
経口投与型である、脳保護剤。
【請求項8】
請求項5乃至7いずれかに記載の脳保護剤において、
哺乳動物の一過性脳虚血発作、脳出血、くも膜下出血、頭蓋内出血、脳梗塞、高血圧性脳症からなる群から選ばれる1種以上の脳血管障害を抑制する機能を有する、脳保護剤。
【請求項9】
下記一般式(I)
【化11】

で示す複素環化合物を含むアミロイドβ沈着抑制剤であって、
前記一般式(I)中、下記一般式(II)で示される構造単位は、
【化12】

下記一般式(III)で示す複数種の構造単位から選ばれる1種以上の構造単位であり、
【化13】

前記一般式(I)において、
前記R1、R2は、それぞれ独立に、水素原子、ハロゲン原子、ヒドロキシ基、アミノ基、アセチルアミノ基、ベンジルアミノ基、トリフルオロメチル基、C1−C6アルキル基、C1−C6アルコキシ基または−O−(CH2)n−R5(前記R5はビニル基、C3−C6シクロアルキル基、フェニル基、nは0または1)からなる群から選ばれる1種以上の官能基を示し、
前記R3、前記R4は、それぞれ独立に、水素原子、C1−C6アルキル基、C3−C8シクロアルキル基、−CH(R7)−R6からなる群から選ばれる1種以上の官能基を示すか、あるいは前記R3と前記R4とが結合して下記一般式(IV)に示すスピロ環を形成してもよく、
【化14】

前記R6は、ビニル基、エチニル基、フェニル(C1−C6アルキル基、C1−C6アルコキシ基、ヒドロキシ基、1〜2個のハロゲン原子、ジC1−C6アルキルアミノ基、シアノ基、ニトロ基、カルボキシ基、フェニル基で置換されていてもよい)フェネチル基、ピリジル基、チエニル基、フリル基からなる群から選ばれる1種以上の官能基を示し、
前記R7は、水素原子またはC1−C6アルキル基を示し、
前記一般式(IV)中、前記構造単位Bは、下記一般式(V)で示す複数種の構造単位から選ばれる1種以上の構造単位であり、
【化15】

前記構造単位Bは、前記一般式(V)中において、前記記号*で示した位置で結合してスピロ環を形成し、
前記R8は、水素原子、ハロゲン原子、ヒドロキシ基、C1−C6アルコキシ基、シアノ基、トリフルオロメチル基からなる群から選ばれる1種以上の官能基を示す、
アミロイドβ沈着抑制剤。
【請求項10】
請求項9記載のアミロイドβ沈着抑制剤において、
前記複素環化合物は、スピロ[イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−インダン]である、
アミロイドβ沈着抑制剤。
【請求項11】
請求項9または10記載のアミロイドβ沈着抑制剤において、
経口投与型である、アミロイドβ沈着抑制剤。
【請求項12】
請求項9乃至11いずれかに記載のアミロイドβ沈着抑制剤において、
哺乳動物のアミロイドーシス、脳アミロイド血管炎、白内障、加齢黄斑変性症、リウマチ、骨粗鬆症、メタボリックシンドローム、しわ、脱毛、からなる群から選ばれる1種以上のアミロイド病理を抑制する機能を有する、アミロイドβ沈着抑制剤。
【請求項13】
下記一般式(I)
【化16】

で示す複素環化合物を含む老化抑制剤であって、
前記一般式(I)中、下記一般式(II)で示される構造単位は、
【化17】

下記一般式(III)で示す複数種の構造単位から選ばれる1種以上の構造単位であり、
【化18】

前記一般式(I)において、
前記R1、R2は、それぞれ独立に、水素原子、ハロゲン原子、ヒドロキシ基、アミノ基、アセチルアミノ基、ベンジルアミノ基、トリフルオロメチル基、C1−C6アルキル基、C1−C6アルコキシ基または−O−(CH2)n−R5(前記R5はビニル基、C3−C6シクロアルキル基、フェニル基、nは0または1)からなる群から選ばれる1種以上の官能基を示し、
前記R3、前記R4は、それぞれ独立に、水素原子、C1−C6アルキル基、C3−C8シクロアルキル基、−CH(R7)−R6からなる群から選ばれる1種以上の官能基を示すか、あるいは前記R3と前記R4とが結合して下記一般式(IV)に示すスピロ環を形成してもよく、
【化19】

前記R6は、ビニル基、エチニル基、フェニル(C1−C6アルキル基、C1−C6アルコキシ基、ヒドロキシ基、1〜2個のハロゲン原子、ジC1−C6アルキルアミノ基、シアノ基、ニトロ基、カルボキシ基、フェニル基で置換されていてもよい)フェネチル基、ピリジル基、チエニル基、フリル基からなる群から選ばれる1種以上の官能基を示し、
前記R7は、水素原子またはC1−C6アルキル基を示し、
前記一般式(IV)中、前記構造単位Bは、下記一般式(V)で示す複数種の構造単位から選ばれる1種以上の構造単位であり、
【化20】

前記構造単位Bは、前記一般式(V)中において、前記記号*で示した位置で結合してスピロ環を形成し、
前記R8は、水素原子、ハロゲン原子、ヒドロキシ基、C1−C6アルコキシ基、シアノ基、トリフルオロメチル基からなる群から選ばれる1種以上の官能基を示す、
老化抑制剤。
【請求項14】
請求項13記載の老化抑制剤において、
前記複素環化合物は、スピロ[イミダゾ[1,2−a]ピリジン−2(3H)−オン−3,2’−インダン]である、
老化抑制剤。
【請求項15】
請求項13または14記載の老化抑制剤において、
経口投与型である、老化抑制剤。
【請求項16】
請求項13乃至15いずれかに記載の老化抑制剤において、
哺乳動物の平均寿命を延長する機能を有する、老化抑制剤。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公開番号】特開2008−94795(P2008−94795A)
【公開日】平成20年4月24日(2008.4.24)
【国際特許分類】
【出願番号】特願2006−280768(P2006−280768)
【出願日】平成18年10月13日(2006.10.13)
【出願人】(591163694)全薬工業株式会社 (10)
【Fターム(参考)】
【公開日】平成20年4月24日(2008.4.24)
【国際特許分類】
【出願日】平成18年10月13日(2006.10.13)
【出願人】(591163694)全薬工業株式会社 (10)
【Fターム(参考)】
[ Back to top ]

