特定の細胞内に選択的に取り込まれる蛍光色素を利用して多種類の細胞から特定の細胞を純化濃縮する方法
【課題】本発明はヒトを含めた動物及びES細胞、iPS細胞、骨髄幹細胞、体性幹細胞に由来する肝細胞をダメージレスに他の細胞から純化濃縮する省力方法を提供する。
【解決手段】長波長レーザー装置を搭載した細胞検出・分離装置及び古くより肝臓検査に用いられてきた安全性の高い長波長蛍光色素を肝細胞の指標として用いるという二つの方法を組み合わせることで、これまで極めて困難であった肝細胞を高い選択性で安全にかつ廉価,易操作性に検出、分離し、純化濃縮する。
【解決手段】長波長レーザー装置を搭載した細胞検出・分離装置及び古くより肝臓検査に用いられてきた安全性の高い長波長蛍光色素を肝細胞の指標として用いるという二つの方法を組み合わせることで、これまで極めて困難であった肝細胞を高い選択性で安全にかつ廉価,易操作性に検出、分離し、純化濃縮する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明はヒトを含めた動物及びES細胞、iPS細胞、骨髄幹細胞、体性幹細胞に由来する肝細胞などを他の細胞から細胞を傷害することなく純化濃縮する省力方法に関する。
【背景技術】
【0002】
多能性幹細胞を用いた再生医療、創薬への応用は、目的の細胞に分化させる技術がそのカギを握っており、成長因子を組み合わせる、低分子化合物を用いる、細胞間相互作用を利用する、新規基材を利用するなどの方法を用い、着々と実績を積み上げ、現実化に近づいてきた(例えば非特許文献1)。多能性幹細胞であるES細胞は長期間未分化性を維持したまま増殖し、かつ長期間培養した後でも三胚葉になりうる能力を持つ細胞で、受精卵から国家の指針に従って樹立された細胞である。
【0003】
肝細胞に関して、ヒトES細胞より発生プロセスに関係した成長因子を組み合わせランフォード培地を用いることにより、成熟した肝細胞を30%前後の割合で得ることに成功している(例えば非特許文献1,2)。
【0004】
一方多能性幹細胞は目的の細胞に分化するために様々な細胞を介した多くのステップを踏む。そのため目的の細胞を得た時、目的の細胞以外多種多様の細胞(夾雑細胞)が混在する。その結果、機能性が低下し、未分化細胞が混在した場合腫瘍が形成され周囲組織や臓器に障害を与える。これらを回避するため細胞を純化する方法が必要である(例えば、非特許文献3)。
【0005】
細胞を純化させるための一般的な方法は目的の細胞の膜表面に存在する抗原を指標として、それを認識する抗体及びその抗体を認識する蛍光色素(GFPFなど)が付加された二次抗体で反応させた後レーザーで励起させ、反応した細胞を検出し振り分ける、いわゆるFACSにより分離する方法がある。(例えば非特許文献4)。
【0006】
この検出分離に用いるレーザー装置は400−600nmの範囲で用いられることが多い。700nm以上の長波長レーザーを励起光源として用いて、赤外蛍光を検出することで生細胞の識別、計測に応用する技術が、特許文献1に記載されている。これは非天然型核酸プローブに蛍光色素を付加する方法で、核酸に直接影響を与えるものであるため、この方法で細胞を分離できたとしても細胞の安全性は保証されない。
【0007】
一方人体を構成する274種類相当の細胞の中で、肝臓を構成する肝細胞のみが97%以上選択的にICGを取り込むことが知られているが、それ以外の末梢組織にはほとんど認められない(非特許文献5)
【0008】
ICG(indocyanine green、インドシアニン・グリーン,C43H47N2NaO6S2)は、当初写真に使用する色素として開発された。緑色を呈する色素であり1950年代末より生体に応用され、肝臓の機能検査に用いられた。最近では眼科領域において血管の走行や変異を調べるのに利用されている。生体にとって安全性の高い色素であり極めて廉価である。
【0009】
この色素は肝細胞に選択的に取り込まれ、代謝されずにそのまま毛細胆管に放出された後、胆汁に混じり排泄される。生体に残存することはない。尿から排泄されることもない(非特許文献5)
【0010】
この色素の大きな特徴は長波長(780nm近傍)を吸収し長波長の蛍光(800nm以上)を発する蛍光色素でもある。アルブミン、リポ蛋白と結合することにより血流内を移動する。この性質を利用した検査が血管造影であり、眼科領域で行われているICG蛍光眼底造影はよく知られている。たとえば、ICGを蛍光染色剤として利用して、近赤外レーザー照射によってICGから発する赤外蛍光を検出することによって眼底像を観察する方法は、特許文献2に記載されている。
【0011】
一方、高出力レーザー光をICGの励起光源として用いる場合は、ICGの光励起によって一重項酸素が発生するため、照射部の組織に損傷をあたえることが知られている(非特許文献6)。
【0012】
細胞の純化のために役立つ細胞分離方法としては、以下の方法が知られている。特許文献3は、再生医療に最適なコンタミネーションフリーを実現した使い捨て交換型のマイクロ流路チップ内で細胞を解析分離する方式である。さらにマイクロ流路内の流れの影響を低減するように改善した方式が特許文献4である。
上記の使い捨て以外の方式は以下の方法が知られている。米国特許第3710933号(特許文献5)または米国特許第3826364号(特許文献6)に記述されている方法が現在一般的な製品に使用されている分離方法であって、液滴形成用ノズルから空気中に試料液を液滴として吐出し、分離対象の細胞を含む液滴は液滴単位で電場によって分離するという方法である。特開昭64−3541(特許文献7)は、フローセルを流れる試料液の周囲にシース流を流し、試料液に電場を加えることで帯電した粒子を試料流からシース流の法へシフトさせて分離計測する方法である。特開平1−170853(特許文献8)は、フローセルを流れる粒子に圧力パルスを与えて、フローセル内の定常的に流れている流路ではない流路に粒子を分離する方法が記載されている。国際公開番号WO98/10267(特許文献9)は、フローセル内に周囲をシース流でしぼって流した微粒子に場を与えて微粒子の流れをシフトさせて分離するという技術が公開されている。国際公開番号WO2004/101731(特許文献10)において、フローセル内の流路の両側に設置したゲル電極によって液体中で帯電している細胞を電場で分離する方法が公開されている。米国特許US6808075(特許文献11)において、粒子の流れに対して垂直にメニスカスを形成するバブルバルブにより圧力パルスを加えて流れをシフトさせて分離する方式が公開されている。PCT/US2006/000237 (特許文献12)は、特許文献8と同様に圧力パルスを与えるが目的とする粒子を含む水滴単位で射出してコンテナに回収方法である。米国特許第4756427号(特許文献13)には、シース流で絞られた試料液の流れの中の粒子を計測しターゲットとなる粒子であると判断した場合に、パルス流で別流路に導入して分離する方法が記載されている。使い捨てチップを利用するフローサイトメーターは特許4358888(特許文献14)に記載されている。
【先行技術文献】
【特許文献】
【0013】
【特許文献1】特開平6−178699
【特許文献2】特開2001−161647
【特許文献3】特開2010-181349
【特許文献4】特願2010-7295
【特許文献5】米国特許第3710933号
【特許文献6】米国特許第3826364号
【特許文献7】特開昭64−3541
【特許文献8】特開平1−170853
【特許文献9】国際公開番号WO98/10267
【特許文献10】国際公開番号WO2004/101731
【特許文献11】米国特許US6808075
【特許文献12】PCT/US2006/000237
【特許文献13】米国特許第4756427号
【特許文献14】特許4358888
【非特許文献】
【0014】
【非特許文献1】Sasaki K, Ichikawa H, Takei S, et al. TheScientificWorld9:884-90 2009.
【非特許文献2】Yoshie S, Shirasawa S,Yokoyama T, et al. Biochem Biophys Res Commun. 391: 1477-1482,2010
【非特許文献3】Blum B, Benvenisty N..Adv Cancer Res. 100:133-58,2008..
【非特許文献4】Gouon-Evans V, Boussemart L, Gadue P et al. Nature Biotechnol.24:1402-1411,2006.
【非特許文献5】浪久利彦、南部勝司、飯島克己他 肝臓, 5, 114-118, 1963.
【非特許文献6】平野達、河野英治、郷渡祐子他 日レ医誌(JJSLSM) 28:122-127,2007
【発明の開示】
【発明が解決しようとする課題】
【0015】
一般に行われている特定の表面抗原をターゲットにした蛍光抗体ラベルにより細胞を特異的な蛍光染色を行い、その蛍光信号に基づいて特定の表面抗原を有する細胞の分離を行う従来の細胞分離方法は手順が複雑である。特に肝細胞の場合、適切な指標になる特異的な細胞膜表面抗原はヒトでは見いだされていないため、いくつかの細胞に反応する抗体を組みせて純化を試みており、手法はさらに煩雑になる(例えば非特許文献4)。肝細胞について強い選択性が確保された細胞分離方法がないため、純化された結果について不確定さが残る。そのため細胞の品質保証が確保されない。
【0016】
ヒト肝細胞に特異な抗原が存在したとしても、操作の煩雑さは消えず、抗原抗体反応による細胞への内的、外的な影響を避けることができない。
【0017】
現在の分離方法は機種操作が複雑であるため、オペレーターが必要である。また、方法が煩雑であるため、高度にトレーニングされた技術者が必要であり、易操作性という装置、方法の普遍化の重要なファクターを満足できていない。
【0018】
抗体は高価であり医療経済への負担が少なくなく、活性もロットにより異なるなど、結果の安定性において不確実さを残す。
【0019】
本発明は上記課題を解決されるためになされたものであり、ヒトを含めた動物細胞及びES細胞、iPS細胞、骨髄幹細胞、体性幹細胞に由来する肝細胞を含む多種類の細胞を廉価で易操作性、かつ細胞傷害の少ない状態で、夾雑細胞から特異的に肝細胞を純化濃縮することを目的とするものである。
【発明の概要】
【課題を解決するための手段】
【0020】
1)夾雑細胞群中のある特定細胞を濃縮する方法において、蛍光抗体を用いずに特定細胞が生きた状態で特異的に内部に取り込む蛍光染色物質を利用することでその特定細胞を生きた状態で染色し、光照射することで該蛍光物質から発生する蛍光を検出することで、その特定細胞を識別し分離を行う方法。
【0021】
上記手段の夾雑細胞群中のある特定細胞を濃縮する方法において、その特定細胞が生きた状態で特異的に内部に取り込む細胞へのダメージレスの蛍光染色物質を利用することでその特定細胞のみを蛍光染色し、その蛍光物質の光照射で発生する蛍光を検出することで、その特定細胞を識別し汚染のない状態で生きたまま細胞分離を行う。この具体的な例として、下記の手段をとる。
【0022】
2) 上記1)において、夾雑細胞群のなかから肝細胞を分離濃縮する方法であって、染色に用いる化学物質はインドシアニングリーンであり、光照射に用いる波長は750nmから800nmの範囲であって、蛍光の検出波長は800nmから900nmの範囲であることを特徴とする肝細胞分離濃縮方法。
【0023】
夾雑細胞群とはES細胞またはiPS細胞から分化した細胞群であって、その中に含まれる肝細胞を再生医療用として濃縮することを考える。肝細胞に特異的に取り込まれるICG蛍光色素を肝細胞検出の指標として、さらにそのICGを光励起可能な近赤外レーザー装置を搭載した細胞検出・分離装置を用いることによって、これまで解決が極めて困難であったES細胞またはiPS細胞から分化した肝細胞を生きたまま純化濃縮というプロセスとを実現する。
【0024】
本発明に関わるレーザー光源として、少なくともICGを励起するために照射波長が750nmから800nmのものを含む必要がある。。また、ICGが発する蛍光波長領域は800nmより長波長側に発光スペクトル極大があるので、800nmから900nmの長波長蛍光を検出する光学系をふくんでいる必要がある。ICG色素は結合するものにより、照射エネルギーより蛍光色素の波長が変化する可能性があり、このような観点から上記範囲であることが望ましい。
【0025】
3)上記の肝細胞分離濃縮方法において、細胞分離濃縮処理の前の試料細胞液にスーパーオキシドディスムターゼあるいはマンガネーゼスーパーオキシドディスムターゼを事前に混入することで、細胞分離処理時のレーザー光照射によってインドシアニングリーンから発生する活性酸素を低減する対策を行うことを特徴とする細胞分離方法が、肝細胞を細胞損傷なく分離する手段として有効である。
【0026】
その理由は、非特許文献6によると、ICGは照射パワー密度100mW/cm2程度、照射エネルギー密度mJ/cm2程度の光励起によって活性酸素を発生して細胞にダメージを与えるので、以下の様に活性酸素の発生を抑える対策で、再生医療用として純化した肝細胞の損傷の問題を解決する。活性酸素は、一重項酸素・スーパーオキシドアニオン・過酸化水素・ヒドロキシラジカルがあげられる。
スーパーオキシドディスムターゼ(Superoxide dismutase;(以下、「SOD」という)は、生体内で酸素毒性を示す活性酸素を分解する酵素である。SODはその活性中心に銅(Cu)イオンと亜鉛(Zn)イオン、またはマンガン(Mn)イオンや、鉄(Fe)イオンなど、金属イオンをもった酵素で、細胞質やミトコンドリアに多く局在している。中でもマンガンイオンを持つ酵素は、マンガネーゼスーパーオキシドディスムターゼ(Manganese superoxide dismutase;以下「MnSOD」という)と呼ばれ、ミトコンドリア特有の酵素である。これらのSODは、活性酸素による細胞の損傷を防御する作用を有すると考えられている。
【0027】
そのため、ICGに光照射することによって発生する活性酸素による細胞損傷防止としては、SOD(スーパーオキシドディスムターゼ)やカタラーゼなどの活性酸素除去酵素を、レーザーを照射するまえにサンプル細胞液に混入しておくことでレーザー照射によって発生する活性酸素をその場で消滅させることができるからである。その混入する濃度としては、血清中MnSOD濃度は、健常者で平均値±標準偏差(ng/mL)=51.3±13.9であることが分かっているので、少なくともその濃度以上が望ましい。
【0028】
4)夾雑細胞群中のある特定細胞を濃縮する方法において、蛍光抗体を用いずに特定細胞が生きた状態で特異的に内部に取り込む蛍光染色物質を利用することでその特定細胞を生きた状態で染色し、染色した特定細胞を含む夾雑細胞群を含む試料液をマイクロ流路に流し、細胞が流れている状態で光照射を行い、特定細胞が照射領域を通過した時に発生する蛍光を検出した信号をもとに、そのマイクロ流路の両側面に接続したソーティング流路を介して圧空気ポンプと電磁バルブ経由で空気圧を、サンプル流路の両側から短時間だけ作用させることで、その特定細胞の流れを変化させてチップ内の分岐流路に分離する方法で細胞分離を行う。
【0029】
特許文献4に記載されている様に、使い捨て型マイクロ流路チップの流路の両側面に接続した分離流路に、高速電磁バルブと空気圧シリンダーポンプとを空気を介して接続し、検出信号をトリガーとして一定時間のみ高速電磁バルブを閉状態から開状態にすることで細胞が流れる流路に側面からパルス的な空気圧を及ぼす方式とする。さらに、両側の空気圧を陽圧と陰圧とすることでpush-pull方式とする。この方式のメリットはソーティング力を増大するメリットとマイクロ流路内にソーティング流の影響を及ぼす影響を低減する効果がある。この方式の細胞分離装置の光源としてインドシアニングリーンの励起用の750nmから790nmの波長範囲のレーザー光源を用いて、波長800nm以上の蛍光を検出し、その信号によって電磁バルブを開状態とすることで細胞を分離する。以上の手段によって、細胞にダメージを与える蛍光抗体染色を用いずに、しかもクロスコンタミネーションの心配がない使い捨てマイクロ流路チップ内での肝細胞を分離する。この方法は、肝臓の再生医療として、ES細胞やiPS細胞から分化した肝細胞から移植用肝臓組織を形成するうえでの必須の技術である。
【0030】
5)細胞分離に用いるマイクロ流路を形成したチップは、流路の上流側と下流側に接続するリザーバーとソーティング流路が形成されていて、上流側のリザーバーの上部空間に対して空気加圧あるいは下流側のリザーバーの上部空間に対して大気より陰圧とすることで、チップ内のサンプルの送液を非接触で行うことで、サンプルがチップ内に閉じ込められた状態で行うことを特徴とする細胞分離方法。
【0031】
この手段における細胞検出分離装置の細胞流路系は、細胞の汚染を除くという観点から、閉鎖系であって、使い捨て型の流路系である。その為には、特許文献3や4に示されているように、使い捨て型マイクロ流路チップを利用するのが望ましい。さらに、細胞検出分離装置が汎用型安全キャビネット内に設置して可動可能とすることで、大気中浮遊細菌などの細胞への汚染を低減することが可能となる。
【0032】
6)マイクロ流路を形成したチップが樹脂製であって、流路およびリザーバーの表面を親水処理を施すことで細胞培養プレートとして使用できるマイクロ流路チップ。
【0033】
細胞分離用に用いたマイクロ流路チップの分離細胞を回収した部分が、そのまま培養プレートとして使用可能とするために、流路が閉鎖系で、雑菌に汚染の危険がなく、細胞が接着可能な親水処理が施されている。樹脂の親水性処理としては、界面活性剤でコーティングする方法がよい。
7)親水処理を施したチップを用いて細胞分離を行った後に、その分離した細胞をそのままチップ内で培養して、細胞品質を検証するためのスクリーニングを行うことを特徴とする細胞分離方法。
【0034】
親水処理を施したチップを利用すれば、機械的に細胞数を一定にし、細胞を汚染することなく、そのまま培養することができる。再現性の高いスクリーニング用の細胞解析を簡単に行うことができる。品質の保証された細胞を再生医療に応用するためにあらかじめチックすることができる。
【0035】
8)特定の化合物がに特定の細胞に特異的に取り込まれ、一定時間細胞内にとどまり、その後に細胞外に排出されることを利用して、純化した細胞から、その特定の化合物を細胞から排除することを特徴とする細胞純化方法。
【0036】
ここで特定の化合物とはICG等の蛍光色素であって、肝細胞に選択的、特異性で取り込まれる性質がある。ICGは肝臓を構成する肝細胞が97%取り込み、それ以外の末梢組織にはほとんど見られない極めて強い選択性を持つ(非特許文献5)。さらに、ICGの投与量、投与時間により、残り3%を制御できる。一般的に、ICG染色条件を以下のようにする。投与量1ml,5mgに調整、投与時間30分から12時間の幅を持たせる。この幅は、作製した肝細胞の分化段階によりICG摂取の程度が違うことに対応するものであるが、この幅により3%を制御できる。さらに培養液中にはアルブミン、リポ蛋白等を成分として含ませ、ICGと結合し肝細胞に取り込まれやすい状態にすることが望ましい。図1はこの様にして染色した場合の染色の特異性を示すものである。ヒトES細胞由来肝細胞の場合は肝細胞に分化した細胞とそうでないものとで染色の違いは明確である。
【0037】
ICGを含む蛍光色素は細胞にダメージレスであり、細胞に摂取された後特定の時間細胞内に維持され、確実に排泄されることが必要である。少なくとも数時間で排泄されるのが望ましい。ICGの場合、6時間でほぼ消失することがわかっている(非特許文献2)。投与量、投与時間の影響は軽度である。図6は、ES細胞から分化誘導させた肝細胞を純化させて生体ヘ移植するプロセスの概略をしめしたものである。ICGを利用して純化した肝細胞は、6時間以上の放置でICGが細胞から排除後に生体内へ移植を行う方法とする。
【0038】
医療に応用する際、ランニングコストが廉価であればその分、医療経済を圧迫しないという点で低価格な蛍光色素が望ましい。ICGを含む蛍光色素は使用される抗体と比較した場合、価格において1/100以下である。しかも肝細胞に選択的に取り込まれ、代謝されずに胆汁に排出される。肝細胞への病的な影響は報告されていない。
【発明の効果】
【0039】
上記で述べたように、本発明は流路閉鎖系長波長セルソーターと安全性の高い廉価なICGを含む長波長の蛍光色素を組み合わせることにより、特異的に、かつ高い選択性で特定細胞がほとんど傷害を受けずに簡便に夾雑細胞から純化濃縮できる。このことにより、再生医療、創薬開発に純化濃縮された高品質の細胞を廉価に提供できる。
【図面の簡単な説明】
【0040】
【図1】実施例に関わるICG摂取ヒトES細胞由来肝細胞の位相差顕微鏡写真である。Bar=40 μm
【図2】実施例に関わるICG摂取ヒトES細胞由来肝細胞の電子顕微鏡写真であるである。a: 成熟した肝細胞に分化している。Bar=2 μm b.毛細胆管内にICGと考えられる黒い粒子が認められる。Bar=0.5 μm
【図3】実施例に関わるHepG2細胞についてICGを取り込んだものとそうでないものと蛍光強度の差を示したものである。a: 対象(ICGを取り込ませていない)。bと比較して左側に存在する。 b.ICGを取り込ませたHepG2.対象に比較し右側に移動する。
【図4】実施例に関わるHepG2細胞についてICGを取り込んだものとそうでないものとの細胞の大きさと蛍光強度の差を示したものである。
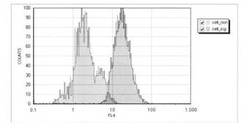
【図5】図4の所見をヒストグラムにしたものである。
【図6】ES細胞から分化誘導させた肝細胞を純化させて、再生医療、創薬開発等のために使用されるのに適した純化濃縮された高品質の細胞を得るまでのプロセスの概略をしめしたものである。
【図7】無菌処理細胞分離を実現するために、使い捨てチップ型フローセルを用いた細胞分離を行うためのフローセル構造と電磁バルブと定圧ポンプを示した図である。
【図8】本発明によるICG励起用波長785nmレーザーと波長473nmレーザーとを搭載し、ICG由来の波長800nm以上長波長の蛍光およびその他の蛍光と散乱光信号を検出する細胞分離装置であって、使い捨てチップ型フローセルを用いた細胞分離を行うためのフローセルと光学系と制御系を示した図である。
【発明を実施するための形態】
【0041】
以下、本発明についてより詳細に説明する。
本発明は流路閉鎖系長波長セルソーターと安全性の高い廉価なICGを含む長波長の蛍光色素を組み合わせ、肝細胞を含む長波長蛍光色素を摂取した細胞を生きたまま汚染されずに純化濃縮する装置である。この装置は極めて強い細胞選択性を発揮できる簡便で易操作性の省力タイプのセルソーターである。
【0042】
本発明に関わる細胞検出・分離装置のレーザー発振装置は波長785nm、蛍光検出は波長800nm以上で、それぞれ使用する光学フィルターの波長範囲は750−790,800−900nm以上という要求を満たす。ICG色素は結合するものにより、照射エネルギーより蛍光色素の波長が変化する可能性があり、このような観点から上記範囲であることが望ましい。
【0043】
細胞検出分離装置の細胞流路系は閉鎖系である。そのため細胞の汚染の危険性は100%避けることができ、検出、分離後に再び培養することが可能である。同時に、チップをそのまま培養プレートとして使用可能である。これらの特徴から、あらかじめ迅速なスクリーニングを実施することにより、再生医療、創薬開発に純度が高く機能性の高い細胞を速やかに供給できる。
【0044】
細胞検出装置と分離装置の本体は同じで、検出と分離を同時に行うことが可能である。操作が極めて簡単な理想的なタイプである。
【0045】
本発明において細胞分離方法として、マイクロ流路内において細胞の流れに側面からの水流で細胞を横方向にシフトさせる方法をとるが、この方法において上流と下流の流れに影響を及ぼさない対策として、両側面からのpush-pull方式により、逃がす細胞が少なくなり高い効率性を持つ。
【0046】
ICGの97%は肝細胞に選択的、特異的で取り込まれる。したがってその高い選択性から細胞純化の指標としては最適である。
【0047】
ICGは785nmのレーザー照射により波長840nm近傍の蛍光を発する。この蛍光は極めて特異的であり、これを含んだ細胞とそうでない細胞とを明確に識別できるため、細胞を純化するために都合がよい。
【0048】
ICGは半世紀生体で使われてきた色素であるため色素自身の安全性については折り紙つきである。排出は約6時間で完了する(非特許文献2)。ICGを摂取した細胞でも細胞移植用細胞として使用が可能である。
【0049】
ICGは数百円の単位であり、一方抗体(一次抗体、二次抗体を含めて)は数万円単位であり、必要とする試薬は1/100以下に抑え込むことができる。
【0050】
ICGを摂取した細胞はトリプシンで分散させた後、遠心を一度おこなうだけで、すぐに検出分離が可能になる。操作が非常に簡単である。
【実施例】
【0051】
以下、本発明を実施例に基づいてさらに具体的に説明するが、本発明は下記実施例により制限されるものではない。
【0052】
ヒトES細胞由来肝細胞、HepG2、初代肝細胞を用いた。これらの細胞を6cmのデッシュで培養した。ヒトES細胞由来肝細胞は成長因子FGF,BMP-4,Oncostatinを組み合わせ、ランフォード無血清培地で分化誘導し培養した。ヒト肝癌細胞を株化させたHepG2は、DMEM培地を基本培地として血清10%と非必須アミノ酸を終濃度100uMになるように添加し、培養をおこなった。また、ラット初代肝細胞はWilliam's E培地を基本培地として開発されたLanford培地を用いて培養した。
いずれも3−5%CO2インキュベータ内で、37℃で培養した。
【0053】
ヒトES細胞由来肝臓細胞に10%ICGを6時間取り込ませたものを図1に示す。摂取した細胞とそうでない細胞が区別できる。
【0054】
これらの細胞を電子顕微鏡で観察してみると、細胞は丸い大型の核、豊富な粗面小胞体、滑面小胞体を備え、発達した毛細胆管、その中にICGと考えらる電子密度の高い構造を排出しており、機能性を有した肝細胞であることがわかる(図2)。
【0055】
初代肝細胞は30分、HepG2細胞に12時間かけ、ICGを取り込ませた。次に0.5%トリプシンで剥離し分散した後、新しく開発した長波長レーザー装置を搭載したセルソーターでHepG2細胞の検出を試みた。細胞は5000個測定した。HepG2は純粋に株化された細胞なので、コントロール(摂取させていないもの)と明確な差を見ることができた。お互い重なりあうところは極めて少なく、明確に区別できることがわかった。初代肝細胞の場合は蛍光輝度の低いものとそうでないものとが存在した。これは胆管細胞や血管内皮細胞、線維芽細胞などが含まれて入り、それらがICGを取り込まないため分離したものと考えられる。
【0056】
図3は、摂取したものとそうでないものとの蛍光強度の違いを示す。
図4は、細胞の大きさと蛍光強度を摂取したものとそうでないものとを比較した。
図5は、それらをヒストグラムで示した。
【0057】
図6は、本発明によるES細胞から分化誘導させた肝細胞の純化方法の流れを示したものである。この方法は、次のステップを含む。ES細胞の自己複製、分化誘導、肝細胞のICGによるダメージレス特異的染色、ICGがレーザー照射をうけた時のサンプル細胞群の活性酸素低減対策の事前処理、ICG励起用レーザーを搭載したチップ内細胞分離を利用した無菌的セルソーティング処理、純化した肝細胞からのICG除去というステップがある。ES細胞の自己複製の過程は、DMEM/F12を基本培地として20%KSRを含む培地で培養し、分化させずに未分化性、増殖性(自己複製)を維持するためにフィーダー細胞を使用する。分化誘導の過程は、成長因子であるFGFとBMP-4とOncostatinを組み合わせ、ランフォード無血清培地で誘導を行う。この結果として、ES細胞コロニーと分化誘導細胞(目的の肝細胞と目的外の細胞)が得られる。
【0058】
ES細胞はのぞかれないまま移植細胞に含まれると奇形腫が形成され臓器を圧迫し傷害を引き起こす。また目的外の細胞も、のぞかれないまま残ると移植組織の機能低下をもたらす。そのために、目的の分化誘導細胞である肝細胞のみを特異的に染色するために、10%ICGを含む培地で6時間放置する。これによって、ICGが肝細胞に特異的に取り込まれ、細胞毒性のない蛍光ラベルが完了する。その後、これらの細胞溶液に活性酸素分解酵素であるスーパーオキシドディスムターゼを50ng/mL以上の濃度で添加する。次に、ICGからの蛍光信号により無菌的な細胞分離を行うために、波長785nmレーザー光源を搭載し、波長800nm以上の蛍光信号を検出する光学系を有し、閉鎖系のマイクロ流路内で細胞分離を行う装置を利用する。細胞分離の結果、純化した肝細胞群が得られる。この肝細胞群を培地中で6時間放置することでICGを排出させる。以上のステップは、細胞毒性の無い特異的蛍光染色とその蛍光により無菌的な肝細胞の純化を実現するため、再生医療用やセルベース創薬スクリーニング用の肝細胞の純化プロセスに最適なものである。
【0059】
次に、使い捨てチップ内の細胞分離を実現する実施形態を図7および図8を用いて説明する。
【0060】
図7は、使い捨てチップ型フローセルに、シリンダーポンプと電磁バルブを接続した状態を示している。使い捨てチップは、以前の発明である特許文献14に記載したものに、ソーティング用の流路4-1と流路4-2とそれぞれソーティングリザーバー5-1、5-2を対称的に追加した構造とする。使い捨てチップ型のフローセルは、透明な樹脂製である。樹脂の種類としては、ポリメタルアクリレート(PMMA)、シクロオレフィン・コポリマー(COC)、メチルペンテンポリマーなどが使用できる。ソーティングリザーバーを流路4-2にも設置した対称構造として電磁バルブとシリンダーポンプを接続する。対称構造は、電磁バルブがOPENしたときに同一時間に同一の圧力が流路27に対して加わるようにするためである。
【0061】
図8にはさらに光学系と制御系回路との接続関係を示した。チップの断面図は図7のBB断面である。図7に示したように、チップの上流側に空気圧を加えることで、シース液とともにサンプル液を流路27に流し、対向するソーティング流路4-1、4-2の領域よりやや上流の主流路の中央部にレーザー光52を照射する。レーザー光52は、波長785nmのレーザー光源と波長473nmのレーザー光源から射出したレーザー光をダイクロイックミラー80で合わせたものである。細胞がこの照射領域を通過した瞬間に散乱光と蛍光がパルス的に発生する。波長473nmの散乱光はダイクロイックミラー54とバンドパスフィルター57によって波長473nm近傍の波長のみを透過させて検出器61で検出する。検出器61の前には遮光板60を設置して、レーザー透過光を除去する。蛍光は、ダイクロイックミラー55、56とバンドパスフィルター58,59によって照射レーザー光よりも長波長で複数の波長領域を分割してそれぞれ異なる検出器62、63で検出する。ICGからの蛍光検出は、バンドパスフィルター59として波長800nmから波長900nmまで透過させるものを使用することで検出器63で検出する。473nmの散乱光信号は細胞サイズを評価するための指標として用い、波長800nmより長波長の蛍光信号はICGを取り込んだ肝細胞を検出するための指標として用いる。各検出パルス信号は、増幅してAD変換する回路64によってデジタル化し、マイクロコンピューター69によって、予め設定した分離条件を複数の検出信号が満たすか否かを判断し、満足する場合に電磁バルブドライバー66にトリガー信号を一定遅延時間後に出力する。この遅延時間は、細胞がレーザー照射領域からソーティング流路4-1、4-2の領域に流れるまでの時間に調整する。トリガー信号を受信した電磁バルブドライバー66は、電磁バルブ7-1,7-2に一定時間だけOPENする信号を出力する。バルブがOPEN状態の時間幅は、流路4-1と流路4-2の幅を等しくWとして、細胞が流路27を流れる流速をVとすると、W/V(秒)と設定するのが望ましい。電磁バルブOPEN時に目的の細胞がソーティングリザーバー5に流れ込む。主流路とソーティング流路との間の流れは、バルブ7-1と7-2とがCLOSE状態では発生しないので、一旦ソーティングリザーバー5に取り込まれた細胞はその場に安定して保存される。
【0062】
図7に示したようにチップの上流側のリザーバー20の内部には、図には記していないが定圧ポンプで一定の空気圧を加えるようにしてある。リザーバー20の内部には試料液リザーバー10がありその内側に試料液をいれ、その外側にシース液を入れる。シース液としてはphosphate buffer saline(PBS)を用いることができる。共通の空気圧によって、試料液1と左右のシース液2が下流に向かって流れ、3本の流路が合流したあと流路27を試料液がシース液によって細く絞られた状態で流れる。流路27の幅は80μmであり、深さは50μmである。合流後の試料液の幅は流路幅の約1/10である。流路27には、側面から対向するソーティング流路4-1、4-2があり、その流路はリザーバー5に接続している。この対向領域よりも数100μmだけ上流側の流路27の中央部に、波長785nmと波長473nmのレーザー光52を照射する。そのビームサイズは長さ50μm幅20μmの長円としている。
【0063】
細胞がこの照射領域を通過した瞬間に散乱光と蛍光がパルス的に発生する。散乱光はダイクロイックミラー54とバンドパスフィルター57によって照射レーザー光と同じ波長を選択して検出器61で検出する。検出器61の前には遮光板60を設置して、レーザー透過光を除去する。蛍光は、ダイクロイックミラー55、56とバンドパスフィルター58,59によって照射レーザー光よりも長波長で複数の波長領域を分割してそれぞれ異なる検出器62、63で検出する。各検出パルス信号は、増幅してAD変換する回路64によってデジタル化し、マイクロコンピューター69によって、予め設定した分離条件を複数の検出信号が満たすか否かを判断し、満足する場合に電磁バルブドライバー66にトリガー信号を一定遅延時間後に出力する。この遅延時間は、細胞がレーザー照射領域からソーティング流路4-1、4-2の領域に流れるまでの時間と同じにする。トリガー信号を受信した電磁バルブドライバー66は、電磁バルブ7-1,7-2に一定時間だけOPENする信号を出力する。バルブがOPEN状態の時間幅は、流路4-1と流路4-2の幅を等しくWとして、細胞が流路27を流れる流速をVとすると、W/V(秒)と設定するのが望ましい。電磁バルブOPEN時に目的の細胞がソーティングリザーバー5-1に流れ込む。主流路とソーティング流路との間の流れは、バルブ7-1と7-2とがCLOSE状態では発生しないので、一旦ソーティングリザーバー5-1に取り込まれた細胞はその場に安定して保存される。また、図7に示したフローセルは、下流側に分離流路11,23,24を形成してあるので、目的の細胞がソーティング流路4−1と4−2による圧力によって、ソーティングリザーバー5−1に取り込まれるほどの移動量がなかった場合は、下流側で流路23へ分離される。したがって、図7に示したフローセルは、流路27の流速が早い場合は流路23へ分離し、流速が遅い場合はソーティングリザーバー5−1に分離するという流速に対して2段階のマージンの広い分離を実現する構造となっている。
【産業上の利用可能性】
【0064】
本発明によれば、特異的かつ高い選択性で特定細胞をほとんど無傷で簡便に夾雑細胞から単離濃縮できるため、再生医療、創薬開発等のために使用されるのに適した純化濃縮された高品質の細胞が提供される。
【符号の説明】
【0065】
1…試料液流路
2…シース液流路
3…照射光
4−1…ソーティング流路(PULL側)
4−2…ソーティング流路(PUSH側)
5…ソーティングリザーバー
6…フィルター7−1、7−2…電磁バルブ
8−1…負圧定圧ポンプ
8−2…陽圧定圧ポンプ
9−1…分離対象である細胞
9−2…分離非対象の細胞
10…試料液リザーバー
11…回収試料液リザーバー
20…シース液リザーバー
22…シース液用ポート
23…シース液回収ポート
24…シース液回収ポート
25…チップ用基板
27…流路
31…試料液リザーバー
32 …シース液用ポート
34…廃液リザーバー
35 …回収試料液リザーバー
36 …試料液
37…シース液リザーバー
50−1…波長785nmのレーザー光源
50−2…波長473nmのレーザー光源
51 …対物レンズ
52…波長785nmと波長473nmのレーザー光
53…ソーティング流路4−1と4−2で挟まれた領域
54,55,56…ダイクロイックミラー
57,58,59…バンドパスフィルター
60…透過レーザー光遮断用空間フィルター
61…フォトダイオード
62,63…光電子増倍管
64…AD変換器
69…AD変換器
70…キーボード
71…ディスプレイ
【技術分野】
【0001】
本発明はヒトを含めた動物及びES細胞、iPS細胞、骨髄幹細胞、体性幹細胞に由来する肝細胞などを他の細胞から細胞を傷害することなく純化濃縮する省力方法に関する。
【背景技術】
【0002】
多能性幹細胞を用いた再生医療、創薬への応用は、目的の細胞に分化させる技術がそのカギを握っており、成長因子を組み合わせる、低分子化合物を用いる、細胞間相互作用を利用する、新規基材を利用するなどの方法を用い、着々と実績を積み上げ、現実化に近づいてきた(例えば非特許文献1)。多能性幹細胞であるES細胞は長期間未分化性を維持したまま増殖し、かつ長期間培養した後でも三胚葉になりうる能力を持つ細胞で、受精卵から国家の指針に従って樹立された細胞である。
【0003】
肝細胞に関して、ヒトES細胞より発生プロセスに関係した成長因子を組み合わせランフォード培地を用いることにより、成熟した肝細胞を30%前後の割合で得ることに成功している(例えば非特許文献1,2)。
【0004】
一方多能性幹細胞は目的の細胞に分化するために様々な細胞を介した多くのステップを踏む。そのため目的の細胞を得た時、目的の細胞以外多種多様の細胞(夾雑細胞)が混在する。その結果、機能性が低下し、未分化細胞が混在した場合腫瘍が形成され周囲組織や臓器に障害を与える。これらを回避するため細胞を純化する方法が必要である(例えば、非特許文献3)。
【0005】
細胞を純化させるための一般的な方法は目的の細胞の膜表面に存在する抗原を指標として、それを認識する抗体及びその抗体を認識する蛍光色素(GFPFなど)が付加された二次抗体で反応させた後レーザーで励起させ、反応した細胞を検出し振り分ける、いわゆるFACSにより分離する方法がある。(例えば非特許文献4)。
【0006】
この検出分離に用いるレーザー装置は400−600nmの範囲で用いられることが多い。700nm以上の長波長レーザーを励起光源として用いて、赤外蛍光を検出することで生細胞の識別、計測に応用する技術が、特許文献1に記載されている。これは非天然型核酸プローブに蛍光色素を付加する方法で、核酸に直接影響を与えるものであるため、この方法で細胞を分離できたとしても細胞の安全性は保証されない。
【0007】
一方人体を構成する274種類相当の細胞の中で、肝臓を構成する肝細胞のみが97%以上選択的にICGを取り込むことが知られているが、それ以外の末梢組織にはほとんど認められない(非特許文献5)
【0008】
ICG(indocyanine green、インドシアニン・グリーン,C43H47N2NaO6S2)は、当初写真に使用する色素として開発された。緑色を呈する色素であり1950年代末より生体に応用され、肝臓の機能検査に用いられた。最近では眼科領域において血管の走行や変異を調べるのに利用されている。生体にとって安全性の高い色素であり極めて廉価である。
【0009】
この色素は肝細胞に選択的に取り込まれ、代謝されずにそのまま毛細胆管に放出された後、胆汁に混じり排泄される。生体に残存することはない。尿から排泄されることもない(非特許文献5)
【0010】
この色素の大きな特徴は長波長(780nm近傍)を吸収し長波長の蛍光(800nm以上)を発する蛍光色素でもある。アルブミン、リポ蛋白と結合することにより血流内を移動する。この性質を利用した検査が血管造影であり、眼科領域で行われているICG蛍光眼底造影はよく知られている。たとえば、ICGを蛍光染色剤として利用して、近赤外レーザー照射によってICGから発する赤外蛍光を検出することによって眼底像を観察する方法は、特許文献2に記載されている。
【0011】
一方、高出力レーザー光をICGの励起光源として用いる場合は、ICGの光励起によって一重項酸素が発生するため、照射部の組織に損傷をあたえることが知られている(非特許文献6)。
【0012】
細胞の純化のために役立つ細胞分離方法としては、以下の方法が知られている。特許文献3は、再生医療に最適なコンタミネーションフリーを実現した使い捨て交換型のマイクロ流路チップ内で細胞を解析分離する方式である。さらにマイクロ流路内の流れの影響を低減するように改善した方式が特許文献4である。
上記の使い捨て以外の方式は以下の方法が知られている。米国特許第3710933号(特許文献5)または米国特許第3826364号(特許文献6)に記述されている方法が現在一般的な製品に使用されている分離方法であって、液滴形成用ノズルから空気中に試料液を液滴として吐出し、分離対象の細胞を含む液滴は液滴単位で電場によって分離するという方法である。特開昭64−3541(特許文献7)は、フローセルを流れる試料液の周囲にシース流を流し、試料液に電場を加えることで帯電した粒子を試料流からシース流の法へシフトさせて分離計測する方法である。特開平1−170853(特許文献8)は、フローセルを流れる粒子に圧力パルスを与えて、フローセル内の定常的に流れている流路ではない流路に粒子を分離する方法が記載されている。国際公開番号WO98/10267(特許文献9)は、フローセル内に周囲をシース流でしぼって流した微粒子に場を与えて微粒子の流れをシフトさせて分離するという技術が公開されている。国際公開番号WO2004/101731(特許文献10)において、フローセル内の流路の両側に設置したゲル電極によって液体中で帯電している細胞を電場で分離する方法が公開されている。米国特許US6808075(特許文献11)において、粒子の流れに対して垂直にメニスカスを形成するバブルバルブにより圧力パルスを加えて流れをシフトさせて分離する方式が公開されている。PCT/US2006/000237 (特許文献12)は、特許文献8と同様に圧力パルスを与えるが目的とする粒子を含む水滴単位で射出してコンテナに回収方法である。米国特許第4756427号(特許文献13)には、シース流で絞られた試料液の流れの中の粒子を計測しターゲットとなる粒子であると判断した場合に、パルス流で別流路に導入して分離する方法が記載されている。使い捨てチップを利用するフローサイトメーターは特許4358888(特許文献14)に記載されている。
【先行技術文献】
【特許文献】
【0013】
【特許文献1】特開平6−178699
【特許文献2】特開2001−161647
【特許文献3】特開2010-181349
【特許文献4】特願2010-7295
【特許文献5】米国特許第3710933号
【特許文献6】米国特許第3826364号
【特許文献7】特開昭64−3541
【特許文献8】特開平1−170853
【特許文献9】国際公開番号WO98/10267
【特許文献10】国際公開番号WO2004/101731
【特許文献11】米国特許US6808075
【特許文献12】PCT/US2006/000237
【特許文献13】米国特許第4756427号
【特許文献14】特許4358888
【非特許文献】
【0014】
【非特許文献1】Sasaki K, Ichikawa H, Takei S, et al. TheScientificWorld9:884-90 2009.
【非特許文献2】Yoshie S, Shirasawa S,Yokoyama T, et al. Biochem Biophys Res Commun. 391: 1477-1482,2010
【非特許文献3】Blum B, Benvenisty N..Adv Cancer Res. 100:133-58,2008..
【非特許文献4】Gouon-Evans V, Boussemart L, Gadue P et al. Nature Biotechnol.24:1402-1411,2006.
【非特許文献5】浪久利彦、南部勝司、飯島克己他 肝臓, 5, 114-118, 1963.
【非特許文献6】平野達、河野英治、郷渡祐子他 日レ医誌(JJSLSM) 28:122-127,2007
【発明の開示】
【発明が解決しようとする課題】
【0015】
一般に行われている特定の表面抗原をターゲットにした蛍光抗体ラベルにより細胞を特異的な蛍光染色を行い、その蛍光信号に基づいて特定の表面抗原を有する細胞の分離を行う従来の細胞分離方法は手順が複雑である。特に肝細胞の場合、適切な指標になる特異的な細胞膜表面抗原はヒトでは見いだされていないため、いくつかの細胞に反応する抗体を組みせて純化を試みており、手法はさらに煩雑になる(例えば非特許文献4)。肝細胞について強い選択性が確保された細胞分離方法がないため、純化された結果について不確定さが残る。そのため細胞の品質保証が確保されない。
【0016】
ヒト肝細胞に特異な抗原が存在したとしても、操作の煩雑さは消えず、抗原抗体反応による細胞への内的、外的な影響を避けることができない。
【0017】
現在の分離方法は機種操作が複雑であるため、オペレーターが必要である。また、方法が煩雑であるため、高度にトレーニングされた技術者が必要であり、易操作性という装置、方法の普遍化の重要なファクターを満足できていない。
【0018】
抗体は高価であり医療経済への負担が少なくなく、活性もロットにより異なるなど、結果の安定性において不確実さを残す。
【0019】
本発明は上記課題を解決されるためになされたものであり、ヒトを含めた動物細胞及びES細胞、iPS細胞、骨髄幹細胞、体性幹細胞に由来する肝細胞を含む多種類の細胞を廉価で易操作性、かつ細胞傷害の少ない状態で、夾雑細胞から特異的に肝細胞を純化濃縮することを目的とするものである。
【発明の概要】
【課題を解決するための手段】
【0020】
1)夾雑細胞群中のある特定細胞を濃縮する方法において、蛍光抗体を用いずに特定細胞が生きた状態で特異的に内部に取り込む蛍光染色物質を利用することでその特定細胞を生きた状態で染色し、光照射することで該蛍光物質から発生する蛍光を検出することで、その特定細胞を識別し分離を行う方法。
【0021】
上記手段の夾雑細胞群中のある特定細胞を濃縮する方法において、その特定細胞が生きた状態で特異的に内部に取り込む細胞へのダメージレスの蛍光染色物質を利用することでその特定細胞のみを蛍光染色し、その蛍光物質の光照射で発生する蛍光を検出することで、その特定細胞を識別し汚染のない状態で生きたまま細胞分離を行う。この具体的な例として、下記の手段をとる。
【0022】
2) 上記1)において、夾雑細胞群のなかから肝細胞を分離濃縮する方法であって、染色に用いる化学物質はインドシアニングリーンであり、光照射に用いる波長は750nmから800nmの範囲であって、蛍光の検出波長は800nmから900nmの範囲であることを特徴とする肝細胞分離濃縮方法。
【0023】
夾雑細胞群とはES細胞またはiPS細胞から分化した細胞群であって、その中に含まれる肝細胞を再生医療用として濃縮することを考える。肝細胞に特異的に取り込まれるICG蛍光色素を肝細胞検出の指標として、さらにそのICGを光励起可能な近赤外レーザー装置を搭載した細胞検出・分離装置を用いることによって、これまで解決が極めて困難であったES細胞またはiPS細胞から分化した肝細胞を生きたまま純化濃縮というプロセスとを実現する。
【0024】
本発明に関わるレーザー光源として、少なくともICGを励起するために照射波長が750nmから800nmのものを含む必要がある。。また、ICGが発する蛍光波長領域は800nmより長波長側に発光スペクトル極大があるので、800nmから900nmの長波長蛍光を検出する光学系をふくんでいる必要がある。ICG色素は結合するものにより、照射エネルギーより蛍光色素の波長が変化する可能性があり、このような観点から上記範囲であることが望ましい。
【0025】
3)上記の肝細胞分離濃縮方法において、細胞分離濃縮処理の前の試料細胞液にスーパーオキシドディスムターゼあるいはマンガネーゼスーパーオキシドディスムターゼを事前に混入することで、細胞分離処理時のレーザー光照射によってインドシアニングリーンから発生する活性酸素を低減する対策を行うことを特徴とする細胞分離方法が、肝細胞を細胞損傷なく分離する手段として有効である。
【0026】
その理由は、非特許文献6によると、ICGは照射パワー密度100mW/cm2程度、照射エネルギー密度mJ/cm2程度の光励起によって活性酸素を発生して細胞にダメージを与えるので、以下の様に活性酸素の発生を抑える対策で、再生医療用として純化した肝細胞の損傷の問題を解決する。活性酸素は、一重項酸素・スーパーオキシドアニオン・過酸化水素・ヒドロキシラジカルがあげられる。
スーパーオキシドディスムターゼ(Superoxide dismutase;(以下、「SOD」という)は、生体内で酸素毒性を示す活性酸素を分解する酵素である。SODはその活性中心に銅(Cu)イオンと亜鉛(Zn)イオン、またはマンガン(Mn)イオンや、鉄(Fe)イオンなど、金属イオンをもった酵素で、細胞質やミトコンドリアに多く局在している。中でもマンガンイオンを持つ酵素は、マンガネーゼスーパーオキシドディスムターゼ(Manganese superoxide dismutase;以下「MnSOD」という)と呼ばれ、ミトコンドリア特有の酵素である。これらのSODは、活性酸素による細胞の損傷を防御する作用を有すると考えられている。
【0027】
そのため、ICGに光照射することによって発生する活性酸素による細胞損傷防止としては、SOD(スーパーオキシドディスムターゼ)やカタラーゼなどの活性酸素除去酵素を、レーザーを照射するまえにサンプル細胞液に混入しておくことでレーザー照射によって発生する活性酸素をその場で消滅させることができるからである。その混入する濃度としては、血清中MnSOD濃度は、健常者で平均値±標準偏差(ng/mL)=51.3±13.9であることが分かっているので、少なくともその濃度以上が望ましい。
【0028】
4)夾雑細胞群中のある特定細胞を濃縮する方法において、蛍光抗体を用いずに特定細胞が生きた状態で特異的に内部に取り込む蛍光染色物質を利用することでその特定細胞を生きた状態で染色し、染色した特定細胞を含む夾雑細胞群を含む試料液をマイクロ流路に流し、細胞が流れている状態で光照射を行い、特定細胞が照射領域を通過した時に発生する蛍光を検出した信号をもとに、そのマイクロ流路の両側面に接続したソーティング流路を介して圧空気ポンプと電磁バルブ経由で空気圧を、サンプル流路の両側から短時間だけ作用させることで、その特定細胞の流れを変化させてチップ内の分岐流路に分離する方法で細胞分離を行う。
【0029】
特許文献4に記載されている様に、使い捨て型マイクロ流路チップの流路の両側面に接続した分離流路に、高速電磁バルブと空気圧シリンダーポンプとを空気を介して接続し、検出信号をトリガーとして一定時間のみ高速電磁バルブを閉状態から開状態にすることで細胞が流れる流路に側面からパルス的な空気圧を及ぼす方式とする。さらに、両側の空気圧を陽圧と陰圧とすることでpush-pull方式とする。この方式のメリットはソーティング力を増大するメリットとマイクロ流路内にソーティング流の影響を及ぼす影響を低減する効果がある。この方式の細胞分離装置の光源としてインドシアニングリーンの励起用の750nmから790nmの波長範囲のレーザー光源を用いて、波長800nm以上の蛍光を検出し、その信号によって電磁バルブを開状態とすることで細胞を分離する。以上の手段によって、細胞にダメージを与える蛍光抗体染色を用いずに、しかもクロスコンタミネーションの心配がない使い捨てマイクロ流路チップ内での肝細胞を分離する。この方法は、肝臓の再生医療として、ES細胞やiPS細胞から分化した肝細胞から移植用肝臓組織を形成するうえでの必須の技術である。
【0030】
5)細胞分離に用いるマイクロ流路を形成したチップは、流路の上流側と下流側に接続するリザーバーとソーティング流路が形成されていて、上流側のリザーバーの上部空間に対して空気加圧あるいは下流側のリザーバーの上部空間に対して大気より陰圧とすることで、チップ内のサンプルの送液を非接触で行うことで、サンプルがチップ内に閉じ込められた状態で行うことを特徴とする細胞分離方法。
【0031】
この手段における細胞検出分離装置の細胞流路系は、細胞の汚染を除くという観点から、閉鎖系であって、使い捨て型の流路系である。その為には、特許文献3や4に示されているように、使い捨て型マイクロ流路チップを利用するのが望ましい。さらに、細胞検出分離装置が汎用型安全キャビネット内に設置して可動可能とすることで、大気中浮遊細菌などの細胞への汚染を低減することが可能となる。
【0032】
6)マイクロ流路を形成したチップが樹脂製であって、流路およびリザーバーの表面を親水処理を施すことで細胞培養プレートとして使用できるマイクロ流路チップ。
【0033】
細胞分離用に用いたマイクロ流路チップの分離細胞を回収した部分が、そのまま培養プレートとして使用可能とするために、流路が閉鎖系で、雑菌に汚染の危険がなく、細胞が接着可能な親水処理が施されている。樹脂の親水性処理としては、界面活性剤でコーティングする方法がよい。
7)親水処理を施したチップを用いて細胞分離を行った後に、その分離した細胞をそのままチップ内で培養して、細胞品質を検証するためのスクリーニングを行うことを特徴とする細胞分離方法。
【0034】
親水処理を施したチップを利用すれば、機械的に細胞数を一定にし、細胞を汚染することなく、そのまま培養することができる。再現性の高いスクリーニング用の細胞解析を簡単に行うことができる。品質の保証された細胞を再生医療に応用するためにあらかじめチックすることができる。
【0035】
8)特定の化合物がに特定の細胞に特異的に取り込まれ、一定時間細胞内にとどまり、その後に細胞外に排出されることを利用して、純化した細胞から、その特定の化合物を細胞から排除することを特徴とする細胞純化方法。
【0036】
ここで特定の化合物とはICG等の蛍光色素であって、肝細胞に選択的、特異性で取り込まれる性質がある。ICGは肝臓を構成する肝細胞が97%取り込み、それ以外の末梢組織にはほとんど見られない極めて強い選択性を持つ(非特許文献5)。さらに、ICGの投与量、投与時間により、残り3%を制御できる。一般的に、ICG染色条件を以下のようにする。投与量1ml,5mgに調整、投与時間30分から12時間の幅を持たせる。この幅は、作製した肝細胞の分化段階によりICG摂取の程度が違うことに対応するものであるが、この幅により3%を制御できる。さらに培養液中にはアルブミン、リポ蛋白等を成分として含ませ、ICGと結合し肝細胞に取り込まれやすい状態にすることが望ましい。図1はこの様にして染色した場合の染色の特異性を示すものである。ヒトES細胞由来肝細胞の場合は肝細胞に分化した細胞とそうでないものとで染色の違いは明確である。
【0037】
ICGを含む蛍光色素は細胞にダメージレスであり、細胞に摂取された後特定の時間細胞内に維持され、確実に排泄されることが必要である。少なくとも数時間で排泄されるのが望ましい。ICGの場合、6時間でほぼ消失することがわかっている(非特許文献2)。投与量、投与時間の影響は軽度である。図6は、ES細胞から分化誘導させた肝細胞を純化させて生体ヘ移植するプロセスの概略をしめしたものである。ICGを利用して純化した肝細胞は、6時間以上の放置でICGが細胞から排除後に生体内へ移植を行う方法とする。
【0038】
医療に応用する際、ランニングコストが廉価であればその分、医療経済を圧迫しないという点で低価格な蛍光色素が望ましい。ICGを含む蛍光色素は使用される抗体と比較した場合、価格において1/100以下である。しかも肝細胞に選択的に取り込まれ、代謝されずに胆汁に排出される。肝細胞への病的な影響は報告されていない。
【発明の効果】
【0039】
上記で述べたように、本発明は流路閉鎖系長波長セルソーターと安全性の高い廉価なICGを含む長波長の蛍光色素を組み合わせることにより、特異的に、かつ高い選択性で特定細胞がほとんど傷害を受けずに簡便に夾雑細胞から純化濃縮できる。このことにより、再生医療、創薬開発に純化濃縮された高品質の細胞を廉価に提供できる。
【図面の簡単な説明】
【0040】
【図1】実施例に関わるICG摂取ヒトES細胞由来肝細胞の位相差顕微鏡写真である。Bar=40 μm
【図2】実施例に関わるICG摂取ヒトES細胞由来肝細胞の電子顕微鏡写真であるである。a: 成熟した肝細胞に分化している。Bar=2 μm b.毛細胆管内にICGと考えられる黒い粒子が認められる。Bar=0.5 μm
【図3】実施例に関わるHepG2細胞についてICGを取り込んだものとそうでないものと蛍光強度の差を示したものである。a: 対象(ICGを取り込ませていない)。bと比較して左側に存在する。 b.ICGを取り込ませたHepG2.対象に比較し右側に移動する。
【図4】実施例に関わるHepG2細胞についてICGを取り込んだものとそうでないものとの細胞の大きさと蛍光強度の差を示したものである。
【図5】図4の所見をヒストグラムにしたものである。
【図6】ES細胞から分化誘導させた肝細胞を純化させて、再生医療、創薬開発等のために使用されるのに適した純化濃縮された高品質の細胞を得るまでのプロセスの概略をしめしたものである。
【図7】無菌処理細胞分離を実現するために、使い捨てチップ型フローセルを用いた細胞分離を行うためのフローセル構造と電磁バルブと定圧ポンプを示した図である。
【図8】本発明によるICG励起用波長785nmレーザーと波長473nmレーザーとを搭載し、ICG由来の波長800nm以上長波長の蛍光およびその他の蛍光と散乱光信号を検出する細胞分離装置であって、使い捨てチップ型フローセルを用いた細胞分離を行うためのフローセルと光学系と制御系を示した図である。
【発明を実施するための形態】
【0041】
以下、本発明についてより詳細に説明する。
本発明は流路閉鎖系長波長セルソーターと安全性の高い廉価なICGを含む長波長の蛍光色素を組み合わせ、肝細胞を含む長波長蛍光色素を摂取した細胞を生きたまま汚染されずに純化濃縮する装置である。この装置は極めて強い細胞選択性を発揮できる簡便で易操作性の省力タイプのセルソーターである。
【0042】
本発明に関わる細胞検出・分離装置のレーザー発振装置は波長785nm、蛍光検出は波長800nm以上で、それぞれ使用する光学フィルターの波長範囲は750−790,800−900nm以上という要求を満たす。ICG色素は結合するものにより、照射エネルギーより蛍光色素の波長が変化する可能性があり、このような観点から上記範囲であることが望ましい。
【0043】
細胞検出分離装置の細胞流路系は閉鎖系である。そのため細胞の汚染の危険性は100%避けることができ、検出、分離後に再び培養することが可能である。同時に、チップをそのまま培養プレートとして使用可能である。これらの特徴から、あらかじめ迅速なスクリーニングを実施することにより、再生医療、創薬開発に純度が高く機能性の高い細胞を速やかに供給できる。
【0044】
細胞検出装置と分離装置の本体は同じで、検出と分離を同時に行うことが可能である。操作が極めて簡単な理想的なタイプである。
【0045】
本発明において細胞分離方法として、マイクロ流路内において細胞の流れに側面からの水流で細胞を横方向にシフトさせる方法をとるが、この方法において上流と下流の流れに影響を及ぼさない対策として、両側面からのpush-pull方式により、逃がす細胞が少なくなり高い効率性を持つ。
【0046】
ICGの97%は肝細胞に選択的、特異的で取り込まれる。したがってその高い選択性から細胞純化の指標としては最適である。
【0047】
ICGは785nmのレーザー照射により波長840nm近傍の蛍光を発する。この蛍光は極めて特異的であり、これを含んだ細胞とそうでない細胞とを明確に識別できるため、細胞を純化するために都合がよい。
【0048】
ICGは半世紀生体で使われてきた色素であるため色素自身の安全性については折り紙つきである。排出は約6時間で完了する(非特許文献2)。ICGを摂取した細胞でも細胞移植用細胞として使用が可能である。
【0049】
ICGは数百円の単位であり、一方抗体(一次抗体、二次抗体を含めて)は数万円単位であり、必要とする試薬は1/100以下に抑え込むことができる。
【0050】
ICGを摂取した細胞はトリプシンで分散させた後、遠心を一度おこなうだけで、すぐに検出分離が可能になる。操作が非常に簡単である。
【実施例】
【0051】
以下、本発明を実施例に基づいてさらに具体的に説明するが、本発明は下記実施例により制限されるものではない。
【0052】
ヒトES細胞由来肝細胞、HepG2、初代肝細胞を用いた。これらの細胞を6cmのデッシュで培養した。ヒトES細胞由来肝細胞は成長因子FGF,BMP-4,Oncostatinを組み合わせ、ランフォード無血清培地で分化誘導し培養した。ヒト肝癌細胞を株化させたHepG2は、DMEM培地を基本培地として血清10%と非必須アミノ酸を終濃度100uMになるように添加し、培養をおこなった。また、ラット初代肝細胞はWilliam's E培地を基本培地として開発されたLanford培地を用いて培養した。
いずれも3−5%CO2インキュベータ内で、37℃で培養した。
【0053】
ヒトES細胞由来肝臓細胞に10%ICGを6時間取り込ませたものを図1に示す。摂取した細胞とそうでない細胞が区別できる。
【0054】
これらの細胞を電子顕微鏡で観察してみると、細胞は丸い大型の核、豊富な粗面小胞体、滑面小胞体を備え、発達した毛細胆管、その中にICGと考えらる電子密度の高い構造を排出しており、機能性を有した肝細胞であることがわかる(図2)。
【0055】
初代肝細胞は30分、HepG2細胞に12時間かけ、ICGを取り込ませた。次に0.5%トリプシンで剥離し分散した後、新しく開発した長波長レーザー装置を搭載したセルソーターでHepG2細胞の検出を試みた。細胞は5000個測定した。HepG2は純粋に株化された細胞なので、コントロール(摂取させていないもの)と明確な差を見ることができた。お互い重なりあうところは極めて少なく、明確に区別できることがわかった。初代肝細胞の場合は蛍光輝度の低いものとそうでないものとが存在した。これは胆管細胞や血管内皮細胞、線維芽細胞などが含まれて入り、それらがICGを取り込まないため分離したものと考えられる。
【0056】
図3は、摂取したものとそうでないものとの蛍光強度の違いを示す。
図4は、細胞の大きさと蛍光強度を摂取したものとそうでないものとを比較した。
図5は、それらをヒストグラムで示した。
【0057】
図6は、本発明によるES細胞から分化誘導させた肝細胞の純化方法の流れを示したものである。この方法は、次のステップを含む。ES細胞の自己複製、分化誘導、肝細胞のICGによるダメージレス特異的染色、ICGがレーザー照射をうけた時のサンプル細胞群の活性酸素低減対策の事前処理、ICG励起用レーザーを搭載したチップ内細胞分離を利用した無菌的セルソーティング処理、純化した肝細胞からのICG除去というステップがある。ES細胞の自己複製の過程は、DMEM/F12を基本培地として20%KSRを含む培地で培養し、分化させずに未分化性、増殖性(自己複製)を維持するためにフィーダー細胞を使用する。分化誘導の過程は、成長因子であるFGFとBMP-4とOncostatinを組み合わせ、ランフォード無血清培地で誘導を行う。この結果として、ES細胞コロニーと分化誘導細胞(目的の肝細胞と目的外の細胞)が得られる。
【0058】
ES細胞はのぞかれないまま移植細胞に含まれると奇形腫が形成され臓器を圧迫し傷害を引き起こす。また目的外の細胞も、のぞかれないまま残ると移植組織の機能低下をもたらす。そのために、目的の分化誘導細胞である肝細胞のみを特異的に染色するために、10%ICGを含む培地で6時間放置する。これによって、ICGが肝細胞に特異的に取り込まれ、細胞毒性のない蛍光ラベルが完了する。その後、これらの細胞溶液に活性酸素分解酵素であるスーパーオキシドディスムターゼを50ng/mL以上の濃度で添加する。次に、ICGからの蛍光信号により無菌的な細胞分離を行うために、波長785nmレーザー光源を搭載し、波長800nm以上の蛍光信号を検出する光学系を有し、閉鎖系のマイクロ流路内で細胞分離を行う装置を利用する。細胞分離の結果、純化した肝細胞群が得られる。この肝細胞群を培地中で6時間放置することでICGを排出させる。以上のステップは、細胞毒性の無い特異的蛍光染色とその蛍光により無菌的な肝細胞の純化を実現するため、再生医療用やセルベース創薬スクリーニング用の肝細胞の純化プロセスに最適なものである。
【0059】
次に、使い捨てチップ内の細胞分離を実現する実施形態を図7および図8を用いて説明する。
【0060】
図7は、使い捨てチップ型フローセルに、シリンダーポンプと電磁バルブを接続した状態を示している。使い捨てチップは、以前の発明である特許文献14に記載したものに、ソーティング用の流路4-1と流路4-2とそれぞれソーティングリザーバー5-1、5-2を対称的に追加した構造とする。使い捨てチップ型のフローセルは、透明な樹脂製である。樹脂の種類としては、ポリメタルアクリレート(PMMA)、シクロオレフィン・コポリマー(COC)、メチルペンテンポリマーなどが使用できる。ソーティングリザーバーを流路4-2にも設置した対称構造として電磁バルブとシリンダーポンプを接続する。対称構造は、電磁バルブがOPENしたときに同一時間に同一の圧力が流路27に対して加わるようにするためである。
【0061】
図8にはさらに光学系と制御系回路との接続関係を示した。チップの断面図は図7のBB断面である。図7に示したように、チップの上流側に空気圧を加えることで、シース液とともにサンプル液を流路27に流し、対向するソーティング流路4-1、4-2の領域よりやや上流の主流路の中央部にレーザー光52を照射する。レーザー光52は、波長785nmのレーザー光源と波長473nmのレーザー光源から射出したレーザー光をダイクロイックミラー80で合わせたものである。細胞がこの照射領域を通過した瞬間に散乱光と蛍光がパルス的に発生する。波長473nmの散乱光はダイクロイックミラー54とバンドパスフィルター57によって波長473nm近傍の波長のみを透過させて検出器61で検出する。検出器61の前には遮光板60を設置して、レーザー透過光を除去する。蛍光は、ダイクロイックミラー55、56とバンドパスフィルター58,59によって照射レーザー光よりも長波長で複数の波長領域を分割してそれぞれ異なる検出器62、63で検出する。ICGからの蛍光検出は、バンドパスフィルター59として波長800nmから波長900nmまで透過させるものを使用することで検出器63で検出する。473nmの散乱光信号は細胞サイズを評価するための指標として用い、波長800nmより長波長の蛍光信号はICGを取り込んだ肝細胞を検出するための指標として用いる。各検出パルス信号は、増幅してAD変換する回路64によってデジタル化し、マイクロコンピューター69によって、予め設定した分離条件を複数の検出信号が満たすか否かを判断し、満足する場合に電磁バルブドライバー66にトリガー信号を一定遅延時間後に出力する。この遅延時間は、細胞がレーザー照射領域からソーティング流路4-1、4-2の領域に流れるまでの時間に調整する。トリガー信号を受信した電磁バルブドライバー66は、電磁バルブ7-1,7-2に一定時間だけOPENする信号を出力する。バルブがOPEN状態の時間幅は、流路4-1と流路4-2の幅を等しくWとして、細胞が流路27を流れる流速をVとすると、W/V(秒)と設定するのが望ましい。電磁バルブOPEN時に目的の細胞がソーティングリザーバー5に流れ込む。主流路とソーティング流路との間の流れは、バルブ7-1と7-2とがCLOSE状態では発生しないので、一旦ソーティングリザーバー5に取り込まれた細胞はその場に安定して保存される。
【0062】
図7に示したようにチップの上流側のリザーバー20の内部には、図には記していないが定圧ポンプで一定の空気圧を加えるようにしてある。リザーバー20の内部には試料液リザーバー10がありその内側に試料液をいれ、その外側にシース液を入れる。シース液としてはphosphate buffer saline(PBS)を用いることができる。共通の空気圧によって、試料液1と左右のシース液2が下流に向かって流れ、3本の流路が合流したあと流路27を試料液がシース液によって細く絞られた状態で流れる。流路27の幅は80μmであり、深さは50μmである。合流後の試料液の幅は流路幅の約1/10である。流路27には、側面から対向するソーティング流路4-1、4-2があり、その流路はリザーバー5に接続している。この対向領域よりも数100μmだけ上流側の流路27の中央部に、波長785nmと波長473nmのレーザー光52を照射する。そのビームサイズは長さ50μm幅20μmの長円としている。
【0063】
細胞がこの照射領域を通過した瞬間に散乱光と蛍光がパルス的に発生する。散乱光はダイクロイックミラー54とバンドパスフィルター57によって照射レーザー光と同じ波長を選択して検出器61で検出する。検出器61の前には遮光板60を設置して、レーザー透過光を除去する。蛍光は、ダイクロイックミラー55、56とバンドパスフィルター58,59によって照射レーザー光よりも長波長で複数の波長領域を分割してそれぞれ異なる検出器62、63で検出する。各検出パルス信号は、増幅してAD変換する回路64によってデジタル化し、マイクロコンピューター69によって、予め設定した分離条件を複数の検出信号が満たすか否かを判断し、満足する場合に電磁バルブドライバー66にトリガー信号を一定遅延時間後に出力する。この遅延時間は、細胞がレーザー照射領域からソーティング流路4-1、4-2の領域に流れるまでの時間と同じにする。トリガー信号を受信した電磁バルブドライバー66は、電磁バルブ7-1,7-2に一定時間だけOPENする信号を出力する。バルブがOPEN状態の時間幅は、流路4-1と流路4-2の幅を等しくWとして、細胞が流路27を流れる流速をVとすると、W/V(秒)と設定するのが望ましい。電磁バルブOPEN時に目的の細胞がソーティングリザーバー5-1に流れ込む。主流路とソーティング流路との間の流れは、バルブ7-1と7-2とがCLOSE状態では発生しないので、一旦ソーティングリザーバー5-1に取り込まれた細胞はその場に安定して保存される。また、図7に示したフローセルは、下流側に分離流路11,23,24を形成してあるので、目的の細胞がソーティング流路4−1と4−2による圧力によって、ソーティングリザーバー5−1に取り込まれるほどの移動量がなかった場合は、下流側で流路23へ分離される。したがって、図7に示したフローセルは、流路27の流速が早い場合は流路23へ分離し、流速が遅い場合はソーティングリザーバー5−1に分離するという流速に対して2段階のマージンの広い分離を実現する構造となっている。
【産業上の利用可能性】
【0064】
本発明によれば、特異的かつ高い選択性で特定細胞をほとんど無傷で簡便に夾雑細胞から単離濃縮できるため、再生医療、創薬開発等のために使用されるのに適した純化濃縮された高品質の細胞が提供される。
【符号の説明】
【0065】
1…試料液流路
2…シース液流路
3…照射光
4−1…ソーティング流路(PULL側)
4−2…ソーティング流路(PUSH側)
5…ソーティングリザーバー
6…フィルター7−1、7−2…電磁バルブ
8−1…負圧定圧ポンプ
8−2…陽圧定圧ポンプ
9−1…分離対象である細胞
9−2…分離非対象の細胞
10…試料液リザーバー
11…回収試料液リザーバー
20…シース液リザーバー
22…シース液用ポート
23…シース液回収ポート
24…シース液回収ポート
25…チップ用基板
27…流路
31…試料液リザーバー
32 …シース液用ポート
34…廃液リザーバー
35 …回収試料液リザーバー
36 …試料液
37…シース液リザーバー
50−1…波長785nmのレーザー光源
50−2…波長473nmのレーザー光源
51 …対物レンズ
52…波長785nmと波長473nmのレーザー光
53…ソーティング流路4−1と4−2で挟まれた領域
54,55,56…ダイクロイックミラー
57,58,59…バンドパスフィルター
60…透過レーザー光遮断用空間フィルター
61…フォトダイオード
62,63…光電子増倍管
64…AD変換器
69…AD変換器
70…キーボード
71…ディスプレイ
【特許請求の範囲】
【請求項1】
夾雑細胞群を含むサンプル液中のある特定細胞を分離・濃縮する方法であって、
蛍光抗体を用いずに、前記サンプル液中の前記特定細胞が生きた状態で特異的に内部に取り込む蛍光染色物質を利用して前記特定細胞を生きた状態で蛍光染色する工程、および
光照射によって発生する蛍光を検出することで、前記特定細胞を識別し分離する工程を含む、細胞分離濃縮方法。
【請求項2】
前記夾雑細胞群がES細胞またはiPS細胞から分化した細胞群であり、前記特定細胞が肝細胞であり、前記染色に用いる化学物質はインドシアニングリーンであり、光照射に用いる波長は750nmから800nmの範囲であり、蛍光の検出波長は800nmから900nmの範囲である、請求項1に記載の細胞分離濃縮方法。
【請求項3】
前記細胞を識別し分離する工程の前に前記サンプル液にスーパーオキシドディスムターゼあるいはマンガネーゼスーパーオキシドディスムターゼを事前に混入することで、細胞分離処理時の光照射によってインドシアニングリーンから発生する活性酸素を消滅させることを含む、請求項2に記載の細胞分離濃縮方法。
【請求項4】
前記各工程を前記夾雑細胞群を含む前記サンプル液をマイクロ流路が形成されたチップ上で行うことを含み、
前記細胞が前記マイクロ流路を流れている状態で光照射を行い、特定細胞由来の蛍光を検出した時に発生する蛍光を検出した信号をもとに、そのマイクロ流路の側面に接続したソーティング流路を介して定圧空気ポンプを電磁バルブ経由で空気圧を、前記サンプルが流れる前記マイクロ流路の両側から短時間だけ作用させることで、前記特定細胞の流れを変化させてチップ内の分岐流路に分離することを含む、請求項1に記載の細胞分離濃縮方法。
【請求項5】
前記マイクロ流路が形成された前記チップには、前記マイクロ流路の上流側と下流側に接続するリザーバーとソーティング流路が形成されており、
前記流路の上流側のリザーバーの上部空間に対して空気加圧あるいは下流側のリザーバーの上部空間に対して大気より陰圧とすることで、チップ内のサンプルの送液を非接触で行うことで、細胞サンプルがチップ内に閉じ込められた状態で前記各工程を行うことを含む、請求項4に記載の細胞分離方法。
【請求項6】
親水処理を施したチップを用いて細胞分離を行った後に、その分離した細胞をそのまま前記チップ内で培養して、細胞品質を検証するためのスクリーニングを行うことを含む、請求項4に記載の細胞分離方法。
【請求項7】
インドシアニングリーンが選択的に肝細胞に取り込まれ、一時細胞内にとどまり、速やかに胆汁に排出することを利用することを含む、請求項2に記載の細胞分離法。
【請求項8】
マイクロ流路およびリザーバーを形成した樹脂製のチップであって、前記マイクロ流路および前記リザーバーの表面を親水処理を施すことで細胞培養プレートとして使用できる、マイクロ流路チップ。
【請求項1】
夾雑細胞群を含むサンプル液中のある特定細胞を分離・濃縮する方法であって、
蛍光抗体を用いずに、前記サンプル液中の前記特定細胞が生きた状態で特異的に内部に取り込む蛍光染色物質を利用して前記特定細胞を生きた状態で蛍光染色する工程、および
光照射によって発生する蛍光を検出することで、前記特定細胞を識別し分離する工程を含む、細胞分離濃縮方法。
【請求項2】
前記夾雑細胞群がES細胞またはiPS細胞から分化した細胞群であり、前記特定細胞が肝細胞であり、前記染色に用いる化学物質はインドシアニングリーンであり、光照射に用いる波長は750nmから800nmの範囲であり、蛍光の検出波長は800nmから900nmの範囲である、請求項1に記載の細胞分離濃縮方法。
【請求項3】
前記細胞を識別し分離する工程の前に前記サンプル液にスーパーオキシドディスムターゼあるいはマンガネーゼスーパーオキシドディスムターゼを事前に混入することで、細胞分離処理時の光照射によってインドシアニングリーンから発生する活性酸素を消滅させることを含む、請求項2に記載の細胞分離濃縮方法。
【請求項4】
前記各工程を前記夾雑細胞群を含む前記サンプル液をマイクロ流路が形成されたチップ上で行うことを含み、
前記細胞が前記マイクロ流路を流れている状態で光照射を行い、特定細胞由来の蛍光を検出した時に発生する蛍光を検出した信号をもとに、そのマイクロ流路の側面に接続したソーティング流路を介して定圧空気ポンプを電磁バルブ経由で空気圧を、前記サンプルが流れる前記マイクロ流路の両側から短時間だけ作用させることで、前記特定細胞の流れを変化させてチップ内の分岐流路に分離することを含む、請求項1に記載の細胞分離濃縮方法。
【請求項5】
前記マイクロ流路が形成された前記チップには、前記マイクロ流路の上流側と下流側に接続するリザーバーとソーティング流路が形成されており、
前記流路の上流側のリザーバーの上部空間に対して空気加圧あるいは下流側のリザーバーの上部空間に対して大気より陰圧とすることで、チップ内のサンプルの送液を非接触で行うことで、細胞サンプルがチップ内に閉じ込められた状態で前記各工程を行うことを含む、請求項4に記載の細胞分離方法。
【請求項6】
親水処理を施したチップを用いて細胞分離を行った後に、その分離した細胞をそのまま前記チップ内で培養して、細胞品質を検証するためのスクリーニングを行うことを含む、請求項4に記載の細胞分離方法。
【請求項7】
インドシアニングリーンが選択的に肝細胞に取り込まれ、一時細胞内にとどまり、速やかに胆汁に排出することを利用することを含む、請求項2に記載の細胞分離法。
【請求項8】
マイクロ流路およびリザーバーを形成した樹脂製のチップであって、前記マイクロ流路および前記リザーバーの表面を親水処理を施すことで細胞培養プレートとして使用できる、マイクロ流路チップ。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【公開番号】特開2012−80819(P2012−80819A)
【公開日】平成24年4月26日(2012.4.26)
【国際特許分類】
【出願番号】特願2010−229521(P2010−229521)
【出願日】平成22年10月12日(2010.10.12)
【出願人】(505281023)株式会社オンチップ・バイオテクノロジーズ (8)
【Fターム(参考)】
【公開日】平成24年4月26日(2012.4.26)
【国際特許分類】
【出願日】平成22年10月12日(2010.10.12)
【出願人】(505281023)株式会社オンチップ・バイオテクノロジーズ (8)
【Fターム(参考)】
[ Back to top ]

