珪素およびアルカリ土類金属の合金のまたはアルカリ土類金属シリサイドの酸加水分解によるシランの製造
式SinH2n+2(ここでnは1以上4以下の整数である)の化合物の製造方法であって、式M1xM2ySiz(ここでM1は還元性金属であり、M2はアルカリ金属またはアルカリ土類金属であり、x、yおよびzは0から1まで変化し、zは0と異なり、x+yは0と異なる)の粉末の形態にある少なくとも1種のシリサイドまたは珪素合金の、CO2を含む水溶液との反応により、前記溶液は前記反応の温度および圧力においてCO2で飽和されているかまたは飽和されていない方法。
【発明の詳細な説明】
【発明の概要】
【0001】
本発明は珪素合金のまたはシリサイドの酸加水分解による水素化珪素すなわちシランの製造に関する。
【0002】
いくつかのシラン、より詳細にはモノシランすなわち四水素化珪素(SiH4)はシリコンベクターとして、アモルファスシリコンの、多結晶シリコンの、ナノもしくはミクロ形態シリコンとしても知られているナノ結晶もしくは微結晶シリコンの、シリカの、窒化珪素のまたは他のシリコン化合物の堆積のための技術、たとえば気相堆積技術において使用されている。
【0003】
シランから得られるアモルファスシリコンおよび単結晶シリコンの薄膜としての堆積は太陽電池を製造することを可能にする。
【0004】
また、シランの分解および炭化珪素のような化合物の形成によって酸による腐食に対して抵抗力のあるコーティングを得ることも可能である。
【0005】
最後に、シランは不飽和炭化水素の単結合または多重結合に付加して有機シランを与えることができる。
【0006】
モノシランの市場は集積回路の製造および薄膜または結晶太陽電池(光電池)の製造、半導体部品およびフラットスクリーンの製造において同時に非常に強い拡大を経験するであろう。
【0007】
以下に説明するいくつかのタイプのプロセスが現在までに使用されてきた。
【0008】
まず第1に、450℃と550℃の間の温度でKCl/LiCl浴内でのLiHによるSiCl4の還元が知られている。反応収率は有利なものであるが、このプロセスは、一方では、リチウム資源が非常に限られているのにLiHの入手し易さに、他方では、電気分解によってリチウム金属をリサイクルする可能性に基づいている。反応媒体は非常に腐食性が高く特定の材料を用いる。このプロセスは少量のシランを製造するのに使用されてきた。
【0009】
有機溶媒中でのNaAlH4によるSiF4の還元が別の例である。このプロセスは、他の化学製品の副生成物であるSiF4と、水素化ナトリウムアルミニウムを製造するためにナトリウムとが存在している場合にのみ工業的に実施可能である。このプロセスは、特にこれら2つの理由のために、容易に使用することができない。
【0010】
別の既知の反応は化学量論的なSiMg2合金への液体NH3媒体中での酸攻撃である。反応収支は以下の通りである:
【化1】

【0011】
このプロセスは周囲温度に近い温度で大気圧で行われる。このプロセスは、プロセスを制御する困難さおよび厳しい取締管理を受ける液体アンモニアの使用のため、満足のいくものではない。
【0012】
別の既知の反応はボロネート樹脂または他の樹脂上でのSiHCl3の不均化である。全体的なプロセスはこのように記述される:
a)4SiMetal + 12HCl → 4SiHCl3 + 4H2 (約800℃と約1100℃の間にある温度)
b)4SiHCl3 ←→ SiH4 + 3SiCl4 (周囲温度)
3SiCl4 + 3H2 → 3SiHCl3 + 3HCl (約1000℃の温度)、すなわち、以下の反応収支となる:
4SiMetal + 9HCl → SiH4 + 3SiHCl3 + H2。
【0013】
上記反応の代替的な形態はこのように記述される:
a)4SiMetal + 16HCl → 4SiCl4 + 8H2 (約1000℃と約1100℃の間にある温度)
b)4SiCl3 + 4H2 → 4SiHCl3 + 4HCl (約1000℃の温度)
4SiHCl3 → SiH4 + 3SiCl4、
すなわち、以下の反応収支となる:
4SiMetal + 12HCl → SiH4 + 3SiCl4 + 4H2。
【0014】
このプロセスは、極めて腐食性の高い媒体中で高温を必要とし、大量のエネルギー(段階b)のために約50kWh/kg)を消費する。最大収率を達成するために、段階b)はクロロシランの混合物の再循環のために多くのループを必要とする。極めて腐食性で、毒性で可燃性の製品の使用の他に、このようなタイプのプロセスはエネルギーにおいて非常に費用がかかる。
【0015】
モノシランおよび高次シランの生成は、Gmelin Handbook of Inorganic Chemistryの「Si−珪素、水性相において酸性または塩基性媒体中のシリサイドおよび珪素合金を反応させることによる」に記載されている。
【0016】
特許出願EP 1 46 456およびWO2006/041272は、AlxSiyCaz粉末(x、yおよびzがアルミニウム、珪素およびカルシウムのそれぞれの百分率を表している)をHCl溶液中に入れることによる、水性相におけるモノシランの合成を記載している。生成されたガスの組成は、およそ80%のシラン、10%のジシランおよび5%のトリシランとともに微量のジシロキサンであった。このタイプのプロセスは純粋なすなわち高濃度のHClの取り扱いおよび保管の欠点を有する。このような反応から得られる副生成物は大量に生成され、環境に対して有害である。このプロセスの別の欠点は反応媒体中での泡のおびただしい形成であり、これは反応収率を下げ、消泡剤の存在を必要とする。このような反応は非常に発熱性であり、合金粉末の導入速度を十分に抑えなければ、100℃より高い温度にかなり早く到達する。
【0017】
上に説明したこれらの研究のうち産業発展に有益なプロセスの達成に必要な条件を保証するものはない。
【0018】
費用のかからない出発材料を使用し、産業的な収率で水素化珪素を製造し、上で見られた欠点を全く示さない単純なプロセスが探されてきた。
【0019】
本発明の1つの目的は上述した従来技術の欠点の全てまたはいくつかを解消することである。
【0020】
この目的を達成するために、本発明の主題は、式SinH2n+2(ここでnは1以上4以下の整数である)の化合物の製造方法であって、式M1xM2ySiz(ここでM1は還元性金属であり、M2はアルカリ金属またはアルカリ土類金属であり、x、yおよびzは0から1まで変化し、zは0以外であり、和x+yは0以外である)の粉末の形態にある少なくとも1種のシリサイドまたは珪素合金の、CO2を含む水溶液との反応の段階b)を含み、前記溶液は前記反応の温度および圧力においてCO2で飽和されているかまたは飽和されていない方法である。
【0021】
好ましくは、前記水溶液は前記反応の温度および圧力においてCO2で飽和されている。
【0022】
導入されたCO2がもはや溶け込むことができずに沈殿物を形成する場合に溶液は飽和している。
【0023】
例として、CO2で飽和された溶液を得るために、大気圧で、前記溶液に添加されるのに適した、温度の関数としてのCO2の重量を表1に示す。
【表1】

【0024】
この水溶液は、無機酸(たとえば、HCl、H2SO4またはH3PO4)または有機酸、たとえばCH3COOHを、0.1Nと3Nの間で含み、前記反応の温度においてCO2で飽和されているかまたは飽和されていない酸性溶液を含み得る。
【0025】
還元性金属は、たとえば、Al、B、GaまたはInである。アルカリ金属は、たとえば、Li、Na、KまたはCsである。アルカリ土類金属は、たとえば、Mg、Ca、SrまたはBaである。
【0026】
さらに、本発明の実施形態は以下の特徴の1つ以上を含み得る:
−M1はアルミニウムであり、M2はカルシウムまたはマグネシウムである。
【0027】
−珪素合金は30%ないし38%のアルミニウムと、35%ないし45%の珪素と、15%ないし25%のカルシウムとを含み、百分率は合金中に存在する各元素の重量百分率を表している。
【0028】
−珪素合金はSi0.5Mg、Si0.5Ca、AlSiCa、CaSi、Ca0.5Si、MgSi、AlSiNa、AlSiMg、SiNa、AlSiLi、SiK、Ca0.5AlSi0.33およびCa0.5AlSi0.75、またはこれらの混合物から選択され、好ましくはSi0.5Mg、AlSiNa、SiNa、Si0.25Li、Si0.25Na、Si0.25KまたはSiKである。本発明に適した他の珪素合金はフェロシリコンタイプの合金、たとえばFeSi、FeSiMgまたはFeSiCaである。
【0029】
−前記CO2を含む水溶液は初期pHが6.5と7.5の間にある水へのCO2の添加によって調製される。
【0030】
−前記酸性溶液はCO2と、HCl、H2SO4、H3PO4またはCH3COOHから選択される少なくとも1種の酸とを含む混合物である。
【0031】
−珪素合金の粒径は0.2mmと0.9mmの間、好ましくは0.2mmと0.5mmの間にある。
【0032】
−前記反応は、0℃と100℃の間にある温度で大気圧で行われ、好ましくは0℃と75℃の間、より好ましくは0℃と50℃の間にある温度で、大気圧に近い圧力で行われる。
【0033】
−前記反応は、6未満、好ましくは4と6の間、より好ましくは4.5と5の間にあるpHで行われる。このように、前記反応のpHは、加水分解中に用いられる酸がたとえばHCl、H2SO4またはH3PO4タイプの強酸のみである場合ほど低くない。pHが4未満である反応は、前記水溶液が、CO2に加えて、少なくとも1種の強酸を含む反応である。
【0034】
−この方法は前記反応が少なくとも1種の触媒の存在中で行われることを特徴とする。
【0035】
−上で定義した方法は以下の段階を含む:
a)CO2と水とを含む水溶液の反応器への注入;
b)珪素合金またはシリサイドの前記反応器への導入;
c)段階b)で得られた副生成物の沈降および濾過による分離;
d)シランの液体の形態または加圧された気体の形態への濃縮;
e)段階b)で得られることがある高次シランおよび微量のジシロキサンからモノシランを分離する目的とする、およそ周囲圧力での分留;
f)純粋なモノシランの回収。
【0036】
−前記方法は請求項12および13に記載している。
【0037】
用語「高次シラン」はジシラン、トリシランまたはテトラシランを意味していると理解される。
【0038】
−上で定義したシランの製造方法を行うためのオン・サイトユニットは:
珪素合金(またはシリサイド)を粉末として導入する手段および酸性溶液を導入する手段を備えた少なくとも1つの反応器と;
水蒸気を止める少なくとも1つの還流カラム、デミスタ、シランを分離するための分留カラム、および純粋なモノシランを回収するための二重蒸留カラムを含む精製回路と;
液体生成物を沈降し濾過することによって分離するための少なくとも1つのタンクと
を含む。
【0039】
本発明に係る方法の実施において用いられる合金またはシリサイドは製鋼所においてスラグの発泡と脱酸素を制御するのにも使用される合金またはシリサイドである。これらは低コストな工業製品である。本発明の主題である前記方法の利点の1つは、周囲条件(温度および圧力)に近い条件下で、たとえばワイヤ入りガラスで作られた反応器などの無機化学工業で標準的な設備において前記反応を行うことができることである。これらの合金またはシリサイドを用いる方法は可能な限り市場に近いところにある小型のユニットにおいてシランを製造することを可能にできる。利用可能な合金およびシリサイドならびに動作および環境に関する制約がどのようなものであっても、運転パラメータを調節することによって同一のユニットを用いることができる。
【0040】
全ての場合において、副生成物は再使用可能な無機生成物である。
【0041】
また、合金粉末の粒径は反応速度および結果として反応収率に影響を与えることも発見された。粒子の大きさが小さくなると速度は増加する。反応中の泡の形成は粒子の大きさを制限する要因を構成する。他の全ての条件を同じならば、粒子の大きさを10で割ったとき、同時に生成されるシランの量は約15倍である。
【0042】
加えて、本発明に係る方法は、加水分解反応中に、上で説明した最先端のプロセスの反応と比較して発泡が大きく低減され、反応速度が大きく促進されるという利点を示し、これは望まれるシランの生産品の品質を向上させる。
【0043】
また、本発明に係る方法は、反応中に生成するシランに対して形成されるモノシランの割合が少なくとも70%に等しいという利点を示し、これは本発明が目標とする用途に望まれるシランがとりわけモノシランであるという事実を考慮すると重要である。
【0044】
さらに、本発明に係る方法中に行われる加水分解のための酸としてのCO2の使用は、とりわけ、大気圧に近い圧力の場合に、反応の温度が周囲温度と同程度の大きさであるという利点があるが、そういう状況であれば珪素合金の導入速度を低減する必要がない。
【0045】
本発明に係る方法の別の利点は、合成段階中にシランの前駆物質を生成するための水素の存在が必要ないということである。
【0046】
他の顕著な特徴および利点は、図1を参照して以下の説明を読むと明らかになるであろう。
【図面の簡単な説明】
【0047】
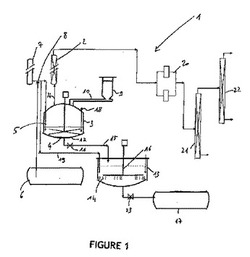
【図1】図1は、本発明に係る方法を行うのに使用されるプラントの図を示す。
【0048】
製造ユニット1は反応器3と、精製システムと、液体製品を沈降および濾過により分離するためのタンク13とを含む少なくとも3つの部分を含む。
【0049】
シランの製造のための加水分解反応は、固体/液体の集合体を混合させることを可能にする混合手段4、たとえばクロースクリアランスのインペラまたはニーダーを備えた反応器3において行われる。この反応器は、一方で、水タンク6から得られる水で満たされたディップパイプ5によって、他方で、酸性溶液の貯蔵のためのシステム7から得られる酸性溶液で満たされる。前記酸性溶液はCO2単独であり得るし、他の酸、たとえばHCl、H2SO4またはH3PO4などとの混合物であり得る。混合物の割合は、前記反応に先立ち、上で特定した解決しようとする課題を考慮して最良の見込み収率を得ることを目的として、ユーザーにより選択される。パイプ5を用いて反応器3を水/酸混合物で満たすために、水および酸性溶液がミキサ8を使用することによって混合される。たとえば、CO2を単独で液体の形態で液体CO2タンクから前記反応器に流し込むことができる。反応器3は、たとえば、頂部から着脱可能な、Uボルトによって取り付けられた蓋と一体となってもよい。ここで、いくつかのディップパイプ5もこの蓋と一体であり、反応器3の壁に触れるように配置される。この蓋は漏れ防止ホッパー9を接続することを可能にする漏れ防止開口部を有している。好ましくは、この反応器は断熱被覆で囲まれる。
【0050】
珪素合金の放出手段9は反応器3の近傍に存在している。このような放出手段は、たとえばホッパー9であり、式M1xM2ySizの粉末の形態にある珪素合金で最初満たされており、ここでM1は還元性の金属であり、M2はアルカリ金属またはアルカリ土類金属であり、x、yおよびzは0と1の間で変化し、zは0以外である。たとえば、ホッパー9はウォームねじと収縮ホース10とを備え、ホッパー9を反応器3から分離することを可能にしている。ホッパー9のデザインは、たとえば、炭化カルシウムをアセチレン反応器へ注ぐのに使用されるホッパーに類似している。合金は、アセチレン製造ユニットにおいて炭化カルシウムを搬送するのに使用されるケグに類似したケグで搬送される。酸性溶液の注入流量はpHプローブ18によって制御することができる。
【0051】
本発明の特定の実施形態によれば、直列に設けられたガス用および分離用の2つの漏れ防止遮断弁(これら2つの間に、切断前に反応器3をパージすることを可能にする側方ブランチを含む)が反応器3の蓋の上方に配置されている。液体を放出するために、同様のデバイス11が反応器3の底部の出口に備わっている。反応器3の底部は手段12、たとえばハッチによって塞がれ、これは液体製品が底部の流路で滞留することを防ぐ。このハッチは底部バルブ11を作動させることによって上昇される。
【0052】
液体はパイプ15を通して沈降/濾過によって分離するためのタンク13へ搬送される。
【0053】
空気は反応領域から排除されたままで維持され、反応の終わりに、未反応の合金が中和される。反応領域は窒素または他の不活性ガス、たとえばアルゴンによって、この領域の全ての付属部分および分留領域(21、22)とともにパージされる。
【0054】
沈降/濾過による分離のためのタンク13は、リアクタ3内で行われた加水分解反応の終わりに、反応器3を不活性ガスによって加圧することによって、溶液と懸濁状態にある生成物とを受け取る。このタンク13はリアクタ3の少なくとも2倍の作業容積を有する。タンク内の脱気中に発生したシランは以下に詳細に説明する精製回路内へ搬送される。前記タンク13は、その高さの底部に、濾過材14を担持した円形スパイダを含む可動式のジャケット16を含む。
【0055】
精製/濾過段階を最適にするために、ミキサ8から得られる水/酸混合物を、パイプ19を経由して精製/濾過タンク13へ搬送することができる。
【0056】
この精製/濾過段階から得られる透明な廃液は次に保管タンク17へ搬送される。これらの廃液は本発明に係る方法の反応のおかげで環境に対して有害でなく且つリサイクル可能であるという利点を示す。
【0057】
所望のシランを回収するために、加水分解により得られる、沈降による分離のためのタンク13へ搬送されない生成物はパイプ24を経由して精製システムへ向けられる。前記精製システムはリアクタ3内での加水分解反応により得られる水蒸気を止める少なくとも1つの還流カラム2を含む。デミスタが前記還流カラム2の出口に導入され、このデミスタは大気と同伴されるであろう水滴を保持することを目的としている。乾燥および中和のための2つのレセプタクル20がデミスタの下流に並列に設置されている。これらの2つのレセプタクルはアルミン酸ナトリウムで満たされている。次に存在するシランおよびシロキサンを分離するために分留カラム21が存在しており、最後に、二重蒸留カラム22が純粋なモノシランを回収するのに使用され、これは続いて所望の用途に使用される。
【0058】
本発明の方法に従って行われる反応に関する反応スキームのいくつかの非制限的な例を以下に述べる。
【0059】
例1:
AlSiCa + 2CO2 + 5H2O → Al(OH)3 + SiH4 + Ca(HCO3)2 + 1/2H2 (1)
この反応スキームは文献に記載されていない。飽和CO2溶液を用いて操作することにより、Ca(OH)2を溶解させて可溶な炭酸水素カルシウムを与え、これは再使用可能な炭化カルシウムに容易に転化することができる。同様に、CO2の存在は水酸化アルミニウムおよびシリカのコロイド質構造物を分解する傾向がある。これら2つの要因は高い反応速度および高い収率を促進する。
【0060】
存在する珪素に対するシランの少なくとも60%の収率を仮定した、(反応(1)に基づく)物質収支:
1kgのシラン(SiH4と等価である)
5kgのAlSiCa;
4.85kgのCO2;
4.7kgのH2O;この量は最先端の反応に必要な重量(数m3)と比べて非常に低い;
4.95kgのAl(OH)3;
8.44kgのCa(HCO3)2 → 14.74kgの容易に再循環可能な副生成物;
1.25kgのコロイダルシリカ;
0.58m3のH2。
【0061】
この経路は、自然に既に存在する複生成物のみを与え、さらに発生したCO2を再使用すること、およびより容易に濾過することができ且つ沈降/分離によって分離するためのタンク13でより容易に処理される複生成物の「ケーキ」をもたらすという利点を導入する。
【0062】
反応スキーム(1)では、温度の上昇が高次シランの形成を促進する。このように、CO2の使用のおかげによる周囲温度に近い反応温度はモノシランの形成を促進する。
【0063】
この反応は中性のpHにある水中において行うことができるが、水酸化カルシウム、コロイダルアルミニウムおよびコロイダルシリカの形成は前記反応を妨害し、反応速度を非常に低くする。
【0064】
例2:
SiCa2 + 4CO2 + 4H2O → SiH4 + 2Ca(HCO3)2 (2)
ここで使用される合金はSiCa2であるが、結果はSiMg2の使用と同様であろう。
【0065】
シリサイドは中性のpHにある水と自発的に反応するが、溶解度に乏しいCa(OH)2の形成をもたらし、反応速度を低減させる。
【0066】
この反応スキームは文献に記載されていない。飽和CO2溶液を用いて操作することによって、Ca(OH)2を溶解させて、こうしてこの溶液をシリサイドに自由に接近するようにして、コロイド質構造の水酸化珪素を崩壊させることができる。
【0067】
存在する珪素に対するシランの少なくとも60%の収率を仮定した、(反応(2)に基づく)物質収支:
1kgのシラン(SiH4と等価である)
6.25kgのSiCa2;
10kgのCO2;
3.75kgのH2O;この量は最先端の反応に必要な重量(数m3)と比べて非常に低い;
18.87kgのCa(HCO3)2;
1.25kgのコロイダルシリカ。
【0068】
この反応スキームの利点は、固体副生成物としてコロイダルシリカのみを与え、既に発生したCO2をさらに使用し、溶解した状態の重炭酸カルシウム(再循環されて炭化カルシウムを与えることができる)を生成することにある。
【0069】
本発明に係る方法を実施するために従うべき手順の一例は以下に説明するとおりであり得る。
【0070】
1−反応器の用意:
前回の反応サイクルの終わりに、反応器3を不活性ガスによってパージし、わずかに過剰な圧力に維持する。
【0071】
2−合金の導入:
合金の粒径は0.2mmと0.5mmの間にあり、1.5kg毎リットルと2kg毎リットルの間にある密度を与える。好ましくは、最初の酸性溶液を反応器3に導入した後に合金を反応器3へ導入する。
【0072】
流量は発泡効果の関数として実地経験により決定される。
【0073】
前記量の合金を、溶液のレベルが脱気を促進するために低いままになるように、連続して導入する。
【0074】
3−反応を進行させる
反応温度を50℃未満に保ってモノシランの生成を促進する。反応器3を貯蔵システム7から得られるある量の酸性溶液で満たし、低い溶液高さが溶液の脱気を促進し、発泡の影響を最小にする。スターラー4による反応器3の攪拌を開始した後に、ホッパー9から得られる合金を徐々に導入される。pHを選択した値に維持しながら同時に酸の注入を行う。
【0075】
CO2を唯一の酸性反応物質として使用する場合、CO2は溶液へ直接注入され、反応媒体の冷却に必要な負のキロカロリーの一部に寄与する。
【0076】
このシーケンスの終わりに、反応器3を数分間攪拌し続けた後に反応器3内に存在する液体を沈降/濾過によって分離するためのタンク13へ搬送する。
【0077】
4−溶液を沈降/濾過によって分離する
各シーケンスの後に、溶液および懸濁状態にある生成物を、重力およびわずかに過剰な圧力によって、手段16により攪拌される沈降/濾過によって分離するためのタンク13内へ移す。この溶液を数分のあいだ攪拌されているタンク13中に保って脱気を完了させた後にタンク13の底部バルブ23を開放して濾過を開始する。溶液は濾過材14を通って流れる。この溶液は、使用する酸に応じて、水分の蒸発によって炭化カルシウムを与えるCa(HCO3)2、または化学もしくは製薬の分野へリサイクルすることができるCaCl2・6H2Oのいずれかを含む。続いて、濾過材14上で得られたケーキをタンク13から取り出す。このケーキは、か焼によって粘土を与えるアルミナおよびシリカ、またはシリカゲルへ転化し得るシリカのいずれかを含んでいる。
【0078】
規模の程度を特定するために、CO2を酸性反応物質として使用する100T/年のモノシランの製造についての製造ユニット1の条件および完全な材料収支を以下に示す。
【0079】
以下の表において、1T=1000kgである。
【0080】
仮定:
−珪素のシランへの転化の収率:60%;
−製造サイクル24h;
−合計反応時間15h;
−製造日数:330日/年;
−反応器の大きさ:直径2m、作業高さ:1m。
【表2】

【0081】
選択されるシリサイドまたは合金が何であっても、以下の一般的な条件が優先する:
−前記反応は中性pHにある水中で行うことができるが、水酸化物の形成は反応速度を下げる。酸性または塩基性の溶液の添加は反応速度を高め、反応を減速する副生成物の一部の溶解を促進する;
−前記反応は酸性溶液において活発である;
−また、大部分の水酸化物を溶解するために、前記反応を塩基性媒体(pH8ないし10)で行うこともできる;
−高次シランの形成は温度の上昇によって促進される;
−反応を妨害する泡の形成を防ぐためにシリコーン系の消泡剤を添加することができるが、たとえばHClなどの酸の使用とは対照的に、酸性溶液としてのCO2の使用はこのような消泡剤の必要性を低減する。
【0082】
一般に、本発明に係るプロセスは、上述した最先端プロセスと比較して、以下の利点を示す:
−酸としてのCO2の添加は、アルミナなどの副生成物の沈殿および凝集を促進し、したがってこのことはそれらの濾過とその後のそれらの処理とを容易にする。
【0083】
−アルミナおよび炭酸塩などの副生成物の重量はより低くなり、したがって泡が少なくなる。したがって、前記反応のより大きな部分を反応器3において行うことができ、それで収率が著しく上昇する。
【0084】
−本発明に係るこの技術はクロロシランを用いるプロセスよりも費用がかからない。
【0085】
−最先端のプロセスのエネルギー消費量は製造されるモノシランのkg当たり50kWhを上回るが、本発明に係る方法の場合、100℃未満の温度において、この消費量は製造されるモノシランのkg当たり10kWh程度である。
【0086】
−CO2が消費されるのと同じ速さで、それを液体の形態で流すことによって再注入することができ、ユーザーによって望まれる流量および速度で前記反応は連続的に起きる。
【0087】
−本発明に係る方法は、前記反応の合金、シリサイドおよび酸性溶液が何であっても、標準的な化学的設備を用いて同一の製造ユニットにおいて行うことができる。
【0088】
−用いられる前記反応は化学的プロセスまたは日常の使用においてリサイクルすることができ、環境に対する影響が小さい副生成物を生成する。
【発明の概要】
【0001】
本発明は珪素合金のまたはシリサイドの酸加水分解による水素化珪素すなわちシランの製造に関する。
【0002】
いくつかのシラン、より詳細にはモノシランすなわち四水素化珪素(SiH4)はシリコンベクターとして、アモルファスシリコンの、多結晶シリコンの、ナノもしくはミクロ形態シリコンとしても知られているナノ結晶もしくは微結晶シリコンの、シリカの、窒化珪素のまたは他のシリコン化合物の堆積のための技術、たとえば気相堆積技術において使用されている。
【0003】
シランから得られるアモルファスシリコンおよび単結晶シリコンの薄膜としての堆積は太陽電池を製造することを可能にする。
【0004】
また、シランの分解および炭化珪素のような化合物の形成によって酸による腐食に対して抵抗力のあるコーティングを得ることも可能である。
【0005】
最後に、シランは不飽和炭化水素の単結合または多重結合に付加して有機シランを与えることができる。
【0006】
モノシランの市場は集積回路の製造および薄膜または結晶太陽電池(光電池)の製造、半導体部品およびフラットスクリーンの製造において同時に非常に強い拡大を経験するであろう。
【0007】
以下に説明するいくつかのタイプのプロセスが現在までに使用されてきた。
【0008】
まず第1に、450℃と550℃の間の温度でKCl/LiCl浴内でのLiHによるSiCl4の還元が知られている。反応収率は有利なものであるが、このプロセスは、一方では、リチウム資源が非常に限られているのにLiHの入手し易さに、他方では、電気分解によってリチウム金属をリサイクルする可能性に基づいている。反応媒体は非常に腐食性が高く特定の材料を用いる。このプロセスは少量のシランを製造するのに使用されてきた。
【0009】
有機溶媒中でのNaAlH4によるSiF4の還元が別の例である。このプロセスは、他の化学製品の副生成物であるSiF4と、水素化ナトリウムアルミニウムを製造するためにナトリウムとが存在している場合にのみ工業的に実施可能である。このプロセスは、特にこれら2つの理由のために、容易に使用することができない。
【0010】
別の既知の反応は化学量論的なSiMg2合金への液体NH3媒体中での酸攻撃である。反応収支は以下の通りである:
【化1】

【0011】
このプロセスは周囲温度に近い温度で大気圧で行われる。このプロセスは、プロセスを制御する困難さおよび厳しい取締管理を受ける液体アンモニアの使用のため、満足のいくものではない。
【0012】
別の既知の反応はボロネート樹脂または他の樹脂上でのSiHCl3の不均化である。全体的なプロセスはこのように記述される:
a)4SiMetal + 12HCl → 4SiHCl3 + 4H2 (約800℃と約1100℃の間にある温度)
b)4SiHCl3 ←→ SiH4 + 3SiCl4 (周囲温度)
3SiCl4 + 3H2 → 3SiHCl3 + 3HCl (約1000℃の温度)、すなわち、以下の反応収支となる:
4SiMetal + 9HCl → SiH4 + 3SiHCl3 + H2。
【0013】
上記反応の代替的な形態はこのように記述される:
a)4SiMetal + 16HCl → 4SiCl4 + 8H2 (約1000℃と約1100℃の間にある温度)
b)4SiCl3 + 4H2 → 4SiHCl3 + 4HCl (約1000℃の温度)
4SiHCl3 → SiH4 + 3SiCl4、
すなわち、以下の反応収支となる:
4SiMetal + 12HCl → SiH4 + 3SiCl4 + 4H2。
【0014】
このプロセスは、極めて腐食性の高い媒体中で高温を必要とし、大量のエネルギー(段階b)のために約50kWh/kg)を消費する。最大収率を達成するために、段階b)はクロロシランの混合物の再循環のために多くのループを必要とする。極めて腐食性で、毒性で可燃性の製品の使用の他に、このようなタイプのプロセスはエネルギーにおいて非常に費用がかかる。
【0015】
モノシランおよび高次シランの生成は、Gmelin Handbook of Inorganic Chemistryの「Si−珪素、水性相において酸性または塩基性媒体中のシリサイドおよび珪素合金を反応させることによる」に記載されている。
【0016】
特許出願EP 1 46 456およびWO2006/041272は、AlxSiyCaz粉末(x、yおよびzがアルミニウム、珪素およびカルシウムのそれぞれの百分率を表している)をHCl溶液中に入れることによる、水性相におけるモノシランの合成を記載している。生成されたガスの組成は、およそ80%のシラン、10%のジシランおよび5%のトリシランとともに微量のジシロキサンであった。このタイプのプロセスは純粋なすなわち高濃度のHClの取り扱いおよび保管の欠点を有する。このような反応から得られる副生成物は大量に生成され、環境に対して有害である。このプロセスの別の欠点は反応媒体中での泡のおびただしい形成であり、これは反応収率を下げ、消泡剤の存在を必要とする。このような反応は非常に発熱性であり、合金粉末の導入速度を十分に抑えなければ、100℃より高い温度にかなり早く到達する。
【0017】
上に説明したこれらの研究のうち産業発展に有益なプロセスの達成に必要な条件を保証するものはない。
【0018】
費用のかからない出発材料を使用し、産業的な収率で水素化珪素を製造し、上で見られた欠点を全く示さない単純なプロセスが探されてきた。
【0019】
本発明の1つの目的は上述した従来技術の欠点の全てまたはいくつかを解消することである。
【0020】
この目的を達成するために、本発明の主題は、式SinH2n+2(ここでnは1以上4以下の整数である)の化合物の製造方法であって、式M1xM2ySiz(ここでM1は還元性金属であり、M2はアルカリ金属またはアルカリ土類金属であり、x、yおよびzは0から1まで変化し、zは0以外であり、和x+yは0以外である)の粉末の形態にある少なくとも1種のシリサイドまたは珪素合金の、CO2を含む水溶液との反応の段階b)を含み、前記溶液は前記反応の温度および圧力においてCO2で飽和されているかまたは飽和されていない方法である。
【0021】
好ましくは、前記水溶液は前記反応の温度および圧力においてCO2で飽和されている。
【0022】
導入されたCO2がもはや溶け込むことができずに沈殿物を形成する場合に溶液は飽和している。
【0023】
例として、CO2で飽和された溶液を得るために、大気圧で、前記溶液に添加されるのに適した、温度の関数としてのCO2の重量を表1に示す。
【表1】

【0024】
この水溶液は、無機酸(たとえば、HCl、H2SO4またはH3PO4)または有機酸、たとえばCH3COOHを、0.1Nと3Nの間で含み、前記反応の温度においてCO2で飽和されているかまたは飽和されていない酸性溶液を含み得る。
【0025】
還元性金属は、たとえば、Al、B、GaまたはInである。アルカリ金属は、たとえば、Li、Na、KまたはCsである。アルカリ土類金属は、たとえば、Mg、Ca、SrまたはBaである。
【0026】
さらに、本発明の実施形態は以下の特徴の1つ以上を含み得る:
−M1はアルミニウムであり、M2はカルシウムまたはマグネシウムである。
【0027】
−珪素合金は30%ないし38%のアルミニウムと、35%ないし45%の珪素と、15%ないし25%のカルシウムとを含み、百分率は合金中に存在する各元素の重量百分率を表している。
【0028】
−珪素合金はSi0.5Mg、Si0.5Ca、AlSiCa、CaSi、Ca0.5Si、MgSi、AlSiNa、AlSiMg、SiNa、AlSiLi、SiK、Ca0.5AlSi0.33およびCa0.5AlSi0.75、またはこれらの混合物から選択され、好ましくはSi0.5Mg、AlSiNa、SiNa、Si0.25Li、Si0.25Na、Si0.25KまたはSiKである。本発明に適した他の珪素合金はフェロシリコンタイプの合金、たとえばFeSi、FeSiMgまたはFeSiCaである。
【0029】
−前記CO2を含む水溶液は初期pHが6.5と7.5の間にある水へのCO2の添加によって調製される。
【0030】
−前記酸性溶液はCO2と、HCl、H2SO4、H3PO4またはCH3COOHから選択される少なくとも1種の酸とを含む混合物である。
【0031】
−珪素合金の粒径は0.2mmと0.9mmの間、好ましくは0.2mmと0.5mmの間にある。
【0032】
−前記反応は、0℃と100℃の間にある温度で大気圧で行われ、好ましくは0℃と75℃の間、より好ましくは0℃と50℃の間にある温度で、大気圧に近い圧力で行われる。
【0033】
−前記反応は、6未満、好ましくは4と6の間、より好ましくは4.5と5の間にあるpHで行われる。このように、前記反応のpHは、加水分解中に用いられる酸がたとえばHCl、H2SO4またはH3PO4タイプの強酸のみである場合ほど低くない。pHが4未満である反応は、前記水溶液が、CO2に加えて、少なくとも1種の強酸を含む反応である。
【0034】
−この方法は前記反応が少なくとも1種の触媒の存在中で行われることを特徴とする。
【0035】
−上で定義した方法は以下の段階を含む:
a)CO2と水とを含む水溶液の反応器への注入;
b)珪素合金またはシリサイドの前記反応器への導入;
c)段階b)で得られた副生成物の沈降および濾過による分離;
d)シランの液体の形態または加圧された気体の形態への濃縮;
e)段階b)で得られることがある高次シランおよび微量のジシロキサンからモノシランを分離する目的とする、およそ周囲圧力での分留;
f)純粋なモノシランの回収。
【0036】
−前記方法は請求項12および13に記載している。
【0037】
用語「高次シラン」はジシラン、トリシランまたはテトラシランを意味していると理解される。
【0038】
−上で定義したシランの製造方法を行うためのオン・サイトユニットは:
珪素合金(またはシリサイド)を粉末として導入する手段および酸性溶液を導入する手段を備えた少なくとも1つの反応器と;
水蒸気を止める少なくとも1つの還流カラム、デミスタ、シランを分離するための分留カラム、および純粋なモノシランを回収するための二重蒸留カラムを含む精製回路と;
液体生成物を沈降し濾過することによって分離するための少なくとも1つのタンクと
を含む。
【0039】
本発明に係る方法の実施において用いられる合金またはシリサイドは製鋼所においてスラグの発泡と脱酸素を制御するのにも使用される合金またはシリサイドである。これらは低コストな工業製品である。本発明の主題である前記方法の利点の1つは、周囲条件(温度および圧力)に近い条件下で、たとえばワイヤ入りガラスで作られた反応器などの無機化学工業で標準的な設備において前記反応を行うことができることである。これらの合金またはシリサイドを用いる方法は可能な限り市場に近いところにある小型のユニットにおいてシランを製造することを可能にできる。利用可能な合金およびシリサイドならびに動作および環境に関する制約がどのようなものであっても、運転パラメータを調節することによって同一のユニットを用いることができる。
【0040】
全ての場合において、副生成物は再使用可能な無機生成物である。
【0041】
また、合金粉末の粒径は反応速度および結果として反応収率に影響を与えることも発見された。粒子の大きさが小さくなると速度は増加する。反応中の泡の形成は粒子の大きさを制限する要因を構成する。他の全ての条件を同じならば、粒子の大きさを10で割ったとき、同時に生成されるシランの量は約15倍である。
【0042】
加えて、本発明に係る方法は、加水分解反応中に、上で説明した最先端のプロセスの反応と比較して発泡が大きく低減され、反応速度が大きく促進されるという利点を示し、これは望まれるシランの生産品の品質を向上させる。
【0043】
また、本発明に係る方法は、反応中に生成するシランに対して形成されるモノシランの割合が少なくとも70%に等しいという利点を示し、これは本発明が目標とする用途に望まれるシランがとりわけモノシランであるという事実を考慮すると重要である。
【0044】
さらに、本発明に係る方法中に行われる加水分解のための酸としてのCO2の使用は、とりわけ、大気圧に近い圧力の場合に、反応の温度が周囲温度と同程度の大きさであるという利点があるが、そういう状況であれば珪素合金の導入速度を低減する必要がない。
【0045】
本発明に係る方法の別の利点は、合成段階中にシランの前駆物質を生成するための水素の存在が必要ないということである。
【0046】
他の顕著な特徴および利点は、図1を参照して以下の説明を読むと明らかになるであろう。
【図面の簡単な説明】
【0047】
【図1】図1は、本発明に係る方法を行うのに使用されるプラントの図を示す。
【0048】
製造ユニット1は反応器3と、精製システムと、液体製品を沈降および濾過により分離するためのタンク13とを含む少なくとも3つの部分を含む。
【0049】
シランの製造のための加水分解反応は、固体/液体の集合体を混合させることを可能にする混合手段4、たとえばクロースクリアランスのインペラまたはニーダーを備えた反応器3において行われる。この反応器は、一方で、水タンク6から得られる水で満たされたディップパイプ5によって、他方で、酸性溶液の貯蔵のためのシステム7から得られる酸性溶液で満たされる。前記酸性溶液はCO2単独であり得るし、他の酸、たとえばHCl、H2SO4またはH3PO4などとの混合物であり得る。混合物の割合は、前記反応に先立ち、上で特定した解決しようとする課題を考慮して最良の見込み収率を得ることを目的として、ユーザーにより選択される。パイプ5を用いて反応器3を水/酸混合物で満たすために、水および酸性溶液がミキサ8を使用することによって混合される。たとえば、CO2を単独で液体の形態で液体CO2タンクから前記反応器に流し込むことができる。反応器3は、たとえば、頂部から着脱可能な、Uボルトによって取り付けられた蓋と一体となってもよい。ここで、いくつかのディップパイプ5もこの蓋と一体であり、反応器3の壁に触れるように配置される。この蓋は漏れ防止ホッパー9を接続することを可能にする漏れ防止開口部を有している。好ましくは、この反応器は断熱被覆で囲まれる。
【0050】
珪素合金の放出手段9は反応器3の近傍に存在している。このような放出手段は、たとえばホッパー9であり、式M1xM2ySizの粉末の形態にある珪素合金で最初満たされており、ここでM1は還元性の金属であり、M2はアルカリ金属またはアルカリ土類金属であり、x、yおよびzは0と1の間で変化し、zは0以外である。たとえば、ホッパー9はウォームねじと収縮ホース10とを備え、ホッパー9を反応器3から分離することを可能にしている。ホッパー9のデザインは、たとえば、炭化カルシウムをアセチレン反応器へ注ぐのに使用されるホッパーに類似している。合金は、アセチレン製造ユニットにおいて炭化カルシウムを搬送するのに使用されるケグに類似したケグで搬送される。酸性溶液の注入流量はpHプローブ18によって制御することができる。
【0051】
本発明の特定の実施形態によれば、直列に設けられたガス用および分離用の2つの漏れ防止遮断弁(これら2つの間に、切断前に反応器3をパージすることを可能にする側方ブランチを含む)が反応器3の蓋の上方に配置されている。液体を放出するために、同様のデバイス11が反応器3の底部の出口に備わっている。反応器3の底部は手段12、たとえばハッチによって塞がれ、これは液体製品が底部の流路で滞留することを防ぐ。このハッチは底部バルブ11を作動させることによって上昇される。
【0052】
液体はパイプ15を通して沈降/濾過によって分離するためのタンク13へ搬送される。
【0053】
空気は反応領域から排除されたままで維持され、反応の終わりに、未反応の合金が中和される。反応領域は窒素または他の不活性ガス、たとえばアルゴンによって、この領域の全ての付属部分および分留領域(21、22)とともにパージされる。
【0054】
沈降/濾過による分離のためのタンク13は、リアクタ3内で行われた加水分解反応の終わりに、反応器3を不活性ガスによって加圧することによって、溶液と懸濁状態にある生成物とを受け取る。このタンク13はリアクタ3の少なくとも2倍の作業容積を有する。タンク内の脱気中に発生したシランは以下に詳細に説明する精製回路内へ搬送される。前記タンク13は、その高さの底部に、濾過材14を担持した円形スパイダを含む可動式のジャケット16を含む。
【0055】
精製/濾過段階を最適にするために、ミキサ8から得られる水/酸混合物を、パイプ19を経由して精製/濾過タンク13へ搬送することができる。
【0056】
この精製/濾過段階から得られる透明な廃液は次に保管タンク17へ搬送される。これらの廃液は本発明に係る方法の反応のおかげで環境に対して有害でなく且つリサイクル可能であるという利点を示す。
【0057】
所望のシランを回収するために、加水分解により得られる、沈降による分離のためのタンク13へ搬送されない生成物はパイプ24を経由して精製システムへ向けられる。前記精製システムはリアクタ3内での加水分解反応により得られる水蒸気を止める少なくとも1つの還流カラム2を含む。デミスタが前記還流カラム2の出口に導入され、このデミスタは大気と同伴されるであろう水滴を保持することを目的としている。乾燥および中和のための2つのレセプタクル20がデミスタの下流に並列に設置されている。これらの2つのレセプタクルはアルミン酸ナトリウムで満たされている。次に存在するシランおよびシロキサンを分離するために分留カラム21が存在しており、最後に、二重蒸留カラム22が純粋なモノシランを回収するのに使用され、これは続いて所望の用途に使用される。
【0058】
本発明の方法に従って行われる反応に関する反応スキームのいくつかの非制限的な例を以下に述べる。
【0059】
例1:
AlSiCa + 2CO2 + 5H2O → Al(OH)3 + SiH4 + Ca(HCO3)2 + 1/2H2 (1)
この反応スキームは文献に記載されていない。飽和CO2溶液を用いて操作することにより、Ca(OH)2を溶解させて可溶な炭酸水素カルシウムを与え、これは再使用可能な炭化カルシウムに容易に転化することができる。同様に、CO2の存在は水酸化アルミニウムおよびシリカのコロイド質構造物を分解する傾向がある。これら2つの要因は高い反応速度および高い収率を促進する。
【0060】
存在する珪素に対するシランの少なくとも60%の収率を仮定した、(反応(1)に基づく)物質収支:
1kgのシラン(SiH4と等価である)
5kgのAlSiCa;
4.85kgのCO2;
4.7kgのH2O;この量は最先端の反応に必要な重量(数m3)と比べて非常に低い;
4.95kgのAl(OH)3;
8.44kgのCa(HCO3)2 → 14.74kgの容易に再循環可能な副生成物;
1.25kgのコロイダルシリカ;
0.58m3のH2。
【0061】
この経路は、自然に既に存在する複生成物のみを与え、さらに発生したCO2を再使用すること、およびより容易に濾過することができ且つ沈降/分離によって分離するためのタンク13でより容易に処理される複生成物の「ケーキ」をもたらすという利点を導入する。
【0062】
反応スキーム(1)では、温度の上昇が高次シランの形成を促進する。このように、CO2の使用のおかげによる周囲温度に近い反応温度はモノシランの形成を促進する。
【0063】
この反応は中性のpHにある水中において行うことができるが、水酸化カルシウム、コロイダルアルミニウムおよびコロイダルシリカの形成は前記反応を妨害し、反応速度を非常に低くする。
【0064】
例2:
SiCa2 + 4CO2 + 4H2O → SiH4 + 2Ca(HCO3)2 (2)
ここで使用される合金はSiCa2であるが、結果はSiMg2の使用と同様であろう。
【0065】
シリサイドは中性のpHにある水と自発的に反応するが、溶解度に乏しいCa(OH)2の形成をもたらし、反応速度を低減させる。
【0066】
この反応スキームは文献に記載されていない。飽和CO2溶液を用いて操作することによって、Ca(OH)2を溶解させて、こうしてこの溶液をシリサイドに自由に接近するようにして、コロイド質構造の水酸化珪素を崩壊させることができる。
【0067】
存在する珪素に対するシランの少なくとも60%の収率を仮定した、(反応(2)に基づく)物質収支:
1kgのシラン(SiH4と等価である)
6.25kgのSiCa2;
10kgのCO2;
3.75kgのH2O;この量は最先端の反応に必要な重量(数m3)と比べて非常に低い;
18.87kgのCa(HCO3)2;
1.25kgのコロイダルシリカ。
【0068】
この反応スキームの利点は、固体副生成物としてコロイダルシリカのみを与え、既に発生したCO2をさらに使用し、溶解した状態の重炭酸カルシウム(再循環されて炭化カルシウムを与えることができる)を生成することにある。
【0069】
本発明に係る方法を実施するために従うべき手順の一例は以下に説明するとおりであり得る。
【0070】
1−反応器の用意:
前回の反応サイクルの終わりに、反応器3を不活性ガスによってパージし、わずかに過剰な圧力に維持する。
【0071】
2−合金の導入:
合金の粒径は0.2mmと0.5mmの間にあり、1.5kg毎リットルと2kg毎リットルの間にある密度を与える。好ましくは、最初の酸性溶液を反応器3に導入した後に合金を反応器3へ導入する。
【0072】
流量は発泡効果の関数として実地経験により決定される。
【0073】
前記量の合金を、溶液のレベルが脱気を促進するために低いままになるように、連続して導入する。
【0074】
3−反応を進行させる
反応温度を50℃未満に保ってモノシランの生成を促進する。反応器3を貯蔵システム7から得られるある量の酸性溶液で満たし、低い溶液高さが溶液の脱気を促進し、発泡の影響を最小にする。スターラー4による反応器3の攪拌を開始した後に、ホッパー9から得られる合金を徐々に導入される。pHを選択した値に維持しながら同時に酸の注入を行う。
【0075】
CO2を唯一の酸性反応物質として使用する場合、CO2は溶液へ直接注入され、反応媒体の冷却に必要な負のキロカロリーの一部に寄与する。
【0076】
このシーケンスの終わりに、反応器3を数分間攪拌し続けた後に反応器3内に存在する液体を沈降/濾過によって分離するためのタンク13へ搬送する。
【0077】
4−溶液を沈降/濾過によって分離する
各シーケンスの後に、溶液および懸濁状態にある生成物を、重力およびわずかに過剰な圧力によって、手段16により攪拌される沈降/濾過によって分離するためのタンク13内へ移す。この溶液を数分のあいだ攪拌されているタンク13中に保って脱気を完了させた後にタンク13の底部バルブ23を開放して濾過を開始する。溶液は濾過材14を通って流れる。この溶液は、使用する酸に応じて、水分の蒸発によって炭化カルシウムを与えるCa(HCO3)2、または化学もしくは製薬の分野へリサイクルすることができるCaCl2・6H2Oのいずれかを含む。続いて、濾過材14上で得られたケーキをタンク13から取り出す。このケーキは、か焼によって粘土を与えるアルミナおよびシリカ、またはシリカゲルへ転化し得るシリカのいずれかを含んでいる。
【0078】
規模の程度を特定するために、CO2を酸性反応物質として使用する100T/年のモノシランの製造についての製造ユニット1の条件および完全な材料収支を以下に示す。
【0079】
以下の表において、1T=1000kgである。
【0080】
仮定:
−珪素のシランへの転化の収率:60%;
−製造サイクル24h;
−合計反応時間15h;
−製造日数:330日/年;
−反応器の大きさ:直径2m、作業高さ:1m。
【表2】

【0081】
選択されるシリサイドまたは合金が何であっても、以下の一般的な条件が優先する:
−前記反応は中性pHにある水中で行うことができるが、水酸化物の形成は反応速度を下げる。酸性または塩基性の溶液の添加は反応速度を高め、反応を減速する副生成物の一部の溶解を促進する;
−前記反応は酸性溶液において活発である;
−また、大部分の水酸化物を溶解するために、前記反応を塩基性媒体(pH8ないし10)で行うこともできる;
−高次シランの形成は温度の上昇によって促進される;
−反応を妨害する泡の形成を防ぐためにシリコーン系の消泡剤を添加することができるが、たとえばHClなどの酸の使用とは対照的に、酸性溶液としてのCO2の使用はこのような消泡剤の必要性を低減する。
【0082】
一般に、本発明に係るプロセスは、上述した最先端プロセスと比較して、以下の利点を示す:
−酸としてのCO2の添加は、アルミナなどの副生成物の沈殿および凝集を促進し、したがってこのことはそれらの濾過とその後のそれらの処理とを容易にする。
【0083】
−アルミナおよび炭酸塩などの副生成物の重量はより低くなり、したがって泡が少なくなる。したがって、前記反応のより大きな部分を反応器3において行うことができ、それで収率が著しく上昇する。
【0084】
−本発明に係るこの技術はクロロシランを用いるプロセスよりも費用がかからない。
【0085】
−最先端のプロセスのエネルギー消費量は製造されるモノシランのkg当たり50kWhを上回るが、本発明に係る方法の場合、100℃未満の温度において、この消費量は製造されるモノシランのkg当たり10kWh程度である。
【0086】
−CO2が消費されるのと同じ速さで、それを液体の形態で流すことによって再注入することができ、ユーザーによって望まれる流量および速度で前記反応は連続的に起きる。
【0087】
−本発明に係る方法は、前記反応の合金、シリサイドおよび酸性溶液が何であっても、標準的な化学的設備を用いて同一の製造ユニットにおいて行うことができる。
【0088】
−用いられる前記反応は化学的プロセスまたは日常の使用においてリサイクルすることができ、環境に対する影響が小さい副生成物を生成する。
【特許請求の範囲】
【請求項1】
式SinH2n+2(ここでnは1以上4以下の整数である)の化合物の製造方法であって、式M1xM2ySiz(ここでM1は還元性金属であり、M2はアルカリ金属またはアルカリ土類金属であり、x、yおよびzは0から1まで変化し、zは0以外であり、和x+yは0以外である)の粉末の形態にある少なくとも1種のシリサイドまたは珪素合金の、CO2を含む水溶液との反応の段階b)を含み、前記溶液は前記反応の温度および圧力においてCO2で飽和されているかまたは飽和されていない方法。
【請求項2】
前記水溶液は前記反応の温度および圧力においてCO2で飽和されていることを特徴とする請求項1に記載の方法。
【請求項3】
M1はアルミニウムであり、M2はカルシウムまたはマグネシウムであることを特徴とする請求項1および2のいずれかに記載の方法。
【請求項4】
前記珪素合金は、前記合金中に存在する各元素の重量で、30%ないし38%のアルミニウムと、35%ないし45%の珪素と、15%ないし25%のカルシウムとを含むことを特徴とする請求項3に記載の方法。
【請求項5】
前記珪素合金はFeSi、FeSiMg、FeSiCa、Si0.5Mg、Si0.5Ca、AlSiCa、CaSi、Ca0.5Si、MgSi、AlSiNa、AlSiMg、SiNa、AlSiLi、SiK、Ca0.5AlSi0.33およびCa0.5AlSi0.75、またはこれらの混合物から選択され、好ましくはSi0.5Mg、AlSiNa、SiNa、Si0.25Li、Si0.25Na、Si0.25KまたはSiKであることを特徴とする請求項1および2のいずれかに記載の方法。
【請求項6】
前記CO2を含む水溶液は初期pHが6.5と7.5の間にある水へのCO2の添加によって調製されることを特徴とする請求項1および2のいずれかに記載の方法。
【請求項7】
前記水溶液はCO2と、HCl、H2SO4、H3PO4またはCH3COOHから選択される少なくとも1種の酸とを含む混合物であることを特徴とする請求項1ないし5の1項に記載の方法。
【請求項8】
前記珪素合金の粒径は0.2mmと0.9mmの間、好ましくは0.2mmと0.5mmの間にあることを特徴とする請求項1ないし7の1項に記載の方法。
【請求項9】
前記反応は大気圧に近い圧力で行われることを特徴とする請求項1ないし8の1項に記載の方法。
【請求項10】
前記反応は0℃と75℃の間、好ましくは0℃と50℃の間の温度で行われることを特徴とする請求項1ないし9の1項に記載の方法。
【請求項11】
前記反応は6未満、好ましくは4と6の間、より好ましくは4.5と5の間にあるpHで行われることを特徴とする請求項1ないし10の1項に記載の方法。
【請求項12】
a)前記CO2を含む水溶液を水と混合する段階と;
b)前記珪素合金と段階a)から得られた混合物の間で混合する段階と;
c)段階b)で得られた副生成物の沈降および濾過することによって分離する段階と;
d)濃縮によって液体または圧縮気体の形態でシランを貯蔵する段階と
を含む請求項1ないし11の1項に記載の方法。
【請求項13】
e)段階b)で得られた高次シランおよび微量のジシロキサンからモノシランを分離することを目的とする、周囲圧力に近い分留の段階
をさらに含む請求項12に記載の方法。
【請求項14】
請求項1ないし13の1項に記載のシランの製造方法の実施のためのオンサイトユニット(1)であって、
−前記珪素合金を粉末として導入する手段(9、10)および前記酸性溶液を導入する手段(5、7)を備えた少なくとも1つの反応器(3)と;
−水蒸気を止める少なくとも1つの還流カラム(2)、デミスタ、シランを分離するための分留カラム(21)、および純粋なモノシランを回収するための二重蒸留カラム(22)を含む精製回路と;
−液体生成物を沈降し濾過することによって分離するための少なくとも1つのタンク(13)と
を含むユニット。
【請求項1】
式SinH2n+2(ここでnは1以上4以下の整数である)の化合物の製造方法であって、式M1xM2ySiz(ここでM1は還元性金属であり、M2はアルカリ金属またはアルカリ土類金属であり、x、yおよびzは0から1まで変化し、zは0以外であり、和x+yは0以外である)の粉末の形態にある少なくとも1種のシリサイドまたは珪素合金の、CO2を含む水溶液との反応の段階b)を含み、前記溶液は前記反応の温度および圧力においてCO2で飽和されているかまたは飽和されていない方法。
【請求項2】
前記水溶液は前記反応の温度および圧力においてCO2で飽和されていることを特徴とする請求項1に記載の方法。
【請求項3】
M1はアルミニウムであり、M2はカルシウムまたはマグネシウムであることを特徴とする請求項1および2のいずれかに記載の方法。
【請求項4】
前記珪素合金は、前記合金中に存在する各元素の重量で、30%ないし38%のアルミニウムと、35%ないし45%の珪素と、15%ないし25%のカルシウムとを含むことを特徴とする請求項3に記載の方法。
【請求項5】
前記珪素合金はFeSi、FeSiMg、FeSiCa、Si0.5Mg、Si0.5Ca、AlSiCa、CaSi、Ca0.5Si、MgSi、AlSiNa、AlSiMg、SiNa、AlSiLi、SiK、Ca0.5AlSi0.33およびCa0.5AlSi0.75、またはこれらの混合物から選択され、好ましくはSi0.5Mg、AlSiNa、SiNa、Si0.25Li、Si0.25Na、Si0.25KまたはSiKであることを特徴とする請求項1および2のいずれかに記載の方法。
【請求項6】
前記CO2を含む水溶液は初期pHが6.5と7.5の間にある水へのCO2の添加によって調製されることを特徴とする請求項1および2のいずれかに記載の方法。
【請求項7】
前記水溶液はCO2と、HCl、H2SO4、H3PO4またはCH3COOHから選択される少なくとも1種の酸とを含む混合物であることを特徴とする請求項1ないし5の1項に記載の方法。
【請求項8】
前記珪素合金の粒径は0.2mmと0.9mmの間、好ましくは0.2mmと0.5mmの間にあることを特徴とする請求項1ないし7の1項に記載の方法。
【請求項9】
前記反応は大気圧に近い圧力で行われることを特徴とする請求項1ないし8の1項に記載の方法。
【請求項10】
前記反応は0℃と75℃の間、好ましくは0℃と50℃の間の温度で行われることを特徴とする請求項1ないし9の1項に記載の方法。
【請求項11】
前記反応は6未満、好ましくは4と6の間、より好ましくは4.5と5の間にあるpHで行われることを特徴とする請求項1ないし10の1項に記載の方法。
【請求項12】
a)前記CO2を含む水溶液を水と混合する段階と;
b)前記珪素合金と段階a)から得られた混合物の間で混合する段階と;
c)段階b)で得られた副生成物の沈降および濾過することによって分離する段階と;
d)濃縮によって液体または圧縮気体の形態でシランを貯蔵する段階と
を含む請求項1ないし11の1項に記載の方法。
【請求項13】
e)段階b)で得られた高次シランおよび微量のジシロキサンからモノシランを分離することを目的とする、周囲圧力に近い分留の段階
をさらに含む請求項12に記載の方法。
【請求項14】
請求項1ないし13の1項に記載のシランの製造方法の実施のためのオンサイトユニット(1)であって、
−前記珪素合金を粉末として導入する手段(9、10)および前記酸性溶液を導入する手段(5、7)を備えた少なくとも1つの反応器(3)と;
−水蒸気を止める少なくとも1つの還流カラム(2)、デミスタ、シランを分離するための分留カラム(21)、および純粋なモノシランを回収するための二重蒸留カラム(22)を含む精製回路と;
−液体生成物を沈降し濾過することによって分離するための少なくとも1つのタンク(13)と
を含むユニット。
【図1】




【公表番号】特表2011−520754(P2011−520754A)
【公表日】平成23年7月21日(2011.7.21)
【国際特許分類】
【出願番号】特願2011−510021(P2011−510021)
【出願日】平成21年4月21日(2009.4.21)
【国際出願番号】PCT/FR2009/050734
【国際公開番号】WO2009/141540
【国際公開日】平成21年11月26日(2009.11.26)
【出願人】(591036572)レール・リキード−ソシエテ・アノニム・プール・レテュード・エ・レクスプロワタシオン・デ・プロセデ・ジョルジュ・クロード (438)
【Fターム(参考)】
【公表日】平成23年7月21日(2011.7.21)
【国際特許分類】
【出願日】平成21年4月21日(2009.4.21)
【国際出願番号】PCT/FR2009/050734
【国際公開番号】WO2009/141540
【国際公開日】平成21年11月26日(2009.11.26)
【出願人】(591036572)レール・リキード−ソシエテ・アノニム・プール・レテュード・エ・レクスプロワタシオン・デ・プロセデ・ジョルジュ・クロード (438)
【Fターム(参考)】
[ Back to top ]

