環式テトラペプチド及びその治療応用
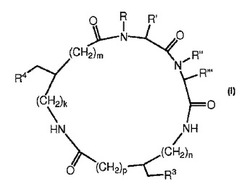
式Iの化合物が提供され、式中、k、m、n、p、R、R’、R’’、R’’’、R3、及びR4は、本出願で定義された通りである。他の実施形態も開示される。
【発明の詳細な説明】
【背景技術】
【0001】
免疫抑制剤は、移植及び自己免疫疾患の治療に一般的に使用されている。これら薬物の生産は高価であり、これら薬物の中で最も頻繁に使用されている薬物、即ちシクロスポリンA、タクロリムス、及びラパマイシンは、望ましくない副作用を示す。副作用のない新しい免疫抑制剤を、特に天然ペプチド免疫調節物質及びそれらの類似体のクラスの中で探索することは、医薬品化学にとって重要な挑戦である。
【0002】
シクロリノペプチドA(CLA)、非常に疎水性である環式ノナペプチドは、1959年に亜麻種子から初めて単離された。CLAは、強力に免疫抑制性であり、シクロスポリンA(CsA)の効力と同等の効力を有する。CLAの作用機序は、CsAの作用機序と類似していることが示された。つまり、CLAは、親和性が非常に低いとはいえ、サイクロフィリンAと複合体を形成して、カルシニューリンの不活化を引き起こす(Gaymesら、Febs Lett、1997年、418巻、224〜227頁)。CLAは、体液性免疫応答及び細胞性免疫応答の両方並びに移植片対宿主反応を阻害し、同種皮膚移植の生存を延長し、ラットのアジュバント多発関節炎後及びニュージーランドブラックマウスの溶血性貧血を緩和し、CsAと同様に、IL1及びIL−2産生を阻害した。残念ながら、CLAの疎水性が高いことは、この化合物の潜在的治療応用の障害である。
【0003】
ペプチド鎖の連続した位置にアラニン残基を含有する直鎖CLA類似体は、免疫抑制性であることが見出された(Wieczorekら、Arch Immunol Ther Exp、1992年、40巻、213〜216頁)。また、直鎖CLA類似体の活性は、N末端基からペプチド鎖を短縮する共に徐々に減少し、同時にC末端テトラペプチド及びトリペプチドに対する活性の増加を示した(Siemionら、Arch Immunol Ther Exp、1994年、42巻、459〜465頁)。単一の親水性トレオニン残基をCLA分子に導入しても、水溶解度が向上する結果にはならなかった。しかしながら、溶解度の向上は、1つ又は2つのフェニルアラニン残基のフェニル環のパラ位にスルホン酸基を導入することにより、生物活性を喪失させることなく達成された(Siemionら、Arch Immunol Ther Exp、1992年、40巻、257〜261頁;Cebratから、J Peptide Res.、1997年、49巻、415〜420頁)。加えて、より長鎖の直鎖ペプチド鎖にテトラペプチド性(Pro−Pro−Phe−Phe)又はトリペプチド性(Pro−Phe−Phe)断片が含まれていることは、免疫抑制活性に重要性であると考えられることが観察されている(Wieczorekら、Arch Immunol Ther Exp、1993年、41巻、291〜296頁;Cebratら、Pol.J Chem、1997年、71巻、1401頁)。
【0004】
プロリン残基間のcis−ペプチド結合が、1,5−二置換テトラゾール環(cis配置のアミド結合の良好な模倣体)で置換されている一連の類似体は、CsAと同等の免疫抑制活性を示した。(Karczmarekら、Biopolymers、2002年、63巻、343〜357頁)。
【0005】
5位及び/又は8位のロイシン残基が、それらのヒドロキシメチル類似体で置換されている合成CLA類似体は、CLAと比較して水溶解度の4倍の増加を示したが、天然CLAと比較して生物活性が25%減少したことも示した(Zubrzakら、Biopolymers(Peptide Science)、2005年、80巻、347〜356頁)。
【0006】
一連の9つのCLA類似体が、CLAプロリン残基をβ2−イソプロリン及びβ3−ホモプロリンに置換することにより得られた。CsAと比較して、これらCLA類似体は、細胞性免疫応答に強力な阻害特性を示した。これら類似体の大多数は、事実上細胞毒性がなかった(Katarzynskaら、J Pept Sci、2009年、14巻、1283〜1294頁)。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】米国特許第4,105,603号
【特許文献2】米国特許第3,972,859号
【特許文献3】米国特許第3,842,067号
【特許文献4】米国特許第3,862,925号
【特許文献5】米国特許第6,015,881号
【特許文献6】米国特許第6,197,927号
【特許文献7】米国特許第7,439,222号
【非特許文献】
【0008】
【非特許文献1】Gaymesら、Febs Lett、1997年、418巻、224〜227頁
【非特許文献2】Wieczorekら、Arch Immunol Ther Exp、1992年、40巻、213〜216頁
【非特許文献3】Siemionら、Arch Immunol Ther Exp、1994年、42巻、459〜465頁
【非特許文献4】Siemionら、Arch Immunol Ther Exp、1992年、40巻、257〜261頁
【非特許文献5】Cebratから、J Peptide Res.、1997年、49巻、415〜420頁
【非特許文献6】Wieczorekら、Arch Immunol Ther Exp、1993年、41巻、291〜296頁
【非特許文献7】Cebratら、Pol.J Chem、1997年、71巻、1401頁
【非特許文献8】Karczmarekら、Biopolymers、2002年、63巻、343〜357頁
【非特許文献9】Zubrzakら、Biopolymers(Peptide Science)、2005年、80巻、347〜356頁
【非特許文献10】Katarzynskaら、J Pept Sci、2009年、14巻、1283〜1294頁
【非特許文献11】Journal of Organic Chemistryの各巻の最初の号
【非特許文献12】Merrifield、J.Am.Chem.Soc、85巻:2149頁(1964年)
【非特許文献13】Houghten、Proc.Natl.Acad.Sci.USA、82巻:5132頁(1985年)
【非特許文献14】Kelley & Winkler in Genetic Engineering Principles and Methods、Setlow,J.K.編。Plenum Press、N.Y.、第12巻、1〜19頁(1990年)
【非特許文献15】Stewart & Young、Solid Phase Peptide Synthesis、Pierce Chemical Co.、Rockford,M.(1984年)
【非特許文献16】Merglerら(1988年)Tetrahedron Letters 29巻:4005〜4008頁
【非特許文献17】Merglerら(1988年)Tetrahedron Letters 29巻:4009〜4012頁
【非特許文献18】Kamberら(編)、Peptides,Chemistry and Biology、ESCOM,Leiden(1992年)525〜526頁
【非特許文献19】Rinikerら(1993)Tetrahedron Letters 49巻:9307〜9320頁
【非特許文献20】Lloyd−Williamsら(1993年)Tetrahedron Letters 49巻:11065〜11133頁
【非特許文献21】Anderssonら(2000年)Biopolymers 55巻:227〜250頁
【非特許文献22】Bray、Nature Reviews 2巻:587〜593頁(2003年)
【非特許文献23】Guillerら、Chem Rev.2000年、100巻、2091〜2157頁
【非特許文献24】Physician’s Desk Reference
【非特許文献25】Noonanら、Int.Arch.Allergy Appl.Immunol.、1978年、56巻、523〜532頁
【非特許文献26】Hansenら、J Immunol Methods、1989年、119巻、203〜210頁
【非特許文献27】Mishellら、J Exp Med、1967年、126巻、423〜442頁
【非特許文献28】Espevikら、J.Immunol.Methods、95巻(1986年):99〜103頁
【非特許文献29】Yamamoto、Eur.J.Pharmacol.、2006年、550巻、166〜172頁
【非特許文献30】Hansen MB、J Immunol Methods、1989年、119巻、203〜210頁
【発明の概要】
【課題を解決するための手段】
【0009】
本発明の実施形態によると、式Iを有する化合物:
【0010】
【化1】

式中、
【0011】
k、m、n、及びpは、各々独立して0、1、又は2であり、
【0012】
R及びR’は、各々独立してH及びC1〜3アルキルから選択されるか、又はR及びR’は、一緒になって−CR1R1’−X−CH2−であり、ここでCR1R1’は骨格窒素に結合されており、R1及びR1’は、各々独立してH及びC1〜3アルキルから選択され、Xは、−CH2−、−CH2CH2−、−CH(OH)−、−O−、−S−、及び−NH−から選択され、
【0013】
R’’及びR’’’は、各々独立してH及びC1〜3アルキルから選択されるか、又はR’’及びR’’’は、一緒になって−CR2R2’−X’−CH2−であり、ここでCR2R2’は骨格窒素に結合されており、R2及びR2’は、各々独立してH及びC1〜3アルキルから選択され、X’は、−CH2−、−CH2CH2−、−CH(OH)−、−O−、−S−、及び−NH−から選択され、
【0014】
R3及びR4は、各々独立してアリール、置換アリール、へテロアリール、及び置換へテロアリールから選択される化合物、
【0015】
又はその薬学的に許容される塩が提供される。
【0016】
幾つかの実施形態では、R3及びR4の少なくとも1つは、フェニルである。幾つかの実施形態では、R3及びR4の少なくとも1つは、4−ヒドロキシフェニルである。幾つかの実施形態では、R3及びR4の少なくとも1つは、4−t−ブトキシフェニルである。幾つかの実施形態では、R3及びR4の少なくとも1つは、2−インドリルである。幾つかの実施形態では、R3及びR4は両方とも、フェニルである。幾つかの実施形態では、R3及びR4の一方はフェニルであり、R3及びR4の他方は、4−ヒドロキシフェニルである。幾つかの実施形態では、R3及びR4の一方はフェニルであり、R3及びR4の他方は、4−t−ブトキシフェニルである。幾つかの実施形態では、R3及びR4の一方はフェニルであり、R3及びR4の他方は、2−インドリルである。幾つかの実施形態では、−CH2−R3に結合された炭素は、絶対(R)立体化学を有する。幾つかの実施形態では、−CH2−R3に結合された炭素は、絶対(S)立体化学を有する。幾つかの実施形態では、−CH2−R4に結合された炭素は、絶対(R)立体化学を有する。幾つかの実施形態では、−CH2−R4に結合された炭素は、絶対(S)立体化学を有する。幾つかの実施形態では、k、m、n、及びpのうちの1つは1であり、k、m、n、及びpの残りは0である。幾つかの実施形態では、k、m、n、及びpのうちの2つは1であり、k、m、n、及びpの残りは0である。幾つかの実施形態では、k及びmの少なくとも1つは、0ではない。幾つかの実施形態では、n及びpの少なくとも1つは、0ではない。幾つかの実施形態では、k及びmの少なくとも1つは、0ではなく、n及びpの少なくとも1つは、0ではない。幾つかの実施形態では、k及びnは両方とも、0である。幾つかの実施形態では、k及びnは両方とも0であり、m及びpの一方は0であり、m及びpの他方は、1である。幾つかの実施形態では、k及びnは両方とも0であり、m及びpは両方とも1である。幾つかの実施形態では、4つのアミノ酸は全てL−アミノ酸である。幾つかの実施形態では、アミノ酸のうちの3つはL−アミノ酸であり、アミノ酸のうちの1つはD−アミノ酸である。幾つかの実施形態では、アミノ酸のうちの2つはL−アミノ酸であり、アミノ酸のうちの2つはD−アミノ酸である。幾つかの実施形態では、アミノ酸のうちの1つはL−アミノ酸であり、アミノ酸のうちの3つはD−アミノ酸である。幾つかの実施形態では、4つのアミノ酸は全てD−アミノ酸である。
【0017】
幾つかの実施形態では、R及びR’は、一緒になって−(CH2)3−を形成し、つまりR及びR’は、一緒になって−CR1R1’−X−CH2−を形成し、式中R1及びR1’は両方ともHであり、XはCH2である。幾つかの実施形態では、R’’及びR’’’は、一緒になって−(CH2)3−を形成し、つまりR’’及びR’’’は、一緒になって−CR2R2’−X’−CH2−を形成し、式中R2及びR2’は両方ともHであり、X’はCH2である。幾つかの実施形態では、R及びR’は、一緒になって−(CH2)4−を形成し、つまりR及びR’は、一緒になって−CR1R1’−X−CH2−を形成し、式中R1及びR1’は両方ともHであり、Xは(CH2)2である。幾つかの実施形態では、R’’及びR’’’は、一緒になって−(CH2)4−を形成し、つまりR’’及びR’’’は、一緒になって−CR2R2’−X−CH2−を形成し、式中R2及びR2’は両方ともHであり、Xは(CH2)2である。幾つかの実施形態では、R及びR’は、一緒になって−CH2−CH(OH)−CH2−を形成し、つまりR及びR’は、一緒になって−CR1R1’−X−CH2−を形成し、式中R1及びR1’は両方ともHであり、XはCH(OH)である。幾つかの実施形態では、R’’及びR’’’は、一緒になって−CH2−CH(OH)−CH2−を形成し、つまりR’’及びR’’’は、一緒になって−CR2R2’−X’−CH2−を形成し、式中R2及びR2’は両方ともHであり、X’はCH(OH)である。R及びR’が一緒になっている幾つかの実施形態では、R’が結合されている炭素は、絶対(S)立体化学を有する。R及びR’が一緒になっている幾つかの実施形態では、R’が結合されている炭素は、絶対(R)立体化学を有する。R’’及びR’’’が一緒になっている幾つかの実施形態では、R’’’が結合されている炭素は、絶対(S)立体化学を有する。R’’及びR’’’が一緒になっている幾つかの実施形態では、R’’’が結合されている炭素は、絶対(R)立体化学を有する。
【0018】
幾つかの実施形態では、化合物は、以下のものからなる群から選択される:
【0019】
【化2】

I−1(環式(−Pro−Pro−β3hoPhe−Phe−))、
【0020】
【化3】

I−2(環式(−Pro−Pro−Phe−β3hoPhe−))、
【0021】
【化4】

I−3(環式(−Pro−Pro−β3hoPhe−β3hoPhe−))、
【0022】
【化5】

I−4(環式(−Pro−Pro−β3hoPhe−Trp−))、
【0023】
【化6】

I−5(環式(−Pro−Pro−β3hoPhe−Tyr−))、
【0024】
【化7】

I−6(環式(−Pro−Pro−β3hoPhe−Tyr(t−Bu)−))、
【0025】
【化8】

I−7(環式(−Pro−Pip−β3hoPhe−Phe−))、及び
【0026】
【化9】

I−8(環式(Pro−Hyp−β3hoPhe−Phe−))。
幾つかの実施形態では、化合物は、式I−1の化合物である。幾つかの実施形態では、化合物は、式I−2の化合物である。幾つかの実施形態では、化合物は、式I−3の化合物である。幾つかの実施形態では、化合物は、式I−4の化合物である。幾つかの実施形態では、化合物は、式I−5の化合物である。幾つかの実施形態では、化合物は、式I−6の化合物である。幾つかの実施形態では、化合物は、式I−7の化合物である。幾つかの実施形態では、化合物は、式I−8の化合物である。
【0027】
幾つかの実施形態では、化合物は、以下のものからなる群から選択される:
【0028】
【化10】

I−A
(環式(−(L)−Pro−(L)−Pro−(L)−β3hoPhe−(L)−Phe−))、
【0029】
【化11】

I−B
(環式(−(L)−Pro−(L)−Pro−(L)−Phe−(L)−β3hoPhe−))、
【0030】
【化12】

I−C
(環式(−(L)−Pro−(L)−Pro−(L)−β3hoPhe−(L)−β3hoPhe−))、
【0031】
【化13】

I−D
(環式(−(L)−Pro−(L)−Pro−(L)−β3HoPhe−(D)−Phe−))、
【0032】
【化14】

I−E
(環式(−(D)−Pro−(D)−Pro−(L)−β3HoPhe−(D)−Phe−))、
【0033】
【化15】

I−F
(環式(−(D)−Pro−(L)−Pro−(L)−β3HoPhe−(L)−Phe−))、
【0034】
【化16】

I−G
(環式(−(L)−Pro−(L)−Pro−(D)−β3HoPhe−(L)−Phe−)、
【0035】
【化17】

I−H
(環式(−(L)−Pro−(D)−Pro−(L)−β3HoPhe−(L)−Phe−)、
【0036】
【化18】

I−J
(環式(−(D)−Pro−(D)−Pro−(D)−β3HoPhe−(D)−Phe−)、
【0037】
【化19】

I−K
(環式(−(D)−Pro−(D)−Pro−(L)−β3HoPhe−(L)−Phe−)、
【0038】
【化20】

I−L
(環式(−(L)−Pro−(L)−Pro−(L)−β3HoPhe−(L)−Trp−)、
【0039】
【化21】

I−M
(c(−(L)−Pro−(L)−Pro−(L)−β3HoPhe−(L)−Tyr−)、
【0040】
【化22】

I−N
(環式[−(L)−Pro−(L)−Pro−(L)−β3HoPhe−(L)−Tyr(tBu)−])、
【0041】
【化23】

I−O
(環式(−(L)−Pro−(L)−Pip−(L)−β3HoPhe−(L)−Phe−))、及び
【0042】
【化24】

I−P
(環式(−(L)−Pro−(L)−t−Hyp−(L)−β3HoPhe−(L)−Phe−))。
幾つかの実施形態では、化合物は、式1−Aの化合物である。幾つかの実施形態では、化合物は、式I−Bの化合物である。幾つかの実施形態では、化合物は、式I−Cの化合物である。幾つかの実施形態では、化合物は、式I−Dの化合物である。幾つかの実施形態では、化合物は、式I−Eの化合物である。幾つかの実施形態では、化合物は、式I−Fの化合物である。幾つかの実施形態では、化合物は、式I−Gの化合物である。幾つかの実施形態では、化合物は、式I−Hの化合物である。幾つかの実施形態では、化合物は、式I−Lの化合物である。幾つかの実施形態では、化合物は、式I−Jの化合物である。幾つかの実施形態では、化合物は、式I−Kの化合物である。幾つかの実施形態では、化合物は、式I−Lの化合物である。幾つかの実施形態では、化合物は、式I−Mの化合物である。幾つかの実施形態では、化合物は、式I−Nの化合物である。幾つかの実施形態では、化合物は、式I−Oの化合物である。幾つかの実施形態では、化合物は、式I−Pの化合物である。
【0043】
幾つかの実施形態では、式Iの化合物中の1つ又は複数のアミノ基は、保護された形態である。
【0044】
また、本発明の実施形態によると、式Iの化合物及びその薬学的に許容される担体、賦形剤、又は希釈剤を含む医薬組成物が提供される。幾つかの実施形態では、化合物は、式I−1の化合物である。幾つかの実施形態では、化合物は、式I−2の化合物である。幾つかの実施形態では、化合物は、式I−3の化合物である。幾つかの実施形態では、化合物は、式I−4の化合物である。幾つかの実施形態では、化合物は、式I−5の化合物である。幾つかの実施形態では、化合物は、式I−6の化合物である。幾つかの実施形態では、化合物は、式I−7の化合物である。幾つかの実施形態では、化合物は、式I−8の化合物である。幾つかの実施形態では、化合物は、式I−Aの化合物である。幾つかの実施形態では、化合物は、式I−Bの化合物である。幾つかの実施形態では、化合物は、式I−Cの化合物である。幾つかの実施形態では、化合物は、式I−Dの化合物である。幾つかの実施形態では、化合物は、式I−Eの化合物である。幾つかの実施形態では、化合物は、式I−Fの化合物である。幾つかの実施形態では、化合物は、式I−Gの化合物である。幾つかの実施形態では、化合物は、式I−Hの化合物である。幾つかの実施形態では、化合物は、式I−Jの化合物である。幾つかの実施形態では、化合物は、式I−Kの化合物である。幾つかの実施形態では、化合物は、式I−Lの化合物である。幾つかの実施形態では、化合物は、式I−Mの化合物である。幾つかの実施形態では、化合物は、式I−Nの化合物である。幾つかの実施形態では、化合物は、式I−Oの化合物である。幾つかの実施形態では、化合物は、式I−Pの化合物である。
【0045】
また、本発明の実施形態によると、患者の免疫応答を抑制する方法であって、その必要性のある患者に有効量の式Iの化合物を投与することを含む方法が提供される。幾つかの実施形態では、抑制される免疫応答は、炎症である。幾つかの実施形態では、抑制される免疫応答は、移植拒絶反応である。幾つかの実施形態では、化合物は、式I−1の化合物である。幾つかの実施形態では、化合物は、式I−2の化合物である。幾つかの実施形態では、化合物は、式I−3の化合物である。幾つかの実施形態では、化合物は、式I−4の化合物である。幾つかの実施形態では、化合物は、式I−5の化合物である。幾つかの実施形態では、化合物は、式I−6の化合物である。幾つかの実施形態では、化合物は、式I−7の化合物である。幾つかの実施形態では、化合物は、式I−8の化合物である。幾つかの実施形態では、化合物は、式I−Aの化合物である。幾つかの実施形態では、化合物は、式I−Bの化合物である。幾つかの実施形態では、化合物は、式I−Cの化合物である。幾つかの実施形態では、化合物は、式I−Dの化合物である。幾つかの実施形態では、化合物は、式I−Eの化合物である。幾つかの実施形態では、化合物は、式I−Fの化合物である。幾つかの実施形態では、化合物は、式I−Gの化合物である。幾つかの実施形態では、化合物は、式I−Hの化合物である。幾つかの実施形態では、化合物は、式I−Jの化合物である。幾つかの実施形態では、化合物は、式I−Kの化合物である。幾つかの実施形態では、化合物は、式I−Lの化合物である。幾つかの実施形態では、化合物は、式I−Mの化合物である。幾つかの実施形態では、化合物は、式I−Nの化合物である。幾つかの実施形態では、化合物は、式I−Oの化合物である。幾つかの実施形態では、化合物は、式I−Pの化合物である。
【0046】
また、本発明の実施形態によると、患者の免疫関連疾患又は状態を治療又は予防する方法であって、その必要性のある患者に有効量の式Iの化合物を投与することを含む方法が提供される。また、本発明の実施形態によると、第2の薬物の毒性特性を低下させる方法であって、第2の薬物と共に式Iの化合物を投与することを含む方法が提供される。幾つかの実施形態では、免疫媒介性疾患又は状態は、自己免疫疾患、炎症プロセス、移植拒絶反応、及びアレルギー反応からなる群から選択される。幾つかの実施形態では、免疫媒介性疾患又は状態は、乾癬、扁平苔癬、及び他の丘疹鱗屑疾患から選択される。幾つかの実施形態では、免疫媒介性疾患又は状態は、湿疹及び皮膚炎から選択される。幾つかの実施形態では、湿疹(eczemea)又は皮膚炎は、湿疹、アトピー性湿疹、脂漏性皮膚炎、及び汗疱から選択される。幾つかの実施形態では、免疫媒介性疾患又は状態は、日光に対する皮膚反応である。幾つかの実施形態では、免疫媒介性疾患又は状態は、非特異的皮層刺激及び昆虫刺傷から選択される。幾つかの実施形態では、免疫媒介性疾患又は状態は、じんま疹である。幾つかの実施形態では、免疫媒介性疾患又は状態は、原発性皮膚腫瘍(例えば、黒色腫);関節リウマチ(自己免疫性及び感染誘発性の両方);クローン病;炎症性腸疾患;過敏性腸症候群;神経変性疾患(例えば、多発性硬化症);パーキンソン病;移植片対宿主反応;重症乾癬;及びアトピー性皮膚炎からなる群から選択される。幾つかの実施形態では、式Iの化合物は、化学療法薬の毒性効果を低減するために、化学療法薬と共に投与される。幾つかの実施形態では、化合物は、式I−1の化合物である。幾つかの実施形態では、化合物は、式I−2の化合物である。幾つかの実施形態では、化合物は、式I−3の化合物である。幾つかの実施形態では、化合物は、式I−4の化合物である。幾つかの実施形態では、化合物は、式I−5の化合物である。幾つかの実施形態では、化合物は、式I−6の化合物である。幾つかの実施形態では、化合物は、式I−7の化合物である。幾つかの実施形態では、化合物は、式I−8の化合物である。幾つかの実施形態では、化合物は、式I−Aの化合物である。幾つかの実施形態では、化合物は、式I−Bの化合物である。幾つかの実施形態では、化合物は、式I−Cの化合物である。幾つかの実施形態では、化合物は、式I−Dの化合物である。幾つかの実施形態では、化合物は、式I−Eの化合物である。幾つかの実施形態では、化合物は、式I−Fの化合物である。幾つかの実施形態では、化合物は、式I−Gの化合物である。幾つかの実施形態では、化合物は、式I−Hの化合物である。幾つかの実施形態では、化合物は、式I−Jの化合物である。幾つかの実施形態では、化合物は、式I−Kの化合物である。幾つかの実施形態では、化合物は、式I−Lの化合物である。幾つかの実施形態では、化合物は、式I−Mの化合物である。幾つかの実施形態では、化合物は、式I−Nの化合物である。幾つかの実施形態では、化合物は、式I−Oの化合物である。幾つかの実施形態では、化合物は、式I−Pの化合物である。
【0047】
また、本発明の実施形態によると、(a)患者の免疫応答を抑制するか、(b)患者の免疫媒介性疾患又は状態を治療又は予防するか、又は(c)第2の薬物の毒性特性を低下させるための式Iの化合物及び化合物を使用するための説明書を含むキットが提供される。幾つかの実施形態では、免疫応答は、炎症である。幾つかの実施形態では、免疫応答は、移植拒絶反応である。幾つかの実施形態では、免疫媒介性疾患又は状態は、自己免疫疾患、炎症プロセス、移植拒絶反応、及びアレルギー反応からなる群から選択される。幾つかの実施形態では、免疫媒介性疾患又は状態は、乾癬、扁平苔癬、及び他の丘疹鱗屑疾患から選択される。幾つかの実施形態では、免疫媒介性疾患又は状態は、湿疹及び皮膚炎から選択される。幾つかの実施形態では、湿疹又は皮膚炎は、湿疹、アトピー性湿疹、脂漏性皮膚炎、及び汗疱から選択される。幾つかの実施形態では、免疫媒介性疾患又は状態は、日光に対する皮膚反応である。幾つかの実施形態では、免疫媒介性疾患又は状態は、非特異的皮層刺激及び昆虫刺傷から選択される。幾つかの実施形態では、免疫媒介性疾患又は状態は、じんま疹である。幾つかの実施形態では、免疫媒介性疾患又は状態は、原発性皮膚腫瘍(例えば、黒色腫);関節リウマチ(自己免疫性及び感染誘発性の両方);クローン病;炎症性腸疾患;過敏性腸症候群;神経変性疾患(例えば、多発性硬化症);パーキンソン病;移植片対宿主反応;重症乾癬;及びアトピー性皮膚炎からなる群から選択される。幾つかの実施形態では、説明書には、化学療法薬の毒性効果を低減するために、式Iの化合物を化学療法薬と共に投与することが指示されている。幾つかの実施形態では、化合物は、式I−1の化合物である。幾つかの実施形態では、化合物は、式I−2の化合物である。幾つかの実施形態では、化合物は、式I−3の化合物である。幾つかの実施形態では、化合物は、式I−4の化合物である。幾つかの実施形態では、化合物は、式I−5の化合物である。幾つかの実施形態では、化合物は、式I−6の化合物である。幾つかの実施形態では、化合物は、式I−7の化合物である。幾つかの実施形態では、化合物は、式I−8の化合物である。幾つかの実施形態では、化合物は、式I−Aの化合物である。幾つかの実施形態では、化合物は、式I−Bの化合物である。幾つかの実施形態では、化合物は、式I−Cの化合物である。幾つかの実施形態では、化合物は、式I−Dの化合物である。幾つかの実施形態では、化合物は、式I−Eの化合物である。幾つかの実施形態では、化合物は、式I−Fの化合物である。幾つかの実施形態では、化合物は、式I−Gの化合物である。幾つかの実施形態では、化合物は、式I−Hの化合物である。幾つかの実施形態では、化合物は、式I−Jの化合物である。幾つかの実施形態では、化合物は、式I−Kの化合物である。幾つかの実施形態では、化合物は、式I−Lの化合物である。幾つかの実施形態では、化合物は、式I−Mの化合物である。幾つかの実施形態では、化合物は、式I−Nの化合物である。幾つかの実施形態では、化合物は、式I−Oの化合物である。幾つかの実施形態では、化合物は、式I−Pの化合物である。
【0048】
また、本発明の実施形態によると、式Iの化合物を製造する方法であって、式II−1、II−2、II−3、又はII−4を有する化合物を環化して、対応する式Iの化合物にすることを含む方法が提供され、式中、R、R’、R’’、R’’’、R3、R4、k、m、n、及びpは、式Iで定義された通りである(以下、式IIの化合物と総称する):
【0049】
【化25】

II−1
【0050】
【化26】

II−2
【0051】
【化27】

II−3
【0052】
【化28】

II−4
幾つかの実施形態では、この方法は、式II−1、II−2、II−3、又はII−4の化合物を合成することを更に含む。幾つかの実施形態では、式II−1、II−2、II−3、又はII−4の化合物は、固相合成により形成される。
【0053】
また、本発明の実施形態によると、式II−1、II−2、II−3、及びII−4の化合物それ自体、並びにこれら化合物の保護型(例えば、N末端アミノ基又は側鎖アミノ基等の1つ又は複数のアミノ基が、例えば、tert−ブトキシカルボニルにより保護されている)及び固相レジンに結合されている場合は、保護又は非保護形態のこれら化合物が提供される。以下では、別様に指定されていない限り又は所与の状況において非論理的でない限り、式IIの化合物又はその亜属または亜種を参照する場合、そのような参照は、(a)(i)少なくとも部分的に保護されているか、又は(a)(ii)完全に非保護又は脱保護されている形態の化合物;(b)(i)レジンに(1)直接的に又は(2)リンカーを介して結合されているか、又は(b)(ii)レジンに結合されない形態の化合物;又は条件(a)及び(b)の組み合わせを含むことが意図されている。更に、本明細書に示される場合、便宜性のため、遊離非保護直鎖ペプチドは、中性分子として、即ちN末端にH2N−及びC末端基に−COOHを有する分子として示される。しかしながら、これらの部分並びに任意のイオン化可能な側鎖部分(例えば、側鎖のカルボン酸又はアミン部分)の実際の電荷は、周囲のpHに依存し、必ずしも示されている通りになるわけではないことが理解されるだろう。
【0054】
幾つかの実施形態では、式IIの化合物は、以下のものからなる群から選択される:
【0055】
【化29】

II−4−a (H−Pro−β3hoPhe−Phe−Pro−OH)、
【0056】
【化30】

II−1−a (H−Pro−Pro−β3hoPhe−Phe−OH)、
【0057】
【化31】

II−2−a (H2N−Phe−Pro−Pro−β3hoPhe−OH)、
【0058】
【化32】

II−3−a (H2N−β3hoPhe−Phe−Pro−Pro−OH)、
【0059】
【化33】

II−4−b (H−Pro−Pro−Phe−β3hoPhe−OH)、
【0060】
【化34】

II−1−b (H−Pro−Pro−Phe−β3hoPhe−OH)、
【0061】
【化35】

II−2−b (H2N−β3hoPhe−Pro−Pro−Phe−OH)、
【0062】
【化36】

II−3−b (H2N−Phe−β3hoPhe−Pro−Pro−OH)、
【0063】
【化37】

II−4−c (H−Pro−β3hoPhe−β3hoPhe−Pro−OH)、
【0064】
【化38】

II−l−c (H−Pro−Pro−β3hoPhe−β3hoPhe−OH)、
【0065】
【化39】

II−2−c (H2N−β3hoPhe−Pro−Pro−β3hoPhe−OH)、
【0066】
【化40】

II−3−c (H2N−β3hoPhe−β3hoPhe−Pro−Pro−−OH)、
【0067】
【化41】

II−4−d (H−Pro−Pro−β3hoPhe−Trp−OH)、
【0068】
【化42】

II−1−d (H−Pro−Pro−β3hoPhe−Trp−OH)、
【0069】
【化43】

II−2−d (H−Pro−Pro−β3hoPhe−Trp−OH)、
【0070】
【化44】

II−3−d (H2N−β3hoPhe−Trp−Pro−Pro−OH)、
【0071】
【化45】

II−4−e (H−Pro−β3hoPhe−Tyr−Pro−OH)、
【0072】
【化46】

II−1−e (H−Pro−Pro−β3hoPhe−Tyr−OH)、
【0073】
【化47】

II−2−e (H2N−Tyr−Pro−Pro−β3hoPhe−OH)、
【0074】
【化48】

II−3−e (H2N−β3hoPhe−Tyr−Pro−Pro−OH)、
【0075】
【化49】

II−4−f (H−Pro−β3hoPhe−Tyr(t−Bu)−Pro−OH)、
【0076】
【化50】

II−1−f (H−Pro−Pro−β3hoPhe−Tyr(t−Bu)−OH)、
【0077】
【化51】

II−2−f (H2N−Tyr(t−Bu)−Pro−Pro−β3hoPhe−OH)、
【0078】
【化52】

II−3−f (H2N−β3hoPhe−Tyr(t−Bu)−Pro−Pro−OH)、
【0079】
【化53】

II−4−g (H−Pip−β3hoPhe−Phe−Pro−OH)、
【0080】
【化54】

II−1−g (H−Pro−Pip−β3hoPhe−Phe−OH)、
【0081】
【化55】

II−2−g (H2N−Phe−Pro−Pip−β3hoPhe−OH)、
【0082】
【化56】

II−3−g (H2N−β3hoPhe−Phe−Pro−Pip−OH)、
【0083】
【化57】

II−4−h (H−Hyp−β3hoPhe−Phe−Pro−OH)、
【0084】
【化58】

II−1−h (H−Pro−Hyp−β3hoPhe−Phe−OH)、
【0085】
【化59】

II−2−h (H2N−Phe−Pro−Hyp−β3hoPhe−OH)、及び
【0086】
【化60】

II−3−h (H2N−β3hoPhe−Phe−Pro−Hyp−OH)。
幾つかの実施形態では、化合物は、式II−4−aの化合物である。幾つかの実施形態では、化合物は、式II−1−aの化合物である。幾つかの実施形態では、化合物は、式II−2−aの化合物である。幾つかの実施形態では、化合物は、式II−3−aの化合物である。幾つかの実施形態では、化合物は、式II−4−bの化合物である。幾つかの実施形態では、化合物は、式II−1−bの化合物である。幾つかの実施形態では、化合物は、式II−2−bの化合物である。幾つかの実施形態では、化合物は、式II−3−bの化合物である。幾つかの実施形態では、化合物は、式II−4−cの化合物である。幾つかの実施形態では、化合物は、式II−1−cの化合物である。幾つかの実施形態では、化合物は、式II−2−cの化合物である。幾つかの実施形態では、化合物は、式II−3−cの化合物である。幾つかの実施形態では、化合物は、式II−4−dの化合物である。幾つかの実施形態では、化合物は、式II−1−dの化合物である。幾つかの実施形態では、化合物は、式II−2−dの化合物である。幾つかの実施形態では、化合物は、式II−3−dの化合物である。幾つかの実施形態では、化合物は、式II−4−eの化合物である。幾つかの実施形態では、化合物は、式II−1−eの化合物である。幾つかの実施形態では、化合物は、式II−2−eの化合物である。幾つかの実施形態では、化合物は、式II−3−eの化合物である。幾つかの実施形態では、化合物は、式II−4−fの化合物である。幾つかの実施形態では、化合物は、式II−1−fの化合物である。幾つかの実施形態では、化合物は、式II−2−fの化合物である。幾つかの実施形態では、化合物は、式II−3−fの化合物である。幾つかの実施形態では、化合物は、式II−4−gの化合物である。幾つかの実施形態では、化合物は、式II−1−gの化合物である。幾つかの実施形態では、化合物は、式II−2−gの化合物である。幾つかの実施形態では、化合物は、式II−3−gの化合物である。幾つかの実施形態では、化合物は、式II−4−hの化合物である。幾つかの実施形態では、化合物は、式II−1−hの化合物である。幾つかの実施形態では、化合物は、式II−2−hの化合物である。幾つかの実施形態では、化合物は、式II−3−hの化合物である。
【0087】
幾つかの実施形態では、式IIの化合物は、以下のものからなる群から選択される:
【0088】
【化61】

II−A−1、
【0089】
【化62】

II−A−2、
【0090】
【化63】

II−A−3、
【0091】
【化64】

II−A−4、
【0092】
【化65】

II−B−1、
【0093】
【化66】

II−B−2、
【0094】
【化67】

II−B−3、
【0095】
【化68】

II−B−4、
【0096】
【化69】

II−C−1、
【0097】
【化70】

II−C−2、
【0098】
【化71】

II−C−3、
【0099】
【化72】

II−C−4、
【0100】
【化73】

II−D−1、
【0101】
【化74】

II−D−2、
【0102】
【化75】

II−D−3、
【0103】
【化76】

II−D−4、
【0104】
【化77】

II−E−1、
【0105】
【化78】

II−E−2、
【0106】
【化79】

II−E−3、
【0107】
【化80】

II−E−4、
【0108】
【化81】

II−F−1、
【0109】
【化82】

II−F−2、
【0110】
【化83】

II−F−3、
【0111】
【化84】

II−F−4、
【0112】
【化85】

II−G−1、
【0113】
【化86】

II−G−2、
【0114】
【化87】

II−G−3、
【0115】
【化88】

II−G−4、
【0116】
【化89】

II−H−1、
【0117】
【化90】

II−H−2、
【0118】
【化91】

II−H−3、
【0119】
【化92】

II−H−4、
【0120】
【化93】

II−J−1、
【0121】
【化94】

II−J−2、
【0122】
【化95】

II−J−3、
【0123】
【化96】

II−J−4、
【0124】
【化97】

II−K−1、
【0125】
【化98】

II−K−2、
【0126】
【化99】

II−K−3、
【0127】
【化100】

II−K−4、
【0128】
【化101】

II−L−1、
【0129】
【化102】

II−L−2、
【0130】
【化103】

II−L−3、
【0131】
【化104】

II−L−4、
【0132】
【化105】

II−M−1、
【0133】
【化106】

II−M−2、
【0134】
【化107】

II−M−3、
【0135】
【化108】

II−M−4、
【0136】
【化109】

II−N−1、
【0137】
【化110】

II−N−2、
【0138】
【化111】

II−N−3、
【0139】
【化112】

II−N−4、
【0140】
【化113】

II−O−1、
【0141】
【化114】

II−O−2、
【0142】
【化115】

II−O−3、
【0143】
【化116】

II−O−4、
【0144】
【化117】

II−P−1、
【0145】
【化118】

II−P−2、
【0146】
【化119】

II−P−3、及び
【0147】
【化120】

II−P−4。
【0148】
幾つかの実施形態では、化合物は、式II−A−1の化合物である。幾つかの実施形態では、化合物は、式II−A−2の化合物である。幾つかの実施形態では、化合物は、式II−A−3の化合物である。幾つかの実施形態では、化合物は、式II−A−4の化合物である。幾つかの実施形態では、化合物は、式II−B−1の化合物である。幾つかの実施形態では、化合物は、式II−B−2の化合物である。幾つかの実施形態では、化合物は、式II−B−3の化合物である。幾つかの実施形態では、化合物は、式II−B−4の化合物である。幾つかの実施形態では、化合物は、式II−C−1の化合物である。幾つかの実施形態では、化合物は、式II−C−2の化合物である。幾つかの実施形態では、化合物は、式II−C−3の化合物である。幾つかの実施形態では、化合物は、式II−C−4の化合物である。幾つかの実施形態では、化合物は、式II−D−1の化合物である。幾つかの実施形態では、化合物は、式II−D−2の化合物である。幾つかの実施形態では、化合物は、式II−D−3の化合物である。幾つかの実施形態では、化合物は、式II−D−4の化合物である。幾つかの実施形態では、化合物は、式II−E−1の化合物である。幾つかの実施形態では、化合物は、式II−E−2の化合物である。幾つかの実施形態では、化合物は、式II−E−3の化合物である。幾つかの実施形態では、化合物は、式II−E−4の化合物である。幾つかの実施形態では、化合物は、式II−F−1の化合物である。幾つかの実施形態では、化合物は、式II−F−2の化合物である。幾つかの実施形態では、化合物は、式II−F−3の化合物である。幾つかの実施形態では、化合物は、式II−F−4の化合物である。幾つかの実施形態では、化合物は、式II−G−1の化合物である。幾つかの実施形態では、化合物は、式II−G−2の化合物である。幾つかの実施形態では、化合物は、式II−G−3の化合物である。幾つかの実施形態では、化合物は、式II−G−4の化合物である。幾つかの実施形態では、化合物は、式II−H−1の化合物である。幾つかの実施形態では、化合物は、式II−H−2の化合物である。幾つかの実施形態では、化合物は、式II−H−3の化合物である。幾つかの実施形態では、化合物は、式II−H−4の化合物である。幾つかの実施形態では、化合物は、式II−J−1の化合物である。幾つかの実施形態では、化合物は、式II−J−2の化合物である。幾つかの実施形態では、化合物は、式II−J−3の化合物である。幾つかの実施形態では、化合物は、式II−J−4の化合物である。幾つかの実施形態では、化合物は、式II−K−1の化合物である。幾つかの実施形態では、化合物は、式II−K−2の化合物である。幾つかの実施形態では、化合物は、式II−K−3の化合物である。幾つかの実施形態では、化合物は、式II−K−4の化合物である。幾つかの実施形態では、化合物は、式II−L−1の化合物である。幾つかの実施形態では、化合物は、式II−L−2の化合物である。幾つかの実施形態では、化合物は、式II−L−3の化合物である。幾つかの実施形態では、化合物は、式II−L−4の化合物である。幾つかの実施形態では、化合物は、式II−M−1の化合物である。幾つかの実施形態では、化合物は、式II−M−2の化合物である。幾つかの実施形態では、化合物は、式II−M−3の化合物である。幾つかの実施形態では、化合物は、式II−M−4の化合物である。幾つかの実施形態では、化合物は、式II−N−1の化合物である。幾つかの実施形態では、化合物は、式II−N−2の化合物である。幾つかの実施形態では、化合物は、式II−N−3の化合物である。幾つかの実施形態では、化合物は、式II−N−4の化合物である。幾つかの実施形態では、化合物は、式II−O−1の化合物である。幾つかの実施形態では、化合物は、式II−O−2の化合物である。幾つかの実施形態では、化合物は、式II−O−3の化合物である。幾つかの実施形態では、化合物は、式II−O−4の化合物である。幾つかの実施形態では、化合物は、式II−P−1の化合物である。幾つかの実施形態では、化合物は、式II−P−2の化合物である。幾つかの実施形態では、化合物は、式II−P−3の化合物である。幾つかの実施形態では、化合物は、式II−P−4の化合物である。
【0149】
式Iの化合物は、免疫抑制活性及び/又は抗炎症活性を示し、同時に幾つかの公知の化合物よりも低い毒性を示すことが見いだされた。したがって、式Iの化合物は、免疫抑制剤及び/又は抗炎症剤として有用であり得る。本明細書で使用される場合、用語「免疫媒介性」は、身体の免疫系が過剰反応する及び/又は身体を攻撃する疾患又は状態を指す。
【0150】
本明細書の全体にわたって、用語及び置換基は、それらの定義を保持する。
【0151】
「アルキル」は、直鎖、分岐鎖、又は環式飽和炭化水素構造、及びそれらの組み合わせを含むことが意図されている。低級アルキルは、1〜6個の炭素原子のアルキル基を指す。低級アルキル基の例には、メチル、エチル、プロピル、イソプロピル、ブチル、並びにs−及びt−ブチル等が含まれる。好ましいアルキル基は、C20以下のものである。シクロアルキルは、アルキルのサブセットであり、3〜8個の炭素原子の環式炭化水素基が含まれる。シクロアルキル基の例には、c−プロピル、c−ブチル、c−ペンチル、及びノルボルニル等が含まれる。
【0152】
C1〜C20の炭化水素には、アルキル、シクロアルキル、ポリシクロアルキル、アルケニル、アルキニル、アリール、及びそれらの組み合わせが含まれる。例には、ベンジル、フェネチル、シクロヘキシルメチル、カンホリル、及びナフチルエチルが含まれる。用語「炭素環」は、完全に炭素からなるが、任意の酸化状態からなる環系を含むことが意図される。したがって、(C3〜C10)炭素環は、シクロプロパン、ベンゼン、及びシクロヘキセン等の系を指し、(C8〜C12)炭素多環は、ノルボルナン、デカリン、インダン、及びナフタレン等の系を指す。
【0153】
アルコキシ又はアルコキシルは、酸素原子により親構成に結合された、直鎖、分岐鎖、環式配置、及びそれらの組み合わせの1〜8個の炭素原子の基を指す。例には、メトキシ、エトキシ、プロポキシ、イソプロポキシ、シクロプロピルオキシ、及びシクロヘキシルオキシ等が含まれる。低級アルコキシは、1〜4個の炭素を含有する基を指す。
【0154】
オキサアルキルは、1個又は複数の炭素が酸素により置換されているアルキル残基を指す。例には、メトキシプロポキシ、及び3,6,9−トリオキサデシル等が含まれる。
【0155】
アシルは、カルボニル官能基により親構成に結合された、直鎖、分岐鎖、環式配置、飽和、不飽和、及び芳香族、並びにそれらの組み合わせの1〜8個の炭素原子の基を指す。アシル残基の1個又は複数の炭素は、親構造との結合点が依然としてカルボニル基である限り、窒素、酸素、又は硫黄により置換されていてもよい。例には、アセチル、ベンゾイル、プロピオニル、イソブチリル、t−ブトキシカルボニル、及びベンジルオキシカルボニル等が含まれる。低級アシルは、1〜4個の炭素を含有する基を指す。
【0156】
アリールは、6員芳香族環、二環式9または10員芳香族環系、又は三環式13または14員芳香族環系を意味する。芳香族6員〜14員炭素環には、例えば、ベンゼン、ナフタレン、インダン、テトラリン、及びフルオレンが含まれる。
【0157】
へテロアリールは、O、N、またはSから選択される1〜3個のヘテロ原子を含有する5または6員ヘテロ芳香族環;O、N、またはSから選択される1〜3個のヘテロ原子を含有する二環式9または10員ヘテロ芳香族環系;又はO、N、またはSから選択される1〜3個のヘテロ原子を含有する三環式13または14員ヘテロ芳香族環系を意味する。5〜10員芳香族複素環には、例えば、イミダゾール、ピリジン、インドール、チオフェン、ベンゾピラノン、チアゾール、フラン、ベンズイミダゾール、キノリン、イソキノリン、キノキサリン、ピリミジン、ピラジン、テトラゾール、及びピラゾールが含まれる。
【0158】
アリールアルキルは、アリール残基がアルキルにより親構造に結合されている置換基を指す。例は、ベンジル及びフェネチル等である。へテロアリールアルキルは、へテロアリール残基がアルキルにより親構造に結合されている置換基を指す。例には、ピリジニルメチル及びピリミジニルエチル等が含まれる
【0159】
ヘテロ環は、1〜3個の炭素が、N、O、及びSからなる群から選択されるヘテロ原子により置換されているシクロアルキル又はアリール残基を意味する。窒素及び硫黄ヘテロ原子は、随意に酸化されていてもよく、窒素ヘテロ原子は、随意に四級化されていてもよい。ヘテロ環の例には、ピロリジン、ピラゾール、ピロール、インドール、キノリン、イソキノリン、テトラヒドロイソキノリン、ベンゾフラン、ベンゾジオキサン、ベンゾジオキソール(置換基として生じる場合、一般的にはメチレンジオキシフェニルと呼ばれる)、テトラゾール、モルホリン、チアゾール、ピリジン、ピリダジン、ピリミジン、チオフェン、フラン、オキサゾール、オキサゾリン、イソオキサゾール、ジオキサン、及びテトラヒドロフラン等が含まれる。へテロアリールは、ヘテロ環が芳香族であるヘテロ環のサブセットであることに留意すべきである。ヘテロシクリル残基の例には、以下のものが更に含まれる:ピペラジニル、2−オキソピペラジニル、2−オキソピペリジニル、2−オキソ−ピロリジニル、2−オキソアゼピニル、アゼピニル、4−ピペリジニル、ピラゾリジニル、イミダゾリル、イミダゾリニル、イミダゾリジニル、ピラジニル、オキサゾリジニル、イソオキサゾリジニル、チアゾリジニル、イソチアゾリル、キヌクリジニル、イソチアゾリジニル、ベンズイミダゾリル、チアジアゾリル、ベンゾピラニル、ベンゾチアゾリル、テトラヒドロフリル、テトラヒドロピラニル、チエニル、ベンゾチエニル、チアモルホリニル、チアモルホリニルスルホキシド、チアモルホリニルスルホン、オキサジアゾリル、トリアゾリル、及びテトラヒドロキノリニル。
【0160】
置換アルキル、アリール、シクロアルキル、ヘテロシクリル等は、各残基の最大3個のH原子が、アルキル、ハロゲン、ハロアルキル、ヒドロキシ、低級アルコキシ、カルボキシ、カルボアルコキシ(アルコキシカルボニルとも呼ばれる)、カルボキサミド(アルキルアミノカルボニルとも呼ばれる)、シアノ、カルボニル、ニトロ、アミノ、アルキルアミノ、ジアルキルアミノ、メルカプト、アルキルチオ、スルホキシド、スルホン、アシルアミノ、アミジノ、フェニル、ベンジル、へテロアリール、フェノキシ、ベンジルオキシ、又はヘテロアリールオキシで置換されているアルキル、アリール、シクロアルキル、又はヘテロシクリルを指す。
【0161】
用語「ハロゲン」は、フッ素、塩素、臭素、又はヨウ素を意味する。
【0162】
以下の略語及び用語は、全体にわたって、示されている意味を有する:
Boc=t−ブチルオキシカルボニル
c−=シクロ
DCM=ジクロロメタン=塩化メチレン=CH2Cl2
DIEA=N,N−ジイソプロピルエチルアミン
DIPEA=ジイソプロピルエチルアミン
DMF=N,N−ジメチルホルムアミド
Fmoc=9−フルオレニルメトキシカルボニル
HATU=O−(7−アザベンゾトリアゾール−1−イル)−1,1,3,3−テトラメチルウロニウムヘキサフルオロホスファート
HBTU=O−(ベンゾトリアゾール−1−イル)−1,1,3,3−テトラメチルウロニウムヘキサフルオロホスファート
HOAc=酢酸
HOAt=1−ヒドロキシ−7−アザベンゾトリアゾール
HOBt=1−ヒドロキシベンゾトリアゾール
Hyp=4−ヒドロキシプロリン
Me=メチル
Pip=ピペコリン酸
Phe=フェニルアラニン
Pro=プロリン
PyBOP=O−(ベンゾトリアゾール−1−イル)−トリスピロリジンホスホニウムヘキサフルオロホスファート
rt=室温
TBTU=O−(ベンゾトリアゾール−1−イル)−1,1,3,3−テトラメチルウロニウムテトラフルオロボラート
TFA=トリフルオロ酢酸
t−Hyp=trans−4−ヒドロキシプロリン
Trp=トリプトファン
Tyr=チロシン
Tyr(tBu)=(O−tert−ブチル)チロシン
【0163】
更に、有機化学者(つまり、当業者)が使用する略語の総合的リストは、Journal of Organic Chemistryの各巻の最初の号に掲載されている。このリストは、典型的には「標準的略語リスト」という題名の表に示されており、参照により本明細書中に組み込まれる。加えて、更なるメチレン基が骨格に存在する非天然アミノ酸に関して、「β3−Ho−」(又は「ベータ3−ホモ」)という表記は、本明細書では、側鎖を保持する炭素原子と末端窒素原子との間の骨格に追加のメチレン(−CH2−)を有するアミノ酸を指すために使用され、「β2−Ho−」(又は「ベータ2−ホモ」)という表記は、本明細書では、側鎖を保持する炭素原子と末端炭素原子との間の骨格に追加のメチレンを有するアミノ酸を指すために使用される。
【0164】
本発明の実施形態には、塩、特に酸付加塩の形態の式Iの化合物が含まれる。好適な塩には、有機酸及び無機酸の両方と形成されるものが含まれる。そのような酸付加塩は、通常は薬学的に許容されるだろうが、薬学的に許容される塩ではない塩が、目的化合物の調製及び精製に有用である場合がある。したがって、好ましい塩には、塩酸、臭化水素酸、硫酸、クエン酸、酒石酸、リン酸、乳酸、ピルビン酸、酢酸、コハク酸、シュウ酸、フマル酸、マレイン酸、オキサロ酢酸、メタンスルホン酸、エタンスルホン酸、p−トルエンスルホン酸、ベンゼンスルホン酸、及びイセチオン酸が含まれる。式Iの化合物の塩は、遊離塩基の形態の適切な化合物を適切な酸と反応させることにより製造することができる。
【0165】
本発明の実施形態によると、式Iの化合物は、環式テトラペプチドである。これらペプチドの合成は、それら自体が当技術分野で公知の方法を使用して合成される対応する直鎖ペプチドを環化することにより達成することができる。例えば、以下の文献を参照されたい:Merrifield、J.Am.Chem.Soc、85巻:2149頁(1964年);Houghten、Proc.Natl.Acad.Sci.USA、82巻:5132頁(1985年);Kelley & Winkler in Genetic Engineering Principles and Methods、Setlow,J.K.編、Plenum Press、N.Y.、第12巻、1〜19頁(1990年);Stewart & Young、Solid Phase Peptide Synthesis、Pierce Chemical Co.、Rockford,M.(1984年);Merglerら(1988年)Tetrahedron Letters 29巻:4005〜4008頁;Merglerら(1988年)Tetrahedron Letters 29巻:4009〜4012頁;Kamberら(編)、Peptides,Chemistry and Biology、ESCOM、Leiden(1992年)525〜526頁;Rinikerら(1993年)Tetrahedron Letters 49巻:9307〜9320頁;Lloyd−Williamsら(1993年)Tetrahedron Letters 49巻:11065〜11133頁;Anderssonら(2000年)Biopolymers 55巻:227〜250頁;Bray、Nature Reviews 2巻:587〜593頁(2003年)、米国特許第4,105,603号、第3,972,859号、第3,842,067号、第3,862,925号、第6,015,881号、第6,197,927号、及び第7,439,222号。そのような合成は、当技術分野で公知の液相合成又は固相合成により、又は両方の組み合わせにより達成することができる。
【0166】
液相合成法(溶液相法と呼ばれることがある)では、全て反応が、均一相中で実施される。連続したアミノ酸は、所望のペプチド材料が形成されるまで、溶液中で結合される。合成中、連続したペプチド中間体は、析出及び/又は洗浄により精製される。
【0167】
固相ペプチド合成(SPPS)では、最初のアミノ酸又はペプチド基が、レジン等の不溶性支持体に結合される。連続したアミノ酸又はペプチド基は、目的のペプチド材料が形成されるまで、最初のアミノ酸又はペプチド基に付加される。したがって、固相合成の産物は、不溶性支持体に結合されたペプチドである。その後、SPPS技術により合成されたペプチドは、レジンから切断され、切断されたペプチドは、単離される。
【0168】
より詳しくは、固相合成は、保護アミノ酸を不活性個体支持体に結合させることにより、想定ペプチドのカルボキシ末端から始まる。不活性個体支持体は、最初のアミノ酸のC末端のアンカーとしての役目を果たすことができれば、いかなる巨大分子であってもよい。典型的には、巨大分子支持体は、Stewart & Young、上記の2頁及び4頁の図1−1及び1−2に示されている架橋ポリマーレジン(例えば、ポリアミド又はポリスチレンレジン)である。幾つかの場合では、C末端アミノ酸は、ポリスチレンレジンに結合され、ベンジルエステルを形成する。巨大分子支持体は、ペプチドアンカー結合が、ペプチド合成中に保護アミノ酸のα−アミノ基を脱保護するのに使用される条件下で安定しているように選択される。塩基解離性のα保護基が使用される場合、ペプチドと個体支持体との間には酸解離性の結合を使用することが望ましい。例えば、上記のStewart & Young、16頁に記載のように、酸解離性エーテルレジンは、塩基解離性Fmocアミノ酸ペプチド合成に効果的である。或いは、酸分解に対して特異的に解離性があるペプチドアンカー結合及びα保護基を使用することができる。例えば、Stewart & Young、上記の11〜12頁に記載のように、フェニルアセトアミドメチル(Pam)レジン等のアミノメチルレジンは、Boc−アミノ酸ペプチド合成と共に良好に機能する。Guillerら、Chem Rev.2000年、100巻、2091〜2157頁には、ペプチド合成をはじめとする固相有機合成及びコンビナトリアルケミストリーにおけるリンカー及び切断戦略が概説されている。
【0169】
最初のアミノ酸を不活性固体支持体に結合した後、最初のアミノ酸のα−アミノ保護基を、例えば塩化メチレン中でトリフルオロ酢酸(TFA)により除去し、例えばトリエチルアミン(TEA)で中和する。最初のアミノ酸のα−アミノ基を脱保護した後、合成における次のα−アミノ及び側鎖が保護されたアミノ酸を付加する。その後、残りのα−アミノ及び必要に応じて側鎖が保護されたアミノ酸を、縮合により所望の順序で順次結合させて、固体支持体に結合された中間化合物を得る。或いは、幾つかのアミノ酸を互いに結合させて所望のペプチドの断片を形成し、その後そのペプチド断片を、伸長する固相ペプチド鎖に付加してもよい。
【0170】
2つのアミノ酸間の、又はアミノ酸とペプチドとの、又はペプチドとペプチドとの縮合反応は、アキシド(axide)法、混合酸無水物法、DCC(N,N’−ジシクロヘキシルカルボジイミド)又はDIC(N,N’−ジイソプロピルカルボジイミド)法、活性エステル法、p−ニトロフェニルエステル法、BOP(ベンゾトリアゾール−1−イル−オキシ−トリス[ジメチルアミノ]ホスホニウムヘキサフルオロホスファート)法、N−ヒドロキシコハク酸イミドエステル法等、及びウッドワード試薬K法等の通常の縮合反応により実施することができる。
【0171】
ペプチドの化学的合成においては、アミノ酸のあらゆる反応性側鎖基を好適な保護基で保護するのが一般的である。最終的に、これら保護基は、所望のポリペプチド鎖が順次構築された後、除去される。また、アミノ酸又はペプチド断片のα−アミノ基を保護するのが一般的であるが、アミノ酸又はペプチド断片のC末端カルボキシ基を、伸長する固相ポリペプチド鎖の遊離N末端基アミノ基と反応させ、その後α−アミノ保護基を選択的に除去して、次のアミノ酸又はペプチド断片の固相ポリペプチド鎖への付加を可能にする。したがって、ポリペプチド合成においては、個々の残基が側鎖保護基を依然として担持しているペプチド鎖に所望の配列で配置されている各々のアミノ酸残基を含有する中間化合物が生産されるのが一般的である。固相から取り外した後、これら保護基を実質的に同時に除去して、所望のポリペプチド産物を生産することができる。
【0172】
α−及びω−アミノ側鎖は、以下のもので保護することができる:例えば、ベンジルオキシカルボニル(Zと略される)、イソニコチニルオキシカルボニル(iNoc)、o−クロロベンジルオキシカルボニル[Z(2Cl)又は2−Cl−Z]、p−ニトロベンジルオキシカルボニル[Z(NO2)]、p−メトキシベンジルオキシカルボニル[Z(OMe)]、t−ブトキシ−カルボニル(Boc)、t−アミルオキシカルボニル(Aoc)、イソボルニルオキシカルボニル、アダマンチルオキシ−カルボニル(Adoc)、2−(4−ビフェニル)−2−プロピルオキシカルボニル(Bpoc)、9−フルオレニルメトキシカルボニル(Fmoc)、メチルスルホニエトキシカルボニル(methylsulfonyethoxycarbonyl)(Msc)、トリフルオロアセチル、フタリル(Pht)、ホルミル(For)、2−ニトロ−フェニルスルフェニル(phenylsulphenyl)(Nps)、ジフェニルホスフィノチオイル(Ppt)、及びジメチルホスフィノチオイル(Mpt)基等。側鎖保護基の更なる例には、以下のものが含まれる:アセチル(Ac)、ベンゾイル(Bz)、tert−ブチル(t−Bu)、トリフェニルメチル(トリチル、Trt)、テトラヒドロピラニル、ベンジル(Bzl)、2,6−ジクロロベンジル、ニトロ、p−トルエンスルホニル(Tos)、キサンチル(Xan)、ベンジル、メチル、エチル、及びt−ブチルエステル、及び芳香族又は脂肪族ウレタン型保護基、ニトロベラトリルオキシカルボニル(Nvoc)等の感光性基、及びトリメチルシリルエチルオキシカルボニル(TEOC)等のフルオリド解離性基。
【0173】
アミノ末端保護基(本明細書では、N末端基保護基とも呼ばれる)の例には、以下のものが含まれる:(1)ホルミル、アクリリル(Acr)、ベンゾイル(Bz)、及びアセチル(Ac)等のアシル型保護基;(2)ベンジルオキシ−カルボニル(Z)、及びp−クロロベンジルオキシカルボニル、p−ニトロベンジルオキシカルボニル、p−ブロモベンジルオキシカルボニル、p−メトキシベンジルオキシカルボニル等の置換Z等の芳香族ウレタン型保護基;(3)t−ブチルオキシカルボニル(BOC)、ジイソプロピルメトキシカルボニル、イソプロピルオキシカルボニル、エトキシカルボニル、アリルオキシカルボニル等の脂肪族ウレタン保護基;(4)9−フルオレニル−メチルオキシカルボニル(Fmoc)、シクロペンチルオキシカルボニル、アダマンチルオキシカルボニル、及びシクロヘキシルオキシカルボニル等のシクロアルキルウレタン型保護基;及び(5)フェニルチオカルボニル等のチオウレタン型保護基。好ましい保護基には、9−フルオレニルメチルオキシカルボニル(Fmoc)、2−(4−ビフェニリル)−プロピル(2)オキシカルボニル(Bpoc)、2−フェニルプロピル(2)−オキシカルボニル(Poc)、及びt−ブチルオキシカルボニル(Boc)が含まれる。
【0174】
カルボキシ官能基の保護基には、ベンジルエステル(OBzl)、シクロヘキシルエステル(Chx)、4−ニトロベンジルエステル(ONb)、t−ブチルエステル(Obut)、及び4−ピリジルメチルエステル(OPic)等が挙げられる。アミノ及びカルボキシル基以外の官能基を有するアルギニン、システイン、及びセリン等の特定のアミノ酸は、好適な保護基により保護されることが望ましいことが多い。例えば、アルギニンのグアニジノ基は、ニトロ、p−トルエンスルホニル、ベンジルオキシカルボニル、アダマンチルオキシカルボニル、p−メトキシベンゼンスルホニル、4−メトキシ−2,6−ジメチルベンゼンスルホニル(Nds)、及び1,3,5−トリメチルフェニルスルホニル(Mts)等で保護することができる。システインのチオール基は、p−メトキシベンジル及びトリチル等で保護することができる。
【0175】
式Iの化合物を、そのままの化学薬品として投与することが可能であり得るが、医薬組成物としてそれらを提供することが望ましい。更なる態様によると、本発明の実施形態によると、式Iの化合物又はその薬学的に許容される塩または溶媒和物を、1つ又は複数のその薬学的担体及び随意に1つ又は複数の他の治療用成分と共に含む医薬組成物が提供される。担体(複数可)は、製剤の他の成分と適合し、その受容者に有害ではないという意味において「許容」されなければならない。
【0176】
製剤には、経口、非経口(皮下、皮内、筋肉内、静脈内、及び関節内を含む)、直腸、及び局所(皮膚、舌下、頬側、及び眼内を含む)投与に好適なものが含まれる。最も好適な経路は、受容者の状態及び障害に依存する場合がある。製剤は、単位剤形で便利に提供されていてもよく、薬学の技術分野で周知の方法のいずれかにより調製することができる。そのような製剤を製造する方法は、式Iの化合物又はその薬学的に許容される塩または溶媒和物(「活性成分」)を、1つ又は複数の副成分を構成する担体と混合するステップを含む。一般的に、製剤は、活性成分を液体担体又は微粉化された固形担体又はその両方と均一に及び密接に混合し、その後必要に応じて、この産物を所望の製剤に成形することにより調製される。
【0177】
本発明の実施形態による経口投与に好適な製剤は、各々が所定量の有効成分を含有するカプセル剤、カシェ剤、または錠剤等の個別単位として、散剤または顆粒剤として、水性液体または非水性液体中の液剤または懸濁剤として、又は水中油型液体乳剤又は油中水型液体乳剤として、提供されてもよい。また、活性成分は、ボーラス剤、舐剤、又はペースト剤として提供されてもよい。
【0178】
錠剤は、随意に1つ又は複数の副成分と共に圧縮又は成形することにより製造することができる。圧縮錠剤は、結合剤、潤滑剤、不活性希釈剤、潤滑作用剤、界面活性剤、又は分散剤と随意に混合された、散剤又は顆粒剤等の易流動性形態の有効成分を、好適な機械で圧縮することにより調製することができる。成形錠剤は、不活性液体希釈剤で湿潤された粉末化合物の混合物を、好適な機械で成形することにより製造することができる。錠剤は、随意にコーティング又は刻印されていてもよく、その中の活性成分の持続性放出、徐放性放出、又は制御放出を提供するように製剤化されていてもよい。
【0179】
非経口投与用の製剤には、酸化防止剤、緩衝剤、静菌剤、及び製剤を目的受容者の血液と等張性にする溶質を含有していてもよい水性及び非水性の無菌注射溶液が含まれる。また、非経口投与用の製剤には、懸濁化剤及び増粘剤を含んでいてもよい水性及び非水性の無菌懸濁液が含まれる。製剤は、多用量容器、例えば密封アンプル及びバイアルの単位用量で提供されてもよく、使用直前に無菌液体担体、例えば生理食塩水又はリン酸緩衝生理食塩水(PBS)等を添加するだけでよいフリーズドライされた(凍結乾燥された)状態で保存することができる。即時調合注射溶液及び懸濁液は、前述した種類の無菌散剤、顆粒剤、及び錠剤から調製することができる。
【0180】
直腸内投与用の製剤は、カカオ脂又はポリエチレングリコール等の通常の担体と共に坐剤として提供されてもよい。
【0181】
口内、例えば頬側又は舌下での局所投与用の製剤には、スクロース及びアカシア又はトラガカント等の風味基剤中に活性成分を含むトローチ剤、及びゼラチン及びグリセリン又はスクロース及びアカシア等の基剤中に活性成分を含む香錠が含まれる。
【0182】
好ましい単位用量製剤は、以下に列挙するような有効量の又はその適切な割合の活性成分を含有するものである。
【0183】
特に上記で言及した成分に加えて、本発明の実施例による製剤は、目的の製剤のタイプに関して当技術分野で一般的な他の作用剤を含んでいてもよく、例えば、経口投与に好適なものは、香味剤を含んでいてもよいことが理解されるべきである。
【0184】
既に述べたように、本発明の実施形態によると、本発明の実施形態による化合物は、ある疾患又は状態の治療又は予防に使用することができる。用語「予防すること」は、本明細書で使用される場合、薬剤を事前に投与して、攻撃を未然に防ぐか又は鈍化させることを指す。医学分野の当業者(本方法の使用クレームに関しての)は、用語「予防する」は、絶対的な用語でないことを認識する。医学分野では、ある状態の可能性又は重症度を実質的に減少させるための薬物の予防的投与を指すと理解されており、それが、出願人らのクレームで意図されている意味である。読者においては、Physician’s Desk Referenceという本分野での標準的教科書に注意を向けられたい。そこでは、用語「予防する」が何百回も使用されている。医学分野の当業者であれば、この用語を絶対的な意味に解釈しない。同様に、本発明の実施形態による化合物は、免疫応答を抑制するために使用することができると述べられている場合、「抑制する」には、応答の程度を低減することが含まれており、応答を必ずしも絶対的に防止しないことが理解されるだろう。
【0185】
審査では、現在のところクレームから除外されない化合物が、本出願の本発明者らに特許付与することができないとみなされる可能性がある。その場合、出願人のクレームにおける種及び属の除外は、特許審査手続きの結果であり、本発明者らの発明の概念又は記述を反映するものではないとみなされるべきである。本発明は、組成物の態様では、一般に公開されているものを除き、式I及びIIの全ての化合物である。
【0186】
本発明の実施形態は、以下の図面を参照すると、より良好に理解されるだろう。
【図面の簡単な説明】
【0187】
【図1】実施例2に記載の実験から導き出された、耳の厚さの抗原特異的増加を示す図である。
【図2】実施例2に記載の実験で観察された、耳下腺リンパ節中の総細胞数を示す図である。
【図3】実施例2に記載されている、耳下腺リンパ節中の生細胞及び死細胞の含有量を示す図である。
【図4】実施例2に記載されている実験に記載されている流入領域リンパ節中の細胞タイプの数及び関与を示す図である。
【図5】実施例3に記載されている、ヒト血液由来の単核細胞に対する式IAの化合物の毒性を示す図である。
【図6】実施例4に記載されている、ヒツジ赤血球に対するマウスの体液性免疫応答に対する、式IAの化合物の腹腔内投与の効果を示す図である。
【図7】実施例5に記載されている、オボアルブミンに対する細胞性免疫応答に対する、式IAの化合物の腹腔内投与の効果を示す図である。
【図8A】PMBC生存に対する、本発明の実施形態によるペプチドのin vitroでの効果を示す図である。
【図8B】PMBC生存に対する、本発明の実施形態によるペプチドのin vitroでの効果を示す図である。
【図9A】PHA誘導性PBMC増殖に対する、本発明の実施形態によるペプチドのin vitroでの効果を示す図である。
【図9B】PHA誘導性PBMC増殖に対する、本発明の実施形態によるペプチドのin vitroでの効果を示す図である。
【図10A】実施例7に記載されている、抗原負荷に応答した耳の厚さの変化に対する、幾つかの化合物の効果を示す図である。
【図10B】実施例7に記載されている、抗原負荷に応答した耳の厚さの変化に対する、幾つかの化合物の効果を示す図である。
【図11】実施例7に記載されている、エバンスブルー試験での毛細血管の透過性を示す図である。
【図12】実施例7に記載されている、流入領域リンパ節中の総細胞数を示す図である。
【図13】実施例7に記載されている、循環白血球の数に対する化合物の効果を示す図である。
【図14】実施例7に記載されている、様々な場合に存在する白血球のタイプを示す図である。
【図15】実施例7に記載されている、マウス耳介の細胞数及び細胞組成に関する形態測定データを提供する図である。
【発明を実施するための形態】
【0188】
実施例1.環式テトラペプチドの合成
本発明の実施形態による環式テトラペプチドは、液相法又は固相法等の公知のペプチド合成法を使用することにより合成することができる。一般的に、合成は、2つの連続したステップを含む:(1)直鎖テトラペプチドを合成するステップ、及び(2)環化して環式テトラペプチドを得るステップ。直鎖テトラペプチドは、保護された形態で調製し、その後、環化前に脱保護してもよい。
【0189】
一例として、固体支持体(Wang型レジンに結合されたFmoc−L−フェニルアラニン、又は2−クロロトリチルレジンに結合されたL−ベータ−3−ホモフェニルアラニンまたはL−プロリンのいずれか)での直鎖テトラペプチドの合成を、以下のプロトコ−ルに従って実施した:
1.レジンを、ジメチルホルムアミド(DMF)中で15分間膨潤させた(0.25mmol、10ml/gレジン)。
2.Fmoc基を、DMF中20%ピペリジン溶液で除去した(2×20分間)。
3.レジンをDMFで洗浄した(3×2分間)。
4.レジンをメタノール(MeOH)で洗浄した(3×2分間)。
5.レジンをジクロロメタン(DCM)で洗浄した(3×2分間)。
6.レジンのアミノ酸又はペプチドアミノ基を、無水DMF(4ml/mmol)に溶解されたFmoc保護アミノ酸(4当量)、HBTU又はTBTU(4当量)、及びDIPEA(4当量)の混合物と共に20時間振とうすることによりアシル化した。
7.レジンをDCMで洗浄した(3×2分間)。
8.レジンをMeOHで洗浄した(3×2分間)。
9.レジンをDCMで洗浄した(3×2分間)。
10.カイザー試験を使用して(プロリン以外の全てのアミノ酸について)、アミノ基が全てアシル化されたか否かを評価した。
【0190】
カイザー試験の結果が陰性だった場合、レジンを、DMFで洗浄し(1×2分間)、新しい結合サイクルをプロトコールの第2工程から開始した。カイザー試験の結果が陽性だった場合、最初の結合に使用した試薬量の半分を用いてアシル化を繰り返した。プロリンのアシル化の場合には、カイザー試験は、アシル化の程度を決定するほどの感受性がなく、そのためプロリンの場合は、結合手順を、半分の試薬量で繰り返した。アシル化を繰り返す場合には、以下の洗浄を実施した:
7A. DCMでの洗浄(3×2分間)
8A. MeOHでの洗浄(3×2分間)
9A. DCMでの洗浄(3×2分間)
【0191】
最後の結合後、プロトコールの第3〜第5工程に従ってレジンを洗浄した。第2工程に記載のように、Fmoc基をペプチドから除去し、第3〜5工程でのようにDMF、MeOH、及びDCMでレジンを再び洗浄した。ペプチドをポリマー支持体から切断する前に、室温にて減圧下のデシケータでKOHペレットを用いてレジンを一晩乾燥した。
【0192】
ペプチドを、トリフルオロ酢酸/水/トリイソプロピルシラン 95:2.5:2.5(容積/容積/容積;10ml/1gのペプチジル−レジン)の混合液を用いて、乾燥したWang型レジンから切断した。得られた溶液を、室温にて減圧下で部分的に蒸発させ、ペプチドを、10容積のエーテルで析出させた。ろ過した後に、粗ペプチドを、0.05MのHCl水溶液に溶解し、蒸発させて乾燥した。残渣を水に溶解し、凍結乾燥した。
【0193】
酢酸/ジクロロメタン/トリフルオロエタノールの1:3:1混合液(容積/容積/容積;10ml/1gのペプチジル−レジン)で処理することにより、ペプチドを2−Cl−トリチルレジンから切断した。その結果生じた切断溶液及び収集した洗浄液をろ過し、周囲温度及び減圧下で蒸発させて乾燥し、残渣を、最小限の容積のDCMに溶解し、20容積のヘキサンで希釈し、再度蒸発させた(2回)。離脱させた粗ペプチドを、水に溶解し、凍結乾燥した。
【0194】
凍結乾燥したペプチドを、減圧下のデシケータでKOH及びP2O5を用いて乾燥して、環化の準備を整えた。
【0195】
上記のプロトコールによる典型的な合成では、Wangレジン(278mg、0.2mmol、0.72mmol/g)に結合されたFmoc−Pheから開始し、Fmoc−L−β3−homoPhe−OH、Fmoc−Pro−OH、及び再度Fmoc−Pro−OHを連続して結合させた後、凍結乾燥後の収量は、94%の純度(HPLC)を有する91mg(82%)の粗直鎖ペプチドだった。
【0196】
粗ペプチドを、PyBOP/HOAt/2,4,6−コリジン(3:3:5)を用いてDCM溶液中で環化し(ペプチド濃度 2×10−4ミリモル/リットル)、直鎖前駆物質の消失は、反応溶液の試料を分析用逆相(RP)HPLCカラムにインジェクトすることにより追跡した。環化の終了時に、溶液を減圧下で蒸発させて乾燥し、残渣を、酢酸エチル(1ミリモルのペプチド当たり1000mlの溶媒)、及び水中0.5NのHCl(1ミリモルのペプチド当たり100mlの溶液)との間に分割した。有機相を、水中0.5NのHCl(2×)、水(1×)、1M NaHCO3(3×)、及び水(1×)で連続して洗浄した。有機溶媒を減圧下で除去し、残留固形物をジオキサンに溶解し、凍結乾燥した。粗製生成物を、溶媒A(水中0.05%TFA)中の溶媒B(82%アセトニトリル/水中0.038%TFA)の溶出勾配を使用して、調製用Vydac社製C18又はKromasil社製C8逆相カラム(250mm/22mm、100A、10μm)で精製した。
【0197】
環化反応の例として、500ml DCM中のH−Pro−Pro−β3−hPhe−Phe−OH×HCl(55.7mg、0.1mmol)の溶液を、2,4,6−コリジン(67.5μL、0.5mmol)の存在下で、PyBOP(157mg、0.3mmol)及びHOAt(40mg、0.3mmol)で処理し、処理及び精製後に、HPLCによる決定で純度99%を有する13.5mg(27%)の環式テトラペプチドを得た。
【0198】
このようにして、式I−AからI−Pの化合物を合成した。以下の表1には、式I−AからI−Pの化合物に関する幾つかのデータが供給されている。
【0199】
【表1】

【0200】
実施例2.BALB/cマウスのオキサゾロンに対する接触過敏症モデルにおける、0.1%軟膏剤としてのペプチドの治療効果
この実験の目的は、一般的に認められている動物モデルにおける化合物I−Aの治療作用及びその毒性を確認することだった。下記に記載の実験では、式I−Aの化合物を、一般的に使用されている医薬賦形剤、即ち50%ワセリン及び50%ラノリンで構成される軟膏剤に基づく0.1%重量/重量の軟膏剤の形態の治療用調製物として塗布した。マウスのオキサゾロンに対する接触過敏症のエフェクター段階の低減におけるこの調製物の有用性を、皮膚疾患の治療に広く使用されているタクロリムス(Protopic(登録商標))及びピメクロリムス(Elidel(登録商標))等の基準調製物と比較して研究した。
【0201】
物質及び方法
マウス:Institute of Laboratory Medicine、ウッチ(Lodz)、ポーランドから入手したBALB/c雌マウス、8〜10週齢を使用した。マウスには、市販のペレット餌及び水を適宜与えた。研究は、施設の倫理委員会により承認された。
【0202】
試薬:油中水型クリーム及び軟膏は、Nepentes社から入手した。環式テトラペプチド(化合物I−A)は、上述のように合成した。Protopic(登録商標)(タクロリムス)は、Astellas社、アイルランドから購入し、Elidel(登録商標)(ピメクロリムス)は、Novartis社から購入し、Hydrocortisonum(登録商標)(ヒドロコルチゾン)は、Aflofarm Farmacja Polska社、ポーランドから購入した。DMSOは、Fluka社から入手し、オキサゾロン、アセトン、エバンスブルー、ギムザ、メイ−グリュンワルド、及びホルマリンは、Sigma社製だった。
【0203】
オキサゾロンに対する接触過敏症:試験は、Noonanら(Int.Arch.Allergy Appl.Immunol.、1978年、56巻、523〜532頁)に従い、幾つかの改変を施して実施した。マウスの腹部を剪毛し(2×2cmの区域)、24時間後、100μlのアセトン中0.5%オキサゾロンを、剪毛区域に塗布した。接触過敏症反応は、5日後に、50μlのアセトン中1%オキサゾロンを耳の両側に塗布することにより誘発した。耳浮腫を、スプリング式ノギスを使用して48時間後に測定した。結果は、耳の厚さの抗原特異的増加として示した(つまり、マウスのバックグラウンド(BG)の耳の厚さを、測定した厚さから減算した)。
【0204】
化合物の塗布:示されている実験では、第2の用量のオキサゾロンにより反応を誘発した24時間及び26時間後に、式I−Aの化合物を耳の両側に0.1%軟膏剤として局所塗布した(1つの耳当たり総容積50μl)。基準化合物は、市販調製物の形態で同様の方法で使用した。
【0205】
リンパ節細胞数の決定:表層耳下腺、下顎、及び副下顎リンパ節を単離し、ステンレス網に押し付けてリン酸緩衝液(PBS)に移すことによりホモジナイズし、2回洗浄し、0.2%トリパンブルーを含有するPBSに再懸濁した。総細胞数及び非生存細胞数を、光学顕微鏡及びビルケル血球計を使用して決定した。誘発用量の抗原でのみ処置されたマウスは、バックグラウンド対照としての役目を果たした。
【0206】
循環白血球数及び血液像の決定:マウスにハロタン麻酔を施し、後眼窩神経叢から出血させ、その後頸椎脱臼した。血中白血球数は、血液をチュルク溶液で希釈し、血球計で細胞を計数することにより決定した。血液塗抹標本を、顕微鏡ガラスに調製し、乾燥し、ギムザ及びメイ−グリュンワルド試薬で染色した。その後、塗抹標本を組織学的に調査した。循環白血球数は、1mm3当たりで示し、血液細胞組成は、所与の細胞タイプの割合として示した。誘発用量の抗原でのみ処置されたマウスは、バックグラウンド対照としての役目を果たした。
【0207】
組織学的分析:耳介を4%ホルマリン溶液で48時間固定し、24時間洗浄し、アルコール類で脱水し、パラフィンに包埋した。パラフィン塊を、Micron社製HM310ミクロトームで薄切りして、6μm切片にした。切片を、ヘマトキシリン及びエオシンで、並びにトルイジンブルーで染色した。組織学的分析は、ニコン社製Eclipse801型光学顕微鏡で実施した。耳介の断面を含有する組織学的スライドでは、血管周囲結合組織及び上皮下結合組織中の好中球、マクロファージ、リンパ球、及びマスト細胞の形態測定評価を実施した。0.07mm2区域にある細胞を、400×倍率で計数した。形態測定分析は、imagineソフトウェアNIS−Elements(ニコン社製)を用いて実施した。全ての検査群について、好中球、マクロファージ、リンパ球、及びマスト細胞の計数を25回実施した。
【0208】
統計:結果は、平均値±標準誤差(SE)として示されている。Brown−Forsyth検定を使用して、群間の等分散性を決定した。分散が均質だった場合、分散分析(一元配置ANOVA)を適用し、その後チューキー法によりポストホック比較を行って、群間の相違の有意性を評価した。ノンパラメトリックデータを、本文中に示されているように、クラスカル−ワリスの分散分析で評価した。有意性は、p<0.05で決定した。統計分析は、ウィンドウズ用STATISTICA7を使用して実施した。統計分析は、本明細書に示されている全てのデータに適用されている。
【0209】
結果:
図1に含まれているデータは、オキサゾロンに対して十分に発症した接触過敏症反応を示したマウスにおける、式I−Aの化合物(図1及びその後の図には「4B8M」と表示されている)及び基準調製物の治療効力を示す。調製物を、方法に記載されているように局所的に塗布した。図1には、耳の厚さの抗原特異的増加(抗原誘発用量の抗原のみが与えられた非感作マウスで測定されたバックグラウンド値を減算した結果として)のみが示されている。化合物I−Aは、耳浮腫の約80%阻害を引き起こし、Protopic(登録商標)及びElidel(登録商標)は、それぞれ約30%及び50%阻害を引き起こした。
【0210】
耳の炎症プロセスの強度は、流入領域リンパ節中の細胞数と相関するはずである。したがって、炎症の阻害は、流入領域リンパ節中の細胞数の減少と関連するはずである。図2には、式I−Aの化合物並びにElidel(登録商標)が両方とも、流入領域リンパ節中のリンパ球数を、非感作マウスで記録されたレベルに減少させたことを示す。しかしながら、Protopic(登録商標)で処置されたマウスでは、リンパ節細胞数は、未処置マウスの細胞数と類似していた。
【0211】
図3には、パーセントで表された、流入領域リンパ節中の生細胞及び死細胞の割合が示されている。式I−Aの化合物が示す毒性は、対照未処置マウスと比較して無視できるほどである。より高い毒性作用がElidel(登録商標)により引き起こされ、Protopic(登録商標)は、リンパ節細胞に関して非常に毒性である。
【0212】
調製物の治療効力に関する補完的な情報は、炎症を起こした耳介中の細胞数及び細胞組成の組織学的分析から導き出すことができる。図4には、局所炎症プロセスに関与する基本的細胞タイプの数及び寄与が示されている。図4では、Mast=マスト細胞、L=リンパ球、MO=マクロファージ、Ne=好中球である。未処置マウス(K+)の耳介は、好中球の浸潤が高いことを特徴とする。式I−Aの化合物の塗布は、対照マウスで観察された変化をほとんど完全に逆行させた(好中球の数は、マクロファージ含有量のある程度の増加で正規化した)。次いで、Protopic(登録商標)は、それぞれの細胞タイプの割合にある程度の変化を引き起こしたが、総細胞浸潤を低減しなかった。Elidel(登録商標)は、総細胞数の中程度の減少を引き起こした。
【0213】
実施例3.ヒト血中単核細胞に対するシクロリノペプチドの毒性と比べた化合物I−Aの毒性
式I−Aの化合物の毒性評価には、ヒト末梢単核血液細胞(PBMC)を選択した。この画分は、およそ80%のリンパ球及び20%の単球で構成される。式I−Aの化合物は、CLAの配列の一部を共有するため、シクロリノペプチド(CLA)を基準化合物として選択した。CLAは、シクロスポリンAの免疫抑制特性と同等の免疫抑制特性を示すが、毒性はより少ない。
【0214】
物質及び方法
細胞毒性試験:一人の供与者から静脈血をヘパリン処理注射器に採取し、リン酸緩衝生理食塩水(PBS)で2倍に希釈し、Lymphoprep(登録商標)(Polfa社製、クトノ、ポーランド)の上にアプライした(密度は1.077g/ml)。1200×gで20分間遠心分離した後、分裂間期の単核細胞を回収し、PBSで3回洗浄した。細胞を、RPMI−1640培地、L−グルタミン、ピルビン酸ナトリウム、2−メルカプトエタノール、各100μg/mlのストレプトマイシン及びペニシリン、並びに10%ウシ胎仔血清で構成される標準培地に再懸濁した。細胞を、96ウエル平底培養プレートに2×105/100μlの密度で分配した。化合物(式I−A及びCLA)を、まずDMSOに溶解し(5mg/500μl)、その後培養培地に溶解した。培養培地で適切に希釈されたDMSOを、対照として使用した。細胞培養インキュベーターで24時間インキュベーションした後、細胞生存率を、比色法により決定した(Hansenら、J Immunol Methods、1989年、119巻、203〜210頁)。
【0215】
結果は、図5に示されており、四重重複ウエル(細胞培養)の平均光学密度値±SEとして表されている。図5に見られるように、式I−Aの化合物(「4B8M」と表示されている)は、10〜100μg/mlの濃度範囲では、検出可能な毒性を示さなかった。その一方で、CLAは、40μg/mlで統計的に有意な細胞毒性を示した。
【0216】
実施例4.SRBCに対する体液性免疫応答に対するペプチドのvivoでの効果
CBA雌マウス、8〜12週齢を、Institute of Laboratory Medicine、ウッチ、ポーランドから入手した。マウスには、水及びペレット餌を自由に摂取させた。研究は、施設の倫理委員会により承認された。ヒツジ赤血球(SRBC)を、Wroclaw University of Life and Environmental Sciences、ポーランドから入手し、RPMI−1640培地で維持した。
【0217】
in vivoにおけるSRBCに対する一次体液性免疫応答:マウスを、0.2mlの5%SRBC懸濁液(0.5mlのSRBCペレットを10mlの容積の0.9%NaClに再懸濁した)で腹膜内免疫した。4日後に、脾臓の抗体産生細胞(AFC)数を、寒天ゲルでの局所溶血アッセイを使用して決定した(Mishellら、J Exp Med、1967年、126巻、423〜442頁に示されているように)。結果は、5匹マウスの平均値±標準誤差として図6に示されており、106個の生脾細胞当たりのAFC数として表されている。
【0218】
マウスを、上述のようにSRBCで免疫し、2時間後に10又は100μgの式I−Aの化合物を投与した。シクロスポリンA(CsA)は、基準薬物としての役目を果たした。SRBCに対する抗体を産生する細胞の数を、4日後に測定した。図6に示されているように、式IAの化合物は、両用量でCsAよりも阻害性だった。
【0219】
実施例5.オボアルブミンに対する体液性免疫応答に対するペプチドのin vivoでの効果
雄CBAマウス、8〜12週齢を、Institute of Laboratory Medicine、ウッチ、ポーランドから入手した。マウスには、水及びペレット餌を自由に摂取させた。オボアルブミンはSigma社製であり、アジュバントはDifco社製だった。
【0220】
遅延型過敏症(DTH)検査:マウスの尾部基部に、フロイント完全アジュバント中に乳化された5μgのオボアルブミン(OVA)を皮下感作した。4日後、マウスの後足蹠に、フロイント不完全アジュバント中の50μgのOVAを負荷した。24時間後、足蹠の厚さをノギスを使用して測定した。対照(バックグラウンド応答マウス)は、感作されなかったが、負荷用量のOVAを受容した。式I−Aの化合物及び基準化合物を、感作量の抗原の2時間前及び24時間後に、2回の100μg腹腔内容量でマウスに投与した。結果は、5匹のマウスで測定され、DTH単位(1DTH単位=10−2cm)で表された足蹠の厚さの抗原特異的増加の平均値±標準誤差として図7に示されており、2回の用量で投与された式I−Aの化合物が、免疫の2時間及び24時間後に、OVAに対する遅延型過敏症反応を阻害したことが示されている。その抑制作用は、CLA及びCsAの抑制作用よりも強力だった。
【0221】
実施例6
環式テトラペプチドを、植物性血球凝集素A(PHA)誘導性のヒト末梢血単核細胞(PBMC)増殖、及びリポポリサッカライド(LPS)誘導性の腫瘍壊死因子アルファ(TNF−α)産生に対するそれらの効果について、1〜100μg/mlの濃度範囲での全血細胞培養によりin vitroで試験した。また、化合物を、1〜100μg/mlの濃度範囲で、ヒトPBMCに対する細胞毒性について試験した。
【0222】
物質及び方法
試薬:RPMI−1640培地(Cibi/Life Technologies社製、英国)、ウシ胎児血清(FCS、Gibco社製)、DMSO、植物性血球凝集素A(PHA)、大腸菌株O111:B4に由来するリポポリサッカライド(LPS)(Sigma社製)、93−[4,5−ジメチルチアゾール−2−イル]−2,5−ジフェニルテトラゾリウムブロミド(MTT)、SDS、及びDMF(Sigma社製)。培養培地は、RPMI−1640、10%FCS添加、L−グルタミン、ピルビン酸ナトリウム、2−メルカプトエタノール(mercaptoetanol)、及び抗生物質(ストレプトマイシン及びペニシリン)で構成されていた。環式テトラペプチドを、まずDMSOに溶解し(5mg/ml)、その後培養培地に溶解して所望の濃度にした。
【0223】
PBMCの単離:一人の供与者(男性、62歳)から静脈血をヘパリン処理注射器に採取し、リン酸緩衝生理食塩水(PBS)で2倍に希釈した。PBMCを、Ficoll−uropoline勾配(密度1.077g/ml)(Lymphoprep;PAA Laboratories社製)で、4℃にて800×gで20分間遠心分離することにより単離した。その後、リンパ球(20%)及び単球(80%)で構成されている分裂間期細胞を、ハンクス培地で3回洗浄し、2×l06細胞/mlの密度で培養培地に再懸濁した。
【0224】
PHAに対するPBMCの増殖応答:単離したPBMCを、100μl等量(2×l05細胞/ウエル)で96ウエル平底プレートに分配した。PHAを、5μg/mlの濃度で使用した。化合物を、1、10、及び100μg/mlの濃度で試験した。適切に希釈されたDMSOは、対照としての役目を果たした。細胞培養インキュベーターで4日間インキュベーションした後、細胞の増殖応答を、比色MTT法により決定した(Hansenら、J.Immunol.Methods、1989年、203〜210頁)。データは、四重重複(quadriplicate)ウエルの平均OD値±標準誤差(SE)として表されている。培養「対照(−)」は、マイトジェンを含有していなかった(PHA)。培養「対照(PHA)」は、PHAを含有していたが、環式テトラペプチドを含有していなかった。
【0225】
毒性試験:2×105個/100μ1/ウエルの密度のPBMCを培養培地に再懸濁し、1、10、及び100μg/ml濃度の環式テトラペプチドと共に細胞培養インキュベーターで24時間培養した。細胞生存を、MTT比色法により決定した(Hansenら、J.Immunol.Methods、1989年、203〜210頁)。データは、四重重複ウエルの平均OD値±標準誤差(SE)として表されている。培養「対照(−)」は、培養培地中に細胞のみを含有していた。
【0226】
TNFアルファ活性の決定(Espevikら、J.Immunol.Methods、95巻(1986年):99〜103頁に示されていような):ヒト全血を、RPMI−1640培地で10倍希釈し、24ウエル培養プレートに1ml等量で分配した。LPSを、1μg/mlの濃度で培養に添加した。研究対象ペプチドを、1、10、及び100μg/mlの濃度で使用した。一晩インキュベーションした後、上清を回収し、サイトカイン決定まで−20℃で凍結した。TNF−α活性を、バイオアッセイを使用して決定した。手短に言えば、WEHI 164.13細胞(ATCC CRL 1751)を2×104細胞/ウエルの濃度で四重重複で接種した。漸進的に希釈したアッセイ上清を、アクチノマイシンD(1μg/ml)の存在下で標的細胞と混合した。インキュベーションの20時間後、MTTをウエルに添加し、培養を更に4時間インキュベートした。次に、細胞溶解緩衝液(20%SDS及び50%DMF、pH4.7)を添加し、24時間後に、630nmを基準波長とした550nmの光学密度を、Dynatech社製5000型分光光度計で測定した。アッセイの検出限界は、約2.5pg/mlだった。TNF−α活性の1単位は、50%細胞死が生じる上清希釈の逆数として定義した。「対照(−)」と表示した培養は、LPSを含有していなかった。「対照(LPS)」と表示した培養は、LPSのみを含有し、研究対象化合物は含有していなかった。データが単一培養(ウエル)由来であるため、統計分析は適用しなかった。
【0227】
細胞増殖及び死滅の比色MTTアッセイ:アッセイは、Hansenら、J.Immunol.Methods、1989年、119巻、203〜210頁に示されているように実施した。手短に言えば、25μlのMTT(5mg/ml)原液を、細胞インキュベーションの終了時にウエル毎に添加し、プレートを、細胞培養インキュベーターで3時間インキュベートした。その後、100μlの抽出緩衝液(20%SDS及び50%DMF、pH4.7)を添加した。更に一晩インキュベーションした後、550nmの光学密度を測定したDynatech社製5000型)。
【0228】
それが適切な場合、結果は、平均値±標準誤差(SE)として示されている。Brown−Forsyth検定を使用して、群間の等分散性を決定した。分散が均質だった場合、分散分析(一元配置ANOVA)を適用し、その後チューキー法によりポストホック比較を行って、群間の相違の有意性を評価した。有意性は、P<0.05で決定した。統計分析は、ウィンドウズ用STATISTICA6.1を使用して実施した。
【0229】
結果:
PBMCの生存に対する化合物の効果:24時間培養でのPMBC生存に対するペプチドの効果は、図8A及び8Bに示されている。ペプチド4B8M(化合物I−A)は、基準化合物として含まれていた。適切に希釈されたDMSOを、対照培養に添加した。結果は、研究した濃度範囲では化合物の毒性徴候を示さなかった。図中、P01=化合物I−D、P02=化合物I−E、P03=化合物I−F、P04=化合物I−G、P05=化合物I−H、P06=化合物I−J、P07=化合物I−K、P08=化合物I−L、P10a=化合物I−M、P10b=化合物I−N、及びP11=化合物I−Oである。
【0230】
図8A及び8Bは、PBMCの生存に対する試験ペプチドの効果を示す。図8A:統計(全比較対適切に希釈されたDMSO):100μg/ml:4B8M NS(P=0.9999);P01 NS(P=1.0000);P02 NS(P=1.0000);P03 NS(P=1.0000);P04 NS(P=0.9047);P05 NS(P=1.0000);P06 NS(P=0.9999);P07 NS(P=1.0000);10μg/ml:4B8M NS(P=1.0000);P01 NS(P=1.0000);P02 NS(P=1.0000);P03 NS(P=1.0000);P04 NS(P=0.9999);P05 NS(P=1.0000);P06 NS(P=1.0000);P07 NS(P=1.0000);1μg/ml;4B8M NS(P=1.0000);P01 NS(P=1.0000);P02 NS(P=1.0000);P03 NS(P=1.0000);P04 NS(P=1.0000);P05 NS(P=1.0000);P06 NS(P=0.8253);P07 NS(P=1.0000)(ANOVA)。図8B:統計(全比較対適切に希釈されたDMSO):100μg/ml:4B8M NS(P=0.0669);P08 NS(P=0.9957);P10b NS(P=1.0000);10μg/ml:4B8M NS(P=0.9999);P08 NS(P=1.0000);P10b NS(P=1.0000);1μg/ml;4B8M NS(P=0.3176);P08 NS(P=0.9999);P10b NS(P=1.0000)(ANOVA)。
【0231】
PHA誘導性PMBC増殖に対するペプチドの効果:PMBCの増殖応答に対するペプチドの効果は、図9A及び9Bに示されている。ペプチド4B8Mは、基準化合物として含まれていた。適切に希釈されたDMSOを、対照培養に添加した。
【0232】
図9A:PHA誘導性PMBC増殖に対するペプチドの効果:統計(全比較対適切に希釈されたDMSO):1μg/ml:4B8M NS(P=0.9995);P01 NS(P=1.0000);P02 NS(P=1.0000);P03 NS(P=1.0000);P04 NS(P=0.9047);P05 NS(P=0.5198);P06 NS(P=1.0000);P07 NS(P=0.1445);10μg/ml:4B8M NS(P=1.0000);P01 NS(P=0.9999);P02 NS(P=1.0000);P03 NS(P=0.9930);P04 NS(P=0.4297);P05 NS(P=1.0000);P06 NS(P=1.0000);P07 NS(P=0.8647);100μg/ml:4B8M NS(P=1.0000);P01 NS(P=1.0000);P02 NS(P=0.9982);P03 P=0.0001;P04 NS(P=0.9970);P05 NS(P=0.2037);P06 NS(P=0.1257);P07 NS(P=1.0000)(ANOVA)。
【0233】
図9B:PHA誘導性PMBC増殖に対するペプチドの効果:統計(全比較対適切に希釈されたDMSO):1μg/ml:4B8M NS(P=0.9919);P08 NS(P=0.9999);P10b NS(P=1.0000);10μg/ml:4B8M NS(P=1.0000);P08 NS(P=1.0000);P10b NS(P=0.2763);100μg/ml:4B8M NS(P=0.4941);P08 NS(P=1.0000);P10b NS(P=0.9933)(ANOVA)。
【0234】
全血細胞培養中のLPS誘導性TNF−α産生に対するペプチドの効果:全血細胞培養中のLPS誘導性TNF−α産生に対するペプチドの効果は、表2A及び2Bに示されている。ペプチド4B8Mは、基準化合物として含まれていた。適切に希釈されたDMSOを、対照培養に添加した。
表2A LPS誘導性TNF−α産生に対するペプチドの効果
【0235】
【表2】

表2B LPS誘導性TNF−アルファ産生に対するペプチドの効果
【0236】
【表3】

【0237】
実施例7.マウスのトルエンジイソシアネート誘導性耳炎に対する化合物LAの阻害効果
トルエンジイソシアネート(TDI)で誘導されたBALB/cマウスの耳炎の抑制における化合物LAの効力。市販のProtopic(登録商標)(タクロリムス)及びElidel(登録商標)(ピメクロリムス)は、基準薬物としての役目を果たした。
【0238】
物質及び方法
マウス:BALB/c雌マウス、8〜10週齢を、Institute of Laboratory Medicine、ウッチ、ポーランドから入手した。マウスには、市販のペレット餌及び水を適宜与えた。研究は、施設の倫理委員会により承認された。
【0239】
試薬。化合物I−Aは、上述のように合成した。Protopic(タクロリムス)は、Astellas社製(アイルランド所在)だった。Elidel(登録商標)(ピメクロリムス)は、Novartis社製だった。DMSOはFluka社製だった、TDI、アセトン、エバンスブルー、トリパンブルー、ギムザ、メイ−グリュンワルド、ヘマトキシリン、エオシン、トルイジンブルー、及びホルマリンは、Sigma社製だった。
【0240】
TDIに対する免疫応答。試験は、多少の改変を施して、Yamamoto、Eur.J.Pharmacol.、2006年、550巻、166〜172頁に従って実施した。マウスの腹部を剪毛し(2×2cmの区域)、24時間後、100μlのアセトン中3%TDIを、3日連続で塗布した。14日後、50μlの0.3%TDIを耳の両側に塗布することにより、反応を誘発した。この手順を、3日毎に5回繰り返した。TDIによる各負荷の5時間及び24時間後に、スプリング式ノギス(Mitutoyo社製)を使用して、耳の厚さを測定した。
【0241】
化合物の塗布。TDIによる各負荷の1時間後に、化合物I−Aを、0.1%軟膏剤の形態で耳の両側に局所塗布した(1つの耳当たりの総容積は100μl〜50μl)。同様の方法で基準薬物を塗布した。
【0242】
リンパ節細胞数の決定。表層耳下腺、下顎、及び副下顎リンパ節を単離し、ステンレス網に押し付けてPBSに移すことによりホモジナイズし、PBSで2回洗浄し、0.2%トリパンブルーを含有するPBSに再懸濁した。総細胞数及び非生存細胞数を、光学顕微鏡及びビルケル血球計を使用して決定した。
【0243】
循環白血球数及び血液像の決定。マウスにハロタン麻酔を施し、後眼窩神経叢から出血させ、その後頸椎脱臼した。血中白血球数は、血液をチュルク溶液で希釈し、血球計で細胞を計数することにより決定した。血液塗抹標本を、顕微鏡ガラスに調製し、乾燥し、ギムザ及びメイ−グリュンワルド試薬で染色した。その後、塗抹標本を組織学的に調査した。細胞数は、1μl当たりで示し、血液細胞組成は、所与の細胞タイプの割合として示した。
【0244】
エバンスブルー試験。マウスには、0.2mlの0.9%NaCl中1mgのエバンスブルーを静脈内投与した。30分後、マウスを犠牲にし、耳を切除し、計量し、50μlの1M KOHに37℃で18時間浸漬した。450μlの0.2Mリン酸(phosphate acid)及びアセトン(5:13の比率)を使用して、耳から色素を抽出した。試料を、3,000rpmで15分間遠心分離した。上清の光学密度(OD)を、630nmで測定した。エバンスブルーの量(μg/ml)は、標準曲線に基づいて決定した。結果は、100mgの湿潤組織当たりのエバンスブルーの量として示した。誘発用量の抗原でのみ処置されたマウスは、バックグラウンド対照としての役目を果たした。
【0245】
組織学的分析。耳介を4%ホルマリン溶液で48時間固定し、24時間洗浄し、アルコール類で脱水し、パラフィンに包埋した。パラフィン塊を、Micron社製HM310ミクロトームで薄切りして、6μm切片にした。切片を、ヘマトキシリン及びエオシンで、並びにトルイジンブルーで染色した。組織学的分析は、ニコン社製Eclipse801型光学顕微鏡を使用して実施した。血管周囲結合組織及び上皮下結合組織中の好中球、マクロファージ、リンパ球、及びマスト細胞の形態測定評価を、耳介の断面を含有する組織学的スライドで実施した。0.07mm2区域にある細胞を、400×倍率で計数した。形態測定分析は、imagine社製ソフトウェアNIS−Elements(ニコン社製)を使用して実施した。検査した全ての調製物について、好中球、マクロファージ、リンパ球、及びマスト細胞の計数を25回実施した。
【0246】
統計。図10A及び10Bの結果は、平均値±標準誤差(SE)として示されている。Brown−Forsyth検定を使用して、群間の等分散性を決定した。分散が均質だった場合、分散分析(一元配置ANOVA)を適用し、その後チューキー法によりポストホック比較を行って、群間の相違の有意性を評価した。ノンパラメトリックデータを、本文中に示されているように、クラスカル−ワリスの分散分析で評価した。有意性は、P<0.05で決定した。統計分析は、ウィンドウズ用STATISTICA7を使用して実施した。
【0247】
結果:
耳の厚さに対する化合物の効果。TDIに対する体液性免疫応答を、方法に記載のように誘発した。抗原による各負荷の1時間後に、テトラペプチド(式I−A、図10A及び10Bでは4B8Mと表示されている)及び基準化合物で、マウスを局所的に処置した。処置の効果は図10A及び10Bに示されており、そこには、図に示されている試験日における投与の5時間後(図10A)及び24時間後(図10B)の耳の厚さの測定が示されている。TDIに対する対照応答は、各抗原負荷後、徐々に上昇した(5時間後の測定で最もよく見られる)。結果は、化合物が耳膨潤の低減に著しい効力があることを示した。
【0248】
図10A:14日目:対照対4B8M P=0.0005;対照対Protopic(登録商標)P=0.0002;対照対Elidel(登録商標)P=0.0152;4B8M対Protopic(登録商標)NS;4B8M対Elidel(登録商標)NS;17日目:対照対4B8M P=0.0001;対照対Protopic(登録商標)P=0.0001;対照対Elidel(登録商標)P=0.0377;4B8M対Protopic(登録商標)NS;4B8M対Elidel(登録商標)P=0.0002;20日目:対照対4B8M P=0.0001;対照対Protopic(登録商標)P=0.0001;対照対Elidel(登録商標)NS;4B8M対Protopic(登録商標)NS;4B8M対Elidel(登録商標)P=0.0001;23日目:対照対4B8M P=0.0001;対照対Protopic(登録商標)P=0.0001;対照対Elidel(登録商標)NS;4B8M対Protopic(登録商標)NS;4B8M対Elidel(登録商標)P=0.0001;27日目:対照対4B8M P=0.0001;対照対Protopic(登録商標)P=0.0001;対照対Elidel(登録商標)P=0.0001;4B8M対Protopic(登録商標)NS;4B8M対Elidel(登録商標)P=0.0001(ANOVA)。図10B:14日目:対照対4B8M P=0.0001;対照対Protopic(登録商標)P=0.0001;対照対Elidel(登録商標)P=0.0004;4B8M対Protopic(登録商標)NS;4B8M対Elidel(登録商標)NS;17日目:対照対4B8M P=0.0001;対照対Protopic(登録商標)P=0.0023;対照対Elidel(登録商標)P=0.0004;4B8M対Protopic(登録商標)NS;4B8M対Elidel(登録商標)NS;20日目:対照対4B8M P=0.0006;対照対Protopic(登録商標)P=0.0003;対照対Elidel(登録商標)P=0.0156;4B8M対Protopic(登録商標)NS;4B8M対Elidel(登録商標)NS;23日目:対照対4B8M P=0.0001;対照対Protopic(登録商標)P=0.0001;対照対Elidel(登録商標)P=0.0039;4B8M対Protopic(登録商標)NS;4B8M対Elidel(登録商標)P=0.0027;27日目:対照対4B8M P=0.0001;対照対Protopic(登録商標)P=0.0001;対照対Elidel(登録商標)P=0.0023;4B8M対Protopic(登録商標)NS;4B8M対Elidel(登録商標)P=0.0016(ANOVA)。
【0249】
皮膚血管の透過性に対する化合物の効果:毛細血管の透過性は、図11に示されており、そこには、エバンスブルー試験における毛細血管の透過性が示されている。上述の手順を、TDIによる5回目の負荷(28日目)の24時間後に実施した。図11に示されているように、血管透過性の速度は、それぞれのマウス群において耳の厚さに対する化合物の効果と厳密に相関していた。統計:BG対対照 P=0.0248;対照対4B8M(I−A)P=0.030;対照対Protopic(登録商標)NS;対照対Elidel(登録商標)NS;4B8M(I−A)対Protopic(登録商標)NS;4B8M(I−A)対Elidel(登録商標)NS(ANOVA)。
【0250】
流入領域リンパ節中の細胞数に対する化合物の効果:図12は、流入領域リンパ節中の総細胞数を示す。図12に示されているように、化合物I−Aでマウスを処置すると、リンパ節細胞数が、ほとんどバックグラウンドレベルに低下する結果となった(未感作マウス)。統計:BG対対照 P=0.0001;対照対4B8M(I−A)P=0.0001;対照対Protopic(登録商標)NS;対照対Elidel(登録商標)NS;4B8M(I−A)対Protopic(登録商標)P=0.0183;4B8M(I−A)対Elidel(登録商標)P=0.0001(クラスカル−ワリスのANOVA)。
【0251】
循環白血球の数に対する化合物の効果。図13は、循環白血球の数に対する化合物の効果を示す。研究対象調製物を塗布すると、循環白血球の数が、対照未感作マウスで観察されたレベルに低下した。統計:BG対対照P=0.0001;対照対4B8M(I−A)P=0.0001;対照対Protopic(登録商標)P=0.0001;対照対Elidel(登録商標)P=0.0001;4B8M(I−A)対Protopic(登録商標)NS;4B8M(I−A)対Elidel(登録商標)NS(ANOVA)。
【0252】
血液細胞組成に対する化合物の効果:TDIに対して十分に発症した反応を示す対照マウスの血液組成は、対照バックグラウンドマウスと比較して、好中球及び好酸球の含有量が増加することを特徴とした(図14、各々の場合の白血球タイプの内訳が示されている)。血液像は、4B8M(I−A)塗布の際に正規化したが(好中球及び好酸球の含有量の低減)、Protopic(登録商標)又はElidel(登録商標)の投与後には正規化しなかった。統計:バンド(B):BG対対照 NS;対照対4B8M(I−A)NS;対照対Protopic(登録商標)P=0.0500;対照対Elidel(登録商標)P=0.0500;4B8M(I−A)対Protopic(登録商標)NS;4B8M対Elidel(登録商標)NS(クラスカル−ワリスのANOVA);セグメント(S):BG対対照 P=0.0131;対照対4B8M(I−A)NS;対照対Protopic(登録商標)NS;対照対Elidel(登録商標)NS;4B8M(I−A)対Protopic(登録商標)P=0.0163;4B8M(I−A)対Elidel(登録商標)NS(クラスカル−ワリスのANOVA);好酸球(E):BG対対照 P=0.0001;対照対4B8M(I−A)P=0.0001;対照対Protopic(登録商標)NS;対照対Elidel(登録商標)NS;4B8M(I−A)対Protopic(登録商標)NS;4B8M対Elidel(登録商標)P=0.0146(クラスカル−ワリスのANOVA);リンパ球(L):BG対対照 P=0.0001;対照対4B8M(I−A)P=0.0043;対照対Protopic(登録商標)NS;対照対Elidel(登録商標)NS;4B8M(I−A)対Protopic(登録商標)P=0.0345;4B8M(I−A)対Elidel(登録商標)NS(クラスカル−ワリスのANOVA)。
【0253】
耳介の細胞組成に対する化合物の効果:図15は、耳介の細胞数及び細胞組成に関する形態測定データを提供する。研究対象マウス群の中で異なっていた、耳介内の細胞タイプの組成は、図15に示されている。対照未感作マウスに多く存在する細胞タイプは、マスト細胞及び好中球(neutrofil)である(それぞれ、分析した区域当たり10個及び5個の細胞)。治療薬で処置しなかった感作対照マウスでは、マスト細胞の数は2倍に、好中球はほとんど5倍に増加した(それぞれ、20個及び23個の細胞)。Protopic(登録商標)及び化合物I−Aは、細胞数を14及び14.8に効果的に低減した。統計:Ne(好中球):BG対対照 P=0.0001;対照対4B8M(I−A)P=0.0151;対照対Protopic(登録商標)P=0.0001;対照対Elidel(登録商標)NS;4B8M対Protopic(登録商標)NS;4B8M(I−A)対Elidel(登録商標)P=0.0003(クラスカル−ワリスのANOVA);MO(マクロファージ):BG対対照 P=0.0144;対照対4B8M(I−A)NS;対照対Protopic(登録商標)NS;対照対Elidel(登録商標)P=0.0255;4B8M対Protopic(登録商標)NS;4B8M(I−A)対Elidel(登録商標)P=0.0031(クラスカル−ワリスのANOVA);L(リンパ球):BG対対照 NS;対照対4B8M(I−A)NS;対照対Protopic(登録商標)NS;対照対Elidel(登録商標)P=0.0023;4B8M対Protopic(登録商標)NS;4B8M(I−A)対Elidel(登録商標)P=0.0001(クラスカル−ワリスのAnova);Mast(マスト細胞):BG対対照 P=0.0001;対照対4B8M(I−A)NS;対照対Protopic(登録商標)P=0.0001;対照対Elidel(登録商標)NS;4B8M(I−A)対Protopic(登録商標)NS;4B8M(I−A)対Elidel(登録商標)P=0.0001(クラスカル−ワリスのANOVA)。
【0254】
実施例8− 化合物I−B及びI−CのIn vitro試験
方法
コンカナバリンA(ConA)に対する脾細胞の増殖応答:脾臓をプラスチック網に押し付けて0.83%NH4C1溶液に移し、赤血球を溶解した(室温で5分間のインキュベーション)。その後、細胞をハンクス培地で2回洗浄し、ガラスウールカラムに通して残屑を除去し、10%ウシ胎仔血清、L−グルタミン、ピルビン酸ナトリウム、2−メルカプトエタノール、ストレプトマイシン、及びペニシリン(100μg/ml)で補完されたRPMI−1640で構成される、下記では「培養培地」と呼ばれる培養培地に再懸濁した。その後細胞を、96ウエル平底組織培養プレート(Nunc社製)に、2×105細胞/100μl/ウエルの密度で分配した。ConA(2.5μg/ml)を添加して、細胞増殖を誘導した。化合物を、1〜100μg/mlの用量で培養に添加した。3日間のインキュベーション後、細胞増殖を、比色MTT法を使用して決定した(Hansen MB、J Immunol Methods、1989年、119巻、203〜210頁)。結果は、550nmにおける四重重複決定(ウエル)の平均光学密度(OD)±SEとして示した。
【0255】
ヒツジ赤血球(SRBC)に対するin vitroの二次体液性免疫応答:マウスを、0.2mlの5%(容積/容積)SRBC懸濁液で腹腔内感作した。4日後に、これらマウスから脾臓を単離し、PBS溶液中でホモジナイズすることにより、単個細胞浮遊液を調製した。遠心分離により細胞をPBSで洗浄した後、細胞を、5×l06細胞/mlの密度で培養培地に再懸濁した。その後細胞を、24ウエル培養プレートに1ml等量で分配し、0.05mlの0.005%SRBCを、抗原として各ウエルに添加した。化合物を、1〜100μg/mlの濃度範囲で、4日間のインキュベーション期間の初めに培養に添加した。培養での抗体産生細胞(AFC)の数を、Mishellら、J Exp Med、1967年、126巻、423〜442頁に従って、寒天ゲルでの局所溶血アッセイ法を使用して決定した。
【0256】
毒性試験:2×105細胞/100μl/ウエルの密度で培養培地に再懸濁された脾細胞を、化合物(1〜100μg/ml)と共に細胞培養インキュベーターで24時間培養した。細胞生存を、MTT比色法により決定した。結果は、550nmにおける4つのウエルの平均光学密度(OD)として示した。それぞれの化合物濃度での細胞の生存率を、それぞれの化合物濃度に対応する適切なDMSO対照群(100%生存)と比較した。
【0257】
結果:
50〜100μg/mlの濃度において、化合物I−Cは、コンカナバリンA誘導性のマウス脾細胞増殖に対して強力な阻害効果を示した。100μg/mでは、この化合物は、脾細胞に対して70%毒性を示した。10μg/m及び100μg/mでは、化合物I−Cは、マウス脾細胞培養中でのSRBCに対するin vitro体液性免疫応答のモデルにおいて、それぞれ33%及び80%抑制を示した。オボアルブミンに対する遅延型過敏症のモデルにおいて、化合物I−Cは、化合物I−Aによる72.7%阻害と比較して、100μgの用量で26.9%阻害を示した。
【0258】
100μg/ml濃度では、化合物I−Bは、コンカナバリンA誘導性の脾細胞増殖に対して弱い抗増殖効果を示した。このような効果は、より低い濃度では観察されなかった。化合物I−Bは、この濃度で30%毒性を示した。
【0259】
前述の発明は、例示の目的で幾らか詳細に記述されているが、本明細書に記載されている本発明の範囲から逸脱することなく、変更及び改変をなすことができることは、当業者であれば直ちに明白であろう。
【背景技術】
【0001】
免疫抑制剤は、移植及び自己免疫疾患の治療に一般的に使用されている。これら薬物の生産は高価であり、これら薬物の中で最も頻繁に使用されている薬物、即ちシクロスポリンA、タクロリムス、及びラパマイシンは、望ましくない副作用を示す。副作用のない新しい免疫抑制剤を、特に天然ペプチド免疫調節物質及びそれらの類似体のクラスの中で探索することは、医薬品化学にとって重要な挑戦である。
【0002】
シクロリノペプチドA(CLA)、非常に疎水性である環式ノナペプチドは、1959年に亜麻種子から初めて単離された。CLAは、強力に免疫抑制性であり、シクロスポリンA(CsA)の効力と同等の効力を有する。CLAの作用機序は、CsAの作用機序と類似していることが示された。つまり、CLAは、親和性が非常に低いとはいえ、サイクロフィリンAと複合体を形成して、カルシニューリンの不活化を引き起こす(Gaymesら、Febs Lett、1997年、418巻、224〜227頁)。CLAは、体液性免疫応答及び細胞性免疫応答の両方並びに移植片対宿主反応を阻害し、同種皮膚移植の生存を延長し、ラットのアジュバント多発関節炎後及びニュージーランドブラックマウスの溶血性貧血を緩和し、CsAと同様に、IL1及びIL−2産生を阻害した。残念ながら、CLAの疎水性が高いことは、この化合物の潜在的治療応用の障害である。
【0003】
ペプチド鎖の連続した位置にアラニン残基を含有する直鎖CLA類似体は、免疫抑制性であることが見出された(Wieczorekら、Arch Immunol Ther Exp、1992年、40巻、213〜216頁)。また、直鎖CLA類似体の活性は、N末端基からペプチド鎖を短縮する共に徐々に減少し、同時にC末端テトラペプチド及びトリペプチドに対する活性の増加を示した(Siemionら、Arch Immunol Ther Exp、1994年、42巻、459〜465頁)。単一の親水性トレオニン残基をCLA分子に導入しても、水溶解度が向上する結果にはならなかった。しかしながら、溶解度の向上は、1つ又は2つのフェニルアラニン残基のフェニル環のパラ位にスルホン酸基を導入することにより、生物活性を喪失させることなく達成された(Siemionら、Arch Immunol Ther Exp、1992年、40巻、257〜261頁;Cebratから、J Peptide Res.、1997年、49巻、415〜420頁)。加えて、より長鎖の直鎖ペプチド鎖にテトラペプチド性(Pro−Pro−Phe−Phe)又はトリペプチド性(Pro−Phe−Phe)断片が含まれていることは、免疫抑制活性に重要性であると考えられることが観察されている(Wieczorekら、Arch Immunol Ther Exp、1993年、41巻、291〜296頁;Cebratら、Pol.J Chem、1997年、71巻、1401頁)。
【0004】
プロリン残基間のcis−ペプチド結合が、1,5−二置換テトラゾール環(cis配置のアミド結合の良好な模倣体)で置換されている一連の類似体は、CsAと同等の免疫抑制活性を示した。(Karczmarekら、Biopolymers、2002年、63巻、343〜357頁)。
【0005】
5位及び/又は8位のロイシン残基が、それらのヒドロキシメチル類似体で置換されている合成CLA類似体は、CLAと比較して水溶解度の4倍の増加を示したが、天然CLAと比較して生物活性が25%減少したことも示した(Zubrzakら、Biopolymers(Peptide Science)、2005年、80巻、347〜356頁)。
【0006】
一連の9つのCLA類似体が、CLAプロリン残基をβ2−イソプロリン及びβ3−ホモプロリンに置換することにより得られた。CsAと比較して、これらCLA類似体は、細胞性免疫応答に強力な阻害特性を示した。これら類似体の大多数は、事実上細胞毒性がなかった(Katarzynskaら、J Pept Sci、2009年、14巻、1283〜1294頁)。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】米国特許第4,105,603号
【特許文献2】米国特許第3,972,859号
【特許文献3】米国特許第3,842,067号
【特許文献4】米国特許第3,862,925号
【特許文献5】米国特許第6,015,881号
【特許文献6】米国特許第6,197,927号
【特許文献7】米国特許第7,439,222号
【非特許文献】
【0008】
【非特許文献1】Gaymesら、Febs Lett、1997年、418巻、224〜227頁
【非特許文献2】Wieczorekら、Arch Immunol Ther Exp、1992年、40巻、213〜216頁
【非特許文献3】Siemionら、Arch Immunol Ther Exp、1994年、42巻、459〜465頁
【非特許文献4】Siemionら、Arch Immunol Ther Exp、1992年、40巻、257〜261頁
【非特許文献5】Cebratから、J Peptide Res.、1997年、49巻、415〜420頁
【非特許文献6】Wieczorekら、Arch Immunol Ther Exp、1993年、41巻、291〜296頁
【非特許文献7】Cebratら、Pol.J Chem、1997年、71巻、1401頁
【非特許文献8】Karczmarekら、Biopolymers、2002年、63巻、343〜357頁
【非特許文献9】Zubrzakら、Biopolymers(Peptide Science)、2005年、80巻、347〜356頁
【非特許文献10】Katarzynskaら、J Pept Sci、2009年、14巻、1283〜1294頁
【非特許文献11】Journal of Organic Chemistryの各巻の最初の号
【非特許文献12】Merrifield、J.Am.Chem.Soc、85巻:2149頁(1964年)
【非特許文献13】Houghten、Proc.Natl.Acad.Sci.USA、82巻:5132頁(1985年)
【非特許文献14】Kelley & Winkler in Genetic Engineering Principles and Methods、Setlow,J.K.編。Plenum Press、N.Y.、第12巻、1〜19頁(1990年)
【非特許文献15】Stewart & Young、Solid Phase Peptide Synthesis、Pierce Chemical Co.、Rockford,M.(1984年)
【非特許文献16】Merglerら(1988年)Tetrahedron Letters 29巻:4005〜4008頁
【非特許文献17】Merglerら(1988年)Tetrahedron Letters 29巻:4009〜4012頁
【非特許文献18】Kamberら(編)、Peptides,Chemistry and Biology、ESCOM,Leiden(1992年)525〜526頁
【非特許文献19】Rinikerら(1993)Tetrahedron Letters 49巻:9307〜9320頁
【非特許文献20】Lloyd−Williamsら(1993年)Tetrahedron Letters 49巻:11065〜11133頁
【非特許文献21】Anderssonら(2000年)Biopolymers 55巻:227〜250頁
【非特許文献22】Bray、Nature Reviews 2巻:587〜593頁(2003年)
【非特許文献23】Guillerら、Chem Rev.2000年、100巻、2091〜2157頁
【非特許文献24】Physician’s Desk Reference
【非特許文献25】Noonanら、Int.Arch.Allergy Appl.Immunol.、1978年、56巻、523〜532頁
【非特許文献26】Hansenら、J Immunol Methods、1989年、119巻、203〜210頁
【非特許文献27】Mishellら、J Exp Med、1967年、126巻、423〜442頁
【非特許文献28】Espevikら、J.Immunol.Methods、95巻(1986年):99〜103頁
【非特許文献29】Yamamoto、Eur.J.Pharmacol.、2006年、550巻、166〜172頁
【非特許文献30】Hansen MB、J Immunol Methods、1989年、119巻、203〜210頁
【発明の概要】
【課題を解決するための手段】
【0009】
本発明の実施形態によると、式Iを有する化合物:
【0010】
【化1】

式中、
【0011】
k、m、n、及びpは、各々独立して0、1、又は2であり、
【0012】
R及びR’は、各々独立してH及びC1〜3アルキルから選択されるか、又はR及びR’は、一緒になって−CR1R1’−X−CH2−であり、ここでCR1R1’は骨格窒素に結合されており、R1及びR1’は、各々独立してH及びC1〜3アルキルから選択され、Xは、−CH2−、−CH2CH2−、−CH(OH)−、−O−、−S−、及び−NH−から選択され、
【0013】
R’’及びR’’’は、各々独立してH及びC1〜3アルキルから選択されるか、又はR’’及びR’’’は、一緒になって−CR2R2’−X’−CH2−であり、ここでCR2R2’は骨格窒素に結合されており、R2及びR2’は、各々独立してH及びC1〜3アルキルから選択され、X’は、−CH2−、−CH2CH2−、−CH(OH)−、−O−、−S−、及び−NH−から選択され、
【0014】
R3及びR4は、各々独立してアリール、置換アリール、へテロアリール、及び置換へテロアリールから選択される化合物、
【0015】
又はその薬学的に許容される塩が提供される。
【0016】
幾つかの実施形態では、R3及びR4の少なくとも1つは、フェニルである。幾つかの実施形態では、R3及びR4の少なくとも1つは、4−ヒドロキシフェニルである。幾つかの実施形態では、R3及びR4の少なくとも1つは、4−t−ブトキシフェニルである。幾つかの実施形態では、R3及びR4の少なくとも1つは、2−インドリルである。幾つかの実施形態では、R3及びR4は両方とも、フェニルである。幾つかの実施形態では、R3及びR4の一方はフェニルであり、R3及びR4の他方は、4−ヒドロキシフェニルである。幾つかの実施形態では、R3及びR4の一方はフェニルであり、R3及びR4の他方は、4−t−ブトキシフェニルである。幾つかの実施形態では、R3及びR4の一方はフェニルであり、R3及びR4の他方は、2−インドリルである。幾つかの実施形態では、−CH2−R3に結合された炭素は、絶対(R)立体化学を有する。幾つかの実施形態では、−CH2−R3に結合された炭素は、絶対(S)立体化学を有する。幾つかの実施形態では、−CH2−R4に結合された炭素は、絶対(R)立体化学を有する。幾つかの実施形態では、−CH2−R4に結合された炭素は、絶対(S)立体化学を有する。幾つかの実施形態では、k、m、n、及びpのうちの1つは1であり、k、m、n、及びpの残りは0である。幾つかの実施形態では、k、m、n、及びpのうちの2つは1であり、k、m、n、及びpの残りは0である。幾つかの実施形態では、k及びmの少なくとも1つは、0ではない。幾つかの実施形態では、n及びpの少なくとも1つは、0ではない。幾つかの実施形態では、k及びmの少なくとも1つは、0ではなく、n及びpの少なくとも1つは、0ではない。幾つかの実施形態では、k及びnは両方とも、0である。幾つかの実施形態では、k及びnは両方とも0であり、m及びpの一方は0であり、m及びpの他方は、1である。幾つかの実施形態では、k及びnは両方とも0であり、m及びpは両方とも1である。幾つかの実施形態では、4つのアミノ酸は全てL−アミノ酸である。幾つかの実施形態では、アミノ酸のうちの3つはL−アミノ酸であり、アミノ酸のうちの1つはD−アミノ酸である。幾つかの実施形態では、アミノ酸のうちの2つはL−アミノ酸であり、アミノ酸のうちの2つはD−アミノ酸である。幾つかの実施形態では、アミノ酸のうちの1つはL−アミノ酸であり、アミノ酸のうちの3つはD−アミノ酸である。幾つかの実施形態では、4つのアミノ酸は全てD−アミノ酸である。
【0017】
幾つかの実施形態では、R及びR’は、一緒になって−(CH2)3−を形成し、つまりR及びR’は、一緒になって−CR1R1’−X−CH2−を形成し、式中R1及びR1’は両方ともHであり、XはCH2である。幾つかの実施形態では、R’’及びR’’’は、一緒になって−(CH2)3−を形成し、つまりR’’及びR’’’は、一緒になって−CR2R2’−X’−CH2−を形成し、式中R2及びR2’は両方ともHであり、X’はCH2である。幾つかの実施形態では、R及びR’は、一緒になって−(CH2)4−を形成し、つまりR及びR’は、一緒になって−CR1R1’−X−CH2−を形成し、式中R1及びR1’は両方ともHであり、Xは(CH2)2である。幾つかの実施形態では、R’’及びR’’’は、一緒になって−(CH2)4−を形成し、つまりR’’及びR’’’は、一緒になって−CR2R2’−X−CH2−を形成し、式中R2及びR2’は両方ともHであり、Xは(CH2)2である。幾つかの実施形態では、R及びR’は、一緒になって−CH2−CH(OH)−CH2−を形成し、つまりR及びR’は、一緒になって−CR1R1’−X−CH2−を形成し、式中R1及びR1’は両方ともHであり、XはCH(OH)である。幾つかの実施形態では、R’’及びR’’’は、一緒になって−CH2−CH(OH)−CH2−を形成し、つまりR’’及びR’’’は、一緒になって−CR2R2’−X’−CH2−を形成し、式中R2及びR2’は両方ともHであり、X’はCH(OH)である。R及びR’が一緒になっている幾つかの実施形態では、R’が結合されている炭素は、絶対(S)立体化学を有する。R及びR’が一緒になっている幾つかの実施形態では、R’が結合されている炭素は、絶対(R)立体化学を有する。R’’及びR’’’が一緒になっている幾つかの実施形態では、R’’’が結合されている炭素は、絶対(S)立体化学を有する。R’’及びR’’’が一緒になっている幾つかの実施形態では、R’’’が結合されている炭素は、絶対(R)立体化学を有する。
【0018】
幾つかの実施形態では、化合物は、以下のものからなる群から選択される:
【0019】
【化2】

I−1(環式(−Pro−Pro−β3hoPhe−Phe−))、
【0020】
【化3】

I−2(環式(−Pro−Pro−Phe−β3hoPhe−))、
【0021】
【化4】

I−3(環式(−Pro−Pro−β3hoPhe−β3hoPhe−))、
【0022】
【化5】

I−4(環式(−Pro−Pro−β3hoPhe−Trp−))、
【0023】
【化6】

I−5(環式(−Pro−Pro−β3hoPhe−Tyr−))、
【0024】
【化7】

I−6(環式(−Pro−Pro−β3hoPhe−Tyr(t−Bu)−))、
【0025】
【化8】

I−7(環式(−Pro−Pip−β3hoPhe−Phe−))、及び
【0026】
【化9】

I−8(環式(Pro−Hyp−β3hoPhe−Phe−))。
幾つかの実施形態では、化合物は、式I−1の化合物である。幾つかの実施形態では、化合物は、式I−2の化合物である。幾つかの実施形態では、化合物は、式I−3の化合物である。幾つかの実施形態では、化合物は、式I−4の化合物である。幾つかの実施形態では、化合物は、式I−5の化合物である。幾つかの実施形態では、化合物は、式I−6の化合物である。幾つかの実施形態では、化合物は、式I−7の化合物である。幾つかの実施形態では、化合物は、式I−8の化合物である。
【0027】
幾つかの実施形態では、化合物は、以下のものからなる群から選択される:
【0028】
【化10】

I−A
(環式(−(L)−Pro−(L)−Pro−(L)−β3hoPhe−(L)−Phe−))、
【0029】
【化11】

I−B
(環式(−(L)−Pro−(L)−Pro−(L)−Phe−(L)−β3hoPhe−))、
【0030】
【化12】

I−C
(環式(−(L)−Pro−(L)−Pro−(L)−β3hoPhe−(L)−β3hoPhe−))、
【0031】
【化13】

I−D
(環式(−(L)−Pro−(L)−Pro−(L)−β3HoPhe−(D)−Phe−))、
【0032】
【化14】

I−E
(環式(−(D)−Pro−(D)−Pro−(L)−β3HoPhe−(D)−Phe−))、
【0033】
【化15】

I−F
(環式(−(D)−Pro−(L)−Pro−(L)−β3HoPhe−(L)−Phe−))、
【0034】
【化16】

I−G
(環式(−(L)−Pro−(L)−Pro−(D)−β3HoPhe−(L)−Phe−)、
【0035】
【化17】

I−H
(環式(−(L)−Pro−(D)−Pro−(L)−β3HoPhe−(L)−Phe−)、
【0036】
【化18】

I−J
(環式(−(D)−Pro−(D)−Pro−(D)−β3HoPhe−(D)−Phe−)、
【0037】
【化19】

I−K
(環式(−(D)−Pro−(D)−Pro−(L)−β3HoPhe−(L)−Phe−)、
【0038】
【化20】

I−L
(環式(−(L)−Pro−(L)−Pro−(L)−β3HoPhe−(L)−Trp−)、
【0039】
【化21】

I−M
(c(−(L)−Pro−(L)−Pro−(L)−β3HoPhe−(L)−Tyr−)、
【0040】
【化22】

I−N
(環式[−(L)−Pro−(L)−Pro−(L)−β3HoPhe−(L)−Tyr(tBu)−])、
【0041】
【化23】

I−O
(環式(−(L)−Pro−(L)−Pip−(L)−β3HoPhe−(L)−Phe−))、及び
【0042】
【化24】

I−P
(環式(−(L)−Pro−(L)−t−Hyp−(L)−β3HoPhe−(L)−Phe−))。
幾つかの実施形態では、化合物は、式1−Aの化合物である。幾つかの実施形態では、化合物は、式I−Bの化合物である。幾つかの実施形態では、化合物は、式I−Cの化合物である。幾つかの実施形態では、化合物は、式I−Dの化合物である。幾つかの実施形態では、化合物は、式I−Eの化合物である。幾つかの実施形態では、化合物は、式I−Fの化合物である。幾つかの実施形態では、化合物は、式I−Gの化合物である。幾つかの実施形態では、化合物は、式I−Hの化合物である。幾つかの実施形態では、化合物は、式I−Lの化合物である。幾つかの実施形態では、化合物は、式I−Jの化合物である。幾つかの実施形態では、化合物は、式I−Kの化合物である。幾つかの実施形態では、化合物は、式I−Lの化合物である。幾つかの実施形態では、化合物は、式I−Mの化合物である。幾つかの実施形態では、化合物は、式I−Nの化合物である。幾つかの実施形態では、化合物は、式I−Oの化合物である。幾つかの実施形態では、化合物は、式I−Pの化合物である。
【0043】
幾つかの実施形態では、式Iの化合物中の1つ又は複数のアミノ基は、保護された形態である。
【0044】
また、本発明の実施形態によると、式Iの化合物及びその薬学的に許容される担体、賦形剤、又は希釈剤を含む医薬組成物が提供される。幾つかの実施形態では、化合物は、式I−1の化合物である。幾つかの実施形態では、化合物は、式I−2の化合物である。幾つかの実施形態では、化合物は、式I−3の化合物である。幾つかの実施形態では、化合物は、式I−4の化合物である。幾つかの実施形態では、化合物は、式I−5の化合物である。幾つかの実施形態では、化合物は、式I−6の化合物である。幾つかの実施形態では、化合物は、式I−7の化合物である。幾つかの実施形態では、化合物は、式I−8の化合物である。幾つかの実施形態では、化合物は、式I−Aの化合物である。幾つかの実施形態では、化合物は、式I−Bの化合物である。幾つかの実施形態では、化合物は、式I−Cの化合物である。幾つかの実施形態では、化合物は、式I−Dの化合物である。幾つかの実施形態では、化合物は、式I−Eの化合物である。幾つかの実施形態では、化合物は、式I−Fの化合物である。幾つかの実施形態では、化合物は、式I−Gの化合物である。幾つかの実施形態では、化合物は、式I−Hの化合物である。幾つかの実施形態では、化合物は、式I−Jの化合物である。幾つかの実施形態では、化合物は、式I−Kの化合物である。幾つかの実施形態では、化合物は、式I−Lの化合物である。幾つかの実施形態では、化合物は、式I−Mの化合物である。幾つかの実施形態では、化合物は、式I−Nの化合物である。幾つかの実施形態では、化合物は、式I−Oの化合物である。幾つかの実施形態では、化合物は、式I−Pの化合物である。
【0045】
また、本発明の実施形態によると、患者の免疫応答を抑制する方法であって、その必要性のある患者に有効量の式Iの化合物を投与することを含む方法が提供される。幾つかの実施形態では、抑制される免疫応答は、炎症である。幾つかの実施形態では、抑制される免疫応答は、移植拒絶反応である。幾つかの実施形態では、化合物は、式I−1の化合物である。幾つかの実施形態では、化合物は、式I−2の化合物である。幾つかの実施形態では、化合物は、式I−3の化合物である。幾つかの実施形態では、化合物は、式I−4の化合物である。幾つかの実施形態では、化合物は、式I−5の化合物である。幾つかの実施形態では、化合物は、式I−6の化合物である。幾つかの実施形態では、化合物は、式I−7の化合物である。幾つかの実施形態では、化合物は、式I−8の化合物である。幾つかの実施形態では、化合物は、式I−Aの化合物である。幾つかの実施形態では、化合物は、式I−Bの化合物である。幾つかの実施形態では、化合物は、式I−Cの化合物である。幾つかの実施形態では、化合物は、式I−Dの化合物である。幾つかの実施形態では、化合物は、式I−Eの化合物である。幾つかの実施形態では、化合物は、式I−Fの化合物である。幾つかの実施形態では、化合物は、式I−Gの化合物である。幾つかの実施形態では、化合物は、式I−Hの化合物である。幾つかの実施形態では、化合物は、式I−Jの化合物である。幾つかの実施形態では、化合物は、式I−Kの化合物である。幾つかの実施形態では、化合物は、式I−Lの化合物である。幾つかの実施形態では、化合物は、式I−Mの化合物である。幾つかの実施形態では、化合物は、式I−Nの化合物である。幾つかの実施形態では、化合物は、式I−Oの化合物である。幾つかの実施形態では、化合物は、式I−Pの化合物である。
【0046】
また、本発明の実施形態によると、患者の免疫関連疾患又は状態を治療又は予防する方法であって、その必要性のある患者に有効量の式Iの化合物を投与することを含む方法が提供される。また、本発明の実施形態によると、第2の薬物の毒性特性を低下させる方法であって、第2の薬物と共に式Iの化合物を投与することを含む方法が提供される。幾つかの実施形態では、免疫媒介性疾患又は状態は、自己免疫疾患、炎症プロセス、移植拒絶反応、及びアレルギー反応からなる群から選択される。幾つかの実施形態では、免疫媒介性疾患又は状態は、乾癬、扁平苔癬、及び他の丘疹鱗屑疾患から選択される。幾つかの実施形態では、免疫媒介性疾患又は状態は、湿疹及び皮膚炎から選択される。幾つかの実施形態では、湿疹(eczemea)又は皮膚炎は、湿疹、アトピー性湿疹、脂漏性皮膚炎、及び汗疱から選択される。幾つかの実施形態では、免疫媒介性疾患又は状態は、日光に対する皮膚反応である。幾つかの実施形態では、免疫媒介性疾患又は状態は、非特異的皮層刺激及び昆虫刺傷から選択される。幾つかの実施形態では、免疫媒介性疾患又は状態は、じんま疹である。幾つかの実施形態では、免疫媒介性疾患又は状態は、原発性皮膚腫瘍(例えば、黒色腫);関節リウマチ(自己免疫性及び感染誘発性の両方);クローン病;炎症性腸疾患;過敏性腸症候群;神経変性疾患(例えば、多発性硬化症);パーキンソン病;移植片対宿主反応;重症乾癬;及びアトピー性皮膚炎からなる群から選択される。幾つかの実施形態では、式Iの化合物は、化学療法薬の毒性効果を低減するために、化学療法薬と共に投与される。幾つかの実施形態では、化合物は、式I−1の化合物である。幾つかの実施形態では、化合物は、式I−2の化合物である。幾つかの実施形態では、化合物は、式I−3の化合物である。幾つかの実施形態では、化合物は、式I−4の化合物である。幾つかの実施形態では、化合物は、式I−5の化合物である。幾つかの実施形態では、化合物は、式I−6の化合物である。幾つかの実施形態では、化合物は、式I−7の化合物である。幾つかの実施形態では、化合物は、式I−8の化合物である。幾つかの実施形態では、化合物は、式I−Aの化合物である。幾つかの実施形態では、化合物は、式I−Bの化合物である。幾つかの実施形態では、化合物は、式I−Cの化合物である。幾つかの実施形態では、化合物は、式I−Dの化合物である。幾つかの実施形態では、化合物は、式I−Eの化合物である。幾つかの実施形態では、化合物は、式I−Fの化合物である。幾つかの実施形態では、化合物は、式I−Gの化合物である。幾つかの実施形態では、化合物は、式I−Hの化合物である。幾つかの実施形態では、化合物は、式I−Jの化合物である。幾つかの実施形態では、化合物は、式I−Kの化合物である。幾つかの実施形態では、化合物は、式I−Lの化合物である。幾つかの実施形態では、化合物は、式I−Mの化合物である。幾つかの実施形態では、化合物は、式I−Nの化合物である。幾つかの実施形態では、化合物は、式I−Oの化合物である。幾つかの実施形態では、化合物は、式I−Pの化合物である。
【0047】
また、本発明の実施形態によると、(a)患者の免疫応答を抑制するか、(b)患者の免疫媒介性疾患又は状態を治療又は予防するか、又は(c)第2の薬物の毒性特性を低下させるための式Iの化合物及び化合物を使用するための説明書を含むキットが提供される。幾つかの実施形態では、免疫応答は、炎症である。幾つかの実施形態では、免疫応答は、移植拒絶反応である。幾つかの実施形態では、免疫媒介性疾患又は状態は、自己免疫疾患、炎症プロセス、移植拒絶反応、及びアレルギー反応からなる群から選択される。幾つかの実施形態では、免疫媒介性疾患又は状態は、乾癬、扁平苔癬、及び他の丘疹鱗屑疾患から選択される。幾つかの実施形態では、免疫媒介性疾患又は状態は、湿疹及び皮膚炎から選択される。幾つかの実施形態では、湿疹又は皮膚炎は、湿疹、アトピー性湿疹、脂漏性皮膚炎、及び汗疱から選択される。幾つかの実施形態では、免疫媒介性疾患又は状態は、日光に対する皮膚反応である。幾つかの実施形態では、免疫媒介性疾患又は状態は、非特異的皮層刺激及び昆虫刺傷から選択される。幾つかの実施形態では、免疫媒介性疾患又は状態は、じんま疹である。幾つかの実施形態では、免疫媒介性疾患又は状態は、原発性皮膚腫瘍(例えば、黒色腫);関節リウマチ(自己免疫性及び感染誘発性の両方);クローン病;炎症性腸疾患;過敏性腸症候群;神経変性疾患(例えば、多発性硬化症);パーキンソン病;移植片対宿主反応;重症乾癬;及びアトピー性皮膚炎からなる群から選択される。幾つかの実施形態では、説明書には、化学療法薬の毒性効果を低減するために、式Iの化合物を化学療法薬と共に投与することが指示されている。幾つかの実施形態では、化合物は、式I−1の化合物である。幾つかの実施形態では、化合物は、式I−2の化合物である。幾つかの実施形態では、化合物は、式I−3の化合物である。幾つかの実施形態では、化合物は、式I−4の化合物である。幾つかの実施形態では、化合物は、式I−5の化合物である。幾つかの実施形態では、化合物は、式I−6の化合物である。幾つかの実施形態では、化合物は、式I−7の化合物である。幾つかの実施形態では、化合物は、式I−8の化合物である。幾つかの実施形態では、化合物は、式I−Aの化合物である。幾つかの実施形態では、化合物は、式I−Bの化合物である。幾つかの実施形態では、化合物は、式I−Cの化合物である。幾つかの実施形態では、化合物は、式I−Dの化合物である。幾つかの実施形態では、化合物は、式I−Eの化合物である。幾つかの実施形態では、化合物は、式I−Fの化合物である。幾つかの実施形態では、化合物は、式I−Gの化合物である。幾つかの実施形態では、化合物は、式I−Hの化合物である。幾つかの実施形態では、化合物は、式I−Jの化合物である。幾つかの実施形態では、化合物は、式I−Kの化合物である。幾つかの実施形態では、化合物は、式I−Lの化合物である。幾つかの実施形態では、化合物は、式I−Mの化合物である。幾つかの実施形態では、化合物は、式I−Nの化合物である。幾つかの実施形態では、化合物は、式I−Oの化合物である。幾つかの実施形態では、化合物は、式I−Pの化合物である。
【0048】
また、本発明の実施形態によると、式Iの化合物を製造する方法であって、式II−1、II−2、II−3、又はII−4を有する化合物を環化して、対応する式Iの化合物にすることを含む方法が提供され、式中、R、R’、R’’、R’’’、R3、R4、k、m、n、及びpは、式Iで定義された通りである(以下、式IIの化合物と総称する):
【0049】
【化25】

II−1
【0050】
【化26】

II−2
【0051】
【化27】

II−3
【0052】
【化28】

II−4
幾つかの実施形態では、この方法は、式II−1、II−2、II−3、又はII−4の化合物を合成することを更に含む。幾つかの実施形態では、式II−1、II−2、II−3、又はII−4の化合物は、固相合成により形成される。
【0053】
また、本発明の実施形態によると、式II−1、II−2、II−3、及びII−4の化合物それ自体、並びにこれら化合物の保護型(例えば、N末端アミノ基又は側鎖アミノ基等の1つ又は複数のアミノ基が、例えば、tert−ブトキシカルボニルにより保護されている)及び固相レジンに結合されている場合は、保護又は非保護形態のこれら化合物が提供される。以下では、別様に指定されていない限り又は所与の状況において非論理的でない限り、式IIの化合物又はその亜属または亜種を参照する場合、そのような参照は、(a)(i)少なくとも部分的に保護されているか、又は(a)(ii)完全に非保護又は脱保護されている形態の化合物;(b)(i)レジンに(1)直接的に又は(2)リンカーを介して結合されているか、又は(b)(ii)レジンに結合されない形態の化合物;又は条件(a)及び(b)の組み合わせを含むことが意図されている。更に、本明細書に示される場合、便宜性のため、遊離非保護直鎖ペプチドは、中性分子として、即ちN末端にH2N−及びC末端基に−COOHを有する分子として示される。しかしながら、これらの部分並びに任意のイオン化可能な側鎖部分(例えば、側鎖のカルボン酸又はアミン部分)の実際の電荷は、周囲のpHに依存し、必ずしも示されている通りになるわけではないことが理解されるだろう。
【0054】
幾つかの実施形態では、式IIの化合物は、以下のものからなる群から選択される:
【0055】
【化29】

II−4−a (H−Pro−β3hoPhe−Phe−Pro−OH)、
【0056】
【化30】

II−1−a (H−Pro−Pro−β3hoPhe−Phe−OH)、
【0057】
【化31】

II−2−a (H2N−Phe−Pro−Pro−β3hoPhe−OH)、
【0058】
【化32】

II−3−a (H2N−β3hoPhe−Phe−Pro−Pro−OH)、
【0059】
【化33】

II−4−b (H−Pro−Pro−Phe−β3hoPhe−OH)、
【0060】
【化34】

II−1−b (H−Pro−Pro−Phe−β3hoPhe−OH)、
【0061】
【化35】

II−2−b (H2N−β3hoPhe−Pro−Pro−Phe−OH)、
【0062】
【化36】

II−3−b (H2N−Phe−β3hoPhe−Pro−Pro−OH)、
【0063】
【化37】

II−4−c (H−Pro−β3hoPhe−β3hoPhe−Pro−OH)、
【0064】
【化38】

II−l−c (H−Pro−Pro−β3hoPhe−β3hoPhe−OH)、
【0065】
【化39】

II−2−c (H2N−β3hoPhe−Pro−Pro−β3hoPhe−OH)、
【0066】
【化40】

II−3−c (H2N−β3hoPhe−β3hoPhe−Pro−Pro−−OH)、
【0067】
【化41】

II−4−d (H−Pro−Pro−β3hoPhe−Trp−OH)、
【0068】
【化42】

II−1−d (H−Pro−Pro−β3hoPhe−Trp−OH)、
【0069】
【化43】

II−2−d (H−Pro−Pro−β3hoPhe−Trp−OH)、
【0070】
【化44】

II−3−d (H2N−β3hoPhe−Trp−Pro−Pro−OH)、
【0071】
【化45】

II−4−e (H−Pro−β3hoPhe−Tyr−Pro−OH)、
【0072】
【化46】

II−1−e (H−Pro−Pro−β3hoPhe−Tyr−OH)、
【0073】
【化47】

II−2−e (H2N−Tyr−Pro−Pro−β3hoPhe−OH)、
【0074】
【化48】

II−3−e (H2N−β3hoPhe−Tyr−Pro−Pro−OH)、
【0075】
【化49】

II−4−f (H−Pro−β3hoPhe−Tyr(t−Bu)−Pro−OH)、
【0076】
【化50】

II−1−f (H−Pro−Pro−β3hoPhe−Tyr(t−Bu)−OH)、
【0077】
【化51】

II−2−f (H2N−Tyr(t−Bu)−Pro−Pro−β3hoPhe−OH)、
【0078】
【化52】

II−3−f (H2N−β3hoPhe−Tyr(t−Bu)−Pro−Pro−OH)、
【0079】
【化53】

II−4−g (H−Pip−β3hoPhe−Phe−Pro−OH)、
【0080】
【化54】

II−1−g (H−Pro−Pip−β3hoPhe−Phe−OH)、
【0081】
【化55】

II−2−g (H2N−Phe−Pro−Pip−β3hoPhe−OH)、
【0082】
【化56】

II−3−g (H2N−β3hoPhe−Phe−Pro−Pip−OH)、
【0083】
【化57】

II−4−h (H−Hyp−β3hoPhe−Phe−Pro−OH)、
【0084】
【化58】

II−1−h (H−Pro−Hyp−β3hoPhe−Phe−OH)、
【0085】
【化59】

II−2−h (H2N−Phe−Pro−Hyp−β3hoPhe−OH)、及び
【0086】
【化60】

II−3−h (H2N−β3hoPhe−Phe−Pro−Hyp−OH)。
幾つかの実施形態では、化合物は、式II−4−aの化合物である。幾つかの実施形態では、化合物は、式II−1−aの化合物である。幾つかの実施形態では、化合物は、式II−2−aの化合物である。幾つかの実施形態では、化合物は、式II−3−aの化合物である。幾つかの実施形態では、化合物は、式II−4−bの化合物である。幾つかの実施形態では、化合物は、式II−1−bの化合物である。幾つかの実施形態では、化合物は、式II−2−bの化合物である。幾つかの実施形態では、化合物は、式II−3−bの化合物である。幾つかの実施形態では、化合物は、式II−4−cの化合物である。幾つかの実施形態では、化合物は、式II−1−cの化合物である。幾つかの実施形態では、化合物は、式II−2−cの化合物である。幾つかの実施形態では、化合物は、式II−3−cの化合物である。幾つかの実施形態では、化合物は、式II−4−dの化合物である。幾つかの実施形態では、化合物は、式II−1−dの化合物である。幾つかの実施形態では、化合物は、式II−2−dの化合物である。幾つかの実施形態では、化合物は、式II−3−dの化合物である。幾つかの実施形態では、化合物は、式II−4−eの化合物である。幾つかの実施形態では、化合物は、式II−1−eの化合物である。幾つかの実施形態では、化合物は、式II−2−eの化合物である。幾つかの実施形態では、化合物は、式II−3−eの化合物である。幾つかの実施形態では、化合物は、式II−4−fの化合物である。幾つかの実施形態では、化合物は、式II−1−fの化合物である。幾つかの実施形態では、化合物は、式II−2−fの化合物である。幾つかの実施形態では、化合物は、式II−3−fの化合物である。幾つかの実施形態では、化合物は、式II−4−gの化合物である。幾つかの実施形態では、化合物は、式II−1−gの化合物である。幾つかの実施形態では、化合物は、式II−2−gの化合物である。幾つかの実施形態では、化合物は、式II−3−gの化合物である。幾つかの実施形態では、化合物は、式II−4−hの化合物である。幾つかの実施形態では、化合物は、式II−1−hの化合物である。幾つかの実施形態では、化合物は、式II−2−hの化合物である。幾つかの実施形態では、化合物は、式II−3−hの化合物である。
【0087】
幾つかの実施形態では、式IIの化合物は、以下のものからなる群から選択される:
【0088】
【化61】

II−A−1、
【0089】
【化62】

II−A−2、
【0090】
【化63】

II−A−3、
【0091】
【化64】

II−A−4、
【0092】
【化65】

II−B−1、
【0093】
【化66】

II−B−2、
【0094】
【化67】

II−B−3、
【0095】
【化68】

II−B−4、
【0096】
【化69】

II−C−1、
【0097】
【化70】

II−C−2、
【0098】
【化71】

II−C−3、
【0099】
【化72】

II−C−4、
【0100】
【化73】

II−D−1、
【0101】
【化74】

II−D−2、
【0102】
【化75】

II−D−3、
【0103】
【化76】

II−D−4、
【0104】
【化77】

II−E−1、
【0105】
【化78】

II−E−2、
【0106】
【化79】

II−E−3、
【0107】
【化80】

II−E−4、
【0108】
【化81】

II−F−1、
【0109】
【化82】

II−F−2、
【0110】
【化83】

II−F−3、
【0111】
【化84】

II−F−4、
【0112】
【化85】

II−G−1、
【0113】
【化86】

II−G−2、
【0114】
【化87】

II−G−3、
【0115】
【化88】

II−G−4、
【0116】
【化89】

II−H−1、
【0117】
【化90】

II−H−2、
【0118】
【化91】

II−H−3、
【0119】
【化92】

II−H−4、
【0120】
【化93】

II−J−1、
【0121】
【化94】

II−J−2、
【0122】
【化95】

II−J−3、
【0123】
【化96】

II−J−4、
【0124】
【化97】

II−K−1、
【0125】
【化98】

II−K−2、
【0126】
【化99】

II−K−3、
【0127】
【化100】

II−K−4、
【0128】
【化101】

II−L−1、
【0129】
【化102】

II−L−2、
【0130】
【化103】

II−L−3、
【0131】
【化104】

II−L−4、
【0132】
【化105】

II−M−1、
【0133】
【化106】

II−M−2、
【0134】
【化107】

II−M−3、
【0135】
【化108】

II−M−4、
【0136】
【化109】

II−N−1、
【0137】
【化110】

II−N−2、
【0138】
【化111】

II−N−3、
【0139】
【化112】

II−N−4、
【0140】
【化113】

II−O−1、
【0141】
【化114】

II−O−2、
【0142】
【化115】

II−O−3、
【0143】
【化116】

II−O−4、
【0144】
【化117】

II−P−1、
【0145】
【化118】

II−P−2、
【0146】
【化119】

II−P−3、及び
【0147】
【化120】

II−P−4。
【0148】
幾つかの実施形態では、化合物は、式II−A−1の化合物である。幾つかの実施形態では、化合物は、式II−A−2の化合物である。幾つかの実施形態では、化合物は、式II−A−3の化合物である。幾つかの実施形態では、化合物は、式II−A−4の化合物である。幾つかの実施形態では、化合物は、式II−B−1の化合物である。幾つかの実施形態では、化合物は、式II−B−2の化合物である。幾つかの実施形態では、化合物は、式II−B−3の化合物である。幾つかの実施形態では、化合物は、式II−B−4の化合物である。幾つかの実施形態では、化合物は、式II−C−1の化合物である。幾つかの実施形態では、化合物は、式II−C−2の化合物である。幾つかの実施形態では、化合物は、式II−C−3の化合物である。幾つかの実施形態では、化合物は、式II−C−4の化合物である。幾つかの実施形態では、化合物は、式II−D−1の化合物である。幾つかの実施形態では、化合物は、式II−D−2の化合物である。幾つかの実施形態では、化合物は、式II−D−3の化合物である。幾つかの実施形態では、化合物は、式II−D−4の化合物である。幾つかの実施形態では、化合物は、式II−E−1の化合物である。幾つかの実施形態では、化合物は、式II−E−2の化合物である。幾つかの実施形態では、化合物は、式II−E−3の化合物である。幾つかの実施形態では、化合物は、式II−E−4の化合物である。幾つかの実施形態では、化合物は、式II−F−1の化合物である。幾つかの実施形態では、化合物は、式II−F−2の化合物である。幾つかの実施形態では、化合物は、式II−F−3の化合物である。幾つかの実施形態では、化合物は、式II−F−4の化合物である。幾つかの実施形態では、化合物は、式II−G−1の化合物である。幾つかの実施形態では、化合物は、式II−G−2の化合物である。幾つかの実施形態では、化合物は、式II−G−3の化合物である。幾つかの実施形態では、化合物は、式II−G−4の化合物である。幾つかの実施形態では、化合物は、式II−H−1の化合物である。幾つかの実施形態では、化合物は、式II−H−2の化合物である。幾つかの実施形態では、化合物は、式II−H−3の化合物である。幾つかの実施形態では、化合物は、式II−H−4の化合物である。幾つかの実施形態では、化合物は、式II−J−1の化合物である。幾つかの実施形態では、化合物は、式II−J−2の化合物である。幾つかの実施形態では、化合物は、式II−J−3の化合物である。幾つかの実施形態では、化合物は、式II−J−4の化合物である。幾つかの実施形態では、化合物は、式II−K−1の化合物である。幾つかの実施形態では、化合物は、式II−K−2の化合物である。幾つかの実施形態では、化合物は、式II−K−3の化合物である。幾つかの実施形態では、化合物は、式II−K−4の化合物である。幾つかの実施形態では、化合物は、式II−L−1の化合物である。幾つかの実施形態では、化合物は、式II−L−2の化合物である。幾つかの実施形態では、化合物は、式II−L−3の化合物である。幾つかの実施形態では、化合物は、式II−L−4の化合物である。幾つかの実施形態では、化合物は、式II−M−1の化合物である。幾つかの実施形態では、化合物は、式II−M−2の化合物である。幾つかの実施形態では、化合物は、式II−M−3の化合物である。幾つかの実施形態では、化合物は、式II−M−4の化合物である。幾つかの実施形態では、化合物は、式II−N−1の化合物である。幾つかの実施形態では、化合物は、式II−N−2の化合物である。幾つかの実施形態では、化合物は、式II−N−3の化合物である。幾つかの実施形態では、化合物は、式II−N−4の化合物である。幾つかの実施形態では、化合物は、式II−O−1の化合物である。幾つかの実施形態では、化合物は、式II−O−2の化合物である。幾つかの実施形態では、化合物は、式II−O−3の化合物である。幾つかの実施形態では、化合物は、式II−O−4の化合物である。幾つかの実施形態では、化合物は、式II−P−1の化合物である。幾つかの実施形態では、化合物は、式II−P−2の化合物である。幾つかの実施形態では、化合物は、式II−P−3の化合物である。幾つかの実施形態では、化合物は、式II−P−4の化合物である。
【0149】
式Iの化合物は、免疫抑制活性及び/又は抗炎症活性を示し、同時に幾つかの公知の化合物よりも低い毒性を示すことが見いだされた。したがって、式Iの化合物は、免疫抑制剤及び/又は抗炎症剤として有用であり得る。本明細書で使用される場合、用語「免疫媒介性」は、身体の免疫系が過剰反応する及び/又は身体を攻撃する疾患又は状態を指す。
【0150】
本明細書の全体にわたって、用語及び置換基は、それらの定義を保持する。
【0151】
「アルキル」は、直鎖、分岐鎖、又は環式飽和炭化水素構造、及びそれらの組み合わせを含むことが意図されている。低級アルキルは、1〜6個の炭素原子のアルキル基を指す。低級アルキル基の例には、メチル、エチル、プロピル、イソプロピル、ブチル、並びにs−及びt−ブチル等が含まれる。好ましいアルキル基は、C20以下のものである。シクロアルキルは、アルキルのサブセットであり、3〜8個の炭素原子の環式炭化水素基が含まれる。シクロアルキル基の例には、c−プロピル、c−ブチル、c−ペンチル、及びノルボルニル等が含まれる。
【0152】
C1〜C20の炭化水素には、アルキル、シクロアルキル、ポリシクロアルキル、アルケニル、アルキニル、アリール、及びそれらの組み合わせが含まれる。例には、ベンジル、フェネチル、シクロヘキシルメチル、カンホリル、及びナフチルエチルが含まれる。用語「炭素環」は、完全に炭素からなるが、任意の酸化状態からなる環系を含むことが意図される。したがって、(C3〜C10)炭素環は、シクロプロパン、ベンゼン、及びシクロヘキセン等の系を指し、(C8〜C12)炭素多環は、ノルボルナン、デカリン、インダン、及びナフタレン等の系を指す。
【0153】
アルコキシ又はアルコキシルは、酸素原子により親構成に結合された、直鎖、分岐鎖、環式配置、及びそれらの組み合わせの1〜8個の炭素原子の基を指す。例には、メトキシ、エトキシ、プロポキシ、イソプロポキシ、シクロプロピルオキシ、及びシクロヘキシルオキシ等が含まれる。低級アルコキシは、1〜4個の炭素を含有する基を指す。
【0154】
オキサアルキルは、1個又は複数の炭素が酸素により置換されているアルキル残基を指す。例には、メトキシプロポキシ、及び3,6,9−トリオキサデシル等が含まれる。
【0155】
アシルは、カルボニル官能基により親構成に結合された、直鎖、分岐鎖、環式配置、飽和、不飽和、及び芳香族、並びにそれらの組み合わせの1〜8個の炭素原子の基を指す。アシル残基の1個又は複数の炭素は、親構造との結合点が依然としてカルボニル基である限り、窒素、酸素、又は硫黄により置換されていてもよい。例には、アセチル、ベンゾイル、プロピオニル、イソブチリル、t−ブトキシカルボニル、及びベンジルオキシカルボニル等が含まれる。低級アシルは、1〜4個の炭素を含有する基を指す。
【0156】
アリールは、6員芳香族環、二環式9または10員芳香族環系、又は三環式13または14員芳香族環系を意味する。芳香族6員〜14員炭素環には、例えば、ベンゼン、ナフタレン、インダン、テトラリン、及びフルオレンが含まれる。
【0157】
へテロアリールは、O、N、またはSから選択される1〜3個のヘテロ原子を含有する5または6員ヘテロ芳香族環;O、N、またはSから選択される1〜3個のヘテロ原子を含有する二環式9または10員ヘテロ芳香族環系;又はO、N、またはSから選択される1〜3個のヘテロ原子を含有する三環式13または14員ヘテロ芳香族環系を意味する。5〜10員芳香族複素環には、例えば、イミダゾール、ピリジン、インドール、チオフェン、ベンゾピラノン、チアゾール、フラン、ベンズイミダゾール、キノリン、イソキノリン、キノキサリン、ピリミジン、ピラジン、テトラゾール、及びピラゾールが含まれる。
【0158】
アリールアルキルは、アリール残基がアルキルにより親構造に結合されている置換基を指す。例は、ベンジル及びフェネチル等である。へテロアリールアルキルは、へテロアリール残基がアルキルにより親構造に結合されている置換基を指す。例には、ピリジニルメチル及びピリミジニルエチル等が含まれる
【0159】
ヘテロ環は、1〜3個の炭素が、N、O、及びSからなる群から選択されるヘテロ原子により置換されているシクロアルキル又はアリール残基を意味する。窒素及び硫黄ヘテロ原子は、随意に酸化されていてもよく、窒素ヘテロ原子は、随意に四級化されていてもよい。ヘテロ環の例には、ピロリジン、ピラゾール、ピロール、インドール、キノリン、イソキノリン、テトラヒドロイソキノリン、ベンゾフラン、ベンゾジオキサン、ベンゾジオキソール(置換基として生じる場合、一般的にはメチレンジオキシフェニルと呼ばれる)、テトラゾール、モルホリン、チアゾール、ピリジン、ピリダジン、ピリミジン、チオフェン、フラン、オキサゾール、オキサゾリン、イソオキサゾール、ジオキサン、及びテトラヒドロフラン等が含まれる。へテロアリールは、ヘテロ環が芳香族であるヘテロ環のサブセットであることに留意すべきである。ヘテロシクリル残基の例には、以下のものが更に含まれる:ピペラジニル、2−オキソピペラジニル、2−オキソピペリジニル、2−オキソ−ピロリジニル、2−オキソアゼピニル、アゼピニル、4−ピペリジニル、ピラゾリジニル、イミダゾリル、イミダゾリニル、イミダゾリジニル、ピラジニル、オキサゾリジニル、イソオキサゾリジニル、チアゾリジニル、イソチアゾリル、キヌクリジニル、イソチアゾリジニル、ベンズイミダゾリル、チアジアゾリル、ベンゾピラニル、ベンゾチアゾリル、テトラヒドロフリル、テトラヒドロピラニル、チエニル、ベンゾチエニル、チアモルホリニル、チアモルホリニルスルホキシド、チアモルホリニルスルホン、オキサジアゾリル、トリアゾリル、及びテトラヒドロキノリニル。
【0160】
置換アルキル、アリール、シクロアルキル、ヘテロシクリル等は、各残基の最大3個のH原子が、アルキル、ハロゲン、ハロアルキル、ヒドロキシ、低級アルコキシ、カルボキシ、カルボアルコキシ(アルコキシカルボニルとも呼ばれる)、カルボキサミド(アルキルアミノカルボニルとも呼ばれる)、シアノ、カルボニル、ニトロ、アミノ、アルキルアミノ、ジアルキルアミノ、メルカプト、アルキルチオ、スルホキシド、スルホン、アシルアミノ、アミジノ、フェニル、ベンジル、へテロアリール、フェノキシ、ベンジルオキシ、又はヘテロアリールオキシで置換されているアルキル、アリール、シクロアルキル、又はヘテロシクリルを指す。
【0161】
用語「ハロゲン」は、フッ素、塩素、臭素、又はヨウ素を意味する。
【0162】
以下の略語及び用語は、全体にわたって、示されている意味を有する:
Boc=t−ブチルオキシカルボニル
c−=シクロ
DCM=ジクロロメタン=塩化メチレン=CH2Cl2
DIEA=N,N−ジイソプロピルエチルアミン
DIPEA=ジイソプロピルエチルアミン
DMF=N,N−ジメチルホルムアミド
Fmoc=9−フルオレニルメトキシカルボニル
HATU=O−(7−アザベンゾトリアゾール−1−イル)−1,1,3,3−テトラメチルウロニウムヘキサフルオロホスファート
HBTU=O−(ベンゾトリアゾール−1−イル)−1,1,3,3−テトラメチルウロニウムヘキサフルオロホスファート
HOAc=酢酸
HOAt=1−ヒドロキシ−7−アザベンゾトリアゾール
HOBt=1−ヒドロキシベンゾトリアゾール
Hyp=4−ヒドロキシプロリン
Me=メチル
Pip=ピペコリン酸
Phe=フェニルアラニン
Pro=プロリン
PyBOP=O−(ベンゾトリアゾール−1−イル)−トリスピロリジンホスホニウムヘキサフルオロホスファート
rt=室温
TBTU=O−(ベンゾトリアゾール−1−イル)−1,1,3,3−テトラメチルウロニウムテトラフルオロボラート
TFA=トリフルオロ酢酸
t−Hyp=trans−4−ヒドロキシプロリン
Trp=トリプトファン
Tyr=チロシン
Tyr(tBu)=(O−tert−ブチル)チロシン
【0163】
更に、有機化学者(つまり、当業者)が使用する略語の総合的リストは、Journal of Organic Chemistryの各巻の最初の号に掲載されている。このリストは、典型的には「標準的略語リスト」という題名の表に示されており、参照により本明細書中に組み込まれる。加えて、更なるメチレン基が骨格に存在する非天然アミノ酸に関して、「β3−Ho−」(又は「ベータ3−ホモ」)という表記は、本明細書では、側鎖を保持する炭素原子と末端窒素原子との間の骨格に追加のメチレン(−CH2−)を有するアミノ酸を指すために使用され、「β2−Ho−」(又は「ベータ2−ホモ」)という表記は、本明細書では、側鎖を保持する炭素原子と末端炭素原子との間の骨格に追加のメチレンを有するアミノ酸を指すために使用される。
【0164】
本発明の実施形態には、塩、特に酸付加塩の形態の式Iの化合物が含まれる。好適な塩には、有機酸及び無機酸の両方と形成されるものが含まれる。そのような酸付加塩は、通常は薬学的に許容されるだろうが、薬学的に許容される塩ではない塩が、目的化合物の調製及び精製に有用である場合がある。したがって、好ましい塩には、塩酸、臭化水素酸、硫酸、クエン酸、酒石酸、リン酸、乳酸、ピルビン酸、酢酸、コハク酸、シュウ酸、フマル酸、マレイン酸、オキサロ酢酸、メタンスルホン酸、エタンスルホン酸、p−トルエンスルホン酸、ベンゼンスルホン酸、及びイセチオン酸が含まれる。式Iの化合物の塩は、遊離塩基の形態の適切な化合物を適切な酸と反応させることにより製造することができる。
【0165】
本発明の実施形態によると、式Iの化合物は、環式テトラペプチドである。これらペプチドの合成は、それら自体が当技術分野で公知の方法を使用して合成される対応する直鎖ペプチドを環化することにより達成することができる。例えば、以下の文献を参照されたい:Merrifield、J.Am.Chem.Soc、85巻:2149頁(1964年);Houghten、Proc.Natl.Acad.Sci.USA、82巻:5132頁(1985年);Kelley & Winkler in Genetic Engineering Principles and Methods、Setlow,J.K.編、Plenum Press、N.Y.、第12巻、1〜19頁(1990年);Stewart & Young、Solid Phase Peptide Synthesis、Pierce Chemical Co.、Rockford,M.(1984年);Merglerら(1988年)Tetrahedron Letters 29巻:4005〜4008頁;Merglerら(1988年)Tetrahedron Letters 29巻:4009〜4012頁;Kamberら(編)、Peptides,Chemistry and Biology、ESCOM、Leiden(1992年)525〜526頁;Rinikerら(1993年)Tetrahedron Letters 49巻:9307〜9320頁;Lloyd−Williamsら(1993年)Tetrahedron Letters 49巻:11065〜11133頁;Anderssonら(2000年)Biopolymers 55巻:227〜250頁;Bray、Nature Reviews 2巻:587〜593頁(2003年)、米国特許第4,105,603号、第3,972,859号、第3,842,067号、第3,862,925号、第6,015,881号、第6,197,927号、及び第7,439,222号。そのような合成は、当技術分野で公知の液相合成又は固相合成により、又は両方の組み合わせにより達成することができる。
【0166】
液相合成法(溶液相法と呼ばれることがある)では、全て反応が、均一相中で実施される。連続したアミノ酸は、所望のペプチド材料が形成されるまで、溶液中で結合される。合成中、連続したペプチド中間体は、析出及び/又は洗浄により精製される。
【0167】
固相ペプチド合成(SPPS)では、最初のアミノ酸又はペプチド基が、レジン等の不溶性支持体に結合される。連続したアミノ酸又はペプチド基は、目的のペプチド材料が形成されるまで、最初のアミノ酸又はペプチド基に付加される。したがって、固相合成の産物は、不溶性支持体に結合されたペプチドである。その後、SPPS技術により合成されたペプチドは、レジンから切断され、切断されたペプチドは、単離される。
【0168】
より詳しくは、固相合成は、保護アミノ酸を不活性個体支持体に結合させることにより、想定ペプチドのカルボキシ末端から始まる。不活性個体支持体は、最初のアミノ酸のC末端のアンカーとしての役目を果たすことができれば、いかなる巨大分子であってもよい。典型的には、巨大分子支持体は、Stewart & Young、上記の2頁及び4頁の図1−1及び1−2に示されている架橋ポリマーレジン(例えば、ポリアミド又はポリスチレンレジン)である。幾つかの場合では、C末端アミノ酸は、ポリスチレンレジンに結合され、ベンジルエステルを形成する。巨大分子支持体は、ペプチドアンカー結合が、ペプチド合成中に保護アミノ酸のα−アミノ基を脱保護するのに使用される条件下で安定しているように選択される。塩基解離性のα保護基が使用される場合、ペプチドと個体支持体との間には酸解離性の結合を使用することが望ましい。例えば、上記のStewart & Young、16頁に記載のように、酸解離性エーテルレジンは、塩基解離性Fmocアミノ酸ペプチド合成に効果的である。或いは、酸分解に対して特異的に解離性があるペプチドアンカー結合及びα保護基を使用することができる。例えば、Stewart & Young、上記の11〜12頁に記載のように、フェニルアセトアミドメチル(Pam)レジン等のアミノメチルレジンは、Boc−アミノ酸ペプチド合成と共に良好に機能する。Guillerら、Chem Rev.2000年、100巻、2091〜2157頁には、ペプチド合成をはじめとする固相有機合成及びコンビナトリアルケミストリーにおけるリンカー及び切断戦略が概説されている。
【0169】
最初のアミノ酸を不活性固体支持体に結合した後、最初のアミノ酸のα−アミノ保護基を、例えば塩化メチレン中でトリフルオロ酢酸(TFA)により除去し、例えばトリエチルアミン(TEA)で中和する。最初のアミノ酸のα−アミノ基を脱保護した後、合成における次のα−アミノ及び側鎖が保護されたアミノ酸を付加する。その後、残りのα−アミノ及び必要に応じて側鎖が保護されたアミノ酸を、縮合により所望の順序で順次結合させて、固体支持体に結合された中間化合物を得る。或いは、幾つかのアミノ酸を互いに結合させて所望のペプチドの断片を形成し、その後そのペプチド断片を、伸長する固相ペプチド鎖に付加してもよい。
【0170】
2つのアミノ酸間の、又はアミノ酸とペプチドとの、又はペプチドとペプチドとの縮合反応は、アキシド(axide)法、混合酸無水物法、DCC(N,N’−ジシクロヘキシルカルボジイミド)又はDIC(N,N’−ジイソプロピルカルボジイミド)法、活性エステル法、p−ニトロフェニルエステル法、BOP(ベンゾトリアゾール−1−イル−オキシ−トリス[ジメチルアミノ]ホスホニウムヘキサフルオロホスファート)法、N−ヒドロキシコハク酸イミドエステル法等、及びウッドワード試薬K法等の通常の縮合反応により実施することができる。
【0171】
ペプチドの化学的合成においては、アミノ酸のあらゆる反応性側鎖基を好適な保護基で保護するのが一般的である。最終的に、これら保護基は、所望のポリペプチド鎖が順次構築された後、除去される。また、アミノ酸又はペプチド断片のα−アミノ基を保護するのが一般的であるが、アミノ酸又はペプチド断片のC末端カルボキシ基を、伸長する固相ポリペプチド鎖の遊離N末端基アミノ基と反応させ、その後α−アミノ保護基を選択的に除去して、次のアミノ酸又はペプチド断片の固相ポリペプチド鎖への付加を可能にする。したがって、ポリペプチド合成においては、個々の残基が側鎖保護基を依然として担持しているペプチド鎖に所望の配列で配置されている各々のアミノ酸残基を含有する中間化合物が生産されるのが一般的である。固相から取り外した後、これら保護基を実質的に同時に除去して、所望のポリペプチド産物を生産することができる。
【0172】
α−及びω−アミノ側鎖は、以下のもので保護することができる:例えば、ベンジルオキシカルボニル(Zと略される)、イソニコチニルオキシカルボニル(iNoc)、o−クロロベンジルオキシカルボニル[Z(2Cl)又は2−Cl−Z]、p−ニトロベンジルオキシカルボニル[Z(NO2)]、p−メトキシベンジルオキシカルボニル[Z(OMe)]、t−ブトキシ−カルボニル(Boc)、t−アミルオキシカルボニル(Aoc)、イソボルニルオキシカルボニル、アダマンチルオキシ−カルボニル(Adoc)、2−(4−ビフェニル)−2−プロピルオキシカルボニル(Bpoc)、9−フルオレニルメトキシカルボニル(Fmoc)、メチルスルホニエトキシカルボニル(methylsulfonyethoxycarbonyl)(Msc)、トリフルオロアセチル、フタリル(Pht)、ホルミル(For)、2−ニトロ−フェニルスルフェニル(phenylsulphenyl)(Nps)、ジフェニルホスフィノチオイル(Ppt)、及びジメチルホスフィノチオイル(Mpt)基等。側鎖保護基の更なる例には、以下のものが含まれる:アセチル(Ac)、ベンゾイル(Bz)、tert−ブチル(t−Bu)、トリフェニルメチル(トリチル、Trt)、テトラヒドロピラニル、ベンジル(Bzl)、2,6−ジクロロベンジル、ニトロ、p−トルエンスルホニル(Tos)、キサンチル(Xan)、ベンジル、メチル、エチル、及びt−ブチルエステル、及び芳香族又は脂肪族ウレタン型保護基、ニトロベラトリルオキシカルボニル(Nvoc)等の感光性基、及びトリメチルシリルエチルオキシカルボニル(TEOC)等のフルオリド解離性基。
【0173】
アミノ末端保護基(本明細書では、N末端基保護基とも呼ばれる)の例には、以下のものが含まれる:(1)ホルミル、アクリリル(Acr)、ベンゾイル(Bz)、及びアセチル(Ac)等のアシル型保護基;(2)ベンジルオキシ−カルボニル(Z)、及びp−クロロベンジルオキシカルボニル、p−ニトロベンジルオキシカルボニル、p−ブロモベンジルオキシカルボニル、p−メトキシベンジルオキシカルボニル等の置換Z等の芳香族ウレタン型保護基;(3)t−ブチルオキシカルボニル(BOC)、ジイソプロピルメトキシカルボニル、イソプロピルオキシカルボニル、エトキシカルボニル、アリルオキシカルボニル等の脂肪族ウレタン保護基;(4)9−フルオレニル−メチルオキシカルボニル(Fmoc)、シクロペンチルオキシカルボニル、アダマンチルオキシカルボニル、及びシクロヘキシルオキシカルボニル等のシクロアルキルウレタン型保護基;及び(5)フェニルチオカルボニル等のチオウレタン型保護基。好ましい保護基には、9−フルオレニルメチルオキシカルボニル(Fmoc)、2−(4−ビフェニリル)−プロピル(2)オキシカルボニル(Bpoc)、2−フェニルプロピル(2)−オキシカルボニル(Poc)、及びt−ブチルオキシカルボニル(Boc)が含まれる。
【0174】
カルボキシ官能基の保護基には、ベンジルエステル(OBzl)、シクロヘキシルエステル(Chx)、4−ニトロベンジルエステル(ONb)、t−ブチルエステル(Obut)、及び4−ピリジルメチルエステル(OPic)等が挙げられる。アミノ及びカルボキシル基以外の官能基を有するアルギニン、システイン、及びセリン等の特定のアミノ酸は、好適な保護基により保護されることが望ましいことが多い。例えば、アルギニンのグアニジノ基は、ニトロ、p−トルエンスルホニル、ベンジルオキシカルボニル、アダマンチルオキシカルボニル、p−メトキシベンゼンスルホニル、4−メトキシ−2,6−ジメチルベンゼンスルホニル(Nds)、及び1,3,5−トリメチルフェニルスルホニル(Mts)等で保護することができる。システインのチオール基は、p−メトキシベンジル及びトリチル等で保護することができる。
【0175】
式Iの化合物を、そのままの化学薬品として投与することが可能であり得るが、医薬組成物としてそれらを提供することが望ましい。更なる態様によると、本発明の実施形態によると、式Iの化合物又はその薬学的に許容される塩または溶媒和物を、1つ又は複数のその薬学的担体及び随意に1つ又は複数の他の治療用成分と共に含む医薬組成物が提供される。担体(複数可)は、製剤の他の成分と適合し、その受容者に有害ではないという意味において「許容」されなければならない。
【0176】
製剤には、経口、非経口(皮下、皮内、筋肉内、静脈内、及び関節内を含む)、直腸、及び局所(皮膚、舌下、頬側、及び眼内を含む)投与に好適なものが含まれる。最も好適な経路は、受容者の状態及び障害に依存する場合がある。製剤は、単位剤形で便利に提供されていてもよく、薬学の技術分野で周知の方法のいずれかにより調製することができる。そのような製剤を製造する方法は、式Iの化合物又はその薬学的に許容される塩または溶媒和物(「活性成分」)を、1つ又は複数の副成分を構成する担体と混合するステップを含む。一般的に、製剤は、活性成分を液体担体又は微粉化された固形担体又はその両方と均一に及び密接に混合し、その後必要に応じて、この産物を所望の製剤に成形することにより調製される。
【0177】
本発明の実施形態による経口投与に好適な製剤は、各々が所定量の有効成分を含有するカプセル剤、カシェ剤、または錠剤等の個別単位として、散剤または顆粒剤として、水性液体または非水性液体中の液剤または懸濁剤として、又は水中油型液体乳剤又は油中水型液体乳剤として、提供されてもよい。また、活性成分は、ボーラス剤、舐剤、又はペースト剤として提供されてもよい。
【0178】
錠剤は、随意に1つ又は複数の副成分と共に圧縮又は成形することにより製造することができる。圧縮錠剤は、結合剤、潤滑剤、不活性希釈剤、潤滑作用剤、界面活性剤、又は分散剤と随意に混合された、散剤又は顆粒剤等の易流動性形態の有効成分を、好適な機械で圧縮することにより調製することができる。成形錠剤は、不活性液体希釈剤で湿潤された粉末化合物の混合物を、好適な機械で成形することにより製造することができる。錠剤は、随意にコーティング又は刻印されていてもよく、その中の活性成分の持続性放出、徐放性放出、又は制御放出を提供するように製剤化されていてもよい。
【0179】
非経口投与用の製剤には、酸化防止剤、緩衝剤、静菌剤、及び製剤を目的受容者の血液と等張性にする溶質を含有していてもよい水性及び非水性の無菌注射溶液が含まれる。また、非経口投与用の製剤には、懸濁化剤及び増粘剤を含んでいてもよい水性及び非水性の無菌懸濁液が含まれる。製剤は、多用量容器、例えば密封アンプル及びバイアルの単位用量で提供されてもよく、使用直前に無菌液体担体、例えば生理食塩水又はリン酸緩衝生理食塩水(PBS)等を添加するだけでよいフリーズドライされた(凍結乾燥された)状態で保存することができる。即時調合注射溶液及び懸濁液は、前述した種類の無菌散剤、顆粒剤、及び錠剤から調製することができる。
【0180】
直腸内投与用の製剤は、カカオ脂又はポリエチレングリコール等の通常の担体と共に坐剤として提供されてもよい。
【0181】
口内、例えば頬側又は舌下での局所投与用の製剤には、スクロース及びアカシア又はトラガカント等の風味基剤中に活性成分を含むトローチ剤、及びゼラチン及びグリセリン又はスクロース及びアカシア等の基剤中に活性成分を含む香錠が含まれる。
【0182】
好ましい単位用量製剤は、以下に列挙するような有効量の又はその適切な割合の活性成分を含有するものである。
【0183】
特に上記で言及した成分に加えて、本発明の実施例による製剤は、目的の製剤のタイプに関して当技術分野で一般的な他の作用剤を含んでいてもよく、例えば、経口投与に好適なものは、香味剤を含んでいてもよいことが理解されるべきである。
【0184】
既に述べたように、本発明の実施形態によると、本発明の実施形態による化合物は、ある疾患又は状態の治療又は予防に使用することができる。用語「予防すること」は、本明細書で使用される場合、薬剤を事前に投与して、攻撃を未然に防ぐか又は鈍化させることを指す。医学分野の当業者(本方法の使用クレームに関しての)は、用語「予防する」は、絶対的な用語でないことを認識する。医学分野では、ある状態の可能性又は重症度を実質的に減少させるための薬物の予防的投与を指すと理解されており、それが、出願人らのクレームで意図されている意味である。読者においては、Physician’s Desk Referenceという本分野での標準的教科書に注意を向けられたい。そこでは、用語「予防する」が何百回も使用されている。医学分野の当業者であれば、この用語を絶対的な意味に解釈しない。同様に、本発明の実施形態による化合物は、免疫応答を抑制するために使用することができると述べられている場合、「抑制する」には、応答の程度を低減することが含まれており、応答を必ずしも絶対的に防止しないことが理解されるだろう。
【0185】
審査では、現在のところクレームから除外されない化合物が、本出願の本発明者らに特許付与することができないとみなされる可能性がある。その場合、出願人のクレームにおける種及び属の除外は、特許審査手続きの結果であり、本発明者らの発明の概念又は記述を反映するものではないとみなされるべきである。本発明は、組成物の態様では、一般に公開されているものを除き、式I及びIIの全ての化合物である。
【0186】
本発明の実施形態は、以下の図面を参照すると、より良好に理解されるだろう。
【図面の簡単な説明】
【0187】
【図1】実施例2に記載の実験から導き出された、耳の厚さの抗原特異的増加を示す図である。
【図2】実施例2に記載の実験で観察された、耳下腺リンパ節中の総細胞数を示す図である。
【図3】実施例2に記載されている、耳下腺リンパ節中の生細胞及び死細胞の含有量を示す図である。
【図4】実施例2に記載されている実験に記載されている流入領域リンパ節中の細胞タイプの数及び関与を示す図である。
【図5】実施例3に記載されている、ヒト血液由来の単核細胞に対する式IAの化合物の毒性を示す図である。
【図6】実施例4に記載されている、ヒツジ赤血球に対するマウスの体液性免疫応答に対する、式IAの化合物の腹腔内投与の効果を示す図である。
【図7】実施例5に記載されている、オボアルブミンに対する細胞性免疫応答に対する、式IAの化合物の腹腔内投与の効果を示す図である。
【図8A】PMBC生存に対する、本発明の実施形態によるペプチドのin vitroでの効果を示す図である。
【図8B】PMBC生存に対する、本発明の実施形態によるペプチドのin vitroでの効果を示す図である。
【図9A】PHA誘導性PBMC増殖に対する、本発明の実施形態によるペプチドのin vitroでの効果を示す図である。
【図9B】PHA誘導性PBMC増殖に対する、本発明の実施形態によるペプチドのin vitroでの効果を示す図である。
【図10A】実施例7に記載されている、抗原負荷に応答した耳の厚さの変化に対する、幾つかの化合物の効果を示す図である。
【図10B】実施例7に記載されている、抗原負荷に応答した耳の厚さの変化に対する、幾つかの化合物の効果を示す図である。
【図11】実施例7に記載されている、エバンスブルー試験での毛細血管の透過性を示す図である。
【図12】実施例7に記載されている、流入領域リンパ節中の総細胞数を示す図である。
【図13】実施例7に記載されている、循環白血球の数に対する化合物の効果を示す図である。
【図14】実施例7に記載されている、様々な場合に存在する白血球のタイプを示す図である。
【図15】実施例7に記載されている、マウス耳介の細胞数及び細胞組成に関する形態測定データを提供する図である。
【発明を実施するための形態】
【0188】
実施例1.環式テトラペプチドの合成
本発明の実施形態による環式テトラペプチドは、液相法又は固相法等の公知のペプチド合成法を使用することにより合成することができる。一般的に、合成は、2つの連続したステップを含む:(1)直鎖テトラペプチドを合成するステップ、及び(2)環化して環式テトラペプチドを得るステップ。直鎖テトラペプチドは、保護された形態で調製し、その後、環化前に脱保護してもよい。
【0189】
一例として、固体支持体(Wang型レジンに結合されたFmoc−L−フェニルアラニン、又は2−クロロトリチルレジンに結合されたL−ベータ−3−ホモフェニルアラニンまたはL−プロリンのいずれか)での直鎖テトラペプチドの合成を、以下のプロトコ−ルに従って実施した:
1.レジンを、ジメチルホルムアミド(DMF)中で15分間膨潤させた(0.25mmol、10ml/gレジン)。
2.Fmoc基を、DMF中20%ピペリジン溶液で除去した(2×20分間)。
3.レジンをDMFで洗浄した(3×2分間)。
4.レジンをメタノール(MeOH)で洗浄した(3×2分間)。
5.レジンをジクロロメタン(DCM)で洗浄した(3×2分間)。
6.レジンのアミノ酸又はペプチドアミノ基を、無水DMF(4ml/mmol)に溶解されたFmoc保護アミノ酸(4当量)、HBTU又はTBTU(4当量)、及びDIPEA(4当量)の混合物と共に20時間振とうすることによりアシル化した。
7.レジンをDCMで洗浄した(3×2分間)。
8.レジンをMeOHで洗浄した(3×2分間)。
9.レジンをDCMで洗浄した(3×2分間)。
10.カイザー試験を使用して(プロリン以外の全てのアミノ酸について)、アミノ基が全てアシル化されたか否かを評価した。
【0190】
カイザー試験の結果が陰性だった場合、レジンを、DMFで洗浄し(1×2分間)、新しい結合サイクルをプロトコールの第2工程から開始した。カイザー試験の結果が陽性だった場合、最初の結合に使用した試薬量の半分を用いてアシル化を繰り返した。プロリンのアシル化の場合には、カイザー試験は、アシル化の程度を決定するほどの感受性がなく、そのためプロリンの場合は、結合手順を、半分の試薬量で繰り返した。アシル化を繰り返す場合には、以下の洗浄を実施した:
7A. DCMでの洗浄(3×2分間)
8A. MeOHでの洗浄(3×2分間)
9A. DCMでの洗浄(3×2分間)
【0191】
最後の結合後、プロトコールの第3〜第5工程に従ってレジンを洗浄した。第2工程に記載のように、Fmoc基をペプチドから除去し、第3〜5工程でのようにDMF、MeOH、及びDCMでレジンを再び洗浄した。ペプチドをポリマー支持体から切断する前に、室温にて減圧下のデシケータでKOHペレットを用いてレジンを一晩乾燥した。
【0192】
ペプチドを、トリフルオロ酢酸/水/トリイソプロピルシラン 95:2.5:2.5(容積/容積/容積;10ml/1gのペプチジル−レジン)の混合液を用いて、乾燥したWang型レジンから切断した。得られた溶液を、室温にて減圧下で部分的に蒸発させ、ペプチドを、10容積のエーテルで析出させた。ろ過した後に、粗ペプチドを、0.05MのHCl水溶液に溶解し、蒸発させて乾燥した。残渣を水に溶解し、凍結乾燥した。
【0193】
酢酸/ジクロロメタン/トリフルオロエタノールの1:3:1混合液(容積/容積/容積;10ml/1gのペプチジル−レジン)で処理することにより、ペプチドを2−Cl−トリチルレジンから切断した。その結果生じた切断溶液及び収集した洗浄液をろ過し、周囲温度及び減圧下で蒸発させて乾燥し、残渣を、最小限の容積のDCMに溶解し、20容積のヘキサンで希釈し、再度蒸発させた(2回)。離脱させた粗ペプチドを、水に溶解し、凍結乾燥した。
【0194】
凍結乾燥したペプチドを、減圧下のデシケータでKOH及びP2O5を用いて乾燥して、環化の準備を整えた。
【0195】
上記のプロトコールによる典型的な合成では、Wangレジン(278mg、0.2mmol、0.72mmol/g)に結合されたFmoc−Pheから開始し、Fmoc−L−β3−homoPhe−OH、Fmoc−Pro−OH、及び再度Fmoc−Pro−OHを連続して結合させた後、凍結乾燥後の収量は、94%の純度(HPLC)を有する91mg(82%)の粗直鎖ペプチドだった。
【0196】
粗ペプチドを、PyBOP/HOAt/2,4,6−コリジン(3:3:5)を用いてDCM溶液中で環化し(ペプチド濃度 2×10−4ミリモル/リットル)、直鎖前駆物質の消失は、反応溶液の試料を分析用逆相(RP)HPLCカラムにインジェクトすることにより追跡した。環化の終了時に、溶液を減圧下で蒸発させて乾燥し、残渣を、酢酸エチル(1ミリモルのペプチド当たり1000mlの溶媒)、及び水中0.5NのHCl(1ミリモルのペプチド当たり100mlの溶液)との間に分割した。有機相を、水中0.5NのHCl(2×)、水(1×)、1M NaHCO3(3×)、及び水(1×)で連続して洗浄した。有機溶媒を減圧下で除去し、残留固形物をジオキサンに溶解し、凍結乾燥した。粗製生成物を、溶媒A(水中0.05%TFA)中の溶媒B(82%アセトニトリル/水中0.038%TFA)の溶出勾配を使用して、調製用Vydac社製C18又はKromasil社製C8逆相カラム(250mm/22mm、100A、10μm)で精製した。
【0197】
環化反応の例として、500ml DCM中のH−Pro−Pro−β3−hPhe−Phe−OH×HCl(55.7mg、0.1mmol)の溶液を、2,4,6−コリジン(67.5μL、0.5mmol)の存在下で、PyBOP(157mg、0.3mmol)及びHOAt(40mg、0.3mmol)で処理し、処理及び精製後に、HPLCによる決定で純度99%を有する13.5mg(27%)の環式テトラペプチドを得た。
【0198】
このようにして、式I−AからI−Pの化合物を合成した。以下の表1には、式I−AからI−Pの化合物に関する幾つかのデータが供給されている。
【0199】
【表1】

【0200】
実施例2.BALB/cマウスのオキサゾロンに対する接触過敏症モデルにおける、0.1%軟膏剤としてのペプチドの治療効果
この実験の目的は、一般的に認められている動物モデルにおける化合物I−Aの治療作用及びその毒性を確認することだった。下記に記載の実験では、式I−Aの化合物を、一般的に使用されている医薬賦形剤、即ち50%ワセリン及び50%ラノリンで構成される軟膏剤に基づく0.1%重量/重量の軟膏剤の形態の治療用調製物として塗布した。マウスのオキサゾロンに対する接触過敏症のエフェクター段階の低減におけるこの調製物の有用性を、皮膚疾患の治療に広く使用されているタクロリムス(Protopic(登録商標))及びピメクロリムス(Elidel(登録商標))等の基準調製物と比較して研究した。
【0201】
物質及び方法
マウス:Institute of Laboratory Medicine、ウッチ(Lodz)、ポーランドから入手したBALB/c雌マウス、8〜10週齢を使用した。マウスには、市販のペレット餌及び水を適宜与えた。研究は、施設の倫理委員会により承認された。
【0202】
試薬:油中水型クリーム及び軟膏は、Nepentes社から入手した。環式テトラペプチド(化合物I−A)は、上述のように合成した。Protopic(登録商標)(タクロリムス)は、Astellas社、アイルランドから購入し、Elidel(登録商標)(ピメクロリムス)は、Novartis社から購入し、Hydrocortisonum(登録商標)(ヒドロコルチゾン)は、Aflofarm Farmacja Polska社、ポーランドから購入した。DMSOは、Fluka社から入手し、オキサゾロン、アセトン、エバンスブルー、ギムザ、メイ−グリュンワルド、及びホルマリンは、Sigma社製だった。
【0203】
オキサゾロンに対する接触過敏症:試験は、Noonanら(Int.Arch.Allergy Appl.Immunol.、1978年、56巻、523〜532頁)に従い、幾つかの改変を施して実施した。マウスの腹部を剪毛し(2×2cmの区域)、24時間後、100μlのアセトン中0.5%オキサゾロンを、剪毛区域に塗布した。接触過敏症反応は、5日後に、50μlのアセトン中1%オキサゾロンを耳の両側に塗布することにより誘発した。耳浮腫を、スプリング式ノギスを使用して48時間後に測定した。結果は、耳の厚さの抗原特異的増加として示した(つまり、マウスのバックグラウンド(BG)の耳の厚さを、測定した厚さから減算した)。
【0204】
化合物の塗布:示されている実験では、第2の用量のオキサゾロンにより反応を誘発した24時間及び26時間後に、式I−Aの化合物を耳の両側に0.1%軟膏剤として局所塗布した(1つの耳当たり総容積50μl)。基準化合物は、市販調製物の形態で同様の方法で使用した。
【0205】
リンパ節細胞数の決定:表層耳下腺、下顎、及び副下顎リンパ節を単離し、ステンレス網に押し付けてリン酸緩衝液(PBS)に移すことによりホモジナイズし、2回洗浄し、0.2%トリパンブルーを含有するPBSに再懸濁した。総細胞数及び非生存細胞数を、光学顕微鏡及びビルケル血球計を使用して決定した。誘発用量の抗原でのみ処置されたマウスは、バックグラウンド対照としての役目を果たした。
【0206】
循環白血球数及び血液像の決定:マウスにハロタン麻酔を施し、後眼窩神経叢から出血させ、その後頸椎脱臼した。血中白血球数は、血液をチュルク溶液で希釈し、血球計で細胞を計数することにより決定した。血液塗抹標本を、顕微鏡ガラスに調製し、乾燥し、ギムザ及びメイ−グリュンワルド試薬で染色した。その後、塗抹標本を組織学的に調査した。循環白血球数は、1mm3当たりで示し、血液細胞組成は、所与の細胞タイプの割合として示した。誘発用量の抗原でのみ処置されたマウスは、バックグラウンド対照としての役目を果たした。
【0207】
組織学的分析:耳介を4%ホルマリン溶液で48時間固定し、24時間洗浄し、アルコール類で脱水し、パラフィンに包埋した。パラフィン塊を、Micron社製HM310ミクロトームで薄切りして、6μm切片にした。切片を、ヘマトキシリン及びエオシンで、並びにトルイジンブルーで染色した。組織学的分析は、ニコン社製Eclipse801型光学顕微鏡で実施した。耳介の断面を含有する組織学的スライドでは、血管周囲結合組織及び上皮下結合組織中の好中球、マクロファージ、リンパ球、及びマスト細胞の形態測定評価を実施した。0.07mm2区域にある細胞を、400×倍率で計数した。形態測定分析は、imagineソフトウェアNIS−Elements(ニコン社製)を用いて実施した。全ての検査群について、好中球、マクロファージ、リンパ球、及びマスト細胞の計数を25回実施した。
【0208】
統計:結果は、平均値±標準誤差(SE)として示されている。Brown−Forsyth検定を使用して、群間の等分散性を決定した。分散が均質だった場合、分散分析(一元配置ANOVA)を適用し、その後チューキー法によりポストホック比較を行って、群間の相違の有意性を評価した。ノンパラメトリックデータを、本文中に示されているように、クラスカル−ワリスの分散分析で評価した。有意性は、p<0.05で決定した。統計分析は、ウィンドウズ用STATISTICA7を使用して実施した。統計分析は、本明細書に示されている全てのデータに適用されている。
【0209】
結果:
図1に含まれているデータは、オキサゾロンに対して十分に発症した接触過敏症反応を示したマウスにおける、式I−Aの化合物(図1及びその後の図には「4B8M」と表示されている)及び基準調製物の治療効力を示す。調製物を、方法に記載されているように局所的に塗布した。図1には、耳の厚さの抗原特異的増加(抗原誘発用量の抗原のみが与えられた非感作マウスで測定されたバックグラウンド値を減算した結果として)のみが示されている。化合物I−Aは、耳浮腫の約80%阻害を引き起こし、Protopic(登録商標)及びElidel(登録商標)は、それぞれ約30%及び50%阻害を引き起こした。
【0210】
耳の炎症プロセスの強度は、流入領域リンパ節中の細胞数と相関するはずである。したがって、炎症の阻害は、流入領域リンパ節中の細胞数の減少と関連するはずである。図2には、式I−Aの化合物並びにElidel(登録商標)が両方とも、流入領域リンパ節中のリンパ球数を、非感作マウスで記録されたレベルに減少させたことを示す。しかしながら、Protopic(登録商標)で処置されたマウスでは、リンパ節細胞数は、未処置マウスの細胞数と類似していた。
【0211】
図3には、パーセントで表された、流入領域リンパ節中の生細胞及び死細胞の割合が示されている。式I−Aの化合物が示す毒性は、対照未処置マウスと比較して無視できるほどである。より高い毒性作用がElidel(登録商標)により引き起こされ、Protopic(登録商標)は、リンパ節細胞に関して非常に毒性である。
【0212】
調製物の治療効力に関する補完的な情報は、炎症を起こした耳介中の細胞数及び細胞組成の組織学的分析から導き出すことができる。図4には、局所炎症プロセスに関与する基本的細胞タイプの数及び寄与が示されている。図4では、Mast=マスト細胞、L=リンパ球、MO=マクロファージ、Ne=好中球である。未処置マウス(K+)の耳介は、好中球の浸潤が高いことを特徴とする。式I−Aの化合物の塗布は、対照マウスで観察された変化をほとんど完全に逆行させた(好中球の数は、マクロファージ含有量のある程度の増加で正規化した)。次いで、Protopic(登録商標)は、それぞれの細胞タイプの割合にある程度の変化を引き起こしたが、総細胞浸潤を低減しなかった。Elidel(登録商標)は、総細胞数の中程度の減少を引き起こした。
【0213】
実施例3.ヒト血中単核細胞に対するシクロリノペプチドの毒性と比べた化合物I−Aの毒性
式I−Aの化合物の毒性評価には、ヒト末梢単核血液細胞(PBMC)を選択した。この画分は、およそ80%のリンパ球及び20%の単球で構成される。式I−Aの化合物は、CLAの配列の一部を共有するため、シクロリノペプチド(CLA)を基準化合物として選択した。CLAは、シクロスポリンAの免疫抑制特性と同等の免疫抑制特性を示すが、毒性はより少ない。
【0214】
物質及び方法
細胞毒性試験:一人の供与者から静脈血をヘパリン処理注射器に採取し、リン酸緩衝生理食塩水(PBS)で2倍に希釈し、Lymphoprep(登録商標)(Polfa社製、クトノ、ポーランド)の上にアプライした(密度は1.077g/ml)。1200×gで20分間遠心分離した後、分裂間期の単核細胞を回収し、PBSで3回洗浄した。細胞を、RPMI−1640培地、L−グルタミン、ピルビン酸ナトリウム、2−メルカプトエタノール、各100μg/mlのストレプトマイシン及びペニシリン、並びに10%ウシ胎仔血清で構成される標準培地に再懸濁した。細胞を、96ウエル平底培養プレートに2×105/100μlの密度で分配した。化合物(式I−A及びCLA)を、まずDMSOに溶解し(5mg/500μl)、その後培養培地に溶解した。培養培地で適切に希釈されたDMSOを、対照として使用した。細胞培養インキュベーターで24時間インキュベーションした後、細胞生存率を、比色法により決定した(Hansenら、J Immunol Methods、1989年、119巻、203〜210頁)。
【0215】
結果は、図5に示されており、四重重複ウエル(細胞培養)の平均光学密度値±SEとして表されている。図5に見られるように、式I−Aの化合物(「4B8M」と表示されている)は、10〜100μg/mlの濃度範囲では、検出可能な毒性を示さなかった。その一方で、CLAは、40μg/mlで統計的に有意な細胞毒性を示した。
【0216】
実施例4.SRBCに対する体液性免疫応答に対するペプチドのvivoでの効果
CBA雌マウス、8〜12週齢を、Institute of Laboratory Medicine、ウッチ、ポーランドから入手した。マウスには、水及びペレット餌を自由に摂取させた。研究は、施設の倫理委員会により承認された。ヒツジ赤血球(SRBC)を、Wroclaw University of Life and Environmental Sciences、ポーランドから入手し、RPMI−1640培地で維持した。
【0217】
in vivoにおけるSRBCに対する一次体液性免疫応答:マウスを、0.2mlの5%SRBC懸濁液(0.5mlのSRBCペレットを10mlの容積の0.9%NaClに再懸濁した)で腹膜内免疫した。4日後に、脾臓の抗体産生細胞(AFC)数を、寒天ゲルでの局所溶血アッセイを使用して決定した(Mishellら、J Exp Med、1967年、126巻、423〜442頁に示されているように)。結果は、5匹マウスの平均値±標準誤差として図6に示されており、106個の生脾細胞当たりのAFC数として表されている。
【0218】
マウスを、上述のようにSRBCで免疫し、2時間後に10又は100μgの式I−Aの化合物を投与した。シクロスポリンA(CsA)は、基準薬物としての役目を果たした。SRBCに対する抗体を産生する細胞の数を、4日後に測定した。図6に示されているように、式IAの化合物は、両用量でCsAよりも阻害性だった。
【0219】
実施例5.オボアルブミンに対する体液性免疫応答に対するペプチドのin vivoでの効果
雄CBAマウス、8〜12週齢を、Institute of Laboratory Medicine、ウッチ、ポーランドから入手した。マウスには、水及びペレット餌を自由に摂取させた。オボアルブミンはSigma社製であり、アジュバントはDifco社製だった。
【0220】
遅延型過敏症(DTH)検査:マウスの尾部基部に、フロイント完全アジュバント中に乳化された5μgのオボアルブミン(OVA)を皮下感作した。4日後、マウスの後足蹠に、フロイント不完全アジュバント中の50μgのOVAを負荷した。24時間後、足蹠の厚さをノギスを使用して測定した。対照(バックグラウンド応答マウス)は、感作されなかったが、負荷用量のOVAを受容した。式I−Aの化合物及び基準化合物を、感作量の抗原の2時間前及び24時間後に、2回の100μg腹腔内容量でマウスに投与した。結果は、5匹のマウスで測定され、DTH単位(1DTH単位=10−2cm)で表された足蹠の厚さの抗原特異的増加の平均値±標準誤差として図7に示されており、2回の用量で投与された式I−Aの化合物が、免疫の2時間及び24時間後に、OVAに対する遅延型過敏症反応を阻害したことが示されている。その抑制作用は、CLA及びCsAの抑制作用よりも強力だった。
【0221】
実施例6
環式テトラペプチドを、植物性血球凝集素A(PHA)誘導性のヒト末梢血単核細胞(PBMC)増殖、及びリポポリサッカライド(LPS)誘導性の腫瘍壊死因子アルファ(TNF−α)産生に対するそれらの効果について、1〜100μg/mlの濃度範囲での全血細胞培養によりin vitroで試験した。また、化合物を、1〜100μg/mlの濃度範囲で、ヒトPBMCに対する細胞毒性について試験した。
【0222】
物質及び方法
試薬:RPMI−1640培地(Cibi/Life Technologies社製、英国)、ウシ胎児血清(FCS、Gibco社製)、DMSO、植物性血球凝集素A(PHA)、大腸菌株O111:B4に由来するリポポリサッカライド(LPS)(Sigma社製)、93−[4,5−ジメチルチアゾール−2−イル]−2,5−ジフェニルテトラゾリウムブロミド(MTT)、SDS、及びDMF(Sigma社製)。培養培地は、RPMI−1640、10%FCS添加、L−グルタミン、ピルビン酸ナトリウム、2−メルカプトエタノール(mercaptoetanol)、及び抗生物質(ストレプトマイシン及びペニシリン)で構成されていた。環式テトラペプチドを、まずDMSOに溶解し(5mg/ml)、その後培養培地に溶解して所望の濃度にした。
【0223】
PBMCの単離:一人の供与者(男性、62歳)から静脈血をヘパリン処理注射器に採取し、リン酸緩衝生理食塩水(PBS)で2倍に希釈した。PBMCを、Ficoll−uropoline勾配(密度1.077g/ml)(Lymphoprep;PAA Laboratories社製)で、4℃にて800×gで20分間遠心分離することにより単離した。その後、リンパ球(20%)及び単球(80%)で構成されている分裂間期細胞を、ハンクス培地で3回洗浄し、2×l06細胞/mlの密度で培養培地に再懸濁した。
【0224】
PHAに対するPBMCの増殖応答:単離したPBMCを、100μl等量(2×l05細胞/ウエル)で96ウエル平底プレートに分配した。PHAを、5μg/mlの濃度で使用した。化合物を、1、10、及び100μg/mlの濃度で試験した。適切に希釈されたDMSOは、対照としての役目を果たした。細胞培養インキュベーターで4日間インキュベーションした後、細胞の増殖応答を、比色MTT法により決定した(Hansenら、J.Immunol.Methods、1989年、203〜210頁)。データは、四重重複(quadriplicate)ウエルの平均OD値±標準誤差(SE)として表されている。培養「対照(−)」は、マイトジェンを含有していなかった(PHA)。培養「対照(PHA)」は、PHAを含有していたが、環式テトラペプチドを含有していなかった。
【0225】
毒性試験:2×105個/100μ1/ウエルの密度のPBMCを培養培地に再懸濁し、1、10、及び100μg/ml濃度の環式テトラペプチドと共に細胞培養インキュベーターで24時間培養した。細胞生存を、MTT比色法により決定した(Hansenら、J.Immunol.Methods、1989年、203〜210頁)。データは、四重重複ウエルの平均OD値±標準誤差(SE)として表されている。培養「対照(−)」は、培養培地中に細胞のみを含有していた。
【0226】
TNFアルファ活性の決定(Espevikら、J.Immunol.Methods、95巻(1986年):99〜103頁に示されていような):ヒト全血を、RPMI−1640培地で10倍希釈し、24ウエル培養プレートに1ml等量で分配した。LPSを、1μg/mlの濃度で培養に添加した。研究対象ペプチドを、1、10、及び100μg/mlの濃度で使用した。一晩インキュベーションした後、上清を回収し、サイトカイン決定まで−20℃で凍結した。TNF−α活性を、バイオアッセイを使用して決定した。手短に言えば、WEHI 164.13細胞(ATCC CRL 1751)を2×104細胞/ウエルの濃度で四重重複で接種した。漸進的に希釈したアッセイ上清を、アクチノマイシンD(1μg/ml)の存在下で標的細胞と混合した。インキュベーションの20時間後、MTTをウエルに添加し、培養を更に4時間インキュベートした。次に、細胞溶解緩衝液(20%SDS及び50%DMF、pH4.7)を添加し、24時間後に、630nmを基準波長とした550nmの光学密度を、Dynatech社製5000型分光光度計で測定した。アッセイの検出限界は、約2.5pg/mlだった。TNF−α活性の1単位は、50%細胞死が生じる上清希釈の逆数として定義した。「対照(−)」と表示した培養は、LPSを含有していなかった。「対照(LPS)」と表示した培養は、LPSのみを含有し、研究対象化合物は含有していなかった。データが単一培養(ウエル)由来であるため、統計分析は適用しなかった。
【0227】
細胞増殖及び死滅の比色MTTアッセイ:アッセイは、Hansenら、J.Immunol.Methods、1989年、119巻、203〜210頁に示されているように実施した。手短に言えば、25μlのMTT(5mg/ml)原液を、細胞インキュベーションの終了時にウエル毎に添加し、プレートを、細胞培養インキュベーターで3時間インキュベートした。その後、100μlの抽出緩衝液(20%SDS及び50%DMF、pH4.7)を添加した。更に一晩インキュベーションした後、550nmの光学密度を測定したDynatech社製5000型)。
【0228】
それが適切な場合、結果は、平均値±標準誤差(SE)として示されている。Brown−Forsyth検定を使用して、群間の等分散性を決定した。分散が均質だった場合、分散分析(一元配置ANOVA)を適用し、その後チューキー法によりポストホック比較を行って、群間の相違の有意性を評価した。有意性は、P<0.05で決定した。統計分析は、ウィンドウズ用STATISTICA6.1を使用して実施した。
【0229】
結果:
PBMCの生存に対する化合物の効果:24時間培養でのPMBC生存に対するペプチドの効果は、図8A及び8Bに示されている。ペプチド4B8M(化合物I−A)は、基準化合物として含まれていた。適切に希釈されたDMSOを、対照培養に添加した。結果は、研究した濃度範囲では化合物の毒性徴候を示さなかった。図中、P01=化合物I−D、P02=化合物I−E、P03=化合物I−F、P04=化合物I−G、P05=化合物I−H、P06=化合物I−J、P07=化合物I−K、P08=化合物I−L、P10a=化合物I−M、P10b=化合物I−N、及びP11=化合物I−Oである。
【0230】
図8A及び8Bは、PBMCの生存に対する試験ペプチドの効果を示す。図8A:統計(全比較対適切に希釈されたDMSO):100μg/ml:4B8M NS(P=0.9999);P01 NS(P=1.0000);P02 NS(P=1.0000);P03 NS(P=1.0000);P04 NS(P=0.9047);P05 NS(P=1.0000);P06 NS(P=0.9999);P07 NS(P=1.0000);10μg/ml:4B8M NS(P=1.0000);P01 NS(P=1.0000);P02 NS(P=1.0000);P03 NS(P=1.0000);P04 NS(P=0.9999);P05 NS(P=1.0000);P06 NS(P=1.0000);P07 NS(P=1.0000);1μg/ml;4B8M NS(P=1.0000);P01 NS(P=1.0000);P02 NS(P=1.0000);P03 NS(P=1.0000);P04 NS(P=1.0000);P05 NS(P=1.0000);P06 NS(P=0.8253);P07 NS(P=1.0000)(ANOVA)。図8B:統計(全比較対適切に希釈されたDMSO):100μg/ml:4B8M NS(P=0.0669);P08 NS(P=0.9957);P10b NS(P=1.0000);10μg/ml:4B8M NS(P=0.9999);P08 NS(P=1.0000);P10b NS(P=1.0000);1μg/ml;4B8M NS(P=0.3176);P08 NS(P=0.9999);P10b NS(P=1.0000)(ANOVA)。
【0231】
PHA誘導性PMBC増殖に対するペプチドの効果:PMBCの増殖応答に対するペプチドの効果は、図9A及び9Bに示されている。ペプチド4B8Mは、基準化合物として含まれていた。適切に希釈されたDMSOを、対照培養に添加した。
【0232】
図9A:PHA誘導性PMBC増殖に対するペプチドの効果:統計(全比較対適切に希釈されたDMSO):1μg/ml:4B8M NS(P=0.9995);P01 NS(P=1.0000);P02 NS(P=1.0000);P03 NS(P=1.0000);P04 NS(P=0.9047);P05 NS(P=0.5198);P06 NS(P=1.0000);P07 NS(P=0.1445);10μg/ml:4B8M NS(P=1.0000);P01 NS(P=0.9999);P02 NS(P=1.0000);P03 NS(P=0.9930);P04 NS(P=0.4297);P05 NS(P=1.0000);P06 NS(P=1.0000);P07 NS(P=0.8647);100μg/ml:4B8M NS(P=1.0000);P01 NS(P=1.0000);P02 NS(P=0.9982);P03 P=0.0001;P04 NS(P=0.9970);P05 NS(P=0.2037);P06 NS(P=0.1257);P07 NS(P=1.0000)(ANOVA)。
【0233】
図9B:PHA誘導性PMBC増殖に対するペプチドの効果:統計(全比較対適切に希釈されたDMSO):1μg/ml:4B8M NS(P=0.9919);P08 NS(P=0.9999);P10b NS(P=1.0000);10μg/ml:4B8M NS(P=1.0000);P08 NS(P=1.0000);P10b NS(P=0.2763);100μg/ml:4B8M NS(P=0.4941);P08 NS(P=1.0000);P10b NS(P=0.9933)(ANOVA)。
【0234】
全血細胞培養中のLPS誘導性TNF−α産生に対するペプチドの効果:全血細胞培養中のLPS誘導性TNF−α産生に対するペプチドの効果は、表2A及び2Bに示されている。ペプチド4B8Mは、基準化合物として含まれていた。適切に希釈されたDMSOを、対照培養に添加した。
表2A LPS誘導性TNF−α産生に対するペプチドの効果
【0235】
【表2】

表2B LPS誘導性TNF−アルファ産生に対するペプチドの効果
【0236】
【表3】

【0237】
実施例7.マウスのトルエンジイソシアネート誘導性耳炎に対する化合物LAの阻害効果
トルエンジイソシアネート(TDI)で誘導されたBALB/cマウスの耳炎の抑制における化合物LAの効力。市販のProtopic(登録商標)(タクロリムス)及びElidel(登録商標)(ピメクロリムス)は、基準薬物としての役目を果たした。
【0238】
物質及び方法
マウス:BALB/c雌マウス、8〜10週齢を、Institute of Laboratory Medicine、ウッチ、ポーランドから入手した。マウスには、市販のペレット餌及び水を適宜与えた。研究は、施設の倫理委員会により承認された。
【0239】
試薬。化合物I−Aは、上述のように合成した。Protopic(タクロリムス)は、Astellas社製(アイルランド所在)だった。Elidel(登録商標)(ピメクロリムス)は、Novartis社製だった。DMSOはFluka社製だった、TDI、アセトン、エバンスブルー、トリパンブルー、ギムザ、メイ−グリュンワルド、ヘマトキシリン、エオシン、トルイジンブルー、及びホルマリンは、Sigma社製だった。
【0240】
TDIに対する免疫応答。試験は、多少の改変を施して、Yamamoto、Eur.J.Pharmacol.、2006年、550巻、166〜172頁に従って実施した。マウスの腹部を剪毛し(2×2cmの区域)、24時間後、100μlのアセトン中3%TDIを、3日連続で塗布した。14日後、50μlの0.3%TDIを耳の両側に塗布することにより、反応を誘発した。この手順を、3日毎に5回繰り返した。TDIによる各負荷の5時間及び24時間後に、スプリング式ノギス(Mitutoyo社製)を使用して、耳の厚さを測定した。
【0241】
化合物の塗布。TDIによる各負荷の1時間後に、化合物I−Aを、0.1%軟膏剤の形態で耳の両側に局所塗布した(1つの耳当たりの総容積は100μl〜50μl)。同様の方法で基準薬物を塗布した。
【0242】
リンパ節細胞数の決定。表層耳下腺、下顎、及び副下顎リンパ節を単離し、ステンレス網に押し付けてPBSに移すことによりホモジナイズし、PBSで2回洗浄し、0.2%トリパンブルーを含有するPBSに再懸濁した。総細胞数及び非生存細胞数を、光学顕微鏡及びビルケル血球計を使用して決定した。
【0243】
循環白血球数及び血液像の決定。マウスにハロタン麻酔を施し、後眼窩神経叢から出血させ、その後頸椎脱臼した。血中白血球数は、血液をチュルク溶液で希釈し、血球計で細胞を計数することにより決定した。血液塗抹標本を、顕微鏡ガラスに調製し、乾燥し、ギムザ及びメイ−グリュンワルド試薬で染色した。その後、塗抹標本を組織学的に調査した。細胞数は、1μl当たりで示し、血液細胞組成は、所与の細胞タイプの割合として示した。
【0244】
エバンスブルー試験。マウスには、0.2mlの0.9%NaCl中1mgのエバンスブルーを静脈内投与した。30分後、マウスを犠牲にし、耳を切除し、計量し、50μlの1M KOHに37℃で18時間浸漬した。450μlの0.2Mリン酸(phosphate acid)及びアセトン(5:13の比率)を使用して、耳から色素を抽出した。試料を、3,000rpmで15分間遠心分離した。上清の光学密度(OD)を、630nmで測定した。エバンスブルーの量(μg/ml)は、標準曲線に基づいて決定した。結果は、100mgの湿潤組織当たりのエバンスブルーの量として示した。誘発用量の抗原でのみ処置されたマウスは、バックグラウンド対照としての役目を果たした。
【0245】
組織学的分析。耳介を4%ホルマリン溶液で48時間固定し、24時間洗浄し、アルコール類で脱水し、パラフィンに包埋した。パラフィン塊を、Micron社製HM310ミクロトームで薄切りして、6μm切片にした。切片を、ヘマトキシリン及びエオシンで、並びにトルイジンブルーで染色した。組織学的分析は、ニコン社製Eclipse801型光学顕微鏡を使用して実施した。血管周囲結合組織及び上皮下結合組織中の好中球、マクロファージ、リンパ球、及びマスト細胞の形態測定評価を、耳介の断面を含有する組織学的スライドで実施した。0.07mm2区域にある細胞を、400×倍率で計数した。形態測定分析は、imagine社製ソフトウェアNIS−Elements(ニコン社製)を使用して実施した。検査した全ての調製物について、好中球、マクロファージ、リンパ球、及びマスト細胞の計数を25回実施した。
【0246】
統計。図10A及び10Bの結果は、平均値±標準誤差(SE)として示されている。Brown−Forsyth検定を使用して、群間の等分散性を決定した。分散が均質だった場合、分散分析(一元配置ANOVA)を適用し、その後チューキー法によりポストホック比較を行って、群間の相違の有意性を評価した。ノンパラメトリックデータを、本文中に示されているように、クラスカル−ワリスの分散分析で評価した。有意性は、P<0.05で決定した。統計分析は、ウィンドウズ用STATISTICA7を使用して実施した。
【0247】
結果:
耳の厚さに対する化合物の効果。TDIに対する体液性免疫応答を、方法に記載のように誘発した。抗原による各負荷の1時間後に、テトラペプチド(式I−A、図10A及び10Bでは4B8Mと表示されている)及び基準化合物で、マウスを局所的に処置した。処置の効果は図10A及び10Bに示されており、そこには、図に示されている試験日における投与の5時間後(図10A)及び24時間後(図10B)の耳の厚さの測定が示されている。TDIに対する対照応答は、各抗原負荷後、徐々に上昇した(5時間後の測定で最もよく見られる)。結果は、化合物が耳膨潤の低減に著しい効力があることを示した。
【0248】
図10A:14日目:対照対4B8M P=0.0005;対照対Protopic(登録商標)P=0.0002;対照対Elidel(登録商標)P=0.0152;4B8M対Protopic(登録商標)NS;4B8M対Elidel(登録商標)NS;17日目:対照対4B8M P=0.0001;対照対Protopic(登録商標)P=0.0001;対照対Elidel(登録商標)P=0.0377;4B8M対Protopic(登録商標)NS;4B8M対Elidel(登録商標)P=0.0002;20日目:対照対4B8M P=0.0001;対照対Protopic(登録商標)P=0.0001;対照対Elidel(登録商標)NS;4B8M対Protopic(登録商標)NS;4B8M対Elidel(登録商標)P=0.0001;23日目:対照対4B8M P=0.0001;対照対Protopic(登録商標)P=0.0001;対照対Elidel(登録商標)NS;4B8M対Protopic(登録商標)NS;4B8M対Elidel(登録商標)P=0.0001;27日目:対照対4B8M P=0.0001;対照対Protopic(登録商標)P=0.0001;対照対Elidel(登録商標)P=0.0001;4B8M対Protopic(登録商標)NS;4B8M対Elidel(登録商標)P=0.0001(ANOVA)。図10B:14日目:対照対4B8M P=0.0001;対照対Protopic(登録商標)P=0.0001;対照対Elidel(登録商標)P=0.0004;4B8M対Protopic(登録商標)NS;4B8M対Elidel(登録商標)NS;17日目:対照対4B8M P=0.0001;対照対Protopic(登録商標)P=0.0023;対照対Elidel(登録商標)P=0.0004;4B8M対Protopic(登録商標)NS;4B8M対Elidel(登録商標)NS;20日目:対照対4B8M P=0.0006;対照対Protopic(登録商標)P=0.0003;対照対Elidel(登録商標)P=0.0156;4B8M対Protopic(登録商標)NS;4B8M対Elidel(登録商標)NS;23日目:対照対4B8M P=0.0001;対照対Protopic(登録商標)P=0.0001;対照対Elidel(登録商標)P=0.0039;4B8M対Protopic(登録商標)NS;4B8M対Elidel(登録商標)P=0.0027;27日目:対照対4B8M P=0.0001;対照対Protopic(登録商標)P=0.0001;対照対Elidel(登録商標)P=0.0023;4B8M対Protopic(登録商標)NS;4B8M対Elidel(登録商標)P=0.0016(ANOVA)。
【0249】
皮膚血管の透過性に対する化合物の効果:毛細血管の透過性は、図11に示されており、そこには、エバンスブルー試験における毛細血管の透過性が示されている。上述の手順を、TDIによる5回目の負荷(28日目)の24時間後に実施した。図11に示されているように、血管透過性の速度は、それぞれのマウス群において耳の厚さに対する化合物の効果と厳密に相関していた。統計:BG対対照 P=0.0248;対照対4B8M(I−A)P=0.030;対照対Protopic(登録商標)NS;対照対Elidel(登録商標)NS;4B8M(I−A)対Protopic(登録商標)NS;4B8M(I−A)対Elidel(登録商標)NS(ANOVA)。
【0250】
流入領域リンパ節中の細胞数に対する化合物の効果:図12は、流入領域リンパ節中の総細胞数を示す。図12に示されているように、化合物I−Aでマウスを処置すると、リンパ節細胞数が、ほとんどバックグラウンドレベルに低下する結果となった(未感作マウス)。統計:BG対対照 P=0.0001;対照対4B8M(I−A)P=0.0001;対照対Protopic(登録商標)NS;対照対Elidel(登録商標)NS;4B8M(I−A)対Protopic(登録商標)P=0.0183;4B8M(I−A)対Elidel(登録商標)P=0.0001(クラスカル−ワリスのANOVA)。
【0251】
循環白血球の数に対する化合物の効果。図13は、循環白血球の数に対する化合物の効果を示す。研究対象調製物を塗布すると、循環白血球の数が、対照未感作マウスで観察されたレベルに低下した。統計:BG対対照P=0.0001;対照対4B8M(I−A)P=0.0001;対照対Protopic(登録商標)P=0.0001;対照対Elidel(登録商標)P=0.0001;4B8M(I−A)対Protopic(登録商標)NS;4B8M(I−A)対Elidel(登録商標)NS(ANOVA)。
【0252】
血液細胞組成に対する化合物の効果:TDIに対して十分に発症した反応を示す対照マウスの血液組成は、対照バックグラウンドマウスと比較して、好中球及び好酸球の含有量が増加することを特徴とした(図14、各々の場合の白血球タイプの内訳が示されている)。血液像は、4B8M(I−A)塗布の際に正規化したが(好中球及び好酸球の含有量の低減)、Protopic(登録商標)又はElidel(登録商標)の投与後には正規化しなかった。統計:バンド(B):BG対対照 NS;対照対4B8M(I−A)NS;対照対Protopic(登録商標)P=0.0500;対照対Elidel(登録商標)P=0.0500;4B8M(I−A)対Protopic(登録商標)NS;4B8M対Elidel(登録商標)NS(クラスカル−ワリスのANOVA);セグメント(S):BG対対照 P=0.0131;対照対4B8M(I−A)NS;対照対Protopic(登録商標)NS;対照対Elidel(登録商標)NS;4B8M(I−A)対Protopic(登録商標)P=0.0163;4B8M(I−A)対Elidel(登録商標)NS(クラスカル−ワリスのANOVA);好酸球(E):BG対対照 P=0.0001;対照対4B8M(I−A)P=0.0001;対照対Protopic(登録商標)NS;対照対Elidel(登録商標)NS;4B8M(I−A)対Protopic(登録商標)NS;4B8M対Elidel(登録商標)P=0.0146(クラスカル−ワリスのANOVA);リンパ球(L):BG対対照 P=0.0001;対照対4B8M(I−A)P=0.0043;対照対Protopic(登録商標)NS;対照対Elidel(登録商標)NS;4B8M(I−A)対Protopic(登録商標)P=0.0345;4B8M(I−A)対Elidel(登録商標)NS(クラスカル−ワリスのANOVA)。
【0253】
耳介の細胞組成に対する化合物の効果:図15は、耳介の細胞数及び細胞組成に関する形態測定データを提供する。研究対象マウス群の中で異なっていた、耳介内の細胞タイプの組成は、図15に示されている。対照未感作マウスに多く存在する細胞タイプは、マスト細胞及び好中球(neutrofil)である(それぞれ、分析した区域当たり10個及び5個の細胞)。治療薬で処置しなかった感作対照マウスでは、マスト細胞の数は2倍に、好中球はほとんど5倍に増加した(それぞれ、20個及び23個の細胞)。Protopic(登録商標)及び化合物I−Aは、細胞数を14及び14.8に効果的に低減した。統計:Ne(好中球):BG対対照 P=0.0001;対照対4B8M(I−A)P=0.0151;対照対Protopic(登録商標)P=0.0001;対照対Elidel(登録商標)NS;4B8M対Protopic(登録商標)NS;4B8M(I−A)対Elidel(登録商標)P=0.0003(クラスカル−ワリスのANOVA);MO(マクロファージ):BG対対照 P=0.0144;対照対4B8M(I−A)NS;対照対Protopic(登録商標)NS;対照対Elidel(登録商標)P=0.0255;4B8M対Protopic(登録商標)NS;4B8M(I−A)対Elidel(登録商標)P=0.0031(クラスカル−ワリスのANOVA);L(リンパ球):BG対対照 NS;対照対4B8M(I−A)NS;対照対Protopic(登録商標)NS;対照対Elidel(登録商標)P=0.0023;4B8M対Protopic(登録商標)NS;4B8M(I−A)対Elidel(登録商標)P=0.0001(クラスカル−ワリスのAnova);Mast(マスト細胞):BG対対照 P=0.0001;対照対4B8M(I−A)NS;対照対Protopic(登録商標)P=0.0001;対照対Elidel(登録商標)NS;4B8M(I−A)対Protopic(登録商標)NS;4B8M(I−A)対Elidel(登録商標)P=0.0001(クラスカル−ワリスのANOVA)。
【0254】
実施例8− 化合物I−B及びI−CのIn vitro試験
方法
コンカナバリンA(ConA)に対する脾細胞の増殖応答:脾臓をプラスチック網に押し付けて0.83%NH4C1溶液に移し、赤血球を溶解した(室温で5分間のインキュベーション)。その後、細胞をハンクス培地で2回洗浄し、ガラスウールカラムに通して残屑を除去し、10%ウシ胎仔血清、L−グルタミン、ピルビン酸ナトリウム、2−メルカプトエタノール、ストレプトマイシン、及びペニシリン(100μg/ml)で補完されたRPMI−1640で構成される、下記では「培養培地」と呼ばれる培養培地に再懸濁した。その後細胞を、96ウエル平底組織培養プレート(Nunc社製)に、2×105細胞/100μl/ウエルの密度で分配した。ConA(2.5μg/ml)を添加して、細胞増殖を誘導した。化合物を、1〜100μg/mlの用量で培養に添加した。3日間のインキュベーション後、細胞増殖を、比色MTT法を使用して決定した(Hansen MB、J Immunol Methods、1989年、119巻、203〜210頁)。結果は、550nmにおける四重重複決定(ウエル)の平均光学密度(OD)±SEとして示した。
【0255】
ヒツジ赤血球(SRBC)に対するin vitroの二次体液性免疫応答:マウスを、0.2mlの5%(容積/容積)SRBC懸濁液で腹腔内感作した。4日後に、これらマウスから脾臓を単離し、PBS溶液中でホモジナイズすることにより、単個細胞浮遊液を調製した。遠心分離により細胞をPBSで洗浄した後、細胞を、5×l06細胞/mlの密度で培養培地に再懸濁した。その後細胞を、24ウエル培養プレートに1ml等量で分配し、0.05mlの0.005%SRBCを、抗原として各ウエルに添加した。化合物を、1〜100μg/mlの濃度範囲で、4日間のインキュベーション期間の初めに培養に添加した。培養での抗体産生細胞(AFC)の数を、Mishellら、J Exp Med、1967年、126巻、423〜442頁に従って、寒天ゲルでの局所溶血アッセイ法を使用して決定した。
【0256】
毒性試験:2×105細胞/100μl/ウエルの密度で培養培地に再懸濁された脾細胞を、化合物(1〜100μg/ml)と共に細胞培養インキュベーターで24時間培養した。細胞生存を、MTT比色法により決定した。結果は、550nmにおける4つのウエルの平均光学密度(OD)として示した。それぞれの化合物濃度での細胞の生存率を、それぞれの化合物濃度に対応する適切なDMSO対照群(100%生存)と比較した。
【0257】
結果:
50〜100μg/mlの濃度において、化合物I−Cは、コンカナバリンA誘導性のマウス脾細胞増殖に対して強力な阻害効果を示した。100μg/mでは、この化合物は、脾細胞に対して70%毒性を示した。10μg/m及び100μg/mでは、化合物I−Cは、マウス脾細胞培養中でのSRBCに対するin vitro体液性免疫応答のモデルにおいて、それぞれ33%及び80%抑制を示した。オボアルブミンに対する遅延型過敏症のモデルにおいて、化合物I−Cは、化合物I−Aによる72.7%阻害と比較して、100μgの用量で26.9%阻害を示した。
【0258】
100μg/ml濃度では、化合物I−Bは、コンカナバリンA誘導性の脾細胞増殖に対して弱い抗増殖効果を示した。このような効果は、より低い濃度では観察されなかった。化合物I−Bは、この濃度で30%毒性を示した。
【0259】
前述の発明は、例示の目的で幾らか詳細に記述されているが、本明細書に記載されている本発明の範囲から逸脱することなく、変更及び改変をなすことができることは、当業者であれば直ちに明白であろう。
【特許請求の範囲】
【請求項1】
式Iを有する化合物又はその薬学的に許容される塩。
【化1】

(式中、
k、m、n、及びpは、各々独立して0、1、又は2であり、 R及びR’は、各々独立してH及びC1〜3アルキルから選択されるか、又はR及びR’は、一緒になって−CR1R1’−X−CH2−であり、ここでCR1R1’は骨格窒素に結合されており、R1及びR1’は、各々独立してH及びC1〜3アルキルから選択され、Xは、−CH2−、−CH2CH2−、−CH(OH)−、−O−、−S−、及び−NH−から選択され、
R’’及びR’’’は、各々独立してH及びC1〜3アルキルから選択されるか、又はR’’及びR’’’は、一緒になって−CR2R2’−X’−CH2−であり、ここでCR2R2’は骨格窒素に結合されており、R2及びR2’は、各々独立してH及びC1〜3アルキルから選択され、X’は、−CH2−、−CH2CH2−、−CH(OH)−、−O−、−S−、及び−NH−から選択され、 R3及びR4は、各々独立してアリール、置換アリール、へテロアリール、及び置換へテロアリールから選択される。)
【請求項2】
R3及びR4の少なくとも1つが、フェニルである、請求項1に記載の化合物。
【請求項3】
R3及びR4の少なくとも1つが、4−ヒドロキシフェニルである、請求項1又は請求項2に記載の化合物。
【請求項4】
R3及びR4の少なくとも1つが、4−t−ブトキシフェニルである、請求項1又は請求項2に記載の化合物。
【請求項5】
R3及びR4の少なくとも1つが、2−インドリルである、請求項1又は請求項2に記載の化合物。
【請求項6】
R3及びR4が両方とも、フェニルである、請求項1又は請求項2に記載の化合物。
【請求項7】
R3及びR4の一方がフェニルであり、R3及びR4の他方が4−ヒドロキシフェニルである、請求項1又は請求項2に記載の化合物。
【請求項8】
R3及びR4の一方がフェニルであり、R3及びR4の他方が4−t−ブトキシフェニルである、請求項1又は請求項2に記載の化合物。
【請求項9】
R3及びR4の一方がフェニルであり、R3及びR4の他方が2−インドリルである、請求項1又は請求項2に記載の化合物。
【請求項10】
−CH2−R3が結合されている炭素が、絶対(R)立体化学を有する、請求項1〜9のいずれか一項に記載の化合物。
【請求項11】
−CH2−R3が結合されている炭素が、絶対(S)立体化学を有する、請求項1〜9のいずれか一項に記載の化合物。
【請求項12】
−CH2−R4が結合されている炭素が、絶対(R)立体化学を有する、請求項1〜11のいずれか一項に記載の化合物。
【請求項13】
−CH2−R4が結合されている炭素が、絶対(S)立体化学を有する、請求項1〜11のいずれか一項に記載の化合物。
【請求項14】
k、m、n、及びpのうちの1つが1であり、k、m、n、及びpの残りが、0である、請求項1〜13のいずれか一項に記載の化合物。
【請求項15】
k、m、n、及びpのうちの2つが1であり、k、m、n、及びpの残りが、0である、請求項1〜13のいずれか一項に記載の化合物。
【請求項16】
k及びmの少なくとも一方が、0ではない、請求項1〜15のいずれか一項に記載の化合物。
【請求項17】
n及びpの少なくとも1つが、0ではない、請求項1〜15のいずれか一項に記載の化合物。
【請求項18】
k及びmの少なくとも1つが0ではなく、n及びpの少なくとも1つが、0ではない、請求項1〜17のいずれか一項に記載の化合物。
【請求項19】
k及びnが両方とも0である、請求項1〜15のいずれか一項に記載の化合物。
【請求項20】
k及びnが両方とも0であり、m及びpの一方が0であり、m及びpの他方が1である、請求項1〜14のいずれか一項に記載の化合物。
【請求項21】
k及びnが両方とも0であり、m及びpが両方とも1である、請求項15に記載の化合物。
【請求項22】
4つのアミノ酸が全て、L−アミノ酸である、請求項1〜21のいずれか一項に記載の化合物。
【請求項23】
前記アミノ酸のうちの3つが、L−アミノ酸であり、前記アミノ酸のうちの1つがD−アミノ酸である、請求項1〜21のいずれか一項に記載の化合物。
【請求項24】
前記アミノ酸のうちの2つが、L−アミノ酸であり、前記アミノ酸のうちの2つがD−アミノ酸である、請求項1〜21のいずれか一項に記載の化合物。
【請求項25】
前記アミノ酸のうちの1つが、L−アミノ酸であり、前記アミノ酸のうちの3つがD−アミノ酸である、請求項1〜21のいずれか一項に記載の化合物。
【請求項26】
4つのアミノ酸が全て、D−アミノ酸である、請求項1〜21のいずれか一項に記載の化合物。
【請求項27】
R及びR’が一緒になって−(CH2)3−を形成する、請求項1〜26のいずれか一項に記載の化合物。
【請求項28】
R’’及びR’’’が一緒になって−(CH2)3−を形成する、請求項1〜27のいずれか一項に記載の化合物。
【請求項29】
R及びR’が一緒になって−(CH2)4−を形成する、請求項1〜26のいずれか一項に記載の化合物。
【請求項30】
R’’及びR’’’が一緒になって−(CH2)4−を形成する、請求項1〜27のいずれか一項に記載の化合物。
【請求項31】
R’及びR’が一緒になって−CH2−CH(OH)−CH2−を形成する、請求項1〜27に記載の化合物。
【請求項32】
OHが結合されている炭素が、絶対(S)立体化学を有する、請求項31に記載の化合物。
【請求項33】
OHが結合されている炭素が、絶対(R)立体化学を有する、請求項31に記載の化合物。
【請求項34】
R’’及びR’’’が一緒になって−CH2−CH(OH)−CH2−を形成する、請求項1〜27のいずれか一項に記載の化合物。
【請求項35】
OHが結合されている炭素が、絶対(S)立体化学を有する、請求項34に記載の化合物。
【請求項36】
OHが結合されている炭素が、絶対(R)立体化学を有する、請求項34に記載の化合物。
【請求項37】
R及びR’が一緒になり、R’が結合されている炭素が、絶対(S)立体化学を有する、請求項1〜21及び27〜36のいずれか一項に記載の化合物。
【請求項38】
R及びR’が一緒になり、R’が結合されている炭素が、絶対(R)立体化学を有する、請求項1〜21及び27〜36のいずれか一項に記載の化合物。
【請求項39】
R’’及びR’’’が一緒になり、R’’’が結合されている炭素が、絶対(S)立体化学を有する、請求項1〜21及び27〜36のいずれか一項に記載の化合物。
【請求項40】
R’’及びR’’’が一緒になり、R’’’が結合されている炭素が、絶対(R)立体化学を有する、請求項1〜21及び27〜36のいずれか一項に記載の化合物。
【請求項41】
前記化合物が、
【化2】

I−1、
【化3】

I−2、
【化4】

I−3、
【化5】

I−4、
【化6】

I−5、
【化7】

I−6、
【化8】

I−7、及び
【化9】

I−8
からなる群から選択される、請求項1に記載の化合物。
【請求項42】
式I−1である、請求項41に記載の化合物。
【請求項43】
式I−2である、請求項41に記載の化合物。
【請求項44】
式I−3である、請求項41に記載の化合物。
【請求項45】
式I−4である、請求項41に記載の化合物。
【請求項46】
式I−5である、請求項41に記載の化合物。
【請求項47】
式I−6である、請求項41に記載の化合物。
【請求項48】
式I−7である、請求項41に記載の化合物。
【請求項49】
式I−8である、請求項41に記載の化合物。
【請求項50】
【化10】

I−A、
【化11】

I−B、
【化12】

I−C、
【化13】

I−D、
【化14】

I−E、
【化15】

I−F、
【化16】

I−G、
【化17】

I−H、
【化18】

I−J、
【化19】

I−K、
【化20】

I−L、
【化21】

I−M、
【化22】

I−N、
【化23】

I−O、及び
【化24】

I−P
からなる群から選択される、請求項1又は請求項41に記載の化合物。
【請求項51】
式I−Aである、請求項50に記載の化合物。
【請求項52】
式I−Bである、請求項50に記載の化合物。
【請求項53】
式I−Cである、請求項50に記載の化合物。
【請求項54】
式I−Dである、請求項50に記載の化合物。
【請求項55】
式I−Eである、請求項50に記載の化合物。
【請求項56】
式I−Fである、請求項50に記載の化合物。
【請求項57】
式I−Gである、請求項50に記載の化合物。
【請求項58】
式I−Hである、請求項50に記載の化合物。
【請求項59】
式I−Iである、請求項50に記載の化合物。
【請求項60】
式I−Jである、請求項50に記載の化合物。
【請求項61】
式I−Kである、請求項50に記載の化合物。
【請求項62】
式I−Lである、請求項50に記載の化合物。
【請求項63】
式I−Mである、請求項50に記載の化合物。
【請求項64】
式I−Nである、請求項50に記載の化合物。
【請求項65】
式I−Oである、請求項50に記載の化合物。
【請求項66】
式I−Pである、請求項50に記載の化合物。
【請求項67】
前記式Iの化合物の1つ又は複数のアミノ基が、保護された形態である、請求項1〜66のいずれか一項に記載の化合物。
【請求項68】
請求項1〜66のいずれか一項に記載の式Iの化合物及びその薬学的に許容される担体、賦形剤、又は希釈剤を含む医薬組成物。
【請求項69】
前記化合物が、式I−1の化合物である、請求項68に記載の医薬組成物。
【請求項70】
前記化合物が、式I−2の化合物である、請求項68に記載の医薬組成物。
【請求項71】
前記化合物が、式I−3の化合物である、請求項68に記載の医薬組成物。
【請求項72】
前記化合物が、式I−4の化合物である、請求項68に記載の医薬組成物。
【請求項73】
前記化合物が、式I−5の化合物である、請求項68に記載の医薬組成物。
【請求項74】
前記化合物が、式I−6の化合物である、請求項68に記載の医薬組成物。
【請求項75】
前記化合物が、式I−7の化合物である、請求項68に記載の医薬組成物。
【請求項76】
前記化合物が、式I−8の化合物である、請求項68に記載の医薬組成物。
【請求項77】
前記化合物が、式I−Aの化合物である、請求項68に記載の医薬組成物。
【請求項78】
前記化合物が、式I−Bの化合物である、請求項68に記載の医薬組成物。
【請求項79】
前記化合物が、式I−Cの化合物である、請求項68に記載の医薬組成物。
【請求項80】
前記化合物が、式I−Dの化合物である、請求項68に記載の医薬組成物。
【請求項81】
前記化合物が、式I−Eの化合物である、請求項68に記載の医薬組成物。
【請求項82】
前記化合物が、式I−Fの化合物である、請求項68に記載の医薬組成物。
【請求項83】
前記化合物が、式I−Gの化合物である、請求項68に記載の医薬組成物。
【請求項84】
前記化合物が、式I−Hの化合物である、請求項68に記載の医薬組成物。
【請求項85】
前記化合物が、式I−Iの化合物である、請求項68に記載の医薬組成物。
【請求項86】
前記化合物が、式I−Jの化合物である、請求項68に記載の医薬組成物。
【請求項87】
前記化合物が、式I−Kの化合物である、請求項68に記載の医薬組成物。
【請求項88】
前記化合物が、式I−Lの化合物である、請求項68に記載の医薬組成物。
【請求項89】
前記化合物が、式I−Mの化合物である、請求項68に記載の医薬組成物。
【請求項90】
前記化合物が、式I−Nの化合物である、請求項68に記載の医薬組成物。
【請求項91】
前記化合物が、式I−Oの化合物である、請求項68に記載の医薬組成物。
【請求項92】
前記化合物が、式I−Pの化合物である、請求項68に記載の医薬組成物。
【請求項93】
患者の免疫応答を抑制する方法であって、その必要性のある患者に有効量の式Iの化合物を投与することを含む方法。
【請求項94】
前記抑制される免疫応答が、炎症である、請求項93に記載の方法。
【請求項95】
前記抑制される免疫応答が、移植拒絶反応である、請求項93に記載の方法。
【請求項96】
患者の免疫媒介性疾患又は状態を治療又は予防する方法であって、その必要性のある患者に有効量の式Iの化合物を投与することを含む方法。
【請求項97】
前記免疫媒介性疾患又は状態が、自己免疫疾患、炎症プロセス、移植拒絶反応、及びアレルギー反応からなる群から選択される、請求項96に記載の方法。
【請求項98】
前記免疫媒介性疾患又は状態が、乾癬、扁平苔癬、及び他の丘疹鱗屑疾患から選択される、請求項96に記載の方法。
【請求項99】
前記免疫媒介性疾患又は状態が、湿疹及び皮膚炎から選択される、請求項96に記載の方法。
【請求項100】
前記湿疹又は皮膚炎が、湿疹、アトピー性湿疹、脂漏性皮膚炎、及び汗疱から選択される、請求項99に記載の方法。
【請求項101】
前記免疫媒介性疾患又は状態が、光に対する皮膚反応である、請求項96に記載の方法。
【請求項102】
前記免疫媒介性疾患又は状態が、非特異的皮層刺激及び昆虫刺傷から選択される、請求項96に記載の方法。
【請求項103】
前記免疫媒介性疾患又は状態が、じんま疹である、請求項96に記載の方法。
【請求項104】
前記免疫媒介性疾患又は状態が、原発性皮膚腫瘍(例えば、黒色腫);関節リウマチ(自己免疫性及び感染誘発性の両方);クローン病;炎症性腸疾患;過敏性腸症候群;神経変性疾患(例えば、多発性硬化症);パーキンソン病;移植片対宿主反応;重症乾癬;及びアトピー性皮膚炎からなる群から選択される、請求項96に記載の方法。
【請求項105】
薬物の毒性特性を低下させる方法であって、前記薬物と共に式Iの化合物を投与することを含む方法。
【請求項106】
前記式Iの化合物が、化学療法薬と共に投与される、請求項105に記載の方法。
【請求項107】
前記化合物が、式I−1の化合物である、請求項93〜106のいずれか一項に記載の方法。
【請求項108】
前記化合物が、式I−2の化合物である、請求項93〜106のいずれか一項に記載の方法。
【請求項109】
前記化合物が、式I−3の化合物である、請求項93〜106のいずれか一項に記載の方法。
【請求項110】
前記化合物が、式I−4の化合物である、請求項93〜106のいずれか一項に記載の方法。
【請求項111】
前記化合物が、式I−5の化合物である、請求項93〜106のいずれか一項に記載の方法。
【請求項112】
前記化合物が、式I−6の化合物である、請求項93〜106のいずれか一項に記載の方法。
【請求項113】
前記化合物が、式I−7の化合物である、請求項93〜106のいずれか一項に記載の方法。
【請求項114】
前記化合物が、式I−8の化合物である、請求項93〜106のいずれか一項に記載の方法。
【請求項115】
前記化合物が、式I−Aの化合物である、請求項93〜106のいずれか一項に記載の方法。
【請求項116】
前記化合物が、式I−Bの化合物である、請求項93〜106のいずれか一項に記載の方法。
【請求項117】
前記化合物が、式I−Cの化合物である、請求項93〜106のいずれか一項に記載の方法。
【請求項118】
前記化合物が、式I−Dの化合物である、請求項93〜106のいずれか一項に記載の方法。
【請求項119】
前記化合物が、式I−Eの化合物である、請求項93〜106のいずれか一項に記載の方法。
【請求項120】
前記化合物が、式I−Fの化合物である、請求項93〜106のいずれか一項に記載の方法。
【請求項121】
前記化合物が、式I−Gの化合物である、請求項93〜106のいずれか一項に記載の方法。
【請求項122】
前記化合物が、式I−Hの化合物である、請求項93〜106のいずれか一項に記載の方法。
【請求項123】
前記化合物が、式I−Iの化合物である、請求項93〜106のいずれか一項に記載の方法。
【請求項124】
前記化合物が、式I−Jの化合物である、請求項93〜106のいずれか一項に記載の方法。
【請求項125】
前記化合物が、式I−Kの化合物である、請求項93〜106のいずれか一項に記載の方法。
【請求項126】
前記化合物が、式I−Lの化合物である、請求項93〜106のいずれか一項に記載の方法。
【請求項127】
前記化合物が、式I−Mの化合物である、請求項93〜106のいずれか一項に記載の方法。
【請求項128】
前記化合物が、式I−Nの化合物である、請求項93〜106のいずれか一項に記載の方法。
【請求項129】
前記化合物が、式I−Oの化合物である、請求項93〜106のいずれか一項に記載の方法。
【請求項130】
前記化合物が、式I−Pの化合物である、請求項93〜106のいずれか一項に記載の方法。
【請求項131】
請求項1〜58のいずれか一項に記載の式Iの化合物、及び(a)患者の免疫応答を抑制するか、(b)患者の免疫媒介性疾患又は状態を治療又は予防するか、又は(c)第2の薬物の毒性特性を低下させるために前記化合物を使用するための説明書を含むキット。
【請求項132】
前記免疫応答が、炎症、移植拒絶反応、及び炎症からなる群から選択される、請求項131に記載のキット。
【請求項133】
前記免疫媒介性疾患又は状態が、自己免疫疾患、炎症プロセス、移植拒絶反応、及びアレルギー反応からなる群から選択される、請求項131に記載のキット。
【請求項134】
前記免疫媒介性疾患又は状態が、乾癬、扁平苔癬、及び他の丘疹鱗屑疾患;湿疹及び皮膚炎;光に対する皮膚反応;非特異的皮膚刺激及び昆虫刺傷;じんま疹;原発性皮膚腫瘍(例えば、黒色腫);関節リウマチ(自己免疫性及び感染誘発性の両方);クローン病;炎症性腸疾患;過敏性腸症候群;神経変性疾患(例えば、多発性硬化症);パーキンソン病;移植片対宿主反応;重症乾癬;及びアトピー性皮膚炎からなる群から選択される、請求項131に記載のキット。
【請求項135】
前記湿疹又は皮膚炎が、湿疹、アトピー性湿疹、脂漏性皮膚炎、及び汗疱から選択される、請求項134に記載のキット。
【請求項136】
前記説明書が、化学療法薬と共に前記式Iの化合物を投与することを指示する、請求項131〜135のいずれか一項に記載のキット。
【請求項137】
請求項1で定義されている式Iの化合物を製造する方法であって、式II−1、II−2、II−3、又はII−4:
【化25】

II−1
【化26】

II−2
【化27】

II−3
【化28】

II−4
を有する化合物(以下、式IIの化合物と総称する)を環化して、前記対応する式Iの化合物にすることを含む方法。
【請求項138】
前記式II−1、II−2、II−3、又はII−4の化合物を合成することを更に含む、請求項137に記載の方法。
【請求項139】
前記式II−1、II−2、II−3、又はII−4の化合物が、固相合成により合成される、請求項138に記載の方法。
【請求項140】
式II−1、II−2、II−3、及びII−4からなる群から選択される化合物。
【請求項141】
式II−1の化合物である、請求項140に記載の化合物。
【請求項142】
式II−2の化合物である、請求項140に記載の化合物。
【請求項143】
式II−3の化合物である、請求項140に記載の化合物。
【請求項144】
式II−4の化合物である、請求項140に記載の化合物。
【請求項145】
【化29】

II−4−a、
【化30】

II−1−a、
【化31】

II−2−a、
【化32】

II−3−a、
【化33】

II−4−b、
【化34】

II−1−b、
【化35】

II−2−b、
【化36】

II−3−b、
【化37】

II−4−c、
【化38】

II−1−c、
【化39】

II−2−c、
【化40】

II−3−c、
【化41】

II−4−d、
【化42】

II−1−d、
【化43】

II−2−d、
【化44】

II−3−d、
【化45】

II−4−e、
【化46】

II−1−e、
【化47】

II−2−e、
【化48】

II−3−e、
【化49】

II−4−f、
【化50】

II−1−f、
【化51】

II−2−f、
【化52】

II−3−f、
【化53】

II−4−g、
【化54】

II−1−g、
【化55】

II−2−g、
【化56】

II−3−g、
【化57】

II−4−h、
【化58】

II−1−h、
【化59】

II−2−h、及び
【化60】

II−3−h
からなる群から選択される、請求項140に記載の化合物。
【請求項146】
式II−1−aである、請求項145に記載の化合物。
【請求項147】
式II−2−aである、請求項145に記載の化合物。
【請求項148】
式II−3−aである、請求項145に記載の化合物。
【請求項149】
式II−4−aである、請求項145に記載の化合物。
【請求項150】
式II−1−bである、請求項145に記載の化合物。
【請求項151】
式II−2−bである、請求項145に記載の化合物。
【請求項152】
式II−3−bである、請求項145に記載の化合物。
【請求項153】
式II−4−bである、請求項145に記載の化合物。
【請求項154】
式II−1−cである、請求項145に記載の化合物。
【請求項155】
式II−2−cである、請求項145に記載の化合物。
【請求項156】
式II−3−cである、請求項145に記載の化合物。
【請求項157】
式II−4−cである、請求項145に記載の化合物。
【請求項158】
式II−1−dである、請求項145に記載の化合物。
【請求項159】
式II−2−dである、請求項145に記載の化合物。
【請求項160】
式II−3−dである、請求項145に記載の化合物。
【請求項161】
式II−4−dである、請求項145に記載の化合物。
【請求項162】
式II−1−eである、請求項145に記載の化合物。
【請求項163】
式II−2−eである、請求項145に記載の化合物。
【請求項164】
式II−3−eである、請求項145に記載の化合物。
【請求項165】
式II−4−eである、請求項145に記載の化合物。
【請求項166】
式II−1−fである、請求項145に記載の化合物。
【請求項167】
式II−2−fである、請求項145に記載の化合物。
【請求項168】
式II−3−fである、請求項145に記載の化合物。
【請求項169】
式II−4−fである、請求項145に記載の化合物。
【請求項170】
式II−1−gである、請求項145に記載の化合物。
【請求項171】
式II−2−gである、請求項145に記載の化合物。
【請求項172】
式II−3−gである、請求項145に記載の化合物。
【請求項173】
式II−4−gである、請求項145に記載の化合物。
【請求項174】
式II−1−hである、請求項145に記載の化合物。
【請求項175】
式II−2−hである、請求項145に記載の化合物。
【請求項176】
式II−3−hである、請求項145に記載の化合物。
【請求項177】
式II−4−hである、請求項145に記載の化合物。
【請求項178】
式II−A−1、II−A−2、II−A−3、II−A−4、II−B−1、II−B−2、II−B−3、II−B−4、II−C−1、II−C−2、II−C−3、II−C−4、II−D−1、II−D−2、II−D−3、II−D−4、II−E−1、II−E−2、II−E−3、II−E−4、II−F−1、II−F−2、II−F−3、II−F−4、II−G−1、II−G−2、II−G−3、II−G−4、II−H−1、II−H−2、II−H−3、II−H−4、II−J−l、II−J−2、II−J−3、II−J−4、II−K−1、II−K−2、II−K−3、II−K−4、II−L−l、II−L−2、II−L−3、II−L−4、II−M−1、II−M−2、II−M−3、II−M−4、II−N−1、II−N−2、II−N−3、II−N−4、II−O−1、II−O−2、II−O−3、II−O−4、II−P−1、II−P−2、II−P−3、及びII−P−4からなる群から選択される、請求項140に記載の化合物。
【請求項179】
式II−A−1である、請求項178に記載の化合物。
【請求項180】
式II−A−2である、請求項178に記載の化合物。
【請求項181】
式II−A−3である、請求項178に記載の化合物。
【請求項182】
式II−A−4である、請求項178に記載の化合物。
【請求項183】
式II−B−1である、請求項178に記載の化合物。
【請求項184】
式II−B−2である、請求項178に記載の化合物。
【請求項185】
式II−B−3である、請求項178に記載の化合物。
【請求項186】
式II−B−4である、請求項178に記載の化合物。
【請求項187】
式II−C−1である、請求項178に記載の化合物。
【請求項188】
式II−C−2である、請求項178に記載の化合物。
【請求項189】
式II−C−3である、請求項178に記載の化合物。
【請求項190】
式II−C−4である、請求項178に記載の化合物。
【請求項191】
式II−D−1である、請求項178に記載の化合物。
【請求項192】
式II−D−2である、請求項178に記載の化合物。
【請求項193】
式II−D−3である、請求項178に記載の化合物。
【請求項194】
式II−D−4である、請求項178に記載の化合物。
【請求項195】
式II−E−1である、請求項178に記載の化合物。
【請求項196】
式II−E−2である、請求項178に記載の化合物。
【請求項197】
式II−E−3である、請求項178に記載の化合物。
【請求項198】
式II−E−4である、請求項178に記載の化合物。
【請求項199】
式II−F−1である、請求項178に記載の化合物。
【請求項200】
式II−F−2である、請求項178に記載の化合物。
【請求項201】
式II−F−3である、請求項178に記載の化合物。
【請求項202】
式II−F−4である、請求項178に記載の化合物。
【請求項203】
式II−G−1である、請求項178に記載の化合物。
【請求項204】
式II−G−2である、請求項178に記載の化合物。
【請求項205】
式II−G−3である、請求項178に記載の化合物。
【請求項206】
式II−G−4である、請求項178に記載の化合物。
【請求項207】
式II−H−1である、請求項178に記載の化合物。
【請求項208】
式II−H−2である、請求項178に記載の化合物。
【請求項209】
式II−H−3である、請求項178に記載の化合物。
【請求項210】
式II−H−4である、請求項178に記載の化合物。
【請求項211】
式II−J−1である、請求項178に記載の化合物。
【請求項212】
式II−J−2である、請求項178に記載の化合物。
【請求項213】
式II−J−3である、請求項178に記載の化合物。
【請求項214】
式II−J−4である、請求項178に記載の化合物。
【請求項215】
式II−K−1である、請求項178に記載の化合物。
【請求項216】
式II−K−2である、請求項178に記載の化合物。
【請求項217】
式II−K−3である、請求項178に記載の化合物。
【請求項218】
式II−K−4である、請求項178に記載の化合物。
【請求項219】
式II−L−1である、請求項178に記載の化合物。
【請求項220】
式II−L−2である、請求項178に記載の化合物。
【請求項221】
式II−L−3である、請求項178に記載の化合物。
【請求項222】
式II−L−4である、請求項178に記載の化合物。
【請求項223】
式II−M−1である、請求項178に記載の化合物。
【請求項224】
式II−M−2である、請求項178に記載の化合物。
【請求項225】
式II−M−3である、請求項178に記載の化合物。
【請求項226】
式II−M−4である、請求項178に記載の化合物。
【請求項227】
式II−N−1である、請求項178に記載の化合物。
【請求項228】
式II−N−2である、請求項178に記載の化合物。
【請求項229】
式II−N−3である、請求項178に記載の化合物。
【請求項230】
式II−N−4である、請求項178に記載の化合物。
【請求項231】
式II−O−1である、請求項178に記載の化合物。
【請求項232】
式II−O−2である、請求項178に記載の化合物。
【請求項233】
式II−O−3である、請求項178に記載の化合物。
【請求項234】
式II−O−4である、請求項178に記載の化合物。
【請求項235】
式II−P−1である、請求項178に記載の化合物。
【請求項236】
式II−P−2である、請求項178に記載の化合物。
【請求項237】
式II−P−3である、請求項178に記載の化合物。
【請求項238】
式II−P−4である、請求項178に記載の化合物。
【請求項239】
1つ又は複数のアミノ基が、保護された形態である、請求項140〜238のいずれか一項に記載の化合物。
【請求項240】
いずれのアミノ基も保護された形態ではない、請求項140〜238のいずれか一項に記載の化合物。
【請求項241】
固相レジンに結合されている、請求項140〜240のいずれか一項に記載の化合物。
【請求項242】
前記固相レジンに直接結合されている、請求項241に記載の化合物。
【請求項243】
前記固相レジンにリンカーを介して結合されている、請求項241に記載の化合物。
【請求項1】
式Iを有する化合物又はその薬学的に許容される塩。
【化1】

(式中、
k、m、n、及びpは、各々独立して0、1、又は2であり、 R及びR’は、各々独立してH及びC1〜3アルキルから選択されるか、又はR及びR’は、一緒になって−CR1R1’−X−CH2−であり、ここでCR1R1’は骨格窒素に結合されており、R1及びR1’は、各々独立してH及びC1〜3アルキルから選択され、Xは、−CH2−、−CH2CH2−、−CH(OH)−、−O−、−S−、及び−NH−から選択され、
R’’及びR’’’は、各々独立してH及びC1〜3アルキルから選択されるか、又はR’’及びR’’’は、一緒になって−CR2R2’−X’−CH2−であり、ここでCR2R2’は骨格窒素に結合されており、R2及びR2’は、各々独立してH及びC1〜3アルキルから選択され、X’は、−CH2−、−CH2CH2−、−CH(OH)−、−O−、−S−、及び−NH−から選択され、 R3及びR4は、各々独立してアリール、置換アリール、へテロアリール、及び置換へテロアリールから選択される。)
【請求項2】
R3及びR4の少なくとも1つが、フェニルである、請求項1に記載の化合物。
【請求項3】
R3及びR4の少なくとも1つが、4−ヒドロキシフェニルである、請求項1又は請求項2に記載の化合物。
【請求項4】
R3及びR4の少なくとも1つが、4−t−ブトキシフェニルである、請求項1又は請求項2に記載の化合物。
【請求項5】
R3及びR4の少なくとも1つが、2−インドリルである、請求項1又は請求項2に記載の化合物。
【請求項6】
R3及びR4が両方とも、フェニルである、請求項1又は請求項2に記載の化合物。
【請求項7】
R3及びR4の一方がフェニルであり、R3及びR4の他方が4−ヒドロキシフェニルである、請求項1又は請求項2に記載の化合物。
【請求項8】
R3及びR4の一方がフェニルであり、R3及びR4の他方が4−t−ブトキシフェニルである、請求項1又は請求項2に記載の化合物。
【請求項9】
R3及びR4の一方がフェニルであり、R3及びR4の他方が2−インドリルである、請求項1又は請求項2に記載の化合物。
【請求項10】
−CH2−R3が結合されている炭素が、絶対(R)立体化学を有する、請求項1〜9のいずれか一項に記載の化合物。
【請求項11】
−CH2−R3が結合されている炭素が、絶対(S)立体化学を有する、請求項1〜9のいずれか一項に記載の化合物。
【請求項12】
−CH2−R4が結合されている炭素が、絶対(R)立体化学を有する、請求項1〜11のいずれか一項に記載の化合物。
【請求項13】
−CH2−R4が結合されている炭素が、絶対(S)立体化学を有する、請求項1〜11のいずれか一項に記載の化合物。
【請求項14】
k、m、n、及びpのうちの1つが1であり、k、m、n、及びpの残りが、0である、請求項1〜13のいずれか一項に記載の化合物。
【請求項15】
k、m、n、及びpのうちの2つが1であり、k、m、n、及びpの残りが、0である、請求項1〜13のいずれか一項に記載の化合物。
【請求項16】
k及びmの少なくとも一方が、0ではない、請求項1〜15のいずれか一項に記載の化合物。
【請求項17】
n及びpの少なくとも1つが、0ではない、請求項1〜15のいずれか一項に記載の化合物。
【請求項18】
k及びmの少なくとも1つが0ではなく、n及びpの少なくとも1つが、0ではない、請求項1〜17のいずれか一項に記載の化合物。
【請求項19】
k及びnが両方とも0である、請求項1〜15のいずれか一項に記載の化合物。
【請求項20】
k及びnが両方とも0であり、m及びpの一方が0であり、m及びpの他方が1である、請求項1〜14のいずれか一項に記載の化合物。
【請求項21】
k及びnが両方とも0であり、m及びpが両方とも1である、請求項15に記載の化合物。
【請求項22】
4つのアミノ酸が全て、L−アミノ酸である、請求項1〜21のいずれか一項に記載の化合物。
【請求項23】
前記アミノ酸のうちの3つが、L−アミノ酸であり、前記アミノ酸のうちの1つがD−アミノ酸である、請求項1〜21のいずれか一項に記載の化合物。
【請求項24】
前記アミノ酸のうちの2つが、L−アミノ酸であり、前記アミノ酸のうちの2つがD−アミノ酸である、請求項1〜21のいずれか一項に記載の化合物。
【請求項25】
前記アミノ酸のうちの1つが、L−アミノ酸であり、前記アミノ酸のうちの3つがD−アミノ酸である、請求項1〜21のいずれか一項に記載の化合物。
【請求項26】
4つのアミノ酸が全て、D−アミノ酸である、請求項1〜21のいずれか一項に記載の化合物。
【請求項27】
R及びR’が一緒になって−(CH2)3−を形成する、請求項1〜26のいずれか一項に記載の化合物。
【請求項28】
R’’及びR’’’が一緒になって−(CH2)3−を形成する、請求項1〜27のいずれか一項に記載の化合物。
【請求項29】
R及びR’が一緒になって−(CH2)4−を形成する、請求項1〜26のいずれか一項に記載の化合物。
【請求項30】
R’’及びR’’’が一緒になって−(CH2)4−を形成する、請求項1〜27のいずれか一項に記載の化合物。
【請求項31】
R’及びR’が一緒になって−CH2−CH(OH)−CH2−を形成する、請求項1〜27に記載の化合物。
【請求項32】
OHが結合されている炭素が、絶対(S)立体化学を有する、請求項31に記載の化合物。
【請求項33】
OHが結合されている炭素が、絶対(R)立体化学を有する、請求項31に記載の化合物。
【請求項34】
R’’及びR’’’が一緒になって−CH2−CH(OH)−CH2−を形成する、請求項1〜27のいずれか一項に記載の化合物。
【請求項35】
OHが結合されている炭素が、絶対(S)立体化学を有する、請求項34に記載の化合物。
【請求項36】
OHが結合されている炭素が、絶対(R)立体化学を有する、請求項34に記載の化合物。
【請求項37】
R及びR’が一緒になり、R’が結合されている炭素が、絶対(S)立体化学を有する、請求項1〜21及び27〜36のいずれか一項に記載の化合物。
【請求項38】
R及びR’が一緒になり、R’が結合されている炭素が、絶対(R)立体化学を有する、請求項1〜21及び27〜36のいずれか一項に記載の化合物。
【請求項39】
R’’及びR’’’が一緒になり、R’’’が結合されている炭素が、絶対(S)立体化学を有する、請求項1〜21及び27〜36のいずれか一項に記載の化合物。
【請求項40】
R’’及びR’’’が一緒になり、R’’’が結合されている炭素が、絶対(R)立体化学を有する、請求項1〜21及び27〜36のいずれか一項に記載の化合物。
【請求項41】
前記化合物が、
【化2】

I−1、
【化3】

I−2、
【化4】

I−3、
【化5】

I−4、
【化6】

I−5、
【化7】

I−6、
【化8】

I−7、及び
【化9】

I−8
からなる群から選択される、請求項1に記載の化合物。
【請求項42】
式I−1である、請求項41に記載の化合物。
【請求項43】
式I−2である、請求項41に記載の化合物。
【請求項44】
式I−3である、請求項41に記載の化合物。
【請求項45】
式I−4である、請求項41に記載の化合物。
【請求項46】
式I−5である、請求項41に記載の化合物。
【請求項47】
式I−6である、請求項41に記載の化合物。
【請求項48】
式I−7である、請求項41に記載の化合物。
【請求項49】
式I−8である、請求項41に記載の化合物。
【請求項50】
【化10】

I−A、
【化11】

I−B、
【化12】

I−C、
【化13】

I−D、
【化14】

I−E、
【化15】

I−F、
【化16】

I−G、
【化17】

I−H、
【化18】

I−J、
【化19】

I−K、
【化20】

I−L、
【化21】

I−M、
【化22】

I−N、
【化23】

I−O、及び
【化24】

I−P
からなる群から選択される、請求項1又は請求項41に記載の化合物。
【請求項51】
式I−Aである、請求項50に記載の化合物。
【請求項52】
式I−Bである、請求項50に記載の化合物。
【請求項53】
式I−Cである、請求項50に記載の化合物。
【請求項54】
式I−Dである、請求項50に記載の化合物。
【請求項55】
式I−Eである、請求項50に記載の化合物。
【請求項56】
式I−Fである、請求項50に記載の化合物。
【請求項57】
式I−Gである、請求項50に記載の化合物。
【請求項58】
式I−Hである、請求項50に記載の化合物。
【請求項59】
式I−Iである、請求項50に記載の化合物。
【請求項60】
式I−Jである、請求項50に記載の化合物。
【請求項61】
式I−Kである、請求項50に記載の化合物。
【請求項62】
式I−Lである、請求項50に記載の化合物。
【請求項63】
式I−Mである、請求項50に記載の化合物。
【請求項64】
式I−Nである、請求項50に記載の化合物。
【請求項65】
式I−Oである、請求項50に記載の化合物。
【請求項66】
式I−Pである、請求項50に記載の化合物。
【請求項67】
前記式Iの化合物の1つ又は複数のアミノ基が、保護された形態である、請求項1〜66のいずれか一項に記載の化合物。
【請求項68】
請求項1〜66のいずれか一項に記載の式Iの化合物及びその薬学的に許容される担体、賦形剤、又は希釈剤を含む医薬組成物。
【請求項69】
前記化合物が、式I−1の化合物である、請求項68に記載の医薬組成物。
【請求項70】
前記化合物が、式I−2の化合物である、請求項68に記載の医薬組成物。
【請求項71】
前記化合物が、式I−3の化合物である、請求項68に記載の医薬組成物。
【請求項72】
前記化合物が、式I−4の化合物である、請求項68に記載の医薬組成物。
【請求項73】
前記化合物が、式I−5の化合物である、請求項68に記載の医薬組成物。
【請求項74】
前記化合物が、式I−6の化合物である、請求項68に記載の医薬組成物。
【請求項75】
前記化合物が、式I−7の化合物である、請求項68に記載の医薬組成物。
【請求項76】
前記化合物が、式I−8の化合物である、請求項68に記載の医薬組成物。
【請求項77】
前記化合物が、式I−Aの化合物である、請求項68に記載の医薬組成物。
【請求項78】
前記化合物が、式I−Bの化合物である、請求項68に記載の医薬組成物。
【請求項79】
前記化合物が、式I−Cの化合物である、請求項68に記載の医薬組成物。
【請求項80】
前記化合物が、式I−Dの化合物である、請求項68に記載の医薬組成物。
【請求項81】
前記化合物が、式I−Eの化合物である、請求項68に記載の医薬組成物。
【請求項82】
前記化合物が、式I−Fの化合物である、請求項68に記載の医薬組成物。
【請求項83】
前記化合物が、式I−Gの化合物である、請求項68に記載の医薬組成物。
【請求項84】
前記化合物が、式I−Hの化合物である、請求項68に記載の医薬組成物。
【請求項85】
前記化合物が、式I−Iの化合物である、請求項68に記載の医薬組成物。
【請求項86】
前記化合物が、式I−Jの化合物である、請求項68に記載の医薬組成物。
【請求項87】
前記化合物が、式I−Kの化合物である、請求項68に記載の医薬組成物。
【請求項88】
前記化合物が、式I−Lの化合物である、請求項68に記載の医薬組成物。
【請求項89】
前記化合物が、式I−Mの化合物である、請求項68に記載の医薬組成物。
【請求項90】
前記化合物が、式I−Nの化合物である、請求項68に記載の医薬組成物。
【請求項91】
前記化合物が、式I−Oの化合物である、請求項68に記載の医薬組成物。
【請求項92】
前記化合物が、式I−Pの化合物である、請求項68に記載の医薬組成物。
【請求項93】
患者の免疫応答を抑制する方法であって、その必要性のある患者に有効量の式Iの化合物を投与することを含む方法。
【請求項94】
前記抑制される免疫応答が、炎症である、請求項93に記載の方法。
【請求項95】
前記抑制される免疫応答が、移植拒絶反応である、請求項93に記載の方法。
【請求項96】
患者の免疫媒介性疾患又は状態を治療又は予防する方法であって、その必要性のある患者に有効量の式Iの化合物を投与することを含む方法。
【請求項97】
前記免疫媒介性疾患又は状態が、自己免疫疾患、炎症プロセス、移植拒絶反応、及びアレルギー反応からなる群から選択される、請求項96に記載の方法。
【請求項98】
前記免疫媒介性疾患又は状態が、乾癬、扁平苔癬、及び他の丘疹鱗屑疾患から選択される、請求項96に記載の方法。
【請求項99】
前記免疫媒介性疾患又は状態が、湿疹及び皮膚炎から選択される、請求項96に記載の方法。
【請求項100】
前記湿疹又は皮膚炎が、湿疹、アトピー性湿疹、脂漏性皮膚炎、及び汗疱から選択される、請求項99に記載の方法。
【請求項101】
前記免疫媒介性疾患又は状態が、光に対する皮膚反応である、請求項96に記載の方法。
【請求項102】
前記免疫媒介性疾患又は状態が、非特異的皮層刺激及び昆虫刺傷から選択される、請求項96に記載の方法。
【請求項103】
前記免疫媒介性疾患又は状態が、じんま疹である、請求項96に記載の方法。
【請求項104】
前記免疫媒介性疾患又は状態が、原発性皮膚腫瘍(例えば、黒色腫);関節リウマチ(自己免疫性及び感染誘発性の両方);クローン病;炎症性腸疾患;過敏性腸症候群;神経変性疾患(例えば、多発性硬化症);パーキンソン病;移植片対宿主反応;重症乾癬;及びアトピー性皮膚炎からなる群から選択される、請求項96に記載の方法。
【請求項105】
薬物の毒性特性を低下させる方法であって、前記薬物と共に式Iの化合物を投与することを含む方法。
【請求項106】
前記式Iの化合物が、化学療法薬と共に投与される、請求項105に記載の方法。
【請求項107】
前記化合物が、式I−1の化合物である、請求項93〜106のいずれか一項に記載の方法。
【請求項108】
前記化合物が、式I−2の化合物である、請求項93〜106のいずれか一項に記載の方法。
【請求項109】
前記化合物が、式I−3の化合物である、請求項93〜106のいずれか一項に記載の方法。
【請求項110】
前記化合物が、式I−4の化合物である、請求項93〜106のいずれか一項に記載の方法。
【請求項111】
前記化合物が、式I−5の化合物である、請求項93〜106のいずれか一項に記載の方法。
【請求項112】
前記化合物が、式I−6の化合物である、請求項93〜106のいずれか一項に記載の方法。
【請求項113】
前記化合物が、式I−7の化合物である、請求項93〜106のいずれか一項に記載の方法。
【請求項114】
前記化合物が、式I−8の化合物である、請求項93〜106のいずれか一項に記載の方法。
【請求項115】
前記化合物が、式I−Aの化合物である、請求項93〜106のいずれか一項に記載の方法。
【請求項116】
前記化合物が、式I−Bの化合物である、請求項93〜106のいずれか一項に記載の方法。
【請求項117】
前記化合物が、式I−Cの化合物である、請求項93〜106のいずれか一項に記載の方法。
【請求項118】
前記化合物が、式I−Dの化合物である、請求項93〜106のいずれか一項に記載の方法。
【請求項119】
前記化合物が、式I−Eの化合物である、請求項93〜106のいずれか一項に記載の方法。
【請求項120】
前記化合物が、式I−Fの化合物である、請求項93〜106のいずれか一項に記載の方法。
【請求項121】
前記化合物が、式I−Gの化合物である、請求項93〜106のいずれか一項に記載の方法。
【請求項122】
前記化合物が、式I−Hの化合物である、請求項93〜106のいずれか一項に記載の方法。
【請求項123】
前記化合物が、式I−Iの化合物である、請求項93〜106のいずれか一項に記載の方法。
【請求項124】
前記化合物が、式I−Jの化合物である、請求項93〜106のいずれか一項に記載の方法。
【請求項125】
前記化合物が、式I−Kの化合物である、請求項93〜106のいずれか一項に記載の方法。
【請求項126】
前記化合物が、式I−Lの化合物である、請求項93〜106のいずれか一項に記載の方法。
【請求項127】
前記化合物が、式I−Mの化合物である、請求項93〜106のいずれか一項に記載の方法。
【請求項128】
前記化合物が、式I−Nの化合物である、請求項93〜106のいずれか一項に記載の方法。
【請求項129】
前記化合物が、式I−Oの化合物である、請求項93〜106のいずれか一項に記載の方法。
【請求項130】
前記化合物が、式I−Pの化合物である、請求項93〜106のいずれか一項に記載の方法。
【請求項131】
請求項1〜58のいずれか一項に記載の式Iの化合物、及び(a)患者の免疫応答を抑制するか、(b)患者の免疫媒介性疾患又は状態を治療又は予防するか、又は(c)第2の薬物の毒性特性を低下させるために前記化合物を使用するための説明書を含むキット。
【請求項132】
前記免疫応答が、炎症、移植拒絶反応、及び炎症からなる群から選択される、請求項131に記載のキット。
【請求項133】
前記免疫媒介性疾患又は状態が、自己免疫疾患、炎症プロセス、移植拒絶反応、及びアレルギー反応からなる群から選択される、請求項131に記載のキット。
【請求項134】
前記免疫媒介性疾患又は状態が、乾癬、扁平苔癬、及び他の丘疹鱗屑疾患;湿疹及び皮膚炎;光に対する皮膚反応;非特異的皮膚刺激及び昆虫刺傷;じんま疹;原発性皮膚腫瘍(例えば、黒色腫);関節リウマチ(自己免疫性及び感染誘発性の両方);クローン病;炎症性腸疾患;過敏性腸症候群;神経変性疾患(例えば、多発性硬化症);パーキンソン病;移植片対宿主反応;重症乾癬;及びアトピー性皮膚炎からなる群から選択される、請求項131に記載のキット。
【請求項135】
前記湿疹又は皮膚炎が、湿疹、アトピー性湿疹、脂漏性皮膚炎、及び汗疱から選択される、請求項134に記載のキット。
【請求項136】
前記説明書が、化学療法薬と共に前記式Iの化合物を投与することを指示する、請求項131〜135のいずれか一項に記載のキット。
【請求項137】
請求項1で定義されている式Iの化合物を製造する方法であって、式II−1、II−2、II−3、又はII−4:
【化25】

II−1
【化26】

II−2
【化27】

II−3
【化28】

II−4
を有する化合物(以下、式IIの化合物と総称する)を環化して、前記対応する式Iの化合物にすることを含む方法。
【請求項138】
前記式II−1、II−2、II−3、又はII−4の化合物を合成することを更に含む、請求項137に記載の方法。
【請求項139】
前記式II−1、II−2、II−3、又はII−4の化合物が、固相合成により合成される、請求項138に記載の方法。
【請求項140】
式II−1、II−2、II−3、及びII−4からなる群から選択される化合物。
【請求項141】
式II−1の化合物である、請求項140に記載の化合物。
【請求項142】
式II−2の化合物である、請求項140に記載の化合物。
【請求項143】
式II−3の化合物である、請求項140に記載の化合物。
【請求項144】
式II−4の化合物である、請求項140に記載の化合物。
【請求項145】
【化29】

II−4−a、
【化30】

II−1−a、
【化31】

II−2−a、
【化32】

II−3−a、
【化33】

II−4−b、
【化34】

II−1−b、
【化35】

II−2−b、
【化36】

II−3−b、
【化37】

II−4−c、
【化38】

II−1−c、
【化39】

II−2−c、
【化40】

II−3−c、
【化41】

II−4−d、
【化42】

II−1−d、
【化43】

II−2−d、
【化44】

II−3−d、
【化45】

II−4−e、
【化46】

II−1−e、
【化47】

II−2−e、
【化48】

II−3−e、
【化49】

II−4−f、
【化50】

II−1−f、
【化51】

II−2−f、
【化52】

II−3−f、
【化53】

II−4−g、
【化54】

II−1−g、
【化55】

II−2−g、
【化56】

II−3−g、
【化57】

II−4−h、
【化58】

II−1−h、
【化59】

II−2−h、及び
【化60】

II−3−h
からなる群から選択される、請求項140に記載の化合物。
【請求項146】
式II−1−aである、請求項145に記載の化合物。
【請求項147】
式II−2−aである、請求項145に記載の化合物。
【請求項148】
式II−3−aである、請求項145に記載の化合物。
【請求項149】
式II−4−aである、請求項145に記載の化合物。
【請求項150】
式II−1−bである、請求項145に記載の化合物。
【請求項151】
式II−2−bである、請求項145に記載の化合物。
【請求項152】
式II−3−bである、請求項145に記載の化合物。
【請求項153】
式II−4−bである、請求項145に記載の化合物。
【請求項154】
式II−1−cである、請求項145に記載の化合物。
【請求項155】
式II−2−cである、請求項145に記載の化合物。
【請求項156】
式II−3−cである、請求項145に記載の化合物。
【請求項157】
式II−4−cである、請求項145に記載の化合物。
【請求項158】
式II−1−dである、請求項145に記載の化合物。
【請求項159】
式II−2−dである、請求項145に記載の化合物。
【請求項160】
式II−3−dである、請求項145に記載の化合物。
【請求項161】
式II−4−dである、請求項145に記載の化合物。
【請求項162】
式II−1−eである、請求項145に記載の化合物。
【請求項163】
式II−2−eである、請求項145に記載の化合物。
【請求項164】
式II−3−eである、請求項145に記載の化合物。
【請求項165】
式II−4−eである、請求項145に記載の化合物。
【請求項166】
式II−1−fである、請求項145に記載の化合物。
【請求項167】
式II−2−fである、請求項145に記載の化合物。
【請求項168】
式II−3−fである、請求項145に記載の化合物。
【請求項169】
式II−4−fである、請求項145に記載の化合物。
【請求項170】
式II−1−gである、請求項145に記載の化合物。
【請求項171】
式II−2−gである、請求項145に記載の化合物。
【請求項172】
式II−3−gである、請求項145に記載の化合物。
【請求項173】
式II−4−gである、請求項145に記載の化合物。
【請求項174】
式II−1−hである、請求項145に記載の化合物。
【請求項175】
式II−2−hである、請求項145に記載の化合物。
【請求項176】
式II−3−hである、請求項145に記載の化合物。
【請求項177】
式II−4−hである、請求項145に記載の化合物。
【請求項178】
式II−A−1、II−A−2、II−A−3、II−A−4、II−B−1、II−B−2、II−B−3、II−B−4、II−C−1、II−C−2、II−C−3、II−C−4、II−D−1、II−D−2、II−D−3、II−D−4、II−E−1、II−E−2、II−E−3、II−E−4、II−F−1、II−F−2、II−F−3、II−F−4、II−G−1、II−G−2、II−G−3、II−G−4、II−H−1、II−H−2、II−H−3、II−H−4、II−J−l、II−J−2、II−J−3、II−J−4、II−K−1、II−K−2、II−K−3、II−K−4、II−L−l、II−L−2、II−L−3、II−L−4、II−M−1、II−M−2、II−M−3、II−M−4、II−N−1、II−N−2、II−N−3、II−N−4、II−O−1、II−O−2、II−O−3、II−O−4、II−P−1、II−P−2、II−P−3、及びII−P−4からなる群から選択される、請求項140に記載の化合物。
【請求項179】
式II−A−1である、請求項178に記載の化合物。
【請求項180】
式II−A−2である、請求項178に記載の化合物。
【請求項181】
式II−A−3である、請求項178に記載の化合物。
【請求項182】
式II−A−4である、請求項178に記載の化合物。
【請求項183】
式II−B−1である、請求項178に記載の化合物。
【請求項184】
式II−B−2である、請求項178に記載の化合物。
【請求項185】
式II−B−3である、請求項178に記載の化合物。
【請求項186】
式II−B−4である、請求項178に記載の化合物。
【請求項187】
式II−C−1である、請求項178に記載の化合物。
【請求項188】
式II−C−2である、請求項178に記載の化合物。
【請求項189】
式II−C−3である、請求項178に記載の化合物。
【請求項190】
式II−C−4である、請求項178に記載の化合物。
【請求項191】
式II−D−1である、請求項178に記載の化合物。
【請求項192】
式II−D−2である、請求項178に記載の化合物。
【請求項193】
式II−D−3である、請求項178に記載の化合物。
【請求項194】
式II−D−4である、請求項178に記載の化合物。
【請求項195】
式II−E−1である、請求項178に記載の化合物。
【請求項196】
式II−E−2である、請求項178に記載の化合物。
【請求項197】
式II−E−3である、請求項178に記載の化合物。
【請求項198】
式II−E−4である、請求項178に記載の化合物。
【請求項199】
式II−F−1である、請求項178に記載の化合物。
【請求項200】
式II−F−2である、請求項178に記載の化合物。
【請求項201】
式II−F−3である、請求項178に記載の化合物。
【請求項202】
式II−F−4である、請求項178に記載の化合物。
【請求項203】
式II−G−1である、請求項178に記載の化合物。
【請求項204】
式II−G−2である、請求項178に記載の化合物。
【請求項205】
式II−G−3である、請求項178に記載の化合物。
【請求項206】
式II−G−4である、請求項178に記載の化合物。
【請求項207】
式II−H−1である、請求項178に記載の化合物。
【請求項208】
式II−H−2である、請求項178に記載の化合物。
【請求項209】
式II−H−3である、請求項178に記載の化合物。
【請求項210】
式II−H−4である、請求項178に記載の化合物。
【請求項211】
式II−J−1である、請求項178に記載の化合物。
【請求項212】
式II−J−2である、請求項178に記載の化合物。
【請求項213】
式II−J−3である、請求項178に記載の化合物。
【請求項214】
式II−J−4である、請求項178に記載の化合物。
【請求項215】
式II−K−1である、請求項178に記載の化合物。
【請求項216】
式II−K−2である、請求項178に記載の化合物。
【請求項217】
式II−K−3である、請求項178に記載の化合物。
【請求項218】
式II−K−4である、請求項178に記載の化合物。
【請求項219】
式II−L−1である、請求項178に記載の化合物。
【請求項220】
式II−L−2である、請求項178に記載の化合物。
【請求項221】
式II−L−3である、請求項178に記載の化合物。
【請求項222】
式II−L−4である、請求項178に記載の化合物。
【請求項223】
式II−M−1である、請求項178に記載の化合物。
【請求項224】
式II−M−2である、請求項178に記載の化合物。
【請求項225】
式II−M−3である、請求項178に記載の化合物。
【請求項226】
式II−M−4である、請求項178に記載の化合物。
【請求項227】
式II−N−1である、請求項178に記載の化合物。
【請求項228】
式II−N−2である、請求項178に記載の化合物。
【請求項229】
式II−N−3である、請求項178に記載の化合物。
【請求項230】
式II−N−4である、請求項178に記載の化合物。
【請求項231】
式II−O−1である、請求項178に記載の化合物。
【請求項232】
式II−O−2である、請求項178に記載の化合物。
【請求項233】
式II−O−3である、請求項178に記載の化合物。
【請求項234】
式II−O−4である、請求項178に記載の化合物。
【請求項235】
式II−P−1である、請求項178に記載の化合物。
【請求項236】
式II−P−2である、請求項178に記載の化合物。
【請求項237】
式II−P−3である、請求項178に記載の化合物。
【請求項238】
式II−P−4である、請求項178に記載の化合物。
【請求項239】
1つ又は複数のアミノ基が、保護された形態である、請求項140〜238のいずれか一項に記載の化合物。
【請求項240】
いずれのアミノ基も保護された形態ではない、請求項140〜238のいずれか一項に記載の化合物。
【請求項241】
固相レジンに結合されている、請求項140〜240のいずれか一項に記載の化合物。
【請求項242】
前記固相レジンに直接結合されている、請求項241に記載の化合物。
【請求項243】
前記固相レジンにリンカーを介して結合されている、請求項241に記載の化合物。
【図9A】


【図9B】


【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8A】


【図8B】


【図10A】


【図10B】


【図11】


【図12】


【図13】


【図14】


【図15】




【図9B】


【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8A】


【図8B】


【図10A】


【図10B】


【図11】


【図12】


【図13】


【図14】


【図15】


【公表番号】特表2013−520440(P2013−520440A)
【公表日】平成25年6月6日(2013.6.6)
【国際特許分類】
【出願番号】特願2012−554079(P2012−554079)
【出願日】平成23年2月19日(2011.2.19)
【国際出願番号】PCT/US2011/025571
【国際公開番号】WO2011/103524
【国際公開日】平成23年8月25日(2011.8.25)
【公序良俗違反の表示】
(特許庁注:以下のものは登録商標)
1.ウィンドウズ
【出願人】(512215082)
【出願人】(512215093)
【Fターム(参考)】
【公表日】平成25年6月6日(2013.6.6)
【国際特許分類】
【出願日】平成23年2月19日(2011.2.19)
【国際出願番号】PCT/US2011/025571
【国際公開番号】WO2011/103524
【国際公開日】平成23年8月25日(2011.8.25)
【公序良俗違反の表示】
(特許庁注:以下のものは登録商標)
1.ウィンドウズ
【出願人】(512215082)

【出願人】(512215093)

【Fターム(参考)】
[ Back to top ]

