生体サンプル中の希有な事象の分析のための高感度マルチパラメータ法
【課題】希有な事象の分析のための高感度マルチパラメータ法を提供する。
【解決手段】CTC、または関心の対象である他の細胞を含む血液のサンプルを、画像分析のため蛍光マーカーで染色し、スキャンして、カートリッジ内における標的細胞または細胞より小さい要素の存在および場所を識別する。所望の標的細胞もしくは細胞より小さい要素を含むサンプルはその後、サンプルを光退色させることにより部分的に、さらに処理され、最初の分析に使用された同じ画像化基準を用いて、同じもしくは異なる蛍光色素に結合した追加のバイオマーカーで、これら同じ標的を再分析することができる。本発明は、標的、例えば、循環上皮細胞、循環腫瘍細胞、循環内皮細胞、白血球、リンパ球サブセット、関心の対象である細胞小器官もしくはレセプターを含有する細胞、細胞破片、破砕細胞とその破片、または捕捉され画像化され得る任意の他の有形成分についての適用を有する。
【解決手段】CTC、または関心の対象である他の細胞を含む血液のサンプルを、画像分析のため蛍光マーカーで染色し、スキャンして、カートリッジ内における標的細胞または細胞より小さい要素の存在および場所を識別する。所望の標的細胞もしくは細胞より小さい要素を含むサンプルはその後、サンプルを光退色させることにより部分的に、さらに処理され、最初の分析に使用された同じ画像化基準を用いて、同じもしくは異なる蛍光色素に結合した追加のバイオマーカーで、これら同じ標的を再分析することができる。本発明は、標的、例えば、循環上皮細胞、循環腫瘍細胞、循環内皮細胞、白血球、リンパ球サブセット、関心の対象である細胞小器官もしくはレセプターを含有する細胞、細胞破片、破砕細胞とその破片、または捕捉され画像化され得る任意の他の有形成分についての適用を有する。
【発明の詳細な説明】
【開示の内容】
【0001】
〔関連出願に対するクロスリファレンス〕
本出願は、2005年9月20日に出願された米国暫定出願第60/718,676号、2005年10月24日に出願された米国暫定出願第60/729,536号、および、2006年3月に出願された米国暫定出願第60/786,117号に基づく優先権を主張する、2008年3月20日に出願された米国出願第12/067,532号の一部継続出願である。前記の出願のそれぞれは、本明細書において参照によりその全体が組み入れられる。
【0002】
〔発明の背景〕
〔発明分野〕
本発明は、腫瘍学および診断試験の分野に関するものである。本発明は、癌または心血管障害等の疾病における、スクリーニング、病期分類、処置応答、再発等に有用である。より具体的には、本発明は、生体サンプルから分離された循環希有細胞(circulating rare cells)の分析と列挙とを容易にする方法を提供するものである。
【0003】
〔背景〕
生体サンプルから得られる、腫瘍細胞のみならず希有細胞またはその他の生物学的存在物を特徴付ける方法は、以前に示されている(US6,365,362)。この二段階法では、分析の前にかなりの量の破片およびその他の妨害物質を除外しつつ、標的細胞を確実に獲得して、画像処理技術による細胞の検査を可能とするために、効率的な濃縮が必要である。この方法は、マルチパラメータ・フローサイトメトリ、顕微鏡法および、免疫細胞化学的分析と、免疫磁気濃縮の要素を、独特の自動化方法で組み合わせたものである。この組合せ方法は、血液サンプル中の上皮細胞を濃縮して、列挙するのに用いられる。このように、この組合せ方法は、癌を測定するツールを提供するものである。
【0004】
この二段階法は、転移性の癌を有する患者のための癌の予後と生存とにおける適用を有する(WO04076643)。血中の、形態学的に無傷の循環癌細胞の存在に基づいて、この方法は、転移性乳癌患者の循環癌細胞の存在を、疾病の進行および生存の時間に関連させ得る。より具体的には、7.5mLにつき5つ以上の循環腫瘍細胞の存在は、最初のフォローアップでの予測値をもたらし、ゆえに、患者の生存の早期予後指標を提供する。
【0005】
上述の検定の特異性は、検出される細胞の数と共に増大し、ほんの少ししか(一般的には5つ未満の循環腫瘍細胞)検出されない場合には不十分である。この問題の1つの解決方法は、疑わしい癌細胞について詳細な遺伝情報を提供することである。したがって、個々の疑わしい癌細胞について、血液サンプルの濃縮をマルチパラメトリック画像血球計算およびマルチパラメトリック遺伝分析に組み入れる方法では、完全なプロファイルおよび確認メカニズムを提供して、患者のスクリーニング、疾病の再発評価、または全体的な生存についての現在の手順をかなり改善することになるであろう。個々に分離された標的細胞の表現型のマルチパラメトリック分析と遺伝型のマルチパラメトリック分析とを組み合わせることによる循環希有細胞の分析の確認検定がこれまでに開示されている(係属中の米国特許出願第12/067,532号参照)。確認は、臨床的にかなりのレベルの感度を与え、したがって、臨床医に対し、得られた任意の定量的情報の確かさを保証するものとなる。極めて少ない数(1、2、3または4)の循環腫瘍細胞(CTC)を用いて関連する疾病状態が評価され、早期疾病検出の確認が与えられる。
【0006】
同一サンプルについて、同一のマーカーを用いて複数の高感度検定を実行し、しかも希有な事象でそれを行い得る技術で他に利用できるものはない。マルチパラメータ・フローサイトメトリは一般的に行われるが、的確な情報を得るには、何百または何千もの標的細胞または事象が要求される。しかしながら、患者の7.5mLの血液中に6つのCTCしかない場合は、あまりにも事象が少ないので、マルチパラメータ分析の実行は言うまでもなく、確実に検出することができない。
【0007】
本発明は、複数の蛍光バイオマーカーを使用して循環希有細胞の検討(interrogation)を可能とする手段を提供することにより、US6,365,362で記述され、CellTracks(登録商標) Autoprep(登録商標) SystemおよびCellTracks(登録商標) Analyzer II System (Immunicon Corporation、ペンシルベニア州ハンティンドン・バレー(Huntingdon Valley))で用いられた濃縮および分析プロトコルを拡張するものである。
【0008】
〔発明の概要〕
本明細書に記述される本発明は、最終結果を成し遂げるために協働する5つの部分からなる方法から成る。本発明は、基本的に、(1)カートリッジをスキャンして、関心の対象である標的細胞として識別し、カートリッジ内でのそれらの場所を識別すること;(2)カートリッジから流体を吸引し、細胞をカバースリップ上のそれらの位置で乾燥させるか、またはそれらの位置に積極的に固定すること;(3)蛍光信号を光退色させ、標的細胞を識別するために最初に用いられていた蛍光を取り除くこと;(4)カートリッジ内の細胞を、一以上の蛍光抗体複合物または色素で再染色し、関心の対象である標的上または標的内で、関心の対象であるマーカー、レセプター、タンパク質等を標識化すること;(5)カートリッジを再スキャンし、以前識別した関心の対象である標的に戻り、それらの細胞が、所望のマーカーまたはタンパク質について陽性か陰性かを決定すること;からなる。
【0009】
関心の対象であるCTCやその他の細胞を含有する血液サンプルは、画像分析のために、蛍光マーカーで染色され、カートリッジ内における標的細胞または細胞より小さい要素(subcellular elements)の存在と場所とを識別するためにスキャンされる。所望の標的細胞または細胞より小さい要素を含有するサンプルは、次いで、サンプルを光退色させることにより部分的に、さらに処理され、最初の分析で使用された同じ画像化基準を用いて、同一または異なる蛍光色素に結合した追加のバイオマーカーで同じ標的を再分析できるようにする。本発明には、標的(たとえば、循環上皮細胞、循環腫瘍細胞、循環内皮細胞、白血球、リンパ球サブセット、関心の対象である細胞小器官もしくはレセプターを含有する細胞、細胞破片、破砕細胞とその破片、または、捕捉され画像化され得る任意のその他の有形成分(any other formed element))についての適用がある。
【0010】
〔発明の詳細な説明〕
血液から捕捉された循環腫瘍細胞(CTC)は、これまで、CellTracks(登録商標) Autoprep(登録商標) SystemおよびCellTracks(登録商標) Analyzer II System(Immunicon Corporation、ペンシルベニア州ハンティンドン・バレー)を用いて、検出および分析がなされてきた。この手順では、上皮性起源の細胞を識別し、これらを汚染白血球から区別するのに蛍光バイオマーカーと色素との組合せが用いられる。CellTracks(登録商標)分析プラットホームは、これらの蛍光マーカーを検出するのに、4つのチャンネルまたは4色に限定される。紫外線チャンネルは、核ステインである4’−6’ジアミジノ−2−フェニルインドール(DAPI)を検出することによって、有核の事象または細胞事象を識別する。アロフィコシアニン(APC)チャンネルは、白血球を識別するのに用いられるCD45−APCを検出するのに用いられる。そして、2つのマーカーチャンネル{フィコエリトリン(PE)およびフルオレセイン・イソチオシアネート(FITC)}は、PEまたはFITCのいずれかに結合したバイオマーカーを検出することに用いられる。標準のCellSearch(登録商標)キット(Veridex LLC、ニュージャージー州ラリタン(Raritan))を用いて、PEは、上皮細胞を識別するのに用いられるサイトケラチンに結合し、FITCチャンネルは、関心の対象である追加的なマーカーに利用可能である。Epithelial Cell Kit(Immunicon Corporation、ペンシルベニア州ハンティンドン・バレー)は、同一の色の組合せを用い、サイトケラチンだけがFITCに結合し、PEチャンネルを解放している。より強い信号伝達するPEチャンネルにより、PEに結合したより薄暗いバイオマーカーの検出が可能になる。
【0011】
CellTracks(登録商標) Analyzer II Systemには、現在4つのチャンネルまたは色だけが存在し、それらの色のうちの3つが上皮細胞および白血球の検出専用であり、1つのチャンネルだけが、追加的なバイオマーカー分析に利用可能なままである。しかしながら、特に薬品工業では、捕捉された標的上の複数のバイオマーカーを検出することへのニーズが存在する。同一の標的上で検出されることが好ましいであろう。本発明は、捕捉された標的に付着したバイオマーカーおよび色素からの蛍光信号の除去と、関心の対象である追加のマーカーによる同じ標的の再染色とを可能にする。カートリッジの最初のスキャン後の乾燥段階で、関心の対象である標的をカートリッジ内の初期の場所に固定して、カートリッジが再染色されたときに、これら同じ標的が容易に見つけられ、関心の対象である追加のバイオマーカーの存在の分析に供されるようにする。
【0012】
手順の第一段階で、CellTracks(登録商標)カートリッジは、CellTracks(登録商標) Autoprep(登録商標) SystemおよびCellTracks(登録商標) Analyzer II Systemで処理される。この処理では、捕捉された標的がスキャンされ、カートリッジ内で場所が識別された所望の標的の存在が確認される。カートリッジ中の液体が吸引によって除去され、カートリッジは、一晩空気乾燥される。吸引と空気乾燥とは、カートリッジが最初のMagNest(登録商標)中に残存したまま行われる。この段階で、標的(通常、CTC等の細胞)が、カートリッジ上の適所で「固定され」、そのため、標的は基本的に不動化され、最初検出された場所の撮像表面に固着される。細胞を固定する好ましい方法は、カートリッジを空気乾燥することである。しかしながら、その他の固定方法も使用され得、実際、ある種の抗原を露出させるか、あるいは、それらの抗原と特定の抗体との最適反応性を達成することが要求される場合もある。この乾燥ステップまたは積極的な固定により、カートリッジをMagNest(登録商標)から取り出すことが可能になり、細胞の移動または損失がほとんど、またはまったくない状態で、カートリッジを処理することが可能になる。このようにして、CellTracks(登録商標) Analyzer II System等(しかしこれに限定されるわけではない)の撮像デバイスにより、後続の分析で標的を再取得することができる。この手順における第2のステップでは、最初の処理中に標的に付着した色素およびマーカーの蛍光を退色させるために、カートリッジを、LED(しかしLEDに限定されるわけではない)によって造り出された強い光に曝露する。蛍光色素が高い割合で励起している場合に光退色が効果的である。色素が高効率で励起される波長帯は、通常狭い(10〜50nm)。LEDは、高効率で狭い波長帯の光を能率的に生み出し、近紫外線からIRまでの放射に利用できる。LEDの効率は、ヒートシンクによってさらに高められる。サンプルにおける光の分布の均一性を改良するために、反射表面または屈折表面からなるオプションのホモジェナイザーを使用できる。明るい色素を退色させる、現在のプロトタイプのLED漂白器では、20分までの時間が掛かり得る。しかしながら、より薄暗い信号の場合には、10〜15分で十分である。最終段階では、蛍光色素に結合した、関心の対象である追加のバイオマーカーで、カートリッジのサンプルが再染色される。染色溶液が取り除かれ、核酸色素溶液(例えばDAPI含有CellFix)で置換され、カートリッジが、撮像デバイス上で再分析される。
【0013】
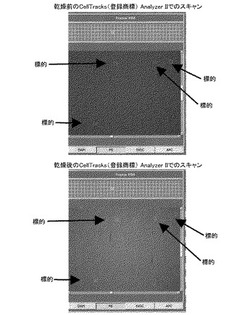
図1Aは、乾燥後のサンプルの完全性を確認するものである。強磁性流体の分布と標的の位置とは、サンプルを乾燥した後、CellTracks(登録商標) Analyzer II Systemで最初スキャンしたときと同じままに保たれる。図1Bは、乾燥の前後で、細胞が無傷のまま、同一の場所に保持されていることを示している。
【0014】
図2は、乾燥後、カートリッジ中で再染色する能力を示すものである。ここでは、標的細胞が血液に加えられ、CellSave防腐剤(Immunicon Corporation)を用いて準備され、一晩保存された。ついで、サンプルは、CellTracks(登録商標) Autoprep(登録商標) SystemおよびCellTracks(登録商標) Analyzer II Systemで、細胞をC11−PEで標識化するCTCキットを使用して処理された。最初のスキャンでは、FITCに結合するマーカーがないため、FITCチャンネルは空のままに保たれる。カートリッジを乾燥し、蛍光信号を退色させた後、サンプルは、カートリッジ中C11−FITCで再染色され、ついで、CellTracks(登録商標) Analyzer II Systemで再スキャンされた。このとき、サンプルは、PEチャンネルとFITCチャンネルとの双方で陽性である。サンプルは、最初C11−PEで染色されたが、以降のC11−FITC結合のための十分な結合部位が残っている。
【0015】
図3Aと図3Bとは、発光ダイオード(LED)を使用して蛍光信号を退色させる能力を示している。細胞が血液中に加えられ、CellSave防腐剤を用いて保存処理され、一晩保存された。ついで、サンプルは、CellTracks(登録商標) Autoprep(登録商標) Systemで、細胞をC11−PEで標識化するCTCキットを使用して処理された。カートリッジは、ついで、CellTracks(登録商標) Analyzer II Systemでスキャンされた。液体の吸引およびカートリッジの乾燥後、カートリッジにCellFixを戻し加えた。カートリッジを、MagNest(登録商標)から取り出し、ついで、20分までの時間、LEDからの光に曝露した。カートリッジをMagNest(登録商標)に戻し入れ、CellFixを吸引し、細胞を、C11−FITCで、ついでDAPIで再染色した。この再染色は、加えられた細胞が再取得され、CellTracks(登録商標) Analyzer II Systemで分析され得るために必要である。退色は、最初のC11−PE染色についてのみ観察された。サンプルは、CellTracks(登録商標) Analyzer II Systemでスキャンした後、平均蛍光強度(MFI)を決めるソフトウェアを使用して染色強度輝度について評価された。
【0016】
図3Aは、C11−PEで明るく染色されるSKBR細胞の退色を示している。20分間の退色後、PE MFIは、〜4000からほとんど0まで低下する。図3Bは、CTCに典型的な、C11−PEでより薄暗く染色したPC3−9細胞の退色を示している。PE MFIは、10〜15分間の退色後、500〜2000の範囲から0にまで低下する。
【0017】
最終目的は、サンプルの最初の処理中、CellTracks(登録商標) Autoprep(登録商標) Systemで前に使用されなかったマーカーで再染色することである。図4の画像は、DAPI、CD45 APCおよびC11−PEの色素の組合せを使用してCellTracks(登録商標) Autoprep(登録商標) Systemで処理したCTCを撮り(take)、これらの信号を退色させ、次いで、DAPI、C11−FITCおよびp−AKT PEにより細胞を再染色する能力を示すものである。AKTは、PI3K経路を経る細胞信号伝達に重要なキナーゼである。この酵素は、リン酸エステル化によって活性化され、腫瘍によっては構造的に活性化されることが知られている。
【0018】
図4Aは、血液から捕捉され、CellTracks(登録商標) Autoprep(登録商標) System上、C11−PEで染色されたSKBR細胞の最初のスキャンを示している。FITCチャンネルが陰性であることに注意されたい。図4Bは、退色およびC11−FITCによる再染色後のサンプルを示している。PEチャンネル信号が陰性であることに注意されたい。図4Cは、退色、および、C11−FITCとpAKT−PEとによる再染色の後のサンプルを示している。
【0019】
本発明により、CellTracks(登録商標) Autoprep(登録商標) SystemおよびCellTracks(登録商標) Analyzer II System中、単一の処理プロトコルを使用する場合には通常可能ではないと思われる、関心の対象である複数の蛍光バイオマーカーを持つCTCの検討が可能になる。これは、最初の実行中に用いられた色素の蛍光信号を退色させ、そのカートリッジ中追加の蛍光バイオマーカーで再染色することで達成される。これにより、同一の蛍光チャンネルを用いて再スキャンすることができる。
【0020】
本発明では、同一のサンプルの複数回の再退色とその後の再染色が考えられる。本発明では、さらに、退色プロセスと、同一細胞上の複数の特定の結合パートナー検定におけるその使用とが考えられる。したがって、蛍光チャンネル、より多くのフィルタ、より多くの光源の追加、ならびに、データを収集し分析する器具およびソフトウェアの複雑さの増大の必要なく、細胞のマルチパラメータ分析を実行し得る。その結果、複雑で高価なシステム改造をせずに、既存の4色蛍光アナライザの能力が、「N」パラメータ分析を実行するように拡大される。ユーザーが、関心の対象であるカートリッジを識別し、それらを乾燥させるかまたは固定し、ついで、あとで高価値の分析を行うためにそれらを保存することもできる。
【0021】
本発明は、同一の細胞上の二つ以上の分析物について、同一の高感度フルオロフォアの使用を提供するものである。このことは、当技術分野における他の技術では不可能である。たとえば、PEは、高い吸収性および蛍光量子収量を持ち、IGF−1Rおよびp−AKT等の高感度マーカーの検出にうまく適合している。これらのマーカーは、標的細胞中低い濃度であるので、抗体複合物がPEではなくFITCに結合した場合には、検出は可能でないであろう。その低い感度および量子収量のために、陽性な細胞上には、FITCを使用して検出可能な信号を与えるほど十分なIGF−1Rがないのである。p−AKTについても同じことが言える。しかしながら、本発明では、CTCはCK−PEを使用して識別され得る。CK−PE信号は0に退色され、抗IGF−1R−PEで再染色され、同一細胞のIGF−1R状態が決定される。IGF−1R信号は、さらに、0に退色され、カートリッジ中、再び抗−p-AKT-PEを使用して再染色される。この処理により、利用可能な最も敏感な蛍光色素を使用して、同一の細胞上で、3つすべての分析物を検定することができる。
【0022】
本発明では、患者を呼び戻して追加のサンプルを採取することなく、サンプルについてのさらなる高価値研究または臨床情報の収集も可能になる。CTCまたは関心の対象であるその他の標的が見出される場合、本発明を用いてサンプルを準備し、これらのCTCの特性を、さらなる侵襲的手順に患者を従わせる必要なく、検討し探求することができる。また、関心の対象である標的をサンプルが含有していないことが判明した場合、さらなる高価値試験、手順および試薬を消費する必要はなくなる。これは、関心の対象である標的をサンプルが実際に含むかどうかが判明する前に試験試薬を加えなければならないその他の方法とは異なるものである。
【0023】
本発明では、さらに、観察された発現に関連し得るかまたは観察された発現を説明し得る遺伝子増幅、トランスロケーションまたはブレークを探すために、同一の細胞上で後続のFISH分析を行うことが考えられる。後続のFISH分析のための好ましい手段は、繰り返し体を含まないプローブ(repeat-free probes)(U.S.12/067,532)の使用を組み入れる。
【0024】
本発明により、一旦見出されたCTCまたは関心の対象である他の標的の詳細分析が可能になる。これは、薬剤開発中に、個々のCTCが標的とされた薬物療法に感受性を有しそうかどうか識別するために使用され得る。ついで、本発明は、細胞内マーカーまたはその他のマーカーが、生体外研究で予測されたように、療法に対応して、アップレギュレートされるか、ダウンレギュレートされるか、または、リン酸化されるかを決定し、このようにして同伴的診断(companion diagnostics)を行うことにより、薬剤メカニズム研究をさらに探求または確認するために使用され得る。本発明は、目標とする個人用医療に対する患者の適合性を決定するためのサンプルを得る、最小の侵襲的方法を提供する際に有用である。本技術分野で既知のその他の適用には、たとえば、炎症性損傷または敗血症性ショック等のインターロイキン発症で重要な白血球サブセットの活性化状態の検出があるが、これらに限定されるわけではない。本方法は、研究使用専用(RUO)サービスとしても有用であり、また、究極的には、病院や基準研究所(reference laboratories)で使用し得る製品として有用であり得る。
【0025】
本発明の好ましい実施形態のあるものについてこれまで記述し、上記で具体的に説明してきたが、本発明は、そのような実施形態に限られることを意図したものではない。これには、本発明の精神から逸脱することなく、種々の変更がなされ得る。本改良の完全な範囲は請求項に示されている。
【図面の簡単な説明】
【0026】
【図1A】乾燥後のサンプルの完全性と標的の場所とが確認されている。
【図1B】細胞が、乾燥前後で同一の場所で示されている。
【図2】乾燥後の再染色されたカートリッジを示している。
【図3A】LEDを使用した蛍光信号の退色を示しており、C11−PEで染色したSKBR細胞の退色と、その後のC11−FITCによる再染色とを示している。
【図3B】LEDを使用した蛍光信号の退色を示しており、C11−PEで染色したPC3-9細胞の退色と、その後のC11−FITCによる再染色とを示している。
【図4A】C11−PEで染色したSKBR細胞の初期スキャンを示している。
【図4B】退色させ、C11−FITCのみで再染色した後のサンプルを示している。
【図4C】C11−FITCとpART−PEとで再染色したサンプルを示している。
【開示の内容】
【0001】
〔関連出願に対するクロスリファレンス〕
本出願は、2005年9月20日に出願された米国暫定出願第60/718,676号、2005年10月24日に出願された米国暫定出願第60/729,536号、および、2006年3月に出願された米国暫定出願第60/786,117号に基づく優先権を主張する、2008年3月20日に出願された米国出願第12/067,532号の一部継続出願である。前記の出願のそれぞれは、本明細書において参照によりその全体が組み入れられる。
【0002】
〔発明の背景〕
〔発明分野〕
本発明は、腫瘍学および診断試験の分野に関するものである。本発明は、癌または心血管障害等の疾病における、スクリーニング、病期分類、処置応答、再発等に有用である。より具体的には、本発明は、生体サンプルから分離された循環希有細胞(circulating rare cells)の分析と列挙とを容易にする方法を提供するものである。
【0003】
〔背景〕
生体サンプルから得られる、腫瘍細胞のみならず希有細胞またはその他の生物学的存在物を特徴付ける方法は、以前に示されている(US6,365,362)。この二段階法では、分析の前にかなりの量の破片およびその他の妨害物質を除外しつつ、標的細胞を確実に獲得して、画像処理技術による細胞の検査を可能とするために、効率的な濃縮が必要である。この方法は、マルチパラメータ・フローサイトメトリ、顕微鏡法および、免疫細胞化学的分析と、免疫磁気濃縮の要素を、独特の自動化方法で組み合わせたものである。この組合せ方法は、血液サンプル中の上皮細胞を濃縮して、列挙するのに用いられる。このように、この組合せ方法は、癌を測定するツールを提供するものである。
【0004】
この二段階法は、転移性の癌を有する患者のための癌の予後と生存とにおける適用を有する(WO04076643)。血中の、形態学的に無傷の循環癌細胞の存在に基づいて、この方法は、転移性乳癌患者の循環癌細胞の存在を、疾病の進行および生存の時間に関連させ得る。より具体的には、7.5mLにつき5つ以上の循環腫瘍細胞の存在は、最初のフォローアップでの予測値をもたらし、ゆえに、患者の生存の早期予後指標を提供する。
【0005】
上述の検定の特異性は、検出される細胞の数と共に増大し、ほんの少ししか(一般的には5つ未満の循環腫瘍細胞)検出されない場合には不十分である。この問題の1つの解決方法は、疑わしい癌細胞について詳細な遺伝情報を提供することである。したがって、個々の疑わしい癌細胞について、血液サンプルの濃縮をマルチパラメトリック画像血球計算およびマルチパラメトリック遺伝分析に組み入れる方法では、完全なプロファイルおよび確認メカニズムを提供して、患者のスクリーニング、疾病の再発評価、または全体的な生存についての現在の手順をかなり改善することになるであろう。個々に分離された標的細胞の表現型のマルチパラメトリック分析と遺伝型のマルチパラメトリック分析とを組み合わせることによる循環希有細胞の分析の確認検定がこれまでに開示されている(係属中の米国特許出願第12/067,532号参照)。確認は、臨床的にかなりのレベルの感度を与え、したがって、臨床医に対し、得られた任意の定量的情報の確かさを保証するものとなる。極めて少ない数(1、2、3または4)の循環腫瘍細胞(CTC)を用いて関連する疾病状態が評価され、早期疾病検出の確認が与えられる。
【0006】
同一サンプルについて、同一のマーカーを用いて複数の高感度検定を実行し、しかも希有な事象でそれを行い得る技術で他に利用できるものはない。マルチパラメータ・フローサイトメトリは一般的に行われるが、的確な情報を得るには、何百または何千もの標的細胞または事象が要求される。しかしながら、患者の7.5mLの血液中に6つのCTCしかない場合は、あまりにも事象が少ないので、マルチパラメータ分析の実行は言うまでもなく、確実に検出することができない。
【0007】
本発明は、複数の蛍光バイオマーカーを使用して循環希有細胞の検討(interrogation)を可能とする手段を提供することにより、US6,365,362で記述され、CellTracks(登録商標) Autoprep(登録商標) SystemおよびCellTracks(登録商標) Analyzer II System (Immunicon Corporation、ペンシルベニア州ハンティンドン・バレー(Huntingdon Valley))で用いられた濃縮および分析プロトコルを拡張するものである。
【0008】
〔発明の概要〕
本明細書に記述される本発明は、最終結果を成し遂げるために協働する5つの部分からなる方法から成る。本発明は、基本的に、(1)カートリッジをスキャンして、関心の対象である標的細胞として識別し、カートリッジ内でのそれらの場所を識別すること;(2)カートリッジから流体を吸引し、細胞をカバースリップ上のそれらの位置で乾燥させるか、またはそれらの位置に積極的に固定すること;(3)蛍光信号を光退色させ、標的細胞を識別するために最初に用いられていた蛍光を取り除くこと;(4)カートリッジ内の細胞を、一以上の蛍光抗体複合物または色素で再染色し、関心の対象である標的上または標的内で、関心の対象であるマーカー、レセプター、タンパク質等を標識化すること;(5)カートリッジを再スキャンし、以前識別した関心の対象である標的に戻り、それらの細胞が、所望のマーカーまたはタンパク質について陽性か陰性かを決定すること;からなる。
【0009】
関心の対象であるCTCやその他の細胞を含有する血液サンプルは、画像分析のために、蛍光マーカーで染色され、カートリッジ内における標的細胞または細胞より小さい要素(subcellular elements)の存在と場所とを識別するためにスキャンされる。所望の標的細胞または細胞より小さい要素を含有するサンプルは、次いで、サンプルを光退色させることにより部分的に、さらに処理され、最初の分析で使用された同じ画像化基準を用いて、同一または異なる蛍光色素に結合した追加のバイオマーカーで同じ標的を再分析できるようにする。本発明には、標的(たとえば、循環上皮細胞、循環腫瘍細胞、循環内皮細胞、白血球、リンパ球サブセット、関心の対象である細胞小器官もしくはレセプターを含有する細胞、細胞破片、破砕細胞とその破片、または、捕捉され画像化され得る任意のその他の有形成分(any other formed element))についての適用がある。
【0010】
〔発明の詳細な説明〕
血液から捕捉された循環腫瘍細胞(CTC)は、これまで、CellTracks(登録商標) Autoprep(登録商標) SystemおよびCellTracks(登録商標) Analyzer II System(Immunicon Corporation、ペンシルベニア州ハンティンドン・バレー)を用いて、検出および分析がなされてきた。この手順では、上皮性起源の細胞を識別し、これらを汚染白血球から区別するのに蛍光バイオマーカーと色素との組合せが用いられる。CellTracks(登録商標)分析プラットホームは、これらの蛍光マーカーを検出するのに、4つのチャンネルまたは4色に限定される。紫外線チャンネルは、核ステインである4’−6’ジアミジノ−2−フェニルインドール(DAPI)を検出することによって、有核の事象または細胞事象を識別する。アロフィコシアニン(APC)チャンネルは、白血球を識別するのに用いられるCD45−APCを検出するのに用いられる。そして、2つのマーカーチャンネル{フィコエリトリン(PE)およびフルオレセイン・イソチオシアネート(FITC)}は、PEまたはFITCのいずれかに結合したバイオマーカーを検出することに用いられる。標準のCellSearch(登録商標)キット(Veridex LLC、ニュージャージー州ラリタン(Raritan))を用いて、PEは、上皮細胞を識別するのに用いられるサイトケラチンに結合し、FITCチャンネルは、関心の対象である追加的なマーカーに利用可能である。Epithelial Cell Kit(Immunicon Corporation、ペンシルベニア州ハンティンドン・バレー)は、同一の色の組合せを用い、サイトケラチンだけがFITCに結合し、PEチャンネルを解放している。より強い信号伝達するPEチャンネルにより、PEに結合したより薄暗いバイオマーカーの検出が可能になる。
【0011】
CellTracks(登録商標) Analyzer II Systemには、現在4つのチャンネルまたは色だけが存在し、それらの色のうちの3つが上皮細胞および白血球の検出専用であり、1つのチャンネルだけが、追加的なバイオマーカー分析に利用可能なままである。しかしながら、特に薬品工業では、捕捉された標的上の複数のバイオマーカーを検出することへのニーズが存在する。同一の標的上で検出されることが好ましいであろう。本発明は、捕捉された標的に付着したバイオマーカーおよび色素からの蛍光信号の除去と、関心の対象である追加のマーカーによる同じ標的の再染色とを可能にする。カートリッジの最初のスキャン後の乾燥段階で、関心の対象である標的をカートリッジ内の初期の場所に固定して、カートリッジが再染色されたときに、これら同じ標的が容易に見つけられ、関心の対象である追加のバイオマーカーの存在の分析に供されるようにする。
【0012】
手順の第一段階で、CellTracks(登録商標)カートリッジは、CellTracks(登録商標) Autoprep(登録商標) SystemおよびCellTracks(登録商標) Analyzer II Systemで処理される。この処理では、捕捉された標的がスキャンされ、カートリッジ内で場所が識別された所望の標的の存在が確認される。カートリッジ中の液体が吸引によって除去され、カートリッジは、一晩空気乾燥される。吸引と空気乾燥とは、カートリッジが最初のMagNest(登録商標)中に残存したまま行われる。この段階で、標的(通常、CTC等の細胞)が、カートリッジ上の適所で「固定され」、そのため、標的は基本的に不動化され、最初検出された場所の撮像表面に固着される。細胞を固定する好ましい方法は、カートリッジを空気乾燥することである。しかしながら、その他の固定方法も使用され得、実際、ある種の抗原を露出させるか、あるいは、それらの抗原と特定の抗体との最適反応性を達成することが要求される場合もある。この乾燥ステップまたは積極的な固定により、カートリッジをMagNest(登録商標)から取り出すことが可能になり、細胞の移動または損失がほとんど、またはまったくない状態で、カートリッジを処理することが可能になる。このようにして、CellTracks(登録商標) Analyzer II System等(しかしこれに限定されるわけではない)の撮像デバイスにより、後続の分析で標的を再取得することができる。この手順における第2のステップでは、最初の処理中に標的に付着した色素およびマーカーの蛍光を退色させるために、カートリッジを、LED(しかしLEDに限定されるわけではない)によって造り出された強い光に曝露する。蛍光色素が高い割合で励起している場合に光退色が効果的である。色素が高効率で励起される波長帯は、通常狭い(10〜50nm)。LEDは、高効率で狭い波長帯の光を能率的に生み出し、近紫外線からIRまでの放射に利用できる。LEDの効率は、ヒートシンクによってさらに高められる。サンプルにおける光の分布の均一性を改良するために、反射表面または屈折表面からなるオプションのホモジェナイザーを使用できる。明るい色素を退色させる、現在のプロトタイプのLED漂白器では、20分までの時間が掛かり得る。しかしながら、より薄暗い信号の場合には、10〜15分で十分である。最終段階では、蛍光色素に結合した、関心の対象である追加のバイオマーカーで、カートリッジのサンプルが再染色される。染色溶液が取り除かれ、核酸色素溶液(例えばDAPI含有CellFix)で置換され、カートリッジが、撮像デバイス上で再分析される。
【0013】
図1Aは、乾燥後のサンプルの完全性を確認するものである。強磁性流体の分布と標的の位置とは、サンプルを乾燥した後、CellTracks(登録商標) Analyzer II Systemで最初スキャンしたときと同じままに保たれる。図1Bは、乾燥の前後で、細胞が無傷のまま、同一の場所に保持されていることを示している。
【0014】
図2は、乾燥後、カートリッジ中で再染色する能力を示すものである。ここでは、標的細胞が血液に加えられ、CellSave防腐剤(Immunicon Corporation)を用いて準備され、一晩保存された。ついで、サンプルは、CellTracks(登録商標) Autoprep(登録商標) SystemおよびCellTracks(登録商標) Analyzer II Systemで、細胞をC11−PEで標識化するCTCキットを使用して処理された。最初のスキャンでは、FITCに結合するマーカーがないため、FITCチャンネルは空のままに保たれる。カートリッジを乾燥し、蛍光信号を退色させた後、サンプルは、カートリッジ中C11−FITCで再染色され、ついで、CellTracks(登録商標) Analyzer II Systemで再スキャンされた。このとき、サンプルは、PEチャンネルとFITCチャンネルとの双方で陽性である。サンプルは、最初C11−PEで染色されたが、以降のC11−FITC結合のための十分な結合部位が残っている。
【0015】
図3Aと図3Bとは、発光ダイオード(LED)を使用して蛍光信号を退色させる能力を示している。細胞が血液中に加えられ、CellSave防腐剤を用いて保存処理され、一晩保存された。ついで、サンプルは、CellTracks(登録商標) Autoprep(登録商標) Systemで、細胞をC11−PEで標識化するCTCキットを使用して処理された。カートリッジは、ついで、CellTracks(登録商標) Analyzer II Systemでスキャンされた。液体の吸引およびカートリッジの乾燥後、カートリッジにCellFixを戻し加えた。カートリッジを、MagNest(登録商標)から取り出し、ついで、20分までの時間、LEDからの光に曝露した。カートリッジをMagNest(登録商標)に戻し入れ、CellFixを吸引し、細胞を、C11−FITCで、ついでDAPIで再染色した。この再染色は、加えられた細胞が再取得され、CellTracks(登録商標) Analyzer II Systemで分析され得るために必要である。退色は、最初のC11−PE染色についてのみ観察された。サンプルは、CellTracks(登録商標) Analyzer II Systemでスキャンした後、平均蛍光強度(MFI)を決めるソフトウェアを使用して染色強度輝度について評価された。
【0016】
図3Aは、C11−PEで明るく染色されるSKBR細胞の退色を示している。20分間の退色後、PE MFIは、〜4000からほとんど0まで低下する。図3Bは、CTCに典型的な、C11−PEでより薄暗く染色したPC3−9細胞の退色を示している。PE MFIは、10〜15分間の退色後、500〜2000の範囲から0にまで低下する。
【0017】
最終目的は、サンプルの最初の処理中、CellTracks(登録商標) Autoprep(登録商標) Systemで前に使用されなかったマーカーで再染色することである。図4の画像は、DAPI、CD45 APCおよびC11−PEの色素の組合せを使用してCellTracks(登録商標) Autoprep(登録商標) Systemで処理したCTCを撮り(take)、これらの信号を退色させ、次いで、DAPI、C11−FITCおよびp−AKT PEにより細胞を再染色する能力を示すものである。AKTは、PI3K経路を経る細胞信号伝達に重要なキナーゼである。この酵素は、リン酸エステル化によって活性化され、腫瘍によっては構造的に活性化されることが知られている。
【0018】
図4Aは、血液から捕捉され、CellTracks(登録商標) Autoprep(登録商標) System上、C11−PEで染色されたSKBR細胞の最初のスキャンを示している。FITCチャンネルが陰性であることに注意されたい。図4Bは、退色およびC11−FITCによる再染色後のサンプルを示している。PEチャンネル信号が陰性であることに注意されたい。図4Cは、退色、および、C11−FITCとpAKT−PEとによる再染色の後のサンプルを示している。
【0019】
本発明により、CellTracks(登録商標) Autoprep(登録商標) SystemおよびCellTracks(登録商標) Analyzer II System中、単一の処理プロトコルを使用する場合には通常可能ではないと思われる、関心の対象である複数の蛍光バイオマーカーを持つCTCの検討が可能になる。これは、最初の実行中に用いられた色素の蛍光信号を退色させ、そのカートリッジ中追加の蛍光バイオマーカーで再染色することで達成される。これにより、同一の蛍光チャンネルを用いて再スキャンすることができる。
【0020】
本発明では、同一のサンプルの複数回の再退色とその後の再染色が考えられる。本発明では、さらに、退色プロセスと、同一細胞上の複数の特定の結合パートナー検定におけるその使用とが考えられる。したがって、蛍光チャンネル、より多くのフィルタ、より多くの光源の追加、ならびに、データを収集し分析する器具およびソフトウェアの複雑さの増大の必要なく、細胞のマルチパラメータ分析を実行し得る。その結果、複雑で高価なシステム改造をせずに、既存の4色蛍光アナライザの能力が、「N」パラメータ分析を実行するように拡大される。ユーザーが、関心の対象であるカートリッジを識別し、それらを乾燥させるかまたは固定し、ついで、あとで高価値の分析を行うためにそれらを保存することもできる。
【0021】
本発明は、同一の細胞上の二つ以上の分析物について、同一の高感度フルオロフォアの使用を提供するものである。このことは、当技術分野における他の技術では不可能である。たとえば、PEは、高い吸収性および蛍光量子収量を持ち、IGF−1Rおよびp−AKT等の高感度マーカーの検出にうまく適合している。これらのマーカーは、標的細胞中低い濃度であるので、抗体複合物がPEではなくFITCに結合した場合には、検出は可能でないであろう。その低い感度および量子収量のために、陽性な細胞上には、FITCを使用して検出可能な信号を与えるほど十分なIGF−1Rがないのである。p−AKTについても同じことが言える。しかしながら、本発明では、CTCはCK−PEを使用して識別され得る。CK−PE信号は0に退色され、抗IGF−1R−PEで再染色され、同一細胞のIGF−1R状態が決定される。IGF−1R信号は、さらに、0に退色され、カートリッジ中、再び抗−p-AKT-PEを使用して再染色される。この処理により、利用可能な最も敏感な蛍光色素を使用して、同一の細胞上で、3つすべての分析物を検定することができる。
【0022】
本発明では、患者を呼び戻して追加のサンプルを採取することなく、サンプルについてのさらなる高価値研究または臨床情報の収集も可能になる。CTCまたは関心の対象であるその他の標的が見出される場合、本発明を用いてサンプルを準備し、これらのCTCの特性を、さらなる侵襲的手順に患者を従わせる必要なく、検討し探求することができる。また、関心の対象である標的をサンプルが含有していないことが判明した場合、さらなる高価値試験、手順および試薬を消費する必要はなくなる。これは、関心の対象である標的をサンプルが実際に含むかどうかが判明する前に試験試薬を加えなければならないその他の方法とは異なるものである。
【0023】
本発明では、さらに、観察された発現に関連し得るかまたは観察された発現を説明し得る遺伝子増幅、トランスロケーションまたはブレークを探すために、同一の細胞上で後続のFISH分析を行うことが考えられる。後続のFISH分析のための好ましい手段は、繰り返し体を含まないプローブ(repeat-free probes)(U.S.12/067,532)の使用を組み入れる。
【0024】
本発明により、一旦見出されたCTCまたは関心の対象である他の標的の詳細分析が可能になる。これは、薬剤開発中に、個々のCTCが標的とされた薬物療法に感受性を有しそうかどうか識別するために使用され得る。ついで、本発明は、細胞内マーカーまたはその他のマーカーが、生体外研究で予測されたように、療法に対応して、アップレギュレートされるか、ダウンレギュレートされるか、または、リン酸化されるかを決定し、このようにして同伴的診断(companion diagnostics)を行うことにより、薬剤メカニズム研究をさらに探求または確認するために使用され得る。本発明は、目標とする個人用医療に対する患者の適合性を決定するためのサンプルを得る、最小の侵襲的方法を提供する際に有用である。本技術分野で既知のその他の適用には、たとえば、炎症性損傷または敗血症性ショック等のインターロイキン発症で重要な白血球サブセットの活性化状態の検出があるが、これらに限定されるわけではない。本方法は、研究使用専用(RUO)サービスとしても有用であり、また、究極的には、病院や基準研究所(reference laboratories)で使用し得る製品として有用であり得る。
【0025】
本発明の好ましい実施形態のあるものについてこれまで記述し、上記で具体的に説明してきたが、本発明は、そのような実施形態に限られることを意図したものではない。これには、本発明の精神から逸脱することなく、種々の変更がなされ得る。本改良の完全な範囲は請求項に示されている。
【図面の簡単な説明】
【0026】
【図1A】乾燥後のサンプルの完全性と標的の場所とが確認されている。
【図1B】細胞が、乾燥前後で同一の場所で示されている。
【図2】乾燥後の再染色されたカートリッジを示している。
【図3A】LEDを使用した蛍光信号の退色を示しており、C11−PEで染色したSKBR細胞の退色と、その後のC11−FITCによる再染色とを示している。
【図3B】LEDを使用した蛍光信号の退色を示しており、C11−PEで染色したPC3-9細胞の退色と、その後のC11−FITCによる再染色とを示している。
【図4A】C11−PEで染色したSKBR細胞の初期スキャンを示している。
【図4B】退色させ、C11−FITCのみで再染色した後のサンプルを示している。
【図4C】C11−FITCとpART−PEとで再染色したサンプルを示している。
【特許請求の範囲】
【請求項1】
希有な事象の分析において感度を増大させる方法において、
a.蛍光標識化によってサンプルを準備することと、
b.標的事象を識別するために前記サンプルをスキャンすることと、
c.サンプルから流体を吸引して、前記標的事象を同一場所に残すことと、
d.前記標的事象を光退色させることと、
e.前記標的事象を、蛍光標識された第二のマーカーで再染色することと、
f.前記標的事象を再スキャンすることと、
g.蛍光標識された追加の各マーカーについて、ステップc〜fを繰り返すことと、
を含む、方法。
【請求項2】
請求項1に記載の方法において、
前記第二の標識されたマーカーが、蛍光抗体複合物、色素、またはそれらの組合せである、方法。
【請求項3】
請求項1に記載の方法において、
前記スキャンおよび前記再スキャンが、CellTracks(登録商標) Autoprep(登録商標) SystemおよびCellTracks(登録商標) Analyzer II Systemで達成される、方法。
【請求項4】
請求項1に記載の方法において、
前記標的事象が、循環上皮細胞、循環腫瘍細胞、循環内皮細胞、白血球、リンパ球サブセット、関心の対象である細胞小器官もしくはレセプターを含有する細胞、細胞破片、破砕細胞およびその破片、またはそれらの組合せからなる群からのものである、方法。
【請求項5】
請求項1に記載の方法において、
前記標的事象が、循環腫瘍細胞である、方法。
【請求項6】
請求項1に記載の方法において、
追加的なステップが、前記標的事象のマルチパラメトリック遺伝子型プロファイリングである、方法。
【請求項7】
請求項6に記載の方法において、
前記遺伝子型プロファイリングが、FISHである、方法。
【請求項8】
混合細胞集団中の標的細胞と疑われるものの検出および列挙を確認する方法において、
a.標的細胞を含むものと疑われる混合細胞集団を含む生物学的試料を被験者から得ることと、
b.免疫磁気濃縮によって前記標的細胞と疑われるものの亜集団を分離することと、
c.マルチパラメトリック表現型プロファイルによって、標的細胞と疑われるものを識別することと、
d.マルチパラメトリック遺伝子型プロファイルのために、標的細胞と疑われるものを準備することと、
e.前記表現型プロファイルによって、標的細胞と疑われるものを確認することであって、前記個々の標的細胞と疑われるものは、前記標的細胞の表現型プロファイルおよび遺伝型プロファイルの両方を含む、確認することと、
を含む、方法。
【請求項9】
請求項8に記載の方法において、
前記表現型プロファイルが、
a.疑わしい標的細胞を蛍光標識化することと、
b.前記疑わしい標的細胞をスキャンすることと、
c.サンプルから流体を吸引することと、
d.前記サンプルを光退色させることと、
e.前記疑わしい標的細胞を再スキャンすることと、
を含む、方法。
【請求項10】
請求項8に記載の方法において、
前記標的細胞が、内皮細胞、上皮細胞、胎児細胞、細菌細胞、心筋細胞、ウイルス感染細胞、およびそれらの組合せからなる群から選ばれる、方法。
【請求項1】
希有な事象の分析において感度を増大させる方法において、
a.蛍光標識化によってサンプルを準備することと、
b.標的事象を識別するために前記サンプルをスキャンすることと、
c.サンプルから流体を吸引して、前記標的事象を同一場所に残すことと、
d.前記標的事象を光退色させることと、
e.前記標的事象を、蛍光標識された第二のマーカーで再染色することと、
f.前記標的事象を再スキャンすることと、
g.蛍光標識された追加の各マーカーについて、ステップc〜fを繰り返すことと、
を含む、方法。
【請求項2】
請求項1に記載の方法において、
前記第二の標識されたマーカーが、蛍光抗体複合物、色素、またはそれらの組合せである、方法。
【請求項3】
請求項1に記載の方法において、
前記スキャンおよび前記再スキャンが、CellTracks(登録商標) Autoprep(登録商標) SystemおよびCellTracks(登録商標) Analyzer II Systemで達成される、方法。
【請求項4】
請求項1に記載の方法において、
前記標的事象が、循環上皮細胞、循環腫瘍細胞、循環内皮細胞、白血球、リンパ球サブセット、関心の対象である細胞小器官もしくはレセプターを含有する細胞、細胞破片、破砕細胞およびその破片、またはそれらの組合せからなる群からのものである、方法。
【請求項5】
請求項1に記載の方法において、
前記標的事象が、循環腫瘍細胞である、方法。
【請求項6】
請求項1に記載の方法において、
追加的なステップが、前記標的事象のマルチパラメトリック遺伝子型プロファイリングである、方法。
【請求項7】
請求項6に記載の方法において、
前記遺伝子型プロファイリングが、FISHである、方法。
【請求項8】
混合細胞集団中の標的細胞と疑われるものの検出および列挙を確認する方法において、
a.標的細胞を含むものと疑われる混合細胞集団を含む生物学的試料を被験者から得ることと、
b.免疫磁気濃縮によって前記標的細胞と疑われるものの亜集団を分離することと、
c.マルチパラメトリック表現型プロファイルによって、標的細胞と疑われるものを識別することと、
d.マルチパラメトリック遺伝子型プロファイルのために、標的細胞と疑われるものを準備することと、
e.前記表現型プロファイルによって、標的細胞と疑われるものを確認することであって、前記個々の標的細胞と疑われるものは、前記標的細胞の表現型プロファイルおよび遺伝型プロファイルの両方を含む、確認することと、
を含む、方法。
【請求項9】
請求項8に記載の方法において、
前記表現型プロファイルが、
a.疑わしい標的細胞を蛍光標識化することと、
b.前記疑わしい標的細胞をスキャンすることと、
c.サンプルから流体を吸引することと、
d.前記サンプルを光退色させることと、
e.前記疑わしい標的細胞を再スキャンすることと、
を含む、方法。
【請求項10】
請求項8に記載の方法において、
前記標的細胞が、内皮細胞、上皮細胞、胎児細胞、細菌細胞、心筋細胞、ウイルス感染細胞、およびそれらの組合せからなる群から選ばれる、方法。
【図1A】


【図1B】


【図2】


【図3A】


【図3B】


【図4A】


【図4B】


【図4C】




【図1B】


【図2】


【図3A】


【図3B】


【図4A】


【図4B】


【図4C】


【公開番号】特開2010−29187(P2010−29187A)
【公開日】平成22年2月12日(2010.2.12)
【国際特許分類】
【外国語出願】
【出願番号】特願2009−175045(P2009−175045)
【出願日】平成21年7月28日(2009.7.28)
【出願人】(505060347)ベリデックス・エルエルシー (43)
【氏名又は名称原語表記】Veridex,LLC
【住所又は居所原語表記】33 Technology Drive,Warren,NJ 07059,U.S.A.
【Fターム(参考)】
【公開日】平成22年2月12日(2010.2.12)
【国際特許分類】
【出願番号】特願2009−175045(P2009−175045)
【出願日】平成21年7月28日(2009.7.28)
【出願人】(505060347)ベリデックス・エルエルシー (43)
【氏名又は名称原語表記】Veridex,LLC
【住所又は居所原語表記】33 Technology Drive,Warren,NJ 07059,U.S.A.
【Fターム(参考)】
[ Back to top ]

