生体リズム情報取得方法
【課題】生物個体の生体リズムに関わる情報を取得するための、簡便かつ低侵襲な方法の提供。
【解決手段】生物個体の口腔粘膜上皮細胞から抽出した生理活性物質、特にα−アミラーゼの活性値の経時的変化に基づいて、前記生物個体の生体リズムに関わる情報を取得する方法を提供する。この方法では、生理活性物質の活性値の経時的変化を示す活性変動曲線を、生体リズムを推定するための分子時刻表として利用し、生物個体の生体リズムのずれを検出することが可能である。
【解決手段】生物個体の口腔粘膜上皮細胞から抽出した生理活性物質、特にα−アミラーゼの活性値の経時的変化に基づいて、前記生物個体の生体リズムに関わる情報を取得する方法を提供する。この方法では、生理活性物質の活性値の経時的変化を示す活性変動曲線を、生体リズムを推定するための分子時刻表として利用し、生物個体の生体リズムのずれを検出することが可能である。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、生物個体の生体リズムに関わる情報を取得する方法に関する。より詳しくは、生物個体の口腔粘膜上皮細胞から抽出した生理活性物質の活性値の経時的変化に基づいて、特に概日リズムに関わる情報を取得する方法に関する。
【背景技術】
【0002】
生物個体の様々な生体現象は、自立的に振動する「周期的なリズム」を示すことが知られている。この周期的なリズムは「生体リズム」と呼ばれている。特に、約一日を周期とする「概日リズム(サーカディアンリズム)」は、睡眠覚醒サイクルや体温、血圧、ホルモン分泌量の日内変動などの生体現象を広く支配していると考えられている。また、心身の活動度や運動能力、薬剤感受性などについても、概日リズムの関与が明らかにされている。
【0003】
生体リズムは、「時計遺伝子(クロックジーン)」と呼ばれる遺伝子群によって制御されている。時計遺伝子(以下、「時計分子」ともいう)は、その発現や活性、局在等を自律的に周期変動(振動)させることにより「体内時計」として機能し、他の種々の遺伝子群を制御することで、上記のような様々な生体現象を支配している。時計分子による体内時計は、体内の各細胞、組織、臓器ごとの様々なレベルで存在しており、これが同調して個体全体の生体リズムが作り出されているものと考えられる。
【0004】
時計分子の遺伝子多型や遺伝子変異は、癌や糖尿病、血管系疾患、神経変性疾患などの発症要因となることが明らかにされている。さらに、近年、双極性障害や鬱病のような精神疾患についても、その発症要因として時計分子の遺伝子多型や変異の関与が指摘されており、時計分子の遺伝子多型や変異によって変調した体内時計を光照射によってリセットする治療方法も試みられるようになっている。
【0005】
一方、例えば、睡眠覚醒サイクルは、体内時計による自律的な制御だけでなく、社会生活による制約も受けている。このため、日々の就寝時刻や起床時刻の変化によって、「実生活の就寝起床サイクル」と「体内時計による睡眠覚醒サイクル」との間にリズムのずれ(位相のずれ)が生じる可能性がある。このようなリズムのずれが、いわゆる「時差ぼけ」や睡眠障害、さらには上記のような精神疾患の原因ともなると考えられている。
【0006】
「実生活の就寝起床サイクル」と「体内時計による睡眠覚醒サイクル」との間のような、いわゆる「外的時間」と「内的時間」との間に生じるずれは、生体リズムの「内的脱同調」とみなされる。この「内的脱同調」とは、体内の各臓器の体内時計が脱同調した状態と言うことができる。内的脱同調は、各臓器の体内時計の外的時間への同調のし易さ、いわば同調速度、が異なることによって生じるものと考えられる。内的脱同調が生じると、体温や血圧等の日内変動に二相性のリズムが観察されることが知られている。
【0007】
生体リズムを利用して、薬剤治療効果の最大化を図る試みも始まっている。薬剤の標的となる分子(薬剤標的分子)や薬剤を代謝する酵素(薬物代謝酵素)の概日リズムに起因して、薬剤による治療効果も日内変動することが考えられる。そこで、薬剤ごとに最適な投薬時刻を定めて、治療効果を最大化しようとする「時間医療」という考え方が提唱されてきている。
【0008】
また、より身近には、心身の活動度や運動能力の概日リズムを利用して、学習やトレーニングにおいて自己の能力を最大限に引き出す活動時刻や、太りにくい(又は、太りやすい)摂食時刻が検討され始めている。
【0009】
以上のことから、体内時計による生体リズムを正確に知ることは、種々の疾患の予防、時差ぼけなどの体調不良の改善、時間医療の実現、自己能力の発揮、ダイエットなどに非常に有益と考えられる。
【0010】
特許文献1には、生物個体から採取した標準検体の遺伝子発現産物量測定データに基づき体内時刻を推定する方法などが開示されている。この体内時計推定方法では、遺伝子発現産物量(すなわち、mRNA)の発現量に基づいて、体内時計を推定するための分子時計表を作成するものである。なお、特許文献1には、具体的な採取組織(又は、細胞)及び測定対象遺伝子は記載されていない。
【0011】
特許文献2には、ヒトの深部体温の計測値から生体リズム曲線を測定するための生体リズム曲線測定装置が記載されている。この生体リズム曲線測定装置では、外乱の影響(外部からの影響)を除去して真の生体リズム曲線を測定できるように工夫されている。なお、特許文献2には、深部体温の具体例として直腸温又は鼓膜温が挙げられており、特に直腸温が好適である旨の記載がある。
【0012】
また、本発明に関連する発明として、特許文献3〜5には、被検者の唾液中のα−アミラーゼ活性を指標としたストレス判定方法が開示されている。このストレス判定方法は、「唾液」中のα−アミラーゼ活性を測定することにより、被験者のストレスの程度を簡便かつ容易に判定可能である。
【特許文献1】国際公開第2004/012128号
【特許文献2】特開平6−189914号公報
【特許文献3】特開2002−168860号公報
【特許文献4】特開2006−345869号公報
【特許文献5】特開2006−345870号公報
【発明の開示】
【発明が解決しようとする課題】
【0013】
特許文献1に開示される体内時計推定方法は、生物個体から採取した標準検体のmRNAの発現量に基づく方法である。特許文献1には、具体的な採取組織(又は、細胞)及び測定対象遺伝子は記載されていないが、従来、白血球中の時計遺伝子発現を調べる方法が、簡便な方法として広く採用されている。しかし、この方法では採血が不可欠となるため、被験者において肉体的苦痛が伴う。
【0014】
さらに、測定者においても、採血した血液から白血球を分離する操作や、白血球からmRNAを抽出する操作、時計遺伝子mRNAの発現解析などを行なう必要があり、非常に手間がかかっていた。一般に、生物検体からmRNAを抽出し、定量を行なうためには、mRNAの分解を防止するための煩雑な操作が必要となるためである。特に、微量の生物検体を扱う場合にmRNAの分解が生じると、安定した測定結果を得ることができなくなる。
【0015】
特許文献2に開示される生体リズム曲線測定装置は、特に直腸温を測定するものである。しかし、直腸での体温測定は、被験者に心理的あるいは肉体的苦痛を与え得るものであり、測定者においても負担感が生じ得る。
【0016】
そこで、本発明は、生物個体の生体リズムに関わる情報を取得するための、簡便かつ低侵襲な方法を提供することを主な目的とする。
【課題を解決するための手段】
【0017】
上記課題解決のため、本発明は、生物個体の口腔粘膜上皮細胞から抽出した生理活性物質、特にα−アミラーゼの活性値の経時的変化に基づいて、前記生物個体の生体リズムに関わる情報を取得する方法を提供する。
この方法では、生理活性物質の活性値の経時的変化を示す活性変動曲線を、生体リズムを推定するための分子時刻表として利用する。
この方法では、分子時計表において、前記活性変動曲線が一日の間に示す活性極大値の数に基づいて、前記生体リズムのずれを検出することができる。
また、分子時計表を生物個体について複数回作製し、照合することにより、生物個体の生体リズムの位相のずれを検出することができる。
さらに、所定時刻における生理活性物質の活性値を、分子時刻表と照合することにより、生物個体の生体リズムの位相のずれを検出することもできる。
【発明の効果】
【0018】
本発明により、簡便かつ低侵襲に生物個体の生体リズムに関わる情報を取得する方法が提供される。
【発明を実施するための最良の形態】
【0019】
1.生理活性物質
本願発明者は、簡便かつ低侵襲に生物個体の生体リズムに関わる情報を取得する方法を確立するため、まず、極めて低侵襲に採取可能な生体組織である口腔粘膜上皮細胞に着目した。そして、口腔粘膜上皮細胞内で発現量の日内変動を示す分子としてα−アミラーゼを同定し、その活性値が生体リズムを示すことを見出し、本願発明を完成させた。
【0020】
すなわち、本願発明は、生物個体の口腔粘膜上皮細胞から抽出したα−アミラーゼの活性値の経時的変化に基づいて、生物個体の生体リズムに関わる情報を取得する方法である。なお、本願発明において対象とする生物個体にはヒトや、マウス・ラット・サル等の実験動物などを広く含み、特に限定されない。
【0021】
α−アミラーゼは、膵液や唾液に含まれる消化酵素として知られている。また、げっ歯類を用いた実験では、唾液腺中のα−アミラーゼ量に概日リズムがみられることが報告されている(Bellavia SL, et. al. Circadian rhythm of alpha-amylase in rat parotid gland. Acta. Odontol. Latinoam. 1990; 5(1):13-23)。しかし、口腔粘膜上皮の細胞内にα−アミラーゼが発現していることはこれまで知られておらず、口腔粘膜上皮細胞内のα−アミラーゼについて生体リズムに関する検討がなされたことはない。
【0022】
2.生理活性物質の取得
口内粘膜上皮細胞は、最も低侵襲に採取することのできる生体組織の一つであり、口内粘膜上皮細胞から得られるゲノムを用いた遺伝子型の判定等に用いられている。
【0023】
本発明において、口内粘膜上皮細胞の採取方法としては、例えば、ブラシやスパーテル等で口腔粘膜表面から細胞を掻き取ることによって行うことができる。採取部位は、頬の裏側の粘膜が好適であり、測定のばらつきを抑えるため左右両側の粘膜から採取することが望ましい。
【0024】
ブラシ等で採取した口内粘膜上皮細胞は、サンプルチューブ内に満たしたリン酸バッファー(PBS)などの緩衝液中でブラシ等を洗浄するようにして緩衝液中に回収することができる。この際、細胞の溶解を防止するため、緩衝液には等張液を使用する。
【0025】
このようにして得た細胞懸濁液を遠心分離やろ過することにより、口内粘膜上皮細胞を分離する。遠心分離やろ過は、通常の方法を用いればよいが、口内粘膜上皮細胞の採取時に混入した唾液を除くため、複数回の操作を行なうことが望ましい。唾液中には唾液腺から分泌された多量のα−アミラーゼが存在しており、これが分離した細胞に混入していると、口内粘膜上皮細胞内のα−アミラーゼのみの活性を正確に測定できなくなるためである。
【0026】
分離した細胞は、タンパク質抽出液を調製するために溶解される。細胞の溶解は、市販のタンパク質抽出試薬や界面活性剤を加えた緩衝液等を用いて行うことができる。また、細胞を懸濁した緩衝液を超音波処理するなどの物理的な細胞破砕によって溶解してもよい。この細胞溶解液を遠心分離やろ過して不溶部分を取り除くことにより、タンパク質抽出液を調製する。
【0027】
調製したタンパク抽出液中のα−アミラーゼ活性の測定は、公知の方法を採用でき、市販の測定装置や測定キットを使用することができる。なお、具体的な測定方法は、実施例において説明する。
【0028】
以上のように、本発明に係る方法では、採取が容易な口腔粘膜上皮細胞を用いるため、従来方法に比べ被験者の心理的・肉体的負担を極めて軽くすることができる。
【0029】
また、mRNAに比べて安定なタンパク質を測定対象とするため、従来方法と異なり煩雑な操作が不要で、簡便な操作で安定した測定結果を得ることが可能である。さらに、一般にmRNAの発現解析は2時間程度を要するのに比べ、α−アミラーゼ活性は後述する市販の測定装置を使用すれば数分程度で測定できるため、短時間で測定結果を得ることができる。
【0030】
3.分子時計表
図1は、α−アミラーゼ活性の経時的変化を示す図である。図は、1日間、所定の時刻ごとに、上述の方法によって口腔粘膜上皮細胞内のα−アミラーゼ活性を測定し、活性値をプロットして得られた活性変動曲線の一例を表している。図中、横軸は時刻、縦軸は活性値を示す。本図では、一例として、0:00が最小値活性値(l)、12:00が最大活性値(h)として測定された場合を示した。
【0031】
活性変動曲線は、各時刻に測定された活性値のプロットから視察によって求めることがきる。また、より正確な曲線を求めるためには、自己相関法(コレログラム)、パワースペクトル法、コサイナー法、ペリオドグラム法などの周期計算法を用いることもできる。
【0032】
図のように、α−アミラーゼの活性値は日内変動し、概日リズムを示す。従って、α−アミラーゼ活性値の経時的変化に基づいて、被験個体の生体リズムに関する情報を得ることが可能であり、α−アミラーゼの活性変動曲線を「分子時計表」として利用することにより、被験個体の生体リズムの推定を行なうことができる。
【0033】
すなわち、例えば、図1の活性変動曲線(以下、「分子時計表」と同義に用いる)を有することが分かっている被験個体について、所定時刻に測定された活性値がhであったとする。この場合、図1の活性変動曲線(分子時計表)に基づけば、被験個体の概日リズム(内的時間)は12:00にあると推定できる。また、活性値がlである場合、被験個体の概日リズム(内的時間)は0:00であり、活性値がmである場合には、6:00又は18:00であると推定することができる。
【0034】
また、同一の被験個体について、例えば3時間間隔で2回測定された活性値がそれぞれp,qであったとする。このとき、pに比べqが高い(p<q)場合には、被験個体の概日リズム(内的時間)は、活性の上昇局面である午前(0:00〜12:00)にあると推定できる。逆に、pに比べqが低い(q<p)場合には、午後(12:00〜24:00)にあると推定できる。さらに、p及びqの変動率(q/p)を求め、活性変動曲線の接線の傾きと照合することで、概日リズムにおける内的時間をより正確に推定することが可能である。
【0035】
4.生体リズムのずれの検出
以下、この活性変動曲線の変化によって、被験個体の生体リズムのずれを検出する方法について説明する。
【0036】
活性変動曲線は、その最大値(又は最小値)、最大値(又は最小値)の観察時刻、最大値から最小値(又は最小値から最大値)への傾き等によって形状を特徴付けることができる。本発明では、この活性変動曲線の形状を「位相」というものとする。また、活性変動曲線(分子時計表)により特定される被験個体の概日リズムの形状についても「位相」という。
【0037】
具体的には、図1に示した活性変動曲線(分子時計表)では、最小値l、最大値h、最小値の観察時刻(外的時間)0:00、最大値の観察時刻12:00によって特徴付けられる形状、すなわち「位相」を有している。
【0038】
(4-1)二相性リズムの検出による方法
まず、分子時計表を用いて、活性変動曲線が一日の間に示す活性極大値の数に基づき、生体リズムのずれを検出する方法について説明する。
【0039】
既に説明したように、生体リズムにおける「内的時間」と「外的時間」との間に生じるずれは、「内的脱同調」とみなされる。そして、この内的脱同調が生じると、体温や血圧等の日内変動に二相性のリズムが観察されることが分かっている。従って、この二相性のリズムを検出することによって、内的脱同調、すなわち生体リズムのずれ、を検出することが可能となる。
【0040】
本発明者らは、実施例において詳述するように、体温や血圧等と同様に、α−アミラーゼ活性の日内変動においても、内的脱同調の指標となり得る多相性のリズムが検出できることを見出した。
【0041】
図2は、典型的な二相性リズムを示すα−アミラーゼの活性変動曲線の位相を示す図である。図は、図1に示した活性変動曲線を有する被験個体において、内的脱同調が生じた場合の活性変動曲線の一例を表している。
【0042】
図1において、被験個体の位相は、一つの極大値(最大値)hと、その観察時刻(外的時間)12:00によって特徴付けられていた。これに対して、図2における被検個体の位相は、2つの極大値h1とh2が出現している。すなわち、図2に示した活性変動曲線は、一日の間に、12:00の極大値h1、18:00の極大値h2の2つの活性極大値を伴う二相性リズムとして観察されている。
【0043】
このような複数の活性極大値は、各臓器の体内時計の外的時間への同調速度が異なることによって、個体全体の生体リズムが一時的に脱同調することによって出現するものと考えられる。
【0044】
従って、分子時計表を用いて、活性変動曲線が一日の間に示す活性極大値の数が2以上であるか否かに基づいて、生体リズムのずれとその程度を検出することが可能である。なお、活性極大値の数は2つに限られず、活性極大値を3以上伴う多相性リズムが観察される場合もある。
【0045】
ここで、図2に示した12:00の極大値h1の観察時刻(外的時間)12:00は、図1に示した当初の活性変動曲線における最大値hの観察時刻と原則的に一致する。被験個体の生体リズムに内的脱同調が生じると、この最大値hの観察時刻12:00とは異なる時刻(図2では18:00)に新たな極大値h2が観察される。そして、活性極大値の観察時刻(上記の例では12:00と18:00)の間隔が長いほど、内的脱同調の程度が大きいとみなすことができる。
【0046】
さらに、極大値h1及び極大値h2の大きさは、被験個体に生じた内的脱同調の程度に依存して変化する。これらの大きさは、被験個体に生じた内的脱同調が次第に修正され、個体全体の生体リズムが徐々に同調していくにつれ、次第に大きさが変化する。すなわち、例えば、生体リズムが内的脱同調前のリズムに回復していく際には、観察時刻18:00に出現した極大値h2は徐々に消失する。
【0047】
また、生体リズムが内的脱同調後のリズムに同調していく場合には、逆に、観察時刻12:00の元々の極大値h1が徐々に消失し、18:00の極大値h2が次第に大きくなる。
【0048】
従って、図2に示した活性変動曲線における極大値h2の大きさ、より好適には極大値h1と極大値h2との振幅比(h2/h1)、に基づけは、生体リズムのずれの程度を知ることができる。この場合、振幅比(h2/h1)が1に近く、極大値h1と極大値h2がほぼ等しい場合が最も内的脱同調の程度が大きいものと判断される。
【0049】
このように、分子時計表を用い、活性変動曲線が一日の間に示す二以上の活性極大値の観察時刻の間隔や、その大きさ及び振幅比に基づいて、生体リズムのずれの程度や、ずれからの回復具合を判定することが可能である。活性変動曲線が3以上の極大値を有する多相性リズムとして観察された場合には、それぞれの極大値の大きさや振幅比に基づいて判定を行うことができる。
【0050】
(4-2)複数回作成した分子時計表の照合による方法
次に、被験個体について複数回作製した分子時計表を照合することにより、生体リズムのずれを検出する方法について説明する。
【0051】
図3は、活性変動曲線の位相の変化を示す図である。図3(A)中、点線で示す活性変動曲線は図1に示した曲線であり(以下、「分子時計表1」ともいう)、実線は同一被験個体について、異なる測定日に図1と同様の測定を行って得た活性変動曲線(以下、「分子時計表2」ともいう)の一例を表している。図中、横軸は時刻、縦軸はα−アミラーゼ活性値を示す。
【0052】
分子時計表1は、最小値(l)の観察時刻(外的時間)を0:00、最大値(l)の観察時刻を12:00とする位相を有しているのに対して、分子時計表2では、最小値(l)の観察時刻が6:00、最大値(l)の観察時刻が18:00となり、位相が変化している。
【0053】
これは、分子時計表1の作製時点と分子時計表2の作製時点とで、被験個体の活性変動曲線の位相にずれが生じたとみることができる。具体的には、分子時計表2の作製時点における被験個体の生体リズム(内的時間)は、分子時計表1の作製時点から6時間遅れた(又は18時間進んだ)ことになる。
【0054】
このように、同一被験個体について複数回分子時計表を作製し、これらを互いに照合することによって、被験個体の生体リズムの位相のずれを検出することができる。
【0055】
(4-3)所定時刻の活性値を分子時計表と照合する方法
続いて、所定時刻における生理活性物質の活性値を、分子時刻表と照合することにより、生体リズムのずれを検出する方法について説明する。
【0056】
図3(B)は、図3(A)において、分子時計表1(図1も参照)を点線から実線に、分子時計表2を実線から点線に換えて示した図である。
【0057】
先に説明したように、図1の活性変動曲線(分子時計表)を有することが分かっている被験個体について、所定時刻に測定された活性値がmであった場合、分子時計表1に基づいて、被験個体の概日リズム(内的時間)は6:00又は18:00と推定できる。
【0058】
ここで、同一被験個体について、異なる測定日の6:00(外的時間)に測定を行って得た活性値がmからlに変化していたと仮定する(図3(B)中、丸印参照)。この場合、被験個体の概日リズム(内的時間)は6時間遅れて(又は18時間進んで)、分子時計表2で示される概日リズムに変化したと推定することができる。
【0059】
このように、所定時刻における活性値を、予め作製した分時計表と照合することよって、より簡便に被験個体の生体リズムの位相のずれを検出することも可能である。
【0060】
以上の通り、本発明に係る方法によれば、α−アミラーゼの活性値の経時的変化を示す活性変動曲線を分子時刻表として利用することで、各被験個体に固有の生体リズムを推定し、生体リズムの位相のずれを検出することが可能である。
【0061】
実施例では、口内粘膜上皮細胞内のα-アミラーゼ活性の具体的な測定データを示し、α-アミラーゼ活性値が概日リズムを示すこと、及びこの概日リズムが起床時刻によって影響を受けて位相にずれを生じ得ることについて説明する。
【実施例】
【0062】
(実施例1)
<α−アミラーゼの同定>
実施例1では、口腔粘膜上皮細胞内において概日リズムを示すタンパク質の同定を行なった。
【0063】
成人男性(32歳)から口腔粘膜上皮細胞を採取した。採取は、10:00,13:00,16:00,19:00,22:00,1:00,4:00,7:00の8回行い、市販の口腔粘膜上皮採取用ブラシ(Medical Packaging Corporation:CYB-1)を使用して行なった。口腔粘膜上皮細胞の採取後、チューブ内に満たしたPBSでブラシを洗浄し、PBS中に細胞を回収した。この細胞懸濁液を遠心分離(3,000rpm,30sec)し、分離した口腔粘膜上皮細胞をタンパク質抽出用バッファー(PIERCE Biotechnology社:RIPA Buffer)で溶解し、再度遠心分離(3,000rp
m,30sec)を行なってタンパク質抽出液を調製した。
【0064】
得られたタンパク質抽出液について、定法に従ってポリアクリルアミドゲル電気泳動(SDS-PAGE)を行った。図4は、電気泳動後のアクリルアミドゲルを、クマシー(CBB)染色して得られたタンパク質の染色像である。図中、レーン1及び14は分子量マーカーである(図中左に分子量を示す)。レーン2−13は、上記の各時刻において採取した口腔粘膜上皮細胞から抽出したタンパク質である。図中、矢印で示す約50kDaのタンパク質(以下、「目的タンパク質」という)に関して発現量の日内変動が認められる。
【0065】
図5は、目的タンパク質の各時刻における発現量を示す図である。発現量は、図4に示した染色像において目的タンパク質のバンドをデンシトメトリーにより定量し、各サンプルにおける総タンパク質量で標準化を行なった値を、1:00を1とした相対値で示した(10:00,13:00,16:00,19:00:n=6,22:00,1:00,4:00,7:00:n=3)。
【0066】
続いて、目的タンパク質について、ペプチド・マス・フィンガープント解析によるタンパク質同定を行なった。目的タンパク質のバンドをアクリルアミドゲルから切り出し、トリプシンによるIn-Gel消化を行なった後、ゲルからペプチド断片を抽出した。得られたペプチド断片を、質量分析計(TOF-MS:Applied Biosystems:oMALDI-Qq-TOF MS/MS QSTAR Pulsar i)によって解析し、MASCOT(Matrix Science)を用いて、NCBInr(Taxonomy human)と照合することにより、タンパク質を同定した。結果、目的タンパク質はα-アミラーゼ
と同定された。
【0067】
以上、実施例1の結果から、口腔粘膜上皮細胞内において概日リズムを示すタンパク質として、α-アミラーゼが同定できた。
【0068】
(実施例2)
<口腔粘膜上皮細胞におけるα-アミラーゼの発現確認>
実施例2では、口腔粘膜上皮細胞でα-アミラーゼが発現していることを確認するための実験を行なった。
【0069】
実施例1と同様の方法で分離した口腔粘膜上皮細胞から、市販のTotal RNA抽出精製キット(AgilentTechnologies)を用いてRNAを抽出し、定法に従ってRT-PCRを行なった。使用したプライマーの配列を、「表1」に示す。
【0070】
【表1】

【0071】
図6は、RT-PCRにより増幅されたDNA断片の泳動像(染色像)を示す図である。図中、レーン1はDNAサイズマーカーである。レーン2はネガティブコントロール)、レーン3は口腔粘膜上皮細胞である。
【0072】
図に示すように、レーン3において、約150bpsのDNA断片(図中矢印)の増幅が確認され、口腔粘膜上皮細胞にα-アミラーゼmRNAが発現していることが確認された。
【0073】
次に、タンパク質レベルでのα-アミラーゼの発現を確認するため、以下の実験を行なった。
【0074】
実施例1と同様の方法で、口腔粘膜上皮細胞の採取後、ブラシをチューブ内に満たしたPBSで洗浄し、細胞懸濁液を得た。この細胞懸濁液について、α-アミラーゼの活性値を測定した。測定は、Salivary α-Amylase Assay Kit (Salmetrics社)を用いて行なった。
【0075】
図7は、α-アミラーゼの活性値を示す図である。図中、「PBS」は上記の細胞懸濁液で測定された活性値(約20U/ml)を示す。この細胞懸濁液では、口腔粘膜上皮細胞は溶解されていないため、測定される活性値は、口腔粘膜上皮細胞の採取時にブラシに付着して混入した唾液中に含まれるα-アミラーゼに由来するものと考えられる。なお、図中、「Saliva」は、PBSで20倍に希釈した唾液のα-アミラーゼ活性を示している。
【0076】
図中、「PBS+TritonX100」及び「PBS+Sonic」は、上記の細胞懸濁液中の口腔粘膜上皮細胞を溶解した場合に測定された活性値を示す。「PBS+TritonX100」では、細胞懸濁液に界面活性剤(TritonX100)を加えて細胞を溶解させた。また、「PBS+Sonic」では、細胞懸濁液を超音波処理することによって細胞を溶解させた。
【0077】
「PBS+TritonX100」及び「PBS+Sonic」で測定された活性値は、それぞれ約50U/ml,65U/mlであり、口腔粘膜上皮細胞を溶解しない場合(「PBS」参照)に測定された活性値よりも高かった。
【0078】
このことは、「PBS+TritonX100」及び「PBS+Sonic」では、細胞を溶解したことで、混入した唾液中に含まれるα-アミラーゼに加え、口腔粘膜上皮細胞内から溶出されたα-アミラーゼの活性が測定されたことを示唆するものであり、口腔粘膜上皮細胞内にα-アミラーゼタンパク質が発現していることを示している。
【0079】
以上、実施例2の結果から、口腔粘膜上皮細胞内において、α-アミラーゼがmRNAレベル及びタンパク質レベルで発現していることが確認された。
【0080】
(実施例3)
<α-アミラーゼ活性の概日リズムの検討>
実施例3では、口腔粘膜上皮細胞内のα-アミラーゼについて、活性値の日内変動を検索し、α-アミラーゼ活性の概日リズムについて検討を行った。
【0081】
(1)8:00起床の被験者A(男性,32歳)を対象に、1:00, 4:00, 7:00, 10:00, 13:00, 16:00, 19:00, 22:00において口内粘膜上皮細胞の採取を行い、500μLのPBSに懸濁した。
(2)遠心分離(3000rpm, 30sec)により細胞を沈殿させ、上清のPBSを廃棄した。分離した細胞は、次の工程まで凍結下で保存した。
(3)細胞に、100mM Na-PO4(pH6.0), 100mM NaCl, 0.1% Triton X-100を30μL加え、細胞を溶解した。再度遠心分離(3000rpm, 30sec)を行い、得られた上清をタンパク抽出液
とした。
(4)タンパク抽出液のタンパク質濃度をBCA Protein Assay Kit (PIERCE Biotechnology社)を用いて測定し、各時刻のサンプルのタンパク質濃度を1mg/mLに揃えた。
(5)タンパク質濃度調整後のタンパク抽出液25μLを、ニプロ社ココロメーター用チップに滴下し、ココロメーターを用いてα-アミラーゼ活性を測定した。
なお、被験者Aは、1:00の口腔粘膜上皮細胞の採取後に就寝し、4:00,7:00の測定の際には、口腔粘膜上皮細胞の採取のため一端起床した後、次の採取時刻まで再度睡眠をとった。
【0082】
結果を図8に示す。図中、横軸は時刻、縦軸はα-アミラーゼの活性値を示す。
【0083】
起床(8:00)後、最初の測定である9:00には、α-アミラーゼ活性値は約12U/mlであった。13:00,16:00では約20U/ml に上昇し、19:00に最大値約25U/mlを示した。その後、22:00,1:00ではそれぞれ約22U/ml,約19U/ml に減少し、4:00,7:00では、9:00の時点と同程度(約12U/ml)で推移した。
【0084】
このことから、α-アミラーゼ活性値が日内変動を示し、この日内変動が起床時刻前後を最小値とし、夕刻19:00を最大値とする概日リズムを示すことが明らかとなった。
【0085】
図9には、比較のため、唾液中のα-アミラーゼの活性値を測定した結果を示す。図中、横軸は時刻、縦軸はα-アミラーゼの活性値を示す。
【0086】
図8に示した口腔粘膜上皮細胞内のα-アミラーゼと異なり、唾液中のα-アミラーゼの活性値には概日リズムがみられていない。これは、唾液腺から分泌されるα-アミラーゼ量は、ストレスに鋭敏に反応することが知られており(先に挙げた特許文献3〜5参照)、測定の際のストレスによってα-アミラーゼ量が変動したことが要因の1つと考えられた。
【0087】
(実施例4)
<α-アミラーゼ活性の概日リズムの検討2>
実施例4では、実施例3と同一の被験者Aを対象に、起床時刻を8:00から6:00に変更し、口腔粘膜上皮細胞内のα-アミラーゼ活性の概日リズムについて検討を行った。なお、就寝時刻は0:00の口腔粘膜上皮細胞採取の後である。
(1)6:00起床の被験者A(男性,32歳)を対象に、0:00, 3:00, 6:00, 9:00, 12:00, 15:00, 18:00, 21:00において口内粘膜上皮細胞の採取を行い、500μLのPBSに懸濁した。
(2)遠心分離(3000rpm, 30sec)により細胞を沈殿させ、上清のPBSを廃棄した。同様の操作を再度行なった。分離した細胞は、次の工程まで凍結下で保存した。
(3)細胞に、20mM Tris-Cl(pH 7.0), 150mM NaCl, 1% Sucrose Monolaurateを30μL加え、細胞を溶解した。再度遠心分離(3000rpm, 30sec)を行い、得られた上清をタンパク質抽出液とした。
(4)吸光度(280nm)により、タンパク質抽出液のタンパク質濃度を測定した。
(5)Salivary α-Amylase Assay Kit (Salmetrics社)を用いて、タンパク抽出液のα-アミラーゼ活性を測定した。手順は、キット添付のプロトコールに従った。
【0088】
結果を図10に示す。図中、横軸は時刻、縦軸は活性値を示す。なお、活性値は、上記(5)で測定された活性値を、(4)で算出したタンパク質量で標準化して示した。
【0089】
起床時刻を6:00に変更した場合、α-アミラーゼ活性の概日リズムは、15:00に最大値(約3.5U/mg)を示し、8:00起床の場合(図8参照)に比べて、最大値が測定された時刻が4時間早くなった。これは、起床時刻を変更したことによって、被験者の生体リズムにずれが生じたことを示唆している。
【0090】
以上、実施例3及び4の結果から、口内粘膜上皮細胞内のα-アミラーゼ活性が概日リズムを示し、さらにこの概日リズムが起床時刻の影響を受けて変化し得ることが示された。
【0091】
(実施例5)
実施例5では、4人の被験者を対象に、以下のスケジュールに従って、生体リズム(睡眠覚醒リズム)を後方に10時間シフトさせ、人為的な内的脱同調(時差ぼけ)状態を生じさせた。
【0092】
(1)第1日目:17:30から4時間おきに口腔粘膜上皮細胞を回収した。就寝時刻23:30。採材開始時刻17:30から、以降4時間おきに口腔粘膜上皮細胞の採取を行った。
(2)第2日目:起床時刻7:30。起床後は、翌日第3日目9:30まで睡眠をとらず、睡眠覚醒リズムをシフトさせた。起床時刻前、1:30, 5:30のサンプリングは一時的に起床して行った。以下、睡眠時間帯にあたるサンプリングについては、同様に一時的に起床して行った。
(3)第3日目:就寝時刻9:30。起床時刻17:30。
(4)第4日目〜第8日目:就寝時刻9:30、起床時刻17:30の睡眠覚醒リズムを維持し続けた。
(5)実施例4と同様にして、採取した口腔粘膜上皮細胞内のα-アミラーゼ活性を測定した。
【0093】
結果を図11に示す。図中、横軸は時刻、縦軸はα-アミラーゼの活性値を示す。図中、上段には、各日の睡眠時間帯を黒塗りで、起床時間帯を白塗りで表すことにより、実験スケジュールを示した。
【0094】
睡眠覚醒リズムをシフトさせる前である第2日目と第3日目の就寝時刻(9:30)前では、9:30にα-アミラーゼ活性の極大値が測定されている(図中、符号「p1」参照)。このとき、α-アミラーゼ活性の概日リズムは一相性となっている。
【0095】
その後、睡眠覚醒リズムをシフトさせた後の第4日目以降では、21:30に新たな活性極大値の出現が確認される(符号「p2」参照)。α-アミラーゼ活性の概日リズムは、二相性のリズムに変化している。
【0096】
この結果は、α-アミラーゼ活性の概日リズムが示す多相性のリズムを検出することで、睡眠覚醒リズムのシフトにより被験者に生じた内的脱同調(時差ぼけ)を検出し得ることを示している。
【0097】
図12は、睡眠覚醒リズムのシフト後に二相性の極大値が観察された時刻である9:30と21:30の時点における、第2日目から第7日目までのα-アミラーゼ活性値を示す図である。
【0098】
睡眠覚醒リズムをシフトさせる前である第2日目においては、9:30の時点におけるα-アミラーゼ活性値は、21:30の時点における活性値に比べて十分に大きい。
【0099】
これに対して、睡眠覚醒リズムをシフトさせた第4日目以降では、9:30の時点におけるα-アミラーゼ活性値が徐々に低下し、逆に、21:30の時点における活性値が次第に上昇している。これは、睡眠覚醒リズムのシフトによって被験者に生じた内的脱同調が徐々に回復し、被験者の生体リズムがシフト後の就寝時刻9:30、起床時刻17:30の睡眠覚醒リズムに次第に同調してきていることを示すものである。
【0100】
従って、この結果から、9:30と21:30に観察される二相性の活性極大値の大きさ又は振幅比に基づけば、被験者の内的脱同調、すなわち生体リズムのずれの程度や、ずれからの回復具合を判定できることが明らかになった。
【産業上の利用可能性】
【0101】
本発明に係る方法によれば、α−アミラーゼの活性値の経時的変化を示す活性変動曲線を分子時刻表として利用することで、各被験個体に固有の生体リズムを簡便かつ低侵襲に推定することができる。従って、各個人が自身に固有の生体リズムを知り、最適な投薬時刻や活動時刻、摂食時刻を設定することが可能となり、時間医療の実現や、自己能力の発揮、ダイエットに役立てることができる。
【0102】
さらに、本発明に係る方法により、生体リズムのずれを検出すれば、生体リズムのずれを原因とする種々の疾患の予防や、時差ぼけなどの体調不良の改善に役立てることができる。
【図面の簡単な説明】
【0103】
【図1】α−アミラーゼ活性の経時的変化の一例を示す図である。
【図2】典型的な二相性リズムを示すα−アミラーゼの活性変動曲線の位相を示す図である。
【図3】α−アミラーゼの活性変動曲線の位相の変化を示す図である。
【図4】口腔粘膜上皮細胞から抽出したタンパク質の染色像である。
【図5】目的タンパク質の各時刻における発現量を示す図である。
【図6】α−アミラーゼのRT-PCRの結果を示す図である。
【図7】口腔粘膜上皮の細胞懸濁液及び細胞溶解液のα-アミラーゼ活性を示す図である。
【図8】実施例3におけるα-アミラーゼ活性の測定結果(8:00起床)を示す図である。
【図9】唾液中のα-アミラーゼ活性を示す図である。
【図10】実施例4におけるα-アミラーゼ活性の測定結果(6:00起床)を示す図である。
【図11】実施例5におけるα-アミラーゼ活性の測定結果(内的脱同調状態)を示す図である。
【図12】第2日目から第7日目までの9:30と21:30の時点におけるα-アミラーゼ活性値を示す図である。
【技術分野】
【0001】
本発明は、生物個体の生体リズムに関わる情報を取得する方法に関する。より詳しくは、生物個体の口腔粘膜上皮細胞から抽出した生理活性物質の活性値の経時的変化に基づいて、特に概日リズムに関わる情報を取得する方法に関する。
【背景技術】
【0002】
生物個体の様々な生体現象は、自立的に振動する「周期的なリズム」を示すことが知られている。この周期的なリズムは「生体リズム」と呼ばれている。特に、約一日を周期とする「概日リズム(サーカディアンリズム)」は、睡眠覚醒サイクルや体温、血圧、ホルモン分泌量の日内変動などの生体現象を広く支配していると考えられている。また、心身の活動度や運動能力、薬剤感受性などについても、概日リズムの関与が明らかにされている。
【0003】
生体リズムは、「時計遺伝子(クロックジーン)」と呼ばれる遺伝子群によって制御されている。時計遺伝子(以下、「時計分子」ともいう)は、その発現や活性、局在等を自律的に周期変動(振動)させることにより「体内時計」として機能し、他の種々の遺伝子群を制御することで、上記のような様々な生体現象を支配している。時計分子による体内時計は、体内の各細胞、組織、臓器ごとの様々なレベルで存在しており、これが同調して個体全体の生体リズムが作り出されているものと考えられる。
【0004】
時計分子の遺伝子多型や遺伝子変異は、癌や糖尿病、血管系疾患、神経変性疾患などの発症要因となることが明らかにされている。さらに、近年、双極性障害や鬱病のような精神疾患についても、その発症要因として時計分子の遺伝子多型や変異の関与が指摘されており、時計分子の遺伝子多型や変異によって変調した体内時計を光照射によってリセットする治療方法も試みられるようになっている。
【0005】
一方、例えば、睡眠覚醒サイクルは、体内時計による自律的な制御だけでなく、社会生活による制約も受けている。このため、日々の就寝時刻や起床時刻の変化によって、「実生活の就寝起床サイクル」と「体内時計による睡眠覚醒サイクル」との間にリズムのずれ(位相のずれ)が生じる可能性がある。このようなリズムのずれが、いわゆる「時差ぼけ」や睡眠障害、さらには上記のような精神疾患の原因ともなると考えられている。
【0006】
「実生活の就寝起床サイクル」と「体内時計による睡眠覚醒サイクル」との間のような、いわゆる「外的時間」と「内的時間」との間に生じるずれは、生体リズムの「内的脱同調」とみなされる。この「内的脱同調」とは、体内の各臓器の体内時計が脱同調した状態と言うことができる。内的脱同調は、各臓器の体内時計の外的時間への同調のし易さ、いわば同調速度、が異なることによって生じるものと考えられる。内的脱同調が生じると、体温や血圧等の日内変動に二相性のリズムが観察されることが知られている。
【0007】
生体リズムを利用して、薬剤治療効果の最大化を図る試みも始まっている。薬剤の標的となる分子(薬剤標的分子)や薬剤を代謝する酵素(薬物代謝酵素)の概日リズムに起因して、薬剤による治療効果も日内変動することが考えられる。そこで、薬剤ごとに最適な投薬時刻を定めて、治療効果を最大化しようとする「時間医療」という考え方が提唱されてきている。
【0008】
また、より身近には、心身の活動度や運動能力の概日リズムを利用して、学習やトレーニングにおいて自己の能力を最大限に引き出す活動時刻や、太りにくい(又は、太りやすい)摂食時刻が検討され始めている。
【0009】
以上のことから、体内時計による生体リズムを正確に知ることは、種々の疾患の予防、時差ぼけなどの体調不良の改善、時間医療の実現、自己能力の発揮、ダイエットなどに非常に有益と考えられる。
【0010】
特許文献1には、生物個体から採取した標準検体の遺伝子発現産物量測定データに基づき体内時刻を推定する方法などが開示されている。この体内時計推定方法では、遺伝子発現産物量(すなわち、mRNA)の発現量に基づいて、体内時計を推定するための分子時計表を作成するものである。なお、特許文献1には、具体的な採取組織(又は、細胞)及び測定対象遺伝子は記載されていない。
【0011】
特許文献2には、ヒトの深部体温の計測値から生体リズム曲線を測定するための生体リズム曲線測定装置が記載されている。この生体リズム曲線測定装置では、外乱の影響(外部からの影響)を除去して真の生体リズム曲線を測定できるように工夫されている。なお、特許文献2には、深部体温の具体例として直腸温又は鼓膜温が挙げられており、特に直腸温が好適である旨の記載がある。
【0012】
また、本発明に関連する発明として、特許文献3〜5には、被検者の唾液中のα−アミラーゼ活性を指標としたストレス判定方法が開示されている。このストレス判定方法は、「唾液」中のα−アミラーゼ活性を測定することにより、被験者のストレスの程度を簡便かつ容易に判定可能である。
【特許文献1】国際公開第2004/012128号
【特許文献2】特開平6−189914号公報
【特許文献3】特開2002−168860号公報
【特許文献4】特開2006−345869号公報
【特許文献5】特開2006−345870号公報
【発明の開示】
【発明が解決しようとする課題】
【0013】
特許文献1に開示される体内時計推定方法は、生物個体から採取した標準検体のmRNAの発現量に基づく方法である。特許文献1には、具体的な採取組織(又は、細胞)及び測定対象遺伝子は記載されていないが、従来、白血球中の時計遺伝子発現を調べる方法が、簡便な方法として広く採用されている。しかし、この方法では採血が不可欠となるため、被験者において肉体的苦痛が伴う。
【0014】
さらに、測定者においても、採血した血液から白血球を分離する操作や、白血球からmRNAを抽出する操作、時計遺伝子mRNAの発現解析などを行なう必要があり、非常に手間がかかっていた。一般に、生物検体からmRNAを抽出し、定量を行なうためには、mRNAの分解を防止するための煩雑な操作が必要となるためである。特に、微量の生物検体を扱う場合にmRNAの分解が生じると、安定した測定結果を得ることができなくなる。
【0015】
特許文献2に開示される生体リズム曲線測定装置は、特に直腸温を測定するものである。しかし、直腸での体温測定は、被験者に心理的あるいは肉体的苦痛を与え得るものであり、測定者においても負担感が生じ得る。
【0016】
そこで、本発明は、生物個体の生体リズムに関わる情報を取得するための、簡便かつ低侵襲な方法を提供することを主な目的とする。
【課題を解決するための手段】
【0017】
上記課題解決のため、本発明は、生物個体の口腔粘膜上皮細胞から抽出した生理活性物質、特にα−アミラーゼの活性値の経時的変化に基づいて、前記生物個体の生体リズムに関わる情報を取得する方法を提供する。
この方法では、生理活性物質の活性値の経時的変化を示す活性変動曲線を、生体リズムを推定するための分子時刻表として利用する。
この方法では、分子時計表において、前記活性変動曲線が一日の間に示す活性極大値の数に基づいて、前記生体リズムのずれを検出することができる。
また、分子時計表を生物個体について複数回作製し、照合することにより、生物個体の生体リズムの位相のずれを検出することができる。
さらに、所定時刻における生理活性物質の活性値を、分子時刻表と照合することにより、生物個体の生体リズムの位相のずれを検出することもできる。
【発明の効果】
【0018】
本発明により、簡便かつ低侵襲に生物個体の生体リズムに関わる情報を取得する方法が提供される。
【発明を実施するための最良の形態】
【0019】
1.生理活性物質
本願発明者は、簡便かつ低侵襲に生物個体の生体リズムに関わる情報を取得する方法を確立するため、まず、極めて低侵襲に採取可能な生体組織である口腔粘膜上皮細胞に着目した。そして、口腔粘膜上皮細胞内で発現量の日内変動を示す分子としてα−アミラーゼを同定し、その活性値が生体リズムを示すことを見出し、本願発明を完成させた。
【0020】
すなわち、本願発明は、生物個体の口腔粘膜上皮細胞から抽出したα−アミラーゼの活性値の経時的変化に基づいて、生物個体の生体リズムに関わる情報を取得する方法である。なお、本願発明において対象とする生物個体にはヒトや、マウス・ラット・サル等の実験動物などを広く含み、特に限定されない。
【0021】
α−アミラーゼは、膵液や唾液に含まれる消化酵素として知られている。また、げっ歯類を用いた実験では、唾液腺中のα−アミラーゼ量に概日リズムがみられることが報告されている(Bellavia SL, et. al. Circadian rhythm of alpha-amylase in rat parotid gland. Acta. Odontol. Latinoam. 1990; 5(1):13-23)。しかし、口腔粘膜上皮の細胞内にα−アミラーゼが発現していることはこれまで知られておらず、口腔粘膜上皮細胞内のα−アミラーゼについて生体リズムに関する検討がなされたことはない。
【0022】
2.生理活性物質の取得
口内粘膜上皮細胞は、最も低侵襲に採取することのできる生体組織の一つであり、口内粘膜上皮細胞から得られるゲノムを用いた遺伝子型の判定等に用いられている。
【0023】
本発明において、口内粘膜上皮細胞の採取方法としては、例えば、ブラシやスパーテル等で口腔粘膜表面から細胞を掻き取ることによって行うことができる。採取部位は、頬の裏側の粘膜が好適であり、測定のばらつきを抑えるため左右両側の粘膜から採取することが望ましい。
【0024】
ブラシ等で採取した口内粘膜上皮細胞は、サンプルチューブ内に満たしたリン酸バッファー(PBS)などの緩衝液中でブラシ等を洗浄するようにして緩衝液中に回収することができる。この際、細胞の溶解を防止するため、緩衝液には等張液を使用する。
【0025】
このようにして得た細胞懸濁液を遠心分離やろ過することにより、口内粘膜上皮細胞を分離する。遠心分離やろ過は、通常の方法を用いればよいが、口内粘膜上皮細胞の採取時に混入した唾液を除くため、複数回の操作を行なうことが望ましい。唾液中には唾液腺から分泌された多量のα−アミラーゼが存在しており、これが分離した細胞に混入していると、口内粘膜上皮細胞内のα−アミラーゼのみの活性を正確に測定できなくなるためである。
【0026】
分離した細胞は、タンパク質抽出液を調製するために溶解される。細胞の溶解は、市販のタンパク質抽出試薬や界面活性剤を加えた緩衝液等を用いて行うことができる。また、細胞を懸濁した緩衝液を超音波処理するなどの物理的な細胞破砕によって溶解してもよい。この細胞溶解液を遠心分離やろ過して不溶部分を取り除くことにより、タンパク質抽出液を調製する。
【0027】
調製したタンパク抽出液中のα−アミラーゼ活性の測定は、公知の方法を採用でき、市販の測定装置や測定キットを使用することができる。なお、具体的な測定方法は、実施例において説明する。
【0028】
以上のように、本発明に係る方法では、採取が容易な口腔粘膜上皮細胞を用いるため、従来方法に比べ被験者の心理的・肉体的負担を極めて軽くすることができる。
【0029】
また、mRNAに比べて安定なタンパク質を測定対象とするため、従来方法と異なり煩雑な操作が不要で、簡便な操作で安定した測定結果を得ることが可能である。さらに、一般にmRNAの発現解析は2時間程度を要するのに比べ、α−アミラーゼ活性は後述する市販の測定装置を使用すれば数分程度で測定できるため、短時間で測定結果を得ることができる。
【0030】
3.分子時計表
図1は、α−アミラーゼ活性の経時的変化を示す図である。図は、1日間、所定の時刻ごとに、上述の方法によって口腔粘膜上皮細胞内のα−アミラーゼ活性を測定し、活性値をプロットして得られた活性変動曲線の一例を表している。図中、横軸は時刻、縦軸は活性値を示す。本図では、一例として、0:00が最小値活性値(l)、12:00が最大活性値(h)として測定された場合を示した。
【0031】
活性変動曲線は、各時刻に測定された活性値のプロットから視察によって求めることがきる。また、より正確な曲線を求めるためには、自己相関法(コレログラム)、パワースペクトル法、コサイナー法、ペリオドグラム法などの周期計算法を用いることもできる。
【0032】
図のように、α−アミラーゼの活性値は日内変動し、概日リズムを示す。従って、α−アミラーゼ活性値の経時的変化に基づいて、被験個体の生体リズムに関する情報を得ることが可能であり、α−アミラーゼの活性変動曲線を「分子時計表」として利用することにより、被験個体の生体リズムの推定を行なうことができる。
【0033】
すなわち、例えば、図1の活性変動曲線(以下、「分子時計表」と同義に用いる)を有することが分かっている被験個体について、所定時刻に測定された活性値がhであったとする。この場合、図1の活性変動曲線(分子時計表)に基づけば、被験個体の概日リズム(内的時間)は12:00にあると推定できる。また、活性値がlである場合、被験個体の概日リズム(内的時間)は0:00であり、活性値がmである場合には、6:00又は18:00であると推定することができる。
【0034】
また、同一の被験個体について、例えば3時間間隔で2回測定された活性値がそれぞれp,qであったとする。このとき、pに比べqが高い(p<q)場合には、被験個体の概日リズム(内的時間)は、活性の上昇局面である午前(0:00〜12:00)にあると推定できる。逆に、pに比べqが低い(q<p)場合には、午後(12:00〜24:00)にあると推定できる。さらに、p及びqの変動率(q/p)を求め、活性変動曲線の接線の傾きと照合することで、概日リズムにおける内的時間をより正確に推定することが可能である。
【0035】
4.生体リズムのずれの検出
以下、この活性変動曲線の変化によって、被験個体の生体リズムのずれを検出する方法について説明する。
【0036】
活性変動曲線は、その最大値(又は最小値)、最大値(又は最小値)の観察時刻、最大値から最小値(又は最小値から最大値)への傾き等によって形状を特徴付けることができる。本発明では、この活性変動曲線の形状を「位相」というものとする。また、活性変動曲線(分子時計表)により特定される被験個体の概日リズムの形状についても「位相」という。
【0037】
具体的には、図1に示した活性変動曲線(分子時計表)では、最小値l、最大値h、最小値の観察時刻(外的時間)0:00、最大値の観察時刻12:00によって特徴付けられる形状、すなわち「位相」を有している。
【0038】
(4-1)二相性リズムの検出による方法
まず、分子時計表を用いて、活性変動曲線が一日の間に示す活性極大値の数に基づき、生体リズムのずれを検出する方法について説明する。
【0039】
既に説明したように、生体リズムにおける「内的時間」と「外的時間」との間に生じるずれは、「内的脱同調」とみなされる。そして、この内的脱同調が生じると、体温や血圧等の日内変動に二相性のリズムが観察されることが分かっている。従って、この二相性のリズムを検出することによって、内的脱同調、すなわち生体リズムのずれ、を検出することが可能となる。
【0040】
本発明者らは、実施例において詳述するように、体温や血圧等と同様に、α−アミラーゼ活性の日内変動においても、内的脱同調の指標となり得る多相性のリズムが検出できることを見出した。
【0041】
図2は、典型的な二相性リズムを示すα−アミラーゼの活性変動曲線の位相を示す図である。図は、図1に示した活性変動曲線を有する被験個体において、内的脱同調が生じた場合の活性変動曲線の一例を表している。
【0042】
図1において、被験個体の位相は、一つの極大値(最大値)hと、その観察時刻(外的時間)12:00によって特徴付けられていた。これに対して、図2における被検個体の位相は、2つの極大値h1とh2が出現している。すなわち、図2に示した活性変動曲線は、一日の間に、12:00の極大値h1、18:00の極大値h2の2つの活性極大値を伴う二相性リズムとして観察されている。
【0043】
このような複数の活性極大値は、各臓器の体内時計の外的時間への同調速度が異なることによって、個体全体の生体リズムが一時的に脱同調することによって出現するものと考えられる。
【0044】
従って、分子時計表を用いて、活性変動曲線が一日の間に示す活性極大値の数が2以上であるか否かに基づいて、生体リズムのずれとその程度を検出することが可能である。なお、活性極大値の数は2つに限られず、活性極大値を3以上伴う多相性リズムが観察される場合もある。
【0045】
ここで、図2に示した12:00の極大値h1の観察時刻(外的時間)12:00は、図1に示した当初の活性変動曲線における最大値hの観察時刻と原則的に一致する。被験個体の生体リズムに内的脱同調が生じると、この最大値hの観察時刻12:00とは異なる時刻(図2では18:00)に新たな極大値h2が観察される。そして、活性極大値の観察時刻(上記の例では12:00と18:00)の間隔が長いほど、内的脱同調の程度が大きいとみなすことができる。
【0046】
さらに、極大値h1及び極大値h2の大きさは、被験個体に生じた内的脱同調の程度に依存して変化する。これらの大きさは、被験個体に生じた内的脱同調が次第に修正され、個体全体の生体リズムが徐々に同調していくにつれ、次第に大きさが変化する。すなわち、例えば、生体リズムが内的脱同調前のリズムに回復していく際には、観察時刻18:00に出現した極大値h2は徐々に消失する。
【0047】
また、生体リズムが内的脱同調後のリズムに同調していく場合には、逆に、観察時刻12:00の元々の極大値h1が徐々に消失し、18:00の極大値h2が次第に大きくなる。
【0048】
従って、図2に示した活性変動曲線における極大値h2の大きさ、より好適には極大値h1と極大値h2との振幅比(h2/h1)、に基づけは、生体リズムのずれの程度を知ることができる。この場合、振幅比(h2/h1)が1に近く、極大値h1と極大値h2がほぼ等しい場合が最も内的脱同調の程度が大きいものと判断される。
【0049】
このように、分子時計表を用い、活性変動曲線が一日の間に示す二以上の活性極大値の観察時刻の間隔や、その大きさ及び振幅比に基づいて、生体リズムのずれの程度や、ずれからの回復具合を判定することが可能である。活性変動曲線が3以上の極大値を有する多相性リズムとして観察された場合には、それぞれの極大値の大きさや振幅比に基づいて判定を行うことができる。
【0050】
(4-2)複数回作成した分子時計表の照合による方法
次に、被験個体について複数回作製した分子時計表を照合することにより、生体リズムのずれを検出する方法について説明する。
【0051】
図3は、活性変動曲線の位相の変化を示す図である。図3(A)中、点線で示す活性変動曲線は図1に示した曲線であり(以下、「分子時計表1」ともいう)、実線は同一被験個体について、異なる測定日に図1と同様の測定を行って得た活性変動曲線(以下、「分子時計表2」ともいう)の一例を表している。図中、横軸は時刻、縦軸はα−アミラーゼ活性値を示す。
【0052】
分子時計表1は、最小値(l)の観察時刻(外的時間)を0:00、最大値(l)の観察時刻を12:00とする位相を有しているのに対して、分子時計表2では、最小値(l)の観察時刻が6:00、最大値(l)の観察時刻が18:00となり、位相が変化している。
【0053】
これは、分子時計表1の作製時点と分子時計表2の作製時点とで、被験個体の活性変動曲線の位相にずれが生じたとみることができる。具体的には、分子時計表2の作製時点における被験個体の生体リズム(内的時間)は、分子時計表1の作製時点から6時間遅れた(又は18時間進んだ)ことになる。
【0054】
このように、同一被験個体について複数回分子時計表を作製し、これらを互いに照合することによって、被験個体の生体リズムの位相のずれを検出することができる。
【0055】
(4-3)所定時刻の活性値を分子時計表と照合する方法
続いて、所定時刻における生理活性物質の活性値を、分子時刻表と照合することにより、生体リズムのずれを検出する方法について説明する。
【0056】
図3(B)は、図3(A)において、分子時計表1(図1も参照)を点線から実線に、分子時計表2を実線から点線に換えて示した図である。
【0057】
先に説明したように、図1の活性変動曲線(分子時計表)を有することが分かっている被験個体について、所定時刻に測定された活性値がmであった場合、分子時計表1に基づいて、被験個体の概日リズム(内的時間)は6:00又は18:00と推定できる。
【0058】
ここで、同一被験個体について、異なる測定日の6:00(外的時間)に測定を行って得た活性値がmからlに変化していたと仮定する(図3(B)中、丸印参照)。この場合、被験個体の概日リズム(内的時間)は6時間遅れて(又は18時間進んで)、分子時計表2で示される概日リズムに変化したと推定することができる。
【0059】
このように、所定時刻における活性値を、予め作製した分時計表と照合することよって、より簡便に被験個体の生体リズムの位相のずれを検出することも可能である。
【0060】
以上の通り、本発明に係る方法によれば、α−アミラーゼの活性値の経時的変化を示す活性変動曲線を分子時刻表として利用することで、各被験個体に固有の生体リズムを推定し、生体リズムの位相のずれを検出することが可能である。
【0061】
実施例では、口内粘膜上皮細胞内のα-アミラーゼ活性の具体的な測定データを示し、α-アミラーゼ活性値が概日リズムを示すこと、及びこの概日リズムが起床時刻によって影響を受けて位相にずれを生じ得ることについて説明する。
【実施例】
【0062】
(実施例1)
<α−アミラーゼの同定>
実施例1では、口腔粘膜上皮細胞内において概日リズムを示すタンパク質の同定を行なった。
【0063】
成人男性(32歳)から口腔粘膜上皮細胞を採取した。採取は、10:00,13:00,16:00,19:00,22:00,1:00,4:00,7:00の8回行い、市販の口腔粘膜上皮採取用ブラシ(Medical Packaging Corporation:CYB-1)を使用して行なった。口腔粘膜上皮細胞の採取後、チューブ内に満たしたPBSでブラシを洗浄し、PBS中に細胞を回収した。この細胞懸濁液を遠心分離(3,000rpm,30sec)し、分離した口腔粘膜上皮細胞をタンパク質抽出用バッファー(PIERCE Biotechnology社:RIPA Buffer)で溶解し、再度遠心分離(3,000rp
m,30sec)を行なってタンパク質抽出液を調製した。
【0064】
得られたタンパク質抽出液について、定法に従ってポリアクリルアミドゲル電気泳動(SDS-PAGE)を行った。図4は、電気泳動後のアクリルアミドゲルを、クマシー(CBB)染色して得られたタンパク質の染色像である。図中、レーン1及び14は分子量マーカーである(図中左に分子量を示す)。レーン2−13は、上記の各時刻において採取した口腔粘膜上皮細胞から抽出したタンパク質である。図中、矢印で示す約50kDaのタンパク質(以下、「目的タンパク質」という)に関して発現量の日内変動が認められる。
【0065】
図5は、目的タンパク質の各時刻における発現量を示す図である。発現量は、図4に示した染色像において目的タンパク質のバンドをデンシトメトリーにより定量し、各サンプルにおける総タンパク質量で標準化を行なった値を、1:00を1とした相対値で示した(10:00,13:00,16:00,19:00:n=6,22:00,1:00,4:00,7:00:n=3)。
【0066】
続いて、目的タンパク質について、ペプチド・マス・フィンガープント解析によるタンパク質同定を行なった。目的タンパク質のバンドをアクリルアミドゲルから切り出し、トリプシンによるIn-Gel消化を行なった後、ゲルからペプチド断片を抽出した。得られたペプチド断片を、質量分析計(TOF-MS:Applied Biosystems:oMALDI-Qq-TOF MS/MS QSTAR Pulsar i)によって解析し、MASCOT(Matrix Science)を用いて、NCBInr(Taxonomy human)と照合することにより、タンパク質を同定した。結果、目的タンパク質はα-アミラーゼ
と同定された。
【0067】
以上、実施例1の結果から、口腔粘膜上皮細胞内において概日リズムを示すタンパク質として、α-アミラーゼが同定できた。
【0068】
(実施例2)
<口腔粘膜上皮細胞におけるα-アミラーゼの発現確認>
実施例2では、口腔粘膜上皮細胞でα-アミラーゼが発現していることを確認するための実験を行なった。
【0069】
実施例1と同様の方法で分離した口腔粘膜上皮細胞から、市販のTotal RNA抽出精製キット(AgilentTechnologies)を用いてRNAを抽出し、定法に従ってRT-PCRを行なった。使用したプライマーの配列を、「表1」に示す。
【0070】
【表1】

【0071】
図6は、RT-PCRにより増幅されたDNA断片の泳動像(染色像)を示す図である。図中、レーン1はDNAサイズマーカーである。レーン2はネガティブコントロール)、レーン3は口腔粘膜上皮細胞である。
【0072】
図に示すように、レーン3において、約150bpsのDNA断片(図中矢印)の増幅が確認され、口腔粘膜上皮細胞にα-アミラーゼmRNAが発現していることが確認された。
【0073】
次に、タンパク質レベルでのα-アミラーゼの発現を確認するため、以下の実験を行なった。
【0074】
実施例1と同様の方法で、口腔粘膜上皮細胞の採取後、ブラシをチューブ内に満たしたPBSで洗浄し、細胞懸濁液を得た。この細胞懸濁液について、α-アミラーゼの活性値を測定した。測定は、Salivary α-Amylase Assay Kit (Salmetrics社)を用いて行なった。
【0075】
図7は、α-アミラーゼの活性値を示す図である。図中、「PBS」は上記の細胞懸濁液で測定された活性値(約20U/ml)を示す。この細胞懸濁液では、口腔粘膜上皮細胞は溶解されていないため、測定される活性値は、口腔粘膜上皮細胞の採取時にブラシに付着して混入した唾液中に含まれるα-アミラーゼに由来するものと考えられる。なお、図中、「Saliva」は、PBSで20倍に希釈した唾液のα-アミラーゼ活性を示している。
【0076】
図中、「PBS+TritonX100」及び「PBS+Sonic」は、上記の細胞懸濁液中の口腔粘膜上皮細胞を溶解した場合に測定された活性値を示す。「PBS+TritonX100」では、細胞懸濁液に界面活性剤(TritonX100)を加えて細胞を溶解させた。また、「PBS+Sonic」では、細胞懸濁液を超音波処理することによって細胞を溶解させた。
【0077】
「PBS+TritonX100」及び「PBS+Sonic」で測定された活性値は、それぞれ約50U/ml,65U/mlであり、口腔粘膜上皮細胞を溶解しない場合(「PBS」参照)に測定された活性値よりも高かった。
【0078】
このことは、「PBS+TritonX100」及び「PBS+Sonic」では、細胞を溶解したことで、混入した唾液中に含まれるα-アミラーゼに加え、口腔粘膜上皮細胞内から溶出されたα-アミラーゼの活性が測定されたことを示唆するものであり、口腔粘膜上皮細胞内にα-アミラーゼタンパク質が発現していることを示している。
【0079】
以上、実施例2の結果から、口腔粘膜上皮細胞内において、α-アミラーゼがmRNAレベル及びタンパク質レベルで発現していることが確認された。
【0080】
(実施例3)
<α-アミラーゼ活性の概日リズムの検討>
実施例3では、口腔粘膜上皮細胞内のα-アミラーゼについて、活性値の日内変動を検索し、α-アミラーゼ活性の概日リズムについて検討を行った。
【0081】
(1)8:00起床の被験者A(男性,32歳)を対象に、1:00, 4:00, 7:00, 10:00, 13:00, 16:00, 19:00, 22:00において口内粘膜上皮細胞の採取を行い、500μLのPBSに懸濁した。
(2)遠心分離(3000rpm, 30sec)により細胞を沈殿させ、上清のPBSを廃棄した。分離した細胞は、次の工程まで凍結下で保存した。
(3)細胞に、100mM Na-PO4(pH6.0), 100mM NaCl, 0.1% Triton X-100を30μL加え、細胞を溶解した。再度遠心分離(3000rpm, 30sec)を行い、得られた上清をタンパク抽出液
とした。
(4)タンパク抽出液のタンパク質濃度をBCA Protein Assay Kit (PIERCE Biotechnology社)を用いて測定し、各時刻のサンプルのタンパク質濃度を1mg/mLに揃えた。
(5)タンパク質濃度調整後のタンパク抽出液25μLを、ニプロ社ココロメーター用チップに滴下し、ココロメーターを用いてα-アミラーゼ活性を測定した。
なお、被験者Aは、1:00の口腔粘膜上皮細胞の採取後に就寝し、4:00,7:00の測定の際には、口腔粘膜上皮細胞の採取のため一端起床した後、次の採取時刻まで再度睡眠をとった。
【0082】
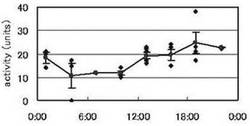
結果を図8に示す。図中、横軸は時刻、縦軸はα-アミラーゼの活性値を示す。
【0083】
起床(8:00)後、最初の測定である9:00には、α-アミラーゼ活性値は約12U/mlであった。13:00,16:00では約20U/ml に上昇し、19:00に最大値約25U/mlを示した。その後、22:00,1:00ではそれぞれ約22U/ml,約19U/ml に減少し、4:00,7:00では、9:00の時点と同程度(約12U/ml)で推移した。
【0084】
このことから、α-アミラーゼ活性値が日内変動を示し、この日内変動が起床時刻前後を最小値とし、夕刻19:00を最大値とする概日リズムを示すことが明らかとなった。
【0085】
図9には、比較のため、唾液中のα-アミラーゼの活性値を測定した結果を示す。図中、横軸は時刻、縦軸はα-アミラーゼの活性値を示す。
【0086】
図8に示した口腔粘膜上皮細胞内のα-アミラーゼと異なり、唾液中のα-アミラーゼの活性値には概日リズムがみられていない。これは、唾液腺から分泌されるα-アミラーゼ量は、ストレスに鋭敏に反応することが知られており(先に挙げた特許文献3〜5参照)、測定の際のストレスによってα-アミラーゼ量が変動したことが要因の1つと考えられた。
【0087】
(実施例4)
<α-アミラーゼ活性の概日リズムの検討2>
実施例4では、実施例3と同一の被験者Aを対象に、起床時刻を8:00から6:00に変更し、口腔粘膜上皮細胞内のα-アミラーゼ活性の概日リズムについて検討を行った。なお、就寝時刻は0:00の口腔粘膜上皮細胞採取の後である。
(1)6:00起床の被験者A(男性,32歳)を対象に、0:00, 3:00, 6:00, 9:00, 12:00, 15:00, 18:00, 21:00において口内粘膜上皮細胞の採取を行い、500μLのPBSに懸濁した。
(2)遠心分離(3000rpm, 30sec)により細胞を沈殿させ、上清のPBSを廃棄した。同様の操作を再度行なった。分離した細胞は、次の工程まで凍結下で保存した。
(3)細胞に、20mM Tris-Cl(pH 7.0), 150mM NaCl, 1% Sucrose Monolaurateを30μL加え、細胞を溶解した。再度遠心分離(3000rpm, 30sec)を行い、得られた上清をタンパク質抽出液とした。
(4)吸光度(280nm)により、タンパク質抽出液のタンパク質濃度を測定した。
(5)Salivary α-Amylase Assay Kit (Salmetrics社)を用いて、タンパク抽出液のα-アミラーゼ活性を測定した。手順は、キット添付のプロトコールに従った。
【0088】
結果を図10に示す。図中、横軸は時刻、縦軸は活性値を示す。なお、活性値は、上記(5)で測定された活性値を、(4)で算出したタンパク質量で標準化して示した。
【0089】
起床時刻を6:00に変更した場合、α-アミラーゼ活性の概日リズムは、15:00に最大値(約3.5U/mg)を示し、8:00起床の場合(図8参照)に比べて、最大値が測定された時刻が4時間早くなった。これは、起床時刻を変更したことによって、被験者の生体リズムにずれが生じたことを示唆している。
【0090】
以上、実施例3及び4の結果から、口内粘膜上皮細胞内のα-アミラーゼ活性が概日リズムを示し、さらにこの概日リズムが起床時刻の影響を受けて変化し得ることが示された。
【0091】
(実施例5)
実施例5では、4人の被験者を対象に、以下のスケジュールに従って、生体リズム(睡眠覚醒リズム)を後方に10時間シフトさせ、人為的な内的脱同調(時差ぼけ)状態を生じさせた。
【0092】
(1)第1日目:17:30から4時間おきに口腔粘膜上皮細胞を回収した。就寝時刻23:30。採材開始時刻17:30から、以降4時間おきに口腔粘膜上皮細胞の採取を行った。
(2)第2日目:起床時刻7:30。起床後は、翌日第3日目9:30まで睡眠をとらず、睡眠覚醒リズムをシフトさせた。起床時刻前、1:30, 5:30のサンプリングは一時的に起床して行った。以下、睡眠時間帯にあたるサンプリングについては、同様に一時的に起床して行った。
(3)第3日目:就寝時刻9:30。起床時刻17:30。
(4)第4日目〜第8日目:就寝時刻9:30、起床時刻17:30の睡眠覚醒リズムを維持し続けた。
(5)実施例4と同様にして、採取した口腔粘膜上皮細胞内のα-アミラーゼ活性を測定した。
【0093】
結果を図11に示す。図中、横軸は時刻、縦軸はα-アミラーゼの活性値を示す。図中、上段には、各日の睡眠時間帯を黒塗りで、起床時間帯を白塗りで表すことにより、実験スケジュールを示した。
【0094】
睡眠覚醒リズムをシフトさせる前である第2日目と第3日目の就寝時刻(9:30)前では、9:30にα-アミラーゼ活性の極大値が測定されている(図中、符号「p1」参照)。このとき、α-アミラーゼ活性の概日リズムは一相性となっている。
【0095】
その後、睡眠覚醒リズムをシフトさせた後の第4日目以降では、21:30に新たな活性極大値の出現が確認される(符号「p2」参照)。α-アミラーゼ活性の概日リズムは、二相性のリズムに変化している。
【0096】
この結果は、α-アミラーゼ活性の概日リズムが示す多相性のリズムを検出することで、睡眠覚醒リズムのシフトにより被験者に生じた内的脱同調(時差ぼけ)を検出し得ることを示している。
【0097】
図12は、睡眠覚醒リズムのシフト後に二相性の極大値が観察された時刻である9:30と21:30の時点における、第2日目から第7日目までのα-アミラーゼ活性値を示す図である。
【0098】
睡眠覚醒リズムをシフトさせる前である第2日目においては、9:30の時点におけるα-アミラーゼ活性値は、21:30の時点における活性値に比べて十分に大きい。
【0099】
これに対して、睡眠覚醒リズムをシフトさせた第4日目以降では、9:30の時点におけるα-アミラーゼ活性値が徐々に低下し、逆に、21:30の時点における活性値が次第に上昇している。これは、睡眠覚醒リズムのシフトによって被験者に生じた内的脱同調が徐々に回復し、被験者の生体リズムがシフト後の就寝時刻9:30、起床時刻17:30の睡眠覚醒リズムに次第に同調してきていることを示すものである。
【0100】
従って、この結果から、9:30と21:30に観察される二相性の活性極大値の大きさ又は振幅比に基づけば、被験者の内的脱同調、すなわち生体リズムのずれの程度や、ずれからの回復具合を判定できることが明らかになった。
【産業上の利用可能性】
【0101】
本発明に係る方法によれば、α−アミラーゼの活性値の経時的変化を示す活性変動曲線を分子時刻表として利用することで、各被験個体に固有の生体リズムを簡便かつ低侵襲に推定することができる。従って、各個人が自身に固有の生体リズムを知り、最適な投薬時刻や活動時刻、摂食時刻を設定することが可能となり、時間医療の実現や、自己能力の発揮、ダイエットに役立てることができる。
【0102】
さらに、本発明に係る方法により、生体リズムのずれを検出すれば、生体リズムのずれを原因とする種々の疾患の予防や、時差ぼけなどの体調不良の改善に役立てることができる。
【図面の簡単な説明】
【0103】
【図1】α−アミラーゼ活性の経時的変化の一例を示す図である。
【図2】典型的な二相性リズムを示すα−アミラーゼの活性変動曲線の位相を示す図である。
【図3】α−アミラーゼの活性変動曲線の位相の変化を示す図である。
【図4】口腔粘膜上皮細胞から抽出したタンパク質の染色像である。
【図5】目的タンパク質の各時刻における発現量を示す図である。
【図6】α−アミラーゼのRT-PCRの結果を示す図である。
【図7】口腔粘膜上皮の細胞懸濁液及び細胞溶解液のα-アミラーゼ活性を示す図である。
【図8】実施例3におけるα-アミラーゼ活性の測定結果(8:00起床)を示す図である。
【図9】唾液中のα-アミラーゼ活性を示す図である。
【図10】実施例4におけるα-アミラーゼ活性の測定結果(6:00起床)を示す図である。
【図11】実施例5におけるα-アミラーゼ活性の測定結果(内的脱同調状態)を示す図である。
【図12】第2日目から第7日目までの9:30と21:30の時点におけるα-アミラーゼ活性値を示す図である。
【特許請求の範囲】
【請求項1】
生物個体の口腔粘膜上皮細胞から抽出した生理活性物質の活性値の経時的変化に基づいて、前記生物個体の生体リズムに関わる情報を取得する方法。
【請求項2】
前記生理活性物質は、α−アミラーゼである請求項1記載の方法。
【請求項3】
前記活性値の経時的変化を示す活性変動曲線を、前記生体リズムを推定するための分子時刻表として利用する請求項1又は2記載の方法。
【請求項4】
前記分子時計表において、前記活性変動曲線が一日の間に示す活性極大値の数に基づいて、前記生体リズムのずれを検出する請求項3記載の方法。
【請求項5】
前記生物個体について複数回作製した前記分子時計表を照合することにより、該生物個体の生体リズムのずれを検出する請求項3記載の方法。
【請求項6】
所定時刻における前記生理活性物質の活性値を、前記分子時刻表と照合することにより、前記生物個体の生体リズムのずれを検出する請求項3記載の方法。
【請求項1】
生物個体の口腔粘膜上皮細胞から抽出した生理活性物質の活性値の経時的変化に基づいて、前記生物個体の生体リズムに関わる情報を取得する方法。
【請求項2】
前記生理活性物質は、α−アミラーゼである請求項1記載の方法。
【請求項3】
前記活性値の経時的変化を示す活性変動曲線を、前記生体リズムを推定するための分子時刻表として利用する請求項1又は2記載の方法。
【請求項4】
前記分子時計表において、前記活性変動曲線が一日の間に示す活性極大値の数に基づいて、前記生体リズムのずれを検出する請求項3記載の方法。
【請求項5】
前記生物個体について複数回作製した前記分子時計表を照合することにより、該生物個体の生体リズムのずれを検出する請求項3記載の方法。
【請求項6】
所定時刻における前記生理活性物質の活性値を、前記分子時刻表と照合することにより、前記生物個体の生体リズムのずれを検出する請求項3記載の方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【公開番号】特開2009−34100(P2009−34100A)
【公開日】平成21年2月19日(2009.2.19)
【国際特許分類】
【出願番号】特願2008−173267(P2008−173267)
【出願日】平成20年7月2日(2008.7.2)
【出願人】(000002185)ソニー株式会社 (34,172)
【Fターム(参考)】
【公開日】平成21年2月19日(2009.2.19)
【国際特許分類】
【出願日】平成20年7月2日(2008.7.2)
【出願人】(000002185)ソニー株式会社 (34,172)
【Fターム(参考)】
[ Back to top ]

