生体人工角膜および作製方法
【課題】本発明は、高い生体適合性、安定性を有し、分解かつ吸収可能で、さらに角膜再生を誘導可能な安全で信頼性のある生体人工角膜を提供するとともに、そのような人工角膜の作製方法を提供することを目的としている。
【解決手段】このため、人体への移植用人工角膜は、基質を有する天然の動物の角膜を提供するステップと、該基質を架橋かつ固定するステップと、該基質由来の抗原を最小化するステップと、該基質に活性層をカップリングするステップと、を含む方法によって作製される。
【解決手段】このため、人体への移植用人工角膜は、基質を有する天然の動物の角膜を提供するステップと、該基質を架橋かつ固定するステップと、該基質由来の抗原を最小化するステップと、該基質に活性層をカップリングするステップと、を含む方法によって作製される。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、ヒトの移植のための医療用人工器官に関し、より詳細には、損傷した角膜を再建するためのデバイスに関する。
【背景技術】
【0002】
角膜の損傷または病変による視力の損失は、最もよく起こる眼科疾患であり、現在、治療法は死体から臓器提供された角膜の移植に依存している。
【発明の開示】
【発明が解決しようとする課題】
【0003】
しかしながら、角膜の移植には臓器移植元の確保などの難しさがあるだけでなく、免疫性の拒絶により移植が失敗する場合が多々ある。
そのため、科学者等はヒトの角膜疾患の治療に動物の角膜の使用を試みており、それには動物の角膜を直接移植することを実現する研究が含まれている。
しかしながら、そのように動物の角膜を直接移植することは、免疫性拒絶のために失敗した。
さらに、低温凍結と単純な殺菌処理により動物の角膜から人工角膜を作製する研究もまた、抗原が完全に排除されず、組織適合性が乏しいため患者の身体が移植片を受け入れられず失敗した。
したがって、未だに動物の角膜から採取可能な有効な人工角膜が必要である。
【0004】
本発明の目的は、高い生体適合性、安定性を有し、分解かつ吸収可能で、さらに角膜再生を誘導可能な安全で信頼性のある生体人工角膜を提供することである。
【0005】
本発明の他の目的は、そのような人工角膜の作製方法を提供することである。
【課題を解決するための手段】
【0006】
本発明の目的を達成するために、本発明は人体へ移植するための人工角膜を提供するものであり、該人工角膜は、基質を有する天然の動物の角膜を提供するステップと、該基質を架橋かつ固定するステップと、該基質由来の抗原を最小化するステップと、該基質に活性層をカップリングするステップと、を含んでなる方法によって作製される。
【発明の効果】
【0007】
この発明は、上記の記載によって、高い生体適合性、安定性を有し、分解かつ吸収可能で、さらに角膜再生を誘導可能な安全で信頼性のある生体人工角膜を提供することができる。
また、そのような人工角膜の作製方法を提供することができる。
【発明を実施するための最良の形態】
【0008】
以下図面に基づいてこの発明の実施例を詳細に説明する。
【実施例】
【0009】
以下の詳細な説明は、本発明を実施する現時点で意図される最良の形態に関するものである。
この説明は限定することを意図するものではなく、単に本発明の実施態様の概括的な原理を例示することを目的とするものである。
本発明の範囲は、添付の特許請求の範囲によって最大限に定義されるものである。
【0010】
本発明は、固定剤で架橋かつ固定し、抗原を最小化するよう処理し、次いで活性層を含有する表層で被覆した、動物の角膜から作製した基質を有する生体人工角膜を提供する。
【0011】
動物の角膜は微生物によって簡単に劣化あるいは分解するため、固定剤でカップリングして固定することが必要である。
通常、グルタルアルデヒドが固定剤として利用されるが、グルタルアルデヒドは毒性のラジカルを生成する。
アルデヒドはアセタール反応によってタンパク質とカップリングして、そのカップリングした生成物が劣化すると毒性のアルデヒドが放出されるため、アルデヒドで固定した製品は長期間残存する毒性を有する。アルデヒド系固定剤に代わる固定剤としてエポキシド、ジアミド、ジイソシアナートまたはカルボジアミドを利用すると、この毒性問題を排除することさえできる。
例えば、エポキシドをアルデヒド型の固定剤に代えて用いると、エポキシドが不安定なため開環、架橋反応が容易に起こるが、反応条件を制御することにより非常に安定で簡単には分解しない架橋生成物を生成することができる。
分解においてカリクレイン、フィブリノリジンおよびグルココルチコイドホルモンが分泌されてコラゲナーゼを助けることによって組織の成長と再生が開始して架橋生成物が滅ぶときにのみポリアルデヒドとアミノ酸とにゆっくりと分解し、吸収される。
そのような種類の受動的な分解および組織再生は同期的に起こるものであり、組織再生による修復に有益であると同時にアルデヒドの残存毒性を有さない。最新の免疫学的理論によれば、動物組織の抗原性は主として特定部位に局在化した特定の配座にある活性基由来であり、これら活性基には−OH、−NH2 、−SHなどが含まれる。
特定の配座は、らせん状タンパク質鎖で形成された特定の水素結合のいくつかにより得られる。
特定の部位と配座は、抗原決定因子と呼ばれる。これら基と容易に反応する一つまたはより多くの活性試薬(例えば、酸無水物、塩化アシル、アミド、エポキシドなど)は、動物の角膜を処理する際にこれら基と結合してこれらを遮断するのに用いられるため、抗原を効果的に除去することができる。
同時に、強力な水素結合を有する試薬(例えば、グアニジン化合物)は、特定の配置を与える水素結合を置換するのに用いられるため、その配置は変化して抗原性が効果的に取り除かれる。
【0012】
方法
【0013】
本発明による生体人工角膜の作製方法は、以下のステップを含んでなり、天然の動物の角膜を基質として用いる。
(1)材料の選択:新鮮な動物の眼球を採取する。角膜の材料は好ましくは透明である。
(2)前処理:動物の角膜を切り出してきれいにトリミングする。
角膜を保存溶液中に配置して−18〜4℃で24〜28時間冷凍し、次いで角膜を取り出して解凍後、界面活性剤溶液中に16〜20時間浸漬するか、あるいはパンクリン(pankrin)溶液に2〜4時間浸漬した後に洗浄する。
必要に応じて10〜20分間超音波で洗浄する。
(3)固定:基質中のコラーゲン分子を以下でより詳細に説明する非アルデヒド固定剤を用いて架橋して固定する。
(4)抗原の最小化:活性試薬を用いて−OHまたは−NH2 または−SHなどの基質のタンパク質中の特定の活性基を遮断し、基質中のタンパク質分子のらせん鎖中の特定の水素結合を、強力な水素結合を有する試薬を用いて置換し、その特定の配置を変性する。
(5)活性層のカップリング:増殖因子に接着可能な特定のポリペプチドまたはグルコサミノグリカンを含有する活性層を、カップリング剤を用いて表層上に組み込む。
【0014】
界面活性剤
【0015】
上記方法のステップ2の界面活性剤は、Triton(商標)X−100、コール酸ナトリウム、ヒドロキシメチルアミノメタン(Tris)、ドデシル硫酸ナトリウム(SDS)またはCHAPSであってよい。
パンクリン(pankrin)は、ペプシン、トリプシンまたはそれら2種の酵素の混合物であってよい。
【0016】
保存溶液
【0017】
上記方法のステップ2における保存溶液は、人工の涙溶液、生理食塩水溶液、グリセリンまたはグリセリンと人工涙の混合溶液であってよい。
【0018】
固定
【0019】
上記方法のステップ3において適用される固定剤は、タンパク質分子と容易に架橋する試薬であってよく、エポキシド、ジアシルジアミド、ジイソシアナート、ポリエチレングリコールまたはカルボジイミドから選択される1つまたは2つの試薬であってよい。
この固定剤は、炭化水素のバックボーンを有するエポキシ化合物であってよく、このバックボーンは水溶性であり、かつそのバックボーン中にエーテルあるいはエステル結合を含まないものである。
この固定剤は、米国特許第6,106,555号公報に開示されているものであり、その全開示がその全てが記載されているものとして、参照として本明細書に組み入れられる。
例にはエポキシド、ジアミド、ジイソシアナート、ポリエチレングリコールまたはカルボジイミドが包まれ、ここでエポキシドは単環式エポキシドまたは二環式エポキシドであるか、あるいは低級ポリ(エポキシド)(低級ポリ(エチレンオキシド)、ポリ(プロピレンオキシド)またはグリシジルエーテルなど)であってよい。
【0020】
エポキシドは単環式エポキシドである、
【化1】

または、二環式エポキシドである、
【化2】

であってよく、また、ポリプロピレンオキシドなどの低級ポリエポキシドであってよい。
【0021】
活性剤
【0022】
上記方法のステップ4における活性剤は、低分子量の無水有機酸、塩化アシル、アシルアミド、または単環式酸化物またはエポキシドであり、強力な水素結合力を有する試薬はグアニジン化合物であってよい。
【0023】
活性層
【0024】
上記方法の5における活性層は、ポリペプチドまたはグリコサミノグリカンなどの活性成分であってよい。
ポリペプチドの一例は、16リジン(K16)、グリシン(G)、アルギニン(R)、アスパラギン酸(D)、セリン(S)、プロリン(P)およびシステイン(C)の縮合から得られるポリペプチドであり、該組成物の配列はK16−G−R−G−D−S−P−Cである。
グリコサミノグリカンは、ヒアルロン酸、コンドロイチン硫酸、デルマタン硫酸、ヘパリン、アセチルヘパリン硫酸またはケラチン硫酸である。
これらポリペプチドまたはグリコサミノグリカンは、広範囲の接着性を呈し、増殖因子の活性効果を高め、あるいは未分化細胞を活性化して適応した分化をさせるため、器官組織の再生修復を誘導する機能を果たすことができる。
接着かつ蓄積可能な血管の増殖因子の例には、血管内皮増殖因子(VEGF)、繊維芽細胞増殖因子(FGF)、血小板由来増殖因子(PDGF−bb)および血管透過性因子(VPF)が包含される。
【0025】
活性層のカップリング剤
【0026】
上記方法のステップ5においてポリペプチドまたはグリコサミノグリカンをカップリングするのに用いられるカップリング剤は、ジアシルジアミド、無水二酸、ジエポキシまたは−NH2 、−OHおよび−COOHと縮合可能なその他の二官能試薬であってよい。
【0027】
本発明は以下の利点を提供する。
人工角膜の組成および三次元構造は、ヒトの角膜のそれと非常に類似している一方で免疫性を有さない。
該人工角膜は、角膜の再生を誘導しかつ促進することができると同時に、角膜の再生に伴って分解し、その分解速度は架橋条件を制御することによって角膜再生速度に一致するよう調整することができる。
人工角膜の物理的および機械的特性は、ヒトの角膜のそれと近く、安定した形態学および良好な可撓性を有する一方、該角膜は様々な曲率で仕上げることができ、さらに、水中で膨張することがないため、角膜を再建するための理想的な基質または支持体とすることができる。
【0028】
実施例1
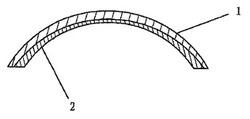
図1と図2を参照すると、生体人工角膜は非アルデヒド固定剤で架橋かつ固定し、抗原を最小化することによって動物の角膜から調製した基質1を含む。
活性表面層2を、増殖因子に接着可能なポリペプチドまたはグリコサミノグリカンからなる活性成分を基質1の内面(眼球面)にカップリングすることによって形成する。
ポリペプチドの一例は、16リジン(K16)、グリシン(G)、アルギニン(R)、アスパラギン酸(D)、セリン(S)、プロリン(P)およびシステイン(C)の縮合から得られるポリペプチドであり、該組成物の配列はK16−G−R−G−D−S−P−Cであり、また、該グリコサミノグリカンは、ヒアルロン酸、コンドロイチン硫酸、デルマタン硫酸、ヘパリン、アセチルヘパリン硫酸またはケラチン硫酸である。
この生体人工角膜は以下のステップによって作製することができる。
【0029】
材料の選択:新鮮な動物の眼球を健康なブタから採取し、輸送前に特別な保存ビン中で凍結する。
【0030】
前処理:動物の角膜を切り出してトリミングする。
次いで角膜を人工涙またはグリセリン保存溶液中に配置して、−18℃で24時間凍結する。
その後、角膜を取り出して解凍し、Triton(商標) X−100、コール酸ナトリウム、ヒドロキシメチルアミノメタン(Tris)、ドデシル硫酸ナトリウム(SDS)またはCHAPSの溶液中に16〜20時間浸漬した(あるいはペプシン、トリプシンまたはその2種の酵素混合溶液に2〜4時間浸漬した)後に洗浄し、必要に応じて10〜20分間超音波で洗浄する。
【0031】
架橋固定:基質1中のコラーゲン分子を、エポキシド固定溶液で8〜48時間、室温で架橋かつ固定する。
【0032】
抗原の最小化:基質1のタンパク質中の特定の活性基、すなわち−OHまたは−NH2または−SHを、無水酸またはメチル化剤、あるいはエポキシドなどの活性剤で遮断し、基質1中のタンパク質のらせん鎖中の特定の水素結合を、強力な水素結合を有する試薬(例えば、塩酸グアニジン溶液)を用いて置換し、その配置を変性する。
【0033】
表面の改質:基質1の表面に、カップリング剤を用いて16リジン(K16)、グリシン(G)、アルギニン(R)、アスパラギン酸(D)、セリン(S)、プロリン(P)およびシステイン(C)の縮合から得られるポリペプチドおよびグリコサミノグリカンとカップリングすることによって活性表面層2を形成する。
【0034】
パッケージ:製品を殺菌剤で殺菌し、無菌状態で保存溶液を満たした小瓶に詰めて密閉する。
【0035】
上記説明は本発明の特定の実施態様に関するものであるが、本発明の趣旨から逸脱することなく、様々な修正を行うことができることは理解すべきである。
添付の特許請求の範囲はそのような修正を包括することを意図するものであり、本発明の真の範囲および趣旨内にはいるものである。
【図面の簡単な説明】
【0036】
【図1】本発明の一実施態様による人工角膜の透視図である。
【図2】図1の人工角膜の断面図である。
【符号の説明】
【0037】
1 基質
2 活性表面層
【技術分野】
【0001】
本発明は、ヒトの移植のための医療用人工器官に関し、より詳細には、損傷した角膜を再建するためのデバイスに関する。
【背景技術】
【0002】
角膜の損傷または病変による視力の損失は、最もよく起こる眼科疾患であり、現在、治療法は死体から臓器提供された角膜の移植に依存している。
【発明の開示】
【発明が解決しようとする課題】
【0003】
しかしながら、角膜の移植には臓器移植元の確保などの難しさがあるだけでなく、免疫性の拒絶により移植が失敗する場合が多々ある。
そのため、科学者等はヒトの角膜疾患の治療に動物の角膜の使用を試みており、それには動物の角膜を直接移植することを実現する研究が含まれている。
しかしながら、そのように動物の角膜を直接移植することは、免疫性拒絶のために失敗した。
さらに、低温凍結と単純な殺菌処理により動物の角膜から人工角膜を作製する研究もまた、抗原が完全に排除されず、組織適合性が乏しいため患者の身体が移植片を受け入れられず失敗した。
したがって、未だに動物の角膜から採取可能な有効な人工角膜が必要である。
【0004】
本発明の目的は、高い生体適合性、安定性を有し、分解かつ吸収可能で、さらに角膜再生を誘導可能な安全で信頼性のある生体人工角膜を提供することである。
【0005】
本発明の他の目的は、そのような人工角膜の作製方法を提供することである。
【課題を解決するための手段】
【0006】
本発明の目的を達成するために、本発明は人体へ移植するための人工角膜を提供するものであり、該人工角膜は、基質を有する天然の動物の角膜を提供するステップと、該基質を架橋かつ固定するステップと、該基質由来の抗原を最小化するステップと、該基質に活性層をカップリングするステップと、を含んでなる方法によって作製される。
【発明の効果】
【0007】
この発明は、上記の記載によって、高い生体適合性、安定性を有し、分解かつ吸収可能で、さらに角膜再生を誘導可能な安全で信頼性のある生体人工角膜を提供することができる。
また、そのような人工角膜の作製方法を提供することができる。
【発明を実施するための最良の形態】
【0008】
以下図面に基づいてこの発明の実施例を詳細に説明する。
【実施例】
【0009】
以下の詳細な説明は、本発明を実施する現時点で意図される最良の形態に関するものである。
この説明は限定することを意図するものではなく、単に本発明の実施態様の概括的な原理を例示することを目的とするものである。
本発明の範囲は、添付の特許請求の範囲によって最大限に定義されるものである。
【0010】
本発明は、固定剤で架橋かつ固定し、抗原を最小化するよう処理し、次いで活性層を含有する表層で被覆した、動物の角膜から作製した基質を有する生体人工角膜を提供する。
【0011】
動物の角膜は微生物によって簡単に劣化あるいは分解するため、固定剤でカップリングして固定することが必要である。
通常、グルタルアルデヒドが固定剤として利用されるが、グルタルアルデヒドは毒性のラジカルを生成する。
アルデヒドはアセタール反応によってタンパク質とカップリングして、そのカップリングした生成物が劣化すると毒性のアルデヒドが放出されるため、アルデヒドで固定した製品は長期間残存する毒性を有する。アルデヒド系固定剤に代わる固定剤としてエポキシド、ジアミド、ジイソシアナートまたはカルボジアミドを利用すると、この毒性問題を排除することさえできる。
例えば、エポキシドをアルデヒド型の固定剤に代えて用いると、エポキシドが不安定なため開環、架橋反応が容易に起こるが、反応条件を制御することにより非常に安定で簡単には分解しない架橋生成物を生成することができる。
分解においてカリクレイン、フィブリノリジンおよびグルココルチコイドホルモンが分泌されてコラゲナーゼを助けることによって組織の成長と再生が開始して架橋生成物が滅ぶときにのみポリアルデヒドとアミノ酸とにゆっくりと分解し、吸収される。
そのような種類の受動的な分解および組織再生は同期的に起こるものであり、組織再生による修復に有益であると同時にアルデヒドの残存毒性を有さない。最新の免疫学的理論によれば、動物組織の抗原性は主として特定部位に局在化した特定の配座にある活性基由来であり、これら活性基には−OH、−NH2 、−SHなどが含まれる。
特定の配座は、らせん状タンパク質鎖で形成された特定の水素結合のいくつかにより得られる。
特定の部位と配座は、抗原決定因子と呼ばれる。これら基と容易に反応する一つまたはより多くの活性試薬(例えば、酸無水物、塩化アシル、アミド、エポキシドなど)は、動物の角膜を処理する際にこれら基と結合してこれらを遮断するのに用いられるため、抗原を効果的に除去することができる。
同時に、強力な水素結合を有する試薬(例えば、グアニジン化合物)は、特定の配置を与える水素結合を置換するのに用いられるため、その配置は変化して抗原性が効果的に取り除かれる。
【0012】
方法
【0013】
本発明による生体人工角膜の作製方法は、以下のステップを含んでなり、天然の動物の角膜を基質として用いる。
(1)材料の選択:新鮮な動物の眼球を採取する。角膜の材料は好ましくは透明である。
(2)前処理:動物の角膜を切り出してきれいにトリミングする。
角膜を保存溶液中に配置して−18〜4℃で24〜28時間冷凍し、次いで角膜を取り出して解凍後、界面活性剤溶液中に16〜20時間浸漬するか、あるいはパンクリン(pankrin)溶液に2〜4時間浸漬した後に洗浄する。
必要に応じて10〜20分間超音波で洗浄する。
(3)固定:基質中のコラーゲン分子を以下でより詳細に説明する非アルデヒド固定剤を用いて架橋して固定する。
(4)抗原の最小化:活性試薬を用いて−OHまたは−NH2 または−SHなどの基質のタンパク質中の特定の活性基を遮断し、基質中のタンパク質分子のらせん鎖中の特定の水素結合を、強力な水素結合を有する試薬を用いて置換し、その特定の配置を変性する。
(5)活性層のカップリング:増殖因子に接着可能な特定のポリペプチドまたはグルコサミノグリカンを含有する活性層を、カップリング剤を用いて表層上に組み込む。
【0014】
界面活性剤
【0015】
上記方法のステップ2の界面活性剤は、Triton(商標)X−100、コール酸ナトリウム、ヒドロキシメチルアミノメタン(Tris)、ドデシル硫酸ナトリウム(SDS)またはCHAPSであってよい。
パンクリン(pankrin)は、ペプシン、トリプシンまたはそれら2種の酵素の混合物であってよい。
【0016】
保存溶液
【0017】
上記方法のステップ2における保存溶液は、人工の涙溶液、生理食塩水溶液、グリセリンまたはグリセリンと人工涙の混合溶液であってよい。
【0018】
固定
【0019】
上記方法のステップ3において適用される固定剤は、タンパク質分子と容易に架橋する試薬であってよく、エポキシド、ジアシルジアミド、ジイソシアナート、ポリエチレングリコールまたはカルボジイミドから選択される1つまたは2つの試薬であってよい。
この固定剤は、炭化水素のバックボーンを有するエポキシ化合物であってよく、このバックボーンは水溶性であり、かつそのバックボーン中にエーテルあるいはエステル結合を含まないものである。
この固定剤は、米国特許第6,106,555号公報に開示されているものであり、その全開示がその全てが記載されているものとして、参照として本明細書に組み入れられる。
例にはエポキシド、ジアミド、ジイソシアナート、ポリエチレングリコールまたはカルボジイミドが包まれ、ここでエポキシドは単環式エポキシドまたは二環式エポキシドであるか、あるいは低級ポリ(エポキシド)(低級ポリ(エチレンオキシド)、ポリ(プロピレンオキシド)またはグリシジルエーテルなど)であってよい。
【0020】
エポキシドは単環式エポキシドである、
【化1】

または、二環式エポキシドである、
【化2】

であってよく、また、ポリプロピレンオキシドなどの低級ポリエポキシドであってよい。
【0021】
活性剤
【0022】
上記方法のステップ4における活性剤は、低分子量の無水有機酸、塩化アシル、アシルアミド、または単環式酸化物またはエポキシドであり、強力な水素結合力を有する試薬はグアニジン化合物であってよい。
【0023】
活性層
【0024】
上記方法の5における活性層は、ポリペプチドまたはグリコサミノグリカンなどの活性成分であってよい。
ポリペプチドの一例は、16リジン(K16)、グリシン(G)、アルギニン(R)、アスパラギン酸(D)、セリン(S)、プロリン(P)およびシステイン(C)の縮合から得られるポリペプチドであり、該組成物の配列はK16−G−R−G−D−S−P−Cである。
グリコサミノグリカンは、ヒアルロン酸、コンドロイチン硫酸、デルマタン硫酸、ヘパリン、アセチルヘパリン硫酸またはケラチン硫酸である。
これらポリペプチドまたはグリコサミノグリカンは、広範囲の接着性を呈し、増殖因子の活性効果を高め、あるいは未分化細胞を活性化して適応した分化をさせるため、器官組織の再生修復を誘導する機能を果たすことができる。
接着かつ蓄積可能な血管の増殖因子の例には、血管内皮増殖因子(VEGF)、繊維芽細胞増殖因子(FGF)、血小板由来増殖因子(PDGF−bb)および血管透過性因子(VPF)が包含される。
【0025】
活性層のカップリング剤
【0026】
上記方法のステップ5においてポリペプチドまたはグリコサミノグリカンをカップリングするのに用いられるカップリング剤は、ジアシルジアミド、無水二酸、ジエポキシまたは−NH2 、−OHおよび−COOHと縮合可能なその他の二官能試薬であってよい。
【0027】
本発明は以下の利点を提供する。
人工角膜の組成および三次元構造は、ヒトの角膜のそれと非常に類似している一方で免疫性を有さない。
該人工角膜は、角膜の再生を誘導しかつ促進することができると同時に、角膜の再生に伴って分解し、その分解速度は架橋条件を制御することによって角膜再生速度に一致するよう調整することができる。
人工角膜の物理的および機械的特性は、ヒトの角膜のそれと近く、安定した形態学および良好な可撓性を有する一方、該角膜は様々な曲率で仕上げることができ、さらに、水中で膨張することがないため、角膜を再建するための理想的な基質または支持体とすることができる。
【0028】
実施例1
図1と図2を参照すると、生体人工角膜は非アルデヒド固定剤で架橋かつ固定し、抗原を最小化することによって動物の角膜から調製した基質1を含む。
活性表面層2を、増殖因子に接着可能なポリペプチドまたはグリコサミノグリカンからなる活性成分を基質1の内面(眼球面)にカップリングすることによって形成する。
ポリペプチドの一例は、16リジン(K16)、グリシン(G)、アルギニン(R)、アスパラギン酸(D)、セリン(S)、プロリン(P)およびシステイン(C)の縮合から得られるポリペプチドであり、該組成物の配列はK16−G−R−G−D−S−P−Cであり、また、該グリコサミノグリカンは、ヒアルロン酸、コンドロイチン硫酸、デルマタン硫酸、ヘパリン、アセチルヘパリン硫酸またはケラチン硫酸である。
この生体人工角膜は以下のステップによって作製することができる。
【0029】
材料の選択:新鮮な動物の眼球を健康なブタから採取し、輸送前に特別な保存ビン中で凍結する。
【0030】
前処理:動物の角膜を切り出してトリミングする。
次いで角膜を人工涙またはグリセリン保存溶液中に配置して、−18℃で24時間凍結する。
その後、角膜を取り出して解凍し、Triton(商標) X−100、コール酸ナトリウム、ヒドロキシメチルアミノメタン(Tris)、ドデシル硫酸ナトリウム(SDS)またはCHAPSの溶液中に16〜20時間浸漬した(あるいはペプシン、トリプシンまたはその2種の酵素混合溶液に2〜4時間浸漬した)後に洗浄し、必要に応じて10〜20分間超音波で洗浄する。
【0031】
架橋固定:基質1中のコラーゲン分子を、エポキシド固定溶液で8〜48時間、室温で架橋かつ固定する。
【0032】
抗原の最小化:基質1のタンパク質中の特定の活性基、すなわち−OHまたは−NH2または−SHを、無水酸またはメチル化剤、あるいはエポキシドなどの活性剤で遮断し、基質1中のタンパク質のらせん鎖中の特定の水素結合を、強力な水素結合を有する試薬(例えば、塩酸グアニジン溶液)を用いて置換し、その配置を変性する。
【0033】
表面の改質:基質1の表面に、カップリング剤を用いて16リジン(K16)、グリシン(G)、アルギニン(R)、アスパラギン酸(D)、セリン(S)、プロリン(P)およびシステイン(C)の縮合から得られるポリペプチドおよびグリコサミノグリカンとカップリングすることによって活性表面層2を形成する。
【0034】
パッケージ:製品を殺菌剤で殺菌し、無菌状態で保存溶液を満たした小瓶に詰めて密閉する。
【0035】
上記説明は本発明の特定の実施態様に関するものであるが、本発明の趣旨から逸脱することなく、様々な修正を行うことができることは理解すべきである。
添付の特許請求の範囲はそのような修正を包括することを意図するものであり、本発明の真の範囲および趣旨内にはいるものである。
【図面の簡単な説明】
【0036】
【図1】本発明の一実施態様による人工角膜の透視図である。
【図2】図1の人工角膜の断面図である。
【符号の説明】
【0037】
1 基質
2 活性表面層
【特許請求の範囲】
【請求項1】
人体への移植用の天然の動物の角膜の作製方法であって、
基質を有する天然の動物の角膜を提供するステップと、
該基質を架橋かつ固定するステップと、
該基質由来の抗原を最小化するステップと、
該基質に活性層をカップリングするステップと、
を含むことを特徴とする生体人工角膜作製方法。
【請求項2】
前記活性層がポリペプチドを含む、請求項1に記載の生体人工角膜作製方法。
【請求項3】
前記架橋かつ固定するステップが、水溶性の炭化水素バックボーンを有し、該バックボーンにエーテル結合またはエステル結合を含まないエポキシ化合物を用いて達成される、請求項1に記載の生体人工角膜作製方法。
【請求項4】
前記エポキシ化合物が、エポキシド、ジアミド、ジイソシアナートおよびカルボジイミドからなる群から選択される、請求項3に記載の生体人工角膜作製方法。
【請求項5】
前記基質由来の抗原を最小化するステップが、
前記基質のタンパク質中の特定の活性基を遮断する活性剤を利用することと、
前記基質中のタンパク質分子のらせん鎖中の特定の水素結合を置換し、その特定の配座を変性する強力な水素結合力を有する試薬を利用することと、
を含む、請求項1に記載の生体人工角膜作製方法。
【請求項6】
人体への移植用人工角膜であって、
基質を有する天然の動物の角膜であって、該基質は架橋され、かつ該基質由来の抗原が最小化され、該基質はカップリングされた活性層を有する、天然の動物の角膜、
を含んでなる
ことを特徴とする生体人工角膜。
【請求項7】
前記活性層がポリペプチドを含む、請求項6に記載の生体人工角膜。
【請求項8】
前記基質が、水溶性の炭化水素バックボーンを有し、該バックボーンにエーテル結合またはエステル結合を含まないエポキシ化合物で固定される、請求項6に記載の生体人工角膜。
【請求項9】
前記エポキシ化合物が、エポキシド、ジアミド、ジイソシアナートおよびカルボジイミドからなる群から選択される、請求項8に記載の生体人工角膜。
【請求項10】
前記抗原が、前記基質のタンパク質中の特定の活性を遮断する活性剤と、前記基質中のタンパク質分子のらせん鎖中の特定の水素結合を置換し、その特定の配座を変性する強力な水素結合力を有する試薬とによって前記基質から最小化される、請求項6に記載の生体人工角膜。
【請求項11】
人体への移植用角膜であって、該角膜は、
基質を有する天然の動物の角膜を提供するステップと、
該基質を架橋かつ固定するステップと、
該基質由来の抗原を最小化するステップと、
該基質に活性層をカップリングするステップと、
を含む方法によって作製されることを特徴とする生体人工角膜。
【請求項12】
前記活性層がポリペプチドを含む、請求項11に記載の生体人工角膜。
【請求項13】
前記基質が、水溶性の炭化水素バックボーンを有し、該バックボーンにエーテル結合またはエステル結合を含まないエポキシ化合物で固定される、請求項11に記載の生体人工角膜。
【請求項14】
前記エポキシ化合物が、エポキシド、ジアミド、ジイソシアナートおよびカルボジイミドからなる群から選択される、請求項13に記載の生体人工角膜。
【請求項15】
前記抗原が、前記基質のタンパク質中の特定の活性を遮断する活性剤と、前記基質中のタンパク質分子のらせん鎖中の特定の水素結合を置換し、その特定の配座を変性する強力な水素結合力を有する試薬とによって前記基質から最小化される、請求項11に記載の生体人工角膜。
【請求項1】
人体への移植用の天然の動物の角膜の作製方法であって、
基質を有する天然の動物の角膜を提供するステップと、
該基質を架橋かつ固定するステップと、
該基質由来の抗原を最小化するステップと、
該基質に活性層をカップリングするステップと、
を含むことを特徴とする生体人工角膜作製方法。
【請求項2】
前記活性層がポリペプチドを含む、請求項1に記載の生体人工角膜作製方法。
【請求項3】
前記架橋かつ固定するステップが、水溶性の炭化水素バックボーンを有し、該バックボーンにエーテル結合またはエステル結合を含まないエポキシ化合物を用いて達成される、請求項1に記載の生体人工角膜作製方法。
【請求項4】
前記エポキシ化合物が、エポキシド、ジアミド、ジイソシアナートおよびカルボジイミドからなる群から選択される、請求項3に記載の生体人工角膜作製方法。
【請求項5】
前記基質由来の抗原を最小化するステップが、
前記基質のタンパク質中の特定の活性基を遮断する活性剤を利用することと、
前記基質中のタンパク質分子のらせん鎖中の特定の水素結合を置換し、その特定の配座を変性する強力な水素結合力を有する試薬を利用することと、
を含む、請求項1に記載の生体人工角膜作製方法。
【請求項6】
人体への移植用人工角膜であって、
基質を有する天然の動物の角膜であって、該基質は架橋され、かつ該基質由来の抗原が最小化され、該基質はカップリングされた活性層を有する、天然の動物の角膜、
を含んでなる
ことを特徴とする生体人工角膜。
【請求項7】
前記活性層がポリペプチドを含む、請求項6に記載の生体人工角膜。
【請求項8】
前記基質が、水溶性の炭化水素バックボーンを有し、該バックボーンにエーテル結合またはエステル結合を含まないエポキシ化合物で固定される、請求項6に記載の生体人工角膜。
【請求項9】
前記エポキシ化合物が、エポキシド、ジアミド、ジイソシアナートおよびカルボジイミドからなる群から選択される、請求項8に記載の生体人工角膜。
【請求項10】
前記抗原が、前記基質のタンパク質中の特定の活性を遮断する活性剤と、前記基質中のタンパク質分子のらせん鎖中の特定の水素結合を置換し、その特定の配座を変性する強力な水素結合力を有する試薬とによって前記基質から最小化される、請求項6に記載の生体人工角膜。
【請求項11】
人体への移植用角膜であって、該角膜は、
基質を有する天然の動物の角膜を提供するステップと、
該基質を架橋かつ固定するステップと、
該基質由来の抗原を最小化するステップと、
該基質に活性層をカップリングするステップと、
を含む方法によって作製されることを特徴とする生体人工角膜。
【請求項12】
前記活性層がポリペプチドを含む、請求項11に記載の生体人工角膜。
【請求項13】
前記基質が、水溶性の炭化水素バックボーンを有し、該バックボーンにエーテル結合またはエステル結合を含まないエポキシ化合物で固定される、請求項11に記載の生体人工角膜。
【請求項14】
前記エポキシ化合物が、エポキシド、ジアミド、ジイソシアナートおよびカルボジイミドからなる群から選択される、請求項13に記載の生体人工角膜。
【請求項15】
前記抗原が、前記基質のタンパク質中の特定の活性を遮断する活性剤と、前記基質中のタンパク質分子のらせん鎖中の特定の水素結合を置換し、その特定の配座を変性する強力な水素結合力を有する試薬とによって前記基質から最小化される、請求項11に記載の生体人工角膜。
【図1】


【図2】




【図2】


【公表番号】特表2009−519792(P2009−519792A)
【公表日】平成21年5月21日(2009.5.21)
【国際特許分類】
【出願番号】特願2008−546077(P2008−546077)
【出願日】平成18年12月18日(2006.12.18)
【国際出願番号】PCT/CN2006/003444
【国際公開番号】WO2007/071169
【国際公開日】平成19年6月28日(2007.6.28)
【出願人】(508183715)
【Fターム(参考)】
【公表日】平成21年5月21日(2009.5.21)
【国際特許分類】
【出願日】平成18年12月18日(2006.12.18)
【国際出願番号】PCT/CN2006/003444
【国際公開番号】WO2007/071169
【国際公開日】平成19年6月28日(2007.6.28)
【出願人】(508183715)

【Fターム(参考)】
[ Back to top ]

