生体分子の一貫連続製造のための装置及び方法
【課題】本発明は、不均一な清澄液混合物から対象分子を精製するための方法及び装置に関する。
【解決手段】本発明の装置は一般に、無菌状態で維持される、連続灌流発酵システムと、灌流発酵システムと一体化した連続粒子除去システムと、粒子除去システムと一体化した連続精製システムとを含む。この方法は、流束対TMP曲線の圧力依存性領域において、対象分子の転移点より下の比流量での連続限外濾過によって、不均一な清澄液混合物を濾過すること含み、比流量は連続限外濾過の間を通して実質的に一定に維持されている。
【解決手段】本発明の装置は一般に、無菌状態で維持される、連続灌流発酵システムと、灌流発酵システムと一体化した連続粒子除去システムと、粒子除去システムと一体化した連続精製システムとを含む。この方法は、流束対TMP曲線の圧力依存性領域において、対象分子の転移点より下の比流量での連続限外濾過によって、不均一な清澄液混合物を濾過すること含み、比流量は連続限外濾過の間を通して実質的に一定に維持されている。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、分子の不均一混合物から対象分子を精製するための改良された方法及びシステムに関する。より詳細には本発明は、連続灌流発酵方法から組織培養液供給流中の対象蛋白質の精製方法に関する。
【背景技術】
【0002】
近年、連続灌流方法とも呼ばれるいくつかの連続細胞培養方法が大きな商業上の成功と共に確立されてきたことは当業者には公知である。しかし、連続灌流発酵に続く単離工程は一般にはバッチ操作であり、物理的及び物流的に連続した上流の工程から分離されている。このような工程では、分離ステップの主たる目的は、大量の比較的希薄な培養上澄み液から生成物を捕獲することである。生成物の濃縮は、工程の物流管理及び必要な空間に関連して重視されなければならない一方で、さらなる下流の必要な精製ステップ数を最小化するために、汚染物質の除去(精製)を同時に行うことが重要である。
【0003】
図1では、当業者には公知である典型的な最新式の連続灌流発酵からの単離工程の略図を示す。連続灌流発酵システムは、発酵システムにおいて生成物を生成する細胞の大部分を保つ細胞保持装置(1)を含む。まだある程度の細胞、細片及び他の粒子を含有する連続灌流システムからの連続収穫産物流れは、収穫産物ポンプ(2)を使用してステンレス鋼タンクなどの大きい収集容器(3)にポンプで送り込まれる。このような収穫産物貯蔵容器は、普通は分解による生成物の損失を実現可能な範囲内に収めるために冷却しなくてはならない。
【0004】
通常は1〜4日以上の後に特定量の収集がなされると、収穫産物収集容器を無菌発酵容器から取り外し、収集物を1回の収穫産物バッチとする。次のステップは、細胞、細片及び粒子を除去することである(ステップ2)。これは工業規模では、通常遠心分離(4)及びその後にデッドエンド膜濾過(5)を行うか、或いはデッドエンド深層濾過(6)及びその後にデッドエンド膜濾過(7)を行う。他の技術として、接線流(又は「クロスフロー」)精密濾過が行われることがある。いずれの場合でも、粒子除去工程の生成物は、清澄組織培養液、即ちcTCF(8)の1バッチである。バイオ製品の粒子分離の詳細については、Biotechnology,Vol.3,Bioprocessing,Wiley−VCH,2 edition(1996),ISBN:3527283137などの標準のテキストで見ることができる。
【0005】
次のステップ(ステップ3)においては、清澄組織培養液のバッチを、更に濃縮物へと処理し、可能であれば生成物を精製する。これは通常クロスフロー限外濾過又は充填層クロマトグラフィーによって行われる。
【0006】
クロスフロー限外濾過の場合、cTCFはシステムの循環タンク(9)にポンプで送り込まれる。収集物をクロスフロー限外濾過膜を通して押し出すためにポンプを使用する(10)。生成物を膜により保持し、保持液として循環タンク内に再循環させ、一方水及びより小さな汚染物質は、限外濾過モジュール内の圧力低下によって生じた膜貫通圧力によって透過液(11)へと膜を通して押し出される。cTCFは、フィルターを通過する毎に、その結果より濃縮され、cTCFの全容積は所望の濃縮係数となるまで減少する。所望の濃縮係数に達したら、工程を止めて、残った濃縮物容量(分離物)をシステムから排出し、回収する。バイオ製品の濃縮のためのクロスフロー限外濾過の詳細は、Biotechnology,Vol.3,Bioprocessing,Wiley−VCH,2 edition(1996),ISBN:3527283137などの標準のテキストで見ることができる。
【0007】
充填層クロマトグラフィーの場合は、cTCFは、樹脂充填層を含有するクロマトグラフィーカラム(12)にポンプで送り込まれる。生成物は樹脂に結合し、次いで通常は適切な溶出緩衝液(14)を使用して濃縮、精製した形態(分離物、13)で溶出し、その後カラムは適切な緩衝液及び清浄液(14)を使用して洗浄し、再生を行う。
【0008】
cTCFの濃縮/精製のために提案されてきた他のクロマトグラフィーの変形は、膨張層クロマトグラフィー及び膜クロマトグラフィーである。膨張層クロマトグラフィーは、粒子を含有する溶液を処理することができる。しかし、濾過面積は減少するが、クロマトグラフィー後の分離物の濾過はまだ必要である。膜クロマトグラフィーは、樹脂充填層の代わりに階層上になった改質した精密濾過膜を利用する。その利点は、物質移動が拡散性であるよりも非常に対流性であり、それによってより早く分離できることである。通常その他の点では、この方法は標準の充填層クロマトグラフィーと同様である。バイオ製品の濃縮及び精製のためのクロマトグラフィーの詳細は、Protein Purification,Principles,High−Resolution Methods,and Applications,Wiley−VCH,2.Edition(1998),ISBN 0−471−18626−0などの標準のテキストで見ることができる。
【0009】
次いで、バルク分離物を冷凍し、後に更に下流の精製ステップで使用するために貯蔵することが多い。
【0010】
従って、前述のように、単離工程は一般にバッチ操作であり、連続した上流の工程から物理的及び物流的に分離している。また、発酵は無菌で行わなければならない一方、単離(即ち粒子除去及び濃縮/精製)は、本質的に清浄な状態で行われるが無菌ではない。
【0011】
前述のように、最新式の方法はいくつかの問題を有している。
【0012】
Pl:製品の滞留時間が長いための収率損失及び質低下の可能性。上記で略述したように、連続灌流発酵からの収穫産物を収集し、単離したバッチを処理できる前に、長時間にわたって貯蔵する必要がある。収集した収穫産物は、冷却されているが、複雑で本質的に不安定な蛋白質製品に対し依然として有害な環境をもたらす。従って、著しい製品の損失が起こり、それによって設備能力の低下と商品コストの増加をもたらす。更に、製品の質に悪影響を及ぼす可能性がある。
【0013】
P2:大用量の収穫産物の中間貯蔵のために大規模な低温室施設又は冷却容器が必要であり、それにより資本コストが高額となり、前述のコンパクト性及び灌流発酵槽の移動性の利点を無効にすることとなる。
【0014】
P3:従来の濃縮/精製技術(例えば、限外濾過、充填層クロマトグラフィー)は比較的処理容量が低く、著しい所要時間がかかり、比較的労働集約的である。その結果、1日に行われる操作は、通常せいぜい1バッチである。
【0015】
P4:更に、最新の単離工程及び方法は、複数の発酵槽が関連する発酵設備において様々なプロセス容量に対応する物流的な問題を有している。大規模な連続灌流設備においては、様々な数の発酵槽が運転可能である。
【0016】
P5:更に、最新式の単離工程は清浄な状態で行われるが、無菌で稼働することができない。これにより微生物充填の問題のために著しい数のバッチが拒絶されることが多い。
【0017】
P6:使い捨てのフィルター、組立品、バッグなどの使い捨て品を使用することは、ヒトの非経口薬品の製造には非常に望ましいが(例えば、洗浄、洗浄の確認及び他の問題を避けるため)、非常にコストがかかり、実は経済的ではないことが多い。
【発明の概要】
【発明が解決しようとする課題】
【0018】
従って、本発明の目的は無菌状態下で長期間稼働することができる一貫連続蛋白質分離方法を提供することにある。
【課題を解決するための手段】
【0019】
本発明は、不均一流体混合物から分子を精製する新規な装置及び方法に関する。より詳細には、本発明は、粒子状汚染物質が除去された不均一な清澄液混合物から対象分子を精製するための方法に関する。この方法は、連続限外濾過の間を通して比流量が実質的に一定に維持されている流束対TMP曲線の圧力依存性領域において、対象分子の転移点より下の比流量で連続限外濾過によって不均一な清澄液混合物を濾過するステップを含む。
【0020】
特定の実施形態において、本発明の方法は、清澄液混合物の体積流量(リットル/時間)の0.1〜2倍にほぼ等しい面積(平方メートル)を有する限外濾過膜による清澄液混合物の濾過を含む。他の実施形態において、本発明の方法は、清澄液混合物の体積流量(リットル/時間)の0.3〜1倍にほぼ等しい面積(平方メートル)を有する限外濾過膜による清澄液混合物の濾過を含む。
【0021】
本発明の方法は有利なことに、相当な濃度分極を伴わずに、保持液濃度を約20%未満、15%未満又は10%未満超える壁濃度を生じる比流量で濾過することが可能である。
【0022】
更に特定の実施形態において、本発明は、連続灌流発酵、粒子状物質除去及び精製/濃縮のための一貫連続無菌方法に関する。本発明の一態様によれば、この方法は、分離工程における比流量が蛋白質の転移点より低いレベルで実質的に一定に維持される流束対TMP曲線の圧力依存性領域において、蛋白質の転移点より低い操作設定点で選択的に対象蛋白質を混合物から分離し、無菌で無粒子の濃縮・部分精製単離生成物を生成する分離工程による組織培養混合物の濾過を含む。
【0023】
本発明の他の態様によれば、この方法は、対象蛋白質を不均一な組織培養液混合物から精製するための連続方法であり、
(a)連続灌流発酵工程によって対象蛋白質を含有する不均一な組織培養液混合物を生成するステップと、
(b)組織培養液混合物を、連続灌流発酵工程と一体化した連続粒子除去工程に移送するステップと、
(c)連続粒子除去工程において粒子状汚染物質を組織培養液から除去し、対象蛋白質を含有する清澄組織培養液を生成するステップと、
(d)清澄組織培養液を、連続粒子除去工程と一体化した連続精製工程に移送するステップと、
(e)連続精製工程において対象蛋白質を清澄組織培養液から生成するステップとを含み、連続灌流発酵工程、連続粒子除去工程及び連続精製工程における混合物の比流量は実質的に一定に維持される。
【0024】
本発明の更に他の態様によれば、この方法は、不均一な組織培養液混合物から対象蛋白質を精製するための半連続方法であり、
(a)連続灌流発酵工程によって対象蛋白質を含有する不均一な組織培養液混合物を生成するステップ、
(b)組織培養液混合物を、連続灌流発酵システムと一体化した連続粒子除去工程に移送するステップと、
(c)連続粒子除去工程において粒子状汚染物質を組織培養液から除去し、対象蛋白質を含有する清澄組織培養液を生成するステップと、
(d)清澄組織培養液を、連続粒子除去工程と一体化したサージ容器に移送するステップと、
(e)清澄組織培養液を、サージ容器と一体化した精製工程に断続的に移送するステップと、
(e)精製システムにおいて対象蛋白質を清澄組織培養液から生成し、対象蛋白質を含有する無菌で無粒子の濃縮・部分精製単離生成物を生成するステップとを含み、連続灌流発酵工程及び連続粒子除去工程における混合物の比流量は実質的に一定に維持される。
【0025】
本発明は、対象蛋白質を不均一な組織培養液混合物から分離するための装置にも関する。本発明の一態様によれば、この装置は、無菌状態を維持するように構成された(a)連続灌流発酵システムと、(b)灌流発酵システムと一体化した連続粒子除去システムと、(c)粒子除去システムと一体化した連続精製システムとを含む。
【0026】
本発明の他の態様によれば、この装置は、無菌状態を維持するように構成された(a)連続灌流発酵システムと、(b)灌流発酵システムと一体化した連続粒子除去システムと、(c)粒子除去システムと一体化した断続的精製システムとを含む。
【0027】
この精製システムは、本明細書に記載する連続又は半連続の一貫無菌システムにおいて、対象蛋白質を不均一混合物から精製又は部分精製することのできる、例えば、限外濾過システム又は対流性吸着/脱離システム又は任意の他のシステムであってもよい。
【0028】
本発明の方法及び装置は、実質的に一定流速で、細胞培養液などの不均一流体混合物の連続の処理が可能なように構成されている。本発明の特定の態様によれば、本発明の方法及び装置は、連続的な期間、精製工程全体を通して流束対TMP曲線の圧力依存性領域において蛋白質の転移点より下で、実質的に一定流速で、細胞又は組織の不均一な培養液混合物の連続の処理を可能とするように構成されている。
【0029】
本発明のこれらの態様及び他の態様は、下記の発明の詳細な説明で詳細に説明する。
本明細書に組み込まれておりその一部を構成する添付図面は、本発明の実施形態を例示し、実施形態の詳細な説明と共に、本発明の原理及び利点を説明するのに用いる。
【図面の簡単な説明】
【0030】
【図1】3つの物理的及び物流的に区分された単離工程ステップ(バッチ式収穫産物収集、バッチ式粒子除去及びバッチ式濃縮/精製)による従来の連続灌流方法の略図である。
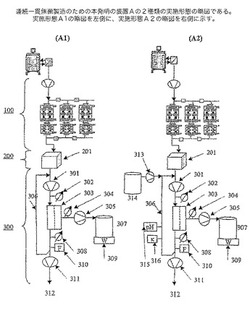
【図2】連続一貫無菌製造のための本発明の装置Aの2種類の実施形態の略図である。実施形態Alの略図を左側に、実施形態A2の略図を右側に示す。
【図3】連続一貫無菌製造のための本発明の装置Bの2種類の実施形態の略図である。実施形態Blの略図を左側に、実施形態B2の略図を右側に示す。
【図4】本発明の装置Aと本発明の装置B両方の構成要素である、本発明の一貫連続粒子除去システム(100)の実施形態の略図である。
【図5】複数の構成要素を組み合わせて、全体的な設備能力を増加させる(A3)、又は濃縮及び分離性能を増加させる(A4)本発明の装置Aのさらなる実施形態の略図である。
【図6】本発明の装置Bのさらなる実施形態の略図である。
【図7】装置A及び装置Bの構成要素を直列に組み合わせて全体的な濃縮及び分離性能を増加させた本発明の装置のさらなる実施形態の図である。
【図8】従来のバッチ操作と、同一の市販のフィルターカプセルを使用した連続粒子除去(一貫連続濾過工程)のための本発明の装置及び方法の実施形態とにおける、フィルターカプセル10”当たりの全充填容量の比較例を示す図である。組換え血液凝固第VIII因子を製造する例示の方法を示す。
【図9】圧力−流束カーブ(膜貫通圧力に対する透過液比流束LMH=リットル/時間/m2)及び操作点決定の例を示す図である。円は、従来のバッチ処理においてTMPを介して調整する通常の操作点を示す。四角は、本発明の装置Aの使用の方法に従って透過液ポンプを介して調整する好ましい操作領域を示す。
【図10】本発明の装置Aの使用の方法に従った一貫連続UFシステム(300)の滞留時間分布及び平均滞留時間の例を示す図である。290cm2モジュール(長さ62.5cm)、120LMHクロスフロー、0.2LMH保持液流、2LMH透過液流の使い捨ての連続システムで測定する。
【図11】本発明の装置Aの実施形態を用いた、血漿蛋白非含有の連続灌流発酵からのr第VIII因子の単離の例を示す図である。1標準偏差の値幅を含めた、本発明の連続方法の平均単離収率と、バッチ式単離の平均収率との比較である。バッチ収率決定のために連続的な3バッチを使用し、一方連続工程のために連続的な3点(日)を使用した。
【図12】本発明の装置Aの性能の例である。示した3種類の異なる連続工程時間の関数としての、一貫連続限外濾過システム(300)の膜貫通圧力及び比流束の例を示す図である。三角=100kD膜、組換え血液凝固第VIII因子(r第VIII因子)。四角=10kD膜、組換えインターロイキン−2。丸=50kD膜、遺伝子組み換え糖蛋白質(Mr>100kD)。示した全ての例は、血漿蛋白非含有の連続灌流発酵からである。
【図13】共発現している2種類の蛋白質製品(緑色蛍光蛋白質GFP及びIL−2SA)の細胞系の連続灌流発酵に直接結合している、本発明の装置Aの長期間の性能の例を示す図である。連続工程時間の関数としての本発明の連続限外濾過システム(300)の膜貫通圧力及び比流束を示す。10kD膜が使用された。
【図14】共発現している2種類の蛋白質生成物(緑色蛍光蛋白質GFP及びIL−2SA)の細胞系の連続灌流発酵に直接結合している、本発明の装置Aの長期間の性能の例を示す図である。10kD膜が使用された。特異的アッセイによって決定した両方の蛋白質製品の濃縮係数及び連続工程時間の関数として示した体積濃縮係数である。
【図15】本発明の装置Bの性能の例を示す図である。対流性吸着器による100に近い継続的吸着/脱離サイクルの間を通しての収率及び圧力の減少である(標的蛋白質:遺伝子組み換え血液凝固第VIII因子変異体、対流性吸着器:市販の吸着器Mustang Q、Pall Corporation)。
【図16】本発明の装置Bの性能の例を示す図である。対流性吸着器による通常の吸着/脱離サイクルの間のUV及び伝導率プロファイルである(標的蛋白質:遺伝子組み換え血液凝固第VIII因子変異体、対流性吸着器:市販の吸着器MustangQ、Pall Corporation)。
【図17】本発明の装置Bの性能の例を示す図である。充填物(粒子除去システム(100)から連続して排出されかつ対流性吸着器システム(400)に半連続的に充填される清澄収穫産物)と、通常の吸着/脱離溶出液とのSDS−PAGEゲル(銀色に着色)を示す。標的蛋白質:遺伝子組み換え血液凝固第VIII因子変異体。対流性吸着器:市販の吸着器Mustang Q、Pall Corporation。溶出液はゲルに供する前に充填濃度まで希釈した。
【発明を実施するための形態】
【0031】
定義
本明細書において明確に定義するもの以外に、本出願で用いる用語は当技術分野で標準のものである。特許請求の範囲の意味の明確性及び確定性を確実なものとするために、特定の用語についての下記の定義を本明細書において規定する。
【0032】
単位、接頭語及び記号は、SIで認められた形式で表示されてもよい。本明細書において記載の数字の範囲は、範囲を定義する数字を含み、定義した範囲内の各整数を含み支持する。特に断りのない限り、「1つ」又は「1つの」という用語は、「少なくとも1つ」を意味するものと解釈すべきである。本明細書において使用されるセクションの見出しは、構成を行う目的のためのみであり、説明の対象を限定するものと解釈すべきではない。それだけには限らないが特許、特許出願、論文、書籍及び協定を含めた、本出願で引用するすべての書類又は書類の一部は、任意の目的のために全内容が参照により本明細書に明確に組み込まれる。
【0033】
「清澄化」及び「清澄」という用語は、残存する溶液が0.2μmの膜を通過するような、溶液からの粒子状物質の除去を意味する。
【0034】
「連続灌流発酵」という用語は、間断なく稼働し、そこにおいて細胞又は微生物がバイオリアクターからの細胞懸濁液の除去によって平衡が保たれている新鮮な培地の連続添加によって指数増殖期に培養液中で維持される、定常状態発酵システム又は工程を意味する。
【0035】
「栽培する」、「培養する」、「成長させる」、「維持する」、「支持する」及び「増す」という用語は、細胞が生存でき、子孫を生成することができることと意味において同義である。
【0036】
「濃縮」という用語は、その動詞形では、残りの溶液の体積当たりの対象分子の量が増えるように、溶液からの水を除去することを意味する。
【0037】
「濃度分極」という用語は、膜貫通圧力、クロスフロー速度、試料の粘度及び溶質濃度などの各要因の組み合わせによって起こる、膜表面上の保持された分子(ゲル層)の蓄積を意味する。
【0038】
「連続」という用語は、長時間にわたって、時間、順序及び/又は操作が間断ないことを意味する。本発明の発酵、清澄化及び濾過工程について用いられた場合、「連続」は対象蛋白質を含有する無菌で無粒子の濃縮・部分精製単離生成物を生成するのに十分に、間断なく長時間稼働することができるように、工程が物理的及び物流的に一体化していることを意味する。連続という用語は、本発明の方法に用いられた場合、工程がバッチ式方法又は完全な連続方法では行われないことを意味するとも理解される。本発明の方法は、例えば、1日から数カ月の長期間にわたり稼働又は工程の順序を遮ることなく連続稼働をすることができる。本発明で使う場合、この方法では、2、3、4、5、6又は7日、2、3、4、5、6、7又は8週間、或いは3、4、5、6又はそれ以上の月数より長い期間連続稼働を行う。
【0039】
「半連続」及び「断続的」という用語は、一貫システムの1つ又は複数の工程又は構成要素が、非連続的又はバッチ式方法で稼働する一方で、一貫システムの他の工程又は構成要素が連続的方法で稼働することを意味する。例えば、本発明のいくつかの実施形態において、精製工程は対流性吸着/脱離工程であり、通常は吸着基質の不均一混合物の吸着を必要とし、結局は基質が飽和し、吸着工程の終了及び結合画分の脱離又は放出が必要となる。このような工程は、連続的な上流の工程と一体化することができるが、本質的に断続的である。
【0040】
「対流性吸着/脱離」という用語は、物質移動が主として対流によって起こるクロマトグラフィー工程を意味する。対流性吸着/脱離は、ある画分の基質への吸着とその後のその画分の基質からの脱離によって、対象分子を含有する混合物の画分を、混合物の他の画分から分離する工程である。
【0041】
「クロスフロー」又は「流体クロスフロー」という用語は、膜表面上を通る流体の流れを意味する。
【0042】
複数のシステム及び/又は工程に関して使われた場合、「一貫」という用語は、システム及び/又は工程が、連続して稼働できる統合システムを構成するような、物理的及び物流的に連結していることを意味する。対象とする無粒子の濃縮・部分精製蛋白質を生成する連続又は半連続の一貫システムに関する本発明のシステムとの関連で、一貫システムは、異なる構成要素を、直接的にかつシステムの異なる構成要素間で無菌状態を維持するのに十分な態様で連結するであろう。
【0043】
「培地(media)」(複数)及び「培地(medium)」(単数)という用語は、本明細書において、同義であり、互換的に使用され、この用語の一方の使用は他方を排除することを意味しない。
【0044】
「混合物」という用語は、蛋白質及び様々な汚染物質などの対象分子を含有する分子及び化合物の不均一な組み合わせを意味する。本発明の好ましい混合物は、当初連続灌流発酵工程から得られる対象とする外来蛋白質を含めた蛋白質の不均一混合物からなる組織培養液である。
【0045】
「ゲル層」という用語は、膜上に形成することができる顕微鏡的に薄い分子膜を意味する。膜表面の目詰まりによって分子の保持に影響を与え、従って濾液の流れを減少させ、又は一定流量の操作においては、TMPを増加させる。
【0046】
「対象分子」という用語は、流体(例えば液体)中の溶液又は懸濁液から分離しようとする粒子又は他の分子種を意味する。対象とする粒子又は分子は、流体から、ほとんどの場合は流体中の他の粒子又は分子から分離される。分離しようとする対象分子の大きさは、使用される膜の孔径を決定するであろう。対象分子は、生物由来又は生化学的な由来であるか、又は遺伝子導入又はin vitro法により生成することが好ましく、蛋白質、ペプチド、ポリペプチド、抗体又は抗体フラグメントが挙げられる。好ましい供給流源の例としては、哺乳動物細胞培養物及び細菌、菌類及び酵母などの微生物細胞培養物が挙げられる。濾過して取り除こうとする化学種には、望ましくないポリペプチド、蛋白質、細胞成分、DNA、コロイド、マイコプラズマ、エンドトキシン、ウィルス、炭水化物及びグリコシル化している又はしていない生物学的に興味がある他の分子が挙げられることにも留意すべきである。
【0047】
「透過液」という用語は、濾液と同義に用いられる。
【0048】
「単離生成物」という用語は、対象蛋白質を含有する、無粒子の濃縮・部分精製生成物を意味する。単離生成物は、限外濾過又は対流性吸着/脱離工程によって実現するのに相当する一定の精製及び濃縮を実現した生成物である。単離生成物は、必ずしも均一ではないが、発酵工程によって生成した当初のバルク生成物と比べて、著しく精製されるであろう。
【0049】
「比流量」という用語は、濾液に関するため「濾過流束」という用語と互換的に使用する。保持液の比流量は、使用される膜面積で規格化した保持液の流量である。
【0050】
流束に関して使用される場合、「実質的に一定な」という用語は、濾過の間の相当な期間流束が概ね一定の程度に維持されていることを意味する。
【0051】
「組織培養液」という用語は、組織培養培地由来成分の不均一混合物を意味する。本発明の好ましい態様によれば、組織培養液は連続灌流発酵工程に由来する。「清澄化」組織培養液は、事前に濾過されて細胞細片及び他の大きい高分子が除去されている組織培養液である。
【0052】
「膜貫通圧力」及びその頭字語「TMP」という用語は、供給液から膜の濾液側への平均加圧力を意味する。TMPは、TMP[バール]=[(PF+PR)/2]−Pf(式中、PFは供給液圧力、PRは保持液圧力、Pfは濾液圧力)によって計算する。
【0053】
「回収率」という用語は、処理後に回収することができる対象分子の量を意味する。通常は出発物質の百分率即ち収率で表す。
【0054】
「保持液」という用語は、濃縮物としても知られている、膜を透過しない試料の一部を意味する。
【0055】
「限外濾過」という用語は、微多孔膜又は半透膜を使用し、異なる大きさ又は分子量に基づいて流体又はイオンを優先的に分離する濾過の一形態を意味する。限外濾過は、通常約10,000ダルトンを超える分子量を有する分子を濾過して取り除くために使用される。
【0056】
本発明は、連続灌流発酵、粒子状物質除去及び精製/濃縮を含む一貫連続無菌方法に関する。本発明の一態様によれば、この方法は、分離工程における比流量が蛋白質の転移点より低いレベルで実質的に一定に維持される流束対TMP曲線の圧力依存性領域において、蛋白質の転移点より低い操作設定点で、選択的に対象蛋白質を混合物から分離し、無菌で無粒子の濃縮・部分精製単離生成物を生成する分離工程による組織培養混合物の濾過を含む。
【0057】
本発明の他の態様によれば、この方法は連続法であり、(a)対象蛋白質を含有する不均一な組織培養液混合物を、連続灌流発酵によって連続して生成するステップと、(b)組織培養液混合物を、連続灌流発酵システムと一体化した粒子除去工程に連続して移送するステップと、(c)粒子除去工程において組織培養液から粒子状汚染物質を連続して除去し、対象蛋白質を含有する清澄組織培養液を連続して生成するステップと、(d)清澄組織培養液を、粒子除去システムと一体化した精製工程に連続して移送するステップと、(e)精製システムにおいて対象蛋白質を清澄組織培養液から連続して分離し、対象蛋白質を含有し、無菌で無粒子の濃縮・部分精製単離生成物を連続して生成するステップとを含む。
【0058】
本発明の更に他の態様によれば、この方法は、(a)対象蛋白質を含有する不均一な組織培養液混合物を、連続灌流発酵によって連続して生成するステップと、(b)組織培養液混合物を、連続灌流発酵システムと一体化した粒子除去工程に連続して移送するステップと、(c)粒子除去工程において組織培養液から粒子状汚染物質を連続して除去して、対象蛋白質を含有する清澄組織培養液を連続して生成するステップと、(d)清澄組織培養液を、粒子除去工程と一体化したサージ容器に連続して移送するステップと、(e)清澄組織培養液を、サージ容器と一体化した精製工程に断続的に移送するステップと、(e)精製システムにおいて対象蛋白質を清澄組織培養液から分離し、対象蛋白質を含有する、無菌で無粒子の濃縮・部分精製単離生成物を生成するステップとを含む半連続法であり、連続灌流発酵工程及び連続粒子除去工程の間を通しての混合物の比流量は、実質的に一定に維持され、平均して一貫半連続精製工程の時間平均処理量に等しい。
【0059】
本発明の方法を実施するための装置
本発明はまた、対象蛋白質を不均一な組織培養液混合物から分離するための装置に関する。一般にこの装置は、(a)連続灌流発酵システム、(b)灌流発酵システムと一体化した連続粒子除去システム、(c)粒子除去システムと一体化した連続精製システムを含み、この装置は無菌状態を維持するように構成されている。本発明の他の態様によれば、この装置は、(a)連続灌流発酵システム、(b)灌流発酵システムと一体化した連続粒子除去システム、(c)粒子除去システムと一体化した断続的精製システムを含み、この装置は無菌状態を維持するように構成されている。この精製システムは、例えば、限外濾過システム、対流性吸着/脱離システム或いは本明細書に記載する連続又は半連続の一貫無菌システムにおいて対象蛋白質を不均一混合物から精製又は部分精製することのできる任意の他のシステムであってもよい。
【0060】
本発明の方法及び装置は、実質的に一定流速で、不均一な組織培養液混合物の連続処理が可能なように構成されている。本発明の特定の態様によれば、本発明の方法及び装置は、実質的に一定流速で、連続した期間、精製工程全体を通して流束対TMP曲線の圧力依存性領域において蛋白質の転移点より下で、不均一な組織培養液混合物の連続処理が可能なように構成されている。
【0061】
特定の実施形態において、本発明は、各々3種類の異なるが完全に一体化した構成要素で構成される2種類の新規な装置(A、B)を提供する、この構成要素の全ては、重要な役割を持ち、共に比類なく効率的で、前述のような従来技術の問題を解決する連続蛋白質単離システムプラットフォームを形成する。
【0062】
各装置の3種類の異なる構成要素は、第1に、一貫連続粒子除去システム(100)、第2に無菌サージ容器(200)、第3に一貫濃縮/精製システム(各々300、400)である。3種類の全ての構成要素、従って開発した新規な装置及びこのような装置を使う方法を下記で詳細に説明する。
【0063】
連続又は半連続の蛋白質製品の一貫濃縮/精製を提供するために、本発明の装置A(この2種類の実施形態を図2に示す)は、一貫連続無菌限外濾過システム(300)を含み、一方、本発明の装置B(この2種類の実施形態を図3に示す)は、一貫半連続対流性吸着/脱離システム(400)を含む。
【0064】
本発明の装置は、1つ又は複数の連続灌流発酵槽と直接一体化しており、従って新規な連続一貫製造プラットホームを形成する。
【実施例】
【0065】
装置A
一貫連続粒子除去システム(100)
図2は、本発明の装置Aの2種類の実施形態を示す。一貫連続粒子除去システム(100)は、連続灌流発酵システム(1)の収穫産物側に直接連結している。
【0066】
図4は、ポンプ(101)、圧力計又は圧力伝送器の各々(107)、連結マニホールド(102)及びいくつかのフィルター系列組立品(103)からなる本発明の一貫連続粒子除去システム(100)の実施形態の更に詳細な略図を示す。すべての構成要素は、軟質チューブ及び/又は硬質管と連結している。
【0067】
ポンプ(101)は、従来の蠕動ポンプであり、これにより、回転部分又はシールが無菌生成物と接触することなしに、細胞培養収穫産物の穏やかなポンプ輸送が可能となる。ポンプ及びポンプチューブは、細胞培養発酵システムの所望の収穫産物流量を送達するように所定の大きさに作られており、この流量は、1日当たり最大15バイオリアクターの容量、例えば15リットル発酵槽で最大9.4リットル/時間、200リットル発酵槽で最大125リットル/時間である。
【0068】
圧力計又は圧力伝送器(107)は、高圧蒸気滅菌処理又は照射によって滅菌できるように設計されている。この設計では、ステンレス鋼ハウジング内の再利用可能なピエゾ抵抗伝送器又は再利用可能なステンレス鋼圧力計のいずれかを使用する。しかし、更なる改良によって、照射により容易に滅菌できる使い捨ての伝送器の使用を含めることができる。
【0069】
この実施形態において、連結マニホールド(102)は、軟質チューブ、チューブクランプ(又は弁)及びシステムの無菌性を損なわないで追加のフィルター系列組立品の連結を可能にする適切な無菌連結器で構成される。チューブ径は、所望の流量で約2m/s以下の線流量速度を出すように所定の大きさに作られ、それにより高背圧及び剪断力を防止することが好ましい。他のこの実施形態において、無菌連結器の代わりに、無菌性を損なうことなしに市販のチューブ溶接機で溶接できる特別な軟質チューブ部品を使用する。このようなチューブ部品は、PVC又は他の適切なポリマーで作られている。
【0070】
フィルター系列組立品(103)は、少なくとも2個の、好ましくは複数の同一のフィルター系列(概略図で示す)で構成され、図4(105)に例として示すようにフィルター系列の1つのみが常時開いている。
【0071】
各フィルター系列は、少なくとも1つのフィルターで構成され、1つの前置フィルター及び1つの最終フィルターが直列していることが好ましい(図4に示す)。特定用途のために容量を増やすことが必要である場合は、各フィルター系列(105、106など)自体も複数の並列のフィルター又はフィルター系列(図示せず)で構成することができる。
【0072】
図4に示す本発明の一実施形態において、組立品の第2のフィルター系列(106)は、感圧破裂板又は破裂ピン(104)によって閉鎖される。稼働中、破裂板又は破裂ピンの機能は、第1のフィルター系列(105)内の圧力が指定限界に達したら、自動的に第2のフィルター系列(107)への流路を開けることである。それにより濾過工程が途切れずに継続することが確実となる。又は安全な圧力除去を実現するために使用される市販の破裂板又は破裂ピンを、本発明のシステムで使用する。この実施形態において、非常に有用であると証明されてきた16PSI以下の一定の破裂圧力限界の破裂板又は破裂ピンを使用する。しかし、ある範囲の一定の圧力限界が可能である。
【0073】
フィルター系列組立品の更なる各フィルター系列も、手動弁又は自動弁或いは他の破裂板又は破裂ピンによって分離される。第2のフィルター系列(106)が稼働中であると、次の破裂板又は破裂ピンへの弁が各々開き、次のフィルター系列がバックアップの役目を果たすことができる等である。
【0074】
他の実施形態においては、自動作働弁がもっぱら使用されており、操作時に制御システムが、これも高圧蒸気滅菌処理によって滅菌できるピエゾ抵抗圧力センサー(107)への入力に基づいて弁を作働させる。しかし、出願人等は、破裂板又は破裂ピンを各々含むこの設計は、長期間の稼働において際立ったロバスト性を実現していることを見出した。
【0075】
最終フィルター定格は、少なくとも3μm又はそれ未満であり、0.45μmが好ましく、0.2μmが更に好ましい。従って操作時のフィルター系列(6)は、関連する細胞細片及び他の粒子だけでなく残りの細胞全てを保持し、その結果無粒子の出力ストリーム(9)即ち清澄組織培養液(cTCF)となる。
【0076】
異なる市販のフィルター材料を使用することができる。この設計においては、高圧蒸気滅菌処理又は照射によって滅菌することができる、Sartopure又はSartoclear前置フィルターカプセル(Sartorius、Goettingen)及びSartobran最終フィルターカプセル(Sartorius、Goettingen)などの使い捨てのフィルターカプセルを使用する。
【0077】
1リットル/分の流量で設計した本発明の装置のこの実施形態の一例として、組立品(103)の各フィルター系列(105、106など)は、3個の30”の前置フィルターカプセル(Kleenpak Ultipleat、Pall Corp.、4.5μm定格、各0.75m2)と、それに続いて3個の20”の最終フィルターカプセル(Sartobran P、Sartorius、0.45μm/0.2μm定格、各1.3m2)で構成される。この特定の実施形態は、組換え血液凝固第VIII因子並びにBドメイン欠失第VIII因子を含めた遺伝子組み換え第VIII因子変異体の大規模な製造のために特に有用であることが見いだされた。
【0078】
しかし、出願人等は、各々の従来のバッチ処理と比較すると、本発明の装置及び方法を使用する時、異なる製造者(Pall、Sartorius、Cuno)からの種々の使用可能なフィルター材料及び構成の粒子除去の効率は一貫しており、著しく向上したことを見出した。
【0079】
従って、新規な本発明の装置及び方法は、例えばカプセル当たりの利用可能なフィルター面積が増した型のフィルター、クロスフローのパターン或いはケーク蓄積を最小限にする振動又はフィルター要素の回転などの他の手段を提供する型のフィルターなどの、新規な型及び形状のフィルターの使用も有益であろう。
【0080】
本発明の方法の他の実施形態において、フィルター系列組立品(103)は、破裂板又は破裂ピンによって各々閉じられたただ1つの無菌バックアップフィルター系列を含むが、操作のための複数のフィルター系列も含む。組立品の第1のフィルター系列は、特定の所定の充填容量を処理するまで稼働し、その後の稼働は、組立品の次のフィルター系列に(手動又は自動で)切り替わる。通常の操作条件下で破裂板又は破裂ピンの圧力限界を超えないように一定の充填容量を指定する。しかし、例えば収穫産物の著しく低い濾過性などのために、濾過中に圧力が通常を超える場合、一定の圧力を超えるとバックアップフィルター系列が開くことによって間断ない連続濾過も確実に行う。バックアップフィルター系列が開いた後に、濾過は組立品の他のフィルター系列に切り替わり、破裂板又は破裂ピンが付いた他のバックアップ濾過系列が、システムの無菌性を損なうことなく組み込まれる。
【0081】
バッチ式粒子除去工程のためのフィルター費用及び処理時間の両方を最小限に抑えるためには、バッチ式フィルター系列は、所望の絶対流量(リットル/時間)及び最大圧力を実現するための、必要最小限のフィルター面積を有するように所定の大きさにする必要があることは当業者には公知である。その結果として、所望のバッチ容量で実行可能な処理時間を実現するために、所望の絶対流量は十分に大きくなくてはならない。このため本質的に大きい比流量(リットル/時間/フィルター面積m2)を必要とする。
【0082】
比較され得る最適化されたバッチ式濾過システムと対照的に、本発明の装置では、絶対流量が連続灌流発酵の収穫産物流量に等しいように、一定に保たれる数分の1の小さい比流量(リットル/時間/組み込まれたフィルター面積m2)で設計されている。
【0083】
出願人等は、このような小さな比流量でも、フィルターにより処理できる容量は、バッチ処理で調整する流量よりも不均衡に大きいことを予想外に見出した。
【0084】
従来のバッチ式単離工程では、極端な濾過面積(従って費用)又は低すぎる絶対流量のいずれかのために、このように小さな比流量では妥当と思われないことに注意することが重要である。これは大体の場合、次のバッチために収穫産物を収集している間、バッチ式粒子除去装置は稼働していないことが主な原因である。更に、本発明の方法においてフィルターが達成できる能力の驚くべき不均衡な増加によって、フィルターの消費、従って製造コストの著しい減少が可能になる。
【0085】
サージ容器(200)
図2に示すように、一貫連続粒子除去システムの出口は、サージ容器(201)と直接、常に連結している。このサージ容器は、使い捨てのバッグ又はステンレス鋼容器などの無菌容器であり、少なくとも1つの入口及び1つの出口を有し、出口は容器の底にあることが好ましい。広範囲の容器の大きさ及びデザインを用いることができる。しかし、サージ容器をシステムの処理容量と比べて小さい所定の大きさにして、容器内の生成物の滞留時間を最小限、即ち24時間未満とすることが好ましく、8時間未満とすることがより好ましく、4時間未満とすることが更に好ましい。
【0086】
出願人等は、本発明の装置によって比類なく実行可能となったこのような短い生成物の滞留時間によって、本質的に不安定な蛋白質製品の収率の著しい増加を可能にし、それによって従来技術の問題の1つを解決することを見出した。
【0087】
図3において装置Bl及びB2で示すように、本発明の装置のいくつかの実施形態において、サージ容器は、はかり又はロードセル(202)上にある。このはかり又はロードセルは、コンピュータ制御システム(図示せず)に重量信号を伝える。
【0088】
更に、本発明の装置(B2)の一実施形態において、緩衝液容器(204)が蠕動ポンプ(203)を経由してサージ容器に連結している。操作時にこの装置が使用され、適切な緩衝液又は希釈液を添加することによって、無粒子の収穫産物流れの伝導率(イオン強度)又はpHなどの性質を調整する。この場合、任意選択で混合システム(205)及びpH又は伝導率などの所望の条件をモニターするためのセンサー(206)を使用する。この設計においては、磁気結合型撹拌機を使用するが、振盪機又は脈動装置などの他の混合システムも使用することができるであろう。
【0089】
一貫連続濃縮/精製(300)
図2において2種類の実施形態が示されている装置Aは、一貫連続無菌限外濾過システム(300)を含む。連続無菌限外濾過システムの実施形態は、循環ポンプ(301)及び循環ループ(306)、1つ又は複数の無菌クロスフロー限外濾過モジュール(303)、透過液ポンプ(305)、はかり又はロードセル(309)の上の無菌透過液受取り容器(307)並びに保持液ポンプ(311)を含む。更に、入口圧力計又は圧力伝送器(302)、透過液圧力計又は圧力伝送器(304)、出口圧力計又は圧力伝送器(308)並びに循環流量計(310)の計器類を含む。操作時に、システム出口(312)では、連続して収集・冷凍され、更に処理されることができる濃縮・部分精製蛋白質製品の連続流を実現する。
【0090】
本発明の実施形態A2は、緩衝液又は希釈液容器(314)、緩衝液/希釈液添加蠕動ポンプ(313)、並びにpHセンサー及び伝導率センサー(315、316)などの循環ループ内の濃縮物の調整をモニターするためのフロースルーセンサーを更に含む。操作時にこの装置が使用され、適切な緩衝液又は希釈液を添加することによって、無粒子の収穫産物流れの伝導率(イオン強度)又はpHなどの性質を調整する。この装置は、蛋白質安定剤を添加するためにも使用することができる。本開示において後述するように、本発明の実施形態A2では、循環ループ自体が混合室の役割を果たすが、代わりに装置B(実施形態B2)で示した構成要素(203、204、205、206)を含むサージ容器設備を使用することによっても調整を行うことができる(装置Bの説明を参照)。
【0091】
本発明の装置の実施形態は、計器類(これらに限定されないが、圧力、流量、容器重量、pH、伝導率など)からの入力データ信号を記録して、定義済みの制御アルゴリムに従ってポンプスピードを制御するデータロギング及びプログラマブル制御システムも含む。
【0092】
すべてのポンプ(301、305、311、313)は蠕動ポンプであり、これにより無菌生成物流れに接触する回転部分又はシールなしに、各々の流体流れのポンプ輸送が可能となる。出願人等は、ロバストで無菌の長期間の作働を実現するために、これが好ましいことを見出した。しかし、他の無菌ポンプ設計を原則として使用することができる。使用される限外濾過モジュールの物質移動特性に応じて、80〜800リットル/時間/組み込まれた膜面積m2の所望のクロスフロー流量のロバスト調整が可能となるために、循環ポンプ(301)及びそのポンプチューブは所定の大きさに作られる。連続灌流発酵からの収穫産物流量の90%〜99%の透過液比流束のロバストで正確な調整を可能にするために、透過液ポンプは所定の大きさに作られる。連続灌流発酵からの収穫産物流量の1%〜10%の保持液流れのロバストで正確な調整を可能にするために、保持液ポンプは所定の大きさに作られる。
【0093】
カプセル収納限外濾過モジュール(303)は、ロバストな無菌操作を可能にするために使用され、高圧蒸気滅菌処理又は照射によって滅菌される。最適な名目上の分画分子量は、対象蛋白質製品の分子量に基づいて選択し、当業者に周知の標準実験によって確認されなくてはならない。膜に損傷を与えずに膜モジュール全体を照射及び/又は高圧蒸気滅菌処理によって滅菌できる限りは、ポリエーテルスルホン、親水化ポリエーテルスルホン又は再生セルロースなどの種々の膜材料を使用できる。親水性材料は、その低いファウリング傾向によって効率性を向上させることがきることが期待されている。
【0094】
出願人等は、装置Aは、組み込まれた全限外濾過膜面積(平方メートル)が連続灌流発酵からの収穫産物の体積流量(リットル/時間)の0.1〜2倍の範囲に等しければ、比類なく効率的であることを見出した。例えば1リットル/時間の灌流収穫産物流量では、設置された全膜面積は、0.1〜2平方メートルとすべきである。出願人等は、装置Aが、設置された限外濾過膜面積(平方メートル)が連続灌流発酵からの収穫産物の体積流量(リットル/時間)0.3〜1倍の範囲と等しい場合は、更に効率的であることを見出した。
【0095】
本発明の一実施形態において、市販の「使い捨ての」中空糸膜モジュール(GE Healthcare、旧Amersham Biosciences)を使用する。しかし、スパイラルモジュール、第2のフローパターン(例えば、渦流れ)により物質移動が強められたカプセル化カセット又はカプセル、回転要素(例えば、ダイナミック円板フィルター)或いは振動フィルターなどの、種々のカプセル化膜及びモジュール設計を用いることができる。特にカプセル化限外濾過カセットは、必要とされる比較的低いクロスフロー流量において高い物質移動係数を実現するため、本発明の装置において有利に使用することができ、従ってシステムの複雑さ及び投資費用を低く抑える一方で、ポンプ容量が減少することが期待される。
【0096】
本発明の装置は、単なる無菌的操作とは対照的に、連続操作のみならず真の無菌操作を可能にする。出願人等は、洗浄だけでなく、高圧蒸気滅菌処理、定置蒸気滅菌又はガンマ線照射による滅菌に対して耐性がある全ての製品接触システムの構成要素を設計することでこれを達成した。この実施形態においては、連続粒子除去(100)及び連続限外濾過(300)のために、使い捨てのカプセル収納モジュールを使用する。生成物が回転要素及びメカニカルシールと接触するのを防止するために、蠕動ポンプを使用する。更にこの実施形態においては、硬質管の代わりに、使い捨てのチューブ及びバッグ組立品を使用する。使い捨ての製品接触構成要素(例えば、チューブ、バッグ、モジュール)又は構成要素グループは、前もって組み立てて共に滅菌し、それによって運転開始及び操作が単純化する。このシステムは、標本抽出及びバッグ又は計器類の交換に関して、環境(例えば、層流フード)に対する無菌システムを開く可能性を最小限にするように設計されている。この装置のこの実施形態においては、マニホールドは、1つの無菌構成要素(例えば、製品受取りバッグ)から次の構成要素への切り換えが開くことなしで可能であるように冗長に設計されている。チューブ、モジュール又はバッグの追加交換は、無菌連結器ではなく、無菌チューブ溶接機を使用して行うことが好ましい。
【0097】
本発明の装置の他の将来の実施形態は、長期稼働におけるロバスト性及び無菌性が確実される限り、定置での、単独での又は使い捨ての構成要素と組み合わせての滅菌ができるステンレス鋼容器、フィルターハウジング又は管などの構成要素も含むことができるであろう。
【0098】
本発明の装置Aの他の実施形態では、より大きな製造設備において複数の発酵槽からの物質を処理するように設計する(A3)。一例を概略的に図5に示す。他の実施形態では、2ステージの連続限外濾過システム(300)を直列に組み合わせることによって、全体の濃縮係数及び分離性能が増加するように設計する(A4、図5で概略的に示す)。
【0099】
装置Aを使用した方法の説明
連続灌流発酵は、通常2週間〜6ヶ月以上の長期間(1キャンペーン)にわたり稼働する。生成物、細胞及び細胞片を含有する組織培養液(TCF)は、装置Aを使用して連続して処理される。無菌で無粒子の濃縮・部分精製生成物流れ(「単離生成物」)が生成し、出口(312)で装置から連続して排出される。連続無菌粒子除去システム(100)のポンプ(101)を使用することによって、収穫産物は、発酵の所望の灌流収穫産物流量Qhで、濾過組立品(103)を通ってポンプで連続して押し出される。
【0100】
連続濾過システムの出力ストリーム、即ち清澄組織培養液(cTCF)は、サージ容器(201)に連続して入る。cTCFは、サージ容器から、無菌限外濾過システム(300)によって、連続灌流発酵からの流量と等しい流量で連続して処理される。調整された流量に対するサージ容器の小さい容量のために、容器内の生成物の平均滞留時間は最小限、即ち12時間未満、好ましくは4時間未満、更に好ましくは2時間未満に抑えられる。
【0101】
適切なクロスフロー、従って物質移動は、限外濾過モジュール内で循環ポンプ(301)を経由して調整される。保持液ポンプ(311)を使用することによって、保持液流量が調整、制御され、従って濃縮された単離生成物が装置Aから出る一定の連続した流量Qiが出口(312)で生じる。透過液ポンプ(305)を使用して透過液の流量Qpを調整し制御するが、この透過液は限外濾過モジュールの透過液側から連続して引き寄せられ、水及び限外濾過膜を通るのに十分に小さい溶液成分(例えば、塩、小さい蛋白質)からなる。
【0102】
透過液の流量(Qp)及び保持液/分離物(Qi)を、注意深く調整し制御し、発酵の収穫産物流量Qhと一致させる。
Qp+Qi=Qh
同時に、流量を調整、制御し、
Qi=1/cf*Qh
を満たすことにより所望の濃縮係数cfを実現する。例えば、当初の収穫産物濃度の10倍の所望の分離物中の生成物濃縮係数を実現するために、保持液/分離物ポンプ(311)を使用して、QiをQi=1/10*Qhで制御し、一方透過液ポンプ(305)を使用して、QpをQp=0.9*Qhで制御する。
【0103】
放流量はポンプ(305)及び(311)によって制御されているので、限外濾過システムは自動的に小さいサージ容器(201)からQp+Qiの流れを引き寄せる。
【0104】
実施形態A2(図2右側参照)を用いる場合は、緩衝液添加ポンプ(313)を使用して、容器314からの注入用の緩衝液又は水の無菌流が連続限外濾過システムに一定流速Qbで連続して添加される。従って、分離物の条件は、例えばイオン強度、pH、安定剤の添加などに関して、自由に連続して調節することができる。従って、流量は
Qp+Qi=Qh+Qb
で制御される。更に、Qi=1/cf*(Qh+Qb)を満たすことによって所望の濃縮係数cfを実現するように、流量比を選択できる。代わりに、この方法は、Qi=Qh+Qbを設定することによって、条件(例えば、pH、伝導率)を変えるためだけに使用することができる。
【0105】
新規な装置Aを使用した方法はまた、限外濾過自体の操作設定点に関して、バッチ式UF工程(従来技術)と対照をなす。従来のバッチ式UF工程は、短期間の小さい膜面積を通しての特定の処理量のために設計されている。従って、バッチ式UFは一般に、物質移動制御領域に依存する圧力の転移点で操作を行う(図9参照)。これにより、当初は望ましく高い比流束となるが、濃度分極によって浸透背圧と、制限的なゲル層(第2の膜)のすばやい形成につながるため、数秒から数分の間に急激に著しく低下する。このような高分子の高い壁濃度は、外側及び内側の膜表面への化合物の吸着の増加、即ち膜ファウリングにもつながる。このファウリングは、時間と共に透過流束を更に減少させるであろう。
【0106】
出願人等は驚いたことに、装置Aでは、圧力−流束カーブの下端で操作することにより組み込まれた限外濾過膜の面積当たりの何倍もの充填容量が得られることを見出した(図9参照)。
【0107】
完全に保持された成分の規格化された壁濃度(cwall)は、下記のように記述できる。
【数1】

式中
J=透過液比流束(リットル/時間/m2)
kd=物質移動係数(リットル/時間/m2)
cbulk=溶液バルク中の成分の濃度
【0108】
バッチ式UFと同様に、連続UFでは、濃度分極を最小限にするために、最適化された物質移動係数で操作する。しかしバッチ式限外濾過と対照的に、出願人等は、透過流束Jを圧力−流束カーブの下端となるように調整する(図9参照)。従って指数関数的関係の結果、膜表面での壁濃度(cwall)は、バッチ式限外濾過よりも著しく低い。例えば、本発明の方法のこの実施形態では、達成可能な物質移動係数の約1/10の目標透過液比流束を調整し、それにより調整したバルク(又は保持液)濃度から10%だけ高い壁濃度を調整する
【0109】
下記の表1は、開発規模の発酵槽からの蛋白質製品の連続単離のために装置A(実施形態A1)を使用した方法の一例を示す。
表1
連続灌流発酵からの蛋白質製品の連続単離のために、装置Aのこの実施形態を用いる方法の例
【表1】

【0110】
各々個別の製品分子のために、例えば膜貫通圧力に基づくなど無菌連続限外濾過設備の耐用期限の基準を定義することができる。膜貫通圧力限界を超えると、連続無菌限外濾過設備は、システムの整合性及び無菌性を損なわずに他の同一の設備と交換される。これは、マニホールド及び無菌連結器のいずれかを使用することによって、或いは使い捨て軟質チューブ及び無菌チューブ溶接機を使用することによって、連続無菌濾過設備と同じように行うことができる。
【0111】
装置B
一貫連続粒子除去システム(100)
図3は、本発明の装置Bの2種類の実施形態を示す。一貫連続粒子除去システム(100)は、連続灌流発酵システム(1)の収穫産物側に直接連結している。装置Bのこの部分は、装置Aと同一である(上記の装置Aの詳細な説明及び図4を参照)。
【0112】
サージ容器(200)
一貫連続粒子除去システムの出口は、図3に示すように、サージ容器(201)に直接に常に連結している。このサージ容器は、少なくとも1つの入口及び1つの出口を有する使い捨てのバッグ又はステンレス鋼容器などの無菌容器であり、出口は容器の底にあることが好ましい。広範囲の容器の大きさ及びデザインを用いることができる。しかし、サージ容器をシステムの処理容量と比べて小さい所定の大きさにして、容器内の生成物の滞留時間を短く、即ち26時間未満とすることが好ましく、12時間未満がより好ましく、4時間未満にすることが更に好ましい。
【0113】
図3において実施形態Bl及びB2で示すように、サージ容器は、はかり又はロードセル(202)上にある。このはかり又はロードセルは、コンピュータ制御システム(図示せず)に重量信号を伝える。
【0114】
更に、本発明の装置(B2)の一実施形態において、緩衝液容器(204)が蠕動ポンプ(203)を経由してサージ容器に連結している。操作時にこの装置が使用され、粒子除去システムから受け取った清澄組織培養液の性質を改質するために、適切な緩衝液又は希釈液或いは適切な蛋白質安定化剤などの成分を添加することによって、無粒子の収穫産物流れの伝導率(イオン強度)又はpHなどの性質を調整する。この場合、この実施形態では、混合システム(205)も含み、pH又は伝導率などの所望の条件(206)をモニターするためのセンサーを使用する。この実施形態において、磁気結合型撹拌機を使用するが、振盪機又は脈動装置などの他の混合システムも使用することができるであろう。
【0115】
本発明の装置の他の実施形態においては、2つのサージ容器を使用する。常時1つのサージ容器が、連続粒子除去システム(100)に直接連結しており、従って清澄液を受け取り、一方他の容器は半連続濃縮/精製システム(400)に連結しており、従って対流性吸着/脱離サイクルに供給を行う。両方の間の切り換えは、最大の充填容量に達すると、受取り容器の重量を利用してスイッチを入れる制御システムによって行う。
【0116】
一貫半連続濃縮/精製(400)
その2種類の実施形態が図3に示されている装置Bは、一貫半連続対流性吸着/脱離システム(400)を含む。
【0117】
一貫半連続対流性吸着/脱離システムは、その充填流量(Qload)が連続灌流収穫工程及び連続濾過工程(Qh)、の流量より著しく高くなるように(即ち、Qload>>Qh)、所定の大きさに作るように設計されている。
【0118】
一貫半連続濃縮/精製システム(400)の実施形態は、充填ポンプ(401)、マルチポート弁組立品(402)及びいくつかの緩衝液容器(404)、無菌廃棄物受取り容器(413)と1つ又は複数の対流性吸着器モジュール(406)とに連結した三方弁(403)、入口及び出口圧力計又は圧力伝送器(405、408)、UVセンサー(409)、pHセンサー、伝導率センサー(409、410)、流量計(412)などの別の計器類、廃棄物容器(413)と生成物溶出液出口(414)とに連結する別の三方弁(407)を含む。
【0119】
本発明の装置の実施形態は、計器類(これらに限定されないが、圧力、UV、pH、伝導率、流量、サージ容器重量などの)からの入力データ信号を記録するデータロギング及びプログラマブル制御システム(図示せず)も含み、プログラムされた手順に従って自動弁及びポンプを制御する。
【0120】
充填ポンプ(401)は、生成物又は無菌緩衝液がシール又は機械的部品との直接の接触を回避するために蠕動ポンプであることが好ましい。出願人等は、これがロバストな無菌の長期間操作を実現するために好ましいことを見出した。しかし、他の無菌ポンプ設計を原則として用いることができる。充填ポンプは、対流性吸着器(406)の組み込まれたマトリックス容量に応じて所定の大きさに作られ、少なくとも12マトリックス容量/分のロバスト調整を可能にする。例えば、この実施形態においては、約0.3リットルのマトリックス容量を有するMustang膜吸着器カプセル(Pall Corp.)を使用する。従って、充填ポンプは、3.6リットル/分までの充填流量が可能となるように所定の大きさに作られる。
【0121】
マルチポート弁組立品(402)の機能は、サージ容器(201)から引き寄せられた生成物を含有する充填物と、無菌緩衝液容器(404)からの無菌緩衝液及び清浄液の各々との間での切り換えを可能にすることである。装置Bのこの実施形態では、各緩衝液容器に連結する軟質チューブを外側からはさみ各ラインを開閉する一連の自動作働のピンチ弁を利用する。出願人等は、このようなピンチ弁は、製品との接触を防止し、従って洗浄及び滅菌する必要がないため、装置Bが特に有利な解決策を実現することを見出した。しかし、作動膜弁などの無菌処理に適切で当業者に周知の広範囲の市販の弁を使用することができる。
【0122】
この実施形態では、三方弁(403、407)は高圧蒸気滅菌に耐える作動膜弁である。しかし、例えばピンチ弁を含めて無菌処理に適切な種々の市販の弁を原則的に使用することができる。
【0123】
対流性吸着器モジュール(406)は、吸着表面への生成物の顕著な対流物質移動を有するクロマトグラフマトリックスを含有し、従来のクロマトグラフィーと対照的に、操作前に高圧蒸気滅菌処理、蒸気処理又は照射によって滅菌を行う。従来の充填層クロマトグラフィーとは対照的に、顕著な対流物質移動によって非常に短い吸着/溶出/再生サイクル時間が可能となり、出願人等は本発明の装置において半連続操作を実現するためにこれを利用する。
【0124】
本発明の装置のこの実施形態では、対流性吸着器(406)は1つ又は複数の市販のイオン交換性の膜吸着器カプセルで構成される(Mustang、Pall corporation又はSartobind、Sartorius)。しかしこの装置では、従来のクロマトグラフィーとは対照的に樹脂の充填がなく、マトリックスは一般にすぐ使用できるモジュール内にカプセル化されているので、他の材料及び形状の膜吸着器と同様に、一貫マトリックスなどの新規な対流性マトリックスも利用することができる。
【0125】
更に、特定の生成物結合リガンドを含有する対流性アフィニティーマトリックスを含めた他の化学的性質も、本発明の装置において比類なく有益な性能をもたらすであろう。
【0126】
本発明の装置の一実施形態においては、連続粒子除去システム(100)と同様の装置内の並列の対流性吸着器系列の組立品の形で、複数の対流性吸着器モジュールを使用する。全吸着器系列を有する全組立品は共に滅菌を行い、それにより操作時に最初の系列の耐用期間が終わった場合は、例えば充填中の背圧又は稼働運転サイクルの最大数などの予め定義された基準に則して、1つの吸着器系列から新鮮な系列への切り換えが可能になる。各吸着器系列は、1つの単体モジュール或いは複数の並列及び/又は直列の対流性吸着器モジュールのいずれかで構成され、結合能力が増加及び/又は稼働率が向上する。
【0127】
本発明の装置は、単なる無菌的操作とは対照的に、連続操作のみならず真の無菌操作を可能にすると強調することは重要である。出願人等は、すべての製品接触システムの構成要素を洗浄だけでなく、高圧蒸気滅菌処理、定置蒸気滅菌又はガンマ線照射よる滅菌にも耐性があるように設計したことによりこれを達成した。この実施形態においては、連続粒子除去(100)と同様に半連続無菌対流性吸着/脱離(400)のために、使い捨てカプセル化モジュールを使用する。蠕動ポンプは、製品が回転要素及びメカニカルシールと接触するのを防止するために使用する。更に、この実施形態においては、硬質管の代わりに、使い捨てのチューブ及びバッグ組立品を使用する。使い捨ての製品に接触する構成要素(例えば、チューブ、バッグ、モジュール)又は構成要素グループは、前もって組み立てて共に滅菌し、それによって運転開始と操作が単純化する。このシステムは、標本抽出並びにバッグ又は計器類の交換に際して、環境(例えば、層流フード)に対して無菌システムが開く可能性を最小限にするように設計されている。この装置のこの実施形態においては、マニホールドは、1つの無菌構成要素(例えば、製品受取りバッグ)から次の構成要素への切り換えを開くことなしで可能であるように冗長に設計されている。チューブ、モジュール又はバッグの追加交換は、無菌連結器ではなく、無菌チューブ溶接機を使用して行うことが好ましい。
【0128】
本発明の装置の他の将来の実施形態は、長期稼働におけるロバスト性及び無菌性が保証される限り、定置での、単独での又は使い捨ての構成要素と組み合わせての滅菌ができるステンレス鋼容器、フィルターハウジング又は管などの構成要素も含むことができるであろう。
【0129】
本発明の装置Bの他の実施形態では、より大きな製造設備において複数の発酵槽からの物質を処理するように設計されている(B3)。一例を概略的に図6に示す。本発明の装置Bの他の実施形態では、複数の対流性吸着/脱離システム(400)とその間に各々の無菌サージ容器を(200)を直列に組み合わせることによって、全体の濃縮係数及び分離性能が増加するように設計する(B4、図6を参照)。
【0130】
更に本発明の装置の他の実施形態では、連続限外濾過システム(300)を追加のサージ容器を経由して半連続対流性吸着/脱離システム(400)と直列に組み合わせることによって全体の濃縮係数及び分離性能が増加するように設計されている。一実施形態の一例を概略的に図7に示す。
【0131】
装置Bを使用した方法の説明
連続灌流発酵は、通常2週間〜6ヶ月以上の長期間(1キャンペーン)にわたり稼働する。生成物、細胞及び細胞片を含有する組織培養液(TCF)は、装置Bを使用して連続して処理される。無菌で無粒子の濃縮・部分精製生成物流れ(「単離生成物」)が生成し、出口(412)で装置から連続して排出される。連続無菌粒子除去システム(100)のポンプ(101)を使用することによって、収穫産物は、発酵の所望の灌流収穫産物流量Qhで、濾過組立品(103)を通ってポンプで連続して押し出される。
【0132】
連続濾過システムの出力ストリーム、即ち清澄組織培養液(cTCF)は、サージ容器(201)に連続して入る。
【0133】
サージ容器が予め定義されたレベルまで満たされると、重量信号又はレベル信号が自動的に一貫無菌半連続濃縮/精製システムの吸着/脱離サイクルを作動させる。サージ容器内の収集物は、迅速に、即ち4時間以内、好ましくは2時間以内、更に好ましくは1時間以内に吸着器設備に充填され、従ってサージ容器が空となる。
【0134】
図3に示すこの実施形態では、無粒子の清澄組織培養液(cTCF)の収集は、同様の小さいサージ容器内で常に行われる。従って小さいサージ容器中の容量は、最小寸法から最大寸法まで異なる。前述の他の実施形態においては、2つの同一のサージ容器間で相互に切り換えて収集が行われる。
【0135】
サージ容器へのcTCFの収集が続いている間、充填された吸着器は、目的生成物を濃縮精製した形で脱着し、次の充填サイクルのために吸着器を準備するように設計された、予め定めたクロマトグラフィー手順のさらなるステップを経由する。従って、全てのサイクルは充填、洗浄、溶離、再生及び再平衡を含み、各々が1種又は複数の適切な緩衝液と共に行われる。
【0136】
ここにおいても、対流性吸着器の性質からこのようなステップの間の流量は多い可能性があるため、全サイクル時間は短く、即ち6時間未満、好ましくは3時間未満、更に好ましくは1.5時間未満に抑えられる。従って、一貫システムでは、サージ容器が再び満たされる前に、吸着器設備が次の充填サイクルの準備ができているように設計されており、従って半連続稼働が可能になる。
【0137】
下記の表2は、組換えヒト血液凝固第VIII因子単離のための本発明の装置Bのこの実施形態を用いた方法の一例を示す(大規模データを示す)。この方法は比類なく有益であることを証明した。各吸着/脱離サイクルの収率及び性能は、バッチと同様であったが、製品の滞留時間が短くなったため全体の製品の収率は10%超増加し、従って製品の劣化が最小限となった。大きさ及び他の特徴が全長第VIII因子とは著しく異なっている、Bドメイン欠失第VIII因子を含めた遺伝子組み換え第VIII因子変異体の単離のために、同じ方法が非常に有益であることも証明した。他の蛋白質及び生体分子の製造に有用であることが期待されている。
【0138】
クロマトグラフィー手順自体(緩衝液の化学的性質及び順序、充填容量及び流量)は、各々個々の分子のためにバッチ式クロマトグラフィー実験において開発することができ、次いで本発明の装置の実施形態で使用するために即座に移行することができる。
表2
連続灌流発酵からの第VIII因子及び第VIII因子変異体の連続単離のための装置Bのこの実施形態を用いた方法の実施例
【表2】

【0139】
各々個別の製品分子のために、例えば充填又は回収中の圧力に基づくなど、対流性吸着器設備の耐用期限の基準を定義する。通常は、サイクルの最大数(nmax)を特定し、確認される。半連続操作においてnmaxサイクルを通して吸着器設備が使用されると、システムの整合性及び無菌性を損なうことなく同一の吸着器設備と交換される。この実施形態においては、マニホールド及び無菌連結器のいずれかを使用することによって、或いは使い捨て軟質チューブ及び無菌チューブ溶接機を使用することによって、連続無菌濾過設備と類似してこれを行うことができる。
【0140】
図3の右側に示す本発明の装置の実施形態を用いる時は、緩衝液、pH調節液、安定化剤溶液又は注入用水の無菌流を、緩衝液添加ポンプ(203)を使用して無菌容器(204)から連続又は断続的に添加する。従って、例えばイオン強度、pH、安定剤の添加などに関するcTCFの条件は、自由に調整できる。
【0141】
発明の効果
本発明の装置及びこの装置を使用する各々の方法は、上記で概説した従来の単離工程の問題を解決する(背景技術参照)。
【0142】
装置A及びB並びにこの装置を使用する各々の方法のすべての実施形態において、潜在的に有害な環境での生成物滞留時間は、比類なく最短化し、それによって本質的に不安定で複雑な生物学的製品の収率と質が著しく増加する。設備能力が増加し、商品コストの減少が可能となる。
【0143】
更に、装置及び各々の方法は、大容量の収穫産物の中間貯蔵のための大規模な低温室設備又は冷却容器の必要をなくし、それによって設備投資コストが減少し、灌流発酵の小型で可動性の利点を十分に実現する。
【0144】
本発明の装置及び各々の方法の両方の実施形態は、本質的に高い自動化によって、従来の労働集約型のバッチ処理と比較して労務費を減少させる。この新規な装置によって、長期間にわたり1日24時間の連続稼働が可能になり、処理容量及び装置稼働率が最大化となる。
【0145】
更に、本発明の装置は、1つ又は複数の発酵槽の設備における物流的な困難を解消する。実施形態は1つ又は複数の連続灌流発酵のいずれかからの物質も処理することができる。
【0146】
重要なことに、新規な装置及び方法によって完全な無菌操作が可能となるため、単純な無菌濾過に続く無菌的処理では達成できなかった微生物の充填問題及びエンドトキシンの問題が解消する。
【0147】
更に、本発明の装置は、使い捨て用品を利用することによって、清浄である確認をする必要を回避又は最小限にできる。本発明の装置及び方法の独自の特性によって、使い捨てのモジュール、チューブ、バッグ及び組立品は、各々長期間使用することができ(キャンペーンの全期間まで)、従って劇的に費用が低下し、経済的な観点から言えば使い捨て品の利用を非常に魅力的なものとしている。
【0148】
本発明の装置A及びB並びに各々の方法のこの実施形態は、組換え血液凝固第VIII因子はもちろん、これに限定されないがBドメイン欠失第VIII因子などの第VIII因子の遺伝子組み換え版の製造に特に有用であることを証明した。しかし、本発明は明らかに、他の蛋白質及び生体分子、特に第VII因子、第IX因子、第X因子及びその他のものなどの複雑で本質的に不安定な蛋白質の製造にも同様に有用であることが期待できる。
【0149】
装置A及び各々の方法の利点
図8は、出願人等が一貫連続粒子除去要素(100)に見出した驚くべきフィルター容量の増加の一例を示す。
【0150】
図10は、通常の条件下でのモデル蛋白質の280nmでの保持液のUV吸着の測定による、本発明の装置Aの実施形態の連続UFシステム(300)の通常の生成物の滞留時間分布及び平均滞留時間を示す。見て分かるとおり、このシステムの生成物の平均滞留時間は、わずか約40分である。従って、装置Aのこの実施形態における発酵槽収穫産物ラインから最終の濃縮された保持液(分離物)への生成物の全滞留時間は、1〜2時間以下に収まる。これは従来のバッチ式単離工程の28時間以上の滞留時間の1/10未満であり、生成物(収穫産物)は少なくとも24時間(数日まで)で回収され、その後生成物は通常少なくとも4〜10時間処理される。
【0151】
図11は、血漿蛋白非含有の連続灌流発酵からの組換え血液凝固因子(r第VIII因子)の、従来のバッチ式単離工程(バッチ式濾過及びバッチ式UF)並びに本発明の装置A及び各々の方法の使用との両方によって得られた全単離収率の比較を示す。図を見て分かるとおり、本発明の連続工程は、著しくより高い製品収率を実現し、それによって製造能力の増加及び製造費の低下が実現する。
【0152】
装置Aを使用した本発明の方法の間に、膜の比流束(リットル/時間/m2/バール)が一定の処理容量で減少する間に、一貫連続限外濾過の膜貫通圧力は時間の経過とともに増加するであろう。これは、濃度分極、ゲル層形成及びファウリングなどの影響によってすべての限外濾過工程に共通である。しかし、バッチ式限外濾過と対照的に、図12において示す例から見て分かるとおり、装置Aの圧力及び比流束の変化は非常に遅く、それにより膜を洗浄又は交換する前に1回に数週間の連続稼働が可能になる。更に、このシステムの変化率及び全体的性能は、生成した生成物又は連続灌流発酵で使用される細胞系に対し極めて非感受性である(図12)。従って、本発明の装置A及び各々の方法は、異なる細胞系からの様々な標的蛋白質に対してロバストかつ予想通りに作動するので、様々な蛋白質の迅速な製造のための一般的なプラットホームにも理想的に適している。
【0153】
驚いたことに、出願人等は装置Aではゲル層形成及びファウリングの悪影響が実際極めて最小化したことと、フィルターの洗浄又は交換が必要となる前に組み込まれた限外濾過膜面積当たりに処理できる全容量が著しく増加したこととを見出した。図13は、長期間にわたる本発明の装置Aのロバスト性能を示す。約25日後に、膜貫通圧力は驚いたことに準定常状態で安定化したように見え、長期性能が更に高いことを示唆した。27日目に、より高い処理量の効果を試験するために保持液流量を意図的に2倍にした。34日後に、システムを開けずに、従って完全なシステムの整合性及び無菌性を維持しながら、無菌のNaOH0.5Mで短い洗い流しを行った。この後、TMPは再び安定化、又は少なくともわずかな率だけ増加した。システム性能への影響を試験するために、連続無菌操作の70日後に、循環流量を意図的に半分に減少させた。予想どおりに、TMPは、減少した物質移動、従って膜表面で増加した壁濃度によって、ある程度高い率で増加し始めた。しかし、このシステムを止めるまでの95日間の操作は成功裡にロバストに終了した。最小限の手作業で(毎日の標本抽出のみ)、膜面積m2当たり全部で4500リットルに近い量が処理された。比較すると、同じ用途のための最適化した従来のバッチ式限外濾過工程は、約100l/m2と45分の1の充填能力であり、常時少なくとも1〜2人のオペレーターが必要である。
【0154】
また驚いたことに、本発明の装置Aの、特に一貫連続限外濾過システム(300)の選択性は、従来のバッチ操作の選択性より著しく高いことを証明した。従来のバッチ式限外濾過では、工程の当初のステージの間に、保持された高分子から第2の膜が形成され(ゲル層)、これが明らかに分画分子量を減少させることは当業者には公知である。その結果、標的分子と汚染したより小さい蛋白質とが保持され、そのため重要な同時精製が実際的に不可能となる。従って、従来のバッチ式限外濾過では、分子量が10倍未満に離れた蛋白質の分離が可能であることはめったにない。しかし、図14から見て分かるとおり、本発明の一貫連続限外濾過工程では、効率的にIL−2SA(約16kD)及び緑色蛍光蛋白質GFP(27〜30kD)を分離するために条件を調整することは可能である。この予想よりも高い分離性能によって、同時濃縮及び精製を可能にする。
【0155】
装置B及び各々の方法の利点
図15は、本発明の装置Bの性能を示す。市販の対流性吸着器(Mustang Q、Pall Corporation、15層モジュール)を使用して、約100の継続的吸着/脱離サイクルを行い、連続灌流培養からの組換え第VIII因子変異体の濃縮精製を行った。達成した平均収率は約95%であり(アッセイの変動からのスプレッドの結果)、一方行われたサイクルの全てを通して圧力は比較的一定であった。従って、少なくとも100の継続的サイクルは吸着器設備を交換するまでに行うことができると明記することができる。
【0156】
本発明の装置Bを使用する方法の詳細な説明で示したように、生成物の全平均滞留時間は、この実施形態において、適切な緩衝液中で濃縮精製し安定化した形で溶離するまで3時間未満である。これは1日1回行われる従来のバッチ式単離工程における24時間の滞留時間より著しく短く、従って本質的に不安定な蛋白質製品の収率が著しく増加する。前に説明したこの実施形態において、1日当たり約13サイクルが行われ、これは図15と関連して、無菌性及び操作の連続性を損なうことなしに行われる半連続吸着器組立品の交換が、7〜8日毎にだけ必要であろうことを意味する。
【0157】
図16は、装置Bの1回の通常の吸着/脱離及び再生サイクルにおけるUV及び伝導率プロファイルの一例を示す。450(CV)超の吸着器容量を充填できる一方で、生成物の溶離が非常に鋭いピークであることが分かる。充填段階並びに洗浄及びストリップ(再生段階)の間に、流れ中の汚染物質は著しく除去される。
【0158】
図17は、半連続対流性吸着/脱離を含む本発明の方法の精製性能を示す。第VIII因子変異体分離物のSDS pageゲルの一例を示す。見て分かるとおり、充填された第VIII因子変異体の95%を含んだ溶出液画分(分離活性アッセイによって決定)は、充填物より蛋白質の含有が著しく少なく、従って精製されている。溶出液(分離物)中にさらなる分解バンドは見られず、これは優れた製品の質を示している。
【0159】
要約すれば、本発明の装置Bは、バッチ処理に匹敵するような同様の精製性能を実現することができ、同時に一方で本質的に不安定な蛋白質製品の収率損失と、製品の滞留時間の最小化による製品の質の問題とを最小化する。同時に、本発明の方法の本質的に高度な自動化によって労務費が劇的に減少し、オペレーター介入の必要性が最小となる。
【0160】
前述で本発明を理解するために例示として少し詳しく説明したが、ある種の変更及び修正が行われ得ることは当業者なら明らかであろう。従って、説明及び例示は、添付特許請求の範囲で叙述した本発明の範囲を限定するものとして解釈するべきではない。
【0161】
従って、本明細書において所与の供給流からの対象分子の高収率を実現するための濾過の改良した方法を提供する本発明の実施形態は、本発明の原理の応用の単なる例示であることを理解すべきである。本発明の精神又は添付特許請求の範囲から逸脱することなしに、本開示の構成要素の形態、使用方法、用途の変更を行えることは前述の説明から明らかである。
【0162】
(参照事項)
(1) 流束対TMP曲線の圧力依存性領域において、対象分子の転移点より下の比流量で連続限外濾過によって不均一な清澄液混合物を濾過するステップを含み、前記比流量が連続限外濾過の間を通して実質的に一定に維持されている、
不均一な清澄液混合物から対象分子を精製する方法。
(2) 保持液の濃度を約20%未満超える壁濃度を生じる比流量で前記清澄混合物を濾過するステップを更に含む、(1)に記載の方法。
(3) 保持液の濃度を約15%未満超える壁濃度を生じる比流量で前記清澄混合物を濾過するステップを更に含む、(1)に記載の方法。
(4) 保持液の濃度を約10%未満超える壁濃度を生じる比流量で前記清澄混合物を濾過するステップを更に含む、(1)に記載の方法。
(5) 前記清澄液混合物を、清澄液混合物の体積流量(リットル/時間)の0.1〜2倍にほぼ等しい面積(平方メートル)を有する限外濾過膜を通して濾過するステップを更に含む、(1)に記載の方法。
(6) 前記限外濾過膜が、前記清澄液混合物の体積流量(リットル/時間)の0.3〜1倍にほぼ等しい面積(平方メートル)を有する、(5)に記載の方法。
(7) 不均一な組織培養液混合物から対象蛋白質を精製するための方法であって、
(a)連続灌流発酵工程によって、対象蛋白質を含有する不均一な組織培養液混合物を製造するステップと、
(b)前記組織培養液混合物を、連続灌流発酵工程と一体化した連続粒子除去工程へと移送するステップと、
(c)前記連続粒子除去工程において、前記組織培養液から粒子状汚染物質を除去し、対象蛋白質を含有する清澄組織培養液を製造するステップと、
(d)前記清澄組織培養液を、連続粒子除去工程と一体化した連続精製工程に移送するステップと、
(e)前記連続精製工程において、前記清澄組織培養液から前記対象蛋白質を精製するステップと
を含み、
前記連続灌流発酵工程、連続粒子除去工程及び連続精製工程の間を通して、混合物の比流量が実質的に一定に維持されている上記方法。
(8) 前記連続精製工程が限外濾過である、(7)に記載の方法。
(9) 前記清澄組織培養混合物を、保持液の濃度を約20%未満超える壁濃度を生じる比流量で濾過するステップを更に含む、(8)に記載の方法。
(10) 前記清澄組織培養混合物を、保持液の濃度を約15%未満超える壁濃度を生じる比流量で濾過するステップを更に含む、(8)に記載の方法。
(11) 前記清澄組織培養混合物を、保持液の濃度を約10%未満超える壁濃度を生じる比流量で濾過するステップを更に含む、(8)に記載の方法。
(12) 前記連続灌流発酵からの体積流量(リットル/時間)の0.1〜2倍にほぼ等しい面積(平方メートル)を有する限外濾過膜を通して、前記清澄組織培養混合物を濾過するステップを更に含む、(8)に記載の方法。
(13) 前記連続灌流発酵からの体積流量(リットル/時間)の0.3〜1倍にほぼ等しい面積(平方メートル)を有する限外濾過膜を通して、前記清澄組織培養混合物を濾過するステップを更に含む、(8)に記載の方法。
(14) 不均一な組織培養液混合物から対象蛋白質を精製するための方法であって、
(a)連続灌流発酵工程によって、対象蛋白質を含む不均一な組織培養液混合物を製造するステップと、
(b)前記組織培養液混合物を、連続灌流発酵システムと一体化した連続粒子除去工程に移送するステップと、
(c)前記連続粒子除去工程において前記組織培養液から粒子状汚染物質を除去し、対象蛋白質を含有する清澄組織培養液を製造するステップと、
(d)前記清澄組織培養液を連続粒子除去工程と一体化したサージ容器に移送するステップと、
(e)前記清澄組織培養液を前記サージ容器と一体化した精製工程に断続的に移送するステップと、
(e)前記精製システムにおいて前記清澄組織培養液から前記対象蛋白質を精製し、対象蛋白質を含有する無菌で無粒子の濃縮・部分精製単離生成物を製造するステップと
を含み、
前記連続灌流発酵工程及び連続粒子除去工程の間を通して、混合物の比流量が実質的に一定に維持されている上記方法。
(15) 前記精製工程が対流性吸着/脱離である、(14)に記載の方法。
(16) 対象蛋白質を不均一な組織培養液混合物から分離するための装置であって、
(a)連続灌流発酵システムと、
(b)灌流発酵システムと一体化した連続粒子除去システムと、
(c)粒子除去システムと一体化した連続精製システムと
を含み、
前記装置が無菌状態下で維持される上記装置。
(17) (a)対象蛋白質を含有する組織培養液を、実質的に一定の体積流量で連続して製造するように構成されている連続灌流発酵システムと、
(b)前記灌流発酵システムと一体化しており、灌流発酵システムから前記組織培養液を連続して受け取り、清澄組織培養液を連続して製造するように構成されている連続粒子除去システムと、
(c)前記粒子除去システムと一体化しており、粒子除去システムから前記清澄組織培養液を連続して受け取り、前記対象蛋白質を含有する単離生成物を連続して製造するように構成されている連続精製システムと
を含み、
前記装置が無菌状態下で維持される、(16)に記載の装置。
(18) 限外濾過システムが、前記連続灌流発酵の体積流量(リットル/時間)の0.1〜2倍にほぼ等しい面積(平方メートル)を有する限外濾過膜を含む、(17)に記載の装置。
(19) 限外濾過システムが、前記連続灌流発酵の体積流量(リットル/時間)の0.3〜1倍にほぼ等しい面積(平方メートル)を有する限外濾過膜を含む、(17)に記載の装置。
(20) 組織培養液流から対象蛋白質を分離するための装置であって、
(a)連続灌流発酵システムと、
(b)灌流発酵システムと一体化した連続粒子除去システムと、
(c)粒子除去システムと一体化した断続的精製システムとを含み、
前記装置が無菌状態下で維持されている上記装置。
(21) (a)対象蛋白質を含有する組織培養液を連続して製造するように構成された灌流発酵システムと、
(b)リアクターと一体化しており、前記リアクターから前記組織培養液を連続して受け取り、清澄組織培養液を連続して製造するように構成された粒子除去システムと、
(c)前記粒子除去システムと一体化しており、前記粒子除去システムから前記清澄組織培養液を連続して受け取り、清澄組織培養液を半連続的に放出するように構成されているサージ容器と、
(d)前記サージ容器と一体化しており、サージ容器から半連続的に前記清澄組織培養液を受け取るように構成された精製システムと
を含み、
無菌状態を維持するように構成されている、(20)に記載の装置。
(22) 前記精製システムが対流性吸着/脱離システムを含む、(20)に記載の装置。
【技術分野】
【0001】
本発明は、分子の不均一混合物から対象分子を精製するための改良された方法及びシステムに関する。より詳細には本発明は、連続灌流発酵方法から組織培養液供給流中の対象蛋白質の精製方法に関する。
【背景技術】
【0002】
近年、連続灌流方法とも呼ばれるいくつかの連続細胞培養方法が大きな商業上の成功と共に確立されてきたことは当業者には公知である。しかし、連続灌流発酵に続く単離工程は一般にはバッチ操作であり、物理的及び物流的に連続した上流の工程から分離されている。このような工程では、分離ステップの主たる目的は、大量の比較的希薄な培養上澄み液から生成物を捕獲することである。生成物の濃縮は、工程の物流管理及び必要な空間に関連して重視されなければならない一方で、さらなる下流の必要な精製ステップ数を最小化するために、汚染物質の除去(精製)を同時に行うことが重要である。
【0003】
図1では、当業者には公知である典型的な最新式の連続灌流発酵からの単離工程の略図を示す。連続灌流発酵システムは、発酵システムにおいて生成物を生成する細胞の大部分を保つ細胞保持装置(1)を含む。まだある程度の細胞、細片及び他の粒子を含有する連続灌流システムからの連続収穫産物流れは、収穫産物ポンプ(2)を使用してステンレス鋼タンクなどの大きい収集容器(3)にポンプで送り込まれる。このような収穫産物貯蔵容器は、普通は分解による生成物の損失を実現可能な範囲内に収めるために冷却しなくてはならない。
【0004】
通常は1〜4日以上の後に特定量の収集がなされると、収穫産物収集容器を無菌発酵容器から取り外し、収集物を1回の収穫産物バッチとする。次のステップは、細胞、細片及び粒子を除去することである(ステップ2)。これは工業規模では、通常遠心分離(4)及びその後にデッドエンド膜濾過(5)を行うか、或いはデッドエンド深層濾過(6)及びその後にデッドエンド膜濾過(7)を行う。他の技術として、接線流(又は「クロスフロー」)精密濾過が行われることがある。いずれの場合でも、粒子除去工程の生成物は、清澄組織培養液、即ちcTCF(8)の1バッチである。バイオ製品の粒子分離の詳細については、Biotechnology,Vol.3,Bioprocessing,Wiley−VCH,2 edition(1996),ISBN:3527283137などの標準のテキストで見ることができる。
【0005】
次のステップ(ステップ3)においては、清澄組織培養液のバッチを、更に濃縮物へと処理し、可能であれば生成物を精製する。これは通常クロスフロー限外濾過又は充填層クロマトグラフィーによって行われる。
【0006】
クロスフロー限外濾過の場合、cTCFはシステムの循環タンク(9)にポンプで送り込まれる。収集物をクロスフロー限外濾過膜を通して押し出すためにポンプを使用する(10)。生成物を膜により保持し、保持液として循環タンク内に再循環させ、一方水及びより小さな汚染物質は、限外濾過モジュール内の圧力低下によって生じた膜貫通圧力によって透過液(11)へと膜を通して押し出される。cTCFは、フィルターを通過する毎に、その結果より濃縮され、cTCFの全容積は所望の濃縮係数となるまで減少する。所望の濃縮係数に達したら、工程を止めて、残った濃縮物容量(分離物)をシステムから排出し、回収する。バイオ製品の濃縮のためのクロスフロー限外濾過の詳細は、Biotechnology,Vol.3,Bioprocessing,Wiley−VCH,2 edition(1996),ISBN:3527283137などの標準のテキストで見ることができる。
【0007】
充填層クロマトグラフィーの場合は、cTCFは、樹脂充填層を含有するクロマトグラフィーカラム(12)にポンプで送り込まれる。生成物は樹脂に結合し、次いで通常は適切な溶出緩衝液(14)を使用して濃縮、精製した形態(分離物、13)で溶出し、その後カラムは適切な緩衝液及び清浄液(14)を使用して洗浄し、再生を行う。
【0008】
cTCFの濃縮/精製のために提案されてきた他のクロマトグラフィーの変形は、膨張層クロマトグラフィー及び膜クロマトグラフィーである。膨張層クロマトグラフィーは、粒子を含有する溶液を処理することができる。しかし、濾過面積は減少するが、クロマトグラフィー後の分離物の濾過はまだ必要である。膜クロマトグラフィーは、樹脂充填層の代わりに階層上になった改質した精密濾過膜を利用する。その利点は、物質移動が拡散性であるよりも非常に対流性であり、それによってより早く分離できることである。通常その他の点では、この方法は標準の充填層クロマトグラフィーと同様である。バイオ製品の濃縮及び精製のためのクロマトグラフィーの詳細は、Protein Purification,Principles,High−Resolution Methods,and Applications,Wiley−VCH,2.Edition(1998),ISBN 0−471−18626−0などの標準のテキストで見ることができる。
【0009】
次いで、バルク分離物を冷凍し、後に更に下流の精製ステップで使用するために貯蔵することが多い。
【0010】
従って、前述のように、単離工程は一般にバッチ操作であり、連続した上流の工程から物理的及び物流的に分離している。また、発酵は無菌で行わなければならない一方、単離(即ち粒子除去及び濃縮/精製)は、本質的に清浄な状態で行われるが無菌ではない。
【0011】
前述のように、最新式の方法はいくつかの問題を有している。
【0012】
Pl:製品の滞留時間が長いための収率損失及び質低下の可能性。上記で略述したように、連続灌流発酵からの収穫産物を収集し、単離したバッチを処理できる前に、長時間にわたって貯蔵する必要がある。収集した収穫産物は、冷却されているが、複雑で本質的に不安定な蛋白質製品に対し依然として有害な環境をもたらす。従って、著しい製品の損失が起こり、それによって設備能力の低下と商品コストの増加をもたらす。更に、製品の質に悪影響を及ぼす可能性がある。
【0013】
P2:大用量の収穫産物の中間貯蔵のために大規模な低温室施設又は冷却容器が必要であり、それにより資本コストが高額となり、前述のコンパクト性及び灌流発酵槽の移動性の利点を無効にすることとなる。
【0014】
P3:従来の濃縮/精製技術(例えば、限外濾過、充填層クロマトグラフィー)は比較的処理容量が低く、著しい所要時間がかかり、比較的労働集約的である。その結果、1日に行われる操作は、通常せいぜい1バッチである。
【0015】
P4:更に、最新の単離工程及び方法は、複数の発酵槽が関連する発酵設備において様々なプロセス容量に対応する物流的な問題を有している。大規模な連続灌流設備においては、様々な数の発酵槽が運転可能である。
【0016】
P5:更に、最新式の単離工程は清浄な状態で行われるが、無菌で稼働することができない。これにより微生物充填の問題のために著しい数のバッチが拒絶されることが多い。
【0017】
P6:使い捨てのフィルター、組立品、バッグなどの使い捨て品を使用することは、ヒトの非経口薬品の製造には非常に望ましいが(例えば、洗浄、洗浄の確認及び他の問題を避けるため)、非常にコストがかかり、実は経済的ではないことが多い。
【発明の概要】
【発明が解決しようとする課題】
【0018】
従って、本発明の目的は無菌状態下で長期間稼働することができる一貫連続蛋白質分離方法を提供することにある。
【課題を解決するための手段】
【0019】
本発明は、不均一流体混合物から分子を精製する新規な装置及び方法に関する。より詳細には、本発明は、粒子状汚染物質が除去された不均一な清澄液混合物から対象分子を精製するための方法に関する。この方法は、連続限外濾過の間を通して比流量が実質的に一定に維持されている流束対TMP曲線の圧力依存性領域において、対象分子の転移点より下の比流量で連続限外濾過によって不均一な清澄液混合物を濾過するステップを含む。
【0020】
特定の実施形態において、本発明の方法は、清澄液混合物の体積流量(リットル/時間)の0.1〜2倍にほぼ等しい面積(平方メートル)を有する限外濾過膜による清澄液混合物の濾過を含む。他の実施形態において、本発明の方法は、清澄液混合物の体積流量(リットル/時間)の0.3〜1倍にほぼ等しい面積(平方メートル)を有する限外濾過膜による清澄液混合物の濾過を含む。
【0021】
本発明の方法は有利なことに、相当な濃度分極を伴わずに、保持液濃度を約20%未満、15%未満又は10%未満超える壁濃度を生じる比流量で濾過することが可能である。
【0022】
更に特定の実施形態において、本発明は、連続灌流発酵、粒子状物質除去及び精製/濃縮のための一貫連続無菌方法に関する。本発明の一態様によれば、この方法は、分離工程における比流量が蛋白質の転移点より低いレベルで実質的に一定に維持される流束対TMP曲線の圧力依存性領域において、蛋白質の転移点より低い操作設定点で選択的に対象蛋白質を混合物から分離し、無菌で無粒子の濃縮・部分精製単離生成物を生成する分離工程による組織培養混合物の濾過を含む。
【0023】
本発明の他の態様によれば、この方法は、対象蛋白質を不均一な組織培養液混合物から精製するための連続方法であり、
(a)連続灌流発酵工程によって対象蛋白質を含有する不均一な組織培養液混合物を生成するステップと、
(b)組織培養液混合物を、連続灌流発酵工程と一体化した連続粒子除去工程に移送するステップと、
(c)連続粒子除去工程において粒子状汚染物質を組織培養液から除去し、対象蛋白質を含有する清澄組織培養液を生成するステップと、
(d)清澄組織培養液を、連続粒子除去工程と一体化した連続精製工程に移送するステップと、
(e)連続精製工程において対象蛋白質を清澄組織培養液から生成するステップとを含み、連続灌流発酵工程、連続粒子除去工程及び連続精製工程における混合物の比流量は実質的に一定に維持される。
【0024】
本発明の更に他の態様によれば、この方法は、不均一な組織培養液混合物から対象蛋白質を精製するための半連続方法であり、
(a)連続灌流発酵工程によって対象蛋白質を含有する不均一な組織培養液混合物を生成するステップ、
(b)組織培養液混合物を、連続灌流発酵システムと一体化した連続粒子除去工程に移送するステップと、
(c)連続粒子除去工程において粒子状汚染物質を組織培養液から除去し、対象蛋白質を含有する清澄組織培養液を生成するステップと、
(d)清澄組織培養液を、連続粒子除去工程と一体化したサージ容器に移送するステップと、
(e)清澄組織培養液を、サージ容器と一体化した精製工程に断続的に移送するステップと、
(e)精製システムにおいて対象蛋白質を清澄組織培養液から生成し、対象蛋白質を含有する無菌で無粒子の濃縮・部分精製単離生成物を生成するステップとを含み、連続灌流発酵工程及び連続粒子除去工程における混合物の比流量は実質的に一定に維持される。
【0025】
本発明は、対象蛋白質を不均一な組織培養液混合物から分離するための装置にも関する。本発明の一態様によれば、この装置は、無菌状態を維持するように構成された(a)連続灌流発酵システムと、(b)灌流発酵システムと一体化した連続粒子除去システムと、(c)粒子除去システムと一体化した連続精製システムとを含む。
【0026】
本発明の他の態様によれば、この装置は、無菌状態を維持するように構成された(a)連続灌流発酵システムと、(b)灌流発酵システムと一体化した連続粒子除去システムと、(c)粒子除去システムと一体化した断続的精製システムとを含む。
【0027】
この精製システムは、本明細書に記載する連続又は半連続の一貫無菌システムにおいて、対象蛋白質を不均一混合物から精製又は部分精製することのできる、例えば、限外濾過システム又は対流性吸着/脱離システム又は任意の他のシステムであってもよい。
【0028】
本発明の方法及び装置は、実質的に一定流速で、細胞培養液などの不均一流体混合物の連続の処理が可能なように構成されている。本発明の特定の態様によれば、本発明の方法及び装置は、連続的な期間、精製工程全体を通して流束対TMP曲線の圧力依存性領域において蛋白質の転移点より下で、実質的に一定流速で、細胞又は組織の不均一な培養液混合物の連続の処理を可能とするように構成されている。
【0029】
本発明のこれらの態様及び他の態様は、下記の発明の詳細な説明で詳細に説明する。
本明細書に組み込まれておりその一部を構成する添付図面は、本発明の実施形態を例示し、実施形態の詳細な説明と共に、本発明の原理及び利点を説明するのに用いる。
【図面の簡単な説明】
【0030】
【図1】3つの物理的及び物流的に区分された単離工程ステップ(バッチ式収穫産物収集、バッチ式粒子除去及びバッチ式濃縮/精製)による従来の連続灌流方法の略図である。
【図2】連続一貫無菌製造のための本発明の装置Aの2種類の実施形態の略図である。実施形態Alの略図を左側に、実施形態A2の略図を右側に示す。
【図3】連続一貫無菌製造のための本発明の装置Bの2種類の実施形態の略図である。実施形態Blの略図を左側に、実施形態B2の略図を右側に示す。
【図4】本発明の装置Aと本発明の装置B両方の構成要素である、本発明の一貫連続粒子除去システム(100)の実施形態の略図である。
【図5】複数の構成要素を組み合わせて、全体的な設備能力を増加させる(A3)、又は濃縮及び分離性能を増加させる(A4)本発明の装置Aのさらなる実施形態の略図である。
【図6】本発明の装置Bのさらなる実施形態の略図である。
【図7】装置A及び装置Bの構成要素を直列に組み合わせて全体的な濃縮及び分離性能を増加させた本発明の装置のさらなる実施形態の図である。
【図8】従来のバッチ操作と、同一の市販のフィルターカプセルを使用した連続粒子除去(一貫連続濾過工程)のための本発明の装置及び方法の実施形態とにおける、フィルターカプセル10”当たりの全充填容量の比較例を示す図である。組換え血液凝固第VIII因子を製造する例示の方法を示す。
【図9】圧力−流束カーブ(膜貫通圧力に対する透過液比流束LMH=リットル/時間/m2)及び操作点決定の例を示す図である。円は、従来のバッチ処理においてTMPを介して調整する通常の操作点を示す。四角は、本発明の装置Aの使用の方法に従って透過液ポンプを介して調整する好ましい操作領域を示す。
【図10】本発明の装置Aの使用の方法に従った一貫連続UFシステム(300)の滞留時間分布及び平均滞留時間の例を示す図である。290cm2モジュール(長さ62.5cm)、120LMHクロスフロー、0.2LMH保持液流、2LMH透過液流の使い捨ての連続システムで測定する。
【図11】本発明の装置Aの実施形態を用いた、血漿蛋白非含有の連続灌流発酵からのr第VIII因子の単離の例を示す図である。1標準偏差の値幅を含めた、本発明の連続方法の平均単離収率と、バッチ式単離の平均収率との比較である。バッチ収率決定のために連続的な3バッチを使用し、一方連続工程のために連続的な3点(日)を使用した。
【図12】本発明の装置Aの性能の例である。示した3種類の異なる連続工程時間の関数としての、一貫連続限外濾過システム(300)の膜貫通圧力及び比流束の例を示す図である。三角=100kD膜、組換え血液凝固第VIII因子(r第VIII因子)。四角=10kD膜、組換えインターロイキン−2。丸=50kD膜、遺伝子組み換え糖蛋白質(Mr>100kD)。示した全ての例は、血漿蛋白非含有の連続灌流発酵からである。
【図13】共発現している2種類の蛋白質製品(緑色蛍光蛋白質GFP及びIL−2SA)の細胞系の連続灌流発酵に直接結合している、本発明の装置Aの長期間の性能の例を示す図である。連続工程時間の関数としての本発明の連続限外濾過システム(300)の膜貫通圧力及び比流束を示す。10kD膜が使用された。
【図14】共発現している2種類の蛋白質生成物(緑色蛍光蛋白質GFP及びIL−2SA)の細胞系の連続灌流発酵に直接結合している、本発明の装置Aの長期間の性能の例を示す図である。10kD膜が使用された。特異的アッセイによって決定した両方の蛋白質製品の濃縮係数及び連続工程時間の関数として示した体積濃縮係数である。
【図15】本発明の装置Bの性能の例を示す図である。対流性吸着器による100に近い継続的吸着/脱離サイクルの間を通しての収率及び圧力の減少である(標的蛋白質:遺伝子組み換え血液凝固第VIII因子変異体、対流性吸着器:市販の吸着器Mustang Q、Pall Corporation)。
【図16】本発明の装置Bの性能の例を示す図である。対流性吸着器による通常の吸着/脱離サイクルの間のUV及び伝導率プロファイルである(標的蛋白質:遺伝子組み換え血液凝固第VIII因子変異体、対流性吸着器:市販の吸着器MustangQ、Pall Corporation)。
【図17】本発明の装置Bの性能の例を示す図である。充填物(粒子除去システム(100)から連続して排出されかつ対流性吸着器システム(400)に半連続的に充填される清澄収穫産物)と、通常の吸着/脱離溶出液とのSDS−PAGEゲル(銀色に着色)を示す。標的蛋白質:遺伝子組み換え血液凝固第VIII因子変異体。対流性吸着器:市販の吸着器Mustang Q、Pall Corporation。溶出液はゲルに供する前に充填濃度まで希釈した。
【発明を実施するための形態】
【0031】
定義
本明細書において明確に定義するもの以外に、本出願で用いる用語は当技術分野で標準のものである。特許請求の範囲の意味の明確性及び確定性を確実なものとするために、特定の用語についての下記の定義を本明細書において規定する。
【0032】
単位、接頭語及び記号は、SIで認められた形式で表示されてもよい。本明細書において記載の数字の範囲は、範囲を定義する数字を含み、定義した範囲内の各整数を含み支持する。特に断りのない限り、「1つ」又は「1つの」という用語は、「少なくとも1つ」を意味するものと解釈すべきである。本明細書において使用されるセクションの見出しは、構成を行う目的のためのみであり、説明の対象を限定するものと解釈すべきではない。それだけには限らないが特許、特許出願、論文、書籍及び協定を含めた、本出願で引用するすべての書類又は書類の一部は、任意の目的のために全内容が参照により本明細書に明確に組み込まれる。
【0033】
「清澄化」及び「清澄」という用語は、残存する溶液が0.2μmの膜を通過するような、溶液からの粒子状物質の除去を意味する。
【0034】
「連続灌流発酵」という用語は、間断なく稼働し、そこにおいて細胞又は微生物がバイオリアクターからの細胞懸濁液の除去によって平衡が保たれている新鮮な培地の連続添加によって指数増殖期に培養液中で維持される、定常状態発酵システム又は工程を意味する。
【0035】
「栽培する」、「培養する」、「成長させる」、「維持する」、「支持する」及び「増す」という用語は、細胞が生存でき、子孫を生成することができることと意味において同義である。
【0036】
「濃縮」という用語は、その動詞形では、残りの溶液の体積当たりの対象分子の量が増えるように、溶液からの水を除去することを意味する。
【0037】
「濃度分極」という用語は、膜貫通圧力、クロスフロー速度、試料の粘度及び溶質濃度などの各要因の組み合わせによって起こる、膜表面上の保持された分子(ゲル層)の蓄積を意味する。
【0038】
「連続」という用語は、長時間にわたって、時間、順序及び/又は操作が間断ないことを意味する。本発明の発酵、清澄化及び濾過工程について用いられた場合、「連続」は対象蛋白質を含有する無菌で無粒子の濃縮・部分精製単離生成物を生成するのに十分に、間断なく長時間稼働することができるように、工程が物理的及び物流的に一体化していることを意味する。連続という用語は、本発明の方法に用いられた場合、工程がバッチ式方法又は完全な連続方法では行われないことを意味するとも理解される。本発明の方法は、例えば、1日から数カ月の長期間にわたり稼働又は工程の順序を遮ることなく連続稼働をすることができる。本発明で使う場合、この方法では、2、3、4、5、6又は7日、2、3、4、5、6、7又は8週間、或いは3、4、5、6又はそれ以上の月数より長い期間連続稼働を行う。
【0039】
「半連続」及び「断続的」という用語は、一貫システムの1つ又は複数の工程又は構成要素が、非連続的又はバッチ式方法で稼働する一方で、一貫システムの他の工程又は構成要素が連続的方法で稼働することを意味する。例えば、本発明のいくつかの実施形態において、精製工程は対流性吸着/脱離工程であり、通常は吸着基質の不均一混合物の吸着を必要とし、結局は基質が飽和し、吸着工程の終了及び結合画分の脱離又は放出が必要となる。このような工程は、連続的な上流の工程と一体化することができるが、本質的に断続的である。
【0040】
「対流性吸着/脱離」という用語は、物質移動が主として対流によって起こるクロマトグラフィー工程を意味する。対流性吸着/脱離は、ある画分の基質への吸着とその後のその画分の基質からの脱離によって、対象分子を含有する混合物の画分を、混合物の他の画分から分離する工程である。
【0041】
「クロスフロー」又は「流体クロスフロー」という用語は、膜表面上を通る流体の流れを意味する。
【0042】
複数のシステム及び/又は工程に関して使われた場合、「一貫」という用語は、システム及び/又は工程が、連続して稼働できる統合システムを構成するような、物理的及び物流的に連結していることを意味する。対象とする無粒子の濃縮・部分精製蛋白質を生成する連続又は半連続の一貫システムに関する本発明のシステムとの関連で、一貫システムは、異なる構成要素を、直接的にかつシステムの異なる構成要素間で無菌状態を維持するのに十分な態様で連結するであろう。
【0043】
「培地(media)」(複数)及び「培地(medium)」(単数)という用語は、本明細書において、同義であり、互換的に使用され、この用語の一方の使用は他方を排除することを意味しない。
【0044】
「混合物」という用語は、蛋白質及び様々な汚染物質などの対象分子を含有する分子及び化合物の不均一な組み合わせを意味する。本発明の好ましい混合物は、当初連続灌流発酵工程から得られる対象とする外来蛋白質を含めた蛋白質の不均一混合物からなる組織培養液である。
【0045】
「ゲル層」という用語は、膜上に形成することができる顕微鏡的に薄い分子膜を意味する。膜表面の目詰まりによって分子の保持に影響を与え、従って濾液の流れを減少させ、又は一定流量の操作においては、TMPを増加させる。
【0046】
「対象分子」という用語は、流体(例えば液体)中の溶液又は懸濁液から分離しようとする粒子又は他の分子種を意味する。対象とする粒子又は分子は、流体から、ほとんどの場合は流体中の他の粒子又は分子から分離される。分離しようとする対象分子の大きさは、使用される膜の孔径を決定するであろう。対象分子は、生物由来又は生化学的な由来であるか、又は遺伝子導入又はin vitro法により生成することが好ましく、蛋白質、ペプチド、ポリペプチド、抗体又は抗体フラグメントが挙げられる。好ましい供給流源の例としては、哺乳動物細胞培養物及び細菌、菌類及び酵母などの微生物細胞培養物が挙げられる。濾過して取り除こうとする化学種には、望ましくないポリペプチド、蛋白質、細胞成分、DNA、コロイド、マイコプラズマ、エンドトキシン、ウィルス、炭水化物及びグリコシル化している又はしていない生物学的に興味がある他の分子が挙げられることにも留意すべきである。
【0047】
「透過液」という用語は、濾液と同義に用いられる。
【0048】
「単離生成物」という用語は、対象蛋白質を含有する、無粒子の濃縮・部分精製生成物を意味する。単離生成物は、限外濾過又は対流性吸着/脱離工程によって実現するのに相当する一定の精製及び濃縮を実現した生成物である。単離生成物は、必ずしも均一ではないが、発酵工程によって生成した当初のバルク生成物と比べて、著しく精製されるであろう。
【0049】
「比流量」という用語は、濾液に関するため「濾過流束」という用語と互換的に使用する。保持液の比流量は、使用される膜面積で規格化した保持液の流量である。
【0050】
流束に関して使用される場合、「実質的に一定な」という用語は、濾過の間の相当な期間流束が概ね一定の程度に維持されていることを意味する。
【0051】
「組織培養液」という用語は、組織培養培地由来成分の不均一混合物を意味する。本発明の好ましい態様によれば、組織培養液は連続灌流発酵工程に由来する。「清澄化」組織培養液は、事前に濾過されて細胞細片及び他の大きい高分子が除去されている組織培養液である。
【0052】
「膜貫通圧力」及びその頭字語「TMP」という用語は、供給液から膜の濾液側への平均加圧力を意味する。TMPは、TMP[バール]=[(PF+PR)/2]−Pf(式中、PFは供給液圧力、PRは保持液圧力、Pfは濾液圧力)によって計算する。
【0053】
「回収率」という用語は、処理後に回収することができる対象分子の量を意味する。通常は出発物質の百分率即ち収率で表す。
【0054】
「保持液」という用語は、濃縮物としても知られている、膜を透過しない試料の一部を意味する。
【0055】
「限外濾過」という用語は、微多孔膜又は半透膜を使用し、異なる大きさ又は分子量に基づいて流体又はイオンを優先的に分離する濾過の一形態を意味する。限外濾過は、通常約10,000ダルトンを超える分子量を有する分子を濾過して取り除くために使用される。
【0056】
本発明は、連続灌流発酵、粒子状物質除去及び精製/濃縮を含む一貫連続無菌方法に関する。本発明の一態様によれば、この方法は、分離工程における比流量が蛋白質の転移点より低いレベルで実質的に一定に維持される流束対TMP曲線の圧力依存性領域において、蛋白質の転移点より低い操作設定点で、選択的に対象蛋白質を混合物から分離し、無菌で無粒子の濃縮・部分精製単離生成物を生成する分離工程による組織培養混合物の濾過を含む。
【0057】
本発明の他の態様によれば、この方法は連続法であり、(a)対象蛋白質を含有する不均一な組織培養液混合物を、連続灌流発酵によって連続して生成するステップと、(b)組織培養液混合物を、連続灌流発酵システムと一体化した粒子除去工程に連続して移送するステップと、(c)粒子除去工程において組織培養液から粒子状汚染物質を連続して除去し、対象蛋白質を含有する清澄組織培養液を連続して生成するステップと、(d)清澄組織培養液を、粒子除去システムと一体化した精製工程に連続して移送するステップと、(e)精製システムにおいて対象蛋白質を清澄組織培養液から連続して分離し、対象蛋白質を含有し、無菌で無粒子の濃縮・部分精製単離生成物を連続して生成するステップとを含む。
【0058】
本発明の更に他の態様によれば、この方法は、(a)対象蛋白質を含有する不均一な組織培養液混合物を、連続灌流発酵によって連続して生成するステップと、(b)組織培養液混合物を、連続灌流発酵システムと一体化した粒子除去工程に連続して移送するステップと、(c)粒子除去工程において組織培養液から粒子状汚染物質を連続して除去して、対象蛋白質を含有する清澄組織培養液を連続して生成するステップと、(d)清澄組織培養液を、粒子除去工程と一体化したサージ容器に連続して移送するステップと、(e)清澄組織培養液を、サージ容器と一体化した精製工程に断続的に移送するステップと、(e)精製システムにおいて対象蛋白質を清澄組織培養液から分離し、対象蛋白質を含有する、無菌で無粒子の濃縮・部分精製単離生成物を生成するステップとを含む半連続法であり、連続灌流発酵工程及び連続粒子除去工程の間を通しての混合物の比流量は、実質的に一定に維持され、平均して一貫半連続精製工程の時間平均処理量に等しい。
【0059】
本発明の方法を実施するための装置
本発明はまた、対象蛋白質を不均一な組織培養液混合物から分離するための装置に関する。一般にこの装置は、(a)連続灌流発酵システム、(b)灌流発酵システムと一体化した連続粒子除去システム、(c)粒子除去システムと一体化した連続精製システムを含み、この装置は無菌状態を維持するように構成されている。本発明の他の態様によれば、この装置は、(a)連続灌流発酵システム、(b)灌流発酵システムと一体化した連続粒子除去システム、(c)粒子除去システムと一体化した断続的精製システムを含み、この装置は無菌状態を維持するように構成されている。この精製システムは、例えば、限外濾過システム、対流性吸着/脱離システム或いは本明細書に記載する連続又は半連続の一貫無菌システムにおいて対象蛋白質を不均一混合物から精製又は部分精製することのできる任意の他のシステムであってもよい。
【0060】
本発明の方法及び装置は、実質的に一定流速で、不均一な組織培養液混合物の連続処理が可能なように構成されている。本発明の特定の態様によれば、本発明の方法及び装置は、実質的に一定流速で、連続した期間、精製工程全体を通して流束対TMP曲線の圧力依存性領域において蛋白質の転移点より下で、不均一な組織培養液混合物の連続処理が可能なように構成されている。
【0061】
特定の実施形態において、本発明は、各々3種類の異なるが完全に一体化した構成要素で構成される2種類の新規な装置(A、B)を提供する、この構成要素の全ては、重要な役割を持ち、共に比類なく効率的で、前述のような従来技術の問題を解決する連続蛋白質単離システムプラットフォームを形成する。
【0062】
各装置の3種類の異なる構成要素は、第1に、一貫連続粒子除去システム(100)、第2に無菌サージ容器(200)、第3に一貫濃縮/精製システム(各々300、400)である。3種類の全ての構成要素、従って開発した新規な装置及びこのような装置を使う方法を下記で詳細に説明する。
【0063】
連続又は半連続の蛋白質製品の一貫濃縮/精製を提供するために、本発明の装置A(この2種類の実施形態を図2に示す)は、一貫連続無菌限外濾過システム(300)を含み、一方、本発明の装置B(この2種類の実施形態を図3に示す)は、一貫半連続対流性吸着/脱離システム(400)を含む。
【0064】
本発明の装置は、1つ又は複数の連続灌流発酵槽と直接一体化しており、従って新規な連続一貫製造プラットホームを形成する。
【実施例】
【0065】
装置A
一貫連続粒子除去システム(100)
図2は、本発明の装置Aの2種類の実施形態を示す。一貫連続粒子除去システム(100)は、連続灌流発酵システム(1)の収穫産物側に直接連結している。
【0066】
図4は、ポンプ(101)、圧力計又は圧力伝送器の各々(107)、連結マニホールド(102)及びいくつかのフィルター系列組立品(103)からなる本発明の一貫連続粒子除去システム(100)の実施形態の更に詳細な略図を示す。すべての構成要素は、軟質チューブ及び/又は硬質管と連結している。
【0067】
ポンプ(101)は、従来の蠕動ポンプであり、これにより、回転部分又はシールが無菌生成物と接触することなしに、細胞培養収穫産物の穏やかなポンプ輸送が可能となる。ポンプ及びポンプチューブは、細胞培養発酵システムの所望の収穫産物流量を送達するように所定の大きさに作られており、この流量は、1日当たり最大15バイオリアクターの容量、例えば15リットル発酵槽で最大9.4リットル/時間、200リットル発酵槽で最大125リットル/時間である。
【0068】
圧力計又は圧力伝送器(107)は、高圧蒸気滅菌処理又は照射によって滅菌できるように設計されている。この設計では、ステンレス鋼ハウジング内の再利用可能なピエゾ抵抗伝送器又は再利用可能なステンレス鋼圧力計のいずれかを使用する。しかし、更なる改良によって、照射により容易に滅菌できる使い捨ての伝送器の使用を含めることができる。
【0069】
この実施形態において、連結マニホールド(102)は、軟質チューブ、チューブクランプ(又は弁)及びシステムの無菌性を損なわないで追加のフィルター系列組立品の連結を可能にする適切な無菌連結器で構成される。チューブ径は、所望の流量で約2m/s以下の線流量速度を出すように所定の大きさに作られ、それにより高背圧及び剪断力を防止することが好ましい。他のこの実施形態において、無菌連結器の代わりに、無菌性を損なうことなしに市販のチューブ溶接機で溶接できる特別な軟質チューブ部品を使用する。このようなチューブ部品は、PVC又は他の適切なポリマーで作られている。
【0070】
フィルター系列組立品(103)は、少なくとも2個の、好ましくは複数の同一のフィルター系列(概略図で示す)で構成され、図4(105)に例として示すようにフィルター系列の1つのみが常時開いている。
【0071】
各フィルター系列は、少なくとも1つのフィルターで構成され、1つの前置フィルター及び1つの最終フィルターが直列していることが好ましい(図4に示す)。特定用途のために容量を増やすことが必要である場合は、各フィルター系列(105、106など)自体も複数の並列のフィルター又はフィルター系列(図示せず)で構成することができる。
【0072】
図4に示す本発明の一実施形態において、組立品の第2のフィルター系列(106)は、感圧破裂板又は破裂ピン(104)によって閉鎖される。稼働中、破裂板又は破裂ピンの機能は、第1のフィルター系列(105)内の圧力が指定限界に達したら、自動的に第2のフィルター系列(107)への流路を開けることである。それにより濾過工程が途切れずに継続することが確実となる。又は安全な圧力除去を実現するために使用される市販の破裂板又は破裂ピンを、本発明のシステムで使用する。この実施形態において、非常に有用であると証明されてきた16PSI以下の一定の破裂圧力限界の破裂板又は破裂ピンを使用する。しかし、ある範囲の一定の圧力限界が可能である。
【0073】
フィルター系列組立品の更なる各フィルター系列も、手動弁又は自動弁或いは他の破裂板又は破裂ピンによって分離される。第2のフィルター系列(106)が稼働中であると、次の破裂板又は破裂ピンへの弁が各々開き、次のフィルター系列がバックアップの役目を果たすことができる等である。
【0074】
他の実施形態においては、自動作働弁がもっぱら使用されており、操作時に制御システムが、これも高圧蒸気滅菌処理によって滅菌できるピエゾ抵抗圧力センサー(107)への入力に基づいて弁を作働させる。しかし、出願人等は、破裂板又は破裂ピンを各々含むこの設計は、長期間の稼働において際立ったロバスト性を実現していることを見出した。
【0075】
最終フィルター定格は、少なくとも3μm又はそれ未満であり、0.45μmが好ましく、0.2μmが更に好ましい。従って操作時のフィルター系列(6)は、関連する細胞細片及び他の粒子だけでなく残りの細胞全てを保持し、その結果無粒子の出力ストリーム(9)即ち清澄組織培養液(cTCF)となる。
【0076】
異なる市販のフィルター材料を使用することができる。この設計においては、高圧蒸気滅菌処理又は照射によって滅菌することができる、Sartopure又はSartoclear前置フィルターカプセル(Sartorius、Goettingen)及びSartobran最終フィルターカプセル(Sartorius、Goettingen)などの使い捨てのフィルターカプセルを使用する。
【0077】
1リットル/分の流量で設計した本発明の装置のこの実施形態の一例として、組立品(103)の各フィルター系列(105、106など)は、3個の30”の前置フィルターカプセル(Kleenpak Ultipleat、Pall Corp.、4.5μm定格、各0.75m2)と、それに続いて3個の20”の最終フィルターカプセル(Sartobran P、Sartorius、0.45μm/0.2μm定格、各1.3m2)で構成される。この特定の実施形態は、組換え血液凝固第VIII因子並びにBドメイン欠失第VIII因子を含めた遺伝子組み換え第VIII因子変異体の大規模な製造のために特に有用であることが見いだされた。
【0078】
しかし、出願人等は、各々の従来のバッチ処理と比較すると、本発明の装置及び方法を使用する時、異なる製造者(Pall、Sartorius、Cuno)からの種々の使用可能なフィルター材料及び構成の粒子除去の効率は一貫しており、著しく向上したことを見出した。
【0079】
従って、新規な本発明の装置及び方法は、例えばカプセル当たりの利用可能なフィルター面積が増した型のフィルター、クロスフローのパターン或いはケーク蓄積を最小限にする振動又はフィルター要素の回転などの他の手段を提供する型のフィルターなどの、新規な型及び形状のフィルターの使用も有益であろう。
【0080】
本発明の方法の他の実施形態において、フィルター系列組立品(103)は、破裂板又は破裂ピンによって各々閉じられたただ1つの無菌バックアップフィルター系列を含むが、操作のための複数のフィルター系列も含む。組立品の第1のフィルター系列は、特定の所定の充填容量を処理するまで稼働し、その後の稼働は、組立品の次のフィルター系列に(手動又は自動で)切り替わる。通常の操作条件下で破裂板又は破裂ピンの圧力限界を超えないように一定の充填容量を指定する。しかし、例えば収穫産物の著しく低い濾過性などのために、濾過中に圧力が通常を超える場合、一定の圧力を超えるとバックアップフィルター系列が開くことによって間断ない連続濾過も確実に行う。バックアップフィルター系列が開いた後に、濾過は組立品の他のフィルター系列に切り替わり、破裂板又は破裂ピンが付いた他のバックアップ濾過系列が、システムの無菌性を損なうことなく組み込まれる。
【0081】
バッチ式粒子除去工程のためのフィルター費用及び処理時間の両方を最小限に抑えるためには、バッチ式フィルター系列は、所望の絶対流量(リットル/時間)及び最大圧力を実現するための、必要最小限のフィルター面積を有するように所定の大きさにする必要があることは当業者には公知である。その結果として、所望のバッチ容量で実行可能な処理時間を実現するために、所望の絶対流量は十分に大きくなくてはならない。このため本質的に大きい比流量(リットル/時間/フィルター面積m2)を必要とする。
【0082】
比較され得る最適化されたバッチ式濾過システムと対照的に、本発明の装置では、絶対流量が連続灌流発酵の収穫産物流量に等しいように、一定に保たれる数分の1の小さい比流量(リットル/時間/組み込まれたフィルター面積m2)で設計されている。
【0083】
出願人等は、このような小さな比流量でも、フィルターにより処理できる容量は、バッチ処理で調整する流量よりも不均衡に大きいことを予想外に見出した。
【0084】
従来のバッチ式単離工程では、極端な濾過面積(従って費用)又は低すぎる絶対流量のいずれかのために、このように小さな比流量では妥当と思われないことに注意することが重要である。これは大体の場合、次のバッチために収穫産物を収集している間、バッチ式粒子除去装置は稼働していないことが主な原因である。更に、本発明の方法においてフィルターが達成できる能力の驚くべき不均衡な増加によって、フィルターの消費、従って製造コストの著しい減少が可能になる。
【0085】
サージ容器(200)
図2に示すように、一貫連続粒子除去システムの出口は、サージ容器(201)と直接、常に連結している。このサージ容器は、使い捨てのバッグ又はステンレス鋼容器などの無菌容器であり、少なくとも1つの入口及び1つの出口を有し、出口は容器の底にあることが好ましい。広範囲の容器の大きさ及びデザインを用いることができる。しかし、サージ容器をシステムの処理容量と比べて小さい所定の大きさにして、容器内の生成物の滞留時間を最小限、即ち24時間未満とすることが好ましく、8時間未満とすることがより好ましく、4時間未満とすることが更に好ましい。
【0086】
出願人等は、本発明の装置によって比類なく実行可能となったこのような短い生成物の滞留時間によって、本質的に不安定な蛋白質製品の収率の著しい増加を可能にし、それによって従来技術の問題の1つを解決することを見出した。
【0087】
図3において装置Bl及びB2で示すように、本発明の装置のいくつかの実施形態において、サージ容器は、はかり又はロードセル(202)上にある。このはかり又はロードセルは、コンピュータ制御システム(図示せず)に重量信号を伝える。
【0088】
更に、本発明の装置(B2)の一実施形態において、緩衝液容器(204)が蠕動ポンプ(203)を経由してサージ容器に連結している。操作時にこの装置が使用され、適切な緩衝液又は希釈液を添加することによって、無粒子の収穫産物流れの伝導率(イオン強度)又はpHなどの性質を調整する。この場合、任意選択で混合システム(205)及びpH又は伝導率などの所望の条件をモニターするためのセンサー(206)を使用する。この設計においては、磁気結合型撹拌機を使用するが、振盪機又は脈動装置などの他の混合システムも使用することができるであろう。
【0089】
一貫連続濃縮/精製(300)
図2において2種類の実施形態が示されている装置Aは、一貫連続無菌限外濾過システム(300)を含む。連続無菌限外濾過システムの実施形態は、循環ポンプ(301)及び循環ループ(306)、1つ又は複数の無菌クロスフロー限外濾過モジュール(303)、透過液ポンプ(305)、はかり又はロードセル(309)の上の無菌透過液受取り容器(307)並びに保持液ポンプ(311)を含む。更に、入口圧力計又は圧力伝送器(302)、透過液圧力計又は圧力伝送器(304)、出口圧力計又は圧力伝送器(308)並びに循環流量計(310)の計器類を含む。操作時に、システム出口(312)では、連続して収集・冷凍され、更に処理されることができる濃縮・部分精製蛋白質製品の連続流を実現する。
【0090】
本発明の実施形態A2は、緩衝液又は希釈液容器(314)、緩衝液/希釈液添加蠕動ポンプ(313)、並びにpHセンサー及び伝導率センサー(315、316)などの循環ループ内の濃縮物の調整をモニターするためのフロースルーセンサーを更に含む。操作時にこの装置が使用され、適切な緩衝液又は希釈液を添加することによって、無粒子の収穫産物流れの伝導率(イオン強度)又はpHなどの性質を調整する。この装置は、蛋白質安定剤を添加するためにも使用することができる。本開示において後述するように、本発明の実施形態A2では、循環ループ自体が混合室の役割を果たすが、代わりに装置B(実施形態B2)で示した構成要素(203、204、205、206)を含むサージ容器設備を使用することによっても調整を行うことができる(装置Bの説明を参照)。
【0091】
本発明の装置の実施形態は、計器類(これらに限定されないが、圧力、流量、容器重量、pH、伝導率など)からの入力データ信号を記録して、定義済みの制御アルゴリムに従ってポンプスピードを制御するデータロギング及びプログラマブル制御システムも含む。
【0092】
すべてのポンプ(301、305、311、313)は蠕動ポンプであり、これにより無菌生成物流れに接触する回転部分又はシールなしに、各々の流体流れのポンプ輸送が可能となる。出願人等は、ロバストで無菌の長期間の作働を実現するために、これが好ましいことを見出した。しかし、他の無菌ポンプ設計を原則として使用することができる。使用される限外濾過モジュールの物質移動特性に応じて、80〜800リットル/時間/組み込まれた膜面積m2の所望のクロスフロー流量のロバスト調整が可能となるために、循環ポンプ(301)及びそのポンプチューブは所定の大きさに作られる。連続灌流発酵からの収穫産物流量の90%〜99%の透過液比流束のロバストで正確な調整を可能にするために、透過液ポンプは所定の大きさに作られる。連続灌流発酵からの収穫産物流量の1%〜10%の保持液流れのロバストで正確な調整を可能にするために、保持液ポンプは所定の大きさに作られる。
【0093】
カプセル収納限外濾過モジュール(303)は、ロバストな無菌操作を可能にするために使用され、高圧蒸気滅菌処理又は照射によって滅菌される。最適な名目上の分画分子量は、対象蛋白質製品の分子量に基づいて選択し、当業者に周知の標準実験によって確認されなくてはならない。膜に損傷を与えずに膜モジュール全体を照射及び/又は高圧蒸気滅菌処理によって滅菌できる限りは、ポリエーテルスルホン、親水化ポリエーテルスルホン又は再生セルロースなどの種々の膜材料を使用できる。親水性材料は、その低いファウリング傾向によって効率性を向上させることがきることが期待されている。
【0094】
出願人等は、装置Aは、組み込まれた全限外濾過膜面積(平方メートル)が連続灌流発酵からの収穫産物の体積流量(リットル/時間)の0.1〜2倍の範囲に等しければ、比類なく効率的であることを見出した。例えば1リットル/時間の灌流収穫産物流量では、設置された全膜面積は、0.1〜2平方メートルとすべきである。出願人等は、装置Aが、設置された限外濾過膜面積(平方メートル)が連続灌流発酵からの収穫産物の体積流量(リットル/時間)0.3〜1倍の範囲と等しい場合は、更に効率的であることを見出した。
【0095】
本発明の一実施形態において、市販の「使い捨ての」中空糸膜モジュール(GE Healthcare、旧Amersham Biosciences)を使用する。しかし、スパイラルモジュール、第2のフローパターン(例えば、渦流れ)により物質移動が強められたカプセル化カセット又はカプセル、回転要素(例えば、ダイナミック円板フィルター)或いは振動フィルターなどの、種々のカプセル化膜及びモジュール設計を用いることができる。特にカプセル化限外濾過カセットは、必要とされる比較的低いクロスフロー流量において高い物質移動係数を実現するため、本発明の装置において有利に使用することができ、従ってシステムの複雑さ及び投資費用を低く抑える一方で、ポンプ容量が減少することが期待される。
【0096】
本発明の装置は、単なる無菌的操作とは対照的に、連続操作のみならず真の無菌操作を可能にする。出願人等は、洗浄だけでなく、高圧蒸気滅菌処理、定置蒸気滅菌又はガンマ線照射による滅菌に対して耐性がある全ての製品接触システムの構成要素を設計することでこれを達成した。この実施形態においては、連続粒子除去(100)及び連続限外濾過(300)のために、使い捨てのカプセル収納モジュールを使用する。生成物が回転要素及びメカニカルシールと接触するのを防止するために、蠕動ポンプを使用する。更にこの実施形態においては、硬質管の代わりに、使い捨てのチューブ及びバッグ組立品を使用する。使い捨ての製品接触構成要素(例えば、チューブ、バッグ、モジュール)又は構成要素グループは、前もって組み立てて共に滅菌し、それによって運転開始及び操作が単純化する。このシステムは、標本抽出及びバッグ又は計器類の交換に関して、環境(例えば、層流フード)に対する無菌システムを開く可能性を最小限にするように設計されている。この装置のこの実施形態においては、マニホールドは、1つの無菌構成要素(例えば、製品受取りバッグ)から次の構成要素への切り換えが開くことなしで可能であるように冗長に設計されている。チューブ、モジュール又はバッグの追加交換は、無菌連結器ではなく、無菌チューブ溶接機を使用して行うことが好ましい。
【0097】
本発明の装置の他の将来の実施形態は、長期稼働におけるロバスト性及び無菌性が確実される限り、定置での、単独での又は使い捨ての構成要素と組み合わせての滅菌ができるステンレス鋼容器、フィルターハウジング又は管などの構成要素も含むことができるであろう。
【0098】
本発明の装置Aの他の実施形態では、より大きな製造設備において複数の発酵槽からの物質を処理するように設計する(A3)。一例を概略的に図5に示す。他の実施形態では、2ステージの連続限外濾過システム(300)を直列に組み合わせることによって、全体の濃縮係数及び分離性能が増加するように設計する(A4、図5で概略的に示す)。
【0099】
装置Aを使用した方法の説明
連続灌流発酵は、通常2週間〜6ヶ月以上の長期間(1キャンペーン)にわたり稼働する。生成物、細胞及び細胞片を含有する組織培養液(TCF)は、装置Aを使用して連続して処理される。無菌で無粒子の濃縮・部分精製生成物流れ(「単離生成物」)が生成し、出口(312)で装置から連続して排出される。連続無菌粒子除去システム(100)のポンプ(101)を使用することによって、収穫産物は、発酵の所望の灌流収穫産物流量Qhで、濾過組立品(103)を通ってポンプで連続して押し出される。
【0100】
連続濾過システムの出力ストリーム、即ち清澄組織培養液(cTCF)は、サージ容器(201)に連続して入る。cTCFは、サージ容器から、無菌限外濾過システム(300)によって、連続灌流発酵からの流量と等しい流量で連続して処理される。調整された流量に対するサージ容器の小さい容量のために、容器内の生成物の平均滞留時間は最小限、即ち12時間未満、好ましくは4時間未満、更に好ましくは2時間未満に抑えられる。
【0101】
適切なクロスフロー、従って物質移動は、限外濾過モジュール内で循環ポンプ(301)を経由して調整される。保持液ポンプ(311)を使用することによって、保持液流量が調整、制御され、従って濃縮された単離生成物が装置Aから出る一定の連続した流量Qiが出口(312)で生じる。透過液ポンプ(305)を使用して透過液の流量Qpを調整し制御するが、この透過液は限外濾過モジュールの透過液側から連続して引き寄せられ、水及び限外濾過膜を通るのに十分に小さい溶液成分(例えば、塩、小さい蛋白質)からなる。
【0102】
透過液の流量(Qp)及び保持液/分離物(Qi)を、注意深く調整し制御し、発酵の収穫産物流量Qhと一致させる。
Qp+Qi=Qh
同時に、流量を調整、制御し、
Qi=1/cf*Qh
を満たすことにより所望の濃縮係数cfを実現する。例えば、当初の収穫産物濃度の10倍の所望の分離物中の生成物濃縮係数を実現するために、保持液/分離物ポンプ(311)を使用して、QiをQi=1/10*Qhで制御し、一方透過液ポンプ(305)を使用して、QpをQp=0.9*Qhで制御する。
【0103】
放流量はポンプ(305)及び(311)によって制御されているので、限外濾過システムは自動的に小さいサージ容器(201)からQp+Qiの流れを引き寄せる。
【0104】
実施形態A2(図2右側参照)を用いる場合は、緩衝液添加ポンプ(313)を使用して、容器314からの注入用の緩衝液又は水の無菌流が連続限外濾過システムに一定流速Qbで連続して添加される。従って、分離物の条件は、例えばイオン強度、pH、安定剤の添加などに関して、自由に連続して調節することができる。従って、流量は
Qp+Qi=Qh+Qb
で制御される。更に、Qi=1/cf*(Qh+Qb)を満たすことによって所望の濃縮係数cfを実現するように、流量比を選択できる。代わりに、この方法は、Qi=Qh+Qbを設定することによって、条件(例えば、pH、伝導率)を変えるためだけに使用することができる。
【0105】
新規な装置Aを使用した方法はまた、限外濾過自体の操作設定点に関して、バッチ式UF工程(従来技術)と対照をなす。従来のバッチ式UF工程は、短期間の小さい膜面積を通しての特定の処理量のために設計されている。従って、バッチ式UFは一般に、物質移動制御領域に依存する圧力の転移点で操作を行う(図9参照)。これにより、当初は望ましく高い比流束となるが、濃度分極によって浸透背圧と、制限的なゲル層(第2の膜)のすばやい形成につながるため、数秒から数分の間に急激に著しく低下する。このような高分子の高い壁濃度は、外側及び内側の膜表面への化合物の吸着の増加、即ち膜ファウリングにもつながる。このファウリングは、時間と共に透過流束を更に減少させるであろう。
【0106】
出願人等は驚いたことに、装置Aでは、圧力−流束カーブの下端で操作することにより組み込まれた限外濾過膜の面積当たりの何倍もの充填容量が得られることを見出した(図9参照)。
【0107】
完全に保持された成分の規格化された壁濃度(cwall)は、下記のように記述できる。
【数1】

式中
J=透過液比流束(リットル/時間/m2)
kd=物質移動係数(リットル/時間/m2)
cbulk=溶液バルク中の成分の濃度
【0108】
バッチ式UFと同様に、連続UFでは、濃度分極を最小限にするために、最適化された物質移動係数で操作する。しかしバッチ式限外濾過と対照的に、出願人等は、透過流束Jを圧力−流束カーブの下端となるように調整する(図9参照)。従って指数関数的関係の結果、膜表面での壁濃度(cwall)は、バッチ式限外濾過よりも著しく低い。例えば、本発明の方法のこの実施形態では、達成可能な物質移動係数の約1/10の目標透過液比流束を調整し、それにより調整したバルク(又は保持液)濃度から10%だけ高い壁濃度を調整する
【0109】
下記の表1は、開発規模の発酵槽からの蛋白質製品の連続単離のために装置A(実施形態A1)を使用した方法の一例を示す。
表1
連続灌流発酵からの蛋白質製品の連続単離のために、装置Aのこの実施形態を用いる方法の例
【表1】

【0110】
各々個別の製品分子のために、例えば膜貫通圧力に基づくなど無菌連続限外濾過設備の耐用期限の基準を定義することができる。膜貫通圧力限界を超えると、連続無菌限外濾過設備は、システムの整合性及び無菌性を損なわずに他の同一の設備と交換される。これは、マニホールド及び無菌連結器のいずれかを使用することによって、或いは使い捨て軟質チューブ及び無菌チューブ溶接機を使用することによって、連続無菌濾過設備と同じように行うことができる。
【0111】
装置B
一貫連続粒子除去システム(100)
図3は、本発明の装置Bの2種類の実施形態を示す。一貫連続粒子除去システム(100)は、連続灌流発酵システム(1)の収穫産物側に直接連結している。装置Bのこの部分は、装置Aと同一である(上記の装置Aの詳細な説明及び図4を参照)。
【0112】
サージ容器(200)
一貫連続粒子除去システムの出口は、図3に示すように、サージ容器(201)に直接に常に連結している。このサージ容器は、少なくとも1つの入口及び1つの出口を有する使い捨てのバッグ又はステンレス鋼容器などの無菌容器であり、出口は容器の底にあることが好ましい。広範囲の容器の大きさ及びデザインを用いることができる。しかし、サージ容器をシステムの処理容量と比べて小さい所定の大きさにして、容器内の生成物の滞留時間を短く、即ち26時間未満とすることが好ましく、12時間未満がより好ましく、4時間未満にすることが更に好ましい。
【0113】
図3において実施形態Bl及びB2で示すように、サージ容器は、はかり又はロードセル(202)上にある。このはかり又はロードセルは、コンピュータ制御システム(図示せず)に重量信号を伝える。
【0114】
更に、本発明の装置(B2)の一実施形態において、緩衝液容器(204)が蠕動ポンプ(203)を経由してサージ容器に連結している。操作時にこの装置が使用され、粒子除去システムから受け取った清澄組織培養液の性質を改質するために、適切な緩衝液又は希釈液或いは適切な蛋白質安定化剤などの成分を添加することによって、無粒子の収穫産物流れの伝導率(イオン強度)又はpHなどの性質を調整する。この場合、この実施形態では、混合システム(205)も含み、pH又は伝導率などの所望の条件(206)をモニターするためのセンサーを使用する。この実施形態において、磁気結合型撹拌機を使用するが、振盪機又は脈動装置などの他の混合システムも使用することができるであろう。
【0115】
本発明の装置の他の実施形態においては、2つのサージ容器を使用する。常時1つのサージ容器が、連続粒子除去システム(100)に直接連結しており、従って清澄液を受け取り、一方他の容器は半連続濃縮/精製システム(400)に連結しており、従って対流性吸着/脱離サイクルに供給を行う。両方の間の切り換えは、最大の充填容量に達すると、受取り容器の重量を利用してスイッチを入れる制御システムによって行う。
【0116】
一貫半連続濃縮/精製(400)
その2種類の実施形態が図3に示されている装置Bは、一貫半連続対流性吸着/脱離システム(400)を含む。
【0117】
一貫半連続対流性吸着/脱離システムは、その充填流量(Qload)が連続灌流収穫工程及び連続濾過工程(Qh)、の流量より著しく高くなるように(即ち、Qload>>Qh)、所定の大きさに作るように設計されている。
【0118】
一貫半連続濃縮/精製システム(400)の実施形態は、充填ポンプ(401)、マルチポート弁組立品(402)及びいくつかの緩衝液容器(404)、無菌廃棄物受取り容器(413)と1つ又は複数の対流性吸着器モジュール(406)とに連結した三方弁(403)、入口及び出口圧力計又は圧力伝送器(405、408)、UVセンサー(409)、pHセンサー、伝導率センサー(409、410)、流量計(412)などの別の計器類、廃棄物容器(413)と生成物溶出液出口(414)とに連結する別の三方弁(407)を含む。
【0119】
本発明の装置の実施形態は、計器類(これらに限定されないが、圧力、UV、pH、伝導率、流量、サージ容器重量などの)からの入力データ信号を記録するデータロギング及びプログラマブル制御システム(図示せず)も含み、プログラムされた手順に従って自動弁及びポンプを制御する。
【0120】
充填ポンプ(401)は、生成物又は無菌緩衝液がシール又は機械的部品との直接の接触を回避するために蠕動ポンプであることが好ましい。出願人等は、これがロバストな無菌の長期間操作を実現するために好ましいことを見出した。しかし、他の無菌ポンプ設計を原則として用いることができる。充填ポンプは、対流性吸着器(406)の組み込まれたマトリックス容量に応じて所定の大きさに作られ、少なくとも12マトリックス容量/分のロバスト調整を可能にする。例えば、この実施形態においては、約0.3リットルのマトリックス容量を有するMustang膜吸着器カプセル(Pall Corp.)を使用する。従って、充填ポンプは、3.6リットル/分までの充填流量が可能となるように所定の大きさに作られる。
【0121】
マルチポート弁組立品(402)の機能は、サージ容器(201)から引き寄せられた生成物を含有する充填物と、無菌緩衝液容器(404)からの無菌緩衝液及び清浄液の各々との間での切り換えを可能にすることである。装置Bのこの実施形態では、各緩衝液容器に連結する軟質チューブを外側からはさみ各ラインを開閉する一連の自動作働のピンチ弁を利用する。出願人等は、このようなピンチ弁は、製品との接触を防止し、従って洗浄及び滅菌する必要がないため、装置Bが特に有利な解決策を実現することを見出した。しかし、作動膜弁などの無菌処理に適切で当業者に周知の広範囲の市販の弁を使用することができる。
【0122】
この実施形態では、三方弁(403、407)は高圧蒸気滅菌に耐える作動膜弁である。しかし、例えばピンチ弁を含めて無菌処理に適切な種々の市販の弁を原則的に使用することができる。
【0123】
対流性吸着器モジュール(406)は、吸着表面への生成物の顕著な対流物質移動を有するクロマトグラフマトリックスを含有し、従来のクロマトグラフィーと対照的に、操作前に高圧蒸気滅菌処理、蒸気処理又は照射によって滅菌を行う。従来の充填層クロマトグラフィーとは対照的に、顕著な対流物質移動によって非常に短い吸着/溶出/再生サイクル時間が可能となり、出願人等は本発明の装置において半連続操作を実現するためにこれを利用する。
【0124】
本発明の装置のこの実施形態では、対流性吸着器(406)は1つ又は複数の市販のイオン交換性の膜吸着器カプセルで構成される(Mustang、Pall corporation又はSartobind、Sartorius)。しかしこの装置では、従来のクロマトグラフィーとは対照的に樹脂の充填がなく、マトリックスは一般にすぐ使用できるモジュール内にカプセル化されているので、他の材料及び形状の膜吸着器と同様に、一貫マトリックスなどの新規な対流性マトリックスも利用することができる。
【0125】
更に、特定の生成物結合リガンドを含有する対流性アフィニティーマトリックスを含めた他の化学的性質も、本発明の装置において比類なく有益な性能をもたらすであろう。
【0126】
本発明の装置の一実施形態においては、連続粒子除去システム(100)と同様の装置内の並列の対流性吸着器系列の組立品の形で、複数の対流性吸着器モジュールを使用する。全吸着器系列を有する全組立品は共に滅菌を行い、それにより操作時に最初の系列の耐用期間が終わった場合は、例えば充填中の背圧又は稼働運転サイクルの最大数などの予め定義された基準に則して、1つの吸着器系列から新鮮な系列への切り換えが可能になる。各吸着器系列は、1つの単体モジュール或いは複数の並列及び/又は直列の対流性吸着器モジュールのいずれかで構成され、結合能力が増加及び/又は稼働率が向上する。
【0127】
本発明の装置は、単なる無菌的操作とは対照的に、連続操作のみならず真の無菌操作を可能にすると強調することは重要である。出願人等は、すべての製品接触システムの構成要素を洗浄だけでなく、高圧蒸気滅菌処理、定置蒸気滅菌又はガンマ線照射よる滅菌にも耐性があるように設計したことによりこれを達成した。この実施形態においては、連続粒子除去(100)と同様に半連続無菌対流性吸着/脱離(400)のために、使い捨てカプセル化モジュールを使用する。蠕動ポンプは、製品が回転要素及びメカニカルシールと接触するのを防止するために使用する。更に、この実施形態においては、硬質管の代わりに、使い捨てのチューブ及びバッグ組立品を使用する。使い捨ての製品に接触する構成要素(例えば、チューブ、バッグ、モジュール)又は構成要素グループは、前もって組み立てて共に滅菌し、それによって運転開始と操作が単純化する。このシステムは、標本抽出並びにバッグ又は計器類の交換に際して、環境(例えば、層流フード)に対して無菌システムが開く可能性を最小限にするように設計されている。この装置のこの実施形態においては、マニホールドは、1つの無菌構成要素(例えば、製品受取りバッグ)から次の構成要素への切り換えを開くことなしで可能であるように冗長に設計されている。チューブ、モジュール又はバッグの追加交換は、無菌連結器ではなく、無菌チューブ溶接機を使用して行うことが好ましい。
【0128】
本発明の装置の他の将来の実施形態は、長期稼働におけるロバスト性及び無菌性が保証される限り、定置での、単独での又は使い捨ての構成要素と組み合わせての滅菌ができるステンレス鋼容器、フィルターハウジング又は管などの構成要素も含むことができるであろう。
【0129】
本発明の装置Bの他の実施形態では、より大きな製造設備において複数の発酵槽からの物質を処理するように設計されている(B3)。一例を概略的に図6に示す。本発明の装置Bの他の実施形態では、複数の対流性吸着/脱離システム(400)とその間に各々の無菌サージ容器を(200)を直列に組み合わせることによって、全体の濃縮係数及び分離性能が増加するように設計する(B4、図6を参照)。
【0130】
更に本発明の装置の他の実施形態では、連続限外濾過システム(300)を追加のサージ容器を経由して半連続対流性吸着/脱離システム(400)と直列に組み合わせることによって全体の濃縮係数及び分離性能が増加するように設計されている。一実施形態の一例を概略的に図7に示す。
【0131】
装置Bを使用した方法の説明
連続灌流発酵は、通常2週間〜6ヶ月以上の長期間(1キャンペーン)にわたり稼働する。生成物、細胞及び細胞片を含有する組織培養液(TCF)は、装置Bを使用して連続して処理される。無菌で無粒子の濃縮・部分精製生成物流れ(「単離生成物」)が生成し、出口(412)で装置から連続して排出される。連続無菌粒子除去システム(100)のポンプ(101)を使用することによって、収穫産物は、発酵の所望の灌流収穫産物流量Qhで、濾過組立品(103)を通ってポンプで連続して押し出される。
【0132】
連続濾過システムの出力ストリーム、即ち清澄組織培養液(cTCF)は、サージ容器(201)に連続して入る。
【0133】
サージ容器が予め定義されたレベルまで満たされると、重量信号又はレベル信号が自動的に一貫無菌半連続濃縮/精製システムの吸着/脱離サイクルを作動させる。サージ容器内の収集物は、迅速に、即ち4時間以内、好ましくは2時間以内、更に好ましくは1時間以内に吸着器設備に充填され、従ってサージ容器が空となる。
【0134】
図3に示すこの実施形態では、無粒子の清澄組織培養液(cTCF)の収集は、同様の小さいサージ容器内で常に行われる。従って小さいサージ容器中の容量は、最小寸法から最大寸法まで異なる。前述の他の実施形態においては、2つの同一のサージ容器間で相互に切り換えて収集が行われる。
【0135】
サージ容器へのcTCFの収集が続いている間、充填された吸着器は、目的生成物を濃縮精製した形で脱着し、次の充填サイクルのために吸着器を準備するように設計された、予め定めたクロマトグラフィー手順のさらなるステップを経由する。従って、全てのサイクルは充填、洗浄、溶離、再生及び再平衡を含み、各々が1種又は複数の適切な緩衝液と共に行われる。
【0136】
ここにおいても、対流性吸着器の性質からこのようなステップの間の流量は多い可能性があるため、全サイクル時間は短く、即ち6時間未満、好ましくは3時間未満、更に好ましくは1.5時間未満に抑えられる。従って、一貫システムでは、サージ容器が再び満たされる前に、吸着器設備が次の充填サイクルの準備ができているように設計されており、従って半連続稼働が可能になる。
【0137】
下記の表2は、組換えヒト血液凝固第VIII因子単離のための本発明の装置Bのこの実施形態を用いた方法の一例を示す(大規模データを示す)。この方法は比類なく有益であることを証明した。各吸着/脱離サイクルの収率及び性能は、バッチと同様であったが、製品の滞留時間が短くなったため全体の製品の収率は10%超増加し、従って製品の劣化が最小限となった。大きさ及び他の特徴が全長第VIII因子とは著しく異なっている、Bドメイン欠失第VIII因子を含めた遺伝子組み換え第VIII因子変異体の単離のために、同じ方法が非常に有益であることも証明した。他の蛋白質及び生体分子の製造に有用であることが期待されている。
【0138】
クロマトグラフィー手順自体(緩衝液の化学的性質及び順序、充填容量及び流量)は、各々個々の分子のためにバッチ式クロマトグラフィー実験において開発することができ、次いで本発明の装置の実施形態で使用するために即座に移行することができる。
表2
連続灌流発酵からの第VIII因子及び第VIII因子変異体の連続単離のための装置Bのこの実施形態を用いた方法の実施例
【表2】

【0139】
各々個別の製品分子のために、例えば充填又は回収中の圧力に基づくなど、対流性吸着器設備の耐用期限の基準を定義する。通常は、サイクルの最大数(nmax)を特定し、確認される。半連続操作においてnmaxサイクルを通して吸着器設備が使用されると、システムの整合性及び無菌性を損なうことなく同一の吸着器設備と交換される。この実施形態においては、マニホールド及び無菌連結器のいずれかを使用することによって、或いは使い捨て軟質チューブ及び無菌チューブ溶接機を使用することによって、連続無菌濾過設備と類似してこれを行うことができる。
【0140】
図3の右側に示す本発明の装置の実施形態を用いる時は、緩衝液、pH調節液、安定化剤溶液又は注入用水の無菌流を、緩衝液添加ポンプ(203)を使用して無菌容器(204)から連続又は断続的に添加する。従って、例えばイオン強度、pH、安定剤の添加などに関するcTCFの条件は、自由に調整できる。
【0141】
発明の効果
本発明の装置及びこの装置を使用する各々の方法は、上記で概説した従来の単離工程の問題を解決する(背景技術参照)。
【0142】
装置A及びB並びにこの装置を使用する各々の方法のすべての実施形態において、潜在的に有害な環境での生成物滞留時間は、比類なく最短化し、それによって本質的に不安定で複雑な生物学的製品の収率と質が著しく増加する。設備能力が増加し、商品コストの減少が可能となる。
【0143】
更に、装置及び各々の方法は、大容量の収穫産物の中間貯蔵のための大規模な低温室設備又は冷却容器の必要をなくし、それによって設備投資コストが減少し、灌流発酵の小型で可動性の利点を十分に実現する。
【0144】
本発明の装置及び各々の方法の両方の実施形態は、本質的に高い自動化によって、従来の労働集約型のバッチ処理と比較して労務費を減少させる。この新規な装置によって、長期間にわたり1日24時間の連続稼働が可能になり、処理容量及び装置稼働率が最大化となる。
【0145】
更に、本発明の装置は、1つ又は複数の発酵槽の設備における物流的な困難を解消する。実施形態は1つ又は複数の連続灌流発酵のいずれかからの物質も処理することができる。
【0146】
重要なことに、新規な装置及び方法によって完全な無菌操作が可能となるため、単純な無菌濾過に続く無菌的処理では達成できなかった微生物の充填問題及びエンドトキシンの問題が解消する。
【0147】
更に、本発明の装置は、使い捨て用品を利用することによって、清浄である確認をする必要を回避又は最小限にできる。本発明の装置及び方法の独自の特性によって、使い捨てのモジュール、チューブ、バッグ及び組立品は、各々長期間使用することができ(キャンペーンの全期間まで)、従って劇的に費用が低下し、経済的な観点から言えば使い捨て品の利用を非常に魅力的なものとしている。
【0148】
本発明の装置A及びB並びに各々の方法のこの実施形態は、組換え血液凝固第VIII因子はもちろん、これに限定されないがBドメイン欠失第VIII因子などの第VIII因子の遺伝子組み換え版の製造に特に有用であることを証明した。しかし、本発明は明らかに、他の蛋白質及び生体分子、特に第VII因子、第IX因子、第X因子及びその他のものなどの複雑で本質的に不安定な蛋白質の製造にも同様に有用であることが期待できる。
【0149】
装置A及び各々の方法の利点
図8は、出願人等が一貫連続粒子除去要素(100)に見出した驚くべきフィルター容量の増加の一例を示す。
【0150】
図10は、通常の条件下でのモデル蛋白質の280nmでの保持液のUV吸着の測定による、本発明の装置Aの実施形態の連続UFシステム(300)の通常の生成物の滞留時間分布及び平均滞留時間を示す。見て分かるとおり、このシステムの生成物の平均滞留時間は、わずか約40分である。従って、装置Aのこの実施形態における発酵槽収穫産物ラインから最終の濃縮された保持液(分離物)への生成物の全滞留時間は、1〜2時間以下に収まる。これは従来のバッチ式単離工程の28時間以上の滞留時間の1/10未満であり、生成物(収穫産物)は少なくとも24時間(数日まで)で回収され、その後生成物は通常少なくとも4〜10時間処理される。
【0151】
図11は、血漿蛋白非含有の連続灌流発酵からの組換え血液凝固因子(r第VIII因子)の、従来のバッチ式単離工程(バッチ式濾過及びバッチ式UF)並びに本発明の装置A及び各々の方法の使用との両方によって得られた全単離収率の比較を示す。図を見て分かるとおり、本発明の連続工程は、著しくより高い製品収率を実現し、それによって製造能力の増加及び製造費の低下が実現する。
【0152】
装置Aを使用した本発明の方法の間に、膜の比流束(リットル/時間/m2/バール)が一定の処理容量で減少する間に、一貫連続限外濾過の膜貫通圧力は時間の経過とともに増加するであろう。これは、濃度分極、ゲル層形成及びファウリングなどの影響によってすべての限外濾過工程に共通である。しかし、バッチ式限外濾過と対照的に、図12において示す例から見て分かるとおり、装置Aの圧力及び比流束の変化は非常に遅く、それにより膜を洗浄又は交換する前に1回に数週間の連続稼働が可能になる。更に、このシステムの変化率及び全体的性能は、生成した生成物又は連続灌流発酵で使用される細胞系に対し極めて非感受性である(図12)。従って、本発明の装置A及び各々の方法は、異なる細胞系からの様々な標的蛋白質に対してロバストかつ予想通りに作動するので、様々な蛋白質の迅速な製造のための一般的なプラットホームにも理想的に適している。
【0153】
驚いたことに、出願人等は装置Aではゲル層形成及びファウリングの悪影響が実際極めて最小化したことと、フィルターの洗浄又は交換が必要となる前に組み込まれた限外濾過膜面積当たりに処理できる全容量が著しく増加したこととを見出した。図13は、長期間にわたる本発明の装置Aのロバスト性能を示す。約25日後に、膜貫通圧力は驚いたことに準定常状態で安定化したように見え、長期性能が更に高いことを示唆した。27日目に、より高い処理量の効果を試験するために保持液流量を意図的に2倍にした。34日後に、システムを開けずに、従って完全なシステムの整合性及び無菌性を維持しながら、無菌のNaOH0.5Mで短い洗い流しを行った。この後、TMPは再び安定化、又は少なくともわずかな率だけ増加した。システム性能への影響を試験するために、連続無菌操作の70日後に、循環流量を意図的に半分に減少させた。予想どおりに、TMPは、減少した物質移動、従って膜表面で増加した壁濃度によって、ある程度高い率で増加し始めた。しかし、このシステムを止めるまでの95日間の操作は成功裡にロバストに終了した。最小限の手作業で(毎日の標本抽出のみ)、膜面積m2当たり全部で4500リットルに近い量が処理された。比較すると、同じ用途のための最適化した従来のバッチ式限外濾過工程は、約100l/m2と45分の1の充填能力であり、常時少なくとも1〜2人のオペレーターが必要である。
【0154】
また驚いたことに、本発明の装置Aの、特に一貫連続限外濾過システム(300)の選択性は、従来のバッチ操作の選択性より著しく高いことを証明した。従来のバッチ式限外濾過では、工程の当初のステージの間に、保持された高分子から第2の膜が形成され(ゲル層)、これが明らかに分画分子量を減少させることは当業者には公知である。その結果、標的分子と汚染したより小さい蛋白質とが保持され、そのため重要な同時精製が実際的に不可能となる。従って、従来のバッチ式限外濾過では、分子量が10倍未満に離れた蛋白質の分離が可能であることはめったにない。しかし、図14から見て分かるとおり、本発明の一貫連続限外濾過工程では、効率的にIL−2SA(約16kD)及び緑色蛍光蛋白質GFP(27〜30kD)を分離するために条件を調整することは可能である。この予想よりも高い分離性能によって、同時濃縮及び精製を可能にする。
【0155】
装置B及び各々の方法の利点
図15は、本発明の装置Bの性能を示す。市販の対流性吸着器(Mustang Q、Pall Corporation、15層モジュール)を使用して、約100の継続的吸着/脱離サイクルを行い、連続灌流培養からの組換え第VIII因子変異体の濃縮精製を行った。達成した平均収率は約95%であり(アッセイの変動からのスプレッドの結果)、一方行われたサイクルの全てを通して圧力は比較的一定であった。従って、少なくとも100の継続的サイクルは吸着器設備を交換するまでに行うことができると明記することができる。
【0156】
本発明の装置Bを使用する方法の詳細な説明で示したように、生成物の全平均滞留時間は、この実施形態において、適切な緩衝液中で濃縮精製し安定化した形で溶離するまで3時間未満である。これは1日1回行われる従来のバッチ式単離工程における24時間の滞留時間より著しく短く、従って本質的に不安定な蛋白質製品の収率が著しく増加する。前に説明したこの実施形態において、1日当たり約13サイクルが行われ、これは図15と関連して、無菌性及び操作の連続性を損なうことなしに行われる半連続吸着器組立品の交換が、7〜8日毎にだけ必要であろうことを意味する。
【0157】
図16は、装置Bの1回の通常の吸着/脱離及び再生サイクルにおけるUV及び伝導率プロファイルの一例を示す。450(CV)超の吸着器容量を充填できる一方で、生成物の溶離が非常に鋭いピークであることが分かる。充填段階並びに洗浄及びストリップ(再生段階)の間に、流れ中の汚染物質は著しく除去される。
【0158】
図17は、半連続対流性吸着/脱離を含む本発明の方法の精製性能を示す。第VIII因子変異体分離物のSDS pageゲルの一例を示す。見て分かるとおり、充填された第VIII因子変異体の95%を含んだ溶出液画分(分離活性アッセイによって決定)は、充填物より蛋白質の含有が著しく少なく、従って精製されている。溶出液(分離物)中にさらなる分解バンドは見られず、これは優れた製品の質を示している。
【0159】
要約すれば、本発明の装置Bは、バッチ処理に匹敵するような同様の精製性能を実現することができ、同時に一方で本質的に不安定な蛋白質製品の収率損失と、製品の滞留時間の最小化による製品の質の問題とを最小化する。同時に、本発明の方法の本質的に高度な自動化によって労務費が劇的に減少し、オペレーター介入の必要性が最小となる。
【0160】
前述で本発明を理解するために例示として少し詳しく説明したが、ある種の変更及び修正が行われ得ることは当業者なら明らかであろう。従って、説明及び例示は、添付特許請求の範囲で叙述した本発明の範囲を限定するものとして解釈するべきではない。
【0161】
従って、本明細書において所与の供給流からの対象分子の高収率を実現するための濾過の改良した方法を提供する本発明の実施形態は、本発明の原理の応用の単なる例示であることを理解すべきである。本発明の精神又は添付特許請求の範囲から逸脱することなしに、本開示の構成要素の形態、使用方法、用途の変更を行えることは前述の説明から明らかである。
【0162】
(参照事項)
(1) 流束対TMP曲線の圧力依存性領域において、対象分子の転移点より下の比流量で連続限外濾過によって不均一な清澄液混合物を濾過するステップを含み、前記比流量が連続限外濾過の間を通して実質的に一定に維持されている、
不均一な清澄液混合物から対象分子を精製する方法。
(2) 保持液の濃度を約20%未満超える壁濃度を生じる比流量で前記清澄混合物を濾過するステップを更に含む、(1)に記載の方法。
(3) 保持液の濃度を約15%未満超える壁濃度を生じる比流量で前記清澄混合物を濾過するステップを更に含む、(1)に記載の方法。
(4) 保持液の濃度を約10%未満超える壁濃度を生じる比流量で前記清澄混合物を濾過するステップを更に含む、(1)に記載の方法。
(5) 前記清澄液混合物を、清澄液混合物の体積流量(リットル/時間)の0.1〜2倍にほぼ等しい面積(平方メートル)を有する限外濾過膜を通して濾過するステップを更に含む、(1)に記載の方法。
(6) 前記限外濾過膜が、前記清澄液混合物の体積流量(リットル/時間)の0.3〜1倍にほぼ等しい面積(平方メートル)を有する、(5)に記載の方法。
(7) 不均一な組織培養液混合物から対象蛋白質を精製するための方法であって、
(a)連続灌流発酵工程によって、対象蛋白質を含有する不均一な組織培養液混合物を製造するステップと、
(b)前記組織培養液混合物を、連続灌流発酵工程と一体化した連続粒子除去工程へと移送するステップと、
(c)前記連続粒子除去工程において、前記組織培養液から粒子状汚染物質を除去し、対象蛋白質を含有する清澄組織培養液を製造するステップと、
(d)前記清澄組織培養液を、連続粒子除去工程と一体化した連続精製工程に移送するステップと、
(e)前記連続精製工程において、前記清澄組織培養液から前記対象蛋白質を精製するステップと
を含み、
前記連続灌流発酵工程、連続粒子除去工程及び連続精製工程の間を通して、混合物の比流量が実質的に一定に維持されている上記方法。
(8) 前記連続精製工程が限外濾過である、(7)に記載の方法。
(9) 前記清澄組織培養混合物を、保持液の濃度を約20%未満超える壁濃度を生じる比流量で濾過するステップを更に含む、(8)に記載の方法。
(10) 前記清澄組織培養混合物を、保持液の濃度を約15%未満超える壁濃度を生じる比流量で濾過するステップを更に含む、(8)に記載の方法。
(11) 前記清澄組織培養混合物を、保持液の濃度を約10%未満超える壁濃度を生じる比流量で濾過するステップを更に含む、(8)に記載の方法。
(12) 前記連続灌流発酵からの体積流量(リットル/時間)の0.1〜2倍にほぼ等しい面積(平方メートル)を有する限外濾過膜を通して、前記清澄組織培養混合物を濾過するステップを更に含む、(8)に記載の方法。
(13) 前記連続灌流発酵からの体積流量(リットル/時間)の0.3〜1倍にほぼ等しい面積(平方メートル)を有する限外濾過膜を通して、前記清澄組織培養混合物を濾過するステップを更に含む、(8)に記載の方法。
(14) 不均一な組織培養液混合物から対象蛋白質を精製するための方法であって、
(a)連続灌流発酵工程によって、対象蛋白質を含む不均一な組織培養液混合物を製造するステップと、
(b)前記組織培養液混合物を、連続灌流発酵システムと一体化した連続粒子除去工程に移送するステップと、
(c)前記連続粒子除去工程において前記組織培養液から粒子状汚染物質を除去し、対象蛋白質を含有する清澄組織培養液を製造するステップと、
(d)前記清澄組織培養液を連続粒子除去工程と一体化したサージ容器に移送するステップと、
(e)前記清澄組織培養液を前記サージ容器と一体化した精製工程に断続的に移送するステップと、
(e)前記精製システムにおいて前記清澄組織培養液から前記対象蛋白質を精製し、対象蛋白質を含有する無菌で無粒子の濃縮・部分精製単離生成物を製造するステップと
を含み、
前記連続灌流発酵工程及び連続粒子除去工程の間を通して、混合物の比流量が実質的に一定に維持されている上記方法。
(15) 前記精製工程が対流性吸着/脱離である、(14)に記載の方法。
(16) 対象蛋白質を不均一な組織培養液混合物から分離するための装置であって、
(a)連続灌流発酵システムと、
(b)灌流発酵システムと一体化した連続粒子除去システムと、
(c)粒子除去システムと一体化した連続精製システムと
を含み、
前記装置が無菌状態下で維持される上記装置。
(17) (a)対象蛋白質を含有する組織培養液を、実質的に一定の体積流量で連続して製造するように構成されている連続灌流発酵システムと、
(b)前記灌流発酵システムと一体化しており、灌流発酵システムから前記組織培養液を連続して受け取り、清澄組織培養液を連続して製造するように構成されている連続粒子除去システムと、
(c)前記粒子除去システムと一体化しており、粒子除去システムから前記清澄組織培養液を連続して受け取り、前記対象蛋白質を含有する単離生成物を連続して製造するように構成されている連続精製システムと
を含み、
前記装置が無菌状態下で維持される、(16)に記載の装置。
(18) 限外濾過システムが、前記連続灌流発酵の体積流量(リットル/時間)の0.1〜2倍にほぼ等しい面積(平方メートル)を有する限外濾過膜を含む、(17)に記載の装置。
(19) 限外濾過システムが、前記連続灌流発酵の体積流量(リットル/時間)の0.3〜1倍にほぼ等しい面積(平方メートル)を有する限外濾過膜を含む、(17)に記載の装置。
(20) 組織培養液流から対象蛋白質を分離するための装置であって、
(a)連続灌流発酵システムと、
(b)灌流発酵システムと一体化した連続粒子除去システムと、
(c)粒子除去システムと一体化した断続的精製システムとを含み、
前記装置が無菌状態下で維持されている上記装置。
(21) (a)対象蛋白質を含有する組織培養液を連続して製造するように構成された灌流発酵システムと、
(b)リアクターと一体化しており、前記リアクターから前記組織培養液を連続して受け取り、清澄組織培養液を連続して製造するように構成された粒子除去システムと、
(c)前記粒子除去システムと一体化しており、前記粒子除去システムから前記清澄組織培養液を連続して受け取り、清澄組織培養液を半連続的に放出するように構成されているサージ容器と、
(d)前記サージ容器と一体化しており、サージ容器から半連続的に前記清澄組織培養液を受け取るように構成された精製システムと
を含み、
無菌状態を維持するように構成されている、(20)に記載の装置。
(22) 前記精製システムが対流性吸着/脱離システムを含む、(20)に記載の装置。
【特許請求の範囲】
【請求項1】
流束対TMP曲線の圧力依存性領域において、対象分子の転移点より下の比流量で連続限外濾過によって不均一な清澄液混合物を濾過するステップを含み、前記比流量が連続限外濾過の間を通して実質的に一定に維持されている、
不均一な清澄液混合物から対象分子を精製する方法。
【請求項2】
保持液の濃度を約20%未満超える壁濃度を生じる比流量で前記清澄混合物を濾過するステップを更に含む、請求項1に記載の方法。
【請求項3】
保持液の濃度を約15%未満超える壁濃度を生じる比流量で前記清澄混合物を濾過するステップを更に含む、請求項1に記載の方法。
【請求項4】
保持液の濃度を約10%未満超える壁濃度を生じる比流量で前記清澄混合物を濾過するステップを更に含む、請求項1に記載の方法。
【請求項5】
前記清澄液混合物を、清澄液混合物の体積流量(リットル/時間)の0.1〜2倍にほぼ等しい面積(平方メートル)を有する限外濾過膜を通して濾過するステップを更に含む、請求項1に記載の方法。
【請求項6】
前記限外濾過膜が、前記清澄液混合物の体積流量(リットル/時間)の0.3〜1倍にほぼ等しい面積(平方メートル)を有する、請求項5に記載の方法。
【請求項7】
不均一な組織培養液混合物から対象蛋白質を精製するための方法であって、
(a)連続灌流発酵工程によって、対象蛋白質を含有する不均一な組織培養液混合物を製造するステップと、
(b)前記組織培養液混合物を、連続灌流発酵工程と一体化した連続粒子除去工程へと移送するステップと、
(c)前記連続粒子除去工程において、前記組織培養液から粒子状汚染物質を除去し、対象蛋白質を含有する清澄組織培養液を製造するステップと、
(d)前記清澄組織培養液を、連続粒子除去工程と一体化した連続精製工程に移送するステップと、
(e)前記連続精製工程において、前記清澄組織培養液から前記対象蛋白質を精製するステップと
を含み、
前記連続灌流発酵工程、連続粒子除去工程及び連続精製工程の間を通して、混合物の比流量が実質的に一定に維持されている上記方法。
【請求項8】
前記連続精製工程が限外濾過である、請求項7に記載の方法。
【請求項9】
前記清澄組織培養混合物を、保持液の濃度を約20%未満超える壁濃度を生じる比流量で濾過するステップを更に含む、請求項8に記載の方法。
【請求項10】
前記清澄組織培養混合物を、保持液の濃度を約15%未満超える壁濃度を生じる比流量で濾過するステップを更に含む、請求項8に記載の方法。
【請求項11】
前記清澄組織培養混合物を、保持液の濃度を約10%未満超える壁濃度を生じる比流量で濾過するステップを更に含む、請求項8に記載の方法。
【請求項12】
前記連続灌流発酵からの体積流量(リットル/時間)の0.1〜2倍にほぼ等しい面積(平方メートル)を有する限外濾過膜を通して、前記清澄組織培養混合物を濾過するステップを更に含む、請求項8に記載の方法。
【請求項13】
前記連続灌流発酵からの体積流量(リットル/時間)の0.3〜1倍にほぼ等しい面積(平方メートル)を有する限外濾過膜を通して、前記清澄組織培養混合物を濾過するステップを更に含む、請求項8に記載の方法。
【請求項14】
不均一な組織培養液混合物から対象蛋白質を精製するための方法であって、
(a)連続灌流発酵工程によって、対象蛋白質を含む不均一な組織培養液混合物を製造するステップと、
(b)前記組織培養液混合物を、連続灌流発酵システムと一体化した連続粒子除去工程に移送するステップと、
(c)前記連続粒子除去工程において前記組織培養液から粒子状汚染物質を除去し、対象蛋白質を含有する清澄組織培養液を製造するステップと、
(d)前記清澄組織培養液を連続粒子除去工程と一体化したサージ容器に移送するステップと、
(e)前記清澄組織培養液を前記サージ容器と一体化した精製工程に断続的に移送するステップと、
(e)前記精製システムにおいて前記清澄組織培養液から前記対象蛋白質を精製し、対象蛋白質を含有する無菌で無粒子の濃縮・部分精製単離生成物を製造するステップと
を含み、
前記連続灌流発酵工程及び連続粒子除去工程の間を通して、混合物の比流量が実質的に一定に維持されている上記方法。
【請求項15】
前記精製工程が対流性吸着/脱離である、請求項14に記載の方法。
【請求項16】
対象蛋白質を不均一な組織培養液混合物から分離するための装置であって、
(a)連続灌流発酵システムと、
(b)灌流発酵システムと一体化した連続粒子除去システムと、
(c)粒子除去システムと一体化した連続精製システムと
を含み、
前記装置が無菌状態下で維持される上記装置。
【請求項17】
(a)対象蛋白質を含有する組織培養液を、実質的に一定の体積流量で連続して製造するように構成されている連続灌流発酵システムと、
(b)前記灌流発酵システムと一体化しており、灌流発酵システムから前記組織培養液を連続して受け取り、清澄組織培養液を連続して製造するように構成されている連続粒子除去システムと、
(c)前記粒子除去システムと一体化しており、粒子除去システムから前記清澄組織培養液を連続して受け取り、前記対象蛋白質を含有する単離生成物を連続して製造するように構成されている連続精製システムと
を含み、
前記装置が無菌状態下で維持される、請求項16に記載の装置。
【請求項18】
限外濾過システムが、前記連続灌流発酵の体積流量(リットル/時間)の0.1〜2倍にほぼ等しい面積(平方メートル)を有する限外濾過膜を含む、請求項17に記載の装置。
【請求項19】
限外濾過システムが、前記連続灌流発酵の体積流量(リットル/時間)の0.3〜1倍にほぼ等しい面積(平方メートル)を有する限外濾過膜を含む、請求項17に記載の装置。
【請求項20】
組織培養液流から対象蛋白質を分離するための装置であって、
(a)連続灌流発酵システムと、
(b)灌流発酵システムと一体化した連続粒子除去システムと、
(c)粒子除去システムと一体化した断続的精製システムとを含み、
前記装置が無菌状態下で維持されている上記装置。
【請求項21】
(a)対象蛋白質を含有する組織培養液を連続して製造するように構成された灌流発酵システムと、
(b)リアクターと一体化しており、前記リアクターから前記組織培養液を連続して受け取り、清澄組織培養液を連続して製造するように構成された粒子除去システムと、
(c)前記粒子除去システムと一体化しており、前記粒子除去システムから前記清澄組織培養液を連続して受け取り、清澄組織培養液を半連続的に放出するように構成されているサージ容器と、
(d)前記サージ容器と一体化しており、サージ容器から半連続的に前記清澄組織培養液を受け取るように構成された精製システムと
を含み、
無菌状態を維持するように構成されている、請求項20に記載の装置。
【請求項22】
前記精製システムが対流性吸着/脱離システムを含む、請求項20に記載の装置。
【請求項1】
流束対TMP曲線の圧力依存性領域において、対象分子の転移点より下の比流量で連続限外濾過によって不均一な清澄液混合物を濾過するステップを含み、前記比流量が連続限外濾過の間を通して実質的に一定に維持されている、
不均一な清澄液混合物から対象分子を精製する方法。
【請求項2】
保持液の濃度を約20%未満超える壁濃度を生じる比流量で前記清澄混合物を濾過するステップを更に含む、請求項1に記載の方法。
【請求項3】
保持液の濃度を約15%未満超える壁濃度を生じる比流量で前記清澄混合物を濾過するステップを更に含む、請求項1に記載の方法。
【請求項4】
保持液の濃度を約10%未満超える壁濃度を生じる比流量で前記清澄混合物を濾過するステップを更に含む、請求項1に記載の方法。
【請求項5】
前記清澄液混合物を、清澄液混合物の体積流量(リットル/時間)の0.1〜2倍にほぼ等しい面積(平方メートル)を有する限外濾過膜を通して濾過するステップを更に含む、請求項1に記載の方法。
【請求項6】
前記限外濾過膜が、前記清澄液混合物の体積流量(リットル/時間)の0.3〜1倍にほぼ等しい面積(平方メートル)を有する、請求項5に記載の方法。
【請求項7】
不均一な組織培養液混合物から対象蛋白質を精製するための方法であって、
(a)連続灌流発酵工程によって、対象蛋白質を含有する不均一な組織培養液混合物を製造するステップと、
(b)前記組織培養液混合物を、連続灌流発酵工程と一体化した連続粒子除去工程へと移送するステップと、
(c)前記連続粒子除去工程において、前記組織培養液から粒子状汚染物質を除去し、対象蛋白質を含有する清澄組織培養液を製造するステップと、
(d)前記清澄組織培養液を、連続粒子除去工程と一体化した連続精製工程に移送するステップと、
(e)前記連続精製工程において、前記清澄組織培養液から前記対象蛋白質を精製するステップと
を含み、
前記連続灌流発酵工程、連続粒子除去工程及び連続精製工程の間を通して、混合物の比流量が実質的に一定に維持されている上記方法。
【請求項8】
前記連続精製工程が限外濾過である、請求項7に記載の方法。
【請求項9】
前記清澄組織培養混合物を、保持液の濃度を約20%未満超える壁濃度を生じる比流量で濾過するステップを更に含む、請求項8に記載の方法。
【請求項10】
前記清澄組織培養混合物を、保持液の濃度を約15%未満超える壁濃度を生じる比流量で濾過するステップを更に含む、請求項8に記載の方法。
【請求項11】
前記清澄組織培養混合物を、保持液の濃度を約10%未満超える壁濃度を生じる比流量で濾過するステップを更に含む、請求項8に記載の方法。
【請求項12】
前記連続灌流発酵からの体積流量(リットル/時間)の0.1〜2倍にほぼ等しい面積(平方メートル)を有する限外濾過膜を通して、前記清澄組織培養混合物を濾過するステップを更に含む、請求項8に記載の方法。
【請求項13】
前記連続灌流発酵からの体積流量(リットル/時間)の0.3〜1倍にほぼ等しい面積(平方メートル)を有する限外濾過膜を通して、前記清澄組織培養混合物を濾過するステップを更に含む、請求項8に記載の方法。
【請求項14】
不均一な組織培養液混合物から対象蛋白質を精製するための方法であって、
(a)連続灌流発酵工程によって、対象蛋白質を含む不均一な組織培養液混合物を製造するステップと、
(b)前記組織培養液混合物を、連続灌流発酵システムと一体化した連続粒子除去工程に移送するステップと、
(c)前記連続粒子除去工程において前記組織培養液から粒子状汚染物質を除去し、対象蛋白質を含有する清澄組織培養液を製造するステップと、
(d)前記清澄組織培養液を連続粒子除去工程と一体化したサージ容器に移送するステップと、
(e)前記清澄組織培養液を前記サージ容器と一体化した精製工程に断続的に移送するステップと、
(e)前記精製システムにおいて前記清澄組織培養液から前記対象蛋白質を精製し、対象蛋白質を含有する無菌で無粒子の濃縮・部分精製単離生成物を製造するステップと
を含み、
前記連続灌流発酵工程及び連続粒子除去工程の間を通して、混合物の比流量が実質的に一定に維持されている上記方法。
【請求項15】
前記精製工程が対流性吸着/脱離である、請求項14に記載の方法。
【請求項16】
対象蛋白質を不均一な組織培養液混合物から分離するための装置であって、
(a)連続灌流発酵システムと、
(b)灌流発酵システムと一体化した連続粒子除去システムと、
(c)粒子除去システムと一体化した連続精製システムと
を含み、
前記装置が無菌状態下で維持される上記装置。
【請求項17】
(a)対象蛋白質を含有する組織培養液を、実質的に一定の体積流量で連続して製造するように構成されている連続灌流発酵システムと、
(b)前記灌流発酵システムと一体化しており、灌流発酵システムから前記組織培養液を連続して受け取り、清澄組織培養液を連続して製造するように構成されている連続粒子除去システムと、
(c)前記粒子除去システムと一体化しており、粒子除去システムから前記清澄組織培養液を連続して受け取り、前記対象蛋白質を含有する単離生成物を連続して製造するように構成されている連続精製システムと
を含み、
前記装置が無菌状態下で維持される、請求項16に記載の装置。
【請求項18】
限外濾過システムが、前記連続灌流発酵の体積流量(リットル/時間)の0.1〜2倍にほぼ等しい面積(平方メートル)を有する限外濾過膜を含む、請求項17に記載の装置。
【請求項19】
限外濾過システムが、前記連続灌流発酵の体積流量(リットル/時間)の0.3〜1倍にほぼ等しい面積(平方メートル)を有する限外濾過膜を含む、請求項17に記載の装置。
【請求項20】
組織培養液流から対象蛋白質を分離するための装置であって、
(a)連続灌流発酵システムと、
(b)灌流発酵システムと一体化した連続粒子除去システムと、
(c)粒子除去システムと一体化した断続的精製システムとを含み、
前記装置が無菌状態下で維持されている上記装置。
【請求項21】
(a)対象蛋白質を含有する組織培養液を連続して製造するように構成された灌流発酵システムと、
(b)リアクターと一体化しており、前記リアクターから前記組織培養液を連続して受け取り、清澄組織培養液を連続して製造するように構成された粒子除去システムと、
(c)前記粒子除去システムと一体化しており、前記粒子除去システムから前記清澄組織培養液を連続して受け取り、清澄組織培養液を半連続的に放出するように構成されているサージ容器と、
(d)前記サージ容器と一体化しており、サージ容器から半連続的に前記清澄組織培養液を受け取るように構成された精製システムと
を含み、
無菌状態を維持するように構成されている、請求項20に記載の装置。
【請求項22】
前記精製システムが対流性吸着/脱離システムを含む、請求項20に記載の装置。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【公開番号】特開2012−213772(P2012−213772A)
【公開日】平成24年11月8日(2012.11.8)
【国際特許分類】
【出願番号】特願2012−129422(P2012−129422)
【出願日】平成24年6月7日(2012.6.7)
【分割の表示】特願2007−534832(P2007−534832)の分割
【原出願日】平成17年9月30日(2005.9.30)
【出願人】(504459294)バイヤー ヘルスケア エルエルシー (2)
【Fターム(参考)】
【公開日】平成24年11月8日(2012.11.8)
【国際特許分類】
【出願日】平成24年6月7日(2012.6.7)
【分割の表示】特願2007−534832(P2007−534832)の分割
【原出願日】平成17年9月30日(2005.9.30)
【出願人】(504459294)バイヤー ヘルスケア エルエルシー (2)
【Fターム(参考)】
[ Back to top ]

