生体分子を定量化するための方法
本発明は、試料中の生体分子の完全補完物(entire complement)を含む1つまたは複数の生体分子の包括的定量化を可能にする方法であって、該生体分子の量を、少なくとも2つの異なる細胞集団からの抽出を通じて得られた標準混合物中の参照生体分子の量に比較することによる、前記方法に関する。本発明はさらに、前記標準混合物自体、その調製および使用に関する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、試料中の完全補完物(entire complement)を含む1つまたは複数の生体分子の包括的定量化を可能にする方法であって、該生体分子の量を、少なくとも2つの異なる細胞集団からの抽出を通じて得られた標準混合物中の参照生体分子の量に比較することによる、前記方法に関する。本発明はさらに、前記標準混合物自体、その調製および使用に関する。
【背景技術】
【0002】
ゲノム、細胞、組織または生物によって発現されるタンパク質など、試料中の生体分子および生体分子断片の包括的定量化は、複雑なタスクである。
近年、質量分析は大きな技術的進歩を成し遂げ、そしてますます広く適用されてきている(R. AebersoldおよびM. Mann, Nature 422 (6928), 198 (2003), B.F. Cravatt, G.M. Simon,およびJ.R. Yates, 3rd, Nature 450 (7172), 991 (2007))。しかし、高解像度質量分析法による、ゲノム、細胞、組織または生物によって発現されるタンパク質などの生体分子の完全補完物、例えば腫瘍プロテオームの正確な定量化は、なお未成熟である(F. Bertucci, D. Birnbaum,およびA. Goncalves, Mol Cell Proteomics 5 (10), 1772 (2006), J.M. Koomen, E.B. Haura, G. Beplerら, Mol Cell Proteomics 7 (10), 1780 (2008))。
【0003】
主には、生体分子の代表の数を定量化することが困難であり、これは、再現性がある結果を得るための、そしてしばしば存在量が少ない疾患関連生体分子、例えば癌関連タンパク質を研究するための必要条件である。
【0004】
特定の疾患状態、例えば腫瘍の分子分類は、患者分離、最適な治療様式の選択および転帰の予測を補助しうる。マイクロアレイを用いたトランスクリプトーム・レベルの測定は、この適用のため有望であることが示されてきており、そして臨床的に適用されはじめている(T.R. Golub, D.K. Slonim, P. Tamayoら, Science (New York, N.Y 286 (5439), 531 (1999), X. Li, R.J. Quigg, J. Zhouら, Current genomics 9 (7), 466 (2008))。
【0005】
細胞培養におけるアミノ酸による安定同位体標識(SILAC)は、非常に正確であり、そして頑強であって、プロテオームを定量化する価値あるツールである(S.E. Ong, B. Blagoev, I. Kratchmarovaら, Mol Cell Proteomics 1(5), 376 (2002), S.E. OngおよびM. Mann, Nature protocols 1 (6), 2650 (2006))。例えば、Chowdhuryら(Rapid Communications in Mass Spectrometry 9:563-569 (1995)は、質量分析および同位体標識類似体を用いて、一部切除(truncated)成熟コラゲナーゼの分子量を調べ、そしてStocklinら(Diabetes 46: 44-50 (1997)は、抽出され、そして精製されている血清試料中のヒトインスリン濃度を調べた。どちらも、生体分子の事前の単離を伴わない生体分子の量の決定を論じておらず、もちろん、試料中に含まれる複数の生体分子、例えばこうした試料中の生体分子の完全補完物の絶対量の決定を論じていない。
【0006】
SILACは、全プロテオームの完全代謝標識を必要とするため、SILACは通常、細胞培養に限定され、そして臨床試料には不適切であると考えられる。近年、いくつかの研究によって、SILACの範囲が広がってきた。Neuro2A細胞株が代謝標識され、そしてマウス全脳に比較されてきている(Y. Ishihama, T. Sato, T. Tabataら, Nature Biotechnology 23 (5), 617 (2005))。総数602のタンパク質が定量化されたが、細胞株および組織間には最大10倍の比があった。試料および内部標準間のこうした高い比は、正確な定量化を行うのを困難にし、これはSILAC対において存在量がより少ないペプチドがノイズレベルに近づきうるためである。SILAC標識Hepa1-6細胞を用いて、マウス肝臓から単離された培養初代肝細胞2由来のタンパク質が最近定量化された(S. Pan, L. Cheng, J.T. Whiteら, Omics 13 (4), 345 (2009))。さらに、以前、マウスがSILAC標識されているが、この方法は、ヒト被験体には適用不能である(M. Kruger, M. Moser, S. Ussarら, Cell 134 (2), 353 (2008))。
【先行技術文献】
【非特許文献】
【0007】
【非特許文献1】R. AebersoldおよびM. Mann, Nature 422 (6928), 198 (2003)
【非特許文献2】B.F. Cravatt, G.M. Simon,およびJ.R. Yates, 3rd, Nature 450 (7172), 991 (2007)
【非特許文献3】F. Bertucci, D. Birnbaum,およびA. Goncalves, Mol Cell Proteomics 5 (10), 1772 (2006)
【非特許文献4】J.M. Koomen, E.B. Haura, G. Beplerら, Mol Cell Proteomics 7 (10), 1780 (2008)
【非特許文献5】T.R. Golub, D.K. Slonim, P. Tamayoら, Science (New York, N.Y 286 (5439), 531 (1999)
【非特許文献6】X. Li, R.J. Quigg, J. Zhouら, Current genomics 9 (7), 466 (2008)
【非特許文献7】S.E. Ong, B. Blagoev, I. Kratchmarovaら, Mol Cell Proteomics 1(5), 376 (2002)
【非特許文献8】S.E. OngおよびM. Mann, Nature protocols 1 (6), 2650 (2006)
【非特許文献9】Chowdhuryら(Rapid Communications in Mass Spectrometry 9:563-569 (1995)
【非特許文献10】Stocklinら(Diabetes 46: 44-50 (1997)
【非特許文献11】Y. Ishihama, T. Sato, T. Tabataら, Nature Biotechnology 23 (5), 617 (2005)
【非特許文献12】S. Pan, L. Cheng, J.T. Whiteら, Omics 13 (4), 345 (2009)
【非特許文献13】M. Kruger, M. Moser, S. Ussarら, Cell 134 (2), 353 (2008)
【発明の概要】
【発明が解決しようとする課題】
【0008】
したがって、試料、例えばヒト試料および特にヒト組織試料などの試料中の、1つまたは複数の生体分子(例えばタンパク質、オリゴヌクレオチド等)、例えばその完全補完物を定量化するための単純でそして迅速な方法であって、さらに、ゲノム、細胞、組織または生物によって発現されるタンパク質など、多数の生体分子、例えばこうした試料中の生体分子の一部または完全補完物を迅速に定量化することを可能にする、前記方法に対する必要性がある。
【課題を解決するための手段】
【0009】
上記目的は、本明細書に記載し、そして請求するような、本発明にしたがった方法によって解決される。
【図面の簡単な説明】
【0010】
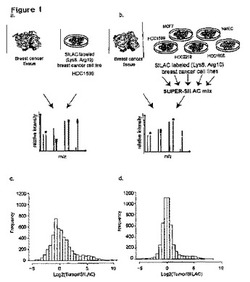
【図1】1つのSILAC標識細胞タイプ対SUPER-SILAC混合物を用いた、腫瘍組織の定量化。(A)内部標準として標識HCC1599乳癌細胞株を用いた腫瘍組織の定量的分析の実験スキーム。標識細胞の溶解物を、腫瘍溶解物と1:1の比で混合した。混合物を消化し、そしてタンデム質量分析と組み合わせた高解像度液体クロマトグラフィー(LC-MS/MS)によって、ペプチドを分析した。(B)4つの乳癌細胞株および正常乳腺上皮細胞を含む、5つの異なる細胞タイプをSILAC標識した。等量のタンパク質を混合して、SUPER-SILAC混合物を形成し、これを次いで、腫瘍組織と混合し、そして(A)におけるように分析した。(C)腫瘍タンパク質およびHCC1599細胞間の比のヒストグラム。頻度は、各ビンにおけるタンパク質数に相当する。(D)腫瘍タンパク質およびSUPER-SILAC混合物間の比のヒストグラム。
【図2】SUPER-SILAC混合物を用いた定量化の正確性。(A)内部標準としてSUPER-SILAC混合物を用いた、腫瘍プロテオームの組み合わせ3つ組分析に対する、単一分析で決定される比の比較。(B)3つの技術的複製物の変異係数のヒストグラム。(C)腫瘍で発現されるキナーゼの組み合わせ3つ組分析に対する、単一分析で決定される比の比較。(D)5つの複製物における5つの癌関連タンパク質の比。
【図3】LTQOrbitrap Velosを用いた、内部標準としてSUPER-SILAC混合物を用いる、腫瘍組織分析。前分画を伴わずに、C18カラム上でペプチドを分離した。(A)腫瘍タンパク質およびSILAC混合物間の比の分布。(B)2つの技術的複製物間を比較した比。
【図4】1つのSILAC標識細胞タイプ対super-SILAC混合物を用いた、星状細胞腫組織の定量化。(A)腫瘍タンパク質および1321N1細胞間の比のヒストグラム。頻度は、各ビンにおけるタンパク質数に相当する。(B)腫瘍タンパク質およびsuper-SILAC混合物間の比のヒストグラム。
【図5】肝臓定量的ホスホプロテオーム(phosphoproteomic)分析の実験設計。(A)対照およびインスリン処置肝臓試料の定量的ホスホプロテオーム分析の実験設計。インスリン処置および非処置標識Hepa1-6細胞の混合物は、内部標準として働く。混合物を消化し、そして生じたペプチドを高解像度LC MS/MSによって分析する。次いで、対照およびインスリン処置肝臓由来の比を比較する(「比の比」)。(B、C)対照肝臓およびHepa1-6細胞のホスホペプチド間(B)の、そしてインスリン処置肝臓およびHepa1-6細胞のホスホペプチド間(C)の比の分布。(D)ボックスプロット、ならびに(E)インスリン処置および対照肝臓試料間のホスホペプチド比の「比の比」ヒストグラム(1つの技術的複製物の代表的な例-3つ組分布はさらにより狭い)。
【図6】インスリン処置に際して、肝臓において活性化されるインスリンシグナル伝達経路のメンバー。インスリン受容体チロシンキナーゼと相互作用した後、インスリンは、インスリンの代謝および分裂促進効果を制御する、一連の仲介因子を活性化する。マウスのインスリン処置後、リン酸化が増加した部位を赤で示し、定量化されるが、インスリンによって制御されない部位を緑で標識する。
【発明を実施するための形態】
【0011】
したがって、1つの側面において、本発明は、試料中の1つまたは複数の生体分子を定量化するための方法であって、前記試料中の前記の1つまたは前記の複数の生体分子の量を決定し;そして標準混合物中の複数の生体分子の中の1つまたは複数の参照生体分子の量に対して、該量を比較する工程を含み、前記の複数の生体分子が、少なくとも2つの異なる細胞集団から、例えばこれらの細胞集団の混合物からの抽出を通じて得られており;前記の1つまたは前記の複数の参照生体分子は、前記の1つまたは前記の複数の生体分子の標識型である、前記方法を提供する。
【0012】
主な態様は、2つの群の生体分子を指すことが理解される。第一の群は、前記試料中の前記の1つまたは複数の生体分子であり、生体分子の前記群はまた、以下において、「第一の生体分子」とも称される。一方、標準混合物中の複数の生体分子への言及があり、これは、前記標準混合物が、前記試料とは別個に保持されていると理解される。したがって、前記標準混合物中の前記の複数の生体分子であるこの第二の群の生体分子はまた、以下において「第二の生体分子」とも称される。したがって、そして第一および第二の生体分子の用語法を用いて表す場合、主な態様は、試料中の1つまたは複数の第一の生体分子を定量化するための方法であって、前記試料中の前記の1つのまたは前記の複数の第一の生体分子の量を決定し;そして、標準混合物中の複数の第二の生体分子の中の1つまたは複数の参照生体分子の量に対して、該量を比較する工程を含み、前記の複数の第二の生体分子は、少なくとも2つの異なる細胞集団からの抽出を通じて得られており、前記の1つまたは複数の参照生体分子が、前記の1つまたは前記の複数の第一の生体分子の標識型である、前記方法に関する。
【0013】
好ましい態様において、前記試料中の前記の1つまたは前記の複数の生体分子、すなわち前記の第一の生体分子の量は、前記標準混合物と前記試料を混合した後に決定される。標準混合物は、したがって、本発明の方法および使用の目的のための内部標準として働く。
【0014】
本発明のこの側面にしたがって、前記の1つまたは前記の複数の生体分子、および前記の1つまたは前記の複数の参照生体分子の量は、好ましくは質量分析によって決定されることが認識されるであろう。
【0015】
厳密に必須ではないが、上記方法は、前記の1つまたは前記の複数の生体分子の配列決定工程をさらに含んでもよい。
好ましい態様において、前記標準混合物中の前記の1つまたは前記の複数の参照生体分子は前選択され、そして前記質量分析は、単一または複数イオンモニタリングにより、この/これらの前選択された参照生体分子をターゲットとする。
【0016】
上記方法において、比較工程は、前記の1つまたは前記の複数の生体分子の単数または複数のピーク、および前記の1つまたは前記の複数の参照生体分子の対応する単数または複数のピークの間の強度比を決定する工程を含む。例えば、比は、前記参照生体分子のシグナルを統合する前に、前記の生体分子のシグナルをまず統合し、そして次いで、一方のシグナルを他方によって割るか、またはその逆を行うことにより、比を決定する工程によって、比を得てもよい。
【0017】
好ましい態様において、前記の1つまたは前記の複数の生体分子の量は、絶対量である。この場合、前記標準混合物中の前記の1つまたは前記の複数の参照生体分子の量はあらかじめ決定されていることが認識されるであろう。前記標準混合物中の前記の1つまたは前記の複数の参照生体分子の量は、前記試料中の前記の1つまたは前記の複数の生体分子の量を決定する前または決定した後のいずれにあらかじめ決定されてもよい。
【0018】
さらなる関連する側面において、本発明は、試料中の1つまたは複数の生体分子を定量化するための標準混合物であって、少なくとも2つの異なる細胞集団、例えばこれらの細胞集団の混合物からの抽出を通じて得られている複数の生体分子の中に、1つまたは複数の参照生体分子を含む、前記混合物を提供する。本発明にやはり含まれるのは、本明細書に記載し、そして請求する任意の方法における、前述の標準混合物の使用である。
【0019】
さらにさらなる関連する側面において、本発明は、試料中の1つまたは複数の生体分子を定量化するための標準混合物を調製するための方法であって、少なくとも2つの異なる細胞集団由来の、例えばこれらの細胞集団の混合物由来の1つまたは複数の参照生体分子を含む複数の生体分子を抽出する工程を含む、前記方法を提供する。
【0020】
本発明にしたがった方法、標準混合物および使用において、単数または複数の参照生体分子は、同位体標識され、好ましくは化学的にまたは代謝的に同位体標識され、そして最も好ましくは代謝的に同位体標識される。特に好ましい態様において、代謝的同位体標識は、細胞培養中のアミノ酸での安定同位体標識(SILAC)であり、そして安定同位体は、2H、13C、15N、17O、18O、33P、34Sおよびその組み合わせからなる群より選択される。特に好ましいのは、安定同位体が13Cおよび15Nより選択される態様である。
【0021】
先に言及するように、さらにさらなる関連する側面において、本発明は、試料中の1つまたは複数の生体分子を定量化するための標準混合物の使用を提供する。標準混合物は、複数の生体分子の中に1つまたは複数の参照生体分子を含み、複数の生体分子は、少なくとも2つの異なる細胞集団から、例えばこれらの細胞集団の混合物からの抽出を通じて得られている。
【0022】
本発明のすべての側面にしたがって、少なくとも2つの異なる細胞集団は、細胞形態、少なくとも1つの生体分子の発現プロファイル、好ましくは複数の生体分子の発現プロファイル、および/または分化状態に関して、互いに異なる。これがあてはまるとすると、少なくとも2つの細胞集団は
(i)異なる細胞タイプの細胞、例えば異なる細胞タイプの初代細胞または異なる細胞タイプの細胞株の細胞;
(ii)同じ細胞タイプの細胞、例えば同じ細胞タイプの初代細胞または同じ細胞タイプの細胞株の細胞;
(iii)異なる細胞株由来の細胞;
(iv)同じ細胞株由来の細胞;
(v)異なる細胞系譜の細胞;
(vi)同じ細胞系譜の細胞;
(vii)異なる細胞培養由来の細胞であって、培養が異なる培養条件に供されている、前記細胞;または
(viii)同じ細胞培養由来の細胞であって、培養中の細胞が同じ培養条件に供されている、前記細胞
の集団であってもよい。
【0023】
特に好ましいのは、オプション(i)、(iii)、(v)および(vii)である。
本発明、方法のすべての側面にしたがって、試料は好ましくはヒト試料であり、そして
細胞、例えば腫瘍細胞、例えば血液関連腫瘍細胞;
全組織または組織の選択された部分;
健康な組織;
疾患、例えば慢性炎症、代謝疾患、特に糖尿病、心臓血管疾患に関連する組織、腫瘍組織、例えば乳癌組織、他の癌腫組織、肉腫組織、神経内分泌腫瘍組織、血液関連腫瘍組織、リンパ腫組織、奇形腫組織、脳腫瘍組織、例えば神経膠芽腫または星状細胞腫組織;
細胞または組織の細胞内区画、例えばミトコンドリア、細胞核、
体液;
上記の抽出物;ならびに
上記から選択されるタンパク質分画、例えば濃縮膜タンパク質、糖タンパク質、リン酸化タンパク質、アセチル化タンパク質、ユビキチン化タンパク質、他の修飾を伴うタンパク質、およびタンパク質複合体
からなる試料またはヒト試料の群より選択されてもよいことが、さらに認識されるであろう。
【0024】
さらに別の好ましい態様において、試料は、疾患または病理学的に変化した組織、好ましくはヒト組織由来の試料である。特に好ましいのはヒト腫瘍組織である。この態様の関連において、前記の少なくとも2つの異なる細胞集団の少なくとも1つのそして好ましくはすべてが、細胞系譜に関して、前記の疾患または病理学的に変化した組織中の疾患または病理学的に変化した細胞に対応することが好ましい。前記の少なくとも2つの異なる細胞集団の少なくとも1つそして好ましくはすべてが、細胞タイプに関して、前記の疾患または病理学的に変化した組織中の疾患または病理学的に変化した細胞に対応することが特に好ましい。
【0025】
上述のように、前記の少なくとも2つの異なる細胞集団のすべてが、疾患または病理学的に変化した細胞に対応するのではないことが意図的に想定される。いいかえると、少なくとも2つの異なる細胞集団の少なくとも1つが、正常の、すなわち疾患でなく、そして病理学的に変化していない細胞に対応してもよい。
【0026】
上に示すように、本明細書に記載しそして請求する本発明の多様な側面の好ましい態様は、前記の複数の生体分子が少なくとも2つの異なる細胞集団の混合物からの抽出を通じて得られているものである。これらの態様と関連して、前記混合物は、好ましくは、各細胞集団の等しいか、または実質的に等しい数の細胞を含有してもよい。しかし、生じる標準混合物が、各細胞集団由来の生体分子の有意な量を含有する限り、この比からの実質的な偏差もまた、意図される。これに関連する有意な量は、標準混合物中の生体分子の総量の少なくとも2%(w/w)、少なくとも3%(w/w)、少なくとも5%(w/w)、少なくとも10%(w/w)、少なくとも15%(w/w)、少なくとも20%(w/w)または少なくとも25%(w/w)である。標準混合物が、再構成されうる凍結乾燥物の形を取る場合、同じことが当てはまる(これは同様に、本明細書に記載しそして請求する本発明の側面の態様である)。
【0027】
同様に好ましいのは、本明細書に記載しそして請求する、本発明の多様な側面の態様であって、前記の複数の生体分子が、少なくとも2つの異なる細胞集団から得られる抽出物を混合することによって得られている、すなわち異なる細胞集団が個々に抽出された後に、場合によって細胞を計数し、そして細胞数を調整した後に、混合が行われているものである。これに関連して、先に得られた抽出物の混合を、異なる細胞集団各々の抽出物が、前記の標準混合物中の前記の複数の生体分子の総量に、等しく、または実質的に等しく寄与する方式で、行うことが好ましい。しかし、やはり、生じる標準混合物が、各細胞集団の抽出物由来の生体分子の有意な量を含有する限り、この比からの実質的な偏差もまた、意図される。ここでも、これに関連する有意な量は、生じる標準混合物中の生体分子の総量の少なくとも2%(w/w)、少なくとも3%(w/w)、少なくとも5%(w/w)、少なくとも10%(w/w)、少なくとも15%(w/w)、少なくとも20%(w/w)または少なくとも25%(w/w)であり、溶液または凍結乾燥物の形である場合も同様である。
【0028】
本明細書に記載しそして請求する本発明のすべての側面のさらなる好ましい態様において、少なくとも2つの異なる細胞集団は、3またはそれより多い異なる細胞集団、好ましくは4またはそれより多い異なる細胞集団、より好ましくは5またはそれより多い異なる細胞集団、6またはそれより多い異なる細胞集団、あるいは10またはそれより多い異なる細胞集団である。
【0029】
特に好ましいのは、前記生体分子がタンパク質またはペプチドである態様である。
本明細書に提供するのは、とりわけ、生物学的試料、例えば腫瘍組織等における、1つまたは複数の生体分子、あるいは生体分子の完全補完物、例えばゲノム、細胞、組織または生物によって発現されるタンパク質を包括的に定量化することを原理的に可能にする方法である。この方法によって、数百または数千の同位体標識された生体分子を正しい量で効率的に産生することが可能になり、そして試料中の数百または数千の対応する生体分子、例えば腫瘍組織中のタンパク質を、1日で質量分析によって定量化するための、標準混合物中の参照生体分子として、これらの標識生体分子を用いることが可能になる。これは、本明細書において、グレードIIの浸潤性腺管癌患者由来の乳癌組織に対して、例示的に立証される。しかし、この新規方法は、より広く適用可能であり、経済的であり、そして実験室においてより容易に適用可能であり、したがって、臨床研究のための魅力的なツールとなっている。
【0030】
第一の側面において、本発明は、試料における1つまたは複数の生体分子を定量化するための方法であって、前記試料における前記の1つまたは複数の生体分子の量を決定する工程を含む、前記方法を提供する。
【0031】
用語「生体分子」は、本明細書において、生存生物によって産生される任意の分子を指し、そしてタンパク質、ペプチド、多糖、炭水化物、脂質、ならびにその類似体および断片からなる群より選択されうる。生体分子の好ましい例は、タンパク質およびペプチドである。
【0032】
本明細書において、用語「ペプチド」は、2またはそれより多いアミノ酸のペプチドまたはポリペプチドを指す。ペプチドまたはポリペプチドはまた、例えば天然存在修飾、例えばリン酸化、アシル化、プレニル化、硫酸化、ヒドロキシル化、アセチル化、炭水化物付加、補欠分子族または補因子の付加、ジスルフィド結合の形成、タンパク質分解、巨大分子複合体の組み立て等を含む、翻訳後修飾によって修飾されてもよい。
【0033】
本発明にしたがって、本明細書に言及するような1つまたは複数の生体分子の量を、標準混合物中の1つまたは複数の参照生体分子の量に比較する。好ましい態様において、前記試料と前記標準混合物を混合した後、前記試料中の前記の1つまたは前記の複数の生体分子の量を決定する。
【0034】
本明細書において、用語「標準混合物」は、複数の生体分子の中の、1つまたは複数の参照生体分子の混合物を指し、前記の複数の生体分子(前記の1つまたは前記の複数の参照生体分子を含む)は、少なくとも2つの異なる細胞集団からの抽出を通じて得られており、そして前記の1つまたは前記の複数の参照生体分子は、試料中の前記の1つまたは前記の複数の生体分子の標識型(上に定義される)である。
【0035】
標準混合物の複数の生体分子を得る工程は、前記の少なくとも2つの異なる細胞集団の混合物から抽出されている場合、前記の複数の生体分子内の少なくとも1つまたは複数のさらなる生体分子と比較した、前記標準混合物中の前記の1つまたは前記の複数の参照生体分子の相対量が、前記の少なくとも1つまたは複数のさらなる生体分子と比較した、前記の1つまたは前記の複数の参照生体分子の相対量に対応する方式で、行われる。
【0036】
本発明はまた、上に定義するような標準混合物自体、ならびに試料中の1またはそれより多い生体分子を定量化するためのこうした標準混合物を調製するための方法であって、少なくとも2つの異なる細胞集団由来の1またはそれより多い参照生体分子を含む複数の生体分子を抽出する工程を含む、前記方法もまた提供する。
【0037】
本発明の関連において、用語「参照生体分子」は、上に定義するような生体分子の標識型を指す。
用語「標識型」は、本明細書において、同位体標識型を含む。好ましくは、標識型は、生体分子の化学的または代謝的同位体標識型であり、そして最も好ましくは、代謝的同位体標識型である。
【0038】
本発明にしたがった生体分子の好ましい「同位体標識型」は、天然存在分子の変異体であり、その構造において、1またはそれより多い原子は、異なる原子量を有する同じ元素の原子(単数または複数)で置換されているが、同位体が直接またはリンカーを通じてのいずれかで共有結合しているか、あるいは同位体が生体分子に対して複合体化されている同位体標識型が、同様に意図される。いずれの場合も、同位体は、好ましくは安定同位体である。
【0039】
本明細書に言及されるような安定同位体は、同一数の陽子および電子を有するが、1またはそれより多いさらなる中性子(単数または複数)を有し、この中性子が元素の分子量を増加させる、元素の非放射性同位体型である。好ましくは、安定同位体は、2H、13C、15N、17O、18O、33P、34Sおよびその組み合わせからなる群より選択される。特に好ましいのは、13Cおよび15N、ならびにその組み合わせである。
【0040】
標識は、当該技術分野に知られる手段によって達成可能である。前駆体分子として同位体標識されたアミノ酸またはペプチドを用いて、標識参照生体分子を合成してもよい。例えば、同位体コード化アフィニティタグ(ICAT)試薬は、参照生体分子、例えばタンパク質を試料調製のアルキル化工程で標識する(Gygiら, 1999, WO 00/11208)。可視ICAT試薬(VICAT試薬)を同様に使用してもよく(WO 04/019000)、これによって、VICAT型試薬は、検出可能部分として、フルオロフォアまたは放射標識を含有する。iTRAQおよび類似の方法を同様に使用してもよい(Ross, P.L., Huang, Y.N., Marchese, J.N., Williamson, B., Parker, K., Hattan, S., Khainovski, N., Pillai, S., Dey, S., Daniels, S.ら (2004). Multiplexed protein quantitation in Saccharomyces cerevisiae using amine-reactive isobaric tagging reagents. Mol Cell Proteomics 3, 1154-1169)。
【0041】
また、好ましくは、代謝標識を用いて、標識参照生体分子を産生してもよい。例えば、同位体標識前駆体分子、例えばタンパク質またはペプチドに取り込まれて、それによってこれらを代謝標識する同位体標識アミノ酸を含有する培地上で、細胞を増殖させてもよい。代謝的同位体標識は、好ましくは、細胞培養中のアミノ酸での安定同位体標識(SILAC)である。代謝標識を用い、そして1つまたは複数の参照生体分子の標識型が単数または複数の参照生体分子のSILAC標識型である場合、上に定義するような標準混合物をまた、SUPER-SILAC混合物とも称する。
【0042】
代謝標識を用いる利点は、各タンパク質のすべてのペプチドが定量化に寄与し、そして分析を特定のタンパク質またはペプチドにターゲティングする必要がないことであるが、これはもちろん、本発明のフレームワークにおいて、可能であり、そして意図されている。さらに、混合物中の任意のペプチドが、分析の深さおよび分離工程の数に応じて、原理的に定量化可能である。これによってアイソフォーム特異的ペプチドおよび修飾ペプチドの定量化が可能になる。以下に示すように、例えば、いかなる濃縮工程も伴わずに、ほぼ100のリン酸化されたペプチドが定量化可能である(表1を参照されたい)。SUPER-SILAC混合物は、ホスホプロテオームに関するのと同じ方式で働くが、徹底的なホスホプロテオーム分析に関しては、好ましくは、ホスホペプチド濃縮工程が含まれる。
【0043】
標準混合物の生体分子、すなわち1つまたは複数の参照生体分子および複数の生体分子は、少なくとも2つの異なる細胞集団からの抽出を通じて、こうした集団の混合物から、または前記集団から個々に得られる抽出物を混合することによってのいずれかで、得られる。標準混合物の複数の生体分子はまた、前記の少なくとも2つの異なる細胞集団の特定の細胞内区画からの抽出を通じて、やはり前記区画の混合物から、または個々の細胞集団の区画から個々に先に得られた抽出物を混合することによってのいずれかで、得られうる。本発明の関連において、適切な細胞内区画は、例えば細胞核、ミトコンドリア、小胞体、ゴルジ体、細胞質、または細胞膜である。
【0044】
本明細書において先に言及するように、本明細書に言及する「少なくとも2つの異なる細胞集団」を形成可能な細胞は、細胞株、特に腫瘍細胞株由来の細胞、または培養中の初代細胞の細胞であってもよい。細胞は、当該技術分野に知られる任意の手段によって人工的に修飾されてもよい。適切な細胞株は、培養中で容易にそして無期限に増殖することを可能にする遺伝子変化を経ている細胞によって形成される。言い換えると、これらは不死化細胞である。当該技術分野で知られる任意の細胞株が、もちろん、試料の性質に応じて、本発明にしたがった方法での使用に適しており、そしてこれらを、一般的に知られる寄託施設または「細胞バンク」、例えばATCCまたはGerman Collection of Microorganisms and Cell Cultures(DSMZ)から得ることも可能である。特に好ましい細胞株は、哺乳動物細胞株、特にヒト細胞株である。
【0045】
適切な初代細胞を組織または体液、好ましくはヒト組織または体液から直接得てもよく、そして初代細胞は、例えば、血液細胞、リンパ球、ニューロン、グリア細胞、上皮細胞、線維芽細胞、肝細胞、筋細胞または心筋細胞であってもよい。
【0046】
本発明の方法の好ましい態様において、少なくとも3つの異なる細胞、少なくとも4つの異なる細胞、少なくとも5つの異なる細胞、または少なくとも10の異なる細胞の混合物からの抽出を通じて、標準混合物の多数の生体分子を得る。
【0047】
用語「異なる細胞集団」は、これらの集団を形成する細胞が、細胞形態に関する互いの形態、上に定義するような少なくとも1つの生体分子の、そして好ましくは上に定義するような複数の生体分子の発現プロファイル、および/または分化状態のいずれかが異なることを意味する。好ましい態様において、細胞は異なる細胞タイプまたは細胞系譜由来の細胞である。しかし、やはり好ましいのは、細胞が同じ細胞タイプまたは系譜由来であるが、他の観点において異なる態様である。例えば、細胞は、同じ細胞タイプまたは系譜の細胞であるが、異なる細胞培養条件下で培養されている点で異なってもよい。異なる細胞集団を導きうる異なる細胞培養条件は、培養温度、培養大気、培地、継代数、細胞密度、および/または用いる基質が異なる条件であってもよい。しかし、所定の培養は、所定の培養内の異なる細胞集団の細胞が、上に同定する他の観点いずれかで異なる限り、同じ培養条件に供されている、本発明の意味で異なる細胞集団を含んでもよい(すなわち「混合」培養)ことが理解されるであろう。
【0048】
やはり好ましいのは、異なる細胞株由来の細胞集団の使用である。これらは、異なる細胞タイプまたは系譜に属する細胞株由来の細胞であってもよい。しかし、好ましい態様において、異なる細胞株の細胞は、同じ細胞系譜に属するか、または同じ細胞系譜に由来する。やはり好ましいのは、異なる細胞株の細胞が、同じ細胞タイプに属するか、または同じ細胞タイプに由来する態様である。適切な細胞株は、腫瘍細胞株、特に癌腫細胞株、肉腫細胞株、リンパ腫細胞株、白血病細胞株、生殖細胞腫瘍細胞株、および芽腫細胞株、脳腫瘍細胞株、例えば神経膠芽腫および星状細胞腫細胞株である。
【0049】
本発明の意味における異なる細胞タイプの例は、内分泌系の細胞タイプ、すなわち甲状腺上皮細胞、傍濾胞細胞、副甲状腺主細胞、好酸性細胞、クロム親和性細胞、松果体細胞;神経系の細胞タイプ、すなわち星状細胞、オリゴデンドロサイト、ミクログリア、ニューロン、シュワン細胞;および他の細胞タイプ、例えば上皮細胞、線維芽細胞、骨芽細胞、骨細胞、破骨細胞、軟骨芽細胞、軟骨細胞、ケラチノサイト、メラニン形成細胞、筋細胞、脂肪細胞、肝細胞、B細胞、T細胞、ナチュラルキラー細胞、好塩基球顆粒球、好酸球顆粒球、好中球顆粒球、単球、マクロファージ、マスト細胞、樹状細胞、多能性幹細胞、全能性幹細胞等である。
【0050】
本発明の意味における異なる細胞系譜の例は、線維芽細胞、内皮細胞、上皮細胞、骨髄系細胞、リンパ球系細胞、白血球、ケラチノサイト、骨芽細胞、または破骨細胞、ニューロン、間質細胞、甲状腺細胞、心筋細胞、肺細胞、肝細胞等である。
【0051】
好ましくは、「異なる細胞集団」は、同じ組織由来の異なる細胞系譜の細胞、例えば腺扁平上皮癌組織由来の扁平細胞系譜および腺様細胞系譜であるか;あるいは異なる細胞株の細胞、例えば乳癌組織由来の異なる上皮細胞株、例えば乳癌組織由来のHCC-1143、HCC-1599、HCC-1937、HDQ-P1、BT-474、CAL-120、もしくはDU-4475細胞、または腎癌組織由来のBFTC-900、CAKI-2、CAL-54細胞、または結腸癌組織由来のCL-40、DLD-1、HCT-116、SW-403、SW480細胞株である。別の好ましい態様において、異なる細胞集団は、ヒト腫瘍組織由来の異なる細胞株、および対応する健康な組織由来の細胞株由来の細胞を含む。
【0052】
本発明のさらに別の好ましい側面において、「異なる細胞集団」は、同じ細胞系譜の異なる細胞タイプであり、例えば白血球系譜に属するBおよびT細胞である。
異なる細胞集団を形成する細胞は、例えばDNA、RNA、細胞表面マーカー発現、遺伝子発現、生化学特性、酵素活性、振る舞い、増殖、アポトーシス、栄養必要性、組織形成、または上に定義する相違の顕在化である任意の他の特徴の改変によって区別可能である。
【0053】
異なる細胞集団を同定し、そして検出するための技術は、当該技術分野に周知である。例えば、細胞間の相違を検出するための一般的な技術には、PCR法、例えば通常のPCR、リアルタイムPCR、RT-PCR、in-situハイブリダイゼーション等;またはマーカー検出法、例えばフローサイトメトリー、磁気ビーズ分離、顕微鏡等;またはタンパク質検出技術、例えばSDS-PAGE、3Dゲル、ウェスタンブロッティング、マイクロアレイ、質量分析等;またはハイブリダイゼーション技術、例えばin-situハイブリダイゼーション、FISH、マイクロアレイ、サザンブロッティング、ノーザンブロッティング等;またはDNA突然変異分析技術、例えば制限断片長多型(RFLP)等が含まれる。
【0054】
本明細書において、用語「試料」は、細胞、その細胞内区画、組織または臓器を指す。組織は、全組織、または組織の選択された部分であってもよい。組織部分は、組織の顕微解剖によって、または生検によって、または細胞内区画の濃縮によって単離可能である。用語「試料」はさらに、健康なならびに疾患または病理学的に変化した細胞または組織を指す。したがって、該用語はさらに、疾患、例えば慢性炎症、代謝疾患、特に糖尿病、心臓血管疾患、腫瘍、特に癌腫、乳癌、肉腫、神経内分泌腫瘍、血液関連腫瘍、リンパ腫、奇形腫あるいは脳腫瘍、例えば神経膠芽腫または星状細胞腫に関連する細胞または組織を指す。試料は、組織培養中に置かれたかまたは組織培養に順応した細胞であってもよい。試料はまた、体液、例えば血漿、リンパ液(lymphe)、血液、尿、唾液、血清、脳脊髄液、精漿、膵液、母乳、または肺洗浄液であってもよい。試料はさらに、原核および真核種を含む任意の種、好ましくはヒト由来の細胞または組織、ならびにウイルス試料であってもよい。
【0055】
組織試料は、さらに分画または前選択された試料、望ましい場合、特定の細胞タイプを含有するかまたは特定の細胞タイプに関して濃縮されるように前選択されたかまたは分画された試料であってもよい。いくつかの既知の分画または前選択技術によって、試料を分画するかまたは前選択してもよい。
【0056】
試料はまた、上記の任意の抽出物であってもよい。該用語はまた、細胞または組織由来のタンパク質分画、例えば膜タンパク質、糖タンパク質、リン酸化タンパク質、アセチル化タンパク質、ユビキチン化タンパク質、他の修飾を含むタンパク質およびタンパク質複合体を含んでもよい。
【0057】
本明細書に記載しそして請求する方法、標準混合物および使用にしたがって、2つまたはそれより多い異なる細胞集団を混合するか、あるいは2つまたはそれより多い異なる細胞集団由来の抽出物を混合すると、定量化正確性が予想外に改善されることが、本発明者らによって見出された。
【0058】
これは特に、分析しようとする試料に「マッチする」よう意図された標準混合物を用いる状況に当てはまる。例えば、腫瘍組織由来の試料に含有される生体分子を定量化することが望ましい場合、本発明にしたがって、マッチする標準混合物、すなわち、例えば対応する健康な組織由来の同じ細胞タイプの細胞を場合によって補充した、腫瘍組織、または腫瘍組織内の細胞の特定の集団と、同じ細胞タイプに属するか、または同じ細胞タイプに由来する、異なる細胞株セット由来の細胞からの抽出を通じて得られた標準混合物を選択することが好ましい。少なくとも2つの異なる細胞から標準混合物を得ると、標準混合物を単一細胞からのみ得た状況に比較して、試料中に含まれる生体分子、例えば腫瘍組織中に含まれるタンパク質のより広いカバーが可能になる。
【0059】
やはり意図されるのは、異なる組織で見られるタンパク質の定量化、例えば異なる組織の「段階分け」または「分子性質決定」に使用するためにあつらえられた標準混合物である。例えば、1つの側面において、抽出のために選択された異なる細胞集団の選択のため、腫瘍発達の所定の段階、または腫瘍発達の多様な段階を代表する、腫瘍細胞株の異なるセットから得られる標準混合物を調製してもよい。この標準混合物を用いて、マッチした腫瘍試料を定量化することによって、数時間以内に、多様な腫瘍マーカーに関して、腫瘍組織の正確な「段階分け」を行うことが可能である。これは、新鮮な腫瘍標本に対して、外科手術中に行うことも可能である。
【0060】
例えば、上皮細胞由来の多様な細胞株を、乳癌、前立腺癌、肺癌および結腸癌組織などの癌腫組織中の生体分子を定量化するのに適した標準混合物の調製に用いてもよいし;造血(血液形成)細胞由来の細胞株を、リンパ腫および白血病試料中の生体分子を定量化するのに適した標準混合物の調製に用いてもよいし;あるいは間葉系細胞由来の異なる細胞株を、肉腫組織中の生体分子を定量化するのに適した標準混合物の調製に用いてもよい。
【0061】
これに関連して、性質決定しようとする腫瘍に対応する健康な組織から得られるか、あるいは、培養および場合によって形質転換または不死化を通じてこうした細胞から得られる、抽出のための少なくとも1つの細胞集団を含むこともまた好適である。
【0062】
本発明の関連において、本発明者らは、乳癌細胞株HCC1599をSILAC標識し、そして浸潤性腺管癌、グレードIIの患者由来の乳癌組織の溶解物と該溶解物を混合した。生じたタンパク質混合物を、FASPプロトコル(J.R. Wisniewski, A. Zougman, N. Nagarajら, Nature methods 6 (5), 359 (2009))にしたがって消化し、そしてStageTip形式で、陰イオン交換クロマトグラフィーによって、ペプチドを6つの分画に分離した(J.R. Wisniewski, A. Zougman,およびM Mann, 投稿済 (2009))。高解像度定量的質量分析と組み合わせたオンライン逆相クロマトグラフィーによって、各分画を分析した(図1A、ならびに実施例4および5)。4438のタンパク質を3つ組分析によって定量化したが、比の分布は広くそして二峰性であり、細胞株に比較して、腫瘍において、発現が4倍より高いタンパク質が755個含有された(図1C)。したがって、単一細胞株のプロテオームは、腫瘍プロテオームを適切に代表せず、そしてしたがって正確な定量化に使用することは不可能である。次に、起源、段階、ならびにエストロゲン受容体およびErbB2発現が異なる4つの乳癌細胞株を選択した。正常な乳腺上皮細胞タイプをSILAC混合物に添加すると、定量的正確性が増加した。SILAC細胞株の上位集合(superset)であるため、この混合物をSUPER-SILACと名付け、これは正確に組織を代表する。
【0063】
標準混合物が組織を正確に代表するかどうかの決定は、例えば、参照生体分子および前記試料中の生体分子の量の比を決定することによって実行可能である。これらの比が1により近ければ、標準混合物は組織により似ており、そしてその結果、定量化はより正確である。例えば、標準混合物中の生体分子の大部分の量(例えば50%より多く)が前記試料中の生体分子の量と2倍より少なく異なる場合、標準混合物は、正確な参照と見なされうる。このアプローチは、本明細書に開示する実施例で用いられている。正確な組織代表のこうした基準を用いて、5つの細胞株の例示的な標準混合物の優れた性能が定量化されてきている。
【0064】
組織を正確に代表する標準混合物を設計するためのさらなるアプローチは、候補細胞集団ならびに組織各々を別個に分析することである。こうした分析を質量分析によって行ってもよい。この比較は、標準混合物が組織を正確に代表するのに必要な組織および細胞集団の組み合わせに類似である細胞株を強調しうる。
【0065】
単一の細胞株ではなく、複数の細胞株の標識混合物を腫瘍に添加すると、3つ組分析で同じ深度が達成されるが、定量化正確性が劇的に改善される(図1B、D)。分布は、ここで、一峰性となり、そして定量化されたタンパク質の90%が、腫瘍およびSUPER-SILAC混合物の間の4倍の比以内にあった(4286タンパク質群のうち3837)。さらに、定量的分布ははるかにより狭く、癌およびSUPER-SILAC混合物中のタンパク質の76%が2倍以下の相違であった。単一分析を同じ腫瘍の3つ組と比較すると、0.97の相関が見出され、プロテオームの90%が1.5倍以内の同じ比を生じた(図2A)。高い定量化正確性は、すべてのタンパク質が、多数のMSスキャンを通じて、そして多数のペプチドを通じて、数回定量化される事実に起因しうる。タンパク質あたりのこれらの多数の定量化事象は、単一の3分析においてさえ、高い正確性を導く。3つの複製物の比較によって、非常に低い変動係数(CV)が明らかになり、平均値は4%であった(図2B)。したがって、数千のタンパク質が数パーセントの誤差で定量化可能であり、これは、今日の臨床実施において用いられる方法よりもはるかにより正確である。
【0066】
また、本発明にしたがった標準混合物を、試料中の生体分子の絶対定量化に用いてもよい。試料中の個々の生体分子の量の概算を達成するため、シグナル強度に基づいて、試料中の他の生体分子に比較した各生体分子の存在量を計算可能である。装置に注入される生体分子の絶対量がわかっていることを考慮すると、試料中の各生体分子の絶対量を概算することが可能である。関心対象の生体分子のより正確な測定値を得るため、本発明にしたがった標準混合物中の参照生体分子を、既知の量の生体分子とともに分析して、そしてそれらの量を比較することが可能である。標準を用いた絶対的定量化を、試料ではなく、本発明の標準混合物に対して行ってもよい。この分析はまた、遡及的に行ってもよい。本発明の標準混合物中の参照生体分子の量がわかっているため、すべての試料中のすべての生体分子の自動的な絶対的定量化が可能になる。同様に、本発明の標準混合物に対してのみ、生体分子(標準を含まない)の絶対量の概算を実行可能であり、そして試料中の生体分子の量をそこから外挿可能である。したがって、試料中の1つまたは複数の生体分子の絶対的定量化のために方法を用いる場合、標準混合物中の1つまたは複数の参照生体分子の量をあらかじめ決定する。当業者には、前記標準混合物中の前記の1つまたは前記の複数の参照生体分子の量を、前記試料中の前記の1つまたは前記の複数の生体分子の量を決定する前に決定しても、またはその後に決定してもよいことが認識されるであろう。
【0067】
本発明の方法はさらに、組織試料中のタンパク質修飾の同定および定量化を可能にする。本発明にしたがった標準混合物は、ペプチドなどの数千の生体分子を含有してもよく、その中に修飾ペプチド(例えばリン酸化ペプチド、アセチル化ペプチド等)を含有してもよい。プロテオーム分析と同じ方式で、標準混合物中のこうした修飾ペプチドは、組織中の修飾ペプチドの定量化を可能にしうる。濃縮を伴いまたは伴わずに修飾ペプチドを同定してもよい。単純な場合、濃縮を伴わず、質量分析を定期的に行い、そしてバイオインフォマティクス分析は、修飾ペプチドのオプションを考慮する。後者の場合、標準混合物を組織と混合し、そして混合物に対して濃縮工程を行う。
【0068】
前記の1つまたは前記の複数の生体分子、および前記の1つまたは前記の複数の参照生体分子の量は、好ましくは質量分析によって決定される。好ましくは、比較工程は、前記の1つまたは前記の複数の生体分子の単数または複数のピーク、および前記の1つまたは前記の複数の参照生体分子の対応する単数または複数のピーク間の強度の比を決定する工程を含む。例えば、前記参照生体分子のシグナルを統合する前に、前記の生体分子のシグナルをまず統合し、そして次いで、一方のシグナルを他方によって割るか、またはその逆を行うことにより、比を決定する工程によって、比を得てもよい。
【0069】
前記決定は、特に質量分析を用いる関連において、酵素消化を含むことがさらに理解される。前記酵素消化に適した酵素にはトリプシンが含まれる。
試料中の生体分子、例えばポリペプチドを同定し、そして/または定量化するため、本発明の方法において、多様な質量分析系を使用してもよい。高い質量正確性、高い感度および高い解像度を持つ質量分析装置には、限定されるわけではないが、マトリックス支援レーザー脱離飛行時間型(MALDI-TOF)質量分析装置、エレクトロスプレーイオン化飛行時間型(ESI-TOF)質量分析装置、フーリエ変換イオンサイクロトロン質量分析装置(FT-ICR-MS)、およびOrbitrap分析装置が含まれる。MSの他の様式には、イオントラップおよび三重四極子質量分析装置が含まれる。イオントラップMSにおいて、分析物を、エレクトロスプレーイオン化またはMALDIによってイオン化し、そして次いで、イオントラップ内に入れる。次いで、イオントラップからの選択的放出に際して、トラップされたイオンをMSによって別個に分析してもよい。また、イオントラップを上述の質量分析装置の他のタイプと組み合わせてもよい。
【0070】
また、断片を生成し、そして分析してもよい。ICATまたはVICATまたはiTRAQ型試薬、あるいはSILAC標識ペプチドで標識した参照生体分子を、例えばMALDI-TOFまたはESI-TOFを用いた単一段階質量分析によって、あるいは単一Orbitrap分析装置系によって、分析してもよい。質量分析の方法は、当業者に周知である(例えば、Yates, J. Mass Spect. 33: 1-19 (1998);KinterおよびSherman, Protein Sequencing and Identification Using Tandem Mass Spectrometry, John Wiley & Sons, New York (2000);AebersoldおよびGoodlett, Chem. Rev. 101: 269-295 (2001);Griffinら, Curr. Opin. Biotechnol. 12: 607-612 (2001)を参照されたい)。
【0071】
高解像度ペプチド断片分離のため、分離法としてキャピラリー逆相クロマトグラフィーを利用する液体クロマトグラフィーESI-MS/MSまたは自動化LC-MS/MSを用いてもよい(Yatesら, Methods Mol. Biol. 112: 553-569 (1999))。動的排除を伴うデータ依存性衝突誘発解離(CID)もまた、質量分析法として使用可能である(Goodlettら, Anal. Chem. 72: 1112-1118 (2000))。
【0072】
試料、例えば組織中の生体分子の、本発明にしたがった標準混合物を用いた質量分析はターゲティング化可能であり、そして感度を例えば10〜100倍またはそれより多く増加させるため、SIM-スキャン(単一イオンモニタリング)を含んでもよい。先の態様は、すべて、ペプチドの非ターゲティング化分析を扱うが、関心対象の1つまたは複数の生体分子、例えば関心対象のペプチドをあらかじめ決定して、そしてこれらに対して分析をターゲティング化することも可能である。新規アルゴリズムは、「マスター実行」および実験実行間をリアルタイムでマッチング可能であり、そしてターゲットとされる生体分子(単数または複数)を同定することも可能である。生体分子(単数または複数)が見出されたら、SIMスキャンを行ってもよい。SIM-スキャンにおいて、特定の質量ウィンドウのみが選択的に集積され、それによって、感度が劇的に増加する。ターゲットとされる生体分子は、本発明にしたがった標準混合物で検出されれば十分であり、そして次いで、増加した感度で、試料中でもまたモニタリングされることが認識されるであろう。SIMスキャンを用いると、試料中に非常にわずかである生体分子に関してさえ、正確な定量化が達成可能である。さらに、試料中の生体分子を定量化する前に、標準混合物の徹底的な性質決定を行うと、試料中の1つまたは複数の生体分子、例えば生体分子、例えばペプチドの完全補完物が質量スペクトルで検出されない場合であっても、ターゲティング化することも可能である。これは、関心対象の生体分子、例えば関心対象のペプチドのクロマトグラフィー溶出時間が先に決定されているため、可能である。さらに、標準混合物中の他の生体分子のクロマトグラフィー溶出時間を用いて、測定中に、関心対象の生体分子(単数または複数)の溶出時間を正確に概算することも可能である。
【0073】
当業者には、同じ方式で、当該技術分野に知られる単一または多数反応モニタリング(SRMまたはMRM)技術(例えば、Picotti, P., Bodenmiller, B., Mueller, L.N., Domon, B.,およびAebersold, R. (2009): Full dynamic range proteome analysis of S. cerevisiae by targeted proteomics. Cell 138, 795-806を参照されたい)によるターゲティング化分析を用いて、測定の感度を増加させることも可能であることが認識されるであろう。狭い質量範囲をモニタリングする代わりに、前駆体から特定の断片への特定の遷移をモニタリングする。
【0074】
本発明の方法は、さらに、前記試料中の前記生体分子の配列決定を含んでもよい。しかし、配列決定能を伴わない質量分析装置(例えばThermo Fisher ScientificのExactive質量分析装置)を用いて、試料中の生体分子の定量化のためにもまた標準混合物を使用可能であることが本発明の利点の1つである。この場合、本発明にしたがった標準混合物中の参照生体分子をまず、「配列決定」質量分析装置(例えばThermo Fisher ScientificのLTQ-Orbitrap Velos)を用いて、徹底的に分析してもよい。こうした分析の結果によって、標準混合物中のすべての参照生体分子、例えばすべてのペプチドのデータベースが生成される。次の工程において、実行間をマッチングすることによって、多数の試料を分析することも可能である。アルゴリズムによって、参照生体分子、例えばペプチドの保持時間および正確な質量(ppmまたはppm以下の質量正確性に基づく)に基づいて、2つのタイプの装置由来の実行間をマッチさせる。本発明にしたがった標準混合物の参照生体分子に、これらの各々を比較することによって、各試料由来の1つまたは複数の生体分子、例えばペプチドを定量化する一方、生体分子、例えばペプチドの同一性を、本発明にしたがった標準混合物の徹底的な分析から得る。試料中の生体分子全体、例えばプロテオームを高い比率で同定するためには、本発明にしたがった標準混合物を、前分画および分離によって可能な限り徹底的に分析すべきである。
【0075】
上記から認識されるであろうように、本発明の方法は、例えば疾患、例えば腫瘍疾患または遺伝疾患に関連する生体分子の検出および定量化に適用可能である。こうしたものとして、異常に発現されるポリペプチドに対応する参照生体分子を含む本発明の標準混合物を含むことによって、本発明の方法を用いて、ポリペプチドの異常な発現と関連することが知られる疾患を分析してもよい。
【0076】
本発明の試薬および方法はまた、多様な疾患を診断し、そしてその予後を決定するのにも適用可能である。例えば、膜タンパク質が濃縮された標準混合物を生成して、組織中の膜タンパク質の定量化を可能にしてもよい。こうした分析は、薬剤ターゲットおよび診断マーカーの開発に非常に重要でありうる。
【0077】
本発明の方法は、疾患、例えば腫瘍または他の疾患の診断に特に有用である。例えば、該方法を用いて、疾患を診断することも可能であり、例えばジストロフィンの発現減少を測定することによって、デュシェンヌ型筋ジストロフィーまたはベッカー型筋ジストロフィーを含む筋ジストロフィーを診断することも可能である。同様に、本発明の方法を用いて、前立腺癌の診断のため、前立腺関連タンパク質の発現を定量化することも可能である。また、本発明の方法を用いて、肺癌、結腸癌、肝臓癌、卵巣癌、乳癌、脳癌または他の癌などの他の癌のマーカーを同定し、そして/またはこうした癌を診断することも可能である。
【0078】
当業者は、本発明の方法が、これらの疾患、および1つまたは複数のポリペプチドの異常な発現に関連する他の疾患に適用可能であることを容易に認識するであろう。
当業者はさらに、疾患と関連することが知られるマーカーおよび関連がまだ知られていないマーカーの分析に、本発明の方法を容易に適用可能である。
【0079】
本発明の方法はまた、疾患の診断または予後徴候となるタンパク質発現パターンの検出および定量化にも適用可能である。該方法を、生検によって探査される体の組織における診断適用に用いることも可能である。該方法はまた、血液、血清または血漿、脳脊髄液、尿、唾液、精漿、膵液、母乳、肺洗浄液等の体液において使用可能である。該方法を用いて、同じ分析において、多数の生体分子を分析し、そして定量化することも可能であるため、同じ分析における多数の生体分子を分析する能力によって、1つの診断マーカー単独の分析ではなく、多数の生体分子を、用いようとする診断適用に相関させることが可能になることから、該方法は、特に診断適用に有用である。したがって、該方法を、例えば疾患と関連する多数の診断マーカーの分析に適用してもよい。診断マーカーセットがひとたび同定されたら、本発明の方法を適用して、単一の診断マーカー単独の分析よりも情報が多いと予期される分析のためのマーカーセットを定量化することも可能である。
【0080】
本発明の方法を用いると、特定の疾患に罹患したか罹患する可能性がある個人の組織または体液および本発明の標準混合物の直接比較定量的タンパク質プロファイリングによって、タンパク質発現の診断パターンを決定することも可能である。
【0081】
さらに、キナーゼは、悪性プロセスにおける基本的タンパク質であるが、しばしば、プロテオーム研究において検出されない。これらの低い存在量にもかかわらず、本発明者らは、100を超えるプロテインキナーゼを同定し、そしてその大部分を非常に正確に定量化した(CV中央値6%、表2)。これらのキナーゼのうち、ErbB2、EGFR、AKT、PAK1、2、ならびにMAPKカスケードの9つのメンバーが定量化されており、これらはすべて悪性の中核を成す経路を代表する。このプロテオームが乳癌化学療法への感受性と関連付けられている、定量化されたタンパク質を含有するかどうかを調べた。最近の概説は、多様な癌における化学感受性および薬剤耐性に関与することが以前示唆された80の因子を列挙し、このうち18が乳癌において調べられた(I. Sekine, C. Shimizu, K. Nishioら, International journal of clinical oncology/ Japan Society of Clinical Oncology 14 (2), 112 (2009))。この分析によって、このリストのうち少なくとも50のタンパク質が、調べた腫瘍において発現されることが示され、このうち38が正確に定量化された(CV中央値3.5%;表3)。図2Dは、複製測定におけるこれらのタンパク質5つの定量化の正確さを示し、受容体状態(ERBB2)、DNA巻き戻しタンパク質トポイソメラーゼ2(TOP2A)の発現レベル、薬剤排出因子(MVP)の上方制御、およびアポトーシスに対する耐性(BCLXおよびAKT2)に関する情報を提供する。トラスツズマブ(ハーセプチンTM)のターゲットであるErbB2は、本発明の標準混合物に比較して、腫瘍においてはるかにより少なくしか発現されていないが、23のペプチドを用いてこれを定量化した(0.08±0.006)。DNA巻き戻しタンパク質TOP2Aは、エトポシドおよびドキソルビシンなどの4つの化学療法剤のターゲットであり、腫瘍において、2.20±0.04倍、高く発現された(30のペプチドから定量化)。免疫組織化学法は、現在、所定の患者試料において、最大で、これらのマーカーのうちのいくつかの存在または非存在を評価することが可能である。対照的に、本発明の標準混合物を臨床研究において適用すると、多数の癌関連タンパク質を同時に定量化することが可能になる。
【0082】
上記測定は、6つのペプチド分画および単一のまたは3つ組の測定を用い、それぞれ、1〜3日の分析時間を要する。本発明者らは次に、ペプチド分画いずれかを省くことによって、方法をさらに合理化可能であるかどうかを調べた。より高い配列決定速度を持つ新世代orbitrap質量分析装置(LTQ-Orbitrap Velos)を用いて、そして総ペプチド消化物をクロマトグラフィーカラム上に直接装填した。本発明者らは、この単純な方法を用いて、3つ組実行において、2100を超えるタンパク質を同定し、そしてこのうちほぼ1500を定量化することが可能であった。SILACは、全細胞プロテオームを均質に標識するため、定量的正確性は、含まれるプロテオームの深度からは独立である。実際、より少ないプロテオームしか含まれなくても、比の分布は変わらず、定量化正確性も変わらなかった(Pearson相関係数0.97;図3)。
【0083】
含まれるプロテオームが多く、そして定量化が正確であることに加えて、組織定量化のための内部標準として、本発明の標準混合物を使用する別の利点は、コストが低いことである。標準的な15cmサイズの細胞培養プレートは、約20〜120の3つ組分析用の混合物を提供する(分画に応じる)。したがって、分析あたりの試薬コストは、必要なSILACアミノ酸も含めて、わずか数セントである(表4)。本発明の標準混合物を、数千の試料に十分なバッチモードで産生し、そして単一または3つ組分析に適した密封アリコット中、SDS緩衝液中に分配してもよい。これは、例えば細胞溶解物が、抗体をチェックするためにすでに分配されている方式と非常に類似であり、そしていかなるロジスティック上の困難も生じない。臨床化学実験室において、試料調製は、本発明の標準混合物と組織溶解物を組み合わせることのみからなり、その後、標準的質量分析が続く。本発明の標準混合物は、腫瘍タイプまたは治療反応と相関させるため、そして新規腫瘍マーカーを発見するための臨床研究において、数千の生体分子レベル、そして特にタンパク質の正確な決定を可能にする。本発明の標準混合物はまた、治療決定の基礎として、診療所における生検のシステム全体の性質決定にルーチンに適用可能である。本発明の標準混合物および方法は、同様に、他の腫瘍、疾患または組織に関連する生体分子の定量化に適している。
【0084】
上記を考慮して、本発明が以下の項目を含むことが認識されるであろう:
1.試料中の1つまたは複数の生体分子を定量化するための方法であって
前記試料中の前記の1つまたは前記の複数の生体分子の量を決定し;そして標準混合物中の複数の生体分子の中の1つまたは複数の参照生体分子の量に対して、該量を比較する工程を含み、前記の複数の生体分子が、少なくとも2つの異なる細胞集団からの抽出によって得られており;
前記の1つまたは前記の複数の参照生体分子が、前記の1つまたは前記の複数の生体分子の標識型である、前記方法。
【0085】
2.前記試料中の前記の1つまたは前記の複数の生体分子の前記量を、前記標準混合物と前記試料を混合した後に決定する、項目1の方法。
3.前記の1つまたは前記の複数の生体分子、および前記の1つまたは前記の複数の参照生体分子の量を、質量分析によって決定する、項目1または2の方法。
【0086】
4.前記の標準混合物中の前記の1つまたは前記の複数の参照生体分子が前選択され、そして質量分析が、単一または複数イオンモニタリングにより、これらをターゲットとする、項目3の方法。
【0087】
5.前記試料中の前記生体分子の配列決定をさらに含む、先行する項目いずれか1つの方法。
6.前記比較工程が、前記の1つまたは前記の複数の生体分子の単数または複数のピーク、および前記の1つまたは前記の複数の参照生体分子の対応する単数または複数のピーク間の強度比を決定する工程を含む、項目3〜5のいずれか一項の方法。
【0088】
7.前記の1つまたは前記の複数の生体分子の前記量が絶対量である、先行する項目のいずれか一項の方法。
8.前記標準混合物中の前記の1つまたは前記の複数の参照生体分子の量をあらかじめ決定する、項目7の方法。
【0089】
9.前記標準混合物中の前記の1つまたは前記の複数の参照生体分子の量を、前記試料中の前記の1つまたは前記の複数の生体分子の量を決定する前に、あらかじめ決定する、項目8の方法。
【0090】
10.前記標準混合物中の前記の1つまたは前記の複数の参照生体分子の量を、前記試料中の前記の1つまたは前記の複数の生体分子の量を決定した後に、あらかじめ決定する、項目8の方法。
【0091】
11.試料中の1つまたは複数の生体分子を定量化するための標準混合物であって、少なくとも2つの異なる細胞集団からの抽出を通じて得られている複数の生体分子の中に、1つまたは複数の参照生体分子を含む、前記混合物。
【0092】
12.試料中の1つまたは複数の生体分子を定量化するための標準混合物を調製するための方法であって
少なくとも2つの異なる細胞集団から、1つまたは複数の参照生体分子を含む複数の生体分子を抽出する
工程を含む、前記方法。
【0093】
13.試料中の1つまたは複数の生体分子を定量化するための標準混合物の使用であって、前記標準混合物が
複数の生体分子の中に1つまたは複数の参照生体分子を含み、前記の複数の生体分子が、少なくとも2つの異なる細胞集団からの抽出を通じて得られている
前記使用。
【0094】
14.前記の少なくとも2つの異なる細胞集団が、互いに、細胞形態、少なくとも1つの生体分子の発現プロファイル、好ましくは複数の生体分子の発現プロファイル、および/または分化状態に関して異なる、項目1〜10または12のいずれか一項の方法、項目11の標準混合物、あるいは項目13の使用。
【0095】
15.前記の少なくとも2つの異なる細胞集団が
(i)異なる細胞タイプの細胞、例えば異なる細胞タイプの初代細胞または異なる細胞タイプの細胞株の細胞;
(ii)同じ細胞タイプの細胞、例えば同じ細胞タイプの初代細胞または同じ細胞タイプの細胞株の細胞;
(iii)異なる細胞株由来の細胞;
(iv)同じ細胞株由来の細胞;
(v)異なる細胞系譜の細胞;
(vi)同じ細胞系譜の細胞;
(vii)異なる細胞培養由来の細胞であって、培養が異なる培養条件に供されている、前記細胞;または
(viii)同じ細胞培養由来の細胞であって、培養中の細胞が同じ培養条件に供されている、前記細胞
の集団である、項目1〜10、12または14のいずれか一項の方法、項目11または14の標準混合物、あるいは項目13または14の使用。
【0096】
16.それぞれ、項目(i)および(ii)にしたがった同じまたは異なる細胞タイプが、内分泌系の細胞タイプ、すなわち甲状腺上皮細胞、傍濾胞細胞、副甲状腺主細胞、好酸性細胞、クロム親和性細胞、松果体細胞;神経系の細胞タイプ、すなわち星状細胞、オリゴデンドロサイト、ミクログリア、ニューロン、シュワン細胞;ならびに他の細胞タイプ、例えば上皮細胞、線維芽細胞、骨芽細胞、骨細胞、破骨細胞、軟骨芽細胞、軟骨細胞、ケラチノサイト、メラニン形成細胞、筋細胞、脂肪細胞、肝細胞、B細胞、T細胞、ナチュラルキラー細胞、好塩基球顆粒球、好酸球顆粒球、好中球顆粒球、単球、マクロファージ、マスト細胞、および樹状細胞、多能性幹細胞、ならびに全能性幹細胞より選択される、項目15の方法、標準混合物、または使用。
【0097】
17.それぞれ、項目(i)および(ii)にしたがった同じまたは異なる初代細胞が、初代血液細胞、初代リンパ球、初代ニューロン、初代グリア細胞、初代上皮細胞、初代線維芽細胞、初代肝細胞、初代筋細胞、初代多能性または全能性幹細胞、および初代心筋細胞より選択される、項目15の方法、標準混合物、または使用。
【0098】
18.それぞれ、項目(i)、(ii)、(iii)および(iv)にしたがった同じまたは異なる細胞株が、腫瘍細胞株である、項目15の方法、標準混合物、または使用。
19.それぞれ、項目(i)、(ii)、(iii)および(iv)にしたがった同じまたは異なる細胞株が、癌腫細胞株、肉腫細胞株、リンパ腫細胞株、白血病細胞株、生殖細胞腫瘍細胞株、および芽腫細胞株より選択される、項目18の方法、標準混合物、または使用。
【0099】
20.それぞれ、項目(i)、(ii)、(iii)および(iv)にしたがった同じまたは異なる細胞株が、乳癌組織由来の細胞株、例えばHCC-1143、HCC-1599、HCC-1937、HCC2218、MCF7、HDQ-P1、BT-474、CAL-120、またはDU-4475;腎癌組織由来の細胞株、例えばBFTC-900、CAKI-2、CAL-54;結腸癌組織由来の細胞株、例えばCL-40、DLD-1、HCT-116、SW-403、SW480;肺癌組織由来の細胞株、例えばNCI-H1395、NCI-H1437、NCI-H2009、NCI-H2087、NCI-H2122、NCI-H2126、NCI-H1770、NCI-H82、NCI-H209、NCI-H2171、A-549、DLKP;ならびに前立腺癌由来の細胞株、例えばLNCaP、PC-3、およびDU-145より選択される、項目18の方法、標準混合物、または使用。
【0100】
21.それぞれ、項目(v)および(vi)にしたがった同じまたは異なる細胞系譜が、線維芽細胞、内皮細胞、上皮細胞、骨髄系細胞、リンパ球系細胞、白血球、ケラチノサイト、骨芽細胞、または破骨細胞、ニューロン、間質細胞、甲状腺細胞、心筋細胞、肺細胞、および肝細胞の系譜より選択される、項目15の方法、標準混合物、または使用。
【0101】
22.それぞれ、項目(vii)および(viii)にしたがった同じまたは異なる培養条件が、培養温度、培養大気、培地、継代数、細胞密度、および/または用いる基質に関して同じかまたは異なる、項目15の方法、標準混合物、または使用。
【0102】
23.前記試料が
細胞、例えば腫瘍細胞、例えば血液関連腫瘍細胞;
全組織または組織の選択された部分;
健康な組織;
疾患、例えば慢性炎症、代謝疾患、特に糖尿病、心臓血管疾患に関連する組織、腫瘍組織、例えば乳癌組織、他の癌腫組織、肉腫組織、神経内分泌腫瘍組織、血液関連腫瘍組織、リンパ腫組織、および奇形腫組織;
細胞または組織の細胞内区画、例えばミトコンドリアまたは細胞核;
体液;
上記の抽出物;ならびに
上記から選択されるタンパク質分画、例えば濃縮膜タンパク質、糖タンパク質、リン酸化タンパク質、アセチル化タンパク質、ユビキチン化タンパク質、他の修飾を伴うタンパク質、およびタンパク質複合体
からなる試料群より選択される
先行する項目いずれか一項の方法、標準混合物、または使用。
【0103】
24.前記試料が、疾患または病理学的に変化した組織、特に腫瘍組織由来の試料であり、そして前記の少なくとも2つの異なる細胞集団の少なくとも1つそして好ましくは少なくともすべてが、細胞系譜および/または細胞タイプに関して、前記組織中の疾患または病理学的に変化した細胞に対応する、先行する項目いずれか一項の方法、標準混合物、または使用。
【0104】
25.前記の少なくとも2つの異なる細胞集団の少なくとも1つが、対応する健康な組織から得られた細胞集団であるか、あるいは、培養および場合によって形質転換または不死化を通じてこうした細胞から得られる、項目24の方法、標準混合物、または使用。
【0105】
26.前記の複数の生体分子が、前記細胞集団の細胞内区画からの抽出を通じて得られている生体分子であるか、あるいは濃縮膜タンパク質、糖タンパク質、リン酸化タンパク質、ペプチド、またはその分画である、先行する項目いずれかの方法、標準混合物、または使用。
【0106】
27.前記の複数の生体分子が、少なくとも2つの異なる細胞集団の混合物からの抽出を通じて得られている、先行する項目いずれかの方法、標準混合物、または使用。
28.少なくとも2つの異なる細胞集団の前記混合物が、各細胞集団の細胞を実質的に等しい数、含有する、項目27の方法、標準混合物、または使用。
【0107】
29.前記の複数の生体分子が、少なくとも2つの異なる細胞集団から得られる抽出物を混合することを通じて得られている、先行する項目いずれかの方法、標準混合物、または使用。
【0108】
30.各細胞集団の抽出物が、前記の複数の生体分子の総量(w/v)または前記標準混合物の体積に実質的に等しく寄与する方式で、前記混合が行われる、項目29の方法、標準混合物、または使用。
【0109】
31.前記の少なくとも2つの異なる細胞集団が、3またはそれより多い異なる細胞集団、4またはそれより多い異なる細胞集団、5またはそれより多い異なる細胞集団、6またはそれより多い異なる細胞集団、あるいは10またはそれより多い異なる細胞集団である、先行する項目いずれかの方法、標準混合物、または使用。
【0110】
32.前記生体分子が、タンパク質、ペプチド、多糖、炭水化物、脂質、ならびにその類似体および断片からなる群より選択される、先行する項目いずれか一項の方法、標準混合物、または使用。
【0111】
33.前記生体分子がタンパク質またはペプチドである、先行する項目いずれか一項の方法、標準混合物、または使用。
34.前記の1つまたは前記の複数の参照生体分子が、同位体標識されている、好ましくは化学的または代謝的に同位体標識されている、そして最も好ましくは代謝的に同位体標識されている、先行する項目いずれか一項の方法、標準混合物、または使用。
【0112】
35.代謝的同位体標識が、細胞培養中のアミノ酸での安定同位体標識(SILAC)である、項目34の方法、標準混合物、または使用。
36.安定同位体が、2H、13C、15N、17O、18O、33P、34Sおよびその組み合わせからなる群より選択される、項目34または35の方法、標準混合物、または使用。
【0113】
以下の実施例は、本発明を例示するが限定しないことが意図されると認識されるであろう。本発明の精神および範囲から逸脱しない、前述の説明および実施例の多様な他の例および修飾は、開示を読んだ後、当業者に明らかであろうし、そしてこうした例または修飾はすべて、付随する請求項の範囲内に含まれると意図される。本明細書に言及するすべての刊行物および特許は、その全体が本明細書に援用される。
【実施例】
【0114】
実施例は本発明を例示する。
実施例1:組織ホモジナイズ
浸潤性腺管癌(グレードII)の凍結試料は、Piotr Ziolkowski博士(Department of Pathology, Wroclaw Medical University, Poland)の厚意によって提供された。インフォームドコンセントにしたがった試料の分析は、地方の倫理委員会によって認可された。凍結腫瘍組織(100mg)を、0.5ml緩衝液(100mM Tris-HCl pH 7.6、0.1M DTT)中、IKA Ultra Turbaxブレンダーを最高速度(25000rpm)、4℃で用いて、ホモジナイズした。次いで、SDSをホモジネートに添加して、最終濃度4%とした。溶解物を95℃で5分間インキュベーションし、そして次いで、短時間、超音波処理した。溶解物を14,000rpmで10分間遠心分離し、そして上清を以下の工程に用いた。
【0115】
実施例2:SILAC標識およびSILAC混合物の調製
ヒト乳腺上皮細胞(HMEC)をLonzaから得た。天然リジンおよびアルギニンが、重い同位体で標識されたアミノ酸、L-13C6 15N4-アルギニン(Arg10)およびL-13C6 15N2-リジン(Lys8)に置換されている、GibcoTM規定ケラチノサイト-SFM(Invitrogen)中で培養することによって、HMECをSILAC標識した。標識アミノ酸をCambridge Isotope Laboratories, Inc, USAより購入した。HCC1599、MCF7およびHCC1937を、German Collection of Microorganisms and Cell Cultures(DSMZ)より得た。HCC2218を、American Type Culture Collection(ATCC)より購入した。天然リジンおよびアルギニンがLys8およびArg10によって置換されており、そして透析血清を補充されているRPMI中で培養することによって、HCC1599、HCC2218およびHCC1937をSILAC標識した。天然アミノ酸の代わりにLys8およびArg10を含有し、そして10%透析血清を補充されているDMEM中でMCF7を増殖させた。SILAC培地中でおよそ8倍加に渡って細胞を培養して、完全標識に到達させた。HMEC、HCC1937およびMCF7細胞の溶解を、集密以下の培養に対して行った。懸濁中で増殖するHCC2218およびHCC1599を対数増殖状態で溶解した。溶解前にすべての細胞2をPBSで洗浄し、そして4%SDS、100mM Tris-HCl pH 7.6および100mM DTTを含有する緩衝液で溶解した。溶解物を95℃で5分間インキュベーションし、そして次いで、短時間、超音波処理した。295nmの励起波長を用いて、350nmでのトリプトファン蛍光発光によって、タンパク質濃度を決定した。トリプトファンを標準として用いて、8M尿素中で測定を行った。SUPER-SILAC混合物の調製のため、等量の溶解物各々を混合し、そして以下の工程で用いた。
【0116】
実施例3:フィルター補助試料調製(FASP)
腫瘍溶解物の等量のタンパク質およびSILAC混合物を合わせ、そして0.1M Tris-HCl pH8.0中の8M尿素中で希釈した(およそ1:8)。試料をMicroconデバイスYM-30(Millipore)上に装填し、そして先に記載されるように(J.R. Wisniewski, A. Zougman, N. Nagarajら, Nature methods 6 (5), 359 (2009))、FASPプロトコルを行った。簡潔には、Microconデバイスを室温で15分間、14,000xgで遠心分離し、その後、尿素溶液で連続2回洗浄した。続いて、100μLの0.1M Tris-HCl、pH8.0中の8M尿素中の50mMヨードアセトアミドを溶解物に添加し、そして暗所で20分間インキュベーションした。インキュベーション後、デバイスを8M尿素で2回洗浄し、そして40mM重炭酸アンモニウムで2回洗浄した。トリプシンを1:50(μgトリプシン:μgタンパク質)の比で濃縮物に添加し、そして37℃で一晩インキュベーションした。遠心分離によって、フィルターからペプチドを収集し、そして40mM重炭酸アンモニウムで2回連続して洗浄した。280nmのUV吸光度でペプチド濃度を決定した。
【0117】
実施例4:強陰イオン交換(SAX)によるペプチド分画
陰イオン交換クロマトグラフィーによって、40μgのペプチドを分離した。200μlマイクロピペットチップ内に6層の3M Empore陰イオン交換ディスク(Varian、1214-5012)を積み重ねることによって、カラムを組み立てた。カラムをメタノールで活性化し、その後、1M NaOHで洗浄した。以下のpH値:11、8、6、5、4および2になるようにNaOHで滴定した、20mM酢酸、20mMリン酸、および20mMホウ酸で構成されたBritton&Robinson緩衝液中で、平衡化および溶出を行った。pH11のカラム上にペプチドを装填し、そして続いて、6つの異なるpH値の緩衝液で溶出させた。溶出したペプチドを、先に記載されるように(J. Rappsilber, Y. Ishihama,およびM. Mann, Analytical chemistry 75 (3), 663 (2003))stage-tipsに結合させた。緩衝液B(80%アセトニトリル、0.5%酢酸)を用いたLC-MS/MS前に、StageTipsからペプチドを溶出させた(J.V. Olsen, L.M. de Godoy, G. Liら, Mol Cell Proteomics 4 (12), 2010 (2005))。
【0118】
実施例5:LC-MS分析
StageTipsから溶出したペプチドを、ナノフローHPLC系(Proxeon Biosystems)を用いて、社内で作製した15cmカラム(内径75μm、3μm ReproSil-Pur C18-AQ媒体)上の逆相クロマトグラフィーによって分離した。HPLCを、オンラインでナノエレクトロスプレーイオン供給源(Proxeon Biosystems)を通じて、LTQ-Orbitrap質量分析装置(Thermo Scientific)に、またはLTQ-Orbitrap Velos質量分析装置(Thermo Scientific)に連結した。緩衝液A(0.5%酢酸)を用い、流速500nl/分でカラム上にペプチドを装填し、そして流速250nl/分で、190分の直線勾配で溶出させた。異なるpH値からの分画に関して、3つの異なる勾配を適用した。pH11およびpH8溶液で溶出した分画には、2〜30%緩衝液Bの勾配を適用した。pH6およびpH5溶液には5〜35%緩衝液Bを、そしてpH4およびpH2には、8〜37%緩衝液Bを適用した。直線勾配後、カラムを洗浄して90%緩衝液Bに到達させ、そして緩衝液Aで再平衡化した。LTQ-Orbitrap Velosと組み合わせたLC実行を、15cmカラム(内径75μm、1.9μm ReproSil-Pur C18-AQ媒体)で行った。5〜30%緩衝液Bの190分間の勾配を用いた。
【0119】
サーベイスキャンおよびタンデム質量スペクトル(MS/MS)獲得間のデータ依存性自動スイッチを適用して、陽イオンモードで質量スペクトルを獲得した。LTQ-Orbitrap測定では「上位5」法で、そしてLTQ-Orbitrap Velos測定では「上位15」で、プロテオーム試料を分析し、m/z 300〜2000の質量範囲で1回のOrbitrapサーベイスキャンを獲得し、その後、LTQにおいて5つの最も強いイオンのMS/MSを獲得した。Orbitrapのターゲット値は、前駆体イオン3の質量正確性を改善するための再較正のため、ロック質量(lock masses)を用いて、m/z 400、60,000の解像度で、サーベイスキャンに関して1,000,000であった。5,000イオンのターゲット値を用いて、衝突誘発解離によって、LTQにおける断片化を行った。イオン選択閾値は1000カウントであった。
【0120】
実施例6:データ分析
LTQ-OrbitrapおよびLTQ-Orbitrap Velos由来の生MSファイルを、MaxQuantによって分析した(J. CoxおよびM. Mann, Nature biotechnology 26 (12), 1367 (2008))(バージョン1.0.13.12)。順方向および逆方向タンパク質配列の両方を含有するデコイIPI-ヒトデータベース、バージョン3.62に対して、MASCOT検索エンジン(バージョン2.2.04、Matrix Science)によって、MS/MSスペクトルを検索した(D.N. Perkins, D.J. Pappin, D.M. Creasyら, Electrophoresis 20 (18), 3551 (1999))。
【0121】
それぞれ7ppmおよび0.5Thの最大初期質量偏差で、親質量および断片イオンを検索した。検索には、メチオニン酸化およびN末端アセチル化、ならびにシステインカルバミドメチル化の固定修飾の多様な修飾が含まれた。最小6アミノ酸のペプチドおよび最大2つの切断欠損は分析を許された。ペプチドおよび4タンパク質同定に関しては、偽発見率(FDR)を0.01に設定した。2つのタンパク質の同定されたペプチドが2つのタンパク質(相同体またはアイソフォーム)によって共有された場合、2つのタンパク質は、MaxQuantによって1つのタンパク質群と報告された。ペプチド修飾の同定のため、検索には、ホスホ(STY)変動修飾が含まれた。
【0122】
実施例7:さらなるSILAC混合物の調製
本発明者らはまた、異なる腫瘍タイプに関するsuper-SILAC混合物を開発した。本発明者らは、神経膠芽腫および星状細胞腫に由来する5つの細胞株を組み合わせて、これらの腫瘍タイプの分析のための内部標準として利用した(表5)。本発明者らは、これを原形質性星状細胞腫(astrocytoma protoplasmaticum)の溶解物と混合し、そして結果を、単一標識星状細胞腫細胞株1321N1を含むものに比較した。この脳腫瘍において、本発明者らは、5,183タンパク質群を同定し、そしてそのうち4,318を定量化した。本発明者らの先の結果と同様に、super-SILAC混合物の比の分布は単一細胞株のものよりはるかに狭かった。定量化した脳腫瘍プロテオームの63%が、内部標準に対して非常に容易に定量化可能な2倍の比以内であり、これに対して単一細胞株に関しては48%であった(図4)。したがって、super-SILAC戦略は、広い腫瘍タイプに適用可能である。
【0123】
実施例8:インスリン刺激に対する肝臓ホスホプロテオーム反応の定量化
本発明者らは、リジン(Lys4)およびアルギニン(Arg6)の重量型で、マウス肝臓腫Hepa1-6細胞を代謝標識することによって、ホスホペプチド標準を生成した。細胞を2つの集団に分け、一方をインスリンで刺激して、標準におけるインスリン依存性リン酸化部位の適切な代表を達成した(図5a)。標識ホスホペプチドを化学的に合成するのに比較して、標準はいくつかの利点を有する。まず、これは、正確な定量化に望ましい量でおおよそ存在する、数万の標準ペプチドの経済的な生成を導くはずである。第二に、これは試料プロセシング初期に試料と標準を混合することを可能にし、プロテオミクス・ワークフロー中に導入される定量化誤差を回避する。
【0124】
本発明者らは、ホスホ-SILAC標準を、対照およびインスリン注射動物由来の肝臓組織溶解物内にスパイク処理した。本発明者らの標準混合物が、適切な存在量で肝臓試料のホスホペプチドの大部分を含有し、定量化可能な比を生じているかどうかを決定するため、本発明者らはSILAC比のヒストグラムを分析した。ホスホペプチドの比の分布は一峰性であり、肝臓および細胞株ホスホプロテオーム間で優れたマッチがあり、そして関心対象の試料由来の軽いホスホペプチドの大部分が、重い標識内部標準に対応物を有する(図5bおよび5c)。
【0125】
標準と肝臓試料の比較は、ペプチドの2つのSILAC型間の重量型対軽量型(H/L)比を生じる。内部標準はすべての試料に渡って同じであるため、インスリン処置および対照試料間の「比の比」は、ホスホペプチド存在量の直接比較を可能にする。インスリン処置およびPBS処置マウス間の「比の比」の分布は驚くほど狭く、定量化の正確性が高いことが立証された(図5d、e)。狭い分布はまた、大部分のリン酸化部位がインスリンに反応しては制御されないことも意味する。
【0126】
本発明者らは、インスリンシグナル伝達経路の既知の因子のほぼすべてにおいて、1またはそれより多いリン酸化部位を同定した(図6)。例には、重要なシグナル伝達仲介因子Irs1およびIrs2が含まれ、本発明者らはこれらに関して、インスリン刺激後のいくつかのセリン部位のリン酸化における2倍より多い変化を定量化した(表6a)。チロシンリン酸化とは対照的に、Irsタンパク質のセリン/スレオニンリン酸化は、インスリンシグナル伝達カスケードの阻害において関連付けられる。Irs1は徹底的に研究されてきたが、Irs2に対するセリンリン酸化に関してはほとんど知られていない。本発明者らのデータは、マウス肝臓において、Irs2に対するセリンリン酸化が、Irs1と同様に、長期インスリン刺激に対する経路の適用に関与する、阻害性フィードバック機構において、役割を果たしていることを示唆する。
【0127】
肝臓において、インスリンの代謝効果は、解糖、グリコーゲン合成および脂肪酸合成増加を導く。したがって、本発明者らは、Aktの下流ターゲットであるGsk3_のセリン9上でのリン酸化増加を観察した(表6b)。Gsk3_上のこのセリンのリン酸化はその阻害を導き、そしてその結果、グリコーゲンシンターゼの活性化を導く。クエン酸をアセチルCoAおよびオキサロ酢酸に変換する酵素であるATPクエン酸リアーゼのセリン455リン酸化は、2倍増加した(表6b)。Aktによるこの部位のリン酸化は、該酵素を活性化し、脂肪酸合成のためのアセチルCoAの供給増加を導くと考えられる。同様に、本発明者らは、「心臓アイソフォーム」として知られているが、肝臓を含む多くの組織で発現される、6-ホスホフルクト-2-キナーゼ/フルクトース-2,6-ビホスファターゼ(Pfkfb2)のより高いレベルのセリン469およびセリン486リン酸化(表6b)(ヒトにおいてはS466およびS483)を検出した。in vitroでのこのアイソフォームに対する研究は、これらのリン酸化部位が解糖の誘導に関与することを示した。インスリンシグナル伝達の重要なブランチは、mTORキナーゼによって仲介される。この経路の活性化を立証するように、本発明者らは、インスリン処置後、Akt1-基質1(PRAS40としてもまた知られる)のスレオニン247およびセリン184でのより高いリン酸化を検出した。このリン酸化事象は、mTORによって仲介され、そしてPRAS40をRaptorから解離させる。また、本発明者らのデータセットによって、以前は知られていなかったインスリンシグナル伝達およびmTOR複合体2(mTORC2)間の関連も示唆され、これは本発明者らが、mTORC2特異的サブユニットRictorのリン酸化増加を見出したためである。インスリンに反応したmTORシグナル伝達の中心的な機能と一致して、mTORキナーゼリン酸化はまた、以前には知られていなかった部位(S2478;表6a)でも上方制御されていた。
【0128】
さらに、本発明者らは、p70s6kのターゲットであるPdcd4の阻害性セリン76リン酸化の増加を検出した。Pdcd4は、翻訳開始因子eIF4Aに結合し、そしてしたがってeIF4Gへの相互作用を阻害することによって、翻訳を妨げる。Ser76上でのPdcd4のリン酸化はその分解を仲介し、この阻害を軽減し、そしてしたがってタンパク質翻訳を増進する。さらに、Ser457上でのPdcd4のリン酸化もまた増加する。Aktによって仲介されるこのリン酸化は、AP-1反応性プロモーターのリプレッサーとしてのPdcd4の機能を阻害し、AP-1転写ターゲットのインスリン依存性上方制御のための機構を提供する。
【0129】
AktおよびmTORシグナル伝達ブランチに加えて、インスリンシグナル伝達ネットワークは、その増殖効果を仲介するためにMAPKカスケードを用いる。AktおよびmTOR経路とは対照的に、本発明者らは、Erk1およびErk2の制御性スレオニンおよびチロシン部位のリン酸化レベルにいかなる変化も検出しなかった。これらのデータは、Erk1およびErk2がインスリン刺激の5〜10分後に一過性にリン酸化されるのみであることを示す先の報告と一致する。同様に、本発明者らは、インスリン刺激後、Raf1上の阻害性セリン233がより多くリン酸化されることを見出した(表6a)。Erk1およびErk2とは対照的に、しかしなお先の報告と一致して、Mapk14(p38a)リン酸化は、インスリン刺激された肝臓30でのみ検出された。本発明者らの大規模リン酸化データは、このように、インスリン受容体のシグナル伝達下流の複雑なパターンおよびクロストークを明らかにする。
【0130】
【表1−1】

【0131】
【表1−2】

【0132】
【表1−3】

【0133】
【表1−4】

【0134】
【表2−1】

【0135】
【表2−2】

【0136】
【表2−3】

【0137】
【表3】

【0138】
【表4】

【0139】
【表5】

【0140】
【表6】

【技術分野】
【0001】
本発明は、試料中の完全補完物(entire complement)を含む1つまたは複数の生体分子の包括的定量化を可能にする方法であって、該生体分子の量を、少なくとも2つの異なる細胞集団からの抽出を通じて得られた標準混合物中の参照生体分子の量に比較することによる、前記方法に関する。本発明はさらに、前記標準混合物自体、その調製および使用に関する。
【背景技術】
【0002】
ゲノム、細胞、組織または生物によって発現されるタンパク質など、試料中の生体分子および生体分子断片の包括的定量化は、複雑なタスクである。
近年、質量分析は大きな技術的進歩を成し遂げ、そしてますます広く適用されてきている(R. AebersoldおよびM. Mann, Nature 422 (6928), 198 (2003), B.F. Cravatt, G.M. Simon,およびJ.R. Yates, 3rd, Nature 450 (7172), 991 (2007))。しかし、高解像度質量分析法による、ゲノム、細胞、組織または生物によって発現されるタンパク質などの生体分子の完全補完物、例えば腫瘍プロテオームの正確な定量化は、なお未成熟である(F. Bertucci, D. Birnbaum,およびA. Goncalves, Mol Cell Proteomics 5 (10), 1772 (2006), J.M. Koomen, E.B. Haura, G. Beplerら, Mol Cell Proteomics 7 (10), 1780 (2008))。
【0003】
主には、生体分子の代表の数を定量化することが困難であり、これは、再現性がある結果を得るための、そしてしばしば存在量が少ない疾患関連生体分子、例えば癌関連タンパク質を研究するための必要条件である。
【0004】
特定の疾患状態、例えば腫瘍の分子分類は、患者分離、最適な治療様式の選択および転帰の予測を補助しうる。マイクロアレイを用いたトランスクリプトーム・レベルの測定は、この適用のため有望であることが示されてきており、そして臨床的に適用されはじめている(T.R. Golub, D.K. Slonim, P. Tamayoら, Science (New York, N.Y 286 (5439), 531 (1999), X. Li, R.J. Quigg, J. Zhouら, Current genomics 9 (7), 466 (2008))。
【0005】
細胞培養におけるアミノ酸による安定同位体標識(SILAC)は、非常に正確であり、そして頑強であって、プロテオームを定量化する価値あるツールである(S.E. Ong, B. Blagoev, I. Kratchmarovaら, Mol Cell Proteomics 1(5), 376 (2002), S.E. OngおよびM. Mann, Nature protocols 1 (6), 2650 (2006))。例えば、Chowdhuryら(Rapid Communications in Mass Spectrometry 9:563-569 (1995)は、質量分析および同位体標識類似体を用いて、一部切除(truncated)成熟コラゲナーゼの分子量を調べ、そしてStocklinら(Diabetes 46: 44-50 (1997)は、抽出され、そして精製されている血清試料中のヒトインスリン濃度を調べた。どちらも、生体分子の事前の単離を伴わない生体分子の量の決定を論じておらず、もちろん、試料中に含まれる複数の生体分子、例えばこうした試料中の生体分子の完全補完物の絶対量の決定を論じていない。
【0006】
SILACは、全プロテオームの完全代謝標識を必要とするため、SILACは通常、細胞培養に限定され、そして臨床試料には不適切であると考えられる。近年、いくつかの研究によって、SILACの範囲が広がってきた。Neuro2A細胞株が代謝標識され、そしてマウス全脳に比較されてきている(Y. Ishihama, T. Sato, T. Tabataら, Nature Biotechnology 23 (5), 617 (2005))。総数602のタンパク質が定量化されたが、細胞株および組織間には最大10倍の比があった。試料および内部標準間のこうした高い比は、正確な定量化を行うのを困難にし、これはSILAC対において存在量がより少ないペプチドがノイズレベルに近づきうるためである。SILAC標識Hepa1-6細胞を用いて、マウス肝臓から単離された培養初代肝細胞2由来のタンパク質が最近定量化された(S. Pan, L. Cheng, J.T. Whiteら, Omics 13 (4), 345 (2009))。さらに、以前、マウスがSILAC標識されているが、この方法は、ヒト被験体には適用不能である(M. Kruger, M. Moser, S. Ussarら, Cell 134 (2), 353 (2008))。
【先行技術文献】
【非特許文献】
【0007】
【非特許文献1】R. AebersoldおよびM. Mann, Nature 422 (6928), 198 (2003)
【非特許文献2】B.F. Cravatt, G.M. Simon,およびJ.R. Yates, 3rd, Nature 450 (7172), 991 (2007)
【非特許文献3】F. Bertucci, D. Birnbaum,およびA. Goncalves, Mol Cell Proteomics 5 (10), 1772 (2006)
【非特許文献4】J.M. Koomen, E.B. Haura, G. Beplerら, Mol Cell Proteomics 7 (10), 1780 (2008)
【非特許文献5】T.R. Golub, D.K. Slonim, P. Tamayoら, Science (New York, N.Y 286 (5439), 531 (1999)
【非特許文献6】X. Li, R.J. Quigg, J. Zhouら, Current genomics 9 (7), 466 (2008)
【非特許文献7】S.E. Ong, B. Blagoev, I. Kratchmarovaら, Mol Cell Proteomics 1(5), 376 (2002)
【非特許文献8】S.E. OngおよびM. Mann, Nature protocols 1 (6), 2650 (2006)
【非特許文献9】Chowdhuryら(Rapid Communications in Mass Spectrometry 9:563-569 (1995)
【非特許文献10】Stocklinら(Diabetes 46: 44-50 (1997)
【非特許文献11】Y. Ishihama, T. Sato, T. Tabataら, Nature Biotechnology 23 (5), 617 (2005)
【非特許文献12】S. Pan, L. Cheng, J.T. Whiteら, Omics 13 (4), 345 (2009)
【非特許文献13】M. Kruger, M. Moser, S. Ussarら, Cell 134 (2), 353 (2008)
【発明の概要】
【発明が解決しようとする課題】
【0008】
したがって、試料、例えばヒト試料および特にヒト組織試料などの試料中の、1つまたは複数の生体分子(例えばタンパク質、オリゴヌクレオチド等)、例えばその完全補完物を定量化するための単純でそして迅速な方法であって、さらに、ゲノム、細胞、組織または生物によって発現されるタンパク質など、多数の生体分子、例えばこうした試料中の生体分子の一部または完全補完物を迅速に定量化することを可能にする、前記方法に対する必要性がある。
【課題を解決するための手段】
【0009】
上記目的は、本明細書に記載し、そして請求するような、本発明にしたがった方法によって解決される。
【図面の簡単な説明】
【0010】
【図1】1つのSILAC標識細胞タイプ対SUPER-SILAC混合物を用いた、腫瘍組織の定量化。(A)内部標準として標識HCC1599乳癌細胞株を用いた腫瘍組織の定量的分析の実験スキーム。標識細胞の溶解物を、腫瘍溶解物と1:1の比で混合した。混合物を消化し、そしてタンデム質量分析と組み合わせた高解像度液体クロマトグラフィー(LC-MS/MS)によって、ペプチドを分析した。(B)4つの乳癌細胞株および正常乳腺上皮細胞を含む、5つの異なる細胞タイプをSILAC標識した。等量のタンパク質を混合して、SUPER-SILAC混合物を形成し、これを次いで、腫瘍組織と混合し、そして(A)におけるように分析した。(C)腫瘍タンパク質およびHCC1599細胞間の比のヒストグラム。頻度は、各ビンにおけるタンパク質数に相当する。(D)腫瘍タンパク質およびSUPER-SILAC混合物間の比のヒストグラム。
【図2】SUPER-SILAC混合物を用いた定量化の正確性。(A)内部標準としてSUPER-SILAC混合物を用いた、腫瘍プロテオームの組み合わせ3つ組分析に対する、単一分析で決定される比の比較。(B)3つの技術的複製物の変異係数のヒストグラム。(C)腫瘍で発現されるキナーゼの組み合わせ3つ組分析に対する、単一分析で決定される比の比較。(D)5つの複製物における5つの癌関連タンパク質の比。
【図3】LTQOrbitrap Velosを用いた、内部標準としてSUPER-SILAC混合物を用いる、腫瘍組織分析。前分画を伴わずに、C18カラム上でペプチドを分離した。(A)腫瘍タンパク質およびSILAC混合物間の比の分布。(B)2つの技術的複製物間を比較した比。
【図4】1つのSILAC標識細胞タイプ対super-SILAC混合物を用いた、星状細胞腫組織の定量化。(A)腫瘍タンパク質および1321N1細胞間の比のヒストグラム。頻度は、各ビンにおけるタンパク質数に相当する。(B)腫瘍タンパク質およびsuper-SILAC混合物間の比のヒストグラム。
【図5】肝臓定量的ホスホプロテオーム(phosphoproteomic)分析の実験設計。(A)対照およびインスリン処置肝臓試料の定量的ホスホプロテオーム分析の実験設計。インスリン処置および非処置標識Hepa1-6細胞の混合物は、内部標準として働く。混合物を消化し、そして生じたペプチドを高解像度LC MS/MSによって分析する。次いで、対照およびインスリン処置肝臓由来の比を比較する(「比の比」)。(B、C)対照肝臓およびHepa1-6細胞のホスホペプチド間(B)の、そしてインスリン処置肝臓およびHepa1-6細胞のホスホペプチド間(C)の比の分布。(D)ボックスプロット、ならびに(E)インスリン処置および対照肝臓試料間のホスホペプチド比の「比の比」ヒストグラム(1つの技術的複製物の代表的な例-3つ組分布はさらにより狭い)。
【図6】インスリン処置に際して、肝臓において活性化されるインスリンシグナル伝達経路のメンバー。インスリン受容体チロシンキナーゼと相互作用した後、インスリンは、インスリンの代謝および分裂促進効果を制御する、一連の仲介因子を活性化する。マウスのインスリン処置後、リン酸化が増加した部位を赤で示し、定量化されるが、インスリンによって制御されない部位を緑で標識する。
【発明を実施するための形態】
【0011】
したがって、1つの側面において、本発明は、試料中の1つまたは複数の生体分子を定量化するための方法であって、前記試料中の前記の1つまたは前記の複数の生体分子の量を決定し;そして標準混合物中の複数の生体分子の中の1つまたは複数の参照生体分子の量に対して、該量を比較する工程を含み、前記の複数の生体分子が、少なくとも2つの異なる細胞集団から、例えばこれらの細胞集団の混合物からの抽出を通じて得られており;前記の1つまたは前記の複数の参照生体分子は、前記の1つまたは前記の複数の生体分子の標識型である、前記方法を提供する。
【0012】
主な態様は、2つの群の生体分子を指すことが理解される。第一の群は、前記試料中の前記の1つまたは複数の生体分子であり、生体分子の前記群はまた、以下において、「第一の生体分子」とも称される。一方、標準混合物中の複数の生体分子への言及があり、これは、前記標準混合物が、前記試料とは別個に保持されていると理解される。したがって、前記標準混合物中の前記の複数の生体分子であるこの第二の群の生体分子はまた、以下において「第二の生体分子」とも称される。したがって、そして第一および第二の生体分子の用語法を用いて表す場合、主な態様は、試料中の1つまたは複数の第一の生体分子を定量化するための方法であって、前記試料中の前記の1つのまたは前記の複数の第一の生体分子の量を決定し;そして、標準混合物中の複数の第二の生体分子の中の1つまたは複数の参照生体分子の量に対して、該量を比較する工程を含み、前記の複数の第二の生体分子は、少なくとも2つの異なる細胞集団からの抽出を通じて得られており、前記の1つまたは複数の参照生体分子が、前記の1つまたは前記の複数の第一の生体分子の標識型である、前記方法に関する。
【0013】
好ましい態様において、前記試料中の前記の1つまたは前記の複数の生体分子、すなわち前記の第一の生体分子の量は、前記標準混合物と前記試料を混合した後に決定される。標準混合物は、したがって、本発明の方法および使用の目的のための内部標準として働く。
【0014】
本発明のこの側面にしたがって、前記の1つまたは前記の複数の生体分子、および前記の1つまたは前記の複数の参照生体分子の量は、好ましくは質量分析によって決定されることが認識されるであろう。
【0015】
厳密に必須ではないが、上記方法は、前記の1つまたは前記の複数の生体分子の配列決定工程をさらに含んでもよい。
好ましい態様において、前記標準混合物中の前記の1つまたは前記の複数の参照生体分子は前選択され、そして前記質量分析は、単一または複数イオンモニタリングにより、この/これらの前選択された参照生体分子をターゲットとする。
【0016】
上記方法において、比較工程は、前記の1つまたは前記の複数の生体分子の単数または複数のピーク、および前記の1つまたは前記の複数の参照生体分子の対応する単数または複数のピークの間の強度比を決定する工程を含む。例えば、比は、前記参照生体分子のシグナルを統合する前に、前記の生体分子のシグナルをまず統合し、そして次いで、一方のシグナルを他方によって割るか、またはその逆を行うことにより、比を決定する工程によって、比を得てもよい。
【0017】
好ましい態様において、前記の1つまたは前記の複数の生体分子の量は、絶対量である。この場合、前記標準混合物中の前記の1つまたは前記の複数の参照生体分子の量はあらかじめ決定されていることが認識されるであろう。前記標準混合物中の前記の1つまたは前記の複数の参照生体分子の量は、前記試料中の前記の1つまたは前記の複数の生体分子の量を決定する前または決定した後のいずれにあらかじめ決定されてもよい。
【0018】
さらなる関連する側面において、本発明は、試料中の1つまたは複数の生体分子を定量化するための標準混合物であって、少なくとも2つの異なる細胞集団、例えばこれらの細胞集団の混合物からの抽出を通じて得られている複数の生体分子の中に、1つまたは複数の参照生体分子を含む、前記混合物を提供する。本発明にやはり含まれるのは、本明細書に記載し、そして請求する任意の方法における、前述の標準混合物の使用である。
【0019】
さらにさらなる関連する側面において、本発明は、試料中の1つまたは複数の生体分子を定量化するための標準混合物を調製するための方法であって、少なくとも2つの異なる細胞集団由来の、例えばこれらの細胞集団の混合物由来の1つまたは複数の参照生体分子を含む複数の生体分子を抽出する工程を含む、前記方法を提供する。
【0020】
本発明にしたがった方法、標準混合物および使用において、単数または複数の参照生体分子は、同位体標識され、好ましくは化学的にまたは代謝的に同位体標識され、そして最も好ましくは代謝的に同位体標識される。特に好ましい態様において、代謝的同位体標識は、細胞培養中のアミノ酸での安定同位体標識(SILAC)であり、そして安定同位体は、2H、13C、15N、17O、18O、33P、34Sおよびその組み合わせからなる群より選択される。特に好ましいのは、安定同位体が13Cおよび15Nより選択される態様である。
【0021】
先に言及するように、さらにさらなる関連する側面において、本発明は、試料中の1つまたは複数の生体分子を定量化するための標準混合物の使用を提供する。標準混合物は、複数の生体分子の中に1つまたは複数の参照生体分子を含み、複数の生体分子は、少なくとも2つの異なる細胞集団から、例えばこれらの細胞集団の混合物からの抽出を通じて得られている。
【0022】
本発明のすべての側面にしたがって、少なくとも2つの異なる細胞集団は、細胞形態、少なくとも1つの生体分子の発現プロファイル、好ましくは複数の生体分子の発現プロファイル、および/または分化状態に関して、互いに異なる。これがあてはまるとすると、少なくとも2つの細胞集団は
(i)異なる細胞タイプの細胞、例えば異なる細胞タイプの初代細胞または異なる細胞タイプの細胞株の細胞;
(ii)同じ細胞タイプの細胞、例えば同じ細胞タイプの初代細胞または同じ細胞タイプの細胞株の細胞;
(iii)異なる細胞株由来の細胞;
(iv)同じ細胞株由来の細胞;
(v)異なる細胞系譜の細胞;
(vi)同じ細胞系譜の細胞;
(vii)異なる細胞培養由来の細胞であって、培養が異なる培養条件に供されている、前記細胞;または
(viii)同じ細胞培養由来の細胞であって、培養中の細胞が同じ培養条件に供されている、前記細胞
の集団であってもよい。
【0023】
特に好ましいのは、オプション(i)、(iii)、(v)および(vii)である。
本発明、方法のすべての側面にしたがって、試料は好ましくはヒト試料であり、そして
細胞、例えば腫瘍細胞、例えば血液関連腫瘍細胞;
全組織または組織の選択された部分;
健康な組織;
疾患、例えば慢性炎症、代謝疾患、特に糖尿病、心臓血管疾患に関連する組織、腫瘍組織、例えば乳癌組織、他の癌腫組織、肉腫組織、神経内分泌腫瘍組織、血液関連腫瘍組織、リンパ腫組織、奇形腫組織、脳腫瘍組織、例えば神経膠芽腫または星状細胞腫組織;
細胞または組織の細胞内区画、例えばミトコンドリア、細胞核、
体液;
上記の抽出物;ならびに
上記から選択されるタンパク質分画、例えば濃縮膜タンパク質、糖タンパク質、リン酸化タンパク質、アセチル化タンパク質、ユビキチン化タンパク質、他の修飾を伴うタンパク質、およびタンパク質複合体
からなる試料またはヒト試料の群より選択されてもよいことが、さらに認識されるであろう。
【0024】
さらに別の好ましい態様において、試料は、疾患または病理学的に変化した組織、好ましくはヒト組織由来の試料である。特に好ましいのはヒト腫瘍組織である。この態様の関連において、前記の少なくとも2つの異なる細胞集団の少なくとも1つのそして好ましくはすべてが、細胞系譜に関して、前記の疾患または病理学的に変化した組織中の疾患または病理学的に変化した細胞に対応することが好ましい。前記の少なくとも2つの異なる細胞集団の少なくとも1つそして好ましくはすべてが、細胞タイプに関して、前記の疾患または病理学的に変化した組織中の疾患または病理学的に変化した細胞に対応することが特に好ましい。
【0025】
上述のように、前記の少なくとも2つの異なる細胞集団のすべてが、疾患または病理学的に変化した細胞に対応するのではないことが意図的に想定される。いいかえると、少なくとも2つの異なる細胞集団の少なくとも1つが、正常の、すなわち疾患でなく、そして病理学的に変化していない細胞に対応してもよい。
【0026】
上に示すように、本明細書に記載しそして請求する本発明の多様な側面の好ましい態様は、前記の複数の生体分子が少なくとも2つの異なる細胞集団の混合物からの抽出を通じて得られているものである。これらの態様と関連して、前記混合物は、好ましくは、各細胞集団の等しいか、または実質的に等しい数の細胞を含有してもよい。しかし、生じる標準混合物が、各細胞集団由来の生体分子の有意な量を含有する限り、この比からの実質的な偏差もまた、意図される。これに関連する有意な量は、標準混合物中の生体分子の総量の少なくとも2%(w/w)、少なくとも3%(w/w)、少なくとも5%(w/w)、少なくとも10%(w/w)、少なくとも15%(w/w)、少なくとも20%(w/w)または少なくとも25%(w/w)である。標準混合物が、再構成されうる凍結乾燥物の形を取る場合、同じことが当てはまる(これは同様に、本明細書に記載しそして請求する本発明の側面の態様である)。
【0027】
同様に好ましいのは、本明細書に記載しそして請求する、本発明の多様な側面の態様であって、前記の複数の生体分子が、少なくとも2つの異なる細胞集団から得られる抽出物を混合することによって得られている、すなわち異なる細胞集団が個々に抽出された後に、場合によって細胞を計数し、そして細胞数を調整した後に、混合が行われているものである。これに関連して、先に得られた抽出物の混合を、異なる細胞集団各々の抽出物が、前記の標準混合物中の前記の複数の生体分子の総量に、等しく、または実質的に等しく寄与する方式で、行うことが好ましい。しかし、やはり、生じる標準混合物が、各細胞集団の抽出物由来の生体分子の有意な量を含有する限り、この比からの実質的な偏差もまた、意図される。ここでも、これに関連する有意な量は、生じる標準混合物中の生体分子の総量の少なくとも2%(w/w)、少なくとも3%(w/w)、少なくとも5%(w/w)、少なくとも10%(w/w)、少なくとも15%(w/w)、少なくとも20%(w/w)または少なくとも25%(w/w)であり、溶液または凍結乾燥物の形である場合も同様である。
【0028】
本明細書に記載しそして請求する本発明のすべての側面のさらなる好ましい態様において、少なくとも2つの異なる細胞集団は、3またはそれより多い異なる細胞集団、好ましくは4またはそれより多い異なる細胞集団、より好ましくは5またはそれより多い異なる細胞集団、6またはそれより多い異なる細胞集団、あるいは10またはそれより多い異なる細胞集団である。
【0029】
特に好ましいのは、前記生体分子がタンパク質またはペプチドである態様である。
本明細書に提供するのは、とりわけ、生物学的試料、例えば腫瘍組織等における、1つまたは複数の生体分子、あるいは生体分子の完全補完物、例えばゲノム、細胞、組織または生物によって発現されるタンパク質を包括的に定量化することを原理的に可能にする方法である。この方法によって、数百または数千の同位体標識された生体分子を正しい量で効率的に産生することが可能になり、そして試料中の数百または数千の対応する生体分子、例えば腫瘍組織中のタンパク質を、1日で質量分析によって定量化するための、標準混合物中の参照生体分子として、これらの標識生体分子を用いることが可能になる。これは、本明細書において、グレードIIの浸潤性腺管癌患者由来の乳癌組織に対して、例示的に立証される。しかし、この新規方法は、より広く適用可能であり、経済的であり、そして実験室においてより容易に適用可能であり、したがって、臨床研究のための魅力的なツールとなっている。
【0030】
第一の側面において、本発明は、試料における1つまたは複数の生体分子を定量化するための方法であって、前記試料における前記の1つまたは複数の生体分子の量を決定する工程を含む、前記方法を提供する。
【0031】
用語「生体分子」は、本明細書において、生存生物によって産生される任意の分子を指し、そしてタンパク質、ペプチド、多糖、炭水化物、脂質、ならびにその類似体および断片からなる群より選択されうる。生体分子の好ましい例は、タンパク質およびペプチドである。
【0032】
本明細書において、用語「ペプチド」は、2またはそれより多いアミノ酸のペプチドまたはポリペプチドを指す。ペプチドまたはポリペプチドはまた、例えば天然存在修飾、例えばリン酸化、アシル化、プレニル化、硫酸化、ヒドロキシル化、アセチル化、炭水化物付加、補欠分子族または補因子の付加、ジスルフィド結合の形成、タンパク質分解、巨大分子複合体の組み立て等を含む、翻訳後修飾によって修飾されてもよい。
【0033】
本発明にしたがって、本明細書に言及するような1つまたは複数の生体分子の量を、標準混合物中の1つまたは複数の参照生体分子の量に比較する。好ましい態様において、前記試料と前記標準混合物を混合した後、前記試料中の前記の1つまたは前記の複数の生体分子の量を決定する。
【0034】
本明細書において、用語「標準混合物」は、複数の生体分子の中の、1つまたは複数の参照生体分子の混合物を指し、前記の複数の生体分子(前記の1つまたは前記の複数の参照生体分子を含む)は、少なくとも2つの異なる細胞集団からの抽出を通じて得られており、そして前記の1つまたは前記の複数の参照生体分子は、試料中の前記の1つまたは前記の複数の生体分子の標識型(上に定義される)である。
【0035】
標準混合物の複数の生体分子を得る工程は、前記の少なくとも2つの異なる細胞集団の混合物から抽出されている場合、前記の複数の生体分子内の少なくとも1つまたは複数のさらなる生体分子と比較した、前記標準混合物中の前記の1つまたは前記の複数の参照生体分子の相対量が、前記の少なくとも1つまたは複数のさらなる生体分子と比較した、前記の1つまたは前記の複数の参照生体分子の相対量に対応する方式で、行われる。
【0036】
本発明はまた、上に定義するような標準混合物自体、ならびに試料中の1またはそれより多い生体分子を定量化するためのこうした標準混合物を調製するための方法であって、少なくとも2つの異なる細胞集団由来の1またはそれより多い参照生体分子を含む複数の生体分子を抽出する工程を含む、前記方法もまた提供する。
【0037】
本発明の関連において、用語「参照生体分子」は、上に定義するような生体分子の標識型を指す。
用語「標識型」は、本明細書において、同位体標識型を含む。好ましくは、標識型は、生体分子の化学的または代謝的同位体標識型であり、そして最も好ましくは、代謝的同位体標識型である。
【0038】
本発明にしたがった生体分子の好ましい「同位体標識型」は、天然存在分子の変異体であり、その構造において、1またはそれより多い原子は、異なる原子量を有する同じ元素の原子(単数または複数)で置換されているが、同位体が直接またはリンカーを通じてのいずれかで共有結合しているか、あるいは同位体が生体分子に対して複合体化されている同位体標識型が、同様に意図される。いずれの場合も、同位体は、好ましくは安定同位体である。
【0039】
本明細書に言及されるような安定同位体は、同一数の陽子および電子を有するが、1またはそれより多いさらなる中性子(単数または複数)を有し、この中性子が元素の分子量を増加させる、元素の非放射性同位体型である。好ましくは、安定同位体は、2H、13C、15N、17O、18O、33P、34Sおよびその組み合わせからなる群より選択される。特に好ましいのは、13Cおよび15N、ならびにその組み合わせである。
【0040】
標識は、当該技術分野に知られる手段によって達成可能である。前駆体分子として同位体標識されたアミノ酸またはペプチドを用いて、標識参照生体分子を合成してもよい。例えば、同位体コード化アフィニティタグ(ICAT)試薬は、参照生体分子、例えばタンパク質を試料調製のアルキル化工程で標識する(Gygiら, 1999, WO 00/11208)。可視ICAT試薬(VICAT試薬)を同様に使用してもよく(WO 04/019000)、これによって、VICAT型試薬は、検出可能部分として、フルオロフォアまたは放射標識を含有する。iTRAQおよび類似の方法を同様に使用してもよい(Ross, P.L., Huang, Y.N., Marchese, J.N., Williamson, B., Parker, K., Hattan, S., Khainovski, N., Pillai, S., Dey, S., Daniels, S.ら (2004). Multiplexed protein quantitation in Saccharomyces cerevisiae using amine-reactive isobaric tagging reagents. Mol Cell Proteomics 3, 1154-1169)。
【0041】
また、好ましくは、代謝標識を用いて、標識参照生体分子を産生してもよい。例えば、同位体標識前駆体分子、例えばタンパク質またはペプチドに取り込まれて、それによってこれらを代謝標識する同位体標識アミノ酸を含有する培地上で、細胞を増殖させてもよい。代謝的同位体標識は、好ましくは、細胞培養中のアミノ酸での安定同位体標識(SILAC)である。代謝標識を用い、そして1つまたは複数の参照生体分子の標識型が単数または複数の参照生体分子のSILAC標識型である場合、上に定義するような標準混合物をまた、SUPER-SILAC混合物とも称する。
【0042】
代謝標識を用いる利点は、各タンパク質のすべてのペプチドが定量化に寄与し、そして分析を特定のタンパク質またはペプチドにターゲティングする必要がないことであるが、これはもちろん、本発明のフレームワークにおいて、可能であり、そして意図されている。さらに、混合物中の任意のペプチドが、分析の深さおよび分離工程の数に応じて、原理的に定量化可能である。これによってアイソフォーム特異的ペプチドおよび修飾ペプチドの定量化が可能になる。以下に示すように、例えば、いかなる濃縮工程も伴わずに、ほぼ100のリン酸化されたペプチドが定量化可能である(表1を参照されたい)。SUPER-SILAC混合物は、ホスホプロテオームに関するのと同じ方式で働くが、徹底的なホスホプロテオーム分析に関しては、好ましくは、ホスホペプチド濃縮工程が含まれる。
【0043】
標準混合物の生体分子、すなわち1つまたは複数の参照生体分子および複数の生体分子は、少なくとも2つの異なる細胞集団からの抽出を通じて、こうした集団の混合物から、または前記集団から個々に得られる抽出物を混合することによってのいずれかで、得られる。標準混合物の複数の生体分子はまた、前記の少なくとも2つの異なる細胞集団の特定の細胞内区画からの抽出を通じて、やはり前記区画の混合物から、または個々の細胞集団の区画から個々に先に得られた抽出物を混合することによってのいずれかで、得られうる。本発明の関連において、適切な細胞内区画は、例えば細胞核、ミトコンドリア、小胞体、ゴルジ体、細胞質、または細胞膜である。
【0044】
本明細書において先に言及するように、本明細書に言及する「少なくとも2つの異なる細胞集団」を形成可能な細胞は、細胞株、特に腫瘍細胞株由来の細胞、または培養中の初代細胞の細胞であってもよい。細胞は、当該技術分野に知られる任意の手段によって人工的に修飾されてもよい。適切な細胞株は、培養中で容易にそして無期限に増殖することを可能にする遺伝子変化を経ている細胞によって形成される。言い換えると、これらは不死化細胞である。当該技術分野で知られる任意の細胞株が、もちろん、試料の性質に応じて、本発明にしたがった方法での使用に適しており、そしてこれらを、一般的に知られる寄託施設または「細胞バンク」、例えばATCCまたはGerman Collection of Microorganisms and Cell Cultures(DSMZ)から得ることも可能である。特に好ましい細胞株は、哺乳動物細胞株、特にヒト細胞株である。
【0045】
適切な初代細胞を組織または体液、好ましくはヒト組織または体液から直接得てもよく、そして初代細胞は、例えば、血液細胞、リンパ球、ニューロン、グリア細胞、上皮細胞、線維芽細胞、肝細胞、筋細胞または心筋細胞であってもよい。
【0046】
本発明の方法の好ましい態様において、少なくとも3つの異なる細胞、少なくとも4つの異なる細胞、少なくとも5つの異なる細胞、または少なくとも10の異なる細胞の混合物からの抽出を通じて、標準混合物の多数の生体分子を得る。
【0047】
用語「異なる細胞集団」は、これらの集団を形成する細胞が、細胞形態に関する互いの形態、上に定義するような少なくとも1つの生体分子の、そして好ましくは上に定義するような複数の生体分子の発現プロファイル、および/または分化状態のいずれかが異なることを意味する。好ましい態様において、細胞は異なる細胞タイプまたは細胞系譜由来の細胞である。しかし、やはり好ましいのは、細胞が同じ細胞タイプまたは系譜由来であるが、他の観点において異なる態様である。例えば、細胞は、同じ細胞タイプまたは系譜の細胞であるが、異なる細胞培養条件下で培養されている点で異なってもよい。異なる細胞集団を導きうる異なる細胞培養条件は、培養温度、培養大気、培地、継代数、細胞密度、および/または用いる基質が異なる条件であってもよい。しかし、所定の培養は、所定の培養内の異なる細胞集団の細胞が、上に同定する他の観点いずれかで異なる限り、同じ培養条件に供されている、本発明の意味で異なる細胞集団を含んでもよい(すなわち「混合」培養)ことが理解されるであろう。
【0048】
やはり好ましいのは、異なる細胞株由来の細胞集団の使用である。これらは、異なる細胞タイプまたは系譜に属する細胞株由来の細胞であってもよい。しかし、好ましい態様において、異なる細胞株の細胞は、同じ細胞系譜に属するか、または同じ細胞系譜に由来する。やはり好ましいのは、異なる細胞株の細胞が、同じ細胞タイプに属するか、または同じ細胞タイプに由来する態様である。適切な細胞株は、腫瘍細胞株、特に癌腫細胞株、肉腫細胞株、リンパ腫細胞株、白血病細胞株、生殖細胞腫瘍細胞株、および芽腫細胞株、脳腫瘍細胞株、例えば神経膠芽腫および星状細胞腫細胞株である。
【0049】
本発明の意味における異なる細胞タイプの例は、内分泌系の細胞タイプ、すなわち甲状腺上皮細胞、傍濾胞細胞、副甲状腺主細胞、好酸性細胞、クロム親和性細胞、松果体細胞;神経系の細胞タイプ、すなわち星状細胞、オリゴデンドロサイト、ミクログリア、ニューロン、シュワン細胞;および他の細胞タイプ、例えば上皮細胞、線維芽細胞、骨芽細胞、骨細胞、破骨細胞、軟骨芽細胞、軟骨細胞、ケラチノサイト、メラニン形成細胞、筋細胞、脂肪細胞、肝細胞、B細胞、T細胞、ナチュラルキラー細胞、好塩基球顆粒球、好酸球顆粒球、好中球顆粒球、単球、マクロファージ、マスト細胞、樹状細胞、多能性幹細胞、全能性幹細胞等である。
【0050】
本発明の意味における異なる細胞系譜の例は、線維芽細胞、内皮細胞、上皮細胞、骨髄系細胞、リンパ球系細胞、白血球、ケラチノサイト、骨芽細胞、または破骨細胞、ニューロン、間質細胞、甲状腺細胞、心筋細胞、肺細胞、肝細胞等である。
【0051】
好ましくは、「異なる細胞集団」は、同じ組織由来の異なる細胞系譜の細胞、例えば腺扁平上皮癌組織由来の扁平細胞系譜および腺様細胞系譜であるか;あるいは異なる細胞株の細胞、例えば乳癌組織由来の異なる上皮細胞株、例えば乳癌組織由来のHCC-1143、HCC-1599、HCC-1937、HDQ-P1、BT-474、CAL-120、もしくはDU-4475細胞、または腎癌組織由来のBFTC-900、CAKI-2、CAL-54細胞、または結腸癌組織由来のCL-40、DLD-1、HCT-116、SW-403、SW480細胞株である。別の好ましい態様において、異なる細胞集団は、ヒト腫瘍組織由来の異なる細胞株、および対応する健康な組織由来の細胞株由来の細胞を含む。
【0052】
本発明のさらに別の好ましい側面において、「異なる細胞集団」は、同じ細胞系譜の異なる細胞タイプであり、例えば白血球系譜に属するBおよびT細胞である。
異なる細胞集団を形成する細胞は、例えばDNA、RNA、細胞表面マーカー発現、遺伝子発現、生化学特性、酵素活性、振る舞い、増殖、アポトーシス、栄養必要性、組織形成、または上に定義する相違の顕在化である任意の他の特徴の改変によって区別可能である。
【0053】
異なる細胞集団を同定し、そして検出するための技術は、当該技術分野に周知である。例えば、細胞間の相違を検出するための一般的な技術には、PCR法、例えば通常のPCR、リアルタイムPCR、RT-PCR、in-situハイブリダイゼーション等;またはマーカー検出法、例えばフローサイトメトリー、磁気ビーズ分離、顕微鏡等;またはタンパク質検出技術、例えばSDS-PAGE、3Dゲル、ウェスタンブロッティング、マイクロアレイ、質量分析等;またはハイブリダイゼーション技術、例えばin-situハイブリダイゼーション、FISH、マイクロアレイ、サザンブロッティング、ノーザンブロッティング等;またはDNA突然変異分析技術、例えば制限断片長多型(RFLP)等が含まれる。
【0054】
本明細書において、用語「試料」は、細胞、その細胞内区画、組織または臓器を指す。組織は、全組織、または組織の選択された部分であってもよい。組織部分は、組織の顕微解剖によって、または生検によって、または細胞内区画の濃縮によって単離可能である。用語「試料」はさらに、健康なならびに疾患または病理学的に変化した細胞または組織を指す。したがって、該用語はさらに、疾患、例えば慢性炎症、代謝疾患、特に糖尿病、心臓血管疾患、腫瘍、特に癌腫、乳癌、肉腫、神経内分泌腫瘍、血液関連腫瘍、リンパ腫、奇形腫あるいは脳腫瘍、例えば神経膠芽腫または星状細胞腫に関連する細胞または組織を指す。試料は、組織培養中に置かれたかまたは組織培養に順応した細胞であってもよい。試料はまた、体液、例えば血漿、リンパ液(lymphe)、血液、尿、唾液、血清、脳脊髄液、精漿、膵液、母乳、または肺洗浄液であってもよい。試料はさらに、原核および真核種を含む任意の種、好ましくはヒト由来の細胞または組織、ならびにウイルス試料であってもよい。
【0055】
組織試料は、さらに分画または前選択された試料、望ましい場合、特定の細胞タイプを含有するかまたは特定の細胞タイプに関して濃縮されるように前選択されたかまたは分画された試料であってもよい。いくつかの既知の分画または前選択技術によって、試料を分画するかまたは前選択してもよい。
【0056】
試料はまた、上記の任意の抽出物であってもよい。該用語はまた、細胞または組織由来のタンパク質分画、例えば膜タンパク質、糖タンパク質、リン酸化タンパク質、アセチル化タンパク質、ユビキチン化タンパク質、他の修飾を含むタンパク質およびタンパク質複合体を含んでもよい。
【0057】
本明細書に記載しそして請求する方法、標準混合物および使用にしたがって、2つまたはそれより多い異なる細胞集団を混合するか、あるいは2つまたはそれより多い異なる細胞集団由来の抽出物を混合すると、定量化正確性が予想外に改善されることが、本発明者らによって見出された。
【0058】
これは特に、分析しようとする試料に「マッチする」よう意図された標準混合物を用いる状況に当てはまる。例えば、腫瘍組織由来の試料に含有される生体分子を定量化することが望ましい場合、本発明にしたがって、マッチする標準混合物、すなわち、例えば対応する健康な組織由来の同じ細胞タイプの細胞を場合によって補充した、腫瘍組織、または腫瘍組織内の細胞の特定の集団と、同じ細胞タイプに属するか、または同じ細胞タイプに由来する、異なる細胞株セット由来の細胞からの抽出を通じて得られた標準混合物を選択することが好ましい。少なくとも2つの異なる細胞から標準混合物を得ると、標準混合物を単一細胞からのみ得た状況に比較して、試料中に含まれる生体分子、例えば腫瘍組織中に含まれるタンパク質のより広いカバーが可能になる。
【0059】
やはり意図されるのは、異なる組織で見られるタンパク質の定量化、例えば異なる組織の「段階分け」または「分子性質決定」に使用するためにあつらえられた標準混合物である。例えば、1つの側面において、抽出のために選択された異なる細胞集団の選択のため、腫瘍発達の所定の段階、または腫瘍発達の多様な段階を代表する、腫瘍細胞株の異なるセットから得られる標準混合物を調製してもよい。この標準混合物を用いて、マッチした腫瘍試料を定量化することによって、数時間以内に、多様な腫瘍マーカーに関して、腫瘍組織の正確な「段階分け」を行うことが可能である。これは、新鮮な腫瘍標本に対して、外科手術中に行うことも可能である。
【0060】
例えば、上皮細胞由来の多様な細胞株を、乳癌、前立腺癌、肺癌および結腸癌組織などの癌腫組織中の生体分子を定量化するのに適した標準混合物の調製に用いてもよいし;造血(血液形成)細胞由来の細胞株を、リンパ腫および白血病試料中の生体分子を定量化するのに適した標準混合物の調製に用いてもよいし;あるいは間葉系細胞由来の異なる細胞株を、肉腫組織中の生体分子を定量化するのに適した標準混合物の調製に用いてもよい。
【0061】
これに関連して、性質決定しようとする腫瘍に対応する健康な組織から得られるか、あるいは、培養および場合によって形質転換または不死化を通じてこうした細胞から得られる、抽出のための少なくとも1つの細胞集団を含むこともまた好適である。
【0062】
本発明の関連において、本発明者らは、乳癌細胞株HCC1599をSILAC標識し、そして浸潤性腺管癌、グレードIIの患者由来の乳癌組織の溶解物と該溶解物を混合した。生じたタンパク質混合物を、FASPプロトコル(J.R. Wisniewski, A. Zougman, N. Nagarajら, Nature methods 6 (5), 359 (2009))にしたがって消化し、そしてStageTip形式で、陰イオン交換クロマトグラフィーによって、ペプチドを6つの分画に分離した(J.R. Wisniewski, A. Zougman,およびM Mann, 投稿済 (2009))。高解像度定量的質量分析と組み合わせたオンライン逆相クロマトグラフィーによって、各分画を分析した(図1A、ならびに実施例4および5)。4438のタンパク質を3つ組分析によって定量化したが、比の分布は広くそして二峰性であり、細胞株に比較して、腫瘍において、発現が4倍より高いタンパク質が755個含有された(図1C)。したがって、単一細胞株のプロテオームは、腫瘍プロテオームを適切に代表せず、そしてしたがって正確な定量化に使用することは不可能である。次に、起源、段階、ならびにエストロゲン受容体およびErbB2発現が異なる4つの乳癌細胞株を選択した。正常な乳腺上皮細胞タイプをSILAC混合物に添加すると、定量的正確性が増加した。SILAC細胞株の上位集合(superset)であるため、この混合物をSUPER-SILACと名付け、これは正確に組織を代表する。
【0063】
標準混合物が組織を正確に代表するかどうかの決定は、例えば、参照生体分子および前記試料中の生体分子の量の比を決定することによって実行可能である。これらの比が1により近ければ、標準混合物は組織により似ており、そしてその結果、定量化はより正確である。例えば、標準混合物中の生体分子の大部分の量(例えば50%より多く)が前記試料中の生体分子の量と2倍より少なく異なる場合、標準混合物は、正確な参照と見なされうる。このアプローチは、本明細書に開示する実施例で用いられている。正確な組織代表のこうした基準を用いて、5つの細胞株の例示的な標準混合物の優れた性能が定量化されてきている。
【0064】
組織を正確に代表する標準混合物を設計するためのさらなるアプローチは、候補細胞集団ならびに組織各々を別個に分析することである。こうした分析を質量分析によって行ってもよい。この比較は、標準混合物が組織を正確に代表するのに必要な組織および細胞集団の組み合わせに類似である細胞株を強調しうる。
【0065】
単一の細胞株ではなく、複数の細胞株の標識混合物を腫瘍に添加すると、3つ組分析で同じ深度が達成されるが、定量化正確性が劇的に改善される(図1B、D)。分布は、ここで、一峰性となり、そして定量化されたタンパク質の90%が、腫瘍およびSUPER-SILAC混合物の間の4倍の比以内にあった(4286タンパク質群のうち3837)。さらに、定量的分布ははるかにより狭く、癌およびSUPER-SILAC混合物中のタンパク質の76%が2倍以下の相違であった。単一分析を同じ腫瘍の3つ組と比較すると、0.97の相関が見出され、プロテオームの90%が1.5倍以内の同じ比を生じた(図2A)。高い定量化正確性は、すべてのタンパク質が、多数のMSスキャンを通じて、そして多数のペプチドを通じて、数回定量化される事実に起因しうる。タンパク質あたりのこれらの多数の定量化事象は、単一の3分析においてさえ、高い正確性を導く。3つの複製物の比較によって、非常に低い変動係数(CV)が明らかになり、平均値は4%であった(図2B)。したがって、数千のタンパク質が数パーセントの誤差で定量化可能であり、これは、今日の臨床実施において用いられる方法よりもはるかにより正確である。
【0066】
また、本発明にしたがった標準混合物を、試料中の生体分子の絶対定量化に用いてもよい。試料中の個々の生体分子の量の概算を達成するため、シグナル強度に基づいて、試料中の他の生体分子に比較した各生体分子の存在量を計算可能である。装置に注入される生体分子の絶対量がわかっていることを考慮すると、試料中の各生体分子の絶対量を概算することが可能である。関心対象の生体分子のより正確な測定値を得るため、本発明にしたがった標準混合物中の参照生体分子を、既知の量の生体分子とともに分析して、そしてそれらの量を比較することが可能である。標準を用いた絶対的定量化を、試料ではなく、本発明の標準混合物に対して行ってもよい。この分析はまた、遡及的に行ってもよい。本発明の標準混合物中の参照生体分子の量がわかっているため、すべての試料中のすべての生体分子の自動的な絶対的定量化が可能になる。同様に、本発明の標準混合物に対してのみ、生体分子(標準を含まない)の絶対量の概算を実行可能であり、そして試料中の生体分子の量をそこから外挿可能である。したがって、試料中の1つまたは複数の生体分子の絶対的定量化のために方法を用いる場合、標準混合物中の1つまたは複数の参照生体分子の量をあらかじめ決定する。当業者には、前記標準混合物中の前記の1つまたは前記の複数の参照生体分子の量を、前記試料中の前記の1つまたは前記の複数の生体分子の量を決定する前に決定しても、またはその後に決定してもよいことが認識されるであろう。
【0067】
本発明の方法はさらに、組織試料中のタンパク質修飾の同定および定量化を可能にする。本発明にしたがった標準混合物は、ペプチドなどの数千の生体分子を含有してもよく、その中に修飾ペプチド(例えばリン酸化ペプチド、アセチル化ペプチド等)を含有してもよい。プロテオーム分析と同じ方式で、標準混合物中のこうした修飾ペプチドは、組織中の修飾ペプチドの定量化を可能にしうる。濃縮を伴いまたは伴わずに修飾ペプチドを同定してもよい。単純な場合、濃縮を伴わず、質量分析を定期的に行い、そしてバイオインフォマティクス分析は、修飾ペプチドのオプションを考慮する。後者の場合、標準混合物を組織と混合し、そして混合物に対して濃縮工程を行う。
【0068】
前記の1つまたは前記の複数の生体分子、および前記の1つまたは前記の複数の参照生体分子の量は、好ましくは質量分析によって決定される。好ましくは、比較工程は、前記の1つまたは前記の複数の生体分子の単数または複数のピーク、および前記の1つまたは前記の複数の参照生体分子の対応する単数または複数のピーク間の強度の比を決定する工程を含む。例えば、前記参照生体分子のシグナルを統合する前に、前記の生体分子のシグナルをまず統合し、そして次いで、一方のシグナルを他方によって割るか、またはその逆を行うことにより、比を決定する工程によって、比を得てもよい。
【0069】
前記決定は、特に質量分析を用いる関連において、酵素消化を含むことがさらに理解される。前記酵素消化に適した酵素にはトリプシンが含まれる。
試料中の生体分子、例えばポリペプチドを同定し、そして/または定量化するため、本発明の方法において、多様な質量分析系を使用してもよい。高い質量正確性、高い感度および高い解像度を持つ質量分析装置には、限定されるわけではないが、マトリックス支援レーザー脱離飛行時間型(MALDI-TOF)質量分析装置、エレクトロスプレーイオン化飛行時間型(ESI-TOF)質量分析装置、フーリエ変換イオンサイクロトロン質量分析装置(FT-ICR-MS)、およびOrbitrap分析装置が含まれる。MSの他の様式には、イオントラップおよび三重四極子質量分析装置が含まれる。イオントラップMSにおいて、分析物を、エレクトロスプレーイオン化またはMALDIによってイオン化し、そして次いで、イオントラップ内に入れる。次いで、イオントラップからの選択的放出に際して、トラップされたイオンをMSによって別個に分析してもよい。また、イオントラップを上述の質量分析装置の他のタイプと組み合わせてもよい。
【0070】
また、断片を生成し、そして分析してもよい。ICATまたはVICATまたはiTRAQ型試薬、あるいはSILAC標識ペプチドで標識した参照生体分子を、例えばMALDI-TOFまたはESI-TOFを用いた単一段階質量分析によって、あるいは単一Orbitrap分析装置系によって、分析してもよい。質量分析の方法は、当業者に周知である(例えば、Yates, J. Mass Spect. 33: 1-19 (1998);KinterおよびSherman, Protein Sequencing and Identification Using Tandem Mass Spectrometry, John Wiley & Sons, New York (2000);AebersoldおよびGoodlett, Chem. Rev. 101: 269-295 (2001);Griffinら, Curr. Opin. Biotechnol. 12: 607-612 (2001)を参照されたい)。
【0071】
高解像度ペプチド断片分離のため、分離法としてキャピラリー逆相クロマトグラフィーを利用する液体クロマトグラフィーESI-MS/MSまたは自動化LC-MS/MSを用いてもよい(Yatesら, Methods Mol. Biol. 112: 553-569 (1999))。動的排除を伴うデータ依存性衝突誘発解離(CID)もまた、質量分析法として使用可能である(Goodlettら, Anal. Chem. 72: 1112-1118 (2000))。
【0072】
試料、例えば組織中の生体分子の、本発明にしたがった標準混合物を用いた質量分析はターゲティング化可能であり、そして感度を例えば10〜100倍またはそれより多く増加させるため、SIM-スキャン(単一イオンモニタリング)を含んでもよい。先の態様は、すべて、ペプチドの非ターゲティング化分析を扱うが、関心対象の1つまたは複数の生体分子、例えば関心対象のペプチドをあらかじめ決定して、そしてこれらに対して分析をターゲティング化することも可能である。新規アルゴリズムは、「マスター実行」および実験実行間をリアルタイムでマッチング可能であり、そしてターゲットとされる生体分子(単数または複数)を同定することも可能である。生体分子(単数または複数)が見出されたら、SIMスキャンを行ってもよい。SIM-スキャンにおいて、特定の質量ウィンドウのみが選択的に集積され、それによって、感度が劇的に増加する。ターゲットとされる生体分子は、本発明にしたがった標準混合物で検出されれば十分であり、そして次いで、増加した感度で、試料中でもまたモニタリングされることが認識されるであろう。SIMスキャンを用いると、試料中に非常にわずかである生体分子に関してさえ、正確な定量化が達成可能である。さらに、試料中の生体分子を定量化する前に、標準混合物の徹底的な性質決定を行うと、試料中の1つまたは複数の生体分子、例えば生体分子、例えばペプチドの完全補完物が質量スペクトルで検出されない場合であっても、ターゲティング化することも可能である。これは、関心対象の生体分子、例えば関心対象のペプチドのクロマトグラフィー溶出時間が先に決定されているため、可能である。さらに、標準混合物中の他の生体分子のクロマトグラフィー溶出時間を用いて、測定中に、関心対象の生体分子(単数または複数)の溶出時間を正確に概算することも可能である。
【0073】
当業者には、同じ方式で、当該技術分野に知られる単一または多数反応モニタリング(SRMまたはMRM)技術(例えば、Picotti, P., Bodenmiller, B., Mueller, L.N., Domon, B.,およびAebersold, R. (2009): Full dynamic range proteome analysis of S. cerevisiae by targeted proteomics. Cell 138, 795-806を参照されたい)によるターゲティング化分析を用いて、測定の感度を増加させることも可能であることが認識されるであろう。狭い質量範囲をモニタリングする代わりに、前駆体から特定の断片への特定の遷移をモニタリングする。
【0074】
本発明の方法は、さらに、前記試料中の前記生体分子の配列決定を含んでもよい。しかし、配列決定能を伴わない質量分析装置(例えばThermo Fisher ScientificのExactive質量分析装置)を用いて、試料中の生体分子の定量化のためにもまた標準混合物を使用可能であることが本発明の利点の1つである。この場合、本発明にしたがった標準混合物中の参照生体分子をまず、「配列決定」質量分析装置(例えばThermo Fisher ScientificのLTQ-Orbitrap Velos)を用いて、徹底的に分析してもよい。こうした分析の結果によって、標準混合物中のすべての参照生体分子、例えばすべてのペプチドのデータベースが生成される。次の工程において、実行間をマッチングすることによって、多数の試料を分析することも可能である。アルゴリズムによって、参照生体分子、例えばペプチドの保持時間および正確な質量(ppmまたはppm以下の質量正確性に基づく)に基づいて、2つのタイプの装置由来の実行間をマッチさせる。本発明にしたがった標準混合物の参照生体分子に、これらの各々を比較することによって、各試料由来の1つまたは複数の生体分子、例えばペプチドを定量化する一方、生体分子、例えばペプチドの同一性を、本発明にしたがった標準混合物の徹底的な分析から得る。試料中の生体分子全体、例えばプロテオームを高い比率で同定するためには、本発明にしたがった標準混合物を、前分画および分離によって可能な限り徹底的に分析すべきである。
【0075】
上記から認識されるであろうように、本発明の方法は、例えば疾患、例えば腫瘍疾患または遺伝疾患に関連する生体分子の検出および定量化に適用可能である。こうしたものとして、異常に発現されるポリペプチドに対応する参照生体分子を含む本発明の標準混合物を含むことによって、本発明の方法を用いて、ポリペプチドの異常な発現と関連することが知られる疾患を分析してもよい。
【0076】
本発明の試薬および方法はまた、多様な疾患を診断し、そしてその予後を決定するのにも適用可能である。例えば、膜タンパク質が濃縮された標準混合物を生成して、組織中の膜タンパク質の定量化を可能にしてもよい。こうした分析は、薬剤ターゲットおよび診断マーカーの開発に非常に重要でありうる。
【0077】
本発明の方法は、疾患、例えば腫瘍または他の疾患の診断に特に有用である。例えば、該方法を用いて、疾患を診断することも可能であり、例えばジストロフィンの発現減少を測定することによって、デュシェンヌ型筋ジストロフィーまたはベッカー型筋ジストロフィーを含む筋ジストロフィーを診断することも可能である。同様に、本発明の方法を用いて、前立腺癌の診断のため、前立腺関連タンパク質の発現を定量化することも可能である。また、本発明の方法を用いて、肺癌、結腸癌、肝臓癌、卵巣癌、乳癌、脳癌または他の癌などの他の癌のマーカーを同定し、そして/またはこうした癌を診断することも可能である。
【0078】
当業者は、本発明の方法が、これらの疾患、および1つまたは複数のポリペプチドの異常な発現に関連する他の疾患に適用可能であることを容易に認識するであろう。
当業者はさらに、疾患と関連することが知られるマーカーおよび関連がまだ知られていないマーカーの分析に、本発明の方法を容易に適用可能である。
【0079】
本発明の方法はまた、疾患の診断または予後徴候となるタンパク質発現パターンの検出および定量化にも適用可能である。該方法を、生検によって探査される体の組織における診断適用に用いることも可能である。該方法はまた、血液、血清または血漿、脳脊髄液、尿、唾液、精漿、膵液、母乳、肺洗浄液等の体液において使用可能である。該方法を用いて、同じ分析において、多数の生体分子を分析し、そして定量化することも可能であるため、同じ分析における多数の生体分子を分析する能力によって、1つの診断マーカー単独の分析ではなく、多数の生体分子を、用いようとする診断適用に相関させることが可能になることから、該方法は、特に診断適用に有用である。したがって、該方法を、例えば疾患と関連する多数の診断マーカーの分析に適用してもよい。診断マーカーセットがひとたび同定されたら、本発明の方法を適用して、単一の診断マーカー単独の分析よりも情報が多いと予期される分析のためのマーカーセットを定量化することも可能である。
【0080】
本発明の方法を用いると、特定の疾患に罹患したか罹患する可能性がある個人の組織または体液および本発明の標準混合物の直接比較定量的タンパク質プロファイリングによって、タンパク質発現の診断パターンを決定することも可能である。
【0081】
さらに、キナーゼは、悪性プロセスにおける基本的タンパク質であるが、しばしば、プロテオーム研究において検出されない。これらの低い存在量にもかかわらず、本発明者らは、100を超えるプロテインキナーゼを同定し、そしてその大部分を非常に正確に定量化した(CV中央値6%、表2)。これらのキナーゼのうち、ErbB2、EGFR、AKT、PAK1、2、ならびにMAPKカスケードの9つのメンバーが定量化されており、これらはすべて悪性の中核を成す経路を代表する。このプロテオームが乳癌化学療法への感受性と関連付けられている、定量化されたタンパク質を含有するかどうかを調べた。最近の概説は、多様な癌における化学感受性および薬剤耐性に関与することが以前示唆された80の因子を列挙し、このうち18が乳癌において調べられた(I. Sekine, C. Shimizu, K. Nishioら, International journal of clinical oncology/ Japan Society of Clinical Oncology 14 (2), 112 (2009))。この分析によって、このリストのうち少なくとも50のタンパク質が、調べた腫瘍において発現されることが示され、このうち38が正確に定量化された(CV中央値3.5%;表3)。図2Dは、複製測定におけるこれらのタンパク質5つの定量化の正確さを示し、受容体状態(ERBB2)、DNA巻き戻しタンパク質トポイソメラーゼ2(TOP2A)の発現レベル、薬剤排出因子(MVP)の上方制御、およびアポトーシスに対する耐性(BCLXおよびAKT2)に関する情報を提供する。トラスツズマブ(ハーセプチンTM)のターゲットであるErbB2は、本発明の標準混合物に比較して、腫瘍においてはるかにより少なくしか発現されていないが、23のペプチドを用いてこれを定量化した(0.08±0.006)。DNA巻き戻しタンパク質TOP2Aは、エトポシドおよびドキソルビシンなどの4つの化学療法剤のターゲットであり、腫瘍において、2.20±0.04倍、高く発現された(30のペプチドから定量化)。免疫組織化学法は、現在、所定の患者試料において、最大で、これらのマーカーのうちのいくつかの存在または非存在を評価することが可能である。対照的に、本発明の標準混合物を臨床研究において適用すると、多数の癌関連タンパク質を同時に定量化することが可能になる。
【0082】
上記測定は、6つのペプチド分画および単一のまたは3つ組の測定を用い、それぞれ、1〜3日の分析時間を要する。本発明者らは次に、ペプチド分画いずれかを省くことによって、方法をさらに合理化可能であるかどうかを調べた。より高い配列決定速度を持つ新世代orbitrap質量分析装置(LTQ-Orbitrap Velos)を用いて、そして総ペプチド消化物をクロマトグラフィーカラム上に直接装填した。本発明者らは、この単純な方法を用いて、3つ組実行において、2100を超えるタンパク質を同定し、そしてこのうちほぼ1500を定量化することが可能であった。SILACは、全細胞プロテオームを均質に標識するため、定量的正確性は、含まれるプロテオームの深度からは独立である。実際、より少ないプロテオームしか含まれなくても、比の分布は変わらず、定量化正確性も変わらなかった(Pearson相関係数0.97;図3)。
【0083】
含まれるプロテオームが多く、そして定量化が正確であることに加えて、組織定量化のための内部標準として、本発明の標準混合物を使用する別の利点は、コストが低いことである。標準的な15cmサイズの細胞培養プレートは、約20〜120の3つ組分析用の混合物を提供する(分画に応じる)。したがって、分析あたりの試薬コストは、必要なSILACアミノ酸も含めて、わずか数セントである(表4)。本発明の標準混合物を、数千の試料に十分なバッチモードで産生し、そして単一または3つ組分析に適した密封アリコット中、SDS緩衝液中に分配してもよい。これは、例えば細胞溶解物が、抗体をチェックするためにすでに分配されている方式と非常に類似であり、そしていかなるロジスティック上の困難も生じない。臨床化学実験室において、試料調製は、本発明の標準混合物と組織溶解物を組み合わせることのみからなり、その後、標準的質量分析が続く。本発明の標準混合物は、腫瘍タイプまたは治療反応と相関させるため、そして新規腫瘍マーカーを発見するための臨床研究において、数千の生体分子レベル、そして特にタンパク質の正確な決定を可能にする。本発明の標準混合物はまた、治療決定の基礎として、診療所における生検のシステム全体の性質決定にルーチンに適用可能である。本発明の標準混合物および方法は、同様に、他の腫瘍、疾患または組織に関連する生体分子の定量化に適している。
【0084】
上記を考慮して、本発明が以下の項目を含むことが認識されるであろう:
1.試料中の1つまたは複数の生体分子を定量化するための方法であって
前記試料中の前記の1つまたは前記の複数の生体分子の量を決定し;そして標準混合物中の複数の生体分子の中の1つまたは複数の参照生体分子の量に対して、該量を比較する工程を含み、前記の複数の生体分子が、少なくとも2つの異なる細胞集団からの抽出によって得られており;
前記の1つまたは前記の複数の参照生体分子が、前記の1つまたは前記の複数の生体分子の標識型である、前記方法。
【0085】
2.前記試料中の前記の1つまたは前記の複数の生体分子の前記量を、前記標準混合物と前記試料を混合した後に決定する、項目1の方法。
3.前記の1つまたは前記の複数の生体分子、および前記の1つまたは前記の複数の参照生体分子の量を、質量分析によって決定する、項目1または2の方法。
【0086】
4.前記の標準混合物中の前記の1つまたは前記の複数の参照生体分子が前選択され、そして質量分析が、単一または複数イオンモニタリングにより、これらをターゲットとする、項目3の方法。
【0087】
5.前記試料中の前記生体分子の配列決定をさらに含む、先行する項目いずれか1つの方法。
6.前記比較工程が、前記の1つまたは前記の複数の生体分子の単数または複数のピーク、および前記の1つまたは前記の複数の参照生体分子の対応する単数または複数のピーク間の強度比を決定する工程を含む、項目3〜5のいずれか一項の方法。
【0088】
7.前記の1つまたは前記の複数の生体分子の前記量が絶対量である、先行する項目のいずれか一項の方法。
8.前記標準混合物中の前記の1つまたは前記の複数の参照生体分子の量をあらかじめ決定する、項目7の方法。
【0089】
9.前記標準混合物中の前記の1つまたは前記の複数の参照生体分子の量を、前記試料中の前記の1つまたは前記の複数の生体分子の量を決定する前に、あらかじめ決定する、項目8の方法。
【0090】
10.前記標準混合物中の前記の1つまたは前記の複数の参照生体分子の量を、前記試料中の前記の1つまたは前記の複数の生体分子の量を決定した後に、あらかじめ決定する、項目8の方法。
【0091】
11.試料中の1つまたは複数の生体分子を定量化するための標準混合物であって、少なくとも2つの異なる細胞集団からの抽出を通じて得られている複数の生体分子の中に、1つまたは複数の参照生体分子を含む、前記混合物。
【0092】
12.試料中の1つまたは複数の生体分子を定量化するための標準混合物を調製するための方法であって
少なくとも2つの異なる細胞集団から、1つまたは複数の参照生体分子を含む複数の生体分子を抽出する
工程を含む、前記方法。
【0093】
13.試料中の1つまたは複数の生体分子を定量化するための標準混合物の使用であって、前記標準混合物が
複数の生体分子の中に1つまたは複数の参照生体分子を含み、前記の複数の生体分子が、少なくとも2つの異なる細胞集団からの抽出を通じて得られている
前記使用。
【0094】
14.前記の少なくとも2つの異なる細胞集団が、互いに、細胞形態、少なくとも1つの生体分子の発現プロファイル、好ましくは複数の生体分子の発現プロファイル、および/または分化状態に関して異なる、項目1〜10または12のいずれか一項の方法、項目11の標準混合物、あるいは項目13の使用。
【0095】
15.前記の少なくとも2つの異なる細胞集団が
(i)異なる細胞タイプの細胞、例えば異なる細胞タイプの初代細胞または異なる細胞タイプの細胞株の細胞;
(ii)同じ細胞タイプの細胞、例えば同じ細胞タイプの初代細胞または同じ細胞タイプの細胞株の細胞;
(iii)異なる細胞株由来の細胞;
(iv)同じ細胞株由来の細胞;
(v)異なる細胞系譜の細胞;
(vi)同じ細胞系譜の細胞;
(vii)異なる細胞培養由来の細胞であって、培養が異なる培養条件に供されている、前記細胞;または
(viii)同じ細胞培養由来の細胞であって、培養中の細胞が同じ培養条件に供されている、前記細胞
の集団である、項目1〜10、12または14のいずれか一項の方法、項目11または14の標準混合物、あるいは項目13または14の使用。
【0096】
16.それぞれ、項目(i)および(ii)にしたがった同じまたは異なる細胞タイプが、内分泌系の細胞タイプ、すなわち甲状腺上皮細胞、傍濾胞細胞、副甲状腺主細胞、好酸性細胞、クロム親和性細胞、松果体細胞;神経系の細胞タイプ、すなわち星状細胞、オリゴデンドロサイト、ミクログリア、ニューロン、シュワン細胞;ならびに他の細胞タイプ、例えば上皮細胞、線維芽細胞、骨芽細胞、骨細胞、破骨細胞、軟骨芽細胞、軟骨細胞、ケラチノサイト、メラニン形成細胞、筋細胞、脂肪細胞、肝細胞、B細胞、T細胞、ナチュラルキラー細胞、好塩基球顆粒球、好酸球顆粒球、好中球顆粒球、単球、マクロファージ、マスト細胞、および樹状細胞、多能性幹細胞、ならびに全能性幹細胞より選択される、項目15の方法、標準混合物、または使用。
【0097】
17.それぞれ、項目(i)および(ii)にしたがった同じまたは異なる初代細胞が、初代血液細胞、初代リンパ球、初代ニューロン、初代グリア細胞、初代上皮細胞、初代線維芽細胞、初代肝細胞、初代筋細胞、初代多能性または全能性幹細胞、および初代心筋細胞より選択される、項目15の方法、標準混合物、または使用。
【0098】
18.それぞれ、項目(i)、(ii)、(iii)および(iv)にしたがった同じまたは異なる細胞株が、腫瘍細胞株である、項目15の方法、標準混合物、または使用。
19.それぞれ、項目(i)、(ii)、(iii)および(iv)にしたがった同じまたは異なる細胞株が、癌腫細胞株、肉腫細胞株、リンパ腫細胞株、白血病細胞株、生殖細胞腫瘍細胞株、および芽腫細胞株より選択される、項目18の方法、標準混合物、または使用。
【0099】
20.それぞれ、項目(i)、(ii)、(iii)および(iv)にしたがった同じまたは異なる細胞株が、乳癌組織由来の細胞株、例えばHCC-1143、HCC-1599、HCC-1937、HCC2218、MCF7、HDQ-P1、BT-474、CAL-120、またはDU-4475;腎癌組織由来の細胞株、例えばBFTC-900、CAKI-2、CAL-54;結腸癌組織由来の細胞株、例えばCL-40、DLD-1、HCT-116、SW-403、SW480;肺癌組織由来の細胞株、例えばNCI-H1395、NCI-H1437、NCI-H2009、NCI-H2087、NCI-H2122、NCI-H2126、NCI-H1770、NCI-H82、NCI-H209、NCI-H2171、A-549、DLKP;ならびに前立腺癌由来の細胞株、例えばLNCaP、PC-3、およびDU-145より選択される、項目18の方法、標準混合物、または使用。
【0100】
21.それぞれ、項目(v)および(vi)にしたがった同じまたは異なる細胞系譜が、線維芽細胞、内皮細胞、上皮細胞、骨髄系細胞、リンパ球系細胞、白血球、ケラチノサイト、骨芽細胞、または破骨細胞、ニューロン、間質細胞、甲状腺細胞、心筋細胞、肺細胞、および肝細胞の系譜より選択される、項目15の方法、標準混合物、または使用。
【0101】
22.それぞれ、項目(vii)および(viii)にしたがった同じまたは異なる培養条件が、培養温度、培養大気、培地、継代数、細胞密度、および/または用いる基質に関して同じかまたは異なる、項目15の方法、標準混合物、または使用。
【0102】
23.前記試料が
細胞、例えば腫瘍細胞、例えば血液関連腫瘍細胞;
全組織または組織の選択された部分;
健康な組織;
疾患、例えば慢性炎症、代謝疾患、特に糖尿病、心臓血管疾患に関連する組織、腫瘍組織、例えば乳癌組織、他の癌腫組織、肉腫組織、神経内分泌腫瘍組織、血液関連腫瘍組織、リンパ腫組織、および奇形腫組織;
細胞または組織の細胞内区画、例えばミトコンドリアまたは細胞核;
体液;
上記の抽出物;ならびに
上記から選択されるタンパク質分画、例えば濃縮膜タンパク質、糖タンパク質、リン酸化タンパク質、アセチル化タンパク質、ユビキチン化タンパク質、他の修飾を伴うタンパク質、およびタンパク質複合体
からなる試料群より選択される
先行する項目いずれか一項の方法、標準混合物、または使用。
【0103】
24.前記試料が、疾患または病理学的に変化した組織、特に腫瘍組織由来の試料であり、そして前記の少なくとも2つの異なる細胞集団の少なくとも1つそして好ましくは少なくともすべてが、細胞系譜および/または細胞タイプに関して、前記組織中の疾患または病理学的に変化した細胞に対応する、先行する項目いずれか一項の方法、標準混合物、または使用。
【0104】
25.前記の少なくとも2つの異なる細胞集団の少なくとも1つが、対応する健康な組織から得られた細胞集団であるか、あるいは、培養および場合によって形質転換または不死化を通じてこうした細胞から得られる、項目24の方法、標準混合物、または使用。
【0105】
26.前記の複数の生体分子が、前記細胞集団の細胞内区画からの抽出を通じて得られている生体分子であるか、あるいは濃縮膜タンパク質、糖タンパク質、リン酸化タンパク質、ペプチド、またはその分画である、先行する項目いずれかの方法、標準混合物、または使用。
【0106】
27.前記の複数の生体分子が、少なくとも2つの異なる細胞集団の混合物からの抽出を通じて得られている、先行する項目いずれかの方法、標準混合物、または使用。
28.少なくとも2つの異なる細胞集団の前記混合物が、各細胞集団の細胞を実質的に等しい数、含有する、項目27の方法、標準混合物、または使用。
【0107】
29.前記の複数の生体分子が、少なくとも2つの異なる細胞集団から得られる抽出物を混合することを通じて得られている、先行する項目いずれかの方法、標準混合物、または使用。
【0108】
30.各細胞集団の抽出物が、前記の複数の生体分子の総量(w/v)または前記標準混合物の体積に実質的に等しく寄与する方式で、前記混合が行われる、項目29の方法、標準混合物、または使用。
【0109】
31.前記の少なくとも2つの異なる細胞集団が、3またはそれより多い異なる細胞集団、4またはそれより多い異なる細胞集団、5またはそれより多い異なる細胞集団、6またはそれより多い異なる細胞集団、あるいは10またはそれより多い異なる細胞集団である、先行する項目いずれかの方法、標準混合物、または使用。
【0110】
32.前記生体分子が、タンパク質、ペプチド、多糖、炭水化物、脂質、ならびにその類似体および断片からなる群より選択される、先行する項目いずれか一項の方法、標準混合物、または使用。
【0111】
33.前記生体分子がタンパク質またはペプチドである、先行する項目いずれか一項の方法、標準混合物、または使用。
34.前記の1つまたは前記の複数の参照生体分子が、同位体標識されている、好ましくは化学的または代謝的に同位体標識されている、そして最も好ましくは代謝的に同位体標識されている、先行する項目いずれか一項の方法、標準混合物、または使用。
【0112】
35.代謝的同位体標識が、細胞培養中のアミノ酸での安定同位体標識(SILAC)である、項目34の方法、標準混合物、または使用。
36.安定同位体が、2H、13C、15N、17O、18O、33P、34Sおよびその組み合わせからなる群より選択される、項目34または35の方法、標準混合物、または使用。
【0113】
以下の実施例は、本発明を例示するが限定しないことが意図されると認識されるであろう。本発明の精神および範囲から逸脱しない、前述の説明および実施例の多様な他の例および修飾は、開示を読んだ後、当業者に明らかであろうし、そしてこうした例または修飾はすべて、付随する請求項の範囲内に含まれると意図される。本明細書に言及するすべての刊行物および特許は、その全体が本明細書に援用される。
【実施例】
【0114】
実施例は本発明を例示する。
実施例1:組織ホモジナイズ
浸潤性腺管癌(グレードII)の凍結試料は、Piotr Ziolkowski博士(Department of Pathology, Wroclaw Medical University, Poland)の厚意によって提供された。インフォームドコンセントにしたがった試料の分析は、地方の倫理委員会によって認可された。凍結腫瘍組織(100mg)を、0.5ml緩衝液(100mM Tris-HCl pH 7.6、0.1M DTT)中、IKA Ultra Turbaxブレンダーを最高速度(25000rpm)、4℃で用いて、ホモジナイズした。次いで、SDSをホモジネートに添加して、最終濃度4%とした。溶解物を95℃で5分間インキュベーションし、そして次いで、短時間、超音波処理した。溶解物を14,000rpmで10分間遠心分離し、そして上清を以下の工程に用いた。
【0115】
実施例2:SILAC標識およびSILAC混合物の調製
ヒト乳腺上皮細胞(HMEC)をLonzaから得た。天然リジンおよびアルギニンが、重い同位体で標識されたアミノ酸、L-13C6 15N4-アルギニン(Arg10)およびL-13C6 15N2-リジン(Lys8)に置換されている、GibcoTM規定ケラチノサイト-SFM(Invitrogen)中で培養することによって、HMECをSILAC標識した。標識アミノ酸をCambridge Isotope Laboratories, Inc, USAより購入した。HCC1599、MCF7およびHCC1937を、German Collection of Microorganisms and Cell Cultures(DSMZ)より得た。HCC2218を、American Type Culture Collection(ATCC)より購入した。天然リジンおよびアルギニンがLys8およびArg10によって置換されており、そして透析血清を補充されているRPMI中で培養することによって、HCC1599、HCC2218およびHCC1937をSILAC標識した。天然アミノ酸の代わりにLys8およびArg10を含有し、そして10%透析血清を補充されているDMEM中でMCF7を増殖させた。SILAC培地中でおよそ8倍加に渡って細胞を培養して、完全標識に到達させた。HMEC、HCC1937およびMCF7細胞の溶解を、集密以下の培養に対して行った。懸濁中で増殖するHCC2218およびHCC1599を対数増殖状態で溶解した。溶解前にすべての細胞2をPBSで洗浄し、そして4%SDS、100mM Tris-HCl pH 7.6および100mM DTTを含有する緩衝液で溶解した。溶解物を95℃で5分間インキュベーションし、そして次いで、短時間、超音波処理した。295nmの励起波長を用いて、350nmでのトリプトファン蛍光発光によって、タンパク質濃度を決定した。トリプトファンを標準として用いて、8M尿素中で測定を行った。SUPER-SILAC混合物の調製のため、等量の溶解物各々を混合し、そして以下の工程で用いた。
【0116】
実施例3:フィルター補助試料調製(FASP)
腫瘍溶解物の等量のタンパク質およびSILAC混合物を合わせ、そして0.1M Tris-HCl pH8.0中の8M尿素中で希釈した(およそ1:8)。試料をMicroconデバイスYM-30(Millipore)上に装填し、そして先に記載されるように(J.R. Wisniewski, A. Zougman, N. Nagarajら, Nature methods 6 (5), 359 (2009))、FASPプロトコルを行った。簡潔には、Microconデバイスを室温で15分間、14,000xgで遠心分離し、その後、尿素溶液で連続2回洗浄した。続いて、100μLの0.1M Tris-HCl、pH8.0中の8M尿素中の50mMヨードアセトアミドを溶解物に添加し、そして暗所で20分間インキュベーションした。インキュベーション後、デバイスを8M尿素で2回洗浄し、そして40mM重炭酸アンモニウムで2回洗浄した。トリプシンを1:50(μgトリプシン:μgタンパク質)の比で濃縮物に添加し、そして37℃で一晩インキュベーションした。遠心分離によって、フィルターからペプチドを収集し、そして40mM重炭酸アンモニウムで2回連続して洗浄した。280nmのUV吸光度でペプチド濃度を決定した。
【0117】
実施例4:強陰イオン交換(SAX)によるペプチド分画
陰イオン交換クロマトグラフィーによって、40μgのペプチドを分離した。200μlマイクロピペットチップ内に6層の3M Empore陰イオン交換ディスク(Varian、1214-5012)を積み重ねることによって、カラムを組み立てた。カラムをメタノールで活性化し、その後、1M NaOHで洗浄した。以下のpH値:11、8、6、5、4および2になるようにNaOHで滴定した、20mM酢酸、20mMリン酸、および20mMホウ酸で構成されたBritton&Robinson緩衝液中で、平衡化および溶出を行った。pH11のカラム上にペプチドを装填し、そして続いて、6つの異なるpH値の緩衝液で溶出させた。溶出したペプチドを、先に記載されるように(J. Rappsilber, Y. Ishihama,およびM. Mann, Analytical chemistry 75 (3), 663 (2003))stage-tipsに結合させた。緩衝液B(80%アセトニトリル、0.5%酢酸)を用いたLC-MS/MS前に、StageTipsからペプチドを溶出させた(J.V. Olsen, L.M. de Godoy, G. Liら, Mol Cell Proteomics 4 (12), 2010 (2005))。
【0118】
実施例5:LC-MS分析
StageTipsから溶出したペプチドを、ナノフローHPLC系(Proxeon Biosystems)を用いて、社内で作製した15cmカラム(内径75μm、3μm ReproSil-Pur C18-AQ媒体)上の逆相クロマトグラフィーによって分離した。HPLCを、オンラインでナノエレクトロスプレーイオン供給源(Proxeon Biosystems)を通じて、LTQ-Orbitrap質量分析装置(Thermo Scientific)に、またはLTQ-Orbitrap Velos質量分析装置(Thermo Scientific)に連結した。緩衝液A(0.5%酢酸)を用い、流速500nl/分でカラム上にペプチドを装填し、そして流速250nl/分で、190分の直線勾配で溶出させた。異なるpH値からの分画に関して、3つの異なる勾配を適用した。pH11およびpH8溶液で溶出した分画には、2〜30%緩衝液Bの勾配を適用した。pH6およびpH5溶液には5〜35%緩衝液Bを、そしてpH4およびpH2には、8〜37%緩衝液Bを適用した。直線勾配後、カラムを洗浄して90%緩衝液Bに到達させ、そして緩衝液Aで再平衡化した。LTQ-Orbitrap Velosと組み合わせたLC実行を、15cmカラム(内径75μm、1.9μm ReproSil-Pur C18-AQ媒体)で行った。5〜30%緩衝液Bの190分間の勾配を用いた。
【0119】
サーベイスキャンおよびタンデム質量スペクトル(MS/MS)獲得間のデータ依存性自動スイッチを適用して、陽イオンモードで質量スペクトルを獲得した。LTQ-Orbitrap測定では「上位5」法で、そしてLTQ-Orbitrap Velos測定では「上位15」で、プロテオーム試料を分析し、m/z 300〜2000の質量範囲で1回のOrbitrapサーベイスキャンを獲得し、その後、LTQにおいて5つの最も強いイオンのMS/MSを獲得した。Orbitrapのターゲット値は、前駆体イオン3の質量正確性を改善するための再較正のため、ロック質量(lock masses)を用いて、m/z 400、60,000の解像度で、サーベイスキャンに関して1,000,000であった。5,000イオンのターゲット値を用いて、衝突誘発解離によって、LTQにおける断片化を行った。イオン選択閾値は1000カウントであった。
【0120】
実施例6:データ分析
LTQ-OrbitrapおよびLTQ-Orbitrap Velos由来の生MSファイルを、MaxQuantによって分析した(J. CoxおよびM. Mann, Nature biotechnology 26 (12), 1367 (2008))(バージョン1.0.13.12)。順方向および逆方向タンパク質配列の両方を含有するデコイIPI-ヒトデータベース、バージョン3.62に対して、MASCOT検索エンジン(バージョン2.2.04、Matrix Science)によって、MS/MSスペクトルを検索した(D.N. Perkins, D.J. Pappin, D.M. Creasyら, Electrophoresis 20 (18), 3551 (1999))。
【0121】
それぞれ7ppmおよび0.5Thの最大初期質量偏差で、親質量および断片イオンを検索した。検索には、メチオニン酸化およびN末端アセチル化、ならびにシステインカルバミドメチル化の固定修飾の多様な修飾が含まれた。最小6アミノ酸のペプチドおよび最大2つの切断欠損は分析を許された。ペプチドおよび4タンパク質同定に関しては、偽発見率(FDR)を0.01に設定した。2つのタンパク質の同定されたペプチドが2つのタンパク質(相同体またはアイソフォーム)によって共有された場合、2つのタンパク質は、MaxQuantによって1つのタンパク質群と報告された。ペプチド修飾の同定のため、検索には、ホスホ(STY)変動修飾が含まれた。
【0122】
実施例7:さらなるSILAC混合物の調製
本発明者らはまた、異なる腫瘍タイプに関するsuper-SILAC混合物を開発した。本発明者らは、神経膠芽腫および星状細胞腫に由来する5つの細胞株を組み合わせて、これらの腫瘍タイプの分析のための内部標準として利用した(表5)。本発明者らは、これを原形質性星状細胞腫(astrocytoma protoplasmaticum)の溶解物と混合し、そして結果を、単一標識星状細胞腫細胞株1321N1を含むものに比較した。この脳腫瘍において、本発明者らは、5,183タンパク質群を同定し、そしてそのうち4,318を定量化した。本発明者らの先の結果と同様に、super-SILAC混合物の比の分布は単一細胞株のものよりはるかに狭かった。定量化した脳腫瘍プロテオームの63%が、内部標準に対して非常に容易に定量化可能な2倍の比以内であり、これに対して単一細胞株に関しては48%であった(図4)。したがって、super-SILAC戦略は、広い腫瘍タイプに適用可能である。
【0123】
実施例8:インスリン刺激に対する肝臓ホスホプロテオーム反応の定量化
本発明者らは、リジン(Lys4)およびアルギニン(Arg6)の重量型で、マウス肝臓腫Hepa1-6細胞を代謝標識することによって、ホスホペプチド標準を生成した。細胞を2つの集団に分け、一方をインスリンで刺激して、標準におけるインスリン依存性リン酸化部位の適切な代表を達成した(図5a)。標識ホスホペプチドを化学的に合成するのに比較して、標準はいくつかの利点を有する。まず、これは、正確な定量化に望ましい量でおおよそ存在する、数万の標準ペプチドの経済的な生成を導くはずである。第二に、これは試料プロセシング初期に試料と標準を混合することを可能にし、プロテオミクス・ワークフロー中に導入される定量化誤差を回避する。
【0124】
本発明者らは、ホスホ-SILAC標準を、対照およびインスリン注射動物由来の肝臓組織溶解物内にスパイク処理した。本発明者らの標準混合物が、適切な存在量で肝臓試料のホスホペプチドの大部分を含有し、定量化可能な比を生じているかどうかを決定するため、本発明者らはSILAC比のヒストグラムを分析した。ホスホペプチドの比の分布は一峰性であり、肝臓および細胞株ホスホプロテオーム間で優れたマッチがあり、そして関心対象の試料由来の軽いホスホペプチドの大部分が、重い標識内部標準に対応物を有する(図5bおよび5c)。
【0125】
標準と肝臓試料の比較は、ペプチドの2つのSILAC型間の重量型対軽量型(H/L)比を生じる。内部標準はすべての試料に渡って同じであるため、インスリン処置および対照試料間の「比の比」は、ホスホペプチド存在量の直接比較を可能にする。インスリン処置およびPBS処置マウス間の「比の比」の分布は驚くほど狭く、定量化の正確性が高いことが立証された(図5d、e)。狭い分布はまた、大部分のリン酸化部位がインスリンに反応しては制御されないことも意味する。
【0126】
本発明者らは、インスリンシグナル伝達経路の既知の因子のほぼすべてにおいて、1またはそれより多いリン酸化部位を同定した(図6)。例には、重要なシグナル伝達仲介因子Irs1およびIrs2が含まれ、本発明者らはこれらに関して、インスリン刺激後のいくつかのセリン部位のリン酸化における2倍より多い変化を定量化した(表6a)。チロシンリン酸化とは対照的に、Irsタンパク質のセリン/スレオニンリン酸化は、インスリンシグナル伝達カスケードの阻害において関連付けられる。Irs1は徹底的に研究されてきたが、Irs2に対するセリンリン酸化に関してはほとんど知られていない。本発明者らのデータは、マウス肝臓において、Irs2に対するセリンリン酸化が、Irs1と同様に、長期インスリン刺激に対する経路の適用に関与する、阻害性フィードバック機構において、役割を果たしていることを示唆する。
【0127】
肝臓において、インスリンの代謝効果は、解糖、グリコーゲン合成および脂肪酸合成増加を導く。したがって、本発明者らは、Aktの下流ターゲットであるGsk3_のセリン9上でのリン酸化増加を観察した(表6b)。Gsk3_上のこのセリンのリン酸化はその阻害を導き、そしてその結果、グリコーゲンシンターゼの活性化を導く。クエン酸をアセチルCoAおよびオキサロ酢酸に変換する酵素であるATPクエン酸リアーゼのセリン455リン酸化は、2倍増加した(表6b)。Aktによるこの部位のリン酸化は、該酵素を活性化し、脂肪酸合成のためのアセチルCoAの供給増加を導くと考えられる。同様に、本発明者らは、「心臓アイソフォーム」として知られているが、肝臓を含む多くの組織で発現される、6-ホスホフルクト-2-キナーゼ/フルクトース-2,6-ビホスファターゼ(Pfkfb2)のより高いレベルのセリン469およびセリン486リン酸化(表6b)(ヒトにおいてはS466およびS483)を検出した。in vitroでのこのアイソフォームに対する研究は、これらのリン酸化部位が解糖の誘導に関与することを示した。インスリンシグナル伝達の重要なブランチは、mTORキナーゼによって仲介される。この経路の活性化を立証するように、本発明者らは、インスリン処置後、Akt1-基質1(PRAS40としてもまた知られる)のスレオニン247およびセリン184でのより高いリン酸化を検出した。このリン酸化事象は、mTORによって仲介され、そしてPRAS40をRaptorから解離させる。また、本発明者らのデータセットによって、以前は知られていなかったインスリンシグナル伝達およびmTOR複合体2(mTORC2)間の関連も示唆され、これは本発明者らが、mTORC2特異的サブユニットRictorのリン酸化増加を見出したためである。インスリンに反応したmTORシグナル伝達の中心的な機能と一致して、mTORキナーゼリン酸化はまた、以前には知られていなかった部位(S2478;表6a)でも上方制御されていた。
【0128】
さらに、本発明者らは、p70s6kのターゲットであるPdcd4の阻害性セリン76リン酸化の増加を検出した。Pdcd4は、翻訳開始因子eIF4Aに結合し、そしてしたがってeIF4Gへの相互作用を阻害することによって、翻訳を妨げる。Ser76上でのPdcd4のリン酸化はその分解を仲介し、この阻害を軽減し、そしてしたがってタンパク質翻訳を増進する。さらに、Ser457上でのPdcd4のリン酸化もまた増加する。Aktによって仲介されるこのリン酸化は、AP-1反応性プロモーターのリプレッサーとしてのPdcd4の機能を阻害し、AP-1転写ターゲットのインスリン依存性上方制御のための機構を提供する。
【0129】
AktおよびmTORシグナル伝達ブランチに加えて、インスリンシグナル伝達ネットワークは、その増殖効果を仲介するためにMAPKカスケードを用いる。AktおよびmTOR経路とは対照的に、本発明者らは、Erk1およびErk2の制御性スレオニンおよびチロシン部位のリン酸化レベルにいかなる変化も検出しなかった。これらのデータは、Erk1およびErk2がインスリン刺激の5〜10分後に一過性にリン酸化されるのみであることを示す先の報告と一致する。同様に、本発明者らは、インスリン刺激後、Raf1上の阻害性セリン233がより多くリン酸化されることを見出した(表6a)。Erk1およびErk2とは対照的に、しかしなお先の報告と一致して、Mapk14(p38a)リン酸化は、インスリン刺激された肝臓30でのみ検出された。本発明者らの大規模リン酸化データは、このように、インスリン受容体のシグナル伝達下流の複雑なパターンおよびクロストークを明らかにする。
【0130】
【表1−1】

【0131】
【表1−2】

【0132】
【表1−3】

【0133】
【表1−4】

【0134】
【表2−1】

【0135】
【表2−2】

【0136】
【表2−3】

【0137】
【表3】

【0138】
【表4】

【0139】
【表5】

【0140】
【表6】

【特許請求の範囲】
【請求項1】
試料における、1つまたは複数の第一の生体分子を定量化するための方法であって、
(a)少なくとも2つの異なる細胞集団混合物から、1つまたは複数の参照生体分子を含む、複数の第二の生体分子を抽出し、ここで前記の少なくとも2つの異なる細胞集団は
(i)異なる細胞タイプの細胞;
(ii)異なる細胞株由来の細胞;
(iii)異なる細胞系譜の細胞;または
(iv)培養が異なる培養条件に供されている、異なる細胞培養由来の細胞
の集団であり、
ここで、前記の1つまたは前記の複数の参照生体分子は、前記の1つまたは前記の複数の第一の生体分子の代謝的同位体標識型である
それによって標準混合物を得て;
(b)前記標準混合物を前記試料と混合し;
(c)前記試料中の前記の1つまたは前記の複数の第一の生体分子の量を決定し;そして
(d)前記標準混合物中の複数の第二の生体分子の中の1つまたは複数の参照生体分子の量に対して、該量を比較する
ここで、前記生体分子はタンパク質またはペプチドであり、そして前記の1つまたは前記の複数の第一の生体分子、および前記の1つまたは前記の複数の参照生体分子の量は、質量分析によって決定される
工程を含む、前記方法。
【請求項2】
前記標準混合物中の前記の1つまたは前記の複数の参照生体分子が前選択され、そして質量分析が、単一または複数イオンモニタリングにより、これらをターゲットとする、請求項1の方法。
【請求項3】
前記比較工程が、前記の1つまたは前記の複数の第一の生体分子の単数または複数のピーク、および前記の1つまたは前記の複数の参照生体分子の対応する単数または複数のピーク間の強度比を決定する工程を含む、請求項1または2の方法。
【請求項4】
試料中の1つまたは複数の第一の生体分子を定量化するための標準混合物を調製するための方法であって、
少なくとも2つの異なる細胞集団の混合物から、1つまたは複数の参照生体分子を含む複数の第二の生体分子を抽出する工程を含み、
前記の少なくとも2つの異なる細胞集団が、
(i)異なる細胞タイプの細胞;
(ii)異なる細胞株由来の細胞;
(iii)異なる細胞系譜の細胞;または
(iv)異なる細胞培養由来の細胞であって、培養が異なる培養条件に供されている、前記細胞
の集団であり、
前記の1つまたは前記の複数の参照生体分子が、前記の1つまたは前記の複数の第一の生体分子の代謝的同位体標識型であり、そして前記生体分子がタンパク質またはペプチドである
前記方法。
【請求項5】
前記の少なくとも2つの異なる細胞集団が、細胞形態、少なくとも1つの生体分子の発現プロファイル、好ましくは複数の生体分子の発現プロファイル、および/または分化状態に関して、互いに異なる、請求項1〜4のいずれか一項の方法。
【請求項6】
前記試料が
細胞、例えば腫瘍細胞、例えば血液関連腫瘍細胞;
全組織または組織の選択された部分;
健康な組織;
疾患、例えば慢性炎症、代謝疾患、特に糖尿病、心臓血管疾患に関連する組織、腫瘍組織、例えば乳癌組織、他の癌腫組織、肉腫組織、神経内分泌腫瘍組織、血液関連腫瘍組織、リンパ腫組織、および奇形腫組織;
細胞または組織の細胞内区画、例えばミトコンドリアまたは細胞核;
体液;
上記の抽出物;ならびに
上記から選択されるタンパク質分画、例えば濃縮膜タンパク質、糖タンパク質、リン酸化タンパク質、アセチル化タンパク質、ユビキチン化タンパク質、他の修飾を伴うタンパク質、およびタンパク質複合体
からなる試料群より選択される、先行する請求項いずれかの一項の方法。
【請求項7】
代謝同位体標識が、細胞培養中のアミノ酸での安定同位体標識(SILAC)である、先行する請求項いずれか一項の方法。
【請求項1】
試料における、1つまたは複数の第一の生体分子を定量化するための方法であって、
(a)少なくとも2つの異なる細胞集団混合物から、1つまたは複数の参照生体分子を含む、複数の第二の生体分子を抽出し、ここで前記の少なくとも2つの異なる細胞集団は
(i)異なる細胞タイプの細胞;
(ii)異なる細胞株由来の細胞;
(iii)異なる細胞系譜の細胞;または
(iv)培養が異なる培養条件に供されている、異なる細胞培養由来の細胞
の集団であり、
ここで、前記の1つまたは前記の複数の参照生体分子は、前記の1つまたは前記の複数の第一の生体分子の代謝的同位体標識型である
それによって標準混合物を得て;
(b)前記標準混合物を前記試料と混合し;
(c)前記試料中の前記の1つまたは前記の複数の第一の生体分子の量を決定し;そして
(d)前記標準混合物中の複数の第二の生体分子の中の1つまたは複数の参照生体分子の量に対して、該量を比較する
ここで、前記生体分子はタンパク質またはペプチドであり、そして前記の1つまたは前記の複数の第一の生体分子、および前記の1つまたは前記の複数の参照生体分子の量は、質量分析によって決定される
工程を含む、前記方法。
【請求項2】
前記標準混合物中の前記の1つまたは前記の複数の参照生体分子が前選択され、そして質量分析が、単一または複数イオンモニタリングにより、これらをターゲットとする、請求項1の方法。
【請求項3】
前記比較工程が、前記の1つまたは前記の複数の第一の生体分子の単数または複数のピーク、および前記の1つまたは前記の複数の参照生体分子の対応する単数または複数のピーク間の強度比を決定する工程を含む、請求項1または2の方法。
【請求項4】
試料中の1つまたは複数の第一の生体分子を定量化するための標準混合物を調製するための方法であって、
少なくとも2つの異なる細胞集団の混合物から、1つまたは複数の参照生体分子を含む複数の第二の生体分子を抽出する工程を含み、
前記の少なくとも2つの異なる細胞集団が、
(i)異なる細胞タイプの細胞;
(ii)異なる細胞株由来の細胞;
(iii)異なる細胞系譜の細胞;または
(iv)異なる細胞培養由来の細胞であって、培養が異なる培養条件に供されている、前記細胞
の集団であり、
前記の1つまたは前記の複数の参照生体分子が、前記の1つまたは前記の複数の第一の生体分子の代謝的同位体標識型であり、そして前記生体分子がタンパク質またはペプチドである
前記方法。
【請求項5】
前記の少なくとも2つの異なる細胞集団が、細胞形態、少なくとも1つの生体分子の発現プロファイル、好ましくは複数の生体分子の発現プロファイル、および/または分化状態に関して、互いに異なる、請求項1〜4のいずれか一項の方法。
【請求項6】
前記試料が
細胞、例えば腫瘍細胞、例えば血液関連腫瘍細胞;
全組織または組織の選択された部分;
健康な組織;
疾患、例えば慢性炎症、代謝疾患、特に糖尿病、心臓血管疾患に関連する組織、腫瘍組織、例えば乳癌組織、他の癌腫組織、肉腫組織、神経内分泌腫瘍組織、血液関連腫瘍組織、リンパ腫組織、および奇形腫組織;
細胞または組織の細胞内区画、例えばミトコンドリアまたは細胞核;
体液;
上記の抽出物;ならびに
上記から選択されるタンパク質分画、例えば濃縮膜タンパク質、糖タンパク質、リン酸化タンパク質、アセチル化タンパク質、ユビキチン化タンパク質、他の修飾を伴うタンパク質、およびタンパク質複合体
からなる試料群より選択される、先行する請求項いずれかの一項の方法。
【請求項7】
代謝同位体標識が、細胞培養中のアミノ酸での安定同位体標識(SILAC)である、先行する請求項いずれか一項の方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公表番号】特表2013−506856(P2013−506856A)
【公表日】平成25年2月28日(2013.2.28)
【国際特許分類】
【出願番号】特願2012−532580(P2012−532580)
【出願日】平成22年10月6日(2010.10.6)
【国際出願番号】PCT/EP2010/064922
【国際公開番号】WO2011/042467
【国際公開日】平成23年4月14日(2011.4.14)
【出願人】(598165611)マックス−プランク−ゲゼルシャフト・ツア・フェルデルング・デア・ヴィッセンシャフテン・エー・ファオ (4)
【Fターム(参考)】
【公表日】平成25年2月28日(2013.2.28)
【国際特許分類】
【出願日】平成22年10月6日(2010.10.6)
【国際出願番号】PCT/EP2010/064922
【国際公開番号】WO2011/042467
【国際公開日】平成23年4月14日(2011.4.14)
【出願人】(598165611)マックス−プランク−ゲゼルシャフト・ツア・フェルデルング・デア・ヴィッセンシャフテン・エー・ファオ (4)
【Fターム(参考)】
[ Back to top ]

