生体吸収性インプラント及びその製造方法
【課題】 この発明は、生体内への補填作業時等に損壊し難い機械的強度を有し、かつ補填後に生体内で速やかに分解及び吸収されて優れた骨結合能力を発揮する生体吸収性インプラント及びその製造方法を提供することを課題とする。
【解決手段】 この生体吸収性インプラントは、平均気孔径が100μm以上200μm以下の大径気孔同士の間に形成される骨格部を有し、前記骨格部は生体吸収性セラミックスからなり、孔径5μm未満の微細気孔の全気孔に対する体積割合が20%以上であり、その表面に前記生体吸収性セラミックスの粒子が互いに接して配列された表面層を有し、この生体吸収性インプラントの製造方法は、生体吸収性セラミックスの顆粒を調製する工程と、前記顆粒と可燃性有機粒子とを混合して顆粒混合物を得る工程と、前記顆粒混合物をプレス成形して成形体を得る工程と、前記成形体を焼成する焼成工程とを含み、前記顆粒のタップ充填密度が理論密度の20%以上30%未満である。
【解決手段】 この生体吸収性インプラントは、平均気孔径が100μm以上200μm以下の大径気孔同士の間に形成される骨格部を有し、前記骨格部は生体吸収性セラミックスからなり、孔径5μm未満の微細気孔の全気孔に対する体積割合が20%以上であり、その表面に前記生体吸収性セラミックスの粒子が互いに接して配列された表面層を有し、この生体吸収性インプラントの製造方法は、生体吸収性セラミックスの顆粒を調製する工程と、前記顆粒と可燃性有機粒子とを混合して顆粒混合物を得る工程と、前記顆粒混合物をプレス成形して成形体を得る工程と、前記成形体を焼成する焼成工程とを含み、前記顆粒のタップ充填密度が理論密度の20%以上30%未満である。
【発明の詳細な説明】
【技術分野】
【0001】
この発明は、生体吸収性インプラント及びその製造方法に関し、さらに詳しくは、体内への補填作業時に損壊し難くい機械的強度を有し、かつ補填後に生体内で速やかに分解及び吸収される生体吸収性インプラント、及び、この生体吸収性インプラントを簡易な方法で製造することのできる生体吸収性インプラントの製造方法に関する。
【背景技術】
【0002】
骨又は歯等が欠損した場合に骨又は歯等を再生させるための治療方法に用いられる生体インプラントとして、例えば、金属材料、セラミックス、ポリマーとセラミックスとの複合体等を材料とした生体インプラントが開発されている。
【0003】
生体インプラントの材料としては、リン酸カルシウム化合物は生体親和性に優れ、その焼成体は骨組織と化学的に結合される材料、或いは骨組織に置換される材料であることが知られている。
【0004】
このような生体インプラントの一例として、特許文献1には、「微細な連続した空孔が全体に亙って均一に分布し、かつ実用上に充分に高い強度を有するリン酸カルシウム多孔体の製造方法を提供」(2頁右欄2行目〜5行目参照。)することを課題として、「結晶質のリン酸カルシウム微粉末に解膠剤を水溶液にして添加し混合する工程と、この混合溶液に起泡剤を添加して連続した微細な空孔を有する多孔性流動体を調整する工程と、この多孔性流動体を乾燥処理してリン酸カルシウムの骨格を有する多孔形成体を作製する工程と、この多孔形成体を加熱して前記解膠剤および起泡剤を分解消失させると共に前記リン酸カルシウム多孔体を焼結する工程とを具備したことを特徴とするリン酸カルシウム多孔体の製造方法。」(請求項1参照。)が記載されている。
【0005】
特許文献2には「機械的強度が十分で、生体親和性が高く、大半の気孔が満遍なく連通状態にあり、かつ大半の気孔内に骨芽細胞等が侵入しやすい多孔質構造を持つリン酸カルシウム系多孔質焼結体およびその製造方法を提供する」(段落番号0012参照。)ことを課題として、「多孔質構造を有するリン酸カルシウム系の焼結体において、焼結体の気孔率が55%以上90%以下であり、球状の気孔がほぼ全体にわたって連通しており、気孔間の連通部分の平均的な直径が50μm以上であり、かつ、気孔径が150μm以上であり、焼結体の三点曲げ強さが5MPa以上であることを特徴とするリン酸カルシウム系多孔質焼結体。」(請求項1)が記載されている。
【0006】
特許文献3には「充分な機械的強度を維持し、しかも骨組織形成速度が早く、人工骨、人工骨補填等に適した生体用セラミックス多孔質部材を提供すること」(段落番号0008参照。)を課題として、「多数の気孔が三次元的に密に分布し、隣接する気孔同士がそれらを区画する骨格壁部において相互に連通した連球状開気孔を有するリン酸カルシウム系焼結体からなる生体用セラミックス多孔質部材において、前記リン酸カルシウム系焼結体を水銀ポロシメータにより測定した細孔径分布における孔径5ミクロン(μm)以上の開気孔の気孔体積が、全気孔体積の80%以上であり、前記リン酸カルシウム系焼結体の孔径5ミクロン(μm)未満の開気孔の気孔体積が、前記気孔体積の20%未満であることを特徴とする生体用セラミックス多孔質部材。」(請求項1参照。)が記載されている。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特許第2597355号公報
【特許文献2】特許第3400740号公報
【特許文献3】特許第3470759号公報
【発明の概要】
【発明が解決しようとする課題】
【0008】
ところで、特許文献1の製造方法では、気孔同士の連通性は発泡の程度、すなわち気孔率に支配され、気孔同士の連通性を向上させるために気孔率を高くすると強度が低下し、また強度を向上させるために気孔率を低くすると気孔の連通性が低下してしまう。
【0009】
特許文献2のリン酸カルシウム系多孔質焼結体は、高気孔率で気孔の連通性が良好であっても、骨格を緻密体とすることで強度を維持することができる。また、特許文献3の生体用セラミックス多孔質部材は、孔径5μm以上の気孔体積が全気孔体積の80%以上であるので、骨組織細胞(骨芽細胞等)や血管が入り込み易く、骨組織形成速度が速く、また骨格壁部分には孔径5μm未満の微細な気孔が実質的に存在しないため、人工骨に適した所定の機械的強度を得ることができる。しかし、セラミックス材料として例えばβ−TCPといった生体吸収性セラミックスを使用して、リン酸カルシウム系多孔質焼結体や生体用セラミックス多孔質部材を吸収置換型骨補填材とした場合には、骨格が緻密なため生体内での分解及び吸収が遅く、生体骨に置換されるまでに時間がかかってしまうか、吸収されずに体内に残存してしまうおそれがある。
【0010】
この発明は、生体内への補填作業時等に損壊し難い機械的強度を有し、かつ補填後に生体内で速やかに分解及び吸収されて優れた骨結合能力を発揮する生体吸収性インプラント及びその製造方法を提供することを課題とする。
【課題を解決するための手段】
【0011】
前記課題を解決するための手段として、
(1) 複数の大径気孔が分布することにより、前記大径気孔同士の間に形成される骨格部を有する多孔体であり、
前記大径気孔はその平均気孔径が100μm以上200μm以下であり、
前記骨格部は、生体吸収性セラミックスからなり、水銀ポロシメータで測定した細孔分布における孔径5μm未満の微細気孔の全気孔に対する体積割合が20%以上であり、その表面に前記生体吸収性セラミックスの粒子が互いに接して配列された表面層を有することを特徴とする生体吸収性インプラントである。
【0012】
前記(1)の好ましい態様として、
(2)前記大径気孔同士を連通する連通部の径が40μm以上であり、気孔率が40%以上55%未満であり、圧縮強度が5MPa以上であり、
(3)前記気孔率が40%以上50%未満であり、圧縮強度が8MPa以上であり、
(4)前記生体吸収性セラミックスが、β−リン酸三カルシウムである。
【0013】
前記他の課題を解決するための手段として、
(5)生体吸収性セラミックスの顆粒を調製する顆粒調製工程と、
前記顆粒調製工程で得られた顆粒と可燃性有機粒子とを混合して顆粒混合物を得る顆粒混合工程と、
前記顆粒混合工程で得られた顆粒混合物をプレス成形して成形体を得る成形工程と、
前記成形工程で得られた成形体を焼成する焼成工程と、
を含み、
前記顆粒のタップ充填密度が、前記生体吸収性セラミックスの組成から求められる理論密度の20%以上30%未満であることを特徴とする生体吸収性インプラントの製造方法である。
【0014】
前記(5)の好ましい態様として、
(6)前記顆粒の50%積算粒子径及び前記可燃性有機粒子の50%積算粒子径が、それぞれ100μm以上300μm未満であり、
(7)前記可燃性有機粒子の前記顆粒混合物に対する体積割合が40%以上55%未満であり、
(8)前記可燃性有機粒子の前記顆粒混合物に対する体積割合が40%以上50%未満であり、
(9)前記プレス成形の圧力が100kg/cm2以上400kg/cm2未満であり、
(10)前記焼成工程における焼成温度は、前記生体吸収性セラミックスが相転移又は分解する温度未満、かつ相転移又は分解する温度より100℃低い温度以上であることを特徴とする。
【発明の効果】
【0015】
この発明に係る生体吸収性インプラントは、平均気孔径が100μm以上200μm以下の大径気孔を複数有するので、この大径気孔に骨芽細胞等の生体組織が侵入し易く、速やかに生体組織が形成される。また大径気孔同士の間に形成される骨格部は、孔径5μm未満の微細気孔の体積割合が全気孔体積の20%以上であるので、生体吸収性インプラントが生体内で速やかに分解及び吸収されて、生体組織に置換される。その結果、この発明に係る生体吸収性インプラントは生体骨との高い結合能力を発揮する。また、前記骨格部は生体吸収性セラミックスの粒子が互いに接して配列された表面層を有するので、この発明の生体吸収性インプラントは体内への補填作業時に損壊し難くい機械的強度を有し、ハンドリング性が良好である。
【0016】
また、この発明に係る生体吸収性インプラントの製造方法は、前述した生体吸収性インプラントを簡易な方法で製造することができる。
【図面の簡単な説明】
【0017】
【図1】図1は、この発明に係る生体吸収性インプラントの断面模式図である。
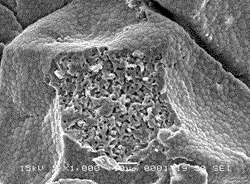
【図2】図2は、実施例1で製造した生体吸収性インプラントの断面を観察したときの走査型電子顕微鏡写真(1000倍)である。
【図3】図3は、図2の写真において、中央部分を拡大(5000倍)して観察したときの走査型電子顕微鏡写真である。
【図4】図4は、図2の写真において、中央部分の周囲を拡大(5000倍)して観察したときの走査型電子顕微鏡写真である。
【発明を実施するための形態】
【0018】
この発明に係る生体吸収性インプラントの一例である生体吸収性インプラントについて、図1を参照しつつ説明する。図1はこの発明に係る生体吸収性インプラントの断面模式図である。この生体吸収性インプラント1は、複数の大径気孔2が3次元的に分布することにより、前記大径気孔2同士の間に形成される骨格部3を有する多孔体4である。
【0019】
前記骨格部3は、生体吸収性セラミックスにより形成され、生体吸収性インプラント1における骨格を成す部位であり、大径気孔2以外の空間を占めている。骨格部3は多数の微細気孔5が存在し、骨格部3の表面は表面層6で囲まれている。表面層6は骨格部3を形成する生体吸収性セラミックスとは異なる生体吸収性セラミックス又は他の材料により形成されるのではなく、骨格部3の内部と表面層6とは、同一の生体吸収性セラミックスにより形成されている。
【0020】
前記大径気孔2は、平均気孔径が100μm以上200μm以下である。前記大径気孔2は、大径気孔2同士が連通してその大部分が生体吸収性インプラント1の表面に開口する開気孔7に連通している。また一部の大径気孔2は開気孔7に連通せずに独立に存在して独立気孔8になって存在する。この発明の生体吸収性インプラント1は、平均気孔径が100μm以上200μm以下である大径気孔2を有し、開気孔7に連通する大径気孔2を有するので、この大径気孔2に骨芽細胞等の生体組織が侵入し易く、速やかに生体組織が形成される。その結果、この発明に係る生体吸収性インプラント1は生体骨との高い結合能力を発揮する。
【0021】
前記骨格部3は、水銀ポロシメータで測定した細孔分布における孔径5μm未満の微細気孔5の全気孔に対する体積割合が20%以上である。このように骨格部3が多数の微細気孔5を有することで、生体吸収性インプラント1を生体内に埋設した後に生体内で速やかに分解及び吸収され、速やかに生体組織に置換される。その結果、この発明に係る生体吸収性インプラント1は生体骨との高い結合能力を発揮する。前記微細気孔5の全気孔に対する体積割合が20%未満であると、相対的に大径気孔2の体積割合が大きくなり、骨格部3の体積割合が小さくなることから機械的強度が低下し易くなる。
【0022】
前記表面層6は、図1に示すように、骨格部3の表面すなわち大径気孔2の内壁面及び生体吸収性インプラント1の外表面に設けられている。前記表面層6は、生体吸収性セラミックスの粒子が互いに接して配列されている。例えば、走査型顕微鏡を用いて骨格部3の表面を生体吸収性セラミックスの粒子の輪郭が視認できる程度の倍率、例えば5000倍で観察すると(図4参照。)、種々の大きさ、例えば1〜5μm程度の直径を有する生体吸収性セラミックスの粒子が並べられ、石垣状に敷き詰められているように見える。骨格部3の断面を、走査型顕微鏡を用いて例えば1000倍で観察すると(図2参照。)、表面層6の厚みは生体吸収性セラミックスの粒子1〜2個分であり、例えば1〜10μm程度である。このように粒子が敷き詰められている表面層6は微細気孔5が多数存在する骨格部3の内部に比べて硬く、骨格部3はその表面全体が硬い殻で囲まれた構造となっている。硬い殻で囲まれて成る骨格部3を有する生体吸収性インプラント1は、生体内への補填作業過程で損壊し難く、また補填した後においても生体内で損壊し難い機械的強度を有し、ハンドリング性が良好である。なお、骨格部3の表面に形成される表面層6は生体吸収性セラミックスの粒子が互いに接して密に敷き詰められることにより硬い殻を形成しているが、表面層6の形態としては、骨格部3の表面全体が生体吸収性セラミックスの粒子で完全に敷き詰められている形態に限らず、補填作業過程で損壊し難い機械的強度を維持することができればよく、生体吸収性セラミックスの粒子が一部脱落して、硬い殻に少なくとも一つ以上の孔が開いている形態も含む。
【0023】
この発明の生体吸収性インプラント1は、微細気孔5だけでなく複数の大径気孔2を有することで骨芽細胞等の生体組織が侵入し易く、速やかに生体組織が形成される。前記微細気孔5の全気孔に対する体積割合は、大径気孔2の全気孔に対する体積割合に連動して変化する。よって、微細気孔5の全気孔に対する体積割合は大径気孔2の全気孔に対する体積割合に依存する。大径気孔2の体積割合が大きくなると、骨芽細胞等の生体組織が侵入し易くなる一方で生体吸収性インプラント1の機械的強度が低下し易くなる。また、大径気孔2の体積割合が小さくなると、生体吸収性インプラント1の機械的強度が高くなる一方で大径気孔2同士が連通し難くなり、生体組織が侵入し難くなる。これらの観点から、大径気孔2の全気孔に対する体積割合は、50%以上80%未満であるのが好ましく、70%以上80%未満であるのがより好ましい。
【0024】
前記大径気孔2は、その大部分が隣接する大径気孔2と連通し、大径気孔2同士を連通する連通部9の径が40μm以上であるのが好ましい。連通部9の径の上限値は、通常大径気孔2の径の上限値となる。連通部9の径が40μm以上であると、骨芽細胞等の生体組織が生体吸収性インプラント1の内部まで侵入し易く、速やかに生体組織が形成される。
【0025】
生体吸収性インプラント1は、その気孔率が40%以上55%未満であるのが好ましく、40%以上50%未満であるのがより好ましい。気孔率が前記範囲内であると、生体内への補填作業過程や補填後に生体吸収性インプラント1が損壊するのを防ぐことができ、また骨芽細胞等の生体組織を生体吸収性インプラント1の内部に侵入させるための気孔及び連通部9を確保することができる。
【0026】
前記大径気孔2の平均気孔径は、通常、後述する可燃性有機粒子の平均粒径より小さい値となる。後述するように、可燃性有機粒子は焼成工程において焼失してしまい、焼失した部分が大径気孔2となる。焼成工程において可燃性有機粒子と生体吸収性セラミックスの粒子とにより形成される成形体を焼成すると体積収縮が生じる。したがって、可燃性有機粒子が焼失した後に形成された大径気孔2の体積は、可燃性有機粒子の体積より通常小さくなる。また、後述する可燃性有機粒子の形状が球状である場合には、球状の大径気孔2が形成され易い。生体吸収性インプラント1の大径気孔2の平均気孔径を測定する場合には、例えば、生体吸収性インプラント1を樹脂に埋包した後、研磨して断面を出し、この断面を走査型電子顕微鏡等で観察し、視野にあるすべての気孔についてそれぞれ円を想定して直径を測定し、これらの測定値の算術平均から求めることができる。
【0027】
また、前記微細気孔5の全気孔に対する体積割合及び連通部9の径は、水銀ポロシメータを用いて測定することができる。この生体吸収性インプラント1の孔径を水銀ポロシメータで測定すると、細孔分布において孔径が10μm以下と10μm以上とに2つのピークが現れる。微細気孔5の全気孔体積に対する体積割合は、細孔分布における孔径5μm未満の微細気孔5を積算して得られる体積割合を全気孔率で除することにより、算出される。全気孔率は、生体吸収性インプラント1の質量及び体積から算出される見掛け密度と生体吸収性セラミックスの組成から求められる理論密度とから、式:(1−見掛け密度/理論密度)×100%により、算出される。連通部9の径は、細孔分布において孔径が10μm以上に現れるピークの孔径で表され、ピークトップに対応する孔径が40μm以上であるのが好ましい。
【0028】
前記生体吸収性インプラント1は、その圧縮強度が5MPa以上であるのが好ましく、8MPa以上であるのがより好ましい。圧縮強度が5MPa以上であると、生体内への補填作業過程で容易に損壊することなくハンドリング性に優れ、あらゆる補填部位に様々な態様で使用することができる。
【0029】
前記圧縮強度は、直径10mm×高さ10mmの円柱体を成す試験体を作製し、この試験体をロードセルを用いて0.5mm/minの速さで圧縮応力を負荷して、応力−ひずみ曲線を作成し、この曲線において応力が最大となった点から算出される。
【0030】
前記生体吸収性セラミックスは、生体内で分解及び吸収され、体に害を及ぼさないセラミックスである限り特に限定されず、例えば、β−リン酸三カルシウム(β−TCP)、α−リン酸三カルシウム(α−TCP)、リン酸一カルシウム一水和物(MCPM)、無水リン酸一カルシウム(MCPA)、リン酸二カルシウム二水和物(DCPD)、無水リン酸二カルシウム(DCPA)、リン酸八カルシウム(OCP)、リン酸四カルシウム(TTCP)等を挙げることができ、これらのセラミックスのうち2種以上が共存するセラミックスであっても良い。これらの中でも吸収速度の観点からβ−リン酸三カルシウムが好ましい。
【0031】
前記生体吸収性インプラント1の形状は特に限定されず、生体内の補填される部位等に応じて所望の形状に製造される。前記生体吸収性インプラント1の形状は、補填される部位の形状と同様の形状、又は、この形状に相当する形状例えば相似形等が挙げられ、具体的には、顆粒状又は粒状、粉末状、繊維状、ブロック状又はフィルム状等が挙げられる。
【0032】
次に、この生体吸収性インプラント1を製造することのできる製造方法の一例を説明する。
【0033】
この発明に係る生体吸収性インプラント1の製造方法は、生体吸収性セラミックスの顆粒を調製する顆粒調製工程と、前記顆粒調製工程で得られた顆粒と可燃性有機粒子とを混合して顆粒混合物を得る顆粒混合工程と、前記顆粒混合工程で得られた顆粒混合物をプレス成形して成形体を得る成形工程と、前記成形工程で得られた成形体を焼成する焼成工程と、を含み、前記顆粒のタップ充填密度が、前記生体吸収性セラミックスの組成から求められる理論密度の20%以上30%未満であることを特徴とする。
【0034】
この発明に係る生体吸収性インプラント1の製造方法では、まず顆粒調製工程として生体吸収性セラミックスの顆粒を調製する。生体吸収性セラミックスの顆粒を調製するための原料としては、前述した生体吸収性セラミックスを使用することができ、吸収速度の観点からβ−TCPが好ましい。この原料の比表面積は3.5m2/g以上であるのが好ましい。原料の比表面積が3.5m2/g以上であると、原料粉末の焼結性が良好となり、製造された生体吸収性インプラント1における骨格部3の表面に生体吸収性セラミックスの粒子が互いに接して配列された表面層6が形成され易くなり、生体内への補填作業過程で損壊し難い生体吸収性インプラント1を製造することができる。なお、原料の比表面積は、比表面積測定装置により測定することができる。
【0035】
原料から顆粒を調製する方法は、顆粒が調製される限り特に限定されず、下方から熱風を送り原料粉体を流動状態に保持しつつバインダ溶液を噴霧することにより原料粉体を凝集造粒させる流動層造粒、原料粉体を撹拌混合しつつバインダ溶液を添加することにより造粒させる撹拌造粒、原料粉体を圧縮成形して顆粒を得る圧縮造粒等を挙げることができる。これらの中でも流動層造粒は、平均粒径が数百μmの球状の顆粒を増産できる点で好ましい。流動層造粒及び撹拌造粒において使用されるバインダ溶液は、顆粒を調製することができる限り特に限定されず、例えばポリビニルアルコール、ポリエリレングリコール、及びアクリル酸、メタクリル酸、アクリルアミド等のポリマーを水に溶解した水溶液を挙げることができる。
【0036】
調製される顆粒のタップ充填密度は、前記生体吸収性セラミックスの組成から求められる理論密度の20%以上30%未満である。顆粒のタップ充填密度が理論密度の20%以上30%未満であると、製造された生体吸収性インプラント1における骨格部3の内部に、水銀ポロシメータで測定した細孔分布における孔径5μm未満の微細気孔5が、全気孔の20%以上の体積割合に形成され易くなる。顆粒のタップ充填密度が理論密度の20%より小さいと顆粒混合工程や成形工程において顆粒が潰れ易く、緻密な骨格部3を有する多孔体4が形成され易く、生体内において速やかに分解及び吸収され難くなる。また顆粒のタップ充填密度が理論密度の30%以上であると微細気孔5が全気孔の20%以上の体積割合に形成され難くなり、その結果緻密な骨格部3を有する多孔体4が形成され易く、生体内において速やかに分解及び吸収され難くなる。なお、タップ充填密度は、メスシリンダーに所定量の顆粒を入れ、体積が変化しなくなるまで機械的にタッピングし、メスシリンダーに充填された顆粒の体積を測定し、この体積で顆粒重量を割ることにより算出することができる。
【0037】
この顆粒調製工程において調製される顆粒は、略球状であり、通常顆粒と称される程度の大きさであれば良く、例えば直径が0.05〜1mm程度の大きさであり、50%積算粒子径(メジアン径)が100μm以上300μm未満であるのが好ましい。顆粒の50%積算粒子径が100μm以上300μm未満であると、大径気孔2の気孔連通性と機械的強度とを両立出来るため、好適である。顆粒の50%積算粒子径が100μm未満であると可燃性有機粒子同士の隙間に顆粒が入り込み、気孔が分断され易くなるため、大径気孔2同士が連通し難くなるおそれがある。また、顆粒の50%積算粒子径が300μm以上であると骨格部3が脆くなり、機械的強度が低下するおそれがある。顆粒のタップ充填密度及び顆粒の粒径は、造粒の条件を調整することにより調製することができる。
【0038】
次いで、顆粒混合工程として、前記顆粒調製工程で得られた顆粒と可燃性有機粒子とを混合して顆粒混合物を得る。
【0039】
顆粒と可燃性有機粒子との混合方法は均一な顆粒混合物が得られる限り特に限定されず、乾式混合及び湿式混合のいずれで行っても良く、顆粒の形態維持の観点から乾式混合が好ましい。
【0040】
可燃性有機粒子は、焼成工程において焼成残渣のない有機物により形成される粒子である限り特に限定されず、例えばアクリル樹脂、メタクリル樹脂、ポリスチレン樹脂等により形成される略球状のビーズを挙げることができる。
【0041】
可燃性有機粒子は、略球状であり、その粒子径が前記顆粒と同程度であるのが良く、50%積算粒子径が100μm以上300μm未満であるのが好ましい。可燃性有機粒子は、焼成工程を経て消失し、生体吸収性インプラント1における大径気孔2を形成する。したがって、可燃性有機粒子の径を変化させることにより、大径気孔2の平均気孔径及び大径気孔2同士が連通する連通部9の径を調整することができ、可燃性有機粒子の50%積算粒子径が100μm以上300μm未満であると、大径気孔2の平均気孔径が100μm以上200μm以下で、連通部9の径が40μm以上の生体吸収性インプラント1が製造され易くなる。
【0042】
前記可燃性有機粒子の前記顆粒混合物に対する体積割合は特に限定されないが、40%以上55%未満であるのが好ましく、40%以上50%未満であるのがより好ましい。可燃性有機粒子は後述する焼成工程で焼失してしまい、生体吸収性インプラント1における大径気孔2を形成する。焼成工程において可燃性有機粒子と生体吸収性セラミックスの粒子とにより形成される成形体を焼成すると体積収縮が生じるので、大径気孔2の体積は可燃性有機粒子の体積より通常小さくなる。一方、生体吸収性インプラント1の気孔率はこの大径気孔2の体積割合の影響を受け、大径気孔2を形成する可燃性有機粒子の前記顆粒混合物に対する体積割合が40%以上55%未満であると、40%以上55%未満の気孔率を有する生体吸収性インプラント1が製造され易くなる。
【0043】
次いで、成形工程として、前記顆粒混合工程で得られた顆粒混合物をプレス成形して成形体を得る。
【0044】
プレス成形としては、所望の形状に成形することができる限り特に限定されず、例えば金型プレス、ラバープレス、水中プレス等を挙げることができる。プレス成形の圧力は、100kg/cm2以上400kg/cm2未満であるのが好ましい。プレス成形の圧力が前記範囲内であると、顆粒を潰すことなく顆粒と可燃性有機粒子とが密に充填された成形体が得られるので、所望の機械的強度を有し、また前述したように多数の微細気孔5を有する骨格部3を備えた生体吸収性インプラント1が得られる。プレス成形の圧力が100kg/cm2未満であると、充分な充填密度を有する成形体が得られないおそれがあり、そのため所望の機械的強度を有する生体吸収性インプラント1が得られないおそれがある。またプレス成形の圧力が400kg/cm2以上であると、成形工程において顆粒が潰れてしまうおそれがあり、顆粒が潰れてしまうと製造される生体吸収性インプラント1における骨格部3が緻密になってしまい、微細気孔5が減少し、生体内で速やかに分解及び吸収され難くなるおそれがある。このように従来よりも低い圧力で成形することで、原料を潰すことなく、原料同士が密に接触した成形体を形成することができるので、前述したように多数の微細気孔5を有する骨格部3が得られ易くなる。
【0045】
次いで、焼成工程として、前記成形工程で得られた成形体を焼成する。
【0046】
前記成形体の焼成方法は特に限定されないが、前記成形体をまず200〜500℃に加熱して可燃性有機粒子を焼成除去し、脱脂した後に、前記生体吸収性セラミックスが相転移又は分解する温度未満、かつ相転移又は分解する温度より100℃低い温度以上、例えば1080〜1150℃で、30分〜5時間の間焼成するのが好ましい。成形体の焼成温度が前記範囲内であると、前述したように、全気孔に対する体積割合が20%以上である微細気孔5及び生体吸収性セラミックスの粒子が互いに接して配列され、硬い殻を形成する表面層6を備えた骨格部3を有する生体吸収性インプラント1を製造し易い。前記生体吸収性セラミックスが相転移又は分解する温度以上の温度で成形体を焼成すると、成形体を構成する生体吸収性セラミックスが相転移又は分解することにより、体積膨張が生じ、そのため骨格部3に形成される気孔の気孔径の拡大、気孔率の上昇及びクラックが発生し、生体吸収性インプラント1の機械的強度が低下するおそれがある。また、前記生体吸収性セラミックスが相転移又は分解する温度より100℃低い温度未満の温度で成形体を焼成すると、顆粒同士及び顆粒内の原料粒子同士の結合が充分に行われず、原料粒子が脱落するおそれがあり、また、骨格部3の表面が十分に焼結されないことにより生体吸収性セラミックスの粒子が緻密に敷き詰められた表面層6が形成されないおそれがあり、その結果得られた生体吸収性インプラント1の機械的強度が低下するおそれがある。
【0047】
このように成形体が焼成されることにより、成形体における可燃性有機粒子が消失して大径気孔2を形成し、また大径気孔2同士の間に骨格部3が形成され、この骨格部3は多数の微細気孔5を有し、骨格部3の表面に表面層6が形成された生体吸収性インプラント1が得られる。こうしてこの発明に係る生体吸収性インプラント1が形成される。
【0048】
この発明に係る生体吸収性インプラント及び生体吸収性インプラントの製造方法は、前記した例に限定されることはなく、本願発明の目的を達成することができる範囲において、種々の変更が可能である。
【実施例】
【0049】
<生体吸収性インプラントの製造>
(顆粒調製工程)
生体吸収性セラミックスであるβ−リン酸三カルシウム(β−TCP)の粉末(比表面積:4.0m2/g)を原料として流動層造粒により略球状の顆粒を調製した。このとき、バインダ水溶液として8質量%ポリビニルアルコール水溶液を使用し、造粒の条件を変化させることにより、表1及び2に示すように、顆粒の50%積算粒子径、顆粒の理論密度に対するタップ充填密度の比率の異なる種々の顆粒を調製した。なお、β−TCPの粉末の比表面積は比表面積測定装置(Mountech社製MacSorb HM)により測定した。顆粒の50%積算粒子径は、9段重ねの篩を用いて篩に残った顆粒の質量を測定し、粒径の小さい方から質量を積算して全質量の50%になる粒子径を求めた。顆粒のタップ充填密度は、容積20ccのメスシリンダーに10g前後の顆粒を入れ、5cmの高さから垂直に落とすタッピング操作を500回行い、顆粒の体積の変化が認められないことを確認した後に体積を読み取り、顆粒の質量を顆粒の体積で除することにより算出した。このとき、顆粒の理論密度を3.07g/cm2として、顆粒の理論密度に対するタップ充填密度の比率を算出した。
【0050】
(顆粒混合工程)
可燃性有機粒子である球状のブチルメタクリレートを準備し、この粒子と得られた顆粒とを均一になるように混合して顆粒混合物を得た。このとき、表1及び2に示すように、ブチルメタクリレートの粒子については、50%積算粒子径の異なる種々の粒子を使用し、また顆粒に対する混合割合も変化させた。ブチルメタクリレートの粒子の50%積算粒子径は、顆粒と同様にして求めた。
【0051】
(成形工程)
得られた顆粒混合物を金型に充填し、プレス成形して円柱状の成形体を得た。このとき、表1及び2に示すように、プレス成形の圧力を変化させた。
【0052】
(焼成工程)
得られた成形体を220℃で3時間、450℃で2時間脱脂し、その後昇温速度100℃/時間で1000℃又は1100℃まで昇温し、この温度に維持したまま3時間焼成し、生体吸収性インプラントを製造した。
【0053】
<評価>
(気孔率)
生体吸収性インプラントの質量及び寸法により算出される体積から見掛け密度を算出した。この見掛け密度とβ−TCPの理論密度3.07g/cm2とから気孔率を算出した。
(水銀ポロシメータ)
得られた生体吸収性インプラントを水銀ポロシメータ(マイクロメリティックス社製オートポアIV9510)を用いて細孔分布を測定した。いずれの生体吸収性インプラントについても、細孔分布において孔径が10μm以下と10μm以上とに2つのピークが現れた。孔径5μm未満の微細気孔を積算して得られる体積割合を気孔率で除して、微細気孔の全気孔に対する割合を算出した。
また、10μm以上に現れたピークトップに対応する孔径を大径気孔の連通部の径とした。
【0054】
(走査型電子顕微鏡)
得られた生体吸収性インプラントを樹脂に埋包した後、研磨して断面を出し、この断面を走査型電子顕微鏡(日本電子株式会社製JSM−6460LA)で観察し(50倍)、視野にあるすべての気孔についてそれぞれ円を想定して直径を測定し、これらの測定値の算術平均を、大径気孔の平均気孔径とした。
また、表1及び2における試験番号1の生体吸収性インプラントを走査型顕微鏡で観察し(1000倍)、撮影した骨格部の断面写真を図2に示す。図2に示されるように、骨格部の断面である中央部分には複数の微細気孔が存在し、骨格部の内部は微細気孔が多数存在しているのが観察された。また、骨格部の表面はβ−TCPの粒子同士が接して配列され、石垣状に敷き詰められ、硬い殻を形成しているのが観察された。図2に示す生体吸収性インプラントの中央部分を5000倍に拡大して撮影した写真を図3に示す。図3に示されるように、骨格部の内部には1〜5μm程度の微細気孔が多数存在しているのが観察された。図2に示す生体吸収性インプラントの中央部分の周囲を5000倍に拡大して撮影した写真を図4に示す。中央部分の周囲は表面層であり、図4に示されるように、直径1〜5μm程度のβ−TCPの粒子が密に敷き詰めされているのが観察された。図2に示されるように、表面層はβ−TCPの粒子1〜2個分程度すなわち1〜10μm程度の厚みを有していた。
【0055】
(圧縮強度)
直径10mm、高さ10mmの円柱体を成す生体吸収性インプラントの試験体を作製し、この試験体をロードセルを用いて0.5mm/minの速さで圧縮応力を負荷して、応力−ひずみ曲線を作成し、この曲線において応力が最大となった点を、圧縮強度とした。
【0056】
(総合評価)
表1及び2における総合評価は以下の基準にしたがって行った。
×:平均気孔径が100μm以上200μm以下を満たすが、微細気孔の全気孔に対する割合が20%以上を満たさないとき
○:平均気孔径が100μm以上200μm以下、微細気孔の全気孔に対する割合が20%以上を満たすが、連通部の径が40μm以上、気孔率が40%以上55%未満、圧縮強度が5MPa以上の少なくとも1項目を満たさないとき
◎:平均気孔径が100μm以上200μm以下、微細気孔の全気孔に対する割合が20%以上、連通部の径が40μm以上を満たし、気孔率が50%以上55%未満又は圧縮強度が5MPa以上8MPa未満であるとき
☆:気孔率が40%以上50%未満、大径気孔の平均気孔径が100μm以上200μm未満、微細気孔の全気孔に対する割合が20%以上、連通部の径が40μm以上、圧縮強度が5MPa以上のすべてを満たしているとき
【0057】
【表1】

【0058】
【表2】

【0059】
この発明に係る生体吸収性インプラントの範囲に含まれる試験番号1〜13、16の生体吸収性インプラントは、大径気孔の平均気孔径が100μm以上200μm未満であるので、骨芽細胞等の生体組織が進入し易く、速やかに生体組織が形成され、また微細気孔の全気孔に対する割合が20%以上であるので、生体内で分解及び吸収され、速やかに生体組織に置換されると判断される。また、図2〜4に例示されるように、これらの生体吸収性インプラントは骨格部の表面にβ−TCPの粒子同士が接して配列された表面層を有しているので、生体内への補填作業時に損壊するのを防止することができ、良好なハンドリング性を有すると判断される。
【符号の説明】
【0060】
1 生体吸収性インプラント
2 大径気孔
3 骨格部
4 多孔体
5 微細気孔
6 表面層
7 開気孔
8 独立気孔
9 連通部
【技術分野】
【0001】
この発明は、生体吸収性インプラント及びその製造方法に関し、さらに詳しくは、体内への補填作業時に損壊し難くい機械的強度を有し、かつ補填後に生体内で速やかに分解及び吸収される生体吸収性インプラント、及び、この生体吸収性インプラントを簡易な方法で製造することのできる生体吸収性インプラントの製造方法に関する。
【背景技術】
【0002】
骨又は歯等が欠損した場合に骨又は歯等を再生させるための治療方法に用いられる生体インプラントとして、例えば、金属材料、セラミックス、ポリマーとセラミックスとの複合体等を材料とした生体インプラントが開発されている。
【0003】
生体インプラントの材料としては、リン酸カルシウム化合物は生体親和性に優れ、その焼成体は骨組織と化学的に結合される材料、或いは骨組織に置換される材料であることが知られている。
【0004】
このような生体インプラントの一例として、特許文献1には、「微細な連続した空孔が全体に亙って均一に分布し、かつ実用上に充分に高い強度を有するリン酸カルシウム多孔体の製造方法を提供」(2頁右欄2行目〜5行目参照。)することを課題として、「結晶質のリン酸カルシウム微粉末に解膠剤を水溶液にして添加し混合する工程と、この混合溶液に起泡剤を添加して連続した微細な空孔を有する多孔性流動体を調整する工程と、この多孔性流動体を乾燥処理してリン酸カルシウムの骨格を有する多孔形成体を作製する工程と、この多孔形成体を加熱して前記解膠剤および起泡剤を分解消失させると共に前記リン酸カルシウム多孔体を焼結する工程とを具備したことを特徴とするリン酸カルシウム多孔体の製造方法。」(請求項1参照。)が記載されている。
【0005】
特許文献2には「機械的強度が十分で、生体親和性が高く、大半の気孔が満遍なく連通状態にあり、かつ大半の気孔内に骨芽細胞等が侵入しやすい多孔質構造を持つリン酸カルシウム系多孔質焼結体およびその製造方法を提供する」(段落番号0012参照。)ことを課題として、「多孔質構造を有するリン酸カルシウム系の焼結体において、焼結体の気孔率が55%以上90%以下であり、球状の気孔がほぼ全体にわたって連通しており、気孔間の連通部分の平均的な直径が50μm以上であり、かつ、気孔径が150μm以上であり、焼結体の三点曲げ強さが5MPa以上であることを特徴とするリン酸カルシウム系多孔質焼結体。」(請求項1)が記載されている。
【0006】
特許文献3には「充分な機械的強度を維持し、しかも骨組織形成速度が早く、人工骨、人工骨補填等に適した生体用セラミックス多孔質部材を提供すること」(段落番号0008参照。)を課題として、「多数の気孔が三次元的に密に分布し、隣接する気孔同士がそれらを区画する骨格壁部において相互に連通した連球状開気孔を有するリン酸カルシウム系焼結体からなる生体用セラミックス多孔質部材において、前記リン酸カルシウム系焼結体を水銀ポロシメータにより測定した細孔径分布における孔径5ミクロン(μm)以上の開気孔の気孔体積が、全気孔体積の80%以上であり、前記リン酸カルシウム系焼結体の孔径5ミクロン(μm)未満の開気孔の気孔体積が、前記気孔体積の20%未満であることを特徴とする生体用セラミックス多孔質部材。」(請求項1参照。)が記載されている。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特許第2597355号公報
【特許文献2】特許第3400740号公報
【特許文献3】特許第3470759号公報
【発明の概要】
【発明が解決しようとする課題】
【0008】
ところで、特許文献1の製造方法では、気孔同士の連通性は発泡の程度、すなわち気孔率に支配され、気孔同士の連通性を向上させるために気孔率を高くすると強度が低下し、また強度を向上させるために気孔率を低くすると気孔の連通性が低下してしまう。
【0009】
特許文献2のリン酸カルシウム系多孔質焼結体は、高気孔率で気孔の連通性が良好であっても、骨格を緻密体とすることで強度を維持することができる。また、特許文献3の生体用セラミックス多孔質部材は、孔径5μm以上の気孔体積が全気孔体積の80%以上であるので、骨組織細胞(骨芽細胞等)や血管が入り込み易く、骨組織形成速度が速く、また骨格壁部分には孔径5μm未満の微細な気孔が実質的に存在しないため、人工骨に適した所定の機械的強度を得ることができる。しかし、セラミックス材料として例えばβ−TCPといった生体吸収性セラミックスを使用して、リン酸カルシウム系多孔質焼結体や生体用セラミックス多孔質部材を吸収置換型骨補填材とした場合には、骨格が緻密なため生体内での分解及び吸収が遅く、生体骨に置換されるまでに時間がかかってしまうか、吸収されずに体内に残存してしまうおそれがある。
【0010】
この発明は、生体内への補填作業時等に損壊し難い機械的強度を有し、かつ補填後に生体内で速やかに分解及び吸収されて優れた骨結合能力を発揮する生体吸収性インプラント及びその製造方法を提供することを課題とする。
【課題を解決するための手段】
【0011】
前記課題を解決するための手段として、
(1) 複数の大径気孔が分布することにより、前記大径気孔同士の間に形成される骨格部を有する多孔体であり、
前記大径気孔はその平均気孔径が100μm以上200μm以下であり、
前記骨格部は、生体吸収性セラミックスからなり、水銀ポロシメータで測定した細孔分布における孔径5μm未満の微細気孔の全気孔に対する体積割合が20%以上であり、その表面に前記生体吸収性セラミックスの粒子が互いに接して配列された表面層を有することを特徴とする生体吸収性インプラントである。
【0012】
前記(1)の好ましい態様として、
(2)前記大径気孔同士を連通する連通部の径が40μm以上であり、気孔率が40%以上55%未満であり、圧縮強度が5MPa以上であり、
(3)前記気孔率が40%以上50%未満であり、圧縮強度が8MPa以上であり、
(4)前記生体吸収性セラミックスが、β−リン酸三カルシウムである。
【0013】
前記他の課題を解決するための手段として、
(5)生体吸収性セラミックスの顆粒を調製する顆粒調製工程と、
前記顆粒調製工程で得られた顆粒と可燃性有機粒子とを混合して顆粒混合物を得る顆粒混合工程と、
前記顆粒混合工程で得られた顆粒混合物をプレス成形して成形体を得る成形工程と、
前記成形工程で得られた成形体を焼成する焼成工程と、
を含み、
前記顆粒のタップ充填密度が、前記生体吸収性セラミックスの組成から求められる理論密度の20%以上30%未満であることを特徴とする生体吸収性インプラントの製造方法である。
【0014】
前記(5)の好ましい態様として、
(6)前記顆粒の50%積算粒子径及び前記可燃性有機粒子の50%積算粒子径が、それぞれ100μm以上300μm未満であり、
(7)前記可燃性有機粒子の前記顆粒混合物に対する体積割合が40%以上55%未満であり、
(8)前記可燃性有機粒子の前記顆粒混合物に対する体積割合が40%以上50%未満であり、
(9)前記プレス成形の圧力が100kg/cm2以上400kg/cm2未満であり、
(10)前記焼成工程における焼成温度は、前記生体吸収性セラミックスが相転移又は分解する温度未満、かつ相転移又は分解する温度より100℃低い温度以上であることを特徴とする。
【発明の効果】
【0015】
この発明に係る生体吸収性インプラントは、平均気孔径が100μm以上200μm以下の大径気孔を複数有するので、この大径気孔に骨芽細胞等の生体組織が侵入し易く、速やかに生体組織が形成される。また大径気孔同士の間に形成される骨格部は、孔径5μm未満の微細気孔の体積割合が全気孔体積の20%以上であるので、生体吸収性インプラントが生体内で速やかに分解及び吸収されて、生体組織に置換される。その結果、この発明に係る生体吸収性インプラントは生体骨との高い結合能力を発揮する。また、前記骨格部は生体吸収性セラミックスの粒子が互いに接して配列された表面層を有するので、この発明の生体吸収性インプラントは体内への補填作業時に損壊し難くい機械的強度を有し、ハンドリング性が良好である。
【0016】
また、この発明に係る生体吸収性インプラントの製造方法は、前述した生体吸収性インプラントを簡易な方法で製造することができる。
【図面の簡単な説明】
【0017】
【図1】図1は、この発明に係る生体吸収性インプラントの断面模式図である。
【図2】図2は、実施例1で製造した生体吸収性インプラントの断面を観察したときの走査型電子顕微鏡写真(1000倍)である。
【図3】図3は、図2の写真において、中央部分を拡大(5000倍)して観察したときの走査型電子顕微鏡写真である。
【図4】図4は、図2の写真において、中央部分の周囲を拡大(5000倍)して観察したときの走査型電子顕微鏡写真である。
【発明を実施するための形態】
【0018】
この発明に係る生体吸収性インプラントの一例である生体吸収性インプラントについて、図1を参照しつつ説明する。図1はこの発明に係る生体吸収性インプラントの断面模式図である。この生体吸収性インプラント1は、複数の大径気孔2が3次元的に分布することにより、前記大径気孔2同士の間に形成される骨格部3を有する多孔体4である。
【0019】
前記骨格部3は、生体吸収性セラミックスにより形成され、生体吸収性インプラント1における骨格を成す部位であり、大径気孔2以外の空間を占めている。骨格部3は多数の微細気孔5が存在し、骨格部3の表面は表面層6で囲まれている。表面層6は骨格部3を形成する生体吸収性セラミックスとは異なる生体吸収性セラミックス又は他の材料により形成されるのではなく、骨格部3の内部と表面層6とは、同一の生体吸収性セラミックスにより形成されている。
【0020】
前記大径気孔2は、平均気孔径が100μm以上200μm以下である。前記大径気孔2は、大径気孔2同士が連通してその大部分が生体吸収性インプラント1の表面に開口する開気孔7に連通している。また一部の大径気孔2は開気孔7に連通せずに独立に存在して独立気孔8になって存在する。この発明の生体吸収性インプラント1は、平均気孔径が100μm以上200μm以下である大径気孔2を有し、開気孔7に連通する大径気孔2を有するので、この大径気孔2に骨芽細胞等の生体組織が侵入し易く、速やかに生体組織が形成される。その結果、この発明に係る生体吸収性インプラント1は生体骨との高い結合能力を発揮する。
【0021】
前記骨格部3は、水銀ポロシメータで測定した細孔分布における孔径5μm未満の微細気孔5の全気孔に対する体積割合が20%以上である。このように骨格部3が多数の微細気孔5を有することで、生体吸収性インプラント1を生体内に埋設した後に生体内で速やかに分解及び吸収され、速やかに生体組織に置換される。その結果、この発明に係る生体吸収性インプラント1は生体骨との高い結合能力を発揮する。前記微細気孔5の全気孔に対する体積割合が20%未満であると、相対的に大径気孔2の体積割合が大きくなり、骨格部3の体積割合が小さくなることから機械的強度が低下し易くなる。
【0022】
前記表面層6は、図1に示すように、骨格部3の表面すなわち大径気孔2の内壁面及び生体吸収性インプラント1の外表面に設けられている。前記表面層6は、生体吸収性セラミックスの粒子が互いに接して配列されている。例えば、走査型顕微鏡を用いて骨格部3の表面を生体吸収性セラミックスの粒子の輪郭が視認できる程度の倍率、例えば5000倍で観察すると(図4参照。)、種々の大きさ、例えば1〜5μm程度の直径を有する生体吸収性セラミックスの粒子が並べられ、石垣状に敷き詰められているように見える。骨格部3の断面を、走査型顕微鏡を用いて例えば1000倍で観察すると(図2参照。)、表面層6の厚みは生体吸収性セラミックスの粒子1〜2個分であり、例えば1〜10μm程度である。このように粒子が敷き詰められている表面層6は微細気孔5が多数存在する骨格部3の内部に比べて硬く、骨格部3はその表面全体が硬い殻で囲まれた構造となっている。硬い殻で囲まれて成る骨格部3を有する生体吸収性インプラント1は、生体内への補填作業過程で損壊し難く、また補填した後においても生体内で損壊し難い機械的強度を有し、ハンドリング性が良好である。なお、骨格部3の表面に形成される表面層6は生体吸収性セラミックスの粒子が互いに接して密に敷き詰められることにより硬い殻を形成しているが、表面層6の形態としては、骨格部3の表面全体が生体吸収性セラミックスの粒子で完全に敷き詰められている形態に限らず、補填作業過程で損壊し難い機械的強度を維持することができればよく、生体吸収性セラミックスの粒子が一部脱落して、硬い殻に少なくとも一つ以上の孔が開いている形態も含む。
【0023】
この発明の生体吸収性インプラント1は、微細気孔5だけでなく複数の大径気孔2を有することで骨芽細胞等の生体組織が侵入し易く、速やかに生体組織が形成される。前記微細気孔5の全気孔に対する体積割合は、大径気孔2の全気孔に対する体積割合に連動して変化する。よって、微細気孔5の全気孔に対する体積割合は大径気孔2の全気孔に対する体積割合に依存する。大径気孔2の体積割合が大きくなると、骨芽細胞等の生体組織が侵入し易くなる一方で生体吸収性インプラント1の機械的強度が低下し易くなる。また、大径気孔2の体積割合が小さくなると、生体吸収性インプラント1の機械的強度が高くなる一方で大径気孔2同士が連通し難くなり、生体組織が侵入し難くなる。これらの観点から、大径気孔2の全気孔に対する体積割合は、50%以上80%未満であるのが好ましく、70%以上80%未満であるのがより好ましい。
【0024】
前記大径気孔2は、その大部分が隣接する大径気孔2と連通し、大径気孔2同士を連通する連通部9の径が40μm以上であるのが好ましい。連通部9の径の上限値は、通常大径気孔2の径の上限値となる。連通部9の径が40μm以上であると、骨芽細胞等の生体組織が生体吸収性インプラント1の内部まで侵入し易く、速やかに生体組織が形成される。
【0025】
生体吸収性インプラント1は、その気孔率が40%以上55%未満であるのが好ましく、40%以上50%未満であるのがより好ましい。気孔率が前記範囲内であると、生体内への補填作業過程や補填後に生体吸収性インプラント1が損壊するのを防ぐことができ、また骨芽細胞等の生体組織を生体吸収性インプラント1の内部に侵入させるための気孔及び連通部9を確保することができる。
【0026】
前記大径気孔2の平均気孔径は、通常、後述する可燃性有機粒子の平均粒径より小さい値となる。後述するように、可燃性有機粒子は焼成工程において焼失してしまい、焼失した部分が大径気孔2となる。焼成工程において可燃性有機粒子と生体吸収性セラミックスの粒子とにより形成される成形体を焼成すると体積収縮が生じる。したがって、可燃性有機粒子が焼失した後に形成された大径気孔2の体積は、可燃性有機粒子の体積より通常小さくなる。また、後述する可燃性有機粒子の形状が球状である場合には、球状の大径気孔2が形成され易い。生体吸収性インプラント1の大径気孔2の平均気孔径を測定する場合には、例えば、生体吸収性インプラント1を樹脂に埋包した後、研磨して断面を出し、この断面を走査型電子顕微鏡等で観察し、視野にあるすべての気孔についてそれぞれ円を想定して直径を測定し、これらの測定値の算術平均から求めることができる。
【0027】
また、前記微細気孔5の全気孔に対する体積割合及び連通部9の径は、水銀ポロシメータを用いて測定することができる。この生体吸収性インプラント1の孔径を水銀ポロシメータで測定すると、細孔分布において孔径が10μm以下と10μm以上とに2つのピークが現れる。微細気孔5の全気孔体積に対する体積割合は、細孔分布における孔径5μm未満の微細気孔5を積算して得られる体積割合を全気孔率で除することにより、算出される。全気孔率は、生体吸収性インプラント1の質量及び体積から算出される見掛け密度と生体吸収性セラミックスの組成から求められる理論密度とから、式:(1−見掛け密度/理論密度)×100%により、算出される。連通部9の径は、細孔分布において孔径が10μm以上に現れるピークの孔径で表され、ピークトップに対応する孔径が40μm以上であるのが好ましい。
【0028】
前記生体吸収性インプラント1は、その圧縮強度が5MPa以上であるのが好ましく、8MPa以上であるのがより好ましい。圧縮強度が5MPa以上であると、生体内への補填作業過程で容易に損壊することなくハンドリング性に優れ、あらゆる補填部位に様々な態様で使用することができる。
【0029】
前記圧縮強度は、直径10mm×高さ10mmの円柱体を成す試験体を作製し、この試験体をロードセルを用いて0.5mm/minの速さで圧縮応力を負荷して、応力−ひずみ曲線を作成し、この曲線において応力が最大となった点から算出される。
【0030】
前記生体吸収性セラミックスは、生体内で分解及び吸収され、体に害を及ぼさないセラミックスである限り特に限定されず、例えば、β−リン酸三カルシウム(β−TCP)、α−リン酸三カルシウム(α−TCP)、リン酸一カルシウム一水和物(MCPM)、無水リン酸一カルシウム(MCPA)、リン酸二カルシウム二水和物(DCPD)、無水リン酸二カルシウム(DCPA)、リン酸八カルシウム(OCP)、リン酸四カルシウム(TTCP)等を挙げることができ、これらのセラミックスのうち2種以上が共存するセラミックスであっても良い。これらの中でも吸収速度の観点からβ−リン酸三カルシウムが好ましい。
【0031】
前記生体吸収性インプラント1の形状は特に限定されず、生体内の補填される部位等に応じて所望の形状に製造される。前記生体吸収性インプラント1の形状は、補填される部位の形状と同様の形状、又は、この形状に相当する形状例えば相似形等が挙げられ、具体的には、顆粒状又は粒状、粉末状、繊維状、ブロック状又はフィルム状等が挙げられる。
【0032】
次に、この生体吸収性インプラント1を製造することのできる製造方法の一例を説明する。
【0033】
この発明に係る生体吸収性インプラント1の製造方法は、生体吸収性セラミックスの顆粒を調製する顆粒調製工程と、前記顆粒調製工程で得られた顆粒と可燃性有機粒子とを混合して顆粒混合物を得る顆粒混合工程と、前記顆粒混合工程で得られた顆粒混合物をプレス成形して成形体を得る成形工程と、前記成形工程で得られた成形体を焼成する焼成工程と、を含み、前記顆粒のタップ充填密度が、前記生体吸収性セラミックスの組成から求められる理論密度の20%以上30%未満であることを特徴とする。
【0034】
この発明に係る生体吸収性インプラント1の製造方法では、まず顆粒調製工程として生体吸収性セラミックスの顆粒を調製する。生体吸収性セラミックスの顆粒を調製するための原料としては、前述した生体吸収性セラミックスを使用することができ、吸収速度の観点からβ−TCPが好ましい。この原料の比表面積は3.5m2/g以上であるのが好ましい。原料の比表面積が3.5m2/g以上であると、原料粉末の焼結性が良好となり、製造された生体吸収性インプラント1における骨格部3の表面に生体吸収性セラミックスの粒子が互いに接して配列された表面層6が形成され易くなり、生体内への補填作業過程で損壊し難い生体吸収性インプラント1を製造することができる。なお、原料の比表面積は、比表面積測定装置により測定することができる。
【0035】
原料から顆粒を調製する方法は、顆粒が調製される限り特に限定されず、下方から熱風を送り原料粉体を流動状態に保持しつつバインダ溶液を噴霧することにより原料粉体を凝集造粒させる流動層造粒、原料粉体を撹拌混合しつつバインダ溶液を添加することにより造粒させる撹拌造粒、原料粉体を圧縮成形して顆粒を得る圧縮造粒等を挙げることができる。これらの中でも流動層造粒は、平均粒径が数百μmの球状の顆粒を増産できる点で好ましい。流動層造粒及び撹拌造粒において使用されるバインダ溶液は、顆粒を調製することができる限り特に限定されず、例えばポリビニルアルコール、ポリエリレングリコール、及びアクリル酸、メタクリル酸、アクリルアミド等のポリマーを水に溶解した水溶液を挙げることができる。
【0036】
調製される顆粒のタップ充填密度は、前記生体吸収性セラミックスの組成から求められる理論密度の20%以上30%未満である。顆粒のタップ充填密度が理論密度の20%以上30%未満であると、製造された生体吸収性インプラント1における骨格部3の内部に、水銀ポロシメータで測定した細孔分布における孔径5μm未満の微細気孔5が、全気孔の20%以上の体積割合に形成され易くなる。顆粒のタップ充填密度が理論密度の20%より小さいと顆粒混合工程や成形工程において顆粒が潰れ易く、緻密な骨格部3を有する多孔体4が形成され易く、生体内において速やかに分解及び吸収され難くなる。また顆粒のタップ充填密度が理論密度の30%以上であると微細気孔5が全気孔の20%以上の体積割合に形成され難くなり、その結果緻密な骨格部3を有する多孔体4が形成され易く、生体内において速やかに分解及び吸収され難くなる。なお、タップ充填密度は、メスシリンダーに所定量の顆粒を入れ、体積が変化しなくなるまで機械的にタッピングし、メスシリンダーに充填された顆粒の体積を測定し、この体積で顆粒重量を割ることにより算出することができる。
【0037】
この顆粒調製工程において調製される顆粒は、略球状であり、通常顆粒と称される程度の大きさであれば良く、例えば直径が0.05〜1mm程度の大きさであり、50%積算粒子径(メジアン径)が100μm以上300μm未満であるのが好ましい。顆粒の50%積算粒子径が100μm以上300μm未満であると、大径気孔2の気孔連通性と機械的強度とを両立出来るため、好適である。顆粒の50%積算粒子径が100μm未満であると可燃性有機粒子同士の隙間に顆粒が入り込み、気孔が分断され易くなるため、大径気孔2同士が連通し難くなるおそれがある。また、顆粒の50%積算粒子径が300μm以上であると骨格部3が脆くなり、機械的強度が低下するおそれがある。顆粒のタップ充填密度及び顆粒の粒径は、造粒の条件を調整することにより調製することができる。
【0038】
次いで、顆粒混合工程として、前記顆粒調製工程で得られた顆粒と可燃性有機粒子とを混合して顆粒混合物を得る。
【0039】
顆粒と可燃性有機粒子との混合方法は均一な顆粒混合物が得られる限り特に限定されず、乾式混合及び湿式混合のいずれで行っても良く、顆粒の形態維持の観点から乾式混合が好ましい。
【0040】
可燃性有機粒子は、焼成工程において焼成残渣のない有機物により形成される粒子である限り特に限定されず、例えばアクリル樹脂、メタクリル樹脂、ポリスチレン樹脂等により形成される略球状のビーズを挙げることができる。
【0041】
可燃性有機粒子は、略球状であり、その粒子径が前記顆粒と同程度であるのが良く、50%積算粒子径が100μm以上300μm未満であるのが好ましい。可燃性有機粒子は、焼成工程を経て消失し、生体吸収性インプラント1における大径気孔2を形成する。したがって、可燃性有機粒子の径を変化させることにより、大径気孔2の平均気孔径及び大径気孔2同士が連通する連通部9の径を調整することができ、可燃性有機粒子の50%積算粒子径が100μm以上300μm未満であると、大径気孔2の平均気孔径が100μm以上200μm以下で、連通部9の径が40μm以上の生体吸収性インプラント1が製造され易くなる。
【0042】
前記可燃性有機粒子の前記顆粒混合物に対する体積割合は特に限定されないが、40%以上55%未満であるのが好ましく、40%以上50%未満であるのがより好ましい。可燃性有機粒子は後述する焼成工程で焼失してしまい、生体吸収性インプラント1における大径気孔2を形成する。焼成工程において可燃性有機粒子と生体吸収性セラミックスの粒子とにより形成される成形体を焼成すると体積収縮が生じるので、大径気孔2の体積は可燃性有機粒子の体積より通常小さくなる。一方、生体吸収性インプラント1の気孔率はこの大径気孔2の体積割合の影響を受け、大径気孔2を形成する可燃性有機粒子の前記顆粒混合物に対する体積割合が40%以上55%未満であると、40%以上55%未満の気孔率を有する生体吸収性インプラント1が製造され易くなる。
【0043】
次いで、成形工程として、前記顆粒混合工程で得られた顆粒混合物をプレス成形して成形体を得る。
【0044】
プレス成形としては、所望の形状に成形することができる限り特に限定されず、例えば金型プレス、ラバープレス、水中プレス等を挙げることができる。プレス成形の圧力は、100kg/cm2以上400kg/cm2未満であるのが好ましい。プレス成形の圧力が前記範囲内であると、顆粒を潰すことなく顆粒と可燃性有機粒子とが密に充填された成形体が得られるので、所望の機械的強度を有し、また前述したように多数の微細気孔5を有する骨格部3を備えた生体吸収性インプラント1が得られる。プレス成形の圧力が100kg/cm2未満であると、充分な充填密度を有する成形体が得られないおそれがあり、そのため所望の機械的強度を有する生体吸収性インプラント1が得られないおそれがある。またプレス成形の圧力が400kg/cm2以上であると、成形工程において顆粒が潰れてしまうおそれがあり、顆粒が潰れてしまうと製造される生体吸収性インプラント1における骨格部3が緻密になってしまい、微細気孔5が減少し、生体内で速やかに分解及び吸収され難くなるおそれがある。このように従来よりも低い圧力で成形することで、原料を潰すことなく、原料同士が密に接触した成形体を形成することができるので、前述したように多数の微細気孔5を有する骨格部3が得られ易くなる。
【0045】
次いで、焼成工程として、前記成形工程で得られた成形体を焼成する。
【0046】
前記成形体の焼成方法は特に限定されないが、前記成形体をまず200〜500℃に加熱して可燃性有機粒子を焼成除去し、脱脂した後に、前記生体吸収性セラミックスが相転移又は分解する温度未満、かつ相転移又は分解する温度より100℃低い温度以上、例えば1080〜1150℃で、30分〜5時間の間焼成するのが好ましい。成形体の焼成温度が前記範囲内であると、前述したように、全気孔に対する体積割合が20%以上である微細気孔5及び生体吸収性セラミックスの粒子が互いに接して配列され、硬い殻を形成する表面層6を備えた骨格部3を有する生体吸収性インプラント1を製造し易い。前記生体吸収性セラミックスが相転移又は分解する温度以上の温度で成形体を焼成すると、成形体を構成する生体吸収性セラミックスが相転移又は分解することにより、体積膨張が生じ、そのため骨格部3に形成される気孔の気孔径の拡大、気孔率の上昇及びクラックが発生し、生体吸収性インプラント1の機械的強度が低下するおそれがある。また、前記生体吸収性セラミックスが相転移又は分解する温度より100℃低い温度未満の温度で成形体を焼成すると、顆粒同士及び顆粒内の原料粒子同士の結合が充分に行われず、原料粒子が脱落するおそれがあり、また、骨格部3の表面が十分に焼結されないことにより生体吸収性セラミックスの粒子が緻密に敷き詰められた表面層6が形成されないおそれがあり、その結果得られた生体吸収性インプラント1の機械的強度が低下するおそれがある。
【0047】
このように成形体が焼成されることにより、成形体における可燃性有機粒子が消失して大径気孔2を形成し、また大径気孔2同士の間に骨格部3が形成され、この骨格部3は多数の微細気孔5を有し、骨格部3の表面に表面層6が形成された生体吸収性インプラント1が得られる。こうしてこの発明に係る生体吸収性インプラント1が形成される。
【0048】
この発明に係る生体吸収性インプラント及び生体吸収性インプラントの製造方法は、前記した例に限定されることはなく、本願発明の目的を達成することができる範囲において、種々の変更が可能である。
【実施例】
【0049】
<生体吸収性インプラントの製造>
(顆粒調製工程)
生体吸収性セラミックスであるβ−リン酸三カルシウム(β−TCP)の粉末(比表面積:4.0m2/g)を原料として流動層造粒により略球状の顆粒を調製した。このとき、バインダ水溶液として8質量%ポリビニルアルコール水溶液を使用し、造粒の条件を変化させることにより、表1及び2に示すように、顆粒の50%積算粒子径、顆粒の理論密度に対するタップ充填密度の比率の異なる種々の顆粒を調製した。なお、β−TCPの粉末の比表面積は比表面積測定装置(Mountech社製MacSorb HM)により測定した。顆粒の50%積算粒子径は、9段重ねの篩を用いて篩に残った顆粒の質量を測定し、粒径の小さい方から質量を積算して全質量の50%になる粒子径を求めた。顆粒のタップ充填密度は、容積20ccのメスシリンダーに10g前後の顆粒を入れ、5cmの高さから垂直に落とすタッピング操作を500回行い、顆粒の体積の変化が認められないことを確認した後に体積を読み取り、顆粒の質量を顆粒の体積で除することにより算出した。このとき、顆粒の理論密度を3.07g/cm2として、顆粒の理論密度に対するタップ充填密度の比率を算出した。
【0050】
(顆粒混合工程)
可燃性有機粒子である球状のブチルメタクリレートを準備し、この粒子と得られた顆粒とを均一になるように混合して顆粒混合物を得た。このとき、表1及び2に示すように、ブチルメタクリレートの粒子については、50%積算粒子径の異なる種々の粒子を使用し、また顆粒に対する混合割合も変化させた。ブチルメタクリレートの粒子の50%積算粒子径は、顆粒と同様にして求めた。
【0051】
(成形工程)
得られた顆粒混合物を金型に充填し、プレス成形して円柱状の成形体を得た。このとき、表1及び2に示すように、プレス成形の圧力を変化させた。
【0052】
(焼成工程)
得られた成形体を220℃で3時間、450℃で2時間脱脂し、その後昇温速度100℃/時間で1000℃又は1100℃まで昇温し、この温度に維持したまま3時間焼成し、生体吸収性インプラントを製造した。
【0053】
<評価>
(気孔率)
生体吸収性インプラントの質量及び寸法により算出される体積から見掛け密度を算出した。この見掛け密度とβ−TCPの理論密度3.07g/cm2とから気孔率を算出した。
(水銀ポロシメータ)
得られた生体吸収性インプラントを水銀ポロシメータ(マイクロメリティックス社製オートポアIV9510)を用いて細孔分布を測定した。いずれの生体吸収性インプラントについても、細孔分布において孔径が10μm以下と10μm以上とに2つのピークが現れた。孔径5μm未満の微細気孔を積算して得られる体積割合を気孔率で除して、微細気孔の全気孔に対する割合を算出した。
また、10μm以上に現れたピークトップに対応する孔径を大径気孔の連通部の径とした。
【0054】
(走査型電子顕微鏡)
得られた生体吸収性インプラントを樹脂に埋包した後、研磨して断面を出し、この断面を走査型電子顕微鏡(日本電子株式会社製JSM−6460LA)で観察し(50倍)、視野にあるすべての気孔についてそれぞれ円を想定して直径を測定し、これらの測定値の算術平均を、大径気孔の平均気孔径とした。
また、表1及び2における試験番号1の生体吸収性インプラントを走査型顕微鏡で観察し(1000倍)、撮影した骨格部の断面写真を図2に示す。図2に示されるように、骨格部の断面である中央部分には複数の微細気孔が存在し、骨格部の内部は微細気孔が多数存在しているのが観察された。また、骨格部の表面はβ−TCPの粒子同士が接して配列され、石垣状に敷き詰められ、硬い殻を形成しているのが観察された。図2に示す生体吸収性インプラントの中央部分を5000倍に拡大して撮影した写真を図3に示す。図3に示されるように、骨格部の内部には1〜5μm程度の微細気孔が多数存在しているのが観察された。図2に示す生体吸収性インプラントの中央部分の周囲を5000倍に拡大して撮影した写真を図4に示す。中央部分の周囲は表面層であり、図4に示されるように、直径1〜5μm程度のβ−TCPの粒子が密に敷き詰めされているのが観察された。図2に示されるように、表面層はβ−TCPの粒子1〜2個分程度すなわち1〜10μm程度の厚みを有していた。
【0055】
(圧縮強度)
直径10mm、高さ10mmの円柱体を成す生体吸収性インプラントの試験体を作製し、この試験体をロードセルを用いて0.5mm/minの速さで圧縮応力を負荷して、応力−ひずみ曲線を作成し、この曲線において応力が最大となった点を、圧縮強度とした。
【0056】
(総合評価)
表1及び2における総合評価は以下の基準にしたがって行った。
×:平均気孔径が100μm以上200μm以下を満たすが、微細気孔の全気孔に対する割合が20%以上を満たさないとき
○:平均気孔径が100μm以上200μm以下、微細気孔の全気孔に対する割合が20%以上を満たすが、連通部の径が40μm以上、気孔率が40%以上55%未満、圧縮強度が5MPa以上の少なくとも1項目を満たさないとき
◎:平均気孔径が100μm以上200μm以下、微細気孔の全気孔に対する割合が20%以上、連通部の径が40μm以上を満たし、気孔率が50%以上55%未満又は圧縮強度が5MPa以上8MPa未満であるとき
☆:気孔率が40%以上50%未満、大径気孔の平均気孔径が100μm以上200μm未満、微細気孔の全気孔に対する割合が20%以上、連通部の径が40μm以上、圧縮強度が5MPa以上のすべてを満たしているとき
【0057】
【表1】

【0058】
【表2】

【0059】
この発明に係る生体吸収性インプラントの範囲に含まれる試験番号1〜13、16の生体吸収性インプラントは、大径気孔の平均気孔径が100μm以上200μm未満であるので、骨芽細胞等の生体組織が進入し易く、速やかに生体組織が形成され、また微細気孔の全気孔に対する割合が20%以上であるので、生体内で分解及び吸収され、速やかに生体組織に置換されると判断される。また、図2〜4に例示されるように、これらの生体吸収性インプラントは骨格部の表面にβ−TCPの粒子同士が接して配列された表面層を有しているので、生体内への補填作業時に損壊するのを防止することができ、良好なハンドリング性を有すると判断される。
【符号の説明】
【0060】
1 生体吸収性インプラント
2 大径気孔
3 骨格部
4 多孔体
5 微細気孔
6 表面層
7 開気孔
8 独立気孔
9 連通部
【特許請求の範囲】
【請求項1】
複数の大径気孔が分布することにより、前記大径気孔同士の間に形成される骨格部を有する多孔体であり、
前記大径気孔はその平均気孔径が100μm以上200μm以下であり、
前記骨格部は、生体吸収性セラミックスからなり、水銀ポロシメータで測定した細孔分布における孔径5μm未満の微細気孔の全気孔に対する体積割合が20%以上であり、その表面に前記生体吸収性セラミックスの粒子が互いに接して配列された表面層を有することを特徴とする生体吸収性インプラント。
【請求項2】
前記大径気孔同士を連通する連通部の径が40μm以上であり、気孔率が40%以上55%未満であり、圧縮強度が5MPa以上であることを特徴とする請求項1に記載の生体吸収性インプラント。
【請求項3】
前記気孔率が40%以上50%未満であり、圧縮強度が8MPa以上であることを特徴とする請求項1又は2に記載の生体吸収性インプラント。
【請求項4】
前記生体吸収性セラミックスが、β−リン酸三カルシウムであることを特徴とする請求項1〜3のいずれか1項に記載の生体吸収性インプラント。
【請求項5】
生体吸収性セラミックスの顆粒を調製する顆粒調製工程と、
前記顆粒調製工程で得られた顆粒と可燃性有機粒子とを混合して顆粒混合物を得る顆粒混合工程と、
前記顆粒混合工程で得られた顆粒混合物をプレス成形して成形体を得る成形工程と、
前記成形工程で得られた成形体を焼成する焼成工程と、
を含み、
前記顆粒のタップ充填密度が、前記生体吸収性セラミックスの組成から求められる理論密度の20%以上30%未満であることを特徴とする生体吸収性インプラントの製造方法。
【請求項6】
前記顆粒の50%積算粒子径及び前記可燃性有機粒子の50%積算粒子径が、それぞれ100μm以上300μm未満であることを特徴とする請求項5に記載の生体吸収性インプラントの製造方法。
【請求項7】
前記可燃性有機粒子の前記顆粒混合物に対する体積割合が40%以上55%未満であることを特徴とする請求項5又は6に記載の生体吸収性インプラントの製造方法。
【請求項8】
前記可燃性有機粒子の前記顆粒混合物に対する体積割合が40%以上50%未満であることを特徴とする請求項5〜7のいずれか1項に記載の生体吸収性インプラントの製造方法。
【請求項9】
前記プレス成形の圧力が100kg/cm2以上400kg/cm2未満であることを特徴とする請求項5〜8のいずれか1項に記載の生体吸収性インプラントの製造方法。
【請求項10】
前記焼成工程における焼成温度は、前記生体吸収性セラミックスが相転移又は分解する温度未満、かつ相転移又は分解する温度より100℃低い温度以上であることを特徴とする請求項5〜9のいずれか1項に記載の生体吸収性インプラントの製造方法。
【請求項1】
複数の大径気孔が分布することにより、前記大径気孔同士の間に形成される骨格部を有する多孔体であり、
前記大径気孔はその平均気孔径が100μm以上200μm以下であり、
前記骨格部は、生体吸収性セラミックスからなり、水銀ポロシメータで測定した細孔分布における孔径5μm未満の微細気孔の全気孔に対する体積割合が20%以上であり、その表面に前記生体吸収性セラミックスの粒子が互いに接して配列された表面層を有することを特徴とする生体吸収性インプラント。
【請求項2】
前記大径気孔同士を連通する連通部の径が40μm以上であり、気孔率が40%以上55%未満であり、圧縮強度が5MPa以上であることを特徴とする請求項1に記載の生体吸収性インプラント。
【請求項3】
前記気孔率が40%以上50%未満であり、圧縮強度が8MPa以上であることを特徴とする請求項1又は2に記載の生体吸収性インプラント。
【請求項4】
前記生体吸収性セラミックスが、β−リン酸三カルシウムであることを特徴とする請求項1〜3のいずれか1項に記載の生体吸収性インプラント。
【請求項5】
生体吸収性セラミックスの顆粒を調製する顆粒調製工程と、
前記顆粒調製工程で得られた顆粒と可燃性有機粒子とを混合して顆粒混合物を得る顆粒混合工程と、
前記顆粒混合工程で得られた顆粒混合物をプレス成形して成形体を得る成形工程と、
前記成形工程で得られた成形体を焼成する焼成工程と、
を含み、
前記顆粒のタップ充填密度が、前記生体吸収性セラミックスの組成から求められる理論密度の20%以上30%未満であることを特徴とする生体吸収性インプラントの製造方法。
【請求項6】
前記顆粒の50%積算粒子径及び前記可燃性有機粒子の50%積算粒子径が、それぞれ100μm以上300μm未満であることを特徴とする請求項5に記載の生体吸収性インプラントの製造方法。
【請求項7】
前記可燃性有機粒子の前記顆粒混合物に対する体積割合が40%以上55%未満であることを特徴とする請求項5又は6に記載の生体吸収性インプラントの製造方法。
【請求項8】
前記可燃性有機粒子の前記顆粒混合物に対する体積割合が40%以上50%未満であることを特徴とする請求項5〜7のいずれか1項に記載の生体吸収性インプラントの製造方法。
【請求項9】
前記プレス成形の圧力が100kg/cm2以上400kg/cm2未満であることを特徴とする請求項5〜8のいずれか1項に記載の生体吸収性インプラントの製造方法。
【請求項10】
前記焼成工程における焼成温度は、前記生体吸収性セラミックスが相転移又は分解する温度未満、かつ相転移又は分解する温度より100℃低い温度以上であることを特徴とする請求項5〜9のいずれか1項に記載の生体吸収性インプラントの製造方法。
【図1】


【図2】


【図3】


【図4】




【図2】


【図3】


【図4】


【公開番号】特開2013−70724(P2013−70724A)
【公開日】平成25年4月22日(2013.4.22)
【国際特許分類】
【出願番号】特願2011−210180(P2011−210180)
【出願日】平成23年9月27日(2011.9.27)
【出願人】(000004547)日本特殊陶業株式会社 (2,912)
【Fターム(参考)】
【公開日】平成25年4月22日(2013.4.22)
【国際特許分類】
【出願日】平成23年9月27日(2011.9.27)
【出願人】(000004547)日本特殊陶業株式会社 (2,912)
【Fターム(参考)】
[ Back to top ]

