生体成分を化学修飾する方法
【課題】マーカー探索に利用できる定量的なシアロ糖鎖のアミド化方法を提供する。
【解決手段】シアロ糖鎖と求核剤とを混合し、これに縮合剤を添加して行われるシアル酸残基のカルボキシル基のアミド化方法において、前記縮合反応を、pH3以下で行うことを特徴とするものであり、好ましい求核剤及び縮合剤として、それぞれ、ヒドラジド基を有する化合物及びカルボジイミドが用いられる。生体成分を化学修飾することで、従来困難であった質量分析法によるシアロ糖鎖の高感度かつ定量的な検出、及びシアロ糖鎖を有するバイオマーカーの比較定量解析が可能となる。
【解決手段】シアロ糖鎖と求核剤とを混合し、これに縮合剤を添加して行われるシアル酸残基のカルボキシル基のアミド化方法において、前記縮合反応を、pH3以下で行うことを特徴とするものであり、好ましい求核剤及び縮合剤として、それぞれ、ヒドラジド基を有する化合物及びカルボジイミドが用いられる。生体成分を化学修飾することで、従来困難であった質量分析法によるシアロ糖鎖の高感度かつ定量的な検出、及びシアロ糖鎖を有するバイオマーカーの比較定量解析が可能となる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、生体成分の質量分析における解析感度を向上させる技術に関し、より詳しくは、生体成分であるシアロ糖鎖を化学修飾することにより、解析感度を向上させる技術に関する。
【背景技術】
【0002】
シアロ糖鎖を有するタンパク質は、癌などの疾患との関連が示唆された新たな診断マーカーとしての可能性が注目されている。
マーカー探索を目的として、該シアロ糖鎖を鋭敏に検出するのに質量分析法は有力な手段となるが、シアル酸は不安定であり分解し易いので、安定化するために、化学修飾した後に分析する方法が利用されている。
【0003】
こうした化学修飾法の例としては、完全メチル化、エステル化、アミド化が挙げられる。
完全メチル化は、強アルカリ条件で行うため、O−アセチル基を持つ糖鎖は分解される。また、カルボン酸以外にヒドロキシル基もメチル化するため、もともとO−メチル基を一部に持つ糖鎖の場合は、メチル化されている部位の特定が不可能となる。
またエステル誘導体はアミド誘導体に比べ加水分解されやすく、また近傍のヒドロキシル基との間でラクトンを形成し易い。
【0004】
これらの点から、マーカー探索を目的とした修飾としてはアミド化が有望な手法であるが(特許文献1、非特許文献1参照)、シアル酸の結合位置によって、アミド化効率が異なり、反応性の低い結合位置の場合には、アミド化ができないという問題がある。
すなわち、一般的にカルボジイミドを用いたアミド化は、カルボジイミドそのものの反応性が高いpH3.5〜4.5付近で行われる。このpHよりも高い場合は、反応性が低くなり、またこのpHより低い場合はカルボジイミドが不安定になり分解されることが報告されている(非特許文献3)。しかし、この条件では反応性の低い結合位置の場合には、アミド化ができない。
以上のとおり、マーカー探索に利用できる定量的なシアロ糖鎖の修飾法がないのが現状である。
【特許文献1】特開2005−148054号公報
【非特許文献1】Sekiya S, Wada Y, Tanaka K. Derivatization for stabilizing sialic acids in MALDI-MS. Anal Chem. 2005 Aug 1;77(15):4962-8.
【非特許文献3】Nakajima N, Ikada Y. Mechanism of amide formation by carbodiimide for bioconjugation in aqueous media. Bioconugate Chem. 1995 6. 123-30.
【発明の開示】
【発明が解決しようとする課題】
【0005】
シアロ糖鎖は、リンケージによって化学反応性が異なることが知られているが、シアロ糖鎖を有するバイオマーカー探索において、反応性の低いシアル酸リンケージをも完全に修飾できれば、比較定量解析が可能になると考えられる。
本発明は、以上のような事情に鑑みてなされたものであって、マーカー探索に利用できる定量的なシアロ糖鎖の修飾法を提供することを目的とするものである。
【課題を解決するための手段】
【0006】
既知の方法でアミド化が可能なシアル酸のリンケージは、α2−6シアル酸であって、該シアル酸を有する糖鎖を、求核剤としてアミノ基を有する化合物である塩化アンモニウムと混合し、縮合剤である4-(4,6-ジメトキシ-1,3,5-トリアジン-2イル)-4-メチルモルホリニウムクロライドを添加する方法が採用されている。
本発明者らは、反応性の低いシアル酸リンケージを完全に修飾できる方法について鋭意検討した結果、生体試料を水に溶解し、求核剤を添加した後、pHを酸性側の適切な値に調節し、過剰量の縮合剤を添加し、一定時間攪拌または放置することにより、反応性の低いシアル酸部分を化学修飾できるという知見を得た。
【0007】
本発明は、これらの知見に基づいて完成に至ったものであり、以下のとおりのものである。
(1)シアロ糖鎖と求核剤を混合した後、pHを3以下に調節し、これに縮合剤を添加して、シアロ糖鎖のカルボキシル基をアミド化することを特徴とするシアロ糖鎖のアミド化方法。
(2)前記求核剤が、ヒドラジド基を有する化合物であることを特徴とする請求項1に記載のシアロ糖鎖のアミド化方法。
(3)前記縮合剤が、カルボジイミドであることを特徴とする請求項1に記載のシアロ糖鎖のアミド化方法。
(4)前記シアロ糖鎖が、α2−3シアル酸を有する糖鎖を含有することを特徴とする請求項1〜3のいずれか1項に記載の方法。
【発明の効果】
【0008】
本発明の方法により、生体成分を化学修飾することで、従来困難であった質量分析法によるシアロ糖鎖の高感度かつ定量的な検出、及びシアロ糖鎖を有するバイオマーカーの比較定量解析が可能となる。
【発明を実施するための最良の形態】
【0009】
以下、本発明のシアロ糖鎖のアミド化方法について説明する。
本発明におけるシアル酸残基のカルボキシル基のアミド化方法は、シアロ糖鎖と求核剤とを混合し、これに縮合剤を添加して行われる。
本発明は、前記縮合反応を、pH3以下で行うことを特徴とするものであり、好ましくはpH2〜3で行う。
なお、試料中に、α2−6等の、反応性の低くないシアル酸リンケージと、α2−3等の、反応性の低いシアル酸リンケージが混在する場合には、あらかじめ通常の条件で修飾反応を実施した後、続いて本発明の方法でアミド化を行っても良い。
【0010】
本発明において、求核剤としては、ヒドラジド基を有する化合物が用いられるが、該ヒドラジド基を有する化合物としては、好ましくは、アセトヒドラジドが用いられる。求核剤として用いる化合物がかさ高くなると、縮合反応における収率が低下するため好ましくない。よって、小さなヒドラジド体、特に、アセトヒドラジドを用いるのが好ましい。
【0011】
また、本発明において、縮合剤としては、カルボジイミド類が用いられるが、修飾する分子が親水性に富むシアロ糖鎖であるため、反応は水系がより好ましい。よって、該縮合剤としては、水溶性のカルボジイミド、特に、1-エチル-3-(3-ジメチルアミノプロピル)カルボジイミド塩酸塩(以下、「EDAC」と記す。)を用いるのが好ましい。
【0012】
以下、本発明を実施例によってさらに具体的に説明するが、本発明はこれらによって何ら限定されるものではない。
(参考例:既知の方法による、リンケージの異なるシアロ糖鎖のアミド化)
既知のアミド化法によるシアル酸のアミド化をまず示す。リンケージの異なるシアロ糖鎖について、既知の方法によるアミド化を行った。
このアミド化法は、アミノ基を有する化合物である塩化アンモニウムと、シアル酸を有する糖鎖を混合し、縮合剤である4-(4,6-ジメトキシ-1,3,5-トリアジン-2イル)-4-メチルモルホリニウムクロライドを添加する方法であり、この方法でアミド化が可能なシアル酸のリンケージは、α2−6シアル酸が報告されている。
【0013】
そこで、末端にα2−6シアル酸を2つ有する蛍光標識したN型2本鎖糖鎖(下記の式(A))を修飾反応のコントロールとして用いた。
リンケージの異なるシアロ化糖鎖の比較は、末端にα2−6シアル酸を1つ有する蛍光標識したN型2本鎖糖鎖(下記の式(B))、及び末端にα2−3シアル酸を1つ有する蛍光標識したN型2本鎖糖鎖(下記の式(C))を用いた。糖鎖BとCはシアル酸のリンケージのみが異なる位置異性体である。
【0014】
【化1】

【0015】
最初に、糖鎖A(4pmol)と糖鎖B(4pmol)の混合物を既知の方法でアミド化し、逆相高速液体クロマトグラフ(以下、「HPLC」と記す。)に供したところ、図1の上段に示すように、2つのピーク(ピーク1、2)がみられた。
これらの2つのピーク1、2を質量分析法(以下、「MS」と記す。)に供したところ、質量電荷比(以下、「m/z値」と記す。)がそれぞれ2031.95、2322.21であり、順に糖鎖A、Bがアミド化されNaイオンが付加した質量数(2031.75、2321.86)に一致した。
よって、α2−6シアル酸含有糖鎖は容易にアミド化されることを確認した。このことは過去の知見とも一致する。
【0016】
次に糖鎖A(4pmol)と糖鎖C(4pmol)の混合物を用いて同様にアミド化し、逆相HPLCに供したところ、図1の下段に示すように、ピークが3つ(ピーク3、4、5)みられた。
これらのピーク3、4、5をMSに供したところ、m/z値がそれぞれ2031.96、2321.94、2054.71であり、順にアミド化された糖CにNaイオンが付加した質量数(2031.75)、アミド化された糖鎖AにNaイオンが付加した質量数(2321.86)、未反応の糖鎖CにNaイオンが2個付加した質量数(2054.71)に一致した。シアル酸が修飾されていない糖鎖はNaイオンがシアル酸の数と同じ数だけ余分に付加することが知られている。
未反応の糖鎖Cがみられること、糖鎖Cのアミド化されたものが、わずかしかみられないことより、α2−3シアル酸含有糖鎖のアミド化は効率の悪いことが確認された。
このときの反応は、糖鎖Aがほぼ完全にアミド化されていることから、アミド化反応そのものが不十分である可能性はないと判断される。
したがって、これらの結果より、既知のアミド化法が、シアル酸のリンケージにより反応性が異なることがわかる。
【0017】
以下、本発明による新たなアミド化方法を用いて、α2−3シアル酸含有糖鎖をアミド化した例を記載する。
(実施例1)
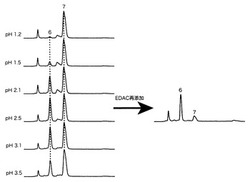
α2−3シアル酸を有する糖鎖D(上記の式(D)、4pmol)を、1Mのアセトヒドラジド溶液30μlに溶解し、HClを用いてpH3.5に合わせ、1MのEDAC溶液4μlを添加し、2時間室温で反応させた。同様に、pHをそれぞれ3.1、2.5、2.1、1.5、及び1.2に合わせた反応も行った。
反応物を逆相HPLCに供したところ、図2の左側に示すとおり、pH2.1、2.5、3.1でピーク6が顕著に高くなることが示された。
該図におけるピーク6、ピーク7を分取し、MSに供したところ、m/z値がそれぞれ790.35、712.43であり、順にアミド化された糖鎖DにNaイオンが付加した質量数(790.30)、未反応の糖鎖Dにプロトンが1個付加した質量数(712.28)に一致した。
糖鎖DのpH2.5での反応後に、さらに1MのEDAC溶液4μlを添加し2時間反応させることを2回繰り返した。得られた反応物を同様に逆相HPLCに供したところ、図2の右側に示すとおり、糖鎖Dのアミド化物に相当するピーク6が主要生成物となった。
【0018】
(実施例2)
既知のアミド化法との比較のため、つぎにN型2本鎖糖鎖A、B、Cを用いて、新たなアミド化法の検討を行った。
末端にα2−6シアル酸を2つ有する蛍光標識したN型2本鎖糖鎖(上記の式(A))を修飾反応のコントロールとして用いた。
リンケージの異なるシアロ化糖鎖の比較は、末端にα2−6シアル酸を1つ有する蛍光標識したN型2本鎖糖鎖(上記の式(B))、及び末端にα2−3シアル酸を1つ有する蛍光標識したN型2本鎖糖鎖(上記の式(C))を用いた。糖鎖BとCはシアル酸のリンケージのみが異なる位置異性体である。
最初に、前記の糖鎖A(4pmol)とB(4pmol)の混合物を、1Mのアセトヒドラジド溶液50μlに溶解し、HClを用いてpH2.5に合わせ、2MのEDAC溶液4μlを添加し、2時間室温で反応させた。その後、2MのEDAC溶液4μlを再添加し2時間室温で反応させた。さらにその後、2MのEDAC溶液4μlを再添加し2時間室温で反応させた。計6時間かけてアミド化したものを、逆相HPLCに供したところ、図3に示すとおり、2つのピーク(ピーク8、9)がみられた。
これらの2つのピークをMSに供したところm/z値がそれぞれ2088.77、 2436.14であり、順にアミド化された糖鎖BにNaイオンが付加した質量数(2088.77)、アミド化された糖鎖AにNaイオンが付加した質量数(2435.91)に一致した。
以上のとおり、α2−6シアル酸含有糖鎖はこの条件でアミド化されることが確認できた。
【0019】
次に前記の糖鎖AとCの混合物を用いて同様の方法でアミド化し、逆相HPLCに供したところ、図3に示すとおり、ピークが2つ(ピーク10、11)みられた。
これらの2つのピークをMSに供したところm/z値がそれぞれ2089.02、2435.84であり、順にアミド化された糖鎖CにNaイオンが付加した質量数(2088.77)、アミド化された糖鎖AにNaイオンが付加した質量数(2435.91)に一致した。
よって、α2−3シアル酸含有糖鎖もこの方法で容易にアミド化されることを確認した。
これらの結果から、上記で示した新たなアミド化法は、これまでアミド化が困難であった反応性の低いシアル酸も容易に修飾できることがわかる。
【0020】
(実施例3)
さらに、α2−3シアル酸の位置が異なる糖鎖E(下記の式(E))、糖鎖Eの位置異性体でありリンケージがα2−6シアル酸である糖鎖F(下記の式(F))、シアル酸が多数結合している糖鎖G(下記の式(G))についても同様にアミド化した。
【0021】
【化2】

【0022】
糖鎖EとA、糖鎖FとA、糖鎖GとAの混合物を、実施例2と同様の方法で修飾し、逆相HPLCに供したところ、それぞれ、図4の上段、中段、及び下段に示すように、ピーク12,13、ピーク14,15、及びピーク16,17を得た。
これらのピーク13、15、16のm/z値(2435.78, 2436.00, 2435.88)は、すべてアミド化された糖鎖AにNaイオンが付加した質量数(2435.91)に一致した。ピーク12、14、17 (m/z: 2088.88, 2089.01, 3496.04)は、それぞれアミド化された糖鎖E、F、GにNaイオンが付加した質量数(2088.77、2088.77、3495.30)に一致した。
これらの結果から、シアル酸の位置が異なる場合でも、シアル酸の数が多い場合でも、本発明によるアミド化法は効率よくシアル酸をアミド化できることがわかる。
【0023】
(実施例4)
α2−3シアル酸含有糖鎖を含む糖タンパク質であるFetuinの糖鎖を本発明のアミド化法を用いて解析した。Fetuinは、N型3本鎖糖鎖にシアル酸が3つ結合したものが最も含有量が多く、90%以上がα2−3シアル酸を含有している。
FetuinをPNGase F処理し、得られたN型糖鎖をピリジルアミンで標識し、実施例2と同様の方法で修飾し、MSにより解析した。
得られたMSスペクトルでは、図5に示すように、m/z値が3148.28のシグナルが最も高く、これは最も含有量の多い3本鎖糖鎖にシアル酸が3つ結合したものに相当する質量数(理論値:3148.17)に一致する。
このように、α2−3シアル酸が修飾できていることを反映する結果が得られた。
【産業上の利用可能性】
【0024】
本発明によれば、従来困難であった質量分析法によるシアロ糖鎖の高感度かつ定量的な検出、及びシアロ糖鎖を有するバイオマーカーの比較定量解析が可能となるので、疾患関連マーカーの探索、疾患診断に新たな手法を提供することができる。
【図面の簡単な説明】
【0025】
【図1】既知のアミド化反応で得られた反応物の逆相HPLCの結果を示す図
【図2】実施例1で得られた反応物の逆相HPLCの結果を示す図
【図3】実施例2で得られた反応物の逆相HPLCの結果を示す図
【図4】実施例3で得られた反応物の逆相HPLCの結果を示す図
【図5】実施例4で得られた反応物のm/z値を示す図
【技術分野】
【0001】
本発明は、生体成分の質量分析における解析感度を向上させる技術に関し、より詳しくは、生体成分であるシアロ糖鎖を化学修飾することにより、解析感度を向上させる技術に関する。
【背景技術】
【0002】
シアロ糖鎖を有するタンパク質は、癌などの疾患との関連が示唆された新たな診断マーカーとしての可能性が注目されている。
マーカー探索を目的として、該シアロ糖鎖を鋭敏に検出するのに質量分析法は有力な手段となるが、シアル酸は不安定であり分解し易いので、安定化するために、化学修飾した後に分析する方法が利用されている。
【0003】
こうした化学修飾法の例としては、完全メチル化、エステル化、アミド化が挙げられる。
完全メチル化は、強アルカリ条件で行うため、O−アセチル基を持つ糖鎖は分解される。また、カルボン酸以外にヒドロキシル基もメチル化するため、もともとO−メチル基を一部に持つ糖鎖の場合は、メチル化されている部位の特定が不可能となる。
またエステル誘導体はアミド誘導体に比べ加水分解されやすく、また近傍のヒドロキシル基との間でラクトンを形成し易い。
【0004】
これらの点から、マーカー探索を目的とした修飾としてはアミド化が有望な手法であるが(特許文献1、非特許文献1参照)、シアル酸の結合位置によって、アミド化効率が異なり、反応性の低い結合位置の場合には、アミド化ができないという問題がある。
すなわち、一般的にカルボジイミドを用いたアミド化は、カルボジイミドそのものの反応性が高いpH3.5〜4.5付近で行われる。このpHよりも高い場合は、反応性が低くなり、またこのpHより低い場合はカルボジイミドが不安定になり分解されることが報告されている(非特許文献3)。しかし、この条件では反応性の低い結合位置の場合には、アミド化ができない。
以上のとおり、マーカー探索に利用できる定量的なシアロ糖鎖の修飾法がないのが現状である。
【特許文献1】特開2005−148054号公報
【非特許文献1】Sekiya S, Wada Y, Tanaka K. Derivatization for stabilizing sialic acids in MALDI-MS. Anal Chem. 2005 Aug 1;77(15):4962-8.
【非特許文献3】Nakajima N, Ikada Y. Mechanism of amide formation by carbodiimide for bioconjugation in aqueous media. Bioconugate Chem. 1995 6. 123-30.
【発明の開示】
【発明が解決しようとする課題】
【0005】
シアロ糖鎖は、リンケージによって化学反応性が異なることが知られているが、シアロ糖鎖を有するバイオマーカー探索において、反応性の低いシアル酸リンケージをも完全に修飾できれば、比較定量解析が可能になると考えられる。
本発明は、以上のような事情に鑑みてなされたものであって、マーカー探索に利用できる定量的なシアロ糖鎖の修飾法を提供することを目的とするものである。
【課題を解決するための手段】
【0006】
既知の方法でアミド化が可能なシアル酸のリンケージは、α2−6シアル酸であって、該シアル酸を有する糖鎖を、求核剤としてアミノ基を有する化合物である塩化アンモニウムと混合し、縮合剤である4-(4,6-ジメトキシ-1,3,5-トリアジン-2イル)-4-メチルモルホリニウムクロライドを添加する方法が採用されている。
本発明者らは、反応性の低いシアル酸リンケージを完全に修飾できる方法について鋭意検討した結果、生体試料を水に溶解し、求核剤を添加した後、pHを酸性側の適切な値に調節し、過剰量の縮合剤を添加し、一定時間攪拌または放置することにより、反応性の低いシアル酸部分を化学修飾できるという知見を得た。
【0007】
本発明は、これらの知見に基づいて完成に至ったものであり、以下のとおりのものである。
(1)シアロ糖鎖と求核剤を混合した後、pHを3以下に調節し、これに縮合剤を添加して、シアロ糖鎖のカルボキシル基をアミド化することを特徴とするシアロ糖鎖のアミド化方法。
(2)前記求核剤が、ヒドラジド基を有する化合物であることを特徴とする請求項1に記載のシアロ糖鎖のアミド化方法。
(3)前記縮合剤が、カルボジイミドであることを特徴とする請求項1に記載のシアロ糖鎖のアミド化方法。
(4)前記シアロ糖鎖が、α2−3シアル酸を有する糖鎖を含有することを特徴とする請求項1〜3のいずれか1項に記載の方法。
【発明の効果】
【0008】
本発明の方法により、生体成分を化学修飾することで、従来困難であった質量分析法によるシアロ糖鎖の高感度かつ定量的な検出、及びシアロ糖鎖を有するバイオマーカーの比較定量解析が可能となる。
【発明を実施するための最良の形態】
【0009】
以下、本発明のシアロ糖鎖のアミド化方法について説明する。
本発明におけるシアル酸残基のカルボキシル基のアミド化方法は、シアロ糖鎖と求核剤とを混合し、これに縮合剤を添加して行われる。
本発明は、前記縮合反応を、pH3以下で行うことを特徴とするものであり、好ましくはpH2〜3で行う。
なお、試料中に、α2−6等の、反応性の低くないシアル酸リンケージと、α2−3等の、反応性の低いシアル酸リンケージが混在する場合には、あらかじめ通常の条件で修飾反応を実施した後、続いて本発明の方法でアミド化を行っても良い。
【0010】
本発明において、求核剤としては、ヒドラジド基を有する化合物が用いられるが、該ヒドラジド基を有する化合物としては、好ましくは、アセトヒドラジドが用いられる。求核剤として用いる化合物がかさ高くなると、縮合反応における収率が低下するため好ましくない。よって、小さなヒドラジド体、特に、アセトヒドラジドを用いるのが好ましい。
【0011】
また、本発明において、縮合剤としては、カルボジイミド類が用いられるが、修飾する分子が親水性に富むシアロ糖鎖であるため、反応は水系がより好ましい。よって、該縮合剤としては、水溶性のカルボジイミド、特に、1-エチル-3-(3-ジメチルアミノプロピル)カルボジイミド塩酸塩(以下、「EDAC」と記す。)を用いるのが好ましい。
【0012】
以下、本発明を実施例によってさらに具体的に説明するが、本発明はこれらによって何ら限定されるものではない。
(参考例:既知の方法による、リンケージの異なるシアロ糖鎖のアミド化)
既知のアミド化法によるシアル酸のアミド化をまず示す。リンケージの異なるシアロ糖鎖について、既知の方法によるアミド化を行った。
このアミド化法は、アミノ基を有する化合物である塩化アンモニウムと、シアル酸を有する糖鎖を混合し、縮合剤である4-(4,6-ジメトキシ-1,3,5-トリアジン-2イル)-4-メチルモルホリニウムクロライドを添加する方法であり、この方法でアミド化が可能なシアル酸のリンケージは、α2−6シアル酸が報告されている。
【0013】
そこで、末端にα2−6シアル酸を2つ有する蛍光標識したN型2本鎖糖鎖(下記の式(A))を修飾反応のコントロールとして用いた。
リンケージの異なるシアロ化糖鎖の比較は、末端にα2−6シアル酸を1つ有する蛍光標識したN型2本鎖糖鎖(下記の式(B))、及び末端にα2−3シアル酸を1つ有する蛍光標識したN型2本鎖糖鎖(下記の式(C))を用いた。糖鎖BとCはシアル酸のリンケージのみが異なる位置異性体である。
【0014】
【化1】

【0015】
最初に、糖鎖A(4pmol)と糖鎖B(4pmol)の混合物を既知の方法でアミド化し、逆相高速液体クロマトグラフ(以下、「HPLC」と記す。)に供したところ、図1の上段に示すように、2つのピーク(ピーク1、2)がみられた。
これらの2つのピーク1、2を質量分析法(以下、「MS」と記す。)に供したところ、質量電荷比(以下、「m/z値」と記す。)がそれぞれ2031.95、2322.21であり、順に糖鎖A、Bがアミド化されNaイオンが付加した質量数(2031.75、2321.86)に一致した。
よって、α2−6シアル酸含有糖鎖は容易にアミド化されることを確認した。このことは過去の知見とも一致する。
【0016】
次に糖鎖A(4pmol)と糖鎖C(4pmol)の混合物を用いて同様にアミド化し、逆相HPLCに供したところ、図1の下段に示すように、ピークが3つ(ピーク3、4、5)みられた。
これらのピーク3、4、5をMSに供したところ、m/z値がそれぞれ2031.96、2321.94、2054.71であり、順にアミド化された糖CにNaイオンが付加した質量数(2031.75)、アミド化された糖鎖AにNaイオンが付加した質量数(2321.86)、未反応の糖鎖CにNaイオンが2個付加した質量数(2054.71)に一致した。シアル酸が修飾されていない糖鎖はNaイオンがシアル酸の数と同じ数だけ余分に付加することが知られている。
未反応の糖鎖Cがみられること、糖鎖Cのアミド化されたものが、わずかしかみられないことより、α2−3シアル酸含有糖鎖のアミド化は効率の悪いことが確認された。
このときの反応は、糖鎖Aがほぼ完全にアミド化されていることから、アミド化反応そのものが不十分である可能性はないと判断される。
したがって、これらの結果より、既知のアミド化法が、シアル酸のリンケージにより反応性が異なることがわかる。
【0017】
以下、本発明による新たなアミド化方法を用いて、α2−3シアル酸含有糖鎖をアミド化した例を記載する。
(実施例1)
α2−3シアル酸を有する糖鎖D(上記の式(D)、4pmol)を、1Mのアセトヒドラジド溶液30μlに溶解し、HClを用いてpH3.5に合わせ、1MのEDAC溶液4μlを添加し、2時間室温で反応させた。同様に、pHをそれぞれ3.1、2.5、2.1、1.5、及び1.2に合わせた反応も行った。
反応物を逆相HPLCに供したところ、図2の左側に示すとおり、pH2.1、2.5、3.1でピーク6が顕著に高くなることが示された。
該図におけるピーク6、ピーク7を分取し、MSに供したところ、m/z値がそれぞれ790.35、712.43であり、順にアミド化された糖鎖DにNaイオンが付加した質量数(790.30)、未反応の糖鎖Dにプロトンが1個付加した質量数(712.28)に一致した。
糖鎖DのpH2.5での反応後に、さらに1MのEDAC溶液4μlを添加し2時間反応させることを2回繰り返した。得られた反応物を同様に逆相HPLCに供したところ、図2の右側に示すとおり、糖鎖Dのアミド化物に相当するピーク6が主要生成物となった。
【0018】
(実施例2)
既知のアミド化法との比較のため、つぎにN型2本鎖糖鎖A、B、Cを用いて、新たなアミド化法の検討を行った。
末端にα2−6シアル酸を2つ有する蛍光標識したN型2本鎖糖鎖(上記の式(A))を修飾反応のコントロールとして用いた。
リンケージの異なるシアロ化糖鎖の比較は、末端にα2−6シアル酸を1つ有する蛍光標識したN型2本鎖糖鎖(上記の式(B))、及び末端にα2−3シアル酸を1つ有する蛍光標識したN型2本鎖糖鎖(上記の式(C))を用いた。糖鎖BとCはシアル酸のリンケージのみが異なる位置異性体である。
最初に、前記の糖鎖A(4pmol)とB(4pmol)の混合物を、1Mのアセトヒドラジド溶液50μlに溶解し、HClを用いてpH2.5に合わせ、2MのEDAC溶液4μlを添加し、2時間室温で反応させた。その後、2MのEDAC溶液4μlを再添加し2時間室温で反応させた。さらにその後、2MのEDAC溶液4μlを再添加し2時間室温で反応させた。計6時間かけてアミド化したものを、逆相HPLCに供したところ、図3に示すとおり、2つのピーク(ピーク8、9)がみられた。
これらの2つのピークをMSに供したところm/z値がそれぞれ2088.77、 2436.14であり、順にアミド化された糖鎖BにNaイオンが付加した質量数(2088.77)、アミド化された糖鎖AにNaイオンが付加した質量数(2435.91)に一致した。
以上のとおり、α2−6シアル酸含有糖鎖はこの条件でアミド化されることが確認できた。
【0019】
次に前記の糖鎖AとCの混合物を用いて同様の方法でアミド化し、逆相HPLCに供したところ、図3に示すとおり、ピークが2つ(ピーク10、11)みられた。
これらの2つのピークをMSに供したところm/z値がそれぞれ2089.02、2435.84であり、順にアミド化された糖鎖CにNaイオンが付加した質量数(2088.77)、アミド化された糖鎖AにNaイオンが付加した質量数(2435.91)に一致した。
よって、α2−3シアル酸含有糖鎖もこの方法で容易にアミド化されることを確認した。
これらの結果から、上記で示した新たなアミド化法は、これまでアミド化が困難であった反応性の低いシアル酸も容易に修飾できることがわかる。
【0020】
(実施例3)
さらに、α2−3シアル酸の位置が異なる糖鎖E(下記の式(E))、糖鎖Eの位置異性体でありリンケージがα2−6シアル酸である糖鎖F(下記の式(F))、シアル酸が多数結合している糖鎖G(下記の式(G))についても同様にアミド化した。
【0021】
【化2】

【0022】
糖鎖EとA、糖鎖FとA、糖鎖GとAの混合物を、実施例2と同様の方法で修飾し、逆相HPLCに供したところ、それぞれ、図4の上段、中段、及び下段に示すように、ピーク12,13、ピーク14,15、及びピーク16,17を得た。
これらのピーク13、15、16のm/z値(2435.78, 2436.00, 2435.88)は、すべてアミド化された糖鎖AにNaイオンが付加した質量数(2435.91)に一致した。ピーク12、14、17 (m/z: 2088.88, 2089.01, 3496.04)は、それぞれアミド化された糖鎖E、F、GにNaイオンが付加した質量数(2088.77、2088.77、3495.30)に一致した。
これらの結果から、シアル酸の位置が異なる場合でも、シアル酸の数が多い場合でも、本発明によるアミド化法は効率よくシアル酸をアミド化できることがわかる。
【0023】
(実施例4)
α2−3シアル酸含有糖鎖を含む糖タンパク質であるFetuinの糖鎖を本発明のアミド化法を用いて解析した。Fetuinは、N型3本鎖糖鎖にシアル酸が3つ結合したものが最も含有量が多く、90%以上がα2−3シアル酸を含有している。
FetuinをPNGase F処理し、得られたN型糖鎖をピリジルアミンで標識し、実施例2と同様の方法で修飾し、MSにより解析した。
得られたMSスペクトルでは、図5に示すように、m/z値が3148.28のシグナルが最も高く、これは最も含有量の多い3本鎖糖鎖にシアル酸が3つ結合したものに相当する質量数(理論値:3148.17)に一致する。
このように、α2−3シアル酸が修飾できていることを反映する結果が得られた。
【産業上の利用可能性】
【0024】
本発明によれば、従来困難であった質量分析法によるシアロ糖鎖の高感度かつ定量的な検出、及びシアロ糖鎖を有するバイオマーカーの比較定量解析が可能となるので、疾患関連マーカーの探索、疾患診断に新たな手法を提供することができる。
【図面の簡単な説明】
【0025】
【図1】既知のアミド化反応で得られた反応物の逆相HPLCの結果を示す図
【図2】実施例1で得られた反応物の逆相HPLCの結果を示す図
【図3】実施例2で得られた反応物の逆相HPLCの結果を示す図
【図4】実施例3で得られた反応物の逆相HPLCの結果を示す図
【図5】実施例4で得られた反応物のm/z値を示す図
【特許請求の範囲】
【請求項1】
シアロ糖鎖と求核剤を混合した後、pHを3以下に調節し、これに縮合剤を添加して、シアロ糖鎖のカルボキシル基をアミド化することを特徴とするシアロ糖鎖のアミド化方法。
【請求項2】
前記求核剤としてヒドラジド基を有する化合物を用いることを特徴とする請求項1に記載のシアロ糖鎖のアミド化方法。
【請求項3】
前記縮合剤が、カルボジイミドである請求項1に記載のシアロ糖鎖のアミド化方法。
【請求項4】
前記シアロ糖鎖が、α2−3シアル酸を有する糖鎖を含有することを特徴とする請求項1〜3のいずれか1項に記載の方法。
【請求項1】
シアロ糖鎖と求核剤を混合した後、pHを3以下に調節し、これに縮合剤を添加して、シアロ糖鎖のカルボキシル基をアミド化することを特徴とするシアロ糖鎖のアミド化方法。
【請求項2】
前記求核剤としてヒドラジド基を有する化合物を用いることを特徴とする請求項1に記載のシアロ糖鎖のアミド化方法。
【請求項3】
前記縮合剤が、カルボジイミドである請求項1に記載のシアロ糖鎖のアミド化方法。
【請求項4】
前記シアロ糖鎖が、α2−3シアル酸を有する糖鎖を含有することを特徴とする請求項1〜3のいずれか1項に記載の方法。
【図1】


【図2】


【図3】


【図4】


【図5】




【図2】


【図3】


【図4】


【図5】


【公開番号】特開2009−162530(P2009−162530A)
【公開日】平成21年7月23日(2009.7.23)
【国際特許分類】
【出願番号】特願2007−339887(P2007−339887)
【出願日】平成19年12月28日(2007.12.28)
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成18年度独立行政法人新エネルギー・産業技術総合開発機構委託研究「健康安心プログラム/糖鎖機能活用技術開発」産業技術力強化法第19条の適用を受ける特許出願
【出願人】(301021533)独立行政法人産業技術総合研究所 (6,529)
【Fターム(参考)】
【公開日】平成21年7月23日(2009.7.23)
【国際特許分類】
【出願日】平成19年12月28日(2007.12.28)
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成18年度独立行政法人新エネルギー・産業技術総合開発機構委託研究「健康安心プログラム/糖鎖機能活用技術開発」産業技術力強化法第19条の適用を受ける特許出願
【出願人】(301021533)独立行政法人産業技術総合研究所 (6,529)
【Fターム(参考)】
[ Back to top ]

