生体成分接触用途の膜の製造方法
【課題】本発明の目的は、上記の問題を考慮して、抗凝固能、好ましくは抗トロンビン活性、および血小板付着抑制能が付与された、生体適合性に優れた生体成分接触用の膜を提供すること、抗凝固能を有する化合物および親水性高分子化合物の溶出量を低減できることにある。また、従来法と比して非常に簡便かつ低コストで生体適合性を膜に付与する技術を提供することである。
【解決手段】膜の生体成分との接触面の反対側の面に液体が充填されていない状態下にて抗トロンビン活性を有する化合物を含む液体を前記生体成分との接触面と接触させて製造することを特徴とする、生体成分接触用途の膜の製造方法。
【解決手段】膜の生体成分との接触面の反対側の面に液体が充填されていない状態下にて抗トロンビン活性を有する化合物を含む液体を前記生体成分との接触面と接触させて製造することを特徴とする、生体成分接触用途の膜の製造方法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、医薬、医療、プロテオーム解析および食品製造などの分野で好適に用いられる膜及びその製造方法に関するものである。
【背景技術】
【0002】
人工材料を生体成分と接触させると、タンパク質や血小板などが表面に付着し、材料の性能が低下するだけでなく、生体反応を激しく刺激する。そのため、生体成分と接触させる用途に用いられる人工材料には表面の生体適合性が強く求められており、世界中の研究者等が新技術の開発に取り組んでいる。例えば、ミクロ相分離構造を持つ表面を形成させたり、表面に親水性高分子をグラフトしヒドロゲル構造を持たせたりした技術が広く知られている。しかしながら、これらの技術は、材料の種類や物性で限定されてしまうことや、未反応物質の残留などが懸念される。
【0003】
特に、複雑な形状を有する多孔質分離膜においては、生体成分が接触する表面の微細構造を制御することは非常に困難である。例えば血液浄化用膜では、血液が常に人工材料と接触しており、凝固反応が活性化されるため、高い生体適合性が求められる。しかしながら、抗凝固剤を投与することで血液凝固を抑制していることが実状であり、現在は血小板やタンパク質の吸着を抑制する機能を人工材料に付与する技術開発が進められている(特許文献1,2参照)。しかしながら、抗凝固剤は、副作用が懸念されるのみでなく、出血傾向の患者には用いることができず、患者毎に投与量を管理しなければならないため、医療従事者への負担が大きいことが問題となっている。
【特許文献1】特表2004−525888号公報
【特許文献2】特開2006−291193号公報
【発明の開示】
【発明が解決しようとする課題】
【0004】
本発明の目的は、上記の問題を考慮して、抗凝固能、好ましくは抗トロンビン活性、および血小板付着抑制能が付与された、生体適合性に優れた生体成分接触用の膜を提供すること、抗凝固能を有する化合物および親水性高分子化合物の溶出量を低減できることにある。また、従来法と比して非常に簡便かつ低コストで生体適合性を膜に付与する技術を提供するものである。
【課題を解決するための手段】
【0005】
上記目的を達成するために、本発明は以下の構成を有するものである。
1.膜の生体成分との接触面の反対側の面に液体が充填されていない状態下にて抗トロンビン活性を有する化合物を含む液体を前記生体成分との接触面と接触させて製造することを特徴とする、生体成分接触用途の膜の製造方法。
2.前記製造された膜において、膜を1cm2当たり160μlのヒト血漿を0.5ml/minの流速で4時間流した際に、膜からの前記抗トロンビン活性を有する化合物の溶出量が1μg/ml未満であることを特徴とする前記1記載の生体成分接触用途の膜の製造方法。
3.前記製造された膜において、前記抗トロンビン活性を有する化合物が膜に1mg/m2以上含まれることを特徴とする前記1または2記載の生体成分接触用途の膜の製造方法。
4.前記液体を生体成分との接触面と接触させた後、放射線を照射することを特徴とする前記1〜3のいずれかに記載の生体成分接触用途の膜の製造方法。
5.前記液体を生体成分との接触面と接触させた後、除去してから放射線を照射することを特徴とする前記4に記載の生体成分接触用途の膜の製造方法。
6.前記放射線を照射した後、界面活性剤を用いて洗浄することを特徴とする前記4または5に記載の生体成分接触用途の膜の製造方法。
7.前記抗トロンビン活性を有する化合物が抗トロンビン活性部分および高分子鎖部分を含むことを特徴とする前記1〜6のいずれかに記載の生体成分接触用途の膜の製造方法。
8.前記抗トロンビン活性を有する化合物が4−メトキシ−ベンゼンスルホニル−Asn(PEG2000−Ome)−Pro−4−アミジノベンジルアミドであることを特徴とする前記7に記載の膜の製造方法。
9.前記膜が前記抗トロンビン活性を有する化合物とは異なる親水性高分子化合物を含むことを特徴とする前記1〜8のいずれかに記載の生体成分接触用途の膜の製造方法。
10.前記親水性高分子化合物が、ポリビニルアルコール、ポリエーテル、ポリビニルピロリドンおよびポリエーテルとポリシロキサンからなる物質からなる群より選ばれる少なくとも一つを含むことを特徴とする前記9に記載の生体成分接触用途の膜の製造方法。
11.前記ポリエーテルとポリシロキサンからなる物質がポリエーテル/ポリシロキサン共重合体であることを特徴とする前記10に記載の生体成分接触用途の膜の製造方法。
12.前記親水性高分子化合物が前記抗トロンビン活性を有する化合物を含む液体に含まれたものを生体成分との接触面と接触させることを特徴とする前記9〜11のいずれかに記載の生体成分接触用途の膜の製造方法。
13.前記抗トロンビン活性を有する化合物を含む液体が下記条件Aを満たし、下記条件Bを満たす有機溶媒を含んだ溶液であることを特徴とする前記1〜12のいずれかに記載の生体成分接触用途の膜の製造方法。
A:含有水分は25vol%以上90vol%以下
B:少なくとも一つが2級または3級である水酸基を含有
14.前記抗トロンビン活性を有する化合物を含む液体がpH3以上10未満の緩衝液を含む溶液であることを特徴とする前記1〜13のいずれかに記載の生体成分接触用途の膜の製造方法。
【発明の効果】
【0006】
本発明によって、高い抗血栓性を有し、溶出物の少ない生体成分接触用途の膜と生産性に優れた製造方法を提供することができる。
【発明を実施するための最良の形態】
【0007】
本発明における生体成分とは、生体由来の細胞、タンパク質、核酸、糖、脂質およびそれらの複合体のことを指す。また生体外で培養された細胞や遺伝子組み替えタンパク質なども生体成分とする。本発明に係る膜は、生体成分の中でも血液成分、すなわち血球や血小板などの細胞や血漿タンパク質などの血漿成分を取り扱う場合に好適である。
【0008】
本発明に係る膜は医療用の基材として好適に用いることができる。医療用基材の例として埋め込み型人工臓器や人工血管、カテーテル、ステント、血液バッグ、コンタクトレンズ、眼内レンズおよび手術用補助器具等が挙げられ、生体成分分離用モジュールや血液浄化用モジュールなどに内蔵され用いられる分離膜や吸着剤なども含まれる。本発明において、生体成分分離用モジュールとは、濾過、透析、吸着などにより生体物質を分離し、一部を回収するモジュールのことをいい、医療用基材に限られるものではない。また、血液浄化用モジュールとは、血液を体外に循環させる際に、吸着や濾過、拡散によって血中の老廃物や有害物質を取り除く機能を有したモジュールのことをいい、具体的に人工腎臓やそのプレもしくはポストカラム、外毒素吸着カラムなどがある。
【0009】
血液浄化用モジュールに内蔵される分離膜の形態は特に限定されるものではなく、平膜や中空糸などの形態で用いられる。一般に、中空糸は処理液量あたりの表面積が大きく、圧損も少なくできるため、本発明の方法を最も効率よく適用することができる。処理液量あたりの膜表面積を大きくするためには、中空糸内径は小さい方が好ましく、1000μm以下が好ましく、500μm以下がより好ましい。一方、平膜は製膜が容易で安価に作成することができると言う利点がある。これらの膜の素材としては、セルロース、セルロースアセテート、ポリカーボネート、ポリスルホン、ポリエーテルスルホン、ポリメタクリル酸メチル(PMMA)等のポリメタクリレート、ポリアクリレート、ポリアミド、ポリフッ化ビニリデン、ポリ塩化ビニル、ポリアクリロニトリル、ポリエステル、ポリウレタン、ポリスチレン、ポリエチレン、ポリプロピレンおよびこれらの誘導体からなる群より選択される1種類以上の素材を例示することができる。この中でPMMAはポリエチレングリコール(PEG)などの親水性高分子化合物と水素結合可能であり、これら親水性高分子化合物を放射線などにより膜表面に共有結合で固定化する場合、効率的な固定化が可能であり好適な素材である。また、近年透析器などに良く用いられているポリスルホンは分画特性が良好であるために好ましい素材である。
【0010】
本発明において「生体成分との接触面の反対側の面に液体が充填されていない状態下」とは、中空糸膜を例に挙げると、生体成分が内表面と接触する場合は、外表面に液体が充填されていない状態を指し、人工腎臓型中空糸膜モジュールで説明すると、透析液接触表面側に液体が充填されていない状態で血液接触表面にのみ液体を充填するということである。なお、充填した液体は、充填後に脱液してもよい。また、単に膜表面が水分を含んでいる状態は、「充填された」状態に該当しない。
【0011】
この原理を以下に説明する。例えば人工腎臓型中空糸膜には内表面と外表面があり、内表面は血液と、外表面は透析液と接触して用いられる。さらに膜厚部には非常に多くの孔が存在し、内表面側と外表面側の間の透過性を担っている。一例として中空糸膜の抗血栓性を向上させる場合、外表面側に抗血栓性物質を塗布もしくは充填し内表面側に拡散させる方法があるが、抗血栓性物質の拡散によって生体にとって安全上好ましいとはいえない。また親水性高分子を中空糸膜の内表面から外表面へ押しつけるような充填方法で膜内表面に局在化させる方法や中空糸膜の内表面側と外表面側に親水性高分子溶液を充填し膜に浸潤させる方法などが知られている。しかしながら、本発明においては、機能性付与のために供する物質を機能性表面(例えば人工腎臓型中空糸膜で血液に対しては内表面側、透析液に対しては外表面側)にのみ、もしくは偏って導入すればよいものであるが、上記方法も機能性付与のために供する物質の分子量が小さいもしくは溶液中における回転半径が小さいなど中空糸膜の孔へ侵入もしくは孔を透過可能である場合、機能性付与のために必要な量を添加しても、十分な機能を発揮し得ず、当該必要量を超えた量を添加する必要があるため、必ずしも好ましい方法ではない。そこで、本発明者等は、鋭意検討した結果、例えば人工腎臓型中空糸膜モジュールにおいて抗血栓性を向上させるため、透析液接触表面側に液体が充填されていない状態で血液接触表面にのみ液体を充填するという方法を考え出した。本方法を用いれば、たとえ機能性物質の分子量や溶液中の回転半径が小さくとも、機能性付与のために供する物質が膜孔に拡散することを低減可能であり、その結果、膜の孔へ侵入もしくは透過することを抑制でき、機能表面側にのみ、もしくは偏って機能性物質が導入でき、産業上操作性やコスト性でも優れている。また後述するように、導入する機能性物質を膜に固定化することで拡散によって誘発される機能化の目的以外の現象を抑制できる。さらに本発明で、透析液接触表面側に液体が充填されていない状態で血液接触表面にのみ液体を充填し、抗トロンビン活性を有する化合物を膜に吸着させた後、充填液を抜き取ることで、充填液と共に機能性付与のために供する物質が膜孔へ拡散することをより抑制できる。
【0012】
本発明に係る抗トロンビン活性を有する化合物とは、トロンビンの活性を抑制することにより強力な血液抗凝固作用を示す化合物である。抗トロンビン活性を有する化合物として、下記の一般式
【0013】
【化1】

【0014】
(式中、PEGは数平均分子量2000のPEG残基、Meはメチル基を表す。)で示される4−メトキシ−ベンゼンスルホニル−Asn(PEG2000−Ome)−Pro−4−アミジノベンジルアミド(以下、化合物Aと略すことがある。)、ATIIIおよびヒルジン、(2R,4R)−1−[(2S)−5−(ジアミノメチリデンアミノ)−2−[[(3R)−3−メチル−1,2,3,4−テトラヒドロキノリン−8−イル]スルホニルアミノ]−4−メチル−ピペリジン−2−カルボン酸などが挙げられる。
【0015】
抗凝固能を有する化合物が上記化合物Aのように高分子鎖部分を含む場合は、その高分子鎖部分で膜と結合することが可能となり、抗トロンビン部分が膜と結合することによる活性低下を抑止できるので好ましい。本発明で言うところの高分子鎖部分とは特定の化学構造を有する繰り返し単位が共有結合で連なった分子鎖で分子量1000以上のものを指す。かかる高分子鎖部分としては、PEG残基、ポリビニルピロリドン(PVP)残基、ポリプロピレングリコール残基、ポリビニルアルコール(PVA)残基およびそれらのいずれかの共重合体の残基等の親水性高分子鎖が挙げられる。このような親水性高分子鎖を有する化合物は、抗凝固能を有する化合物の水溶性が低下しにくいこと、またアミノ基やカルボキシル基を有する誘導体が市販されており、これらを高分子鎖部分に導入して抗凝固能を有する化合物を製造する方法が比較的容易なことから特に好ましく用いることができる。
【0016】
さらに、抗トロンビン活性を有する化合物が血液中に溶出すると、凝固時間を延長させる効果があることや副作用が起こる可能性が考えられるが、本発明においては、かかる溶出量を1μg/ml未満とすることが好ましく、より好ましくは0.8μg/ml未満であり、さらには0.6μg/ml未満に低減させることが好ましい。これによって、抗トロンビン活性を有する化合物による副作用や、膜への導入量を低減させることが可能となり、安全かつ低コストを達成できる。
【0017】
本発明における親水性高分子化合物とは、抗トロンビン活性を有する化合物とは異なるものとして添加されるものであり、水に可溶な高分子化合物および水に不溶でも静電相互作用や水素結合により水分子と弱い相互作用をし得る高分子化合物を指す。また高分子化合物とは数平均分子量が1000以上の化合物をいう。親水性高分子化合物の例としては、例えば、PVA、PVP、PEG、ポリプロピレングリコール、ポリエーテルとポリシロキサンからなる物質、ポリエチレンイミン、ポリアリルアミン、ポリビニルアミン、ポリ酢酸ビニル、ポリアクリル酸、ポリアクリルアミドなどや、これら高分子のモノマーと他のモノマーとの共重合体やグラフト体などが挙げられるが、これらに限定されるものではない。これらのうちポリエーテルとポリシロキサンからなる物質、PVA、ポリエーテル、PVPから選ばれる少なくとも一つを含むものが好適に使用されるが、特にポリエーテルとポリシロキサンからなる物質およびPVAは親水化の効果が高いので好ましい。ここで言うポリエーテルとポリシロキサンからなる物質とはポリエーテルとポリシロキサンとの共重合体、ポリマーコンプレックス、ポリマーブレンド物などが挙げられる。このうち、共重合体は水溶性が高いので水溶液によるグラフト処理が可能なことから、放射線照射施設内での溶媒への引火や発火のリスクを低減できる点で好ましい。ポリエーテル/ポリシロキサン共重合体はポリエーテルユニットとポリシロキサンユニットとからなり、それらの共重合形態はランダム共重合体でもブロック共重合体でもグラフト共重合体でもよく、またこれらの混合物でもよい。ポリエーテルとしてはPPGやPEGが好適に用いられるが、PPGはPEGと比較して疎水性が高いため、基材との間により強い疎水性相互作用を持つことが可能となり、例えば放射線グラフトする場合、効率的にポリエーテルとポリシロキサンからなる物質を基材に対してグラフトできるので好ましい。ただし、ポリエーテル中のPPGの含有率が増加し過ぎると該共重合体の水に対する溶解性が低くなるので、PPGの含有率は5mol%以上であることが好ましく、10mol%以上より好ましく、20mol%以上であることがさらに好ましい。一方で、90mol%以下であることが好ましく、80mol%以下であることがより好ましく、60mol%以下であることがさらに好ましい。なお、本発明におけるPPGの含有率(mol%)は式(1)で算出するものとする。
P=100×(a)/(b) 式(1)
上式中、PはPPGの含有率(mol%)とし、(a)はポリエーテル中のPPGユニットの数、(b)はポリエーテル中のエーテルユニットの数とする。ポリエーテル中のPPGユニットとは下記化学式で表される構造のことを指す。
【0018】
【化2】

【0019】
また、ポリエーテル中のエーテルユニットとは下記化学式で表される構造のことを指す。
【0020】
【化3】

【0021】
上式においてR1は炭素数6以下のアルキル基である。PPG含有率は核磁気共鳴分光法(以下1H−NMRとする)などで測定することが可能である。
また、ポリエーテルは共重合されていてもよく、その場合、ポリエーテル中のPPGの他の共重合成分等としては、入手のしやすさ等の観点から、PEGがよい。また、かかるPEGとPPGからなる物質において、その効果を損なわない程度に他の共重合成分等が含まれていても構わない。
【0022】
抗凝固能を有する化合物の高分子鎖部分としてのPVA、また、親水性高分子化合物としてのPVAについて、ケン化度の低いPVAはさらに基材を親水化する効果が高いので好ましい。ここで言うケン化度とは式(2)で求められる数値である。ただし、ケン化度が低すぎると水に対する溶解性が著しく低くなるので水溶液として基材に対して表面処理することが困難となることがある。そのため、ケン化度は好ましくは50mol%以上であり、より好ましくは74mol%以上であり、さらに好ましくは78mol%以上である。逆にケン化度が高すぎても、水に対する溶解性が低下し、溶解時に加熱などが必要となり、生産性が低下するので好ましくない。したがって、ケン化度は99.9mol%以下が好ましく、95mol%以下がより好ましく、90mol%以下であることがさらに好ましい態様である。
【0023】
【化4】

【0024】
【化5】

【0025】
(k)=(m)/((n)+(m))×100 式(2)
(式2)中の記号は以下の通り。
(k):ケン化度
(m):PVA中の式[化4]で表されるモノマー繰り返し単位数
(n):PVA中の式[化5]で表されるモノマー繰り返し単位数
また、親水性高分子化合物の量も少なすぎると、血小板付着抑制効果が低いという問題がある。本発明の膜は、表面親水性高分子量が20重量%以上であることが好ましい。ここで、表面親水性高分子量とは、膜の表面における親水性高分子のモノマーユニットの重量(モノマーユニットのモル数×モノマーユニットの分子量)を(A)、膜の表面における膜を構成する高分子のモノマーユニットの重量(モノマーユニットのモル数×モノマーユニットの分子量)を(B)としたときに、A/(A+B)で表される比率と定義する。表面親水性高分子量は、膜の表面の親水性の度合いを表すパラメータとなる。
【0026】
表面親水性高分子化合物の量は、膜の表面のみ、すなわち表面から深さ10nm程度までをX線光電子分光法(ESCA)(X線の入射角に対する検出器の角度は90度)により測定することで求められる。すなわちESCAの測定により得られた、膜の処理前後のC1s、O1sスペクトルの面積強度変化から求められる。表面親水性高分子量は、20重量%以上であることが好ましく、32重量%以上であることがより好ましい。表面親水性高分子量が20重量%未満になると、タンパク質などの有機物や生体成分の付着を抑制する効果が低下する。
【0027】
本発明の膜は、抗トロンビン活性を有する化合物を含むものである。膜の表面に抗トロンビン活性を有する化合物のみが導入された場合、トロンビンによる血液凝固反応の活性化を抑制できるが、血小板凝集を抑制できないため、生体成分と接触させる用途において、タンパク質や血小板の膜への付着を完全に抑制することができない。一方、膜の表面に親水性高分子化合物のみが導入された場合、タンパク質や血小板の付着を抑制できるが、トロンビンや他の凝固因子による活性化を抑制できないため、上記同様、血栓の生成等を完全に抑制することができない。すなわち、一方の化合物の量を単に増加させることによって、本発明の課題を解決することはできない。しかしながら、本発明においては、抗トロンビン活性を有する化合物および親水性高分子化合物を共に膜に接触させることにより、初めて複数の凝固反応を抑制でき、抗血栓性に優れた膜が創製可能となるものである。
【0028】
本発明において、抗トロンビン活性を有する化合物と親水性高分子化合物は膜に対して直接結合していてもよいし、いなくてもよい。ただし直接結合している方が、これらの化合物が膜表面から脱離しにくいので効果が持続すること、及びこれらの化合物の溶出量低減が期待できるため好ましい。このときの結合は共有結合、イオン結合、水素結合、配位結合、疎水性相互作用などの化学結合があるが、共有結合は比較的強固な結合であるので好ましい。また、これらの結合を複数組み合せた結合であってもよい。また抗トロンビン活性を有する化合物と親水性高分子化合物とを膜表面に共有結合すなわちグラフトさせる方法としては求核置換反応などによる有機化学的な方法と電離放射線を照射することによる放射線化学的な方法とがある。このうち放射線化学的な方法は反応副生成物が少なく、かつ放射線の種類や線量を適宜選択することで膜の滅菌を同時に行うことも可能であり好ましい。また、抗トロンビン活性を有する化合物と親水性高分子化合物は同時に処理しても、別々に処理してもよい。親水性高分子化合物は、膜の製造時に原料とともに混練される等して、膜の一成分となっていてもよいが、膜の種類によっては、膜の機械的もしくは化学的物性(例えば強度や脆性、表面電荷、表面濡れ性など)を損なう可能性がある。従って、この様な場合は、膜の表面に当該親水性高分子化合物を含む水溶液等を接触させる等の方法により、膜表面に導入固定してもよい。この様な導入固定方法を採ることで、膜の種類を選択せずに適用できる範囲が広がるため、本発明の効果を多くの分野で活用できるだけでなく、用途のために最適化されるように親水性高分子化合物の種類を容易に変更できるため、機能性や生産コストの面からより好適である。
【0029】
溶出物量の確認方法としては、下記要領で測定する方法が例として挙げられる。または、同等の溶出量の結果が得られる方法であればよい。例えば、試薬にHaemoSys社製のECA−Tキットを使用し、装置にTECO Medical Instruments Production社製のCOATRON M1(code 80 800 000)を使用する。血液もしくは生体成分、生体組織と接触する面積(中空糸の場合は血液と接触する糸内表面積とする)(以下、面積Aという)1cm2当たり160μlのヒト血漿で4時間洗浄する。洗浄後のヒト血漿を80μl採取し、20μlの蒸留水を添加する。この溶液をサンプル溶液とする。サンプル溶液を調製してすぐに、ECA prothrombin buffer 100μl、サンプル溶液30μl、ECA−T substrate 25μlを混合し、37℃の温度で60秒間インキュベート後、装置にセッティングする。これにECA ecarin reagent 50μlを添加して測定を行う。予め、任意の濃度に調製した抗トロンビン活性を有する化合物の水溶液もしくはブランクの蒸留水を20μlとヒト血漿80μlの混合溶液を同手法にて測定し、結果を検量線として用い、検量線から算出された抗凝固能を有する化合物の量を溶出量とする。
【0030】
膜表面における抗トロンビン活性を有する化合物の量は、その抗凝固能の強さに応じて適宜変わるが、少なすぎると抗凝固能効果が低いという問題があるので1mg/m2以上が好ましく、5mg/m2以上がより好ましく、10mg/m2以上がさらに好ましい。一方、抗トロンビン活性を有する化合物の量が多すぎるとコストアップや溶出といった問題があるので100g/m2以下が好ましく、50g/m2以下がより好ましく、10g/m2以下が更に好ましい。ここで、膜が多孔質膜の場合は細孔を含めた面積で除する。膜表面における抗トロンビン活性を有する化合物の量は、次のように測定する。すなわち、膜に対する抗トロンビン活性を有する化合物の添加量をベースとして、後続する工程、例えば、主な工程は洗浄工程であり、膜に固定されていない未反応物を除去する工程で除去される量を差し引くことで求められるが、これに限定されるものではない。
【0031】
また、本発明の膜の製造方法においては、抗トロンビン活性を有する化合物および親水性高分子化合物を膜に接触させた状態で放射線照射する方法を用いることが好ましい。さらに、本発明の膜の製造方法の好ましい態様においては、有機溶媒の存在下でこれらの化合物を膜に接触させた状態で放射線照射する方法を用いる。
【0032】
本発明で用いられる放射線とは、高エネルギーの粒子線および電磁波のことであり、そのような放射線としては、例えば、α線、β線、γ線、X線、紫外線、電子線および中性子線などが挙げられる。これらの放射線のうち、エネルギーが特に高く効率よく基材の改質ができるという点で、γ線と電子線がより好ましく用いられる。また、γ線、X線および電子線は、線量をコントロールすることにより滅菌も同時に行うことができるので、医療材料などの基材の改質に好適である。
【0033】
また、膜に対して放射線を照射する場合、放射線の線量が少ない場合は膜中の吸収線量にばらつきが生じるなど、線量のコントロールが困難となる。そのため、放射線の線量は、1kGy以上であることが好ましく、より好ましくは5kGy以上である。また、医療材料などに用いられる膜において、改質と同時に滅菌も行うような場合、放射線の線量は10kGy以上であることが好ましく、より好ましくは20kGy以上である。ただし、過剰な線量の放射線の照射は膜自身を劣化させるので、放射線の線量は5000kGy以下であることが好ましく、より好ましくは1000kGy以下であり、さらに好ましくは100kGy以下である。
【0034】
抗トロンビン活性を有する化合物が放射線照射によりその活性が低下する場合は、有機溶媒によりその活性低下を防ぐことが可能である。すなわち、有機溶媒の存在下に抗トロンビン活性を有する化合物を接触させた膜に、放射線を照射するのである。
【0035】
本発明で好適に用いられる有機溶媒としては、水酸基を含有する溶媒が挙げられる。水酸基は、放射線照射により発生したラジカルを安定化する効果が高く、かつ非イオン性の官能基であり強い表面電荷を有する化合物との相互作用が小さく、かつ酸化還元力も小さく化合物の変性も少ない。特に2級および3級の水酸基は、ラジカルを安定化する効果がより高いので、本発明においては少なくとも一つに2級または3級の水酸基を有する有機溶媒、例えばグリセリンやプロピレングリコール(以下、PGという)やイソプロパノール(以下、IPAという)、2−ブタノール、2,3−ブタンジオールおよび1,3−ブタンジオールなどが用いられる。ただし、エチレングリコールやエタノールのような1級の水酸基のみを有する有機溶媒はラジカルを安定化する効果が低いこと、エタノールのような引火性の高い溶媒は含有率を高くすると危険であることなどから、本発明でいう有機溶媒には含まれない。また、本発明の化合物の滅菌方法を医療材料、またはこれが内蔵される医療用具の製造に用いる際は、その安全性を考慮する必要があるため、非水溶媒は毒性の低いものが好適に用いられる。
【0036】
また、有機溶媒水溶液における水分率の上限は90vol%であり、90vol%を超えると有機溶媒のラジカル安定化の効果が十分に得られない。90vol%以下の範囲においては、水分率が多い方が好ましい。一方、水分率が低い場合、例えば医療用具などに用いる際、洗浄後の有機溶媒残留が生体適合性に影響を与えることが懸念される他、例えば放射線グラフトに用いる場合にグラフト効率が低下することが考えられる。よって水分量は全溶媒量の25vol%以上であることが好ましく、より好ましくは50vol%以上である。
【0037】
本発明において、化合物の有機溶媒における濃度については特に限定されるものではないが、化合物によっては濃度が濃すぎると化合物間で架橋反応が進行してゲル化などにより、化合物本来の物性が失われるおそれがあるので、化合物の有機溶媒の水溶液における濃度は50重量%以下が好ましく、より好ましくは30重量%以下であり、さらに好ましくは20重量%以下である。
【0038】
本発明における水分率とは、次式で定義されるものである。
抗トロンビン活性を有する化合物および該化合物を溶解および/または分散している有機溶媒水溶液に含まれる水の体積)/(抗トロンビン活性を有する化合物および該化合物を溶解および/または分散している有機溶媒水溶液の体積)×100(%)
有機溶媒の存在下で、抗トロンビン活性を有する化合物を膜に接触させる方法としては、抗トロンビン活性を有する化合物を有機溶媒に溶解または分散し、得られた液体に膜を浸漬させたり、膜に塗布したりする方法が挙げられる。ここで、抗凝固能を有する化合物が溶解するとは、その化合物が溶媒に溶けて均一混合物、すなわち溶液になることを指す。また、抗トロンビン活性を有する化合物が分散するとは、その化合物がコロイドやミセル状態など溶媒中に散在することを指す。また、抗トロンビン活性を有する化合物が目的の有機溶媒に溶解しにくい場合は、抗トロンビン活性を有する化合物に対する溶解度が高い溶媒に溶解させた溶液を膜と接触させた後に、その溶媒を目的とする有機溶媒に置換してもよい。このとき抗トロンビン活性を有する化合物を溶解させる溶媒は、水などの無機溶媒でもよい。すなわち、抗トロンビン活性を有する化合物を水に溶解した溶液に膜を接触させた後、水を有機溶媒に置換してから膜に放射線を照射するのである。また、本発明者らは、抗トロンビン活性を有する化合物を有する液体を膜に接触させた状態で放射線照射を行うと、放射線により化合物が膜内部に浸透する場合があり、膜表面に抗凝固機能を付与するために十分な存在量を表面上にて確保できない場合があることを見出した。さらに検討を進めた結果、当該液体を接触させた後、排出等を行って除去し、その後に放射線照射を行うと、膜表面に十分な抗凝固機能を付与するための化合物の存在量を確保でき、最低限の添加量とできることを見出した。
【0039】
また、本発明では、あらかじめ抗トロンビン活性を有する化合物を膜に塗布もしくは吸着させ、その化合物が付着した膜を有機溶媒に浸漬させてもよい。
【0040】
また、本発明において、抗トロンビン活性を有する化合物と親水性高分子化合物を用いられる緩衝液とは、少量の酸や塩基を加えたり、多少濃度が変化したりしてもpHが変化しないようにした溶液のことであり、例えば、リン酸緩衝液、トリスヒドロキシメチルアミノメタン緩衝液、ビス(2−ヒドロキシエチル)イミノトリス(ヒドロキシメチル)メタン(以下、Bis−Trisという)緩衝液、酢酸緩衝液、クエン酸緩衝液およびホウ酸緩衝液などが挙げられる。これらのうち、リン酸緩衝液、Tris緩衝液およびBis−Tris緩衝液は中性および酸性領域における緩衝作用を有することと、生理活性を有する化合物の溶媒として添加されることが多いことから好適である。ただし、pH3未満のような強酸性条件下やpH10以上のような強塩基性条件下では、抗トロンビン活性を有する化合物や親水性高分子中の一部の分子構造に変化を生じ、物理的機能、化学的機能または生物的機能が変化することや例えばグラフト固定化膜を創製する場合に膜自体の性能が低下することが考えられるので、緩衝範囲はpH3以上であり、5以上が好ましい。また、上限としてはpH10未満であり、8以下が好ましい。pHの測定にはガラス電極法を用いるが、同等の精度で測定できるものであれば、これに限定されるものではない。
また、本発明で用いられる緩衝液を含む溶液とは、上記緩衝液の水溶液や、他の溶媒、溶液を含む溶液を意味するものであるが、緩衝液を含む溶液全体として上記した緩衝液のpHの範囲を超えて変動するものを意味するものではなく、好ましくは緩衝液のpHが変動しないものである。
【0041】
また本発明では、抗トロンビン活性を有する化合物と親水性高分子化合物を含む液体を膜に接触させる際、抗酸化剤を併用することも可能である。抗酸化剤が、放射線照射により発生したヒドロキシラジカルを捕捉し、抗凝固能を有する化合物の変性を抑制する効果が期待できるからである。ここでいう抗酸化剤とは、他の分子に電子を与えやすい性質を持つ分子を有する化合物のことを言うが、膜や抗トロンビン活性を有する化合物、親水性高分子化合物が放射線によって変性することを抑制する性質をもつものでもある。
【0042】
抗酸化剤としては、例えば、ビタミンCなどの水溶性ビタミン類、ポリフェノール類、ソジウムハイドロサルファイト、ピロ亜硫酸ナトリウム、二チオン酸ナトリウムなどの無機塩類、尿酸、システインおよびグルタチオンなどが挙げられるが、これらに限定されるものではない。これらの抗酸化剤は単独で用いてもよく、2種類以上を混合して用いてもよい。本発明の膜を医療材料に用いる際は、その安全性を考慮する必要があるため、毒性の低い抗酸化剤が用いられる。抗酸化剤の濃度は、含有する抗酸化剤の種類や放射線の照射線量などにより異なるため、適宜、最適な濃度で使用すればよい。
【0043】
抗トロンビン活性を有する化合物と親水性高分子化合物を膜表面に付与した後に、これら化合物の溶出量を低減するために、放射線を照射する前もしくは後、または前後両方に膜を洗浄することも可能である。特に放射線を照射した後は、抗トロンビン活性を有する化合物と親水性高分子化合物が膜表面に共有結合されているので、過剰な洗浄でも抗トロンビン活性を有する化合物と親水性高分子化合物が過剰に除去される危険性は低い。さらに、洗浄によって未反応物や副生成物を除去できることから、特に医療用途には安心して使用することができる。洗浄には水、生理食塩水、pH緩衝液や有機溶媒を用いることができる。また界面活性剤の溶液は、洗浄効果が高い。
【0044】
本発明において界面活性剤とは、一般にいう界面活性剤を意味するものであり、水に対して強い表面活性を示し、分子内に親水性の部分と疎水性(親油性)の部分とを併せ持つ物質である。界面活性剤のうちイオン系界面活性剤は、イオン性の官能基を有する基材または親水性高分子化合物を用いた場合、静電的な相互作用により界面活性剤が結合して表面の物性が変化する可能性を否定できない。そのため、非イオン性の界面活性剤が好ましく用いられる。非イオン系の界面活性剤のうち、ポリオキシエチレンアルキルフェニルエーテルとポリオキシエチレンアルキルエーテルは特に洗浄効果が優れている。
【0045】
本発明において、界面活性剤は固体や粘性の液体であることが多く、洗浄に用いる場合は、取扱性の面で溶液の状態とすることが好ましい。溶液の濃度は、低すぎると十分な洗浄効果が得られないことがあり、逆に高すぎると生産コストが高くなるのみでなく膜を変性させることにつながりかねない。したがって界面活性剤水溶液の濃度は、好ましくは0.001重量%以上であり、より好ましくは0.005重量%以上であり、さらに好ましくは0.01重量%以上である。一方で、好ましい上限濃度は20重量%以下であり、より好ましくは10重量%以下の範囲であり、さらに好ましくは5重量%以下の範囲である。
【0046】
膜の洗浄方法としては、余剰の抗凝固能を有する化合物および親水性高分子化合物が溶脱し得るように、膜に界面活性剤あるいは界面活性剤を添加した溶液等の洗浄剤を接触せしめる方法であればよい。例えば、洗浄液を所定の流量にて所定の方向に流通させることによって洗浄する方法が、最も効率的でありよく洗浄することができる。また、洗浄方法として、界面活性剤に膜を浸漬させる方法を採ってもよい。例えば、血液浄化用モジュールの充填液として界面活性剤あるいは界面活性剤を添加した溶液を用いることも可能である。膜に界面活性剤あるいは界面活性剤を添加した溶液を所定の方向に流通させるとき、膜の周りを循環させてもよいが、抗トロンビン活性を有する化合物および親水性高分子化合物等が溶出した界面活性剤を再使用することは、洗浄効率の低下につながることがある。洗浄液を所定の流量で流通させて洗浄するときの流量は、少なすぎると十分な洗浄効果が得られないことがある。また、流量が多すぎると洗浄時間が長くなり生産性が低下する。したがって、基材表面積あたりの流量は、0.5L/m2以上が好ましく、より好ましくは1L/m2以上であり、さらに好ましくは3L/m2以上である。一方、流量の上限としては、300L/m2以下が好ましく、より好ましくは200L/m2以下であり、さらに好ましくは100L/m2以下である。
【0047】
また、膜を界面活性剤で洗浄した後に、さらに水や生理食塩水で洗浄することにより、界面活性剤の膜への残存を防ぐことができる。ここで、水および生理食塩水で洗浄するとは、これらを別々に用いて洗浄することを意味する。
【0048】
また、放射線照射前に洗浄することにより、グラフトしていない抗トロンビン活性を有する化合物および親水性高分子化合物の量を少なくすることが可能となり、放射線照射後の洗浄量を少なくすることができる。
【実施例】
【0049】
[PMMA中空糸ミニモジュールの作製方法]
アイソタクティック−PMMA5重量部とシンジオタクティック−PMMA20重量部を、ジメチルスルホキシド75重量部に加え、110℃で8時間撹拌し製膜原液を得た。この製膜原液をオリフィス型二重円筒型口金から吐出し、空気中を300mm通過させた後、水100%の凝固浴中に導き中空糸膜を得た。この際、内部注入気体として乾燥窒素を用いた。得られた中空糸膜の内径は0.2mmであり、膜厚は0.03mmであった。
【0050】
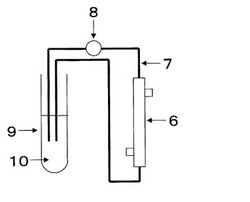
上記のようにして準備したPMMA中空糸膜を50本束ねた。中空糸膜中空部が閉塞しないように留意しつつその両末端をウレタン系ポッティング剤でモジュールケースに固定し、ミニモジュール(図1)を作成した。該ミニモジュールの直径は約7mm、長さは約12cmであり、一般的な中空糸型透析器同様に中空糸の内側に通ずるポート(血液ポート)を2個と外側に通ずるポート(透析液ポート)を2個有している。該ミニモジュールの中空糸およびモジュール内部を蒸留水にて洗浄した。
[緩衝液の調製]
pH5の緩衝液はBis−Tris(同仁化学製)と塩化ナトリウム(シグマアルドリッチ製)を各々最終濃度0.05M,0.1Mとなるように超純水に溶解させ、6規定塩酸(シグマアルドリッチ製)を滴下しながらpH5となるように調製した。pHの測定にはガラス電極法を用い、HORIBA製pHメータ カスタニーLAB F−22を用いて測定した。その結果、pHは5.0であった。
[化合物Aの充填量測定]
化合物Aの充填量測定には、試薬にHaemoSys社製のECA−Tキットを使用し、装置にTECO Medical Instruments Production社製のCOATRON M1(code 80 800 000)を使用した。
1.ヒト血漿(コスモバイオ発売 Human Plasma 12271210, lot.16878)80μlに、測定対象溶液を20μl加え攪拌した。この溶液をサンプル溶液とする。
2.ECA prothrombin buffer 100μl、サンプル溶液30μl、ECA−T substrate 25μlを混合し37℃の温度で60秒間インキュベートし、装置にセッティングした。
3.ECA ecarin reagent 50μl加えて測定を行った。
ブランクの測定対象溶液として超純水を用い調製したサンプルで測定を行った。化合物Aの標準溶液を測定した結果から、検量線を作成し、抗トロンビン活性から化合物Aの存在量を算出した。各実施例、比較例、参考比較例に記載の条件で、ミニモジュールへ化合物Aと化合物Bからなる溶液を充填し、充填前とγ線照射前の溶液中に残存する化合物Aの存在量を測定し、充填量とした。
[化合物Aのグラフト量測定]
各実施例、比較例、参考比較例におけるγ線照射後の洗浄液を上記化合物Aの充填量測定における測定対象溶液とし、化合物Aの存在量を測定した。ここで、化合物AはPG30体積%の水溶液(Bis−Tris緩衝液を添加しpHは5に調整)中でγ線照射すると、抗トロンビン活性がγ線照射前の約80%になることから、抗トロンビン活性から化合物Aの存在量を算出する際、1.25を乗じた。化合物Aのグラフト量を下記式から求めた。
(化合物Aのグラフト量)=(化合物Aの充填量)−(洗浄液中の化合物A存在量)×1.25
[溶出物確認方法]
血液中への溶出物の確認は以下の方法で行った。すなわち、蒸留水に抗トロンビン活性を有する化合物Aと化合物Bを溶解して、所定濃度の化合物A及び化合物Bの水溶液を調製し、各実施例と比較例に示すような組成の溶液に調製し、所定量をミニモジュールに充填し、γ線照射した。化合物A及び化合物Bの水溶液をミニモジュールに充填するときの具体的手順は、各実施例、比較例にて後述する。また、比較例1と2で化合物Aと化合物Bを充填する際に使用した回路を示す概略系統図を図2に示す。
【0051】
図1において、ミニモジュール6の片側の血液ポートに内径0.8mm、長さ52cmのシリコンチューブ7をつなぎ、回路の途中にはペリスタポンプ8を設置した。もう一方の血液ポートに内径0.8mm、長さ16cmのシリコンチューブをつないだ。両シリコンチューブの血液ポートにつないでいない側を、BECTON DICKINSON社製5mlポリスチレンラウンドチューブ9(Code:352054)に差し込み、循環回路を作製した。
【0052】
次に、各実施例、比較例に示す洗浄方法を実施した後、上記回路を使用して、血漿循環実験を以下の方法で行った。すなわち、ヒト血漿(図2中10)5mlを前記ポリスチレンラウンドチューブ9から加えてシリコンチューブを血液ポートに差し入れ、ペリスタポンプ8によって流速を0.5ml/minとして送液し、初流2分間分の量は廃棄した後4時間循環した。循環後の血漿中における化合物Aの溶出量をECA−Tkitにより測定した。
[血液循環試験]
血液はボランティアから提供され、クエン酸を採血量の9分の1の体積比で予め添加した溶液に採血した。循環試験直前にクエン酸加血1mlに対して凝固促進剤としてカルチコールを436μlとなるよう血液に添加した。循環回路にはシリコンチューブ(図3中11)を用い、ペリスタポンプ(図3中8)で循環した。流量は0.9ml/minに調節し、図1記載の1‘と接続したシリコンチューブから血液を入れ、中空糸内部の気泡を除去し、図1記載の1と接続したシリコンチューブから出てきた初流の0.5mlは廃棄した。続いて、素早くシリコンチューブの開口部を包接(図3中12)し閉鎖系の回路を作成した(図3)。循環時間は、回路内の凝固が進むにつれてチューブ内圧が上昇することによって起こる回路の包接部の解放までにかかる時間を測定した。当該時間が長い程、回路内の凝固が起こり難い、抗血栓性に優れた膜であることを示す。
(実施例1)
PMMA中空糸ミニモジュールの血液接触側(中空糸内側)と非接触側(中空糸外側)の液体を圧空によって除去した。続いて、化合物Aを5000μg/mlと下記化学式にて示されるPEG化ポリシロキサン(化合物B)
【0053】
【化6】

【0054】
を1000μg/ml含むPG30体積%の水溶液(Bis−Tris緩衝液を添加しpHは5に調整)を血液接触側にのみ1mlシリンジを用いて約400μlを充填した。4ヶ所のポートを密栓した状態でγ線を照射した。このときγ線の吸収線量は25kGyであった。該ミニモジュールの中空糸膜およびモジュール内部を、ペリスタポンプを用いて25℃の温度の0.025重量%のポリオキシエチレンオクチルフェニルエーテル((以下、TritonX−100という)シグマアルドリッチ製Code30-5140-5)水溶液を流速10ml/minで流し、4時間洗浄した。新たに調製したTritonX−100水溶液を用い、同条件で再び4時間洗浄した。その後、該ミニモジュールの中空糸膜およびモジュール内部を、ペリスタポンプを用いて25℃の温度の蒸留水及び生理食塩水、各300mlを流速10ml/minで流して洗浄し、中空糸膜ミニモジュールを得た。蒸留水洗浄と生理食塩水洗浄は同時ではない(γ線照射後からここまでの操作を操作1と略す)。化合物Aの充填量は1.5g/m2、使用量は1.5g/m2であり、グラフト量は86mg/m2であった。化合物Aの溶出量を測定したところ0μg/mlであった。また血液循環試験の結果、循環時間は35分であった。
(実施例2)
PMMA中空糸ミニモジュールの血液接触側と非接触側の液体を圧空によって除去した。続いて、化合物Aを5000μg/mlと化合物Bを1000μg/ml含むPG30体積%の水溶液(Bis−Tris緩衝液を添加しpHは5に調整)を血液接触側にのみ1mlシリンジを用いて約400μlを充填した。その後、圧空によって充填液を排出させた。4ヶ所のポートを密栓した状態でγ線を照射した。このときγ線の吸収線量は25kGyであった。さらに実施例1の操作1を行った。化合物Aの充填量は0.35g/m2、使用量は0.7g/m2であり、グラフト量は17mg/m2であった。化合物Aの溶出量を測定したところ0μg/mlであった。また血液循環試験の結果、循環時間は38分であった。これは、実施例1では、液体を充填した状態でγ線を照射させたため、若干量の化合物Aが膜内部に浸透して、抗凝固機能を発揮するための表面存在量が低下した(グラフト量は実施例1の方が多いが、これは膜内部の存在量まで測定した結果である)が、本実施例では、充填液の排出除去後にγ線を照射しているため、化合物Aの表面存在量が多いためであると考えられる。
(比較例1)
PMMA中空糸ミニモジュールの血液接触側と非接触側の液体を圧空によって除去した。ペリスタポンプによって1ml/minの流速で化合物A及び化合物Bを含む水溶液(100μg/ml含むPG30体積%の水溶液(Bis−Tris緩衝液を添加しpHは5に調整)水溶液30mlをPMMA中空糸ミニモジュールの一方の血液ポートから導入してもう一方の血液ポートへ流し、15分間循環した。続いて、新たに調製した化合物A及び化合物Bを含む(各々100ppm)水溶液30mlを栄研チューブ(図2中9)に入れ、中空糸内を経由しもう一方の血液ポートから出し、チューブを介しかかる血液ポート側の透析液ポートに入れもう一方の透析液ポートへと流し、これを15分間循環した。その後、実施例1と同一の条件でγ線を照射し、操作1を行った。化合物Aの溶出量を測定したところ0μg/mlであった。また血液循環試験の結果、循環時間は23分であった。
(比較例2)
PMMA中空糸ミニモジュールの血液接触側と非接触側の液体を圧空によって除去した。ペリスタポンプによって1ml/minの流速で化合物A及び化合物Bを含む水溶液(各々1000μg/ml含むPG30体積%の水溶液(Bis−Tris緩衝液を添加しpHは5に調整)水溶液30mlを栄研チューブ(図2中9)に入れ、PMMA中空糸ミニモジュールの一方の血液ポートから導入してもう一方の血液ポートへ流し、15分間循環した。続いて、新たに調製した化合物A及び化合物Bを含む水溶液(濃度は各々1000ppm)水溶液30mlを中空糸内を経由しもう一方の血液ポートから出し、チューブを介しかかる血液ポート側の透析液ポートに入れもう一方の透析液ポートへと流し、これを15分間循環した。その後、実施例1と同一の条件でγ線を照射し、操作1を行った。化合物Aの溶出量を測定したところ0μg/mlであった。また血液循環試験の結果、循環時間は25分であった。
(比較例3)
PMMA中空糸ミニモジュールの血液接触側と非接触側の液体を圧空によって除去した。続いて、化合物Aを5000μg/mlとPEG化ポリシロキサン(化3、化合物B)を1000μg/ml含むPG30体積%の水溶液(Bis−Tris緩衝液を添加しpHは5に調整)を血液接触側及び非接触側に5mlシリンジを用いて約2ml充填した。4ヶ所のポートを密栓した状態でγ線を照射した。このときγ線の吸収線量は25kGyであった。操作1を行った。化合物Aの充填量は1.5g/m2、使用量は8.0g/m2であった(グラフト量は測定しなかった)。化合物Aの溶出量を測定したところ0μg/mlであった。また血液循環試験の結果、循環時間は35分であった。すなわち、本態様では、実施例1、2に比べて化合物Aの使用量が格段に多いものの、血液接触側と非接触側の両方に液体充填した場合は、同等の循環時間の結果しか得られないことが示されている。
(比較例4)
PMMA中空糸ミニモジュールの血液接触側と非接触側に蒸留水を充填し、4ヶ所のポートを密栓した状態でγ線を照射した。このときγ線の吸収線量は25kGyであった。ミニモジュールの中空糸膜およびモジュール内部を、ペリスタポンプを用いて25℃の温度の蒸留水及び生理食塩水、各300mlを流速10ml/minで流して洗浄し、中空糸膜ミニモジュールを得た。蒸留水洗浄と生理食塩水洗浄は同時ではない。化合物Aの溶出量を測定したところ0μg/mlであった。また血液循環試験の結果、循環時間は20分であった。
【図面の簡単な説明】
【0055】
【図1】本発明の実施例および比較例で用いたミニモジュールを例示する概略側面図である。
【図2】本発明の実施例および比較例における化合物Aの溶出確認で血漿循環および洗浄に使用した回路を示す概略系統図である。また、比較例1と2で化合物Aと化合物Bを充填する際に使用した回路を示す概略系統図である。
【図3】本発明の実施例および比較例における血液循環試験で使用した回路を示す概略系統図である。
【符号の説明】
【0056】
1、1’:血液ポート
2、2’:透析液ポート
3:モジュールケース
4:中空糸分離膜
5:ポッティング剤
6:ミニモジュール
7:シリコンチューブ(0.8×4.1)
8:ペリスタポンプ
9:ポリスチレンラウンドチューブまたは栄研チューブ
10:血漿
11:シリコンチューブ(2×4)
12:包接部シリコンチューブ(2×4)
【技術分野】
【0001】
本発明は、医薬、医療、プロテオーム解析および食品製造などの分野で好適に用いられる膜及びその製造方法に関するものである。
【背景技術】
【0002】
人工材料を生体成分と接触させると、タンパク質や血小板などが表面に付着し、材料の性能が低下するだけでなく、生体反応を激しく刺激する。そのため、生体成分と接触させる用途に用いられる人工材料には表面の生体適合性が強く求められており、世界中の研究者等が新技術の開発に取り組んでいる。例えば、ミクロ相分離構造を持つ表面を形成させたり、表面に親水性高分子をグラフトしヒドロゲル構造を持たせたりした技術が広く知られている。しかしながら、これらの技術は、材料の種類や物性で限定されてしまうことや、未反応物質の残留などが懸念される。
【0003】
特に、複雑な形状を有する多孔質分離膜においては、生体成分が接触する表面の微細構造を制御することは非常に困難である。例えば血液浄化用膜では、血液が常に人工材料と接触しており、凝固反応が活性化されるため、高い生体適合性が求められる。しかしながら、抗凝固剤を投与することで血液凝固を抑制していることが実状であり、現在は血小板やタンパク質の吸着を抑制する機能を人工材料に付与する技術開発が進められている(特許文献1,2参照)。しかしながら、抗凝固剤は、副作用が懸念されるのみでなく、出血傾向の患者には用いることができず、患者毎に投与量を管理しなければならないため、医療従事者への負担が大きいことが問題となっている。
【特許文献1】特表2004−525888号公報
【特許文献2】特開2006−291193号公報
【発明の開示】
【発明が解決しようとする課題】
【0004】
本発明の目的は、上記の問題を考慮して、抗凝固能、好ましくは抗トロンビン活性、および血小板付着抑制能が付与された、生体適合性に優れた生体成分接触用の膜を提供すること、抗凝固能を有する化合物および親水性高分子化合物の溶出量を低減できることにある。また、従来法と比して非常に簡便かつ低コストで生体適合性を膜に付与する技術を提供するものである。
【課題を解決するための手段】
【0005】
上記目的を達成するために、本発明は以下の構成を有するものである。
1.膜の生体成分との接触面の反対側の面に液体が充填されていない状態下にて抗トロンビン活性を有する化合物を含む液体を前記生体成分との接触面と接触させて製造することを特徴とする、生体成分接触用途の膜の製造方法。
2.前記製造された膜において、膜を1cm2当たり160μlのヒト血漿を0.5ml/minの流速で4時間流した際に、膜からの前記抗トロンビン活性を有する化合物の溶出量が1μg/ml未満であることを特徴とする前記1記載の生体成分接触用途の膜の製造方法。
3.前記製造された膜において、前記抗トロンビン活性を有する化合物が膜に1mg/m2以上含まれることを特徴とする前記1または2記載の生体成分接触用途の膜の製造方法。
4.前記液体を生体成分との接触面と接触させた後、放射線を照射することを特徴とする前記1〜3のいずれかに記載の生体成分接触用途の膜の製造方法。
5.前記液体を生体成分との接触面と接触させた後、除去してから放射線を照射することを特徴とする前記4に記載の生体成分接触用途の膜の製造方法。
6.前記放射線を照射した後、界面活性剤を用いて洗浄することを特徴とする前記4または5に記載の生体成分接触用途の膜の製造方法。
7.前記抗トロンビン活性を有する化合物が抗トロンビン活性部分および高分子鎖部分を含むことを特徴とする前記1〜6のいずれかに記載の生体成分接触用途の膜の製造方法。
8.前記抗トロンビン活性を有する化合物が4−メトキシ−ベンゼンスルホニル−Asn(PEG2000−Ome)−Pro−4−アミジノベンジルアミドであることを特徴とする前記7に記載の膜の製造方法。
9.前記膜が前記抗トロンビン活性を有する化合物とは異なる親水性高分子化合物を含むことを特徴とする前記1〜8のいずれかに記載の生体成分接触用途の膜の製造方法。
10.前記親水性高分子化合物が、ポリビニルアルコール、ポリエーテル、ポリビニルピロリドンおよびポリエーテルとポリシロキサンからなる物質からなる群より選ばれる少なくとも一つを含むことを特徴とする前記9に記載の生体成分接触用途の膜の製造方法。
11.前記ポリエーテルとポリシロキサンからなる物質がポリエーテル/ポリシロキサン共重合体であることを特徴とする前記10に記載の生体成分接触用途の膜の製造方法。
12.前記親水性高分子化合物が前記抗トロンビン活性を有する化合物を含む液体に含まれたものを生体成分との接触面と接触させることを特徴とする前記9〜11のいずれかに記載の生体成分接触用途の膜の製造方法。
13.前記抗トロンビン活性を有する化合物を含む液体が下記条件Aを満たし、下記条件Bを満たす有機溶媒を含んだ溶液であることを特徴とする前記1〜12のいずれかに記載の生体成分接触用途の膜の製造方法。
A:含有水分は25vol%以上90vol%以下
B:少なくとも一つが2級または3級である水酸基を含有
14.前記抗トロンビン活性を有する化合物を含む液体がpH3以上10未満の緩衝液を含む溶液であることを特徴とする前記1〜13のいずれかに記載の生体成分接触用途の膜の製造方法。
【発明の効果】
【0006】
本発明によって、高い抗血栓性を有し、溶出物の少ない生体成分接触用途の膜と生産性に優れた製造方法を提供することができる。
【発明を実施するための最良の形態】
【0007】
本発明における生体成分とは、生体由来の細胞、タンパク質、核酸、糖、脂質およびそれらの複合体のことを指す。また生体外で培養された細胞や遺伝子組み替えタンパク質なども生体成分とする。本発明に係る膜は、生体成分の中でも血液成分、すなわち血球や血小板などの細胞や血漿タンパク質などの血漿成分を取り扱う場合に好適である。
【0008】
本発明に係る膜は医療用の基材として好適に用いることができる。医療用基材の例として埋め込み型人工臓器や人工血管、カテーテル、ステント、血液バッグ、コンタクトレンズ、眼内レンズおよび手術用補助器具等が挙げられ、生体成分分離用モジュールや血液浄化用モジュールなどに内蔵され用いられる分離膜や吸着剤なども含まれる。本発明において、生体成分分離用モジュールとは、濾過、透析、吸着などにより生体物質を分離し、一部を回収するモジュールのことをいい、医療用基材に限られるものではない。また、血液浄化用モジュールとは、血液を体外に循環させる際に、吸着や濾過、拡散によって血中の老廃物や有害物質を取り除く機能を有したモジュールのことをいい、具体的に人工腎臓やそのプレもしくはポストカラム、外毒素吸着カラムなどがある。
【0009】
血液浄化用モジュールに内蔵される分離膜の形態は特に限定されるものではなく、平膜や中空糸などの形態で用いられる。一般に、中空糸は処理液量あたりの表面積が大きく、圧損も少なくできるため、本発明の方法を最も効率よく適用することができる。処理液量あたりの膜表面積を大きくするためには、中空糸内径は小さい方が好ましく、1000μm以下が好ましく、500μm以下がより好ましい。一方、平膜は製膜が容易で安価に作成することができると言う利点がある。これらの膜の素材としては、セルロース、セルロースアセテート、ポリカーボネート、ポリスルホン、ポリエーテルスルホン、ポリメタクリル酸メチル(PMMA)等のポリメタクリレート、ポリアクリレート、ポリアミド、ポリフッ化ビニリデン、ポリ塩化ビニル、ポリアクリロニトリル、ポリエステル、ポリウレタン、ポリスチレン、ポリエチレン、ポリプロピレンおよびこれらの誘導体からなる群より選択される1種類以上の素材を例示することができる。この中でPMMAはポリエチレングリコール(PEG)などの親水性高分子化合物と水素結合可能であり、これら親水性高分子化合物を放射線などにより膜表面に共有結合で固定化する場合、効率的な固定化が可能であり好適な素材である。また、近年透析器などに良く用いられているポリスルホンは分画特性が良好であるために好ましい素材である。
【0010】
本発明において「生体成分との接触面の反対側の面に液体が充填されていない状態下」とは、中空糸膜を例に挙げると、生体成分が内表面と接触する場合は、外表面に液体が充填されていない状態を指し、人工腎臓型中空糸膜モジュールで説明すると、透析液接触表面側に液体が充填されていない状態で血液接触表面にのみ液体を充填するということである。なお、充填した液体は、充填後に脱液してもよい。また、単に膜表面が水分を含んでいる状態は、「充填された」状態に該当しない。
【0011】
この原理を以下に説明する。例えば人工腎臓型中空糸膜には内表面と外表面があり、内表面は血液と、外表面は透析液と接触して用いられる。さらに膜厚部には非常に多くの孔が存在し、内表面側と外表面側の間の透過性を担っている。一例として中空糸膜の抗血栓性を向上させる場合、外表面側に抗血栓性物質を塗布もしくは充填し内表面側に拡散させる方法があるが、抗血栓性物質の拡散によって生体にとって安全上好ましいとはいえない。また親水性高分子を中空糸膜の内表面から外表面へ押しつけるような充填方法で膜内表面に局在化させる方法や中空糸膜の内表面側と外表面側に親水性高分子溶液を充填し膜に浸潤させる方法などが知られている。しかしながら、本発明においては、機能性付与のために供する物質を機能性表面(例えば人工腎臓型中空糸膜で血液に対しては内表面側、透析液に対しては外表面側)にのみ、もしくは偏って導入すればよいものであるが、上記方法も機能性付与のために供する物質の分子量が小さいもしくは溶液中における回転半径が小さいなど中空糸膜の孔へ侵入もしくは孔を透過可能である場合、機能性付与のために必要な量を添加しても、十分な機能を発揮し得ず、当該必要量を超えた量を添加する必要があるため、必ずしも好ましい方法ではない。そこで、本発明者等は、鋭意検討した結果、例えば人工腎臓型中空糸膜モジュールにおいて抗血栓性を向上させるため、透析液接触表面側に液体が充填されていない状態で血液接触表面にのみ液体を充填するという方法を考え出した。本方法を用いれば、たとえ機能性物質の分子量や溶液中の回転半径が小さくとも、機能性付与のために供する物質が膜孔に拡散することを低減可能であり、その結果、膜の孔へ侵入もしくは透過することを抑制でき、機能表面側にのみ、もしくは偏って機能性物質が導入でき、産業上操作性やコスト性でも優れている。また後述するように、導入する機能性物質を膜に固定化することで拡散によって誘発される機能化の目的以外の現象を抑制できる。さらに本発明で、透析液接触表面側に液体が充填されていない状態で血液接触表面にのみ液体を充填し、抗トロンビン活性を有する化合物を膜に吸着させた後、充填液を抜き取ることで、充填液と共に機能性付与のために供する物質が膜孔へ拡散することをより抑制できる。
【0012】
本発明に係る抗トロンビン活性を有する化合物とは、トロンビンの活性を抑制することにより強力な血液抗凝固作用を示す化合物である。抗トロンビン活性を有する化合物として、下記の一般式
【0013】
【化1】

【0014】
(式中、PEGは数平均分子量2000のPEG残基、Meはメチル基を表す。)で示される4−メトキシ−ベンゼンスルホニル−Asn(PEG2000−Ome)−Pro−4−アミジノベンジルアミド(以下、化合物Aと略すことがある。)、ATIIIおよびヒルジン、(2R,4R)−1−[(2S)−5−(ジアミノメチリデンアミノ)−2−[[(3R)−3−メチル−1,2,3,4−テトラヒドロキノリン−8−イル]スルホニルアミノ]−4−メチル−ピペリジン−2−カルボン酸などが挙げられる。
【0015】
抗凝固能を有する化合物が上記化合物Aのように高分子鎖部分を含む場合は、その高分子鎖部分で膜と結合することが可能となり、抗トロンビン部分が膜と結合することによる活性低下を抑止できるので好ましい。本発明で言うところの高分子鎖部分とは特定の化学構造を有する繰り返し単位が共有結合で連なった分子鎖で分子量1000以上のものを指す。かかる高分子鎖部分としては、PEG残基、ポリビニルピロリドン(PVP)残基、ポリプロピレングリコール残基、ポリビニルアルコール(PVA)残基およびそれらのいずれかの共重合体の残基等の親水性高分子鎖が挙げられる。このような親水性高分子鎖を有する化合物は、抗凝固能を有する化合物の水溶性が低下しにくいこと、またアミノ基やカルボキシル基を有する誘導体が市販されており、これらを高分子鎖部分に導入して抗凝固能を有する化合物を製造する方法が比較的容易なことから特に好ましく用いることができる。
【0016】
さらに、抗トロンビン活性を有する化合物が血液中に溶出すると、凝固時間を延長させる効果があることや副作用が起こる可能性が考えられるが、本発明においては、かかる溶出量を1μg/ml未満とすることが好ましく、より好ましくは0.8μg/ml未満であり、さらには0.6μg/ml未満に低減させることが好ましい。これによって、抗トロンビン活性を有する化合物による副作用や、膜への導入量を低減させることが可能となり、安全かつ低コストを達成できる。
【0017】
本発明における親水性高分子化合物とは、抗トロンビン活性を有する化合物とは異なるものとして添加されるものであり、水に可溶な高分子化合物および水に不溶でも静電相互作用や水素結合により水分子と弱い相互作用をし得る高分子化合物を指す。また高分子化合物とは数平均分子量が1000以上の化合物をいう。親水性高分子化合物の例としては、例えば、PVA、PVP、PEG、ポリプロピレングリコール、ポリエーテルとポリシロキサンからなる物質、ポリエチレンイミン、ポリアリルアミン、ポリビニルアミン、ポリ酢酸ビニル、ポリアクリル酸、ポリアクリルアミドなどや、これら高分子のモノマーと他のモノマーとの共重合体やグラフト体などが挙げられるが、これらに限定されるものではない。これらのうちポリエーテルとポリシロキサンからなる物質、PVA、ポリエーテル、PVPから選ばれる少なくとも一つを含むものが好適に使用されるが、特にポリエーテルとポリシロキサンからなる物質およびPVAは親水化の効果が高いので好ましい。ここで言うポリエーテルとポリシロキサンからなる物質とはポリエーテルとポリシロキサンとの共重合体、ポリマーコンプレックス、ポリマーブレンド物などが挙げられる。このうち、共重合体は水溶性が高いので水溶液によるグラフト処理が可能なことから、放射線照射施設内での溶媒への引火や発火のリスクを低減できる点で好ましい。ポリエーテル/ポリシロキサン共重合体はポリエーテルユニットとポリシロキサンユニットとからなり、それらの共重合形態はランダム共重合体でもブロック共重合体でもグラフト共重合体でもよく、またこれらの混合物でもよい。ポリエーテルとしてはPPGやPEGが好適に用いられるが、PPGはPEGと比較して疎水性が高いため、基材との間により強い疎水性相互作用を持つことが可能となり、例えば放射線グラフトする場合、効率的にポリエーテルとポリシロキサンからなる物質を基材に対してグラフトできるので好ましい。ただし、ポリエーテル中のPPGの含有率が増加し過ぎると該共重合体の水に対する溶解性が低くなるので、PPGの含有率は5mol%以上であることが好ましく、10mol%以上より好ましく、20mol%以上であることがさらに好ましい。一方で、90mol%以下であることが好ましく、80mol%以下であることがより好ましく、60mol%以下であることがさらに好ましい。なお、本発明におけるPPGの含有率(mol%)は式(1)で算出するものとする。
P=100×(a)/(b) 式(1)
上式中、PはPPGの含有率(mol%)とし、(a)はポリエーテル中のPPGユニットの数、(b)はポリエーテル中のエーテルユニットの数とする。ポリエーテル中のPPGユニットとは下記化学式で表される構造のことを指す。
【0018】
【化2】

【0019】
また、ポリエーテル中のエーテルユニットとは下記化学式で表される構造のことを指す。
【0020】
【化3】

【0021】
上式においてR1は炭素数6以下のアルキル基である。PPG含有率は核磁気共鳴分光法(以下1H−NMRとする)などで測定することが可能である。
また、ポリエーテルは共重合されていてもよく、その場合、ポリエーテル中のPPGの他の共重合成分等としては、入手のしやすさ等の観点から、PEGがよい。また、かかるPEGとPPGからなる物質において、その効果を損なわない程度に他の共重合成分等が含まれていても構わない。
【0022】
抗凝固能を有する化合物の高分子鎖部分としてのPVA、また、親水性高分子化合物としてのPVAについて、ケン化度の低いPVAはさらに基材を親水化する効果が高いので好ましい。ここで言うケン化度とは式(2)で求められる数値である。ただし、ケン化度が低すぎると水に対する溶解性が著しく低くなるので水溶液として基材に対して表面処理することが困難となることがある。そのため、ケン化度は好ましくは50mol%以上であり、より好ましくは74mol%以上であり、さらに好ましくは78mol%以上である。逆にケン化度が高すぎても、水に対する溶解性が低下し、溶解時に加熱などが必要となり、生産性が低下するので好ましくない。したがって、ケン化度は99.9mol%以下が好ましく、95mol%以下がより好ましく、90mol%以下であることがさらに好ましい態様である。
【0023】
【化4】

【0024】
【化5】

【0025】
(k)=(m)/((n)+(m))×100 式(2)
(式2)中の記号は以下の通り。
(k):ケン化度
(m):PVA中の式[化4]で表されるモノマー繰り返し単位数
(n):PVA中の式[化5]で表されるモノマー繰り返し単位数
また、親水性高分子化合物の量も少なすぎると、血小板付着抑制効果が低いという問題がある。本発明の膜は、表面親水性高分子量が20重量%以上であることが好ましい。ここで、表面親水性高分子量とは、膜の表面における親水性高分子のモノマーユニットの重量(モノマーユニットのモル数×モノマーユニットの分子量)を(A)、膜の表面における膜を構成する高分子のモノマーユニットの重量(モノマーユニットのモル数×モノマーユニットの分子量)を(B)としたときに、A/(A+B)で表される比率と定義する。表面親水性高分子量は、膜の表面の親水性の度合いを表すパラメータとなる。
【0026】
表面親水性高分子化合物の量は、膜の表面のみ、すなわち表面から深さ10nm程度までをX線光電子分光法(ESCA)(X線の入射角に対する検出器の角度は90度)により測定することで求められる。すなわちESCAの測定により得られた、膜の処理前後のC1s、O1sスペクトルの面積強度変化から求められる。表面親水性高分子量は、20重量%以上であることが好ましく、32重量%以上であることがより好ましい。表面親水性高分子量が20重量%未満になると、タンパク質などの有機物や生体成分の付着を抑制する効果が低下する。
【0027】
本発明の膜は、抗トロンビン活性を有する化合物を含むものである。膜の表面に抗トロンビン活性を有する化合物のみが導入された場合、トロンビンによる血液凝固反応の活性化を抑制できるが、血小板凝集を抑制できないため、生体成分と接触させる用途において、タンパク質や血小板の膜への付着を完全に抑制することができない。一方、膜の表面に親水性高分子化合物のみが導入された場合、タンパク質や血小板の付着を抑制できるが、トロンビンや他の凝固因子による活性化を抑制できないため、上記同様、血栓の生成等を完全に抑制することができない。すなわち、一方の化合物の量を単に増加させることによって、本発明の課題を解決することはできない。しかしながら、本発明においては、抗トロンビン活性を有する化合物および親水性高分子化合物を共に膜に接触させることにより、初めて複数の凝固反応を抑制でき、抗血栓性に優れた膜が創製可能となるものである。
【0028】
本発明において、抗トロンビン活性を有する化合物と親水性高分子化合物は膜に対して直接結合していてもよいし、いなくてもよい。ただし直接結合している方が、これらの化合物が膜表面から脱離しにくいので効果が持続すること、及びこれらの化合物の溶出量低減が期待できるため好ましい。このときの結合は共有結合、イオン結合、水素結合、配位結合、疎水性相互作用などの化学結合があるが、共有結合は比較的強固な結合であるので好ましい。また、これらの結合を複数組み合せた結合であってもよい。また抗トロンビン活性を有する化合物と親水性高分子化合物とを膜表面に共有結合すなわちグラフトさせる方法としては求核置換反応などによる有機化学的な方法と電離放射線を照射することによる放射線化学的な方法とがある。このうち放射線化学的な方法は反応副生成物が少なく、かつ放射線の種類や線量を適宜選択することで膜の滅菌を同時に行うことも可能であり好ましい。また、抗トロンビン活性を有する化合物と親水性高分子化合物は同時に処理しても、別々に処理してもよい。親水性高分子化合物は、膜の製造時に原料とともに混練される等して、膜の一成分となっていてもよいが、膜の種類によっては、膜の機械的もしくは化学的物性(例えば強度や脆性、表面電荷、表面濡れ性など)を損なう可能性がある。従って、この様な場合は、膜の表面に当該親水性高分子化合物を含む水溶液等を接触させる等の方法により、膜表面に導入固定してもよい。この様な導入固定方法を採ることで、膜の種類を選択せずに適用できる範囲が広がるため、本発明の効果を多くの分野で活用できるだけでなく、用途のために最適化されるように親水性高分子化合物の種類を容易に変更できるため、機能性や生産コストの面からより好適である。
【0029】
溶出物量の確認方法としては、下記要領で測定する方法が例として挙げられる。または、同等の溶出量の結果が得られる方法であればよい。例えば、試薬にHaemoSys社製のECA−Tキットを使用し、装置にTECO Medical Instruments Production社製のCOATRON M1(code 80 800 000)を使用する。血液もしくは生体成分、生体組織と接触する面積(中空糸の場合は血液と接触する糸内表面積とする)(以下、面積Aという)1cm2当たり160μlのヒト血漿で4時間洗浄する。洗浄後のヒト血漿を80μl採取し、20μlの蒸留水を添加する。この溶液をサンプル溶液とする。サンプル溶液を調製してすぐに、ECA prothrombin buffer 100μl、サンプル溶液30μl、ECA−T substrate 25μlを混合し、37℃の温度で60秒間インキュベート後、装置にセッティングする。これにECA ecarin reagent 50μlを添加して測定を行う。予め、任意の濃度に調製した抗トロンビン活性を有する化合物の水溶液もしくはブランクの蒸留水を20μlとヒト血漿80μlの混合溶液を同手法にて測定し、結果を検量線として用い、検量線から算出された抗凝固能を有する化合物の量を溶出量とする。
【0030】
膜表面における抗トロンビン活性を有する化合物の量は、その抗凝固能の強さに応じて適宜変わるが、少なすぎると抗凝固能効果が低いという問題があるので1mg/m2以上が好ましく、5mg/m2以上がより好ましく、10mg/m2以上がさらに好ましい。一方、抗トロンビン活性を有する化合物の量が多すぎるとコストアップや溶出といった問題があるので100g/m2以下が好ましく、50g/m2以下がより好ましく、10g/m2以下が更に好ましい。ここで、膜が多孔質膜の場合は細孔を含めた面積で除する。膜表面における抗トロンビン活性を有する化合物の量は、次のように測定する。すなわち、膜に対する抗トロンビン活性を有する化合物の添加量をベースとして、後続する工程、例えば、主な工程は洗浄工程であり、膜に固定されていない未反応物を除去する工程で除去される量を差し引くことで求められるが、これに限定されるものではない。
【0031】
また、本発明の膜の製造方法においては、抗トロンビン活性を有する化合物および親水性高分子化合物を膜に接触させた状態で放射線照射する方法を用いることが好ましい。さらに、本発明の膜の製造方法の好ましい態様においては、有機溶媒の存在下でこれらの化合物を膜に接触させた状態で放射線照射する方法を用いる。
【0032】
本発明で用いられる放射線とは、高エネルギーの粒子線および電磁波のことであり、そのような放射線としては、例えば、α線、β線、γ線、X線、紫外線、電子線および中性子線などが挙げられる。これらの放射線のうち、エネルギーが特に高く効率よく基材の改質ができるという点で、γ線と電子線がより好ましく用いられる。また、γ線、X線および電子線は、線量をコントロールすることにより滅菌も同時に行うことができるので、医療材料などの基材の改質に好適である。
【0033】
また、膜に対して放射線を照射する場合、放射線の線量が少ない場合は膜中の吸収線量にばらつきが生じるなど、線量のコントロールが困難となる。そのため、放射線の線量は、1kGy以上であることが好ましく、より好ましくは5kGy以上である。また、医療材料などに用いられる膜において、改質と同時に滅菌も行うような場合、放射線の線量は10kGy以上であることが好ましく、より好ましくは20kGy以上である。ただし、過剰な線量の放射線の照射は膜自身を劣化させるので、放射線の線量は5000kGy以下であることが好ましく、より好ましくは1000kGy以下であり、さらに好ましくは100kGy以下である。
【0034】
抗トロンビン活性を有する化合物が放射線照射によりその活性が低下する場合は、有機溶媒によりその活性低下を防ぐことが可能である。すなわち、有機溶媒の存在下に抗トロンビン活性を有する化合物を接触させた膜に、放射線を照射するのである。
【0035】
本発明で好適に用いられる有機溶媒としては、水酸基を含有する溶媒が挙げられる。水酸基は、放射線照射により発生したラジカルを安定化する効果が高く、かつ非イオン性の官能基であり強い表面電荷を有する化合物との相互作用が小さく、かつ酸化還元力も小さく化合物の変性も少ない。特に2級および3級の水酸基は、ラジカルを安定化する効果がより高いので、本発明においては少なくとも一つに2級または3級の水酸基を有する有機溶媒、例えばグリセリンやプロピレングリコール(以下、PGという)やイソプロパノール(以下、IPAという)、2−ブタノール、2,3−ブタンジオールおよび1,3−ブタンジオールなどが用いられる。ただし、エチレングリコールやエタノールのような1級の水酸基のみを有する有機溶媒はラジカルを安定化する効果が低いこと、エタノールのような引火性の高い溶媒は含有率を高くすると危険であることなどから、本発明でいう有機溶媒には含まれない。また、本発明の化合物の滅菌方法を医療材料、またはこれが内蔵される医療用具の製造に用いる際は、その安全性を考慮する必要があるため、非水溶媒は毒性の低いものが好適に用いられる。
【0036】
また、有機溶媒水溶液における水分率の上限は90vol%であり、90vol%を超えると有機溶媒のラジカル安定化の効果が十分に得られない。90vol%以下の範囲においては、水分率が多い方が好ましい。一方、水分率が低い場合、例えば医療用具などに用いる際、洗浄後の有機溶媒残留が生体適合性に影響を与えることが懸念される他、例えば放射線グラフトに用いる場合にグラフト効率が低下することが考えられる。よって水分量は全溶媒量の25vol%以上であることが好ましく、より好ましくは50vol%以上である。
【0037】
本発明において、化合物の有機溶媒における濃度については特に限定されるものではないが、化合物によっては濃度が濃すぎると化合物間で架橋反応が進行してゲル化などにより、化合物本来の物性が失われるおそれがあるので、化合物の有機溶媒の水溶液における濃度は50重量%以下が好ましく、より好ましくは30重量%以下であり、さらに好ましくは20重量%以下である。
【0038】
本発明における水分率とは、次式で定義されるものである。
抗トロンビン活性を有する化合物および該化合物を溶解および/または分散している有機溶媒水溶液に含まれる水の体積)/(抗トロンビン活性を有する化合物および該化合物を溶解および/または分散している有機溶媒水溶液の体積)×100(%)
有機溶媒の存在下で、抗トロンビン活性を有する化合物を膜に接触させる方法としては、抗トロンビン活性を有する化合物を有機溶媒に溶解または分散し、得られた液体に膜を浸漬させたり、膜に塗布したりする方法が挙げられる。ここで、抗凝固能を有する化合物が溶解するとは、その化合物が溶媒に溶けて均一混合物、すなわち溶液になることを指す。また、抗トロンビン活性を有する化合物が分散するとは、その化合物がコロイドやミセル状態など溶媒中に散在することを指す。また、抗トロンビン活性を有する化合物が目的の有機溶媒に溶解しにくい場合は、抗トロンビン活性を有する化合物に対する溶解度が高い溶媒に溶解させた溶液を膜と接触させた後に、その溶媒を目的とする有機溶媒に置換してもよい。このとき抗トロンビン活性を有する化合物を溶解させる溶媒は、水などの無機溶媒でもよい。すなわち、抗トロンビン活性を有する化合物を水に溶解した溶液に膜を接触させた後、水を有機溶媒に置換してから膜に放射線を照射するのである。また、本発明者らは、抗トロンビン活性を有する化合物を有する液体を膜に接触させた状態で放射線照射を行うと、放射線により化合物が膜内部に浸透する場合があり、膜表面に抗凝固機能を付与するために十分な存在量を表面上にて確保できない場合があることを見出した。さらに検討を進めた結果、当該液体を接触させた後、排出等を行って除去し、その後に放射線照射を行うと、膜表面に十分な抗凝固機能を付与するための化合物の存在量を確保でき、最低限の添加量とできることを見出した。
【0039】
また、本発明では、あらかじめ抗トロンビン活性を有する化合物を膜に塗布もしくは吸着させ、その化合物が付着した膜を有機溶媒に浸漬させてもよい。
【0040】
また、本発明において、抗トロンビン活性を有する化合物と親水性高分子化合物を用いられる緩衝液とは、少量の酸や塩基を加えたり、多少濃度が変化したりしてもpHが変化しないようにした溶液のことであり、例えば、リン酸緩衝液、トリスヒドロキシメチルアミノメタン緩衝液、ビス(2−ヒドロキシエチル)イミノトリス(ヒドロキシメチル)メタン(以下、Bis−Trisという)緩衝液、酢酸緩衝液、クエン酸緩衝液およびホウ酸緩衝液などが挙げられる。これらのうち、リン酸緩衝液、Tris緩衝液およびBis−Tris緩衝液は中性および酸性領域における緩衝作用を有することと、生理活性を有する化合物の溶媒として添加されることが多いことから好適である。ただし、pH3未満のような強酸性条件下やpH10以上のような強塩基性条件下では、抗トロンビン活性を有する化合物や親水性高分子中の一部の分子構造に変化を生じ、物理的機能、化学的機能または生物的機能が変化することや例えばグラフト固定化膜を創製する場合に膜自体の性能が低下することが考えられるので、緩衝範囲はpH3以上であり、5以上が好ましい。また、上限としてはpH10未満であり、8以下が好ましい。pHの測定にはガラス電極法を用いるが、同等の精度で測定できるものであれば、これに限定されるものではない。
また、本発明で用いられる緩衝液を含む溶液とは、上記緩衝液の水溶液や、他の溶媒、溶液を含む溶液を意味するものであるが、緩衝液を含む溶液全体として上記した緩衝液のpHの範囲を超えて変動するものを意味するものではなく、好ましくは緩衝液のpHが変動しないものである。
【0041】
また本発明では、抗トロンビン活性を有する化合物と親水性高分子化合物を含む液体を膜に接触させる際、抗酸化剤を併用することも可能である。抗酸化剤が、放射線照射により発生したヒドロキシラジカルを捕捉し、抗凝固能を有する化合物の変性を抑制する効果が期待できるからである。ここでいう抗酸化剤とは、他の分子に電子を与えやすい性質を持つ分子を有する化合物のことを言うが、膜や抗トロンビン活性を有する化合物、親水性高分子化合物が放射線によって変性することを抑制する性質をもつものでもある。
【0042】
抗酸化剤としては、例えば、ビタミンCなどの水溶性ビタミン類、ポリフェノール類、ソジウムハイドロサルファイト、ピロ亜硫酸ナトリウム、二チオン酸ナトリウムなどの無機塩類、尿酸、システインおよびグルタチオンなどが挙げられるが、これらに限定されるものではない。これらの抗酸化剤は単独で用いてもよく、2種類以上を混合して用いてもよい。本発明の膜を医療材料に用いる際は、その安全性を考慮する必要があるため、毒性の低い抗酸化剤が用いられる。抗酸化剤の濃度は、含有する抗酸化剤の種類や放射線の照射線量などにより異なるため、適宜、最適な濃度で使用すればよい。
【0043】
抗トロンビン活性を有する化合物と親水性高分子化合物を膜表面に付与した後に、これら化合物の溶出量を低減するために、放射線を照射する前もしくは後、または前後両方に膜を洗浄することも可能である。特に放射線を照射した後は、抗トロンビン活性を有する化合物と親水性高分子化合物が膜表面に共有結合されているので、過剰な洗浄でも抗トロンビン活性を有する化合物と親水性高分子化合物が過剰に除去される危険性は低い。さらに、洗浄によって未反応物や副生成物を除去できることから、特に医療用途には安心して使用することができる。洗浄には水、生理食塩水、pH緩衝液や有機溶媒を用いることができる。また界面活性剤の溶液は、洗浄効果が高い。
【0044】
本発明において界面活性剤とは、一般にいう界面活性剤を意味するものであり、水に対して強い表面活性を示し、分子内に親水性の部分と疎水性(親油性)の部分とを併せ持つ物質である。界面活性剤のうちイオン系界面活性剤は、イオン性の官能基を有する基材または親水性高分子化合物を用いた場合、静電的な相互作用により界面活性剤が結合して表面の物性が変化する可能性を否定できない。そのため、非イオン性の界面活性剤が好ましく用いられる。非イオン系の界面活性剤のうち、ポリオキシエチレンアルキルフェニルエーテルとポリオキシエチレンアルキルエーテルは特に洗浄効果が優れている。
【0045】
本発明において、界面活性剤は固体や粘性の液体であることが多く、洗浄に用いる場合は、取扱性の面で溶液の状態とすることが好ましい。溶液の濃度は、低すぎると十分な洗浄効果が得られないことがあり、逆に高すぎると生産コストが高くなるのみでなく膜を変性させることにつながりかねない。したがって界面活性剤水溶液の濃度は、好ましくは0.001重量%以上であり、より好ましくは0.005重量%以上であり、さらに好ましくは0.01重量%以上である。一方で、好ましい上限濃度は20重量%以下であり、より好ましくは10重量%以下の範囲であり、さらに好ましくは5重量%以下の範囲である。
【0046】
膜の洗浄方法としては、余剰の抗凝固能を有する化合物および親水性高分子化合物が溶脱し得るように、膜に界面活性剤あるいは界面活性剤を添加した溶液等の洗浄剤を接触せしめる方法であればよい。例えば、洗浄液を所定の流量にて所定の方向に流通させることによって洗浄する方法が、最も効率的でありよく洗浄することができる。また、洗浄方法として、界面活性剤に膜を浸漬させる方法を採ってもよい。例えば、血液浄化用モジュールの充填液として界面活性剤あるいは界面活性剤を添加した溶液を用いることも可能である。膜に界面活性剤あるいは界面活性剤を添加した溶液を所定の方向に流通させるとき、膜の周りを循環させてもよいが、抗トロンビン活性を有する化合物および親水性高分子化合物等が溶出した界面活性剤を再使用することは、洗浄効率の低下につながることがある。洗浄液を所定の流量で流通させて洗浄するときの流量は、少なすぎると十分な洗浄効果が得られないことがある。また、流量が多すぎると洗浄時間が長くなり生産性が低下する。したがって、基材表面積あたりの流量は、0.5L/m2以上が好ましく、より好ましくは1L/m2以上であり、さらに好ましくは3L/m2以上である。一方、流量の上限としては、300L/m2以下が好ましく、より好ましくは200L/m2以下であり、さらに好ましくは100L/m2以下である。
【0047】
また、膜を界面活性剤で洗浄した後に、さらに水や生理食塩水で洗浄することにより、界面活性剤の膜への残存を防ぐことができる。ここで、水および生理食塩水で洗浄するとは、これらを別々に用いて洗浄することを意味する。
【0048】
また、放射線照射前に洗浄することにより、グラフトしていない抗トロンビン活性を有する化合物および親水性高分子化合物の量を少なくすることが可能となり、放射線照射後の洗浄量を少なくすることができる。
【実施例】
【0049】
[PMMA中空糸ミニモジュールの作製方法]
アイソタクティック−PMMA5重量部とシンジオタクティック−PMMA20重量部を、ジメチルスルホキシド75重量部に加え、110℃で8時間撹拌し製膜原液を得た。この製膜原液をオリフィス型二重円筒型口金から吐出し、空気中を300mm通過させた後、水100%の凝固浴中に導き中空糸膜を得た。この際、内部注入気体として乾燥窒素を用いた。得られた中空糸膜の内径は0.2mmであり、膜厚は0.03mmであった。
【0050】
上記のようにして準備したPMMA中空糸膜を50本束ねた。中空糸膜中空部が閉塞しないように留意しつつその両末端をウレタン系ポッティング剤でモジュールケースに固定し、ミニモジュール(図1)を作成した。該ミニモジュールの直径は約7mm、長さは約12cmであり、一般的な中空糸型透析器同様に中空糸の内側に通ずるポート(血液ポート)を2個と外側に通ずるポート(透析液ポート)を2個有している。該ミニモジュールの中空糸およびモジュール内部を蒸留水にて洗浄した。
[緩衝液の調製]
pH5の緩衝液はBis−Tris(同仁化学製)と塩化ナトリウム(シグマアルドリッチ製)を各々最終濃度0.05M,0.1Mとなるように超純水に溶解させ、6規定塩酸(シグマアルドリッチ製)を滴下しながらpH5となるように調製した。pHの測定にはガラス電極法を用い、HORIBA製pHメータ カスタニーLAB F−22を用いて測定した。その結果、pHは5.0であった。
[化合物Aの充填量測定]
化合物Aの充填量測定には、試薬にHaemoSys社製のECA−Tキットを使用し、装置にTECO Medical Instruments Production社製のCOATRON M1(code 80 800 000)を使用した。
1.ヒト血漿(コスモバイオ発売 Human Plasma 12271210, lot.16878)80μlに、測定対象溶液を20μl加え攪拌した。この溶液をサンプル溶液とする。
2.ECA prothrombin buffer 100μl、サンプル溶液30μl、ECA−T substrate 25μlを混合し37℃の温度で60秒間インキュベートし、装置にセッティングした。
3.ECA ecarin reagent 50μl加えて測定を行った。
ブランクの測定対象溶液として超純水を用い調製したサンプルで測定を行った。化合物Aの標準溶液を測定した結果から、検量線を作成し、抗トロンビン活性から化合物Aの存在量を算出した。各実施例、比較例、参考比較例に記載の条件で、ミニモジュールへ化合物Aと化合物Bからなる溶液を充填し、充填前とγ線照射前の溶液中に残存する化合物Aの存在量を測定し、充填量とした。
[化合物Aのグラフト量測定]
各実施例、比較例、参考比較例におけるγ線照射後の洗浄液を上記化合物Aの充填量測定における測定対象溶液とし、化合物Aの存在量を測定した。ここで、化合物AはPG30体積%の水溶液(Bis−Tris緩衝液を添加しpHは5に調整)中でγ線照射すると、抗トロンビン活性がγ線照射前の約80%になることから、抗トロンビン活性から化合物Aの存在量を算出する際、1.25を乗じた。化合物Aのグラフト量を下記式から求めた。
(化合物Aのグラフト量)=(化合物Aの充填量)−(洗浄液中の化合物A存在量)×1.25
[溶出物確認方法]
血液中への溶出物の確認は以下の方法で行った。すなわち、蒸留水に抗トロンビン活性を有する化合物Aと化合物Bを溶解して、所定濃度の化合物A及び化合物Bの水溶液を調製し、各実施例と比較例に示すような組成の溶液に調製し、所定量をミニモジュールに充填し、γ線照射した。化合物A及び化合物Bの水溶液をミニモジュールに充填するときの具体的手順は、各実施例、比較例にて後述する。また、比較例1と2で化合物Aと化合物Bを充填する際に使用した回路を示す概略系統図を図2に示す。
【0051】
図1において、ミニモジュール6の片側の血液ポートに内径0.8mm、長さ52cmのシリコンチューブ7をつなぎ、回路の途中にはペリスタポンプ8を設置した。もう一方の血液ポートに内径0.8mm、長さ16cmのシリコンチューブをつないだ。両シリコンチューブの血液ポートにつないでいない側を、BECTON DICKINSON社製5mlポリスチレンラウンドチューブ9(Code:352054)に差し込み、循環回路を作製した。
【0052】
次に、各実施例、比較例に示す洗浄方法を実施した後、上記回路を使用して、血漿循環実験を以下の方法で行った。すなわち、ヒト血漿(図2中10)5mlを前記ポリスチレンラウンドチューブ9から加えてシリコンチューブを血液ポートに差し入れ、ペリスタポンプ8によって流速を0.5ml/minとして送液し、初流2分間分の量は廃棄した後4時間循環した。循環後の血漿中における化合物Aの溶出量をECA−Tkitにより測定した。
[血液循環試験]
血液はボランティアから提供され、クエン酸を採血量の9分の1の体積比で予め添加した溶液に採血した。循環試験直前にクエン酸加血1mlに対して凝固促進剤としてカルチコールを436μlとなるよう血液に添加した。循環回路にはシリコンチューブ(図3中11)を用い、ペリスタポンプ(図3中8)で循環した。流量は0.9ml/minに調節し、図1記載の1‘と接続したシリコンチューブから血液を入れ、中空糸内部の気泡を除去し、図1記載の1と接続したシリコンチューブから出てきた初流の0.5mlは廃棄した。続いて、素早くシリコンチューブの開口部を包接(図3中12)し閉鎖系の回路を作成した(図3)。循環時間は、回路内の凝固が進むにつれてチューブ内圧が上昇することによって起こる回路の包接部の解放までにかかる時間を測定した。当該時間が長い程、回路内の凝固が起こり難い、抗血栓性に優れた膜であることを示す。
(実施例1)
PMMA中空糸ミニモジュールの血液接触側(中空糸内側)と非接触側(中空糸外側)の液体を圧空によって除去した。続いて、化合物Aを5000μg/mlと下記化学式にて示されるPEG化ポリシロキサン(化合物B)
【0053】
【化6】

【0054】
を1000μg/ml含むPG30体積%の水溶液(Bis−Tris緩衝液を添加しpHは5に調整)を血液接触側にのみ1mlシリンジを用いて約400μlを充填した。4ヶ所のポートを密栓した状態でγ線を照射した。このときγ線の吸収線量は25kGyであった。該ミニモジュールの中空糸膜およびモジュール内部を、ペリスタポンプを用いて25℃の温度の0.025重量%のポリオキシエチレンオクチルフェニルエーテル((以下、TritonX−100という)シグマアルドリッチ製Code30-5140-5)水溶液を流速10ml/minで流し、4時間洗浄した。新たに調製したTritonX−100水溶液を用い、同条件で再び4時間洗浄した。その後、該ミニモジュールの中空糸膜およびモジュール内部を、ペリスタポンプを用いて25℃の温度の蒸留水及び生理食塩水、各300mlを流速10ml/minで流して洗浄し、中空糸膜ミニモジュールを得た。蒸留水洗浄と生理食塩水洗浄は同時ではない(γ線照射後からここまでの操作を操作1と略す)。化合物Aの充填量は1.5g/m2、使用量は1.5g/m2であり、グラフト量は86mg/m2であった。化合物Aの溶出量を測定したところ0μg/mlであった。また血液循環試験の結果、循環時間は35分であった。
(実施例2)
PMMA中空糸ミニモジュールの血液接触側と非接触側の液体を圧空によって除去した。続いて、化合物Aを5000μg/mlと化合物Bを1000μg/ml含むPG30体積%の水溶液(Bis−Tris緩衝液を添加しpHは5に調整)を血液接触側にのみ1mlシリンジを用いて約400μlを充填した。その後、圧空によって充填液を排出させた。4ヶ所のポートを密栓した状態でγ線を照射した。このときγ線の吸収線量は25kGyであった。さらに実施例1の操作1を行った。化合物Aの充填量は0.35g/m2、使用量は0.7g/m2であり、グラフト量は17mg/m2であった。化合物Aの溶出量を測定したところ0μg/mlであった。また血液循環試験の結果、循環時間は38分であった。これは、実施例1では、液体を充填した状態でγ線を照射させたため、若干量の化合物Aが膜内部に浸透して、抗凝固機能を発揮するための表面存在量が低下した(グラフト量は実施例1の方が多いが、これは膜内部の存在量まで測定した結果である)が、本実施例では、充填液の排出除去後にγ線を照射しているため、化合物Aの表面存在量が多いためであると考えられる。
(比較例1)
PMMA中空糸ミニモジュールの血液接触側と非接触側の液体を圧空によって除去した。ペリスタポンプによって1ml/minの流速で化合物A及び化合物Bを含む水溶液(100μg/ml含むPG30体積%の水溶液(Bis−Tris緩衝液を添加しpHは5に調整)水溶液30mlをPMMA中空糸ミニモジュールの一方の血液ポートから導入してもう一方の血液ポートへ流し、15分間循環した。続いて、新たに調製した化合物A及び化合物Bを含む(各々100ppm)水溶液30mlを栄研チューブ(図2中9)に入れ、中空糸内を経由しもう一方の血液ポートから出し、チューブを介しかかる血液ポート側の透析液ポートに入れもう一方の透析液ポートへと流し、これを15分間循環した。その後、実施例1と同一の条件でγ線を照射し、操作1を行った。化合物Aの溶出量を測定したところ0μg/mlであった。また血液循環試験の結果、循環時間は23分であった。
(比較例2)
PMMA中空糸ミニモジュールの血液接触側と非接触側の液体を圧空によって除去した。ペリスタポンプによって1ml/minの流速で化合物A及び化合物Bを含む水溶液(各々1000μg/ml含むPG30体積%の水溶液(Bis−Tris緩衝液を添加しpHは5に調整)水溶液30mlを栄研チューブ(図2中9)に入れ、PMMA中空糸ミニモジュールの一方の血液ポートから導入してもう一方の血液ポートへ流し、15分間循環した。続いて、新たに調製した化合物A及び化合物Bを含む水溶液(濃度は各々1000ppm)水溶液30mlを中空糸内を経由しもう一方の血液ポートから出し、チューブを介しかかる血液ポート側の透析液ポートに入れもう一方の透析液ポートへと流し、これを15分間循環した。その後、実施例1と同一の条件でγ線を照射し、操作1を行った。化合物Aの溶出量を測定したところ0μg/mlであった。また血液循環試験の結果、循環時間は25分であった。
(比較例3)
PMMA中空糸ミニモジュールの血液接触側と非接触側の液体を圧空によって除去した。続いて、化合物Aを5000μg/mlとPEG化ポリシロキサン(化3、化合物B)を1000μg/ml含むPG30体積%の水溶液(Bis−Tris緩衝液を添加しpHは5に調整)を血液接触側及び非接触側に5mlシリンジを用いて約2ml充填した。4ヶ所のポートを密栓した状態でγ線を照射した。このときγ線の吸収線量は25kGyであった。操作1を行った。化合物Aの充填量は1.5g/m2、使用量は8.0g/m2であった(グラフト量は測定しなかった)。化合物Aの溶出量を測定したところ0μg/mlであった。また血液循環試験の結果、循環時間は35分であった。すなわち、本態様では、実施例1、2に比べて化合物Aの使用量が格段に多いものの、血液接触側と非接触側の両方に液体充填した場合は、同等の循環時間の結果しか得られないことが示されている。
(比較例4)
PMMA中空糸ミニモジュールの血液接触側と非接触側に蒸留水を充填し、4ヶ所のポートを密栓した状態でγ線を照射した。このときγ線の吸収線量は25kGyであった。ミニモジュールの中空糸膜およびモジュール内部を、ペリスタポンプを用いて25℃の温度の蒸留水及び生理食塩水、各300mlを流速10ml/minで流して洗浄し、中空糸膜ミニモジュールを得た。蒸留水洗浄と生理食塩水洗浄は同時ではない。化合物Aの溶出量を測定したところ0μg/mlであった。また血液循環試験の結果、循環時間は20分であった。
【図面の簡単な説明】
【0055】
【図1】本発明の実施例および比較例で用いたミニモジュールを例示する概略側面図である。
【図2】本発明の実施例および比較例における化合物Aの溶出確認で血漿循環および洗浄に使用した回路を示す概略系統図である。また、比較例1と2で化合物Aと化合物Bを充填する際に使用した回路を示す概略系統図である。
【図3】本発明の実施例および比較例における血液循環試験で使用した回路を示す概略系統図である。
【符号の説明】
【0056】
1、1’:血液ポート
2、2’:透析液ポート
3:モジュールケース
4:中空糸分離膜
5:ポッティング剤
6:ミニモジュール
7:シリコンチューブ(0.8×4.1)
8:ペリスタポンプ
9:ポリスチレンラウンドチューブまたは栄研チューブ
10:血漿
11:シリコンチューブ(2×4)
12:包接部シリコンチューブ(2×4)
【特許請求の範囲】
【請求項1】
膜の生体成分との接触面の反対側の面に液体が充填されていない状態下にて抗トロンビン活性を有する化合物を含む液体を前記生体成分との接触面と接触させて製造することを特徴とする、生体成分接触用途の膜の製造方法。
【請求項2】
前記製造された膜において、膜を1cm2当たり160μlのヒト血漿を0.5ml/minの流速で4時間流した際に、膜からの前記抗トロンビン活性を有する化合物の溶出量が1μg/ml未満であることを特徴とする請求項1記載の生体成分接触用途の膜の製造方法。
【請求項3】
前記製造された膜において、前記抗トロンビン活性を有する化合物が膜に1mg/m2以上含まれることを特徴とする請求項1または2記載の生体成分接触用途の膜の製造方法。
【請求項4】
前記液体を生体成分との接触面と接触させた後、放射線を照射することを特徴とする請求項1〜3のいずれかに記載の生体成分接触用途の膜の製造方法。
【請求項5】
前記液体を生体成分との接触面と接触させた後、除去してから放射線を照射することを特徴とする請求項4に記載の生体成分接触用途の膜の製造方法。
【請求項6】
前記放射線を照射した後、界面活性剤を用いて洗浄することを特徴とする請求項4または5に記載の生体成分接触用途の膜の製造方法。
【請求項7】
前記抗トロンビン活性を有する化合物が抗トロンビン活性部分および高分子鎖部分を含むことを特徴とする請求項1〜6のいずれかに記載の生体成分接触用途の膜の製造方法。
【請求項8】
前記抗トロンビン活性を有する化合物が4−メトキシ−ベンゼンスルホニル−Asn(PEG2000−Ome)−Pro−4−アミジノベンジルアミドであることを特徴とする請求項7に記載の膜の製造方法。
【請求項9】
前記膜が前記抗トロンビン活性を有する化合物とは異なる親水性高分子化合物を含むことを特徴とする請求項1〜8のいずれかに記載の生体成分接触用途の膜の製造方法。
【請求項10】
前記親水性高分子化合物が、ポリビニルアルコール、ポリエーテル、ポリビニルピロリドンおよびポリエーテルとポリシロキサンからなる物質からなる群より選ばれる少なくとも一つを含むことを特徴とする請求項9に記載の生体成分接触用途の膜の製造方法。
【請求項11】
前記ポリエーテルとポリシロキサンからなる物質がポリエーテル/ポリシロキサン共重合体であることを特徴とする請求項10に記載の生体成分接触用途の膜の製造方法。
【請求項12】
前記親水性高分子化合物が前記抗トロンビン活性を有する化合物を含む液体に含まれたものを生体成分との接触面と接触させることを特徴とする請求項9〜11のいずれかに記載の生体成分接触用途の膜の製造方法。
【請求項13】
前記抗トロンビン活性を有する化合物を含む液体が下記条件Aを満たし、下記条件Bを満たす有機溶媒を含んだ溶液であることを特徴とする請求項1〜12のいずれかに記載の生体成分接触用途の膜の製造方法。
A:含有水分は25vol%以上90vol%以下
B:少なくとも一つが2級または3級である水酸基を含有
【請求項14】
前記抗トロンビン活性を有する化合物を含む液体がpH3以上10未満の緩衝液を含む溶液であることを特徴とする請求項1〜13のいずれかに記載の生体成分接触用途の膜の製造方法。
【請求項1】
膜の生体成分との接触面の反対側の面に液体が充填されていない状態下にて抗トロンビン活性を有する化合物を含む液体を前記生体成分との接触面と接触させて製造することを特徴とする、生体成分接触用途の膜の製造方法。
【請求項2】
前記製造された膜において、膜を1cm2当たり160μlのヒト血漿を0.5ml/minの流速で4時間流した際に、膜からの前記抗トロンビン活性を有する化合物の溶出量が1μg/ml未満であることを特徴とする請求項1記載の生体成分接触用途の膜の製造方法。
【請求項3】
前記製造された膜において、前記抗トロンビン活性を有する化合物が膜に1mg/m2以上含まれることを特徴とする請求項1または2記載の生体成分接触用途の膜の製造方法。
【請求項4】
前記液体を生体成分との接触面と接触させた後、放射線を照射することを特徴とする請求項1〜3のいずれかに記載の生体成分接触用途の膜の製造方法。
【請求項5】
前記液体を生体成分との接触面と接触させた後、除去してから放射線を照射することを特徴とする請求項4に記載の生体成分接触用途の膜の製造方法。
【請求項6】
前記放射線を照射した後、界面活性剤を用いて洗浄することを特徴とする請求項4または5に記載の生体成分接触用途の膜の製造方法。
【請求項7】
前記抗トロンビン活性を有する化合物が抗トロンビン活性部分および高分子鎖部分を含むことを特徴とする請求項1〜6のいずれかに記載の生体成分接触用途の膜の製造方法。
【請求項8】
前記抗トロンビン活性を有する化合物が4−メトキシ−ベンゼンスルホニル−Asn(PEG2000−Ome)−Pro−4−アミジノベンジルアミドであることを特徴とする請求項7に記載の膜の製造方法。
【請求項9】
前記膜が前記抗トロンビン活性を有する化合物とは異なる親水性高分子化合物を含むことを特徴とする請求項1〜8のいずれかに記載の生体成分接触用途の膜の製造方法。
【請求項10】
前記親水性高分子化合物が、ポリビニルアルコール、ポリエーテル、ポリビニルピロリドンおよびポリエーテルとポリシロキサンからなる物質からなる群より選ばれる少なくとも一つを含むことを特徴とする請求項9に記載の生体成分接触用途の膜の製造方法。
【請求項11】
前記ポリエーテルとポリシロキサンからなる物質がポリエーテル/ポリシロキサン共重合体であることを特徴とする請求項10に記載の生体成分接触用途の膜の製造方法。
【請求項12】
前記親水性高分子化合物が前記抗トロンビン活性を有する化合物を含む液体に含まれたものを生体成分との接触面と接触させることを特徴とする請求項9〜11のいずれかに記載の生体成分接触用途の膜の製造方法。
【請求項13】
前記抗トロンビン活性を有する化合物を含む液体が下記条件Aを満たし、下記条件Bを満たす有機溶媒を含んだ溶液であることを特徴とする請求項1〜12のいずれかに記載の生体成分接触用途の膜の製造方法。
A:含有水分は25vol%以上90vol%以下
B:少なくとも一つが2級または3級である水酸基を含有
【請求項14】
前記抗トロンビン活性を有する化合物を含む液体がpH3以上10未満の緩衝液を含む溶液であることを特徴とする請求項1〜13のいずれかに記載の生体成分接触用途の膜の製造方法。
【図1】


【図2】


【図3】




【図2】


【図3】


【公開番号】特開2010−82067(P2010−82067A)
【公開日】平成22年4月15日(2010.4.15)
【国際特許分類】
【出願番号】特願2008−252827(P2008−252827)
【出願日】平成20年9月30日(2008.9.30)
【出願人】(000003159)東レ株式会社 (7,677)
【Fターム(参考)】
【公開日】平成22年4月15日(2010.4.15)
【国際特許分類】
【出願日】平成20年9月30日(2008.9.30)
【出願人】(000003159)東レ株式会社 (7,677)
【Fターム(参考)】
[ Back to top ]

