生体物質を担持した粒子、それを用いたセンサー及び検体の検出方法
【課題】 従来、多孔質の粒子の中に十分な生体物質を担持することができなかった。
【解決手段】 そこで、本発明は、従来よりも生体物質の担持量が多い粒子を提供するものである。それは、ロッド状の粒子であって、前記ロッド状の長軸方向に対して交差するメソ孔を有し、前記メソ孔の中に生体物質を担持する粒子を提供することにより解決する。
【解決手段】 そこで、本発明は、従来よりも生体物質の担持量が多い粒子を提供するものである。それは、ロッド状の粒子であって、前記ロッド状の長軸方向に対して交差するメソ孔を有し、前記メソ孔の中に生体物質を担持する粒子を提供することにより解決する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、生体物質を固定化し、生体物質を安定化させる技術に関する。より詳しくは、メソ孔の中に生体物質を担持した粒子に関し、バイオセンサーの応用が可能になる。
【背景技術】
【0002】
酵素は、熱や環境によって容易に酵素を構成するタンパク質の立体構造が変化し、本来の機能を失うことが知られている。酵素やタンパク質を安定に扱うため、従来から種々の方法が検討されている。その1つに固体表面に酵素やタンパク質を担持する方法があり、例えば固定化酵素等実用化している技術がある。
【0003】
酵素の固定化には、ゾル−ゲル法で作成されたシリカ、溶融石英、多孔質の無機物、多孔質有機高分子材料などが使用されている。近年では,界面活性剤の分子集合体を鋳型にして形成されるメソポーラス材料、特にメソポーラスシリカへの固定化が提案されている。例えば特許文献1や特許文献2にその技術が記載されている。
【特許文献1】特開2000−139459号公報
【特許文献2】特開2002−95471号公報
【発明の開示】
【発明が解決しようとする課題】
【0004】
しかし、従来のメソポーラスシリカに酵素を固定化する技術においては、いくつかの課題があった。すなわち、特許文献1や特許文献2に開示されているMCM−41やSBA−15のようなメソポーラスシリカの場合には、細孔径が小さく、細孔内に担持できるタンパク質は、サイズの小さいものに限定されていた。また,SBA−15のようなメソポーラスシリカは,ロッド状粒子の長軸方向に平行にチューブ状細孔径が形成されているために、チューブ状細孔のアスペクト比が大きく、細孔の内部へのタンパク質や基質の拡散が必ずしも良好ではなかった。また、表面における細孔の開口部の数が少なく、タンパク質の導入量が少なかった。
【課題を解決するための手段】
【0005】
本発明は上記課題に鑑みなされたもので、アスペクト比の小さいメソ孔を有するメソポーラスシリカを用いて、生体物質の固定化担体に利用したものである。本発明者らは、鋭意検討の末、このようなロッド状の粒子の長軸方向を交差するアスペクト比の小さなメソ孔構造を生体物質の固定化担体に利用することによって、従来のメソポーラスシリカに比べ、大量の生体物質をメソ孔内部に吸着できた。さらに、固定化後も生体物質が安定化していることを確認した。
【0006】
すなわち本発明は、
ロッド状の粒子であって、
前記ロッド状の長軸方向に対して交差するメソ孔を有し、
前記メソ孔の中に生体物質を担持する粒子を提供するものである。
【0007】
また本発明は、
検体を検出するセンサーであって、
ロッド状の粒子であって、前記ロッド状の長軸方向に対して交差するメソ孔を有し、且つ前記メソ孔の中に生体物質を担持する粒子と、
電極とを備え、
前記検体と前記メソ孔中に担持させた前記生体物質との反応に基づいた電気的出力信号を検出するセンサーを提供するものである。
【0008】
さらに本発明は、
検体の検出方法において、
ロッド状の粒子であって、前記ロッド状の長軸方向に対して交差するメソ孔を有し、且つ前記メソ孔の中に生体物質を担持する粒子を用いたセンサーを用意する工程と、
前記センサーに検体を含む流体を付与する工程と、
前記生体物質と前記検体との反応に基づいた出力信号を検出する工程とを備える検体の検出方法を提供するものである。
【発明の効果】
【0009】
本発明によれば、アスペクト比が小さく、生体物質を大量にメソ孔内に固定化できる粒子を提供することが可能になる。これにより、バイオセンサー等に応用した場合の検出感度を高めることが可能になる。
【発明を実施するための最良の形態】
【0010】
以下、本発明を詳細に説明する。
【0011】
先ず、本発明に用いられる多孔質材料について説明する。
【0012】
図1は,本発明に用いられるメソ孔がロッド状の粒子の長軸方向に交差している粒子の模式図である。本明細書では、メソ孔の位置をロッド状の粒子の長軸方向に交差する位置に配置されている又はロッド状の粒子の短軸方向に配向しているとの記載を用いているが、図1にしめした構造を表現しているものであり、別のもの表現しているものではない。
【0013】
ロッド状構造体の短軸方向にチューブ状のメソ孔が配列している。チューブ状メソ孔は、典型的には図1に示すようにメソ孔がハニカムパッキングしている。しかし,本発明に利用する多孔質体においてはチューブ状メソ孔がロッドの短軸方向にほぼ平行に形成されていれば良く、どのような配置のものでも良い。例えば、桝目の交差点にメソ孔が配置する構造でも良い。
【0014】
本明細書でのロッド状構造体とは、例えば、図1に示すものを言い、長軸と短軸を有しているものである。電子顕微鏡で確認したときに、短軸は、150nmから500nmの範囲に入り、長軸は、0.5μmから2μmの範囲に入るものを言う。形状は、図1にあるように楕円、長方形、ひし形、多角形が考えられる。
【0015】
本発明におけるメソ孔(又はメソ細孔)とは、IUPACの定義によるもので、孔径が2nmから50nmの範囲の径の細孔を指す。より好ましくはメソ孔の孔径が、10nmから30nmであることがいい。これは壁面と酵素の相互作用により、酵素をより安定に担持できるためであると考えられる。また、メソ孔の長さは、孔径に対して10倍よりも大きく30倍以下であることが好ましい。これは、従来メソ孔の長さが長いため、十分な酵素が担持することができなかった。それに対して本発明の粒子は、アスペクト比が小さく、従来のメソポーラス粒子よりも飛躍的に大量の酵素を担持することが可能になっている。
【0016】
このメソポーラス粒子のメソ孔は、界面活性剤分子集合体(ミセル)が形成するものである。ある条件においてはミセルを形成する分子の会合数が等しいために、同じ形の細孔が形成されるものである。ミセルの形状は、球状、チューブ状、層状など種々の形態が知られているが、本発明に関わるメソポーラス材料を形成するミセルの形状は基本的にチューブ状のものである。チューブ間は繋がっていても分離されていても良い。
【0017】
本発明に利用されるメソポーラス材料において、多孔質材料の細孔壁を形成する材料は、上記細孔構造を有するものであれば、どのようなものでも適用可能である。例えば、酸化チタン、酸化スズ、酸化ケイ素などがある。その中で、ケイ素を成分を含む材料が好ましく、特にシリカが好ましく用いられる。また,1以上の炭素原子を含有する有機基と,前記有機基と2箇所以上で結合する2以上のケイ素原子と、前記ケイ素原子と結合する1以上の酸素原子から構成される有機シリカハイブリッド材料でも良い。
【0018】
界面活性剤ミセルを鋳型に用いるアスペクト比の小さなメソポーラス材料の作成方法に関しては、例えば、Journal of the American Chemical Society詩第126巻第7740頁に記載されている。ただし、本発明に利用されるメソポーラス材料は、上記メソポーラス材料の特徴を満たすものであれば、これらの方法に限定されない。
【0019】
以下、ゾル−ゲル法を用いた短軸配向性メソポーラスシリカの合成方法について説明する。
【0020】
反応溶液は、界面活性剤と有機分子、そして金属アルコキシド等の目的材料の原料になる物質を含む溶液である。細孔壁を形成する材料に応じて、加水分解反応触媒である酸等を適当量添加する場合もある。
【0021】
目的材料に応じて、原料としてハロゲン化物、カルコゲン化物、金属アルコキシド等が用いられる。例えば、細孔壁がシリカの場合には、金属アルコキシドであるテトラエトキシシランやテトラメトキシシランが好ましく用いられる。当然、アルコキシド以外のシリカ源でも本発明に適応可能である。
【0022】
使用する界面活性剤は、ポリエチレンオキシドを親水基として含むブロックコポリマーなどの非イオン性界面活性剤等が用いられる。しかし、使用可能な界面活性剤はこれらに限定されず、目的の構造が得られるものであれば特に限定しない。
【0023】
短軸方向へのチューブ状メソ細孔の配向制御は、添加する有機分子およびその添加量によって制御される。例えばn−デカンを添加することによって、短軸方向に配向した細孔構造を有したロッド状メソポーラスシリカが合成される。
【0024】
使用する酸も塩酸、硝酸のような一般的なものを使用することが可能である。
【0025】
上記のような反応溶液を水熱条件下で反応させることにより,本発明のメソポーラス材料を合成することができる。合成させる際の温度は,80℃〜150℃の温度領域において選択される。反応時間は数時間〜数日程度で、反応温度や反応時間は適宜最適化される。
【0026】
この様にして合成されたメソポーラス材料は、純水で洗浄した後に空気中で自然乾燥させることで、細孔内に界面活性剤ミセルをテンプレートとして含む無機−有機複合粉末材料が得られる。以上のように作製された無機−有機複合粉末材料からテンプレートの界面活性剤ミセルを除去することで、本発明に利用することができるアスペクト比の小さい短軸方向配向性のメソポーラス材料を作製することができる。界面活性剤の除去方法には、種々の方法があるが、細孔構造を破壊せずに界面活性剤を除去できる方法であれば、どのような方法を使用しても良い。
【0027】
最も一般的に用いられる方法は、酸素を含んだ雰囲気中で焼成する方法である。例えば、合成した材料を空気中で、550℃において10時間焼成することによって、メソ孔構造をほとんど破壊することなく、完全に界面活性剤を除去することができる。焼成温度と時間は、細孔壁を形成する材料と使用する界面活性剤により、最適化されるのが好ましい。
【0028】
このような方法で合成したメソポーラス粉末試料について、窒素ガス吸脱着測定を行い、細孔径に関する知見を得ることができる。本発明におけるメソポーラス材料の細孔径は、実質的に均一な径であることを特徴とする。ここでいう均一径の細孔とは、窒素ガス吸着測定の結果から、Berret−Joyner−Halenda(BJH)法により評価される細孔径分布において、求められた細孔径分布が、単一の極大値を有する。さらに細孔径分布において、全メソ孔中の60%以上のメソ孔が、10nmの幅を持つ範囲内に含まれることを示す。尚、細孔径は、後に説明する界面活性剤を適宜選択することで変化させることができる。
【0029】
細孔の周期構造はX線回折(XRD)測定によって知見を得ることが可能である。本発明におけるメソポーラス材料は、XRD測定において、1ナノメートル以上の構造周期に対応する角度領域に少なくとも1つの回折ピークを有することを特徴とする。
【0030】
本発明に利用されるメソポーラス材料のメソ細孔表面には、細孔壁の成分とは異なる材料、例えば、有機物や金属酸化物の層を形成させることが可能である。
【0031】
細孔表面を有機物で修飾する方法としては、シランカップリング剤で細孔表面を修飾する方法等が一般的に用いられる。無機酸化物で修飾方法としては、酸化物を形成し得る金属を含有する金属塩の水溶液を用いて細孔表面を修飾する方法等が一般的である。
【0032】
シランカップリング剤は、一般的にR−Si−X3の化学式で表される化合物で、分子中に2個以上の異なった官能基を持っている。上記Xは無機材料から成る多孔体表面と反応することができる部位である。例えば、メソポーラス材料がシリカである場合は、Sol−Gel Science誌1989年第662頁に記述されている。ここには、細孔表面に存在するシラノール基の水素が有機ケイ素基によって置換され、Si−O−Si−R結合を形成し、細孔表面に有機物Rの層を形成することが開示されている。
【0033】
Xとしては、クロル基、アルコキシ基、アセトキシ基、イソプロペノキシ基、アミノ基等が知られているが、本発明において特に限定はない。また、細孔表面と反応し、Rの層を形成することができれば、Xが三官能基のものでなくても、二官能基や一官能基のカップリング剤を用いても良い。
【0034】
一方上記Rは有機基であり、アミノ基やカルボン基、マレイミド基等が好ましく用いられるが、上記有機基に限定したものではない。
【0035】
次に、酸化物を形成し得る金属を含有する金属塩の水溶液を用いて細孔表面を修飾する方法について説明する。ここでいう酸化物とは、金属等の元素と酸素の結合を少なくとも1つ有する化合物の事を指す。酸化物層を形成し得る金属としては、チタン、アルミニウム、ジルコニウム、スズ等がある。例えば、メソポーラスシリカをオキシ硝酸ジルコニウムの水溶液で処理を行うことにより、表面にジルコニウムの酸化物層を形成することが可能である。ただし、細孔表面に金属酸化物の層を形成することができる金属塩の水溶液であれば、前記金属塩を構成する金属は、これらに限定されない。
【0036】
続いて、本発明の生体物質生体物質固定化材料について説明する。
【0037】
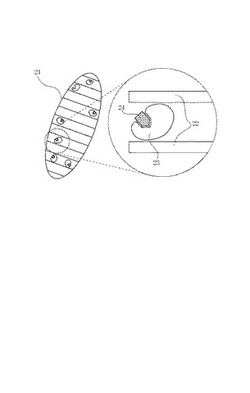
この生体物質を固定化した材料の構造の例を図2に、模式的に示した。この図において,21は前記短軸方向配向性の構造体であり、22はメソポーラス材料の細孔壁である。23はタンパク質、酵素等の生体物質であり、24はこれら生体物質と特異的結合性を持った基質や反応特異性を持ったフラグメントである。
【0038】
また、不図示ではあるが、22と23を連結するアンカーがあっても良い。このアンカーは生体物質の大きな構造変化を抑制して安定に維持する効果を与える場合もあるが、必須の構成要素ではない。
【0039】
アンカーを構成する成分としては、メソポーラス材料と基本的には同じ構造が望ましい。
【0040】
特に生体物質に結合するために、次のような官能基を有していることが好ましい。
水酸基、アミド基、アミノ基、ピリジン基、ウレア基、ウレタン基、カルボン基、フェノール基、アゾ基、ヒドロキシル基、マレイミド基、シラン誘導体、アミノアルキレン基
個々の細孔には1個またはそれ以上の生体物質を収容する。したがって、この細孔は生体物質を固定化するのに適した大きさが必要であり、その大きさは固定化する生体物質の大きさにより適宜決定される。
【0041】
細孔内に生体物質を固定化する場合、静電的結合により細孔内表面に吸着させることが好ましい。しかし、静電的結合による保持だけではなくvan der waals力、水素結合,イオン結合の非共有結合などで生体物質を細孔内に保持することも可能である。
【0042】
固定化する生体物質としては、抗原や抗体、タンパク質、酵素分子がある。またFab抗体などの活性部位を含む断片であっても良い。生体物質は、動植物や微生物から抽出し、所望によりそれを切断しても良く、また遺伝子工学的、化学的に合成しても良い。
【0043】
以下、実施例を用いて、本発明をさらに詳細に説明するが、本発明は実施例の内容に限定されるものではない。
【実施例1】
【0044】
本実施例は、実質的に均一なチューブ状メソ細孔がロッドの短軸方向に対して並行に形成されたメソポーラスシリカを作製し、酵素の固定化剤として利用した例である。
【0045】
2.40gの非イオン界面活性剤であるトリブロックコポリマー(EO20PO70EO20;HO(CH2CH2O)20(CH2CH(CH3)O)70(CH2CH2O)20H)を76.5mlの純水に溶解させた。さらに7.5mlの36wt.%濃塩酸を添加し、室温で30分撹拌した。続いて、n−デカンを13.9g添加し、室温で2時間撹拌した。さらに,この混合溶液に加水分解触媒としてNH4Fを0.027g,および5.10gのテトラエトキシシラン(TEOS)を添加したものを前駆溶液とした。最終的な前駆溶液の組成(モル比)は、TEOS:HCl:EO20PO70EO20:NH4F:n−decane:H2O=0.25:0.9:0.004:0.007:1:42.9となるようにした。
【0046】
この前駆体溶液を40℃において、20時間撹拌し、100℃で48時間反応させた。得られた白色沈殿物は純水で十分に洗浄し、真空乾燥させた。
【0047】
得られた粉末試料を、空気中550℃で焼成し、細孔内から界面活性剤を分解・除去し、中空の細孔とした。界面活性剤等の有機物の除去は、赤外吸収スペクトルによって確認された。
【0048】
合成されたメソポーラスシリカ粉末をX線回折法により評価した結果、図3のように面間隔11.7nmのヘキサゴナル構造の(100)面に帰属される回折ピークを始め、(110)、(200)、(210)面に帰属される回折ピークを確認した。この結果は、このメソポーラスシリカの細孔構造が、高い規則性を持ったヘキサゴナル配列を有していることを示している。
【0049】
77Kにおける窒素吸脱着等温線測定を行った結果、吸着等温線形状はIUPAC分類におけるIV型となった。B.E.T.法によって算出された比表面積は700m2/gとなり、細孔容量は1.88ml/gとなった。また、この吸着等温線の結果から、BJH法により細孔径を算出すると、本実施例で合成したメソポーラスシリカの細孔径分布は、14.3nmに単一のピークを有する狭い分布となり、細孔の90%以内が10nmの分布内に収まった。
【0050】
次に、走査型電子顕微鏡(SEM)を用いて観察を行ったところ、図4のようにロッド状の構造体が確認された。さらに高倍率でSEM観察を行ったところ、図5のように構造体の短軸方向に直径14nmのチューブ状メソ細孔が配向していた。また、その断面図では図6のように、比較的均一なチューブ状のメソ細孔がハニカムパッキングした細孔構造を形成していた。尚、観察中に電子線によりメソ細孔構造が破壊されることはなかった。
【0051】
次に、この合成されたメソポーラスシリカのメソ細孔内に、酸化還元酵素の一種である西洋わさびペルオキシダーゼ(HRPと略記,平均直径=4.8nm,等電点(IEP)=7.8)を固定化させ、熱と有機溶媒に対する安定性を測定した。
【0052】
5mMのリン酸緩衝液(pH=7.0)を用いてHRPを5mg/mlに調製し、この酵素溶液1ml中に、合成した前記メソポーラスシリカを10mg添加した。混合溶液は4℃、20時間の条件下でシェーカーを用いて攪拌し、HRPをメソポーラスシリカ細孔内に吸着させた。反応終了後、4℃、10分、20000gで遠心分離を行いHRP−メソポーラスシリカの沈殿物は純水で3回洗浄した。この際、元の酵素溶液と上澄み液のそれぞれをUV−Vis吸光度測定を行った。HRPの403nmにおける吸収極大を利用し、吸着前後の濃度変化からHRPのメソポーラスシリカへの吸着量を算出した。洗浄後の酵素固定化メソポーラスシリカは、10時間の凍結真空乾燥を行い粉末試料を得た。吸着したHRPはメソポーラスシリカの1gの重量に対し、252mg/gと高い値を示した。また、リン酸緩衝液のpHを変化させることによって、HRPの吸着量が変化した。この結果から、HRPとメソポーラスシリカ細孔は、静電的相互作用によって固定化されているものと考えられる。
【0053】
細孔の中にHRP分子が導入されていることは、HRP吸着後のメソポーラスシリカにおける窒素吸着測定により、その細孔への吸着量が減少したことで確認した。
【0054】
次に上記方法によって作製されたHRPを固定化したメソポーラスシリカを用いて,トルエン中での酸化反応による有機溶媒への耐性およびフェノールの酸化反応による熱に対する安定性を測定した。
【0055】
メソポーラスシリカに固定化されたHRPの有機溶媒中での酵素活性を評価するために、酸化剤にtert−ブチルヒドロペルオキシドを用いた,トルエン中での1,2−ジアミノベンゼンの酸化反応を利用した。50mM 1,2−ジアミノベンゼンを含む無水トルエンを8mlとn−デカンにtert−ブチルヒドロペルオキシドを溶解して調製した1.1M tert−ブチルヒドロペルオキシド溶液2mlとを混合した。この混合溶液1mlに上記方法によって調製されたHRP固定化メソポーラスシリカ10mgを加え、37℃で反応を開始させた。1,2−ジアミノベンゼンの酸化によって生成する1,2−ジニトロベンゼンの470nmでの吸光度を測定し、経時変化を求めることによってトルエン溶媒中でのHRPの酵素活性を決定した。
【0056】
また比較試験としてHRPそのものを0.5mg調製し、上記の酸化反応を行い、同様に470nmでの吸光度の上昇を測定した。その結果を図7に示す。HRP(Free HRP)だけではトルエン中における酸化反応は全く起こらなかったが、HRPを固定化したメソポーラスシリカでは、非常に高い活性を示した。これは、トルエンにHRPを添加した直後にHRPが変性してしまったためであると考えられ、メソポーラスシリカにHRPを固定化することによって高い安定性を発現していることが分かった。
【0057】
続いて、HRPを固定化したメソポーラスシリカおよび固定化していない通常のHRPをリン酸緩衝溶液中、70度で0〜2時間熱処理した。その後、残存の酵素活性を測定した結果を図8に示す。メソポーラスシリカ内に固定化されたHRPの熱安定性は、フェノールの酸化分解速度を測定することによって決定した。フェノールの定量は4−アミノアンチピリン比色法を用いた。
【0058】
上記HRP吸着によって調製したHRP固定化メソポーラスシリカ10mgに、50mM 酢酸ナトリウム緩衝液(pH=4.0)400μlを加え、70℃で30、60、90、120分間それぞれ加熱した。加熱後遠心分離を行いHRP固定化シリカを純水で2回洗浄した。次に50mM Tris−HCl(ヒドロキシメチルアミノメタン塩酸塩)緩衝液(pH=7.5)400μl、5000ppmフェノール水溶液8μl、30%過酸化水素水2μlを加えて、37℃にて30分間反応させた。遠心分離後、上澄み液を150μlと1Mのグリシン水溶液(pH=9.6)で調製した1% ヘキサシアノ鉄酸塩と1% 4−アミノアンチピリンをそれぞれ150μl、300μl加え撹拌した後、すばやく500nm付近の吸光度を測定した。
【0059】
固定化されていないHRPは、70℃、30分の熱処理により酵素活性が半減してしまい2時間後には初期の酵素活性に対し約10%しか活性を示さなかった。これに対してHRPを固定化したメソポーラスシリカでは、熱に対する高い安定化効果が確認された。70℃、2時間の熱処理後も90%以上の酵素活性を有していた。
【0060】
上記のフェノールの酸化反応を用いて、HRPの温度依存性を測定した結果を図9に示した。HRPおよび固定化HRPは、25℃から100℃で、それぞれ30分前処理した後、酵素活性を測定した。通常のHRPが70℃,30分の条件下において、残存活性が0%になったのに対して短軸配向性メソポーラスに固定化したHRPは同条件下でも50%以上の活性を示した。また、100℃で処理をしても0%になることはなく、40%近くの酵素活性を保持していた。
【0061】
(比較例1)
比較例として、ロッド状粒子の長軸方向に平行にチューブ状細孔径が形成されているSBA−15を合成し、HRPの吸着及び有機溶媒中の安定効果を測定した。SBA−15の合成方法は、例えば、Science誌第279号第548頁に記載されている。
【0062】
合成したSBA−15をX線回折法により評価した結果、面間隔9.8nmのヘキサゴナル構造の(100)面に帰属される回折ピークを確認した。また、窒素吸着等温線測定より合成したSBA−15は800m2/gの比表面積と7.4nmの細孔径を有していた。
【0063】
合成したSBA−15を実施例1と同様のHRP吸着実験を行った。HRPの吸着量は25mg/gとなり、本発明に利用した短軸配向性メソポーラスシリカに比べ、1/10以下の非常に少ない吸着量を示した。また、HRP吸着後の試料を用いた窒素吸着等温線解析から、HRPの吸着前後でSBA−15の細孔容量に減少が見られず、HRPがSBA−15細孔内にほとんど吸着していないことが分かった。HRPの平均直径が4.8nm、SBA−15の細孔径が7.4nmであることを考慮すると細孔の開口部が少ないため、吸着しにくい状態であったことが予想される。またメソポーラスシリカへのHRPの経時吸着量を測定した結果、飽和吸着量に達する時間が、短軸配向性メソポーラスシリカにおいて非常に短かった。
【0064】
続いて、このSBA−15を用いて上記方法によるHRPの有機溶媒安定性の測定を行い、本発明によるメソポーラスシリカとの比較を行った。僅かにSBA−15に固定化されたHRPによる酵素活性が観察された。しかし、SBA−15固定化HRPにおいて、反応開始と共に徐々に反応生成物である1,2−ジニトロベンゼンが確認された。これに対し、本発明のメソポーラスシリカでは,反応開始直後からSBA−15に比べて10倍以上の1,2−ジニトロベンゼンが確認された。
【0065】
したがって、本発明者らはこれらの結果をSBA−15ではロッド状粒子の長軸方向に平行にチューブ状細孔径が形成されているためにチューブ状細孔のアスペクト比が大きい。これにより、外部から細孔の内部、および細孔内部から外部へのHRPや基質の拡散が悪いこと、及び、表面における細孔の開口部の数が少ないため、HRPや基質の導入が遅くなることが原因であると推察した。この結果から、本発明に利用した短軸配向性のメソポーラスシリカが、生体物質等の担持剤として優れている点が明らかになった。
【実施例2】
【0066】
本実施例は、実施例1で作製した短軸配向性メソポーラスシリカ表面をジルコニウムの酸化物で修飾し、ウシ血清アルブミン(BSAと略記,直径=7.0nm,IEP=4.7)を固定化させ熱に対する安定性を測定した例である。
【0067】
オキシ硝酸ジルコニウム2水和物10gを純水90mlに添加し、室温で溶解させ10wt%のオキシ硝酸ジルコニウム水溶液を調製した。この溶液に実施例1で合成した短軸配向性のメソポーラスシリカを添加して、20時間浸漬させた。その後、遠心分離により上澄みを取り除き、純水で3回洗浄し室温で乾燥させた。
【0068】
ジルコニウムで修飾した短軸配向性メソポーラスシリカをX線回折法により評価した結果、修飾前とほぼ同様の回折パターンを示し、メソ孔の周期構造が壊れていないことを確認した。また、X線光電子分光分析(XPS)を用いてシリカ表面の化学結合状態を測定した結果、Zr−Oに起因するピークが確認され、シリカ表面にジルコニウムの酸化物層が形成されていることを確認した。
【0069】
続いて、ジルコニウム修飾後のメソポーラスシリカの細孔内にBSAを固定化し、HRP標識した抗BSA抗体との抗原抗体反応を利用して安定化効果を測定した。
【0070】
ジルコニウム修飾後の短軸配向性メソポーラスシリカ10mgに、10mMのリン酸緩衝液(pH=5.0)を用いてBSAを1mg/mlに調製した溶液を5ml添加し、4℃で6時間撹拌した。これにより、メソポーラスシリカのメソ細孔内にBSAを固定化させた。その後、純水で3回洗浄した。なお、ジルコニウム修飾していない短軸配向性のメソポーラスシリカを用いてBSAの吸着実験を行ったところ、全く吸着しなかった。
【0071】
上記のBSA固定化メソポーラスシリカに、西洋わさびペルオキシダーゼで標識した抗BSA抗体(HRP−antiBSAと略記)を添加し、室温にて所定時間(1〜4時間)反応させた。非特異吸着した(HRP−antiBSA)を除くために、この固定化メソポーラスシリカを純水で数回洗浄した。その後、凍結真空乾燥を行い、この乾燥試料を37℃で任意の時間放置した。次に50mM Tris−HCl(pH=7.5)400μl、5000ppmフェノール水溶液 8μl、30%過酸化水素水2μlを加えて、37℃にて30分間反応させた。遠心分離後、上澄み液を150μlと1Mのグリシン水溶液(pH=9.6)で調製した1% ヘキサシアノ鉄酸塩と,1% 4−アミノアンチピリンをそれぞれ150μl、300μl加え撹拌した。その後、すばやく500nm付近の吸光度を測定し固定化されたBSAに特異的に結合したHRP−antiBSAに標識されたHRPの酵素活性を測定した。
【0072】
また、メソポーラスシリカに対して、非特異的なオバルブミン(卵白アルブミン,直径7.0nm,IEP4.9)を上記の方法と同様にして固定化し、前述の抗BSA抗体を反応させ、両者の吸光度の差を上記手順により測定した。その結果、非特異的なオバルブミンは、本実施例によるBSA固定化メソポーラスシリカに比べ、HRP活性が明らかに小さかった。これらの結果より、メソポーラスシリカにBSAが固定化され、且つメソポーラスシリカへの固定化後も細孔内において有効に抗原抗体反応が起きていることを確認した。
【0073】
また、上記で得たBSA固定化メソポーラスシリカと通常のBSA粉末を乾燥状態において40℃で3週間保存した後、同様のHRP活性による変化を測定した。37℃で乾燥保存を開始する直前の両者の結合活性を100とした結果、固定化していないBSAは1週間後には相対活性が0となり、完全に失活してしまった。一方、階層的メソポーラスシリカに固定化したBSAは、3週間後においても90%以上の相対活性を示した。
【実施例3】
【0074】
本実施例は、実施例1で合成した短軸配向性メソポーラスシリカの表面をシランカップリング剤を用いて修飾しα−アミラーゼを共有結合によってシリカ表面に固定化させた例である。
【0075】
実施例1で合成した短軸配向性メソポーラスシリカ1.0gをトルエンで調製した10%(v/v)の3−aminopropyl triethoxysilane溶液の50ml中に添加し、この溶液を窒素雰囲気下において120℃で48時間撹拌した。反応後、沈殿物は濾過し、トルエン、メタノール、ジクロロメタンで洗浄した後、室温で乾燥させた。
【0076】
次にこの乾燥試料の1.0gをリン酸緩衝溶液(pH=6.6)で調製した2.5% glutaraldehyde溶液の25mlに溶解させ室温で1時間撹拌した。得られた沈殿物は純水を用いて4回以上洗浄し、その後室温において乾燥した。
【0077】
Glutaraldehydeで修飾した短軸配向性メソポーラスシリカをX線回折法により評価した結果、修飾前とほぼ同様の回折パターンを示しており、メソ細孔構造が壊れていないことを確認した。また、FT−IRを用いてシリカ表面に導入した官能基の同定を行った結果、R−CH=N、C=O、−CHOに起因するピークがそれぞれ確認されシリカ表面にSi(CH2)3N=CH(CH2)3CHOが共有結合していることを確認した。
【0078】
続いて、修飾後のメソポーラスシリカの細孔内にα−アミラーゼを固定化し澱粉のマルトースへの加水分解反応を用いて安定化効果を測定した。
【0079】
50mMのリン酸緩衝液(pH=6.0)を用いてα−アミラーゼを1mg/mlに調製し、この溶液1ml中に上記方法で合成・修飾した短軸配向性メソポーラスシリカ0.2gを添加した。混合溶液は4℃、20時間の条件下でシェーカーを用いて含浸させ、α−アミラーゼをメソポーラスシリカ細孔内に吸着させた。反応終了後、ペレットを濾過して、純水で3回洗浄した。この際、元の酵素溶液と上澄み液のそれぞれを,UV−Vis吸光度測定を行った。α−アミラーゼの280nmにおける吸収極大を利用し、吸着前後の濃度変化からメソポーラスシリカへの吸着量を算出した。吸着したα−アミラーゼは140mg/gと高い値を示した。表面修飾を行わなかったメソポーラスシリカへの同条件でのα−アミラーゼの吸着実験では、ほとんど吸着挙動を示さなかった。したがって、α−アミラーゼがシリカ表面に修飾した−CHOおよびα−アミラーゼの−NH2と結合しシリカ表面に固定化された。
【0080】
続いて、アミラーゼ固定化メソポーラスシリカおよび固定化していないフリーのアミラーゼを酢酸ナトリウム緩衝溶液中25℃から70℃でそれぞれ熱処理した後、酵素活性を測定した。
【0081】
上記アミラーゼ固定化メソポーラスシリカ10mgに50mM 酢酸ナトリウム緩衝液(pH=5.0)400μlを加え、25℃から70℃でそれぞれ30分処理した。加熱後遠心分離を行いアミラーゼ固定化シリカを純水で2回洗浄した。同様の50mM酢酸ナトリウム緩衝液を用いて、0.125%の可溶性澱粉を調製し、この澱粉溶液の300μlを洗浄後のアミラーゼ固定化シリカに添加し、40℃で15分反応させた。反応停止後、遠心分離により上澄みを得て、この上澄み溶液に1mlの0.5N酢酸及びヨウ素−カリウム溶液(0.015%ヨウ素−0.15%ヨウ化カリウム溶液)を3ml加え、よく撹拌してから700nmにおける吸収極大を測定した。通常のα−アミラーゼが60℃、30分の条件下において、相対活性が20%になったのに対して、短軸配向性メソポーラスシリカに固定化したα−アミラーゼでは、同条件下において90%以上の相対活性を示し、安定化効果が確認された。
【実施例4】
【0082】
実施例1で合成した短軸配向性のメソポーラスシリカの細孔内に、ヤギ由来のIgG Fabフラグメント(直径約12nm)を固定化させ抗原−抗体間の特異的結合反応を利用して、抗体の安定性測定を行った例である。
【0083】
実施例1で合成した短軸配向性メソポーラスシリカおよび比較例1で使用したSBA−15各10mgに、抗マウス免疫グロブリンG(IgG)のFabフラグメントを10mMリン酸緩衝液で1mg/mlに調製した溶液を10ml添加した。その溶液を4℃で6時間撹拌することによりメソポーラスシリカのメソ孔内に抗体を固定化させた。UV−Vis吸光光度計を用いて280nmでの吸光度を測定することによって、Fabの吸着量を算出した。短軸配向性のメソポーラスシリカにおいては、約150mg/mlのFabの細孔内吸着を確認した。しかし、通常のSBA−15では全く吸着を確認できなかった。
【0084】
その後、純水で3回洗浄した。上記の抗体固定化メソポーラスシリカに西洋わさびペルオキシダーゼで標識したマウス由来のIgG抗体(HRP−IgGと略記)溶液を添加し、室温にて所定時間(1〜4時間)反応させた。非特異吸着したHRP−IgGを除くために、この抗原−抗体固定化メソポーラスシリカを純水で数回洗浄した。その後、凍結真空乾燥を行いこの乾燥試料を37℃で任意の時間放置した。次に50mM Tris−HCl(pH=7.5)400μl、5000ppmフェノール水溶液 8μl、30%過酸化水素水2μlを加えて、37℃にて30分間反応させた。遠心分離後、上澄み液を150μlと1Mのグリシン水溶液(pH=9.6)で調製した1% ヘキサシアノ鉄酸塩と1% 4−アミノアンチピリンをそれぞれ150μl、300μl加え撹拌した。その後、すばやく500nm付近の吸光度を測定し、固定化されたFabフラグメントに特異的に結合したIgG抗体に標識されたHRPの酵素活性を測定した。
【0085】
また、前記の短軸配向性メソポーラスシリカに対して、抗マウスではないIgGのFabフラグメントを上記の方法と同様にして固定化した。前述のマウス由来のIgG抗体に特異的な結合をするFabと非特異的なFabとを用いた場合の両者の吸光度の差を上記手順により測定した。その結果、抗マウスではないIgGのFabフラグメントは、本実施例による抗マウスIgGのFabフラグメント固定化メソポーラスシリカに比べ、HRP活性が明らかに小さかった。これらの結果より、短軸配向性メソポーラスシリカに直径12nmの活性化物質が固定化されかつメソポーラスシリカへの固定化後も、細孔内において有効に抗原抗体反応が起きていることを確認した。
【0086】
また、上記で得たFab固定化メソポーラスシリカと固定化していないFab粉末を乾燥状態において37℃で3週間保存し、抗原抗体反応によるHRP活性の変化を測定した。37℃で乾燥保存を開始する直前の両者の結合活性を100とした結果、通常のFabフラグメントは12時間で相対活性が0となり、完全に失活してしまった。一方、短軸配向性メソポーラスシリカに固定化したFabフラグメントによる抗原抗体反応は、2週間後においても80%以上の相対活性を示した。
【図面の簡単な説明】
【0087】
【図1】本発明に利用された短軸配向性メソポーラス材料を説明するための模式図である。
【図2】本発明の実施例1で合成された短軸配向性ポーラス材料を利用した安定化酵素の構造の模式図である。
【図3】本発明に利用された短軸配向性メソポーラス材料のX線回折の結果である。
【図4】本発明に利用された短軸配向性メソポーラス材料の走査型電子顕微鏡写真のイメージである。
【図5】本発明に利用された短軸配向性メソポーラス材料の走査型電子顕微鏡写真の高倍率イメージである。
【図6】図4で示された短軸配向性メソポーラス材料の断面における走査型電子顕微鏡写真の高倍率イメージである。
【図7】実施例1で合成された短軸配向性メソポーラス材料内に西洋わさびペルオキシダーゼを固定化し,トルエン中で酵素反応を行った場合の転化率と時間経過を示すグラフである。
【図8】実施例1で合成された短軸配向性メソポーラス材料内に西洋わさびペルオキシダーゼを固定化し,70℃で熱処理を行った場合の、酵素の相対活性と熱処理時間の関係を示すグラフである。
【図9】実施例1で合成された短軸配向性メソポーラス材料内に西洋わさびペルオキシダーゼを固定化し、所定の温度で30分熱処理した場合の相対活性の温度依存性を示すグラフである。
【符号の説明】
【0088】
11 メソ孔を有したロッド状構造体
12 メソ細孔
13 細孔壁
21 短軸配向性のロッド状構造体
22 細孔壁
23 酵素やタンパク質を始めとする生体物質
24 生体物質と特異的結合をする基質などのフラグメント
【技術分野】
【0001】
本発明は、生体物質を固定化し、生体物質を安定化させる技術に関する。より詳しくは、メソ孔の中に生体物質を担持した粒子に関し、バイオセンサーの応用が可能になる。
【背景技術】
【0002】
酵素は、熱や環境によって容易に酵素を構成するタンパク質の立体構造が変化し、本来の機能を失うことが知られている。酵素やタンパク質を安定に扱うため、従来から種々の方法が検討されている。その1つに固体表面に酵素やタンパク質を担持する方法があり、例えば固定化酵素等実用化している技術がある。
【0003】
酵素の固定化には、ゾル−ゲル法で作成されたシリカ、溶融石英、多孔質の無機物、多孔質有機高分子材料などが使用されている。近年では,界面活性剤の分子集合体を鋳型にして形成されるメソポーラス材料、特にメソポーラスシリカへの固定化が提案されている。例えば特許文献1や特許文献2にその技術が記載されている。
【特許文献1】特開2000−139459号公報
【特許文献2】特開2002−95471号公報
【発明の開示】
【発明が解決しようとする課題】
【0004】
しかし、従来のメソポーラスシリカに酵素を固定化する技術においては、いくつかの課題があった。すなわち、特許文献1や特許文献2に開示されているMCM−41やSBA−15のようなメソポーラスシリカの場合には、細孔径が小さく、細孔内に担持できるタンパク質は、サイズの小さいものに限定されていた。また,SBA−15のようなメソポーラスシリカは,ロッド状粒子の長軸方向に平行にチューブ状細孔径が形成されているために、チューブ状細孔のアスペクト比が大きく、細孔の内部へのタンパク質や基質の拡散が必ずしも良好ではなかった。また、表面における細孔の開口部の数が少なく、タンパク質の導入量が少なかった。
【課題を解決するための手段】
【0005】
本発明は上記課題に鑑みなされたもので、アスペクト比の小さいメソ孔を有するメソポーラスシリカを用いて、生体物質の固定化担体に利用したものである。本発明者らは、鋭意検討の末、このようなロッド状の粒子の長軸方向を交差するアスペクト比の小さなメソ孔構造を生体物質の固定化担体に利用することによって、従来のメソポーラスシリカに比べ、大量の生体物質をメソ孔内部に吸着できた。さらに、固定化後も生体物質が安定化していることを確認した。
【0006】
すなわち本発明は、
ロッド状の粒子であって、
前記ロッド状の長軸方向に対して交差するメソ孔を有し、
前記メソ孔の中に生体物質を担持する粒子を提供するものである。
【0007】
また本発明は、
検体を検出するセンサーであって、
ロッド状の粒子であって、前記ロッド状の長軸方向に対して交差するメソ孔を有し、且つ前記メソ孔の中に生体物質を担持する粒子と、
電極とを備え、
前記検体と前記メソ孔中に担持させた前記生体物質との反応に基づいた電気的出力信号を検出するセンサーを提供するものである。
【0008】
さらに本発明は、
検体の検出方法において、
ロッド状の粒子であって、前記ロッド状の長軸方向に対して交差するメソ孔を有し、且つ前記メソ孔の中に生体物質を担持する粒子を用いたセンサーを用意する工程と、
前記センサーに検体を含む流体を付与する工程と、
前記生体物質と前記検体との反応に基づいた出力信号を検出する工程とを備える検体の検出方法を提供するものである。
【発明の効果】
【0009】
本発明によれば、アスペクト比が小さく、生体物質を大量にメソ孔内に固定化できる粒子を提供することが可能になる。これにより、バイオセンサー等に応用した場合の検出感度を高めることが可能になる。
【発明を実施するための最良の形態】
【0010】
以下、本発明を詳細に説明する。
【0011】
先ず、本発明に用いられる多孔質材料について説明する。
【0012】
図1は,本発明に用いられるメソ孔がロッド状の粒子の長軸方向に交差している粒子の模式図である。本明細書では、メソ孔の位置をロッド状の粒子の長軸方向に交差する位置に配置されている又はロッド状の粒子の短軸方向に配向しているとの記載を用いているが、図1にしめした構造を表現しているものであり、別のもの表現しているものではない。
【0013】
ロッド状構造体の短軸方向にチューブ状のメソ孔が配列している。チューブ状メソ孔は、典型的には図1に示すようにメソ孔がハニカムパッキングしている。しかし,本発明に利用する多孔質体においてはチューブ状メソ孔がロッドの短軸方向にほぼ平行に形成されていれば良く、どのような配置のものでも良い。例えば、桝目の交差点にメソ孔が配置する構造でも良い。
【0014】
本明細書でのロッド状構造体とは、例えば、図1に示すものを言い、長軸と短軸を有しているものである。電子顕微鏡で確認したときに、短軸は、150nmから500nmの範囲に入り、長軸は、0.5μmから2μmの範囲に入るものを言う。形状は、図1にあるように楕円、長方形、ひし形、多角形が考えられる。
【0015】
本発明におけるメソ孔(又はメソ細孔)とは、IUPACの定義によるもので、孔径が2nmから50nmの範囲の径の細孔を指す。より好ましくはメソ孔の孔径が、10nmから30nmであることがいい。これは壁面と酵素の相互作用により、酵素をより安定に担持できるためであると考えられる。また、メソ孔の長さは、孔径に対して10倍よりも大きく30倍以下であることが好ましい。これは、従来メソ孔の長さが長いため、十分な酵素が担持することができなかった。それに対して本発明の粒子は、アスペクト比が小さく、従来のメソポーラス粒子よりも飛躍的に大量の酵素を担持することが可能になっている。
【0016】
このメソポーラス粒子のメソ孔は、界面活性剤分子集合体(ミセル)が形成するものである。ある条件においてはミセルを形成する分子の会合数が等しいために、同じ形の細孔が形成されるものである。ミセルの形状は、球状、チューブ状、層状など種々の形態が知られているが、本発明に関わるメソポーラス材料を形成するミセルの形状は基本的にチューブ状のものである。チューブ間は繋がっていても分離されていても良い。
【0017】
本発明に利用されるメソポーラス材料において、多孔質材料の細孔壁を形成する材料は、上記細孔構造を有するものであれば、どのようなものでも適用可能である。例えば、酸化チタン、酸化スズ、酸化ケイ素などがある。その中で、ケイ素を成分を含む材料が好ましく、特にシリカが好ましく用いられる。また,1以上の炭素原子を含有する有機基と,前記有機基と2箇所以上で結合する2以上のケイ素原子と、前記ケイ素原子と結合する1以上の酸素原子から構成される有機シリカハイブリッド材料でも良い。
【0018】
界面活性剤ミセルを鋳型に用いるアスペクト比の小さなメソポーラス材料の作成方法に関しては、例えば、Journal of the American Chemical Society詩第126巻第7740頁に記載されている。ただし、本発明に利用されるメソポーラス材料は、上記メソポーラス材料の特徴を満たすものであれば、これらの方法に限定されない。
【0019】
以下、ゾル−ゲル法を用いた短軸配向性メソポーラスシリカの合成方法について説明する。
【0020】
反応溶液は、界面活性剤と有機分子、そして金属アルコキシド等の目的材料の原料になる物質を含む溶液である。細孔壁を形成する材料に応じて、加水分解反応触媒である酸等を適当量添加する場合もある。
【0021】
目的材料に応じて、原料としてハロゲン化物、カルコゲン化物、金属アルコキシド等が用いられる。例えば、細孔壁がシリカの場合には、金属アルコキシドであるテトラエトキシシランやテトラメトキシシランが好ましく用いられる。当然、アルコキシド以外のシリカ源でも本発明に適応可能である。
【0022】
使用する界面活性剤は、ポリエチレンオキシドを親水基として含むブロックコポリマーなどの非イオン性界面活性剤等が用いられる。しかし、使用可能な界面活性剤はこれらに限定されず、目的の構造が得られるものであれば特に限定しない。
【0023】
短軸方向へのチューブ状メソ細孔の配向制御は、添加する有機分子およびその添加量によって制御される。例えばn−デカンを添加することによって、短軸方向に配向した細孔構造を有したロッド状メソポーラスシリカが合成される。
【0024】
使用する酸も塩酸、硝酸のような一般的なものを使用することが可能である。
【0025】
上記のような反応溶液を水熱条件下で反応させることにより,本発明のメソポーラス材料を合成することができる。合成させる際の温度は,80℃〜150℃の温度領域において選択される。反応時間は数時間〜数日程度で、反応温度や反応時間は適宜最適化される。
【0026】
この様にして合成されたメソポーラス材料は、純水で洗浄した後に空気中で自然乾燥させることで、細孔内に界面活性剤ミセルをテンプレートとして含む無機−有機複合粉末材料が得られる。以上のように作製された無機−有機複合粉末材料からテンプレートの界面活性剤ミセルを除去することで、本発明に利用することができるアスペクト比の小さい短軸方向配向性のメソポーラス材料を作製することができる。界面活性剤の除去方法には、種々の方法があるが、細孔構造を破壊せずに界面活性剤を除去できる方法であれば、どのような方法を使用しても良い。
【0027】
最も一般的に用いられる方法は、酸素を含んだ雰囲気中で焼成する方法である。例えば、合成した材料を空気中で、550℃において10時間焼成することによって、メソ孔構造をほとんど破壊することなく、完全に界面活性剤を除去することができる。焼成温度と時間は、細孔壁を形成する材料と使用する界面活性剤により、最適化されるのが好ましい。
【0028】
このような方法で合成したメソポーラス粉末試料について、窒素ガス吸脱着測定を行い、細孔径に関する知見を得ることができる。本発明におけるメソポーラス材料の細孔径は、実質的に均一な径であることを特徴とする。ここでいう均一径の細孔とは、窒素ガス吸着測定の結果から、Berret−Joyner−Halenda(BJH)法により評価される細孔径分布において、求められた細孔径分布が、単一の極大値を有する。さらに細孔径分布において、全メソ孔中の60%以上のメソ孔が、10nmの幅を持つ範囲内に含まれることを示す。尚、細孔径は、後に説明する界面活性剤を適宜選択することで変化させることができる。
【0029】
細孔の周期構造はX線回折(XRD)測定によって知見を得ることが可能である。本発明におけるメソポーラス材料は、XRD測定において、1ナノメートル以上の構造周期に対応する角度領域に少なくとも1つの回折ピークを有することを特徴とする。
【0030】
本発明に利用されるメソポーラス材料のメソ細孔表面には、細孔壁の成分とは異なる材料、例えば、有機物や金属酸化物の層を形成させることが可能である。
【0031】
細孔表面を有機物で修飾する方法としては、シランカップリング剤で細孔表面を修飾する方法等が一般的に用いられる。無機酸化物で修飾方法としては、酸化物を形成し得る金属を含有する金属塩の水溶液を用いて細孔表面を修飾する方法等が一般的である。
【0032】
シランカップリング剤は、一般的にR−Si−X3の化学式で表される化合物で、分子中に2個以上の異なった官能基を持っている。上記Xは無機材料から成る多孔体表面と反応することができる部位である。例えば、メソポーラス材料がシリカである場合は、Sol−Gel Science誌1989年第662頁に記述されている。ここには、細孔表面に存在するシラノール基の水素が有機ケイ素基によって置換され、Si−O−Si−R結合を形成し、細孔表面に有機物Rの層を形成することが開示されている。
【0033】
Xとしては、クロル基、アルコキシ基、アセトキシ基、イソプロペノキシ基、アミノ基等が知られているが、本発明において特に限定はない。また、細孔表面と反応し、Rの層を形成することができれば、Xが三官能基のものでなくても、二官能基や一官能基のカップリング剤を用いても良い。
【0034】
一方上記Rは有機基であり、アミノ基やカルボン基、マレイミド基等が好ましく用いられるが、上記有機基に限定したものではない。
【0035】
次に、酸化物を形成し得る金属を含有する金属塩の水溶液を用いて細孔表面を修飾する方法について説明する。ここでいう酸化物とは、金属等の元素と酸素の結合を少なくとも1つ有する化合物の事を指す。酸化物層を形成し得る金属としては、チタン、アルミニウム、ジルコニウム、スズ等がある。例えば、メソポーラスシリカをオキシ硝酸ジルコニウムの水溶液で処理を行うことにより、表面にジルコニウムの酸化物層を形成することが可能である。ただし、細孔表面に金属酸化物の層を形成することができる金属塩の水溶液であれば、前記金属塩を構成する金属は、これらに限定されない。
【0036】
続いて、本発明の生体物質生体物質固定化材料について説明する。
【0037】
この生体物質を固定化した材料の構造の例を図2に、模式的に示した。この図において,21は前記短軸方向配向性の構造体であり、22はメソポーラス材料の細孔壁である。23はタンパク質、酵素等の生体物質であり、24はこれら生体物質と特異的結合性を持った基質や反応特異性を持ったフラグメントである。
【0038】
また、不図示ではあるが、22と23を連結するアンカーがあっても良い。このアンカーは生体物質の大きな構造変化を抑制して安定に維持する効果を与える場合もあるが、必須の構成要素ではない。
【0039】
アンカーを構成する成分としては、メソポーラス材料と基本的には同じ構造が望ましい。
【0040】
特に生体物質に結合するために、次のような官能基を有していることが好ましい。
水酸基、アミド基、アミノ基、ピリジン基、ウレア基、ウレタン基、カルボン基、フェノール基、アゾ基、ヒドロキシル基、マレイミド基、シラン誘導体、アミノアルキレン基
個々の細孔には1個またはそれ以上の生体物質を収容する。したがって、この細孔は生体物質を固定化するのに適した大きさが必要であり、その大きさは固定化する生体物質の大きさにより適宜決定される。
【0041】
細孔内に生体物質を固定化する場合、静電的結合により細孔内表面に吸着させることが好ましい。しかし、静電的結合による保持だけではなくvan der waals力、水素結合,イオン結合の非共有結合などで生体物質を細孔内に保持することも可能である。
【0042】
固定化する生体物質としては、抗原や抗体、タンパク質、酵素分子がある。またFab抗体などの活性部位を含む断片であっても良い。生体物質は、動植物や微生物から抽出し、所望によりそれを切断しても良く、また遺伝子工学的、化学的に合成しても良い。
【0043】
以下、実施例を用いて、本発明をさらに詳細に説明するが、本発明は実施例の内容に限定されるものではない。
【実施例1】
【0044】
本実施例は、実質的に均一なチューブ状メソ細孔がロッドの短軸方向に対して並行に形成されたメソポーラスシリカを作製し、酵素の固定化剤として利用した例である。
【0045】
2.40gの非イオン界面活性剤であるトリブロックコポリマー(EO20PO70EO20;HO(CH2CH2O)20(CH2CH(CH3)O)70(CH2CH2O)20H)を76.5mlの純水に溶解させた。さらに7.5mlの36wt.%濃塩酸を添加し、室温で30分撹拌した。続いて、n−デカンを13.9g添加し、室温で2時間撹拌した。さらに,この混合溶液に加水分解触媒としてNH4Fを0.027g,および5.10gのテトラエトキシシラン(TEOS)を添加したものを前駆溶液とした。最終的な前駆溶液の組成(モル比)は、TEOS:HCl:EO20PO70EO20:NH4F:n−decane:H2O=0.25:0.9:0.004:0.007:1:42.9となるようにした。
【0046】
この前駆体溶液を40℃において、20時間撹拌し、100℃で48時間反応させた。得られた白色沈殿物は純水で十分に洗浄し、真空乾燥させた。
【0047】
得られた粉末試料を、空気中550℃で焼成し、細孔内から界面活性剤を分解・除去し、中空の細孔とした。界面活性剤等の有機物の除去は、赤外吸収スペクトルによって確認された。
【0048】
合成されたメソポーラスシリカ粉末をX線回折法により評価した結果、図3のように面間隔11.7nmのヘキサゴナル構造の(100)面に帰属される回折ピークを始め、(110)、(200)、(210)面に帰属される回折ピークを確認した。この結果は、このメソポーラスシリカの細孔構造が、高い規則性を持ったヘキサゴナル配列を有していることを示している。
【0049】
77Kにおける窒素吸脱着等温線測定を行った結果、吸着等温線形状はIUPAC分類におけるIV型となった。B.E.T.法によって算出された比表面積は700m2/gとなり、細孔容量は1.88ml/gとなった。また、この吸着等温線の結果から、BJH法により細孔径を算出すると、本実施例で合成したメソポーラスシリカの細孔径分布は、14.3nmに単一のピークを有する狭い分布となり、細孔の90%以内が10nmの分布内に収まった。
【0050】
次に、走査型電子顕微鏡(SEM)を用いて観察を行ったところ、図4のようにロッド状の構造体が確認された。さらに高倍率でSEM観察を行ったところ、図5のように構造体の短軸方向に直径14nmのチューブ状メソ細孔が配向していた。また、その断面図では図6のように、比較的均一なチューブ状のメソ細孔がハニカムパッキングした細孔構造を形成していた。尚、観察中に電子線によりメソ細孔構造が破壊されることはなかった。
【0051】
次に、この合成されたメソポーラスシリカのメソ細孔内に、酸化還元酵素の一種である西洋わさびペルオキシダーゼ(HRPと略記,平均直径=4.8nm,等電点(IEP)=7.8)を固定化させ、熱と有機溶媒に対する安定性を測定した。
【0052】
5mMのリン酸緩衝液(pH=7.0)を用いてHRPを5mg/mlに調製し、この酵素溶液1ml中に、合成した前記メソポーラスシリカを10mg添加した。混合溶液は4℃、20時間の条件下でシェーカーを用いて攪拌し、HRPをメソポーラスシリカ細孔内に吸着させた。反応終了後、4℃、10分、20000gで遠心分離を行いHRP−メソポーラスシリカの沈殿物は純水で3回洗浄した。この際、元の酵素溶液と上澄み液のそれぞれをUV−Vis吸光度測定を行った。HRPの403nmにおける吸収極大を利用し、吸着前後の濃度変化からHRPのメソポーラスシリカへの吸着量を算出した。洗浄後の酵素固定化メソポーラスシリカは、10時間の凍結真空乾燥を行い粉末試料を得た。吸着したHRPはメソポーラスシリカの1gの重量に対し、252mg/gと高い値を示した。また、リン酸緩衝液のpHを変化させることによって、HRPの吸着量が変化した。この結果から、HRPとメソポーラスシリカ細孔は、静電的相互作用によって固定化されているものと考えられる。
【0053】
細孔の中にHRP分子が導入されていることは、HRP吸着後のメソポーラスシリカにおける窒素吸着測定により、その細孔への吸着量が減少したことで確認した。
【0054】
次に上記方法によって作製されたHRPを固定化したメソポーラスシリカを用いて,トルエン中での酸化反応による有機溶媒への耐性およびフェノールの酸化反応による熱に対する安定性を測定した。
【0055】
メソポーラスシリカに固定化されたHRPの有機溶媒中での酵素活性を評価するために、酸化剤にtert−ブチルヒドロペルオキシドを用いた,トルエン中での1,2−ジアミノベンゼンの酸化反応を利用した。50mM 1,2−ジアミノベンゼンを含む無水トルエンを8mlとn−デカンにtert−ブチルヒドロペルオキシドを溶解して調製した1.1M tert−ブチルヒドロペルオキシド溶液2mlとを混合した。この混合溶液1mlに上記方法によって調製されたHRP固定化メソポーラスシリカ10mgを加え、37℃で反応を開始させた。1,2−ジアミノベンゼンの酸化によって生成する1,2−ジニトロベンゼンの470nmでの吸光度を測定し、経時変化を求めることによってトルエン溶媒中でのHRPの酵素活性を決定した。
【0056】
また比較試験としてHRPそのものを0.5mg調製し、上記の酸化反応を行い、同様に470nmでの吸光度の上昇を測定した。その結果を図7に示す。HRP(Free HRP)だけではトルエン中における酸化反応は全く起こらなかったが、HRPを固定化したメソポーラスシリカでは、非常に高い活性を示した。これは、トルエンにHRPを添加した直後にHRPが変性してしまったためであると考えられ、メソポーラスシリカにHRPを固定化することによって高い安定性を発現していることが分かった。
【0057】
続いて、HRPを固定化したメソポーラスシリカおよび固定化していない通常のHRPをリン酸緩衝溶液中、70度で0〜2時間熱処理した。その後、残存の酵素活性を測定した結果を図8に示す。メソポーラスシリカ内に固定化されたHRPの熱安定性は、フェノールの酸化分解速度を測定することによって決定した。フェノールの定量は4−アミノアンチピリン比色法を用いた。
【0058】
上記HRP吸着によって調製したHRP固定化メソポーラスシリカ10mgに、50mM 酢酸ナトリウム緩衝液(pH=4.0)400μlを加え、70℃で30、60、90、120分間それぞれ加熱した。加熱後遠心分離を行いHRP固定化シリカを純水で2回洗浄した。次に50mM Tris−HCl(ヒドロキシメチルアミノメタン塩酸塩)緩衝液(pH=7.5)400μl、5000ppmフェノール水溶液8μl、30%過酸化水素水2μlを加えて、37℃にて30分間反応させた。遠心分離後、上澄み液を150μlと1Mのグリシン水溶液(pH=9.6)で調製した1% ヘキサシアノ鉄酸塩と1% 4−アミノアンチピリンをそれぞれ150μl、300μl加え撹拌した後、すばやく500nm付近の吸光度を測定した。
【0059】
固定化されていないHRPは、70℃、30分の熱処理により酵素活性が半減してしまい2時間後には初期の酵素活性に対し約10%しか活性を示さなかった。これに対してHRPを固定化したメソポーラスシリカでは、熱に対する高い安定化効果が確認された。70℃、2時間の熱処理後も90%以上の酵素活性を有していた。
【0060】
上記のフェノールの酸化反応を用いて、HRPの温度依存性を測定した結果を図9に示した。HRPおよび固定化HRPは、25℃から100℃で、それぞれ30分前処理した後、酵素活性を測定した。通常のHRPが70℃,30分の条件下において、残存活性が0%になったのに対して短軸配向性メソポーラスに固定化したHRPは同条件下でも50%以上の活性を示した。また、100℃で処理をしても0%になることはなく、40%近くの酵素活性を保持していた。
【0061】
(比較例1)
比較例として、ロッド状粒子の長軸方向に平行にチューブ状細孔径が形成されているSBA−15を合成し、HRPの吸着及び有機溶媒中の安定効果を測定した。SBA−15の合成方法は、例えば、Science誌第279号第548頁に記載されている。
【0062】
合成したSBA−15をX線回折法により評価した結果、面間隔9.8nmのヘキサゴナル構造の(100)面に帰属される回折ピークを確認した。また、窒素吸着等温線測定より合成したSBA−15は800m2/gの比表面積と7.4nmの細孔径を有していた。
【0063】
合成したSBA−15を実施例1と同様のHRP吸着実験を行った。HRPの吸着量は25mg/gとなり、本発明に利用した短軸配向性メソポーラスシリカに比べ、1/10以下の非常に少ない吸着量を示した。また、HRP吸着後の試料を用いた窒素吸着等温線解析から、HRPの吸着前後でSBA−15の細孔容量に減少が見られず、HRPがSBA−15細孔内にほとんど吸着していないことが分かった。HRPの平均直径が4.8nm、SBA−15の細孔径が7.4nmであることを考慮すると細孔の開口部が少ないため、吸着しにくい状態であったことが予想される。またメソポーラスシリカへのHRPの経時吸着量を測定した結果、飽和吸着量に達する時間が、短軸配向性メソポーラスシリカにおいて非常に短かった。
【0064】
続いて、このSBA−15を用いて上記方法によるHRPの有機溶媒安定性の測定を行い、本発明によるメソポーラスシリカとの比較を行った。僅かにSBA−15に固定化されたHRPによる酵素活性が観察された。しかし、SBA−15固定化HRPにおいて、反応開始と共に徐々に反応生成物である1,2−ジニトロベンゼンが確認された。これに対し、本発明のメソポーラスシリカでは,反応開始直後からSBA−15に比べて10倍以上の1,2−ジニトロベンゼンが確認された。
【0065】
したがって、本発明者らはこれらの結果をSBA−15ではロッド状粒子の長軸方向に平行にチューブ状細孔径が形成されているためにチューブ状細孔のアスペクト比が大きい。これにより、外部から細孔の内部、および細孔内部から外部へのHRPや基質の拡散が悪いこと、及び、表面における細孔の開口部の数が少ないため、HRPや基質の導入が遅くなることが原因であると推察した。この結果から、本発明に利用した短軸配向性のメソポーラスシリカが、生体物質等の担持剤として優れている点が明らかになった。
【実施例2】
【0066】
本実施例は、実施例1で作製した短軸配向性メソポーラスシリカ表面をジルコニウムの酸化物で修飾し、ウシ血清アルブミン(BSAと略記,直径=7.0nm,IEP=4.7)を固定化させ熱に対する安定性を測定した例である。
【0067】
オキシ硝酸ジルコニウム2水和物10gを純水90mlに添加し、室温で溶解させ10wt%のオキシ硝酸ジルコニウム水溶液を調製した。この溶液に実施例1で合成した短軸配向性のメソポーラスシリカを添加して、20時間浸漬させた。その後、遠心分離により上澄みを取り除き、純水で3回洗浄し室温で乾燥させた。
【0068】
ジルコニウムで修飾した短軸配向性メソポーラスシリカをX線回折法により評価した結果、修飾前とほぼ同様の回折パターンを示し、メソ孔の周期構造が壊れていないことを確認した。また、X線光電子分光分析(XPS)を用いてシリカ表面の化学結合状態を測定した結果、Zr−Oに起因するピークが確認され、シリカ表面にジルコニウムの酸化物層が形成されていることを確認した。
【0069】
続いて、ジルコニウム修飾後のメソポーラスシリカの細孔内にBSAを固定化し、HRP標識した抗BSA抗体との抗原抗体反応を利用して安定化効果を測定した。
【0070】
ジルコニウム修飾後の短軸配向性メソポーラスシリカ10mgに、10mMのリン酸緩衝液(pH=5.0)を用いてBSAを1mg/mlに調製した溶液を5ml添加し、4℃で6時間撹拌した。これにより、メソポーラスシリカのメソ細孔内にBSAを固定化させた。その後、純水で3回洗浄した。なお、ジルコニウム修飾していない短軸配向性のメソポーラスシリカを用いてBSAの吸着実験を行ったところ、全く吸着しなかった。
【0071】
上記のBSA固定化メソポーラスシリカに、西洋わさびペルオキシダーゼで標識した抗BSA抗体(HRP−antiBSAと略記)を添加し、室温にて所定時間(1〜4時間)反応させた。非特異吸着した(HRP−antiBSA)を除くために、この固定化メソポーラスシリカを純水で数回洗浄した。その後、凍結真空乾燥を行い、この乾燥試料を37℃で任意の時間放置した。次に50mM Tris−HCl(pH=7.5)400μl、5000ppmフェノール水溶液 8μl、30%過酸化水素水2μlを加えて、37℃にて30分間反応させた。遠心分離後、上澄み液を150μlと1Mのグリシン水溶液(pH=9.6)で調製した1% ヘキサシアノ鉄酸塩と,1% 4−アミノアンチピリンをそれぞれ150μl、300μl加え撹拌した。その後、すばやく500nm付近の吸光度を測定し固定化されたBSAに特異的に結合したHRP−antiBSAに標識されたHRPの酵素活性を測定した。
【0072】
また、メソポーラスシリカに対して、非特異的なオバルブミン(卵白アルブミン,直径7.0nm,IEP4.9)を上記の方法と同様にして固定化し、前述の抗BSA抗体を反応させ、両者の吸光度の差を上記手順により測定した。その結果、非特異的なオバルブミンは、本実施例によるBSA固定化メソポーラスシリカに比べ、HRP活性が明らかに小さかった。これらの結果より、メソポーラスシリカにBSAが固定化され、且つメソポーラスシリカへの固定化後も細孔内において有効に抗原抗体反応が起きていることを確認した。
【0073】
また、上記で得たBSA固定化メソポーラスシリカと通常のBSA粉末を乾燥状態において40℃で3週間保存した後、同様のHRP活性による変化を測定した。37℃で乾燥保存を開始する直前の両者の結合活性を100とした結果、固定化していないBSAは1週間後には相対活性が0となり、完全に失活してしまった。一方、階層的メソポーラスシリカに固定化したBSAは、3週間後においても90%以上の相対活性を示した。
【実施例3】
【0074】
本実施例は、実施例1で合成した短軸配向性メソポーラスシリカの表面をシランカップリング剤を用いて修飾しα−アミラーゼを共有結合によってシリカ表面に固定化させた例である。
【0075】
実施例1で合成した短軸配向性メソポーラスシリカ1.0gをトルエンで調製した10%(v/v)の3−aminopropyl triethoxysilane溶液の50ml中に添加し、この溶液を窒素雰囲気下において120℃で48時間撹拌した。反応後、沈殿物は濾過し、トルエン、メタノール、ジクロロメタンで洗浄した後、室温で乾燥させた。
【0076】
次にこの乾燥試料の1.0gをリン酸緩衝溶液(pH=6.6)で調製した2.5% glutaraldehyde溶液の25mlに溶解させ室温で1時間撹拌した。得られた沈殿物は純水を用いて4回以上洗浄し、その後室温において乾燥した。
【0077】
Glutaraldehydeで修飾した短軸配向性メソポーラスシリカをX線回折法により評価した結果、修飾前とほぼ同様の回折パターンを示しており、メソ細孔構造が壊れていないことを確認した。また、FT−IRを用いてシリカ表面に導入した官能基の同定を行った結果、R−CH=N、C=O、−CHOに起因するピークがそれぞれ確認されシリカ表面にSi(CH2)3N=CH(CH2)3CHOが共有結合していることを確認した。
【0078】
続いて、修飾後のメソポーラスシリカの細孔内にα−アミラーゼを固定化し澱粉のマルトースへの加水分解反応を用いて安定化効果を測定した。
【0079】
50mMのリン酸緩衝液(pH=6.0)を用いてα−アミラーゼを1mg/mlに調製し、この溶液1ml中に上記方法で合成・修飾した短軸配向性メソポーラスシリカ0.2gを添加した。混合溶液は4℃、20時間の条件下でシェーカーを用いて含浸させ、α−アミラーゼをメソポーラスシリカ細孔内に吸着させた。反応終了後、ペレットを濾過して、純水で3回洗浄した。この際、元の酵素溶液と上澄み液のそれぞれを,UV−Vis吸光度測定を行った。α−アミラーゼの280nmにおける吸収極大を利用し、吸着前後の濃度変化からメソポーラスシリカへの吸着量を算出した。吸着したα−アミラーゼは140mg/gと高い値を示した。表面修飾を行わなかったメソポーラスシリカへの同条件でのα−アミラーゼの吸着実験では、ほとんど吸着挙動を示さなかった。したがって、α−アミラーゼがシリカ表面に修飾した−CHOおよびα−アミラーゼの−NH2と結合しシリカ表面に固定化された。
【0080】
続いて、アミラーゼ固定化メソポーラスシリカおよび固定化していないフリーのアミラーゼを酢酸ナトリウム緩衝溶液中25℃から70℃でそれぞれ熱処理した後、酵素活性を測定した。
【0081】
上記アミラーゼ固定化メソポーラスシリカ10mgに50mM 酢酸ナトリウム緩衝液(pH=5.0)400μlを加え、25℃から70℃でそれぞれ30分処理した。加熱後遠心分離を行いアミラーゼ固定化シリカを純水で2回洗浄した。同様の50mM酢酸ナトリウム緩衝液を用いて、0.125%の可溶性澱粉を調製し、この澱粉溶液の300μlを洗浄後のアミラーゼ固定化シリカに添加し、40℃で15分反応させた。反応停止後、遠心分離により上澄みを得て、この上澄み溶液に1mlの0.5N酢酸及びヨウ素−カリウム溶液(0.015%ヨウ素−0.15%ヨウ化カリウム溶液)を3ml加え、よく撹拌してから700nmにおける吸収極大を測定した。通常のα−アミラーゼが60℃、30分の条件下において、相対活性が20%になったのに対して、短軸配向性メソポーラスシリカに固定化したα−アミラーゼでは、同条件下において90%以上の相対活性を示し、安定化効果が確認された。
【実施例4】
【0082】
実施例1で合成した短軸配向性のメソポーラスシリカの細孔内に、ヤギ由来のIgG Fabフラグメント(直径約12nm)を固定化させ抗原−抗体間の特異的結合反応を利用して、抗体の安定性測定を行った例である。
【0083】
実施例1で合成した短軸配向性メソポーラスシリカおよび比較例1で使用したSBA−15各10mgに、抗マウス免疫グロブリンG(IgG)のFabフラグメントを10mMリン酸緩衝液で1mg/mlに調製した溶液を10ml添加した。その溶液を4℃で6時間撹拌することによりメソポーラスシリカのメソ孔内に抗体を固定化させた。UV−Vis吸光光度計を用いて280nmでの吸光度を測定することによって、Fabの吸着量を算出した。短軸配向性のメソポーラスシリカにおいては、約150mg/mlのFabの細孔内吸着を確認した。しかし、通常のSBA−15では全く吸着を確認できなかった。
【0084】
その後、純水で3回洗浄した。上記の抗体固定化メソポーラスシリカに西洋わさびペルオキシダーゼで標識したマウス由来のIgG抗体(HRP−IgGと略記)溶液を添加し、室温にて所定時間(1〜4時間)反応させた。非特異吸着したHRP−IgGを除くために、この抗原−抗体固定化メソポーラスシリカを純水で数回洗浄した。その後、凍結真空乾燥を行いこの乾燥試料を37℃で任意の時間放置した。次に50mM Tris−HCl(pH=7.5)400μl、5000ppmフェノール水溶液 8μl、30%過酸化水素水2μlを加えて、37℃にて30分間反応させた。遠心分離後、上澄み液を150μlと1Mのグリシン水溶液(pH=9.6)で調製した1% ヘキサシアノ鉄酸塩と1% 4−アミノアンチピリンをそれぞれ150μl、300μl加え撹拌した。その後、すばやく500nm付近の吸光度を測定し、固定化されたFabフラグメントに特異的に結合したIgG抗体に標識されたHRPの酵素活性を測定した。
【0085】
また、前記の短軸配向性メソポーラスシリカに対して、抗マウスではないIgGのFabフラグメントを上記の方法と同様にして固定化した。前述のマウス由来のIgG抗体に特異的な結合をするFabと非特異的なFabとを用いた場合の両者の吸光度の差を上記手順により測定した。その結果、抗マウスではないIgGのFabフラグメントは、本実施例による抗マウスIgGのFabフラグメント固定化メソポーラスシリカに比べ、HRP活性が明らかに小さかった。これらの結果より、短軸配向性メソポーラスシリカに直径12nmの活性化物質が固定化されかつメソポーラスシリカへの固定化後も、細孔内において有効に抗原抗体反応が起きていることを確認した。
【0086】
また、上記で得たFab固定化メソポーラスシリカと固定化していないFab粉末を乾燥状態において37℃で3週間保存し、抗原抗体反応によるHRP活性の変化を測定した。37℃で乾燥保存を開始する直前の両者の結合活性を100とした結果、通常のFabフラグメントは12時間で相対活性が0となり、完全に失活してしまった。一方、短軸配向性メソポーラスシリカに固定化したFabフラグメントによる抗原抗体反応は、2週間後においても80%以上の相対活性を示した。
【図面の簡単な説明】
【0087】
【図1】本発明に利用された短軸配向性メソポーラス材料を説明するための模式図である。
【図2】本発明の実施例1で合成された短軸配向性ポーラス材料を利用した安定化酵素の構造の模式図である。
【図3】本発明に利用された短軸配向性メソポーラス材料のX線回折の結果である。
【図4】本発明に利用された短軸配向性メソポーラス材料の走査型電子顕微鏡写真のイメージである。
【図5】本発明に利用された短軸配向性メソポーラス材料の走査型電子顕微鏡写真の高倍率イメージである。
【図6】図4で示された短軸配向性メソポーラス材料の断面における走査型電子顕微鏡写真の高倍率イメージである。
【図7】実施例1で合成された短軸配向性メソポーラス材料内に西洋わさびペルオキシダーゼを固定化し,トルエン中で酵素反応を行った場合の転化率と時間経過を示すグラフである。
【図8】実施例1で合成された短軸配向性メソポーラス材料内に西洋わさびペルオキシダーゼを固定化し,70℃で熱処理を行った場合の、酵素の相対活性と熱処理時間の関係を示すグラフである。
【図9】実施例1で合成された短軸配向性メソポーラス材料内に西洋わさびペルオキシダーゼを固定化し、所定の温度で30分熱処理した場合の相対活性の温度依存性を示すグラフである。
【符号の説明】
【0088】
11 メソ孔を有したロッド状構造体
12 メソ細孔
13 細孔壁
21 短軸配向性のロッド状構造体
22 細孔壁
23 酵素やタンパク質を始めとする生体物質
24 生体物質と特異的結合をする基質などのフラグメント
【特許請求の範囲】
【請求項1】
ロッド状の粒子であって、
前記ロッド状の長軸方向に対して交差するメソ孔を有し、
前記メソ孔の中に生体物質を担持することを特徴とする粒子。
【請求項2】
前記メソ孔の長さが、前記孔径の10倍より大きく30倍以下である請求項1記載の粒子。
【請求項3】
前記メソ孔の孔径が10nm以上で30nm以下である請求項1記載の粒子。
【請求項4】
前記粒子は、複数のメソ孔を有し、前記メソ孔がハニカム状に配置されている請求項1記載の粒子。
【請求項5】
前記生体物質が、蛋白質である請求項1記載の粒子。
【請求項6】
窒素ガス吸着測定により求められた前記メソ孔の細孔径分布が、単一の極大値を有し、かつ全メソ孔中の60%以上が、10nm以下の孔径分布幅の範囲内である請求項第1記載の粒子。
【請求項7】
X線回折分析において、1nm以上の構造周期に対応する角度領域に少なくとも1つの回折ピークを有する請求項1記載の粒子。
【請求項8】
検体を検出するセンサーであって、
請求項1記載の粒子と、
電極とを備え、
前記検体と前記メソ孔中に担持させた前記生体物質との反応に基づいた電気的出力信号を検出することを特徴とするセンサー。
【請求項9】
検体の検出方法において、
請求項1記載の粒子を用いたセンサーを用意する工程と、
前記センサーに検体を含む流体を付与する工程と、
前記生体物質と前記検体との反応に基づいた出力信号を検出する工程とを備えることを特徴とする検体の検出方法。
【請求項1】
ロッド状の粒子であって、
前記ロッド状の長軸方向に対して交差するメソ孔を有し、
前記メソ孔の中に生体物質を担持することを特徴とする粒子。
【請求項2】
前記メソ孔の長さが、前記孔径の10倍より大きく30倍以下である請求項1記載の粒子。
【請求項3】
前記メソ孔の孔径が10nm以上で30nm以下である請求項1記載の粒子。
【請求項4】
前記粒子は、複数のメソ孔を有し、前記メソ孔がハニカム状に配置されている請求項1記載の粒子。
【請求項5】
前記生体物質が、蛋白質である請求項1記載の粒子。
【請求項6】
窒素ガス吸着測定により求められた前記メソ孔の細孔径分布が、単一の極大値を有し、かつ全メソ孔中の60%以上が、10nm以下の孔径分布幅の範囲内である請求項第1記載の粒子。
【請求項7】
X線回折分析において、1nm以上の構造周期に対応する角度領域に少なくとも1つの回折ピークを有する請求項1記載の粒子。
【請求項8】
検体を検出するセンサーであって、
請求項1記載の粒子と、
電極とを備え、
前記検体と前記メソ孔中に担持させた前記生体物質との反応に基づいた電気的出力信号を検出することを特徴とするセンサー。
【請求項9】
検体の検出方法において、
請求項1記載の粒子を用いたセンサーを用意する工程と、
前記センサーに検体を含む流体を付与する工程と、
前記生体物質と前記検体との反応に基づいた出力信号を検出する工程とを備えることを特徴とする検体の検出方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【公開番号】特開2007−174937(P2007−174937A)
【公開日】平成19年7月12日(2007.7.12)
【国際特許分類】
【出願番号】特願2005−375172(P2005−375172)
【出願日】平成17年12月27日(2005.12.27)
【出願人】(000001007)キヤノン株式会社 (59,756)
【Fターム(参考)】
【公開日】平成19年7月12日(2007.7.12)
【国際特許分類】
【出願日】平成17年12月27日(2005.12.27)
【出願人】(000001007)キヤノン株式会社 (59,756)
【Fターム(参考)】
[ Back to top ]

