生体物質検出用素子を用いた計測装置及び計測方法
【課題】 バックグラウンド信号や個体差のバラツキを除去し,高精度・高感度に測定対象であるウイルス、細菌、細胞等の数を測定する。
【解決手段】 基板と、基板の表面に設けられた複数の作用電極と、複数の電極のそれぞれと接続され基板の表面と反対側に設けられた配線と、作用電極上に測定対象を捕捉するプローブとを有するアレイを用い、酸化還元反応により発光する試薬を含む参照溶液を当該アレイ上に接触させ、対向電極と配線のそれぞれの接続を制御して、作用電極と対向電極との間に電圧を印加し、測定試料の導入による光強度の変化や差に基づいて、プローブに捕捉された測定対象の有無を測定する。
【解決手段】 基板と、基板の表面に設けられた複数の作用電極と、複数の電極のそれぞれと接続され基板の表面と反対側に設けられた配線と、作用電極上に測定対象を捕捉するプローブとを有するアレイを用い、酸化還元反応により発光する試薬を含む参照溶液を当該アレイ上に接触させ、対向電極と配線のそれぞれの接続を制御して、作用電極と対向電極との間に電圧を印加し、測定試料の導入による光強度の変化や差に基づいて、プローブに捕捉された測定対象の有無を測定する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は,電気的及び光学的な計測を行い,生体物質を高精度および高感度に計測することのできる計測装置,および計測方法に関する。
【背景技術】
【0002】
ウイルス・細菌等の生体物質を検出する方法として抗原抗体反応に代表される免疫学的手法が広く知られている。例えば,近年ウイルスや細菌に罹患しているかどうかの簡易検査を目的として,イムノクロマトグラフィーと微粒子凝集を基礎原理とした検出キットが広まっている(例えば,特許文献1)。これらのキットは,検体導入部,標識用抗体を保持する部,抗原検出用のテスト部から構成される。標識物質としては,凝集により発色する金属微粒子が用いられる。検体を導入すると検体と共に標識用抗体が展開され,検体内に検出対象物が存在するとテスト部において検出対象物を介して標識用抗体が結合する。この時,標識物質の凝集によってテスト部で発色が起こり,発色の有無から検体内の検出対象物の有無の判定を行う。操作が簡便かつ,実施時間が数分〜数十分と短時間であり,目視による判定が可能であることから簡易検査として適している。
【0003】
抗原抗体反応を利用した,より高感度な生体物質の検出手法としてはイムノアッセイが広く普及している。イムノアッセイは,大別して光学的な手法により検出が可能な標識用抗体を用いる手法と,標識物質を用いずに通常の固定化抗体と検出対象物の結合がもたらす環境変化を利用して検出を行う手法に分けることができる。前者にはEnzyme-Linked ImmunoSorbent Assay(ELISA)法(例えば,非特許文献1),Luminescent Oxygen Channeling Immunoassay(LOCI)法(例えば,特許文献2)等が含まれる。一方,後者にはラテックス凝集法(例えば,特許文献3),表面プラズモン共鳴(SPR)(例えば,特許文献4),水晶発振子マイクロバランス法(QCM)(例えば,特許文献5),キャパシタンス測定(例えば,非特許文献2),インピーダンス測定(例えば,特許文献6),界面電位測定(例えば,非特許文献3)等が含まれる。
【0004】
ELISA法では,抗体を固定化した基板に検出対象物と標識用抗体を注入,一定時間反応後に洗浄を行って遊離している標識用抗体を除去する。その後,基板表面に残留した標識酵素と基質を反応させ,反応生成物量を光学的に測定し,検出対象物濃度を求める。LOCI法では,検出対象物の異なる部位を認識する別々の抗体を各々に固定化した微粒子A,Bを用いる。検出対象物と微粒子A,Bを混合すると,検出対象物を介して微粒子A,Bが結合する。微粒子A,Bに固定化された抗体にはごく近傍に存在する場合にのみ発光を生じる標識物質が修飾されているため,検出対象物と結合していない微粒子を除去することなく,検出対象物濃度を求めることができる。
【0005】
ラテックス凝集法では,抗体が固定化されたラテックス微粒子の分散液中に検出対象物を注入すると,検出対象物を起点としてラテックス微粒子が凝集クラスターに成長した時の光学的特性(吸光極大波長,透過光強度,散乱光強度)の変化を測定する。SPR・QCM・キャパシタンス測定・インピーダンス測定・界面電位測定は,どれもセンサ表面に固定化された抗体に検出対象物が結合した時の表面のある物理量の変化を検出している。SPRは誘電率の変化によるプラズマ共鳴角の変化を,QCMは質量の変化による共鳴振動数の変化を,キャパシタンス測定・インピーダンス測定・界面電位測定はそれぞれキャパシタンス・インピーダンス・界面電位の変化を検出している。
【0006】
また,生体分子を1個検出することを目的として,蛍光標識と顕微鏡を組み合わせた1分子イメージングという技術が近年急速に発達している(例えば,非特許文献4)。1分子イメージングでは高感度測定を行うために,染み出し深さが光の波長の半分程度であるエバネッセント光を用いて,バックグラウンド信号を低減し,1分子を検出している。
【0007】
別の生体分子の1個検出を目指した手法として,微小電極を複数配置した電極及び電界効果型トランジスタ(FET),電荷結合素子(CCD)を組み合わせて生体物質を1個検出する手法が報告されている(例えば,特許文献7)。この手法では電極表面に固定化された抗体に検出対象物が結合したことによる電荷の変化を検出し,この時の電荷の変化量がある閾値を超えたときに生体物質が1個有ると判定を行うことで生体物質の検出を行っている。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】特開平1-32169
【特許文献2】EP0515194A
【特許文献3】US4250394
【特許文献4】US4997278
【特許文献5】US6006589
【特許文献6】US7192752
【特許文献7】US7022287
【非特許文献】
【0009】
【非特許文献1】Immunochemistry, 1971, 8, 871-874.
【非特許文献2】Anal. Chem., 1997, 69, 3651-3657.
【非特許文献3】Analyst, 2002, 127, 1137-151.
【非特許文献4】Nature, 1996, 380, 451-453.
【発明の概要】
【発明が解決しようとする課題】
【0010】
従来技術ではウイルス・細菌・細胞を1個単位で定量することはできなかった。
微粒子凝集を用いたイムノクロマトグラフィーやラテックス凝集法では複数の微粒子が凝集した時に初めて光学的特性の変化が発生する。したがって,原理的に生体物質の1個単位測定は困難であった。
【0011】
従来のイムノアッセイではバックグラウンド信号の影響により1個単位で検出することは困難であった。例えば,標識用抗体を用いたELISA法では洗浄工程により除去しきれなかった標識用抗体がバックグラウンド信号を発生させる。これはLOCI法についても同様である。一方,生体物質の結合によるセンサ表面の物理量変化を検出する手法(SPR,QCM,キャパシタンス測定,インピーダンス測定,界面電位測定)にとっては,検出対象物以外の物質(夾雑物)の非特異的吸着がバックグラウンド信号源となる。これらの手法は予め実験的に定めた検出対象物の濃度とシグナル信号値との相関関係から検出対象物の濃度を求めているが,検出対象物の濃度が微小になるとシグナル信号値に対するバックグラウンド信号値の比が無視できなくなるほど大きくなるため,1個単位での検出が困難であった。複数の微小電極と電荷変化を組み合わせた手法においても,電荷変化をもたらす異物の吸着がバックグラウンド信号となることから,同様の課題があると言える。
【0012】
1分子イメージングでは生体物質1個単位での検出は可能であるが,光の波長以下の位置分解能を持たず光の波長以下の集積化が困難である。また、照明領域が非常に小さいため,基板全域を走査するには長時間を必要とする。以上の理由から、1分子イメージングでは数千〜数万の生体物質の定量は困難である。また、得られる情報にはサイズ情報が含まれていないため、サイズ選択性をもたすことができない。
【0013】
本発明では,生体物質を1個単位で計測し,定量する計測装置および計測方法を提供する。
【課題を解決するための手段】
【0014】
本発明の代表的な形態としては、基板と、基板の表面に設けられた複数の作用電極と、複数の電極のそれぞれと接続され基板の表面と反対側に設けられた配線と、作用電極上に測定対象を捕捉するプローブとを有するアレイと、酸化還元反応により発光する試薬を含む参照溶液を当該アレイ上に接触させる溶液接触手段と、参照溶液に接触するように設けられた対向電極と、配線のそれぞれの接続を制御して、作用電極と対向電極との間の電圧を制御する電圧制御手段と、アレイからの光を検出する光検出器と、溶液接触手段により試料溶液を接触させ、光検出器により検出される光強度の測定に基づいて、プローブに捕捉された測定対象の有無を測定する計算部と、を有する計測装置である。
【0015】
また、計測方法としては、上記したアレイ上に参照溶液を導入する工程と、アレイ上に試料溶液を導入する工程と、複数の作用電極のそれぞれの電気的接続を制御する工程と、接続された作用電極と参照溶液と接触した対向電極との間の電圧印加を制御する工程と、アレイからの光を光検出器により検出する工程と、参照溶液を導入したアレイについて、試料溶液を導入した場合と導入しない場合における光強度の測定に基づいて、プローブに捕捉された測定対象の有無を測定する工程とを有する。
【0016】
そして、複数の作用電極それぞれについて、捕捉された測定対象の数をカウントして、試料中の測定対象の数を測定して定量する。
【0017】
捕捉された測定対象の有無の検出としては、参照溶液を導入したアレイについて、試料溶液を導入してからの光強度の変化が閾値を超えるかどうかの判定をする方法や、参照溶液を導入したアレイについて、試料溶液を導入した場合と導入しない場合の光強度の差が閾値を超えるかどうかを判定をする方法を用いることができる。
【0018】
また、作用電極への電圧印加の開始時間と受光素子での計測開始時間を同期させて計測するようにしてもよい。
【発明の効果】
【0019】
上記構成により、発光強度の測定により検出対象物の1個単位の有無を判定することができる。そして、従来問題となっていたバックグラウンド信号が測定値に与える影響を抑制することができる。また,検出対象物の有無を判定することで従来同様に問題となっていた検出対象の個体差に起因する信号変化のバラツキの影響も抑制することができる。さらに,検出対象が有ると判定した電極の数を総和することで,検体中の検出対象の量を求めることが可能となる。これにより,標識物質を使用することなく検出対象を定量することができる。加えて、作用電極への電圧印加の開始時間と受光素子での計測開始時間を同期させて計測することにより、隣接する複数の作用電極間の間隔が光学顕微鏡の位置分解能以下であっても個々の作用電極を区別することができる。
【0020】
以上より,前記のように各作用電極についてバックグラウンド信号や個体差のバラツキを除去できるため,従来よりも高精度・高感度な測定が可能となる。
【図面の簡単な説明】
【0021】
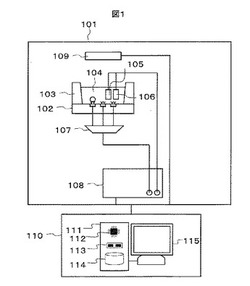
【図1】計測装置の一例を示す概念図。
【図2】計測方法のフローチャートの一例。
【図3】計測装置の一例を示す概念図。
【図4】計測方法のフローチャートの一例。
【図5(A)(B)】図3の測定セルの一例を示す概念図。
【図5(C)(D)】図3の測定セルの一例を示す概念図。
【図5(E)(F)】図3の測定セルの一例を示す概念図。
【図5(G)(H)】図3の測定セルの一例を示す概念図。
【図6】計測方法のフローチャートの一例。
【図7】素子の一例を示す俯瞰図
【図8】素子の一例を示す断面図
【図9】作用電極にプローブを固定化した場合の概念図。
【図10】作用電極に検出対象が結合した場合の概念図。
【図11】素子の一例を示す断面図。
【図12】ある作用電極の発光強度を時系列順に並べた図
【図13】素子に用いる作用電極の一例を示す断面図。
【図14】素子に用いる作用電極の一例において,作用電極にプローブを固定化した場合の概念図。
【図15】素子に用いる作用電極の一例において,作用電極に検出対象が結合した場合の概念図。
【図16】素子に用いる作用電極の一例を示す断面図。
【図17】素子に用いる作用電極の一例を示す断面図。
【図18】素子に用いる作用電極の一例を示す断面図。
【図19】素子に用いる作用電極の一例において,作用電極にプローブを固定化した場合の概念図。
【図20】素子に用いる作用電極の一例において,作用電極に検出対象が結合した場合の概念図。
【図21】素子に用いる作用電極の一例を示す断面図。
【図22】素子に用いる作用電極の一例を示す断面図。
【図23】作用電極の直径と検出対象の結合による発光強度減少率の関係を示す図。
【図24】作用電極の周囲の壁の高さを変化させた時の,作用電極の直径と検出対象の結合による発光強度減少率の関係を示す図。
【図25】作用電極の直径と検出対象の直径の比を変化させた時の,作用電極の直径と検出対象の結合による発光強度減少率の関係を示す図。
【図26】典型的な電気化学発光の反応経路を示す図。
【図27】典型的な電気化学発光における無次元数πと検出対象の結合による発光強度減少率の関係を示す図。
【図28】隣接する作用電極間隔が光の波長分解能以下であるような素子の一例を示す概念図。
【図29】実験と計算でそれぞれ求めた作用電極の直径と検出対象の結合による発光強度減少率の関係を示す図。
【図30】実験で用いた16個の作用電極を有する素子の俯瞰図。
【発明を実施するための形態】
【0022】
以下,図面を参照して本発明の実施の形態を説明する。
【0023】
図1は,素子とそれを用いた計測装置の概念図である。本計測装置は,計測部101と制御部110から構成される。素子102上に形成された容器103中には参照用溶液104が入れられる。参照用溶液104は酸化還元反応を起こす試薬を含んでいる。この酸化還元反応を起こす試薬は、電気的エネルギーにより発光するような試薬を用いる。参照用溶液104中には対向電極105と参照電極106が配置されている。素子の各作用電極はそれぞれマルチプレクサ107の入力端子に接続されている。素子についての詳細は後述する。対向電極105とマルチプレクサ107の出力端子はポテンショスタット108に接続されている。ポテンショスタット108と受光素子109は制御部110と接続されている。マルチプレクサ107の役割は,素子102上の複数の作用電極のうち少なくとも1つをポテンショスタット108と接続することである。ポテンショスタット108の役割は,素子102上の複数の作用電極のうち少なくとも1つと対向電極105の間に電位差を印圧し,作用電極上に発生した光子を受光素子109で検出することである。制御部110としては,例えば図1に示したようなパーソナルコンピュータ(PC)を用いることができる。PCは,データ処理装置111,データ表示装置115を有し,データ処理装置111は,例えば演算装置112,一時記憶装置113,不揮発性記憶装置114を有している。
【0024】
図2は,計測方法のフローチャートの一例である。図1と併せて説明する。まず,容器103に参照用溶液104を注入する。続いて,マルチプレクサ107により入力端子と出力端子の接続を切り替えながら,ポテンショスタット108と受光素子109で各作用電極上の発光を測定し,それぞれの発光強度を記録する。これにより,素子102上の全ての作用電極について発光強度を測定する。
【0025】
次に,容器103に試料溶液を注入する。試料溶液は、例えば被検者の血液・唾液・尿等の生体試料やそれらを調整して得られた溶液などをいう。試料溶液中の検出対象が素子102の作用電極上に固定化されたプローブに結合するまで,一定時間待機する。続いて,マルチプレクサ107により入力端子と出力端子の接続を切り替えながら,ポテンショスタット108と受光素子109で発光強度を測定し,それぞれの発光強度を記録する。試料溶液注入前に測定した発光強度と比較し,発光強度の変化が閾値よりも大きければカウンターをインクリメントする。これにより,素子102上の作用電極一つ一つについて検出対象の結合の有無を判定し,素子102上の全ての作用電極上に結合した検出対象の数を数える。最後に,カウンターの値,すなわち素子102上の全ての作用電極上に結合した検出対象の数を出力する。
【0026】
作用電極上に光子を発生させる手段としては,酸化還元反応を起こす試薬に作用電極から電気的エネルギーを受け渡す手段を用いればよい。そのような手段の一例としては,電気化学発光が挙げられる。電気化学発光に必要な試薬としては,例えばトリ(ビピリジル)ルテニウムまたはその誘導体等がある。電気化学発光に必要な作用電極の材料としては例えば金,白金,グラッシーカーボン,ホウ素をドープしたダイヤモンド等がある。
【0027】
他の光子を発生させる手段としては、一重項酸素を用いた発光が挙げられる。一重項酸素は酸化力が非常に強く、例えばオレフィン化合物は酸化すると発光するという特徴を持っているため、一重項酸素とそのような物質を組み合わせれば発光系を構築することができる。一重項酸素を発生させるのに必要な電極としては半導体電極、例えば酸化チタン等がある。
【0028】
作用電極上に発生した光子を計測させる手順としては、各作用電極に電圧を印加する時間と受光素子で光子を計測する時間を同期させればよい。例えば、1つの作用電極に電圧を印加後、電流値が定常状態になった時刻から受光素子で計測を開始し、一定時間経過後、電圧印加と計測を終了し、また次の作用電極に同様の操作を繰り返していく手法がある。このように計測することで、各作用電極での発光を電極1個単位で確実に計測でき、かつ電極表面に検出対象物が捕捉されている場合、安定した発光強度の変化を計測することができる。
【0029】
閾値を用いて作用電極上の検出対象をカウントすることで,一つの作用電極で検出対象の量を測定する従来の方法と比べて,測定精度を向上させることができる。発光強度を変化させる要因として,検出対象の結合以外に,夾雑物の非特異的吸着,温度の変化などの外乱がある。一つの電極で検出対象の量を測定する従来の方法では,これら外乱が測定精度を低下させるが,閾値を用いて作用電極上の検出対象をカウントする場合,外乱が閾値よりも小さいときは外乱はカウント値に影響を及ぼさない。従って,閾値を用いて作用電極上の検出対象をカウントすることで,外乱の影響を抑制し,測定精度を向上させることができる。
【0030】
作用電極上に備えられたプローブとしては,検出対象を選択的に捕捉する能力を有した物質であればよい。そのような物質の一例としては,例えば生物学的親和性を有する,抗体・ウイルス認識部位・レセプター等が挙げられる。別の一例としては,静電気相互作用により検出対象と結合できる正または負に帯電した物質が挙げられる。別の一例としては、特定の官能基と配位結合や共有結合を作る官能基である、活性エステル基やチオール基、アミン基などが挙げられる。
【0031】
図3は,計測装置の別の概念図である。図3(A)に示すように、本測定装置は,測定部301と制御部311からなる。測定部301では,参照用溶液容器302内の参照用溶液がポンプ303によって流路304内を通り,測定セル307を経て廃液容器308に達する。流路304上にはバルブ306があり,シリンジ305によって試料溶液が流路中の測定溶液に注入される。
【0032】
図3(B)は測定セル307の詳細図であり,素子313に流路312が接している。素子313上の各作用電極はマルチプレクサ314の入力端子に接続されている。また,この例では,素子313上に対向電極315と参照電極316も載っており,同じく流路312に接している。マルチプレクサ314の出力端子と対向電極315及び参照電極316はポテンショスタット309に接続されている。マルチプレクサ314の役割は,素子313上の複数の作用電極のうち一つをポテンショスタット309と接続することである。ポテンショスタット309の役割は,素子313上の複数の作用電極のうち一つと対向電極315の間に電位差を印圧し,作用電極に発生した光子を受光素子310で検出することである。
【0033】
図4は,本発明による計測装置を用いた計測方法のフローチャートの一例である。図3と併せて説明する。まず,流路304にポンプ303を用いて参照用溶液容器302内の参照用溶液を流す。続いて,マルチプレクサ314により入力端子と出力端子の接続を切り替えながら,ポテンショスタット309と受光素子310で発光を測定し,それぞれの発光強度を記録する。これにより,素子313上の全ての作用電極について発光強度を測定する。
【0034】
次に,流路304に試料溶液を注入し,測定セル307内で反応させる。続いて,マルチプレクサ314により入力端子と出力端子の接続を切り替えながら,ポテンショスタット309と受光素子310で発光を測定し,それぞれの発光強度を記録する。試料溶液注入前に測定した発光強度と比較し,発光強度の変化が閾値よりも大きければカウンターをインクリメントする。これにより,素子313上の作用電極一つ一つについて検出対象の結合の有無を判定し,素子313上の全ての作用電極上に結合した検出対象の数を数える。最後に,カウンターの値,すなわち素子313上の全ての作用電極上に結合した検出対象の数を出力する。
【0035】
以上の例では,同一作用電極の発光強度変化を調べたが,参照用の作用電極群と検出用の作用電極群を同一又は別の素子上に用意して,参照用の作用電極群と検出用の作用電極群の発光強度の差を調べてもよい。比較においては、それぞれ同じ数の作用電極が同じ間隔で複数並んでいるものを用いて比較をしてもよいし、参照用とする作用電極を特定して、その特定された参照用作用電極と、検出用の作用電極群それぞれとの発光を比較するようにしてもよい。
【0036】
図5は,図3における測定セル307の別の構成例を示した俯瞰図である。溶液導入側の流路501が流路の切り替え可能な弁502に接続され,弁502は参照用流路503と検出用流路504に接続されている。参照用流路と検出用流路には複数の作用電極が面した素子507が接しており,各流路の先には再び流路の切り替え可能な弁505があり,溶液排出側の流路506に接続されている。これらの弁502,505により、参照用溶液は参照用流路503と検出用流路504両方に流れるようにし、測定試料については、検出用流路504のみに流れるようにすることができる。また、図5(A)のように、参照用流路503に面した素子507と検出用流路504に面した素子507で作用電極の配置を同じようにしてもよいし、図5(B)のように、参照用流路503の作用電極は少なくして代表的な値をとるようにしてもよい。さらに、図5(C)(D)のように、素子507を別々に設けるようにしてもよい。
【0037】
図6は,本発明による計測装置を用いた計測方法のフローチャートの一例である。図3及び図5と併せて説明する。まず、測定セル307内の流路501に参照用溶液を流す。ここで参照用溶液は、参照用流路503と検出用流路504を通って流路506に抜けるように流される。続いて切り替え弁502を検出用流路側に切り替えて検出用流路504にシリンジ305とポンプ303を用いて試料溶液を流し、検出用流路504内で反応させる。マルチプレクサ314により入力端子と出力端子の接続を切り替えながら,ポテンショスタット309と受光素子310で発光を測定し,それぞれの発光強度を記録する。これにより,素子507上の全ての作用電極について発光強度を測定する。参照用流路内の作用電極の発光強度と検出用流路内の発光強度を比較し,発光強度の差が閾値よりも大きければカウンターをインクリメントする。これにより,素子507上の検出用流路内の作用電極一つ一つについて検出対象の結合の有無を判定し,素子507の検出用流路内の全ての作用電極上に結合した検出対象の数を数える。最後に,カウンターの値,すなわち素子507上の全ての作用電極上に結合した検出対象の数を出力する。尚、ここでは参照用溶液を先に流路内に充填しているが、血液・唾液・尿等の生体試料そのものを参照用溶液で希釈したものを試料溶液として採用すれば、検出用流路に参照用溶液を充填させる工程を省くことができる。また、ここでは参照用流路503と検出用流路504とが流路501とから分岐するようにしているが、図5(E)(F)、図5(G)(H)のように、はじめから流路を分けておいてもよい。この場合、参照用流路での発光の計測と検出用流路での発光の計測とを並列して行うことができ、測定時間の短縮をすることができる。
【0038】
図2,図4,図6の測定フローにおいて,容器又は流路に入れる参照用溶液,試料溶液の量は予め決めた一定量にしておくことが望ましい。このようにすることで,複数の試料溶液間で検出対象濃度を比較したり,検出対象濃度の絶対値を求めたりすることができる。試料溶液の検出対象濃度が高いと,作用電極のほぼ全てに結合してしまうことがある。その場合,濃度を正しく見積もることができないため,試料溶液量を減らしたり,希釈したりすることで正しく計測することができるようになる。尚,発光強度の変化の変わりに電極に流れる電流値の変化を調べてもよい。
【0039】
試料溶液の計測後,使用した素子を迅速に新規な素子へと交換するためには,素子を1つのチップとしチップ単位で交換できるのが望ましい。この際,回路の配線の利便性を高めるために素子とマルチプレクサを組み合わせて1つのチップとすることも考えられる。このように素子を1つのチップとすれば,交換の迅速化が図れるだけでなく,例えば様々な種類のプローブが作用電極に備えられた素子を準備すれば,チップを交換するだけで多項目を計測することが可能となる。
以上の例では,マルチプレクサにより受光素子と素子上の複数の作用電極をその都度1対1対応させて発光の計測を1つ1つ行ったが,CCDやフォトダイオードアレイのような複数の受光素子を有するものを用いて,複数の発光を同時に計測してもよい。例えば,受光素子として光電子増倍管を用いた場合,受光素子が1個のみであり各作用電極1個に対して逐次的に処理を行うため,全処理時間は(作用電極数)×(作用電極1個当たりの全処理時間)となる。例えば,受光素子としてCCDやフォトダイオードアレイを用いた場合,受光素子が複数備わっているため,各受光素子に対応させた複数の作用電極を同時に光子を発生させて計測すれば、全処理時間は(受光素子1個当たりに対応した作用電極数)×(1回当たりの全処理時間)となる。したがって,作用電極数と処理時間がトレードオフの関係となっているため,場合に応じて全処理時間が短くなるように受光素子を選べばよい。
【0040】
また,発光強度変化又は発光強度の差の閾値を用いて作用電極上の検出対象の有無を判定する例を述べたが,時系列の変化を用いても検出対象を高精度に検出することができる。例えば,図12のようにある1つの作用電極の発光強度を時系列順に並べることで,作用電極上にある物質が捕捉されていた時間を求めることができる。作用電極上に備えられたプローブは検出対象と特異的に結合するため,夾雑物が吸着によって捕捉されてしまった場合よりも,検出対象が捕捉されている時間は長い。したがって,物質の捕捉時間から,捕捉されていた物質が検出対象か夾雑物かを判定することで,判定の精度を向上させることができる。
【0041】
ビーズやリポソームを標識として用いれば,本手法はタンパク質などを検出にも有効である。作用電極上に固定化するプローブ、ビーズやリポソームに固定化する別のプローブとして,検出対象に結合するようなものを選択する。このようにすれば,検出対象を介して作用電極上にビーズやリポソームが固定化されるため,作用電極よりも小さな物質も検出することができる。検出対象を1個単位でカウントすることはできないが,標識の非特異的吸着が抑えられる点や溶液中に遊離している標識が信号として検出されにくいため,いわゆるホモジニアスアッセイが可能となる。
【0042】
以下,素子について説明を行う。図7〜図10は本発明による素子の一例を示した図である。図7は前記素子の一部分の俯瞰図である。基板701上に複数の作用電極702が備えられていて,個々の作用電極702には配線703が接続されている。作用電極は図1のように基板に埋め込まれていると,検出対象物が結合するのに障害が少なくてよい。図8は図7の作用電極の断面図を示している。基板801には作用電極802が備えられていて,作用電極802には配線803が接続されている。
【0043】
図9は,図8の作用電極にプローブが備えられた場合の概念図を示している。基板901には作用電極902が備えられていて,作用電極902には配線903が接続され,作用電極902上にはプローブ904が備えられている。プローブ904は,検出対象を選択的に捕捉できる能力を有する物質,例えば抗体やレセプター,ウイルス認識部位,正または負に帯電した物質等が望ましい。プローブ904の作用電極902上への固定化は,物理的吸着でも化学的結合でもよい。また,同一種類のプローブをこの複数の電極上に載せるようにしてもよいが,測定条件によっては異なる種類のプローブを,固定化する範囲を決めて,もしくは混在させて電極上に固定化してもよい。基板901の部分には夾雑物の非特異的吸着による検出の誤判定を抑制するために,非特異的吸着を抑制する物質,例えばポリエチレングリコール等が修飾されていることが望ましい。
【0044】
図10は図9のプローブが備えられた作用電極上に検出対象が結合した場合の概念図を示している。基板1001には作用電極1002が備えられていて,作用電極1002には配線1003が接続され,作用電極1002上にはプローブ1004が備えら,プローブ1004に検出対象1005が1個結合している。上記基板にはSiO2,Si3N4などの絶縁物を用いる。作用電極には金,白金,銀,銅やカーボンを用いることが望ましいが,求められる耐久性に応じて,チタン,アルミニウム,クロムなどを用いることもできる。配線には導電体を用いる。作用電極と配線の接続は,例えば半導体製造プロセスを用いて,配線の形成後に作用電極を形成するなどすればよい。尚,配線の径は図7のように作用電極の径より小さい必要はなく,例えば,作用電極と配線が同じ径であったり(図11(A)),作用電極の径よりも配線が太かったりしてもよく(図11(B)),基板表面に露出している部分の検出対象との結合により,本発明の効果は得られる。作用電極の大きさとしては,検出対象と対となる大きさであればよい。そして、作用電極の直径を検出対象の直径のおよそ2倍以下とすることで,作用電極に2つ以上の検出対象が結合するのを防ぐことができる。一方,作用電極の直径を検出対象の直径の2分の1以上とすることで,検出対象よりも小さな物質が非特異的に作用電極に結合した際に生じる発光変化を小さくし,検出対象に対する選択性を向上させた。
【0045】
検出対象はウイルス・細菌・細胞などである。ウイルス・細菌・細胞のおおよその大きさを表1に示す。
【0046】
【表1】

【0047】
これより,作用電極の大きさとしては,検出対象に合わせて,ウイルスの場合には5〜200nm程度,細菌の場合には150nm〜16μm程度,細胞の場合には5〜20μm程度となる。
【0048】
図13〜22は,素子に備わっている作用電極の別の例を示す概念図である。基板1301には1段掘り下げられた部位があり,掘り下げられた部位の底面部に作用電極1302が備えられている。作用電極1303には配線1303が接続されていて,作用電極1302の周囲に壁1304が存在している。図14は図13の作用電極にプローブが固定化された状態を,図15は図14のプローブに検出対象物が結合している状態を示している。図16は図13の壁が作用電極の一部にせり出した形状を示している。このように壁が作用電極の一部を覆っている場合,本実施例においては作用電極が露出した部分が実効的な作用電極であるとみなせる。したがって,作用電極全体の大きさを小さくすることなく,壁の開口部の大きさで作用電極の実効的な大きさを制御することができるようになるため,製造工程の一部を共通化することが可能となる。また,作用電極の大きさを小さくすることが困難な場合にも有効である。図17は,壁が作用電極近傍にのみ存在している形状の例を示している。図18は,作用電極が凹型の形状である例を示している。図19は図18の凹型作用電極にプローブが固定化された形状を,図20は図19のプローブに検出対象物が結合している状態を示している。ここで,検出対象物が1つだけ結合できることを保証するためには,壁の開口径は検出対象物の2倍以下であるとことが望ましい。
【0049】
図21,図22は図13,図18の別の形態である。図21のように壁がテーパー状であっても図13で得られた壁による拡散阻害の効果は得られる。また,図22のように作用電極が丸く凹んでいても,図18で得られた凹型電極の効果は得られる。
【0050】
以下,それぞれの構成をとった場合の効果について説明する。
【0051】
図23は図9の状態から図10の状態へ変化したときの,作用電極の大きさと発光強度の変化率の関係を,有限要素法を用いて数値解析的に求めた結果を示している。作用電極を直径0.2,1,2,5,10,25,50,100μmの円板とし,検出対象を作用電極と同じ直径の球体とし,作用電極と検出対象は接触状態にあるとした。発光系には電気化学発光を用いて,電気化学発光の典型的な条件として,トリス(2,2'-ビピリジル)ルテニウム(Ru(bpy)32+)5mM(拡散係数590μm2/s),トリプロピルアミン100mM,印加電圧1.2V(電極反応の反応速度10000μm/s)を採用し,定常状態時における発光強度を計算し,作用電極表面上における検出対象の有無による発光強度の変化量を求めた。図23に示すように,作用電極表面上に検出対象が有る事によって発光強度は減少し,その減少率は作用電極の直径によらずほぼ一定値であった。
【0052】
図24は,図13のような作用電極の周囲の壁の高さを変えていった場合の,作用電極表面上における検出対象の有無による発光強度の変化量の違いを示している。発光系には図23と同じものを採用した。作用電極を直径0.2,1,2,10,20μmの円板とし,検出対象を作用電極と同じ直径の球体とし,作用電極と検出対象は接触状態にあるとした。壁の開口径は作用電極と同じとし,壁の高さを検出対象の半径に対して,1/4,1/2,3/4と変化させていった時の作用電極表面上における検出対象の有無による発光強度の変化量を,図23の時と同様に有限要素法により数値解析的に求めた。図24より,壁の高さが増加するほど発光強度の減少率は増加していった。これは壁の高さが増加することにより,作用電極表面への酸化還元を起こす試薬の供給が阻害されるためと考えられる。このように,各作用電極の周囲に壁を設けることによって,作用電極近傍における検出対象の有無による発光強度の変化量を増大させることができる。
【0053】
図25は作用電極の直径に対して検出対象の直径の比が変化していった時の,作用電極表面上における検出対象の有無による発光強度の変化量の違いを示している。発光系には図23と同じものを採用した。作用電極を直径0.2,1,2,10,20μmの円板とし,検出対象を球体とし,その直径を作用電極の直径の1,2,5倍と変化させていった時の作用電極表面上における検出対象の有無による発光強度の変化量を,図23の時と同様に有限要素法により数値解析的に求めた。図25より作用電極に対する検出対象の大きさが大きいほど,発光強度の減少率は大きくなった。これは検出対象の大きさが増加したことにより,作用電極表面への酸化還元反応を起こす試薬の供給が阻害されるためと考えられる。したがって,作用電極の直径を検出対象の直径よりも小さくすれば,判定の閾値を高く設定することができるため,排除体積効果による選択性向上の効果と合わせて選択性をより向上させることができる。また,検出の有無を判定する際に単純な閾値でなく,予め得ている作用電極と検出対象の大きさの情報から計算される発光強度の減少率の上限と下限を定め,その範囲内に実測値が入れば検出対象を有りと判定する方法もある。このように判定範囲を定めることにより,稀に非特異的に作用電極に吸着してしまった検出対象物より大きな異物による誤判定を抑制することができる。
【0054】
以下,図23〜25で示した現象を説明する。ここでは発光系として電気化学発光に着目するが,他の酸化還元反応を介した発光系でも同様の議論が通用する。図26に電気化学発光における典型的な反応経路を示す。Aは電気化学発光試薬を,Cは電気化学発光反応における触媒を,Pは光子を表す。電気化学発光は電気化学発光試薬が作用電極から電気エネルギーを受け取って励起され,基底状態に戻る過程でエネルギーを光子として放出することで発生する。一般に電気化学反応の一連の反応の中で,電極から電子を受け取る反応(電極反応)の速度が最も遅いため,電気化学反応は電極反応律速となる(図26においては(1)が電極反応)。
【0055】
また,図26の反応経路からもわかる通り,電気化学発光強度は電極反応における電気化学発光試薬の濃度の時間変化,すなわち電流値に依存し,定常状態においては電流値に比例する。したがって,電気化学発光強度の挙動を調べることは電極反応における電流値の挙動を調べることと同値である。ここでは触媒を介した電気化学反応を例示したが,触媒を介さない電気化学発光反応(例えば,アニオンとカチオンによるアニヒレーションを経由する反応)においても同様の議論が通用する。電気化学発光試薬の濃度をC,電極反応の速度をk,電気化学発光試薬の拡散係数をDとすると,定常状態における電極反応は数1で表される。
【0056】
【数1】

【0057】
いま系の挙動を支配する独立変数はC(mol/m3),k(m/s),D(m2/s)に加え,電極半径d(m)の4つであるから,バッキンガムのπ定理より電極反応の挙動の指標となる無次元数πはπ=(D/k)/dと導出できる。この無次元数πは定性的には次のように理解される。(D/k)は長さの次元を持ち,電極反応で電気化学試薬が消費される速度に対する電気化学発光試薬の供給速度がどれほど大きいかを表す。したがって(D/k)に対してdで比を取って規格化すれば,ある条件下において電極反応が電極反応速度律速であるか拡散供給律速であるかを無次元数πから評価することができる。
【0058】
図27に,図9の状態から図10の状態へ変化したときの発光強度の変化率を無次元数πを用いて表した図を示す。無次元数πが十分大きい時は拡散速度が十分速いため,電極表面に電気化学発光試薬が十分行渡り電極表面上の検出対象の有無によって電流値は変化しない。一方,無次元数πが十分小さい時は反応速度が十分速いため,電極表面に検出対象が有ると電気化学発光試薬が作用電極と検出対象の間の隙間に到達する前に消費されるため,電流値は減少する。この減少率は検出対象による排除体積効果なので無次元数が十分小さい領域では一定値をとる。図23,図25において,減少率が電極の直径に依らずほぼ一定であったのは無次元数πの値が拡散供給律速領域の0.001〜0.5の範囲にあったためである。以上の議論から,電極表面上の検出対象の存在によって発光強度が減少した理由の一つとしては,検出対象による酸化還元反応を起こす試薬の拡散阻害によるものであると考えられる。
【0059】
検出対象の有無の判定精度を考えた時,減少率の閾値としては大きいほど望ましい。図13〜17に示した壁を設けた電極の場合,図24で示したように壁により検出対象が有ることによる拡散阻害の効果が増幅されるため,減少率の閾値を平板電極よりも高く設定することができ,検出の判定精度を向上させることができる。
【0060】
発光強度の測定を考えた時,発光強度の絶対値は大きいほど測定が容易となるため,発光強度の絶対値は大きい方が望ましい。図18〜20に示した凹型電極の場合,図13〜17の壁による減少率の増幅効果に加えて,電極面積が平板電極よりも大きくなるため発光強度の絶対値も大きくなり,測定をより容易にすることができる。
【0061】
また、対向電極を作用電極に近づけることでも発光強度の絶対値を大きくすることができる。例えば,対向電極を作用電極の真上に平行に配置し,対向電極と作用電極の間隔を小さくしていけば,電流値が増大し発光強度も増大する。対向電極で光量を損失させないためには,発光に対して透明な電極材料がよく、例えば酸化インジウムスズ(ITO)電極等が望ましい。壁や凹型電極には検出対象に対する選択性を向上させる効果もある。平板電極では,検出対象よりも大きい物質が電極表面に非特異的に吸着した場合,検出対象と同様の発光強度の変化をもたらし,検出の誤判定を引き起こす可能性がある。しかし,壁を設けた電極や凹型電極では,壁や凹型電極の開口径よりも大きい物質が電極表面に接近することができず,検出対象に対する選択性を向上することができる。
【0062】
検出対象物を高効率で検出するためには,結合確率を増加させるために作用電極数は多いほど望ましい。また,高濃度域の検出対象物を検出するためにも作用電極数は多いほど良い。素子全体の大きさを一定にしつつ作用電極数を増大するためには,作用電極の高集積化すなわち図28のような各作用電極の間隔の微小化をする必要がある。しかし,この作用電極間隔が光学顕微鏡の分解能以下の大きさになると,素子上の各作用電極を同時に発光させて受光素子で検出する手法や従来の光学顕微鏡では,隣接した各作用電極を区別することができなくなってしまう。したがって,作用電極の高集積化と検出の高効率化及び検出対象物の検出上限にはトレードオフの関係がある。
【0063】
マルチプレクサを用いて各作用電極を1個ずつ発光させて検出する手法は,このトレードオフを解決する手法である。このように、例えば各作用電極に1個ずつ電圧を印加し,印加した時間と受光素子で計測を行う時間を同期させることにより,各作用電極の発光を1個観察でき,作用電極間隔が光の波長以下であっても隣接した各作用電極を区別することが可能となる。この手法と光学顕微鏡の分解能以下の電極間隔を組み合わせることにより,検出の高効率化及び高濃度域の検出対象物の検出が可能となる。
【0064】
また,この手法と光学顕微鏡の分解能以下の電極間隔の組み合わせには,光学顕微鏡の位置分解能以下の位置情報を取得できるという効果もある。光学顕微鏡の位置分解能は光の波長の半分程度(0.3〜0.5μm)であるため,この波長以下の電極間隔を有する素子とこの手法を用いれば,発光した光の波長以下の位置情報を取得することができる。例えば,100nm程度の大きさの作用電極と100nm程度の大きさの電極間隔を有する電極アレイを用いて,扁平な細胞を検出対象とすれば,100nm程度の位置分解能を持って細胞の表面形状を取得することが可能となる。
【0065】
1つの素子上に異種抗体を2種類以上固定化した素子を用いて検出対象の検出を行うことで,同時に複数種の検出対象を検出することが可能となる。例えば,A型インフルエンザウイルスに対する抗体を固定化した直径100nmの作用電極とB型インフルエンザウイルスに対する抗体を固定化した直径100nmの作用電極をそれぞれ10000個程度有する作用電極群をそれぞれの抗体毎に例えば領域を分けて設けた素子を用いて,インフルエンザウイルスの罹患が疑われる患者の検体を測定すれば,ウイルスの罹患と型の判定を同時に行うことができる。尚,検出対象はウイルスのみに限らず細菌・細胞でも同様の効果が得られる。
【0066】
図29は作用電極の大きさと作用電極上に結合された検出対象の有無による発光強度の変化率を示している。作用電極として10,25,100μmの直径を持つ金電極を,電気化学発光試薬としてトリス(2,2'-ビピリジル)ルテニウム(Ru(bpy)32+)5mM,トリプロピルアミン100mMリン酸バッファー溶液を用いた。対向電極として白金電極を,参照電極として飽和塩化カリウム銀塩化銀電極を用いて,印加電圧1.2Vの条件で電気化学発光を起こした。検出対象のモデルとしては,作用電極とほぼ同じサイズのポリスチレンビーズを用いた。電圧印加後5秒経過してから受光素子による計測を開始し,受光開始後2秒経過してから電圧印加と計測を終了した。その結果,図29に示したように発光強度の変化率の実測値(黒丸)は有限要素法による計算値(白丸)と良く一致した。したがって,有限要素法による数値解析が実際の測定を良く再現できていることがわかる。
【0067】
16個の直径300nmの金電極が電極間隔300nmで図30のように配置されている素子を用いて,300nmのビーズを検出対象として実験を行った。各作用電極には便宜的に1〜16の番号をつけた。金電極表面にはビオチンを化学結合により固定し,ビーズ表面にはストレプトアビジンを化学結合により固定した。このビーズを500個程度含んだ1 μLの検体を素子の上に滴下し,10分間反応させてビーズを金電極の表面に捕捉させた。その後,リン酸バッファー溶液により洗浄を行い,リン酸バッファー中で光学顕微鏡による蛍光観察を,電気化学発光試薬を含む溶液中で電気化学発光を計測した。電気化学発光試薬としてトリス(2,2'-ビピリジル)ルテニウム(Ru(bpy)32+)5mM,トリプロピルアミン100mMリン酸バッファー溶液を用いた。対向電極として白金電極を,参照電極として飽和塩化カリウム銀塩化銀電極を用いて,印加電圧1.2Vの条件で電気化学発光を起こした。
【0068】
各作用電極に電圧印加後1秒経過してから受光素子による計測を開始し,受光開始後2秒経過してから電圧印加と計測を終了する手法と、同様の操作を全ての作用電極に同時に行って計測する手法を用いた。ここでは、閾値を15%と定め、全作用電極に電圧を同時に印加させた結果,どの作用電極での発光かどうかの位置情報を得ることができず、ビーズが捕捉されているかどうか判断することはできなかった。一方,図2の手順で閾値を15%と定め、各作用電極に1個ずつ電圧を印加していった結果、個々の作用電極からの発光を区別することができた。
【0069】
個々の作用電極の発光強度の変化からビーズの有無を検出した結果,ビーズが捕捉されていると区別できるのは5個であった(電極番号で言えば,1,7,12,13,14を検出)。したがって,隣接する作用電極が光学顕微鏡の位置分解能以下の範囲に入っているために従来法では個々の作用電極が区別できないような条件下でも,各作用電極に電圧を印加する時間と受光素子で計測を開始する時間を同期させて計測することで個々の作用電極を区別することができた。
【符号の説明】
【0070】
101,301 測定部
102,313,507 素子
103 容器
104 溶液
105,315 対向電極
106,316 参照電極
107,314 マルチプレクサ
108,309 ポテンショスタット
109,310 受光素子
110,311 制御部
111 データ処理装置
112 演算装置
113 一時記憶装置
114 不揮発性記憶装置
115 データ表示装置
302 参照用溶液容器
303 ポンプ
304,312 流路
305 シリンジ
306 バルブ
307 測定セル
308 廃液容器
501 導入側流路
502 切り替え弁
503 参照用流路
504 検出用流路
505 切り替え弁
506 排出側流路
701,801,901,1001,1101,1301,1401,1501,1601,1701,1801,1901,2001,2101,2201,2801 基板
702,802,902,1002,1102,1302,1402,1502,1602,1702,1802,1902,2002,2102,2202,2802 作用電極
703,803,903,1003,1103,1303,1403,1503,1603,1703,1803,1903,2003,2103,2203,2803 配線
904,1004,1405,1505,1904,2004 固定化プローブ
1005,1506,2005 検出対象
1304,1404,1504,1604,1704,2104 壁
【技術分野】
【0001】
本発明は,電気的及び光学的な計測を行い,生体物質を高精度および高感度に計測することのできる計測装置,および計測方法に関する。
【背景技術】
【0002】
ウイルス・細菌等の生体物質を検出する方法として抗原抗体反応に代表される免疫学的手法が広く知られている。例えば,近年ウイルスや細菌に罹患しているかどうかの簡易検査を目的として,イムノクロマトグラフィーと微粒子凝集を基礎原理とした検出キットが広まっている(例えば,特許文献1)。これらのキットは,検体導入部,標識用抗体を保持する部,抗原検出用のテスト部から構成される。標識物質としては,凝集により発色する金属微粒子が用いられる。検体を導入すると検体と共に標識用抗体が展開され,検体内に検出対象物が存在するとテスト部において検出対象物を介して標識用抗体が結合する。この時,標識物質の凝集によってテスト部で発色が起こり,発色の有無から検体内の検出対象物の有無の判定を行う。操作が簡便かつ,実施時間が数分〜数十分と短時間であり,目視による判定が可能であることから簡易検査として適している。
【0003】
抗原抗体反応を利用した,より高感度な生体物質の検出手法としてはイムノアッセイが広く普及している。イムノアッセイは,大別して光学的な手法により検出が可能な標識用抗体を用いる手法と,標識物質を用いずに通常の固定化抗体と検出対象物の結合がもたらす環境変化を利用して検出を行う手法に分けることができる。前者にはEnzyme-Linked ImmunoSorbent Assay(ELISA)法(例えば,非特許文献1),Luminescent Oxygen Channeling Immunoassay(LOCI)法(例えば,特許文献2)等が含まれる。一方,後者にはラテックス凝集法(例えば,特許文献3),表面プラズモン共鳴(SPR)(例えば,特許文献4),水晶発振子マイクロバランス法(QCM)(例えば,特許文献5),キャパシタンス測定(例えば,非特許文献2),インピーダンス測定(例えば,特許文献6),界面電位測定(例えば,非特許文献3)等が含まれる。
【0004】
ELISA法では,抗体を固定化した基板に検出対象物と標識用抗体を注入,一定時間反応後に洗浄を行って遊離している標識用抗体を除去する。その後,基板表面に残留した標識酵素と基質を反応させ,反応生成物量を光学的に測定し,検出対象物濃度を求める。LOCI法では,検出対象物の異なる部位を認識する別々の抗体を各々に固定化した微粒子A,Bを用いる。検出対象物と微粒子A,Bを混合すると,検出対象物を介して微粒子A,Bが結合する。微粒子A,Bに固定化された抗体にはごく近傍に存在する場合にのみ発光を生じる標識物質が修飾されているため,検出対象物と結合していない微粒子を除去することなく,検出対象物濃度を求めることができる。
【0005】
ラテックス凝集法では,抗体が固定化されたラテックス微粒子の分散液中に検出対象物を注入すると,検出対象物を起点としてラテックス微粒子が凝集クラスターに成長した時の光学的特性(吸光極大波長,透過光強度,散乱光強度)の変化を測定する。SPR・QCM・キャパシタンス測定・インピーダンス測定・界面電位測定は,どれもセンサ表面に固定化された抗体に検出対象物が結合した時の表面のある物理量の変化を検出している。SPRは誘電率の変化によるプラズマ共鳴角の変化を,QCMは質量の変化による共鳴振動数の変化を,キャパシタンス測定・インピーダンス測定・界面電位測定はそれぞれキャパシタンス・インピーダンス・界面電位の変化を検出している。
【0006】
また,生体分子を1個検出することを目的として,蛍光標識と顕微鏡を組み合わせた1分子イメージングという技術が近年急速に発達している(例えば,非特許文献4)。1分子イメージングでは高感度測定を行うために,染み出し深さが光の波長の半分程度であるエバネッセント光を用いて,バックグラウンド信号を低減し,1分子を検出している。
【0007】
別の生体分子の1個検出を目指した手法として,微小電極を複数配置した電極及び電界効果型トランジスタ(FET),電荷結合素子(CCD)を組み合わせて生体物質を1個検出する手法が報告されている(例えば,特許文献7)。この手法では電極表面に固定化された抗体に検出対象物が結合したことによる電荷の変化を検出し,この時の電荷の変化量がある閾値を超えたときに生体物質が1個有ると判定を行うことで生体物質の検出を行っている。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】特開平1-32169
【特許文献2】EP0515194A
【特許文献3】US4250394
【特許文献4】US4997278
【特許文献5】US6006589
【特許文献6】US7192752
【特許文献7】US7022287
【非特許文献】
【0009】
【非特許文献1】Immunochemistry, 1971, 8, 871-874.
【非特許文献2】Anal. Chem., 1997, 69, 3651-3657.
【非特許文献3】Analyst, 2002, 127, 1137-151.
【非特許文献4】Nature, 1996, 380, 451-453.
【発明の概要】
【発明が解決しようとする課題】
【0010】
従来技術ではウイルス・細菌・細胞を1個単位で定量することはできなかった。
微粒子凝集を用いたイムノクロマトグラフィーやラテックス凝集法では複数の微粒子が凝集した時に初めて光学的特性の変化が発生する。したがって,原理的に生体物質の1個単位測定は困難であった。
【0011】
従来のイムノアッセイではバックグラウンド信号の影響により1個単位で検出することは困難であった。例えば,標識用抗体を用いたELISA法では洗浄工程により除去しきれなかった標識用抗体がバックグラウンド信号を発生させる。これはLOCI法についても同様である。一方,生体物質の結合によるセンサ表面の物理量変化を検出する手法(SPR,QCM,キャパシタンス測定,インピーダンス測定,界面電位測定)にとっては,検出対象物以外の物質(夾雑物)の非特異的吸着がバックグラウンド信号源となる。これらの手法は予め実験的に定めた検出対象物の濃度とシグナル信号値との相関関係から検出対象物の濃度を求めているが,検出対象物の濃度が微小になるとシグナル信号値に対するバックグラウンド信号値の比が無視できなくなるほど大きくなるため,1個単位での検出が困難であった。複数の微小電極と電荷変化を組み合わせた手法においても,電荷変化をもたらす異物の吸着がバックグラウンド信号となることから,同様の課題があると言える。
【0012】
1分子イメージングでは生体物質1個単位での検出は可能であるが,光の波長以下の位置分解能を持たず光の波長以下の集積化が困難である。また、照明領域が非常に小さいため,基板全域を走査するには長時間を必要とする。以上の理由から、1分子イメージングでは数千〜数万の生体物質の定量は困難である。また、得られる情報にはサイズ情報が含まれていないため、サイズ選択性をもたすことができない。
【0013】
本発明では,生体物質を1個単位で計測し,定量する計測装置および計測方法を提供する。
【課題を解決するための手段】
【0014】
本発明の代表的な形態としては、基板と、基板の表面に設けられた複数の作用電極と、複数の電極のそれぞれと接続され基板の表面と反対側に設けられた配線と、作用電極上に測定対象を捕捉するプローブとを有するアレイと、酸化還元反応により発光する試薬を含む参照溶液を当該アレイ上に接触させる溶液接触手段と、参照溶液に接触するように設けられた対向電極と、配線のそれぞれの接続を制御して、作用電極と対向電極との間の電圧を制御する電圧制御手段と、アレイからの光を検出する光検出器と、溶液接触手段により試料溶液を接触させ、光検出器により検出される光強度の測定に基づいて、プローブに捕捉された測定対象の有無を測定する計算部と、を有する計測装置である。
【0015】
また、計測方法としては、上記したアレイ上に参照溶液を導入する工程と、アレイ上に試料溶液を導入する工程と、複数の作用電極のそれぞれの電気的接続を制御する工程と、接続された作用電極と参照溶液と接触した対向電極との間の電圧印加を制御する工程と、アレイからの光を光検出器により検出する工程と、参照溶液を導入したアレイについて、試料溶液を導入した場合と導入しない場合における光強度の測定に基づいて、プローブに捕捉された測定対象の有無を測定する工程とを有する。
【0016】
そして、複数の作用電極それぞれについて、捕捉された測定対象の数をカウントして、試料中の測定対象の数を測定して定量する。
【0017】
捕捉された測定対象の有無の検出としては、参照溶液を導入したアレイについて、試料溶液を導入してからの光強度の変化が閾値を超えるかどうかの判定をする方法や、参照溶液を導入したアレイについて、試料溶液を導入した場合と導入しない場合の光強度の差が閾値を超えるかどうかを判定をする方法を用いることができる。
【0018】
また、作用電極への電圧印加の開始時間と受光素子での計測開始時間を同期させて計測するようにしてもよい。
【発明の効果】
【0019】
上記構成により、発光強度の測定により検出対象物の1個単位の有無を判定することができる。そして、従来問題となっていたバックグラウンド信号が測定値に与える影響を抑制することができる。また,検出対象物の有無を判定することで従来同様に問題となっていた検出対象の個体差に起因する信号変化のバラツキの影響も抑制することができる。さらに,検出対象が有ると判定した電極の数を総和することで,検体中の検出対象の量を求めることが可能となる。これにより,標識物質を使用することなく検出対象を定量することができる。加えて、作用電極への電圧印加の開始時間と受光素子での計測開始時間を同期させて計測することにより、隣接する複数の作用電極間の間隔が光学顕微鏡の位置分解能以下であっても個々の作用電極を区別することができる。
【0020】
以上より,前記のように各作用電極についてバックグラウンド信号や個体差のバラツキを除去できるため,従来よりも高精度・高感度な測定が可能となる。
【図面の簡単な説明】
【0021】
【図1】計測装置の一例を示す概念図。
【図2】計測方法のフローチャートの一例。
【図3】計測装置の一例を示す概念図。
【図4】計測方法のフローチャートの一例。
【図5(A)(B)】図3の測定セルの一例を示す概念図。
【図5(C)(D)】図3の測定セルの一例を示す概念図。
【図5(E)(F)】図3の測定セルの一例を示す概念図。
【図5(G)(H)】図3の測定セルの一例を示す概念図。
【図6】計測方法のフローチャートの一例。
【図7】素子の一例を示す俯瞰図
【図8】素子の一例を示す断面図
【図9】作用電極にプローブを固定化した場合の概念図。
【図10】作用電極に検出対象が結合した場合の概念図。
【図11】素子の一例を示す断面図。
【図12】ある作用電極の発光強度を時系列順に並べた図
【図13】素子に用いる作用電極の一例を示す断面図。
【図14】素子に用いる作用電極の一例において,作用電極にプローブを固定化した場合の概念図。
【図15】素子に用いる作用電極の一例において,作用電極に検出対象が結合した場合の概念図。
【図16】素子に用いる作用電極の一例を示す断面図。
【図17】素子に用いる作用電極の一例を示す断面図。
【図18】素子に用いる作用電極の一例を示す断面図。
【図19】素子に用いる作用電極の一例において,作用電極にプローブを固定化した場合の概念図。
【図20】素子に用いる作用電極の一例において,作用電極に検出対象が結合した場合の概念図。
【図21】素子に用いる作用電極の一例を示す断面図。
【図22】素子に用いる作用電極の一例を示す断面図。
【図23】作用電極の直径と検出対象の結合による発光強度減少率の関係を示す図。
【図24】作用電極の周囲の壁の高さを変化させた時の,作用電極の直径と検出対象の結合による発光強度減少率の関係を示す図。
【図25】作用電極の直径と検出対象の直径の比を変化させた時の,作用電極の直径と検出対象の結合による発光強度減少率の関係を示す図。
【図26】典型的な電気化学発光の反応経路を示す図。
【図27】典型的な電気化学発光における無次元数πと検出対象の結合による発光強度減少率の関係を示す図。
【図28】隣接する作用電極間隔が光の波長分解能以下であるような素子の一例を示す概念図。
【図29】実験と計算でそれぞれ求めた作用電極の直径と検出対象の結合による発光強度減少率の関係を示す図。
【図30】実験で用いた16個の作用電極を有する素子の俯瞰図。
【発明を実施するための形態】
【0022】
以下,図面を参照して本発明の実施の形態を説明する。
【0023】
図1は,素子とそれを用いた計測装置の概念図である。本計測装置は,計測部101と制御部110から構成される。素子102上に形成された容器103中には参照用溶液104が入れられる。参照用溶液104は酸化還元反応を起こす試薬を含んでいる。この酸化還元反応を起こす試薬は、電気的エネルギーにより発光するような試薬を用いる。参照用溶液104中には対向電極105と参照電極106が配置されている。素子の各作用電極はそれぞれマルチプレクサ107の入力端子に接続されている。素子についての詳細は後述する。対向電極105とマルチプレクサ107の出力端子はポテンショスタット108に接続されている。ポテンショスタット108と受光素子109は制御部110と接続されている。マルチプレクサ107の役割は,素子102上の複数の作用電極のうち少なくとも1つをポテンショスタット108と接続することである。ポテンショスタット108の役割は,素子102上の複数の作用電極のうち少なくとも1つと対向電極105の間に電位差を印圧し,作用電極上に発生した光子を受光素子109で検出することである。制御部110としては,例えば図1に示したようなパーソナルコンピュータ(PC)を用いることができる。PCは,データ処理装置111,データ表示装置115を有し,データ処理装置111は,例えば演算装置112,一時記憶装置113,不揮発性記憶装置114を有している。
【0024】
図2は,計測方法のフローチャートの一例である。図1と併せて説明する。まず,容器103に参照用溶液104を注入する。続いて,マルチプレクサ107により入力端子と出力端子の接続を切り替えながら,ポテンショスタット108と受光素子109で各作用電極上の発光を測定し,それぞれの発光強度を記録する。これにより,素子102上の全ての作用電極について発光強度を測定する。
【0025】
次に,容器103に試料溶液を注入する。試料溶液は、例えば被検者の血液・唾液・尿等の生体試料やそれらを調整して得られた溶液などをいう。試料溶液中の検出対象が素子102の作用電極上に固定化されたプローブに結合するまで,一定時間待機する。続いて,マルチプレクサ107により入力端子と出力端子の接続を切り替えながら,ポテンショスタット108と受光素子109で発光強度を測定し,それぞれの発光強度を記録する。試料溶液注入前に測定した発光強度と比較し,発光強度の変化が閾値よりも大きければカウンターをインクリメントする。これにより,素子102上の作用電極一つ一つについて検出対象の結合の有無を判定し,素子102上の全ての作用電極上に結合した検出対象の数を数える。最後に,カウンターの値,すなわち素子102上の全ての作用電極上に結合した検出対象の数を出力する。
【0026】
作用電極上に光子を発生させる手段としては,酸化還元反応を起こす試薬に作用電極から電気的エネルギーを受け渡す手段を用いればよい。そのような手段の一例としては,電気化学発光が挙げられる。電気化学発光に必要な試薬としては,例えばトリ(ビピリジル)ルテニウムまたはその誘導体等がある。電気化学発光に必要な作用電極の材料としては例えば金,白金,グラッシーカーボン,ホウ素をドープしたダイヤモンド等がある。
【0027】
他の光子を発生させる手段としては、一重項酸素を用いた発光が挙げられる。一重項酸素は酸化力が非常に強く、例えばオレフィン化合物は酸化すると発光するという特徴を持っているため、一重項酸素とそのような物質を組み合わせれば発光系を構築することができる。一重項酸素を発生させるのに必要な電極としては半導体電極、例えば酸化チタン等がある。
【0028】
作用電極上に発生した光子を計測させる手順としては、各作用電極に電圧を印加する時間と受光素子で光子を計測する時間を同期させればよい。例えば、1つの作用電極に電圧を印加後、電流値が定常状態になった時刻から受光素子で計測を開始し、一定時間経過後、電圧印加と計測を終了し、また次の作用電極に同様の操作を繰り返していく手法がある。このように計測することで、各作用電極での発光を電極1個単位で確実に計測でき、かつ電極表面に検出対象物が捕捉されている場合、安定した発光強度の変化を計測することができる。
【0029】
閾値を用いて作用電極上の検出対象をカウントすることで,一つの作用電極で検出対象の量を測定する従来の方法と比べて,測定精度を向上させることができる。発光強度を変化させる要因として,検出対象の結合以外に,夾雑物の非特異的吸着,温度の変化などの外乱がある。一つの電極で検出対象の量を測定する従来の方法では,これら外乱が測定精度を低下させるが,閾値を用いて作用電極上の検出対象をカウントする場合,外乱が閾値よりも小さいときは外乱はカウント値に影響を及ぼさない。従って,閾値を用いて作用電極上の検出対象をカウントすることで,外乱の影響を抑制し,測定精度を向上させることができる。
【0030】
作用電極上に備えられたプローブとしては,検出対象を選択的に捕捉する能力を有した物質であればよい。そのような物質の一例としては,例えば生物学的親和性を有する,抗体・ウイルス認識部位・レセプター等が挙げられる。別の一例としては,静電気相互作用により検出対象と結合できる正または負に帯電した物質が挙げられる。別の一例としては、特定の官能基と配位結合や共有結合を作る官能基である、活性エステル基やチオール基、アミン基などが挙げられる。
【0031】
図3は,計測装置の別の概念図である。図3(A)に示すように、本測定装置は,測定部301と制御部311からなる。測定部301では,参照用溶液容器302内の参照用溶液がポンプ303によって流路304内を通り,測定セル307を経て廃液容器308に達する。流路304上にはバルブ306があり,シリンジ305によって試料溶液が流路中の測定溶液に注入される。
【0032】
図3(B)は測定セル307の詳細図であり,素子313に流路312が接している。素子313上の各作用電極はマルチプレクサ314の入力端子に接続されている。また,この例では,素子313上に対向電極315と参照電極316も載っており,同じく流路312に接している。マルチプレクサ314の出力端子と対向電極315及び参照電極316はポテンショスタット309に接続されている。マルチプレクサ314の役割は,素子313上の複数の作用電極のうち一つをポテンショスタット309と接続することである。ポテンショスタット309の役割は,素子313上の複数の作用電極のうち一つと対向電極315の間に電位差を印圧し,作用電極に発生した光子を受光素子310で検出することである。
【0033】
図4は,本発明による計測装置を用いた計測方法のフローチャートの一例である。図3と併せて説明する。まず,流路304にポンプ303を用いて参照用溶液容器302内の参照用溶液を流す。続いて,マルチプレクサ314により入力端子と出力端子の接続を切り替えながら,ポテンショスタット309と受光素子310で発光を測定し,それぞれの発光強度を記録する。これにより,素子313上の全ての作用電極について発光強度を測定する。
【0034】
次に,流路304に試料溶液を注入し,測定セル307内で反応させる。続いて,マルチプレクサ314により入力端子と出力端子の接続を切り替えながら,ポテンショスタット309と受光素子310で発光を測定し,それぞれの発光強度を記録する。試料溶液注入前に測定した発光強度と比較し,発光強度の変化が閾値よりも大きければカウンターをインクリメントする。これにより,素子313上の作用電極一つ一つについて検出対象の結合の有無を判定し,素子313上の全ての作用電極上に結合した検出対象の数を数える。最後に,カウンターの値,すなわち素子313上の全ての作用電極上に結合した検出対象の数を出力する。
【0035】
以上の例では,同一作用電極の発光強度変化を調べたが,参照用の作用電極群と検出用の作用電極群を同一又は別の素子上に用意して,参照用の作用電極群と検出用の作用電極群の発光強度の差を調べてもよい。比較においては、それぞれ同じ数の作用電極が同じ間隔で複数並んでいるものを用いて比較をしてもよいし、参照用とする作用電極を特定して、その特定された参照用作用電極と、検出用の作用電極群それぞれとの発光を比較するようにしてもよい。
【0036】
図5は,図3における測定セル307の別の構成例を示した俯瞰図である。溶液導入側の流路501が流路の切り替え可能な弁502に接続され,弁502は参照用流路503と検出用流路504に接続されている。参照用流路と検出用流路には複数の作用電極が面した素子507が接しており,各流路の先には再び流路の切り替え可能な弁505があり,溶液排出側の流路506に接続されている。これらの弁502,505により、参照用溶液は参照用流路503と検出用流路504両方に流れるようにし、測定試料については、検出用流路504のみに流れるようにすることができる。また、図5(A)のように、参照用流路503に面した素子507と検出用流路504に面した素子507で作用電極の配置を同じようにしてもよいし、図5(B)のように、参照用流路503の作用電極は少なくして代表的な値をとるようにしてもよい。さらに、図5(C)(D)のように、素子507を別々に設けるようにしてもよい。
【0037】
図6は,本発明による計測装置を用いた計測方法のフローチャートの一例である。図3及び図5と併せて説明する。まず、測定セル307内の流路501に参照用溶液を流す。ここで参照用溶液は、参照用流路503と検出用流路504を通って流路506に抜けるように流される。続いて切り替え弁502を検出用流路側に切り替えて検出用流路504にシリンジ305とポンプ303を用いて試料溶液を流し、検出用流路504内で反応させる。マルチプレクサ314により入力端子と出力端子の接続を切り替えながら,ポテンショスタット309と受光素子310で発光を測定し,それぞれの発光強度を記録する。これにより,素子507上の全ての作用電極について発光強度を測定する。参照用流路内の作用電極の発光強度と検出用流路内の発光強度を比較し,発光強度の差が閾値よりも大きければカウンターをインクリメントする。これにより,素子507上の検出用流路内の作用電極一つ一つについて検出対象の結合の有無を判定し,素子507の検出用流路内の全ての作用電極上に結合した検出対象の数を数える。最後に,カウンターの値,すなわち素子507上の全ての作用電極上に結合した検出対象の数を出力する。尚、ここでは参照用溶液を先に流路内に充填しているが、血液・唾液・尿等の生体試料そのものを参照用溶液で希釈したものを試料溶液として採用すれば、検出用流路に参照用溶液を充填させる工程を省くことができる。また、ここでは参照用流路503と検出用流路504とが流路501とから分岐するようにしているが、図5(E)(F)、図5(G)(H)のように、はじめから流路を分けておいてもよい。この場合、参照用流路での発光の計測と検出用流路での発光の計測とを並列して行うことができ、測定時間の短縮をすることができる。
【0038】
図2,図4,図6の測定フローにおいて,容器又は流路に入れる参照用溶液,試料溶液の量は予め決めた一定量にしておくことが望ましい。このようにすることで,複数の試料溶液間で検出対象濃度を比較したり,検出対象濃度の絶対値を求めたりすることができる。試料溶液の検出対象濃度が高いと,作用電極のほぼ全てに結合してしまうことがある。その場合,濃度を正しく見積もることができないため,試料溶液量を減らしたり,希釈したりすることで正しく計測することができるようになる。尚,発光強度の変化の変わりに電極に流れる電流値の変化を調べてもよい。
【0039】
試料溶液の計測後,使用した素子を迅速に新規な素子へと交換するためには,素子を1つのチップとしチップ単位で交換できるのが望ましい。この際,回路の配線の利便性を高めるために素子とマルチプレクサを組み合わせて1つのチップとすることも考えられる。このように素子を1つのチップとすれば,交換の迅速化が図れるだけでなく,例えば様々な種類のプローブが作用電極に備えられた素子を準備すれば,チップを交換するだけで多項目を計測することが可能となる。
以上の例では,マルチプレクサにより受光素子と素子上の複数の作用電極をその都度1対1対応させて発光の計測を1つ1つ行ったが,CCDやフォトダイオードアレイのような複数の受光素子を有するものを用いて,複数の発光を同時に計測してもよい。例えば,受光素子として光電子増倍管を用いた場合,受光素子が1個のみであり各作用電極1個に対して逐次的に処理を行うため,全処理時間は(作用電極数)×(作用電極1個当たりの全処理時間)となる。例えば,受光素子としてCCDやフォトダイオードアレイを用いた場合,受光素子が複数備わっているため,各受光素子に対応させた複数の作用電極を同時に光子を発生させて計測すれば、全処理時間は(受光素子1個当たりに対応した作用電極数)×(1回当たりの全処理時間)となる。したがって,作用電極数と処理時間がトレードオフの関係となっているため,場合に応じて全処理時間が短くなるように受光素子を選べばよい。
【0040】
また,発光強度変化又は発光強度の差の閾値を用いて作用電極上の検出対象の有無を判定する例を述べたが,時系列の変化を用いても検出対象を高精度に検出することができる。例えば,図12のようにある1つの作用電極の発光強度を時系列順に並べることで,作用電極上にある物質が捕捉されていた時間を求めることができる。作用電極上に備えられたプローブは検出対象と特異的に結合するため,夾雑物が吸着によって捕捉されてしまった場合よりも,検出対象が捕捉されている時間は長い。したがって,物質の捕捉時間から,捕捉されていた物質が検出対象か夾雑物かを判定することで,判定の精度を向上させることができる。
【0041】
ビーズやリポソームを標識として用いれば,本手法はタンパク質などを検出にも有効である。作用電極上に固定化するプローブ、ビーズやリポソームに固定化する別のプローブとして,検出対象に結合するようなものを選択する。このようにすれば,検出対象を介して作用電極上にビーズやリポソームが固定化されるため,作用電極よりも小さな物質も検出することができる。検出対象を1個単位でカウントすることはできないが,標識の非特異的吸着が抑えられる点や溶液中に遊離している標識が信号として検出されにくいため,いわゆるホモジニアスアッセイが可能となる。
【0042】
以下,素子について説明を行う。図7〜図10は本発明による素子の一例を示した図である。図7は前記素子の一部分の俯瞰図である。基板701上に複数の作用電極702が備えられていて,個々の作用電極702には配線703が接続されている。作用電極は図1のように基板に埋め込まれていると,検出対象物が結合するのに障害が少なくてよい。図8は図7の作用電極の断面図を示している。基板801には作用電極802が備えられていて,作用電極802には配線803が接続されている。
【0043】
図9は,図8の作用電極にプローブが備えられた場合の概念図を示している。基板901には作用電極902が備えられていて,作用電極902には配線903が接続され,作用電極902上にはプローブ904が備えられている。プローブ904は,検出対象を選択的に捕捉できる能力を有する物質,例えば抗体やレセプター,ウイルス認識部位,正または負に帯電した物質等が望ましい。プローブ904の作用電極902上への固定化は,物理的吸着でも化学的結合でもよい。また,同一種類のプローブをこの複数の電極上に載せるようにしてもよいが,測定条件によっては異なる種類のプローブを,固定化する範囲を決めて,もしくは混在させて電極上に固定化してもよい。基板901の部分には夾雑物の非特異的吸着による検出の誤判定を抑制するために,非特異的吸着を抑制する物質,例えばポリエチレングリコール等が修飾されていることが望ましい。
【0044】
図10は図9のプローブが備えられた作用電極上に検出対象が結合した場合の概念図を示している。基板1001には作用電極1002が備えられていて,作用電極1002には配線1003が接続され,作用電極1002上にはプローブ1004が備えら,プローブ1004に検出対象1005が1個結合している。上記基板にはSiO2,Si3N4などの絶縁物を用いる。作用電極には金,白金,銀,銅やカーボンを用いることが望ましいが,求められる耐久性に応じて,チタン,アルミニウム,クロムなどを用いることもできる。配線には導電体を用いる。作用電極と配線の接続は,例えば半導体製造プロセスを用いて,配線の形成後に作用電極を形成するなどすればよい。尚,配線の径は図7のように作用電極の径より小さい必要はなく,例えば,作用電極と配線が同じ径であったり(図11(A)),作用電極の径よりも配線が太かったりしてもよく(図11(B)),基板表面に露出している部分の検出対象との結合により,本発明の効果は得られる。作用電極の大きさとしては,検出対象と対となる大きさであればよい。そして、作用電極の直径を検出対象の直径のおよそ2倍以下とすることで,作用電極に2つ以上の検出対象が結合するのを防ぐことができる。一方,作用電極の直径を検出対象の直径の2分の1以上とすることで,検出対象よりも小さな物質が非特異的に作用電極に結合した際に生じる発光変化を小さくし,検出対象に対する選択性を向上させた。
【0045】
検出対象はウイルス・細菌・細胞などである。ウイルス・細菌・細胞のおおよその大きさを表1に示す。
【0046】
【表1】

【0047】
これより,作用電極の大きさとしては,検出対象に合わせて,ウイルスの場合には5〜200nm程度,細菌の場合には150nm〜16μm程度,細胞の場合には5〜20μm程度となる。
【0048】
図13〜22は,素子に備わっている作用電極の別の例を示す概念図である。基板1301には1段掘り下げられた部位があり,掘り下げられた部位の底面部に作用電極1302が備えられている。作用電極1303には配線1303が接続されていて,作用電極1302の周囲に壁1304が存在している。図14は図13の作用電極にプローブが固定化された状態を,図15は図14のプローブに検出対象物が結合している状態を示している。図16は図13の壁が作用電極の一部にせり出した形状を示している。このように壁が作用電極の一部を覆っている場合,本実施例においては作用電極が露出した部分が実効的な作用電極であるとみなせる。したがって,作用電極全体の大きさを小さくすることなく,壁の開口部の大きさで作用電極の実効的な大きさを制御することができるようになるため,製造工程の一部を共通化することが可能となる。また,作用電極の大きさを小さくすることが困難な場合にも有効である。図17は,壁が作用電極近傍にのみ存在している形状の例を示している。図18は,作用電極が凹型の形状である例を示している。図19は図18の凹型作用電極にプローブが固定化された形状を,図20は図19のプローブに検出対象物が結合している状態を示している。ここで,検出対象物が1つだけ結合できることを保証するためには,壁の開口径は検出対象物の2倍以下であるとことが望ましい。
【0049】
図21,図22は図13,図18の別の形態である。図21のように壁がテーパー状であっても図13で得られた壁による拡散阻害の効果は得られる。また,図22のように作用電極が丸く凹んでいても,図18で得られた凹型電極の効果は得られる。
【0050】
以下,それぞれの構成をとった場合の効果について説明する。
【0051】
図23は図9の状態から図10の状態へ変化したときの,作用電極の大きさと発光強度の変化率の関係を,有限要素法を用いて数値解析的に求めた結果を示している。作用電極を直径0.2,1,2,5,10,25,50,100μmの円板とし,検出対象を作用電極と同じ直径の球体とし,作用電極と検出対象は接触状態にあるとした。発光系には電気化学発光を用いて,電気化学発光の典型的な条件として,トリス(2,2'-ビピリジル)ルテニウム(Ru(bpy)32+)5mM(拡散係数590μm2/s),トリプロピルアミン100mM,印加電圧1.2V(電極反応の反応速度10000μm/s)を採用し,定常状態時における発光強度を計算し,作用電極表面上における検出対象の有無による発光強度の変化量を求めた。図23に示すように,作用電極表面上に検出対象が有る事によって発光強度は減少し,その減少率は作用電極の直径によらずほぼ一定値であった。
【0052】
図24は,図13のような作用電極の周囲の壁の高さを変えていった場合の,作用電極表面上における検出対象の有無による発光強度の変化量の違いを示している。発光系には図23と同じものを採用した。作用電極を直径0.2,1,2,10,20μmの円板とし,検出対象を作用電極と同じ直径の球体とし,作用電極と検出対象は接触状態にあるとした。壁の開口径は作用電極と同じとし,壁の高さを検出対象の半径に対して,1/4,1/2,3/4と変化させていった時の作用電極表面上における検出対象の有無による発光強度の変化量を,図23の時と同様に有限要素法により数値解析的に求めた。図24より,壁の高さが増加するほど発光強度の減少率は増加していった。これは壁の高さが増加することにより,作用電極表面への酸化還元を起こす試薬の供給が阻害されるためと考えられる。このように,各作用電極の周囲に壁を設けることによって,作用電極近傍における検出対象の有無による発光強度の変化量を増大させることができる。
【0053】
図25は作用電極の直径に対して検出対象の直径の比が変化していった時の,作用電極表面上における検出対象の有無による発光強度の変化量の違いを示している。発光系には図23と同じものを採用した。作用電極を直径0.2,1,2,10,20μmの円板とし,検出対象を球体とし,その直径を作用電極の直径の1,2,5倍と変化させていった時の作用電極表面上における検出対象の有無による発光強度の変化量を,図23の時と同様に有限要素法により数値解析的に求めた。図25より作用電極に対する検出対象の大きさが大きいほど,発光強度の減少率は大きくなった。これは検出対象の大きさが増加したことにより,作用電極表面への酸化還元反応を起こす試薬の供給が阻害されるためと考えられる。したがって,作用電極の直径を検出対象の直径よりも小さくすれば,判定の閾値を高く設定することができるため,排除体積効果による選択性向上の効果と合わせて選択性をより向上させることができる。また,検出の有無を判定する際に単純な閾値でなく,予め得ている作用電極と検出対象の大きさの情報から計算される発光強度の減少率の上限と下限を定め,その範囲内に実測値が入れば検出対象を有りと判定する方法もある。このように判定範囲を定めることにより,稀に非特異的に作用電極に吸着してしまった検出対象物より大きな異物による誤判定を抑制することができる。
【0054】
以下,図23〜25で示した現象を説明する。ここでは発光系として電気化学発光に着目するが,他の酸化還元反応を介した発光系でも同様の議論が通用する。図26に電気化学発光における典型的な反応経路を示す。Aは電気化学発光試薬を,Cは電気化学発光反応における触媒を,Pは光子を表す。電気化学発光は電気化学発光試薬が作用電極から電気エネルギーを受け取って励起され,基底状態に戻る過程でエネルギーを光子として放出することで発生する。一般に電気化学反応の一連の反応の中で,電極から電子を受け取る反応(電極反応)の速度が最も遅いため,電気化学反応は電極反応律速となる(図26においては(1)が電極反応)。
【0055】
また,図26の反応経路からもわかる通り,電気化学発光強度は電極反応における電気化学発光試薬の濃度の時間変化,すなわち電流値に依存し,定常状態においては電流値に比例する。したがって,電気化学発光強度の挙動を調べることは電極反応における電流値の挙動を調べることと同値である。ここでは触媒を介した電気化学反応を例示したが,触媒を介さない電気化学発光反応(例えば,アニオンとカチオンによるアニヒレーションを経由する反応)においても同様の議論が通用する。電気化学発光試薬の濃度をC,電極反応の速度をk,電気化学発光試薬の拡散係数をDとすると,定常状態における電極反応は数1で表される。
【0056】
【数1】

【0057】
いま系の挙動を支配する独立変数はC(mol/m3),k(m/s),D(m2/s)に加え,電極半径d(m)の4つであるから,バッキンガムのπ定理より電極反応の挙動の指標となる無次元数πはπ=(D/k)/dと導出できる。この無次元数πは定性的には次のように理解される。(D/k)は長さの次元を持ち,電極反応で電気化学試薬が消費される速度に対する電気化学発光試薬の供給速度がどれほど大きいかを表す。したがって(D/k)に対してdで比を取って規格化すれば,ある条件下において電極反応が電極反応速度律速であるか拡散供給律速であるかを無次元数πから評価することができる。
【0058】
図27に,図9の状態から図10の状態へ変化したときの発光強度の変化率を無次元数πを用いて表した図を示す。無次元数πが十分大きい時は拡散速度が十分速いため,電極表面に電気化学発光試薬が十分行渡り電極表面上の検出対象の有無によって電流値は変化しない。一方,無次元数πが十分小さい時は反応速度が十分速いため,電極表面に検出対象が有ると電気化学発光試薬が作用電極と検出対象の間の隙間に到達する前に消費されるため,電流値は減少する。この減少率は検出対象による排除体積効果なので無次元数が十分小さい領域では一定値をとる。図23,図25において,減少率が電極の直径に依らずほぼ一定であったのは無次元数πの値が拡散供給律速領域の0.001〜0.5の範囲にあったためである。以上の議論から,電極表面上の検出対象の存在によって発光強度が減少した理由の一つとしては,検出対象による酸化還元反応を起こす試薬の拡散阻害によるものであると考えられる。
【0059】
検出対象の有無の判定精度を考えた時,減少率の閾値としては大きいほど望ましい。図13〜17に示した壁を設けた電極の場合,図24で示したように壁により検出対象が有ることによる拡散阻害の効果が増幅されるため,減少率の閾値を平板電極よりも高く設定することができ,検出の判定精度を向上させることができる。
【0060】
発光強度の測定を考えた時,発光強度の絶対値は大きいほど測定が容易となるため,発光強度の絶対値は大きい方が望ましい。図18〜20に示した凹型電極の場合,図13〜17の壁による減少率の増幅効果に加えて,電極面積が平板電極よりも大きくなるため発光強度の絶対値も大きくなり,測定をより容易にすることができる。
【0061】
また、対向電極を作用電極に近づけることでも発光強度の絶対値を大きくすることができる。例えば,対向電極を作用電極の真上に平行に配置し,対向電極と作用電極の間隔を小さくしていけば,電流値が増大し発光強度も増大する。対向電極で光量を損失させないためには,発光に対して透明な電極材料がよく、例えば酸化インジウムスズ(ITO)電極等が望ましい。壁や凹型電極には検出対象に対する選択性を向上させる効果もある。平板電極では,検出対象よりも大きい物質が電極表面に非特異的に吸着した場合,検出対象と同様の発光強度の変化をもたらし,検出の誤判定を引き起こす可能性がある。しかし,壁を設けた電極や凹型電極では,壁や凹型電極の開口径よりも大きい物質が電極表面に接近することができず,検出対象に対する選択性を向上することができる。
【0062】
検出対象物を高効率で検出するためには,結合確率を増加させるために作用電極数は多いほど望ましい。また,高濃度域の検出対象物を検出するためにも作用電極数は多いほど良い。素子全体の大きさを一定にしつつ作用電極数を増大するためには,作用電極の高集積化すなわち図28のような各作用電極の間隔の微小化をする必要がある。しかし,この作用電極間隔が光学顕微鏡の分解能以下の大きさになると,素子上の各作用電極を同時に発光させて受光素子で検出する手法や従来の光学顕微鏡では,隣接した各作用電極を区別することができなくなってしまう。したがって,作用電極の高集積化と検出の高効率化及び検出対象物の検出上限にはトレードオフの関係がある。
【0063】
マルチプレクサを用いて各作用電極を1個ずつ発光させて検出する手法は,このトレードオフを解決する手法である。このように、例えば各作用電極に1個ずつ電圧を印加し,印加した時間と受光素子で計測を行う時間を同期させることにより,各作用電極の発光を1個観察でき,作用電極間隔が光の波長以下であっても隣接した各作用電極を区別することが可能となる。この手法と光学顕微鏡の分解能以下の電極間隔を組み合わせることにより,検出の高効率化及び高濃度域の検出対象物の検出が可能となる。
【0064】
また,この手法と光学顕微鏡の分解能以下の電極間隔の組み合わせには,光学顕微鏡の位置分解能以下の位置情報を取得できるという効果もある。光学顕微鏡の位置分解能は光の波長の半分程度(0.3〜0.5μm)であるため,この波長以下の電極間隔を有する素子とこの手法を用いれば,発光した光の波長以下の位置情報を取得することができる。例えば,100nm程度の大きさの作用電極と100nm程度の大きさの電極間隔を有する電極アレイを用いて,扁平な細胞を検出対象とすれば,100nm程度の位置分解能を持って細胞の表面形状を取得することが可能となる。
【0065】
1つの素子上に異種抗体を2種類以上固定化した素子を用いて検出対象の検出を行うことで,同時に複数種の検出対象を検出することが可能となる。例えば,A型インフルエンザウイルスに対する抗体を固定化した直径100nmの作用電極とB型インフルエンザウイルスに対する抗体を固定化した直径100nmの作用電極をそれぞれ10000個程度有する作用電極群をそれぞれの抗体毎に例えば領域を分けて設けた素子を用いて,インフルエンザウイルスの罹患が疑われる患者の検体を測定すれば,ウイルスの罹患と型の判定を同時に行うことができる。尚,検出対象はウイルスのみに限らず細菌・細胞でも同様の効果が得られる。
【0066】
図29は作用電極の大きさと作用電極上に結合された検出対象の有無による発光強度の変化率を示している。作用電極として10,25,100μmの直径を持つ金電極を,電気化学発光試薬としてトリス(2,2'-ビピリジル)ルテニウム(Ru(bpy)32+)5mM,トリプロピルアミン100mMリン酸バッファー溶液を用いた。対向電極として白金電極を,参照電極として飽和塩化カリウム銀塩化銀電極を用いて,印加電圧1.2Vの条件で電気化学発光を起こした。検出対象のモデルとしては,作用電極とほぼ同じサイズのポリスチレンビーズを用いた。電圧印加後5秒経過してから受光素子による計測を開始し,受光開始後2秒経過してから電圧印加と計測を終了した。その結果,図29に示したように発光強度の変化率の実測値(黒丸)は有限要素法による計算値(白丸)と良く一致した。したがって,有限要素法による数値解析が実際の測定を良く再現できていることがわかる。
【0067】
16個の直径300nmの金電極が電極間隔300nmで図30のように配置されている素子を用いて,300nmのビーズを検出対象として実験を行った。各作用電極には便宜的に1〜16の番号をつけた。金電極表面にはビオチンを化学結合により固定し,ビーズ表面にはストレプトアビジンを化学結合により固定した。このビーズを500個程度含んだ1 μLの検体を素子の上に滴下し,10分間反応させてビーズを金電極の表面に捕捉させた。その後,リン酸バッファー溶液により洗浄を行い,リン酸バッファー中で光学顕微鏡による蛍光観察を,電気化学発光試薬を含む溶液中で電気化学発光を計測した。電気化学発光試薬としてトリス(2,2'-ビピリジル)ルテニウム(Ru(bpy)32+)5mM,トリプロピルアミン100mMリン酸バッファー溶液を用いた。対向電極として白金電極を,参照電極として飽和塩化カリウム銀塩化銀電極を用いて,印加電圧1.2Vの条件で電気化学発光を起こした。
【0068】
各作用電極に電圧印加後1秒経過してから受光素子による計測を開始し,受光開始後2秒経過してから電圧印加と計測を終了する手法と、同様の操作を全ての作用電極に同時に行って計測する手法を用いた。ここでは、閾値を15%と定め、全作用電極に電圧を同時に印加させた結果,どの作用電極での発光かどうかの位置情報を得ることができず、ビーズが捕捉されているかどうか判断することはできなかった。一方,図2の手順で閾値を15%と定め、各作用電極に1個ずつ電圧を印加していった結果、個々の作用電極からの発光を区別することができた。
【0069】
個々の作用電極の発光強度の変化からビーズの有無を検出した結果,ビーズが捕捉されていると区別できるのは5個であった(電極番号で言えば,1,7,12,13,14を検出)。したがって,隣接する作用電極が光学顕微鏡の位置分解能以下の範囲に入っているために従来法では個々の作用電極が区別できないような条件下でも,各作用電極に電圧を印加する時間と受光素子で計測を開始する時間を同期させて計測することで個々の作用電極を区別することができた。
【符号の説明】
【0070】
101,301 測定部
102,313,507 素子
103 容器
104 溶液
105,315 対向電極
106,316 参照電極
107,314 マルチプレクサ
108,309 ポテンショスタット
109,310 受光素子
110,311 制御部
111 データ処理装置
112 演算装置
113 一時記憶装置
114 不揮発性記憶装置
115 データ表示装置
302 参照用溶液容器
303 ポンプ
304,312 流路
305 シリンジ
306 バルブ
307 測定セル
308 廃液容器
501 導入側流路
502 切り替え弁
503 参照用流路
504 検出用流路
505 切り替え弁
506 排出側流路
701,801,901,1001,1101,1301,1401,1501,1601,1701,1801,1901,2001,2101,2201,2801 基板
702,802,902,1002,1102,1302,1402,1502,1602,1702,1802,1902,2002,2102,2202,2802 作用電極
703,803,903,1003,1103,1303,1403,1503,1603,1703,1803,1903,2003,2103,2203,2803 配線
904,1004,1405,1505,1904,2004 固定化プローブ
1005,1506,2005 検出対象
1304,1404,1504,1604,1704,2104 壁
【特許請求の範囲】
【請求項1】
基板と、前記基板の表面に設けられた複数の作用電極と、前記複数の電極のそれぞれと接続され前記基板の表面と反対側に設けられた配線と、前記作用電極上に測定対象を捕捉するプローブとを有するアレイと、
酸化還元反応により発光する試薬を含む参照溶液を前記アレイ上に接触させる溶液接触手段と、
前記参照溶液に接触するように設けられた対向電極と、
前記配線のそれぞれの接続を制御して、前記作用電極と前記対向電極との間の電圧を制御する電圧制御手段と、
前記アレイからの光を検出する光検出器と、
前記溶液接触手段により試料溶液を接触させ、前記光検出器により検出される光強度の測定に基づいて、前記プローブに捕捉された前記測定対象の有無を測定する計算部と、を有することを特徴とする計測装置。
【請求項2】
前記計算部は、測定された前記測定対象の数をカウントすることを特徴とする請求項1記載の計測装置。
【請求項3】
前記計算部は、前記測定対象の捕捉の有無を判定するための光強度変化の閾値を記憶していることを特徴とする請求項1記載の計測装置。
【請求項4】
前記電圧制御手段は、前記複数の作用電極のうち1つを選択して電圧を印加することを特徴とする請求項1記載の計測装置。
【請求項5】
前記溶液接触手段は、前記アレイを底面に保持し、前記参照溶液を保持する容器であることを特徴とする請求項1記載の計測装置。
【請求項6】
前記溶液接触手段は、前記参照溶液を流す流路であることを特徴とする請求項1記載の計測装置。
【請求項7】
前記流路は、前記流路は前記測定対象を流す第1の流路と、前記測定対象を流さない第2の流路とを備え、前記計算部は、前記第1の流路に接触しているアレイからの光と、前記第2の流路に接触しているアレイからの光との強度差により、測定対象の計測をすることを特徴とする請求項6記載の計測装置。
【請求項8】
前記作用電極が底面となるように前記基板上に側壁を有することを特徴とする請求項1記載の計測装置。
【請求項9】
前記複数の作用電極の間隔は、光の波長分解能よりも小さいことを特徴とする請求項1記載の計測装置。
【請求項10】
前記電圧制御手段は一定時間電圧を印加し、前記計算部は光強度が変化した時間を測定して、前記測定対象の捕捉の有無を判定することを特徴とする請求項1記載の計測装置。
【請求項11】
前記作用電極の大きさは、前記測定対象と対となる大きさであることを特徴とする請求項記載の計測装置。
【請求項12】
前記作用電極の大きさは、前記測定対象の大きさの半分以上2倍以下であることを特徴とする請求項記載の計測装置。
【請求項13】
前記測定対象は、細胞、細菌、ウイルス、ビーズ、リポソーム、たんぱく質のいずれかであることを特徴とする請求項1記載の計測装置。
【請求項14】
基板と、前記基板の表面に設けられた複数の作用電極と、前記複数の電極のそれぞれと接続され前記基板の表面と反対側に設けられた配線と、前記作用電極上に測定対象を捕捉するプローブとを有するアレイ上に、酸化還元反応により発光する試薬を含む参照溶液を導入する工程と、
前記アレイ上に、試料溶液を導入する工程と、
前記複数の作用電極のそれぞれの電気的接続を制御する工程と、
接続された前記作用電極と、前記参照溶液と接触した対向電極との間の電圧印加を制御する工程と、
前記前記アレイからの光を光検出器により検出する工程と、
前記参照溶液を導入したアレイについて、前記試料溶液を導入した場合と導入しない場合における光強度の測定に基づいて、前記プローブに捕捉された前記測定対象の有無を測定する工程と、を有することを特徴とする計測方法。
【請求項15】
前記複数の作用電極それぞれについて、前記測定対象の捕捉の有無を測定し、捕捉された測定対象の数をカウントする工程とを有することを特徴とする請求項14記載の計測方法。
【請求項16】
前記参照溶液を導入した前記アレイについて、前記試料溶液を導入してからの光強度の変化が閾値を超えるかどうかの判定をして、前記プローブに捕捉された前記測定対象の有無を測定することを特徴とする請求項14記載の計測方法。
【請求項17】
前記参照溶液を導入した前記アレイについて、前記試料溶液を導入した場合と導入しない場合の光強度の差に基づいて、前記プローブに捕捉された前記測定対象の有無を測定することを特徴とする請求項14記載の計測方法。
【請求項18】
前記電圧印加の工程と、前記光検出器により検出する工程とのタイミングを同期させて計測することを特徴とする請求項14記載の計測方法。
【請求項1】
基板と、前記基板の表面に設けられた複数の作用電極と、前記複数の電極のそれぞれと接続され前記基板の表面と反対側に設けられた配線と、前記作用電極上に測定対象を捕捉するプローブとを有するアレイと、
酸化還元反応により発光する試薬を含む参照溶液を前記アレイ上に接触させる溶液接触手段と、
前記参照溶液に接触するように設けられた対向電極と、
前記配線のそれぞれの接続を制御して、前記作用電極と前記対向電極との間の電圧を制御する電圧制御手段と、
前記アレイからの光を検出する光検出器と、
前記溶液接触手段により試料溶液を接触させ、前記光検出器により検出される光強度の測定に基づいて、前記プローブに捕捉された前記測定対象の有無を測定する計算部と、を有することを特徴とする計測装置。
【請求項2】
前記計算部は、測定された前記測定対象の数をカウントすることを特徴とする請求項1記載の計測装置。
【請求項3】
前記計算部は、前記測定対象の捕捉の有無を判定するための光強度変化の閾値を記憶していることを特徴とする請求項1記載の計測装置。
【請求項4】
前記電圧制御手段は、前記複数の作用電極のうち1つを選択して電圧を印加することを特徴とする請求項1記載の計測装置。
【請求項5】
前記溶液接触手段は、前記アレイを底面に保持し、前記参照溶液を保持する容器であることを特徴とする請求項1記載の計測装置。
【請求項6】
前記溶液接触手段は、前記参照溶液を流す流路であることを特徴とする請求項1記載の計測装置。
【請求項7】
前記流路は、前記流路は前記測定対象を流す第1の流路と、前記測定対象を流さない第2の流路とを備え、前記計算部は、前記第1の流路に接触しているアレイからの光と、前記第2の流路に接触しているアレイからの光との強度差により、測定対象の計測をすることを特徴とする請求項6記載の計測装置。
【請求項8】
前記作用電極が底面となるように前記基板上に側壁を有することを特徴とする請求項1記載の計測装置。
【請求項9】
前記複数の作用電極の間隔は、光の波長分解能よりも小さいことを特徴とする請求項1記載の計測装置。
【請求項10】
前記電圧制御手段は一定時間電圧を印加し、前記計算部は光強度が変化した時間を測定して、前記測定対象の捕捉の有無を判定することを特徴とする請求項1記載の計測装置。
【請求項11】
前記作用電極の大きさは、前記測定対象と対となる大きさであることを特徴とする請求項記載の計測装置。
【請求項12】
前記作用電極の大きさは、前記測定対象の大きさの半分以上2倍以下であることを特徴とする請求項記載の計測装置。
【請求項13】
前記測定対象は、細胞、細菌、ウイルス、ビーズ、リポソーム、たんぱく質のいずれかであることを特徴とする請求項1記載の計測装置。
【請求項14】
基板と、前記基板の表面に設けられた複数の作用電極と、前記複数の電極のそれぞれと接続され前記基板の表面と反対側に設けられた配線と、前記作用電極上に測定対象を捕捉するプローブとを有するアレイ上に、酸化還元反応により発光する試薬を含む参照溶液を導入する工程と、
前記アレイ上に、試料溶液を導入する工程と、
前記複数の作用電極のそれぞれの電気的接続を制御する工程と、
接続された前記作用電極と、前記参照溶液と接触した対向電極との間の電圧印加を制御する工程と、
前記前記アレイからの光を光検出器により検出する工程と、
前記参照溶液を導入したアレイについて、前記試料溶液を導入した場合と導入しない場合における光強度の測定に基づいて、前記プローブに捕捉された前記測定対象の有無を測定する工程と、を有することを特徴とする計測方法。
【請求項15】
前記複数の作用電極それぞれについて、前記測定対象の捕捉の有無を測定し、捕捉された測定対象の数をカウントする工程とを有することを特徴とする請求項14記載の計測方法。
【請求項16】
前記参照溶液を導入した前記アレイについて、前記試料溶液を導入してからの光強度の変化が閾値を超えるかどうかの判定をして、前記プローブに捕捉された前記測定対象の有無を測定することを特徴とする請求項14記載の計測方法。
【請求項17】
前記参照溶液を導入した前記アレイについて、前記試料溶液を導入した場合と導入しない場合の光強度の差に基づいて、前記プローブに捕捉された前記測定対象の有無を測定することを特徴とする請求項14記載の計測方法。
【請求項18】
前記電圧印加の工程と、前記光検出器により検出する工程とのタイミングを同期させて計測することを特徴とする請求項14記載の計測方法。
【図1】


【図2】


【図3】


【図4】


【図5(A)(B)】


【図5(C)(D)】


【図5(E)(F)】


【図5(G)(H)】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24】


【図25】


【図26】


【図27】


【図28】


【図29】


【図30】




【図2】


【図3】


【図4】


【図5(A)(B)】


【図5(C)(D)】


【図5(E)(F)】


【図5(G)(H)】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24】


【図25】


【図26】


【図27】


【図28】


【図29】


【図30】


【公開番号】特開2012−58042(P2012−58042A)
【公開日】平成24年3月22日(2012.3.22)
【国際特許分類】
【出願番号】特願2010−200445(P2010−200445)
【出願日】平成22年9月8日(2010.9.8)
【出願人】(000005108)株式会社日立製作所 (27,607)
【Fターム(参考)】
【公開日】平成24年3月22日(2012.3.22)
【国際特許分類】
【出願日】平成22年9月8日(2010.9.8)
【出願人】(000005108)株式会社日立製作所 (27,607)
【Fターム(参考)】
[ Back to top ]

