生体物質解析チップ、生体物質解析キットおよびこれらを用いる生体物質解析法
【課題】親和性プローブを基板表面により均一な密度で固定することで微小な領域で、定量測定を行うことのできる生体物質解析チップとこれを用いる生体物質解析キットおよびこれらを用いる生体物質解析法を提供すること。
【解決手段】2種類のモノマーを重合させて調製するポリマー層でできた重合生成薄膜を有するものを作成することとする。これは、前記ポリマー層が重合用の第1の官能基を2箇所に有する第1のモノマーと重合用の第2の官能基を2箇所に有する第2のモノマーを交互に配するように重合した構造で、前記第1のモノマーおよび前記第2のモノマーの片方に親和性プローブ結合残基を持つ構造とする。
【解決手段】2種類のモノマーを重合させて調製するポリマー層でできた重合生成薄膜を有するものを作成することとする。これは、前記ポリマー層が重合用の第1の官能基を2箇所に有する第1のモノマーと重合用の第2の官能基を2箇所に有する第2のモノマーを交互に配するように重合した構造で、前記第1のモノマーおよび前記第2のモノマーの片方に親和性プローブ結合残基を持つ構造とする。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は細胞ないし細胞集合体である組織で発現している遺伝子産物であるmRNAないしタンパク質を定量的に計測するための生体物質解析チップ、生体物質解析キットおよび方生体物質解析法に関する。
【背景技術】
【0002】
ゲノム計画の進展とともにDNAレベルで生体を理解し、病気の診断や生命現象の理解をしようとする動きが活発化してきた。生命現象の理解や遺伝子の働きを調べるには遺伝子の発現状況を調べることが有効である。遺伝子の発現状況を調べるには遺伝子の転写産物であるmRNAを調べる方法とmRNAから翻訳されるタンパク質を調べる方法がある。mRNAを調べる有力な方法として、固体表面上に数多くのDNAプローブを種類毎に区分けして固定したDNAプローブアレー、あるいはDNAプローブチップ(実際には固定されているのはオリゴヌクレオチドの誘導体であるのでオリゴチップと呼ぶこともある)がある。DNAプローブアレーを用いるmRNA検査では、予め十分多量な細胞検体からRNA成分を抽出し、リバーストランスクリプターゼによる逆転写反応でcDNAを合成し、PCR増幅やcRNA合成により増幅を行う。また相補鎖合成時に標識dNTPを取り込ませて多量の標識DNA鎖を得る。最近ではアミノアリルdNTPを取り込ませて、その後にアミノ基に蛍光色素を反応させて蛍光標識DNA鎖を得る方法が主流となっている。このようにして得られた蛍光標識DNA鎖をいわゆるDNAプローブアレーとハイブリダイズさせて各種発現遺伝子の解析を行う。DNAプローブアレー上には通常数十から150μmφの微小スポット状に高密度にDNAプローブを固定して標的cDNA捕捉速度を高め、高感度検出ができるようにしている。
【0003】
DNAチップを作るには光化学反応と半導体工業でよく用いられるリソグラフィーを用いて区画された多数のセルに設計された配列のオリゴマーを一塩基ずつ合成して行く方法(非特許文献1:Science 251, 767-773(1991))、あるいはDNAプローブやタンパク質プローブを各区画に一つ一つ植え込んでいく方法(非特許文献2:Proc. Natl. Acad. Sci. USA 93, 4613-4918 (1996))などがある。
【0004】
これらチップは、いずれもスライドガラスなどの平面上に多数のプローブをアレイ状に整列させた構造をしている。どのプローブがどの位置にあるかは、プローブが固定されている物理的な位置のみでインデクシングされるのが一般的である。検出には、DNAチップの類では標識物に蛍光色素を用いるケースが圧倒的に多いが、電気化学発光を用いるケースやDedox(酸化還元)反応を用いて電気信号として検出する方法も実用化している。
【0005】
DNAプローブのかわりに抗体や抗原を基板上にアレイ状に固定したプロテインチップの概念も実用化されている。基板上にアレルギーを起こす数十から数百の抗原(アレルゲン)を固定したデバイスに検体血清を反応させ、各抗原と抗原抗体反応を起こす血清中に存在するIgMを特異的に捕捉し、IgMに結合する酵素標識2次抗体を反応させ、酵素活性を化学発光と組み合わせることで測定して、アレルゲンを検出するアレルゲン検査用のシステムが医療検査用に実用化されている。プロテインチップにおいても、高感度検出を行うために固体表面に抗体や抗原を高密度に固定することで測定対象物質の捕捉速度を高めている。
【0006】
プロテインチップ上に捕捉した測定対象物質の検出には、酵素標識物を用いて化学発光ないし生物発光の系で検出するケースが多い。そのほか、蛍光標識検出や、電気化学発光検出、質量分析器による分析を行うケースと多様な方法が実用化されている。
【0007】
電気化学発光法では、電極表面に抗原捕捉用の抗体が存在する。サンドイッチ用抗体の標識物にはルテニウム錯体を用いる(非特許文献3:Clin. Chem., 37, 1534-1539 (1991))。電極表面ではルテニウムが酸化され、TPAのレドックス反応とカップルさせて還元するときに励起状態となったルテニウムの電子が基底状態に落ちる時に光を発する。
【0008】
本発明に関連するところでは、生体物質検出法の一つでプロテインチップと類似の技術であるサンドイッチイムノアッセイ法において、標識物に粒子を用いて測定対象物質を分子計数する方法が報告されている(非特許文献4:Analytical Biochemistry 202,120−125 (1992))。
【0009】
【非特許文献1】Science 251, 767-773(1991)
【非特許文献2】Proc. Natl. Acad. Sci. USA 93, 4613-4918(1996)
【非特許文献3】Clin. Chem., 37, 1534-1539 (1991)
【非特許文献4】Analytical Biochemistry 202,120−125 (1992)
【発明の開示】
【発明が解決しようとする課題】
【0010】
上記従来技術では、DNAプローブチップあるいはプロテインチップを用いる遺伝子転写産物であるmRNAや翻訳産物であるタンパク質の識別や検出法に関してはよく検討されており、何らかの方法で溶液状の試料が準備できていればそれなりに測定ができる。また、出願人の一人により特許出願されている特願2004−226361、特願2004−297194あるいは特願2004−318770に開示されているように、mRNAやDNAマイクロアレイの分野においてもナノ粒子を用いて解析する方法が提案されている。
【0011】
しかしながら、生体物質を基板上に捕捉するための親和性プローブ(以下生体物質に結合して何らかの情報を得るために使われる物質の総称を親和性プローブと呼ぶことにする)はDNAプローブや抗体などの生体有機物であるので、これらの固定にはガラスやシリコンの基板と生体有機物を固定する上で下記の問題がある。すなわち、
1)親和性プローブを基板上に固定するために物理的な吸着や共有結合形成を用いるが、吸着反応と共有結合反応のいずれも基板表面の状態に依存するために均一な固定が困難であるケースが多い。
2)親和性プローブの基板上への固定の立体方向の制御ができない。すなわち、溶液中の測定対象生体物質を捕捉するための親和性部位を測定対象生体物質と反応する方角に向けて固定することが難しい。このため、親和性プローブ自身の立体障害で測定対象の捕捉量が低下する。
3)親和性プローブの密度がコントロールできない。一般的に、固定時の親和性プローブ濃度や固定時間をコントロールすることで任意の密度の親和性プローブを固定した基板が得られると思われがちであるが、実際には制御が難しいことが多い。非特許文献4では、親和性プローブの固定時にこれとは異なる生体物質を共存させて実際の親和性プローブ固定密度をコントロールしている。親和性プローブを希薄状態で基板表面に固定しようとすると、島状に密度の高いところと周りの密度の薄いところができてしまう。
4)あるいは、上記1)から3)の問題に関連するが、親和性プローブの固定エリアが狭くなると各エリアで親和性プローブの固定量が異なるようになり、定量的な測定に害を及ぼす可能性がある。さらに、親和性プローブの固定エリアが狭くなると蛍光法のように親和性プローブエリア全体の蛍光強度を測定し、その蛍光強度を基に試料中の目的生体物質の量を定量解析することができなくなる。このために、上記非特許文献4あるいは特許出願発明のように基板上に捕捉した目的生体物質にナノ粒子を結合させてこれを計数する方法を取るわけであるが、親和性プローブが均一についていないと、部位ごとに結合するナノ粒子の数が異なることになり、計数による定量検出精度が当然低下することになる。
【0012】
基板に固定する親和性プローブ密度には最適条件が存在する。このために、親和性プローブ密度を任意にコントロールする必要性が出てくる。
【0013】
従来のプローブ固定法ではシランカップリング反応を用いて無機質であるガラスやシリコンウエハー表面に官能性残基を導入し、この官能性残基に親和性プローブを固定する方法が多用されている。しかしながらシランカップリング反応は、基板の表面状態に依存し、必ずしも均一に親和性プローブを固定する方法として最適なものではない。
【0014】
本発明の目的は、親和性プローブを基板表面により均一な密度で固定することで微小な領域で、定量測定を行うことのできる生体物質解析チップとこれを用いる生体物質解析キットおよびこれらを用いる生体物質解析法を提供することにある。
【課題を解決するための手段】
【0015】
本発明では、ガラスやシリコン基板表面のSi−OHないしSi=Oあるいは、金属表面のMe−OHやMe=O(Me:金属原子)のような残基に直接反応するようなシランカップリングを用いることはしない。このような表面に存在する−OHや=O残基は表面状態により存在する量が異なるので、本質的に均一な活性基を導入することが困難と考えたからである。そこで、基板表面の状態に依存せずに親和性プローブを固定する残基を導入する必要がある。これには、基板表面状態にかかわらず、ポリマー層を基板表面に導入し、このポリマー層が一定間隔で親和性プローブを固定するための官能基を持つように設計すればよい。このとき重要なのは、いかにして親和性プローブを固定するための官能基の間隔をそろえるかである。
【0016】
すなわち、2種類のモノマーを重合させて調製するポリマー層でできた重合生成薄膜を有するものを作成することとする。これは、前記ポリマー層が重合用の第1の官能基を2箇所に有する第1のモノマーと重合用の第2の官能基を2箇所に有する第2のモノマーを交互に配するように重合した構造で、前記第1のモノマーおよび前記第2のモノマーの片方に親和性プローブ結合残基を持つ構造をしている。具体的には、基板に第1のモノマーとしてジイソシアナート類と第2のモノマーとしてジアミン類を等モル比で反応させ重合させる。このケースでは、第1の官能基はイソシアナート基、第2の官能基はアミノ基ということになる。ジイソシアナートとしてはたとえばアルキルジイソシアナートやフェニレンジイソシアナート類を用いることができる。また、親和性プローブ結合用にはジイソシアナート類かジアミン類の側鎖に官能基を導入したモノマーを用いればよい。
【0017】
例えば、ジアミン類の側鎖にカルボキシル基を導入したモノマーを用いる。これを基板表面で重合させると、ジイソシアナート類とジアミン類が交互に結合したポリマーが得られる。よってカルボキシル基はジイソシアナート類とジアミン類からなる周期のジアミン部分の側鎖に存在することになる。このため、ポリマー上に一定間隔で親和性プローブを固定することが可能となる。このときの重合生成薄膜はポリ尿素ということになる。重合上条件に関しては、既存の真空蒸着法を用いることができるジイソシアナート類とジアミン類の主鎖の長さを調製することで導入するカルボキシル基の間隔を調製できる。また、これにより、従来は表面に官能基を導入することが困難であった金や白金などの電極上にも自在に官能基を持つ薄膜を形成することができる。
【0018】
基板上に導入したカルボキシル基をカルボジイミド系の活性化剤を用いて生体物質捕捉用残基としてアミノ基を有するプローブを直接固定してもよい。あるいは、この側鎖カルボキシル基にジシクロヘキシルカルボジイミド系の活性化剤存在下でエチレンジアミンを反応させると、高収率で側鎖カルボキシル基に一級アミン残基を導入することができる。すなわち基板表面には一級アミンがほぼ一定間隔で並んだ状態となる。次にNucleic Acids Research,27,1970-1977(1999)およびCHEMBIOCHEM2, 686- 694(2001)記載の1,4−フェニレンヂイソチオシアナートで一級アミンを修飾し、表面にイソチオシアナート基を導入する。最後に5’末端にアミノ基を有するDNAプローブ(スペーサー部:5’末端側10塩基プラスターゲットのcDNAと反応する部分:平均32塩基長)を反応させる。この反応条件は上記文献に詳しい。上記方法でDNAプローブが約9nm間隔で固定された基板が得られる。
【0019】
カルボキシル基をもつポリ尿素を基板上に形成する例のほか、側鎖にプローブとなるポリヌクレオチドやペプチドなどを固定できるような反応基を導入できる残基を周期的に持つポリマーであればいずれも利用することができる。たとえば、2種のモノマーの組み合わせがR1−C=O−O−O=C−R2やR1−C=O−O−O=C−R2−C=O−O−O=C−R3(R1〜R3は任意の残基)の構造を有する酸無水物とNH2−R5−NH2(R5は任意の残基)の構造を有するジアミンモノマーで、R5にカルボキシル基を有するジアミノフェニル酢酸モノマーを用いることができる。酸無水物としては、4,4’−ヘキサフルオロイソプロピリデンビスフタル酸無水物のような構造のものを用いることができる。
【0020】
このようなポリマーは、すなわちポリイミドである。ポリイミドは一般的にこのようなビス無水フタル酸とビスアミノ化合物を用いる。あるいは、たとえば長カルボキシル基を有するジアミノフェニル酢酸あるいは1,10−ジアミノデカンのような脂肪族ジアミンの脂肪族位置にカルボン酸残基を有するモノマーとジ酸クロリドモノマーであるテレフタロイルジクロリドを蒸着重合により基板上に膜形成を行うポリアミドを利用することができる。プローブ固定用には長鎖脂肪族ジアミンに各種反応性残基を導入しておけばよい。蒸着重合としては既存の方法、たとえば、Jpn. J. Appl. Phys. 33, L1721-L1724(1994)やThin Solid Films, 215, 94-97 (1992)記載の方法に準じて、使用するモノマーの気化条件を考慮して行えばよい。
【発明の効果】
【0021】
本発明により、細胞内発現しているmRNAやタンパク質を分子レベルで検出できるようになる。
【発明を実施するための最良の形態】
【0022】
(実施例1)
図1は本発明を実行するに好適な生体物質解析チップの1例を示す図である。図1(A)は実施例の生体物質解析チップを示す平面図、(B)は図1(A)のA−A位置で矢印方向に見た断面図である。
【0023】
この生体物質解析チップ100は、ガラス基板1の上面に親和性官能基を固定するためのポリマー薄膜層21を作成する。ポリマー層21の上にはテフロン(登録商標)層22がプリントされている。したがって表面に出ているポリマー層21は図の23のような区画となっている。この区画は50×50μmで細胞1個を収納できる。ポリマー薄膜層21の上には親和性プローブとしてポリT(T30)を固定し、mRNAを網羅的に捕捉するようにすることができる。あるいは、上記「課題を解決するための手段」に記載したDNAプローブ(スペーサー部:5’末端側10塩基+ターゲットのmRNAないしcDNAと反応する部分:平均32塩基長)を固定することで特定のmRNAあるいはcDNAを捕捉するようなチップを得ることができる。もちろん通常のDNAチップのように複数のDNAプローブをスポットした構造とする。区画21の集合の周りには溶液を保持するための仕切り5が存在する。
【0024】
まず、基板1の上面に形成する親和性官能基を固定するためのポリマー薄膜層について説明する。ポリマー薄膜層21は第1のモノマーとしてアルキルジイソシアナートと第2のモノマーとしてジアミノフェニル酢酸を等モル比で反応させ重合させる。すなわちポリマー薄膜としては尿素樹脂薄膜ということになる。アルキルジイソシアナートとしては、例えば、ヘキサメチレンジイソシアナートを用いることができる。また、生体物質捕捉用残基は第2のモノマーであるジアミノフェニル酢酸のカルボキシル基ということになる。重合条件に関しては、既存の真空蒸着法を用いることができる。
【0025】
このようにして基板上に形成したポリ尿素薄膜21はアルキルジイソシアナートとジアミノフェニル酢酸モノマーが交互に反応して形成する構造のため、側鎖のカルボン酸基が比較的そろった間隔で存在することになる。アルキル基の長さを調製することで導入するカルボキシル基の間隔を調製できる。また、これにより、従来は表面に官能基を導入することが困難であった金や白金などの電極上にも官能基を持つ薄膜を形成することができる。基板上に導入したカルボキシル基をカルボジイミド系の活性化剤を用いて生体物質捕捉用残基としてアミノ基を有するプローブを直接固定してもよい。あるいは、この側鎖カルボキシル基にジシクロヘキシルカルボジイミド系の活性化剤存在下でエチレンジアミンを反応させると、高収率で側鎖カルボキシル基に一級アミン残基を導入することができる。すなわち基板表面には一級アミンがほぼ一定間隔で並んだ状態となる。
【0026】
次にNucleic Acids Research,27,1970-1977(1999)およびCHEMBIOCHEM2, 686- 694(2001)記載の1,4−フェニレンヂイソチオシアナートで一級アミンを修飾し、表面にイソチオシアナート基を導入する。最後に5’末端にアミノ基を有するポリT(T30)を反応させる。この反応条件は上記文献に詳しい。上記方法でポリTが約9nm間隔で固定された基板が得られる。
【0027】
実施例では、カルボキシル基をもつポリ尿素を基板1上に形成して用いたが、このほかにも、側鎖にプローブとなるポリヌクレオチドやペプチドなどを固定できるような反応基を導入できる残基を周期的に持つポリマーであれば利用することができる。たとえば、2種のモノマーの組み合わせがR1−C=O−O−O=C−R2−R3−C=O−O−O=C−R4の構造を有する酸無水物(R1〜R4は任意の残基)とNH2−R5−NH2の構造を有するジアミンモノマー(R5は任意の残基)で、R5にカルボキシル基を有するジアミノフェニル酢酸モノマーを用いることができる。酸無水物としては、4,4’−ヘキサフルオロイソプロピリデンビスフタル酸無水物のような構造のものを用いることができる。このようなポリマーは、すなわちポリイミドである。ポリイミドは一般的にこのようなビス無水フタル酸とビスアミノ化合物を用いる。あるいは、たとえばカルボキシル基を有するジアミノフェニル酢酸あるいは1,10−ジアミノデカンのような脂肪族ジアミンの脂肪族位置にカルボン酸残基を有するモノマーとジ酸クロリドモノマーであるテレフタロイルジクロリドを蒸着重合により基板上に膜形成を行うポリアミドを利用することができる。プローブ固定用には長鎖脂肪族ジアミンに各種反応性残基を導入しておけばよい。蒸着重合としては既存の方法、たとえば、Jpn. J. Appl. Phys. 33, L1721-L1724(1994)やThin Solid Films, 215, 94-97 (1992)記載の方法に準じて、使用するモノマーの気化条件を考慮して行えばよい。
【0028】
なお、図1において、5は樹脂製の壁であり、ポリ尿素薄膜21の周辺に設け、試料溶液の周辺への流出を防止するためのものである。必ず必要と言うものではない。
【0029】
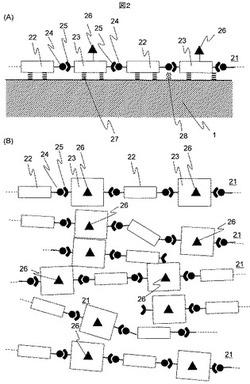
図2(A)は、基板1の上面に蒸着重合で形成された第1のモノマーとしてアルキルジイソシアナートと第2のモノマーとしてジアミノフェニル酢酸を等モル比で反応させ重合させたポリマー薄膜層21の断面構造を示す模式図であり、図2(B)は、ポリマー薄膜層21の平面構造を示す模式図である。
【0030】
ポリマー薄膜層21は、第1のモノマー部分22と第2のモノマー部分23が、第1のモノマー部分22の第1の官能基24と第2のモノマー部分23の第2の官能基25とがお互いに連結し、交互に重合した二つのモノマーの連鎖構造となっている。第2のモノマー部分23には側鎖として第3の官能基26が存在する。ポリマー層薄膜21は基板表面との間での弱い結合27と、基板1のガラス表面のシラノール基とポリマー側の官能基のパイ電子がごく一部分で共有結合した状態28でアンカリングしていると推定される。図2(B)を参照して分かるように、第1のモノマー部分22の第1の官能基24と第2のモノマー部分23の第2の官能基25とがお互いに連結し、交互に重合した二つのモノマーの連鎖構造は、全てが、平行に整然と並ぶわけではないので、第三の官能基26が、均等に、整然と配列されるわけではない。すなわち、図2(B)に示すように、反転したもの、傾いたものが混在する。しかし、第三の官能基26を有する第2のモノマー部分23は、第1のモノマー部分22を介在させて配列されることになるので、第三の官能基26が、むやみに集まったり、閑散と分布してしまったりすることは防止できる。
【0031】
図3は、基板1の表面に形成されたポリマー薄膜層21の第三の官能基26とDNAプローブ31の5’末端部分32の官能基33とが結合する様子を模式的に示す図である。ここで、ポリマー薄膜層21は、第1のモノマー22と第2のモノマー23が交互に重合しているので、分子レベルで見ると第2のモノマー23の側鎖である第3の官能基26の間隔はほぼ一定となり、したがって第3の官能基26に結合するDNAプローブ31もほぼ一定間隔となる。もちろんポリマー鎖同士の2次元的な広がりも考える必要があるが、側鎖のカルボキシル基(図2(A)では第3の官能基26に相当)のマイナス荷電の反発力により、図2(B)に示すように、異なる鎖の間隔もほぼ一定となることが期待できる。
【0032】
図4は、図1−3に示す基板を用いて、mRNAを検出する工程を示す図である。図4(A)は基板1の上面のポリマー薄膜層21の上面に、例えば、細胞を破砕して得られた試料溶液41を配し、試料溶液41中にはmRNA43やタンパク質45が分散した様子を模視的に示す断面図である。溶液41はいわゆるPBSでEDTAは含まないものを使用する。基板1の上面のポリマー薄膜層21の表面にプローブ31が固定されている。ここではプローブ31はポリTからなるものを使用する。mRNAが測定対象であるので液滴中に細胞浸透性のRNaseインヒビターを予め入れておき、mRNAの分解を極力防ぐ。
【0033】
図4(B)は、図4(A)の状態から時間が経過した状態を模視的に示す図である。時間が経過するのに応じて、mRNA43は基板上のポリTプローブ31にハイブリダイズする。mRNAのハイブリダイゼーションによる基板表面のポリAプローブへの捕捉には4時間程度を要する。
【0034】
図4(C)は、基板1の上面のポリマー薄膜層21の上面のポリTプローブ31に捕捉されたmRNA群43を識別する方法を説明する図である。まず、図4(B)に示すポリTプローブ31に捕捉されたmRNA群を有する基板1を0.5%SDSと0.1MのNaClを含む50mMリン酸緩衝液pH7.4で洗浄し、基板1上のポリTプローブ31にハイブリダイズしなかった物を除去する。次いで、ポリTプローブ31にハイブリダイズしたmRNA群43は、種々の異なったものがあるので、これを識別するための標識プローブの混合溶液51を添加する。ここでは、標識プローブとしては異なる粒子径の金ナノ粒子に異なるDNA配列を持つDNAプローブを結合させたものを用いる。図では模式的に5nmの金ナノ粒子53で標識したDNAプローブ63、10nmの金ナノ粒子54で標識したDNAプローブ64、15nmの金ナノ粒子55で標識したDNAプローブ65の3種を含む溶液51を基板上に加えた状態を表す。金ナノ粒子標識DNAプローブの非特異的な吸着を防ぐために、溶液51は0.5%SDSと0.1MのNaClを含む50mMリン酸緩衝液pH7.4の組成としている。
【0035】
1時間45℃でインキュベーションした後、同一の緩衝液で洗浄後、さらに10mMのNaClを含むクエン酸緩衝液pH7で洗浄する。この状態で基板上には、ポリTプローブ31にハイブリダイズしたmRNA群とポリTプローブ31に捕捉された各mRNAにハイブリダイズした標識プローブ63,64,65が3体結合した状態になっている。標識プローブ63,64,65には、走査型電子顕微鏡や操作型原子間力顕微鏡で容易に識別できる粒子径の異なる金ナノ粒子標識物53、54、55が結合している。したがって、金ナノ粒子53、54、55を、粒子径を区別しながらカウントすることで、基板1上のポリTプローブ31に捕捉されたmRNAの種類と量を測定することができる。
【0036】
区画21は5×5μmと微小なため、そこに固定できるプローブ数としては限られた数となってしまう。各区画ごとのプローブ固定量を一定に保とうとすると、基板表面の状態に固定量が依存するような方法は取ることができない。本方法を用いることで、基板表面のプローブ分子間隔をほぼ9nmに保つことができる。このため5×5μm程度のスポットでのプローブ固定量のばらつきは従来法のCV=30%程度から本発明によりCV=7%程度まで少なくすることができる。
(実施例2)
ここで、実施例による識別能力について評価すると以下のようである。
【0037】
基板1の上面のポリマー薄膜層21の表面にプローブ31が固定されるが、プローブ31としてポリTを用いることとし、通常のDNAチップの様に複数の配列のDNAプローブをポリマー薄膜層21の表面にスポットして用いる例を考える。すなわち、上述したようにして調製したイソチオシアナート残基がほぼ一定間隔になるように配された表面にインクジェット装置を用いて各プローブをスポットする。スポットの大きさは1μmφとし、各スポットが2μmピッチで並んでいるとする。
【0038】
また、各スポットに3種類の捕捉用DNAプローブをミクスチャーとして固定し、各々捕捉用プローブに対応する検出用のDNAプローブに上述のように3種類の異なる粒子径のナノ粒子を標識したものを用いるとする。
【0039】
図5(A)に本発明を用いる3種類のDNAプローブを同一スポット位置に固定し、スポットごとに異なるDNAプローブを固定したDNAマイクロアレイの例を断面図で示す。基板1の上には蒸着重合で作成した反応性残基がほぼ等間隔で並んだ層21の活性基を利用して3種のプローブ92−1,92−2,92−3のグループと、これらとは異なる3種のプローブ93−1,93−2,93−3がスポットエリア92と93に別個に固定されている。試料混合液91を添加して2時間50℃でインキュベーションする。試料混合液91は1本鎖状態のcDNA混合物で、たとえば白血球由来のmRNA混合物を逆転写して得たものである。溶媒は0.5%SDSを含む50mMのリン酸緩衝液(pH7.4)である。反応終了後、0.5%SDSを含む50mMのリン酸緩衝液(pH7.4)で洗浄する。
【0040】
図5(B)に基板上の層21の表面のプローブにcDNAが捕捉された状態を(示す。異なるcDNA102−1,102−2,102−3がスポットエリア92の対応するDNAプローブにハイブリダイズ、cDN103−2,103−3がスポットエリア93の対応するプローブにハイブリダイズしている。スポット93のプローブ93−1に対応しているcDNAは試料中に存在しないケースで、このためいずれのスポットエリアにもハイブリダイズした痕跡は見られない。
【0041】
図5(C)に、基板上の層21の表面のプローブに捕捉されたcDNAが3種の異なる粒子径5、10、15μmの金ナノ粒子を標識した第2のDNAプローブ112−1,112−2,112−3、113−1、113−2、112−3と反応させるためにリン酸緩衝液95を添加した状態を示す。第2のDNAプローブはそれぞれ1本鎖cDNA102−1,102−2,102−3,103−1,103−2,103−3に相補な配列を有する(cDNA103−1は試料中に含まれないので図には描かれていない)。反応は0.5%SDSを含む50mMのリン酸緩衝液(pH7.4)95中で、55℃で30分間行う。金ナノ粒子標識DNAプローブの混合液は予め90℃5秒加熱し、55℃に冷却して直ちに基板上に滴下する。0.5%SDSを含む50mMのリン酸緩衝液(pH7.4)で洗浄する。
【0042】
図5(D)に、基板上の各スポットエリアにcDNA配列に従い金ナノ粒子112−1,112−2,112−3,113−2,113−3で標識したDNAプローブがハイブリダイズした状態を示す。操作型電子顕微鏡か原子間力顕微鏡で基板表面をスキャンして、各スポットエリアに結合している金ナノ粒子を粒径別にカウントする。
【0043】
区画21は5×5μmと微小なため、そこに固定できるプローブ数としては限られた数となってしまう。各区画ごとに3種類のプローブを固定しようとすると更に固定量のばらつき変動が大きくなる。本方法を用いることで、基板表面のプローブ分子間隔をほぼ9nmに保つことができる。3種類のプローブを固定すると、5×5μm程度のスポットでのプローブ固定量のばらつきは従来法のCV=40%程度から本発明によりCV=10%程度まで少なくすることができる。
【図面の簡単な説明】
【0044】
【図1】本発明を実行するに好適な生体物質解析チップの1例を示す図であり、(A)は実施例の生体物質解析チップを示す平面図、(B)は図1(A)のA−A位置で矢印方向に見た断面図である。
【図2】(A)は、基板1の上面に蒸着重合で形成された第1のモノマーとしてアルキルジイソシアナートと第2のモノマーとしてジアミノフェニル酢酸を等モル比で反応させ重合させたポリマー薄膜層21の断面構造を示す模式図であり、図2(B)は、ポリマー薄膜層21の平面構造を示す模式図である。
【図3】基板1の表面に形成されたポリマー薄膜層21の第三の官能基26とDNAプローブ31の5’末端部分32の官能基33とが結合する様子を模式的に示す図である。
【図4】(A)−(D)は、図1−3に示す基板を用いて、mRNAを検出する工程を示す図である。
【図5】(A)−(D)は、複数のDNAプローブを同一スポット位置に固定し、各スポット位置でDNAプローブを異なるものとしたDNAマイクロアレイを用いて、mRNAを検出する工程を示す図である。
【符号の説明】
【0045】
100…生体物質解析チップ、1…ガラス基板、5…樹脂製の壁、21…ポリマー薄膜層、22…第1のモノマー部分、23…第2のモノマー部分、24…第1のモノマー部分の第1の官能基、25…第2のモノマー部分の第2の官能基、26…第2のモノマー部分の側鎖としての第3の官能基、27…ポリマー層薄膜と基板表面との間の弱い結合、28…基板のガラス表面のシラノール基とポリマー側の官能基のパイ電子の共有結合した状態、31,92,93…DNAプローブ、32…DNAプローブの5’末端部分、33…DNAプローブの5’末端部分の官能基、41…細胞を破砕して得られた試料溶液、43…mRNA、45…タンパク質、53,54,55,112,113…金ナノ粒子、63,64,65…金ナノ粒子で標識したDNAプローブ、102,103…cDNA。
【技術分野】
【0001】
本発明は細胞ないし細胞集合体である組織で発現している遺伝子産物であるmRNAないしタンパク質を定量的に計測するための生体物質解析チップ、生体物質解析キットおよび方生体物質解析法に関する。
【背景技術】
【0002】
ゲノム計画の進展とともにDNAレベルで生体を理解し、病気の診断や生命現象の理解をしようとする動きが活発化してきた。生命現象の理解や遺伝子の働きを調べるには遺伝子の発現状況を調べることが有効である。遺伝子の発現状況を調べるには遺伝子の転写産物であるmRNAを調べる方法とmRNAから翻訳されるタンパク質を調べる方法がある。mRNAを調べる有力な方法として、固体表面上に数多くのDNAプローブを種類毎に区分けして固定したDNAプローブアレー、あるいはDNAプローブチップ(実際には固定されているのはオリゴヌクレオチドの誘導体であるのでオリゴチップと呼ぶこともある)がある。DNAプローブアレーを用いるmRNA検査では、予め十分多量な細胞検体からRNA成分を抽出し、リバーストランスクリプターゼによる逆転写反応でcDNAを合成し、PCR増幅やcRNA合成により増幅を行う。また相補鎖合成時に標識dNTPを取り込ませて多量の標識DNA鎖を得る。最近ではアミノアリルdNTPを取り込ませて、その後にアミノ基に蛍光色素を反応させて蛍光標識DNA鎖を得る方法が主流となっている。このようにして得られた蛍光標識DNA鎖をいわゆるDNAプローブアレーとハイブリダイズさせて各種発現遺伝子の解析を行う。DNAプローブアレー上には通常数十から150μmφの微小スポット状に高密度にDNAプローブを固定して標的cDNA捕捉速度を高め、高感度検出ができるようにしている。
【0003】
DNAチップを作るには光化学反応と半導体工業でよく用いられるリソグラフィーを用いて区画された多数のセルに設計された配列のオリゴマーを一塩基ずつ合成して行く方法(非特許文献1:Science 251, 767-773(1991))、あるいはDNAプローブやタンパク質プローブを各区画に一つ一つ植え込んでいく方法(非特許文献2:Proc. Natl. Acad. Sci. USA 93, 4613-4918 (1996))などがある。
【0004】
これらチップは、いずれもスライドガラスなどの平面上に多数のプローブをアレイ状に整列させた構造をしている。どのプローブがどの位置にあるかは、プローブが固定されている物理的な位置のみでインデクシングされるのが一般的である。検出には、DNAチップの類では標識物に蛍光色素を用いるケースが圧倒的に多いが、電気化学発光を用いるケースやDedox(酸化還元)反応を用いて電気信号として検出する方法も実用化している。
【0005】
DNAプローブのかわりに抗体や抗原を基板上にアレイ状に固定したプロテインチップの概念も実用化されている。基板上にアレルギーを起こす数十から数百の抗原(アレルゲン)を固定したデバイスに検体血清を反応させ、各抗原と抗原抗体反応を起こす血清中に存在するIgMを特異的に捕捉し、IgMに結合する酵素標識2次抗体を反応させ、酵素活性を化学発光と組み合わせることで測定して、アレルゲンを検出するアレルゲン検査用のシステムが医療検査用に実用化されている。プロテインチップにおいても、高感度検出を行うために固体表面に抗体や抗原を高密度に固定することで測定対象物質の捕捉速度を高めている。
【0006】
プロテインチップ上に捕捉した測定対象物質の検出には、酵素標識物を用いて化学発光ないし生物発光の系で検出するケースが多い。そのほか、蛍光標識検出や、電気化学発光検出、質量分析器による分析を行うケースと多様な方法が実用化されている。
【0007】
電気化学発光法では、電極表面に抗原捕捉用の抗体が存在する。サンドイッチ用抗体の標識物にはルテニウム錯体を用いる(非特許文献3:Clin. Chem., 37, 1534-1539 (1991))。電極表面ではルテニウムが酸化され、TPAのレドックス反応とカップルさせて還元するときに励起状態となったルテニウムの電子が基底状態に落ちる時に光を発する。
【0008】
本発明に関連するところでは、生体物質検出法の一つでプロテインチップと類似の技術であるサンドイッチイムノアッセイ法において、標識物に粒子を用いて測定対象物質を分子計数する方法が報告されている(非特許文献4:Analytical Biochemistry 202,120−125 (1992))。
【0009】
【非特許文献1】Science 251, 767-773(1991)
【非特許文献2】Proc. Natl. Acad. Sci. USA 93, 4613-4918(1996)
【非特許文献3】Clin. Chem., 37, 1534-1539 (1991)
【非特許文献4】Analytical Biochemistry 202,120−125 (1992)
【発明の開示】
【発明が解決しようとする課題】
【0010】
上記従来技術では、DNAプローブチップあるいはプロテインチップを用いる遺伝子転写産物であるmRNAや翻訳産物であるタンパク質の識別や検出法に関してはよく検討されており、何らかの方法で溶液状の試料が準備できていればそれなりに測定ができる。また、出願人の一人により特許出願されている特願2004−226361、特願2004−297194あるいは特願2004−318770に開示されているように、mRNAやDNAマイクロアレイの分野においてもナノ粒子を用いて解析する方法が提案されている。
【0011】
しかしながら、生体物質を基板上に捕捉するための親和性プローブ(以下生体物質に結合して何らかの情報を得るために使われる物質の総称を親和性プローブと呼ぶことにする)はDNAプローブや抗体などの生体有機物であるので、これらの固定にはガラスやシリコンの基板と生体有機物を固定する上で下記の問題がある。すなわち、
1)親和性プローブを基板上に固定するために物理的な吸着や共有結合形成を用いるが、吸着反応と共有結合反応のいずれも基板表面の状態に依存するために均一な固定が困難であるケースが多い。
2)親和性プローブの基板上への固定の立体方向の制御ができない。すなわち、溶液中の測定対象生体物質を捕捉するための親和性部位を測定対象生体物質と反応する方角に向けて固定することが難しい。このため、親和性プローブ自身の立体障害で測定対象の捕捉量が低下する。
3)親和性プローブの密度がコントロールできない。一般的に、固定時の親和性プローブ濃度や固定時間をコントロールすることで任意の密度の親和性プローブを固定した基板が得られると思われがちであるが、実際には制御が難しいことが多い。非特許文献4では、親和性プローブの固定時にこれとは異なる生体物質を共存させて実際の親和性プローブ固定密度をコントロールしている。親和性プローブを希薄状態で基板表面に固定しようとすると、島状に密度の高いところと周りの密度の薄いところができてしまう。
4)あるいは、上記1)から3)の問題に関連するが、親和性プローブの固定エリアが狭くなると各エリアで親和性プローブの固定量が異なるようになり、定量的な測定に害を及ぼす可能性がある。さらに、親和性プローブの固定エリアが狭くなると蛍光法のように親和性プローブエリア全体の蛍光強度を測定し、その蛍光強度を基に試料中の目的生体物質の量を定量解析することができなくなる。このために、上記非特許文献4あるいは特許出願発明のように基板上に捕捉した目的生体物質にナノ粒子を結合させてこれを計数する方法を取るわけであるが、親和性プローブが均一についていないと、部位ごとに結合するナノ粒子の数が異なることになり、計数による定量検出精度が当然低下することになる。
【0012】
基板に固定する親和性プローブ密度には最適条件が存在する。このために、親和性プローブ密度を任意にコントロールする必要性が出てくる。
【0013】
従来のプローブ固定法ではシランカップリング反応を用いて無機質であるガラスやシリコンウエハー表面に官能性残基を導入し、この官能性残基に親和性プローブを固定する方法が多用されている。しかしながらシランカップリング反応は、基板の表面状態に依存し、必ずしも均一に親和性プローブを固定する方法として最適なものではない。
【0014】
本発明の目的は、親和性プローブを基板表面により均一な密度で固定することで微小な領域で、定量測定を行うことのできる生体物質解析チップとこれを用いる生体物質解析キットおよびこれらを用いる生体物質解析法を提供することにある。
【課題を解決するための手段】
【0015】
本発明では、ガラスやシリコン基板表面のSi−OHないしSi=Oあるいは、金属表面のMe−OHやMe=O(Me:金属原子)のような残基に直接反応するようなシランカップリングを用いることはしない。このような表面に存在する−OHや=O残基は表面状態により存在する量が異なるので、本質的に均一な活性基を導入することが困難と考えたからである。そこで、基板表面の状態に依存せずに親和性プローブを固定する残基を導入する必要がある。これには、基板表面状態にかかわらず、ポリマー層を基板表面に導入し、このポリマー層が一定間隔で親和性プローブを固定するための官能基を持つように設計すればよい。このとき重要なのは、いかにして親和性プローブを固定するための官能基の間隔をそろえるかである。
【0016】
すなわち、2種類のモノマーを重合させて調製するポリマー層でできた重合生成薄膜を有するものを作成することとする。これは、前記ポリマー層が重合用の第1の官能基を2箇所に有する第1のモノマーと重合用の第2の官能基を2箇所に有する第2のモノマーを交互に配するように重合した構造で、前記第1のモノマーおよび前記第2のモノマーの片方に親和性プローブ結合残基を持つ構造をしている。具体的には、基板に第1のモノマーとしてジイソシアナート類と第2のモノマーとしてジアミン類を等モル比で反応させ重合させる。このケースでは、第1の官能基はイソシアナート基、第2の官能基はアミノ基ということになる。ジイソシアナートとしてはたとえばアルキルジイソシアナートやフェニレンジイソシアナート類を用いることができる。また、親和性プローブ結合用にはジイソシアナート類かジアミン類の側鎖に官能基を導入したモノマーを用いればよい。
【0017】
例えば、ジアミン類の側鎖にカルボキシル基を導入したモノマーを用いる。これを基板表面で重合させると、ジイソシアナート類とジアミン類が交互に結合したポリマーが得られる。よってカルボキシル基はジイソシアナート類とジアミン類からなる周期のジアミン部分の側鎖に存在することになる。このため、ポリマー上に一定間隔で親和性プローブを固定することが可能となる。このときの重合生成薄膜はポリ尿素ということになる。重合上条件に関しては、既存の真空蒸着法を用いることができるジイソシアナート類とジアミン類の主鎖の長さを調製することで導入するカルボキシル基の間隔を調製できる。また、これにより、従来は表面に官能基を導入することが困難であった金や白金などの電極上にも自在に官能基を持つ薄膜を形成することができる。
【0018】
基板上に導入したカルボキシル基をカルボジイミド系の活性化剤を用いて生体物質捕捉用残基としてアミノ基を有するプローブを直接固定してもよい。あるいは、この側鎖カルボキシル基にジシクロヘキシルカルボジイミド系の活性化剤存在下でエチレンジアミンを反応させると、高収率で側鎖カルボキシル基に一級アミン残基を導入することができる。すなわち基板表面には一級アミンがほぼ一定間隔で並んだ状態となる。次にNucleic Acids Research,27,1970-1977(1999)およびCHEMBIOCHEM2, 686- 694(2001)記載の1,4−フェニレンヂイソチオシアナートで一級アミンを修飾し、表面にイソチオシアナート基を導入する。最後に5’末端にアミノ基を有するDNAプローブ(スペーサー部:5’末端側10塩基プラスターゲットのcDNAと反応する部分:平均32塩基長)を反応させる。この反応条件は上記文献に詳しい。上記方法でDNAプローブが約9nm間隔で固定された基板が得られる。
【0019】
カルボキシル基をもつポリ尿素を基板上に形成する例のほか、側鎖にプローブとなるポリヌクレオチドやペプチドなどを固定できるような反応基を導入できる残基を周期的に持つポリマーであればいずれも利用することができる。たとえば、2種のモノマーの組み合わせがR1−C=O−O−O=C−R2やR1−C=O−O−O=C−R2−C=O−O−O=C−R3(R1〜R3は任意の残基)の構造を有する酸無水物とNH2−R5−NH2(R5は任意の残基)の構造を有するジアミンモノマーで、R5にカルボキシル基を有するジアミノフェニル酢酸モノマーを用いることができる。酸無水物としては、4,4’−ヘキサフルオロイソプロピリデンビスフタル酸無水物のような構造のものを用いることができる。
【0020】
このようなポリマーは、すなわちポリイミドである。ポリイミドは一般的にこのようなビス無水フタル酸とビスアミノ化合物を用いる。あるいは、たとえば長カルボキシル基を有するジアミノフェニル酢酸あるいは1,10−ジアミノデカンのような脂肪族ジアミンの脂肪族位置にカルボン酸残基を有するモノマーとジ酸クロリドモノマーであるテレフタロイルジクロリドを蒸着重合により基板上に膜形成を行うポリアミドを利用することができる。プローブ固定用には長鎖脂肪族ジアミンに各種反応性残基を導入しておけばよい。蒸着重合としては既存の方法、たとえば、Jpn. J. Appl. Phys. 33, L1721-L1724(1994)やThin Solid Films, 215, 94-97 (1992)記載の方法に準じて、使用するモノマーの気化条件を考慮して行えばよい。
【発明の効果】
【0021】
本発明により、細胞内発現しているmRNAやタンパク質を分子レベルで検出できるようになる。
【発明を実施するための最良の形態】
【0022】
(実施例1)
図1は本発明を実行するに好適な生体物質解析チップの1例を示す図である。図1(A)は実施例の生体物質解析チップを示す平面図、(B)は図1(A)のA−A位置で矢印方向に見た断面図である。
【0023】
この生体物質解析チップ100は、ガラス基板1の上面に親和性官能基を固定するためのポリマー薄膜層21を作成する。ポリマー層21の上にはテフロン(登録商標)層22がプリントされている。したがって表面に出ているポリマー層21は図の23のような区画となっている。この区画は50×50μmで細胞1個を収納できる。ポリマー薄膜層21の上には親和性プローブとしてポリT(T30)を固定し、mRNAを網羅的に捕捉するようにすることができる。あるいは、上記「課題を解決するための手段」に記載したDNAプローブ(スペーサー部:5’末端側10塩基+ターゲットのmRNAないしcDNAと反応する部分:平均32塩基長)を固定することで特定のmRNAあるいはcDNAを捕捉するようなチップを得ることができる。もちろん通常のDNAチップのように複数のDNAプローブをスポットした構造とする。区画21の集合の周りには溶液を保持するための仕切り5が存在する。
【0024】
まず、基板1の上面に形成する親和性官能基を固定するためのポリマー薄膜層について説明する。ポリマー薄膜層21は第1のモノマーとしてアルキルジイソシアナートと第2のモノマーとしてジアミノフェニル酢酸を等モル比で反応させ重合させる。すなわちポリマー薄膜としては尿素樹脂薄膜ということになる。アルキルジイソシアナートとしては、例えば、ヘキサメチレンジイソシアナートを用いることができる。また、生体物質捕捉用残基は第2のモノマーであるジアミノフェニル酢酸のカルボキシル基ということになる。重合条件に関しては、既存の真空蒸着法を用いることができる。
【0025】
このようにして基板上に形成したポリ尿素薄膜21はアルキルジイソシアナートとジアミノフェニル酢酸モノマーが交互に反応して形成する構造のため、側鎖のカルボン酸基が比較的そろった間隔で存在することになる。アルキル基の長さを調製することで導入するカルボキシル基の間隔を調製できる。また、これにより、従来は表面に官能基を導入することが困難であった金や白金などの電極上にも官能基を持つ薄膜を形成することができる。基板上に導入したカルボキシル基をカルボジイミド系の活性化剤を用いて生体物質捕捉用残基としてアミノ基を有するプローブを直接固定してもよい。あるいは、この側鎖カルボキシル基にジシクロヘキシルカルボジイミド系の活性化剤存在下でエチレンジアミンを反応させると、高収率で側鎖カルボキシル基に一級アミン残基を導入することができる。すなわち基板表面には一級アミンがほぼ一定間隔で並んだ状態となる。
【0026】
次にNucleic Acids Research,27,1970-1977(1999)およびCHEMBIOCHEM2, 686- 694(2001)記載の1,4−フェニレンヂイソチオシアナートで一級アミンを修飾し、表面にイソチオシアナート基を導入する。最後に5’末端にアミノ基を有するポリT(T30)を反応させる。この反応条件は上記文献に詳しい。上記方法でポリTが約9nm間隔で固定された基板が得られる。
【0027】
実施例では、カルボキシル基をもつポリ尿素を基板1上に形成して用いたが、このほかにも、側鎖にプローブとなるポリヌクレオチドやペプチドなどを固定できるような反応基を導入できる残基を周期的に持つポリマーであれば利用することができる。たとえば、2種のモノマーの組み合わせがR1−C=O−O−O=C−R2−R3−C=O−O−O=C−R4の構造を有する酸無水物(R1〜R4は任意の残基)とNH2−R5−NH2の構造を有するジアミンモノマー(R5は任意の残基)で、R5にカルボキシル基を有するジアミノフェニル酢酸モノマーを用いることができる。酸無水物としては、4,4’−ヘキサフルオロイソプロピリデンビスフタル酸無水物のような構造のものを用いることができる。このようなポリマーは、すなわちポリイミドである。ポリイミドは一般的にこのようなビス無水フタル酸とビスアミノ化合物を用いる。あるいは、たとえばカルボキシル基を有するジアミノフェニル酢酸あるいは1,10−ジアミノデカンのような脂肪族ジアミンの脂肪族位置にカルボン酸残基を有するモノマーとジ酸クロリドモノマーであるテレフタロイルジクロリドを蒸着重合により基板上に膜形成を行うポリアミドを利用することができる。プローブ固定用には長鎖脂肪族ジアミンに各種反応性残基を導入しておけばよい。蒸着重合としては既存の方法、たとえば、Jpn. J. Appl. Phys. 33, L1721-L1724(1994)やThin Solid Films, 215, 94-97 (1992)記載の方法に準じて、使用するモノマーの気化条件を考慮して行えばよい。
【0028】
なお、図1において、5は樹脂製の壁であり、ポリ尿素薄膜21の周辺に設け、試料溶液の周辺への流出を防止するためのものである。必ず必要と言うものではない。
【0029】
図2(A)は、基板1の上面に蒸着重合で形成された第1のモノマーとしてアルキルジイソシアナートと第2のモノマーとしてジアミノフェニル酢酸を等モル比で反応させ重合させたポリマー薄膜層21の断面構造を示す模式図であり、図2(B)は、ポリマー薄膜層21の平面構造を示す模式図である。
【0030】
ポリマー薄膜層21は、第1のモノマー部分22と第2のモノマー部分23が、第1のモノマー部分22の第1の官能基24と第2のモノマー部分23の第2の官能基25とがお互いに連結し、交互に重合した二つのモノマーの連鎖構造となっている。第2のモノマー部分23には側鎖として第3の官能基26が存在する。ポリマー層薄膜21は基板表面との間での弱い結合27と、基板1のガラス表面のシラノール基とポリマー側の官能基のパイ電子がごく一部分で共有結合した状態28でアンカリングしていると推定される。図2(B)を参照して分かるように、第1のモノマー部分22の第1の官能基24と第2のモノマー部分23の第2の官能基25とがお互いに連結し、交互に重合した二つのモノマーの連鎖構造は、全てが、平行に整然と並ぶわけではないので、第三の官能基26が、均等に、整然と配列されるわけではない。すなわち、図2(B)に示すように、反転したもの、傾いたものが混在する。しかし、第三の官能基26を有する第2のモノマー部分23は、第1のモノマー部分22を介在させて配列されることになるので、第三の官能基26が、むやみに集まったり、閑散と分布してしまったりすることは防止できる。
【0031】
図3は、基板1の表面に形成されたポリマー薄膜層21の第三の官能基26とDNAプローブ31の5’末端部分32の官能基33とが結合する様子を模式的に示す図である。ここで、ポリマー薄膜層21は、第1のモノマー22と第2のモノマー23が交互に重合しているので、分子レベルで見ると第2のモノマー23の側鎖である第3の官能基26の間隔はほぼ一定となり、したがって第3の官能基26に結合するDNAプローブ31もほぼ一定間隔となる。もちろんポリマー鎖同士の2次元的な広がりも考える必要があるが、側鎖のカルボキシル基(図2(A)では第3の官能基26に相当)のマイナス荷電の反発力により、図2(B)に示すように、異なる鎖の間隔もほぼ一定となることが期待できる。
【0032】
図4は、図1−3に示す基板を用いて、mRNAを検出する工程を示す図である。図4(A)は基板1の上面のポリマー薄膜層21の上面に、例えば、細胞を破砕して得られた試料溶液41を配し、試料溶液41中にはmRNA43やタンパク質45が分散した様子を模視的に示す断面図である。溶液41はいわゆるPBSでEDTAは含まないものを使用する。基板1の上面のポリマー薄膜層21の表面にプローブ31が固定されている。ここではプローブ31はポリTからなるものを使用する。mRNAが測定対象であるので液滴中に細胞浸透性のRNaseインヒビターを予め入れておき、mRNAの分解を極力防ぐ。
【0033】
図4(B)は、図4(A)の状態から時間が経過した状態を模視的に示す図である。時間が経過するのに応じて、mRNA43は基板上のポリTプローブ31にハイブリダイズする。mRNAのハイブリダイゼーションによる基板表面のポリAプローブへの捕捉には4時間程度を要する。
【0034】
図4(C)は、基板1の上面のポリマー薄膜層21の上面のポリTプローブ31に捕捉されたmRNA群43を識別する方法を説明する図である。まず、図4(B)に示すポリTプローブ31に捕捉されたmRNA群を有する基板1を0.5%SDSと0.1MのNaClを含む50mMリン酸緩衝液pH7.4で洗浄し、基板1上のポリTプローブ31にハイブリダイズしなかった物を除去する。次いで、ポリTプローブ31にハイブリダイズしたmRNA群43は、種々の異なったものがあるので、これを識別するための標識プローブの混合溶液51を添加する。ここでは、標識プローブとしては異なる粒子径の金ナノ粒子に異なるDNA配列を持つDNAプローブを結合させたものを用いる。図では模式的に5nmの金ナノ粒子53で標識したDNAプローブ63、10nmの金ナノ粒子54で標識したDNAプローブ64、15nmの金ナノ粒子55で標識したDNAプローブ65の3種を含む溶液51を基板上に加えた状態を表す。金ナノ粒子標識DNAプローブの非特異的な吸着を防ぐために、溶液51は0.5%SDSと0.1MのNaClを含む50mMリン酸緩衝液pH7.4の組成としている。
【0035】
1時間45℃でインキュベーションした後、同一の緩衝液で洗浄後、さらに10mMのNaClを含むクエン酸緩衝液pH7で洗浄する。この状態で基板上には、ポリTプローブ31にハイブリダイズしたmRNA群とポリTプローブ31に捕捉された各mRNAにハイブリダイズした標識プローブ63,64,65が3体結合した状態になっている。標識プローブ63,64,65には、走査型電子顕微鏡や操作型原子間力顕微鏡で容易に識別できる粒子径の異なる金ナノ粒子標識物53、54、55が結合している。したがって、金ナノ粒子53、54、55を、粒子径を区別しながらカウントすることで、基板1上のポリTプローブ31に捕捉されたmRNAの種類と量を測定することができる。
【0036】
区画21は5×5μmと微小なため、そこに固定できるプローブ数としては限られた数となってしまう。各区画ごとのプローブ固定量を一定に保とうとすると、基板表面の状態に固定量が依存するような方法は取ることができない。本方法を用いることで、基板表面のプローブ分子間隔をほぼ9nmに保つことができる。このため5×5μm程度のスポットでのプローブ固定量のばらつきは従来法のCV=30%程度から本発明によりCV=7%程度まで少なくすることができる。
(実施例2)
ここで、実施例による識別能力について評価すると以下のようである。
【0037】
基板1の上面のポリマー薄膜層21の表面にプローブ31が固定されるが、プローブ31としてポリTを用いることとし、通常のDNAチップの様に複数の配列のDNAプローブをポリマー薄膜層21の表面にスポットして用いる例を考える。すなわち、上述したようにして調製したイソチオシアナート残基がほぼ一定間隔になるように配された表面にインクジェット装置を用いて各プローブをスポットする。スポットの大きさは1μmφとし、各スポットが2μmピッチで並んでいるとする。
【0038】
また、各スポットに3種類の捕捉用DNAプローブをミクスチャーとして固定し、各々捕捉用プローブに対応する検出用のDNAプローブに上述のように3種類の異なる粒子径のナノ粒子を標識したものを用いるとする。
【0039】
図5(A)に本発明を用いる3種類のDNAプローブを同一スポット位置に固定し、スポットごとに異なるDNAプローブを固定したDNAマイクロアレイの例を断面図で示す。基板1の上には蒸着重合で作成した反応性残基がほぼ等間隔で並んだ層21の活性基を利用して3種のプローブ92−1,92−2,92−3のグループと、これらとは異なる3種のプローブ93−1,93−2,93−3がスポットエリア92と93に別個に固定されている。試料混合液91を添加して2時間50℃でインキュベーションする。試料混合液91は1本鎖状態のcDNA混合物で、たとえば白血球由来のmRNA混合物を逆転写して得たものである。溶媒は0.5%SDSを含む50mMのリン酸緩衝液(pH7.4)である。反応終了後、0.5%SDSを含む50mMのリン酸緩衝液(pH7.4)で洗浄する。
【0040】
図5(B)に基板上の層21の表面のプローブにcDNAが捕捉された状態を(示す。異なるcDNA102−1,102−2,102−3がスポットエリア92の対応するDNAプローブにハイブリダイズ、cDN103−2,103−3がスポットエリア93の対応するプローブにハイブリダイズしている。スポット93のプローブ93−1に対応しているcDNAは試料中に存在しないケースで、このためいずれのスポットエリアにもハイブリダイズした痕跡は見られない。
【0041】
図5(C)に、基板上の層21の表面のプローブに捕捉されたcDNAが3種の異なる粒子径5、10、15μmの金ナノ粒子を標識した第2のDNAプローブ112−1,112−2,112−3、113−1、113−2、112−3と反応させるためにリン酸緩衝液95を添加した状態を示す。第2のDNAプローブはそれぞれ1本鎖cDNA102−1,102−2,102−3,103−1,103−2,103−3に相補な配列を有する(cDNA103−1は試料中に含まれないので図には描かれていない)。反応は0.5%SDSを含む50mMのリン酸緩衝液(pH7.4)95中で、55℃で30分間行う。金ナノ粒子標識DNAプローブの混合液は予め90℃5秒加熱し、55℃に冷却して直ちに基板上に滴下する。0.5%SDSを含む50mMのリン酸緩衝液(pH7.4)で洗浄する。
【0042】
図5(D)に、基板上の各スポットエリアにcDNA配列に従い金ナノ粒子112−1,112−2,112−3,113−2,113−3で標識したDNAプローブがハイブリダイズした状態を示す。操作型電子顕微鏡か原子間力顕微鏡で基板表面をスキャンして、各スポットエリアに結合している金ナノ粒子を粒径別にカウントする。
【0043】
区画21は5×5μmと微小なため、そこに固定できるプローブ数としては限られた数となってしまう。各区画ごとに3種類のプローブを固定しようとすると更に固定量のばらつき変動が大きくなる。本方法を用いることで、基板表面のプローブ分子間隔をほぼ9nmに保つことができる。3種類のプローブを固定すると、5×5μm程度のスポットでのプローブ固定量のばらつきは従来法のCV=40%程度から本発明によりCV=10%程度まで少なくすることができる。
【図面の簡単な説明】
【0044】
【図1】本発明を実行するに好適な生体物質解析チップの1例を示す図であり、(A)は実施例の生体物質解析チップを示す平面図、(B)は図1(A)のA−A位置で矢印方向に見た断面図である。
【図2】(A)は、基板1の上面に蒸着重合で形成された第1のモノマーとしてアルキルジイソシアナートと第2のモノマーとしてジアミノフェニル酢酸を等モル比で反応させ重合させたポリマー薄膜層21の断面構造を示す模式図であり、図2(B)は、ポリマー薄膜層21の平面構造を示す模式図である。
【図3】基板1の表面に形成されたポリマー薄膜層21の第三の官能基26とDNAプローブ31の5’末端部分32の官能基33とが結合する様子を模式的に示す図である。
【図4】(A)−(D)は、図1−3に示す基板を用いて、mRNAを検出する工程を示す図である。
【図5】(A)−(D)は、複数のDNAプローブを同一スポット位置に固定し、各スポット位置でDNAプローブを異なるものとしたDNAマイクロアレイを用いて、mRNAを検出する工程を示す図である。
【符号の説明】
【0045】
100…生体物質解析チップ、1…ガラス基板、5…樹脂製の壁、21…ポリマー薄膜層、22…第1のモノマー部分、23…第2のモノマー部分、24…第1のモノマー部分の第1の官能基、25…第2のモノマー部分の第2の官能基、26…第2のモノマー部分の側鎖としての第3の官能基、27…ポリマー層薄膜と基板表面との間の弱い結合、28…基板のガラス表面のシラノール基とポリマー側の官能基のパイ電子の共有結合した状態、31,92,93…DNAプローブ、32…DNAプローブの5’末端部分、33…DNAプローブの5’末端部分の官能基、41…細胞を破砕して得られた試料溶液、43…mRNA、45…タンパク質、53,54,55,112,113…金ナノ粒子、63,64,65…金ナノ粒子で標識したDNAプローブ、102,103…cDNA。
【特許請求の範囲】
【請求項1】
基板と、該基板の一つの表面に所定の生体物質の捕捉用残基を有する固体チップであり、前記基板の一つの表面に2種類のモノマーを重合させて調製するポリマー層を有し、前記ポリマー層の内、第1の官能基を2箇所に有する第1のモノマーと重合用の第2の官能基を2箇所に有する第2のモノマーを実質的に交互に配するように重合した構造で、前記第1のモノマーおよび前記第2のモノマーの片方に生体物質捕捉用残基を持つ構造であることを特徴とする生体物質解析チップ。
【請求項2】
前記第1のモノマーと第2のモノマーの組み合わせがNCS−R1−NCS(R1は任意の残基)の構造を有するジイソシアナートモノマーとNH2−R2−NH2(R2は任意の残基)の構造を有するジアミンモノマーでポリマー層とがポリ尿素ある請求項1記載の生体物質解析チップ。
【請求項3】
前記第1のモノマーと第2のモノマーの組み合わせがR1−C=O−O−O=C−R2あるいはR1−C=O−O−O=C−R2−C=O−O−O=C−R3(R1〜R3は任意の残基)の構造を有する酸無水物とNH2−R5−NH2(R5は任意の残基)の構造を有するジアミンモノマーで、ポリマー層がポリアミドないしポリイミドある請求項1または請求項2記載の生体物質解析チップ。
【請求項4】
前記生体物質捕捉用残基がカルボキシル基である請求項1ないし請求項3のいずれかに記載の細胞構成物質分取チップ。
【請求項5】
前記カルボキシル基にイソチオシアン酸が導入された構造である請求項4記載の細胞構成物質分取チップ。
【請求項6】
前記カルボキシル基にジアミン類を反応させて固体チップ表面にアミンを導入し、前記固体表面に導入したアミンにヂイソチオシアナート類を反応させて固体チップ表面にイソチオシアナート残基を導入した構造の請求項4または請求項5記載の細胞構成物質分取チップ。
【請求項7】
所定の生体物質の捕捉用残基を有する固体チップが、前記固体チップ表面に2種類のモノマーを重合させて調製するポリマー層を有し、少なくても前記ポリマー層が重合用の前記2つのモノマーの内第1の官能基を2箇所に有する第1のモノマーと重合用の第2の官能基を2箇所に有する第2のモノマーを実質的に交互に配するように重合した構造で、前記2つのモノマーの内少なくとも1種のモノマーに生体物質捕捉用残基を持つ構造で、前記生体物質捕捉用残基に所定の生体物質を捕捉するための分子が共有結合で固定した細胞構成物質解析チップと、前記生体物質捕捉用残基に固定した分子に捕捉された所定の生体物質に結合し該所定の生体物質を特定するための標識物を含む生体物質とを有することを特徴とする生体物質解析キット。
【請求項8】
前記標識物が5から300nmのナノ粒子からなる請求項7記載の生体物質解析キット。
【請求項9】
所定の生体物質の捕捉用残基を有する固体チップが、前記固体チップ表面に2種類のモノマーを重合させて調製するポリマー層を有し、少なくても前記ポリマー層が重合用の前記2つのモノマーの内第1の官能基を2箇所に有する第1のモノマーと重合用の第2の官能基を2箇所に有する第2のモノマーを実質的に交互に配するように重合した構造で、前記2つのモノマーの内少なくとも1種のモノマーに生体物質捕捉用残基を持つ構造で、前記生体物質捕捉用残基に所定の生体物質を捕捉するための分子が共有結合で固定した細胞構成物質解析チップの表面上の空間に生体物質を含む緩衝液を添加する工程、前記細胞構成物質解析チップ表面に存在し共有結合で固定された生体物質を捕捉するための分子で所定の生体物質を捕捉する工程、該所定の生体物質と結合し該所定の生体物質を特定するためのナノ粒子で標識された生体物質を結合する工程、細胞構成物質解析チップの表面に固定されるナノ粒子を計数する工程、からなることを特徴とする生体物質解析法。
【請求項1】
基板と、該基板の一つの表面に所定の生体物質の捕捉用残基を有する固体チップであり、前記基板の一つの表面に2種類のモノマーを重合させて調製するポリマー層を有し、前記ポリマー層の内、第1の官能基を2箇所に有する第1のモノマーと重合用の第2の官能基を2箇所に有する第2のモノマーを実質的に交互に配するように重合した構造で、前記第1のモノマーおよび前記第2のモノマーの片方に生体物質捕捉用残基を持つ構造であることを特徴とする生体物質解析チップ。
【請求項2】
前記第1のモノマーと第2のモノマーの組み合わせがNCS−R1−NCS(R1は任意の残基)の構造を有するジイソシアナートモノマーとNH2−R2−NH2(R2は任意の残基)の構造を有するジアミンモノマーでポリマー層とがポリ尿素ある請求項1記載の生体物質解析チップ。
【請求項3】
前記第1のモノマーと第2のモノマーの組み合わせがR1−C=O−O−O=C−R2あるいはR1−C=O−O−O=C−R2−C=O−O−O=C−R3(R1〜R3は任意の残基)の構造を有する酸無水物とNH2−R5−NH2(R5は任意の残基)の構造を有するジアミンモノマーで、ポリマー層がポリアミドないしポリイミドある請求項1または請求項2記載の生体物質解析チップ。
【請求項4】
前記生体物質捕捉用残基がカルボキシル基である請求項1ないし請求項3のいずれかに記載の細胞構成物質分取チップ。
【請求項5】
前記カルボキシル基にイソチオシアン酸が導入された構造である請求項4記載の細胞構成物質分取チップ。
【請求項6】
前記カルボキシル基にジアミン類を反応させて固体チップ表面にアミンを導入し、前記固体表面に導入したアミンにヂイソチオシアナート類を反応させて固体チップ表面にイソチオシアナート残基を導入した構造の請求項4または請求項5記載の細胞構成物質分取チップ。
【請求項7】
所定の生体物質の捕捉用残基を有する固体チップが、前記固体チップ表面に2種類のモノマーを重合させて調製するポリマー層を有し、少なくても前記ポリマー層が重合用の前記2つのモノマーの内第1の官能基を2箇所に有する第1のモノマーと重合用の第2の官能基を2箇所に有する第2のモノマーを実質的に交互に配するように重合した構造で、前記2つのモノマーの内少なくとも1種のモノマーに生体物質捕捉用残基を持つ構造で、前記生体物質捕捉用残基に所定の生体物質を捕捉するための分子が共有結合で固定した細胞構成物質解析チップと、前記生体物質捕捉用残基に固定した分子に捕捉された所定の生体物質に結合し該所定の生体物質を特定するための標識物を含む生体物質とを有することを特徴とする生体物質解析キット。
【請求項8】
前記標識物が5から300nmのナノ粒子からなる請求項7記載の生体物質解析キット。
【請求項9】
所定の生体物質の捕捉用残基を有する固体チップが、前記固体チップ表面に2種類のモノマーを重合させて調製するポリマー層を有し、少なくても前記ポリマー層が重合用の前記2つのモノマーの内第1の官能基を2箇所に有する第1のモノマーと重合用の第2の官能基を2箇所に有する第2のモノマーを実質的に交互に配するように重合した構造で、前記2つのモノマーの内少なくとも1種のモノマーに生体物質捕捉用残基を持つ構造で、前記生体物質捕捉用残基に所定の生体物質を捕捉するための分子が共有結合で固定した細胞構成物質解析チップの表面上の空間に生体物質を含む緩衝液を添加する工程、前記細胞構成物質解析チップ表面に存在し共有結合で固定された生体物質を捕捉するための分子で所定の生体物質を捕捉する工程、該所定の生体物質と結合し該所定の生体物質を特定するためのナノ粒子で標識された生体物質を結合する工程、細胞構成物質解析チップの表面に固定されるナノ粒子を計数する工程、からなることを特徴とする生体物質解析法。
【図1】


【図2】


【図3】


【図4】


【図5】




【図2】


【図3】


【図4】


【図5】


【公開番号】特開2007−78553(P2007−78553A)
【公開日】平成19年3月29日(2007.3.29)
【国際特許分類】
【出願番号】特願2005−268092(P2005−268092)
【出願日】平成17年9月15日(2005.9.15)
【出願人】(504296024)有限責任中間法人 オンチップ・セロミクス・コンソーシアム (39)
【出願人】(000231464)株式会社アルバック (1,740)
【公開日】平成19年3月29日(2007.3.29)
【国際特許分類】
【出願日】平成17年9月15日(2005.9.15)
【出願人】(504296024)有限責任中間法人 オンチップ・セロミクス・コンソーシアム (39)
【出願人】(000231464)株式会社アルバック (1,740)
[ Back to top ]

