生体細胞の培養方法及び培養装置
【課題】 生体細胞、特にマイクロキャリアを用いて生体細胞を培養する際に、培養液の撹拌速度を高精度に制御することで、長期に亘って生体細胞の培養を持続する。
【解決手段】生体細胞を培養するための培養液を収容する培養槽と、前記培養槽に配設され、前記培養槽内の培養液に含まれる溶存酸素濃度を測定するための複数の溶存酸素濃度計測手段と、培養槽内の培養液を撹拌する撹拌手段と、前記複数の溶存酸素濃度計測手段で測定した溶存酸素濃度の差異を算出するとともに、当該差異に基づいて上記撹拌手段を制御する制御手段とを備える。
【解決手段】生体細胞を培養するための培養液を収容する培養槽と、前記培養槽に配設され、前記培養槽内の培養液に含まれる溶存酸素濃度を測定するための複数の溶存酸素濃度計測手段と、培養槽内の培養液を撹拌する撹拌手段と、前記複数の溶存酸素濃度計測手段で測定した溶存酸素濃度の差異を算出するとともに、当該差異に基づいて上記撹拌手段を制御する制御手段とを備える。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、生体細胞の培養方法及び生体細胞を培養できる培養装置に関する。
【背景技術】
【0002】
生体細胞の培養では、目的生産物の生産性向上のために生体細胞を高密度で培養することが望まれている。生体細胞のなかには、浮遊状態では生育や増殖することができず、細胞外マトリックスやこれを模した足場と接着した状態で生育や増殖が可能となるものがある。このような付着依存性を有する細胞を培養する場合、増殖のための足場が必要であり、小規模培養の場合はローラーボトルや培養フラスコの壁面を足場として付着させて増殖させることにより培養する手法が用いられてきた。中規模又は大規模での培養では、表面や内部に細胞が付着して増殖することが可能な培養面を有するマイクロキャリアと称される微細な粒子が使用され、これを培養液中に浮遊させることにより、浮遊性の細胞のごとく培養する手法が用いられる。
【0003】
非特許文献1には、マイクロキャリアを用いた培養において、培養に好適なマイクロキャリア密度が存在すること、及び過剰な撹拌は大きな増殖阻害を引き起こすことが記載されている。これまでに種々のマイクロキャリアを使用する細胞培養装置が開発されている。特許文献1には、コイル状に整形した多孔質チューブの表面から酸素供給を行うことを特徴とする培養装置に関する記載がある。特許文献2には、マイクロキャリアを沈降分離する手段を培養槽内に設置することによって培地の交換を連続的に実施することを特徴とする培養装置に関する記載がある。特許文献3には、培養槽外に酸素供給槽を設け、培養槽内に設置した振動スクリーンによってマイクロキャリアを除いた培養液を酸素供給槽に導き、酸素供給槽内で液中通気法によって酸素を溶解させた後、培養槽に循環させることを特徴とする培養装置に関する記載がある。特許文献4には、煩雑なマイクロキャリア培養の操作手順を自動化したことを特徴とする培養装置に関する記載がある。特許文献5には、円筒型カラムにマイクロキャリアを充填した状態で細胞の培養を行わせることを特徴とする培養装置に関する記載がある。
【0004】
これら従来の手法は、培養密度の高密度化のために必要となる酸素や栄養源の供給方法に主眼がおかれて開発されたものであるが、共通する問題としてスケールアップに対応できないことがある。例えば、マイクロキャリアを用いた生体細胞の培養では、マイクロキャリアの細胞増殖面上で増殖した細胞量によって比重が大きくなり、培養液中での沈降速度が大きくなる現象が生じるため、培養槽内の撹拌速度を適宜調整する必要がある。すなわち、マイクロキャリアを培養液中に浮遊させるための撹拌速度は、培養初期と培養終期とでは異なる。培養初期にあわせた回転速度で培養を継続した場合には、培養終期では細胞が増殖したマイクロキャリアが培養槽底に沈積してしまう虞がある。逆に、培養終期にあわせた回転速度で培養を開始した場合には、培養初期に過剰撹拌となって細胞増殖を阻害してしまう虞がある。したがって、マイクロキャリア上の細胞の増殖量に対応して撹拌速度を適切に制御することが好ましい。
【0005】
特許文献6には、培養槽外に設けた酸素供給槽にマイクロキャリアを除いた培養液を循環させて酸素供給を行う培養装置において、培養槽内に複数の濁度計測手段を配置して分離用スクリーン近傍のマイクロキャリア濃度を低く、槽底部でのマイクロキャリア濃度を高くする濃度分布を形成させることに関する記載がある。しかしながら、通常用いられる濁度計測手段は、培養液の濁度を光学的に計測するものであり、培養中に細胞や細胞由来の固形物、培地由来の脂質等が光透過用透明部材に付着し、計測感度が次第に低下するという問題がある。また、細胞付着量によってマイクロキャリアにおける光透過量及び/又は散乱量が変化することから、濁度計測値とマイクロキャリア密度の関係も培養中に変化してしまい、精密な計測が困難であるといった問題がある。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特開平03-272678公報
【特許文献2】特開平06-209761公報
【特許文献3】特開平06-269274公報
【特許文献4】特開2005-237274公報
【特許文献5】特開平4-169176公報
【特許文献6】特開平7-203945公報
【非特許文献】
【0007】
【非特許文献1】バイオテクノロジー アンド バイオエンジニアリング(Biotechnology and Bioengineering)第32巻975頁〜982頁(1988年発行)
【発明の概要】
【発明が解決しようとする課題】
【0008】
本発明は、上述した実情に鑑み、生体細胞、特にマイクロキャリアを用いて生体細胞を培養する際に、培養液の撹拌速度を高精度に制御することで、長期に亘って生体細胞の培養を持続することができる生体細胞の培養方法及び培養装置を提供することを目的とする。
【課題を解決するための手段】
【0009】
上記の目的を達成する本発明は、以下の内容を包含する。
(1)培養槽内の培養液における溶存酸素濃度を当該培養槽内の空間における複数の箇所について測定し、測定された複数の溶存酸素濃度の差に基づいて、培養槽内の培養液に対する撹拌速度を決定することを特徴とする生体細胞の培養方法。
(2)前記生体細胞は生育及び増殖に関する付着依存性を有し、当該生体細胞を微粒子担体に付着した状態で培養することを特徴とする(1)記載の生体細胞の培養方法。
(3)前記微粒子担体は、前記生体細胞の足場となる培養面を有するマイクロキャリアであることを特徴とする(1)記載の生体細胞の培養方法。
(4)前記溶存酸素濃度は、培養槽内の槽底部近傍及び液面近傍において測定されることを特徴とする(1)記載の生体細胞の培養方法。
(5)生体細胞を培養するための培養液を収容する培養槽と、前記培養槽に配設され、前記培養槽内の培養液に含まれる溶存酸素濃度を測定するための複数の溶存酸素濃度計測手段と、培養槽内の培養液を撹拌する撹拌手段と、前記複数の溶存酸素濃度計測手段で測定した溶存酸素濃度の差異を算出するとともに、当該差異に基づいて上記撹拌手段を制御する制御手段とを備え、前記制御手段は、前記溶存酸素濃度の差異が許容範囲内にあるか否かを判定し、当該差異が許容範囲外である場合には許容範囲内に収まるように撹拌機の回転速度を制御することを特徴とする生体細胞の培養装置。
(6)前記生体細胞は生育及び増殖に関する付着依存性を有し、当該生体細胞を微粒子担体に付着した状態で培養することを特徴とする(5)記載の生体細胞の培養装置。
(7)前記微粒子担体は、前記生体細胞の足場となる培養面を有するマイクロキャリアであることを特徴とする(5)記載の生体細胞の培養装置。
(8)前記溶存酸素濃度測定手段は、少なくとも、前記培養槽内の槽底部近傍及び液面近傍に配設されていることを特徴とする(5)記載の生体細胞の培養装置。
(9)培養槽に収容された培養液の濁度を測定する濁度測定手段を有しないことを特徴とする(5)記載の生体細胞の培養装置。
【発明の効果】
【0010】
本発明に係る生体細胞の培養方法及び培養装置によれば、生体細胞や生体細胞を付着した微粒子担体の濃度をより均一に制御しながら培養を行うことができる。したがって、本発明に係る生体細胞の培養方法及び培養装置を適用することによって、生体細胞に望ましい撹拌条件を高精度に維持することができ、生体細胞や生体細胞を付着した微粒子担体の混合不良又は過剰混合を回避することができ、生体細胞の培養を良好に実施できる。
【図面の簡単な説明】
【0011】
【図1】本発明の培養方法の一実施例を示すフロー図である。
【図2】本発明の培養装置の一実施例を示すフロー図である。
【図3】本発明の一実施例での培養実験の結果を示す図である。
【図4】比較として実施した培養実験の結果を示す図である。
【発明を実施するための形態】
【0012】
以下、図面を参照して本発明に係る生体細胞の培養方法及び培養装置を詳細に説明する。本発明に係る生体細胞の培養方法は、例えば、医薬品等の主原料となる物質を生産する生体細胞の培養に適用することができる。本発明において、生産対象の物質としては、培養した生体細胞それ自体、及び抗体や酵素等のタンパク質、低分子化合物及び高分子化合物等の生理活性物質、ウイルス等を挙げることができる。また、培養対象の生体細胞としては、動物細胞、植物細胞、昆虫細胞、細菌、酵母、真菌及び藻類等を挙げることができる。特に、抗体や酵素等のタンパク質、ウイルスを生産する動物細胞を培養対象とすることが好ましい。
【0013】
特に本発明においては、付着依存性を有する生体細胞を培養対象とすることが好ましい。ここで、付着依存性とは、浮遊状態では生育や増殖することができず、細胞外マトリックスやこれを模した足場と接着した状態で生育や増殖が可能なる特徴を意味する。このような付着依存性を有する生体細胞は、通常、足場となる微粒子担体に付着した状態で培養が行われる。微粒子担体としては、特に限定されず、生体細胞の培養に使用されている如何なる形状、寸法の担体を使用することができる。微粒子担体の一例としては、足場となる培養面を有するマイクロキャリアを挙げることができる。
【0014】
本発明に係る生体細胞の培養方法及び培養装置では、上述した生体細胞をそのまま培養する系及び上述した生体細胞を微粒子担体に付着した状態で培養する系のいずれにも適用することができる。本発明に係る生体細胞の培養方法及び培養装置では、培養槽における空間的に離間した位置における溶存酸素濃度の差異を測定し、この差異に基づいて培養対象の生体細胞や生体細胞を付着した微粒子担体の密度分布を判断し、密度分布が均一となるように撹拌条件を制御する。すなわち、本発明に係る生体細胞の培養方法及び培養装置は、培養液中の所定の空間における生体細胞や生体細胞を付着した微粒子担体の密度が、当該空間における溶存酸素濃度と相関しているといった知見に基づいている。
【0015】
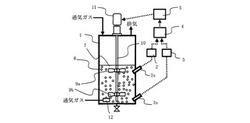
図1は、本発明を適用した生体細胞の培養方法の一例を示すフロー図である。本培養方法においては、例えば、ガラス製で直径240mm、培養液張り込み高さ330mm、培養容積15Lの培養槽1、溶存酸素濃度計測手段2及び3、判定装置4、制御装置5を備えている。培養槽1内に張り込まれた培養液7中には、生体細胞を付着した微粒子担体であるマイクロキャリア8が浮遊している。マイクロキャリア8には付着依存性を有する生体細胞が増殖するための培養面が設けられている。生体細胞を培養面に接触させると増殖を開始する。マイクロキャリア8は培養液よりもわずかに比重が大きく、生体細胞が増殖するとさらに比重が大きくなる。このため、静置状態では培養槽1の底部に沈降する。このため、培養液中に設けられた回転直径100mmのパドル形撹拌翼9a及び9bを回転させて培養液7を流動させることにより、マイクロキャリア8を浮遊させている。撹拌翼9a及び9bは撹拌軸10に取り付けられており、撹拌機駆動モータ11によって所望の速度で回転させる。撹拌翼9a及び9bの撹拌速度は、撹拌機駆動モータ11の回転速度を制御することによって調整することができる。
【0016】
本例においては、培養装置は、溶存酸素濃度計測手段2及び3の2基を備えている。溶存酸素濃度計測手段2及び3は、それぞれ、液面から50mm下の液面近傍にセンサー2s、槽底から50mmの槽底部近傍にセンサー3sを有している。なお、培養における溶存酸素濃度は、溶存酸素濃度計測手段2、3及びセンサー3s、2sでの計測値を基に酸素濃度を増減する方法、又は散気管12からの培養液中への酸素含有ガスの吹き込み量を増減する方法のいずれかまたは両法を併用することによって制御されている。
【0017】
本発明に係る生体細胞の培養方法及び培養装置では、溶存酸素濃度計測手段2及び3で測定した溶存酸素濃度計測値DOをそれぞれ判定装置4に伝達する。判定装置4においては、溶存酸素濃度計測手段2及び3より伝達された溶存酸素濃度計測値DO(mg/L)の差分ΔDO(mg/L)を求める。すなわち、溶存酸素濃度計測手段2より伝達された溶存酸素濃度計測値DOHが4.5 mg/L、溶存酸素濃度計測手段3より伝達された溶存酸素濃度計測値DOLが3.1mg/Lである場合に、ΔDO=1.4 mg/Lとなる。本来、培養槽は均一混合状態を得るために撹拌機が設置されており、細胞が存在しない場合はΔDOは無視しうるものである。したがって、ΔDO=1.4 mg/Lといった溶存酸素濃度の差異が生じるのは、生体細胞による酸素消費量が培養液の領域によって異なることが主要因である。培養液中の生体細胞による酸素消費量Oc(mg/s・L)は式1により算出される。
【0018】
【数1】

【0019】
一方、培養液中に酸素が溶解して増加する溶存酸素濃度の変化は、式2により算出される。
【0020】
【数2】

【0021】
ここで、計測の間に溶存酸素濃度計測値に変化が無い場合には、式3が成立する。
【0022】
【数3】

【0023】
すなわち、細胞による酸素消費量と通気による酸素溶解量とが同一になり、式4が成り立つ。
【0024】
【数4】

【0025】
式4より式5が得られる。
【0026】
【数5】

【0027】
ここで、DOH=CH、DOL=CLとすると、ΔDOについては下記の式6のようになる。
【0028】
【数6】

【0029】
ここで、XH−XL=ΔX、1000・γ/ KLa=α(mg/個)とおくと、式6は式7となる。
【0030】
【数7】

【0031】
すなわち、ΔXは係数αによってΔDOに比例することがわかる。なお、αは撹拌や通気量によっての変化するKLaを含むものであるため一定ではない。このため、同じ培養装置を使用しての培養を繰り返し実施することにより、細胞の増殖とそれに伴って増加する通気量によってαの変化をある程度推測できるようにしておくことが肝要である。発明者らの検討により、本発明に係る生体細胞の培養方法及び培養装置において、αはおおむね1〜10×10-5(mg/個)の範囲で変化する。
【0032】
つぎに、培養槽1より培養液中に浮遊するマイクロキャリアを採取し、マイクロキャリア表面で増殖している細胞密度X*(個/ml)を計測する。マイクロキャリア上の細胞を計測する方法は特に限定するものではなく、トリプシン処理によって細胞を剥離させてから計測する方法や、核放出法によって液中に放出された核数を計測する方法等を用いる。なお、マイクロキャリアの採取では、事前に培養槽内でのマイクロキャリアの分布を解消してから実施することが肝要である。
【0033】
判定装置4において、細胞密度X*(個/ml)とΔXを比較してΔXが許容範囲にあるかどうかを判定する。許容範囲としては、培養装置と培養する細胞との関係で設定される。発明者らの検討では、通常5〜20%の範囲に設定すれば、特に大きな培養阻害を引き起こすことは無い。
【0034】
判定装置4においてΔXが許容範囲外であると判断した場合、判定装置4は撹拌機駆動モータ11の回転速度を増加する指令を制御装置5に伝達する。判定装置4においてΔXが許容範囲内であると判断した場合、判断装置4は撹拌機駆動モータ11の回転速度を現状維持する指令を制御装置5に伝達する。制御装置5は判定装置4に指令に基づき、撹拌機駆動モータ11の回転数を制御する。これによって、ΔXが許容範囲外である場合には撹拌翼9a及び9bの回転数が増加されることによって培養液7の撹拌が強化され、マイクロキャリア8の分散状況が改善される。所定時間後に上記の計測、判定動作を繰り返し行うことで、ΔXが許容範囲内に収まるように撹拌翼9a及び9bの回転速度制御を繰り返して行うことが好ましい。これにより、生体細胞が増殖することによって比重が大きくなり、沈降しやすくなったマイクロキャリアを培養液中に良好に浮遊させ、より均一に分散した状態で培養することが可能となる。
【0035】
また、本発明に係る培養方法及び培養装置では、濁度測定装置を用いて生体細胞や生体細胞を付着したマイクロキャリアの分散状態を判断しておらず、長期使用に伴う濁度測定装置の測定感度劣化に起因する制御不良を防止することができる。換言すれると、本発明に係る培養方法及び培養装置によれば、溶存酸素濃度に基づいて生体細胞や生体細胞を付着したマイクロキャリアの分散状態を判断するため、長期間に亘って生体細胞の培養を係属することができる。
【0036】
図3に本例において実際に動物細胞の培養を行った1例を示す。動物細胞としては、CHO-K1細胞を使用した。培地としては、CD-CHO培地(インビトロジェン製)を使用した。マイクロキャリアとしては、サイトデックス1(GEヘルスケア製)を乾燥重量で0.5%の比率で培地に加えた。培養中の酸素の通気は、液中に酸素を断続的に通気する方法で行った。培養を開始するに当たっては、あらかじめ別容器にて調製したCHO-K1細胞をトリプシン処理で剥離させ、細胞密度が2×105(個/ml)となるように播種して培養を開始した。なお、溶存酸素濃度計測手段3による溶存酸素濃度計測値DOLの制御値は3.0mg/Lに設定した。また、ΔXの許容範囲は10%とした。本培養装置の場合、撹拌回転数が20rpm以下ではマイクロキャリアの一部が培養槽底に沈積するため、培養開始持の回転数を25rpmとした。培養期間中、1日に1回の頻度で培養液を採取し、マイクロキャリア上で増殖した細胞量を計測した。なお、培養液採取の際は、マイクロキャリアが均一に培養液中に分散するよう、手動にて回転数を50rpmに増加させた。その結果、図3に示すようにΔDOの値はおおむね0.5mg/Lの範囲内に維持された。撹拌回転数は38rpmまで増加した。最高細胞到達密度は、培養6日目の7×106(個/ml)であった。培養6日目のマイクロキャリアを光学顕微鏡で観察すると、その表面の全面が細胞によって覆われたいわゆるコンフルエントの状態であり、マイクロキャリアの損傷もほとんど認められなかった。
【0037】
図4には、図3に示す実験と同じ装置を使用しながら本発明になる培養方法を適用しなかった場合の実験結果を比較として示す。培養開始手法は上記のとおりである。本実実施例では、撹拌速度を全期間を通じて25rpmとした。培養液採取の際のみ、手動にて回転数を50回転に増加させた。その結果、図4に示すようにΔDOの値は培養8日目に18mg/Lまで増加した。このとき、マイクロキャリアの大半は培養液張り込み高さの半分以下の部分にあり、液面付近の培養液に固形物はほとんど見られなかった。最高細胞到達密度は、培養7日目の4×106(個/ml)であった。培養7日目のマイクロキャリアの表面には細胞の増殖していない部分が残されており、マイクロキャリアの断片も認められた。
【0038】
なお、本発明は、上述した図1に示したような構成の培養装置及びこれを用いた生体細胞の培養方法に限定されるものではなく、例えば、図2に示すような培養装置及びこれを用いた生体細胞の培養方法に適用することもできる。図2に示す培養装置は、図1に示した培養装置において培地16を収容する培地槽15及び使用済みの培養液18を収容する廃液槽17を設置し、培養中に培地の交換を実施できるものである。なお、図2中には図示していないが、培養設備には不可欠であるところの、空気、酸素、窒素及び炭酸ガス等のガス供給設備、温水冷水供給設備、蒸気供給設備、給排水設備、及び各種の計測手段を具備している。
【0039】
培養槽1は断面で表わしている。培養槽1内に張り込まれた培養液7は、攪拌翼9a及び9bで均一に混合される。図2に示す培養装置においても、上述したように、溶存酸素濃度計測手段2及び3、判定装置4及び制御装置5を備え、溶存酸素濃度計測手段2及び3で測定した溶存酸素濃度計測値DOに基づいて撹拌翼9a及び9bの回転速度制御を行い、生体細胞や生体細胞を付着したマイクロキャリアをより均一に分散するように撹拌することができる。
【0040】
なお、図2に示す培養装置において、培養に必要な酸素は、酸素含有ガスを槽底部に配置された散気手段12から液中に供給する液中通気法と槽上部気相部に通気する上面通気法の二つの方法により供給される。
【0041】
液中及び上面への通気系統のそれぞれに空気、酸素、炭酸ガスの各ガスについての流量制御機能と供給量計測機能を具備している。上面への通気は、本実施形態では空気を一定量で通気し、培養液のpHに対応して炭酸ガスを混合した。炭酸ガス濃度の制御はpHを制御量とし、炭酸ガス流量を操作因子とする通常の比例制御で実施した。散気手段12からの培養液中への通気は、本実施形態では培養液の溶存酸素濃度を制御量とし、酸素通気量を操作因子とした。
【0042】
培養槽1は圧力計25の計測結果をもとに、圧力調整弁26によって一定の圧力に保持されている。通常は外部からの細菌等の侵入を防ぐため、0.01〜0.05MPaに加圧されている。なお、使用されるガス類はあらかじめ細菌等の微粒子を除去したものを使用する。
【0043】
培地槽15は移送管路21、廃液槽17は移送管路22によって培養槽1と連通している。移送管路21には弁31、移送管路22には弁32が設置されている。例えば、培養槽1に弁31を開くことによって培地槽15から移送管路21によって培地16を所定量移送することができる。ついで、あらかじめ調整されたマイクロキャリア及び種細胞を培養槽に注入し、培養を開始する。なお、培養中は、所定時間ごとに培養槽1から培養液を採取し、細胞密度やグルコース濃度、グルタミン濃度及びアンモニア濃度などの必要な成分を計測することができる。
【0044】
また、培養槽1から採取した培養液中のグルコース濃度、グルタミン濃度及びアンモニア濃度などの成分が培養に適さなくなったと判断された場合には、培地の交換を実施することができる。この場合、撹拌及び液中への通気を止め、マイクロキャリアを沈降させる。ついで、弁32を開いて移送管路22によって廃液槽17に培養槽1から使用済みの培養液18が排出される。なお、移送管路22は培養槽内のマイクロキャリアの沈降面より上部に開口しており、マイクロキャリアを廃液槽17に流出させないよう配慮されている。使用済みの培養液18の排出が完了後、弁32を閉じる。ついで、弁31を開いて培地槽15から移送管路21によって所定量の培地16を培養槽1に移送する。移送完了後、培養を再開する。
【0045】
上記の培養操作中は、本発明になる培養方法を適用することによって、過剰な撹拌を防ぎつつ、マイクロキャリアをほぼ均一に分散させた状態で培養を実施できる。本培養装置によれば、過剰な撹拌を防ぎ、マイクロキャリアをほぼ均一に分散させた状態で培養を実施できることによって、良好な培養を行うことが可能となる。
【符号の説明】
【0046】
1…培養槽、2、3…微粒子密度計測手段、4…判定装置、5…制御装置、7…培養液、8・・・マイクロキャリア、9…撹拌翼、 11…撹拌機駆動モータ、15…培地槽、17・・・廃液槽
【技術分野】
【0001】
本発明は、生体細胞の培養方法及び生体細胞を培養できる培養装置に関する。
【背景技術】
【0002】
生体細胞の培養では、目的生産物の生産性向上のために生体細胞を高密度で培養することが望まれている。生体細胞のなかには、浮遊状態では生育や増殖することができず、細胞外マトリックスやこれを模した足場と接着した状態で生育や増殖が可能となるものがある。このような付着依存性を有する細胞を培養する場合、増殖のための足場が必要であり、小規模培養の場合はローラーボトルや培養フラスコの壁面を足場として付着させて増殖させることにより培養する手法が用いられてきた。中規模又は大規模での培養では、表面や内部に細胞が付着して増殖することが可能な培養面を有するマイクロキャリアと称される微細な粒子が使用され、これを培養液中に浮遊させることにより、浮遊性の細胞のごとく培養する手法が用いられる。
【0003】
非特許文献1には、マイクロキャリアを用いた培養において、培養に好適なマイクロキャリア密度が存在すること、及び過剰な撹拌は大きな増殖阻害を引き起こすことが記載されている。これまでに種々のマイクロキャリアを使用する細胞培養装置が開発されている。特許文献1には、コイル状に整形した多孔質チューブの表面から酸素供給を行うことを特徴とする培養装置に関する記載がある。特許文献2には、マイクロキャリアを沈降分離する手段を培養槽内に設置することによって培地の交換を連続的に実施することを特徴とする培養装置に関する記載がある。特許文献3には、培養槽外に酸素供給槽を設け、培養槽内に設置した振動スクリーンによってマイクロキャリアを除いた培養液を酸素供給槽に導き、酸素供給槽内で液中通気法によって酸素を溶解させた後、培養槽に循環させることを特徴とする培養装置に関する記載がある。特許文献4には、煩雑なマイクロキャリア培養の操作手順を自動化したことを特徴とする培養装置に関する記載がある。特許文献5には、円筒型カラムにマイクロキャリアを充填した状態で細胞の培養を行わせることを特徴とする培養装置に関する記載がある。
【0004】
これら従来の手法は、培養密度の高密度化のために必要となる酸素や栄養源の供給方法に主眼がおかれて開発されたものであるが、共通する問題としてスケールアップに対応できないことがある。例えば、マイクロキャリアを用いた生体細胞の培養では、マイクロキャリアの細胞増殖面上で増殖した細胞量によって比重が大きくなり、培養液中での沈降速度が大きくなる現象が生じるため、培養槽内の撹拌速度を適宜調整する必要がある。すなわち、マイクロキャリアを培養液中に浮遊させるための撹拌速度は、培養初期と培養終期とでは異なる。培養初期にあわせた回転速度で培養を継続した場合には、培養終期では細胞が増殖したマイクロキャリアが培養槽底に沈積してしまう虞がある。逆に、培養終期にあわせた回転速度で培養を開始した場合には、培養初期に過剰撹拌となって細胞増殖を阻害してしまう虞がある。したがって、マイクロキャリア上の細胞の増殖量に対応して撹拌速度を適切に制御することが好ましい。
【0005】
特許文献6には、培養槽外に設けた酸素供給槽にマイクロキャリアを除いた培養液を循環させて酸素供給を行う培養装置において、培養槽内に複数の濁度計測手段を配置して分離用スクリーン近傍のマイクロキャリア濃度を低く、槽底部でのマイクロキャリア濃度を高くする濃度分布を形成させることに関する記載がある。しかしながら、通常用いられる濁度計測手段は、培養液の濁度を光学的に計測するものであり、培養中に細胞や細胞由来の固形物、培地由来の脂質等が光透過用透明部材に付着し、計測感度が次第に低下するという問題がある。また、細胞付着量によってマイクロキャリアにおける光透過量及び/又は散乱量が変化することから、濁度計測値とマイクロキャリア密度の関係も培養中に変化してしまい、精密な計測が困難であるといった問題がある。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特開平03-272678公報
【特許文献2】特開平06-209761公報
【特許文献3】特開平06-269274公報
【特許文献4】特開2005-237274公報
【特許文献5】特開平4-169176公報
【特許文献6】特開平7-203945公報
【非特許文献】
【0007】
【非特許文献1】バイオテクノロジー アンド バイオエンジニアリング(Biotechnology and Bioengineering)第32巻975頁〜982頁(1988年発行)
【発明の概要】
【発明が解決しようとする課題】
【0008】
本発明は、上述した実情に鑑み、生体細胞、特にマイクロキャリアを用いて生体細胞を培養する際に、培養液の撹拌速度を高精度に制御することで、長期に亘って生体細胞の培養を持続することができる生体細胞の培養方法及び培養装置を提供することを目的とする。
【課題を解決するための手段】
【0009】
上記の目的を達成する本発明は、以下の内容を包含する。
(1)培養槽内の培養液における溶存酸素濃度を当該培養槽内の空間における複数の箇所について測定し、測定された複数の溶存酸素濃度の差に基づいて、培養槽内の培養液に対する撹拌速度を決定することを特徴とする生体細胞の培養方法。
(2)前記生体細胞は生育及び増殖に関する付着依存性を有し、当該生体細胞を微粒子担体に付着した状態で培養することを特徴とする(1)記載の生体細胞の培養方法。
(3)前記微粒子担体は、前記生体細胞の足場となる培養面を有するマイクロキャリアであることを特徴とする(1)記載の生体細胞の培養方法。
(4)前記溶存酸素濃度は、培養槽内の槽底部近傍及び液面近傍において測定されることを特徴とする(1)記載の生体細胞の培養方法。
(5)生体細胞を培養するための培養液を収容する培養槽と、前記培養槽に配設され、前記培養槽内の培養液に含まれる溶存酸素濃度を測定するための複数の溶存酸素濃度計測手段と、培養槽内の培養液を撹拌する撹拌手段と、前記複数の溶存酸素濃度計測手段で測定した溶存酸素濃度の差異を算出するとともに、当該差異に基づいて上記撹拌手段を制御する制御手段とを備え、前記制御手段は、前記溶存酸素濃度の差異が許容範囲内にあるか否かを判定し、当該差異が許容範囲外である場合には許容範囲内に収まるように撹拌機の回転速度を制御することを特徴とする生体細胞の培養装置。
(6)前記生体細胞は生育及び増殖に関する付着依存性を有し、当該生体細胞を微粒子担体に付着した状態で培養することを特徴とする(5)記載の生体細胞の培養装置。
(7)前記微粒子担体は、前記生体細胞の足場となる培養面を有するマイクロキャリアであることを特徴とする(5)記載の生体細胞の培養装置。
(8)前記溶存酸素濃度測定手段は、少なくとも、前記培養槽内の槽底部近傍及び液面近傍に配設されていることを特徴とする(5)記載の生体細胞の培養装置。
(9)培養槽に収容された培養液の濁度を測定する濁度測定手段を有しないことを特徴とする(5)記載の生体細胞の培養装置。
【発明の効果】
【0010】
本発明に係る生体細胞の培養方法及び培養装置によれば、生体細胞や生体細胞を付着した微粒子担体の濃度をより均一に制御しながら培養を行うことができる。したがって、本発明に係る生体細胞の培養方法及び培養装置を適用することによって、生体細胞に望ましい撹拌条件を高精度に維持することができ、生体細胞や生体細胞を付着した微粒子担体の混合不良又は過剰混合を回避することができ、生体細胞の培養を良好に実施できる。
【図面の簡単な説明】
【0011】
【図1】本発明の培養方法の一実施例を示すフロー図である。
【図2】本発明の培養装置の一実施例を示すフロー図である。
【図3】本発明の一実施例での培養実験の結果を示す図である。
【図4】比較として実施した培養実験の結果を示す図である。
【発明を実施するための形態】
【0012】
以下、図面を参照して本発明に係る生体細胞の培養方法及び培養装置を詳細に説明する。本発明に係る生体細胞の培養方法は、例えば、医薬品等の主原料となる物質を生産する生体細胞の培養に適用することができる。本発明において、生産対象の物質としては、培養した生体細胞それ自体、及び抗体や酵素等のタンパク質、低分子化合物及び高分子化合物等の生理活性物質、ウイルス等を挙げることができる。また、培養対象の生体細胞としては、動物細胞、植物細胞、昆虫細胞、細菌、酵母、真菌及び藻類等を挙げることができる。特に、抗体や酵素等のタンパク質、ウイルスを生産する動物細胞を培養対象とすることが好ましい。
【0013】
特に本発明においては、付着依存性を有する生体細胞を培養対象とすることが好ましい。ここで、付着依存性とは、浮遊状態では生育や増殖することができず、細胞外マトリックスやこれを模した足場と接着した状態で生育や増殖が可能なる特徴を意味する。このような付着依存性を有する生体細胞は、通常、足場となる微粒子担体に付着した状態で培養が行われる。微粒子担体としては、特に限定されず、生体細胞の培養に使用されている如何なる形状、寸法の担体を使用することができる。微粒子担体の一例としては、足場となる培養面を有するマイクロキャリアを挙げることができる。
【0014】
本発明に係る生体細胞の培養方法及び培養装置では、上述した生体細胞をそのまま培養する系及び上述した生体細胞を微粒子担体に付着した状態で培養する系のいずれにも適用することができる。本発明に係る生体細胞の培養方法及び培養装置では、培養槽における空間的に離間した位置における溶存酸素濃度の差異を測定し、この差異に基づいて培養対象の生体細胞や生体細胞を付着した微粒子担体の密度分布を判断し、密度分布が均一となるように撹拌条件を制御する。すなわち、本発明に係る生体細胞の培養方法及び培養装置は、培養液中の所定の空間における生体細胞や生体細胞を付着した微粒子担体の密度が、当該空間における溶存酸素濃度と相関しているといった知見に基づいている。
【0015】
図1は、本発明を適用した生体細胞の培養方法の一例を示すフロー図である。本培養方法においては、例えば、ガラス製で直径240mm、培養液張り込み高さ330mm、培養容積15Lの培養槽1、溶存酸素濃度計測手段2及び3、判定装置4、制御装置5を備えている。培養槽1内に張り込まれた培養液7中には、生体細胞を付着した微粒子担体であるマイクロキャリア8が浮遊している。マイクロキャリア8には付着依存性を有する生体細胞が増殖するための培養面が設けられている。生体細胞を培養面に接触させると増殖を開始する。マイクロキャリア8は培養液よりもわずかに比重が大きく、生体細胞が増殖するとさらに比重が大きくなる。このため、静置状態では培養槽1の底部に沈降する。このため、培養液中に設けられた回転直径100mmのパドル形撹拌翼9a及び9bを回転させて培養液7を流動させることにより、マイクロキャリア8を浮遊させている。撹拌翼9a及び9bは撹拌軸10に取り付けられており、撹拌機駆動モータ11によって所望の速度で回転させる。撹拌翼9a及び9bの撹拌速度は、撹拌機駆動モータ11の回転速度を制御することによって調整することができる。
【0016】
本例においては、培養装置は、溶存酸素濃度計測手段2及び3の2基を備えている。溶存酸素濃度計測手段2及び3は、それぞれ、液面から50mm下の液面近傍にセンサー2s、槽底から50mmの槽底部近傍にセンサー3sを有している。なお、培養における溶存酸素濃度は、溶存酸素濃度計測手段2、3及びセンサー3s、2sでの計測値を基に酸素濃度を増減する方法、又は散気管12からの培養液中への酸素含有ガスの吹き込み量を増減する方法のいずれかまたは両法を併用することによって制御されている。
【0017】
本発明に係る生体細胞の培養方法及び培養装置では、溶存酸素濃度計測手段2及び3で測定した溶存酸素濃度計測値DOをそれぞれ判定装置4に伝達する。判定装置4においては、溶存酸素濃度計測手段2及び3より伝達された溶存酸素濃度計測値DO(mg/L)の差分ΔDO(mg/L)を求める。すなわち、溶存酸素濃度計測手段2より伝達された溶存酸素濃度計測値DOHが4.5 mg/L、溶存酸素濃度計測手段3より伝達された溶存酸素濃度計測値DOLが3.1mg/Lである場合に、ΔDO=1.4 mg/Lとなる。本来、培養槽は均一混合状態を得るために撹拌機が設置されており、細胞が存在しない場合はΔDOは無視しうるものである。したがって、ΔDO=1.4 mg/Lといった溶存酸素濃度の差異が生じるのは、生体細胞による酸素消費量が培養液の領域によって異なることが主要因である。培養液中の生体細胞による酸素消費量Oc(mg/s・L)は式1により算出される。
【0018】
【数1】

【0019】
一方、培養液中に酸素が溶解して増加する溶存酸素濃度の変化は、式2により算出される。
【0020】
【数2】

【0021】
ここで、計測の間に溶存酸素濃度計測値に変化が無い場合には、式3が成立する。
【0022】
【数3】

【0023】
すなわち、細胞による酸素消費量と通気による酸素溶解量とが同一になり、式4が成り立つ。
【0024】
【数4】

【0025】
式4より式5が得られる。
【0026】
【数5】

【0027】
ここで、DOH=CH、DOL=CLとすると、ΔDOについては下記の式6のようになる。
【0028】
【数6】

【0029】
ここで、XH−XL=ΔX、1000・γ/ KLa=α(mg/個)とおくと、式6は式7となる。
【0030】
【数7】

【0031】
すなわち、ΔXは係数αによってΔDOに比例することがわかる。なお、αは撹拌や通気量によっての変化するKLaを含むものであるため一定ではない。このため、同じ培養装置を使用しての培養を繰り返し実施することにより、細胞の増殖とそれに伴って増加する通気量によってαの変化をある程度推測できるようにしておくことが肝要である。発明者らの検討により、本発明に係る生体細胞の培養方法及び培養装置において、αはおおむね1〜10×10-5(mg/個)の範囲で変化する。
【0032】
つぎに、培養槽1より培養液中に浮遊するマイクロキャリアを採取し、マイクロキャリア表面で増殖している細胞密度X*(個/ml)を計測する。マイクロキャリア上の細胞を計測する方法は特に限定するものではなく、トリプシン処理によって細胞を剥離させてから計測する方法や、核放出法によって液中に放出された核数を計測する方法等を用いる。なお、マイクロキャリアの採取では、事前に培養槽内でのマイクロキャリアの分布を解消してから実施することが肝要である。
【0033】
判定装置4において、細胞密度X*(個/ml)とΔXを比較してΔXが許容範囲にあるかどうかを判定する。許容範囲としては、培養装置と培養する細胞との関係で設定される。発明者らの検討では、通常5〜20%の範囲に設定すれば、特に大きな培養阻害を引き起こすことは無い。
【0034】
判定装置4においてΔXが許容範囲外であると判断した場合、判定装置4は撹拌機駆動モータ11の回転速度を増加する指令を制御装置5に伝達する。判定装置4においてΔXが許容範囲内であると判断した場合、判断装置4は撹拌機駆動モータ11の回転速度を現状維持する指令を制御装置5に伝達する。制御装置5は判定装置4に指令に基づき、撹拌機駆動モータ11の回転数を制御する。これによって、ΔXが許容範囲外である場合には撹拌翼9a及び9bの回転数が増加されることによって培養液7の撹拌が強化され、マイクロキャリア8の分散状況が改善される。所定時間後に上記の計測、判定動作を繰り返し行うことで、ΔXが許容範囲内に収まるように撹拌翼9a及び9bの回転速度制御を繰り返して行うことが好ましい。これにより、生体細胞が増殖することによって比重が大きくなり、沈降しやすくなったマイクロキャリアを培養液中に良好に浮遊させ、より均一に分散した状態で培養することが可能となる。
【0035】
また、本発明に係る培養方法及び培養装置では、濁度測定装置を用いて生体細胞や生体細胞を付着したマイクロキャリアの分散状態を判断しておらず、長期使用に伴う濁度測定装置の測定感度劣化に起因する制御不良を防止することができる。換言すれると、本発明に係る培養方法及び培養装置によれば、溶存酸素濃度に基づいて生体細胞や生体細胞を付着したマイクロキャリアの分散状態を判断するため、長期間に亘って生体細胞の培養を係属することができる。
【0036】
図3に本例において実際に動物細胞の培養を行った1例を示す。動物細胞としては、CHO-K1細胞を使用した。培地としては、CD-CHO培地(インビトロジェン製)を使用した。マイクロキャリアとしては、サイトデックス1(GEヘルスケア製)を乾燥重量で0.5%の比率で培地に加えた。培養中の酸素の通気は、液中に酸素を断続的に通気する方法で行った。培養を開始するに当たっては、あらかじめ別容器にて調製したCHO-K1細胞をトリプシン処理で剥離させ、細胞密度が2×105(個/ml)となるように播種して培養を開始した。なお、溶存酸素濃度計測手段3による溶存酸素濃度計測値DOLの制御値は3.0mg/Lに設定した。また、ΔXの許容範囲は10%とした。本培養装置の場合、撹拌回転数が20rpm以下ではマイクロキャリアの一部が培養槽底に沈積するため、培養開始持の回転数を25rpmとした。培養期間中、1日に1回の頻度で培養液を採取し、マイクロキャリア上で増殖した細胞量を計測した。なお、培養液採取の際は、マイクロキャリアが均一に培養液中に分散するよう、手動にて回転数を50rpmに増加させた。その結果、図3に示すようにΔDOの値はおおむね0.5mg/Lの範囲内に維持された。撹拌回転数は38rpmまで増加した。最高細胞到達密度は、培養6日目の7×106(個/ml)であった。培養6日目のマイクロキャリアを光学顕微鏡で観察すると、その表面の全面が細胞によって覆われたいわゆるコンフルエントの状態であり、マイクロキャリアの損傷もほとんど認められなかった。
【0037】
図4には、図3に示す実験と同じ装置を使用しながら本発明になる培養方法を適用しなかった場合の実験結果を比較として示す。培養開始手法は上記のとおりである。本実実施例では、撹拌速度を全期間を通じて25rpmとした。培養液採取の際のみ、手動にて回転数を50回転に増加させた。その結果、図4に示すようにΔDOの値は培養8日目に18mg/Lまで増加した。このとき、マイクロキャリアの大半は培養液張り込み高さの半分以下の部分にあり、液面付近の培養液に固形物はほとんど見られなかった。最高細胞到達密度は、培養7日目の4×106(個/ml)であった。培養7日目のマイクロキャリアの表面には細胞の増殖していない部分が残されており、マイクロキャリアの断片も認められた。
【0038】
なお、本発明は、上述した図1に示したような構成の培養装置及びこれを用いた生体細胞の培養方法に限定されるものではなく、例えば、図2に示すような培養装置及びこれを用いた生体細胞の培養方法に適用することもできる。図2に示す培養装置は、図1に示した培養装置において培地16を収容する培地槽15及び使用済みの培養液18を収容する廃液槽17を設置し、培養中に培地の交換を実施できるものである。なお、図2中には図示していないが、培養設備には不可欠であるところの、空気、酸素、窒素及び炭酸ガス等のガス供給設備、温水冷水供給設備、蒸気供給設備、給排水設備、及び各種の計測手段を具備している。
【0039】
培養槽1は断面で表わしている。培養槽1内に張り込まれた培養液7は、攪拌翼9a及び9bで均一に混合される。図2に示す培養装置においても、上述したように、溶存酸素濃度計測手段2及び3、判定装置4及び制御装置5を備え、溶存酸素濃度計測手段2及び3で測定した溶存酸素濃度計測値DOに基づいて撹拌翼9a及び9bの回転速度制御を行い、生体細胞や生体細胞を付着したマイクロキャリアをより均一に分散するように撹拌することができる。
【0040】
なお、図2に示す培養装置において、培養に必要な酸素は、酸素含有ガスを槽底部に配置された散気手段12から液中に供給する液中通気法と槽上部気相部に通気する上面通気法の二つの方法により供給される。
【0041】
液中及び上面への通気系統のそれぞれに空気、酸素、炭酸ガスの各ガスについての流量制御機能と供給量計測機能を具備している。上面への通気は、本実施形態では空気を一定量で通気し、培養液のpHに対応して炭酸ガスを混合した。炭酸ガス濃度の制御はpHを制御量とし、炭酸ガス流量を操作因子とする通常の比例制御で実施した。散気手段12からの培養液中への通気は、本実施形態では培養液の溶存酸素濃度を制御量とし、酸素通気量を操作因子とした。
【0042】
培養槽1は圧力計25の計測結果をもとに、圧力調整弁26によって一定の圧力に保持されている。通常は外部からの細菌等の侵入を防ぐため、0.01〜0.05MPaに加圧されている。なお、使用されるガス類はあらかじめ細菌等の微粒子を除去したものを使用する。
【0043】
培地槽15は移送管路21、廃液槽17は移送管路22によって培養槽1と連通している。移送管路21には弁31、移送管路22には弁32が設置されている。例えば、培養槽1に弁31を開くことによって培地槽15から移送管路21によって培地16を所定量移送することができる。ついで、あらかじめ調整されたマイクロキャリア及び種細胞を培養槽に注入し、培養を開始する。なお、培養中は、所定時間ごとに培養槽1から培養液を採取し、細胞密度やグルコース濃度、グルタミン濃度及びアンモニア濃度などの必要な成分を計測することができる。
【0044】
また、培養槽1から採取した培養液中のグルコース濃度、グルタミン濃度及びアンモニア濃度などの成分が培養に適さなくなったと判断された場合には、培地の交換を実施することができる。この場合、撹拌及び液中への通気を止め、マイクロキャリアを沈降させる。ついで、弁32を開いて移送管路22によって廃液槽17に培養槽1から使用済みの培養液18が排出される。なお、移送管路22は培養槽内のマイクロキャリアの沈降面より上部に開口しており、マイクロキャリアを廃液槽17に流出させないよう配慮されている。使用済みの培養液18の排出が完了後、弁32を閉じる。ついで、弁31を開いて培地槽15から移送管路21によって所定量の培地16を培養槽1に移送する。移送完了後、培養を再開する。
【0045】
上記の培養操作中は、本発明になる培養方法を適用することによって、過剰な撹拌を防ぎつつ、マイクロキャリアをほぼ均一に分散させた状態で培養を実施できる。本培養装置によれば、過剰な撹拌を防ぎ、マイクロキャリアをほぼ均一に分散させた状態で培養を実施できることによって、良好な培養を行うことが可能となる。
【符号の説明】
【0046】
1…培養槽、2、3…微粒子密度計測手段、4…判定装置、5…制御装置、7…培養液、8・・・マイクロキャリア、9…撹拌翼、 11…撹拌機駆動モータ、15…培地槽、17・・・廃液槽
【特許請求の範囲】
【請求項1】
培養槽内の培養液における溶存酸素濃度を当該培養槽内の空間における複数の箇所について測定し、測定された複数の溶存酸素濃度の差に基づいて、培養槽内の培養液に対する撹拌速度を決定することを特徴とする生体細胞の培養方法。
【請求項2】
前記生体細胞は生育及び増殖に関する付着依存性を有し、当該生体細胞を微粒子担体に付着した状態で培養することを特徴とする請求項1記載の生体細胞の培養方法。
【請求項3】
前記微粒子担体は、前記生体細胞の足場となる培養面を有するマイクロキャリアであることを特徴とする請求項1記載の生体細胞の培養方法。
【請求項4】
前記溶存酸素濃度は、培養槽内の槽底部近傍及び液面近傍において測定されることを特徴とする請求項1記載の生体細胞の培養方法。
【請求項5】
生体細胞を培養するための培養液を収容する培養槽と、
前記培養槽に配設され、前記培養槽内の培養液に含まれる溶存酸素濃度を測定するための複数の溶存酸素濃度計測手段と、
培養槽内の培養液を撹拌する撹拌手段と、
前記複数の溶存酸素濃度計測手段で測定した溶存酸素濃度の差異を算出するとともに、当該差異に基づいて上記撹拌手段を制御する制御手段とを備え、
前記制御手段は、前記溶存酸素濃度の差異が許容範囲内にあるか否かを判定し、当該差異が許容範囲外である場合には許容範囲内に収まるように撹拌機の回転速度を制御することを特徴とする生体細胞の培養装置。
【請求項6】
前記生体細胞は生育及び増殖に関する付着依存性を有し、当該生体細胞を微粒子担体に付着した状態で培養することを特徴とする請求項5記載の生体細胞の培養装置。
【請求項7】
前記微粒子担体は、前記生体細胞の足場となる培養面を有するマイクロキャリアであることを特徴とする請求項5記載の生体細胞の培養装置。
【請求項8】
前記溶存酸素濃度測定手段は、少なくとも、前記培養槽内の槽底部近傍及び液面近傍に配設されていることを特徴とする請求項5記載の生体細胞の培養装置。
【請求項9】
培養槽に収容された培養液の濁度を測定する濁度測定手段を有しないことを特徴とする請求項5記載の生体細胞の培養装置。
【請求項1】
培養槽内の培養液における溶存酸素濃度を当該培養槽内の空間における複数の箇所について測定し、測定された複数の溶存酸素濃度の差に基づいて、培養槽内の培養液に対する撹拌速度を決定することを特徴とする生体細胞の培養方法。
【請求項2】
前記生体細胞は生育及び増殖に関する付着依存性を有し、当該生体細胞を微粒子担体に付着した状態で培養することを特徴とする請求項1記載の生体細胞の培養方法。
【請求項3】
前記微粒子担体は、前記生体細胞の足場となる培養面を有するマイクロキャリアであることを特徴とする請求項1記載の生体細胞の培養方法。
【請求項4】
前記溶存酸素濃度は、培養槽内の槽底部近傍及び液面近傍において測定されることを特徴とする請求項1記載の生体細胞の培養方法。
【請求項5】
生体細胞を培養するための培養液を収容する培養槽と、
前記培養槽に配設され、前記培養槽内の培養液に含まれる溶存酸素濃度を測定するための複数の溶存酸素濃度計測手段と、
培養槽内の培養液を撹拌する撹拌手段と、
前記複数の溶存酸素濃度計測手段で測定した溶存酸素濃度の差異を算出するとともに、当該差異に基づいて上記撹拌手段を制御する制御手段とを備え、
前記制御手段は、前記溶存酸素濃度の差異が許容範囲内にあるか否かを判定し、当該差異が許容範囲外である場合には許容範囲内に収まるように撹拌機の回転速度を制御することを特徴とする生体細胞の培養装置。
【請求項6】
前記生体細胞は生育及び増殖に関する付着依存性を有し、当該生体細胞を微粒子担体に付着した状態で培養することを特徴とする請求項5記載の生体細胞の培養装置。
【請求項7】
前記微粒子担体は、前記生体細胞の足場となる培養面を有するマイクロキャリアであることを特徴とする請求項5記載の生体細胞の培養装置。
【請求項8】
前記溶存酸素濃度測定手段は、少なくとも、前記培養槽内の槽底部近傍及び液面近傍に配設されていることを特徴とする請求項5記載の生体細胞の培養装置。
【請求項9】
培養槽に収容された培養液の濁度を測定する濁度測定手段を有しないことを特徴とする請求項5記載の生体細胞の培養装置。
【図1】


【図2】


【図3】


【図4】




【図2】


【図3】


【図4】


【公開番号】特開2011−92117(P2011−92117A)
【公開日】平成23年5月12日(2011.5.12)
【国際特許分類】
【出願番号】特願2009−250419(P2009−250419)
【出願日】平成21年10月30日(2009.10.30)
【出願人】(000005452)株式会社日立プラントテクノロジー (1,767)
【Fターム(参考)】
【公開日】平成23年5月12日(2011.5.12)
【国際特許分類】
【出願日】平成21年10月30日(2009.10.30)
【出願人】(000005452)株式会社日立プラントテクノロジー (1,767)
【Fターム(参考)】
[ Back to top ]

