生体組織正常化方法
【課題】 生体又は生体組織を迅速且つ正確に正常化できる生体組織正常化方法を提供する。
【解決手段】 生体100の異なる部位に1対のパッド素子1、2を付着し、この1対のパッド素子1、2間に電源からの電流を電流制御手段3が通電して生体又は生体組織における正常化機構を蛋白質を介して活性化させるようにしているので、疾患の異常な生体又は生体組織の正常化を迅速且つ正確に行うことができるという効果を奏する。パッドには発熱層を加え、更に効果を高めることもできる。
【解決手段】 生体100の異なる部位に1対のパッド素子1、2を付着し、この1対のパッド素子1、2間に電源からの電流を電流制御手段3が通電して生体又は生体組織における正常化機構を蛋白質を介して活性化させるようにしているので、疾患の異常な生体又は生体組織の正常化を迅速且つ正確に行うことができるという効果を奏する。パッドには発熱層を加え、更に効果を高めることもできる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は生体又は生体組織を活性化させる生体組織正常化方法に関し、特に生体又は生体組織の正常化機構を活性化させる生体組織正常化方法に関する。
【背景技術】
【0002】
近年、あらゆる細胞に存在するユビキチン(Ubiquitin)は、その機能が解明され、不要となった蛋白質に結合してその目印となる役目を有する。このユビキチンが結合した不要な蛋白質(ユビキチン化蛋白質)は、このユビキチンを目印として酵素プロテアソームに取り込まれて分解される。このような不要な蛋白質を分解する生体正常化機構は、ユビキチン・プロテアソームシステムとして働き、細胞の分裂、DNAの修復、蛋白質の品質管理、免疫等の多く組織の正常化に関与している。
また、生体正常化機構は、電気温熱式治療器により、生体の所定部位を加熱して熱ショック蛋白質(Heat Shock Protein;以下「HSP」という。)を発現誘導して活性化される。
【0003】
前記HSPは、ストレス蛋白質とも呼ばれる分子量が数万から約15万の一群の蛋白質を指し、分子量によりいくつかのファミリーに分類されている。HSPは、新生蛋白質、変性蛋白質及び異常蛋白質の疎水部分に非共有結合して、蛋白質の折り畳み、細胞内小器官への輸送、変性蛋白質の再折り畳みや分解を介助して、細胞内蛋白質の品質管理を行い、細胞内に異常蛋白質や変性蛋白質が蓄積するのを防いでいる。これらの機能は分子シャペロンと総称されており、HSPは熱ショックをはじめさまざまな物理的・化学的な傷害因子により誘導される。HSPを多く発現した細胞は、さまざまな傷害因子に対して強い抵抗力を獲得することは既に確立された事実である。
【0004】
HSP70ファミリーに属する分子量72キロダルトンのHSP70は、ストレスにより初めて誘導される蛋白質であり、最も研究が進んでいる。細胞を熱ショックなどの非致死的なストレスに曝すことによりHSP70を予め過剰発現させておくと、致死的な傷害因子に対しても強い抵抗性を示し、細胞は生き延びることができる。
【0005】
この抵抗性は、分子シャペロンの機能を介して細胞内に異常蛋白質や変性蛋白質が蓄積するのを防ぐことに加えて、ストレスを受けた細胞のミトコンドリアなどの細胞内小器官の機能を保全し、細胞壊死を抑制して炎症反応を抑え、アポトーシスを抑制して細胞損失を抑えることが示されている(Samali,A. et ai., Cell Stress & Chaperones 3:228, 1998)。
【0006】
さまざまな病的状態では、細胞は物理的・化学的ストレスに曝される。実験動物を用いた多くの疾患モデルにおいて、HSP70を何らかの方法で過剰に発現させると、傷害が軽減されることが明らかにされており、HSP70の臨床応用についての期待が高まっている(Minowada,G. et al., J.Clin.Invest., 95:2,1995とその引用文献を参照)。
【0007】
ヒトの疾患との関連で、細胞が遭遇するさまざまなストレスについて言及すると、まず、代表的なストレスとして虚血があげられる。予め実験動物に全身の熱ショック負荷を行いHSP70を過剰発現させておくと、脳動脈や冠状動脈を結紮した場合でも、脳(Kitagawa,K. et al., J.Cereb. Blood Flow Metab., 11:449,1991)や心臓(Donnelly,T.J. et al., Circulation 85 :1048,1992)の梗塞部位が縮小することが示されている。また、HSP70の遺伝子導入を行ったマウスでも、心筋梗塞の抑制効果が示されている(Maber, M.S. et al., J.Clin.Invest.,95:1446,1995)。HSP70の虚血による細胞障害の抑制効果は、脳と心臓に限らず総ての臓器についても適応される。
【0008】
活性酸素・フリーラジカルは、感染、炎症、変性疾患、自己免疫疾患、動脈硬化、老化にともない産生量が増加して細胞障害を引き起こす。HSP70は、これらの活性酸素・フリーラジカルによる細胞障害を抑制することが示されている(Polla B.S. et al., Proc.Natl.Acad Sci.USA,93:6458,1996)。
【0009】
虚血・再灌流傷害は、再灌流時の活性酸素の産生亢進が主要な病因の一つとして確率されており、HSPが脳、心臓、肝、小腸などにおいて軽減されることが知られている。このHSPによる保護作用は、総ての臓器に適応される。また、臓器移植は、虚血再灌流傷害の典型例の一つである。事実、HSP70を過剰発現させておくと、皮膚の移植片の生着率が改善することが示されており(Koenig,W.J. et al., Plast Recontsr. Surg., 90:659,1992)、肝移植の際にも、移植肝がHSP70を多く発現するほど急性拒絶反応が軽減することも報告されている(Flohe,S. et al., Traspl.lnt., 11:89,1998)。また、紫外線、放射線、重金属、アルコール、抗癌剤やパラコートは、主に活性酸素・フリーラジカルによる傷害を引き起こす。HSP70は、紫外線、放射線による皮膚、粘膜、目のレンズや網膜の傷害の予防と治療、さらにアルコール性臓器傷害、重金属や薬物中毒の治療効果も期待できる。
【0010】
また、癌細胞は、HSP70を細胞表面に発現し、このHSP70がNK細胞を活性化することから(kurosawa,S. et al., Eur.J.lmmunol., 23:1029,1993)、このHSP70の発現を介して癌免疫を賦活化させることもできる。また、微生物の侵入に対しても、宿主マクロファージのHSPの発現が強いほど感染抵抗性が増すことも示されており(Denagel,D.C. et al., Crit.Rev.lmmunol., 13:71, 1993)、免疫賦活−生体防御能の増強効果も期待できる。
【0011】
HSP70による細胞内蛋白質の品質管理の働きに注目して、細胞内に異常蛋白質が蓄積する疾患、例えば、βアミロイドの沈着によるアルツハイマー病、異常プリオン蛋白質の沈着するクロイツフェルド・ヤコブ病、さらにアミロイドーシス、ウィルソン病、パーキンソン病などの変性疾患の予防と治療にも効果が期待できる。
【0012】
また、外科手術、外傷などの生体侵襲などの身体的ストレスに対する耐性効果が期待されるばかりでなく、精神的ストレスによるアレルギー疾患、ストレス潰瘍、慢性炎症性疾患などの発症や増悪を抑制する効果も期待できる。HSP70は、敗血症による多臓器不全・ショックの軽減(Hauser,G.J. et al., Am.J.Physiol., 271:H2529,1996)や、成人呼吸窮迫症候群(adult respiratory distress syndrome)の予後を改善することも報告されており(Villar,J. et al., Am.Rev.Respir.Dis., 147:177,1993)、これらの重度の生体侵襲時の治療薬としてもその効果が期待される。
【0013】
HSPは、細胞内(生体内)物質であるため、その誘導にともない副作用が発生する可能性は少ない。またHSP70の過剰発現が原因となる疾患も報告されていない。動物実験では、全身の熱ショック、一過性の阻血操作、HSP70の遺伝子導入などが行われているが、実際の臨床に応用することは困難である。このため、組織や細胞に害を与えず、しかも選択的にHSPを誘導する機器は臨床的にも優れた治療装置といえる。
【0014】
転写因子は外界からのシグナル伝達系の最下位に位置するため、それを標的にすることで副作用を最小限にとどめることができると考えられる。NF−κBは転写因子の一つであり、細胞質内では阻害蛋白質であるIκBと結合して不活性化されている。細胞が種々の刺激を受けるとIκBがリン酸化を受け、それに引き続きユビキチン化を受けてプロテアソームにより分解される。遊離状態となったNF−κBは核へ移行し、さまざまな遺伝子を特異的に活性化する。NF−κBの制御下にある遺伝子には、免疫系の細胞で重要な働きをするサイトカイン(TNF−α,β,IL−2,6,8等)等があげられる。これらの遺伝子は、細胞が刺激を受けた際に発現誘導されるため、免疫応答にNF−κBが深く関わっていることが分かる。しかし、その炎症応答が過剰になってしまうと、さまざまな疾患を引き起こすことが知られている。例えば、リウマチや喘息、皮膚炎等さまざまな炎症性の疾患、自己免疫疾患、ウィルス性疾患、動脈硬化症等などの疾患にNF−κBが関与していることから、NF−κBを制御することの意義は臨床的にも極めて大きいものである(Anning Lin. Cancer Biology, 2003, Aggarwal BB et al. Indian J Exp Biol ,2004, Alok C. Bharti et al. Biochemical Pharmacology, 2002)。
【0015】
【非特許文献1】Samali,A. et ai., Cell Stress & Chaperones 3:228, 1998
【非特許文献2】Minowada,G. et al., J.Clin.Invest., 95:2,1995とその引用文献
【非特許文献3】Kitagawa,K. et al., J.Cereb. Blood Flow Metab.,11:449,1991
【非特許文献4】Donnelly,T.J. et al., Circulation 85 :1048,1992
【非特許文献5】Maber, M.S. et al., J.Clin.Invest.,95:1446,1995
【非特許文献6】Polla B.S. et al., Proc.Natl.Acad Sci.USA,93:6458,1996
【非特許文献7】Koenig,W.J. et al., Plast Recontsr. Surg., 90:659,1992
【非特許文献8】Flohe,S. et al., Traspl.lnt., 11:89,1998
【非特許文献9】kurosawa,S. et al., Eur.J.lmmunol., 23:1029,1993
【非特許文献10】Denagel,D.C. et al., Crit.Rev.lmmunol., 13:71, 1993
【非特許文献11】Hauser,G.J. et al., Am.J.Physiol., 271:H2529,1996
【非特許文献12】Villar,J. et al., Am.Rev.Respir.Dis., 147:177,1993
【非特許文献13】Anning Lin. Cancer Biology, 2003
【非特許文献14】Aggarwal BB et al. Indian J Exp Biol ,2004
【非特許文献15】Alok C. Bharti et al. Biochemical Pharmacology, 2002
【発明の開示】
【発明が解決しようとする課題】
【0016】
しかしながら、前記ユビキチン・プロテアソームシステムに基づく生体正常化機構は、生体組織の正常(健康)時においてはあらゆる細胞に存在するユビキチンの量が十分でなく、不要となった蛋白質を迅速且つ確実に分解して排除できないという課題を有していた。また、生体組織の異常(疾患)時においては、ユビキチンが結合した不要となった蛋白質を分解して排除することから、細胞内のユビキチンも減少することとなり、この異常(疾患)の細胞が計画的な細胞死に至らず、腫瘍等の異常な細胞が減少せず異常(疾患)を改善できないという課題を有していた。
【0017】
他方、電気温熱式治療器等によるHSPに基づく生体正常化機構は、生体に対して極めて高い温度(例えば、42℃)を1時間以上加熱しなければHSPが十分に発現誘導せず活性化されないことから、加熱による生体組織の損傷等を伴い、迅速且つ正確な生体の正常化ができないという課題を有していた。
さらに、NF−κBの活性を制御するIκBの量及びリン酸化状態に影響することにより生体を正常化する方法はなかった。
【0018】
本発明は、前記課題を解消するためになされたもので、生体又は生体組織を迅速且つ正確に正常化できる生体組織正常化方法を提供することを目的とする。
【課題を解決するための手段】
【0019】
本発明に係る生体組織正常化方法は、微弱な直流電流を所定の間隔で間歇的に生体又は生体組織に通電し、当該生体又は生体組織における正常化機構を蛋白質を介して活性化させるものである。このように本発明においては、微弱な直流電流を所定の間隔で間歇的に生体又は生体組織に通電し、当該生体又は生体組織における正常化機構を蛋白質を介して活性化させることにより、疾患の異常な生体又は生体組織の正常化を迅速且つ正確に行うことができるという効果を奏する。
【0020】
また、本発明に係る生体組織正常化方法は必要に応じて、前記直流電流が通電される生体又は生体組織に温熱を加えるものである。このように本発明においては、直流電流が通電される生体又は生体組織に温熱を加えることにより、生体又は生体組織の正常化をより迅速且つ正確に行うことができるという効果を有する。
【0021】
また、本発明に係る生体組織正常化方法は必要に応じて前記蛋白質が、ユビキチンであるものである。このように本発明においては、蛋白質が、ユビキチンであることから生体又は生体組織の正常化をより迅速且つ正確に行うことができるという効果を有する。
【0022】
また、本発明に係る生体組織正常化方法は必要に応じて、前記蛋白質が、熱ショック蛋白質であるものである。このように本発明においては、生体又は生体組織の正常化をより迅速且つ正確に行うことができるという効果を有する。
【0023】
また、本発明に係る生体組織正常化方法は必要に応じて、前記蛋白質が、IκB蛋白質であるものである。このように本発明においては、蛋白質が、IκB蛋白質であることから生体又は生体組織の正常化をより迅速且つ正確に行うことができるという効果を有する。
【0024】
また、本発明に係る生体組織正常化方法は必要に応じて、前記直流電流の間歇的な間隔が、30Hzないし100Hzであるものである。このように本発明においては、直流電流の間歇的な間隔が、50Hzないし60Hzであることから生体又は生体組織の正常化をより迅速且つ正確に行うことができるという効果を有する。
【0025】
また、本発明に係る生体組織正常化方法は必要に応じて、前記温熱が、38℃以上45℃以下であるものである。このように本発明においては、温熱が、38℃以上45℃以下であることから生体又は生体組織の正常化をより迅速且つ正確に行うことができるという効果を有する。
【0026】
本発明に係る治療装置は、生体又は生体組織の異なる部位に1対のパッド素子を付着し、当該1対のパッド素子間に電流を電流制御手段が通電して前記生体を治療する治療装置において、前記パッド素子が生体又は生体組織の表面に付着する導電性のシート体からなる導電層と、当該導電層の背面側に配設され、伝熱特性を有し且つ絶縁性のシート体からなる絶縁層と、当該絶縁層の背面側に配設され、両端部分に1対の電極が配設され、当該1対の電極間に抵抗が配設される発熱層とを備え、前記電流制御手段が、前記1対のパッド素子における各導電層間に微弱な直流電流を所定の間隔で間歇的に供給制御すると共に、前記1対のパッド素子の各発熱層における各1対の電極間に電流を供給制御するものである。
【0027】
このように本発明においては、生体又は生体組織の異なる部位に付着する1対のパッド素子が生体又は生体組織の表面に付着する導電性のシート体からなる導電層、伝熱特性を有し且つ絶縁性のシート体からなる絶縁層、両端部分に1対の電極が配設され、当該1対の電極間に抵抗が配設される発熱層を順次積層して形成され、前記各導電層間に微弱な直流電流を所定の間隔で間歇的に供給制御すると共に、前記各発熱層における各1対の電極間に電流を電流制御手段が供給制御することにより、電流が通電される生体又は生体組織に同時に加熱できることとなり、生体又は生体組織の正常化をより迅速且つ正確に行うことができるという効果を有する。
【0028】
また、本発明に係る治療装置は必要に応じて、前記パッド素子の発熱層が、1対の電極が各々短冊状に形成され、当該電極間の抵抗が短冊状の電極に平行な方向に配向性を有するカーボン繊維で形成されるものである。このように本発明においては前記パッド素子の発熱層が、1対の電極が各々短冊状に形成され、当該電極間の抵抗が短冊状の電極に平行な方向に配向性を有するカーボン繊維で形成されることにより、電極間がカーボン繊維により短絡されることなくこの各平行なカーボン繊維相互間の適度な抵抗値により発熱できることとなり、生体又は生体組織の正常化をより迅速且つ正確に行うことができるという効果を有する。
【0029】
また、本発明に係る治療装置は必要に応じて、前記各導電層に供給される直流電流が、50Hzないし60Hzの周期で間歇的に供給制御されるものである。このように本発明においては、各導電層に供給される直流電流が、50Hzないし60Hzの周期で間歇的に供給制御されることにより、生体又は生体組織による電流刺激を効果的に行うことができることとなり、生体又は生体組織の正常化をより迅速且つ正確に行うことができるという効果を有する。
【0030】
また、本発明に係る治療装置は必要に応じて、前記1対のパッド素子の各発熱層が、38℃以上45℃以下に加熱するものである。このように本発明においては、1対のパッド素子の各発熱層が、38℃以上45℃以下に加熱することにより、生体又は生体組織による適度な温熱刺激を与えることができることとなり、生体又は生体組織の正常化をより迅速且つ正確に行うことができるという効果を有する。
【0031】
また、本発明に係る治療装置は必要に応じて、前記導電層に供給される直流電流が、1分以上で任意の供給時間とし、当該供給時間に反比例した電圧値を0.4V以下0.01V以上の間で設定して印加されるものである。このように本発明においては、前記導電層に供給される直流電流が、1分以上で任意の供給時間とし、当該供給時間に反比例した電圧値を0.2V以下0.03V以上の間で設定して印加されることにより、電流刺激と温熱刺激とを適度にバランスをとることができることとなり、生体又は生体組織の正常化をより迅速且つ正確に行うことができるという効果を有する。
【発明を実施するための最良の形態】
【0032】
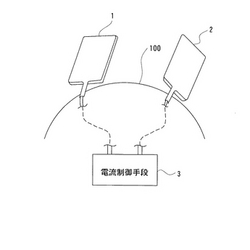
以下、本発明の一実施形態に係る治療装置を生体組織正常化方法と共に、図1ないし図3に基づいて説明する。この図1は本実施形態に係る治療装置の全体概略構成図、図2は図1に記載の治療装置におけるパッド素子の平面図、図3は図2に記載のパッド素子のA−A線断面図、図4は図3に記載のパット素子のB−B線断面図を示す。
【0033】
前記各図において本実施形態に係る治療装置は、生体100の異なる部位に1対のパッド素子1、2を付着し、この1対のパッド素子1、2間に電源200からの電流を電流制御手段3が通電して前記生体100を治療する治療装置において、前記パッド素子1、2が、生体100表面に付着する導電性のシート体からなる導電層11、21と、この導電層11、21の背面側に配設され、伝熱特性を有し且つ絶縁性のシート体からなる絶縁層12、22と、この絶縁層12、22の背面側に配設され、両端部分に1対の電極13a・13b、23a・23bが配設され、この1対の電極13a・13b、23a・23b間に抵抗13c、23cが配設される発熱層13、23と、この発熱層13、23の背面最外側に配設され、断熱特性を有し且つ絶縁性のシート体からなる被覆層14、24とを備え、電流制御手段3が、前記1対のパッド素子1、2における各導電層11、21間に微弱な直流電流を所定の間隔で間歇的に供給制御すると共に、前記1対のパッド素子1、2の各発熱層13、23における各1対の電極13a・13b、23a・23b間に直流電流を供給制御する構成である。
【0034】
前記発熱層13、23は、1対の電極13a・13b、23a・23bが各々短冊状に形成され、この電極13a・13b、23a・23b間の抵抗13c、23cが短冊状の電極13a・13b、23a・23bに平行な方向に配向性を有するカーボン繊維16でで形成され、加熱温度42℃に加熱される構成である。
前記電流制御手段3は、導電層11、21に対して55Hzの周期で間歇的にON状態となるように10分以上30分以下の間だけ微弱電流を供給し、印加電圧を0.2V以下0.03V以上に制御する構成である。
【0035】
前記電流制御手段3が生体又は生体組織に通電する微弱電流、印加電圧及び間歇的な通電(印加)の周波数についてヒトを対象とした試験結果に基づいて説明する。このヒト対象の試験はヒトの両足の印加部位に0.2[V]から0.4[V]の印加電圧を印加し、ヒトの抵抗値(ヒト口腔内の抵抗値)を約0.2[MΩ]とすると、ヒトの体内での電圧降下(電位差)が0.1[V]ないし0.2[V]が発生している。この電位差0.1[V]ないし0.2[V]及びヒトの抵抗値約0.2[MΩ]より前記微弱電流は、0.5[μA]ないし1.0[μA]が前記電流制御手段3により通電制御される。
【0036】
このヒト対象の試験において、被試験者におけるヒトの両足に印加電圧0.3[V]を印加し、周波数を35[Hz]から150[Hz]で変化させて被試験者の感覚(快適感〜不快適感)を次の通り検出した。
【0037】
まず、35Hzでは、まだ違和感があり、長時間の処理で気持ちが悪くなることが解った。45Hzでは、しびれ感が強く、気持ちが悪く(不快)感じ、長時間の処理が無理であることが解った。50Hzでは、快適感の許容範囲であることが解った。55Hzでは、極めて快適であることが解った。60Hzでは、快適感の許容範囲であることが解った。
【0038】
また、65Hzでは、少し刺激が感じられなくなり、0.350Vに挙げると55Hz時に近いような刺激を感じることができるものの、ただ、最適ではないことが解った。70Hzでは、ほとんど刺激を感じられないことが解った。75Hzでは、ほとんど刺激を感じられず、印加電圧を0.400Vに上げると少し刺激を感じることが解った。100Hzでは、全く刺激を感じられず、印加電圧を0.450Vに上げると少し刺激を感じることが解った。150Hzでは、全く刺激を感じられず、印加電圧を0.600Vにまで上げたが感じないことが解った。
【0039】
また、印加電圧を0.25[V]、0.3[V]、0.35[V]及び0.4[V]とした場合におけるこの直流電圧を間歇印加する周波数の最適周波数を試験にて求めた。この印加電圧が0.250[V]の場合に周波数を35<Hz<50で変化させると、35[Hz]以下はしびれ感が強く気持ちが悪く感じ、50[Hz]以上では感じない。また、印加電圧が0.300[V]の場合に周波数を45<Hz<60で変化させると、45[Hz]以下はしびれ感が強く気持ちが悪く感じ、75[Hz]以上では感じない。また、印加電圧が0.400[V]の場合に周波数を65<Hz<75で変化させると、75[Hz]以下は強く筋肉の収縮が現れるか、気持ちが悪く感じ、75[Hz]以上では感じない。
【0040】
以上の試験結果より、印加電圧が0.3[V]で周波数55(±1)[Hz]が最適周波数であり、50[Hz]ないし60[Hz]の範囲で電流制御手段3が制御することが望ましいことが解る。
また、生体又は生体組織に対する電気信号の機能から、前記電流制御手段3は次の通り微弱電流を制御することできる。即ち、生体又は生体組織の非興奮性細胞に生体電流に相当する微弱電流を強制的に通電して、体内のタンパク質を介して活性化するものである。このように非興奮性細胞にのみ生体電流に相当する微弱電流を通電し、筋肉性細胞等の興奮性細胞に生体電流に相当する外部からの電流を通電しないので収縮等の刺激を与えることがない。
従って、電流制御手段3は、興奮性細胞が、例えば筋肉性細胞を不快に収縮させない電流レベルの微弱電流を通電するように制御する。
【0041】
次に、本実施形態における治療装置の動作により発現する蛋白質の誘導効果をヒトの培養細胞系、ヌードマウス、ΔF508CFTRを安定高発現させた培養細胞系について、以下の実験に基づいて具体的に説明する。
【実施例】
【0042】
(検討項目)
(1)ヒトの培養細胞系における評価を以下のi)、ii) 、iii)の三点について行った。
【0043】
i) HSP70の誘導
ii) 細胞障害の有無
iii) ユビキチン化の促進
(2)ヌードマウスにおける評価を以下のi)、ii) 、iii)、iv)の四点について行った。
【0044】
i) 一回処置における正常組織中のHSP70の誘導
ii) 一回処置による腫瘍組織中のHSP70の誘導
iii) 腫瘍組織におけるユビキチン化の促進
iv) 1日1回処置あるいは1日1回の3日間処置による正常組織中のIκB−α及びそのリン酸化体の発現
【0045】
(3)ΔF508CFTRを安定高発現させた培養細胞系における評価を以下のi)、ii) の二点について行った。
i) HSP70の誘導
ii) ユビキチン化の促進
【0046】
(4)2型糖尿病モデルマウス(高脂肪食負荷マウス)における評価を以下のi)、ii)、 iii)、iv)、v)、vi)、vii)、viii)、ix)の九点について行った。以下の検討は,本発明に係る生体組織正常化方法を1週間に2回処置し続けて10週間後に行った。
i)空腹時血糖値
ii)インスリン値
iii)血清アディポネクチン値
iv)グルコース負荷試験
v)インスリン負荷試験
vi)内臓脂肪の組織重量
vii)皮下脂肪の組織重量
viii)肝重量
ix)褐色脂肪細胞中のUCP1mRNAの誘導
【0047】
(5)急性胃潰瘍モデルマウスにおける評価を以下の点について行った。以下の検討は、本発明に係る生体組織正常化方法を1週間に2回処置し続けて2週間後に行った。
i)胃粘膜損傷割合
【0048】
(6)正常マウスにおける評価を以下の点について行った。以下の検討は、本発明を最初の血球測定2週間前から1週間に1回処置し続けて2週間ごとに行った。
i)血液1mLあたりの白血球数
【0049】
(実施方法)
1)HSP70の測定はマウス抗HSP70モノクローナル抗体を用いたイムノブロットを行い、結合した抗体を増感化学発光法(Enhanced chemiluminescence;ECL)ウエスタンブロット検出キット(アマシャム社製)で検出し測定した。ローディングコントロールとしてカルネキシン(CNX)を検出した。
2)ユビキチン化蛋白質の測定は、マウス抗ユビキチン化蛋白質モノクローナル抗体を用いたイムノブロットを行い、 結合した抗体を増感化学発光法(Enhanced chemiluminescence;ECL)ウエスタンブロット検出キット(アマシャム社製)で検出し測定した。
【0050】
3)IκB−α及びIκB−αリン酸化体の測定はラビット抗IκB−αポリクローナル抗体及びラビット抗リン酸化IκB−αポリクローナル抗体を用いたイムノブロットを行い、結合した抗体を増感化学発光法(Enhanced chemiluminescence;ECL)ウエスタンブロット検出キット(アマシャム社製)で検出し測定した。
4)倒立型実体顕微鏡(オリンパス社製)を用いて、治療装置処置による細胞傷害の有無を、形態変化を撮影して確認した。
5)血糖値の測定は、自己血糖測定器(ロシュ社製)を用いて測定した。
【0051】
6)インスリン値および血清アディポネクチン値の測定は、スカイライト・バイオテック(株)の LipoSEARCH(高感度ゲルろ過HPLCによる網羅的解析システム)により測定した。
7)UCP1mRNAの測定は、RT−PCRを行うためにRT−PCRキット(タカラ社製)で検出し測定した。
【0052】
8)急性胃潰瘍モデルマウスはマウスに塩酸エタノールを経口投与することによって作成した。胃粘膜損傷割合の測定は、損傷胃粘膜面積を解剖顕微鏡下で測定し、以下の式に従って求めた。
胃粘膜損傷割合=(損傷胃粘膜総面積/胃粘膜総面積)×10
9)白血球数の測定は、血球数測定装置SysmexF−520(Sysmex社製)を用いて測定した。
【0053】
(実施結果)
(1) ヒト培養細胞系については、前記実験方法により図5、図6、図7に示すようにな以下の評価結果が得られた。
【0054】
i) HSP70の誘導(図5(A)、(B)を参照)
HSP70の誘導レベルを微弱電流単独(実施1−1)及び温熱単独(実施1−2)、微弱電流及び温熱の同時併用(実施1−3)について治療10分処置後に5時間、静置・培養して、ウエスタンブロット法により検出した。その結果、微弱電流単独(実施1−1)と温熱単独(実施1−2)においてHSP70の誘導が約3.5倍、約1.9倍(図5(B)を参照)であることがみられ、同時併用(実施1−3)の場合には、特に約5.2倍という明確なHSP70の誘導がみられた。
【0055】
ii) 細胞障害の有無(図6参照)
上記の条件下で電子顕微鏡を用いて細胞障害の有無を調べた。その結果、微弱電流単独(実施2−1)及び温熱単独(実施2−2)、微弱電流及び温熱の同時併用(実施2−3)治療処置により細胞傷害が起こらないことを確認した。
【0056】
iii) ユビキチン化の促進(図7(A)、(B)を参照)
前記図5における微弱電流及び温熱の同時併用を治療処置を条件とし、10分間の治療処置後に0時間(実施3−1)、2時間(実施3−2)、5時間(実施3−3)、8時間(実施4)、静置・培養した時のユビキチン化蛋白質の量をウエスタンブロット法により検出した。その結果、5時間経過時には10倍、8時間経過時には68倍という指数関数的にユビキチン化が促進されていることを認めた。
(2)ヌードマウスにについては、前記実施方法により図8、図9、図10及び図11に示すような以下の評価結果が得られた。
【0057】
i) 一回処置における正常組織中のHSP70の誘導(図8(A)、(B)を参照)
このヌードマウスの正常組織に微弱電流及び温熱を同時に併用した治療処理条件とし、治療処置を経時的に10分(実施4−1)、20分(実施4−2)の各処置後に6時間飼育し、正常組織中(大腸の例を示す)のHSP70の誘導レベルをウエスタンブロット法により検出した。その結果、20分(実施4−2)の処置の場合には、約2.7倍という明確なHSP70の誘導が認められた。
【0058】
ii) 一回処置による腫瘍組織中のHSP70の誘導(図9(A)、(B)を参照)
このヌードマウスの腫瘍組織に微弱電流及び温熱を同時に併用した治療処置条件とし、この治療処置を20分間処置した後に6時間飼育し、腫瘍組織中におけるHSP70の誘導レベルを(実施5a−1)、(実施5b−1)に示すようにウエスタンブロット法により検出した。その結果、腫瘍組織においても約1.9倍及び2.4倍という明確なHSP70の誘導が認められた。
【0059】
iii) 腫瘍組織におけるユビキチン化の促進(図10(A)、(B)、(C)を参照)
ヌードマウスの腫瘍組織に対して微弱電流単独(実施6−1)、温熱単独(実施6−2)及び同時併用(実施6−3)の場合について、治療処置20分間処置した後に6時間飼育し、腫瘍組織においてユビキチン化蛋白質を、ウエスタンブロット法により検出した。その結果、微弱電流単独(実施6−1)及び温熱単独(実施6−2)においては、共に1.5倍というHSP70の誘導が認められ、1.3倍及び1.6倍のユビキチン化蛋白質の増加が認められた。特に、同時併用(実施6−3)の場合は、約2.3倍というHSPの明確な誘導が認められ、3.5倍という著明なユビキチン化蛋白質の増加が認められた。
【0060】
iv) 1日1回処置あるいは1日1回の3日間処置による正常組織中のIκB−α及びそのリン酸化体の発現(図11(A)、(B)、(C)を参照)
ヌードマウスの正常組織に対して微弱電流及び温熱を同時に併用して処置を1日1回(実施7−1)・(実施7−2)、あるいは1日1回の3日間(実施7−3)・(実施7−4)行い、このヌードマウスの正常組織中(大腸の例を示す)のIκB及びIκB−αリン酸化体をウエスタンブロット法により検出した。その結果、1日1回の3日間(実施7−3)・(実施7−4)の処置においてIκBの量及びIκB−αリン酸化体が比較例より明確に増加していることを見出した。
【0061】
(3)ΔF508CFTRを安定高発現させた培養細胞系にについては、前記実施方法により図12及び図13に示すような以下の評価結果が得られた。
i) HSP70の誘導(図12(A)、(B)を参照)
HSP70の誘導レベルを微弱電流単独(実施8−1)、温熱単独(実施8−2)及び微弱電流と温熱との同時併用(実施8−3)について、治療処置を10分間処置した後に5時間、静置・培養して、ウェスタンブロット法により検出した。その結果、微弱電流単独(実施8−1)と温熱単独(実施8−2)において62倍と18倍のHSP70の誘導がみられたが、同時併用(実施8−3)はより明確な約105倍というHSP70の誘導がみられた。
【0062】
ii) ユビキチン化の促進(図13(A)、(B)を参照参照)
微弱電流単独(実施9−1)、温熱単独(実施9−2)及び微弱電流と温熱との同時併用(実施9−3)について、治療処置を10分間処置した後に5時間、静置・培養した後、ユビキチン化ΔF508CFTRをウエスタンブロット法により検出した。その結果、微弱電流単独(実施9−1)及び同時併用(実施9−3)の各処置により、共に検出3.9倍というΔF508CFTRのユビキチン化が促進されることを見出した。
【0063】
(4)2型糖尿病モデルマウス(高脂肪食負荷マウス)については、前記実施方法により図14,図15,図16,図17,図18,図19,図20,図21及び図22に示すような以下の評価結果が得られた。
i)10週間処置後の空腹時血糖値(図14を参照)
この高脂肪食負荷マウスに微弱電流及び温熱を同時に併用した群(実施10)では,空腹時血糖値の有意な低下が認められた。(P<0.05,n=8)
ii)10週間処置後のインスリン値(図15を参照)
この高脂肪食負荷マウスに微弱電流及び温熱を同時に併用した群(実施11)では,インスリン値の有意な低下が認められた。(P<0.05,n=8)
iii)10週間処置後の血清アディポネクチン値(図16を参照)
この高脂肪食負荷マウスに微弱電流及び温熱を同時に併用した群(実施12)では,血清アディポネクチン値の有意な増加が認められた。(P<0.05,n=8)
【0064】
iv)グルコース負荷試験(図17を参照)
この高脂肪食負荷マウスに微弱電流及び温熱を同時に併用した群(実施13)では,耐糖能の改善が有意に認められた。(P<0.001,n=8)
v)インスリン負荷試験(図18を参照)
この高脂肪食負荷マウスに微弱電流及び温熱を同時に併用した群(実施14)では,インスリン感受性の改善が有意に認められた。(P<0.05,n=8)
vi)10週間処置後の内臓脂肪の組織重量(図19を参照)
この高脂肪食負荷マウスに微弱電流及び温熱を同時に併用した群(実施15)では,内臓脂肪の組織重量が有意に減少していることが認められた。(P<0.05,n=8)
【0065】
vii)10週間処置後の皮下脂肪の組織重量(図20を参照)
この高脂肪食負荷マウスに微弱電流及び温熱を同時に併用した群(実施16)では,皮下脂肪の組織重量が有意に減少していることが認められた。(P<0.05,n=8)
viii)10週間処置後の肝重量(図21を参照)
この高脂肪食負荷マウスに微弱電流及び温熱を同時に併用した群(実施17)では,肝重量が有意に減少していることが認められた。(P<0.05,n=8)
xi)10週間処置後のUCP1mRNAの誘導(図22を参照)
この高脂肪食負荷マウスに微弱電流及び温熱を同時に併用した群(実施18)では,褐色脂肪細胞中のUCP1mRNA発現量が有意に増加していることが認められた。(P<0.05,n=8)
【0066】
(5)急性胃潰瘍モデルマウスについては,前記実施方法により図23に示すような以下の評価結果が得られた。
i)2週間処置後の胃粘膜損傷割合(図23を参照)
微弱電流及び温熱を同時に併用した群(実施19・1)、急性胃潰瘍モデルマウス群(実施19・2)、急性胃潰瘍モデルマウスに微弱電流及び温熱を同時に併用した群(実施19・3)で、胃粘膜損傷割合を測定した。その結果、急性胃潰瘍モデルマウスに微弱電流及び温熱を同時に併用した群(実施19・3)で、胃粘膜損傷割合の有意な低下が認められた。(P<0.05,n=4・7)
【0067】
(6)正常マウスについては,前記実施方法により図24に示すような以下の評価結果が得られた。
i)2週間ごとの白血球数変化率(図24を参照)
微弱電流及び温熱を同時に併用した群(実施20)では,血球1mL当りの白血球数が有意に増加していることが認められた。(P<0.01,n=5)
以上のように本発明に係る生体組織正常化方法及び治療装置は、極めて優れたHSP誘導能を有し、各種疾患に有効であることが明らかである。また、本発明に係る生体組織正常化方法及び治療装置は、その安全性の高さから考えても、臨床上極めて優れた有用性が期待できる。前記各種疾患の具体例としては、脳神経疾患、心脈管系疾患、消化器系疾患、、代謝性疾患、自己免疫疾患、変性疾患、虚血性神経細胞障害、虚血・再灌流傷害、嚢胞性繊維症、悪性腫瘍、感染症、肝不全、腎不全、薬物中毒、重金属中毒、放射線傷害、紫外線傷害、生体侵襲、又は老化等がある。脳神経疾患には、脳卒中、脳卒中後遺症、遅発性神経細胞死、アルツハイマー病、パーキンソン病、多発性硬化症又はクロイツフェルド・ヤコブ病等がある。
【0068】
また、本発明に係る生体組織正常化方法及び治療装置は、エビキチン化蛋白質を介して生体又は生体組織における正常化機構を活性化されるものであり、細胞内の約80%の蛋白質がユビキチン化された後にプロテアソームで分解される。しかし、プロテアソームの働きが阻害されると、細胞内に分解されないユビキチン化蛋白質が増加するため、細胞は計画的な細胞死の道を選択する。この原理を利用して、プロテアソーム阻害剤が現在、抗癌剤として注目されている(Julian A.Cancer Cell, 2003, Angelika M. B et al. European Journalof Cancer, 2004)。
【0069】
プロテアソーム阻害剤は、蛋白質の合成や分解が盛んな増殖期に作用しやすい。正常細胞と比較して、腫瘍細胞内では細胞増殖に関連する蛋白質の調節異常が生じているため、細胞の増殖率が非常に速い。そのため腫瘍組織は、増殖期の細胞に作用するプロテアソーム阻害剤の影響を受けやすい。本発明に係る生体組織正常化方法及び治療装置は、ユビキチン化を促進するため、細胞内のユビキチン化蛋白質が非常に増加する。そのためプロテアソームが飽和状態となり、プロテアソームの働きが阻害された時と同様な状態になる。
【0070】
すなわち、本発明に係る生体組織正常化方法及び治療装置は、プロテアソームを阻害することによる抗腫瘍効果も有している。また、その効果は、これらの原理に基づき、腫瘍細胞特異的に発揮されることも期待できる。このようにユビキチン化蛋白質を介したユビキチン・プロテアソームシステムの正常化機構成により改善される疾患としては、神経変性疾患(例えば、パーキンソン病、アルツハイマー病、筋萎縮性側索硬化症(ALS)、ミオクロニーてんかん等)、癌疾患(例えば、家族性乳がん、卵巣がん等)、色素性乾皮症等がある。
【0071】
NF−κBが過剰に活性化されると、リウマチや喘息、皮膚炎等さまざまな炎症性疾患、自己免疫疾患、ウィルス性疾患、動脈硬化症等が引き起こされるため、NF−κBを制御することの意義は臨床的にも極めて大きいものである。したがって、本発明の治療装置は、その微弱電流等の効果によりIκBの量を増加させるつつ、IκBのリン酸化を適度に抑制するため、NF−κBによる過剰な免疫応答の結果として引き起こされる種々の病態を改善することが期待される。
【0072】
なお、本発明は、前記実施の形態においてヒトの培養細胞系、ヌードマウス、ΔF508CFTRを安定高発現させた培養細胞系の動物の組織細胞を対象として説明したが、植物の組織細胞に対しても適用することができ、同様の作用・効果が奏し得られる。
【図面の簡単な説明】
【0073】
【図1】本発明の一実施形態に係る治療装置の全体概略構成図である。
【図2】図1に記載の治療装置におけるパッド素子の平面図である。
【図3】図2に記載のパッド素子のA−A線断面図である。
【図4】図3に記載のパット素子のB−B線断面図である。
【図5】ヒトの培養細胞系におけるHSP70の誘導の評価結果である。
【図6】ヒトの培養細胞系における細胞障害の有無の評価結果である。
【図7】ヒトの培養細胞系におけるユビキチン化の促進の評価結果である。
【図8】ヌードマウスに対する一回処置による正常組織中のHSP70の誘導の評価結果である。
【図9】ヌードマウスに対する一回処置による腫瘍組織中のHSP70の誘導の評価結果である。
【図10】ヌードマウスに対する一回処置による腫瘍組織中のユビキチン化の促進の評価結果である。
【図11】ヌードマウスに対する1日1回処置あるいは1日1回の3日間処置によるIκB−α及びそのリン酸化体の発現量の検討の評価結果である。
【図12】遺伝子変異細胞ΔF508CFTRを安定高発現させた培養細胞系におけるHSP70の誘導の評価結果である。
【図13】遺伝子変異細胞ΔF508CFTRを安定高発現させた培養細胞系におけるユビキチン化の促進の評価結果である。
【図14】2型糖尿病モデルマウス(高脂肪食負荷マウス)について行った実験評価で10週間処置後の空腹時血糖値である。
【図15】2型糖尿病モデルマウスについて行った実験評価で10週間処置後のインスリン値である。
【図16】2型糖尿病モデルマウスについて行った実験評価で10週間処置後の血清アディポネクチン値である。
【図17】2型糖尿病モデルマウスについて行った実験評価でグルコース負荷試験結果である。
【図18】2型糖尿病モデルマウスについて行った実験評価でインスリン負荷試験結果である。
【図19】2型糖尿病モデルマウスについて行った実験評価で10週間処置後の内臓脂肪の組織重量である。
【図20】2型糖尿病モデルマウスについて行った実験評価で10週間処置後の皮下脂肪の組織重量である。
【図21】2型糖尿病モデルマウスについて行った実験評価で10週間処置後の肝重量である。
【図22】2型糖尿病モデルマウスについて行った実験評価で10週間処置後のUCP1mRNAの誘導である。
【図23】2型糖尿病モデルマウスについて行った実験評価で2週間処置後の胃粘膜損傷割合である。
【図24】2型糖尿病モデルマウスについて行った実験評価で2週間ごとの白血球数変化率である。
【符号の説明】
【0074】
1、2 パッド素子
3 電流制御手段
11、21 導電層
12、22 絶縁層
13、23 発熱層
13a・13b、23a・23b 電極
16 カーボン繊維
14、24 被覆層
100 生体
200 電源
【技術分野】
【0001】
本発明は生体又は生体組織を活性化させる生体組織正常化方法に関し、特に生体又は生体組織の正常化機構を活性化させる生体組織正常化方法に関する。
【背景技術】
【0002】
近年、あらゆる細胞に存在するユビキチン(Ubiquitin)は、その機能が解明され、不要となった蛋白質に結合してその目印となる役目を有する。このユビキチンが結合した不要な蛋白質(ユビキチン化蛋白質)は、このユビキチンを目印として酵素プロテアソームに取り込まれて分解される。このような不要な蛋白質を分解する生体正常化機構は、ユビキチン・プロテアソームシステムとして働き、細胞の分裂、DNAの修復、蛋白質の品質管理、免疫等の多く組織の正常化に関与している。
また、生体正常化機構は、電気温熱式治療器により、生体の所定部位を加熱して熱ショック蛋白質(Heat Shock Protein;以下「HSP」という。)を発現誘導して活性化される。
【0003】
前記HSPは、ストレス蛋白質とも呼ばれる分子量が数万から約15万の一群の蛋白質を指し、分子量によりいくつかのファミリーに分類されている。HSPは、新生蛋白質、変性蛋白質及び異常蛋白質の疎水部分に非共有結合して、蛋白質の折り畳み、細胞内小器官への輸送、変性蛋白質の再折り畳みや分解を介助して、細胞内蛋白質の品質管理を行い、細胞内に異常蛋白質や変性蛋白質が蓄積するのを防いでいる。これらの機能は分子シャペロンと総称されており、HSPは熱ショックをはじめさまざまな物理的・化学的な傷害因子により誘導される。HSPを多く発現した細胞は、さまざまな傷害因子に対して強い抵抗力を獲得することは既に確立された事実である。
【0004】
HSP70ファミリーに属する分子量72キロダルトンのHSP70は、ストレスにより初めて誘導される蛋白質であり、最も研究が進んでいる。細胞を熱ショックなどの非致死的なストレスに曝すことによりHSP70を予め過剰発現させておくと、致死的な傷害因子に対しても強い抵抗性を示し、細胞は生き延びることができる。
【0005】
この抵抗性は、分子シャペロンの機能を介して細胞内に異常蛋白質や変性蛋白質が蓄積するのを防ぐことに加えて、ストレスを受けた細胞のミトコンドリアなどの細胞内小器官の機能を保全し、細胞壊死を抑制して炎症反応を抑え、アポトーシスを抑制して細胞損失を抑えることが示されている(Samali,A. et ai., Cell Stress & Chaperones 3:228, 1998)。
【0006】
さまざまな病的状態では、細胞は物理的・化学的ストレスに曝される。実験動物を用いた多くの疾患モデルにおいて、HSP70を何らかの方法で過剰に発現させると、傷害が軽減されることが明らかにされており、HSP70の臨床応用についての期待が高まっている(Minowada,G. et al., J.Clin.Invest., 95:2,1995とその引用文献を参照)。
【0007】
ヒトの疾患との関連で、細胞が遭遇するさまざまなストレスについて言及すると、まず、代表的なストレスとして虚血があげられる。予め実験動物に全身の熱ショック負荷を行いHSP70を過剰発現させておくと、脳動脈や冠状動脈を結紮した場合でも、脳(Kitagawa,K. et al., J.Cereb. Blood Flow Metab., 11:449,1991)や心臓(Donnelly,T.J. et al., Circulation 85 :1048,1992)の梗塞部位が縮小することが示されている。また、HSP70の遺伝子導入を行ったマウスでも、心筋梗塞の抑制効果が示されている(Maber, M.S. et al., J.Clin.Invest.,95:1446,1995)。HSP70の虚血による細胞障害の抑制効果は、脳と心臓に限らず総ての臓器についても適応される。
【0008】
活性酸素・フリーラジカルは、感染、炎症、変性疾患、自己免疫疾患、動脈硬化、老化にともない産生量が増加して細胞障害を引き起こす。HSP70は、これらの活性酸素・フリーラジカルによる細胞障害を抑制することが示されている(Polla B.S. et al., Proc.Natl.Acad Sci.USA,93:6458,1996)。
【0009】
虚血・再灌流傷害は、再灌流時の活性酸素の産生亢進が主要な病因の一つとして確率されており、HSPが脳、心臓、肝、小腸などにおいて軽減されることが知られている。このHSPによる保護作用は、総ての臓器に適応される。また、臓器移植は、虚血再灌流傷害の典型例の一つである。事実、HSP70を過剰発現させておくと、皮膚の移植片の生着率が改善することが示されており(Koenig,W.J. et al., Plast Recontsr. Surg., 90:659,1992)、肝移植の際にも、移植肝がHSP70を多く発現するほど急性拒絶反応が軽減することも報告されている(Flohe,S. et al., Traspl.lnt., 11:89,1998)。また、紫外線、放射線、重金属、アルコール、抗癌剤やパラコートは、主に活性酸素・フリーラジカルによる傷害を引き起こす。HSP70は、紫外線、放射線による皮膚、粘膜、目のレンズや網膜の傷害の予防と治療、さらにアルコール性臓器傷害、重金属や薬物中毒の治療効果も期待できる。
【0010】
また、癌細胞は、HSP70を細胞表面に発現し、このHSP70がNK細胞を活性化することから(kurosawa,S. et al., Eur.J.lmmunol., 23:1029,1993)、このHSP70の発現を介して癌免疫を賦活化させることもできる。また、微生物の侵入に対しても、宿主マクロファージのHSPの発現が強いほど感染抵抗性が増すことも示されており(Denagel,D.C. et al., Crit.Rev.lmmunol., 13:71, 1993)、免疫賦活−生体防御能の増強効果も期待できる。
【0011】
HSP70による細胞内蛋白質の品質管理の働きに注目して、細胞内に異常蛋白質が蓄積する疾患、例えば、βアミロイドの沈着によるアルツハイマー病、異常プリオン蛋白質の沈着するクロイツフェルド・ヤコブ病、さらにアミロイドーシス、ウィルソン病、パーキンソン病などの変性疾患の予防と治療にも効果が期待できる。
【0012】
また、外科手術、外傷などの生体侵襲などの身体的ストレスに対する耐性効果が期待されるばかりでなく、精神的ストレスによるアレルギー疾患、ストレス潰瘍、慢性炎症性疾患などの発症や増悪を抑制する効果も期待できる。HSP70は、敗血症による多臓器不全・ショックの軽減(Hauser,G.J. et al., Am.J.Physiol., 271:H2529,1996)や、成人呼吸窮迫症候群(adult respiratory distress syndrome)の予後を改善することも報告されており(Villar,J. et al., Am.Rev.Respir.Dis., 147:177,1993)、これらの重度の生体侵襲時の治療薬としてもその効果が期待される。
【0013】
HSPは、細胞内(生体内)物質であるため、その誘導にともない副作用が発生する可能性は少ない。またHSP70の過剰発現が原因となる疾患も報告されていない。動物実験では、全身の熱ショック、一過性の阻血操作、HSP70の遺伝子導入などが行われているが、実際の臨床に応用することは困難である。このため、組織や細胞に害を与えず、しかも選択的にHSPを誘導する機器は臨床的にも優れた治療装置といえる。
【0014】
転写因子は外界からのシグナル伝達系の最下位に位置するため、それを標的にすることで副作用を最小限にとどめることができると考えられる。NF−κBは転写因子の一つであり、細胞質内では阻害蛋白質であるIκBと結合して不活性化されている。細胞が種々の刺激を受けるとIκBがリン酸化を受け、それに引き続きユビキチン化を受けてプロテアソームにより分解される。遊離状態となったNF−κBは核へ移行し、さまざまな遺伝子を特異的に活性化する。NF−κBの制御下にある遺伝子には、免疫系の細胞で重要な働きをするサイトカイン(TNF−α,β,IL−2,6,8等)等があげられる。これらの遺伝子は、細胞が刺激を受けた際に発現誘導されるため、免疫応答にNF−κBが深く関わっていることが分かる。しかし、その炎症応答が過剰になってしまうと、さまざまな疾患を引き起こすことが知られている。例えば、リウマチや喘息、皮膚炎等さまざまな炎症性の疾患、自己免疫疾患、ウィルス性疾患、動脈硬化症等などの疾患にNF−κBが関与していることから、NF−κBを制御することの意義は臨床的にも極めて大きいものである(Anning Lin. Cancer Biology, 2003, Aggarwal BB et al. Indian J Exp Biol ,2004, Alok C. Bharti et al. Biochemical Pharmacology, 2002)。
【0015】
【非特許文献1】Samali,A. et ai., Cell Stress & Chaperones 3:228, 1998
【非特許文献2】Minowada,G. et al., J.Clin.Invest., 95:2,1995とその引用文献
【非特許文献3】Kitagawa,K. et al., J.Cereb. Blood Flow Metab.,11:449,1991
【非特許文献4】Donnelly,T.J. et al., Circulation 85 :1048,1992
【非特許文献5】Maber, M.S. et al., J.Clin.Invest.,95:1446,1995
【非特許文献6】Polla B.S. et al., Proc.Natl.Acad Sci.USA,93:6458,1996
【非特許文献7】Koenig,W.J. et al., Plast Recontsr. Surg., 90:659,1992
【非特許文献8】Flohe,S. et al., Traspl.lnt., 11:89,1998
【非特許文献9】kurosawa,S. et al., Eur.J.lmmunol., 23:1029,1993
【非特許文献10】Denagel,D.C. et al., Crit.Rev.lmmunol., 13:71, 1993
【非特許文献11】Hauser,G.J. et al., Am.J.Physiol., 271:H2529,1996
【非特許文献12】Villar,J. et al., Am.Rev.Respir.Dis., 147:177,1993
【非特許文献13】Anning Lin. Cancer Biology, 2003
【非特許文献14】Aggarwal BB et al. Indian J Exp Biol ,2004
【非特許文献15】Alok C. Bharti et al. Biochemical Pharmacology, 2002
【発明の開示】
【発明が解決しようとする課題】
【0016】
しかしながら、前記ユビキチン・プロテアソームシステムに基づく生体正常化機構は、生体組織の正常(健康)時においてはあらゆる細胞に存在するユビキチンの量が十分でなく、不要となった蛋白質を迅速且つ確実に分解して排除できないという課題を有していた。また、生体組織の異常(疾患)時においては、ユビキチンが結合した不要となった蛋白質を分解して排除することから、細胞内のユビキチンも減少することとなり、この異常(疾患)の細胞が計画的な細胞死に至らず、腫瘍等の異常な細胞が減少せず異常(疾患)を改善できないという課題を有していた。
【0017】
他方、電気温熱式治療器等によるHSPに基づく生体正常化機構は、生体に対して極めて高い温度(例えば、42℃)を1時間以上加熱しなければHSPが十分に発現誘導せず活性化されないことから、加熱による生体組織の損傷等を伴い、迅速且つ正確な生体の正常化ができないという課題を有していた。
さらに、NF−κBの活性を制御するIκBの量及びリン酸化状態に影響することにより生体を正常化する方法はなかった。
【0018】
本発明は、前記課題を解消するためになされたもので、生体又は生体組織を迅速且つ正確に正常化できる生体組織正常化方法を提供することを目的とする。
【課題を解決するための手段】
【0019】
本発明に係る生体組織正常化方法は、微弱な直流電流を所定の間隔で間歇的に生体又は生体組織に通電し、当該生体又は生体組織における正常化機構を蛋白質を介して活性化させるものである。このように本発明においては、微弱な直流電流を所定の間隔で間歇的に生体又は生体組織に通電し、当該生体又は生体組織における正常化機構を蛋白質を介して活性化させることにより、疾患の異常な生体又は生体組織の正常化を迅速且つ正確に行うことができるという効果を奏する。
【0020】
また、本発明に係る生体組織正常化方法は必要に応じて、前記直流電流が通電される生体又は生体組織に温熱を加えるものである。このように本発明においては、直流電流が通電される生体又は生体組織に温熱を加えることにより、生体又は生体組織の正常化をより迅速且つ正確に行うことができるという効果を有する。
【0021】
また、本発明に係る生体組織正常化方法は必要に応じて前記蛋白質が、ユビキチンであるものである。このように本発明においては、蛋白質が、ユビキチンであることから生体又は生体組織の正常化をより迅速且つ正確に行うことができるという効果を有する。
【0022】
また、本発明に係る生体組織正常化方法は必要に応じて、前記蛋白質が、熱ショック蛋白質であるものである。このように本発明においては、生体又は生体組織の正常化をより迅速且つ正確に行うことができるという効果を有する。
【0023】
また、本発明に係る生体組織正常化方法は必要に応じて、前記蛋白質が、IκB蛋白質であるものである。このように本発明においては、蛋白質が、IκB蛋白質であることから生体又は生体組織の正常化をより迅速且つ正確に行うことができるという効果を有する。
【0024】
また、本発明に係る生体組織正常化方法は必要に応じて、前記直流電流の間歇的な間隔が、30Hzないし100Hzであるものである。このように本発明においては、直流電流の間歇的な間隔が、50Hzないし60Hzであることから生体又は生体組織の正常化をより迅速且つ正確に行うことができるという効果を有する。
【0025】
また、本発明に係る生体組織正常化方法は必要に応じて、前記温熱が、38℃以上45℃以下であるものである。このように本発明においては、温熱が、38℃以上45℃以下であることから生体又は生体組織の正常化をより迅速且つ正確に行うことができるという効果を有する。
【0026】
本発明に係る治療装置は、生体又は生体組織の異なる部位に1対のパッド素子を付着し、当該1対のパッド素子間に電流を電流制御手段が通電して前記生体を治療する治療装置において、前記パッド素子が生体又は生体組織の表面に付着する導電性のシート体からなる導電層と、当該導電層の背面側に配設され、伝熱特性を有し且つ絶縁性のシート体からなる絶縁層と、当該絶縁層の背面側に配設され、両端部分に1対の電極が配設され、当該1対の電極間に抵抗が配設される発熱層とを備え、前記電流制御手段が、前記1対のパッド素子における各導電層間に微弱な直流電流を所定の間隔で間歇的に供給制御すると共に、前記1対のパッド素子の各発熱層における各1対の電極間に電流を供給制御するものである。
【0027】
このように本発明においては、生体又は生体組織の異なる部位に付着する1対のパッド素子が生体又は生体組織の表面に付着する導電性のシート体からなる導電層、伝熱特性を有し且つ絶縁性のシート体からなる絶縁層、両端部分に1対の電極が配設され、当該1対の電極間に抵抗が配設される発熱層を順次積層して形成され、前記各導電層間に微弱な直流電流を所定の間隔で間歇的に供給制御すると共に、前記各発熱層における各1対の電極間に電流を電流制御手段が供給制御することにより、電流が通電される生体又は生体組織に同時に加熱できることとなり、生体又は生体組織の正常化をより迅速且つ正確に行うことができるという効果を有する。
【0028】
また、本発明に係る治療装置は必要に応じて、前記パッド素子の発熱層が、1対の電極が各々短冊状に形成され、当該電極間の抵抗が短冊状の電極に平行な方向に配向性を有するカーボン繊維で形成されるものである。このように本発明においては前記パッド素子の発熱層が、1対の電極が各々短冊状に形成され、当該電極間の抵抗が短冊状の電極に平行な方向に配向性を有するカーボン繊維で形成されることにより、電極間がカーボン繊維により短絡されることなくこの各平行なカーボン繊維相互間の適度な抵抗値により発熱できることとなり、生体又は生体組織の正常化をより迅速且つ正確に行うことができるという効果を有する。
【0029】
また、本発明に係る治療装置は必要に応じて、前記各導電層に供給される直流電流が、50Hzないし60Hzの周期で間歇的に供給制御されるものである。このように本発明においては、各導電層に供給される直流電流が、50Hzないし60Hzの周期で間歇的に供給制御されることにより、生体又は生体組織による電流刺激を効果的に行うことができることとなり、生体又は生体組織の正常化をより迅速且つ正確に行うことができるという効果を有する。
【0030】
また、本発明に係る治療装置は必要に応じて、前記1対のパッド素子の各発熱層が、38℃以上45℃以下に加熱するものである。このように本発明においては、1対のパッド素子の各発熱層が、38℃以上45℃以下に加熱することにより、生体又は生体組織による適度な温熱刺激を与えることができることとなり、生体又は生体組織の正常化をより迅速且つ正確に行うことができるという効果を有する。
【0031】
また、本発明に係る治療装置は必要に応じて、前記導電層に供給される直流電流が、1分以上で任意の供給時間とし、当該供給時間に反比例した電圧値を0.4V以下0.01V以上の間で設定して印加されるものである。このように本発明においては、前記導電層に供給される直流電流が、1分以上で任意の供給時間とし、当該供給時間に反比例した電圧値を0.2V以下0.03V以上の間で設定して印加されることにより、電流刺激と温熱刺激とを適度にバランスをとることができることとなり、生体又は生体組織の正常化をより迅速且つ正確に行うことができるという効果を有する。
【発明を実施するための最良の形態】
【0032】
以下、本発明の一実施形態に係る治療装置を生体組織正常化方法と共に、図1ないし図3に基づいて説明する。この図1は本実施形態に係る治療装置の全体概略構成図、図2は図1に記載の治療装置におけるパッド素子の平面図、図3は図2に記載のパッド素子のA−A線断面図、図4は図3に記載のパット素子のB−B線断面図を示す。
【0033】
前記各図において本実施形態に係る治療装置は、生体100の異なる部位に1対のパッド素子1、2を付着し、この1対のパッド素子1、2間に電源200からの電流を電流制御手段3が通電して前記生体100を治療する治療装置において、前記パッド素子1、2が、生体100表面に付着する導電性のシート体からなる導電層11、21と、この導電層11、21の背面側に配設され、伝熱特性を有し且つ絶縁性のシート体からなる絶縁層12、22と、この絶縁層12、22の背面側に配設され、両端部分に1対の電極13a・13b、23a・23bが配設され、この1対の電極13a・13b、23a・23b間に抵抗13c、23cが配設される発熱層13、23と、この発熱層13、23の背面最外側に配設され、断熱特性を有し且つ絶縁性のシート体からなる被覆層14、24とを備え、電流制御手段3が、前記1対のパッド素子1、2における各導電層11、21間に微弱な直流電流を所定の間隔で間歇的に供給制御すると共に、前記1対のパッド素子1、2の各発熱層13、23における各1対の電極13a・13b、23a・23b間に直流電流を供給制御する構成である。
【0034】
前記発熱層13、23は、1対の電極13a・13b、23a・23bが各々短冊状に形成され、この電極13a・13b、23a・23b間の抵抗13c、23cが短冊状の電極13a・13b、23a・23bに平行な方向に配向性を有するカーボン繊維16でで形成され、加熱温度42℃に加熱される構成である。
前記電流制御手段3は、導電層11、21に対して55Hzの周期で間歇的にON状態となるように10分以上30分以下の間だけ微弱電流を供給し、印加電圧を0.2V以下0.03V以上に制御する構成である。
【0035】
前記電流制御手段3が生体又は生体組織に通電する微弱電流、印加電圧及び間歇的な通電(印加)の周波数についてヒトを対象とした試験結果に基づいて説明する。このヒト対象の試験はヒトの両足の印加部位に0.2[V]から0.4[V]の印加電圧を印加し、ヒトの抵抗値(ヒト口腔内の抵抗値)を約0.2[MΩ]とすると、ヒトの体内での電圧降下(電位差)が0.1[V]ないし0.2[V]が発生している。この電位差0.1[V]ないし0.2[V]及びヒトの抵抗値約0.2[MΩ]より前記微弱電流は、0.5[μA]ないし1.0[μA]が前記電流制御手段3により通電制御される。
【0036】
このヒト対象の試験において、被試験者におけるヒトの両足に印加電圧0.3[V]を印加し、周波数を35[Hz]から150[Hz]で変化させて被試験者の感覚(快適感〜不快適感)を次の通り検出した。
【0037】
まず、35Hzでは、まだ違和感があり、長時間の処理で気持ちが悪くなることが解った。45Hzでは、しびれ感が強く、気持ちが悪く(不快)感じ、長時間の処理が無理であることが解った。50Hzでは、快適感の許容範囲であることが解った。55Hzでは、極めて快適であることが解った。60Hzでは、快適感の許容範囲であることが解った。
【0038】
また、65Hzでは、少し刺激が感じられなくなり、0.350Vに挙げると55Hz時に近いような刺激を感じることができるものの、ただ、最適ではないことが解った。70Hzでは、ほとんど刺激を感じられないことが解った。75Hzでは、ほとんど刺激を感じられず、印加電圧を0.400Vに上げると少し刺激を感じることが解った。100Hzでは、全く刺激を感じられず、印加電圧を0.450Vに上げると少し刺激を感じることが解った。150Hzでは、全く刺激を感じられず、印加電圧を0.600Vにまで上げたが感じないことが解った。
【0039】
また、印加電圧を0.25[V]、0.3[V]、0.35[V]及び0.4[V]とした場合におけるこの直流電圧を間歇印加する周波数の最適周波数を試験にて求めた。この印加電圧が0.250[V]の場合に周波数を35<Hz<50で変化させると、35[Hz]以下はしびれ感が強く気持ちが悪く感じ、50[Hz]以上では感じない。また、印加電圧が0.300[V]の場合に周波数を45<Hz<60で変化させると、45[Hz]以下はしびれ感が強く気持ちが悪く感じ、75[Hz]以上では感じない。また、印加電圧が0.400[V]の場合に周波数を65<Hz<75で変化させると、75[Hz]以下は強く筋肉の収縮が現れるか、気持ちが悪く感じ、75[Hz]以上では感じない。
【0040】
以上の試験結果より、印加電圧が0.3[V]で周波数55(±1)[Hz]が最適周波数であり、50[Hz]ないし60[Hz]の範囲で電流制御手段3が制御することが望ましいことが解る。
また、生体又は生体組織に対する電気信号の機能から、前記電流制御手段3は次の通り微弱電流を制御することできる。即ち、生体又は生体組織の非興奮性細胞に生体電流に相当する微弱電流を強制的に通電して、体内のタンパク質を介して活性化するものである。このように非興奮性細胞にのみ生体電流に相当する微弱電流を通電し、筋肉性細胞等の興奮性細胞に生体電流に相当する外部からの電流を通電しないので収縮等の刺激を与えることがない。
従って、電流制御手段3は、興奮性細胞が、例えば筋肉性細胞を不快に収縮させない電流レベルの微弱電流を通電するように制御する。
【0041】
次に、本実施形態における治療装置の動作により発現する蛋白質の誘導効果をヒトの培養細胞系、ヌードマウス、ΔF508CFTRを安定高発現させた培養細胞系について、以下の実験に基づいて具体的に説明する。
【実施例】
【0042】
(検討項目)
(1)ヒトの培養細胞系における評価を以下のi)、ii) 、iii)の三点について行った。
【0043】
i) HSP70の誘導
ii) 細胞障害の有無
iii) ユビキチン化の促進
(2)ヌードマウスにおける評価を以下のi)、ii) 、iii)、iv)の四点について行った。
【0044】
i) 一回処置における正常組織中のHSP70の誘導
ii) 一回処置による腫瘍組織中のHSP70の誘導
iii) 腫瘍組織におけるユビキチン化の促進
iv) 1日1回処置あるいは1日1回の3日間処置による正常組織中のIκB−α及びそのリン酸化体の発現
【0045】
(3)ΔF508CFTRを安定高発現させた培養細胞系における評価を以下のi)、ii) の二点について行った。
i) HSP70の誘導
ii) ユビキチン化の促進
【0046】
(4)2型糖尿病モデルマウス(高脂肪食負荷マウス)における評価を以下のi)、ii)、 iii)、iv)、v)、vi)、vii)、viii)、ix)の九点について行った。以下の検討は,本発明に係る生体組織正常化方法を1週間に2回処置し続けて10週間後に行った。
i)空腹時血糖値
ii)インスリン値
iii)血清アディポネクチン値
iv)グルコース負荷試験
v)インスリン負荷試験
vi)内臓脂肪の組織重量
vii)皮下脂肪の組織重量
viii)肝重量
ix)褐色脂肪細胞中のUCP1mRNAの誘導
【0047】
(5)急性胃潰瘍モデルマウスにおける評価を以下の点について行った。以下の検討は、本発明に係る生体組織正常化方法を1週間に2回処置し続けて2週間後に行った。
i)胃粘膜損傷割合
【0048】
(6)正常マウスにおける評価を以下の点について行った。以下の検討は、本発明を最初の血球測定2週間前から1週間に1回処置し続けて2週間ごとに行った。
i)血液1mLあたりの白血球数
【0049】
(実施方法)
1)HSP70の測定はマウス抗HSP70モノクローナル抗体を用いたイムノブロットを行い、結合した抗体を増感化学発光法(Enhanced chemiluminescence;ECL)ウエスタンブロット検出キット(アマシャム社製)で検出し測定した。ローディングコントロールとしてカルネキシン(CNX)を検出した。
2)ユビキチン化蛋白質の測定は、マウス抗ユビキチン化蛋白質モノクローナル抗体を用いたイムノブロットを行い、 結合した抗体を増感化学発光法(Enhanced chemiluminescence;ECL)ウエスタンブロット検出キット(アマシャム社製)で検出し測定した。
【0050】
3)IκB−α及びIκB−αリン酸化体の測定はラビット抗IκB−αポリクローナル抗体及びラビット抗リン酸化IκB−αポリクローナル抗体を用いたイムノブロットを行い、結合した抗体を増感化学発光法(Enhanced chemiluminescence;ECL)ウエスタンブロット検出キット(アマシャム社製)で検出し測定した。
4)倒立型実体顕微鏡(オリンパス社製)を用いて、治療装置処置による細胞傷害の有無を、形態変化を撮影して確認した。
5)血糖値の測定は、自己血糖測定器(ロシュ社製)を用いて測定した。
【0051】
6)インスリン値および血清アディポネクチン値の測定は、スカイライト・バイオテック(株)の LipoSEARCH(高感度ゲルろ過HPLCによる網羅的解析システム)により測定した。
7)UCP1mRNAの測定は、RT−PCRを行うためにRT−PCRキット(タカラ社製)で検出し測定した。
【0052】
8)急性胃潰瘍モデルマウスはマウスに塩酸エタノールを経口投与することによって作成した。胃粘膜損傷割合の測定は、損傷胃粘膜面積を解剖顕微鏡下で測定し、以下の式に従って求めた。
胃粘膜損傷割合=(損傷胃粘膜総面積/胃粘膜総面積)×10
9)白血球数の測定は、血球数測定装置SysmexF−520(Sysmex社製)を用いて測定した。
【0053】
(実施結果)
(1) ヒト培養細胞系については、前記実験方法により図5、図6、図7に示すようにな以下の評価結果が得られた。
【0054】
i) HSP70の誘導(図5(A)、(B)を参照)
HSP70の誘導レベルを微弱電流単独(実施1−1)及び温熱単独(実施1−2)、微弱電流及び温熱の同時併用(実施1−3)について治療10分処置後に5時間、静置・培養して、ウエスタンブロット法により検出した。その結果、微弱電流単独(実施1−1)と温熱単独(実施1−2)においてHSP70の誘導が約3.5倍、約1.9倍(図5(B)を参照)であることがみられ、同時併用(実施1−3)の場合には、特に約5.2倍という明確なHSP70の誘導がみられた。
【0055】
ii) 細胞障害の有無(図6参照)
上記の条件下で電子顕微鏡を用いて細胞障害の有無を調べた。その結果、微弱電流単独(実施2−1)及び温熱単独(実施2−2)、微弱電流及び温熱の同時併用(実施2−3)治療処置により細胞傷害が起こらないことを確認した。
【0056】
iii) ユビキチン化の促進(図7(A)、(B)を参照)
前記図5における微弱電流及び温熱の同時併用を治療処置を条件とし、10分間の治療処置後に0時間(実施3−1)、2時間(実施3−2)、5時間(実施3−3)、8時間(実施4)、静置・培養した時のユビキチン化蛋白質の量をウエスタンブロット法により検出した。その結果、5時間経過時には10倍、8時間経過時には68倍という指数関数的にユビキチン化が促進されていることを認めた。
(2)ヌードマウスにについては、前記実施方法により図8、図9、図10及び図11に示すような以下の評価結果が得られた。
【0057】
i) 一回処置における正常組織中のHSP70の誘導(図8(A)、(B)を参照)
このヌードマウスの正常組織に微弱電流及び温熱を同時に併用した治療処理条件とし、治療処置を経時的に10分(実施4−1)、20分(実施4−2)の各処置後に6時間飼育し、正常組織中(大腸の例を示す)のHSP70の誘導レベルをウエスタンブロット法により検出した。その結果、20分(実施4−2)の処置の場合には、約2.7倍という明確なHSP70の誘導が認められた。
【0058】
ii) 一回処置による腫瘍組織中のHSP70の誘導(図9(A)、(B)を参照)
このヌードマウスの腫瘍組織に微弱電流及び温熱を同時に併用した治療処置条件とし、この治療処置を20分間処置した後に6時間飼育し、腫瘍組織中におけるHSP70の誘導レベルを(実施5a−1)、(実施5b−1)に示すようにウエスタンブロット法により検出した。その結果、腫瘍組織においても約1.9倍及び2.4倍という明確なHSP70の誘導が認められた。
【0059】
iii) 腫瘍組織におけるユビキチン化の促進(図10(A)、(B)、(C)を参照)
ヌードマウスの腫瘍組織に対して微弱電流単独(実施6−1)、温熱単独(実施6−2)及び同時併用(実施6−3)の場合について、治療処置20分間処置した後に6時間飼育し、腫瘍組織においてユビキチン化蛋白質を、ウエスタンブロット法により検出した。その結果、微弱電流単独(実施6−1)及び温熱単独(実施6−2)においては、共に1.5倍というHSP70の誘導が認められ、1.3倍及び1.6倍のユビキチン化蛋白質の増加が認められた。特に、同時併用(実施6−3)の場合は、約2.3倍というHSPの明確な誘導が認められ、3.5倍という著明なユビキチン化蛋白質の増加が認められた。
【0060】
iv) 1日1回処置あるいは1日1回の3日間処置による正常組織中のIκB−α及びそのリン酸化体の発現(図11(A)、(B)、(C)を参照)
ヌードマウスの正常組織に対して微弱電流及び温熱を同時に併用して処置を1日1回(実施7−1)・(実施7−2)、あるいは1日1回の3日間(実施7−3)・(実施7−4)行い、このヌードマウスの正常組織中(大腸の例を示す)のIκB及びIκB−αリン酸化体をウエスタンブロット法により検出した。その結果、1日1回の3日間(実施7−3)・(実施7−4)の処置においてIκBの量及びIκB−αリン酸化体が比較例より明確に増加していることを見出した。
【0061】
(3)ΔF508CFTRを安定高発現させた培養細胞系にについては、前記実施方法により図12及び図13に示すような以下の評価結果が得られた。
i) HSP70の誘導(図12(A)、(B)を参照)
HSP70の誘導レベルを微弱電流単独(実施8−1)、温熱単独(実施8−2)及び微弱電流と温熱との同時併用(実施8−3)について、治療処置を10分間処置した後に5時間、静置・培養して、ウェスタンブロット法により検出した。その結果、微弱電流単独(実施8−1)と温熱単独(実施8−2)において62倍と18倍のHSP70の誘導がみられたが、同時併用(実施8−3)はより明確な約105倍というHSP70の誘導がみられた。
【0062】
ii) ユビキチン化の促進(図13(A)、(B)を参照参照)
微弱電流単独(実施9−1)、温熱単独(実施9−2)及び微弱電流と温熱との同時併用(実施9−3)について、治療処置を10分間処置した後に5時間、静置・培養した後、ユビキチン化ΔF508CFTRをウエスタンブロット法により検出した。その結果、微弱電流単独(実施9−1)及び同時併用(実施9−3)の各処置により、共に検出3.9倍というΔF508CFTRのユビキチン化が促進されることを見出した。
【0063】
(4)2型糖尿病モデルマウス(高脂肪食負荷マウス)については、前記実施方法により図14,図15,図16,図17,図18,図19,図20,図21及び図22に示すような以下の評価結果が得られた。
i)10週間処置後の空腹時血糖値(図14を参照)
この高脂肪食負荷マウスに微弱電流及び温熱を同時に併用した群(実施10)では,空腹時血糖値の有意な低下が認められた。(P<0.05,n=8)
ii)10週間処置後のインスリン値(図15を参照)
この高脂肪食負荷マウスに微弱電流及び温熱を同時に併用した群(実施11)では,インスリン値の有意な低下が認められた。(P<0.05,n=8)
iii)10週間処置後の血清アディポネクチン値(図16を参照)
この高脂肪食負荷マウスに微弱電流及び温熱を同時に併用した群(実施12)では,血清アディポネクチン値の有意な増加が認められた。(P<0.05,n=8)
【0064】
iv)グルコース負荷試験(図17を参照)
この高脂肪食負荷マウスに微弱電流及び温熱を同時に併用した群(実施13)では,耐糖能の改善が有意に認められた。(P<0.001,n=8)
v)インスリン負荷試験(図18を参照)
この高脂肪食負荷マウスに微弱電流及び温熱を同時に併用した群(実施14)では,インスリン感受性の改善が有意に認められた。(P<0.05,n=8)
vi)10週間処置後の内臓脂肪の組織重量(図19を参照)
この高脂肪食負荷マウスに微弱電流及び温熱を同時に併用した群(実施15)では,内臓脂肪の組織重量が有意に減少していることが認められた。(P<0.05,n=8)
【0065】
vii)10週間処置後の皮下脂肪の組織重量(図20を参照)
この高脂肪食負荷マウスに微弱電流及び温熱を同時に併用した群(実施16)では,皮下脂肪の組織重量が有意に減少していることが認められた。(P<0.05,n=8)
viii)10週間処置後の肝重量(図21を参照)
この高脂肪食負荷マウスに微弱電流及び温熱を同時に併用した群(実施17)では,肝重量が有意に減少していることが認められた。(P<0.05,n=8)
xi)10週間処置後のUCP1mRNAの誘導(図22を参照)
この高脂肪食負荷マウスに微弱電流及び温熱を同時に併用した群(実施18)では,褐色脂肪細胞中のUCP1mRNA発現量が有意に増加していることが認められた。(P<0.05,n=8)
【0066】
(5)急性胃潰瘍モデルマウスについては,前記実施方法により図23に示すような以下の評価結果が得られた。
i)2週間処置後の胃粘膜損傷割合(図23を参照)
微弱電流及び温熱を同時に併用した群(実施19・1)、急性胃潰瘍モデルマウス群(実施19・2)、急性胃潰瘍モデルマウスに微弱電流及び温熱を同時に併用した群(実施19・3)で、胃粘膜損傷割合を測定した。その結果、急性胃潰瘍モデルマウスに微弱電流及び温熱を同時に併用した群(実施19・3)で、胃粘膜損傷割合の有意な低下が認められた。(P<0.05,n=4・7)
【0067】
(6)正常マウスについては,前記実施方法により図24に示すような以下の評価結果が得られた。
i)2週間ごとの白血球数変化率(図24を参照)
微弱電流及び温熱を同時に併用した群(実施20)では,血球1mL当りの白血球数が有意に増加していることが認められた。(P<0.01,n=5)
以上のように本発明に係る生体組織正常化方法及び治療装置は、極めて優れたHSP誘導能を有し、各種疾患に有効であることが明らかである。また、本発明に係る生体組織正常化方法及び治療装置は、その安全性の高さから考えても、臨床上極めて優れた有用性が期待できる。前記各種疾患の具体例としては、脳神経疾患、心脈管系疾患、消化器系疾患、、代謝性疾患、自己免疫疾患、変性疾患、虚血性神経細胞障害、虚血・再灌流傷害、嚢胞性繊維症、悪性腫瘍、感染症、肝不全、腎不全、薬物中毒、重金属中毒、放射線傷害、紫外線傷害、生体侵襲、又は老化等がある。脳神経疾患には、脳卒中、脳卒中後遺症、遅発性神経細胞死、アルツハイマー病、パーキンソン病、多発性硬化症又はクロイツフェルド・ヤコブ病等がある。
【0068】
また、本発明に係る生体組織正常化方法及び治療装置は、エビキチン化蛋白質を介して生体又は生体組織における正常化機構を活性化されるものであり、細胞内の約80%の蛋白質がユビキチン化された後にプロテアソームで分解される。しかし、プロテアソームの働きが阻害されると、細胞内に分解されないユビキチン化蛋白質が増加するため、細胞は計画的な細胞死の道を選択する。この原理を利用して、プロテアソーム阻害剤が現在、抗癌剤として注目されている(Julian A.Cancer Cell, 2003, Angelika M. B et al. European Journalof Cancer, 2004)。
【0069】
プロテアソーム阻害剤は、蛋白質の合成や分解が盛んな増殖期に作用しやすい。正常細胞と比較して、腫瘍細胞内では細胞増殖に関連する蛋白質の調節異常が生じているため、細胞の増殖率が非常に速い。そのため腫瘍組織は、増殖期の細胞に作用するプロテアソーム阻害剤の影響を受けやすい。本発明に係る生体組織正常化方法及び治療装置は、ユビキチン化を促進するため、細胞内のユビキチン化蛋白質が非常に増加する。そのためプロテアソームが飽和状態となり、プロテアソームの働きが阻害された時と同様な状態になる。
【0070】
すなわち、本発明に係る生体組織正常化方法及び治療装置は、プロテアソームを阻害することによる抗腫瘍効果も有している。また、その効果は、これらの原理に基づき、腫瘍細胞特異的に発揮されることも期待できる。このようにユビキチン化蛋白質を介したユビキチン・プロテアソームシステムの正常化機構成により改善される疾患としては、神経変性疾患(例えば、パーキンソン病、アルツハイマー病、筋萎縮性側索硬化症(ALS)、ミオクロニーてんかん等)、癌疾患(例えば、家族性乳がん、卵巣がん等)、色素性乾皮症等がある。
【0071】
NF−κBが過剰に活性化されると、リウマチや喘息、皮膚炎等さまざまな炎症性疾患、自己免疫疾患、ウィルス性疾患、動脈硬化症等が引き起こされるため、NF−κBを制御することの意義は臨床的にも極めて大きいものである。したがって、本発明の治療装置は、その微弱電流等の効果によりIκBの量を増加させるつつ、IκBのリン酸化を適度に抑制するため、NF−κBによる過剰な免疫応答の結果として引き起こされる種々の病態を改善することが期待される。
【0072】
なお、本発明は、前記実施の形態においてヒトの培養細胞系、ヌードマウス、ΔF508CFTRを安定高発現させた培養細胞系の動物の組織細胞を対象として説明したが、植物の組織細胞に対しても適用することができ、同様の作用・効果が奏し得られる。
【図面の簡単な説明】
【0073】
【図1】本発明の一実施形態に係る治療装置の全体概略構成図である。
【図2】図1に記載の治療装置におけるパッド素子の平面図である。
【図3】図2に記載のパッド素子のA−A線断面図である。
【図4】図3に記載のパット素子のB−B線断面図である。
【図5】ヒトの培養細胞系におけるHSP70の誘導の評価結果である。
【図6】ヒトの培養細胞系における細胞障害の有無の評価結果である。
【図7】ヒトの培養細胞系におけるユビキチン化の促進の評価結果である。
【図8】ヌードマウスに対する一回処置による正常組織中のHSP70の誘導の評価結果である。
【図9】ヌードマウスに対する一回処置による腫瘍組織中のHSP70の誘導の評価結果である。
【図10】ヌードマウスに対する一回処置による腫瘍組織中のユビキチン化の促進の評価結果である。
【図11】ヌードマウスに対する1日1回処置あるいは1日1回の3日間処置によるIκB−α及びそのリン酸化体の発現量の検討の評価結果である。
【図12】遺伝子変異細胞ΔF508CFTRを安定高発現させた培養細胞系におけるHSP70の誘導の評価結果である。
【図13】遺伝子変異細胞ΔF508CFTRを安定高発現させた培養細胞系におけるユビキチン化の促進の評価結果である。
【図14】2型糖尿病モデルマウス(高脂肪食負荷マウス)について行った実験評価で10週間処置後の空腹時血糖値である。
【図15】2型糖尿病モデルマウスについて行った実験評価で10週間処置後のインスリン値である。
【図16】2型糖尿病モデルマウスについて行った実験評価で10週間処置後の血清アディポネクチン値である。
【図17】2型糖尿病モデルマウスについて行った実験評価でグルコース負荷試験結果である。
【図18】2型糖尿病モデルマウスについて行った実験評価でインスリン負荷試験結果である。
【図19】2型糖尿病モデルマウスについて行った実験評価で10週間処置後の内臓脂肪の組織重量である。
【図20】2型糖尿病モデルマウスについて行った実験評価で10週間処置後の皮下脂肪の組織重量である。
【図21】2型糖尿病モデルマウスについて行った実験評価で10週間処置後の肝重量である。
【図22】2型糖尿病モデルマウスについて行った実験評価で10週間処置後のUCP1mRNAの誘導である。
【図23】2型糖尿病モデルマウスについて行った実験評価で2週間処置後の胃粘膜損傷割合である。
【図24】2型糖尿病モデルマウスについて行った実験評価で2週間ごとの白血球数変化率である。
【符号の説明】
【0074】
1、2 パッド素子
3 電流制御手段
11、21 導電層
12、22 絶縁層
13、23 発熱層
13a・13b、23a・23b 電極
16 カーボン繊維
14、24 被覆層
100 生体
200 電源
【特許請求の範囲】
【請求項1】
微弱な直流電流を所定の間隔で間歇的に生体又は生体組織に通電し、当該生体又は生体組織における正常化機構を蛋白質を介して活性化させることを
特徴とする生体組織正常化方法。
【請求項2】
前記請求項1に記載の生体組織正常化方法において、
前記直流電流が通電される生体又は生体組織に温熱を加えることを
特徴とする生体組織正常化方法。
【請求項3】
前記請求項1又は2に記載の生体組織正常化方法において、
前記蛋白質が、ユビキチン化蛋白質であることを
特徴とする生体組織正常化方法。
【請求項4】
前記請求項1ないし3のいずれかに記載の生体組織正常化方法において、
前記蛋白質が、熱ショック蛋白質であることを
特徴とする生体組織正常化方法。
【請求項5】
前記請求項1ないし4のいずれかに記載の生体組織正常化方法において、
前記蛋白質が、IκB蛋白質であることを
特徴とする生体組織正常化方法。
【請求項6】
前記請求項1ないし5のいずれかに記載の生体組織正常化方法において、
前記直流電流の間歇的な間隔が、30Hzないし100Hzであることを
特徴とする生体組織正常化方法。
【請求項7】
前記請求項2ないし6のいずれかに記載の生体組織正常化方法において、
前記温熱が、38℃以上45℃以下であることを
特徴とする生体組織正常化方法。
【請求項8】
生体又は生体組織の異なる部位に1対のパッド素子を付着し、当該1対のパッド素子間に電流を電流制御手段が通電して前記生体を治療する治療装置において、
前記パッド素子が生体又は生体組織の表面に付着する導電性のシート体からなる導電層と、当該導電層の背面側に配設され、伝熱特性を有し且つ絶縁性のシート体からなる絶縁層と、当該絶縁層の背面側に配設され、両端部分に1対の電極が配設され、当該1対の電極間に抵抗が配設される発熱層とを備え、
前記電流制御手段が、前記1対のパッド素子における各導電層間に微弱な直流電流を所定の間隔で間歇的に供給制御すると共に、前記1対のパッド素子の各発熱層における各1対の電極間に電流を供給制御することを
特徴とする治療装置。
【請求項9】
前記請求項8に記載の治療装置において、
前記パッド素子の発熱層が、1対の電極が各々短冊状に形成され、当該電極間の抵抗が短冊状の電極に平行な方向に配向性を有するカーボン繊維で形成されることを
特徴とする治療装置。
【請求項10】
前記請求項8又は9に記載の治療装置において、
前記各導電層に供給される直流電流が、50Hzないし60Hzの周期で間歇的に供給制御されることを
特徴とする治療装置。
【請求項11】
前記請求項8ないし10のいずれかに記載の治療装置において、
前記1対のパッド素子の各発熱層が、38℃以上45℃以下に加熱することを
特徴とする治療装置。
【請求項12】
前記請求項8ないし11のいずれかに記載の治療装置において、
前記導電層に供給される直流電流が、1分以上で任意の供給時間とし、当該供給時間に反比例した電圧値を0.4V以下0.01V以上の間で設定して印加されることを
特徴とする治療装置。
【請求項1】
微弱な直流電流を所定の間隔で間歇的に生体又は生体組織に通電し、当該生体又は生体組織における正常化機構を蛋白質を介して活性化させることを
特徴とする生体組織正常化方法。
【請求項2】
前記請求項1に記載の生体組織正常化方法において、
前記直流電流が通電される生体又は生体組織に温熱を加えることを
特徴とする生体組織正常化方法。
【請求項3】
前記請求項1又は2に記載の生体組織正常化方法において、
前記蛋白質が、ユビキチン化蛋白質であることを
特徴とする生体組織正常化方法。
【請求項4】
前記請求項1ないし3のいずれかに記載の生体組織正常化方法において、
前記蛋白質が、熱ショック蛋白質であることを
特徴とする生体組織正常化方法。
【請求項5】
前記請求項1ないし4のいずれかに記載の生体組織正常化方法において、
前記蛋白質が、IκB蛋白質であることを
特徴とする生体組織正常化方法。
【請求項6】
前記請求項1ないし5のいずれかに記載の生体組織正常化方法において、
前記直流電流の間歇的な間隔が、30Hzないし100Hzであることを
特徴とする生体組織正常化方法。
【請求項7】
前記請求項2ないし6のいずれかに記載の生体組織正常化方法において、
前記温熱が、38℃以上45℃以下であることを
特徴とする生体組織正常化方法。
【請求項8】
生体又は生体組織の異なる部位に1対のパッド素子を付着し、当該1対のパッド素子間に電流を電流制御手段が通電して前記生体を治療する治療装置において、
前記パッド素子が生体又は生体組織の表面に付着する導電性のシート体からなる導電層と、当該導電層の背面側に配設され、伝熱特性を有し且つ絶縁性のシート体からなる絶縁層と、当該絶縁層の背面側に配設され、両端部分に1対の電極が配設され、当該1対の電極間に抵抗が配設される発熱層とを備え、
前記電流制御手段が、前記1対のパッド素子における各導電層間に微弱な直流電流を所定の間隔で間歇的に供給制御すると共に、前記1対のパッド素子の各発熱層における各1対の電極間に電流を供給制御することを
特徴とする治療装置。
【請求項9】
前記請求項8に記載の治療装置において、
前記パッド素子の発熱層が、1対の電極が各々短冊状に形成され、当該電極間の抵抗が短冊状の電極に平行な方向に配向性を有するカーボン繊維で形成されることを
特徴とする治療装置。
【請求項10】
前記請求項8又は9に記載の治療装置において、
前記各導電層に供給される直流電流が、50Hzないし60Hzの周期で間歇的に供給制御されることを
特徴とする治療装置。
【請求項11】
前記請求項8ないし10のいずれかに記載の治療装置において、
前記1対のパッド素子の各発熱層が、38℃以上45℃以下に加熱することを
特徴とする治療装置。
【請求項12】
前記請求項8ないし11のいずれかに記載の治療装置において、
前記導電層に供給される直流電流が、1分以上で任意の供給時間とし、当該供給時間に反比例した電圧値を0.4V以下0.01V以上の間で設定して印加されることを
特徴とする治療装置。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24】


【公開番号】特開2006−263456(P2006−263456A)
【公開日】平成18年10月5日(2006.10.5)
【国際特許分類】
【出願番号】特願2006−44363(P2006−44363)
【出願日】平成18年2月21日(2006.2.21)
【出願人】(000100399)つちやゴム株式会社 (10)
【出願人】(504159235)国立大学法人 熊本大学 (314)
【Fターム(参考)】
【公開日】平成18年10月5日(2006.10.5)
【国際特許分類】
【出願日】平成18年2月21日(2006.2.21)
【出願人】(000100399)つちやゴム株式会社 (10)
【出願人】(504159235)国立大学法人 熊本大学 (314)
【Fターム(参考)】
[ Back to top ]

