生体適合性に優れた血液浄化用中空糸膜の製造方法
【課題】
紡糸原液に添加されるビタミンの抗酸化作用が有効に発揮できる血液浄化用中空糸膜の製造方法を提供する。
【解決手段】
二重管ノズルの外側環状部と中心孔から紡糸原液と芯液をそれぞれ同時に吐出した後、凝固性液体中を通過させて凝固させ、洗浄する工程を含む血液浄化用中空糸膜の製造方法において、前記紡糸原液に脂溶性ビタミン、好ましくはビタミンEを0.05〜1.2質量%含有させ、さらにクエン酸を0.004〜0.045質量%含有させることを特徴とする。
紡糸原液に添加されるビタミンの抗酸化作用が有効に発揮できる血液浄化用中空糸膜の製造方法を提供する。
【解決手段】
二重管ノズルの外側環状部と中心孔から紡糸原液と芯液をそれぞれ同時に吐出した後、凝固性液体中を通過させて凝固させ、洗浄する工程を含む血液浄化用中空糸膜の製造方法において、前記紡糸原液に脂溶性ビタミン、好ましくはビタミンEを0.05〜1.2質量%含有させ、さらにクエン酸を0.004〜0.045質量%含有させることを特徴とする。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、血液透析時に産生する活性酸素を消去することができる、生体適合性に優れた血液浄化用中空糸膜の製造方法に関するものである。
【背景技術】
【0002】
腎不全治療などにおける血液浄化法では、血液中の尿毒素、老廃物を除去する目的で、天然素材であるセルロース、またその誘導体であるセルロースジアセテート、セルローストリアセテート、合成高分子であるポリスルホン、ポリエーテルスルホン、ポリメチルメタクリレート、ポリアクリロニトリルなどの高分子を用いた透析膜や限外濾過膜を分離材として用いた血液透析器、血液濾過器あるいは血液透析濾過器などの血液浄化器が広く使用されている。特に中空糸型の膜を分離材として用いた血液浄化器は、体外循環にかかわる循環血液量の低減、血中の物質除去効率の高さ、さらに血液浄化器組立ての生産性などの利点から血液浄化分野での利用度が高い。
【0003】
中空糸膜を用いた血液浄化器は、通常、中空糸膜の中空部に血液を流し、外側部に透析液を向流に流し、血液から透析液への拡散に基づく物質移動により尿素、クレアチニンなどの低分子量物質を血中から除くことを主眼としている。しかしながら、長期透析患者の増加に伴い、透析合併症が問題となり、近年では透析による除去対象物質は尿素、クレアチニンなどの低分子量物質のみでなく、分子量数千の中分子量から分子量1〜2万の高分子量の物質まで拡大し、これらの物質も除去できることが血液浄化膜に要求されている。特に分子量11700のβ2ミクログロブリンは、手根管症候群の原因物質であることがわかっており、除去ターゲットとなっている。このような高分子量物質除去の治療に用いられる膜はハイパフォーマンス膜と呼ばれている。近年、わが国においては、合成高分子が基材の主成分である非対称構造の中空糸膜がハイパフォーマンス膜として臨床で多く用いられている。
【0004】
しかしながら、生体構成物質ではない透析器および透析処置器材との血液接触により、血液中の白血球、血小板および補体等の活性化が生じることに由来すると思われる合併症等が併発し、透析患者のQOLが低下する一因となっている(例えば、非特許文献1、2参照)。さらに、長期間に渡って血液透析を行う場合には、血液中の血球成分の活性化時に活性酸素が産生され、その酸化ストレスの蓄積により、過酸化脂質の増加などが確認されており、それに起因すると思われる長期透析患者の動脈硬化性疾患等の合併症が増加している。
【0005】
これらの問題を解決するため、生体内で抗酸化作用、膜安定化作用、血小板凝集抑制作用などの生理作用を発揮するビタミンEを透析膜の表面に被覆する人工臓器が提案、上市されている(例えば、非特許文献3、特許文献1〜4参照)。しかしながら、人工臓器の組み立て工程後にビタミンEのコートを行う場合には、引火性有機溶媒もしくはフロン系溶媒の使用が提案されており、透析器内に充填するのに要する溶媒量が多く環境リスクが高いこと、溶媒種によっては危険物としての対応が必要な溶媒であったり、オゾン層を破壊する物質に関するモントリオール議定書により使用不可の溶媒となっていることなどの問題があった。さらには、製造するにあたり、製膜・人工臓器組み立て後にビタミンEをコートするため製造コストがかかることや、表面コート層により細孔を通過する物質への透過阻害が懸念されること、透析膜内表層への蛋白吸着層によりビタミンEが被覆され、その効果が低減されるという問題があった。
【0006】
さらに、人工臓器の製造過程において、最終的には放射線滅菌等の滅菌工程が必要となるが、膜が水分と共存したウェット状態での放射線滅菌を施された場合、放射線滅菌時に水が分解し、ラジカルが産生する。この現象を利用して、ウェット状態でラジカルを産生させ、添加親水性ポリマーの架橋を促進する方法が人工臓器に応用されている(例えば、非特許文献4参照)。産生するラジカルは接触物質と直ちに反応するため、当然、ビタミンEが産生ラジカルと接触すればビタミンEが直ちに酸化されることが想定される。ビタミンEが酸化されるとキノン構造を有する化合物(トコフェリルキノン)等に変化するが、この構造では期待する抗酸化性は発現しないばかりか、最小中毒量(TDLo:Toxic Dose Lowest)データから生体に与えるリスクについて、ビタミンEよりも高まることが懸念されるため、ビタミンEの活性を維持することは抗酸化性の効率、安全性確保の観点から重要である。
【0007】
放射線滅菌時のラジカル生成を防ぐために、ドライ状態で放射線滅菌することで、ラジカルの産生量をコントロールし、保管時の安定性を改善するという方法が提案されているが(例えば、特許文献5)、ビタミンEの状態に関しては何ら考慮されていない。これら滅菌方法に加えて、一般にラジカルが連鎖反応を進めていく過程で、重金属が連鎖反応を加速することが知られており、製造・保管過程におけるラジカル産生量を抑制しつつ、かつラジカル連鎖反応を制御することが重要である。
【0008】
一方、ビタミンEのコーティング工程増設によるコスト増加・抗酸化性効率という問題点を解消すべく、紡糸原液にビタミンEを添加する方法が提案されている(例えば、特許文献6参照)。かかる方法は、簡便にコスト低減を達成できるという点では優れるが、製造工程での熱負荷や金属不純物によるビタミンEの酸化が懸念される。本文中にビタミンEの状態に関しては言及されておらず、製造工程におけるビタミンEの酸化を抑制することでビタミンEの抗酸化機能を十分に発現する抗酸化性膜を提案するには至っていない。
【先行技術文献】
【特許文献】
【0009】
【特許文献1】特許第3193819号公報
【特許文献2】特開平11−178919号公報
【特許文献3】特許第3357262号公報
【特許文献4】特許第4038583号公報
【特許文献5】特許第3928910号公報
【特許文献6】特開平09−66225号公報
【非特許文献】
【0010】
【非特許文献1】人工臓器18巻5号,539−1546(1989)
【非特許文献2】腎と透析,15−19,別冊1998
【非特許文献3】透析会誌43(3),275−279(2010)
【非特許文献4】腎と透析,26−31(2009)
【発明の概要】
【発明が解決しようとする課題】
【0011】
本発明は、かかる従来技術の問題を解消するためになされたものであり、その目的は、紡糸原液に添加される脂溶性ビタミンが膜全体に分布し、製造・保管時の脂溶性ビタミンの酸化を抑制することで、その抗酸化作用が有効に発揮できる血液浄化用中空糸膜の製造方法、並びにそれによって得られる中空糸膜、及びそれを使用した透析器を提供することにある。
【課題を解決するための手段】
【0012】
本発明者らは、上記目的を達成するために紡糸原液に添加される脂溶性ビタミンの酸化抑制方法について鋭意検討した結果、特定範囲の量のクエン酸を紡糸原液に添加することによりクエン酸が金属イオンを安定化し、金属イオンによるラジカル連鎖反応を防ぐ結果、脂溶性ビタミンの酸化を抑制できることを見出し、本発明の完成に至った。
【0013】
即ち、本発明は、以下の(1)〜(6)の構成を有するものである。
(1)二重管ノズルの外側環状部と中心孔から紡糸原液と芯液をそれぞれ同時に吐出した後、凝固性液体中を通過させて凝固させ、洗浄する工程を含む血液浄化用中空糸膜の製造方法において、前記紡糸原液に脂溶性ビタミンを0.05〜1.2質量%含有させ、さらにクエン酸を0.004〜0.045質量%含有させることを特徴とする血液浄化用中空糸膜の製造方法。
(2)前記脂溶性ビタミンがビタミンEであることを特徴とする(1)に記載の血液浄化用中空糸膜の製造方法。
(3)前記ビタミンEがα−トコフェロール、酢酸−α−トコフェロール、コハク酸−α−トコフェロール、またはコハク酸トコフェロールカルシウムであることを特徴とする(1)または(2)に記載の血液浄化用中空糸膜の製造方法。
(4)(1)〜(3)のいずれかに記載の製造方法によって得られる血液浄化用中空糸膜であって、前記膜中の脂溶性ビタミン含有量が0.05〜1.2質量%であり、高速液体クロマトグラフィーの測定に基づく前記脂溶性ビタミン中の酸化物/非酸化物のピーク面積割合が30%以下であることを特徴とする血液浄化用中空糸膜。
(5)(4)に記載の血液浄化用中空糸膜を使用して構成されることを特徴とする中空糸膜型透析器。
(6)中空糸膜型透析器内部の空間をドライ状態で放射線および/または電子線で滅菌処理していることを特徴とする(5)に記載の中空糸膜型透析器。
【発明の効果】
【0014】
本発明の方法によれば、紡糸原液に脂溶性ビタミンを含有させ、さらにそれを酸化から保護するクエン酸を適切な量で含有させているので、簡便かつ低コストな方法で脂溶性ビタミンが膜内に分散した抗酸化性を有する中空糸膜を製造することができる。特に、製造過程、滅菌過程での酸化を抑制することで、膜中に活性な脂溶性ビタミンを多く残存させることができ、この活性なビタミンにより透析時に産生する活性酸素を効果的に消去することができる。
【図面の簡単な説明】
【0015】
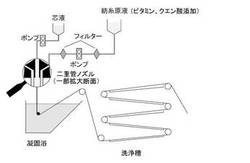
【図1】図1は、本発明の製造方法の一例を概略的に示したものである。
【発明を実施するための形態】
【0016】
本発明の血液浄化用中空糸膜の製造方法は、図1に概略的に示されているように、基本的には、従来公知の方法からなり、二重管ノズルの外側環状部と中心孔から紡糸原液と芯液をそれぞれ同時に吐出した後、凝固浴の凝固性液体中を通過させて膜を形成し、それを洗浄する工程を含むものである。本発明の製造方法の特徴は、特に紡糸原液に特定範囲の量の脂溶性ビタミンとクエン酸を含有させることにある。紡糸原液に脂溶性ビタミンを含有させることにより、簡単な方法で抗酸化作用等を有する脂溶性ビタミンを膜内に均一に分散させることができ、さらにクエン酸を含有させることにより脂溶性ビタミンの酸化を効果的に抑制することができる。従って、本発明の中空糸膜及びそれを使用した透析器は、従来のものに比べて、透析過程において産生する活性酸素を効果的に消去することができ、活性酸素が原因とされている種々の疾患を軽減することができる。
【0017】
紡糸原液は、ポリマーあるいは複数のポリマーの組合せと、溶媒、非溶媒を含み、さらに脂溶性ビタミン、クエン酸を含むことを特徴とする。紡糸原液中での総ポリマー質量割合は、安定した製膜・性能が担保できる範囲であれば問題はないが、15〜20質量%であることが好ましい。ポリマーの質量割合が低すぎると、紡糸原液の粘度が低くなるため可紡性が低くなるだけでなく、脂溶性ビタミンの膜内保持に関して好ましくない影響が出ることがある。一方、ポリマー質量割合が高すぎると中空糸膜の構造が密になりすぎ所期の膜性能を得ることができないことがある。
【0018】
中空糸膜の素材となるポリマーは、セルロース系、ビニル系、芳香族系のいずれのものに限定されるものではないが、脂溶性ビタミンを均一に分散させるため、疎水性の高いセルローストリアセテート、セルロースジアセテート等のセルロースエステル、セルロースアセテートプロピオネート、セルロースアセテートブチレート等のセルロース混合エステル、芳香族ポリスルホン系ポリマー、芳香族ポリアミド系ポリマー、芳香族ポリイミド系ポリマー、芳香族ポリエーテル系ポリマー、芳香族ポリエステル系ポリマー、芳香族ポリケトン系ポリマー、芳香族ポリサルフェート系ポリマー等が好ましい。さらに中空糸加工性、製膜性、生体適合性の観点から、セルロースエステル、芳香族ポリスルホン系ポリマーが特に好ましい。なお、上記の芳香族ポリスルホン系ポリマーとは、分子中に芳香族官能基を有するポリスルホン系ポリマーであれば特に限定されるものではなく、例えば、芳香族ポリスルホン、芳香族ポリエーテルスルホン等が挙げられる。
【0019】
上記ポリマーには、必要に応じて、親水性ポリマーを添加することができる。親水性ポリマーとしては、ポリビニルアルコール、ポリエチレングリコール、ポリプロピレングリコール、ポリビニルピロリドン、ポリエチレンイミンおよびそれらの共重合体等からなる合成ポリマー、あるいは多糖類が挙げられる。この中でも上記疎水性との相溶性、製膜性等の観点からポリビニルピロリドンが特に好ましい。
【0020】
紡糸原液中の総溶媒割合は50〜70質量%、総非溶媒割合は10〜30質量%であることが好ましい。脂溶性ビタミンの溶解を安定化するためにも、紡糸原液中の総溶媒割合は50質量%以上とすることが好ましい。溶媒としては、ポリマー及び脂溶性ビタミンを可溶化できる、いわゆる非プロトン性の極性溶媒、N,N−ジメチルホルムアミド、N,N−ジメチルアセトアミド、γ−ブチロラクトン、N−メチルピロリドンなどを単独または混合して用いることが好ましい。非溶媒としては、無機塩やアルコール類などが挙げられるが、グリセリン、エチレングリコール、トリエチレングリコール、ポリエチレングリコールなどのグリコール類を単独または混合して用いることが好ましい。
【0021】
本発明の製造方法では、紡糸原液に脂溶性ビタミンとクエン酸を含有させることが従来にない特徴である。紡糸原液中の脂溶性ビタミンの含有量は、0.05〜1.2質量%、好ましくは0.1〜1.0質量%である。脂溶性ビタミンの含有量が上記範囲未満では、脂溶性ビタミンの効果が十分ではなく、上記範囲を越えた場合も製造は可能であるが、原料費用増加により費用対効果の観点から不利である。脂溶性ビタミンとしては、ビタミンA、ビタミンD、ビタミンE、ビタミンK等が挙げられるが、耐熱性及び抗酸化機能の点からビタミンEが好ましい。ビタミンEとしては、α−トコフェロール、そしてビタミンE誘導体の酢酸−α−トコフェロール、コハク酸−α―トコフェロール、コハク酸トコフェロールカルシウムが挙げられる。これらビタミンE誘導体についても、血液と接触した際に血液成分により脱エステル化され、α−トコフェロールに変換されるため同様の効果が期待できる。
【0022】
製造過程において、原料および製造機台から、鉄やクロム等の重金属が混入することは避けられず、これら重金属は複数の酸化数をとることから、脂溶性ビタミンと酸化還元反応を引き起こし脂溶性ビタミンが変質することが知られている。そこで、紡糸原液にクエン酸を添加させることで、原料、製造機台からの重金属不純物とクエン酸が反応し、重金属を安定化させることで脂溶性ビタミンと重金属との反応を抑制することが可能となる。さらに、重金属はフェントン反応で代表されるように過酸化物量を増幅させることが知られており、予め重金属を安定化させておくことで、滅菌工程及び滅菌後の保管過程における過酸化物による脂溶性ビタミンの酸化を防ぐことが可能となる。紡糸原液中のクエン酸の含有量は0.004〜0.045質量%、好ましくは0.005〜0.04質量%である。クエン酸の含有量が上記範囲未満では、糸切れ抑制には効果は見られるが、金属不純物と脂溶性ビタミンとの反応を完全に抑制することができないため好ましくない。紡糸原液に含まれる金属不純物のモル量に対して、7倍から60倍相当添加する必要がある。一方、上記範囲を超えると過剰なクエン酸による酸性化が進行し、脂溶性ビタミンの酸化を誘起し、さらには製造機台の腐食を促進するため好ましくない。
【0023】
上記のように調製された紡糸原液は、加熱され、ポリマー、脂溶性ビタミン、クエン酸が均一に溶解された状態を経て、濾過された後に、二重管ノズルの外側環状部(スリット)から押し出され、二重管ノズルの中心孔からは芯液(内液)が同時に突出される。芯液としては、疎水性ポリマーを溶解しない液体を用いることがよく、例えば、流動パラフィン、または不活性な液体を用いるのが好ましい。ノズルより押し出された紡糸原液は、乾式部を走行させた後、凝固性液体(凝固浴)中を通過させて凝固、相分離し、脂溶性ビタミンが膜全体に分布した膜構造が形成される。紡糸原液に添加したクエン酸は、凝固性液体(凝固浴)を通過した時点で大半が凝固性液体(凝固浴)に溶出していると推定されるが、紡糸原液の溶解過程においてすでに金属不純物を安定化しており何ら問題はない。凝固性液体としては、水、または水と紡糸原液で用いた溶媒並びに非溶媒の混合水溶液を使用することができる。必要に応じて、酸化防止剤や潤滑剤などの添加剤を加えることもできる。
【0024】
凝固浴を経た中空糸膜は、洗浄工程において溶媒などの不要な成分を洗い流す。このときに用いる洗浄液は、脂溶性ビタミンを溶解させない溶媒が好ましく、例えば水が用いられる。上記洗浄液には、必要に応じて、還元水等の還元性水溶液やアスコルビン酸等の還元性物質を添加することができる。洗浄工程を経た中空糸膜は必要に応じてグリセリン処理を行う。例えば、セルロース系ポリマーからなる中空糸膜の場合はグリセリン水溶液の浴を通過させた後、乾燥工程を経て巻き取る。この場合、浴のグリセリン濃度は60〜90質量%が好ましい。グリセリン濃度が低すぎると、乾燥時に中空糸膜が縮み易く、保存安定性が悪くなることがある。さらには残存水分の懸念も高まり、滅菌工程において水由来のラジカルが産生され、脂溶性ビタミンの酸化を促進する可能性がある。また、グリセリン濃度が高すぎると、中空糸膜に余分なグリセリンが付着しやすく、血液浄化器に組み立てる時に中空糸膜端部の接着性が悪くなることがある。グリセリン浴の温度は、50℃以上80℃以下が好ましい。グリセリン浴の温度が低すぎると、グリセリン水溶液の粘度が高く、中空糸膜の細孔の隅々までグリセリン水溶液が行き渡らない可能性がある。グリセリン浴の温度が高すぎると、中空糸膜が熱で変性、変質してしまう可能性がある。
【0025】
洗浄後の膜について、洗浄に用いた溶媒ならびにグリセリン処理工程で付与された水分を乾燥工程にて除去する。乾燥工程の温度は、40℃以上80℃以下が好ましい。乾燥温度が低すぎると、これら溶媒の除去が不十分になり、血液浄化器に組み立てる時に中空糸膜端部の接着性が悪くなることがある。さらには、残留水分が滅菌過程においてラジカルを生成させ、脂溶性ビタミンの酸化を促進する可能性がある。逆に乾燥温度が高すぎると、中空糸膜、さらには脂溶性ビタミンが熱で変性、変質してしまう可能性がある。
【0026】
これらの工程を経て、巻き取ることで、酸化が抑制された脂溶性ビタミンを含有せしめた中空糸膜を作製することができる。具体的には、本発明の製造方法によって得られた中空糸膜は、膜中の脂溶性ビタミン含有量が0.05〜1.2質量%であり、高速液クロマトグラフィーの測定に基づく前記脂溶性ビタミン中の酸化物/非酸化物のピーク面積割合が30%以下であることができる。30%以下に抑えることで、ビタミン酸化物の割合を数%に抑えることができ、ビタミンの効能を維持した膜とすることができる。これらの方法で製造された中空糸膜は、内径150〜300μm、膜厚み10〜70μmであることが好ましい。
【0027】
本発明の製造方法によって得られた中空糸膜は、透析器の血液浄化のために使用されることができる。膜表面に脂溶性ビタミンをコートした場合では、血液中の蛋白等に被覆され、ビタミンの効果が軽減されることが推定されるが、本発明では、脂溶性ビタミンが膜全体に分布していることで、先に記述した懸念もなく血液浄化時に産生する活性酸素を効率的に消去することが期待できる。かかる中空糸膜型透析器のモジュール化は、例えば中空糸膜束を透析器の容器へ挿入し、両束端にポリウレタン等のポッティング剤を注入して両端をシールした後、余分なポッティング剤を切断除去して中空糸膜端面を開口させ、ヘッダーを取り付けることにより行うことができる。
【0028】
中空糸膜型透析器は、脱酸素剤と共に包装袋に密封し、透析器内部の空間をドライ状態で放射線および/または電子線で照射滅菌を行うのが好ましい。放射線または電子線としては、α線、β線、γ線、電子線などが挙げられるが、滅菌効率および取り扱い易さ等からγ線又は電子線が好適に用いられる。放射線または電子線の照射線量は、殺菌が可能な線量であれば特に限定はないが、一般には10〜30kGyが好適である。
【実施例】
【0029】
以下、本発明の製造方法及びそれによって得られる中空糸膜の有効性を、実施例を挙げて説明するが、本発明はこれらに限定されるものではない。なお、実施例における物性の評価方法は以下の通りである。
【0030】
1.ビタミンE分析の前処理
中空糸膜20mgを少量のN−メチルピロリドン(NMP)に溶解し、エタノールを貧溶媒として再沈殿を行った。遠心分離により沈殿したポリマーを除去し、上澄みを分取し、一定量のエタノール溶液とした。この溶液を前処理液とした。
【0031】
2.ビタミンEの定量
前記前処理液を高速液体クロマトグラフィー装置(HPLC)に供し、ビタミンEの検出を行った。ビタミンEの定量については、ナカライテスク社製DL−α−トコフェロールを標品とし、適当な濃度となるようエタノール溶液で適宜希釈調整を行ったもので濃度を算出した。
[HPLC条件]
装置:Agilent1100
カラム:Imtakt Unison UK−C18
(内径2mm、カラム長100mm)
移動相:A 0.1%ギ酸、B イソプロパロール
0min(40%B)−15min(98%B)−25min(98%B)
流速:0.2ml/min
カラム温度:45℃
注入量:5μl
検出波長:291nm及び260nm
【0032】
3.ビタミンEの酸化物/非酸化物ピーク面積割合
前記前処理液を高速液体クロマトグラフィー装置(HPLC)に供し、非酸化ビタミンE(α−トコフェロール)及び酸化ビタミンE(α−トコフェリルキノン)の検出を行った。各々、最大吸収波長ならびに溶出時間が異なり、標品を用いて溶出時間を確認した。溶出時間については、装置、測定条件に応じて変わるので、測定の度に確認を行った。上記測定条件において非酸化ビタミンEについては、291nm検出波長で14.3分に溶出するピーク、酸化ビタミンEについては、260nm検出波長で13分に溶出するピークを検出し、下記式を用いて算定した。
ピーク面積割合(%)=酸化ビタミンE(260nm検出、13分)/
非酸化ビタミンE(291nm検出、14.3分)×100
【0033】
(実施例1)
紡糸原液は、三酢酸セルロース(CTA)(ダイセル化学工業社)15.2質量%、α―トコフェロール0.5質量%、クエン酸0.015質量%となるようにN−メチル−2−ピロリドン及びトリエチレングリコール混合溶媒を用いて均一に溶解して作製した。混合溶媒中の溶媒比は、N−メチル−2−ピロリドンが70質量%、トリエチレングリコールが30質量%となるように調整した。得られた紡糸原液を加温した二重管ノズルの外側環状部より吐出し、同時に中心孔より流動パラフィンを芯液として吐出した。乾式部を走行させた後、凝固性液体中を通過させて凝固、相分離し、膜構造を形成させ、洗浄工程にて不要な成分を除去した。続いて、75質量%グリセリン浴を通過させ、40℃の雰囲気で乾燥後、中空糸を巻き取った。ポリカーボネート製のケースのなかに前記中空糸を約10000本挿入し、両端部をウレタン樹脂で固定するとともに切断開口させ、流入口を有するキャップを装着した。その後、芯液を除去、洗浄後、血液浄化器を解体し、中空糸を取り出した。得られた中空糸膜は、内径195μm、膜厚17μmであった。紡糸原液のビタミン含有量及びクエン酸含有量、並びに中空糸膜のビタミンE含有量及びビタミンEの酸化物/非酸化物ピーク面積割合を表1に示す。
【0034】
(実施例2)
紡糸原液は、三酢酸セルロース(CTA)(ダイセル化学工業社)15.2質量%、α―トコフェロール0.5質量%、クエン酸0.005質量%となるようにN−メチル−2−ピロリドン及びトリエチレングリコール混合溶媒を用いて均一に溶解して作製した。混合溶媒中の溶媒比は、N−メチル−2−ピロリドンが70質量%、トリエチレングリコールが30質量%となるように調整した。得られた紡糸原液を加温した二重管ノズルの外側環状部より吐出し、同時に中心孔より流動パラフィンを芯液として吐出した。乾式部を走行させた後、凝固性液体中を通過させて凝固、相分離し、膜構造を形成させ、洗浄工程にて不要な成分を除去した。続いて、75質量%グリセリン浴を通過させ、40℃の雰囲気で乾燥後、中空糸を巻き取った。ポリカーボネート製のケースのなかに前記中空糸を約10000本挿入し、両端部をウレタン樹脂で固定するとともに切断開口させ、流入口を有するキャップを装着した。その後、芯液を除去、洗浄後、血液浄化器を解体し、中空糸を取り出した。得られた中空糸膜は、内径196μm、膜厚19μmであった。紡糸原液のビタミン含有量及びクエン酸含有量、並びに中空糸膜のビタミンE含有量及びビタミンEの酸化物/非酸化物ピーク面積割合を表1に示す。
【0035】
(実施例3)
紡糸原液は、三酢酸セルロース(CTA)(ダイセル化学工業社)15.2質量%、α―トコフェロール0.5質量%、クエン酸0.03質量%となるようにN−メチル−2−ピロリドン及びトリエチレングリコール混合溶媒を用いて均一に溶解して作製した。混合溶媒中の溶媒比は、N−メチル−2−ピロリドンが質量70%、トリエチレングリコールが30質量%となるように調整した。得られた紡糸原液を加温した二重管ノズルの外側環状部より吐出し、同時に中心孔より流動パラフィンを芯液として吐出した。乾式部を走行させた後、凝固性液体中を通過させて凝固、相分離し、膜構造を形成させ、洗浄工程にて不要な成分を除去した。続いて、75質量%グリセリン浴を通過させ、40℃の雰囲気で乾燥後、中空糸を巻き取った。ポリカーボネート製のケースのなかに前記中空糸を約10000本挿入し、両端部をウレタン樹脂で固定するとともに切断開口させ、流入口を有するキャップを装着した。その後、芯液を除去、洗浄後、血液浄化器を解体し、中空糸を取り出した。得られた中空糸膜は、内径195μm、膜厚21μmであった。紡糸原液のビタミン含有量及びクエン酸含有量、並びに中空糸膜のビタミンE含有量及びビタミンEの酸化物/非酸化物ピーク面積割合を表1に示す。
【0036】
(実施例4)
紡糸原液は、三酢酸セルロース(CTA)(ダイセル化学工業社)15.2質量%、α―トコフェロール0.5質量%、クエン酸0.04質量%となるようにN−メチル−2−ピロリドン及びトリエチレングリコール混合溶媒を用いて均一に溶解して作製した。混合溶媒中の溶媒比は、N−メチル−2−ピロリドンが70質量%、トリエチレングリコールが30質量%となるように調整した。得られた紡糸原液を加温した二重管ノズルの外側環状部より吐出し、同時に中心孔より流動パラフィンを芯液として吐出した。乾式部を走行させた後、凝固性液体中を通過させて凝固、相分離し、膜構造を形成させ、洗浄工程にて不要な成分を除去した。続いて、75質量%グリセリン浴を通過させ、40℃の雰囲気で乾燥後、中空糸を巻き取った。ポリカーボネート製のケースのなかに前記中空糸を約10000本挿入し、両端部をウレタン樹脂で固定するとともに切断開口させ、流入口を有するキャップを装着した。その後、芯液を除去、洗浄後、血液浄化器を解体し、中空糸を取り出した。得られた中空糸膜は、内径194μm、膜厚18μmであった。紡糸原液のビタミン含有量及びクエン酸含有量、並びに中空糸膜のビタミンE含有量及びビタミンEの酸化物/非酸化物ピーク面積割合を表1に示す。
【0037】
(実施例5)
紡糸原液は、三酢酸セルロース(CTA)(ダイセル化学工業社)15.2質量%、α―トコフェロール0.5質量%、クエン酸0.015質量%となるようにN−メチル−2−ピロリドン及びトリエチレングリコール混合溶媒を用いて均一に溶解して作製した。混合溶媒中の溶媒比は、N−メチル−2−ピロリドンが70質量%、トリエチレングリコールが30質量%となるように調整した。得られた紡糸原液を加温した二重管ノズルの外側環状部より吐出し、同時に中心孔より流動パラフィンを芯液として吐出した。乾式部を走行させた後、凝固性液体中を通過させて凝固、相分離し、膜構造を形成させ、洗浄工程にて不要な成分を除去した。続いて、75質量%グリセリン浴を通過させ、40℃の雰囲気で乾燥後、中空糸を巻き取った。ポリカーボネート製のケースのなかに前記中空糸を約10000本挿入し、両端部をウレタン樹脂で固定するとともに切断開口させ、流入口を有するキャップを装着した。その後、芯液を除去、洗浄後、血液浄化器全体を鉄粉系の汎用タイプの脱酸素剤とともに、外層がポリエステルフィルム、中間層がアルミ箔、内層がポリエチレンフィルムからなる包装袋に入れ真空包装を施し、25kGy線量のγ線を照射し滅菌処理を行った。滅菌後、血液浄化器を取り出し、解体後、中空糸を取り出した。得られた中空糸膜は、内径195μm、膜厚17μmであった。紡糸原液のビタミン含有量及びクエン酸含有量、並びに中空糸膜のビタミンE含有量及びビタミンEの酸化物/非酸化物ピーク面積割合を表1に示す。
【0038】
(実施例6)
紡糸原液は、三酢酸セルロース(CTA)(ダイセル化学工業社)15.2質量%、α―トコフェロール1.0質量%、クエン酸0.015質量%となるようにN−メチル−2−ピロリドン及びトリエチレングリコール混合溶媒を用いて均一に溶解して作製した。混合溶媒中の溶媒比は、N−メチル−2−ピロリドンが70質量%、トリエチレングリコールが30質量%となるように調整した。得られた紡糸原液を加温した二重管ノズルの外側環状部より吐出し、同時に中心孔より流動パラフィンを芯液として吐出した。乾式部を走行させた後、凝固性液体中を通過させて凝固、相分離し、膜構造を形成させ、洗浄工程にて不要な成分を除去した。続いて、75質量%グリセリン浴を通過させ、40℃の雰囲気で乾燥後、中空糸を巻き取った。ポリカーボネート製のケースのなかに前記中空糸を約10000本挿入し、両端部をウレタン樹脂で固定するとともに切断開口させ、流入口を有するキャップを装着した。その後、芯液を除去、洗浄後、血液浄化器を解体し、中空糸を取り出した。得られた中空糸膜は、内径196μm、膜厚18μmであった。紡糸原液のビタミン含有量及びクエン酸含有量、並びに中空糸膜のビタミンE含有量及びビタミンEの酸化物/非酸化物ピーク面積割合を表1に示す。
【0039】
(実施例7)
紡糸原液は、三酢酸セルロース(CTA)(ダイセル化学工業社)15.2質量%、α―トコフェロール0.10質量%、クエン酸0.015質量%となるようにN−メチル−2−ピロリドン及びトリエチレングリコール混合溶媒を用いて均一に溶解して作製した。混合溶媒中の溶媒比は、N−メチル−2−ピロリドンが70質量%、トリエチレングリコールが30質量%となるように調整した。得られた紡糸原液を加温した二重管ノズルの外側環状部より吐出し、同時に中心孔より流動パラフィンを芯液として吐出した。乾式部を走行させた後、凝固性液体中を通過させて凝固、相分離し、膜構造を形成させ、洗浄工程にて不要な成分を除去した。続いて、75質量%グリセリン浴を通過させ、40℃の雰囲気で乾燥後、中空糸を巻き取った。ポリカーボネート製のケースのなかに前記中空糸を約10000本挿入し、両端部をウレタン樹脂で固定するとともに切断開口させ、流入口を有するキャップを装着した。その後、芯液を除去、洗浄後、血液浄化器を解体し、中空糸を取り出した。得られた中空糸膜は、内径194μm、膜厚18μmであった。紡糸原液のビタミン含有量及びクエン酸含有量、並びに中空糸膜のビタミンE含有量及びビタミンEの酸化物/非酸化物ピーク面積割合を表1に示す。
【0040】
(比較例1)
紡糸原液は、三酢酸セルロース(CTA)(ダイセル化学工業社)15.2質量%、α―トコフェロール0.5質量%、クエン酸0.002質量%となるようにN−メチル−2−ピロリドン及びトリエチレングリコール混合溶媒を用いて均一に溶解して作製した。混合溶媒中の溶媒比は、N−メチル−2−ピロリドンが70質量%、トリエチレングリコールが30質量%となるように調整した。得られた紡糸原液を加温した二重管ノズルの外側環状部より吐出し、同時に中心孔より流動パラフィンを芯液として吐出した。乾式部を走行させた後、凝固性液体中を通過させて凝固、相分離し、膜構造を形成させ、洗浄工程にて不要な成分を除去した。続いて、75質量%グリセリン浴を通過させ、40℃の雰囲気で乾燥後、中空糸を巻き取った。ポリカーボネート製のケースのなかに前記中空糸を約10000本挿入し、両端部をウレタン樹脂で固定するとともに切断開口させ、流入口を有するキャップを装着した。その後、芯液を除去、洗浄後、血液浄化器を解体し、中空糸を取り出した。得られた中空糸膜は、内径195μm、膜厚15μmであった。紡糸原液のビタミン含有量及びクエン酸含有量、並びに中空糸膜のビタミンE含有量及びビタミンEの酸化物/非酸化物ピーク面積割合を表1に示す。
【0041】
(比較例2)
紡糸原液は、三酢酸セルロース(CTA)(ダイセル化学工業社)15.2質量%、α―トコフェロール0.5質量%、クエン酸0.05質量%となるようにN−メチル−2−ピロリドン及びトリエチレングリコール混合溶媒を用いて均一に溶解して作製した。混合溶媒中の溶媒比は、N−メチル−2−ピロリドンが70質量%、トリエチレングリコールが30質量%となるように調整した。得られた紡糸原液を加温した二重管ノズルの外側環状部より吐出し、同時に中心孔より流動パラフィンを芯液として吐出した。乾式部を走行させた後、凝固性液体中を通過させて凝固、相分離し、膜構造を形成させ、洗浄工程にて不要な成分を除去した。続いて、75質量%グリセリン浴を通過させ、40℃の雰囲気で乾燥後、中空糸を巻き取った。ポリカーボネート製のケースのなかに前記中空糸を約10000本挿入し、両端部をウレタン樹脂で固定するとともに切断開口させ、流入口を有するキャップを装着した。その後、芯液を除去、洗浄後、血液浄化器を解体し、中空糸を取り出した。得られた中空糸膜は、内径195μm、膜厚15μmであった。紡糸原液のビタミン含有量及びクエン酸含有量、並びに中空糸膜のビタミンE含有量及びビタミンEの酸化物/非酸化物ピーク面積割合を表1に示す。
【0042】
(比較例3)
紡糸原液は、三酢酸セルロース(CTA)(ダイセル化学工業社)15.2質量%、α―トコフェロール0.025質量%、クエン酸0.015質量%となるようにN−メチル−2−ピロリドン及びトリエチレングリコール混合溶媒を用いて均一に溶解して作製した。混合溶媒中の溶媒比は、N−メチル−2−ピロリドンが70質量%、トリエチレングリコールが30質量%となるように調整した。得られた紡糸原液を加温した二重管ノズルの外側環状部より吐出し、同時に中心孔より流動パラフィンを芯液として吐出した。乾式部を走行させた後、凝固性液体中を通過させて凝固、相分離し、膜構造を形成させ、洗浄工程にて不要な成分を除去した。続いて、75質量%グリセリン浴を通過させ、40℃の雰囲気で乾燥後、中空糸を巻き取った。ポリカーボネート製のケースのなかに前記中空糸を約10000本挿入し、両端部をウレタン樹脂で固定するとともに切断開口させ、流入口を有するキャップを装着した。その後、芯液を除去、洗浄後、血液浄化器を解体し、中空糸を取り出した。得られた中空糸膜は、内径195μm、膜厚17μmであった。紡糸原液のビタミン含有量及びクエン酸含有量、並びに中空糸膜のビタミンE含有量を表1に示す。
【0043】
(比較例4)
市販されている脂溶性ビタミンをコーティングした透析器(旭ビタブレン、旭化成クラレメディカル製)について、透析器内の充填水を排水した後、透析器を解体し、中空糸を取り出した。そして、室温にて乾燥させた後、他の実施例と同様に評価した。中空糸膜のビタミンE含有量及びビタミンEの酸化物/非酸化物ピーク面積割合を表1に示す。
【0044】
【表1】

【0045】
上記表1から明らかなように、実施例1〜7の中空糸膜は、いずれも酸化体ビタミンEのピーク面積割合が抑えられており、製造過程でのビタミンの酸化を抑制する効果が認められる。一方、比較例1,2の中空糸膜は、クエン酸による重金属の安定化が不足、あるいは過剰添加による酸性化により、いずれも酸化ビタミンEのピーク面積割合が高く、ビタミンEの酸化が進んでいる。比較例3については、ビタミン添加が不十分で、十分な効果が期待できない。比較例4については、ウェット状態での滅菌であり、滅菌時の産生ラジカルによりビタミン酸化が進んでいる。
【産業上の利用可能性】
【0046】
本発明により、簡便かつ低コストに生体適合性に優れた中空糸膜型血液浄化器を製造することができる。さらに、放射線滅菌工程時などの脂溶性ビタミンの酸化を防ぐことから、効果的な抗酸化性能および高い安全性が期待できる。
【技術分野】
【0001】
本発明は、血液透析時に産生する活性酸素を消去することができる、生体適合性に優れた血液浄化用中空糸膜の製造方法に関するものである。
【背景技術】
【0002】
腎不全治療などにおける血液浄化法では、血液中の尿毒素、老廃物を除去する目的で、天然素材であるセルロース、またその誘導体であるセルロースジアセテート、セルローストリアセテート、合成高分子であるポリスルホン、ポリエーテルスルホン、ポリメチルメタクリレート、ポリアクリロニトリルなどの高分子を用いた透析膜や限外濾過膜を分離材として用いた血液透析器、血液濾過器あるいは血液透析濾過器などの血液浄化器が広く使用されている。特に中空糸型の膜を分離材として用いた血液浄化器は、体外循環にかかわる循環血液量の低減、血中の物質除去効率の高さ、さらに血液浄化器組立ての生産性などの利点から血液浄化分野での利用度が高い。
【0003】
中空糸膜を用いた血液浄化器は、通常、中空糸膜の中空部に血液を流し、外側部に透析液を向流に流し、血液から透析液への拡散に基づく物質移動により尿素、クレアチニンなどの低分子量物質を血中から除くことを主眼としている。しかしながら、長期透析患者の増加に伴い、透析合併症が問題となり、近年では透析による除去対象物質は尿素、クレアチニンなどの低分子量物質のみでなく、分子量数千の中分子量から分子量1〜2万の高分子量の物質まで拡大し、これらの物質も除去できることが血液浄化膜に要求されている。特に分子量11700のβ2ミクログロブリンは、手根管症候群の原因物質であることがわかっており、除去ターゲットとなっている。このような高分子量物質除去の治療に用いられる膜はハイパフォーマンス膜と呼ばれている。近年、わが国においては、合成高分子が基材の主成分である非対称構造の中空糸膜がハイパフォーマンス膜として臨床で多く用いられている。
【0004】
しかしながら、生体構成物質ではない透析器および透析処置器材との血液接触により、血液中の白血球、血小板および補体等の活性化が生じることに由来すると思われる合併症等が併発し、透析患者のQOLが低下する一因となっている(例えば、非特許文献1、2参照)。さらに、長期間に渡って血液透析を行う場合には、血液中の血球成分の活性化時に活性酸素が産生され、その酸化ストレスの蓄積により、過酸化脂質の増加などが確認されており、それに起因すると思われる長期透析患者の動脈硬化性疾患等の合併症が増加している。
【0005】
これらの問題を解決するため、生体内で抗酸化作用、膜安定化作用、血小板凝集抑制作用などの生理作用を発揮するビタミンEを透析膜の表面に被覆する人工臓器が提案、上市されている(例えば、非特許文献3、特許文献1〜4参照)。しかしながら、人工臓器の組み立て工程後にビタミンEのコートを行う場合には、引火性有機溶媒もしくはフロン系溶媒の使用が提案されており、透析器内に充填するのに要する溶媒量が多く環境リスクが高いこと、溶媒種によっては危険物としての対応が必要な溶媒であったり、オゾン層を破壊する物質に関するモントリオール議定書により使用不可の溶媒となっていることなどの問題があった。さらには、製造するにあたり、製膜・人工臓器組み立て後にビタミンEをコートするため製造コストがかかることや、表面コート層により細孔を通過する物質への透過阻害が懸念されること、透析膜内表層への蛋白吸着層によりビタミンEが被覆され、その効果が低減されるという問題があった。
【0006】
さらに、人工臓器の製造過程において、最終的には放射線滅菌等の滅菌工程が必要となるが、膜が水分と共存したウェット状態での放射線滅菌を施された場合、放射線滅菌時に水が分解し、ラジカルが産生する。この現象を利用して、ウェット状態でラジカルを産生させ、添加親水性ポリマーの架橋を促進する方法が人工臓器に応用されている(例えば、非特許文献4参照)。産生するラジカルは接触物質と直ちに反応するため、当然、ビタミンEが産生ラジカルと接触すればビタミンEが直ちに酸化されることが想定される。ビタミンEが酸化されるとキノン構造を有する化合物(トコフェリルキノン)等に変化するが、この構造では期待する抗酸化性は発現しないばかりか、最小中毒量(TDLo:Toxic Dose Lowest)データから生体に与えるリスクについて、ビタミンEよりも高まることが懸念されるため、ビタミンEの活性を維持することは抗酸化性の効率、安全性確保の観点から重要である。
【0007】
放射線滅菌時のラジカル生成を防ぐために、ドライ状態で放射線滅菌することで、ラジカルの産生量をコントロールし、保管時の安定性を改善するという方法が提案されているが(例えば、特許文献5)、ビタミンEの状態に関しては何ら考慮されていない。これら滅菌方法に加えて、一般にラジカルが連鎖反応を進めていく過程で、重金属が連鎖反応を加速することが知られており、製造・保管過程におけるラジカル産生量を抑制しつつ、かつラジカル連鎖反応を制御することが重要である。
【0008】
一方、ビタミンEのコーティング工程増設によるコスト増加・抗酸化性効率という問題点を解消すべく、紡糸原液にビタミンEを添加する方法が提案されている(例えば、特許文献6参照)。かかる方法は、簡便にコスト低減を達成できるという点では優れるが、製造工程での熱負荷や金属不純物によるビタミンEの酸化が懸念される。本文中にビタミンEの状態に関しては言及されておらず、製造工程におけるビタミンEの酸化を抑制することでビタミンEの抗酸化機能を十分に発現する抗酸化性膜を提案するには至っていない。
【先行技術文献】
【特許文献】
【0009】
【特許文献1】特許第3193819号公報
【特許文献2】特開平11−178919号公報
【特許文献3】特許第3357262号公報
【特許文献4】特許第4038583号公報
【特許文献5】特許第3928910号公報
【特許文献6】特開平09−66225号公報
【非特許文献】
【0010】
【非特許文献1】人工臓器18巻5号,539−1546(1989)
【非特許文献2】腎と透析,15−19,別冊1998
【非特許文献3】透析会誌43(3),275−279(2010)
【非特許文献4】腎と透析,26−31(2009)
【発明の概要】
【発明が解決しようとする課題】
【0011】
本発明は、かかる従来技術の問題を解消するためになされたものであり、その目的は、紡糸原液に添加される脂溶性ビタミンが膜全体に分布し、製造・保管時の脂溶性ビタミンの酸化を抑制することで、その抗酸化作用が有効に発揮できる血液浄化用中空糸膜の製造方法、並びにそれによって得られる中空糸膜、及びそれを使用した透析器を提供することにある。
【課題を解決するための手段】
【0012】
本発明者らは、上記目的を達成するために紡糸原液に添加される脂溶性ビタミンの酸化抑制方法について鋭意検討した結果、特定範囲の量のクエン酸を紡糸原液に添加することによりクエン酸が金属イオンを安定化し、金属イオンによるラジカル連鎖反応を防ぐ結果、脂溶性ビタミンの酸化を抑制できることを見出し、本発明の完成に至った。
【0013】
即ち、本発明は、以下の(1)〜(6)の構成を有するものである。
(1)二重管ノズルの外側環状部と中心孔から紡糸原液と芯液をそれぞれ同時に吐出した後、凝固性液体中を通過させて凝固させ、洗浄する工程を含む血液浄化用中空糸膜の製造方法において、前記紡糸原液に脂溶性ビタミンを0.05〜1.2質量%含有させ、さらにクエン酸を0.004〜0.045質量%含有させることを特徴とする血液浄化用中空糸膜の製造方法。
(2)前記脂溶性ビタミンがビタミンEであることを特徴とする(1)に記載の血液浄化用中空糸膜の製造方法。
(3)前記ビタミンEがα−トコフェロール、酢酸−α−トコフェロール、コハク酸−α−トコフェロール、またはコハク酸トコフェロールカルシウムであることを特徴とする(1)または(2)に記載の血液浄化用中空糸膜の製造方法。
(4)(1)〜(3)のいずれかに記載の製造方法によって得られる血液浄化用中空糸膜であって、前記膜中の脂溶性ビタミン含有量が0.05〜1.2質量%であり、高速液体クロマトグラフィーの測定に基づく前記脂溶性ビタミン中の酸化物/非酸化物のピーク面積割合が30%以下であることを特徴とする血液浄化用中空糸膜。
(5)(4)に記載の血液浄化用中空糸膜を使用して構成されることを特徴とする中空糸膜型透析器。
(6)中空糸膜型透析器内部の空間をドライ状態で放射線および/または電子線で滅菌処理していることを特徴とする(5)に記載の中空糸膜型透析器。
【発明の効果】
【0014】
本発明の方法によれば、紡糸原液に脂溶性ビタミンを含有させ、さらにそれを酸化から保護するクエン酸を適切な量で含有させているので、簡便かつ低コストな方法で脂溶性ビタミンが膜内に分散した抗酸化性を有する中空糸膜を製造することができる。特に、製造過程、滅菌過程での酸化を抑制することで、膜中に活性な脂溶性ビタミンを多く残存させることができ、この活性なビタミンにより透析時に産生する活性酸素を効果的に消去することができる。
【図面の簡単な説明】
【0015】
【図1】図1は、本発明の製造方法の一例を概略的に示したものである。
【発明を実施するための形態】
【0016】
本発明の血液浄化用中空糸膜の製造方法は、図1に概略的に示されているように、基本的には、従来公知の方法からなり、二重管ノズルの外側環状部と中心孔から紡糸原液と芯液をそれぞれ同時に吐出した後、凝固浴の凝固性液体中を通過させて膜を形成し、それを洗浄する工程を含むものである。本発明の製造方法の特徴は、特に紡糸原液に特定範囲の量の脂溶性ビタミンとクエン酸を含有させることにある。紡糸原液に脂溶性ビタミンを含有させることにより、簡単な方法で抗酸化作用等を有する脂溶性ビタミンを膜内に均一に分散させることができ、さらにクエン酸を含有させることにより脂溶性ビタミンの酸化を効果的に抑制することができる。従って、本発明の中空糸膜及びそれを使用した透析器は、従来のものに比べて、透析過程において産生する活性酸素を効果的に消去することができ、活性酸素が原因とされている種々の疾患を軽減することができる。
【0017】
紡糸原液は、ポリマーあるいは複数のポリマーの組合せと、溶媒、非溶媒を含み、さらに脂溶性ビタミン、クエン酸を含むことを特徴とする。紡糸原液中での総ポリマー質量割合は、安定した製膜・性能が担保できる範囲であれば問題はないが、15〜20質量%であることが好ましい。ポリマーの質量割合が低すぎると、紡糸原液の粘度が低くなるため可紡性が低くなるだけでなく、脂溶性ビタミンの膜内保持に関して好ましくない影響が出ることがある。一方、ポリマー質量割合が高すぎると中空糸膜の構造が密になりすぎ所期の膜性能を得ることができないことがある。
【0018】
中空糸膜の素材となるポリマーは、セルロース系、ビニル系、芳香族系のいずれのものに限定されるものではないが、脂溶性ビタミンを均一に分散させるため、疎水性の高いセルローストリアセテート、セルロースジアセテート等のセルロースエステル、セルロースアセテートプロピオネート、セルロースアセテートブチレート等のセルロース混合エステル、芳香族ポリスルホン系ポリマー、芳香族ポリアミド系ポリマー、芳香族ポリイミド系ポリマー、芳香族ポリエーテル系ポリマー、芳香族ポリエステル系ポリマー、芳香族ポリケトン系ポリマー、芳香族ポリサルフェート系ポリマー等が好ましい。さらに中空糸加工性、製膜性、生体適合性の観点から、セルロースエステル、芳香族ポリスルホン系ポリマーが特に好ましい。なお、上記の芳香族ポリスルホン系ポリマーとは、分子中に芳香族官能基を有するポリスルホン系ポリマーであれば特に限定されるものではなく、例えば、芳香族ポリスルホン、芳香族ポリエーテルスルホン等が挙げられる。
【0019】
上記ポリマーには、必要に応じて、親水性ポリマーを添加することができる。親水性ポリマーとしては、ポリビニルアルコール、ポリエチレングリコール、ポリプロピレングリコール、ポリビニルピロリドン、ポリエチレンイミンおよびそれらの共重合体等からなる合成ポリマー、あるいは多糖類が挙げられる。この中でも上記疎水性との相溶性、製膜性等の観点からポリビニルピロリドンが特に好ましい。
【0020】
紡糸原液中の総溶媒割合は50〜70質量%、総非溶媒割合は10〜30質量%であることが好ましい。脂溶性ビタミンの溶解を安定化するためにも、紡糸原液中の総溶媒割合は50質量%以上とすることが好ましい。溶媒としては、ポリマー及び脂溶性ビタミンを可溶化できる、いわゆる非プロトン性の極性溶媒、N,N−ジメチルホルムアミド、N,N−ジメチルアセトアミド、γ−ブチロラクトン、N−メチルピロリドンなどを単独または混合して用いることが好ましい。非溶媒としては、無機塩やアルコール類などが挙げられるが、グリセリン、エチレングリコール、トリエチレングリコール、ポリエチレングリコールなどのグリコール類を単独または混合して用いることが好ましい。
【0021】
本発明の製造方法では、紡糸原液に脂溶性ビタミンとクエン酸を含有させることが従来にない特徴である。紡糸原液中の脂溶性ビタミンの含有量は、0.05〜1.2質量%、好ましくは0.1〜1.0質量%である。脂溶性ビタミンの含有量が上記範囲未満では、脂溶性ビタミンの効果が十分ではなく、上記範囲を越えた場合も製造は可能であるが、原料費用増加により費用対効果の観点から不利である。脂溶性ビタミンとしては、ビタミンA、ビタミンD、ビタミンE、ビタミンK等が挙げられるが、耐熱性及び抗酸化機能の点からビタミンEが好ましい。ビタミンEとしては、α−トコフェロール、そしてビタミンE誘導体の酢酸−α−トコフェロール、コハク酸−α―トコフェロール、コハク酸トコフェロールカルシウムが挙げられる。これらビタミンE誘導体についても、血液と接触した際に血液成分により脱エステル化され、α−トコフェロールに変換されるため同様の効果が期待できる。
【0022】
製造過程において、原料および製造機台から、鉄やクロム等の重金属が混入することは避けられず、これら重金属は複数の酸化数をとることから、脂溶性ビタミンと酸化還元反応を引き起こし脂溶性ビタミンが変質することが知られている。そこで、紡糸原液にクエン酸を添加させることで、原料、製造機台からの重金属不純物とクエン酸が反応し、重金属を安定化させることで脂溶性ビタミンと重金属との反応を抑制することが可能となる。さらに、重金属はフェントン反応で代表されるように過酸化物量を増幅させることが知られており、予め重金属を安定化させておくことで、滅菌工程及び滅菌後の保管過程における過酸化物による脂溶性ビタミンの酸化を防ぐことが可能となる。紡糸原液中のクエン酸の含有量は0.004〜0.045質量%、好ましくは0.005〜0.04質量%である。クエン酸の含有量が上記範囲未満では、糸切れ抑制には効果は見られるが、金属不純物と脂溶性ビタミンとの反応を完全に抑制することができないため好ましくない。紡糸原液に含まれる金属不純物のモル量に対して、7倍から60倍相当添加する必要がある。一方、上記範囲を超えると過剰なクエン酸による酸性化が進行し、脂溶性ビタミンの酸化を誘起し、さらには製造機台の腐食を促進するため好ましくない。
【0023】
上記のように調製された紡糸原液は、加熱され、ポリマー、脂溶性ビタミン、クエン酸が均一に溶解された状態を経て、濾過された後に、二重管ノズルの外側環状部(スリット)から押し出され、二重管ノズルの中心孔からは芯液(内液)が同時に突出される。芯液としては、疎水性ポリマーを溶解しない液体を用いることがよく、例えば、流動パラフィン、または不活性な液体を用いるのが好ましい。ノズルより押し出された紡糸原液は、乾式部を走行させた後、凝固性液体(凝固浴)中を通過させて凝固、相分離し、脂溶性ビタミンが膜全体に分布した膜構造が形成される。紡糸原液に添加したクエン酸は、凝固性液体(凝固浴)を通過した時点で大半が凝固性液体(凝固浴)に溶出していると推定されるが、紡糸原液の溶解過程においてすでに金属不純物を安定化しており何ら問題はない。凝固性液体としては、水、または水と紡糸原液で用いた溶媒並びに非溶媒の混合水溶液を使用することができる。必要に応じて、酸化防止剤や潤滑剤などの添加剤を加えることもできる。
【0024】
凝固浴を経た中空糸膜は、洗浄工程において溶媒などの不要な成分を洗い流す。このときに用いる洗浄液は、脂溶性ビタミンを溶解させない溶媒が好ましく、例えば水が用いられる。上記洗浄液には、必要に応じて、還元水等の還元性水溶液やアスコルビン酸等の還元性物質を添加することができる。洗浄工程を経た中空糸膜は必要に応じてグリセリン処理を行う。例えば、セルロース系ポリマーからなる中空糸膜の場合はグリセリン水溶液の浴を通過させた後、乾燥工程を経て巻き取る。この場合、浴のグリセリン濃度は60〜90質量%が好ましい。グリセリン濃度が低すぎると、乾燥時に中空糸膜が縮み易く、保存安定性が悪くなることがある。さらには残存水分の懸念も高まり、滅菌工程において水由来のラジカルが産生され、脂溶性ビタミンの酸化を促進する可能性がある。また、グリセリン濃度が高すぎると、中空糸膜に余分なグリセリンが付着しやすく、血液浄化器に組み立てる時に中空糸膜端部の接着性が悪くなることがある。グリセリン浴の温度は、50℃以上80℃以下が好ましい。グリセリン浴の温度が低すぎると、グリセリン水溶液の粘度が高く、中空糸膜の細孔の隅々までグリセリン水溶液が行き渡らない可能性がある。グリセリン浴の温度が高すぎると、中空糸膜が熱で変性、変質してしまう可能性がある。
【0025】
洗浄後の膜について、洗浄に用いた溶媒ならびにグリセリン処理工程で付与された水分を乾燥工程にて除去する。乾燥工程の温度は、40℃以上80℃以下が好ましい。乾燥温度が低すぎると、これら溶媒の除去が不十分になり、血液浄化器に組み立てる時に中空糸膜端部の接着性が悪くなることがある。さらには、残留水分が滅菌過程においてラジカルを生成させ、脂溶性ビタミンの酸化を促進する可能性がある。逆に乾燥温度が高すぎると、中空糸膜、さらには脂溶性ビタミンが熱で変性、変質してしまう可能性がある。
【0026】
これらの工程を経て、巻き取ることで、酸化が抑制された脂溶性ビタミンを含有せしめた中空糸膜を作製することができる。具体的には、本発明の製造方法によって得られた中空糸膜は、膜中の脂溶性ビタミン含有量が0.05〜1.2質量%であり、高速液クロマトグラフィーの測定に基づく前記脂溶性ビタミン中の酸化物/非酸化物のピーク面積割合が30%以下であることができる。30%以下に抑えることで、ビタミン酸化物の割合を数%に抑えることができ、ビタミンの効能を維持した膜とすることができる。これらの方法で製造された中空糸膜は、内径150〜300μm、膜厚み10〜70μmであることが好ましい。
【0027】
本発明の製造方法によって得られた中空糸膜は、透析器の血液浄化のために使用されることができる。膜表面に脂溶性ビタミンをコートした場合では、血液中の蛋白等に被覆され、ビタミンの効果が軽減されることが推定されるが、本発明では、脂溶性ビタミンが膜全体に分布していることで、先に記述した懸念もなく血液浄化時に産生する活性酸素を効率的に消去することが期待できる。かかる中空糸膜型透析器のモジュール化は、例えば中空糸膜束を透析器の容器へ挿入し、両束端にポリウレタン等のポッティング剤を注入して両端をシールした後、余分なポッティング剤を切断除去して中空糸膜端面を開口させ、ヘッダーを取り付けることにより行うことができる。
【0028】
中空糸膜型透析器は、脱酸素剤と共に包装袋に密封し、透析器内部の空間をドライ状態で放射線および/または電子線で照射滅菌を行うのが好ましい。放射線または電子線としては、α線、β線、γ線、電子線などが挙げられるが、滅菌効率および取り扱い易さ等からγ線又は電子線が好適に用いられる。放射線または電子線の照射線量は、殺菌が可能な線量であれば特に限定はないが、一般には10〜30kGyが好適である。
【実施例】
【0029】
以下、本発明の製造方法及びそれによって得られる中空糸膜の有効性を、実施例を挙げて説明するが、本発明はこれらに限定されるものではない。なお、実施例における物性の評価方法は以下の通りである。
【0030】
1.ビタミンE分析の前処理
中空糸膜20mgを少量のN−メチルピロリドン(NMP)に溶解し、エタノールを貧溶媒として再沈殿を行った。遠心分離により沈殿したポリマーを除去し、上澄みを分取し、一定量のエタノール溶液とした。この溶液を前処理液とした。
【0031】
2.ビタミンEの定量
前記前処理液を高速液体クロマトグラフィー装置(HPLC)に供し、ビタミンEの検出を行った。ビタミンEの定量については、ナカライテスク社製DL−α−トコフェロールを標品とし、適当な濃度となるようエタノール溶液で適宜希釈調整を行ったもので濃度を算出した。
[HPLC条件]
装置:Agilent1100
カラム:Imtakt Unison UK−C18
(内径2mm、カラム長100mm)
移動相:A 0.1%ギ酸、B イソプロパロール
0min(40%B)−15min(98%B)−25min(98%B)
流速:0.2ml/min
カラム温度:45℃
注入量:5μl
検出波長:291nm及び260nm
【0032】
3.ビタミンEの酸化物/非酸化物ピーク面積割合
前記前処理液を高速液体クロマトグラフィー装置(HPLC)に供し、非酸化ビタミンE(α−トコフェロール)及び酸化ビタミンE(α−トコフェリルキノン)の検出を行った。各々、最大吸収波長ならびに溶出時間が異なり、標品を用いて溶出時間を確認した。溶出時間については、装置、測定条件に応じて変わるので、測定の度に確認を行った。上記測定条件において非酸化ビタミンEについては、291nm検出波長で14.3分に溶出するピーク、酸化ビタミンEについては、260nm検出波長で13分に溶出するピークを検出し、下記式を用いて算定した。
ピーク面積割合(%)=酸化ビタミンE(260nm検出、13分)/
非酸化ビタミンE(291nm検出、14.3分)×100
【0033】
(実施例1)
紡糸原液は、三酢酸セルロース(CTA)(ダイセル化学工業社)15.2質量%、α―トコフェロール0.5質量%、クエン酸0.015質量%となるようにN−メチル−2−ピロリドン及びトリエチレングリコール混合溶媒を用いて均一に溶解して作製した。混合溶媒中の溶媒比は、N−メチル−2−ピロリドンが70質量%、トリエチレングリコールが30質量%となるように調整した。得られた紡糸原液を加温した二重管ノズルの外側環状部より吐出し、同時に中心孔より流動パラフィンを芯液として吐出した。乾式部を走行させた後、凝固性液体中を通過させて凝固、相分離し、膜構造を形成させ、洗浄工程にて不要な成分を除去した。続いて、75質量%グリセリン浴を通過させ、40℃の雰囲気で乾燥後、中空糸を巻き取った。ポリカーボネート製のケースのなかに前記中空糸を約10000本挿入し、両端部をウレタン樹脂で固定するとともに切断開口させ、流入口を有するキャップを装着した。その後、芯液を除去、洗浄後、血液浄化器を解体し、中空糸を取り出した。得られた中空糸膜は、内径195μm、膜厚17μmであった。紡糸原液のビタミン含有量及びクエン酸含有量、並びに中空糸膜のビタミンE含有量及びビタミンEの酸化物/非酸化物ピーク面積割合を表1に示す。
【0034】
(実施例2)
紡糸原液は、三酢酸セルロース(CTA)(ダイセル化学工業社)15.2質量%、α―トコフェロール0.5質量%、クエン酸0.005質量%となるようにN−メチル−2−ピロリドン及びトリエチレングリコール混合溶媒を用いて均一に溶解して作製した。混合溶媒中の溶媒比は、N−メチル−2−ピロリドンが70質量%、トリエチレングリコールが30質量%となるように調整した。得られた紡糸原液を加温した二重管ノズルの外側環状部より吐出し、同時に中心孔より流動パラフィンを芯液として吐出した。乾式部を走行させた後、凝固性液体中を通過させて凝固、相分離し、膜構造を形成させ、洗浄工程にて不要な成分を除去した。続いて、75質量%グリセリン浴を通過させ、40℃の雰囲気で乾燥後、中空糸を巻き取った。ポリカーボネート製のケースのなかに前記中空糸を約10000本挿入し、両端部をウレタン樹脂で固定するとともに切断開口させ、流入口を有するキャップを装着した。その後、芯液を除去、洗浄後、血液浄化器を解体し、中空糸を取り出した。得られた中空糸膜は、内径196μm、膜厚19μmであった。紡糸原液のビタミン含有量及びクエン酸含有量、並びに中空糸膜のビタミンE含有量及びビタミンEの酸化物/非酸化物ピーク面積割合を表1に示す。
【0035】
(実施例3)
紡糸原液は、三酢酸セルロース(CTA)(ダイセル化学工業社)15.2質量%、α―トコフェロール0.5質量%、クエン酸0.03質量%となるようにN−メチル−2−ピロリドン及びトリエチレングリコール混合溶媒を用いて均一に溶解して作製した。混合溶媒中の溶媒比は、N−メチル−2−ピロリドンが質量70%、トリエチレングリコールが30質量%となるように調整した。得られた紡糸原液を加温した二重管ノズルの外側環状部より吐出し、同時に中心孔より流動パラフィンを芯液として吐出した。乾式部を走行させた後、凝固性液体中を通過させて凝固、相分離し、膜構造を形成させ、洗浄工程にて不要な成分を除去した。続いて、75質量%グリセリン浴を通過させ、40℃の雰囲気で乾燥後、中空糸を巻き取った。ポリカーボネート製のケースのなかに前記中空糸を約10000本挿入し、両端部をウレタン樹脂で固定するとともに切断開口させ、流入口を有するキャップを装着した。その後、芯液を除去、洗浄後、血液浄化器を解体し、中空糸を取り出した。得られた中空糸膜は、内径195μm、膜厚21μmであった。紡糸原液のビタミン含有量及びクエン酸含有量、並びに中空糸膜のビタミンE含有量及びビタミンEの酸化物/非酸化物ピーク面積割合を表1に示す。
【0036】
(実施例4)
紡糸原液は、三酢酸セルロース(CTA)(ダイセル化学工業社)15.2質量%、α―トコフェロール0.5質量%、クエン酸0.04質量%となるようにN−メチル−2−ピロリドン及びトリエチレングリコール混合溶媒を用いて均一に溶解して作製した。混合溶媒中の溶媒比は、N−メチル−2−ピロリドンが70質量%、トリエチレングリコールが30質量%となるように調整した。得られた紡糸原液を加温した二重管ノズルの外側環状部より吐出し、同時に中心孔より流動パラフィンを芯液として吐出した。乾式部を走行させた後、凝固性液体中を通過させて凝固、相分離し、膜構造を形成させ、洗浄工程にて不要な成分を除去した。続いて、75質量%グリセリン浴を通過させ、40℃の雰囲気で乾燥後、中空糸を巻き取った。ポリカーボネート製のケースのなかに前記中空糸を約10000本挿入し、両端部をウレタン樹脂で固定するとともに切断開口させ、流入口を有するキャップを装着した。その後、芯液を除去、洗浄後、血液浄化器を解体し、中空糸を取り出した。得られた中空糸膜は、内径194μm、膜厚18μmであった。紡糸原液のビタミン含有量及びクエン酸含有量、並びに中空糸膜のビタミンE含有量及びビタミンEの酸化物/非酸化物ピーク面積割合を表1に示す。
【0037】
(実施例5)
紡糸原液は、三酢酸セルロース(CTA)(ダイセル化学工業社)15.2質量%、α―トコフェロール0.5質量%、クエン酸0.015質量%となるようにN−メチル−2−ピロリドン及びトリエチレングリコール混合溶媒を用いて均一に溶解して作製した。混合溶媒中の溶媒比は、N−メチル−2−ピロリドンが70質量%、トリエチレングリコールが30質量%となるように調整した。得られた紡糸原液を加温した二重管ノズルの外側環状部より吐出し、同時に中心孔より流動パラフィンを芯液として吐出した。乾式部を走行させた後、凝固性液体中を通過させて凝固、相分離し、膜構造を形成させ、洗浄工程にて不要な成分を除去した。続いて、75質量%グリセリン浴を通過させ、40℃の雰囲気で乾燥後、中空糸を巻き取った。ポリカーボネート製のケースのなかに前記中空糸を約10000本挿入し、両端部をウレタン樹脂で固定するとともに切断開口させ、流入口を有するキャップを装着した。その後、芯液を除去、洗浄後、血液浄化器全体を鉄粉系の汎用タイプの脱酸素剤とともに、外層がポリエステルフィルム、中間層がアルミ箔、内層がポリエチレンフィルムからなる包装袋に入れ真空包装を施し、25kGy線量のγ線を照射し滅菌処理を行った。滅菌後、血液浄化器を取り出し、解体後、中空糸を取り出した。得られた中空糸膜は、内径195μm、膜厚17μmであった。紡糸原液のビタミン含有量及びクエン酸含有量、並びに中空糸膜のビタミンE含有量及びビタミンEの酸化物/非酸化物ピーク面積割合を表1に示す。
【0038】
(実施例6)
紡糸原液は、三酢酸セルロース(CTA)(ダイセル化学工業社)15.2質量%、α―トコフェロール1.0質量%、クエン酸0.015質量%となるようにN−メチル−2−ピロリドン及びトリエチレングリコール混合溶媒を用いて均一に溶解して作製した。混合溶媒中の溶媒比は、N−メチル−2−ピロリドンが70質量%、トリエチレングリコールが30質量%となるように調整した。得られた紡糸原液を加温した二重管ノズルの外側環状部より吐出し、同時に中心孔より流動パラフィンを芯液として吐出した。乾式部を走行させた後、凝固性液体中を通過させて凝固、相分離し、膜構造を形成させ、洗浄工程にて不要な成分を除去した。続いて、75質量%グリセリン浴を通過させ、40℃の雰囲気で乾燥後、中空糸を巻き取った。ポリカーボネート製のケースのなかに前記中空糸を約10000本挿入し、両端部をウレタン樹脂で固定するとともに切断開口させ、流入口を有するキャップを装着した。その後、芯液を除去、洗浄後、血液浄化器を解体し、中空糸を取り出した。得られた中空糸膜は、内径196μm、膜厚18μmであった。紡糸原液のビタミン含有量及びクエン酸含有量、並びに中空糸膜のビタミンE含有量及びビタミンEの酸化物/非酸化物ピーク面積割合を表1に示す。
【0039】
(実施例7)
紡糸原液は、三酢酸セルロース(CTA)(ダイセル化学工業社)15.2質量%、α―トコフェロール0.10質量%、クエン酸0.015質量%となるようにN−メチル−2−ピロリドン及びトリエチレングリコール混合溶媒を用いて均一に溶解して作製した。混合溶媒中の溶媒比は、N−メチル−2−ピロリドンが70質量%、トリエチレングリコールが30質量%となるように調整した。得られた紡糸原液を加温した二重管ノズルの外側環状部より吐出し、同時に中心孔より流動パラフィンを芯液として吐出した。乾式部を走行させた後、凝固性液体中を通過させて凝固、相分離し、膜構造を形成させ、洗浄工程にて不要な成分を除去した。続いて、75質量%グリセリン浴を通過させ、40℃の雰囲気で乾燥後、中空糸を巻き取った。ポリカーボネート製のケースのなかに前記中空糸を約10000本挿入し、両端部をウレタン樹脂で固定するとともに切断開口させ、流入口を有するキャップを装着した。その後、芯液を除去、洗浄後、血液浄化器を解体し、中空糸を取り出した。得られた中空糸膜は、内径194μm、膜厚18μmであった。紡糸原液のビタミン含有量及びクエン酸含有量、並びに中空糸膜のビタミンE含有量及びビタミンEの酸化物/非酸化物ピーク面積割合を表1に示す。
【0040】
(比較例1)
紡糸原液は、三酢酸セルロース(CTA)(ダイセル化学工業社)15.2質量%、α―トコフェロール0.5質量%、クエン酸0.002質量%となるようにN−メチル−2−ピロリドン及びトリエチレングリコール混合溶媒を用いて均一に溶解して作製した。混合溶媒中の溶媒比は、N−メチル−2−ピロリドンが70質量%、トリエチレングリコールが30質量%となるように調整した。得られた紡糸原液を加温した二重管ノズルの外側環状部より吐出し、同時に中心孔より流動パラフィンを芯液として吐出した。乾式部を走行させた後、凝固性液体中を通過させて凝固、相分離し、膜構造を形成させ、洗浄工程にて不要な成分を除去した。続いて、75質量%グリセリン浴を通過させ、40℃の雰囲気で乾燥後、中空糸を巻き取った。ポリカーボネート製のケースのなかに前記中空糸を約10000本挿入し、両端部をウレタン樹脂で固定するとともに切断開口させ、流入口を有するキャップを装着した。その後、芯液を除去、洗浄後、血液浄化器を解体し、中空糸を取り出した。得られた中空糸膜は、内径195μm、膜厚15μmであった。紡糸原液のビタミン含有量及びクエン酸含有量、並びに中空糸膜のビタミンE含有量及びビタミンEの酸化物/非酸化物ピーク面積割合を表1に示す。
【0041】
(比較例2)
紡糸原液は、三酢酸セルロース(CTA)(ダイセル化学工業社)15.2質量%、α―トコフェロール0.5質量%、クエン酸0.05質量%となるようにN−メチル−2−ピロリドン及びトリエチレングリコール混合溶媒を用いて均一に溶解して作製した。混合溶媒中の溶媒比は、N−メチル−2−ピロリドンが70質量%、トリエチレングリコールが30質量%となるように調整した。得られた紡糸原液を加温した二重管ノズルの外側環状部より吐出し、同時に中心孔より流動パラフィンを芯液として吐出した。乾式部を走行させた後、凝固性液体中を通過させて凝固、相分離し、膜構造を形成させ、洗浄工程にて不要な成分を除去した。続いて、75質量%グリセリン浴を通過させ、40℃の雰囲気で乾燥後、中空糸を巻き取った。ポリカーボネート製のケースのなかに前記中空糸を約10000本挿入し、両端部をウレタン樹脂で固定するとともに切断開口させ、流入口を有するキャップを装着した。その後、芯液を除去、洗浄後、血液浄化器を解体し、中空糸を取り出した。得られた中空糸膜は、内径195μm、膜厚15μmであった。紡糸原液のビタミン含有量及びクエン酸含有量、並びに中空糸膜のビタミンE含有量及びビタミンEの酸化物/非酸化物ピーク面積割合を表1に示す。
【0042】
(比較例3)
紡糸原液は、三酢酸セルロース(CTA)(ダイセル化学工業社)15.2質量%、α―トコフェロール0.025質量%、クエン酸0.015質量%となるようにN−メチル−2−ピロリドン及びトリエチレングリコール混合溶媒を用いて均一に溶解して作製した。混合溶媒中の溶媒比は、N−メチル−2−ピロリドンが70質量%、トリエチレングリコールが30質量%となるように調整した。得られた紡糸原液を加温した二重管ノズルの外側環状部より吐出し、同時に中心孔より流動パラフィンを芯液として吐出した。乾式部を走行させた後、凝固性液体中を通過させて凝固、相分離し、膜構造を形成させ、洗浄工程にて不要な成分を除去した。続いて、75質量%グリセリン浴を通過させ、40℃の雰囲気で乾燥後、中空糸を巻き取った。ポリカーボネート製のケースのなかに前記中空糸を約10000本挿入し、両端部をウレタン樹脂で固定するとともに切断開口させ、流入口を有するキャップを装着した。その後、芯液を除去、洗浄後、血液浄化器を解体し、中空糸を取り出した。得られた中空糸膜は、内径195μm、膜厚17μmであった。紡糸原液のビタミン含有量及びクエン酸含有量、並びに中空糸膜のビタミンE含有量を表1に示す。
【0043】
(比較例4)
市販されている脂溶性ビタミンをコーティングした透析器(旭ビタブレン、旭化成クラレメディカル製)について、透析器内の充填水を排水した後、透析器を解体し、中空糸を取り出した。そして、室温にて乾燥させた後、他の実施例と同様に評価した。中空糸膜のビタミンE含有量及びビタミンEの酸化物/非酸化物ピーク面積割合を表1に示す。
【0044】
【表1】

【0045】
上記表1から明らかなように、実施例1〜7の中空糸膜は、いずれも酸化体ビタミンEのピーク面積割合が抑えられており、製造過程でのビタミンの酸化を抑制する効果が認められる。一方、比較例1,2の中空糸膜は、クエン酸による重金属の安定化が不足、あるいは過剰添加による酸性化により、いずれも酸化ビタミンEのピーク面積割合が高く、ビタミンEの酸化が進んでいる。比較例3については、ビタミン添加が不十分で、十分な効果が期待できない。比較例4については、ウェット状態での滅菌であり、滅菌時の産生ラジカルによりビタミン酸化が進んでいる。
【産業上の利用可能性】
【0046】
本発明により、簡便かつ低コストに生体適合性に優れた中空糸膜型血液浄化器を製造することができる。さらに、放射線滅菌工程時などの脂溶性ビタミンの酸化を防ぐことから、効果的な抗酸化性能および高い安全性が期待できる。
【特許請求の範囲】
【請求項1】
二重管ノズルの外側環状部と中心孔から紡糸原液と芯液をそれぞれ同時に吐出した後、凝固性液体中を通過させて凝固させ、洗浄する工程を含む血液浄化用中空糸膜の製造方法において、前記紡糸原液に脂溶性ビタミンを0.05〜1.2質量%含有させ、さらにクエン酸を0.004〜0.045質量%含有させることを特徴とする血液浄化用中空糸膜の製造方法。
【請求項2】
前記脂溶性ビタミンがビタミンEであることを特徴とする請求項1に記載の血液浄化用中空糸の製造方法。
【請求項3】
前記ビタミンEがα−トコフェロール、酢酸−α−トコフェロール、コハク酸−α−トコフェロール、またはコハク酸トコフェロールカルシウムであることを特徴とする請求項1または2に記載の血液浄化用中空糸膜の製造方法。
【請求項4】
請求項1〜3のいずれかに記載の製造方法によって得られる血液浄化用中空糸膜であって、前記膜中の脂溶性ビタミン含有量が0.05〜1.2質量%であり、高速液クロマトグラフィーの測定に基づく前記脂溶性ビタミン中の酸化物/非酸化物のピーク面積割合が30%以下であることを特徴とする血液浄化用中空糸膜。
【請求項5】
請求項4に記載の血液浄化用中空糸膜を使用して構成されることを特徴とする中空糸膜型透析器。
【請求項6】
中空糸膜型透析器内部の空間をドライ状態で放射線および/または電子線で滅菌処理していることを特徴とする請求項5に記載の中空糸膜型透析器。
【請求項1】
二重管ノズルの外側環状部と中心孔から紡糸原液と芯液をそれぞれ同時に吐出した後、凝固性液体中を通過させて凝固させ、洗浄する工程を含む血液浄化用中空糸膜の製造方法において、前記紡糸原液に脂溶性ビタミンを0.05〜1.2質量%含有させ、さらにクエン酸を0.004〜0.045質量%含有させることを特徴とする血液浄化用中空糸膜の製造方法。
【請求項2】
前記脂溶性ビタミンがビタミンEであることを特徴とする請求項1に記載の血液浄化用中空糸の製造方法。
【請求項3】
前記ビタミンEがα−トコフェロール、酢酸−α−トコフェロール、コハク酸−α−トコフェロール、またはコハク酸トコフェロールカルシウムであることを特徴とする請求項1または2に記載の血液浄化用中空糸膜の製造方法。
【請求項4】
請求項1〜3のいずれかに記載の製造方法によって得られる血液浄化用中空糸膜であって、前記膜中の脂溶性ビタミン含有量が0.05〜1.2質量%であり、高速液クロマトグラフィーの測定に基づく前記脂溶性ビタミン中の酸化物/非酸化物のピーク面積割合が30%以下であることを特徴とする血液浄化用中空糸膜。
【請求項5】
請求項4に記載の血液浄化用中空糸膜を使用して構成されることを特徴とする中空糸膜型透析器。
【請求項6】
中空糸膜型透析器内部の空間をドライ状態で放射線および/または電子線で滅菌処理していることを特徴とする請求項5に記載の中空糸膜型透析器。
【図1】




【公開番号】特開2013−94525(P2013−94525A)
【公開日】平成25年5月20日(2013.5.20)
【国際特許分類】
【出願番号】特願2011−242093(P2011−242093)
【出願日】平成23年11月4日(2011.11.4)
【出願人】(000003160)東洋紡株式会社 (3,622)
【Fターム(参考)】
【公開日】平成25年5月20日(2013.5.20)
【国際特許分類】
【出願日】平成23年11月4日(2011.11.4)
【出願人】(000003160)東洋紡株式会社 (3,622)
【Fターム(参考)】
[ Back to top ]

