生体関連物質を検出する方法
【課題】核酸マイクロアレイ等のツールの担体としてゲル担体又はそれに類似した特性を有する担体を用いた場合であっても、バックグラウンドの上昇を効果的に抑制し得る、生体関連物質の検出方法を提供する。
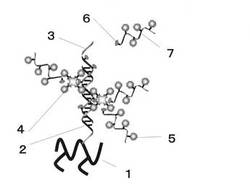
【解決手段】本発明に係る生体関連物質の検出方法は、(1)ゲル担体に固定化された生体関連物質(2)と、第一物質(6)が結合された生体関連物質(3)とを結合させる工程、(2)第二物質(4)を、前記生体関連物質(3)に結合している前記第一物質(6)に結合させる工程、(3)第一物質(6)と標識物質(5)とが結合された核酸(7)を、前記第二物質(4)に結合させる工程、及び(4)前記標識物質(5)を検出する工程を含むことを特徴とする方法である。
【解決手段】本発明に係る生体関連物質の検出方法は、(1)ゲル担体に固定化された生体関連物質(2)と、第一物質(6)が結合された生体関連物質(3)とを結合させる工程、(2)第二物質(4)を、前記生体関連物質(3)に結合している前記第一物質(6)に結合させる工程、(3)第一物質(6)と標識物質(5)とが結合された核酸(7)を、前記第二物質(4)に結合させる工程、及び(4)前記標識物質(5)を検出する工程を含むことを特徴とする方法である。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、生体関連物質を検出する方法に関する。詳しくは、バックグラウンドの上昇を効果的に抑制して当該検出を行う方法に関する。
【背景技術】
【0002】
検体から生体情報を取り出す手法は、体の機能解明及び疾病の発症メカニズムや標的分子の解明といった基礎研究から、腫瘍の悪性度及び予後予測、薬物の効果及び副作用の予測、並びに治療効果の判定等の臨床応用まで期待されている。その手法の一つとして、生体関連物質を検出する方法があり、当該方法として、核酸マイクロアレイ、プロテインアレイ及び抗体アレイといったツールを使用する方法がある。
上記ツールは、担体に、プローブと呼ばれる検体中の目的のサンプルと結合し得る物質が固定化されている。そのプローブと検体中のサンプルとを結合させ、結合したサンプルの量を何らかのシグナルで読み取り、当該結合の有無や結合量を情報として取り出す。検出されるシグナルとしては、プローブと結合したサンプルに起因する目的シグナルの他に、当該サンプルに起因しないシグナルであるバックグラウンドというものがあり、バックグラウンドの上昇を抑え、上記目的シグナルの検出強度を増大させることが、より高感度に生体情報を取り出すための課題となっている。
【0003】
従来、生体関連物質を検出する方法として汎用的に用いられているのが、アビジンとビオチンとの結合、及び抗体の使用による免疫学的手法を利用した、ABC法である。ABC法とは、まず生体組織又は担体に固定化した検体中のサンプルに一次抗体を結合させた後、当該一次抗体にビオチン結合二次抗体を結合させる。次いで、当該二次抗体に結合しているビオチンにアビジンを結合させ、さらにビオチン結合蛍光タンパク質又はビオチン結合酵素を、上記アビジンに複数結合させることで、目的の検出シグナルの強度を増大させる方法である(非特許文献1参照)。
【先行技術文献】
【非特許文献】
【0004】
【非特許文献1】Hsu SM et al., “Use of avidin-biotin-peroxidase complex (ABC) in immunoperoxidase techniques: a comparison between ABC and unlabeled antibody (PAP) procedures”., J. Histochem. Cytochem., vol. 29(4), p. 577-580, 1981
【発明の概要】
【発明が解決しようとする課題】
【0005】
しかしながら、前記ツールを用い、従来のABC法を利用してシグナル検出を行う場合に、当該ツールの担体(プローブ等が固定化された担体)として、ゲルで構成される担体(以下、ゲル担体)を用いると、目的の検出シグナル強度を増大させるために使用した抗体、蛍光タンパク質及び酵素が当該ゲル担体に捕捉され、結果としてバックグラウンドの上昇を招いてしまうという問題があった。
このような状況下において、前記ツールの担体としてゲル担体を用いた場合であっても、バックグラウンドの上昇を効果的に抑制し得る、目的シグナルの検出方法の開発が望まれていた。
【課題を解決するための手段】
【0006】
本発明は、上記状況を考慮してなされたもので、以下に示す、生体関連物質を検出する方法等を提供するものである。
下記(1)〜(4)の工程を含む、生体関連物質の検出方法。
(1)ゲル担体に固定化された生体関連物質(A)と、第一物質(S)が結合された生体関連物質(B)とを結合させる工程、
(2)第二物質(E)を、前記生体関連物質(B)に結合している前記第一物質(S)に結合させる工程、
(3)第一物質(S)と標識物質(R)とが結合された核酸(C)を、前記第二物質(E)に結合させる工程、及び
(4)前記標識物質(R)を検出する工程。
ここで、前記第一物質(S)としては、例えばビオチンが挙げられ、前記第二物質(E)としては、例えばアビジン又はストレプトアビジンが挙げられる。
【発明の効果】
【0007】
本発明によれば、核酸マイクロアレイ等のツールを用いて目的サンプル(生体関連物質)に起因するシグナルの検出を行う場合に、当該ツールに用いる担体がゲル担体であっても、バックグラウンドの上昇を効果的に抑制し、目的の検出シグナルの強度を増大することができる、生体関連物質の検出方法を提供することができる。
【図面の簡単な説明】
【0008】
【図1】本発明に係る生体関連物質の検出方法の一実施例を示す概略図である。
【図2】本発明の実施例及び比較例における検出シグナルの強度を示す図である。
【発明を実施するための形態】
【0009】
以下、本発明を詳細に説明する。本発明の範囲はこれらの説明に拘束されることはなく、以下の例示以外についても、本発明の趣旨を損なわない範囲で適宜変更し実施することができる。なお、本明細書において引用された全ての刊行物、例えば先行技術文献、及び公開公報、特許公報その他の特許文献は、参照として本明細書に組み込まれる。
【0010】
本発明に係る生体関連物質の検出方法(以下、本発明の検出方法)は、前述の通り、下記(1)〜(4)の工程を含むことを特徴とするものである。
(1)ゲル担体に固定化された生体関連物質(A)と、第一物質(S)が結合された生体関連物質(B)とを結合させる工程、
(2)複数の前記物質(S)と結合し得る第二物質(E)を、前記物質(B)に結合している前記物質(S)に結合させる工程、
(3)第一物質(S)と標識物質(R)とが結合された核酸(C)を、前記物質(E)に結合させる工程、及び
(4)前記物質(R)を検出する工程。
【0011】
以下、上記各工程について具体的に説明する。なお、工程(4)の検出に供される、工程(1)〜(3)後に得られる各物質等の結合後の状態については、図1の概略図を参照することができる。
【0012】
1.工程(1)について
本工程においては、生体関連物質(A)と生体関連物質(B)とを互いに結合(ハイブリダイゼーション)させる。当該物質(B)は、本発明において検出対象となる物質である。結合の種類としては、具体的には、共有結合、配位結合、水素結合、疎水性相互作用及びイオン結合等が挙げられる。当該物質(A)及び物質(B)としては、互いに同一又は異なって、例えばタンパク質、ペプチド、核酸、脂質及び糖等が好ましく挙げられる。ここで、核酸としては、例えば各種DNA、RNA及びPNA(ペプチド核酸)等又はこれらの混合物が挙げられる。例えば、当該物質(A)及び物質(B)のうちの一方が核酸である場合は、他方は、当該核酸に相補的な配列を有する核酸であるか、又は当該核酸と結合し得るタンパク質若しくはペプチドであることが好ましい。また、当該核酸等は、前記結合を阻害しない範囲内において、化学的な修飾がなされているものであってもよい。
【0013】
本発明において、前記物質(A)はゲル担体に固定化されている物質である。当該物質(A)とゲル担体との固定化の方法としては、例えば、直接当該物質(A)とゲル担体とを共有結合、配位結合、物理吸着及び化学吸着等によって固定化する方法が挙げられる。その他、当該物質(A)をゲル担体に固定化する方法としては、予め粒子等に当該物質(A)を固定化しておいて、その粒子をゲル担体へ包含する方法も挙げられる。この場合、使用する粒子は、ゲル担体中で均一に分散する材料であれば、いずれでもよい。当該物質(A)の粒子への固定化方法は、直接ゲル担体に固定化する方法と同様の方法が挙げられる。
【0014】
本発明において、前記物質(B)は、前記物質(A)に結合し得る物質であり、通常、検体中に存在する生体関連物質又はそれを増幅した生体関連物質が用いられる。また、当該物質(B)には、第一物質(S)が結合されている。当該物質(B)と当該物質(S)との結合の種類としては、例えば、共有結合及び配位結合が挙げられる。また、当該物質(B)1分子当たりの当該物質(S)の結合数は、特に限定はされない。
上記物質(S)は、後述する第二物質(E)と互いに結合し得るものであればよく、限定はされない。例えば、ビオチン、リン酸基、ヘム等が挙げられる。なお、当該物質(S)と物質(E)との結合の種類は、限定はされず、例えば、共有結合、配位結合、水素結合、疎水性相互作用及びイオン結合が挙げられる。
【0015】
上記物質(B)として、PCR、逆転写反応及び転写反応等を利用して調製(増幅)した核酸(例えばRNA)を用いる場合は、例えば、当該物質(S)が予め結合したNTP等を用いることにより調製することができる。
前記物質(A)と物質(B)との結合の反応条件は、これら物質の種類等により適宜設定することができ、特に限定はされない。例えば、pH緩衝水溶液中において15〜70℃の温度範囲内であることが好ましい。pH緩衝水溶液としては、pH 6〜8の範囲内で緩衝能を有する緩衝液であればよく、特に限定はされない。前記物質(A)及び物質(B)が核酸である場合は、SSC溶液、Tris-HCl溶液、リン酸溶液及びホウ酸溶液等が好ましく挙げられる。
【0016】
担体とは、生体関連物質(A)を固定化する土台となる物質のことであり、本発明では、ゲルで構成される担体(ゲル担体)が用いられる。ゲルとは、高分子が架橋して三次元的な網目構造を形成したものであり、その種類は特に限定はされず、公知の各種物理ゲル又は化学ゲルが利用できる。
【0017】
物理ゲルとしては、例えば、アガロース、アガロペクチン、アミロース、アミロペクチン、アラビアゴム、アラビナン、イソリケナン、インスリン、エチルセルロース、エチルヒドロキシエチルセルロース、カードラン、カゼイン、カラギーナン、カルボキシメチルセルロース、カルボキシメチルデンプン、カロース、寒天、キサンタンガム、キチン、グアーガム、キトサン、クインスシード、クラウンゴール多糖、グリコーゲン、グルコマンナン、ケラタン硫酸、紅藻デンプン、酵母マンナン、コラーゲン、ゼラチン、デンプン、アルギン酸塩、アルギン酸プロピレングリコールエステル、ジェランガム、シゾフィラン、セルロース、ゾウゲヤシマンナン、タマリンドシードガム、ツニシン、ニゲラン、ヒドロキシプロピルセルロース、プスツラン、フノラン、分解キシログルカン、HMペクチン、ポリアミジン、ポリペルフルオロカーボンスルホン酸、ポリメタクリル酸−ポリエチレングリコール共重合体、ポリメトキシエチレングリコールメタクリレート、ポルフィラン、メチルセルロース、メチルデンプン、レンチナン、ローカストビーンガム、ポリビニルアルコール及びポリアクリル酸ナトリウム等が挙げられる。
【0018】
化学ゲルとしては、例えば、ポリアクリルアミドゲル、ポリイソプロピルアクリルアミドゲル、ジメチルアクリルアミドゲル、ポリビニルピロリドンゲル、絹フィブロイン、ケラチンタンパク質、メタクリル酸2-(ジメチルアミノ)エチル、2-ジメチルアミノエチルメタクリレートゲル、HSタンパク質、デキストラン、ヒアルロン酸ゲル、ビスアクリルアミドメチルエーテルゲル、ポリ-(2-アクリルアミド-2-メチルプロパンスルホン酸)ゲル、ポリアクリル酸ゲル、ポリ-(N,N-アクリル酸ジメチルアミノエチルエステル)ゲル、ポリアクリル酸ナトリウム架橋体、ポリ-(N-アクリロイルアミノエトキシエタノール)ゲル、ポリ-(N-アクリロイルアミノプロパノール)ゲル、ポリアクリロキシプロパンスルホン酸ゲル、ポリイソブチレン・マレイン酸共重合体ゲル、ポリエチレンイミンゲル、ポリエチレンオキシド・プロピレンオキシド共重合体ゲル、ポリエチレンオキシド・ポリエチレングリコールゲル、ポリエチレン-酢酸ビニルコポリマーゲル、ポリジオキソランゲル、ポリジメチルアミノプロピルアクリルアミドゲル、ポリ-(2-ヒドロキシエチルメタクリレート)・ポリメタクリル酸2-ヒドロキシエチルゲル、ポリビニルピリジンゲル、ポリビニルメチルエーテルゲル、ポリプロピレンオキシドゲル、ポリ-(N-メチロールアクリルアミド)ゲル等が挙げられる。
【0019】
また、物理ゲルと化学ゲル、物理ゲルと無機物、化学ゲルと無機物、物理ゲルと化学ゲルと無機物のように、それぞれを組み合わせたゲルも利用でき、その種類は特に限定はされない。
上記各種ゲルの中でも、例えばアガロースゲルやアクリルアミドゲル等が好ましく、加熱によって溶解しにくいアクリルアミドゲルがより好ましい。
ゲル担体は、前記物質(A)を三次元に、すなわちゲル担体の内部にも固定化できるものが好ましい。二次元に、すなわちゲル担体の表面のみに固定化するより多くの物質(A)を固定化できるためである。
ゲル担体は、ゲル担体のみで用いることもできる。また、各工程を行う上でゲル担体のみでは取り扱いにくい場合、ゲル担体を他の物質、例えばガラス板、プラスチック板等に保持させた状態で用いることもできる。ゲル担体を保持する物質としては、後述する検出方法で生体関連物質を検出可能な材料、形状であれば特に限定されない。
【0020】
ゲル担体を保持するデバイスとしては、例えばゲル担体を保持する核酸アレイが挙げられる。ゲル担体を保持する核酸アレイとして本発明の検出方法に用い得る核酸アレイ(物質(A)としての核酸プローブが担体に固定化されたもの)の具体例としては、貫通孔型マイクロアレイ(製品名:ジェノパール(登録商標);掲載ウェブサイト:http://www.mrc.co.jp/genome/top.html;特許第3488456号公報、特許第3510882号公報等参照)が挙げられる。上記の貫通孔型マイクロアレイは、所定の核酸プローブを固定化したゲル担体をその種類毎に別々の中空繊維等管状体の中空部内に保持させ、そのすべての中空繊維等管状体を集束させ固定した後、繊維の長手方向で切断を繰り返すことにより得られるマイクロアレイである。
【0021】
以下、上記貫通孔型マイクロアレイに関して詳細に説明する。このマイクロアレイは、例えば、下記(i)〜(iv)の工程を経て作製することができる。
(i) 複数本の中空繊維を、中空繊維の長手方向が同一方向となるように3次元に配列して配列体を製造する工程
(ii) 前記配列体を包埋し、ブロック体を製造する工程
(iii) 核酸プローブ(オリゴヌクレオチドプローブ)を含むゲル前駆体重合性溶液を前記ブロック体の各中空繊維の中空部に導入して重合反応を行い、核酸プローブを含むゲル状物を中空部に保持させる工程
(iv) 中空繊維の長手方向と交差する方向で切断して、ブロック体を薄片化する工程
【0022】
中空繊維に使用される材料は、限定はされず、例えば、特開2004-163211号公報等に記載の材料が好ましく挙げられる。
中空繊維は、その長手方向の長さが同一となるように3次元に配列される(工程(i))。配列方法としては、例えば、粘着シート等のシート状物に複数本の中空繊維を所定の間隔をもって平行に配置し、シート状とした後、このシートを螺旋状に巻き取る方法(特開平11-108928号公報参照)や、複数の孔が所定の間隔をもって設けられた多孔板2枚を孔部が一致するように重ね合わせ、それらの孔部に中空繊維を通過させ、その後2枚の多孔板の間隔を開いて仮固定し、2枚の多孔板間における中空繊維の周辺に硬化性樹脂原料を充満させて硬化させる方法(特開2001-133453号公報参照)などが挙げられる。
【0023】
製造された配列体はその配列が乱れないように包埋される(工程(ii))。包埋の方法としては、ポリウレタン樹脂及びエポキシ樹脂等を繊維間の隙間に流し込む方法のほか、繊維どうしを熱融着により接着する方法等が好ましく挙げられる。
包埋された配列体には、各中空繊維の中空部に、核酸プローブを含むゲル前駆体重合性溶液(ゲル形成溶液)を充填し、中空部内で重合反応を行う(工程(iii))。これにより、各中空繊維の中空部に、核酸プローブが固定化されたゲル状物を保持させることができる。
ゲル前駆体重合性溶液とは、ゲル形成重合性モノマー等の反応性物質を含有する溶液であって、該モノマー等を重合、架橋させることにより該溶液がゲル状物となることが可能な溶液をいう。そのようなモノマーとしては、例えば、アクリルアミド、ジメチルアクリルアミド、ビニルピロリドン、メチレンビスアクリルアミド等が挙げられる。この場合、溶液には重合開始剤等が含まれていてもよい。
【0024】
中空繊維内に核酸プローブを固定化した後、中空繊維の長手方向と交差する方向(好ましくは直交する方向)で、ブロック体を切断して薄片化する(工程(iv))。このようにして得られた薄片が核酸アレイ(DNAマイクロアレイ)として使用できる。当該アレイの厚みは、0.01〜1 mm程度であることが好ましい。ブロック体の切断は、例えば、ミクロトーム及びレーザー等により行うことができる。
【0025】
2.工程(2)について
本工程においては、第二物質(E)を、生体関連物質(B)に結合している第一物質(S)に結合させる工程である。ここで、当該物質(E)は、少なくとも2つの物質(S)との結合能を有する物質であればよく、すなわち、本工程において当該物質(S)と結合し、さらに後の工程において別の第一物質(S)とも結合し得る物質であればよく、特に限定はされない。
第一物質(S)と第二物質(E)との組み合わせとしては、それぞれ、例えば、ビオチンとアビジン又はストレプトアビジンとの組み合わせ、リン酸基を有する物質と金属錯体との組み合わせ、ヘムとグロビンとの組み合わせ等が好ましく挙げられ、中でもビオチンとアビジン又はストレプトアビジンとの組み合わせが好ましい。
【0026】
詳しくは、前記物質(A)が核酸であり、前記物質(B)がPCR等により増幅した核酸である場合、ビオチンは当該増幅過程において前記物質(B)に結合させることができるため、前記物質(A)及び前記物質(B)がいずれも核酸の場合は、第一物質(S)はビオチンであることが好ましい。その際、核酸の塩基、リン酸基及び糖が、当該物質(S)と前記物質(E)との結合に影響を与えないということも考慮すると、当該物質(S)及び当該物質(E)の組み合わせとしては、前述の通り、ビオチンとアビジン又はストレプトアビジンとの組み合わせが好ましい。
【0027】
本発明において、当該物質(E)としては、後述する工程(4)において検出及び検出強度の測定が可能なシグナルを発する標識物質(R’)が結合されたものを用いることもできる。当該物質(R’)は、後述する標識物質(R)と同種のものであってもよいし異種のものであってもよい。シグナル強度を増大させるためには、当該物質(R)と物質(R’)とは、同一波長の励起光により同一波長の蛍光が検出できるものであることが好ましい。なお、当該物質(R’)の詳細については、後述する物質(R)についての説明が同様に適用できる。
前記物質(E)と前記物質(S)との結合の反応条件は、限定はされないが、pH 4〜9の緩衝水溶液中、4〜70℃において、両者を混合することが好ましい。緩衝液はpH 4〜9の範囲内で緩衝能を有する緩衝液であれば、特に限定はされない。例えば、工程(1)の項目で例示した緩衝液を使用することができる。
【0028】
3.工程(3)について
本工程においては、第一物質(S)を介して生体関連物質(B)に結合している第二物質(E)に対して、核酸(C)を結合させる工程である。ここで、用いる核酸(C)には予め第一物質(S)が結合されており、核酸(C)はこの第一物質(S)を介して前記物質(E)に結合された状態となる。核酸(C)に結合している前記物質(S)の詳細については、前述した前記物質(B)に結合している物質(S)と同様の説明が適用できる。また、前記物質(E)1分子当たりに結合される核酸(C)は、少なくとも1分子、好ましくは2分子以上、より好ましくは3分子以上である。
【0029】
当該核酸(C)は、前記物質(S)の他に、さらに標識物質(R)が結合されたものでもある。当該物質(R)は、後述する工程(4)において検出及び検出強度の測定が可能なシグナルを発する標識物質であればよく、限定はされない。例えば、蛍光、発光、ラジオアイソトープ及び発色等のシグナルを発する物質が好ましい。より詳細には、蛍光物質、放射性同位体、酵素、金属及び金属錯体等が挙げられ、蛍光、発光、吸光度及び散乱光によるシグナルを検出する場合は、本発明に用いる生体関連物質の吸収波長と重ならない波長のシグナルを発する物質が好ましい。蛍光物質としては、各種蛍光色素及び蛍光タンパク質が挙げられ、蛍光色素としては、各種レポーター色素、例えばCy5、Cy3、VIC、FAM、HEX、TET、フルオレセイン、FITC、TAMRA、Texas red、Yakima Yellow、ULYSIS、ARES等が挙げられる。蛍光タンパク質としては、例えば、GFP、EGFP、BFP、YFP等が挙げられる。
【0030】
当該核酸(C)1分子当たりに結合される標識物質(R)の数は、限定されないが、複数結合されているのが好ましい。標識物質(R)の数が多いほど、シグナル強度を増幅することができるためである。
本発明において、前記生体関連物質(A)及び(B)のいずれかが核酸の場合、核酸(C)は当該物質(A)及び(B)の塩基配列と相補的でない(ハイブリダイゼーションしない)塩基配列を有するものであることが好ましい。これは核酸(C)が当該物質(A)及び(B)の塩基配列と相補的である塩基配列を有する場合、核酸(C)が生体関連物質(A)又は生体関連物質(B)に結合し、生体関連物質(B)を検出できないためである。
【0031】
ここでいう「相補的でない」とは、核酸(C)の塩基配列中に、前記物質(A)又は(B)の塩基配列の相補配列と重複する塩基配列が連続して15 mer以上無いことであり、好ましくは10 mer以上無いことであり、より好ましくは6 mer以上無いことである。なお、前記物質(B)の塩基配列は、前記物質(A)に結合し得る塩基配列を有する遺伝子を公知のデータベースを用いて検索し確認することができ、その情報に基づいて、核酸(C)を合成する(塩基配列を設計する)ことができる。
また、核酸(C)の鎖長は、ゲル担体中での核酸(C)の拡散が著しく低下しない鎖長であり且つ標識物質(R)を複数結合できる鎖長であることが好ましい。例えば、下限は、2 mer以上であることが好ましく、より好ましくは15 mer以上であり、上限は、500 mer以下であることが好ましく、より好ましくは200 mer以下、さらに好ましくは100 mer以下である。
【0032】
前記物質(E)と、前記物質(S)が結合された核酸(C)との結合の反応条件は、限定はされないが、pH 4〜9の緩衝水溶液中、4〜70℃において、両者を混合することが好ましい。緩衝液はpH 4〜9の範囲内で緩衝能を有する緩衝液であれば、特に限定はされず、例えば、工程(1)の項目で例示した緩衝液を使用することができる。
【0033】
4.工程(4)について
本工程においては、核酸(C)に結合されている標識物質(R)、及び前記第二物質(E)に結合されていてもよい標識物質(R’)の検出を行う。当該検出は、当該物質(R)及び物質(R’)に適した方法及び装置等を用いて行うことができ、これら物質に由来するシグナル強度を画像化及び/又は数値化等することで行うことができる。
例えば、当該物質(R)及び物質(R’)が蛍光色素や蛍光タンパク質の場合は、検出する蛍光の波長に合わせた励起光源、検出波長を限定するためのフィルターセット、CCDカメラ、及び必要に応じて顕微鏡等を組み合わせて検出を行うことができる。担体が立体的形状(例えば円柱状)を有するものである場合は、該担体中における検出シグナルを簡便に且つ立体的にとらえるために、所定の励起光源やフィルターセットを用いた共焦点の顕微鏡を使用することもできる。
【0034】
また、当該物質(R)及び物質(R’)が金属の場合は、金属特有の吸光、散乱光を検出可能な装置で検出することができる。当該物質(R)及び物質(R’)が金属錯体の場合は、核スピン共鳴を原理とする装置で検出することができる。当該物質(R)及び物質(R’)が放射性同位体の場合は、放射線を検出可能な装置を用いて検出することができる。
【0035】
本発明の工程(1)〜(4)により、生体関連物質(B)に結合された第一物質(S)に結合した第二物質(E)に対し、さらに第一物質(S)を介して、標識物質(R)が結合された核酸(C)が多数結合することで、検出シグナルの強度が増大し、かつゲル担体等を用いた場合でもバックグラウンドの上昇を効果的に抑えることができる。
なお、本発明の検出方法は、前述した工程(1)〜(4)以外に、他の工程を含むものであってもよく、限定はされない。他の工程としては、例えば、工程(1)〜(3)において適宜行い得る洗浄工程や、工程(4)で得られた検出結果に基づいて生体関連物質(B)の物性を判定する工程(例えば、前記物質(A)が核酸プローブ(キャプチャープローブ)である場合は、当該物質(B)となる標的核酸の塩基配列や遺伝子多型等を判定する工程)が挙げられる。
【0036】
以下に、実施例を挙げて本発明をより具体的に説明するが、本発明はこれらに限定されるものではない。
【実施例1】
【0037】
以下の通り、核酸マイクロアレイアレイを用いた生体関連物質の検出を行った。
1.ゲルで構成される担体に固定化した生体関連物質(A)の準備
生体関連物質(A)としてのプローブ核酸がゲル担体に固定化された、貫通孔型の核酸マイクロアレイ(三菱レイヨン社製:Genopal(登録商標))を用いた。当該プローブ核酸(生体関連物質(A))は、3種の5’末端ビニル化核酸(65 mer)(配列番号2〜4及び下記表1参照)を用いた。なお、核酸マイクロアレイ上には、プローブ搭載部分(プローブスポット)と、プローブ非搭載部分(ゲルのみのスポット)があり、後者のスポットをバックグラウンドとした。
【0038】
【表1】

【0039】
2.生体関連物質(B)(aRNA)の調製
第一物質(S)が結合した生体関連物質(B)として、マウスTotal RNAより合成したビオチン結合aRNAを用いた(第一物質(S):ビオチン,生体関連物質(B):aRNA)。ビオチン結合aRNAの調製(合成及び精製)は、Message Amp II-Biotin Enhancedキット(アプライドバイオシステムズ社製)を用い、添付のプロトコールに従って行った。当該キットはTotal RNAからの逆転写によりcDNAを合成し、cDNAからaRNAを転写して増幅させるためのキットである。当該転写の際にビオチンが結合したUTPを使用することで、ビオチン結合aRNAを合成した。
【0040】
3.ハイブリダイゼーション(生体関連物質(A)と生体関連物質(B)との結合)
Message AmpII-Biotin Enhancedキット(アプライドバイオシステムズ社製)付属の5x Array Fragmentation Bufferを用いて、以下の方法でビオチン結合aRNAの断片化を行った。ビオチン結合aRNA 5μgをプラスチックチューブに入れ、5x Array Fragmentation Bufferを4μl添加し、20μlにメスアップしてよく混合した後、94℃で7.5分間加熱して断片化を行った。断片化後の溶液 20μlに、18μlの1M Tris-HCl溶液(インビトロジェン社製)、18μlの1M NaCl溶液(ナカライテスク社製)及び15μlの0.5% Tween 20溶液をそれぞれ混合し、Nuclease-free waterで150μlにメスアップして、検体液を調製した。
調製した検体液に、前記1.項の核酸マイクロアレイアレイを浸漬し、65℃で16時間ハイブリダイゼーション反応を行った。当該アレイからハイブリダイゼーションに用いた検体液を除去した後、当該アレイを65℃の0.12M TNT溶液(0.12M Tris-HCl、0.12M NaCl、0.5% Tween 20溶液)中に浸漬し(20分間×2回)、次いで、65℃に温めた0.12M TN溶液(0.12M Tris-HCl、0.12M NaCl)に10分間浸漬して、洗浄した。
【0041】
4.ストレプトアビジン結合工程
標識物質(R’)を結合させた第二物質(E)として、当該ストレプトアビジン(第二物質(E))にCy5(標識物質(R’))が結合したCy5-ストレプトアビジン(GE Healthcare社製)を用いた。前記3.項の洗浄後の核酸マイクロアレイを、2μg/mlに溶解したCy5-ストレプトアビジン溶液5 mlに30分間浸漬し、さらに当該アレイを0.12 M TNT溶液中に5分間浸漬し、これを4回繰り返した。次いで、当該アレイを0.12M TN溶液に1回浸漬して洗浄した。
【0042】
5.ビオチンを結合し且つ蛍光色素を標識した核酸(C)をストレプトアビジンに結合する工程
検出シグナル強度を増大させるために用いる核酸(C)の調製を、以下の通りに行った。核酸(C)としては、5’末端にビオチンが結合した30 merの核酸断片(インビトロジェン社;配列番号1及び前記表1参照)を用いた。核酸(C)への蛍光色素(標識物質(R))の結合には、Platinum Bright 647 Labeling kit(フナコシ)を用いた。当該キットは、647 nmの蛍光を発する蛍光色素を核酸に結合させるキットである。核酸(C)に蛍光色素を結合し精製する操作は、20 pmol/μlの核酸(C)を用い、当該キットに添付のプロトコールに従って行った。上記精製後の核酸(C)を、濃度が1 pmol/μlとなるように0.12M TNT溶液で150μlに調製し、その溶液(40℃)に前記4.項の洗浄後の核酸マイクロアレイを30分間浸漬した。その後、当該アレイを、40℃に温めた0.12M TN溶液(0.12M Tris-HCl、0.12M NaCl)に浸漬して(10分間×2回)洗浄した。
【0043】
6.シグナル強度測定
核酸マイクロアレイにおけるシグナルの検出及び強度測定は、DNAチップ検出装置(横河電機製:MB-M3A、レーザー波長:633nm)を用い、Cy5及びPlatinum Bright 647の蛍光を測定して行った(露光時間:0.1秒, 1秒, 4秒, 40秒)。Cy5及びPlatinum Bright 647は、いずれも633nmの波長で励起され、同波長(670nm)の蛍光を発するものである。
なお、シグナル強度測定の結果は、以下の各比較例の結果と併せて後述する。
【0044】
〔比較例1〕
実施例1における1.項〜4.項の工程を行い、その後、5.項の「核酸(C)をストレプトアビジンに結合する工程」は行わずに、6.項の「シグナル強度測定」を行った。本比較例は、実施例1における、核酸(C)による検出シグナル強度の増大を確認するための比較実験として行った。
【0045】
〔比較例2〕
実施例1における1.項〜4.項の工程を行い、5.項の「核酸(C)をストレプトアビジンに結合する工程」の代わりに、下記5’.項の工程を行った。その後、実施例1における6.項の「シグナル強度測定」を行った。本比較例は、ABC法(抗体を用いる方法)によるシグナル強度の検出結果を確認するための比較実験として行った。
【0046】
5’.ビオチン標識抗ストレプトアビジンIgG抗体による標識
ビオチン標識抗ストレプトアビジンIgG抗体(Vector社)100μg/μl、BSA 20mg/μlの溶液で染色し、50mM TNT溶液によって室温で5分間、4回洗浄した。さらに、Cy5-ストレプトアビジン(実施例1で使用したものと同様)を結合し、0.12M TNT溶液により室温で5分間の洗浄を4回行った。
【0047】
〔比較例3〕
実施例1における1.項の工程を行い、その後、2.項〜4.項の工程を行わずに、5.項及び6.項の工程を行った。本比較例は、核酸(C)が核酸マイクロアレイのプローブと結合しないことを確認するための比較実験として行った。
【0048】
シグナル強度測定の結果
前述した実施例1及び比較例1〜3におけるシグナル強度測定の結果を、下記表2及び図2に示した。
比較例1の結果は、Cy5-ストレプトアビジンのみによる検出シグナルであり、プローブスポットの検出シグナル強度は約600程度であった。これに対し、実施例1では、核酸(C)を結合させることでプローブスポットの検出シグナル強度が、比較例1の約7倍に増大した。実施例1の検出シグナル強度には、Cy5-ストレプトアビジンの蛍光シグナルとPlatinum Bright 647の蛍光シグナルが含まれているため、実施例1と比較例1との検出シグナル強度の差分が、核酸(C)の効果であることが確認された。
【0049】
また、比較例2では、バックグラウンドが約5000であったのに対して、実施例1では約200しかなく、バックグラウンドの上昇が効果的に抑えられることが確認された。
ストレプトアビジン及びビオチン結合aRNAを使用しない比較例3では、検出シグナル強度が約20と低かったことから、核酸マイクロアレイに搭載した核酸プローブと核酸(C)とは結合しないことが確認された。
【0050】
【表2】

【符号の説明】
【0051】
1 ゲルで構成される担体(ゲル担体)
2 生体関連物質(A)
3 生体関連物質(B)
4 第二物質(E)
5 標識物質(R)
6 第一物質(S)
7 核酸(C)
【配列表フリーテキスト】
【0052】
配列番号1:合成DNA
【技術分野】
【0001】
本発明は、生体関連物質を検出する方法に関する。詳しくは、バックグラウンドの上昇を効果的に抑制して当該検出を行う方法に関する。
【背景技術】
【0002】
検体から生体情報を取り出す手法は、体の機能解明及び疾病の発症メカニズムや標的分子の解明といった基礎研究から、腫瘍の悪性度及び予後予測、薬物の効果及び副作用の予測、並びに治療効果の判定等の臨床応用まで期待されている。その手法の一つとして、生体関連物質を検出する方法があり、当該方法として、核酸マイクロアレイ、プロテインアレイ及び抗体アレイといったツールを使用する方法がある。
上記ツールは、担体に、プローブと呼ばれる検体中の目的のサンプルと結合し得る物質が固定化されている。そのプローブと検体中のサンプルとを結合させ、結合したサンプルの量を何らかのシグナルで読み取り、当該結合の有無や結合量を情報として取り出す。検出されるシグナルとしては、プローブと結合したサンプルに起因する目的シグナルの他に、当該サンプルに起因しないシグナルであるバックグラウンドというものがあり、バックグラウンドの上昇を抑え、上記目的シグナルの検出強度を増大させることが、より高感度に生体情報を取り出すための課題となっている。
【0003】
従来、生体関連物質を検出する方法として汎用的に用いられているのが、アビジンとビオチンとの結合、及び抗体の使用による免疫学的手法を利用した、ABC法である。ABC法とは、まず生体組織又は担体に固定化した検体中のサンプルに一次抗体を結合させた後、当該一次抗体にビオチン結合二次抗体を結合させる。次いで、当該二次抗体に結合しているビオチンにアビジンを結合させ、さらにビオチン結合蛍光タンパク質又はビオチン結合酵素を、上記アビジンに複数結合させることで、目的の検出シグナルの強度を増大させる方法である(非特許文献1参照)。
【先行技術文献】
【非特許文献】
【0004】
【非特許文献1】Hsu SM et al., “Use of avidin-biotin-peroxidase complex (ABC) in immunoperoxidase techniques: a comparison between ABC and unlabeled antibody (PAP) procedures”., J. Histochem. Cytochem., vol. 29(4), p. 577-580, 1981
【発明の概要】
【発明が解決しようとする課題】
【0005】
しかしながら、前記ツールを用い、従来のABC法を利用してシグナル検出を行う場合に、当該ツールの担体(プローブ等が固定化された担体)として、ゲルで構成される担体(以下、ゲル担体)を用いると、目的の検出シグナル強度を増大させるために使用した抗体、蛍光タンパク質及び酵素が当該ゲル担体に捕捉され、結果としてバックグラウンドの上昇を招いてしまうという問題があった。
このような状況下において、前記ツールの担体としてゲル担体を用いた場合であっても、バックグラウンドの上昇を効果的に抑制し得る、目的シグナルの検出方法の開発が望まれていた。
【課題を解決するための手段】
【0006】
本発明は、上記状況を考慮してなされたもので、以下に示す、生体関連物質を検出する方法等を提供するものである。
下記(1)〜(4)の工程を含む、生体関連物質の検出方法。
(1)ゲル担体に固定化された生体関連物質(A)と、第一物質(S)が結合された生体関連物質(B)とを結合させる工程、
(2)第二物質(E)を、前記生体関連物質(B)に結合している前記第一物質(S)に結合させる工程、
(3)第一物質(S)と標識物質(R)とが結合された核酸(C)を、前記第二物質(E)に結合させる工程、及び
(4)前記標識物質(R)を検出する工程。
ここで、前記第一物質(S)としては、例えばビオチンが挙げられ、前記第二物質(E)としては、例えばアビジン又はストレプトアビジンが挙げられる。
【発明の効果】
【0007】
本発明によれば、核酸マイクロアレイ等のツールを用いて目的サンプル(生体関連物質)に起因するシグナルの検出を行う場合に、当該ツールに用いる担体がゲル担体であっても、バックグラウンドの上昇を効果的に抑制し、目的の検出シグナルの強度を増大することができる、生体関連物質の検出方法を提供することができる。
【図面の簡単な説明】
【0008】
【図1】本発明に係る生体関連物質の検出方法の一実施例を示す概略図である。
【図2】本発明の実施例及び比較例における検出シグナルの強度を示す図である。
【発明を実施するための形態】
【0009】
以下、本発明を詳細に説明する。本発明の範囲はこれらの説明に拘束されることはなく、以下の例示以外についても、本発明の趣旨を損なわない範囲で適宜変更し実施することができる。なお、本明細書において引用された全ての刊行物、例えば先行技術文献、及び公開公報、特許公報その他の特許文献は、参照として本明細書に組み込まれる。
【0010】
本発明に係る生体関連物質の検出方法(以下、本発明の検出方法)は、前述の通り、下記(1)〜(4)の工程を含むことを特徴とするものである。
(1)ゲル担体に固定化された生体関連物質(A)と、第一物質(S)が結合された生体関連物質(B)とを結合させる工程、
(2)複数の前記物質(S)と結合し得る第二物質(E)を、前記物質(B)に結合している前記物質(S)に結合させる工程、
(3)第一物質(S)と標識物質(R)とが結合された核酸(C)を、前記物質(E)に結合させる工程、及び
(4)前記物質(R)を検出する工程。
【0011】
以下、上記各工程について具体的に説明する。なお、工程(4)の検出に供される、工程(1)〜(3)後に得られる各物質等の結合後の状態については、図1の概略図を参照することができる。
【0012】
1.工程(1)について
本工程においては、生体関連物質(A)と生体関連物質(B)とを互いに結合(ハイブリダイゼーション)させる。当該物質(B)は、本発明において検出対象となる物質である。結合の種類としては、具体的には、共有結合、配位結合、水素結合、疎水性相互作用及びイオン結合等が挙げられる。当該物質(A)及び物質(B)としては、互いに同一又は異なって、例えばタンパク質、ペプチド、核酸、脂質及び糖等が好ましく挙げられる。ここで、核酸としては、例えば各種DNA、RNA及びPNA(ペプチド核酸)等又はこれらの混合物が挙げられる。例えば、当該物質(A)及び物質(B)のうちの一方が核酸である場合は、他方は、当該核酸に相補的な配列を有する核酸であるか、又は当該核酸と結合し得るタンパク質若しくはペプチドであることが好ましい。また、当該核酸等は、前記結合を阻害しない範囲内において、化学的な修飾がなされているものであってもよい。
【0013】
本発明において、前記物質(A)はゲル担体に固定化されている物質である。当該物質(A)とゲル担体との固定化の方法としては、例えば、直接当該物質(A)とゲル担体とを共有結合、配位結合、物理吸着及び化学吸着等によって固定化する方法が挙げられる。その他、当該物質(A)をゲル担体に固定化する方法としては、予め粒子等に当該物質(A)を固定化しておいて、その粒子をゲル担体へ包含する方法も挙げられる。この場合、使用する粒子は、ゲル担体中で均一に分散する材料であれば、いずれでもよい。当該物質(A)の粒子への固定化方法は、直接ゲル担体に固定化する方法と同様の方法が挙げられる。
【0014】
本発明において、前記物質(B)は、前記物質(A)に結合し得る物質であり、通常、検体中に存在する生体関連物質又はそれを増幅した生体関連物質が用いられる。また、当該物質(B)には、第一物質(S)が結合されている。当該物質(B)と当該物質(S)との結合の種類としては、例えば、共有結合及び配位結合が挙げられる。また、当該物質(B)1分子当たりの当該物質(S)の結合数は、特に限定はされない。
上記物質(S)は、後述する第二物質(E)と互いに結合し得るものであればよく、限定はされない。例えば、ビオチン、リン酸基、ヘム等が挙げられる。なお、当該物質(S)と物質(E)との結合の種類は、限定はされず、例えば、共有結合、配位結合、水素結合、疎水性相互作用及びイオン結合が挙げられる。
【0015】
上記物質(B)として、PCR、逆転写反応及び転写反応等を利用して調製(増幅)した核酸(例えばRNA)を用いる場合は、例えば、当該物質(S)が予め結合したNTP等を用いることにより調製することができる。
前記物質(A)と物質(B)との結合の反応条件は、これら物質の種類等により適宜設定することができ、特に限定はされない。例えば、pH緩衝水溶液中において15〜70℃の温度範囲内であることが好ましい。pH緩衝水溶液としては、pH 6〜8の範囲内で緩衝能を有する緩衝液であればよく、特に限定はされない。前記物質(A)及び物質(B)が核酸である場合は、SSC溶液、Tris-HCl溶液、リン酸溶液及びホウ酸溶液等が好ましく挙げられる。
【0016】
担体とは、生体関連物質(A)を固定化する土台となる物質のことであり、本発明では、ゲルで構成される担体(ゲル担体)が用いられる。ゲルとは、高分子が架橋して三次元的な網目構造を形成したものであり、その種類は特に限定はされず、公知の各種物理ゲル又は化学ゲルが利用できる。
【0017】
物理ゲルとしては、例えば、アガロース、アガロペクチン、アミロース、アミロペクチン、アラビアゴム、アラビナン、イソリケナン、インスリン、エチルセルロース、エチルヒドロキシエチルセルロース、カードラン、カゼイン、カラギーナン、カルボキシメチルセルロース、カルボキシメチルデンプン、カロース、寒天、キサンタンガム、キチン、グアーガム、キトサン、クインスシード、クラウンゴール多糖、グリコーゲン、グルコマンナン、ケラタン硫酸、紅藻デンプン、酵母マンナン、コラーゲン、ゼラチン、デンプン、アルギン酸塩、アルギン酸プロピレングリコールエステル、ジェランガム、シゾフィラン、セルロース、ゾウゲヤシマンナン、タマリンドシードガム、ツニシン、ニゲラン、ヒドロキシプロピルセルロース、プスツラン、フノラン、分解キシログルカン、HMペクチン、ポリアミジン、ポリペルフルオロカーボンスルホン酸、ポリメタクリル酸−ポリエチレングリコール共重合体、ポリメトキシエチレングリコールメタクリレート、ポルフィラン、メチルセルロース、メチルデンプン、レンチナン、ローカストビーンガム、ポリビニルアルコール及びポリアクリル酸ナトリウム等が挙げられる。
【0018】
化学ゲルとしては、例えば、ポリアクリルアミドゲル、ポリイソプロピルアクリルアミドゲル、ジメチルアクリルアミドゲル、ポリビニルピロリドンゲル、絹フィブロイン、ケラチンタンパク質、メタクリル酸2-(ジメチルアミノ)エチル、2-ジメチルアミノエチルメタクリレートゲル、HSタンパク質、デキストラン、ヒアルロン酸ゲル、ビスアクリルアミドメチルエーテルゲル、ポリ-(2-アクリルアミド-2-メチルプロパンスルホン酸)ゲル、ポリアクリル酸ゲル、ポリ-(N,N-アクリル酸ジメチルアミノエチルエステル)ゲル、ポリアクリル酸ナトリウム架橋体、ポリ-(N-アクリロイルアミノエトキシエタノール)ゲル、ポリ-(N-アクリロイルアミノプロパノール)ゲル、ポリアクリロキシプロパンスルホン酸ゲル、ポリイソブチレン・マレイン酸共重合体ゲル、ポリエチレンイミンゲル、ポリエチレンオキシド・プロピレンオキシド共重合体ゲル、ポリエチレンオキシド・ポリエチレングリコールゲル、ポリエチレン-酢酸ビニルコポリマーゲル、ポリジオキソランゲル、ポリジメチルアミノプロピルアクリルアミドゲル、ポリ-(2-ヒドロキシエチルメタクリレート)・ポリメタクリル酸2-ヒドロキシエチルゲル、ポリビニルピリジンゲル、ポリビニルメチルエーテルゲル、ポリプロピレンオキシドゲル、ポリ-(N-メチロールアクリルアミド)ゲル等が挙げられる。
【0019】
また、物理ゲルと化学ゲル、物理ゲルと無機物、化学ゲルと無機物、物理ゲルと化学ゲルと無機物のように、それぞれを組み合わせたゲルも利用でき、その種類は特に限定はされない。
上記各種ゲルの中でも、例えばアガロースゲルやアクリルアミドゲル等が好ましく、加熱によって溶解しにくいアクリルアミドゲルがより好ましい。
ゲル担体は、前記物質(A)を三次元に、すなわちゲル担体の内部にも固定化できるものが好ましい。二次元に、すなわちゲル担体の表面のみに固定化するより多くの物質(A)を固定化できるためである。
ゲル担体は、ゲル担体のみで用いることもできる。また、各工程を行う上でゲル担体のみでは取り扱いにくい場合、ゲル担体を他の物質、例えばガラス板、プラスチック板等に保持させた状態で用いることもできる。ゲル担体を保持する物質としては、後述する検出方法で生体関連物質を検出可能な材料、形状であれば特に限定されない。
【0020】
ゲル担体を保持するデバイスとしては、例えばゲル担体を保持する核酸アレイが挙げられる。ゲル担体を保持する核酸アレイとして本発明の検出方法に用い得る核酸アレイ(物質(A)としての核酸プローブが担体に固定化されたもの)の具体例としては、貫通孔型マイクロアレイ(製品名:ジェノパール(登録商標);掲載ウェブサイト:http://www.mrc.co.jp/genome/top.html;特許第3488456号公報、特許第3510882号公報等参照)が挙げられる。上記の貫通孔型マイクロアレイは、所定の核酸プローブを固定化したゲル担体をその種類毎に別々の中空繊維等管状体の中空部内に保持させ、そのすべての中空繊維等管状体を集束させ固定した後、繊維の長手方向で切断を繰り返すことにより得られるマイクロアレイである。
【0021】
以下、上記貫通孔型マイクロアレイに関して詳細に説明する。このマイクロアレイは、例えば、下記(i)〜(iv)の工程を経て作製することができる。
(i) 複数本の中空繊維を、中空繊維の長手方向が同一方向となるように3次元に配列して配列体を製造する工程
(ii) 前記配列体を包埋し、ブロック体を製造する工程
(iii) 核酸プローブ(オリゴヌクレオチドプローブ)を含むゲル前駆体重合性溶液を前記ブロック体の各中空繊維の中空部に導入して重合反応を行い、核酸プローブを含むゲル状物を中空部に保持させる工程
(iv) 中空繊維の長手方向と交差する方向で切断して、ブロック体を薄片化する工程
【0022】
中空繊維に使用される材料は、限定はされず、例えば、特開2004-163211号公報等に記載の材料が好ましく挙げられる。
中空繊維は、その長手方向の長さが同一となるように3次元に配列される(工程(i))。配列方法としては、例えば、粘着シート等のシート状物に複数本の中空繊維を所定の間隔をもって平行に配置し、シート状とした後、このシートを螺旋状に巻き取る方法(特開平11-108928号公報参照)や、複数の孔が所定の間隔をもって設けられた多孔板2枚を孔部が一致するように重ね合わせ、それらの孔部に中空繊維を通過させ、その後2枚の多孔板の間隔を開いて仮固定し、2枚の多孔板間における中空繊維の周辺に硬化性樹脂原料を充満させて硬化させる方法(特開2001-133453号公報参照)などが挙げられる。
【0023】
製造された配列体はその配列が乱れないように包埋される(工程(ii))。包埋の方法としては、ポリウレタン樹脂及びエポキシ樹脂等を繊維間の隙間に流し込む方法のほか、繊維どうしを熱融着により接着する方法等が好ましく挙げられる。
包埋された配列体には、各中空繊維の中空部に、核酸プローブを含むゲル前駆体重合性溶液(ゲル形成溶液)を充填し、中空部内で重合反応を行う(工程(iii))。これにより、各中空繊維の中空部に、核酸プローブが固定化されたゲル状物を保持させることができる。
ゲル前駆体重合性溶液とは、ゲル形成重合性モノマー等の反応性物質を含有する溶液であって、該モノマー等を重合、架橋させることにより該溶液がゲル状物となることが可能な溶液をいう。そのようなモノマーとしては、例えば、アクリルアミド、ジメチルアクリルアミド、ビニルピロリドン、メチレンビスアクリルアミド等が挙げられる。この場合、溶液には重合開始剤等が含まれていてもよい。
【0024】
中空繊維内に核酸プローブを固定化した後、中空繊維の長手方向と交差する方向(好ましくは直交する方向)で、ブロック体を切断して薄片化する(工程(iv))。このようにして得られた薄片が核酸アレイ(DNAマイクロアレイ)として使用できる。当該アレイの厚みは、0.01〜1 mm程度であることが好ましい。ブロック体の切断は、例えば、ミクロトーム及びレーザー等により行うことができる。
【0025】
2.工程(2)について
本工程においては、第二物質(E)を、生体関連物質(B)に結合している第一物質(S)に結合させる工程である。ここで、当該物質(E)は、少なくとも2つの物質(S)との結合能を有する物質であればよく、すなわち、本工程において当該物質(S)と結合し、さらに後の工程において別の第一物質(S)とも結合し得る物質であればよく、特に限定はされない。
第一物質(S)と第二物質(E)との組み合わせとしては、それぞれ、例えば、ビオチンとアビジン又はストレプトアビジンとの組み合わせ、リン酸基を有する物質と金属錯体との組み合わせ、ヘムとグロビンとの組み合わせ等が好ましく挙げられ、中でもビオチンとアビジン又はストレプトアビジンとの組み合わせが好ましい。
【0026】
詳しくは、前記物質(A)が核酸であり、前記物質(B)がPCR等により増幅した核酸である場合、ビオチンは当該増幅過程において前記物質(B)に結合させることができるため、前記物質(A)及び前記物質(B)がいずれも核酸の場合は、第一物質(S)はビオチンであることが好ましい。その際、核酸の塩基、リン酸基及び糖が、当該物質(S)と前記物質(E)との結合に影響を与えないということも考慮すると、当該物質(S)及び当該物質(E)の組み合わせとしては、前述の通り、ビオチンとアビジン又はストレプトアビジンとの組み合わせが好ましい。
【0027】
本発明において、当該物質(E)としては、後述する工程(4)において検出及び検出強度の測定が可能なシグナルを発する標識物質(R’)が結合されたものを用いることもできる。当該物質(R’)は、後述する標識物質(R)と同種のものであってもよいし異種のものであってもよい。シグナル強度を増大させるためには、当該物質(R)と物質(R’)とは、同一波長の励起光により同一波長の蛍光が検出できるものであることが好ましい。なお、当該物質(R’)の詳細については、後述する物質(R)についての説明が同様に適用できる。
前記物質(E)と前記物質(S)との結合の反応条件は、限定はされないが、pH 4〜9の緩衝水溶液中、4〜70℃において、両者を混合することが好ましい。緩衝液はpH 4〜9の範囲内で緩衝能を有する緩衝液であれば、特に限定はされない。例えば、工程(1)の項目で例示した緩衝液を使用することができる。
【0028】
3.工程(3)について
本工程においては、第一物質(S)を介して生体関連物質(B)に結合している第二物質(E)に対して、核酸(C)を結合させる工程である。ここで、用いる核酸(C)には予め第一物質(S)が結合されており、核酸(C)はこの第一物質(S)を介して前記物質(E)に結合された状態となる。核酸(C)に結合している前記物質(S)の詳細については、前述した前記物質(B)に結合している物質(S)と同様の説明が適用できる。また、前記物質(E)1分子当たりに結合される核酸(C)は、少なくとも1分子、好ましくは2分子以上、より好ましくは3分子以上である。
【0029】
当該核酸(C)は、前記物質(S)の他に、さらに標識物質(R)が結合されたものでもある。当該物質(R)は、後述する工程(4)において検出及び検出強度の測定が可能なシグナルを発する標識物質であればよく、限定はされない。例えば、蛍光、発光、ラジオアイソトープ及び発色等のシグナルを発する物質が好ましい。より詳細には、蛍光物質、放射性同位体、酵素、金属及び金属錯体等が挙げられ、蛍光、発光、吸光度及び散乱光によるシグナルを検出する場合は、本発明に用いる生体関連物質の吸収波長と重ならない波長のシグナルを発する物質が好ましい。蛍光物質としては、各種蛍光色素及び蛍光タンパク質が挙げられ、蛍光色素としては、各種レポーター色素、例えばCy5、Cy3、VIC、FAM、HEX、TET、フルオレセイン、FITC、TAMRA、Texas red、Yakima Yellow、ULYSIS、ARES等が挙げられる。蛍光タンパク質としては、例えば、GFP、EGFP、BFP、YFP等が挙げられる。
【0030】
当該核酸(C)1分子当たりに結合される標識物質(R)の数は、限定されないが、複数結合されているのが好ましい。標識物質(R)の数が多いほど、シグナル強度を増幅することができるためである。
本発明において、前記生体関連物質(A)及び(B)のいずれかが核酸の場合、核酸(C)は当該物質(A)及び(B)の塩基配列と相補的でない(ハイブリダイゼーションしない)塩基配列を有するものであることが好ましい。これは核酸(C)が当該物質(A)及び(B)の塩基配列と相補的である塩基配列を有する場合、核酸(C)が生体関連物質(A)又は生体関連物質(B)に結合し、生体関連物質(B)を検出できないためである。
【0031】
ここでいう「相補的でない」とは、核酸(C)の塩基配列中に、前記物質(A)又は(B)の塩基配列の相補配列と重複する塩基配列が連続して15 mer以上無いことであり、好ましくは10 mer以上無いことであり、より好ましくは6 mer以上無いことである。なお、前記物質(B)の塩基配列は、前記物質(A)に結合し得る塩基配列を有する遺伝子を公知のデータベースを用いて検索し確認することができ、その情報に基づいて、核酸(C)を合成する(塩基配列を設計する)ことができる。
また、核酸(C)の鎖長は、ゲル担体中での核酸(C)の拡散が著しく低下しない鎖長であり且つ標識物質(R)を複数結合できる鎖長であることが好ましい。例えば、下限は、2 mer以上であることが好ましく、より好ましくは15 mer以上であり、上限は、500 mer以下であることが好ましく、より好ましくは200 mer以下、さらに好ましくは100 mer以下である。
【0032】
前記物質(E)と、前記物質(S)が結合された核酸(C)との結合の反応条件は、限定はされないが、pH 4〜9の緩衝水溶液中、4〜70℃において、両者を混合することが好ましい。緩衝液はpH 4〜9の範囲内で緩衝能を有する緩衝液であれば、特に限定はされず、例えば、工程(1)の項目で例示した緩衝液を使用することができる。
【0033】
4.工程(4)について
本工程においては、核酸(C)に結合されている標識物質(R)、及び前記第二物質(E)に結合されていてもよい標識物質(R’)の検出を行う。当該検出は、当該物質(R)及び物質(R’)に適した方法及び装置等を用いて行うことができ、これら物質に由来するシグナル強度を画像化及び/又は数値化等することで行うことができる。
例えば、当該物質(R)及び物質(R’)が蛍光色素や蛍光タンパク質の場合は、検出する蛍光の波長に合わせた励起光源、検出波長を限定するためのフィルターセット、CCDカメラ、及び必要に応じて顕微鏡等を組み合わせて検出を行うことができる。担体が立体的形状(例えば円柱状)を有するものである場合は、該担体中における検出シグナルを簡便に且つ立体的にとらえるために、所定の励起光源やフィルターセットを用いた共焦点の顕微鏡を使用することもできる。
【0034】
また、当該物質(R)及び物質(R’)が金属の場合は、金属特有の吸光、散乱光を検出可能な装置で検出することができる。当該物質(R)及び物質(R’)が金属錯体の場合は、核スピン共鳴を原理とする装置で検出することができる。当該物質(R)及び物質(R’)が放射性同位体の場合は、放射線を検出可能な装置を用いて検出することができる。
【0035】
本発明の工程(1)〜(4)により、生体関連物質(B)に結合された第一物質(S)に結合した第二物質(E)に対し、さらに第一物質(S)を介して、標識物質(R)が結合された核酸(C)が多数結合することで、検出シグナルの強度が増大し、かつゲル担体等を用いた場合でもバックグラウンドの上昇を効果的に抑えることができる。
なお、本発明の検出方法は、前述した工程(1)〜(4)以外に、他の工程を含むものであってもよく、限定はされない。他の工程としては、例えば、工程(1)〜(3)において適宜行い得る洗浄工程や、工程(4)で得られた検出結果に基づいて生体関連物質(B)の物性を判定する工程(例えば、前記物質(A)が核酸プローブ(キャプチャープローブ)である場合は、当該物質(B)となる標的核酸の塩基配列や遺伝子多型等を判定する工程)が挙げられる。
【0036】
以下に、実施例を挙げて本発明をより具体的に説明するが、本発明はこれらに限定されるものではない。
【実施例1】
【0037】
以下の通り、核酸マイクロアレイアレイを用いた生体関連物質の検出を行った。
1.ゲルで構成される担体に固定化した生体関連物質(A)の準備
生体関連物質(A)としてのプローブ核酸がゲル担体に固定化された、貫通孔型の核酸マイクロアレイ(三菱レイヨン社製:Genopal(登録商標))を用いた。当該プローブ核酸(生体関連物質(A))は、3種の5’末端ビニル化核酸(65 mer)(配列番号2〜4及び下記表1参照)を用いた。なお、核酸マイクロアレイ上には、プローブ搭載部分(プローブスポット)と、プローブ非搭載部分(ゲルのみのスポット)があり、後者のスポットをバックグラウンドとした。
【0038】
【表1】

【0039】
2.生体関連物質(B)(aRNA)の調製
第一物質(S)が結合した生体関連物質(B)として、マウスTotal RNAより合成したビオチン結合aRNAを用いた(第一物質(S):ビオチン,生体関連物質(B):aRNA)。ビオチン結合aRNAの調製(合成及び精製)は、Message Amp II-Biotin Enhancedキット(アプライドバイオシステムズ社製)を用い、添付のプロトコールに従って行った。当該キットはTotal RNAからの逆転写によりcDNAを合成し、cDNAからaRNAを転写して増幅させるためのキットである。当該転写の際にビオチンが結合したUTPを使用することで、ビオチン結合aRNAを合成した。
【0040】
3.ハイブリダイゼーション(生体関連物質(A)と生体関連物質(B)との結合)
Message AmpII-Biotin Enhancedキット(アプライドバイオシステムズ社製)付属の5x Array Fragmentation Bufferを用いて、以下の方法でビオチン結合aRNAの断片化を行った。ビオチン結合aRNA 5μgをプラスチックチューブに入れ、5x Array Fragmentation Bufferを4μl添加し、20μlにメスアップしてよく混合した後、94℃で7.5分間加熱して断片化を行った。断片化後の溶液 20μlに、18μlの1M Tris-HCl溶液(インビトロジェン社製)、18μlの1M NaCl溶液(ナカライテスク社製)及び15μlの0.5% Tween 20溶液をそれぞれ混合し、Nuclease-free waterで150μlにメスアップして、検体液を調製した。
調製した検体液に、前記1.項の核酸マイクロアレイアレイを浸漬し、65℃で16時間ハイブリダイゼーション反応を行った。当該アレイからハイブリダイゼーションに用いた検体液を除去した後、当該アレイを65℃の0.12M TNT溶液(0.12M Tris-HCl、0.12M NaCl、0.5% Tween 20溶液)中に浸漬し(20分間×2回)、次いで、65℃に温めた0.12M TN溶液(0.12M Tris-HCl、0.12M NaCl)に10分間浸漬して、洗浄した。
【0041】
4.ストレプトアビジン結合工程
標識物質(R’)を結合させた第二物質(E)として、当該ストレプトアビジン(第二物質(E))にCy5(標識物質(R’))が結合したCy5-ストレプトアビジン(GE Healthcare社製)を用いた。前記3.項の洗浄後の核酸マイクロアレイを、2μg/mlに溶解したCy5-ストレプトアビジン溶液5 mlに30分間浸漬し、さらに当該アレイを0.12 M TNT溶液中に5分間浸漬し、これを4回繰り返した。次いで、当該アレイを0.12M TN溶液に1回浸漬して洗浄した。
【0042】
5.ビオチンを結合し且つ蛍光色素を標識した核酸(C)をストレプトアビジンに結合する工程
検出シグナル強度を増大させるために用いる核酸(C)の調製を、以下の通りに行った。核酸(C)としては、5’末端にビオチンが結合した30 merの核酸断片(インビトロジェン社;配列番号1及び前記表1参照)を用いた。核酸(C)への蛍光色素(標識物質(R))の結合には、Platinum Bright 647 Labeling kit(フナコシ)を用いた。当該キットは、647 nmの蛍光を発する蛍光色素を核酸に結合させるキットである。核酸(C)に蛍光色素を結合し精製する操作は、20 pmol/μlの核酸(C)を用い、当該キットに添付のプロトコールに従って行った。上記精製後の核酸(C)を、濃度が1 pmol/μlとなるように0.12M TNT溶液で150μlに調製し、その溶液(40℃)に前記4.項の洗浄後の核酸マイクロアレイを30分間浸漬した。その後、当該アレイを、40℃に温めた0.12M TN溶液(0.12M Tris-HCl、0.12M NaCl)に浸漬して(10分間×2回)洗浄した。
【0043】
6.シグナル強度測定
核酸マイクロアレイにおけるシグナルの検出及び強度測定は、DNAチップ検出装置(横河電機製:MB-M3A、レーザー波長:633nm)を用い、Cy5及びPlatinum Bright 647の蛍光を測定して行った(露光時間:0.1秒, 1秒, 4秒, 40秒)。Cy5及びPlatinum Bright 647は、いずれも633nmの波長で励起され、同波長(670nm)の蛍光を発するものである。
なお、シグナル強度測定の結果は、以下の各比較例の結果と併せて後述する。
【0044】
〔比較例1〕
実施例1における1.項〜4.項の工程を行い、その後、5.項の「核酸(C)をストレプトアビジンに結合する工程」は行わずに、6.項の「シグナル強度測定」を行った。本比較例は、実施例1における、核酸(C)による検出シグナル強度の増大を確認するための比較実験として行った。
【0045】
〔比較例2〕
実施例1における1.項〜4.項の工程を行い、5.項の「核酸(C)をストレプトアビジンに結合する工程」の代わりに、下記5’.項の工程を行った。その後、実施例1における6.項の「シグナル強度測定」を行った。本比較例は、ABC法(抗体を用いる方法)によるシグナル強度の検出結果を確認するための比較実験として行った。
【0046】
5’.ビオチン標識抗ストレプトアビジンIgG抗体による標識
ビオチン標識抗ストレプトアビジンIgG抗体(Vector社)100μg/μl、BSA 20mg/μlの溶液で染色し、50mM TNT溶液によって室温で5分間、4回洗浄した。さらに、Cy5-ストレプトアビジン(実施例1で使用したものと同様)を結合し、0.12M TNT溶液により室温で5分間の洗浄を4回行った。
【0047】
〔比較例3〕
実施例1における1.項の工程を行い、その後、2.項〜4.項の工程を行わずに、5.項及び6.項の工程を行った。本比較例は、核酸(C)が核酸マイクロアレイのプローブと結合しないことを確認するための比較実験として行った。
【0048】
シグナル強度測定の結果
前述した実施例1及び比較例1〜3におけるシグナル強度測定の結果を、下記表2及び図2に示した。
比較例1の結果は、Cy5-ストレプトアビジンのみによる検出シグナルであり、プローブスポットの検出シグナル強度は約600程度であった。これに対し、実施例1では、核酸(C)を結合させることでプローブスポットの検出シグナル強度が、比較例1の約7倍に増大した。実施例1の検出シグナル強度には、Cy5-ストレプトアビジンの蛍光シグナルとPlatinum Bright 647の蛍光シグナルが含まれているため、実施例1と比較例1との検出シグナル強度の差分が、核酸(C)の効果であることが確認された。
【0049】
また、比較例2では、バックグラウンドが約5000であったのに対して、実施例1では約200しかなく、バックグラウンドの上昇が効果的に抑えられることが確認された。
ストレプトアビジン及びビオチン結合aRNAを使用しない比較例3では、検出シグナル強度が約20と低かったことから、核酸マイクロアレイに搭載した核酸プローブと核酸(C)とは結合しないことが確認された。
【0050】
【表2】

【符号の説明】
【0051】
1 ゲルで構成される担体(ゲル担体)
2 生体関連物質(A)
3 生体関連物質(B)
4 第二物質(E)
5 標識物質(R)
6 第一物質(S)
7 核酸(C)
【配列表フリーテキスト】
【0052】
配列番号1:合成DNA
【特許請求の範囲】
【請求項1】
下記(1)〜(4)の工程を含む、生体関連物質の検出方法。
(1)ゲル担体に固定化された生体関連物質(A)と、第一物質(S)が結合された生体関連物質(B)とを結合させる工程、
(2)第二物質(E)を、前記生体関連物質(B)に結合している前記第一物質(S)に結合させる工程、
(3)第一物質(S)と標識物質(R)とが結合された核酸(C)を、前記第二物質(E)に結合させる工程、及び
(4)前記標識物質(R)を検出する工程。
【請求項2】
前記第一物質(S)がビオチンであり、前記第二物質(E)がアビジン又はストレプトアビジンである、請求項1記載の方法。
【請求項1】
下記(1)〜(4)の工程を含む、生体関連物質の検出方法。
(1)ゲル担体に固定化された生体関連物質(A)と、第一物質(S)が結合された生体関連物質(B)とを結合させる工程、
(2)第二物質(E)を、前記生体関連物質(B)に結合している前記第一物質(S)に結合させる工程、
(3)第一物質(S)と標識物質(R)とが結合された核酸(C)を、前記第二物質(E)に結合させる工程、及び
(4)前記標識物質(R)を検出する工程。
【請求項2】
前記第一物質(S)がビオチンであり、前記第二物質(E)がアビジン又はストレプトアビジンである、請求項1記載の方法。
【図1】


【図2】




【図2】


【公開番号】特開2012−32265(P2012−32265A)
【公開日】平成24年2月16日(2012.2.16)
【国際特許分類】
【出願番号】特願2010−171806(P2010−171806)
【出願日】平成22年7月30日(2010.7.30)
【出願人】(000006035)三菱レイヨン株式会社 (2,875)
【Fターム(参考)】
【公開日】平成24年2月16日(2012.2.16)
【国際特許分類】
【出願日】平成22年7月30日(2010.7.30)
【出願人】(000006035)三菱レイヨン株式会社 (2,875)
【Fターム(参考)】
[ Back to top ]

