生体高分子結晶の製造方法
【課題】簡便かつ効率的に生体高分子結晶を製造できる新規な方法を提供すること。
【解決手段】結晶化剤溶液と生体高分子溶液とが混合された混合液を入れた容器を振動させる振動工程、及び、振動させた混合液を入れた容器を保管する保管工程、を含むことを特徴とする生体高分子結晶の製造方法、並びに、生体高分子溶液を入れた容器を振動させる振動工程、振動させた生体高分子溶液と、生体高分子溶液を入れた容器を振動させる振動工程、振動させた生体高分子溶液と結晶化剤溶液とを混合した混合液を得る混合工程、及び、混合液を入れた容器を保管する保管工程、を含むことを特徴とする生体高分子結晶の製造方法。
【解決手段】結晶化剤溶液と生体高分子溶液とが混合された混合液を入れた容器を振動させる振動工程、及び、振動させた混合液を入れた容器を保管する保管工程、を含むことを特徴とする生体高分子結晶の製造方法、並びに、生体高分子溶液を入れた容器を振動させる振動工程、振動させた生体高分子溶液と、生体高分子溶液を入れた容器を振動させる振動工程、振動させた生体高分子溶液と結晶化剤溶液とを混合した混合液を得る混合工程、及び、混合液を入れた容器を保管する保管工程、を含むことを特徴とする生体高分子結晶の製造方法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、生体高分子結晶の製造方法に関し、生体高分子結晶が蛋白質結晶である場合に特に好適に適用することができる。
【背景技術】
【0002】
蛋白質等の生体高分子を結晶化させるには、バッチ法、透析法、液相間拡散法、気液相関拡散法等の方法が用いられている(非特許文献1参照)。
例えば、バッチ法によれば、蛋白質溶液に硫酸アンモニウム等の沈殿剤を結晶化濃度まで直接加える。一般には、生体高分子溶液の入った容器に沈殿剤を加え生体高分子が過飽和となるように制御し、生体高分子結晶を作製していた。このバッチ法では、高濃度の高分子試料を大量に必要とすること、操作に熟練を要し再現性が低いこと、結晶化条件のスクリーニングが困難であること等の欠点がある。また、従来の上記結晶化方法は、特定の高分子に比較的特異な結晶化条件を要し、汎用的な条件がないという欠点を有している。
【0003】
また、例えば、特許文献1には、蛋白質結晶の核形成に適した温度条件に設定した蛋白質溶液に可視域と思われるレーザー光を照射し、このレーザー光の散乱状況を解析することにより蛋白質結晶の核形成の開始を検出し、核形成の開始を検出した時点で蛋白質溶液を結晶成長に適した温度条件に制御するようにした技術が開示されている。
さらに、特許文献2には、過飽和状態であるが蛋白質結晶の核形成に適さない低過飽和度の溶液(準安定溶液)にネオジウムYAGレーザーの第四高調波266nm光、あるいは500Wキセノンランプ光を照射することにより、ニワトリ卵白リゾチームの結晶を出現させる方法が開示されている。
特許文献3には、結晶化対象の溶質が溶解している溶液に対し、ピコ秒パルスレーザーおよびフェムト秒パルスレーザーの少なくとも一方のパルスレーザーを照射することにより結晶核を生成させる結晶核の製造方法が開示されている。
【0004】
【特許文献1】特開平6−116098号公報
【特許文献2】特開2003−306497号公報
【特許文献3】国際公開第2004/018744号パンフレット
【非特許文献1】日本生化学会編、新生化学実験講座1「蛋白質I−分離・精製・性質−」、1990年、東京化学同人発行、高野常弘氏執筆、第14章「結晶化」
【発明の開示】
【発明が解決しようとする課題】
【0005】
本発明の目的は、簡便かつ効率的に生体高分子結晶を製造できる新規な製造方法を提供することである。
【課題を解決するための手段】
【0006】
上記の課題は、以下の<1>及び<7>に記載の解決手段により達成された。好ましい実施態様である<2>〜<6>及び<8>〜<11>と共に以下に記載する。
<1> 結晶化剤溶液と生体高分子溶液とが混合された混合液を入れた容器を振動させる振動工程、及び、振動させた混合液を入れた容器を保管する保管工程、を含むことを特徴とする生体高分子結晶の製造方法、
<2> 保管工程において振動させた混合液を撹拌する上記<1>に記載の生体高分子結晶の製造方法、
<3> 振動工程における振動の振動数が保管工程における撹拌の振動数よりも大きい上記<2>に記載の生体高分子結晶の製造方法、
<4> 混合液に光を照射する光照射工程を含む上記<1>〜<3>いずれか1つに記載の生体高分子結晶の製造方法、
<5> 保管した混合液中に生成した結晶の有無を判定する判定工程を実施し、結晶の生成が認められない混合液に、振動工程をさらに実施する上記<1>〜<4>いずれか1つに記載の生体高分子結晶の製造方法、
<6> 生体高分子が蛋白質である上記<1>〜<5>いずれか1つに記載の生体高分子結晶の製造方法、
<7> 生体高分子溶液を入れた容器を振動させる振動工程、振動させた生体高分子溶液と結晶化剤溶液とを混合した混合液を得る混合工程、及び、混合液を入れた容器を保管する保管工程、を含むことを特徴とする生体高分子結晶の製造方法、
<8> 生体高分子溶液に光を照射する光照射工程を含む上記<7>に記載の生体高分子結晶の製造方法、
<9> 保管した混合液中に生成した結晶の有無を判定する判定工程を実施し、結晶の生成が認められない混合液に、振動工程をさらに実施する上記<7>又は<8>に記載の生体高分子結晶の製造方法、
<10> 生体高分子が両性電解質であり、生体高分子溶液のpHが生体高分子の等電点近傍である上記<7>〜<9>いずれか1つに記載の生体高分子結晶の製造方法、
<11> 生体高分子が蛋白質である上記<7>〜<11>いずれか1つに記載の生体高分子結晶の製造方法。
【発明の効果】
【0007】
本発明によれば、簡便かつ効率的に生体高分子結晶を製造できる新規な製造方法を提供することができた。
【発明を実施するための最良の形態】
【0008】
以下に、本発明について、詳細に説明する。
【0009】
本発明の生体高分子結晶の製造方法における1つの実施態様は、結晶化剤溶液と生体高分子溶液とが混合された混合液を入れた容器を振動させる振動工程、及び、振動させた混合液を入れた容器を保管する保管工程、を含むことを特徴とする生体高分子結晶の製造方法(以下、「1液法」ともいう。)である。
本発明の生体高分子結晶の製造方法における他の実施態様は、生体高分子溶液を入れた容器を振動させる振動工程、振動させた生体高分子溶液と結晶化剤溶液とを混合した混合液を得る混合工程、及び、混合液を入れた容器を保管する保管工程、を含むことを特徴とする生体高分子結晶の製造方法(以下、「2液法」ともいう。)である。
なお、1液法や2液法と明示せず、単に「本発明の生体高分子結晶の製造方法」と記載した場合は、1液法及び2液法の両方を表していることは言うまでもない。
【0010】
蛋白質等の生体高分子の結晶化において、従来、結晶化を促進させるための結晶生育条件を理論的に特定することができず、各種の条件を変えながら多数の試験を系統的に実行した結果から最良の条件を求めるスクリーニングの手法を用いざるを得なかった。このため、対象となる生体高分子溶液を各種の結晶生育条件、すなわち、生体高分子溶液の種類・濃度や生育温度を変化させた幾通りもの条件下で、試験を反復実行する必要があった。
本発明者等は、生体高分子の結晶化を行うための簡便な方法の探索を行い、振動に着目した。
通常、結晶化を行う生体高分子溶液に対し、振動を与えるとより分散が進行し、結晶化が生じにくいように思われる。しかしながら、本発明者等が検討した結果、生体高分子が溶解した溶液に振動を与えた後、保管した場合のほうが、振動を与えず単に保管した場合に比べ、生体高分子結晶が生成しやすいことを見いだした。
【0011】
<1液法>
本発明の生体高分子結晶の製造方法における1つの実施態様は、結晶化剤溶液と生体高分子溶液とが混合された混合液を入れた容器を振動させる振動工程、及び、振動させた混合液を入れた容器を保管する保管工程、を含むことを特徴とする生体高分子結晶の製造方法(1液法)である。
【0012】
(振動工程)
1液法における振動工程は、結晶化剤溶液と生体高分子溶液とが混合された混合液を入れた容器を振動させる工程である。
【0013】
本発明における「生体高分子溶液」とは、生体高分子と、前記生体高分子を溶解する溶媒とを含む液であればよい。
本発明における「結晶化剤溶液」とは、結晶化剤と、前記結晶化剤を溶解する溶媒とを含む液であればよい。
本発明の生体高分子結晶の製造方法において混合液は、生体高分子と、結晶化剤と、溶媒とを少なくとも含み、非電解質ポリマーやその他の公知の添加剤等を含んでいてもよい。
また、混合液において、含有していてもよい他の化合物は溶解していても、溶解していなくともよいが、溶解していることが好ましい。
結晶化剤溶液と生体高分子溶液との混合方法としては、特に制限はなく、公知の方法にて混合すればよい。
【0014】
本発明の生体高分子結晶の製造方法は、種々の生体高分子の結晶化に適用することができる。
生体高分子として具体的には、ポリペプチド、蛋白質、及び、核酸(例えば、DNAなど。)、並びに、それらの誘導体等が例示できる。また、前記生体高分子には、合成ポリペプチドや合成蛋白質等の合成物も含まれる。また、ポリペプチドとしては、大腸菌、酵母、動物細胞における発現によって得た後に慣用方法で単離されたポリペプチド、又は、合成ポリペプチドを挙げることができる。前記誘導体には、例えば、糖蛋白質、DNAコンジュゲート等が含まれる。
また、前記生体高分子の(重量平均)分子量が1,000以上であることが好ましい。
これらの中でも、本発明の生体高分子結晶の製造方法は、ポリペプチド、蛋白質及びこれらの誘導体の結晶化に好適であり、蛋白質及びその誘導体(本発明において、単に「蛋白質」ともいう。)の結晶化により好適である。また、蛋白質には、酵素も含まれる。
さらに、振動の付与は、温度変化などに比べ、生体高分子が変性しにくいため、本発明の生体高分子結晶の製造方法は、酵素などの生理活性を有する蛋白質及びその誘導体の結晶化に特に好適である。
【0015】
生体高分子溶液、結晶化剤溶液、及び、混合液に含まれる溶媒は、使用する生体高分子や結晶化剤に応じてそれぞれ独立に選択でき、水、有機溶媒、又は、水及び水と混合する有機溶媒(水性有機溶媒)の混合物などが例示できる。この中でも、緩衝液であることが好ましく、酢酸緩衝液、CAPS緩衝液、HEPES緩衝液、クエン酸緩衝液、酒石酸緩衝液、カコジル酸緩衝液、又は、Tris緩衝液であることがより好ましい。
本発明の生体高分子結晶の製造方法における生体高分子溶液中の生体高分子の濃度については、特に制限はなく、例えば、飽和濃度が1〜100%である溶液又は過飽和の溶液が例示できる。また、溶液濃度を維持するため、溶質である生体高分子の補充、温度の低下、及び/又は、沈殿剤の追加等を行ってもよい。
本発明の生体高分子結晶の製造方法における結晶化剤溶液中の結晶化剤の濃度については、特に制限はない。また、溶液濃度を維持するため、溶質である結晶化剤の補充等を行ってもよい。
なお、本発明において、「核形成」とは、生体高分子の溶液中から生体高分子の結晶が出現する初期の段階をいい、形成される核を「結晶核」ともいう。結晶核は、安定に存在しうる生体高分子の集合体であって、結晶成長を引き起こすことのできる生体高分子の集合体である。
「結晶成長」とは、上記の結晶核の表面に溶質分子である生体高分子が取り込まれて、結晶が大きくなることをいう。
【0016】
本発明に用いることができる生体高分子は、より容易に結晶を作製することができるため、その純度及び均質性が高いことが好ましい。このため、本発明の生体高分子結晶の製造方法は、結晶の製造に先立って、生体高分子を精製する工程を含むことが好ましい。
結晶化前の生体高分子の精製は、公知の方法により行うことができ、例えば、アフィニティークロマトグラフィー、慣用のクロマトグラフィー、rpHPLC、FPLC等によって行うことが好ましい。
また、核酸においては、公知の単離法により得た後、精製により純度を高めた後に結晶化させることが好ましい。
また、蛋白質においては、公知の方法により純度を高め、等電点電気泳動法又は光散乱法等により純度を確認した後に結晶化させることが好ましい。
【0017】
本発明における振動とは、混合液をその容器ごと物理的に揺り動かすことであればよく、前後、左右及び/又は上下への運動を規則的又は不規則に繰り返すものであればよい。
振動工程は、混合液を入れた容器を振動(容器自体を超音波振動させる場合も含む。)させる工程であるため、スターラー等による溶液の撹拌や、溶液への超音波の照射などは含まれない。
本発明の生体高分子の製造方法は、混合液を入れた容器自体を振動させることで、混合液に剪断力を与えず、かつ振動による熱の発生も低く押さえながら、結晶化を促進することができる。
混合液を入れた容器を振動させる方法としては、特に制限はなく、公知の方法により振動させればよい。混合液に剪断力を与えず、かつ振動による熱の付与も低く押さえることができる点から、混合液を入れた容器を振動装置に固定し振動させる方法、混合液を入れた容器と振動装置の振動部分とを接触させて振動させる方法が好ましく例示できる。
混合液を入れる容器としては、特に制限はなく、一般的な形状及び材質のものを用いることが好ましい。容器の容量は、特に制限はなく、適宜選択すればよく、例えば、数μLから数百Lの範囲が挙げられる。また、生体高分子の使用量も特に制限はなく、例えば、数mgから数tの範囲が挙げられる。
【0018】
前記振動工程における振動は、500rpm以上7,000rpm以下で行われることが好ましく、1,000rpmを越え5,000rpm以下で行われることがより好ましく、1,500rpm以上4,000rpm以下で行われることがさらに好ましい。上記範囲であると、十分な振動を生体高分子溶液に与えることができ、生体高分子結晶を容易に得ることができる。
また、前記振動工程における振動させる時間は、5秒間以上2時間以下であることが好ましく、10秒間以上1時間以下であることがより好ましく、20秒間以上30分間以下であることがさらに好ましい。上記範囲であると、十分な振動を生体高分子溶液に与えることができ、また、生体高分子として蛋白質等を使用した場合に変性が起こりにくく、生体高分子結晶を容易に得ることができる。
【0019】
本発明における「結晶化剤」とは、生体高分子の溶解度を下げる働きをする化合物を意味し、沈殿剤、pH緩衝剤、その他高分子の結晶化に使用される添加剤等の化合物が挙げられる。
本発明に用いることができる結晶化剤としては、塩類、有機溶媒、水溶性高分子等が例示でき、公知のものを用いることができる。また、使用する結晶化剤の種類は、使用する生体高分子に応じて適宜選択すればよい。
塩類としては、硫酸塩、硝酸塩、リン酸塩、有機酸塩、及び、アルカリ金属又はアルカリ土類金属のハロゲン化物などを用いることができ、具体的には、硫酸アンモニウム、塩化ナトリウム、及び、クエン酸ナトリウムが例示できる。
有機溶媒としては、水溶性の有機溶媒を例示できる。具体的には、例えば、2−メチル−2,4−ペンタジオール(MPD)やエタノール、プロパノールジオキサンなどを用いることができる。
水溶性高分子としては、ポリエチレングリコールやポリプロピレングリコールなどが例示できる。
結晶化剤の添加量は、特に制限はなく、使用する生体高分子及び使用する結晶化剤の種類に応じ、適宜設定すればよい。
また、本発明の生体高分子結晶の製造方法における結晶化剤溶液の添加時期は、1液法においては、振動工程の前に生体高分子溶液へ添加され、2液法においては、混合工程にて生体高分子溶液へ添加される。
【0020】
また、本発明の生体高分子結晶の製造方法は、例えば、溶液中の生体高分子の濃度を維持する等のために、1液法における振動させた混合液と、後述するような振動させた混合液中の生体高分子と同一の生体高分子を含む他の生体高分子溶液とを混合し、さらに保管工程を行って、生体高分子結晶を生成させることもできる。
【0021】
(保管工程)
1液法における保管工程は、振動させた混合液を保管する工程である。
保管時間は、生体高分子結晶の成長が十分に行われる範囲で適宜選択することができ、例えば、生体高分子や結晶化剤、使用した溶媒の種類や、結晶生成の有無、生成した結晶の大きさ等を考慮して、適宜決定すればよい。
保管時の温度は、生体高分子の結晶化を妨げる温度でなければ、特に制限はない。また、保管時の温度は、一定温度に保っても、変化してもよいが、温度変化が1℃以内であることが好ましい。
また、保管工程における生体高分子溶液は、密閉容器に入れて保管しても、非密閉容器に入れて保管してもよい。容器内外において、雰囲気中の溶媒量、例えば、湿度は、必要に応じ、適宜設定することができる。また、容器内外の雰囲気は、使用する生体高分子の種類に応じて適宜選択すればよく、例えば、大気雰囲気下であっても、窒素雰囲気下であっても、アルゴン雰囲気下であってもよい。
【0022】
また、保管工程では、静置して保管しても、撹拌しながら保管してもよい。撹拌しながら保管することにより、大粒の結晶を得ることが期待できる。
保管工程における撹拌の振動数は、10rpm以300rpm以下であることが好ましく、20rpm以上100rpm以下であることがより好ましく、30rpm以上60rpm以下であることがさらに好ましい。
また、前記振動工程における振動の振動数は、前記保管工程における撹拌の振動数よりも大きいことが好ましく、前記保管工程における撹拌の振動数より5倍以上大きいことがより好ましく、前記保管工程における撹拌の振動数より10倍以上大きいことがさらに好ましい。
【0023】
本発明の生体高分子結晶の製造方法において、混合液中に生成した生体高分子結晶は、任意の方法により混合液と分離すればよい。具体的には、濾紙やフィルター等を用いて濾過する方法や、ピンセット等により生体高分子溶液から生体高分子結晶を採取する方法などが例示できる。
得られた生体高分子結晶は、必要に応じ、洗浄を行ったり、乾燥を行ったり、大きさや形状を加工したり、また、再結晶を行ってもよい。
【0024】
<2液法>
本発明の生体高分子結晶の製造方法における他の実施態様は、生体高分子溶液を入れた容器を振動させる振動工程、振動させた生体高分子溶液と結晶化剤溶液とを混合した混合液を得る混合工程、及び、混合液を入れた容器を保管する保管工程、を含むことを特徴とする生体高分子結晶の製造方法(2液法)である。
【0025】
(振動工程)
2液法における振動工程は、生体高分子溶液を入れた容器を振動させる工程であり、前述した1液法における振動工程とは、結晶化剤を含まない生体高分子溶液を使用する点で異なるが、他の点においては特に明示がない限り同様であり、容器の振動に関する好ましい範囲は同様である。
2液法の振動工程における生体高分子溶液中の生体高分子の濃度については、特に制限はなく、結晶生成が可能であれば、希薄溶液であっても、飽和溶液であっても、過飽和溶液であってもよい。
また、生体高分子が蛋白質などの両性電解質である場合、生体高分子溶液又は混合液のpHは、両性電解質の等電点又はその近傍であることが好ましく、(両性電解質の等電点−3)〜(蛋白質の両性電解質+3)の範囲であることがより好ましく、(両性電解質の等電点−1)〜(両性電解質の等電点+1)の範囲であることがさらに好ましい。上記範囲であると、両性電解質の結晶化をより容易に行うことができる。
【0026】
(混合工程)
2液法における混合工程は、振動させた生体高分子溶液と結晶化剤溶液とを混合した混合液を得る工程である。
振動させた生体高分子溶液の濃度が低い場合、結晶化剤溶液と混合しただけでは生体高分子溶液の飽和度が過飽和になりにくい場合があるので、振動させた生体高分子溶液中の生体高分子と同一の生体高分子を含む他の生体高分子溶液(高濃度)をさらに加えて混合液を得るようにしてもよい。
前記他の生体高分子溶液中における生体高分子の濃度については、特に制限はなく、例えば、飽和濃度が1〜100%である溶液又は過飽和の溶液が例示できる。
また、混合工程では、結晶化剤溶液や添加した他の生体高分子溶液などが結晶化に悪影響を与えないように、保管工程の前に混合液を十分混合しておくことが好ましく、保管工程の前に混合液を均一な液にしておくことがより好ましい。
また、混合工程においては、結晶化剤溶液及び他の生体高分子溶液に加えて、後述するような他の添加剤を混合してもよい。
【0027】
(保管工程)
2液法における保管工程は、混合液を入れた容器を保管する保管工程であり、前述した1液法における保管工程とは、混合液への結晶化剤溶液の添加時期の違い以外は同様の工程であり、容器の保管に関する好ましい範囲等は前述した1液法における保管工程と同様である。
【0028】
(光照射工程)
本発明の生体高分子結晶の製造方法は、生体高分子溶液又は混合液に光を照射する工程(単に「光照射工程」ともいう。)を含むことが好ましい。
なお、光照射工程における生体高分子溶液は、1液法においては、振動させる前の生体高分子溶液であっても、振動させた生体高分子溶液であっても、保管した後、結晶の生成が認められない生体高分子溶液であってもよく、また、2液法においては、振動させる前の生体高分子溶液であっても、振動させた生体高分子溶液であっても、混合液であっても、保管した後、結晶の生成が認められない混合液であってもよい。
本発明の生体高分子結晶の製造方法において、光照射工程は、行わなくても、1回行っても、2回以上行ってもよい。
前記光照射工程は、少なくとも1回は振動工程の前に行うことが好ましい。特に振動工程の前に光照射工程を行うことにより、結晶化をより一層促進することができる。
【0029】
前記光照射工程に用いることができる光としては、生体高分子の電子遷移を起こさせる(生体高分子を電子的に励起させる)波長を含む単色光又は連続光を使用することが好ましく、紫外光(波長390nm未満、好ましくは380nm未満、より好ましくは350nm未満)を使用することが好ましい。電子遷移を起こさせる波長とは、生体高分子を電子的に励起させる波長のことであり、分子吸光係数が10以上である波長をいう。
本発明に用いることができる紫外光には、波長150〜300nmのdeep UV、波長300〜350のmid UV、及び、波長350〜390nmのnear UVが含まれる。生体高分子が一般的な蛋白質の場合には、180〜320nmの紫外線が好ましく使用できる。
【0030】
生体高分子の結晶化のために用いることのできる光源は、タングステンランプ、水銀灯、キセノンランプなどの定常点灯光源の他に、固体レーザー、気体レーザー、半導体レーザー、エキシマーレーザーなどのレーザー光源を使用することもできる。例えば、パルスキセノン光源、マイクロ波励起ランプ、KrF(249nm)、ArF(193nm)、XeCl(308nm)、KrCl(222nm)及びF2(157nm)等のエキシマーレーザーによれば、効率よくパルス状に紫外光を発生することができるので好ましい。
照射する光の強度は、適宜選択できるが、数μW〜数100Wの範囲にある強度の光を用いることが好ましい。
光照射は、定常光でもよく、パルス光でもよい。必要に応じて、照射強度、1パルス当たりのエネルギー、パルス間隔等を変化させることもできる。
光の照射時間は、1秒〜2時間であることが好ましく、5秒〜1時間であることがより好ましい。
【0031】
また、前記光照射工程においては、多光子励起が可能な強度の可視光を生体高分子溶液に照射してもよい。
多光子励起とは、物質(分子)が2つ以上の光子を吸収(多光子吸収)して励起される現象である。多光子励起では2つ以上の光子を吸収するが、二光子吸収が好ましい。また、二光子吸収には段階的二光子吸収及び同時二光子吸収が存在するが、同時二光子吸収であることが好ましい。
従来は、紫外光を用いて生体高分子結晶の核形成及び/又は結晶成長を行っていたが、紫外線を照射することによって、特に生体高分子として蛋白質を使用した場合には、蛋白質が変性するという問題が生じることがあった。
【0032】
多光子励起(多光子吸収)の起こる確率は、二光子励起の場合、加えた光電場(入射光強度)の二乗に比例するため、入射光エネルギーが集中している領域でのみ多光子吸収が誘起される。したがって、照射する可視光をレンズで集光すれば、焦点付近でのみ多光子吸収が生じ、その他の部分では吸収が生じないという状態とすることが可能である。このように焦点付近の限られた空間でのみ生体高分子の電子遷移を生じさせることにより、結晶化された蛋白質等の生体高分子に損傷を与えることなく、生体高分子の結晶を製造することができる。
【0033】
多光子励起が可能な可視光の照射方法としては、可視光(波長380〜780nm、好ましくは390〜780nm、より好ましくは400〜780nm)を用い、これを集光して照射する方法が例示できる。
可視光としては、500〜800nmの波長であることが好ましく、550〜640nmの波長であることがより好ましい。使用する波長が上記範囲内であると、集光部以外の高分子に変性を生じることがないので好ましい。光源としては連続光のレーザーからフェムト秒レーザーまで用いることができる。エキシマーレーザー励起の色素レーザー、チタンサファイアレーザー励起の色素レーザー、あるいはYAGレーザー励起の色素レーザー、OPOレーザー、ダイオードレーザーが例示できる。パルス励起された色素レーザー、OPOレーザーが好ましく、数十〜数百ピコ秒のパルス幅を有する色素レーザー、あるいはOPOレーザーが特に好ましい。
【0034】
可視光のエネルギーは、集光後の光が多光子吸収を起こすエネルギーを有する範囲で適宜選択することができるが、106W以上であることが好ましく、107〜1010Wであることが好ましく、108〜109Wであることがより好ましい。照射する可視光のエネルギーが上記範囲内であると、集光された光が生体高分子結晶の核形成及び/又は核成長を促進することができるので好ましい。
可視光は連続的に照射してもよく、また、パルス照射してもよいが、パルス照射することが好ましい。
【0035】
集光した可視光は1秒〜1時間照射することが好ましく、1秒〜30分照射することがより好ましい。照射時間が上記範囲内であると、蛋白質等の生体高分子の変質を起こすことなく生体高分子結晶の核形成及び/又は結晶成長を促進することができるので好ましい。
【0036】
(判定工程)
本発明の生体高分子結晶の製造方法は、保管した混合液中に生成した結晶の有無を判定する判定工程を含むことが好ましい。
判定工程における結晶の有無を判定する方法としては、特に制限はないが、目視により観察する方法、又は、画像処理や光学的手法を用いたセンサーを使用する方法が好ましく例示できる。
判定工程は、必要に応じ、定期的に行うことが好ましく、例えば、保管開始後、1日後、2日後、3日後、5日後、7日後、30日後、60日後及び90日後にそれぞれ判定工程を行ってもよい。
また、生体高分子結晶の生成有無の確認後、結晶が生じていない場合には、本発明の生体高分子結晶の製造方法は、生体高分子結晶が生成していない混合液をさらに振動させる工程を含むことが好ましい。
本発明の生体高分子結晶の製造方法において、前記振動工程、及び、前記保管工程を少なくとも一回ずつ行っても、結晶が生成しなかった場合、前記振動工程、及び、前記保管工程を少なくとも一回ずつ再度行うことが好ましい。また、必要に応じて、結晶が生成するまで前記振動工程、及び、前記保管工程を何度も繰り返してもよい。
また、前記振動工程の前後に前記光照射工程を行うことがより好ましく、前記振動工程の前に前記光照射工程を行うことがさらに好ましい。
【0037】
(非電解質ポリマー)
前記生体高分子溶液、前記結晶化剤溶液又は前記混合液は、非電解質ポリマーを含有してもよい。特に、本発明の生体高分子結晶の製造方法が、光照射工程を含む場合、結晶化が著しく促進され、光の照射時間を短くすることができ、生体高分子の変性や酵素活性低下等を抑制するるため、非電解質ポリマーを含有していることが好ましい。
非電解質ポリマーとは、イオン性基を有しない高分子又はオリゴマーであり、(重量平均)分子量は400〜100,000であることが好ましい。非電解質ポリマーは水溶性の非電解質ポリマーであることが好ましい。
非電解質ポリマーとしては、ポリビニルアルコール、ポリアクリルアミド、ポリアルキレングリコールが例示できる。
これらの中でも、非電解質ポリマーとしては、ポリアルキレングリコールが好ましい。
ポリアルキレングリコールとしては、ポリエチレングリコール、ポリプロピレングリコール等が例示でき、ポリエチレングリコールが好ましい。
また、非電解質ポリマーの添加時期は、特に制限はないが、後述する光照射工程の少なくとも前に添加しておくことが好ましい。
本発明に用いることができるポリアルキレングリコールは、分子量が400〜20,000であることが好ましく、800〜10,000であることがより好ましく、1,000〜8,000であることがさらに好ましい。したがって、本発明において、非電解質ポリマーは、分子量が1,000〜8,000のポリエチレングリコールであることが特に好ましい。
【0038】
非電解質ポリマーの添加量は、前記生体高分子溶液、前記結晶化剤溶液又は前記混合液において、0.1〜100mg/mLであることが好ましく、0.5〜10mg/mLであることがより好ましい。非電解質ポリマーの添加量が上記範囲内であると、光照射による結晶化が効果的に促進される。
【0039】
(その他の添加剤)
また、生体高分子や溶媒、結晶化剤、非電解質ポリマー以外にも、必要に応じて、生体高分子溶液、結晶化剤溶液及び/又は混合液に公知の添加剤を添加してもよい。
また、非電解質ポリマー、及び/又は、添加剤は、一部は上述したように、振動工程前において添加する必要はなく、振動工程の前後であっても、振動工程時であっても、後述する工程の前後であっても、後述する工程時であってもよい。ただし、保管工程においては、結晶化に影響が出ないよう配慮する必要があることは言うまでもない。
また、添加は1回で行っても、複数回に分けて行ってもよい。
【0040】
また、本発明の生体高分子結晶の製造方法における結晶化の形式は、特に制限はなく、ハンギングドロップ蒸気拡散法、シッティングドロップ蒸気拡散法、ミクロ透析法、自由界面拡散法、保管バッチ法を用いることができる。
その他の結晶化を促進する条件は、前掲の日本生化学会編、新生化学実験講座1「蛋白質I−分離・精製・性質−」、高野常弘氏執筆、第14章「結晶化」、及び、A. McPherson著、”Preparation and Analysis of Protein Crystals”(John Wiley & Son, Inc.)を参照することができる。
【0041】
本発明の生体高分子結晶の製造方法に使用することができる装置としては、特に制限はなく、公知の手段や装置を組み合わせてもよい。また、例えば、保管工程や結晶生成確認工程において、公知の手段や装置が必要なければ用いなくともよい。
本発明の生体高分子結晶の製造方法に使用することができる装置は、例えば、振動手段及び保管場所があれば行うことができるが、必要に応じて、光照射手段や判定手段、生体高分子溶液調製手段、添加剤添加手段、温度調節手段、湿度調節手段など各種の手段を組み合わせて用いればよい。
また、本発明の生体高分子結晶の製造方法は、必要な手段を1以上有する装置を2以上組み合わせて行ってもよく、必要な全ての手段が備わった装置のみを用いて行ってもよい。
【0042】
振動手段としては、公知の振動、撹拌、超音波発生手段等を用いることができる。
振動手段における振動子としては、圧電振動子、吸引力、電磁力など、様々な構成のものが挙げられ、振動を与えられるものであれば特に制限はない。
生体高分子溶液に振動を与える方法としては、例えば、生体高分子が溶解した溶液を入れた容器を振動している振動手段に接触させる方法、生体高分子が溶解した溶液を入れた容器をプレートに固定し、プレート全体を振動させる方法等が挙げられる。
【0043】
また、光照射手段としては、例えば、光源、及び、光を生体高分子溶液まで導くための光学系より構成することができる。生体高分子の電子遷移が紫外光で起こる場合は、光源から照射試料まで光を導く光路に用いられる、レンズ、ミラー等の光学部品が紫外線を効率よく透過あるいは反射するものを用いることが好ましい。
前記光源には、前述した定常点灯光源やレーザー光源を好適に用いることができる。
前記光学系には、適宜、反射鏡、集光レンズ、光フィルター、赤外線遮断フィルター、光ファイバー、導光板、非線形光学素子等の光学部材を使用することができる。
特に、多光子励起が可能な強度の可視光を照射する場合には、集光レンズを使用することが好ましい。
【0044】
温度調節手段としては、公知の加熱手段や冷却手段、及び、これらの組み合わせを例示でき、また、温度の検出は、生体高分子溶液や混合液等の内部温度を検出しても、周囲の外気温を検出してもよい。また、温度調節手段は、必要な温度調節を行うプログラム回路を備えていてもよい。
【0045】
また、本発明の生体高分子結晶の製造方法に使用することができる装置は、必要に応じて、混合液中における結晶核の生成、結晶化剤の濃度、pH等を検出し、また、これらを制御するための装置、回路、プログラムを具備していてもよい。結晶条件の検出及び制御のためには、複数の結晶条件検出用セルを1チップ化した装置とすることが好ましい。このような検出チップは、特開2001−213699号公報に記載されたように、半導体装置の一般的な製造プロセスにより製造することができる。
また、本発明の生体高分子結晶の製造方法に使用することができる装置に、特開平6−116098号公報に記載されているような、結晶核の生成又は結晶成長には寄与しないが、結晶核の生成状況を検出するための生体高分子が吸収しない長波のレーザー光を使用する手段を備えることもできる。
【0046】
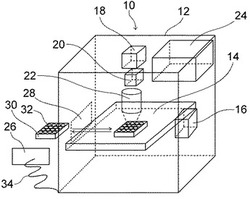
本発明の生体高分子結晶の製造方法に使用することができる装置として具体的には、例えば、図1に示すような装置を好ましく使用することができる。
図1は、本発明の生体高分子結晶の製造方法に使用することができる装置の一例の概念図である。
図1に示す装置10は、直方体の空間を有する装置本体12と、生体高分子溶液又は混合液への各種の操作や保管を行う上下及び前後左右に移動可能なXYZステージ14と、生体高分子溶液又は混合液へ振動を付与するための振動ユニット16と、キセノン光源18と、切り替えフィルター20と、集光部22と、温度制御部24と、制御用コンピューター26とを備えている。また、前記装置本体12には、開閉可能な搬入口28を備えている。
【0047】
結晶化プレート30には、複数のウェル32が備えられており、結晶化を行う混合液がウェル32のそれぞれに入れられている。結晶化プレート30は、搬入口28より装置10へ搬入又は搬出される。
混合液等を入れる容器としては、特に制限はなく、例えば、前記結晶化プレート30以外に、マイクロプレートや、試験管、チューブ状の容器などを好適に使用することができる。
装置本体12内に搬入された結晶化プレート30は、XYZステージ14に置かれる。XYZステージ14上の結晶化プレート30は、XYZステージ14に固定されていてもよく、固定されていなくともよいが、XYZステージ14を振動させて、生体高分子溶液又は混合液を振動させる場合は、固定することが好ましい。
光照射工程を行う場合、キセノン光源18から発せられた光が、切り替えフィルター20及び集光部22を透過し、ウェル32中の混合液へ照射される。光照射は、複数のウェル32全体、すなわち、結晶化プレート30全体に対して行ってもよく、XYZステージ14や切り替えフィルター20、集光部22等を操作して、1つずつ各ウェル32に対して、又は、2以上のウェル32に対して、行ってもよい。光照射工程を行う場合、ウェル32は少なくとも開口部又は光を透過可能な面を有していることが好ましい。
生体高分子溶液への振動の付与は、振動ユニット16によりXYZステージ14を振動させ、XYZステージ14に固定された結晶化プレート30を振動させ、各ウェル32内の混合液を振動させる。また、各ウェル32を結晶化プレート30から取り出し、振動ユニット16の振動部に接触させ、生体高分子溶液に振動を与える態様も挙げられる。振動を付与されたウェル32は、結晶化プレート30へ戻される。
振動を付与した後、混合液の保管は、装置10内で行うことも、装置10の外で行うこともできる。
【0048】
制御用コンピューター26は、ケーブル34により装置本体12と接続されており、装置本体12内の種々の部分に接続されている。制御用コンピューター26は、XYZステージ14の動作制御、振動ユニット16の動作制御、キセノン光源18や光学系(切り替えフィルター20及び集光部22)の制御、温度制御部24による装置本体12の温湿度制御、搬入口28の開閉制御などを行うことができる。また、図1において図示していないが、搬出入機構を用い、制御用コンピューター26により、結晶化プレート30の搬出入の制御を行うこともできる。
【0049】
本発明の生体高分子結晶の製造方法によって得られた生体高分子結晶は、X線結晶構造解析のための試料に供されるばかりでなく、一般に保存安定性が極めて高いので、予防用又は治療用剤形として医薬組成物に使用することが可能であり、生体高分子が結晶型であることにより特に有利な投与が可能になる。生体高分子結晶は、例えば経口、皮下、皮内、腹腔内、静脈内、筋肉内等の投与に適当である。本発明の生体高分子結晶の製造方法によって得られた生体高分子結晶は、活性物質として、結晶化された生体高分子の薬理学的有効量、及び、必要に応じて1種又は2種以上の慣用の医薬的に許容される担体からなる医薬組成物に好適に用いることができる。
【0050】
また、本発明の生体高分子結晶の製造方法によって得られた生体高分子結晶は、原理的に、多くの生体高分子について知られているのと同じ方法で、医薬製剤中に、例えば薬理学的に有効な生体高分子0.001μg/kg〜100mg/kg体重の1日用量を投与するためのデポ製剤として使用することができる。したがって、広範囲の様々な生体高分子が本発明によって結晶化された形態で、例えば治療剤デポ製剤、抗原デポ製剤、DNAデポ製剤又は糖デポ製剤として使用できる。結晶中に含有される結晶化補助剤はしかも、アジュバント(ワクチン接種において)として使用される。
【実施例】
【0051】
以下に本発明の実施例を示すが、本発明はこれらの実施例により限定されるものではない。
なお、下記にて使用したマイクロバッチプレートは、Greiner社製の96穴のマイクロバッチ用プレートであり、ウェルは円形状の浅底ウェルで直径約3mmであった。
【0052】
(実施例1:1液法、振動付与)
マイクロバッチプレートの各ウェルに、予めパラフィンオイルを100μL注ぎ、ウェルのオイル中で1.4M NaCl・0.2重量% PEG8000(重量平均分子量が8,000のポリエチレングリコール、50mM酢酸緩衝液、pH4.3)と、18mg/ml Lysozyme溶液(リゾチーム溶液、50mM酢酸緩衝液、pH4.3)とを等量混合した(最終濃度:9mg/ml Lysozyme、0.7M NaCl・0.1重量% PEG8000)。
次に各ウェルに対して2,000rpm、5分間振動を与えた。
温度20℃、湿度50%の環境下で4日間結晶生成を行い、2日後及び4日後における結晶の有無を判定し、下記式により結晶化率を求めた。
結晶化率=(結晶のあるウェル数)/(実験したウェル数)×100
結果を表1に示す。
【0053】
(比較例1:1液法、振動なし)
2,000rpm、5分間の振動を与えなかった以外は、実施例1と同様に、結晶生成を行い、結晶化率を求めた。結果を表1に示す。
【0054】
【表1】

【0055】
(実施例2:1液法、振動付与)
1.5ml容器に0.7M NaCl及び0.1重量% PEG8000を含む12.5mg/ml Lysozyme溶液(50mM酢酸緩衝液、pH4.3)を注ぎ、容器に対して4,000rpmで5分間加振した。
上記Lysozyme溶液をマイクロバッチプレートに移し、マイクロバッチの結晶化実験に供した。
温度20℃、湿度50%の環境下で4日間結晶生成を行い、結晶の有無を判定し、前記式により結晶化率を求めた。結果を表2に示す。
【0056】
(比較例2:1液法、振動なし)
4,000rpm、5分間の振動を与えなかった以外は、実施例1と同様に、結晶生成を行い、結晶化率を求めた。結果を表2に示す。
【0057】
【表2】

【0058】
(実施例3:1液法、光照射及び振動付与)
マイクロバッチプレートの各ウェルに予めパラフィンオイルを100μL注ぎ、ウェルのオイル中で1.4M NaCl・0.2重量% PEG8000(50mM酢酸緩衝液、pH4.3)と、14mg/ml Lysozyme溶液(50mM酢酸緩衝液、pH4.3)を等量混合した(最終濃度:7mg/ml Lysozyme、0.7M NaCl・0.1重量% PEG8000)。
次に、プレートの上からキセノンランプにて各ウェルにそれぞれ10秒間、20秒間又は30秒間光照射した。
さらに、各ウェルに対して2,000rpm、5分間加振した。
温度20℃、湿度50%の環境下で結晶生成を行い、1日後のトータルの結晶数を測定した。結果を表3に示す。
【0059】
(比較例3:1液法、光照射のみ)
2,000rpm、5分間の振動を与えなかった以外は、実施例3と同様に、結晶生成を行い、1日後のトータルの結晶数を測定した。結果を表3に示す。
【0060】
【表3】

【0061】
(実施例4:2液法、振動付与)
1.5ml容器に0.7M NaCl・0.1% PEG8000を含む0.25mg/ml Lysozyme溶液(50mM酢酸緩衝液、pH4.3)を調製し、容器に対して4,000rpmで10分間加振した。
上記Lysozyme溶液を他のLysozyme溶液(50mM酢酸緩衝液)と3:5で混合し、最終濃度が10.3mg/mlとなるようなLysozyme溶液を得た。
上記Lysozyme溶液をシッティングドロップ法による結晶化実験に供した(ウェル数:N=8)。なお、リザーバーは、0.7M NaCl溶液(50mM酢酸緩衝液、pH4.3)を用いた。
温度20℃、湿度50%の環境下で結晶生成を行い、12日後の結晶数を測定した。結果を表4に示す。
【0062】
(比較例4:2液法、振動なし)
4,000rpm、10分間の振動を与えなかった以外は、実施例4と同様に、結晶生成を行い、12日後の結晶数を測定した。結果を表4に示す。
【0063】
(比較例5:2液法、振動付与、Lysozymeなし)
0.25mg/ml Lysozyme溶液を0mg/ml Lysozyme溶液に変更した以外は、実施例4と同様に、結晶生成を行い、12日後の結晶数を測定した。結果を表4に示す。
【0064】
(比較例6:2液法、振動なし、Lysozymeなし)
0.25mg/ml Lysozyme溶液を0mg/ml Lysozyme溶液に変更し、4,000rpm、10分間の振動を与えなかった以外は、実施例4と同様に、結晶生成を行い、12日後の結晶数を求めた。結果を表4に示す。
【0065】
【表4】

【0066】
(実施例5:2液法、振動付与、等電点近傍溶液)
Catalaseの等電点(pH5.4付近)に近いpHの溶媒を用い、0.6ml容器にて2mg/ml Catalase(カタラーゼ、50mM酢酸緩衝液、pH5.4)を調製し、容器に対して3,000rpmで20分間加振した。
上記Catalase溶液を50mM酢酸緩衝液(pH5.4)にて10倍希釈した後、Catalase溶液(0.1Mトリスヒドロキシメチルアミノメタン緩衝液(Tris緩衝液)、pH8.5)と1:4混合し、2mg/ml Catalase溶液を得た。
上記Catalase溶液をパラフィンオイル中で結晶化液(2M硫酸アンモニウム(硫安)/0.1MTris緩衝液、pH8.5)等量混合し、マイクロバッチ法による結晶化実験に供した(ウェル数:N=6)。
温度20℃、湿度50%の環境下で結晶生成を行い、14日後の結晶化率を前記式により求めた。結果を表5に示す。
【0067】
(比較例7:2液法、振動なし、等電点近傍溶液)
3,000rpm、20分間の振動を与えなかった以外は、実施例5と同様に、結晶生成を行い、14日後の結晶化率を求めた。結果を表5に示す。
【0068】
【表5】

【0069】
(実施例6:2液法、振動付与、等電点近傍溶液)
Lysozymeの等電点(pH11.3付近)に近いpHの溶媒(50mM 3-(cyclohexylamino)-1-propanesulfonic acid緩衝液(CAPS緩衝液)、pH11.3)にて、0.5mg/ml Lysozyme溶液を調製した。
上記0.5mg/ml Lysozyme溶液を0.6ml容器に移し、4,000rpmにて1分間振動を与えた。
上記の加振したLysozyme溶液と、加振してないLysozyme溶液(50mM酢酸緩衝液、pH4.3)とを1:4で混合して、35mg/mlのLysozyme溶液を得た。
パラフィンオイル中で、1.4M NaCl(50mM酢酸緩衝液、pH4.3)と等量混合してマイクロバッチの結晶化実験に供した(ウェル数:N=6)。
温度20℃、湿度50%の環境下で結晶生成を行い、1日後の結晶化率を前記式により求めた。結果を表6に示す。
【0070】
(実施例7:2液法、振動付与、等電点近傍溶液)
振動を与える時間を5分間に変更した以外は、実施例6と同様に、結晶生成を行い、1日後の結晶化率を求めた。結果を表6に示す。
【0071】
(比較例8:2液法、振動なし、等電点近傍溶液)
4,000rpm、1分間の振動を与えなかった以外は、実施例6と同様に、結晶生成を行い、1日後の結晶化率を求めた。結果を表6に示す。
【0072】
(比較例9:2液法、振動なし、等電点近傍溶液)
4,000rpm、1分間の振動を与える代わりに5分間静置した以外は、実施例6と同様に、結晶生成を行い、1日後の結晶化率を求めた。結果を表6に示す。
【0073】
【表6】

【0074】
(実施例8:2液法、振動付与)
Lysozymeの等電点(pH11.3付近)と異なる溶媒(50mM酢酸緩衝液、pH4.3)にて、0.5mg/ml Lysozyme溶液を調製した。
上記0.5mg/ml Lysozyme溶液を0.6ml容器に移し、4,000rpmにて5分間振動を与えた。
上記の加振したLysozyme溶液と、加振してないLysozyme溶液(50mM酢酸緩衝液、pH4.3)とを1:4で混合して、35mg/mlのLysozyme溶液を得た。
パラフィンオイル中で、1.4M NaCl(50mM酢酸緩衝液、pH4.3)と等量混合してマイクロバッチの結晶化実験に供した(ウェル数:N=6)。
温度20℃、湿度50%の環境下で結晶生成を行い、1日後の結晶化率を前記式により求めた。結果を表7に示す。
【0075】
(比較例10:2液法、振動なし)
4,000rpm、5分間の振動を与える代わりに5分間静置した以外は、実施例8と同様に、結晶生成を行い、1日後の結晶化率を求めた。結果を表7に示す。
【0076】
【表7】

【0077】
(実施例9:2液法、光照射及び振動付与)
Catalaseの等電点(pH5.4付近)の溶媒を用い、2mg/ml Catalase(50mM酢酸緩衝液、pH5.4)を調製し、キセノンランプにて10分照射した。
上記Catalase溶液を0.6ml容器に移し、容器に対して3,000rpmで20分間加振した。
上記Catalase溶液を50mM酢酸緩衝液(pH5.4)にて10倍希釈した後、Catalase溶液(0.1M Tris緩衝液、pH8.5)と1:4で混合し、2mg/ml Catalase溶液を得た。
上記Catalase溶液をパラフィンオイル中で結晶化液(2M硫安/0.1M Tris緩衝液、pH8.5)等量混合し、マイクロバッチ法による結晶化実験に供した(ウェル数:N=6)。
温度20℃、湿度50%の環境下で結晶生成を行い、14日後の結晶化率を前記式により求めた。結果を表8に示す。
【0078】
(比較例11:2液法、光照射のみ)
3,000rpm、20分間の振動を与えなかった以外は、実施例9と同様に、結晶生成を行い、14日後の結晶化率を求めた。結果を表8に示す。
【0079】
【表8】

【図面の簡単な説明】
【0080】
【図1】本発明の生体高分子結晶の製造方法に使用することができる装置の一例の概念図である。
【符号の説明】
【0081】
10:装置
12:装置本体
14:XYZステージ
16:振動ユニット
18:キセノン光源
20:切り替えフィルター
22:集光部
24:温度制御部
26:制御用コンピューター
28:搬入口
30:結晶化プレート
32:ウェル
34:ケーブル
【技術分野】
【0001】
本発明は、生体高分子結晶の製造方法に関し、生体高分子結晶が蛋白質結晶である場合に特に好適に適用することができる。
【背景技術】
【0002】
蛋白質等の生体高分子を結晶化させるには、バッチ法、透析法、液相間拡散法、気液相関拡散法等の方法が用いられている(非特許文献1参照)。
例えば、バッチ法によれば、蛋白質溶液に硫酸アンモニウム等の沈殿剤を結晶化濃度まで直接加える。一般には、生体高分子溶液の入った容器に沈殿剤を加え生体高分子が過飽和となるように制御し、生体高分子結晶を作製していた。このバッチ法では、高濃度の高分子試料を大量に必要とすること、操作に熟練を要し再現性が低いこと、結晶化条件のスクリーニングが困難であること等の欠点がある。また、従来の上記結晶化方法は、特定の高分子に比較的特異な結晶化条件を要し、汎用的な条件がないという欠点を有している。
【0003】
また、例えば、特許文献1には、蛋白質結晶の核形成に適した温度条件に設定した蛋白質溶液に可視域と思われるレーザー光を照射し、このレーザー光の散乱状況を解析することにより蛋白質結晶の核形成の開始を検出し、核形成の開始を検出した時点で蛋白質溶液を結晶成長に適した温度条件に制御するようにした技術が開示されている。
さらに、特許文献2には、過飽和状態であるが蛋白質結晶の核形成に適さない低過飽和度の溶液(準安定溶液)にネオジウムYAGレーザーの第四高調波266nm光、あるいは500Wキセノンランプ光を照射することにより、ニワトリ卵白リゾチームの結晶を出現させる方法が開示されている。
特許文献3には、結晶化対象の溶質が溶解している溶液に対し、ピコ秒パルスレーザーおよびフェムト秒パルスレーザーの少なくとも一方のパルスレーザーを照射することにより結晶核を生成させる結晶核の製造方法が開示されている。
【0004】
【特許文献1】特開平6−116098号公報
【特許文献2】特開2003−306497号公報
【特許文献3】国際公開第2004/018744号パンフレット
【非特許文献1】日本生化学会編、新生化学実験講座1「蛋白質I−分離・精製・性質−」、1990年、東京化学同人発行、高野常弘氏執筆、第14章「結晶化」
【発明の開示】
【発明が解決しようとする課題】
【0005】
本発明の目的は、簡便かつ効率的に生体高分子結晶を製造できる新規な製造方法を提供することである。
【課題を解決するための手段】
【0006】
上記の課題は、以下の<1>及び<7>に記載の解決手段により達成された。好ましい実施態様である<2>〜<6>及び<8>〜<11>と共に以下に記載する。
<1> 結晶化剤溶液と生体高分子溶液とが混合された混合液を入れた容器を振動させる振動工程、及び、振動させた混合液を入れた容器を保管する保管工程、を含むことを特徴とする生体高分子結晶の製造方法、
<2> 保管工程において振動させた混合液を撹拌する上記<1>に記載の生体高分子結晶の製造方法、
<3> 振動工程における振動の振動数が保管工程における撹拌の振動数よりも大きい上記<2>に記載の生体高分子結晶の製造方法、
<4> 混合液に光を照射する光照射工程を含む上記<1>〜<3>いずれか1つに記載の生体高分子結晶の製造方法、
<5> 保管した混合液中に生成した結晶の有無を判定する判定工程を実施し、結晶の生成が認められない混合液に、振動工程をさらに実施する上記<1>〜<4>いずれか1つに記載の生体高分子結晶の製造方法、
<6> 生体高分子が蛋白質である上記<1>〜<5>いずれか1つに記載の生体高分子結晶の製造方法、
<7> 生体高分子溶液を入れた容器を振動させる振動工程、振動させた生体高分子溶液と結晶化剤溶液とを混合した混合液を得る混合工程、及び、混合液を入れた容器を保管する保管工程、を含むことを特徴とする生体高分子結晶の製造方法、
<8> 生体高分子溶液に光を照射する光照射工程を含む上記<7>に記載の生体高分子結晶の製造方法、
<9> 保管した混合液中に生成した結晶の有無を判定する判定工程を実施し、結晶の生成が認められない混合液に、振動工程をさらに実施する上記<7>又は<8>に記載の生体高分子結晶の製造方法、
<10> 生体高分子が両性電解質であり、生体高分子溶液のpHが生体高分子の等電点近傍である上記<7>〜<9>いずれか1つに記載の生体高分子結晶の製造方法、
<11> 生体高分子が蛋白質である上記<7>〜<11>いずれか1つに記載の生体高分子結晶の製造方法。
【発明の効果】
【0007】
本発明によれば、簡便かつ効率的に生体高分子結晶を製造できる新規な製造方法を提供することができた。
【発明を実施するための最良の形態】
【0008】
以下に、本発明について、詳細に説明する。
【0009】
本発明の生体高分子結晶の製造方法における1つの実施態様は、結晶化剤溶液と生体高分子溶液とが混合された混合液を入れた容器を振動させる振動工程、及び、振動させた混合液を入れた容器を保管する保管工程、を含むことを特徴とする生体高分子結晶の製造方法(以下、「1液法」ともいう。)である。
本発明の生体高分子結晶の製造方法における他の実施態様は、生体高分子溶液を入れた容器を振動させる振動工程、振動させた生体高分子溶液と結晶化剤溶液とを混合した混合液を得る混合工程、及び、混合液を入れた容器を保管する保管工程、を含むことを特徴とする生体高分子結晶の製造方法(以下、「2液法」ともいう。)である。
なお、1液法や2液法と明示せず、単に「本発明の生体高分子結晶の製造方法」と記載した場合は、1液法及び2液法の両方を表していることは言うまでもない。
【0010】
蛋白質等の生体高分子の結晶化において、従来、結晶化を促進させるための結晶生育条件を理論的に特定することができず、各種の条件を変えながら多数の試験を系統的に実行した結果から最良の条件を求めるスクリーニングの手法を用いざるを得なかった。このため、対象となる生体高分子溶液を各種の結晶生育条件、すなわち、生体高分子溶液の種類・濃度や生育温度を変化させた幾通りもの条件下で、試験を反復実行する必要があった。
本発明者等は、生体高分子の結晶化を行うための簡便な方法の探索を行い、振動に着目した。
通常、結晶化を行う生体高分子溶液に対し、振動を与えるとより分散が進行し、結晶化が生じにくいように思われる。しかしながら、本発明者等が検討した結果、生体高分子が溶解した溶液に振動を与えた後、保管した場合のほうが、振動を与えず単に保管した場合に比べ、生体高分子結晶が生成しやすいことを見いだした。
【0011】
<1液法>
本発明の生体高分子結晶の製造方法における1つの実施態様は、結晶化剤溶液と生体高分子溶液とが混合された混合液を入れた容器を振動させる振動工程、及び、振動させた混合液を入れた容器を保管する保管工程、を含むことを特徴とする生体高分子結晶の製造方法(1液法)である。
【0012】
(振動工程)
1液法における振動工程は、結晶化剤溶液と生体高分子溶液とが混合された混合液を入れた容器を振動させる工程である。
【0013】
本発明における「生体高分子溶液」とは、生体高分子と、前記生体高分子を溶解する溶媒とを含む液であればよい。
本発明における「結晶化剤溶液」とは、結晶化剤と、前記結晶化剤を溶解する溶媒とを含む液であればよい。
本発明の生体高分子結晶の製造方法において混合液は、生体高分子と、結晶化剤と、溶媒とを少なくとも含み、非電解質ポリマーやその他の公知の添加剤等を含んでいてもよい。
また、混合液において、含有していてもよい他の化合物は溶解していても、溶解していなくともよいが、溶解していることが好ましい。
結晶化剤溶液と生体高分子溶液との混合方法としては、特に制限はなく、公知の方法にて混合すればよい。
【0014】
本発明の生体高分子結晶の製造方法は、種々の生体高分子の結晶化に適用することができる。
生体高分子として具体的には、ポリペプチド、蛋白質、及び、核酸(例えば、DNAなど。)、並びに、それらの誘導体等が例示できる。また、前記生体高分子には、合成ポリペプチドや合成蛋白質等の合成物も含まれる。また、ポリペプチドとしては、大腸菌、酵母、動物細胞における発現によって得た後に慣用方法で単離されたポリペプチド、又は、合成ポリペプチドを挙げることができる。前記誘導体には、例えば、糖蛋白質、DNAコンジュゲート等が含まれる。
また、前記生体高分子の(重量平均)分子量が1,000以上であることが好ましい。
これらの中でも、本発明の生体高分子結晶の製造方法は、ポリペプチド、蛋白質及びこれらの誘導体の結晶化に好適であり、蛋白質及びその誘導体(本発明において、単に「蛋白質」ともいう。)の結晶化により好適である。また、蛋白質には、酵素も含まれる。
さらに、振動の付与は、温度変化などに比べ、生体高分子が変性しにくいため、本発明の生体高分子結晶の製造方法は、酵素などの生理活性を有する蛋白質及びその誘導体の結晶化に特に好適である。
【0015】
生体高分子溶液、結晶化剤溶液、及び、混合液に含まれる溶媒は、使用する生体高分子や結晶化剤に応じてそれぞれ独立に選択でき、水、有機溶媒、又は、水及び水と混合する有機溶媒(水性有機溶媒)の混合物などが例示できる。この中でも、緩衝液であることが好ましく、酢酸緩衝液、CAPS緩衝液、HEPES緩衝液、クエン酸緩衝液、酒石酸緩衝液、カコジル酸緩衝液、又は、Tris緩衝液であることがより好ましい。
本発明の生体高分子結晶の製造方法における生体高分子溶液中の生体高分子の濃度については、特に制限はなく、例えば、飽和濃度が1〜100%である溶液又は過飽和の溶液が例示できる。また、溶液濃度を維持するため、溶質である生体高分子の補充、温度の低下、及び/又は、沈殿剤の追加等を行ってもよい。
本発明の生体高分子結晶の製造方法における結晶化剤溶液中の結晶化剤の濃度については、特に制限はない。また、溶液濃度を維持するため、溶質である結晶化剤の補充等を行ってもよい。
なお、本発明において、「核形成」とは、生体高分子の溶液中から生体高分子の結晶が出現する初期の段階をいい、形成される核を「結晶核」ともいう。結晶核は、安定に存在しうる生体高分子の集合体であって、結晶成長を引き起こすことのできる生体高分子の集合体である。
「結晶成長」とは、上記の結晶核の表面に溶質分子である生体高分子が取り込まれて、結晶が大きくなることをいう。
【0016】
本発明に用いることができる生体高分子は、より容易に結晶を作製することができるため、その純度及び均質性が高いことが好ましい。このため、本発明の生体高分子結晶の製造方法は、結晶の製造に先立って、生体高分子を精製する工程を含むことが好ましい。
結晶化前の生体高分子の精製は、公知の方法により行うことができ、例えば、アフィニティークロマトグラフィー、慣用のクロマトグラフィー、rpHPLC、FPLC等によって行うことが好ましい。
また、核酸においては、公知の単離法により得た後、精製により純度を高めた後に結晶化させることが好ましい。
また、蛋白質においては、公知の方法により純度を高め、等電点電気泳動法又は光散乱法等により純度を確認した後に結晶化させることが好ましい。
【0017】
本発明における振動とは、混合液をその容器ごと物理的に揺り動かすことであればよく、前後、左右及び/又は上下への運動を規則的又は不規則に繰り返すものであればよい。
振動工程は、混合液を入れた容器を振動(容器自体を超音波振動させる場合も含む。)させる工程であるため、スターラー等による溶液の撹拌や、溶液への超音波の照射などは含まれない。
本発明の生体高分子の製造方法は、混合液を入れた容器自体を振動させることで、混合液に剪断力を与えず、かつ振動による熱の発生も低く押さえながら、結晶化を促進することができる。
混合液を入れた容器を振動させる方法としては、特に制限はなく、公知の方法により振動させればよい。混合液に剪断力を与えず、かつ振動による熱の付与も低く押さえることができる点から、混合液を入れた容器を振動装置に固定し振動させる方法、混合液を入れた容器と振動装置の振動部分とを接触させて振動させる方法が好ましく例示できる。
混合液を入れる容器としては、特に制限はなく、一般的な形状及び材質のものを用いることが好ましい。容器の容量は、特に制限はなく、適宜選択すればよく、例えば、数μLから数百Lの範囲が挙げられる。また、生体高分子の使用量も特に制限はなく、例えば、数mgから数tの範囲が挙げられる。
【0018】
前記振動工程における振動は、500rpm以上7,000rpm以下で行われることが好ましく、1,000rpmを越え5,000rpm以下で行われることがより好ましく、1,500rpm以上4,000rpm以下で行われることがさらに好ましい。上記範囲であると、十分な振動を生体高分子溶液に与えることができ、生体高分子結晶を容易に得ることができる。
また、前記振動工程における振動させる時間は、5秒間以上2時間以下であることが好ましく、10秒間以上1時間以下であることがより好ましく、20秒間以上30分間以下であることがさらに好ましい。上記範囲であると、十分な振動を生体高分子溶液に与えることができ、また、生体高分子として蛋白質等を使用した場合に変性が起こりにくく、生体高分子結晶を容易に得ることができる。
【0019】
本発明における「結晶化剤」とは、生体高分子の溶解度を下げる働きをする化合物を意味し、沈殿剤、pH緩衝剤、その他高分子の結晶化に使用される添加剤等の化合物が挙げられる。
本発明に用いることができる結晶化剤としては、塩類、有機溶媒、水溶性高分子等が例示でき、公知のものを用いることができる。また、使用する結晶化剤の種類は、使用する生体高分子に応じて適宜選択すればよい。
塩類としては、硫酸塩、硝酸塩、リン酸塩、有機酸塩、及び、アルカリ金属又はアルカリ土類金属のハロゲン化物などを用いることができ、具体的には、硫酸アンモニウム、塩化ナトリウム、及び、クエン酸ナトリウムが例示できる。
有機溶媒としては、水溶性の有機溶媒を例示できる。具体的には、例えば、2−メチル−2,4−ペンタジオール(MPD)やエタノール、プロパノールジオキサンなどを用いることができる。
水溶性高分子としては、ポリエチレングリコールやポリプロピレングリコールなどが例示できる。
結晶化剤の添加量は、特に制限はなく、使用する生体高分子及び使用する結晶化剤の種類に応じ、適宜設定すればよい。
また、本発明の生体高分子結晶の製造方法における結晶化剤溶液の添加時期は、1液法においては、振動工程の前に生体高分子溶液へ添加され、2液法においては、混合工程にて生体高分子溶液へ添加される。
【0020】
また、本発明の生体高分子結晶の製造方法は、例えば、溶液中の生体高分子の濃度を維持する等のために、1液法における振動させた混合液と、後述するような振動させた混合液中の生体高分子と同一の生体高分子を含む他の生体高分子溶液とを混合し、さらに保管工程を行って、生体高分子結晶を生成させることもできる。
【0021】
(保管工程)
1液法における保管工程は、振動させた混合液を保管する工程である。
保管時間は、生体高分子結晶の成長が十分に行われる範囲で適宜選択することができ、例えば、生体高分子や結晶化剤、使用した溶媒の種類や、結晶生成の有無、生成した結晶の大きさ等を考慮して、適宜決定すればよい。
保管時の温度は、生体高分子の結晶化を妨げる温度でなければ、特に制限はない。また、保管時の温度は、一定温度に保っても、変化してもよいが、温度変化が1℃以内であることが好ましい。
また、保管工程における生体高分子溶液は、密閉容器に入れて保管しても、非密閉容器に入れて保管してもよい。容器内外において、雰囲気中の溶媒量、例えば、湿度は、必要に応じ、適宜設定することができる。また、容器内外の雰囲気は、使用する生体高分子の種類に応じて適宜選択すればよく、例えば、大気雰囲気下であっても、窒素雰囲気下であっても、アルゴン雰囲気下であってもよい。
【0022】
また、保管工程では、静置して保管しても、撹拌しながら保管してもよい。撹拌しながら保管することにより、大粒の結晶を得ることが期待できる。
保管工程における撹拌の振動数は、10rpm以300rpm以下であることが好ましく、20rpm以上100rpm以下であることがより好ましく、30rpm以上60rpm以下であることがさらに好ましい。
また、前記振動工程における振動の振動数は、前記保管工程における撹拌の振動数よりも大きいことが好ましく、前記保管工程における撹拌の振動数より5倍以上大きいことがより好ましく、前記保管工程における撹拌の振動数より10倍以上大きいことがさらに好ましい。
【0023】
本発明の生体高分子結晶の製造方法において、混合液中に生成した生体高分子結晶は、任意の方法により混合液と分離すればよい。具体的には、濾紙やフィルター等を用いて濾過する方法や、ピンセット等により生体高分子溶液から生体高分子結晶を採取する方法などが例示できる。
得られた生体高分子結晶は、必要に応じ、洗浄を行ったり、乾燥を行ったり、大きさや形状を加工したり、また、再結晶を行ってもよい。
【0024】
<2液法>
本発明の生体高分子結晶の製造方法における他の実施態様は、生体高分子溶液を入れた容器を振動させる振動工程、振動させた生体高分子溶液と結晶化剤溶液とを混合した混合液を得る混合工程、及び、混合液を入れた容器を保管する保管工程、を含むことを特徴とする生体高分子結晶の製造方法(2液法)である。
【0025】
(振動工程)
2液法における振動工程は、生体高分子溶液を入れた容器を振動させる工程であり、前述した1液法における振動工程とは、結晶化剤を含まない生体高分子溶液を使用する点で異なるが、他の点においては特に明示がない限り同様であり、容器の振動に関する好ましい範囲は同様である。
2液法の振動工程における生体高分子溶液中の生体高分子の濃度については、特に制限はなく、結晶生成が可能であれば、希薄溶液であっても、飽和溶液であっても、過飽和溶液であってもよい。
また、生体高分子が蛋白質などの両性電解質である場合、生体高分子溶液又は混合液のpHは、両性電解質の等電点又はその近傍であることが好ましく、(両性電解質の等電点−3)〜(蛋白質の両性電解質+3)の範囲であることがより好ましく、(両性電解質の等電点−1)〜(両性電解質の等電点+1)の範囲であることがさらに好ましい。上記範囲であると、両性電解質の結晶化をより容易に行うことができる。
【0026】
(混合工程)
2液法における混合工程は、振動させた生体高分子溶液と結晶化剤溶液とを混合した混合液を得る工程である。
振動させた生体高分子溶液の濃度が低い場合、結晶化剤溶液と混合しただけでは生体高分子溶液の飽和度が過飽和になりにくい場合があるので、振動させた生体高分子溶液中の生体高分子と同一の生体高分子を含む他の生体高分子溶液(高濃度)をさらに加えて混合液を得るようにしてもよい。
前記他の生体高分子溶液中における生体高分子の濃度については、特に制限はなく、例えば、飽和濃度が1〜100%である溶液又は過飽和の溶液が例示できる。
また、混合工程では、結晶化剤溶液や添加した他の生体高分子溶液などが結晶化に悪影響を与えないように、保管工程の前に混合液を十分混合しておくことが好ましく、保管工程の前に混合液を均一な液にしておくことがより好ましい。
また、混合工程においては、結晶化剤溶液及び他の生体高分子溶液に加えて、後述するような他の添加剤を混合してもよい。
【0027】
(保管工程)
2液法における保管工程は、混合液を入れた容器を保管する保管工程であり、前述した1液法における保管工程とは、混合液への結晶化剤溶液の添加時期の違い以外は同様の工程であり、容器の保管に関する好ましい範囲等は前述した1液法における保管工程と同様である。
【0028】
(光照射工程)
本発明の生体高分子結晶の製造方法は、生体高分子溶液又は混合液に光を照射する工程(単に「光照射工程」ともいう。)を含むことが好ましい。
なお、光照射工程における生体高分子溶液は、1液法においては、振動させる前の生体高分子溶液であっても、振動させた生体高分子溶液であっても、保管した後、結晶の生成が認められない生体高分子溶液であってもよく、また、2液法においては、振動させる前の生体高分子溶液であっても、振動させた生体高分子溶液であっても、混合液であっても、保管した後、結晶の生成が認められない混合液であってもよい。
本発明の生体高分子結晶の製造方法において、光照射工程は、行わなくても、1回行っても、2回以上行ってもよい。
前記光照射工程は、少なくとも1回は振動工程の前に行うことが好ましい。特に振動工程の前に光照射工程を行うことにより、結晶化をより一層促進することができる。
【0029】
前記光照射工程に用いることができる光としては、生体高分子の電子遷移を起こさせる(生体高分子を電子的に励起させる)波長を含む単色光又は連続光を使用することが好ましく、紫外光(波長390nm未満、好ましくは380nm未満、より好ましくは350nm未満)を使用することが好ましい。電子遷移を起こさせる波長とは、生体高分子を電子的に励起させる波長のことであり、分子吸光係数が10以上である波長をいう。
本発明に用いることができる紫外光には、波長150〜300nmのdeep UV、波長300〜350のmid UV、及び、波長350〜390nmのnear UVが含まれる。生体高分子が一般的な蛋白質の場合には、180〜320nmの紫外線が好ましく使用できる。
【0030】
生体高分子の結晶化のために用いることのできる光源は、タングステンランプ、水銀灯、キセノンランプなどの定常点灯光源の他に、固体レーザー、気体レーザー、半導体レーザー、エキシマーレーザーなどのレーザー光源を使用することもできる。例えば、パルスキセノン光源、マイクロ波励起ランプ、KrF(249nm)、ArF(193nm)、XeCl(308nm)、KrCl(222nm)及びF2(157nm)等のエキシマーレーザーによれば、効率よくパルス状に紫外光を発生することができるので好ましい。
照射する光の強度は、適宜選択できるが、数μW〜数100Wの範囲にある強度の光を用いることが好ましい。
光照射は、定常光でもよく、パルス光でもよい。必要に応じて、照射強度、1パルス当たりのエネルギー、パルス間隔等を変化させることもできる。
光の照射時間は、1秒〜2時間であることが好ましく、5秒〜1時間であることがより好ましい。
【0031】
また、前記光照射工程においては、多光子励起が可能な強度の可視光を生体高分子溶液に照射してもよい。
多光子励起とは、物質(分子)が2つ以上の光子を吸収(多光子吸収)して励起される現象である。多光子励起では2つ以上の光子を吸収するが、二光子吸収が好ましい。また、二光子吸収には段階的二光子吸収及び同時二光子吸収が存在するが、同時二光子吸収であることが好ましい。
従来は、紫外光を用いて生体高分子結晶の核形成及び/又は結晶成長を行っていたが、紫外線を照射することによって、特に生体高分子として蛋白質を使用した場合には、蛋白質が変性するという問題が生じることがあった。
【0032】
多光子励起(多光子吸収)の起こる確率は、二光子励起の場合、加えた光電場(入射光強度)の二乗に比例するため、入射光エネルギーが集中している領域でのみ多光子吸収が誘起される。したがって、照射する可視光をレンズで集光すれば、焦点付近でのみ多光子吸収が生じ、その他の部分では吸収が生じないという状態とすることが可能である。このように焦点付近の限られた空間でのみ生体高分子の電子遷移を生じさせることにより、結晶化された蛋白質等の生体高分子に損傷を与えることなく、生体高分子の結晶を製造することができる。
【0033】
多光子励起が可能な可視光の照射方法としては、可視光(波長380〜780nm、好ましくは390〜780nm、より好ましくは400〜780nm)を用い、これを集光して照射する方法が例示できる。
可視光としては、500〜800nmの波長であることが好ましく、550〜640nmの波長であることがより好ましい。使用する波長が上記範囲内であると、集光部以外の高分子に変性を生じることがないので好ましい。光源としては連続光のレーザーからフェムト秒レーザーまで用いることができる。エキシマーレーザー励起の色素レーザー、チタンサファイアレーザー励起の色素レーザー、あるいはYAGレーザー励起の色素レーザー、OPOレーザー、ダイオードレーザーが例示できる。パルス励起された色素レーザー、OPOレーザーが好ましく、数十〜数百ピコ秒のパルス幅を有する色素レーザー、あるいはOPOレーザーが特に好ましい。
【0034】
可視光のエネルギーは、集光後の光が多光子吸収を起こすエネルギーを有する範囲で適宜選択することができるが、106W以上であることが好ましく、107〜1010Wであることが好ましく、108〜109Wであることがより好ましい。照射する可視光のエネルギーが上記範囲内であると、集光された光が生体高分子結晶の核形成及び/又は核成長を促進することができるので好ましい。
可視光は連続的に照射してもよく、また、パルス照射してもよいが、パルス照射することが好ましい。
【0035】
集光した可視光は1秒〜1時間照射することが好ましく、1秒〜30分照射することがより好ましい。照射時間が上記範囲内であると、蛋白質等の生体高分子の変質を起こすことなく生体高分子結晶の核形成及び/又は結晶成長を促進することができるので好ましい。
【0036】
(判定工程)
本発明の生体高分子結晶の製造方法は、保管した混合液中に生成した結晶の有無を判定する判定工程を含むことが好ましい。
判定工程における結晶の有無を判定する方法としては、特に制限はないが、目視により観察する方法、又は、画像処理や光学的手法を用いたセンサーを使用する方法が好ましく例示できる。
判定工程は、必要に応じ、定期的に行うことが好ましく、例えば、保管開始後、1日後、2日後、3日後、5日後、7日後、30日後、60日後及び90日後にそれぞれ判定工程を行ってもよい。
また、生体高分子結晶の生成有無の確認後、結晶が生じていない場合には、本発明の生体高分子結晶の製造方法は、生体高分子結晶が生成していない混合液をさらに振動させる工程を含むことが好ましい。
本発明の生体高分子結晶の製造方法において、前記振動工程、及び、前記保管工程を少なくとも一回ずつ行っても、結晶が生成しなかった場合、前記振動工程、及び、前記保管工程を少なくとも一回ずつ再度行うことが好ましい。また、必要に応じて、結晶が生成するまで前記振動工程、及び、前記保管工程を何度も繰り返してもよい。
また、前記振動工程の前後に前記光照射工程を行うことがより好ましく、前記振動工程の前に前記光照射工程を行うことがさらに好ましい。
【0037】
(非電解質ポリマー)
前記生体高分子溶液、前記結晶化剤溶液又は前記混合液は、非電解質ポリマーを含有してもよい。特に、本発明の生体高分子結晶の製造方法が、光照射工程を含む場合、結晶化が著しく促進され、光の照射時間を短くすることができ、生体高分子の変性や酵素活性低下等を抑制するるため、非電解質ポリマーを含有していることが好ましい。
非電解質ポリマーとは、イオン性基を有しない高分子又はオリゴマーであり、(重量平均)分子量は400〜100,000であることが好ましい。非電解質ポリマーは水溶性の非電解質ポリマーであることが好ましい。
非電解質ポリマーとしては、ポリビニルアルコール、ポリアクリルアミド、ポリアルキレングリコールが例示できる。
これらの中でも、非電解質ポリマーとしては、ポリアルキレングリコールが好ましい。
ポリアルキレングリコールとしては、ポリエチレングリコール、ポリプロピレングリコール等が例示でき、ポリエチレングリコールが好ましい。
また、非電解質ポリマーの添加時期は、特に制限はないが、後述する光照射工程の少なくとも前に添加しておくことが好ましい。
本発明に用いることができるポリアルキレングリコールは、分子量が400〜20,000であることが好ましく、800〜10,000であることがより好ましく、1,000〜8,000であることがさらに好ましい。したがって、本発明において、非電解質ポリマーは、分子量が1,000〜8,000のポリエチレングリコールであることが特に好ましい。
【0038】
非電解質ポリマーの添加量は、前記生体高分子溶液、前記結晶化剤溶液又は前記混合液において、0.1〜100mg/mLであることが好ましく、0.5〜10mg/mLであることがより好ましい。非電解質ポリマーの添加量が上記範囲内であると、光照射による結晶化が効果的に促進される。
【0039】
(その他の添加剤)
また、生体高分子や溶媒、結晶化剤、非電解質ポリマー以外にも、必要に応じて、生体高分子溶液、結晶化剤溶液及び/又は混合液に公知の添加剤を添加してもよい。
また、非電解質ポリマー、及び/又は、添加剤は、一部は上述したように、振動工程前において添加する必要はなく、振動工程の前後であっても、振動工程時であっても、後述する工程の前後であっても、後述する工程時であってもよい。ただし、保管工程においては、結晶化に影響が出ないよう配慮する必要があることは言うまでもない。
また、添加は1回で行っても、複数回に分けて行ってもよい。
【0040】
また、本発明の生体高分子結晶の製造方法における結晶化の形式は、特に制限はなく、ハンギングドロップ蒸気拡散法、シッティングドロップ蒸気拡散法、ミクロ透析法、自由界面拡散法、保管バッチ法を用いることができる。
その他の結晶化を促進する条件は、前掲の日本生化学会編、新生化学実験講座1「蛋白質I−分離・精製・性質−」、高野常弘氏執筆、第14章「結晶化」、及び、A. McPherson著、”Preparation and Analysis of Protein Crystals”(John Wiley & Son, Inc.)を参照することができる。
【0041】
本発明の生体高分子結晶の製造方法に使用することができる装置としては、特に制限はなく、公知の手段や装置を組み合わせてもよい。また、例えば、保管工程や結晶生成確認工程において、公知の手段や装置が必要なければ用いなくともよい。
本発明の生体高分子結晶の製造方法に使用することができる装置は、例えば、振動手段及び保管場所があれば行うことができるが、必要に応じて、光照射手段や判定手段、生体高分子溶液調製手段、添加剤添加手段、温度調節手段、湿度調節手段など各種の手段を組み合わせて用いればよい。
また、本発明の生体高分子結晶の製造方法は、必要な手段を1以上有する装置を2以上組み合わせて行ってもよく、必要な全ての手段が備わった装置のみを用いて行ってもよい。
【0042】
振動手段としては、公知の振動、撹拌、超音波発生手段等を用いることができる。
振動手段における振動子としては、圧電振動子、吸引力、電磁力など、様々な構成のものが挙げられ、振動を与えられるものであれば特に制限はない。
生体高分子溶液に振動を与える方法としては、例えば、生体高分子が溶解した溶液を入れた容器を振動している振動手段に接触させる方法、生体高分子が溶解した溶液を入れた容器をプレートに固定し、プレート全体を振動させる方法等が挙げられる。
【0043】
また、光照射手段としては、例えば、光源、及び、光を生体高分子溶液まで導くための光学系より構成することができる。生体高分子の電子遷移が紫外光で起こる場合は、光源から照射試料まで光を導く光路に用いられる、レンズ、ミラー等の光学部品が紫外線を効率よく透過あるいは反射するものを用いることが好ましい。
前記光源には、前述した定常点灯光源やレーザー光源を好適に用いることができる。
前記光学系には、適宜、反射鏡、集光レンズ、光フィルター、赤外線遮断フィルター、光ファイバー、導光板、非線形光学素子等の光学部材を使用することができる。
特に、多光子励起が可能な強度の可視光を照射する場合には、集光レンズを使用することが好ましい。
【0044】
温度調節手段としては、公知の加熱手段や冷却手段、及び、これらの組み合わせを例示でき、また、温度の検出は、生体高分子溶液や混合液等の内部温度を検出しても、周囲の外気温を検出してもよい。また、温度調節手段は、必要な温度調節を行うプログラム回路を備えていてもよい。
【0045】
また、本発明の生体高分子結晶の製造方法に使用することができる装置は、必要に応じて、混合液中における結晶核の生成、結晶化剤の濃度、pH等を検出し、また、これらを制御するための装置、回路、プログラムを具備していてもよい。結晶条件の検出及び制御のためには、複数の結晶条件検出用セルを1チップ化した装置とすることが好ましい。このような検出チップは、特開2001−213699号公報に記載されたように、半導体装置の一般的な製造プロセスにより製造することができる。
また、本発明の生体高分子結晶の製造方法に使用することができる装置に、特開平6−116098号公報に記載されているような、結晶核の生成又は結晶成長には寄与しないが、結晶核の生成状況を検出するための生体高分子が吸収しない長波のレーザー光を使用する手段を備えることもできる。
【0046】
本発明の生体高分子結晶の製造方法に使用することができる装置として具体的には、例えば、図1に示すような装置を好ましく使用することができる。
図1は、本発明の生体高分子結晶の製造方法に使用することができる装置の一例の概念図である。
図1に示す装置10は、直方体の空間を有する装置本体12と、生体高分子溶液又は混合液への各種の操作や保管を行う上下及び前後左右に移動可能なXYZステージ14と、生体高分子溶液又は混合液へ振動を付与するための振動ユニット16と、キセノン光源18と、切り替えフィルター20と、集光部22と、温度制御部24と、制御用コンピューター26とを備えている。また、前記装置本体12には、開閉可能な搬入口28を備えている。
【0047】
結晶化プレート30には、複数のウェル32が備えられており、結晶化を行う混合液がウェル32のそれぞれに入れられている。結晶化プレート30は、搬入口28より装置10へ搬入又は搬出される。
混合液等を入れる容器としては、特に制限はなく、例えば、前記結晶化プレート30以外に、マイクロプレートや、試験管、チューブ状の容器などを好適に使用することができる。
装置本体12内に搬入された結晶化プレート30は、XYZステージ14に置かれる。XYZステージ14上の結晶化プレート30は、XYZステージ14に固定されていてもよく、固定されていなくともよいが、XYZステージ14を振動させて、生体高分子溶液又は混合液を振動させる場合は、固定することが好ましい。
光照射工程を行う場合、キセノン光源18から発せられた光が、切り替えフィルター20及び集光部22を透過し、ウェル32中の混合液へ照射される。光照射は、複数のウェル32全体、すなわち、結晶化プレート30全体に対して行ってもよく、XYZステージ14や切り替えフィルター20、集光部22等を操作して、1つずつ各ウェル32に対して、又は、2以上のウェル32に対して、行ってもよい。光照射工程を行う場合、ウェル32は少なくとも開口部又は光を透過可能な面を有していることが好ましい。
生体高分子溶液への振動の付与は、振動ユニット16によりXYZステージ14を振動させ、XYZステージ14に固定された結晶化プレート30を振動させ、各ウェル32内の混合液を振動させる。また、各ウェル32を結晶化プレート30から取り出し、振動ユニット16の振動部に接触させ、生体高分子溶液に振動を与える態様も挙げられる。振動を付与されたウェル32は、結晶化プレート30へ戻される。
振動を付与した後、混合液の保管は、装置10内で行うことも、装置10の外で行うこともできる。
【0048】
制御用コンピューター26は、ケーブル34により装置本体12と接続されており、装置本体12内の種々の部分に接続されている。制御用コンピューター26は、XYZステージ14の動作制御、振動ユニット16の動作制御、キセノン光源18や光学系(切り替えフィルター20及び集光部22)の制御、温度制御部24による装置本体12の温湿度制御、搬入口28の開閉制御などを行うことができる。また、図1において図示していないが、搬出入機構を用い、制御用コンピューター26により、結晶化プレート30の搬出入の制御を行うこともできる。
【0049】
本発明の生体高分子結晶の製造方法によって得られた生体高分子結晶は、X線結晶構造解析のための試料に供されるばかりでなく、一般に保存安定性が極めて高いので、予防用又は治療用剤形として医薬組成物に使用することが可能であり、生体高分子が結晶型であることにより特に有利な投与が可能になる。生体高分子結晶は、例えば経口、皮下、皮内、腹腔内、静脈内、筋肉内等の投与に適当である。本発明の生体高分子結晶の製造方法によって得られた生体高分子結晶は、活性物質として、結晶化された生体高分子の薬理学的有効量、及び、必要に応じて1種又は2種以上の慣用の医薬的に許容される担体からなる医薬組成物に好適に用いることができる。
【0050】
また、本発明の生体高分子結晶の製造方法によって得られた生体高分子結晶は、原理的に、多くの生体高分子について知られているのと同じ方法で、医薬製剤中に、例えば薬理学的に有効な生体高分子0.001μg/kg〜100mg/kg体重の1日用量を投与するためのデポ製剤として使用することができる。したがって、広範囲の様々な生体高分子が本発明によって結晶化された形態で、例えば治療剤デポ製剤、抗原デポ製剤、DNAデポ製剤又は糖デポ製剤として使用できる。結晶中に含有される結晶化補助剤はしかも、アジュバント(ワクチン接種において)として使用される。
【実施例】
【0051】
以下に本発明の実施例を示すが、本発明はこれらの実施例により限定されるものではない。
なお、下記にて使用したマイクロバッチプレートは、Greiner社製の96穴のマイクロバッチ用プレートであり、ウェルは円形状の浅底ウェルで直径約3mmであった。
【0052】
(実施例1:1液法、振動付与)
マイクロバッチプレートの各ウェルに、予めパラフィンオイルを100μL注ぎ、ウェルのオイル中で1.4M NaCl・0.2重量% PEG8000(重量平均分子量が8,000のポリエチレングリコール、50mM酢酸緩衝液、pH4.3)と、18mg/ml Lysozyme溶液(リゾチーム溶液、50mM酢酸緩衝液、pH4.3)とを等量混合した(最終濃度:9mg/ml Lysozyme、0.7M NaCl・0.1重量% PEG8000)。
次に各ウェルに対して2,000rpm、5分間振動を与えた。
温度20℃、湿度50%の環境下で4日間結晶生成を行い、2日後及び4日後における結晶の有無を判定し、下記式により結晶化率を求めた。
結晶化率=(結晶のあるウェル数)/(実験したウェル数)×100
結果を表1に示す。
【0053】
(比較例1:1液法、振動なし)
2,000rpm、5分間の振動を与えなかった以外は、実施例1と同様に、結晶生成を行い、結晶化率を求めた。結果を表1に示す。
【0054】
【表1】

【0055】
(実施例2:1液法、振動付与)
1.5ml容器に0.7M NaCl及び0.1重量% PEG8000を含む12.5mg/ml Lysozyme溶液(50mM酢酸緩衝液、pH4.3)を注ぎ、容器に対して4,000rpmで5分間加振した。
上記Lysozyme溶液をマイクロバッチプレートに移し、マイクロバッチの結晶化実験に供した。
温度20℃、湿度50%の環境下で4日間結晶生成を行い、結晶の有無を判定し、前記式により結晶化率を求めた。結果を表2に示す。
【0056】
(比較例2:1液法、振動なし)
4,000rpm、5分間の振動を与えなかった以外は、実施例1と同様に、結晶生成を行い、結晶化率を求めた。結果を表2に示す。
【0057】
【表2】

【0058】
(実施例3:1液法、光照射及び振動付与)
マイクロバッチプレートの各ウェルに予めパラフィンオイルを100μL注ぎ、ウェルのオイル中で1.4M NaCl・0.2重量% PEG8000(50mM酢酸緩衝液、pH4.3)と、14mg/ml Lysozyme溶液(50mM酢酸緩衝液、pH4.3)を等量混合した(最終濃度:7mg/ml Lysozyme、0.7M NaCl・0.1重量% PEG8000)。
次に、プレートの上からキセノンランプにて各ウェルにそれぞれ10秒間、20秒間又は30秒間光照射した。
さらに、各ウェルに対して2,000rpm、5分間加振した。
温度20℃、湿度50%の環境下で結晶生成を行い、1日後のトータルの結晶数を測定した。結果を表3に示す。
【0059】
(比較例3:1液法、光照射のみ)
2,000rpm、5分間の振動を与えなかった以外は、実施例3と同様に、結晶生成を行い、1日後のトータルの結晶数を測定した。結果を表3に示す。
【0060】
【表3】

【0061】
(実施例4:2液法、振動付与)
1.5ml容器に0.7M NaCl・0.1% PEG8000を含む0.25mg/ml Lysozyme溶液(50mM酢酸緩衝液、pH4.3)を調製し、容器に対して4,000rpmで10分間加振した。
上記Lysozyme溶液を他のLysozyme溶液(50mM酢酸緩衝液)と3:5で混合し、最終濃度が10.3mg/mlとなるようなLysozyme溶液を得た。
上記Lysozyme溶液をシッティングドロップ法による結晶化実験に供した(ウェル数:N=8)。なお、リザーバーは、0.7M NaCl溶液(50mM酢酸緩衝液、pH4.3)を用いた。
温度20℃、湿度50%の環境下で結晶生成を行い、12日後の結晶数を測定した。結果を表4に示す。
【0062】
(比較例4:2液法、振動なし)
4,000rpm、10分間の振動を与えなかった以外は、実施例4と同様に、結晶生成を行い、12日後の結晶数を測定した。結果を表4に示す。
【0063】
(比較例5:2液法、振動付与、Lysozymeなし)
0.25mg/ml Lysozyme溶液を0mg/ml Lysozyme溶液に変更した以外は、実施例4と同様に、結晶生成を行い、12日後の結晶数を測定した。結果を表4に示す。
【0064】
(比較例6:2液法、振動なし、Lysozymeなし)
0.25mg/ml Lysozyme溶液を0mg/ml Lysozyme溶液に変更し、4,000rpm、10分間の振動を与えなかった以外は、実施例4と同様に、結晶生成を行い、12日後の結晶数を求めた。結果を表4に示す。
【0065】
【表4】

【0066】
(実施例5:2液法、振動付与、等電点近傍溶液)
Catalaseの等電点(pH5.4付近)に近いpHの溶媒を用い、0.6ml容器にて2mg/ml Catalase(カタラーゼ、50mM酢酸緩衝液、pH5.4)を調製し、容器に対して3,000rpmで20分間加振した。
上記Catalase溶液を50mM酢酸緩衝液(pH5.4)にて10倍希釈した後、Catalase溶液(0.1Mトリスヒドロキシメチルアミノメタン緩衝液(Tris緩衝液)、pH8.5)と1:4混合し、2mg/ml Catalase溶液を得た。
上記Catalase溶液をパラフィンオイル中で結晶化液(2M硫酸アンモニウム(硫安)/0.1MTris緩衝液、pH8.5)等量混合し、マイクロバッチ法による結晶化実験に供した(ウェル数:N=6)。
温度20℃、湿度50%の環境下で結晶生成を行い、14日後の結晶化率を前記式により求めた。結果を表5に示す。
【0067】
(比較例7:2液法、振動なし、等電点近傍溶液)
3,000rpm、20分間の振動を与えなかった以外は、実施例5と同様に、結晶生成を行い、14日後の結晶化率を求めた。結果を表5に示す。
【0068】
【表5】

【0069】
(実施例6:2液法、振動付与、等電点近傍溶液)
Lysozymeの等電点(pH11.3付近)に近いpHの溶媒(50mM 3-(cyclohexylamino)-1-propanesulfonic acid緩衝液(CAPS緩衝液)、pH11.3)にて、0.5mg/ml Lysozyme溶液を調製した。
上記0.5mg/ml Lysozyme溶液を0.6ml容器に移し、4,000rpmにて1分間振動を与えた。
上記の加振したLysozyme溶液と、加振してないLysozyme溶液(50mM酢酸緩衝液、pH4.3)とを1:4で混合して、35mg/mlのLysozyme溶液を得た。
パラフィンオイル中で、1.4M NaCl(50mM酢酸緩衝液、pH4.3)と等量混合してマイクロバッチの結晶化実験に供した(ウェル数:N=6)。
温度20℃、湿度50%の環境下で結晶生成を行い、1日後の結晶化率を前記式により求めた。結果を表6に示す。
【0070】
(実施例7:2液法、振動付与、等電点近傍溶液)
振動を与える時間を5分間に変更した以外は、実施例6と同様に、結晶生成を行い、1日後の結晶化率を求めた。結果を表6に示す。
【0071】
(比較例8:2液法、振動なし、等電点近傍溶液)
4,000rpm、1分間の振動を与えなかった以外は、実施例6と同様に、結晶生成を行い、1日後の結晶化率を求めた。結果を表6に示す。
【0072】
(比較例9:2液法、振動なし、等電点近傍溶液)
4,000rpm、1分間の振動を与える代わりに5分間静置した以外は、実施例6と同様に、結晶生成を行い、1日後の結晶化率を求めた。結果を表6に示す。
【0073】
【表6】

【0074】
(実施例8:2液法、振動付与)
Lysozymeの等電点(pH11.3付近)と異なる溶媒(50mM酢酸緩衝液、pH4.3)にて、0.5mg/ml Lysozyme溶液を調製した。
上記0.5mg/ml Lysozyme溶液を0.6ml容器に移し、4,000rpmにて5分間振動を与えた。
上記の加振したLysozyme溶液と、加振してないLysozyme溶液(50mM酢酸緩衝液、pH4.3)とを1:4で混合して、35mg/mlのLysozyme溶液を得た。
パラフィンオイル中で、1.4M NaCl(50mM酢酸緩衝液、pH4.3)と等量混合してマイクロバッチの結晶化実験に供した(ウェル数:N=6)。
温度20℃、湿度50%の環境下で結晶生成を行い、1日後の結晶化率を前記式により求めた。結果を表7に示す。
【0075】
(比較例10:2液法、振動なし)
4,000rpm、5分間の振動を与える代わりに5分間静置した以外は、実施例8と同様に、結晶生成を行い、1日後の結晶化率を求めた。結果を表7に示す。
【0076】
【表7】

【0077】
(実施例9:2液法、光照射及び振動付与)
Catalaseの等電点(pH5.4付近)の溶媒を用い、2mg/ml Catalase(50mM酢酸緩衝液、pH5.4)を調製し、キセノンランプにて10分照射した。
上記Catalase溶液を0.6ml容器に移し、容器に対して3,000rpmで20分間加振した。
上記Catalase溶液を50mM酢酸緩衝液(pH5.4)にて10倍希釈した後、Catalase溶液(0.1M Tris緩衝液、pH8.5)と1:4で混合し、2mg/ml Catalase溶液を得た。
上記Catalase溶液をパラフィンオイル中で結晶化液(2M硫安/0.1M Tris緩衝液、pH8.5)等量混合し、マイクロバッチ法による結晶化実験に供した(ウェル数:N=6)。
温度20℃、湿度50%の環境下で結晶生成を行い、14日後の結晶化率を前記式により求めた。結果を表8に示す。
【0078】
(比較例11:2液法、光照射のみ)
3,000rpm、20分間の振動を与えなかった以外は、実施例9と同様に、結晶生成を行い、14日後の結晶化率を求めた。結果を表8に示す。
【0079】
【表8】

【図面の簡単な説明】
【0080】
【図1】本発明の生体高分子結晶の製造方法に使用することができる装置の一例の概念図である。
【符号の説明】
【0081】
10:装置
12:装置本体
14:XYZステージ
16:振動ユニット
18:キセノン光源
20:切り替えフィルター
22:集光部
24:温度制御部
26:制御用コンピューター
28:搬入口
30:結晶化プレート
32:ウェル
34:ケーブル
【特許請求の範囲】
【請求項1】
結晶化剤溶液と生体高分子溶液とが混合された混合液を入れた容器を振動させる振動工程、及び、
振動させた混合液を入れた容器を保管する保管工程、を含むことを特徴とする
生体高分子結晶の製造方法。
【請求項2】
保管工程において振動させた混合液を撹拌する請求項1に記載の生体高分子結晶の製造方法。
【請求項3】
振動工程における振動の振動数が保管工程における撹拌の振動数よりも大きい請求項2に記載の生体高分子結晶の製造方法。
【請求項4】
混合液に光を照射する光照射工程を含む請求項1〜3いずれか1つに記載の生体高分子結晶の製造方法。
【請求項5】
保管した混合液中に生成した結晶の有無を判定する判定工程を実施し、
結晶の生成が認められない混合液に、振動工程をさらに実施する請求項1〜4いずれか1つに記載の生体高分子結晶の製造方法。
【請求項6】
生体高分子が蛋白質である請求項1〜5いずれか1つに記載の生体高分子結晶の製造方法。
【請求項7】
生体高分子溶液を入れた容器を振動させる振動工程、
振動させた生体高分子溶液と結晶化剤溶液とを混合した混合液を得る混合工程、及び、
混合液を入れた容器を保管する保管工程、を含むことを特徴とする
生体高分子結晶の製造方法。
【請求項8】
生体高分子溶液に光を照射する光照射工程を含む請求項7に記載の生体高分子結晶の製造方法。
【請求項9】
保管した混合液中に生成した結晶の有無を判定する判定工程を実施し、
結晶の生成が認められない混合液に、振動工程をさらに実施する請求項7又は8に記載の生体高分子結晶の製造方法。
【請求項10】
生体高分子が両性電解質であり、生体高分子溶液のpHが生体高分子の等電点近傍である請求項7〜9いずれか1つに記載の生体高分子結晶の製造方法。
【請求項11】
生体高分子が蛋白質である請求項7〜10いずれか1つに記載の生体高分子結晶の製造方法。
【請求項1】
結晶化剤溶液と生体高分子溶液とが混合された混合液を入れた容器を振動させる振動工程、及び、
振動させた混合液を入れた容器を保管する保管工程、を含むことを特徴とする
生体高分子結晶の製造方法。
【請求項2】
保管工程において振動させた混合液を撹拌する請求項1に記載の生体高分子結晶の製造方法。
【請求項3】
振動工程における振動の振動数が保管工程における撹拌の振動数よりも大きい請求項2に記載の生体高分子結晶の製造方法。
【請求項4】
混合液に光を照射する光照射工程を含む請求項1〜3いずれか1つに記載の生体高分子結晶の製造方法。
【請求項5】
保管した混合液中に生成した結晶の有無を判定する判定工程を実施し、
結晶の生成が認められない混合液に、振動工程をさらに実施する請求項1〜4いずれか1つに記載の生体高分子結晶の製造方法。
【請求項6】
生体高分子が蛋白質である請求項1〜5いずれか1つに記載の生体高分子結晶の製造方法。
【請求項7】
生体高分子溶液を入れた容器を振動させる振動工程、
振動させた生体高分子溶液と結晶化剤溶液とを混合した混合液を得る混合工程、及び、
混合液を入れた容器を保管する保管工程、を含むことを特徴とする
生体高分子結晶の製造方法。
【請求項8】
生体高分子溶液に光を照射する光照射工程を含む請求項7に記載の生体高分子結晶の製造方法。
【請求項9】
保管した混合液中に生成した結晶の有無を判定する判定工程を実施し、
結晶の生成が認められない混合液に、振動工程をさらに実施する請求項7又は8に記載の生体高分子結晶の製造方法。
【請求項10】
生体高分子が両性電解質であり、生体高分子溶液のpHが生体高分子の等電点近傍である請求項7〜9いずれか1つに記載の生体高分子結晶の製造方法。
【請求項11】
生体高分子が蛋白質である請求項7〜10いずれか1つに記載の生体高分子結晶の製造方法。
【図1】




【公開番号】特開2010−1220(P2010−1220A)
【公開日】平成22年1月7日(2010.1.7)
【国際特許分類】
【出願番号】特願2008−158827(P2008−158827)
【出願日】平成20年6月18日(2008.6.18)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 平成20年3月12日 社団法人日本化学会発行の「日本化学会第88春季年会 講演予稿集1」に発表
【出願人】(504145364)国立大学法人群馬大学 (352)
【出願人】(000005821)パナソニック株式会社 (73,050)
【Fターム(参考)】
【公開日】平成22年1月7日(2010.1.7)
【国際特許分類】
【出願日】平成20年6月18日(2008.6.18)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 平成20年3月12日 社団法人日本化学会発行の「日本化学会第88春季年会 講演予稿集1」に発表
【出願人】(504145364)国立大学法人群馬大学 (352)
【出願人】(000005821)パナソニック株式会社 (73,050)
【Fターム(参考)】
[ Back to top ]

