生分解性トリブロックコポリマー、その合成方法、ならびにそれから作製されるヒドロゲルおよび生体材料
【課題】薬物送達システムを提供すること。
【解決手段】シクロデキストリンおよび両親媒性コポリマーから形成されるヒドロゲルを含む薬物送達システムであって、該両親媒性コポリマーは、ポリ(アルキレンオキシド)を含むAポリマーブロックおよびポリ(ヒドロキシアルカノエート)を含むBポリマーブロックを含み、かつ治療有効量の少なくとも1種の治療剤が、ヒドロゲルの内心に含まれる。本発明の好ましい実施形態において、Aポリマーブロック10は、ポリ(エチレンオキシド)(PEO)であり、そしてBポリマーブロックは、ポリ[(R)−3−ヒドロキブチレート](PHB)であり、そして該コポリマーは、トリブロックABAコポリマーPEO−PHB−PEOである。両親媒性トリブロックコポリマーを合成する方法がまた、提供される。
【解決手段】シクロデキストリンおよび両親媒性コポリマーから形成されるヒドロゲルを含む薬物送達システムであって、該両親媒性コポリマーは、ポリ(アルキレンオキシド)を含むAポリマーブロックおよびポリ(ヒドロキシアルカノエート)を含むBポリマーブロックを含み、かつ治療有効量の少なくとも1種の治療剤が、ヒドロゲルの内心に含まれる。本発明の好ましい実施形態において、Aポリマーブロック10は、ポリ(エチレンオキシド)(PEO)であり、そしてBポリマーブロックは、ポリ[(R)−3−ヒドロキブチレート](PHB)であり、そして該コポリマーは、トリブロックABAコポリマーPEO−PHB−PEOである。両親媒性トリブロックコポリマーを合成する方法がまた、提供される。
【発明の詳細な説明】
【技術分野】
【0001】
(発明の分野)
本発明は、ポリ(ヒドロキシアルカノエート)ポリマーブロックおよびポリ(アルキレンオキシド)ポリマーブロックを有する、両親媒性コポリマーを合成する方法、このようなポリマーとシクロデキストリンとによって形成されるヒドロゲル、ならびにこのようなポリマーおよびヒドロゲルに基づく、注射可能なヒドロゲル薬物送達システムを含む生体材料に関する。
【背景技術】
【0002】
(発明の背景)
多くの薬物は、ヒトまたは他の哺乳動物の身体中に治療効果(これは、経時的にかなり変化する)を生じる方法によって送達するために合成される。静脈内経路によって送達される薬物は、血漿薬物濃度においてほぼ即時のピークを生じ得、続いて、この薬物が代謝されるにつれて、血漿レベルが次第に低下する。経口経路または筋肉内経路によって送達される薬物は、この薬物の全身取り込みの間に次第に増加する、血漿中の薬物濃度を生じ得、続いて、ピークの血漿薬物レベルから低下する。薬物投薬は、頻繁な間隔で(例えば、毎日)繰り返されることが必要であり得るが、これはせいぜい、連続的または一定の治療レベルに近づくにすぎない。
【0003】
多くの型の治療剤を、長期間にわたるこれらの薬物の徐放を提供する送達システムにおいて送達することが有利である。制御放出および薬物の送達のために使用される種々のポリマーが、過去20年間で開発された。これらのポリマーのほとんどは、移植物または注射可能な微小球に形成される。このようなポリマーは、生分解性かつ生体適合性であり、そして生分解性かつ生体適合性でなければならない。適切な形態のポリマーを生成するために、複雑な製造プロセスが必要とされ、これには代表的に、有機溶媒が関与する。しかし、有機溶媒の使用は、いくつかのタンパク質薬物の分解を引き起こし得、そしてさらに、有機溶媒は、微量でさえも、毒性であり得る。
【0004】
ポリマーヒドロゲルが、薬物送達および制御放出のために開発されている。例えば、化学的に架橋したポリマーヒドロゲルが、移植物として使用されている。いくつかの注射可能な薬物送達システムは、注射後に、身体内で化学的に架橋したヒドロゲルを形成し、薬物の蓄積を提供する。しかし、身体内で起こる化学反応は、これらのポリマーの存在および/またはこれらのポリマーのいくらかの分解に起因して、組織の刺激および損傷を引き起こし得る。
【0005】
物理的なポリマーヒドロゲルは、生体材料適用のために広範に開発されている。例としては、エナンチオマーポリマーまたはポリペプチドセグメントと、温度感受性特性またはpH感受性特性を有するヒドロゲルとの複合体化によって形成されるヒドロゲルが挙げられる。これらは、タンパク質のような繊細な生体活性剤の捕捉に関与する穏やかな水性条件に起因して、制御された薬物送達のための特別な注意を引く。例えば、インサイチュで形成される、熱感受性ブロックコポリマーから形成されるヒドロゲルはまた、薬物のための徐放材料として提唱されている。これらは、ゲル形成に関与する化学反応が存在しないという利点を有する。これらのコポリマーヒドロゲルは、通常、高分子薬物(例えば、タンパク質およびホルモン)のために設計される。このような温度感受性ヒドロゲルの欠点は、このようなゲルを注射において使用する実用性である。
【0006】
より最近は、両親媒性ブロックコポリマーは、固相および溶液中おけるその独特の鎖構造および物理的特性に起因して、基礎研究および適用についての特別な興味を引いた。Forster,S.ら、Adv.Mater.10:195−217(1998);Alexandridis,P.Curr.Opin.Colloid Interface
Sci.1:490−501(1996)。これらは、非常に規則的な自己構築構造体のための、超分子ポリマー化学における構築ブロックとして、徹底的に研究された。Forster(1998),Alexandridis(1996);Vanhest,J.ら、W.Science 268:1592−1595(1995);Jenekhe,S.ら、Science 283:372−375(1999);Kukula,H.ら、J.Am.Chem.Soc.124:1658−1663(2002)。両親媒性ブロックコポリマーは、この自己構築を利用する生体材料と考えられた。これらの研究は、新規な巨視的特性を有する生体材料を生じ、これらは、制御された薬物送達および組織操作のために使用される。Jeong,B.ら、Adv.Drug Delivery Rev.54:27−51(2002);Kissel,T.ら、Adv.Drug Delivery Rev.54:99−134(2002)。
【0007】
ポリ(エチレンオキシド)(PEO)は、親水性の生体適合性ポリエーテルとして広範に使用される。Herold,D.ら、Biochem.Pharmacol.38:73−76(1989)。親水性セグメントとしてPEOを含有する両親媒性ABAトリブロックコポリマーは、以前に研究されており、そして生体材料としての使用について記載されている。用語ABAとは、本明細書中で、第一のポリマーの中心セグメント(Bブロックポリマーと称される)、ならびに第二のポリマーの第一末端および第二末端のセグメント(Aブロックポリマーと称される)を含むポリマーをいうように使用される。代表的な例として、市販のポリ(エチレンオキシド)−ポリ(プロピレンオキシド)−ポリ(エチレンオキシド)(PEO−PPO−PEO、PluronicsTM)トリブロックコポリマーが、それらの相挙動および薬物送達のための潜在的な適用の観点で、徹底的に研究されている。Alexandridis,P.ら、Colloids Surf.96:1−46(1995);Bromberg,L.ら、Adv.Drug Del Rev.31:197−221(1998)。最近、さらなる注意が、PEOと生分解性ポリエステルとの両親媒性ABAトリブロックコポリマーに集中している。PEOおよびポリエステルからなるトリブロックコポリマー(例えば、ポリ(L−乳酸)(PLLA)、ポリ(グリコール酸))またはこれらのコポリエステルの合成および特徴付けが、報告されている。Jeong,B.ら、Nature 388:860−862(1997);Jeong,B.ら、Macromolecules 32:7064−7069(1999);米国特許第5,384,333号;米国特許第5,702,717号;米国特許第4,716,203号;米国特許第5,476,909号。このような両親媒性ブロックコポリマーは、水中で、ミセル、またはゲルさえも形成する傾向があり、これらは、注射可能な薬物送達システムのために潜在的に有用である。
【0008】
別の興味深いヒドロゲル系は、線状ポリマー(例えば、ポリ(エチレンオキシド)(PEO)をシクロデキストリン(CD)の内側空洞に貫入させて、ネックレス様の超分子構造を有する包接複合体を形成することによって作製される、ポリロタキサンからなる。Harada A.ら、Nature 356:325(1992);Li J.ら、Polym.J.26:1019(1994)。しかし、高分子量のPEOのみが、α−CDとヒドロゲルを形成し得、そしてこのヒドロゲルの、水溶液中での解離は、PEOの親水性の性質に起因して、迅速である。
【0009】
関連するヒドロゲルを使用する、注射可能な薬物送達システムは、発明者Liらの名義の米国特許出願2002/0019369 A1(発明の名称Injectable Drug Delivery Systems with Cyclodextrin−Polymer Based Hydrogels)に開示されており、その開示は、明白に本明細書中に参考として援用される。この出願は、シクロデキストリンポリマーベースの注射可能な組成物を開示し、この組成物は、CD、ポリ(エチレングリコール)(PEG)、PEG誘導体またはPEGコポリマーであるポリマー、および薬物から形成される。ポリ(プロピレングリコール)または他のポリ(アルキレングリコール)の使用が、このシステムにおけるポリマーとして参照される。この刊行物に開示されるポリマーヒドロゲルは、有望な徐放システムを提供するが、これらは、1週間より長い徐放のために最適化された放出速度論を提供することが実証されていない。
【0010】
ポリ[(R)−3−ヒドロキシブチレート](PHB)は、多くの微生物によって、炭素およびエネルギーの貯蔵物質として合成される、光学活性な生分解性ポリエステルである。Doi,Y.Microbial Polyesters;VCH Publisher,New York(1990)。
【0011】
Chaらに対する米国特許第5,702,717号は、疎水性のAポリマーブロック(これは、ポリ(α−ヒドロキシ酸)またはポリ(エチレンカーボネート)であり得る)および親水性のBポリマーブロック(これは、ポリ(エチレングリコール)である)から作製される、熱感受性の生分解性コポリマーを開示する。これらのポリマーは、薬物送達について開示されており、そして逆熱発生挙動を示すと特徴付けられている。ポリ(α−ヒドロキシ酸)ポリマーブロックの潜在的な例の開示される列挙は、ヒドロキシ酪酸を含む;しかし、これは、ポリ(β−ヒドロキシアルカノエート)であり、そしてChaらによって教示されるポリマークラスの範囲内ではなく、そしてChaらによって求められた特徴の全てを示すようではない。さらに、Chaらは、環状モノマーの開環重合が関与する合成プロセスを利用し、これは、ポリ(α−ヒドロキシ酸)の潜在的に望ましくないラセミ化を生じ得る。
【発明の概要】
【課題を解決するための手段】
【0012】
(発明の要旨)
本発明は、シクロデキストリンおよび両親媒性コポリマーから形成されるヒドロゲル、ならびにこのヒドロゲルの中心に含まれる治療有効量の少なくとも1つの治療剤を含有する、薬物送達システムを提供し、このコポリマーは、ポリ(アルキレンオキシド)を含むAポリマーブロックおよびポリ(ヒドロキシアルカノエート)を含むBポリマーブロックを含む。
【0013】
本発明はまた、両親媒性ABAトリブロックコポリマーを合成するためのプロセスを提供し、このコポリマーは、ポリ(エチレンオキシド)をAブロックポリマーとして、およびポリ(3−ヒドロキシブチレート)をBブロックポリマーとして含有する。このプロセスは、以下を包含する:ポリ(3−ヒドロキシブチレート)を、より低分子量を有するテレケリックポリ(3−ヒドロキシブチレート)−ジオールに変換する工程;メトキシ−ポリ(エチレンオキシド)−モノカルボン酸を、メトキシ−ポリ(エチレンオキシド)から生成する工程;ならびに1−3−ジシクロヘキシルカルボジイミドを使用して、ポリ(3−ヒドロキシブチレート)−ジオールをメトキシ−ポリ(エチレンオキシド)−モノカルボン酸とカップリングして、ABAトリブロックコポリマーを生じる工程。
【0014】
本発明はまた、シクロデキストリン、水ベースの流体中の治療有効量の少なくとも1つの治療剤、および両親媒性コポリマーを合わせることによって、ヒドロゲル薬物送達システムを形成するためのプロセスを提供し、ここで、このコポリマーは、ポリ(アルキレンオキシド)を含むAポリマーブロック、およびポリ(ヒドロキシアルカノエート)を含むBポリマーブロックを含有する。
【0015】
本発明の別の局面において、処置を必要とするヒトまたは他の哺乳動物を、少なくとも1つの治療剤で処置する方法が提供される。この方法は、少なくとも1つの治療剤を薬物送達システムにおいて投与することを提供し、この薬物送達システムは、シクロデキストリンおよび両親媒性コポリマーから形成されるヒドロゲルを含有し、ここで、このコポリマーは、ポリ(アルキレンオキシド)を含むAポリマーブロック、およびポリ(ヒドロキシアルカノエート)を含むBポリマーブロックを含有し、ここで、治療有効量の少なくとも1つの治療剤は、このヒドロゲルの中心に含まれる。
【0016】
本発明の1つの好ましい実施形態において、Aポリマーブロックは、ポリ(エチレンオキシド)(PEO)であり、そしてBポリマーブロックは、ポリ[(R)−3−ヒドロキシブチレート](PHB)である。α−シクロデキストリン(α−CD)とヒドロゲルを形成するためにこの実施例において使用されるコポリマーは、トリブロックPEO−PHB−PEOコポリマーである。
【0017】
本発明の実施例の両親媒性トリブロックコポリマーは、末端セグメントとしてPEOを使用し、そして中間セグメントとしてPHBを使用して、興味深い特徴を有する。なぜなら、PHBは、非常に結晶性かつ疎水性であるからである。さらに、PHBは、PLLAおよび他の多くの従来使用される生体ポリエステルより低いインビボ分解速度を有する。Gogolewski,S.ら、J.Biomed.Mat.Res.27:1135−1148(1993)。従って、PEO−PHB−PEOトリブロックコポリマーは、以前に開発されたポリマーより長期間の移植または薬物の制御送達のために、より有望であり得る。
【0018】
α−CDとPEOブロックとの間の複合体の自己構築に加えて、PHBの中央セグメントブロックの間の疎水性−疎水性相互作用は、ヒドロゲル網目構造をさらに強化する。このヒドロゲルの特性は、PHBおよびPEOの分子量およびモル比を調節することによって微調整され得、これらを種々の生物医学的適用(例えば、タンパク質、ペプチド、遺伝子、低分子、抗体およびそのフラグメント、ならびにヒト組換えタンパク質、抗原、DNA、RNAまたはDNAナノ粒子の送達のため、ならびに組織操作のため)のために潜在的に魅力的にする。
【0019】
本発明のPEO−PHB−PEOヒドロゲルは、他の公知のヒドロゲルと比較して、大いに増加された徐放特徴を有する。これは部分的に、中央セクションの、驚くべき程度までの疎水性の増加に起因する。これらのヒドロゲルはまた、増強された安定性を示し、ゲルをより迅速に形成し、そして必要とされるシクロデキストリンの使用がより少なく、任意の所望でない副作用(例えば、潜在的な炎症であり、これは、過剰のシクロデキストリンが利用される場合に起こり得る)を最小にする。
【0020】
本発明のPEO−PHB−PEOトリブロックコポリマーは、水性媒体中でのミセル形成に対する強い傾向を有する。本発明のコポリマーからのミセルの形成は、比較的温度非感受性である。この温度非感受性は、PHBおよびPLLAが類似の化学構造を有することを考慮して、他のポリ(α−ヒドロキシアルカン酸)(例えば、PLLAまたはPGA)(Jeong(2002);Kissel(2002);Jeong(1997);Jeong(1999))から形成されるミセルの相対的な温度不安定性と比較される場合に、予測不可能である。従って、本発明のミセルは、例えば、15〜45℃の範囲にわたって、薬物送達によく適している。なぜなら、これらは、この範囲内のより高い温度において、尚早に分解する傾向がなく、そしてこの範囲内のより低い温度において、より大きいサイズに迅速に凝集しないからである。
【0021】
本発明は、以下を提供する。
(項目1)
以下:
シクロデキストリンおよび両親媒性コポリマーから形成されるヒドロゲルであって、該コポリマーが、ポリ(アルキレンオキシド)を含むAポリマーブロックおよびポリ(ヒドロキシアルカノエート)を含むBポリマーブロックを含む、ヒドロゲル;および
ヒドロゲルの内心に(intimately)含まれる治療有効量の少なくとも1種の治療剤、
を含む薬物送達システム。
(項目2)
薬学的に受容可能な水性塩基をさらに含む、項目1に記載のシステム。
(項目3)
前記薬物送達システムが、注射可能である、項目1に記載のシステム。
(項目4)
前記ヒドロゲルが、チキソトロピーである、項目3に記載のシステム。
(項目5)
前記システムが、薬物送達の開始後少なくとも1週間の間、少なくとも1種の治療剤の徐放を提供する、項目1に記載のシステム。
(項目6)
前記システムが、薬物送達の開始後少なくとも2週間の間、少なくとも1種の治療剤の徐放を提供する、項目1に記載のシステム。
(項目7)
前記ポリ(アルキレンオキシド)が、以下:ポリ(エチレンオキシド)、ポリ(テトラメチレンオキシド)およびポリ(テトラヒドロフラン)からなる群から選択される、項目1に記載のシステム。
(項目8)
前記ポリ(アルキレンオキシド)が、ポリ(エチレンオキシド)である、項目7に記載のシステム。
(項目9)
前記ポリ(ヒドロキシアルカノエート)が、以下:
ポリ[(R)−3−ヒドロキシブチレート];ポリ[(R)−4−ヒドロキシブチレート];ポリ[(R)−3−ヒドロキシバレレート];ポリ[(R)−3−ヒドロキシブチレート]−co−ポリ[(R)−3−ヒドロキシバレレート];ポリ[(R)−3−ヒドロキシヘキサノエート];ポリ[(R)−3−ヒドロキシヘプタノエート];このような(R)エナンチオマーのそれぞれの(S)エナンチオマー;このような(S)エナンチオマーおよび(R)エナンチオマーのラセミ混合物;およびそれらの混合物、からなる群から選択される、項目1に記載のシステム。
(項目10)
前記ポリ(ヒドロキシアルカノエート)が、以下:ポリ[(R)−3−ヒドロキシブチレート];ポリ[(R)−4−ヒドロキシブチレート];このような(R)エナンチオマーのそれぞれの(S)エナンチオマー;(S)エナンチオマーおよび(R)エナンチオマーのラセミ混合物;およびそれらの混合物、からなる群から選択される、項目1に記載のシステム。
(項目11)
前記ポリ(ヒドロキシアルカノエート)が、ポリ[(R)−3−ヒドロキシブチレート]を含む、項目1に記載のシステム。
(項目12)
前記コポリマーが、1つのBポリマーブロック中間セグメントおよび2つのAポリマーブロック末端セグメントを含む両親媒性トリブロックコポリマーである、項目1に記載のシステム。
(項目13)
前記ポリ(ヒドロキシアルカノエート)Bブロックポリマーが、以下:ポリ[(R)−3−ヒドロキシブチレート];ポリ[(R)−4−ヒドロキシブチレート];ポリ[(R)−3−ヒドロキシバレレート];ポリ[(R)−3−ヒドロキシブチレート]−co−ポリ[(R)−3−ヒドロキシバレレート];ポリ[(R)−3−ヒドロキシヘキサノエート];ポリ[(R)−3−ヒドロキシヘプタノエート];このような(R)エナンチオマーのそれぞれの(S)エナンチオマー;このような(S)エナンチオマーおよび(R)エナンチオマーのラセミ混合物;およびそれらの混合物、からなる群から選択される、項目12に記載のシステム。
(項目14)
前記ポリ(アルキレンオキシド)Aブロックポリマーが、以下:ポリ(エチレンオキシド)、ポリ(テトラメチレンオキシド)およびポリ(テトラヒドロフラン)からなる群から選択される、項目12に記載のシステム。
(項目15)
ポリ(アルキレンオキシド)Aブロックポリマーが、ポリ(エチレンオキシド)である、項目14に記載のシステム。
(項目16)
前記ポリ(ヒドロキシアルカノエート)Bブロックポリマーが、以下:ポリ[(R)−3−ヒドロキシブチレート];ポリ[(R)−4−ヒドロキシブチレート];ポリ[(R)−3−ヒドロキシバレレート];ポリ[(R)−3−ヒドロキシブチレート]−co−ポリ[(R)−3−ヒドロキシバレレート];ポリ[(R)−3−ヒドロキシヘキサノエート];ポリ[(R)−3− ヒドロキシヘプタノエート];このような(R)エナンチオマーのそれぞれの(S)エナンチオマー;(S)エナンチオマーおよび(R)エナンチオマーのラセミ混合物;およびそれらの混合物、からなる群から選択される、項目15に記載のシステム。
(項目17)
前記ポリ(アルキレンオキシド)Aブロックポリマーおよび前記ポリ(ヒドロキシアルカノエート)Bブロックポリマーの各々が、500から20,000の分子量を有する、項目1に記載のシステム。
(項目18)
前記ポリ(アルキレンオキシド)Aブロックポリマーおよび前記ポリ(ヒドロキシアルカノエート)Bブロックポリマーの各々が、2,000から10,000の分子量を有する、項目1に記載のシステム。
(項目19)
前記ポリ(ヒドロキシアルカノエート)Bブロックポリマーが、3,000から2,500の分子量を有する、項目1に記載のシステム。
(項目20)
前記シクロデキストリンが、コポリマーの5重量%〜80重量%のレベルで含まれる、項目1に記載のシステム。
(項目21)
前記シクロデキストリンが、コポリマーの5重量%〜50重量%のレベルで含まれる、項目1に記載のシステム。
(項目22)
前記ヒドロゲルが、約1重量%〜約80重量%のレベルでコポリマーを含む水溶液を含む、項目1に記載のシステム。
(項目23)
前記ヒドロゲルが、約10重量%〜約40重量%のレベルでコポリマーを含む水溶液を含む、項目1に記載のシステム。
(項目24)
治療剤と複合体化し、そして/または治療剤と結合体化する第2のポリマーをさらに含む、項目1に記載のシステム。
(項目25)
前記第2のポリマーが、以下:ポリエステル、ポリウレタン、ポリアミド、ポリエーテル、ポリサッカリド、ポリ(アミノ酸)、ポリペプチドおよびタンパク質からなる群から選択されるポリマーである、項目24に記載のシステム。
(項目26)
前記第2のポリマーが、ポリ(エチレングリコール)セグメントを有する二官能性ポリマーまたは単官能性ポリマーである、項目24に記載のシステム。
(項目27)
DNAナノ粒子をさらに含む、項目1に記載のシステム。
(項目28)
前記コポリマーが、1,000から50,000の分子量を有する、項目1に記載のシステム。
(項目29)
前記コポリマー5,000〜35,000の分子量を有する、項目1に記載のシステム。
(項目30)
前記少なくとも1種の治療剤が、以下:ペプチド、タンパク質、低分子、遺伝子、抗原、抗体およびそのフラグメントならびにヒト組換えタンパク質、DNA、RNAおよびDNAナノ粒子からなる群から選択される、項目1に記載のシステム。
(項目31)
前記少なくとも1種の治療剤が、高分子形態である、項目1に記載のシステム。
(項目32)
前記少なくとも1種の治療剤が、以下:鎮痛剤、麻酔薬、抗関節炎薬物、疾患改変抗リウマチ薬物、抗喘息薬物、抗凝固剤、抗痙攣薬、抗うつ剤、抗糖尿病薬、抗悪性腫瘍薬、抗精神病薬、降圧薬、抗生物質、抗ヒスタミン剤、消炎剤、抗炎症薬、筋肉弛緩剤、駆虫薬、抗ウイルス薬、抗再狭窄薬、鎮痙剤、軟骨保護剤(chondroprotective agent)、抗接着剤、抗腫瘍細胞侵襲剤、血管弛緩薬、血管収縮薬および免疫抑制薬からなる群から選択される、項目1に記載のシステム。
(項目33)
前記少なくとも1種の治療剤が、以下:ペプチド、タンパク質(サイトカイン、成長因子、血管新生因子、可溶性レセプター、抗体およびそのフラグメントならびにヒト組換えタンパク質を含む)、低分子、遺伝子、抗原(ワクチンを含む)、DNA、RNAおよびDNAナノ粒子、からなる群から選択される、項目1に記載のシステム。
(項目34)
前記ヒドロゲルが、移植可能デバイスに適用される、項目1に記載のシステム。
(項目35)
前記移植可能デバイスが、以下:ステント、カテーテル、気道チューブ、導管、スクリュー、プレート、シャント、人工関節、人工心臓、人工弁および他の人工器官からなる群から選択される、項目34に記載のシステム。
(項目36)
以下:
シクロデキストリンおよび両親媒性コポリマーから形成されるヒドロゲルであって、該コポリマーが、ポリ(エチレンオキシド)を含むAポリマーブロックおよびポリ(ヒドロキシブチレート)を含むBポリマーブロックを含む、ヒドロゲル;および
ヒドロゲルの内心に(intimately)含まれる治療有効量の少なくとも1種の治療剤、
を含む薬物送達システム。
(項目37)
シクロデキストリンおよび両親媒性コポリマーを含むヒドロゲルであって、該コポリマーが、ポリ(アルキレンオキシド)を含むAポリマーブロックおよびポリ(ヒドロキシアルカノエート)を含むBポリマーブロックを含む、ヒドロゲル。
(項目38)
両親媒性ABAトリブロックコポリマーを合成するためのプロセスであって、該ABAトリブロックコポリマーは、Aブロックポリマーとしてポリ(エチレンオキシド)およびBブロックポリマーとしてポリ(3−ヒドロキシアルカノエート)を含み、該プロセスは、以下:
低い分子量を有するテレケリックポリ(3−ヒドロキシアルカノエート)−ジオールにポリ(3−ヒドロキシアルカノエート)を変換する工程;
メトキシ−ポリ(エチレンオキシド)からメトキシ−ポリ(エチレンオキシド)−モノカルボン酸を生成する工程;および
1,3−ジシクロヘキシルカルボジイミドを用いて、メトキシ−ポリ(エチレンオキシド)−モノカルボン酸とポリ(3−ヒドロキシアルカノエート)−ジオールとをカップリングして、ABAトリブロックコポリマーを得る工程、
を包含する、プロセス。
(項目39)
前記ポリ(3−ヒドロキシアルカノエート)が、ポリ(3−ヒドロキシブチレート)であり、そしてポリ(3−ヒドロキシアルカノエート)−ジオールが、ポリ(3−ヒドロキシブチレート)−ジオールである、項目38に記載のプロセス。
(項目40)
前記ポリ(3−ヒドロキシアルカノエート)が、エチレングリコールを用いるエステル交換反応によって、テレケリックポリ(3−ヒドロキシアルカノエート)−ジオールに変換される、項目38に記載のプロセス。
(項目41)
前記メトキシ−ポリ(エチレンオキシド)−モノカルボン酸が、1,4−ジオキサン中、4−(ジメチルアミノ)ピリジンおよびトリエチルアミンの存在下、無水コハク酸とメトキシ−ポリ(エチレンオキシド)とを反応することによって生成される、項目38に記載のプロセス。
(項目42)
前記ポリ(3−ヒドロキシアルカノエート)−ジオールおよび前記メトキシ−ポリ(エチレンオキシド)−モノカルボン酸が、カップリング工程の前に乾燥される、項目38に記載のプロセス。
(項目43)
前記ポリ(3−ヒドロキシアルカノエート)−ジオールおよび前記メトキシ−ポリ(エチレンオキシド)−モノカルボン酸が、乾燥塩化メチレン中でカップリングされる、項目38に記載のプロセス。
(項目44)
前記ポリ(3−ヒドロキシアルカノエート)−ジオールおよび前記メトキシ−ポリ(エチレンオキシド)−モノカルボン酸が、窒素雰囲気下、乾燥塩化メチレン中でカップリングされる、項目43に記載のプロセス。
(項目45)
前記ポリ(3−ヒドロキシアルカノエート)−ジオールおよび前記メトキシ−ポリ(エチレンオキシド)−モノカルボン酸が、過剰なメトキシ−ポリ(エチレンオキシド)−モノカルボン酸とカップリングされる、項目38に記載のプロセス。
(項目46)
ABAトリブロックコポリマーを、以下:メタノール/ジエチルエーテルおよびクロロホルム/ジエチルエーテルからなる群から選択される混合溶媒を使用して、単離する工程をさらに包含する、項目38に記載のプロセス。
(項目47)
以下:
両親媒性ABAコポリマーから形成されるミセルであって、ここで、コポリマーが、ポリ(アルキレンオキシド)を含むAポリマーブロックおよび以下:ポリ[(R)−3−ヒドロキシブチレート]、ポリ[(R)−4−ヒドロキシブチレート]、このような(R)エナンチオマーのそれぞれの(S)エナンチオマー、このような(S)エナンチオマーおよび(R)エナンチオマーのラセミ混合物、およびそれらの混合物からなる群から選択される、ポリ(ヒドロキシアルカノエート)を含むBポリマーブロックを含む、ミセル;および
ミセル内にintimately含まれる治療有効量の少なくとも1種の治療剤、
を含む、薬物送達システム。
(項目48)
薬学的に受容可能な水性塩基をさらに含む、項目47に記載のシステム。
(項目49)
前記ミセルが、ヒドロゲルを形成するように水性塩基中で十分な濃度である、項目48のシステム。
(項目50)
前記ヒドロゲルが、移植可能デバイスに適用される、項目49に記載のシステム。
(項目51)
前記移植可能なデバイスが、以下:ステント、カテーテル、気道チューブ、導管、スクリュー、プレート、シャント、人工関節、人工心臓、人工弁および他の人工器官からなる群から選択される、項目50に記載のシステム。
(項目52)
前記システムが、薬物放出の開始後、少なくとも約1週間の間、少なくとも1種の治療剤の徐放を提供する、項目47に記載のシステム。
(項目53)
前記ポリ(アルキレンオキシド)が、以下:ポリ(エチレンオキシド)、ポリ(テトラメチレンオキシド)およびポリ(テトラヒドロフラン)からなる群から選択される、項目47に記載のシステム。
(項目54)
前記ポリ(アルキレンオキシド)が、ポリ(エチレンオキシド)である、項目53に記載のシステム。
(項目55)
前記ポリ(ヒドロキシアルカノエート)が、ポリ[(R)−3−ヒドロキシブチレート]を含む、項目54に記載のシステム。
(項目56)
前記ポリ(ヒドロキシアルカノエート)が、ポリ[(R)−3−ヒドロキシブチレート]を含む、項目47に記載のシステム。
(項目57)
前記ポリ(アルキレンオキシド)Aブロックポリマーおよび前記ポリ(ヒドロキシアルカノエート)Bブロックポリマーの各々が、500〜20,000の分子量を有する、項目47に記載のシステム。
(項目58)
前記ポリ(アルキレンオキシド)Aブロックポリマーおよび前記ポリ(ヒドロキシアルカノエート)Bブロックポリマーの各々が、2,000〜10,000の分子量を有する、項目47に記載のシステム。
(項目59)
前記ポリ(ヒドロキシアルカノエート)Bブロックポリマーが、3,000〜2,500の分子量を有する、項目47に記載のシステム。
(項目60)
前記治療剤と複合体化し、そして/または結合体化する第2のポリマーをさらに含む、項目47に記載のシステム。
(項目61)
前記ミセルが、少なくとも1種の治療剤をカプセル化するナノ粒子または微粒子を形成する、項目47に記載のシステム。
(項目62)
前記コポリマーが、1,000〜50,000の分子量を有する、項目47に記載のシステム。
(項目63)
前記コポリマーが、5,000〜35,000の分子量を有する、項目47に記載のシステム。
(項目64)
前記少なくとも1種の治療剤が、以下:ペプチド、タンパク質、低分子、遺伝子、抗原、抗体およびそれらのフラグメント、ならびにヒト組換えタンパク質、DNA、RNAおよびDNAナノ粒子からなる群から選択される、項目47に記載のシステム。
(項目65)
前記少なくとも1種の治療剤が、高分子形態である、項目47に記載のシステム。
(項目66)
前記少なくとも1種の治療剤が、以下:鎮痛剤、麻酔薬、抗関節炎薬物、疾患改変抗リウマチ薬物、抗喘息薬物、抗凝固剤、抗痙攣薬、抗うつ剤、抗糖尿病薬、抗悪性腫瘍薬、抗精神病薬、降圧薬、抗生物質、抗ヒスタミン剤、消炎剤、抗炎症薬、筋肉弛緩剤、駆虫薬、抗ウイルス薬、抗再狭窄薬、鎮痙剤、軟骨保護剤、抗接着剤、抗腫瘍細胞侵襲剤、血管弛緩薬、血管収縮薬および免疫抑制薬からなる群から選択される、項目47に記載のシステム。
(項目67)
前記少なくとも1種の治療剤が、以下:ペプチド、タンパク質(サイトカイン、成長因子、血管新生因子、可溶性レセプター、抗体およびそのフラグメントならびにヒト組換えタンパク質を含む)、低分子、遺伝子、抗原(ワクチンを含む)、DNA、RNAおよびDNAナノ粒子、からなる群から選択される、項目47に記載のシステム。
(項目68)
前記ミセルが、15℃〜45℃の範囲の温度で実質的に安定である、項目47に記載のシステム。
【図面の簡単な説明】
【0022】
本発明の上記局面および付随する利点の多くは、添付の図面と組み合わせて考慮される場合に、以下の詳細な説明を参照することによって、より容易に理解される。
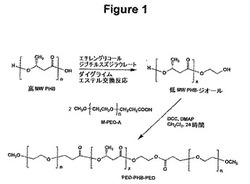
【図1】図1は、本発明の実施形態に従う、ポリ(エチレンオキシド)−ポリ[(R)−3−ヒドロキシブチレート]−ポリ(エチレンオキシド)(PEO−PHB−PEO)コポリマーの合成のための化学反応スキームを提供する。
【図2】図2は、実施例1において生成されたPEO−PHB−PEOコポリマーについて、および対応するプレポリマーについての、ゲル透過クロマトグラフィー(GPC)のクロマトグラムを提供する。
【図3】図3は、実施例1において生成されたPEO−PHB−PEOコポリマーについて、および対応するプレポリマーについての1H NMRスペクトルを提供する。
【図4】図4は、実施例1のプロセスに従って生成されたPEO−PHB−PEO(2000−3900−2000)コポリマーについて、および対応するプレポリマーについてのFTIRスペクトルを提供する。
【図5】図5は、実施例1のプロセスに従って生成されたPEO−PHB−PEOコポリマーについて、および対応するプレポリマーについての、熱重量分析(TGA)の間の減量曲線を提供する。
【図6】図6は、実施例1のプロセスに従って生成された、様々な分子量のPEO−PHB−PEOコポリマーについて、および対応するプレポリマーについての、示差走査熱分析(DSC)サーモグラムを提供する。
【図7】図7は、実施例1のプロセスに従って生成された、様々な分子量のPEO−PHB−PEOコポリマーについて、および対応するプレポリマーについての、示差走査熱分析(DSC)サーモグラムを提供する。
【図8】図8は、実施例1のプロセスに従って生成された、様々な分子量のPEO−PHB−PEOコポリマーについて、および対応するプレポリマーについての、広角X線回折(XRD)図を提供する。
【図9】図9は、実施例1のプロセスに従って生成された、様々な分子量のPEO−PHB−PEOコポリマーについて、および対応するプレポリマーについての、広角X線回折(XRD)図を提供する。
【図10】図10は、以下から放出される、BSA−FITC(1.0mgのBSA−FITCを負荷された300mgのヒドロゲル)についての、実施例2からのインビトロ放出プロフィールを示す:α−CD−PEO(10000)ヒドロゲル(黒丸)(従来技術);α−CD−PEO(20000)ヒドロゲル(黒菱形)(従来技術);本発明の実施形態に従うα−CD−PEO−PHB−PEO(5000−2350−5000)ヒドロゲル(黒三角);および本発明の実施形態に従うα−CD−PEO−PHB−PEO(5000−3850−5000)ヒドロゲル(黒四角)。
【図11】図11は、以下から放出される、デキストラン−FITC(1.0mgのデキストラン−FITC(20,000のMn)を負荷された300mgのヒドロゲル)についての、実施例3からのインビトロ放出プロフィールを示す:PEOーPHB−PEO(5000−5500−5000)ヒドロゲル(黒四角);本発明の実施形態に従うα−CD−PEO−PHB−PEO(5000−5500−5000)ヒドロゲル(黒丸);および本発明の実施形態に従うα−CD−PEO−PHB−PEO(5000−3800−5000)ヒドロゲル(黒三角)。
【図12】図12は、α−CDと複合体化した種々の分子量のPEO−PHB−PEOコポリマーと比較した、複合体化していないPEO−PHB−PEOコポリマーについてのXRD図を提供する。
【図13】図13は、γ−CDと複合体化した種々の分子量のPEO−PHB−PEOコポリマーと比較した、複合体化していないPEO−PHB−PEOコポリマーについてのXRD図を提供する。
【図14】図14は、α−CDと複合体化した種々の分子量のPEO−PHB−PEOコポリマーと比較した、複合体化していないPEO−PHB−PEOコポリマーについてのDSCサーモグラムを提供する。
【図15】図15は、γ−CDと複合体化した種々の分子量のPEO−PHB−PEOコポリマーと比較した、複合体化していないPEO−PHB−PEOコポリマーについてのDSCサーモグラムを提供する。
【図16】図16は、複合体化していないα−CD、およびPEO−PHB−PEO(2000−5200−2000)コポリマーと複合体化したα−CDについての13C CP/MAS NMRスペクトルを提供し、矢印は、コンホメーションが制限されたグリコシド単結合に隣接するC−1およびC−4についての分解された共鳴を示す。
【図17】図17は、DMSO−d6中での、PEO−PHB−PEO(2000−5200−2000)コポリマーと複合体化したα−CDの400 1H NMRスペクトルを提供する。
【図18】図18は、複合体化していないPEO−PHB−PEO(2000−5200−2000)コポリマーについての、α−CDまたはγ−CDのいずれかと複合体化したこのコポリマーと比較した、および純粋なα−CDと比較した、異なる解像度のFTIRスペクトルを提供する。
【図19】図19は、複合体化していないPEO−PHB−PEO(2000−5200−2000)コポリマーについての、α−CDまたはγ−CDのいずれかと複合体化したこのコポリマーと比較した、および純粋なα−CDと比較した、異なる解像度のFTIRスペクトルを提供する。
【図20】図20は、純粋なα−CD、純粋なPEO−PHB−PEO(2000−5200−2000)コポリマーおよびこのコポリマーとα−CDとの複合体の、熱重量分析(TGA)曲線を提供する。
【図21】図21は、実施例5からのPEO−PHB−PEOコポリマーの、様々な濃度の23℃の水溶液における、ピレンプローブ(6.0×10−7M)についての373nmにおいてモニタリングされた、定常状態蛍光励起スペクトルを提供する。
【図22】図22は、実施例5からのPEO−PHB−PEOコポリマーの濃度の、23℃のコポリマー溶液中のピレンのI337/I334の比に対する影響を図示する。
【図23】図23は、実施例5からのPEO−PHB−PEOコポリマーの様々な濃度の水溶液中のピレンのI337/I334の比に対する温度の影響を図示する。
【図24a】図24aは、リン酸緩衝化生理食塩水の関節内注射の1週間後の、ウサギ膝関節の組織学を示す画像(元の倍率10倍)を提供する。
【図24b】図24bは、α−CD−PEO−PHB−PEO(5000−2000−5000)ヒドロゲルの関節内注射の1週間後の、ウサギ膝関節の組織学を示す画像(元の倍率10倍)を提供する。
【発明を実施するための形態】
【0023】
(好ましい実施形態の詳細な説明)
本発明は、シクロデキストリンおよび両親媒性コポリマーから形成されるヒドロゲル、ならびにこのヒドロゲルの中心に含まれる治療有効量の少なくとも1つの治療剤を含有する、薬物送達システムを提供し、この両親媒性コポリマーは、ポリ(アルキレンオキシド)を含むAポリマーブロックおよびポリ(ヒドロキシアルカノエート)を含むBポリマーブロックを含有する。本発明の1つの好ましい実施形態において、Aポリマーブロックは、ポリ(エチレンオキシド)(PEO)であり、そしてBポリマーブロックは、ポリ[(R)−3−ヒドロキシブチレート](PHB)であり、そしてこのコポリマーは、トリブロックABAコポリマーPEO−PHB−PEOである。本発明のポリ(アルキレンオキシド)−ポリ(ヒドロキシアルカノエート)−ポリ(アルキレンオキシド)コポリマーのAブロックポリマー成分およびBブロックポリマー成分が、ここで記載される。
【0024】
(ポリ(アルキレンオキシド))
親水性のポリ(アルキレンオキシド)の末端セグメント構造(Aブロックポリマー)が、本発明のトリブロックコポリマーにおいて使用される。ポリ(アルキレンオキシド)は、ポリ(エチレンオキシド)、ポリ(テトラメチレンオキシド)およびポリ(テトラヒドロフラン)から適切に選択される。本発明において使用するために好ましいポリ(アルキレンオキシド)は、ポリ(エチレンオキシド)(PEO)またはその誘導体であり、そして最も好ましくは、PEOである。PEOはまた、ポリ(エチレングリコール)ともまた称され、そして本明細書中で使用される場合、用語ポリ(エチレンオキシド)(および略号PEO)は、ポリ(エチレングリコール)(PEG)もまた言及することが意図される。
【0025】
ポリ(アルキレンオキシド)は、異なる形態および異なる末端基を有し得る。例えば、PEOの場合、PEO誘導体は、異なる構造(例えば、星型PEO、櫛形PEOなど)を有し得る。ポリ(エチレンオキシド)は、修飾された分子の形態(例えば、PEG化(PEGylated)多糖類、PEG化ポリ(アミノ酸)、PEG化タンパク質など)であり得る。さらに、PEOのポリアミン誘導体(例えば、PEG化ポリ(エチレンイミン)またはPEG化ポリリジン)が使用され得る。
【0026】
本発明のコポリマーにおいてAブロックポリマーとして利用される、PEOまたは他のポリ(アルキレンオキシド)の相対分子量(Mr)範囲は、適切には、500〜2,000であり、そして好ましくは、2,000〜10,000である。
【0027】
(ポリ(ヒドロキシアルカノエート))
高度に疎水性のポリ(ヒドロキシアルカノエート)の中央部分の構造(Bブロックポリマー)は、本発明のトリブロックコポリマーにおいて使用される。適切なポリ(ヒドロキシアルカノエート)は、a)ポリマー鎖間の疎水性−疎水性相互作用が、マクロ分子の組立てを促進し、必要とされるCDの濃度を減少するように、比較的疎水性であり;b)生体分解性であり;そしてc)無毒性かつ生体適合性である。
【0028】
本発明において使用するために適切な疎水性Bポリマーブロックは、ポリ(ヒドロキシアルカノエート)である。本発明において使用するために適切なポリ(ヒドロキシアルカノエート)の例としては以下が挙げられる:ポリ[(R)−3−ヒドロキシブチレート](PHB)(ポリ[(R)−3−ヒドロキシ酪酸(hydroxybutryic acid)]またはポリ(β−ヒドロキシ酸)とも呼ばれる);ポリ[(R)−4−ヒドロキシブチレート](PGHB);ポリ[(R)−3−ヒドロキシバレレート](PHV);ポリ[(R)−3−ヒドロキシブチレート]−co−ポリ[(R)−3−ヒドロキシバレレート](PHB/HV);ポリ[(R)−3−ヒドロキシヘキサノエート](PHHx);ポリ[(R)−3−ヒドロキシヘプタノエート](PHHp);上記の(R)鏡像異性体の各々の(S)鏡像異性体;上記(S)鏡像異性体および(R)鏡像異性体のラセミ混合物;ならびに上記ポリ(ヒドロキシアルカノエート)の混合物。好ましいポリ(ヒドロキシアルカノエート)は、ポリ(β−ヒドロキシアルカノエート)であり、より具体的には、ポリ[(R)−3−ヒドロキシブチレート](PHB)および関連のポリ[(R)−3−ヒドロキシアルカノエート]である。本発明において使用するために最も好ましいポリ(ヒドロキシアルカノエート)は、PHBである。
【0029】
PHBまたは本発明のコポリマーにおいてBブロックポリマーとして利用される他のポリ(ヒドロキシアルカノエート)の相対分子量(Mr)範囲は、適切には、500〜2,000であり、好ましくは、2,000〜10,000であり、より好ましくは、2,500〜7,500であり、そして、最も好ましくは、3,000〜5,000である。
【0030】
(コポリマー)
本発明は、本明細書中で以下にさらに説明される、独特の合成プロセスを用いて産生される、ポリ(アルキレンオキシド)とポリ(ヒドロキシアルカノエート)との両親媒性コポリマーを提供する。好ましくは、これらのコポリマーは、ABAトリブロックコポリマー(例えば、例として、PEO−PHB−PEO)である。本発明のこのようなトリブロックコポリマーは、シクロデキストリンとヒドロゲルを形成し、持続放出薬物送達および他の生物医学的適用に有用である。本発明はまた、ポリ(アルキレンオキシド)とポリ(ヒドロキシアルカノエート)とのABブロックコポリマー(例えば、例として、PEO−PHB)に関する。このようなABブロックコポリマーはまた、シクロデキストリンと有用なヒドロゲルを形成すると考えられる。従って、トリブロックABAポリマーが好ましいが、本明細書中に記載される本発明の全ての実施形態がまた、ポリ(アルキレンオキシド)とポリ(ヒドロキシアルカノエート)とのABブロックコポリマーに適用されることが理解されるべきである。本発明のポリマーの他の改変がまた可能である。例えば、かさ高いブロッキング基は、生物分解性結合(例えば、L−フェニルアラニン、L−トリプトファン、ニコチニル基など)を介してポリマー鎖の末端に結合体化され得る。
【0031】
本発明のPEO−PHB−PEOポリマーの分子量は、適切には、1,000と50,000との間であり、好ましくは、5,000と35,000との間である。
【0032】
本発明のコポリマーは、生物吸収性、生物分解性、生体適合性であるように処方され得、シクロデキストリンとヒドロゲルを形成し得る。生物吸収性とは、分散したポリマー分子の分解を伴ってかまたは伴わずに、ポリマーが、体内において、その最初の適用部位から消失し得ることを意味する。生物分解性とは、加水分解または酵素的分解によって、ポリマーが、体内において、崩壊または分解し得ることを意味する。生体適合性とは、全ての成分が、体内で無毒性であることを意味する。
【0033】
(シクロデキストリン)
シクロデキストリン(すなわち、1つのシクロデキストリン)は、トリブロックコポリマーのセグメントを複合化するための錯化剤として本発明において使用される。次いで、これらのシクロデキストリン貫通ポリマーのクラスター形成は、ヒドロゲルを形成する。シクロデキストリンは、α1,4結合により連結された6、7、8またはそれ以上のD(+)グリコピラノース単位から構成される、一連の天然の環状オリゴ糖である。シクロデキストリンは、生物分解性かつ生体適合性であり、天然に合成されても人工的に合成されてもよい。シクロデキストリンは、例えば、微生物により天然に合成され得る。シクロデキストリンは、例えば、溶解度、複合体形成能および特異性を改善するように、その特性を操作するように人工的に改変され得る。本明細書中で使用される場合、シクロデキストリンは、天然の形態および人工的に改変された形態の全ての形態をさす。適切なシクロデキストリンとしては、α−シクロデキストリン、β−シクロデキストリン、γ−シクロデキストリンおよびこれらの誘導体(疎水性誘導体、親水性誘導体、荷電シクロデキストリンなどを含む)が挙げられる。好ましいシクロデキストリンは、α−シクロデキストリンである。
【0034】
(ポリマー合成)
PEO−PHB−PEOトリブロックコポリマーの合成のための手順は、図1の反応スキームにおいて示されている。本発明に従ってPEO−PHB−PEOトリブロックコポリマーを合成するために、まず、従来技術を使用して、ポリマー前駆体が調製される。天然の供給源であるPHBは、高い分子量を有し、1つのヒドロキシ末端基と1つのカルボキシ末端基を有する。天然の供給源であるPHBはまた、光学活性において純粋である。高分子量の天然供給源であるPHBは、公知の技術を使用して、エチレングリコールとのエステル転移反応によって、低い分子量を有するテレケリック(telechelic)ヒドロキシル末端PHB(PHB−ジオール)に変換される。例えば、エステル転移反応は、触媒としてジラウリル酸ジブチルスズを用いてジグリム(ジエチレングリコールジメチルエーテル)中にて行われ得る。エステル転移反応は、2〜3時間から一晩進行されて、ゲル浸透クロマトグラフィー(GPC)により決定される場合に、数百〜数千の範囲の平均分子量を有するPHB−ジオールを生じる。メトキシ−PEO−モノカルボン酸(M−PEO−A)プレポリマーは、適切には、1,4−ジオキサン中、公知の技術を使用して、4−(ジメチルアミノ)ピリジン(DMAP)およびトリエチルアミンの存在下、メトキシ−PEOと無水コハク酸との反応により調製される。
【0035】
次いで、これらのポリマー前駆体(すなわち、プレポリマー)は、本発明の方法に従ってカップリングされ、所望のトリブロックコポリマーを得る。プレポリマー(PHB−ジオールおよびM−PEO−A)は、好ましくはまず乾燥される。なぜならば、カップリング反応は湿度感受性であるからである。二官能化PHB−ジオールは、カップリング剤として1,3−ジシクロヘキシルカルボジイミド(DCC)を使用してM−PEO−Aとカップリングされ、PEO−PHB−PEOトリブロックコポリマーを得る。再度、湿度感受性に起因して、カップリング反応は、窒素雰囲気下にて、乾燥塩化メチレン中で行われる。M−PEO−Aは、全てのPHB−ジオールがトリブロックコポリマーに変換されることを確実にするために、カップリング反応において過剰であるべきである。
【0036】
次いで、標的のトリブロックコポリマーが単離され、1回以上の沈殿および混合溶媒(適切には、メタノール/ジエチルエーテルまたはクロロホルム/ジエチルエーテル)での注意深い分取により反応混合物から精製される。このポリマーのPHBブロックは、十分に規定された(R)ラセミ立体配置を保持する。
【0037】
PHBの(R)鏡像異性体を使用するトリブロックコポリマーの産生に加えて、この合成プロセスはまた、PHBの(S)鏡像異性体、ならびに(S)および(R)鏡像異性体のラセミ混合物、ならびに、他の関連のポリ(3−ヒドロキシアルカノエート)およびそのコポリマーの産生にも有用であることが予期される。
【0038】
(ヒドロゲルアセンブリ)
本発明の両親媒性トリブロック(triblock)コポリマーとシクロデキストリンとの間の超分子自己アセンブリは、物理的に架橋している注射可能なヒドロゲルを形成する。超分子自己アセンブリは、良好に規定された微視的アセンブリおよび巨視的特徴を有する特異的な相への複数分子成分の自発会合に関する。本発明のヒドロゲルでは、疎水性相互作用が、PHBの(例えば)断片中央間で生じながら、PEO(例えば)断片が、お互いに自己アセンブリする。薬物は、本発明のシクロデキストリンポリマーに基づく注射可能なヒドロゲルから形成されるインビボでのマトリックスまたはキャリアから持続的な様式で送達され得る。
【0039】
シクロデキストリン−ポリマーに基づく注射可能なヒドロゲル組成物は、任意の適切な方法で調製され得る。薬物なしのヒドロゲルを形成するために、シクロデキストリンを水性キャリア流体(例えば、脱イオン化水または生理食塩水)と合わせる。シクロデキストリン溶液を混合し、次いで、両親媒性コポリマー成分(例えば、PEO−PHB−PEO)を加える。混合物を、ほぼ0℃〜25℃の温度まで、好ましくは冷蔵温度(例えば、4℃)まで冷却する。得られる生成物は、白色の粘稠性ヒドロゲルである。
【0040】
ヒドロゲルを、薬物の送達に使用するために調製しているならば、最初に、水溶液中の薬物を、シクロデキストリンと適切に合わせて、その後、コポリマーを加える。あるいは、最初に、薬物の溶液をコポリマーと合わせ得る。薬物を最初に含む水溶液は、薬学的に受容可能で注射可能な水性流体である。薬学的に受容可能で注射可能な水溶性流体としては、注射可能な生理食塩水であり得るが、これに限定されない。望むならば、この水性流体はまた、緩衝剤および/または保存剤を含み得る。適切な緩衝剤としては、アルカリ炭酸塩またはアルカリ土類炭酸塩、リン酸塩、炭酸水素塩、クエン酸塩、ホウ酸塩、酢酸塩およびコハク酸塩が挙げられるが、これらに限定されない。適切な保存剤としては、重亜硫酸ナトリウム、チオ硫酸ナトリウム、アスコルビン酸塩、ベンザルコニウムクロライド、クロロブタノール、チオメルソール、ホウ酸フェニル水銀、パラベン、ベンジルアルコールおよびフェニルエタノールが挙げられるが、これらに限定されない。使用するならば、保存剤および緩衝剤は、利用される治療剤との適合性に一部基づいて選択される。
【0041】
好ましくは、ポリマーは、シクロデキストリンとヒドロゲルを形成する水溶液中にある。例えば、適切な水溶性ポリマー溶液は、約1%〜約80%のポリマー、好ましくは、約10%〜約40%のポリマーを含む。適切なヒドロゲルは、約1.0%〜約20%のシクロデキストリン(w/w)(全溶液の重量に基づく)、好ましくは、約5%〜15%のシクロデキストリンを含む。述べたように、ヒドロゲルは、代表的には、水性キャリア流体を使用して形成される。例えば、代表的な水溶液は、約1%〜約80%のポリマー、好ましくは、約10%〜約40%を含む。
【0042】
本発明に従って、特定の用途のために、所望の放出動力学(薬物送達適用のため)および物理的特性(すなわち、ゾル粘性およびゲル−ゾル変換特性)を有する注射可能なヒドロゲルを提供する十分な量および相対的な割合で、シクロデキストリンおよびポリマーを合わせる。注射可能な薬物送達システムに使用するとき、皮下ニードルを通して(剪断誘導変換による)ゾルとして注射可能なゲルを生じるのに十分な量のシクロデキストリンが使用される。適切には、シクロデキストリンとポリマーとの重量比は、0.05:1.0〜0.5:1.0である(すなわち、シクロデキストリンは、ポリマーの5重量%〜80重量%含まれる)。好ましくは、シクロデキストリンは、ポリマーの5重量%〜50重量%含まれる。
【0043】
所望の放出動力学(薬物送達のため)および物理的特性を達成するのに必要な最小量のシクロデキストリンを使用して、インビボでの炎症応答を引き起こし得るシクロデキストリンレベルを避けることが望ましい。本発明のヒドロゲルは、シクロデキストリンおよびホモポリマーPEOにより形成される従来のヒドロゲルよりも、ゲルを形成するのに実質的により少ないシクロデキストリン(例えば、50%未満)を必要とすると考えられる。1つの極端な例として、特定のPEO/PHBの組み合わせを有する幾つかのコポリマーは、CDなしでゲルを形成し得る。しかしながら、CDとでは、ゲルは、有意に改善された放出動力学を与える。このことは、CDの量が、ゲルの放出動力学を調整するために選択され得るので、重要である。
【0044】
(ヒドロゲル特性およびさらなる成分)
本発明のヒドロゲルは、生体吸収性、生分解性および生体適合性である。それは、温度感受性であると考えられており、揺変性であり、そして特定条件下でゲルとゾルの間を反転する。ゲル−ゾル変換温度は、一般的に室温より上であり、これは、ゲルの組成ならびにコポリマーの化学構造および分子量に依存する。本発明のトリブロックABAポリマー(AブロックとしてPEOおよびBブロックとしてPHBを含む)からのヒドロゲルの形成は、相対的に温度非感受性であると分っている。10〜45℃の範囲の温度で、ゲルおよびミセルの形成は、主に、温度よりもむしろ濃度に依存する。このポリマーと形成されるヒドロゲルおよびミセル(これは、低温で解離し難く、高温で大きなサイズに凝集し難い)は、それ故安定であり、薬物送達のために容易に取り扱われる。
【0045】
ヒドロゲルの揺変性の性質のために、ヒドロゲルが、注射可能なヒドロゲル(およびこれに含まれる任意の薬物)を与えるのに十分な剪断力に供されるとき、ゾルに変換する。例えば、ヒドロゲルは、27Gと同じほど小さなニードルを通過するように通され得る。
【0046】
ヒドロゲルのpHは、ほぼ約6.5〜約7.8であり、これは、身体に注射するのに適したpHレベル範囲である。pHレベルは、任意の適切な酸または塩基(例えば、塩酸または水酸化ナトリウム)の使用によって調整され得る。
【0047】
ヒドロゲル組成物はまた、第2のポリマーを含み得、これは、薬物と複合体化し得るか、薬物と抱合し得るか、またはそれらの両方かであり得る。この第2のポリマーは、適切には、ポリエステル、ポリウレタン、ポリアミド、ポリエーテル、ポリサッカライド、ポリ(アミノ酸)、ポリペプチドまたはタンパク質であり得る。好ましくは、この第2のポリマーは、ジ−またはモノ−官能性ポリマーまたは(ポリエチレングリコール)断片を有するポリイオン性ポリマーである。薬物がヒドロゲルと抱合するか、または複合体化するかする場合において、ヒドロゲル処方物は、マトリックスとしてだけでなく、薬物のキャリアとして作用する。これは、薬物が、ヒドロゲル中に物理的に包括されるだけでなく、ヒドロゲルを形成する分子と抱合するかまたは複合体化することを意味する。第2のポリマーはまた、ヒドロゲルマトリックスの特性(例えば、空隙率および粘性)を変えるために使用され得る。第2のポリマーの量は、所望の結果を達成するのに十分であるべきである(例えば、薬物と複合体化する、および/または抱合するのに十分な量)。
【0048】
ヒドロゲルの特性は、異なるポリマーブロック分子量を使用することによって、シクロデキストリン含量を調整することによって、そして、第2のポリマーを使用することによって整調可能である。例えば、ヒドロゲルは、より可撓性のあるヒドロゲルか、またはより剛直性のヒドロゲルであるように調整され得る。さらに以下に議論されるように、ヒドロゲル構造は、種々の粘性およびより長いかまたは短い薬物放出速度を有するように調整され得る。ポリ(ヒドロキシアルカンノエート)の疎水性の程度はまた、所望の徐放速度のために選択され得る。
【0049】
ヒドロゲルはまた、DNAナノスフェア(nanoshere)を保持し得る。DNAナノスフェアは、DNAおよびポリカチオンの塩誘導複合体コアセルベーション(例えば、遺伝子送達ビヒクルのようなゼラチンおよびキトサン)によって合成されるナノ粒子である。Leong,K.ら、Journal of Controlled Release 53:183−193(1998)。DNA凝縮、または結合断片を有するPEGコポリマーは、これらポリマーが、DNAを凝縮するか、または結合して、ヒドロゲル中にDNAナノスフェアを形成しながら、シクロデキストリンを有するヒドロゲルを形成し得る。
【0050】
(治療剤および薬物徐放のための方法)
本発明のヒドロゲルは、薬物のための持続され、制御された放出マトリックスとして使用するのに適している。このヒドロキシマトリックスを、緊密にこの中に含まれる1つ以上の治療剤とカップされるとき、生分解性徐放薬送達システムが、提供される。本明細書中において、用語「徐放」(すなわち、延長された放出または制御された放出)は、本明細書において、ヒトまたは他の哺乳類の体内に導入するか、または開放創、火傷または組織表面か、あるいは体腔または潜在的生体空間に適用され、しかも、所定の時間にわたって、かつ、この所定の時間全体で所望の治療効果を達成するのに十分な治療レベルで、1つ以上の治療剤の流れを持続的に放出する薬物送達システムまたは組成物のことを言うために使用される。徐放流れへの言及は、組成物またはそのマトリックスもしくは成分のインビボでの生分解性の結果として、あるいは治療薬剤または治療剤の抱合体の代謝的変換または分解の結果として生じる放出を含むことが意図される。
【0051】
延長した放出の持続時間は、ブロックポリマーの分子量、(特に疎水性ポリ(ヒドロキシアルカノエート)部分(例えば、PHB)の分子量に依存する。放出速度は、以下を選択することによる治療応答の所望な時間を達成するために、本発明に従って変更され得る:特にポリ(ヒドロキシアルカノエート);選択されたポリ(ヒドロキシルアルカノエート)の立体異性体状態;選択されたポリ(ヒドロキシアルカノエート)の分子量;および所望の持続時間および徐放速度を達成するためにヒドロゲルに使用されるシクロデキストリンの相対量。疎水性ポリ(アルキレンオキシド)の分子量および選択はまた、疎水性ポリ(ヒドロキシアルカノエート)成分の程度より小さいが、徐放動力学に影響する。第2のポリマーはまた、さらに上で議論されるように放出動力学を変更するために利用され得る。本発明のヒドロゲルは、ブロックポリマーおよびコポリマーの分子量、ならびに本発明のヒドロゲル内のシクロデキストリン含量の調節、および第2のポリマーの潜在的な使用によって、1日またはそれ以上の間にわたる徐放を提供し得、そして適切には5日より長い延長した放出を提供し、より好ましくは1週間より長く、なおさらに好ましくは2週間またはそれより長く、そして潜在的に1ヶ月またはそれより長い延長された放出を提供し得る。
【0052】
種々の治療剤(すなわち、薬物)は、本発明のヒドロゲル中に送達され得る。本明細書中で使用される場合、「治療剤」および「薬物」は、生物学的活性分子(ペプチド、タンパク質(例えば、サイトカイン、成長因子、脈管形成因子、可溶性レセプター、抗体およびそのフラグメントならびにヒト組換えタンパク質)、低分子、遺伝子、抗原(例えば、ワクチン)、DNA、RNAおよびDNAナノ粒子を含む)を包含することが意図される。本明細書中で使用される場合、用語「薬物」および「治療剤」はまた、本来薬学的活性であるかまたは生物学的活性である化合物または種だけでなく、1つ以上のそれらの活性な化合物または種を含む物質ならびに結合体、改変体および薬学的に活性なフラグメントおよびその抗体誘導体を包含することが意図される。
【0053】
本発明はまた、シクロデキストリンおよび1つ以上の治療剤を用いて、本明細書中に記載される両親媒性トリブロックコポリマーから形成される医薬を製造する方法を提供する。従って、本発明は、シクロデキストリンとトリブロックコポリマーとの間の封入複合体化に基づく超分子を提供し、ここで、1つ以上の治療剤は、内心に含まれ得る。これらのヒドロゲルは、タンパク質またはペプチド薬物の制御送達に期待される。
【0054】
薬物送達システムについて、治療剤は、薬学的に受容可能注射可能な水性塩基に適切に処方され得、そして治療剤は、注射または他のモードの送達に適切な任意の薬物あるいはこのような薬物の組み合わせであり得る。適切な薬物としては、以下が挙げられるが、これらに限定されない:鎮痛剤、麻酔薬、抗関節炎薬物、疾患改変抗リウマチ薬物(DMA
RDS)、抗喘息薬物、抗凝固剤、抗痙攣薬、抗うつ剤、抗糖尿病薬、抗悪性腫瘍薬、抗精神病薬、降圧薬、抗生物質、抗ヒスタミン剤、消炎剤、抗炎症薬、筋肉弛緩剤、駆虫薬、抗ウイルス薬、抗再狭窄薬、鎮痙剤、軟骨保護剤(chondroprotective agent)、抗接着剤、抗腫瘍細胞侵襲剤、血管弛緩薬、血管収縮薬、免疫抑制薬および他の生物学的に活性な分子(ペプチド、タンパク質(例えば、サイトカイン、成長因子、脈管形成因子、可溶性レセプター、抗体およびそのフラグメントならびにヒト組換えタンパク質)、低分子、遺伝子、抗原(例えば、ワクチン)、DNA、RNAおよびDNAナノ粒子を含む)。
【0055】
薬物は、適切な巨大分子形態(すなわち、通常の巨大分子である薬物または巨大分子に結合体化されるか、PEG化されるか、またはそうでなければ変換された低分子である薬物)または低分子形態であり得る。巨大分子形態は、本発明のヒドロゲルにおける送達に非常に適切である。従って、巨大分子(例えば、タンパク質、これは、成長因子、サイトカイン、抗体、酵素などを含む)は、本発明のヒドロゲルにおいて送達される。効果的でかつ均一な徐放について、低分子量薬物は、例として、ポリ(エチレングリコール)のように適切に結合体化され、次いでヒドロゲルに取り込まれる巨大分子を形成する。低分子の薬物は、本発明のヒドロゲルに取り込まれるために、微粒子および/またはナノ粒子(例えば、DNAナノ粒子)と適切に結合体化されるかまたは連結され得る。本発明のトリブロックコポリマーの疎水性中間セグメントは、ミセルを形成し得るので、ヒドロゲルはまた、疎水性薬物(例えばパクリタキセル(TaxolTM)、疎水性低分子を含む)を補足し得る。
【0056】
本発明のヒドロゲル中で適切に送達され得る治療剤のさらなる例は、Surgical
Irrigatiton Solution and Method for Inhibition of Pain and Inflammationと題された、Demopulosらに発行された米国特許第6,420,432号、およびSolutions and Methods for Inhibition of Pain,Inflammation and Cartilage Degradationと題されたDemopulosらによる国際PCT特許出願WO 01/07067(これらの開示は、本明細書によって参考として明確に援用される)に開示される。米国特許第6,420,432号は、疼痛、炎症、平滑筋痙攣または再狭窄を阻害するために、単独でまたは組み合わせて送達される鎮痛剤、抗炎症剤、抗痙攣剤、および抗狭窄剤を開示する。薬剤の選択は、任意の外傷、状態または他の理由(外科的、手術的、介在的または診断的手順を含む)から生じる望ましくない機構を阻害するための所定の適用(例えば、関節鏡検査手順の間の関節内への抗炎症/抗疼痛剤の送達、尿生殖器手順の間の尿生殖器官への抗炎症/抗疼痛剤および/または抗痙攣剤の送達、心臓血管手順の間の血管内への抗疼痛/抗炎症剤、抗痙攣剤および/または抗再狭窄剤の送達、または一般的な外科的手順、眼科的手順、歯周手順または他の一般的な外科手順の間の創傷への抗疼痛/抗炎症剤の送達)のために決定される。開示される抗炎症/鎮痛剤としては、セロトニンレセプターアンタゴニスト;セロトニンレセプターアゴニスト;ヒスタミンレセプターアンタゴニスト;ブラジキニンレセプターアンタゴニスト;カリクレインインヒビター;タヒキニンレセプターアンタゴニスト(ニューロキニン1およびニューロキニン2レセプターサブタイプアンタゴニストを含む);カルシトニン遺伝子関連ペプチド(CGRP)レセプターアンタゴニスト;インターロイキンレセプターアンタゴニスト;アラキドン酸代謝のための合成経路において活性な酵素のインヒビター((a)ホスホリパーゼインヒビター(PLA2アイソフォームインヒビターおよびPLCγアイソフォームインヒビターを含む)、(b)シクロオキシゲナーゼインヒビター、ならびに(c)リポオキシゲナーゼインヒビターを含む);プロスタノイドレセプターアンタゴニスト(エイコサノイドEP−1およびEP−4レセプターサブタイプアンタゴニストおよびトロンボキサンレセプターサブタイプアンタゴニストを含む);ロイコトリエンレセプターアンタゴニスト(ロイコトリエンB4レセプターサブタイプアンタゴニストおよびロイコトリエンD4レセプターサブタイプアンタゴニストを含む);オピオイドレセプターアゴニスト(μ−オピオイド、δ−オピオイド、およびκ−オピオイドレセプターサブタイプアゴニストを含む);プリノセプターアゴニストおよびアンタゴニスト(P2XレセプターアンタゴニストおよびP2Yレセプターアゴニストを含む);ならびにアデノシントリホスフェート(ATP)感受性カリウムチャネルオープナーが挙げられる。開示される抗痙攣剤としては、セロトニンレセプターアンタゴニスト;タヒキニンレセプターアンタゴニスト;ATP感受性カリウムチャネルオープナー;カルシウムチャネルアンタゴニスト;エンドセリンレセプターアンタゴニスト;カルシウムチャネルアンタゴニスト;ならびに一酸化窒素ドナー(酵素アクチベーター)が挙げられる。開示される抗再狭窄剤としては、抗血小板剤((a)トロンビンインヒビターおよびレセプターアンタゴニスト、(b)アデノシンジスホスフェート(ADP)レセプターアンタゴニスト(プリノセプター1レセプターアンタゴニストとしても公知)、(c)トロンボキサンインヒビターおよびレセプターアンタゴニスト、ならびに(d)血小板膜糖タンパク質レセプターアンタゴニストを含む);細胞接着分子のインヒビター((a)セレクチンインヒビターおよび(b)インテグリンインヒビターを含む);抗化学走化性剤;インターロイキンレセプターアンタゴニスト;ならびに細胞内シグナル伝達インヒビター((a)プロテインキナーゼC(PKC)インヒビターおよびタンパク質チロシンホスファターゼ、(b)細胞内タンパク質チロシンキナーゼインヒビターの調節因子、(c)src homology2(SH2)ドメインのインヒビター、および(d)カルシウムチャネルアンタゴニストを含む)が挙げられる。このような組成物が泌尿器科学的手順、一般的な外科手順または腫瘍学的手順の間に送達される場合、抗接着剤または抗腫瘍浸潤/接着/転移剤もまた、単独でまたは組み合わせて(例えば、CD44レセプターアンタゴニスト;インテグリンレセプターアンタゴニストおよびセレクチンレセプターアンタゴニスト;プロテイナーゼインヒビター;タンパク質チロシンキナーゼインヒビター;プロテインキナーゼCインヒビター;ならびに有糸分裂促進活性化プロテインキナーゼ(MAPK)インヒビター)含まれ得る。これらの種々の組成物および手順の各々が、延長した放出および作用の持続期間を提供するために、本発明のヒドロゲル中の治療剤を送達することによって実行され得る。
【0057】
WO01/07067は、軟骨異化を阻害するかまたは軟骨同化を促進する軟骨保護剤を開示する。開示される同化促進軟骨保護剤としては、インターロイキン(IL)アゴニスト;形質転換増殖因子(TGF)−βスーパーファミリーのメンバー(TGF−βアゴニストおよび骨形態形成タンパク質アゴニストを含む);インシュリン様増殖因子;および線維芽細胞増殖因子が挙げられる。開示される異化阻害性軟骨保護剤としては、IL−1レセプターアンタゴニスト;腫瘍壊死因子(TNF)−αレセプターアンタゴニスト;シクロオキシゲナーゼ−2特異的インヒビター;MAPキナーゼインヒビター;一酸化窒素シンターゼインヒビター;および核因子kBインヒビター;マトリックスメタロプロテイナーゼのインヒビター;細胞接着分子(インテグリンアゴニストおよびインテグリンアンタゴニストを含む);抗化学走化性剤;細胞内シグナル伝達インヒビター(プロテインキナーゼCインヒビターおよびタンパク質チロシンキナーゼインヒビターを含む;細胞内タンパク質チロシンホスファターゼの調節因子;ならびにSH2ドメインのインヒビターが挙げられる。このような軟骨保護組成物は、延長した放出および作用の持続期間を提供するために、本発明のヒドロゲル中に、例えば、関節内注射によって送達され得る。
【0058】
本発明のヒドロゲルおよび治療剤薬物送達系は、薬物送達系に含まれる薬物が治療的に活性である疾患状態または状態に罹患するヒトまたは他の哺乳動物に、(例えば、移植することによって、体腔または潜在的空間内に配置することによって、身体の組織表面を被覆することによって、または移植可能なデバイスの表面をコーティングすることによって)適切に注入されるかまたはそれ以外で送達される。非限定的な例として、適切な治療剤を含む薬物送達系は、外傷または慢性疼痛、関節炎、多発性硬化症および他の自己免疫障害、炎症および/または外傷もしくは外科もしくは他の手術手順からの疼痛、不安、および/または他の神経学的もしくは神経学的障害、心臓血管疾患、または高血圧、泌尿器科学的障害もしくは婦人科学的障害のような状態、化学療法剤での処置を受ける癌、鬱血、ホルモン障害または平衡失調などを罹患するヒトまたは他の哺乳動物を処置するために送達され得る。ヒドロゲル中で使用される特定の薬物は、ヒトまたは他の哺乳動物が罹患する状態の薬理学的処置のために、ヒトまたは他の哺乳動物が必要とするタイプである。
【0059】
注射可能な組成物は、任意の適切な方法でヒトまたは他の哺乳動物の身体内に、好ましくは、皮下注射針によって注射され得るかまたは移植され得る。例えば、ヒドロゲルは、関節内的、脈管内的に、尿生殖器管内に、皮下的に、筋肉内的に、皮内的に、頭蓋内に、腹腔内的に、胸内に、あるいは任意の体腔または潜在的な空間内に、投与され得る。あるいは、ヒドロゲルは、例えば、関節鏡手順の間、関節に、あるいは、手術手順、外科手順、診断手順または介入手順の間、尿生殖管内に、脈管構造内に、心膜内もしくは胸膜内の空間内に、または身体内の任意の体腔もしくは潜在的空間内に、カテーテルまたはシリンジによって導入され得る。ヒドロゲルは、高い局所濃度の薬物を達成し、持続放出貯蔵場所を形成するために、制限された領域または組織に投与され得る。他の適用において、開いた外科または外傷損傷に、火傷に、あるいは皮膚または他の組織表面へのヒドロゲルの局所適用が実行され得る。
【0060】
(さらなる生体材料適用)
本発明のトリブロックコポリマーは、濃度に依存して、ゲルを形成するために、液体懸濁液または凝縮物を保持する、ミセルを形成する。上記本明細書中に記載される合成方法によって作製される生分解性トリブロックコポリマーによって形成されるミセルは、それ自体、制御放出のための薬物(例えば、疎水性薬物)のカプセル化のために使用され得る。トリブロックコポリマーミセルはまた、持続放出処方物として薬物をカプセル化する際に使用するためのミクロスフェアまたはナノスフェアを形成するために乾燥され得る。本発明のトリブロックコポリマーを使用してミクロ粒子またはナノ粒子に適切な技術が他のポリマーのために使用される公知の技術から適用され得ることが考えられる。このような技術の非限定的な例は、以下に開示される:Song,C.ら,Journal of Controlled Release 43:197−212(1997);Kim,S.ら,Journal of Controlled Release 56:197−208(1998);Kim,I.ら,International Journal
of Pharmaceutics 205:165−172(2000);およびJeong,Y.ら,International Journal of Pharmaceutics 188:49−58(1999)(これらの各々の開示が、本明細書によって参考として援用される)。従って、生分解性トリブロックコポリマーのミセル(またはそれらから形成されるミクロ粒子もしくはナノ粒子)は、全身送達(非限定的な例として、投与の脈管内経路、吸入経路、筋肉内経路および皮下経路による投与を含む)のために使用され得る。生分解性トリブロックコポリマーおよびシクロデキストリンによって形成される本発明のヒドロゲルはまた、組織工学適用のため、細胞培養およびカプセル化のために媒体として使用され得る。合成組織(エキソビボまたはインビボでヒドロゲルにおいて形成される)は、ヒトまたは他の哺乳動物(例えば、合成軟骨)内に移植され得るか、または外部的に(例えば、合成皮膚内に)適用され得る。治療剤は、組織増殖、生存力または治癒を補助するために、本発明のトリブロックコポリマーまたはヒドロゲルを使用して形成される合成組織内に含まれ得る。
【0061】
本発明のヒドロゲルはまた、外科手順の間に、付着形成を妨げるための、コーティングとしての利用を有し得る。1つ以上の治療剤はまた、このような組成物に含まれ得る。
【0062】
本発明のヒドロゲル(1つ以上の治療剤を含む)はまた、移植可能なデバイス(例えば、ステント、カテーテル、気管内チューブ、導管、ネジ、プレート、シャント、人工関節、人工心臓または弁、他の人工器官など)をコーティングするために使用され得る。このようなデバイスは、生分解性または非生分解性材料から構築され得る。本明細書中に記載されるヒドロゲルのための他の生体材料および生物学的材料はまた、本発明の範囲内であると考えられる。
【実施例】
【0063】
(実施例)
本発明は、本発明のトリブロックポリマーおよびヒドロゲル、ならびにそれらの特性を示す、以下の実施例を考慮してより良く理解される。これらの実施例は、単に例示であり、本発明を全体として反映しない。
【0064】
(実施例1)
(トリブロックコポリマーの合成および特徴付け)
(a.トリブロックコポリマーの合成)
種々の分子量を有するテレケリックヒドロキシル化PHB(PHB−ジオール)プレポリマーを、以前に報告されたように、ジグリム中の触媒としてジブチルジラウレートを用いて、天然のPHBおよびジエチレングリコールからのエステル交換手順によって調製した。Thomas,D,ら、Macromol.Chem.Phys.197:1609−1614(1996)。エステル交換反応を数時間〜一晩進行させて、数百〜数千の範囲の平均分子量(GPCによって決定される)を有するPHB−ジオールを作製した。1820および4740のMnを有するM−PEO−モノカルボン酸(M−PEO−A)プレポリマーを、以前に報告されるように、1,4−ジオキサン中、4−(ジメチルアミノ)ピリジン(DMAP)およびトリエチルアミンの存在下で、M−PEOと無水コハク酸との反応によって調製された。Bae,Y.ら、J.Controlled Release 64:3−13(2000)。
【0065】
次いで、本発明の例として、これらの二官能性PHB−ジオールプレポリマーを、1,3−ジシクロヘキシルカルボジイミドを使用して、M−PEO−Aプレポリマー(Mn約1820および4740)と結合し、PEO−PHB−PEOトリブロックコポリマーを得た。反応が湿度感受性であるので、窒素雰囲気下で、乾燥塩化メチレン中で実行した。標的とされるトリブロックコポリマーを単離し、そしてクロロホルム/ジエチルエーテルまたはメタノール/ジエチルエーテルの混合溶媒からの沈殿および注意深い分別によって反応混合物から単離および精製した。
【0066】
(b.トリブロックコポリマーの分子特徴付け)
ゲル浸透クロマトグラフィー(GPC)分析を実施して、トリブロックコポリマーの分子量および分子量分布を決定した。全ての精製したトリブロックコポリマーのGPCクロマトグラフィーは、単峰形であったピークを示した。図2は、対応するプレポリマーと一緒に、PEO−PHB−PEOトリブロックコポリマーについての代表的なGPCクロマトグラムを示す。PEO−PHB−PEOトリブロックコポリマーの分子量は、ABAトリブロックコポリマーに対応する、そのPEOおよびPHB前駆体よりも高い。
【0067】
全てのトリブロックコポリマーを、1H NMR分光法によって分析し、これによって、トリブロックコポリマーがPEOおよびPHBの両方を含み、コポリマーの中程度PHBブロックの長さを与えたことを確認した。図3は、PEO−PHB−PEOトリブロックコポリマーおよびその前駆体プレポリマーの1H NMRスペクトルを示す。本実施例に使用される2つのM−PEG−Aプレポリマーがほとんど単分散である(重量平均分子量/数平均分子量(Mw/Mn)=1.03)であるので、コポリマー中のPEOブロックの分子量は、それらのM−PEO−Aプレポリマーと同一であると考えられ得る。従って、コポリマー中のPHBブロック分子量は、PHBセグメントおよびPEOセグメントについてのピークの積分間の比から決定され得る。
【0068】
1H NMRスペクトルはまた、PHB−ジオールの定量的反応についての強い証拠を提供する。図3bにおいて、PHBヒドロキシ末端単位のプロトンは、明らかに、c’についての1.26ppm(ダブレット)およびb’についての4.25ppm(マルチプレット)を示し(Li,J.ら,Bull.Chem.Soc.Jpn.70:1887−1893(1997);Li,J.ら,Bull.Chem.Soc.Jpn,71:1683−1689(1998))、一方、エチレングリコール末端基は、dについて3.84ppm(トリプレット)およびeについて4.26ppm(トリプレット)を見出し得る(Thomas,D.ら,Macromol.Chem.Phys.197:1659−1614(1996))。図3cにおいて、PHBヒドロキシ末端単位についての全てのピークが消え、そしてエチレングリコール末端基のピークは、4.32ppmに単一のピークになり、M−PEO−AのPHB−ジオールの完全な結合を確認した。
【0069】
表1は、本実施例において合成された全てのトリブロックコポリマーの分子量、分子量分布および組成(ブロック長さおよび重量でのPHB内容物)を示す。2つのシリーズのトリブロックコポリマーを、Mn1820および4740のM−PEO−Aを使用して合成した。各シリーズのトリブロックコポリマーは、数百〜5000より長い範囲の中程度PHBブロック長さを有する。トリブロックコポリマーの固体状態特性は、以下のセクションにおいて後に記載されるように、PHB/PEOブロック長さの間の組成および比に依存する。
【0070】
【表1】

【0071】
(a)GPCによって決定した。(b)1H NMRおよびGPCの結果の組み合わせによって決定した。(c)TGAの結果から計算した。
【0072】
PEO−PHB−PEO(2000−3900−2000)およびその開始PEO前駆体およびPHB前駆体のFTIRスペクトルを、図4に示す。PHB前駆体およびPEO前駆体についての全ての特徴的な吸収は、トリブロックコポリマーのスペクトルに見られる。カルボニルストレッチは、コポリマーおよびPHB前駆体について、1723cm−1に存在する。エーテルストレッチは、コポリマーおよびPEO前駆体についての1102cm−1に存在する。963cm−1および843cm−1のバンドは、PEOの結晶相の特徴であることが分かる。Bailey,J.ら,Poly(Ethylene Oxide),Academic Press,New York,(1976)。2つのピークは、コポリマーのスペクトルに見られ、そしてそれらの強度は、PEOブロック含有量およびその結晶度と関連する。この結果は、DSCおよびXRDからの結果と良好に一致し、以下のセクションに考察される。
【0073】
(c.熱安定性)
トリブロックコポリマーの熱安定性は、熱重量分析(TGA)を使用して評価した。図5は、トリブロックコポリマーならびにPEO前駆体およびPHB前駆体についての重量損失曲線を示す。PEO−PHB−PEOトリブロックコポリマーは、段階的に熱分解を受ける。PHBブロックは、最初に、約260℃で分解し始め、次いで、PEOブロックは、約350℃で分解し始める。PHBブロックが310〜320℃で分解を完了した後に、PEOブロックが分解し始めることに留意されるべきである。従って、トリブロックコポリマーおよびPHB含有量の組成を、表1の種々の分子量コポリマーに列挙されるように、この二段階分解挙動から計算され得る。この結果は、1H NMRから得られた結果に従って良好である。質量の10%の損失が、TGAから決定したコポリマーの各ブロックについて計算した温度を、表2に列挙する。この結果は、トリブロックコポリマーが、それらの前駆体よりも良好に熱安定性を有することを示す。
【0074】
【表2】

【0075】
(d.固体状態挙動)
示差走査熱量測定(DSC)および広角X線回折(XRD)研究を実行して、コポリマー中のPEOブロックおよびPHBブロックのミクロ相および結晶化についての情報を得た。図6および7は、異なる組成を有するPEO前駆体およびPHB前駆体ならびにPEO−PHB−PEOトリブロックコポリマーについてのDSC温度記録を示す。さらに、各ブロックの熱遷移および結晶度に対応する数値を、表3に示す。PEOおよびPHBの両方が、結晶ポリマーである。コポリマーPEO−PHB−PEO(2000−0500−2000)および短いPHBブロックを有するPEO−PHB−PEO(5000−0800−5000)について、PHB融解転移ピークを観察せず、これは、PHB結晶相が形成されなかったことを示す。PHBブロックの融解転移温度(Tm)は、PHBブロック長さでの減少を伴って、減少した。融解エンタルピーおよびPHBブロックの結晶度は、純粋なPHB−ジオールと比較して、コポリマー中で有意に増加し、これは、おそらく、ソフトPEOブロックの存在によって引き起こされる。対照的に、全てのトリブロックコポリマー中のPEOブロックは、純粋なPEO前駆体と比較して、低い融解エンタルピーおよび低い結晶度を有した。PEOブロックの全ての融解温度、融解エンタルピーおよび結晶度は、PHBブロック長さの増加、またはコポリマー中のPHBの内容物とともに減少した。これらは、ハードPHBブロックによって引き起こされ得、これは、コポリマー中のPEOブロックの結晶度を抑制した。
【0076】
【表3】

【0077】
図8および9は、この実験において合成されたPEO前駆体およびPHB前駆体ならびにPEO−PHB−PEOトリブロックコポリマーについてのXRDダイアグラムを示す。PHBブロックについての反射ピークは、短いPHBセグメントを有するコポリマーについてのダイアグラムでは見られず(図8cおよび9c)、これは、PHB結晶相が形成されなかったことを示す。より長いPHBセグメントを有するコポリマーについて、PHBブロックは、その前駆体PHB−ジオールに類似した別々の結晶相を形成した。PEOブロックについての反射ピークは、コポリマー中のPEO結晶相がそのホモポリマーと類似の構造であることを示す。PEO反射ピークは、PEOブロックについてのそれらの融点が、XRDが測定されるおよその周囲温度(上記表2を示す)であったので、PEO−PHB−PEO(2000−3800−2000)およびPEO−PHB−PEO(2000−5500−2000)について見られなかった。XRDの結果は、DSC測定で良好に一致する。
【0078】
(e.PEO−PHB−PEOトリブロックコポリマーのミセル形成)
より低いPHB含有量を有するトリブロックコポリマー(例えば、PEO−PHB−PEO(2000−0500−2000)、PEO−PHB−PEO(5000−0800−5000)およびPEO−PHB−PEO(5000−3800−5000))は、水溶性である。これらは、低濃度で水溶液でミセルを形成し得、これは、色素溶解度実験によって確認された。ミセル形成の駆動力は、PHBブロック間の強力な疎水性相互作用でることが考えられる。水溶液中のブロックコポリマーの臨界的ミセル濃度(cmc)は、プローブとしてピレンを使用する蛍光技術によって決定された。表3は、室温での3つの水溶性トリブロックコポリマーについてのcmc値を列挙する。PHBブロックが水溶液中で強く凝集する傾向があるので、cmcは、コポリマー中のPHBブロック長さに強く依存し、すなわち、より長いPHBブロックを有するコポリマーがかなり低いcmcを有することが見出された。
【0079】
(実施例2)
(トリブロックコポリマーおよびシクロデキストリン複合体化および放出動力学)
(a.封入複合体の形成)
PEO−PHB−PEOトリブロックコポリマーの合成のための図1の反応スキームを、再び実施した。まとめると、高分子量PHBを最初に低分子量のPHBジオールに転換した。次いで、PHBジオールを、PEOモノカルボン酸(Mr5000)とカップリングさせPEO−PHB−PEOトリブロックコポリマーを得た。2つのトリブロックコポリマーPEO−PHB−PEO(5000−2300−5000)およびPEO−PHB−PEO(5000−3850−5000)を調製し、NMR、GPC、FI−IRおよびDSCによって特徴付けた。両方とものコポリマーは、室温で水溶性である。これらは、低濃度の水溶液中でミセルを形成した。これは1,3,5−ジフェニルヘキサトリエンおよびピレンを用いる色素溶解性実験によって確認された。ミセル形成の駆動力は、PHBブロック間の強い疎水性相互作用から由来すると考えられる。
【0080】
ミセルの形成に関らず、両方のポリマーの10重量%水溶液は良好な流動性であり、透明のままだった。いずれかのポリマー溶液に、9.7重量%のα−CDを添加する際、室温でゲル化が起こった。他のホモPEOに比べると、ゲル化は、このコポリマーで低濃度にて誘導され得た。理論に束縛されることを意図しないが、α−CDおよびPEO−PHB−PEOトリブロックコポリマーのPEOブロックによって形成された封入複合体は微結晶に凝集され、これは、物理的架橋として作用し、超分子ポリマーネットワークの形成を誘導し、次いでヒドロゲルの形成をもたらすことが仮定される。PHBブロックのミセル化は、コポリマーおよびα−CD溶液のゲル化において重要な役割を担っていると考えられている。PHBブロック間の疎水性相互作用は、ポリマーネットワークの形成を促進する。従って、水溶液中のPEO−PHB−PEOトリブロックコポリマーおよびα−CDのゲル化の駆動力は、α−CDとPEOブロック間の封入体形成およびトリブロックコポリマーのPHBブロックのミセル化の組み合わせと考えられる。
【0081】
ヒドロゲル中のPEO−PHB−PEOコポリマーのPEOブロックとα−CDとの間の封入複合体形成は、ヒドロゲルの広角X線回析研究によって確認された。ヒドロゲルの回折計は、α−CD−PEO複合体について、多くの鋭い反射および2θ=19.4°(d=4.57Å)にて主要な反射を有するパターンを示し、これは、α−CDおよびPEOの結晶質ネックレス様複合体(crystalline necklace−like complex)のチャネル型構造を表す。Li J.ら、Macromolecules 34:7236(2001);Li J.ら、Macromolecules 34:8829(2001)。このパターンは、α−CDとPEOブロックとの封入複合体の存在を示唆する。固体PEO−PHB−PEGのパターンは、13.7°(d=6.46Å)および17.2°(d=5.16Å)で2つの鋭い反射(PHB結晶質相に由来する)を示す。興味深いことに、PHB結晶質相についてのパターンはまた、α−CD−PEO−PHB−PEO(5000−3850−5000)ヒドロゲルのダイアグラムに現れるが、このパターンは弱い。PEO−PHB−PEO(5000−3850−5000)の10重量%水溶液についてのX線回析は、鋭い反射ピークを示さないことに留意されたい。この結果は、超分子システムが、より高度に順序化され、PEOブロックとのα−CD複合体の自己アセンブリがPHBブロックの凝集を促進したことを示唆する。
【0082】
(b.放出動態学)
これらのヒドロゲルの安定性および送達特性を実証するために、モデルタンパク質薬物としてフルオロセインイソチオシアネート標識化ウシ血清アルブミン(BSA−FITC、分子量67,000)のインビトロ放出を研究した(図10)。本発明のα−CD−PEO−PHB−PEOヒドロゲルの放出特性を既知(従来技術)のα−CD−PEOホモポリマーヒドロゲルの放出特性と比較した。α−CD−PEOホモポリマーヒドロゲルは、20,000のPEO Mrであっても、2日以内にリン酸緩衝化生理食塩水(PBS)に溶解した。対照的に、α−CD−PEO−PHB−PEOヒドロゲルは、BSA−FITCについての持続性放出動態学を示す。興味深いことに、PHBブロック分子量の小さな差異(わずかに1500Mr)が、放出速度に顕著な減少を引き起こした。α−CD−PEO−PHB−PEO(5000−2350−5000)は4日間放出が持続したが、α−CD−PEO−PHB−PEO(5000−3850−5000)は、5日以上の長期間にわたって放出が持続した。2週間後、BSA−FITCの顕著な放出は起こらなかった。これらの結果は、本発明の超分子量の特性が、異なるコポリマーにより微調整されて広範な適用が利用可能になることを示す。いくつかのペグ化タンパク質薬物はまた、活性成分であり得、PEO鎖は、α−CDとの複合体化に関与し得、さらに処方物の制御された放出特性を改善し得る。ヒドロゲルの流体力学的特性のさらなる研究は、ゲルがチキソトロープ剤であること、すなわち、ヒドロゲルの粘度は、ゲルが剪断されるにつれて減少し、針を通って注射可能な制御放出処方物を提供することを示す。
【0083】
(実施例3)
(代替のモデル薬物についてのヒドロゲル放出動力学)
(a.α−CD−PEO−PHB−PEOヒドロゲルの調製)
コポリマー溶液またはゲルを、最初に、0.6mLキュベット中で、実施例1の手順に従って合成した0.060gのトリブロックPEO−PHB−PEOコポリマーに、0.090gのPBSを添加することによって調製した。次いで、14.5%のα−CDおよび0.5%のデキストラン−FITC(分子量20,000)を含む0.30gPBS溶液を、キュベット中のPBSコポリマー混合物に添加した。これらの溶液を徹底的に混合し、室温で一晩静置させた。この混合物は、キュベット中でヒドロゲルを形成し、次いで、そのインビトロ放出動力学をさらに以下に記載するように研究した。この手順は、PEO−PHB−PEO(5000−5500−5000)コポリマーを1回、そしてPEO−PHB−PEO(5000−3800−5000)コポリマーを1回用いて実施した。
【0084】
(b.純粋なPEO−PHB−PEOヒドロゲルの調製)
コポリマー溶液またはゲルを、最初に、0.6mLキュベット中で、実施例1の手順に従って合成した0.060gのトリブロックPEO−PHB−PEOコポリマーに、0.090gのPBSを添加することによって調製した。次いで、0.5%のデキストラン−FITC(分子量20,000)を含む0.30gPBS溶液を、キュベット中のPBSコポリマーに添加した。これらの溶液を徹底的に混合し、室温で一晩静置させた。この混合物は、キュベット中でヒドロゲルを形成し、次いで、そのインビトロ放出動力学をさらに以下に記載するように研究した。この手順は、PEO−PHB−PEO(5000−5500−5000)コポリマーを1回、そしてPEO−PHB−PEO(5000−3800−5000)コポリマーを1回用いて実施した。
【0085】
(c.放出動力学)
インビトロ放出動態学研究のために、デキストラン−FITCを含有するそれぞれのヒドロゲルの入ったキュベットを、12mLのPBSを含む試験管に上下逆に入れ、37℃の水浴中でインキュベートした。PBSを、所定の時間間隔で換えた。各間隔で放出されたデキストラン−FITCの濃度を、蛍光ミクロ−プレートリーダーを用いて分析した。
【0086】
上記の手順を実施する場合、PEO−PHB−PEO(5000−5500−5000)は、α−CDを伴っても伴わなくても、ヒドロゲルを形成することが見出され、PEO−PHB−PEO(5000−3800−5000)は、α−CDを伴うときのみヒドロゲルを形成し、そしてα−CDを伴わないPEO−PHB−PEO(5000−3800−5000)は、透明な溶液のままであり、すなわち、薬物の持続性放出に適してないことが理解される。図11は、ヒドロゲルからのデキストラン−FITCのインビトロ放出プロフィールを示す。α−CD−PEO−PHB−PEO(5000−5500−5000)とα−CD−PEO−PHB−PEO(5000−3800−5000)の両方のヒドロゲルは、数週間にわたってデキストラン−FITCの持続性放出を実証するが、純粋なPEO−PHB−PEO(5000−5500−5000)ヒドロゲルは、1週間未満にわたってデキストラン−FITCを放出した。これらの結果は、複週間まで薬物の持続放出のために、α−CDは、PEO−PHB−PEOトリブロックのゲル化だけを補助するのでなく、トリブロックコポリマーとより安定なヒドロゲルを形成する。α−CD−PEO−PHB−PEO(5000−5500−5000)ヒドロゲルは、α−CD−PEO−PHB−PEO (5000−3800−5000)ヒドロゲルよりもより遅い放出速度を示し、このことは、超分子ヒドロゲルの特性が、異なるPHB長を用いることによって本発明に従って微調整され得ることを示す。
【0087】
(実施例4)
(α−シクロデキストランおよびγ−シクロデキストランを用いる封入複合体処方物)
上記のように、シクロデキストラン(CD)は、α−1,4−グリコシド結合によって結合された6〜8つのグルコース単位からなる環状分子であり、それぞれ、α−CD、β−CDおよびγ−CDと称される。CDは、疎水性キャビティを規定するドーナツ形状を有する。CDの疎水性キャビティの深さは同じ(約7.0Å)であるが、このキャビティの内径は異なっており、α−CDについては、約4.5Åであり、β−CDについては、約7.0Åであり、γ−CDについては、約8.5Åである。Bender, M.et
al., Cyclodextrin Chemistry, Springer−Verlag: Berlin (1978)。CDのポリマー鎖の断面積とCDのキャビティサイズとの間の相関は、IC形成において重要な役割を果たしていることが分かった。例えば、Harada, A.et al., Nature 370: 126 (1994)を参照のこと。以下に本明細書中に記載の実験において、PEO−PHB−PEOトリブロックコポリマーとα−CDまたはγ−CDとの間の封入複合体(inclusion complexes;IC) を、調製して、そして、特徴づけ、本発明のヒドロゲルを形成する際のそれらの有用性を実証した。これらの実験は、α−CDおよびγ−CDの両方が、PEOブロックを含む傾向にあるが、他方、その中央のPHBブロックは、CD分子によって部分的にのみ被覆されることを実証する。
【0088】
(a.封入複合体の調製)
PEO−PHB−PEOトリブロックコポリマーを、上記の実施例1の手順を使用して調製した。この実験のために調製したトリブロックコポリマーの分子的特徴を、表4に提供する。PEO−PHB−PEOトリブロックポリマー(20mg)を、室温で一晩、0.06mLのH2Oに浸漬した。その後、3.0mLのα−CDまたはγ−CDのいずれかの飽和水溶液を添加し、そして、各々混合物を、10分間に亘って水浴中で超音波処理し、その後、室温で2日間に亘り、静置した。その沈殿した生成物を、遠心分離によって回収し、次いで、水とアセトンで交互に洗浄した。最後に、その生成物を、2週間に亘り、70℃にて減圧下で乾燥した。
【0089】
(表4)
【0090】
【表4】

【0091】
(a)GPCによって決定した(b) 1H NMRおよびGPCの結果によって決定した(c)DSCの2回目の昇温実行において決定した。
【0092】
(b.測定)
X線回折(XRD)測定を、Siemens D5005回折装置およびNiフィルタCuKα(1.54051Å)放射(40kV,40mA)を使用して実施した。粉末サンプルを、サンプルホルダーに載せて、そして、1工程につき1秒間で、5°から35°まで0.01°のステップでスキャンした。
【0093】
示差走査熱量計(Differential scanning calorimetry;DSC)測定を、自動冷却附属機器を備え、かつインジウムを使用して較正したTA Instruments 2920示差走査熱量計を使用して実施した。各々のサンプルに対して以下のプロトコルを使用した:20℃/分で、室温から200℃まで昇温;2分間に亘って200℃で保持;5℃/分で、200℃から−30℃まで冷却;そして、最後に、5℃/分で、−30℃から200℃まで再度昇温。この2回目の加熱実行の間に、データを収集した。ピーク極大として、遷移温度を取得した。熱重量分析(Thermogravimetric analyses;TGA)を、TA Instrument SDT 2960を使用して実施した。サンプルを、動的な窒素雰囲気下(流速70ml/分)において室温から800℃まで20℃/分で加熱した。
【0094】
上記の複合体の1H NMRスペクトルを、Bruker DPX− 400 NMRスペクトロメータにて400MHzで記録した。これらの複合体の化学シフトは、DMSOについての、δ=2.50に対して帰属される。13C CP/MAS NMRスペクトルを、室温において、サンプル スピン速度(sample spinning rate)にてBruker DPX−400 NMRスペクトロメータで取得した。このスペクトルを、2.75μs プロトン90°パルス、接触時間3ミリ秒間、および繰り返し時間3秒間で、取得した。
【0095】
フーリエ変換赤外(FTIR)スペクトルを、Bio−Rad 165 FTIR分光光度計で記録し; 64スキャンを、室温で2cm−1の分解能で加算平均(signal−averaged)した。サンプルを、KBr中に複合体を分散して、その混合物を圧縮してディスクを形成することによって調製した。
【0096】
(c.結果および考察)
α−CDまたはγ−CDの水溶液を、10分間に亘って水中に浸漬し、そして、超音波処理したPEO−PHB−PEOトリブロックコポリマーに添加すると、結晶質の沈殿物として複合体が形成された。沈殿物の外観は、そのコポリマーとCDとの間の結晶質の封入複合体(IC)の形成を示す。Harada, A.et al., Macromolecules, 26: 5698 (1993)。比較すると、β−CDとPEO−PHB−PEOトリブロックコポリマー溶液の混合物中では、2週間の静置の後においても、沈殿はなんら形成されなかった。この観察によって、PEO−PHB−PEOトリブロックポリマーがα−CDおよびγ−CDとともにICを形成し得るが、β−CDを用いると、トリブロックポリマーを形成し得ないことが示される。このIC形成の収量を、表5に示す。
【0097】
(表5)
【0098】
【表5】

【0099】
CD−PEO−PHB−PEO ICの形成は、X線回折(XRD)研究によって大いに支持された。図12によって、α−CDおよびPEO(Mn2000)によって形成されたICと比較して、純粋なPEO−PHB−PEO (2000−5200−2000)、および全部で3つのPEO−PHB−PEOトリブロックコポリマーのXRDパターンを示した。図12eにおいて、2θ=19.4°および2θ=22.1°で突起した2つのピークを有する多くの鋭角的な回折が、CDおよびPEOの結晶質のネックレス様複合体のチャネル型構造(channel type structure)を表す。例えば、 Takeo, K.et al.,Agric.Biol.Chem., 34: 1787 (1970)を参照のこと。α−CD−PEO−PHB−PEO ICについての類似の回折パターンの観察(図12b〜d)によって、αCD−PEO−PHB−PEO ICが、α−CD−PEO ICの構造と類似のチャネル型構造を呈することが示される。α−CD−PEO−ICと比較したときに、2θ=13.6°および17.0°での2つの余分な小さいピークが、α−CD−PEO−PHB−PEO ICのパターンにおいて現れる。この2つのピークの相対強度は、PEO−PHB−PEO中のPEOに対するPHBの比が増大するに伴い増大する。図12aに示されるように、純粋なPEO−PHB−PEOに関して、13.6°および17.0°でのピークは、結晶質のPHBの特徴である。したがって、この2つのピークの存在は、PHBブロックの一部分が凝集して結晶質相を形成し、その結晶質相とIC結晶が共存することを示すことが考えられる。
【0100】
γ−CD−PEO−PHB−PEO ICのXRDパターンが、純粋PEO−PHB−PEOおよびγ−CD−PPO ICのXRDパターンと比較して、図13に示されている。ピークの各々の相対強度が異なっているが、γ−CD−PEO−PHB−PEO ICのXRDパターンが、互いに非常に類似しており、かつ、γ−CD−PPO ICのXRDパターンに類似しており、ここでは、チャネル型構造が、確立されている。さらに、7.6°での特徴的なピークが観察され、これは、γ−CDポリマーICのチャネル型構造に対する識別特徴としての役割を果たす重要な特徴である。例えば、Harada, A.et al., Macromolecules, 29: 5611 (1996)を参照のこと。したがって、γ−CD−PEO−PHB−PEO ICは、チャネル型構造を呈すると考えられる。結晶質PHBブロックに帰属される2θ=13.6°および2θ=17.0°での2つのピークはまた、α−CD−PEO−PHB−PEO ICと同様に、γ−CD−PEO−PHB−PEO ICのXRDパターンにおいて観察される。化学量論的なα−CD−PEOおよびγ−CD−PPO ICと比較した、α−CD−PEO−PHB−PEOおよびγ−CD−PEO−PHB−PEO ICについてのブロードなXRDパターン(図12eおよび図13e)は、ICのより低い結晶性に起因し、ICのチャネルを「分解(break up)」そして短縮する被覆されないPHBによって引き起こされるのが最も可能性が高い。
【0101】
純粋なPEO−PHB−PEO(2000−5200−2000)およびα−CD−PEO−PHB−PEO ICのDSC曲線を、図14に示した。図14aに示されるように、純粋なPEO−PHB−PEO(2000−5200−2000)のDSC曲線における23.3℃および153.6℃での2つの吸熱ピークが存在し、これらのピークは、それぞれ、PEOブロックおよびPHBブロックの結晶融合に対応する。ICの形成の際に、PEOブロックに対応する吸熱ピークは、図14b〜図14dにおいては存在しない。これは、そのPEOブロックが、ホストであるα−CDの格子のチャネルに別々に取り込まれており、次いで、凝集してその結晶質相を形成することができないためである。しかし、PHBブロックに対応するその吸熱ピークは、なおも、観察可能である(図14〜14d)。しかし、その融合温度は、より低い範囲まで移動し、そのエンタルピー変化が、CD−PEO−PEO ICの劇的な減少を生じる。この結果によって、PHBブロックの各々が、α−CDによって部分的に被覆され、そして、最も可能性があることとして、PHBブロックの中央部分が、α−CDによって複合体化されないこということが示される。融合温度の低下およびエンタルピー変化は、PHBブロックの部分的な取り込みから生じる結晶の摂動に起因する。Shuai, X.ら(Macromolecules, 35: 3778 (2002))は、DMSO中のポリ[(R)−3−ヒドロキシブチレート]とα−CDとの間のICの形成を報告している。彼らの結果によって、PHB鎖が、α−CDによってのみ部分的に含まれることが示されている。本発明の系について、α−CDをPHBブロックにスレッディング(threading)することは、PHBの疎水性によってなおも阻まれるが、PEOブロックにスレディングするCDは、PHBブロックまでさらにスライドし得ることが示される。そのα−CD−PEO−PHB−PEO ICにおいて、融合温度およびエンタルピー変化は、中央のPHBブロックの鎖の長さの増加に伴って増加する傾向にある。これは、より長いPHBブロックを有するα−CD−PEO−PHB−PEO ICが、PHB鎖のより長い複合体化していない部分を有するためである。
【0102】
図15は、純粋なPEO−PHB−PEO(2000−5200−2000)およびγ−CD−PEO−PHB−PEO ICのDSC曲線を示す。図14の結果と類似の結果が、取得され得る。α−CD−PEO−PHB−PEOおよびγ−CD−PEO−PHB−PEO ICの両方についてのDSCの結果の全ては、このPEOブロックが、CDによって完全に被覆されているが、他方、そのPHBブロックは、部分的に被覆されており、それらのXRDの結果と矛盾しないことを示す。
【0103】
図16は、α−CDおよびα−CD−PEO−PHB−PEO (2000−5200−2000) ICの13C CP/MAS NMRスペクトルを示す。非複合体状態であるα−CDのスペクトルは、C1およびC4について複数に分解される共鳴を示す。単一のコンフォメーション的に拘束されたグリコシド結合に隣接するC1およびC4についての共鳴は、そのスペクトルにおいて特に観測される。これらの結果は、その結晶質の複合体化していない状態でα−CDがより対称性の低いコンフォメーションを呈することを示す。対照的に、α−CD−PEO−PHB−PEO(2000−5200−2000)ICにとって、CDの全てのC1〜C6は、単一の分解されない共鳴を示し、これによって、α−CDがより対照的なコンフォメーションを採用することを示し、α−CDのグルコース単位の各々が、そのIC中の類似の環境で存在することを示す。
【0104】
α−CDまたはγ−CDによる中央のPHBブロックの部分的な切断がまた、そのCD−PEO−PHB−PEO ICの1H NMRスペクトルによって実証された。図17
は、DMSO−d6中のα−CD−PEO−PHB−PEO(2000−5200−2000)の1H NMRスペクトルを示す。図17において示されるように、α−CDおよびPEO−PHB−PEO(2000−5200−2000)に帰属する全てのプロトンシグナルが、確認される。結晶質ICの成分の比は、そのピークの積分値を比較することによって決定され得る。以前に報告されるように、PEOは、α−CDおよびγ−CDとの封入複合体を形成し得、CDに対するPEO繰り返し単位の比は、それぞれ、2および4である。例えば、Haradaら(1994)を参照のこと。しかし、α−CD−PEO−PHB−PEO(2000−5200−2000)ICについての図17から得られるα−CDに対するPEO繰り返し単位の比は、1.4であり、これによって、α−CDとPEOブロックの化学量論的複合体を形成するよりも、多くのα−CD分子が、α−CD−PEO−PHB−PEO(2000−5200−2000)IC中に含まれていることを示す。他方、固相13C CP/MAS NMR測定によって、そのICにおける全てのα−CDが、ポリマー鎖状にスレッディングされ、そして、チャネル構造をとる。次いで、いくつかのα−CDが、中央のPHBブロックに滑り込むと考えられる。全ての試験したCD−PEO−PHB−PEO ICについて、CDに対するPEO繰り返し単位の比は、表5に要約される。γーCDとのICの場合、その比は、2.1と2.6との間であり、これによって、いくつかのγ−CD分子もまた、その中央のPHBブロックに滑り込むことが示される。これらの結果によって、PEOブロックが、α−CDまたはγ−CDによって完全に被覆されるが、他方、その中央のPHBブロックが、CD−PEO−PHB−PEO IC中で部分的に被覆されるという仮説がさらに支持される。
【0105】
図18は、純粋なPEO−PHB−PEO(20−52−20) およびα−CDと比較したときの、α−CD−PEO−PHB−PEO ICのFTIRスペクトルを示す。α−CDについてのスペクトルは、その対称性および非対称性のO−H伸縮モードに起因する3360cm−1でのブロードなバンドを示す。ICの形成に際に、そのブロードな、ヒドロキシルバンドは、ICのスペクトルにおいて、3390cm−1の高周波数側にシフトすることを示す(図18bおよび図18c)。これは、そのチャネル構造におけるCDのヒドロキシル基間の水素結合の形成に起因する可能性が最も高い。純粋なPEO−PHB−PEO (2000−5200−2000)のFTIRスペクトルは、PEO−PHB−PEO(2000−5200−2000)におけるPHB部分に帰属される1723cm−1での強いカルボニル伸縮バンドによって特徴付けられる(図18a)。このカルボニル伸縮バンドは、強い1723cm−1のバンドと、弱い1736cm−1のショルダーバンドに分離され、これらは、それぞれ、結晶質のPHB相のカルボニル伸縮バンドおよびアモルファスPHB領域のカルボニル伸縮バンドに対応する。Ikejima,T.,etal.,Macromol.Chem.Phys.,200:413(1999)。
【0106】
図19は、FTIRスペクトルのカルボニル伸縮領域の拡大を示す。純粋なPEO−PHB−PEO (2000−5200−2000)と比較すると、1723cm−1でのピークは、急激に減少するが、他方、1736cm−1のショルダーは、α−CD−PEO−PHB−PEO(2000−5200−2000)およびγ−CD−PEO−PHB−PEO (2000−5200−2000)のスペクトルにおいて急激に増大する。ICが形成されると、そのPHBセグメントのいくつかは、ICチャネルの個々に位置づけられ、次いで、凝集してPHB結晶を形成することができない。1723cm−1でのピークの存在は、PHBブロックの一部分のみが、CDによって被覆され、かつその残りのPHBセグメントは、なお、凝集して結晶質相を形成し得ることを示す。これは、上で議論したXRDの結果およびDSCの結果と一致する。
【0107】
図20は、α−CD、純粋なPEO−PHB−PEO(2000−5200−2000)およびそれらのICについての450℃までの熱重量分析(TGA)スキャンの結果を示す。図20において示されるように、α−CDは、279.2℃で分解し始める。純粋なPEP−PHB−PEO(2000−5200−2000)は、加熱の際に、初めに58.7%の質量損失を示し、そして、次に、39.3%の質量損失を示し、それぞれ、222.4℃および243.8℃で熱分解が始まった。この第1の室慮損失は、PHBブロックの分解に起因し、そして、この第2の質量損失は、PEOブロックの分解に起因すると考えられる。しかし、α−CD−PEO−PHB−PEO IC中のPHBブロック、PEOブロックおよびα−CDブロックの分解の開始は、247.2 ℃、 309.3
℃ および365.8℃でそれぞれ観測される。これらは、全て、PEO−PHB−PEO(2000−5200−2000)中のPHBおよびPEOおよび純粋なα−CDの分解の開始温度よりも、高い。α−CD−PEO−PHB−PEO ICのより高い分解温度は、α−CDおよびPEO−PHB−PEOの両方の熱安定性に対する複合体形成の寄与に起因すると考えられる。類似の結果が、また、γ−CD−PEO−PHB−PEO
ICについて観察された。
【0108】
(実施例5)
(PEO−PHB−PEOコポリマーミセル特徴付け)
実施例1の全部の手順に従って生成されたPEO−PHB−PEOコポリマーから、水性媒体中でミセルを形成し、次いで以下のように特徴付けした。
【0109】
(a.材料)
天然供給源ポリ[(R)−3−ヒドロキシブチレート](PHB)を、Aldrichから購入した。PHBサンプルを、クロロホルム中に溶解することにより精製した後、ろ過し、そして使用前に石油エーテル中に沈殿させた。精製したPHBのMnおよびMwは、それぞれ8.7×104および2.3×105であった。分子量約5000のメトキシ−ポリ(エチレンオキシド)モノプロピオン酸(M−PEO−A)を、Shearwater Polymers,Inc.,USAから購入した。M−EPO−AのMnおよびMwは、それぞれ4740および4880であると見出された。ビス(2−メトキシエチル)エーテル(ジグライムe、99%)、エチレングリコール(99%)、ジラウリン酸ジブチルスズ(95%)、1,3−N,N’−ジシクロヘキシルカルボジイミド(DCC、99%)、4−(ジメチルアミノ)ピリジン(DMAP、99%)、無水コハク酸(97%)およびトリエチルアミン(99%)を、Aldrichから得た。ジグライム(ジグライムe)を、モレキュラーシーブを用いて乾燥させ、使用前にCaH2から塩化メチレンを蒸留した。
【0110】
(b.純粋なPEO−PHB−PEOヒドロゲルの調製)
低分子量のテレケリック水酸化PHB(PHB−ジオール)プレポリマーを、ジグライム中に触媒としてジラウリン酸ブチルスズを用いて、天然PHBおよびジエチレングリコールからエステル交換により調製した(収率80%)。PHB−ジオール(0.38g、1.2×10−4mol、Mn=3220)、M−PEO−A(1.42g、3.0×10−4mol、Mn=4740)およびDMAP(12mg、9.8×10−5mol)を、減圧下60℃(油浴)にて一晩、50mL二頚フラスコ中で乾燥させ、無水塩化メチレン(25〜30mL)をこのフラスコに加え、次いで蒸留により無水塩化メチレンを除去して(油浴、75℃)、系中の微量の水を除去した。このフラスコを冷やして、4mlの無水塩化メチレンに溶解したDCC(0.098g、4.7×10−4mol)を加え、この混合物を、窒素下室温で一晩、攪拌した。沈殿したジクロロヘキシルウレア(DCU)を、濾過により除去した。ポリマーを、2回ジエチルエーテルから沈殿させた。メタノールまたはクロロホルムに再溶解させた所望のトリブロック(triblock)コポリマー生成物を、分留によりさらに精製した。収率:0.75g、56%。GPC(THF):Mn=12720、Mn(PHBブロック)=3820、Mn(PHBブロック)=4740、Mw=13770、Mw/Mn=1.08。Tm=54℃(PEOブロックについて)および140℃(PEOブロックについて)。1H NMR(400 MHz、CDCl3);δ5.29(m、PHBブロックのメチンH)、4.32(s、−COOCH2CH2COO−)、3.68(s、PEOブロックの−CH2OCH2−)、3.42(s、−OCH3末端基)、2.48〜2.67(m、PHBブロックのメチレンH)、1.31(d、PHBブロックのメチルH)。IR(KBr):2886、1723、1456、1380、1111、1061、962、842、516cm−1。
【0111】
(c.ポリマー特徴付け)
ゲル透過クロマトグラフィー(GPC)分析を、直列した2つのPhenogel 5μ 50および1000Åカラム(サイズ:300×4.6mm)ならびにShimadzu RID−10A屈折率検出器を装備したShimadzu SCL−10AおよびLC−8Aシステムを用いて行なった。溶離剤としてTHFを、流速0.30mL/分、40℃で使用した。単分散したポリ(エチレングリコール)標準物質を用いて、検量線を得た。1H NMRスペクトルを、室温で400MHzにてBruker AV−400NMR分光器上に記録した。1H NMR測定を、収集時間3.2秒、パルス繰返し時間2.0秒、30°パルス幅、5208−Hzスペクトル幅および32Kデータポイントを用いて行なった。化学シフトは、溶媒ピークに起因していた(CH3Clに対してδ=7.3ppm)。
【0112】
(d.蛍光分光法)
定常状態蛍光スペクトルを、Shimadzu RF−5301PC分光蛍光光度計上に記録した。励起スペクトルを、373nmでモニターした。励起側および発光側の両方いついてスリット幅を1.5nmに維持した。規定量のブロックポリマーを、既知濃度の水性ピレン溶液に溶解することによって、サンプル溶液を調製し、そしてこの溶液を、1日静置して平衡化させた。
【0113】
(e.結果および考察)
PEO−PHB−PEOトリブロックコポリマーのミセル形成を、色素吸収技術を使用して研究した。水溶液中のPEO−PHB−PEOトリブロックコポリマーの臨界ミセル濃度(cmc)値を、プローブとしてピレンの蛍光励起スペクトルを使用して決定した。Wilhelm,M.ら、Macromolecules 24:1033−1040(1991);Noda,T.ら、Macromolecules 33:3694−3704(2000)。この方法は、ピレンはミセル相に可溶化されるときの水中ピレンについて0−0最大吸収の334nm〜337nmのシフトに基づく。
【0114】
図21は、水中ピレンについて、PEO−PHB−PEOコポリマーの種々の濃度での励起スペクトルを示す。コポリマー濃度の増加につれて、334〜337nmの0−0吸収バンドのレッドシフトが観察された。図22は、ピレン励起スペクトルのI337/I334の強度比を、コポリマー濃度の対数関数として示す。I337/I334対Log
Cプロットは、S字形曲線を示した。I337/I334の強度比の無視できる変化が
、低濃度範囲で観察された。コポリマー濃度の増加につれて、強度比は、ある濃度でかなりの増加を示し、このことはピレンがミセルの疎水性コア領域に取り込まれることを示している。それゆえ、図22において、cmc値は、低濃度領域の交差点から決定される。極めて低いcmc値(1.4×10−5g/mL)は、トリブロックコポリマーが水性環境中でミセル形成の強い傾向があることを示す。
【0115】
ミセルの形成は、予想外にも、相対的に温度非感受性であることが見出された。図23に示されるように、15〜45℃の範囲の温度で、I337/I334比は、主に、温度ではなくコポリマー濃度に依存している。それゆえ、PEO−PHB−PEOトリブロックコポリマーのミセル形成は、相対的に温度非感受性である。このことは、中間のポリ(α−ヒドロキシアルカン酸)を有し、通常、温度感受性であるPLLAまたはPGAからなるPEOブロックを隣接するトリブロックコポリマーと全く異なる。Jeong(2002);Kissel(2002);Jeong(1997);Jeong(1999))。理論によって制限されることを望んでいないが、本発明者らは、PHBが、ポリ(α−ヒドロキシアルカン酸)よりも高い結晶性および疎水性を有し、従って、ブロックポリマーにおけるPHB断片の自己組織化の傾向は、はるかにより強く、温度変化に依存しないと考える。
【0116】
要約すると、新規の生分解性両親媒性PEO−PHB−PEOトリブロックコポリマーの温度非感受性ミセル形成を実証してきた。PHBは、PLLAに関連した化学構造を有しているが、PEO−PHB−PEOトリブロックコポリマーのミセル挙動は、PEO−PLLA−PEOトリブロックコポリマーと全く異なる。PEO−PHB−PEOトリブロックコポリマーにより形成されたミセル(これは、低温で解離し難く、高温で容易に大きなサイズに凝集しない)は、より安定であり、容易に取り扱われる。
【0117】
(実施例6)
(α−CD−EPO−PHB−PEOヒドロゲルのインビボ組織生物適合性)
αーCDおよびEPO−PHB−PEO(5000−2000−5000)から、実施例2の手順に従って形成されたヒドロゲルを、3匹のウサギの膝関節に関節内注射した。リン酸緩衝生理食塩水(PBS)を、ネガティブコントロールとして使用した。注射後7日目に、これらの動物を屠殺した。膝関節を収集して、組織学により試験した。このサンプルを、盲目的な条件下で評価した。
【0118】
ウサギ膝関節におけるヒドロゲルのインビボ生体適合性試験の代表的な結果を、図24a(PBSコントロール)および図24b(α−CD−EPO−PHB−PEOヒドロゲル)に示す。図24b中のスライドに示されるように、α−CD−EPO−PHB−PEOヒドロゲルに曝露された滑膜において軽度の線維形成があったが、これら2つのサンプルの間で有意な違いはなかった。全部の分析は、ヒドロゲルの注射後、関節滑膜において明かに炎症性湿潤がなかったことを示した。この結果は、ウサギ膝関節においてヒドロゲルの生物適合性を示した。ヒドロゲルを注射した膝とPBSを注射した膝との間で、組織学的にも、形態学的にも有意な違いはなかった。
【0119】
本発明の好ましい実施形態を説明し、記載してきたが、発明の意図および範囲から逸脱することなく、本明細書中に種々の変化がなされ得ることは、十分理解されている。
【技術分野】
【0001】
(発明の分野)
本発明は、ポリ(ヒドロキシアルカノエート)ポリマーブロックおよびポリ(アルキレンオキシド)ポリマーブロックを有する、両親媒性コポリマーを合成する方法、このようなポリマーとシクロデキストリンとによって形成されるヒドロゲル、ならびにこのようなポリマーおよびヒドロゲルに基づく、注射可能なヒドロゲル薬物送達システムを含む生体材料に関する。
【背景技術】
【0002】
(発明の背景)
多くの薬物は、ヒトまたは他の哺乳動物の身体中に治療効果(これは、経時的にかなり変化する)を生じる方法によって送達するために合成される。静脈内経路によって送達される薬物は、血漿薬物濃度においてほぼ即時のピークを生じ得、続いて、この薬物が代謝されるにつれて、血漿レベルが次第に低下する。経口経路または筋肉内経路によって送達される薬物は、この薬物の全身取り込みの間に次第に増加する、血漿中の薬物濃度を生じ得、続いて、ピークの血漿薬物レベルから低下する。薬物投薬は、頻繁な間隔で(例えば、毎日)繰り返されることが必要であり得るが、これはせいぜい、連続的または一定の治療レベルに近づくにすぎない。
【0003】
多くの型の治療剤を、長期間にわたるこれらの薬物の徐放を提供する送達システムにおいて送達することが有利である。制御放出および薬物の送達のために使用される種々のポリマーが、過去20年間で開発された。これらのポリマーのほとんどは、移植物または注射可能な微小球に形成される。このようなポリマーは、生分解性かつ生体適合性であり、そして生分解性かつ生体適合性でなければならない。適切な形態のポリマーを生成するために、複雑な製造プロセスが必要とされ、これには代表的に、有機溶媒が関与する。しかし、有機溶媒の使用は、いくつかのタンパク質薬物の分解を引き起こし得、そしてさらに、有機溶媒は、微量でさえも、毒性であり得る。
【0004】
ポリマーヒドロゲルが、薬物送達および制御放出のために開発されている。例えば、化学的に架橋したポリマーヒドロゲルが、移植物として使用されている。いくつかの注射可能な薬物送達システムは、注射後に、身体内で化学的に架橋したヒドロゲルを形成し、薬物の蓄積を提供する。しかし、身体内で起こる化学反応は、これらのポリマーの存在および/またはこれらのポリマーのいくらかの分解に起因して、組織の刺激および損傷を引き起こし得る。
【0005】
物理的なポリマーヒドロゲルは、生体材料適用のために広範に開発されている。例としては、エナンチオマーポリマーまたはポリペプチドセグメントと、温度感受性特性またはpH感受性特性を有するヒドロゲルとの複合体化によって形成されるヒドロゲルが挙げられる。これらは、タンパク質のような繊細な生体活性剤の捕捉に関与する穏やかな水性条件に起因して、制御された薬物送達のための特別な注意を引く。例えば、インサイチュで形成される、熱感受性ブロックコポリマーから形成されるヒドロゲルはまた、薬物のための徐放材料として提唱されている。これらは、ゲル形成に関与する化学反応が存在しないという利点を有する。これらのコポリマーヒドロゲルは、通常、高分子薬物(例えば、タンパク質およびホルモン)のために設計される。このような温度感受性ヒドロゲルの欠点は、このようなゲルを注射において使用する実用性である。
【0006】
より最近は、両親媒性ブロックコポリマーは、固相および溶液中おけるその独特の鎖構造および物理的特性に起因して、基礎研究および適用についての特別な興味を引いた。Forster,S.ら、Adv.Mater.10:195−217(1998);Alexandridis,P.Curr.Opin.Colloid Interface
Sci.1:490−501(1996)。これらは、非常に規則的な自己構築構造体のための、超分子ポリマー化学における構築ブロックとして、徹底的に研究された。Forster(1998),Alexandridis(1996);Vanhest,J.ら、W.Science 268:1592−1595(1995);Jenekhe,S.ら、Science 283:372−375(1999);Kukula,H.ら、J.Am.Chem.Soc.124:1658−1663(2002)。両親媒性ブロックコポリマーは、この自己構築を利用する生体材料と考えられた。これらの研究は、新規な巨視的特性を有する生体材料を生じ、これらは、制御された薬物送達および組織操作のために使用される。Jeong,B.ら、Adv.Drug Delivery Rev.54:27−51(2002);Kissel,T.ら、Adv.Drug Delivery Rev.54:99−134(2002)。
【0007】
ポリ(エチレンオキシド)(PEO)は、親水性の生体適合性ポリエーテルとして広範に使用される。Herold,D.ら、Biochem.Pharmacol.38:73−76(1989)。親水性セグメントとしてPEOを含有する両親媒性ABAトリブロックコポリマーは、以前に研究されており、そして生体材料としての使用について記載されている。用語ABAとは、本明細書中で、第一のポリマーの中心セグメント(Bブロックポリマーと称される)、ならびに第二のポリマーの第一末端および第二末端のセグメント(Aブロックポリマーと称される)を含むポリマーをいうように使用される。代表的な例として、市販のポリ(エチレンオキシド)−ポリ(プロピレンオキシド)−ポリ(エチレンオキシド)(PEO−PPO−PEO、PluronicsTM)トリブロックコポリマーが、それらの相挙動および薬物送達のための潜在的な適用の観点で、徹底的に研究されている。Alexandridis,P.ら、Colloids Surf.96:1−46(1995);Bromberg,L.ら、Adv.Drug Del Rev.31:197−221(1998)。最近、さらなる注意が、PEOと生分解性ポリエステルとの両親媒性ABAトリブロックコポリマーに集中している。PEOおよびポリエステルからなるトリブロックコポリマー(例えば、ポリ(L−乳酸)(PLLA)、ポリ(グリコール酸))またはこれらのコポリエステルの合成および特徴付けが、報告されている。Jeong,B.ら、Nature 388:860−862(1997);Jeong,B.ら、Macromolecules 32:7064−7069(1999);米国特許第5,384,333号;米国特許第5,702,717号;米国特許第4,716,203号;米国特許第5,476,909号。このような両親媒性ブロックコポリマーは、水中で、ミセル、またはゲルさえも形成する傾向があり、これらは、注射可能な薬物送達システムのために潜在的に有用である。
【0008】
別の興味深いヒドロゲル系は、線状ポリマー(例えば、ポリ(エチレンオキシド)(PEO)をシクロデキストリン(CD)の内側空洞に貫入させて、ネックレス様の超分子構造を有する包接複合体を形成することによって作製される、ポリロタキサンからなる。Harada A.ら、Nature 356:325(1992);Li J.ら、Polym.J.26:1019(1994)。しかし、高分子量のPEOのみが、α−CDとヒドロゲルを形成し得、そしてこのヒドロゲルの、水溶液中での解離は、PEOの親水性の性質に起因して、迅速である。
【0009】
関連するヒドロゲルを使用する、注射可能な薬物送達システムは、発明者Liらの名義の米国特許出願2002/0019369 A1(発明の名称Injectable Drug Delivery Systems with Cyclodextrin−Polymer Based Hydrogels)に開示されており、その開示は、明白に本明細書中に参考として援用される。この出願は、シクロデキストリンポリマーベースの注射可能な組成物を開示し、この組成物は、CD、ポリ(エチレングリコール)(PEG)、PEG誘導体またはPEGコポリマーであるポリマー、および薬物から形成される。ポリ(プロピレングリコール)または他のポリ(アルキレングリコール)の使用が、このシステムにおけるポリマーとして参照される。この刊行物に開示されるポリマーヒドロゲルは、有望な徐放システムを提供するが、これらは、1週間より長い徐放のために最適化された放出速度論を提供することが実証されていない。
【0010】
ポリ[(R)−3−ヒドロキシブチレート](PHB)は、多くの微生物によって、炭素およびエネルギーの貯蔵物質として合成される、光学活性な生分解性ポリエステルである。Doi,Y.Microbial Polyesters;VCH Publisher,New York(1990)。
【0011】
Chaらに対する米国特許第5,702,717号は、疎水性のAポリマーブロック(これは、ポリ(α−ヒドロキシ酸)またはポリ(エチレンカーボネート)であり得る)および親水性のBポリマーブロック(これは、ポリ(エチレングリコール)である)から作製される、熱感受性の生分解性コポリマーを開示する。これらのポリマーは、薬物送達について開示されており、そして逆熱発生挙動を示すと特徴付けられている。ポリ(α−ヒドロキシ酸)ポリマーブロックの潜在的な例の開示される列挙は、ヒドロキシ酪酸を含む;しかし、これは、ポリ(β−ヒドロキシアルカノエート)であり、そしてChaらによって教示されるポリマークラスの範囲内ではなく、そしてChaらによって求められた特徴の全てを示すようではない。さらに、Chaらは、環状モノマーの開環重合が関与する合成プロセスを利用し、これは、ポリ(α−ヒドロキシ酸)の潜在的に望ましくないラセミ化を生じ得る。
【発明の概要】
【課題を解決するための手段】
【0012】
(発明の要旨)
本発明は、シクロデキストリンおよび両親媒性コポリマーから形成されるヒドロゲル、ならびにこのヒドロゲルの中心に含まれる治療有効量の少なくとも1つの治療剤を含有する、薬物送達システムを提供し、このコポリマーは、ポリ(アルキレンオキシド)を含むAポリマーブロックおよびポリ(ヒドロキシアルカノエート)を含むBポリマーブロックを含む。
【0013】
本発明はまた、両親媒性ABAトリブロックコポリマーを合成するためのプロセスを提供し、このコポリマーは、ポリ(エチレンオキシド)をAブロックポリマーとして、およびポリ(3−ヒドロキシブチレート)をBブロックポリマーとして含有する。このプロセスは、以下を包含する:ポリ(3−ヒドロキシブチレート)を、より低分子量を有するテレケリックポリ(3−ヒドロキシブチレート)−ジオールに変換する工程;メトキシ−ポリ(エチレンオキシド)−モノカルボン酸を、メトキシ−ポリ(エチレンオキシド)から生成する工程;ならびに1−3−ジシクロヘキシルカルボジイミドを使用して、ポリ(3−ヒドロキシブチレート)−ジオールをメトキシ−ポリ(エチレンオキシド)−モノカルボン酸とカップリングして、ABAトリブロックコポリマーを生じる工程。
【0014】
本発明はまた、シクロデキストリン、水ベースの流体中の治療有効量の少なくとも1つの治療剤、および両親媒性コポリマーを合わせることによって、ヒドロゲル薬物送達システムを形成するためのプロセスを提供し、ここで、このコポリマーは、ポリ(アルキレンオキシド)を含むAポリマーブロック、およびポリ(ヒドロキシアルカノエート)を含むBポリマーブロックを含有する。
【0015】
本発明の別の局面において、処置を必要とするヒトまたは他の哺乳動物を、少なくとも1つの治療剤で処置する方法が提供される。この方法は、少なくとも1つの治療剤を薬物送達システムにおいて投与することを提供し、この薬物送達システムは、シクロデキストリンおよび両親媒性コポリマーから形成されるヒドロゲルを含有し、ここで、このコポリマーは、ポリ(アルキレンオキシド)を含むAポリマーブロック、およびポリ(ヒドロキシアルカノエート)を含むBポリマーブロックを含有し、ここで、治療有効量の少なくとも1つの治療剤は、このヒドロゲルの中心に含まれる。
【0016】
本発明の1つの好ましい実施形態において、Aポリマーブロックは、ポリ(エチレンオキシド)(PEO)であり、そしてBポリマーブロックは、ポリ[(R)−3−ヒドロキシブチレート](PHB)である。α−シクロデキストリン(α−CD)とヒドロゲルを形成するためにこの実施例において使用されるコポリマーは、トリブロックPEO−PHB−PEOコポリマーである。
【0017】
本発明の実施例の両親媒性トリブロックコポリマーは、末端セグメントとしてPEOを使用し、そして中間セグメントとしてPHBを使用して、興味深い特徴を有する。なぜなら、PHBは、非常に結晶性かつ疎水性であるからである。さらに、PHBは、PLLAおよび他の多くの従来使用される生体ポリエステルより低いインビボ分解速度を有する。Gogolewski,S.ら、J.Biomed.Mat.Res.27:1135−1148(1993)。従って、PEO−PHB−PEOトリブロックコポリマーは、以前に開発されたポリマーより長期間の移植または薬物の制御送達のために、より有望であり得る。
【0018】
α−CDとPEOブロックとの間の複合体の自己構築に加えて、PHBの中央セグメントブロックの間の疎水性−疎水性相互作用は、ヒドロゲル網目構造をさらに強化する。このヒドロゲルの特性は、PHBおよびPEOの分子量およびモル比を調節することによって微調整され得、これらを種々の生物医学的適用(例えば、タンパク質、ペプチド、遺伝子、低分子、抗体およびそのフラグメント、ならびにヒト組換えタンパク質、抗原、DNA、RNAまたはDNAナノ粒子の送達のため、ならびに組織操作のため)のために潜在的に魅力的にする。
【0019】
本発明のPEO−PHB−PEOヒドロゲルは、他の公知のヒドロゲルと比較して、大いに増加された徐放特徴を有する。これは部分的に、中央セクションの、驚くべき程度までの疎水性の増加に起因する。これらのヒドロゲルはまた、増強された安定性を示し、ゲルをより迅速に形成し、そして必要とされるシクロデキストリンの使用がより少なく、任意の所望でない副作用(例えば、潜在的な炎症であり、これは、過剰のシクロデキストリンが利用される場合に起こり得る)を最小にする。
【0020】
本発明のPEO−PHB−PEOトリブロックコポリマーは、水性媒体中でのミセル形成に対する強い傾向を有する。本発明のコポリマーからのミセルの形成は、比較的温度非感受性である。この温度非感受性は、PHBおよびPLLAが類似の化学構造を有することを考慮して、他のポリ(α−ヒドロキシアルカン酸)(例えば、PLLAまたはPGA)(Jeong(2002);Kissel(2002);Jeong(1997);Jeong(1999))から形成されるミセルの相対的な温度不安定性と比較される場合に、予測不可能である。従って、本発明のミセルは、例えば、15〜45℃の範囲にわたって、薬物送達によく適している。なぜなら、これらは、この範囲内のより高い温度において、尚早に分解する傾向がなく、そしてこの範囲内のより低い温度において、より大きいサイズに迅速に凝集しないからである。
【0021】
本発明は、以下を提供する。
(項目1)
以下:
シクロデキストリンおよび両親媒性コポリマーから形成されるヒドロゲルであって、該コポリマーが、ポリ(アルキレンオキシド)を含むAポリマーブロックおよびポリ(ヒドロキシアルカノエート)を含むBポリマーブロックを含む、ヒドロゲル;および
ヒドロゲルの内心に(intimately)含まれる治療有効量の少なくとも1種の治療剤、
を含む薬物送達システム。
(項目2)
薬学的に受容可能な水性塩基をさらに含む、項目1に記載のシステム。
(項目3)
前記薬物送達システムが、注射可能である、項目1に記載のシステム。
(項目4)
前記ヒドロゲルが、チキソトロピーである、項目3に記載のシステム。
(項目5)
前記システムが、薬物送達の開始後少なくとも1週間の間、少なくとも1種の治療剤の徐放を提供する、項目1に記載のシステム。
(項目6)
前記システムが、薬物送達の開始後少なくとも2週間の間、少なくとも1種の治療剤の徐放を提供する、項目1に記載のシステム。
(項目7)
前記ポリ(アルキレンオキシド)が、以下:ポリ(エチレンオキシド)、ポリ(テトラメチレンオキシド)およびポリ(テトラヒドロフラン)からなる群から選択される、項目1に記載のシステム。
(項目8)
前記ポリ(アルキレンオキシド)が、ポリ(エチレンオキシド)である、項目7に記載のシステム。
(項目9)
前記ポリ(ヒドロキシアルカノエート)が、以下:
ポリ[(R)−3−ヒドロキシブチレート];ポリ[(R)−4−ヒドロキシブチレート];ポリ[(R)−3−ヒドロキシバレレート];ポリ[(R)−3−ヒドロキシブチレート]−co−ポリ[(R)−3−ヒドロキシバレレート];ポリ[(R)−3−ヒドロキシヘキサノエート];ポリ[(R)−3−ヒドロキシヘプタノエート];このような(R)エナンチオマーのそれぞれの(S)エナンチオマー;このような(S)エナンチオマーおよび(R)エナンチオマーのラセミ混合物;およびそれらの混合物、からなる群から選択される、項目1に記載のシステム。
(項目10)
前記ポリ(ヒドロキシアルカノエート)が、以下:ポリ[(R)−3−ヒドロキシブチレート];ポリ[(R)−4−ヒドロキシブチレート];このような(R)エナンチオマーのそれぞれの(S)エナンチオマー;(S)エナンチオマーおよび(R)エナンチオマーのラセミ混合物;およびそれらの混合物、からなる群から選択される、項目1に記載のシステム。
(項目11)
前記ポリ(ヒドロキシアルカノエート)が、ポリ[(R)−3−ヒドロキシブチレート]を含む、項目1に記載のシステム。
(項目12)
前記コポリマーが、1つのBポリマーブロック中間セグメントおよび2つのAポリマーブロック末端セグメントを含む両親媒性トリブロックコポリマーである、項目1に記載のシステム。
(項目13)
前記ポリ(ヒドロキシアルカノエート)Bブロックポリマーが、以下:ポリ[(R)−3−ヒドロキシブチレート];ポリ[(R)−4−ヒドロキシブチレート];ポリ[(R)−3−ヒドロキシバレレート];ポリ[(R)−3−ヒドロキシブチレート]−co−ポリ[(R)−3−ヒドロキシバレレート];ポリ[(R)−3−ヒドロキシヘキサノエート];ポリ[(R)−3−ヒドロキシヘプタノエート];このような(R)エナンチオマーのそれぞれの(S)エナンチオマー;このような(S)エナンチオマーおよび(R)エナンチオマーのラセミ混合物;およびそれらの混合物、からなる群から選択される、項目12に記載のシステム。
(項目14)
前記ポリ(アルキレンオキシド)Aブロックポリマーが、以下:ポリ(エチレンオキシド)、ポリ(テトラメチレンオキシド)およびポリ(テトラヒドロフラン)からなる群から選択される、項目12に記載のシステム。
(項目15)
ポリ(アルキレンオキシド)Aブロックポリマーが、ポリ(エチレンオキシド)である、項目14に記載のシステム。
(項目16)
前記ポリ(ヒドロキシアルカノエート)Bブロックポリマーが、以下:ポリ[(R)−3−ヒドロキシブチレート];ポリ[(R)−4−ヒドロキシブチレート];ポリ[(R)−3−ヒドロキシバレレート];ポリ[(R)−3−ヒドロキシブチレート]−co−ポリ[(R)−3−ヒドロキシバレレート];ポリ[(R)−3−ヒドロキシヘキサノエート];ポリ[(R)−3− ヒドロキシヘプタノエート];このような(R)エナンチオマーのそれぞれの(S)エナンチオマー;(S)エナンチオマーおよび(R)エナンチオマーのラセミ混合物;およびそれらの混合物、からなる群から選択される、項目15に記載のシステム。
(項目17)
前記ポリ(アルキレンオキシド)Aブロックポリマーおよび前記ポリ(ヒドロキシアルカノエート)Bブロックポリマーの各々が、500から20,000の分子量を有する、項目1に記載のシステム。
(項目18)
前記ポリ(アルキレンオキシド)Aブロックポリマーおよび前記ポリ(ヒドロキシアルカノエート)Bブロックポリマーの各々が、2,000から10,000の分子量を有する、項目1に記載のシステム。
(項目19)
前記ポリ(ヒドロキシアルカノエート)Bブロックポリマーが、3,000から2,500の分子量を有する、項目1に記載のシステム。
(項目20)
前記シクロデキストリンが、コポリマーの5重量%〜80重量%のレベルで含まれる、項目1に記載のシステム。
(項目21)
前記シクロデキストリンが、コポリマーの5重量%〜50重量%のレベルで含まれる、項目1に記載のシステム。
(項目22)
前記ヒドロゲルが、約1重量%〜約80重量%のレベルでコポリマーを含む水溶液を含む、項目1に記載のシステム。
(項目23)
前記ヒドロゲルが、約10重量%〜約40重量%のレベルでコポリマーを含む水溶液を含む、項目1に記載のシステム。
(項目24)
治療剤と複合体化し、そして/または治療剤と結合体化する第2のポリマーをさらに含む、項目1に記載のシステム。
(項目25)
前記第2のポリマーが、以下:ポリエステル、ポリウレタン、ポリアミド、ポリエーテル、ポリサッカリド、ポリ(アミノ酸)、ポリペプチドおよびタンパク質からなる群から選択されるポリマーである、項目24に記載のシステム。
(項目26)
前記第2のポリマーが、ポリ(エチレングリコール)セグメントを有する二官能性ポリマーまたは単官能性ポリマーである、項目24に記載のシステム。
(項目27)
DNAナノ粒子をさらに含む、項目1に記載のシステム。
(項目28)
前記コポリマーが、1,000から50,000の分子量を有する、項目1に記載のシステム。
(項目29)
前記コポリマー5,000〜35,000の分子量を有する、項目1に記載のシステム。
(項目30)
前記少なくとも1種の治療剤が、以下:ペプチド、タンパク質、低分子、遺伝子、抗原、抗体およびそのフラグメントならびにヒト組換えタンパク質、DNA、RNAおよびDNAナノ粒子からなる群から選択される、項目1に記載のシステム。
(項目31)
前記少なくとも1種の治療剤が、高分子形態である、項目1に記載のシステム。
(項目32)
前記少なくとも1種の治療剤が、以下:鎮痛剤、麻酔薬、抗関節炎薬物、疾患改変抗リウマチ薬物、抗喘息薬物、抗凝固剤、抗痙攣薬、抗うつ剤、抗糖尿病薬、抗悪性腫瘍薬、抗精神病薬、降圧薬、抗生物質、抗ヒスタミン剤、消炎剤、抗炎症薬、筋肉弛緩剤、駆虫薬、抗ウイルス薬、抗再狭窄薬、鎮痙剤、軟骨保護剤(chondroprotective agent)、抗接着剤、抗腫瘍細胞侵襲剤、血管弛緩薬、血管収縮薬および免疫抑制薬からなる群から選択される、項目1に記載のシステム。
(項目33)
前記少なくとも1種の治療剤が、以下:ペプチド、タンパク質(サイトカイン、成長因子、血管新生因子、可溶性レセプター、抗体およびそのフラグメントならびにヒト組換えタンパク質を含む)、低分子、遺伝子、抗原(ワクチンを含む)、DNA、RNAおよびDNAナノ粒子、からなる群から選択される、項目1に記載のシステム。
(項目34)
前記ヒドロゲルが、移植可能デバイスに適用される、項目1に記載のシステム。
(項目35)
前記移植可能デバイスが、以下:ステント、カテーテル、気道チューブ、導管、スクリュー、プレート、シャント、人工関節、人工心臓、人工弁および他の人工器官からなる群から選択される、項目34に記載のシステム。
(項目36)
以下:
シクロデキストリンおよび両親媒性コポリマーから形成されるヒドロゲルであって、該コポリマーが、ポリ(エチレンオキシド)を含むAポリマーブロックおよびポリ(ヒドロキシブチレート)を含むBポリマーブロックを含む、ヒドロゲル;および
ヒドロゲルの内心に(intimately)含まれる治療有効量の少なくとも1種の治療剤、
を含む薬物送達システム。
(項目37)
シクロデキストリンおよび両親媒性コポリマーを含むヒドロゲルであって、該コポリマーが、ポリ(アルキレンオキシド)を含むAポリマーブロックおよびポリ(ヒドロキシアルカノエート)を含むBポリマーブロックを含む、ヒドロゲル。
(項目38)
両親媒性ABAトリブロックコポリマーを合成するためのプロセスであって、該ABAトリブロックコポリマーは、Aブロックポリマーとしてポリ(エチレンオキシド)およびBブロックポリマーとしてポリ(3−ヒドロキシアルカノエート)を含み、該プロセスは、以下:
低い分子量を有するテレケリックポリ(3−ヒドロキシアルカノエート)−ジオールにポリ(3−ヒドロキシアルカノエート)を変換する工程;
メトキシ−ポリ(エチレンオキシド)からメトキシ−ポリ(エチレンオキシド)−モノカルボン酸を生成する工程;および
1,3−ジシクロヘキシルカルボジイミドを用いて、メトキシ−ポリ(エチレンオキシド)−モノカルボン酸とポリ(3−ヒドロキシアルカノエート)−ジオールとをカップリングして、ABAトリブロックコポリマーを得る工程、
を包含する、プロセス。
(項目39)
前記ポリ(3−ヒドロキシアルカノエート)が、ポリ(3−ヒドロキシブチレート)であり、そしてポリ(3−ヒドロキシアルカノエート)−ジオールが、ポリ(3−ヒドロキシブチレート)−ジオールである、項目38に記載のプロセス。
(項目40)
前記ポリ(3−ヒドロキシアルカノエート)が、エチレングリコールを用いるエステル交換反応によって、テレケリックポリ(3−ヒドロキシアルカノエート)−ジオールに変換される、項目38に記載のプロセス。
(項目41)
前記メトキシ−ポリ(エチレンオキシド)−モノカルボン酸が、1,4−ジオキサン中、4−(ジメチルアミノ)ピリジンおよびトリエチルアミンの存在下、無水コハク酸とメトキシ−ポリ(エチレンオキシド)とを反応することによって生成される、項目38に記載のプロセス。
(項目42)
前記ポリ(3−ヒドロキシアルカノエート)−ジオールおよび前記メトキシ−ポリ(エチレンオキシド)−モノカルボン酸が、カップリング工程の前に乾燥される、項目38に記載のプロセス。
(項目43)
前記ポリ(3−ヒドロキシアルカノエート)−ジオールおよび前記メトキシ−ポリ(エチレンオキシド)−モノカルボン酸が、乾燥塩化メチレン中でカップリングされる、項目38に記載のプロセス。
(項目44)
前記ポリ(3−ヒドロキシアルカノエート)−ジオールおよび前記メトキシ−ポリ(エチレンオキシド)−モノカルボン酸が、窒素雰囲気下、乾燥塩化メチレン中でカップリングされる、項目43に記載のプロセス。
(項目45)
前記ポリ(3−ヒドロキシアルカノエート)−ジオールおよび前記メトキシ−ポリ(エチレンオキシド)−モノカルボン酸が、過剰なメトキシ−ポリ(エチレンオキシド)−モノカルボン酸とカップリングされる、項目38に記載のプロセス。
(項目46)
ABAトリブロックコポリマーを、以下:メタノール/ジエチルエーテルおよびクロロホルム/ジエチルエーテルからなる群から選択される混合溶媒を使用して、単離する工程をさらに包含する、項目38に記載のプロセス。
(項目47)
以下:
両親媒性ABAコポリマーから形成されるミセルであって、ここで、コポリマーが、ポリ(アルキレンオキシド)を含むAポリマーブロックおよび以下:ポリ[(R)−3−ヒドロキシブチレート]、ポリ[(R)−4−ヒドロキシブチレート]、このような(R)エナンチオマーのそれぞれの(S)エナンチオマー、このような(S)エナンチオマーおよび(R)エナンチオマーのラセミ混合物、およびそれらの混合物からなる群から選択される、ポリ(ヒドロキシアルカノエート)を含むBポリマーブロックを含む、ミセル;および
ミセル内にintimately含まれる治療有効量の少なくとも1種の治療剤、
を含む、薬物送達システム。
(項目48)
薬学的に受容可能な水性塩基をさらに含む、項目47に記載のシステム。
(項目49)
前記ミセルが、ヒドロゲルを形成するように水性塩基中で十分な濃度である、項目48のシステム。
(項目50)
前記ヒドロゲルが、移植可能デバイスに適用される、項目49に記載のシステム。
(項目51)
前記移植可能なデバイスが、以下:ステント、カテーテル、気道チューブ、導管、スクリュー、プレート、シャント、人工関節、人工心臓、人工弁および他の人工器官からなる群から選択される、項目50に記載のシステム。
(項目52)
前記システムが、薬物放出の開始後、少なくとも約1週間の間、少なくとも1種の治療剤の徐放を提供する、項目47に記載のシステム。
(項目53)
前記ポリ(アルキレンオキシド)が、以下:ポリ(エチレンオキシド)、ポリ(テトラメチレンオキシド)およびポリ(テトラヒドロフラン)からなる群から選択される、項目47に記載のシステム。
(項目54)
前記ポリ(アルキレンオキシド)が、ポリ(エチレンオキシド)である、項目53に記載のシステム。
(項目55)
前記ポリ(ヒドロキシアルカノエート)が、ポリ[(R)−3−ヒドロキシブチレート]を含む、項目54に記載のシステム。
(項目56)
前記ポリ(ヒドロキシアルカノエート)が、ポリ[(R)−3−ヒドロキシブチレート]を含む、項目47に記載のシステム。
(項目57)
前記ポリ(アルキレンオキシド)Aブロックポリマーおよび前記ポリ(ヒドロキシアルカノエート)Bブロックポリマーの各々が、500〜20,000の分子量を有する、項目47に記載のシステム。
(項目58)
前記ポリ(アルキレンオキシド)Aブロックポリマーおよび前記ポリ(ヒドロキシアルカノエート)Bブロックポリマーの各々が、2,000〜10,000の分子量を有する、項目47に記載のシステム。
(項目59)
前記ポリ(ヒドロキシアルカノエート)Bブロックポリマーが、3,000〜2,500の分子量を有する、項目47に記載のシステム。
(項目60)
前記治療剤と複合体化し、そして/または結合体化する第2のポリマーをさらに含む、項目47に記載のシステム。
(項目61)
前記ミセルが、少なくとも1種の治療剤をカプセル化するナノ粒子または微粒子を形成する、項目47に記載のシステム。
(項目62)
前記コポリマーが、1,000〜50,000の分子量を有する、項目47に記載のシステム。
(項目63)
前記コポリマーが、5,000〜35,000の分子量を有する、項目47に記載のシステム。
(項目64)
前記少なくとも1種の治療剤が、以下:ペプチド、タンパク質、低分子、遺伝子、抗原、抗体およびそれらのフラグメント、ならびにヒト組換えタンパク質、DNA、RNAおよびDNAナノ粒子からなる群から選択される、項目47に記載のシステム。
(項目65)
前記少なくとも1種の治療剤が、高分子形態である、項目47に記載のシステム。
(項目66)
前記少なくとも1種の治療剤が、以下:鎮痛剤、麻酔薬、抗関節炎薬物、疾患改変抗リウマチ薬物、抗喘息薬物、抗凝固剤、抗痙攣薬、抗うつ剤、抗糖尿病薬、抗悪性腫瘍薬、抗精神病薬、降圧薬、抗生物質、抗ヒスタミン剤、消炎剤、抗炎症薬、筋肉弛緩剤、駆虫薬、抗ウイルス薬、抗再狭窄薬、鎮痙剤、軟骨保護剤、抗接着剤、抗腫瘍細胞侵襲剤、血管弛緩薬、血管収縮薬および免疫抑制薬からなる群から選択される、項目47に記載のシステム。
(項目67)
前記少なくとも1種の治療剤が、以下:ペプチド、タンパク質(サイトカイン、成長因子、血管新生因子、可溶性レセプター、抗体およびそのフラグメントならびにヒト組換えタンパク質を含む)、低分子、遺伝子、抗原(ワクチンを含む)、DNA、RNAおよびDNAナノ粒子、からなる群から選択される、項目47に記載のシステム。
(項目68)
前記ミセルが、15℃〜45℃の範囲の温度で実質的に安定である、項目47に記載のシステム。
【図面の簡単な説明】
【0022】
本発明の上記局面および付随する利点の多くは、添付の図面と組み合わせて考慮される場合に、以下の詳細な説明を参照することによって、より容易に理解される。
【図1】図1は、本発明の実施形態に従う、ポリ(エチレンオキシド)−ポリ[(R)−3−ヒドロキシブチレート]−ポリ(エチレンオキシド)(PEO−PHB−PEO)コポリマーの合成のための化学反応スキームを提供する。
【図2】図2は、実施例1において生成されたPEO−PHB−PEOコポリマーについて、および対応するプレポリマーについての、ゲル透過クロマトグラフィー(GPC)のクロマトグラムを提供する。
【図3】図3は、実施例1において生成されたPEO−PHB−PEOコポリマーについて、および対応するプレポリマーについての1H NMRスペクトルを提供する。
【図4】図4は、実施例1のプロセスに従って生成されたPEO−PHB−PEO(2000−3900−2000)コポリマーについて、および対応するプレポリマーについてのFTIRスペクトルを提供する。
【図5】図5は、実施例1のプロセスに従って生成されたPEO−PHB−PEOコポリマーについて、および対応するプレポリマーについての、熱重量分析(TGA)の間の減量曲線を提供する。
【図6】図6は、実施例1のプロセスに従って生成された、様々な分子量のPEO−PHB−PEOコポリマーについて、および対応するプレポリマーについての、示差走査熱分析(DSC)サーモグラムを提供する。
【図7】図7は、実施例1のプロセスに従って生成された、様々な分子量のPEO−PHB−PEOコポリマーについて、および対応するプレポリマーについての、示差走査熱分析(DSC)サーモグラムを提供する。
【図8】図8は、実施例1のプロセスに従って生成された、様々な分子量のPEO−PHB−PEOコポリマーについて、および対応するプレポリマーについての、広角X線回折(XRD)図を提供する。
【図9】図9は、実施例1のプロセスに従って生成された、様々な分子量のPEO−PHB−PEOコポリマーについて、および対応するプレポリマーについての、広角X線回折(XRD)図を提供する。
【図10】図10は、以下から放出される、BSA−FITC(1.0mgのBSA−FITCを負荷された300mgのヒドロゲル)についての、実施例2からのインビトロ放出プロフィールを示す:α−CD−PEO(10000)ヒドロゲル(黒丸)(従来技術);α−CD−PEO(20000)ヒドロゲル(黒菱形)(従来技術);本発明の実施形態に従うα−CD−PEO−PHB−PEO(5000−2350−5000)ヒドロゲル(黒三角);および本発明の実施形態に従うα−CD−PEO−PHB−PEO(5000−3850−5000)ヒドロゲル(黒四角)。
【図11】図11は、以下から放出される、デキストラン−FITC(1.0mgのデキストラン−FITC(20,000のMn)を負荷された300mgのヒドロゲル)についての、実施例3からのインビトロ放出プロフィールを示す:PEOーPHB−PEO(5000−5500−5000)ヒドロゲル(黒四角);本発明の実施形態に従うα−CD−PEO−PHB−PEO(5000−5500−5000)ヒドロゲル(黒丸);および本発明の実施形態に従うα−CD−PEO−PHB−PEO(5000−3800−5000)ヒドロゲル(黒三角)。
【図12】図12は、α−CDと複合体化した種々の分子量のPEO−PHB−PEOコポリマーと比較した、複合体化していないPEO−PHB−PEOコポリマーについてのXRD図を提供する。
【図13】図13は、γ−CDと複合体化した種々の分子量のPEO−PHB−PEOコポリマーと比較した、複合体化していないPEO−PHB−PEOコポリマーについてのXRD図を提供する。
【図14】図14は、α−CDと複合体化した種々の分子量のPEO−PHB−PEOコポリマーと比較した、複合体化していないPEO−PHB−PEOコポリマーについてのDSCサーモグラムを提供する。
【図15】図15は、γ−CDと複合体化した種々の分子量のPEO−PHB−PEOコポリマーと比較した、複合体化していないPEO−PHB−PEOコポリマーについてのDSCサーモグラムを提供する。
【図16】図16は、複合体化していないα−CD、およびPEO−PHB−PEO(2000−5200−2000)コポリマーと複合体化したα−CDについての13C CP/MAS NMRスペクトルを提供し、矢印は、コンホメーションが制限されたグリコシド単結合に隣接するC−1およびC−4についての分解された共鳴を示す。
【図17】図17は、DMSO−d6中での、PEO−PHB−PEO(2000−5200−2000)コポリマーと複合体化したα−CDの400 1H NMRスペクトルを提供する。
【図18】図18は、複合体化していないPEO−PHB−PEO(2000−5200−2000)コポリマーについての、α−CDまたはγ−CDのいずれかと複合体化したこのコポリマーと比較した、および純粋なα−CDと比較した、異なる解像度のFTIRスペクトルを提供する。
【図19】図19は、複合体化していないPEO−PHB−PEO(2000−5200−2000)コポリマーについての、α−CDまたはγ−CDのいずれかと複合体化したこのコポリマーと比較した、および純粋なα−CDと比較した、異なる解像度のFTIRスペクトルを提供する。
【図20】図20は、純粋なα−CD、純粋なPEO−PHB−PEO(2000−5200−2000)コポリマーおよびこのコポリマーとα−CDとの複合体の、熱重量分析(TGA)曲線を提供する。
【図21】図21は、実施例5からのPEO−PHB−PEOコポリマーの、様々な濃度の23℃の水溶液における、ピレンプローブ(6.0×10−7M)についての373nmにおいてモニタリングされた、定常状態蛍光励起スペクトルを提供する。
【図22】図22は、実施例5からのPEO−PHB−PEOコポリマーの濃度の、23℃のコポリマー溶液中のピレンのI337/I334の比に対する影響を図示する。
【図23】図23は、実施例5からのPEO−PHB−PEOコポリマーの様々な濃度の水溶液中のピレンのI337/I334の比に対する温度の影響を図示する。
【図24a】図24aは、リン酸緩衝化生理食塩水の関節内注射の1週間後の、ウサギ膝関節の組織学を示す画像(元の倍率10倍)を提供する。
【図24b】図24bは、α−CD−PEO−PHB−PEO(5000−2000−5000)ヒドロゲルの関節内注射の1週間後の、ウサギ膝関節の組織学を示す画像(元の倍率10倍)を提供する。
【発明を実施するための形態】
【0023】
(好ましい実施形態の詳細な説明)
本発明は、シクロデキストリンおよび両親媒性コポリマーから形成されるヒドロゲル、ならびにこのヒドロゲルの中心に含まれる治療有効量の少なくとも1つの治療剤を含有する、薬物送達システムを提供し、この両親媒性コポリマーは、ポリ(アルキレンオキシド)を含むAポリマーブロックおよびポリ(ヒドロキシアルカノエート)を含むBポリマーブロックを含有する。本発明の1つの好ましい実施形態において、Aポリマーブロックは、ポリ(エチレンオキシド)(PEO)であり、そしてBポリマーブロックは、ポリ[(R)−3−ヒドロキシブチレート](PHB)であり、そしてこのコポリマーは、トリブロックABAコポリマーPEO−PHB−PEOである。本発明のポリ(アルキレンオキシド)−ポリ(ヒドロキシアルカノエート)−ポリ(アルキレンオキシド)コポリマーのAブロックポリマー成分およびBブロックポリマー成分が、ここで記載される。
【0024】
(ポリ(アルキレンオキシド))
親水性のポリ(アルキレンオキシド)の末端セグメント構造(Aブロックポリマー)が、本発明のトリブロックコポリマーにおいて使用される。ポリ(アルキレンオキシド)は、ポリ(エチレンオキシド)、ポリ(テトラメチレンオキシド)およびポリ(テトラヒドロフラン)から適切に選択される。本発明において使用するために好ましいポリ(アルキレンオキシド)は、ポリ(エチレンオキシド)(PEO)またはその誘導体であり、そして最も好ましくは、PEOである。PEOはまた、ポリ(エチレングリコール)ともまた称され、そして本明細書中で使用される場合、用語ポリ(エチレンオキシド)(および略号PEO)は、ポリ(エチレングリコール)(PEG)もまた言及することが意図される。
【0025】
ポリ(アルキレンオキシド)は、異なる形態および異なる末端基を有し得る。例えば、PEOの場合、PEO誘導体は、異なる構造(例えば、星型PEO、櫛形PEOなど)を有し得る。ポリ(エチレンオキシド)は、修飾された分子の形態(例えば、PEG化(PEGylated)多糖類、PEG化ポリ(アミノ酸)、PEG化タンパク質など)であり得る。さらに、PEOのポリアミン誘導体(例えば、PEG化ポリ(エチレンイミン)またはPEG化ポリリジン)が使用され得る。
【0026】
本発明のコポリマーにおいてAブロックポリマーとして利用される、PEOまたは他のポリ(アルキレンオキシド)の相対分子量(Mr)範囲は、適切には、500〜2,000であり、そして好ましくは、2,000〜10,000である。
【0027】
(ポリ(ヒドロキシアルカノエート))
高度に疎水性のポリ(ヒドロキシアルカノエート)の中央部分の構造(Bブロックポリマー)は、本発明のトリブロックコポリマーにおいて使用される。適切なポリ(ヒドロキシアルカノエート)は、a)ポリマー鎖間の疎水性−疎水性相互作用が、マクロ分子の組立てを促進し、必要とされるCDの濃度を減少するように、比較的疎水性であり;b)生体分解性であり;そしてc)無毒性かつ生体適合性である。
【0028】
本発明において使用するために適切な疎水性Bポリマーブロックは、ポリ(ヒドロキシアルカノエート)である。本発明において使用するために適切なポリ(ヒドロキシアルカノエート)の例としては以下が挙げられる:ポリ[(R)−3−ヒドロキシブチレート](PHB)(ポリ[(R)−3−ヒドロキシ酪酸(hydroxybutryic acid)]またはポリ(β−ヒドロキシ酸)とも呼ばれる);ポリ[(R)−4−ヒドロキシブチレート](PGHB);ポリ[(R)−3−ヒドロキシバレレート](PHV);ポリ[(R)−3−ヒドロキシブチレート]−co−ポリ[(R)−3−ヒドロキシバレレート](PHB/HV);ポリ[(R)−3−ヒドロキシヘキサノエート](PHHx);ポリ[(R)−3−ヒドロキシヘプタノエート](PHHp);上記の(R)鏡像異性体の各々の(S)鏡像異性体;上記(S)鏡像異性体および(R)鏡像異性体のラセミ混合物;ならびに上記ポリ(ヒドロキシアルカノエート)の混合物。好ましいポリ(ヒドロキシアルカノエート)は、ポリ(β−ヒドロキシアルカノエート)であり、より具体的には、ポリ[(R)−3−ヒドロキシブチレート](PHB)および関連のポリ[(R)−3−ヒドロキシアルカノエート]である。本発明において使用するために最も好ましいポリ(ヒドロキシアルカノエート)は、PHBである。
【0029】
PHBまたは本発明のコポリマーにおいてBブロックポリマーとして利用される他のポリ(ヒドロキシアルカノエート)の相対分子量(Mr)範囲は、適切には、500〜2,000であり、好ましくは、2,000〜10,000であり、より好ましくは、2,500〜7,500であり、そして、最も好ましくは、3,000〜5,000である。
【0030】
(コポリマー)
本発明は、本明細書中で以下にさらに説明される、独特の合成プロセスを用いて産生される、ポリ(アルキレンオキシド)とポリ(ヒドロキシアルカノエート)との両親媒性コポリマーを提供する。好ましくは、これらのコポリマーは、ABAトリブロックコポリマー(例えば、例として、PEO−PHB−PEO)である。本発明のこのようなトリブロックコポリマーは、シクロデキストリンとヒドロゲルを形成し、持続放出薬物送達および他の生物医学的適用に有用である。本発明はまた、ポリ(アルキレンオキシド)とポリ(ヒドロキシアルカノエート)とのABブロックコポリマー(例えば、例として、PEO−PHB)に関する。このようなABブロックコポリマーはまた、シクロデキストリンと有用なヒドロゲルを形成すると考えられる。従って、トリブロックABAポリマーが好ましいが、本明細書中に記載される本発明の全ての実施形態がまた、ポリ(アルキレンオキシド)とポリ(ヒドロキシアルカノエート)とのABブロックコポリマーに適用されることが理解されるべきである。本発明のポリマーの他の改変がまた可能である。例えば、かさ高いブロッキング基は、生物分解性結合(例えば、L−フェニルアラニン、L−トリプトファン、ニコチニル基など)を介してポリマー鎖の末端に結合体化され得る。
【0031】
本発明のPEO−PHB−PEOポリマーの分子量は、適切には、1,000と50,000との間であり、好ましくは、5,000と35,000との間である。
【0032】
本発明のコポリマーは、生物吸収性、生物分解性、生体適合性であるように処方され得、シクロデキストリンとヒドロゲルを形成し得る。生物吸収性とは、分散したポリマー分子の分解を伴ってかまたは伴わずに、ポリマーが、体内において、その最初の適用部位から消失し得ることを意味する。生物分解性とは、加水分解または酵素的分解によって、ポリマーが、体内において、崩壊または分解し得ることを意味する。生体適合性とは、全ての成分が、体内で無毒性であることを意味する。
【0033】
(シクロデキストリン)
シクロデキストリン(すなわち、1つのシクロデキストリン)は、トリブロックコポリマーのセグメントを複合化するための錯化剤として本発明において使用される。次いで、これらのシクロデキストリン貫通ポリマーのクラスター形成は、ヒドロゲルを形成する。シクロデキストリンは、α1,4結合により連結された6、7、8またはそれ以上のD(+)グリコピラノース単位から構成される、一連の天然の環状オリゴ糖である。シクロデキストリンは、生物分解性かつ生体適合性であり、天然に合成されても人工的に合成されてもよい。シクロデキストリンは、例えば、微生物により天然に合成され得る。シクロデキストリンは、例えば、溶解度、複合体形成能および特異性を改善するように、その特性を操作するように人工的に改変され得る。本明細書中で使用される場合、シクロデキストリンは、天然の形態および人工的に改変された形態の全ての形態をさす。適切なシクロデキストリンとしては、α−シクロデキストリン、β−シクロデキストリン、γ−シクロデキストリンおよびこれらの誘導体(疎水性誘導体、親水性誘導体、荷電シクロデキストリンなどを含む)が挙げられる。好ましいシクロデキストリンは、α−シクロデキストリンである。
【0034】
(ポリマー合成)
PEO−PHB−PEOトリブロックコポリマーの合成のための手順は、図1の反応スキームにおいて示されている。本発明に従ってPEO−PHB−PEOトリブロックコポリマーを合成するために、まず、従来技術を使用して、ポリマー前駆体が調製される。天然の供給源であるPHBは、高い分子量を有し、1つのヒドロキシ末端基と1つのカルボキシ末端基を有する。天然の供給源であるPHBはまた、光学活性において純粋である。高分子量の天然供給源であるPHBは、公知の技術を使用して、エチレングリコールとのエステル転移反応によって、低い分子量を有するテレケリック(telechelic)ヒドロキシル末端PHB(PHB−ジオール)に変換される。例えば、エステル転移反応は、触媒としてジラウリル酸ジブチルスズを用いてジグリム(ジエチレングリコールジメチルエーテル)中にて行われ得る。エステル転移反応は、2〜3時間から一晩進行されて、ゲル浸透クロマトグラフィー(GPC)により決定される場合に、数百〜数千の範囲の平均分子量を有するPHB−ジオールを生じる。メトキシ−PEO−モノカルボン酸(M−PEO−A)プレポリマーは、適切には、1,4−ジオキサン中、公知の技術を使用して、4−(ジメチルアミノ)ピリジン(DMAP)およびトリエチルアミンの存在下、メトキシ−PEOと無水コハク酸との反応により調製される。
【0035】
次いで、これらのポリマー前駆体(すなわち、プレポリマー)は、本発明の方法に従ってカップリングされ、所望のトリブロックコポリマーを得る。プレポリマー(PHB−ジオールおよびM−PEO−A)は、好ましくはまず乾燥される。なぜならば、カップリング反応は湿度感受性であるからである。二官能化PHB−ジオールは、カップリング剤として1,3−ジシクロヘキシルカルボジイミド(DCC)を使用してM−PEO−Aとカップリングされ、PEO−PHB−PEOトリブロックコポリマーを得る。再度、湿度感受性に起因して、カップリング反応は、窒素雰囲気下にて、乾燥塩化メチレン中で行われる。M−PEO−Aは、全てのPHB−ジオールがトリブロックコポリマーに変換されることを確実にするために、カップリング反応において過剰であるべきである。
【0036】
次いで、標的のトリブロックコポリマーが単離され、1回以上の沈殿および混合溶媒(適切には、メタノール/ジエチルエーテルまたはクロロホルム/ジエチルエーテル)での注意深い分取により反応混合物から精製される。このポリマーのPHBブロックは、十分に規定された(R)ラセミ立体配置を保持する。
【0037】
PHBの(R)鏡像異性体を使用するトリブロックコポリマーの産生に加えて、この合成プロセスはまた、PHBの(S)鏡像異性体、ならびに(S)および(R)鏡像異性体のラセミ混合物、ならびに、他の関連のポリ(3−ヒドロキシアルカノエート)およびそのコポリマーの産生にも有用であることが予期される。
【0038】
(ヒドロゲルアセンブリ)
本発明の両親媒性トリブロック(triblock)コポリマーとシクロデキストリンとの間の超分子自己アセンブリは、物理的に架橋している注射可能なヒドロゲルを形成する。超分子自己アセンブリは、良好に規定された微視的アセンブリおよび巨視的特徴を有する特異的な相への複数分子成分の自発会合に関する。本発明のヒドロゲルでは、疎水性相互作用が、PHBの(例えば)断片中央間で生じながら、PEO(例えば)断片が、お互いに自己アセンブリする。薬物は、本発明のシクロデキストリンポリマーに基づく注射可能なヒドロゲルから形成されるインビボでのマトリックスまたはキャリアから持続的な様式で送達され得る。
【0039】
シクロデキストリン−ポリマーに基づく注射可能なヒドロゲル組成物は、任意の適切な方法で調製され得る。薬物なしのヒドロゲルを形成するために、シクロデキストリンを水性キャリア流体(例えば、脱イオン化水または生理食塩水)と合わせる。シクロデキストリン溶液を混合し、次いで、両親媒性コポリマー成分(例えば、PEO−PHB−PEO)を加える。混合物を、ほぼ0℃〜25℃の温度まで、好ましくは冷蔵温度(例えば、4℃)まで冷却する。得られる生成物は、白色の粘稠性ヒドロゲルである。
【0040】
ヒドロゲルを、薬物の送達に使用するために調製しているならば、最初に、水溶液中の薬物を、シクロデキストリンと適切に合わせて、その後、コポリマーを加える。あるいは、最初に、薬物の溶液をコポリマーと合わせ得る。薬物を最初に含む水溶液は、薬学的に受容可能で注射可能な水性流体である。薬学的に受容可能で注射可能な水溶性流体としては、注射可能な生理食塩水であり得るが、これに限定されない。望むならば、この水性流体はまた、緩衝剤および/または保存剤を含み得る。適切な緩衝剤としては、アルカリ炭酸塩またはアルカリ土類炭酸塩、リン酸塩、炭酸水素塩、クエン酸塩、ホウ酸塩、酢酸塩およびコハク酸塩が挙げられるが、これらに限定されない。適切な保存剤としては、重亜硫酸ナトリウム、チオ硫酸ナトリウム、アスコルビン酸塩、ベンザルコニウムクロライド、クロロブタノール、チオメルソール、ホウ酸フェニル水銀、パラベン、ベンジルアルコールおよびフェニルエタノールが挙げられるが、これらに限定されない。使用するならば、保存剤および緩衝剤は、利用される治療剤との適合性に一部基づいて選択される。
【0041】
好ましくは、ポリマーは、シクロデキストリンとヒドロゲルを形成する水溶液中にある。例えば、適切な水溶性ポリマー溶液は、約1%〜約80%のポリマー、好ましくは、約10%〜約40%のポリマーを含む。適切なヒドロゲルは、約1.0%〜約20%のシクロデキストリン(w/w)(全溶液の重量に基づく)、好ましくは、約5%〜15%のシクロデキストリンを含む。述べたように、ヒドロゲルは、代表的には、水性キャリア流体を使用して形成される。例えば、代表的な水溶液は、約1%〜約80%のポリマー、好ましくは、約10%〜約40%を含む。
【0042】
本発明に従って、特定の用途のために、所望の放出動力学(薬物送達適用のため)および物理的特性(すなわち、ゾル粘性およびゲル−ゾル変換特性)を有する注射可能なヒドロゲルを提供する十分な量および相対的な割合で、シクロデキストリンおよびポリマーを合わせる。注射可能な薬物送達システムに使用するとき、皮下ニードルを通して(剪断誘導変換による)ゾルとして注射可能なゲルを生じるのに十分な量のシクロデキストリンが使用される。適切には、シクロデキストリンとポリマーとの重量比は、0.05:1.0〜0.5:1.0である(すなわち、シクロデキストリンは、ポリマーの5重量%〜80重量%含まれる)。好ましくは、シクロデキストリンは、ポリマーの5重量%〜50重量%含まれる。
【0043】
所望の放出動力学(薬物送達のため)および物理的特性を達成するのに必要な最小量のシクロデキストリンを使用して、インビボでの炎症応答を引き起こし得るシクロデキストリンレベルを避けることが望ましい。本発明のヒドロゲルは、シクロデキストリンおよびホモポリマーPEOにより形成される従来のヒドロゲルよりも、ゲルを形成するのに実質的により少ないシクロデキストリン(例えば、50%未満)を必要とすると考えられる。1つの極端な例として、特定のPEO/PHBの組み合わせを有する幾つかのコポリマーは、CDなしでゲルを形成し得る。しかしながら、CDとでは、ゲルは、有意に改善された放出動力学を与える。このことは、CDの量が、ゲルの放出動力学を調整するために選択され得るので、重要である。
【0044】
(ヒドロゲル特性およびさらなる成分)
本発明のヒドロゲルは、生体吸収性、生分解性および生体適合性である。それは、温度感受性であると考えられており、揺変性であり、そして特定条件下でゲルとゾルの間を反転する。ゲル−ゾル変換温度は、一般的に室温より上であり、これは、ゲルの組成ならびにコポリマーの化学構造および分子量に依存する。本発明のトリブロックABAポリマー(AブロックとしてPEOおよびBブロックとしてPHBを含む)からのヒドロゲルの形成は、相対的に温度非感受性であると分っている。10〜45℃の範囲の温度で、ゲルおよびミセルの形成は、主に、温度よりもむしろ濃度に依存する。このポリマーと形成されるヒドロゲルおよびミセル(これは、低温で解離し難く、高温で大きなサイズに凝集し難い)は、それ故安定であり、薬物送達のために容易に取り扱われる。
【0045】
ヒドロゲルの揺変性の性質のために、ヒドロゲルが、注射可能なヒドロゲル(およびこれに含まれる任意の薬物)を与えるのに十分な剪断力に供されるとき、ゾルに変換する。例えば、ヒドロゲルは、27Gと同じほど小さなニードルを通過するように通され得る。
【0046】
ヒドロゲルのpHは、ほぼ約6.5〜約7.8であり、これは、身体に注射するのに適したpHレベル範囲である。pHレベルは、任意の適切な酸または塩基(例えば、塩酸または水酸化ナトリウム)の使用によって調整され得る。
【0047】
ヒドロゲル組成物はまた、第2のポリマーを含み得、これは、薬物と複合体化し得るか、薬物と抱合し得るか、またはそれらの両方かであり得る。この第2のポリマーは、適切には、ポリエステル、ポリウレタン、ポリアミド、ポリエーテル、ポリサッカライド、ポリ(アミノ酸)、ポリペプチドまたはタンパク質であり得る。好ましくは、この第2のポリマーは、ジ−またはモノ−官能性ポリマーまたは(ポリエチレングリコール)断片を有するポリイオン性ポリマーである。薬物がヒドロゲルと抱合するか、または複合体化するかする場合において、ヒドロゲル処方物は、マトリックスとしてだけでなく、薬物のキャリアとして作用する。これは、薬物が、ヒドロゲル中に物理的に包括されるだけでなく、ヒドロゲルを形成する分子と抱合するかまたは複合体化することを意味する。第2のポリマーはまた、ヒドロゲルマトリックスの特性(例えば、空隙率および粘性)を変えるために使用され得る。第2のポリマーの量は、所望の結果を達成するのに十分であるべきである(例えば、薬物と複合体化する、および/または抱合するのに十分な量)。
【0048】
ヒドロゲルの特性は、異なるポリマーブロック分子量を使用することによって、シクロデキストリン含量を調整することによって、そして、第2のポリマーを使用することによって整調可能である。例えば、ヒドロゲルは、より可撓性のあるヒドロゲルか、またはより剛直性のヒドロゲルであるように調整され得る。さらに以下に議論されるように、ヒドロゲル構造は、種々の粘性およびより長いかまたは短い薬物放出速度を有するように調整され得る。ポリ(ヒドロキシアルカンノエート)の疎水性の程度はまた、所望の徐放速度のために選択され得る。
【0049】
ヒドロゲルはまた、DNAナノスフェア(nanoshere)を保持し得る。DNAナノスフェアは、DNAおよびポリカチオンの塩誘導複合体コアセルベーション(例えば、遺伝子送達ビヒクルのようなゼラチンおよびキトサン)によって合成されるナノ粒子である。Leong,K.ら、Journal of Controlled Release 53:183−193(1998)。DNA凝縮、または結合断片を有するPEGコポリマーは、これらポリマーが、DNAを凝縮するか、または結合して、ヒドロゲル中にDNAナノスフェアを形成しながら、シクロデキストリンを有するヒドロゲルを形成し得る。
【0050】
(治療剤および薬物徐放のための方法)
本発明のヒドロゲルは、薬物のための持続され、制御された放出マトリックスとして使用するのに適している。このヒドロキシマトリックスを、緊密にこの中に含まれる1つ以上の治療剤とカップされるとき、生分解性徐放薬送達システムが、提供される。本明細書中において、用語「徐放」(すなわち、延長された放出または制御された放出)は、本明細書において、ヒトまたは他の哺乳類の体内に導入するか、または開放創、火傷または組織表面か、あるいは体腔または潜在的生体空間に適用され、しかも、所定の時間にわたって、かつ、この所定の時間全体で所望の治療効果を達成するのに十分な治療レベルで、1つ以上の治療剤の流れを持続的に放出する薬物送達システムまたは組成物のことを言うために使用される。徐放流れへの言及は、組成物またはそのマトリックスもしくは成分のインビボでの生分解性の結果として、あるいは治療薬剤または治療剤の抱合体の代謝的変換または分解の結果として生じる放出を含むことが意図される。
【0051】
延長した放出の持続時間は、ブロックポリマーの分子量、(特に疎水性ポリ(ヒドロキシアルカノエート)部分(例えば、PHB)の分子量に依存する。放出速度は、以下を選択することによる治療応答の所望な時間を達成するために、本発明に従って変更され得る:特にポリ(ヒドロキシアルカノエート);選択されたポリ(ヒドロキシルアルカノエート)の立体異性体状態;選択されたポリ(ヒドロキシアルカノエート)の分子量;および所望の持続時間および徐放速度を達成するためにヒドロゲルに使用されるシクロデキストリンの相対量。疎水性ポリ(アルキレンオキシド)の分子量および選択はまた、疎水性ポリ(ヒドロキシアルカノエート)成分の程度より小さいが、徐放動力学に影響する。第2のポリマーはまた、さらに上で議論されるように放出動力学を変更するために利用され得る。本発明のヒドロゲルは、ブロックポリマーおよびコポリマーの分子量、ならびに本発明のヒドロゲル内のシクロデキストリン含量の調節、および第2のポリマーの潜在的な使用によって、1日またはそれ以上の間にわたる徐放を提供し得、そして適切には5日より長い延長した放出を提供し、より好ましくは1週間より長く、なおさらに好ましくは2週間またはそれより長く、そして潜在的に1ヶ月またはそれより長い延長された放出を提供し得る。
【0052】
種々の治療剤(すなわち、薬物)は、本発明のヒドロゲル中に送達され得る。本明細書中で使用される場合、「治療剤」および「薬物」は、生物学的活性分子(ペプチド、タンパク質(例えば、サイトカイン、成長因子、脈管形成因子、可溶性レセプター、抗体およびそのフラグメントならびにヒト組換えタンパク質)、低分子、遺伝子、抗原(例えば、ワクチン)、DNA、RNAおよびDNAナノ粒子を含む)を包含することが意図される。本明細書中で使用される場合、用語「薬物」および「治療剤」はまた、本来薬学的活性であるかまたは生物学的活性である化合物または種だけでなく、1つ以上のそれらの活性な化合物または種を含む物質ならびに結合体、改変体および薬学的に活性なフラグメントおよびその抗体誘導体を包含することが意図される。
【0053】
本発明はまた、シクロデキストリンおよび1つ以上の治療剤を用いて、本明細書中に記載される両親媒性トリブロックコポリマーから形成される医薬を製造する方法を提供する。従って、本発明は、シクロデキストリンとトリブロックコポリマーとの間の封入複合体化に基づく超分子を提供し、ここで、1つ以上の治療剤は、内心に含まれ得る。これらのヒドロゲルは、タンパク質またはペプチド薬物の制御送達に期待される。
【0054】
薬物送達システムについて、治療剤は、薬学的に受容可能注射可能な水性塩基に適切に処方され得、そして治療剤は、注射または他のモードの送達に適切な任意の薬物あるいはこのような薬物の組み合わせであり得る。適切な薬物としては、以下が挙げられるが、これらに限定されない:鎮痛剤、麻酔薬、抗関節炎薬物、疾患改変抗リウマチ薬物(DMA
RDS)、抗喘息薬物、抗凝固剤、抗痙攣薬、抗うつ剤、抗糖尿病薬、抗悪性腫瘍薬、抗精神病薬、降圧薬、抗生物質、抗ヒスタミン剤、消炎剤、抗炎症薬、筋肉弛緩剤、駆虫薬、抗ウイルス薬、抗再狭窄薬、鎮痙剤、軟骨保護剤(chondroprotective agent)、抗接着剤、抗腫瘍細胞侵襲剤、血管弛緩薬、血管収縮薬、免疫抑制薬および他の生物学的に活性な分子(ペプチド、タンパク質(例えば、サイトカイン、成長因子、脈管形成因子、可溶性レセプター、抗体およびそのフラグメントならびにヒト組換えタンパク質)、低分子、遺伝子、抗原(例えば、ワクチン)、DNA、RNAおよびDNAナノ粒子を含む)。
【0055】
薬物は、適切な巨大分子形態(すなわち、通常の巨大分子である薬物または巨大分子に結合体化されるか、PEG化されるか、またはそうでなければ変換された低分子である薬物)または低分子形態であり得る。巨大分子形態は、本発明のヒドロゲルにおける送達に非常に適切である。従って、巨大分子(例えば、タンパク質、これは、成長因子、サイトカイン、抗体、酵素などを含む)は、本発明のヒドロゲルにおいて送達される。効果的でかつ均一な徐放について、低分子量薬物は、例として、ポリ(エチレングリコール)のように適切に結合体化され、次いでヒドロゲルに取り込まれる巨大分子を形成する。低分子の薬物は、本発明のヒドロゲルに取り込まれるために、微粒子および/またはナノ粒子(例えば、DNAナノ粒子)と適切に結合体化されるかまたは連結され得る。本発明のトリブロックコポリマーの疎水性中間セグメントは、ミセルを形成し得るので、ヒドロゲルはまた、疎水性薬物(例えばパクリタキセル(TaxolTM)、疎水性低分子を含む)を補足し得る。
【0056】
本発明のヒドロゲル中で適切に送達され得る治療剤のさらなる例は、Surgical
Irrigatiton Solution and Method for Inhibition of Pain and Inflammationと題された、Demopulosらに発行された米国特許第6,420,432号、およびSolutions and Methods for Inhibition of Pain,Inflammation and Cartilage Degradationと題されたDemopulosらによる国際PCT特許出願WO 01/07067(これらの開示は、本明細書によって参考として明確に援用される)に開示される。米国特許第6,420,432号は、疼痛、炎症、平滑筋痙攣または再狭窄を阻害するために、単独でまたは組み合わせて送達される鎮痛剤、抗炎症剤、抗痙攣剤、および抗狭窄剤を開示する。薬剤の選択は、任意の外傷、状態または他の理由(外科的、手術的、介在的または診断的手順を含む)から生じる望ましくない機構を阻害するための所定の適用(例えば、関節鏡検査手順の間の関節内への抗炎症/抗疼痛剤の送達、尿生殖器手順の間の尿生殖器官への抗炎症/抗疼痛剤および/または抗痙攣剤の送達、心臓血管手順の間の血管内への抗疼痛/抗炎症剤、抗痙攣剤および/または抗再狭窄剤の送達、または一般的な外科的手順、眼科的手順、歯周手順または他の一般的な外科手順の間の創傷への抗疼痛/抗炎症剤の送達)のために決定される。開示される抗炎症/鎮痛剤としては、セロトニンレセプターアンタゴニスト;セロトニンレセプターアゴニスト;ヒスタミンレセプターアンタゴニスト;ブラジキニンレセプターアンタゴニスト;カリクレインインヒビター;タヒキニンレセプターアンタゴニスト(ニューロキニン1およびニューロキニン2レセプターサブタイプアンタゴニストを含む);カルシトニン遺伝子関連ペプチド(CGRP)レセプターアンタゴニスト;インターロイキンレセプターアンタゴニスト;アラキドン酸代謝のための合成経路において活性な酵素のインヒビター((a)ホスホリパーゼインヒビター(PLA2アイソフォームインヒビターおよびPLCγアイソフォームインヒビターを含む)、(b)シクロオキシゲナーゼインヒビター、ならびに(c)リポオキシゲナーゼインヒビターを含む);プロスタノイドレセプターアンタゴニスト(エイコサノイドEP−1およびEP−4レセプターサブタイプアンタゴニストおよびトロンボキサンレセプターサブタイプアンタゴニストを含む);ロイコトリエンレセプターアンタゴニスト(ロイコトリエンB4レセプターサブタイプアンタゴニストおよびロイコトリエンD4レセプターサブタイプアンタゴニストを含む);オピオイドレセプターアゴニスト(μ−オピオイド、δ−オピオイド、およびκ−オピオイドレセプターサブタイプアゴニストを含む);プリノセプターアゴニストおよびアンタゴニスト(P2XレセプターアンタゴニストおよびP2Yレセプターアゴニストを含む);ならびにアデノシントリホスフェート(ATP)感受性カリウムチャネルオープナーが挙げられる。開示される抗痙攣剤としては、セロトニンレセプターアンタゴニスト;タヒキニンレセプターアンタゴニスト;ATP感受性カリウムチャネルオープナー;カルシウムチャネルアンタゴニスト;エンドセリンレセプターアンタゴニスト;カルシウムチャネルアンタゴニスト;ならびに一酸化窒素ドナー(酵素アクチベーター)が挙げられる。開示される抗再狭窄剤としては、抗血小板剤((a)トロンビンインヒビターおよびレセプターアンタゴニスト、(b)アデノシンジスホスフェート(ADP)レセプターアンタゴニスト(プリノセプター1レセプターアンタゴニストとしても公知)、(c)トロンボキサンインヒビターおよびレセプターアンタゴニスト、ならびに(d)血小板膜糖タンパク質レセプターアンタゴニストを含む);細胞接着分子のインヒビター((a)セレクチンインヒビターおよび(b)インテグリンインヒビターを含む);抗化学走化性剤;インターロイキンレセプターアンタゴニスト;ならびに細胞内シグナル伝達インヒビター((a)プロテインキナーゼC(PKC)インヒビターおよびタンパク質チロシンホスファターゼ、(b)細胞内タンパク質チロシンキナーゼインヒビターの調節因子、(c)src homology2(SH2)ドメインのインヒビター、および(d)カルシウムチャネルアンタゴニストを含む)が挙げられる。このような組成物が泌尿器科学的手順、一般的な外科手順または腫瘍学的手順の間に送達される場合、抗接着剤または抗腫瘍浸潤/接着/転移剤もまた、単独でまたは組み合わせて(例えば、CD44レセプターアンタゴニスト;インテグリンレセプターアンタゴニストおよびセレクチンレセプターアンタゴニスト;プロテイナーゼインヒビター;タンパク質チロシンキナーゼインヒビター;プロテインキナーゼCインヒビター;ならびに有糸分裂促進活性化プロテインキナーゼ(MAPK)インヒビター)含まれ得る。これらの種々の組成物および手順の各々が、延長した放出および作用の持続期間を提供するために、本発明のヒドロゲル中の治療剤を送達することによって実行され得る。
【0057】
WO01/07067は、軟骨異化を阻害するかまたは軟骨同化を促進する軟骨保護剤を開示する。開示される同化促進軟骨保護剤としては、インターロイキン(IL)アゴニスト;形質転換増殖因子(TGF)−βスーパーファミリーのメンバー(TGF−βアゴニストおよび骨形態形成タンパク質アゴニストを含む);インシュリン様増殖因子;および線維芽細胞増殖因子が挙げられる。開示される異化阻害性軟骨保護剤としては、IL−1レセプターアンタゴニスト;腫瘍壊死因子(TNF)−αレセプターアンタゴニスト;シクロオキシゲナーゼ−2特異的インヒビター;MAPキナーゼインヒビター;一酸化窒素シンターゼインヒビター;および核因子kBインヒビター;マトリックスメタロプロテイナーゼのインヒビター;細胞接着分子(インテグリンアゴニストおよびインテグリンアンタゴニストを含む);抗化学走化性剤;細胞内シグナル伝達インヒビター(プロテインキナーゼCインヒビターおよびタンパク質チロシンキナーゼインヒビターを含む;細胞内タンパク質チロシンホスファターゼの調節因子;ならびにSH2ドメインのインヒビターが挙げられる。このような軟骨保護組成物は、延長した放出および作用の持続期間を提供するために、本発明のヒドロゲル中に、例えば、関節内注射によって送達され得る。
【0058】
本発明のヒドロゲルおよび治療剤薬物送達系は、薬物送達系に含まれる薬物が治療的に活性である疾患状態または状態に罹患するヒトまたは他の哺乳動物に、(例えば、移植することによって、体腔または潜在的空間内に配置することによって、身体の組織表面を被覆することによって、または移植可能なデバイスの表面をコーティングすることによって)適切に注入されるかまたはそれ以外で送達される。非限定的な例として、適切な治療剤を含む薬物送達系は、外傷または慢性疼痛、関節炎、多発性硬化症および他の自己免疫障害、炎症および/または外傷もしくは外科もしくは他の手術手順からの疼痛、不安、および/または他の神経学的もしくは神経学的障害、心臓血管疾患、または高血圧、泌尿器科学的障害もしくは婦人科学的障害のような状態、化学療法剤での処置を受ける癌、鬱血、ホルモン障害または平衡失調などを罹患するヒトまたは他の哺乳動物を処置するために送達され得る。ヒドロゲル中で使用される特定の薬物は、ヒトまたは他の哺乳動物が罹患する状態の薬理学的処置のために、ヒトまたは他の哺乳動物が必要とするタイプである。
【0059】
注射可能な組成物は、任意の適切な方法でヒトまたは他の哺乳動物の身体内に、好ましくは、皮下注射針によって注射され得るかまたは移植され得る。例えば、ヒドロゲルは、関節内的、脈管内的に、尿生殖器管内に、皮下的に、筋肉内的に、皮内的に、頭蓋内に、腹腔内的に、胸内に、あるいは任意の体腔または潜在的な空間内に、投与され得る。あるいは、ヒドロゲルは、例えば、関節鏡手順の間、関節に、あるいは、手術手順、外科手順、診断手順または介入手順の間、尿生殖管内に、脈管構造内に、心膜内もしくは胸膜内の空間内に、または身体内の任意の体腔もしくは潜在的空間内に、カテーテルまたはシリンジによって導入され得る。ヒドロゲルは、高い局所濃度の薬物を達成し、持続放出貯蔵場所を形成するために、制限された領域または組織に投与され得る。他の適用において、開いた外科または外傷損傷に、火傷に、あるいは皮膚または他の組織表面へのヒドロゲルの局所適用が実行され得る。
【0060】
(さらなる生体材料適用)
本発明のトリブロックコポリマーは、濃度に依存して、ゲルを形成するために、液体懸濁液または凝縮物を保持する、ミセルを形成する。上記本明細書中に記載される合成方法によって作製される生分解性トリブロックコポリマーによって形成されるミセルは、それ自体、制御放出のための薬物(例えば、疎水性薬物)のカプセル化のために使用され得る。トリブロックコポリマーミセルはまた、持続放出処方物として薬物をカプセル化する際に使用するためのミクロスフェアまたはナノスフェアを形成するために乾燥され得る。本発明のトリブロックコポリマーを使用してミクロ粒子またはナノ粒子に適切な技術が他のポリマーのために使用される公知の技術から適用され得ることが考えられる。このような技術の非限定的な例は、以下に開示される:Song,C.ら,Journal of Controlled Release 43:197−212(1997);Kim,S.ら,Journal of Controlled Release 56:197−208(1998);Kim,I.ら,International Journal
of Pharmaceutics 205:165−172(2000);およびJeong,Y.ら,International Journal of Pharmaceutics 188:49−58(1999)(これらの各々の開示が、本明細書によって参考として援用される)。従って、生分解性トリブロックコポリマーのミセル(またはそれらから形成されるミクロ粒子もしくはナノ粒子)は、全身送達(非限定的な例として、投与の脈管内経路、吸入経路、筋肉内経路および皮下経路による投与を含む)のために使用され得る。生分解性トリブロックコポリマーおよびシクロデキストリンによって形成される本発明のヒドロゲルはまた、組織工学適用のため、細胞培養およびカプセル化のために媒体として使用され得る。合成組織(エキソビボまたはインビボでヒドロゲルにおいて形成される)は、ヒトまたは他の哺乳動物(例えば、合成軟骨)内に移植され得るか、または外部的に(例えば、合成皮膚内に)適用され得る。治療剤は、組織増殖、生存力または治癒を補助するために、本発明のトリブロックコポリマーまたはヒドロゲルを使用して形成される合成組織内に含まれ得る。
【0061】
本発明のヒドロゲルはまた、外科手順の間に、付着形成を妨げるための、コーティングとしての利用を有し得る。1つ以上の治療剤はまた、このような組成物に含まれ得る。
【0062】
本発明のヒドロゲル(1つ以上の治療剤を含む)はまた、移植可能なデバイス(例えば、ステント、カテーテル、気管内チューブ、導管、ネジ、プレート、シャント、人工関節、人工心臓または弁、他の人工器官など)をコーティングするために使用され得る。このようなデバイスは、生分解性または非生分解性材料から構築され得る。本明細書中に記載されるヒドロゲルのための他の生体材料および生物学的材料はまた、本発明の範囲内であると考えられる。
【実施例】
【0063】
(実施例)
本発明は、本発明のトリブロックポリマーおよびヒドロゲル、ならびにそれらの特性を示す、以下の実施例を考慮してより良く理解される。これらの実施例は、単に例示であり、本発明を全体として反映しない。
【0064】
(実施例1)
(トリブロックコポリマーの合成および特徴付け)
(a.トリブロックコポリマーの合成)
種々の分子量を有するテレケリックヒドロキシル化PHB(PHB−ジオール)プレポリマーを、以前に報告されたように、ジグリム中の触媒としてジブチルジラウレートを用いて、天然のPHBおよびジエチレングリコールからのエステル交換手順によって調製した。Thomas,D,ら、Macromol.Chem.Phys.197:1609−1614(1996)。エステル交換反応を数時間〜一晩進行させて、数百〜数千の範囲の平均分子量(GPCによって決定される)を有するPHB−ジオールを作製した。1820および4740のMnを有するM−PEO−モノカルボン酸(M−PEO−A)プレポリマーを、以前に報告されるように、1,4−ジオキサン中、4−(ジメチルアミノ)ピリジン(DMAP)およびトリエチルアミンの存在下で、M−PEOと無水コハク酸との反応によって調製された。Bae,Y.ら、J.Controlled Release 64:3−13(2000)。
【0065】
次いで、本発明の例として、これらの二官能性PHB−ジオールプレポリマーを、1,3−ジシクロヘキシルカルボジイミドを使用して、M−PEO−Aプレポリマー(Mn約1820および4740)と結合し、PEO−PHB−PEOトリブロックコポリマーを得た。反応が湿度感受性であるので、窒素雰囲気下で、乾燥塩化メチレン中で実行した。標的とされるトリブロックコポリマーを単離し、そしてクロロホルム/ジエチルエーテルまたはメタノール/ジエチルエーテルの混合溶媒からの沈殿および注意深い分別によって反応混合物から単離および精製した。
【0066】
(b.トリブロックコポリマーの分子特徴付け)
ゲル浸透クロマトグラフィー(GPC)分析を実施して、トリブロックコポリマーの分子量および分子量分布を決定した。全ての精製したトリブロックコポリマーのGPCクロマトグラフィーは、単峰形であったピークを示した。図2は、対応するプレポリマーと一緒に、PEO−PHB−PEOトリブロックコポリマーについての代表的なGPCクロマトグラムを示す。PEO−PHB−PEOトリブロックコポリマーの分子量は、ABAトリブロックコポリマーに対応する、そのPEOおよびPHB前駆体よりも高い。
【0067】
全てのトリブロックコポリマーを、1H NMR分光法によって分析し、これによって、トリブロックコポリマーがPEOおよびPHBの両方を含み、コポリマーの中程度PHBブロックの長さを与えたことを確認した。図3は、PEO−PHB−PEOトリブロックコポリマーおよびその前駆体プレポリマーの1H NMRスペクトルを示す。本実施例に使用される2つのM−PEG−Aプレポリマーがほとんど単分散である(重量平均分子量/数平均分子量(Mw/Mn)=1.03)であるので、コポリマー中のPEOブロックの分子量は、それらのM−PEO−Aプレポリマーと同一であると考えられ得る。従って、コポリマー中のPHBブロック分子量は、PHBセグメントおよびPEOセグメントについてのピークの積分間の比から決定され得る。
【0068】
1H NMRスペクトルはまた、PHB−ジオールの定量的反応についての強い証拠を提供する。図3bにおいて、PHBヒドロキシ末端単位のプロトンは、明らかに、c’についての1.26ppm(ダブレット)およびb’についての4.25ppm(マルチプレット)を示し(Li,J.ら,Bull.Chem.Soc.Jpn.70:1887−1893(1997);Li,J.ら,Bull.Chem.Soc.Jpn,71:1683−1689(1998))、一方、エチレングリコール末端基は、dについて3.84ppm(トリプレット)およびeについて4.26ppm(トリプレット)を見出し得る(Thomas,D.ら,Macromol.Chem.Phys.197:1659−1614(1996))。図3cにおいて、PHBヒドロキシ末端単位についての全てのピークが消え、そしてエチレングリコール末端基のピークは、4.32ppmに単一のピークになり、M−PEO−AのPHB−ジオールの完全な結合を確認した。
【0069】
表1は、本実施例において合成された全てのトリブロックコポリマーの分子量、分子量分布および組成(ブロック長さおよび重量でのPHB内容物)を示す。2つのシリーズのトリブロックコポリマーを、Mn1820および4740のM−PEO−Aを使用して合成した。各シリーズのトリブロックコポリマーは、数百〜5000より長い範囲の中程度PHBブロック長さを有する。トリブロックコポリマーの固体状態特性は、以下のセクションにおいて後に記載されるように、PHB/PEOブロック長さの間の組成および比に依存する。
【0070】
【表1】

【0071】
(a)GPCによって決定した。(b)1H NMRおよびGPCの結果の組み合わせによって決定した。(c)TGAの結果から計算した。
【0072】
PEO−PHB−PEO(2000−3900−2000)およびその開始PEO前駆体およびPHB前駆体のFTIRスペクトルを、図4に示す。PHB前駆体およびPEO前駆体についての全ての特徴的な吸収は、トリブロックコポリマーのスペクトルに見られる。カルボニルストレッチは、コポリマーおよびPHB前駆体について、1723cm−1に存在する。エーテルストレッチは、コポリマーおよびPEO前駆体についての1102cm−1に存在する。963cm−1および843cm−1のバンドは、PEOの結晶相の特徴であることが分かる。Bailey,J.ら,Poly(Ethylene Oxide),Academic Press,New York,(1976)。2つのピークは、コポリマーのスペクトルに見られ、そしてそれらの強度は、PEOブロック含有量およびその結晶度と関連する。この結果は、DSCおよびXRDからの結果と良好に一致し、以下のセクションに考察される。
【0073】
(c.熱安定性)
トリブロックコポリマーの熱安定性は、熱重量分析(TGA)を使用して評価した。図5は、トリブロックコポリマーならびにPEO前駆体およびPHB前駆体についての重量損失曲線を示す。PEO−PHB−PEOトリブロックコポリマーは、段階的に熱分解を受ける。PHBブロックは、最初に、約260℃で分解し始め、次いで、PEOブロックは、約350℃で分解し始める。PHBブロックが310〜320℃で分解を完了した後に、PEOブロックが分解し始めることに留意されるべきである。従って、トリブロックコポリマーおよびPHB含有量の組成を、表1の種々の分子量コポリマーに列挙されるように、この二段階分解挙動から計算され得る。この結果は、1H NMRから得られた結果に従って良好である。質量の10%の損失が、TGAから決定したコポリマーの各ブロックについて計算した温度を、表2に列挙する。この結果は、トリブロックコポリマーが、それらの前駆体よりも良好に熱安定性を有することを示す。
【0074】
【表2】

【0075】
(d.固体状態挙動)
示差走査熱量測定(DSC)および広角X線回折(XRD)研究を実行して、コポリマー中のPEOブロックおよびPHBブロックのミクロ相および結晶化についての情報を得た。図6および7は、異なる組成を有するPEO前駆体およびPHB前駆体ならびにPEO−PHB−PEOトリブロックコポリマーについてのDSC温度記録を示す。さらに、各ブロックの熱遷移および結晶度に対応する数値を、表3に示す。PEOおよびPHBの両方が、結晶ポリマーである。コポリマーPEO−PHB−PEO(2000−0500−2000)および短いPHBブロックを有するPEO−PHB−PEO(5000−0800−5000)について、PHB融解転移ピークを観察せず、これは、PHB結晶相が形成されなかったことを示す。PHBブロックの融解転移温度(Tm)は、PHBブロック長さでの減少を伴って、減少した。融解エンタルピーおよびPHBブロックの結晶度は、純粋なPHB−ジオールと比較して、コポリマー中で有意に増加し、これは、おそらく、ソフトPEOブロックの存在によって引き起こされる。対照的に、全てのトリブロックコポリマー中のPEOブロックは、純粋なPEO前駆体と比較して、低い融解エンタルピーおよび低い結晶度を有した。PEOブロックの全ての融解温度、融解エンタルピーおよび結晶度は、PHBブロック長さの増加、またはコポリマー中のPHBの内容物とともに減少した。これらは、ハードPHBブロックによって引き起こされ得、これは、コポリマー中のPEOブロックの結晶度を抑制した。
【0076】
【表3】

【0077】
図8および9は、この実験において合成されたPEO前駆体およびPHB前駆体ならびにPEO−PHB−PEOトリブロックコポリマーについてのXRDダイアグラムを示す。PHBブロックについての反射ピークは、短いPHBセグメントを有するコポリマーについてのダイアグラムでは見られず(図8cおよび9c)、これは、PHB結晶相が形成されなかったことを示す。より長いPHBセグメントを有するコポリマーについて、PHBブロックは、その前駆体PHB−ジオールに類似した別々の結晶相を形成した。PEOブロックについての反射ピークは、コポリマー中のPEO結晶相がそのホモポリマーと類似の構造であることを示す。PEO反射ピークは、PEOブロックについてのそれらの融点が、XRDが測定されるおよその周囲温度(上記表2を示す)であったので、PEO−PHB−PEO(2000−3800−2000)およびPEO−PHB−PEO(2000−5500−2000)について見られなかった。XRDの結果は、DSC測定で良好に一致する。
【0078】
(e.PEO−PHB−PEOトリブロックコポリマーのミセル形成)
より低いPHB含有量を有するトリブロックコポリマー(例えば、PEO−PHB−PEO(2000−0500−2000)、PEO−PHB−PEO(5000−0800−5000)およびPEO−PHB−PEO(5000−3800−5000))は、水溶性である。これらは、低濃度で水溶液でミセルを形成し得、これは、色素溶解度実験によって確認された。ミセル形成の駆動力は、PHBブロック間の強力な疎水性相互作用でることが考えられる。水溶液中のブロックコポリマーの臨界的ミセル濃度(cmc)は、プローブとしてピレンを使用する蛍光技術によって決定された。表3は、室温での3つの水溶性トリブロックコポリマーについてのcmc値を列挙する。PHBブロックが水溶液中で強く凝集する傾向があるので、cmcは、コポリマー中のPHBブロック長さに強く依存し、すなわち、より長いPHBブロックを有するコポリマーがかなり低いcmcを有することが見出された。
【0079】
(実施例2)
(トリブロックコポリマーおよびシクロデキストリン複合体化および放出動力学)
(a.封入複合体の形成)
PEO−PHB−PEOトリブロックコポリマーの合成のための図1の反応スキームを、再び実施した。まとめると、高分子量PHBを最初に低分子量のPHBジオールに転換した。次いで、PHBジオールを、PEOモノカルボン酸(Mr5000)とカップリングさせPEO−PHB−PEOトリブロックコポリマーを得た。2つのトリブロックコポリマーPEO−PHB−PEO(5000−2300−5000)およびPEO−PHB−PEO(5000−3850−5000)を調製し、NMR、GPC、FI−IRおよびDSCによって特徴付けた。両方とものコポリマーは、室温で水溶性である。これらは、低濃度の水溶液中でミセルを形成した。これは1,3,5−ジフェニルヘキサトリエンおよびピレンを用いる色素溶解性実験によって確認された。ミセル形成の駆動力は、PHBブロック間の強い疎水性相互作用から由来すると考えられる。
【0080】
ミセルの形成に関らず、両方のポリマーの10重量%水溶液は良好な流動性であり、透明のままだった。いずれかのポリマー溶液に、9.7重量%のα−CDを添加する際、室温でゲル化が起こった。他のホモPEOに比べると、ゲル化は、このコポリマーで低濃度にて誘導され得た。理論に束縛されることを意図しないが、α−CDおよびPEO−PHB−PEOトリブロックコポリマーのPEOブロックによって形成された封入複合体は微結晶に凝集され、これは、物理的架橋として作用し、超分子ポリマーネットワークの形成を誘導し、次いでヒドロゲルの形成をもたらすことが仮定される。PHBブロックのミセル化は、コポリマーおよびα−CD溶液のゲル化において重要な役割を担っていると考えられている。PHBブロック間の疎水性相互作用は、ポリマーネットワークの形成を促進する。従って、水溶液中のPEO−PHB−PEOトリブロックコポリマーおよびα−CDのゲル化の駆動力は、α−CDとPEOブロック間の封入体形成およびトリブロックコポリマーのPHBブロックのミセル化の組み合わせと考えられる。
【0081】
ヒドロゲル中のPEO−PHB−PEOコポリマーのPEOブロックとα−CDとの間の封入複合体形成は、ヒドロゲルの広角X線回析研究によって確認された。ヒドロゲルの回折計は、α−CD−PEO複合体について、多くの鋭い反射および2θ=19.4°(d=4.57Å)にて主要な反射を有するパターンを示し、これは、α−CDおよびPEOの結晶質ネックレス様複合体(crystalline necklace−like complex)のチャネル型構造を表す。Li J.ら、Macromolecules 34:7236(2001);Li J.ら、Macromolecules 34:8829(2001)。このパターンは、α−CDとPEOブロックとの封入複合体の存在を示唆する。固体PEO−PHB−PEGのパターンは、13.7°(d=6.46Å)および17.2°(d=5.16Å)で2つの鋭い反射(PHB結晶質相に由来する)を示す。興味深いことに、PHB結晶質相についてのパターンはまた、α−CD−PEO−PHB−PEO(5000−3850−5000)ヒドロゲルのダイアグラムに現れるが、このパターンは弱い。PEO−PHB−PEO(5000−3850−5000)の10重量%水溶液についてのX線回析は、鋭い反射ピークを示さないことに留意されたい。この結果は、超分子システムが、より高度に順序化され、PEOブロックとのα−CD複合体の自己アセンブリがPHBブロックの凝集を促進したことを示唆する。
【0082】
(b.放出動態学)
これらのヒドロゲルの安定性および送達特性を実証するために、モデルタンパク質薬物としてフルオロセインイソチオシアネート標識化ウシ血清アルブミン(BSA−FITC、分子量67,000)のインビトロ放出を研究した(図10)。本発明のα−CD−PEO−PHB−PEOヒドロゲルの放出特性を既知(従来技術)のα−CD−PEOホモポリマーヒドロゲルの放出特性と比較した。α−CD−PEOホモポリマーヒドロゲルは、20,000のPEO Mrであっても、2日以内にリン酸緩衝化生理食塩水(PBS)に溶解した。対照的に、α−CD−PEO−PHB−PEOヒドロゲルは、BSA−FITCについての持続性放出動態学を示す。興味深いことに、PHBブロック分子量の小さな差異(わずかに1500Mr)が、放出速度に顕著な減少を引き起こした。α−CD−PEO−PHB−PEO(5000−2350−5000)は4日間放出が持続したが、α−CD−PEO−PHB−PEO(5000−3850−5000)は、5日以上の長期間にわたって放出が持続した。2週間後、BSA−FITCの顕著な放出は起こらなかった。これらの結果は、本発明の超分子量の特性が、異なるコポリマーにより微調整されて広範な適用が利用可能になることを示す。いくつかのペグ化タンパク質薬物はまた、活性成分であり得、PEO鎖は、α−CDとの複合体化に関与し得、さらに処方物の制御された放出特性を改善し得る。ヒドロゲルの流体力学的特性のさらなる研究は、ゲルがチキソトロープ剤であること、すなわち、ヒドロゲルの粘度は、ゲルが剪断されるにつれて減少し、針を通って注射可能な制御放出処方物を提供することを示す。
【0083】
(実施例3)
(代替のモデル薬物についてのヒドロゲル放出動力学)
(a.α−CD−PEO−PHB−PEOヒドロゲルの調製)
コポリマー溶液またはゲルを、最初に、0.6mLキュベット中で、実施例1の手順に従って合成した0.060gのトリブロックPEO−PHB−PEOコポリマーに、0.090gのPBSを添加することによって調製した。次いで、14.5%のα−CDおよび0.5%のデキストラン−FITC(分子量20,000)を含む0.30gPBS溶液を、キュベット中のPBSコポリマー混合物に添加した。これらの溶液を徹底的に混合し、室温で一晩静置させた。この混合物は、キュベット中でヒドロゲルを形成し、次いで、そのインビトロ放出動力学をさらに以下に記載するように研究した。この手順は、PEO−PHB−PEO(5000−5500−5000)コポリマーを1回、そしてPEO−PHB−PEO(5000−3800−5000)コポリマーを1回用いて実施した。
【0084】
(b.純粋なPEO−PHB−PEOヒドロゲルの調製)
コポリマー溶液またはゲルを、最初に、0.6mLキュベット中で、実施例1の手順に従って合成した0.060gのトリブロックPEO−PHB−PEOコポリマーに、0.090gのPBSを添加することによって調製した。次いで、0.5%のデキストラン−FITC(分子量20,000)を含む0.30gPBS溶液を、キュベット中のPBSコポリマーに添加した。これらの溶液を徹底的に混合し、室温で一晩静置させた。この混合物は、キュベット中でヒドロゲルを形成し、次いで、そのインビトロ放出動力学をさらに以下に記載するように研究した。この手順は、PEO−PHB−PEO(5000−5500−5000)コポリマーを1回、そしてPEO−PHB−PEO(5000−3800−5000)コポリマーを1回用いて実施した。
【0085】
(c.放出動力学)
インビトロ放出動態学研究のために、デキストラン−FITCを含有するそれぞれのヒドロゲルの入ったキュベットを、12mLのPBSを含む試験管に上下逆に入れ、37℃の水浴中でインキュベートした。PBSを、所定の時間間隔で換えた。各間隔で放出されたデキストラン−FITCの濃度を、蛍光ミクロ−プレートリーダーを用いて分析した。
【0086】
上記の手順を実施する場合、PEO−PHB−PEO(5000−5500−5000)は、α−CDを伴っても伴わなくても、ヒドロゲルを形成することが見出され、PEO−PHB−PEO(5000−3800−5000)は、α−CDを伴うときのみヒドロゲルを形成し、そしてα−CDを伴わないPEO−PHB−PEO(5000−3800−5000)は、透明な溶液のままであり、すなわち、薬物の持続性放出に適してないことが理解される。図11は、ヒドロゲルからのデキストラン−FITCのインビトロ放出プロフィールを示す。α−CD−PEO−PHB−PEO(5000−5500−5000)とα−CD−PEO−PHB−PEO(5000−3800−5000)の両方のヒドロゲルは、数週間にわたってデキストラン−FITCの持続性放出を実証するが、純粋なPEO−PHB−PEO(5000−5500−5000)ヒドロゲルは、1週間未満にわたってデキストラン−FITCを放出した。これらの結果は、複週間まで薬物の持続放出のために、α−CDは、PEO−PHB−PEOトリブロックのゲル化だけを補助するのでなく、トリブロックコポリマーとより安定なヒドロゲルを形成する。α−CD−PEO−PHB−PEO(5000−5500−5000)ヒドロゲルは、α−CD−PEO−PHB−PEO (5000−3800−5000)ヒドロゲルよりもより遅い放出速度を示し、このことは、超分子ヒドロゲルの特性が、異なるPHB長を用いることによって本発明に従って微調整され得ることを示す。
【0087】
(実施例4)
(α−シクロデキストランおよびγ−シクロデキストランを用いる封入複合体処方物)
上記のように、シクロデキストラン(CD)は、α−1,4−グリコシド結合によって結合された6〜8つのグルコース単位からなる環状分子であり、それぞれ、α−CD、β−CDおよびγ−CDと称される。CDは、疎水性キャビティを規定するドーナツ形状を有する。CDの疎水性キャビティの深さは同じ(約7.0Å)であるが、このキャビティの内径は異なっており、α−CDについては、約4.5Åであり、β−CDについては、約7.0Åであり、γ−CDについては、約8.5Åである。Bender, M.et
al., Cyclodextrin Chemistry, Springer−Verlag: Berlin (1978)。CDのポリマー鎖の断面積とCDのキャビティサイズとの間の相関は、IC形成において重要な役割を果たしていることが分かった。例えば、Harada, A.et al., Nature 370: 126 (1994)を参照のこと。以下に本明細書中に記載の実験において、PEO−PHB−PEOトリブロックコポリマーとα−CDまたはγ−CDとの間の封入複合体(inclusion complexes;IC) を、調製して、そして、特徴づけ、本発明のヒドロゲルを形成する際のそれらの有用性を実証した。これらの実験は、α−CDおよびγ−CDの両方が、PEOブロックを含む傾向にあるが、他方、その中央のPHBブロックは、CD分子によって部分的にのみ被覆されることを実証する。
【0088】
(a.封入複合体の調製)
PEO−PHB−PEOトリブロックコポリマーを、上記の実施例1の手順を使用して調製した。この実験のために調製したトリブロックコポリマーの分子的特徴を、表4に提供する。PEO−PHB−PEOトリブロックポリマー(20mg)を、室温で一晩、0.06mLのH2Oに浸漬した。その後、3.0mLのα−CDまたはγ−CDのいずれかの飽和水溶液を添加し、そして、各々混合物を、10分間に亘って水浴中で超音波処理し、その後、室温で2日間に亘り、静置した。その沈殿した生成物を、遠心分離によって回収し、次いで、水とアセトンで交互に洗浄した。最後に、その生成物を、2週間に亘り、70℃にて減圧下で乾燥した。
【0089】
(表4)
【0090】
【表4】

【0091】
(a)GPCによって決定した(b) 1H NMRおよびGPCの結果によって決定した(c)DSCの2回目の昇温実行において決定した。
【0092】
(b.測定)
X線回折(XRD)測定を、Siemens D5005回折装置およびNiフィルタCuKα(1.54051Å)放射(40kV,40mA)を使用して実施した。粉末サンプルを、サンプルホルダーに載せて、そして、1工程につき1秒間で、5°から35°まで0.01°のステップでスキャンした。
【0093】
示差走査熱量計(Differential scanning calorimetry;DSC)測定を、自動冷却附属機器を備え、かつインジウムを使用して較正したTA Instruments 2920示差走査熱量計を使用して実施した。各々のサンプルに対して以下のプロトコルを使用した:20℃/分で、室温から200℃まで昇温;2分間に亘って200℃で保持;5℃/分で、200℃から−30℃まで冷却;そして、最後に、5℃/分で、−30℃から200℃まで再度昇温。この2回目の加熱実行の間に、データを収集した。ピーク極大として、遷移温度を取得した。熱重量分析(Thermogravimetric analyses;TGA)を、TA Instrument SDT 2960を使用して実施した。サンプルを、動的な窒素雰囲気下(流速70ml/分)において室温から800℃まで20℃/分で加熱した。
【0094】
上記の複合体の1H NMRスペクトルを、Bruker DPX− 400 NMRスペクトロメータにて400MHzで記録した。これらの複合体の化学シフトは、DMSOについての、δ=2.50に対して帰属される。13C CP/MAS NMRスペクトルを、室温において、サンプル スピン速度(sample spinning rate)にてBruker DPX−400 NMRスペクトロメータで取得した。このスペクトルを、2.75μs プロトン90°パルス、接触時間3ミリ秒間、および繰り返し時間3秒間で、取得した。
【0095】
フーリエ変換赤外(FTIR)スペクトルを、Bio−Rad 165 FTIR分光光度計で記録し; 64スキャンを、室温で2cm−1の分解能で加算平均(signal−averaged)した。サンプルを、KBr中に複合体を分散して、その混合物を圧縮してディスクを形成することによって調製した。
【0096】
(c.結果および考察)
α−CDまたはγ−CDの水溶液を、10分間に亘って水中に浸漬し、そして、超音波処理したPEO−PHB−PEOトリブロックコポリマーに添加すると、結晶質の沈殿物として複合体が形成された。沈殿物の外観は、そのコポリマーとCDとの間の結晶質の封入複合体(IC)の形成を示す。Harada, A.et al., Macromolecules, 26: 5698 (1993)。比較すると、β−CDとPEO−PHB−PEOトリブロックコポリマー溶液の混合物中では、2週間の静置の後においても、沈殿はなんら形成されなかった。この観察によって、PEO−PHB−PEOトリブロックポリマーがα−CDおよびγ−CDとともにICを形成し得るが、β−CDを用いると、トリブロックポリマーを形成し得ないことが示される。このIC形成の収量を、表5に示す。
【0097】
(表5)
【0098】
【表5】

【0099】
CD−PEO−PHB−PEO ICの形成は、X線回折(XRD)研究によって大いに支持された。図12によって、α−CDおよびPEO(Mn2000)によって形成されたICと比較して、純粋なPEO−PHB−PEO (2000−5200−2000)、および全部で3つのPEO−PHB−PEOトリブロックコポリマーのXRDパターンを示した。図12eにおいて、2θ=19.4°および2θ=22.1°で突起した2つのピークを有する多くの鋭角的な回折が、CDおよびPEOの結晶質のネックレス様複合体のチャネル型構造(channel type structure)を表す。例えば、 Takeo, K.et al.,Agric.Biol.Chem., 34: 1787 (1970)を参照のこと。α−CD−PEO−PHB−PEO ICについての類似の回折パターンの観察(図12b〜d)によって、αCD−PEO−PHB−PEO ICが、α−CD−PEO ICの構造と類似のチャネル型構造を呈することが示される。α−CD−PEO−ICと比較したときに、2θ=13.6°および17.0°での2つの余分な小さいピークが、α−CD−PEO−PHB−PEO ICのパターンにおいて現れる。この2つのピークの相対強度は、PEO−PHB−PEO中のPEOに対するPHBの比が増大するに伴い増大する。図12aに示されるように、純粋なPEO−PHB−PEOに関して、13.6°および17.0°でのピークは、結晶質のPHBの特徴である。したがって、この2つのピークの存在は、PHBブロックの一部分が凝集して結晶質相を形成し、その結晶質相とIC結晶が共存することを示すことが考えられる。
【0100】
γ−CD−PEO−PHB−PEO ICのXRDパターンが、純粋PEO−PHB−PEOおよびγ−CD−PPO ICのXRDパターンと比較して、図13に示されている。ピークの各々の相対強度が異なっているが、γ−CD−PEO−PHB−PEO ICのXRDパターンが、互いに非常に類似しており、かつ、γ−CD−PPO ICのXRDパターンに類似しており、ここでは、チャネル型構造が、確立されている。さらに、7.6°での特徴的なピークが観察され、これは、γ−CDポリマーICのチャネル型構造に対する識別特徴としての役割を果たす重要な特徴である。例えば、Harada, A.et al., Macromolecules, 29: 5611 (1996)を参照のこと。したがって、γ−CD−PEO−PHB−PEO ICは、チャネル型構造を呈すると考えられる。結晶質PHBブロックに帰属される2θ=13.6°および2θ=17.0°での2つのピークはまた、α−CD−PEO−PHB−PEO ICと同様に、γ−CD−PEO−PHB−PEO ICのXRDパターンにおいて観察される。化学量論的なα−CD−PEOおよびγ−CD−PPO ICと比較した、α−CD−PEO−PHB−PEOおよびγ−CD−PEO−PHB−PEO ICについてのブロードなXRDパターン(図12eおよび図13e)は、ICのより低い結晶性に起因し、ICのチャネルを「分解(break up)」そして短縮する被覆されないPHBによって引き起こされるのが最も可能性が高い。
【0101】
純粋なPEO−PHB−PEO(2000−5200−2000)およびα−CD−PEO−PHB−PEO ICのDSC曲線を、図14に示した。図14aに示されるように、純粋なPEO−PHB−PEO(2000−5200−2000)のDSC曲線における23.3℃および153.6℃での2つの吸熱ピークが存在し、これらのピークは、それぞれ、PEOブロックおよびPHBブロックの結晶融合に対応する。ICの形成の際に、PEOブロックに対応する吸熱ピークは、図14b〜図14dにおいては存在しない。これは、そのPEOブロックが、ホストであるα−CDの格子のチャネルに別々に取り込まれており、次いで、凝集してその結晶質相を形成することができないためである。しかし、PHBブロックに対応するその吸熱ピークは、なおも、観察可能である(図14〜14d)。しかし、その融合温度は、より低い範囲まで移動し、そのエンタルピー変化が、CD−PEO−PEO ICの劇的な減少を生じる。この結果によって、PHBブロックの各々が、α−CDによって部分的に被覆され、そして、最も可能性があることとして、PHBブロックの中央部分が、α−CDによって複合体化されないこということが示される。融合温度の低下およびエンタルピー変化は、PHBブロックの部分的な取り込みから生じる結晶の摂動に起因する。Shuai, X.ら(Macromolecules, 35: 3778 (2002))は、DMSO中のポリ[(R)−3−ヒドロキシブチレート]とα−CDとの間のICの形成を報告している。彼らの結果によって、PHB鎖が、α−CDによってのみ部分的に含まれることが示されている。本発明の系について、α−CDをPHBブロックにスレッディング(threading)することは、PHBの疎水性によってなおも阻まれるが、PEOブロックにスレディングするCDは、PHBブロックまでさらにスライドし得ることが示される。そのα−CD−PEO−PHB−PEO ICにおいて、融合温度およびエンタルピー変化は、中央のPHBブロックの鎖の長さの増加に伴って増加する傾向にある。これは、より長いPHBブロックを有するα−CD−PEO−PHB−PEO ICが、PHB鎖のより長い複合体化していない部分を有するためである。
【0102】
図15は、純粋なPEO−PHB−PEO(2000−5200−2000)およびγ−CD−PEO−PHB−PEO ICのDSC曲線を示す。図14の結果と類似の結果が、取得され得る。α−CD−PEO−PHB−PEOおよびγ−CD−PEO−PHB−PEO ICの両方についてのDSCの結果の全ては、このPEOブロックが、CDによって完全に被覆されているが、他方、そのPHBブロックは、部分的に被覆されており、それらのXRDの結果と矛盾しないことを示す。
【0103】
図16は、α−CDおよびα−CD−PEO−PHB−PEO (2000−5200−2000) ICの13C CP/MAS NMRスペクトルを示す。非複合体状態であるα−CDのスペクトルは、C1およびC4について複数に分解される共鳴を示す。単一のコンフォメーション的に拘束されたグリコシド結合に隣接するC1およびC4についての共鳴は、そのスペクトルにおいて特に観測される。これらの結果は、その結晶質の複合体化していない状態でα−CDがより対称性の低いコンフォメーションを呈することを示す。対照的に、α−CD−PEO−PHB−PEO(2000−5200−2000)ICにとって、CDの全てのC1〜C6は、単一の分解されない共鳴を示し、これによって、α−CDがより対照的なコンフォメーションを採用することを示し、α−CDのグルコース単位の各々が、そのIC中の類似の環境で存在することを示す。
【0104】
α−CDまたはγ−CDによる中央のPHBブロックの部分的な切断がまた、そのCD−PEO−PHB−PEO ICの1H NMRスペクトルによって実証された。図17
は、DMSO−d6中のα−CD−PEO−PHB−PEO(2000−5200−2000)の1H NMRスペクトルを示す。図17において示されるように、α−CDおよびPEO−PHB−PEO(2000−5200−2000)に帰属する全てのプロトンシグナルが、確認される。結晶質ICの成分の比は、そのピークの積分値を比較することによって決定され得る。以前に報告されるように、PEOは、α−CDおよびγ−CDとの封入複合体を形成し得、CDに対するPEO繰り返し単位の比は、それぞれ、2および4である。例えば、Haradaら(1994)を参照のこと。しかし、α−CD−PEO−PHB−PEO(2000−5200−2000)ICについての図17から得られるα−CDに対するPEO繰り返し単位の比は、1.4であり、これによって、α−CDとPEOブロックの化学量論的複合体を形成するよりも、多くのα−CD分子が、α−CD−PEO−PHB−PEO(2000−5200−2000)IC中に含まれていることを示す。他方、固相13C CP/MAS NMR測定によって、そのICにおける全てのα−CDが、ポリマー鎖状にスレッディングされ、そして、チャネル構造をとる。次いで、いくつかのα−CDが、中央のPHBブロックに滑り込むと考えられる。全ての試験したCD−PEO−PHB−PEO ICについて、CDに対するPEO繰り返し単位の比は、表5に要約される。γーCDとのICの場合、その比は、2.1と2.6との間であり、これによって、いくつかのγ−CD分子もまた、その中央のPHBブロックに滑り込むことが示される。これらの結果によって、PEOブロックが、α−CDまたはγ−CDによって完全に被覆されるが、他方、その中央のPHBブロックが、CD−PEO−PHB−PEO IC中で部分的に被覆されるという仮説がさらに支持される。
【0105】
図18は、純粋なPEO−PHB−PEO(20−52−20) およびα−CDと比較したときの、α−CD−PEO−PHB−PEO ICのFTIRスペクトルを示す。α−CDについてのスペクトルは、その対称性および非対称性のO−H伸縮モードに起因する3360cm−1でのブロードなバンドを示す。ICの形成に際に、そのブロードな、ヒドロキシルバンドは、ICのスペクトルにおいて、3390cm−1の高周波数側にシフトすることを示す(図18bおよび図18c)。これは、そのチャネル構造におけるCDのヒドロキシル基間の水素結合の形成に起因する可能性が最も高い。純粋なPEO−PHB−PEO (2000−5200−2000)のFTIRスペクトルは、PEO−PHB−PEO(2000−5200−2000)におけるPHB部分に帰属される1723cm−1での強いカルボニル伸縮バンドによって特徴付けられる(図18a)。このカルボニル伸縮バンドは、強い1723cm−1のバンドと、弱い1736cm−1のショルダーバンドに分離され、これらは、それぞれ、結晶質のPHB相のカルボニル伸縮バンドおよびアモルファスPHB領域のカルボニル伸縮バンドに対応する。Ikejima,T.,etal.,Macromol.Chem.Phys.,200:413(1999)。
【0106】
図19は、FTIRスペクトルのカルボニル伸縮領域の拡大を示す。純粋なPEO−PHB−PEO (2000−5200−2000)と比較すると、1723cm−1でのピークは、急激に減少するが、他方、1736cm−1のショルダーは、α−CD−PEO−PHB−PEO(2000−5200−2000)およびγ−CD−PEO−PHB−PEO (2000−5200−2000)のスペクトルにおいて急激に増大する。ICが形成されると、そのPHBセグメントのいくつかは、ICチャネルの個々に位置づけられ、次いで、凝集してPHB結晶を形成することができない。1723cm−1でのピークの存在は、PHBブロックの一部分のみが、CDによって被覆され、かつその残りのPHBセグメントは、なお、凝集して結晶質相を形成し得ることを示す。これは、上で議論したXRDの結果およびDSCの結果と一致する。
【0107】
図20は、α−CD、純粋なPEO−PHB−PEO(2000−5200−2000)およびそれらのICについての450℃までの熱重量分析(TGA)スキャンの結果を示す。図20において示されるように、α−CDは、279.2℃で分解し始める。純粋なPEP−PHB−PEO(2000−5200−2000)は、加熱の際に、初めに58.7%の質量損失を示し、そして、次に、39.3%の質量損失を示し、それぞれ、222.4℃および243.8℃で熱分解が始まった。この第1の室慮損失は、PHBブロックの分解に起因し、そして、この第2の質量損失は、PEOブロックの分解に起因すると考えられる。しかし、α−CD−PEO−PHB−PEO IC中のPHBブロック、PEOブロックおよびα−CDブロックの分解の開始は、247.2 ℃、 309.3
℃ および365.8℃でそれぞれ観測される。これらは、全て、PEO−PHB−PEO(2000−5200−2000)中のPHBおよびPEOおよび純粋なα−CDの分解の開始温度よりも、高い。α−CD−PEO−PHB−PEO ICのより高い分解温度は、α−CDおよびPEO−PHB−PEOの両方の熱安定性に対する複合体形成の寄与に起因すると考えられる。類似の結果が、また、γ−CD−PEO−PHB−PEO
ICについて観察された。
【0108】
(実施例5)
(PEO−PHB−PEOコポリマーミセル特徴付け)
実施例1の全部の手順に従って生成されたPEO−PHB−PEOコポリマーから、水性媒体中でミセルを形成し、次いで以下のように特徴付けした。
【0109】
(a.材料)
天然供給源ポリ[(R)−3−ヒドロキシブチレート](PHB)を、Aldrichから購入した。PHBサンプルを、クロロホルム中に溶解することにより精製した後、ろ過し、そして使用前に石油エーテル中に沈殿させた。精製したPHBのMnおよびMwは、それぞれ8.7×104および2.3×105であった。分子量約5000のメトキシ−ポリ(エチレンオキシド)モノプロピオン酸(M−PEO−A)を、Shearwater Polymers,Inc.,USAから購入した。M−EPO−AのMnおよびMwは、それぞれ4740および4880であると見出された。ビス(2−メトキシエチル)エーテル(ジグライムe、99%)、エチレングリコール(99%)、ジラウリン酸ジブチルスズ(95%)、1,3−N,N’−ジシクロヘキシルカルボジイミド(DCC、99%)、4−(ジメチルアミノ)ピリジン(DMAP、99%)、無水コハク酸(97%)およびトリエチルアミン(99%)を、Aldrichから得た。ジグライム(ジグライムe)を、モレキュラーシーブを用いて乾燥させ、使用前にCaH2から塩化メチレンを蒸留した。
【0110】
(b.純粋なPEO−PHB−PEOヒドロゲルの調製)
低分子量のテレケリック水酸化PHB(PHB−ジオール)プレポリマーを、ジグライム中に触媒としてジラウリン酸ブチルスズを用いて、天然PHBおよびジエチレングリコールからエステル交換により調製した(収率80%)。PHB−ジオール(0.38g、1.2×10−4mol、Mn=3220)、M−PEO−A(1.42g、3.0×10−4mol、Mn=4740)およびDMAP(12mg、9.8×10−5mol)を、減圧下60℃(油浴)にて一晩、50mL二頚フラスコ中で乾燥させ、無水塩化メチレン(25〜30mL)をこのフラスコに加え、次いで蒸留により無水塩化メチレンを除去して(油浴、75℃)、系中の微量の水を除去した。このフラスコを冷やして、4mlの無水塩化メチレンに溶解したDCC(0.098g、4.7×10−4mol)を加え、この混合物を、窒素下室温で一晩、攪拌した。沈殿したジクロロヘキシルウレア(DCU)を、濾過により除去した。ポリマーを、2回ジエチルエーテルから沈殿させた。メタノールまたはクロロホルムに再溶解させた所望のトリブロック(triblock)コポリマー生成物を、分留によりさらに精製した。収率:0.75g、56%。GPC(THF):Mn=12720、Mn(PHBブロック)=3820、Mn(PHBブロック)=4740、Mw=13770、Mw/Mn=1.08。Tm=54℃(PEOブロックについて)および140℃(PEOブロックについて)。1H NMR(400 MHz、CDCl3);δ5.29(m、PHBブロックのメチンH)、4.32(s、−COOCH2CH2COO−)、3.68(s、PEOブロックの−CH2OCH2−)、3.42(s、−OCH3末端基)、2.48〜2.67(m、PHBブロックのメチレンH)、1.31(d、PHBブロックのメチルH)。IR(KBr):2886、1723、1456、1380、1111、1061、962、842、516cm−1。
【0111】
(c.ポリマー特徴付け)
ゲル透過クロマトグラフィー(GPC)分析を、直列した2つのPhenogel 5μ 50および1000Åカラム(サイズ:300×4.6mm)ならびにShimadzu RID−10A屈折率検出器を装備したShimadzu SCL−10AおよびLC−8Aシステムを用いて行なった。溶離剤としてTHFを、流速0.30mL/分、40℃で使用した。単分散したポリ(エチレングリコール)標準物質を用いて、検量線を得た。1H NMRスペクトルを、室温で400MHzにてBruker AV−400NMR分光器上に記録した。1H NMR測定を、収集時間3.2秒、パルス繰返し時間2.0秒、30°パルス幅、5208−Hzスペクトル幅および32Kデータポイントを用いて行なった。化学シフトは、溶媒ピークに起因していた(CH3Clに対してδ=7.3ppm)。
【0112】
(d.蛍光分光法)
定常状態蛍光スペクトルを、Shimadzu RF−5301PC分光蛍光光度計上に記録した。励起スペクトルを、373nmでモニターした。励起側および発光側の両方いついてスリット幅を1.5nmに維持した。規定量のブロックポリマーを、既知濃度の水性ピレン溶液に溶解することによって、サンプル溶液を調製し、そしてこの溶液を、1日静置して平衡化させた。
【0113】
(e.結果および考察)
PEO−PHB−PEOトリブロックコポリマーのミセル形成を、色素吸収技術を使用して研究した。水溶液中のPEO−PHB−PEOトリブロックコポリマーの臨界ミセル濃度(cmc)値を、プローブとしてピレンの蛍光励起スペクトルを使用して決定した。Wilhelm,M.ら、Macromolecules 24:1033−1040(1991);Noda,T.ら、Macromolecules 33:3694−3704(2000)。この方法は、ピレンはミセル相に可溶化されるときの水中ピレンについて0−0最大吸収の334nm〜337nmのシフトに基づく。
【0114】
図21は、水中ピレンについて、PEO−PHB−PEOコポリマーの種々の濃度での励起スペクトルを示す。コポリマー濃度の増加につれて、334〜337nmの0−0吸収バンドのレッドシフトが観察された。図22は、ピレン励起スペクトルのI337/I334の強度比を、コポリマー濃度の対数関数として示す。I337/I334対Log
Cプロットは、S字形曲線を示した。I337/I334の強度比の無視できる変化が
、低濃度範囲で観察された。コポリマー濃度の増加につれて、強度比は、ある濃度でかなりの増加を示し、このことはピレンがミセルの疎水性コア領域に取り込まれることを示している。それゆえ、図22において、cmc値は、低濃度領域の交差点から決定される。極めて低いcmc値(1.4×10−5g/mL)は、トリブロックコポリマーが水性環境中でミセル形成の強い傾向があることを示す。
【0115】
ミセルの形成は、予想外にも、相対的に温度非感受性であることが見出された。図23に示されるように、15〜45℃の範囲の温度で、I337/I334比は、主に、温度ではなくコポリマー濃度に依存している。それゆえ、PEO−PHB−PEOトリブロックコポリマーのミセル形成は、相対的に温度非感受性である。このことは、中間のポリ(α−ヒドロキシアルカン酸)を有し、通常、温度感受性であるPLLAまたはPGAからなるPEOブロックを隣接するトリブロックコポリマーと全く異なる。Jeong(2002);Kissel(2002);Jeong(1997);Jeong(1999))。理論によって制限されることを望んでいないが、本発明者らは、PHBが、ポリ(α−ヒドロキシアルカン酸)よりも高い結晶性および疎水性を有し、従って、ブロックポリマーにおけるPHB断片の自己組織化の傾向は、はるかにより強く、温度変化に依存しないと考える。
【0116】
要約すると、新規の生分解性両親媒性PEO−PHB−PEOトリブロックコポリマーの温度非感受性ミセル形成を実証してきた。PHBは、PLLAに関連した化学構造を有しているが、PEO−PHB−PEOトリブロックコポリマーのミセル挙動は、PEO−PLLA−PEOトリブロックコポリマーと全く異なる。PEO−PHB−PEOトリブロックコポリマーにより形成されたミセル(これは、低温で解離し難く、高温で容易に大きなサイズに凝集しない)は、より安定であり、容易に取り扱われる。
【0117】
(実施例6)
(α−CD−EPO−PHB−PEOヒドロゲルのインビボ組織生物適合性)
αーCDおよびEPO−PHB−PEO(5000−2000−5000)から、実施例2の手順に従って形成されたヒドロゲルを、3匹のウサギの膝関節に関節内注射した。リン酸緩衝生理食塩水(PBS)を、ネガティブコントロールとして使用した。注射後7日目に、これらの動物を屠殺した。膝関節を収集して、組織学により試験した。このサンプルを、盲目的な条件下で評価した。
【0118】
ウサギ膝関節におけるヒドロゲルのインビボ生体適合性試験の代表的な結果を、図24a(PBSコントロール)および図24b(α−CD−EPO−PHB−PEOヒドロゲル)に示す。図24b中のスライドに示されるように、α−CD−EPO−PHB−PEOヒドロゲルに曝露された滑膜において軽度の線維形成があったが、これら2つのサンプルの間で有意な違いはなかった。全部の分析は、ヒドロゲルの注射後、関節滑膜において明かに炎症性湿潤がなかったことを示した。この結果は、ウサギ膝関節においてヒドロゲルの生物適合性を示した。ヒドロゲルを注射した膝とPBSを注射した膝との間で、組織学的にも、形態学的にも有意な違いはなかった。
【0119】
本発明の好ましい実施形態を説明し、記載してきたが、発明の意図および範囲から逸脱することなく、本明細書中に種々の変化がなされ得ることは、十分理解されている。
【特許請求の範囲】
【請求項1】
以下:
シクロデキストリンおよび両親媒性コポリマーから形成されるヒドロゲルであって、該コポリマーが、ポリ(アルキレンオキシド)を含むAポリマーブロックおよびポリ(ヒドロキシアルカノエート)を含むBポリマーブロックを含む、ヒドロゲル;および
ヒドロゲル内に含まれる治療有効量の少なくとも1種の治療剤、
を含む薬物送達システム。
【請求項2】
薬学的に受容可能な水性塩基をさらに含む、請求項1に記載のシステム。
【請求項3】
前記薬物送達システムが、注射可能である、請求項1に記載のシステム。
【請求項4】
前記ヒドロゲルが、チキソトロピーである、請求項3に記載のシステム。
【請求項5】
前記システムが、薬物送達の開始後少なくとも1週間の間、少なくとも1種の治療剤の徐放を提供する、請求項1に記載のシステム。
【請求項6】
前記システムが、薬物送達の開始後少なくとも2週間の間、少なくとも1種の治療剤の徐放を提供する、請求項1に記載のシステム。
【請求項7】
前記ポリ(アルキレンオキシド)が、以下:ポリ(エチレンオキシド)、ポリ(テトラメチレンオキシド)およびポリ(テトラヒドロフラン)からなる群から選択される、請求項1に記載のシステム。
【請求項8】
前記ポリ(アルキレンオキシド)が、ポリ(エチレンオキシド)である、請求項7に記載のシステム。
【請求項9】
前記ポリ(ヒドロキシアルカノエート)が、以下:
ポリ[(R)−3−ヒドロキシブチレート];ポリ[(R)−4−ヒドロキシブチレート];ポリ[(R)−3−ヒドロキシバレレート];ポリ[(R)−3−ヒドロキシブチレート]−co−ポリ[(R)−3−ヒドロキシバレレート];ポリ[(R)−3−ヒドロキシヘキサノエート];ポリ[(R)−3−ヒドロキシヘプタノエート];このような(R)エナンチオマーのそれぞれの(S)エナンチオマー;このような(S)エナンチオマーおよび(R)エナンチオマーのラセミ混合物;およびそれらの混合物、からなる群から選択される、請求項1に記載のシステム。
【請求項10】
前記ポリ(ヒドロキシアルカノエート)が、以下:ポリ[(R)−3−ヒドロキシブチレート];ポリ[(R)−4−ヒドロキシブチレート];このような(R)エナンチオマーのそれぞれの(S)エナンチオマー;(S)エナンチオマーおよび(R)エナンチオマーのラセミ混合物;およびそれらの混合物、からなる群から選択される、請求項1に記載のシステム。
【請求項11】
前記ポリ(ヒドロキシアルカノエート)が、ポリ[(R)−3−ヒドロキシブチレート]を含む、請求項1に記載のシステム。
【請求項12】
前記コポリマーが、1つのBポリマーブロック中間セグメントおよび2つのAポリマーブロック末端セグメントを含む両親媒性トリブロックコポリマーである、請求項1に記載のシステム。
【請求項13】
前記ポリ(ヒドロキシアルカノエート)Bブロックポリマーが、以下:ポリ[(R)−3−ヒドロキシブチレート];ポリ[(R)−4−ヒドロキシブチレート];ポリ[(R)−3−ヒドロキシバレレート];ポリ[(R)−3−ヒドロキシブチレート]−co−ポリ[(R)−3−ヒドロキシバレレート];ポリ[(R)−3−ヒドロキシヘキサノエート];ポリ[(R)−3−ヒドロキシヘプタノエート];このような(R)エナンチオマーのそれぞれの(S)エナンチオマー;このような(S)エナンチオマーおよび(R)エナンチオマーのラセミ混合物;およびそれらの混合物、からなる群から選択される、請求項12に記載のシステム。
【請求項14】
前記ポリ(アルキレンオキシド)Aブロックポリマーが、以下:ポリ(エチレンオキシド)、ポリ(テトラメチレンオキシド)およびポリ(テトラヒドロフラン)からなる群から選択される、請求項12に記載のシステム。
【請求項15】
ポリ(アルキレンオキシド)Aブロックポリマーが、ポリ(エチレンオキシド)である、請求項14に記載のシステム。
【請求項16】
前記ポリ(ヒドロキシアルカノエート)Bブロックポリマーが、以下:ポリ[(R)−3−ヒドロキシブチレート];ポリ[(R)−4−ヒドロキシブチレート];ポリ[(R)−3−ヒドロキシバレレート];ポリ[(R)−3−ヒドロキシブチレート]−co−ポリ[(R)−3−ヒドロキシバレレート];ポリ[(R)−3−ヒドロキシヘキサノエート];ポリ[(R)−3− ヒドロキシヘプタノエート];このような(R)エナンチオマーのそれぞれの(S)エナンチオマー;(S)エナンチオマーおよび(R)エナンチオマーのラセミ混合物;およびそれらの混合物、からなる群から選択される、請求項15に記載のシステム。
【請求項17】
前記ポリ(アルキレンオキシド)Aブロックポリマーおよび前記ポリ(ヒドロキシアルカノエート)Bブロックポリマーの各々が、500から20,000の分子量を有する、請求項1に記載のシステム。
【請求項18】
前記ポリ(アルキレンオキシド)Aブロックポリマーおよび前記ポリ(ヒドロキシアルカノエート)Bブロックポリマーの各々が、2,000から10,000の分子量を有する、請求項1に記載のシステム。
【請求項19】
前記ポリ(ヒドロキシアルカノエート)Bブロックポリマーが、3,000から2,500の分子量を有する、請求項1に記載のシステム。
【請求項20】
前記シクロデキストリンが、コポリマーの5重量%〜80重量%のレベルで含まれる、請求項1に記載のシステム。
【請求項21】
前記シクロデキストリンが、コポリマーの5重量%〜50重量%のレベルで含まれる、請求項1に記載のシステム。
【請求項22】
前記ヒドロゲルが、1重量%〜80重量%のレベルでコポリマーを含む水溶液を含む、請求項1に記載のシステム。
【請求項23】
前記ヒドロゲルが、10重量%〜40重量%のレベルでコポリマーを含む水溶液を含む、請求項1に記載のシステム。
【請求項24】
治療剤と複合体化し、そして/または治療剤と結合体化する第2のポリマーをさらに含む、請求項1に記載のシステム。
【請求項25】
前記第2のポリマーが、以下:ポリエステル、ポリウレタン、ポリアミド、ポリエーテル、ポリサッカリド、ポリ(アミノ酸)、ポリペプチドおよびタンパク質からなる群から選択されるポリマーである、請求項24に記載のシステム。
【請求項26】
前記第2のポリマーが、ポリ(エチレングリコール)セグメントを有する二官能性ポリマーまたは単官能性ポリマーである、請求項24に記載のシステム。
【請求項27】
DNAナノ粒子をさらに含む、請求項1に記載のシステム。
【請求項28】
前記コポリマーが、1,000から50,000の分子量を有する、請求項1に記載のシステム。
【請求項29】
前記コポリマー5,000〜35,000の分子量を有する、請求項1に記載のシステム。
【請求項30】
前記少なくとも1種の治療剤が、以下:ペプチド、タンパク質、低分子、遺伝子、抗原、抗体およびそのフラグメントならびにヒト組換えタンパク質、DNA、RNAおよびDNAナノ粒子からなる群から選択される、請求項1に記載のシステム。
【請求項31】
前記少なくとも1種の治療剤が、高分子形態である、請求項1に記載のシステム。
【請求項32】
前記少なくとも1種の治療剤が、以下:鎮痛剤、麻酔薬、抗関節炎薬物、疾患改変抗リウマチ薬物、抗喘息薬物、抗凝固剤、抗痙攣薬、抗うつ剤、抗糖尿病薬、抗悪性腫瘍薬、抗精神病薬、降圧薬、抗生物質、抗ヒスタミン剤、消炎剤、抗炎症薬、筋肉弛緩剤、駆虫薬、抗ウイルス薬、抗再狭窄薬、鎮痙剤、軟骨保護剤(chondroprotective agent)、抗接着剤、抗腫瘍細胞侵襲剤、血管弛緩薬、血管収縮薬および免疫抑制薬からなる群から選択される、請求項1に記載のシステム。
【請求項33】
前記少なくとも1種の治療剤が、以下:ペプチド、タンパク質(サイトカイン、成長因子、血管新生因子、可溶性レセプター、抗体およびそのフラグメントならびにヒト組換えタンパク質を含む)、低分子、遺伝子、抗原(ワクチンを含む)、DNA、RNAおよびDNAナノ粒子、からなる群から選択される、請求項1に記載のシステム。
【請求項34】
前記ヒドロゲルが、移植可能デバイスに適用される、請求項1に記載のシステム。
【請求項35】
前記移植可能デバイスが、以下:ステント、カテーテル、気道チューブ、導管、スクリュー、プレート、シャント、人工関節、人工心臓、人工弁および他の人工器官からなる群から選択される、請求項34に記載のシステム。
【請求項36】
以下:
シクロデキストリンおよび両親媒性コポリマーから形成されるヒドロゲルであって、該コポリマーが、ポリ(エチレンオキシド)を含むAポリマーブロックおよびポリ(ヒドロキシブチレート)を含むBポリマーブロックを含む、ヒドロゲル;および
ヒドロゲルの内心に含まれる治療有効量の少なくとも1種の治療剤、
を含む薬物送達システム。
【請求項37】
シクロデキストリンおよび両親媒性コポリマーを含むヒドロゲルであって、該コポリマーが、ポリ(アルキレンオキシド)を含むAポリマーブロックおよびポリ(ヒドロキシアルカノエート)を含むBポリマーブロックを含む、ヒドロゲル。
【請求項38】
以下:
シクロデキストリンおよび両親媒性コポリマーから形成されるヒドロゲルであって、該コポリマーが、ポリ(アルキレンオキシド)を含むAポリマーブロックおよびポリ(ヒドロキシアルカノエート)を含むBポリマーブロックを含む、ヒドロゲル;および
ヒドロゲル内に含まれる診断剤、
を含む薬物送達システム。
【請求項39】
以下:
シクロデキストリンおよび両親媒性コポリマーから形成されるヒドロゲルであって、該コポリマーが、ポリ(エチレンオキシド)を含むAポリマーブロックおよびポリ(ヒドロキシブチレート)を含むBポリマーブロックを含む、ヒドロゲル;および
ヒドロゲル内に含まれる診断剤、
を含む薬物送達システム。
【請求項40】
明細書中に記載の薬物送達システム。
【請求項1】
以下:
シクロデキストリンおよび両親媒性コポリマーから形成されるヒドロゲルであって、該コポリマーが、ポリ(アルキレンオキシド)を含むAポリマーブロックおよびポリ(ヒドロキシアルカノエート)を含むBポリマーブロックを含む、ヒドロゲル;および
ヒドロゲル内に含まれる治療有効量の少なくとも1種の治療剤、
を含む薬物送達システム。
【請求項2】
薬学的に受容可能な水性塩基をさらに含む、請求項1に記載のシステム。
【請求項3】
前記薬物送達システムが、注射可能である、請求項1に記載のシステム。
【請求項4】
前記ヒドロゲルが、チキソトロピーである、請求項3に記載のシステム。
【請求項5】
前記システムが、薬物送達の開始後少なくとも1週間の間、少なくとも1種の治療剤の徐放を提供する、請求項1に記載のシステム。
【請求項6】
前記システムが、薬物送達の開始後少なくとも2週間の間、少なくとも1種の治療剤の徐放を提供する、請求項1に記載のシステム。
【請求項7】
前記ポリ(アルキレンオキシド)が、以下:ポリ(エチレンオキシド)、ポリ(テトラメチレンオキシド)およびポリ(テトラヒドロフラン)からなる群から選択される、請求項1に記載のシステム。
【請求項8】
前記ポリ(アルキレンオキシド)が、ポリ(エチレンオキシド)である、請求項7に記載のシステム。
【請求項9】
前記ポリ(ヒドロキシアルカノエート)が、以下:
ポリ[(R)−3−ヒドロキシブチレート];ポリ[(R)−4−ヒドロキシブチレート];ポリ[(R)−3−ヒドロキシバレレート];ポリ[(R)−3−ヒドロキシブチレート]−co−ポリ[(R)−3−ヒドロキシバレレート];ポリ[(R)−3−ヒドロキシヘキサノエート];ポリ[(R)−3−ヒドロキシヘプタノエート];このような(R)エナンチオマーのそれぞれの(S)エナンチオマー;このような(S)エナンチオマーおよび(R)エナンチオマーのラセミ混合物;およびそれらの混合物、からなる群から選択される、請求項1に記載のシステム。
【請求項10】
前記ポリ(ヒドロキシアルカノエート)が、以下:ポリ[(R)−3−ヒドロキシブチレート];ポリ[(R)−4−ヒドロキシブチレート];このような(R)エナンチオマーのそれぞれの(S)エナンチオマー;(S)エナンチオマーおよび(R)エナンチオマーのラセミ混合物;およびそれらの混合物、からなる群から選択される、請求項1に記載のシステム。
【請求項11】
前記ポリ(ヒドロキシアルカノエート)が、ポリ[(R)−3−ヒドロキシブチレート]を含む、請求項1に記載のシステム。
【請求項12】
前記コポリマーが、1つのBポリマーブロック中間セグメントおよび2つのAポリマーブロック末端セグメントを含む両親媒性トリブロックコポリマーである、請求項1に記載のシステム。
【請求項13】
前記ポリ(ヒドロキシアルカノエート)Bブロックポリマーが、以下:ポリ[(R)−3−ヒドロキシブチレート];ポリ[(R)−4−ヒドロキシブチレート];ポリ[(R)−3−ヒドロキシバレレート];ポリ[(R)−3−ヒドロキシブチレート]−co−ポリ[(R)−3−ヒドロキシバレレート];ポリ[(R)−3−ヒドロキシヘキサノエート];ポリ[(R)−3−ヒドロキシヘプタノエート];このような(R)エナンチオマーのそれぞれの(S)エナンチオマー;このような(S)エナンチオマーおよび(R)エナンチオマーのラセミ混合物;およびそれらの混合物、からなる群から選択される、請求項12に記載のシステム。
【請求項14】
前記ポリ(アルキレンオキシド)Aブロックポリマーが、以下:ポリ(エチレンオキシド)、ポリ(テトラメチレンオキシド)およびポリ(テトラヒドロフラン)からなる群から選択される、請求項12に記載のシステム。
【請求項15】
ポリ(アルキレンオキシド)Aブロックポリマーが、ポリ(エチレンオキシド)である、請求項14に記載のシステム。
【請求項16】
前記ポリ(ヒドロキシアルカノエート)Bブロックポリマーが、以下:ポリ[(R)−3−ヒドロキシブチレート];ポリ[(R)−4−ヒドロキシブチレート];ポリ[(R)−3−ヒドロキシバレレート];ポリ[(R)−3−ヒドロキシブチレート]−co−ポリ[(R)−3−ヒドロキシバレレート];ポリ[(R)−3−ヒドロキシヘキサノエート];ポリ[(R)−3− ヒドロキシヘプタノエート];このような(R)エナンチオマーのそれぞれの(S)エナンチオマー;(S)エナンチオマーおよび(R)エナンチオマーのラセミ混合物;およびそれらの混合物、からなる群から選択される、請求項15に記載のシステム。
【請求項17】
前記ポリ(アルキレンオキシド)Aブロックポリマーおよび前記ポリ(ヒドロキシアルカノエート)Bブロックポリマーの各々が、500から20,000の分子量を有する、請求項1に記載のシステム。
【請求項18】
前記ポリ(アルキレンオキシド)Aブロックポリマーおよび前記ポリ(ヒドロキシアルカノエート)Bブロックポリマーの各々が、2,000から10,000の分子量を有する、請求項1に記載のシステム。
【請求項19】
前記ポリ(ヒドロキシアルカノエート)Bブロックポリマーが、3,000から2,500の分子量を有する、請求項1に記載のシステム。
【請求項20】
前記シクロデキストリンが、コポリマーの5重量%〜80重量%のレベルで含まれる、請求項1に記載のシステム。
【請求項21】
前記シクロデキストリンが、コポリマーの5重量%〜50重量%のレベルで含まれる、請求項1に記載のシステム。
【請求項22】
前記ヒドロゲルが、1重量%〜80重量%のレベルでコポリマーを含む水溶液を含む、請求項1に記載のシステム。
【請求項23】
前記ヒドロゲルが、10重量%〜40重量%のレベルでコポリマーを含む水溶液を含む、請求項1に記載のシステム。
【請求項24】
治療剤と複合体化し、そして/または治療剤と結合体化する第2のポリマーをさらに含む、請求項1に記載のシステム。
【請求項25】
前記第2のポリマーが、以下:ポリエステル、ポリウレタン、ポリアミド、ポリエーテル、ポリサッカリド、ポリ(アミノ酸)、ポリペプチドおよびタンパク質からなる群から選択されるポリマーである、請求項24に記載のシステム。
【請求項26】
前記第2のポリマーが、ポリ(エチレングリコール)セグメントを有する二官能性ポリマーまたは単官能性ポリマーである、請求項24に記載のシステム。
【請求項27】
DNAナノ粒子をさらに含む、請求項1に記載のシステム。
【請求項28】
前記コポリマーが、1,000から50,000の分子量を有する、請求項1に記載のシステム。
【請求項29】
前記コポリマー5,000〜35,000の分子量を有する、請求項1に記載のシステム。
【請求項30】
前記少なくとも1種の治療剤が、以下:ペプチド、タンパク質、低分子、遺伝子、抗原、抗体およびそのフラグメントならびにヒト組換えタンパク質、DNA、RNAおよびDNAナノ粒子からなる群から選択される、請求項1に記載のシステム。
【請求項31】
前記少なくとも1種の治療剤が、高分子形態である、請求項1に記載のシステム。
【請求項32】
前記少なくとも1種の治療剤が、以下:鎮痛剤、麻酔薬、抗関節炎薬物、疾患改変抗リウマチ薬物、抗喘息薬物、抗凝固剤、抗痙攣薬、抗うつ剤、抗糖尿病薬、抗悪性腫瘍薬、抗精神病薬、降圧薬、抗生物質、抗ヒスタミン剤、消炎剤、抗炎症薬、筋肉弛緩剤、駆虫薬、抗ウイルス薬、抗再狭窄薬、鎮痙剤、軟骨保護剤(chondroprotective agent)、抗接着剤、抗腫瘍細胞侵襲剤、血管弛緩薬、血管収縮薬および免疫抑制薬からなる群から選択される、請求項1に記載のシステム。
【請求項33】
前記少なくとも1種の治療剤が、以下:ペプチド、タンパク質(サイトカイン、成長因子、血管新生因子、可溶性レセプター、抗体およびそのフラグメントならびにヒト組換えタンパク質を含む)、低分子、遺伝子、抗原(ワクチンを含む)、DNA、RNAおよびDNAナノ粒子、からなる群から選択される、請求項1に記載のシステム。
【請求項34】
前記ヒドロゲルが、移植可能デバイスに適用される、請求項1に記載のシステム。
【請求項35】
前記移植可能デバイスが、以下:ステント、カテーテル、気道チューブ、導管、スクリュー、プレート、シャント、人工関節、人工心臓、人工弁および他の人工器官からなる群から選択される、請求項34に記載のシステム。
【請求項36】
以下:
シクロデキストリンおよび両親媒性コポリマーから形成されるヒドロゲルであって、該コポリマーが、ポリ(エチレンオキシド)を含むAポリマーブロックおよびポリ(ヒドロキシブチレート)を含むBポリマーブロックを含む、ヒドロゲル;および
ヒドロゲルの内心に含まれる治療有効量の少なくとも1種の治療剤、
を含む薬物送達システム。
【請求項37】
シクロデキストリンおよび両親媒性コポリマーを含むヒドロゲルであって、該コポリマーが、ポリ(アルキレンオキシド)を含むAポリマーブロックおよびポリ(ヒドロキシアルカノエート)を含むBポリマーブロックを含む、ヒドロゲル。
【請求項38】
以下:
シクロデキストリンおよび両親媒性コポリマーから形成されるヒドロゲルであって、該コポリマーが、ポリ(アルキレンオキシド)を含むAポリマーブロックおよびポリ(ヒドロキシアルカノエート)を含むBポリマーブロックを含む、ヒドロゲル;および
ヒドロゲル内に含まれる診断剤、
を含む薬物送達システム。
【請求項39】
以下:
シクロデキストリンおよび両親媒性コポリマーから形成されるヒドロゲルであって、該コポリマーが、ポリ(エチレンオキシド)を含むAポリマーブロックおよびポリ(ヒドロキシブチレート)を含むBポリマーブロックを含む、ヒドロゲル;および
ヒドロゲル内に含まれる診断剤、
を含む薬物送達システム。
【請求項40】
明細書中に記載の薬物送達システム。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24a】


【図24b】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24a】


【図24b】


【公開番号】特開2010−180248(P2010−180248A)
【公開日】平成22年8月19日(2010.8.19)
【国際特許分類】
【出願番号】特願2010−118853(P2010−118853)
【出願日】平成22年5月24日(2010.5.24)
【分割の表示】特願2004−523596(P2004−523596)の分割
【原出願日】平成15年7月18日(2003.7.18)
【出願人】(502022025)オメロス コーポレイション (10)
【出願人】(501094487)インスティチュート オブ マテリアルズ リサーチ アンド エンジニアリング (3)
【Fターム(参考)】
【公開日】平成22年8月19日(2010.8.19)
【国際特許分類】
【出願日】平成22年5月24日(2010.5.24)
【分割の表示】特願2004−523596(P2004−523596)の分割
【原出願日】平成15年7月18日(2003.7.18)
【出願人】(502022025)オメロス コーポレイション (10)
【出願人】(501094487)インスティチュート オブ マテリアルズ リサーチ アンド エンジニアリング (3)
【Fターム(参考)】
[ Back to top ]

