生分解性プラスチック分解酵素の活性抑制剤
【課題】生分解性プラスチックの分解を制御し、それにより生分解性プラスチックをより利用しやすくする技術の提供。
【解決手段】臨界ミセル濃度以上の濃度で非イオン性界面活性剤を含む、生分解性プラスチック分解酵素の活性抑制剤。
【解決手段】臨界ミセル濃度以上の濃度で非イオン性界面活性剤を含む、生分解性プラスチック分解酵素の活性抑制剤。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、生分解性プラスチック分解酵素の活性抑制剤、及び該活性抑制剤を使用する生分解性プラスチックの分解抑制方法に関する。
【背景技術】
【0002】
農業現場において、プラスチックは必要不可欠な資材としてパイプハウスの被覆やマルチに大量に使用されており、現在、農林業用の使用済プラスチックの排出量は約15万tといわれる。この使用済プラスチックは回収に労力がかかるばかりでなく、燃焼などによりCO2やダイオキシンが発生して地球温暖化などの環境に悪影響を及ぼす。環境に対する負荷の少ない資源を用いる観点からも、近年は生分解性プラスチックの研究が進み、実用化され始めている。
現在、農業資材以外の目的に生産されたものも含めて、生分解性プラスチックの国内生産量は10万tを超えたと推測されている。また、これまでに土壌や汚泥、空気等から採取された微生物から生分解性プラスチック分解酵素が単離されている(特許文献1、2、3)。しかしながら、農業資材に必要な強度と生分解性のバランスは難しく、資材に強度を持たせると生分解性が充分に発揮されないといった問題が存在する。従って、使用中は分解せず、使用後速やかに分解させるように、生分解性プラスチックの分解を制御することが求められている。
【先行技術文献】
【特許文献】
【0003】
【特許文献1】特開2004−261102号公報
【特許文献2】特開2004−75905号公報
【特許文献3】特開2005−304388号公報
【発明の概要】
【発明が解決しようとする課題】
【0004】
本発明は、生分解性プラスチックの分解を制御し、それにより生分解性プラスチックをより利用しやすくする技術を提供することを目的とする。
【課題を解決するための手段】
【0005】
本発明は、クチナーゼ類似構造を有する生分解性プラスチック分解酵素の酵素活性が、臨界ミセル濃度(cmc)以上の濃度の非イオン性界面活性剤により阻害されるという知見に基づくものである。
即ち、本発明は、臨界ミセル濃度以上の濃度で非イオン性界面活性剤を含む、生分解性プラスチック分解酵素の活性抑制剤を提供する。
また、本発明は、生分解性プラスチック物品の表面に前記非イオン性界面活性剤が施されてなるプラスチック物品を提供する。
また、本発明は、前記活性抑制剤を生分解性プラスチック物品の表面に適用し、表面に残存させる工程を含む、生分解性プラスチックの分解を抑制する方法を提供する。
また、本発明は、前記活性抑制剤を生分解性プラスチックの表面に適用し、表面に残存させる工程、及び、前記残存している活性抑制剤を前記生分解性プラスチック物品の表面から取り除く工程を含む、生分解性プラスチックの分解を制御する方法を提供する。
【発明の効果】
【0006】
本発明により、生分解性プラスチックの使用中は分解せず、使用後速やかに分解させるように分解を制御し、それにより生分解性プラスチックをより利用しやすくすることができる。
【図面の簡単な説明】
【0007】
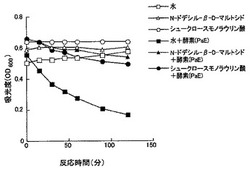
【図1】PaEの生分解性プラスチック分解酵素活性に対する、N-ドデシル-β-D-マルトシド及びシュークロースモノラウリン酸の影響を示す。
【図2】PaEの生分解性プラスチック分解酵素活性に対する、n-オクチルβ-D-グルコシド、Triton X100、Tween 20及びTween80の影響を示す。
【図3】PaEの生分解性プラスチック分解酵素活性に対する、ソホロリピッドの影響を示す。
【図4】PaEの生分解性プラスチック分解酵素活性に対するMELの影響を示す。
【図5】糸状菌47-9由来の生分解性プラスチック分解酵素活性に対する、MEL及びTween80の影響を示す。
【図6】MELが、PaEによるPBSA膜の分解活性を抑制する様子を示す。
【図7】MELで処理した膜が、MEL濃度依存的にPaEによる生分解性プラスチック分解を抑制する様子を示す。
【図8】蛍光MELがPBSA膜に結合する様子を示す。
【図9】MELで処理した膜のMEL剥離により分解性が回復する様子を示す。
【図10】P. antarcticaリパーゼによるTween 20の分解を示す。
【図11】MELで処理した膜が、PaEによるポリ乳酸の分解を抑制する様子を示す。
【図12】PaEがポリウレタンを分解する様子を示す。
【発明を実施するための形態】
【0008】
生分解性プラスチックの分解は、その化学構造と、分解微生物及びその生産する分解酵素の活性化条件(例えば水、温度、栄養)に依存する。また、植物の葉表面から多様な生分解性プラスチック分解菌が分離される。本願発明者らは、非イオン性界面活性剤が、クチナーゼ類似構造を持つ生分解性プラスチック分解酵素の活性を広く抑制することを見出した。
【0009】
本発明の活性抑制剤に使用できる非イオン性界面活性剤は特に限定はされず、ポリエチレングリコール型、多価アルコール型を問わず使用することができる。本発明においては、例えば、微生物が生産する糖脂質界面活性剤(バイオサーファクタント)であるマンノシルエリスリトールリピッド(MEL:Morita, T. et al., J Biosci Bioeng 104 (1), 78 (2007);Morita, T. et al., FEMS Yeast Res 7 (2), 286 (2007))やソホロリピッド、Triton X100などのアルキルフェノールアルキレンオキシド付加物、Tween 20及びTween80などの、ソルビタン脂肪酸エステルアルキレンオキシドを付加物、N-ドデシルβ-マルトシド、シュークロースモノラウリン酸などのショ糖脂肪酸エステル、n-オクチルβ-D-グルコシド、セロビオースリピッド、ソホロリピッドなどを使用することが可能であり、上記のうち、マンノシルエリスリトールリピッド、ソホロリピッド、Triton X100、Tween 20及びTween80が特に好ましい。ここで、アルキレンオキシドとしてはエチレンオキシド、又は、エチレンオキシドとプロピレンオキシドの混合物が好ましく、特にエチレンオキシドが好ましい。また、非イオン性界面活性剤のHLB(Hydrophile-Lipophile Balance)が6〜18であることが好ましく、8〜17であることがより好ましい。
【0010】
ここで、バイオサーファクタント(以下、BSとも呼ぶ)とは、微生物が植物油や糖質などの各種バイオマスを原料として生産・分泌する両親媒性脂質の一種である。糖型BSは、その分子中に親水基として糖鎖構造を有し、疎水基として各種の中鎖および長鎖脂肪酸(飽和、不飽和、分枝、ヒドロキシ型など)が上記親水基に結合した分子構造をとっている。各種BSの中でも糖型BSは、生産性に優れることから最もよく研究され、細菌及び酵母によって生産される多くの種類の物質が報告されている。
【0011】
バイオサーファクタントとしては、ラムノリピッド、ソホロリピッド、マンノシルエリスリトールリピッド、トレハロースリピッド、セロビオースリピッド、オリゴ糖リピッドなどバイオサーファクタントなどが知られているが、本発明においては、上記の中でも、特にマンノシルエリスリトールリピッドが好ましく使用される。マンノシルエリスリトールリピッドは、草花や土壌など身近な環境に広く分布する、シュードザイマ(Pseudozyma)属やウスチラゴ(Ustilago)属などの酵母によって生産されることから、高い安全性が見込まれる。例えばシュードザイマ・アンタークティカ(Pseudozyma antarctica)及びシュードザイマ・ツクバエンシス(Pseudozyma tsukubaensis)に属する微生物由来のMELを使用することが可能であり、特にシュードザイマ・アンタークティカ(Pseudozyma antarctica)に属する微生物は、MELの生産性に優れることから、これから得られるマンノシルエリスリトールリピッドを用いることが望ましい。
【0012】
本発明に用いるマンノシルエリスリトールリピッド(以下、MELとも呼ぶ)は、MEL生産微生物の培養によって得られ、その化学構造の代表例は以下の式(1)に示され、4−O−β−D−マンノピラノシル−エリスリトールをその基本構造とするものである。
【化1】

(1)
【0013】
ただし、上記式(1)中、R1は炭素数2〜24、好ましくは6〜18の脂肪族アシル基であり、直鎖あるいは分岐状の飽和または不飽和脂肪族アシル基を含む。R2は、水素またはアセチル基を表す。R3は水素または炭素数2〜24、好ましくは2〜18の脂肪族アシル基であり、直鎖あるいは分岐状の飽和または不飽和脂肪族アシル基を含む。2箇所あるR2及びR3は同一であっても異なっていてもよい。上記置換基R1及びR3の脂肪族アシル基の種類及びその炭素数は、MEL生産培地に含有させる油脂類中の脂肪酸に基本的には依存するが、その炭素数は使用するMEL生産菌の脂肪酸の資化の程度により変化する。したがって、得られる各MELは、通常、置換基Rの脂肪酸残基部分が異なる化合物の混合物の形態である。
MELの代表例としてMEL−A、MEL−B、MEL−C、MEL−Dの4種類が知られている(北本大、薬学雑誌、128、695 (2008))。その化学構造を以下に示す。
【化2】

【0014】
これら式中、R1は上記式(1)と同様の基であり、Acはアセチル基を表す。
上述のシュードザイマ・アンタークティカ(Pseudozyma antarctica)に属する微生物は、MEL-A、-B、-Cを混合物として生産することが知られており、その主成分はMEL-Aである。これらはシリカゲルカラムクロマトグラフィーなど、一般的に用いられる分離生成方法によって単離精製することができる。本発明では混合物のまま用いても良いし、単離されたものを用いてもよい。
【0015】
ソホロリピッドは、ソホロース(β1→2結合した2分子のブドウ糖からなる糖)あるいはヒドロキシル基が一部アセチル化したソホロースと、ヒドロキシ脂肪酸(構造中にヒドロキシル基を有する脂肪酸)とからなる糖脂質であり、ヒドロキシ脂肪酸のカルボキシル基が遊離した酸型と、分子内のソホロースと結合したラクトン型と、に大別される。一般的に、発酵生産によって得られるSLは、ラクトン型と酸型の混合物として得られ、通常、ラクトン型を50%以上含む。
【化3】

【0016】
ただし、上記式(1)中、R1、R2は、水素またはアセチル基を表し、同一であっても異なっていてもよい。また、nは9〜17の整数である。発酵生産によって得られるSLは、酸型、ラクトン型の含有比、R1、R2のアセチル基含有率、及び脂肪酸の炭素数(n)が、使用するSL生産菌により変化する。したがって、得られる各SLは、通常、アセチル基、脂肪酸鎖長部分の組成が異なる酸型、ラクトン型SLの混合物の形態である。
【0017】
本発明に用いるソホロリピッドは、生産する微生物、製造法に依らず用いることができる。SLを生産する微生物の例としては、例えばスターメレラ(キャンディダ)・ボンビコーラ(Starmerella(Candida) bombicola)、キャンディダ・ボゴリエンシス(Candida bogoriensis)、キャンディダ・マグノリエ(Candida magnoliae)、またはキャンディダ・アピコーラ(Candida apicola)等に属する微生物が挙げられ、このうち特に、スターメレラ(キャンディダ)・ボンビコーラに属する微生物が生産性に優れることから好ましい。
これらは保存機関から分譲された菌株、あるいはその継代培養菌株であってもよい。
【0018】
酸型、及びラクトン型ソホロリピッドは、シリカゲルカラムクロマトグラフィーなど、一般的に用いられる分離生成方法によって単離精製することができる。上記のうち、本発明では非イオン型界面活性剤であるラクトン型ソホロリピッドを使用することが可能であり、ラクトン型ソホロリピッド単離して用いることがより望ましいが、これを主成分として含む混合物を用いても良い。
【0019】
上記の非イオン性界面活性剤の種類は、例えば活性を抑制したい生分解性プラスチック分解酵素の種類などに応じて決定することが可能であり、前記酵素の活性を最も効率的に抑制できる組合せが明らかになれば、それを用いることができる。また、MELのように臨界ミセル濃度の値が低く、水溶解性が低い界面活性剤は散布量が少なくて済み、屋外や浴室等の水濡れの多い場面で用いやすいことから、用いる場面に応じた界面活性剤を選ぶことにより、効果的かつ長期間に渡り分解を抑制することができる。
【0020】
本発明の活性抑制剤は臨界ミセル濃度以上の濃度で上記の非イオン性界面活性剤を含む。ここで、臨界ミセル濃度(cmc)とは当業者に知られる通り、界面活性剤の使用時にミセルを形成するのに必要な最低限の界面活性剤濃度を意味する。本発明の活性抑制剤は、上記の非イオン性界面活性剤を当業者がその使用の態様に応じて、例えば20mMトリス塩酸バッファーpH6.8等の溶媒に溶解し、必要により粘度調整剤等の既知の添加剤を加えて使用することができる。
【0021】
本発明の活性抑制剤は広く生分解性プラスチック分解酵素の活性を抑制することが可能であり、生分解性プラスチック分解酵素の種類は特に限定されないが、本発明においては、生分解性プラスチック分解酵素はクチナーゼ類似構造を有するものであることが好ましい。このような生分解性プラスチック分解酵素は、植物の葉の表面に生息できる微生物が多く生産することが知られ、例えば、イネから分離される酵母Pseudozyma antarctica(シュードザイマ・アンタークティカ)が生産する生分解性プラスチック分解酵素(PaE)や、ムギから単離される生分解性プラスチック分解糸状菌、および麹菌の生分解性プラスチック分解酵素は、いずれもクチナーゼ(クチン分解酵素)類似の構造を示す。本発明においては、酵母Pseudozyma antarctica JCM10317の生産する生分解性プラスチック分解酵素であるPaEや、糸状菌47-9(受託番号NITE P-753:特願2008-250869)の培養液に含まれる糸状菌由来の生分解性プラスチック分解酵素を好ましく使用することができる。
【0022】
本発明においては、上記の活性抑制剤を生分解性プラスチック物品の表面に適用し、表面に残存させることにより、生分解性プラスチック分解酵素の分解活性を抑制し、それにより生分解性プラスチックの分解を抑制することができる。また、上記の方法により、生分解性プラスチック物品の表面に前述の非イオン性界面活性剤が施されてなるプラスチック物品が得られる。
本発明の活性抑制剤が適用される生分解性プラスチック物品特に限定はされないが、使用される期間にわたって外部環境の中で一定の強度が要求される、例えばパイプハウスの被覆やマルチなどの農林業用の物品が好ましい。
本発明の活性抑制剤が適用される生分解性プラスチック物品を構成する生分解性プラスチックの種類は特に限定はされず、任意のものを使用することができる。本明細書において、生分解性プラスチックとは、例えば、ポリヒドロキシ酪酸、ポリカプロラクトン、およびポリコハク酸ブチレン、ポリ乳酸等のポリエステルなど、当該技術分野において一般に生分解性プラスチックとして認識されているものに限定はされず、一部の特殊な酵素のみが分解することが可能である他のプラスチックも含まれる。このようなプラスチックの例としては、例えばエステル結合を含むプラスチック(例えばポリウレタンなどのポリエステル)や、エステル結合を含む可塑剤を混合したプラスチック(例えばフタル酸エステル、アジピン酸エステル、リン酸エステルなど)などが挙げられる。本発明においては、コハク酸系ポリエステル[ポリブチレンサクシネート(PBS)およびポリブチレンサクシネートアジペート(PBSA)との混合物]及びポリ乳酸(PLA)が好ましい。
【0023】
また、本発明の活性抑制剤を生分解性プラスチック物品の表面に適用し、表面に残存させる様式も特に限定はされず、使用する非イオン性界面活性剤の種類や性質、生分解性プラスチック物品の種類や形状に応じて当業者が最適の方法を適宜決定することができる。例えば、水やトリス塩酸バッファーに非イオン性界面活性剤を溶解し、そこに生分解性プラスチック物品を浸漬させることにより十分な効果を得ることが可能である。その他、塗布または散布用の形態(スプレー剤等)により生分解性プラスチック物品に適用することも可能である。
【0024】
また、上記の方法に、前記残存している活性抑制剤を前記生分解性プラスチック物品の表面から取り除く工程を組み合わせることにより、生分解性プラスチックの分解を制御することが可能となる。即ち、生分解性プラスチック物品の表面に前述の非イオン性界面活性剤を施すことにより生分解性プラスチックの分解を抑制し、また、界面活性剤を剥離することで分解を促進させることの組み合わせにより、生分解性プラスチックの使用中、及び使用後に、その分解速度を制御することが可能になる。
活性抑制剤を生分解性プラスチック物品の表面から取り除く工程は、例えば、使用した非イオン性界面活性剤が溶解する溶媒(例えば脂溶性が高いMELの場合はエタノールなど)や、非イオン性界面活性剤が分解する溶液(例えば糖脂質系のMELなどでは、エタノール、希アルカリ溶液、0.5M程度のトリス塩酸バッファーpH8.8や、尿素溶液など)に浸漬、散布、塗布する方法を用いることができる。さらに、非イオン性界面活性剤が分解するような生物的処理を用いることもできる。例えば、MEL等の糖脂質を分解する方法としては、油分解酵素であるリパーゼや、リパーゼ生産微生物による処理が考えられる。また、細菌などが生産するリパーゼがTween 20を分解することが知られており(Saeed HM, et. al., Biotechnology 5 (1), 62, (2006))、この知見に基づきリパーゼを使用して生分解性プラスチックの表面上のTween 20を取り除くことも可能である。
【0025】
さらに、糸状菌によるプラスチックの分解(浸食)の多くが、ポリエステルの分解によって生じることが知られており、本発明の活性抑制剤でポリエステル分解酵素の分解活性を抑制することで、プラスチックに生えるカビを抑えることも可能となる。
また、植物病原性真菌による植物への侵入にもクチナーゼが必要であるころが知られており、本発明の活性抑制剤でその活性を抑えることにより植物の病害防除に用いることも可能となる。
以下、実施例により本発明をより詳細に説明する。
【実施例】
【0026】
1.酵母シュードザイマアンタークティカJCM10317由来の生分解性プラスチック分解酵素活性に対する非イオン性界面活性剤の影響
PBSAエマルジョン(昭和高分子 ビオノーレEM-301)を含む20mM トリス塩酸緩衝液 pH6.8 1.9mlに各種濃度の界面活性剤 10μlを加え、生分解性プラスチック分解酵素溶液20μl〜100μl(酵母シュードザイマアンタークティカJCM10317培養液から調製したもの)を加え、PBSAエマルジョン水溶液の吸光度(OD600)を測定した。酵素によるPBSAエマルジョン分解に伴う吸光度の減少量が界面活性剤の種類と濃度でどの程度変化するのか解析した。従って、グラフ中の線の傾きが大きく下がるものは、生分解性プラスチック分解酵素によりエマルジョンが分解していることを示し、線の傾きが緩いものは分解酵素による分解が抑制されていることを示している(図1、図2)。また、図3、図4に示す実験では、全体の液量を1/10 (200μl)にし、96穴マイクロプレート内で反応させた。
【0027】
(図1)
・反応液中の界面活性剤 250mg/L
・各界面活性剤のcmc濃度(mg/L)
N-ドデシル-β-D-マルトシド 87
シュークロースモノラウリン酸 210
(図2)
・界面活性剤 cmc濃度(mg/L) 反応液中の濃度(mg/L)
Tween20 74 250
Tween80 16 250
TritonX100 151 250
N-オクチルグルコシド 7300 10000
【0028】
(図3:ソホロリピッドによる阻害)
使用した界面活性剤の詳細は以下の通り。
・SL-mix(SL-lacとSL-acの混合物)
グルコース、オリーブ油、オレイン酸を原料として、スターメレラ(キャンディダ)ボンビコーラを培養した結果得られた培養液から、酢酸エチルで油溶性成分を抽出し、抽出液についてシリカゲルカラムクロマトグラフィーで原料由来の油脂、脂肪酸などを除去して回収したMEL混合物。酸型(34%)、ラクトン型(66%)。脂肪酸組成は、C18(93%)、C16(2%)。
・SL-lac(非イオン性界面活性剤)
上記SL混合物を、シリカゲルカラムクロマトグラフィーで分離精製して得られたラクトン型SL。脂肪酸組成は上記に同じ。
・SL-ac(陰イオン性界面活性剤)
上記SL混合物を、シリカゲルカラムクロマトグラフィーで分離精製して得られた酸型SL。脂肪酸組成は上記に同じ。
各界面活性剤のcmc濃度(mg/L)は以下の通り。
SL(ソホロリピッド Lac:ラクトン型) 11
SL(ソホロリピッド ac:酸化型) 95
mix:混合物 17
【0029】
ソホロリピッドでは、非イオン界面活性剤であるSL-Lacを用いた場合に、5mg/L以上の濃度で生分解性プラスチック分解を抑制する効果が得られる。一方、陰イオン性界面活性剤であるac型では、125mg/Lの濃度であっても抑制効果が無い。また、SL-LacとSL-acが混合されたSL-mixでは、SL-Lacに比べると少し弱いが、12.5mg/L以上の濃度で生分解性プラスチック分解を抑制する効果を得ることができる。
【0030】
(図4:マンノシルエリスリトールリピッドによる阻害)
使用した界面活性剤の詳細は以下の通り。
・MEL
大豆油を原料として、シュードザイマ・アンタークティカを培養した結果得られた培養液から、酢酸エチルで油溶性成分を抽出し、抽出液についてシリカゲルカラムクロマトグラフィーで原料由来の油脂、脂肪酸などを除去して回収したMEL混合物。
MEL-A、MEL-B、MEL-Cの混合物であり、その組成はMEL-Aが70%。2本ある脂肪酸の鎖長は、C8(30%)、C10(54%)、C12(10%)の組成。
cmc濃度:1.8 (mg/L)。
・MEL-A、MEL-B、MEL-C
上記MEL混合物を、シリカゲルカラムクロマトグラフィーで分離精製したもの。
脂肪酸組成は上記に同じ。構造式は前述の通り(脂肪酸鎖R1はC8〜C12が主成分)。
・MEL-Bt
シュードザイマ・ツクバエンシスが生産したMEL-Bの精製物(T. Fukuoka, et al., Carbohyd. Res., 343, 555 (2008))。脂肪酸組成はC8(29%)、C10(4%)、C12(24%)、C14(36%)。構造式は前述のMEL-B(脂肪酸鎖R1はC8〜C14が主成分)。
【0031】
マンノシルエリスリトールリピッドは、今回用いたMEL-A、MEL-B、MEL-C、これらの混合物であるMEL、MEL-Btは、いずれも5mg/L以上の濃度で生分解性プラスチック分解を抑制する効果を得ることができる。これらの中で、特に、混合物であるMELから精製されたMEL-CおよびMEL-Bでは、混合物に比べて生分解性プラスチックによる分解抑制効果が高く、MEL-CはMEL-Bよりもさらに高い抑制効果を得ることができる。シュードザイマ・ツクバエンシス由来のMEL-Btは、MEL-AやMEL(混合物)に比べると少し弱いが、5mg/L以上の濃度で生分解性プラスチック分解を抑制する効果を得ることができる。
【0032】
2.糸状菌47-9(受託番号NITE P-753)由来の生分解性プラスチック分解酵素活性に対する界面活性剤の影響
PBSAエマルジョン(昭和高分子 ビオノーレEM-301)を含む20mM トリス塩酸緩衝液 pH6.8 1.9mlに各種濃度の非イオン性界面活性剤(MEL及びTween20)10μlを加え、生分解性プラスチック分解酵素溶液20μl〜100μl(糸状菌47-9培養液から調製したもの)を加え、PBSAエマルジョン水溶液の吸光度(OD600)を測定した。酵素によるPBSAエマルジョン分解に伴う吸光度の減少量が界面活性剤の種類と濃度でどの程度変化するのか解析した(図5)。
【0033】
糸状菌47-9由来の生分解性プラスチック分解酵素は、PaEとは異なる構造と基質特異性を有する(特願2008-250869)が、MELやTween80ではcmc値を超える5mg/L以上の濃度で生分解性プラスチックの分解が抑制された。
【0034】
以上の1、2に示す通り、酵母シュードザイマアンタークティカJCM10317及び糸状菌47-9由来の生分解性プラスチック分解酵素の活性阻害実験の結果より、マンノシルエリスリトールリピッド、ソホロリピッド、Triton X100、Tween 20、Tween 80、N-ドデシル-β-D-マルトシド、シュークロースモノラウリン酸は、いずれもcmc濃度以上で、生分解性プラスチック分解酵素の活性を阻害することが確認された。
以上より、非イオン性界面活性剤は、cmc値以上の条件下で、クチナーゼ類似構造を有する生分解性プラスチック分解酵素のエステル結合分解活性阻害剤として用いることができることが分かった。
【0035】
3.非イオン性界面活性剤による生分解性プラスチック分解の阻害
PBSA膜(ビオノーレ3020から100mg/27cm2となるように自作したものを1cm角に切断したもの)を0.8%MELを含む20mMトリス塩酸バッファーpH6.8 内に1分間浸漬後、膜を取り出して、2ml の20mMトリス塩酸バッファーpH6.8で2回洗浄した。また、8%MEL100μlをガラス試験管に入れ、エタノールを蒸発させた。前処理をしないPBSA膜、MEL処理済PBSA膜を各々ガラス試験管に入れたもの、前処理をしないPBSA膜を、MEL処理をしたガラス試験管に入れた物3種類を用意し、各々20mMトリス塩酸バッファーpH6.8 2ml、酵母シュードザイマアンタークティカJCM10317培養液から精製した生分解性プラスチック分解酵素(PaE)100μlを加え、30℃で一夜振とうした。その結果、水に溶解したMELにPBSA等の生分解性プラスチック膜を数秒間浸すだけで、生分解性プラスチックは生分解性プラスチック分解酵素で分解されなくなった(図6)。
【0036】
次に、上記と同様にPBSA膜(ビオノーレ3020から100mg/27cm2となるように自作したものを1cm角に切断したもの)を作成し、MEL(0.8-0.0008%)を含む20mMトリス塩酸バッファーpH6.8 内に1分間浸漬後、膜を取り出して、2ml の20mMトリス塩酸バッファーpH6.8で2回洗浄した。20mMトリス塩酸バッファーpH8.8 1ml中に酵母シュードザイマアンタークティカJCM10317培養液から精製した生分解性プラスチック分解酵素25μlを加え、25℃で1時間振とうした。その結果、上記の阻害活性はMEL濃度依存的であることが分かった(図7)。
【0037】
4.PBSA膜への蛍光MELの結合
蛍光MEL(NDB結合MEL(Ueno Y, et. al. J. Controlled Realease 123, 247 (2007))を水に懸濁し、PBSA膜(ビオノーレ3001 0.2μm)上に10μl滴下した。風乾後、1mlの20mMトリス塩酸バッファーpH6.8で2回洗浄した場合と、洗浄前に100%エタノールで1回洗浄後、バッファーで洗浄したものを作成し、蛍光顕微鏡(BP485/20フィルター)で蛍光MELのスポットを観察したところ、MELによる皮膜が生分解性プラスチック表面を覆い、水(緩衝液)による洗浄では、MELが剥離しないことが確認された(図8)。
【0038】
5.抑制剤を取り除くことによる生分解性プラスチック分解性の回復
PBSA膜(ビオノーレ3001 0.2μm)およびPBS膜(ビオノーレ1001 0.2μm)を2cm角に切断した。0.8%MELを含む20mMトリス塩酸バッファーpH6.8 内に1分間浸漬後、膜を取り出して、2ml の20mMトリス塩酸バッファーpH6.8で2回洗浄した。または、MEL処理後、100%エタノールで1分間または、0.5Mトリス塩酸バッファーpH8.8で1時間浸浸後、トリス塩酸バッファーpH6.8で2回洗浄した。生分解性プラスチック分解活性が確認されている酵母シュードザイマアンタークティカJCM10317を、寒天培地*1の表面に塗布後、30℃一夜培養した上に、これらの膜を乗せて、30℃で培養を継続させた。PBSAは1,2日間PBSは5,7日培養後、膜を取り出し、残存する膜の量を輝度増加量*2から算出した(図9)。
【0039】
*1
培地組成 酵母用誘導型酵素生産株選択培地 (FMM: Fungi Minimum Medium)
下層
NaNO3 0.2 (%)
KH2PO4 0.02
MgSO4・7H2O 0.02
酵母エキス(ディフコ社) 0.1
水道水
寒天 1.5
上層B PBSAエマルジョン* 1.0 (%)
[ビオノーレエマルジョンEM-301 (PBSA)]
大豆油(和光純薬) 1.0
寒天 1.5
【0040】
*2 画像解析は以下のプロトコールに従った。
市販のスキャナー透過原稿ポジフィルムモードで膜をスキャンする。解析にAquacosmos ver2.0(浜松ホトニクス)を用いる場合は、画像をTIFFファイル(グレースケール)で保存する。Aquacosmos上でファイルを開き、計測ウインドウでツールバーを選択して、ドラッグでプラスチック膜の絵を一枚囲う。「前回と同じ計測ウインドウを作成」を選んで、取り込んだ画像上の全ての膜を、同じ大きさの独立した計測ウインドウとして選定する。また、この時に未処理の膜および、膜のない白色に抜けた場所も、コントロールとして同じように囲う。解析メニュー内の「領域解析」から各領域の輝度の計算を行う。コントロールをもとに、膜の分解量を計算する。
(計測した膜の輝度−未分解膜の輝度)/(白い画面の輝度−未分解膜の輝度)X100=分解(%)
【0041】
図7より、生分解性プラスチック分解菌を培養している表面に生分解性プラスチック(PBSA)のフィルムを接触させると、30℃で通常は翌日からPBSAが分解されるが、MELで処理したフィルムは分解されなかった。MELはエタノールによく溶解する。また、MELは糖と脂質がエステル結合した構造を持ち、エステル結合は一般的にアルカリ条件下で切断されやすい。MELを剥離させる方法を検討した結果、エタノールや希アルカリ溶液で膜を洗浄することで、生分解性プラスチック分解活性が高まることが明らかになった。
また、酵母シュードザイマアンタークティカのリパーゼ(Lipozyme CALBL ノボザイム社)がTween 20を分解することが確認されているため(図10)、このリパーゼはTween 20 を適用した生分解性プラスチックの分解性を回復させるために使用させることができると考えられる。
【0042】
6.ポリ乳酸及びポリウレタンの分解の抑制
(ポリ乳酸の分解抑制)
10穴ガラスプレートの各ウェルにポリマー20μL(1%となるようジクロロメタンに溶解)をのせ、溶媒を揮発させて膜を形成させた。そのうち半数のウェルには、10μLの0.8% MEL溶液をのせて5分間処理した後ミリQ水にて洗浄し風乾した。各ポリマー膜にPaE粗酵素溶液(20 mM Tris pH8.8にて希釈)を50μLずつのせて30℃で2日間反応させた。
反応後の溶液を回収し20mLミリQ水にて希釈した後、0.45μmのテフロン(登録商標)フィルターにて濾過した後、溶液中の全有機炭素量をTOC-V(SHIMADZU)にて測定した。実験は3連で行いその平均値から、酵素を入れないものおよび酵素のみの値を対照値とし、それらを差し引いてTOC値とした。
【0043】
(PaE酵素によるポリウレタンの分解)
10穴ガラスプレートの各ウェルにポリマー10μLをのせ、溶媒を揮発させて膜を形成させた。各ポリマー膜にPaE粗酵素溶液(20 mM Tris pH8.8にて希釈)を50μLずつのせて30℃で40時間間反応させた。
反応後の溶液を回収し20mLミリQ水にて希釈した後、0.45μmのテフロン(登録商標)フィルターにて濾過した後、溶液中の全有機炭素量をTOC-V(SHIMADZU)にて測定した。実験は3連で行いその平均値から、酵素を入れないものおよび酵素のみの値を対照値とし、それらを差し引いてTOC値とした。
【0044】
PBSA膜もPBS膜もMEL処理によりシュードザイマ・アンタークティカ生分解性プラスチック分解酵素(PaE)による分解活性が抑制された。PaEはポリ乳酸(PLA)を分解することができるが、その分解活性も同様にMEL処理により抑えられた(図11)。また、PaEはポリウレタンも分解しすることも確認されており(図12)、同様にMELはポリウレタンの分解を抑制すると考えられる。
【技術分野】
【0001】
本発明は、生分解性プラスチック分解酵素の活性抑制剤、及び該活性抑制剤を使用する生分解性プラスチックの分解抑制方法に関する。
【背景技術】
【0002】
農業現場において、プラスチックは必要不可欠な資材としてパイプハウスの被覆やマルチに大量に使用されており、現在、農林業用の使用済プラスチックの排出量は約15万tといわれる。この使用済プラスチックは回収に労力がかかるばかりでなく、燃焼などによりCO2やダイオキシンが発生して地球温暖化などの環境に悪影響を及ぼす。環境に対する負荷の少ない資源を用いる観点からも、近年は生分解性プラスチックの研究が進み、実用化され始めている。
現在、農業資材以外の目的に生産されたものも含めて、生分解性プラスチックの国内生産量は10万tを超えたと推測されている。また、これまでに土壌や汚泥、空気等から採取された微生物から生分解性プラスチック分解酵素が単離されている(特許文献1、2、3)。しかしながら、農業資材に必要な強度と生分解性のバランスは難しく、資材に強度を持たせると生分解性が充分に発揮されないといった問題が存在する。従って、使用中は分解せず、使用後速やかに分解させるように、生分解性プラスチックの分解を制御することが求められている。
【先行技術文献】
【特許文献】
【0003】
【特許文献1】特開2004−261102号公報
【特許文献2】特開2004−75905号公報
【特許文献3】特開2005−304388号公報
【発明の概要】
【発明が解決しようとする課題】
【0004】
本発明は、生分解性プラスチックの分解を制御し、それにより生分解性プラスチックをより利用しやすくする技術を提供することを目的とする。
【課題を解決するための手段】
【0005】
本発明は、クチナーゼ類似構造を有する生分解性プラスチック分解酵素の酵素活性が、臨界ミセル濃度(cmc)以上の濃度の非イオン性界面活性剤により阻害されるという知見に基づくものである。
即ち、本発明は、臨界ミセル濃度以上の濃度で非イオン性界面活性剤を含む、生分解性プラスチック分解酵素の活性抑制剤を提供する。
また、本発明は、生分解性プラスチック物品の表面に前記非イオン性界面活性剤が施されてなるプラスチック物品を提供する。
また、本発明は、前記活性抑制剤を生分解性プラスチック物品の表面に適用し、表面に残存させる工程を含む、生分解性プラスチックの分解を抑制する方法を提供する。
また、本発明は、前記活性抑制剤を生分解性プラスチックの表面に適用し、表面に残存させる工程、及び、前記残存している活性抑制剤を前記生分解性プラスチック物品の表面から取り除く工程を含む、生分解性プラスチックの分解を制御する方法を提供する。
【発明の効果】
【0006】
本発明により、生分解性プラスチックの使用中は分解せず、使用後速やかに分解させるように分解を制御し、それにより生分解性プラスチックをより利用しやすくすることができる。
【図面の簡単な説明】
【0007】
【図1】PaEの生分解性プラスチック分解酵素活性に対する、N-ドデシル-β-D-マルトシド及びシュークロースモノラウリン酸の影響を示す。
【図2】PaEの生分解性プラスチック分解酵素活性に対する、n-オクチルβ-D-グルコシド、Triton X100、Tween 20及びTween80の影響を示す。
【図3】PaEの生分解性プラスチック分解酵素活性に対する、ソホロリピッドの影響を示す。
【図4】PaEの生分解性プラスチック分解酵素活性に対するMELの影響を示す。
【図5】糸状菌47-9由来の生分解性プラスチック分解酵素活性に対する、MEL及びTween80の影響を示す。
【図6】MELが、PaEによるPBSA膜の分解活性を抑制する様子を示す。
【図7】MELで処理した膜が、MEL濃度依存的にPaEによる生分解性プラスチック分解を抑制する様子を示す。
【図8】蛍光MELがPBSA膜に結合する様子を示す。
【図9】MELで処理した膜のMEL剥離により分解性が回復する様子を示す。
【図10】P. antarcticaリパーゼによるTween 20の分解を示す。
【図11】MELで処理した膜が、PaEによるポリ乳酸の分解を抑制する様子を示す。
【図12】PaEがポリウレタンを分解する様子を示す。
【発明を実施するための形態】
【0008】
生分解性プラスチックの分解は、その化学構造と、分解微生物及びその生産する分解酵素の活性化条件(例えば水、温度、栄養)に依存する。また、植物の葉表面から多様な生分解性プラスチック分解菌が分離される。本願発明者らは、非イオン性界面活性剤が、クチナーゼ類似構造を持つ生分解性プラスチック分解酵素の活性を広く抑制することを見出した。
【0009】
本発明の活性抑制剤に使用できる非イオン性界面活性剤は特に限定はされず、ポリエチレングリコール型、多価アルコール型を問わず使用することができる。本発明においては、例えば、微生物が生産する糖脂質界面活性剤(バイオサーファクタント)であるマンノシルエリスリトールリピッド(MEL:Morita, T. et al., J Biosci Bioeng 104 (1), 78 (2007);Morita, T. et al., FEMS Yeast Res 7 (2), 286 (2007))やソホロリピッド、Triton X100などのアルキルフェノールアルキレンオキシド付加物、Tween 20及びTween80などの、ソルビタン脂肪酸エステルアルキレンオキシドを付加物、N-ドデシルβ-マルトシド、シュークロースモノラウリン酸などのショ糖脂肪酸エステル、n-オクチルβ-D-グルコシド、セロビオースリピッド、ソホロリピッドなどを使用することが可能であり、上記のうち、マンノシルエリスリトールリピッド、ソホロリピッド、Triton X100、Tween 20及びTween80が特に好ましい。ここで、アルキレンオキシドとしてはエチレンオキシド、又は、エチレンオキシドとプロピレンオキシドの混合物が好ましく、特にエチレンオキシドが好ましい。また、非イオン性界面活性剤のHLB(Hydrophile-Lipophile Balance)が6〜18であることが好ましく、8〜17であることがより好ましい。
【0010】
ここで、バイオサーファクタント(以下、BSとも呼ぶ)とは、微生物が植物油や糖質などの各種バイオマスを原料として生産・分泌する両親媒性脂質の一種である。糖型BSは、その分子中に親水基として糖鎖構造を有し、疎水基として各種の中鎖および長鎖脂肪酸(飽和、不飽和、分枝、ヒドロキシ型など)が上記親水基に結合した分子構造をとっている。各種BSの中でも糖型BSは、生産性に優れることから最もよく研究され、細菌及び酵母によって生産される多くの種類の物質が報告されている。
【0011】
バイオサーファクタントとしては、ラムノリピッド、ソホロリピッド、マンノシルエリスリトールリピッド、トレハロースリピッド、セロビオースリピッド、オリゴ糖リピッドなどバイオサーファクタントなどが知られているが、本発明においては、上記の中でも、特にマンノシルエリスリトールリピッドが好ましく使用される。マンノシルエリスリトールリピッドは、草花や土壌など身近な環境に広く分布する、シュードザイマ(Pseudozyma)属やウスチラゴ(Ustilago)属などの酵母によって生産されることから、高い安全性が見込まれる。例えばシュードザイマ・アンタークティカ(Pseudozyma antarctica)及びシュードザイマ・ツクバエンシス(Pseudozyma tsukubaensis)に属する微生物由来のMELを使用することが可能であり、特にシュードザイマ・アンタークティカ(Pseudozyma antarctica)に属する微生物は、MELの生産性に優れることから、これから得られるマンノシルエリスリトールリピッドを用いることが望ましい。
【0012】
本発明に用いるマンノシルエリスリトールリピッド(以下、MELとも呼ぶ)は、MEL生産微生物の培養によって得られ、その化学構造の代表例は以下の式(1)に示され、4−O−β−D−マンノピラノシル−エリスリトールをその基本構造とするものである。
【化1】

(1)
【0013】
ただし、上記式(1)中、R1は炭素数2〜24、好ましくは6〜18の脂肪族アシル基であり、直鎖あるいは分岐状の飽和または不飽和脂肪族アシル基を含む。R2は、水素またはアセチル基を表す。R3は水素または炭素数2〜24、好ましくは2〜18の脂肪族アシル基であり、直鎖あるいは分岐状の飽和または不飽和脂肪族アシル基を含む。2箇所あるR2及びR3は同一であっても異なっていてもよい。上記置換基R1及びR3の脂肪族アシル基の種類及びその炭素数は、MEL生産培地に含有させる油脂類中の脂肪酸に基本的には依存するが、その炭素数は使用するMEL生産菌の脂肪酸の資化の程度により変化する。したがって、得られる各MELは、通常、置換基Rの脂肪酸残基部分が異なる化合物の混合物の形態である。
MELの代表例としてMEL−A、MEL−B、MEL−C、MEL−Dの4種類が知られている(北本大、薬学雑誌、128、695 (2008))。その化学構造を以下に示す。
【化2】

【0014】
これら式中、R1は上記式(1)と同様の基であり、Acはアセチル基を表す。
上述のシュードザイマ・アンタークティカ(Pseudozyma antarctica)に属する微生物は、MEL-A、-B、-Cを混合物として生産することが知られており、その主成分はMEL-Aである。これらはシリカゲルカラムクロマトグラフィーなど、一般的に用いられる分離生成方法によって単離精製することができる。本発明では混合物のまま用いても良いし、単離されたものを用いてもよい。
【0015】
ソホロリピッドは、ソホロース(β1→2結合した2分子のブドウ糖からなる糖)あるいはヒドロキシル基が一部アセチル化したソホロースと、ヒドロキシ脂肪酸(構造中にヒドロキシル基を有する脂肪酸)とからなる糖脂質であり、ヒドロキシ脂肪酸のカルボキシル基が遊離した酸型と、分子内のソホロースと結合したラクトン型と、に大別される。一般的に、発酵生産によって得られるSLは、ラクトン型と酸型の混合物として得られ、通常、ラクトン型を50%以上含む。
【化3】

【0016】
ただし、上記式(1)中、R1、R2は、水素またはアセチル基を表し、同一であっても異なっていてもよい。また、nは9〜17の整数である。発酵生産によって得られるSLは、酸型、ラクトン型の含有比、R1、R2のアセチル基含有率、及び脂肪酸の炭素数(n)が、使用するSL生産菌により変化する。したがって、得られる各SLは、通常、アセチル基、脂肪酸鎖長部分の組成が異なる酸型、ラクトン型SLの混合物の形態である。
【0017】
本発明に用いるソホロリピッドは、生産する微生物、製造法に依らず用いることができる。SLを生産する微生物の例としては、例えばスターメレラ(キャンディダ)・ボンビコーラ(Starmerella(Candida) bombicola)、キャンディダ・ボゴリエンシス(Candida bogoriensis)、キャンディダ・マグノリエ(Candida magnoliae)、またはキャンディダ・アピコーラ(Candida apicola)等に属する微生物が挙げられ、このうち特に、スターメレラ(キャンディダ)・ボンビコーラに属する微生物が生産性に優れることから好ましい。
これらは保存機関から分譲された菌株、あるいはその継代培養菌株であってもよい。
【0018】
酸型、及びラクトン型ソホロリピッドは、シリカゲルカラムクロマトグラフィーなど、一般的に用いられる分離生成方法によって単離精製することができる。上記のうち、本発明では非イオン型界面活性剤であるラクトン型ソホロリピッドを使用することが可能であり、ラクトン型ソホロリピッド単離して用いることがより望ましいが、これを主成分として含む混合物を用いても良い。
【0019】
上記の非イオン性界面活性剤の種類は、例えば活性を抑制したい生分解性プラスチック分解酵素の種類などに応じて決定することが可能であり、前記酵素の活性を最も効率的に抑制できる組合せが明らかになれば、それを用いることができる。また、MELのように臨界ミセル濃度の値が低く、水溶解性が低い界面活性剤は散布量が少なくて済み、屋外や浴室等の水濡れの多い場面で用いやすいことから、用いる場面に応じた界面活性剤を選ぶことにより、効果的かつ長期間に渡り分解を抑制することができる。
【0020】
本発明の活性抑制剤は臨界ミセル濃度以上の濃度で上記の非イオン性界面活性剤を含む。ここで、臨界ミセル濃度(cmc)とは当業者に知られる通り、界面活性剤の使用時にミセルを形成するのに必要な最低限の界面活性剤濃度を意味する。本発明の活性抑制剤は、上記の非イオン性界面活性剤を当業者がその使用の態様に応じて、例えば20mMトリス塩酸バッファーpH6.8等の溶媒に溶解し、必要により粘度調整剤等の既知の添加剤を加えて使用することができる。
【0021】
本発明の活性抑制剤は広く生分解性プラスチック分解酵素の活性を抑制することが可能であり、生分解性プラスチック分解酵素の種類は特に限定されないが、本発明においては、生分解性プラスチック分解酵素はクチナーゼ類似構造を有するものであることが好ましい。このような生分解性プラスチック分解酵素は、植物の葉の表面に生息できる微生物が多く生産することが知られ、例えば、イネから分離される酵母Pseudozyma antarctica(シュードザイマ・アンタークティカ)が生産する生分解性プラスチック分解酵素(PaE)や、ムギから単離される生分解性プラスチック分解糸状菌、および麹菌の生分解性プラスチック分解酵素は、いずれもクチナーゼ(クチン分解酵素)類似の構造を示す。本発明においては、酵母Pseudozyma antarctica JCM10317の生産する生分解性プラスチック分解酵素であるPaEや、糸状菌47-9(受託番号NITE P-753:特願2008-250869)の培養液に含まれる糸状菌由来の生分解性プラスチック分解酵素を好ましく使用することができる。
【0022】
本発明においては、上記の活性抑制剤を生分解性プラスチック物品の表面に適用し、表面に残存させることにより、生分解性プラスチック分解酵素の分解活性を抑制し、それにより生分解性プラスチックの分解を抑制することができる。また、上記の方法により、生分解性プラスチック物品の表面に前述の非イオン性界面活性剤が施されてなるプラスチック物品が得られる。
本発明の活性抑制剤が適用される生分解性プラスチック物品特に限定はされないが、使用される期間にわたって外部環境の中で一定の強度が要求される、例えばパイプハウスの被覆やマルチなどの農林業用の物品が好ましい。
本発明の活性抑制剤が適用される生分解性プラスチック物品を構成する生分解性プラスチックの種類は特に限定はされず、任意のものを使用することができる。本明細書において、生分解性プラスチックとは、例えば、ポリヒドロキシ酪酸、ポリカプロラクトン、およびポリコハク酸ブチレン、ポリ乳酸等のポリエステルなど、当該技術分野において一般に生分解性プラスチックとして認識されているものに限定はされず、一部の特殊な酵素のみが分解することが可能である他のプラスチックも含まれる。このようなプラスチックの例としては、例えばエステル結合を含むプラスチック(例えばポリウレタンなどのポリエステル)や、エステル結合を含む可塑剤を混合したプラスチック(例えばフタル酸エステル、アジピン酸エステル、リン酸エステルなど)などが挙げられる。本発明においては、コハク酸系ポリエステル[ポリブチレンサクシネート(PBS)およびポリブチレンサクシネートアジペート(PBSA)との混合物]及びポリ乳酸(PLA)が好ましい。
【0023】
また、本発明の活性抑制剤を生分解性プラスチック物品の表面に適用し、表面に残存させる様式も特に限定はされず、使用する非イオン性界面活性剤の種類や性質、生分解性プラスチック物品の種類や形状に応じて当業者が最適の方法を適宜決定することができる。例えば、水やトリス塩酸バッファーに非イオン性界面活性剤を溶解し、そこに生分解性プラスチック物品を浸漬させることにより十分な効果を得ることが可能である。その他、塗布または散布用の形態(スプレー剤等)により生分解性プラスチック物品に適用することも可能である。
【0024】
また、上記の方法に、前記残存している活性抑制剤を前記生分解性プラスチック物品の表面から取り除く工程を組み合わせることにより、生分解性プラスチックの分解を制御することが可能となる。即ち、生分解性プラスチック物品の表面に前述の非イオン性界面活性剤を施すことにより生分解性プラスチックの分解を抑制し、また、界面活性剤を剥離することで分解を促進させることの組み合わせにより、生分解性プラスチックの使用中、及び使用後に、その分解速度を制御することが可能になる。
活性抑制剤を生分解性プラスチック物品の表面から取り除く工程は、例えば、使用した非イオン性界面活性剤が溶解する溶媒(例えば脂溶性が高いMELの場合はエタノールなど)や、非イオン性界面活性剤が分解する溶液(例えば糖脂質系のMELなどでは、エタノール、希アルカリ溶液、0.5M程度のトリス塩酸バッファーpH8.8や、尿素溶液など)に浸漬、散布、塗布する方法を用いることができる。さらに、非イオン性界面活性剤が分解するような生物的処理を用いることもできる。例えば、MEL等の糖脂質を分解する方法としては、油分解酵素であるリパーゼや、リパーゼ生産微生物による処理が考えられる。また、細菌などが生産するリパーゼがTween 20を分解することが知られており(Saeed HM, et. al., Biotechnology 5 (1), 62, (2006))、この知見に基づきリパーゼを使用して生分解性プラスチックの表面上のTween 20を取り除くことも可能である。
【0025】
さらに、糸状菌によるプラスチックの分解(浸食)の多くが、ポリエステルの分解によって生じることが知られており、本発明の活性抑制剤でポリエステル分解酵素の分解活性を抑制することで、プラスチックに生えるカビを抑えることも可能となる。
また、植物病原性真菌による植物への侵入にもクチナーゼが必要であるころが知られており、本発明の活性抑制剤でその活性を抑えることにより植物の病害防除に用いることも可能となる。
以下、実施例により本発明をより詳細に説明する。
【実施例】
【0026】
1.酵母シュードザイマアンタークティカJCM10317由来の生分解性プラスチック分解酵素活性に対する非イオン性界面活性剤の影響
PBSAエマルジョン(昭和高分子 ビオノーレEM-301)を含む20mM トリス塩酸緩衝液 pH6.8 1.9mlに各種濃度の界面活性剤 10μlを加え、生分解性プラスチック分解酵素溶液20μl〜100μl(酵母シュードザイマアンタークティカJCM10317培養液から調製したもの)を加え、PBSAエマルジョン水溶液の吸光度(OD600)を測定した。酵素によるPBSAエマルジョン分解に伴う吸光度の減少量が界面活性剤の種類と濃度でどの程度変化するのか解析した。従って、グラフ中の線の傾きが大きく下がるものは、生分解性プラスチック分解酵素によりエマルジョンが分解していることを示し、線の傾きが緩いものは分解酵素による分解が抑制されていることを示している(図1、図2)。また、図3、図4に示す実験では、全体の液量を1/10 (200μl)にし、96穴マイクロプレート内で反応させた。
【0027】
(図1)
・反応液中の界面活性剤 250mg/L
・各界面活性剤のcmc濃度(mg/L)
N-ドデシル-β-D-マルトシド 87
シュークロースモノラウリン酸 210
(図2)
・界面活性剤 cmc濃度(mg/L) 反応液中の濃度(mg/L)
Tween20 74 250
Tween80 16 250
TritonX100 151 250
N-オクチルグルコシド 7300 10000
【0028】
(図3:ソホロリピッドによる阻害)
使用した界面活性剤の詳細は以下の通り。
・SL-mix(SL-lacとSL-acの混合物)
グルコース、オリーブ油、オレイン酸を原料として、スターメレラ(キャンディダ)ボンビコーラを培養した結果得られた培養液から、酢酸エチルで油溶性成分を抽出し、抽出液についてシリカゲルカラムクロマトグラフィーで原料由来の油脂、脂肪酸などを除去して回収したMEL混合物。酸型(34%)、ラクトン型(66%)。脂肪酸組成は、C18(93%)、C16(2%)。
・SL-lac(非イオン性界面活性剤)
上記SL混合物を、シリカゲルカラムクロマトグラフィーで分離精製して得られたラクトン型SL。脂肪酸組成は上記に同じ。
・SL-ac(陰イオン性界面活性剤)
上記SL混合物を、シリカゲルカラムクロマトグラフィーで分離精製して得られた酸型SL。脂肪酸組成は上記に同じ。
各界面活性剤のcmc濃度(mg/L)は以下の通り。
SL(ソホロリピッド Lac:ラクトン型) 11
SL(ソホロリピッド ac:酸化型) 95
mix:混合物 17
【0029】
ソホロリピッドでは、非イオン界面活性剤であるSL-Lacを用いた場合に、5mg/L以上の濃度で生分解性プラスチック分解を抑制する効果が得られる。一方、陰イオン性界面活性剤であるac型では、125mg/Lの濃度であっても抑制効果が無い。また、SL-LacとSL-acが混合されたSL-mixでは、SL-Lacに比べると少し弱いが、12.5mg/L以上の濃度で生分解性プラスチック分解を抑制する効果を得ることができる。
【0030】
(図4:マンノシルエリスリトールリピッドによる阻害)
使用した界面活性剤の詳細は以下の通り。
・MEL
大豆油を原料として、シュードザイマ・アンタークティカを培養した結果得られた培養液から、酢酸エチルで油溶性成分を抽出し、抽出液についてシリカゲルカラムクロマトグラフィーで原料由来の油脂、脂肪酸などを除去して回収したMEL混合物。
MEL-A、MEL-B、MEL-Cの混合物であり、その組成はMEL-Aが70%。2本ある脂肪酸の鎖長は、C8(30%)、C10(54%)、C12(10%)の組成。
cmc濃度:1.8 (mg/L)。
・MEL-A、MEL-B、MEL-C
上記MEL混合物を、シリカゲルカラムクロマトグラフィーで分離精製したもの。
脂肪酸組成は上記に同じ。構造式は前述の通り(脂肪酸鎖R1はC8〜C12が主成分)。
・MEL-Bt
シュードザイマ・ツクバエンシスが生産したMEL-Bの精製物(T. Fukuoka, et al., Carbohyd. Res., 343, 555 (2008))。脂肪酸組成はC8(29%)、C10(4%)、C12(24%)、C14(36%)。構造式は前述のMEL-B(脂肪酸鎖R1はC8〜C14が主成分)。
【0031】
マンノシルエリスリトールリピッドは、今回用いたMEL-A、MEL-B、MEL-C、これらの混合物であるMEL、MEL-Btは、いずれも5mg/L以上の濃度で生分解性プラスチック分解を抑制する効果を得ることができる。これらの中で、特に、混合物であるMELから精製されたMEL-CおよびMEL-Bでは、混合物に比べて生分解性プラスチックによる分解抑制効果が高く、MEL-CはMEL-Bよりもさらに高い抑制効果を得ることができる。シュードザイマ・ツクバエンシス由来のMEL-Btは、MEL-AやMEL(混合物)に比べると少し弱いが、5mg/L以上の濃度で生分解性プラスチック分解を抑制する効果を得ることができる。
【0032】
2.糸状菌47-9(受託番号NITE P-753)由来の生分解性プラスチック分解酵素活性に対する界面活性剤の影響
PBSAエマルジョン(昭和高分子 ビオノーレEM-301)を含む20mM トリス塩酸緩衝液 pH6.8 1.9mlに各種濃度の非イオン性界面活性剤(MEL及びTween20)10μlを加え、生分解性プラスチック分解酵素溶液20μl〜100μl(糸状菌47-9培養液から調製したもの)を加え、PBSAエマルジョン水溶液の吸光度(OD600)を測定した。酵素によるPBSAエマルジョン分解に伴う吸光度の減少量が界面活性剤の種類と濃度でどの程度変化するのか解析した(図5)。
【0033】
糸状菌47-9由来の生分解性プラスチック分解酵素は、PaEとは異なる構造と基質特異性を有する(特願2008-250869)が、MELやTween80ではcmc値を超える5mg/L以上の濃度で生分解性プラスチックの分解が抑制された。
【0034】
以上の1、2に示す通り、酵母シュードザイマアンタークティカJCM10317及び糸状菌47-9由来の生分解性プラスチック分解酵素の活性阻害実験の結果より、マンノシルエリスリトールリピッド、ソホロリピッド、Triton X100、Tween 20、Tween 80、N-ドデシル-β-D-マルトシド、シュークロースモノラウリン酸は、いずれもcmc濃度以上で、生分解性プラスチック分解酵素の活性を阻害することが確認された。
以上より、非イオン性界面活性剤は、cmc値以上の条件下で、クチナーゼ類似構造を有する生分解性プラスチック分解酵素のエステル結合分解活性阻害剤として用いることができることが分かった。
【0035】
3.非イオン性界面活性剤による生分解性プラスチック分解の阻害
PBSA膜(ビオノーレ3020から100mg/27cm2となるように自作したものを1cm角に切断したもの)を0.8%MELを含む20mMトリス塩酸バッファーpH6.8 内に1分間浸漬後、膜を取り出して、2ml の20mMトリス塩酸バッファーpH6.8で2回洗浄した。また、8%MEL100μlをガラス試験管に入れ、エタノールを蒸発させた。前処理をしないPBSA膜、MEL処理済PBSA膜を各々ガラス試験管に入れたもの、前処理をしないPBSA膜を、MEL処理をしたガラス試験管に入れた物3種類を用意し、各々20mMトリス塩酸バッファーpH6.8 2ml、酵母シュードザイマアンタークティカJCM10317培養液から精製した生分解性プラスチック分解酵素(PaE)100μlを加え、30℃で一夜振とうした。その結果、水に溶解したMELにPBSA等の生分解性プラスチック膜を数秒間浸すだけで、生分解性プラスチックは生分解性プラスチック分解酵素で分解されなくなった(図6)。
【0036】
次に、上記と同様にPBSA膜(ビオノーレ3020から100mg/27cm2となるように自作したものを1cm角に切断したもの)を作成し、MEL(0.8-0.0008%)を含む20mMトリス塩酸バッファーpH6.8 内に1分間浸漬後、膜を取り出して、2ml の20mMトリス塩酸バッファーpH6.8で2回洗浄した。20mMトリス塩酸バッファーpH8.8 1ml中に酵母シュードザイマアンタークティカJCM10317培養液から精製した生分解性プラスチック分解酵素25μlを加え、25℃で1時間振とうした。その結果、上記の阻害活性はMEL濃度依存的であることが分かった(図7)。
【0037】
4.PBSA膜への蛍光MELの結合
蛍光MEL(NDB結合MEL(Ueno Y, et. al. J. Controlled Realease 123, 247 (2007))を水に懸濁し、PBSA膜(ビオノーレ3001 0.2μm)上に10μl滴下した。風乾後、1mlの20mMトリス塩酸バッファーpH6.8で2回洗浄した場合と、洗浄前に100%エタノールで1回洗浄後、バッファーで洗浄したものを作成し、蛍光顕微鏡(BP485/20フィルター)で蛍光MELのスポットを観察したところ、MELによる皮膜が生分解性プラスチック表面を覆い、水(緩衝液)による洗浄では、MELが剥離しないことが確認された(図8)。
【0038】
5.抑制剤を取り除くことによる生分解性プラスチック分解性の回復
PBSA膜(ビオノーレ3001 0.2μm)およびPBS膜(ビオノーレ1001 0.2μm)を2cm角に切断した。0.8%MELを含む20mMトリス塩酸バッファーpH6.8 内に1分間浸漬後、膜を取り出して、2ml の20mMトリス塩酸バッファーpH6.8で2回洗浄した。または、MEL処理後、100%エタノールで1分間または、0.5Mトリス塩酸バッファーpH8.8で1時間浸浸後、トリス塩酸バッファーpH6.8で2回洗浄した。生分解性プラスチック分解活性が確認されている酵母シュードザイマアンタークティカJCM10317を、寒天培地*1の表面に塗布後、30℃一夜培養した上に、これらの膜を乗せて、30℃で培養を継続させた。PBSAは1,2日間PBSは5,7日培養後、膜を取り出し、残存する膜の量を輝度増加量*2から算出した(図9)。
【0039】
*1
培地組成 酵母用誘導型酵素生産株選択培地 (FMM: Fungi Minimum Medium)
下層
NaNO3 0.2 (%)
KH2PO4 0.02
MgSO4・7H2O 0.02
酵母エキス(ディフコ社) 0.1
水道水
寒天 1.5
上層B PBSAエマルジョン* 1.0 (%)
[ビオノーレエマルジョンEM-301 (PBSA)]
大豆油(和光純薬) 1.0
寒天 1.5
【0040】
*2 画像解析は以下のプロトコールに従った。
市販のスキャナー透過原稿ポジフィルムモードで膜をスキャンする。解析にAquacosmos ver2.0(浜松ホトニクス)を用いる場合は、画像をTIFFファイル(グレースケール)で保存する。Aquacosmos上でファイルを開き、計測ウインドウでツールバーを選択して、ドラッグでプラスチック膜の絵を一枚囲う。「前回と同じ計測ウインドウを作成」を選んで、取り込んだ画像上の全ての膜を、同じ大きさの独立した計測ウインドウとして選定する。また、この時に未処理の膜および、膜のない白色に抜けた場所も、コントロールとして同じように囲う。解析メニュー内の「領域解析」から各領域の輝度の計算を行う。コントロールをもとに、膜の分解量を計算する。
(計測した膜の輝度−未分解膜の輝度)/(白い画面の輝度−未分解膜の輝度)X100=分解(%)
【0041】
図7より、生分解性プラスチック分解菌を培養している表面に生分解性プラスチック(PBSA)のフィルムを接触させると、30℃で通常は翌日からPBSAが分解されるが、MELで処理したフィルムは分解されなかった。MELはエタノールによく溶解する。また、MELは糖と脂質がエステル結合した構造を持ち、エステル結合は一般的にアルカリ条件下で切断されやすい。MELを剥離させる方法を検討した結果、エタノールや希アルカリ溶液で膜を洗浄することで、生分解性プラスチック分解活性が高まることが明らかになった。
また、酵母シュードザイマアンタークティカのリパーゼ(Lipozyme CALBL ノボザイム社)がTween 20を分解することが確認されているため(図10)、このリパーゼはTween 20 を適用した生分解性プラスチックの分解性を回復させるために使用させることができると考えられる。
【0042】
6.ポリ乳酸及びポリウレタンの分解の抑制
(ポリ乳酸の分解抑制)
10穴ガラスプレートの各ウェルにポリマー20μL(1%となるようジクロロメタンに溶解)をのせ、溶媒を揮発させて膜を形成させた。そのうち半数のウェルには、10μLの0.8% MEL溶液をのせて5分間処理した後ミリQ水にて洗浄し風乾した。各ポリマー膜にPaE粗酵素溶液(20 mM Tris pH8.8にて希釈)を50μLずつのせて30℃で2日間反応させた。
反応後の溶液を回収し20mLミリQ水にて希釈した後、0.45μmのテフロン(登録商標)フィルターにて濾過した後、溶液中の全有機炭素量をTOC-V(SHIMADZU)にて測定した。実験は3連で行いその平均値から、酵素を入れないものおよび酵素のみの値を対照値とし、それらを差し引いてTOC値とした。
【0043】
(PaE酵素によるポリウレタンの分解)
10穴ガラスプレートの各ウェルにポリマー10μLをのせ、溶媒を揮発させて膜を形成させた。各ポリマー膜にPaE粗酵素溶液(20 mM Tris pH8.8にて希釈)を50μLずつのせて30℃で40時間間反応させた。
反応後の溶液を回収し20mLミリQ水にて希釈した後、0.45μmのテフロン(登録商標)フィルターにて濾過した後、溶液中の全有機炭素量をTOC-V(SHIMADZU)にて測定した。実験は3連で行いその平均値から、酵素を入れないものおよび酵素のみの値を対照値とし、それらを差し引いてTOC値とした。
【0044】
PBSA膜もPBS膜もMEL処理によりシュードザイマ・アンタークティカ生分解性プラスチック分解酵素(PaE)による分解活性が抑制された。PaEはポリ乳酸(PLA)を分解することができるが、その分解活性も同様にMEL処理により抑えられた(図11)。また、PaEはポリウレタンも分解しすることも確認されており(図12)、同様にMELはポリウレタンの分解を抑制すると考えられる。
【特許請求の範囲】
【請求項1】
臨界ミセル濃度以上の濃度で非イオン性界面活性剤を含む、生分解性プラスチック分解酵素の活性抑制剤。
【請求項2】
非イオン性界面活性剤がアルキルフェノールアルキレンオキシド付加物、ソルビタン脂肪酸エステルアルキレンオキシド付加物及びバイオサーファクタントからなる群から選択される、請求項1記載の活性抑制剤。
【請求項3】
非イオン性界面活性剤のHLB値が6〜18である、請求項1又は2記載の活性抑制剤。
【請求項4】
非イオン性界面活性剤が、マンノシルエリスリトールリピッド、ソホロリピッド、Triton X100、Tween 20及びTween80からなる群から選択される、請求項1〜3のいずれか1項記載の活性抑制剤。
【請求項5】
マンノシルエリスリトールリピッドが、MEL-A、MEL-B 又は MEL-C である、請求項4記載の活性抑制剤。
【請求項6】
生分解性プラスチック分解酵素が、クチナーゼ類似構造を有する分解酵素である、請求項1〜5のいずれか1項記載の活性抑制剤。
【請求項7】
生分解性プラスチック分解酵素がPaE又は糸状菌由来酵素である、請求項1〜6のいずれか1項記載の活性抑制剤。
【請求項8】
生分解性プラスチック物品の表面に請求項1〜5のいずれか1項記載の非イオン性界面活性剤が施されてなるプラスチック物品。
【請求項9】
生分解性プラスチックがPBS、PBSA又はPLAである、請求項8記載の物品。
【請求項10】
請求項1〜7のいずれか1項記載の活性抑制剤を生分解性プラスチック物品の表面に適用し、表面に残存させる工程を含む、生分解性プラスチックの分解を抑制する方法。
【請求項11】
請求項10記載の活性抑制剤を生分解性プラスチック物品の表面に適用し、表面に残存させる工程、及び、前記残存している活性抑制剤を前記生分解性プラスチック物品の表面から取り除く工程を含む、生分解性プラスチックの分解を制御する方法。
【請求項1】
臨界ミセル濃度以上の濃度で非イオン性界面活性剤を含む、生分解性プラスチック分解酵素の活性抑制剤。
【請求項2】
非イオン性界面活性剤がアルキルフェノールアルキレンオキシド付加物、ソルビタン脂肪酸エステルアルキレンオキシド付加物及びバイオサーファクタントからなる群から選択される、請求項1記載の活性抑制剤。
【請求項3】
非イオン性界面活性剤のHLB値が6〜18である、請求項1又は2記載の活性抑制剤。
【請求項4】
非イオン性界面活性剤が、マンノシルエリスリトールリピッド、ソホロリピッド、Triton X100、Tween 20及びTween80からなる群から選択される、請求項1〜3のいずれか1項記載の活性抑制剤。
【請求項5】
マンノシルエリスリトールリピッドが、MEL-A、MEL-B 又は MEL-C である、請求項4記載の活性抑制剤。
【請求項6】
生分解性プラスチック分解酵素が、クチナーゼ類似構造を有する分解酵素である、請求項1〜5のいずれか1項記載の活性抑制剤。
【請求項7】
生分解性プラスチック分解酵素がPaE又は糸状菌由来酵素である、請求項1〜6のいずれか1項記載の活性抑制剤。
【請求項8】
生分解性プラスチック物品の表面に請求項1〜5のいずれか1項記載の非イオン性界面活性剤が施されてなるプラスチック物品。
【請求項9】
生分解性プラスチックがPBS、PBSA又はPLAである、請求項8記載の物品。
【請求項10】
請求項1〜7のいずれか1項記載の活性抑制剤を生分解性プラスチック物品の表面に適用し、表面に残存させる工程を含む、生分解性プラスチックの分解を抑制する方法。
【請求項11】
請求項10記載の活性抑制剤を生分解性プラスチック物品の表面に適用し、表面に残存させる工程、及び、前記残存している活性抑制剤を前記生分解性プラスチック物品の表面から取り除く工程を含む、生分解性プラスチックの分解を制御する方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図9】


【図10】


【図11】


【図12】


【図6】


【図7】


【図8】




【図2】


【図3】


【図4】


【図5】


【図9】


【図10】


【図11】


【図12】


【図6】


【図7】


【図8】


【公開番号】特開2010−227006(P2010−227006A)
【公開日】平成22年10月14日(2010.10.14)
【国際特許分類】
【出願番号】特願2009−78020(P2009−78020)
【出願日】平成21年3月27日(2009.3.27)
【出願人】(501245414)独立行政法人農業環境技術研究所 (60)
【出願人】(301021533)独立行政法人産業技術総合研究所 (6,529)
【Fターム(参考)】
【公開日】平成22年10月14日(2010.10.14)
【国際特許分類】
【出願日】平成21年3月27日(2009.3.27)
【出願人】(501245414)独立行政法人農業環境技術研究所 (60)
【出願人】(301021533)独立行政法人産業技術総合研究所 (6,529)
【Fターム(参考)】
[ Back to top ]

